胚体内胚葉
【課題】胚性幹(ES)細胞や胚性生殖(EG)細胞などのヒト多能性幹細胞の、効率の良い、一定方向への分化を達成する方法の提供。
【解決手段】ヒト多能性細胞および前記ヒト多能性細胞から分化したヒト胚体内胚葉細胞を含む細胞培養物であって、前記細胞培養物において、ヒト多能性細胞5個につき少なくとも1個のヒト胚体内胚葉細胞が存在する、細胞培養物。
【解決手段】ヒト多能性細胞および前記ヒト多能性細胞から分化したヒト胚体内胚葉細胞を含む細胞培養物であって、前記細胞培養物において、ヒト多能性細胞5個につき少なくとも1個のヒト胚体内胚葉細胞が存在する、細胞培養物。
【発明の詳細な説明】
【技術分野】
【0001】
本願は、2003年12月23日に出願された、名称「DEFINITIVE ENDODERM(胚体内胚葉)」の米国仮特許出願第60/532,004号明細書に対する米国特許法第119条(e)に基づく優先権と、2004年7月9日に出願された、名称「CHEMOKINE CELL SURFACE RECEPTOR FOR THE ISOLATION OF DEFINITIVE ENDODERM(胚体内胚葉分離用ケモカイン細胞表面受容体)」の米国仮特許出願第60/586,566号明細書に対する米国特許法第119条(e)に基づく優先権と、2004年7月14日に出願された、名称「CHEMOKINE CELL SURFACE RECEPTOR FOR THE ISOLATION OF DEFINITIVE ENDODERM(胚体内胚葉分離用ケモカイン細胞表面受容体)」の米国仮特許出願第60/587,942号明細書に対する米国特許法第119条(e)に基づく優先権とを主張する正規特許出願である。上記優先権を伴う各出願における全開示内容は、引用することにより本明細書の一部とされる。
【0002】
本発明は、医学および細胞生物学の分野に関する。より詳細には、本発明は、哺乳類胚体内胚葉細胞を含む組成物と、そのような細胞の作製、分離および使用方法に関する。
【背景技術】
【0003】
胚性幹(ES)細胞や胚性生殖(EG)細胞などのヒト多能性幹細胞は、まず1994年に、線維芽細胞フィーダーを使用しない培養(Bongo et al.、1994)、そして線維芽細胞フィーダーを使用した培養(Hogan、1997)において分離された。その後、Thomson、ReubinoffおよびShamblottが、有糸分裂的に不活性化したマウスの支持細胞層を用いてヒトESおよびEG細胞の連続培養を確立した(Reubinoff et al.、2000;Shamblott et al.、1998;Thomson et al.、1998)。
ヒトESおよびEG細胞(hESC)は、ヒト発生の初期段階の研究、並びに糖尿病やパーキンソン病などのいくつかの病状における治療的介入に極めて貴重な機会を提供する。例えば、hESCに由来するインシュリン産生β細胞の使用により、ドナー膵臓からの細胞を利用する現在の細胞療法に多大な進歩をもたらす。しかしながら、現在、hESCからインシュリン産生β細胞を生成する方法は知られていない。そのため、ドナー膵臓の膵島細胞を利用する糖尿病用の細胞治療法は、移植に必要な良質の膵島細胞の不足により制限されている。一人のI型糖尿病患者に対する細胞療法では、約8×108個の膵島細胞の移植を必要とする。(Shapiro et al.,2000;Shapiro et al.,2001a;Shapiro et al.,2001b)。よって、臓器移植を成功させるのに十分な膵島細胞を得るためには、少なくとも2つの健康なドナー臓器が必要である。hESCは、ヒト細胞療法用に相当な量の良質の分化細胞を発生させるための出発物質の源を提供する。
hESCが細胞療法の用途に非常に適している所以たる二つの特性は、多能性と、遺伝子変化が蓄積することなく、これらの細胞を培養物中において長期間維持する能力である。多能性は、3つの一次胚葉(内胚葉、中胚葉、外胚葉)全ての誘導体に分化し、引いては、胚体外組織(例えば、胎盤)および生殖細胞に加え、成熟した生物体の全体細胞型を形成する、hESCの能力により定義される。多能性は、hESCに並はずれた有用性を付与するが、この特性はまた、これらの細胞とその誘導体を研究および取り扱う上で、独自の難題をもたらす。多種多様な細胞型が、分化hESC培養物中に発生し得ることから、非常に多くの細胞型が、非常に低い効率で作製される。さらに、特定の細胞型の作製を評価する上での成功は、適切なマーカーを明確にすることに大きく依存している。効率の良い、一定方向への分化を達成することは、hESCの治療への応用にとってかなり重要な
ことである。
【発明の開示】
【発明が解決しようとする課題】
【0004】
細胞療法の用途において有用な細胞を生成する出発物質としてhESCを使用するためには、上述の問題を克服することが有益である。例えば、膵島細胞移植治療に必要なレベルの細胞物質にするためには、分化のかなり初期段階で、膵島/β細胞系列の方向にhESCを効率的に誘導することが有益である。
また、分化プロセスの効率的な誘導に加えて、膵島/β細胞系列方向への分化経路にそって中間細胞型を分離し特徴付けることや、分化における更なる段階に適した系列前駆物質などの細胞を使用することも有益である。
【課題を解決するための手段】
【0005】
本発明のいくつかの実施形態は、胚体内胚葉細胞を含む細胞培養物に関連するものである。前記胚体内胚葉細胞は、腸管または腸管に由来する器官の細胞に分化し得る多分化能細胞である。ある実施形態によると、胚体内胚葉細胞は、哺乳類細胞であり、好適な一実施形態においては、胚体内胚葉細胞はヒト細胞である。本発明のいくつかの実施形態において、胚体内胚葉細胞は、一定のマーカーを発現する場合もあれば、顕著には発現しない場合もある。いくつかの実施形態においては、SOX17、CXCR4、MIXL1、GATA4、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1、およびCRIP1から選択される一以上のマーカーが、胚体内胚葉細胞において発現する。他の実施形態においては、OCT4、アルファフェトプロテイン(AFP)、トロンボモジュリン(TM)、SPARCおよびSOX7から選択される一以上のマーカーは、胚体内胚葉細胞において顕著に発現することはない。
本発明の他の実施形態により、多能性細胞から胚体内胚葉を作製する方法を説明する。いくつかの実施形態において、多能性細胞は桑実胚に由来する。いくつかの実施形態においては、多能性幹細胞は、幹細胞である。これらの方法で使用される幹細胞としては、胚性幹細胞が挙げられるが、これに限定されるものではない。胚性幹細胞は、胚の内部細胞塊または胚の生殖隆起に由来し得る。胚性幹細胞は、これらに限定されはしないが、ヒトを含むさまざまな哺乳類種を始めとした、さまざまな動物種に由来し得る。好適な一実施形態においては、ヒト胚性幹細胞が、胚体内胚葉の作製に使用される。
本発明のいくつかの実施形態においては、一以上の増殖因子が、多能性細胞から胚体内胚葉細胞への分化プロセス(分化工程)で使用される。分化プロセスにおいて使用される前記一以上の増殖因子は、TGFβスーパーファミリーの増殖因子を含んでいてもよい。そのような実施形態において、前記一以上の増殖因子は、増殖因子のTGFβスーパーファミリーのノーダル/アクチビンおよび/またはBMPサブグループを含む。いくつかの実施形態において、前記一以上の増殖因子は、ノーダル、アクチビンA、アクチビンB、BMP4、Wnt3aまたはこれら増殖因子のあらゆる組み合わせからなる群から選択される。
本発明の実施形態はまた、胚体内胚葉細胞で濃縮された細胞の集団に関する。ある実施形態において、胚体内胚葉細胞は、分離または実質的に精製される。いくつかの実施形態において、分離または実質的に精製された胚体内胚葉細胞は、OCT4、AFP、TM、SPARCおよび/またはSOX7マーカーより、SOX17および/またはCXRC4マーカーを高度に発現する。
また、胚体内胚葉で細胞集団を濃縮する方法も検討されている。いくつかの実施形態において、胚体内胚葉細胞の表面には存在するが、混合細胞集団内の他の細胞の表面には存在しない分子に結合する試薬に細胞を接触させ、その試薬に結合した細胞を分離することにより、胚体内胚葉細胞を混合細胞集団から分離あるいは実質的に精製することができる。ある実施形態において、胚体内胚葉細胞の表面に存在する分子はCXCR4である。
本発明のさらに別の実施形態は、CXCR4抗体、SDF−1リガンドまたはCXCR4
に対する他のリガンドに関するものであり、濃縮、分離または実質的に精製された形態で胚体内胚葉細胞を得るために使用することができる。例えば、CXCR4抗体、SDF−1リガンドまたはCXCR4に対する他のリガンドは、親和性による分離や磁気による分離などの方法において試薬として使用し、試薬に結合する胚体内胚葉細胞の調整物を濃縮、分離または実質的に精製することができる。
本明細書に記載されている発明の他の実施形態は、多能性細胞や胚体内胚葉細胞を含む細胞培養物などの組成物に関する。ある実施形態において、細胞培養物は、幹細胞と胚体内胚葉細胞とを共に含む。そのような培養物に存在する幹細胞の数は、その培養物中の胚体内胚葉細胞の数より多くても、等しくても、または少なくてもよい。いくつかの実施形態において、幹細胞はヒト胚性幹細胞である。ある実施形態において、hESCは、支持細胞層で維持される。そのような実施形態において、支持細胞層の細胞は、ヒト、マウスまたは他の適切な生物体から得られる、線維芽細胞などの細胞であってもよい。
また、本発明のいくつかの実施形態において、胚体内胚葉細胞とhESCを含む組成物は、一以上の増殖因子も含む。そのような増殖因子としては、TGFβスーパーファミリーの増殖因子を挙げることができる。そのような実施形態において、前記一以上の増殖因子は、増殖因子のTGFβスーパーファミリーのノーダル/アクチビンおよび/またはBMPサブグループを含む。いくつかの実施形態において、前記一以上の増殖因子は、ノーダル、アクチビンA、アクチビンB、BMP4、Wnt3aまたはこれら増殖因子のあらゆる組み合わせからなる群から選択される。
本発明の他の実施形態は、以下番号を付した項目を参照して説明する。
1.ヒト細胞を含む細胞培養物であって、前記ヒト細胞の少なくとも約10%が胚体内胚葉細胞であり、前記胚体内胚葉細胞が、腸管またはそれに由来する器官の細胞に分化し得る多分化能細胞である細胞培養物
2.前記ヒト細胞の少なくとも約50%が、胚体内胚葉細胞である項目1に記載の細胞培養物。
3.前記ヒト細胞の少なくとも約80%が、胚体内胚葉細胞である項目1に記載の細胞培養物。
4.前記胚体内胚葉細胞が、SOX17およびCXCR4からなる群から選択されるマーカーを発現する項目1に記載の細胞培養物。
5.前記胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、OCT4、アルファフェトプロテイン(AFP)、トロンボモジュリン(TM)、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目4に記載の細胞培養物。
6.前記胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーを発現しない項目4に記載の細胞培養物。
7.前記胚体内胚葉細胞が、MIXL1、GATA4およびHNF3bからなる群から選択されるマーカーを発現する項目4に記載の細胞培養物。
8.前記胚体内胚葉細胞が、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーを発現する項目4に記載の細胞培養物
9.前記胚体内胚葉細胞が、SOX17およびCXCR4を発現する項目1に記載の細胞培養物。
10.前記胚体内胚葉細胞において、SOX17およびCXCR4の発現が、OCT4、AFP、TM、SPARCおよびSOX7の発現より多い項目9に記載の細胞培養物。
11.前記胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7を発現しない項目9に記載の細胞培養物。
12.前記胚体内胚葉細胞が、MIXL1、GATA4およびHNF3bを発現する項目9に記載の細胞培養物。
13.前記胚体内胚葉細胞が、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーを発現する項目9に記載の細胞
培養物。
14.前記細胞培養物において、多能性細胞約1個につき少なくとも約2個程度の胚体内胚葉細胞が存在する項目1に記載の細胞培養物。
15.前記多能性細胞が、胚性幹細胞を含む項目14に記載の細胞培養物。
16.前記胚性幹細胞が、桑実胚、胚の内部細胞塊(ICM)および胚の生殖隆起からなる群から選択される組織に由来する項目15に記載の細胞培養物。
17.さらに、約10%未満の血清を含む培地を含む項目1に記載の細胞培養物。
18.さらに、TGFβスーパーファミリーのノーダル/アクチビンサブグループの増殖因子を含む項目1に記載の細胞培養物。
19.さらに、ノーダル、アクチビンA、アクチビンBおよびそれらの組み合わせからなる群から選択される増殖因子を含む項目1に記載の細胞培養物。
20.細胞を含む細胞集団であって、前記細胞の少なくとも約90%が、ヒト胚体内胚葉細胞であり、前記ヒト胚体内胚葉細胞が、腸管またはそれに由来する器官の細胞に分化し得る多分化能細胞である細胞集団。
21.前記細胞の少なくとも約95%が、ヒト胚体内胚葉細胞である項目20に記載の細胞集団。
22.前記細胞の少なくとも約98%が、ヒト胚体内胚葉細胞である項目20に記載の細胞集団。
23.前記ヒト胚体内胚葉細胞が、SOX17およびCXCR4からなる群から選択されるマーカーを発現する項目20に記載の細胞集団。
24.前記ヒト胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目23に記載の細胞集団。
25.前記ヒト胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーを発現しない項目23に記載の細胞集団。
26.前記ヒト胚体内胚葉細胞が、MIXL1、GATA4およびHNF3bからなる群から選択されるマーカーを発現する項目23に記載の細胞集団。
27.前記胚体内胚葉細胞が、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーを発現する項目23に記載の細胞集団。
28.前記ヒト胚体内胚葉細胞が、SOX17およびCXCR4を発現する項目20に記載の細胞集団。
29.前記ヒト胚体内胚葉細胞において、SOX17およびCXCR4の発現が、OCT4、AFP、TM、SPARCおよびSOX7の発現より多い項目28に記載の細胞集団。
30.前記ヒト胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7を発現しない項目28に記載の細胞集団。
31.前記ヒト胚体内胚葉細胞が、MIXL1、GATA4およびHNF3bを発現する項目28に記載の細胞集団。
32.前記胚体内胚葉細胞が、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーを発現する項目28に記載の細胞集団。
33.前記細胞集団において、多能性細胞約1個につき少なくとも約2個程度のヒト胚体内胚葉細胞が存在する項目20に記載の細胞集団。
34.前記多能性細胞が、胚性幹細胞を含む項目33に記載の細胞集団。
35.前記胚性幹細胞が、桑実胚、胚のICMおよび胚の生殖隆起から選択される組織に由来する項目34に記載の細胞集団。
36.胚体内胚葉細胞の作製方法であって、前記方法は、
多能性ヒト細胞を含む細胞集団を得る工程と、
腸管またはそれに由来する器官の細胞に分化し得る多分化能細胞である胚体内胚葉細胞へ
の、前記多能性細胞の分化を促進するのに十分な量のTGFβスーパーファミリーの少なくとも一つの増殖因子を前記細胞集団に供給する工程と、
胚体内胚葉細胞が形成するための十分な時間を与える工程とを含み、前記胚体内胚葉細胞が形成するための十分な時間を、前記細胞集団における胚体内胚葉細胞の存在を検出することにより決定した胚体内胚葉細胞の作製方法。
37.前記多能性細胞の少なくとも約10%が、胚体内胚葉細胞に分化する項目36に記載の方法。
38.前記多能性細胞の少なくとも約50%が、胚体内胚葉細胞に分化する項目36に記載の方法。
39.前記多能性細胞の少なくとも約70%が、胚体内胚葉細胞に分化する項目36に記載の方法。
40.前記多能性細胞の少なくとも約80%が、胚体内胚葉細胞に分化する項目36に記載の方法。
41.前記細胞集団における胚体内胚葉細胞の存在の検出が、前記細胞集団の細胞において、SOX17およびCXCR4からなる群から選択される少なくとも一つのマーカー、並びにOCT4、AFP、TM、SPARCおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目36に記載の方法。
42.前記細胞集団における胚体内胚葉細胞の存在の検出が、前記細胞集団の細胞において、SOX17およびCXCR4からなる群から選択される少なくとも一つのマーカー、並びにAFP、TMおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、AFP、TMおよびSOX7からなる群から選択されるマーカーの発現より多い項目36に記載の方法。
43.前記マーカーの少なくとも一つの発現が、Q−PCRにより測定される項目42に記載の方法。
44.前記マーカーの少なくとも一つの発現が、免疫細胞化学により測定される項目42に記載の方法。
45.前記細胞集団における胚体内胚葉細胞の存在の検出が、前記細胞集団の細胞において、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択される少なくとも一つのマーカー、並びにOCT4、AFP、TM、SPARCおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーの発現が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目36に記載の方法。
46.前記少なくとも一つの増殖因子が、TGFβスーパーファミリーのノーダル/アクチビンサブグループのものである項目36に記載の方法。
47.前記少なくとも一つの増殖因子が、ノーダル、アクチビンA、アクチビンBおよびそれらの組み合わせからなる群から選択される項目46に記載の方法。
48.前記少なくとも一つの増殖因子が、ノーダルである項目47に記載の方法
49.前記の少なくとも一つの増殖因子が、アクチビンAである項目47に記載の方法。50.前記少なくとも一つの増殖因子が、アクチビンBである項目47に記載の方法。
51.TGFβスーパーファミリーの複数の増殖因子を供給する項目36に記載の方法。52.前記複数の増殖因子が、ノーダル、アクチビンAおよびアクチビンBを含む項目51に記載の方法。
53.前記少なくとも一つの増殖因子を、少なくとも約10ng/mlの濃度で供給する項目36に記載の方法。
54.前記少なくとも一つの増殖因子を、少なくとも約100ng/mlの濃度で供給する項目36に記載の方法。
55.前記少なくとも一つの増殖因子を、少なくとも約500ng/mlの濃度で供給する項目36に記載の方法。
56.前記少なくとも一つの増殖因子を、少なくとも約1000ng/mlの濃度で供給する項目36に記載の方法。
57.前記少なくとも一つの増殖因子を、少なくとも約5000ng/mlの濃度で供給する項目36に記載の方法。
58.前記細胞集団を、約10%未満の血清を含む培地で増殖させる項目36に記載の方法。
59.前記多能性細胞が、幹細胞を含む項目36に記載の方法。
60.前記多能性細胞が、胚性幹細胞を含む項目59に記載の方法。
61.前記胚性幹細胞が、桑実胚、胚のICMおよび胚の生殖隆起からなる群から選択される組織に由来する項目60に記載の方法。
62.項目36に記載の方法により作製される胚体内胚葉細胞。
63.胚体内胚葉細胞で濃縮された細胞集団を作製する方法であって、前記方法が、
腸管またはそれに由来する器官の細胞に分化し得る多分化能細胞である胚体内胚葉細胞を産生するように、多能性ヒト細胞の集団内の細胞を分化させる工程と、
前記胚体内胚葉細胞においては発現するが、前記細胞集団内に存在する他の細胞型においては実質的に発現しないマーカーに結合する試薬を、前記細胞集団に供給する工程と、
前記試薬に結合した前記胚体内胚葉細胞を、前記細胞集団内に存在する他の細胞型から分離することにより、胚体内胚葉細胞で濃縮された細胞集団を作製する工程とを含む方法。64.前記分化させる工程が、さらに、多能性ヒト細胞を含む細胞集団を得ることと、腸管またはそれに由来する器官の細胞に分化し得る多分化能細胞である胚体内胚葉細胞への前記多能性細胞の分化を促進するのに十分な量でTGFβスーパーファミリーの少なくとも一つの増殖因子を前記細胞集団に供給することと、胚体内胚葉細胞が形成するための十分な時間を与えることとを含み、前記胚体内胚葉細胞が形成するための十分な時間を、前記細胞集団における胚体内胚葉細胞の存在を検出することにより決定した項目63に記載の方法。
65.検出することが、前記細胞集団の細胞において、SOX17およびCXCR4からなる群から選択される少なくとも一つのマーカー、並びにOCT4、AFP、TM、SPARCおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目63に記載の方法。
66.検出することが、前記細胞集団の細胞において、SOX17およびCXCR4からなる群から選択される少なくとも一つのマーカー、並びにAFP、TMおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、AFP、TMおよびSOX7からなる群から選択されるマーカーの発現より多い項目63に記載の方法。
67.検出することが、前記細胞集団の細胞において、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択される少なくとも一つのマーカー、並びにOCT4、AFP、TM、SPARCおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーの発現が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目63に記載の方法。68.前記細胞の少なくとも約95%が、胚体内胚葉細胞である項目63に記載の方法。69.前記細胞の少なくとも約98%が、胚体内胚葉細胞である項目63に記載の方法
70.前記マーカーが、CXCR4である項目63に記載の方法。
71.前記試薬が、抗体である項目63に記載の方法。
72.前記抗体が、CXCR4に親和性を有する項目71に記載の方法。
73.項目63に記載の方法により作製される胚体内胚葉細胞で濃縮された集団。
74.前記胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーを顕著に発現することのない項目4または9のいずれか一つに記載の細胞培養物。
75.前記胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーを顕著に発現することのない項目23または28のいずれか一つに記載の細胞集団。
当然のことながら、上記方法および組成物は、生体外で培養される細胞に関する。しかしながら、上記の生体外で分化させた細胞組成物は、生体内用に使用してもよい。
本発明の更なる実施形態は、2003年12月23日に出願された、名称「DEFINITIVE ENDODERM(胚体内胚葉)」の米国仮特許出願第60/532,004号明細書、2004年7月9日に出願された、名称「CHEMOKINE CELL SURFACE RECEPTOR FOR THE ISOLATION OF DEFINITIVE ENDODERM(胚体内胚葉分離用ケモカイン細胞表面受容体)」の米国仮特許出願第60/586,566号明細書、および2004年7月14日に出願された、名称「CHEMOKINE CELL SURFACE RECEPTOR FOR THE ISOLATION OF DEFINITIVE ENDODERM(胚体内胚葉分離用ケモカイン細胞表面受容体)」の米国仮特許出願第60/587,942号明細書にも記載されている場合があり、それらの全内容を引用することにより本明細書の一部とする。
【図面の簡単な説明】
【0006】
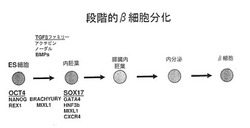
【図1】図1は、hESCからベータ細胞を作製するために提案された分化経路を示す模式図である。前記経路における第一段階は、ES細胞を胚体内胚葉系列に関係づけ、ES細胞の、膵臓内胚葉、内分泌内胚葉または島/β細胞への更なる分化において周知の初期段階の一つを現す。この移行の媒介に有用ないくつかの因子は、これらに限定されるものではないが、アクチビン、ノーダルおよびBMPを含むTGFβファミリーのメンバーである。胚体内胚葉標的細胞を明示する典型的なマーカーは、SOX17、GATA4、HNF3b、MIX1およびCXCR4である。
【図2】図2は、保存モチーフの位置を示し、GENOVAC社による免疫化処理に使用された領域にスポットを当てた、ヒトSOX17cDNAを示す図である。
【図3】図3は、SOX17が、SOX7に最も密接に関係し、SOX18に対しては幾分関係性が低いことを示す関係系統樹である。SOX17タンパク質は、同一種内のSOX群F亜科の他のメンバーより、種同属体の間でより密接に関係している。
【図4】図4は、ラット抗SOX17抗体を用いて調べたウェスタンブロットを示す。このブロットは、繊維芽細胞で過剰発現したヒトSOX17タンパク質に対するこの抗体の特異性(レーン1)や、EGFPとの免疫反応性の欠如(レーン2)、また最も密接に関係したSOXファミリーメンバーであるSOX7(レーン3)を示す。
【図5】図5A〜Bは、相当数のAFP+同時標識細胞(A)を示すSOX17+細胞のクラスターを示す顕微鏡写真である。これは、AFP+細胞がほとんどまたは全く見られない他のSOX17+クラスター(B)とは著しい対照を成している。
【図6】図6A〜Cは、壁側内胚葉およびSOX17を示す顕微鏡写真である。パネルAは、hES細胞のランダムに分化した培養物中における、壁側内胚葉細胞の細胞表面に位置するヒトトロンボモジュリン(TM)タンパク質に対する免疫細胞化学法を示している。パネルBは、TMおよびSOX17に対し二重標識した、Aに示したものと同一の領域である。パネルCは、DAPIで標識された核を有する同一領域の位相差画像である。DAPIで標識された核とSOX17標識の完全な相関性に注目されたい。
【図7】図7A〜Bは、定量PCR(Q−PCR)によるSOX17遺伝子発現と、SOX17特異抗体による抗SOX17陽性細胞とを示す棒グラフである。パネルAは、未分化対照培地(SR20)と比較して、レチノイン酸(RA)はSOX17発現を強力に抑制する一方で、アクチビンAはSOX17遺伝子発現を増加させることを示している。パネルBは、同一のパターンを示し、これら同程度の変化は、SOX17+細胞数に反映されており、これは、SOX17遺伝子発現の定量PCR測定が、単一細胞レベルでの変化に高度に反映されていることを示している。
【図8】図8Aは、10%ウシ胎児血清(FBS)中、ランダムに分化させた細胞がAFPの大幅な発現増加を示す一方で、アクチビンAの存在下における分化hESCの培養物のAFP遺伝子発現が低レベルにとどまることを示す棒グラフである。発現量には約7倍の差がある。図8B〜Cは、10%FBSのみの場合(上)に対して、アクチビンA処理状態(下)において見られる非常に少ない小さなAFP+細胞クラスターにより示されるように、アクチビンAによるAFP発現の抑制も、単一細胞レベルにおいて明白であることを示す2枚の顕微鏡写真の画像である。
【図9】図9A〜Bは、フローサイトメトリーを用いたAFP+細胞数の定量化を示す比較画像である。この図は、アクチビンAの存在下(右のパネル)および不在下(左のパネル)におけるAFP遺伝子発現(図8A)における変化の大きさが、AFP+細胞数に厳密に対応することを示しており、これは、単一細胞レベルで生じる変化を示すための定量PCR分析の有用性をさらに裏付けている。
【図10】図10A〜Fは、ノーダル、アクチビンAおよびアクチビンB(NAA)にhESCを暴露することにより、5日間(A〜C)でSOX17+細胞の数が著しく増加することを示す顕微鏡写真である。各領域に存在する総細胞数をSOX17+細胞の相対存在量と比較することにより、DAPIで染色された核(D〜F)により示されているように、NAAによる5日間の処理後、全細胞の約30〜50%が、SOX17に対し免疫反応性を有することが分かる。
【図11】図11は、分化hESCにおいて、アクチビンA(0、10、30又は100ng/mL)が、SOX17遺伝子発現を用量依存的に増加させることを示す棒グラフである。発現は、接着培養での3日間の処理後、すでに激しく増加しており、その後の1、3および5日間の浮遊培養中も引き続き同様に増加している。
【図12】図12A〜Cは、MIXL1(パネルA)、GATA4(パネルB)およびHNF3b(パネルC)の発現に対するアクチビンAの効果を示す棒グラフである。また、アクチビンA用量依存的増加は、胚体内胚葉のその他の3つのマーカーである、MIXL1、GATA4およびHNF3bに関しても見られる。アクチビンの投与量に応じて増加する発現の程度は、SOX17に関して観察されたものと非常に類似しており、これは、アクチビンAが、4つ全ての遺伝子(SOX17+、MIXL1+、GATA4+およびHNF3b+)を共に発現する細胞の集団を特定していることを強く示唆している。
【図13】図13A〜Cは、AFP(パネルA)、SOX7(パネルB)およびSPARC(パネルC)の発現に対するアクチビンAの効果を示す棒グラフである。臓側内胚葉のマーカーAFPの発現は、アクチビンAの用量に依存して減少している。いくつかの時点において、原始内胚葉(SOX7)および壁側内胚葉(SPARC)のマーカーは、変化していないか、または抑制されており、これは、アクチビンAが、これらの胚外内胚葉細胞型を特定する働きをしないことを示唆している。これは、SOX17、MIXL1、GATA4およびHNF3bの発現の増加が、アクチビンAに応じた胚体内胚葉細胞数の増加によるものであることをさらに裏付けている。
【図14】図14A〜Bは、ZIC1(パネルA)およびBrachyury(パネルB)の発現に対するアクチビンAの効果を示す棒グラフである。神経マーカーZIC1の一貫した発現は、神経分化へのアクチビンA用量依存的効果がないことを示す。Brachyuryの発現の減少によって示されているように、アクチビンA100ng/mLを用いた処理を介した中胚葉の分化は著しく抑制されている。これは、おそらく、中内胚葉前駆体からの胚体内胚葉の特異化が進んだ結果であろう。未処理の対照培養物と比較して、分化後期では、少量のアクチビンAを用いた処理(10および30ng/mL)により、Brachyuryの発現が維持されている。
【図15】図15A〜Bは、アクチビンを用いた処理により壁側内胚葉の分化が低減したことを示す顕微鏡写真である。血清のみで分化させた場合、TMhiの壁側内胚葉の領域が、培養物(A)全体に渡って見られた。一方、アクチビンが含まれており(B)、尚且つTM免疫反応性の全体的な強度が低い場合、TM+細胞への分化は殆ど見られない。
【図16】図16A〜Dは、アクチビンAおよびアクチビンBを用いた処理によるマーカーの発現を示す顕微鏡写真である。アクチビンAおよびアクチビンBを用いて4日間連続でhESCを処理し、SOX17、AFPおよびTM抗体で三重標識した。パネルAは、SOX17;パネルBはAFP;パネルCはTM:そしてパネルDが位相(Phase)/DAPIである。AFP(B)およびTM(C)免疫反応性の完全な欠如に関連した多数のSOX17陽性細胞(A)に注目されたい。
【図17】図17は、hESCからの、生体外での胚体内胚葉および臓側内胚葉の発生を示す顕微鏡写真である。臓側内胚葉の領域は、AFPhi/SOX17lo/-により同定されるが、胚体内胚葉は、全く反対の特性、SOX17hi/AFPlo/-を示す。これら二つの領域が互いに近接しているため、この領域を選択した。しかしながら、AFPhi細胞のいずれの領域からも完全に孤立して、SOX17hi/AFPlo/-の領域が見られることが頻繁にある。これは、胚体内胚葉細胞が、臓側内胚葉細胞とは別個に発生することを示唆している。
【図18】図18は、TGFβファミリーのリガンドと受容体を表す図である。AR SmadsとBR Smadsを活性化する因子は、ヒト胚性幹細胞から胚体内胚葉を作製する上で有用である。(J Cell Physiol.187:265−76参照)。
【図19】図19は、TGFβ因子を単独および組合せて用いて処理した結果として、経時的にSOX17発現の誘導を示す棒グラフである。
【図20】図20は、TGFβ因子の組合せを用いて処理した結果として、経時的にSOX17+細胞数の増加を示す棒グラフである。
【図21】図21は、TGFβ因子の組合せを用いて処理した結果として、経時的にSOX17発現の誘導を示す棒グラフである。
【図22】図22は、アクチビンAが、SOX17+細胞数の用量依存的な増加を引き起こすことを示す棒グラフである。
【図23】図23は、アクチビンAおよびアクチビンBで処理された培養物へのWnt3aの添加により、アクチビンAおよびアクチビンBのみにより引き起こされたレベル以上にSOX17の発現が増加することを示す棒グラフである。
【図24】図24A〜Cは、胚体内胚葉への分化が、FBSの少ない条件下で増強されることを示す棒グラフである。2%のFBS(2AA)を含む培地におけるアクチビンAおよびBを用いたhESCの処理は、10%のFBSを含む培地(10AA)における同様の処理と比べて、2〜3倍高いレベルのSOX17発現を引き起こす(パネルA)。また、胚体内胚葉マーカーMIXL1(パネルB)の誘導も同様に影響され、AFP(臓側内胚葉)(パネルC)は、10%FBS条件下より2%FBS条件下で、より大きく抑制されている。
【図25】図25A〜Dは、培養物中、SOX17+細胞が分離していることを示す顕微鏡写真である。SOX17免疫反応細胞は、hESCコロニー(C、D)の分化領域縁部に存在し、増殖性細胞核抗原(PCNA)(パネルB)で標識されるが、OCT4(パネルC)での同時標識はされない。さらに、OCT4+未分化hESC(矢じり形で示す)およびSOX17+細胞(矢印)のいずれにおいても、核のDAPI標識により、明瞭な有糸分裂像が見られる(D)。
【図26】図26は、様々な培地条件下での分化hESCにおけるCXCR4の相対的発現量を示す棒グラフである。
【図27】図27A〜Dは、図26に示した同様の分化処理全体に渡って、胚体内胚葉マーカーに関するパネルが、いかにCXCR4と非常によく似た発現パターンを共有しているかを示す棒グラフである。
【図28】図28A〜Eは、図26に示した同様の処理全体に渡って、中胚葉(Brachyury、MOX1)、外胚葉(SOX1、ZIC1)および臓側内胚葉(SOX7)のマーカーが、いかにCXCR4の発現に対し逆相関性を呈するかを示す棒グラフである。
【図29】図29A〜Fは、図26〜28に示した培地条件の内の3つに関して、SOX17免疫反応細胞における相対的な差異を示す顕微鏡写真である。
【図30】図30A〜Cは、分化培地に添加したアクチビンAの濃度が高くなるにつれ、CXCR4+の細胞数が増加することを示すフローサイトメトリーによるドットプロットである。
【図31】図31A〜Dは、高用量のアクチビンAによる処理(A100−CX+)により分離されたCXCR4+細胞が、母集団(A100)よりも胚体内胚葉マーカーでさらに濃縮されていることを示す棒グラフである。
【図32】図32は、母集団における遺伝子発現、並びに、蛍光標識細胞分取法(FACS)を用いて分離されたCXCR4+およびCXCR4-細胞からの遺伝子発現を示す棒グラフである。これは、CXCR4+細胞が、各母集団に存在するCXCR4の遺伝子発現を本質的にすべて含み、CXCR4-集団は、CXCR4遺伝子発現をほとんどまたは全く含まないことを示している。
【図33】図33A〜Dは、これら非胚体内胚葉マーカーの発現においては既に抑制されている、高用量アクチビンA処理により分離されたCXCR4+細胞における中胚葉(Brachyury、MOX1)、外胚葉(ZIC1)および臓側内胚葉(SOX7)の遺伝子発現の減少を示す棒グラフである。
【図34−1】図34A〜Mは、胚体内胚葉細胞の同定に使用することのできるマーカー遺伝子の発現パターンを示す棒グラフである。胚体内胚葉マーカーである、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1の発現解析は、パネルG〜Lにそれぞれ示されている。また、先に説明した系列標識遺伝子である、SOX17、SOX7、SOX17/SOX7、TM、ZIC1およびMOX1の発現解析は、パネルA〜Fにそれぞれ示されている。パネルMは、CXCR4の発現解析を示している。パネルA〜Mそれぞれに関して、hESCと表示した列は、精製されたヒト胚性幹細胞からの遺伝子発現を示し、2NFは、アクチビンを添加することなく2%FBSで処理した細胞を示し、0.1A100は、アクチビンA100ng/ml、0.1%FBSで処理した細胞を示し、1A100は、アクチビンA100ng/ml、1%FBSで処理した細胞を示し、そして、2A100は、アクチビンA100ng/ml、2%FBSで処理した細胞を示す。
【図34−2】図34A〜Mは、胚体内胚葉細胞の同定に使用することのできるマーカー遺伝子の発現パターンを示す棒グラフである。胚体内胚葉マーカーである、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1の発現解析は、パネルG〜Lにそれぞれ示されている。また、先に説明した系列標識遺伝子である、SOX17、SOX7、SOX17/SOX7、TM、ZIC1およびMOX1の発現解析は、パネルA〜Fにそれぞれ示されている。パネルMは、CXCR4の発現解析を示している。パネルA〜Mそれぞれに関して、hESCと表示した列は、精製されたヒト胚性幹細胞からの遺伝子発現を示し、2NFは、アクチビンを添加することなく2%FBSで処理した細胞を示し、0.1A100は、アクチビンA100ng/ml、0.1%FBSで処理した細胞を示し、1A100は、アクチビンA100ng/ml、1%FBSで処理した細胞を示し、そして、2A100は、アクチビンA100ng/ml、2%FBSで処理した細胞を示す。
【図34−3】図34A〜Mは、胚体内胚葉細胞の同定に使用することのできるマーカー遺伝子の発現パターンを示す棒グラフである。胚体内胚葉マーカーである、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1の発現解析は、パネルG〜Lにそれぞれ示されている。また、先に説明した系列標識遺伝子である、SOX17、SOX7、SOX17/SOX7、TM、ZIC1およびMOX1の発現解析は、パネルA〜Fにそれぞれ示されている。パネルMは、CXCR4の発現解析を示している。パネルA〜Mそれぞれに関して、hESCと表示した列は、精製されたヒト胚性幹細胞からの遺伝子発現を示し、2NFは、アクチビンを添加することなく2%FBSで処理した細胞を示し、0.1A100は、アクチビンA100ng/ml、0.1%FBSで処理した細胞を示し、1A100は、アクチビンA100ng/ml、1%FBSで処理した細胞を示し、そして、2A100は、アクチビンA100ng/ml、2%FBSで処理した細胞を示す。
【発明を実施するための形態】
【0007】
原腸形成と呼ばれるヒト発生初期における極めて重要な段階は、受精後2〜3週間で生じる。原腸形成が極めて重要である理由は、三つの一次胚葉が初めて特定化され組織化されるのがこの時だからである(Lu et al.,2001;Schoenwolf and Smith, 2000)。外胚葉は、体の外皮および全神経系の最終形成をつかさどる一方で、心臓、血液、骨、骨格筋、および他の結合組織は、中胚葉に由来する。胚体内胚葉は、食道、胃、小腸および大腸を含む全腸管、並びに肺、肝臓、胸腺、副甲状腺、甲状腺、胆嚢、および膵臓などの腸管に由来する器官の形成をつかさどる胚葉と定義される(Grapin−Botton and Melton,2000;Kimelman and Griffin,2000;Tremblay et al.,2000;Wells and Melton,1999;Wells and Melton,2000)。胚体内胚葉と、原始内胚葉と呼ばれる、完全に別個の系列の細胞とを区別することは非常に重要である。原始内胚葉は、主として、胚体外組織、主に、ライヘルト膜の細胞外マトリックス物質と胎盤の卵黄嚢の壁側および臓側内胚葉部分の形成をつかさどる。
原腸形成の間、胚体内胚葉形成の過程は、中内胚葉細胞(中胚葉または内胚葉を形成することのできる細胞)が原始線条と呼ばれる構造を通って移動する、細胞移動現象から始まる。胚体内胚葉は、線条前部を通り、そして結節(線条最前部における特殊構造)を通って移動する細胞に由来する。移動が生じるにつれ、胚体内胚葉は、まず、腸管最前部に位置し、腸管後端の形成で終了する。
Conlon et al.,1994;Feldman et al.,1998;Zhou et al.,1993;Aoki et al.,2002;Dougan et al.,2003;Tremblay et al.,2000;Vincent et al.,2003;Alexander et al.,1999;Alexander and Stainier,1999;Kikuchi et al.,2001;Hudson et al.,1997によるゼブラフィッシュとツメガエル、およびKanai−Azuma et al.,2002によるマウスにおける研究などの、胚体内胚葉形成に関する生体内解析は、ヒト胚性幹細胞を用いて、培養皿内でいかに特定の胚葉細胞型を発生させるかに関する基礎を築いている。培養皿内での発生を再現させる上で大きな障害となる、生体外ESC培養に関連した二つの側面がある。第一に、組織化された胚葉または器官構造が作製されない。胚葉および器官に特異な遺伝子マーカーの大部分は、hESC分化培養系において、不均一に発現する。したがって、器官特定の境界がこのように欠如していることから、特定の組織や細胞型の形成を評価するのは困難である。また、特定の胚葉内の一細胞型または組織型において発現するほとんど全ての遺伝子は、別の種類の胚葉の他の細胞または組織型においても発現する。特定の境界がない場合、1〜3個の遺伝子の小標本を用いて遺伝子発現特異性を決定する手段は殆ど無い。したがって、非常に多くの遺伝子を検査しなければならず、そのいくつかは目的の器官または組織の特定の細胞型に存在するものであったり、また、いくつかは、発現しないものであったりする。第二に、特定の発生経路をたどるためには、遺伝子発現パターンのタイミングが非常に重要である。
さらに複雑な問題として、注意すべきは、生体外における幹細胞分化は、いくぶん非同期的に生じ、生体内と比較すると、かなり非同期的に生じるようである。そのため、一細胞群では、原腸形成に関与する遺伝子が発現している一方で、別の細胞群では、最終分化を
始めていることもある。さらに、外因性因子適用の有無にかかわらず、hESC単層または胚様体(EB)の操作により、全体的な遺伝子発現パターンおよび分化状態に関して、大きな差異が生じる場合がある。これらの理由から、培養物に、効果的に特定の分化経路をたどらせるために、異種細胞混合物内の遺伝子発現パターンによって外因性因子の適用時期を決める必要がある。また、培養容器内の細胞の形態学的関連を考慮することも有益である。いわゆる胚様体へと形成される場合、hESCに均一に影響を及ぼす能力は、培養容器内でhESCコロニーおよび/または単層として増殖分化させたhESCほど最適ではない場合もある。
異種性と非同期性の上記問題に対処する効果的な方法として、本発明のいくつかの実施形態では、細胞を分化させる方法を、分化経路において中間細胞型を濃縮、分離および/または精製する方法と組み合わせることを検討する。
本発明の実施形態は、幹細胞などの多能性細胞を、多分化能胚体内胚葉細胞へと分化させることにより、培養物中に胚体内胚葉細胞を作製する新規且つ特定の方法に関する。本明細書に使用されている、「多分化能」または「多分化能細胞」とは、他の特定の細胞型を限定数発生させる細胞型のことを言う。前述のように、胚体内胚葉細胞は、外胚葉または中胚葉から産生される組織に分化するのではなく、腸管や、腸管に由来する器官に分化する。ある好適な実施形態において、胚体内胚葉細胞は、hESCに由来する。そのような工程は、膵臓、肝臓、肺、胃、腸および甲状腺などのヒト内胚葉由来組織の効率的作製の基礎を提供することができる。例えば、胚体内胚葉の作製が、幹細胞の機能性インスリン産生β細胞への分化における第一段階である場合もある。有用な量のインスリン産生β細胞を得るため、膵島/β細胞運命に達する前に生じる各分化段階において、効率よく分化させることが望ましい。幹細胞の胚体内胚葉細胞への分化は、おそらく機能性膵島/β細胞の作製(図1に示す)に向かう最も初期の段階に相当するため、この段階で効率よく分化させることは特に望ましい。
多能性細胞を胚体内胚葉細胞に効率よく分化させることが望ましいことから、本発明のいくつかの態様は、多能性細胞を約50〜80%胚体内胚葉細胞へ転換する、インビトロ方法論に関する。通常、そのような方法には、時間的に特定された所定のやり方における培養物や増殖因子に関する条件の適用が含まれる。胚体内胚葉細胞に特異的に結合する試薬を使用することで、細胞集団内の他の細胞から胚体内胚葉細胞を分離および/または精製することにより、胚体内胚葉細胞でその細胞集団をさらに濃縮することができる。よって、本発明の態様は、胚体内胚葉細胞と、そのような細胞を作製並びに分離および/または精製する方法とに関する。
細胞培養物または細胞集団内の胚体内胚葉細胞の量を測定するためには、培養物または集団において、他の細胞からこの細胞型を識別する方法が望ましい。従って、本発明のある実施形態は、その存在、不在および/または相対的発現量が胚体内胚葉に特異的である細胞マーカーと、そのようなマーカーの発現を検出および測定する方法とに関する。本明細書において使用する、「発現」とは、材料または物質の生成、並びに材料または物質の生成レベルまたは量のことを言う。よって、特異的なマーカーの発現を測定するということは、マーカーの存在または不在を簡易に検出すること、あるいは発現するマーカーの相対量または絶対量のいずれかを検出することを言う。本明細書に使用する、「マーカー」は、観察または検出できるあらゆる分子のことを指す。例えば、マーカーは、特異的遺伝子の転写物などの核酸、遺伝子のポリペプチド生成物、非遺伝子生成物ポリペプチド、糖タンパク質、炭水化物、糖脂質、脂質,リポタンパクまたは小分子を含むが、これらに限定されるものではない。
本発明のいくつかの実施形態において、マーカーの発現の有無および/または量は、定量PCR(Q−PCR)により測定される。例えば、SOX17、CXCR4、OCT4、AFP、TM、SPARC、SOX7、MIXL1、GATA4、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1、CRIP1などの一定の遺伝子マーカーや、本明細書に記載している他のマーカーにより産生される転写物の量は、定量Q−PCRにより測定される。他の実施形態においては、上記遺伝子により発現し
たタンパク質の検出に免疫組織化学が使用される。さらに別の実施形態において、そのようなマーカーの量または相対的比率の確認および測定には、Q−PCRおよび免疫組織化学技術の両方を利用する。
上記のような方法を利用することにより、一以上の適切なマーカーの発現を測定するために、胚体内胚葉細胞を同定するだけでなく、細胞培養物あるいは細胞集団における胚体内胚葉細胞の比率を求めることも可能である。例えば、本発明のいくつかの実施形態において、作製される胚体内胚葉細胞または細胞集団は、非胚体内胚葉細胞型または細胞集団より約2桁多い量のSOX17および/またはCXCR4遺伝子を発現する。他の実施形態において、作製される胚体内胚葉細胞または細胞集団は、非胚体内胚葉細胞型または細胞集団より3桁以上多い量のSOX17および/またはCXCR4遺伝子を発現する。さらに別の実施形態において、作製される胚体内胚葉細胞または細胞集団は、非胚体内胚葉細胞型または細胞集団より、約2桁あるいは3桁以上多い量のSOX17、CXCR4、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択される一以上のマーカーを発現する。
本発明の更なる態様は、胚体内胚葉と、胚体内胚葉細胞で濃縮された細胞集団とを含む細胞培養物に関する。そのため、ある実施形態は、胚体内胚葉細胞を含む細胞培養物に関するものであり、培養物中、前記細胞の少なくとも約50〜80%が、胚体内胚葉細胞である。好適な一実施形態は、ヒト細胞を含む細胞培養物に関するものであり、培養物中、ヒト細胞の少なくとも約50〜80%が、胚体内胚葉細胞である。分化方法の効率は、一定のパラメーターを変更することにより調整できるため、本明細書に記載した分化方法では、多能性細胞の胚体内胚葉への転換は、約5%、約10%、約15%、約20%、約25%、約30%、約35%、約40%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約85%、約90%、約95%、または約95%以上でありうる。前記一定のパラメーターとしては、細胞増殖条件、増殖因子濃度および培養段階のタイミングが挙げられるが、これらに限定されるものではない。本発明の別の実施形態においては、幹細胞集団などの多能性細胞集団の、実質的に純粋な胚体内胚葉細胞集団への転換を検討する。
本明細書に記載している組成物および方法には、いくつかの有用な特性がある。例えば、胚体内胚葉を含む細胞培養物および細胞集団、並びにそのような細胞培養物および細胞集団を作製する方法は、ヒト発生の初期段階をモデル化する上で有用である。さらに、本明細書に記載の組成物と方法は、糖尿病などの病状における治療行為にも役立つ。例えば、胚体内胚葉は、限られた数の組織のみの源となるため、純粋な組織または細胞型の発生に使用することができる。
【0008】
多能性細胞からの胚体内胚葉の作製
本明細書に記載されている胚体内胚葉細胞培養物および胚体内胚葉細胞を含む組成物は、胚性幹細胞などの多能性細胞から作製される。本明細書で使用している、「胚性、胚の(embryonic)」とは、単一の接合体に始まり、発達した配偶子細胞以外の多能性または全能性細胞をもはや含まない多細胞性構造体に終わる、生物体の一連の発生段階を指す。配偶子融合により誘導された胚に加え、用語「胚性、胚の(embryonic)」は、体細胞核移植により誘導された胚も指す。胚体内胚葉細胞を誘導する好ましい方法では、胚体内胚葉作製のための出発物質として、ヒト胚性幹細胞(hESC)を利用する。この方法で使用される胚性幹細胞は、桑実胚、胚の内部細胞塊または胚の生殖隆起から得られたものに由来する細胞であってもよい。ヒト幹細胞は、当技術分野において周知の方法を用いて、実質的に分化することなく多能性の状態で培養物中に維持できる。そのような方法は、例えば、米国特許第5,453,357号明細書、第5,670,372号明細書、第5,690,926号明細書、第5,843,780号明細書、第6,200,806号明細書および第6,251,671号明細書に記載されており、これらの全開示内容は、引用することにより本明細書の一部とされる。
本明細書に記載されている方法のいくつかの実施形態において、hESCは、支持細胞層
で維持される。そのような実施形態においては、hESCを多能性の状態で維持できるいかなる支持細胞層も、本明細書に記載されている方法において使用することができる。ヒト胚性幹細胞の培養に一般に使用される一支持細胞層は、マウス線維芽細胞の層である。さらに最近では、ヒト線維芽細胞の支持細胞層が、hESCの培養に使用するために開発されている(米国特許出願第2002/0072117号明細書参照。この全開示内容は、引用することにより本明細書の一部とされる)。本明細書に記載されている方法の別の実施形態は、支持細胞層を使用することなく、多能性hESCの維持を可能にする。そのような方法は、米国特許出願第2003/0175956号明細書に記載されており、その全開示内容は、引用することにより本明細書の一部とされる。
ここで使用されるヒト胚性幹細胞は、血清の有無にかかわらず培養物中に維持することができる。いくつかの実施形態においては、血清代替物が使用される。別の実施形態においては、米国特許出願第2003/0190748号明細書に記載されているような、無血清培養技術が使用される。この特許出願の全開示内容は、引用することにより本明細書の一部とされる。
幹細胞は、胚体内胚葉への分化が望まれるまで、定期的な継代培養によって、培養物中、多能性の状態で維持される。いくつかの実施形態においては、胚体内胚葉への分化を促進するのに十分な量のTGFβスーパーファミリーの増殖因子を幹細胞培養物に提供することにより、胚体内胚葉に分化させる。胚体内胚葉の作製に有用なTGFβスーパーファミリーの増殖因子は、ノーダル/アクチビンまたはBMPサブグループから選択される。本明細書に記載されている分化方法に係るいくつかの実施形態において、増殖因子は、ノーダル、アクチビンA、アクチビンBおよびBMP4からなる群から選択される。さらに、増殖因子Wnt3aおよび他のWntファミリーメンバーは、胚体内胚葉細胞の作製に有用である。本発明のある実施形態においては、上記増殖因子はいかなる組み合わせでも使用できる。
本明細書に記載されている分化方法の実施形態のいくつかに関して、上記増殖因子は、幹細胞の少なくとも一部の、胚体内胚葉への分化を促進するのに十分な濃度で培養物中に存在するよう、細胞に提供される。本発明のいくつかの実施形態において、上記増殖因子は、少なくとも約5ng/ml、少なくとも約10ng/ml、少なくとも約25ng/ml、少なくとも約50ng/ml、少なくとも約75ng/ml、少なくとも約100ng/ml、少なくとも約200ng/ml、少なくとも約300ng/ml、少なくとも約400ng/ml、少なくとも約500ng/ml、少なくとも約1000ng/ml、少なくとも約2000ng/ml、少なくとも約3000ng/ml、少なくとも約4000ng/ml、少なくとも約5000ng/mlまたは約5000ng/ml以上の濃度で細胞培養物中に存在する。
本発明のある実施形態において、上記増殖因子は、添加後、細胞培養物から除去する。例えば、増殖因子は、添加後、約1日以内、約2日以内、約3日以内、約4日以内、約5日以内、約6日以内、約7日以内、約8日以内、約9日以内又は10日以内に除去してもよい。好適な実施形態において、増殖因子は、添加の約4日後に除去する。
胚体内胚葉細胞の培養物は、少量の血清を含むか、あるいは、血清を含まない培地で増殖させることができる。本発明のある実施形態において、血清濃度は、約0.05%v/v〜約20%v/vの範囲であればよい。例えば、ある実施形態において、培地の血清濃度は、約0.05%(v/v)未満、約0.1%(v/v)未満、約0.2%(v/v)未満、約0.3%(v/v)未満、約0.4%(v/v)未満、約0.5%(v/v)未満、約0.6%(v/v)未満、約0.7%(v/v)未満、約0.8%(v/v)未満、約0.9%(v/v)未満、約1%(v/v)未満、約2%(v/v)未満、約3%(v/v)未満、約4%(v/v)未満、約5%(v/v)未満、約6%(v/v)未満、約7%(v/v)未満、約8%(v/v)未満、約9%(v/v)未満、約10%(v/v)未満、約15%(v/v)未満または約20%(v/v)未満であってもよい。いくつかの実施形態において、胚体内胚葉細胞は、血清なしで増殖させる。他の実施形態においては、胚体内胚葉細胞は、血清代替物を用いて増殖させる。さらに別の実施形態において
、胚体内胚葉細胞は、B27の存在下で増殖させる。そのような実施形態において、B27サプリメントの濃度は、約0.2%v/v〜約20%v/vの範囲であればよい。
hESC培養物の胚体内胚葉への進行は、胚体内胚葉に特有のマーカーの発現を測定することによりモニターすることができる。いくつかの実施形態において、あるマーカーの発現は、マーカーの有無を検出することにより測定される。また、あるマーカーの発現は、細胞培養物または細胞集団の細胞内におけるマーカーの存在量を測ることにより測定される。そのような実施形態において、マーカーの発現測定は、定性的測定であっても定量的測定であってもよい。マーカー遺伝子により作製される発現マーカーを定量化する一方法は、定量PCR(Q−PCR)を利用したものである。Q−PCRを行う方法は、当技術分野においては周知である。また、当技術分野において周知となっている他の方法も、マーカー遺伝子発現の定量化に使用できる。例えば、マーカー遺伝子産物の発現は、目的のマーカー遺伝子産物に特異な抗体を使用することにより検出することができる。本発明のいくつかの実施形態において、胚体内胚葉に特有のマーカー遺伝子の発現のほかに、hESCや他の細胞型に特有のマーカー遺伝子の著しい発現の欠如も測定される。
以下の実施例においてさらに説明するように、胚体内胚葉の信頼できるマーカーは、SOX17遺伝子である。そのため、本明細書に記載されている方法により作製される胚体内胚葉細胞は、SOX17マーカー遺伝子を発現することにより、SOX17遺伝子産物を産生する。胚体内胚葉の他のマーカーは、MIXL1、GATA4、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1である。本発明のいくつかの実施形態において、胚体内胚葉細胞は、原始および臓側内胚葉に特有のSOX7マーカー遺伝子(表1参照)より高いレベルでSOX17マーカー遺伝子を発現する。さらに、いくつかの実施形態においては、SOX17マーカー遺伝子の発現が、hESCに特有のOCT4マーカー遺伝子の発現より多い。本発明の他の実施形態において、胚体内胚葉細胞は、AFP、SPARCまたはトロンボモジュリン(TM)マーカー遺伝子より高いレベルでSOX17マーカー遺伝子を発現する。本発明のある実施形態において、本明細書に記載されている方法により作製されるSOX17発現胚体内胚葉細胞は、有意水準または量のPDX1を発現しない(PDX1陰性)。
胚体内胚葉の別のマーカーは、CXCR4遺伝子である。CXCR4遺伝子は、リガンドが化学誘引物質SDF−1である細胞表面ケモカイン受容体をエンコードする。成体における、CXCR4受容体を有する細胞の主な役割は、造血細胞の骨髄への移動、リンパ球輸送および様々なB細胞とマクロファージ血液細胞系列の分化であると考えられている[Kim,C.およびBroxmeyer,H.J.Leukocyte Biol.65、6−15(1999)]。また、CXCR4受容体は、HIV−1のT細胞侵入のための共同受容体としても機能する[Feng,Y.et al.Science、272、872−877(1996)]。[McGrath,K.E.et al.Dev.Biology 213、442−456(1999)]により行われた広範囲に及ぶ一連の研究では、ケモカイン受容体CXCR4とその特異なリガンド、SDF−1[Kim,C.,およびBroxmyer,H.,J.Leukocyte Biol.65、6−15(1999)]の発現は、マウスの初期発生および成人期において描写された。いずれかの遺伝子が、遺伝子導入マウス内で分裂した場合に、後期胚の致死を引き起こすことが実証されたとき[Nagasawa et al.Nature、382、635−638(1996)]、Ma,Q.,et al Immunity、10、463−471(1999)]、発生過程におけるCXCR4/SDF1の相互作用が明らかになった。McGrath et al.は、RNase保護とインサイツハイブリッド形成方法論を組合せて使用し、CXCR4が、初期原腸陥入胚(E7.5)の間に検出される最も大量のケモカイン受容体メッセンジャーRNAであることを実証した。原腸陥入胚では、CXCR4/SDF−1シグナル伝達は、原条胚葉細胞の移動を誘導することに主に関与しているようであり、このとき存在する胚体内胚葉、中胚葉および胚外中胚葉で見られる。E7.2〜7.8のマウス胚において、CXCR4とアルファフェトプロテインは互いに排他的であり、臓側内胚葉において発現しないことを示している[McGrath,K.E.e
t al.Dev.Biology 213、442−456(1999)]。
本発明のいくつかの実施形態において、本明細書に記載されている方法により作製される胚体内胚葉細胞は、CXCR4マーカー遺伝子を発現する。他の実施形態において、本明細書に記載されている方法により作製される胚体内胚葉細胞は、CXCR4マーカー遺伝子および胚体内胚葉の他のマーカーを発現する。他のマーカーとしては、SOX17、MIXL1、GATA4、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1が挙げられるが、これらに限定されるものではない。本発明のいくつかの実施形態において、胚体内胚葉細胞は、SOX7マーカー遺伝子より高いレベルでCXCR4マーカー遺伝子を発現する。さらに、いくつかの実施形態においては、CXCR4マーカー遺伝子の発現が、OCT4マーカー遺伝子の発現より多い。本発明の他の実施形態において、胚体内胚葉細胞は、AFP、SPARCまたはトロンボモジュリン(TM)マーカー遺伝子より高いレベルでCXCR4マーカー遺伝子を発現する。本発明のある実施形態において、本明細書に記載されている方法により作製される、CXCR4を発現する胚体内胚葉細胞は、有意水準または量のPDX1を発現しない(PDX1陰性)。
当然のことながら、内胚葉細胞におけるCXCR4の発現が、SOX17の発現を妨げることはない。従って、本発明のいくつかの実施形態において、胚体内胚葉細胞は、SOX17およびCXCR4マーカー遺伝子のいずれも、SOX7マーカー遺伝子より高いレベルで発現するものである。さらに、いくつかの実施形態においては、SOX17およびCXCR4マーカー遺伝子の両方の発現が、OCT4マーカー遺伝子の発現より多い。本発明の他の実施形態において、胚体内胚葉細胞は、SOX17およびCXCR4マーカー遺伝子のいずれも、AFP、SPARCまたはトロンボモジュリン(TM)マーカー遺伝子より高いレベルで発現する。本発明のある実施形態において、本明細書に記載されている方法により作製される、SOX17/CXCR4を発現する胚体内胚葉細胞は、有意水準または量のPDX1を発現しない(PDX1陰性)。
当然のことながら、SOX17および/またはCXCR4マーカーの発現は、分化条件により、胚体内胚葉細胞内において様々なレベルで誘導される。そのため、本発明のいくつかの実施形態において、胚体内胚葉細胞または細胞集団におけるSOX17マーカーおよび/またはCXCR4マーカーの発現は、非胚体内胚葉細胞または細胞集団、例えば、多能性幹細胞におけるSOX17マーカーおよび/またはCXCR4マーカーの発現より少なくとも約2倍から少なくとも約1万倍多い。本発明の他の実施形態において、胚体内胚葉細胞または細胞集団におけるSOX17マーカーおよび/またはCXCR4マーカーの発現は、非胚体内胚葉細胞または細胞集団、例えば、多能性幹細胞におけるSOX17マーカーおよび/またはCXCR4マーカーの発現より、少なくとも約4倍、少なくとも約6倍、少なくとも約8倍、少なくとも約10倍、少なくとも約15倍、少なくとも約20倍、少なくとも約40倍、少なくとも約80倍、少なくとも約100倍、少なくとも約150倍、少なくとも約200倍、少なくとも約500倍、少なくとも約750倍、少なくとも約1000倍、少なくとも約2500倍、少なくとも約5000倍、少なくとも約7500倍、または少なくとも約10,000倍多い。いくつかの実施形態において、胚体内胚葉細胞または細胞集団におけるSOX17マーカーおよび/またはCXCR4マーカーの発現は、非胚体内胚葉細胞または細胞集団、例えば、多能性幹細胞におけるSOX17マーカーおよび/またはCXCR4マーカーの発現よりはるかに多い。
当然のことながら、本発明のいくつかの実施形態において、胚体内胚葉細胞または細胞集団におけるGATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーの発現は、非胚体内胚葉細胞または細胞集団におけるGATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1の発現に比べ増加する。
また、当然のことながら、胚体内胚葉細胞における、SOX17マーカーの発現量と、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現量との間には
、広範な差がある。同様に、胚体内胚葉細胞における、CXCR4マーカーの発現量と、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現量との間には、広範な差異が存在する。そのため、本発明のいくつかの実施形態において、SOX17マーカーまたはCXCR4マーカーの発現は、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より、少なくとも約2倍から少なくとも約1万倍多い。本発明の他の実施形態において、SOX17マーカーまたはCXCR4マーカーの発現は、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より、少なくとも約4倍、少なくとも約6倍、少なくとも約8倍、少なくとも約10倍、少なくとも約15倍、少なくとも約20倍、少なくとも約40倍、少なくとも約80倍、少なくとも約100倍、少なくとも約150倍、少なくとも約200倍、少なくとも約500倍、少なくとも約750倍、少なくとも約1000倍、少なくとも約2500倍、少なくとも約5000倍、少なくとも約7500倍または少なくとも約10000倍多い。いくつかの実施形態においては、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーが、胚体内胚葉細胞において著しく発現することはない。
当然のことながら、本発明のいくつかの実施形態において、胚体内胚葉細胞におけるGATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーの発現は、胚体内胚葉細胞におけるOCT4、SPARC、AFP、TMおよび/またはSOX7の発現に比べ増加する。
【0009】
胚体内胚葉を含む組成物
本発明のいくつかの態様は、幹細胞などの多能性細胞と胚体内胚葉細胞のいずれをも含む細胞集団および細胞培養物などの組成物に関する。例えば、本明細書に記載されている方法を用いて、hESCおよび胚体内胚葉細胞の混合物を含む組成物を作製することができる。いくつかの実施形態においては、多能性細胞約95個につき、少なくとも約5個の胚体内胚葉細胞を含む組成物が作製される。他の実施形態においては、多能性細胞約5個につき、少なくとも約95個の胚体内胚葉細胞を含む組成物が作製される。さらに、多能性細胞に対する胚体内胚葉細胞の比率がその他の比率である組成物が検討される。例えば、多能性細胞約100万個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約10万個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約1万個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約1000個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約500個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約100個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約10個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約5個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約2個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約2個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約5個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約10個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約20個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約50個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約100個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約1000個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約1万個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約10万個の胚体内胚葉細胞、および多能性細胞約1個につき、少なくとも約100万個の胚体内胚葉細胞を含む組成物が検討される。本発明のいくつかの実施形態において、多能性細胞は、ヒト多能性幹細胞である。ある実施形態において、幹細胞は、桑実胚、胚の内部細胞塊または胚の生殖隆起に由来する。他のある実施形態において、多能性細胞は、胚形成期を過ぎて発達した多細胞性構造体の生殖腺または生殖組織に由来する。
本発明のいくつかの態様は、少なくとも約5%から少なくとも約95%の胚体内胚葉細胞を含む細胞培養物または細胞集団に関する。いくつかの実施形態において、細胞培養物または細胞集団は、哺乳類細胞を含む。好適な実施形態において、細胞培養物または細胞集
団は、ヒト細胞を含む。例えば、ある特定の実施形態は、ヒト細胞を含む細胞培養物に関し、このヒト細胞の少なくとも約5%から少なくとも約95%が、胚体内胚葉細胞である。本発明の他の実施形態は、ヒト細胞を含む細胞培養物に関し、このヒト細胞の少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%または90%より多くが、胚体内胚葉細胞である。
本発明の更なる実施形態は、ヒト胚体内胚葉細胞などのヒト細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、SOX17またはCXCR4マーカーのいずれかの発現が、ヒト細胞の少なくとも約5%において、OCT4、SPARC、アルファフェトプロテイン(AFP)、トロンボモジュリン(TM)および/またはSOX7マーカーの発現より多い。他の実施形態においては、SOX17またはCXCR4マーカーのいずれかの発現が、ヒト細胞の少なくとも約10%において、ヒト細胞の少なくとも約15%において、ヒト細胞の少なくとも約20%において、ヒト細胞の少なくとも約25%において、ヒト細胞の少なくとも約30%において、ヒト細胞の少なくとも約35%において、ヒト細胞の少なくとも約40%において、ヒト細胞の少なくとも約45%において、ヒト細胞の少なくとも約50%において、ヒト細胞の少なくとも約55%において、ヒト細胞の少なくとも約60%において、ヒト細胞の少なくとも約65%において、ヒト細胞の少なくとも約70%において、ヒト細胞の少なくとも約75%において、ヒト細胞の少なくとも約80%において、ヒト細胞の少なくとも約85%において、ヒト細胞の少なくとも約90%において、ヒト細胞の少なくとも約95%においてまたは95%を超えるヒト細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
当然のことながら、本発明のいくつかの実施形態は、ヒト胚体内胚葉細胞などのヒト細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、GATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択される一以上のマーカーの発現は、ヒト細胞の少なくとも約5%から少なくとも約95%を超えるヒト細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
本発明のさらに別の実施形態は、ヒト胚体内胚葉細胞などのヒト細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、SOX17とCXCR4マーカーの両方の発現が、ヒト細胞の少なくとも約5%において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。他の実施形態においては、SOX17とCXCR4マーカーの両方の発現が、ヒト細胞の少なくとも約10%において、ヒト細胞の少なくとも約15%において、ヒト細胞の少なくとも約20%において、ヒト細胞の少なくとも約25%において、ヒト細胞の少なくとも約30%において、ヒト細胞の少なくとも約35%において、ヒト細胞の少なくとも約40%において、ヒト細胞の少なくとも約45%において、ヒト細胞の少なくとも約50%において、ヒト細胞の少なくとも約55%において、ヒト細胞の少なくとも約60%において、ヒト細胞の少なくとも約65%において、ヒト細胞の少なくとも約70%において、ヒト細胞の少なくとも約75%において、ヒト細胞の少なくとも約80%において、ヒト細胞の少なくとも約85%において、ヒト細胞の少なくとも約90%において、ヒト細胞の少なくとも約95%においてまたは95%を超えるヒト細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
当然のことながら、本発明のいくつかの実施形態は、ヒト胚体内胚葉細胞などのヒト細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、GATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1マーカーの発現は、ヒト細胞の少なくとも約5%から少なくとも約95%を超えるヒト細胞において、OCT4、SPARC、AFP、TMおよび/またはS
OX7マーカーの発現より多い。
本発明の更なる実施形態は、ヒト内胚葉細胞などの哺乳類内胚葉細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、SOX17またはCXCR4マーカーいずれかの発現は、内胚葉細胞の少なくとも約5%において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。他の実施形態において、SOX17またはCXCR4マーカーいずれかの発現は、内胚葉細胞の少なくとも約10%において、内胚葉細胞の少なくとも約15%において、内胚葉細胞の少なくとも約20%において、内胚葉細胞の少なくとも約25%において、内胚葉細胞の少なくとも約30%において、内胚葉細胞の少なくとも約35%において、内胚葉細胞の少なくとも約40%において、内胚葉細胞の少なくとも約45%において、内胚葉細胞の少なくとも約50%において、内胚葉細胞の少なくとも約55%において、内胚葉細胞の少なくとも約60%において、内胚葉細胞の少なくとも約65%において、内胚葉細胞の少なくとも約70%において、内胚葉細胞の少なくとも約75%において、内胚葉細胞の少なくとも約80%において、内胚葉細胞の少なくとも約85%において、内胚葉細胞の少なくとも約90%において、内胚葉細胞の少なくとも約95%において、または95%を超える内胚葉細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
当然のことながら、本発明のいくつかの実施形態は、哺乳類内胚葉細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、GATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択される一以上のマーカーの発現が、内胚葉細胞の少なくとも約5%から少なくとも約95%を超える内胚葉細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
本発明のさらに他の実施形態は、ヒト内胚葉細胞などの哺乳類内胚葉細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、SOX17とCXCR4マーカーの両方の発現が、内胚葉細胞の少なくとも約5%において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。他の実施形態においては、SOX17とCXCR4マーカーの両方の発現が、内胚葉細胞の少なくとも約10%において、内胚葉細胞の少なくとも約15%において、内胚葉細胞の少なくとも約20%において、内胚葉細胞の少なくとも約25%において、内胚葉細胞の少なくとも約30%において、内胚葉細胞の少なくとも約35%において、内胚葉細胞の少なくとも約40%において、内胚葉細胞の少なくとも約45%において、内胚葉細胞の少なくとも約50%において、内胚葉細胞の少なくとも約55%において、内胚葉細胞の少なくとも約60%において、内胚葉細胞の少なくとも約65%において、内胚葉細胞の少なくとも約70%において、内胚葉細胞の少なくとも約75%において、内胚葉細胞の少なくとも約80%において、内胚葉細胞の少なくとも約85%において、内胚葉細胞の少なくとも約90%において、内胚葉細胞の少なくとも約95%、または95%を越える内胚葉細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
当然のことであるが、本発明のいくつかの実施形態は、哺乳類内胚葉細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、GATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1マーカーの発現は、内胚葉細胞の少なくとも約5%から少なくとも約95%を超える内胚葉細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
本明細書に記載されている方法を用いて、胚体内胚葉細胞を含み、実質的に他の細胞型を含まない組成物を作製することができる。細胞培養物または細胞集団内の細胞に関して、「実質的に含まない」という表現は、細胞培養物または細胞集団が含まない特定の細胞型が、細胞培養物または細胞集団に存在する細胞総数の約5%未満の量で存在することを意味する。本発明のいくつかの実施形態において、本明細書に記載されている方法により作製される胚体内胚葉細胞集団または細胞培養物は、OCT4、SOX7、AFP、SPA
RC、TM、ZIC1またはBRACHマーカー遺伝子を著しく発現する細胞を実質的に含まない。
本発明の一実施形態において、マーカー遺伝子の発現に基づいて胚体内胚葉細胞を表した場合、SOX17高、MIXL1高、AFP低、SPARC低、トロンボモジュリン低、SOX7低、CXCR4高となる。
【0010】
胚体内胚葉の濃縮、分離および/または精製
本発明のさらなる態様に関して、胚体内胚葉細胞は、そのような細胞に特異な親和性標識を使用することにより、濃縮、分離および/または精製することができる。胚体内胚葉細胞に特異な親和性標識の例としては、胚体内胚葉細胞の細胞表面には存在するが、本明細書に記載されている方法により作製される細胞培養物において見られる他の細胞型には実質的に存在しないポリペプチドなどのマーカー分子に特異的な抗体、リガンドまたは他の結合剤が挙げられる。いくつかの実施形態においては、CXCR4に結合する抗体が、胚体内胚葉細胞の濃縮、分離または精製のための親和性標識として使用される。また、他の実施形態においては、ケモカインSDF−1または他のSDF−1系分子も、親和性標識として使用することができる。そのような分子としては、SDF−1断片、SDF−1融合物、またはSDF−1模倣物が挙げられるが、これらに限定されるものではない。
抗体を作製する方法、およびそれらを細胞分離に使用する方法は、当技術分野において周知であり、そのような方法は、本明細書に記載されている細胞や抗体を用いて実施することができる。一実施形態において、CXCR4に結合する抗体は、電磁ビーズに付着させた後、細胞間および基質接着性を低下させるよう酵素的に処理した細胞培養物中の胚体内胚葉細胞に結合させる。そして、細胞/抗体/ビーズ複合体を、ビーズ結合胚体内胚葉細胞を非結合細胞から分離するために使用する変動磁界に曝す。一旦、胚体内胚葉細胞を培養物中の他の細胞から物理的に分離すると、抗体結合を破壊し、その細胞を適切な組織培養培地に再度蒔き培養する。
本発明の実施形態において、濃縮、分離または精製された胚体内胚葉細胞培養物または集団を得る更なる方法を検討する。例えば、いくつかの実施形態において、CXCR4抗体は、細胞間および基質接着性を低下させるよう処理された胚体内胚葉含有細胞培養物と共に培養される。その後、細胞を洗浄し、遠心分離し、再懸濁させる。そして、細胞懸濁液を、一次抗体に結合し得るFITC標識抗体などの二次抗体と共に培養する。その後、その細胞を洗浄し、遠心分離し、緩衝液中に再懸濁させる。そして、細胞懸濁液を、蛍光活性化細胞選別装置(FACS)を用いて分析選別する。CXCR4陽性細胞を、CXCR4陰性細胞とは別に回収することにより、そのような細胞型を分離することができる。必要に応じて、分離された細胞組成物は、親和性を利用した別の方法を利用するか、あるいは胚体内胚葉に特異的な、同じまたは別のマーカーを用いてさらに一連の選別を行なうことにより、さらに精製することができる。
本発明の他の実施形態において、胚体内胚葉は、CXCR4に結合するリガンドまたは他の分子を用いて、濃縮、分離および/または精製される。いくつかの実施例において、その分子は、SDF−1、或いはその断片、融合物または模倣物である。
好適な実施形態において、胚体内胚葉細胞は、幹細胞培養物が、胚体内胚葉系列に沿って分化するよう誘導された後、濃縮され、他の非胚体内胚葉細胞から分離および/または精製される。当然のことながら、上記濃縮、分離および精製方法は、分化のどの段階においても、上記のような培養物と共に採用することができる。
また、上述の方法に加え、胚体内胚葉細胞は、細胞を分離する他の技術により分離してもよい。さらに、胚体内胚葉細胞は、前記胚体内胚葉細胞の選択的生存または選択的増殖を促進する増殖条件で、連続継代培養法により濃縮または分離してもよい。
本明細書に記載されている方法を用いて、濃縮、分離および/または精製された組織および/または胚体内胚葉細胞の集団は、少なくともいくらか分化した、幹細胞培養物または集団などの多能性細胞培養物または細胞集団から生体外で作製することができる。いくつかの実施形態において、細胞は、ランダムに分化する。しかしながら、好適な実施形態に
おいて、細胞は、主として胚体内胚葉に分化するように誘導される。いくつかの好適な濃縮、分離および/または精製方法は、ヒト胚性幹細胞からの胚体内胚葉の生体外での作製に関する。本明細書に記載されている方法を用いて、細胞集団または細胞培養物の胚体内胚葉含有量を、未処理の細胞集団または細胞培養物と比較して、少なくとも約2倍から約1000倍に濃縮することができる。いくつかの実施形態において、胚体内胚葉細胞は、未処理の細胞集団または細胞培養物と比較して、少なくとも約5倍から約500倍に濃縮することができる。他の実施形態において、胚体内胚葉細胞は、未処理の細胞集団または細胞培養物と比較して、少なくとも約10倍から約200倍まで濃縮することができる。さらに他の実施形態において、胚体内胚葉細胞は、未処理の細胞集団または細胞培養物と比較して、少なくとも約20倍から約100倍まで濃縮することができる。さらに他の実施形態において、胚体内胚葉細胞は、未処理の細胞集団または細胞培養物と比較して、少なくとも約40倍から約80倍まで濃縮することができる。ある実施形態において、胚体内胚葉細胞は、未処理の細胞集団または細胞培養物と比較して、少なくとも約2倍から約20倍まで濃縮することができる。
本発明について、一般的に説明してきたが、ある特定の実施例を参照することにより一層理解を深めることができる。それら実施例は、あくまでも説明のみを目的としてここに挙げられており、何ら限定することを意図するものではない。
【実施例】
【0011】
以下の実施例の多くは、多能性ヒト細胞の使用について説明している。多能性ヒト細胞の作製方法は、当技術分野において周知であり、米国特許第5,453,357号明細書、第5,670,372号明細書、第5,690,926号明細書、第6,090,622号明細書、第6,200,806号明細書および第6,251,671号明細書、並びに米国特許出願公開第2004/0229350号明細書を含む多数の科学出版物に記載されており、これらの全開示内容は、引用することにより本明細書の一部とされる。
【0012】
実施例1
ヒトES細胞
内胚葉発生に関して研究するため、正常な核型を維持しながら、培養物中、一見無制限に分裂可能な、多能性のヒト胚性幹細胞を用いた。ES細胞は、分離に際し免疫学的または機械的方法のいずれかを使用し、5日目の胚の内部細胞塊から得た。具体的には、患者によるインフォームド・コンセントを得た後、体外受精サイクルの余剰の凍結受精卵から、ヒト胚性幹細胞株hESCyt−25を得た。解凍すると同時に、孵化した胚盤胞は、ES培地(DMEM、20%FBS、非必須アミノ酸、β−メルカプトエタノール、ITSサプリメント)において、マウスの胚線維芽細胞(MEF)上に蒔き培養した。胚は培養皿に付着し、約2週間後、未分化hESCの領域を、MEFを入れた新しい皿に移植した。移植は、機械的に切離し、ディスパーゼを用いて短時間分解し、引き続き細胞クラスターを機械的に除去し、洗浄し、そして再度蒔くことにより行なった。誘導以後、hESCyt−25は、100回に渡り連続継代した。胚体内胚葉を作製するための出発物質としてhESCyt−25ヒト胚性幹細胞株を用いた。
当技術分野における当業者にとっては当然のことであるが、幹細胞または他の多能性細胞も、本明細書に記載されている分化方法のための出発物質として使用することができる。例えば、当技術分野において周知の方法により分離することのできる、胚の生殖隆起から得られる細胞を、多能性細胞出発物質として使用することができる。
【0013】
実施例2
hESCyt−25特性
ヒト胚性幹細胞株のhESCyt−25は、培養物中において、18カ月に渡り正常な形態、核型、増殖、および自己複製特性を維持した。この細胞株は、OCT4、SSEA−4およびTRA−1−60抗原に対し強い免疫反応を示し、それら全抗原は、未分化hE
SCに特有なものであり、また、他の樹立したhESC株と同一の形態およびアルカリホスファターゼ活性を示す。さらに、ヒト幹細胞株hESCyt−25はまた、懸濁培養をした場合、容易に胚様体(EB)を形成する。多能性を実証するがごとく、hESCyT−25は、3つの主要な胚葉に対応する様々な細胞型に分化する。外胚葉の産生は、ZIC1に関してはQ−PCRにより、またネスチンおよびさらに成熟したニューロンマーカーに関しては免疫細胞化学(ICC)により立証した。β−IIIチューブリンの免疫細胞化学的染色が、初期ニューロンの特徴である細長い細胞のクラスターにおいて観察された。先に、レチノイン酸を用いてEBを懸濁処理し、多能性幹細胞の、胚外系列の臓側内胚葉(VE)への分化を誘導した。処理した細胞は、54時間の処理によりVEの二つのマーカーである、アルファフェトプロテイン(AFP)およびSOX7を高いレベルで発現した。単層で分化した細胞は、免疫細胞化学的染色により示されるように、弧発的な斑状にAFPを発現した。また、下記に説明するように、hESCyT−25細胞株は、AFPが発現することなく、SOX17に対するリアルタイムの定量ポリメラーゼ連鎖反応(Q−PCR)と免疫細胞化学により確認されるように、胚体内胚葉を形成することもできた。中胚葉への分化を立証するために、いくつかの時点で、Brachyury遺伝子の発現に関し、分化EBを分析した。Brachyuryの発現は、実験の間、漸次増加した。上記の点から、hESCyT−25株は、三つの胚葉に対応する細胞を形成する能力により示されるように、多能性を有する。
【0014】
実施例3
SOX17抗体の作製
hESC培養物において胚体内胚葉を同定する上での主要な障害は、適切な手段がないことである。そこで、ヒトSOX17タンパク質に対して産生される抗体の作製を行なった。
マーカーSOX17は、原腸形成の間に形成されるにつれ、胚体内胚葉全体において発現し、その発現は、器官形成が開始される頃まで、(発現量は、A−P軸に沿って異なるが)腸管内で維持される。また、SOX17は、胚外内胚葉細胞のサブセットにおいても発現する。中胚葉または外胚葉では、このタンパク質の発現は観察されていない。現在、SOX17は、胚外系列を除外するためにマーカーと併用した場合、胚体内胚葉系列に対する適切なマーカーであることが分かっている。
ここに詳細に説明するように、SOX17抗体は、SOX17陽性胚体内胚葉細胞の作製を目的とした、各種処理と分化方法の効果を具体的に調べるのに利用した。また、AFP、SPARCおよびトロンボモジュリンに反応する他の抗体も、臓側および壁側内胚葉(胚外内胚葉)の産生を除外するために使用した。
SOX17に対する抗体を作製するため、SOX17タンパク質(図2)のC末端のアミノ酸172−414(配列番号:2)に対応するヒトのSOX17cDNA(配列番号:1)の一部を、抗体製造会社、GENOVAC社(フライベルク、ドイツ)において、そこで開発された方法により、ラットの遺伝子による免疫化に用いた。遺伝子による免疫化方法は、米国特許第5,830,876号明細書、第5,817,637号明細書、第6,165,993号明細書および第6,261,281号明細書、並びに国際公開第WO00/29442号および第WO99/13915号に見られ、これらの全開示内容は、引用することにより本明細書の一部とされる。
また、遺伝子による免疫化のための他の適切な方法は、非特許文献にも記載されている。例えば、Barry et al.は、Biotechniques16:616−620、1994に、遺伝子免疫化によるモノクローナル抗体の作製(the production of monoclonal antibodies by genetic immunization)について記載しており、その全開示内容は、引用することにより本明細書の一部とされる。特定のタンパク質に対して抗体を産生する遺伝子免疫法の具体的な例は、例えば、Costaglia et al.、(1998)Genetic immunization against the human thyrotropin r
eceptor causes thyroiditis and allows production of monoclonal antibodies recognizing the native receptor、J.Immunol.160:1458−1465;Kilpatrick et al(1998)Gene gun delivered DNA−based immunizations mediate rapid production of murine monoclonal antibodies
to the Flt−3 receptor、Hybridoma 17:569−576;Schmolke et al.、(1998)Identification of hepatitis G virus particles in human serum by E2−specific monoclonal antibodies generated by DNA immunization、J.Virol.72:4541−4545;Krasemann et al.、(1999)Generation of monoclonal antibodies against proteins with an unconventional nucleic acid−based immunization strategy、J.Biotechnol.73:119−129;およびUlivieri et al.、(1996)Generation of a monoclonal antibody to a defined portion of the Heliobacter pylori vacuolating cytotoxin by DNA immunization、J.Biotechnol.51:191−194に見られ、これらの全開示内容は、引用することにより本明細書の一部とされる。
SOX7およびSOX18は、図3に示す関係系統樹に描かれているように、SOX17に対し最も近いSoxファミリーである。SOX17抗体が、SOX17に特異的であり、尚且つ、その最も近いファミリーメンバーと反応しないことを立証するために、陰性対照として、ヒトのSOX7ポリペプチドを使用した。具体的には、遺伝子免疫化により作製された抗体が、SOX17に特異的であることを立証するために、SOX7および他のタンパク質を、ヒト線維芽細胞において発現させた後、ウェスタンブロットおよびICCによりSOX17抗体との交差反応を分析した。SOX17、SOX7およびEGFP発現ベクターの作製、それらのヒト線維芽細胞への形質移入、およびウェスタンブロットによる分析には、例えば、以下の方法を用いた。SOX17、SOX7およびEGFPの作製に使われた発現ベクターは、それぞれpCMV6(OriGene Technologies Inc.、ロックヴィル、メリーランド州)、pCMV−SPORT6(Invitrogen社、カールズバッド、カリフォルニア州)およびpEGFP−N1(Clonetech社、パロアルト、カリフォルニア州)であった。タンパク質の製造には、テロメラーゼ不死化MDXヒト線維芽細胞を、リポフェクタミン2000(Invitrogen社、カールズバッド、カリフォルニア州)の存在下で、スーパーコイルDNAに一過性に形質移入した。形質移入後36時間で、プロテアーゼ阻害剤カクテル(Roche Diagnostics Corporation、インディアナポリス、インディアナ州)を含む、50mMのTRIS−HCl(pH8)、150mMのNaCl、0.1%のSDS、0.5%のデオキシコール酸塩において、全細胞溶解物を回収した。NuPAGE(4〜12%の勾配ポリアクリルアミド、Invitrogen社、カールズバッド、カリフォルニア州)を用いてSDS−PAGEにより分離し、エレクトロブロッティングによりPDVF膜(Hercules社、カリフォルニア州)に移植した細胞タンパク質100μgのウェスタンブロット分析では、10mMのTRIS−HCl(pH8)、150mMのNaCl、10%のBSA、0.05%のTween−20(Sigma社、セントルイス、ミズーリ州)において、1/1000に希釈したラットのSOX17抗血清、引き続き、アルカリホスファターゼ標識抗ラットIgG(Alkaline Phosphatase conjugated anti−rat IgG)(Jackson ImmunoResearch Laboratories、ウエスト・グローブ、ペンシルバニア州)で検出し、ベクターブラックアルカリホスファターゼ染色(Vec
tor Black Alkaline Phosphatase staining)(Vector Laboratories、バーリンゲーム、カリフォルニア州)により明らかにした。採用したタンパク質サイズ基準は、広範囲のカラーマーカー(Sigma社、セントルイス、ミズーリ州)であった。図4において、SOX17、SOX7またはEGFP cDNAが一過性に形質移入されたヒト線維芽細胞から作製した抽出タンパク質を、SOX17抗体を用いてウェスタンブロット上で検出した。hSOX17形質移入細胞からの抽出タンパク質のみが、ヒトのSOX17タンパク質の予測分子量46Kdaに近い51Kdaまでのバンドを生じさせた。ヒトのSOX7またはEGFP形質移入細胞のいずれかから作られた抽出物に対するSOX17抗体の反応は全くなかった。さらに、SOX17抗体は、hSOX17発現コンストラクトを形質移入されたヒト線維芽細胞の核を明確に標識したが、EGFPのみを形質移入された細胞は標識しなかった。このように、SOX17抗体は、ICCにより特異性を示した。
【0015】
実施例4
胚体内胚葉のマーカーとしてのSOX17抗体の検証
SOX17抗体が、ヒトSOX17タンパク質に対して特異的であり、さらには、胚体内胚葉を標識する証拠として、部分的に分化したhESCを、SOX17とAFP抗体で同時標識した。SOX遺伝子ファミリーサブグループF(図3)の近縁関係にあるメンバーであるSOX7やSOX17およびAFPは、それぞれ臓側内胚葉で発現することが実証されている。しかしながら、AFPおよびSOX7は、胚体内胚葉細胞において、ICCにより検出できるレベルでは発現しないため、本物の胚体内胚葉細胞に対する陰性マーカーとして用いることができる。SOX17抗体は、離散的にグループ化した細胞として存在するか、或いはAFP陽性細胞と混ざり合う細胞集団を標識することが明らかにされた。特に、図5Aは、少数のSOX17細胞が、AFPで同時標識されたことを示している。しかしながら、SOX17+細胞の場にAFP+細胞が、殆どまたは全くない領域も見られた(図5B)。同様に、壁側内胚葉も、SOX17を発現すると報告されているため、壁側マーカーSPARCおよび/またはトロンボモジュリン(TM)と共にSOX17で同時標識している抗体は、壁側内胚葉であるSOX17+細胞を同定するのに使用することができる。図6A〜Cに示すように、トロンボモジュリンとSOX17とで同時標識された壁側内胚葉細胞は、hES細胞のランダムな分化により産生された。
上記の細胞標識実験から見て、胚体内胚葉細胞は、マーカープロファイルSOX17hi/AFPlo/[TMloまたはSPARClo]により同定することができる。すなわち、SOX17マーカーの発現は、臓側内胚葉に特有のAFPマーカーおよび壁側内胚葉に特有のTMまたはSPARCマーカーの発現より多い。従って、SOX17に対しては陽性であるが、AFPおよびTMまたはSPARCに対しては陰性である細胞が、胚体内胚葉である。
胚体内胚葉を予測するSOX17hi/AFPlo/TMlo/SPARCloマーカープロファイルの特異性の更なる証拠を得るべく、SOX17およびAFP遺伝子発現を、量的に抗体標識細胞の相対数と比較した。図7Aに示されているように、レチノイン酸(臓側内胚葉誘導物質)またはアクチビンA(胚体内胚葉誘導物質)で処理したhESCでは、SOX17mRNAの発現量に、10倍の差が生じた。この結果は、SOX17抗体標識細胞数における10倍の差を反映していた(図7B)。さらに、図8Aに示されているように、hESCのアクチビンA処理により、AFP遺伝子発現は、処理しなかった場合に比べ6.8倍抑制された。これは、図8B〜Cに示されているように、これらの培養物におけるAFP標識細胞の数の著しい減少により、視覚的に示された。さらにこれを定量化するために、AFP遺伝子発現におけるこの約7倍の減少が、フローサイトメトリーにより測定したAFP抗体標識細胞数が同様に7倍減少した結果であることが立証された(図9A〜B)。この結果は、Q−PCRにより確認される、遺伝子発現における量的変化が、抗体染色により観察される、細胞型の特異性における変化を反映することを示す点において極めて重要である。
ノーダルファミリーメンバー(ノーダル、アクチビンAおよびアクチビンB−NAA)の存在下におけるhESCの培養により、SOX17抗体標識細胞は、時間と共に著しく増加した。5日間継続したアクチビン処理により、50%を超える細胞が、SOX17で標識された(図10A〜F)。5日間のアクチビン処理後、AFPで標識された細胞は、ほとんどまたは全くなかった。
つまり、ヒトのSOX17タンパク質のカルボキシ末端242アミノ酸に対して産生された抗体は、ウェスタンブロットでヒトのSOX17タンパク質を同定したが、その最も近いSOXファミリー類縁体である、SOX7は認識しなかった。SOX17抗体は、主としてSOX17+/AFPlo/-(標識細胞の95%を超える)である分化hESC培養物中の細胞の一部、並びにSOX17およびAFP(臓側内胚葉)で同時標識しているわずかなパーセンテージ(<5%)の細胞も認識した。hESC培養物のアクチビン処理により、SOX17遺伝子発現およびSOX17標識細胞が著しく増加し、AFPmRNAの発現やAFP抗体で標識された細胞の数は著しく抑制された。
【0016】
実施例5
Q−PCR遺伝子発現測定
以下の実験では、hESC分化に対する様々な処理の効果を調べる主な測定法として、リアルタイム定量RT−PCR(Q−PCR)を採用した。具体的には、遺伝子発現のリアルタイム測定結果を、Q−PCRにより複数の時点で、複数のマーカー遺伝子に関して分析した。細胞集団の全体的な動態に関する理解を深めるために、望ましいおよび望ましくない細胞型に特有のマーカー遺伝子を評価した。Q−PCR分析の長所としては、その感度が極めて高いことや、ゲノム配列が容易に入手可能であるため、必要なマーカーの開発が比較的容易であることが挙げられる。さらに、Q−PCRの極めて高い感度により、非常に大きな集団内の比較的少数の細胞から遺伝子発現を検出することが可能となる。また、極めて低レベルの遺伝子発現を検出する性能により、その集団内での「分化傾向」が示される。これらの細胞表現型の明らかな分化に先立って、免疫細胞化学技法を用いては、特定の分化経路に沿った傾向を認識することはできない。このため、Q−PCRは、分化処理の成果を調べる免疫細胞化学技法を少なくとも補完するものであり、尚且つ、その技法より潜在的にはるかに優れた分析方法を提供する。さらに、Q−PCRは、分析の準ハイスループットスケールでの定量フォーマットにおける分化プロトコルの成果を評価するメカニズムを提供する。
ここで取ったアプローチは、Rotor Gene3000装置(Corbett Research)でSYBR Greenケミストリを用い、且つ、ツーステップRT−PCRフォーマットを使用して、相対的な定量化を行うことであった。このようなアプローチにより、将来、更なるマーカー遺伝子を分析するためのcDNAサンプルを保存することが可能となり、よって、サンプル間の逆転写効率におけるばらつきを避けることができる。
プライマーは、極力、エキソン同士の境界上に位置するか、或いは少なくとも800bpのイントロンにまたがるように設計した。これは、コンタミしたゲノムDNAからの増幅を排除するように実験的に決定されたものである。イントロンを含まないマーカー遺伝子を採用した場合、またはマーカー遺伝子が偽遺伝子を有する場合、RNAサンプルのデオキシリボヌクレアーゼI処理を行なった。
我々は、細胞サンプルにおける遺伝子発現に関する幅広いプロファイルの説明を提供するために、標的または非標的細胞型の多数のマーカーの遺伝子発現の測定には、通常Q−PCRを利用した。hESC分化(具体的には、外胚葉、中胚葉、胚体内胚葉、および胚外内胚葉)の初期段階に関するマーカーで、そのための有効なプライマーセットが入手可能なものを下記表1に挙げている。また、これらのプライマーセットのヒト特異性も立証された。これは、hESCが多くの場合マウス支持細胞層で増殖することから、重要な事である。最も一般的には、それぞれの条件において三組のサンプルを採取し、個別に、各定量に関連した生物学的変動を評価するためにそれぞれのサンプルを二つずつ分析した。
PCRテンプレートを作成するために、総RNAは、RNeasy(Qiagen社)を用いて分離し、RiboGreen(Molecular Probes社)を用いて定量した。総RNA350〜500ngからの逆転写は、oligo−dTおよびランダムプライマーの混合物を含むiScript逆転写酵素キット(BioRad社)を使用して行なった。各20μLの反応物は、その後、総量100μLまで希釈し、3μLを、400nMの順方向および逆方向プライマーと5μLの2X SYBR Greenマスターミックス(Qiagen社)とを含む、各10μLのQ−PCR反応物に使用した。2段階のサイクリングパラメータを使用し、85〜94°C(各プライマーセットの単位複製配列の融解温度によって具体的に選択された)で5秒間の変性と、引き続き、60°Cで45秒間のアニール/伸長を採用した。蛍光データは、各伸長段階の最後の15秒間に収集した。3ポイント10倍希釈シリーズ(three point、10−fold dilution series)を、各回ごとに検量線を作成するために使用し、この検量線に基づいて、サイクル閾値(Ct)を定量値に変換した。各サンプルの定量化された値を、ハウスキーピング遺伝子能力に対して規準化した後、三組のサンプルに関して平均および標準偏差を計算した。PCRサイクルの終わりに際し、融解曲線分析を行い、反応物の特異性を確認した。単一の特定産物が、そのPCR単位複製配列に適したTmで単一のピークにより示された。さらに、逆転写酵素なしで行われた反応は、陰性対照としての役目を果たし、増幅しない。
Q−PCR法を確立する上での第一段階は、実験系に適したハウスキーピング遺伝子(HG)を検証することであった。RNAインプット、RNAの完全性および逆転写効率に関する全サンプルの規準化にHGが使用されるため、規準化が有意であるためには、HGが、全種類のサンプルにおいて、長期に渡り一定レベルで発現することが重要であった。我々は、分化hESCにおいて、サイクロフィリンG、ヒポキサンチン・ホスホリボシルトランスフェラーゼ1(HPRT)、ベータ−2−ミクログロブリン、ヒドロキシメチルビアン(hydroxymethylbiane)シンターゼ(HMBS)、TATA結合タンパク質(TBP)、およびグルクロニダーゼ(glucoronidase)ベータ(GUS)の発現量を測定した。我々の得た結果は、ベータ−2−ミクログロブリンの発現量が、分化するにしたがって上昇することを示した。従って、規準化のためのこの遺伝子の使用は除外した。他の遺伝子は、長時間に渡り、且つ全処理を通して一定の発現量を示した。我々は、通常、サイクロフィリンGおよびGUSの双方を使用し、全サンプルに関する規準化因子を計算した。多数のHGを使用することにより、規準化プロセスに伴う変動性を低減すると同時に、相対的な遺伝子発現値の信頼性を高める。
規準化に使用する遺伝子を得た後、Q−PCRを使用し、様々な実験処理を施す全サンプルにおいて、多くのマーカー遺伝子の相対的な遺伝子発現量を求めた。使用したマーカー遺伝子を選択したのは、それらが、初期胚葉の典型的な特定集団において濃縮を示すからであり、特に、胚体内胚葉および胚外内胚葉において、特異的に発現する遺伝子グループに集中したためである。これらの遺伝子およびそれらの相対的な濃縮分析結果を、表1に示す。
【表1】

多くの遺伝子が、一以上の胚葉で発現するため、同一実験において、多くの遺伝子の発現量を定量的に比較することが有益である。SOX17は、胚体内胚葉において発現し、臓側および壁側内胚葉では少しばかり発現する。SOX7およびAFPは、この初期発生の時点において臓側内胚葉で発現する。SPARCおよびTMは、壁側内胚葉で発現し、Brachyuryは初期中胚葉で発現する。
胚体内胚葉細胞は、SOX17mRNAを高度に発現し、AFPおよびSOX7(臓側内胚葉)、SPARC(壁側内胚葉)およびBrachyury(中胚葉)の発現レベルは低いものと予想された。さらに、ZIC1をここで使用し、初期外胚葉の誘導をさらに排除した。最終的に、GATA4およびHNF3bが、胚体および胚外内胚葉の両方において発現した。従って、それらは、胚体内胚葉におけるSOX17の発現と相関する(表1)。典型的な実験を、図11〜14に示している。図11〜14は、表1に記載されているマーカー遺伝子が、各種サンプル間でいかに互いに相関しているかを示しており、それにより、胚体内胚葉および胚外内胚葉、並びに中胚葉および神経細胞型に特異的な分化パターンを明示している。
上記のデータから、アクチビン投与量の増加が、SOX17遺伝子発現の増加をもたらしたことは明らかである。さらに、このSOX17発現は、主に、胚外内胚葉ではなく胚体内胚葉を示した。この結論は、SOX17遺伝子発現がAFP、SOX7およびSPARC遺伝子発現と逆相関にあるという観察結果に基づいている。
【0017】
実施例6
ヒトES細胞の胚体内胚葉への誘導分化
ヒトES細胞培養物は、それらの未分化の状態が能動的に維持されない条件下で培養された場合、ランダムに分化する。この不均一な分化により、壁側および臓側内胚葉(AFP、SPARCおよびSOX7発現)の双方からなる胚外内胚葉細胞、並びにZIC1、ネスチン(外胚葉)およびBrachyury(中胚葉)の発現によって示される、初期の外胚葉および中胚葉誘導体が産生される。胚体内胚葉細胞の出現は、ES細胞培養物における特異的な抗体マーカーの欠如により、従来検証または特定されていない。そのため、ES細胞培養物における初期胚体内胚葉の産生は、あまりよく研究されていない。胚体内胚葉細胞に対するよい抗体試薬の入手が不可能なため、性質決定のほとんどは、外胚葉および胚外内胚葉に集中している。概して、ランダムに分化したES細胞培養物には、SOX17hi胚体内胚葉細胞と比較すると、非常に多くの胚外および神経外胚葉細胞型がある。
未分化hESCコロニーは、繊維芽細胞フィーダーの床で増殖するため、コロニーの縁部
は、コロニーの内側に存在するそれらの細胞とは異なる別の形態を呈する。これらの外縁細胞の多くは、それほど均一ではなくより大きな細胞体の形態や、OCT4の高発現量により識別できる。ES細胞は、分化し始めると、未分化ES細胞と比較してOCT4発現量が増加または減少するとされている。未分化閾(undifferentiated threshold)に対するOCT4発現量の上下変化は、多能性の状態から脱した分化の初期段階を意味する可能性がある。
未分化のコロニーを、SOX17免疫細胞化学により調べた際、時折SOX17陽性細胞の小さな10〜15個の細胞集団が、その周辺のランダムな場所、および未分化のESCコロニー間の接合部で検出された。上述のように、これらのコロニー外縁に散在したポケットは、コロニーがサイズ的に大きくなり、より多くなるにつれ、古典的ESC形態とは異なった分化をする最初の細胞の数個となるようであった。若くて小さな完全に未分化のコロニー(<1mm;4〜5日目)は、コロニー内または縁部においてSOX17陽性細胞は全く見られなかった。一方、古くて大きいコロニー(直径1〜2mm、>5日目)には、いくつかのコロニーの周辺、または先に説明した古典的hESC形態とは異なって分化した縁部の内側の領域において、散在し孤立した斑状のSOX17陽性AFP陰性細胞があった。これが有効なSOX17抗体の最初の発生であったとすれば、そのような初期の「未分化」ESC培養物で発生する胚体内胚葉細胞は、これまで立証されたことはない。
Q−PCRによるSOX17およびSPARC遺伝子発現量の逆相関に基づくと、大部分のSOX17陽性AFP陰性細胞は、抗体同時標識により壁側マーカーに対し陰性を示すであろう。これは、図15A〜Bで示されているように、TMを発現している壁側内胚葉細胞に関して明確に立証された。ノーダル因子アクチビンAおよびBへの暴露により、TM発現強度およびTM陽性細胞数は著しく減少した。アクチビン処理培養物におけるSOX17、AFPおよびTM抗体を用いた三重標識により、AFPおよびTMに対しても陰性であったSOX17陽性細胞のクラスターが観察された(図16A〜D)。これらは、分化ESC培養物におけるSOX17陽性胚体内胚葉細胞の最初の細胞を示すものである(図16A〜Dおよび図17)。
上述のSOX17抗体およびQ−PCRのツールを使用し、SOX17hi/AFPlo/SPARC/TMlo胚体内胚葉細胞になるようにESCを効果的にプログラムミングすることのできる数々の手法を調べた。我々は、SOX17遺伝子発現に関するQ−PCRによる集団レベルと、SOX17タンパク質の抗体標識による個々の細胞レベルとで測定した、これら細胞の数および増殖能力を増強することを目的とした様々な分化手順を適用した。
生体外の細胞培養物において胚性幹細胞から胚体内胚葉細胞を作製する際に使用する、ノーダル/アクチビン/BMPなどのTGFβファミリー増殖因子の効果を分析し、説明したのは、我々が初めてであった。典型的な実験では、アクチビンA、アクチビンB、BMPまたはそれら増殖因子の組み合わせを、未分化ヒト幹細胞株hESCyt−25の培養物に添加し、分化プロセスを開始させた。
図19に示されているように、100ng/mlのアクチビンAを添加したところ、分化開始後4日目までに、未分化hESCに対し、19倍のSOX17遺伝子発現の誘導が起きた。アクチビンファミリーの第二のメンバーであるアクチビンBをアクチビンAと共に添加したところ、混合アクチビン処理後4日目までに未分化hESCに対し、37倍の誘導が起きた。最後に、ノダール/アクチビンおよびBMPサブグループBMP4からTGFβファミリー第三のメンバーを、アクチビンAおよびアクチビンBと共に添加したところ、発光量比は未分化hESCの57倍まで増加した(図19)。アクチビンおよびBMPを用いたSOX17の誘導を、因子無添加培地である対照と比較した場合、4日目の時点で、5倍、10倍および15倍の誘導が起きていた。アクチビンA、BおよびBMPを用いた三重処理後5日目までに、SOX17は、hESCに比べ70倍を超えて誘導された。これらのデータは、ノーダル/アクチビンTGFβファミリーメンバーの高投与量および長時間処理により、SOX17発現が増加することを示している。
ノーダルおよび関連分子アクチビンA、BおよびBMPは、生体内または生体外における胚体内胚葉形成およびSOX17の発現を促進する。さらに、BMPを添加することにより、SOX17の誘導が高まるが、これはおそらく、ノーダルコレセプターであるクリプト(Cripto)の更なる誘導によるものであろう。
我々は、BMP4とアクチビンAおよびBの組み合わせにより、SOX17の誘導、引いては、胚体内胚葉形成が、相加的に増強されることを立証した。アクチビンAおよびBとの組み合わせで、長時間(>4日)BMP4を添加していると、壁側および臓側内胚葉、並びに胚体内胚葉においてSOX17が誘導されることもある。したがって、本発明のいくつかの実施形態において、添加4日以内に、前記処理においてBMP4を除くことが大切である。
個々の細胞レベルでTGFβ因子を用いた処理の効果を求めるため、SOX17抗体標識を使用し、TGFβ因子添加の経時変化を調べた。先に図10A〜Fで示したように、SOX17標識細胞の相対数は、時間と共に著しく増加した。相対的に定量化(図20)した場合、SOX17標識細胞は、20倍を超える増加を示している。この結果は、細胞数およびSOX17遺伝子発現量のいずれも、TGFβ因子への暴露時間とともに増加していることを示している。図21に示されているように、ノーダル、アクチビンA、アクチビンBおよびBMP4への暴露4日後、SOX17誘導のレベルは、未分化hESCの168倍に到達した。また、図22は、SOX17陽性細胞の相対数もまた、投与量に依存していたことを示している。アクチビンAの投与量が100ng/mL以上である場合、SOX17遺伝子発現および細胞数を強力に誘導することができた。
TGFβファミリーメンバーに加えて、Wnt分子ファミリーが、胚体内胚葉の特異化および/または維持に役立つ場合もある。アクチビンのみで処理したサンプルに対し、アクチビンとWnt3aとを用いて処理したサンプルにおいて、SOX17遺伝子発現が増加したことにより示されているように、Wnt分子の使用も、hESCを胚体内胚葉に分化させるのに有益であった(図23)。
上記実験の全ては、添加因子と共に10%の血清を含む組織培養培地を使用して行なった。驚くべきことに、図24A〜Cに示されているように、血清濃度が、添加アクチビンの存在下におけるSOX17発現量に影響を及ぼすことを発見した。血清レベルを10%から2%に低下させた場合、SOX17発現は、アクチビンAおよびBの存在下、3倍になった。
最後に、図25A〜Dに示したように、アクチビンにより誘導されたSOX17+細胞が、培養物中において分離することを立証した。矢印は、PCNA/DAPIで標識された有糸分裂プレートパターン(mitotic plate pattern)および位相差有糸分裂プロファイル(phase contrast mitotic profile)からも明らかなように有糸分裂中のSOX17/PCNA/DAPIで標識された細胞を示す。
【0018】
実施例7
ケモカイン受容体4(CXCR4)発現は、中胚葉、外胚葉または臓側内胚葉用のマーカーではなく、胚体内胚葉用マーカーと相関する
上述のごとく、TGFβファミリー、より具体的には、アクチビン/ノーダルサブファミリーのサイトカインの適用により、ESCは胚体内胚葉細胞層に分化すべく誘導される。さらに、分化培養培地におけるウシ胎児血清(FBS)の割合が、ESCからの胚体内胚葉分化の効率に影響することを明らかにした。この影響とは、培地においてアクチビンAが所定の濃度である場合、FBSレベルが高くなると、胚体内胚葉への最大分化が阻害されるというものである。外因性アクチビンAの不在下では、胚体内胚葉系列へのESCの分化は非常に非効率的であり、FBS濃度がESCの分化プロセスに及ぼす影響は、かなり緩やかである。
これらの実験では、hESCは、100ng/mLアクチビンAを含むまたは含まない、0.5%、2.0%または10%のFBSを添加したRPMI培地(インビトロゲン社、
カールスバッド、カリフォルニア州;カタログ番号61870−036)で6日間増殖させることにより分化させた。さらに、分化の最初3日間は、アクチビンA100ng/mLと併せて、0.5%から2.0%の範囲のFBS勾配も採用した。6日後、各培養条件の複製サンプルを収集し、リアルタイム定量PCRにより相対的遺伝子発現を分析した。残りの細胞は、SOX17タンパク質の免疫蛍光検出用に準備した。
CXCR4の発現量は、使用した7つの培養条件により、著しく変化した(図26)。一般に、CXCR4発現量は、アクチビンAで処理した培養物で多く(A100)、外因性アクチビンAを入れなかった培養物では少なかった(NF)。さらに、A100で処理した培養物において、CXCR4発現は、FBS濃度が最も低い時、最も高かった。相対的発現がアクチビンAを加えなかった状態(NF)にむしろ近いほど、10%FBSの条件下でCXCR4レベルは著しく低下した。
上述のごとく、SOX17、GSC、MIXL1およびHNF3β遺伝子の発現は、胚体内胚葉としての細胞の特性と一致する。7つの分化条件の全てにおいて、これら4つの遺伝子の相対的発現は、CXCR4のそれと酷似している(図27A〜D)。これは、CXCR4も、胚体内胚葉のマーカーであることを示している。
外胚葉および中胚葉系列は、それらの各種マーカーの発現により胚体内胚葉と識別される。初期中胚葉は、BrachyuryおよびMOX1遺伝子を発現し、一方、新生神経外胚葉はSOX1およびZIC1を発現する。図28A〜Dは、外因性アクチビンAを添加しなかった培養物が、中胚葉および外胚葉遺伝子の発現で選択的に濃縮され、アクチビンAで処理した培養物の中では、10%のFBS条件においても、中胚葉および外胚葉マーカー発現のレベルが増加したことを示している。これらの発現パターンは、CXCR4とは逆であり、CXCR4が、この発生時期においてESC由来の中胚葉または外胚葉ではあまり発現しないことを明らかにした。
哺乳類発生の初期、胚外系列への分化も起こる。ここで特に関連性があるのは、SOX17を含む、胚体内胚葉と共通の多くの遺伝子の発現を共有する臓側内胚葉の分化である。胚体内胚葉を胚外臓側内胚葉と識別するためには、これら二つの間で異なったマーカーを調べなくてはならない。SOX7は、臓側内胚葉では発現するが、胚体内胚葉系列では発現しないマーカーの代表である。よって、SOX7発現の不在下で、強度のSOX17遺伝子発現を示す培養状態は、臓側内胚葉ではなく、胚体内胚葉を含む傾向にある。SOX7はアクチビンAを加えなかった培養物で高度に発現しており、また、SOX7はFBSが10%含まれたときアクチビンAの存在下でも発現の増加を示したことが、図28Eに示されている。このパターンは、CXCR4の発現パターンとは逆であることから、CXCR4が、臓側内胚葉では高度に発現されないことを示唆している。
上記各分化条件下で存在するSOX17免疫反応(SOX17+)細胞の相対数も求めた。hESCを、高用量アクチビンAの存在下、低FBS濃度(0.5%〜2.0%)で分化させた場合、SOX17+細胞は、培養物全体に渡り偏在的に分布した。高用量アクチビンAを使用するが、含まれるFBSが10%(v/v)である場合、SOX17+細胞の出現頻度はかなり低く、培養物全体に渡り均等に分布するのではなく、常に孤立したクラスターとして出現した(図29AおよびC並びにBおよびE)。外因性アクチビンAを使用しなかった場合、SOX17+細胞の更なる減少が見られた。これらの条件下でも、SOX17+細胞は、クラスターとして出現した。これらクラスターは、高容量アクチビンA、低濃度FBSで処理した場合に見られるものより小さく、はるかにまれであった(図29CおよびF)。これらの結果は、CXCR4の発現パターンが、胚体内胚葉遺伝子発現と一致しているだけでなく、各条件下における胚体内胚葉細胞の数とも一致していることを立証している。
【0019】
実施例8
胚体内胚葉で濃縮する分化条件は、CXCR4陽性細胞の比率を増加させる
アクチビンAの投与量も、胚体内胚葉がESCから誘導される効率に影響を及ぼす。この実施例は、アクチビンAの投与量増加により、培養物中のCXCR4+細胞の比率が高く
なることを実証している。
hESCは、0.5%〜2%FBS(分化の最初の3日間で0.5%から1.0%へ、そして2.0%へと増加した)および0、10または100ng/mLのアクチビンAを添加したRPMI培地で分化させた。7日間分化させた後、細胞を、室温で5分間、2% FBSおよび2mM(EDTA)を含みCa2+/Mg2+を含まないPBSにおいて分離させた。細胞は、35umのナイロンフィルターを通して濾過し、数を数え、ペレット状にした。ペレットは、少量の50%のヒト血清/50%の正常なロバ血清で再懸濁させ、非特異的抗体結合部位を遮断するために氷上で2分間培養した。これに、50uL(約105個の細胞を含む)につき、1uLのマウス抗CXCR4抗体(アブカム(Abcam)社、カタログ番号ab10403−100)を添加し、45分間氷上で標識化を行なった。細胞を、2%のヒト血清(緩衝液)を含むPBS5mLを添加することにより洗浄し、ペレット状にした。緩衝液5mLで2回目の洗浄を完了し、その後、細胞は、105個の細胞ごとに緩衝液50uLに再懸濁させた。二次抗体(FITC標識ロバ抗マウス;Jackson ImmunoResearch、カタログ番号715−096−151)を、最終濃度5ug/mLで加え、30分間標識化し、その後、上述のように緩衝液で二度洗浄した。細胞は緩衝液中、5×106個の細胞/mLで再懸濁させ、フローサイトメトリー・コアファシリティー(flow cytometry core facility)(The Scripps Research Institute)において、スタッフによりFACS Vantage(Beckton Dickenson社)を使用して分析および選別した。細胞は、リアタイム定量PCRにより、遺伝子発現解析のために総RNAを引き続き分離するため、RLT溶解緩衝液(Qiagen社)の中に直接回収した。
分化培養培地において、アクチビンAの投与量が増加するにつれ、フローサイトメトリーにより求めたCXCR4+細胞の数の著しい増加が観察された(図30A〜C)。CXCR4+細胞は、R4ゲート内にあったものであり、このゲートは、イベントの0.2%がR4ゲート内に位置する二次抗体のみの対照を使用して設定した。CXCR4+細胞数の著しい増加は、アクチビンAの投与量が増加するにつれて生じた胚体内胚葉遺伝子発現の力強い増加と相関する(図31A〜D)。
【0020】
実施例9
CXCR4陽性細胞の分離により胚体内胚葉遺伝子発現を濃縮し、中胚葉、外胚葉および臓側内胚葉のマーカーを発現する細胞を減少させる
上記実施例8において同定したCXCR4+およびCXCR4-細胞を回収し、相対的な遺伝子発現を分析し、母集団の遺伝子発現を同時に測定した。
CXCR4遺伝子発現の相対量は、アクチビンAの投与量の増加と共に著しく増加した(図32)。これは、CXCR4+細胞のアクチビンA用量依存的な増加と非常によく相関した(図30A〜C)。各集団から分離したCXCR4+細胞が、その集団におけるCXCR4遺伝子発現ほぼ全ての原因であったことも明白である。これは、これらの細胞を回収するFACS法の効率の良さを立証している。
遺伝子発現解析は、CXCR4+細胞に、CXCR4遺伝子発現の大部分のみでなく、胚体内胚葉のマーカーに関する他の遺伝子発現も含まれることを明らかにした。図31A〜Dに示されているように、CXCR4+細胞は、SOX17、GSC、HNF3BおよびMIXL1に関して、親A100集団よりもさらに濃縮された。さらに、CXCR4-画分には、これらの胚体内胚葉マーカーに関する遺伝子発現は殆どなかった。また、CXCR4+およびCXCR4-集団は、中胚葉、外胚葉および胚外内胚葉のマーカーに関し逆パターンの遺伝子発現を示した。図33A〜Dは、Brachyury、MOX1、ZIC1およびSOX7の遺伝子発現に関して、A100母集団と比較し、CXCR4+細胞が激減したことを示している。このA100母集団においては、アクチビンAの投与量が少ないかまたは全くない条件に比べ、これらのマーカーの発現はもともと低かった。これらの結果は、高用量アクチビンAの存在下で分化させたhESCからCXCR4+細胞を分
離することにより、胚体内胚葉で高度に濃縮され、且つ、実質的に純胚体内胚葉である集団が得られることを明らかにしている。
【0021】
実施例10
CXCR4を用いた、細胞集団内の胚体内胚葉細胞の定量化
細胞培養物または細胞集団に存在する胚体内胚葉細胞の比率の定量化を確認するために、CXCR4および胚体内胚葉の他のマーカーを発現している細胞をFACSにより分析した。前記比率の定量化は、本明細書において先に求めたもの、並びに、2003年12月23日に出願された、名称「DEFINITIVE ENDODERM(胚体内胚葉)」の米国仮特許出願第60/532,004号明細書において求められたものであり、この全開示内容は、引用することにより本明細書の一部とされる。
上記実施例で説明したような方法を用いて、hESCを分化させ胚体内胚葉を作製した。具体的には、分化細胞培養物において示される収率および純度を増加させるため、培地の血清濃度を以下のように制御した:1日目は0.2%FBS、2日目は1.0%FBS、そして3〜6日目は2.0%FBSとした。分化した培養物は、三つの細胞表面エピトープ、E−カドヘリン、CXCR4、およびトロンボモジュリンを用いて、FACSで分取した。そして、分取した細胞集団は、Q−PCRにより分析し、胚体および胚外内胚葉並びに他の細胞型に関するマーカーの相対的発現量を求めた。最適に分化した培養物から採取したCXCR4分取細胞は、純度98%を超える胚体内胚葉細胞を分離する結果となった。
表2は、ここで説明した方法を用いてhESCから分化させた胚体内胚葉培養物に関するマーカー分析の結果示す。
【表2】

具体的には、表2は、CXCR4およびSOX17陽性細胞(内胚葉)が、細胞培養物中の細胞の70%〜80%を占めることを示している。これらのSOX17を発現している細胞のうち、2%未満がTM(壁側内胚葉)を発現し、1%未満がAFP(臓側内胚葉)を発現した。SOX17/CXCR4陽性細胞の比率から、TM陽性およびAFP陽性細胞(壁側および臓側内胚葉の合計:3%)の比率を差し引くと、細胞培養物の約67%から約77%が胚体内胚葉であったことが分かる。細胞の約10%は、hESCのマーカーであるE−カドヘリン(ECAD)に陽性であり、細胞の約10〜20%は他の細胞型であった。
FACS分離前に得られる分化細胞培養物中の胚体内胚葉の純度は、FBS濃度を5〜6日間の分化過程を通して0.5%以下に維持することにより、上記の低血清処理と比較して改善できることが分かった。しかしながら、5〜6日間の分化過程を通して0.5%以下に細胞培養物を維持することは、作製される胚体内胚葉細胞総数を減少させることにもなる。
ここに記載した方法により作製された胚体内胚葉細胞は、それほど分化を伴わず、50日
間を超えてアクチビンの存在下、培養物中に維持し増殖させた。そのような場合、SOX17、CXCR4、MIXL1、GATA4、HNF3βの発現は、培養期間中維持される。さらに、TM、SPARC、OCT4、AFP、SOX7、ZIC1およびBRACHは、これらの培養物において検出されなかった。そのような細胞は、それほど分化を伴わず、実質的に50日を越えて培養物中で維持し、増殖させることができるようである。
【0022】
実施例11
胚体内胚葉細胞の更なるマーカー
以下の実験では、RNAを、精製した胚体内胚葉およびヒト胚性幹細胞集団から分離した。その後、精製した各集団から得たRNAの遺伝子チップ分析により遺伝子発現を分析した。また、Q−PCRも行い、胚体内胚葉のマーカーとして、胚体内胚葉では発現するが、胚性幹細胞では発現しない遺伝子の可能性をさらに調査した。
ヒト胚性幹細胞(hESC)を、20%のノックアウト血清リプレースメント、4ng/mLの組換え型ヒト塩基性線維芽細胞増殖因子(bFGF)、0.1mMの2−メルカプトエタノール、L−グルタミン、非必須アミノ酸、およびペニシリン/ストレプトマイシンを添加したDMEM/F12培地で維持した。hESCは、100ng/mLの組換え型ヒトアクチビンA、ウシ胎児血清(FBS)、およびペニシリン/ストレプトマイシンを添加したRPMI培地で5日間培養することにより、胚体内胚葉に分化させた。FBSの濃度は、以下のように日毎に変化させた:0.1%(一日目)、0.2%(2日目)、2%(3〜5日目)。
遺伝子発現解析用にhESCおよび胚体内胚葉の精製集団を得るため、蛍光活性細胞分離法(FACS)により細胞を分離した。hESCは、SSEA4抗原(R&D Systems社、カタログ番号FAB1435P)を使用して、胚体内胚葉は、CXCR4(R&D Systems社、カタログ番号FAB170P)を使用して、免疫精製を行なった。細胞は、トリプシン/EDTA(Invitrogen社、カタログ番号25300−054)を用いて分離し、2%のヒト血清を含むリン酸緩衝生理食塩水(PBS)中で洗浄し、非特異的結合を遮断するために10分間氷上で100%のヒト血清中に再懸濁させた。800uLのヒト血清中、5×106個の細胞に対し、フィコエリトリン標識抗体200uLを添加することにより、氷上で30分間染色を行なった。細胞は、PBS緩衝液8mLで二度洗浄し、PBS緩衝液1mL中に再懸濁させた。FACS Vantage(BD Biosciences)を使用し、The Scripps Research Instituteのコアファシリティにより、FACS分離が行われた。細胞は、RLT溶解緩衝液中に直接回収し、RNAは、製造業者(Qiagen社)の使用説明に従いRNeasyにより分離した。
アフィメトリクス(Affymetrix)社製プラットフォームおよびU133 Plus 2.0高密度オリゴヌクレオチドアレイを使用し、発現プロファイルデータを作製するため、Expression Analysis社(ダラム、ノースカロライナ)に、精製したRNAを二部提出した。提示されたデータは、hESCおよび胚体内胚葉の2つの集団の間で、特異的に発現した遺伝子を同定する群比較である。hESCにおいて見られた発現量を超えて、力強い上昇変化を示した遺伝子を、胚体内胚葉に極めて特有である新しいマーカー候補として選択した。選択した遺伝子は、上述のように、Q−PCRにより分析し、遺伝子チップ上で見られる遺伝子発現変化を検証し、またhESCが分化する間のこれら遺伝子の発現パターンも調べた。
図34A〜Mは、一定のマーカーに関する遺伝子発現結果を示している。結果は、100ng/mlのアクチビンAの添加後1日目、3日目および5日目に分析した細胞培養物、5日間の分化過程の終わりに精製したCXCR4発現胚体内胚葉細胞(CXDE)、および精製ヒト胚性幹細胞(HESC)について示している。図34Cおよび図34G〜Mを比較することにより、六つのマーカー遺伝子FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1が、互いにほぼ等しく、またCXCR4およびSOX17/SOX7の発現パターンとも等しい発現パターンを示すことが立証されている。先
に説明したように、SOX17は、胚体内胚葉およびSOX7発現胚外内胚葉の両方において発現する。SOX7は胚体内胚葉で発現しないため、SOX17/SOX7の比率により、全体として集団内で見られるSOX17発現に対する胚体内胚葉の寄与について信頼性のある推定が得られる。パネルG〜LおよびMのパネルCに対する類似性は、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1が、胚体内胚葉のマーカーである可能性が高く、胚外内胚葉細胞においては著しく発現することはないことを示している。
当然のことながら、ここに記載したQ−PCRの結果は、ICCによりさらに確認することができる。
本明細書に記載した方法、組成物および装置は、好適な実施形態の現時点での代表的および模範的なものであり、本発明の範囲を限定することを意図したものではない。当技術分野における当業者は、本発明の精神に包含され、開示内容の範囲により明確にされる変更および他の用途を考え付くこともあろう。よって、種々の代替および変更が、本発明の範囲および精神から逸脱することなく、ここに開示した本発明に帰することは当業者にとっては明らかであろう。
請求項および本開示事項全体に渡って使用されている、「本質的に〜から成る」という表現により、その表現の中に記載されたあらゆる要素を含み、記載されている要素に関する開示において特定した働きあるいは作用を妨げたり寄与したりすることのない他の要素に限定された、あらゆる要素を含むことを意味する。よって、「本質的に〜から成る」という表現は、記載されている要素は必要、すなわち必須であるが、他の要素は任意であり、記載されている要素の働きまたは作用に影響するかどうかによって存在する場合もあれば存在しない場合もあることを示している。
【0023】
本特許出願においては、多数の文献および特許参考文献が引用されている。本特許出願において引用された全ての参考文献は、その全内容を引用することにより本明細書の一部とされる。
いくつかの参考文献に関しては、本文中、完全な典拠を記載している。その他の参考文献に関しては、本文中、著者および年度により言及しており、その完全な典拠を以下に示す。
Alexander, J., Rothenberg, M., Henry, G. L., and Stainier, D. Y. (1999). Casanova plays an early and essential role in endoderm formation in zebrafish. Dev Biol
215, 343-357.
Alexander, J., and Stainier, D. Y. (1999). A molecular pathway leading to endoderm formation in zebrafish. Curr Biol 9, 1147-1157.
Aoki, T. O., Mathieu, J., Saint-Etienne, L., Rebagliati, M. R., Peyrieras, N., and Rosa, F. M. (2002). Regulation of nodal signalling and mesendoderm formation by TARAM-A, a TGFbeta-related type I receptor. Dev Biol 241, 273-288.
Beck, S., Le Good, J. A., Guzman, M., Ben Haim, N., Roy, K., Beermann, F., and Constam, D. B. (2002). Extra-embryonic proteases regulate Nodal signalling during
gastrulation. Nat Cell Biol 4, 981-985.
Beddington, R. S., Rashbass, P., and Wilson, V. (1992). Brachyury--a gene affecting mouse gastrulation and early organogenesis. Dev Suppl, 157-165.
Bongso, A., Fong, C. Y., Ng, S. C., and Ratnam, S. (1994). Isolation and culture
of inner cell mass cells from human blastocysts. Hum Reprod 9, 2110-2117.
Chang, H., Brown, C. W., and Matzuk, M. M. (2002). Genetic analysis of the mammalian transforming growth factor-beta superfamily. Endocr Rev 23, 787-823.
Conlon, F. L., Lyons, K. M., Takaesu, N., Barth, K. S., Kispert, A., Herrmann, B., and Robertson, E. J. (1994). A primary requirement for nodal in the formation
and maintenance of the primitive streak in the mouse. Development 120, 1919-1928.
Dougan, S. T., Warga, R. M., Kane, D. A., Schier, A. F., and Talbot, W. S. (2003). The role of the zebrafish nodal-related genes squint and cyclops in patterning of mesendoderm. Development 130, 1837-1851.
Feldman, B., Gates, M. A., Egan, E. S., Dougan, S. T., Rennebeck, G., Sirotkin, H. I., Schier, A. F., and Talbot, W. S. (1998). Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature 395, 181-185.
Feng, Y., Broder, C. C., Kennedy, P. E., and Berger, E. A. (1996). HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane, G protein-coupled receptor. Science 272, 872-877.
Futaki, S., Hayashi, Y., Yamashita, M., Yagi, K., Bono, H., Hayashizaki, Y., Okazaki, Y., and Sekiguchi, K. (2003). Molecular basis of constitutive production of basement membrane components: Gene expression profiles of engelbreth-holm-swarm tumor and F9 embryonal carcinoma cells. J Biol Chem.
Grapin-Botton, A., and Melton, D. A. (2000). Endoderm development: from patterning to organogenesis. Trends Genet 16, 124-130.
Harris, T. M., and Childs, G. (2002). Global gene expression patterns during differentiation of F9 embryonal carcinoma cells into parietal endoderm. Funct Integr Genomics 2, 105-119.
Hogan, B. L. (1996). Bone morphogenetic proteins in development. Curr Opin Genet
Dev 6, 432-438.
Hogan, B. L. (1997). Pluripotent embryonic cells and methods of making same (U.S.A., Vanderbilt University).
Howe, C. C., Overton, G. C., Sawicki, J., Solter, D., Stein, P., and Strickland,
S. (1988). Expression of SPARC/osteonectin transcript in murine embryos and gonads. Differentiation 37, 20-25.
Hudson, C., Clements, D., Friday, R. V., Stott, D., and Woodland, H. R. (1997). Xsox17alpha and -beta mediate endoderm formation in Xenopus. Cell 91, 397-405.
Imada, M., Imada, S., Iwasaki, H., Kume, A., Yamaguchi, H., and Moore, E. E. (1987). Fetomodulin: marker surface protein of fetal development which is modulatable by cyclic AMP. Dev Biol 122, 483-491.
Kanai-Azuma, M., Kanai, Y., Gad, J. M., Tajima, Y., Taya, C., Kurohmaru, M., Sanai, Y., Yonekawa, H., Yazaki, K., Tam, P. P., and Hayashi, Y. (2002). Depletion of definitive gut endoderm in Sox17-null mutant mice. Development 129, 2367-2379.
Katoh, M. (2002). Expression of human SOX7 in normal tissues and tumors. Int J Mol Med 9, 363-368.
Kikuchi, Y., Agathon, A., Alexander, J., Thisse, C., Waldron, S., Yelon, D., Thisse, B., and Stainier, D. Y. (2001). casanova encodes a novel Sox-related protein necessary and sufficient for early endoderm formation in zebrafish. Genes Dev 15, 1493-1505.
Kim, C. H., and Broxmeyer, H. E. (1999). Chemokines: signal lamps for trafficking of T and B cells for development and effector function. J Leukoc Biol 65, 6-15.
Kimelman, D., and Griffin, K. J. (2000). Vertebrate mesendoderm induction and patterning. Curr Opin Genet Dev 10, 350-356.
Kubo A, Shinozaki K, Shannon JM, Kouskoff V, Kennedy M, Woo S, Fehling HJ, Keller G. (2004) Development of definitive endoderm from embryonic stem cells in culture. Development. 131,1651-62.
Kumar, A., Novoselov, V., Celeste, A. J., Wolfman, N. M., ten Dijke, P., and Kuehn, M. R. (2001). Nodal signaling uses activin and transforming growth factor-be
ta receptor-regulated Smads. J Biol Chem 276, 656-661.
Labosky, P. A., Barlow, D. P., and Hogan, B. L. (1994a). Embryonic germ cell lines and their derivation from mouse primordial germ cells. Ciba Found Symp 182, 157-168; discussion 168-178.
Labosky, P. A., Barlow, D. P., and Hogan, B. L. (1994b). Mouse embryonic germ (EG) cell lines: transmission through the germline and differences in the methylation imprint of insulin-like growth factor 2 receptor (Igf2r) gene compared with embryonic stem (ES) cell lines. Development 120, 3197-3204.
Lickert, H., Kutsch, S., Kanzler, B., Tamai, Y., Taketo, M. M., and Kemler, R. (2002). Formation of multiple hearts in mice following deletion of beta-catenin in the embryonic endoderm. Dev Cell 3, 171-181.
Lu, C. C., Brennan, J., and Robertson, E. J. (2001). From fertilization to gastrulation: axis formation in the mouse embryo. Curr Opin Genet Dev 11, 384-392.
Ma, Q., Jones, D., and Springer, T. A. (1999). The chemokine receptor CXCR4 is required for the retention of B lineage and granulocytic precursors within the bone marrow microenvironment. Immunity 10, 463-471.
McGrath KE, Koniski AD, Maltby KM, McGann JK, Palis J. (1999) Embryonic expression and function of the chemokine SDF-1 and its receptor, CXCR4. Dev Biol. 213, 442-56.
Miyazono, K., Kusanagi, K., and Inoue, H. (2001). Divergence and convergence of TGF-beta/BMP signaling. J Cell Physiol 187, 265-276.
Nagasawa, T., Hirota, S., Tachibana, K., Takakura, N., Nishikawa, S., Kitamura, Y., Yoshida, N., Kikutani, H., and Kishimoto, T. (1996). Defects of B-cell lymphopoiesis and bone-marrow myelopoiesis in mice lacking the CXC chemokine PBSF/SDF-1. Nature 382, 635-638.
Niwa, H. (2001). Molecular mechanism to maintain stem cell renewal of ES cells. Cell Struct Funct 26, 137-148.
Ogura, H., Aruga, J., and Mikoshiba, K. (2001). Behavioral abnormalities of Zic1
and Zic2 mutant mice: implications as models for human neurological disorders. Behav Genet 31, 317-324.
Reubinoff, B. E., Pera, M. F., Fong, C. Y., Trounson, A., and Bongso, A. (2000).
Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat Biotechnol 18, 399-404.
Rodaway, A., and Patient, R. (2001). Mesendoderm. an ancient germ layer? Cell 105, 169-172.
Rodaway, A., Takeda, H., Koshida, S., Broadbent, J., Price, B., Smith, J. C., Patient, R., and Holder, N. (1999). Induction of the mesendoderm in the zebrafish germ ring by yolk cell-derived TGF-beta family signals and discrimination of mesoderm and endoderm by FGF. Development 126, 3067-3078.
Rohr, K. B., Schulte-Merker, S., and Tautz, D. (1999). Zebrafish zic1 expression
in brain and somites is affected by BMP and hedgehog signalling. Mech Dev 85, 147-159.
Schier, A. F. (2003). Nodal signaling in vertebrate development. Annu Rev Cell Dev Biol 19, 589-621.
Schoenwolf, G. C., and Smith, J. L. (2000). Gastrulation and early mesodermal patterning in vertebrates. Methods Mol Biol 135, 113-125.
Shamblott, M. J., Axelman, J., Wang, S., Bugg, E. M., Littlefield, J. W., Donovan, P. J., Blumenthal, P. D., Huggins, G. R., and Gearhart, J. D. (1998). Derivation of pluripotent stem cells from cultured human primordial germ cells. Proc Natl Acad Sci U S A 95, 13726-13731.
Shapiro, A. M., Lakey, J. R., Ryan, E. A., Korbutt, G. S., Toth, E., Warnock, G.
L., Kneteman, N. M., and Rajotte, R. V. (2000). Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med 343, 230-238.
Shapiro, A. M., Ryan, E. A., and Lakey, J. R. (2001a). Pancreatic islet transplantation in the treatment of diabetes mellitus. Best Pract Res Clin Endocrinol Metab 15, 241-264.
Shapiro, J., Ryan, E., Warnock, G. L., Kneteman, N. M., Lakey, J., Korbutt, G. S., and Rajotte, R. V. (2001b). Could fewer islet cells be transplanted in type 1
diabetes? Insulin independence should be dominant force in islet transplantation. Bmj 322, 861.
Shiozawa, M., Hiraoka, Y., Komatsu, N., Ogawa, M., Sakai, Y., and Aiso, S. (1996). Cloning and characterization of Xenopus laevis xSox7 cDNA. Biochim Biophys Acta 1309, 73-76.
Smith, J. (1997). Brachyury and the T-box genes. Curr Opin Genet Dev 7, 474-480.Smith, J. C., Armes, N. A., Conlon, F. L., Tada, M., Umbhauer, M., and Weston, K. M. (1997). Upstream and downstream from Brachyury, a gene required for vertebrate mesoderm formation. Cold Spring Harb Symp Quant Biol 62, 337-346.
Takash, W., Canizares, J., Bonneaud, N., Poulat, F., Mattei, M. G., Jay, P., and
Berta, P. (2001). SOX7 transcription factor: sequence, chromosomal localisation, expression, transactivation and interference with Wnt signalling. Nucleic Acids Res 29, 4274-4283.
Taniguchi, K., Hiraoka, Y., Ogawa, M., Sakai, Y., Kido, S., and Aiso, S. (1999).
Isolation and characterization of a mouse SRY-related cDNA, mSox7. Biochim Biophys Acta 1445, 225-231.
Technau, U. (2001). Brachyury, the blastopore and the evolution of the mesoderm.
Bioessays 23, 788-794.
Thomson, J. A., Itskovitz-Eldor, J., Shapiro, S. S., Waknitz, M. A., Swiergiel, J. J., Marshall, V. S., and Jones, J. M. (1998). Embryonic stem cell lines derived from human blastocysts. Science 282, 1145-1147.
Tremblay, K. D., Hoodless, P. A., Bikoff, E. K., and Robertson, E. J. (2000). Formation of the definitive endoderm in mouse is a Smad2-dependent process. Development 127, 3079-3090.
Vandesompele, J., De Preter, K., Pattyn, F., Poppe, B., Van Roy, N., De Paepe, A., and Speleman, F. (2002). Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol 3, RESEARCH0034.
Varlet, I., Collignon, J., and Robertson, E. J. (1997). nodal expression in the primitive endoderm is required for specification of the anterior axis during mouse gastrulation. Development 124, 1033-1044.
Vincent, S. D., Dunn, N. R., Hayashi, S., Norris, D. P., and Robertson, E. J. (2003). Cell fate decisions within the mouse organizer are governed by graded Nodal signals. Genes Dev 17, 1646-1662.
Weiler-Guettler, H., Aird, W. C., Rayburn, H., Husain, M., and Rosenberg, R. D. (1996). Developmentally regulated gene expression of thrombomodulin in postimplantation mouse embryos. Development 122, 2271-2281.
Weiler-Guettler, H., Yu, K., Soff, G., Gudas, L. J., and Rosenberg, R. D. (1992). Thrombomodulin gene regulation by cAMP and retinoic acid in F9 embryonal carcinoma cells. Proceedings Of The National Academy Of Sciences Of The United States
Of America 89, 2155-2159.
Wells, J. M., and Melton, D. A. (1999). Vertebrate endoderm development. Annu Rev Cell Dev Biol 15, 393-410.
Wells, J. M., and Melton, D. A. (2000). Early mouse endoderm is patterned by soluble factors from adjacent germ layers. Development 127, 1563-1572.
Willison, K. (1990). The mouse Brachyury gene and mesoderm formation. Trends Genet 6, 104-105.
Zhao, G. Q. (2003). Consequences of knocking out BMP signaling in the mouse. Genesis 35, 43-56.
Zhou, X., Sasaki, H., Lowe, L., Hogan, B. L., and Kuehn, M. R. (1993). Nodal is a novel TGF-beta-like gene expressed in the mouse node during gastrulation. Nature 361, 543-547.
【技術分野】
【0001】
本願は、2003年12月23日に出願された、名称「DEFINITIVE ENDODERM(胚体内胚葉)」の米国仮特許出願第60/532,004号明細書に対する米国特許法第119条(e)に基づく優先権と、2004年7月9日に出願された、名称「CHEMOKINE CELL SURFACE RECEPTOR FOR THE ISOLATION OF DEFINITIVE ENDODERM(胚体内胚葉分離用ケモカイン細胞表面受容体)」の米国仮特許出願第60/586,566号明細書に対する米国特許法第119条(e)に基づく優先権と、2004年7月14日に出願された、名称「CHEMOKINE CELL SURFACE RECEPTOR FOR THE ISOLATION OF DEFINITIVE ENDODERM(胚体内胚葉分離用ケモカイン細胞表面受容体)」の米国仮特許出願第60/587,942号明細書に対する米国特許法第119条(e)に基づく優先権とを主張する正規特許出願である。上記優先権を伴う各出願における全開示内容は、引用することにより本明細書の一部とされる。
【0002】
本発明は、医学および細胞生物学の分野に関する。より詳細には、本発明は、哺乳類胚体内胚葉細胞を含む組成物と、そのような細胞の作製、分離および使用方法に関する。
【背景技術】
【0003】
胚性幹(ES)細胞や胚性生殖(EG)細胞などのヒト多能性幹細胞は、まず1994年に、線維芽細胞フィーダーを使用しない培養(Bongo et al.、1994)、そして線維芽細胞フィーダーを使用した培養(Hogan、1997)において分離された。その後、Thomson、ReubinoffおよびShamblottが、有糸分裂的に不活性化したマウスの支持細胞層を用いてヒトESおよびEG細胞の連続培養を確立した(Reubinoff et al.、2000;Shamblott et al.、1998;Thomson et al.、1998)。
ヒトESおよびEG細胞(hESC)は、ヒト発生の初期段階の研究、並びに糖尿病やパーキンソン病などのいくつかの病状における治療的介入に極めて貴重な機会を提供する。例えば、hESCに由来するインシュリン産生β細胞の使用により、ドナー膵臓からの細胞を利用する現在の細胞療法に多大な進歩をもたらす。しかしながら、現在、hESCからインシュリン産生β細胞を生成する方法は知られていない。そのため、ドナー膵臓の膵島細胞を利用する糖尿病用の細胞治療法は、移植に必要な良質の膵島細胞の不足により制限されている。一人のI型糖尿病患者に対する細胞療法では、約8×108個の膵島細胞の移植を必要とする。(Shapiro et al.,2000;Shapiro et al.,2001a;Shapiro et al.,2001b)。よって、臓器移植を成功させるのに十分な膵島細胞を得るためには、少なくとも2つの健康なドナー臓器が必要である。hESCは、ヒト細胞療法用に相当な量の良質の分化細胞を発生させるための出発物質の源を提供する。
hESCが細胞療法の用途に非常に適している所以たる二つの特性は、多能性と、遺伝子変化が蓄積することなく、これらの細胞を培養物中において長期間維持する能力である。多能性は、3つの一次胚葉(内胚葉、中胚葉、外胚葉)全ての誘導体に分化し、引いては、胚体外組織(例えば、胎盤)および生殖細胞に加え、成熟した生物体の全体細胞型を形成する、hESCの能力により定義される。多能性は、hESCに並はずれた有用性を付与するが、この特性はまた、これらの細胞とその誘導体を研究および取り扱う上で、独自の難題をもたらす。多種多様な細胞型が、分化hESC培養物中に発生し得ることから、非常に多くの細胞型が、非常に低い効率で作製される。さらに、特定の細胞型の作製を評価する上での成功は、適切なマーカーを明確にすることに大きく依存している。効率の良い、一定方向への分化を達成することは、hESCの治療への応用にとってかなり重要な
ことである。
【発明の開示】
【発明が解決しようとする課題】
【0004】
細胞療法の用途において有用な細胞を生成する出発物質としてhESCを使用するためには、上述の問題を克服することが有益である。例えば、膵島細胞移植治療に必要なレベルの細胞物質にするためには、分化のかなり初期段階で、膵島/β細胞系列の方向にhESCを効率的に誘導することが有益である。
また、分化プロセスの効率的な誘導に加えて、膵島/β細胞系列方向への分化経路にそって中間細胞型を分離し特徴付けることや、分化における更なる段階に適した系列前駆物質などの細胞を使用することも有益である。
【課題を解決するための手段】
【0005】
本発明のいくつかの実施形態は、胚体内胚葉細胞を含む細胞培養物に関連するものである。前記胚体内胚葉細胞は、腸管または腸管に由来する器官の細胞に分化し得る多分化能細胞である。ある実施形態によると、胚体内胚葉細胞は、哺乳類細胞であり、好適な一実施形態においては、胚体内胚葉細胞はヒト細胞である。本発明のいくつかの実施形態において、胚体内胚葉細胞は、一定のマーカーを発現する場合もあれば、顕著には発現しない場合もある。いくつかの実施形態においては、SOX17、CXCR4、MIXL1、GATA4、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1、およびCRIP1から選択される一以上のマーカーが、胚体内胚葉細胞において発現する。他の実施形態においては、OCT4、アルファフェトプロテイン(AFP)、トロンボモジュリン(TM)、SPARCおよびSOX7から選択される一以上のマーカーは、胚体内胚葉細胞において顕著に発現することはない。
本発明の他の実施形態により、多能性細胞から胚体内胚葉を作製する方法を説明する。いくつかの実施形態において、多能性細胞は桑実胚に由来する。いくつかの実施形態においては、多能性幹細胞は、幹細胞である。これらの方法で使用される幹細胞としては、胚性幹細胞が挙げられるが、これに限定されるものではない。胚性幹細胞は、胚の内部細胞塊または胚の生殖隆起に由来し得る。胚性幹細胞は、これらに限定されはしないが、ヒトを含むさまざまな哺乳類種を始めとした、さまざまな動物種に由来し得る。好適な一実施形態においては、ヒト胚性幹細胞が、胚体内胚葉の作製に使用される。
本発明のいくつかの実施形態においては、一以上の増殖因子が、多能性細胞から胚体内胚葉細胞への分化プロセス(分化工程)で使用される。分化プロセスにおいて使用される前記一以上の増殖因子は、TGFβスーパーファミリーの増殖因子を含んでいてもよい。そのような実施形態において、前記一以上の増殖因子は、増殖因子のTGFβスーパーファミリーのノーダル/アクチビンおよび/またはBMPサブグループを含む。いくつかの実施形態において、前記一以上の増殖因子は、ノーダル、アクチビンA、アクチビンB、BMP4、Wnt3aまたはこれら増殖因子のあらゆる組み合わせからなる群から選択される。
本発明の実施形態はまた、胚体内胚葉細胞で濃縮された細胞の集団に関する。ある実施形態において、胚体内胚葉細胞は、分離または実質的に精製される。いくつかの実施形態において、分離または実質的に精製された胚体内胚葉細胞は、OCT4、AFP、TM、SPARCおよび/またはSOX7マーカーより、SOX17および/またはCXRC4マーカーを高度に発現する。
また、胚体内胚葉で細胞集団を濃縮する方法も検討されている。いくつかの実施形態において、胚体内胚葉細胞の表面には存在するが、混合細胞集団内の他の細胞の表面には存在しない分子に結合する試薬に細胞を接触させ、その試薬に結合した細胞を分離することにより、胚体内胚葉細胞を混合細胞集団から分離あるいは実質的に精製することができる。ある実施形態において、胚体内胚葉細胞の表面に存在する分子はCXCR4である。
本発明のさらに別の実施形態は、CXCR4抗体、SDF−1リガンドまたはCXCR4
に対する他のリガンドに関するものであり、濃縮、分離または実質的に精製された形態で胚体内胚葉細胞を得るために使用することができる。例えば、CXCR4抗体、SDF−1リガンドまたはCXCR4に対する他のリガンドは、親和性による分離や磁気による分離などの方法において試薬として使用し、試薬に結合する胚体内胚葉細胞の調整物を濃縮、分離または実質的に精製することができる。
本明細書に記載されている発明の他の実施形態は、多能性細胞や胚体内胚葉細胞を含む細胞培養物などの組成物に関する。ある実施形態において、細胞培養物は、幹細胞と胚体内胚葉細胞とを共に含む。そのような培養物に存在する幹細胞の数は、その培養物中の胚体内胚葉細胞の数より多くても、等しくても、または少なくてもよい。いくつかの実施形態において、幹細胞はヒト胚性幹細胞である。ある実施形態において、hESCは、支持細胞層で維持される。そのような実施形態において、支持細胞層の細胞は、ヒト、マウスまたは他の適切な生物体から得られる、線維芽細胞などの細胞であってもよい。
また、本発明のいくつかの実施形態において、胚体内胚葉細胞とhESCを含む組成物は、一以上の増殖因子も含む。そのような増殖因子としては、TGFβスーパーファミリーの増殖因子を挙げることができる。そのような実施形態において、前記一以上の増殖因子は、増殖因子のTGFβスーパーファミリーのノーダル/アクチビンおよび/またはBMPサブグループを含む。いくつかの実施形態において、前記一以上の増殖因子は、ノーダル、アクチビンA、アクチビンB、BMP4、Wnt3aまたはこれら増殖因子のあらゆる組み合わせからなる群から選択される。
本発明の他の実施形態は、以下番号を付した項目を参照して説明する。
1.ヒト細胞を含む細胞培養物であって、前記ヒト細胞の少なくとも約10%が胚体内胚葉細胞であり、前記胚体内胚葉細胞が、腸管またはそれに由来する器官の細胞に分化し得る多分化能細胞である細胞培養物
2.前記ヒト細胞の少なくとも約50%が、胚体内胚葉細胞である項目1に記載の細胞培養物。
3.前記ヒト細胞の少なくとも約80%が、胚体内胚葉細胞である項目1に記載の細胞培養物。
4.前記胚体内胚葉細胞が、SOX17およびCXCR4からなる群から選択されるマーカーを発現する項目1に記載の細胞培養物。
5.前記胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、OCT4、アルファフェトプロテイン(AFP)、トロンボモジュリン(TM)、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目4に記載の細胞培養物。
6.前記胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーを発現しない項目4に記載の細胞培養物。
7.前記胚体内胚葉細胞が、MIXL1、GATA4およびHNF3bからなる群から選択されるマーカーを発現する項目4に記載の細胞培養物。
8.前記胚体内胚葉細胞が、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーを発現する項目4に記載の細胞培養物
9.前記胚体内胚葉細胞が、SOX17およびCXCR4を発現する項目1に記載の細胞培養物。
10.前記胚体内胚葉細胞において、SOX17およびCXCR4の発現が、OCT4、AFP、TM、SPARCおよびSOX7の発現より多い項目9に記載の細胞培養物。
11.前記胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7を発現しない項目9に記載の細胞培養物。
12.前記胚体内胚葉細胞が、MIXL1、GATA4およびHNF3bを発現する項目9に記載の細胞培養物。
13.前記胚体内胚葉細胞が、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーを発現する項目9に記載の細胞
培養物。
14.前記細胞培養物において、多能性細胞約1個につき少なくとも約2個程度の胚体内胚葉細胞が存在する項目1に記載の細胞培養物。
15.前記多能性細胞が、胚性幹細胞を含む項目14に記載の細胞培養物。
16.前記胚性幹細胞が、桑実胚、胚の内部細胞塊(ICM)および胚の生殖隆起からなる群から選択される組織に由来する項目15に記載の細胞培養物。
17.さらに、約10%未満の血清を含む培地を含む項目1に記載の細胞培養物。
18.さらに、TGFβスーパーファミリーのノーダル/アクチビンサブグループの増殖因子を含む項目1に記載の細胞培養物。
19.さらに、ノーダル、アクチビンA、アクチビンBおよびそれらの組み合わせからなる群から選択される増殖因子を含む項目1に記載の細胞培養物。
20.細胞を含む細胞集団であって、前記細胞の少なくとも約90%が、ヒト胚体内胚葉細胞であり、前記ヒト胚体内胚葉細胞が、腸管またはそれに由来する器官の細胞に分化し得る多分化能細胞である細胞集団。
21.前記細胞の少なくとも約95%が、ヒト胚体内胚葉細胞である項目20に記載の細胞集団。
22.前記細胞の少なくとも約98%が、ヒト胚体内胚葉細胞である項目20に記載の細胞集団。
23.前記ヒト胚体内胚葉細胞が、SOX17およびCXCR4からなる群から選択されるマーカーを発現する項目20に記載の細胞集団。
24.前記ヒト胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目23に記載の細胞集団。
25.前記ヒト胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーを発現しない項目23に記載の細胞集団。
26.前記ヒト胚体内胚葉細胞が、MIXL1、GATA4およびHNF3bからなる群から選択されるマーカーを発現する項目23に記載の細胞集団。
27.前記胚体内胚葉細胞が、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーを発現する項目23に記載の細胞集団。
28.前記ヒト胚体内胚葉細胞が、SOX17およびCXCR4を発現する項目20に記載の細胞集団。
29.前記ヒト胚体内胚葉細胞において、SOX17およびCXCR4の発現が、OCT4、AFP、TM、SPARCおよびSOX7の発現より多い項目28に記載の細胞集団。
30.前記ヒト胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7を発現しない項目28に記載の細胞集団。
31.前記ヒト胚体内胚葉細胞が、MIXL1、GATA4およびHNF3bを発現する項目28に記載の細胞集団。
32.前記胚体内胚葉細胞が、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーを発現する項目28に記載の細胞集団。
33.前記細胞集団において、多能性細胞約1個につき少なくとも約2個程度のヒト胚体内胚葉細胞が存在する項目20に記載の細胞集団。
34.前記多能性細胞が、胚性幹細胞を含む項目33に記載の細胞集団。
35.前記胚性幹細胞が、桑実胚、胚のICMおよび胚の生殖隆起から選択される組織に由来する項目34に記載の細胞集団。
36.胚体内胚葉細胞の作製方法であって、前記方法は、
多能性ヒト細胞を含む細胞集団を得る工程と、
腸管またはそれに由来する器官の細胞に分化し得る多分化能細胞である胚体内胚葉細胞へ
の、前記多能性細胞の分化を促進するのに十分な量のTGFβスーパーファミリーの少なくとも一つの増殖因子を前記細胞集団に供給する工程と、
胚体内胚葉細胞が形成するための十分な時間を与える工程とを含み、前記胚体内胚葉細胞が形成するための十分な時間を、前記細胞集団における胚体内胚葉細胞の存在を検出することにより決定した胚体内胚葉細胞の作製方法。
37.前記多能性細胞の少なくとも約10%が、胚体内胚葉細胞に分化する項目36に記載の方法。
38.前記多能性細胞の少なくとも約50%が、胚体内胚葉細胞に分化する項目36に記載の方法。
39.前記多能性細胞の少なくとも約70%が、胚体内胚葉細胞に分化する項目36に記載の方法。
40.前記多能性細胞の少なくとも約80%が、胚体内胚葉細胞に分化する項目36に記載の方法。
41.前記細胞集団における胚体内胚葉細胞の存在の検出が、前記細胞集団の細胞において、SOX17およびCXCR4からなる群から選択される少なくとも一つのマーカー、並びにOCT4、AFP、TM、SPARCおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目36に記載の方法。
42.前記細胞集団における胚体内胚葉細胞の存在の検出が、前記細胞集団の細胞において、SOX17およびCXCR4からなる群から選択される少なくとも一つのマーカー、並びにAFP、TMおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、AFP、TMおよびSOX7からなる群から選択されるマーカーの発現より多い項目36に記載の方法。
43.前記マーカーの少なくとも一つの発現が、Q−PCRにより測定される項目42に記載の方法。
44.前記マーカーの少なくとも一つの発現が、免疫細胞化学により測定される項目42に記載の方法。
45.前記細胞集団における胚体内胚葉細胞の存在の検出が、前記細胞集団の細胞において、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択される少なくとも一つのマーカー、並びにOCT4、AFP、TM、SPARCおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーの発現が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目36に記載の方法。
46.前記少なくとも一つの増殖因子が、TGFβスーパーファミリーのノーダル/アクチビンサブグループのものである項目36に記載の方法。
47.前記少なくとも一つの増殖因子が、ノーダル、アクチビンA、アクチビンBおよびそれらの組み合わせからなる群から選択される項目46に記載の方法。
48.前記少なくとも一つの増殖因子が、ノーダルである項目47に記載の方法
49.前記の少なくとも一つの増殖因子が、アクチビンAである項目47に記載の方法。50.前記少なくとも一つの増殖因子が、アクチビンBである項目47に記載の方法。
51.TGFβスーパーファミリーの複数の増殖因子を供給する項目36に記載の方法。52.前記複数の増殖因子が、ノーダル、アクチビンAおよびアクチビンBを含む項目51に記載の方法。
53.前記少なくとも一つの増殖因子を、少なくとも約10ng/mlの濃度で供給する項目36に記載の方法。
54.前記少なくとも一つの増殖因子を、少なくとも約100ng/mlの濃度で供給する項目36に記載の方法。
55.前記少なくとも一つの増殖因子を、少なくとも約500ng/mlの濃度で供給する項目36に記載の方法。
56.前記少なくとも一つの増殖因子を、少なくとも約1000ng/mlの濃度で供給する項目36に記載の方法。
57.前記少なくとも一つの増殖因子を、少なくとも約5000ng/mlの濃度で供給する項目36に記載の方法。
58.前記細胞集団を、約10%未満の血清を含む培地で増殖させる項目36に記載の方法。
59.前記多能性細胞が、幹細胞を含む項目36に記載の方法。
60.前記多能性細胞が、胚性幹細胞を含む項目59に記載の方法。
61.前記胚性幹細胞が、桑実胚、胚のICMおよび胚の生殖隆起からなる群から選択される組織に由来する項目60に記載の方法。
62.項目36に記載の方法により作製される胚体内胚葉細胞。
63.胚体内胚葉細胞で濃縮された細胞集団を作製する方法であって、前記方法が、
腸管またはそれに由来する器官の細胞に分化し得る多分化能細胞である胚体内胚葉細胞を産生するように、多能性ヒト細胞の集団内の細胞を分化させる工程と、
前記胚体内胚葉細胞においては発現するが、前記細胞集団内に存在する他の細胞型においては実質的に発現しないマーカーに結合する試薬を、前記細胞集団に供給する工程と、
前記試薬に結合した前記胚体内胚葉細胞を、前記細胞集団内に存在する他の細胞型から分離することにより、胚体内胚葉細胞で濃縮された細胞集団を作製する工程とを含む方法。64.前記分化させる工程が、さらに、多能性ヒト細胞を含む細胞集団を得ることと、腸管またはそれに由来する器官の細胞に分化し得る多分化能細胞である胚体内胚葉細胞への前記多能性細胞の分化を促進するのに十分な量でTGFβスーパーファミリーの少なくとも一つの増殖因子を前記細胞集団に供給することと、胚体内胚葉細胞が形成するための十分な時間を与えることとを含み、前記胚体内胚葉細胞が形成するための十分な時間を、前記細胞集団における胚体内胚葉細胞の存在を検出することにより決定した項目63に記載の方法。
65.検出することが、前記細胞集団の細胞において、SOX17およびCXCR4からなる群から選択される少なくとも一つのマーカー、並びにOCT4、AFP、TM、SPARCおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目63に記載の方法。
66.検出することが、前記細胞集団の細胞において、SOX17およびCXCR4からなる群から選択される少なくとも一つのマーカー、並びにAFP、TMおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、SOX17およびCXCR4からなる群から選択されるマーカーの発現が、AFP、TMおよびSOX7からなる群から選択されるマーカーの発現より多い項目63に記載の方法。
67.検出することが、前記細胞集団の細胞において、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択される少なくとも一つのマーカー、並びにOCT4、AFP、TM、SPARCおよびSOX7からなる群から選択される少なくとも一つのマーカーの発現を検出することを含み、前記胚体内胚葉細胞において、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーの発現が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーの発現より多い項目63に記載の方法。68.前記細胞の少なくとも約95%が、胚体内胚葉細胞である項目63に記載の方法。69.前記細胞の少なくとも約98%が、胚体内胚葉細胞である項目63に記載の方法
70.前記マーカーが、CXCR4である項目63に記載の方法。
71.前記試薬が、抗体である項目63に記載の方法。
72.前記抗体が、CXCR4に親和性を有する項目71に記載の方法。
73.項目63に記載の方法により作製される胚体内胚葉細胞で濃縮された集団。
74.前記胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーを顕著に発現することのない項目4または9のいずれか一つに記載の細胞培養物。
75.前記胚体内胚葉細胞が、OCT4、AFP、TM、SPARCおよびSOX7からなる群から選択されるマーカーを顕著に発現することのない項目23または28のいずれか一つに記載の細胞集団。
当然のことながら、上記方法および組成物は、生体外で培養される細胞に関する。しかしながら、上記の生体外で分化させた細胞組成物は、生体内用に使用してもよい。
本発明の更なる実施形態は、2003年12月23日に出願された、名称「DEFINITIVE ENDODERM(胚体内胚葉)」の米国仮特許出願第60/532,004号明細書、2004年7月9日に出願された、名称「CHEMOKINE CELL SURFACE RECEPTOR FOR THE ISOLATION OF DEFINITIVE ENDODERM(胚体内胚葉分離用ケモカイン細胞表面受容体)」の米国仮特許出願第60/586,566号明細書、および2004年7月14日に出願された、名称「CHEMOKINE CELL SURFACE RECEPTOR FOR THE ISOLATION OF DEFINITIVE ENDODERM(胚体内胚葉分離用ケモカイン細胞表面受容体)」の米国仮特許出願第60/587,942号明細書にも記載されている場合があり、それらの全内容を引用することにより本明細書の一部とする。
【図面の簡単な説明】
【0006】
【図1】図1は、hESCからベータ細胞を作製するために提案された分化経路を示す模式図である。前記経路における第一段階は、ES細胞を胚体内胚葉系列に関係づけ、ES細胞の、膵臓内胚葉、内分泌内胚葉または島/β細胞への更なる分化において周知の初期段階の一つを現す。この移行の媒介に有用ないくつかの因子は、これらに限定されるものではないが、アクチビン、ノーダルおよびBMPを含むTGFβファミリーのメンバーである。胚体内胚葉標的細胞を明示する典型的なマーカーは、SOX17、GATA4、HNF3b、MIX1およびCXCR4である。
【図2】図2は、保存モチーフの位置を示し、GENOVAC社による免疫化処理に使用された領域にスポットを当てた、ヒトSOX17cDNAを示す図である。
【図3】図3は、SOX17が、SOX7に最も密接に関係し、SOX18に対しては幾分関係性が低いことを示す関係系統樹である。SOX17タンパク質は、同一種内のSOX群F亜科の他のメンバーより、種同属体の間でより密接に関係している。
【図4】図4は、ラット抗SOX17抗体を用いて調べたウェスタンブロットを示す。このブロットは、繊維芽細胞で過剰発現したヒトSOX17タンパク質に対するこの抗体の特異性(レーン1)や、EGFPとの免疫反応性の欠如(レーン2)、また最も密接に関係したSOXファミリーメンバーであるSOX7(レーン3)を示す。
【図5】図5A〜Bは、相当数のAFP+同時標識細胞(A)を示すSOX17+細胞のクラスターを示す顕微鏡写真である。これは、AFP+細胞がほとんどまたは全く見られない他のSOX17+クラスター(B)とは著しい対照を成している。
【図6】図6A〜Cは、壁側内胚葉およびSOX17を示す顕微鏡写真である。パネルAは、hES細胞のランダムに分化した培養物中における、壁側内胚葉細胞の細胞表面に位置するヒトトロンボモジュリン(TM)タンパク質に対する免疫細胞化学法を示している。パネルBは、TMおよびSOX17に対し二重標識した、Aに示したものと同一の領域である。パネルCは、DAPIで標識された核を有する同一領域の位相差画像である。DAPIで標識された核とSOX17標識の完全な相関性に注目されたい。
【図7】図7A〜Bは、定量PCR(Q−PCR)によるSOX17遺伝子発現と、SOX17特異抗体による抗SOX17陽性細胞とを示す棒グラフである。パネルAは、未分化対照培地(SR20)と比較して、レチノイン酸(RA)はSOX17発現を強力に抑制する一方で、アクチビンAはSOX17遺伝子発現を増加させることを示している。パネルBは、同一のパターンを示し、これら同程度の変化は、SOX17+細胞数に反映されており、これは、SOX17遺伝子発現の定量PCR測定が、単一細胞レベルでの変化に高度に反映されていることを示している。
【図8】図8Aは、10%ウシ胎児血清(FBS)中、ランダムに分化させた細胞がAFPの大幅な発現増加を示す一方で、アクチビンAの存在下における分化hESCの培養物のAFP遺伝子発現が低レベルにとどまることを示す棒グラフである。発現量には約7倍の差がある。図8B〜Cは、10%FBSのみの場合(上)に対して、アクチビンA処理状態(下)において見られる非常に少ない小さなAFP+細胞クラスターにより示されるように、アクチビンAによるAFP発現の抑制も、単一細胞レベルにおいて明白であることを示す2枚の顕微鏡写真の画像である。
【図9】図9A〜Bは、フローサイトメトリーを用いたAFP+細胞数の定量化を示す比較画像である。この図は、アクチビンAの存在下(右のパネル)および不在下(左のパネル)におけるAFP遺伝子発現(図8A)における変化の大きさが、AFP+細胞数に厳密に対応することを示しており、これは、単一細胞レベルで生じる変化を示すための定量PCR分析の有用性をさらに裏付けている。
【図10】図10A〜Fは、ノーダル、アクチビンAおよびアクチビンB(NAA)にhESCを暴露することにより、5日間(A〜C)でSOX17+細胞の数が著しく増加することを示す顕微鏡写真である。各領域に存在する総細胞数をSOX17+細胞の相対存在量と比較することにより、DAPIで染色された核(D〜F)により示されているように、NAAによる5日間の処理後、全細胞の約30〜50%が、SOX17に対し免疫反応性を有することが分かる。
【図11】図11は、分化hESCにおいて、アクチビンA(0、10、30又は100ng/mL)が、SOX17遺伝子発現を用量依存的に増加させることを示す棒グラフである。発現は、接着培養での3日間の処理後、すでに激しく増加しており、その後の1、3および5日間の浮遊培養中も引き続き同様に増加している。
【図12】図12A〜Cは、MIXL1(パネルA)、GATA4(パネルB)およびHNF3b(パネルC)の発現に対するアクチビンAの効果を示す棒グラフである。また、アクチビンA用量依存的増加は、胚体内胚葉のその他の3つのマーカーである、MIXL1、GATA4およびHNF3bに関しても見られる。アクチビンの投与量に応じて増加する発現の程度は、SOX17に関して観察されたものと非常に類似しており、これは、アクチビンAが、4つ全ての遺伝子(SOX17+、MIXL1+、GATA4+およびHNF3b+)を共に発現する細胞の集団を特定していることを強く示唆している。
【図13】図13A〜Cは、AFP(パネルA)、SOX7(パネルB)およびSPARC(パネルC)の発現に対するアクチビンAの効果を示す棒グラフである。臓側内胚葉のマーカーAFPの発現は、アクチビンAの用量に依存して減少している。いくつかの時点において、原始内胚葉(SOX7)および壁側内胚葉(SPARC)のマーカーは、変化していないか、または抑制されており、これは、アクチビンAが、これらの胚外内胚葉細胞型を特定する働きをしないことを示唆している。これは、SOX17、MIXL1、GATA4およびHNF3bの発現の増加が、アクチビンAに応じた胚体内胚葉細胞数の増加によるものであることをさらに裏付けている。
【図14】図14A〜Bは、ZIC1(パネルA)およびBrachyury(パネルB)の発現に対するアクチビンAの効果を示す棒グラフである。神経マーカーZIC1の一貫した発現は、神経分化へのアクチビンA用量依存的効果がないことを示す。Brachyuryの発現の減少によって示されているように、アクチビンA100ng/mLを用いた処理を介した中胚葉の分化は著しく抑制されている。これは、おそらく、中内胚葉前駆体からの胚体内胚葉の特異化が進んだ結果であろう。未処理の対照培養物と比較して、分化後期では、少量のアクチビンAを用いた処理(10および30ng/mL)により、Brachyuryの発現が維持されている。
【図15】図15A〜Bは、アクチビンを用いた処理により壁側内胚葉の分化が低減したことを示す顕微鏡写真である。血清のみで分化させた場合、TMhiの壁側内胚葉の領域が、培養物(A)全体に渡って見られた。一方、アクチビンが含まれており(B)、尚且つTM免疫反応性の全体的な強度が低い場合、TM+細胞への分化は殆ど見られない。
【図16】図16A〜Dは、アクチビンAおよびアクチビンBを用いた処理によるマーカーの発現を示す顕微鏡写真である。アクチビンAおよびアクチビンBを用いて4日間連続でhESCを処理し、SOX17、AFPおよびTM抗体で三重標識した。パネルAは、SOX17;パネルBはAFP;パネルCはTM:そしてパネルDが位相(Phase)/DAPIである。AFP(B)およびTM(C)免疫反応性の完全な欠如に関連した多数のSOX17陽性細胞(A)に注目されたい。
【図17】図17は、hESCからの、生体外での胚体内胚葉および臓側内胚葉の発生を示す顕微鏡写真である。臓側内胚葉の領域は、AFPhi/SOX17lo/-により同定されるが、胚体内胚葉は、全く反対の特性、SOX17hi/AFPlo/-を示す。これら二つの領域が互いに近接しているため、この領域を選択した。しかしながら、AFPhi細胞のいずれの領域からも完全に孤立して、SOX17hi/AFPlo/-の領域が見られることが頻繁にある。これは、胚体内胚葉細胞が、臓側内胚葉細胞とは別個に発生することを示唆している。
【図18】図18は、TGFβファミリーのリガンドと受容体を表す図である。AR SmadsとBR Smadsを活性化する因子は、ヒト胚性幹細胞から胚体内胚葉を作製する上で有用である。(J Cell Physiol.187:265−76参照)。
【図19】図19は、TGFβ因子を単独および組合せて用いて処理した結果として、経時的にSOX17発現の誘導を示す棒グラフである。
【図20】図20は、TGFβ因子の組合せを用いて処理した結果として、経時的にSOX17+細胞数の増加を示す棒グラフである。
【図21】図21は、TGFβ因子の組合せを用いて処理した結果として、経時的にSOX17発現の誘導を示す棒グラフである。
【図22】図22は、アクチビンAが、SOX17+細胞数の用量依存的な増加を引き起こすことを示す棒グラフである。
【図23】図23は、アクチビンAおよびアクチビンBで処理された培養物へのWnt3aの添加により、アクチビンAおよびアクチビンBのみにより引き起こされたレベル以上にSOX17の発現が増加することを示す棒グラフである。
【図24】図24A〜Cは、胚体内胚葉への分化が、FBSの少ない条件下で増強されることを示す棒グラフである。2%のFBS(2AA)を含む培地におけるアクチビンAおよびBを用いたhESCの処理は、10%のFBSを含む培地(10AA)における同様の処理と比べて、2〜3倍高いレベルのSOX17発現を引き起こす(パネルA)。また、胚体内胚葉マーカーMIXL1(パネルB)の誘導も同様に影響され、AFP(臓側内胚葉)(パネルC)は、10%FBS条件下より2%FBS条件下で、より大きく抑制されている。
【図25】図25A〜Dは、培養物中、SOX17+細胞が分離していることを示す顕微鏡写真である。SOX17免疫反応細胞は、hESCコロニー(C、D)の分化領域縁部に存在し、増殖性細胞核抗原(PCNA)(パネルB)で標識されるが、OCT4(パネルC)での同時標識はされない。さらに、OCT4+未分化hESC(矢じり形で示す)およびSOX17+細胞(矢印)のいずれにおいても、核のDAPI標識により、明瞭な有糸分裂像が見られる(D)。
【図26】図26は、様々な培地条件下での分化hESCにおけるCXCR4の相対的発現量を示す棒グラフである。
【図27】図27A〜Dは、図26に示した同様の分化処理全体に渡って、胚体内胚葉マーカーに関するパネルが、いかにCXCR4と非常によく似た発現パターンを共有しているかを示す棒グラフである。
【図28】図28A〜Eは、図26に示した同様の処理全体に渡って、中胚葉(Brachyury、MOX1)、外胚葉(SOX1、ZIC1)および臓側内胚葉(SOX7)のマーカーが、いかにCXCR4の発現に対し逆相関性を呈するかを示す棒グラフである。
【図29】図29A〜Fは、図26〜28に示した培地条件の内の3つに関して、SOX17免疫反応細胞における相対的な差異を示す顕微鏡写真である。
【図30】図30A〜Cは、分化培地に添加したアクチビンAの濃度が高くなるにつれ、CXCR4+の細胞数が増加することを示すフローサイトメトリーによるドットプロットである。
【図31】図31A〜Dは、高用量のアクチビンAによる処理(A100−CX+)により分離されたCXCR4+細胞が、母集団(A100)よりも胚体内胚葉マーカーでさらに濃縮されていることを示す棒グラフである。
【図32】図32は、母集団における遺伝子発現、並びに、蛍光標識細胞分取法(FACS)を用いて分離されたCXCR4+およびCXCR4-細胞からの遺伝子発現を示す棒グラフである。これは、CXCR4+細胞が、各母集団に存在するCXCR4の遺伝子発現を本質的にすべて含み、CXCR4-集団は、CXCR4遺伝子発現をほとんどまたは全く含まないことを示している。
【図33】図33A〜Dは、これら非胚体内胚葉マーカーの発現においては既に抑制されている、高用量アクチビンA処理により分離されたCXCR4+細胞における中胚葉(Brachyury、MOX1)、外胚葉(ZIC1)および臓側内胚葉(SOX7)の遺伝子発現の減少を示す棒グラフである。
【図34−1】図34A〜Mは、胚体内胚葉細胞の同定に使用することのできるマーカー遺伝子の発現パターンを示す棒グラフである。胚体内胚葉マーカーである、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1の発現解析は、パネルG〜Lにそれぞれ示されている。また、先に説明した系列標識遺伝子である、SOX17、SOX7、SOX17/SOX7、TM、ZIC1およびMOX1の発現解析は、パネルA〜Fにそれぞれ示されている。パネルMは、CXCR4の発現解析を示している。パネルA〜Mそれぞれに関して、hESCと表示した列は、精製されたヒト胚性幹細胞からの遺伝子発現を示し、2NFは、アクチビンを添加することなく2%FBSで処理した細胞を示し、0.1A100は、アクチビンA100ng/ml、0.1%FBSで処理した細胞を示し、1A100は、アクチビンA100ng/ml、1%FBSで処理した細胞を示し、そして、2A100は、アクチビンA100ng/ml、2%FBSで処理した細胞を示す。
【図34−2】図34A〜Mは、胚体内胚葉細胞の同定に使用することのできるマーカー遺伝子の発現パターンを示す棒グラフである。胚体内胚葉マーカーである、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1の発現解析は、パネルG〜Lにそれぞれ示されている。また、先に説明した系列標識遺伝子である、SOX17、SOX7、SOX17/SOX7、TM、ZIC1およびMOX1の発現解析は、パネルA〜Fにそれぞれ示されている。パネルMは、CXCR4の発現解析を示している。パネルA〜Mそれぞれに関して、hESCと表示した列は、精製されたヒト胚性幹細胞からの遺伝子発現を示し、2NFは、アクチビンを添加することなく2%FBSで処理した細胞を示し、0.1A100は、アクチビンA100ng/ml、0.1%FBSで処理した細胞を示し、1A100は、アクチビンA100ng/ml、1%FBSで処理した細胞を示し、そして、2A100は、アクチビンA100ng/ml、2%FBSで処理した細胞を示す。
【図34−3】図34A〜Mは、胚体内胚葉細胞の同定に使用することのできるマーカー遺伝子の発現パターンを示す棒グラフである。胚体内胚葉マーカーである、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1の発現解析は、パネルG〜Lにそれぞれ示されている。また、先に説明した系列標識遺伝子である、SOX17、SOX7、SOX17/SOX7、TM、ZIC1およびMOX1の発現解析は、パネルA〜Fにそれぞれ示されている。パネルMは、CXCR4の発現解析を示している。パネルA〜Mそれぞれに関して、hESCと表示した列は、精製されたヒト胚性幹細胞からの遺伝子発現を示し、2NFは、アクチビンを添加することなく2%FBSで処理した細胞を示し、0.1A100は、アクチビンA100ng/ml、0.1%FBSで処理した細胞を示し、1A100は、アクチビンA100ng/ml、1%FBSで処理した細胞を示し、そして、2A100は、アクチビンA100ng/ml、2%FBSで処理した細胞を示す。
【発明を実施するための形態】
【0007】
原腸形成と呼ばれるヒト発生初期における極めて重要な段階は、受精後2〜3週間で生じる。原腸形成が極めて重要である理由は、三つの一次胚葉が初めて特定化され組織化されるのがこの時だからである(Lu et al.,2001;Schoenwolf and Smith, 2000)。外胚葉は、体の外皮および全神経系の最終形成をつかさどる一方で、心臓、血液、骨、骨格筋、および他の結合組織は、中胚葉に由来する。胚体内胚葉は、食道、胃、小腸および大腸を含む全腸管、並びに肺、肝臓、胸腺、副甲状腺、甲状腺、胆嚢、および膵臓などの腸管に由来する器官の形成をつかさどる胚葉と定義される(Grapin−Botton and Melton,2000;Kimelman and Griffin,2000;Tremblay et al.,2000;Wells and Melton,1999;Wells and Melton,2000)。胚体内胚葉と、原始内胚葉と呼ばれる、完全に別個の系列の細胞とを区別することは非常に重要である。原始内胚葉は、主として、胚体外組織、主に、ライヘルト膜の細胞外マトリックス物質と胎盤の卵黄嚢の壁側および臓側内胚葉部分の形成をつかさどる。
原腸形成の間、胚体内胚葉形成の過程は、中内胚葉細胞(中胚葉または内胚葉を形成することのできる細胞)が原始線条と呼ばれる構造を通って移動する、細胞移動現象から始まる。胚体内胚葉は、線条前部を通り、そして結節(線条最前部における特殊構造)を通って移動する細胞に由来する。移動が生じるにつれ、胚体内胚葉は、まず、腸管最前部に位置し、腸管後端の形成で終了する。
Conlon et al.,1994;Feldman et al.,1998;Zhou et al.,1993;Aoki et al.,2002;Dougan et al.,2003;Tremblay et al.,2000;Vincent et al.,2003;Alexander et al.,1999;Alexander and Stainier,1999;Kikuchi et al.,2001;Hudson et al.,1997によるゼブラフィッシュとツメガエル、およびKanai−Azuma et al.,2002によるマウスにおける研究などの、胚体内胚葉形成に関する生体内解析は、ヒト胚性幹細胞を用いて、培養皿内でいかに特定の胚葉細胞型を発生させるかに関する基礎を築いている。培養皿内での発生を再現させる上で大きな障害となる、生体外ESC培養に関連した二つの側面がある。第一に、組織化された胚葉または器官構造が作製されない。胚葉および器官に特異な遺伝子マーカーの大部分は、hESC分化培養系において、不均一に発現する。したがって、器官特定の境界がこのように欠如していることから、特定の組織や細胞型の形成を評価するのは困難である。また、特定の胚葉内の一細胞型または組織型において発現するほとんど全ての遺伝子は、別の種類の胚葉の他の細胞または組織型においても発現する。特定の境界がない場合、1〜3個の遺伝子の小標本を用いて遺伝子発現特異性を決定する手段は殆ど無い。したがって、非常に多くの遺伝子を検査しなければならず、そのいくつかは目的の器官または組織の特定の細胞型に存在するものであったり、また、いくつかは、発現しないものであったりする。第二に、特定の発生経路をたどるためには、遺伝子発現パターンのタイミングが非常に重要である。
さらに複雑な問題として、注意すべきは、生体外における幹細胞分化は、いくぶん非同期的に生じ、生体内と比較すると、かなり非同期的に生じるようである。そのため、一細胞群では、原腸形成に関与する遺伝子が発現している一方で、別の細胞群では、最終分化を
始めていることもある。さらに、外因性因子適用の有無にかかわらず、hESC単層または胚様体(EB)の操作により、全体的な遺伝子発現パターンおよび分化状態に関して、大きな差異が生じる場合がある。これらの理由から、培養物に、効果的に特定の分化経路をたどらせるために、異種細胞混合物内の遺伝子発現パターンによって外因性因子の適用時期を決める必要がある。また、培養容器内の細胞の形態学的関連を考慮することも有益である。いわゆる胚様体へと形成される場合、hESCに均一に影響を及ぼす能力は、培養容器内でhESCコロニーおよび/または単層として増殖分化させたhESCほど最適ではない場合もある。
異種性と非同期性の上記問題に対処する効果的な方法として、本発明のいくつかの実施形態では、細胞を分化させる方法を、分化経路において中間細胞型を濃縮、分離および/または精製する方法と組み合わせることを検討する。
本発明の実施形態は、幹細胞などの多能性細胞を、多分化能胚体内胚葉細胞へと分化させることにより、培養物中に胚体内胚葉細胞を作製する新規且つ特定の方法に関する。本明細書に使用されている、「多分化能」または「多分化能細胞」とは、他の特定の細胞型を限定数発生させる細胞型のことを言う。前述のように、胚体内胚葉細胞は、外胚葉または中胚葉から産生される組織に分化するのではなく、腸管や、腸管に由来する器官に分化する。ある好適な実施形態において、胚体内胚葉細胞は、hESCに由来する。そのような工程は、膵臓、肝臓、肺、胃、腸および甲状腺などのヒト内胚葉由来組織の効率的作製の基礎を提供することができる。例えば、胚体内胚葉の作製が、幹細胞の機能性インスリン産生β細胞への分化における第一段階である場合もある。有用な量のインスリン産生β細胞を得るため、膵島/β細胞運命に達する前に生じる各分化段階において、効率よく分化させることが望ましい。幹細胞の胚体内胚葉細胞への分化は、おそらく機能性膵島/β細胞の作製(図1に示す)に向かう最も初期の段階に相当するため、この段階で効率よく分化させることは特に望ましい。
多能性細胞を胚体内胚葉細胞に効率よく分化させることが望ましいことから、本発明のいくつかの態様は、多能性細胞を約50〜80%胚体内胚葉細胞へ転換する、インビトロ方法論に関する。通常、そのような方法には、時間的に特定された所定のやり方における培養物や増殖因子に関する条件の適用が含まれる。胚体内胚葉細胞に特異的に結合する試薬を使用することで、細胞集団内の他の細胞から胚体内胚葉細胞を分離および/または精製することにより、胚体内胚葉細胞でその細胞集団をさらに濃縮することができる。よって、本発明の態様は、胚体内胚葉細胞と、そのような細胞を作製並びに分離および/または精製する方法とに関する。
細胞培養物または細胞集団内の胚体内胚葉細胞の量を測定するためには、培養物または集団において、他の細胞からこの細胞型を識別する方法が望ましい。従って、本発明のある実施形態は、その存在、不在および/または相対的発現量が胚体内胚葉に特異的である細胞マーカーと、そのようなマーカーの発現を検出および測定する方法とに関する。本明細書において使用する、「発現」とは、材料または物質の生成、並びに材料または物質の生成レベルまたは量のことを言う。よって、特異的なマーカーの発現を測定するということは、マーカーの存在または不在を簡易に検出すること、あるいは発現するマーカーの相対量または絶対量のいずれかを検出することを言う。本明細書に使用する、「マーカー」は、観察または検出できるあらゆる分子のことを指す。例えば、マーカーは、特異的遺伝子の転写物などの核酸、遺伝子のポリペプチド生成物、非遺伝子生成物ポリペプチド、糖タンパク質、炭水化物、糖脂質、脂質,リポタンパクまたは小分子を含むが、これらに限定されるものではない。
本発明のいくつかの実施形態において、マーカーの発現の有無および/または量は、定量PCR(Q−PCR)により測定される。例えば、SOX17、CXCR4、OCT4、AFP、TM、SPARC、SOX7、MIXL1、GATA4、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1、CRIP1などの一定の遺伝子マーカーや、本明細書に記載している他のマーカーにより産生される転写物の量は、定量Q−PCRにより測定される。他の実施形態においては、上記遺伝子により発現し
たタンパク質の検出に免疫組織化学が使用される。さらに別の実施形態において、そのようなマーカーの量または相対的比率の確認および測定には、Q−PCRおよび免疫組織化学技術の両方を利用する。
上記のような方法を利用することにより、一以上の適切なマーカーの発現を測定するために、胚体内胚葉細胞を同定するだけでなく、細胞培養物あるいは細胞集団における胚体内胚葉細胞の比率を求めることも可能である。例えば、本発明のいくつかの実施形態において、作製される胚体内胚葉細胞または細胞集団は、非胚体内胚葉細胞型または細胞集団より約2桁多い量のSOX17および/またはCXCR4遺伝子を発現する。他の実施形態において、作製される胚体内胚葉細胞または細胞集団は、非胚体内胚葉細胞型または細胞集団より3桁以上多い量のSOX17および/またはCXCR4遺伝子を発現する。さらに別の実施形態において、作製される胚体内胚葉細胞または細胞集団は、非胚体内胚葉細胞型または細胞集団より、約2桁あるいは3桁以上多い量のSOX17、CXCR4、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択される一以上のマーカーを発現する。
本発明の更なる態様は、胚体内胚葉と、胚体内胚葉細胞で濃縮された細胞集団とを含む細胞培養物に関する。そのため、ある実施形態は、胚体内胚葉細胞を含む細胞培養物に関するものであり、培養物中、前記細胞の少なくとも約50〜80%が、胚体内胚葉細胞である。好適な一実施形態は、ヒト細胞を含む細胞培養物に関するものであり、培養物中、ヒト細胞の少なくとも約50〜80%が、胚体内胚葉細胞である。分化方法の効率は、一定のパラメーターを変更することにより調整できるため、本明細書に記載した分化方法では、多能性細胞の胚体内胚葉への転換は、約5%、約10%、約15%、約20%、約25%、約30%、約35%、約40%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約85%、約90%、約95%、または約95%以上でありうる。前記一定のパラメーターとしては、細胞増殖条件、増殖因子濃度および培養段階のタイミングが挙げられるが、これらに限定されるものではない。本発明の別の実施形態においては、幹細胞集団などの多能性細胞集団の、実質的に純粋な胚体内胚葉細胞集団への転換を検討する。
本明細書に記載している組成物および方法には、いくつかの有用な特性がある。例えば、胚体内胚葉を含む細胞培養物および細胞集団、並びにそのような細胞培養物および細胞集団を作製する方法は、ヒト発生の初期段階をモデル化する上で有用である。さらに、本明細書に記載の組成物と方法は、糖尿病などの病状における治療行為にも役立つ。例えば、胚体内胚葉は、限られた数の組織のみの源となるため、純粋な組織または細胞型の発生に使用することができる。
【0008】
多能性細胞からの胚体内胚葉の作製
本明細書に記載されている胚体内胚葉細胞培養物および胚体内胚葉細胞を含む組成物は、胚性幹細胞などの多能性細胞から作製される。本明細書で使用している、「胚性、胚の(embryonic)」とは、単一の接合体に始まり、発達した配偶子細胞以外の多能性または全能性細胞をもはや含まない多細胞性構造体に終わる、生物体の一連の発生段階を指す。配偶子融合により誘導された胚に加え、用語「胚性、胚の(embryonic)」は、体細胞核移植により誘導された胚も指す。胚体内胚葉細胞を誘導する好ましい方法では、胚体内胚葉作製のための出発物質として、ヒト胚性幹細胞(hESC)を利用する。この方法で使用される胚性幹細胞は、桑実胚、胚の内部細胞塊または胚の生殖隆起から得られたものに由来する細胞であってもよい。ヒト幹細胞は、当技術分野において周知の方法を用いて、実質的に分化することなく多能性の状態で培養物中に維持できる。そのような方法は、例えば、米国特許第5,453,357号明細書、第5,670,372号明細書、第5,690,926号明細書、第5,843,780号明細書、第6,200,806号明細書および第6,251,671号明細書に記載されており、これらの全開示内容は、引用することにより本明細書の一部とされる。
本明細書に記載されている方法のいくつかの実施形態において、hESCは、支持細胞層
で維持される。そのような実施形態においては、hESCを多能性の状態で維持できるいかなる支持細胞層も、本明細書に記載されている方法において使用することができる。ヒト胚性幹細胞の培養に一般に使用される一支持細胞層は、マウス線維芽細胞の層である。さらに最近では、ヒト線維芽細胞の支持細胞層が、hESCの培養に使用するために開発されている(米国特許出願第2002/0072117号明細書参照。この全開示内容は、引用することにより本明細書の一部とされる)。本明細書に記載されている方法の別の実施形態は、支持細胞層を使用することなく、多能性hESCの維持を可能にする。そのような方法は、米国特許出願第2003/0175956号明細書に記載されており、その全開示内容は、引用することにより本明細書の一部とされる。
ここで使用されるヒト胚性幹細胞は、血清の有無にかかわらず培養物中に維持することができる。いくつかの実施形態においては、血清代替物が使用される。別の実施形態においては、米国特許出願第2003/0190748号明細書に記載されているような、無血清培養技術が使用される。この特許出願の全開示内容は、引用することにより本明細書の一部とされる。
幹細胞は、胚体内胚葉への分化が望まれるまで、定期的な継代培養によって、培養物中、多能性の状態で維持される。いくつかの実施形態においては、胚体内胚葉への分化を促進するのに十分な量のTGFβスーパーファミリーの増殖因子を幹細胞培養物に提供することにより、胚体内胚葉に分化させる。胚体内胚葉の作製に有用なTGFβスーパーファミリーの増殖因子は、ノーダル/アクチビンまたはBMPサブグループから選択される。本明細書に記載されている分化方法に係るいくつかの実施形態において、増殖因子は、ノーダル、アクチビンA、アクチビンBおよびBMP4からなる群から選択される。さらに、増殖因子Wnt3aおよび他のWntファミリーメンバーは、胚体内胚葉細胞の作製に有用である。本発明のある実施形態においては、上記増殖因子はいかなる組み合わせでも使用できる。
本明細書に記載されている分化方法の実施形態のいくつかに関して、上記増殖因子は、幹細胞の少なくとも一部の、胚体内胚葉への分化を促進するのに十分な濃度で培養物中に存在するよう、細胞に提供される。本発明のいくつかの実施形態において、上記増殖因子は、少なくとも約5ng/ml、少なくとも約10ng/ml、少なくとも約25ng/ml、少なくとも約50ng/ml、少なくとも約75ng/ml、少なくとも約100ng/ml、少なくとも約200ng/ml、少なくとも約300ng/ml、少なくとも約400ng/ml、少なくとも約500ng/ml、少なくとも約1000ng/ml、少なくとも約2000ng/ml、少なくとも約3000ng/ml、少なくとも約4000ng/ml、少なくとも約5000ng/mlまたは約5000ng/ml以上の濃度で細胞培養物中に存在する。
本発明のある実施形態において、上記増殖因子は、添加後、細胞培養物から除去する。例えば、増殖因子は、添加後、約1日以内、約2日以内、約3日以内、約4日以内、約5日以内、約6日以内、約7日以内、約8日以内、約9日以内又は10日以内に除去してもよい。好適な実施形態において、増殖因子は、添加の約4日後に除去する。
胚体内胚葉細胞の培養物は、少量の血清を含むか、あるいは、血清を含まない培地で増殖させることができる。本発明のある実施形態において、血清濃度は、約0.05%v/v〜約20%v/vの範囲であればよい。例えば、ある実施形態において、培地の血清濃度は、約0.05%(v/v)未満、約0.1%(v/v)未満、約0.2%(v/v)未満、約0.3%(v/v)未満、約0.4%(v/v)未満、約0.5%(v/v)未満、約0.6%(v/v)未満、約0.7%(v/v)未満、約0.8%(v/v)未満、約0.9%(v/v)未満、約1%(v/v)未満、約2%(v/v)未満、約3%(v/v)未満、約4%(v/v)未満、約5%(v/v)未満、約6%(v/v)未満、約7%(v/v)未満、約8%(v/v)未満、約9%(v/v)未満、約10%(v/v)未満、約15%(v/v)未満または約20%(v/v)未満であってもよい。いくつかの実施形態において、胚体内胚葉細胞は、血清なしで増殖させる。他の実施形態においては、胚体内胚葉細胞は、血清代替物を用いて増殖させる。さらに別の実施形態において
、胚体内胚葉細胞は、B27の存在下で増殖させる。そのような実施形態において、B27サプリメントの濃度は、約0.2%v/v〜約20%v/vの範囲であればよい。
hESC培養物の胚体内胚葉への進行は、胚体内胚葉に特有のマーカーの発現を測定することによりモニターすることができる。いくつかの実施形態において、あるマーカーの発現は、マーカーの有無を検出することにより測定される。また、あるマーカーの発現は、細胞培養物または細胞集団の細胞内におけるマーカーの存在量を測ることにより測定される。そのような実施形態において、マーカーの発現測定は、定性的測定であっても定量的測定であってもよい。マーカー遺伝子により作製される発現マーカーを定量化する一方法は、定量PCR(Q−PCR)を利用したものである。Q−PCRを行う方法は、当技術分野においては周知である。また、当技術分野において周知となっている他の方法も、マーカー遺伝子発現の定量化に使用できる。例えば、マーカー遺伝子産物の発現は、目的のマーカー遺伝子産物に特異な抗体を使用することにより検出することができる。本発明のいくつかの実施形態において、胚体内胚葉に特有のマーカー遺伝子の発現のほかに、hESCや他の細胞型に特有のマーカー遺伝子の著しい発現の欠如も測定される。
以下の実施例においてさらに説明するように、胚体内胚葉の信頼できるマーカーは、SOX17遺伝子である。そのため、本明細書に記載されている方法により作製される胚体内胚葉細胞は、SOX17マーカー遺伝子を発現することにより、SOX17遺伝子産物を産生する。胚体内胚葉の他のマーカーは、MIXL1、GATA4、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1である。本発明のいくつかの実施形態において、胚体内胚葉細胞は、原始および臓側内胚葉に特有のSOX7マーカー遺伝子(表1参照)より高いレベルでSOX17マーカー遺伝子を発現する。さらに、いくつかの実施形態においては、SOX17マーカー遺伝子の発現が、hESCに特有のOCT4マーカー遺伝子の発現より多い。本発明の他の実施形態において、胚体内胚葉細胞は、AFP、SPARCまたはトロンボモジュリン(TM)マーカー遺伝子より高いレベルでSOX17マーカー遺伝子を発現する。本発明のある実施形態において、本明細書に記載されている方法により作製されるSOX17発現胚体内胚葉細胞は、有意水準または量のPDX1を発現しない(PDX1陰性)。
胚体内胚葉の別のマーカーは、CXCR4遺伝子である。CXCR4遺伝子は、リガンドが化学誘引物質SDF−1である細胞表面ケモカイン受容体をエンコードする。成体における、CXCR4受容体を有する細胞の主な役割は、造血細胞の骨髄への移動、リンパ球輸送および様々なB細胞とマクロファージ血液細胞系列の分化であると考えられている[Kim,C.およびBroxmeyer,H.J.Leukocyte Biol.65、6−15(1999)]。また、CXCR4受容体は、HIV−1のT細胞侵入のための共同受容体としても機能する[Feng,Y.et al.Science、272、872−877(1996)]。[McGrath,K.E.et al.Dev.Biology 213、442−456(1999)]により行われた広範囲に及ぶ一連の研究では、ケモカイン受容体CXCR4とその特異なリガンド、SDF−1[Kim,C.,およびBroxmyer,H.,J.Leukocyte Biol.65、6−15(1999)]の発現は、マウスの初期発生および成人期において描写された。いずれかの遺伝子が、遺伝子導入マウス内で分裂した場合に、後期胚の致死を引き起こすことが実証されたとき[Nagasawa et al.Nature、382、635−638(1996)]、Ma,Q.,et al Immunity、10、463−471(1999)]、発生過程におけるCXCR4/SDF1の相互作用が明らかになった。McGrath et al.は、RNase保護とインサイツハイブリッド形成方法論を組合せて使用し、CXCR4が、初期原腸陥入胚(E7.5)の間に検出される最も大量のケモカイン受容体メッセンジャーRNAであることを実証した。原腸陥入胚では、CXCR4/SDF−1シグナル伝達は、原条胚葉細胞の移動を誘導することに主に関与しているようであり、このとき存在する胚体内胚葉、中胚葉および胚外中胚葉で見られる。E7.2〜7.8のマウス胚において、CXCR4とアルファフェトプロテインは互いに排他的であり、臓側内胚葉において発現しないことを示している[McGrath,K.E.e
t al.Dev.Biology 213、442−456(1999)]。
本発明のいくつかの実施形態において、本明細書に記載されている方法により作製される胚体内胚葉細胞は、CXCR4マーカー遺伝子を発現する。他の実施形態において、本明細書に記載されている方法により作製される胚体内胚葉細胞は、CXCR4マーカー遺伝子および胚体内胚葉の他のマーカーを発現する。他のマーカーとしては、SOX17、MIXL1、GATA4、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1が挙げられるが、これらに限定されるものではない。本発明のいくつかの実施形態において、胚体内胚葉細胞は、SOX7マーカー遺伝子より高いレベルでCXCR4マーカー遺伝子を発現する。さらに、いくつかの実施形態においては、CXCR4マーカー遺伝子の発現が、OCT4マーカー遺伝子の発現より多い。本発明の他の実施形態において、胚体内胚葉細胞は、AFP、SPARCまたはトロンボモジュリン(TM)マーカー遺伝子より高いレベルでCXCR4マーカー遺伝子を発現する。本発明のある実施形態において、本明細書に記載されている方法により作製される、CXCR4を発現する胚体内胚葉細胞は、有意水準または量のPDX1を発現しない(PDX1陰性)。
当然のことながら、内胚葉細胞におけるCXCR4の発現が、SOX17の発現を妨げることはない。従って、本発明のいくつかの実施形態において、胚体内胚葉細胞は、SOX17およびCXCR4マーカー遺伝子のいずれも、SOX7マーカー遺伝子より高いレベルで発現するものである。さらに、いくつかの実施形態においては、SOX17およびCXCR4マーカー遺伝子の両方の発現が、OCT4マーカー遺伝子の発現より多い。本発明の他の実施形態において、胚体内胚葉細胞は、SOX17およびCXCR4マーカー遺伝子のいずれも、AFP、SPARCまたはトロンボモジュリン(TM)マーカー遺伝子より高いレベルで発現する。本発明のある実施形態において、本明細書に記載されている方法により作製される、SOX17/CXCR4を発現する胚体内胚葉細胞は、有意水準または量のPDX1を発現しない(PDX1陰性)。
当然のことながら、SOX17および/またはCXCR4マーカーの発現は、分化条件により、胚体内胚葉細胞内において様々なレベルで誘導される。そのため、本発明のいくつかの実施形態において、胚体内胚葉細胞または細胞集団におけるSOX17マーカーおよび/またはCXCR4マーカーの発現は、非胚体内胚葉細胞または細胞集団、例えば、多能性幹細胞におけるSOX17マーカーおよび/またはCXCR4マーカーの発現より少なくとも約2倍から少なくとも約1万倍多い。本発明の他の実施形態において、胚体内胚葉細胞または細胞集団におけるSOX17マーカーおよび/またはCXCR4マーカーの発現は、非胚体内胚葉細胞または細胞集団、例えば、多能性幹細胞におけるSOX17マーカーおよび/またはCXCR4マーカーの発現より、少なくとも約4倍、少なくとも約6倍、少なくとも約8倍、少なくとも約10倍、少なくとも約15倍、少なくとも約20倍、少なくとも約40倍、少なくとも約80倍、少なくとも約100倍、少なくとも約150倍、少なくとも約200倍、少なくとも約500倍、少なくとも約750倍、少なくとも約1000倍、少なくとも約2500倍、少なくとも約5000倍、少なくとも約7500倍、または少なくとも約10,000倍多い。いくつかの実施形態において、胚体内胚葉細胞または細胞集団におけるSOX17マーカーおよび/またはCXCR4マーカーの発現は、非胚体内胚葉細胞または細胞集団、例えば、多能性幹細胞におけるSOX17マーカーおよび/またはCXCR4マーカーの発現よりはるかに多い。
当然のことながら、本発明のいくつかの実施形態において、胚体内胚葉細胞または細胞集団におけるGATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーの発現は、非胚体内胚葉細胞または細胞集団におけるGATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1の発現に比べ増加する。
また、当然のことながら、胚体内胚葉細胞における、SOX17マーカーの発現量と、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現量との間には
、広範な差がある。同様に、胚体内胚葉細胞における、CXCR4マーカーの発現量と、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現量との間には、広範な差異が存在する。そのため、本発明のいくつかの実施形態において、SOX17マーカーまたはCXCR4マーカーの発現は、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より、少なくとも約2倍から少なくとも約1万倍多い。本発明の他の実施形態において、SOX17マーカーまたはCXCR4マーカーの発現は、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より、少なくとも約4倍、少なくとも約6倍、少なくとも約8倍、少なくとも約10倍、少なくとも約15倍、少なくとも約20倍、少なくとも約40倍、少なくとも約80倍、少なくとも約100倍、少なくとも約150倍、少なくとも約200倍、少なくとも約500倍、少なくとも約750倍、少なくとも約1000倍、少なくとも約2500倍、少なくとも約5000倍、少なくとも約7500倍または少なくとも約10000倍多い。いくつかの実施形態においては、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーが、胚体内胚葉細胞において著しく発現することはない。
当然のことながら、本発明のいくつかの実施形態において、胚体内胚葉細胞におけるGATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択されるマーカーの発現は、胚体内胚葉細胞におけるOCT4、SPARC、AFP、TMおよび/またはSOX7の発現に比べ増加する。
【0009】
胚体内胚葉を含む組成物
本発明のいくつかの態様は、幹細胞などの多能性細胞と胚体内胚葉細胞のいずれをも含む細胞集団および細胞培養物などの組成物に関する。例えば、本明細書に記載されている方法を用いて、hESCおよび胚体内胚葉細胞の混合物を含む組成物を作製することができる。いくつかの実施形態においては、多能性細胞約95個につき、少なくとも約5個の胚体内胚葉細胞を含む組成物が作製される。他の実施形態においては、多能性細胞約5個につき、少なくとも約95個の胚体内胚葉細胞を含む組成物が作製される。さらに、多能性細胞に対する胚体内胚葉細胞の比率がその他の比率である組成物が検討される。例えば、多能性細胞約100万個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約10万個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約1万個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約1000個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約500個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約100個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約10個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約5個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約2個につき、少なくとも約1個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約2個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約5個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約10個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約20個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約50個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約100個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約1000個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約1万個の胚体内胚葉細胞、多能性細胞約1個につき、少なくとも約10万個の胚体内胚葉細胞、および多能性細胞約1個につき、少なくとも約100万個の胚体内胚葉細胞を含む組成物が検討される。本発明のいくつかの実施形態において、多能性細胞は、ヒト多能性幹細胞である。ある実施形態において、幹細胞は、桑実胚、胚の内部細胞塊または胚の生殖隆起に由来する。他のある実施形態において、多能性細胞は、胚形成期を過ぎて発達した多細胞性構造体の生殖腺または生殖組織に由来する。
本発明のいくつかの態様は、少なくとも約5%から少なくとも約95%の胚体内胚葉細胞を含む細胞培養物または細胞集団に関する。いくつかの実施形態において、細胞培養物または細胞集団は、哺乳類細胞を含む。好適な実施形態において、細胞培養物または細胞集
団は、ヒト細胞を含む。例えば、ある特定の実施形態は、ヒト細胞を含む細胞培養物に関し、このヒト細胞の少なくとも約5%から少なくとも約95%が、胚体内胚葉細胞である。本発明の他の実施形態は、ヒト細胞を含む細胞培養物に関し、このヒト細胞の少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%または90%より多くが、胚体内胚葉細胞である。
本発明の更なる実施形態は、ヒト胚体内胚葉細胞などのヒト細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、SOX17またはCXCR4マーカーのいずれかの発現が、ヒト細胞の少なくとも約5%において、OCT4、SPARC、アルファフェトプロテイン(AFP)、トロンボモジュリン(TM)および/またはSOX7マーカーの発現より多い。他の実施形態においては、SOX17またはCXCR4マーカーのいずれかの発現が、ヒト細胞の少なくとも約10%において、ヒト細胞の少なくとも約15%において、ヒト細胞の少なくとも約20%において、ヒト細胞の少なくとも約25%において、ヒト細胞の少なくとも約30%において、ヒト細胞の少なくとも約35%において、ヒト細胞の少なくとも約40%において、ヒト細胞の少なくとも約45%において、ヒト細胞の少なくとも約50%において、ヒト細胞の少なくとも約55%において、ヒト細胞の少なくとも約60%において、ヒト細胞の少なくとも約65%において、ヒト細胞の少なくとも約70%において、ヒト細胞の少なくとも約75%において、ヒト細胞の少なくとも約80%において、ヒト細胞の少なくとも約85%において、ヒト細胞の少なくとも約90%において、ヒト細胞の少なくとも約95%においてまたは95%を超えるヒト細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
当然のことながら、本発明のいくつかの実施形態は、ヒト胚体内胚葉細胞などのヒト細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、GATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択される一以上のマーカーの発現は、ヒト細胞の少なくとも約5%から少なくとも約95%を超えるヒト細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
本発明のさらに別の実施形態は、ヒト胚体内胚葉細胞などのヒト細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、SOX17とCXCR4マーカーの両方の発現が、ヒト細胞の少なくとも約5%において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。他の実施形態においては、SOX17とCXCR4マーカーの両方の発現が、ヒト細胞の少なくとも約10%において、ヒト細胞の少なくとも約15%において、ヒト細胞の少なくとも約20%において、ヒト細胞の少なくとも約25%において、ヒト細胞の少なくとも約30%において、ヒト細胞の少なくとも約35%において、ヒト細胞の少なくとも約40%において、ヒト細胞の少なくとも約45%において、ヒト細胞の少なくとも約50%において、ヒト細胞の少なくとも約55%において、ヒト細胞の少なくとも約60%において、ヒト細胞の少なくとも約65%において、ヒト細胞の少なくとも約70%において、ヒト細胞の少なくとも約75%において、ヒト細胞の少なくとも約80%において、ヒト細胞の少なくとも約85%において、ヒト細胞の少なくとも約90%において、ヒト細胞の少なくとも約95%においてまたは95%を超えるヒト細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
当然のことながら、本発明のいくつかの実施形態は、ヒト胚体内胚葉細胞などのヒト細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、GATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1マーカーの発現は、ヒト細胞の少なくとも約5%から少なくとも約95%を超えるヒト細胞において、OCT4、SPARC、AFP、TMおよび/またはS
OX7マーカーの発現より多い。
本発明の更なる実施形態は、ヒト内胚葉細胞などの哺乳類内胚葉細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、SOX17またはCXCR4マーカーいずれかの発現は、内胚葉細胞の少なくとも約5%において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。他の実施形態において、SOX17またはCXCR4マーカーいずれかの発現は、内胚葉細胞の少なくとも約10%において、内胚葉細胞の少なくとも約15%において、内胚葉細胞の少なくとも約20%において、内胚葉細胞の少なくとも約25%において、内胚葉細胞の少なくとも約30%において、内胚葉細胞の少なくとも約35%において、内胚葉細胞の少なくとも約40%において、内胚葉細胞の少なくとも約45%において、内胚葉細胞の少なくとも約50%において、内胚葉細胞の少なくとも約55%において、内胚葉細胞の少なくとも約60%において、内胚葉細胞の少なくとも約65%において、内胚葉細胞の少なくとも約70%において、内胚葉細胞の少なくとも約75%において、内胚葉細胞の少なくとも約80%において、内胚葉細胞の少なくとも約85%において、内胚葉細胞の少なくとも約90%において、内胚葉細胞の少なくとも約95%において、または95%を超える内胚葉細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
当然のことながら、本発明のいくつかの実施形態は、哺乳類内胚葉細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、GATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1からなる群から選択される一以上のマーカーの発現が、内胚葉細胞の少なくとも約5%から少なくとも約95%を超える内胚葉細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
本発明のさらに他の実施形態は、ヒト内胚葉細胞などの哺乳類内胚葉細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、SOX17とCXCR4マーカーの両方の発現が、内胚葉細胞の少なくとも約5%において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。他の実施形態においては、SOX17とCXCR4マーカーの両方の発現が、内胚葉細胞の少なくとも約10%において、内胚葉細胞の少なくとも約15%において、内胚葉細胞の少なくとも約20%において、内胚葉細胞の少なくとも約25%において、内胚葉細胞の少なくとも約30%において、内胚葉細胞の少なくとも約35%において、内胚葉細胞の少なくとも約40%において、内胚葉細胞の少なくとも約45%において、内胚葉細胞の少なくとも約50%において、内胚葉細胞の少なくとも約55%において、内胚葉細胞の少なくとも約60%において、内胚葉細胞の少なくとも約65%において、内胚葉細胞の少なくとも約70%において、内胚葉細胞の少なくとも約75%において、内胚葉細胞の少なくとも約80%において、内胚葉細胞の少なくとも約85%において、内胚葉細胞の少なくとも約90%において、内胚葉細胞の少なくとも約95%、または95%を越える内胚葉細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
当然のことであるが、本発明のいくつかの実施形態は、哺乳類内胚葉細胞を含む細胞培養物または細胞集団などの組成物に関するものであり、GATA4、MIXL1、HNF3b、GSC、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1マーカーの発現は、内胚葉細胞の少なくとも約5%から少なくとも約95%を超える内胚葉細胞において、OCT4、SPARC、AFP、TMおよび/またはSOX7マーカーの発現より多い。
本明細書に記載されている方法を用いて、胚体内胚葉細胞を含み、実質的に他の細胞型を含まない組成物を作製することができる。細胞培養物または細胞集団内の細胞に関して、「実質的に含まない」という表現は、細胞培養物または細胞集団が含まない特定の細胞型が、細胞培養物または細胞集団に存在する細胞総数の約5%未満の量で存在することを意味する。本発明のいくつかの実施形態において、本明細書に記載されている方法により作製される胚体内胚葉細胞集団または細胞培養物は、OCT4、SOX7、AFP、SPA
RC、TM、ZIC1またはBRACHマーカー遺伝子を著しく発現する細胞を実質的に含まない。
本発明の一実施形態において、マーカー遺伝子の発現に基づいて胚体内胚葉細胞を表した場合、SOX17高、MIXL1高、AFP低、SPARC低、トロンボモジュリン低、SOX7低、CXCR4高となる。
【0010】
胚体内胚葉の濃縮、分離および/または精製
本発明のさらなる態様に関して、胚体内胚葉細胞は、そのような細胞に特異な親和性標識を使用することにより、濃縮、分離および/または精製することができる。胚体内胚葉細胞に特異な親和性標識の例としては、胚体内胚葉細胞の細胞表面には存在するが、本明細書に記載されている方法により作製される細胞培養物において見られる他の細胞型には実質的に存在しないポリペプチドなどのマーカー分子に特異的な抗体、リガンドまたは他の結合剤が挙げられる。いくつかの実施形態においては、CXCR4に結合する抗体が、胚体内胚葉細胞の濃縮、分離または精製のための親和性標識として使用される。また、他の実施形態においては、ケモカインSDF−1または他のSDF−1系分子も、親和性標識として使用することができる。そのような分子としては、SDF−1断片、SDF−1融合物、またはSDF−1模倣物が挙げられるが、これらに限定されるものではない。
抗体を作製する方法、およびそれらを細胞分離に使用する方法は、当技術分野において周知であり、そのような方法は、本明細書に記載されている細胞や抗体を用いて実施することができる。一実施形態において、CXCR4に結合する抗体は、電磁ビーズに付着させた後、細胞間および基質接着性を低下させるよう酵素的に処理した細胞培養物中の胚体内胚葉細胞に結合させる。そして、細胞/抗体/ビーズ複合体を、ビーズ結合胚体内胚葉細胞を非結合細胞から分離するために使用する変動磁界に曝す。一旦、胚体内胚葉細胞を培養物中の他の細胞から物理的に分離すると、抗体結合を破壊し、その細胞を適切な組織培養培地に再度蒔き培養する。
本発明の実施形態において、濃縮、分離または精製された胚体内胚葉細胞培養物または集団を得る更なる方法を検討する。例えば、いくつかの実施形態において、CXCR4抗体は、細胞間および基質接着性を低下させるよう処理された胚体内胚葉含有細胞培養物と共に培養される。その後、細胞を洗浄し、遠心分離し、再懸濁させる。そして、細胞懸濁液を、一次抗体に結合し得るFITC標識抗体などの二次抗体と共に培養する。その後、その細胞を洗浄し、遠心分離し、緩衝液中に再懸濁させる。そして、細胞懸濁液を、蛍光活性化細胞選別装置(FACS)を用いて分析選別する。CXCR4陽性細胞を、CXCR4陰性細胞とは別に回収することにより、そのような細胞型を分離することができる。必要に応じて、分離された細胞組成物は、親和性を利用した別の方法を利用するか、あるいは胚体内胚葉に特異的な、同じまたは別のマーカーを用いてさらに一連の選別を行なうことにより、さらに精製することができる。
本発明の他の実施形態において、胚体内胚葉は、CXCR4に結合するリガンドまたは他の分子を用いて、濃縮、分離および/または精製される。いくつかの実施例において、その分子は、SDF−1、或いはその断片、融合物または模倣物である。
好適な実施形態において、胚体内胚葉細胞は、幹細胞培養物が、胚体内胚葉系列に沿って分化するよう誘導された後、濃縮され、他の非胚体内胚葉細胞から分離および/または精製される。当然のことながら、上記濃縮、分離および精製方法は、分化のどの段階においても、上記のような培養物と共に採用することができる。
また、上述の方法に加え、胚体内胚葉細胞は、細胞を分離する他の技術により分離してもよい。さらに、胚体内胚葉細胞は、前記胚体内胚葉細胞の選択的生存または選択的増殖を促進する増殖条件で、連続継代培養法により濃縮または分離してもよい。
本明細書に記載されている方法を用いて、濃縮、分離および/または精製された組織および/または胚体内胚葉細胞の集団は、少なくともいくらか分化した、幹細胞培養物または集団などの多能性細胞培養物または細胞集団から生体外で作製することができる。いくつかの実施形態において、細胞は、ランダムに分化する。しかしながら、好適な実施形態に
おいて、細胞は、主として胚体内胚葉に分化するように誘導される。いくつかの好適な濃縮、分離および/または精製方法は、ヒト胚性幹細胞からの胚体内胚葉の生体外での作製に関する。本明細書に記載されている方法を用いて、細胞集団または細胞培養物の胚体内胚葉含有量を、未処理の細胞集団または細胞培養物と比較して、少なくとも約2倍から約1000倍に濃縮することができる。いくつかの実施形態において、胚体内胚葉細胞は、未処理の細胞集団または細胞培養物と比較して、少なくとも約5倍から約500倍に濃縮することができる。他の実施形態において、胚体内胚葉細胞は、未処理の細胞集団または細胞培養物と比較して、少なくとも約10倍から約200倍まで濃縮することができる。さらに他の実施形態において、胚体内胚葉細胞は、未処理の細胞集団または細胞培養物と比較して、少なくとも約20倍から約100倍まで濃縮することができる。さらに他の実施形態において、胚体内胚葉細胞は、未処理の細胞集団または細胞培養物と比較して、少なくとも約40倍から約80倍まで濃縮することができる。ある実施形態において、胚体内胚葉細胞は、未処理の細胞集団または細胞培養物と比較して、少なくとも約2倍から約20倍まで濃縮することができる。
本発明について、一般的に説明してきたが、ある特定の実施例を参照することにより一層理解を深めることができる。それら実施例は、あくまでも説明のみを目的としてここに挙げられており、何ら限定することを意図するものではない。
【実施例】
【0011】
以下の実施例の多くは、多能性ヒト細胞の使用について説明している。多能性ヒト細胞の作製方法は、当技術分野において周知であり、米国特許第5,453,357号明細書、第5,670,372号明細書、第5,690,926号明細書、第6,090,622号明細書、第6,200,806号明細書および第6,251,671号明細書、並びに米国特許出願公開第2004/0229350号明細書を含む多数の科学出版物に記載されており、これらの全開示内容は、引用することにより本明細書の一部とされる。
【0012】
実施例1
ヒトES細胞
内胚葉発生に関して研究するため、正常な核型を維持しながら、培養物中、一見無制限に分裂可能な、多能性のヒト胚性幹細胞を用いた。ES細胞は、分離に際し免疫学的または機械的方法のいずれかを使用し、5日目の胚の内部細胞塊から得た。具体的には、患者によるインフォームド・コンセントを得た後、体外受精サイクルの余剰の凍結受精卵から、ヒト胚性幹細胞株hESCyt−25を得た。解凍すると同時に、孵化した胚盤胞は、ES培地(DMEM、20%FBS、非必須アミノ酸、β−メルカプトエタノール、ITSサプリメント)において、マウスの胚線維芽細胞(MEF)上に蒔き培養した。胚は培養皿に付着し、約2週間後、未分化hESCの領域を、MEFを入れた新しい皿に移植した。移植は、機械的に切離し、ディスパーゼを用いて短時間分解し、引き続き細胞クラスターを機械的に除去し、洗浄し、そして再度蒔くことにより行なった。誘導以後、hESCyt−25は、100回に渡り連続継代した。胚体内胚葉を作製するための出発物質としてhESCyt−25ヒト胚性幹細胞株を用いた。
当技術分野における当業者にとっては当然のことであるが、幹細胞または他の多能性細胞も、本明細書に記載されている分化方法のための出発物質として使用することができる。例えば、当技術分野において周知の方法により分離することのできる、胚の生殖隆起から得られる細胞を、多能性細胞出発物質として使用することができる。
【0013】
実施例2
hESCyt−25特性
ヒト胚性幹細胞株のhESCyt−25は、培養物中において、18カ月に渡り正常な形態、核型、増殖、および自己複製特性を維持した。この細胞株は、OCT4、SSEA−4およびTRA−1−60抗原に対し強い免疫反応を示し、それら全抗原は、未分化hE
SCに特有なものであり、また、他の樹立したhESC株と同一の形態およびアルカリホスファターゼ活性を示す。さらに、ヒト幹細胞株hESCyt−25はまた、懸濁培養をした場合、容易に胚様体(EB)を形成する。多能性を実証するがごとく、hESCyT−25は、3つの主要な胚葉に対応する様々な細胞型に分化する。外胚葉の産生は、ZIC1に関してはQ−PCRにより、またネスチンおよびさらに成熟したニューロンマーカーに関しては免疫細胞化学(ICC)により立証した。β−IIIチューブリンの免疫細胞化学的染色が、初期ニューロンの特徴である細長い細胞のクラスターにおいて観察された。先に、レチノイン酸を用いてEBを懸濁処理し、多能性幹細胞の、胚外系列の臓側内胚葉(VE)への分化を誘導した。処理した細胞は、54時間の処理によりVEの二つのマーカーである、アルファフェトプロテイン(AFP)およびSOX7を高いレベルで発現した。単層で分化した細胞は、免疫細胞化学的染色により示されるように、弧発的な斑状にAFPを発現した。また、下記に説明するように、hESCyT−25細胞株は、AFPが発現することなく、SOX17に対するリアルタイムの定量ポリメラーゼ連鎖反応(Q−PCR)と免疫細胞化学により確認されるように、胚体内胚葉を形成することもできた。中胚葉への分化を立証するために、いくつかの時点で、Brachyury遺伝子の発現に関し、分化EBを分析した。Brachyuryの発現は、実験の間、漸次増加した。上記の点から、hESCyT−25株は、三つの胚葉に対応する細胞を形成する能力により示されるように、多能性を有する。
【0014】
実施例3
SOX17抗体の作製
hESC培養物において胚体内胚葉を同定する上での主要な障害は、適切な手段がないことである。そこで、ヒトSOX17タンパク質に対して産生される抗体の作製を行なった。
マーカーSOX17は、原腸形成の間に形成されるにつれ、胚体内胚葉全体において発現し、その発現は、器官形成が開始される頃まで、(発現量は、A−P軸に沿って異なるが)腸管内で維持される。また、SOX17は、胚外内胚葉細胞のサブセットにおいても発現する。中胚葉または外胚葉では、このタンパク質の発現は観察されていない。現在、SOX17は、胚外系列を除外するためにマーカーと併用した場合、胚体内胚葉系列に対する適切なマーカーであることが分かっている。
ここに詳細に説明するように、SOX17抗体は、SOX17陽性胚体内胚葉細胞の作製を目的とした、各種処理と分化方法の効果を具体的に調べるのに利用した。また、AFP、SPARCおよびトロンボモジュリンに反応する他の抗体も、臓側および壁側内胚葉(胚外内胚葉)の産生を除外するために使用した。
SOX17に対する抗体を作製するため、SOX17タンパク質(図2)のC末端のアミノ酸172−414(配列番号:2)に対応するヒトのSOX17cDNA(配列番号:1)の一部を、抗体製造会社、GENOVAC社(フライベルク、ドイツ)において、そこで開発された方法により、ラットの遺伝子による免疫化に用いた。遺伝子による免疫化方法は、米国特許第5,830,876号明細書、第5,817,637号明細書、第6,165,993号明細書および第6,261,281号明細書、並びに国際公開第WO00/29442号および第WO99/13915号に見られ、これらの全開示内容は、引用することにより本明細書の一部とされる。
また、遺伝子による免疫化のための他の適切な方法は、非特許文献にも記載されている。例えば、Barry et al.は、Biotechniques16:616−620、1994に、遺伝子免疫化によるモノクローナル抗体の作製(the production of monoclonal antibodies by genetic immunization)について記載しており、その全開示内容は、引用することにより本明細書の一部とされる。特定のタンパク質に対して抗体を産生する遺伝子免疫法の具体的な例は、例えば、Costaglia et al.、(1998)Genetic immunization against the human thyrotropin r
eceptor causes thyroiditis and allows production of monoclonal antibodies recognizing the native receptor、J.Immunol.160:1458−1465;Kilpatrick et al(1998)Gene gun delivered DNA−based immunizations mediate rapid production of murine monoclonal antibodies
to the Flt−3 receptor、Hybridoma 17:569−576;Schmolke et al.、(1998)Identification of hepatitis G virus particles in human serum by E2−specific monoclonal antibodies generated by DNA immunization、J.Virol.72:4541−4545;Krasemann et al.、(1999)Generation of monoclonal antibodies against proteins with an unconventional nucleic acid−based immunization strategy、J.Biotechnol.73:119−129;およびUlivieri et al.、(1996)Generation of a monoclonal antibody to a defined portion of the Heliobacter pylori vacuolating cytotoxin by DNA immunization、J.Biotechnol.51:191−194に見られ、これらの全開示内容は、引用することにより本明細書の一部とされる。
SOX7およびSOX18は、図3に示す関係系統樹に描かれているように、SOX17に対し最も近いSoxファミリーである。SOX17抗体が、SOX17に特異的であり、尚且つ、その最も近いファミリーメンバーと反応しないことを立証するために、陰性対照として、ヒトのSOX7ポリペプチドを使用した。具体的には、遺伝子免疫化により作製された抗体が、SOX17に特異的であることを立証するために、SOX7および他のタンパク質を、ヒト線維芽細胞において発現させた後、ウェスタンブロットおよびICCによりSOX17抗体との交差反応を分析した。SOX17、SOX7およびEGFP発現ベクターの作製、それらのヒト線維芽細胞への形質移入、およびウェスタンブロットによる分析には、例えば、以下の方法を用いた。SOX17、SOX7およびEGFPの作製に使われた発現ベクターは、それぞれpCMV6(OriGene Technologies Inc.、ロックヴィル、メリーランド州)、pCMV−SPORT6(Invitrogen社、カールズバッド、カリフォルニア州)およびpEGFP−N1(Clonetech社、パロアルト、カリフォルニア州)であった。タンパク質の製造には、テロメラーゼ不死化MDXヒト線維芽細胞を、リポフェクタミン2000(Invitrogen社、カールズバッド、カリフォルニア州)の存在下で、スーパーコイルDNAに一過性に形質移入した。形質移入後36時間で、プロテアーゼ阻害剤カクテル(Roche Diagnostics Corporation、インディアナポリス、インディアナ州)を含む、50mMのTRIS−HCl(pH8)、150mMのNaCl、0.1%のSDS、0.5%のデオキシコール酸塩において、全細胞溶解物を回収した。NuPAGE(4〜12%の勾配ポリアクリルアミド、Invitrogen社、カールズバッド、カリフォルニア州)を用いてSDS−PAGEにより分離し、エレクトロブロッティングによりPDVF膜(Hercules社、カリフォルニア州)に移植した細胞タンパク質100μgのウェスタンブロット分析では、10mMのTRIS−HCl(pH8)、150mMのNaCl、10%のBSA、0.05%のTween−20(Sigma社、セントルイス、ミズーリ州)において、1/1000に希釈したラットのSOX17抗血清、引き続き、アルカリホスファターゼ標識抗ラットIgG(Alkaline Phosphatase conjugated anti−rat IgG)(Jackson ImmunoResearch Laboratories、ウエスト・グローブ、ペンシルバニア州)で検出し、ベクターブラックアルカリホスファターゼ染色(Vec
tor Black Alkaline Phosphatase staining)(Vector Laboratories、バーリンゲーム、カリフォルニア州)により明らかにした。採用したタンパク質サイズ基準は、広範囲のカラーマーカー(Sigma社、セントルイス、ミズーリ州)であった。図4において、SOX17、SOX7またはEGFP cDNAが一過性に形質移入されたヒト線維芽細胞から作製した抽出タンパク質を、SOX17抗体を用いてウェスタンブロット上で検出した。hSOX17形質移入細胞からの抽出タンパク質のみが、ヒトのSOX17タンパク質の予測分子量46Kdaに近い51Kdaまでのバンドを生じさせた。ヒトのSOX7またはEGFP形質移入細胞のいずれかから作られた抽出物に対するSOX17抗体の反応は全くなかった。さらに、SOX17抗体は、hSOX17発現コンストラクトを形質移入されたヒト線維芽細胞の核を明確に標識したが、EGFPのみを形質移入された細胞は標識しなかった。このように、SOX17抗体は、ICCにより特異性を示した。
【0015】
実施例4
胚体内胚葉のマーカーとしてのSOX17抗体の検証
SOX17抗体が、ヒトSOX17タンパク質に対して特異的であり、さらには、胚体内胚葉を標識する証拠として、部分的に分化したhESCを、SOX17とAFP抗体で同時標識した。SOX遺伝子ファミリーサブグループF(図3)の近縁関係にあるメンバーであるSOX7やSOX17およびAFPは、それぞれ臓側内胚葉で発現することが実証されている。しかしながら、AFPおよびSOX7は、胚体内胚葉細胞において、ICCにより検出できるレベルでは発現しないため、本物の胚体内胚葉細胞に対する陰性マーカーとして用いることができる。SOX17抗体は、離散的にグループ化した細胞として存在するか、或いはAFP陽性細胞と混ざり合う細胞集団を標識することが明らかにされた。特に、図5Aは、少数のSOX17細胞が、AFPで同時標識されたことを示している。しかしながら、SOX17+細胞の場にAFP+細胞が、殆どまたは全くない領域も見られた(図5B)。同様に、壁側内胚葉も、SOX17を発現すると報告されているため、壁側マーカーSPARCおよび/またはトロンボモジュリン(TM)と共にSOX17で同時標識している抗体は、壁側内胚葉であるSOX17+細胞を同定するのに使用することができる。図6A〜Cに示すように、トロンボモジュリンとSOX17とで同時標識された壁側内胚葉細胞は、hES細胞のランダムな分化により産生された。
上記の細胞標識実験から見て、胚体内胚葉細胞は、マーカープロファイルSOX17hi/AFPlo/[TMloまたはSPARClo]により同定することができる。すなわち、SOX17マーカーの発現は、臓側内胚葉に特有のAFPマーカーおよび壁側内胚葉に特有のTMまたはSPARCマーカーの発現より多い。従って、SOX17に対しては陽性であるが、AFPおよびTMまたはSPARCに対しては陰性である細胞が、胚体内胚葉である。
胚体内胚葉を予測するSOX17hi/AFPlo/TMlo/SPARCloマーカープロファイルの特異性の更なる証拠を得るべく、SOX17およびAFP遺伝子発現を、量的に抗体標識細胞の相対数と比較した。図7Aに示されているように、レチノイン酸(臓側内胚葉誘導物質)またはアクチビンA(胚体内胚葉誘導物質)で処理したhESCでは、SOX17mRNAの発現量に、10倍の差が生じた。この結果は、SOX17抗体標識細胞数における10倍の差を反映していた(図7B)。さらに、図8Aに示されているように、hESCのアクチビンA処理により、AFP遺伝子発現は、処理しなかった場合に比べ6.8倍抑制された。これは、図8B〜Cに示されているように、これらの培養物におけるAFP標識細胞の数の著しい減少により、視覚的に示された。さらにこれを定量化するために、AFP遺伝子発現におけるこの約7倍の減少が、フローサイトメトリーにより測定したAFP抗体標識細胞数が同様に7倍減少した結果であることが立証された(図9A〜B)。この結果は、Q−PCRにより確認される、遺伝子発現における量的変化が、抗体染色により観察される、細胞型の特異性における変化を反映することを示す点において極めて重要である。
ノーダルファミリーメンバー(ノーダル、アクチビンAおよびアクチビンB−NAA)の存在下におけるhESCの培養により、SOX17抗体標識細胞は、時間と共に著しく増加した。5日間継続したアクチビン処理により、50%を超える細胞が、SOX17で標識された(図10A〜F)。5日間のアクチビン処理後、AFPで標識された細胞は、ほとんどまたは全くなかった。
つまり、ヒトのSOX17タンパク質のカルボキシ末端242アミノ酸に対して産生された抗体は、ウェスタンブロットでヒトのSOX17タンパク質を同定したが、その最も近いSOXファミリー類縁体である、SOX7は認識しなかった。SOX17抗体は、主としてSOX17+/AFPlo/-(標識細胞の95%を超える)である分化hESC培養物中の細胞の一部、並びにSOX17およびAFP(臓側内胚葉)で同時標識しているわずかなパーセンテージ(<5%)の細胞も認識した。hESC培養物のアクチビン処理により、SOX17遺伝子発現およびSOX17標識細胞が著しく増加し、AFPmRNAの発現やAFP抗体で標識された細胞の数は著しく抑制された。
【0016】
実施例5
Q−PCR遺伝子発現測定
以下の実験では、hESC分化に対する様々な処理の効果を調べる主な測定法として、リアルタイム定量RT−PCR(Q−PCR)を採用した。具体的には、遺伝子発現のリアルタイム測定結果を、Q−PCRにより複数の時点で、複数のマーカー遺伝子に関して分析した。細胞集団の全体的な動態に関する理解を深めるために、望ましいおよび望ましくない細胞型に特有のマーカー遺伝子を評価した。Q−PCR分析の長所としては、その感度が極めて高いことや、ゲノム配列が容易に入手可能であるため、必要なマーカーの開発が比較的容易であることが挙げられる。さらに、Q−PCRの極めて高い感度により、非常に大きな集団内の比較的少数の細胞から遺伝子発現を検出することが可能となる。また、極めて低レベルの遺伝子発現を検出する性能により、その集団内での「分化傾向」が示される。これらの細胞表現型の明らかな分化に先立って、免疫細胞化学技法を用いては、特定の分化経路に沿った傾向を認識することはできない。このため、Q−PCRは、分化処理の成果を調べる免疫細胞化学技法を少なくとも補完するものであり、尚且つ、その技法より潜在的にはるかに優れた分析方法を提供する。さらに、Q−PCRは、分析の準ハイスループットスケールでの定量フォーマットにおける分化プロトコルの成果を評価するメカニズムを提供する。
ここで取ったアプローチは、Rotor Gene3000装置(Corbett Research)でSYBR Greenケミストリを用い、且つ、ツーステップRT−PCRフォーマットを使用して、相対的な定量化を行うことであった。このようなアプローチにより、将来、更なるマーカー遺伝子を分析するためのcDNAサンプルを保存することが可能となり、よって、サンプル間の逆転写効率におけるばらつきを避けることができる。
プライマーは、極力、エキソン同士の境界上に位置するか、或いは少なくとも800bpのイントロンにまたがるように設計した。これは、コンタミしたゲノムDNAからの増幅を排除するように実験的に決定されたものである。イントロンを含まないマーカー遺伝子を採用した場合、またはマーカー遺伝子が偽遺伝子を有する場合、RNAサンプルのデオキシリボヌクレアーゼI処理を行なった。
我々は、細胞サンプルにおける遺伝子発現に関する幅広いプロファイルの説明を提供するために、標的または非標的細胞型の多数のマーカーの遺伝子発現の測定には、通常Q−PCRを利用した。hESC分化(具体的には、外胚葉、中胚葉、胚体内胚葉、および胚外内胚葉)の初期段階に関するマーカーで、そのための有効なプライマーセットが入手可能なものを下記表1に挙げている。また、これらのプライマーセットのヒト特異性も立証された。これは、hESCが多くの場合マウス支持細胞層で増殖することから、重要な事である。最も一般的には、それぞれの条件において三組のサンプルを採取し、個別に、各定量に関連した生物学的変動を評価するためにそれぞれのサンプルを二つずつ分析した。
PCRテンプレートを作成するために、総RNAは、RNeasy(Qiagen社)を用いて分離し、RiboGreen(Molecular Probes社)を用いて定量した。総RNA350〜500ngからの逆転写は、oligo−dTおよびランダムプライマーの混合物を含むiScript逆転写酵素キット(BioRad社)を使用して行なった。各20μLの反応物は、その後、総量100μLまで希釈し、3μLを、400nMの順方向および逆方向プライマーと5μLの2X SYBR Greenマスターミックス(Qiagen社)とを含む、各10μLのQ−PCR反応物に使用した。2段階のサイクリングパラメータを使用し、85〜94°C(各プライマーセットの単位複製配列の融解温度によって具体的に選択された)で5秒間の変性と、引き続き、60°Cで45秒間のアニール/伸長を採用した。蛍光データは、各伸長段階の最後の15秒間に収集した。3ポイント10倍希釈シリーズ(three point、10−fold dilution series)を、各回ごとに検量線を作成するために使用し、この検量線に基づいて、サイクル閾値(Ct)を定量値に変換した。各サンプルの定量化された値を、ハウスキーピング遺伝子能力に対して規準化した後、三組のサンプルに関して平均および標準偏差を計算した。PCRサイクルの終わりに際し、融解曲線分析を行い、反応物の特異性を確認した。単一の特定産物が、そのPCR単位複製配列に適したTmで単一のピークにより示された。さらに、逆転写酵素なしで行われた反応は、陰性対照としての役目を果たし、増幅しない。
Q−PCR法を確立する上での第一段階は、実験系に適したハウスキーピング遺伝子(HG)を検証することであった。RNAインプット、RNAの完全性および逆転写効率に関する全サンプルの規準化にHGが使用されるため、規準化が有意であるためには、HGが、全種類のサンプルにおいて、長期に渡り一定レベルで発現することが重要であった。我々は、分化hESCにおいて、サイクロフィリンG、ヒポキサンチン・ホスホリボシルトランスフェラーゼ1(HPRT)、ベータ−2−ミクログロブリン、ヒドロキシメチルビアン(hydroxymethylbiane)シンターゼ(HMBS)、TATA結合タンパク質(TBP)、およびグルクロニダーゼ(glucoronidase)ベータ(GUS)の発現量を測定した。我々の得た結果は、ベータ−2−ミクログロブリンの発現量が、分化するにしたがって上昇することを示した。従って、規準化のためのこの遺伝子の使用は除外した。他の遺伝子は、長時間に渡り、且つ全処理を通して一定の発現量を示した。我々は、通常、サイクロフィリンGおよびGUSの双方を使用し、全サンプルに関する規準化因子を計算した。多数のHGを使用することにより、規準化プロセスに伴う変動性を低減すると同時に、相対的な遺伝子発現値の信頼性を高める。
規準化に使用する遺伝子を得た後、Q−PCRを使用し、様々な実験処理を施す全サンプルにおいて、多くのマーカー遺伝子の相対的な遺伝子発現量を求めた。使用したマーカー遺伝子を選択したのは、それらが、初期胚葉の典型的な特定集団において濃縮を示すからであり、特に、胚体内胚葉および胚外内胚葉において、特異的に発現する遺伝子グループに集中したためである。これらの遺伝子およびそれらの相対的な濃縮分析結果を、表1に示す。
【表1】

多くの遺伝子が、一以上の胚葉で発現するため、同一実験において、多くの遺伝子の発現量を定量的に比較することが有益である。SOX17は、胚体内胚葉において発現し、臓側および壁側内胚葉では少しばかり発現する。SOX7およびAFPは、この初期発生の時点において臓側内胚葉で発現する。SPARCおよびTMは、壁側内胚葉で発現し、Brachyuryは初期中胚葉で発現する。
胚体内胚葉細胞は、SOX17mRNAを高度に発現し、AFPおよびSOX7(臓側内胚葉)、SPARC(壁側内胚葉)およびBrachyury(中胚葉)の発現レベルは低いものと予想された。さらに、ZIC1をここで使用し、初期外胚葉の誘導をさらに排除した。最終的に、GATA4およびHNF3bが、胚体および胚外内胚葉の両方において発現した。従って、それらは、胚体内胚葉におけるSOX17の発現と相関する(表1)。典型的な実験を、図11〜14に示している。図11〜14は、表1に記載されているマーカー遺伝子が、各種サンプル間でいかに互いに相関しているかを示しており、それにより、胚体内胚葉および胚外内胚葉、並びに中胚葉および神経細胞型に特異的な分化パターンを明示している。
上記のデータから、アクチビン投与量の増加が、SOX17遺伝子発現の増加をもたらしたことは明らかである。さらに、このSOX17発現は、主に、胚外内胚葉ではなく胚体内胚葉を示した。この結論は、SOX17遺伝子発現がAFP、SOX7およびSPARC遺伝子発現と逆相関にあるという観察結果に基づいている。
【0017】
実施例6
ヒトES細胞の胚体内胚葉への誘導分化
ヒトES細胞培養物は、それらの未分化の状態が能動的に維持されない条件下で培養された場合、ランダムに分化する。この不均一な分化により、壁側および臓側内胚葉(AFP、SPARCおよびSOX7発現)の双方からなる胚外内胚葉細胞、並びにZIC1、ネスチン(外胚葉)およびBrachyury(中胚葉)の発現によって示される、初期の外胚葉および中胚葉誘導体が産生される。胚体内胚葉細胞の出現は、ES細胞培養物における特異的な抗体マーカーの欠如により、従来検証または特定されていない。そのため、ES細胞培養物における初期胚体内胚葉の産生は、あまりよく研究されていない。胚体内胚葉細胞に対するよい抗体試薬の入手が不可能なため、性質決定のほとんどは、外胚葉および胚外内胚葉に集中している。概して、ランダムに分化したES細胞培養物には、SOX17hi胚体内胚葉細胞と比較すると、非常に多くの胚外および神経外胚葉細胞型がある。
未分化hESCコロニーは、繊維芽細胞フィーダーの床で増殖するため、コロニーの縁部
は、コロニーの内側に存在するそれらの細胞とは異なる別の形態を呈する。これらの外縁細胞の多くは、それほど均一ではなくより大きな細胞体の形態や、OCT4の高発現量により識別できる。ES細胞は、分化し始めると、未分化ES細胞と比較してOCT4発現量が増加または減少するとされている。未分化閾(undifferentiated threshold)に対するOCT4発現量の上下変化は、多能性の状態から脱した分化の初期段階を意味する可能性がある。
未分化のコロニーを、SOX17免疫細胞化学により調べた際、時折SOX17陽性細胞の小さな10〜15個の細胞集団が、その周辺のランダムな場所、および未分化のESCコロニー間の接合部で検出された。上述のように、これらのコロニー外縁に散在したポケットは、コロニーがサイズ的に大きくなり、より多くなるにつれ、古典的ESC形態とは異なった分化をする最初の細胞の数個となるようであった。若くて小さな完全に未分化のコロニー(<1mm;4〜5日目)は、コロニー内または縁部においてSOX17陽性細胞は全く見られなかった。一方、古くて大きいコロニー(直径1〜2mm、>5日目)には、いくつかのコロニーの周辺、または先に説明した古典的hESC形態とは異なって分化した縁部の内側の領域において、散在し孤立した斑状のSOX17陽性AFP陰性細胞があった。これが有効なSOX17抗体の最初の発生であったとすれば、そのような初期の「未分化」ESC培養物で発生する胚体内胚葉細胞は、これまで立証されたことはない。
Q−PCRによるSOX17およびSPARC遺伝子発現量の逆相関に基づくと、大部分のSOX17陽性AFP陰性細胞は、抗体同時標識により壁側マーカーに対し陰性を示すであろう。これは、図15A〜Bで示されているように、TMを発現している壁側内胚葉細胞に関して明確に立証された。ノーダル因子アクチビンAおよびBへの暴露により、TM発現強度およびTM陽性細胞数は著しく減少した。アクチビン処理培養物におけるSOX17、AFPおよびTM抗体を用いた三重標識により、AFPおよびTMに対しても陰性であったSOX17陽性細胞のクラスターが観察された(図16A〜D)。これらは、分化ESC培養物におけるSOX17陽性胚体内胚葉細胞の最初の細胞を示すものである(図16A〜Dおよび図17)。
上述のSOX17抗体およびQ−PCRのツールを使用し、SOX17hi/AFPlo/SPARC/TMlo胚体内胚葉細胞になるようにESCを効果的にプログラムミングすることのできる数々の手法を調べた。我々は、SOX17遺伝子発現に関するQ−PCRによる集団レベルと、SOX17タンパク質の抗体標識による個々の細胞レベルとで測定した、これら細胞の数および増殖能力を増強することを目的とした様々な分化手順を適用した。
生体外の細胞培養物において胚性幹細胞から胚体内胚葉細胞を作製する際に使用する、ノーダル/アクチビン/BMPなどのTGFβファミリー増殖因子の効果を分析し、説明したのは、我々が初めてであった。典型的な実験では、アクチビンA、アクチビンB、BMPまたはそれら増殖因子の組み合わせを、未分化ヒト幹細胞株hESCyt−25の培養物に添加し、分化プロセスを開始させた。
図19に示されているように、100ng/mlのアクチビンAを添加したところ、分化開始後4日目までに、未分化hESCに対し、19倍のSOX17遺伝子発現の誘導が起きた。アクチビンファミリーの第二のメンバーであるアクチビンBをアクチビンAと共に添加したところ、混合アクチビン処理後4日目までに未分化hESCに対し、37倍の誘導が起きた。最後に、ノダール/アクチビンおよびBMPサブグループBMP4からTGFβファミリー第三のメンバーを、アクチビンAおよびアクチビンBと共に添加したところ、発光量比は未分化hESCの57倍まで増加した(図19)。アクチビンおよびBMPを用いたSOX17の誘導を、因子無添加培地である対照と比較した場合、4日目の時点で、5倍、10倍および15倍の誘導が起きていた。アクチビンA、BおよびBMPを用いた三重処理後5日目までに、SOX17は、hESCに比べ70倍を超えて誘導された。これらのデータは、ノーダル/アクチビンTGFβファミリーメンバーの高投与量および長時間処理により、SOX17発現が増加することを示している。
ノーダルおよび関連分子アクチビンA、BおよびBMPは、生体内または生体外における胚体内胚葉形成およびSOX17の発現を促進する。さらに、BMPを添加することにより、SOX17の誘導が高まるが、これはおそらく、ノーダルコレセプターであるクリプト(Cripto)の更なる誘導によるものであろう。
我々は、BMP4とアクチビンAおよびBの組み合わせにより、SOX17の誘導、引いては、胚体内胚葉形成が、相加的に増強されることを立証した。アクチビンAおよびBとの組み合わせで、長時間(>4日)BMP4を添加していると、壁側および臓側内胚葉、並びに胚体内胚葉においてSOX17が誘導されることもある。したがって、本発明のいくつかの実施形態において、添加4日以内に、前記処理においてBMP4を除くことが大切である。
個々の細胞レベルでTGFβ因子を用いた処理の効果を求めるため、SOX17抗体標識を使用し、TGFβ因子添加の経時変化を調べた。先に図10A〜Fで示したように、SOX17標識細胞の相対数は、時間と共に著しく増加した。相対的に定量化(図20)した場合、SOX17標識細胞は、20倍を超える増加を示している。この結果は、細胞数およびSOX17遺伝子発現量のいずれも、TGFβ因子への暴露時間とともに増加していることを示している。図21に示されているように、ノーダル、アクチビンA、アクチビンBおよびBMP4への暴露4日後、SOX17誘導のレベルは、未分化hESCの168倍に到達した。また、図22は、SOX17陽性細胞の相対数もまた、投与量に依存していたことを示している。アクチビンAの投与量が100ng/mL以上である場合、SOX17遺伝子発現および細胞数を強力に誘導することができた。
TGFβファミリーメンバーに加えて、Wnt分子ファミリーが、胚体内胚葉の特異化および/または維持に役立つ場合もある。アクチビンのみで処理したサンプルに対し、アクチビンとWnt3aとを用いて処理したサンプルにおいて、SOX17遺伝子発現が増加したことにより示されているように、Wnt分子の使用も、hESCを胚体内胚葉に分化させるのに有益であった(図23)。
上記実験の全ては、添加因子と共に10%の血清を含む組織培養培地を使用して行なった。驚くべきことに、図24A〜Cに示されているように、血清濃度が、添加アクチビンの存在下におけるSOX17発現量に影響を及ぼすことを発見した。血清レベルを10%から2%に低下させた場合、SOX17発現は、アクチビンAおよびBの存在下、3倍になった。
最後に、図25A〜Dに示したように、アクチビンにより誘導されたSOX17+細胞が、培養物中において分離することを立証した。矢印は、PCNA/DAPIで標識された有糸分裂プレートパターン(mitotic plate pattern)および位相差有糸分裂プロファイル(phase contrast mitotic profile)からも明らかなように有糸分裂中のSOX17/PCNA/DAPIで標識された細胞を示す。
【0018】
実施例7
ケモカイン受容体4(CXCR4)発現は、中胚葉、外胚葉または臓側内胚葉用のマーカーではなく、胚体内胚葉用マーカーと相関する
上述のごとく、TGFβファミリー、より具体的には、アクチビン/ノーダルサブファミリーのサイトカインの適用により、ESCは胚体内胚葉細胞層に分化すべく誘導される。さらに、分化培養培地におけるウシ胎児血清(FBS)の割合が、ESCからの胚体内胚葉分化の効率に影響することを明らかにした。この影響とは、培地においてアクチビンAが所定の濃度である場合、FBSレベルが高くなると、胚体内胚葉への最大分化が阻害されるというものである。外因性アクチビンAの不在下では、胚体内胚葉系列へのESCの分化は非常に非効率的であり、FBS濃度がESCの分化プロセスに及ぼす影響は、かなり緩やかである。
これらの実験では、hESCは、100ng/mLアクチビンAを含むまたは含まない、0.5%、2.0%または10%のFBSを添加したRPMI培地(インビトロゲン社、
カールスバッド、カリフォルニア州;カタログ番号61870−036)で6日間増殖させることにより分化させた。さらに、分化の最初3日間は、アクチビンA100ng/mLと併せて、0.5%から2.0%の範囲のFBS勾配も採用した。6日後、各培養条件の複製サンプルを収集し、リアルタイム定量PCRにより相対的遺伝子発現を分析した。残りの細胞は、SOX17タンパク質の免疫蛍光検出用に準備した。
CXCR4の発現量は、使用した7つの培養条件により、著しく変化した(図26)。一般に、CXCR4発現量は、アクチビンAで処理した培養物で多く(A100)、外因性アクチビンAを入れなかった培養物では少なかった(NF)。さらに、A100で処理した培養物において、CXCR4発現は、FBS濃度が最も低い時、最も高かった。相対的発現がアクチビンAを加えなかった状態(NF)にむしろ近いほど、10%FBSの条件下でCXCR4レベルは著しく低下した。
上述のごとく、SOX17、GSC、MIXL1およびHNF3β遺伝子の発現は、胚体内胚葉としての細胞の特性と一致する。7つの分化条件の全てにおいて、これら4つの遺伝子の相対的発現は、CXCR4のそれと酷似している(図27A〜D)。これは、CXCR4も、胚体内胚葉のマーカーであることを示している。
外胚葉および中胚葉系列は、それらの各種マーカーの発現により胚体内胚葉と識別される。初期中胚葉は、BrachyuryおよびMOX1遺伝子を発現し、一方、新生神経外胚葉はSOX1およびZIC1を発現する。図28A〜Dは、外因性アクチビンAを添加しなかった培養物が、中胚葉および外胚葉遺伝子の発現で選択的に濃縮され、アクチビンAで処理した培養物の中では、10%のFBS条件においても、中胚葉および外胚葉マーカー発現のレベルが増加したことを示している。これらの発現パターンは、CXCR4とは逆であり、CXCR4が、この発生時期においてESC由来の中胚葉または外胚葉ではあまり発現しないことを明らかにした。
哺乳類発生の初期、胚外系列への分化も起こる。ここで特に関連性があるのは、SOX17を含む、胚体内胚葉と共通の多くの遺伝子の発現を共有する臓側内胚葉の分化である。胚体内胚葉を胚外臓側内胚葉と識別するためには、これら二つの間で異なったマーカーを調べなくてはならない。SOX7は、臓側内胚葉では発現するが、胚体内胚葉系列では発現しないマーカーの代表である。よって、SOX7発現の不在下で、強度のSOX17遺伝子発現を示す培養状態は、臓側内胚葉ではなく、胚体内胚葉を含む傾向にある。SOX7はアクチビンAを加えなかった培養物で高度に発現しており、また、SOX7はFBSが10%含まれたときアクチビンAの存在下でも発現の増加を示したことが、図28Eに示されている。このパターンは、CXCR4の発現パターンとは逆であることから、CXCR4が、臓側内胚葉では高度に発現されないことを示唆している。
上記各分化条件下で存在するSOX17免疫反応(SOX17+)細胞の相対数も求めた。hESCを、高用量アクチビンAの存在下、低FBS濃度(0.5%〜2.0%)で分化させた場合、SOX17+細胞は、培養物全体に渡り偏在的に分布した。高用量アクチビンAを使用するが、含まれるFBSが10%(v/v)である場合、SOX17+細胞の出現頻度はかなり低く、培養物全体に渡り均等に分布するのではなく、常に孤立したクラスターとして出現した(図29AおよびC並びにBおよびE)。外因性アクチビンAを使用しなかった場合、SOX17+細胞の更なる減少が見られた。これらの条件下でも、SOX17+細胞は、クラスターとして出現した。これらクラスターは、高容量アクチビンA、低濃度FBSで処理した場合に見られるものより小さく、はるかにまれであった(図29CおよびF)。これらの結果は、CXCR4の発現パターンが、胚体内胚葉遺伝子発現と一致しているだけでなく、各条件下における胚体内胚葉細胞の数とも一致していることを立証している。
【0019】
実施例8
胚体内胚葉で濃縮する分化条件は、CXCR4陽性細胞の比率を増加させる
アクチビンAの投与量も、胚体内胚葉がESCから誘導される効率に影響を及ぼす。この実施例は、アクチビンAの投与量増加により、培養物中のCXCR4+細胞の比率が高く
なることを実証している。
hESCは、0.5%〜2%FBS(分化の最初の3日間で0.5%から1.0%へ、そして2.0%へと増加した)および0、10または100ng/mLのアクチビンAを添加したRPMI培地で分化させた。7日間分化させた後、細胞を、室温で5分間、2% FBSおよび2mM(EDTA)を含みCa2+/Mg2+を含まないPBSにおいて分離させた。細胞は、35umのナイロンフィルターを通して濾過し、数を数え、ペレット状にした。ペレットは、少量の50%のヒト血清/50%の正常なロバ血清で再懸濁させ、非特異的抗体結合部位を遮断するために氷上で2分間培養した。これに、50uL(約105個の細胞を含む)につき、1uLのマウス抗CXCR4抗体(アブカム(Abcam)社、カタログ番号ab10403−100)を添加し、45分間氷上で標識化を行なった。細胞を、2%のヒト血清(緩衝液)を含むPBS5mLを添加することにより洗浄し、ペレット状にした。緩衝液5mLで2回目の洗浄を完了し、その後、細胞は、105個の細胞ごとに緩衝液50uLに再懸濁させた。二次抗体(FITC標識ロバ抗マウス;Jackson ImmunoResearch、カタログ番号715−096−151)を、最終濃度5ug/mLで加え、30分間標識化し、その後、上述のように緩衝液で二度洗浄した。細胞は緩衝液中、5×106個の細胞/mLで再懸濁させ、フローサイトメトリー・コアファシリティー(flow cytometry core facility)(The Scripps Research Institute)において、スタッフによりFACS Vantage(Beckton Dickenson社)を使用して分析および選別した。細胞は、リアタイム定量PCRにより、遺伝子発現解析のために総RNAを引き続き分離するため、RLT溶解緩衝液(Qiagen社)の中に直接回収した。
分化培養培地において、アクチビンAの投与量が増加するにつれ、フローサイトメトリーにより求めたCXCR4+細胞の数の著しい増加が観察された(図30A〜C)。CXCR4+細胞は、R4ゲート内にあったものであり、このゲートは、イベントの0.2%がR4ゲート内に位置する二次抗体のみの対照を使用して設定した。CXCR4+細胞数の著しい増加は、アクチビンAの投与量が増加するにつれて生じた胚体内胚葉遺伝子発現の力強い増加と相関する(図31A〜D)。
【0020】
実施例9
CXCR4陽性細胞の分離により胚体内胚葉遺伝子発現を濃縮し、中胚葉、外胚葉および臓側内胚葉のマーカーを発現する細胞を減少させる
上記実施例8において同定したCXCR4+およびCXCR4-細胞を回収し、相対的な遺伝子発現を分析し、母集団の遺伝子発現を同時に測定した。
CXCR4遺伝子発現の相対量は、アクチビンAの投与量の増加と共に著しく増加した(図32)。これは、CXCR4+細胞のアクチビンA用量依存的な増加と非常によく相関した(図30A〜C)。各集団から分離したCXCR4+細胞が、その集団におけるCXCR4遺伝子発現ほぼ全ての原因であったことも明白である。これは、これらの細胞を回収するFACS法の効率の良さを立証している。
遺伝子発現解析は、CXCR4+細胞に、CXCR4遺伝子発現の大部分のみでなく、胚体内胚葉のマーカーに関する他の遺伝子発現も含まれることを明らかにした。図31A〜Dに示されているように、CXCR4+細胞は、SOX17、GSC、HNF3BおよびMIXL1に関して、親A100集団よりもさらに濃縮された。さらに、CXCR4-画分には、これらの胚体内胚葉マーカーに関する遺伝子発現は殆どなかった。また、CXCR4+およびCXCR4-集団は、中胚葉、外胚葉および胚外内胚葉のマーカーに関し逆パターンの遺伝子発現を示した。図33A〜Dは、Brachyury、MOX1、ZIC1およびSOX7の遺伝子発現に関して、A100母集団と比較し、CXCR4+細胞が激減したことを示している。このA100母集団においては、アクチビンAの投与量が少ないかまたは全くない条件に比べ、これらのマーカーの発現はもともと低かった。これらの結果は、高用量アクチビンAの存在下で分化させたhESCからCXCR4+細胞を分
離することにより、胚体内胚葉で高度に濃縮され、且つ、実質的に純胚体内胚葉である集団が得られることを明らかにしている。
【0021】
実施例10
CXCR4を用いた、細胞集団内の胚体内胚葉細胞の定量化
細胞培養物または細胞集団に存在する胚体内胚葉細胞の比率の定量化を確認するために、CXCR4および胚体内胚葉の他のマーカーを発現している細胞をFACSにより分析した。前記比率の定量化は、本明細書において先に求めたもの、並びに、2003年12月23日に出願された、名称「DEFINITIVE ENDODERM(胚体内胚葉)」の米国仮特許出願第60/532,004号明細書において求められたものであり、この全開示内容は、引用することにより本明細書の一部とされる。
上記実施例で説明したような方法を用いて、hESCを分化させ胚体内胚葉を作製した。具体的には、分化細胞培養物において示される収率および純度を増加させるため、培地の血清濃度を以下のように制御した:1日目は0.2%FBS、2日目は1.0%FBS、そして3〜6日目は2.0%FBSとした。分化した培養物は、三つの細胞表面エピトープ、E−カドヘリン、CXCR4、およびトロンボモジュリンを用いて、FACSで分取した。そして、分取した細胞集団は、Q−PCRにより分析し、胚体および胚外内胚葉並びに他の細胞型に関するマーカーの相対的発現量を求めた。最適に分化した培養物から採取したCXCR4分取細胞は、純度98%を超える胚体内胚葉細胞を分離する結果となった。
表2は、ここで説明した方法を用いてhESCから分化させた胚体内胚葉培養物に関するマーカー分析の結果示す。
【表2】

具体的には、表2は、CXCR4およびSOX17陽性細胞(内胚葉)が、細胞培養物中の細胞の70%〜80%を占めることを示している。これらのSOX17を発現している細胞のうち、2%未満がTM(壁側内胚葉)を発現し、1%未満がAFP(臓側内胚葉)を発現した。SOX17/CXCR4陽性細胞の比率から、TM陽性およびAFP陽性細胞(壁側および臓側内胚葉の合計:3%)の比率を差し引くと、細胞培養物の約67%から約77%が胚体内胚葉であったことが分かる。細胞の約10%は、hESCのマーカーであるE−カドヘリン(ECAD)に陽性であり、細胞の約10〜20%は他の細胞型であった。
FACS分離前に得られる分化細胞培養物中の胚体内胚葉の純度は、FBS濃度を5〜6日間の分化過程を通して0.5%以下に維持することにより、上記の低血清処理と比較して改善できることが分かった。しかしながら、5〜6日間の分化過程を通して0.5%以下に細胞培養物を維持することは、作製される胚体内胚葉細胞総数を減少させることにもなる。
ここに記載した方法により作製された胚体内胚葉細胞は、それほど分化を伴わず、50日
間を超えてアクチビンの存在下、培養物中に維持し増殖させた。そのような場合、SOX17、CXCR4、MIXL1、GATA4、HNF3βの発現は、培養期間中維持される。さらに、TM、SPARC、OCT4、AFP、SOX7、ZIC1およびBRACHは、これらの培養物において検出されなかった。そのような細胞は、それほど分化を伴わず、実質的に50日を越えて培養物中で維持し、増殖させることができるようである。
【0022】
実施例11
胚体内胚葉細胞の更なるマーカー
以下の実験では、RNAを、精製した胚体内胚葉およびヒト胚性幹細胞集団から分離した。その後、精製した各集団から得たRNAの遺伝子チップ分析により遺伝子発現を分析した。また、Q−PCRも行い、胚体内胚葉のマーカーとして、胚体内胚葉では発現するが、胚性幹細胞では発現しない遺伝子の可能性をさらに調査した。
ヒト胚性幹細胞(hESC)を、20%のノックアウト血清リプレースメント、4ng/mLの組換え型ヒト塩基性線維芽細胞増殖因子(bFGF)、0.1mMの2−メルカプトエタノール、L−グルタミン、非必須アミノ酸、およびペニシリン/ストレプトマイシンを添加したDMEM/F12培地で維持した。hESCは、100ng/mLの組換え型ヒトアクチビンA、ウシ胎児血清(FBS)、およびペニシリン/ストレプトマイシンを添加したRPMI培地で5日間培養することにより、胚体内胚葉に分化させた。FBSの濃度は、以下のように日毎に変化させた:0.1%(一日目)、0.2%(2日目)、2%(3〜5日目)。
遺伝子発現解析用にhESCおよび胚体内胚葉の精製集団を得るため、蛍光活性細胞分離法(FACS)により細胞を分離した。hESCは、SSEA4抗原(R&D Systems社、カタログ番号FAB1435P)を使用して、胚体内胚葉は、CXCR4(R&D Systems社、カタログ番号FAB170P)を使用して、免疫精製を行なった。細胞は、トリプシン/EDTA(Invitrogen社、カタログ番号25300−054)を用いて分離し、2%のヒト血清を含むリン酸緩衝生理食塩水(PBS)中で洗浄し、非特異的結合を遮断するために10分間氷上で100%のヒト血清中に再懸濁させた。800uLのヒト血清中、5×106個の細胞に対し、フィコエリトリン標識抗体200uLを添加することにより、氷上で30分間染色を行なった。細胞は、PBS緩衝液8mLで二度洗浄し、PBS緩衝液1mL中に再懸濁させた。FACS Vantage(BD Biosciences)を使用し、The Scripps Research Instituteのコアファシリティにより、FACS分離が行われた。細胞は、RLT溶解緩衝液中に直接回収し、RNAは、製造業者(Qiagen社)の使用説明に従いRNeasyにより分離した。
アフィメトリクス(Affymetrix)社製プラットフォームおよびU133 Plus 2.0高密度オリゴヌクレオチドアレイを使用し、発現プロファイルデータを作製するため、Expression Analysis社(ダラム、ノースカロライナ)に、精製したRNAを二部提出した。提示されたデータは、hESCおよび胚体内胚葉の2つの集団の間で、特異的に発現した遺伝子を同定する群比較である。hESCにおいて見られた発現量を超えて、力強い上昇変化を示した遺伝子を、胚体内胚葉に極めて特有である新しいマーカー候補として選択した。選択した遺伝子は、上述のように、Q−PCRにより分析し、遺伝子チップ上で見られる遺伝子発現変化を検証し、またhESCが分化する間のこれら遺伝子の発現パターンも調べた。
図34A〜Mは、一定のマーカーに関する遺伝子発現結果を示している。結果は、100ng/mlのアクチビンAの添加後1日目、3日目および5日目に分析した細胞培養物、5日間の分化過程の終わりに精製したCXCR4発現胚体内胚葉細胞(CXDE)、および精製ヒト胚性幹細胞(HESC)について示している。図34Cおよび図34G〜Mを比較することにより、六つのマーカー遺伝子FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1が、互いにほぼ等しく、またCXCR4およびSOX17/SOX7の発現パターンとも等しい発現パターンを示すことが立証されている。先
に説明したように、SOX17は、胚体内胚葉およびSOX7発現胚外内胚葉の両方において発現する。SOX7は胚体内胚葉で発現しないため、SOX17/SOX7の比率により、全体として集団内で見られるSOX17発現に対する胚体内胚葉の寄与について信頼性のある推定が得られる。パネルG〜LおよびMのパネルCに対する類似性は、FGF17、VWF、CALCR、FOXQ1、CMKOR1およびCRIP1が、胚体内胚葉のマーカーである可能性が高く、胚外内胚葉細胞においては著しく発現することはないことを示している。
当然のことながら、ここに記載したQ−PCRの結果は、ICCによりさらに確認することができる。
本明細書に記載した方法、組成物および装置は、好適な実施形態の現時点での代表的および模範的なものであり、本発明の範囲を限定することを意図したものではない。当技術分野における当業者は、本発明の精神に包含され、開示内容の範囲により明確にされる変更および他の用途を考え付くこともあろう。よって、種々の代替および変更が、本発明の範囲および精神から逸脱することなく、ここに開示した本発明に帰することは当業者にとっては明らかであろう。
請求項および本開示事項全体に渡って使用されている、「本質的に〜から成る」という表現により、その表現の中に記載されたあらゆる要素を含み、記載されている要素に関する開示において特定した働きあるいは作用を妨げたり寄与したりすることのない他の要素に限定された、あらゆる要素を含むことを意味する。よって、「本質的に〜から成る」という表現は、記載されている要素は必要、すなわち必須であるが、他の要素は任意であり、記載されている要素の働きまたは作用に影響するかどうかによって存在する場合もあれば存在しない場合もあることを示している。
【0023】
本特許出願においては、多数の文献および特許参考文献が引用されている。本特許出願において引用された全ての参考文献は、その全内容を引用することにより本明細書の一部とされる。
いくつかの参考文献に関しては、本文中、完全な典拠を記載している。その他の参考文献に関しては、本文中、著者および年度により言及しており、その完全な典拠を以下に示す。
Alexander, J., Rothenberg, M., Henry, G. L., and Stainier, D. Y. (1999). Casanova plays an early and essential role in endoderm formation in zebrafish. Dev Biol
215, 343-357.
Alexander, J., and Stainier, D. Y. (1999). A molecular pathway leading to endoderm formation in zebrafish. Curr Biol 9, 1147-1157.
Aoki, T. O., Mathieu, J., Saint-Etienne, L., Rebagliati, M. R., Peyrieras, N., and Rosa, F. M. (2002). Regulation of nodal signalling and mesendoderm formation by TARAM-A, a TGFbeta-related type I receptor. Dev Biol 241, 273-288.
Beck, S., Le Good, J. A., Guzman, M., Ben Haim, N., Roy, K., Beermann, F., and Constam, D. B. (2002). Extra-embryonic proteases regulate Nodal signalling during
gastrulation. Nat Cell Biol 4, 981-985.
Beddington, R. S., Rashbass, P., and Wilson, V. (1992). Brachyury--a gene affecting mouse gastrulation and early organogenesis. Dev Suppl, 157-165.
Bongso, A., Fong, C. Y., Ng, S. C., and Ratnam, S. (1994). Isolation and culture
of inner cell mass cells from human blastocysts. Hum Reprod 9, 2110-2117.
Chang, H., Brown, C. W., and Matzuk, M. M. (2002). Genetic analysis of the mammalian transforming growth factor-beta superfamily. Endocr Rev 23, 787-823.
Conlon, F. L., Lyons, K. M., Takaesu, N., Barth, K. S., Kispert, A., Herrmann, B., and Robertson, E. J. (1994). A primary requirement for nodal in the formation
and maintenance of the primitive streak in the mouse. Development 120, 1919-1928.
Dougan, S. T., Warga, R. M., Kane, D. A., Schier, A. F., and Talbot, W. S. (2003). The role of the zebrafish nodal-related genes squint and cyclops in patterning of mesendoderm. Development 130, 1837-1851.
Feldman, B., Gates, M. A., Egan, E. S., Dougan, S. T., Rennebeck, G., Sirotkin, H. I., Schier, A. F., and Talbot, W. S. (1998). Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature 395, 181-185.
Feng, Y., Broder, C. C., Kennedy, P. E., and Berger, E. A. (1996). HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane, G protein-coupled receptor. Science 272, 872-877.
Futaki, S., Hayashi, Y., Yamashita, M., Yagi, K., Bono, H., Hayashizaki, Y., Okazaki, Y., and Sekiguchi, K. (2003). Molecular basis of constitutive production of basement membrane components: Gene expression profiles of engelbreth-holm-swarm tumor and F9 embryonal carcinoma cells. J Biol Chem.
Grapin-Botton, A., and Melton, D. A. (2000). Endoderm development: from patterning to organogenesis. Trends Genet 16, 124-130.
Harris, T. M., and Childs, G. (2002). Global gene expression patterns during differentiation of F9 embryonal carcinoma cells into parietal endoderm. Funct Integr Genomics 2, 105-119.
Hogan, B. L. (1996). Bone morphogenetic proteins in development. Curr Opin Genet
Dev 6, 432-438.
Hogan, B. L. (1997). Pluripotent embryonic cells and methods of making same (U.S.A., Vanderbilt University).
Howe, C. C., Overton, G. C., Sawicki, J., Solter, D., Stein, P., and Strickland,
S. (1988). Expression of SPARC/osteonectin transcript in murine embryos and gonads. Differentiation 37, 20-25.
Hudson, C., Clements, D., Friday, R. V., Stott, D., and Woodland, H. R. (1997). Xsox17alpha and -beta mediate endoderm formation in Xenopus. Cell 91, 397-405.
Imada, M., Imada, S., Iwasaki, H., Kume, A., Yamaguchi, H., and Moore, E. E. (1987). Fetomodulin: marker surface protein of fetal development which is modulatable by cyclic AMP. Dev Biol 122, 483-491.
Kanai-Azuma, M., Kanai, Y., Gad, J. M., Tajima, Y., Taya, C., Kurohmaru, M., Sanai, Y., Yonekawa, H., Yazaki, K., Tam, P. P., and Hayashi, Y. (2002). Depletion of definitive gut endoderm in Sox17-null mutant mice. Development 129, 2367-2379.
Katoh, M. (2002). Expression of human SOX7 in normal tissues and tumors. Int J Mol Med 9, 363-368.
Kikuchi, Y., Agathon, A., Alexander, J., Thisse, C., Waldron, S., Yelon, D., Thisse, B., and Stainier, D. Y. (2001). casanova encodes a novel Sox-related protein necessary and sufficient for early endoderm formation in zebrafish. Genes Dev 15, 1493-1505.
Kim, C. H., and Broxmeyer, H. E. (1999). Chemokines: signal lamps for trafficking of T and B cells for development and effector function. J Leukoc Biol 65, 6-15.
Kimelman, D., and Griffin, K. J. (2000). Vertebrate mesendoderm induction and patterning. Curr Opin Genet Dev 10, 350-356.
Kubo A, Shinozaki K, Shannon JM, Kouskoff V, Kennedy M, Woo S, Fehling HJ, Keller G. (2004) Development of definitive endoderm from embryonic stem cells in culture. Development. 131,1651-62.
Kumar, A., Novoselov, V., Celeste, A. J., Wolfman, N. M., ten Dijke, P., and Kuehn, M. R. (2001). Nodal signaling uses activin and transforming growth factor-be
ta receptor-regulated Smads. J Biol Chem 276, 656-661.
Labosky, P. A., Barlow, D. P., and Hogan, B. L. (1994a). Embryonic germ cell lines and their derivation from mouse primordial germ cells. Ciba Found Symp 182, 157-168; discussion 168-178.
Labosky, P. A., Barlow, D. P., and Hogan, B. L. (1994b). Mouse embryonic germ (EG) cell lines: transmission through the germline and differences in the methylation imprint of insulin-like growth factor 2 receptor (Igf2r) gene compared with embryonic stem (ES) cell lines. Development 120, 3197-3204.
Lickert, H., Kutsch, S., Kanzler, B., Tamai, Y., Taketo, M. M., and Kemler, R. (2002). Formation of multiple hearts in mice following deletion of beta-catenin in the embryonic endoderm. Dev Cell 3, 171-181.
Lu, C. C., Brennan, J., and Robertson, E. J. (2001). From fertilization to gastrulation: axis formation in the mouse embryo. Curr Opin Genet Dev 11, 384-392.
Ma, Q., Jones, D., and Springer, T. A. (1999). The chemokine receptor CXCR4 is required for the retention of B lineage and granulocytic precursors within the bone marrow microenvironment. Immunity 10, 463-471.
McGrath KE, Koniski AD, Maltby KM, McGann JK, Palis J. (1999) Embryonic expression and function of the chemokine SDF-1 and its receptor, CXCR4. Dev Biol. 213, 442-56.
Miyazono, K., Kusanagi, K., and Inoue, H. (2001). Divergence and convergence of TGF-beta/BMP signaling. J Cell Physiol 187, 265-276.
Nagasawa, T., Hirota, S., Tachibana, K., Takakura, N., Nishikawa, S., Kitamura, Y., Yoshida, N., Kikutani, H., and Kishimoto, T. (1996). Defects of B-cell lymphopoiesis and bone-marrow myelopoiesis in mice lacking the CXC chemokine PBSF/SDF-1. Nature 382, 635-638.
Niwa, H. (2001). Molecular mechanism to maintain stem cell renewal of ES cells. Cell Struct Funct 26, 137-148.
Ogura, H., Aruga, J., and Mikoshiba, K. (2001). Behavioral abnormalities of Zic1
and Zic2 mutant mice: implications as models for human neurological disorders. Behav Genet 31, 317-324.
Reubinoff, B. E., Pera, M. F., Fong, C. Y., Trounson, A., and Bongso, A. (2000).
Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat Biotechnol 18, 399-404.
Rodaway, A., and Patient, R. (2001). Mesendoderm. an ancient germ layer? Cell 105, 169-172.
Rodaway, A., Takeda, H., Koshida, S., Broadbent, J., Price, B., Smith, J. C., Patient, R., and Holder, N. (1999). Induction of the mesendoderm in the zebrafish germ ring by yolk cell-derived TGF-beta family signals and discrimination of mesoderm and endoderm by FGF. Development 126, 3067-3078.
Rohr, K. B., Schulte-Merker, S., and Tautz, D. (1999). Zebrafish zic1 expression
in brain and somites is affected by BMP and hedgehog signalling. Mech Dev 85, 147-159.
Schier, A. F. (2003). Nodal signaling in vertebrate development. Annu Rev Cell Dev Biol 19, 589-621.
Schoenwolf, G. C., and Smith, J. L. (2000). Gastrulation and early mesodermal patterning in vertebrates. Methods Mol Biol 135, 113-125.
Shamblott, M. J., Axelman, J., Wang, S., Bugg, E. M., Littlefield, J. W., Donovan, P. J., Blumenthal, P. D., Huggins, G. R., and Gearhart, J. D. (1998). Derivation of pluripotent stem cells from cultured human primordial germ cells. Proc Natl Acad Sci U S A 95, 13726-13731.
Shapiro, A. M., Lakey, J. R., Ryan, E. A., Korbutt, G. S., Toth, E., Warnock, G.
L., Kneteman, N. M., and Rajotte, R. V. (2000). Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med 343, 230-238.
Shapiro, A. M., Ryan, E. A., and Lakey, J. R. (2001a). Pancreatic islet transplantation in the treatment of diabetes mellitus. Best Pract Res Clin Endocrinol Metab 15, 241-264.
Shapiro, J., Ryan, E., Warnock, G. L., Kneteman, N. M., Lakey, J., Korbutt, G. S., and Rajotte, R. V. (2001b). Could fewer islet cells be transplanted in type 1
diabetes? Insulin independence should be dominant force in islet transplantation. Bmj 322, 861.
Shiozawa, M., Hiraoka, Y., Komatsu, N., Ogawa, M., Sakai, Y., and Aiso, S. (1996). Cloning and characterization of Xenopus laevis xSox7 cDNA. Biochim Biophys Acta 1309, 73-76.
Smith, J. (1997). Brachyury and the T-box genes. Curr Opin Genet Dev 7, 474-480.Smith, J. C., Armes, N. A., Conlon, F. L., Tada, M., Umbhauer, M., and Weston, K. M. (1997). Upstream and downstream from Brachyury, a gene required for vertebrate mesoderm formation. Cold Spring Harb Symp Quant Biol 62, 337-346.
Takash, W., Canizares, J., Bonneaud, N., Poulat, F., Mattei, M. G., Jay, P., and
Berta, P. (2001). SOX7 transcription factor: sequence, chromosomal localisation, expression, transactivation and interference with Wnt signalling. Nucleic Acids Res 29, 4274-4283.
Taniguchi, K., Hiraoka, Y., Ogawa, M., Sakai, Y., Kido, S., and Aiso, S. (1999).
Isolation and characterization of a mouse SRY-related cDNA, mSox7. Biochim Biophys Acta 1445, 225-231.
Technau, U. (2001). Brachyury, the blastopore and the evolution of the mesoderm.
Bioessays 23, 788-794.
Thomson, J. A., Itskovitz-Eldor, J., Shapiro, S. S., Waknitz, M. A., Swiergiel, J. J., Marshall, V. S., and Jones, J. M. (1998). Embryonic stem cell lines derived from human blastocysts. Science 282, 1145-1147.
Tremblay, K. D., Hoodless, P. A., Bikoff, E. K., and Robertson, E. J. (2000). Formation of the definitive endoderm in mouse is a Smad2-dependent process. Development 127, 3079-3090.
Vandesompele, J., De Preter, K., Pattyn, F., Poppe, B., Van Roy, N., De Paepe, A., and Speleman, F. (2002). Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol 3, RESEARCH0034.
Varlet, I., Collignon, J., and Robertson, E. J. (1997). nodal expression in the primitive endoderm is required for specification of the anterior axis during mouse gastrulation. Development 124, 1033-1044.
Vincent, S. D., Dunn, N. R., Hayashi, S., Norris, D. P., and Robertson, E. J. (2003). Cell fate decisions within the mouse organizer are governed by graded Nodal signals. Genes Dev 17, 1646-1662.
Weiler-Guettler, H., Aird, W. C., Rayburn, H., Husain, M., and Rosenberg, R. D. (1996). Developmentally regulated gene expression of thrombomodulin in postimplantation mouse embryos. Development 122, 2271-2281.
Weiler-Guettler, H., Yu, K., Soff, G., Gudas, L. J., and Rosenberg, R. D. (1992). Thrombomodulin gene regulation by cAMP and retinoic acid in F9 embryonal carcinoma cells. Proceedings Of The National Academy Of Sciences Of The United States
Of America 89, 2155-2159.
Wells, J. M., and Melton, D. A. (1999). Vertebrate endoderm development. Annu Rev Cell Dev Biol 15, 393-410.
Wells, J. M., and Melton, D. A. (2000). Early mouse endoderm is patterned by soluble factors from adjacent germ layers. Development 127, 1563-1572.
Willison, K. (1990). The mouse Brachyury gene and mesoderm formation. Trends Genet 6, 104-105.
Zhao, G. Q. (2003). Consequences of knocking out BMP signaling in the mouse. Genesis 35, 43-56.
Zhou, X., Sasaki, H., Lowe, L., Hogan, B. L., and Kuehn, M. R. (1993). Nodal is a novel TGF-beta-like gene expressed in the mouse node during gastrulation. Nature 361, 543-547.
【特許請求の範囲】
【請求項1】
ヒト多能性細胞および前記ヒト多能性細胞から分化したヒト胚体内胚葉細胞を含む細胞培養物であって、前記細胞培養物において、ヒト多能性細胞5個につき少なくとも1個のヒト胚体内胚葉細胞が存在する、細胞培養物。
【請求項2】
前記細胞培養物において、ヒト多能性細胞2個につき少なくとも1個のヒト胚体内胚葉細胞が存在する請求項1に記載の細胞培養物。
【請求項3】
前記細胞培養物において、ヒト多能性細胞1個につき少なくとも2個のヒト胚体内胚葉細胞が存在する請求項1に記載の細胞培養物。
【請求項4】
前記細胞培養物において、ヒト多能性細胞1個につき少なくとも5個のヒト胚体内胚葉細胞が存在する請求項1に記載の細胞培養物。
【請求項5】
前記細胞培養物において、ヒト多能性細胞1個につき少なくとも10個のヒト胚体内胚葉細胞が存在する請求項1に記載の細胞培養物。
【請求項6】
前記ヒト多能性細胞が、胚性幹細胞を含む請求項1〜5のいずれか1項に記載の細胞培養物。
【請求項7】
前記胚性幹細胞が、桑実胚および胚の内部細胞塊(ICM)からなる群から選択される組織に由来する請求項6に記載の細胞培養物。
【請求項8】
前記ヒト多能性細胞が、胚の生殖隆起に由来する請求項1〜5のいずれか1項に記載の細胞培養物。
【請求項9】
さらに培地を含む、請求項1〜8のいずれか1項に記載の細胞培養物。
【請求項10】
前記培地はB27を欠く、請求項9に記載の細胞培養物。
【請求項11】
前記培地は血清代替物を欠く、請求項9に記載の細胞培養物。
【請求項12】
さらに、TGFβスーパーファミリーのノーダル/アクチビンサブグループの増殖因子を含む請求項9に記載の細胞培養物。
【請求項13】
さらに、ノーダル、アクチビンA、アクチビンBおよびそれらの組み合わせからなる群から選択される増殖因子を含む請求項12に記載の細胞培養物。
【請求項14】
前記培地が、Wntファミリーメンバーを含む、請求項12に記載の細胞培養物。
【請求項15】
前記培地が、ノーダルを含む、請求項9に記載の細胞培養物。
【請求項16】
前記培地がアクチビンBを含む、請求項9に記載の細胞培養物。
【請求項17】
壁側内胚葉細胞を実質的に含まない、請求項1〜16のいずれか1項に記載の細胞培養物。
【請求項18】
臓側内胚葉細胞を実質的に含まない、請求項1〜16のいずれか1項に記載の細胞培養物。
【請求項19】
外胚葉系列に由来する細胞を実質的に含まない、請求項1〜16のいずれか1項に記載の細胞培養物。
【請求項20】
前記ヒト細胞は非組み換え細胞である、請求項1〜19のいずれか1項に記載の細胞培養物。
【請求項21】
前記ヒト胚体内胚葉細胞が培養容器の表面に付着する、請求項1〜20のいずれか1項に記載の細胞培養物。
【請求項1】
ヒト多能性細胞および前記ヒト多能性細胞から分化したヒト胚体内胚葉細胞を含む細胞培養物であって、前記細胞培養物において、ヒト多能性細胞5個につき少なくとも1個のヒト胚体内胚葉細胞が存在する、細胞培養物。
【請求項2】
前記細胞培養物において、ヒト多能性細胞2個につき少なくとも1個のヒト胚体内胚葉細胞が存在する請求項1に記載の細胞培養物。
【請求項3】
前記細胞培養物において、ヒト多能性細胞1個につき少なくとも2個のヒト胚体内胚葉細胞が存在する請求項1に記載の細胞培養物。
【請求項4】
前記細胞培養物において、ヒト多能性細胞1個につき少なくとも5個のヒト胚体内胚葉細胞が存在する請求項1に記載の細胞培養物。
【請求項5】
前記細胞培養物において、ヒト多能性細胞1個につき少なくとも10個のヒト胚体内胚葉細胞が存在する請求項1に記載の細胞培養物。
【請求項6】
前記ヒト多能性細胞が、胚性幹細胞を含む請求項1〜5のいずれか1項に記載の細胞培養物。
【請求項7】
前記胚性幹細胞が、桑実胚および胚の内部細胞塊(ICM)からなる群から選択される組織に由来する請求項6に記載の細胞培養物。
【請求項8】
前記ヒト多能性細胞が、胚の生殖隆起に由来する請求項1〜5のいずれか1項に記載の細胞培養物。
【請求項9】
さらに培地を含む、請求項1〜8のいずれか1項に記載の細胞培養物。
【請求項10】
前記培地はB27を欠く、請求項9に記載の細胞培養物。
【請求項11】
前記培地は血清代替物を欠く、請求項9に記載の細胞培養物。
【請求項12】
さらに、TGFβスーパーファミリーのノーダル/アクチビンサブグループの増殖因子を含む請求項9に記載の細胞培養物。
【請求項13】
さらに、ノーダル、アクチビンA、アクチビンBおよびそれらの組み合わせからなる群から選択される増殖因子を含む請求項12に記載の細胞培養物。
【請求項14】
前記培地が、Wntファミリーメンバーを含む、請求項12に記載の細胞培養物。
【請求項15】
前記培地が、ノーダルを含む、請求項9に記載の細胞培養物。
【請求項16】
前記培地がアクチビンBを含む、請求項9に記載の細胞培養物。
【請求項17】
壁側内胚葉細胞を実質的に含まない、請求項1〜16のいずれか1項に記載の細胞培養物。
【請求項18】
臓側内胚葉細胞を実質的に含まない、請求項1〜16のいずれか1項に記載の細胞培養物。
【請求項19】
外胚葉系列に由来する細胞を実質的に含まない、請求項1〜16のいずれか1項に記載の細胞培養物。
【請求項20】
前記ヒト細胞は非組み換え細胞である、請求項1〜19のいずれか1項に記載の細胞培養物。
【請求項21】
前記ヒト胚体内胚葉細胞が培養容器の表面に付着する、請求項1〜20のいずれか1項に記載の細胞培養物。
【図1】


【図2】


【図3】


【図7】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図26】


【図27】


【図28】


【図30】


【図31】


【図32】


【図33】


【図34−1】


【図34−2】


【図34−3】


【図4】


【図5】


【図6】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図25】


【図29】




【図2】


【図3】


【図7】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図26】


【図27】


【図28】


【図30】


【図31】


【図32】


【図33】


【図34−1】


【図34−2】


【図34−3】


【図4】


【図5】


【図6】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図25】


【図29】


【公開番号】特開2011−250794(P2011−250794A)
【公開日】平成23年12月15日(2011.12.15)
【国際特許分類】
【出願番号】特願2011−168363(P2011−168363)
【出願日】平成23年8月1日(2011.8.1)
【分割の表示】特願2006−547496(P2006−547496)の分割
【原出願日】平成16年12月23日(2004.12.23)
【出願人】(503431792)ヴィアサイト,インコーポレイテッド (9)
【Fターム(参考)】
【公開日】平成23年12月15日(2011.12.15)
【国際特許分類】
【出願日】平成23年8月1日(2011.8.1)
【分割の表示】特願2006−547496(P2006−547496)の分割
【原出願日】平成16年12月23日(2004.12.23)
【出願人】(503431792)ヴィアサイト,インコーポレイテッド (9)
【Fターム(参考)】
[ Back to top ]

