脂肪組織間質細胞の神経細胞への分化誘導方法
【課題】脂肪組織間質細胞をより簡便且つより確実に神経細胞へ分化させる方法を提供する。
【解決手段】脂肪組織間質細胞の分化誘導方法であって、脂肪組織から採取された脂肪組織間質細胞を塩基性繊維芽細胞増殖因子(bFGF)および上皮細胞増殖因子(EGF)を含む培地で培養する段階を備え、脂肪組織間質細胞がneurosphere様浮遊細胞塊を形成するように分化誘導することを特徴とする方法。該neurosphere様浮遊細胞塊は純粋に分離・培養することができるので、脂肪組織間質細胞から神経細胞をより簡便、且つより確実に分化誘導することができ、したがって、再生医療を実現するための神経細胞を得ることが可能となる。
【解決手段】脂肪組織間質細胞の分化誘導方法であって、脂肪組織から採取された脂肪組織間質細胞を塩基性繊維芽細胞増殖因子(bFGF)および上皮細胞増殖因子(EGF)を含む培地で培養する段階を備え、脂肪組織間質細胞がneurosphere様浮遊細胞塊を形成するように分化誘導することを特徴とする方法。該neurosphere様浮遊細胞塊は純粋に分離・培養することができるので、脂肪組織間質細胞から神経細胞をより簡便、且つより確実に分化誘導することができ、したがって、再生医療を実現するための神経細胞を得ることが可能となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、脂肪組織に由来する間質細胞(脂肪組織間質細胞)の分化誘導方法、および該誘導細胞、並びに該分化誘導に用いる培地に関する。特に本発明は、脂肪組織間質細胞を、神経細胞の表現型を発現するように分化誘導する方法、および該誘導細胞、並びに該分化誘導に用いる培地に関する。
【背景技術】
【0002】
近年、組織再生を目的とした幹細胞研究が、盛んに行われている。その理由は、すでに壊死、変性を起こしてしまった組織に外部から細胞を移植することで、組織を回復できる可能性があるからである。
【0003】
組織再生に用いることができる幹細胞の候補として第一に考えられるのは、胚性幹細胞(ES細胞)である。組織再生に用いる幹細胞には、細胞を未分化な状態で容易に増殖させることができ、且つ目的の組織に分化可能であることが必要とされるところ、ES細胞は、試験管内で未分化な状態を維持したまま、ほぼ無限に増殖させることが可能であるとともに、様々な系譜の細胞へと分化させることが可能である。しかしながら、ES細胞は胚を破壊して採取するため、倫理的な問題がある。加えて、法的な問題点も解決されておらず、現段階では神経再生に用いるのは現実的ではない。また、ES細胞は原理的に移植を必要とする個体と異なる個体からの細胞を用いるため、免疫拒絶の問題も考えられる(非特許文献1参照)。
【0004】
このため、近年では、体性幹細胞と呼ばれる、成体の組織から採取可能な幹細胞が注目を集めている。体性幹細胞は、成体の脳、皮膚、骨髄、脂肪などに存在しており、試験管内で未分化な状態で増殖可能である。また、それぞれの由来する組織の細胞への分化が可能である。
【0005】
ここで、組織再生の中でも、重要度の高いものの一つとして、神経再生が挙げられる。神経細胞は、発生初期に増殖、分布することにより神経系が構築されて以降は自己再生能に乏しく、一度傷害を受けた神経組織は修復されない。そのため、幹細胞から分化させた神経細胞を移植することで、傷害を受けた神経組織を修復する技術が求められている。
【0006】
体性幹細胞の上述した性質に鑑みると、神経再生に用いる体性幹細胞として第一に考えられるのは、大脳脳室下領域から採取できる神経幹細胞(neural stem cells: NSCs)である。神経幹細胞は、in vitroでneurosphereと呼ばれる浮遊細胞塊を形成しながら増殖可能であり、また、特定の分化条件に置くと神経細胞に分化可能であるという報告がある(非特許文献2参照)。しかしながら、神経幹細胞は採取する際に個体の大脳に大きな傷害を与えるため、同一個体の細胞を用いて神経再生を行うことには大きな困難性を伴う。よって、神経幹細胞の場合も異なる個体から採取することが必要となり、ES細胞と同様に、倫理的な問題のほか、免疫拒絶の問題も生じる。
一方、近年、体性幹細胞については、由来組織以外の組織の細胞へも分化可能であるという報告がなされている(例えば非特許文献3)。特に、体性幹細胞の1つである脂肪組織間質細胞から、神経細胞を分化誘導する技術が報告されている(例えば特許文献1、2)。
【0007】
特許文献1には、脂肪組織間質細胞から神経細胞を分化誘導する方法が記載されている。特許文献1の方法は、脂肪組織間質細胞を10%ウシ胎児血清及び5%ニワトリ胚エキスを含むDMEMで培養した後、20%ウシ胎児血清(FBS)を含むDMEMで培養し、その後、BHAを含む無血清DMEMで培養することにより、幼若な神経細胞のマーカーであるNSE、および神経幹細胞のマーカーであるネスチンの発現を誘導する。しかしながら、この方法ではNSEおよびネスチンを誘導させるための前処理が煩雑であり、一般に培地に使用されないニワトリ胚エキスのロット差がその成否に影響するという問題点がある。
【0008】
一方、特許文献2には、脂肪組織間質細胞を神経細胞へ分化誘導する方法が記載されている。特許文献2の方法は、脂肪組織間質細胞を20%FBS含有DMEMで培養した後、1mMβ‐メルカプトエタノール含有無血清DMEMで培養するものであり、培養後の細胞には神経突起が出現すると記載されている。しかしながら、この方法で得られた細胞の突起が神経突起であることは証明されておらず、また、神経細胞へ分化し始めたとしてもその分化のレベルが神経細胞のどの段階のレベルであるか不明である。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特表2003-523767号公報
【特許文献2】国際公開第03/008592号パンフレット
【非特許文献】
【0010】
【非特許文献1】Swijinenburgら、2005、Circulation 112(9 suppl): I166-172
【非特許文献2】Suら、2004、Mol Cell Biol. 24: 8018-25
【非特許文献3】Petersenら、1999、Science 284: 1168-1170
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明はこのような事情に基づきなされたものであり、脂肪組織間質細胞をより簡便、且つより確実に神経細胞へ分化させる方法、そのために用いる培地の組成及び当該誘導細胞を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明は、脂肪組織間質細胞の分化誘導方法であって、脂肪組織間質細胞を脂肪組織から採取する段階と、脂肪組織間質細胞をdcAMP(dibutyryl cyclic AMP)又はホルスコリン(forskolin)を含む培地で培養する段階を備え、脂肪組織間質細胞が幼若な神経細胞のマーカーを発現するように分化誘導することを特徴とする。
【0013】
また、本発明の異なる態様として、本発明は、脂肪組織間質細胞の分化誘導方法であって、脂肪組織間質細胞を脂肪組織から採取する段階と、脂肪組織間質細胞を塩基性線維芽細胞増殖因子および上皮細胞増殖因子を含む培地で培養して、ネスチンおよびNSEを発現するように分化誘導する第1分化誘導段階と、第1分化誘導段階で分化誘導した細胞を、レチノイン酸、dcAMP、およびソニックヘッジホッグ(Sonic hedgehog)を含む培地で培養して、NSEの発現を増強するとともに、MAP-2を発現するように分化誘導する第2分化誘導段階とを備え、脂肪組織間質細胞が神経細胞の表現型を発現するように分化誘導することを特徴とする。
【発明の効果】
【0014】
本発明によれば、本発明に係る培地で脂肪組織間質細胞を培養することにより、脂肪組織間質細胞からより簡便、且つより確実に神経細胞を分化誘導することができる。したがって、再生医療を実現するための神経細胞を得ることが可能となる。
【図面の簡単な説明】
【0015】
【図1】犬脂肪組織間質細胞(上図)、およびdcAMPまたはホルスコリンにより分化誘導された犬脂肪組織間質細胞(下図)の形態を示す図である。
【図2】犬脂肪組織間質細胞、およびdcAMPまたはホルスコリンにより分化誘導された犬脂肪組織間質細胞における神経細胞マーカー(NSE、NF-68、またはMAP-2)の発現を示す図である。
【図3】dcAMPにより分化誘導される過程での犬脂肪組織間質細胞のNSE発現の経時的変化を示す図である。
【図4】dcAMPまたはホルスコリンにより分化誘導された犬脂肪組織間質細胞におけるNSEの発現を示す図である。
【図5】dcAMPにより分化誘導された犬脂肪組織間質細胞における神経細胞トランポーター、あるいはグリア細胞トランスポーターであるGLUT-3、GLT-1、EAAT4、またはEAAC1 mRNAの発現を示す図である。
【図6】犬脂肪組織間質細胞より生成されたsphere、および犬神経幹細胞より生成されたNeurosphereの形態を示す図である。
【図7】犬脂肪組織間質細胞より生成されたSphereのネスチン mRNAの発現を示す図である。
【図8】犬脂肪組織間質細胞および犬神経幹細胞より生成されたNeurosphereより分化誘導された細胞の、神経細胞マーカータンパク質であるNSEおよびMAP-2の発現を示す図である。
【図9】犬脂肪組織間質細胞、sphereから分化誘導された細胞、およびNeurosphereから分化誘導された細胞のグルタミン酸刺激によるカルシウムイメージを示す図である。
【発明を実施するための形態】
【0016】
(第1実施形態)
以下に、本発明の第1実施形態について詳述する。
【0017】
本発明の第1実施形態は、脂肪組織間質細胞の分化誘導方法であって、脂肪組織間質細胞を脂肪組織から採取する段階と、脂肪組織に由来する間質細胞(脂肪組織間質細胞)を、例えば試験管内においてdcAMP(dibutyryl cyclic AMP)又はホルスコリン(forskolin)を含む培地で培養する段階とを備え、脂肪組織間質細胞が幼若な神経細胞のマーカーを発現するように分化誘導することを特徴とする。
【0018】
分化誘導により、紡錘形を呈した脂肪組織間質細胞は、円形の細胞体から複数の突起を伸ばす神経細胞様の形態を示すようになる。また、分化誘導された脂肪組織間質細胞は、幼若な神経細胞のマーカーを発現する。幼若な神経細胞のマーカーとしては、例えばNSE(neuron specific enolase)を挙げることができる。分化誘導された脂肪組織間質細胞は、NSEを強く発現する。
【0019】
ここで、幼若な神経細胞とは、胎児期に認められる神経前駆細胞のような細胞をいう。
【0020】
まず、本第1実施形態において分化誘導させる、脂肪組織間質細胞の採取、および分化誘導前の培養について説明する。
【0021】
脂肪組織間質細胞 (adipose tissue-derived stromal cells: ATSCs) は、脂肪組織から得ることができる体性幹細胞であり、生体に対して最小限の傷害を与えるのみで採取することが可能である。脂肪組織間質細胞は、生体中の様々な部位の脂肪組織に存在している間葉系幹細胞であり、FBSを含む単純な培地中で、未分化な状態で容易に増殖する。また、脂肪組織は生体内に多量に存在しているため、他の体性幹細胞に比べて得られる細胞数が多い。
【0022】
ここで、本第1実施形態に係る脂肪組織間質細胞は、犬の脂肪組織から効率よく確実に採取でき、本第1実施形態及び後述の第2実施形態に係る分化誘導の効率が高いため、犬の脂肪組織から採取することが好ましい。言い換えれば、本第1実施形態に係る分化誘導方法は、犬の脂肪組織間質細胞を用いて、幼若な神経細胞のマーカーを発現するように分化誘導するのが好適である。
【0023】
また、本第1実施形態に係る脂肪組織間質細胞は、採取する脂肪組織は特に限定されないが、好ましい脂肪組織としては、生体内で最も多量に存在している、腹腔脂肪組織が挙げられる。
【0024】
本第1実施形態に係る脂肪組織間質細胞は、例えば脂肪吸引により採取された腹腔脂肪組織について、コラゲナーゼなどの消化酵素を処理して細胞ごとに分離することにより、得ることができる。ここで、分離された脂肪組織間質細胞が含まれる細胞溶液をナイロンメッシュに通した後、溶血緩衝液を用いて細胞溶液に含まれる赤血球を溶血させ、次いでこれを培養液で遠心洗浄すると、純度の高い脂肪組織間質細胞を得ることが可能である。
【0025】
また、得られた脂肪組織間質細胞は、10%FBSを含むDMEMで培養することにより、未分化な状態でその細胞数を増やすことができる。
【0026】
続いて、得られた脂肪組織間質細胞を、幼若な神経細胞のマーカーを発現するように分化誘導する過程について説明する。
【0027】
本第1実施形態に係る分化誘導は、脂肪組織から採取した脂肪組織間質細胞、若しくは脂肪組織から採取して培養した脂肪組織間質細胞を、dcAMP又はホルスコリンを含有する、無血清DMEMで培養することにより行われる。
【0028】
dcAMPは、細胞内cAMP濃度を上昇させる化学薬剤である。細胞内cAMP濃度が上昇すると、細胞の生存が促進される。
【0029】
dcAMPを用いて分化誘導させる場合、cAMPを分解するホスホジエステラーゼの阻害剤である、IBMX (Isobutyl-methylxanthine) も併せて添加することが好ましい。
【0030】
一方、ホルスコリンもまた、dcAMPと同様に細胞内cAMP濃度を増加させる。
【0031】
ホルスコリンを用いて分化誘導させる場合、BHA(Butylhydroxyanisole)、およびバルプロ酸も併せて添加することが分化誘導の確実性を高めることから好ましい。
【0032】
dcAMPおよびIBMXを含む培地、もしくはホルスコリン、BHA、およびバルプロ酸を含む培地で脂肪組織間質細胞を培養して分化誘導させると、いずれも50%ないし60%の細胞で、神経細胞に特徴的な複数の突起を伸ばす形態に変化した細胞が認められる。
【0033】
また、分化誘導した脂肪組織間質細胞では、NSEの著明な発現増加が認められる。すなわち、本第1実施形態の分化誘導方法により、脂肪組織間質細胞が幼若な神経細胞へ分化する。
【0034】
(第2実施形態)
続いて、本発明の第2実施形態について説明する。
【0035】
本発明の第2実施形態は、脂肪組織間質細胞の分化誘導方法であって、脂肪組織間質細胞を脂肪組織から採取する段階と、脂肪組織間質細胞を塩基性線維芽細胞増殖因子 (basic fibroblast growth factor: bFGF) および上皮細胞増殖因子 (epidermal growth factor: EGF) を含む培地で培養し、神経幹細胞のマーカーであるネスチン (nestin) 、およびNSEが発現されるように分化誘導する第1分化誘導段階と、レチノイン酸、dcAMP、およびソニックヘッジホッグ(Sonic hedgehog) を含む培地で培養し、NSEの発現が増強されるとともに、神経細胞のマーカーであるMAP-2が発現されるように分化誘導する第2分化誘導段階とを備え、脂肪組織間質細胞が神経細胞の表現型を発現するように分化誘導することを特徴とする。
【0036】
ここで、本第2実施形態に係る脂肪組織間質細胞は、第1実施形態と同様に、犬の脂肪組織から効率よく確実に採取でき、本第2実施形態に係る分化誘導の効率が高いため、犬の脂肪組織から採取することが好ましい。言い換えれば、本第2実施形態に係る分化誘導方法は、犬の脂肪組織間質細胞を用いて、神経細胞の表現型を発現するように分化誘導するのが好適である。
【0037】
また、本第2実施形態に係る脂肪組織間質細胞についても、採取する脂肪組織は特に限定されないが、好ましい脂肪組織としては、生体内で最も多量に存在している、腹腔脂肪組織が挙げられる。
【0038】
本第2実施形態に係る脂肪組織間質細胞は、第1実施形態と同様に、例えば脂肪吸引により採取された腹腔脂肪組織について、コラゲナーゼなどの消化酵素を処理して細胞ごとに分離することにより、得ることができる。ここで、分離された脂肪組織間質細胞が含まれる細胞溶液をナイロンメッシュに通した後、溶血緩衝液を用いて細胞溶液に含まれる赤血球を溶血させ、次いでこれを培養液で遠心洗浄すると、純度の高い脂肪組織間質細胞を得ることが可能である。
【0039】
また、得られた脂肪組織間質細胞は、10%FBSを含むDMEMで継代培養することにより、未分化な状態でその細胞数を増やすことができる。
【0040】
続いて、得られた脂肪組織間質細胞を、神経細胞の表現型を発現するように分化誘導する過程について説明する。
【0041】
本第2実施形態に係る第1分化誘導段階は、脂肪組織から採取した脂肪組織間質細胞、若しくは脂肪組織から採取して培養した脂肪組織間質細胞を、塩基性線維芽細胞増殖因子および上皮細胞増殖因子を含有する培地、例えば好ましい培地として、無血清ダルベッコ(Dulbecco)改変イーグル培地(DMEM)で培養することにより行われる。
【0042】
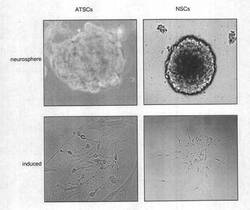
第1分化誘導段階により、脂肪組織間質細胞は、神経幹細胞から得られたneurosphereに酷似した浮遊細胞塊 (sphere)を形成する。
【0043】
また、神経幹細胞のマーカーであるネスチンのmRNA発現は、第1分化誘導段階前の脂肪組織間質細胞では認められないのに対し、第1分化誘導段階後の脂肪組織間質細胞では、神経幹細胞から得られたneurosphereと同様に、ネスチンのmRNAを発現する。
【0044】
続いて、第1分化誘導段階で得られた、sphereを形成した細胞について、第2分化誘導段階を行う。
【0045】
本第2実施形態に係る第2分化誘導段階は、sphereを形成した細胞を、レチノイン酸、dcAMP、およびソニックヘッジホッグを含有する培地、例えば好ましい培地として無血清DMEMで培養することにより行われる。
【0046】
第2分化誘導段階は、例えばPDL/lamininコートしたカバースリップ上で行うことができる。
【0047】
第2分化誘導段階により、細胞塊を形成した細胞から、突起を伸ばす細胞が出現する。
【0048】
また、第1分化誘導段階後では発現が微弱だったNSEの発現が、第2分化誘導段階により増強されるほか、神経細胞のマーカーであるMAP-2の発現が確認される。
【0049】
さらに、分化誘導前の脂肪組織間質細胞を神経興奮性薬剤であるグルタミン酸で刺激すると、刺激の前後で、細胞内カルシウム濃度に有意な差は見られないが、第1および第2分化誘導段階を受けた細胞をグルタミン酸で刺激すると、細胞内カルシウム濃度の上昇が認められる。すなわち、本第2実施形態の分化誘導方法により、脂肪組織間質細胞が、神経細胞へ分化する。
【実施例】
【0050】
次に、本発明の実施例を説明する。
【0051】
実施に当たって以下の試薬を用いた。
【0052】
抗ヒトNSE (neuron specific enolase)モノクローナル抗体はDako社から、抗ブタNF-68 (Neurofilament68)モノクローナル抗体および、抗ウシMAP-2 (microtubule associated protein 2)モノクローナル抗体はSigma社から購入した。Goat serumはBethyl社から、FITC標識した抗mouse IgG抗体はSantacruz社から購入した。蛍光色素である、fluo-3 AM (fluo-3 acetoxymethylester)はMolecular Probe社から購入した。DMEM(Dulbecco’s modified Eagle medium)はSigma社から、牛胎仔血清 (FBS)、NB (Neurobasal medium -A)、B27 (B27supplement without vitamin A)はGibco社から購入した。dcAMP (Dybutyril cyclic AMP)はSigma社から、ホルスコリン (forskolin)およびIBMX (isoburylmethylxanthine)、BHA (butylated hydroxyanisole)、バルプロ酸はWako社から購入した。塩基性線維芽細胞増殖因子 (Basic fibroblast growth factor, bFGF)はPeprotech社から、上皮細胞増殖因子 (epidermal growth factor, EGF)はSigma社から購入した。レチノイン酸はSigma社から、ソニックヘッジホッグ(Sonic Hedgehog, SHH)はR&D社から購入した。Triton-X 100(TX-100)、Tween-20はSigma社から購入した。上記以外の試薬はWako社から購入した。また、各種mRNAをRT-PCRにより検出するために用いたプライマーの配列を塩基配列表に示した。
【0053】
(実施例1)
実施例1は、本第1実施形態に即した、犬に由来する脂肪組織間質細胞(犬脂肪組織間質細胞)の分化誘導を示す。
【0054】
犬脂肪組織間質細胞 (ATSCs)として、犬の腹腔脂肪組織に由来する間質細胞を採取した。すなわち、1〜2歳齢の健常ビーグル犬の腹腔脂肪組織を無菌的に採取し、コラゲナーゼ溶液 (2mg/ml Collagenase、4mg/ml bovine serum albumin (BSA)、20mM HEPESを含むDMEM)を用いて37℃で1時間消化した。次いで、得られた溶液を100μmナイロンメッシュに通し、溶血緩衝液 (154mM NH4Cl、10mM KHCO3、0.1mM EDTA)を加えた後、10%FBSを含むDMEMで3回洗浄し、得られた沈渣を犬脂肪組織間質細胞とした。得られた犬脂肪組織間質細胞はφ90mmシャーレ内で10%FBSを含むDMEMで培養し(図 1 上)、3回継代したものを実験に供した。なお、培養液は5日に一度交換した。
【0055】
分化誘導は、a) 培養液を100μM dcAMPと125μM IBMXを含むDMEMに交換する方法、ならびにb) 培養液を10μMホルスコリン (fsk)、200μM BHA、2μM バルプロ酸を含むDMEMに交換する方法の2種を行い、いずれも交換後10日目まで培養した。
【0056】
dcAMPを含む誘導培地に交換したところ、交換3日後から、小さく丸い細胞体から複数の突起を伸ばす形態に変化した細胞が認められた (図1 左下)。誘導培地に換えた後10日後には、形態的に変化の見られた細胞は、全体の約60%であった。
【0057】
一方、ホルスコリンを含む誘導培地に交換した場合も、やはり交換3日後から、丸い細胞体から複数の突起を伸長する細胞が見られた (図1右下)。しかし、dcAMPで誘導した場合と比べて細胞体が大きく、また、培地を交換して10日後に形態の変化していた細胞は、全体の約50%であった。
【0058】
犬脂肪組織間質細胞をdcAMPで分化誘導した細胞では、NSEの著明な発現増加が見られ、さらにNF-68の微弱な発現が見られた。しかしながら、MAP-2の発現は見られなかった (図2左)。また、分化誘導後の、NSEの発現を経時的に比較したところ、誘導培地に換えた後10日目までは増加し (図3)、その後はプラトーであった。
【0059】
一方、犬脂肪組織間質細胞をホルスコリンで分化誘導した細胞にも、NSEの発現増加が見られたが、NF-68の発現は見られなかった。また、MAP-2の発現は見られなかった (図2右)。ホルスコリンによる分化誘導後の犬脂肪組織間質細胞においては、形態の変化した細胞に限って細胞体、および突起にNSEの強い発現が見られた(図4中)。発現の見られた細胞は、ホルスコリンを処理した細胞全体の約60%だった。
【0060】
これに対し、分化誘導前の犬脂肪組織間質細胞にはNSEの発現が見られたものは全体の3%程度で、いずれも微弱な発現だった (図4 左)。
【0061】
分化誘導前の犬脂肪組織間質細胞には、すでにグリア細胞トランスポーターであるGLUT-3、GLT-1、神経細胞トランポーターであるEAAC1のmRNAの発現が見られたが (図5下段)、脂肪組織間質細胞をdcAMPで分化誘導した細胞においては、GLUT-3、 GLT-1、EAAC1の発現増加が見られた。また、神経細胞トランポーターであるEAAT4の発現は、分化誘導前と変わらず見られなかった (図5 上段)。
【0062】
(実施例2)
実施例2は、本第2実施形態に即した犬脂肪組織間質細胞の分化誘導を示す。
【0063】
実施例1と同様に、犬脂肪組織間質細胞として、犬の腹腔脂肪組織に由来する間質細胞を採取した。すなわち、1〜2歳齢の健常ビーグル犬の腹腔脂肪組織を無菌的に採取し、コラゲナーゼ溶液 (2mg/ml Collagenase、4mg/ml bovine serum albumin(BSA)、20mM HEPESを含むDMEM)を用いて37℃で1時間消化した。次いで、得られた溶液を100μm ナイロンメッシュに通し、溶血緩衝液 (154mM NH4Cl、10mM KHCO3、0.1mM EDTA)を加えた後、10%FBSを含むDMEMで3回洗浄し、得られた沈渣を犬脂肪組織間質細胞とした。得られた犬脂肪組織間質細胞はφ90mmシャーレ内で10%FBSを含むDMEMで培養し (図1 上)、3回継代したものを実験に供した。なお、培養液は5日に一度交換した。
【0064】
また、実施例2において対照として用いるために、犬神経幹細胞 (NSCs)を採取した。すなわち、1〜2歳齢の健常ビーグル犬の大脳脳室下領域を無菌的に採取し、0.05% Trypsin溶液で、37℃、1時間消化した後、25ゲージのシリンジを3回通した。その後、B27を含むNB (NB/B27)で3回洗浄し、φ90mmシャーレで20ng/ml塩基性線維芽細胞増殖因子および20ng/ml 上皮細胞増殖因子を含むNB/B27で培養し、neurosphereを形成させた。培養液は、5日に一度全体の70%を交換した。
【0065】
犬脂肪組織間質細胞は、塩基性線維芽細胞増殖因子、および上皮細胞増殖因子を含む無血清培地に交換した後、3日目からneurosphere様の浮遊細胞塊 (sphere)が見られ、細胞塊を形成した状態で、増殖した。生存している細胞はほとんどがsphereを形成した (図6 左上) 。その後、得られたsphereをレチノイン酸、dcAMP、ソニックヘッジホッグを含む培地でPDL/lamininコートしたカバースリップ上に培養したところ、交換した翌日にはカバースリップ上に付着し、その後、3日目から突起を伸ばす細胞が見られた (図6 下段)。
【0066】
一方、対照として用いた神経幹細胞は、塩基性線維芽細胞増殖因子、上皮細胞増殖因子を含む培地内でneurosphereを形成し、増殖した (図6 右上)。レチノイン酸を含む培地に交換すると、交換後3日目からPDL/lamininコートしたカバースリップ上に付着し、突起を伸ばす神経細胞が見られた (図6 右下)。
【0067】
分化誘導前の犬脂肪組織間質細胞には、ネスチンのmRNAの発現が検出されなかった。それに対して、犬脂肪組織間質細胞から分化誘導したsphereには、対照として用いたneurosphereと同様にネスチンのmRNAの発現が検出された (図7)。
【0068】
第1分化誘導段階により、犬脂肪組織間質細胞から得たsphereは、NSEについてのみ、neurosphereと同程度の微弱な発現が見られた。これに対し、第2分化誘導段階によりsphereから得た細胞には、neurosphereを分化誘導した細胞よりさらに強いNSEの発現が見られた (図8 上段)。また、抗MAP-2モノクローナル抗体を用いてイムノブロットしたところ、sphereから分化誘導した細胞、neurosphereから分化誘導した細胞ともに、脳ホモジナイズで検出された分子量 (280Kda)と異なる分子量 (50KDa)のバンドが見られた。犬脂肪組織間質細胞から得たsphereを分化誘導した細胞の方がその分子量のタンパク発現が強かった (図8 下段)。
【0069】
sphereを分化誘導した細胞、およびneurosphereを分化誘導した細胞では、グルタミン酸刺激後に、カルシウムイオンの蛍光モニターであるfluo-3の蛍光強度の著明な増加が検出された (図9 上)。sphereを分化誘導した細胞では、刺激を与えた後の蛍光強度が、刺激する前の約2.5倍に増強された。一方、対照として用いたneurosphereを分化誘導した細胞では、グルタミン酸による刺激によって、蛍光強度が刺激する前の3.5倍程度に増強された。蛍光強度は、ともに刺激後すぐに減少し、刺激から200秒を経過するとプラトーに達した。誘導前の犬脂肪組織間質細胞では、刺激の前後で、蛍光強度に有意な差は見られなかった (図9下)。
【産業上の利用可能性】
【0070】
本発明によれば、神経組織を対象とした再生医療に必要とされる、分化誘導方法、分化誘導された神経細胞、および当該分化誘導方法に用いられる培地が提供される。本発明の分化誘導方法により、神経組織の再生を必要とする個体から幹細胞を得、神経細胞へ分化させ、その細胞をその個体へ戻すことにより、免疫学的な拒絶を受けずに再生させた神経組織を成着させることができる。
【技術分野】
【0001】
本発明は、脂肪組織に由来する間質細胞(脂肪組織間質細胞)の分化誘導方法、および該誘導細胞、並びに該分化誘導に用いる培地に関する。特に本発明は、脂肪組織間質細胞を、神経細胞の表現型を発現するように分化誘導する方法、および該誘導細胞、並びに該分化誘導に用いる培地に関する。
【背景技術】
【0002】
近年、組織再生を目的とした幹細胞研究が、盛んに行われている。その理由は、すでに壊死、変性を起こしてしまった組織に外部から細胞を移植することで、組織を回復できる可能性があるからである。
【0003】
組織再生に用いることができる幹細胞の候補として第一に考えられるのは、胚性幹細胞(ES細胞)である。組織再生に用いる幹細胞には、細胞を未分化な状態で容易に増殖させることができ、且つ目的の組織に分化可能であることが必要とされるところ、ES細胞は、試験管内で未分化な状態を維持したまま、ほぼ無限に増殖させることが可能であるとともに、様々な系譜の細胞へと分化させることが可能である。しかしながら、ES細胞は胚を破壊して採取するため、倫理的な問題がある。加えて、法的な問題点も解決されておらず、現段階では神経再生に用いるのは現実的ではない。また、ES細胞は原理的に移植を必要とする個体と異なる個体からの細胞を用いるため、免疫拒絶の問題も考えられる(非特許文献1参照)。
【0004】
このため、近年では、体性幹細胞と呼ばれる、成体の組織から採取可能な幹細胞が注目を集めている。体性幹細胞は、成体の脳、皮膚、骨髄、脂肪などに存在しており、試験管内で未分化な状態で増殖可能である。また、それぞれの由来する組織の細胞への分化が可能である。
【0005】
ここで、組織再生の中でも、重要度の高いものの一つとして、神経再生が挙げられる。神経細胞は、発生初期に増殖、分布することにより神経系が構築されて以降は自己再生能に乏しく、一度傷害を受けた神経組織は修復されない。そのため、幹細胞から分化させた神経細胞を移植することで、傷害を受けた神経組織を修復する技術が求められている。
【0006】
体性幹細胞の上述した性質に鑑みると、神経再生に用いる体性幹細胞として第一に考えられるのは、大脳脳室下領域から採取できる神経幹細胞(neural stem cells: NSCs)である。神経幹細胞は、in vitroでneurosphereと呼ばれる浮遊細胞塊を形成しながら増殖可能であり、また、特定の分化条件に置くと神経細胞に分化可能であるという報告がある(非特許文献2参照)。しかしながら、神経幹細胞は採取する際に個体の大脳に大きな傷害を与えるため、同一個体の細胞を用いて神経再生を行うことには大きな困難性を伴う。よって、神経幹細胞の場合も異なる個体から採取することが必要となり、ES細胞と同様に、倫理的な問題のほか、免疫拒絶の問題も生じる。
一方、近年、体性幹細胞については、由来組織以外の組織の細胞へも分化可能であるという報告がなされている(例えば非特許文献3)。特に、体性幹細胞の1つである脂肪組織間質細胞から、神経細胞を分化誘導する技術が報告されている(例えば特許文献1、2)。
【0007】
特許文献1には、脂肪組織間質細胞から神経細胞を分化誘導する方法が記載されている。特許文献1の方法は、脂肪組織間質細胞を10%ウシ胎児血清及び5%ニワトリ胚エキスを含むDMEMで培養した後、20%ウシ胎児血清(FBS)を含むDMEMで培養し、その後、BHAを含む無血清DMEMで培養することにより、幼若な神経細胞のマーカーであるNSE、および神経幹細胞のマーカーであるネスチンの発現を誘導する。しかしながら、この方法ではNSEおよびネスチンを誘導させるための前処理が煩雑であり、一般に培地に使用されないニワトリ胚エキスのロット差がその成否に影響するという問題点がある。
【0008】
一方、特許文献2には、脂肪組織間質細胞を神経細胞へ分化誘導する方法が記載されている。特許文献2の方法は、脂肪組織間質細胞を20%FBS含有DMEMで培養した後、1mMβ‐メルカプトエタノール含有無血清DMEMで培養するものであり、培養後の細胞には神経突起が出現すると記載されている。しかしながら、この方法で得られた細胞の突起が神経突起であることは証明されておらず、また、神経細胞へ分化し始めたとしてもその分化のレベルが神経細胞のどの段階のレベルであるか不明である。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特表2003-523767号公報
【特許文献2】国際公開第03/008592号パンフレット
【非特許文献】
【0010】
【非特許文献1】Swijinenburgら、2005、Circulation 112(9 suppl): I166-172
【非特許文献2】Suら、2004、Mol Cell Biol. 24: 8018-25
【非特許文献3】Petersenら、1999、Science 284: 1168-1170
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明はこのような事情に基づきなされたものであり、脂肪組織間質細胞をより簡便、且つより確実に神経細胞へ分化させる方法、そのために用いる培地の組成及び当該誘導細胞を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明は、脂肪組織間質細胞の分化誘導方法であって、脂肪組織間質細胞を脂肪組織から採取する段階と、脂肪組織間質細胞をdcAMP(dibutyryl cyclic AMP)又はホルスコリン(forskolin)を含む培地で培養する段階を備え、脂肪組織間質細胞が幼若な神経細胞のマーカーを発現するように分化誘導することを特徴とする。
【0013】
また、本発明の異なる態様として、本発明は、脂肪組織間質細胞の分化誘導方法であって、脂肪組織間質細胞を脂肪組織から採取する段階と、脂肪組織間質細胞を塩基性線維芽細胞増殖因子および上皮細胞増殖因子を含む培地で培養して、ネスチンおよびNSEを発現するように分化誘導する第1分化誘導段階と、第1分化誘導段階で分化誘導した細胞を、レチノイン酸、dcAMP、およびソニックヘッジホッグ(Sonic hedgehog)を含む培地で培養して、NSEの発現を増強するとともに、MAP-2を発現するように分化誘導する第2分化誘導段階とを備え、脂肪組織間質細胞が神経細胞の表現型を発現するように分化誘導することを特徴とする。
【発明の効果】
【0014】
本発明によれば、本発明に係る培地で脂肪組織間質細胞を培養することにより、脂肪組織間質細胞からより簡便、且つより確実に神経細胞を分化誘導することができる。したがって、再生医療を実現するための神経細胞を得ることが可能となる。
【図面の簡単な説明】
【0015】
【図1】犬脂肪組織間質細胞(上図)、およびdcAMPまたはホルスコリンにより分化誘導された犬脂肪組織間質細胞(下図)の形態を示す図である。
【図2】犬脂肪組織間質細胞、およびdcAMPまたはホルスコリンにより分化誘導された犬脂肪組織間質細胞における神経細胞マーカー(NSE、NF-68、またはMAP-2)の発現を示す図である。
【図3】dcAMPにより分化誘導される過程での犬脂肪組織間質細胞のNSE発現の経時的変化を示す図である。
【図4】dcAMPまたはホルスコリンにより分化誘導された犬脂肪組織間質細胞におけるNSEの発現を示す図である。
【図5】dcAMPにより分化誘導された犬脂肪組織間質細胞における神経細胞トランポーター、あるいはグリア細胞トランスポーターであるGLUT-3、GLT-1、EAAT4、またはEAAC1 mRNAの発現を示す図である。
【図6】犬脂肪組織間質細胞より生成されたsphere、および犬神経幹細胞より生成されたNeurosphereの形態を示す図である。
【図7】犬脂肪組織間質細胞より生成されたSphereのネスチン mRNAの発現を示す図である。
【図8】犬脂肪組織間質細胞および犬神経幹細胞より生成されたNeurosphereより分化誘導された細胞の、神経細胞マーカータンパク質であるNSEおよびMAP-2の発現を示す図である。
【図9】犬脂肪組織間質細胞、sphereから分化誘導された細胞、およびNeurosphereから分化誘導された細胞のグルタミン酸刺激によるカルシウムイメージを示す図である。
【発明を実施するための形態】
【0016】
(第1実施形態)
以下に、本発明の第1実施形態について詳述する。
【0017】
本発明の第1実施形態は、脂肪組織間質細胞の分化誘導方法であって、脂肪組織間質細胞を脂肪組織から採取する段階と、脂肪組織に由来する間質細胞(脂肪組織間質細胞)を、例えば試験管内においてdcAMP(dibutyryl cyclic AMP)又はホルスコリン(forskolin)を含む培地で培養する段階とを備え、脂肪組織間質細胞が幼若な神経細胞のマーカーを発現するように分化誘導することを特徴とする。
【0018】
分化誘導により、紡錘形を呈した脂肪組織間質細胞は、円形の細胞体から複数の突起を伸ばす神経細胞様の形態を示すようになる。また、分化誘導された脂肪組織間質細胞は、幼若な神経細胞のマーカーを発現する。幼若な神経細胞のマーカーとしては、例えばNSE(neuron specific enolase)を挙げることができる。分化誘導された脂肪組織間質細胞は、NSEを強く発現する。
【0019】
ここで、幼若な神経細胞とは、胎児期に認められる神経前駆細胞のような細胞をいう。
【0020】
まず、本第1実施形態において分化誘導させる、脂肪組織間質細胞の採取、および分化誘導前の培養について説明する。
【0021】
脂肪組織間質細胞 (adipose tissue-derived stromal cells: ATSCs) は、脂肪組織から得ることができる体性幹細胞であり、生体に対して最小限の傷害を与えるのみで採取することが可能である。脂肪組織間質細胞は、生体中の様々な部位の脂肪組織に存在している間葉系幹細胞であり、FBSを含む単純な培地中で、未分化な状態で容易に増殖する。また、脂肪組織は生体内に多量に存在しているため、他の体性幹細胞に比べて得られる細胞数が多い。
【0022】
ここで、本第1実施形態に係る脂肪組織間質細胞は、犬の脂肪組織から効率よく確実に採取でき、本第1実施形態及び後述の第2実施形態に係る分化誘導の効率が高いため、犬の脂肪組織から採取することが好ましい。言い換えれば、本第1実施形態に係る分化誘導方法は、犬の脂肪組織間質細胞を用いて、幼若な神経細胞のマーカーを発現するように分化誘導するのが好適である。
【0023】
また、本第1実施形態に係る脂肪組織間質細胞は、採取する脂肪組織は特に限定されないが、好ましい脂肪組織としては、生体内で最も多量に存在している、腹腔脂肪組織が挙げられる。
【0024】
本第1実施形態に係る脂肪組織間質細胞は、例えば脂肪吸引により採取された腹腔脂肪組織について、コラゲナーゼなどの消化酵素を処理して細胞ごとに分離することにより、得ることができる。ここで、分離された脂肪組織間質細胞が含まれる細胞溶液をナイロンメッシュに通した後、溶血緩衝液を用いて細胞溶液に含まれる赤血球を溶血させ、次いでこれを培養液で遠心洗浄すると、純度の高い脂肪組織間質細胞を得ることが可能である。
【0025】
また、得られた脂肪組織間質細胞は、10%FBSを含むDMEMで培養することにより、未分化な状態でその細胞数を増やすことができる。
【0026】
続いて、得られた脂肪組織間質細胞を、幼若な神経細胞のマーカーを発現するように分化誘導する過程について説明する。
【0027】
本第1実施形態に係る分化誘導は、脂肪組織から採取した脂肪組織間質細胞、若しくは脂肪組織から採取して培養した脂肪組織間質細胞を、dcAMP又はホルスコリンを含有する、無血清DMEMで培養することにより行われる。
【0028】
dcAMPは、細胞内cAMP濃度を上昇させる化学薬剤である。細胞内cAMP濃度が上昇すると、細胞の生存が促進される。
【0029】
dcAMPを用いて分化誘導させる場合、cAMPを分解するホスホジエステラーゼの阻害剤である、IBMX (Isobutyl-methylxanthine) も併せて添加することが好ましい。
【0030】
一方、ホルスコリンもまた、dcAMPと同様に細胞内cAMP濃度を増加させる。
【0031】
ホルスコリンを用いて分化誘導させる場合、BHA(Butylhydroxyanisole)、およびバルプロ酸も併せて添加することが分化誘導の確実性を高めることから好ましい。
【0032】
dcAMPおよびIBMXを含む培地、もしくはホルスコリン、BHA、およびバルプロ酸を含む培地で脂肪組織間質細胞を培養して分化誘導させると、いずれも50%ないし60%の細胞で、神経細胞に特徴的な複数の突起を伸ばす形態に変化した細胞が認められる。
【0033】
また、分化誘導した脂肪組織間質細胞では、NSEの著明な発現増加が認められる。すなわち、本第1実施形態の分化誘導方法により、脂肪組織間質細胞が幼若な神経細胞へ分化する。
【0034】
(第2実施形態)
続いて、本発明の第2実施形態について説明する。
【0035】
本発明の第2実施形態は、脂肪組織間質細胞の分化誘導方法であって、脂肪組織間質細胞を脂肪組織から採取する段階と、脂肪組織間質細胞を塩基性線維芽細胞増殖因子 (basic fibroblast growth factor: bFGF) および上皮細胞増殖因子 (epidermal growth factor: EGF) を含む培地で培養し、神経幹細胞のマーカーであるネスチン (nestin) 、およびNSEが発現されるように分化誘導する第1分化誘導段階と、レチノイン酸、dcAMP、およびソニックヘッジホッグ(Sonic hedgehog) を含む培地で培養し、NSEの発現が増強されるとともに、神経細胞のマーカーであるMAP-2が発現されるように分化誘導する第2分化誘導段階とを備え、脂肪組織間質細胞が神経細胞の表現型を発現するように分化誘導することを特徴とする。
【0036】
ここで、本第2実施形態に係る脂肪組織間質細胞は、第1実施形態と同様に、犬の脂肪組織から効率よく確実に採取でき、本第2実施形態に係る分化誘導の効率が高いため、犬の脂肪組織から採取することが好ましい。言い換えれば、本第2実施形態に係る分化誘導方法は、犬の脂肪組織間質細胞を用いて、神経細胞の表現型を発現するように分化誘導するのが好適である。
【0037】
また、本第2実施形態に係る脂肪組織間質細胞についても、採取する脂肪組織は特に限定されないが、好ましい脂肪組織としては、生体内で最も多量に存在している、腹腔脂肪組織が挙げられる。
【0038】
本第2実施形態に係る脂肪組織間質細胞は、第1実施形態と同様に、例えば脂肪吸引により採取された腹腔脂肪組織について、コラゲナーゼなどの消化酵素を処理して細胞ごとに分離することにより、得ることができる。ここで、分離された脂肪組織間質細胞が含まれる細胞溶液をナイロンメッシュに通した後、溶血緩衝液を用いて細胞溶液に含まれる赤血球を溶血させ、次いでこれを培養液で遠心洗浄すると、純度の高い脂肪組織間質細胞を得ることが可能である。
【0039】
また、得られた脂肪組織間質細胞は、10%FBSを含むDMEMで継代培養することにより、未分化な状態でその細胞数を増やすことができる。
【0040】
続いて、得られた脂肪組織間質細胞を、神経細胞の表現型を発現するように分化誘導する過程について説明する。
【0041】
本第2実施形態に係る第1分化誘導段階は、脂肪組織から採取した脂肪組織間質細胞、若しくは脂肪組織から採取して培養した脂肪組織間質細胞を、塩基性線維芽細胞増殖因子および上皮細胞増殖因子を含有する培地、例えば好ましい培地として、無血清ダルベッコ(Dulbecco)改変イーグル培地(DMEM)で培養することにより行われる。
【0042】
第1分化誘導段階により、脂肪組織間質細胞は、神経幹細胞から得られたneurosphereに酷似した浮遊細胞塊 (sphere)を形成する。
【0043】
また、神経幹細胞のマーカーであるネスチンのmRNA発現は、第1分化誘導段階前の脂肪組織間質細胞では認められないのに対し、第1分化誘導段階後の脂肪組織間質細胞では、神経幹細胞から得られたneurosphereと同様に、ネスチンのmRNAを発現する。
【0044】
続いて、第1分化誘導段階で得られた、sphereを形成した細胞について、第2分化誘導段階を行う。
【0045】
本第2実施形態に係る第2分化誘導段階は、sphereを形成した細胞を、レチノイン酸、dcAMP、およびソニックヘッジホッグを含有する培地、例えば好ましい培地として無血清DMEMで培養することにより行われる。
【0046】
第2分化誘導段階は、例えばPDL/lamininコートしたカバースリップ上で行うことができる。
【0047】
第2分化誘導段階により、細胞塊を形成した細胞から、突起を伸ばす細胞が出現する。
【0048】
また、第1分化誘導段階後では発現が微弱だったNSEの発現が、第2分化誘導段階により増強されるほか、神経細胞のマーカーであるMAP-2の発現が確認される。
【0049】
さらに、分化誘導前の脂肪組織間質細胞を神経興奮性薬剤であるグルタミン酸で刺激すると、刺激の前後で、細胞内カルシウム濃度に有意な差は見られないが、第1および第2分化誘導段階を受けた細胞をグルタミン酸で刺激すると、細胞内カルシウム濃度の上昇が認められる。すなわち、本第2実施形態の分化誘導方法により、脂肪組織間質細胞が、神経細胞へ分化する。
【実施例】
【0050】
次に、本発明の実施例を説明する。
【0051】
実施に当たって以下の試薬を用いた。
【0052】
抗ヒトNSE (neuron specific enolase)モノクローナル抗体はDako社から、抗ブタNF-68 (Neurofilament68)モノクローナル抗体および、抗ウシMAP-2 (microtubule associated protein 2)モノクローナル抗体はSigma社から購入した。Goat serumはBethyl社から、FITC標識した抗mouse IgG抗体はSantacruz社から購入した。蛍光色素である、fluo-3 AM (fluo-3 acetoxymethylester)はMolecular Probe社から購入した。DMEM(Dulbecco’s modified Eagle medium)はSigma社から、牛胎仔血清 (FBS)、NB (Neurobasal medium -A)、B27 (B27supplement without vitamin A)はGibco社から購入した。dcAMP (Dybutyril cyclic AMP)はSigma社から、ホルスコリン (forskolin)およびIBMX (isoburylmethylxanthine)、BHA (butylated hydroxyanisole)、バルプロ酸はWako社から購入した。塩基性線維芽細胞増殖因子 (Basic fibroblast growth factor, bFGF)はPeprotech社から、上皮細胞増殖因子 (epidermal growth factor, EGF)はSigma社から購入した。レチノイン酸はSigma社から、ソニックヘッジホッグ(Sonic Hedgehog, SHH)はR&D社から購入した。Triton-X 100(TX-100)、Tween-20はSigma社から購入した。上記以外の試薬はWako社から購入した。また、各種mRNAをRT-PCRにより検出するために用いたプライマーの配列を塩基配列表に示した。
【0053】
(実施例1)
実施例1は、本第1実施形態に即した、犬に由来する脂肪組織間質細胞(犬脂肪組織間質細胞)の分化誘導を示す。
【0054】
犬脂肪組織間質細胞 (ATSCs)として、犬の腹腔脂肪組織に由来する間質細胞を採取した。すなわち、1〜2歳齢の健常ビーグル犬の腹腔脂肪組織を無菌的に採取し、コラゲナーゼ溶液 (2mg/ml Collagenase、4mg/ml bovine serum albumin (BSA)、20mM HEPESを含むDMEM)を用いて37℃で1時間消化した。次いで、得られた溶液を100μmナイロンメッシュに通し、溶血緩衝液 (154mM NH4Cl、10mM KHCO3、0.1mM EDTA)を加えた後、10%FBSを含むDMEMで3回洗浄し、得られた沈渣を犬脂肪組織間質細胞とした。得られた犬脂肪組織間質細胞はφ90mmシャーレ内で10%FBSを含むDMEMで培養し(図 1 上)、3回継代したものを実験に供した。なお、培養液は5日に一度交換した。
【0055】
分化誘導は、a) 培養液を100μM dcAMPと125μM IBMXを含むDMEMに交換する方法、ならびにb) 培養液を10μMホルスコリン (fsk)、200μM BHA、2μM バルプロ酸を含むDMEMに交換する方法の2種を行い、いずれも交換後10日目まで培養した。
【0056】
dcAMPを含む誘導培地に交換したところ、交換3日後から、小さく丸い細胞体から複数の突起を伸ばす形態に変化した細胞が認められた (図1 左下)。誘導培地に換えた後10日後には、形態的に変化の見られた細胞は、全体の約60%であった。
【0057】
一方、ホルスコリンを含む誘導培地に交換した場合も、やはり交換3日後から、丸い細胞体から複数の突起を伸長する細胞が見られた (図1右下)。しかし、dcAMPで誘導した場合と比べて細胞体が大きく、また、培地を交換して10日後に形態の変化していた細胞は、全体の約50%であった。
【0058】
犬脂肪組織間質細胞をdcAMPで分化誘導した細胞では、NSEの著明な発現増加が見られ、さらにNF-68の微弱な発現が見られた。しかしながら、MAP-2の発現は見られなかった (図2左)。また、分化誘導後の、NSEの発現を経時的に比較したところ、誘導培地に換えた後10日目までは増加し (図3)、その後はプラトーであった。
【0059】
一方、犬脂肪組織間質細胞をホルスコリンで分化誘導した細胞にも、NSEの発現増加が見られたが、NF-68の発現は見られなかった。また、MAP-2の発現は見られなかった (図2右)。ホルスコリンによる分化誘導後の犬脂肪組織間質細胞においては、形態の変化した細胞に限って細胞体、および突起にNSEの強い発現が見られた(図4中)。発現の見られた細胞は、ホルスコリンを処理した細胞全体の約60%だった。
【0060】
これに対し、分化誘導前の犬脂肪組織間質細胞にはNSEの発現が見られたものは全体の3%程度で、いずれも微弱な発現だった (図4 左)。
【0061】
分化誘導前の犬脂肪組織間質細胞には、すでにグリア細胞トランスポーターであるGLUT-3、GLT-1、神経細胞トランポーターであるEAAC1のmRNAの発現が見られたが (図5下段)、脂肪組織間質細胞をdcAMPで分化誘導した細胞においては、GLUT-3、 GLT-1、EAAC1の発現増加が見られた。また、神経細胞トランポーターであるEAAT4の発現は、分化誘導前と変わらず見られなかった (図5 上段)。
【0062】
(実施例2)
実施例2は、本第2実施形態に即した犬脂肪組織間質細胞の分化誘導を示す。
【0063】
実施例1と同様に、犬脂肪組織間質細胞として、犬の腹腔脂肪組織に由来する間質細胞を採取した。すなわち、1〜2歳齢の健常ビーグル犬の腹腔脂肪組織を無菌的に採取し、コラゲナーゼ溶液 (2mg/ml Collagenase、4mg/ml bovine serum albumin(BSA)、20mM HEPESを含むDMEM)を用いて37℃で1時間消化した。次いで、得られた溶液を100μm ナイロンメッシュに通し、溶血緩衝液 (154mM NH4Cl、10mM KHCO3、0.1mM EDTA)を加えた後、10%FBSを含むDMEMで3回洗浄し、得られた沈渣を犬脂肪組織間質細胞とした。得られた犬脂肪組織間質細胞はφ90mmシャーレ内で10%FBSを含むDMEMで培養し (図1 上)、3回継代したものを実験に供した。なお、培養液は5日に一度交換した。
【0064】
また、実施例2において対照として用いるために、犬神経幹細胞 (NSCs)を採取した。すなわち、1〜2歳齢の健常ビーグル犬の大脳脳室下領域を無菌的に採取し、0.05% Trypsin溶液で、37℃、1時間消化した後、25ゲージのシリンジを3回通した。その後、B27を含むNB (NB/B27)で3回洗浄し、φ90mmシャーレで20ng/ml塩基性線維芽細胞増殖因子および20ng/ml 上皮細胞増殖因子を含むNB/B27で培養し、neurosphereを形成させた。培養液は、5日に一度全体の70%を交換した。
【0065】
犬脂肪組織間質細胞は、塩基性線維芽細胞増殖因子、および上皮細胞増殖因子を含む無血清培地に交換した後、3日目からneurosphere様の浮遊細胞塊 (sphere)が見られ、細胞塊を形成した状態で、増殖した。生存している細胞はほとんどがsphereを形成した (図6 左上) 。その後、得られたsphereをレチノイン酸、dcAMP、ソニックヘッジホッグを含む培地でPDL/lamininコートしたカバースリップ上に培養したところ、交換した翌日にはカバースリップ上に付着し、その後、3日目から突起を伸ばす細胞が見られた (図6 下段)。
【0066】
一方、対照として用いた神経幹細胞は、塩基性線維芽細胞増殖因子、上皮細胞増殖因子を含む培地内でneurosphereを形成し、増殖した (図6 右上)。レチノイン酸を含む培地に交換すると、交換後3日目からPDL/lamininコートしたカバースリップ上に付着し、突起を伸ばす神経細胞が見られた (図6 右下)。
【0067】
分化誘導前の犬脂肪組織間質細胞には、ネスチンのmRNAの発現が検出されなかった。それに対して、犬脂肪組織間質細胞から分化誘導したsphereには、対照として用いたneurosphereと同様にネスチンのmRNAの発現が検出された (図7)。
【0068】
第1分化誘導段階により、犬脂肪組織間質細胞から得たsphereは、NSEについてのみ、neurosphereと同程度の微弱な発現が見られた。これに対し、第2分化誘導段階によりsphereから得た細胞には、neurosphereを分化誘導した細胞よりさらに強いNSEの発現が見られた (図8 上段)。また、抗MAP-2モノクローナル抗体を用いてイムノブロットしたところ、sphereから分化誘導した細胞、neurosphereから分化誘導した細胞ともに、脳ホモジナイズで検出された分子量 (280Kda)と異なる分子量 (50KDa)のバンドが見られた。犬脂肪組織間質細胞から得たsphereを分化誘導した細胞の方がその分子量のタンパク発現が強かった (図8 下段)。
【0069】
sphereを分化誘導した細胞、およびneurosphereを分化誘導した細胞では、グルタミン酸刺激後に、カルシウムイオンの蛍光モニターであるfluo-3の蛍光強度の著明な増加が検出された (図9 上)。sphereを分化誘導した細胞では、刺激を与えた後の蛍光強度が、刺激する前の約2.5倍に増強された。一方、対照として用いたneurosphereを分化誘導した細胞では、グルタミン酸による刺激によって、蛍光強度が刺激する前の3.5倍程度に増強された。蛍光強度は、ともに刺激後すぐに減少し、刺激から200秒を経過するとプラトーに達した。誘導前の犬脂肪組織間質細胞では、刺激の前後で、蛍光強度に有意な差は見られなかった (図9下)。
【産業上の利用可能性】
【0070】
本発明によれば、神経組織を対象とした再生医療に必要とされる、分化誘導方法、分化誘導された神経細胞、および当該分化誘導方法に用いられる培地が提供される。本発明の分化誘導方法により、神経組織の再生を必要とする個体から幹細胞を得、神経細胞へ分化させ、その細胞をその個体へ戻すことにより、免疫学的な拒絶を受けずに再生させた神経組織を成着させることができる。
【特許請求の範囲】
【請求項1】
脂肪組織から採取された脂肪組織間質細胞を塩基性線維芽細胞増殖因子および上皮細胞増殖因子を含む培地で培養して、ネスチンおよびNSEが発現している浮遊細胞塊を得る分化誘導方法。
【請求項2】
脂肪組織から採取された脂肪組織間質細胞を塩基性線維芽細胞増殖因子および上皮細胞増殖因子を含む培地で培養して、ネスチンおよびNSEを発現するように分化誘導する第1分化誘導段階と、
前記第1分化誘導段階で分化誘導した細胞を、レチノイン酸、dcAMP、およびソニックヘッジホッグ(Sonic hedgehog)を含む培地で培養して、NSEの発現を増強するとともに、MAP-2を発現するように分化誘導する第2分化誘導段階とを備え、
前記脂肪組織間質細胞が神経細胞の表現型を発現するように分化誘導することを特徴とする脂肪組織間質細胞の分化誘導方法。
【請求項3】
前記脂肪組織間質細胞は、腹腔脂肪組織から採取されることを特徴とする請求項2に記載の脂肪組織間質細胞の分化誘導方法。
【請求項4】
前記脂肪組織間質細胞は、犬の脂肪組織から採取された脂肪組織間質細胞であることを特徴とする請求項2または3に記載の脂肪組織間質細胞の分化誘導方法。
【請求項5】
請求項1から4のいずれか1つに記載の分化誘導方法で使用される培地であって、
DMEMと、
塩基性線維芽細胞増殖因子と、
上皮細胞増殖因子とを含み、
培養される脂肪組織間質細胞が、ネスチンおよびNSEを発現するように分化誘導することを特徴とする培地。
【請求項1】
脂肪組織から採取された脂肪組織間質細胞を塩基性線維芽細胞増殖因子および上皮細胞増殖因子を含む培地で培養して、ネスチンおよびNSEが発現している浮遊細胞塊を得る分化誘導方法。
【請求項2】
脂肪組織から採取された脂肪組織間質細胞を塩基性線維芽細胞増殖因子および上皮細胞増殖因子を含む培地で培養して、ネスチンおよびNSEを発現するように分化誘導する第1分化誘導段階と、
前記第1分化誘導段階で分化誘導した細胞を、レチノイン酸、dcAMP、およびソニックヘッジホッグ(Sonic hedgehog)を含む培地で培養して、NSEの発現を増強するとともに、MAP-2を発現するように分化誘導する第2分化誘導段階とを備え、
前記脂肪組織間質細胞が神経細胞の表現型を発現するように分化誘導することを特徴とする脂肪組織間質細胞の分化誘導方法。
【請求項3】
前記脂肪組織間質細胞は、腹腔脂肪組織から採取されることを特徴とする請求項2に記載の脂肪組織間質細胞の分化誘導方法。
【請求項4】
前記脂肪組織間質細胞は、犬の脂肪組織から採取された脂肪組織間質細胞であることを特徴とする請求項2または3に記載の脂肪組織間質細胞の分化誘導方法。
【請求項5】
請求項1から4のいずれか1つに記載の分化誘導方法で使用される培地であって、
DMEMと、
塩基性線維芽細胞増殖因子と、
上皮細胞増殖因子とを含み、
培養される脂肪組織間質細胞が、ネスチンおよびNSEを発現するように分化誘導することを特徴とする培地。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2013−63088(P2013−63088A)
【公開日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願番号】特願2012−273080(P2012−273080)
【出願日】平成24年12月14日(2012.12.14)
【分割の表示】特願2007−128467(P2007−128467)の分割
【原出願日】平成19年5月14日(2007.5.14)
【出願人】(000173865)一般財団法人日本生物科学研究所 (6)
【Fターム(参考)】
【公開日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願日】平成24年12月14日(2012.12.14)
【分割の表示】特願2007−128467(P2007−128467)の分割
【原出願日】平成19年5月14日(2007.5.14)
【出願人】(000173865)一般財団法人日本生物科学研究所 (6)
【Fターム(参考)】
[ Back to top ]

