脈絡膜上薬物送達のための装置および製剤
【課題】脈絡膜上薬物送達のための装置および製剤
【解決手段】眼へ生物活性物質を送達するための製剤、装置、および方法が提供される。製剤は、脈絡膜上腔の近傍の強膜組織内へ、または脈絡膜上腔内へ、下にある脈絡膜を損傷させることなく送達される。提供される1つのクラスの製剤は、投与された領域に近い脈絡膜上腔内に局在される製剤である。提供される別のクラスの製剤は、脈絡膜上腔の別の領域に移行可能であって、眼の後方領域の治療のために眼の前方領域に注射することを可能にする製剤である。
【解決手段】眼へ生物活性物質を送達するための製剤、装置、および方法が提供される。製剤は、脈絡膜上腔の近傍の強膜組織内へ、または脈絡膜上腔内へ、下にある脈絡膜を損傷させることなく送達される。提供される1つのクラスの製剤は、投与された領域に近い脈絡膜上腔内に局在される製剤である。提供される別のクラスの製剤は、脈絡膜上腔の別の領域に移行可能であって、眼の後方領域の治療のために眼の前方領域に注射することを可能にする製剤である。
【発明の詳細な説明】
【背景技術】
【0001】
[関連出願]
米国特許法第119条(e)に基づいて、2006年2月22日出願の米国仮出願第60/776,903号の優先権を主張する。該仮出願は、参照によりその全体を本明細書に組み込まれるものとする。
【技術分野】
【0002】
本発明は、眼への薬物送達の分野に関するものである。
【0003】
眼は、視覚のための光学的および神経学的プロセスを提供する様々な特殊化組織を備えた複合器官である。医学的治療を目的とした眼へのアクセスは、組織の小ささおよび繊細性によって妨げられる。網膜、黄斑、および視神経を含む眼の後方領域は、眼が眼窩内に陥凹しているゆえに、とりわけアクセスが困難である。また、局所点眼薬は、後方領域に十分に浸透することができず、治療の選択肢をさらに限定する。
【0004】
脈絡膜上腔は、内側血管膜である脈絡膜と、眼の外層である強膜との間に位置する眼の中の潜在空隙である。脈絡膜上腔は、毛様体に近い眼の前方部分から視神経に近い眼の後方端まで達している。脈絡膜が、眼の眼圧によって強膜に近接しているゆえに、脈絡膜上腔は、はっきり見えないのが通常である。脈絡膜は、強膜に強く付着しているわけではないので、これらの組織は、液体貯留またはその他の状態が生じた際に、分離して脈絡膜上腔を形成する。脈絡膜上腔は、眼の後方領域を治療する目的で眼の前方領域からアクセスするための潜在ルートを提供する。
【0005】
本発明は、脈絡膜上腔に投与するための製剤と、薬物およびその他の物質を低侵襲的に脈絡膜上腔へ送達するための装置と、に関するものである。
【発明の開示】
【0006】
少なくとも300,000mPasのゼロせん断粘度によって特徴付けられる製剤が提供される。サブクラスの製剤は、さらに、1000s-1のせん断速度において約400mPas以下の粘度によって特徴付けられる。
【0007】
眼の脈絡膜上腔への注射のため、生物活性物質と、注射後に広がって薬物を脈絡膜上腔の領域内に均一に分布させるおよび局在させるためのゲル状材料として機能する、チクソトロピー性ポリマー賦形剤と、が含まれる。一実施形態において、ゲル状材料は、脈絡膜上腔への注射後に架橋する。生物活性物質は、微小粒子または微小球を含むことが可能である。ポリマー賦形剤は、ヒアルロン酸、コンドロイチン硫酸、ゼラチン、ポリヒドロキシエチルメタクリレート、デルマタン硫酸、ポリエチレンオキシド、ポリエチレングリコール、ポリプロピレンオキシド、ポリプロピレングリコール、アルギン酸塩、でんぷん誘導体、水溶性のキチン誘導体、水溶性のセルロース誘導体、またはポリビニルピロリドンを含むことが可能である。
【0008】
別の実施形態では、眼の脈絡膜上腔へ送達するための製剤であって、生物活性物質と、約1〜33ミクロンの範囲の外径をともなう微小球と、を含む製剤が提供される。微小粒子または微小球は、さらに、放出制御コーティングおよび/または組織親和性表面を追加で含むことが可能である。
【0009】
生物活性物質は、好ましくは、抗生物質、ステロイド、非ステロイド性抗炎症剤、神経保護剤、抗VEGF剤、または新血管形成抑制剤を含む。
【0010】
また、製剤を眼の脈絡膜上腔内へ低侵襲的に送達するための機器であって、下にある脈絡膜組織を損傷させることなく強膜組織を通ることを可能にするように成形された先端突先を有する針と、製剤を脈絡膜上腔の近傍または中へ送達するために突先の配置を誘導するためのセンサと、を含む機器が提供される。
【0011】
センサは、強膜組織の画像を提供することが可能である。センサは、好ましくは、超音波、光、または差圧に反応する。
【0012】
別の実施形態では、製剤を眼の脈絡膜上腔内へ低侵襲的に送達するための機器であって、強膜組織を通ることを可能にするように成形された先端突先を有する針と、脈絡膜に接触した際にそれを外傷させないために内方膨張作用を脈絡膜に付与する内側突先と、を含む機器が提供される。
【0013】
薬物を眼に投与するための方法であって、生物活性物質とポリマー賦形剤とを含む製剤を、賦形剤が送達後にゲル化して生物活性物質を局在させるように、脈絡膜上腔の中に配置することを含む方法が提供される。製剤は、脈絡膜上腔の後方または前方の領域の中に配置することが可能である。
【0014】
別の実施形態では、薬物を眼の後方領域に投与するための方法であって、約1〜33ミクロンの範囲の外径をともなう微小球または微小粒子を含む、生物活性物質を含む製剤を、それらの微小球または微小粒子が次いで後方領域へ移行するように、脈絡膜上腔の前方領域の中に配置することを含む方法が提供される。製剤は、好ましくは、微小粒子または微小球を脈絡膜上腔の中に均一に分散させるためのポリマー賦形剤を含む。
【0015】
別の実施形態では、薬物を眼の脈絡膜上腔の中に投与する方法であって、針を、脈絡膜上腔に向けて強膜の厚さの少なくとも半分の深さに配置するステップと、製剤を、それが脈絡膜上腔の近傍の強膜組織を切開して脈絡膜上腔に進入するように、針を通して強膜に注射するステップと、を含む方法が提供される。
【0016】
本明細書で開示される方法において、製剤は、好ましくは、チクソトロピー性ポリマーを含む。
【発明を実施するための最良の形態】
【0017】
本発明は、眼の治療のために薬物を送達することを目的として、眼の脈絡膜上腔にアクセスするための、製剤、機器、および関連の方法を含む。具体的に言うと、本発明は、眼の特定領域を含む眼の治療を目的として、送達される薬物の局在性によって脈絡膜上腔へ投与されるように設計された製剤に関する。本発明は、また、小さい針を通じて製剤および薬物含有材料を脈絡膜上腔に直接注射するための、低侵襲的機器の設計、ならびにその使用の方法に関する。
【0018】
生物的に活性の物質または材料は、有機体または生物学的プロセスに影響を及ぼす薬物またはその他の物質であり、診断、治癒、緩和、治療、もしくは疾病予防における使用、または体の構造もしくは任意の機能に作用させるための使用を含む。製剤は、生物活性物質を含有している。
【0019】
本明細書において、眼の前方領域は、眼窩内にある眼の露出前面から一般に容易にアクセス可能であるような眼の領域である。眼の後方領域は、一般にそれ以外の眼の領域であり、露出していない眼の表面を通して主として外科的にアクセスされ、したがって、その表面へのアクセスを得るためにしばしば眼の一時的後退を必要とするような眼の領域である。
【0020】
製剤:
本発明の製剤は、脈絡膜上腔環境との適合性を提供するものであり、製剤の移行によって生物活性物質の分布を制御するように、そして時間的な持続放出を可能にするように調製することが可能である。製剤は、生理学的に適合性の賦形剤とあわせて調製される1つまたは複数の生物活性物質を含み、通常は、注射によって眼の脈絡膜上腔に投与される。適切な生物活性物質は、感染症を治療するための抗生物質、炎症および浮腫を治療するためのステロイドおよび非ステロイド性抗炎症剤、カルシウムチャンネル遮断薬など視神経を治療するための神経保護剤、ならびに抗VEGF化合物または新血管形成抑制剤など黄斑変性症を治療するためのレチナール剤を含む。
【0021】
局所治療のための製剤:
例えば斑状病変、後方網膜、または視神経を治療するなどの眼の局所領域の治療のため、薬物は、送達後の移行を制限する形態で調合し、病変領域へ送達することが可能である。特定の理論に縛られることは意図していないものの、我々の観測によると、薬物微小粒子は、恐らくは腔内のぶどう膜−強膜間の流体の流れゆえに、生理学的条件下において脈絡膜上腔の後方領域に向かって移動するのが一般的である。このような薬物微小粒子は、薬物の移行を制限するために、十分な大きさに、そして随意には組織表面親和性をともなうように形成することが可能である。組織表面親和性は、微小粒子にポリマーもしくは脂質の表面コーティングを加えることによって、または微小粒子表面に化学的もしくは生物学的な部分を加えることによって変更することが可能である。組織親和性は、こうして、表面電荷から、疎水性から、または組織との結合特性を提供して薬物の移行を制限するために微小粒子の表面に組み入れ可能である抗体もしくはインテグリンなどの生物学的標的剤から得られる。代わりに、または加えて、薬物は、薬物の移行を制限するために、1つまたは複数のポリマー賦形剤とあわせて調製することが可能である。ポリマー賦形剤は、その場(in−situ)において粘性ゲル状材料として機能するように選択および調製されることによって、脈絡膜上腔の領域内へ広がって薬物を均一に分布させるおよび保持することが可能である。ポリマー賦形剤は、適切な粘性、流動性、および溶解特性を提供するように選択および調製することが可能である。例えば、カルボキシメチルセルロースは、脈絡膜上腔内にゲル状材料を形成するためにゼロせん断粘度において適切な粘度を有するように調製することが可能である、弱チクソトロピー性の水溶性ポリマーである。ポリマーのチクソトロピー効果は、疎水性部分を追加すること、より高分子量のポリマーを選択すること、または適切な表面活性剤とあわせて調製することなどのように、結合特性を高めるために適切な化学的変更をポリマーに加えることよって向上させることが可能である。好ましいのは、製剤を小口径の針を通じて注射可能にしつつ、製剤の局在性および薬物保持特性を最大にするために、ヒアルロン酸のようにチクソトロピー特性の強い高結合性のポリマー賦形剤を使用することである。小口径の針を通じた送達および脈絡膜上腔内における局在性をともに可能にするため、製剤の溶解特性は、ポリマー賦形剤の水溶性、分子量、および濃度を適切なチクソトロピー特性の範囲内に加減することによって調整することが可能である。材料および組み入れられた薬物の移行または溶解をさらに制限するため、ポリマー賦形剤は、送達後に粘度を増大させるまたは架橋するように調製することが可能である。例えば、高チクソトロピー性の製剤は、小口径の針を通じた注射の最中は低粘度であるが、ゼロせん断条件下において脈絡膜上腔内にひとたび入ると、その有効粘度を劇的に増大させる。チクソトロピー性の強い天然ポリマーであるヒアルロン酸は、1〜2重量パーセントの濃度で調製された場合に、ゼロせん断ではおよそ300,000〜7,000,000mPasの粘度を呈し、小口径の針を通じた注射に典型的な1000s-1のせん断速度では150〜400mPasの粘度を呈する。厳密な粘度は、分子量に依存する。例えば、ヒアルロン酸をビスエポキシドまたはジビニルスルホンの架橋剤とあわせて調製するなどの、ポリマー賦形剤の分子量または架橋度を高めるための化学的方法もまた、その場(in−situ)において製剤の局在性を増大させるために使用することが可能である。また、例えば、生理的温度、pH、または脈絡膜上腔に関係したイオンなど、脈絡膜上腔内の環境もまた、ポリマー賦形剤の粘度または架橋性を増大させるために使用することが可能である。また、脈絡膜上腔内における移行を制限するために、ゲル状材料を、表面電荷、疎水性、または特殊な組織親和性をともなうように調製することも可能である。
【0022】
本発明にしたがった、ポリマー賦形剤として使用するのに適した生理的に適合性の水溶性ポリマーは、ポリビニルアルコール、ポリビニルピロリドン、ポリエチレングリコール、ポリエチレンオキシド、ポリヒドロキシエチルメタクリレート、ポリプロピレングリコール、およびプロピレンオキシドなどの合成ポリマー、セルロース誘導体、キチン誘導体、アルギン酸塩、ゼラチン、でんぶん誘導体、ヒアルロン酸、コンドロイチン硫酸、デルマタン硫酸、およびその他のグリコサミノグリカンなどの生体ポリマー、ならびにこのようなポリマーの混合またはコポリマーを含む。ポリマー賦形剤は、ポリマーの濃度、分子量、水溶性、架橋性、酵素標識性、および組織接着特性によって制御された速度で、時間とともに溶解可能であるように選択される。とりわけ有利であるのは、小口径の針を通じた送達に典型的な高いせん断速度では投与を促進するために低粘度を呈するが、ゼロせん断ではその場(in−situ)において薬物を局在させるために高粘度を呈することを可能にする、強いチクソトロピー特性を製剤に付与するポリマー賦形剤である。
【0023】
眼の前方領域を治療するには、薬物の移行を制限するためのポリマー賦形剤を薬物と組み合わせ、それを脈絡膜上腔の所望の前方領域に注射することができる。
【0024】
眼の後方領域を治療するための一方法は、局在特性をともなう製剤を、脈絡膜上腔の後方領域に直接投与することを含む。製剤は、軟性のマイクロカニューレを脈絡膜上腔の前方領域に入れ、次いで、その遠位突先を、薬物および局在化賦形剤の送達に先立って後方領域へ進めることによって、脈絡膜上腔の後方領域に送達させることができる。軟性のマイクロカニューレは、投与薬物を局在させる特性を持つ製剤の場合も同様に、その送達に先立って、斑状病変などの所望の治療領域の中心へ進めることができる。
【0025】
とりわけ後方領域などの、眼の局所領域の治療は、本発明の薬物調剤を、共通発明者による米国特許出願60/566,776に記載されたように軟性の機器によって脈絡膜上腔の様々な領域に局所的に調剤を送達するための投与機器とあわせて使用することによって促進される。当該出願は、引用によってその全体を本明細書に組み込まれるものとする。
【0026】
後方領域へ移行させるための製剤
例えば黄斑全体、脈絡膜、または視神経を治療するなどの眼の後方領域の治療のため、薬物は、送達後の移行を可能にする形態で調合し、脈絡膜上腔の前方領域へ送達することが可能である。薬物は、迅速に溶解するポリマー賦形剤または投与後の薬物の移行を可能にするほどに小さい微小粒子もしくは微小球をともなった可溶性の形態で調製することが可能である。ポリマー賦形剤が使用される場合は、薬物を投与領域内に均一に分布させて薬物濃度の過度に高い領域を最小限に抑えるように、そして、賦形剤を次いで溶解させて脈絡膜上腔の後方領域への薬物の移行を可能にするように、低粘度の、迅速に吸収される製剤を選択することができる。とりわけ実用的なのは、このようなポリマー賦形剤を、薬物の微小粒子または微小球とあわせて使用することである。薬物は、医師によって容易にアクセス可能な眼の前方領域に注射され、注射部位から離れた後方の脈絡膜および黄斑などの後方領域の治療に使用することができるので、このような薬物の移行の使用は有利である。微小粒子または微小球としては、約1〜33ミクロンの範囲の外径をともなうものが好ましい。
【0027】
持続放出
製剤に持続放出特性を付与するには、薬物微小粒子、1つもしくは複数のポリマー賦形剤、または両者の組み合わせを採用することも可能である。微小粒子によって得られる薬物放出速度は、薬物の可溶性を調整することまたは放出制御コーティングを塗布することによって加減することが可能である。ポリマー賦形剤は、組み入れられた薬物からの持続放出を提供することも可能である。ポリマー賦形剤は、例えば、薬物の放出を減速させるために、薬物の拡散を制限するまたは薬物の親和性を提供するように選択することが可能である。ポリマー賦形剤の溶解速度もまた、それが持続放出特性に及ぼす影響の動力学を制御するために調整することが可能である。
【0028】
送達機器
薬物を低侵襲的に脈絡膜上腔へ送達するための機器は、薬物または薬物含有材料を脈絡膜上腔に直接注射するための針を含むことが可能である。機器は、また、内側の脈絡膜の層を刺すまたは外傷させることなく結膜および強膜組織の中を脈絡膜上腔までまたは脈絡膜上腔のすぐ近傍まで針を進めるための要素を含むことが可能である。送達機器の先端突先の位置は、超音波もしくは光コヒーレンス断層撮影、機器の組織接触部分に付けた外部の深さマーカもしくはストップ、機器に組み込まれた深さもしくは位置センサ、またはこのようなセンサの組み合わせなどの、低侵襲的な撮像技術によって確認することが可能である。例えば、送達機器は、脈絡膜の深さおよび位置を決定するための光導体もしくは超音波センサなどのセンサ、または脈絡膜上腔への進入による局所的流体圧力の変化を決定するための圧力トランスデューサを、その先端突先に組み込むことが可能である。
【0029】
送達機器の先端突先は、好ましくは、切断、鈍的切開、または切断と鈍的切開との組み合わせのいずれかによって強膜への貫通を促進するように成形される。機器の特徴は、超音波、高流体圧力、または組織切除エネルギなどの、組織貫通を補助するエネルギ送達要素をその遠位突先に含むことが可能である。機器の組織接触部分の外径は、組織切開または創縫合のための追加特徴を必要とすることなく低侵襲的な使用を可能にするために、好ましくは、20〜25ゲージ針(公称外径0.0358〜0.0203インチ)とおよそ同程度の大きさである。送達機器に適した材料は、ステンレス鋼、タングステン、およびニッケルチタン合金を含む金属、ならびにナイロン、ポリエチレン、ポリプロピレン、ポリイミド、およびポリエーテルエーテルケトンなどの構造ポリマー、ならびにセラミックスなどの、高弾性率の材料を含む。機器の組織接触部分は、組織貫通を補助するための潤滑コーティング、または医療撮像中における配置および誘導を補助するためのエネルギ反射性もしくはエネルギ吸収性のコーティングなどの、表面処理を含むことも可能である。
【0030】
針は、挿入の位置確認と、挿入の角度および深さの制御とを可能にするために、板または固定機構に対して浅い角度で取り付けるまたはスライド可能に設置することが可能である。図4に示されるような板は、眼球の表面(眼の表面)上に予め配置された板を通って針を進めることを可能にするための注入ポートを含むことが可能である。板は、さらに、眼表面上の標的部位に板を安定させるための真空補助シール12を含むことが可能である。吸い込み力を提供するため、板には、ライン13によって、シリンジまたは真空ポンプなどの外付けの真空源がつながれる。板は、好ましくは、眼球の曲率にぴたりと合うように湾曲された底面または底部フランジを有することが望ましい。針11は、強膜1の中を脈絡膜上腔2に進入するまで進められるが、脈絡膜3には入らない。
【0031】
注射中に針の道筋を封じるための、針の道筋に沿った軟性フランジまたは真空シールなどの要素もまた、送達を補助するために組み込むことが可能である。図4には、吸い込みライン13に取り付けられた真空界面シール12による配置による、送達機器1の、標的強膜1、脈絡膜上腔2、および脈絡膜3に対する位置が示されている。
【0032】
機器は、また、微小粒子薬物の注射、または細い針によって送達可能であるよりも大きい薬物送達インプラントの注射を可能にするために、脈絡膜上腔を機械的に開かせるための要素を含むことも可能である。一実施形態において、このような送達機器は、強膜組織を指定の深さまで貫通するために提供された第1の要素と、進むことが可能で脈絡膜を無傷で内方に膨張させることによって脈絡膜上腔に到る経路を維持することができる第2の要素と、を含むことが可能である。第2の要素は、第1の要素の中または近傍に配置することが可能である。このような要素を有する機器の実施形態が、図3aおよび図3bに示されている。
【0033】
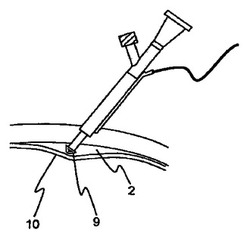
図3aには、膨張する突先を備えた送達機器が示されている。送達機器は、切断または切除の突先4、脈絡膜膨張の突先8を機器の遠位端に含み、そして、組織を通る機器を誘導するために使用される超音波センサ6を含む。機器の近位端(切断用の突先から離れた端)には、ルアーコネクタ7が提供される。ノブ5は、膨張の突先8を作動させるための機構につながれる。機器は、脈絡膜3の近傍の脈絡膜上腔2を扱うために、強膜1に面して配置される。機器は、次いで、誘導のための深さセンサを使用して、強膜組織の中を進められる。深さセンサによって、突先4が脈絡膜上腔2に達するまたは脈絡膜上腔2の近傍にあることが示されると、膨張の突先8は、脈絡膜に対する損傷を回避するために作動される。図3bを参照すると、ノブ5は、膨張の突先をその作動ポジション9まで進めるために作動され、その結果、脈絡膜10を膨張させた。このようにして、切除の突先4によって脈絡膜が外傷されることなく脈絡膜上腔2に到る経路が得られる。
【0034】
別の実施形態において、送達機器は、高角度の短いベベルを先端突先に備えることによってそのベベルが強膜組織に入るまたは強膜組織の中を進むことを可能にする薄肉の針を含む。開口のあるベベル部分を内向きに維持することによって、薬物が脈絡膜上腔から溢れる事態が阻止される。強膜組織に入るまたは強膜組織の中を通る針の突先の正確な配置を通じて、様々なタイプのアクセスおよび送達が実現可能である。針が、強膜の中を通って脈絡膜上腔内へ進められる場合は、その針は、脈絡膜上腔内への直接注射に使用すること、またはマイクロカニューレなどのその他の機器を配置するための導入器として機能することが可能である。針が、強膜の内側の境界にごく接近して配置される場合は、その針を通じた製剤の注射は、流体が残りの任意の介在強膜組織を切開することまたはその中を流れること、および脈絡膜上腔へ送達されることを可能にする。このような方式に役立つ機器の実施形態が、図8に示されている。
【0035】
図8において、脈絡膜上腔2に物質を注射するためのシステムは、アクセスカニューレ26と、高解像度の撮像機器27とを含む。アクセスカニューレは、皮下注射器タイプの針(不図示)、またはトロカールをともなった導入器シースに適応することが可能である。さらに、アクセス手段は、図4または図5に示されるような板を含むことができる。アクセスカニューレは、組織への貫通に適するように成形された鋭いベベル遠位突先を組み入れている。撮像機器は、超音波、光コヒーレンス断層撮影(OCT)、またはマイクロコンピュータ断層撮影(MicroCT)などの、リアルタイムモダリティを含むことが可能である。強膜を通るアクセス針または導入器の前進は、撮像機器を使用して監視される。アクセスカニューレ26は、その先端突先が強膜28の内側の境界にごく接近するまで進められ、その地点において、薬物の注射がなされる。針を通じた製剤の注射は、流体が残りの任意の介在強膜組織を切開することまたはその中を流れること、および脈絡膜上腔29へ送達されることを可能にする。
【0036】
一実施形態において、送達機器は、強膜内の道筋を維持するまたは脈絡膜に接触せずに脈絡膜上腔へと貫通する組織経路を提供するために、特定の角度での組織への進入を可能にする。図5を参照すると、近位端にルアーコネクタ7を、遠位端に針のベベル突先14を備えた機器の実施形態が示されている。針は、針の突先14の貫通の深さおよび角度を設定するために、傾斜した停止板15に取り付けられる。アセンブリは、停止板が眼球の表面に行き当たるまで進められ、標的の深さに針の突先を配置する。取り付け板は、針の突先の配置を示すまたは指示するためのセンサを含むことも可能である。
【0037】
一実施形態において、脈絡膜上腔への低侵襲的アクセスを得るためのシステムは、アクセスカニューレと、組織の道筋内におけるアクセスカニューレの遠位突先の位置を決定することによって脈絡膜上腔への進入に際して直結フィードバックを提供するために使用される光学機器と、を含む。強膜(白)と脈絡膜(茶)との間の色の差を使用して位置情報を提供することも可能であるし、あるいはOCT法を使用して脈絡膜との境界までの強膜からの距離を決定することも可能である。光学機器は、マイクロカニューレに組み込まれることも可能であるし、あるいはミクロ内視鏡または光ファイバセンサとトランスデューサなど組織特性を検出することができる独立した機器であることも可能である。光信号は、内視鏡の場合のように直接可視化のためにカメラおよびモニタに送信されることも可能であるし、あるいは光ファイバの突先における組織特性の変化を信号通知することによって深さを示す光信号処理システムに送られることも可能である。アクセスマイクロカニューレは、金属またはプラスチックで作成された針または導入器タイプの機器であることが可能である。アクセスカニューレの遠位端は、眼組織を突き刺すのに適している。もし独立した機器である場合は、光学機器は、その他の機器または注入液を脈絡膜上腔にアクセス可能にして治療を施すために、挿管後、アクセスマイクロカニューレから取り除かれる。このようなシステムの実施形態が、図6に示されている。光学機器は、CCDカメラ16につながれた軟性のミクロ内視鏡18を含み、その画像は、モニタ19で見ることができる。内視鏡は、外径が好ましくは1mm未満であるアクセスカニューレ17内にスライド可能に嵌められる大きさである。アクセスカニューレ17は、組織にアクセスするための鋭いベベル遠位突先を含む。内視鏡の遠位突先は、カニューレの突先の画像を提供するために、カニューレのベベルの近位端に配置される。カニューレは、扁平部領域において眼の表面に対して低角度で進められ、強膜1を貫いた後、内視鏡画像によって脈絡膜上腔2へのアクセスが示されるまで進み続ける。
【0038】
別の実施形態において、システムの光学機器は、遠位突先に偏斜照明光源を備えている。光散乱の量および光の強度は、組織の種類、および組織を突き切る小光点の深さに応じて変化する。この変化は、医師が表面から観測することも可能であるし、あるいはセンサによって測定することも可能である。焦点は、マイクロカニューレ上の受照ビーコン突先として組み込み可能である。図7を参照すると、アクセス機器は、脈絡膜上腔2内への無傷アクセスに適した大きさの軟性のマイクロカニューレまたはマイクロカテーテル20を備えている。マイクロカテーテルは、脈絡膜上腔2に材料を送達するための管腔22と、受照遠位突先を提供するための光ファイバ23とを含む。光ファイバは、レーザーダイオード、超高輝度LED、白熱光源または類似の光源などの、照明光源24につながれる。マイクロカテーテルは、アクセスカニューレ21内にスライド可能に設置されている。アクセスカニューレが組織の中を進められるにつれて、組織に光を透過させている光25は変化する。強膜組織は、強膜組織内からの光を高度に散乱させるが、ひとたび脈絡膜上腔の内部に入ると、表面において見られる光強度および後方散乱は大幅に減少する。これは、受照突先が、強膜1を通過して、脈絡膜上腔において標的位置にあることを示している。
【0039】
送達機器にとってとりわけ実用的なのは、前述のように、送達機器に適合した製剤である。送達の最中に管腔が閉塞するのを阻止するため、微小粒子形態の薬物は、管腔の直径より大幅に小さいことが好ましい。平均外のり寸法が最大で機器の管腔のおよそ10〜20%であるような、微小粒子が好ましい。有用な製剤は、約1〜33ミクロンの範囲の外径をともなう微小球または微小粒子を含む。やはり好ましいのは、製剤内にポリマー賦形剤を使用することによって、製剤を脈絡膜上腔の近傍の強膜組織に注射すること、そして、次いで、遠位突先と脈絡膜上腔との間の組織を賦形剤含有流体によって切開し、薬物を脈絡膜上腔に入れるための流路を形成することを可能にすることである。チクソトロピー特性を備えた製剤は、細い針の管腔内を通過するにも、流体によって強膜組織を切開するにも有利である。
【0040】
以下の実施例は、例示の目的でのみ提示され、本発明をいかなるかたちで制限することもない。
【0041】
実施例1
脈絡膜上腔の中を前方領域から後方領域へ移行する粒子のサイズ範囲を評価するためのモデル薬物として、リン酸緩衝生理食塩水中に懸濁された蛍光染色されたポリスチレン微小球(カリフォルニア州、パロアルトのDuke Scientifics,Inc.のFirefli(商標))が使用された。
【0042】
除核された人の死体の眼が、眼の前方部分にある扁平部領域内において、脈絡膜まで放射状に切開された。1体積パーセントの0.15mlの微小球懸濁(平均直径6ミクロン)が、鈍的な27ゲージ針を終端とするシリンジを使用して、脈絡膜上腔の前方領域内へ送達された。針は、引き抜かれ、切り口は、シアノアクリレート接着剤によって封じられた。
【0043】
眼は、次いで、注入管を介してリザーバに取り付けられた30ゲージ針を前房に導入することによって、10mmHgの圧力のもとで、リン酸緩衝生理食塩水によって24時間にわたって還流された。リザーバは、ラボジャッキに載せられ、一定の還流圧を提供するために持ち上げられた。検査の数時間前に、眼は、脱水によって強膜組織を明確にして、脈絡膜上腔の直接可視化を可能にするために、グリセリンの入ったビーカーに入れられた。
【0044】
微小球は、微小球の蛍光発光用に選択された蛍光フィルタを備えた実体蛍光顕微鏡(Leica,Inc.のModel MZ−16)を使用して可視化された。低倍率(7〜35X)のもとでは、微小球は、滴注の部位から視神経領域へ後方に伸びて主として脈絡膜上腔の後方領域で纏まる流線状のパターンとして明確に見ることができた。
【0045】
実験は、直径が1ミクロン、6ミクロン、10ミクロン、15ミクロン、24ミクロン、および33ミクロンの微小球懸濁を使用して繰り返され、その結果、眼の後方領域へ移行および分布する同じパターンが得られた。
【0046】
実施例2
7,000,000mPasのゼロせん断粘度および1000s-1のせん断速度において400mPasの粘度のチクソトロピー特性をともなうダルトン分子量4,000,000の濃度2.3%のヒアルロン酸ナトリウムである手術用の粘弾性物質(Advanced Medical Optics,Inc.のHealon 5)を含むポリマー賦形剤の中に、直径6ミクロンおよび33ミクロンの蛍光微小球の混合が、モデル薬物として懸濁されたことを除き、実施例1の実験が、繰り返された。混合は、実施例1の方式で脈絡膜上腔に導入された。24時間の還流後、微小球は、前方の滴注部位の脈絡膜上腔内にのみ存在し、移行の徴候を示さなかった。これは、チクソトロピー性ポリマー賦形剤による局在化の効果を実証している。
【0047】
実施例3
ポリマー賦形剤の粘度が薬物の局在性に対して及ぼす効果を実証するため、抗VEG抗体であるベバシズマブ(GenentechのAvastin(商標))が、直径5ミクロンのカルボキシル化蛍光微小球に吸着され、ヒアルロン酸をベースにしたそれぞれ異なる粘度およびチクソトロピー特性の3種の手術用粘弾性物質(Advanced Medical Optics,Inc.のHealon、Healon GV、Healon 5)の1つと等体積で混合されたことを除き、実施例1の実験が、繰り返された。(Healonは、ゼロせん断速度において300,000mPasの粘度、1000s-1のせん断速度において150mPasの粘度。Healon GVは、ゼロせん断速度において3,000,000mPasの粘度、1000s-1のせん断速度において200mPasの粘度。Healon 5は、ゼロせん断速度において7,000,000mPasの粘度、1000s-1のせん断速度において400mPasの粘度。)各混合は、実施例1の方式によって、眼の前方領域内の扁平部において、脈絡膜上腔の前方領域に導入された。24時間の還流後、HealonおよびHealon GVの中の微小球は、脈絡膜上腔の後方領域に移行する過程にあることが見い出され、製剤は、滴注の扁平部位および後極の両方において見い出された。Healon 5の中の微小球は、脈絡膜上腔の扁平部領域内の最初の滴注部位に局在する粘弾性物質の中に分散された状態にとどまった。
【0048】
実施例4:
ベバシズマブ(GenentechのAvastin(商標))が、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(Sigma−AldrichのEDAC)を使用して、直径5ミクロンのカルボキシル化蛍光微小球に共有結合的に架橋され、実施例3と同様にそれぞれ粘度およびチクソトロピー特性の異なる3種の手術用粘弾性物質(Advanced Medical Optics,Inc.のHealon、Healon GV、Healon 5)の1つと等体積で混合されたことを除き、実施例1の実験が、繰り返された。混合は、実施例1の方式によって、扁平部において脈絡膜上腔に導入された。24時間の還流後、微小球は、いずれの粘弾性キャリアの場合も、もっぱら脈絡膜上腔の扁平部領域内にとどまった。
【0049】
実施例5:
架橋性ポリマー賦形剤が薬物の局在性に対して及ぼす効果を実証するため、直径10ミクロンの蛍光微小球が、4%のアルギン酸塩溶液と混合され、扁平部領域において脈絡膜上腔に導入されたことを除き、実施例1の実験が、繰り返された。アルギン酸塩賦形剤の架橋を開始させるため、切開部位を封じる前に、等容量の1MのCaCl2溶液が、微小球/アルギン酸塩の懸濁の部位に滴注された。混合は、実施例1のように還流させる前に、5分間にわたってゲル化することを許された。微小球は、架橋したポリマー賦形剤の中に分散された状態で、もっぱら滴注部位にとどまった。
【0050】
実施例6:
微小粒子形態の1.5mgのトリアムシノロンアセトニドを、300,000mPaのゼロせん断粘度および1000s-1のせん断速度において150mPasの粘度をともなう15マイクロリットルのHealon粘弾性物質(カリフォルニア州、アーヴァインのAdvanced Medical Optics)の中に懸濁させることによって、薬物含有注入液が調合された。40頭のブタ被験体に麻酔をかけ、右目を無菌状態で覆って準備した。上縁の近くで結膜周囲切開を施して、強膜の領域を露出させ、その領域への外科的アクセスを可能にした。強膜内に、小さい放射状の切開が施され、むきだしの脈絡膜が露出された。直径360ミクロンの突先および直径325ミクロンの本体を備えた軟性のマイクロカニューレ(iScience Interventional Corp.のiTrackマイクロカニューレ)が、強膜の切り口に挿入され、黄斑の後ろ側の標的領域に向けて後方へ進められた。薬物の懸濁は、脈絡膜上腔の後方領域に注射され、標的領域において脈絡膜と強膜との間に層を形成することが観測された。マイクロカニューレは引き抜かれ、強膜および結膜の切り口は、7−0 Vicryl縫合によって閉じられた。被験体は観測され、眼の組織は、12時間、24時間、48時間、4日間、7日間、14日間、30日間、および90日間で回復された。被験体に対する血管造影的、組織学的、および写真的調査は、後眼部の病変の徴候をいっさい示さなかった。回復された脈絡膜サンプルは、いずれの回復期間の場合も、組織1gあたり少なくとも1mgの範囲の高濃度の薬物を示した。
【0051】
実施例7:
20mlのHealon 5および50ml(1.5mg)のベバシズマブ(GenentechのAvastin(商標))を含む薬物含有製剤が調合された。18頭のブタ被験体を麻酔し、右目を無菌状態で覆って準備した。上縁の近くで結膜周囲切開を施して、強膜の領域を露出させ、その領域への外科的アクセスを可能にした。強膜内に、小さい放射状の切開が施され、むきだしの脈絡膜が露出された。直径360ミクロンの突先および直径325ミクロンの本体を備えた軟性のマイクロカニューレ(iScience Interventional Corp.のiTrackマイクロカニューレ)が、強膜の切り口に挿入され、黄斑の後ろ側の標的領域に向けて後方へ進められた。製剤は、脈絡膜上腔の後方領域に注射され、標的領域において脈絡膜と強膜との間に層を形成することが観測された。マイクロカニューレは引き抜かれ、強膜および結膜の切り口は、7−0 Vicryl縫合によって閉じられた。別の18頭のブタ被験体が麻酔され、それぞれ、硝子体への注射を通じて50mlのベバシズマブをボーラス投与された。各被験体グループは、ともに、注射後0.5日間、7日間、30日間、60日間、90日間、および120日間で評価され放棄された。血清サンプルが採取され、酵素をベースにした免疫測定法を使用してベバシズマブに関して検査された。硝子体内注射された被験体では、脈絡膜上送達グループと比べ、より高いプラズマレベルのベバシズマブがより長い持続時間にわたって見い出された。酵素をベースにした免疫測定法を使用して、特定の組織および領域の中のベバシズマブを定量するために、右の眼球が取り除かれ解剖された。酵素免疫測定法は、硝子体内注射を通じて送達されたベバシズマブが眼全体に分布されたこと、しかしながら、脈絡膜上に送達された場合は大部分が網膜および脈絡膜の中にとどまり、硝子体腔および前房の中でほとんど見い出されなかったことを示した。
【0052】
実施例8:
抗炎症特性および抗VEGF特性をともに備えた治療を提供するために、0.2mlのHealon 5と、0.6mlのAvastinと、24mgのトリアムシノロンアセトニドとからなる製剤が調合されたことを除き、実施例1の実験が、繰り返された。扁平部領域において、強膜を横断する長さおよそ5mmの切開が縦方向に施され、死体の眼球の脈絡膜が露出された。この眼球の脈絡膜は、およそ30分間にわたるグリセロールへの浸漬および12mmHgの圧力下における生理食塩水による還流を経て明瞭化されている。実施例6の軟性のマイクロカニューレは、製剤を与えられ、マイクロカニューレの突先は、強膜の切り口を通って脈絡膜上腔に挿入された。マイクロカニューレの突先にある光ファイバビーコンの補助によって、マイクロカニューレの遠位端は、眼球の後極に向けて進路を取り、視神経までおよそ5mmの位置において停止した。Viscoelastic Injector(iScience Interventional)を使用して、脈絡膜上腔の後方領域に、70マイクロリットルの製剤が注射された。マイクロカニューレは、扁平部の切り口を通して引き抜くことによって取り除かれた。混合は、明瞭化された強膜を通じて見ることができた。そして、視神経の近くには、やはりカテーテルの道筋をたどる混合の沈殿が形成された。切り口は、シアノアクリレート(Locktite 4011)によって封じられ、眼球は、12mmHgのもとで、生理食塩水によって3時間にわたって再び還流された。強膜は、投与された製剤を調べるために、グリセロールへの浸漬によって再び明瞭化された。製剤は、脈絡膜上腔の後方領域内において、ポリマー賦形剤の中に分散された薬物の層を形成したことを、顕微鏡によって観察された。
【0053】
実施例9:
脈絡膜上腔への低侵襲的な物質送達を評価するために、一連の実験が実施された。これらの実験のゴールは、脈絡膜上腔を直接貫通することなしに、強膜組織を通って脈絡膜上腔内へ物質を送達する手段として、低侵襲的な撮像および流体による切開を使用することであった。
【0054】
人の死体の眼がアイバンクから取得され、リン酸緩衝生理食塩水(PBS)によっておよそ20mmHgの圧力まで膨らませることによって準備された。送達針が、内径255mm×外径355mmのステンレス製の皮下注射針チューブを使用して作成された。針の遠位突先は、長さが400μmで角度が50°の、二面の短いベベル点になるように磨かれた。組み立てを完成するため、作成された針は、次いで、銀ろう付によって、標準的な25ゲージ×1インチの皮下注射針とされた。
【0055】
針は、眼の表面に対して鋭角(<10°)で、強膜組織の中をゆっくり進められた。針の進入は、縁からおよそ4mmの扁平部領域において開始され、針は、強膜を貫通して脈絡膜上腔内に達することなく長さ5〜6mmの道筋を形成するように、強膜組織の中を後方へ進められた。強膜組織内における針の突先の配置を誘導および確認するため、そして注射の記録をとるために、高解像度の超音波システム(iScience Surgical Corp.のiUltrasound)が使用された。
【0056】
第1の実験セットでは、ヒアルロン酸の手術用粘弾性物質(Advanced Medical Optics,Inc.のHealon 5)を単独で含むポリマー賦形剤が注射された。第2の実験セットでは、粘弾性物質は、モデル微小粒子薬物を表すために、直径10ミクロンのポリスチレン微小球の1%の水溶液(Duke Scientific,Inc.)と、1:1の比率で混合された。送達体積および注射圧力を制御するため、粘弾性物質および混合は、ネジ駆動式のシリンジ(iScience Surgical Corp.のViscoInjector)を使用して、針を通じて送達された。注射は、針のベベルを眼球の中心に向けて内向きにすることによってなされた。3つの死体の眼における複数の位置が、実験のために使用された。
【0057】
第1の実験では、針の道筋は、およそ3〜4mmの長さであり、注入液は、逆流して道筋から流れ出ることを観測された。針の突先を、より長い道筋に通したところ、より高い注射圧力が得られ、注入液は、強膜の残りの介在層を切開して脈絡膜上腔へ送達されることが可能になった。試行の結果、針の突先を強膜の外側層の中(<強膜厚さの1/2)に配置すると、粘弾性物質は、強膜内ポケット内に送達されるあるいは場合によっては強膜内ポケットを通り抜けて眼球の外表面に達することがわかった。針の突先を強膜の根元により近づけた場合は、注射は、残りの介在強膜組織を切開して脈絡膜上腔に進入し、脈絡膜上腔の注射領域を満たすべく広がった。図1は、はっきり見ることができる(針を取り除いた後の)針の道筋30と、注入液で満たされた脈絡膜上腔の領域31とを示している。強膜1および脈絡膜3も示されている。図2は、微小球とヒアルロン酸賦形剤とを含有する注入液で満たされた脈絡膜上腔の領域33と、強膜内の針4の突先と、針の影32とを示している。
【0058】
実施例10:
人の死体の眼の中の脈絡膜上腔への低侵襲的アクセスを可能にするため、ミクロ内視鏡撮像を使用した実験が実施された。マイクロメータ調整式のステージ上に、外径350ミクロンの、1200ピクセルの撮像束を含むカスタムメイドの軟性のミクロ内視鏡(ニューヨーク州、ブルースターのEndoscopy Support Services)が搭載された。ステージは、内視鏡を制御式に上下に可動にする垂直スタンド上に搭載された。ミクロ内視鏡は、1/2インチチップのCCDカメラに取り付けられ、次いで、ビデオモニタに取り付けられた。アクセスのために組織を突き刺すための手段として、20ゲージ皮下注射針が内視鏡にあてがわれた。
【0059】
カメラはオンにされ、光導体を備えた外付け光源(マサチューセッツ州ボックスボーロ、Dolan JennerのModel MI−150)が、経強膜撮像照明を提供するために使用された。針は、その遠位突先が、人の死体の全眼球の強膜表面に、縁からおよそ4mm後方で接触するまで進められた。ミクロ内視鏡は、次いで、針の端を通して白い強膜表面が見えるようになるまで降下された。針は、次いで、僅かな前後の回転によって、強膜組織内へゆっくり進められた。針がこのように進められるにつれて、内視鏡は、針によって形成される道筋をたどるために下降された。強膜では、または強膜内では、内視鏡画像は、白または白っぽい灰色に見えた。針が強膜組織に突き刺されるにつれ、画像の色は、濃い脈絡膜組織の存在を示す濃い茶に変化し、脈絡膜上腔への外科的アクセスを示した。
【0060】
実施例11:
人の死体の眼の中の脈絡膜上腔への低侵襲的アクセスを可能にするため、光ファイバ受照誘導を使用した実験が実施された。受照遠位突先を備えた軟性のマイクロカニューレ(カリフォルニア州、メンロパークのiScience InterventionalのiTrack−250A)が、25ゲージ皮下注射針の中に配された。マイクロカニューレは、遠位突先の照明を可能にしたプラスチック光ファイバを備えている。マイクロカテーテルファイバコネクタは、635nm(赤)レーザーダイオード光ファイバ照明器(iScience InterventionalのiLumin)に取り付けられ、該照明器は、マイクロカニューレの突先のための安定した赤色光の放射を提供するためにオンにされた。マイクロカニューレは、25ゲージ針の中を、針の遠位ベベルには達するが同ベベルを超えることはないように通された。
【0061】
マイクロカニューレを僅かに進めることを可能にするため、針は、その突先が強膜組織内に十分に埋め込まれるまで、人の死体の全眼球の扁平部領域の中をゆっくり進められた。強膜組織は、光をかなりの度合いで拡散させるので、マイクロカニューレの突先からの照明は、明瞭に見ることができた。針がゆっくり進むにつれて、マイクロカニューレもまた、同時に前方へ押された。皮下注射針の突先が、強膜組織に十分に突き刺されて脈絡膜上腔に達したとき、マイクロカニューレの突先の赤色光は、直ちに暗くなった。なぜならば、受照突先は、拡散性の強膜組織を通過してその下の脈絡膜上腔内に達したからである。マイクロカニューレは、針を固定したまま進められ、そうして、マイクロカニューレの突先は、脈絡膜上腔内に配された。マイクロカニューレの突先が強膜組織の内部にあると、広い光拡散をともなわない赤い焦点が見えるので、脈絡膜上腔の中を後方へ進むマイクロカニューレのさらなる前進は、経強膜的に見ることができるであろう。高周波数の超音波システム(iScience InterventionalのiUltraSound)を使用して、脈絡膜上腔内におけるマイクロカニューレの位置が確認された。
【図面の簡単な説明】
【0062】
【図1】実施例9にしたがった、ヒアルロン酸の手術用粘弾性材料を針によって強膜に注射した後における、眼の一部の超音波画像である。
【図2】実施例9にしたがった、粘弾性材料と1%のポリスチレン微小球溶液との1:1体積比の混合を針によって強膜に注射する最中における、眼の一部の超音波画像である。
【図3a】膨張する切断または切除の突先を有する、本発明にしたがった送達機器の実施形態の図である。
【図3b】膨張する切断または切除の突先を有する、本発明にしたがった送達機器の実施形態の図である。
【図4】本発明にしたがった送達機器の、標的である強膜、脈絡膜上腔、および脈絡膜に対する位置を示した図である。
【図5】眼への針の貫通の深さおよび角度を設定するための停止板を有する、本発明にしたがった送達機器の実施形態の図である。
【図6】手術中にカニューレの突先の位置を監視するためのミクロ内視鏡およびカメラに適応した、本発明にしたがった送達機器の実施形態の図である。
【図7】カテーテルを通じて眼の中へ薬物を送達するための管腔と、カニューレの突先を照射するための照明源につながれた光ファイバ線と、を有する送達機器の実施形態の図である。
【図8】本発明にしたがった機器を、カニューレの突先の位置を監視するための高解像度の撮像機器とあわせて使用する実施形態の図である。
【背景技術】
【0001】
[関連出願]
米国特許法第119条(e)に基づいて、2006年2月22日出願の米国仮出願第60/776,903号の優先権を主張する。該仮出願は、参照によりその全体を本明細書に組み込まれるものとする。
【技術分野】
【0002】
本発明は、眼への薬物送達の分野に関するものである。
【0003】
眼は、視覚のための光学的および神経学的プロセスを提供する様々な特殊化組織を備えた複合器官である。医学的治療を目的とした眼へのアクセスは、組織の小ささおよび繊細性によって妨げられる。網膜、黄斑、および視神経を含む眼の後方領域は、眼が眼窩内に陥凹しているゆえに、とりわけアクセスが困難である。また、局所点眼薬は、後方領域に十分に浸透することができず、治療の選択肢をさらに限定する。
【0004】
脈絡膜上腔は、内側血管膜である脈絡膜と、眼の外層である強膜との間に位置する眼の中の潜在空隙である。脈絡膜上腔は、毛様体に近い眼の前方部分から視神経に近い眼の後方端まで達している。脈絡膜が、眼の眼圧によって強膜に近接しているゆえに、脈絡膜上腔は、はっきり見えないのが通常である。脈絡膜は、強膜に強く付着しているわけではないので、これらの組織は、液体貯留またはその他の状態が生じた際に、分離して脈絡膜上腔を形成する。脈絡膜上腔は、眼の後方領域を治療する目的で眼の前方領域からアクセスするための潜在ルートを提供する。
【0005】
本発明は、脈絡膜上腔に投与するための製剤と、薬物およびその他の物質を低侵襲的に脈絡膜上腔へ送達するための装置と、に関するものである。
【発明の開示】
【0006】
少なくとも300,000mPasのゼロせん断粘度によって特徴付けられる製剤が提供される。サブクラスの製剤は、さらに、1000s-1のせん断速度において約400mPas以下の粘度によって特徴付けられる。
【0007】
眼の脈絡膜上腔への注射のため、生物活性物質と、注射後に広がって薬物を脈絡膜上腔の領域内に均一に分布させるおよび局在させるためのゲル状材料として機能する、チクソトロピー性ポリマー賦形剤と、が含まれる。一実施形態において、ゲル状材料は、脈絡膜上腔への注射後に架橋する。生物活性物質は、微小粒子または微小球を含むことが可能である。ポリマー賦形剤は、ヒアルロン酸、コンドロイチン硫酸、ゼラチン、ポリヒドロキシエチルメタクリレート、デルマタン硫酸、ポリエチレンオキシド、ポリエチレングリコール、ポリプロピレンオキシド、ポリプロピレングリコール、アルギン酸塩、でんぷん誘導体、水溶性のキチン誘導体、水溶性のセルロース誘導体、またはポリビニルピロリドンを含むことが可能である。
【0008】
別の実施形態では、眼の脈絡膜上腔へ送達するための製剤であって、生物活性物質と、約1〜33ミクロンの範囲の外径をともなう微小球と、を含む製剤が提供される。微小粒子または微小球は、さらに、放出制御コーティングおよび/または組織親和性表面を追加で含むことが可能である。
【0009】
生物活性物質は、好ましくは、抗生物質、ステロイド、非ステロイド性抗炎症剤、神経保護剤、抗VEGF剤、または新血管形成抑制剤を含む。
【0010】
また、製剤を眼の脈絡膜上腔内へ低侵襲的に送達するための機器であって、下にある脈絡膜組織を損傷させることなく強膜組織を通ることを可能にするように成形された先端突先を有する針と、製剤を脈絡膜上腔の近傍または中へ送達するために突先の配置を誘導するためのセンサと、を含む機器が提供される。
【0011】
センサは、強膜組織の画像を提供することが可能である。センサは、好ましくは、超音波、光、または差圧に反応する。
【0012】
別の実施形態では、製剤を眼の脈絡膜上腔内へ低侵襲的に送達するための機器であって、強膜組織を通ることを可能にするように成形された先端突先を有する針と、脈絡膜に接触した際にそれを外傷させないために内方膨張作用を脈絡膜に付与する内側突先と、を含む機器が提供される。
【0013】
薬物を眼に投与するための方法であって、生物活性物質とポリマー賦形剤とを含む製剤を、賦形剤が送達後にゲル化して生物活性物質を局在させるように、脈絡膜上腔の中に配置することを含む方法が提供される。製剤は、脈絡膜上腔の後方または前方の領域の中に配置することが可能である。
【0014】
別の実施形態では、薬物を眼の後方領域に投与するための方法であって、約1〜33ミクロンの範囲の外径をともなう微小球または微小粒子を含む、生物活性物質を含む製剤を、それらの微小球または微小粒子が次いで後方領域へ移行するように、脈絡膜上腔の前方領域の中に配置することを含む方法が提供される。製剤は、好ましくは、微小粒子または微小球を脈絡膜上腔の中に均一に分散させるためのポリマー賦形剤を含む。
【0015】
別の実施形態では、薬物を眼の脈絡膜上腔の中に投与する方法であって、針を、脈絡膜上腔に向けて強膜の厚さの少なくとも半分の深さに配置するステップと、製剤を、それが脈絡膜上腔の近傍の強膜組織を切開して脈絡膜上腔に進入するように、針を通して強膜に注射するステップと、を含む方法が提供される。
【0016】
本明細書で開示される方法において、製剤は、好ましくは、チクソトロピー性ポリマーを含む。
【発明を実施するための最良の形態】
【0017】
本発明は、眼の治療のために薬物を送達することを目的として、眼の脈絡膜上腔にアクセスするための、製剤、機器、および関連の方法を含む。具体的に言うと、本発明は、眼の特定領域を含む眼の治療を目的として、送達される薬物の局在性によって脈絡膜上腔へ投与されるように設計された製剤に関する。本発明は、また、小さい針を通じて製剤および薬物含有材料を脈絡膜上腔に直接注射するための、低侵襲的機器の設計、ならびにその使用の方法に関する。
【0018】
生物的に活性の物質または材料は、有機体または生物学的プロセスに影響を及ぼす薬物またはその他の物質であり、診断、治癒、緩和、治療、もしくは疾病予防における使用、または体の構造もしくは任意の機能に作用させるための使用を含む。製剤は、生物活性物質を含有している。
【0019】
本明細書において、眼の前方領域は、眼窩内にある眼の露出前面から一般に容易にアクセス可能であるような眼の領域である。眼の後方領域は、一般にそれ以外の眼の領域であり、露出していない眼の表面を通して主として外科的にアクセスされ、したがって、その表面へのアクセスを得るためにしばしば眼の一時的後退を必要とするような眼の領域である。
【0020】
製剤:
本発明の製剤は、脈絡膜上腔環境との適合性を提供するものであり、製剤の移行によって生物活性物質の分布を制御するように、そして時間的な持続放出を可能にするように調製することが可能である。製剤は、生理学的に適合性の賦形剤とあわせて調製される1つまたは複数の生物活性物質を含み、通常は、注射によって眼の脈絡膜上腔に投与される。適切な生物活性物質は、感染症を治療するための抗生物質、炎症および浮腫を治療するためのステロイドおよび非ステロイド性抗炎症剤、カルシウムチャンネル遮断薬など視神経を治療するための神経保護剤、ならびに抗VEGF化合物または新血管形成抑制剤など黄斑変性症を治療するためのレチナール剤を含む。
【0021】
局所治療のための製剤:
例えば斑状病変、後方網膜、または視神経を治療するなどの眼の局所領域の治療のため、薬物は、送達後の移行を制限する形態で調合し、病変領域へ送達することが可能である。特定の理論に縛られることは意図していないものの、我々の観測によると、薬物微小粒子は、恐らくは腔内のぶどう膜−強膜間の流体の流れゆえに、生理学的条件下において脈絡膜上腔の後方領域に向かって移動するのが一般的である。このような薬物微小粒子は、薬物の移行を制限するために、十分な大きさに、そして随意には組織表面親和性をともなうように形成することが可能である。組織表面親和性は、微小粒子にポリマーもしくは脂質の表面コーティングを加えることによって、または微小粒子表面に化学的もしくは生物学的な部分を加えることによって変更することが可能である。組織親和性は、こうして、表面電荷から、疎水性から、または組織との結合特性を提供して薬物の移行を制限するために微小粒子の表面に組み入れ可能である抗体もしくはインテグリンなどの生物学的標的剤から得られる。代わりに、または加えて、薬物は、薬物の移行を制限するために、1つまたは複数のポリマー賦形剤とあわせて調製することが可能である。ポリマー賦形剤は、その場(in−situ)において粘性ゲル状材料として機能するように選択および調製されることによって、脈絡膜上腔の領域内へ広がって薬物を均一に分布させるおよび保持することが可能である。ポリマー賦形剤は、適切な粘性、流動性、および溶解特性を提供するように選択および調製することが可能である。例えば、カルボキシメチルセルロースは、脈絡膜上腔内にゲル状材料を形成するためにゼロせん断粘度において適切な粘度を有するように調製することが可能である、弱チクソトロピー性の水溶性ポリマーである。ポリマーのチクソトロピー効果は、疎水性部分を追加すること、より高分子量のポリマーを選択すること、または適切な表面活性剤とあわせて調製することなどのように、結合特性を高めるために適切な化学的変更をポリマーに加えることよって向上させることが可能である。好ましいのは、製剤を小口径の針を通じて注射可能にしつつ、製剤の局在性および薬物保持特性を最大にするために、ヒアルロン酸のようにチクソトロピー特性の強い高結合性のポリマー賦形剤を使用することである。小口径の針を通じた送達および脈絡膜上腔内における局在性をともに可能にするため、製剤の溶解特性は、ポリマー賦形剤の水溶性、分子量、および濃度を適切なチクソトロピー特性の範囲内に加減することによって調整することが可能である。材料および組み入れられた薬物の移行または溶解をさらに制限するため、ポリマー賦形剤は、送達後に粘度を増大させるまたは架橋するように調製することが可能である。例えば、高チクソトロピー性の製剤は、小口径の針を通じた注射の最中は低粘度であるが、ゼロせん断条件下において脈絡膜上腔内にひとたび入ると、その有効粘度を劇的に増大させる。チクソトロピー性の強い天然ポリマーであるヒアルロン酸は、1〜2重量パーセントの濃度で調製された場合に、ゼロせん断ではおよそ300,000〜7,000,000mPasの粘度を呈し、小口径の針を通じた注射に典型的な1000s-1のせん断速度では150〜400mPasの粘度を呈する。厳密な粘度は、分子量に依存する。例えば、ヒアルロン酸をビスエポキシドまたはジビニルスルホンの架橋剤とあわせて調製するなどの、ポリマー賦形剤の分子量または架橋度を高めるための化学的方法もまた、その場(in−situ)において製剤の局在性を増大させるために使用することが可能である。また、例えば、生理的温度、pH、または脈絡膜上腔に関係したイオンなど、脈絡膜上腔内の環境もまた、ポリマー賦形剤の粘度または架橋性を増大させるために使用することが可能である。また、脈絡膜上腔内における移行を制限するために、ゲル状材料を、表面電荷、疎水性、または特殊な組織親和性をともなうように調製することも可能である。
【0022】
本発明にしたがった、ポリマー賦形剤として使用するのに適した生理的に適合性の水溶性ポリマーは、ポリビニルアルコール、ポリビニルピロリドン、ポリエチレングリコール、ポリエチレンオキシド、ポリヒドロキシエチルメタクリレート、ポリプロピレングリコール、およびプロピレンオキシドなどの合成ポリマー、セルロース誘導体、キチン誘導体、アルギン酸塩、ゼラチン、でんぶん誘導体、ヒアルロン酸、コンドロイチン硫酸、デルマタン硫酸、およびその他のグリコサミノグリカンなどの生体ポリマー、ならびにこのようなポリマーの混合またはコポリマーを含む。ポリマー賦形剤は、ポリマーの濃度、分子量、水溶性、架橋性、酵素標識性、および組織接着特性によって制御された速度で、時間とともに溶解可能であるように選択される。とりわけ有利であるのは、小口径の針を通じた送達に典型的な高いせん断速度では投与を促進するために低粘度を呈するが、ゼロせん断ではその場(in−situ)において薬物を局在させるために高粘度を呈することを可能にする、強いチクソトロピー特性を製剤に付与するポリマー賦形剤である。
【0023】
眼の前方領域を治療するには、薬物の移行を制限するためのポリマー賦形剤を薬物と組み合わせ、それを脈絡膜上腔の所望の前方領域に注射することができる。
【0024】
眼の後方領域を治療するための一方法は、局在特性をともなう製剤を、脈絡膜上腔の後方領域に直接投与することを含む。製剤は、軟性のマイクロカニューレを脈絡膜上腔の前方領域に入れ、次いで、その遠位突先を、薬物および局在化賦形剤の送達に先立って後方領域へ進めることによって、脈絡膜上腔の後方領域に送達させることができる。軟性のマイクロカニューレは、投与薬物を局在させる特性を持つ製剤の場合も同様に、その送達に先立って、斑状病変などの所望の治療領域の中心へ進めることができる。
【0025】
とりわけ後方領域などの、眼の局所領域の治療は、本発明の薬物調剤を、共通発明者による米国特許出願60/566,776に記載されたように軟性の機器によって脈絡膜上腔の様々な領域に局所的に調剤を送達するための投与機器とあわせて使用することによって促進される。当該出願は、引用によってその全体を本明細書に組み込まれるものとする。
【0026】
後方領域へ移行させるための製剤
例えば黄斑全体、脈絡膜、または視神経を治療するなどの眼の後方領域の治療のため、薬物は、送達後の移行を可能にする形態で調合し、脈絡膜上腔の前方領域へ送達することが可能である。薬物は、迅速に溶解するポリマー賦形剤または投与後の薬物の移行を可能にするほどに小さい微小粒子もしくは微小球をともなった可溶性の形態で調製することが可能である。ポリマー賦形剤が使用される場合は、薬物を投与領域内に均一に分布させて薬物濃度の過度に高い領域を最小限に抑えるように、そして、賦形剤を次いで溶解させて脈絡膜上腔の後方領域への薬物の移行を可能にするように、低粘度の、迅速に吸収される製剤を選択することができる。とりわけ実用的なのは、このようなポリマー賦形剤を、薬物の微小粒子または微小球とあわせて使用することである。薬物は、医師によって容易にアクセス可能な眼の前方領域に注射され、注射部位から離れた後方の脈絡膜および黄斑などの後方領域の治療に使用することができるので、このような薬物の移行の使用は有利である。微小粒子または微小球としては、約1〜33ミクロンの範囲の外径をともなうものが好ましい。
【0027】
持続放出
製剤に持続放出特性を付与するには、薬物微小粒子、1つもしくは複数のポリマー賦形剤、または両者の組み合わせを採用することも可能である。微小粒子によって得られる薬物放出速度は、薬物の可溶性を調整することまたは放出制御コーティングを塗布することによって加減することが可能である。ポリマー賦形剤は、組み入れられた薬物からの持続放出を提供することも可能である。ポリマー賦形剤は、例えば、薬物の放出を減速させるために、薬物の拡散を制限するまたは薬物の親和性を提供するように選択することが可能である。ポリマー賦形剤の溶解速度もまた、それが持続放出特性に及ぼす影響の動力学を制御するために調整することが可能である。
【0028】
送達機器
薬物を低侵襲的に脈絡膜上腔へ送達するための機器は、薬物または薬物含有材料を脈絡膜上腔に直接注射するための針を含むことが可能である。機器は、また、内側の脈絡膜の層を刺すまたは外傷させることなく結膜および強膜組織の中を脈絡膜上腔までまたは脈絡膜上腔のすぐ近傍まで針を進めるための要素を含むことが可能である。送達機器の先端突先の位置は、超音波もしくは光コヒーレンス断層撮影、機器の組織接触部分に付けた外部の深さマーカもしくはストップ、機器に組み込まれた深さもしくは位置センサ、またはこのようなセンサの組み合わせなどの、低侵襲的な撮像技術によって確認することが可能である。例えば、送達機器は、脈絡膜の深さおよび位置を決定するための光導体もしくは超音波センサなどのセンサ、または脈絡膜上腔への進入による局所的流体圧力の変化を決定するための圧力トランスデューサを、その先端突先に組み込むことが可能である。
【0029】
送達機器の先端突先は、好ましくは、切断、鈍的切開、または切断と鈍的切開との組み合わせのいずれかによって強膜への貫通を促進するように成形される。機器の特徴は、超音波、高流体圧力、または組織切除エネルギなどの、組織貫通を補助するエネルギ送達要素をその遠位突先に含むことが可能である。機器の組織接触部分の外径は、組織切開または創縫合のための追加特徴を必要とすることなく低侵襲的な使用を可能にするために、好ましくは、20〜25ゲージ針(公称外径0.0358〜0.0203インチ)とおよそ同程度の大きさである。送達機器に適した材料は、ステンレス鋼、タングステン、およびニッケルチタン合金を含む金属、ならびにナイロン、ポリエチレン、ポリプロピレン、ポリイミド、およびポリエーテルエーテルケトンなどの構造ポリマー、ならびにセラミックスなどの、高弾性率の材料を含む。機器の組織接触部分は、組織貫通を補助するための潤滑コーティング、または医療撮像中における配置および誘導を補助するためのエネルギ反射性もしくはエネルギ吸収性のコーティングなどの、表面処理を含むことも可能である。
【0030】
針は、挿入の位置確認と、挿入の角度および深さの制御とを可能にするために、板または固定機構に対して浅い角度で取り付けるまたはスライド可能に設置することが可能である。図4に示されるような板は、眼球の表面(眼の表面)上に予め配置された板を通って針を進めることを可能にするための注入ポートを含むことが可能である。板は、さらに、眼表面上の標的部位に板を安定させるための真空補助シール12を含むことが可能である。吸い込み力を提供するため、板には、ライン13によって、シリンジまたは真空ポンプなどの外付けの真空源がつながれる。板は、好ましくは、眼球の曲率にぴたりと合うように湾曲された底面または底部フランジを有することが望ましい。針11は、強膜1の中を脈絡膜上腔2に進入するまで進められるが、脈絡膜3には入らない。
【0031】
注射中に針の道筋を封じるための、針の道筋に沿った軟性フランジまたは真空シールなどの要素もまた、送達を補助するために組み込むことが可能である。図4には、吸い込みライン13に取り付けられた真空界面シール12による配置による、送達機器1の、標的強膜1、脈絡膜上腔2、および脈絡膜3に対する位置が示されている。
【0032】
機器は、また、微小粒子薬物の注射、または細い針によって送達可能であるよりも大きい薬物送達インプラントの注射を可能にするために、脈絡膜上腔を機械的に開かせるための要素を含むことも可能である。一実施形態において、このような送達機器は、強膜組織を指定の深さまで貫通するために提供された第1の要素と、進むことが可能で脈絡膜を無傷で内方に膨張させることによって脈絡膜上腔に到る経路を維持することができる第2の要素と、を含むことが可能である。第2の要素は、第1の要素の中または近傍に配置することが可能である。このような要素を有する機器の実施形態が、図3aおよび図3bに示されている。
【0033】
図3aには、膨張する突先を備えた送達機器が示されている。送達機器は、切断または切除の突先4、脈絡膜膨張の突先8を機器の遠位端に含み、そして、組織を通る機器を誘導するために使用される超音波センサ6を含む。機器の近位端(切断用の突先から離れた端)には、ルアーコネクタ7が提供される。ノブ5は、膨張の突先8を作動させるための機構につながれる。機器は、脈絡膜3の近傍の脈絡膜上腔2を扱うために、強膜1に面して配置される。機器は、次いで、誘導のための深さセンサを使用して、強膜組織の中を進められる。深さセンサによって、突先4が脈絡膜上腔2に達するまたは脈絡膜上腔2の近傍にあることが示されると、膨張の突先8は、脈絡膜に対する損傷を回避するために作動される。図3bを参照すると、ノブ5は、膨張の突先をその作動ポジション9まで進めるために作動され、その結果、脈絡膜10を膨張させた。このようにして、切除の突先4によって脈絡膜が外傷されることなく脈絡膜上腔2に到る経路が得られる。
【0034】
別の実施形態において、送達機器は、高角度の短いベベルを先端突先に備えることによってそのベベルが強膜組織に入るまたは強膜組織の中を進むことを可能にする薄肉の針を含む。開口のあるベベル部分を内向きに維持することによって、薬物が脈絡膜上腔から溢れる事態が阻止される。強膜組織に入るまたは強膜組織の中を通る針の突先の正確な配置を通じて、様々なタイプのアクセスおよび送達が実現可能である。針が、強膜の中を通って脈絡膜上腔内へ進められる場合は、その針は、脈絡膜上腔内への直接注射に使用すること、またはマイクロカニューレなどのその他の機器を配置するための導入器として機能することが可能である。針が、強膜の内側の境界にごく接近して配置される場合は、その針を通じた製剤の注射は、流体が残りの任意の介在強膜組織を切開することまたはその中を流れること、および脈絡膜上腔へ送達されることを可能にする。このような方式に役立つ機器の実施形態が、図8に示されている。
【0035】
図8において、脈絡膜上腔2に物質を注射するためのシステムは、アクセスカニューレ26と、高解像度の撮像機器27とを含む。アクセスカニューレは、皮下注射器タイプの針(不図示)、またはトロカールをともなった導入器シースに適応することが可能である。さらに、アクセス手段は、図4または図5に示されるような板を含むことができる。アクセスカニューレは、組織への貫通に適するように成形された鋭いベベル遠位突先を組み入れている。撮像機器は、超音波、光コヒーレンス断層撮影(OCT)、またはマイクロコンピュータ断層撮影(MicroCT)などの、リアルタイムモダリティを含むことが可能である。強膜を通るアクセス針または導入器の前進は、撮像機器を使用して監視される。アクセスカニューレ26は、その先端突先が強膜28の内側の境界にごく接近するまで進められ、その地点において、薬物の注射がなされる。針を通じた製剤の注射は、流体が残りの任意の介在強膜組織を切開することまたはその中を流れること、および脈絡膜上腔29へ送達されることを可能にする。
【0036】
一実施形態において、送達機器は、強膜内の道筋を維持するまたは脈絡膜に接触せずに脈絡膜上腔へと貫通する組織経路を提供するために、特定の角度での組織への進入を可能にする。図5を参照すると、近位端にルアーコネクタ7を、遠位端に針のベベル突先14を備えた機器の実施形態が示されている。針は、針の突先14の貫通の深さおよび角度を設定するために、傾斜した停止板15に取り付けられる。アセンブリは、停止板が眼球の表面に行き当たるまで進められ、標的の深さに針の突先を配置する。取り付け板は、針の突先の配置を示すまたは指示するためのセンサを含むことも可能である。
【0037】
一実施形態において、脈絡膜上腔への低侵襲的アクセスを得るためのシステムは、アクセスカニューレと、組織の道筋内におけるアクセスカニューレの遠位突先の位置を決定することによって脈絡膜上腔への進入に際して直結フィードバックを提供するために使用される光学機器と、を含む。強膜(白)と脈絡膜(茶)との間の色の差を使用して位置情報を提供することも可能であるし、あるいはOCT法を使用して脈絡膜との境界までの強膜からの距離を決定することも可能である。光学機器は、マイクロカニューレに組み込まれることも可能であるし、あるいはミクロ内視鏡または光ファイバセンサとトランスデューサなど組織特性を検出することができる独立した機器であることも可能である。光信号は、内視鏡の場合のように直接可視化のためにカメラおよびモニタに送信されることも可能であるし、あるいは光ファイバの突先における組織特性の変化を信号通知することによって深さを示す光信号処理システムに送られることも可能である。アクセスマイクロカニューレは、金属またはプラスチックで作成された針または導入器タイプの機器であることが可能である。アクセスカニューレの遠位端は、眼組織を突き刺すのに適している。もし独立した機器である場合は、光学機器は、その他の機器または注入液を脈絡膜上腔にアクセス可能にして治療を施すために、挿管後、アクセスマイクロカニューレから取り除かれる。このようなシステムの実施形態が、図6に示されている。光学機器は、CCDカメラ16につながれた軟性のミクロ内視鏡18を含み、その画像は、モニタ19で見ることができる。内視鏡は、外径が好ましくは1mm未満であるアクセスカニューレ17内にスライド可能に嵌められる大きさである。アクセスカニューレ17は、組織にアクセスするための鋭いベベル遠位突先を含む。内視鏡の遠位突先は、カニューレの突先の画像を提供するために、カニューレのベベルの近位端に配置される。カニューレは、扁平部領域において眼の表面に対して低角度で進められ、強膜1を貫いた後、内視鏡画像によって脈絡膜上腔2へのアクセスが示されるまで進み続ける。
【0038】
別の実施形態において、システムの光学機器は、遠位突先に偏斜照明光源を備えている。光散乱の量および光の強度は、組織の種類、および組織を突き切る小光点の深さに応じて変化する。この変化は、医師が表面から観測することも可能であるし、あるいはセンサによって測定することも可能である。焦点は、マイクロカニューレ上の受照ビーコン突先として組み込み可能である。図7を参照すると、アクセス機器は、脈絡膜上腔2内への無傷アクセスに適した大きさの軟性のマイクロカニューレまたはマイクロカテーテル20を備えている。マイクロカテーテルは、脈絡膜上腔2に材料を送達するための管腔22と、受照遠位突先を提供するための光ファイバ23とを含む。光ファイバは、レーザーダイオード、超高輝度LED、白熱光源または類似の光源などの、照明光源24につながれる。マイクロカテーテルは、アクセスカニューレ21内にスライド可能に設置されている。アクセスカニューレが組織の中を進められるにつれて、組織に光を透過させている光25は変化する。強膜組織は、強膜組織内からの光を高度に散乱させるが、ひとたび脈絡膜上腔の内部に入ると、表面において見られる光強度および後方散乱は大幅に減少する。これは、受照突先が、強膜1を通過して、脈絡膜上腔において標的位置にあることを示している。
【0039】
送達機器にとってとりわけ実用的なのは、前述のように、送達機器に適合した製剤である。送達の最中に管腔が閉塞するのを阻止するため、微小粒子形態の薬物は、管腔の直径より大幅に小さいことが好ましい。平均外のり寸法が最大で機器の管腔のおよそ10〜20%であるような、微小粒子が好ましい。有用な製剤は、約1〜33ミクロンの範囲の外径をともなう微小球または微小粒子を含む。やはり好ましいのは、製剤内にポリマー賦形剤を使用することによって、製剤を脈絡膜上腔の近傍の強膜組織に注射すること、そして、次いで、遠位突先と脈絡膜上腔との間の組織を賦形剤含有流体によって切開し、薬物を脈絡膜上腔に入れるための流路を形成することを可能にすることである。チクソトロピー特性を備えた製剤は、細い針の管腔内を通過するにも、流体によって強膜組織を切開するにも有利である。
【0040】
以下の実施例は、例示の目的でのみ提示され、本発明をいかなるかたちで制限することもない。
【0041】
実施例1
脈絡膜上腔の中を前方領域から後方領域へ移行する粒子のサイズ範囲を評価するためのモデル薬物として、リン酸緩衝生理食塩水中に懸濁された蛍光染色されたポリスチレン微小球(カリフォルニア州、パロアルトのDuke Scientifics,Inc.のFirefli(商標))が使用された。
【0042】
除核された人の死体の眼が、眼の前方部分にある扁平部領域内において、脈絡膜まで放射状に切開された。1体積パーセントの0.15mlの微小球懸濁(平均直径6ミクロン)が、鈍的な27ゲージ針を終端とするシリンジを使用して、脈絡膜上腔の前方領域内へ送達された。針は、引き抜かれ、切り口は、シアノアクリレート接着剤によって封じられた。
【0043】
眼は、次いで、注入管を介してリザーバに取り付けられた30ゲージ針を前房に導入することによって、10mmHgの圧力のもとで、リン酸緩衝生理食塩水によって24時間にわたって還流された。リザーバは、ラボジャッキに載せられ、一定の還流圧を提供するために持ち上げられた。検査の数時間前に、眼は、脱水によって強膜組織を明確にして、脈絡膜上腔の直接可視化を可能にするために、グリセリンの入ったビーカーに入れられた。
【0044】
微小球は、微小球の蛍光発光用に選択された蛍光フィルタを備えた実体蛍光顕微鏡(Leica,Inc.のModel MZ−16)を使用して可視化された。低倍率(7〜35X)のもとでは、微小球は、滴注の部位から視神経領域へ後方に伸びて主として脈絡膜上腔の後方領域で纏まる流線状のパターンとして明確に見ることができた。
【0045】
実験は、直径が1ミクロン、6ミクロン、10ミクロン、15ミクロン、24ミクロン、および33ミクロンの微小球懸濁を使用して繰り返され、その結果、眼の後方領域へ移行および分布する同じパターンが得られた。
【0046】
実施例2
7,000,000mPasのゼロせん断粘度および1000s-1のせん断速度において400mPasの粘度のチクソトロピー特性をともなうダルトン分子量4,000,000の濃度2.3%のヒアルロン酸ナトリウムである手術用の粘弾性物質(Advanced Medical Optics,Inc.のHealon 5)を含むポリマー賦形剤の中に、直径6ミクロンおよび33ミクロンの蛍光微小球の混合が、モデル薬物として懸濁されたことを除き、実施例1の実験が、繰り返された。混合は、実施例1の方式で脈絡膜上腔に導入された。24時間の還流後、微小球は、前方の滴注部位の脈絡膜上腔内にのみ存在し、移行の徴候を示さなかった。これは、チクソトロピー性ポリマー賦形剤による局在化の効果を実証している。
【0047】
実施例3
ポリマー賦形剤の粘度が薬物の局在性に対して及ぼす効果を実証するため、抗VEG抗体であるベバシズマブ(GenentechのAvastin(商標))が、直径5ミクロンのカルボキシル化蛍光微小球に吸着され、ヒアルロン酸をベースにしたそれぞれ異なる粘度およびチクソトロピー特性の3種の手術用粘弾性物質(Advanced Medical Optics,Inc.のHealon、Healon GV、Healon 5)の1つと等体積で混合されたことを除き、実施例1の実験が、繰り返された。(Healonは、ゼロせん断速度において300,000mPasの粘度、1000s-1のせん断速度において150mPasの粘度。Healon GVは、ゼロせん断速度において3,000,000mPasの粘度、1000s-1のせん断速度において200mPasの粘度。Healon 5は、ゼロせん断速度において7,000,000mPasの粘度、1000s-1のせん断速度において400mPasの粘度。)各混合は、実施例1の方式によって、眼の前方領域内の扁平部において、脈絡膜上腔の前方領域に導入された。24時間の還流後、HealonおよびHealon GVの中の微小球は、脈絡膜上腔の後方領域に移行する過程にあることが見い出され、製剤は、滴注の扁平部位および後極の両方において見い出された。Healon 5の中の微小球は、脈絡膜上腔の扁平部領域内の最初の滴注部位に局在する粘弾性物質の中に分散された状態にとどまった。
【0048】
実施例4:
ベバシズマブ(GenentechのAvastin(商標))が、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(Sigma−AldrichのEDAC)を使用して、直径5ミクロンのカルボキシル化蛍光微小球に共有結合的に架橋され、実施例3と同様にそれぞれ粘度およびチクソトロピー特性の異なる3種の手術用粘弾性物質(Advanced Medical Optics,Inc.のHealon、Healon GV、Healon 5)の1つと等体積で混合されたことを除き、実施例1の実験が、繰り返された。混合は、実施例1の方式によって、扁平部において脈絡膜上腔に導入された。24時間の還流後、微小球は、いずれの粘弾性キャリアの場合も、もっぱら脈絡膜上腔の扁平部領域内にとどまった。
【0049】
実施例5:
架橋性ポリマー賦形剤が薬物の局在性に対して及ぼす効果を実証するため、直径10ミクロンの蛍光微小球が、4%のアルギン酸塩溶液と混合され、扁平部領域において脈絡膜上腔に導入されたことを除き、実施例1の実験が、繰り返された。アルギン酸塩賦形剤の架橋を開始させるため、切開部位を封じる前に、等容量の1MのCaCl2溶液が、微小球/アルギン酸塩の懸濁の部位に滴注された。混合は、実施例1のように還流させる前に、5分間にわたってゲル化することを許された。微小球は、架橋したポリマー賦形剤の中に分散された状態で、もっぱら滴注部位にとどまった。
【0050】
実施例6:
微小粒子形態の1.5mgのトリアムシノロンアセトニドを、300,000mPaのゼロせん断粘度および1000s-1のせん断速度において150mPasの粘度をともなう15マイクロリットルのHealon粘弾性物質(カリフォルニア州、アーヴァインのAdvanced Medical Optics)の中に懸濁させることによって、薬物含有注入液が調合された。40頭のブタ被験体に麻酔をかけ、右目を無菌状態で覆って準備した。上縁の近くで結膜周囲切開を施して、強膜の領域を露出させ、その領域への外科的アクセスを可能にした。強膜内に、小さい放射状の切開が施され、むきだしの脈絡膜が露出された。直径360ミクロンの突先および直径325ミクロンの本体を備えた軟性のマイクロカニューレ(iScience Interventional Corp.のiTrackマイクロカニューレ)が、強膜の切り口に挿入され、黄斑の後ろ側の標的領域に向けて後方へ進められた。薬物の懸濁は、脈絡膜上腔の後方領域に注射され、標的領域において脈絡膜と強膜との間に層を形成することが観測された。マイクロカニューレは引き抜かれ、強膜および結膜の切り口は、7−0 Vicryl縫合によって閉じられた。被験体は観測され、眼の組織は、12時間、24時間、48時間、4日間、7日間、14日間、30日間、および90日間で回復された。被験体に対する血管造影的、組織学的、および写真的調査は、後眼部の病変の徴候をいっさい示さなかった。回復された脈絡膜サンプルは、いずれの回復期間の場合も、組織1gあたり少なくとも1mgの範囲の高濃度の薬物を示した。
【0051】
実施例7:
20mlのHealon 5および50ml(1.5mg)のベバシズマブ(GenentechのAvastin(商標))を含む薬物含有製剤が調合された。18頭のブタ被験体を麻酔し、右目を無菌状態で覆って準備した。上縁の近くで結膜周囲切開を施して、強膜の領域を露出させ、その領域への外科的アクセスを可能にした。強膜内に、小さい放射状の切開が施され、むきだしの脈絡膜が露出された。直径360ミクロンの突先および直径325ミクロンの本体を備えた軟性のマイクロカニューレ(iScience Interventional Corp.のiTrackマイクロカニューレ)が、強膜の切り口に挿入され、黄斑の後ろ側の標的領域に向けて後方へ進められた。製剤は、脈絡膜上腔の後方領域に注射され、標的領域において脈絡膜と強膜との間に層を形成することが観測された。マイクロカニューレは引き抜かれ、強膜および結膜の切り口は、7−0 Vicryl縫合によって閉じられた。別の18頭のブタ被験体が麻酔され、それぞれ、硝子体への注射を通じて50mlのベバシズマブをボーラス投与された。各被験体グループは、ともに、注射後0.5日間、7日間、30日間、60日間、90日間、および120日間で評価され放棄された。血清サンプルが採取され、酵素をベースにした免疫測定法を使用してベバシズマブに関して検査された。硝子体内注射された被験体では、脈絡膜上送達グループと比べ、より高いプラズマレベルのベバシズマブがより長い持続時間にわたって見い出された。酵素をベースにした免疫測定法を使用して、特定の組織および領域の中のベバシズマブを定量するために、右の眼球が取り除かれ解剖された。酵素免疫測定法は、硝子体内注射を通じて送達されたベバシズマブが眼全体に分布されたこと、しかしながら、脈絡膜上に送達された場合は大部分が網膜および脈絡膜の中にとどまり、硝子体腔および前房の中でほとんど見い出されなかったことを示した。
【0052】
実施例8:
抗炎症特性および抗VEGF特性をともに備えた治療を提供するために、0.2mlのHealon 5と、0.6mlのAvastinと、24mgのトリアムシノロンアセトニドとからなる製剤が調合されたことを除き、実施例1の実験が、繰り返された。扁平部領域において、強膜を横断する長さおよそ5mmの切開が縦方向に施され、死体の眼球の脈絡膜が露出された。この眼球の脈絡膜は、およそ30分間にわたるグリセロールへの浸漬および12mmHgの圧力下における生理食塩水による還流を経て明瞭化されている。実施例6の軟性のマイクロカニューレは、製剤を与えられ、マイクロカニューレの突先は、強膜の切り口を通って脈絡膜上腔に挿入された。マイクロカニューレの突先にある光ファイバビーコンの補助によって、マイクロカニューレの遠位端は、眼球の後極に向けて進路を取り、視神経までおよそ5mmの位置において停止した。Viscoelastic Injector(iScience Interventional)を使用して、脈絡膜上腔の後方領域に、70マイクロリットルの製剤が注射された。マイクロカニューレは、扁平部の切り口を通して引き抜くことによって取り除かれた。混合は、明瞭化された強膜を通じて見ることができた。そして、視神経の近くには、やはりカテーテルの道筋をたどる混合の沈殿が形成された。切り口は、シアノアクリレート(Locktite 4011)によって封じられ、眼球は、12mmHgのもとで、生理食塩水によって3時間にわたって再び還流された。強膜は、投与された製剤を調べるために、グリセロールへの浸漬によって再び明瞭化された。製剤は、脈絡膜上腔の後方領域内において、ポリマー賦形剤の中に分散された薬物の層を形成したことを、顕微鏡によって観察された。
【0053】
実施例9:
脈絡膜上腔への低侵襲的な物質送達を評価するために、一連の実験が実施された。これらの実験のゴールは、脈絡膜上腔を直接貫通することなしに、強膜組織を通って脈絡膜上腔内へ物質を送達する手段として、低侵襲的な撮像および流体による切開を使用することであった。
【0054】
人の死体の眼がアイバンクから取得され、リン酸緩衝生理食塩水(PBS)によっておよそ20mmHgの圧力まで膨らませることによって準備された。送達針が、内径255mm×外径355mmのステンレス製の皮下注射針チューブを使用して作成された。針の遠位突先は、長さが400μmで角度が50°の、二面の短いベベル点になるように磨かれた。組み立てを完成するため、作成された針は、次いで、銀ろう付によって、標準的な25ゲージ×1インチの皮下注射針とされた。
【0055】
針は、眼の表面に対して鋭角(<10°)で、強膜組織の中をゆっくり進められた。針の進入は、縁からおよそ4mmの扁平部領域において開始され、針は、強膜を貫通して脈絡膜上腔内に達することなく長さ5〜6mmの道筋を形成するように、強膜組織の中を後方へ進められた。強膜組織内における針の突先の配置を誘導および確認するため、そして注射の記録をとるために、高解像度の超音波システム(iScience Surgical Corp.のiUltrasound)が使用された。
【0056】
第1の実験セットでは、ヒアルロン酸の手術用粘弾性物質(Advanced Medical Optics,Inc.のHealon 5)を単独で含むポリマー賦形剤が注射された。第2の実験セットでは、粘弾性物質は、モデル微小粒子薬物を表すために、直径10ミクロンのポリスチレン微小球の1%の水溶液(Duke Scientific,Inc.)と、1:1の比率で混合された。送達体積および注射圧力を制御するため、粘弾性物質および混合は、ネジ駆動式のシリンジ(iScience Surgical Corp.のViscoInjector)を使用して、針を通じて送達された。注射は、針のベベルを眼球の中心に向けて内向きにすることによってなされた。3つの死体の眼における複数の位置が、実験のために使用された。
【0057】
第1の実験では、針の道筋は、およそ3〜4mmの長さであり、注入液は、逆流して道筋から流れ出ることを観測された。針の突先を、より長い道筋に通したところ、より高い注射圧力が得られ、注入液は、強膜の残りの介在層を切開して脈絡膜上腔へ送達されることが可能になった。試行の結果、針の突先を強膜の外側層の中(<強膜厚さの1/2)に配置すると、粘弾性物質は、強膜内ポケット内に送達されるあるいは場合によっては強膜内ポケットを通り抜けて眼球の外表面に達することがわかった。針の突先を強膜の根元により近づけた場合は、注射は、残りの介在強膜組織を切開して脈絡膜上腔に進入し、脈絡膜上腔の注射領域を満たすべく広がった。図1は、はっきり見ることができる(針を取り除いた後の)針の道筋30と、注入液で満たされた脈絡膜上腔の領域31とを示している。強膜1および脈絡膜3も示されている。図2は、微小球とヒアルロン酸賦形剤とを含有する注入液で満たされた脈絡膜上腔の領域33と、強膜内の針4の突先と、針の影32とを示している。
【0058】
実施例10:
人の死体の眼の中の脈絡膜上腔への低侵襲的アクセスを可能にするため、ミクロ内視鏡撮像を使用した実験が実施された。マイクロメータ調整式のステージ上に、外径350ミクロンの、1200ピクセルの撮像束を含むカスタムメイドの軟性のミクロ内視鏡(ニューヨーク州、ブルースターのEndoscopy Support Services)が搭載された。ステージは、内視鏡を制御式に上下に可動にする垂直スタンド上に搭載された。ミクロ内視鏡は、1/2インチチップのCCDカメラに取り付けられ、次いで、ビデオモニタに取り付けられた。アクセスのために組織を突き刺すための手段として、20ゲージ皮下注射針が内視鏡にあてがわれた。
【0059】
カメラはオンにされ、光導体を備えた外付け光源(マサチューセッツ州ボックスボーロ、Dolan JennerのModel MI−150)が、経強膜撮像照明を提供するために使用された。針は、その遠位突先が、人の死体の全眼球の強膜表面に、縁からおよそ4mm後方で接触するまで進められた。ミクロ内視鏡は、次いで、針の端を通して白い強膜表面が見えるようになるまで降下された。針は、次いで、僅かな前後の回転によって、強膜組織内へゆっくり進められた。針がこのように進められるにつれて、内視鏡は、針によって形成される道筋をたどるために下降された。強膜では、または強膜内では、内視鏡画像は、白または白っぽい灰色に見えた。針が強膜組織に突き刺されるにつれ、画像の色は、濃い脈絡膜組織の存在を示す濃い茶に変化し、脈絡膜上腔への外科的アクセスを示した。
【0060】
実施例11:
人の死体の眼の中の脈絡膜上腔への低侵襲的アクセスを可能にするため、光ファイバ受照誘導を使用した実験が実施された。受照遠位突先を備えた軟性のマイクロカニューレ(カリフォルニア州、メンロパークのiScience InterventionalのiTrack−250A)が、25ゲージ皮下注射針の中に配された。マイクロカニューレは、遠位突先の照明を可能にしたプラスチック光ファイバを備えている。マイクロカテーテルファイバコネクタは、635nm(赤)レーザーダイオード光ファイバ照明器(iScience InterventionalのiLumin)に取り付けられ、該照明器は、マイクロカニューレの突先のための安定した赤色光の放射を提供するためにオンにされた。マイクロカニューレは、25ゲージ針の中を、針の遠位ベベルには達するが同ベベルを超えることはないように通された。
【0061】
マイクロカニューレを僅かに進めることを可能にするため、針は、その突先が強膜組織内に十分に埋め込まれるまで、人の死体の全眼球の扁平部領域の中をゆっくり進められた。強膜組織は、光をかなりの度合いで拡散させるので、マイクロカニューレの突先からの照明は、明瞭に見ることができた。針がゆっくり進むにつれて、マイクロカニューレもまた、同時に前方へ押された。皮下注射針の突先が、強膜組織に十分に突き刺されて脈絡膜上腔に達したとき、マイクロカニューレの突先の赤色光は、直ちに暗くなった。なぜならば、受照突先は、拡散性の強膜組織を通過してその下の脈絡膜上腔内に達したからである。マイクロカニューレは、針を固定したまま進められ、そうして、マイクロカニューレの突先は、脈絡膜上腔内に配された。マイクロカニューレの突先が強膜組織の内部にあると、広い光拡散をともなわない赤い焦点が見えるので、脈絡膜上腔の中を後方へ進むマイクロカニューレのさらなる前進は、経強膜的に見ることができるであろう。高周波数の超音波システム(iScience InterventionalのiUltraSound)を使用して、脈絡膜上腔内におけるマイクロカニューレの位置が確認された。
【図面の簡単な説明】
【0062】
【図1】実施例9にしたがった、ヒアルロン酸の手術用粘弾性材料を針によって強膜に注射した後における、眼の一部の超音波画像である。
【図2】実施例9にしたがった、粘弾性材料と1%のポリスチレン微小球溶液との1:1体積比の混合を針によって強膜に注射する最中における、眼の一部の超音波画像である。
【図3a】膨張する切断または切除の突先を有する、本発明にしたがった送達機器の実施形態の図である。
【図3b】膨張する切断または切除の突先を有する、本発明にしたがった送達機器の実施形態の図である。
【図4】本発明にしたがった送達機器の、標的である強膜、脈絡膜上腔、および脈絡膜に対する位置を示した図である。
【図5】眼への針の貫通の深さおよび角度を設定するための停止板を有する、本発明にしたがった送達機器の実施形態の図である。
【図6】手術中にカニューレの突先の位置を監視するためのミクロ内視鏡およびカメラに適応した、本発明にしたがった送達機器の実施形態の図である。
【図7】カテーテルを通じて眼の中へ薬物を送達するための管腔と、カニューレの突先を照射するための照明源につながれた光ファイバ線と、を有する送達機器の実施形態の図である。
【図8】本発明にしたがった機器を、カニューレの突先の位置を監視するための高解像度の撮像機器とあわせて使用する実施形態の図である。
【特許請求の範囲】
【請求項1】
製剤であって、
眼の脈絡膜上腔への注射のために、少なくとも300,000mPasのゼロせん断粘度によって特徴付けられ、
生物活性物質と、
注射後に広がって薬物を脈絡膜上腔の領域内に均一に分布させるおよび局在させるためのゲル状材料として機能するチクソトロピー性ポリマー賦形剤と、
を備える製剤。
【請求項2】
請求項1に記載の製剤であって、さらに、
1000s-1のせん断速度において約400mPas以下の粘度によって特徴付けられる製剤。
【請求項3】
請求項1に記載の製剤であって、
前記ゲル状材料は、脈絡膜上腔への注射後に架橋する、製剤。
【請求項4】
請求項1に記載の製剤であって、
前記生物活性物質は、微小粒子または微小球を含む、製剤。
【請求項5】
請求項1ないし4のいずれかに記載の製剤であって、
前記ポリマー賦形剤は、ヒアルロン酸、コンドロイチン硫酸、ゼラチン、ポリヒドロキシエチルメタクリレート、デルマタン硫酸、ポリエチレンオキシド、ポリエチレングリコール、ポリプロピレンオキシド、ポリプロピレングリコール、アルギン酸塩、でんぷん誘導体、水溶性のキチン誘導体、水溶性のセルロース誘導体、またはポリビニルピロリドンを含む、製剤。
【請求項6】
眼の脈絡膜上腔へ送達するための製剤であって、
生物活性物質と、
約1〜33ミクロンの範囲の外径をともなう微小球または微小粒子と、
を備える製剤。
【請求項7】
請求項6に記載の製剤であって、さらに、
前記微小球または微小粒子を脈絡膜上腔内に均一に分散させるためのポリマー賦形剤を備える製剤。
【請求項8】
請求項4または6に記載の製剤であって、
微小粒子または微小球は、放出制御コーティングを追加で含む、製剤。
【請求項9】
請求項4または6に記載の製剤であって、
微小粒子または微小球は、組織親和性表面を追加で含む、製剤。
【請求項10】
請求項1ないし4または6のいずれかに記載の製剤であって、
生物活性物質は、抗生物質、ステロイド、非ステロイド性抗炎症剤、神経保護剤、抗VEGF剤、または新血管形成抑制剤を含む、製剤。
【請求項11】
請求項10に記載の製剤であって、
生物活性物質は、ステロイド、および抗VEGF剤または新血管形成抑制剤をともに含む、製剤。
【請求項12】
製剤を眼の脈絡膜上腔内へ低侵襲的に送達するための機器であって、
下にある脈絡膜組織を損傷させることなく強膜組織を通ることを可能にするように成形された先端突先を有する針と、
前記製剤を脈絡膜上腔の近傍または中へ送達するために前記突先の配置を誘導するためのセンサと、
を備える機器。
【請求項13】
請求項12に記載の機器であって、
前記センサは、強膜組織の画像を提供する、機器。
【請求項14】
請求項12に記載の機器であって、
前記センサは、超音波、光、または差圧に反応する、機器。
【請求項15】
製剤を眼の脈絡膜上腔内へ低侵襲的に送達するための機器であって、
強膜組織を通ることを可能にするように成形された先端突先を有する針と、
脈絡膜に接触した際にそれを外傷させないために内方膨張作用を脈絡膜に付与する内側突先と、
を備える機器。
【請求項16】
請求項12ないし15のいずれかに記載の機器であって、さらに、
ポリマー賦形剤および生物活性物質を含む製剤を含有する、機器。
【請求項17】
請求項12ないし15のいずれかに記載の機器であって、さらに、
針と介在組織との間の境界を封じるためのフランジを備える機器。
【請求項18】
請求項12ないし15のいずれかに記載の機器であって、さらに、
眼の外表面と境界を接し、眼の表面に対する前記先端突先の貫通の深さおよび角度を設定するために前記機器の上に配置された、傾斜した停止板を備える機器。
【請求項19】
薬物を眼に投与するための方法であって、
生物活性物質とポリマー賦形剤とを含む製剤を、前記賦形剤が送達後にゲル化して前記生物活性物質を局在させるように、脈絡膜上腔の中に配置することを備える方法。
【請求項20】
請求項19に記載の方法であって、
前記製剤は、脈絡膜上腔の後方領域の中に配置される、方法。
【請求項21】
請求項19に記載の方法であって、
前記製剤は、脈絡膜上腔の前方領域の中に配置される、方法。
【請求項22】
薬物を眼の後方領域に投与するための方法であって、
約1〜33ミクロンの範囲の外径をともなう微小球または微小粒子を有する生物活性物質を含む製剤を、前記微小球または微小粒子が次いで前記後方領域へ移行するように、脈絡膜上腔の前方領域の中に配置することを備える方法。
【請求項23】
請求項22に記載の方法であって、
前記製剤は、微小粒子または微小球を脈絡膜上腔の中に均一に分散させるためのポリマー賦形剤を含む、方法。
【請求項24】
薬物を眼の脈絡膜上腔の中に投与する方法であって、
針を、脈絡膜上腔に向けて強膜の厚さの少なくとも半分の深さに配置するステップと、
製剤を、前記製剤が前記脈絡膜上腔の近傍の強膜組織を切開して前記脈絡膜上腔に進入するように、前記針を通して強膜に注射するステップと、
を備える方法。
【請求項25】
請求項19ないし24のいずれかに記載の方法であって、
前記製剤は、チクソトロピー性ポリマーを含む、方法。
【請求項1】
製剤であって、
眼の脈絡膜上腔への注射のために、少なくとも300,000mPasのゼロせん断粘度によって特徴付けられ、
生物活性物質と、
注射後に広がって薬物を脈絡膜上腔の領域内に均一に分布させるおよび局在させるためのゲル状材料として機能するチクソトロピー性ポリマー賦形剤と、
を備える製剤。
【請求項2】
請求項1に記載の製剤であって、さらに、
1000s-1のせん断速度において約400mPas以下の粘度によって特徴付けられる製剤。
【請求項3】
請求項1に記載の製剤であって、
前記ゲル状材料は、脈絡膜上腔への注射後に架橋する、製剤。
【請求項4】
請求項1に記載の製剤であって、
前記生物活性物質は、微小粒子または微小球を含む、製剤。
【請求項5】
請求項1ないし4のいずれかに記載の製剤であって、
前記ポリマー賦形剤は、ヒアルロン酸、コンドロイチン硫酸、ゼラチン、ポリヒドロキシエチルメタクリレート、デルマタン硫酸、ポリエチレンオキシド、ポリエチレングリコール、ポリプロピレンオキシド、ポリプロピレングリコール、アルギン酸塩、でんぷん誘導体、水溶性のキチン誘導体、水溶性のセルロース誘導体、またはポリビニルピロリドンを含む、製剤。
【請求項6】
眼の脈絡膜上腔へ送達するための製剤であって、
生物活性物質と、
約1〜33ミクロンの範囲の外径をともなう微小球または微小粒子と、
を備える製剤。
【請求項7】
請求項6に記載の製剤であって、さらに、
前記微小球または微小粒子を脈絡膜上腔内に均一に分散させるためのポリマー賦形剤を備える製剤。
【請求項8】
請求項4または6に記載の製剤であって、
微小粒子または微小球は、放出制御コーティングを追加で含む、製剤。
【請求項9】
請求項4または6に記載の製剤であって、
微小粒子または微小球は、組織親和性表面を追加で含む、製剤。
【請求項10】
請求項1ないし4または6のいずれかに記載の製剤であって、
生物活性物質は、抗生物質、ステロイド、非ステロイド性抗炎症剤、神経保護剤、抗VEGF剤、または新血管形成抑制剤を含む、製剤。
【請求項11】
請求項10に記載の製剤であって、
生物活性物質は、ステロイド、および抗VEGF剤または新血管形成抑制剤をともに含む、製剤。
【請求項12】
製剤を眼の脈絡膜上腔内へ低侵襲的に送達するための機器であって、
下にある脈絡膜組織を損傷させることなく強膜組織を通ることを可能にするように成形された先端突先を有する針と、
前記製剤を脈絡膜上腔の近傍または中へ送達するために前記突先の配置を誘導するためのセンサと、
を備える機器。
【請求項13】
請求項12に記載の機器であって、
前記センサは、強膜組織の画像を提供する、機器。
【請求項14】
請求項12に記載の機器であって、
前記センサは、超音波、光、または差圧に反応する、機器。
【請求項15】
製剤を眼の脈絡膜上腔内へ低侵襲的に送達するための機器であって、
強膜組織を通ることを可能にするように成形された先端突先を有する針と、
脈絡膜に接触した際にそれを外傷させないために内方膨張作用を脈絡膜に付与する内側突先と、
を備える機器。
【請求項16】
請求項12ないし15のいずれかに記載の機器であって、さらに、
ポリマー賦形剤および生物活性物質を含む製剤を含有する、機器。
【請求項17】
請求項12ないし15のいずれかに記載の機器であって、さらに、
針と介在組織との間の境界を封じるためのフランジを備える機器。
【請求項18】
請求項12ないし15のいずれかに記載の機器であって、さらに、
眼の外表面と境界を接し、眼の表面に対する前記先端突先の貫通の深さおよび角度を設定するために前記機器の上に配置された、傾斜した停止板を備える機器。
【請求項19】
薬物を眼に投与するための方法であって、
生物活性物質とポリマー賦形剤とを含む製剤を、前記賦形剤が送達後にゲル化して前記生物活性物質を局在させるように、脈絡膜上腔の中に配置することを備える方法。
【請求項20】
請求項19に記載の方法であって、
前記製剤は、脈絡膜上腔の後方領域の中に配置される、方法。
【請求項21】
請求項19に記載の方法であって、
前記製剤は、脈絡膜上腔の前方領域の中に配置される、方法。
【請求項22】
薬物を眼の後方領域に投与するための方法であって、
約1〜33ミクロンの範囲の外径をともなう微小球または微小粒子を有する生物活性物質を含む製剤を、前記微小球または微小粒子が次いで前記後方領域へ移行するように、脈絡膜上腔の前方領域の中に配置することを備える方法。
【請求項23】
請求項22に記載の方法であって、
前記製剤は、微小粒子または微小球を脈絡膜上腔の中に均一に分散させるためのポリマー賦形剤を含む、方法。
【請求項24】
薬物を眼の脈絡膜上腔の中に投与する方法であって、
針を、脈絡膜上腔に向けて強膜の厚さの少なくとも半分の深さに配置するステップと、
製剤を、前記製剤が前記脈絡膜上腔の近傍の強膜組織を切開して前記脈絡膜上腔に進入するように、前記針を通して強膜に注射するステップと、
を備える方法。
【請求項25】
請求項19ないし24のいずれかに記載の方法であって、
前記製剤は、チクソトロピー性ポリマーを含む、方法。
【図1】


【図2】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2009−531298(P2009−531298A)
【公表日】平成21年9月3日(2009.9.3)
【国際特許分類】
【出願番号】特願2008−556462(P2008−556462)
【出願日】平成19年2月22日(2007.2.22)
【国際出願番号】PCT/US2007/004874
【国際公開番号】WO2007/100745
【国際公開日】平成19年9月7日(2007.9.7)
【出願人】(505097125)アイサイエンス・インターベンショナル・コーポレーション (13)
【氏名又は名称原語表記】ISCIENCE INTERVENTIONAL CORPORATION
【Fターム(参考)】
【公表日】平成21年9月3日(2009.9.3)
【国際特許分類】
【出願日】平成19年2月22日(2007.2.22)
【国際出願番号】PCT/US2007/004874
【国際公開番号】WO2007/100745
【国際公開日】平成19年9月7日(2007.9.7)
【出願人】(505097125)アイサイエンス・インターベンショナル・コーポレーション (13)
【氏名又は名称原語表記】ISCIENCE INTERVENTIONAL CORPORATION
【Fターム(参考)】
[ Back to top ]

