脊椎固定術における脂肪組織由来のストローマ細胞の使用
【課題】骨の病態の治療のための方法および組成物の提供。
【解決手段】哺乳動物における脊椎固定手術後の骨の癒合の促進方法であって、脂肪組織由来の単離された成人ストローマ(ADAS)細胞を前記哺乳動物の脊椎へ投与することを含み、ここで、前記ADAS細胞が骨細胞の特徴の少なくとも1つを発現する細胞にin vivoで分化する、方法。脂肪組織由来の単離されたストローマ細胞およびこれに関連する産物は多数の用途を持ち、研究、診断、および脊椎固定手術などにおける治療上の適用が含まれる。
【解決手段】哺乳動物における脊椎固定手術後の骨の癒合の促進方法であって、脂肪組織由来の単離された成人ストローマ(ADAS)細胞を前記哺乳動物の脊椎へ投与することを含み、ここで、前記ADAS細胞が骨細胞の特徴の少なくとも1つを発現する細胞にin vivoで分化する、方法。脂肪組織由来の単離されたストローマ細胞およびこれに関連する産物は多数の用途を持ち、研究、診断、および脊椎固定手術などにおける治療上の適用が含まれる。
【発明の詳細な説明】
【背景技術】
【0001】
骨の病態には一般的に以下の2つのタイプがある: 1) 非代謝性の骨の病態、例えば骨折、骨/脊椎変形、骨肉腫、骨髄腫、骨異形成および脊柱側弯など、ならびに2) 代謝性の骨の病態、例えば骨粗しょう症、骨軟化症、くる病、線維性骨炎、腎性骨ジストロフィーおよび骨のパジェット病など。代謝性骨の病態の1つである骨粗しょう症は、骨量の減少および骨組織微細構造の変化による骨の脆弱性および易破壊性の増加に特徴がある全身性疾患であり、その主要な臨床症候として以下が含まれる:脊柱後弯症、ならびに背腰骨、椎骨中心、大腿骨頚部、とう骨底端部、肋骨、上腕骨上端部およびその他の骨折。骨組織中で、骨形成と骨吸収による破壊は定常的に発生している。この骨形成と骨吸収による骨破壊との間のバランスが悪化すると、骨の量的減少が発生する。骨粗しょう症の治療のためには、従来、エストロゲン、カルシトニンおよびビスホスホナートなどの骨吸収抑制剤が主として使用されてきた。
【0002】
骨/脊椎疾患に関して、アメリカ人口の75%以上が、その人生のどこかの時点で、背中の痛みに悩まされる。根底にある医学的疾病が背中の痛みをもたらすこともある。これらとして以下が含まれる: 脊柱側弯、脊椎狭窄、椎間板変性症、感染過程、腫瘍、および外傷。骨幹骨の大きな部分での損傷の修復は今日整形外科医が直面する重大な問題である。こうした骨の欠損は急性負傷によって発生することもあるが、それらの大規模な損傷は先天性奇形、良性および悪性腫瘍、骨感染、ならびに非癒合性骨折から共通して二次的にもたらされるものである。新鮮な自己骨移植片材料の使用が、歴史的に治療の標準として考えられてきたが、これは感染、奇形および機能の欠失などの実質的な罹病を伴う(Kahnら、1995、Clin. Orthop. ReI. Res. 313:69-75)。移植片の採取がもたらす難題から、その供給の限界も相まって、臨床的に重大な骨損傷の修復のための別の戦略の開発に向けられることとなった。この問題の主要な解決手法として、有効な骨移植物材料の開発に焦点が向けられた。
【0003】
これらの研究成果から、骨移植物の一般的な3つのクラスが現れたが、これらのクラスは骨伝導性、骨誘導性、または直接骨形成性として分類することができる。同種移植骨はおそらく最もよく知られているタイプの骨伝導性移植物である。多年にわたって広く使用されてはいるが、病気の伝染のリスク、宿主拒絶、および骨誘導性の欠如がその有望性を損なわせている(Leads, 1988, JAMA 260:2487-2488)。合成骨伝導性移植物には、チタン繊維金属ならびにヒドロキシアパタイトおよび/またはリン酸三カルシウムで構成されるセラミックスが含まれる。これらの移植物の適度な多孔質性が骨成長を促進するが、それらの骨誘導性能力の欠如から、その利用性には限界がある。多様な骨誘導性化合物も研究されてきた。これらとして脱灰骨マトリックスが含まれ、これは、骨形態形成タンパク質(BMP)を含有することが知られている。BMPの最初の発見以来、他者が特性決定し、クローン化し、発現させ、大きな骨損傷の修復のために、精製または組換えBMPを同所移植した(Gerhartら、1993、Clin. Orthop. ReI. Res. 293:317-326; Stevensonら、1994、J. Bone Joint Surg. 76:1676-1687; Wozneyら、1988 Science 242:1528-1534)。この手法の成功は、BMPによって提供される誘導性シグナルに応答する能力がある間葉細胞の存在によるものであった(Laneら、1994, In First International Conference on Bone Morphogenic Proteins)。骨形成分化を経験し、最終的に手術部位での新たな骨合成を担うのは、これらの間葉細胞前駆細胞である。
【0004】
骨誘導性手法の別法の1つが、直接的に骨形成性の生細胞の移植である。骨髄は骨形成能を持つ細胞集団を含有することが示されているので、骨格の修復が必要な部位への新鮮な自己または同系骨髄の移植に基づく実験的治療法を考案する者が出た(Grundelら、1991, Clin. Orthop. ReI. Res. 266:244-258; Werntzら、1996, J. Orthop. Res. 14:85-93; Wolffら、1994, J. Orthop. Res. 12:439-446)。原理としては正しいが、必要な数の骨前駆細胞を含む十分な骨髄の取得の実現性には限界がある。
【0005】
再生医療の最新分野では、損傷した組織および器官を修復するための新規治療法として、生体材料、成長因子、および細胞の併用を模索している。この専門分野が成長するとともに、組織再生での適用に供するための、信頼性があり、安全で有効なヒト成人幹細胞の起源材料への需要がある。規制上の目的から、これらの細胞は定量的な尺度での純度が確定されなければならない。臨床レベルでの実用上の目的のためには、これらの細胞は治療時点での要請に応じて即時に入手できる「既製」品として市販されていなければならない。商業上の観点からは、自己由来ではなく、同種異系の成人幹細胞の移植のための利用可能性は、製品の開発上顕著に有利な影響を与えるはずである。こうした状況下では、1体のドナーに由来する細胞の単一のロットを複数の哺乳動物に移植することができれば、品質管理および品質保証の両方のコストを低下させることとなる。
【0006】
研究から、複数の組織部位での成人幹細胞の存在が証明されている。間葉幹細胞(MSC)または骨髄ストローマ細胞(BMSC)として知られている、骨髄に由来する細胞は十分に特性決定されている(Castro-Malaspinaら、1980, Blood 56:289-30125; Piersmaら、1985, Exp. Hematol 13:237-243; Simmonsら、1991, Blood 78:55-62; Beresfordら、1992, J. Cell. Sci. 102:341-3 51; Liesveldら、1989, Blood 73:1794-1800; Liesveldら、Exp. Hematol 19:63-70; Bennettら、1991, J. Cell. Sci. 99:131-139)。最近の研究で、同種異系骨髄由来のMSCを移植し(Bartholomewら、2002, Exp. Hematol. 30:42-8)、これを使用してイヌモデルでの危機的な大きさの整形外科的損傷を修復する(Arinzehら、2003, J. Bone Joint Surg. Am. 85- A: 1927-35)ことができることが証明された。しかし、MSCは有核骨髄細胞10,000〜100,000個のうち約1個、または骨髄吸引物1 ml当たり約200細胞に相当する(Bruderら、2000, Principles of Tissue Engineering, 2nd Edition, Academic Press)。組織再生での適用に十分な数のMSCを取得するためには、骨髄由来のMSCのin vitroでの複数回の継代培養による増数が必要である。
【0007】
骨髄とは異なって、脂肪組織は外科的採取が容易であり、アメリカの平均的成人には豊富にある。最近、脂肪組織が幹細胞の起源として役立つことが証明された(脂肪由来の成人幹細胞、すなわちADAS細胞として知られている)。これらの細胞は複数の系統経路にしたがって分化する能力がある。ヒトおよびげっ歯類ADAS細胞は、特定の化学物質、ホルモン、および/またはサイトカインに応答して、脂肪細胞、骨細胞、軟骨細胞、筋肉細胞、および神経細胞に合致する生化学的および組織学的特性を発現する。最近の研究では、マウスADAS細胞は危機的な大きさの頭蓋冠損傷の修復を促進した(Cowanら、2004, Nat. Biotechnol. 22:560-7)。
【0008】
骨移植術は骨の病態の治療のために使用されることが多い。実際、世界で毎年1400万以上の骨移植手術が実施される。骨移植の成功または失敗は、移植片の部位の生存性、移植片の加工、および移植を受ける組織の免疫学的適合性などの、多数の要因によって決まる。骨の病態の患者数から見ても、治療、診断、および研究に使用する新たな骨材料への需要がある。本発明はこの需要を満足させるものである。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Kahnら、1995、Clin. Orthop. ReI. Res. 313:69-75
【非特許文献2】Leads, 1988, JAMA 260:2487-2488
【非特許文献3】Gerhartら、1993、Clin. Orthop. ReI. Res. 293:317-326
【非特許文献4】Stevensonら、1994、J. Bone Joint Surg. 76:1676-1687
【非特許文献5】Wozneyら、1988 Science 242:1528-1534
【非特許文献6】Laneら、1994, In First International Conference on Bone Morphogenic Proteins
【非特許文献7】Grundelら、1991, Clin. Orthop. ReI. Res. 266:244-258
【非特許文献8】Werntzら、1996, J. Orthop. Res. 14:85-93
【非特許文献9】Wolffら、1994, J. Orthop. Res. 12:439-446
【非特許文献10】Castro-Malaspinaら、1980, Blood 56:289-30125
【非特許文献11】Piersmaら、1985, Exp. Hematol 13:237-243
【非特許文献12】Simmonsら、1991, Blood 78:55-62
【非特許文献13】Beresfordら、1992, J. Cell. Sci. 102:341-3 51
【非特許文献14】Liesveldら、1989, Blood 73:1794-1800
【非特許文献15】Liesveldら、Exp. Hematol 19:63-70
【非特許文献16】Bennettら、1991, J. Cell. Sci. 99:131-139
【非特許文献17】Bartholomewら、2002, Exp. Hematol. 30:42-8
【非特許文献18】Arinzehら、2003, J. Bone Joint Surg. Am. 85- A: 1927-35
【非特許文献19】Bruderら、2000, Principles of Tissue Engineering, 2nd Edition, Academic Press
【非特許文献20】Cowanら、2004, Nat. Biotechnol. 22:560-7
【発明の概要】
【課題を解決するための手段】
【0010】
発明の簡単な要約
本発明として、哺乳動物における脊椎固定手術後の骨の癒合の促進方法であって、脂肪組織由来の単離された成人ストローマ(ADAS)細胞を前記哺乳動物の脊椎へ投与することを含み、ここで、前記ADAS細胞が骨細胞の特徴の少なくとも1つを発現する細胞にin vivoで分化する、前記方法が含まれる。
【0011】
本発明としてまた、哺乳動物における1以上の脊椎固定の実施方法であって、脂肪組織由来の単離された成人ストローマ(ADAS)細胞を前記哺乳動物の脊椎へ投与することによって単層または多層脊椎固定を促進することを含む方法が含まれる。好ましくは、哺乳動物の脊椎へのADASの投与後、このADAS細胞は骨細胞の特徴の少なくとも1つを発現する細胞にin vivoで分化する。
【0012】
1態様においては、ADAS細胞の哺乳動物への投与の前に、この細胞を分化するように誘導することなく一定時間in vitro培養する。
【0013】
別の態様において、ADAS細胞はその哺乳動物に対して同種異系である。
【0014】
さらに別の態様において、ADAS細胞は脊椎椎体間固定のための骨形成を誘導する。
【0015】
別の態様において、ADAS細胞は脊椎横突起間(intertransverse process)固定のための骨形成を誘導する。
【0016】
1態様において、ADAS細胞はさらに生体適合性マトリックスを含む。好ましくは、生体適合性マトリックスは、アルギン酸カルシウム、アガロース、フィブリン、コラーゲン、ラミニン、フィブロネクチン、グリコサミノグリカン、ヒアルロン酸、ヘパリン硫酸、コンドロイチン硫酸A、デルマタン硫酸、および骨マトリックスゼラチンからなる群から選択される。
【0017】
別の態様において、ADAS細胞は遺伝的に改変されたものである。
【0018】
さらに別の態様中、ADAS細胞は哺乳動物の脊椎の1以上の椎体間間隙中に投与される。
【0019】
別の態様中、脊椎固定は、頸部関節、胸部関節、腰部関節、腰仙関節および仙腸(SI)関節からなる群から選択される脊椎のセグメント内のものである。
【0020】
さらに別の態様において、ADAS細胞は、後方進入法、後側方進入法、前方進入法、前側方進入法、および側方進入法からなる群から選択された進入法によって1以上の椎体間間隙に投与される。
【0021】
さらに別の態様において、哺乳動物はヒトである。
図面の簡単な説明
本発明を説明する目的で、本発明のいくつかの実施形態を図面に示す。しかし、本発明はこれらの図面に描写した実施形態の厳密な配置および手段に限定されるものではない。
【図面の簡単な説明】
【0022】
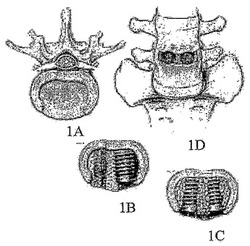
【図1】図1は脊椎固定手術を表す画像である。図1Aは腰椎の椎間間隙を示している。図1Bおよび1Cは間隙を安定させるためのそれぞれ機械デバイスと骨移植片の導入を示している。図1Dは脊椎を表す画像である。
【図2】図2は複数の系統経路にしたがって分化するADAS細胞の能力を表す画像である。化学物質と成長因子の特定カクテルに応答して、ヒトADAS細胞はin vitroで軟骨細胞、骨芽細胞、脂肪細胞、ならびに神経様およびグリア様細胞に分化することができる。
【図3】図3はヒトADAS細胞の骨形成を表す画像である。
【図4】図4は脂肪細胞形成および骨形成分化の際のADAS細胞でのアルデヒドホスファターゼ発現を示すグラフである。
【図5】図5はADAS細胞がin vivoで骨を形成することを証明する画像である。
【発明を実施するための形態】
【0023】
詳細な説明
本発明は骨の病態の治療のための方法および組成物を包含する。好ましい1実施形態において、本発明の脂肪組織由来の単離された成人ストローマ(ADAS)細胞を使用して、哺乳動物における脊椎固定手術後の骨の癒合を促進する。
【0024】
定義
本明細書で使用する場合、以下の用語のそれぞれは、この節でそれと関連付けた意味を持つ。
【0025】
冠詞「1つの("a"および"an")」は本明細書中、その冠詞の文法上の対象の1または1以上(すなわち少なくとも1つ)を示すために使用される。例えば、「1つの要素」とは、1つの要素または1より多い要素を意味する。
【0026】
用語「約」は、当業者にはそれを使用する文脈によって理解されるはずであり、またある程度差異があるものとなる。
【0027】
用語「脂肪組織由来の細胞」とは、脂肪組織に起源を持つ細胞のことである。脂肪組織から単離した当初の細胞集団は、限定するわけではないがストローマ血管画分(SVF)細胞を含む、異種細胞集団である。
【0028】
本明細書で使用する用語「脂肪由来のストローマ細胞」、「脂肪組織由来のストローマ細胞」、「脂肪組織由来の成人ストローマ(ADAS)細胞」、「脂肪由来の幹細胞(ASC)」は互換的に使用され、それらは、限定するわけではないが脂肪細胞、骨細胞、軟骨細胞、筋肉および神経/グリア細胞系統などの多様な各種細胞型になる幹細胞様前駆細胞として機能する、脂肪組織を起源とするストローマ細胞をいう。
【0029】
「脂肪」とはあらゆる脂肪組織のことである。脂肪組織は褐色または白色脂肪組織である。好ましくは、脂肪組織は皮下白色脂肪組織である。こうした細胞として一次細胞培養物または不死化した細胞系が含まれる。脂肪組織は脂肪組織を持つどんな生物体からのものでもよい。好ましくはこの脂肪組織は哺乳動物のものであり、最も好ましくはこの脂肪組織はヒトのものである。好都合なヒト脂肪組織の起源は脂肪吸引手術に由来するものである。しかし、脂肪組織の起源または脂肪組織の単離方法は本発明にとって重大ではない。
【0030】
「同種異系」とは、同一の種の異なる動物個体に由来する移植片である。
【0031】
本明細書で使用する用語「自己由来」とは、後に再導入される個体と同一の個体に由来するあらゆる物質を意味する。
【0032】
「異種性」とは、別の種の哺乳動物に由来する移植片である。
【0033】
本明細書で使用する用語「生体適合性格子」とは、組織の発達をもたらす三次元構造の形成を促進することができる基材を意味する。これに関して例えば、細胞外マトリックス材料、合成ポリマー、サイトカイン、成長因子などを含むものなどのこうした生体適合性格子上で細胞を培養するか、これに播種することができる。格子は組織型の発達を促進するために所望される形状に成形することができる。また少なくとも細胞の培養中の早期の一時期に、培地および/または基材に、適切な組織型および構造の発達を促進する因子(例えば、成長因子、サイトカイン、細胞外マトリックス材料など)を補充することができる。
【0034】
本明細書で使用する用語「骨の病態(または損傷もしくは疾病)」とは、限定するわけではないが、骨の急性、慢性、代謝性および非代謝性疾患を含む骨の障害または疾病である。この用語は疾病、外傷または組織の正常な発達の病態に起因する病態を包含する。骨の病態の例として、限定するわけではないが以下が含まれる: 骨折、骨/脊椎変形、骨肉腫、骨髄腫、骨異形成、脊柱側弯、骨粗しょう症、骨軟化症、くる病、線維性骨炎、腎性骨ジストロフィー、および骨のパジェット病。
【0035】
「分化用培地」とは、本明細書中では、細胞成長用培地でインキュベートしたときに完全には分化しない幹細胞、脂肪由来成人ストローマ細胞またはその他のこうした前駆体細胞が、分化した細胞の特徴のいくつかまたは全部を持つ細胞に発達するように、この培地にある添加剤を含ませるかまたはある添加剤を欠損させたものを意味するために使用される。
【0036】
「増大性」は、本明細書中で、細胞の増殖能力、例えば、数の拡大、または細胞集団の場合ならば集団の倍増能力を示すために使用される。
【0037】
「移植片」とは、細胞、組織、器官またはその他の移植用のあらゆる生体適合性格子である。
【0038】
「成長因子」として、限定するわけではないが、ピコグラム/ml〜ミリグラム/mlレベルの濃度の、以下を含む特定の因子を想定している: 成長ホルモン、エリスロポエチン、トロンボポエチン、インターロイキン3、インターロイキン6、インターロイキン7、マクロファージコロニー刺激因子、c-kitリガンド/幹細胞因子、オステオプロテグリンリガンド、インスリン、インスリン様成長因子、表皮成長因子(EGF)、線維芽成長因子(FGF)、神経成長因子、毛様体神経栄養因子、血小板由来成長因子(PDGF)、および骨形態形成タンパク質。
【0039】
本明細書中で使用する用語「成長用培地」は、細胞の成長を促進する培養培地の意味である。成長用培地は一般的に動物血清を含むものである。事例によっては、成長用培地が動物血清を含まないこともある。
【0040】
「単離された細胞」とは、組織もしくは哺乳動物中でその単離された細胞に天然には付随する他の成分および/または細胞から分離した細胞をいう。
【0041】
本明細書中で使用する用語「多能性の」または「多能性」とは、中枢神経系の幹細胞が2以上の細胞型に分化する能力を意味する。
【0042】
本明細書中で使用する用語「モジュレート」とは生物学的状態の何らかの変化、すなわち増加、減少などを意味する。
【0043】
本明細書中で使用する用語「非免疫原性」とは、ADAS細胞がMLR中でT細胞の増殖を誘導しないことの発見を意味する。しかし、非免疫原性はMLR中でのT細胞増殖に限定されるべきではなく、むしろin vivoでT細胞増殖を誘導しないADAS細胞にも適用されるべきである。
【0044】
「増殖」は、本明細書中では、特に細胞について同様の形態のものの複製または増加を称するために使用される。すなわち、増殖はより多くの数の細胞の産生を包含するものであって、これは中でも単純に細胞の数を数えるか、または細胞内への3H-チミジンの取り込みを測定することなどによって、測定することができる。
【0045】
「細胞周期の、もしくはそれを経た進行」は、本明細書中では、細胞が有糸分裂および/もしくは減数分裂の準備をし、かつ/またはこれに進む過程を称するために使用される。細胞周期を経た進行として、Gl期、S期、G2期、およびM期を経た進行が含まれる。
【0046】
用語「前駆細胞」、「前駆体細胞」、および「幹細胞」は、当分野および本明細書中では互換的に使用され、かつ、無限数の有糸分裂をして、それ自身を再生するかまたは所望の細胞型に分化していく子孫細胞を産生するかのいずれかの能力を潜在的に持つ、多能性または系統不確定(uncommitted)前駆体細胞のいずれかをいう。多能性幹細胞とは異なって、系統確定(committed)前駆体細胞は一般的に、互いに表現型が異なる多種の細胞型を発生させることはできないと考えられている。その代わりに、前駆体細胞は1種または場合によっては2種の系統確定細胞型を生じる。
【0047】
本明細書中で使用する用語「ストローマ細胞培地」は、ADAS細胞の培養に有用な培地である。ストローマ細胞培地の限定するわけではない例は、以下を含む培地である: DMEM/F12ハム培地、10%ウシ胎仔血清、100 Uペニシリン/100μgストレプトマイシン/0.25μgファンギゾン。典型的には、ストローマ細胞培地は基本培地、血清および抗生物質/抗真菌物質を含む。しかし、ADAS細胞は、抗生物質/抗真菌物質を含まないで、少なくとも1種の成長因子を補充したストローマ細胞培地で培養することができる。好ましくは、成長因子はヒト表皮成長因子(hEGF)である。hEGFの好ましい濃度は約1〜50 ng/ml、より好ましくは、その濃度は約5 ng/mlである。好ましい基本培地はDMEM/F12(1:1)である。好ましい血清はウシ胎仔血清(FBS)であるが、ウマ血清またはヒト血清を含むその他の血清も使用することができる。ストローマ細胞の成長を支持するためには、上記の培地に好ましくは最大20%のFBSを添加することとなる。しかし、ストローマ細胞の成長に必要なFBS中の成長因子、サイトカイン、およびホルモンが同定されて、成長培地に適切な濃度で供給されるならば、規定培地を使用することもできる。さらに、培養培地に追加の成分を添加してよいことも認識される。こうした成分として限定するわけではないが以下が含まれる: 抗生物質、抗真菌物質、アルブミン、成長因子、アミノ酸、および細胞の培養について当分野で知られているその他の成分。培地に添加することができる抗生物質として、限定するわけではないが、ペニシリンおよびストレプトマイシンが含まれる。培養培地中のペニシリンの濃度は約10〜約200 unit/mlである。培養培地中のストレプトマイシンの濃度は約10〜約200μg/mlである。しかし、本発明はどんな意味でもストローマ細胞培養用の何らかの培地に限定されるものと解釈すべきではない。むしろ組織培養中でストローマ細胞を支持することができるどんな培地でも使用することができる。
【0048】
用語「薬学的に許容される担体(または培地)」は、用語「生物学的に適合性の担体または培地」と互換的に使用されるが、ヒトおよび動物の組織に接触させて使用するのに好適な範囲で、妥当な利便性/リスクの比率に見合うものであって、過剰の毒性、刺激アレルギー性反応またはその他の合併症がない、試薬、細胞、化合物、物質、組成物、および/または投与剤である。
【0049】
本明細書中で使用する用語としての「好適な椎体間間隙」は、隣接する椎骨間の空間を意味し、ここには健康な脊椎では椎間板が存在しているが、脊柱上で損耗によって椎間板物質が少なくとも一部欠損しているか、または当分野で知られた技法を使用して、椎間板部分に外科的に間隙を創設するように調製したものかのいずれかである。
【0050】
本明細書中で使用する、「治療上有効な量」とは、細胞を投与された被験体に有益な効果をもたらすのに十分なADAS細胞の量である。
【0051】
「治療する(または〜の治療)」とは、骨の病態の影響を軽減する、またはその進行を遅延、停止もしくは逆行させるか、あるいはその発症を遅延または防止することである。
【0052】
本明細書中で使用する「内在性」とは、生物体、細胞または系の中からの、またはそこで産生されるあらゆる物質である。
【0053】
「外来性」とは、生物体、細胞または系の外から導入されるか、またはこれらの外で産生されるあらゆる物質である。
【0054】
「コードする」とは、遺伝子、cDNA、またはmRNAなどのポリヌクレオチド中のヌクレオチドの特異的配列であって、一定のヌクレオチド(すなわち、rRNA、tRNAおよびmRNA)配列または一定のアミノ酸配列のいずれか、ならびにそれらがもたらす生物学的性質を持つ、生物学的過程中の別のポリマーおよび巨大分子の合成のための鋳型として作用する、固有の性質を称する。例えば、ある遺伝子に対応するmRNAの転写および翻訳が細胞中またはその他の生物学的系中でタンパク質を産生するならば、その遺伝子はそのタンパク質をコードする。そのヌクレオチド配列がmRNA配列と同一である配列表に通常示されるコード鎖と、遺伝子またはcDNAの転写のための鋳型として使用される非コード鎖の両方を、タンパク質またはその遺伝子もしくはcDNAの別の産物をコードするものとして、称することができる。
【0055】
別に特定する以外は、「アミノ酸配列をコードするヌクレオチド配列」は、互いに縮重変異体であって同一のアミノ酸配列をコードする、すべてのヌクレオチド配列を含む。タンパク質およびRNAをコードするヌクレオチド配列にはイントロンが含まれうる。
【0056】
「単離された核酸」とは、天然状態ではそれに隣接している配列から分離されている核酸セグメントまたは断片、すなわち、通常はこの断片に隣接している配列から、すなわちそれが天然に存在するゲノム中の断片に隣接する配列から取り出されたDNA断片である。この用語はある核酸に天然には随伴するその他の成分、すなわち、細胞中でそれに天然に随伴するRNAもしくはDNAまたはタンパク質から、実質的に精製された核酸にも適用される。したがってこの用語には、例えば、ベクター中、自己複製するプラスミドもしくはウイルス中、または原核もしくは真核生物のゲノムDNA中に組み込まれるか、あるいはその他の配列から独立して分離された分子(すなわち、PCRまたは制限酵素消化によって作成されたcDNAまたはゲノムもしくはcDNA断片)として存在する、組換えDNAが含まれる。また、別のポリペプチド配列をもコードするハイブリッド遺伝子の一部である組換えDNAも含まれる。
【0057】
本発明に関しては、共通して出現する核酸塩基について以下の略語を使用する。「A」はアデノシン、「C」はシトシン、「G」はグアノシン、「T」はチミジン、そして「U」はウリジンである。
【0058】
語句「転写制御下で」または「機能し得るように連結し」は、本明細書中での使用では、プロモーターがポリヌクレオチドとの関係でRNAポリメラーゼの開始およびそのポリヌクレオチドの発現を制御するのに適正な位置および配向性にあることを意味している。
【0059】
本明細書中で使用する用語「プロモーター/調節配列」は、そのプロモーター/調節配列に機能し得るように連結された遺伝子産物の発現にとって必要とされる核酸配列を意味する。いくつかの例では、この配列はコアプロモーター配列であってもよく、別の例では、この配列はその遺伝子産物の発現にとって必要とされるエンハンサー配列およびその他の調節エレメントをも含んでもよい。プロモーター/調節配列は、例えば、遺伝子産物を組織特異的様相で発現させるものであってもよい。
【0060】
「構成的」プロモーターは、遺伝子産物をコードするか特定するポリヌクレオチドに機能し得るように連結されたときに、細胞の大部分のまたは全生理学的条件下で、その細胞中でその遺伝子産物の産生を引き起こす、ヌクレオチド配列である。
【0061】
「誘導性」プロモーターは、遺伝子産物をコードするか特定するポリヌクレオチドに機能し得るように連結されたときに、実質的には細胞中にそのプロモーターに対応するインデューサーが存在するときにのみ、その細胞中でその遺伝子産物の産生を引き起こす、ヌクレオチド配列である。
【0062】
「組織特異的」プロモーターは、遺伝子産物をコードするか特定するポリヌクレオチドに機能し得るように連結されたときに、実質的に細胞がそのプロモーターに対応する組織型の細胞であるときのみ、その細胞中でその遺伝子産物の産生を引き起こす、ヌクレオチド配列である。
【0063】
「ベクター」は、単離された核酸を含む部分と、その単離された核酸を細胞の内部に送達するために使用することができる部分の、複合物質である。膨大な数のベクターが当分野で知られており、限定するわけではないが、線状ポリヌクレオチド、イオン性もしくは両親媒性化合物と結合したポリヌクレオチド、プラスミド、およびウイルスが含まれる。こうして、用語「ベクター」として、自己複製性プラスミドまたはウイルスが含まれる。この用語には、例えば、ポリリシン化合物、リポソームなどの、核酸の細胞中への導入を促進する、非プラスミド性および非ウイルス性化合物が含まれるものと解釈すべきである。ウイルスベクターの例として、限定するわけではないが、アデノウイルスベクター、アデノ随伴ウイルスベクター、レトロウイルスベクターなどが含まれる。
【0064】
「発現ベクター」は、発現させるヌクレオチド配列に機能し得るように連結された発現制御配列を含んでいる組換えポリヌクレオチドを含むベクターである。発現ベクターは発現にとって十分なcis-作用性エレメントを含んでいる。発現のためのその他のエレメントは宿主細胞によって供給されるか、in vitro発現系で供給される。発現ベクターとして、コスミド、プラスミド(すなわち、裸のまたはリポソームに含有された)および組換えポリヌクレオチドを組み込んだウイルスなどの、当分野で既知のすべてのものが含まれる。
【0065】
説明
本発明は、脂肪組織由来の成人ストローマ(ADAS)細胞が、限定するわけではないが、脂肪細胞、骨細胞、軟骨細胞、筋肉および神経/グリア細胞系統を含む、多様な各種の細胞型に分化することができるという発見に関係している。特に、本発明は、ADAS細胞がin vivoで骨形成系統にしたがって分化するという観察に関連する。
【0066】
本開示に基づき、実験/治療上の目的で、ADAS細胞を細胞治療および/または遺伝子地量で成功裏に使用することができる。例えば、この細胞を骨疾病の治療で使用することができる。好ましくは、この細胞を、脊椎固定手術後の骨の癒合を促進するために使用する。脊椎固定は、椎間板変性症、脊椎狭窄、脊柱側弯、脊椎骨折、腫瘍などに苦しむ哺乳動物の背中の痛みを治療するために使用される、一般的な整形外科術および神経外科術である。
【0067】
ADASの単離および培養
本発明の方法に有用なADAS細胞は当業者に知られた多様な方法によって単離することができる。例えば、そうした方法が米国特許第6,153,432号に記載されている。この全部を本明細書中に組み入れるものとする。好ましい1方法では、ADAS細胞を哺乳動物被験体、好ましくはヒト被験体から単離する。ヒトでは、ADAS細胞は典型的には脂肪吸引物から単離される。本発明の細胞をヒト被験体に移植しようとするならば、自己由来移植物を提供するように、ADAS細胞を同一の被験体から単離するのが好ましい。
【0068】
本発明の別の態様において、投与されるADAS細胞はそのレシピエントについて同種異系でもよい。同種異系ADAS細胞はレシピエントと同一の種の異なる個体であるドナーから単離される。単離後、本明細書中に開示する同種異系産物の生成方法を使用して、細胞を培養する。本発明はレシピエントについて異種性であるADAS細胞も包含する。
【0069】
本発明を何ら限定するわけではないが、本明細書中に開示する方法を使用して、脂肪組織からストローマ細胞を単離することができる。簡単に述べると、皮下沈着物から脂肪吸引術によってヒト脂肪組織を取り出す。次に脂肪組織を脂肪吸引カップから500 ml滅菌ビーカーに移し、約10分間静置する。沈殿した血液を吸引によって除去する。約125 ml(またはそれ未満)の体積の組織を250 ml遠心管に移し、その後この管にKrebs-Ringerバッファーを充填する。組織およびバッファーを約3分、または明確な分離ができるまで静置し、その後吸引によってバッファーを除去する。組織を、さらに4〜5回、または組織が橙〜黄色になり、かつバッファーが淡褐色になるまで、Krebs-Ringerバッファーで洗浄する。
【0070】
コラゲナーゼ処理を使用して、脂肪組織のストローマ細胞を解離させることができる。簡単に述べると、組織からバッファーを除去し、約2 mgコラゲナーゼ/ml Krebsバッファー(Worthington、ME) 溶液で、1 mlコラゲナーゼ溶液/組織mlの比率で交換する。管を断続的に振蕩させながら、37℃水浴中で約30〜35分間インキュベートする。
【0071】
500 X g、室温で5分間の遠心分離によって、脂肪組織のその他の成分からストローマ細胞を単離する。油分および脂肪細胞層を吸引によって除去する。残った画分を、リン酸緩衝化生理食塩水(PBS)約100 mlに激しく回転させることによって懸濁させ、50 ml管に分配して、500 X gで5分間、遠心分離する。バッファーを吸引によって除去して、ストローマ細胞を残留させる。次にストローマ細胞をストローマ細胞用培地に再懸濁させて、適切な細胞密度でプレーティングし、5% CO2中、37℃で一晩インキュベートする。組織培養皿またはフラスコに付着させた後、培養したストローマ細胞を即時使用することも、一定時間または多数回の継代培養期間、培養物中に維持した後、本明細書中に開示する方法にしたがって細胞を使用することもできる。しかし、本発明はストローマ細胞の単離方法のいずれか1つに限定されるものとは全く解釈すべきではない。むしろ、ADAS細胞のどんな単離方法も本発明に包含されるべきものである。
【0072】
ADASを培養するためには、細胞培養中で線維芽細胞を支持するどんな培地でも使用することができる。線維芽細胞の成長を支持する培地製剤として、限定するわけではないが、以下が含まれる: 最少必須Eagle培地、ADC-I、LPM(ウシ血清アルブミンを含まない)、FlO(PIAM)、F12(HAM)、DCCMl、DCCM2、RPMI 1640、BGJ培地(Fitton-Jackson改変または非改変)、基本イーグル培地(BME-Earle塩添加)、ダルベッコ改変Eagle培地(DMEM-無血清)、Yamane、IMEM-20、Glasgow改変Eagle培地(GMEM)、Leibovitz L-15培地、McCoy 5A培地、培地Ml99(M199E-Earle塩添加)、培地M199(M199H-Hank塩添加)、最少必須イーグル培地(MEM-E-Earle塩添加)、最少必須Eagle培地(MEM-H-Hank塩添加)および最少必須イーグル培地(MEM-NAA-非必須アミノ酸添加)、など。ADASの培養にとって好ましい培地はDMEM、より好ましくはDMEM/F12(1:1)である。
【0073】
本発明の方法に有用な培地のその他の限定するわけではない例として、ウシまたはその他の種の胎仔血清を少なくとも1%〜約30%、好ましくは少なくとも約5%〜15%、最も好ましくは約10%の濃度で含有するものがある。ニワトリまたはその他の種の胚抽出物を約1%〜30%、好ましくは少なくとも約5%〜15%、最も好ましくは約10%の濃度で存在させることもできる。
【0074】
単離後、ADAS細胞を培養装置でストローマ細胞培地中、一定時間または細胞が集密に達するまでインキュベートした後、細胞を別の培養装置に植え継ぎをする。培養装置はin vitroでの細胞の培養に使用されるどんな培養装置でもよい。好ましくは、集密度が70%を超えた後、細胞を別の培養装置に植え継ぎをする。より好ましくは、集密度が90%を超えるものである。一定時間とは、in vitroでの細胞の培養に好適な任意の時間である。ADAS細胞の培養中、いつでもストローマ細胞培地を交換することができる。好ましくは、ストローマ細胞培地を3〜4日毎に交換する。その後ADAS細胞を培養装置から回収し、その時点で即時にADAS細胞を使用するか、または後日使用するために凍結保存することができる。ADAS細胞は、トリプシン処理、EDTA処理、または培養装置から細胞を回収するために使用されるその他の任意の操作法によって、回収することができる。
【0075】
培養中の細胞について記載するために、種々の用語を使用する。細胞培養物とは、一般的に、生物の生体から取得して、制御された条件下で成長させた細胞である。一次細胞培養物とは、生物体から直接取得した、最初の継代培養前の細胞、組織または器官の培養物である。細胞は細胞成長および/または分裂を促進する条件下で成長培地中に置かれたとき、培養物中で増大し、その結果より大きな細胞集団となる。細胞が培養物中で増大するとき、細胞増殖の速度は典型的には、その細胞の数が2倍になるのに要する時間(あるいは倍増時間としても知られている)によって測定される。
【0076】
継代培養の各回は世代と称される。細胞を継代培養するとき、これらは継代されたと称される。細胞、または細胞系の特定の集団は、継代された回数によって呼称されるか、またはそれを特性とする場合がある。例えば、10回継代して培養された細胞集団はPlO培養物と称されることがある。一次培養物、すなわち、組織からの細胞の単離後の最初の培養物はPOで示される。最初の継代培養後、その細胞は二次培養物(Plまたは第1世代)と記載される。2回目の継代培養後は、その細胞は三次培養物(P2または第2世代)となり、以下同様である。当業者には、継代の期間中、集団の倍増が何度もあることが理解されるはずである。したがって、培養物の集団の倍増回数は継代数よりも大きい。継代間の期間中の細胞の増大(すなわち、集団倍増の回数)は多くの要因に応じて決まり、これらとして限定するわけではないが、播種密度、基質、培地、および継代間の時間が含まれる。
【0077】
遺伝的改変
本発明の細胞はまた、レシピエント中で、治療上の目的で、またはその細胞の同化および/もしくはその分化を追跡するための方法において、外来タンパク質または分子を発現させるために使用することもできる。こうして、本発明は、外来性DNAのADAS細胞中への導入とそれに付随するその外来性DNAのADAS細胞中での発現のための発現ベクターおよび方法を包含する。細胞へのDNAの導入および発現の方法は当業者にとって周知であり、例えば、以下に記載されているものが含まれる: Sambrookら(2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York)、およびAusubelら(1997, Current Protocols in Molecular Biology, John Wiley & Sons, New York)。
【0078】
レシピエント中に導入された後、ADAS細胞の移動、同化および生存を追跡するために使用する1分子を、単離した核酸にコードさせることが可能である。細胞を追跡するのに有用なタンパク質として、限定するわけではないが、以下が含まれる: 緑色蛍光タンパク質(GFP)、その他の蛍光タンパク質のいずれか(例えば、強化された緑、シアン、黄、青および赤色蛍光タンパク質; Clontech, Palo Alto, CA)、またはその他の標識タンパク質(例えば、LacZ、FLAG-tag、Myc、HiS6、など)。
【0079】
本発明のADAS細胞の移動、同化および/または分化の追跡は、ベクターまたはウイルスによって発現される検出可能な分子の使用に限定されるわけではない。ある細胞の移動、同化、および/または分化は、哺乳動物内に移植されたADAS細胞の局在化を促進する一連のプローブを使用して評価することもできる。ADAS細胞移植物の追跡はさらに、本明細書中で別に詳細に記載する、細胞特異的マーカーのための抗体または核酸プローブを使用して、達成することができる。
【0080】
本明細書中で使用する用語「遺伝的改変」とは、外来性DNAの意図的導入によるADAS細胞の遺伝型の安定的または一時的変更である。DNAは合成でも天然由来でもよく、遺伝子、遺伝子の一部、またはその他の有用なDNA配列を含んでいてもよい。本明細書中で使用する用語「遺伝的改変」は、天然のウイルス活性、天然の遺伝子組み換え、またはそれに類似するものなどによる、天然に生起する変化を含むことを意味していない。
【0081】
外来性DNAは以下によってADAS細胞に導入することができる: ウイルスベクター(レトロウイルス、改変ヘルペスウイルス、ヘルペスウイルス、アデノウイルス、アデノ随伴ウイルス、レンチウイルス、など)の使用、または直接DNAトランスフェクション(リポフェクション、リン酸カルシウムトランスフェクション、DEAE-デキストラン、エレクトロポレーション、など)。
【0082】
細胞の遺伝的改変の目的が生物学的活性物質の産生のためである場合、その物質は一般的に所定の障害の治療に有用なものということになる。例えば、骨形成に関係する一定の成長因子産物を分泌するように、細胞を遺伝的に改変するのが望ましい。
【0083】
本発明の細胞を、細胞内に外来性遺伝物質を導入することによって、細胞の培養に有益な栄養素、成長因子、サイトカイン、などの分子を産生するように、遺伝的に改変することができる。その上、こうした分子を産生するように細胞を遺伝的に改変させることによって、その細胞を、これを必要とする哺乳動物に移植したとき、この哺乳動物にまた別の治療効果をもたらすことができる。例えば、遺伝的に改変された細胞が、哺乳動物内で近隣の細胞に有益な分子を分泌することができるようになる。
【0084】
本明細書中で使用する用語「成長因子産物」とは、細胞に対して成長、増殖、分化、または栄養作用を持つ、タンパク質、ペプチド、マイトジェン、またはその他の分子である。例えば、骨障害の治療に有用な成長因子産物として、限定するわけではないが、FGF、TGF-β、インスリン様成長因子、および骨形態形成タンパク質が含まれる。
【0085】
本発明にしたがって、異種タンパク質をコードするヌクレオチド配列を含む遺伝子構築物をADAS細胞内に導入する。すなわち、細胞を遺伝的に変更させて、その発現が哺乳動物に対して治療効果を持つ遺伝子を導入する。本発明のいくつかの態様によれば、治療する哺乳動物から、または別の哺乳動物からのADAS細胞を遺伝的に変更させて、欠陥がある遺伝子を交換し、かつ/またはその発現が治療を受ける哺乳動物に対して治療効果を持つ遺伝子を導入する。
【0086】
遺伝子構築物を細胞内にトランスフェクトするすべての場合において、異種遺伝子は、細胞内でその遺伝子の発現を達成するのに必要な調節配列に機能し得るように連結される。こうした調節配列として典型的にはプロモーターおよびポリアデニル化シグナルが含まれる。
【0087】
遺伝子構築物は好ましくは、異種タンパク質をコードする配列を含む発現ベクターであって、このベクターが細胞内にトランスフェクトされたとき、そのコード配列がその細胞によって発現されるように、必須の調節配列に機能し得るように連結されたベクターとして提供される。このコード配列は、細胞内でその配列の発現に必要な調節エレメントに機能し得るように連結されている。タンパク質をコードするヌクレオチド配列はcDNA、ゲノムDNA、合成DNAもしくはそれらのハイブリッドまたはmRNAなどのRNA分子である。
【0088】
遺伝子構築物は、調節エレメントに機能し得るように連結された、有益なタンパク質をコードするヌクレオチド配列を含み、これは細胞内に、機能性細胞質分子、機能性エピソーム分子として残留していてもよく、または細胞の染色体DNA内に組み込まれてもよい。外来性遺伝物質は細胞内に導入されて、そこで独立した遺伝子物質としてプラスミドの形態のままでいてもよい。あるいは、染色体中に組み込まれることができる線状DNAを細胞内に導入することもできる。細胞内にDNAを導入する際は、染色体内へのDNAの組み込みを促進する試薬を添加してもよい。組み込みを促進するために有用なDNA配列もDNA分子内に含ませてもよい。あるいは、RNAを細胞内に導入してもよい。
【0089】
遺伝子発現のための調節エレメントとして以下が含まれる: プロモーター、開始コドン、停止コドン、およびポリアデニル化シグナル。これらのエレメントが本発明の細胞内で機能性であるものが好ましい。その上、これらのエレメントが、タンパク質をコードするヌクレオチド配列に、このヌクレオチド配列が細胞内で発現することによってタンパク質が産生されるように、機能し得るように連結されていることが好ましい。開始および停止コドンは一般的にはタンパク質をコードするヌクレオチド配列の一部であるとみなされる。しかし、これらのエレメントが細胞内で機能性であることが好ましい。同様に、使用するプロモーターおよびポリアデニル化シグナルは本発明の細胞内で機能性でなければならない。本発明の実践上有用なプロモーターの例として、限定するわけではないが、サイトメガロウイルスプロモーター、SV40プロモーターおよびレトロウイルスプロモーターなどの、多くの細胞中で活性なプロモーターが含まれる。本発明の実践上有用なプロモーターのその他の例として、限定するわけではないが、以下が含まれる: 組織特異的プロモーター、すなわちある組織では機能するが別の組織では機能しないプロモーター; また、特定のもしくは一般的エンハンサー配列を含むか含まない、細胞内で通常発現されている遺伝子のプロモーター。いくつかの実施形態では、エンハンサー配列を含むか含まない、細胞内で構成的に遺伝子を発現させるプロモーターが使用される。こうした実施形態では、エンハンサー配列はそれが適切であるかまたは望ましい場合に加えられる。
【0090】
本発明の細胞は、当業者が容易に利用し得る周知の技法を使用して、トランスフェクトすることができる。外来性遺伝子は標準的方法を使用して細胞内に導入され、そこで細胞がその遺伝子によってコードされるタンパク質を発現する。いくつかの実施形態中、細胞はリン酸カルシウム沈殿トランスフェクション、DEAEデキストラントランスフェクション、エレクトロポレーション、マイクロインジェクション、リポソーム媒介導入、化学物質媒介導入、リガンド媒介導入または組換えウイルスベクター導入によってトランスフェクトされる。
【0091】
いくつかの実施形態では、組換えアデノウイルスベクターを使用して、所望の配列を持つDNAを細胞内に導入する。いくつかの実施形態では、組換えレトロウイルスベクターを使用して、所望の配列を持つDNAを細胞内に導入する。いくつかの実施形態では、標準CaPO4、DEAEデキストランまたは脂質担体媒介トランスフェクション技法を利用して、分裂中の細胞に所望のDNAを組み入れる。標準的な抗生物質耐性選択法を使用して、トランスフェクトした細胞を同定および選択することができる。いくつかの実施形態では、マイクロインジェクションによってDNAを直接細胞内に導入する。同様に、周知のエレクトロポレーションまたは粒子衝撃法を使用して、外来DNAを細胞内に導入することかできる。通常、第2の遺伝子を同時トランスフェクトするか、治療上の遺伝子に連結させる。第2遺伝子は選択可能な抗生物質耐性遺伝子であることが多い。トランスフェクトされた細胞は、選択性遺伝子を取り込まない細胞を殺傷する抗生物質中でその細胞を成長させることによって、選択することができる。2つの遺伝子を連結させないで同時トランスフェクトする場合の大部分で、抗生物質処理で生き残った細胞はその中に両方の遺伝子を持ち、その両方を発現する。
【0092】
本明細書中に記載する方法は、当分野で周知の多数の手法で、またそれらに多様な改変および置換を加えて、実施することができるものと解釈すべきである。また、細胞型同士の作用形態または相互作用について示したどんな理論も、本発明をいかなる意味でも限定する意図はなく、本発明の方法をより完全に理解することができるために提供しているものであることも、理解されたい。
【0093】
ADAS細胞の治療上の使用
ADAS細胞が様々な細胞系譜にしたがって分化し得るという事実に加えて、本発明は、ADAS細胞がT細胞の増殖の誘発に関して免疫原性特性を欠如しているという発見にも関係している。この特徴は、レシピエントの免疫細胞による免疫拒絶の可能性が低いことを示す。その上、ADAS細胞は混合リンパ球反応中、同種異系PBMCを刺激しないことが示されている。
【0094】
本発明のいくつかの実施形態では、ADAS細胞による細胞/遺伝子療法の開始前に、哺乳動物を免疫抑制する必要がないか、望ましいことでもないことがある。したがって、同種異系、またはさらには異種の、ADAS細胞移植が本発明に含まれる。
【0095】
骨の疾病、障害、または病態の治療のためのADAS細胞の使用は、免疫抑制剤の必要を伴わないで、レシピエント中にADAS細胞を導入することができるという、新たな利点を提供する。細胞の移植の成功には、レシピエントで発生する移植片拒絶免疫応答を誘発しないで、ドナー細胞の永久的移植定着が必要であると考えられる。通常は、移植片拒絶反応を防止するため、シクロスポリン、メトトレキセート、ステロイドおよびFK506などの非特異的免疫抑制剤が使用される。これらの薬剤は毎日投与され、投与を停止すれば、通常は移植片拒絶の結果をもたらす。しかし、非特異的免疫抑制剤の使用の望ましくない結果は、これらが免疫応答のすべての様相を抑制することによって機能することで(全般的免疫抑制)、したがってレシピエントの感染およびその他の疾病への感受性が非常に増大することとなる。
【0096】
本発明は、免疫抑制剤を必要とせずに、未分化または分化したADAS細胞をレシピエントに導入することによる、骨の疾病、障害、または病態の治療方法を提供する。したがって、移植されたADAS細胞のレシピエントにとって、感染および免疫抑制療法に伴うがんに関係した症状などの、その他の疾病を招く感受性が低下する。
【0097】
本発明には、同種異系もしくは異種ADAS細胞、または別の面でレシピエントとは遺伝上本質的に異なるADAS細胞のレシピエントへの投与によって、そのレシピエントにある恩恵を提供することが含まれる。本発明は、骨の疾病、障害または病態の治療のためのADAS細胞の使用方法であって、この細胞をレシピエントに投与する際、免疫抑制剤の使用の必要性がないもの、を提供する。
【0098】
別の実施形態では、本発明で使用するADAS細胞は、限定するわけではないが、ヒト、マウス、ラット、類人猿、テナガザル、ウシを含む、どんな種の哺乳動物の脂肪組織からでも単離することができる。好ましくは、ADAS細胞をヒト、マウス、またはラットから単離する。より好ましくは、ADAS細胞をヒトから単離する。
【0099】
ADAS細胞は一定時間のin vitro培養後、哺乳動物に投与することができる。ADAS細胞を、ADAS細胞がin vitroで分化するように誘導する様相で、培養してもよい。しかし、ADAS細胞を未分化の状態でレシピエントに移植し、移植されたADAS細胞が分化して、骨細胞の少なくとも1つの特徴をin vivoで発現するのが好ましい。
【0100】
本発明のADAS細胞を、当分野で知られた技法、すなわち米国特許第5,082,670および5,618,531号(それぞれを参照として本明細書中に組み入れる)に記載されているものなど、を使用して、哺乳動物に移植するか、または身体のその他の好適ないずれかの部位に移植することができる。本発明の細胞の移植は、当分野で周知の、また本明細書中に記載したもの、あるいは将来開発される、技法を使用して、達成することができる。本発明は、哺乳動物、好ましくは、ヒトへの細胞の移植、移植片移植、注入、またはその他の導入のための方法を含む。
【0101】
哺乳動物に投与するADAS細胞の数は、例えば、脂肪組織の処理後の細胞の収量に関係する。細胞の総数の一部分を後の使用のために保持するか凍結保存することができる。その上、送達される用量は哺乳動物への細胞の送達経路如何による。
【0102】
ADAS細胞の投与量は広範な限度で変化し、それぞれの特定の場合において、個々の必要性にしたがって調整される。使用する細胞の数はレシピエントの体重および病状、投与の回数および/または頻度、ならびに当業者に知られているその他の変数に応じて決められる。この数は所望の治療効果を達成するための桁数で調整される。
【0103】
体重100 kgについて約105〜約1013のADAS細胞を個体に投与することができる。いくつかの実施形態では、体重100 kg当たり約1.5 x 106〜約1.5 x 1012細胞を投与する。いくつかの実施形態では、体重100 kg当たり約1 x 109〜約5 x 1011細胞を投与する。別の実施形態では、体重100 kg当たり約4 x 109〜約2 x 1011細胞を投与する。さらに別の実施形態では、体重100 kg当たり約5 x 108細胞〜約1 x 1010細胞を投与する。
【0104】
ADAS細胞は、適切な希釈液に、約0.01〜約5 X 106細胞/mlの濃度で懸濁させることができる。注射溶液のために好適な賦形剤は、ADAS細胞およびレシピエントと、生物学的および生理学的に適合性のものであって、緩衝化した生理食塩水溶液またはその他の好適な賦形剤などである。投与のための組成物は適正な滅菌度と安定性に適合する、標準的方法にしたがって、製剤化し、製造し、また貯蔵することができる。
【0105】
細胞を既知のカプセル封入技法にしたがって、カプセル封入して、生物学的に活性な分子を送達するために使用することもできる。これらとして、マイクロカプセル封入(例えば、本明細書中に参照として組み入れる、米国特許第4,352,883; 4,353,888; および5,084,350号、参照)、またはマクロカプセル封入(例えば、米国特許第5,284,761; 5,158,881; 4,976,859; および4,968,733号; ならびに国際特許公開公報 WO 92/19195; WO 95/05452、参照、これらの全部を参照として本明細書中に組み入れる)が含まれる。マクロカプセル封入については、このデバイス中の細胞数を変更させることができる。好ましくは、各デバイスが103〜109細胞、最も好ましくは、約105〜107細胞を含有する。数個のマクロカプセル封入デバイスを哺乳動物に移植することができる。細胞のマクロカプセル封入および移植の方法は当分野で周知であり、また例えば、米国特許第6,498,018号に記載されている。
【0106】
本発明の細胞の哺乳動物への投与方法は、以下を含むいくつかの要因に応じて変更される: 治療する疾病のタイプ、哺乳動物の年齢、細胞が分化しているかしていないか、細胞の中に異種DNAが導入されているか、など。特定の骨の疾病または障害に苦しむ哺乳動物に投与する化合物を導入するため、細胞を直接の注射によるか、または当分野で使用される任意のその他の手段によって、所望の部位に導入することができる。
【0107】
ADAS細胞は多様な手段で宿主に投与することができる。投与方法として、限定するわけではないが、以下が含まれる: 血管内、大脳内、腸管外、腹腔内、静脈内、硬膜外、脊髄内、幹内(intrastemal)、関節内、滑膜内、髄膜内、動脈内、心臓内、または筋肉内。好ましくは、細胞を脊椎固定手術で使用する。
【0108】
組成物
本発明は哺乳動物に移植するためのマトリックスであって、このマトリックスが本発明のADAS細胞を含むものをも提供する。このマトリックスとしてはまた、限定するわけではないが、ADAS細胞、ADAS細胞溶解物、ADAS細胞馴化培地、およびADAS細胞が産生した細胞外マトリックスも含まれる。
【0109】
このマトリックスは限定するわけではないが以下のものなどの、1以上の生体活性因子を含有するか、これで処理されたものでもよい: 抗アポトーシス性薬剤(すなわち、エリスロポエチン、トロンボポエチン、インスリン様成長因子Iおよびインスリン様成長因子II、肝細胞成長因子、カスパーゼインヒビター); 抗炎症性薬剤(すなわち、p38 MAPKインヒビター、TGF-ベータインヒビター、スタチン、IL-6およびIL-Iインヒビター、ならびに非ステロイド抗炎症剤); 免疫抑制/免疫モジュレート剤; mTORインヒビター; 抗増殖剤; コルチコステロイド(すなわち、プレドニゾロン、ヒドロコルチゾン); 抗血栓剤; ならびに抗酸化剤。生体活性因子の存在は、ADAS細胞の増殖および/または分化を促進することができる。
【0110】
本発明はいくつかの態様でさらに、骨組織の再生を必要とする哺乳動物に、本発明のADAS細胞、マトリックス、ADAS細胞溶解物、ADAS産生物(すなわちADAS細胞が分泌する分子)、またはこれらのあらゆる組み合わせを含む組成物を投与することによる、哺乳動物の骨組織の再生方法を提供する。これに関連して、本発明は骨の病態の治療に使用することができる、医薬組成物を包含する。例えば、骨の病態として、限定するわけではないが、以下が含まれる: 骨折、骨/脊椎変形、骨肉腫、骨髄腫、骨異形成、脊柱側弯、骨粗しょう症、骨軟化症、くる病、線維性骨炎、腎性骨ジストロフィー、および骨のパジェット病。好ましくは、本発明は、脊椎固定手術後の骨の癒合を促進するための組成物および方法を提供する。
【0111】
限定するわけではない1実施形態では、新しい骨組織の産生が必要な部位に直接投与するための、本発明の細胞を含む剤形が調製される。例えば、本発明の細胞を注射用に、ヒドロゲル溶液に懸濁させることができる。あるいは、移植に先立って、細胞を含有するヒドロゲル溶液を例えば型枠の中で硬化させて、その中に細胞を分散させたマトリックスを形成させるか、またはマトリックスが硬化した後、この細胞成形物を培養して細胞を分裂増殖させた後、移植することができる。ヒドロゲルは有機ポリマー(天然または合成)であって、共有結合、イオン結合または水素結合によって架橋されて三次元開放格子構造を形成し、これが水分子を捕捉して、ゲルを形成するものである。ヒドロゲルを形成させるために使用することができる材料の例として、以下が含まれる: アルギン酸およびその塩などの多糖類、ペプチド、ポリホスファジン、およびポリアクリレート、これらはイオン性架橋される、またはブロックポリマー類、ポリエチレンオキシド-ポリプロピレングリコールブロックコポリマー、これらはそれぞれ温度またはpHによって架橋される。
【0112】
いくつかの実施形態では、ポリマーは、水、バッファー塩溶液、または水性アルコール溶液などの水性溶液に少なくとも部分的に可溶性であって、荷電側鎖基を持つかまたはその単価イオン性塩である。カチオンと反応することができる酸性側鎖基を持つポリマーの例は、ポリホスファゼン、ポリアクリル酸、ポリメタクリル酸、アクリル酸およびメタクリル酸のコポリマー、ポリ酢酸ビニル、ならびにスルホン化ポリスチレンなどのスルホン化ポリマー。アクリルもしくはメタクリル酸とビニルエーテルモノマーもしくはポリマーの反応によって形成される酸性側鎖基を持つコポリマーも使用することができる。酸性基の例はカルボン酸基、スルホン酸基、ハロゲン化(好ましくはフッ化)アルコール基、フェノール性OH基、および酸性OH基である。
【0113】
アニオンと反応することができる塩基性側鎖基を持つポリマーの例は、ポリビニルアミン、ポリビニルピリジン、ポリビニルイミダゾール、および何らかのイミノ置換があるポリホスファゼンである。ポリマーのアンモニウム塩または第四級塩も、骨格窒素または付随イミノ基から形成させることができる。塩基性側鎖基の例はアミノおよびイミノ基である。
【0114】
ポリマーのその他の例として、限定するわけではないが以下が含まれる: ポリ-アルファ-ヒドロキシエステル、ポリジオキサノン、フマル酸プロピレン、ポリエチレングリコール、ポリエルトエステル、ポリ無水物およびポリウレタン、ポリ-L-乳酸、ポリグリコール酸、ならびにポリ-乳酸-グリコール酸コポリマー。
【0115】
スキャフォールドを使用するADAS細胞の移植
本発明の細胞を三次元スキャフォールドの上またはその中に播種して、in vivoで移植し、そこで播種された細胞がその型枠上で増殖し、その哺乳動物の細胞と共同して、in vivoで代替組織を形成するようにさせることができる。
【0116】
本発明のいくつかの態様では、スキャフォールドはADAS細胞の細胞外マトリックス、細胞溶解物(例えば、可溶性細胞画分)、またはそれらの組み合わせを含む。いくつかの実施形態では、スキャフォールドは本発明の細胞が分泌する細胞外マトリックスタンパク質を含む。あるいは、細胞外マトリックスは以下からなる群から選択された外来性物質である: アルギン酸カルシウム、アガロース、フィブリン、コラーゲン、ラミニン、フィブロネクチン、グリコサミノグリカン、ヒアルロン酸、ヘパリン硫酸、コンドロイチン硫酸A、デルマタン硫酸、および骨マトリックスゼラチン。いくつかの態様では、マトリックスは天然または合成ポリマーを含む。
【0117】
本発明には、生体適合性のスキャフォールド、格子、自己組織化する構造などが含まれ、生分解性または非分解性、液体または固体のいずれでもよい。こうしたスキャフォールドは細胞を基礎とする治療法、外科的修復、組織再生法、および創傷の治療の分野で知られている。好ましくは、スキャフォールドを、細胞、細胞外マトリックス、馴化培地、細胞溶解物、またはこれらの組み合わせとともに前処理(例えば、播種、接種、接触)する。本発明のいくつかの態様では、細胞はスキャフォールドに付着する。播種されたスキャフォールドは限定するわけではないが以下を含む、当分野で知られているいずれかの方法で、哺乳動物の体内に導入することができる: 移植、注射、外科的貼着、別の組織との移植、注射、など。本発明のスキャフォールドはin vivoの組織または器官の形状および/またはサイズに造形することができる。例えば、限定するわけではないが、スキャフォールドを以下のように設計することができる: スキャフォールド構造がその後崩壊することなく播種した細胞を支持し、細胞を播種のときから組織移植物が宿主組織中で再成形されるまで支持し、そして播種された細胞を付着、増殖、および発展させて、これらを支持するのに十分な構造的完全性を持つ組織構造にする。
【0118】
本発明のスキャフォールドを、組織形成を刺激するか、あるいはその他に本発明の実践を促進または改善する、成長因子、細胞、薬剤もしくは本明細書中に別に記載するその他の成分のいずれかの1種以上と組み合わせて、投与することができる。スキャフォールド上に播種するADAS細胞は成長因子または薬剤を発現するように遺伝子工学的に操作することができる。
【0119】
別の好ましい実施形態では、本発明の細胞をスキャフォールド上に播種するが、この際その材料は実際の骨の特徴を模倣する、多孔性および生体構造上の強度の特定化した物理的性質を提示し、それによって最終構造の安定化と代謝物質および細胞栄養素の進入および退出を促進する。すなわち、この材料は構造上の支持体を提供すべきであり、またその中に宿主の血管形成および細胞の移動が発生し得る、足場を形成することができるものである。好ましい実施形態では、ADAS細胞はスキャフォールドに適用する前に、まず担体と混合する。好適な担体として、限定するわけではないが、以下が含まれる: アルギン酸カルシウム、アガロース、I、II、IV型もしくはその他のコラーゲンイソ型、フィブリン、ポリ乳酸/ポリグリコール酸、ヒアルロン酸誘導体、ゼラチン、ラミニン、フィブロネクチン、でんぷん、多糖類、糖類、プロテオグリカン、合成ポリマー、リン酸カルシウム、およびセラミックス(すなわちヒドロキシアパタイト、リン酸三カルシウム)。
【0120】
三次元型枠の外側表面を以下のように改変して、細胞の付着もしくは成長および組織の分化を改善することができる: 枠のプラズマコーティング、または以下の1以上の添加; タンパク質(例えば、コラーゲン、弾性繊維、網状繊維)、グリコタンパク質、グリコサミノグリカン(例えば、ヘパリン硫酸、コンドロイチン-4-硫酸、コンドロイチン-6-硫酸、デルマタン硫酸、ケラチン硫酸)、細胞マトリックス、ならびに/または限定するわけではないが、ゼラチン、アルギン酸塩、アガー、およびアガロースなどの、その他の物質。
【0121】
いくつかの実施形態では、培養中、本発明の細胞が成長できる程度の、in vivoで見られる細胞の微細環境を再創設した後、in vivoで移植することが重要である。その上、細胞の接種の前、接種中、またはその後に、培養培地中に、成長因子、骨形成誘発剤、および血管形成因子を添加して、哺乳動物中に移植した後、ADAS細胞による分化および組織形成の開始を誘導することができる。
【0122】
ADAS細胞の治療上の適用
本発明は、疾病を治療するために、ヒトを含む哺乳動物にADAS細胞に投与し、その際ADAS細胞の導入が治療上の緩和を導入することになる方法を提供する。本発明の細胞は単独で、あるいは別に本明細書中で検討するその他の細胞および/または生体活性因子との混合物として投与することができる。本発明のADAS細胞とともに投与することができる細胞として、限定するわけではないが、以下が含まれる: その他の複能性もしくは多能性細胞、骨細胞、骨芽細胞、破骨細胞、骨内皮細胞、幹細胞、および骨髄細胞。哺乳動物への投与時、または少し前に、別種の型の細胞をADAS細胞と混合するか、または哺乳動物への投与前の一定時間、これらをともに同時培養してもよい。
【0123】
当業者は、ADAS細胞を哺乳動物に移植し、そこで周囲の環境からシグナルおよび合図を受け取ると、この細胞がin vivoで隣接する細胞環境から指図された成熟細胞に分化することを、容易に理解できるはずである。好ましくは、ADAS細胞は少なくとも骨細胞の1つの特徴を示す細胞に分化する。あるいは、ADAS細胞はin vitroで所望の細胞型に分化させて、そして分化した細胞を、それを必要とする哺乳動物に投与することができる。
【0124】
本発明はまた、骨の疾病を治療するためのその他の治療上の処置と組み合わせてADAS細胞を移植片移植するものも包含する。好ましくは、この細胞は脊椎固定手術後の骨の癒合を促進するのに有用なものである。ADAS細胞を別の細胞とともに同時移植片移植することができる。それらは哺乳動物に有益な影響を与える、遺伝的に改変されたものおよび遺伝的に改変されない細胞の両方である。したがって、本明細書中に開示する方法をその他の治療上の処置と組み合わせることができる。これは本明細書中に提供する教示を一度目標とした当業者であれば理解するはずである。
【0125】
ADAS細胞をその他の有益な薬剤または生物学的分子(成長因子、栄養因子)とともに投与することができる。ADAS細胞をその他の薬剤とともに投与する場合、これらを単一の医薬組成物中で一緒に、あるいは別々の医薬組成物中で、同時にまたは順次、その他の薬剤とともに(その他の薬剤の投与の前または後に)投与することができる。同時投与することができる生体活性因子として、限定するわけではないが、以下が含まれる: 抗アポトーシス薬剤(すなわち、エリスロポエチン、トロンボポエチン、インスリン様成長因子Iおよびインスリン様成長因子II、肝細胞成長因子、カスパーゼインヒビター); 抗炎症性薬剤(すなわち、p38 MAPKインヒビター、TGF-ベータインヒビター、スタチン、IL-6およびIL-Iインヒビター、および非ステロイド抗炎症性薬剤); 免疫抑制/免疫モジュレート薬剤; mTORインヒビター; 抗増殖性薬剤(すなわち、アザチオプリン、マイコフエノレートモフェチル); コルチコステロイド(すなわち、プレドニゾロン、ヒドロコルチゾン); 抗血栓性薬剤; および抗酸化剤。
【0126】
本発明は、哺乳動物への、未分化細胞として、すなわち、成長培地で培養したままでの、ADAS細胞の投与を包含する。あるいは、ADAS細胞を、培養物中で、所望の表現型、例えば骨形成性表現型に分化するように刺激する条件に曝露した後、投与することができる。
【0127】
本発明の細胞を、修復または増強が必要な部位に、外科的に移植するか、注入するか、送達する(例えば、カテーテルもしくはシリンジによる)か、またはその他の方法で直接もしくは間接的に投与することができる。細胞を、マトリックス(例えば、三次元スキャフォールド)によって投与することもできる。細胞は従来からの薬学的に許容される担体とともに投与することができる。本発明の細胞またはその成分(例えば、細胞外マトリックス、細胞溶解物、馴化培地)の投与経路として以下が含まれる: 筋内、眼内、腸管外(静脈内を含む)、動脈内、皮下、経口、および経鼻投与。特定の非経口投与経路として、限定するわけではないが、以下が含まれる: 筋内、皮下、腹腔内、大脳内、心室内、脳室内、髄膜内、大槽内、脊髄内および/または脊椎周囲投与経路。好ましくは、細胞を脊椎固定手術中に使用する。
【0128】
本発明の細胞を単独で、または骨の創傷および欠損の修復に有用な組成物との混合物として、導入することができる。こうした組成物として、限定するわけではないが以下が含まれる: 骨形成性タンパク質、ヒドロキシアパタイト/リン酸三カルシウム粒子(HA/TCP)、ゼラチン、ポリ-L-リジン、およびコラーゲン。例えば、本発明の細胞を脱灰骨マトリックス(DBM)または骨形成性(自身の正当な場所での骨形成性)および骨誘導性の複合材料を作製するためのその他のマトリックスと組み合わせることができる。
【0129】
移植した細胞の分化、生存または活性を増強するため、本明細書中で別に検討する、別の生体活性因子を追加することができる。例えば、生体活性因子として、限定するわけではないが以下が含まれる: 骨形態形成タンパク質、血管内皮成長因子、線維芽細胞成長因子、ならびに骨伝導性および/または骨誘導性能力を持つその他のサイトカイン。移植した骨組織の血管形成および生存を促進するため、VEGF、PDGFまたはbFGFなどの血管形成因子を単独または内皮細胞もしくはその前駆細胞と組み合わせて添加することもできる。
【0130】
あるいは、移植するADAS細胞を遺伝子工学的に操作して、こうした成長因子、抗酸化物質、抗アポトーシス物質、抗炎症性物質、または血管形成因子を発現するようにすることができる。
【0131】
医薬組成物
本発明の範囲内にさらに包含されるものとして、限定するわけではないが、ADAS細胞自体が分泌する細胞外マトリックスを含む、ADAS細胞産物、ADAS細胞の細胞溶解物(例えば、可溶性細胞画分)、およびADAS細胞馴化培地がある。これに関して、ADAS細胞を含む組成物を投与するという用語において、本発明には、少なくとも以下の1種を含む医薬組成物が含まれる: ADAS細胞、それによって産生される細胞外マトリックス、その細胞溶解物、またはADAS馴化培地。本発明の医薬組成物は好ましくは薬学的に許容される担体または賦形剤を含む。医薬組成物は好ましくは本明細書中に定義する骨の病態の治療のために使用される。
【0132】
本発明の医薬組成物には、薬学的に許容される担体中の、ADAS細胞の同種もしくは異種集団、その細胞外マトリックスもしくは細胞溶解物、またはその馴化培地を含ませることができる。本発明の細胞の薬学的に許容される担体として、本発明の細胞またはその組成物もしくは成分と有害な反応をしない、好適な有機もしくは無機担体物質が含まれる。生体適合性の範囲内で、好適な薬学的に許容される担体として、以下が含まれる: 水、塩溶液(Ringer溶液など)、アルコール、油、ゼラチン、およびラクトース、アミロース、もしくはでんぷんなどの炭水化物、、脂肪酸エステル、ヒドロキシメチルセルロース、ならびにポリビニルピロリドン。こうした調製品を滅菌し、また所望ならば以下のような補助剤と混合することができる: 潤滑剤、保存剤、安定剤、湿潤剤、乳化剤、浸透圧調整のための塩類、バッファー、および着色剤。本発明での使用に好適な医薬担体は当分野で知られており、また例えば以下に記載されている: Pharmaceutical Sciences(17.sup.th Ed., Mack Pub. Co., Easton, Pa.)およびWO 96/05309。これらのそれぞれを参照として本明細書中に組み入れる。
【0133】
限定するわけではない別の例として、本発明の細胞を単独で、または薬学的に許容される担体中で投与するか、あるいは本明細書中で別に記載するマトリックス上またはその中に播種し、これを使用して、損傷もしくは破壊した骨組織を修復もしくは交換するか、現存する骨組織を増強するか、新しい、もしくは変更した組織を導入するか、あるいは人工的プロテーゼを改変することができる。
【0134】
細胞を半固体または固体デバイス中で投与する場合、体内の厳密な位置への外科的移植が、典型的には好適な投与手段である。細胞を液体または液状医薬組成物の形態で投与する場合は、細胞をより普遍的な位置(すなわち拡散して罹患した範囲全体)に投与して、そこから特定の位置に(すなわち化学的シグナルに応答することによって)移動させることができる。
【0135】
別の実施形態として、ADAS細胞成分(例えば、細胞溶解物もしくはその成分)または産物(例えば、細胞外マトリックス、ADAS細胞によって天然に、または遺伝子改変によって産生される栄養およびその他の生物学的因子、ADAS培養からの馴化培地)を含む医薬組成物を投与することによる、治療方法を包含する。この場合も、これらの方法でさらに、本明細書中で別に開示する、その他の活性な薬剤の投与を含む。
【0136】
ADAS細胞はまた、意図する治療効果を増強、制御、またはそうではなく誘導するために、添加剤とともに適用することができる。同様に、細胞を、移植した細胞を支持し、かつ/またはその命運を決定づけることによってin vivoでの組織再生を促進する、生体適合性マトリックスとともに適用することができる。
【0137】
哺乳動物へのADAS細胞の投与の前に、プラスミド、ウイルスまたは別のベクター戦略を使用して、細胞に安定的にまたは一時的に目的の核酸をトランスフェクトまたは形質導入することができる。細胞によって提供される治療応答を促進する意図で、遺伝子産物を発現するように遺伝子操作した後、細胞を投与することができる。
【0138】
本発明のADAS細胞を使用して、疾病もしくは外傷または組織の正常発達不全の結果として骨組織の修復または交換が必要な哺乳動物を治療することができる。治療には、新たな骨組織を産生させるための、本発明の細胞の使用が必要でありうる。例えば、本発明の未分化の、または骨形成分化を誘導された細胞を使用して、代謝性および非代謝性骨疾病を含む骨の病態を治療することができる。骨の病態の例として限定するわけではないが、以下が含まれる: 骨折、骨/脊椎変形、骨肉腫、骨髄腫、骨異形成、脊柱側弯、骨粗しょう症、骨軟化症、くる病、線維性骨炎、腎性骨ジストロフィー、および骨のパジェット病。
【0139】
脊椎固定
本明細書中に記載したように、背中の痛みは国民、特に高齢者の健康上の重要な問題として現存する。持続し、かつ重篤な背中の痛みは衰弱および身体障害をもたらすことが多い。この痛みは脊椎の椎間板の異常と密接に関係している。本開示に基づき、変性した椎間板を、その椎間板内の損傷した組織を復旧させることによって、治療することができる。本発明のADAS細胞を使用して、骨の発達を刺激し、そして変性の多様な段階にある椎間板を復旧させることができる。
【0140】
しかし、多くの場合、損傷かつ/または機能不全の背中の部位の少なくとも一部を除去することが必要となる。例えば、椎間板の1つが破断した場合、切除手術を実施して、その破断した椎間板を除去し、そして除去した椎間板を挟む2つの椎骨同士を固定することができる。脊椎固定術とは、脊柱を構成する2つ以上の椎骨を、移植および内部デバイス(桿状物など)で固定して、単一の一体化した骨に癒合させる術式である。脊椎固定は椎骨間の不自然な動きを排除して神経末端の圧迫を低下させる。その上、脊椎固定を使用して、例えば以下を治療することができる: 外傷に起因する脊椎の損傷; 脊椎間の緩衝板の突出および変性(椎間板すべり症または椎間板ヘルニアとも称されることがある); 異常な弯曲(脊柱側弯症または脊椎後弯症など); および感染もしくは腫瘍に起因する脊椎の弱体化または不安定化。本発明は脊椎固定手術の成功率を向上させるための組成物および方法を包含する。
【0141】
本発明のADAS細胞はin vivoで骨を形成することが示されたので、従来脊椎固定手術で使用されてきた骨移植片の代わりにADAS細胞を使用することができる。具体的には、ADAS細胞を使用して、隣接する2つの椎骨間(椎体内)、および隣接する横突起間(脊椎のいずれかの側の横突起間間隙内)での骨形成を刺激することができる。
【0142】
本発明のADAS細胞は脊椎障害の治療において以下のような多数の適用ができる: 椎間板修復中のプロテオグリカンに富むマトリックスの産生、脊椎横突起間固定における椎間体のための骨の産生、および長骨の破損の治癒のための骨の産生の促進。本発明は脊椎固定手術においてADAS細胞を使用して、骨の癒合を促進することができるという発見に基づくものである。
【0143】
椎間板が破損した場合、脊椎切除術を実施して、破損した椎間板を除去し、除去した椎間板を挟む2つの椎骨を固定することができる。脊椎固定のための方法の典型的な実行についての詳細は、米国特許第6,033,438および5,015,247号に開示されており、これらの内容の全部を参照として本明細書中に組み入れる。
【0144】
椎間板変性症は普通、セグメントの固定によって治療され、これによって脊椎内間隙の前方および後方脊椎要素の両方を固定する。固定術を考える場合、前方および後方要素にかかる機械的応力を考慮することが重要である。前方の運動セグメント要素(脊椎体および椎間板)は脊椎に与えられる圧迫力のレベルの約80%を受け持つ。脊椎体および椎間板の後方1/3が脊椎内の軸圧縮の中点となる。これらの力学は、所定の病理についてどんなタイプの固定術が最善の治療結果を持つかの評価において重要である。本発明は、骨代用品の原料としてADAS細胞を使用する、脊椎固定手術を提供する。
【0145】
1実施形態では、本発明として、哺乳動物において、その哺乳動物中の1以上の好適な脊椎体間間隙に、シリンジ、カテーテルまたはカニューレでの細胞の注入により、有効な量のADAS細胞を導入して、単一または複数の脊椎固定を促進することを含む、1以上の脊椎固定の実施方法が含まれる。ADAS細胞は、細胞が分化し、かつ骨を形成する期間中、生理学的条件下、すなわち、in vivo状態でなければならない。ADAS細胞の存在によって、脊椎固定手術での骨の癒合が促進される。
【0146】
別の実施形態では、本発明として以下を含む哺乳動物における1以上の脊椎固定術を実施するための方法が含まれる: 少なくとも1つの好適な脊椎体間間隙の後方部分に、桿状体と椎弓スクリューまたはプレートと椎弓スクリューから選択される金属移植を、隣接する椎骨にそれらを接着することによって取り付ける; その脊椎体間間隙の前方部分に有効な量のADAS細胞を注入する; そしてADAS細胞を、少なくとも骨細胞の1つの特徴を表示して、それによってin vivoで骨を形成する細胞に分化させる。
【0147】
本発明として、脊椎体間間隙への前方、後方、または後側方進入法のいずれかを使用することによる、脊椎固定の実施方法が含まれる。後側方(一方の側方もしくは両側方)進入法は前方進入法よりも手術による死亡率が低下するが、脊柱管の馬尾およびそこから出る神経根の周囲で作業する間は注意が必要である。脊椎体間間隙の後方からの進入および可視化は前方進入法よりも制限が多いが、多くの脊椎外科医はこれらの状況をどのように取り扱うかについて訓練されている。
【0148】
本明細書中で別に検討するように、ADAS細胞に一定量の成長因子、骨形成性タンパク質、またはそのための医薬担体などの、骨成長を促進するのに好適な、1以上の活性な生体活性薬剤をも含ませることができる。
【0149】
ADAS細胞が治療上または構造上の効果をもたらす機序の1つは、新たに産生されるか、現存するか、あるいは修復された組織または組織成分中にそれら自身またはその子孫を組み込むことによるものである。例えば、ADAS細胞および/またはその子孫が新しく産生される骨または別の構造的もしくは機能的組織に組み込まれて、それによって治療上のまたは構造上の改善をもたらすか、これに寄与することができる。ADAS細胞が治療上のまたは構造上の利益を提供する別の機構の1つは、所定の組織もしくは組織成分の構造または機能の創設、維持、復旧および/または再生成を促進する分子、例えば成長因子、を発現し、かつ/または分泌することによるものである。
【0150】
本明細書中でさらに記載するように、ADAS細胞を、その他の細胞、あるいは合成もしくは生体スキャフォールドなどのデバイス、この細胞に関連する特徴を改変または増強する因子、薬品、化学物質またはその他の薬剤を送達するための、物質またはデバイスと組み合わせて使用してもよい。
【0151】
本明細書中に開示する発明にしたがって、哺乳動物から脂肪組織を回収した後すぐに、ADAS細胞をその哺乳動物に送達することができる。例えば、脂肪組織の処理およびADAS細胞の組成物の取得後すぐに、細胞を投与することができる。結局は、送達の時期は哺乳動物の入手可能性および脂肪組織の処理に要する時間に応じて決まる。別の実施形態では、本明細書で検討するように、哺乳動物に再注入する細胞に、その他の改変、精製、刺激、またはその他の操作を加える場合は、送達までの時間は比較的長くなる。哺乳動物に投与する細胞の数は、例えば、脂肪組織処理後の細胞の収率に関係する。細胞の総数の一部をその後の使用のために残すか、凍結保存してもよい。
【0152】
以下の実施例で本発明の態様をさらに説明する。しかし、これらはどんな意味にも、本明細書中に示す本発明の教示または開示を限定するものではない。
【実施例】
【0153】
ここで本発明を以下の実施例を引用して説明する。これらの実施例は説明のみの目的で提供するものであって、本発明はこれらの実施例に限定されるわけではなく、本明細書中に提供する教示の結果として明白なすべての変化形を包含する。
【0154】
以下の実験を実施して、脊椎固定手術の結果に対するADAS細胞の役割を調べた。例えば脊椎固定手術に及ぼす同系および同種異系ADAS細胞の効果である。ここでの結果は、ADAS細胞が骨形成性であって、脊椎固定の改善に寄与することを証明している。本開示に基づいて、ADAS細胞を使用して、被外傷動物、好適な数の骨形成細胞を欠損している骨粗しょう症哺乳動物、および非癒合骨折を有する哺乳動物を含むがそれらに限定されない哺乳動物を、治療することができる。
【0155】
実施例1: 脊椎固定手術における自己移植骨片の代替物
75%を超えるアメリカ国民が背中の痛みに苦しんでいる。いくつかの症例では、根底にある病気が背中の痛みをもたらすことがある。これらの病気として、脊柱側弯、脊椎管狭窄症、椎間板変性症、感染過程、腫瘍、および外傷が含まれる。人口の1%については、背中の痛みが非常に重篤であるので、生涯にわたり身体障害に向き合うことを余儀なくされる。人口の別の1%は背中の痛みによって限られた時間、動けなくなる。背中の痛みを持つ哺乳動物の大部分は保存療法によって治療される。しかし、安静および投薬などの療法で効果がない場合、外科医は脊椎固定手術を勧めることが多い。この手術の目的は2以上の隣接する椎骨間に異所性骨を形成させて、それら2つを一体化構造へと「癒合」させることである。椎骨関節の固定化が脊髄から出る神経根への圧迫とそれによる痛みの感覚を低減させる。外科医は腰椎への後側方進入法を使用して、異所性骨を形成させるため、2つの椎体間の構造的支持体とともに骨移植片または骨誘導性材料を導入する(図1)。
【0156】
何らかの特定の理論に束縛されることは望まないが、脊椎固定のための「理想的な」移植片材料は以下の性質を提供すると考えられる: 構造的支持(回復期間の間、材料が脊椎/手術部位を安定化する); 骨伝導性(材料がそれ自体の上で骨の内部成長および隣接する骨との一体化を促進する); 骨誘導性(材料が、骨の形成および成長を、天然にはそれを起こさないであろう細胞から動員し刺激する); ならびに骨形成性(それ自体新しい骨を形成する能力がある細胞を材料が含有する)。
【0157】
現在、脊椎固定修復のための「黄金標準」は、自己由来骨であり、通常はその個体の腸骨稜から取得する。外科医は哺乳動物自身の骨を必要な部位に移植する。それにもかかわらず、これは完璧な解決法には遠い。哺乳動物の30%で、手術後、ドナー部位が感染するか、傷つくか、骨折するか、または痛みが生じる。実際、哺乳動物が複数の脊椎固定のために自己移植骨を必要とする場合、腸骨稜は十分な材料を提供できない場合がある。その哺乳動物の根本的な健康状態が脊椎固定手術の結果にさらに影響を与える。骨粗しょう症または糖尿病、喫煙、もしくは加齢による血管の不良を持つ哺乳動物では、脊椎固定の部位の新たな骨形成の低下および非癒合を示す(Whangら、2003, Spine J. 3:155-65)。このように、脊椎固定手術における自己移植骨の代替物としての需要がある。
【0158】
利用し得る代替材料はあるが、すべて共通の限界に直面している。すなわち骨形成能力を持たないことである。遺体からの同種移植骨片を滅菌し、保存し、そして必要に応じて手術室で使用することができる。これらの材料を特定の使用のために事前に成形するか、または外科処置部位にペーストとして適用できるように粉末化することができる。しかし、同種移植片は炎症を起こさせ、免疫応答を誘発しうるし、また限られた数の事例では感染源となっている(Whangら、2003, Spine J. 3:155-65)。同種移植片骨は滅菌するので、これはもはや生存する天然の骨形成細胞(骨芽細胞、骨細胞)を含有せず、かつ骨形成特性を欠失している。臨床試験において、多層脊椎固定術では、同種移植片骨は自己移植骨よりも劣っている(Whangら、2003, Spine J. 3:155-65)。ヒドロキシアパタイトおよびリン酸三カルシウム(HA/TCP)などのセラミック材料は骨伝導性であり、新しい骨の形成を促進する。しかし、これらは骨形成性およびおよび骨誘導性の特性を欠損しているので、その利用性は限られる。骨形態形成タンパク質(BMP)などの骨誘導性成長因子が市販されている(Sofamor/MedtronicsのInfuseTM)が、新しい骨形成を促進するためには、脊椎固定部位の中に骨形成細胞の存在を必要とする(Whangら、2003, Spine J. 3:155-65)。骨形成細胞の開発はこれらの代替脊椎固定材料のいずれによる結果も改善する可能性を持つ。
【0159】
臨床前脊椎固定試験のモデルとして、多くの動物種が供されている。これらとして、ラット、ウサギ、イヌ、ヒツジ、ヤギ、および非ヒト霊長類が含まれる(Khanら、2004, Biomaterials 25:1475-85; Liebschnerら、2004, Biomaterials 25:1697-714; Sandhuら、2001, Eur. Spine J. 10:S122-31)。これらの中で、ラット(Bodenら、1998, Spine 23:2486-92; Cuiら、2001, Spine 26:2305-10; Wangら、2003、J. Bone Joint Surg. Am. 85-A: 905-l1)およびウサギ(Khanら、2004, Biomaterials 25:1475-85; Kruytら、2004, Biomaterials 25:1463-73)が、動物のサイズおよび費用の面で、「概念の実証」の研究のために使用された。それぞれの種において、外科医は、他の哺乳動物を治療するために使用したのと同様に、腰椎への後側方進入法を使用することができる。脊椎固定の実現可能性研究のために、ウサギがより普通に使用される(Khanら、2004, Biomaterials 25:1475-85)が、これは、部分的にはこの動物のサイズと、ウサギの脊椎固定速度がヒトで観察されるのと同様であるという、確認された観察によるものである。それにもかかわらず、ウサギはラットモデルに比較して、一定の欠点を示す。十分特性決定された近交配系が入手可能なラットとは異なって、実験用ウサギは同系または類似遺伝子型ハプロタイプを示さない。したがって、ウサギ1個体から別の個体へ拒絶のリスクが無く細胞を常套的に移植するのは不可能である。ラット後側方脊椎固定モデルを使用して、コラーゲンスキャフォールド中で提供した骨形態形成タンパク質7の骨誘導性効果を証明するのに成功した(Salamonら、2003, J. Spine Disord. Tech. 16:90-5)。いくつかのグループがラットモデルを使用して、脊椎固定に対する骨髄ストローマ細胞の骨形成効果を評価するのに成功した(Bodenら、1998, Spine 23:2486-92; Cuiら、2001, Spine 26:2305-10; Wangら、2003, J. Bone Joint Surg. Am. 85-A:905-l1)。彼らは、スキャフォールド単独と比較して、骨髄ストローマ細胞の移植後4〜9週間以内の脊椎固定において統計的に有意な改善を達成した。各研究で、n = 4〜8匹の動物のコホート集団を使用した。
【0160】
脊椎固定術におけるADAS細胞の役割を評価するため、以下の実験を計画する。
【0161】
ADAS細胞の単離
雄Fischerラットから皮下脂肪組織を採取する(8〜10週齢、n = 25、1ラット当たり約3グラムの組織を取得)。ADAS細胞を公表されている方法論にしたがって調製する(Austら、2004, Cytotherapy 6:7-14; Halvorsenら、2001, Metabolism 50:407-413; Senら、2001, Journal of Cellular Biochemistry 81:312-319)。簡単に述べると、脂肪組織を細かく切り、洗浄し、そして1%ウシ血清アルブミンおよび0.1%コラゲナーゼI型(Worthington Biochemical, Lakewood NJ)を含有する等量のリン酸緩衝化生理食塩水中に懸濁する。37℃で撹拌(50 rpm)しながら60分の消化後、懸濁物を室温で5分間、1200 rpmで遠心分離して、ストローマ血管画分細胞をペレット化する。このストローマ血管細胞を、「Stromal Media」(10%ウシ胎仔血清(Hyclone、Logan UT)および1%抗生物質/抗真菌剤を補充したDMEM/ハムF-12培地)中に1 cm2当たり組織消化物0.1グラムの密度で、プレーティングする。細胞を加湿5% CO2インキュベーター内で75%集密度に達するまで、3〜6日間インキュベートする。これで約25〜30 X 104細胞/cm2が生成される。この時点で、ADAS細胞をトリプシン/EDTAでの消化によって回収し、5 x 103細胞/cm2のプレーティング密度で継代培養する。細胞を2継代まで増殖させて、6000万個を超える細胞(表1)を取得する。細胞を、文献に記載されているように、1〜3週間にわたる誘導期間での標準的アッセイを使用して、その骨形成能および脂肪細胞形成能について、in vitroで評価する(Halvorsenら、2001, Tissue Eng. 7:729-41; Hicokら、2004, Tissue Engineering 10:371-380)。使用まで、細胞は液体窒素中で凍結保存することができる。
【0162】
細胞を組織学的に追跡する目的で、最初の継代培養中に、追跡可能なマーカーを提供するようにβ-ガラクトシダーゼを発現するLacZ遺伝子を保有するレトロウイルスベクターで細胞を標識する。レトロウイルスベクターの安定した組み込みは、移植期間中にマーカーが失われるというリスクを低下させる。この方法を常套的に使用して、移植した細胞を追跡した。
【表1】

【0163】
実施例2: ADAS細胞のin vitro骨形成
ヒトADAS細胞は、アスコルビン酸塩、β-グリセロリン酸塩、デキサメタゾン、および1,25ジヒドロキシビタミンD3の存在下で培養したとき、in vitroで骨形成性表現型を示することが証明されている(Halvorsenら、2001, Tissue Eng. 7:729-41)。これらの条件下で、ADAS細胞は、リン酸カルシウム沈着についてのアリザリンレッドまたはvon Kossaのいずれかによる陽性染色によって証明されるように、それらの細胞外マトリックスを石灰化する(図3)。
【0164】
10日間にわたるヒトADAS細胞の骨形成にはアルカリホスファターゼ活性の増大が伴うことが観察された。培養期間の終了時、(石灰化された)骨形成細胞は、対照条件下に維持した細胞に比較して、アルカリホスファターゼのレベルが3倍高かった(図4)。同様に、骨形成条件下では、分泌されるオステオカルシンタンパク質のレベルが時間依存的に増加した。ADAS細胞は、オステオカルシン、オステオポンチン、骨形態形成タンパク質(BMP)2および4、ならびにBMP受容体IA、IB、およびIIを始めとする、骨芽細胞表現型に合致する多くの遺伝子マーカーを発現した。
【0165】
ADAS細胞が複数の系統経路にしたがって分化する能力を持つことも証明された。化学物質と成長因子の特定カクテルに応答して、ADAS細胞は軟骨細胞、骨芽細胞、脂肪細胞、ならびに神経様およびグリア様細胞にin vitroで分化することができる(図2)。
【0166】
実施例3: ADAS細胞はin vivoで骨形成性である
in vitroでの知見を拡大するため、ヒトADAS細胞を免疫不全SCIDマウスに移植した。ADAS細胞を、ヒドロキシアパタイト/リン酸三カルシウム(HA/TCP)のスキャフォールドの3 cm3の立方体上にロードし、皮下移植した。6週間後、この移植物を取り出し、固定し、脱灰し、ヘマトキシリン/エオシンまたはヒト核抗原特異的抗体で染色した(図5)。H&E染色に基づいて、ヒトADAS細胞の存在下で、ヒドロキシアパタイト/リン酸三カルシウムスキャフォールドの近傍で新しい骨が形成されたことが観察された。ヒト細胞は、ヒト抗原特異的抗体による免疫蛍光分析に基づいて、骨内で同定された。スキャフォールドのみ(細胞を含まない)の存在下では、新しい骨は形成されず、ヒト細胞も検出されなかった。これらの研究から、ADAS細胞はin vivoで骨形成能力があることが証明される。
【0167】
実施例4: ADAS細胞は同種異系移植がされうる
脊椎固定モデルにおけるADAS細胞の同種異系移植の概念の実証を提供するため、以下の実験を実施する。ADAS細胞は混合リンパ球反応において同種異系リンパ球から増殖性応答を誘発することができないことが証明されている。いかなる特定の理論に束縛されることも望まないが、ADAS細胞は、同種異系抗原に対するリンパ球の免疫応答を阻害する因子を放出すると考えられる。ヒヒモデルではADAS細胞の存在によって皮膚移植片の生存期間が延長されたので、このことは組織工学用途のために成人幹細胞を同種異系移植することができることを示している。
【0168】
イヌモデルを使用して、イヌの大腿骨幹に重大なサイズの部分欠損を作製することができる。ヒドロキシアパタイト/リン酸三カルシウムスキャフォールドを単独でまたは自己由来もしくは同種異系ADAS細胞のいずれかと組み合わせて用いて、この欠損を修復させることができる。同種異系細胞はHLA-IおよびHLA-2抗原のいずれとも不適合である(表2)。移植レシピエントはいかなる免疫抑制療法も受けない。この動物を16週間後に絶命させ、ADAS細胞存在下で観察される骨修復の程度をスキャフォールド単独(ADAS細胞を含まない)の移植と比較することができる。いかなる特定の理論にも束縛されることは望まないが、同種異系ADAS細胞と自己由来のものの間では、得られる修復に何ら有意な差異が観察できないであろうし、また同種異系細胞に対するいかなる免疫応答の証拠もないであろうと考えられる。これらの実験は、組織工学的構築物中への成人幹細胞の同種異系移植が実現可能であり、いくつかの事例では免疫抑制療法を必要としないという事実を証明するものとなる。
【表2】

【0169】
実施例5: 脊椎固定での同系ADAS細胞
ADAS細胞がin vivoで骨形成性であって、好適な生体物質担体と組み合わせることによって、動物モデルでの脊椎固定を改善および加速することができるという仮説に取り組むため、以下の実験を実施する。表3に実験計画を要約して示す。最初の研究は、ヒト自己由来細胞移植において存在する状況を模倣するため、同系ADAS細胞(同一系統のラットからの細胞)を用いて実施する。免疫応答および拒絶に関係する問題を除去することによって、これらの実験で脊椎固定のためのADAS細胞の骨形成能力に焦点が当てられる。脊椎固定モデルとしてラットを使用するこれらの実験を当分野で知られている方法にしたがって設計する(Bodenら、1995, Spine 20:412-20; Wangら、2003, J. Bone Joint Surg. Am. 85-A: 905-ll; Cuiら、2001, Spine 26:2305-10; Sandhuら、2001, Eur. Spine J. 10 Suppl. 2: S122-31; Wangら、2003, 脊椎 J. 3: 155-65)。
【0170】
外科手術および安楽死
Cui(Cuiら、2001, Spine 26:2305-10)の記載にしたがって、96匹の雌Fischerラットに単層横突間(intertransverse)脊椎関節固定術(L4-L5)を実施する。動物をケタミン(80 mg/kg)およびキシラジン(7 mg/kg)で麻酔し、剃毛し、覆いをかけ、その皮膚をベタジンおよび70%エタノールで消毒する。L3からL5まで、正中線後部縦切開を実施する。棘突起および椎弓板に沿って椎間関節の外側面まで、骨膜を持ち上げる。骨鉗子を使用して椎間関節を除去し、創傷部を生理食塩水溶液で洗浄する。動物からランダムにn = 32のコホートを構成する。コホートAは治療しない。コホートBには癒合部にヒドロキシアパタイト/リン酸三カルシウム(40 mg)単独の移植を施す。コホートCには癒合部に、Fischerラットの皮下脂肪組織由来の2 x 106 ADAS細胞(同系細胞)と組み合わせたヒドロキシアパタイト/リン酸三カルシウム(40 mg)の移植を施す。移植物の配置後、深在筋膜および皮膚切開部を縫合する。術後の鎮痛のために塩酸ブプレノルフィン(0.1 mg/kg)を与えた動物を、術後24時間まで、運動性および機能の回復についてモニターする。外科手術の6および12週間後に、各コホートからの16匹の動物のグループを、CO2窒息によって絶命させる。その時点で、分析のため、血清試料および腰椎を採取する。
【0171】
X線による検証
手術後および手術後6週間間隔で、動物について腰仙椎の前後および側方X線撮影をする。X線分析は、腰椎の手術部位での異所性骨形成および仮骨形成を検出するのに役立つ。絶命後、切除した検体について微小コンピュータ断層撮影(微小-CT)を実施する。当分野で既知の方法を使用して、新しい骨形成物の構造および体積を測定することができる(Mankaniら、2004, Radiology 230:369-76)。
【0172】
脊椎癒合の手触診
動物の絶命の際に、L3-L5腰椎を動物から切除する。検体について、L3-4およびL4-5での伸張および弯曲について触診する。検体を何らかの運動性の有無について等級化する。いずれかの方向に運動性がある検体にはスコア「0」をつけ、一方どの次元でも運動性がないものはスコア「1」として癒合したものと考える(Cuiら、2001, Spine 26:2305-10; Grauerら、2004, Spine J. 4:281-6)。
【0173】
脊椎癒合の生体力学的試験
試験の前に、すべての筋肉を除去し、L4-5で椎間板を分断して、癒合物のみが2つの椎骨を接続しているようにする。スチールk-ワイヤ(3.2 mm)ピンを椎体内に前後方向に入れる。k-ワイアに沿って負荷をかけて、0.5 cm/分の変位速度で、一軸引張試験を実施する。伸縮計によって変位を測定し、ロードセルによって負荷を測定する。コンピュータ処理した負荷変位プロットから、破断するピーク負荷を測定する。この負荷変位曲線上の2点(破断までの50%および75%負荷点)間の曲線の傾きとして、剛性を決定する。同様の手法でL3-4に隣接するセグメントを試験する。
【0174】
組織学的分析
腰椎検体(各コホートについて各時点でのn = 8)をホルマリン中で48時間固定し、リン酸緩衝化生理食塩水中の0.25 Mエチレンジアミン四酢酸で2週間、4℃で脱灰し、X-gal(1 mg/ml)の溶液中、37℃で16時間、インキュベートする。検体をパラフィンに埋め込み、横切断し(5μm)、ヘマトキシリンおよびエオシンで染色する。Medivue(Nikon)ソフトウェアを使用して、各検体からの10個の切片を分析して、異所性骨によって占有される各移植物の平均%(±標準偏差)を定量する。
【0175】
いかなる特定の理論にも束縛されることは望まないが、ADAS細胞は以下の結果が得られるならば、脊椎固定に成功していると考えられる: 1) コホートA(未処置)で6および12週目の時点で、癒合の最低限証拠(動物の90%で手動操作癒合スコアが0であり、異所性骨のX線による証拠がなく、組織学およびCT解析に基づいて1検体当たり10個の切片で手術部位の面積の5%未満が骨マトリックスにより占有されている)が観察される; 2) コホートBおよびCで6および12週目の時点の動物の組織学的分析での、HA/TCPスキャフォールドの検出; 3) コホートB(HA/TCP単独)で6および12週目の時点での、癒合の最低限証拠(動物の90%で手動操作癒合スコアが0であり、異所性骨のX線による証拠がなく、組織学およびCT解析に基づいて1検体当たり10個の切片で手術部位の面積の5%未満が骨マトリックスにより占有されている); 4) コホートCで手術後6週間の、β-ガラクトシダーゼ酵素活性または組織学的分析での免疫検出に基づいた、移植されたADAS細胞の検出; および5) スキャフォールド単独(コホートB)または空の損傷部(コホートA)対照に比較して、6および12週目の時点で、ADAS細胞の存在下(コホートC)での優れた脊椎固定(動物の90%で手動操作癒合スコアが「1」であり、手術部位で異所性骨のX線による証拠があり、組織学およびCT解析に基づいて、1検体当たり10個の切片でHA/TCP移植物の面積の30%を超える割合が骨マトリックスによって占有されている)。
【0176】
この実施例で設定した実験は、ラットモデルでの腰椎固定を促進かつ改善するための、ADAS細胞の有用性に取り組むのに役立つものである。
【表3】

【0177】
実施例6: 脊椎固定での同種異系ADAS細胞
ADAS細胞を、生体物質スキャフォールドとともに同種異系移植することによって、生体物質スキャフォールド単独に比較して優れた脊椎固定が達成されるという仮説に取り組むため、以下の実験を実施する。表4に実験計画を要約して示す。骨髄由来のMSCを移植して、明白な免疫拒絶の証拠を示さずに骨の欠損を修復することが可能であることは示されている(Arinzehら、2003, J. Bone Joint Surg. Am. 85- A:1927-35)。本明細書中で開示する実験は腰椎固定モデルでの同種異系ADAS細胞の有用性を証明している。
【0178】
文献中の以前の研究(Akahaneら、1999, J. Bone Miner Res. 14:561-8; Yoshikawaら、2000, J. Bone Miner Res. 15:1147-57)に基づいて、以下の実験のために、FischerおよびACI近交系ラットを選択する。これらの動物は組織適合性抗原不適合を示し、所定の免疫抑制療法無しでは骨形成性組織移植物を拒絶する(Akahaneら、1999, J. Bone Miner Res. 14:561-8; Yoshikawaら、2000, J. Bone Miner Res. 15:1147-57)。
【0179】
Fischerラットの腰椎固定部への移植のために、ACIラットから単離した同種異系ADAS細胞を使用する。同系自己由来ADAS細胞に関係する実験と平行して、本明細書中の実験を実施し、それによって、比較分析が可能になる。同種異系ADAS細胞に対する免疫応答の有無を、一方向混合リンパ球反応およびコホートから取得した血清サンプルのフローサイトメトリー分析に基づいて、評価することができる。
【表4】

【0180】
本明細書中で別に述べるように、皮下脂肪組織を雄ACIラット(8〜10週齢、n = 25、1ラットについて約3グラムの組織を取得)から採取する。各継代から取得する細胞の数は表1に概説した算出にしたがう。ACIラットからのADAS細胞を、FischerラットADAS細胞について使用したものと同一のin vitro分析に供する。本明細書中で別に記載したように、手術および検証法(すなわちX線検証、脊椎固定の手触診)を実施する。HA/TCP移植物に体積100μl中に約 2 x 106細胞を含ませることができる。
【0181】
組織学的分析のため、腰椎検体をホルマリン中で48時間固定し、リン酸緩衝化生理食塩水中の0.25 Mエチレンジアミン四酢酸で2週間、4℃で脱灰し、X-gal(1 mg/ml)の溶液中、37℃で16時間、インキュベートする。検体をパラフィンに埋め込み、横切断し(5μm)、ヘマトキシリンおよびエオシンで染色する。Medivue(Nikon)ソフトウェアを使用して、各検体からの10個の切片を分析して、異所性骨によって占有される各移植物の平均%(±標準偏差)を定量する。浸潤性リンパ球の有無について、切片を評価する。いかなる特定の理論にも束縛されることは望まないが、移植物内またはその周囲の任意の免疫細胞を同定するための細胞の免疫組織学的染色用に、汎造血系抗体に対する抗体(抗CD45)を使用することができる。浸潤性リンパ球の数は、1検体当たり10個の切片で、Medivueソフトウェアプログラムを使用して、定量することができる。
【0182】
血清免疫応答
ACI系統のADAS細胞への血清抗体の結合を、フローサイトメトリーによって評価する。ACIラットからのADAS細胞を液体窒素保存物からすばやく解凍し、5日間培養して、最大の生存力および表面抗原の発現を促進する。トリプシン処理によって細胞を採取し、染色用バッファー(Ix DPBS、5% FBS、0.5% BSA、0.1%アジ化ナトリウム)で洗浄し、5 x 106細胞/mlで再懸濁させる。細胞(5 x 105細胞)90μlを2 ml エッペンドルフチューブに分注する。各チューブに、未希釈ラット血清、または染色バッファー中に1:10で希釈した血清10μlを添加して、1:10および1:100の効果的な血清の希釈物を取得する。すべてのチューブを氷上で30分インキュベートし、洗浄用バッファー(IX DPBS、0.5% BSAおよび0.1%アジ化ナトリウム)で洗浄し、その後染色用バッファー100μl中に再懸濁させる。すべてのチューブに、ヤギ抗ラット(IgG/IgM)FITC二次抗体を最終希釈度1:100で添加する。対照のチューブには、二次抗体のみ(陰性対照)、またはACI ADAS細胞でのFischerラットの反復免疫化によって産生されたFischer抗ACIラット血清(陽性抗体)とともにACI ADAS細胞を入れる。それら懸濁物を暗所の氷上で15分インキュベートし、本明細書中で別に記載する洗浄用バッファーで2回洗浄する。次に、細胞を1%パラホルムアルデヒド200μl中で固定し、氷上にて固定液中で少なくとも15分インキュベートした後、回収する。フローサイトメトリー分析用に20,000個を取得する。結果を、二次抗体単独の陰性対照に比較した平均蛍光強度の増加に基づいた、二次抗体で染色されたACI細胞の%で表される。
【0183】
一方向混合リンパ球反応(MLR)
このアッセイは以下の論理的根拠に基づくものである: T細胞がin vivoでACI同種抗原で感作されるならば、それらはin vitroでの再刺激に対して、より速い動力学的速度で応答するであろう。同種異系ACI系統のADAS細胞に対するレシピエントラットT細胞の活性化はMLRアッセイによって評価することができる。応答細胞としてプールしておいた腸間膜プラス頸部LN細胞を使用して、各ラットについてMLRアッセイを実施する。以下の3グループから1グループ当たり8匹の動物を評価する(表5): 処置しない(コホートA); スキャフォールドのみ(コホート B); スキャフォールド + 同種異系細胞(コホート D)。このアッセイは、応答細胞を、培地中、放射線照射(5000R)した同系Fischer脾臓刺激細胞、または放射線照射した同種異系ACI脾臓刺激細胞とともに培養することにより準備される。培地または同系脾臓細胞に応答したT細胞増殖がバックグラウンド応答となる。これはつまり、典型的には、同種異系細胞に対する応答から同系応答を差し引くことで、真の増殖を評価する。陽性または陰性対照として、放射線照射した同種異系ACI(陽性)および同系Fischer(陰性)リンパ球を用いてアッセイを準備する。これはつまり、同種異系 対 同系HLA 1および2抗原の両方の発現が応答細胞であるFischer由来リンパ球による頑健な増殖性応答、または無応答のいずれかを確実にする。96ウェルプレート中で、1処置について3重にウェルを使用して、MLRアッセイを実施する。応答細胞を4 x 105細胞/ウェルでプレーティングし、脾臓細胞刺激細胞は1 x 105細胞/ウェルでプレーティングする。使用する培養培地は非必須アミノ酸、ピルビン酸ナトリウム、2-メルカプトエタノール、および抗生物質/抗真菌剤を補充したIscove改変ダルベッコ培地+10% FBS(Hyclone)である。培養の3および7日目の回収用に、レプリカ培養プレートを準備する。2または6日目に、培養物を3H-チミジン(1μCi/ウェル)でパルス刺激し、約16時間後、シンチレーション計数のために、細胞を回収する。結果を1分当たりのカウント数(cpm)で報告するが、これは培養ウェル内のT細胞増殖の程度を反映するものである。
【表5】

【0184】
いかなる特定の理論にも束縛されることは望まないが、同種異系ADAS細胞は以下の結果が得られるならば、脊椎固定に成功していると考えられる: コホートA(未処置)で6および12週目の時点で、癒合の最低限証拠(動物の90%で手動操作癒合スコアが0であり、異所性骨のX線による証拠がなく、組織学およびCT解析に基づいて、1検体当たり10個の切片で手術部位の面積の5%未満が骨マトリックスにより占有されている); コホートBおよびDで6および12週目の時点の全動物の組織学的分析での、HA/TCPスキャフォールドの検出; コホートB(HA/TCP単独)で6および12週目の時点での、癒合の最低限証拠(動物の90%で手動操作癒合スコアが0であり、異所性骨のX線による証拠がなく、組織学およびX線解析に基づいて1検体当たり10個の切片で手術部位の面積の5%未満が骨マトリックスによって占有されている) ; コホートB(HA/TCP単独)で6および12週目の時点での、癒合の最低限証拠(動物の90%で手動操作癒合スコアが0であり、異所性骨のX線による証拠がなく、組織学およびCT解析に基づいて1検体当たり10個の切片で手術部位の面積の5%未満が骨マトリックスによって占有されている); コホートDで手術後6週間までの、組織学的分析におけるβ-ガラクトシダーゼ酵素活性に基づいた、移植されたADAS細胞の検出; スキャフォールド単独(コホートB)または空の損傷部(コホートA)対照に比較して、6および12週目の時点で、ADAS細胞の存在下(コホートD)での、優れた脊椎固定(動物の90%で手動操作癒合スコアが「1」であり、手術部位で異所性骨のX線による証拠があり、組織学およびCT解析に基づいて1検体当たり10個の切片でHA/TCP移植物の面積の30%を超える割合が骨マトリックスによって占有されている); コホートAおよびB(細胞処理しない)に比較して、コホートCおよびD(ADAS細胞移植物)における抗ADAS抗体レベルの増加が1.5倍未満; ならびにコホートA、BおよびDを比較したとき、一方向混合リンパ球反応において、培地単独または同系由来脾臓細胞に比較して、同種異系由来脾臓細胞によって刺激された応答細胞の増殖の増強の証拠がない。混合リンパ球反応の陽性対照は少なくとも10,000 cpmの増殖応答を示すはずである。
【0185】
実施例7: 脊椎固定モデルにおける同系および同種異系ADAS細胞の比較および相対的有効性の対比
本明細書中に示す開示は、同種異系(HLA不適合)および同系(HLA適合性)ADAS細胞が脊椎固定を達成する上で同等の機能を示すかどうかの判定を可能にする、データを提供する。この実験計画を表6に要約する。いかなる特定の理論にも束縛されることは望まないが、同種異系MSCを使用して、イヌにおける重大なサイズの骨の欠損の修復達成に成功したという以前の研究(Arinzehら、2003, J. Bone Joint Surg. Am. 85- A:1927-35)に基づけば、2つの細胞集団は同等であると考えられる。同系および同種異系ADAS細胞の比較は、重要な医学的および商業的意義を提供する。本明細書中に示す開示は、組織再生療法のための同種異系ADAS細胞の使用を提供する。
【表6】

【0186】
いかなる特定の理論にも束縛されることは望まないが、同種異系および同系ADAS細胞コホート間で、表6のすべてのパラメーターが統計学的有意差を示さない(p > 0.05、好ましくはp > 0.30)場合には、脊椎固定の成功について、同種異系ADAS細胞は同系ADAS細胞に匹敵すると考えられる。
【0187】
本明細書中に引用したそれぞれおよびすべての特許、特許出願、および刊行物の開示は、その全部を参照として本明細書中に組み入れる。
【0188】
本発明を特定の実施形態を引用して開示したが、本発明の真の精神および範囲から逸脱することなく、他の当業者が本発明の別の実施形態および変更形を考案できることは明らかである。添付する特許請求の範囲はこうした実施形態および等価な変更形のすべてを含むことを意図している。
【背景技術】
【0001】
骨の病態には一般的に以下の2つのタイプがある: 1) 非代謝性の骨の病態、例えば骨折、骨/脊椎変形、骨肉腫、骨髄腫、骨異形成および脊柱側弯など、ならびに2) 代謝性の骨の病態、例えば骨粗しょう症、骨軟化症、くる病、線維性骨炎、腎性骨ジストロフィーおよび骨のパジェット病など。代謝性骨の病態の1つである骨粗しょう症は、骨量の減少および骨組織微細構造の変化による骨の脆弱性および易破壊性の増加に特徴がある全身性疾患であり、その主要な臨床症候として以下が含まれる:脊柱後弯症、ならびに背腰骨、椎骨中心、大腿骨頚部、とう骨底端部、肋骨、上腕骨上端部およびその他の骨折。骨組織中で、骨形成と骨吸収による破壊は定常的に発生している。この骨形成と骨吸収による骨破壊との間のバランスが悪化すると、骨の量的減少が発生する。骨粗しょう症の治療のためには、従来、エストロゲン、カルシトニンおよびビスホスホナートなどの骨吸収抑制剤が主として使用されてきた。
【0002】
骨/脊椎疾患に関して、アメリカ人口の75%以上が、その人生のどこかの時点で、背中の痛みに悩まされる。根底にある医学的疾病が背中の痛みをもたらすこともある。これらとして以下が含まれる: 脊柱側弯、脊椎狭窄、椎間板変性症、感染過程、腫瘍、および外傷。骨幹骨の大きな部分での損傷の修復は今日整形外科医が直面する重大な問題である。こうした骨の欠損は急性負傷によって発生することもあるが、それらの大規模な損傷は先天性奇形、良性および悪性腫瘍、骨感染、ならびに非癒合性骨折から共通して二次的にもたらされるものである。新鮮な自己骨移植片材料の使用が、歴史的に治療の標準として考えられてきたが、これは感染、奇形および機能の欠失などの実質的な罹病を伴う(Kahnら、1995、Clin. Orthop. ReI. Res. 313:69-75)。移植片の採取がもたらす難題から、その供給の限界も相まって、臨床的に重大な骨損傷の修復のための別の戦略の開発に向けられることとなった。この問題の主要な解決手法として、有効な骨移植物材料の開発に焦点が向けられた。
【0003】
これらの研究成果から、骨移植物の一般的な3つのクラスが現れたが、これらのクラスは骨伝導性、骨誘導性、または直接骨形成性として分類することができる。同種移植骨はおそらく最もよく知られているタイプの骨伝導性移植物である。多年にわたって広く使用されてはいるが、病気の伝染のリスク、宿主拒絶、および骨誘導性の欠如がその有望性を損なわせている(Leads, 1988, JAMA 260:2487-2488)。合成骨伝導性移植物には、チタン繊維金属ならびにヒドロキシアパタイトおよび/またはリン酸三カルシウムで構成されるセラミックスが含まれる。これらの移植物の適度な多孔質性が骨成長を促進するが、それらの骨誘導性能力の欠如から、その利用性には限界がある。多様な骨誘導性化合物も研究されてきた。これらとして脱灰骨マトリックスが含まれ、これは、骨形態形成タンパク質(BMP)を含有することが知られている。BMPの最初の発見以来、他者が特性決定し、クローン化し、発現させ、大きな骨損傷の修復のために、精製または組換えBMPを同所移植した(Gerhartら、1993、Clin. Orthop. ReI. Res. 293:317-326; Stevensonら、1994、J. Bone Joint Surg. 76:1676-1687; Wozneyら、1988 Science 242:1528-1534)。この手法の成功は、BMPによって提供される誘導性シグナルに応答する能力がある間葉細胞の存在によるものであった(Laneら、1994, In First International Conference on Bone Morphogenic Proteins)。骨形成分化を経験し、最終的に手術部位での新たな骨合成を担うのは、これらの間葉細胞前駆細胞である。
【0004】
骨誘導性手法の別法の1つが、直接的に骨形成性の生細胞の移植である。骨髄は骨形成能を持つ細胞集団を含有することが示されているので、骨格の修復が必要な部位への新鮮な自己または同系骨髄の移植に基づく実験的治療法を考案する者が出た(Grundelら、1991, Clin. Orthop. ReI. Res. 266:244-258; Werntzら、1996, J. Orthop. Res. 14:85-93; Wolffら、1994, J. Orthop. Res. 12:439-446)。原理としては正しいが、必要な数の骨前駆細胞を含む十分な骨髄の取得の実現性には限界がある。
【0005】
再生医療の最新分野では、損傷した組織および器官を修復するための新規治療法として、生体材料、成長因子、および細胞の併用を模索している。この専門分野が成長するとともに、組織再生での適用に供するための、信頼性があり、安全で有効なヒト成人幹細胞の起源材料への需要がある。規制上の目的から、これらの細胞は定量的な尺度での純度が確定されなければならない。臨床レベルでの実用上の目的のためには、これらの細胞は治療時点での要請に応じて即時に入手できる「既製」品として市販されていなければならない。商業上の観点からは、自己由来ではなく、同種異系の成人幹細胞の移植のための利用可能性は、製品の開発上顕著に有利な影響を与えるはずである。こうした状況下では、1体のドナーに由来する細胞の単一のロットを複数の哺乳動物に移植することができれば、品質管理および品質保証の両方のコストを低下させることとなる。
【0006】
研究から、複数の組織部位での成人幹細胞の存在が証明されている。間葉幹細胞(MSC)または骨髄ストローマ細胞(BMSC)として知られている、骨髄に由来する細胞は十分に特性決定されている(Castro-Malaspinaら、1980, Blood 56:289-30125; Piersmaら、1985, Exp. Hematol 13:237-243; Simmonsら、1991, Blood 78:55-62; Beresfordら、1992, J. Cell. Sci. 102:341-3 51; Liesveldら、1989, Blood 73:1794-1800; Liesveldら、Exp. Hematol 19:63-70; Bennettら、1991, J. Cell. Sci. 99:131-139)。最近の研究で、同種異系骨髄由来のMSCを移植し(Bartholomewら、2002, Exp. Hematol. 30:42-8)、これを使用してイヌモデルでの危機的な大きさの整形外科的損傷を修復する(Arinzehら、2003, J. Bone Joint Surg. Am. 85- A: 1927-35)ことができることが証明された。しかし、MSCは有核骨髄細胞10,000〜100,000個のうち約1個、または骨髄吸引物1 ml当たり約200細胞に相当する(Bruderら、2000, Principles of Tissue Engineering, 2nd Edition, Academic Press)。組織再生での適用に十分な数のMSCを取得するためには、骨髄由来のMSCのin vitroでの複数回の継代培養による増数が必要である。
【0007】
骨髄とは異なって、脂肪組織は外科的採取が容易であり、アメリカの平均的成人には豊富にある。最近、脂肪組織が幹細胞の起源として役立つことが証明された(脂肪由来の成人幹細胞、すなわちADAS細胞として知られている)。これらの細胞は複数の系統経路にしたがって分化する能力がある。ヒトおよびげっ歯類ADAS細胞は、特定の化学物質、ホルモン、および/またはサイトカインに応答して、脂肪細胞、骨細胞、軟骨細胞、筋肉細胞、および神経細胞に合致する生化学的および組織学的特性を発現する。最近の研究では、マウスADAS細胞は危機的な大きさの頭蓋冠損傷の修復を促進した(Cowanら、2004, Nat. Biotechnol. 22:560-7)。
【0008】
骨移植術は骨の病態の治療のために使用されることが多い。実際、世界で毎年1400万以上の骨移植手術が実施される。骨移植の成功または失敗は、移植片の部位の生存性、移植片の加工、および移植を受ける組織の免疫学的適合性などの、多数の要因によって決まる。骨の病態の患者数から見ても、治療、診断、および研究に使用する新たな骨材料への需要がある。本発明はこの需要を満足させるものである。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Kahnら、1995、Clin. Orthop. ReI. Res. 313:69-75
【非特許文献2】Leads, 1988, JAMA 260:2487-2488
【非特許文献3】Gerhartら、1993、Clin. Orthop. ReI. Res. 293:317-326
【非特許文献4】Stevensonら、1994、J. Bone Joint Surg. 76:1676-1687
【非特許文献5】Wozneyら、1988 Science 242:1528-1534
【非特許文献6】Laneら、1994, In First International Conference on Bone Morphogenic Proteins
【非特許文献7】Grundelら、1991, Clin. Orthop. ReI. Res. 266:244-258
【非特許文献8】Werntzら、1996, J. Orthop. Res. 14:85-93
【非特許文献9】Wolffら、1994, J. Orthop. Res. 12:439-446
【非特許文献10】Castro-Malaspinaら、1980, Blood 56:289-30125
【非特許文献11】Piersmaら、1985, Exp. Hematol 13:237-243
【非特許文献12】Simmonsら、1991, Blood 78:55-62
【非特許文献13】Beresfordら、1992, J. Cell. Sci. 102:341-3 51
【非特許文献14】Liesveldら、1989, Blood 73:1794-1800
【非特許文献15】Liesveldら、Exp. Hematol 19:63-70
【非特許文献16】Bennettら、1991, J. Cell. Sci. 99:131-139
【非特許文献17】Bartholomewら、2002, Exp. Hematol. 30:42-8
【非特許文献18】Arinzehら、2003, J. Bone Joint Surg. Am. 85- A: 1927-35
【非特許文献19】Bruderら、2000, Principles of Tissue Engineering, 2nd Edition, Academic Press
【非特許文献20】Cowanら、2004, Nat. Biotechnol. 22:560-7
【発明の概要】
【課題を解決するための手段】
【0010】
発明の簡単な要約
本発明として、哺乳動物における脊椎固定手術後の骨の癒合の促進方法であって、脂肪組織由来の単離された成人ストローマ(ADAS)細胞を前記哺乳動物の脊椎へ投与することを含み、ここで、前記ADAS細胞が骨細胞の特徴の少なくとも1つを発現する細胞にin vivoで分化する、前記方法が含まれる。
【0011】
本発明としてまた、哺乳動物における1以上の脊椎固定の実施方法であって、脂肪組織由来の単離された成人ストローマ(ADAS)細胞を前記哺乳動物の脊椎へ投与することによって単層または多層脊椎固定を促進することを含む方法が含まれる。好ましくは、哺乳動物の脊椎へのADASの投与後、このADAS細胞は骨細胞の特徴の少なくとも1つを発現する細胞にin vivoで分化する。
【0012】
1態様においては、ADAS細胞の哺乳動物への投与の前に、この細胞を分化するように誘導することなく一定時間in vitro培養する。
【0013】
別の態様において、ADAS細胞はその哺乳動物に対して同種異系である。
【0014】
さらに別の態様において、ADAS細胞は脊椎椎体間固定のための骨形成を誘導する。
【0015】
別の態様において、ADAS細胞は脊椎横突起間(intertransverse process)固定のための骨形成を誘導する。
【0016】
1態様において、ADAS細胞はさらに生体適合性マトリックスを含む。好ましくは、生体適合性マトリックスは、アルギン酸カルシウム、アガロース、フィブリン、コラーゲン、ラミニン、フィブロネクチン、グリコサミノグリカン、ヒアルロン酸、ヘパリン硫酸、コンドロイチン硫酸A、デルマタン硫酸、および骨マトリックスゼラチンからなる群から選択される。
【0017】
別の態様において、ADAS細胞は遺伝的に改変されたものである。
【0018】
さらに別の態様中、ADAS細胞は哺乳動物の脊椎の1以上の椎体間間隙中に投与される。
【0019】
別の態様中、脊椎固定は、頸部関節、胸部関節、腰部関節、腰仙関節および仙腸(SI)関節からなる群から選択される脊椎のセグメント内のものである。
【0020】
さらに別の態様において、ADAS細胞は、後方進入法、後側方進入法、前方進入法、前側方進入法、および側方進入法からなる群から選択された進入法によって1以上の椎体間間隙に投与される。
【0021】
さらに別の態様において、哺乳動物はヒトである。
図面の簡単な説明
本発明を説明する目的で、本発明のいくつかの実施形態を図面に示す。しかし、本発明はこれらの図面に描写した実施形態の厳密な配置および手段に限定されるものではない。
【図面の簡単な説明】
【0022】
【図1】図1は脊椎固定手術を表す画像である。図1Aは腰椎の椎間間隙を示している。図1Bおよび1Cは間隙を安定させるためのそれぞれ機械デバイスと骨移植片の導入を示している。図1Dは脊椎を表す画像である。
【図2】図2は複数の系統経路にしたがって分化するADAS細胞の能力を表す画像である。化学物質と成長因子の特定カクテルに応答して、ヒトADAS細胞はin vitroで軟骨細胞、骨芽細胞、脂肪細胞、ならびに神経様およびグリア様細胞に分化することができる。
【図3】図3はヒトADAS細胞の骨形成を表す画像である。
【図4】図4は脂肪細胞形成および骨形成分化の際のADAS細胞でのアルデヒドホスファターゼ発現を示すグラフである。
【図5】図5はADAS細胞がin vivoで骨を形成することを証明する画像である。
【発明を実施するための形態】
【0023】
詳細な説明
本発明は骨の病態の治療のための方法および組成物を包含する。好ましい1実施形態において、本発明の脂肪組織由来の単離された成人ストローマ(ADAS)細胞を使用して、哺乳動物における脊椎固定手術後の骨の癒合を促進する。
【0024】
定義
本明細書で使用する場合、以下の用語のそれぞれは、この節でそれと関連付けた意味を持つ。
【0025】
冠詞「1つの("a"および"an")」は本明細書中、その冠詞の文法上の対象の1または1以上(すなわち少なくとも1つ)を示すために使用される。例えば、「1つの要素」とは、1つの要素または1より多い要素を意味する。
【0026】
用語「約」は、当業者にはそれを使用する文脈によって理解されるはずであり、またある程度差異があるものとなる。
【0027】
用語「脂肪組織由来の細胞」とは、脂肪組織に起源を持つ細胞のことである。脂肪組織から単離した当初の細胞集団は、限定するわけではないがストローマ血管画分(SVF)細胞を含む、異種細胞集団である。
【0028】
本明細書で使用する用語「脂肪由来のストローマ細胞」、「脂肪組織由来のストローマ細胞」、「脂肪組織由来の成人ストローマ(ADAS)細胞」、「脂肪由来の幹細胞(ASC)」は互換的に使用され、それらは、限定するわけではないが脂肪細胞、骨細胞、軟骨細胞、筋肉および神経/グリア細胞系統などの多様な各種細胞型になる幹細胞様前駆細胞として機能する、脂肪組織を起源とするストローマ細胞をいう。
【0029】
「脂肪」とはあらゆる脂肪組織のことである。脂肪組織は褐色または白色脂肪組織である。好ましくは、脂肪組織は皮下白色脂肪組織である。こうした細胞として一次細胞培養物または不死化した細胞系が含まれる。脂肪組織は脂肪組織を持つどんな生物体からのものでもよい。好ましくはこの脂肪組織は哺乳動物のものであり、最も好ましくはこの脂肪組織はヒトのものである。好都合なヒト脂肪組織の起源は脂肪吸引手術に由来するものである。しかし、脂肪組織の起源または脂肪組織の単離方法は本発明にとって重大ではない。
【0030】
「同種異系」とは、同一の種の異なる動物個体に由来する移植片である。
【0031】
本明細書で使用する用語「自己由来」とは、後に再導入される個体と同一の個体に由来するあらゆる物質を意味する。
【0032】
「異種性」とは、別の種の哺乳動物に由来する移植片である。
【0033】
本明細書で使用する用語「生体適合性格子」とは、組織の発達をもたらす三次元構造の形成を促進することができる基材を意味する。これに関して例えば、細胞外マトリックス材料、合成ポリマー、サイトカイン、成長因子などを含むものなどのこうした生体適合性格子上で細胞を培養するか、これに播種することができる。格子は組織型の発達を促進するために所望される形状に成形することができる。また少なくとも細胞の培養中の早期の一時期に、培地および/または基材に、適切な組織型および構造の発達を促進する因子(例えば、成長因子、サイトカイン、細胞外マトリックス材料など)を補充することができる。
【0034】
本明細書で使用する用語「骨の病態(または損傷もしくは疾病)」とは、限定するわけではないが、骨の急性、慢性、代謝性および非代謝性疾患を含む骨の障害または疾病である。この用語は疾病、外傷または組織の正常な発達の病態に起因する病態を包含する。骨の病態の例として、限定するわけではないが以下が含まれる: 骨折、骨/脊椎変形、骨肉腫、骨髄腫、骨異形成、脊柱側弯、骨粗しょう症、骨軟化症、くる病、線維性骨炎、腎性骨ジストロフィー、および骨のパジェット病。
【0035】
「分化用培地」とは、本明細書中では、細胞成長用培地でインキュベートしたときに完全には分化しない幹細胞、脂肪由来成人ストローマ細胞またはその他のこうした前駆体細胞が、分化した細胞の特徴のいくつかまたは全部を持つ細胞に発達するように、この培地にある添加剤を含ませるかまたはある添加剤を欠損させたものを意味するために使用される。
【0036】
「増大性」は、本明細書中で、細胞の増殖能力、例えば、数の拡大、または細胞集団の場合ならば集団の倍増能力を示すために使用される。
【0037】
「移植片」とは、細胞、組織、器官またはその他の移植用のあらゆる生体適合性格子である。
【0038】
「成長因子」として、限定するわけではないが、ピコグラム/ml〜ミリグラム/mlレベルの濃度の、以下を含む特定の因子を想定している: 成長ホルモン、エリスロポエチン、トロンボポエチン、インターロイキン3、インターロイキン6、インターロイキン7、マクロファージコロニー刺激因子、c-kitリガンド/幹細胞因子、オステオプロテグリンリガンド、インスリン、インスリン様成長因子、表皮成長因子(EGF)、線維芽成長因子(FGF)、神経成長因子、毛様体神経栄養因子、血小板由来成長因子(PDGF)、および骨形態形成タンパク質。
【0039】
本明細書中で使用する用語「成長用培地」は、細胞の成長を促進する培養培地の意味である。成長用培地は一般的に動物血清を含むものである。事例によっては、成長用培地が動物血清を含まないこともある。
【0040】
「単離された細胞」とは、組織もしくは哺乳動物中でその単離された細胞に天然には付随する他の成分および/または細胞から分離した細胞をいう。
【0041】
本明細書中で使用する用語「多能性の」または「多能性」とは、中枢神経系の幹細胞が2以上の細胞型に分化する能力を意味する。
【0042】
本明細書中で使用する用語「モジュレート」とは生物学的状態の何らかの変化、すなわち増加、減少などを意味する。
【0043】
本明細書中で使用する用語「非免疫原性」とは、ADAS細胞がMLR中でT細胞の増殖を誘導しないことの発見を意味する。しかし、非免疫原性はMLR中でのT細胞増殖に限定されるべきではなく、むしろin vivoでT細胞増殖を誘導しないADAS細胞にも適用されるべきである。
【0044】
「増殖」は、本明細書中では、特に細胞について同様の形態のものの複製または増加を称するために使用される。すなわち、増殖はより多くの数の細胞の産生を包含するものであって、これは中でも単純に細胞の数を数えるか、または細胞内への3H-チミジンの取り込みを測定することなどによって、測定することができる。
【0045】
「細胞周期の、もしくはそれを経た進行」は、本明細書中では、細胞が有糸分裂および/もしくは減数分裂の準備をし、かつ/またはこれに進む過程を称するために使用される。細胞周期を経た進行として、Gl期、S期、G2期、およびM期を経た進行が含まれる。
【0046】
用語「前駆細胞」、「前駆体細胞」、および「幹細胞」は、当分野および本明細書中では互換的に使用され、かつ、無限数の有糸分裂をして、それ自身を再生するかまたは所望の細胞型に分化していく子孫細胞を産生するかのいずれかの能力を潜在的に持つ、多能性または系統不確定(uncommitted)前駆体細胞のいずれかをいう。多能性幹細胞とは異なって、系統確定(committed)前駆体細胞は一般的に、互いに表現型が異なる多種の細胞型を発生させることはできないと考えられている。その代わりに、前駆体細胞は1種または場合によっては2種の系統確定細胞型を生じる。
【0047】
本明細書中で使用する用語「ストローマ細胞培地」は、ADAS細胞の培養に有用な培地である。ストローマ細胞培地の限定するわけではない例は、以下を含む培地である: DMEM/F12ハム培地、10%ウシ胎仔血清、100 Uペニシリン/100μgストレプトマイシン/0.25μgファンギゾン。典型的には、ストローマ細胞培地は基本培地、血清および抗生物質/抗真菌物質を含む。しかし、ADAS細胞は、抗生物質/抗真菌物質を含まないで、少なくとも1種の成長因子を補充したストローマ細胞培地で培養することができる。好ましくは、成長因子はヒト表皮成長因子(hEGF)である。hEGFの好ましい濃度は約1〜50 ng/ml、より好ましくは、その濃度は約5 ng/mlである。好ましい基本培地はDMEM/F12(1:1)である。好ましい血清はウシ胎仔血清(FBS)であるが、ウマ血清またはヒト血清を含むその他の血清も使用することができる。ストローマ細胞の成長を支持するためには、上記の培地に好ましくは最大20%のFBSを添加することとなる。しかし、ストローマ細胞の成長に必要なFBS中の成長因子、サイトカイン、およびホルモンが同定されて、成長培地に適切な濃度で供給されるならば、規定培地を使用することもできる。さらに、培養培地に追加の成分を添加してよいことも認識される。こうした成分として限定するわけではないが以下が含まれる: 抗生物質、抗真菌物質、アルブミン、成長因子、アミノ酸、および細胞の培養について当分野で知られているその他の成分。培地に添加することができる抗生物質として、限定するわけではないが、ペニシリンおよびストレプトマイシンが含まれる。培養培地中のペニシリンの濃度は約10〜約200 unit/mlである。培養培地中のストレプトマイシンの濃度は約10〜約200μg/mlである。しかし、本発明はどんな意味でもストローマ細胞培養用の何らかの培地に限定されるものと解釈すべきではない。むしろ組織培養中でストローマ細胞を支持することができるどんな培地でも使用することができる。
【0048】
用語「薬学的に許容される担体(または培地)」は、用語「生物学的に適合性の担体または培地」と互換的に使用されるが、ヒトおよび動物の組織に接触させて使用するのに好適な範囲で、妥当な利便性/リスクの比率に見合うものであって、過剰の毒性、刺激アレルギー性反応またはその他の合併症がない、試薬、細胞、化合物、物質、組成物、および/または投与剤である。
【0049】
本明細書中で使用する用語としての「好適な椎体間間隙」は、隣接する椎骨間の空間を意味し、ここには健康な脊椎では椎間板が存在しているが、脊柱上で損耗によって椎間板物質が少なくとも一部欠損しているか、または当分野で知られた技法を使用して、椎間板部分に外科的に間隙を創設するように調製したものかのいずれかである。
【0050】
本明細書中で使用する、「治療上有効な量」とは、細胞を投与された被験体に有益な効果をもたらすのに十分なADAS細胞の量である。
【0051】
「治療する(または〜の治療)」とは、骨の病態の影響を軽減する、またはその進行を遅延、停止もしくは逆行させるか、あるいはその発症を遅延または防止することである。
【0052】
本明細書中で使用する「内在性」とは、生物体、細胞または系の中からの、またはそこで産生されるあらゆる物質である。
【0053】
「外来性」とは、生物体、細胞または系の外から導入されるか、またはこれらの外で産生されるあらゆる物質である。
【0054】
「コードする」とは、遺伝子、cDNA、またはmRNAなどのポリヌクレオチド中のヌクレオチドの特異的配列であって、一定のヌクレオチド(すなわち、rRNA、tRNAおよびmRNA)配列または一定のアミノ酸配列のいずれか、ならびにそれらがもたらす生物学的性質を持つ、生物学的過程中の別のポリマーおよび巨大分子の合成のための鋳型として作用する、固有の性質を称する。例えば、ある遺伝子に対応するmRNAの転写および翻訳が細胞中またはその他の生物学的系中でタンパク質を産生するならば、その遺伝子はそのタンパク質をコードする。そのヌクレオチド配列がmRNA配列と同一である配列表に通常示されるコード鎖と、遺伝子またはcDNAの転写のための鋳型として使用される非コード鎖の両方を、タンパク質またはその遺伝子もしくはcDNAの別の産物をコードするものとして、称することができる。
【0055】
別に特定する以外は、「アミノ酸配列をコードするヌクレオチド配列」は、互いに縮重変異体であって同一のアミノ酸配列をコードする、すべてのヌクレオチド配列を含む。タンパク質およびRNAをコードするヌクレオチド配列にはイントロンが含まれうる。
【0056】
「単離された核酸」とは、天然状態ではそれに隣接している配列から分離されている核酸セグメントまたは断片、すなわち、通常はこの断片に隣接している配列から、すなわちそれが天然に存在するゲノム中の断片に隣接する配列から取り出されたDNA断片である。この用語はある核酸に天然には随伴するその他の成分、すなわち、細胞中でそれに天然に随伴するRNAもしくはDNAまたはタンパク質から、実質的に精製された核酸にも適用される。したがってこの用語には、例えば、ベクター中、自己複製するプラスミドもしくはウイルス中、または原核もしくは真核生物のゲノムDNA中に組み込まれるか、あるいはその他の配列から独立して分離された分子(すなわち、PCRまたは制限酵素消化によって作成されたcDNAまたはゲノムもしくはcDNA断片)として存在する、組換えDNAが含まれる。また、別のポリペプチド配列をもコードするハイブリッド遺伝子の一部である組換えDNAも含まれる。
【0057】
本発明に関しては、共通して出現する核酸塩基について以下の略語を使用する。「A」はアデノシン、「C」はシトシン、「G」はグアノシン、「T」はチミジン、そして「U」はウリジンである。
【0058】
語句「転写制御下で」または「機能し得るように連結し」は、本明細書中での使用では、プロモーターがポリヌクレオチドとの関係でRNAポリメラーゼの開始およびそのポリヌクレオチドの発現を制御するのに適正な位置および配向性にあることを意味している。
【0059】
本明細書中で使用する用語「プロモーター/調節配列」は、そのプロモーター/調節配列に機能し得るように連結された遺伝子産物の発現にとって必要とされる核酸配列を意味する。いくつかの例では、この配列はコアプロモーター配列であってもよく、別の例では、この配列はその遺伝子産物の発現にとって必要とされるエンハンサー配列およびその他の調節エレメントをも含んでもよい。プロモーター/調節配列は、例えば、遺伝子産物を組織特異的様相で発現させるものであってもよい。
【0060】
「構成的」プロモーターは、遺伝子産物をコードするか特定するポリヌクレオチドに機能し得るように連結されたときに、細胞の大部分のまたは全生理学的条件下で、その細胞中でその遺伝子産物の産生を引き起こす、ヌクレオチド配列である。
【0061】
「誘導性」プロモーターは、遺伝子産物をコードするか特定するポリヌクレオチドに機能し得るように連結されたときに、実質的には細胞中にそのプロモーターに対応するインデューサーが存在するときにのみ、その細胞中でその遺伝子産物の産生を引き起こす、ヌクレオチド配列である。
【0062】
「組織特異的」プロモーターは、遺伝子産物をコードするか特定するポリヌクレオチドに機能し得るように連結されたときに、実質的に細胞がそのプロモーターに対応する組織型の細胞であるときのみ、その細胞中でその遺伝子産物の産生を引き起こす、ヌクレオチド配列である。
【0063】
「ベクター」は、単離された核酸を含む部分と、その単離された核酸を細胞の内部に送達するために使用することができる部分の、複合物質である。膨大な数のベクターが当分野で知られており、限定するわけではないが、線状ポリヌクレオチド、イオン性もしくは両親媒性化合物と結合したポリヌクレオチド、プラスミド、およびウイルスが含まれる。こうして、用語「ベクター」として、自己複製性プラスミドまたはウイルスが含まれる。この用語には、例えば、ポリリシン化合物、リポソームなどの、核酸の細胞中への導入を促進する、非プラスミド性および非ウイルス性化合物が含まれるものと解釈すべきである。ウイルスベクターの例として、限定するわけではないが、アデノウイルスベクター、アデノ随伴ウイルスベクター、レトロウイルスベクターなどが含まれる。
【0064】
「発現ベクター」は、発現させるヌクレオチド配列に機能し得るように連結された発現制御配列を含んでいる組換えポリヌクレオチドを含むベクターである。発現ベクターは発現にとって十分なcis-作用性エレメントを含んでいる。発現のためのその他のエレメントは宿主細胞によって供給されるか、in vitro発現系で供給される。発現ベクターとして、コスミド、プラスミド(すなわち、裸のまたはリポソームに含有された)および組換えポリヌクレオチドを組み込んだウイルスなどの、当分野で既知のすべてのものが含まれる。
【0065】
説明
本発明は、脂肪組織由来の成人ストローマ(ADAS)細胞が、限定するわけではないが、脂肪細胞、骨細胞、軟骨細胞、筋肉および神経/グリア細胞系統を含む、多様な各種の細胞型に分化することができるという発見に関係している。特に、本発明は、ADAS細胞がin vivoで骨形成系統にしたがって分化するという観察に関連する。
【0066】
本開示に基づき、実験/治療上の目的で、ADAS細胞を細胞治療および/または遺伝子地量で成功裏に使用することができる。例えば、この細胞を骨疾病の治療で使用することができる。好ましくは、この細胞を、脊椎固定手術後の骨の癒合を促進するために使用する。脊椎固定は、椎間板変性症、脊椎狭窄、脊柱側弯、脊椎骨折、腫瘍などに苦しむ哺乳動物の背中の痛みを治療するために使用される、一般的な整形外科術および神経外科術である。
【0067】
ADASの単離および培養
本発明の方法に有用なADAS細胞は当業者に知られた多様な方法によって単離することができる。例えば、そうした方法が米国特許第6,153,432号に記載されている。この全部を本明細書中に組み入れるものとする。好ましい1方法では、ADAS細胞を哺乳動物被験体、好ましくはヒト被験体から単離する。ヒトでは、ADAS細胞は典型的には脂肪吸引物から単離される。本発明の細胞をヒト被験体に移植しようとするならば、自己由来移植物を提供するように、ADAS細胞を同一の被験体から単離するのが好ましい。
【0068】
本発明の別の態様において、投与されるADAS細胞はそのレシピエントについて同種異系でもよい。同種異系ADAS細胞はレシピエントと同一の種の異なる個体であるドナーから単離される。単離後、本明細書中に開示する同種異系産物の生成方法を使用して、細胞を培養する。本発明はレシピエントについて異種性であるADAS細胞も包含する。
【0069】
本発明を何ら限定するわけではないが、本明細書中に開示する方法を使用して、脂肪組織からストローマ細胞を単離することができる。簡単に述べると、皮下沈着物から脂肪吸引術によってヒト脂肪組織を取り出す。次に脂肪組織を脂肪吸引カップから500 ml滅菌ビーカーに移し、約10分間静置する。沈殿した血液を吸引によって除去する。約125 ml(またはそれ未満)の体積の組織を250 ml遠心管に移し、その後この管にKrebs-Ringerバッファーを充填する。組織およびバッファーを約3分、または明確な分離ができるまで静置し、その後吸引によってバッファーを除去する。組織を、さらに4〜5回、または組織が橙〜黄色になり、かつバッファーが淡褐色になるまで、Krebs-Ringerバッファーで洗浄する。
【0070】
コラゲナーゼ処理を使用して、脂肪組織のストローマ細胞を解離させることができる。簡単に述べると、組織からバッファーを除去し、約2 mgコラゲナーゼ/ml Krebsバッファー(Worthington、ME) 溶液で、1 mlコラゲナーゼ溶液/組織mlの比率で交換する。管を断続的に振蕩させながら、37℃水浴中で約30〜35分間インキュベートする。
【0071】
500 X g、室温で5分間の遠心分離によって、脂肪組織のその他の成分からストローマ細胞を単離する。油分および脂肪細胞層を吸引によって除去する。残った画分を、リン酸緩衝化生理食塩水(PBS)約100 mlに激しく回転させることによって懸濁させ、50 ml管に分配して、500 X gで5分間、遠心分離する。バッファーを吸引によって除去して、ストローマ細胞を残留させる。次にストローマ細胞をストローマ細胞用培地に再懸濁させて、適切な細胞密度でプレーティングし、5% CO2中、37℃で一晩インキュベートする。組織培養皿またはフラスコに付着させた後、培養したストローマ細胞を即時使用することも、一定時間または多数回の継代培養期間、培養物中に維持した後、本明細書中に開示する方法にしたがって細胞を使用することもできる。しかし、本発明はストローマ細胞の単離方法のいずれか1つに限定されるものとは全く解釈すべきではない。むしろ、ADAS細胞のどんな単離方法も本発明に包含されるべきものである。
【0072】
ADASを培養するためには、細胞培養中で線維芽細胞を支持するどんな培地でも使用することができる。線維芽細胞の成長を支持する培地製剤として、限定するわけではないが、以下が含まれる: 最少必須Eagle培地、ADC-I、LPM(ウシ血清アルブミンを含まない)、FlO(PIAM)、F12(HAM)、DCCMl、DCCM2、RPMI 1640、BGJ培地(Fitton-Jackson改変または非改変)、基本イーグル培地(BME-Earle塩添加)、ダルベッコ改変Eagle培地(DMEM-無血清)、Yamane、IMEM-20、Glasgow改変Eagle培地(GMEM)、Leibovitz L-15培地、McCoy 5A培地、培地Ml99(M199E-Earle塩添加)、培地M199(M199H-Hank塩添加)、最少必須イーグル培地(MEM-E-Earle塩添加)、最少必須Eagle培地(MEM-H-Hank塩添加)および最少必須イーグル培地(MEM-NAA-非必須アミノ酸添加)、など。ADASの培養にとって好ましい培地はDMEM、より好ましくはDMEM/F12(1:1)である。
【0073】
本発明の方法に有用な培地のその他の限定するわけではない例として、ウシまたはその他の種の胎仔血清を少なくとも1%〜約30%、好ましくは少なくとも約5%〜15%、最も好ましくは約10%の濃度で含有するものがある。ニワトリまたはその他の種の胚抽出物を約1%〜30%、好ましくは少なくとも約5%〜15%、最も好ましくは約10%の濃度で存在させることもできる。
【0074】
単離後、ADAS細胞を培養装置でストローマ細胞培地中、一定時間または細胞が集密に達するまでインキュベートした後、細胞を別の培養装置に植え継ぎをする。培養装置はin vitroでの細胞の培養に使用されるどんな培養装置でもよい。好ましくは、集密度が70%を超えた後、細胞を別の培養装置に植え継ぎをする。より好ましくは、集密度が90%を超えるものである。一定時間とは、in vitroでの細胞の培養に好適な任意の時間である。ADAS細胞の培養中、いつでもストローマ細胞培地を交換することができる。好ましくは、ストローマ細胞培地を3〜4日毎に交換する。その後ADAS細胞を培養装置から回収し、その時点で即時にADAS細胞を使用するか、または後日使用するために凍結保存することができる。ADAS細胞は、トリプシン処理、EDTA処理、または培養装置から細胞を回収するために使用されるその他の任意の操作法によって、回収することができる。
【0075】
培養中の細胞について記載するために、種々の用語を使用する。細胞培養物とは、一般的に、生物の生体から取得して、制御された条件下で成長させた細胞である。一次細胞培養物とは、生物体から直接取得した、最初の継代培養前の細胞、組織または器官の培養物である。細胞は細胞成長および/または分裂を促進する条件下で成長培地中に置かれたとき、培養物中で増大し、その結果より大きな細胞集団となる。細胞が培養物中で増大するとき、細胞増殖の速度は典型的には、その細胞の数が2倍になるのに要する時間(あるいは倍増時間としても知られている)によって測定される。
【0076】
継代培養の各回は世代と称される。細胞を継代培養するとき、これらは継代されたと称される。細胞、または細胞系の特定の集団は、継代された回数によって呼称されるか、またはそれを特性とする場合がある。例えば、10回継代して培養された細胞集団はPlO培養物と称されることがある。一次培養物、すなわち、組織からの細胞の単離後の最初の培養物はPOで示される。最初の継代培養後、その細胞は二次培養物(Plまたは第1世代)と記載される。2回目の継代培養後は、その細胞は三次培養物(P2または第2世代)となり、以下同様である。当業者には、継代の期間中、集団の倍増が何度もあることが理解されるはずである。したがって、培養物の集団の倍増回数は継代数よりも大きい。継代間の期間中の細胞の増大(すなわち、集団倍増の回数)は多くの要因に応じて決まり、これらとして限定するわけではないが、播種密度、基質、培地、および継代間の時間が含まれる。
【0077】
遺伝的改変
本発明の細胞はまた、レシピエント中で、治療上の目的で、またはその細胞の同化および/もしくはその分化を追跡するための方法において、外来タンパク質または分子を発現させるために使用することもできる。こうして、本発明は、外来性DNAのADAS細胞中への導入とそれに付随するその外来性DNAのADAS細胞中での発現のための発現ベクターおよび方法を包含する。細胞へのDNAの導入および発現の方法は当業者にとって周知であり、例えば、以下に記載されているものが含まれる: Sambrookら(2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York)、およびAusubelら(1997, Current Protocols in Molecular Biology, John Wiley & Sons, New York)。
【0078】
レシピエント中に導入された後、ADAS細胞の移動、同化および生存を追跡するために使用する1分子を、単離した核酸にコードさせることが可能である。細胞を追跡するのに有用なタンパク質として、限定するわけではないが、以下が含まれる: 緑色蛍光タンパク質(GFP)、その他の蛍光タンパク質のいずれか(例えば、強化された緑、シアン、黄、青および赤色蛍光タンパク質; Clontech, Palo Alto, CA)、またはその他の標識タンパク質(例えば、LacZ、FLAG-tag、Myc、HiS6、など)。
【0079】
本発明のADAS細胞の移動、同化および/または分化の追跡は、ベクターまたはウイルスによって発現される検出可能な分子の使用に限定されるわけではない。ある細胞の移動、同化、および/または分化は、哺乳動物内に移植されたADAS細胞の局在化を促進する一連のプローブを使用して評価することもできる。ADAS細胞移植物の追跡はさらに、本明細書中で別に詳細に記載する、細胞特異的マーカーのための抗体または核酸プローブを使用して、達成することができる。
【0080】
本明細書中で使用する用語「遺伝的改変」とは、外来性DNAの意図的導入によるADAS細胞の遺伝型の安定的または一時的変更である。DNAは合成でも天然由来でもよく、遺伝子、遺伝子の一部、またはその他の有用なDNA配列を含んでいてもよい。本明細書中で使用する用語「遺伝的改変」は、天然のウイルス活性、天然の遺伝子組み換え、またはそれに類似するものなどによる、天然に生起する変化を含むことを意味していない。
【0081】
外来性DNAは以下によってADAS細胞に導入することができる: ウイルスベクター(レトロウイルス、改変ヘルペスウイルス、ヘルペスウイルス、アデノウイルス、アデノ随伴ウイルス、レンチウイルス、など)の使用、または直接DNAトランスフェクション(リポフェクション、リン酸カルシウムトランスフェクション、DEAE-デキストラン、エレクトロポレーション、など)。
【0082】
細胞の遺伝的改変の目的が生物学的活性物質の産生のためである場合、その物質は一般的に所定の障害の治療に有用なものということになる。例えば、骨形成に関係する一定の成長因子産物を分泌するように、細胞を遺伝的に改変するのが望ましい。
【0083】
本発明の細胞を、細胞内に外来性遺伝物質を導入することによって、細胞の培養に有益な栄養素、成長因子、サイトカイン、などの分子を産生するように、遺伝的に改変することができる。その上、こうした分子を産生するように細胞を遺伝的に改変させることによって、その細胞を、これを必要とする哺乳動物に移植したとき、この哺乳動物にまた別の治療効果をもたらすことができる。例えば、遺伝的に改変された細胞が、哺乳動物内で近隣の細胞に有益な分子を分泌することができるようになる。
【0084】
本明細書中で使用する用語「成長因子産物」とは、細胞に対して成長、増殖、分化、または栄養作用を持つ、タンパク質、ペプチド、マイトジェン、またはその他の分子である。例えば、骨障害の治療に有用な成長因子産物として、限定するわけではないが、FGF、TGF-β、インスリン様成長因子、および骨形態形成タンパク質が含まれる。
【0085】
本発明にしたがって、異種タンパク質をコードするヌクレオチド配列を含む遺伝子構築物をADAS細胞内に導入する。すなわち、細胞を遺伝的に変更させて、その発現が哺乳動物に対して治療効果を持つ遺伝子を導入する。本発明のいくつかの態様によれば、治療する哺乳動物から、または別の哺乳動物からのADAS細胞を遺伝的に変更させて、欠陥がある遺伝子を交換し、かつ/またはその発現が治療を受ける哺乳動物に対して治療効果を持つ遺伝子を導入する。
【0086】
遺伝子構築物を細胞内にトランスフェクトするすべての場合において、異種遺伝子は、細胞内でその遺伝子の発現を達成するのに必要な調節配列に機能し得るように連結される。こうした調節配列として典型的にはプロモーターおよびポリアデニル化シグナルが含まれる。
【0087】
遺伝子構築物は好ましくは、異種タンパク質をコードする配列を含む発現ベクターであって、このベクターが細胞内にトランスフェクトされたとき、そのコード配列がその細胞によって発現されるように、必須の調節配列に機能し得るように連結されたベクターとして提供される。このコード配列は、細胞内でその配列の発現に必要な調節エレメントに機能し得るように連結されている。タンパク質をコードするヌクレオチド配列はcDNA、ゲノムDNA、合成DNAもしくはそれらのハイブリッドまたはmRNAなどのRNA分子である。
【0088】
遺伝子構築物は、調節エレメントに機能し得るように連結された、有益なタンパク質をコードするヌクレオチド配列を含み、これは細胞内に、機能性細胞質分子、機能性エピソーム分子として残留していてもよく、または細胞の染色体DNA内に組み込まれてもよい。外来性遺伝物質は細胞内に導入されて、そこで独立した遺伝子物質としてプラスミドの形態のままでいてもよい。あるいは、染色体中に組み込まれることができる線状DNAを細胞内に導入することもできる。細胞内にDNAを導入する際は、染色体内へのDNAの組み込みを促進する試薬を添加してもよい。組み込みを促進するために有用なDNA配列もDNA分子内に含ませてもよい。あるいは、RNAを細胞内に導入してもよい。
【0089】
遺伝子発現のための調節エレメントとして以下が含まれる: プロモーター、開始コドン、停止コドン、およびポリアデニル化シグナル。これらのエレメントが本発明の細胞内で機能性であるものが好ましい。その上、これらのエレメントが、タンパク質をコードするヌクレオチド配列に、このヌクレオチド配列が細胞内で発現することによってタンパク質が産生されるように、機能し得るように連結されていることが好ましい。開始および停止コドンは一般的にはタンパク質をコードするヌクレオチド配列の一部であるとみなされる。しかし、これらのエレメントが細胞内で機能性であることが好ましい。同様に、使用するプロモーターおよびポリアデニル化シグナルは本発明の細胞内で機能性でなければならない。本発明の実践上有用なプロモーターの例として、限定するわけではないが、サイトメガロウイルスプロモーター、SV40プロモーターおよびレトロウイルスプロモーターなどの、多くの細胞中で活性なプロモーターが含まれる。本発明の実践上有用なプロモーターのその他の例として、限定するわけではないが、以下が含まれる: 組織特異的プロモーター、すなわちある組織では機能するが別の組織では機能しないプロモーター; また、特定のもしくは一般的エンハンサー配列を含むか含まない、細胞内で通常発現されている遺伝子のプロモーター。いくつかの実施形態では、エンハンサー配列を含むか含まない、細胞内で構成的に遺伝子を発現させるプロモーターが使用される。こうした実施形態では、エンハンサー配列はそれが適切であるかまたは望ましい場合に加えられる。
【0090】
本発明の細胞は、当業者が容易に利用し得る周知の技法を使用して、トランスフェクトすることができる。外来性遺伝子は標準的方法を使用して細胞内に導入され、そこで細胞がその遺伝子によってコードされるタンパク質を発現する。いくつかの実施形態中、細胞はリン酸カルシウム沈殿トランスフェクション、DEAEデキストラントランスフェクション、エレクトロポレーション、マイクロインジェクション、リポソーム媒介導入、化学物質媒介導入、リガンド媒介導入または組換えウイルスベクター導入によってトランスフェクトされる。
【0091】
いくつかの実施形態では、組換えアデノウイルスベクターを使用して、所望の配列を持つDNAを細胞内に導入する。いくつかの実施形態では、組換えレトロウイルスベクターを使用して、所望の配列を持つDNAを細胞内に導入する。いくつかの実施形態では、標準CaPO4、DEAEデキストランまたは脂質担体媒介トランスフェクション技法を利用して、分裂中の細胞に所望のDNAを組み入れる。標準的な抗生物質耐性選択法を使用して、トランスフェクトした細胞を同定および選択することができる。いくつかの実施形態では、マイクロインジェクションによってDNAを直接細胞内に導入する。同様に、周知のエレクトロポレーションまたは粒子衝撃法を使用して、外来DNAを細胞内に導入することかできる。通常、第2の遺伝子を同時トランスフェクトするか、治療上の遺伝子に連結させる。第2遺伝子は選択可能な抗生物質耐性遺伝子であることが多い。トランスフェクトされた細胞は、選択性遺伝子を取り込まない細胞を殺傷する抗生物質中でその細胞を成長させることによって、選択することができる。2つの遺伝子を連結させないで同時トランスフェクトする場合の大部分で、抗生物質処理で生き残った細胞はその中に両方の遺伝子を持ち、その両方を発現する。
【0092】
本明細書中に記載する方法は、当分野で周知の多数の手法で、またそれらに多様な改変および置換を加えて、実施することができるものと解釈すべきである。また、細胞型同士の作用形態または相互作用について示したどんな理論も、本発明をいかなる意味でも限定する意図はなく、本発明の方法をより完全に理解することができるために提供しているものであることも、理解されたい。
【0093】
ADAS細胞の治療上の使用
ADAS細胞が様々な細胞系譜にしたがって分化し得るという事実に加えて、本発明は、ADAS細胞がT細胞の増殖の誘発に関して免疫原性特性を欠如しているという発見にも関係している。この特徴は、レシピエントの免疫細胞による免疫拒絶の可能性が低いことを示す。その上、ADAS細胞は混合リンパ球反応中、同種異系PBMCを刺激しないことが示されている。
【0094】
本発明のいくつかの実施形態では、ADAS細胞による細胞/遺伝子療法の開始前に、哺乳動物を免疫抑制する必要がないか、望ましいことでもないことがある。したがって、同種異系、またはさらには異種の、ADAS細胞移植が本発明に含まれる。
【0095】
骨の疾病、障害、または病態の治療のためのADAS細胞の使用は、免疫抑制剤の必要を伴わないで、レシピエント中にADAS細胞を導入することができるという、新たな利点を提供する。細胞の移植の成功には、レシピエントで発生する移植片拒絶免疫応答を誘発しないで、ドナー細胞の永久的移植定着が必要であると考えられる。通常は、移植片拒絶反応を防止するため、シクロスポリン、メトトレキセート、ステロイドおよびFK506などの非特異的免疫抑制剤が使用される。これらの薬剤は毎日投与され、投与を停止すれば、通常は移植片拒絶の結果をもたらす。しかし、非特異的免疫抑制剤の使用の望ましくない結果は、これらが免疫応答のすべての様相を抑制することによって機能することで(全般的免疫抑制)、したがってレシピエントの感染およびその他の疾病への感受性が非常に増大することとなる。
【0096】
本発明は、免疫抑制剤を必要とせずに、未分化または分化したADAS細胞をレシピエントに導入することによる、骨の疾病、障害、または病態の治療方法を提供する。したがって、移植されたADAS細胞のレシピエントにとって、感染および免疫抑制療法に伴うがんに関係した症状などの、その他の疾病を招く感受性が低下する。
【0097】
本発明には、同種異系もしくは異種ADAS細胞、または別の面でレシピエントとは遺伝上本質的に異なるADAS細胞のレシピエントへの投与によって、そのレシピエントにある恩恵を提供することが含まれる。本発明は、骨の疾病、障害または病態の治療のためのADAS細胞の使用方法であって、この細胞をレシピエントに投与する際、免疫抑制剤の使用の必要性がないもの、を提供する。
【0098】
別の実施形態では、本発明で使用するADAS細胞は、限定するわけではないが、ヒト、マウス、ラット、類人猿、テナガザル、ウシを含む、どんな種の哺乳動物の脂肪組織からでも単離することができる。好ましくは、ADAS細胞をヒト、マウス、またはラットから単離する。より好ましくは、ADAS細胞をヒトから単離する。
【0099】
ADAS細胞は一定時間のin vitro培養後、哺乳動物に投与することができる。ADAS細胞を、ADAS細胞がin vitroで分化するように誘導する様相で、培養してもよい。しかし、ADAS細胞を未分化の状態でレシピエントに移植し、移植されたADAS細胞が分化して、骨細胞の少なくとも1つの特徴をin vivoで発現するのが好ましい。
【0100】
本発明のADAS細胞を、当分野で知られた技法、すなわち米国特許第5,082,670および5,618,531号(それぞれを参照として本明細書中に組み入れる)に記載されているものなど、を使用して、哺乳動物に移植するか、または身体のその他の好適ないずれかの部位に移植することができる。本発明の細胞の移植は、当分野で周知の、また本明細書中に記載したもの、あるいは将来開発される、技法を使用して、達成することができる。本発明は、哺乳動物、好ましくは、ヒトへの細胞の移植、移植片移植、注入、またはその他の導入のための方法を含む。
【0101】
哺乳動物に投与するADAS細胞の数は、例えば、脂肪組織の処理後の細胞の収量に関係する。細胞の総数の一部分を後の使用のために保持するか凍結保存することができる。その上、送達される用量は哺乳動物への細胞の送達経路如何による。
【0102】
ADAS細胞の投与量は広範な限度で変化し、それぞれの特定の場合において、個々の必要性にしたがって調整される。使用する細胞の数はレシピエントの体重および病状、投与の回数および/または頻度、ならびに当業者に知られているその他の変数に応じて決められる。この数は所望の治療効果を達成するための桁数で調整される。
【0103】
体重100 kgについて約105〜約1013のADAS細胞を個体に投与することができる。いくつかの実施形態では、体重100 kg当たり約1.5 x 106〜約1.5 x 1012細胞を投与する。いくつかの実施形態では、体重100 kg当たり約1 x 109〜約5 x 1011細胞を投与する。別の実施形態では、体重100 kg当たり約4 x 109〜約2 x 1011細胞を投与する。さらに別の実施形態では、体重100 kg当たり約5 x 108細胞〜約1 x 1010細胞を投与する。
【0104】
ADAS細胞は、適切な希釈液に、約0.01〜約5 X 106細胞/mlの濃度で懸濁させることができる。注射溶液のために好適な賦形剤は、ADAS細胞およびレシピエントと、生物学的および生理学的に適合性のものであって、緩衝化した生理食塩水溶液またはその他の好適な賦形剤などである。投与のための組成物は適正な滅菌度と安定性に適合する、標準的方法にしたがって、製剤化し、製造し、また貯蔵することができる。
【0105】
細胞を既知のカプセル封入技法にしたがって、カプセル封入して、生物学的に活性な分子を送達するために使用することもできる。これらとして、マイクロカプセル封入(例えば、本明細書中に参照として組み入れる、米国特許第4,352,883; 4,353,888; および5,084,350号、参照)、またはマクロカプセル封入(例えば、米国特許第5,284,761; 5,158,881; 4,976,859; および4,968,733号; ならびに国際特許公開公報 WO 92/19195; WO 95/05452、参照、これらの全部を参照として本明細書中に組み入れる)が含まれる。マクロカプセル封入については、このデバイス中の細胞数を変更させることができる。好ましくは、各デバイスが103〜109細胞、最も好ましくは、約105〜107細胞を含有する。数個のマクロカプセル封入デバイスを哺乳動物に移植することができる。細胞のマクロカプセル封入および移植の方法は当分野で周知であり、また例えば、米国特許第6,498,018号に記載されている。
【0106】
本発明の細胞の哺乳動物への投与方法は、以下を含むいくつかの要因に応じて変更される: 治療する疾病のタイプ、哺乳動物の年齢、細胞が分化しているかしていないか、細胞の中に異種DNAが導入されているか、など。特定の骨の疾病または障害に苦しむ哺乳動物に投与する化合物を導入するため、細胞を直接の注射によるか、または当分野で使用される任意のその他の手段によって、所望の部位に導入することができる。
【0107】
ADAS細胞は多様な手段で宿主に投与することができる。投与方法として、限定するわけではないが、以下が含まれる: 血管内、大脳内、腸管外、腹腔内、静脈内、硬膜外、脊髄内、幹内(intrastemal)、関節内、滑膜内、髄膜内、動脈内、心臓内、または筋肉内。好ましくは、細胞を脊椎固定手術で使用する。
【0108】
組成物
本発明は哺乳動物に移植するためのマトリックスであって、このマトリックスが本発明のADAS細胞を含むものをも提供する。このマトリックスとしてはまた、限定するわけではないが、ADAS細胞、ADAS細胞溶解物、ADAS細胞馴化培地、およびADAS細胞が産生した細胞外マトリックスも含まれる。
【0109】
このマトリックスは限定するわけではないが以下のものなどの、1以上の生体活性因子を含有するか、これで処理されたものでもよい: 抗アポトーシス性薬剤(すなわち、エリスロポエチン、トロンボポエチン、インスリン様成長因子Iおよびインスリン様成長因子II、肝細胞成長因子、カスパーゼインヒビター); 抗炎症性薬剤(すなわち、p38 MAPKインヒビター、TGF-ベータインヒビター、スタチン、IL-6およびIL-Iインヒビター、ならびに非ステロイド抗炎症剤); 免疫抑制/免疫モジュレート剤; mTORインヒビター; 抗増殖剤; コルチコステロイド(すなわち、プレドニゾロン、ヒドロコルチゾン); 抗血栓剤; ならびに抗酸化剤。生体活性因子の存在は、ADAS細胞の増殖および/または分化を促進することができる。
【0110】
本発明はいくつかの態様でさらに、骨組織の再生を必要とする哺乳動物に、本発明のADAS細胞、マトリックス、ADAS細胞溶解物、ADAS産生物(すなわちADAS細胞が分泌する分子)、またはこれらのあらゆる組み合わせを含む組成物を投与することによる、哺乳動物の骨組織の再生方法を提供する。これに関連して、本発明は骨の病態の治療に使用することができる、医薬組成物を包含する。例えば、骨の病態として、限定するわけではないが、以下が含まれる: 骨折、骨/脊椎変形、骨肉腫、骨髄腫、骨異形成、脊柱側弯、骨粗しょう症、骨軟化症、くる病、線維性骨炎、腎性骨ジストロフィー、および骨のパジェット病。好ましくは、本発明は、脊椎固定手術後の骨の癒合を促進するための組成物および方法を提供する。
【0111】
限定するわけではない1実施形態では、新しい骨組織の産生が必要な部位に直接投与するための、本発明の細胞を含む剤形が調製される。例えば、本発明の細胞を注射用に、ヒドロゲル溶液に懸濁させることができる。あるいは、移植に先立って、細胞を含有するヒドロゲル溶液を例えば型枠の中で硬化させて、その中に細胞を分散させたマトリックスを形成させるか、またはマトリックスが硬化した後、この細胞成形物を培養して細胞を分裂増殖させた後、移植することができる。ヒドロゲルは有機ポリマー(天然または合成)であって、共有結合、イオン結合または水素結合によって架橋されて三次元開放格子構造を形成し、これが水分子を捕捉して、ゲルを形成するものである。ヒドロゲルを形成させるために使用することができる材料の例として、以下が含まれる: アルギン酸およびその塩などの多糖類、ペプチド、ポリホスファジン、およびポリアクリレート、これらはイオン性架橋される、またはブロックポリマー類、ポリエチレンオキシド-ポリプロピレングリコールブロックコポリマー、これらはそれぞれ温度またはpHによって架橋される。
【0112】
いくつかの実施形態では、ポリマーは、水、バッファー塩溶液、または水性アルコール溶液などの水性溶液に少なくとも部分的に可溶性であって、荷電側鎖基を持つかまたはその単価イオン性塩である。カチオンと反応することができる酸性側鎖基を持つポリマーの例は、ポリホスファゼン、ポリアクリル酸、ポリメタクリル酸、アクリル酸およびメタクリル酸のコポリマー、ポリ酢酸ビニル、ならびにスルホン化ポリスチレンなどのスルホン化ポリマー。アクリルもしくはメタクリル酸とビニルエーテルモノマーもしくはポリマーの反応によって形成される酸性側鎖基を持つコポリマーも使用することができる。酸性基の例はカルボン酸基、スルホン酸基、ハロゲン化(好ましくはフッ化)アルコール基、フェノール性OH基、および酸性OH基である。
【0113】
アニオンと反応することができる塩基性側鎖基を持つポリマーの例は、ポリビニルアミン、ポリビニルピリジン、ポリビニルイミダゾール、および何らかのイミノ置換があるポリホスファゼンである。ポリマーのアンモニウム塩または第四級塩も、骨格窒素または付随イミノ基から形成させることができる。塩基性側鎖基の例はアミノおよびイミノ基である。
【0114】
ポリマーのその他の例として、限定するわけではないが以下が含まれる: ポリ-アルファ-ヒドロキシエステル、ポリジオキサノン、フマル酸プロピレン、ポリエチレングリコール、ポリエルトエステル、ポリ無水物およびポリウレタン、ポリ-L-乳酸、ポリグリコール酸、ならびにポリ-乳酸-グリコール酸コポリマー。
【0115】
スキャフォールドを使用するADAS細胞の移植
本発明の細胞を三次元スキャフォールドの上またはその中に播種して、in vivoで移植し、そこで播種された細胞がその型枠上で増殖し、その哺乳動物の細胞と共同して、in vivoで代替組織を形成するようにさせることができる。
【0116】
本発明のいくつかの態様では、スキャフォールドはADAS細胞の細胞外マトリックス、細胞溶解物(例えば、可溶性細胞画分)、またはそれらの組み合わせを含む。いくつかの実施形態では、スキャフォールドは本発明の細胞が分泌する細胞外マトリックスタンパク質を含む。あるいは、細胞外マトリックスは以下からなる群から選択された外来性物質である: アルギン酸カルシウム、アガロース、フィブリン、コラーゲン、ラミニン、フィブロネクチン、グリコサミノグリカン、ヒアルロン酸、ヘパリン硫酸、コンドロイチン硫酸A、デルマタン硫酸、および骨マトリックスゼラチン。いくつかの態様では、マトリックスは天然または合成ポリマーを含む。
【0117】
本発明には、生体適合性のスキャフォールド、格子、自己組織化する構造などが含まれ、生分解性または非分解性、液体または固体のいずれでもよい。こうしたスキャフォールドは細胞を基礎とする治療法、外科的修復、組織再生法、および創傷の治療の分野で知られている。好ましくは、スキャフォールドを、細胞、細胞外マトリックス、馴化培地、細胞溶解物、またはこれらの組み合わせとともに前処理(例えば、播種、接種、接触)する。本発明のいくつかの態様では、細胞はスキャフォールドに付着する。播種されたスキャフォールドは限定するわけではないが以下を含む、当分野で知られているいずれかの方法で、哺乳動物の体内に導入することができる: 移植、注射、外科的貼着、別の組織との移植、注射、など。本発明のスキャフォールドはin vivoの組織または器官の形状および/またはサイズに造形することができる。例えば、限定するわけではないが、スキャフォールドを以下のように設計することができる: スキャフォールド構造がその後崩壊することなく播種した細胞を支持し、細胞を播種のときから組織移植物が宿主組織中で再成形されるまで支持し、そして播種された細胞を付着、増殖、および発展させて、これらを支持するのに十分な構造的完全性を持つ組織構造にする。
【0118】
本発明のスキャフォールドを、組織形成を刺激するか、あるいはその他に本発明の実践を促進または改善する、成長因子、細胞、薬剤もしくは本明細書中に別に記載するその他の成分のいずれかの1種以上と組み合わせて、投与することができる。スキャフォールド上に播種するADAS細胞は成長因子または薬剤を発現するように遺伝子工学的に操作することができる。
【0119】
別の好ましい実施形態では、本発明の細胞をスキャフォールド上に播種するが、この際その材料は実際の骨の特徴を模倣する、多孔性および生体構造上の強度の特定化した物理的性質を提示し、それによって最終構造の安定化と代謝物質および細胞栄養素の進入および退出を促進する。すなわち、この材料は構造上の支持体を提供すべきであり、またその中に宿主の血管形成および細胞の移動が発生し得る、足場を形成することができるものである。好ましい実施形態では、ADAS細胞はスキャフォールドに適用する前に、まず担体と混合する。好適な担体として、限定するわけではないが、以下が含まれる: アルギン酸カルシウム、アガロース、I、II、IV型もしくはその他のコラーゲンイソ型、フィブリン、ポリ乳酸/ポリグリコール酸、ヒアルロン酸誘導体、ゼラチン、ラミニン、フィブロネクチン、でんぷん、多糖類、糖類、プロテオグリカン、合成ポリマー、リン酸カルシウム、およびセラミックス(すなわちヒドロキシアパタイト、リン酸三カルシウム)。
【0120】
三次元型枠の外側表面を以下のように改変して、細胞の付着もしくは成長および組織の分化を改善することができる: 枠のプラズマコーティング、または以下の1以上の添加; タンパク質(例えば、コラーゲン、弾性繊維、網状繊維)、グリコタンパク質、グリコサミノグリカン(例えば、ヘパリン硫酸、コンドロイチン-4-硫酸、コンドロイチン-6-硫酸、デルマタン硫酸、ケラチン硫酸)、細胞マトリックス、ならびに/または限定するわけではないが、ゼラチン、アルギン酸塩、アガー、およびアガロースなどの、その他の物質。
【0121】
いくつかの実施形態では、培養中、本発明の細胞が成長できる程度の、in vivoで見られる細胞の微細環境を再創設した後、in vivoで移植することが重要である。その上、細胞の接種の前、接種中、またはその後に、培養培地中に、成長因子、骨形成誘発剤、および血管形成因子を添加して、哺乳動物中に移植した後、ADAS細胞による分化および組織形成の開始を誘導することができる。
【0122】
ADAS細胞の治療上の適用
本発明は、疾病を治療するために、ヒトを含む哺乳動物にADAS細胞に投与し、その際ADAS細胞の導入が治療上の緩和を導入することになる方法を提供する。本発明の細胞は単独で、あるいは別に本明細書中で検討するその他の細胞および/または生体活性因子との混合物として投与することができる。本発明のADAS細胞とともに投与することができる細胞として、限定するわけではないが、以下が含まれる: その他の複能性もしくは多能性細胞、骨細胞、骨芽細胞、破骨細胞、骨内皮細胞、幹細胞、および骨髄細胞。哺乳動物への投与時、または少し前に、別種の型の細胞をADAS細胞と混合するか、または哺乳動物への投与前の一定時間、これらをともに同時培養してもよい。
【0123】
当業者は、ADAS細胞を哺乳動物に移植し、そこで周囲の環境からシグナルおよび合図を受け取ると、この細胞がin vivoで隣接する細胞環境から指図された成熟細胞に分化することを、容易に理解できるはずである。好ましくは、ADAS細胞は少なくとも骨細胞の1つの特徴を示す細胞に分化する。あるいは、ADAS細胞はin vitroで所望の細胞型に分化させて、そして分化した細胞を、それを必要とする哺乳動物に投与することができる。
【0124】
本発明はまた、骨の疾病を治療するためのその他の治療上の処置と組み合わせてADAS細胞を移植片移植するものも包含する。好ましくは、この細胞は脊椎固定手術後の骨の癒合を促進するのに有用なものである。ADAS細胞を別の細胞とともに同時移植片移植することができる。それらは哺乳動物に有益な影響を与える、遺伝的に改変されたものおよび遺伝的に改変されない細胞の両方である。したがって、本明細書中に開示する方法をその他の治療上の処置と組み合わせることができる。これは本明細書中に提供する教示を一度目標とした当業者であれば理解するはずである。
【0125】
ADAS細胞をその他の有益な薬剤または生物学的分子(成長因子、栄養因子)とともに投与することができる。ADAS細胞をその他の薬剤とともに投与する場合、これらを単一の医薬組成物中で一緒に、あるいは別々の医薬組成物中で、同時にまたは順次、その他の薬剤とともに(その他の薬剤の投与の前または後に)投与することができる。同時投与することができる生体活性因子として、限定するわけではないが、以下が含まれる: 抗アポトーシス薬剤(すなわち、エリスロポエチン、トロンボポエチン、インスリン様成長因子Iおよびインスリン様成長因子II、肝細胞成長因子、カスパーゼインヒビター); 抗炎症性薬剤(すなわち、p38 MAPKインヒビター、TGF-ベータインヒビター、スタチン、IL-6およびIL-Iインヒビター、および非ステロイド抗炎症性薬剤); 免疫抑制/免疫モジュレート薬剤; mTORインヒビター; 抗増殖性薬剤(すなわち、アザチオプリン、マイコフエノレートモフェチル); コルチコステロイド(すなわち、プレドニゾロン、ヒドロコルチゾン); 抗血栓性薬剤; および抗酸化剤。
【0126】
本発明は、哺乳動物への、未分化細胞として、すなわち、成長培地で培養したままでの、ADAS細胞の投与を包含する。あるいは、ADAS細胞を、培養物中で、所望の表現型、例えば骨形成性表現型に分化するように刺激する条件に曝露した後、投与することができる。
【0127】
本発明の細胞を、修復または増強が必要な部位に、外科的に移植するか、注入するか、送達する(例えば、カテーテルもしくはシリンジによる)か、またはその他の方法で直接もしくは間接的に投与することができる。細胞を、マトリックス(例えば、三次元スキャフォールド)によって投与することもできる。細胞は従来からの薬学的に許容される担体とともに投与することができる。本発明の細胞またはその成分(例えば、細胞外マトリックス、細胞溶解物、馴化培地)の投与経路として以下が含まれる: 筋内、眼内、腸管外(静脈内を含む)、動脈内、皮下、経口、および経鼻投与。特定の非経口投与経路として、限定するわけではないが、以下が含まれる: 筋内、皮下、腹腔内、大脳内、心室内、脳室内、髄膜内、大槽内、脊髄内および/または脊椎周囲投与経路。好ましくは、細胞を脊椎固定手術中に使用する。
【0128】
本発明の細胞を単独で、または骨の創傷および欠損の修復に有用な組成物との混合物として、導入することができる。こうした組成物として、限定するわけではないが以下が含まれる: 骨形成性タンパク質、ヒドロキシアパタイト/リン酸三カルシウム粒子(HA/TCP)、ゼラチン、ポリ-L-リジン、およびコラーゲン。例えば、本発明の細胞を脱灰骨マトリックス(DBM)または骨形成性(自身の正当な場所での骨形成性)および骨誘導性の複合材料を作製するためのその他のマトリックスと組み合わせることができる。
【0129】
移植した細胞の分化、生存または活性を増強するため、本明細書中で別に検討する、別の生体活性因子を追加することができる。例えば、生体活性因子として、限定するわけではないが以下が含まれる: 骨形態形成タンパク質、血管内皮成長因子、線維芽細胞成長因子、ならびに骨伝導性および/または骨誘導性能力を持つその他のサイトカイン。移植した骨組織の血管形成および生存を促進するため、VEGF、PDGFまたはbFGFなどの血管形成因子を単独または内皮細胞もしくはその前駆細胞と組み合わせて添加することもできる。
【0130】
あるいは、移植するADAS細胞を遺伝子工学的に操作して、こうした成長因子、抗酸化物質、抗アポトーシス物質、抗炎症性物質、または血管形成因子を発現するようにすることができる。
【0131】
医薬組成物
本発明の範囲内にさらに包含されるものとして、限定するわけではないが、ADAS細胞自体が分泌する細胞外マトリックスを含む、ADAS細胞産物、ADAS細胞の細胞溶解物(例えば、可溶性細胞画分)、およびADAS細胞馴化培地がある。これに関して、ADAS細胞を含む組成物を投与するという用語において、本発明には、少なくとも以下の1種を含む医薬組成物が含まれる: ADAS細胞、それによって産生される細胞外マトリックス、その細胞溶解物、またはADAS馴化培地。本発明の医薬組成物は好ましくは薬学的に許容される担体または賦形剤を含む。医薬組成物は好ましくは本明細書中に定義する骨の病態の治療のために使用される。
【0132】
本発明の医薬組成物には、薬学的に許容される担体中の、ADAS細胞の同種もしくは異種集団、その細胞外マトリックスもしくは細胞溶解物、またはその馴化培地を含ませることができる。本発明の細胞の薬学的に許容される担体として、本発明の細胞またはその組成物もしくは成分と有害な反応をしない、好適な有機もしくは無機担体物質が含まれる。生体適合性の範囲内で、好適な薬学的に許容される担体として、以下が含まれる: 水、塩溶液(Ringer溶液など)、アルコール、油、ゼラチン、およびラクトース、アミロース、もしくはでんぷんなどの炭水化物、、脂肪酸エステル、ヒドロキシメチルセルロース、ならびにポリビニルピロリドン。こうした調製品を滅菌し、また所望ならば以下のような補助剤と混合することができる: 潤滑剤、保存剤、安定剤、湿潤剤、乳化剤、浸透圧調整のための塩類、バッファー、および着色剤。本発明での使用に好適な医薬担体は当分野で知られており、また例えば以下に記載されている: Pharmaceutical Sciences(17.sup.th Ed., Mack Pub. Co., Easton, Pa.)およびWO 96/05309。これらのそれぞれを参照として本明細書中に組み入れる。
【0133】
限定するわけではない別の例として、本発明の細胞を単独で、または薬学的に許容される担体中で投与するか、あるいは本明細書中で別に記載するマトリックス上またはその中に播種し、これを使用して、損傷もしくは破壊した骨組織を修復もしくは交換するか、現存する骨組織を増強するか、新しい、もしくは変更した組織を導入するか、あるいは人工的プロテーゼを改変することができる。
【0134】
細胞を半固体または固体デバイス中で投与する場合、体内の厳密な位置への外科的移植が、典型的には好適な投与手段である。細胞を液体または液状医薬組成物の形態で投与する場合は、細胞をより普遍的な位置(すなわち拡散して罹患した範囲全体)に投与して、そこから特定の位置に(すなわち化学的シグナルに応答することによって)移動させることができる。
【0135】
別の実施形態として、ADAS細胞成分(例えば、細胞溶解物もしくはその成分)または産物(例えば、細胞外マトリックス、ADAS細胞によって天然に、または遺伝子改変によって産生される栄養およびその他の生物学的因子、ADAS培養からの馴化培地)を含む医薬組成物を投与することによる、治療方法を包含する。この場合も、これらの方法でさらに、本明細書中で別に開示する、その他の活性な薬剤の投与を含む。
【0136】
ADAS細胞はまた、意図する治療効果を増強、制御、またはそうではなく誘導するために、添加剤とともに適用することができる。同様に、細胞を、移植した細胞を支持し、かつ/またはその命運を決定づけることによってin vivoでの組織再生を促進する、生体適合性マトリックスとともに適用することができる。
【0137】
哺乳動物へのADAS細胞の投与の前に、プラスミド、ウイルスまたは別のベクター戦略を使用して、細胞に安定的にまたは一時的に目的の核酸をトランスフェクトまたは形質導入することができる。細胞によって提供される治療応答を促進する意図で、遺伝子産物を発現するように遺伝子操作した後、細胞を投与することができる。
【0138】
本発明のADAS細胞を使用して、疾病もしくは外傷または組織の正常発達不全の結果として骨組織の修復または交換が必要な哺乳動物を治療することができる。治療には、新たな骨組織を産生させるための、本発明の細胞の使用が必要でありうる。例えば、本発明の未分化の、または骨形成分化を誘導された細胞を使用して、代謝性および非代謝性骨疾病を含む骨の病態を治療することができる。骨の病態の例として限定するわけではないが、以下が含まれる: 骨折、骨/脊椎変形、骨肉腫、骨髄腫、骨異形成、脊柱側弯、骨粗しょう症、骨軟化症、くる病、線維性骨炎、腎性骨ジストロフィー、および骨のパジェット病。
【0139】
脊椎固定
本明細書中に記載したように、背中の痛みは国民、特に高齢者の健康上の重要な問題として現存する。持続し、かつ重篤な背中の痛みは衰弱および身体障害をもたらすことが多い。この痛みは脊椎の椎間板の異常と密接に関係している。本開示に基づき、変性した椎間板を、その椎間板内の損傷した組織を復旧させることによって、治療することができる。本発明のADAS細胞を使用して、骨の発達を刺激し、そして変性の多様な段階にある椎間板を復旧させることができる。
【0140】
しかし、多くの場合、損傷かつ/または機能不全の背中の部位の少なくとも一部を除去することが必要となる。例えば、椎間板の1つが破断した場合、切除手術を実施して、その破断した椎間板を除去し、そして除去した椎間板を挟む2つの椎骨同士を固定することができる。脊椎固定術とは、脊柱を構成する2つ以上の椎骨を、移植および内部デバイス(桿状物など)で固定して、単一の一体化した骨に癒合させる術式である。脊椎固定は椎骨間の不自然な動きを排除して神経末端の圧迫を低下させる。その上、脊椎固定を使用して、例えば以下を治療することができる: 外傷に起因する脊椎の損傷; 脊椎間の緩衝板の突出および変性(椎間板すべり症または椎間板ヘルニアとも称されることがある); 異常な弯曲(脊柱側弯症または脊椎後弯症など); および感染もしくは腫瘍に起因する脊椎の弱体化または不安定化。本発明は脊椎固定手術の成功率を向上させるための組成物および方法を包含する。
【0141】
本発明のADAS細胞はin vivoで骨を形成することが示されたので、従来脊椎固定手術で使用されてきた骨移植片の代わりにADAS細胞を使用することができる。具体的には、ADAS細胞を使用して、隣接する2つの椎骨間(椎体内)、および隣接する横突起間(脊椎のいずれかの側の横突起間間隙内)での骨形成を刺激することができる。
【0142】
本発明のADAS細胞は脊椎障害の治療において以下のような多数の適用ができる: 椎間板修復中のプロテオグリカンに富むマトリックスの産生、脊椎横突起間固定における椎間体のための骨の産生、および長骨の破損の治癒のための骨の産生の促進。本発明は脊椎固定手術においてADAS細胞を使用して、骨の癒合を促進することができるという発見に基づくものである。
【0143】
椎間板が破損した場合、脊椎切除術を実施して、破損した椎間板を除去し、除去した椎間板を挟む2つの椎骨を固定することができる。脊椎固定のための方法の典型的な実行についての詳細は、米国特許第6,033,438および5,015,247号に開示されており、これらの内容の全部を参照として本明細書中に組み入れる。
【0144】
椎間板変性症は普通、セグメントの固定によって治療され、これによって脊椎内間隙の前方および後方脊椎要素の両方を固定する。固定術を考える場合、前方および後方要素にかかる機械的応力を考慮することが重要である。前方の運動セグメント要素(脊椎体および椎間板)は脊椎に与えられる圧迫力のレベルの約80%を受け持つ。脊椎体および椎間板の後方1/3が脊椎内の軸圧縮の中点となる。これらの力学は、所定の病理についてどんなタイプの固定術が最善の治療結果を持つかの評価において重要である。本発明は、骨代用品の原料としてADAS細胞を使用する、脊椎固定手術を提供する。
【0145】
1実施形態では、本発明として、哺乳動物において、その哺乳動物中の1以上の好適な脊椎体間間隙に、シリンジ、カテーテルまたはカニューレでの細胞の注入により、有効な量のADAS細胞を導入して、単一または複数の脊椎固定を促進することを含む、1以上の脊椎固定の実施方法が含まれる。ADAS細胞は、細胞が分化し、かつ骨を形成する期間中、生理学的条件下、すなわち、in vivo状態でなければならない。ADAS細胞の存在によって、脊椎固定手術での骨の癒合が促進される。
【0146】
別の実施形態では、本発明として以下を含む哺乳動物における1以上の脊椎固定術を実施するための方法が含まれる: 少なくとも1つの好適な脊椎体間間隙の後方部分に、桿状体と椎弓スクリューまたはプレートと椎弓スクリューから選択される金属移植を、隣接する椎骨にそれらを接着することによって取り付ける; その脊椎体間間隙の前方部分に有効な量のADAS細胞を注入する; そしてADAS細胞を、少なくとも骨細胞の1つの特徴を表示して、それによってin vivoで骨を形成する細胞に分化させる。
【0147】
本発明として、脊椎体間間隙への前方、後方、または後側方進入法のいずれかを使用することによる、脊椎固定の実施方法が含まれる。後側方(一方の側方もしくは両側方)進入法は前方進入法よりも手術による死亡率が低下するが、脊柱管の馬尾およびそこから出る神経根の周囲で作業する間は注意が必要である。脊椎体間間隙の後方からの進入および可視化は前方進入法よりも制限が多いが、多くの脊椎外科医はこれらの状況をどのように取り扱うかについて訓練されている。
【0148】
本明細書中で別に検討するように、ADAS細胞に一定量の成長因子、骨形成性タンパク質、またはそのための医薬担体などの、骨成長を促進するのに好適な、1以上の活性な生体活性薬剤をも含ませることができる。
【0149】
ADAS細胞が治療上または構造上の効果をもたらす機序の1つは、新たに産生されるか、現存するか、あるいは修復された組織または組織成分中にそれら自身またはその子孫を組み込むことによるものである。例えば、ADAS細胞および/またはその子孫が新しく産生される骨または別の構造的もしくは機能的組織に組み込まれて、それによって治療上のまたは構造上の改善をもたらすか、これに寄与することができる。ADAS細胞が治療上のまたは構造上の利益を提供する別の機構の1つは、所定の組織もしくは組織成分の構造または機能の創設、維持、復旧および/または再生成を促進する分子、例えば成長因子、を発現し、かつ/または分泌することによるものである。
【0150】
本明細書中でさらに記載するように、ADAS細胞を、その他の細胞、あるいは合成もしくは生体スキャフォールドなどのデバイス、この細胞に関連する特徴を改変または増強する因子、薬品、化学物質またはその他の薬剤を送達するための、物質またはデバイスと組み合わせて使用してもよい。
【0151】
本明細書中に開示する発明にしたがって、哺乳動物から脂肪組織を回収した後すぐに、ADAS細胞をその哺乳動物に送達することができる。例えば、脂肪組織の処理およびADAS細胞の組成物の取得後すぐに、細胞を投与することができる。結局は、送達の時期は哺乳動物の入手可能性および脂肪組織の処理に要する時間に応じて決まる。別の実施形態では、本明細書で検討するように、哺乳動物に再注入する細胞に、その他の改変、精製、刺激、またはその他の操作を加える場合は、送達までの時間は比較的長くなる。哺乳動物に投与する細胞の数は、例えば、脂肪組織処理後の細胞の収率に関係する。細胞の総数の一部をその後の使用のために残すか、凍結保存してもよい。
【0152】
以下の実施例で本発明の態様をさらに説明する。しかし、これらはどんな意味にも、本明細書中に示す本発明の教示または開示を限定するものではない。
【実施例】
【0153】
ここで本発明を以下の実施例を引用して説明する。これらの実施例は説明のみの目的で提供するものであって、本発明はこれらの実施例に限定されるわけではなく、本明細書中に提供する教示の結果として明白なすべての変化形を包含する。
【0154】
以下の実験を実施して、脊椎固定手術の結果に対するADAS細胞の役割を調べた。例えば脊椎固定手術に及ぼす同系および同種異系ADAS細胞の効果である。ここでの結果は、ADAS細胞が骨形成性であって、脊椎固定の改善に寄与することを証明している。本開示に基づいて、ADAS細胞を使用して、被外傷動物、好適な数の骨形成細胞を欠損している骨粗しょう症哺乳動物、および非癒合骨折を有する哺乳動物を含むがそれらに限定されない哺乳動物を、治療することができる。
【0155】
実施例1: 脊椎固定手術における自己移植骨片の代替物
75%を超えるアメリカ国民が背中の痛みに苦しんでいる。いくつかの症例では、根底にある病気が背中の痛みをもたらすことがある。これらの病気として、脊柱側弯、脊椎管狭窄症、椎間板変性症、感染過程、腫瘍、および外傷が含まれる。人口の1%については、背中の痛みが非常に重篤であるので、生涯にわたり身体障害に向き合うことを余儀なくされる。人口の別の1%は背中の痛みによって限られた時間、動けなくなる。背中の痛みを持つ哺乳動物の大部分は保存療法によって治療される。しかし、安静および投薬などの療法で効果がない場合、外科医は脊椎固定手術を勧めることが多い。この手術の目的は2以上の隣接する椎骨間に異所性骨を形成させて、それら2つを一体化構造へと「癒合」させることである。椎骨関節の固定化が脊髄から出る神経根への圧迫とそれによる痛みの感覚を低減させる。外科医は腰椎への後側方進入法を使用して、異所性骨を形成させるため、2つの椎体間の構造的支持体とともに骨移植片または骨誘導性材料を導入する(図1)。
【0156】
何らかの特定の理論に束縛されることは望まないが、脊椎固定のための「理想的な」移植片材料は以下の性質を提供すると考えられる: 構造的支持(回復期間の間、材料が脊椎/手術部位を安定化する); 骨伝導性(材料がそれ自体の上で骨の内部成長および隣接する骨との一体化を促進する); 骨誘導性(材料が、骨の形成および成長を、天然にはそれを起こさないであろう細胞から動員し刺激する); ならびに骨形成性(それ自体新しい骨を形成する能力がある細胞を材料が含有する)。
【0157】
現在、脊椎固定修復のための「黄金標準」は、自己由来骨であり、通常はその個体の腸骨稜から取得する。外科医は哺乳動物自身の骨を必要な部位に移植する。それにもかかわらず、これは完璧な解決法には遠い。哺乳動物の30%で、手術後、ドナー部位が感染するか、傷つくか、骨折するか、または痛みが生じる。実際、哺乳動物が複数の脊椎固定のために自己移植骨を必要とする場合、腸骨稜は十分な材料を提供できない場合がある。その哺乳動物の根本的な健康状態が脊椎固定手術の結果にさらに影響を与える。骨粗しょう症または糖尿病、喫煙、もしくは加齢による血管の不良を持つ哺乳動物では、脊椎固定の部位の新たな骨形成の低下および非癒合を示す(Whangら、2003, Spine J. 3:155-65)。このように、脊椎固定手術における自己移植骨の代替物としての需要がある。
【0158】
利用し得る代替材料はあるが、すべて共通の限界に直面している。すなわち骨形成能力を持たないことである。遺体からの同種移植骨片を滅菌し、保存し、そして必要に応じて手術室で使用することができる。これらの材料を特定の使用のために事前に成形するか、または外科処置部位にペーストとして適用できるように粉末化することができる。しかし、同種移植片は炎症を起こさせ、免疫応答を誘発しうるし、また限られた数の事例では感染源となっている(Whangら、2003, Spine J. 3:155-65)。同種移植片骨は滅菌するので、これはもはや生存する天然の骨形成細胞(骨芽細胞、骨細胞)を含有せず、かつ骨形成特性を欠失している。臨床試験において、多層脊椎固定術では、同種移植片骨は自己移植骨よりも劣っている(Whangら、2003, Spine J. 3:155-65)。ヒドロキシアパタイトおよびリン酸三カルシウム(HA/TCP)などのセラミック材料は骨伝導性であり、新しい骨の形成を促進する。しかし、これらは骨形成性およびおよび骨誘導性の特性を欠損しているので、その利用性は限られる。骨形態形成タンパク質(BMP)などの骨誘導性成長因子が市販されている(Sofamor/MedtronicsのInfuseTM)が、新しい骨形成を促進するためには、脊椎固定部位の中に骨形成細胞の存在を必要とする(Whangら、2003, Spine J. 3:155-65)。骨形成細胞の開発はこれらの代替脊椎固定材料のいずれによる結果も改善する可能性を持つ。
【0159】
臨床前脊椎固定試験のモデルとして、多くの動物種が供されている。これらとして、ラット、ウサギ、イヌ、ヒツジ、ヤギ、および非ヒト霊長類が含まれる(Khanら、2004, Biomaterials 25:1475-85; Liebschnerら、2004, Biomaterials 25:1697-714; Sandhuら、2001, Eur. Spine J. 10:S122-31)。これらの中で、ラット(Bodenら、1998, Spine 23:2486-92; Cuiら、2001, Spine 26:2305-10; Wangら、2003、J. Bone Joint Surg. Am. 85-A: 905-l1)およびウサギ(Khanら、2004, Biomaterials 25:1475-85; Kruytら、2004, Biomaterials 25:1463-73)が、動物のサイズおよび費用の面で、「概念の実証」の研究のために使用された。それぞれの種において、外科医は、他の哺乳動物を治療するために使用したのと同様に、腰椎への後側方進入法を使用することができる。脊椎固定の実現可能性研究のために、ウサギがより普通に使用される(Khanら、2004, Biomaterials 25:1475-85)が、これは、部分的にはこの動物のサイズと、ウサギの脊椎固定速度がヒトで観察されるのと同様であるという、確認された観察によるものである。それにもかかわらず、ウサギはラットモデルに比較して、一定の欠点を示す。十分特性決定された近交配系が入手可能なラットとは異なって、実験用ウサギは同系または類似遺伝子型ハプロタイプを示さない。したがって、ウサギ1個体から別の個体へ拒絶のリスクが無く細胞を常套的に移植するのは不可能である。ラット後側方脊椎固定モデルを使用して、コラーゲンスキャフォールド中で提供した骨形態形成タンパク質7の骨誘導性効果を証明するのに成功した(Salamonら、2003, J. Spine Disord. Tech. 16:90-5)。いくつかのグループがラットモデルを使用して、脊椎固定に対する骨髄ストローマ細胞の骨形成効果を評価するのに成功した(Bodenら、1998, Spine 23:2486-92; Cuiら、2001, Spine 26:2305-10; Wangら、2003, J. Bone Joint Surg. Am. 85-A:905-l1)。彼らは、スキャフォールド単独と比較して、骨髄ストローマ細胞の移植後4〜9週間以内の脊椎固定において統計的に有意な改善を達成した。各研究で、n = 4〜8匹の動物のコホート集団を使用した。
【0160】
脊椎固定術におけるADAS細胞の役割を評価するため、以下の実験を計画する。
【0161】
ADAS細胞の単離
雄Fischerラットから皮下脂肪組織を採取する(8〜10週齢、n = 25、1ラット当たり約3グラムの組織を取得)。ADAS細胞を公表されている方法論にしたがって調製する(Austら、2004, Cytotherapy 6:7-14; Halvorsenら、2001, Metabolism 50:407-413; Senら、2001, Journal of Cellular Biochemistry 81:312-319)。簡単に述べると、脂肪組織を細かく切り、洗浄し、そして1%ウシ血清アルブミンおよび0.1%コラゲナーゼI型(Worthington Biochemical, Lakewood NJ)を含有する等量のリン酸緩衝化生理食塩水中に懸濁する。37℃で撹拌(50 rpm)しながら60分の消化後、懸濁物を室温で5分間、1200 rpmで遠心分離して、ストローマ血管画分細胞をペレット化する。このストローマ血管細胞を、「Stromal Media」(10%ウシ胎仔血清(Hyclone、Logan UT)および1%抗生物質/抗真菌剤を補充したDMEM/ハムF-12培地)中に1 cm2当たり組織消化物0.1グラムの密度で、プレーティングする。細胞を加湿5% CO2インキュベーター内で75%集密度に達するまで、3〜6日間インキュベートする。これで約25〜30 X 104細胞/cm2が生成される。この時点で、ADAS細胞をトリプシン/EDTAでの消化によって回収し、5 x 103細胞/cm2のプレーティング密度で継代培養する。細胞を2継代まで増殖させて、6000万個を超える細胞(表1)を取得する。細胞を、文献に記載されているように、1〜3週間にわたる誘導期間での標準的アッセイを使用して、その骨形成能および脂肪細胞形成能について、in vitroで評価する(Halvorsenら、2001, Tissue Eng. 7:729-41; Hicokら、2004, Tissue Engineering 10:371-380)。使用まで、細胞は液体窒素中で凍結保存することができる。
【0162】
細胞を組織学的に追跡する目的で、最初の継代培養中に、追跡可能なマーカーを提供するようにβ-ガラクトシダーゼを発現するLacZ遺伝子を保有するレトロウイルスベクターで細胞を標識する。レトロウイルスベクターの安定した組み込みは、移植期間中にマーカーが失われるというリスクを低下させる。この方法を常套的に使用して、移植した細胞を追跡した。
【表1】

【0163】
実施例2: ADAS細胞のin vitro骨形成
ヒトADAS細胞は、アスコルビン酸塩、β-グリセロリン酸塩、デキサメタゾン、および1,25ジヒドロキシビタミンD3の存在下で培養したとき、in vitroで骨形成性表現型を示することが証明されている(Halvorsenら、2001, Tissue Eng. 7:729-41)。これらの条件下で、ADAS細胞は、リン酸カルシウム沈着についてのアリザリンレッドまたはvon Kossaのいずれかによる陽性染色によって証明されるように、それらの細胞外マトリックスを石灰化する(図3)。
【0164】
10日間にわたるヒトADAS細胞の骨形成にはアルカリホスファターゼ活性の増大が伴うことが観察された。培養期間の終了時、(石灰化された)骨形成細胞は、対照条件下に維持した細胞に比較して、アルカリホスファターゼのレベルが3倍高かった(図4)。同様に、骨形成条件下では、分泌されるオステオカルシンタンパク質のレベルが時間依存的に増加した。ADAS細胞は、オステオカルシン、オステオポンチン、骨形態形成タンパク質(BMP)2および4、ならびにBMP受容体IA、IB、およびIIを始めとする、骨芽細胞表現型に合致する多くの遺伝子マーカーを発現した。
【0165】
ADAS細胞が複数の系統経路にしたがって分化する能力を持つことも証明された。化学物質と成長因子の特定カクテルに応答して、ADAS細胞は軟骨細胞、骨芽細胞、脂肪細胞、ならびに神経様およびグリア様細胞にin vitroで分化することができる(図2)。
【0166】
実施例3: ADAS細胞はin vivoで骨形成性である
in vitroでの知見を拡大するため、ヒトADAS細胞を免疫不全SCIDマウスに移植した。ADAS細胞を、ヒドロキシアパタイト/リン酸三カルシウム(HA/TCP)のスキャフォールドの3 cm3の立方体上にロードし、皮下移植した。6週間後、この移植物を取り出し、固定し、脱灰し、ヘマトキシリン/エオシンまたはヒト核抗原特異的抗体で染色した(図5)。H&E染色に基づいて、ヒトADAS細胞の存在下で、ヒドロキシアパタイト/リン酸三カルシウムスキャフォールドの近傍で新しい骨が形成されたことが観察された。ヒト細胞は、ヒト抗原特異的抗体による免疫蛍光分析に基づいて、骨内で同定された。スキャフォールドのみ(細胞を含まない)の存在下では、新しい骨は形成されず、ヒト細胞も検出されなかった。これらの研究から、ADAS細胞はin vivoで骨形成能力があることが証明される。
【0167】
実施例4: ADAS細胞は同種異系移植がされうる
脊椎固定モデルにおけるADAS細胞の同種異系移植の概念の実証を提供するため、以下の実験を実施する。ADAS細胞は混合リンパ球反応において同種異系リンパ球から増殖性応答を誘発することができないことが証明されている。いかなる特定の理論に束縛されることも望まないが、ADAS細胞は、同種異系抗原に対するリンパ球の免疫応答を阻害する因子を放出すると考えられる。ヒヒモデルではADAS細胞の存在によって皮膚移植片の生存期間が延長されたので、このことは組織工学用途のために成人幹細胞を同種異系移植することができることを示している。
【0168】
イヌモデルを使用して、イヌの大腿骨幹に重大なサイズの部分欠損を作製することができる。ヒドロキシアパタイト/リン酸三カルシウムスキャフォールドを単独でまたは自己由来もしくは同種異系ADAS細胞のいずれかと組み合わせて用いて、この欠損を修復させることができる。同種異系細胞はHLA-IおよびHLA-2抗原のいずれとも不適合である(表2)。移植レシピエントはいかなる免疫抑制療法も受けない。この動物を16週間後に絶命させ、ADAS細胞存在下で観察される骨修復の程度をスキャフォールド単独(ADAS細胞を含まない)の移植と比較することができる。いかなる特定の理論にも束縛されることは望まないが、同種異系ADAS細胞と自己由来のものの間では、得られる修復に何ら有意な差異が観察できないであろうし、また同種異系細胞に対するいかなる免疫応答の証拠もないであろうと考えられる。これらの実験は、組織工学的構築物中への成人幹細胞の同種異系移植が実現可能であり、いくつかの事例では免疫抑制療法を必要としないという事実を証明するものとなる。
【表2】

【0169】
実施例5: 脊椎固定での同系ADAS細胞
ADAS細胞がin vivoで骨形成性であって、好適な生体物質担体と組み合わせることによって、動物モデルでの脊椎固定を改善および加速することができるという仮説に取り組むため、以下の実験を実施する。表3に実験計画を要約して示す。最初の研究は、ヒト自己由来細胞移植において存在する状況を模倣するため、同系ADAS細胞(同一系統のラットからの細胞)を用いて実施する。免疫応答および拒絶に関係する問題を除去することによって、これらの実験で脊椎固定のためのADAS細胞の骨形成能力に焦点が当てられる。脊椎固定モデルとしてラットを使用するこれらの実験を当分野で知られている方法にしたがって設計する(Bodenら、1995, Spine 20:412-20; Wangら、2003, J. Bone Joint Surg. Am. 85-A: 905-ll; Cuiら、2001, Spine 26:2305-10; Sandhuら、2001, Eur. Spine J. 10 Suppl. 2: S122-31; Wangら、2003, 脊椎 J. 3: 155-65)。
【0170】
外科手術および安楽死
Cui(Cuiら、2001, Spine 26:2305-10)の記載にしたがって、96匹の雌Fischerラットに単層横突間(intertransverse)脊椎関節固定術(L4-L5)を実施する。動物をケタミン(80 mg/kg)およびキシラジン(7 mg/kg)で麻酔し、剃毛し、覆いをかけ、その皮膚をベタジンおよび70%エタノールで消毒する。L3からL5まで、正中線後部縦切開を実施する。棘突起および椎弓板に沿って椎間関節の外側面まで、骨膜を持ち上げる。骨鉗子を使用して椎間関節を除去し、創傷部を生理食塩水溶液で洗浄する。動物からランダムにn = 32のコホートを構成する。コホートAは治療しない。コホートBには癒合部にヒドロキシアパタイト/リン酸三カルシウム(40 mg)単独の移植を施す。コホートCには癒合部に、Fischerラットの皮下脂肪組織由来の2 x 106 ADAS細胞(同系細胞)と組み合わせたヒドロキシアパタイト/リン酸三カルシウム(40 mg)の移植を施す。移植物の配置後、深在筋膜および皮膚切開部を縫合する。術後の鎮痛のために塩酸ブプレノルフィン(0.1 mg/kg)を与えた動物を、術後24時間まで、運動性および機能の回復についてモニターする。外科手術の6および12週間後に、各コホートからの16匹の動物のグループを、CO2窒息によって絶命させる。その時点で、分析のため、血清試料および腰椎を採取する。
【0171】
X線による検証
手術後および手術後6週間間隔で、動物について腰仙椎の前後および側方X線撮影をする。X線分析は、腰椎の手術部位での異所性骨形成および仮骨形成を検出するのに役立つ。絶命後、切除した検体について微小コンピュータ断層撮影(微小-CT)を実施する。当分野で既知の方法を使用して、新しい骨形成物の構造および体積を測定することができる(Mankaniら、2004, Radiology 230:369-76)。
【0172】
脊椎癒合の手触診
動物の絶命の際に、L3-L5腰椎を動物から切除する。検体について、L3-4およびL4-5での伸張および弯曲について触診する。検体を何らかの運動性の有無について等級化する。いずれかの方向に運動性がある検体にはスコア「0」をつけ、一方どの次元でも運動性がないものはスコア「1」として癒合したものと考える(Cuiら、2001, Spine 26:2305-10; Grauerら、2004, Spine J. 4:281-6)。
【0173】
脊椎癒合の生体力学的試験
試験の前に、すべての筋肉を除去し、L4-5で椎間板を分断して、癒合物のみが2つの椎骨を接続しているようにする。スチールk-ワイヤ(3.2 mm)ピンを椎体内に前後方向に入れる。k-ワイアに沿って負荷をかけて、0.5 cm/分の変位速度で、一軸引張試験を実施する。伸縮計によって変位を測定し、ロードセルによって負荷を測定する。コンピュータ処理した負荷変位プロットから、破断するピーク負荷を測定する。この負荷変位曲線上の2点(破断までの50%および75%負荷点)間の曲線の傾きとして、剛性を決定する。同様の手法でL3-4に隣接するセグメントを試験する。
【0174】
組織学的分析
腰椎検体(各コホートについて各時点でのn = 8)をホルマリン中で48時間固定し、リン酸緩衝化生理食塩水中の0.25 Mエチレンジアミン四酢酸で2週間、4℃で脱灰し、X-gal(1 mg/ml)の溶液中、37℃で16時間、インキュベートする。検体をパラフィンに埋め込み、横切断し(5μm)、ヘマトキシリンおよびエオシンで染色する。Medivue(Nikon)ソフトウェアを使用して、各検体からの10個の切片を分析して、異所性骨によって占有される各移植物の平均%(±標準偏差)を定量する。
【0175】
いかなる特定の理論にも束縛されることは望まないが、ADAS細胞は以下の結果が得られるならば、脊椎固定に成功していると考えられる: 1) コホートA(未処置)で6および12週目の時点で、癒合の最低限証拠(動物の90%で手動操作癒合スコアが0であり、異所性骨のX線による証拠がなく、組織学およびCT解析に基づいて1検体当たり10個の切片で手術部位の面積の5%未満が骨マトリックスにより占有されている)が観察される; 2) コホートBおよびCで6および12週目の時点の動物の組織学的分析での、HA/TCPスキャフォールドの検出; 3) コホートB(HA/TCP単独)で6および12週目の時点での、癒合の最低限証拠(動物の90%で手動操作癒合スコアが0であり、異所性骨のX線による証拠がなく、組織学およびCT解析に基づいて1検体当たり10個の切片で手術部位の面積の5%未満が骨マトリックスにより占有されている); 4) コホートCで手術後6週間の、β-ガラクトシダーゼ酵素活性または組織学的分析での免疫検出に基づいた、移植されたADAS細胞の検出; および5) スキャフォールド単独(コホートB)または空の損傷部(コホートA)対照に比較して、6および12週目の時点で、ADAS細胞の存在下(コホートC)での優れた脊椎固定(動物の90%で手動操作癒合スコアが「1」であり、手術部位で異所性骨のX線による証拠があり、組織学およびCT解析に基づいて、1検体当たり10個の切片でHA/TCP移植物の面積の30%を超える割合が骨マトリックスによって占有されている)。
【0176】
この実施例で設定した実験は、ラットモデルでの腰椎固定を促進かつ改善するための、ADAS細胞の有用性に取り組むのに役立つものである。
【表3】

【0177】
実施例6: 脊椎固定での同種異系ADAS細胞
ADAS細胞を、生体物質スキャフォールドとともに同種異系移植することによって、生体物質スキャフォールド単独に比較して優れた脊椎固定が達成されるという仮説に取り組むため、以下の実験を実施する。表4に実験計画を要約して示す。骨髄由来のMSCを移植して、明白な免疫拒絶の証拠を示さずに骨の欠損を修復することが可能であることは示されている(Arinzehら、2003, J. Bone Joint Surg. Am. 85- A:1927-35)。本明細書中で開示する実験は腰椎固定モデルでの同種異系ADAS細胞の有用性を証明している。
【0178】
文献中の以前の研究(Akahaneら、1999, J. Bone Miner Res. 14:561-8; Yoshikawaら、2000, J. Bone Miner Res. 15:1147-57)に基づいて、以下の実験のために、FischerおよびACI近交系ラットを選択する。これらの動物は組織適合性抗原不適合を示し、所定の免疫抑制療法無しでは骨形成性組織移植物を拒絶する(Akahaneら、1999, J. Bone Miner Res. 14:561-8; Yoshikawaら、2000, J. Bone Miner Res. 15:1147-57)。
【0179】
Fischerラットの腰椎固定部への移植のために、ACIラットから単離した同種異系ADAS細胞を使用する。同系自己由来ADAS細胞に関係する実験と平行して、本明細書中の実験を実施し、それによって、比較分析が可能になる。同種異系ADAS細胞に対する免疫応答の有無を、一方向混合リンパ球反応およびコホートから取得した血清サンプルのフローサイトメトリー分析に基づいて、評価することができる。
【表4】

【0180】
本明細書中で別に述べるように、皮下脂肪組織を雄ACIラット(8〜10週齢、n = 25、1ラットについて約3グラムの組織を取得)から採取する。各継代から取得する細胞の数は表1に概説した算出にしたがう。ACIラットからのADAS細胞を、FischerラットADAS細胞について使用したものと同一のin vitro分析に供する。本明細書中で別に記載したように、手術および検証法(すなわちX線検証、脊椎固定の手触診)を実施する。HA/TCP移植物に体積100μl中に約 2 x 106細胞を含ませることができる。
【0181】
組織学的分析のため、腰椎検体をホルマリン中で48時間固定し、リン酸緩衝化生理食塩水中の0.25 Mエチレンジアミン四酢酸で2週間、4℃で脱灰し、X-gal(1 mg/ml)の溶液中、37℃で16時間、インキュベートする。検体をパラフィンに埋め込み、横切断し(5μm)、ヘマトキシリンおよびエオシンで染色する。Medivue(Nikon)ソフトウェアを使用して、各検体からの10個の切片を分析して、異所性骨によって占有される各移植物の平均%(±標準偏差)を定量する。浸潤性リンパ球の有無について、切片を評価する。いかなる特定の理論にも束縛されることは望まないが、移植物内またはその周囲の任意の免疫細胞を同定するための細胞の免疫組織学的染色用に、汎造血系抗体に対する抗体(抗CD45)を使用することができる。浸潤性リンパ球の数は、1検体当たり10個の切片で、Medivueソフトウェアプログラムを使用して、定量することができる。
【0182】
血清免疫応答
ACI系統のADAS細胞への血清抗体の結合を、フローサイトメトリーによって評価する。ACIラットからのADAS細胞を液体窒素保存物からすばやく解凍し、5日間培養して、最大の生存力および表面抗原の発現を促進する。トリプシン処理によって細胞を採取し、染色用バッファー(Ix DPBS、5% FBS、0.5% BSA、0.1%アジ化ナトリウム)で洗浄し、5 x 106細胞/mlで再懸濁させる。細胞(5 x 105細胞)90μlを2 ml エッペンドルフチューブに分注する。各チューブに、未希釈ラット血清、または染色バッファー中に1:10で希釈した血清10μlを添加して、1:10および1:100の効果的な血清の希釈物を取得する。すべてのチューブを氷上で30分インキュベートし、洗浄用バッファー(IX DPBS、0.5% BSAおよび0.1%アジ化ナトリウム)で洗浄し、その後染色用バッファー100μl中に再懸濁させる。すべてのチューブに、ヤギ抗ラット(IgG/IgM)FITC二次抗体を最終希釈度1:100で添加する。対照のチューブには、二次抗体のみ(陰性対照)、またはACI ADAS細胞でのFischerラットの反復免疫化によって産生されたFischer抗ACIラット血清(陽性抗体)とともにACI ADAS細胞を入れる。それら懸濁物を暗所の氷上で15分インキュベートし、本明細書中で別に記載する洗浄用バッファーで2回洗浄する。次に、細胞を1%パラホルムアルデヒド200μl中で固定し、氷上にて固定液中で少なくとも15分インキュベートした後、回収する。フローサイトメトリー分析用に20,000個を取得する。結果を、二次抗体単独の陰性対照に比較した平均蛍光強度の増加に基づいた、二次抗体で染色されたACI細胞の%で表される。
【0183】
一方向混合リンパ球反応(MLR)
このアッセイは以下の論理的根拠に基づくものである: T細胞がin vivoでACI同種抗原で感作されるならば、それらはin vitroでの再刺激に対して、より速い動力学的速度で応答するであろう。同種異系ACI系統のADAS細胞に対するレシピエントラットT細胞の活性化はMLRアッセイによって評価することができる。応答細胞としてプールしておいた腸間膜プラス頸部LN細胞を使用して、各ラットについてMLRアッセイを実施する。以下の3グループから1グループ当たり8匹の動物を評価する(表5): 処置しない(コホートA); スキャフォールドのみ(コホート B); スキャフォールド + 同種異系細胞(コホート D)。このアッセイは、応答細胞を、培地中、放射線照射(5000R)した同系Fischer脾臓刺激細胞、または放射線照射した同種異系ACI脾臓刺激細胞とともに培養することにより準備される。培地または同系脾臓細胞に応答したT細胞増殖がバックグラウンド応答となる。これはつまり、典型的には、同種異系細胞に対する応答から同系応答を差し引くことで、真の増殖を評価する。陽性または陰性対照として、放射線照射した同種異系ACI(陽性)および同系Fischer(陰性)リンパ球を用いてアッセイを準備する。これはつまり、同種異系 対 同系HLA 1および2抗原の両方の発現が応答細胞であるFischer由来リンパ球による頑健な増殖性応答、または無応答のいずれかを確実にする。96ウェルプレート中で、1処置について3重にウェルを使用して、MLRアッセイを実施する。応答細胞を4 x 105細胞/ウェルでプレーティングし、脾臓細胞刺激細胞は1 x 105細胞/ウェルでプレーティングする。使用する培養培地は非必須アミノ酸、ピルビン酸ナトリウム、2-メルカプトエタノール、および抗生物質/抗真菌剤を補充したIscove改変ダルベッコ培地+10% FBS(Hyclone)である。培養の3および7日目の回収用に、レプリカ培養プレートを準備する。2または6日目に、培養物を3H-チミジン(1μCi/ウェル)でパルス刺激し、約16時間後、シンチレーション計数のために、細胞を回収する。結果を1分当たりのカウント数(cpm)で報告するが、これは培養ウェル内のT細胞増殖の程度を反映するものである。
【表5】

【0184】
いかなる特定の理論にも束縛されることは望まないが、同種異系ADAS細胞は以下の結果が得られるならば、脊椎固定に成功していると考えられる: コホートA(未処置)で6および12週目の時点で、癒合の最低限証拠(動物の90%で手動操作癒合スコアが0であり、異所性骨のX線による証拠がなく、組織学およびCT解析に基づいて、1検体当たり10個の切片で手術部位の面積の5%未満が骨マトリックスにより占有されている); コホートBおよびDで6および12週目の時点の全動物の組織学的分析での、HA/TCPスキャフォールドの検出; コホートB(HA/TCP単独)で6および12週目の時点での、癒合の最低限証拠(動物の90%で手動操作癒合スコアが0であり、異所性骨のX線による証拠がなく、組織学およびX線解析に基づいて1検体当たり10個の切片で手術部位の面積の5%未満が骨マトリックスによって占有されている) ; コホートB(HA/TCP単独)で6および12週目の時点での、癒合の最低限証拠(動物の90%で手動操作癒合スコアが0であり、異所性骨のX線による証拠がなく、組織学およびCT解析に基づいて1検体当たり10個の切片で手術部位の面積の5%未満が骨マトリックスによって占有されている); コホートDで手術後6週間までの、組織学的分析におけるβ-ガラクトシダーゼ酵素活性に基づいた、移植されたADAS細胞の検出; スキャフォールド単独(コホートB)または空の損傷部(コホートA)対照に比較して、6および12週目の時点で、ADAS細胞の存在下(コホートD)での、優れた脊椎固定(動物の90%で手動操作癒合スコアが「1」であり、手術部位で異所性骨のX線による証拠があり、組織学およびCT解析に基づいて1検体当たり10個の切片でHA/TCP移植物の面積の30%を超える割合が骨マトリックスによって占有されている); コホートAおよびB(細胞処理しない)に比較して、コホートCおよびD(ADAS細胞移植物)における抗ADAS抗体レベルの増加が1.5倍未満; ならびにコホートA、BおよびDを比較したとき、一方向混合リンパ球反応において、培地単独または同系由来脾臓細胞に比較して、同種異系由来脾臓細胞によって刺激された応答細胞の増殖の増強の証拠がない。混合リンパ球反応の陽性対照は少なくとも10,000 cpmの増殖応答を示すはずである。
【0185】
実施例7: 脊椎固定モデルにおける同系および同種異系ADAS細胞の比較および相対的有効性の対比
本明細書中に示す開示は、同種異系(HLA不適合)および同系(HLA適合性)ADAS細胞が脊椎固定を達成する上で同等の機能を示すかどうかの判定を可能にする、データを提供する。この実験計画を表6に要約する。いかなる特定の理論にも束縛されることは望まないが、同種異系MSCを使用して、イヌにおける重大なサイズの骨の欠損の修復達成に成功したという以前の研究(Arinzehら、2003, J. Bone Joint Surg. Am. 85- A:1927-35)に基づけば、2つの細胞集団は同等であると考えられる。同系および同種異系ADAS細胞の比較は、重要な医学的および商業的意義を提供する。本明細書中に示す開示は、組織再生療法のための同種異系ADAS細胞の使用を提供する。
【表6】

【0186】
いかなる特定の理論にも束縛されることは望まないが、同種異系および同系ADAS細胞コホート間で、表6のすべてのパラメーターが統計学的有意差を示さない(p > 0.05、好ましくはp > 0.30)場合には、脊椎固定の成功について、同種異系ADAS細胞は同系ADAS細胞に匹敵すると考えられる。
【0187】
本明細書中に引用したそれぞれおよびすべての特許、特許出願、および刊行物の開示は、その全部を参照として本明細書中に組み入れる。
【0188】
本発明を特定の実施形態を引用して開示したが、本発明の真の精神および範囲から逸脱することなく、他の当業者が本発明の別の実施形態および変更形を考案できることは明らかである。添付する特許請求の範囲はこうした実施形態および等価な変更形のすべてを含むことを意図している。
【特許請求の範囲】
【請求項1】
哺乳動物における脊椎固定手術後の骨の癒合の促進方法であって、脂肪組織由来の単離された成人ストローマ(ADAS)細胞を前記哺乳動物の脊椎へ投与することを含み、ここで、前記ADAS細胞が骨細胞の特徴の少なくとも1つを発現する細胞にin vivoで分化する、方法。
【請求項2】
ADAS細胞の哺乳動物への投与の前に、このADAS細胞を分化するように誘導することなく一定時間in vitro培養する、請求項1に記載の方法。
【請求項3】
ADAS細胞が前記哺乳動物に対して同種異系である、請求項1に記載の方法。
【請求項4】
ADAS細胞が脊椎椎体間固定のための骨形成を誘導する、請求項1に記載の方法。
【請求項5】
ADAS細胞が脊椎横突起間(intertransverse process)固定のための骨形成を誘導する、請求項1に記載の方法。
【請求項6】
ADAS細胞がさらに生体適合性マトリックスを含む、請求項1に記載の方法。
【請求項7】
生体適合性マトリックスが、アルギン酸カルシウム、アガロース、フィブリン、コラーゲン、ラミニン、フィブロネクチン、グリコサミノグリカン、ヒアルロン酸、ヘパリン硫酸、コンドロイチン硫酸A、デルマタン硫酸、および骨マトリックスゼラチンからなる群から選択される、請求項1に記載の方法。
【請求項8】
ADAS細胞が遺伝的に改変されている、請求項1に記載の方法。
【請求項9】
ADAS細胞を哺乳動物の脊椎の1以上の椎体間間隙中に投与する、請求項1に記載の方法。
【請求項10】
脊椎固定が、頸部関節、胸部関節、腰部関節、腰仙関節および仙腸(SI)関節からなる群から選択される脊椎のセグメント内のものである、請求項1に記載の方法。
【請求項11】
ADAS細胞を、後方進入法、後側方進入法、前方進入法、前側方進入法、および側方進入法からなる群から選択される進入法によって、1以上の椎体間間隙に投与する、請求項1に記載の方法。
【請求項12】
前記哺乳動物がヒトである、請求項1に記載の方法。
【請求項13】
哺乳動物における1以上の脊椎固定の実施方法であって、脂肪組織由来の単離された成人ストローマ(ADAS)細胞を前記哺乳動物の脊椎へ投与することによって単層または多層脊椎固定を促進することを含む方法。
【請求項14】
ADAS細胞が骨細胞の特徴の少なくとも1つを発現する細胞にin vivoで分化する、請求項13に記載の方法。
【請求項15】
ADAS細胞の哺乳動物への投与の前に、このADAS細胞を分化するように誘導することなく一定時間in vitro培養する、請求項13に記載の方法。
【請求項16】
ADAS細胞が前記哺乳動物に対して同種異系である、請求項13に記載の方法。
【請求項17】
ADAS細胞が脊椎椎体間固定のための骨形成を誘導する、請求項13に記載の方法。
【請求項18】
ADAS細胞が脊椎横突起間固定のための骨形成を誘導する、請求項13に記載の方法。
【請求項19】
ADAS細胞がさらに生体適合性マトリックスを含む、請求項13に記載の方法。
【請求項20】
生体適合性マトリックスが、アルギン酸カルシウム、アガロース、フィブリン、コラーゲン、ラミニン、フィブロネクチン、グリコサミノグリカン、ヒアルロン酸、ヘパリン硫酸、コンドロイチン硫酸A、デルマタン硫酸、および骨マトリックスゼラチンからなる群から選択される、請求項13に記載の方法。
【請求項21】
ADAS細胞が遺伝的に改変されている、請求項13に記載の方法。
【請求項22】
ADAS細胞を哺乳動物の脊椎の1以上の椎体間間隙中に投与する、請求項13に記載の方法。
【請求項23】
脊椎固定が、頸部関節、胸部関節、腰部関節、腰仙関節およびSI関節からなる群から選択される脊椎のセグメント内のものである、請求項13に記載の方法。
【請求項24】
ADAS細胞を、後方進入法、後側方進入法、前方進入法、前側方進入法、および側方進入法からなる群から選択される進入法によって、1以上の椎体間間隙に投与する、請求項13に記載の方法。
【請求項25】
哺乳動物がヒトである、請求項13に記載の方法。
【請求項1】
哺乳動物における脊椎固定手術後の骨の癒合の促進方法であって、脂肪組織由来の単離された成人ストローマ(ADAS)細胞を前記哺乳動物の脊椎へ投与することを含み、ここで、前記ADAS細胞が骨細胞の特徴の少なくとも1つを発現する細胞にin vivoで分化する、方法。
【請求項2】
ADAS細胞の哺乳動物への投与の前に、このADAS細胞を分化するように誘導することなく一定時間in vitro培養する、請求項1に記載の方法。
【請求項3】
ADAS細胞が前記哺乳動物に対して同種異系である、請求項1に記載の方法。
【請求項4】
ADAS細胞が脊椎椎体間固定のための骨形成を誘導する、請求項1に記載の方法。
【請求項5】
ADAS細胞が脊椎横突起間(intertransverse process)固定のための骨形成を誘導する、請求項1に記載の方法。
【請求項6】
ADAS細胞がさらに生体適合性マトリックスを含む、請求項1に記載の方法。
【請求項7】
生体適合性マトリックスが、アルギン酸カルシウム、アガロース、フィブリン、コラーゲン、ラミニン、フィブロネクチン、グリコサミノグリカン、ヒアルロン酸、ヘパリン硫酸、コンドロイチン硫酸A、デルマタン硫酸、および骨マトリックスゼラチンからなる群から選択される、請求項1に記載の方法。
【請求項8】
ADAS細胞が遺伝的に改変されている、請求項1に記載の方法。
【請求項9】
ADAS細胞を哺乳動物の脊椎の1以上の椎体間間隙中に投与する、請求項1に記載の方法。
【請求項10】
脊椎固定が、頸部関節、胸部関節、腰部関節、腰仙関節および仙腸(SI)関節からなる群から選択される脊椎のセグメント内のものである、請求項1に記載の方法。
【請求項11】
ADAS細胞を、後方進入法、後側方進入法、前方進入法、前側方進入法、および側方進入法からなる群から選択される進入法によって、1以上の椎体間間隙に投与する、請求項1に記載の方法。
【請求項12】
前記哺乳動物がヒトである、請求項1に記載の方法。
【請求項13】
哺乳動物における1以上の脊椎固定の実施方法であって、脂肪組織由来の単離された成人ストローマ(ADAS)細胞を前記哺乳動物の脊椎へ投与することによって単層または多層脊椎固定を促進することを含む方法。
【請求項14】
ADAS細胞が骨細胞の特徴の少なくとも1つを発現する細胞にin vivoで分化する、請求項13に記載の方法。
【請求項15】
ADAS細胞の哺乳動物への投与の前に、このADAS細胞を分化するように誘導することなく一定時間in vitro培養する、請求項13に記載の方法。
【請求項16】
ADAS細胞が前記哺乳動物に対して同種異系である、請求項13に記載の方法。
【請求項17】
ADAS細胞が脊椎椎体間固定のための骨形成を誘導する、請求項13に記載の方法。
【請求項18】
ADAS細胞が脊椎横突起間固定のための骨形成を誘導する、請求項13に記載の方法。
【請求項19】
ADAS細胞がさらに生体適合性マトリックスを含む、請求項13に記載の方法。
【請求項20】
生体適合性マトリックスが、アルギン酸カルシウム、アガロース、フィブリン、コラーゲン、ラミニン、フィブロネクチン、グリコサミノグリカン、ヒアルロン酸、ヘパリン硫酸、コンドロイチン硫酸A、デルマタン硫酸、および骨マトリックスゼラチンからなる群から選択される、請求項13に記載の方法。
【請求項21】
ADAS細胞が遺伝的に改変されている、請求項13に記載の方法。
【請求項22】
ADAS細胞を哺乳動物の脊椎の1以上の椎体間間隙中に投与する、請求項13に記載の方法。
【請求項23】
脊椎固定が、頸部関節、胸部関節、腰部関節、腰仙関節およびSI関節からなる群から選択される脊椎のセグメント内のものである、請求項13に記載の方法。
【請求項24】
ADAS細胞を、後方進入法、後側方進入法、前方進入法、前側方進入法、および側方進入法からなる群から選択される進入法によって、1以上の椎体間間隙に投与する、請求項13に記載の方法。
【請求項25】
哺乳動物がヒトである、請求項13に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−48917(P2013−48917A)
【公開日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願番号】特願2012−241874(P2012−241874)
【出願日】平成24年11月1日(2012.11.1)
【分割の表示】特願2008−525020(P2008−525020)の分割
【原出願日】平成18年7月26日(2006.7.26)
【出願人】(508032789)ボード オブ スーパーバイザーズ オブ ルイジアナ ステイト ユニバーシティ アンド アグリカルチュラル アンド メカニカル カレッジ (2)
【Fターム(参考)】
【公開日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願日】平成24年11月1日(2012.11.1)
【分割の表示】特願2008−525020(P2008−525020)の分割
【原出願日】平成18年7月26日(2006.7.26)
【出願人】(508032789)ボード オブ スーパーバイザーズ オブ ルイジアナ ステイト ユニバーシティ アンド アグリカルチュラル アンド メカニカル カレッジ (2)
【Fターム(参考)】
[ Back to top ]

