腫瘍細胞を同定、選択及び解析する方法
本発明は、腫瘍の状態及び/又は対応する進行度を診断する方法であって、患者から採取される、少なくとも1つの循環性腫瘍細胞(CTC)又は播種性腫瘍細胞(CTD)を高い確率で含有する有機液体の試料を、CTC又はCTDの集団に濃縮する方法に関する。本発明によれば、少なくとも1つのタイプのCTC又はCTDを、少なくとも90%の純度を持つ診断用試料を構成するように、マイクロ流体装置中で単一の細胞を個別に選択することによって単離する。このようにして得られた試料に対して、診断を可能にするのに適したその特徴が強調されるようにその後分子解析を行う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、包括的には、循環性希少細胞又は播種性希少細胞の同定、単離及びその後の解析に基づいた診断方法に関する。特に、本発明は、腫瘍学分野において適用され、したがって循環性腫瘍細胞(circulating tumor cell:CTC)又は播種性腫瘍細胞(disseminated tumor cells:DTC)の同定及び単離を含む診断方法に関する。
【背景技術】
【0002】
多数の病理学的状態(特に腫瘍の病理学的状態)の診断は典型的には、一方では異なる侵襲度によって特徴付け、また他方では特異性、感度、及び信頼性に関して異なるレベルの性能によって特徴付けられる方法によって行われる。
【0003】
いくつかのスクリーニング法は、末梢血流におけるバイオマーカー(例えばCA−125、CEA、PSA)又は他の体液におけるバイオマーカー(例えば糞便中の潜血の試験又は糞便DNAの試験)の存在の検出を目的とした解析に基づく。しかしながら、該方法は、例えば腫瘍組織の直接的解析に基づかず、バイオマーカーの濃度の関数である間接的評価に基づく。それゆえ、その感度及び特異性は特に高いわけではない。
【0004】
一例として考えられる、男性集団における癌のうちで最もよく見られる形態の1つである(癌のすべての症例のおよそ4分の1を占め、ヨーロッパにおいて年間300000人の新たな症例がある)前立腺癌の症例では、血清学的パラメーター(PSA量)に基づくスクリーニングが広く普及しているが、感度及び特異性は低い。
【0005】
時には直腸内触診等のより侵襲的な手順により臨床像を得ることができるが、さらに正確な診断のために前立腺生検を行うことがしばしば必要であり、侵襲性が増加すると、患者にとっては不快感が増大し、保険制度にとっては無視できない費用となる。
【0006】
同じような状況は結腸・直腸癌等の他の情況でも起こり、その場合、糞便中の潜血の評価にしばしば頼るか、そうでなければ、結腸内視鏡検査及び場合によっては結腸・直腸から直接採取した組織のサンプリングによる生検を介して侵襲的解析を行う。
【0007】
このような情況では、概して早期診断によってさらに効果的な治療が可能になるので、早期にかつ高度の感度及び特異性で癌の発症を評価することは明らかに利益がある。
【0008】
このような意味で、循環性腫瘍細胞(CTC)に対する最近の研究(例えば、非特許文献1)から、末梢血流中に原発性腫瘍に由来する細胞が見出されることが証明されている。たとえこれらの細胞が非常に希少であっても、それらを同定及び単離する可能性は、後に診断する目的で特徴付けられる腫瘍組織試料を得る今までに記載された侵襲的方法に対して、可能性のある非常に興味深い代替案を構成する。FDA等の規制団体は、転移を示す患者を評価するためのCTCに基づいたいくつかの臨床用システムを既に承認している。
【0009】
癌に冒された大多数の患者については、実際は、癌が十分早期に同定された場合に、外科的に、放射線療法を用いて、化学療法を用いて、又は上記方法の組み合わせによって排除することができる限りでは、死亡を引き起こすのは主腫瘍ではない。その代わりに、最も頻度の高い死亡原因は、転移(すなわち、主腫瘍から離脱し、主腫瘍部位からかなりの距離であっても身体の他の区域に向かって移動する悪性細胞によって生じる腫瘍コロニー)である。転移したコロニーを同定及び排除することは困難であるため、すべての転移を首尾よく治療するのは不可能であることが多い。したがって、臨床的な見地からは、転移したコロニーの形成は、癌の自然増悪における決定的な事象と判断することができる。
【0010】
したがって、乳癌、結腸癌、及び前立腺癌の症例において、CTCの数と疾病の転帰不良のリスク増加との間に相関関係があることが実証されたため、CTCを単離して、それから臨床的重要性を持つ有益な全体像を分子解析を用いて得る可能性が非常に重要な診断的影響を持つことは明らかであろう。
【0011】
また、播種性腫瘍細胞(DTC)(すなわち骨髄又はリンパ節中に見出すことができる腫瘍細胞)の解析は、或る特定の情況において、原発性腫瘍の解析よりもさらに一層重要であることが証明された。例えば、いくつかの研究グループが、HER2(原発性腫瘍で検出されず、単一のDTCにおいて検出できる)の過剰発現が非常に高い死亡リスクの予測を示すことに言及している(非特許文献2)。
【0012】
さらに、1セットの細胞の解析と比較して、単一の複数細胞の解析がより有益になり得ることは、例えば、特許文献1から既知である。特に、全く同一の患者の異なるDTCが異なる染色体変化(異なる部位における欠損及び増幅)を有することが見出された(非特許文献3)。
【0013】
現行の技術水準では、しかしながら、循環性腫瘍細胞及び播種性腫瘍細胞の単離については、非常に複雑かつ困難な主として解析的性質のアプローチが利用可能であるが、その収量は限定的であり、得られる試料の純度は低い。したがって、CTC又はDTCの上記試料は、シークエンシング等の最も厳密で確実な診断手順のいくつかとは適合性がない。純度が限定されているため、実際は、シークエンスの塩基における誤った判定によって引き起こされる偽陽性及び偽陰性のリスクが高い。
【0014】
対象となる細胞の一部を損失するリスクが高い操作を要する予備的な処理(例えば、遠心分離、フラッシング及びインキュベーション)に頼ることなく、ミリリットルオーダーの体積の血液を処理することができる、抗EpCAM抗体(白血球で発現されないが上皮細胞で発現される)でコートした内部表面を備えたマイクロ流体装置を用いてCTCを単離する試みが行われた(非特許文献4)。しかしながら、上記方法は平均して50%〜60%の純度レベルをもたらし、それは試料の純度が重要である下流の解析(例えば、コピー数変化、マイクロサテライト不安定性、ヘテロ接合性の消失(LoH)、高いシグナル対ノイズ(S/N)比が診断用途での基本となる遺伝子発現の評価、若しくは新薬の同定等、又はさらに癌幹細胞についての研究の分野において)の実施に十分であるとは認められない。
【0015】
同様の考察は非常に高い診断能力が強調される他の方法に拡張することができるが、大量で複雑で費用がかかりしたがって医療行為に適用ができないような解析作業の後でなくては、生物学的試料の濃縮及びその中の希少細胞集団の単離についての既知の手順によって十分なレベルの純度を得ることができないため、他の方法は具体的に実施することができない。例えば、非特許文献5(関連部分について引用することにより本明細書の一部をなすものとする)は、いくつかのマイクロRNA(miRNA)、すなわち約22ヌクレオチドを含有するRNAの短い一本鎖の非コード断片が癌の発生及び増悪に直接関与することが最近証明された。定量的PCRを用いた原発性腫瘍(前立腺癌)の細胞中のmiR−15a及びmiR−16の発現の研究から、対応する健常組織と比較して、両方のmiRNAがかなり低く調節されることが指摘された。上記データは、in situハイブリダイゼーション(ISH)を用いて確認された。さらに、いくつかの症例では、たとえこれらのmiRNAの低調節が癌発生の初期に既に記録されていても、一般的には、miR−15a−miR−16クラスターの欠失が病期の進行に関連することが証明されている。したがって、診断的な見地から、腫瘍細胞を単離する可能性、及び腫瘍細胞がこれらのmiRNAの低調節を示すかどうかを評価する可能性は、治療法の最も適切な形態の選択のためにも医師にとって有用である疾病の進行状態に対する正確な指標を提供する。
【0016】
治療的性質の考察をさらに進めるために、腫瘍学分野におけるいくつかの治療的アプローチが、モノクローナル抗体(細胞受容体を介する増殖因子によって媒介されるもの等の細胞外の増殖の必須のシグナルを腫瘍細胞から枯渇させて、腫瘍細胞の生存に直接影響することができる)の使用に基づくことは有益な想起である。例えば、この情況において、対象となる標的の1つは、表皮増殖因子受容体(EGFr)である。表皮増殖因子(EGF)と対応する受容体EGFrとの間の結合は、細胞の生化学的事象のカスケード(EGFrの自己リン酸化及び内部移行、そしてそれは細胞増殖へと発展する)を引き起こす。
【0017】
EGF及びトランスフォーミング増殖因子−α(TGF−α)の両方がEGFrに結合し、細胞増殖及び腫瘍の増殖をもたらすことが示されている。多くの場合、EGFrの発現増加には腫瘍細胞によるTGF−α又はEGFの産生が伴っており、したがって癌の増悪におけるオートクライン増殖制御の関与が示唆される。したがって、EGF、TGF−α及びEGFrを発現又は過剰発現する腫瘍の治療において、それらに対する抗体を使用することが提案された。特許文献2として公開された国際特許出願中で記載されるように、腫瘍細胞におけるK−RAS遺伝子又はB−RAF遺伝子中で変異の存在が最近実証されており、これはEGFrのポリペプチドに結合するようにデザインされた薬剤による治療に腫瘍が応答しないという事実に対する示唆を構成するものである。
【0018】
非侵襲的手順を用いて患者から採取した腫瘍細胞の試料から開始して、かかる変異の存在を検出する可能性は、抗EGFrモノクローナル抗体の使用に基づいた治療法を続けるべきか、そうでなければ、それが効果的でないことを予め理解してこの治療法を却下するべきかどうかを評価するための非常に重要なツールを医師に提供することが理解される。しかしながら、この展望においても、血液又はいくつかの体液中の希少細胞の濃縮、同定及び単離の方法論によって、その後の解析が信頼できること(偽陽性、偽陰性等の除外)、及び場合によっては方法論を実質的に行うことができること(例えば、純度が低いためにシグナル対ノイズ比が低すぎて有効な読み取りを得ることができない場合について)を保証する十分な純度を得ることができない。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】欧州特許第1109938号
【特許文献2】国際公開第28112274号
【非特許文献】
【0020】
【非特許文献1】Zieglschmid et al., Crit. Rev. Clin. Lab. Sci. 42, 155-196 (2005)
【非特許文献2】Klein et al., Tumour cell. 13(5), 441-53 (2008)
【非特許文献3】Klein et al., Proc. Natnl. Acad. Sci. USA 96, 4494-4499 (1999)
【非特許文献4】Nagrath et al., Nature, 450, 1235-1241 (2007)
【非特許文献5】Bonci et al. "The miR-15a-miR-16-1 cluster controls prostate cancer by targeting multiple oncogenic activities" October 19, 2008; doi:10.1038/nm.1880
【発明の概要】
【0021】
したがって、本発明の目的は、今までに記載された既知の技術分野の短所を克服する、非侵襲的性質のサンプリングを用いて得られる循環性希少細胞又は播種性希少細胞を同定し、単離し、その後に解析する方法を提供することである。
【0022】
したがって、本発明によれば、患者から採取された有機液体から開始して得られる対象となる細胞(同定された後、少なくとも90%の純度が得られるまで単離される)の試料に対して実行され、請求項1において規定される方法によって行われる、診断目的の手順が提供される。
【0023】
好ましくは、上記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞を単離する工程は、少なくとも95%の純度を有する腫瘍細胞又はそれらの一部分の試料が得られるように行われる。さらにより好ましくは、上記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞を単離する工程は、100%の純度を有する腫瘍細胞又はそれらの一部分の試料が得られるように行われる。
【0024】
特に、本発明の優先的な実施の形態によれば、希少細胞を単離する工程は本出願人によって開発された技術に従って行われ、この工程はマイクロメートルの大きさの数十万もの電極を集積したシリコンマイクロチップの使用に基づき、単一の純度で対象となる細胞を単離するように個別の細胞をマニピュレーションすることによって細胞を分子解析に利用可能にする。このように、本発明による方法は、高純度の細胞を提供し、プロセスの最も繊細な部分(個別の細胞の単離)について高度に自動化されており、診断及び予測について高い信頼性のある解析技法の実施を可能にする。今までに記載されたものを考慮すると、本発明の診断的及び治療的なレベルでの革新的な範囲が明らかに現われてくる。それにより、疾病過程の異なる期における腫瘍治療の改善が可能になり、生検に匹敵する信頼レベルを有する非侵襲的早期診断、並びに転移期及びアジュバント期の両方で、特異的抗癌剤を用いた治療の過程で及び/又は疾病の変遷及び臨床治療に対する応答の質を追跡するための術後期で、感度の高い正確なフォローアップの両方を可能にする。
【0025】
本発明によれば、患者から非侵襲的様式で採取された有機液体は、第一に、当該技術分野において既知の1つ又は複数の方法論(フィコール、赤血球の選択的溶解、トラックエッチ膜等のフォトリソグラフィによるマイクロマシニング又は他の技法を用いて得られた細胞の大きさに基づいたフィルターによる濾過、枯渇又は磁気濃縮等)に従って、対象となる細胞の濃縮を1回又は複数回行うことによって処理される。次いで、濃縮した細胞を、対象となる細胞及び/又は混入細胞等の同定のために特異的抗体で標識する。
【0026】
この文脈において、「有機液体」又は「身体の液体」という表現は、対象となる細胞を見出す確率が高い身体の試料から開始して得られる液体を指す。有機液体は、身体の試料から直接的(例えば、末梢血流、骨髄、尿等)又は間接的(例えば、リンパ節からの組織のトリプシン処理によって等)に採取することができる。
【0027】
この文脈において、「対象となる細胞」という表現は、適切な解析技法を用いて検出可能である、患者の病理学的状態に関する診断的又は治療的な性質の示唆を提供することができる特徴を持つ細胞を指す。
【0028】
例えば、身体の液体は末梢血(一般に使用される方法論に従って実質的に非侵襲的に患者から取り出すことができる)であり、対象となる細胞は循環性腫瘍細胞(CTC)である。
【0029】
さらなる例として、有機液体は骨髄からの血液であり、対象となる細胞は播種性腫瘍細胞(DTC)である。
【0030】
次いで、本発明の方法は、濃縮した試料から単一の細胞を個別に選択し、自動的又は半自動的で非手動的にこの細胞を単離することができるマイクロ流体システムの使用によって特徴付けられる。
【0031】
単純化のために以下では「単一の細胞」又は「個別の細胞」という用語を使用するが、一般に、単離されず1つ又は複数の、腫瘍細胞であっても非腫瘍細胞であってもよい他の細胞に結合されたものとして対象となる細胞が存在する可能性がある限りでは、この用語は単一の細胞又は単一の細胞凝集塊を含むものとして理解されなくてはならない。さらに、単離された核等の細胞の一部分を解析する可能性があることも理解すべきである。
【0032】
マイクロ流体システムにおける細胞の上記単離を介して、対象となる細胞のみ、すなわち100%に等しい純度の試料を含有するセットが得られ、したがって、それは分子解析の複数の手順を行うのに適切であると認められる。
【0033】
有利には、単一の細胞を個別に選択する上記マイクロ流体システムにおいて、選択は細胞自体の画像に基づいて行われる。
【0034】
有利には、細胞の上記画像は、細胞自体の懸濁培地中の流れがない中で取得される。
【0035】
有利には、上記画像は、蛍光での取得画像を含む。
【0036】
本明細書において「マイクロ流体装置」とは、層流形態で液体の体積を管理するようにデザインされ、解析の間に液体を含有する空間が少なくとも1つの1mm未満の大きさを持つ装置と理解される。
【0037】
本明細書において「単一の細胞を個別に選択することができる装置」とは、各細胞に対して個別に評価されるパラメーターに基づいて、1つ又は複数の単一の細胞の選択を、一度に又は同時に実行することができる装置と理解される。
【0038】
「非手動的単離」とは、例えば、可動型誘電泳動ケージを用いた移動の場合等において、操作者の手動性が必要とされない細胞の移動と理解される。
【0039】
「自動的単離」とは、例えば、マイクロプロセッサによって実質的に非対話的に遂行されるプログラムによって管理される、誘電泳動ケージを用いた移動の場合等において、操作者の介入が必要とされない細胞の移動と理解される。
【0040】
「半自動的単離」とは、例えば、マイクロプロセッサにより遂行される対話型プログラムによって管理される、例えば誘電泳動ケージを用いた移動の場合等において、操作者による対話がマニピュレーションに対して間接的制御を及ぼすことを可能にする細胞の移動と理解される。
【0041】
有利には、上記選択は自動的又は半自動的に行われる。
【0042】
本明細書において、「自動的選択」とは、例えば、細胞を対象となる腫瘍細胞に効果的に対応させる自動分類機により自動的に決定される場合等において、操作者の判断の介入が必要とされない細胞の選択と理解される。例えば、細胞の取得画像を処理し、そこから区別できる特色を抽出し、アルゴリズムに基づいてそれらを分類する画像分類機によりこれを行うことができる。
【0043】
本明細書において、「半自動的選択」とは、操作者の判断の介入が必要とされる細胞の選択と理解される。例えば、細胞の画像を取得し、そこから区別できる特色を抽出し、それらを選択すべきかどうかに関する最終決定について、操作者に提案するシステムによりこれを行うことができる。
【0044】
次いで、回収される試料の純度が高いため、回収される細胞に対する分子解析を様々な技法を介して行うことができ、中でも非限定的な例として以下のものが挙げられる:
シークエンシング(例えば変異の同定を目的とする)
マイクロサテライト解析(例えば定量的蛍光PCR、すなわちQF−PCRによる)
比較ゲノムハイブリダイゼーション(CGH)
アレイCGH
エンドポイントPCR
リアルタイムPCR
メチル化解析:
ピロシークエンシングによる定量的メチル化解析
重亜硫酸塩ゲノムシークエンシングPCR(BSP)
メチル化特異的PCR(MSP)
DNAの複合重亜硫酸塩制限解析(COBRA)
メチル化感受性単一ヌクレオチドプライマー伸長(MS−SNuPE)
遺伝子発現解析
RT−PCR
単一細胞遺伝子発現
デジタルPCR。
【0045】
本発明のさらなる特徴及び利点は、この後に続く、添付された図面を参照して提供されるその実施形態のいくつかの非限定な例の説明から明らかになるであろう。
【図面の簡単な説明】
【0046】
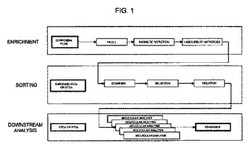
【図1】本発明による非侵襲的診断方法の一実施形態を要約したフローチャートである。
【図2】本発明による方法を実行する装置の一例(又はその実質的であり特徴付ける部分)の概略図である。
【図3A】本発明の方法によって循環性腫瘍細胞のスキャニングの過程で取得した画像である。
【図3B】本発明の方法によって循環性腫瘍細胞のスキャニングの過程で取得した画像である。
【図3C】本発明の方法によって循環性腫瘍細胞のスキャニングの過程で取得した画像である。
【図4A】本発明の方法によって同定及び単離された循環性腫瘍細胞の遺伝子解析の過程で得られた一連の電気泳動図である。
【図4B】本発明の方法によって同定及び単離された循環性腫瘍細胞の遺伝子解析の過程で得られた一連の電気泳動図である。
【図4C】本発明の方法によって同定及び単離された循環性腫瘍細胞の遺伝子解析の過程で得られた一連の電気泳動図である。
【図4D】本発明の方法によって同定及び単離された循環性腫瘍細胞の遺伝子解析の過程で得られた一連の電気泳動図である。
【図5】mCRCに冒された患者の末梢血流から本発明の方法によって選択及び単離された循環性腫瘍細胞のスキャニングの過程において取得した画像である。
【図6】mCRCに冒された患者の末梢血流から本発明の方法によって単離されたCTCのK−RAS上の変異Gly2Valの検出に関するスペクトルである。
【図7】mCRCに冒された患者の末梢血流から本発明の方法によって単離されたCTCのK−RAS上の変異Gly2Valの検出に関するスペクトルである。
【図8】濃縮した試料のスキャニングの過程において取得した5つの画像である。上記画像はDEPArray(商標)チップ上の5つの誘電泳動ケージの内容物に関する。図の細胞は互いに一緒に、その他の図の細胞とは分離して回収した。図8は循環性腫瘍細胞に対応する陰性対照(正常白血球)を示す。
【図9】濃縮した試料のスキャニングの過程において取得した5つの画像である。上記画像はDEPArray(商標)チップ上の5つの誘電泳動ケージの内容物に関する。図の細胞は互いに一緒に、その他の図の細胞とは分離して回収した。図9は循環性腫瘍細胞に対応する陰性対照(正常白血球)を示す。
【図10】濃縮した試料のスキャニングの過程において取得した5つの画像である。上記画像はDEPArray(商標)チップ上の5つの誘電泳動ケージの内容物に関する。図の細胞は互いに一緒に、その他の図の細胞とは分離して回収した。図10は本発明の方法による循環性腫瘍細胞を示す。
【発明を実施するための形態】
【0047】
本発明の課題は、好ましくは非侵襲的性質のサンプリングを用いて得られた、希少細胞、特に循環性腫瘍細胞又は播種性腫瘍細胞を同定、単離及びそのすぐ後に解析する方法である。
【0048】
サンプリング
試料は、患者の末梢循環から採取することができるか、又は他の場合には当該分野における既知の様々な技法を介して骨髄から採取することができる。
【0049】
前濃縮
採取された試料中の腫瘍細胞の比率は様々な方法、例えば、フィコール又はパーコール等の溶液によって構成した密度勾配での遠心分離、様々なタイプのフィルター等の機械的濃縮、目的のために提供された装置である誘電泳動活性化細胞選別装置(DACS)を介する誘電泳動による分離を用いた濃縮、例えば、対象とならない赤血球の選択的溶解等の選択的溶解、正の選択(集団が回収されるように特異的抗体に結合されたビーズを使用して)、又は負の選択(対象とならない細胞集団の枯渇)で免疫磁気ビーズを介した、免疫磁気分離(手順の特異性を増加させるために2つのタイプの選択をカップリングできる)、特異的蛍光抗体により標識された細胞でのFACS、有利には、上皮受容体(EpCAM等)についての特異的抗体によりコートされた表面を提示するマイクロ流体システムを用いた固相免疫分離等を使用して、濃縮することができる。
【0050】
大部分については、これらの手順は自動化することができ、密度勾配での遠心分離による分離はすべての選別手順に先行することができるか、又はその代わりに、すべての選別手順を全血に対して適用することができる。
【0051】
一般に、プロセスは希釈から開始するが、これはすべての技法に厳密に必要ではない。
【0052】
他の濃縮技法
当業者に周知のさらなる技法は、Miltenyi Biotech社によって開発されたMACSと呼ばれる技法、又はほかにはStem-cell technologies社によって開発されたEasy−sepである。
【0053】
あるいは、より大きな大きさの常磁性ビーズを使用することが可能であり、特殊なカラムの使用を必要としないが、ウェル又は試験管により作業する場合も使用することができる(例えば抗EpCAMのDynabead等)。
【0054】
まとめると、少なくとも1タイプの腫瘍細胞を含む細胞の集団に上記試料を濃縮する上記工程が、
a.質量密度、
b.形態、
c.電気的特性、
d.化学的特性、
e.機械的特性、
f.表面抗原の発現、
g.細胞質内抗原の発現、
h.誘電特性、
i.磁気的特性、
l.幾何学的特性(大きさ等)、及び
m.光学的特性、
又はその組み合わせ
からなる群から選択される少なくとも1つのパラメーターに基づいて行われる細胞の選択を用いた連続的工程からなる方法により行うことができる。
【0055】
有利には、次いでさらに、腫瘍細胞の濃縮は、第1の工程において回収された単核細胞からの細胞の正の選択又は負の選択を行う第2の工程を用いて達成される。明らかに、第2の濃縮工程は、特異的抗原を発現する能力又は特異的抗原を発現しない能力に基づいて行われ、以下の技法のうちの1つにより評価される選択を含むことができる。
a.MACS、すなわち磁気活性化細胞選別装置、
b.DACS、すなわち誘電泳動活性化細胞選別装置、
c.FACS、すなわち蛍光活性化細胞選別装置。
【0056】
単一の腫瘍細胞の単離
次に、腫瘍細胞を含有する試料は、単一の細胞を個別に選択し、自動式又は半自動式の非手動性手段でこれらの細胞を単離することができるマイクロ流体装置中に挿入される。この目的のために、誘電泳動による単離(例えば、国際出願PCT/IB2007/000963号若しくは国際出願PCT/IB2007/000751号、又はさらにManaresi et al., IEEE J. Solid-State Circuits, 38, 2297-2305 (2003)及びRomani et al., Proceedings of the International Solid State Circuit Conference, 1, 224-225 (2004)中に記載される技法を使用するDEPArray)、又は他の場合には光電子トラップ若しくは光泳動単離、又はさらに、レーザーピンセット(例えば、Reichle et al., Electrophoresis, 22, 272-82 (2002)又はFiedler et al., Anal. Chem., 70, 1909-15 (1998)を参照)を使用することは可能である。
【0057】
上記文献の内容は、単なる参照として関連部分に関するものとして、引用することにより本明細書の一部をなすものとする。
【0058】
対象となる細胞の同定は、例えば、以下のセンサー、
外部センサー、
蛍光顕微鏡等の光学センサー、又はさらに
内部センサー、
蛍光細胞の同定の統合方法を記載する、国際公開第2007049103号及び国際公開第2007010367号中で開示されるような光学センサー、
細胞のインピーダンス測定特徴の検出についての国際公開第2007049103号及び国際公開第2007010367号中で開示されたようなインピーダンス測定センサー
を介して、行うことができる。
【0059】
さらに、細胞の選択のためのシグナルは、例えば抗体にカップリングし、その後該抗体が細胞にカップリングするマイクロビーズの存在等のように間接的であってもよい。インピーダンス測定センサー又は光学センサーを用いて(明視野で、又は蛍光で)、既に今までに記載されていたように、細胞にカップリングした1つ又は複数のマイクロビーズの存在を検出することができる。
【0060】
本発明によれば、マイクロ流体装置を用いた単一の腫瘍細胞の個別のマニピュレーションによって、好ましくは自動化された手段で、少なくとも90%の純度を有する被解析試料を構成するように、採取された前濃縮試料中に含有される腫瘍細胞を単離する。
【0061】
好ましくは、95%を超える純度を有する被解析試料を構成するように、腫瘍細胞を単離する。さらにより好ましくは、100%の純度を有する被解析試料を構成するように、腫瘍細胞を単離する。
【0062】
遺伝子解析
本発明に従って回収された腫瘍細胞に対して、今までに記載されたものに従って、異なるレベルの解像度及び感度で、並びに研究の診断的な目的に従って、その遺伝的特性評価又は染色体の特性評価を可能にする様々なタイプの解析を行うことができる。
【0063】
例えば、K−RAS遺伝子の変異の存在を検出するために、転移を示す患者から採取したCTCのシークエンシングに進むことが可能である。
【0064】
前立腺癌の症例において、単一の細胞の全ゲノム増幅を用いてCTCの欠失の存在を評価することが可能である。
【0065】
さらに、原発不明癌(CUP)の事例において、CTCの遺伝的プロファイル及び/又は発現プロファイルを介して原発組織を同定することが可能であり、したがって最も適切な治療法の選択のための基本となる情報が得られる。
【0066】
播種性腫瘍細胞の事例において、次いで、予後指標及び可能性のある治療標的を同定するために、単一のCTC及び/又はDTC上の遺伝子発現の解析を行うことが可能である。
【0067】
非限定例によって、以下に記載されるものは、図1中に示されるフローチャートに従った本発明による方法の優先的な実施形態である。
【0068】
開始試料
健康な男性のドナーから採取した17mlの全血の試料中に、乳癌細胞株MCF7に属する2000個の細胞をスパイクすることによって導入した。
【0069】
予備的な濃縮
本発明の優先的な実施形態は、連続的工程からなるプロセスを意図する。
【0070】
(a)フィコール。 試料を抗凝固剤(例えば、EDTA)により処理し、ポリプロピレン製の50ml容の滅菌試験管の中へ、好ましくは8時間以内に移した。これから50μlの体積を抽出し、それをコールターカウンターを使用する白血球(WBC)及び赤血球(RBC)のカウントのために使用した。
【0071】
次いで試料をpH7.2のPBS及びEDTA(2mM)で1:4に希釈した。
【0072】
或る体積(≦30ml)の希釈した血液を15mlのフィコール−ハイパック(密度=1.077g/ml)上に正確に重層化した。
【0073】
次に、試料は(ブレーキなしの)チルトローター遠心分離機中で、22℃で30分間、654gで遠心分離した。
【0074】
界面のリンパ球の層を干渉しないように注意して、(パスツールタイプの)ピペットにより、血漿を除去した。ただし自動式のピペッターも使用することができる。ドロップカウンターにより層を慎重に収集し、50ml容のポリプロピレン滅菌コニカル試験管の中へ移した。
【0075】
試験管をPBS及びEDTA(2mM)により満たし、振盪し、10℃で10分間300gで遠心分離した。
【0076】
上清部分を廃棄した。
【0077】
試験管をPBS及びEDTA(2mM)により満たし、再び振盪し、10℃で10分間300gで遠心分離した。上清部分を抜き取った。
【0078】
試料から細胞沈殿(すなわち、末梢血流単核細胞、PBMNCの複合物)を採取して、5mlのバッファー中に再懸濁した。これから50μlのアリコートを採取して、コールターによりWBCカウントを行った。
【0079】
試験管をバッファーにより満たし、振盪し、10℃で10分間200gで遠心分離した。上清部分を廃棄した。
【0080】
赤血球排除のための前濃縮の第1の工程としてフィコールに対する代替案は、細胞の化学的特性を利用する赤血球の選択的溶解に代表される。
【0081】
(b)CD45 MACS枯渇
細胞沈殿を合計107個の細胞に対して80μlのバッファー中で再懸濁した。
【0082】
20μl量の抗CD45のマイクロビーズを合計107個の細胞に加えた。4℃で15分間の振盪及びインキュベーションの工程が続いた。
【0083】
試験管をバッファーにより満たし、10℃で10分間300gで遠心分離することによって、細胞を洗浄した。
【0084】
上清部分を廃棄し、細胞沈殿を合計108個の細胞に対して500μlのバッファー中で再懸濁した。
【0085】
LSタイプのMACSカラム(Miltenyi社)は、製造業者によって提供された指示に従って、適切なMACSセパレーターの磁場中に配置した。
【0086】
プレフィルターを各カラム上に配置した。
【0087】
プレフィルター及びカラムの両方を、3mlのバッファーによりリンスすることによって調製した。
【0088】
細胞懸濁液をカラムに(又はプレフィルター上に)適用した。
【0089】
細胞懸濁液を含有していた試験管であって、現在は空の試験管を9mlのバッファーにより満たした。
【0090】
標識されていない細胞を収集し、3mlのバッファーを3回加えることによってカラムを洗浄し、各回で以前の工程においてバッファーで満たした試験管に洗浄物を採取した。
【0091】
カラムをセパレーターから除去し、試験管上に置いた。
【0092】
5ml量のバッファーを、ピペットを使用してカラムの中へ導入した。
【0093】
磁気的に標識された細胞を含有する画分を、プランジャーの操作によってすぐ後で放出させた。
【0094】
混入細胞の数をさらに減少させるために、枯渇させる細胞上に選択的に存在する抗原を認識する抗体により官能基化したさらなる磁気マイクロビーズ、例えば、抗GPAマイクロビーズ(フィコールから残存赤血球を排除するため)等を含む枯渇カクテルを使用することが可能である。
【0095】
混入細胞の数をその上さらに減少させるために、磁気カラムにおける二次通過を実行することが可能である。
【0096】
(c)固定及び標識
MACS後の細胞を10分間300gで遠心分離し、40μlのバッファー中で沈殿を再懸濁した。
【0097】
試料を1.5ml容の試験管の中へ移した。これに直前に調製した4%パラホルムアルデヒドを760μl加え、続いて室温で20分間インキュベーションした。
【0098】
微小遠心管中で相対遠心加速度(r. c. f.)0.2r.p.m.で5分間遠心分離した後に、上清画分を抜き取った。
【0099】
これに続いて1mlのPBSで洗浄し、微小遠心管中で相対遠心加速度0.2r.p.m.で5分間遠心分離し、再び上清画分を吸引した。
【0100】
これに100μlの3%PBS/BSA(ブロッキングバッファー)を加えた。
【0101】
試料を室温で10分間インキュベーションした。
【0102】
微量遠心分離機中で相対遠心加速度0.2r.p.m.で5分間さらに遠心分離した後に、上清画分の吸引が続き、EpCAM−FITC及びCD45−PE(Miltenyi社、製造業者により推奨されたプロトコルに従う)で染色を行った。
【0103】
プロセスを完了させるために、1000μlのスーパーバッファー(Hepes400mM、1%BSA)及び水で希釈した1μlのヘキスト33324(100μg/ml)のにより最終洗浄を行い、試料をボルテックスで撹拌した。
【0104】
試料の品質管理を行い、マーカーの蛍光強度及び全細胞濃度を確認した。標識試料の一部を最小体積の特異的バッファー(誘電泳動操作に役立つ)中に再懸濁し、試料の品質管理のために装置上にロードし、蛍光顕微鏡下で管理した。細胞の蛍光強度を異なるチャンネルで示し、ヘキスト33324で標識された細胞(全有核細胞)をカウントした。細胞濃度が単一の細胞の単離のための装置の適切な操作に至適な濃度よりも高ければ、次の工程は試料を希釈して所望の濃度を得ることである。
【0105】
単離
次いで、このようにして得た細胞を、腫瘍細胞の誘電泳動操作及び単離のために、チップDEPArray(登録商標)CONV600K(Silicon BioSystems社によって製造、例えば、国際公開第0069525号を参照)中に挿入した。装置全体を図2において図示する。
【0106】
スキャニング、同定及び選択を試料で行い、腫瘍細胞の選別及び回収を行った。
【0107】
3つの異なる蛍光チャンネル(すなわち3つの異なる波長)を備えた顕微鏡で自動的又は手動的にケージされた細胞をスキャンした。DAPIチャンネル(「DAPIチャンネル」とはUV励起及び青色の発光を意味し、それはしたがってヘキスト33324の可視化に使用される)における観察により、(陽性)有核細胞の同定が可能になるが、EpCAM及びCD45に関するチャンネルの観察から、腫瘍細胞(適合する形態でのDAPI+、EpCAM+及びCD45−)と、リンパ球(DAPI+、EpCAM−、CD45+)と、誤ったシグナル(DAPI+、EpCAM+及びCD45+若しくはDAPI−、EpCAM+及びCD45+も、又は腫瘍細胞と不適合な形態でのDAPI+、EpCAM+及びCD45−)との間の区別を可能にする。
【0108】
図3A、図3B、図3Cは、DEPArray(登録商標)CONV600K内の試料の細胞のスキャニングの過程において取得した画像を示す。さらに特に、図3Aは、考慮した3つのチャンネルにおける3つの腫瘍細胞の画像を示す。図3Bは、考慮した3つのチャンネルにおける誤った細胞の画像を示す。図3Cは、考慮した3つのチャンネルにおける2つのリンパ球の画像を示す。
【0109】
次いで、細胞の選択は、DAPIに陽性(有核細胞)、EpCAMに陽性、CD45に陰性であることが見出される細胞を含有するケージの選択によって行われた。16個の細胞がチップ上に同定され、そのうちのいくつかは2つであった。15個の細胞(そのうちのいくつかは2つである)が、0.2mlのPCRチューブ中に数マイクロリットル(<40μl)で最終的に回収された。
【0110】
確定的な解析は、Applied Biosystems社のMinifilerキットを使用して行った。
【0111】
Minifilerキットを使用して行った断片の解析(QF−PCR)の結果を図4A、図4B、図4C、図4Dにおいて示す。考慮した4つの蛍光チャンネルにおいて、異なるマイクロサテライトを解析した。血液中へのスパイクによって腫瘍細胞が導入された男性の被験体に由来する対立遺伝子による微量の混入が、どんな場合にもないことを示すことができる。
【0112】
抗EpCAM抗体に対する代替案として、例えば、血球において発現されない1つ又は複数のタイプのサイトケラチンを認識する抗体等の異なるタイプの抗体を使用することが可能である。
【0113】
あるいは、癌をより特徴づける抗体(腫瘍特異的)を使用することが可能であり、それらは例えば
前立腺について、前立腺特異的抗原(PSA)、
肺について、甲状腺転写因子1(TTF−1)、
乳房について、ヒト表皮増殖因子受容体2(HER2/neu)
等である。
【0114】
適用の可能性
選択及び単離の自動化可能手順の後に100%の純度を有するCTCの試料を得ることにより、そうでなければ、正確に信頼性をもち、かつ精密に解析することができないような複数の状態について実現可能な診断経路が与えられる。
【実施例】
【0115】
実施例1
癌患者における変異(例えば、K−RAS遺伝子中の)の非侵襲的評価。
【0116】
以下において記載されるものは、転移性結腸・直腸癌(mCRC)に冒された患者の末梢血流からのCTCの単離の事例である。
【0117】
7.5mlの末梢血流の試料を、EDTA抗凝固剤(Beckton Dickinson社)を含むバキュテイナーチューブ中へ患者から抜き取った。試料をコールターカウンター(Beckman Coulter社)で解析し、白血球(WBC)は42×106及び赤血球(RBC)は43.95×109であった。次いで、PBMCを遠心分離を介して単離した(フィコール1077中で)。回収したPBMC(コールターカウンターによるカウントに基づいて16.5×106)を、BSA及びEDTAを含むPBS(ランニングバッファー、Miltenyi社)で洗浄し、製造業者の説明書に従って抗CD45抗体及び抗GPA抗体(Miltenyi社)にコンジュゲートした磁気マイクロビーズによる枯渇を介して選択した。得られた細胞(CD45及びGPAについて陰性画分)を、PBS中の2%のPFAで室温(RT)で20分間固定した。これに続いてPBSで洗浄し、3%のPBS/BSA(ブロッキングバッファー)中で室温で10分間インキュベーションした。PBSでのフラッシング後に、CD45標識は、100μlのMiltenyi社ランニングバッファー(RB)中に10μlのPEコンジュゲート抗CD45抗体(Miltenyi社)により、4℃で10分間行った。1mlのRBを加え、遠心分離し、上清部分から抜き取ることによって反応をブロックした。次いで、細胞は90μlのInsidePerm(Miltenyi社)で透過性にし、同時に10μlのFITCコンジュゲート抗CK抗体により室温で10分間標識した。1mlのInside Permを加え、遠心分離し、上清画分を除去することによって反応を終了させた。沈殿を、固定及び透過性にした細胞の誘電泳動による操作のために至適化したバッファー(水(SB)中のヘペス(400mM)+BSA(2%)及びDAPI(1mg/ml))中に再懸濁し、最終的にSBで洗浄し、チップDEPArray(商標)CONV600K(100000個の誘電泳動ケージを有する)へのインジェクションのために再懸濁した。チップ上に存在するのは約16000個の細胞であった。DAPI/FITC/PEにおけるスキャニング後に、CTCを同定した。図5は、本発明の方法を用いて選択及び単離したCTC(白色矢印によって示される)の画像を含み、上記画像は、3つのそれぞれのチャンネルにおける蛍光を強調するように適切に処理されている:緑色チャンネルにおけるFITCコンジュゲート抗CKモノクローナル抗体(Miltenyi社)、赤色チャンネルにおけるPEコンジュゲート抗CD45モノクローナル抗体(Miltenyi社)、及び青色チャンネルにおける核の同定のためのDNAのDAPI標識。
【0118】
処理された画像の解析から様々なタイプの可能性のある事象を明瞭に区別することが可能であるが、画像に基づかず全体的な蛍光の強度にだけ基づくあまり厳密でない解析においては、画像を偽陽性として却下する可能性があることに注目するべきである。
【0119】
例えば、ID382によるケージは1対のCTCを含有している。存在する3つのCTCのうちの2つが最終的に1つの同一のケージに存在する確率は無視できるので、これらは明らかに開始時に既に結合されていた。抗体(例えば抗CK)が非特異的手段でトラップされることを考慮すると、一般に、細胞のクラスターが誤った蛍光シグナルを生じさせ得るので、画像解析なしでは、この事象は却下される可能性がある。したがって、2つのID382細胞の回収は100%の純度を有する(大多数の分子解析と矛盾しない)。
【0120】
ID11439によるケージはDAPI+/CK+/CD45+の事象を示す。画像解析なしでは、誤ったものとして、上記事象は却下される可能性があるが、その代りに、画像により事象における蛍光分布の検出が可能になるので、3つの他のCK−の有核細胞(そのうち2つはCD45+)と共に、ケージされたDAPI+/CK+/CD45−のCTC(白色矢印によって示された)として、データを解釈することが可能である。上記ケージの内容物は分離して回収することができる。可動型誘電泳動ケージに基づいたシステムを使用して、最初は同じケージを共有する細胞を単一のケージ中で隔離することを、適切なパターンのケージの適用によって行うことができる。ケージの他の混入細胞からCTCを隔離することが可能でない場合、上記回収物に対して混入物の存在の情報を関連づけて、ケージの内容物を回収することはいかなる事例においても可能である。これは本発明による技法のさらなる利点である。回収された細胞の純度は以下へ示され、これは解析下流において考慮に入れることができる。問題となっている事例において、したがって、他の3つと共に細胞を回収することができるか(25%の純度)、又は他の場合には、単独で分離及び回収されて100%純粋な回収物(単独で単離された場合)、若しくは他の場合には、1つの混入物と共に単離された場合は50%純粋な回収物、若しくは他のケージ中に存在する可能性がある混入物なしで、1つの混入物及びさらに9つのCTCと共に単離された場合は90%純粋な回収物(この事例ではない)を得ることができる。
【0121】
ケージID5007は、DAPI+/CK+/CD45+の事象であるので、全蛍光に基づいて、ID11439の事象に類似するような事象を示す。しかしながら、画像に基づいて、どのように誤った事象であるかどうかを、その事象を抗CK抗体をトラップしたクラスターに結びつけて考えられる限りでは、決定することが可能である。
【0122】
ケージID13103は、DAPI+/CK+/CD45+の事象であるので、全蛍光に基づいて、ID11439の事象に類似するような事象を示す。しかしながら、画像に基づいて、どのように誤った事象であるかどうかを、CD45+(非CTC)シグナルを有する単一の二重陽性細胞に結びつけて考えられる限りでは、決定することが可能である。
【0123】
ID8614によるケージは、CK+/CD45−であるがDAPI−の事象(CTCとして分類されなかった)を示す。2つの細胞がCK−であり、その内の1つの細胞がCD45+でもあるので、ID7796によるケージは、CTCとして分類されない2つの細胞を含む対照事象(2つの白血球)を示す。
【0124】
対象となる細胞は、その結果単離することができるか、又はそうでなければ、実験の目的に従って、試料の純度の面から、及び細胞が含まれる細胞凝集体からの細胞の分離の容易性に従って、単離することができる。この意味において、画像に基づいた選択は、偽陽性及び偽陰性の除外に特に効果的である。
【0125】
フィコールに対する代替案として、赤血球(RBC)の選択的溶解に基づいた技法を使用することが可能である。この事例において、第一に、試料中に顆粒球も残存する。RBCの上記除去後に、腫瘍細胞は、正の免疫磁気選択(例えば、抗EpCAM抗体にカップリングされた磁気マイクロビーズで)、又は負の免疫磁気選択を介して(例えば、抗CD45抗体に、又は抗CD45抗体及びCTC中に存在しない抗原に対する他の抗体を含む反応混液にカップリングした磁気マイクロビーズを介して)さらに濃縮することができる。任意の事例において、存在する少数のCTCは、何万又は何十万もの白血球を含有する試料において得られる。
【0126】
末梢血流からのCTCの単離は、同様に、Veridex社のCellSearch(商標)システム等のFDAによって認可された濃縮及び標識の手順と互換性をもつ。この事例において、CellSearchシステムは、自動化された手段(AutoPrepマシンによる)において標識及び濃縮を行うためにも使用することができる。このシステムにより、存在する少数のCTCは、典型的には、わずか数千の混入白血球の(典型的な値は1000〜5000)と共に試料中に得られる(約90%の至適収量で)。CellSearch AutoPrepは優れた濃縮システムであり、その主要な限定としては、EpCAMの正の免疫磁気選別に基づくということである。したがって、いくつかのタイプの腫瘍において、CTCがEpCAMを過剰発現しない場合、少数のCTCしかを見出すことができない。かかる事例において、CD45+細胞の枯渇のために負の選択が示される。
【0127】
EGFr受容体に対して指向性があるモノクローナル抗体に基づいた治療法の非有効性に、K−RASのいくつかの変異が関係のあることが実証されているので、K−RAS遺伝子の変異状態の検出には多くの臨床的重要性がある。上記変異は、EGFrの上流の阻害にもかかわらず、実際は、細胞増殖の機構を下流で活性化する。セツキシマブ及びパニツムマブによる治療法はこれまでは、野生型K−RASの患者のためだけ示されている。CTC中の変異を同定する可能性は、特に、生検が可能でないか、行うのに非常に複雑なすべての状況において、生検に頼る必要がなくなる可能性を提供する。外科手術で取り出された組織が利用可能な場合でさえ、CTCを解析する可能性は、任意の事例において関心を持たれる。腫瘍は遺伝的見地から内因的に不安定であり、転移は原発性腫瘍の部位とは異なる部位に位置する細胞に由来することがあり得る。したがって、CTCは転移する細胞の分子像をより良好に反映することができる。
【0128】
CTCからのK−RASの変異を検出する可能性を確認するために、転移性結腸・直腸癌(mCRC)に冒された患者の末梢血流からのCTCを解析した。上記の濃縮手順に従って、CTCをDEPArray(商標)上で同定及び単離した。100%の純度により、シークエンシングを介して可能性のある変異の存在の検出が可能になる。例えばネステッドPCRにより開始コピーを事前に増幅した後に、既知の技法を使用して、シークエンシングを行う。
【0129】
問題となっている事例において、下流の解析は、Sigma社製のOmniplexキットによるDOP−PCR技法を使用して行った。増幅後に、Applied Biosystems社製のキャピラリー電気泳動シークエンサーにより、産物を解析した。
【0130】
図6は、解析された試料の1つにおける変異の検出例を示し、この変異はコドン12中のグリシンからバリンへの変異に対応する(対応する陰性対照を図7中に示す)。
【0131】
実施例2
単一の細胞の全ゲノム増幅及びCGHアレイを介する(例えば前立腺癌における)欠失のCTCの評価。この事例において、異なるウェル中に回収される単一の細胞の単離が有利に行われる。このような手段で、解析は集団の不均質性を考慮に入れ、いくつかの腫瘍細胞の中にだけ存在する変異を同定するのがより容易なように、平均的なシグナルだけでなく、各細胞に関する複数のシグナルも供給する。
【0132】
実施例3
遺伝的プロファイル及び/又はCTCの発現プロファイルを介する、CUP腫瘍における原発組織の非侵襲的同定。
【0133】
実施例4
予後指標の同定のための単一の播種性腫瘍細胞(DTC)の遺伝子発現の解析、及び潜在的な治療標的。この事例においても、異なるウェル中に回収される単一の細胞の単離が有利に行われる。このような手段で、解析は集団の不均質性を考慮に入れ、いくつかの腫瘍細胞の中にだけ存在する変異を同定するのがより容易なように、平均的なシグナルだけでなく、各細胞についての複数のシグナルも供給する。
【0134】
実施例5
既に言及したたように、一般に、「細胞の単離」に関して上で述べたことは、例えば、核等の「細胞の一部分の単離」にも適用されるとして理解される。実際、重要な情報は、或る特定のタイプの生体分子情報についての任意の事例において、細胞の一部分の単離によって得ることができる(例えば核において含有されるゲノムDNAの評価によって)。
【0135】
核の単離の例において、細胞の選択は、非腫瘍細胞から腫瘍細胞(CTC又はDTC)の核を区別可能なようにマークする技法(例えば、FISH等)を介して行うことができる。この事例において、複数のシグナルの存在は、ゲノムDNAの重複の存在を示す(腫瘍細胞の特徴であり、一般に正常細胞にはない)。
【0136】
特に乳癌の例において、HER2遺伝子(通常染色体17に位置する)に関するゲノム領域の重複を評価することは興味深い。したがって、2つのタイプのプローブ(染色体17の動原体について1つ及びHER2遺伝子について1つ)を適用する。遺伝子/染色体比が2より大きければ、細胞は、試験に対して陽性であると通常は判断される。上記情報は、例えば、対応するHER2受容体の過剰発現の事例においてだけ有効性を示すトラスツズマブ(ハーセプチン)等の薬物の使用において密接な関係がある。精製された形態の上記細胞をカウントすることだけでなく、同定及び単離することも、腫瘍の遺伝的特徴に対するさらに詳しい情報の取得を可能にする。
【0137】
実施例6
DNAにおけるコピー数多型(CNV)の存在は、腫瘍の典型的な特徴である。新薬の評価に関して、疾病の過程にCNVを関連づけるため、及び潜在的にCNVが疾病の過程に重要な影響があるゲノムの領域に対してCNVを関連づけるためにCNVを評価できることは非常に興味深い(予後良好の事例及び予後不良の事例において)。この情報は薬理作用のための標的となる遺伝子の同定に有用であり得る。さらに次いで、癌診断のステージにおいて、取得した経験に基づいて治療法を正しく方向付けるために最小限の侵襲的手段で患者のCTCのCNVプロファイルを同定することが可能だろう。
【0138】
CNVを決定する可能性を実証するために、CTCの少量の試料及びそれに応じて少量の陰性対照試料を分離及び単離した。
【0139】
転移性乳癌(mBrCa)を患う患者から7.5mlの末梢血の試料を採取し、CellSaveチューブ(Veridex社)中に入れた。試料は、濃縮し、標準的な手順に従って、CellSearch AutoPrepにより、蛍光抗体(PEコンジュゲート抗CK、APCコンジュゲート抗CD45)及びDAPIで標識した。濃縮した細胞をVeridex社のカートリッジから抽出し、減少した体積中で再懸濁した。上記試料は、307200個の電極及び多数のプログラム可能なケージ(典型的には19200個〜76800個の間)を備えたチップDEPArray(商標)A300K(Silicon BioSystems社)に注入した。スキャニング後に、5つの細胞を有する2つの陰性対照、5つのCTCを有する2つの試料、単一のCTCを有する1つ試料が単離された[?CONTROLLARE - L'ITALIANO NON E' COMPRENSIBILE]。
【0140】
図8及び図9は、CNV検出のための陰性対照として5つの各々の白血球(DAPI+/CD45+/CK−)を有する、第1の回収及び第2の回収において回収された細胞をそれぞれ示す。図10は、5つのCTCが分離して回収されたことを示し、それらはCNV解析の対象となる。
【0141】
本発明による方法を使用して行われた選択及び単離の後に、そして試料が90%を超える純度でここで利用可能であるとすれば(問題となっている事例において、図10中で示されたCTCの回収については100%)、欧州特許第1109938号において示された方法論に従う全ゲノム増幅に基づいた解析、ライゲーションを介したPCR、続いて分裂中期の比較ゲノムハイブリダイゼーション(CGH)又はCGHアレイを首尾よく実行することが可能であるが、より低い純度の試料では、検出されるシグナルが非腫瘍細胞の存在下において弱いか又は不明瞭である限りでは、これらは不可能であるか又は本質的に信頼性が低くなるだろう。
【技術分野】
【0001】
本発明は、包括的には、循環性希少細胞又は播種性希少細胞の同定、単離及びその後の解析に基づいた診断方法に関する。特に、本発明は、腫瘍学分野において適用され、したがって循環性腫瘍細胞(circulating tumor cell:CTC)又は播種性腫瘍細胞(disseminated tumor cells:DTC)の同定及び単離を含む診断方法に関する。
【背景技術】
【0002】
多数の病理学的状態(特に腫瘍の病理学的状態)の診断は典型的には、一方では異なる侵襲度によって特徴付け、また他方では特異性、感度、及び信頼性に関して異なるレベルの性能によって特徴付けられる方法によって行われる。
【0003】
いくつかのスクリーニング法は、末梢血流におけるバイオマーカー(例えばCA−125、CEA、PSA)又は他の体液におけるバイオマーカー(例えば糞便中の潜血の試験又は糞便DNAの試験)の存在の検出を目的とした解析に基づく。しかしながら、該方法は、例えば腫瘍組織の直接的解析に基づかず、バイオマーカーの濃度の関数である間接的評価に基づく。それゆえ、その感度及び特異性は特に高いわけではない。
【0004】
一例として考えられる、男性集団における癌のうちで最もよく見られる形態の1つである(癌のすべての症例のおよそ4分の1を占め、ヨーロッパにおいて年間300000人の新たな症例がある)前立腺癌の症例では、血清学的パラメーター(PSA量)に基づくスクリーニングが広く普及しているが、感度及び特異性は低い。
【0005】
時には直腸内触診等のより侵襲的な手順により臨床像を得ることができるが、さらに正確な診断のために前立腺生検を行うことがしばしば必要であり、侵襲性が増加すると、患者にとっては不快感が増大し、保険制度にとっては無視できない費用となる。
【0006】
同じような状況は結腸・直腸癌等の他の情況でも起こり、その場合、糞便中の潜血の評価にしばしば頼るか、そうでなければ、結腸内視鏡検査及び場合によっては結腸・直腸から直接採取した組織のサンプリングによる生検を介して侵襲的解析を行う。
【0007】
このような情況では、概して早期診断によってさらに効果的な治療が可能になるので、早期にかつ高度の感度及び特異性で癌の発症を評価することは明らかに利益がある。
【0008】
このような意味で、循環性腫瘍細胞(CTC)に対する最近の研究(例えば、非特許文献1)から、末梢血流中に原発性腫瘍に由来する細胞が見出されることが証明されている。たとえこれらの細胞が非常に希少であっても、それらを同定及び単離する可能性は、後に診断する目的で特徴付けられる腫瘍組織試料を得る今までに記載された侵襲的方法に対して、可能性のある非常に興味深い代替案を構成する。FDA等の規制団体は、転移を示す患者を評価するためのCTCに基づいたいくつかの臨床用システムを既に承認している。
【0009】
癌に冒された大多数の患者については、実際は、癌が十分早期に同定された場合に、外科的に、放射線療法を用いて、化学療法を用いて、又は上記方法の組み合わせによって排除することができる限りでは、死亡を引き起こすのは主腫瘍ではない。その代わりに、最も頻度の高い死亡原因は、転移(すなわち、主腫瘍から離脱し、主腫瘍部位からかなりの距離であっても身体の他の区域に向かって移動する悪性細胞によって生じる腫瘍コロニー)である。転移したコロニーを同定及び排除することは困難であるため、すべての転移を首尾よく治療するのは不可能であることが多い。したがって、臨床的な見地からは、転移したコロニーの形成は、癌の自然増悪における決定的な事象と判断することができる。
【0010】
したがって、乳癌、結腸癌、及び前立腺癌の症例において、CTCの数と疾病の転帰不良のリスク増加との間に相関関係があることが実証されたため、CTCを単離して、それから臨床的重要性を持つ有益な全体像を分子解析を用いて得る可能性が非常に重要な診断的影響を持つことは明らかであろう。
【0011】
また、播種性腫瘍細胞(DTC)(すなわち骨髄又はリンパ節中に見出すことができる腫瘍細胞)の解析は、或る特定の情況において、原発性腫瘍の解析よりもさらに一層重要であることが証明された。例えば、いくつかの研究グループが、HER2(原発性腫瘍で検出されず、単一のDTCにおいて検出できる)の過剰発現が非常に高い死亡リスクの予測を示すことに言及している(非特許文献2)。
【0012】
さらに、1セットの細胞の解析と比較して、単一の複数細胞の解析がより有益になり得ることは、例えば、特許文献1から既知である。特に、全く同一の患者の異なるDTCが異なる染色体変化(異なる部位における欠損及び増幅)を有することが見出された(非特許文献3)。
【0013】
現行の技術水準では、しかしながら、循環性腫瘍細胞及び播種性腫瘍細胞の単離については、非常に複雑かつ困難な主として解析的性質のアプローチが利用可能であるが、その収量は限定的であり、得られる試料の純度は低い。したがって、CTC又はDTCの上記試料は、シークエンシング等の最も厳密で確実な診断手順のいくつかとは適合性がない。純度が限定されているため、実際は、シークエンスの塩基における誤った判定によって引き起こされる偽陽性及び偽陰性のリスクが高い。
【0014】
対象となる細胞の一部を損失するリスクが高い操作を要する予備的な処理(例えば、遠心分離、フラッシング及びインキュベーション)に頼ることなく、ミリリットルオーダーの体積の血液を処理することができる、抗EpCAM抗体(白血球で発現されないが上皮細胞で発現される)でコートした内部表面を備えたマイクロ流体装置を用いてCTCを単離する試みが行われた(非特許文献4)。しかしながら、上記方法は平均して50%〜60%の純度レベルをもたらし、それは試料の純度が重要である下流の解析(例えば、コピー数変化、マイクロサテライト不安定性、ヘテロ接合性の消失(LoH)、高いシグナル対ノイズ(S/N)比が診断用途での基本となる遺伝子発現の評価、若しくは新薬の同定等、又はさらに癌幹細胞についての研究の分野において)の実施に十分であるとは認められない。
【0015】
同様の考察は非常に高い診断能力が強調される他の方法に拡張することができるが、大量で複雑で費用がかかりしたがって医療行為に適用ができないような解析作業の後でなくては、生物学的試料の濃縮及びその中の希少細胞集団の単離についての既知の手順によって十分なレベルの純度を得ることができないため、他の方法は具体的に実施することができない。例えば、非特許文献5(関連部分について引用することにより本明細書の一部をなすものとする)は、いくつかのマイクロRNA(miRNA)、すなわち約22ヌクレオチドを含有するRNAの短い一本鎖の非コード断片が癌の発生及び増悪に直接関与することが最近証明された。定量的PCRを用いた原発性腫瘍(前立腺癌)の細胞中のmiR−15a及びmiR−16の発現の研究から、対応する健常組織と比較して、両方のmiRNAがかなり低く調節されることが指摘された。上記データは、in situハイブリダイゼーション(ISH)を用いて確認された。さらに、いくつかの症例では、たとえこれらのmiRNAの低調節が癌発生の初期に既に記録されていても、一般的には、miR−15a−miR−16クラスターの欠失が病期の進行に関連することが証明されている。したがって、診断的な見地から、腫瘍細胞を単離する可能性、及び腫瘍細胞がこれらのmiRNAの低調節を示すかどうかを評価する可能性は、治療法の最も適切な形態の選択のためにも医師にとって有用である疾病の進行状態に対する正確な指標を提供する。
【0016】
治療的性質の考察をさらに進めるために、腫瘍学分野におけるいくつかの治療的アプローチが、モノクローナル抗体(細胞受容体を介する増殖因子によって媒介されるもの等の細胞外の増殖の必須のシグナルを腫瘍細胞から枯渇させて、腫瘍細胞の生存に直接影響することができる)の使用に基づくことは有益な想起である。例えば、この情況において、対象となる標的の1つは、表皮増殖因子受容体(EGFr)である。表皮増殖因子(EGF)と対応する受容体EGFrとの間の結合は、細胞の生化学的事象のカスケード(EGFrの自己リン酸化及び内部移行、そしてそれは細胞増殖へと発展する)を引き起こす。
【0017】
EGF及びトランスフォーミング増殖因子−α(TGF−α)の両方がEGFrに結合し、細胞増殖及び腫瘍の増殖をもたらすことが示されている。多くの場合、EGFrの発現増加には腫瘍細胞によるTGF−α又はEGFの産生が伴っており、したがって癌の増悪におけるオートクライン増殖制御の関与が示唆される。したがって、EGF、TGF−α及びEGFrを発現又は過剰発現する腫瘍の治療において、それらに対する抗体を使用することが提案された。特許文献2として公開された国際特許出願中で記載されるように、腫瘍細胞におけるK−RAS遺伝子又はB−RAF遺伝子中で変異の存在が最近実証されており、これはEGFrのポリペプチドに結合するようにデザインされた薬剤による治療に腫瘍が応答しないという事実に対する示唆を構成するものである。
【0018】
非侵襲的手順を用いて患者から採取した腫瘍細胞の試料から開始して、かかる変異の存在を検出する可能性は、抗EGFrモノクローナル抗体の使用に基づいた治療法を続けるべきか、そうでなければ、それが効果的でないことを予め理解してこの治療法を却下するべきかどうかを評価するための非常に重要なツールを医師に提供することが理解される。しかしながら、この展望においても、血液又はいくつかの体液中の希少細胞の濃縮、同定及び単離の方法論によって、その後の解析が信頼できること(偽陽性、偽陰性等の除外)、及び場合によっては方法論を実質的に行うことができること(例えば、純度が低いためにシグナル対ノイズ比が低すぎて有効な読み取りを得ることができない場合について)を保証する十分な純度を得ることができない。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】欧州特許第1109938号
【特許文献2】国際公開第28112274号
【非特許文献】
【0020】
【非特許文献1】Zieglschmid et al., Crit. Rev. Clin. Lab. Sci. 42, 155-196 (2005)
【非特許文献2】Klein et al., Tumour cell. 13(5), 441-53 (2008)
【非特許文献3】Klein et al., Proc. Natnl. Acad. Sci. USA 96, 4494-4499 (1999)
【非特許文献4】Nagrath et al., Nature, 450, 1235-1241 (2007)
【非特許文献5】Bonci et al. "The miR-15a-miR-16-1 cluster controls prostate cancer by targeting multiple oncogenic activities" October 19, 2008; doi:10.1038/nm.1880
【発明の概要】
【0021】
したがって、本発明の目的は、今までに記載された既知の技術分野の短所を克服する、非侵襲的性質のサンプリングを用いて得られる循環性希少細胞又は播種性希少細胞を同定し、単離し、その後に解析する方法を提供することである。
【0022】
したがって、本発明によれば、患者から採取された有機液体から開始して得られる対象となる細胞(同定された後、少なくとも90%の純度が得られるまで単離される)の試料に対して実行され、請求項1において規定される方法によって行われる、診断目的の手順が提供される。
【0023】
好ましくは、上記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞を単離する工程は、少なくとも95%の純度を有する腫瘍細胞又はそれらの一部分の試料が得られるように行われる。さらにより好ましくは、上記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞を単離する工程は、100%の純度を有する腫瘍細胞又はそれらの一部分の試料が得られるように行われる。
【0024】
特に、本発明の優先的な実施の形態によれば、希少細胞を単離する工程は本出願人によって開発された技術に従って行われ、この工程はマイクロメートルの大きさの数十万もの電極を集積したシリコンマイクロチップの使用に基づき、単一の純度で対象となる細胞を単離するように個別の細胞をマニピュレーションすることによって細胞を分子解析に利用可能にする。このように、本発明による方法は、高純度の細胞を提供し、プロセスの最も繊細な部分(個別の細胞の単離)について高度に自動化されており、診断及び予測について高い信頼性のある解析技法の実施を可能にする。今までに記載されたものを考慮すると、本発明の診断的及び治療的なレベルでの革新的な範囲が明らかに現われてくる。それにより、疾病過程の異なる期における腫瘍治療の改善が可能になり、生検に匹敵する信頼レベルを有する非侵襲的早期診断、並びに転移期及びアジュバント期の両方で、特異的抗癌剤を用いた治療の過程で及び/又は疾病の変遷及び臨床治療に対する応答の質を追跡するための術後期で、感度の高い正確なフォローアップの両方を可能にする。
【0025】
本発明によれば、患者から非侵襲的様式で採取された有機液体は、第一に、当該技術分野において既知の1つ又は複数の方法論(フィコール、赤血球の選択的溶解、トラックエッチ膜等のフォトリソグラフィによるマイクロマシニング又は他の技法を用いて得られた細胞の大きさに基づいたフィルターによる濾過、枯渇又は磁気濃縮等)に従って、対象となる細胞の濃縮を1回又は複数回行うことによって処理される。次いで、濃縮した細胞を、対象となる細胞及び/又は混入細胞等の同定のために特異的抗体で標識する。
【0026】
この文脈において、「有機液体」又は「身体の液体」という表現は、対象となる細胞を見出す確率が高い身体の試料から開始して得られる液体を指す。有機液体は、身体の試料から直接的(例えば、末梢血流、骨髄、尿等)又は間接的(例えば、リンパ節からの組織のトリプシン処理によって等)に採取することができる。
【0027】
この文脈において、「対象となる細胞」という表現は、適切な解析技法を用いて検出可能である、患者の病理学的状態に関する診断的又は治療的な性質の示唆を提供することができる特徴を持つ細胞を指す。
【0028】
例えば、身体の液体は末梢血(一般に使用される方法論に従って実質的に非侵襲的に患者から取り出すことができる)であり、対象となる細胞は循環性腫瘍細胞(CTC)である。
【0029】
さらなる例として、有機液体は骨髄からの血液であり、対象となる細胞は播種性腫瘍細胞(DTC)である。
【0030】
次いで、本発明の方法は、濃縮した試料から単一の細胞を個別に選択し、自動的又は半自動的で非手動的にこの細胞を単離することができるマイクロ流体システムの使用によって特徴付けられる。
【0031】
単純化のために以下では「単一の細胞」又は「個別の細胞」という用語を使用するが、一般に、単離されず1つ又は複数の、腫瘍細胞であっても非腫瘍細胞であってもよい他の細胞に結合されたものとして対象となる細胞が存在する可能性がある限りでは、この用語は単一の細胞又は単一の細胞凝集塊を含むものとして理解されなくてはならない。さらに、単離された核等の細胞の一部分を解析する可能性があることも理解すべきである。
【0032】
マイクロ流体システムにおける細胞の上記単離を介して、対象となる細胞のみ、すなわち100%に等しい純度の試料を含有するセットが得られ、したがって、それは分子解析の複数の手順を行うのに適切であると認められる。
【0033】
有利には、単一の細胞を個別に選択する上記マイクロ流体システムにおいて、選択は細胞自体の画像に基づいて行われる。
【0034】
有利には、細胞の上記画像は、細胞自体の懸濁培地中の流れがない中で取得される。
【0035】
有利には、上記画像は、蛍光での取得画像を含む。
【0036】
本明細書において「マイクロ流体装置」とは、層流形態で液体の体積を管理するようにデザインされ、解析の間に液体を含有する空間が少なくとも1つの1mm未満の大きさを持つ装置と理解される。
【0037】
本明細書において「単一の細胞を個別に選択することができる装置」とは、各細胞に対して個別に評価されるパラメーターに基づいて、1つ又は複数の単一の細胞の選択を、一度に又は同時に実行することができる装置と理解される。
【0038】
「非手動的単離」とは、例えば、可動型誘電泳動ケージを用いた移動の場合等において、操作者の手動性が必要とされない細胞の移動と理解される。
【0039】
「自動的単離」とは、例えば、マイクロプロセッサによって実質的に非対話的に遂行されるプログラムによって管理される、誘電泳動ケージを用いた移動の場合等において、操作者の介入が必要とされない細胞の移動と理解される。
【0040】
「半自動的単離」とは、例えば、マイクロプロセッサにより遂行される対話型プログラムによって管理される、例えば誘電泳動ケージを用いた移動の場合等において、操作者による対話がマニピュレーションに対して間接的制御を及ぼすことを可能にする細胞の移動と理解される。
【0041】
有利には、上記選択は自動的又は半自動的に行われる。
【0042】
本明細書において、「自動的選択」とは、例えば、細胞を対象となる腫瘍細胞に効果的に対応させる自動分類機により自動的に決定される場合等において、操作者の判断の介入が必要とされない細胞の選択と理解される。例えば、細胞の取得画像を処理し、そこから区別できる特色を抽出し、アルゴリズムに基づいてそれらを分類する画像分類機によりこれを行うことができる。
【0043】
本明細書において、「半自動的選択」とは、操作者の判断の介入が必要とされる細胞の選択と理解される。例えば、細胞の画像を取得し、そこから区別できる特色を抽出し、それらを選択すべきかどうかに関する最終決定について、操作者に提案するシステムによりこれを行うことができる。
【0044】
次いで、回収される試料の純度が高いため、回収される細胞に対する分子解析を様々な技法を介して行うことができ、中でも非限定的な例として以下のものが挙げられる:
シークエンシング(例えば変異の同定を目的とする)
マイクロサテライト解析(例えば定量的蛍光PCR、すなわちQF−PCRによる)
比較ゲノムハイブリダイゼーション(CGH)
アレイCGH
エンドポイントPCR
リアルタイムPCR
メチル化解析:
ピロシークエンシングによる定量的メチル化解析
重亜硫酸塩ゲノムシークエンシングPCR(BSP)
メチル化特異的PCR(MSP)
DNAの複合重亜硫酸塩制限解析(COBRA)
メチル化感受性単一ヌクレオチドプライマー伸長(MS−SNuPE)
遺伝子発現解析
RT−PCR
単一細胞遺伝子発現
デジタルPCR。
【0045】
本発明のさらなる特徴及び利点は、この後に続く、添付された図面を参照して提供されるその実施形態のいくつかの非限定な例の説明から明らかになるであろう。
【図面の簡単な説明】
【0046】
【図1】本発明による非侵襲的診断方法の一実施形態を要約したフローチャートである。
【図2】本発明による方法を実行する装置の一例(又はその実質的であり特徴付ける部分)の概略図である。
【図3A】本発明の方法によって循環性腫瘍細胞のスキャニングの過程で取得した画像である。
【図3B】本発明の方法によって循環性腫瘍細胞のスキャニングの過程で取得した画像である。
【図3C】本発明の方法によって循環性腫瘍細胞のスキャニングの過程で取得した画像である。
【図4A】本発明の方法によって同定及び単離された循環性腫瘍細胞の遺伝子解析の過程で得られた一連の電気泳動図である。
【図4B】本発明の方法によって同定及び単離された循環性腫瘍細胞の遺伝子解析の過程で得られた一連の電気泳動図である。
【図4C】本発明の方法によって同定及び単離された循環性腫瘍細胞の遺伝子解析の過程で得られた一連の電気泳動図である。
【図4D】本発明の方法によって同定及び単離された循環性腫瘍細胞の遺伝子解析の過程で得られた一連の電気泳動図である。
【図5】mCRCに冒された患者の末梢血流から本発明の方法によって選択及び単離された循環性腫瘍細胞のスキャニングの過程において取得した画像である。
【図6】mCRCに冒された患者の末梢血流から本発明の方法によって単離されたCTCのK−RAS上の変異Gly2Valの検出に関するスペクトルである。
【図7】mCRCに冒された患者の末梢血流から本発明の方法によって単離されたCTCのK−RAS上の変異Gly2Valの検出に関するスペクトルである。
【図8】濃縮した試料のスキャニングの過程において取得した5つの画像である。上記画像はDEPArray(商標)チップ上の5つの誘電泳動ケージの内容物に関する。図の細胞は互いに一緒に、その他の図の細胞とは分離して回収した。図8は循環性腫瘍細胞に対応する陰性対照(正常白血球)を示す。
【図9】濃縮した試料のスキャニングの過程において取得した5つの画像である。上記画像はDEPArray(商標)チップ上の5つの誘電泳動ケージの内容物に関する。図の細胞は互いに一緒に、その他の図の細胞とは分離して回収した。図9は循環性腫瘍細胞に対応する陰性対照(正常白血球)を示す。
【図10】濃縮した試料のスキャニングの過程において取得した5つの画像である。上記画像はDEPArray(商標)チップ上の5つの誘電泳動ケージの内容物に関する。図の細胞は互いに一緒に、その他の図の細胞とは分離して回収した。図10は本発明の方法による循環性腫瘍細胞を示す。
【発明を実施するための形態】
【0047】
本発明の課題は、好ましくは非侵襲的性質のサンプリングを用いて得られた、希少細胞、特に循環性腫瘍細胞又は播種性腫瘍細胞を同定、単離及びそのすぐ後に解析する方法である。
【0048】
サンプリング
試料は、患者の末梢循環から採取することができるか、又は他の場合には当該分野における既知の様々な技法を介して骨髄から採取することができる。
【0049】
前濃縮
採取された試料中の腫瘍細胞の比率は様々な方法、例えば、フィコール又はパーコール等の溶液によって構成した密度勾配での遠心分離、様々なタイプのフィルター等の機械的濃縮、目的のために提供された装置である誘電泳動活性化細胞選別装置(DACS)を介する誘電泳動による分離を用いた濃縮、例えば、対象とならない赤血球の選択的溶解等の選択的溶解、正の選択(集団が回収されるように特異的抗体に結合されたビーズを使用して)、又は負の選択(対象とならない細胞集団の枯渇)で免疫磁気ビーズを介した、免疫磁気分離(手順の特異性を増加させるために2つのタイプの選択をカップリングできる)、特異的蛍光抗体により標識された細胞でのFACS、有利には、上皮受容体(EpCAM等)についての特異的抗体によりコートされた表面を提示するマイクロ流体システムを用いた固相免疫分離等を使用して、濃縮することができる。
【0050】
大部分については、これらの手順は自動化することができ、密度勾配での遠心分離による分離はすべての選別手順に先行することができるか、又はその代わりに、すべての選別手順を全血に対して適用することができる。
【0051】
一般に、プロセスは希釈から開始するが、これはすべての技法に厳密に必要ではない。
【0052】
他の濃縮技法
当業者に周知のさらなる技法は、Miltenyi Biotech社によって開発されたMACSと呼ばれる技法、又はほかにはStem-cell technologies社によって開発されたEasy−sepである。
【0053】
あるいは、より大きな大きさの常磁性ビーズを使用することが可能であり、特殊なカラムの使用を必要としないが、ウェル又は試験管により作業する場合も使用することができる(例えば抗EpCAMのDynabead等)。
【0054】
まとめると、少なくとも1タイプの腫瘍細胞を含む細胞の集団に上記試料を濃縮する上記工程が、
a.質量密度、
b.形態、
c.電気的特性、
d.化学的特性、
e.機械的特性、
f.表面抗原の発現、
g.細胞質内抗原の発現、
h.誘電特性、
i.磁気的特性、
l.幾何学的特性(大きさ等)、及び
m.光学的特性、
又はその組み合わせ
からなる群から選択される少なくとも1つのパラメーターに基づいて行われる細胞の選択を用いた連続的工程からなる方法により行うことができる。
【0055】
有利には、次いでさらに、腫瘍細胞の濃縮は、第1の工程において回収された単核細胞からの細胞の正の選択又は負の選択を行う第2の工程を用いて達成される。明らかに、第2の濃縮工程は、特異的抗原を発現する能力又は特異的抗原を発現しない能力に基づいて行われ、以下の技法のうちの1つにより評価される選択を含むことができる。
a.MACS、すなわち磁気活性化細胞選別装置、
b.DACS、すなわち誘電泳動活性化細胞選別装置、
c.FACS、すなわち蛍光活性化細胞選別装置。
【0056】
単一の腫瘍細胞の単離
次に、腫瘍細胞を含有する試料は、単一の細胞を個別に選択し、自動式又は半自動式の非手動性手段でこれらの細胞を単離することができるマイクロ流体装置中に挿入される。この目的のために、誘電泳動による単離(例えば、国際出願PCT/IB2007/000963号若しくは国際出願PCT/IB2007/000751号、又はさらにManaresi et al., IEEE J. Solid-State Circuits, 38, 2297-2305 (2003)及びRomani et al., Proceedings of the International Solid State Circuit Conference, 1, 224-225 (2004)中に記載される技法を使用するDEPArray)、又は他の場合には光電子トラップ若しくは光泳動単離、又はさらに、レーザーピンセット(例えば、Reichle et al., Electrophoresis, 22, 272-82 (2002)又はFiedler et al., Anal. Chem., 70, 1909-15 (1998)を参照)を使用することは可能である。
【0057】
上記文献の内容は、単なる参照として関連部分に関するものとして、引用することにより本明細書の一部をなすものとする。
【0058】
対象となる細胞の同定は、例えば、以下のセンサー、
外部センサー、
蛍光顕微鏡等の光学センサー、又はさらに
内部センサー、
蛍光細胞の同定の統合方法を記載する、国際公開第2007049103号及び国際公開第2007010367号中で開示されるような光学センサー、
細胞のインピーダンス測定特徴の検出についての国際公開第2007049103号及び国際公開第2007010367号中で開示されたようなインピーダンス測定センサー
を介して、行うことができる。
【0059】
さらに、細胞の選択のためのシグナルは、例えば抗体にカップリングし、その後該抗体が細胞にカップリングするマイクロビーズの存在等のように間接的であってもよい。インピーダンス測定センサー又は光学センサーを用いて(明視野で、又は蛍光で)、既に今までに記載されていたように、細胞にカップリングした1つ又は複数のマイクロビーズの存在を検出することができる。
【0060】
本発明によれば、マイクロ流体装置を用いた単一の腫瘍細胞の個別のマニピュレーションによって、好ましくは自動化された手段で、少なくとも90%の純度を有する被解析試料を構成するように、採取された前濃縮試料中に含有される腫瘍細胞を単離する。
【0061】
好ましくは、95%を超える純度を有する被解析試料を構成するように、腫瘍細胞を単離する。さらにより好ましくは、100%の純度を有する被解析試料を構成するように、腫瘍細胞を単離する。
【0062】
遺伝子解析
本発明に従って回収された腫瘍細胞に対して、今までに記載されたものに従って、異なるレベルの解像度及び感度で、並びに研究の診断的な目的に従って、その遺伝的特性評価又は染色体の特性評価を可能にする様々なタイプの解析を行うことができる。
【0063】
例えば、K−RAS遺伝子の変異の存在を検出するために、転移を示す患者から採取したCTCのシークエンシングに進むことが可能である。
【0064】
前立腺癌の症例において、単一の細胞の全ゲノム増幅を用いてCTCの欠失の存在を評価することが可能である。
【0065】
さらに、原発不明癌(CUP)の事例において、CTCの遺伝的プロファイル及び/又は発現プロファイルを介して原発組織を同定することが可能であり、したがって最も適切な治療法の選択のための基本となる情報が得られる。
【0066】
播種性腫瘍細胞の事例において、次いで、予後指標及び可能性のある治療標的を同定するために、単一のCTC及び/又はDTC上の遺伝子発現の解析を行うことが可能である。
【0067】
非限定例によって、以下に記載されるものは、図1中に示されるフローチャートに従った本発明による方法の優先的な実施形態である。
【0068】
開始試料
健康な男性のドナーから採取した17mlの全血の試料中に、乳癌細胞株MCF7に属する2000個の細胞をスパイクすることによって導入した。
【0069】
予備的な濃縮
本発明の優先的な実施形態は、連続的工程からなるプロセスを意図する。
【0070】
(a)フィコール。 試料を抗凝固剤(例えば、EDTA)により処理し、ポリプロピレン製の50ml容の滅菌試験管の中へ、好ましくは8時間以内に移した。これから50μlの体積を抽出し、それをコールターカウンターを使用する白血球(WBC)及び赤血球(RBC)のカウントのために使用した。
【0071】
次いで試料をpH7.2のPBS及びEDTA(2mM)で1:4に希釈した。
【0072】
或る体積(≦30ml)の希釈した血液を15mlのフィコール−ハイパック(密度=1.077g/ml)上に正確に重層化した。
【0073】
次に、試料は(ブレーキなしの)チルトローター遠心分離機中で、22℃で30分間、654gで遠心分離した。
【0074】
界面のリンパ球の層を干渉しないように注意して、(パスツールタイプの)ピペットにより、血漿を除去した。ただし自動式のピペッターも使用することができる。ドロップカウンターにより層を慎重に収集し、50ml容のポリプロピレン滅菌コニカル試験管の中へ移した。
【0075】
試験管をPBS及びEDTA(2mM)により満たし、振盪し、10℃で10分間300gで遠心分離した。
【0076】
上清部分を廃棄した。
【0077】
試験管をPBS及びEDTA(2mM)により満たし、再び振盪し、10℃で10分間300gで遠心分離した。上清部分を抜き取った。
【0078】
試料から細胞沈殿(すなわち、末梢血流単核細胞、PBMNCの複合物)を採取して、5mlのバッファー中に再懸濁した。これから50μlのアリコートを採取して、コールターによりWBCカウントを行った。
【0079】
試験管をバッファーにより満たし、振盪し、10℃で10分間200gで遠心分離した。上清部分を廃棄した。
【0080】
赤血球排除のための前濃縮の第1の工程としてフィコールに対する代替案は、細胞の化学的特性を利用する赤血球の選択的溶解に代表される。
【0081】
(b)CD45 MACS枯渇
細胞沈殿を合計107個の細胞に対して80μlのバッファー中で再懸濁した。
【0082】
20μl量の抗CD45のマイクロビーズを合計107個の細胞に加えた。4℃で15分間の振盪及びインキュベーションの工程が続いた。
【0083】
試験管をバッファーにより満たし、10℃で10分間300gで遠心分離することによって、細胞を洗浄した。
【0084】
上清部分を廃棄し、細胞沈殿を合計108個の細胞に対して500μlのバッファー中で再懸濁した。
【0085】
LSタイプのMACSカラム(Miltenyi社)は、製造業者によって提供された指示に従って、適切なMACSセパレーターの磁場中に配置した。
【0086】
プレフィルターを各カラム上に配置した。
【0087】
プレフィルター及びカラムの両方を、3mlのバッファーによりリンスすることによって調製した。
【0088】
細胞懸濁液をカラムに(又はプレフィルター上に)適用した。
【0089】
細胞懸濁液を含有していた試験管であって、現在は空の試験管を9mlのバッファーにより満たした。
【0090】
標識されていない細胞を収集し、3mlのバッファーを3回加えることによってカラムを洗浄し、各回で以前の工程においてバッファーで満たした試験管に洗浄物を採取した。
【0091】
カラムをセパレーターから除去し、試験管上に置いた。
【0092】
5ml量のバッファーを、ピペットを使用してカラムの中へ導入した。
【0093】
磁気的に標識された細胞を含有する画分を、プランジャーの操作によってすぐ後で放出させた。
【0094】
混入細胞の数をさらに減少させるために、枯渇させる細胞上に選択的に存在する抗原を認識する抗体により官能基化したさらなる磁気マイクロビーズ、例えば、抗GPAマイクロビーズ(フィコールから残存赤血球を排除するため)等を含む枯渇カクテルを使用することが可能である。
【0095】
混入細胞の数をその上さらに減少させるために、磁気カラムにおける二次通過を実行することが可能である。
【0096】
(c)固定及び標識
MACS後の細胞を10分間300gで遠心分離し、40μlのバッファー中で沈殿を再懸濁した。
【0097】
試料を1.5ml容の試験管の中へ移した。これに直前に調製した4%パラホルムアルデヒドを760μl加え、続いて室温で20分間インキュベーションした。
【0098】
微小遠心管中で相対遠心加速度(r. c. f.)0.2r.p.m.で5分間遠心分離した後に、上清画分を抜き取った。
【0099】
これに続いて1mlのPBSで洗浄し、微小遠心管中で相対遠心加速度0.2r.p.m.で5分間遠心分離し、再び上清画分を吸引した。
【0100】
これに100μlの3%PBS/BSA(ブロッキングバッファー)を加えた。
【0101】
試料を室温で10分間インキュベーションした。
【0102】
微量遠心分離機中で相対遠心加速度0.2r.p.m.で5分間さらに遠心分離した後に、上清画分の吸引が続き、EpCAM−FITC及びCD45−PE(Miltenyi社、製造業者により推奨されたプロトコルに従う)で染色を行った。
【0103】
プロセスを完了させるために、1000μlのスーパーバッファー(Hepes400mM、1%BSA)及び水で希釈した1μlのヘキスト33324(100μg/ml)のにより最終洗浄を行い、試料をボルテックスで撹拌した。
【0104】
試料の品質管理を行い、マーカーの蛍光強度及び全細胞濃度を確認した。標識試料の一部を最小体積の特異的バッファー(誘電泳動操作に役立つ)中に再懸濁し、試料の品質管理のために装置上にロードし、蛍光顕微鏡下で管理した。細胞の蛍光強度を異なるチャンネルで示し、ヘキスト33324で標識された細胞(全有核細胞)をカウントした。細胞濃度が単一の細胞の単離のための装置の適切な操作に至適な濃度よりも高ければ、次の工程は試料を希釈して所望の濃度を得ることである。
【0105】
単離
次いで、このようにして得た細胞を、腫瘍細胞の誘電泳動操作及び単離のために、チップDEPArray(登録商標)CONV600K(Silicon BioSystems社によって製造、例えば、国際公開第0069525号を参照)中に挿入した。装置全体を図2において図示する。
【0106】
スキャニング、同定及び選択を試料で行い、腫瘍細胞の選別及び回収を行った。
【0107】
3つの異なる蛍光チャンネル(すなわち3つの異なる波長)を備えた顕微鏡で自動的又は手動的にケージされた細胞をスキャンした。DAPIチャンネル(「DAPIチャンネル」とはUV励起及び青色の発光を意味し、それはしたがってヘキスト33324の可視化に使用される)における観察により、(陽性)有核細胞の同定が可能になるが、EpCAM及びCD45に関するチャンネルの観察から、腫瘍細胞(適合する形態でのDAPI+、EpCAM+及びCD45−)と、リンパ球(DAPI+、EpCAM−、CD45+)と、誤ったシグナル(DAPI+、EpCAM+及びCD45+若しくはDAPI−、EpCAM+及びCD45+も、又は腫瘍細胞と不適合な形態でのDAPI+、EpCAM+及びCD45−)との間の区別を可能にする。
【0108】
図3A、図3B、図3Cは、DEPArray(登録商標)CONV600K内の試料の細胞のスキャニングの過程において取得した画像を示す。さらに特に、図3Aは、考慮した3つのチャンネルにおける3つの腫瘍細胞の画像を示す。図3Bは、考慮した3つのチャンネルにおける誤った細胞の画像を示す。図3Cは、考慮した3つのチャンネルにおける2つのリンパ球の画像を示す。
【0109】
次いで、細胞の選択は、DAPIに陽性(有核細胞)、EpCAMに陽性、CD45に陰性であることが見出される細胞を含有するケージの選択によって行われた。16個の細胞がチップ上に同定され、そのうちのいくつかは2つであった。15個の細胞(そのうちのいくつかは2つである)が、0.2mlのPCRチューブ中に数マイクロリットル(<40μl)で最終的に回収された。
【0110】
確定的な解析は、Applied Biosystems社のMinifilerキットを使用して行った。
【0111】
Minifilerキットを使用して行った断片の解析(QF−PCR)の結果を図4A、図4B、図4C、図4Dにおいて示す。考慮した4つの蛍光チャンネルにおいて、異なるマイクロサテライトを解析した。血液中へのスパイクによって腫瘍細胞が導入された男性の被験体に由来する対立遺伝子による微量の混入が、どんな場合にもないことを示すことができる。
【0112】
抗EpCAM抗体に対する代替案として、例えば、血球において発現されない1つ又は複数のタイプのサイトケラチンを認識する抗体等の異なるタイプの抗体を使用することが可能である。
【0113】
あるいは、癌をより特徴づける抗体(腫瘍特異的)を使用することが可能であり、それらは例えば
前立腺について、前立腺特異的抗原(PSA)、
肺について、甲状腺転写因子1(TTF−1)、
乳房について、ヒト表皮増殖因子受容体2(HER2/neu)
等である。
【0114】
適用の可能性
選択及び単離の自動化可能手順の後に100%の純度を有するCTCの試料を得ることにより、そうでなければ、正確に信頼性をもち、かつ精密に解析することができないような複数の状態について実現可能な診断経路が与えられる。
【実施例】
【0115】
実施例1
癌患者における変異(例えば、K−RAS遺伝子中の)の非侵襲的評価。
【0116】
以下において記載されるものは、転移性結腸・直腸癌(mCRC)に冒された患者の末梢血流からのCTCの単離の事例である。
【0117】
7.5mlの末梢血流の試料を、EDTA抗凝固剤(Beckton Dickinson社)を含むバキュテイナーチューブ中へ患者から抜き取った。試料をコールターカウンター(Beckman Coulter社)で解析し、白血球(WBC)は42×106及び赤血球(RBC)は43.95×109であった。次いで、PBMCを遠心分離を介して単離した(フィコール1077中で)。回収したPBMC(コールターカウンターによるカウントに基づいて16.5×106)を、BSA及びEDTAを含むPBS(ランニングバッファー、Miltenyi社)で洗浄し、製造業者の説明書に従って抗CD45抗体及び抗GPA抗体(Miltenyi社)にコンジュゲートした磁気マイクロビーズによる枯渇を介して選択した。得られた細胞(CD45及びGPAについて陰性画分)を、PBS中の2%のPFAで室温(RT)で20分間固定した。これに続いてPBSで洗浄し、3%のPBS/BSA(ブロッキングバッファー)中で室温で10分間インキュベーションした。PBSでのフラッシング後に、CD45標識は、100μlのMiltenyi社ランニングバッファー(RB)中に10μlのPEコンジュゲート抗CD45抗体(Miltenyi社)により、4℃で10分間行った。1mlのRBを加え、遠心分離し、上清部分から抜き取ることによって反応をブロックした。次いで、細胞は90μlのInsidePerm(Miltenyi社)で透過性にし、同時に10μlのFITCコンジュゲート抗CK抗体により室温で10分間標識した。1mlのInside Permを加え、遠心分離し、上清画分を除去することによって反応を終了させた。沈殿を、固定及び透過性にした細胞の誘電泳動による操作のために至適化したバッファー(水(SB)中のヘペス(400mM)+BSA(2%)及びDAPI(1mg/ml))中に再懸濁し、最終的にSBで洗浄し、チップDEPArray(商標)CONV600K(100000個の誘電泳動ケージを有する)へのインジェクションのために再懸濁した。チップ上に存在するのは約16000個の細胞であった。DAPI/FITC/PEにおけるスキャニング後に、CTCを同定した。図5は、本発明の方法を用いて選択及び単離したCTC(白色矢印によって示される)の画像を含み、上記画像は、3つのそれぞれのチャンネルにおける蛍光を強調するように適切に処理されている:緑色チャンネルにおけるFITCコンジュゲート抗CKモノクローナル抗体(Miltenyi社)、赤色チャンネルにおけるPEコンジュゲート抗CD45モノクローナル抗体(Miltenyi社)、及び青色チャンネルにおける核の同定のためのDNAのDAPI標識。
【0118】
処理された画像の解析から様々なタイプの可能性のある事象を明瞭に区別することが可能であるが、画像に基づかず全体的な蛍光の強度にだけ基づくあまり厳密でない解析においては、画像を偽陽性として却下する可能性があることに注目するべきである。
【0119】
例えば、ID382によるケージは1対のCTCを含有している。存在する3つのCTCのうちの2つが最終的に1つの同一のケージに存在する確率は無視できるので、これらは明らかに開始時に既に結合されていた。抗体(例えば抗CK)が非特異的手段でトラップされることを考慮すると、一般に、細胞のクラスターが誤った蛍光シグナルを生じさせ得るので、画像解析なしでは、この事象は却下される可能性がある。したがって、2つのID382細胞の回収は100%の純度を有する(大多数の分子解析と矛盾しない)。
【0120】
ID11439によるケージはDAPI+/CK+/CD45+の事象を示す。画像解析なしでは、誤ったものとして、上記事象は却下される可能性があるが、その代りに、画像により事象における蛍光分布の検出が可能になるので、3つの他のCK−の有核細胞(そのうち2つはCD45+)と共に、ケージされたDAPI+/CK+/CD45−のCTC(白色矢印によって示された)として、データを解釈することが可能である。上記ケージの内容物は分離して回収することができる。可動型誘電泳動ケージに基づいたシステムを使用して、最初は同じケージを共有する細胞を単一のケージ中で隔離することを、適切なパターンのケージの適用によって行うことができる。ケージの他の混入細胞からCTCを隔離することが可能でない場合、上記回収物に対して混入物の存在の情報を関連づけて、ケージの内容物を回収することはいかなる事例においても可能である。これは本発明による技法のさらなる利点である。回収された細胞の純度は以下へ示され、これは解析下流において考慮に入れることができる。問題となっている事例において、したがって、他の3つと共に細胞を回収することができるか(25%の純度)、又は他の場合には、単独で分離及び回収されて100%純粋な回収物(単独で単離された場合)、若しくは他の場合には、1つの混入物と共に単離された場合は50%純粋な回収物、若しくは他のケージ中に存在する可能性がある混入物なしで、1つの混入物及びさらに9つのCTCと共に単離された場合は90%純粋な回収物(この事例ではない)を得ることができる。
【0121】
ケージID5007は、DAPI+/CK+/CD45+の事象であるので、全蛍光に基づいて、ID11439の事象に類似するような事象を示す。しかしながら、画像に基づいて、どのように誤った事象であるかどうかを、その事象を抗CK抗体をトラップしたクラスターに結びつけて考えられる限りでは、決定することが可能である。
【0122】
ケージID13103は、DAPI+/CK+/CD45+の事象であるので、全蛍光に基づいて、ID11439の事象に類似するような事象を示す。しかしながら、画像に基づいて、どのように誤った事象であるかどうかを、CD45+(非CTC)シグナルを有する単一の二重陽性細胞に結びつけて考えられる限りでは、決定することが可能である。
【0123】
ID8614によるケージは、CK+/CD45−であるがDAPI−の事象(CTCとして分類されなかった)を示す。2つの細胞がCK−であり、その内の1つの細胞がCD45+でもあるので、ID7796によるケージは、CTCとして分類されない2つの細胞を含む対照事象(2つの白血球)を示す。
【0124】
対象となる細胞は、その結果単離することができるか、又はそうでなければ、実験の目的に従って、試料の純度の面から、及び細胞が含まれる細胞凝集体からの細胞の分離の容易性に従って、単離することができる。この意味において、画像に基づいた選択は、偽陽性及び偽陰性の除外に特に効果的である。
【0125】
フィコールに対する代替案として、赤血球(RBC)の選択的溶解に基づいた技法を使用することが可能である。この事例において、第一に、試料中に顆粒球も残存する。RBCの上記除去後に、腫瘍細胞は、正の免疫磁気選択(例えば、抗EpCAM抗体にカップリングされた磁気マイクロビーズで)、又は負の免疫磁気選択を介して(例えば、抗CD45抗体に、又は抗CD45抗体及びCTC中に存在しない抗原に対する他の抗体を含む反応混液にカップリングした磁気マイクロビーズを介して)さらに濃縮することができる。任意の事例において、存在する少数のCTCは、何万又は何十万もの白血球を含有する試料において得られる。
【0126】
末梢血流からのCTCの単離は、同様に、Veridex社のCellSearch(商標)システム等のFDAによって認可された濃縮及び標識の手順と互換性をもつ。この事例において、CellSearchシステムは、自動化された手段(AutoPrepマシンによる)において標識及び濃縮を行うためにも使用することができる。このシステムにより、存在する少数のCTCは、典型的には、わずか数千の混入白血球の(典型的な値は1000〜5000)と共に試料中に得られる(約90%の至適収量で)。CellSearch AutoPrepは優れた濃縮システムであり、その主要な限定としては、EpCAMの正の免疫磁気選別に基づくということである。したがって、いくつかのタイプの腫瘍において、CTCがEpCAMを過剰発現しない場合、少数のCTCしかを見出すことができない。かかる事例において、CD45+細胞の枯渇のために負の選択が示される。
【0127】
EGFr受容体に対して指向性があるモノクローナル抗体に基づいた治療法の非有効性に、K−RASのいくつかの変異が関係のあることが実証されているので、K−RAS遺伝子の変異状態の検出には多くの臨床的重要性がある。上記変異は、EGFrの上流の阻害にもかかわらず、実際は、細胞増殖の機構を下流で活性化する。セツキシマブ及びパニツムマブによる治療法はこれまでは、野生型K−RASの患者のためだけ示されている。CTC中の変異を同定する可能性は、特に、生検が可能でないか、行うのに非常に複雑なすべての状況において、生検に頼る必要がなくなる可能性を提供する。外科手術で取り出された組織が利用可能な場合でさえ、CTCを解析する可能性は、任意の事例において関心を持たれる。腫瘍は遺伝的見地から内因的に不安定であり、転移は原発性腫瘍の部位とは異なる部位に位置する細胞に由来することがあり得る。したがって、CTCは転移する細胞の分子像をより良好に反映することができる。
【0128】
CTCからのK−RASの変異を検出する可能性を確認するために、転移性結腸・直腸癌(mCRC)に冒された患者の末梢血流からのCTCを解析した。上記の濃縮手順に従って、CTCをDEPArray(商標)上で同定及び単離した。100%の純度により、シークエンシングを介して可能性のある変異の存在の検出が可能になる。例えばネステッドPCRにより開始コピーを事前に増幅した後に、既知の技法を使用して、シークエンシングを行う。
【0129】
問題となっている事例において、下流の解析は、Sigma社製のOmniplexキットによるDOP−PCR技法を使用して行った。増幅後に、Applied Biosystems社製のキャピラリー電気泳動シークエンサーにより、産物を解析した。
【0130】
図6は、解析された試料の1つにおける変異の検出例を示し、この変異はコドン12中のグリシンからバリンへの変異に対応する(対応する陰性対照を図7中に示す)。
【0131】
実施例2
単一の細胞の全ゲノム増幅及びCGHアレイを介する(例えば前立腺癌における)欠失のCTCの評価。この事例において、異なるウェル中に回収される単一の細胞の単離が有利に行われる。このような手段で、解析は集団の不均質性を考慮に入れ、いくつかの腫瘍細胞の中にだけ存在する変異を同定するのがより容易なように、平均的なシグナルだけでなく、各細胞に関する複数のシグナルも供給する。
【0132】
実施例3
遺伝的プロファイル及び/又はCTCの発現プロファイルを介する、CUP腫瘍における原発組織の非侵襲的同定。
【0133】
実施例4
予後指標の同定のための単一の播種性腫瘍細胞(DTC)の遺伝子発現の解析、及び潜在的な治療標的。この事例においても、異なるウェル中に回収される単一の細胞の単離が有利に行われる。このような手段で、解析は集団の不均質性を考慮に入れ、いくつかの腫瘍細胞の中にだけ存在する変異を同定するのがより容易なように、平均的なシグナルだけでなく、各細胞についての複数のシグナルも供給する。
【0134】
実施例5
既に言及したたように、一般に、「細胞の単離」に関して上で述べたことは、例えば、核等の「細胞の一部分の単離」にも適用されるとして理解される。実際、重要な情報は、或る特定のタイプの生体分子情報についての任意の事例において、細胞の一部分の単離によって得ることができる(例えば核において含有されるゲノムDNAの評価によって)。
【0135】
核の単離の例において、細胞の選択は、非腫瘍細胞から腫瘍細胞(CTC又はDTC)の核を区別可能なようにマークする技法(例えば、FISH等)を介して行うことができる。この事例において、複数のシグナルの存在は、ゲノムDNAの重複の存在を示す(腫瘍細胞の特徴であり、一般に正常細胞にはない)。
【0136】
特に乳癌の例において、HER2遺伝子(通常染色体17に位置する)に関するゲノム領域の重複を評価することは興味深い。したがって、2つのタイプのプローブ(染色体17の動原体について1つ及びHER2遺伝子について1つ)を適用する。遺伝子/染色体比が2より大きければ、細胞は、試験に対して陽性であると通常は判断される。上記情報は、例えば、対応するHER2受容体の過剰発現の事例においてだけ有効性を示すトラスツズマブ(ハーセプチン)等の薬物の使用において密接な関係がある。精製された形態の上記細胞をカウントすることだけでなく、同定及び単離することも、腫瘍の遺伝的特徴に対するさらに詳しい情報の取得を可能にする。
【0137】
実施例6
DNAにおけるコピー数多型(CNV)の存在は、腫瘍の典型的な特徴である。新薬の評価に関して、疾病の過程にCNVを関連づけるため、及び潜在的にCNVが疾病の過程に重要な影響があるゲノムの領域に対してCNVを関連づけるためにCNVを評価できることは非常に興味深い(予後良好の事例及び予後不良の事例において)。この情報は薬理作用のための標的となる遺伝子の同定に有用であり得る。さらに次いで、癌診断のステージにおいて、取得した経験に基づいて治療法を正しく方向付けるために最小限の侵襲的手段で患者のCTCのCNVプロファイルを同定することが可能だろう。
【0138】
CNVを決定する可能性を実証するために、CTCの少量の試料及びそれに応じて少量の陰性対照試料を分離及び単離した。
【0139】
転移性乳癌(mBrCa)を患う患者から7.5mlの末梢血の試料を採取し、CellSaveチューブ(Veridex社)中に入れた。試料は、濃縮し、標準的な手順に従って、CellSearch AutoPrepにより、蛍光抗体(PEコンジュゲート抗CK、APCコンジュゲート抗CD45)及びDAPIで標識した。濃縮した細胞をVeridex社のカートリッジから抽出し、減少した体積中で再懸濁した。上記試料は、307200個の電極及び多数のプログラム可能なケージ(典型的には19200個〜76800個の間)を備えたチップDEPArray(商標)A300K(Silicon BioSystems社)に注入した。スキャニング後に、5つの細胞を有する2つの陰性対照、5つのCTCを有する2つの試料、単一のCTCを有する1つ試料が単離された[?CONTROLLARE - L'ITALIANO NON E' COMPRENSIBILE]。
【0140】
図8及び図9は、CNV検出のための陰性対照として5つの各々の白血球(DAPI+/CD45+/CK−)を有する、第1の回収及び第2の回収において回収された細胞をそれぞれ示す。図10は、5つのCTCが分離して回収されたことを示し、それらはCNV解析の対象となる。
【0141】
本発明による方法を使用して行われた選択及び単離の後に、そして試料が90%を超える純度でここで利用可能であるとすれば(問題となっている事例において、図10中で示されたCTCの回収については100%)、欧州特許第1109938号において示された方法論に従う全ゲノム増幅に基づいた解析、ライゲーションを介したPCR、続いて分裂中期の比較ゲノムハイブリダイゼーション(CGH)又はCGHアレイを首尾よく実行することが可能であるが、より低い純度の試料では、検出されるシグナルが非腫瘍細胞の存在下において弱いか又は不明瞭である限りでは、これらは不可能であるか又は本質的に信頼性が低くなるだろう。
【特許請求の範囲】
【請求項1】
腫瘍の状態及び/又は対応する進行度を診断する方法であって、
a.患者から少なくとも1つの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を高い確率で含有する有機液体の試料を得る工程と、
b.前記有機液体の試料を、少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を含む細胞の少なくとも1つの集団に濃縮する工程と、
c.前記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞を単離する工程であって、精製試料を得る、単離する工程と、
d.前記精製試料に対して、前記診断を可能にするのに適した前記少なくとも1つの細胞の少なくとも1つの特徴が強調されるように、分子解析を行う工程と、
を含み、
前記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞又は細胞の一部分を単離する工程を、単一の細胞又は細胞の一部分をマイクロ流体装置において個別に選択することによって、少なくとも90%の純度を有する精製試料が得られるように行うことを特徴とする、方法。
【請求項2】
前記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞又は細胞の一部分を単離する工程を、少なくとも95%の純度を有する診断用試料が得られるように行うことを特徴とする、請求項1に記載の方法。
【請求項3】
前記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞又は細胞の一部分を単離する工程を、100%の純度を有する診断用試料が得られるように行うことを特徴とする、請求項2に記載の方法。
【請求項4】
前記細胞を前記マイクロ流体システムによって非手動的に単離することを特徴とする、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記細胞を前記マイクロ流体システムによって自動的又は半自動的に単離することを特徴とする、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記細胞の前記個別の選択を、前記有機液体の流れがない中で評価されるパラメーターに基づいて行うことを特徴とする、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記細胞の前記個別の選択を画像に基づいて行うことを特徴とする、請求項1〜6のいずれか一項に記載の方法。
【請求項8】
前記画像が蛍光画像を含むことを特徴とする、請求項7に記載の方法。
【請求項9】
前記細胞の前記個別の選択をインピーダンス測定特性に基づいて行うことを特徴とする、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を、少なくとも1つのタイプのトレーサーにより標識する工程を含むことを特徴とする、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
前記少なくとも1つのタイプのトレーサーがFISHプローブであることを特徴とする、請求項10に記載の方法。
【請求項12】
前記少なくとも1つのタイプのトレーサーが、
蛍光体、
色原体、
(蛍光又は非蛍光の)マイクロビーズ、
から構成されるセットから選択されるマーカーとコンジュゲートした抗体であることを特徴とする、請求項10に記載の方法。
【請求項13】
前記少なくとも1つのタイプの抗体が、
EpCAM、
サイトケラチン8、
サイトケラチン18、
サイトケラチン19、
サイトケラチン20、
CD45、
EGFR、
IGFR、
PSA、
TTF1、
HER2/neu、
MUC−1
からなる群から選択される抗原を認識することを特徴とする、請求項12に記載の方法。
【請求項14】
前記循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の少なくとも1つの細胞又は一部分を単離する工程を、前記少なくとも1つのトレーサーにより事前に標識された、前記マイクロ流体装置中に存在する単一の細胞を個別に選択することによって行うことを特徴とする、請求項10に記載の方法。
【請求項15】
前記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞又は細胞の一部分を単離する工程を、好ましくはアレイに従って前記マイクロ流体装置中に配置される該マイクロ流体装置の複数の部位のうちの特定の部位それぞれで単一の細胞を捕捉することによって、及びその後、捕捉された細胞の中から単一の細胞を選択することによって、該マイクロ流体装置に対して内部又は外部のセンサーを用いて検出することができる少なくとも1つのパラメーターに基づいて行うことを特徴とする、請求項1〜14のいずれか一項に記載の方法。
【請求項16】
前記有機液体の前記試料を濃縮する工程が、
a.質量密度、
b.形態、
c.電気的特性、
d.化学的特性、
e.機械的特性、
f.表面抗原の発現、
g.細胞質内抗原の発現、
h.誘電特性、
i.磁気的特性、
l.光学的特性、
m.幾何学的特性、
又はその組み合わせ
からなる群から選択される少なくとも1つのパラメーターに基づいて行われる細胞の選択を含むことを特徴とする、請求項1〜15のいずれか一項に記載の方法。
【請求項17】
前記有機液体の前記試料を、少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を含む細胞の少なくとも1つの集団に濃縮する工程が、有核細胞を分離した後に該有核細胞に濃縮されるように前記有機液体の前記試料を処理する工程を含むことを特徴とする、請求項1〜16のいずれか一項に記載の方法。
【請求項18】
前記有機液体の前記試料を、少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を含む細胞の少なくとも1つの集団に濃縮する工程が、前記有機液体の前記試料を密度勾配において遠心分離する工程を少なくとも含むことを特徴とする、請求項17に記載の方法。
【請求項19】
前記有機液体の前記試料を、少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を含む細胞の少なくとも1つの集団に濃縮する工程が、赤血球の選択的溶解を行う工程を少なくとも含むことを特徴とする、請求項17に記載の方法。
【請求項20】
前記有機液体の前記試料を、少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を含む細胞の少なくとも1つの集団に濃縮する工程が、
a)CD45陰性、
b)CD45陰性及びGPA陰性、
c)CD45陰性及びCD14陰性、
d)CD45陰性、CD14陰性及びGPA陰性、
e)EpCAM陽性、
f)CK陽性
のモダリティの少なくとも1つに従って、抗体にカップリングされた磁気ビーズを介する正の選択及び/又は負の選択を実行する工程を少なくとも含むことを特徴とする、前の請求項1〜19のいずれか一項に記載の方法。
【請求項21】
前記少なくとも1つの濃縮工程を、前記単離工程を行うために使用したものと同じ前記マイクロ流体装置内で該単離工程と組み合わせて行うことを特徴とする、請求項1〜20のいずれか一項に記載の方法。
【請求項22】
互いに分離されかつ液圧的に連結される複数の異なるチャンバーを装備し、単一のチップによって又は複数の別個のチップによって少なくとも1つの表面上に範囲が定められる、マイクロ流体装置を使用することを特徴とする、請求項21に記載の方法。
【請求項23】
前記分子解析の工程が、
シークエンシング、
マイクロサテライト解析、
比較ゲノムハイブリダイゼーション(CGH)、
アレイCGH、
エンドポイントPCR、
リアルタイムPCR、
メチル化解析:
ピロシークエンシングによる定量的メチル化解析
重亜硫酸塩ゲノムシークエンシングPCR(BSP)
メチル化特異的PCR(MSP)
DNAの複合重亜硫酸塩制限解析(COBRA)
メチル化感受性単一ヌクレオチドプライマー伸長(MS−SNuPE)
遺伝子発現解析
RT−PCR
単一細胞遺伝子発現
デジタルPCR
の中から選択される手順を用いて行うことを特徴とする、請求項1〜22のいずれか一項に記載の方法。
【請求項24】
前記分子解析の工程が、点(単一ヌクレオチド)変異の存在に到達することを目的とすることを特徴とする、請求項23に記載の方法。
【請求項25】
前記点(単一ヌクレオチド)変異がK−RAS遺伝子及び/又はB−RAF遺伝子を考慮するものであり、それらの存在が所定の治療法に対する患者の非応答性の指標であることを特徴とする、請求項24に記載の方法。
【請求項26】
前記分子解析の工程が、癌抑制遺伝子の過剰メチル化の存在の評価を目的とすることを特徴とする、請求項1〜23のいずれか一項に記載の方法。
【請求項27】
前記分子解析の工程が、欠失及び/又は重複の存在の評価を目的とすることを特徴とする、請求項1〜23にのいずれか一項に記載の方法。
【請求項28】
前記分子解析の工程が、前立腺癌の疑いがある患者の腫瘍細胞中の染色体領域13q14における欠失の存在の評価を目的とすることを特徴とする、請求項27に記載の方法。
【請求項29】
前記分子解析の工程が、前立腺癌の疑いがある患者の腫瘍細胞中の遺伝子BCL2、CCND1及びWNT3Aの少なくとも1つの過剰発現の評価を目的とすることを特徴とする、請求項1〜23のいずれか一項に記載の方法。
【請求項1】
腫瘍の状態及び/又は対応する進行度を診断する方法であって、
a.患者から少なくとも1つの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を高い確率で含有する有機液体の試料を得る工程と、
b.前記有機液体の試料を、少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を含む細胞の少なくとも1つの集団に濃縮する工程と、
c.前記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞を単離する工程であって、精製試料を得る、単離する工程と、
d.前記精製試料に対して、前記診断を可能にするのに適した前記少なくとも1つの細胞の少なくとも1つの特徴が強調されるように、分子解析を行う工程と、
を含み、
前記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞又は細胞の一部分を単離する工程を、単一の細胞又は細胞の一部分をマイクロ流体装置において個別に選択することによって、少なくとも90%の純度を有する精製試料が得られるように行うことを特徴とする、方法。
【請求項2】
前記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞又は細胞の一部分を単離する工程を、少なくとも95%の純度を有する診断用試料が得られるように行うことを特徴とする、請求項1に記載の方法。
【請求項3】
前記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞又は細胞の一部分を単離する工程を、100%の純度を有する診断用試料が得られるように行うことを特徴とする、請求項2に記載の方法。
【請求項4】
前記細胞を前記マイクロ流体システムによって非手動的に単離することを特徴とする、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記細胞を前記マイクロ流体システムによって自動的又は半自動的に単離することを特徴とする、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記細胞の前記個別の選択を、前記有機液体の流れがない中で評価されるパラメーターに基づいて行うことを特徴とする、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記細胞の前記個別の選択を画像に基づいて行うことを特徴とする、請求項1〜6のいずれか一項に記載の方法。
【請求項8】
前記画像が蛍光画像を含むことを特徴とする、請求項7に記載の方法。
【請求項9】
前記細胞の前記個別の選択をインピーダンス測定特性に基づいて行うことを特徴とする、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を、少なくとも1つのタイプのトレーサーにより標識する工程を含むことを特徴とする、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
前記少なくとも1つのタイプのトレーサーがFISHプローブであることを特徴とする、請求項10に記載の方法。
【請求項12】
前記少なくとも1つのタイプのトレーサーが、
蛍光体、
色原体、
(蛍光又は非蛍光の)マイクロビーズ、
から構成されるセットから選択されるマーカーとコンジュゲートした抗体であることを特徴とする、請求項10に記載の方法。
【請求項13】
前記少なくとも1つのタイプの抗体が、
EpCAM、
サイトケラチン8、
サイトケラチン18、
サイトケラチン19、
サイトケラチン20、
CD45、
EGFR、
IGFR、
PSA、
TTF1、
HER2/neu、
MUC−1
からなる群から選択される抗原を認識することを特徴とする、請求項12に記載の方法。
【請求項14】
前記循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の少なくとも1つの細胞又は一部分を単離する工程を、前記少なくとも1つのトレーサーにより事前に標識された、前記マイクロ流体装置中に存在する単一の細胞を個別に選択することによって行うことを特徴とする、請求項10に記載の方法。
【請求項15】
前記少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分の中から少なくとも1つの細胞又は細胞の一部分を単離する工程を、好ましくはアレイに従って前記マイクロ流体装置中に配置される該マイクロ流体装置の複数の部位のうちの特定の部位それぞれで単一の細胞を捕捉することによって、及びその後、捕捉された細胞の中から単一の細胞を選択することによって、該マイクロ流体装置に対して内部又は外部のセンサーを用いて検出することができる少なくとも1つのパラメーターに基づいて行うことを特徴とする、請求項1〜14のいずれか一項に記載の方法。
【請求項16】
前記有機液体の前記試料を濃縮する工程が、
a.質量密度、
b.形態、
c.電気的特性、
d.化学的特性、
e.機械的特性、
f.表面抗原の発現、
g.細胞質内抗原の発現、
h.誘電特性、
i.磁気的特性、
l.光学的特性、
m.幾何学的特性、
又はその組み合わせ
からなる群から選択される少なくとも1つのパラメーターに基づいて行われる細胞の選択を含むことを特徴とする、請求項1〜15のいずれか一項に記載の方法。
【請求項17】
前記有機液体の前記試料を、少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を含む細胞の少なくとも1つの集団に濃縮する工程が、有核細胞を分離した後に該有核細胞に濃縮されるように前記有機液体の前記試料を処理する工程を含むことを特徴とする、請求項1〜16のいずれか一項に記載の方法。
【請求項18】
前記有機液体の前記試料を、少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を含む細胞の少なくとも1つの集団に濃縮する工程が、前記有機液体の前記試料を密度勾配において遠心分離する工程を少なくとも含むことを特徴とする、請求項17に記載の方法。
【請求項19】
前記有機液体の前記試料を、少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を含む細胞の少なくとも1つの集団に濃縮する工程が、赤血球の選択的溶解を行う工程を少なくとも含むことを特徴とする、請求項17に記載の方法。
【請求項20】
前記有機液体の前記試料を、少なくとも1つのタイプの循環性腫瘍細胞若しくは播種性腫瘍細胞又はそれらの一部分を含む細胞の少なくとも1つの集団に濃縮する工程が、
a)CD45陰性、
b)CD45陰性及びGPA陰性、
c)CD45陰性及びCD14陰性、
d)CD45陰性、CD14陰性及びGPA陰性、
e)EpCAM陽性、
f)CK陽性
のモダリティの少なくとも1つに従って、抗体にカップリングされた磁気ビーズを介する正の選択及び/又は負の選択を実行する工程を少なくとも含むことを特徴とする、前の請求項1〜19のいずれか一項に記載の方法。
【請求項21】
前記少なくとも1つの濃縮工程を、前記単離工程を行うために使用したものと同じ前記マイクロ流体装置内で該単離工程と組み合わせて行うことを特徴とする、請求項1〜20のいずれか一項に記載の方法。
【請求項22】
互いに分離されかつ液圧的に連結される複数の異なるチャンバーを装備し、単一のチップによって又は複数の別個のチップによって少なくとも1つの表面上に範囲が定められる、マイクロ流体装置を使用することを特徴とする、請求項21に記載の方法。
【請求項23】
前記分子解析の工程が、
シークエンシング、
マイクロサテライト解析、
比較ゲノムハイブリダイゼーション(CGH)、
アレイCGH、
エンドポイントPCR、
リアルタイムPCR、
メチル化解析:
ピロシークエンシングによる定量的メチル化解析
重亜硫酸塩ゲノムシークエンシングPCR(BSP)
メチル化特異的PCR(MSP)
DNAの複合重亜硫酸塩制限解析(COBRA)
メチル化感受性単一ヌクレオチドプライマー伸長(MS−SNuPE)
遺伝子発現解析
RT−PCR
単一細胞遺伝子発現
デジタルPCR
の中から選択される手順を用いて行うことを特徴とする、請求項1〜22のいずれか一項に記載の方法。
【請求項24】
前記分子解析の工程が、点(単一ヌクレオチド)変異の存在に到達することを目的とすることを特徴とする、請求項23に記載の方法。
【請求項25】
前記点(単一ヌクレオチド)変異がK−RAS遺伝子及び/又はB−RAF遺伝子を考慮するものであり、それらの存在が所定の治療法に対する患者の非応答性の指標であることを特徴とする、請求項24に記載の方法。
【請求項26】
前記分子解析の工程が、癌抑制遺伝子の過剰メチル化の存在の評価を目的とすることを特徴とする、請求項1〜23のいずれか一項に記載の方法。
【請求項27】
前記分子解析の工程が、欠失及び/又は重複の存在の評価を目的とすることを特徴とする、請求項1〜23にのいずれか一項に記載の方法。
【請求項28】
前記分子解析の工程が、前立腺癌の疑いがある患者の腫瘍細胞中の染色体領域13q14における欠失の存在の評価を目的とすることを特徴とする、請求項27に記載の方法。
【請求項29】
前記分子解析の工程が、前立腺癌の疑いがある患者の腫瘍細胞中の遺伝子BCL2、CCND1及びWNT3Aの少なくとも1つの過剰発現の評価を目的とすることを特徴とする、請求項1〜23のいずれか一項に記載の方法。
【図1】


【図2】


【図3A】


【図3B】


【図3C】


【図4A】


【図4B】


【図4C】


【図4D】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3A】


【図3B】


【図3C】


【図4A】


【図4B】


【図4C】


【図4D】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公表番号】特表2012−507733(P2012−507733A)
【公表日】平成24年3月29日(2012.3.29)
【国際特許分類】
【出願番号】特願2011−535174(P2011−535174)
【出願日】平成21年11月4日(2009.11.4)
【国際出願番号】PCT/IB2009/007316
【国際公開番号】WO2010/052543
【国際公開日】平成22年5月14日(2010.5.14)
【出願人】(507008482)シリコン・バイオシステムズ・ソシエタ・ペル・アチオニ (7)
【Fターム(参考)】
【公表日】平成24年3月29日(2012.3.29)
【国際特許分類】
【出願日】平成21年11月4日(2009.11.4)
【国際出願番号】PCT/IB2009/007316
【国際公開番号】WO2010/052543
【国際公開日】平成22年5月14日(2010.5.14)
【出願人】(507008482)シリコン・バイオシステムズ・ソシエタ・ペル・アチオニ (7)
【Fターム(参考)】
[ Back to top ]

