腫瘍細胞移動の抑制方法及びこれに用いる薬剤
【課題】腫瘍細胞の移動を抑制する新規な方法を提案する。
【解決手段】本発明によれば、ユビキチンに対する抗体による腫瘍細胞移動の抑制方法及びこれに用いる薬剤が提供される。ユビキチンに対する抗体が腫瘍細胞の移動を抑制することが示される。好ましくは、ユビキチンに対する抗体はMEL-14(たとえば、MEL-14-F(ab’)2)、抗体14372または抗体10C2-2である。腫瘍細胞の移動を抑制するために、ユビキチンに対する抗体の有効量を腫瘍細胞に接触させる。
【解決手段】本発明によれば、ユビキチンに対する抗体による腫瘍細胞移動の抑制方法及びこれに用いる薬剤が提供される。ユビキチンに対する抗体が腫瘍細胞の移動を抑制することが示される。好ましくは、ユビキチンに対する抗体はMEL-14(たとえば、MEL-14-F(ab’)2)、抗体14372または抗体10C2-2である。腫瘍細胞の移動を抑制するために、ユビキチンに対する抗体の有効量を腫瘍細胞に接触させる。
【発明の詳細な説明】
【背景技術】
【0001】
関連出願の相互参照
本出願は2005年8月25日に提出した発明の名称「発癌の幹細胞融合モデル」の米国仮出願第60/711,249号に基づいて優先権を主張し、当該出願の全内容を参照することにより取り込まれる。
【技術分野】
【0002】
本発明は、ユビキチンに対する抗体による腫瘍細胞移動の抑制方法及びこれに用いる薬剤に関する。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】US 6,007,816 A clumn2
【非特許文献】
【0004】
【非特許文献1】Chen et al. Science. 15 April 2005, Vol. 308. Pages 369-373, especially pages 371 and 373
【非特許文献2】La; et al. Cancer Res. 15 June 2002, Vol. 62, pages 3335-3339, especially page 3336
【発明の開示】
【発明が解決しようとする課題】
【0005】
癌は、その組織異質性と遺伝子の不安定性のため、治療が難しいとされている。癌は人類の病気として、紀元前1600年の古代エジプトの書物の中で既に記述されている。古代ギリシャの医師ヒポクラテスは、良性腫瘍と悪性腫瘍の間の違いを見つけ、悪性腫瘍を「カルシノス(carcinos)」と名付けた。先進国では、癌は現在二番目に多い死因となっている。
米国大統領リチャード・ニクソンが70年代に「癌との闘い」を宣言して以来、癌に関する大量の知識が蓄積されてきた。過去200年間に、癌の発生に関して数多くの仮説が提案された。早期のものとしては、刺激説、胚胎発生説、寄生説が含まれる。その後、実験腫瘍学の確立につれて、化学発癌物質が同定された。ヒト腫瘍と実験動物の腫瘍の分子分析を通して、多くの癌遺伝子と癌抑制遺伝子が発見された。これらの研究成果により遺伝子突然変異説が確立され、この説は過去30年の間支配的な地位を占めていた。
現在の遺伝子突然変異説の固有の正確さにかかわらず、依然として癌の多くの重要な特性を説明できないでいる。実際に、遺伝子突然変異説の限界については既に多くの学者によって徹底的に論じられている。
【0006】
最近、幹細胞研究および「癌幹細胞」の発見から得られる見識により、「発癌の幹細胞理論」がますます多くの支持を得るようになっている。発癌の幹細胞理論では、幹細胞が遺伝子突然変異を蓄積して悪性細胞に変化することが示唆されている。しかし、当該幹細胞理論は全体的に遺伝子突然変異説に依存したものであるため、たとえば、浸潤および転移などの、癌の独特の特性が何に起因するのかを十分に解釈できていない。
【0007】
突然変異はまれな事象である。数学モデルでは、悪性形質転換には高頻度での事象が必要であることが示唆される。癌の持つ特質の実現可能な特性としてゲノムの不安定性が提示された。ゲノムの不安定性の表現型として、異数性がヒトのほとんど全ての固形癌に観察され、遺伝子突然変異理論では説明が困難である。自主的な突然変異要素として異数性が癌の原因とされているが、異数性に内在するメカニズムは未だに究明されていない。
【0008】
従って、癌に関する研究はかなり進歩したが、癌の起源は謎として残っている。現在の遺伝子突然変異説に基づく発癌のモデルでは癌の多くの側面を説明するには限界があるので、本発明者らは多段階発癌モデルを新たに提案した。当該モデルでは、癌発生が遺伝子の突然変異と細胞融合を伴うと考えられる。具体的に言えば、癌は「改変された」前癌細胞と骨髄由来の幹細胞(BMDSC)との融合に起因しうる。悪性腫瘍の特質の一つである「異数性」は、この細胞融合の直接的な結果である。「幹細胞融合」モデルを使って、悪性腫瘍細胞とBMDSCとの著しい類似性を説明することができる。当該モデルにより、なぜ非突然変異誘発物質が発癌物質でありうるのか、なぜ非突然変異誘発過程、たとえば、創傷治癒および慢性炎症などが悪性形質転換を促しうるのかをも説明する。
【課題を解決するための手段】
【0009】
発明の要旨
【0010】
本発明の一つの実施態様では、癌細胞の移動をモデリングするための方法を開示する。前記方法は、好ましくは、骨髄由来の幹細胞を提供し、遺伝的に改変された細胞を提供し、前記骨髄由来の幹細胞を前記遺伝的に改変された細胞と融合して、これにより融合細胞を形成し、前記融合細胞の移動の指標を測定することを含む。代案として、この二種類の細胞を直接融合させるほかに、骨髄由来の幹細胞と遺伝的に改変された細胞を既に融合した融合細胞から得てもよいし前記融合細胞を培養してもよい。
【0011】
本発明の別の実施態様では、腫瘍細胞移動に対する生物学的または化学的物質の効果をスクリーニングするための方法を記載する。前記方法は骨髄由来の幹細胞の遺伝的に改変された細胞との融合に由来する融合細胞を提供し、前記融合細胞を生物学的または化学的物質と接触させて、腫瘍細胞の移動が促進されるか、抑制されるか、または無変化であるかどうかを測定することを含む。
【0012】
本発明の更に別の実施態様では、腫瘍細胞の移動を抑制するための方法が記載され、腫瘍細胞を有効量のユビキチンに対する抗体と接触させることを含むことを包含する。好ましくは、当該抗体はMEL-14(たとえば、MEL-14-F(ab’)2)、抗体14372または抗体10C2-2である。更に詳しくは、ヒトを除く対象において、腫瘍細胞の移動を抑制する方法であって、
腫瘍の腫瘍細胞を有効量のユビキチンに対する抗体と接触させることを含む、前記方法、およびインビトロで、腫瘍細胞の移動を抑制する方法であって、腫瘍の腫瘍細胞を有効量のユビキチンに対する抗体と接触させることを含む、前記方法を包含する。加えて、ユビキチンに対する抗体を含む腫瘍細胞の移動を抑制するための薬剤を包含する。好ましくは、当該抗体はMEL-14(たとえば、MEL-14-F(ab’)2)、抗体14372または抗体10C2-2である。
【0013】
本発明の方法は腫瘍細胞移動のインビトロ研究用の、および標識遺伝子で修飾された骨髄細胞、たとえば、緑色蛍光タンパク(eGFP)遺伝子組み換え体を移植した動物を用いるインビボ研究用の新規で改良された発癌モデルを示す。本発明のさらなる特色とメリットは以下の特定の実施態様の詳細な記載と添付の図面から明らかになるであろう。
【発明を実施するための最良の形態】
【0014】
好ましい態様の説明
【0015】
本明細書において用いる「転移」は癌が体の一部分から別の部分に広がることを意味する。広がった細胞により形成される腫瘍を「転移腫瘍」または「転移」と呼ぶ。
【0016】
「悪性細胞」という用語は癌性細胞を意味し、すなわち、コントロールを受けずに分裂して近隣の組織を浸潤でき、血流およびリンパ系を介して体のほかの部分に広がることができる異常な細胞を意味する。
【0017】
「改変された細胞」または「遺伝的に改変された細胞」という用語は、本明細書ではBMDSCとの融合後の骨髄由来幹細胞の正常な分化経路を歪曲するのに十分な遺伝的またはエピジェネティックな変化を有するあらゆる細胞として定義される。「改変された」細胞は多段階発癌モデルにおけるいわゆる「開始された(initiated)」(前癌)細胞を含む。
【0018】
「融合細胞」という用語は改変された細胞と骨髄由来の幹細胞が融合してできた細胞を意味する。
【0019】
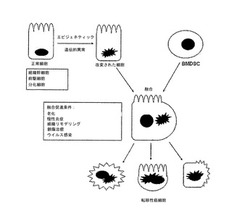
悪性腫瘍の起源、特に、ヒト悪性腫瘍の90%超を占めている上皮性悪性腫瘍の起源については、未だ議論が交わされている。本発明者らが提案する発癌のモデルは主に高度の悪性上皮性悪性腫瘍の発生起源に着目している。当該モデルでは、骨髄由来の幹細胞(BMDSC)と「改変された」組織細胞との融合が鍵となっている(図1)。市販のカラムを用いて分化した細胞の表面マーカーを発現した全ての骨髄由来の細胞を取り除くことにより精製BMDSC集団が得られる。前記カラムを通過する系統陰性細胞をCD34陽性、CD133陽性およびSCA-l陽性細胞について積極的に選別することにより幹細胞をさらに豊富に得ることができる。この方法は、ネズミとヒトの両方のBMDSCに使用できる。本発明の一部はBMDSCと「改変された」組織細胞との融合がハイブリッド細胞の悪性形質転換をもたらしうるという認識に関する。従って、多段階発癌モデルにおけるいわゆる「開始された」細胞と良性腫瘍細胞に移動能力を与えることができる。
【0020】
融合すると、「改変された」組織細胞の中にある遺伝的またはエピジェネティックな異常のために、BMDSCの正常な分化経路が妨げられる。遺伝的異常は、遺伝子突然変異説で提唱されているように遺伝子突然変異、転座、欠失または増幅でありうる。エピジェネティックな異常はDNA配列の域を超えて、細胞の成長と機能の調節異常が結果として起きるあらゆる変化、たとえば、DNAメチル化、クロマチン修飾、または改変された細胞信号などの変化でありうる。融合により改変された細胞とBMDSCの両方の表現型を有する娘細胞を形成することができる。言い換えれば、娘細胞はBMDSCから自己再生、組織浸潤と移動の能力を得ることができ、これにより、悪性細胞に変わる。さらに、融合過程、それに続く有糸分裂と染色体の個々のコピーの喪失が異数性をもたらす。異数性はゲノムの不安定性と癌進行の推進力となりうる。本発明者らのモデルに従えば、一つの融合事象によって、古典的な多段階発癌過程に関連する多数の事象と同様の形質転換(良性から悪性への)効果が得られる。
【0021】
本発明者らのモデルに基づけば、癌の多くの悪性表現型、たとえば、浸潤および転移などがBMDSCから生じることがわかる。多細胞生物の発達と生存の過程においては、細胞融合は自然でよくある事象である。遺伝子突然変異と幹細胞融合の相対確率を比較すると、正常細胞の完全な悪性腫瘍への進行は一つの進化過程として見ることができる。多くのまれな事象をたびたび起こる事象に置き換える経路は結果として進化において圧倒的に好まれる経路をもたらすであろう。
【0022】
BMDSCは高い適応性を有する。多くの実験によって証明されているが、骨髄の中には造血幹細胞(HSC)だけでなく、間葉幹細胞(MSC)、内皮前駆細胞、および肝臓、肺、皮膚と胃腸管の上皮細胞に分化しうる上皮組織の幹細胞も含む。これらのBMDSCが非造血組織に移動して、損傷組織の保持と修復において関与しうる。表1に要約するように、BMDSCと転移性癌細胞は生物活性とこれら活性の分子基盤において驚くほどの類似性を有する。
【表1】

【0023】
BMDSCと転移性癌細胞は自己再生、移動と組織浸潤ができる。いくつかの癌細胞は幹細胞マーカーといわれているものを発現する。たとえば、c-kitは漿液性卵巣癌、睾丸癌、悪性黒色腫と小細胞肺癌において強く発現される。CD34は皮膚線維肉腫、上皮様肉腫と単発性線維性腫瘍において発現される。このほかに、テロメラーゼ陽性の幹細胞と類似して、全ての型の癌細胞はテロメアを維持する能力を取得する。BMDSCが特定のケモカイン受容体を発現し、ケモカインとリガンドの相互作用でその目的地に到達する。
【0024】
興味深いことに、同じケモカイン−リガンド対がBMDSCのホーミングと悪性細胞転移に関与している。既に知られている現象であるが、低分化の癌は通常高転移性であるが放射線療法に対して感受性が高い。このような現象の原因は文献によってまだ完全に解明されていないが、BMDSCが放射線に非常に敏感であるのときわめて類似している。実際、放射線に対するこの感受性に基づいて骨髄除去が臨床的に行われている。これらを考え合わせると、癌細胞はBMDSCからこれらの特性を取得すると推測される。事実、最近のデータにより、骨髄由来の細胞から慢性ヘリコバクター感染のマウスにおいて胃癌が生じうることが示されている。このほかにも、腎移植を受けた患者においてドナー細胞由来のヒト皮膚癌が観察されたという報告がある。
【0025】
本発明者らは、過去にBMDSCと「改変された」細胞との融合事象が癌細胞移動を引き起こすことを提言している。上述のように、融合は多くの生物の生命にとって基本的な現象の一つである。細胞内小胞間融合は細胞の基本機能に不可欠なものある。エンベロープを持ったウイルスは膜融合を通してウイルスのキャプシドを細胞質内に送達する。酵母菌からヒトまで、生命は融合で始まる。筋肉、骨および胎盤の発達の過程において、細胞と細胞の融合は正常な生物学的過程の一部である。早くも1911年には、悪性腫瘍が白血球と体細胞とのハイブリダイゼーションの結果でありうるという提言がある。また研究では、哺乳動物の体細胞が共培養された精子を取り込んだとき、および/またはインサイチュ(in situ)の精子を実験的に誘導して侵入させることにより、発癌性形質転換が起こることも示されている。今まで長期間に渡って存在する学説では、腫瘍細胞とリンパ球のハイブリダイゼーションにより転移性細胞が結果として得られるとされてきた。しかし、本発明以前には、悪性形質転換がBMDSCと「改変された」の前癌組織細胞との融合の結果であると記載したまたは示唆した人は誰1人いなかった。
【0026】
幹細胞は自然な細胞融合を通して他の細胞の表現型を採用することができる。いくつかの研究によって、BMDSCがさまざまな標的細胞と融合することが証明されている。細胞融合事象を検出するためのCre/lox組換えに基づく方法を使って、Alvarez-Doladoら(Nature 425, 968-973 [2003])は骨髄由来の細胞がインビボで肝細胞、脳内のプルキンエ神経細胞および心臓における心筋細胞と融合して多核細胞を形成することを証明した。骨髄由来の肝細胞の連続移植を通して、Wangら(Nature 422, 897-901[2003])は、細胞融合が骨髄由来の肝細胞の主要供給源であることを証明した。また、雌のドナー・マウスから雄のレシピエントのマウスに移植された肝細胞の細胞遺伝学的分析で、二倍体間の融合(80, XXXY)および二倍体と四倍体の融合(120, XXXXYY)の核型が証明された。理論上、細胞融合は、正常細胞、前癌細胞および癌細胞の間で何度も起こりうる。しかしながら、本発明は、特に発癌の重要な段階としての「改変された」前癌組織細胞とBMDSCとの融合を含む。BMDSCとの多くの融合が起こり、これにより融合が起こった後少なくとも四倍体核型を形成する。
【0027】
改変された組織細胞との融合後、幹細胞の正常な自己再生と分化は前記改変された細胞由来の異常信号によって乱されると考えられる。突然変異を蓄積し形質転換されることを意図する、発癌の他の幹細胞モデルに比べて、本発明は分化細胞より幹細胞の方がよりDNA損傷に耐え難いというほかの研究と一致する。幹細胞はその多能性分化潜在能を維持するために、DNA損傷に対してより敏感であるべきである。BMDSCが成熟細胞に比べて、放射線により敏感であるのは疑いのないことである。この事実は臨床で行われている骨髄除去の基礎である。組織幹細胞はDNA損傷物質により敏感で死滅されやすいという知見もある。放射線または細胞毒性物質にさらされることにより腸陰窩幹細胞のアポトーシス・レベルが顕著に高くなる。したがって、幹細胞よりはむしろ、組織細胞が遺伝的およびエピジェネティックな異常を蓄積する可能性が高い。BMDSCと融合した後、娘細胞が形質転換して悪性腫瘍を生じる。
【0028】
100年余りかかって癌の独特な病理学的特徴の一つとして染色体異常が同定された。固形ヒト癌の殆ど全てにおいて異数性が観察されている。さらに、臨床データでは、異数性の程度が病気の重症度と関連していることが示されている。癌の異数性に関する学説では、発癌における異数性の重要性を強調しているが、異数性の基礎にあるメカニズムについては未だ不明である。本明細書に記載する発癌の幹細胞融合モデルにおいて、異数性は個々の染色体コピーの喪失をもたらす細胞融合の必然的な結果である。提案した発癌の幹細胞融合モデルの早期の直接応用において、研究により、前立腺癌細胞の過染色症が前立腺の正常上皮細胞と注入された精子の推定融合の結果であり得ることを立証している。さらに、一部のヒト前癌性病変、たとえば、バレット食道、潰瘍性大腸炎およびHPV陽性の非定型子宮頸部扁平上皮細胞などでは、四倍体細胞の頻度が増加している。DNAの倍数性分析で、大多数の異数性ヒト前立腺癌が四倍体であることが立証されている。これらの証拠により癌の異数性が一つの四倍体事象(すなわち、融合)に由来することが示される。
【0029】
慢性組織損傷、炎症と癌との関連が長年観察されている。この関連に内在する分子細胞的機構については、数多くの的確な研究と再考がある。本発明者らは、組織損傷と発癌の関係について以下のように考える。慢性組織損傷、炎症とその後の組織修復のため、局部の組織幹細胞の再生能が消耗される。局部の炎症ミクロ環境は次いでBMDSCのホーミングと組織修復におけるBMDSCの関与に有利に働く。BMDSCは時々「改変された」の組織細胞と融合して悪性形質転換を起こす。
【0030】
代謝回転率が高いと結果として局所組織幹細胞の消耗とBMDSCの浸潤が起こりうるので、正常に迅速な再生が行われる組織では癌の発生率が高まることが予測される。実際、皮膚、肺、胃腸管の上皮は、継続的に環境の傷害要素にさらされ絶えず再生状態にあり、癌の割合が高い組織である。性不一致骨髄移植のマウスにおいて創傷治癒中に骨髄由来の角化細胞の移植増大が立証されたが、同研究により、急性損傷における皮膚上皮細胞と骨髄由来の細胞との融合の存在は排除されている。ヘリコバクター感染は胃癌発生の主な原因因子の一つである。慢性組織損傷と進行中の組織修復が胃内の上皮細胞の増殖とアポトーシスの不均衡をもたらす。実際、骨髄由来の細胞がヘリコバクターに感染したマウスの胃癌の起源であることが最近報告された。
【0031】
老化は癌の最大危険因子の一つである。発癌の早期多段階理論は、癌の年齢分布を分析してできたものである。その後、遺伝子突然変異説では、癌の年齢分布が癌を発生させるのに十分な多数の突然変異を蓄積するのに要する時間を反映していると考えられている。しかし、代わりに、老化をもたらす機構も幹細胞の機能に影響すると説明することもできるであろう。酸化損傷と細胞老化は不適切な細胞間の融合の頻度を高め、悪性形質転換の発生率を増やす可能性がある。たとえば、老化細胞は組織再生または修復、組織ミクロ環境を変更しうる分泌因子を危険にさらし、更に、幹細胞の活性を変更しうるであろう。さらに、幹細胞自身も老化関連損傷の直接標的である。白髪化はメラノサイト幹細胞の自己維持能の欠陥によってもたらされることが立証されている。腸の上皮幹細胞も老化に伴って重要な機能傷害にさらされることが示される。HSCの老化と機能不全は白血病の発生を許容する条件を形成しうる。したがって、発癌の時間動態は老化過程における細胞間の相互作用を反映する可能性がある。
【0032】
その他の条件は、細胞−細胞融合を促して、その結果として癌の発生率を増やす可能性があり、組織リモデリングとウイルス感染を含む。女性における乳癌と卵巣癌の高発生と慢性肝炎後の肝細胞癌の高発生は、組織リモデリングが悪性形質転換を促す例でありうる。また、エプスタイン・バー・ウイルス(EBV)はバーキットリンパ腫、非ホジキンリンパ腫、ホジキン疾患、鼻咽腔癌、胃腺癌及び乳癌を含む広範囲の癌に関連することが示されている。早期の研究では、EBVが細胞間融合を誘発し、特に腫瘍から単離されたウィルスにより誘発することが示されている。これらのデータと合わせて、本発明者らの発癌の幹細胞融合モデルにより、なぜEBV感染がこのように多くの癌と関連しているかを説明できるであろう。
【0033】
本明細書に示す発癌の幹細胞融合モデルは容易に検査できる。従って、本発明者らは既にいくつかの実験を使ってこのモデルを検査した。良性腫瘍細胞とBMDSCとの融合をインビトロで行った。融合後、形態と転移および浸潤の能力とをインビトロおよびインビボで測定する。そのほかに、細胞融合の証拠は性不一致骨髄またはトランスジェニック骨髄を移植したマウスにできた自然発生の固形腫瘍の精密検査により示すことができるだろう。しかし、融合が起こるとき娘細胞において重複する性染色体がしばしば失われるので、性染色体を検出するためのたとえば蛍光インサイチュ(in situ)ハイブリダイゼーション(FISH)などの広く使用されている技術は適切ではないかもしれない。実際、正常な女性において発生する悪性腫瘍の相当数は性染色体陰性となり、重複する第二X染色体の喪失を示している。形質導入されたDNA種またはドナー由来のミトコンドリアDNAの存在を検出する方法が適当であろう。最後に、骨髄移植を受けた後に癌腫を発生した患者から採取した標本を検査することにより、遡及的研究を行うことができるだろう。たとえば、ドナー由来のミトコンドリアDNAの存在を検出する方法などの技術が性染色体を検出するFISHよりも有益であろう。
【0034】
癌、特に癌腫の幹細胞融合モデルは、幹細胞の治療応用に関してと同様、癌の研究および薬物開発に関しても重要な意義を有する。悪性細胞は分化を誘発する治療に感受性があるかもしれない。分化は自己再生活性のスイッチを切り、悪性細胞の転移と組織への浸潤能力を低下させることができるだろう。実際、いくつかの分化誘発薬物、たとえば、レチノイン酸とペルオキシソーム増殖剤応答性受容体−ガンマ(PPARγ)作動物質などがそれぞれ、急性骨髄性白血病または脂肪肉腫の治療に用いられ成功を収めている。遺伝子導入を通して、分化信号を悪性腫瘍細胞に導入するのは、新規で実行可能な癌治療のアプローチであろう。また、転移細胞はBMDSCと同様のホーミング・パターンを持つ可能性がある。従って、BMDSCのホーミングをブロックするアプローチは癌転移を抑制するのに使用できるだろう。これと一致して、最近の研究では、RNA干渉によるケモカイン受容体CXCR4のサイレンシングが、マウスの乳癌転移をブロックすることを立証している。癌の制御が困難なのは、その遺伝的特徴が非常に無秩序であることに起因する。しかし、癌細胞のBMDSCに由来する悪性特徴により、新たな治療をデザインするための保存された標的を示しうる。
【0035】
従って、BMDSCとその子孫細胞が好中球、リンパ球とその他の白血球を含むので、癌転移は同じ保存された分子構造を用いるであろう。従って、本発明者らは、インビボで好中球、リンパ球とその他の白血球の運動性と管外遊出をブロックできる、ユビキチンに対する抗体が癌細胞の運動性と管外遊出をブロックし結果的に転移をブロックするかどうかを検証した。さらに、腫瘍におけるBMDSC/改変された細胞の融合の存在を測定することにより、幹細胞に基づく治療に潜在する意図しない結果に研究者の目を向けさせることができるだろう(すなわち、幹細胞の不適切な投与が実際に悪性腫瘍の発生率を高めている可能性がある)。
【0036】
慢性組織損傷とその後に起こる修復は組織幹細胞を消耗しBMDSCを補充する。従って、BMDSCと組織細胞との融合機会が増大する。その他の因子、たとえば、老化、ウイルス感染と組織リモデリングなども細胞融合の機会を増やす。重要なのは、一つの融合工程で、多くの「悪性」特徴を付与でき多数の突然変異を要することなく「改変された」細胞を形質転換できうることである。
【0037】
腫瘍細胞と非腫瘍細胞の融合および腫瘍原性に対する効果に関して何百という研究が行われたが、本発明以前には、骨髄由来の幹細胞と腫瘍細胞の融合に関する科学文献は知られていなかった。
【0038】
従って、本発明の第一の実施態様において、癌細胞の移動をモデリングする方法は、(a)骨髄由来の幹細胞を提供する工程、(b)遺伝的に改変された細胞を提供する工程、(c) 前記骨髄由来の幹細胞を前記遺伝的に改変された細胞と融合して、これにより融合細胞を形成する工程、(d) 前記融合細胞について移動の指標を測定する工程を含む。BMDSCと遺伝的に改変された細胞のどちらも商業的および学術的な組織培養と生体供給源から容易に得られる。同様に、細胞融合は通常行われており、利用可能な多くのプロトコルがある(たとえば、protocol-online.org.のハイブリドーマ・プロトコル参照)。前記融合細胞(とその子孫細胞)に関する移動の指標を測定するには、インビトロの「スクラッチ分析」(たとえば、Lal A, Glazer CA, Martinson HM, ら、Cancer Res 2002, 62:3335-3340)によりまたはインビボの動物実験(たとえば、以下の実施例で記載する一つまたは複数の融合細胞を含む腫瘍細胞を注入し、転移をモニタリングすること)により行うことができる。
【0039】
本発明はさらに、インビトロあるいはインビボのどちらかで腫瘍細胞の移動に対する生物学的または化学的物質の効果をスクリーニングする方法を含む。前記方法は骨髄由来の幹細胞の遺伝的に改変された細胞との融合に由来する融合細胞を提供し、前記融合細胞を生物学的または化学的物質と接触させ、腫瘍細胞の移動が促進されるか、抑制されるか、または無変化であるかどうかを測定する。移動に対する物質の効果をスクリーニングする特に優れた標的は保存タンパク質であろう。
【0040】
ユビキチン(ub)は自然界で発見された、最も保存されたタンパク質である。その76のアミノ酸配列のうち、昆虫、サケと人類のような進化が異なる種の間でも、完全に相同する。ユビキチンはいくつかの他の膜受体の外側表面ドメインの部分を修復する。リンパ球のホーミング受容体(LHR)のばあい、ubの存在はLHRの機能と密接に関連し、リンパ節によるリンパ球の結合と移動を促進する。ubと関連することが示されている全ての受容体は細胞運動を仲介することも知られている。これらの知見に対する可能な解釈として、ubが細胞外基質を通して細胞運動を仲介することに関連すると考えられる。ubのこの潜在的な機能は、たとえば、細胞分化、寄生虫感染、腫瘍浸潤と腫瘍細胞転移などの、多くの真核細胞の過程に対する研究において、重要な意義を持つ。
【0041】
従って、たとえば、前記生物学的または化学的物質はユビキチンに対する抗体、たとえば、MEL-14(CD62L)(Abcam Plc.,Zymed Laboratories らを介して入手可能。ユビキチンに対する21種の異なる抗体についてはabcam.com参照)である。以下の述べるように、この抗体と接触させた細胞はスクラッチ分析に供するか、動物実験に用いて前記抗体の細胞移動に対する効果を測定する。
【0042】
本発明の別の実施態様において、腫瘍細胞の移動を抑制する方法を記載し、この方法は有効量のユビキチンに対する抗体と腫瘍細胞を接触させることを含む。好ましくは、本実施態様は、より高い悪性度の腫瘍にこのような抑制を集中できるように前記抗体と腫瘍細胞を接触させる前に、腫瘍細胞の中に融合細胞が存在することを確認する工程を含む。
【0043】
腫瘍細胞標本の中に少なくとも四倍体DNAと骨髄由来の幹細胞に特異的な少なくとも一つの細胞表面マーカーを伴う細胞を含むかどうかを測定しうる。このような表面細胞マーカーはc-kit、CD34とCD133及びケモカイン受容体、たとえばCXCR4などを含む。また、骨髄由来の幹細胞と非幹細胞の融合を検出するためにCre/lox組換えの利用を含んでもよい。
【実施例】
【0044】
非制限的実施例
以下の実験で用いられる実験技術は確立されたもので広く一般に受け入れられている。
【0045】
第一の研究目的は、骨髄由来の幹細胞と形質転換された細胞の相互作用が腫瘍の進行を変えることができるという発癌に関する以前に提案した仮説を検証することである。二つのタイプの実験を行うことができる。一組目の実験において、遺伝子組み換えによりeGFPを発現するようになったマウスからマウス骨髄に由来する細胞を単離して、ハイブリッド細胞の形成を促進する条件化でクロンテック(Clontech)の赤色蛍光タンパク質で標識した一過性にトランスフェクションしたヒトまたはマウスの形質転換細胞と結合する。その後、これらのハイブリッド細胞を調べる細胞系に適したマウスの系統に注射する。
【0046】
原発性または転移性腫瘍成長の変化を時間の関数としてモニターする。この実験が解決しようとする二つの基本的な課題は、骨髄由来の幹細胞を形質転換の様々な段階の腫瘍細胞と融合することにより腫瘍の進行を調節するかどうかと、受容体に対する抗体でヒトまたはマウスの異種移植物を処理すると異種移植腫瘍の転移表現型が変わるかどうかということである。これらの仮説を検証するためのモデルとして働く代表的な受容体は、転移腫瘍細胞によって発現されるCXCR4である。
【0047】
乳癌、皮膚癌および前立腺癌用に確立されたモデル系、形質転換されたマウス(308、308 10Gy5、または4T1)とヒト(DU145またはPC-3M)細胞系の投与に対する宿主免疫反応を最小にするために、無胸腺ヌード、Balb/cまたはSCIDマウスにおける腫瘍成長および進行の確立された異種移植モデルを使用しなければならない。皮下接種または尾静脈注射を用いてマウス細胞系を無胸腺ヌードマウスに投与する。ヒト細胞系はSCIDマウスに投与する。細胞系を含有するアリコートを、単独で、または組み合わせて注射し、この日を第0日として、腫瘍の成長を最長40日間観察する。その後、マウスを死亡させ、組織を取り出し腫瘍の大きさと肺の転移の相対レベルを定量する。
【0048】
実験1
A群:8匹の遺伝子導入マウス
【0049】
ヘテロ接合遺伝子導入のeGFPマウス[C57BL/6-TgN(ACTbEGFP)1Osb] (ジャクソン・ラボラトリー(Jackson Laboratory))をGFPで標識した骨髄細胞の供給源として用いる。GFPマウスは緑色蛍光の発現により紫外線下で同定する。2〜4ヶ月齢雌性ヘテロ接合体をBMTのドナーとして用いる。ドナーの性別はレシピエント宿主の性別とは異なる。
【0050】
骨髄由来の細胞は、ヘテロ接合GFPマウスからハンクス(Hank)の平衡液でこのマウスの大腿骨と脛骨を洗い流すことにより得られる。体細胞ハイブリッドを生じさせるために、ポリエチレン・グリコール(PEG)処理を行う24時間前に、106の骨髄由来の細胞と106の腫瘍細胞を60mmの培養皿に配置する。分子量3000-3700のPEG5gを121℃で5分間高圧蒸気殺菌して調製する。前記殺菌PEGを次いで37℃に加温しておいた2X血清不含培養液5mlと組合せて50%溶液を調製する。次に、一皿当たり1mlの50%PEG溶液を共培養した細胞に徐々に添加し、前記細胞を37℃で一分間インキュベーションする。
【0051】
次に、血清不含培養液を1ml添加し、さらに1分間インキュベーションを続ける。更に2mlの培養液を添加し、2分間インキュベーションを続ける。その後、血清不含培養液を4ml添加し、4分間インキュベーションを続ける。その後、血清を含む培養液を各プレートに添加し、37℃で48時間インキュベーションを続ける。二日後、各皿をトリプシンを用いて継代し、選択するために四枚の100mm培養プレートに再配置する。共培養した細胞の両方の型の特徴を示す細胞発現マーカーを選び出して、90%の成長密度まで培養して、以下の実験に用いる。
【0052】
実験2:ネズミおよびヒトの良性腫瘍細胞の改変された腫瘍原性と進行
GFPで標識した骨髄細胞を単独で、または形質転換された良性ヒトもしくはマウス細胞と組み合わせてマウスに接種する。
【0053】
A群:72匹のマウス。株:308細胞用の無胸腺ヌードマウス;DU145またはPC-3M腫瘍用のSCID(疼痛カテゴリーD)。必要とされるマウスの総数:(4匹/処理)(6処理)(3回の実験)=72匹
【0054】
GFPで標識された骨髄(BM)由来の細胞、および/または形質転換された良性ヒトもしくはマウス細胞をマウスに接種する。腫瘍接種はベル型広口瓶内でイソフルランを用いて麻酔したマウスに行う。前記マウスは、ポリプロピレン製遠心チューブ内のイソフルランで処理した綿ボールを含む前記瓶内に配置する。接種中、マウスの呼吸数、動き、筋弛緩および方向性のある動きの欠如(lack of directed movement)を観察することによりモニターする。接種後、マウスをケージに戻し、正常な意識が戻るまでモニターする。
【0055】
マウスごとに、5X105の細胞を含む100μlのPBSを投与する。無胸腺ヌードマウスに308細胞、BM細胞、あるいはBM細胞及び308細胞のPEG処理混合物を接種する。SCIDマウスに、DU145細胞、BM細胞あるいはBM細胞及びDU145細胞のPEG処理混合物を接種する。皮下的にまたは尾静脈の注射で接種を行う。マウスに尾静脈感染させるとき、これらマウスを拘束ボックスの中に閉じ込める。アルコールで尾部を消毒した後、2%キシロカインで局所麻酔する。マウスごとに、25-30ゲージの注射針を用い200μl以下の溶液を注射する。注射で壊死が生じたばあい、尾部に塩化エチルを噴霧し、ベタジン(betadine)に浸漬し、滅菌したはさみで壊死領域のすぐ上の組織を取り除く。前記尾部を硝酸銀で焼灼して止血する。
【0056】
腫瘍の成長を週に二回、ノギスで腫瘍の大きさを測定してモニターし、以下の式を用いて腫瘍の体積を計算する。体積=+1/2(縦)(横2)。第2、3、4週に、それぞれマウスを死亡させ、転移の程度と生じた腫瘍の体積をモニターする。
【0057】
密閉チャンバーで二酸化炭素を使ってマウスを窒息死させ、腫瘍と器官を採取する。これはマウスを安楽死させる常用方法で、その苦痛を最小限にすることができ、AVMA安楽死パネル(AVMA Panel on Euthanasia)により推薦されている方法である。
実験手順の概要概略
【0058】
1.皮下または尾静脈注射により良性の形質転換された細胞と幹細胞の混合物を投与して、308とDU145の異種移植を確立する。
【0059】
2.注射の各方法の処理群−(6):308細胞;BM細胞;BM細胞+308 細胞のPEG処理混合物;DU145;BM細胞、PEG処理されたDU145とBM細胞の混合物。
【0060】
3. CO2でマウスを窒息死させた後、発達した転移を伴う原発性腫瘍と器官を取り出す。
【0061】
4.腫瘍標本を病理組織学的分析に送り、融合事象と関連して転移する能力または進行の変化を検出する。前記病理組織学的分析は、腫瘍成長と時間の比較、転移の相対数及び大きさ、腫瘍の組織学的特徴が含まれるべきである。
【0062】
実験3:腫瘍原性または進行の抑制
マウスに転移性形質転換ヒト(PC3-M)またはマウス(308 10Gy5または4T1)細胞と、CXCR4受容体の抑制剤とを接種する。必要とされるマウス総数: (4匹/処理) (3処理) (3投与時点) (3実験) = 108匹。
【0063】
腫瘍接種はベル型広口瓶内でイソフルランを用いて麻酔したマウスに行う。前記マウスは、ポリプロピレン製遠心チューブ内のイソフルランで処理した綿ボールを含む前記瓶内に配置する。接種中、マウスの呼吸数、動き、筋弛緩および方向性のある動きの欠如を観察することによりモニターする。接種後、マウスをケージに戻し、正常な意識が戻るまでモニターする。
【0064】
4匹のBalb/cマウスの乳腺脂肪体に104の4T1細胞を含むPBS100μlを注射により投与する。無胸腺ヌードマウスに1X106の308 10Gy5細胞を含むPBS100μlを注射する。SCIDマウスに1X106のPC-3M細胞を含むPBS100μlを注射する。腫瘍細胞接種前、接種時と接種後にそれぞれマウスにCRCX4受容体に対する抗体を投与することにより実験を行う。4T1細胞はBalb/cマウスの乳腺脂肪体に注射する。308 10Gy5細胞をヌードマウスの尾静脈に注射し、PC-3M細胞をSCIDマウスの尾静脈に注射する。尾静脈注射を受けるマウスは、拘束ボックスの中に閉じ込める。アルコールで尾部に消毒を施し、2%キシロカインを適用して局所麻酔し、マウスごとに、25-30ゲージの注射針を用い200μl以下の溶液を注射する。注射で壊死が生じたばあい、尾部に塩化エチルを噴霧し、ベタジンに浸漬し、滅菌したはさみで壊死領域のすぐ上の組織を取り除く。次に、前記尾部を硝酸銀で焼灼して止血する。
【0065】
腫瘍の成長を週に二回、ノギスで腫瘍の大きさを測定してモニターし、以下の式を用いて腫瘍の体積を計算する。体積=1/2(縦)(横2)。第10、15、20日目に、それぞれマウスを死亡させ、肺転移と腫瘍の体積をモニターする。
【0066】
転移の抑制剤候補を接種する前後で、動物をモニターして、腫瘍細胞のアポトーシス、分化と転移の抑制における変化を分析する。
【0067】
CO2でマウスを窒息死させた後、宿主マウスにおいて発達した原発性腫瘍と転移を取り出す。
【0068】
組織標本を病理組織学的分析に送り、処置と関連する転移または進行の変化を検出する。前記病理組織学的分析は、腫瘍成長と時間の比較、転移の相対数及び大きさ、腫瘍組織の組織学的特徴が含まれるべきである。
【0069】
インビトロの癌細胞/融合細胞の移動抑制分析
細胞:二つの転移性癌細胞系を使って、ユビキチン抗体の細胞運動を抑制する能力を調べた。PC-3Mはヒト前立腺癌細胞系である。4T1はマウス乳癌細胞系である。両細胞系は10%FBSとグルタマックス(Glutamax)1を添加したDMEM培養液(以下、DMEM培養液)で維持した。
【0070】
抗体:三つのユビキチン抗体を用いた。14372はユビキチンに対するポリクローナル抗体である。10C2-2とMel-14は共にユビキチンに対するモノクローナル抗体である。
【0071】
手順(1):各穴に滅菌したカバースリップを含む六穴プレートに、各穴当たりDMEM培養液中の1x106の細胞を播種し、37℃で5% CO2の加湿したインキュベーターで一晩培養した(標準条件)。
【0072】
次の日、ピペットの先端で前記カバースリップ上に生えた単層細胞を一度引っ掻いて削った。培養液を吸い取って、前記穴を1mLのDMEM培養液で洗浄した。各細胞系は、三つの異なる濃度の各抗体で処理した:5μg/mL/106 細胞、25μg/mL/106 細胞と100μg/mL/106細胞。前記プレートを細胞と共に11時間インキュベーションした。対照となる細胞は、DPBSで処理した。
【0073】
インキュベーション終了後、前記カバースリップの削った部分の閉鎖状況を分析して、細胞移動の結果とした。次に、前記カバースリップを1:1のメチルアルコール:アセトンを用い-20℃で5分間処理して、固定し染色した後、DPBSで洗浄をした。カバースリップをスライド・ガラスにのせた。ニコン(Nikon)TE2000の顕微鏡からなるワークステーションを使って4倍に拡大して、メタコム(Metacam)というソフトで画像を取り込んだ。
【0074】
インビボの癌細胞/融合細胞転移抑制分析
細胞:マウス転移性乳癌細胞系、4T1を使用しユビキチン抗体の転移を抑制する能力を調べた。前記細胞はDMEM培養液中に、前述のプロトコルに記載した培養条件に従って維持した。
【0075】
抗体:モノクローナル・ユビキチン抗体、Mel-14を分析に使用した。
【0076】
手順:強化緑色蛍光タンパク質(EGFP)用の発現ベクターを使って4T1細胞を一過的にトランスフェクションした。トランスフェクションから48時間後に細胞を集めて、DPBS中180μg/106細胞の濃度でユビキチン抗体、Mel-14か、対照抗体、ラット(Rat)IgG2Aのどちらかと共に1時間インキュベーションした。インキュベーション後、尾静脈を通して250,000の細胞をSCIDマウスに総量50μlで注射した 。一週間後、マウスを死亡させ、肺を取り出し、4%ホルマリンで固定した。ニコン・エクリプス(Nikon Eclipse)600顕微鏡で10倍拡大して、肺全体を平らにし転移性コロニーの存在を検査した。前記肺にEGFP陽性細胞が存在することで、転移が起こったことが示された。
【0077】
結果
【表2】

【表3】

【表4】

【0078】
参考文献:
1. Auerbach R, Lewis R, Shinners B, Kubal L, Akhtar N. 「血管形成分析:重要概説(Angiogenesis Assays: A Critical Overview)」 Clinical Chemistry 49 (1), 1 Jan. 2003:32-40.
【0079】
上の表に示されるように、ユビキチンに対する抗体は腫瘍細胞の移動を抑制した。
【産業上の利用可能性】
【0080】
治療方法
本発明の方法は、対象における腫瘍の移動を抑制するのに用いることができる。脊椎動物の対象、好ましくは哺乳動物、より好ましくはヒトに、腫瘍細胞の移動を抑制するのに有効な量の合成物(compound)を投与する。前記合成物または医薬的に許容しうるその塩は好ましくは医薬組成物の形態で投与される。
【0081】
前記合成物の用量は好ましくは有効量の抗体または他の物質を含有する医薬投薬単位を含む。有効量とはインビボで安定した状態の濃度を達成するのに十分な量を意味し、疾患の関連パラメーターにおいて測定可能な低下をもたらす。
【0082】
モノクローナル抗体は患者に直接注入する治療に現在日常的に用いられている。前記抗体は凍結乾燥し水か生理食塩水のどちらかで戻すまで保存できる。抗体に基づく治療では、4mg/kg体重という用量はヒトにとって典型的で安全な投薬量である。たとえば、これは乳癌抗体治療薬ハーセプチンの有効用量である。従って、本発明の一実施態様において、患者に体重当たり4mgの抗ユビキチン抗体が静脈を通して患者に投薬される。
【0083】
投与される活性合成物の量は適切な生物学的または化学的物質、疾患または状態、投与経路、レシピエントの健康状態と体重、もしあれば、他の同時に行われる治療の存在、治療頻度、所望される効果の性状、たとえば、腫瘍転移の抑制、および経験のある医師の判断に依存する。
【0084】
前述の組成物と治療方法は、有害な細胞浸潤、増殖、転移に関連するいかなる疾患または状態の患者において細胞の移動(たとえば、浸潤または転移)を抑制するのに役立つ。
【0085】
添付の特許請求の範囲と均等な範囲と意義内で、種々の改変を行うことができる。
【図面の簡単な説明】
【0086】
【図1】図1は骨髄由来の幹細胞と「改変された」組織細胞との融合が仲介する悪性形質転換の略図である。
【背景技術】
【0001】
関連出願の相互参照
本出願は2005年8月25日に提出した発明の名称「発癌の幹細胞融合モデル」の米国仮出願第60/711,249号に基づいて優先権を主張し、当該出願の全内容を参照することにより取り込まれる。
【技術分野】
【0002】
本発明は、ユビキチンに対する抗体による腫瘍細胞移動の抑制方法及びこれに用いる薬剤に関する。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】US 6,007,816 A clumn2
【非特許文献】
【0004】
【非特許文献1】Chen et al. Science. 15 April 2005, Vol. 308. Pages 369-373, especially pages 371 and 373
【非特許文献2】La; et al. Cancer Res. 15 June 2002, Vol. 62, pages 3335-3339, especially page 3336
【発明の開示】
【発明が解決しようとする課題】
【0005】
癌は、その組織異質性と遺伝子の不安定性のため、治療が難しいとされている。癌は人類の病気として、紀元前1600年の古代エジプトの書物の中で既に記述されている。古代ギリシャの医師ヒポクラテスは、良性腫瘍と悪性腫瘍の間の違いを見つけ、悪性腫瘍を「カルシノス(carcinos)」と名付けた。先進国では、癌は現在二番目に多い死因となっている。
米国大統領リチャード・ニクソンが70年代に「癌との闘い」を宣言して以来、癌に関する大量の知識が蓄積されてきた。過去200年間に、癌の発生に関して数多くの仮説が提案された。早期のものとしては、刺激説、胚胎発生説、寄生説が含まれる。その後、実験腫瘍学の確立につれて、化学発癌物質が同定された。ヒト腫瘍と実験動物の腫瘍の分子分析を通して、多くの癌遺伝子と癌抑制遺伝子が発見された。これらの研究成果により遺伝子突然変異説が確立され、この説は過去30年の間支配的な地位を占めていた。
現在の遺伝子突然変異説の固有の正確さにかかわらず、依然として癌の多くの重要な特性を説明できないでいる。実際に、遺伝子突然変異説の限界については既に多くの学者によって徹底的に論じられている。
【0006】
最近、幹細胞研究および「癌幹細胞」の発見から得られる見識により、「発癌の幹細胞理論」がますます多くの支持を得るようになっている。発癌の幹細胞理論では、幹細胞が遺伝子突然変異を蓄積して悪性細胞に変化することが示唆されている。しかし、当該幹細胞理論は全体的に遺伝子突然変異説に依存したものであるため、たとえば、浸潤および転移などの、癌の独特の特性が何に起因するのかを十分に解釈できていない。
【0007】
突然変異はまれな事象である。数学モデルでは、悪性形質転換には高頻度での事象が必要であることが示唆される。癌の持つ特質の実現可能な特性としてゲノムの不安定性が提示された。ゲノムの不安定性の表現型として、異数性がヒトのほとんど全ての固形癌に観察され、遺伝子突然変異理論では説明が困難である。自主的な突然変異要素として異数性が癌の原因とされているが、異数性に内在するメカニズムは未だに究明されていない。
【0008】
従って、癌に関する研究はかなり進歩したが、癌の起源は謎として残っている。現在の遺伝子突然変異説に基づく発癌のモデルでは癌の多くの側面を説明するには限界があるので、本発明者らは多段階発癌モデルを新たに提案した。当該モデルでは、癌発生が遺伝子の突然変異と細胞融合を伴うと考えられる。具体的に言えば、癌は「改変された」前癌細胞と骨髄由来の幹細胞(BMDSC)との融合に起因しうる。悪性腫瘍の特質の一つである「異数性」は、この細胞融合の直接的な結果である。「幹細胞融合」モデルを使って、悪性腫瘍細胞とBMDSCとの著しい類似性を説明することができる。当該モデルにより、なぜ非突然変異誘発物質が発癌物質でありうるのか、なぜ非突然変異誘発過程、たとえば、創傷治癒および慢性炎症などが悪性形質転換を促しうるのかをも説明する。
【課題を解決するための手段】
【0009】
発明の要旨
【0010】
本発明の一つの実施態様では、癌細胞の移動をモデリングするための方法を開示する。前記方法は、好ましくは、骨髄由来の幹細胞を提供し、遺伝的に改変された細胞を提供し、前記骨髄由来の幹細胞を前記遺伝的に改変された細胞と融合して、これにより融合細胞を形成し、前記融合細胞の移動の指標を測定することを含む。代案として、この二種類の細胞を直接融合させるほかに、骨髄由来の幹細胞と遺伝的に改変された細胞を既に融合した融合細胞から得てもよいし前記融合細胞を培養してもよい。
【0011】
本発明の別の実施態様では、腫瘍細胞移動に対する生物学的または化学的物質の効果をスクリーニングするための方法を記載する。前記方法は骨髄由来の幹細胞の遺伝的に改変された細胞との融合に由来する融合細胞を提供し、前記融合細胞を生物学的または化学的物質と接触させて、腫瘍細胞の移動が促進されるか、抑制されるか、または無変化であるかどうかを測定することを含む。
【0012】
本発明の更に別の実施態様では、腫瘍細胞の移動を抑制するための方法が記載され、腫瘍細胞を有効量のユビキチンに対する抗体と接触させることを含むことを包含する。好ましくは、当該抗体はMEL-14(たとえば、MEL-14-F(ab’)2)、抗体14372または抗体10C2-2である。更に詳しくは、ヒトを除く対象において、腫瘍細胞の移動を抑制する方法であって、
腫瘍の腫瘍細胞を有効量のユビキチンに対する抗体と接触させることを含む、前記方法、およびインビトロで、腫瘍細胞の移動を抑制する方法であって、腫瘍の腫瘍細胞を有効量のユビキチンに対する抗体と接触させることを含む、前記方法を包含する。加えて、ユビキチンに対する抗体を含む腫瘍細胞の移動を抑制するための薬剤を包含する。好ましくは、当該抗体はMEL-14(たとえば、MEL-14-F(ab’)2)、抗体14372または抗体10C2-2である。
【0013】
本発明の方法は腫瘍細胞移動のインビトロ研究用の、および標識遺伝子で修飾された骨髄細胞、たとえば、緑色蛍光タンパク(eGFP)遺伝子組み換え体を移植した動物を用いるインビボ研究用の新規で改良された発癌モデルを示す。本発明のさらなる特色とメリットは以下の特定の実施態様の詳細な記載と添付の図面から明らかになるであろう。
【発明を実施するための最良の形態】
【0014】
好ましい態様の説明
【0015】
本明細書において用いる「転移」は癌が体の一部分から別の部分に広がることを意味する。広がった細胞により形成される腫瘍を「転移腫瘍」または「転移」と呼ぶ。
【0016】
「悪性細胞」という用語は癌性細胞を意味し、すなわち、コントロールを受けずに分裂して近隣の組織を浸潤でき、血流およびリンパ系を介して体のほかの部分に広がることができる異常な細胞を意味する。
【0017】
「改変された細胞」または「遺伝的に改変された細胞」という用語は、本明細書ではBMDSCとの融合後の骨髄由来幹細胞の正常な分化経路を歪曲するのに十分な遺伝的またはエピジェネティックな変化を有するあらゆる細胞として定義される。「改変された」細胞は多段階発癌モデルにおけるいわゆる「開始された(initiated)」(前癌)細胞を含む。
【0018】
「融合細胞」という用語は改変された細胞と骨髄由来の幹細胞が融合してできた細胞を意味する。
【0019】
悪性腫瘍の起源、特に、ヒト悪性腫瘍の90%超を占めている上皮性悪性腫瘍の起源については、未だ議論が交わされている。本発明者らが提案する発癌のモデルは主に高度の悪性上皮性悪性腫瘍の発生起源に着目している。当該モデルでは、骨髄由来の幹細胞(BMDSC)と「改変された」組織細胞との融合が鍵となっている(図1)。市販のカラムを用いて分化した細胞の表面マーカーを発現した全ての骨髄由来の細胞を取り除くことにより精製BMDSC集団が得られる。前記カラムを通過する系統陰性細胞をCD34陽性、CD133陽性およびSCA-l陽性細胞について積極的に選別することにより幹細胞をさらに豊富に得ることができる。この方法は、ネズミとヒトの両方のBMDSCに使用できる。本発明の一部はBMDSCと「改変された」組織細胞との融合がハイブリッド細胞の悪性形質転換をもたらしうるという認識に関する。従って、多段階発癌モデルにおけるいわゆる「開始された」細胞と良性腫瘍細胞に移動能力を与えることができる。
【0020】
融合すると、「改変された」組織細胞の中にある遺伝的またはエピジェネティックな異常のために、BMDSCの正常な分化経路が妨げられる。遺伝的異常は、遺伝子突然変異説で提唱されているように遺伝子突然変異、転座、欠失または増幅でありうる。エピジェネティックな異常はDNA配列の域を超えて、細胞の成長と機能の調節異常が結果として起きるあらゆる変化、たとえば、DNAメチル化、クロマチン修飾、または改変された細胞信号などの変化でありうる。融合により改変された細胞とBMDSCの両方の表現型を有する娘細胞を形成することができる。言い換えれば、娘細胞はBMDSCから自己再生、組織浸潤と移動の能力を得ることができ、これにより、悪性細胞に変わる。さらに、融合過程、それに続く有糸分裂と染色体の個々のコピーの喪失が異数性をもたらす。異数性はゲノムの不安定性と癌進行の推進力となりうる。本発明者らのモデルに従えば、一つの融合事象によって、古典的な多段階発癌過程に関連する多数の事象と同様の形質転換(良性から悪性への)効果が得られる。
【0021】
本発明者らのモデルに基づけば、癌の多くの悪性表現型、たとえば、浸潤および転移などがBMDSCから生じることがわかる。多細胞生物の発達と生存の過程においては、細胞融合は自然でよくある事象である。遺伝子突然変異と幹細胞融合の相対確率を比較すると、正常細胞の完全な悪性腫瘍への進行は一つの進化過程として見ることができる。多くのまれな事象をたびたび起こる事象に置き換える経路は結果として進化において圧倒的に好まれる経路をもたらすであろう。
【0022】
BMDSCは高い適応性を有する。多くの実験によって証明されているが、骨髄の中には造血幹細胞(HSC)だけでなく、間葉幹細胞(MSC)、内皮前駆細胞、および肝臓、肺、皮膚と胃腸管の上皮細胞に分化しうる上皮組織の幹細胞も含む。これらのBMDSCが非造血組織に移動して、損傷組織の保持と修復において関与しうる。表1に要約するように、BMDSCと転移性癌細胞は生物活性とこれら活性の分子基盤において驚くほどの類似性を有する。
【表1】

【0023】
BMDSCと転移性癌細胞は自己再生、移動と組織浸潤ができる。いくつかの癌細胞は幹細胞マーカーといわれているものを発現する。たとえば、c-kitは漿液性卵巣癌、睾丸癌、悪性黒色腫と小細胞肺癌において強く発現される。CD34は皮膚線維肉腫、上皮様肉腫と単発性線維性腫瘍において発現される。このほかに、テロメラーゼ陽性の幹細胞と類似して、全ての型の癌細胞はテロメアを維持する能力を取得する。BMDSCが特定のケモカイン受容体を発現し、ケモカインとリガンドの相互作用でその目的地に到達する。
【0024】
興味深いことに、同じケモカイン−リガンド対がBMDSCのホーミングと悪性細胞転移に関与している。既に知られている現象であるが、低分化の癌は通常高転移性であるが放射線療法に対して感受性が高い。このような現象の原因は文献によってまだ完全に解明されていないが、BMDSCが放射線に非常に敏感であるのときわめて類似している。実際、放射線に対するこの感受性に基づいて骨髄除去が臨床的に行われている。これらを考え合わせると、癌細胞はBMDSCからこれらの特性を取得すると推測される。事実、最近のデータにより、骨髄由来の細胞から慢性ヘリコバクター感染のマウスにおいて胃癌が生じうることが示されている。このほかにも、腎移植を受けた患者においてドナー細胞由来のヒト皮膚癌が観察されたという報告がある。
【0025】
本発明者らは、過去にBMDSCと「改変された」細胞との融合事象が癌細胞移動を引き起こすことを提言している。上述のように、融合は多くの生物の生命にとって基本的な現象の一つである。細胞内小胞間融合は細胞の基本機能に不可欠なものある。エンベロープを持ったウイルスは膜融合を通してウイルスのキャプシドを細胞質内に送達する。酵母菌からヒトまで、生命は融合で始まる。筋肉、骨および胎盤の発達の過程において、細胞と細胞の融合は正常な生物学的過程の一部である。早くも1911年には、悪性腫瘍が白血球と体細胞とのハイブリダイゼーションの結果でありうるという提言がある。また研究では、哺乳動物の体細胞が共培養された精子を取り込んだとき、および/またはインサイチュ(in situ)の精子を実験的に誘導して侵入させることにより、発癌性形質転換が起こることも示されている。今まで長期間に渡って存在する学説では、腫瘍細胞とリンパ球のハイブリダイゼーションにより転移性細胞が結果として得られるとされてきた。しかし、本発明以前には、悪性形質転換がBMDSCと「改変された」の前癌組織細胞との融合の結果であると記載したまたは示唆した人は誰1人いなかった。
【0026】
幹細胞は自然な細胞融合を通して他の細胞の表現型を採用することができる。いくつかの研究によって、BMDSCがさまざまな標的細胞と融合することが証明されている。細胞融合事象を検出するためのCre/lox組換えに基づく方法を使って、Alvarez-Doladoら(Nature 425, 968-973 [2003])は骨髄由来の細胞がインビボで肝細胞、脳内のプルキンエ神経細胞および心臓における心筋細胞と融合して多核細胞を形成することを証明した。骨髄由来の肝細胞の連続移植を通して、Wangら(Nature 422, 897-901[2003])は、細胞融合が骨髄由来の肝細胞の主要供給源であることを証明した。また、雌のドナー・マウスから雄のレシピエントのマウスに移植された肝細胞の細胞遺伝学的分析で、二倍体間の融合(80, XXXY)および二倍体と四倍体の融合(120, XXXXYY)の核型が証明された。理論上、細胞融合は、正常細胞、前癌細胞および癌細胞の間で何度も起こりうる。しかしながら、本発明は、特に発癌の重要な段階としての「改変された」前癌組織細胞とBMDSCとの融合を含む。BMDSCとの多くの融合が起こり、これにより融合が起こった後少なくとも四倍体核型を形成する。
【0027】
改変された組織細胞との融合後、幹細胞の正常な自己再生と分化は前記改変された細胞由来の異常信号によって乱されると考えられる。突然変異を蓄積し形質転換されることを意図する、発癌の他の幹細胞モデルに比べて、本発明は分化細胞より幹細胞の方がよりDNA損傷に耐え難いというほかの研究と一致する。幹細胞はその多能性分化潜在能を維持するために、DNA損傷に対してより敏感であるべきである。BMDSCが成熟細胞に比べて、放射線により敏感であるのは疑いのないことである。この事実は臨床で行われている骨髄除去の基礎である。組織幹細胞はDNA損傷物質により敏感で死滅されやすいという知見もある。放射線または細胞毒性物質にさらされることにより腸陰窩幹細胞のアポトーシス・レベルが顕著に高くなる。したがって、幹細胞よりはむしろ、組織細胞が遺伝的およびエピジェネティックな異常を蓄積する可能性が高い。BMDSCと融合した後、娘細胞が形質転換して悪性腫瘍を生じる。
【0028】
100年余りかかって癌の独特な病理学的特徴の一つとして染色体異常が同定された。固形ヒト癌の殆ど全てにおいて異数性が観察されている。さらに、臨床データでは、異数性の程度が病気の重症度と関連していることが示されている。癌の異数性に関する学説では、発癌における異数性の重要性を強調しているが、異数性の基礎にあるメカニズムについては未だ不明である。本明細書に記載する発癌の幹細胞融合モデルにおいて、異数性は個々の染色体コピーの喪失をもたらす細胞融合の必然的な結果である。提案した発癌の幹細胞融合モデルの早期の直接応用において、研究により、前立腺癌細胞の過染色症が前立腺の正常上皮細胞と注入された精子の推定融合の結果であり得ることを立証している。さらに、一部のヒト前癌性病変、たとえば、バレット食道、潰瘍性大腸炎およびHPV陽性の非定型子宮頸部扁平上皮細胞などでは、四倍体細胞の頻度が増加している。DNAの倍数性分析で、大多数の異数性ヒト前立腺癌が四倍体であることが立証されている。これらの証拠により癌の異数性が一つの四倍体事象(すなわち、融合)に由来することが示される。
【0029】
慢性組織損傷、炎症と癌との関連が長年観察されている。この関連に内在する分子細胞的機構については、数多くの的確な研究と再考がある。本発明者らは、組織損傷と発癌の関係について以下のように考える。慢性組織損傷、炎症とその後の組織修復のため、局部の組織幹細胞の再生能が消耗される。局部の炎症ミクロ環境は次いでBMDSCのホーミングと組織修復におけるBMDSCの関与に有利に働く。BMDSCは時々「改変された」の組織細胞と融合して悪性形質転換を起こす。
【0030】
代謝回転率が高いと結果として局所組織幹細胞の消耗とBMDSCの浸潤が起こりうるので、正常に迅速な再生が行われる組織では癌の発生率が高まることが予測される。実際、皮膚、肺、胃腸管の上皮は、継続的に環境の傷害要素にさらされ絶えず再生状態にあり、癌の割合が高い組織である。性不一致骨髄移植のマウスにおいて創傷治癒中に骨髄由来の角化細胞の移植増大が立証されたが、同研究により、急性損傷における皮膚上皮細胞と骨髄由来の細胞との融合の存在は排除されている。ヘリコバクター感染は胃癌発生の主な原因因子の一つである。慢性組織損傷と進行中の組織修復が胃内の上皮細胞の増殖とアポトーシスの不均衡をもたらす。実際、骨髄由来の細胞がヘリコバクターに感染したマウスの胃癌の起源であることが最近報告された。
【0031】
老化は癌の最大危険因子の一つである。発癌の早期多段階理論は、癌の年齢分布を分析してできたものである。その後、遺伝子突然変異説では、癌の年齢分布が癌を発生させるのに十分な多数の突然変異を蓄積するのに要する時間を反映していると考えられている。しかし、代わりに、老化をもたらす機構も幹細胞の機能に影響すると説明することもできるであろう。酸化損傷と細胞老化は不適切な細胞間の融合の頻度を高め、悪性形質転換の発生率を増やす可能性がある。たとえば、老化細胞は組織再生または修復、組織ミクロ環境を変更しうる分泌因子を危険にさらし、更に、幹細胞の活性を変更しうるであろう。さらに、幹細胞自身も老化関連損傷の直接標的である。白髪化はメラノサイト幹細胞の自己維持能の欠陥によってもたらされることが立証されている。腸の上皮幹細胞も老化に伴って重要な機能傷害にさらされることが示される。HSCの老化と機能不全は白血病の発生を許容する条件を形成しうる。したがって、発癌の時間動態は老化過程における細胞間の相互作用を反映する可能性がある。
【0032】
その他の条件は、細胞−細胞融合を促して、その結果として癌の発生率を増やす可能性があり、組織リモデリングとウイルス感染を含む。女性における乳癌と卵巣癌の高発生と慢性肝炎後の肝細胞癌の高発生は、組織リモデリングが悪性形質転換を促す例でありうる。また、エプスタイン・バー・ウイルス(EBV)はバーキットリンパ腫、非ホジキンリンパ腫、ホジキン疾患、鼻咽腔癌、胃腺癌及び乳癌を含む広範囲の癌に関連することが示されている。早期の研究では、EBVが細胞間融合を誘発し、特に腫瘍から単離されたウィルスにより誘発することが示されている。これらのデータと合わせて、本発明者らの発癌の幹細胞融合モデルにより、なぜEBV感染がこのように多くの癌と関連しているかを説明できるであろう。
【0033】
本明細書に示す発癌の幹細胞融合モデルは容易に検査できる。従って、本発明者らは既にいくつかの実験を使ってこのモデルを検査した。良性腫瘍細胞とBMDSCとの融合をインビトロで行った。融合後、形態と転移および浸潤の能力とをインビトロおよびインビボで測定する。そのほかに、細胞融合の証拠は性不一致骨髄またはトランスジェニック骨髄を移植したマウスにできた自然発生の固形腫瘍の精密検査により示すことができるだろう。しかし、融合が起こるとき娘細胞において重複する性染色体がしばしば失われるので、性染色体を検出するためのたとえば蛍光インサイチュ(in situ)ハイブリダイゼーション(FISH)などの広く使用されている技術は適切ではないかもしれない。実際、正常な女性において発生する悪性腫瘍の相当数は性染色体陰性となり、重複する第二X染色体の喪失を示している。形質導入されたDNA種またはドナー由来のミトコンドリアDNAの存在を検出する方法が適当であろう。最後に、骨髄移植を受けた後に癌腫を発生した患者から採取した標本を検査することにより、遡及的研究を行うことができるだろう。たとえば、ドナー由来のミトコンドリアDNAの存在を検出する方法などの技術が性染色体を検出するFISHよりも有益であろう。
【0034】
癌、特に癌腫の幹細胞融合モデルは、幹細胞の治療応用に関してと同様、癌の研究および薬物開発に関しても重要な意義を有する。悪性細胞は分化を誘発する治療に感受性があるかもしれない。分化は自己再生活性のスイッチを切り、悪性細胞の転移と組織への浸潤能力を低下させることができるだろう。実際、いくつかの分化誘発薬物、たとえば、レチノイン酸とペルオキシソーム増殖剤応答性受容体−ガンマ(PPARγ)作動物質などがそれぞれ、急性骨髄性白血病または脂肪肉腫の治療に用いられ成功を収めている。遺伝子導入を通して、分化信号を悪性腫瘍細胞に導入するのは、新規で実行可能な癌治療のアプローチであろう。また、転移細胞はBMDSCと同様のホーミング・パターンを持つ可能性がある。従って、BMDSCのホーミングをブロックするアプローチは癌転移を抑制するのに使用できるだろう。これと一致して、最近の研究では、RNA干渉によるケモカイン受容体CXCR4のサイレンシングが、マウスの乳癌転移をブロックすることを立証している。癌の制御が困難なのは、その遺伝的特徴が非常に無秩序であることに起因する。しかし、癌細胞のBMDSCに由来する悪性特徴により、新たな治療をデザインするための保存された標的を示しうる。
【0035】
従って、BMDSCとその子孫細胞が好中球、リンパ球とその他の白血球を含むので、癌転移は同じ保存された分子構造を用いるであろう。従って、本発明者らは、インビボで好中球、リンパ球とその他の白血球の運動性と管外遊出をブロックできる、ユビキチンに対する抗体が癌細胞の運動性と管外遊出をブロックし結果的に転移をブロックするかどうかを検証した。さらに、腫瘍におけるBMDSC/改変された細胞の融合の存在を測定することにより、幹細胞に基づく治療に潜在する意図しない結果に研究者の目を向けさせることができるだろう(すなわち、幹細胞の不適切な投与が実際に悪性腫瘍の発生率を高めている可能性がある)。
【0036】
慢性組織損傷とその後に起こる修復は組織幹細胞を消耗しBMDSCを補充する。従って、BMDSCと組織細胞との融合機会が増大する。その他の因子、たとえば、老化、ウイルス感染と組織リモデリングなども細胞融合の機会を増やす。重要なのは、一つの融合工程で、多くの「悪性」特徴を付与でき多数の突然変異を要することなく「改変された」細胞を形質転換できうることである。
【0037】
腫瘍細胞と非腫瘍細胞の融合および腫瘍原性に対する効果に関して何百という研究が行われたが、本発明以前には、骨髄由来の幹細胞と腫瘍細胞の融合に関する科学文献は知られていなかった。
【0038】
従って、本発明の第一の実施態様において、癌細胞の移動をモデリングする方法は、(a)骨髄由来の幹細胞を提供する工程、(b)遺伝的に改変された細胞を提供する工程、(c) 前記骨髄由来の幹細胞を前記遺伝的に改変された細胞と融合して、これにより融合細胞を形成する工程、(d) 前記融合細胞について移動の指標を測定する工程を含む。BMDSCと遺伝的に改変された細胞のどちらも商業的および学術的な組織培養と生体供給源から容易に得られる。同様に、細胞融合は通常行われており、利用可能な多くのプロトコルがある(たとえば、protocol-online.org.のハイブリドーマ・プロトコル参照)。前記融合細胞(とその子孫細胞)に関する移動の指標を測定するには、インビトロの「スクラッチ分析」(たとえば、Lal A, Glazer CA, Martinson HM, ら、Cancer Res 2002, 62:3335-3340)によりまたはインビボの動物実験(たとえば、以下の実施例で記載する一つまたは複数の融合細胞を含む腫瘍細胞を注入し、転移をモニタリングすること)により行うことができる。
【0039】
本発明はさらに、インビトロあるいはインビボのどちらかで腫瘍細胞の移動に対する生物学的または化学的物質の効果をスクリーニングする方法を含む。前記方法は骨髄由来の幹細胞の遺伝的に改変された細胞との融合に由来する融合細胞を提供し、前記融合細胞を生物学的または化学的物質と接触させ、腫瘍細胞の移動が促進されるか、抑制されるか、または無変化であるかどうかを測定する。移動に対する物質の効果をスクリーニングする特に優れた標的は保存タンパク質であろう。
【0040】
ユビキチン(ub)は自然界で発見された、最も保存されたタンパク質である。その76のアミノ酸配列のうち、昆虫、サケと人類のような進化が異なる種の間でも、完全に相同する。ユビキチンはいくつかの他の膜受体の外側表面ドメインの部分を修復する。リンパ球のホーミング受容体(LHR)のばあい、ubの存在はLHRの機能と密接に関連し、リンパ節によるリンパ球の結合と移動を促進する。ubと関連することが示されている全ての受容体は細胞運動を仲介することも知られている。これらの知見に対する可能な解釈として、ubが細胞外基質を通して細胞運動を仲介することに関連すると考えられる。ubのこの潜在的な機能は、たとえば、細胞分化、寄生虫感染、腫瘍浸潤と腫瘍細胞転移などの、多くの真核細胞の過程に対する研究において、重要な意義を持つ。
【0041】
従って、たとえば、前記生物学的または化学的物質はユビキチンに対する抗体、たとえば、MEL-14(CD62L)(Abcam Plc.,Zymed Laboratories らを介して入手可能。ユビキチンに対する21種の異なる抗体についてはabcam.com参照)である。以下の述べるように、この抗体と接触させた細胞はスクラッチ分析に供するか、動物実験に用いて前記抗体の細胞移動に対する効果を測定する。
【0042】
本発明の別の実施態様において、腫瘍細胞の移動を抑制する方法を記載し、この方法は有効量のユビキチンに対する抗体と腫瘍細胞を接触させることを含む。好ましくは、本実施態様は、より高い悪性度の腫瘍にこのような抑制を集中できるように前記抗体と腫瘍細胞を接触させる前に、腫瘍細胞の中に融合細胞が存在することを確認する工程を含む。
【0043】
腫瘍細胞標本の中に少なくとも四倍体DNAと骨髄由来の幹細胞に特異的な少なくとも一つの細胞表面マーカーを伴う細胞を含むかどうかを測定しうる。このような表面細胞マーカーはc-kit、CD34とCD133及びケモカイン受容体、たとえばCXCR4などを含む。また、骨髄由来の幹細胞と非幹細胞の融合を検出するためにCre/lox組換えの利用を含んでもよい。
【実施例】
【0044】
非制限的実施例
以下の実験で用いられる実験技術は確立されたもので広く一般に受け入れられている。
【0045】
第一の研究目的は、骨髄由来の幹細胞と形質転換された細胞の相互作用が腫瘍の進行を変えることができるという発癌に関する以前に提案した仮説を検証することである。二つのタイプの実験を行うことができる。一組目の実験において、遺伝子組み換えによりeGFPを発現するようになったマウスからマウス骨髄に由来する細胞を単離して、ハイブリッド細胞の形成を促進する条件化でクロンテック(Clontech)の赤色蛍光タンパク質で標識した一過性にトランスフェクションしたヒトまたはマウスの形質転換細胞と結合する。その後、これらのハイブリッド細胞を調べる細胞系に適したマウスの系統に注射する。
【0046】
原発性または転移性腫瘍成長の変化を時間の関数としてモニターする。この実験が解決しようとする二つの基本的な課題は、骨髄由来の幹細胞を形質転換の様々な段階の腫瘍細胞と融合することにより腫瘍の進行を調節するかどうかと、受容体に対する抗体でヒトまたはマウスの異種移植物を処理すると異種移植腫瘍の転移表現型が変わるかどうかということである。これらの仮説を検証するためのモデルとして働く代表的な受容体は、転移腫瘍細胞によって発現されるCXCR4である。
【0047】
乳癌、皮膚癌および前立腺癌用に確立されたモデル系、形質転換されたマウス(308、308 10Gy5、または4T1)とヒト(DU145またはPC-3M)細胞系の投与に対する宿主免疫反応を最小にするために、無胸腺ヌード、Balb/cまたはSCIDマウスにおける腫瘍成長および進行の確立された異種移植モデルを使用しなければならない。皮下接種または尾静脈注射を用いてマウス細胞系を無胸腺ヌードマウスに投与する。ヒト細胞系はSCIDマウスに投与する。細胞系を含有するアリコートを、単独で、または組み合わせて注射し、この日を第0日として、腫瘍の成長を最長40日間観察する。その後、マウスを死亡させ、組織を取り出し腫瘍の大きさと肺の転移の相対レベルを定量する。
【0048】
実験1
A群:8匹の遺伝子導入マウス
【0049】
ヘテロ接合遺伝子導入のeGFPマウス[C57BL/6-TgN(ACTbEGFP)1Osb] (ジャクソン・ラボラトリー(Jackson Laboratory))をGFPで標識した骨髄細胞の供給源として用いる。GFPマウスは緑色蛍光の発現により紫外線下で同定する。2〜4ヶ月齢雌性ヘテロ接合体をBMTのドナーとして用いる。ドナーの性別はレシピエント宿主の性別とは異なる。
【0050】
骨髄由来の細胞は、ヘテロ接合GFPマウスからハンクス(Hank)の平衡液でこのマウスの大腿骨と脛骨を洗い流すことにより得られる。体細胞ハイブリッドを生じさせるために、ポリエチレン・グリコール(PEG)処理を行う24時間前に、106の骨髄由来の細胞と106の腫瘍細胞を60mmの培養皿に配置する。分子量3000-3700のPEG5gを121℃で5分間高圧蒸気殺菌して調製する。前記殺菌PEGを次いで37℃に加温しておいた2X血清不含培養液5mlと組合せて50%溶液を調製する。次に、一皿当たり1mlの50%PEG溶液を共培養した細胞に徐々に添加し、前記細胞を37℃で一分間インキュベーションする。
【0051】
次に、血清不含培養液を1ml添加し、さらに1分間インキュベーションを続ける。更に2mlの培養液を添加し、2分間インキュベーションを続ける。その後、血清不含培養液を4ml添加し、4分間インキュベーションを続ける。その後、血清を含む培養液を各プレートに添加し、37℃で48時間インキュベーションを続ける。二日後、各皿をトリプシンを用いて継代し、選択するために四枚の100mm培養プレートに再配置する。共培養した細胞の両方の型の特徴を示す細胞発現マーカーを選び出して、90%の成長密度まで培養して、以下の実験に用いる。
【0052】
実験2:ネズミおよびヒトの良性腫瘍細胞の改変された腫瘍原性と進行
GFPで標識した骨髄細胞を単独で、または形質転換された良性ヒトもしくはマウス細胞と組み合わせてマウスに接種する。
【0053】
A群:72匹のマウス。株:308細胞用の無胸腺ヌードマウス;DU145またはPC-3M腫瘍用のSCID(疼痛カテゴリーD)。必要とされるマウスの総数:(4匹/処理)(6処理)(3回の実験)=72匹
【0054】
GFPで標識された骨髄(BM)由来の細胞、および/または形質転換された良性ヒトもしくはマウス細胞をマウスに接種する。腫瘍接種はベル型広口瓶内でイソフルランを用いて麻酔したマウスに行う。前記マウスは、ポリプロピレン製遠心チューブ内のイソフルランで処理した綿ボールを含む前記瓶内に配置する。接種中、マウスの呼吸数、動き、筋弛緩および方向性のある動きの欠如(lack of directed movement)を観察することによりモニターする。接種後、マウスをケージに戻し、正常な意識が戻るまでモニターする。
【0055】
マウスごとに、5X105の細胞を含む100μlのPBSを投与する。無胸腺ヌードマウスに308細胞、BM細胞、あるいはBM細胞及び308細胞のPEG処理混合物を接種する。SCIDマウスに、DU145細胞、BM細胞あるいはBM細胞及びDU145細胞のPEG処理混合物を接種する。皮下的にまたは尾静脈の注射で接種を行う。マウスに尾静脈感染させるとき、これらマウスを拘束ボックスの中に閉じ込める。アルコールで尾部を消毒した後、2%キシロカインで局所麻酔する。マウスごとに、25-30ゲージの注射針を用い200μl以下の溶液を注射する。注射で壊死が生じたばあい、尾部に塩化エチルを噴霧し、ベタジン(betadine)に浸漬し、滅菌したはさみで壊死領域のすぐ上の組織を取り除く。前記尾部を硝酸銀で焼灼して止血する。
【0056】
腫瘍の成長を週に二回、ノギスで腫瘍の大きさを測定してモニターし、以下の式を用いて腫瘍の体積を計算する。体積=+1/2(縦)(横2)。第2、3、4週に、それぞれマウスを死亡させ、転移の程度と生じた腫瘍の体積をモニターする。
【0057】
密閉チャンバーで二酸化炭素を使ってマウスを窒息死させ、腫瘍と器官を採取する。これはマウスを安楽死させる常用方法で、その苦痛を最小限にすることができ、AVMA安楽死パネル(AVMA Panel on Euthanasia)により推薦されている方法である。
実験手順の概要概略
【0058】
1.皮下または尾静脈注射により良性の形質転換された細胞と幹細胞の混合物を投与して、308とDU145の異種移植を確立する。
【0059】
2.注射の各方法の処理群−(6):308細胞;BM細胞;BM細胞+308 細胞のPEG処理混合物;DU145;BM細胞、PEG処理されたDU145とBM細胞の混合物。
【0060】
3. CO2でマウスを窒息死させた後、発達した転移を伴う原発性腫瘍と器官を取り出す。
【0061】
4.腫瘍標本を病理組織学的分析に送り、融合事象と関連して転移する能力または進行の変化を検出する。前記病理組織学的分析は、腫瘍成長と時間の比較、転移の相対数及び大きさ、腫瘍の組織学的特徴が含まれるべきである。
【0062】
実験3:腫瘍原性または進行の抑制
マウスに転移性形質転換ヒト(PC3-M)またはマウス(308 10Gy5または4T1)細胞と、CXCR4受容体の抑制剤とを接種する。必要とされるマウス総数: (4匹/処理) (3処理) (3投与時点) (3実験) = 108匹。
【0063】
腫瘍接種はベル型広口瓶内でイソフルランを用いて麻酔したマウスに行う。前記マウスは、ポリプロピレン製遠心チューブ内のイソフルランで処理した綿ボールを含む前記瓶内に配置する。接種中、マウスの呼吸数、動き、筋弛緩および方向性のある動きの欠如を観察することによりモニターする。接種後、マウスをケージに戻し、正常な意識が戻るまでモニターする。
【0064】
4匹のBalb/cマウスの乳腺脂肪体に104の4T1細胞を含むPBS100μlを注射により投与する。無胸腺ヌードマウスに1X106の308 10Gy5細胞を含むPBS100μlを注射する。SCIDマウスに1X106のPC-3M細胞を含むPBS100μlを注射する。腫瘍細胞接種前、接種時と接種後にそれぞれマウスにCRCX4受容体に対する抗体を投与することにより実験を行う。4T1細胞はBalb/cマウスの乳腺脂肪体に注射する。308 10Gy5細胞をヌードマウスの尾静脈に注射し、PC-3M細胞をSCIDマウスの尾静脈に注射する。尾静脈注射を受けるマウスは、拘束ボックスの中に閉じ込める。アルコールで尾部に消毒を施し、2%キシロカインを適用して局所麻酔し、マウスごとに、25-30ゲージの注射針を用い200μl以下の溶液を注射する。注射で壊死が生じたばあい、尾部に塩化エチルを噴霧し、ベタジンに浸漬し、滅菌したはさみで壊死領域のすぐ上の組織を取り除く。次に、前記尾部を硝酸銀で焼灼して止血する。
【0065】
腫瘍の成長を週に二回、ノギスで腫瘍の大きさを測定してモニターし、以下の式を用いて腫瘍の体積を計算する。体積=1/2(縦)(横2)。第10、15、20日目に、それぞれマウスを死亡させ、肺転移と腫瘍の体積をモニターする。
【0066】
転移の抑制剤候補を接種する前後で、動物をモニターして、腫瘍細胞のアポトーシス、分化と転移の抑制における変化を分析する。
【0067】
CO2でマウスを窒息死させた後、宿主マウスにおいて発達した原発性腫瘍と転移を取り出す。
【0068】
組織標本を病理組織学的分析に送り、処置と関連する転移または進行の変化を検出する。前記病理組織学的分析は、腫瘍成長と時間の比較、転移の相対数及び大きさ、腫瘍組織の組織学的特徴が含まれるべきである。
【0069】
インビトロの癌細胞/融合細胞の移動抑制分析
細胞:二つの転移性癌細胞系を使って、ユビキチン抗体の細胞運動を抑制する能力を調べた。PC-3Mはヒト前立腺癌細胞系である。4T1はマウス乳癌細胞系である。両細胞系は10%FBSとグルタマックス(Glutamax)1を添加したDMEM培養液(以下、DMEM培養液)で維持した。
【0070】
抗体:三つのユビキチン抗体を用いた。14372はユビキチンに対するポリクローナル抗体である。10C2-2とMel-14は共にユビキチンに対するモノクローナル抗体である。
【0071】
手順(1):各穴に滅菌したカバースリップを含む六穴プレートに、各穴当たりDMEM培養液中の1x106の細胞を播種し、37℃で5% CO2の加湿したインキュベーターで一晩培養した(標準条件)。
【0072】
次の日、ピペットの先端で前記カバースリップ上に生えた単層細胞を一度引っ掻いて削った。培養液を吸い取って、前記穴を1mLのDMEM培養液で洗浄した。各細胞系は、三つの異なる濃度の各抗体で処理した:5μg/mL/106 細胞、25μg/mL/106 細胞と100μg/mL/106細胞。前記プレートを細胞と共に11時間インキュベーションした。対照となる細胞は、DPBSで処理した。
【0073】
インキュベーション終了後、前記カバースリップの削った部分の閉鎖状況を分析して、細胞移動の結果とした。次に、前記カバースリップを1:1のメチルアルコール:アセトンを用い-20℃で5分間処理して、固定し染色した後、DPBSで洗浄をした。カバースリップをスライド・ガラスにのせた。ニコン(Nikon)TE2000の顕微鏡からなるワークステーションを使って4倍に拡大して、メタコム(Metacam)というソフトで画像を取り込んだ。
【0074】
インビボの癌細胞/融合細胞転移抑制分析
細胞:マウス転移性乳癌細胞系、4T1を使用しユビキチン抗体の転移を抑制する能力を調べた。前記細胞はDMEM培養液中に、前述のプロトコルに記載した培養条件に従って維持した。
【0075】
抗体:モノクローナル・ユビキチン抗体、Mel-14を分析に使用した。
【0076】
手順:強化緑色蛍光タンパク質(EGFP)用の発現ベクターを使って4T1細胞を一過的にトランスフェクションした。トランスフェクションから48時間後に細胞を集めて、DPBS中180μg/106細胞の濃度でユビキチン抗体、Mel-14か、対照抗体、ラット(Rat)IgG2Aのどちらかと共に1時間インキュベーションした。インキュベーション後、尾静脈を通して250,000の細胞をSCIDマウスに総量50μlで注射した 。一週間後、マウスを死亡させ、肺を取り出し、4%ホルマリンで固定した。ニコン・エクリプス(Nikon Eclipse)600顕微鏡で10倍拡大して、肺全体を平らにし転移性コロニーの存在を検査した。前記肺にEGFP陽性細胞が存在することで、転移が起こったことが示された。
【0077】
結果
【表2】

【表3】

【表4】

【0078】
参考文献:
1. Auerbach R, Lewis R, Shinners B, Kubal L, Akhtar N. 「血管形成分析:重要概説(Angiogenesis Assays: A Critical Overview)」 Clinical Chemistry 49 (1), 1 Jan. 2003:32-40.
【0079】
上の表に示されるように、ユビキチンに対する抗体は腫瘍細胞の移動を抑制した。
【産業上の利用可能性】
【0080】
治療方法
本発明の方法は、対象における腫瘍の移動を抑制するのに用いることができる。脊椎動物の対象、好ましくは哺乳動物、より好ましくはヒトに、腫瘍細胞の移動を抑制するのに有効な量の合成物(compound)を投与する。前記合成物または医薬的に許容しうるその塩は好ましくは医薬組成物の形態で投与される。
【0081】
前記合成物の用量は好ましくは有効量の抗体または他の物質を含有する医薬投薬単位を含む。有効量とはインビボで安定した状態の濃度を達成するのに十分な量を意味し、疾患の関連パラメーターにおいて測定可能な低下をもたらす。
【0082】
モノクローナル抗体は患者に直接注入する治療に現在日常的に用いられている。前記抗体は凍結乾燥し水か生理食塩水のどちらかで戻すまで保存できる。抗体に基づく治療では、4mg/kg体重という用量はヒトにとって典型的で安全な投薬量である。たとえば、これは乳癌抗体治療薬ハーセプチンの有効用量である。従って、本発明の一実施態様において、患者に体重当たり4mgの抗ユビキチン抗体が静脈を通して患者に投薬される。
【0083】
投与される活性合成物の量は適切な生物学的または化学的物質、疾患または状態、投与経路、レシピエントの健康状態と体重、もしあれば、他の同時に行われる治療の存在、治療頻度、所望される効果の性状、たとえば、腫瘍転移の抑制、および経験のある医師の判断に依存する。
【0084】
前述の組成物と治療方法は、有害な細胞浸潤、増殖、転移に関連するいかなる疾患または状態の患者において細胞の移動(たとえば、浸潤または転移)を抑制するのに役立つ。
【0085】
添付の特許請求の範囲と均等な範囲と意義内で、種々の改変を行うことができる。
【図面の簡単な説明】
【0086】
【図1】図1は骨髄由来の幹細胞と「改変された」組織細胞との融合が仲介する悪性形質転換の略図である。
【特許請求の範囲】
【請求項1】
ヒトを除く対象において、腫瘍細胞の移動を抑制する方法であって、
腫瘍の腫瘍細胞を有効量のユビキチンに対する抗体と接触させることを含む、前記方法。
【請求項2】
前記接触させる工程前に、前記腫瘍の中の融合細胞の存在を確認する工程をさらに含む、請求項1記載の方法。
【請求項3】
前記抗体はMEL-14を含む、請求項1記載の方法。
【請求項4】
前記抗体は抗体14372および抗体10C2-2から成る群より選択される、請求項1記載の方法。
【請求項5】
インビトロで、腫瘍細胞の移動を抑制する方法であって、
腫瘍の腫瘍細胞を有効量のユビキチンに対する抗体と接触させることを含む、前記方法。
【請求項6】
前記接触させる工程前に、前記腫瘍の中の融合細胞の存在を確認する工程をさらに含む、請求項5記載の方法。
【請求項7】
前記抗体はMEL-14を含む、請求項5記載の方法。
【請求項8】
前記抗体は抗体14372および抗体10C2-2から成る群より選択される、請求項5記載の方法。
【請求項9】
ユビキチンに対する抗体を含む腫瘍細胞の移動を抑制するための薬剤。
【請求項10】
前記抗体はMEL-14を含む、請求項9記載の薬剤。
【請求項11】
前記抗体は抗体14372および抗体10C2-2から成る群より選択される、請求項9記載の薬剤。
【請求項1】
ヒトを除く対象において、腫瘍細胞の移動を抑制する方法であって、
腫瘍の腫瘍細胞を有効量のユビキチンに対する抗体と接触させることを含む、前記方法。
【請求項2】
前記接触させる工程前に、前記腫瘍の中の融合細胞の存在を確認する工程をさらに含む、請求項1記載の方法。
【請求項3】
前記抗体はMEL-14を含む、請求項1記載の方法。
【請求項4】
前記抗体は抗体14372および抗体10C2-2から成る群より選択される、請求項1記載の方法。
【請求項5】
インビトロで、腫瘍細胞の移動を抑制する方法であって、
腫瘍の腫瘍細胞を有効量のユビキチンに対する抗体と接触させることを含む、前記方法。
【請求項6】
前記接触させる工程前に、前記腫瘍の中の融合細胞の存在を確認する工程をさらに含む、請求項5記載の方法。
【請求項7】
前記抗体はMEL-14を含む、請求項5記載の方法。
【請求項8】
前記抗体は抗体14372および抗体10C2-2から成る群より選択される、請求項5記載の方法。
【請求項9】
ユビキチンに対する抗体を含む腫瘍細胞の移動を抑制するための薬剤。
【請求項10】
前記抗体はMEL-14を含む、請求項9記載の薬剤。
【請求項11】
前記抗体は抗体14372および抗体10C2-2から成る群より選択される、請求項9記載の薬剤。
【図1】




【公開番号】特開2011−225613(P2011−225613A)
【公開日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願番号】特願2011−170717(P2011−170717)
【出願日】平成23年8月4日(2011.8.4)
【分割の表示】特願2008−528229(P2008−528229)の分割
【原出願日】平成18年8月25日(2006.8.25)
【出願人】(506120806)アリゾナ ボード オブ リージェンツ オン ビハーフ ザ ユニバーシティー オブ アリゾナ (3)
【氏名又は名称原語表記】ARIZONA BOARD OF REGENTS on behalf of THE UNIVERSITY OF ARIZONA
【住所又は居所原語表記】Room 204, 888 North Euclid Avenue, Tucson, AZ 85721 (US)
【Fターム(参考)】
【公開日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願日】平成23年8月4日(2011.8.4)
【分割の表示】特願2008−528229(P2008−528229)の分割
【原出願日】平成18年8月25日(2006.8.25)
【出願人】(506120806)アリゾナ ボード オブ リージェンツ オン ビハーフ ザ ユニバーシティー オブ アリゾナ (3)
【氏名又は名称原語表記】ARIZONA BOARD OF REGENTS on behalf of THE UNIVERSITY OF ARIZONA
【住所又は居所原語表記】Room 204, 888 North Euclid Avenue, Tucson, AZ 85721 (US)
【Fターム(参考)】
[ Back to top ]

