腫瘍血管新生阻害剤
【課題】 抗腫瘍剤として有用な物質及びそのスクリーニング方法等を提供する。
【解決手段】 TMEM176Bの発現または機能を抑制する物質、具体的には、TMEM176Bをコードする遺伝子の転写産物に対するアンチセンス核酸、リボザイム核酸もしくはRNAi活性を有する核酸、又はTMEM176Bと結合する抗体等を有効成分として含有する、抗腫瘍剤、詳しくは血管新生阻害剤;及び、TMEM176Bをコードする遺伝子もしくはTMEM176Bの発現量を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法。
【解決手段】 TMEM176Bの発現または機能を抑制する物質、具体的には、TMEM176Bをコードする遺伝子の転写産物に対するアンチセンス核酸、リボザイム核酸もしくはRNAi活性を有する核酸、又はTMEM176Bと結合する抗体等を有効成分として含有する、抗腫瘍剤、詳しくは血管新生阻害剤;及び、TMEM176Bをコードする遺伝子もしくはTMEM176Bの発現量を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血管新生阻害剤、詳しくは、腫瘍血管内皮細胞の遊走を抑制する活性を有し、癌治療薬・予防薬等の医薬として有用な物質およびそのスクリーニング方法等に関する。
【背景技術】
【0002】
腫瘍の治療法として現在広く用いられているものの多くは、化学療法であれ、放射線療法であれ、腫瘍細胞の増殖を抑制するものがほとんどである。従って、正常細胞に影響を与えることなく腫瘍細胞選択的に増殖を抑制することが非常に重要であるが、腫瘍細胞に選択的に作用する薬剤でも、腫瘍細胞が他の正常な細胞に比べてはるかに活発に分裂、増殖を繰り返しているという性状に依存するところが大きい。
一方、血管新生は細胞増殖に不可欠であり、悪性腫瘍が増殖する際にも、腫瘍細胞は、増殖に必要な栄養や酸素を得るために自ら血管新生促進物質を産生し、血管新生を誘導する。また、悪性腫瘍が他の臓器や部位へ転移する場合も血管新生が誘導され、腫瘍細胞は血流にのって移動する。そこで、固形腫瘍の増殖を抑制するために、腫瘍細胞への栄養ならびに酸素の供給源である血管新生を断つという治療が提唱されてきた。すなわち腫瘍細胞そのものを攻撃することなく腫瘍細胞を栄養や酸素の枯渇状態に陥れ、結果として腫瘍細胞の増殖抑制、そして退縮という治療効果をあげるというものである。
この手法の具体的な標的として、腫瘍に到達している腫瘍血管があげられている。癌細胞を含む腫瘍は1〜2mm3程度の大きさになると血管新生促進物質を産生し、当該細胞自身の増殖に要する栄養と酸素とを摂取し、代謝老廃物を運び去るためのシステムを自ら構築するようになる。このシステムにより、当該細胞の初期成長が促進される。そのため、血管新生の抑制による腫瘍細胞の増殖・転移抑制が癌治療に有効であると考えられ、血管新生阻害活性を有する物質に関する研究が行われた。
これまで、血管新生阻害剤の研究は、血管内皮細胞株、正常血管内皮細胞を用いて行われてきたが、最近、腫瘍血管と正常血管の性状は極めて異なることが明らかになってきた(非特許文献1を参照)。例えば、正常血管は動脈、静脈、毛細血管が秩序を持った階層構造をとっているのに対し、腫瘍血管は無秩序な走行をしている。また腫瘍血管内皮細胞同士の関係(接着など)は正常血管内皮細胞に比べて疎であり、周皮細胞も少ないため血管の透過性が亢進している。このように腫瘍血管は正常血管に比べて未熟な血管であるといえる。すなわち、癌治療薬として理想的な血管新生阻害剤の標的を発見するには、従来の正常血管内皮細胞を用いた方法では不十分であると言わざるを得ない。そこで、本発明者らは、理想的な血管新生阻害剤の標的因子の探索のため、腫瘍血管内皮細胞の分離培養技術を確立した。
一方、Transmembrane protein 176B(TMEM176B)は、別名LR8またはClast1ともよばれる4つの推定膜貫通領域をもつ蛋白質である。マウスにおいては小脳の発達に、ラットにおいては樹状細胞の成熟化に関与していることがそれぞれ報告されている(非特許文献2及び3を参照)。
しかしながら、その生理的な機能は不明であり、TMEM176Bが腫瘍血管内皮細胞に高発現していることも、TMEM176Bの発現または機能を抑制することによって腫瘍血管内皮細胞の遊走が抑制されることも知られていなかった。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】樋田京子ら著、細胞、第40巻、第12号、第18頁(2008年)
【非特許文献2】Yukiteru Maedaら、Brain Research、第1104巻、第1号、第18-26頁 (2006年)
【非特許文献3】Condamine Tら、J Leukoc Biol.、第88巻、第3号、第507-515項(2010年)
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明が解決しようとする課題は、血管新生阻害剤、詳しくは、腫瘍血管内皮細胞の遊走を抑制する活性を有し、癌治療薬・予防薬等の医薬として有用な物質およびそのスクリーニング方法を提供することにある。
【課題を解決するための手段】
【0005】
本願発明者らは、腫瘍血管新生阻害活性を有する物質を探索するために、腫瘍血管内皮細胞の分離培養を行い、鋭意検討を行った結果、腫瘍血管内皮細胞の遊走に関与する因子の単離および当該因子の発現または機能を抑制する物質の単離に成功した。
すなわち、本発明者らは、正常血管内皮細胞と比較して腫瘍血管内皮細胞において高発現する因子として、TMEM176Bを見出し、更には、TMEM176Bの発現を阻害するsiRNAが腫瘍血管内皮細胞に対して遊走抑制活性を示すことを見出した。本発明は上記の知見をもとに完成するに至ったものである。
即ち本発明は、
〔1〕 TMEM176Bの発現または機能を抑制する物質を有効成分として含有する、抗腫瘍剤;
〔2〕 物質が、TMEM176Bの発現を抑制する、以下の(1)〜(3)からなる群より選択される物質である、〔1〕に記載の剤:
(1)TMEM176Bをコードする遺伝子の転写産物に対するアンチセンス核酸、
(2)TMEM176Bをコードする遺伝子の転写産物に対するリボザイム核酸、及び
(3)TMEM176Bをコードする遺伝子の転写産物に対してRNAi活性を有する核酸もしくはその前駆体;
〔3〕 物質が、TMEM176Bと結合する抗体である、〔1〕に記載の剤;
〔4〕 TMEM176Bが、以下の(a)〜(e)から選択されるいずれかのアミノ酸配列からなるタンパク質である、〔1〕〜〔3〕のいずれかに記載の剤:
(a)配列番号:2、4、6または8で示されるアミノ酸配列、
(b)配列番号:2、4、6または8で示されるアミノ酸配列において、1もしくは複数のアミノ酸が欠失、付加、挿入もしくは置換され、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(c)配列番号:2、4、6または8で示されるアミノ酸配列と60%以上の配列同一性を有し、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(d)配列番号:1、3、5または7で示される塩基配列を有するDNAによりコードされるアミノ酸配列、及び
(e)配列番号:1、3、5または7で示される塩基配列を有するDNAに対し相補性を有するDNAと、ストリンジェントな条件下でハイブリダイズするDNAによりコードされ、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列;
〔5〕 血管新生阻害剤である、〔1〕〜〔4〕のいずれかに記載の剤;
〔6〕 腫瘍血管新生阻害剤である、〔5〕に記載の剤;
〔7〕 腫瘍血管内皮細胞遊走抑制剤である、〔1〕〜〔6〕のいずれかに記載の剤;
〔8〕 TMEM176Bの発現量を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法;
〔9〕 以下の(1)〜(3)の工程を含む、〔8〕に記載のスクリーニング方法:
(1)TMEM176Bをコードする遺伝子もしくは該遺伝子の転写調節領域の制御下にあるレポータータンパク質をコードする核酸を含む細胞に、被検物質を接触させる工程、
(2)前記細胞におけるTMEM176Bもしくはレポータータンパク質の発現量を測定する工程、および
(3)被検物質の非存在下において測定した場合と比較して、発現量を低下させる化合物を血管新生阻害剤の候補として選択する工程;
〔10〕 TMEM176Bをコードする遺伝子の発現量を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法;
〔11〕 TMEM176Bの機能を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法;
〔12〕 癌を発症する危険性があるか否か、あるいは、癌に罹患しているか否かを判定する方法であって、以下の(1)および(2)の工程を含む方法:
(1)被験動物より採取した試料中の、TMEM176Bをコードする遺伝子もしくはTMEM176Bの発現量、またはTMEM176Bの機能を測定する工程、
(2)正常動物由来の試料において測定した場合と比較して、前記発現量もしくは機能が上昇している被験動物を、癌を発症する危険性があるか、癌に罹患していると判定する工程;
〔13〕 以下の群:
(1)配列番号:29〜43で示される塩基配列、及び
(2)配列番号:29〜43で示される塩基配列の3’末端に2〜4塩基が付加された塩基配列、
から選択されるいずれかの塩基配列からなるオリゴヌクレオチド;
〔14〕 二重鎖RNA部分が、配列番号:29〜43から選択されるいずれかの配列番号で示される塩基配列からなる、siRNA;
〔15〕 3’末端に2〜4塩基のオーバーハングが付加されていることを特徴とする、〔14〕に記載のsiRNA;
〔16〕 少なくとも1つの塩基が化学的に修飾されている〔14〕または〔15〕に記載のsiRNA;
〔17〕 少なくとも1つのホスホジエステル結合が化学的に修飾されている〔14〕〜〔16〕のいずれかに記載のsiRNA;
〔18〕 〔14〕〜〔17〕のいずれかに記載のsiRNAを有効成分として含有する抗腫瘍剤;
〔19〕 TMEM176Bの発現または機能を抑制する物質を有効成分として含有する、血管新生阻害剤;
〔20〕 物質が、TMEM176Bの発現を抑制する、以下の(1)〜(3)からなる群より選択される物質である、〔19〕に記載の剤:
(1)TMEM176Bをコードする遺伝子の転写産物に対するアンチセンス核酸、
(2)TMEM176Bをコードする遺伝子の転写産物に対するリボザイム核酸、及び
(3)TMEM176Bをコードする遺伝子の転写産物に対してRNAi活性を有する核酸もしくはその前駆体;
〔21〕 物質が、TMEM176Bと結合する抗体である、〔19〕に記載の剤;
〔22〕 TMEM176Bが、以下の(a)〜(e)から選択されるアミノ酸配列からなるタンパク質である、〔19〕〜〔21〕のいずれかに記載の剤:
(a)配列番号:2、4、6または8で示されるアミノ酸配列、
(b)配列番号:2、4、6または8で示されるアミノ酸配列において、1もしくは複数のアミノ酸が欠失、付加、挿入もしくは置換され、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(c)配列番号:2、4、6または8で示されるアミノ酸配列と60%以上の配列同一性を有し、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(d)配列番号:1、3、5または7で示される塩基配列を有するDNAによりコードされるアミノ酸配列、
(e)配列番号:1、3、5または7で示される塩基配列を有するDNAに対し相補性を有するDNAと、ストリンジェントな条件下でハイブリダイズするDNAによりコードされ、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ
酸配列;
〔23〕 〔14〕〜〔17〕のいずれかに記載のsiRNAを有効成分として含有する血管新生阻害剤;
に関する。
【発明の効果】
【0006】
本発明により、血管新生阻害剤、詳しくは、腫瘍血管内皮細胞の遊走を抑制する活性を有し、癌治療薬・予防薬等の医薬として有用な物質およびそのスクリーニング方法等を提供することが可能になった。
【図面の簡単な説明】
【0007】
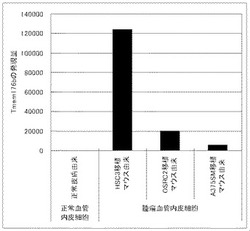
【図1】マウス初代腫瘍血管内皮細胞およびマウス初代正常血管内皮細胞でのマウスTMEM176Bの発現量を比較した結果を示す図である。縦軸は、TMEM176BのmRNAの発現量(Quantity値)を示す。正常血管内皮細胞は、正常マウスの皮膚組織から採取した血管内皮細胞を用いた。また、腫瘍血管内皮細胞としては、HSC3(ヒト舌癌細胞)、OSRC2(ヒト腎癌細胞)、A375SM(ヒト高転移性のメラノーマ細胞)をそれぞれ移植したマウスの腫瘍組織より採取した血管内皮細胞を用いた。マウスTMEM176Bの発現は、マウス初代正常血管内皮細胞と比較して、マウス初代腫瘍血管内皮細胞で顕著に高いことが示された。
【発明を実施するための形態】
【0008】
本発明は、TMEM176Bの発現を抑制する物質または機能を抑制する物質を含有してなる、血管新生阻害剤、詳しくは腫瘍血管内皮細胞遊走抑制剤を提供する。
I. TMEM176BまたはこれをコードするTMEM176B遺伝子
本明細書において、TMEM176Bは公知のタンパク質であり、Genbank Accession No.: NP_001094781、NP_001094782、NP_054739、またはNP_001094784として知られている、配列番号:2、4、6または8で表されるヒトTMEM176Bのアミノ酸配列またはこれと実質的に同一のアミノ酸配列を含むタンパク質である。本明細書において、タンパク質およびペプチドは、ペプチド標記の慣例に従って左端がN末端(アミノ末端)、右端がC末端(カルボキシル末端)で記載される。
本明細書において、TMEM176Bはヒトや他の温血動物(例えば、モルモット、ラット、マウス、ニワトリ、ウサギ、イヌ、ブタ、ヒツジ、ウシ、サルなど)の細胞[例えば、ヒト肺線維芽細胞、マウス顆粒細胞など]もしくはそれらの細胞が由来するあらゆる組織[例えば、肺、脳など]または生体内で発現している組織[例えば、胸腺、心臓、肝臓、腎臓、大腸など]等から、公知のタンパク質分離精製技術により単離・精製されるものであってよい。
【0009】
「配列番号:2、4、6または8で表されるアミノ酸配列またはこれと実質的に同一のアミノ酸配列」としては、以下の(a)〜(e)が挙げられる:
(a)配列番号:2、4、6または8で示されるアミノ酸配列;
(b) 配列番号:2、4、6または8で示されるアミノ酸配列において、1もしくは複数のアミノ酸が欠失、付加、挿入もしくは置換され、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列;
(c)配列番号:2、4、6または8で示されるアミノ酸配列と60%以上の相同性を有し、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列;
(d)配列番号:1、3、5または7で示される塩基配列を有するDNAによりコードされるアミノ酸配列;又は、
(e)配列番号:1、3、5または7で示される塩基配列を有するDNAに対し相補性を有するDNAとストリンジェントな条件下でハイブリダイズするDNAによりコードされ、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列。
具体的には、配列番号:2、4、6または8で表されるアミノ酸配列からなるヒトタンパク質の他の哺乳動物におけるオルソログのアミノ酸配列、または配列番号:2、4、6または8で表されるアミノ酸配列からなるヒトタンパク質もしくはそのオルソログのスプライスバリアント、アレル変異体もしくは多型バリアントにおけるアミノ酸配列が挙げられる。
ここで「相同性」とは、当該技術分野において公知の数学的アルゴリズムを用いて2つのアミノ酸配列をアラインさせた場合の、最適なアラインメント(好ましくは、該アルゴリズムは最適なアラインメントのために配列の一方もしくは両方へのギャップの導入を考慮し得るものである)における、オーバーラップする全アミノ酸残基に対する同一アミノ酸および類似アミノ酸残基の割合(%)を意味する。「類似アミノ酸」とは物理化学的性質において類似したアミノ酸を意味し、例えば、芳香族アミノ酸(Phe、Trp、Tyr)、脂肪族アミノ酸(Ala、Leu、Ile、Val)、極性アミノ酸(Gln、Asn)、塩基性アミノ酸(Lys、Arg、His)、酸性アミノ酸(Glu、Asp)、水酸基を有するアミノ酸(Ser、Thr)、側鎖の小さいアミノ酸(Gly、Ala、Ser、Thr、Met)などの同じグループに分類されるアミノ酸が挙げられる。このような類似アミノ酸による置換はタンパク質の表現型に変化をもたらさない(即ち、保存的アミノ酸置換である)ことが予測される。保存的アミノ酸置換の具体例は当該技術分野で周知であり、種々の文献に記載されている(例えば、Bowieら,Science, 247: 1306-1310 (1990)を参照)。
【0010】
本明細書におけるアミノ酸配列の相同性は、相同性計算アルゴリズムNCBI BLAST(National Center for Biotechnology Information Basic Local Alignment Search Tool)を用い、以下の条件(期待値=10;ギャップを許す;マトリクス=BLOSUM62;フィルタリング=OFF)にて計算することができる。アミノ酸配列の相同性を決定するための他のアルゴリズムとしては、例えば、Karlinら, Proc. Natl. Acad. Sci. USA, 90: 5873-5877 (1993)に記載のアルゴリズム[該アルゴリズムはNBLASTおよびXBLASTプログラム(version 2.0)に組み込まれている(Altschulら, Nucleic Acids Res., 25: 3389-3402 (1997))]、Needlemanら, J. Mol. Biol., 48: 444-453 (1970)に記載のアルゴリズム[該アルゴリズムはGCGソフトウェアパッケージ中のGAPプログラムに組み込まれている]、MyersおよびMiller, CABIOS, 4: 11-17 (1988)に記載のアルゴリズム[該アルゴリズムはCGC配列アラインメントソフトウェアパッケージの一部であるALIGNプログラム(version 2.0)に組み込まれている]、Pearsonら, Proc. Natl. Acad. Sci. USA, 85: 2444-2448 (1988)に記載のアルゴリズム[該アルゴリズムはGCGソフトウェアパッケージ中のFASTAプログラムに組み込まれている]等が挙げられ、それらも同様に好ましく用いられ得る。
【0011】
上記(e)におけるストリンジェントな条件とは、例えば、Current Protocols in Molecular Biology, John Wiley & Sons,6.3.1-6.3.6, 1999に記載される条件、例えば、6×SSC(sodium chloride/sodium citrate)/45℃でのハイブリダイゼーション、次いで0.2×SSC/0.1% SDS/50〜65℃での一回以上の洗浄等が挙げられるが、当業者であれば、これと同等のストリンジェンシーを与えるハイブリダイゼーションの条件を適宜選択することができる。
【0012】
より好ましくは、「配列番号:2、4、6または8で表されるアミノ酸配列と実質的に同一のアミノ酸配列」として、配列番号:2、4、6または8で表されるアミノ酸配列と、約60%以上、好ましくは約90%以上、より好ましくは約95%以上、いっそう好ましくは約97%以上、特に好ましくは約98%以上、最も好ましくは約99%以上の同一性を有するアミノ酸配列が挙げられる。
【0013】
「配列番号:2、4、6または8で表されるアミノ酸配列と実質的に同一のアミノ酸配列を含むタンパク質」は、配列番号:2、4、6または8で表されるアミノ酸配列と実質的に同一のアミノ酸配列を含み、かつ配列番号:2、4、6または8で表されるアミノ酸配列からなるタンパク質と実質的に同質の機能を有するタンパク質である。
ここで「実質的に同質の機能」とは、例えば生理学的に、あるいは薬理学的にみて、その性質が定性的に同じであることを意味し、機能の程度(例、約0.1〜約10倍、好ましくは0.5〜2倍)や、タンパク質の分子量などの量的要素は異なっていてもよい。また、現時点でTMEM176Bの生体内での役割、すなわち生理機能は未知であるが、配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るタンパク質を、「実質的に同質の機能を有するタンパク質」と見なすことができる。
【0014】
本発明におけるタンパク質:TMEM176Bとして、例えば、(i)配列番号:2、4、6または8で表されるアミノ酸配列中の1〜50個、好ましくは1〜30個、より好ましくは1〜10個、さらに好ましくは1〜数(5、4、3もしくは2)個のアミノ酸が欠失したアミノ酸配列、(ii)配列番号:2、4、6または8で表されるアミノ酸配列に1〜50個、好ましくは1〜30個、より好ましくは1〜10個、さらに好ましくは1〜数(5、4、3もしくは2)個のアミノ酸が付加したアミノ酸配列、(iii)配列番号:2、4、6または8で表されるアミノ酸配列に1〜50個、好ましくは1〜30個、より好ましくは1〜10個、さらに好ましくは1〜数(5、4、3もしくは2)個のアミノ酸が挿入されたアミノ酸配列、(iv)配列番号:2、4、6または8で表されるアミノ酸配列中の1〜50個、好ましくは1〜30個、より好ましくは1〜10個、さらに好ましくは1〜数(5、4、3もしくは2)個のアミノ酸が他のアミノ酸で置換されたアミノ酸配列、または(v)それらを組み合わせたアミノ酸配列を含有するタンパク質などのいわゆるムテインも含まれる。
上記のようにアミノ酸配列が挿入、欠失、付加または置換されている場合、その挿入、欠失、付加または置換の位置は、配列番号:2、4、6または8で表わされるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得る限り、特に限定されない。
ここでアミノ酸の欠失、付加、挿入または置換を人為的に行う場合の手法としては、例えば、配列番号:2、4、6または8で示されるアミノ酸配列をコードするDNAに対して慣用の部位特異的変異導入を施し、その後このDNAを常法により発現させる手法が挙げられる。ここで部位特異的変異導入法としては、例えば、アンバー変異を利用する方法(ギャップド・デュプレックス法、Nucleic Acids Res., 12,9441-9456(1984))、変異導入用プライマーを用いたPCRによる方法等が挙げられる。
【0015】
TMEM176Bの好ましい例としては、例えば、配列番号:2、4、6または8で表されるアミノ酸配列からなるヒトタンパク質(Genbank Accession No.: NP_001094781、NP_001094782、NP_054739、またはNP_001094784)、あるいは他の哺乳動物におけるそのオルソログ(例えば、マウスTMEM176Bタンパク質(配列番号10、12、14または16、Genbank Accession No. NP_075543、NP_001157679、NP_001157680またはNP_001157681)、ラットTMEM176B(Genbank Accession No. NP_599217)等)、アレル変異体、多型バリアント〔例えば一塩基多型(SNPs)〕などがあげられる。
【0016】
「TMEM176Bをコードする遺伝子」は、上記(a)〜(e)で示される、配列番号:2、4、6または8で表されるアミノ酸配列またはこれと実質的に同一のアミノ酸配列をコードする塩基配列を有する遺伝子を表す。具体的には、以下の(f)〜(j):
(f)配列番号:2、4、6または8で示されるアミノ酸配列をコードする塩基配列、
(g)配列番号:2、4、6または8で示されるアミノ酸配列において、1もしくは複数のアミノ酸が欠失、付加、挿入もしくは置換され、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列をコードする塩基配列、
(h)配列番号:2、4、6または8で示されるアミノ酸配列と60%以上の相同性を有し、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列をコードする塩基配列、
(i)配列番号:1、3、5または7で示される塩基配列、
(j)配列番号:1、3、5または7で示される塩基配列を有するDNAに対し相補性を有するDNAとストリンジェントな条件下でハイブリダイズするDNAの塩基配列であって、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列をコードする塩基配列、
を有する遺伝子が挙げられる。
尚、ここで遺伝子とは、cDNAもしくはゲノムDNA等のDNA、またはmRNA等のRNAのいずれでもよく、また一本鎖の核酸配列および二本鎖の核酸配列を共に含む概念である。また、本明細書において、配列番号:1、3、5または7等に示される核酸配列は、便宜的にDNA配列であるが、mRNAなどRNA配列を示す場合には、チミン(T)をウラシル(U)として解する。
【0017】
II.TMEM176Bの発現を抑制する物質
本発明において「TMEM176Bの発現を抑制する物質」とは、TMEM176Bをコードする遺伝子(TMEM176B遺伝子)の転写レベル、転写後調節のレベル、TMEM176Bへの翻訳レベル、翻訳後修飾のレベル等のいかなる段階で作用するものであってもよい。従って、TMEM176Bの発現を抑制する物質としては、例えば、TMEM176B遺伝子の転写を阻害する物質(例、アンチジーン)、初期転写産物からmRNAへのプロセッシングを阻害する物質、mRNAの細胞質への輸送を阻害する物質、mRNAからTMEM176Bの翻訳を阻害するか(例、アンチセンス核酸、miRNA)あるいはmRNAを分解する(例、siRNA、リボザイム)物質、初期翻訳産物の翻訳後修飾を阻害する物質などが含まれる。いずれの段階で作用するものであっても好ましく用いることができるが、
より好ましくは、以下の(1)〜(3)からなる群より選択される物質が例示される。
(1)TMEM176Bをコードする遺伝子の転写産物に対するアンチセンス核酸、
(2)TMEM176Bをコードする遺伝子の転写産物に対するリボザイム核酸、及び
(3)TMEM176Bをコードする遺伝子の転写産物に対してRNAi活性を有する核酸もしくはその前駆体。
転写産物の好ましい例としては、mRNAが挙げられる。
【0018】
TMEM176B遺伝子のmRNAからTMEM176Bへの翻訳を特異的に阻害する(あるいはmRNAを分解する)物質として、好ましくは、これらのmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸が挙げられる。
TMEM176B遺伝子のmRNAの塩基配列と実質的に相補的な塩基配列とは、哺乳動物の標的組織である腫瘍血管の生理的条件下において、該mRNAの標的配列に結合してその翻訳を阻害し得る(あるいは該標的配列を切断する)程度の相補性を有する塩基配列を意味し、具体的には、例えば、該mRNAの塩基配列と完全相補的な塩基配列(すなわち、mRNAの相補鎖の塩基配列)と、オーバーラップする領域に関して、約80%以上、好ましくは約90%以上、より好ましくは約95%以上、特に好ましくは約97%以上の相同性を有する塩基配列である。
本発明における「塩基配列の相同性」は、相同性計算アルゴリズムNCBI BLAST(National Center for Biotechnology Information Basic Local Alignment Search Tool)を用い、以下の条件(期待値=10;ギャップを許す;フィルタリング=ON;マッチスコア=1;ミスマッチスコア=-3)にて計算することができる。
【0019】
より具体的には、TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列としては、以下の(k)または(l):
(k)配列番号:1、3、5または7で表される塩基配列と相補的もしくは実質的に相補的な塩基配列;
(l)配列番号:1、3、5または7で表される塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列であって、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るタンパク質をコードする配列と相補的もしくは実質的に相補的な塩基配列;
が挙げられる。
ストリンジェントな条件は、前述のとおりである。
【0020】
TMEM176B遺伝子のmRNAの好ましい例としては、配列番号:1、3、5または7で表される塩基配列(Genbank Accession No.:NM_001101311、NM_001101312、NM_014020またはNM_001101314)を含むヒトTMEM176BのmRNA、あるいは他の哺乳動物におけるそれらのオルソログ(例えば、マウスTMEM176B(配列番号9、11、13または15、Genbank Accession No.:NM_023056、NM_001164207、NM_001164208またはNM_001164209)、ラットTMEM176B(Genbank Accession No. NM_134390)等)、さらにはそれらのスプライスバリアント、アレル変異体、多型バリアント等が挙げられる。
【0021】
TMEM176B遺伝子のmRNAの塩基配列と「相補的もしくは実質的に相補的な塩基配列の一部」とは、TMEM176B遺伝子のmRNAに特異的に結合することができ、且つ該mRNAからのタンパク質の翻訳を阻害(あるいは該mRNAを分解)し得るものであれば、その長さや位置に特に制限はないが、配列特異性の面から、標的配列に相補的もしくは実質的に相補的な部分を少なくとも10塩基以上、好ましくは約15塩基以上を含むものである。
【0022】
具体的には、TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸として、以下の(1)〜(3)のいずれかのものが好ましく例示される:
(1) TMEM176B遺伝子のmRNAに対するアンチセンス核酸、
(2) TMEM176B遺伝子のmRNAに対するリボザイム核酸、
(3) TMEM176B遺伝子のmRNAに対してRNAi活性を有する核酸もしくはその前駆体。
【0023】
(1) TMEM176B遺伝子のmRNAに対するアンチセンス核酸
本発明における「TMEM176B遺伝子のmRNAに対するアンチセンス核酸」とは、該mRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸であって、標的mRNAと特異的かつ安定した二重鎖を形成して結合することにより、タンパク質合成を抑制する機能を有するものである。
アンチセンス核酸は、2-デオキシ-D-リボースを含有しているポリデオキシリボヌクレオチド、D-リボースを含有しているポリリボヌクレオチド、プリンまたはピリミジン塩基のN-グリコシドであるその他のタイプのポリヌクレオチド、非ヌクレオチド骨格を有するその他のポリマー(例えば、市販のタンパク質核酸および合成配列特異的な核酸ポリマー)または特殊な結合を含有するその他のポリマー(但し、該ポリマーはDNAやRNA中に見出されるような塩基のペアリングや塩基の付着を許容する配置をもつヌクレオチドを含有する)などが挙げられる。それらは、二本鎖DNA、一本鎖DNA、二本鎖RNA、一本鎖RNA、DNA:RNAハイブリッドであってもよく、さらに非修飾ポリヌクレオチド(または非修飾オリゴヌクレオチド)、公知の修飾の付加されたもの、例えば当該分野で知られた標識のあるもの、キャップの付いたもの、メチル化されたもの、1個以上の天然のヌクレオチドを類縁物で置換したもの、分子内ヌクレオチド修飾のされたもの、例えば非荷電結合(例えば、メチルホスホネート、ホスホトリエステル、ホスホルアミデート、カルバメートなど)を持つもの、電荷を有する結合または硫黄含有結合(例、ホスホロチオエート、ホスホロジチオエートなど)を持つもの、例えばタンパク質(例、ヌクレアーゼ、ヌクレアーゼ・インヒビター、トキシン、抗体、シグナルペプチド、ポリ-L-リジンなど)や糖(例、モノサッカライドなど)などの側鎖基を有しているもの、インターカレント化合物(例、アクリジン、ソラレンなど)を持つもの、キレート化合物(例えば、金属、放射活性をもつ金属、ホウ素、酸化性の金属など)を含有するもの、アルキル化剤を含有するもの、修飾された結合を持つもの(例えば、αアノマー型の核酸など)であってもよい。ここで「ヌクレオシド」、「ヌクレオチド」および「核酸」とは、プリンおよびピリミジン塩基を含有するのみでなく、修飾されたその他の複素環型塩基をもつようなものを含んでいて良い。このような修飾物は、メチル化されたプリンおよびピリミジン、アシル化されたプリンおよびピリミジン、あるいはその他の複素環を含むものであってよい。修飾されたヌクレオシドおよび修飾されたヌクレオチドはまた糖部分が修飾されていてよく、例えば、1個以上の水酸基がハロゲンとか、脂肪族基などで置換されていたり、またはエーテル、アミンなどの官能基に変換されていたりしてよい。
【0024】
上記の通り、アンチセンス核酸はDNAであってもRNAであってもよく、あるいはDNA/RNAキメラであってもよい。アンチセンス核酸がDNAの場合、標的RNAとアンチセンスDNAとによって形成されるRNA:DNAハイブリッドは、内在性RNase Hに認識されて標的RNAの選択的な分解を引き起こすことができる。したがって、RNase Hによる分解を指向するアンチセンスDNAの場合、標的配列は、mRNA中の配列だけでなく、TMEM176B遺伝子の初期翻訳産物におけるイントロン領域の配列であってもよい。イントロン配列は、ゲノム配列と、TMEM176B遺伝子のcDNA塩基配列とをBLAST、FASTA等のホモロジー検索プログラムを用いて比較することにより、決定することができる。
【0025】
本発明のアンチセンス核酸の標的領域は、該アンチセンス核酸がハイブリダイズすることにより、結果としてタンパク質:TMEM176Bへの翻訳が阻害されるものであればその長さに特に制限はなく、TMEM176BをコードするmRNAの全配列であっても部分配列であってもよく、短いもので約10塩基程度、長いものでmRNAもしくは初期転写産物の全配列が挙げられる。合成の容易さや抗原性、細胞内移行性の問題等を考慮すれば、約10〜約40塩基、特に約15〜約30塩基からなるオリゴヌクレオチドが好ましいが、それに限定されない。具体的には、TMEM176B遺伝子の5’端ヘアピンループ、5’端6-ベースペア・リピート、5’端非翻訳領域、翻訳開始コドン、タンパク質コード領域、ORF翻訳終止コドン、3’端非翻訳領域、3’端パリンドローム領域または3’端ヘアピンループなどが、アンチセンス核酸の好ましい標的領域として選択しうるが、それらに限定されない。
【0026】
さらに、本発明のアンチセンス核酸は、TMEM176B遺伝子のmRNAや初期転写産物とハイブリダイズしてタンパク質への翻訳を阻害するだけでなく、二本鎖DNAであるこれらの遺伝子と結合して三重鎖(トリプレックス)を形成し、RNAへの転写を阻害し得るもの(アンチジーン)であってもよい。
【0027】
アンチセンス核酸を構成するヌクレオチド分子は、天然型のDNAもしくはRNAでもよいが、安定性(化学的および/または対酵素)や比活性(RNAとの親和性)を向上させるために、種々の化学修飾を含むことができる。例えば、ヌクレアーゼなどの加水分解酵素による分解を防ぐために、アンチセンス核酸を構成する各ヌクレオチドのリン酸残基(ホスフェート)を、例えば、ホスホロチオエート(PS)、メチルホスホネート、ホスホロジチオネートなどの化学修飾リン酸残基に置換することができる。また、各ヌクレオチドの糖(リボース)の2’位の水酸基を、-OR(R=CH3(2’-O-Me)、CH2CH2OCH3(2’-O-MOE)、CH2CH2NHC(NH)NH2、CH2CONHCH3、CH2CH2CN等)に置換してもよい。さらに、塩基部分(ピリミジン、プリン)に化学修飾を施してもよく、例えば、ピリミジン塩基の5位へのメチル基やカチオン性官能基の導入、あるいは2位のカルボニル基のチオカルボニルへの置換などが挙げられる。
【0028】
RNAの糖部のコンフォメーションはC2’-endo(S型)とC3’-endo(N型)の2つが支配的であり、一本鎖RNAではこの両者の平衡として存在するが、二本鎖を形成するとN型に固定される。したがって、標的RNAに対して強い結合能を付与するために、2’酸素と4’炭素を架橋することにより、糖部のコンフォメーションをN型に固定したRNA誘導体であるBNA(LNA)(Imanishi, T. et al., Chem. Commun., 1653-9, 2002; Jepsen, J.S. et al., Oligonucleotides, 14, 130-46, 2004)やENA(Morita, K. et al., Nucleosides Nucleotides Nucleic Acids, 22, 1619-21, 2003)もまた、好ましく用いられ得る。
【0029】
本発明のアンチセンスオリゴヌクレオチドは、TMEM176B遺伝子のcDNA配列もしくはゲノミックDNA配列に基づいてmRNAもしくは初期転写産物の標的配列を決定し、市販のDNA/RNA自動合成機(アプライド・バイオシステムズ社、ベックマン社等)を用いて、これに相補的な配列を合成することにより調製することができる。また、上記した各種修飾を含むアンチセンス核酸も、いずれも自体公知の手法により、化学的に合成することができる。
【0030】
(2) TMEM176B遺伝子のmRNAに対するリボザイム核酸
TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸の他の好ましい例としては、該mRNAをコード領域の内部で特異的に切断し得るリボザイム核酸が挙げられる。「リボザイム」とは、狭義には、核酸を切断する酵素活性を有するRNAをいうが、本明細書では配列特異的な核酸切断活性を有する限りDNAをも包含する概念として用いるものとする。リボザイム核酸として最も汎用性の高いものとしては、ウイロイドやウイルソイド等の感染性RNAに見られるセルフスプライシングRNAがあり、ハンマーヘッド型やヘアピン型等が知られている。ハンマーヘッド型は約40塩基程度で酵素活性を発揮し、ハンマーヘッド構造をとる部分に隣接する両端の数塩基ずつ(合わせて約10塩基程度)をmRNAの所望の切断部位と相補的な配列にすることにより、標的mRNAのみを特異的に切断することが可能である。このタイプのリボザイム核酸は、RNAのみを基質とするので、ゲノムDNAを攻撃することがないというさらなる利点を有する。TMEM176B遺伝子のmRNAが自身で二本鎖構造をとる場合には、RNAヘリカーゼと特異的に結合し得るウイルス核酸由来のRNAモチーフを連結したハイブリッドリボザイムを用いることにより、標的配列を一本鎖にすることができる[Proc. Natl. Acad. Sci. USA, 98(10): 5572-5577 (2001)]。さらに、リボザイムを、それをコードするDNAを含む発現ベクターの形態で使用する場合には、転写産物の細胞質への移行を促進するために、tRNAを改変した配列をさらに連結したハイブリッドリボザイムとすることもできる[Nucleic Acids Res., 29(13): 2780-2788 (2001)]。
【0031】
(3) TMEM176B遺伝子のmRNAに対するsiRNA
本明細書においては、TMEM176B遺伝子のmRNAに相補的なオリゴRNAとその相補鎖とからなる二本鎖RNA、いわゆるsiRNAもまた、TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸に包含されるものとして定義される。短い二本鎖RNAを細胞内に導入するとそのRNAに相補的なmRNAが分解される、いわゆるRNA干渉(RNAi)と呼ばれる現象は、以前から線虫、昆虫、植物等で知られていたが、この現象が動物細胞でも広く起こることが確認されて以来[Nature, 411(6836): 494-498 (2001)]、上記のアンチセンス核酸やリボザイムの代替技術として汎用されている。
【0032】
siRNAは、標的遺伝子のcDNA配列情報に基づいて、例えば、Elbashirら(Genes Dev., 15, 188-200 (2001))、Teramotoら(FEBS Lett. 579(13):p2878-82(2005))の提唱する規則に従って設計することができる。siRNAの標的配列は、原則的には15〜50塩基、好ましくは19〜49塩基、更に好ましくは19〜27塩基の長さを有しており、例えばAA+(N)19(AAに続く、19塩基の塩基配列)、AA+(N)21(AAに続く、21塩基の塩基配列)もしくはA+(N)21(Aに続く、21塩基の塩基配列)であってもよい。
本発明の核酸は、5’または3’末端に、付加的な塩基を有していてもよい。該付加的塩基の長さは、通常2〜4塩基程度であり、siRNAの全長として19塩基以上である。該付加的塩基は、DNAでもRNAでもよいが、DNAを用いると核酸の安定性を向上させることができる場合がある。このような付加的塩基の配列としては、例えばug-3’、uu-3’、tg-3’、tt-3’、ggg-3’、guuu-3’、gttt-3’、ttttt-3’、uuuuu-3’などの配列が挙げられるが、これらに限定されるものではない。
また、siRNAは、3'末端に突出部配列(オーバーハング)を有していてもよく、具体的には、dTdT(dTはデオキシリボ核酸のデオキシチミジン残基を表わす)を付加したものが挙げられる。また、末端付加がない平滑末端(ブラントエンド)であってもよい。
また、siRNAは、センス鎖とアンチセンス鎖が異なる塩基数であってもよく、例えば、アンチセンス鎖が3'末端および5'末端に突出部配列(オーバーハング)を有している「aiRNA」を挙げることができる。典型的なaiRNAは、アンチセンス鎖が21塩基からなり、センス鎖が15塩基からなり、アンチセンス鎖の両端で各々3塩基のオーバーハング構造をとる(Sun, X.ら著、Nature Biotechnology Vol26 No.12 p1379、国際公開第WO2009/029688号パンフレット)。
具体的には、実施例5に記載されているような、25塩基長のブラントエンド型のsiRNAや、実施例9に記載されているような標的配列部分が19塩基長で3'末端にdTdTを付加された合計21塩基長のsiRNAが挙げられる。
標的配列の位置は特に制限されるわけではないが、5’-UTRおよび開始コドンから約50塩基まで、並びに3’-UTR以外の領域から標的配列を選択することが望ましい。上述の規則その他に基づいて選択された標的配列の候補群について、標的以外のmRNAにおいて16-17塩基の連続した配列に相同性がないかどうかを、BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)等のホモロジー検索ソフトを用いて調べ、選択した標的配列の特異性を確認する。特異性の確認された標的配列について、AA(もしくはNA)以降の19-21塩基にTTもしくはUUの3’末端オーバーハングを有するセンス鎖と、該19-21塩基に相補的な配列およびTTもしくはUUの3’末端オーバーハングを有するアンチセンス鎖とからなる2本鎖RNAをsiRNAとして設計してもよい。また、siRNAの前駆体であるショートヘアピンRNA(shRNA)は、ループ構造を形成しうる任意のリンカー配列(例えば、5-25塩基程度)を適宜選択し、上記センス鎖とアンチセンス鎖とを該リンカー配列を介して連結することにより設計することができる。
【0033】
siRNAおよび/またはshRNAの配列は、種々のwebサイト上に無料で提供される検索ソフトを用いて検索が可能である。このようなサイトとしては、例えば、Ambionが提供するsiRNA Target Finder(http://www.ambion.com/jp/techlib/misc/siRNA_finder.html)およびpSilencer(登録商標) Expression Vector用インサートデザインツール(http://www.ambion.com/jp/techlib/misc/psilencer_converter.html)、RNAi Codexが提供するGeneSeer(http://codex.cshl.edu/scripts/newsearchhairpin.cgi)があるがこれらに限定されない。
【0034】
siRNAを構成するリボヌクレオシド分子もまた、安定性、比活性などを向上させるために、上記のアンチセンス核酸の場合と同様の修飾を受けていてもよい。但し、siRNAの場合、天然型RNA中のすべてのリボヌクレオシド分子を修飾型で置換すると、RNAi活性が失われる場合があるので、RISC複合体が機能できる最小限の修飾ヌクレオシドの導入が必要である。
当該修飾として具体的には、siRNAを構成するヌクレオチド分子の一部を、天然型のDNAや、安定性(化学的および/または対酵素)や比活性(RNAとの親和性)を向上させるために、種々の化学修飾を施したRNAに置換することができる(Usman and Cedergren,1992,TIBS 17,34;Usman et al.,1994,Nucleic Acids Symp.Ser.31,163を参照)。例えば、ヌクレアーゼなどの加水分解酵素による分解を防ぐために、siRNAを構成する各ヌクレオチドのリン酸残基(ホスフェート)を、例えば、ホスホロチオエート(PS)、メチルホスホネート、ホスホロジチオネートなどの化学修飾リン酸残基に置換することができる。また、各ヌクレオチドの糖(リボース)の2’位の水酸基を、-OR(R=CH3(2’-O-Me)、CH2CH2OCH3(2’-O-MOE)、CH2CH2NHC(NH)NH2、CH2CONHCH3、CH2CH2CN等)、フッ素原子(-F)に置換してもよい。さらに、塩基部分(ピリミジン、プリン)に化学修飾を施してもよく、例えば、ピリミジン塩基の5位へのメチル基やカチオン性官能基の導入、あるいは2位のカルボニル基のチオカルボニルへの置換などが挙げられる。その他上記(1)に記載されたアンチセンス核酸における修飾方法を用いることができる。あるいは、siRNAにおけるRNAの一部をDNAに置換する化学修飾(2'-デオキシ化、2'-H)を施してもよい。また、糖(リボース)の2'位と4'位を-O-CH2-で架橋しコンフォメーションを N 型に固定した人工核酸(LNA:Locked Nucleic Acid)を用いてもよい。
また、siRNAを構成するセンス鎖およびアンチセンス鎖は、リンカーを介し、細胞表層に存在する受容体を特異的に認識するリガンド、ペプチド、糖鎖、抗体、脂質や正電荷や分子構造的に細胞膜表層に吸着し貫通するオリゴアルギニン、Tatペプチド、RevペプチドまたはAntペプチドなどと化学結合していてもよい。
【0035】
siRNAは、mRNA上の標的配列のセンス鎖およびアンチセンス鎖をDNA/RNA自動合成機でそれぞれ合成し、適当なアニーリング緩衝液中、約90〜約95℃で約1分程度変性させた後、約30〜約70℃で約1〜約8時間アニーリングさせることにより調製することができる。また、siRNAの前駆体となるショートヘアピンRNA(shRNA)を合成し、これを、ダイサー(dicer)を用いて切断することにより調製することもできる。
【0036】
本明細書においては、生体内でTMEM176B遺伝子のmRNAに対するsiRNAを生成し得るようにデザインされた核酸もまた、TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸に包含されるものとして定義される。そのような核酸としては、上記したshRNAやsiRNAを発現するように構築された発現ベクターなどが挙げられる。shRNAは、mRNA上の標的配列のセンス鎖およびアンチセンス鎖を適当なループ構造を形成しうる長さ(例えば5〜25塩基程度)のスペーサー配列を間に挿入して連結した塩基配列を含むオリゴRNAをデザインし、これをDNA/RNA自動合成機で合成することにより調製することができる。shRNAを発現するベクターには、タンデムタイプとステムループ(ヘアピン)タイプとがある。前者はsiRNAのセンス鎖の発現カセットとアンチセンス鎖の発現カセットをタンデムに連結したもので、細胞内で各鎖が発現してアニーリングすることにより2本鎖のsiRNA(dsRNA)を形成するというものである。一方、後者はshRNAの発現カセットをベクターに挿入したもので、細胞内でshRNAが発現しdicerによるプロセシングを受けてdsRNAを形成するというものである。プロモーターとしては、polII系プロモーター(例えば、CMV前初期プロモーター)を使用することもできるが、短いRNAの転写を正確に行わせるために、polIII系プロモーターを使用するのが一般的である。polIII系プロモーターとしては、マウスおよびヒトのU6-snRNAプロモーター、ヒトH1-RNase P RNAプロモーター、ヒトバリン-tRNAプロモーターなどが挙げられる。また、転写終結シグナルとして4個以上Tが連続した配列が用いられる。
このようにして構築したsiRNAもしくはshRNA発現カセットを、次いでプラスミドベクターやウイルスベクターに挿入する。このようなベクターとしては、レトロウイルス、レンチウイルス、アデノウイルス、アデノ随伴ウイルス、ヘルペスウイルス、センダイウイルスなどのウイルスベクターや、動物細胞発現プラスミドなどが用いられる。
【0037】
上記siRNAは、ヌクレオチド配列の情報に基づいて、例えば394 Applied Biosystems,Inc.合成機等のDNA/RNA自動合成機を用いて常法に従って化学的に合成することができる。例えば,Caruthers et al.,1992,Methods in Enzymology 211,3-19;Thompson et al.,国際公開99/54459;Wincott et al.,1995,Nucleic Acids Res.23,2677-2684;Wincott et al.,1997,Methods Mol.Bio.,74,59;Brennan et al.,1998,Biotechnol Bioeng.,61,33-45;Usman et al.,1987 J.Am.Chem.Soc.,109,7845;Scaringe et al.,1990 Nucleic Acids Res.,18,5433);および米国特許第6001311号に記載される方法等が挙げられる。具体的には、当業者に公知の核酸保護基(例えば5’末端にジメトキシトリチル基)およびカップリング基(例えば3’末端にホスホルアミダイト)を用いて合成できる。すなわち、5'末端の保護基を、TCA(トリクロロ酢酸)等の酸で脱保護し、カップリング反応を行う。ついでアセチル基でキャッピングを行った後、次の核酸の縮合反応を行う。修飾されたRNAやDNAを含むsiRNAの場合には、原料として修飾されたRNA(例えば、2'-O-メチルヌクレオチド、2'-デオキシ−2'-フルオロヌクレオチド)を用いればよく、カップリング反応の条件は適宜調整できる。また、リン酸結合部分が修飾されたホスホロチオエート結合を導入する場合には、ボーケージ試薬(3H-1,2-ベンゾジチオール-3-オン1,1-ジオキシド)を用いることができる。
【0038】
あるいは,オリゴヌクレオチドは,別々に合成し、合成後に例えばライゲーションにより一緒につなげてもよいし(Moore et al.,1992,Science 256,9923;Draper et al.国際公開WO93/23569;Shabarova et al.,1991,Nucleic Acids Research 19,4247;Bellon et al.,1997,Nucleosides&Nucleotides,16,951;Bellon et al.,1997,Nucleosides&Nucleotides;Bellon et al.,1997,Bioconjugate Chem.8,204)、または合成および/または脱保護の後にハイブリダイゼーションにより,一緒につなげてもよい。siRNA分子はまたタンデム合成法により合成することができる。すなわち、両方のsiRNA鎖を,切断可能なリンカーにより分離された単一の連続するオリゴヌクレオチドとして合成し,次にこれを切断して別々のsiRNAフラグメントを生成し,これをハイブリダイズさせて精製する。リンカーはポリヌクレオチドリンカーであっても非ヌクレオチドリンカーであってもよい。
【0039】
合成したsiRNA分子は、当業者に公知の方法を用いて精製できる。例えばゲル電気泳動により精製する方法,または高速液体クロマトグラフィー(HPLC)を用いて精製する方法が挙げられる。
また、siRNA分子をDNAまたはRNAベクター中に挿入させて、組換えベクターを用いて発現させることもできる。ベクターは,DNAプラスミドまたはウイルスベクターでありうる。siRNAを発現するウイルスベクターは,限定されないが、アデノウイルス等を用いることができる。
【0040】
具体的なsiRNAとしては例えば、以下の群:
(1)二重鎖RNA部分が、配列番号:29〜43からなる塩基配列を含むsiRNA、
(2)3'末端に2〜4塩基のオーバーハングが付加されていることを特徴とする前記(1)に記載のsiRNA、
(3)少なくとも1つの塩基が化学的に修飾されている前記(1)または(2)に記載のsiRNA、または、
(4)少なくとも1つのホスホジエステル結合が化学的に修飾されている前記(1)〜(3)のいずれかに記載のsiRNA、
等を例示することができる。ここでsiRNAの二重鎖RNA部分の塩基の長さは15〜50塩基、好ましくは19〜50塩基、更に好ましくは19〜49塩基、15〜49塩基、更に好ましくは19〜25塩基、15〜25塩基、更に好ましくは19〜23塩基である。
【0041】
TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸は、リポソーム、ミクロスフェアのような特殊な形態で供与されたり、遺伝子治療に適用されたり、付加された形態で与えられることができうる。こうして付加形態で用いられるものとしては、リン酸基骨格の電荷を中和するように働くポリリジンのようなポリカチオン体、細胞膜との相互作用を高めたり、核酸の取込みを増大させたりするような脂質(例、ホスホリピド、コレステロールなど)などの疎水性のものが挙げられる。付加するに好ましい脂質としては、コレステロールやその誘導体(例、コレステリルクロロホルメート、コール酸など)が挙げられる。こうしたものは、核酸の3’端または5’端に付着させることができ、塩基、糖、分子内ヌクレオシド結合を介して付着させることができうる。その他の基としては、核酸の3’端または5’端に特異的に配置されたキャップ用の基で、エキソヌクレアーゼ、RNaseなどのヌクレアーゼによる分解を阻止するためのものが挙げられる。こうしたキャップ用の基としては、ポリエチレングリコール、テトラエチレングリコールなどのグリコールをはじめとした当該分野で知られた水酸基の保護基が挙げられるが、それに限定されるものではない。
【0042】
これらの核酸のタンパク質:TMEM176B発現阻害活性は、TMEM176B遺伝子を導入した形質転換体、生体内や生体外のTMEM176B遺伝子発現系、または生体内や生体外のタンパク質:TMEM176Bの翻訳系を用いて調べることができる。
【0043】
本発明におけるTMEM176Bの発現を阻害する物質は、上記のようなTMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸に限定されず、TMEM176Bの産生を直接的または間接的に阻害する限り、低分子化合物などの他の物質であってもよい。そのような物質は、例えば、後述する本発明のスクリーニング方法により取得することができる。
【0044】
III. TMEM176Bの機能を抑制する物質
本発明において「TMEM176Bの機能を抑制する物質」とは、いったん機能的に産生されたTMEM176Bの機能を発揮するのを抑制する限りいかなるものでもよい。
【0045】
具体的には、TMEM176Bの機能を抑制する物質として、例えば、TMEM176Bに対する抗体が挙げられる。該抗体はポリクローナル抗体、モノクローナル抗体の何れであってもよい。これらの抗体は、自体公知の抗体または抗血清の製造法に従って製造することができる。抗体のアイソタイプは特に限定されないが、好ましくはIgG、IgMまたはIgA、特に好ましくはIgGが挙げられる。また、該抗体は、標的抗原を特異的に認識し結合するための相補性決定領域(CDR)を少なくとも有するものであれば特に制限はなく、完全抗体分子の他、例えばFab、Fab'、F(ab’)2等のフラグメント、scFv、scFv-Fc、ミニボディー、ダイアボディー等の遺伝子工学的に作製されたコンジュゲート分子、あるいはポリエチレングリコール(PEG)等のタンパク質安定化作用を有する分子等で修飾されたそれらの誘導体などであってもよい。
好ましい一実施態様において、TMEM176Bに対する抗体はヒトを投与対象とする医薬品として使用されることから、該抗体(好ましくはモノクローナル抗体)はヒトに投与した場合に抗原性を示す危険性が低減された抗体、具体的には、完全ヒト抗体、ヒト化抗体、マウス−ヒトキメラ抗体などであり、特に好ましくは完全ヒト抗体である。ヒト化抗体およびキメラ抗体は、常法に従って遺伝子工学的に作製することができる。また、完全ヒト抗体は、ヒト−ヒト(もしくはマウス)ハイブリドーマより製造することも可能ではあるが、大量の抗体を安定に且つ低コストで提供するためには、ヒト抗体産生マウスやファージディスプレイ法を用いて製造することが望ましい。
TMEM176Bの機能を抑制する物質は、腫瘍血管移行性、細胞膜透過性に優れた物質であることが望ましい。したがって、TMEM176Bの機能を抑制する別の好ましい物質は、Lipinski's Ruleに見合った低分子化合物である。そのような化合物は、例えば、後述する本発明のスクリーニング法を用いて取得することができる。
【0046】
TMEM176Bの発現もしくは機能を抑制する物質は、血管新生阻害活性、詳しくは腫瘍血管新生阻害活性、更に詳しくは、腫瘍血管内皮細胞の遊走抑制活性を示すことから、抗腫瘍剤として、癌に罹患した患者の病態を改善したり、癌への罹患、特には癌の転移・再発を予防したりするのに有用である。
従って、TMEM176Bの発現もしくは機能を抑制する物質を含有する医薬は、癌の予防および/または治療剤(抗腫瘍剤)として使用することができる。
また、TMEM176Bの発現もしくは機能を抑制する物質は、血管新生の異常を伴う疾患の治療もしくは予防に有用である。従って、TMEM176Bの発現もしくは機能を抑制する物質を含有する医薬は、血管新生の異常を伴う疾患の予防および/または治療剤として使用することができる。
【0047】
IV.アンチセンス核酸、リボザイム核酸、siRNAおよびその前駆体を含有する医薬
TMEM176B遺伝子の転写産物に相補的に結合し、該転写産物からのタンパク質の翻訳を抑制することができる本発明のアンチセンス核酸や、TMEM176B遺伝子の転写産物(mRNA)と相同な(もしくは相補的な)塩基配列を有し、当該転写産物を標的として該転写産物を切断し得るsiRNA(もしくはリボザイム)、さらに該siRNAの前駆体であるshRNAなど(以下、包括的に「本発明の核酸」という場合がある)は、生体内におけるTMEM176Bの発現を抑制し、腫瘍血管内皮細胞の遊走を抑制するので、抗腫瘍剤等の医薬として使用することができる。
本発明の核酸を含有する医薬は低毒性であり、そのまま液剤として、または適当な剤型の医薬組成物として、ヒトまたは非ヒト哺乳動物(例、ラット、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して経口的または非経口的(例、血管内投与、皮下投与など)に投与することができる。
【0048】
本発明の核酸を上記の抗腫瘍剤として使用する場合、自体公知の方法に従って製剤化し、投与することができる。即ち、本発明の核酸を、単独あるいはレトロウイルスベクター、アデノウイルスベクター、アデノウイルスアソシエーテッドウイルスベクターなどの適当な哺乳動物細胞用の発現ベクターに機能可能な態様で挿入した後、常套手段に従って製剤化することができる。該核酸は、そのままで、あるいは摂取促進のための補助剤とともに、遺伝子銃やハイドロゲルカテーテルのようなカテーテルによって投与することができる。あるいは、エアロゾル化して吸入剤として気管内に局所投与することもできる。
さらに、体内動態の改良、半減期の長期化、細胞内取り込み効率の改善を目的に、前記核酸を単独またはリポソームなどの担体とともに製剤(注射剤)化し、静脈、皮下等に投与してもよい。
【0049】
本発明の核酸は、それ自体を投与してもよいし、または適当な医薬組成物として投与してもよい。投与に用いられる医薬組成物としては、本発明の核酸と薬理学的に許容され得る担体、希釈剤もしくは賦形剤とを含むものであってよい。このような医薬組成物は、経口または非経口投与に適する剤形として提供される。
【0050】
非経口投与のための組成物としては、例えば、注射剤、坐剤等が用いられ、注射剤は静脈注射剤、皮下注射剤、皮内注射剤、筋肉注射剤、点滴注射剤等の剤形を包含しても良い。このような注射剤は、公知の方法に従って調製できる。注射剤の調製方法としては、例えば、上記本発明の核酸を通常注射剤に用いられる無菌の水性液、または油性液に溶解、懸濁または乳化することによって調製できる。注射用の水性液としては、例えば、生理食塩水、ブドウ糖やその他の補助薬を含む等張液等が用いられ、適当な溶解補助剤、例えば、アルコール(例、エタノール)、ポリアルコール(例、プロピレングリコール、ポリエチレングリコール)、非イオン界面活性剤〔例、ポリソルベート80、HCO-50(polyoxyethylene(50mol)adduct of hydrogenated castor oil)〕等と併用してもよい。油性液としては、例えば、ゴマ油、大豆油等が用いられ、溶解補助剤として安息香酸ベンジル、ベンジルアルコール等を併用してもよい。調製された注射液は、適当なアンプルに充填されることが好ましい。直腸投与に用いられる坐剤は、上記核酸を通常の坐薬用基剤に混合することによって調製されてもよい。
【0051】
経口投与のための組成物としては、固体または液体の剤形、具体的には錠剤(糖衣錠、フィルムコーティング錠を含む)、丸剤、顆粒剤、散剤、カプセル剤(ソフトカプセル剤を含む)、シロップ剤、乳剤、懸濁剤等が挙げられる。このような組成物は公知の方法によって製造され、製剤分野において通常用いられる担体、希釈剤もしくは賦形剤を含有していても良い。錠剤用の担体、賦形剤としては、例えば、乳糖、でんぷん、蔗糖、ステアリン酸マグネシウムが用いられる。
【0052】
上記の非経口用または経口用医薬組成物は、活性成分の投与量に適合するような投薬単位の剤形に調製されることが好都合である。このような投薬単位の剤形としては、例えば、錠剤、丸剤、カプセル剤、注射剤(アンプル)、坐剤が挙げられる。本発明の核酸は、例えば、投薬単位剤形当たり通常5〜500mg、とりわけ注射剤では5〜100mg、その他の剤形では10〜250mg含有されていることが好ましい。
【0053】
本発明の核酸を含有する上記医薬の投与量は、投与対象、対象疾患、症状、投与ルートなどによっても異なるが、例えば、癌の治療・予防のために使用する場合には、本発明の核酸を1回量として、通常0.01〜20mg/kg体重程度、好ましくは0.1〜10mg/kg体重程度、さらに好ましくは0.1〜5mg/kg体重程度を、1日1〜5回程度、好ましくは1日1〜3回程度、静脈注射により投与するのが好都合である。他の非経口投与および経口投与の場合もこれに準ずる量を投与することができる。症状が特に重い場合には、その症状に応じて増量してもよい。
【0054】
なお前記した各組成物は、本発明の核酸との配合により好ましくない相互作用を生じない限り適宜他の活性成分を含有してもよい。
【0055】
V.TMEM176Bに対する抗体、TMEM176Bの発現もしくは機能を抑制する低分子化合物等を含有する医薬
TMEM176Bに対する抗体や、TMEM176Bの発現もしくは機能を抑制する低分子化合物は、TMEM176Bの産生または機能を阻害することができる。したがって、これらの物質は、生体内におけるTMEM176Bの発現もしくは機能を抑制するので、癌の予防および/または治療剤等の医薬として使用することができる。
上記の抗体や低分子化合物を含有する医薬は低毒性であり、そのまま液剤として、または適当な剤型の医薬組成物として、ヒトまたは哺乳動物(例、ラット、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して経口的または非経口的(例、血管内投与、皮下投与など)に投与することができる。
【0056】
上記の抗体や低分子化合物は、それ自体を投与してもよいし、または適当な医薬組成物として投与してもよい。投与に用いられる医薬組成物としては、上記の抗体もしくは低分子化合物またはその塩と薬理学的に許容され得る担体、希釈剤もしくは賦形剤とを含むものであってもよい。このような医薬組成物は、経口または非経口投与に適する剤形として提供される。
【0057】
非経口投与のための組成物としては、例えば、注射剤、坐剤等が用いられ、注射剤は静脈注射剤、皮下注射剤、皮内注射剤、筋肉注射剤、点滴注射剤等の剤形を包含しても良い。このような注射剤は、公知の方法に従って調製できる。注射剤の調製方法としては、例えば、上記本発明の抗体または低分子化合物もしくはその塩を通常注射剤に用いられる無菌の水性液、または油性液に溶解、懸濁または乳化することによって調製できる。注射用の水性液としては、例えば、生理食塩水、ブドウ糖やその他の補助薬を含む等張液等が用いられ、適当な溶解補助剤、例えば、アルコール(例、エタノール)、ポリアルコール(例、プロピレングリコール、ポリエチレングリコール)、非イオン界面活性剤〔例、ポリソルベート80、HCO-50(polyoxyethylene(50mol)adduct of hydrogenated castor oil)〕等と併用してもよい。油性液としては、例えば、ゴマ油、大豆油等が用いられ、溶解補助剤として安息香酸ベンジル、ベンジルアルコール等を併用してもよい。調製された注射液は、適当なアンプルに充填されることが好ましい。直腸投与に用いられる坐剤は、上記抗体またはその塩を通常の坐薬用基剤に混合することによって調製されても良い。
【0058】
経口投与のための組成物としては、固体または液体の剤形、具体的には錠剤(糖衣錠、フィルムコーティング錠を含む)、丸剤、顆粒剤、散剤、カプセル剤(ソフトカプセル剤を含む)、シロップ剤、乳剤、懸濁剤等が挙げられる。このような組成物は公知の方法によって製造され、製剤分野において通常用いられる担体、希釈剤もしくは賦形剤を含有していても良い。錠剤用の担体、賦形剤としては、例えば、乳糖、でんぷん、蔗糖、ステアリン酸マグネシウムが用いられる。
【0059】
上記の非経口用または経口用医薬組成物は、活性成分の投与量に適合するような投薬単位の剤形に調製されることが好都合である。このような投薬単位の剤形としては、例えば、錠剤、丸剤、カプセル剤、注射剤(アンプル)、坐剤が挙げられる。抗体や低分子化合物は、投薬単位剤形当たり通常5〜500mg、とりわけ注射剤では5〜100mg、その他の剤形では10〜250mg含有されていることが好ましい。
【0060】
上記の抗体もしくは低分子化合物またはその塩を含有する上記医薬の投与量は、投与対象、対象疾患、症状、投与ルートなどによっても異なるが、例えば、癌の治療・予防のために使用する場合には、抗体もしくは低分子化合物を1回量として、通常0.01〜20mg/kg体重程度、好ましくは0.1〜10mg/kg体重程度、さらに好ましくは0.1〜5mg/kg体重程度を、1日1〜5回程度、好ましくは1日1〜3回程度、静脈注射により投与するのが好都合である。他の非経口投与および経口投与の場合もこれに準ずる量を投与することができる。症状が特に重い場合には、その症状に応じて増量してもよい。
なお前記した各組成物は、上記抗体や低分子化合物との配合により好ましくない相互作用を生じない限り他の活性成分を含有してもよい。
【0061】
上述のTMEM176Bに対するアンチセンス核酸、リボザイム核酸、siRNAおよびその前駆体を含有する医薬や、TMEM176Bに対する抗体、TMEM176Bの発現もしくは機能を抑制する低分子化合物等を含有する医薬組成物は、血管新生阻害剤として、癌の治療、予防、または進行防止に用いることができる。すなわち、癌の増殖、転移、癌性腹水もしくは癌性胸水の蓄積を抑制するために用いることができる。癌として具体的には、固形癌、移行上皮癌、大腸癌、結腸直腸癌、結腸癌、肺癌(小細胞癌)、肺癌(非小細胞肺癌)、腎癌(腎細胞癌)、腎盂尿管癌、胆道癌、肝臓癌(肝細胞癌)、脳腫瘍、神経膠腫(グリオーマ)、膠芽腫、多型性神経膠芽腫、膵臓癌、頭頸部癌(扁平上皮癌)、多発性骨髄腫、骨軟部腫瘍、前立腺癌、陰茎癌、精巣癌、卵巣癌、消化管間質腫瘍(GIST)、胃癌、女性生殖器癌、子宮頸癌、乳癌、黒色腫(メラノーマ)、リンパ腫(非ホジキン)、リンパ腫(ホジキン)、リンパ腫(びまん性大細胞型)、白血病(急性骨髄性)、白血病(慢性リンパ性)、食道癌、口腔癌、舌癌、咽頭癌、喉頭癌、耳下腺癌、顎下腺癌、唾液腺癌、甲状腺癌、副腎皮質癌、線維性組織球腫、髄膜腫、膀胱癌、ユーイング肉腫、カポジ肉腫、中皮腫または隆起性皮膚線維肉腫等が挙げられる。
また、上述のTMEM176Bに対するアンチセンス核酸、リボザイム核酸、siRNAおよびその前駆体を含有する核酸、TMEM176Bに対する抗体またはTMEM176Bの発現もしくは機能を抑制する低分子化合物等を含有する医薬組成物は、異常な血管内皮細胞の遊走を抑制することから、血管新生阻害剤として、血管新生の異常を伴う疾患、具体的には、糖尿病網膜症、脈絡膜血管新生、黄斑変性症、心不全、骨髄形成異常、インフルエンザ、炎症、関節炎、C型肝炎、乾癬、浮腫、神経変性疾患、アミロイドーシス、特発性肺線維症、多発性硬化症、ウィルソン病、フォンヒッペル・リンダウ病、クローン病、全身性肥満細胞症、骨髄増殖症候群、骨髄異形成等、好ましくは、糖尿病網膜症、黄斑変性症、炎症、関節炎、乾癬、浮腫、特発性肺線維症、フォンヒッペル・リンダウ病、クローン病等の治療、予防、または進行防止にも用いることができる。
【0062】
上述のTMEM176Bに対するアンチセンス核酸、リボザイム核酸、siRNAおよびその前駆体を含有する医薬や、TMEM176Bに対する抗体、TMEM176Bの発現もしくは機能を抑制する低分子化合物等を含有する医薬組成物を癌の治療または予防に使用する場合には、単独で使用してもよいが、1種または2種以上の抗癌作用を有する薬剤および/または放射線療法と併用してもよい。
併用する薬剤としては、特に限定されるものではないが、例えば、Bevacizumab、Sunitinib、Sorafenib、Erlotinib、Erbitaxなどの血管新生阻害薬、ASA404をはじめとする血管破滅薬、5-FU(フルオロウラシル)、ゲムシタビン、シスプラチン、イリノテカン、カルボプラチン、パクリタキセル等の化学療法剤等が挙げられる。
【0063】
VI. 疾病に対する医薬候補化合物のスクリーニング
上述の通り、TMEM176Bの発現および/または機能を抑制すると、腫瘍血管内皮細胞の遊走が抑制され、血管新生阻害活性を有する。従って、TMEM176Bの発現および/または機能を抑制する化合物またはその塩は、癌の予防および/または治療剤(抗腫瘍剤)として使用することができる。
したがって、TMEM176Bを産生する細胞は、TMEM176B(またはTMEM176B遺伝子)の発現量および/または機能を指標とすることにより、血管新生阻害活性を有する物質のスクリーニングのためのツールとして用いることができる。
【0064】
TMEM176Bの発現および/または機能を抑制する化合物またはその塩をスクリーニングする場合、該スクリーニング方法は、TMEM176Bを産生する能力を有する細胞を、被検物質の存在下および非存在下に培養し、両条件下におけるTMEM176Bの発現量および/または機能を比較することを含む。
【0065】
上記のスクリーニング方法において用いられるTMEM176Bを産生する能力を有する細胞としては、それらを生来発現しているヒトもしくは他の哺乳動物細胞またはそれを含む生体試料(例:血液、組織、臓器等)であれば特に制限はない。非ヒト動物由来の血液、組織、臓器等の場合は、それらを生体から単離して培養してもよいし、あるいは生体自体に被検物質を投与し、一定時間経過後にそれら生体試料を単離してもよい。
また、TMEM176Bを産生する能力を有する細胞としては、公知慣用の遺伝子工学的手法により作製された各種の形質転換体が例示される。宿主としては、例えば、H4IIE-C3細胞、HepG2細胞、HEK293細胞、COS7細胞、CHO細胞などの動物細胞が好ましく用いられる。
具体的には、TMEM176BをコードするDNA(即ち、配列番号:1、3、5または7で表される塩基配列または該塩基配列に対し相補性を有する塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号:2、4、6または8で表されるアミノ酸配列からなるタンパク質と同質の機能を有するポリペプチドをコードする塩基配列を含むDNA)を、適当な発現ベクター中のプロモーターの下流に連結して宿主動物細胞に導入することにより調製することができる。
【0066】
TMEM176Bをコードする遺伝子の調製方法について、以下に説明する。
TMEM176Bをコードする遺伝子は、通常の遺伝子工学的方法(例えば、Sambrook J., Frisch E. F., Maniatis T.著、モレキュラークローニング第2版(Molecular Cloning 2nd edition)、コールド スプリング ハーバー ラボラトリー発行(Cold Spring Harbor Laboratory press)等に記載されている方法)に準じて取得することができる。すなわち、TMEM176BをコードするDNAは、例えば、配列番号:1、3、5または7で表される塩基配列に基づいて、適当なオリゴヌクレオチドをプローブもしくはプライマーとして合成し、前記したTMEM176Bを産生する細胞・組織由来のcDNAもしくはcDNAライブラリーから、ハイブリダイゼーション法やPCR法を用いてクローニングすることができる。ハイブリダイゼーションは、例えば、モレキュラー・クローニング(Molecular Cloning)第2版(上記)に記載の方法などに従って行なうことができる。また、市販のライブラリーを使用する場合、ハイブリダイゼーションは、該ライブラリーに添付された使用説明書に記載の方法に従って行なうことができる。
【0067】
DNAの塩基配列は、公知のキット、例えば、MutanTM-super Express Km(宝酒造(株))、MutanTM-K(宝酒造(株))等を用いて、ODA-LA PCR法、Gapped duplex法、Kunkel法等の自体公知の方法あるいはそれらに準じる方法に従って変換することができる。
【0068】
クローン化されたDNAは、目的によりそのまま、または所望により制限酵素で消化するか、リンカーを付加した後に、使用することができる。該DNAはその5’末端側に翻訳開始コドンとしてのATGを有し、また3’末端側には翻訳終止コドンとしてのTAA、TGAまたはTAGを有していてもよい。これらの翻訳開始コドンや翻訳終止コドンは、適当な合成DNAアダプターを用いて付加することができる。
次いで、得られたTMEM176B遺伝子を用いて、通常の遺伝子工学的方法に準じてTMEM176B(タンパク質)を製造・取得することができる。
例えば、TMEM176B遺伝子が宿主細胞中で発現できるようなプラスミドを作製し、これを宿主細胞に導入して形質転換し、さらに形質転換された宿主細胞(形質転換体)を培養することで得られる培養物からTMEM176Bを取得すればよい。上記プラスミドとしては、例えば、宿主細胞中で複製可能な遺伝情報を含み、自律的に複製できるものであって、宿主細胞からの単離・精製が容易であり、宿主細胞中で機能可能なプロモーターを有し、検出可能なマーカーをもつ発現ベクターに、TMEM176Bをコードする遺伝子が導入されたものを好ましく挙げることができる。
尚、発現ベクターとしては、各種のものが市販されている。
例えば、大腸菌での発現に使用される発現ベクターは、lac、trp、tacなどのプロモーターを含む発現ベクターであって、これらはファルマシア社、タカラバイオ等から市販されている。当該発現ベクターにTMEM176Bをコードする遺伝子を導入するために用いられる制限酵素もタカラバイオ等から市販されている。さらなる高発現を導くことが必要な場合には、タンパク質:TMEM176Bをコードする遺伝子の上流にリボゾーム結合領域を連結してもよい。用いられるリボゾーム結合領域としては、Guarente L.ら(Cell 20, p543)や谷口ら(Genetics of Industrial Microorganisms, p202, 講談社)による報告に記載されたものを挙げることができる。
【0069】
また、動物細胞発現プラスミド(例:pA1-11、pXT1、pRc/CMV、pRc/RSV、pcDNAI/Neo);λファージなどのバクテリオファージ;レトロウイルス、ワクシニアウイルス、アデノウイルスなどの動物ウイルスベクターなどを用いることもできる。プロモーターとしては、遺伝子の発現に用いる宿主に対応して適切なプロモーターであればいかなるものでもよい。例えば、SRαプロモーター、SV40プロモーター、LTRプロモーター、CMV(サイトメガロウイルス)プロモーター、RSV(ラウス肉腫ウイルス)プロモーター、MoMuLV(モロニーマウス白血病ウイルス)LTR、HSV-TK(単純ヘルペスウイルスチミジンキナーゼ)プロモーター、βアクチン遺伝子プロモーター、aP2遺伝子プロモーターなどが用いられる。なかでも、CMVプロモーター、SRαプロモーターなどが好ましい。
発現ベクターとしては、上記の他に、所望によりエンハンサー、スプライシングシグナル、ポリA付加シグナル、選択マーカー、SV40複製起点(以下、SV40 oriと略称する場合がある)などを含有しているものを用いることができる。
【0070】
選択マーカーとしては、例えば、ジヒドロ葉酸還元酵素遺伝子(以下、dhfrと略称する場合がある、メソトレキセート(MTX)耐性)、アンピシリン耐性遺伝子(以下、amprと略称する場合がある)、ネオマイシン耐性遺伝子(以下、neorと略称する場合がある、G418耐性)等が挙げられる。特に、dhfr遺伝子欠損チャイニーズハムスター細胞を用い、dhfr遺伝子を選択マーカーとして使用する場合、チミジンを含まない培地によって目的遺伝子を選択することもできる。
【0071】
上記したTMEM176BをコードするDNAを含む発現ベクターで宿主を形質転換することにより、TMEM176B発現細胞を製造することができる。
宿主細胞としては、原核生物もしくは真核生物である微生物細胞、昆虫細胞または哺乳動物細胞等を挙げることができる。哺乳動物細胞としては、例えば、HepG2細胞、HEK293細胞、HeLa細胞、ヒトFL細胞、サルCOS-7細胞、サルVero細胞、チャイニーズハムスター卵巣細胞(以下、CHO細胞と略記)、dhfr遺伝子欠損CHO細胞(以下、CHO(dhfr-)細胞と略記)、マウスL細胞,マウスAtT-20細胞、マウスミエローマ細胞,ラットH4IIE-C3細胞、ラットGH3細胞などが用いられ得る。例えば、TMEM176Bの大量調製が容易になるという観点では、大腸菌等を好ましく挙げることができる。
前記のようにして得られたプラスミドは、通常の遺伝子工学的方法により前記宿主細胞に導入することができる。形質転換体の培養は、微生物培養、昆虫細胞もしくは哺乳動物細胞の培養に使用される通常の方法によって行うことができる。例えば大腸菌の場合、適当な炭素源、窒素源およびビタミン等の微量栄養物を適宜含む培地中で培養を行う。培養方法としては、固体培養、液体培養のいずれの方法でもよく、好ましくは、通気撹拌培養法等の液体培養を挙げることができる。
【0072】
形質転換は、リン酸カルシウム共沈殿法、PEG法、エレクトロポレーション法、マイクロインジェクション法、リポフェクション法などにより行うことができる。例えば、細胞工学別冊8 新細胞工学実験プロトコール,263-267 (1995)(秀潤社発行)、ヴィロロジー(Virology),52巻,456 (1973)に記載の方法を用いることができる。
【0073】
上記のようにして得られる形質転換細胞や生来TMEM176Bを産生する能力を有する哺乳動物細胞または該細胞を含む組織・臓器は、例えば、約5〜20%の胎仔牛血清を含む最小必須培地(MEM)〔Science,122巻,501(1952)〕,ダルベッコ改変イーグル培地(DMEM)〔Virology,8巻,396(1959)〕,RPMI 1640培地〔The Journal of the American Medical Association,199巻,519(1967)〕,199培地〔Proceeding of the Society for the Biological Medicine,73巻,1(1950)〕などの培地中で培養することができる。培地のpHは約6〜8であるのが好ましい。培養は通常約30〜40℃で行ない、必要に応じて通気や撹拌を加える。
【0074】
TMEM176Bの取得は、一般のタンパク質の単離・精製に通常使用される方法を組み合わせて実施すればよい。例えば、前記の培養により得られた形質転換体を遠心分離等で集め、該形質転換体を破砕または溶解せしめ、必要であればタンパク質の可溶化を行い、イオン交換、疎水、ゲルろ過等の各種クロマトグラフィーを用いた工程を単独で、若しくは組み合わせることにより精製すればよい。精製されたタンパク質の高次構造を復元する操作をさらに行ってもよい。また、例えば、前記の培養により得られた形質転換体を遠心分離などで除去し、培養上清からTMEM176Bを前記と同様にして精製してもよい。
【0075】
本発明のスクリーニングを実施するに当たり、被検物質としては、例えばタンパク質、ペプチド、非ペプチド性化合物、合成化合物、発酵生産物、細胞抽出液、植物抽出液、動物組織抽出液などが挙げられ、これらの物質は新規なものであってもよいし、公知のものであってもよい。
また、TMEM176BもしくはTMEM176B遺伝子の発現量を低下させる物質、またはTMEM176Bの機能を低下させる物質を選択する際に、被検物質を接触させない対照細胞を比較対照として用いることもできる。ここで「被検物質を接触させない」とは、被検物質の代わりに被検物質と同量の溶媒(ブランク)を添加する場合や、TMEM176BもしくはTMEM176B遺伝子の発現量またはTMEM176Bの機能に影響を与えないネガティブコントロール物質を添加する場合も含まれる。
【0076】
被検物質の上記細胞との接触は、例えば、上記の培地や各種緩衝液(例えば、HEPES緩衝液、リン酸緩衝液、リン酸緩衝生理食塩水、トリス塩酸緩衝液、ホウ酸緩衝液、酢酸緩衝液など)の中に被検物質を添加して、細胞を一定時間インキュベートすることにより実施することができる。添加される被検物質の濃度は化合物の種類(溶解度、毒性等)により異なるが、例えば、約0.1nM〜約100μMの範囲で適宜選択される。インキュベート時間としては、例えば、約10分〜約24時間が挙げられる。
【0077】
TMEM176Bを産生する細胞が、非ヒト哺乳動物個体の形態で提供される場合、該動物個体の状態は特に制限されないが、例えば、がん細胞を移植したモデルマウス〔例えば、A375SM(ヒト高転移性のメラノーマ細胞)を KSN /Slc nudeマウスの右背部皮下に移植して作製したマウス〕等のモデル動物であってもよい。使用される動物の飼育条件に特に制限はないが、SPFグレード以上の環境下で飼育されたものであることが好ましい。被検物質の該細胞との接触は、該動物個体への被検物質の投与によって行われる。投与経路は特に制限されないが、例えば、静脈内投与、動脈内投与、皮下投与、皮内投与、腹腔内投与、経口投与、気道内投与、直腸投与等が挙げられる。投与量も特に制限はないが、例えば、1回量として約0.5〜20 mg/kgを、1日1〜5回、好ましくは1日1〜3回、1〜14日間投与することができる。
あるいは、上記のスクリーニング方法は、TMEM176Bを産生する能力を有する細胞に代えて、該細胞の抽出液、あるいは該細胞から単離精製したTMEM176Bに、被検物質を接触させることにより行うこともできる。
【0078】
(TMEM176B遺伝子またはTMEM176Bの発現量の測定)
本発明は、TMEM176Bを産生する能力を有する細胞における該タンパク質(遺伝子)の発現を、被検物質の存在下と非存在下で比較することを特徴とする、血管新生阻害活性を有する物質のスクリーニング方法を提供する。本方法において用いられる細胞、被検物質の種類、被検物質と細胞との接触の態様などは、上記と同様である。
【0079】
TMEM176Bの発現量は、前記したTMEM176BをコードするDNAとストリンジェントな条件下でハイブリダイズし得る核酸、即ち、配列番号:1、3、5または7で表される塩基配列もしくはそれと相補的な塩基配列とストリンジェントな条件下でハイブリダイズし得る核酸(DNA)(以下、「本発明の検出用核酸」という場合がある)を用いて、TMEM176B遺伝子のmRNAを検出することにより、RNAレベルで測定することができる。あるいは、該発現量は、前記したTMEM176Bに対する抗体(以下、「本発明の検出用抗体」という場合がある)を用いて、これらのタンパク質を検出することにより、タンパク質レベルで測定することもできる。
従って、より具体的には、本発明は、
(a)TMEM176Bを産生する能力を有する細胞を被検物質の存在下および非存在下に培養し、両条件下における該タンパク質をコードするmRNAの量を、本発明の検出用核酸を用いて測定、比較することを特徴とする、血管新生阻害活性を有する物質のスクリーニング方法、および
(b)TMEM176Bを産生する能力を有する細胞を被検物質の存在下および非存在下に培養し、両条件下における該タンパク質の量を、本発明の検出用抗体を用いて測定、比較することを特徴とする、血管新生阻害活性を有する物質のスクリーニング方法を提供する。
【0080】
すなわち、TMEM176Bの発現量を変化させる物質のスクリーニングは、以下のようにして行うことができる。
(i)正常あるいは疾患(例えば、大腸がん、肺がんなどの移植モデルマウス:KSN /Slc nudeマウスの右背部皮下にがん細胞を移植したモデルマウスなど)モデル非ヒト哺乳動物(例えば、マウス、ラット、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して被検物質を投与し、一定時間経過した後(30分後〜3日後、好ましくは1時間後〜2日後、より好ましくは1時間後〜24時間後)に、血液、あるいは特定の臓器(例えば、脳等)、あるいは臓器から単離した組織または細胞を得る。
TMEM176BのmRNAは、通常の方法により細胞等からmRNAを抽出して定量することができ、あるいは自体公知のノーザンブロット解析により定量することもできる。一方、TMEM176Bのタンパク質量は、ウェスタンブロット解析や以下に詳述する各種イムノアッセイ法を用いて定量することができる。
(ii)TMEM176B遺伝子を発現する細胞(例えば、TMEM176Bを導入した形質転換体)を上記の方法に従って作製し、常法に従って培養する際に被検物質を培地もしくは緩衝液中に添加し、一定時間インキュベート後(1日後〜7日後、好ましくは1日後〜3日後、より好ましくは2日後〜3日後)、該細胞に含まれるTMEM176BあるいはそれをコードするmRNAを、上記(i)と同様にして定量、解析することができる。
【0081】
TMEM176B遺伝子(mRNA)の発現レベルの検出および定量は、前記細胞から調製したRNAまたはそれから転写された相補的なポリヌクレオチドを用いて、ノーザンブロット法、RT-PCR法など公知の方法で実施できる。具体的には、TMEM176B遺伝子の塩基配列において連続する少なくとも15塩基を有するポリヌクレオチドおよび/またはその相補的なポリヌクレオチドをプライマーまたはプローブとして用いることによって、RNA中のTMEM176B遺伝子の発現の有無やその発現レベルを検出、測定することができる。そのようなプローブもしくはプライマーは、TMEM176B遺伝子の塩基配列をもとに、例えばprimer 3( HYPERLINK http://www.genome.wi.mit.edu/cgi-bin/primer/primer3.cgi http://www.genome.wi.mit.edu/cgi-bin/primer/primer3.cgi)あるいはベクターNTI(Infomax社製)を利用して設計することができる。
【0082】
ノーザンブロット法を利用する場合、前記プライマーもしくはプローブを放射性同位元素(32P、33Pなど:RI)や蛍光物質などで標識し、それを、常法に従ってナイロンメンブレン等にトランスファーした細胞由来のRNAとハイブリダイズさせた後、形成された前記プライマーもしくはプローブ(DNAまたはRNA)とRNAとの二重鎖を、前記プライマーもしくはプローブの標識物(RI若しくは蛍光物質)に由来するシグナルとして放射線検出器(BAS-1800II、富士フィルム社製)または蛍光検出器で検出、測定する方法を例示することができる。また、AlkPhos Direct Labelling and Detection System (Amersham PharamciaBiotech社製)を用いて、該プロトコールに従って前記プローブを標識し、細胞由来のRNAとハイブリダイズさせた後、前記プローブの標識物に由来するシグナルをマルチバイオイメージャーSTORM860(Amersham Pharmacia Biotech社製)で検出、測定する方法を使用することもできる。
RT-PCR法を利用する場合は、細胞由来のRNAから常法に従ってcDNAを調製して、これを鋳型として標的のTMEM176B遺伝子の領域が増幅できるように、TMEM176B遺伝子の配列に基づき調製した一対のプライマー(上記cDNA(−鎖)に結合する正鎖、+鎖に結合する逆鎖)をこれとハイブリダイズさせて、常法に従ってPCR法を行い、得られた増幅二本鎖DNAを検出する方法を例示することができる。なお、増幅された二本鎖DNAの検出は、上記PCRを予めRIや蛍光物質で標識しておいたプライマーを用いて行うことによって産生される標識二本鎖DNAを検出する方法、産生された二本鎖DNAを常法に従ってナイロンメンブレン等にトランスファーさせて、標識した前記プライマーをプローブとして使用してこれとハイブリダイズさせて検出する方法などを用いることができる。なお、生成された標識二本鎖DNA産物はアジレント2100バイオアナライザ(横河アナリティカルシステムズ社製)などで測定することができる。また、SYBR Green RT-PCR Reagents (Applied Biosystems 社製)で該プロトコールに従ってRT-PCR反応液を調製し、ABI PRIME 7900 Sequence Detection System (Applied Biosystems 社製)で反応させて、該反応物を検出することもできる。
被検物質を添加した細胞におけるTMEM176B遺伝子の発現が被検物質を添加しない対照細胞での発現量と比較して2/3倍以下、好ましくは1/2倍以下、更に好ましくは1/3倍以下であれば、該被検物質はTMEM176B遺伝子の発現抑制物質として選択することができる。
また、TMEM176Bの発現量を変化させる物質のスクリーニングは、TMEM176B遺伝子の転写調節領域を用いたレポーター遺伝子アッセイで行うことも可能である。ここで、「転写調節領域」とは、通常、当該染色体遺伝子の上流数kbから数十kbの範囲を指し、例えば、(i)5'-レース法(5'-RACE法)(例えば、5'-full Race Core Kit(タカラバイオ社製)等を用いて実施されうる)、オリゴキャップ法、S1プライマーマッピング等の通常の方法により、5'末端を決定するステップ;(ii)Genome Walker Kit(クローンテック社製)等を用いて5'-上流領域を取得し、得られた上流領域について、プロモーター活性を測定するステップ;を含む手法等により同定することが出来る。
【0083】
TMEM176B遺伝子の転写調節領域の下流に機能可能な形でレポータータンパク質をコードする核酸(以下、「レポーター遺伝子」という)を連結して、レポータータンパク質発現ベクターを構築する。該ベクターは当業者に公知の方法で調製すればよい。すなわち、「Molecular Cloning:A Laboratory Manual 2nd edition」(1989),Cold Spring Harbor Laboratory Press、「Current Protocols In Molecular Biology」(1987),John Wiley & Sons,Inc.等に記載される通常の遺伝子工学的手法に従って切り出されたTMEM176B遺伝子の転写調節領域を、レポーター遺伝子を含むプラスミド上に組み込むことができる。
レポータータンパク質としては、β-グルクロニダーゼ(GUS)、ルシフェラーゼ、クロラムフェニコールトランスアセチラーゼ(CAT)、β-ガラクトシダーゼ(GAS)およびグリーン蛍光タンパク質(GFP)等が挙げられる。
調製したTMEM176B遺伝子の転写調節領域を機能可能な形で連結されてなるレポーター遺伝子を、通常の遺伝子工学的手法を用いて、当該レポーター遺伝子を導入する細胞において使用可能なベクターに挿入し、プラスミドを作製し、適当な宿主細胞へ導入することができる。ベクターに搭載される選択マーカー遺伝子に応じた選抜条件の培地で培養することにより、安定な形質転換細胞を得ることができる。あるいは、TMEM176B遺伝子の転写調節領域を機能可能な形で連結されてなるレポーター遺伝子は、宿主細胞内に一過的に発現させてもよい。
また、レポーター遺伝子の発現量を測定する方法としては、個々のレポーター遺伝子に応じた方法を利用すればよい。例えば、レポーター遺伝子としてルシフェラーゼ遺伝子を用いる場合には、前記形質転換細胞を数日間培養後、当該細胞の抽出物を得、次いで当該抽出物をルシフェリンおよびATPと反応させて化学発光させ、その発光強度を測定することによりプロモーター活性を検出することができる。この際、ピッカジーンデュアルキット(登録商標;東洋インキ製)等の市販のルシフェラーゼ反応検出キットを用いることができる。
【0084】
TMEM176Bのタンパク質量の測定方法としては、具体的には、例えば、
(i)本発明の検出用抗体と、試料液および標識化されたTMEM176Bとを競合的に反応させ、該抗体に結合した標識化されたタンパク質を検出することにより試料液中のTMEM176Bを定量する方法や、
(ii)試料液と、担体上に不溶化した本発明の検出用抗体および標識化された別の本発明の検出用抗体とを、同時あるいは連続的に反応させた後、不溶化担体上の標識剤の量(活性)を測定することにより、試料液中のTMEM176Bを定量する方法等が挙げられる。
【0085】
TMEM176Bのタンパク質発現レベルの検出および定量は、TMEM176Bを認識する抗体を用いたウェスタンブロット法等の公知方法に従って定量できる。ウェスタンブロット法は、一次抗体としてTMEM176Bを認識する抗体を用いた後、二次抗体として125Iなどの放射性同位元素、蛍光物質、ホースラディッシュペルオキシダーゼ(HRP)等の酵素等で標識した一次抗体に結合する抗体を用いて標識し、これら標識物質由来のシグナルを放射線測定器(BAI-1800II:富士フィルム社製など)、蛍光検出器などで測定することによって実施できる。また、一次抗体としてTMEM176Bを認識する抗体を用いた後、ECL Plus Western Blotting Detection System(アマシャム ファルマシアバイオテク社製)を利用して該プロトコールに従って検出し、マルチバイオメージャーSTORM860(アマシャム ファルマシアバイオテク社製)で測定することもできる。
【0086】
上記の抗体は、その形態に特に制限はなく、TMEM176Bを免疫抗原とするポリクローナル抗体であっても、またそのモノクローナル抗体であってもよく、さらにはTMEM176Bを構成するアミノ酸配列のうち少なくとも連続する、通常8アミノ酸、好ましくは15アミノ酸、より好ましくは20アミノ酸からなるポリペプチドに対して抗原結合性を有する抗体を用いることもできる。
これらの抗体の製造方法は、すでに周知であり、本発明の抗体もこれらの常法に従って製造することができる(Current protocols in Molecular Biology edit. Ausubel et al. (1987) Publish. John Wiley and Sons. Section 11.12〜11.13)。
【0087】
上記(ii)の定量法においては、2種の抗体はTMEM176Bの異なる部分を認識するものであることが望ましい。例えば、一方の抗体がTMEM176BのN端部を認識する抗体であれば、他方の抗体として該タンパク質のC端部と反応するものを用いることができる。
標識物質を用いる測定法に用いられる標識剤としては、例えば、放射性同位元素、酵素、蛍光物質、発光物質などが用いられる。放射性同位元素としては、例えば、〔125I〕、〔131I〕、〔3H〕、〔14C〕などが用いられる。上記酵素としては、安定で比活性の大きなものが好ましく、例えば、β-ガラクトシダーゼ、β-グルコシダーゼ、アルカリフォスファターゼ、パーオキシダーゼ、リンゴ酸脱水素酵素などが用いられる。蛍光物質としては、例えば、フルオレスカミン、フルオレッセンイソチオシアネートなどが用いられる。発光物質としては、例えば、ルミノール、ルミノール誘導体、ルシフェリン、ルシゲニンなどが用いられる。さらに、抗体あるいは抗原と標識剤との結合にビオチン-(ストレプト)アビジン系を用いることもできる。
【0088】
本発明の検出用抗体を用いるTMEM176Bの定量法は、特に制限されるべきものではなく、試料液中の抗原量に対応した、抗体、抗原もしくは抗体−抗原複合体の量を化学的または物理的手段により検出し、これを既知量の抗原を含む標準液を用いて作製した標準曲線より算出する測定法であれば、いずれの測定法を用いてもよい。例えば、ネフロメトリー、競合法、イムノメトリック法およびサンドイッチ法が好適に用いられる。感度、特異性の点で、例えば、後述するサンドイッチ法を用いるのが好ましい。
【0089】
抗原あるいは抗体の不溶化にあたっては、物理吸着を用いてもよく、また通常タンパク質あるいは酵素等を不溶化・固定化するのに用いられる化学結合を用いてもよい。担体としては、アガロース、デキストラン、セルロースなどの不溶性多糖類、ポリスチレン、ポリアクリルアミド、シリコン等の合成樹脂、あるいはガラス等があげられる。
【0090】
サンドイッチ法においては不溶化した本発明の検出用抗体に試料液を反応させ(1次反応)、さらに標識化した別の本発明の検出用抗体を反応させた(2次反応)後、不溶化担体上の標識剤の量もしくは活性を測定することにより、試料液中のTMEM176Bを定量することができる。1次反応と2次反応は逆の順序で行っても、また、同時に行ってもよいし、時間をずらして行ってもよい。標識化剤および不溶化の方法は前記のそれらに準じることができる。また、サンドイッチ法による免疫測定法において、固相化抗体あるいは標識化抗体に用いられる抗体は必ずしも1種類である必要はなく、測定感度を向上させる等の目的で2種類以上の抗体の混合物を用いてもよい。
【0091】
本発明の検出用抗体は、サンドイッチ法以外の測定システム、例えば、競合法、イムノメトリック法あるいはネフロメトリーなどにも用いることができる。
競合法では、試料液中のTMEM176Bと標識したTMEM176Bとを抗体に対して競合的に反応させた後、未反応の標識抗原(F)と、抗体と結合した標識抗原(B)とを分離し(B/F分離)、B,Fいずれかの標識量を測定することにより、試料液中のTMEM176Bを定量する。本反応法には、抗体として可溶性抗体を用い、ポリエチレングリコールや前記抗体(1次抗体)に対する2次抗体などを用いてB/F分離を行う液相法、および、1次抗体として固相化抗体を用いるか(直接法)、あるいは1次抗体は可溶性のものを用い、2次抗体として固相化抗体を用いる(間接法)固相化法とが用いられる。
イムノメトリック法では、試料液中のTMEM176Bと固相化したTMEM176Bとを一定量の標識化抗体に対して競合反応させた後、固相と液相を分離するか、あるいは試料液中のTMEM176Bと過剰量の標識化抗体とを反応させ、次に固相化したTMEM176Bを加えて未反応の標識化抗体を固相に結合させた後、固相と液相を分離する。次に、いずれかの相の標識量を測定し試料液中の抗原量を定量する。
また、ネフロメトリーでは、ゲル内あるいは溶液中で抗原抗体反応の結果生じた不溶性の沈降物の量を測定する。試料液中のTMEM176Bの量がわずかであり、少量の沈降物しか得られない場合にもレーザーの散乱を利用するレーザーネフロメトリーなどが好適に用いられる。
【0092】
これら個々の免疫学的測定法を本発明の定量方法に適用するにあたっては、特別の条件、操作等の設定は必要とされない。それぞれの方法における通常の条件、操作法に当業者の通常の技術的配慮を加えてTMEM176Bの測定系を構築すればよい。これらの一般的な技術手段の詳細については、総説、成書などを参照することができる。
例えば、入江 寛編「ラジオイムノアッセイ」(講談社、昭和49年発行)、入江 寛編「続ラジオイムノアッセイ」(講談社、昭和54年発行)、石川栄治ら編「酵素免疫測定法」(医学書院、昭和53年発行)、石川栄治ら編「酵素免疫測定法」(第2版)(医学書院、昭和57年発行)、石川栄治ら編「酵素免疫測定法」(第3版)(医学書院、昭和62年発行)、「Methods in ENZYMOLOGY」 Vol. 70 (Immunochemical Techniques (Part A))、同書 Vol. 73 (Immunochemical Techniques (Part B))、同書 Vol. 74 (Immunochemical Techniques (Part C))、同書 Vol. 84 (Immunochemical Techniques (Part D: Selected Immunoassays))、同書 Vol. 92 (Immunochemical Techniques (Part E: Monoclonal Antibodies and General Immunoassay Methods))、同書 Vol. 121 (Immunochemical Techniques (Part I: Hybridoma Technology and Monoclonal Antibodies))(以上、アカデミックプレス社発行)などを参照することができる。
以上のようにして、本発明の検出用抗体を用いることによって、細胞におけるTMEM176Bの量を感度よく定量することができる。
【0093】
例えば、上記スクリーニング法において、被検物質の存在下におけるTMEM176Bの発現量(mRNA量またはタンパク質量)が、被検物質の非存在下における場合に比べて、約20%以上、好ましくは約30%以上、より好ましくは約50%以上阻害された場合、該被検物質を、TMEM176Bの発現抑制物質、従って、血管新生阻害活性を有する物質の候補として選択することができる。
【0094】
あるいは、上記スクリーニング法において、TMEM176B遺伝子を発現する細胞に代えて、TMEM176B遺伝子の内在の転写調節領域の制御下にあるレポーター遺伝子を含む細胞を用いることができる。このような細胞は、TMEM176B遺伝子の転写調節領域の制御下にあるレポーター遺伝子(例、ルシフェラーゼ、GFPなど)を導入したトランスジェニック動物の細胞、組織、臓器もしくは個体であってもよい。かかる細胞を用いる場合には、TMEM176Bの発現量は、レポーター遺伝子の発現レベルを、常法を用いて測定することにより評価することができる。
【0095】
(TMEM176Bの機能の測定)
本発明のスクリーニング方法は、被検物質がTMEM176Bの機能を抑制するか否かを指標として行うこともできる。
具体的には、TMEM176Bを発現する腫瘍血管内皮細胞において、被検物質を添加することにより、該細胞の遊走が抑制されるか否かを測定することにより実施することができる。例えば、被検物質存在下における腫瘍血管内皮細胞の細胞遊走が、被検物質の非存在下における細胞遊走に比べて、約10%以上、好ましくは約20%以上、より好ましくは約30%以上、更に好ましくは約50%以上阻害された場合に、該被検物質を、TMEM176Bの機能抑制物質、従って、血管新生阻害活性を有する物質の候補として選択することができる。
上記のスクリーニング方法において、コントロールとして、常法を用いて作製される、TMEM176B遺伝子がノックアウトされた細胞を用いることにより、被検物質がTMEM176B遺伝子を発現していないコントロール細胞において上記機能を示さないことを確認できる。すなわち、上記のスクリーニング方法において得られる血管新生阻害活性を有する候補物質の作用機序が、TMEM176BもしくはTMEM176B遺伝子の発現抑制またはTMEM176Bの機能抑制に基づくものであることが確認できる。
【0096】
本発明の上記いずれかのスクリーニング方法を用いて得られる、TMEM176Bの発現または機能を抑制する物質は、癌の予防および/または治療用に、医薬として有用である。
本発明のスクリーニング方法を用いて得られる化合物を上述の予防・治療剤として使用する場合、上記TMEM176Bの発現または機能を抑制する低分子化合物と同様に製剤化することができ、同様の投与経路および投与量で、ヒトまたは哺乳動物(例えば、マウス、ラット、ウサギ、ヒツジ、ブタ、ウシ、ウマ、ネコ、イヌ、サル、チンパンジーなど)に対して、経口的にまたは非経口的に投与することができる。
【0097】
VII. 癌の発症または発症リスクの判定方法
また、本発明は、被験動物より採取した試料中のTMEM176Bの発現量を測定することを特徴とする癌の発症または発症リスクの判定方法を提供する。当該方法は以下の(a)および(b)の工程を含む。
(a)被験動物より採取した試料中の、TMEM176B遺伝子もしくはTMEM176Bの発現量、またはTMEM176Bの機能を測定する工程
(b)正常動物由来の試料において測定した場合と比較して、前記発現量もしくは機能が上昇している被験動物を、癌を発症しているか、将来発症するリスクが高いと判定する工程
を提供する。
【0098】
被験動物としては、ヒトもしくは他の哺乳動物が挙げられるが、好ましくはヒト、あるいは実験動物として汎用されるマウス、ラット、ウサギ、イヌ、サル等である。測定対象試料としては、血液、血漿、血清、脳脊髄液、リンパ液、唾液、粘膜、尿、涙、精液、関節液、生検サンプル等が挙げられる。
【0099】
試料中のTMEM176B遺伝子の発現量およびタンパク質:TMEM176Bの量は、該遺伝子もしくは該タンパク質の発現量を指標とする上記スクリーニング法に記載されたのと同様の方法により測定することができる。
上記測定の結果、被験動物より採取した試料中のTMEM176B遺伝子の発現量またはTMEM176Bの量が、正常動物より採取した試料中のTMEM176B遺伝子の発現量またはTMEM176Bの量と比較して有意に高かった場合、該被験動物は、癌を発症しているか、将来発症するリスクが高いと判定することができる。あるいは、正常動物における発現量を予め同定しておき、例えば、その平均値+2SDをカットオフ値として規定し、被験動物より採取した試料中のTMEM176B遺伝子の発現量またはTMEM176Bの量が、当該カットオフ値を超えた場合に、該被験動物は、癌を発症しているか、将来発症するリスクが高いと判定することもできる。
【実施例】
【0100】
以下、実施例により本発明をより詳細に説明するが、本発明はこれらの実施例により何ら限定されるものではない。
【0101】
〔実施例1〕
移植用癌細胞懸濁液の調製
HSC3(ヒト舌癌細胞)は10%FBS(Hyclone社製)を含有するDMEM培地(SIGMA社製)を用いて、A375SM(ヒト高転移性のメラノーマ細胞)は10%FBS(Hyclone社製)を含有するMEM培地(GIBCO社製)を用いて、OSRC2(ヒト腎癌細胞)は10%FBS(Hyclone社製)を含有するRPMI培地(SIGMA社製)を用いて、それぞれ37℃、5% CO2条件下で培養した。培地を吸引除去後、PBS(日水製薬社)で1回洗浄し、0.5%トリプシン‐EDTA溶液(SIGMA 社製)を添加して、37℃、5% CO2条件下5分で剥離した細胞を、10% FBS含有DMEM培地(SIGMA社)を用いて懸濁した。該細胞懸濁液を1000rpm、4℃、5分間遠心して細胞を回収し、ハンクス緩衝液(Hank's buffered salt solution、以下HBSSと記す。GIBCO社製)で1x10 7細胞/mlに希釈・懸濁して移植用癌細胞懸濁液とした。
【0102】
〔実施例2〕
マウスへの癌細胞の移植
6〜7週齢のマウス(ストレイン:KSN/Slc nude、性別:female、ブリーダー:日本エスエルシー)の右背部皮下に、1匹当たり実施例1で調製した移植用癌細胞懸濁液0.1mlを、1mLシリンジ注射器(テルモ社製)と27G針(テルモ社製)を用いて注入した。移植腫瘍の直径が約10mmになるまで飼育した。
【0103】
〔実施例3〕
マウス初代血管内皮細胞の調製
実施例2にて作成した腫瘍皮下移植マウスをイソフルラン(アボットジャパン社製)で全身麻酔後、安楽死させた。腫瘍部分(腫瘍塊)を摘出し、終濃度10〜15mg/ml のII 型コラゲナーゼ(Collagenase Type II、GIBCO社)溶液20ml中でハサミを用いて細かく切断後、終濃度20〜30μg/mlとなるようにDNase(Roche社製)を加え、37℃で30分インキュベート(振蕩)して細胞懸濁液を調製した。該細胞懸濁液を含むチューブを氷上にたて、沈殿した未消化の組織片を除いた懸濁液(上層部分)を100μmメッシュサイズのセルストレーナー(BD Biosciences社製)を通して新しい50mLチューブに移した。そこに該細胞懸濁液と等量のFBSを添加してコラゲナーゼを失活させた。1000rpm、4℃、5分間遠心して細胞を回収後、20mLのHBSS(GIBCO社製)で懸濁した。該細胞懸濁液を同量(20ml)のHistopaque(登録商標)‐1077(SIGMA ALDRICH社製)上に重層し、2000rpm、4℃で20分遠心し、中間層に分離された単核球細胞を回収した。回収液に40mlのHBSS(GIBCO社製)を添加し、1000rpm、4℃で10分間遠心して細胞を回収後、40mlの0.5%BSA(Albumin solution,from bovine serum,30%,ASEPTICALLY FILLED:SIGMA社製)含有HBSSで再懸濁した。1000rpm、4℃、5分間遠心した後、1mlの0.5%BSA含有HBSSで懸濁し、室温で20分インキュベート(攪拌)した。そこに、ラット抗マウスCD31抗体(Purified Rat Anti-mouse CD31、BD Biosciences pharmingen社製)を5μl加え、4℃で30分間インキュベート(攪拌)した。1000rpm、4℃、5分間遠心した後、細胞を0.5%BSA含有HBSS にて懸濁して、再度1000rpm、4℃、5分間遠心した。回収した細胞を80μl の0.5% BSA含有MACS buffer(脱気した2mM EDTA含有PBS緩衝液)で懸濁後、ヤギ抗ラットIgG 磁気ビーズ (Goat Anti-Rat IgG Microbeads、Miltenyi Biotec社製)を20μl加え、4℃で15分間静置した。1000rpm、4℃、5分間遠心し、沈殿した細胞を1mlのMACS bufferで懸濁した。該懸濁液の細胞数が1×107個以下であれば MSカラム(MS Columns、Miltenyi Biotec社製)を、1×107個以上であればLSカラム(LS Columns、Miltenyi Biotec社製)を用いて以下の操作(MACS)を行った。先ず、選択したカラムを付属の磁気マグネットに設置し、500μl のMACS bufferを3回加えキァリブレーション(初期較正)した後、細胞懸濁液1mLをカラムに加え、500μlのMACS bufferで3回洗浄した。カラムをマグネットから外し、カラム内に残った磁気標識されたCD31陽性細胞を、カラムに付随しているシリンジを用い、1mLのMACS bufferで15mlチューブに押し出した。該細胞を血管内皮細胞専用培地EGM-2MV(Lonza社製)を用いて再懸濁し、細胞数を計測後、1.5%ゼラチン(SIGMA社製)含有PBSでコーティングした6 well plate (Nunc社製)に約2x105細胞/ wellの割合でまき、終濃度500ng/mlのジフテリア毒素(Calbiochem社)を含む20%FBS含有EGM-2MV培地で16時間培養後、ジフテリア毒素を含まない培地に変換し約2週間培養した。培養後の細胞を回収し、0.5%BSA含有HBSSにて再懸濁した後、上記CD31抗体の代わりにBS1-B4(Vector Laboratories社)を用いたMACSによってBS1-B4陽性細胞を分離・回収し、腫瘍血管内皮細胞として以下の実験に使用した。一方、正常血管内皮細胞は、腫瘍細胞を移植していないマウスの皮膚血管を出発材料とし、上記腫瘍血管内皮細胞の調製法と同様の操作で調製した。
【0104】
〔実施例4〕
マウス初代血管内皮細胞の培養
血管内皮細胞用増殖培地(ブレットキットEGM-2MV、Lonza社製)を用いて37℃、5% CO2条件下で培養した。継代の際は、フラスコから培地を吸引除去後、PBS(GIBCO社製)で1回洗浄し、0.05%トリプシン‐EDTA溶液(GIBCO社製)を添加後、37℃、5% CO2条件下3分で剥離した細胞を、10% FBS含有DMEM培地(ナカライテスク社製)を添加して懸濁・回収した。該細胞懸濁液を800rpmで室温、5分間遠心して細胞を回収し、EGM-2MV培地で希釈・懸濁して培養した。
【0105】
〔実施例5〕
マウス初代血管内皮細胞へのsiRNAトランスフェクション
0.8mlのEBM-2培地(Lonza社製)に10μMのsiRNA溶液1.44μlとLipofectamine RNAiMAX試薬(Invitrogen社製)8μlを添加して混和後、室温で10〜20分静置して以下に示すsiRNA(センス鎖のみを示す)とリポソームの複合体を形成させた。
mTMEM176B-1 siRNA:CCCUGGGACUAAGUCUCCGAAGUAU(配列番号17)
mTMEM176B-2 siRNA:UGCAAUCAAGCAUGGACCCUGGGUA(配列番号18)
【0106】
そこに、0.5%のFBSを含有するEBM-2培地で9x104細胞/mlに希釈した血管内皮細胞懸濁液を4ml添加し、混合した。該混合液を、RNA調製用として6穴プレート(旭テクノグラス社製)に1.5ml/ウェルで、遊走アッセイ用として6穴プレート(旭テクノグラス社製)に2.25ml/ウェルでそれぞれ分注した。37℃、5% CO2条件下で6時間培養後、等容のEGM-2MV培地(Lonza社製)をそれぞれ添加し、各アッセイを実施するまで37℃、5% CO2条件下で培養した。
尚、ここで用いたsiRNAは、Invitrogen社市販品である(mTMEM176B-1:TMEM176B Stealth Select RNAi siRNA (MSS227202)、およびmTMEM176B-2:TMEM176B Stealth Select RNAi siRNA (MSS227203)である。
【0107】
〔実施例6〕
遊走アッセイ
アンジオジェネシスシステム:血管内皮遊走アッセイ(ベクトン・ディッキンソン社製)を用いて測定した。即ち、siRNAトランスフェクション48時間後に、実施例5にて作成した遊走アッセイ用6穴プレートの培地を吸引除去し、PBS(GIBCO社製)で1回洗浄後、0.2% BSAを含有するEBM-2培地を1〜2ml/ウェルで添加して37℃、5% CO2条件下で2〜3時間培養した。ピペッティングにて細胞を剥離・懸濁させた後、0.2%トリパンブルー(GIBCO社)染色にて細胞数を計測した(10〜20x104細胞/ml程度になるよう、必要に応じて0.2% BSAを含有するEBM-2培地で希釈した)。室温に戻した遊走アッセイ用96穴プレート(ベクトン・ディッキンソン社製)の上部チャンバーに0.075ml/ウェルで上記細胞懸濁液を添加し、続いて、EBM-2培地で10倍希釈したEGM-2MV培地を0.225ml/ウェルで下部ウェルに添加し、CO2インキュベーター(37℃、5% CO2条件下)で16〜20時間培養した。上部チャンバー内の培養液を吸引除去後、HBSS(GIBCO社)にて4μg/mlの濃度に調製した Calcein AM(ベクトン・ディッキンソン社製)溶液0.225ml/ウェルで満たした別の96穴プレート(Falcon社製)に該チャンバーを浸し、そのままCO2インキュベーター(37℃、5% CO2条件下)で90分間培養して、チャンバーメンブレンを通過(遊走)した細胞を蛍光標識した。下方測光型蛍光プレートリーダー(CytoFluorII, PerSeptive Biosystems社製)で蛍光値を測定し(励起波長485nm/測定波長530nm)、上部チャンバーに撒きこんだ細胞数で補正して104細胞当たりの蛍光値を算出した。細胞を含まない培地のみ(ブランク)の測定値を0%、siRNAを含まないトランスフェクション試薬のみを添加した細胞(モック)の測定値を100%として、siRNAを導入した細胞の相対値(%)を計算した。以下の計算式にて遊走抑制率を計算した。
遊走抑制率=100%- siRNAを導入した細胞の相対値(%)
結果を表1に示した。
【0108】
【表1】

【0109】
以上の結果から、TMEM176B遺伝子のsiRNAをトランスフェクションしてTMEM176Bの遺伝子発現を抑制することにより、初代腫瘍血管内皮細胞及び初代正常血管内皮細胞の遊走が抑制された。このことから、TMEM176BのsiRNAは、血管内皮細胞の遊走抑制活性を有することがわかった。
【0110】
〔実施例7〕
定量的RT-PCR
(RNA調製)
実施例5記載の細胞から、QuickGene-800(富士フィルム社製)を用い、添付のプロトコールに従ってRNAを調製した。即ち、siRNAトランスフェクションの48時間後に、実施例5にて作成したRNA調製用6穴プレートの各ウェルから培地を吸引除去した後、QuickGene RNA cultured cell kit S(富士フィルム社製)添付のLRC溶解液に2-メルカプトエタノールを10μl/mlで添加した混合液を350μl/ウェルで添加し、細胞溶解液を調製した。70%エタノール溶液を350μl添加して混合後、10000rpmで室温、1分間遠心して混合液を回収し、回収した混合液全量をキット添付のカートリッジに添加した。該カートリッジをQuickGene-800の所定の場所にセット後、RNAモードを選択してRNAを自動調製した。調製したRNAはNanodrop-1000(Thermo scientific社製)で濃度を測定し、RT-PCR反応に供した。
(RT−PCR)
調製したRNAを鋳型としてTaqMan Reverse Transcription Reagents(ABI社製)を用いてcDNAを合成した。得られたcDNAを鋳型として定量しようとする遺伝子をコードする塩基配列領域を特異的に増幅できるように、一対のプライマー(上記cDNA(−鎖)に結合する正鎖、+鎖に結合する逆鎖)を設計し、通常の方法で合成した。マウスTMEM176Bを定量する際には下記に示される塩基配列からなるプライマー1および2を用いた。
マウスTMEM176B プライマー1:CTCCAAGTCTACTCCTCAAGCTCCA(配列番号19)
マウスTMEM176B プライマー2:CCAGAGTCCTACAGGAAAGCAGAGA(配列番号20)
18S ribosomal RNA プライマー1:GGGAGCCTGAGAAACGGC(配列番号21)
18S ribosomal RNA プライマー2:GGGTCGGGAGTGGGTAATTT(配列番号22)
【0111】
合成したプライマーおよびSYBR Green RT-PCR Reagents (Applied Biosystems 社製)を用いてプロトコールに従ってRT-PCR反応液を調製し、ABI PRIME 7900 Sequence Detection System (Applied Biosystems 社製)で反応させて、該反応物を検出、定量した。各サンプルにおけるマウスTMEM176Bの発現量を18SリボソームRNAの発現量で補正した値をそれぞれのサンプルにおけるTMEM176Bの発現レベルとし、通常、遺伝子発現抑制率は以下の計算式により求めた。
((対照細胞の発現レベル)−(siRNAを導入した細胞の発現レベル))/(対照細胞の発現レベル)×100
ここで対照細胞とは、siRNAを含まない、トランスフェクション試薬のみを添加した細胞(モック)を意味する。表2はマウスTMEM176B遺伝子の各siRNA(実施例5を参照)を、マウス初代腫瘍血管内皮細胞へ導入した際のマウスTMEM176Bの遺伝子発現抑制率を示す。
【0112】
【表2】

【0113】
以上の結果から、mTMEM176B-1、mTMEM176B-2の2種類のsiRNAにより、TMEM176Bの発現が抑制されていることがわかった。
【0114】
〔実施例8〕
マウス初代腫瘍血管内皮細胞での発現
実施例4で調製した細胞から実施例7に記載の方法でRNAを調製し、下記に示される塩基配列からなるプライマー3および4を用い、定量的RT-PCRを実施した。
マウスTMEM176B プライマー3:TGTTCCTAGCGTTCTGCATCATGC(配列番号23)
マウスTMEM176B プライマー4:CCGGCCATACATACTTCGGAGACTT(配列番号24)
その結果、TMEM176Bの発現は、マウス初代正常血管内皮細胞と比較して、マウス初代腫瘍血管内皮細胞で顕著に高いことが示された。(図1)
【0115】
〔実施例9〕
ヒトTMEM176Bの発現抑制
ヒトTMEM176Bに対するsiRNA配列(表3を参照)(19塩基対と2塩基の3'末端オーバーハングとからなる21塩基の二本鎖siRNA)を、アミダイトを用いたホスホロアミダイト法によりRNA合成機(ABI394)にて合成した。
1mlのOpti-MEM培地(GIBCO社製)あたりLipofectamine RNAiMAX試薬(Invitrogen社製)10μlを添加して混和後、6穴プレート(旭テクノグラス社製)に400μl/ウェルで分注した。該RNAiMAX希釈溶液400μlに10μMのsiRNA溶液2μlを添加あるいは非添加し、室温で20分間静置してsiRNAとリポソームの複合体を形成させた。そこに、10%のFBSを含有するDMEM培地(GIBCO社製)で1x105細胞/mlに調製したHEK293(ヒト胎児腎由来細胞株)の細胞懸濁液を1.6ml添加し、37℃、5% CO2条件下で一晩培養した。その後、6穴プレートの各ウェルから培地を吸引除去した後、QuickGene RNA cultured cell kit S(富士フィルム社製)添付のLRC溶解液に2-メルカプトエタノールを10μl/mlで添加した混合液を350μl添加し、細胞溶解液を調製した。以降、実施例7記載の方法でRNAを調製し、ヒトTMEM176Bに特異的なプライマーおよびヒトGAPDHに特異的なプライマーを用い、定量的RT-PCRを実施した。各サンプルにおけるヒトTMEM176Bの発現量をGAPDHの発現量で補正した値をそれぞれのサンプルにおけるTMEM176Bの発現レベルとし、実施例7に記載の方法で遺伝子発現抑制率を求めた。対照細胞としては、無処置の細胞を用いた。
使用したプライマーは以下のとおり。
ヒトTMEM176B プライマー1: CCAATGGCAGAAGGAGGAGTGTAGAG(配列番号25)
ヒトTMEM176B プライマー2: TGCTGTGAACAACTTCCTCAGCATCT(配列番号26)
ヒトGAPDH プライマー1:GCACCGTCAAGGCTGAGAAC(配列番号27)
ヒトGAPDH プライマー2:TGGTGAAGACGCCAGTGGA(配列番号28)
【0116】
各siRNAの配列と遺伝子発現抑制効果を表3に示した。尚、表3には、標的遺伝子のセンス鎖に相当する部分を表示しており、実際に調製したsiRNAは、表3に示した配列の3'末端にオーバーハング配列「dTdT」が付加されている。
【0117】
【表3】

【0118】
以上の結果から、製造したヒトTMEM176BのsiRNAは、ヒトTMEM176Bに対して遺伝子発現抑制効果を有することがわかった。
【産業上の利用可能性】
【0119】
本発明のTMEM176BまたはTMEM176B遺伝子の発現または機能を抑制する物質は、腫瘍血管内皮細胞の遊走抑制活性を示し、医薬、詳しくは癌の治療または予防薬として有用である。また、本発明のスクリーニング方法は、癌の治療または予防薬の候補物質となる、血管新生阻害剤を探索するために有用である。
【0120】
本発明を好ましい態様を強調して説明してきたが、好ましい態様が変更され得ることは当業者にとって自明であろう。本発明は、本発明が本明細書に詳細に記載された以外の方法で実施され得ることを意図する。したがって、本発明は添付の「請求の範囲」の精神および範囲に包含されるすべての変更を含むものである。
ここで述べられた特許および特許出願明細書を含む全ての刊行物に記載された内容は、ここに引用されたことによって、その全てが明示されたと同程度に本明細書に組み込まれるものである。
【配列表フリーテキスト】
【0121】
配列番号17〜18、および29〜43:siRNA
配列番号19〜28:PCRプライマー
【技術分野】
【0001】
本発明は、血管新生阻害剤、詳しくは、腫瘍血管内皮細胞の遊走を抑制する活性を有し、癌治療薬・予防薬等の医薬として有用な物質およびそのスクリーニング方法等に関する。
【背景技術】
【0002】
腫瘍の治療法として現在広く用いられているものの多くは、化学療法であれ、放射線療法であれ、腫瘍細胞の増殖を抑制するものがほとんどである。従って、正常細胞に影響を与えることなく腫瘍細胞選択的に増殖を抑制することが非常に重要であるが、腫瘍細胞に選択的に作用する薬剤でも、腫瘍細胞が他の正常な細胞に比べてはるかに活発に分裂、増殖を繰り返しているという性状に依存するところが大きい。
一方、血管新生は細胞増殖に不可欠であり、悪性腫瘍が増殖する際にも、腫瘍細胞は、増殖に必要な栄養や酸素を得るために自ら血管新生促進物質を産生し、血管新生を誘導する。また、悪性腫瘍が他の臓器や部位へ転移する場合も血管新生が誘導され、腫瘍細胞は血流にのって移動する。そこで、固形腫瘍の増殖を抑制するために、腫瘍細胞への栄養ならびに酸素の供給源である血管新生を断つという治療が提唱されてきた。すなわち腫瘍細胞そのものを攻撃することなく腫瘍細胞を栄養や酸素の枯渇状態に陥れ、結果として腫瘍細胞の増殖抑制、そして退縮という治療効果をあげるというものである。
この手法の具体的な標的として、腫瘍に到達している腫瘍血管があげられている。癌細胞を含む腫瘍は1〜2mm3程度の大きさになると血管新生促進物質を産生し、当該細胞自身の増殖に要する栄養と酸素とを摂取し、代謝老廃物を運び去るためのシステムを自ら構築するようになる。このシステムにより、当該細胞の初期成長が促進される。そのため、血管新生の抑制による腫瘍細胞の増殖・転移抑制が癌治療に有効であると考えられ、血管新生阻害活性を有する物質に関する研究が行われた。
これまで、血管新生阻害剤の研究は、血管内皮細胞株、正常血管内皮細胞を用いて行われてきたが、最近、腫瘍血管と正常血管の性状は極めて異なることが明らかになってきた(非特許文献1を参照)。例えば、正常血管は動脈、静脈、毛細血管が秩序を持った階層構造をとっているのに対し、腫瘍血管は無秩序な走行をしている。また腫瘍血管内皮細胞同士の関係(接着など)は正常血管内皮細胞に比べて疎であり、周皮細胞も少ないため血管の透過性が亢進している。このように腫瘍血管は正常血管に比べて未熟な血管であるといえる。すなわち、癌治療薬として理想的な血管新生阻害剤の標的を発見するには、従来の正常血管内皮細胞を用いた方法では不十分であると言わざるを得ない。そこで、本発明者らは、理想的な血管新生阻害剤の標的因子の探索のため、腫瘍血管内皮細胞の分離培養技術を確立した。
一方、Transmembrane protein 176B(TMEM176B)は、別名LR8またはClast1ともよばれる4つの推定膜貫通領域をもつ蛋白質である。マウスにおいては小脳の発達に、ラットにおいては樹状細胞の成熟化に関与していることがそれぞれ報告されている(非特許文献2及び3を参照)。
しかしながら、その生理的な機能は不明であり、TMEM176Bが腫瘍血管内皮細胞に高発現していることも、TMEM176Bの発現または機能を抑制することによって腫瘍血管内皮細胞の遊走が抑制されることも知られていなかった。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】樋田京子ら著、細胞、第40巻、第12号、第18頁(2008年)
【非特許文献2】Yukiteru Maedaら、Brain Research、第1104巻、第1号、第18-26頁 (2006年)
【非特許文献3】Condamine Tら、J Leukoc Biol.、第88巻、第3号、第507-515項(2010年)
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明が解決しようとする課題は、血管新生阻害剤、詳しくは、腫瘍血管内皮細胞の遊走を抑制する活性を有し、癌治療薬・予防薬等の医薬として有用な物質およびそのスクリーニング方法を提供することにある。
【課題を解決するための手段】
【0005】
本願発明者らは、腫瘍血管新生阻害活性を有する物質を探索するために、腫瘍血管内皮細胞の分離培養を行い、鋭意検討を行った結果、腫瘍血管内皮細胞の遊走に関与する因子の単離および当該因子の発現または機能を抑制する物質の単離に成功した。
すなわち、本発明者らは、正常血管内皮細胞と比較して腫瘍血管内皮細胞において高発現する因子として、TMEM176Bを見出し、更には、TMEM176Bの発現を阻害するsiRNAが腫瘍血管内皮細胞に対して遊走抑制活性を示すことを見出した。本発明は上記の知見をもとに完成するに至ったものである。
即ち本発明は、
〔1〕 TMEM176Bの発現または機能を抑制する物質を有効成分として含有する、抗腫瘍剤;
〔2〕 物質が、TMEM176Bの発現を抑制する、以下の(1)〜(3)からなる群より選択される物質である、〔1〕に記載の剤:
(1)TMEM176Bをコードする遺伝子の転写産物に対するアンチセンス核酸、
(2)TMEM176Bをコードする遺伝子の転写産物に対するリボザイム核酸、及び
(3)TMEM176Bをコードする遺伝子の転写産物に対してRNAi活性を有する核酸もしくはその前駆体;
〔3〕 物質が、TMEM176Bと結合する抗体である、〔1〕に記載の剤;
〔4〕 TMEM176Bが、以下の(a)〜(e)から選択されるいずれかのアミノ酸配列からなるタンパク質である、〔1〕〜〔3〕のいずれかに記載の剤:
(a)配列番号:2、4、6または8で示されるアミノ酸配列、
(b)配列番号:2、4、6または8で示されるアミノ酸配列において、1もしくは複数のアミノ酸が欠失、付加、挿入もしくは置換され、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(c)配列番号:2、4、6または8で示されるアミノ酸配列と60%以上の配列同一性を有し、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(d)配列番号:1、3、5または7で示される塩基配列を有するDNAによりコードされるアミノ酸配列、及び
(e)配列番号:1、3、5または7で示される塩基配列を有するDNAに対し相補性を有するDNAと、ストリンジェントな条件下でハイブリダイズするDNAによりコードされ、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列;
〔5〕 血管新生阻害剤である、〔1〕〜〔4〕のいずれかに記載の剤;
〔6〕 腫瘍血管新生阻害剤である、〔5〕に記載の剤;
〔7〕 腫瘍血管内皮細胞遊走抑制剤である、〔1〕〜〔6〕のいずれかに記載の剤;
〔8〕 TMEM176Bの発現量を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法;
〔9〕 以下の(1)〜(3)の工程を含む、〔8〕に記載のスクリーニング方法:
(1)TMEM176Bをコードする遺伝子もしくは該遺伝子の転写調節領域の制御下にあるレポータータンパク質をコードする核酸を含む細胞に、被検物質を接触させる工程、
(2)前記細胞におけるTMEM176Bもしくはレポータータンパク質の発現量を測定する工程、および
(3)被検物質の非存在下において測定した場合と比較して、発現量を低下させる化合物を血管新生阻害剤の候補として選択する工程;
〔10〕 TMEM176Bをコードする遺伝子の発現量を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法;
〔11〕 TMEM176Bの機能を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法;
〔12〕 癌を発症する危険性があるか否か、あるいは、癌に罹患しているか否かを判定する方法であって、以下の(1)および(2)の工程を含む方法:
(1)被験動物より採取した試料中の、TMEM176Bをコードする遺伝子もしくはTMEM176Bの発現量、またはTMEM176Bの機能を測定する工程、
(2)正常動物由来の試料において測定した場合と比較して、前記発現量もしくは機能が上昇している被験動物を、癌を発症する危険性があるか、癌に罹患していると判定する工程;
〔13〕 以下の群:
(1)配列番号:29〜43で示される塩基配列、及び
(2)配列番号:29〜43で示される塩基配列の3’末端に2〜4塩基が付加された塩基配列、
から選択されるいずれかの塩基配列からなるオリゴヌクレオチド;
〔14〕 二重鎖RNA部分が、配列番号:29〜43から選択されるいずれかの配列番号で示される塩基配列からなる、siRNA;
〔15〕 3’末端に2〜4塩基のオーバーハングが付加されていることを特徴とする、〔14〕に記載のsiRNA;
〔16〕 少なくとも1つの塩基が化学的に修飾されている〔14〕または〔15〕に記載のsiRNA;
〔17〕 少なくとも1つのホスホジエステル結合が化学的に修飾されている〔14〕〜〔16〕のいずれかに記載のsiRNA;
〔18〕 〔14〕〜〔17〕のいずれかに記載のsiRNAを有効成分として含有する抗腫瘍剤;
〔19〕 TMEM176Bの発現または機能を抑制する物質を有効成分として含有する、血管新生阻害剤;
〔20〕 物質が、TMEM176Bの発現を抑制する、以下の(1)〜(3)からなる群より選択される物質である、〔19〕に記載の剤:
(1)TMEM176Bをコードする遺伝子の転写産物に対するアンチセンス核酸、
(2)TMEM176Bをコードする遺伝子の転写産物に対するリボザイム核酸、及び
(3)TMEM176Bをコードする遺伝子の転写産物に対してRNAi活性を有する核酸もしくはその前駆体;
〔21〕 物質が、TMEM176Bと結合する抗体である、〔19〕に記載の剤;
〔22〕 TMEM176Bが、以下の(a)〜(e)から選択されるアミノ酸配列からなるタンパク質である、〔19〕〜〔21〕のいずれかに記載の剤:
(a)配列番号:2、4、6または8で示されるアミノ酸配列、
(b)配列番号:2、4、6または8で示されるアミノ酸配列において、1もしくは複数のアミノ酸が欠失、付加、挿入もしくは置換され、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(c)配列番号:2、4、6または8で示されるアミノ酸配列と60%以上の配列同一性を有し、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(d)配列番号:1、3、5または7で示される塩基配列を有するDNAによりコードされるアミノ酸配列、
(e)配列番号:1、3、5または7で示される塩基配列を有するDNAに対し相補性を有するDNAと、ストリンジェントな条件下でハイブリダイズするDNAによりコードされ、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ
酸配列;
〔23〕 〔14〕〜〔17〕のいずれかに記載のsiRNAを有効成分として含有する血管新生阻害剤;
に関する。
【発明の効果】
【0006】
本発明により、血管新生阻害剤、詳しくは、腫瘍血管内皮細胞の遊走を抑制する活性を有し、癌治療薬・予防薬等の医薬として有用な物質およびそのスクリーニング方法等を提供することが可能になった。
【図面の簡単な説明】
【0007】
【図1】マウス初代腫瘍血管内皮細胞およびマウス初代正常血管内皮細胞でのマウスTMEM176Bの発現量を比較した結果を示す図である。縦軸は、TMEM176BのmRNAの発現量(Quantity値)を示す。正常血管内皮細胞は、正常マウスの皮膚組織から採取した血管内皮細胞を用いた。また、腫瘍血管内皮細胞としては、HSC3(ヒト舌癌細胞)、OSRC2(ヒト腎癌細胞)、A375SM(ヒト高転移性のメラノーマ細胞)をそれぞれ移植したマウスの腫瘍組織より採取した血管内皮細胞を用いた。マウスTMEM176Bの発現は、マウス初代正常血管内皮細胞と比較して、マウス初代腫瘍血管内皮細胞で顕著に高いことが示された。
【発明を実施するための形態】
【0008】
本発明は、TMEM176Bの発現を抑制する物質または機能を抑制する物質を含有してなる、血管新生阻害剤、詳しくは腫瘍血管内皮細胞遊走抑制剤を提供する。
I. TMEM176BまたはこれをコードするTMEM176B遺伝子
本明細書において、TMEM176Bは公知のタンパク質であり、Genbank Accession No.: NP_001094781、NP_001094782、NP_054739、またはNP_001094784として知られている、配列番号:2、4、6または8で表されるヒトTMEM176Bのアミノ酸配列またはこれと実質的に同一のアミノ酸配列を含むタンパク質である。本明細書において、タンパク質およびペプチドは、ペプチド標記の慣例に従って左端がN末端(アミノ末端)、右端がC末端(カルボキシル末端)で記載される。
本明細書において、TMEM176Bはヒトや他の温血動物(例えば、モルモット、ラット、マウス、ニワトリ、ウサギ、イヌ、ブタ、ヒツジ、ウシ、サルなど)の細胞[例えば、ヒト肺線維芽細胞、マウス顆粒細胞など]もしくはそれらの細胞が由来するあらゆる組織[例えば、肺、脳など]または生体内で発現している組織[例えば、胸腺、心臓、肝臓、腎臓、大腸など]等から、公知のタンパク質分離精製技術により単離・精製されるものであってよい。
【0009】
「配列番号:2、4、6または8で表されるアミノ酸配列またはこれと実質的に同一のアミノ酸配列」としては、以下の(a)〜(e)が挙げられる:
(a)配列番号:2、4、6または8で示されるアミノ酸配列;
(b) 配列番号:2、4、6または8で示されるアミノ酸配列において、1もしくは複数のアミノ酸が欠失、付加、挿入もしくは置換され、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列;
(c)配列番号:2、4、6または8で示されるアミノ酸配列と60%以上の相同性を有し、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列;
(d)配列番号:1、3、5または7で示される塩基配列を有するDNAによりコードされるアミノ酸配列;又は、
(e)配列番号:1、3、5または7で示される塩基配列を有するDNAに対し相補性を有するDNAとストリンジェントな条件下でハイブリダイズするDNAによりコードされ、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列。
具体的には、配列番号:2、4、6または8で表されるアミノ酸配列からなるヒトタンパク質の他の哺乳動物におけるオルソログのアミノ酸配列、または配列番号:2、4、6または8で表されるアミノ酸配列からなるヒトタンパク質もしくはそのオルソログのスプライスバリアント、アレル変異体もしくは多型バリアントにおけるアミノ酸配列が挙げられる。
ここで「相同性」とは、当該技術分野において公知の数学的アルゴリズムを用いて2つのアミノ酸配列をアラインさせた場合の、最適なアラインメント(好ましくは、該アルゴリズムは最適なアラインメントのために配列の一方もしくは両方へのギャップの導入を考慮し得るものである)における、オーバーラップする全アミノ酸残基に対する同一アミノ酸および類似アミノ酸残基の割合(%)を意味する。「類似アミノ酸」とは物理化学的性質において類似したアミノ酸を意味し、例えば、芳香族アミノ酸(Phe、Trp、Tyr)、脂肪族アミノ酸(Ala、Leu、Ile、Val)、極性アミノ酸(Gln、Asn)、塩基性アミノ酸(Lys、Arg、His)、酸性アミノ酸(Glu、Asp)、水酸基を有するアミノ酸(Ser、Thr)、側鎖の小さいアミノ酸(Gly、Ala、Ser、Thr、Met)などの同じグループに分類されるアミノ酸が挙げられる。このような類似アミノ酸による置換はタンパク質の表現型に変化をもたらさない(即ち、保存的アミノ酸置換である)ことが予測される。保存的アミノ酸置換の具体例は当該技術分野で周知であり、種々の文献に記載されている(例えば、Bowieら,Science, 247: 1306-1310 (1990)を参照)。
【0010】
本明細書におけるアミノ酸配列の相同性は、相同性計算アルゴリズムNCBI BLAST(National Center for Biotechnology Information Basic Local Alignment Search Tool)を用い、以下の条件(期待値=10;ギャップを許す;マトリクス=BLOSUM62;フィルタリング=OFF)にて計算することができる。アミノ酸配列の相同性を決定するための他のアルゴリズムとしては、例えば、Karlinら, Proc. Natl. Acad. Sci. USA, 90: 5873-5877 (1993)に記載のアルゴリズム[該アルゴリズムはNBLASTおよびXBLASTプログラム(version 2.0)に組み込まれている(Altschulら, Nucleic Acids Res., 25: 3389-3402 (1997))]、Needlemanら, J. Mol. Biol., 48: 444-453 (1970)に記載のアルゴリズム[該アルゴリズムはGCGソフトウェアパッケージ中のGAPプログラムに組み込まれている]、MyersおよびMiller, CABIOS, 4: 11-17 (1988)に記載のアルゴリズム[該アルゴリズムはCGC配列アラインメントソフトウェアパッケージの一部であるALIGNプログラム(version 2.0)に組み込まれている]、Pearsonら, Proc. Natl. Acad. Sci. USA, 85: 2444-2448 (1988)に記載のアルゴリズム[該アルゴリズムはGCGソフトウェアパッケージ中のFASTAプログラムに組み込まれている]等が挙げられ、それらも同様に好ましく用いられ得る。
【0011】
上記(e)におけるストリンジェントな条件とは、例えば、Current Protocols in Molecular Biology, John Wiley & Sons,6.3.1-6.3.6, 1999に記載される条件、例えば、6×SSC(sodium chloride/sodium citrate)/45℃でのハイブリダイゼーション、次いで0.2×SSC/0.1% SDS/50〜65℃での一回以上の洗浄等が挙げられるが、当業者であれば、これと同等のストリンジェンシーを与えるハイブリダイゼーションの条件を適宜選択することができる。
【0012】
より好ましくは、「配列番号:2、4、6または8で表されるアミノ酸配列と実質的に同一のアミノ酸配列」として、配列番号:2、4、6または8で表されるアミノ酸配列と、約60%以上、好ましくは約90%以上、より好ましくは約95%以上、いっそう好ましくは約97%以上、特に好ましくは約98%以上、最も好ましくは約99%以上の同一性を有するアミノ酸配列が挙げられる。
【0013】
「配列番号:2、4、6または8で表されるアミノ酸配列と実質的に同一のアミノ酸配列を含むタンパク質」は、配列番号:2、4、6または8で表されるアミノ酸配列と実質的に同一のアミノ酸配列を含み、かつ配列番号:2、4、6または8で表されるアミノ酸配列からなるタンパク質と実質的に同質の機能を有するタンパク質である。
ここで「実質的に同質の機能」とは、例えば生理学的に、あるいは薬理学的にみて、その性質が定性的に同じであることを意味し、機能の程度(例、約0.1〜約10倍、好ましくは0.5〜2倍)や、タンパク質の分子量などの量的要素は異なっていてもよい。また、現時点でTMEM176Bの生体内での役割、すなわち生理機能は未知であるが、配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るタンパク質を、「実質的に同質の機能を有するタンパク質」と見なすことができる。
【0014】
本発明におけるタンパク質:TMEM176Bとして、例えば、(i)配列番号:2、4、6または8で表されるアミノ酸配列中の1〜50個、好ましくは1〜30個、より好ましくは1〜10個、さらに好ましくは1〜数(5、4、3もしくは2)個のアミノ酸が欠失したアミノ酸配列、(ii)配列番号:2、4、6または8で表されるアミノ酸配列に1〜50個、好ましくは1〜30個、より好ましくは1〜10個、さらに好ましくは1〜数(5、4、3もしくは2)個のアミノ酸が付加したアミノ酸配列、(iii)配列番号:2、4、6または8で表されるアミノ酸配列に1〜50個、好ましくは1〜30個、より好ましくは1〜10個、さらに好ましくは1〜数(5、4、3もしくは2)個のアミノ酸が挿入されたアミノ酸配列、(iv)配列番号:2、4、6または8で表されるアミノ酸配列中の1〜50個、好ましくは1〜30個、より好ましくは1〜10個、さらに好ましくは1〜数(5、4、3もしくは2)個のアミノ酸が他のアミノ酸で置換されたアミノ酸配列、または(v)それらを組み合わせたアミノ酸配列を含有するタンパク質などのいわゆるムテインも含まれる。
上記のようにアミノ酸配列が挿入、欠失、付加または置換されている場合、その挿入、欠失、付加または置換の位置は、配列番号:2、4、6または8で表わされるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得る限り、特に限定されない。
ここでアミノ酸の欠失、付加、挿入または置換を人為的に行う場合の手法としては、例えば、配列番号:2、4、6または8で示されるアミノ酸配列をコードするDNAに対して慣用の部位特異的変異導入を施し、その後このDNAを常法により発現させる手法が挙げられる。ここで部位特異的変異導入法としては、例えば、アンバー変異を利用する方法(ギャップド・デュプレックス法、Nucleic Acids Res., 12,9441-9456(1984))、変異導入用プライマーを用いたPCRによる方法等が挙げられる。
【0015】
TMEM176Bの好ましい例としては、例えば、配列番号:2、4、6または8で表されるアミノ酸配列からなるヒトタンパク質(Genbank Accession No.: NP_001094781、NP_001094782、NP_054739、またはNP_001094784)、あるいは他の哺乳動物におけるそのオルソログ(例えば、マウスTMEM176Bタンパク質(配列番号10、12、14または16、Genbank Accession No. NP_075543、NP_001157679、NP_001157680またはNP_001157681)、ラットTMEM176B(Genbank Accession No. NP_599217)等)、アレル変異体、多型バリアント〔例えば一塩基多型(SNPs)〕などがあげられる。
【0016】
「TMEM176Bをコードする遺伝子」は、上記(a)〜(e)で示される、配列番号:2、4、6または8で表されるアミノ酸配列またはこれと実質的に同一のアミノ酸配列をコードする塩基配列を有する遺伝子を表す。具体的には、以下の(f)〜(j):
(f)配列番号:2、4、6または8で示されるアミノ酸配列をコードする塩基配列、
(g)配列番号:2、4、6または8で示されるアミノ酸配列において、1もしくは複数のアミノ酸が欠失、付加、挿入もしくは置換され、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列をコードする塩基配列、
(h)配列番号:2、4、6または8で示されるアミノ酸配列と60%以上の相同性を有し、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列をコードする塩基配列、
(i)配列番号:1、3、5または7で示される塩基配列、
(j)配列番号:1、3、5または7で示される塩基配列を有するDNAに対し相補性を有するDNAとストリンジェントな条件下でハイブリダイズするDNAの塩基配列であって、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列をコードする塩基配列、
を有する遺伝子が挙げられる。
尚、ここで遺伝子とは、cDNAもしくはゲノムDNA等のDNA、またはmRNA等のRNAのいずれでもよく、また一本鎖の核酸配列および二本鎖の核酸配列を共に含む概念である。また、本明細書において、配列番号:1、3、5または7等に示される核酸配列は、便宜的にDNA配列であるが、mRNAなどRNA配列を示す場合には、チミン(T)をウラシル(U)として解する。
【0017】
II.TMEM176Bの発現を抑制する物質
本発明において「TMEM176Bの発現を抑制する物質」とは、TMEM176Bをコードする遺伝子(TMEM176B遺伝子)の転写レベル、転写後調節のレベル、TMEM176Bへの翻訳レベル、翻訳後修飾のレベル等のいかなる段階で作用するものであってもよい。従って、TMEM176Bの発現を抑制する物質としては、例えば、TMEM176B遺伝子の転写を阻害する物質(例、アンチジーン)、初期転写産物からmRNAへのプロセッシングを阻害する物質、mRNAの細胞質への輸送を阻害する物質、mRNAからTMEM176Bの翻訳を阻害するか(例、アンチセンス核酸、miRNA)あるいはmRNAを分解する(例、siRNA、リボザイム)物質、初期翻訳産物の翻訳後修飾を阻害する物質などが含まれる。いずれの段階で作用するものであっても好ましく用いることができるが、
より好ましくは、以下の(1)〜(3)からなる群より選択される物質が例示される。
(1)TMEM176Bをコードする遺伝子の転写産物に対するアンチセンス核酸、
(2)TMEM176Bをコードする遺伝子の転写産物に対するリボザイム核酸、及び
(3)TMEM176Bをコードする遺伝子の転写産物に対してRNAi活性を有する核酸もしくはその前駆体。
転写産物の好ましい例としては、mRNAが挙げられる。
【0018】
TMEM176B遺伝子のmRNAからTMEM176Bへの翻訳を特異的に阻害する(あるいはmRNAを分解する)物質として、好ましくは、これらのmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸が挙げられる。
TMEM176B遺伝子のmRNAの塩基配列と実質的に相補的な塩基配列とは、哺乳動物の標的組織である腫瘍血管の生理的条件下において、該mRNAの標的配列に結合してその翻訳を阻害し得る(あるいは該標的配列を切断する)程度の相補性を有する塩基配列を意味し、具体的には、例えば、該mRNAの塩基配列と完全相補的な塩基配列(すなわち、mRNAの相補鎖の塩基配列)と、オーバーラップする領域に関して、約80%以上、好ましくは約90%以上、より好ましくは約95%以上、特に好ましくは約97%以上の相同性を有する塩基配列である。
本発明における「塩基配列の相同性」は、相同性計算アルゴリズムNCBI BLAST(National Center for Biotechnology Information Basic Local Alignment Search Tool)を用い、以下の条件(期待値=10;ギャップを許す;フィルタリング=ON;マッチスコア=1;ミスマッチスコア=-3)にて計算することができる。
【0019】
より具体的には、TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列としては、以下の(k)または(l):
(k)配列番号:1、3、5または7で表される塩基配列と相補的もしくは実質的に相補的な塩基配列;
(l)配列番号:1、3、5または7で表される塩基配列とストリンジェントな条件下でハイブリダイズする塩基配列であって、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るタンパク質をコードする配列と相補的もしくは実質的に相補的な塩基配列;
が挙げられる。
ストリンジェントな条件は、前述のとおりである。
【0020】
TMEM176B遺伝子のmRNAの好ましい例としては、配列番号:1、3、5または7で表される塩基配列(Genbank Accession No.:NM_001101311、NM_001101312、NM_014020またはNM_001101314)を含むヒトTMEM176BのmRNA、あるいは他の哺乳動物におけるそれらのオルソログ(例えば、マウスTMEM176B(配列番号9、11、13または15、Genbank Accession No.:NM_023056、NM_001164207、NM_001164208またはNM_001164209)、ラットTMEM176B(Genbank Accession No. NM_134390)等)、さらにはそれらのスプライスバリアント、アレル変異体、多型バリアント等が挙げられる。
【0021】
TMEM176B遺伝子のmRNAの塩基配列と「相補的もしくは実質的に相補的な塩基配列の一部」とは、TMEM176B遺伝子のmRNAに特異的に結合することができ、且つ該mRNAからのタンパク質の翻訳を阻害(あるいは該mRNAを分解)し得るものであれば、その長さや位置に特に制限はないが、配列特異性の面から、標的配列に相補的もしくは実質的に相補的な部分を少なくとも10塩基以上、好ましくは約15塩基以上を含むものである。
【0022】
具体的には、TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸として、以下の(1)〜(3)のいずれかのものが好ましく例示される:
(1) TMEM176B遺伝子のmRNAに対するアンチセンス核酸、
(2) TMEM176B遺伝子のmRNAに対するリボザイム核酸、
(3) TMEM176B遺伝子のmRNAに対してRNAi活性を有する核酸もしくはその前駆体。
【0023】
(1) TMEM176B遺伝子のmRNAに対するアンチセンス核酸
本発明における「TMEM176B遺伝子のmRNAに対するアンチセンス核酸」とは、該mRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸であって、標的mRNAと特異的かつ安定した二重鎖を形成して結合することにより、タンパク質合成を抑制する機能を有するものである。
アンチセンス核酸は、2-デオキシ-D-リボースを含有しているポリデオキシリボヌクレオチド、D-リボースを含有しているポリリボヌクレオチド、プリンまたはピリミジン塩基のN-グリコシドであるその他のタイプのポリヌクレオチド、非ヌクレオチド骨格を有するその他のポリマー(例えば、市販のタンパク質核酸および合成配列特異的な核酸ポリマー)または特殊な結合を含有するその他のポリマー(但し、該ポリマーはDNAやRNA中に見出されるような塩基のペアリングや塩基の付着を許容する配置をもつヌクレオチドを含有する)などが挙げられる。それらは、二本鎖DNA、一本鎖DNA、二本鎖RNA、一本鎖RNA、DNA:RNAハイブリッドであってもよく、さらに非修飾ポリヌクレオチド(または非修飾オリゴヌクレオチド)、公知の修飾の付加されたもの、例えば当該分野で知られた標識のあるもの、キャップの付いたもの、メチル化されたもの、1個以上の天然のヌクレオチドを類縁物で置換したもの、分子内ヌクレオチド修飾のされたもの、例えば非荷電結合(例えば、メチルホスホネート、ホスホトリエステル、ホスホルアミデート、カルバメートなど)を持つもの、電荷を有する結合または硫黄含有結合(例、ホスホロチオエート、ホスホロジチオエートなど)を持つもの、例えばタンパク質(例、ヌクレアーゼ、ヌクレアーゼ・インヒビター、トキシン、抗体、シグナルペプチド、ポリ-L-リジンなど)や糖(例、モノサッカライドなど)などの側鎖基を有しているもの、インターカレント化合物(例、アクリジン、ソラレンなど)を持つもの、キレート化合物(例えば、金属、放射活性をもつ金属、ホウ素、酸化性の金属など)を含有するもの、アルキル化剤を含有するもの、修飾された結合を持つもの(例えば、αアノマー型の核酸など)であってもよい。ここで「ヌクレオシド」、「ヌクレオチド」および「核酸」とは、プリンおよびピリミジン塩基を含有するのみでなく、修飾されたその他の複素環型塩基をもつようなものを含んでいて良い。このような修飾物は、メチル化されたプリンおよびピリミジン、アシル化されたプリンおよびピリミジン、あるいはその他の複素環を含むものであってよい。修飾されたヌクレオシドおよび修飾されたヌクレオチドはまた糖部分が修飾されていてよく、例えば、1個以上の水酸基がハロゲンとか、脂肪族基などで置換されていたり、またはエーテル、アミンなどの官能基に変換されていたりしてよい。
【0024】
上記の通り、アンチセンス核酸はDNAであってもRNAであってもよく、あるいはDNA/RNAキメラであってもよい。アンチセンス核酸がDNAの場合、標的RNAとアンチセンスDNAとによって形成されるRNA:DNAハイブリッドは、内在性RNase Hに認識されて標的RNAの選択的な分解を引き起こすことができる。したがって、RNase Hによる分解を指向するアンチセンスDNAの場合、標的配列は、mRNA中の配列だけでなく、TMEM176B遺伝子の初期翻訳産物におけるイントロン領域の配列であってもよい。イントロン配列は、ゲノム配列と、TMEM176B遺伝子のcDNA塩基配列とをBLAST、FASTA等のホモロジー検索プログラムを用いて比較することにより、決定することができる。
【0025】
本発明のアンチセンス核酸の標的領域は、該アンチセンス核酸がハイブリダイズすることにより、結果としてタンパク質:TMEM176Bへの翻訳が阻害されるものであればその長さに特に制限はなく、TMEM176BをコードするmRNAの全配列であっても部分配列であってもよく、短いもので約10塩基程度、長いものでmRNAもしくは初期転写産物の全配列が挙げられる。合成の容易さや抗原性、細胞内移行性の問題等を考慮すれば、約10〜約40塩基、特に約15〜約30塩基からなるオリゴヌクレオチドが好ましいが、それに限定されない。具体的には、TMEM176B遺伝子の5’端ヘアピンループ、5’端6-ベースペア・リピート、5’端非翻訳領域、翻訳開始コドン、タンパク質コード領域、ORF翻訳終止コドン、3’端非翻訳領域、3’端パリンドローム領域または3’端ヘアピンループなどが、アンチセンス核酸の好ましい標的領域として選択しうるが、それらに限定されない。
【0026】
さらに、本発明のアンチセンス核酸は、TMEM176B遺伝子のmRNAや初期転写産物とハイブリダイズしてタンパク質への翻訳を阻害するだけでなく、二本鎖DNAであるこれらの遺伝子と結合して三重鎖(トリプレックス)を形成し、RNAへの転写を阻害し得るもの(アンチジーン)であってもよい。
【0027】
アンチセンス核酸を構成するヌクレオチド分子は、天然型のDNAもしくはRNAでもよいが、安定性(化学的および/または対酵素)や比活性(RNAとの親和性)を向上させるために、種々の化学修飾を含むことができる。例えば、ヌクレアーゼなどの加水分解酵素による分解を防ぐために、アンチセンス核酸を構成する各ヌクレオチドのリン酸残基(ホスフェート)を、例えば、ホスホロチオエート(PS)、メチルホスホネート、ホスホロジチオネートなどの化学修飾リン酸残基に置換することができる。また、各ヌクレオチドの糖(リボース)の2’位の水酸基を、-OR(R=CH3(2’-O-Me)、CH2CH2OCH3(2’-O-MOE)、CH2CH2NHC(NH)NH2、CH2CONHCH3、CH2CH2CN等)に置換してもよい。さらに、塩基部分(ピリミジン、プリン)に化学修飾を施してもよく、例えば、ピリミジン塩基の5位へのメチル基やカチオン性官能基の導入、あるいは2位のカルボニル基のチオカルボニルへの置換などが挙げられる。
【0028】
RNAの糖部のコンフォメーションはC2’-endo(S型)とC3’-endo(N型)の2つが支配的であり、一本鎖RNAではこの両者の平衡として存在するが、二本鎖を形成するとN型に固定される。したがって、標的RNAに対して強い結合能を付与するために、2’酸素と4’炭素を架橋することにより、糖部のコンフォメーションをN型に固定したRNA誘導体であるBNA(LNA)(Imanishi, T. et al., Chem. Commun., 1653-9, 2002; Jepsen, J.S. et al., Oligonucleotides, 14, 130-46, 2004)やENA(Morita, K. et al., Nucleosides Nucleotides Nucleic Acids, 22, 1619-21, 2003)もまた、好ましく用いられ得る。
【0029】
本発明のアンチセンスオリゴヌクレオチドは、TMEM176B遺伝子のcDNA配列もしくはゲノミックDNA配列に基づいてmRNAもしくは初期転写産物の標的配列を決定し、市販のDNA/RNA自動合成機(アプライド・バイオシステムズ社、ベックマン社等)を用いて、これに相補的な配列を合成することにより調製することができる。また、上記した各種修飾を含むアンチセンス核酸も、いずれも自体公知の手法により、化学的に合成することができる。
【0030】
(2) TMEM176B遺伝子のmRNAに対するリボザイム核酸
TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸の他の好ましい例としては、該mRNAをコード領域の内部で特異的に切断し得るリボザイム核酸が挙げられる。「リボザイム」とは、狭義には、核酸を切断する酵素活性を有するRNAをいうが、本明細書では配列特異的な核酸切断活性を有する限りDNAをも包含する概念として用いるものとする。リボザイム核酸として最も汎用性の高いものとしては、ウイロイドやウイルソイド等の感染性RNAに見られるセルフスプライシングRNAがあり、ハンマーヘッド型やヘアピン型等が知られている。ハンマーヘッド型は約40塩基程度で酵素活性を発揮し、ハンマーヘッド構造をとる部分に隣接する両端の数塩基ずつ(合わせて約10塩基程度)をmRNAの所望の切断部位と相補的な配列にすることにより、標的mRNAのみを特異的に切断することが可能である。このタイプのリボザイム核酸は、RNAのみを基質とするので、ゲノムDNAを攻撃することがないというさらなる利点を有する。TMEM176B遺伝子のmRNAが自身で二本鎖構造をとる場合には、RNAヘリカーゼと特異的に結合し得るウイルス核酸由来のRNAモチーフを連結したハイブリッドリボザイムを用いることにより、標的配列を一本鎖にすることができる[Proc. Natl. Acad. Sci. USA, 98(10): 5572-5577 (2001)]。さらに、リボザイムを、それをコードするDNAを含む発現ベクターの形態で使用する場合には、転写産物の細胞質への移行を促進するために、tRNAを改変した配列をさらに連結したハイブリッドリボザイムとすることもできる[Nucleic Acids Res., 29(13): 2780-2788 (2001)]。
【0031】
(3) TMEM176B遺伝子のmRNAに対するsiRNA
本明細書においては、TMEM176B遺伝子のmRNAに相補的なオリゴRNAとその相補鎖とからなる二本鎖RNA、いわゆるsiRNAもまた、TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸に包含されるものとして定義される。短い二本鎖RNAを細胞内に導入するとそのRNAに相補的なmRNAが分解される、いわゆるRNA干渉(RNAi)と呼ばれる現象は、以前から線虫、昆虫、植物等で知られていたが、この現象が動物細胞でも広く起こることが確認されて以来[Nature, 411(6836): 494-498 (2001)]、上記のアンチセンス核酸やリボザイムの代替技術として汎用されている。
【0032】
siRNAは、標的遺伝子のcDNA配列情報に基づいて、例えば、Elbashirら(Genes Dev., 15, 188-200 (2001))、Teramotoら(FEBS Lett. 579(13):p2878-82(2005))の提唱する規則に従って設計することができる。siRNAの標的配列は、原則的には15〜50塩基、好ましくは19〜49塩基、更に好ましくは19〜27塩基の長さを有しており、例えばAA+(N)19(AAに続く、19塩基の塩基配列)、AA+(N)21(AAに続く、21塩基の塩基配列)もしくはA+(N)21(Aに続く、21塩基の塩基配列)であってもよい。
本発明の核酸は、5’または3’末端に、付加的な塩基を有していてもよい。該付加的塩基の長さは、通常2〜4塩基程度であり、siRNAの全長として19塩基以上である。該付加的塩基は、DNAでもRNAでもよいが、DNAを用いると核酸の安定性を向上させることができる場合がある。このような付加的塩基の配列としては、例えばug-3’、uu-3’、tg-3’、tt-3’、ggg-3’、guuu-3’、gttt-3’、ttttt-3’、uuuuu-3’などの配列が挙げられるが、これらに限定されるものではない。
また、siRNAは、3'末端に突出部配列(オーバーハング)を有していてもよく、具体的には、dTdT(dTはデオキシリボ核酸のデオキシチミジン残基を表わす)を付加したものが挙げられる。また、末端付加がない平滑末端(ブラントエンド)であってもよい。
また、siRNAは、センス鎖とアンチセンス鎖が異なる塩基数であってもよく、例えば、アンチセンス鎖が3'末端および5'末端に突出部配列(オーバーハング)を有している「aiRNA」を挙げることができる。典型的なaiRNAは、アンチセンス鎖が21塩基からなり、センス鎖が15塩基からなり、アンチセンス鎖の両端で各々3塩基のオーバーハング構造をとる(Sun, X.ら著、Nature Biotechnology Vol26 No.12 p1379、国際公開第WO2009/029688号パンフレット)。
具体的には、実施例5に記載されているような、25塩基長のブラントエンド型のsiRNAや、実施例9に記載されているような標的配列部分が19塩基長で3'末端にdTdTを付加された合計21塩基長のsiRNAが挙げられる。
標的配列の位置は特に制限されるわけではないが、5’-UTRおよび開始コドンから約50塩基まで、並びに3’-UTR以外の領域から標的配列を選択することが望ましい。上述の規則その他に基づいて選択された標的配列の候補群について、標的以外のmRNAにおいて16-17塩基の連続した配列に相同性がないかどうかを、BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)等のホモロジー検索ソフトを用いて調べ、選択した標的配列の特異性を確認する。特異性の確認された標的配列について、AA(もしくはNA)以降の19-21塩基にTTもしくはUUの3’末端オーバーハングを有するセンス鎖と、該19-21塩基に相補的な配列およびTTもしくはUUの3’末端オーバーハングを有するアンチセンス鎖とからなる2本鎖RNAをsiRNAとして設計してもよい。また、siRNAの前駆体であるショートヘアピンRNA(shRNA)は、ループ構造を形成しうる任意のリンカー配列(例えば、5-25塩基程度)を適宜選択し、上記センス鎖とアンチセンス鎖とを該リンカー配列を介して連結することにより設計することができる。
【0033】
siRNAおよび/またはshRNAの配列は、種々のwebサイト上に無料で提供される検索ソフトを用いて検索が可能である。このようなサイトとしては、例えば、Ambionが提供するsiRNA Target Finder(http://www.ambion.com/jp/techlib/misc/siRNA_finder.html)およびpSilencer(登録商標) Expression Vector用インサートデザインツール(http://www.ambion.com/jp/techlib/misc/psilencer_converter.html)、RNAi Codexが提供するGeneSeer(http://codex.cshl.edu/scripts/newsearchhairpin.cgi)があるがこれらに限定されない。
【0034】
siRNAを構成するリボヌクレオシド分子もまた、安定性、比活性などを向上させるために、上記のアンチセンス核酸の場合と同様の修飾を受けていてもよい。但し、siRNAの場合、天然型RNA中のすべてのリボヌクレオシド分子を修飾型で置換すると、RNAi活性が失われる場合があるので、RISC複合体が機能できる最小限の修飾ヌクレオシドの導入が必要である。
当該修飾として具体的には、siRNAを構成するヌクレオチド分子の一部を、天然型のDNAや、安定性(化学的および/または対酵素)や比活性(RNAとの親和性)を向上させるために、種々の化学修飾を施したRNAに置換することができる(Usman and Cedergren,1992,TIBS 17,34;Usman et al.,1994,Nucleic Acids Symp.Ser.31,163を参照)。例えば、ヌクレアーゼなどの加水分解酵素による分解を防ぐために、siRNAを構成する各ヌクレオチドのリン酸残基(ホスフェート)を、例えば、ホスホロチオエート(PS)、メチルホスホネート、ホスホロジチオネートなどの化学修飾リン酸残基に置換することができる。また、各ヌクレオチドの糖(リボース)の2’位の水酸基を、-OR(R=CH3(2’-O-Me)、CH2CH2OCH3(2’-O-MOE)、CH2CH2NHC(NH)NH2、CH2CONHCH3、CH2CH2CN等)、フッ素原子(-F)に置換してもよい。さらに、塩基部分(ピリミジン、プリン)に化学修飾を施してもよく、例えば、ピリミジン塩基の5位へのメチル基やカチオン性官能基の導入、あるいは2位のカルボニル基のチオカルボニルへの置換などが挙げられる。その他上記(1)に記載されたアンチセンス核酸における修飾方法を用いることができる。あるいは、siRNAにおけるRNAの一部をDNAに置換する化学修飾(2'-デオキシ化、2'-H)を施してもよい。また、糖(リボース)の2'位と4'位を-O-CH2-で架橋しコンフォメーションを N 型に固定した人工核酸(LNA:Locked Nucleic Acid)を用いてもよい。
また、siRNAを構成するセンス鎖およびアンチセンス鎖は、リンカーを介し、細胞表層に存在する受容体を特異的に認識するリガンド、ペプチド、糖鎖、抗体、脂質や正電荷や分子構造的に細胞膜表層に吸着し貫通するオリゴアルギニン、Tatペプチド、RevペプチドまたはAntペプチドなどと化学結合していてもよい。
【0035】
siRNAは、mRNA上の標的配列のセンス鎖およびアンチセンス鎖をDNA/RNA自動合成機でそれぞれ合成し、適当なアニーリング緩衝液中、約90〜約95℃で約1分程度変性させた後、約30〜約70℃で約1〜約8時間アニーリングさせることにより調製することができる。また、siRNAの前駆体となるショートヘアピンRNA(shRNA)を合成し、これを、ダイサー(dicer)を用いて切断することにより調製することもできる。
【0036】
本明細書においては、生体内でTMEM176B遺伝子のmRNAに対するsiRNAを生成し得るようにデザインされた核酸もまた、TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸に包含されるものとして定義される。そのような核酸としては、上記したshRNAやsiRNAを発現するように構築された発現ベクターなどが挙げられる。shRNAは、mRNA上の標的配列のセンス鎖およびアンチセンス鎖を適当なループ構造を形成しうる長さ(例えば5〜25塩基程度)のスペーサー配列を間に挿入して連結した塩基配列を含むオリゴRNAをデザインし、これをDNA/RNA自動合成機で合成することにより調製することができる。shRNAを発現するベクターには、タンデムタイプとステムループ(ヘアピン)タイプとがある。前者はsiRNAのセンス鎖の発現カセットとアンチセンス鎖の発現カセットをタンデムに連結したもので、細胞内で各鎖が発現してアニーリングすることにより2本鎖のsiRNA(dsRNA)を形成するというものである。一方、後者はshRNAの発現カセットをベクターに挿入したもので、細胞内でshRNAが発現しdicerによるプロセシングを受けてdsRNAを形成するというものである。プロモーターとしては、polII系プロモーター(例えば、CMV前初期プロモーター)を使用することもできるが、短いRNAの転写を正確に行わせるために、polIII系プロモーターを使用するのが一般的である。polIII系プロモーターとしては、マウスおよびヒトのU6-snRNAプロモーター、ヒトH1-RNase P RNAプロモーター、ヒトバリン-tRNAプロモーターなどが挙げられる。また、転写終結シグナルとして4個以上Tが連続した配列が用いられる。
このようにして構築したsiRNAもしくはshRNA発現カセットを、次いでプラスミドベクターやウイルスベクターに挿入する。このようなベクターとしては、レトロウイルス、レンチウイルス、アデノウイルス、アデノ随伴ウイルス、ヘルペスウイルス、センダイウイルスなどのウイルスベクターや、動物細胞発現プラスミドなどが用いられる。
【0037】
上記siRNAは、ヌクレオチド配列の情報に基づいて、例えば394 Applied Biosystems,Inc.合成機等のDNA/RNA自動合成機を用いて常法に従って化学的に合成することができる。例えば,Caruthers et al.,1992,Methods in Enzymology 211,3-19;Thompson et al.,国際公開99/54459;Wincott et al.,1995,Nucleic Acids Res.23,2677-2684;Wincott et al.,1997,Methods Mol.Bio.,74,59;Brennan et al.,1998,Biotechnol Bioeng.,61,33-45;Usman et al.,1987 J.Am.Chem.Soc.,109,7845;Scaringe et al.,1990 Nucleic Acids Res.,18,5433);および米国特許第6001311号に記載される方法等が挙げられる。具体的には、当業者に公知の核酸保護基(例えば5’末端にジメトキシトリチル基)およびカップリング基(例えば3’末端にホスホルアミダイト)を用いて合成できる。すなわち、5'末端の保護基を、TCA(トリクロロ酢酸)等の酸で脱保護し、カップリング反応を行う。ついでアセチル基でキャッピングを行った後、次の核酸の縮合反応を行う。修飾されたRNAやDNAを含むsiRNAの場合には、原料として修飾されたRNA(例えば、2'-O-メチルヌクレオチド、2'-デオキシ−2'-フルオロヌクレオチド)を用いればよく、カップリング反応の条件は適宜調整できる。また、リン酸結合部分が修飾されたホスホロチオエート結合を導入する場合には、ボーケージ試薬(3H-1,2-ベンゾジチオール-3-オン1,1-ジオキシド)を用いることができる。
【0038】
あるいは,オリゴヌクレオチドは,別々に合成し、合成後に例えばライゲーションにより一緒につなげてもよいし(Moore et al.,1992,Science 256,9923;Draper et al.国際公開WO93/23569;Shabarova et al.,1991,Nucleic Acids Research 19,4247;Bellon et al.,1997,Nucleosides&Nucleotides,16,951;Bellon et al.,1997,Nucleosides&Nucleotides;Bellon et al.,1997,Bioconjugate Chem.8,204)、または合成および/または脱保護の後にハイブリダイゼーションにより,一緒につなげてもよい。siRNA分子はまたタンデム合成法により合成することができる。すなわち、両方のsiRNA鎖を,切断可能なリンカーにより分離された単一の連続するオリゴヌクレオチドとして合成し,次にこれを切断して別々のsiRNAフラグメントを生成し,これをハイブリダイズさせて精製する。リンカーはポリヌクレオチドリンカーであっても非ヌクレオチドリンカーであってもよい。
【0039】
合成したsiRNA分子は、当業者に公知の方法を用いて精製できる。例えばゲル電気泳動により精製する方法,または高速液体クロマトグラフィー(HPLC)を用いて精製する方法が挙げられる。
また、siRNA分子をDNAまたはRNAベクター中に挿入させて、組換えベクターを用いて発現させることもできる。ベクターは,DNAプラスミドまたはウイルスベクターでありうる。siRNAを発現するウイルスベクターは,限定されないが、アデノウイルス等を用いることができる。
【0040】
具体的なsiRNAとしては例えば、以下の群:
(1)二重鎖RNA部分が、配列番号:29〜43からなる塩基配列を含むsiRNA、
(2)3'末端に2〜4塩基のオーバーハングが付加されていることを特徴とする前記(1)に記載のsiRNA、
(3)少なくとも1つの塩基が化学的に修飾されている前記(1)または(2)に記載のsiRNA、または、
(4)少なくとも1つのホスホジエステル結合が化学的に修飾されている前記(1)〜(3)のいずれかに記載のsiRNA、
等を例示することができる。ここでsiRNAの二重鎖RNA部分の塩基の長さは15〜50塩基、好ましくは19〜50塩基、更に好ましくは19〜49塩基、15〜49塩基、更に好ましくは19〜25塩基、15〜25塩基、更に好ましくは19〜23塩基である。
【0041】
TMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸は、リポソーム、ミクロスフェアのような特殊な形態で供与されたり、遺伝子治療に適用されたり、付加された形態で与えられることができうる。こうして付加形態で用いられるものとしては、リン酸基骨格の電荷を中和するように働くポリリジンのようなポリカチオン体、細胞膜との相互作用を高めたり、核酸の取込みを増大させたりするような脂質(例、ホスホリピド、コレステロールなど)などの疎水性のものが挙げられる。付加するに好ましい脂質としては、コレステロールやその誘導体(例、コレステリルクロロホルメート、コール酸など)が挙げられる。こうしたものは、核酸の3’端または5’端に付着させることができ、塩基、糖、分子内ヌクレオシド結合を介して付着させることができうる。その他の基としては、核酸の3’端または5’端に特異的に配置されたキャップ用の基で、エキソヌクレアーゼ、RNaseなどのヌクレアーゼによる分解を阻止するためのものが挙げられる。こうしたキャップ用の基としては、ポリエチレングリコール、テトラエチレングリコールなどのグリコールをはじめとした当該分野で知られた水酸基の保護基が挙げられるが、それに限定されるものではない。
【0042】
これらの核酸のタンパク質:TMEM176B発現阻害活性は、TMEM176B遺伝子を導入した形質転換体、生体内や生体外のTMEM176B遺伝子発現系、または生体内や生体外のタンパク質:TMEM176Bの翻訳系を用いて調べることができる。
【0043】
本発明におけるTMEM176Bの発現を阻害する物質は、上記のようなTMEM176B遺伝子のmRNAの塩基配列と相補的もしくは実質的に相補的な塩基配列またはその一部を含む核酸に限定されず、TMEM176Bの産生を直接的または間接的に阻害する限り、低分子化合物などの他の物質であってもよい。そのような物質は、例えば、後述する本発明のスクリーニング方法により取得することができる。
【0044】
III. TMEM176Bの機能を抑制する物質
本発明において「TMEM176Bの機能を抑制する物質」とは、いったん機能的に産生されたTMEM176Bの機能を発揮するのを抑制する限りいかなるものでもよい。
【0045】
具体的には、TMEM176Bの機能を抑制する物質として、例えば、TMEM176Bに対する抗体が挙げられる。該抗体はポリクローナル抗体、モノクローナル抗体の何れであってもよい。これらの抗体は、自体公知の抗体または抗血清の製造法に従って製造することができる。抗体のアイソタイプは特に限定されないが、好ましくはIgG、IgMまたはIgA、特に好ましくはIgGが挙げられる。また、該抗体は、標的抗原を特異的に認識し結合するための相補性決定領域(CDR)を少なくとも有するものであれば特に制限はなく、完全抗体分子の他、例えばFab、Fab'、F(ab’)2等のフラグメント、scFv、scFv-Fc、ミニボディー、ダイアボディー等の遺伝子工学的に作製されたコンジュゲート分子、あるいはポリエチレングリコール(PEG)等のタンパク質安定化作用を有する分子等で修飾されたそれらの誘導体などであってもよい。
好ましい一実施態様において、TMEM176Bに対する抗体はヒトを投与対象とする医薬品として使用されることから、該抗体(好ましくはモノクローナル抗体)はヒトに投与した場合に抗原性を示す危険性が低減された抗体、具体的には、完全ヒト抗体、ヒト化抗体、マウス−ヒトキメラ抗体などであり、特に好ましくは完全ヒト抗体である。ヒト化抗体およびキメラ抗体は、常法に従って遺伝子工学的に作製することができる。また、完全ヒト抗体は、ヒト−ヒト(もしくはマウス)ハイブリドーマより製造することも可能ではあるが、大量の抗体を安定に且つ低コストで提供するためには、ヒト抗体産生マウスやファージディスプレイ法を用いて製造することが望ましい。
TMEM176Bの機能を抑制する物質は、腫瘍血管移行性、細胞膜透過性に優れた物質であることが望ましい。したがって、TMEM176Bの機能を抑制する別の好ましい物質は、Lipinski's Ruleに見合った低分子化合物である。そのような化合物は、例えば、後述する本発明のスクリーニング法を用いて取得することができる。
【0046】
TMEM176Bの発現もしくは機能を抑制する物質は、血管新生阻害活性、詳しくは腫瘍血管新生阻害活性、更に詳しくは、腫瘍血管内皮細胞の遊走抑制活性を示すことから、抗腫瘍剤として、癌に罹患した患者の病態を改善したり、癌への罹患、特には癌の転移・再発を予防したりするのに有用である。
従って、TMEM176Bの発現もしくは機能を抑制する物質を含有する医薬は、癌の予防および/または治療剤(抗腫瘍剤)として使用することができる。
また、TMEM176Bの発現もしくは機能を抑制する物質は、血管新生の異常を伴う疾患の治療もしくは予防に有用である。従って、TMEM176Bの発現もしくは機能を抑制する物質を含有する医薬は、血管新生の異常を伴う疾患の予防および/または治療剤として使用することができる。
【0047】
IV.アンチセンス核酸、リボザイム核酸、siRNAおよびその前駆体を含有する医薬
TMEM176B遺伝子の転写産物に相補的に結合し、該転写産物からのタンパク質の翻訳を抑制することができる本発明のアンチセンス核酸や、TMEM176B遺伝子の転写産物(mRNA)と相同な(もしくは相補的な)塩基配列を有し、当該転写産物を標的として該転写産物を切断し得るsiRNA(もしくはリボザイム)、さらに該siRNAの前駆体であるshRNAなど(以下、包括的に「本発明の核酸」という場合がある)は、生体内におけるTMEM176Bの発現を抑制し、腫瘍血管内皮細胞の遊走を抑制するので、抗腫瘍剤等の医薬として使用することができる。
本発明の核酸を含有する医薬は低毒性であり、そのまま液剤として、または適当な剤型の医薬組成物として、ヒトまたは非ヒト哺乳動物(例、ラット、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して経口的または非経口的(例、血管内投与、皮下投与など)に投与することができる。
【0048】
本発明の核酸を上記の抗腫瘍剤として使用する場合、自体公知の方法に従って製剤化し、投与することができる。即ち、本発明の核酸を、単独あるいはレトロウイルスベクター、アデノウイルスベクター、アデノウイルスアソシエーテッドウイルスベクターなどの適当な哺乳動物細胞用の発現ベクターに機能可能な態様で挿入した後、常套手段に従って製剤化することができる。該核酸は、そのままで、あるいは摂取促進のための補助剤とともに、遺伝子銃やハイドロゲルカテーテルのようなカテーテルによって投与することができる。あるいは、エアロゾル化して吸入剤として気管内に局所投与することもできる。
さらに、体内動態の改良、半減期の長期化、細胞内取り込み効率の改善を目的に、前記核酸を単独またはリポソームなどの担体とともに製剤(注射剤)化し、静脈、皮下等に投与してもよい。
【0049】
本発明の核酸は、それ自体を投与してもよいし、または適当な医薬組成物として投与してもよい。投与に用いられる医薬組成物としては、本発明の核酸と薬理学的に許容され得る担体、希釈剤もしくは賦形剤とを含むものであってよい。このような医薬組成物は、経口または非経口投与に適する剤形として提供される。
【0050】
非経口投与のための組成物としては、例えば、注射剤、坐剤等が用いられ、注射剤は静脈注射剤、皮下注射剤、皮内注射剤、筋肉注射剤、点滴注射剤等の剤形を包含しても良い。このような注射剤は、公知の方法に従って調製できる。注射剤の調製方法としては、例えば、上記本発明の核酸を通常注射剤に用いられる無菌の水性液、または油性液に溶解、懸濁または乳化することによって調製できる。注射用の水性液としては、例えば、生理食塩水、ブドウ糖やその他の補助薬を含む等張液等が用いられ、適当な溶解補助剤、例えば、アルコール(例、エタノール)、ポリアルコール(例、プロピレングリコール、ポリエチレングリコール)、非イオン界面活性剤〔例、ポリソルベート80、HCO-50(polyoxyethylene(50mol)adduct of hydrogenated castor oil)〕等と併用してもよい。油性液としては、例えば、ゴマ油、大豆油等が用いられ、溶解補助剤として安息香酸ベンジル、ベンジルアルコール等を併用してもよい。調製された注射液は、適当なアンプルに充填されることが好ましい。直腸投与に用いられる坐剤は、上記核酸を通常の坐薬用基剤に混合することによって調製されてもよい。
【0051】
経口投与のための組成物としては、固体または液体の剤形、具体的には錠剤(糖衣錠、フィルムコーティング錠を含む)、丸剤、顆粒剤、散剤、カプセル剤(ソフトカプセル剤を含む)、シロップ剤、乳剤、懸濁剤等が挙げられる。このような組成物は公知の方法によって製造され、製剤分野において通常用いられる担体、希釈剤もしくは賦形剤を含有していても良い。錠剤用の担体、賦形剤としては、例えば、乳糖、でんぷん、蔗糖、ステアリン酸マグネシウムが用いられる。
【0052】
上記の非経口用または経口用医薬組成物は、活性成分の投与量に適合するような投薬単位の剤形に調製されることが好都合である。このような投薬単位の剤形としては、例えば、錠剤、丸剤、カプセル剤、注射剤(アンプル)、坐剤が挙げられる。本発明の核酸は、例えば、投薬単位剤形当たり通常5〜500mg、とりわけ注射剤では5〜100mg、その他の剤形では10〜250mg含有されていることが好ましい。
【0053】
本発明の核酸を含有する上記医薬の投与量は、投与対象、対象疾患、症状、投与ルートなどによっても異なるが、例えば、癌の治療・予防のために使用する場合には、本発明の核酸を1回量として、通常0.01〜20mg/kg体重程度、好ましくは0.1〜10mg/kg体重程度、さらに好ましくは0.1〜5mg/kg体重程度を、1日1〜5回程度、好ましくは1日1〜3回程度、静脈注射により投与するのが好都合である。他の非経口投与および経口投与の場合もこれに準ずる量を投与することができる。症状が特に重い場合には、その症状に応じて増量してもよい。
【0054】
なお前記した各組成物は、本発明の核酸との配合により好ましくない相互作用を生じない限り適宜他の活性成分を含有してもよい。
【0055】
V.TMEM176Bに対する抗体、TMEM176Bの発現もしくは機能を抑制する低分子化合物等を含有する医薬
TMEM176Bに対する抗体や、TMEM176Bの発現もしくは機能を抑制する低分子化合物は、TMEM176Bの産生または機能を阻害することができる。したがって、これらの物質は、生体内におけるTMEM176Bの発現もしくは機能を抑制するので、癌の予防および/または治療剤等の医薬として使用することができる。
上記の抗体や低分子化合物を含有する医薬は低毒性であり、そのまま液剤として、または適当な剤型の医薬組成物として、ヒトまたは哺乳動物(例、ラット、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して経口的または非経口的(例、血管内投与、皮下投与など)に投与することができる。
【0056】
上記の抗体や低分子化合物は、それ自体を投与してもよいし、または適当な医薬組成物として投与してもよい。投与に用いられる医薬組成物としては、上記の抗体もしくは低分子化合物またはその塩と薬理学的に許容され得る担体、希釈剤もしくは賦形剤とを含むものであってもよい。このような医薬組成物は、経口または非経口投与に適する剤形として提供される。
【0057】
非経口投与のための組成物としては、例えば、注射剤、坐剤等が用いられ、注射剤は静脈注射剤、皮下注射剤、皮内注射剤、筋肉注射剤、点滴注射剤等の剤形を包含しても良い。このような注射剤は、公知の方法に従って調製できる。注射剤の調製方法としては、例えば、上記本発明の抗体または低分子化合物もしくはその塩を通常注射剤に用いられる無菌の水性液、または油性液に溶解、懸濁または乳化することによって調製できる。注射用の水性液としては、例えば、生理食塩水、ブドウ糖やその他の補助薬を含む等張液等が用いられ、適当な溶解補助剤、例えば、アルコール(例、エタノール)、ポリアルコール(例、プロピレングリコール、ポリエチレングリコール)、非イオン界面活性剤〔例、ポリソルベート80、HCO-50(polyoxyethylene(50mol)adduct of hydrogenated castor oil)〕等と併用してもよい。油性液としては、例えば、ゴマ油、大豆油等が用いられ、溶解補助剤として安息香酸ベンジル、ベンジルアルコール等を併用してもよい。調製された注射液は、適当なアンプルに充填されることが好ましい。直腸投与に用いられる坐剤は、上記抗体またはその塩を通常の坐薬用基剤に混合することによって調製されても良い。
【0058】
経口投与のための組成物としては、固体または液体の剤形、具体的には錠剤(糖衣錠、フィルムコーティング錠を含む)、丸剤、顆粒剤、散剤、カプセル剤(ソフトカプセル剤を含む)、シロップ剤、乳剤、懸濁剤等が挙げられる。このような組成物は公知の方法によって製造され、製剤分野において通常用いられる担体、希釈剤もしくは賦形剤を含有していても良い。錠剤用の担体、賦形剤としては、例えば、乳糖、でんぷん、蔗糖、ステアリン酸マグネシウムが用いられる。
【0059】
上記の非経口用または経口用医薬組成物は、活性成分の投与量に適合するような投薬単位の剤形に調製されることが好都合である。このような投薬単位の剤形としては、例えば、錠剤、丸剤、カプセル剤、注射剤(アンプル)、坐剤が挙げられる。抗体や低分子化合物は、投薬単位剤形当たり通常5〜500mg、とりわけ注射剤では5〜100mg、その他の剤形では10〜250mg含有されていることが好ましい。
【0060】
上記の抗体もしくは低分子化合物またはその塩を含有する上記医薬の投与量は、投与対象、対象疾患、症状、投与ルートなどによっても異なるが、例えば、癌の治療・予防のために使用する場合には、抗体もしくは低分子化合物を1回量として、通常0.01〜20mg/kg体重程度、好ましくは0.1〜10mg/kg体重程度、さらに好ましくは0.1〜5mg/kg体重程度を、1日1〜5回程度、好ましくは1日1〜3回程度、静脈注射により投与するのが好都合である。他の非経口投与および経口投与の場合もこれに準ずる量を投与することができる。症状が特に重い場合には、その症状に応じて増量してもよい。
なお前記した各組成物は、上記抗体や低分子化合物との配合により好ましくない相互作用を生じない限り他の活性成分を含有してもよい。
【0061】
上述のTMEM176Bに対するアンチセンス核酸、リボザイム核酸、siRNAおよびその前駆体を含有する医薬や、TMEM176Bに対する抗体、TMEM176Bの発現もしくは機能を抑制する低分子化合物等を含有する医薬組成物は、血管新生阻害剤として、癌の治療、予防、または進行防止に用いることができる。すなわち、癌の増殖、転移、癌性腹水もしくは癌性胸水の蓄積を抑制するために用いることができる。癌として具体的には、固形癌、移行上皮癌、大腸癌、結腸直腸癌、結腸癌、肺癌(小細胞癌)、肺癌(非小細胞肺癌)、腎癌(腎細胞癌)、腎盂尿管癌、胆道癌、肝臓癌(肝細胞癌)、脳腫瘍、神経膠腫(グリオーマ)、膠芽腫、多型性神経膠芽腫、膵臓癌、頭頸部癌(扁平上皮癌)、多発性骨髄腫、骨軟部腫瘍、前立腺癌、陰茎癌、精巣癌、卵巣癌、消化管間質腫瘍(GIST)、胃癌、女性生殖器癌、子宮頸癌、乳癌、黒色腫(メラノーマ)、リンパ腫(非ホジキン)、リンパ腫(ホジキン)、リンパ腫(びまん性大細胞型)、白血病(急性骨髄性)、白血病(慢性リンパ性)、食道癌、口腔癌、舌癌、咽頭癌、喉頭癌、耳下腺癌、顎下腺癌、唾液腺癌、甲状腺癌、副腎皮質癌、線維性組織球腫、髄膜腫、膀胱癌、ユーイング肉腫、カポジ肉腫、中皮腫または隆起性皮膚線維肉腫等が挙げられる。
また、上述のTMEM176Bに対するアンチセンス核酸、リボザイム核酸、siRNAおよびその前駆体を含有する核酸、TMEM176Bに対する抗体またはTMEM176Bの発現もしくは機能を抑制する低分子化合物等を含有する医薬組成物は、異常な血管内皮細胞の遊走を抑制することから、血管新生阻害剤として、血管新生の異常を伴う疾患、具体的には、糖尿病網膜症、脈絡膜血管新生、黄斑変性症、心不全、骨髄形成異常、インフルエンザ、炎症、関節炎、C型肝炎、乾癬、浮腫、神経変性疾患、アミロイドーシス、特発性肺線維症、多発性硬化症、ウィルソン病、フォンヒッペル・リンダウ病、クローン病、全身性肥満細胞症、骨髄増殖症候群、骨髄異形成等、好ましくは、糖尿病網膜症、黄斑変性症、炎症、関節炎、乾癬、浮腫、特発性肺線維症、フォンヒッペル・リンダウ病、クローン病等の治療、予防、または進行防止にも用いることができる。
【0062】
上述のTMEM176Bに対するアンチセンス核酸、リボザイム核酸、siRNAおよびその前駆体を含有する医薬や、TMEM176Bに対する抗体、TMEM176Bの発現もしくは機能を抑制する低分子化合物等を含有する医薬組成物を癌の治療または予防に使用する場合には、単独で使用してもよいが、1種または2種以上の抗癌作用を有する薬剤および/または放射線療法と併用してもよい。
併用する薬剤としては、特に限定されるものではないが、例えば、Bevacizumab、Sunitinib、Sorafenib、Erlotinib、Erbitaxなどの血管新生阻害薬、ASA404をはじめとする血管破滅薬、5-FU(フルオロウラシル)、ゲムシタビン、シスプラチン、イリノテカン、カルボプラチン、パクリタキセル等の化学療法剤等が挙げられる。
【0063】
VI. 疾病に対する医薬候補化合物のスクリーニング
上述の通り、TMEM176Bの発現および/または機能を抑制すると、腫瘍血管内皮細胞の遊走が抑制され、血管新生阻害活性を有する。従って、TMEM176Bの発現および/または機能を抑制する化合物またはその塩は、癌の予防および/または治療剤(抗腫瘍剤)として使用することができる。
したがって、TMEM176Bを産生する細胞は、TMEM176B(またはTMEM176B遺伝子)の発現量および/または機能を指標とすることにより、血管新生阻害活性を有する物質のスクリーニングのためのツールとして用いることができる。
【0064】
TMEM176Bの発現および/または機能を抑制する化合物またはその塩をスクリーニングする場合、該スクリーニング方法は、TMEM176Bを産生する能力を有する細胞を、被検物質の存在下および非存在下に培養し、両条件下におけるTMEM176Bの発現量および/または機能を比較することを含む。
【0065】
上記のスクリーニング方法において用いられるTMEM176Bを産生する能力を有する細胞としては、それらを生来発現しているヒトもしくは他の哺乳動物細胞またはそれを含む生体試料(例:血液、組織、臓器等)であれば特に制限はない。非ヒト動物由来の血液、組織、臓器等の場合は、それらを生体から単離して培養してもよいし、あるいは生体自体に被検物質を投与し、一定時間経過後にそれら生体試料を単離してもよい。
また、TMEM176Bを産生する能力を有する細胞としては、公知慣用の遺伝子工学的手法により作製された各種の形質転換体が例示される。宿主としては、例えば、H4IIE-C3細胞、HepG2細胞、HEK293細胞、COS7細胞、CHO細胞などの動物細胞が好ましく用いられる。
具体的には、TMEM176BをコードするDNA(即ち、配列番号:1、3、5または7で表される塩基配列または該塩基配列に対し相補性を有する塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号:2、4、6または8で表されるアミノ酸配列からなるタンパク質と同質の機能を有するポリペプチドをコードする塩基配列を含むDNA)を、適当な発現ベクター中のプロモーターの下流に連結して宿主動物細胞に導入することにより調製することができる。
【0066】
TMEM176Bをコードする遺伝子の調製方法について、以下に説明する。
TMEM176Bをコードする遺伝子は、通常の遺伝子工学的方法(例えば、Sambrook J., Frisch E. F., Maniatis T.著、モレキュラークローニング第2版(Molecular Cloning 2nd edition)、コールド スプリング ハーバー ラボラトリー発行(Cold Spring Harbor Laboratory press)等に記載されている方法)に準じて取得することができる。すなわち、TMEM176BをコードするDNAは、例えば、配列番号:1、3、5または7で表される塩基配列に基づいて、適当なオリゴヌクレオチドをプローブもしくはプライマーとして合成し、前記したTMEM176Bを産生する細胞・組織由来のcDNAもしくはcDNAライブラリーから、ハイブリダイゼーション法やPCR法を用いてクローニングすることができる。ハイブリダイゼーションは、例えば、モレキュラー・クローニング(Molecular Cloning)第2版(上記)に記載の方法などに従って行なうことができる。また、市販のライブラリーを使用する場合、ハイブリダイゼーションは、該ライブラリーに添付された使用説明書に記載の方法に従って行なうことができる。
【0067】
DNAの塩基配列は、公知のキット、例えば、MutanTM-super Express Km(宝酒造(株))、MutanTM-K(宝酒造(株))等を用いて、ODA-LA PCR法、Gapped duplex法、Kunkel法等の自体公知の方法あるいはそれらに準じる方法に従って変換することができる。
【0068】
クローン化されたDNAは、目的によりそのまま、または所望により制限酵素で消化するか、リンカーを付加した後に、使用することができる。該DNAはその5’末端側に翻訳開始コドンとしてのATGを有し、また3’末端側には翻訳終止コドンとしてのTAA、TGAまたはTAGを有していてもよい。これらの翻訳開始コドンや翻訳終止コドンは、適当な合成DNAアダプターを用いて付加することができる。
次いで、得られたTMEM176B遺伝子を用いて、通常の遺伝子工学的方法に準じてTMEM176B(タンパク質)を製造・取得することができる。
例えば、TMEM176B遺伝子が宿主細胞中で発現できるようなプラスミドを作製し、これを宿主細胞に導入して形質転換し、さらに形質転換された宿主細胞(形質転換体)を培養することで得られる培養物からTMEM176Bを取得すればよい。上記プラスミドとしては、例えば、宿主細胞中で複製可能な遺伝情報を含み、自律的に複製できるものであって、宿主細胞からの単離・精製が容易であり、宿主細胞中で機能可能なプロモーターを有し、検出可能なマーカーをもつ発現ベクターに、TMEM176Bをコードする遺伝子が導入されたものを好ましく挙げることができる。
尚、発現ベクターとしては、各種のものが市販されている。
例えば、大腸菌での発現に使用される発現ベクターは、lac、trp、tacなどのプロモーターを含む発現ベクターであって、これらはファルマシア社、タカラバイオ等から市販されている。当該発現ベクターにTMEM176Bをコードする遺伝子を導入するために用いられる制限酵素もタカラバイオ等から市販されている。さらなる高発現を導くことが必要な場合には、タンパク質:TMEM176Bをコードする遺伝子の上流にリボゾーム結合領域を連結してもよい。用いられるリボゾーム結合領域としては、Guarente L.ら(Cell 20, p543)や谷口ら(Genetics of Industrial Microorganisms, p202, 講談社)による報告に記載されたものを挙げることができる。
【0069】
また、動物細胞発現プラスミド(例:pA1-11、pXT1、pRc/CMV、pRc/RSV、pcDNAI/Neo);λファージなどのバクテリオファージ;レトロウイルス、ワクシニアウイルス、アデノウイルスなどの動物ウイルスベクターなどを用いることもできる。プロモーターとしては、遺伝子の発現に用いる宿主に対応して適切なプロモーターであればいかなるものでもよい。例えば、SRαプロモーター、SV40プロモーター、LTRプロモーター、CMV(サイトメガロウイルス)プロモーター、RSV(ラウス肉腫ウイルス)プロモーター、MoMuLV(モロニーマウス白血病ウイルス)LTR、HSV-TK(単純ヘルペスウイルスチミジンキナーゼ)プロモーター、βアクチン遺伝子プロモーター、aP2遺伝子プロモーターなどが用いられる。なかでも、CMVプロモーター、SRαプロモーターなどが好ましい。
発現ベクターとしては、上記の他に、所望によりエンハンサー、スプライシングシグナル、ポリA付加シグナル、選択マーカー、SV40複製起点(以下、SV40 oriと略称する場合がある)などを含有しているものを用いることができる。
【0070】
選択マーカーとしては、例えば、ジヒドロ葉酸還元酵素遺伝子(以下、dhfrと略称する場合がある、メソトレキセート(MTX)耐性)、アンピシリン耐性遺伝子(以下、amprと略称する場合がある)、ネオマイシン耐性遺伝子(以下、neorと略称する場合がある、G418耐性)等が挙げられる。特に、dhfr遺伝子欠損チャイニーズハムスター細胞を用い、dhfr遺伝子を選択マーカーとして使用する場合、チミジンを含まない培地によって目的遺伝子を選択することもできる。
【0071】
上記したTMEM176BをコードするDNAを含む発現ベクターで宿主を形質転換することにより、TMEM176B発現細胞を製造することができる。
宿主細胞としては、原核生物もしくは真核生物である微生物細胞、昆虫細胞または哺乳動物細胞等を挙げることができる。哺乳動物細胞としては、例えば、HepG2細胞、HEK293細胞、HeLa細胞、ヒトFL細胞、サルCOS-7細胞、サルVero細胞、チャイニーズハムスター卵巣細胞(以下、CHO細胞と略記)、dhfr遺伝子欠損CHO細胞(以下、CHO(dhfr-)細胞と略記)、マウスL細胞,マウスAtT-20細胞、マウスミエローマ細胞,ラットH4IIE-C3細胞、ラットGH3細胞などが用いられ得る。例えば、TMEM176Bの大量調製が容易になるという観点では、大腸菌等を好ましく挙げることができる。
前記のようにして得られたプラスミドは、通常の遺伝子工学的方法により前記宿主細胞に導入することができる。形質転換体の培養は、微生物培養、昆虫細胞もしくは哺乳動物細胞の培養に使用される通常の方法によって行うことができる。例えば大腸菌の場合、適当な炭素源、窒素源およびビタミン等の微量栄養物を適宜含む培地中で培養を行う。培養方法としては、固体培養、液体培養のいずれの方法でもよく、好ましくは、通気撹拌培養法等の液体培養を挙げることができる。
【0072】
形質転換は、リン酸カルシウム共沈殿法、PEG法、エレクトロポレーション法、マイクロインジェクション法、リポフェクション法などにより行うことができる。例えば、細胞工学別冊8 新細胞工学実験プロトコール,263-267 (1995)(秀潤社発行)、ヴィロロジー(Virology),52巻,456 (1973)に記載の方法を用いることができる。
【0073】
上記のようにして得られる形質転換細胞や生来TMEM176Bを産生する能力を有する哺乳動物細胞または該細胞を含む組織・臓器は、例えば、約5〜20%の胎仔牛血清を含む最小必須培地(MEM)〔Science,122巻,501(1952)〕,ダルベッコ改変イーグル培地(DMEM)〔Virology,8巻,396(1959)〕,RPMI 1640培地〔The Journal of the American Medical Association,199巻,519(1967)〕,199培地〔Proceeding of the Society for the Biological Medicine,73巻,1(1950)〕などの培地中で培養することができる。培地のpHは約6〜8であるのが好ましい。培養は通常約30〜40℃で行ない、必要に応じて通気や撹拌を加える。
【0074】
TMEM176Bの取得は、一般のタンパク質の単離・精製に通常使用される方法を組み合わせて実施すればよい。例えば、前記の培養により得られた形質転換体を遠心分離等で集め、該形質転換体を破砕または溶解せしめ、必要であればタンパク質の可溶化を行い、イオン交換、疎水、ゲルろ過等の各種クロマトグラフィーを用いた工程を単独で、若しくは組み合わせることにより精製すればよい。精製されたタンパク質の高次構造を復元する操作をさらに行ってもよい。また、例えば、前記の培養により得られた形質転換体を遠心分離などで除去し、培養上清からTMEM176Bを前記と同様にして精製してもよい。
【0075】
本発明のスクリーニングを実施するに当たり、被検物質としては、例えばタンパク質、ペプチド、非ペプチド性化合物、合成化合物、発酵生産物、細胞抽出液、植物抽出液、動物組織抽出液などが挙げられ、これらの物質は新規なものであってもよいし、公知のものであってもよい。
また、TMEM176BもしくはTMEM176B遺伝子の発現量を低下させる物質、またはTMEM176Bの機能を低下させる物質を選択する際に、被検物質を接触させない対照細胞を比較対照として用いることもできる。ここで「被検物質を接触させない」とは、被検物質の代わりに被検物質と同量の溶媒(ブランク)を添加する場合や、TMEM176BもしくはTMEM176B遺伝子の発現量またはTMEM176Bの機能に影響を与えないネガティブコントロール物質を添加する場合も含まれる。
【0076】
被検物質の上記細胞との接触は、例えば、上記の培地や各種緩衝液(例えば、HEPES緩衝液、リン酸緩衝液、リン酸緩衝生理食塩水、トリス塩酸緩衝液、ホウ酸緩衝液、酢酸緩衝液など)の中に被検物質を添加して、細胞を一定時間インキュベートすることにより実施することができる。添加される被検物質の濃度は化合物の種類(溶解度、毒性等)により異なるが、例えば、約0.1nM〜約100μMの範囲で適宜選択される。インキュベート時間としては、例えば、約10分〜約24時間が挙げられる。
【0077】
TMEM176Bを産生する細胞が、非ヒト哺乳動物個体の形態で提供される場合、該動物個体の状態は特に制限されないが、例えば、がん細胞を移植したモデルマウス〔例えば、A375SM(ヒト高転移性のメラノーマ細胞)を KSN /Slc nudeマウスの右背部皮下に移植して作製したマウス〕等のモデル動物であってもよい。使用される動物の飼育条件に特に制限はないが、SPFグレード以上の環境下で飼育されたものであることが好ましい。被検物質の該細胞との接触は、該動物個体への被検物質の投与によって行われる。投与経路は特に制限されないが、例えば、静脈内投与、動脈内投与、皮下投与、皮内投与、腹腔内投与、経口投与、気道内投与、直腸投与等が挙げられる。投与量も特に制限はないが、例えば、1回量として約0.5〜20 mg/kgを、1日1〜5回、好ましくは1日1〜3回、1〜14日間投与することができる。
あるいは、上記のスクリーニング方法は、TMEM176Bを産生する能力を有する細胞に代えて、該細胞の抽出液、あるいは該細胞から単離精製したTMEM176Bに、被検物質を接触させることにより行うこともできる。
【0078】
(TMEM176B遺伝子またはTMEM176Bの発現量の測定)
本発明は、TMEM176Bを産生する能力を有する細胞における該タンパク質(遺伝子)の発現を、被検物質の存在下と非存在下で比較することを特徴とする、血管新生阻害活性を有する物質のスクリーニング方法を提供する。本方法において用いられる細胞、被検物質の種類、被検物質と細胞との接触の態様などは、上記と同様である。
【0079】
TMEM176Bの発現量は、前記したTMEM176BをコードするDNAとストリンジェントな条件下でハイブリダイズし得る核酸、即ち、配列番号:1、3、5または7で表される塩基配列もしくはそれと相補的な塩基配列とストリンジェントな条件下でハイブリダイズし得る核酸(DNA)(以下、「本発明の検出用核酸」という場合がある)を用いて、TMEM176B遺伝子のmRNAを検出することにより、RNAレベルで測定することができる。あるいは、該発現量は、前記したTMEM176Bに対する抗体(以下、「本発明の検出用抗体」という場合がある)を用いて、これらのタンパク質を検出することにより、タンパク質レベルで測定することもできる。
従って、より具体的には、本発明は、
(a)TMEM176Bを産生する能力を有する細胞を被検物質の存在下および非存在下に培養し、両条件下における該タンパク質をコードするmRNAの量を、本発明の検出用核酸を用いて測定、比較することを特徴とする、血管新生阻害活性を有する物質のスクリーニング方法、および
(b)TMEM176Bを産生する能力を有する細胞を被検物質の存在下および非存在下に培養し、両条件下における該タンパク質の量を、本発明の検出用抗体を用いて測定、比較することを特徴とする、血管新生阻害活性を有する物質のスクリーニング方法を提供する。
【0080】
すなわち、TMEM176Bの発現量を変化させる物質のスクリーニングは、以下のようにして行うことができる。
(i)正常あるいは疾患(例えば、大腸がん、肺がんなどの移植モデルマウス:KSN /Slc nudeマウスの右背部皮下にがん細胞を移植したモデルマウスなど)モデル非ヒト哺乳動物(例えば、マウス、ラット、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して被検物質を投与し、一定時間経過した後(30分後〜3日後、好ましくは1時間後〜2日後、より好ましくは1時間後〜24時間後)に、血液、あるいは特定の臓器(例えば、脳等)、あるいは臓器から単離した組織または細胞を得る。
TMEM176BのmRNAは、通常の方法により細胞等からmRNAを抽出して定量することができ、あるいは自体公知のノーザンブロット解析により定量することもできる。一方、TMEM176Bのタンパク質量は、ウェスタンブロット解析や以下に詳述する各種イムノアッセイ法を用いて定量することができる。
(ii)TMEM176B遺伝子を発現する細胞(例えば、TMEM176Bを導入した形質転換体)を上記の方法に従って作製し、常法に従って培養する際に被検物質を培地もしくは緩衝液中に添加し、一定時間インキュベート後(1日後〜7日後、好ましくは1日後〜3日後、より好ましくは2日後〜3日後)、該細胞に含まれるTMEM176BあるいはそれをコードするmRNAを、上記(i)と同様にして定量、解析することができる。
【0081】
TMEM176B遺伝子(mRNA)の発現レベルの検出および定量は、前記細胞から調製したRNAまたはそれから転写された相補的なポリヌクレオチドを用いて、ノーザンブロット法、RT-PCR法など公知の方法で実施できる。具体的には、TMEM176B遺伝子の塩基配列において連続する少なくとも15塩基を有するポリヌクレオチドおよび/またはその相補的なポリヌクレオチドをプライマーまたはプローブとして用いることによって、RNA中のTMEM176B遺伝子の発現の有無やその発現レベルを検出、測定することができる。そのようなプローブもしくはプライマーは、TMEM176B遺伝子の塩基配列をもとに、例えばprimer 3( HYPERLINK http://www.genome.wi.mit.edu/cgi-bin/primer/primer3.cgi http://www.genome.wi.mit.edu/cgi-bin/primer/primer3.cgi)あるいはベクターNTI(Infomax社製)を利用して設計することができる。
【0082】
ノーザンブロット法を利用する場合、前記プライマーもしくはプローブを放射性同位元素(32P、33Pなど:RI)や蛍光物質などで標識し、それを、常法に従ってナイロンメンブレン等にトランスファーした細胞由来のRNAとハイブリダイズさせた後、形成された前記プライマーもしくはプローブ(DNAまたはRNA)とRNAとの二重鎖を、前記プライマーもしくはプローブの標識物(RI若しくは蛍光物質)に由来するシグナルとして放射線検出器(BAS-1800II、富士フィルム社製)または蛍光検出器で検出、測定する方法を例示することができる。また、AlkPhos Direct Labelling and Detection System (Amersham PharamciaBiotech社製)を用いて、該プロトコールに従って前記プローブを標識し、細胞由来のRNAとハイブリダイズさせた後、前記プローブの標識物に由来するシグナルをマルチバイオイメージャーSTORM860(Amersham Pharmacia Biotech社製)で検出、測定する方法を使用することもできる。
RT-PCR法を利用する場合は、細胞由来のRNAから常法に従ってcDNAを調製して、これを鋳型として標的のTMEM176B遺伝子の領域が増幅できるように、TMEM176B遺伝子の配列に基づき調製した一対のプライマー(上記cDNA(−鎖)に結合する正鎖、+鎖に結合する逆鎖)をこれとハイブリダイズさせて、常法に従ってPCR法を行い、得られた増幅二本鎖DNAを検出する方法を例示することができる。なお、増幅された二本鎖DNAの検出は、上記PCRを予めRIや蛍光物質で標識しておいたプライマーを用いて行うことによって産生される標識二本鎖DNAを検出する方法、産生された二本鎖DNAを常法に従ってナイロンメンブレン等にトランスファーさせて、標識した前記プライマーをプローブとして使用してこれとハイブリダイズさせて検出する方法などを用いることができる。なお、生成された標識二本鎖DNA産物はアジレント2100バイオアナライザ(横河アナリティカルシステムズ社製)などで測定することができる。また、SYBR Green RT-PCR Reagents (Applied Biosystems 社製)で該プロトコールに従ってRT-PCR反応液を調製し、ABI PRIME 7900 Sequence Detection System (Applied Biosystems 社製)で反応させて、該反応物を検出することもできる。
被検物質を添加した細胞におけるTMEM176B遺伝子の発現が被検物質を添加しない対照細胞での発現量と比較して2/3倍以下、好ましくは1/2倍以下、更に好ましくは1/3倍以下であれば、該被検物質はTMEM176B遺伝子の発現抑制物質として選択することができる。
また、TMEM176Bの発現量を変化させる物質のスクリーニングは、TMEM176B遺伝子の転写調節領域を用いたレポーター遺伝子アッセイで行うことも可能である。ここで、「転写調節領域」とは、通常、当該染色体遺伝子の上流数kbから数十kbの範囲を指し、例えば、(i)5'-レース法(5'-RACE法)(例えば、5'-full Race Core Kit(タカラバイオ社製)等を用いて実施されうる)、オリゴキャップ法、S1プライマーマッピング等の通常の方法により、5'末端を決定するステップ;(ii)Genome Walker Kit(クローンテック社製)等を用いて5'-上流領域を取得し、得られた上流領域について、プロモーター活性を測定するステップ;を含む手法等により同定することが出来る。
【0083】
TMEM176B遺伝子の転写調節領域の下流に機能可能な形でレポータータンパク質をコードする核酸(以下、「レポーター遺伝子」という)を連結して、レポータータンパク質発現ベクターを構築する。該ベクターは当業者に公知の方法で調製すればよい。すなわち、「Molecular Cloning:A Laboratory Manual 2nd edition」(1989),Cold Spring Harbor Laboratory Press、「Current Protocols In Molecular Biology」(1987),John Wiley & Sons,Inc.等に記載される通常の遺伝子工学的手法に従って切り出されたTMEM176B遺伝子の転写調節領域を、レポーター遺伝子を含むプラスミド上に組み込むことができる。
レポータータンパク質としては、β-グルクロニダーゼ(GUS)、ルシフェラーゼ、クロラムフェニコールトランスアセチラーゼ(CAT)、β-ガラクトシダーゼ(GAS)およびグリーン蛍光タンパク質(GFP)等が挙げられる。
調製したTMEM176B遺伝子の転写調節領域を機能可能な形で連結されてなるレポーター遺伝子を、通常の遺伝子工学的手法を用いて、当該レポーター遺伝子を導入する細胞において使用可能なベクターに挿入し、プラスミドを作製し、適当な宿主細胞へ導入することができる。ベクターに搭載される選択マーカー遺伝子に応じた選抜条件の培地で培養することにより、安定な形質転換細胞を得ることができる。あるいは、TMEM176B遺伝子の転写調節領域を機能可能な形で連結されてなるレポーター遺伝子は、宿主細胞内に一過的に発現させてもよい。
また、レポーター遺伝子の発現量を測定する方法としては、個々のレポーター遺伝子に応じた方法を利用すればよい。例えば、レポーター遺伝子としてルシフェラーゼ遺伝子を用いる場合には、前記形質転換細胞を数日間培養後、当該細胞の抽出物を得、次いで当該抽出物をルシフェリンおよびATPと反応させて化学発光させ、その発光強度を測定することによりプロモーター活性を検出することができる。この際、ピッカジーンデュアルキット(登録商標;東洋インキ製)等の市販のルシフェラーゼ反応検出キットを用いることができる。
【0084】
TMEM176Bのタンパク質量の測定方法としては、具体的には、例えば、
(i)本発明の検出用抗体と、試料液および標識化されたTMEM176Bとを競合的に反応させ、該抗体に結合した標識化されたタンパク質を検出することにより試料液中のTMEM176Bを定量する方法や、
(ii)試料液と、担体上に不溶化した本発明の検出用抗体および標識化された別の本発明の検出用抗体とを、同時あるいは連続的に反応させた後、不溶化担体上の標識剤の量(活性)を測定することにより、試料液中のTMEM176Bを定量する方法等が挙げられる。
【0085】
TMEM176Bのタンパク質発現レベルの検出および定量は、TMEM176Bを認識する抗体を用いたウェスタンブロット法等の公知方法に従って定量できる。ウェスタンブロット法は、一次抗体としてTMEM176Bを認識する抗体を用いた後、二次抗体として125Iなどの放射性同位元素、蛍光物質、ホースラディッシュペルオキシダーゼ(HRP)等の酵素等で標識した一次抗体に結合する抗体を用いて標識し、これら標識物質由来のシグナルを放射線測定器(BAI-1800II:富士フィルム社製など)、蛍光検出器などで測定することによって実施できる。また、一次抗体としてTMEM176Bを認識する抗体を用いた後、ECL Plus Western Blotting Detection System(アマシャム ファルマシアバイオテク社製)を利用して該プロトコールに従って検出し、マルチバイオメージャーSTORM860(アマシャム ファルマシアバイオテク社製)で測定することもできる。
【0086】
上記の抗体は、その形態に特に制限はなく、TMEM176Bを免疫抗原とするポリクローナル抗体であっても、またそのモノクローナル抗体であってもよく、さらにはTMEM176Bを構成するアミノ酸配列のうち少なくとも連続する、通常8アミノ酸、好ましくは15アミノ酸、より好ましくは20アミノ酸からなるポリペプチドに対して抗原結合性を有する抗体を用いることもできる。
これらの抗体の製造方法は、すでに周知であり、本発明の抗体もこれらの常法に従って製造することができる(Current protocols in Molecular Biology edit. Ausubel et al. (1987) Publish. John Wiley and Sons. Section 11.12〜11.13)。
【0087】
上記(ii)の定量法においては、2種の抗体はTMEM176Bの異なる部分を認識するものであることが望ましい。例えば、一方の抗体がTMEM176BのN端部を認識する抗体であれば、他方の抗体として該タンパク質のC端部と反応するものを用いることができる。
標識物質を用いる測定法に用いられる標識剤としては、例えば、放射性同位元素、酵素、蛍光物質、発光物質などが用いられる。放射性同位元素としては、例えば、〔125I〕、〔131I〕、〔3H〕、〔14C〕などが用いられる。上記酵素としては、安定で比活性の大きなものが好ましく、例えば、β-ガラクトシダーゼ、β-グルコシダーゼ、アルカリフォスファターゼ、パーオキシダーゼ、リンゴ酸脱水素酵素などが用いられる。蛍光物質としては、例えば、フルオレスカミン、フルオレッセンイソチオシアネートなどが用いられる。発光物質としては、例えば、ルミノール、ルミノール誘導体、ルシフェリン、ルシゲニンなどが用いられる。さらに、抗体あるいは抗原と標識剤との結合にビオチン-(ストレプト)アビジン系を用いることもできる。
【0088】
本発明の検出用抗体を用いるTMEM176Bの定量法は、特に制限されるべきものではなく、試料液中の抗原量に対応した、抗体、抗原もしくは抗体−抗原複合体の量を化学的または物理的手段により検出し、これを既知量の抗原を含む標準液を用いて作製した標準曲線より算出する測定法であれば、いずれの測定法を用いてもよい。例えば、ネフロメトリー、競合法、イムノメトリック法およびサンドイッチ法が好適に用いられる。感度、特異性の点で、例えば、後述するサンドイッチ法を用いるのが好ましい。
【0089】
抗原あるいは抗体の不溶化にあたっては、物理吸着を用いてもよく、また通常タンパク質あるいは酵素等を不溶化・固定化するのに用いられる化学結合を用いてもよい。担体としては、アガロース、デキストラン、セルロースなどの不溶性多糖類、ポリスチレン、ポリアクリルアミド、シリコン等の合成樹脂、あるいはガラス等があげられる。
【0090】
サンドイッチ法においては不溶化した本発明の検出用抗体に試料液を反応させ(1次反応)、さらに標識化した別の本発明の検出用抗体を反応させた(2次反応)後、不溶化担体上の標識剤の量もしくは活性を測定することにより、試料液中のTMEM176Bを定量することができる。1次反応と2次反応は逆の順序で行っても、また、同時に行ってもよいし、時間をずらして行ってもよい。標識化剤および不溶化の方法は前記のそれらに準じることができる。また、サンドイッチ法による免疫測定法において、固相化抗体あるいは標識化抗体に用いられる抗体は必ずしも1種類である必要はなく、測定感度を向上させる等の目的で2種類以上の抗体の混合物を用いてもよい。
【0091】
本発明の検出用抗体は、サンドイッチ法以外の測定システム、例えば、競合法、イムノメトリック法あるいはネフロメトリーなどにも用いることができる。
競合法では、試料液中のTMEM176Bと標識したTMEM176Bとを抗体に対して競合的に反応させた後、未反応の標識抗原(F)と、抗体と結合した標識抗原(B)とを分離し(B/F分離)、B,Fいずれかの標識量を測定することにより、試料液中のTMEM176Bを定量する。本反応法には、抗体として可溶性抗体を用い、ポリエチレングリコールや前記抗体(1次抗体)に対する2次抗体などを用いてB/F分離を行う液相法、および、1次抗体として固相化抗体を用いるか(直接法)、あるいは1次抗体は可溶性のものを用い、2次抗体として固相化抗体を用いる(間接法)固相化法とが用いられる。
イムノメトリック法では、試料液中のTMEM176Bと固相化したTMEM176Bとを一定量の標識化抗体に対して競合反応させた後、固相と液相を分離するか、あるいは試料液中のTMEM176Bと過剰量の標識化抗体とを反応させ、次に固相化したTMEM176Bを加えて未反応の標識化抗体を固相に結合させた後、固相と液相を分離する。次に、いずれかの相の標識量を測定し試料液中の抗原量を定量する。
また、ネフロメトリーでは、ゲル内あるいは溶液中で抗原抗体反応の結果生じた不溶性の沈降物の量を測定する。試料液中のTMEM176Bの量がわずかであり、少量の沈降物しか得られない場合にもレーザーの散乱を利用するレーザーネフロメトリーなどが好適に用いられる。
【0092】
これら個々の免疫学的測定法を本発明の定量方法に適用するにあたっては、特別の条件、操作等の設定は必要とされない。それぞれの方法における通常の条件、操作法に当業者の通常の技術的配慮を加えてTMEM176Bの測定系を構築すればよい。これらの一般的な技術手段の詳細については、総説、成書などを参照することができる。
例えば、入江 寛編「ラジオイムノアッセイ」(講談社、昭和49年発行)、入江 寛編「続ラジオイムノアッセイ」(講談社、昭和54年発行)、石川栄治ら編「酵素免疫測定法」(医学書院、昭和53年発行)、石川栄治ら編「酵素免疫測定法」(第2版)(医学書院、昭和57年発行)、石川栄治ら編「酵素免疫測定法」(第3版)(医学書院、昭和62年発行)、「Methods in ENZYMOLOGY」 Vol. 70 (Immunochemical Techniques (Part A))、同書 Vol. 73 (Immunochemical Techniques (Part B))、同書 Vol. 74 (Immunochemical Techniques (Part C))、同書 Vol. 84 (Immunochemical Techniques (Part D: Selected Immunoassays))、同書 Vol. 92 (Immunochemical Techniques (Part E: Monoclonal Antibodies and General Immunoassay Methods))、同書 Vol. 121 (Immunochemical Techniques (Part I: Hybridoma Technology and Monoclonal Antibodies))(以上、アカデミックプレス社発行)などを参照することができる。
以上のようにして、本発明の検出用抗体を用いることによって、細胞におけるTMEM176Bの量を感度よく定量することができる。
【0093】
例えば、上記スクリーニング法において、被検物質の存在下におけるTMEM176Bの発現量(mRNA量またはタンパク質量)が、被検物質の非存在下における場合に比べて、約20%以上、好ましくは約30%以上、より好ましくは約50%以上阻害された場合、該被検物質を、TMEM176Bの発現抑制物質、従って、血管新生阻害活性を有する物質の候補として選択することができる。
【0094】
あるいは、上記スクリーニング法において、TMEM176B遺伝子を発現する細胞に代えて、TMEM176B遺伝子の内在の転写調節領域の制御下にあるレポーター遺伝子を含む細胞を用いることができる。このような細胞は、TMEM176B遺伝子の転写調節領域の制御下にあるレポーター遺伝子(例、ルシフェラーゼ、GFPなど)を導入したトランスジェニック動物の細胞、組織、臓器もしくは個体であってもよい。かかる細胞を用いる場合には、TMEM176Bの発現量は、レポーター遺伝子の発現レベルを、常法を用いて測定することにより評価することができる。
【0095】
(TMEM176Bの機能の測定)
本発明のスクリーニング方法は、被検物質がTMEM176Bの機能を抑制するか否かを指標として行うこともできる。
具体的には、TMEM176Bを発現する腫瘍血管内皮細胞において、被検物質を添加することにより、該細胞の遊走が抑制されるか否かを測定することにより実施することができる。例えば、被検物質存在下における腫瘍血管内皮細胞の細胞遊走が、被検物質の非存在下における細胞遊走に比べて、約10%以上、好ましくは約20%以上、より好ましくは約30%以上、更に好ましくは約50%以上阻害された場合に、該被検物質を、TMEM176Bの機能抑制物質、従って、血管新生阻害活性を有する物質の候補として選択することができる。
上記のスクリーニング方法において、コントロールとして、常法を用いて作製される、TMEM176B遺伝子がノックアウトされた細胞を用いることにより、被検物質がTMEM176B遺伝子を発現していないコントロール細胞において上記機能を示さないことを確認できる。すなわち、上記のスクリーニング方法において得られる血管新生阻害活性を有する候補物質の作用機序が、TMEM176BもしくはTMEM176B遺伝子の発現抑制またはTMEM176Bの機能抑制に基づくものであることが確認できる。
【0096】
本発明の上記いずれかのスクリーニング方法を用いて得られる、TMEM176Bの発現または機能を抑制する物質は、癌の予防および/または治療用に、医薬として有用である。
本発明のスクリーニング方法を用いて得られる化合物を上述の予防・治療剤として使用する場合、上記TMEM176Bの発現または機能を抑制する低分子化合物と同様に製剤化することができ、同様の投与経路および投与量で、ヒトまたは哺乳動物(例えば、マウス、ラット、ウサギ、ヒツジ、ブタ、ウシ、ウマ、ネコ、イヌ、サル、チンパンジーなど)に対して、経口的にまたは非経口的に投与することができる。
【0097】
VII. 癌の発症または発症リスクの判定方法
また、本発明は、被験動物より採取した試料中のTMEM176Bの発現量を測定することを特徴とする癌の発症または発症リスクの判定方法を提供する。当該方法は以下の(a)および(b)の工程を含む。
(a)被験動物より採取した試料中の、TMEM176B遺伝子もしくはTMEM176Bの発現量、またはTMEM176Bの機能を測定する工程
(b)正常動物由来の試料において測定した場合と比較して、前記発現量もしくは機能が上昇している被験動物を、癌を発症しているか、将来発症するリスクが高いと判定する工程
を提供する。
【0098】
被験動物としては、ヒトもしくは他の哺乳動物が挙げられるが、好ましくはヒト、あるいは実験動物として汎用されるマウス、ラット、ウサギ、イヌ、サル等である。測定対象試料としては、血液、血漿、血清、脳脊髄液、リンパ液、唾液、粘膜、尿、涙、精液、関節液、生検サンプル等が挙げられる。
【0099】
試料中のTMEM176B遺伝子の発現量およびタンパク質:TMEM176Bの量は、該遺伝子もしくは該タンパク質の発現量を指標とする上記スクリーニング法に記載されたのと同様の方法により測定することができる。
上記測定の結果、被験動物より採取した試料中のTMEM176B遺伝子の発現量またはTMEM176Bの量が、正常動物より採取した試料中のTMEM176B遺伝子の発現量またはTMEM176Bの量と比較して有意に高かった場合、該被験動物は、癌を発症しているか、将来発症するリスクが高いと判定することができる。あるいは、正常動物における発現量を予め同定しておき、例えば、その平均値+2SDをカットオフ値として規定し、被験動物より採取した試料中のTMEM176B遺伝子の発現量またはTMEM176Bの量が、当該カットオフ値を超えた場合に、該被験動物は、癌を発症しているか、将来発症するリスクが高いと判定することもできる。
【実施例】
【0100】
以下、実施例により本発明をより詳細に説明するが、本発明はこれらの実施例により何ら限定されるものではない。
【0101】
〔実施例1〕
移植用癌細胞懸濁液の調製
HSC3(ヒト舌癌細胞)は10%FBS(Hyclone社製)を含有するDMEM培地(SIGMA社製)を用いて、A375SM(ヒト高転移性のメラノーマ細胞)は10%FBS(Hyclone社製)を含有するMEM培地(GIBCO社製)を用いて、OSRC2(ヒト腎癌細胞)は10%FBS(Hyclone社製)を含有するRPMI培地(SIGMA社製)を用いて、それぞれ37℃、5% CO2条件下で培養した。培地を吸引除去後、PBS(日水製薬社)で1回洗浄し、0.5%トリプシン‐EDTA溶液(SIGMA 社製)を添加して、37℃、5% CO2条件下5分で剥離した細胞を、10% FBS含有DMEM培地(SIGMA社)を用いて懸濁した。該細胞懸濁液を1000rpm、4℃、5分間遠心して細胞を回収し、ハンクス緩衝液(Hank's buffered salt solution、以下HBSSと記す。GIBCO社製)で1x10 7細胞/mlに希釈・懸濁して移植用癌細胞懸濁液とした。
【0102】
〔実施例2〕
マウスへの癌細胞の移植
6〜7週齢のマウス(ストレイン:KSN/Slc nude、性別:female、ブリーダー:日本エスエルシー)の右背部皮下に、1匹当たり実施例1で調製した移植用癌細胞懸濁液0.1mlを、1mLシリンジ注射器(テルモ社製)と27G針(テルモ社製)を用いて注入した。移植腫瘍の直径が約10mmになるまで飼育した。
【0103】
〔実施例3〕
マウス初代血管内皮細胞の調製
実施例2にて作成した腫瘍皮下移植マウスをイソフルラン(アボットジャパン社製)で全身麻酔後、安楽死させた。腫瘍部分(腫瘍塊)を摘出し、終濃度10〜15mg/ml のII 型コラゲナーゼ(Collagenase Type II、GIBCO社)溶液20ml中でハサミを用いて細かく切断後、終濃度20〜30μg/mlとなるようにDNase(Roche社製)を加え、37℃で30分インキュベート(振蕩)して細胞懸濁液を調製した。該細胞懸濁液を含むチューブを氷上にたて、沈殿した未消化の組織片を除いた懸濁液(上層部分)を100μmメッシュサイズのセルストレーナー(BD Biosciences社製)を通して新しい50mLチューブに移した。そこに該細胞懸濁液と等量のFBSを添加してコラゲナーゼを失活させた。1000rpm、4℃、5分間遠心して細胞を回収後、20mLのHBSS(GIBCO社製)で懸濁した。該細胞懸濁液を同量(20ml)のHistopaque(登録商標)‐1077(SIGMA ALDRICH社製)上に重層し、2000rpm、4℃で20分遠心し、中間層に分離された単核球細胞を回収した。回収液に40mlのHBSS(GIBCO社製)を添加し、1000rpm、4℃で10分間遠心して細胞を回収後、40mlの0.5%BSA(Albumin solution,from bovine serum,30%,ASEPTICALLY FILLED:SIGMA社製)含有HBSSで再懸濁した。1000rpm、4℃、5分間遠心した後、1mlの0.5%BSA含有HBSSで懸濁し、室温で20分インキュベート(攪拌)した。そこに、ラット抗マウスCD31抗体(Purified Rat Anti-mouse CD31、BD Biosciences pharmingen社製)を5μl加え、4℃で30分間インキュベート(攪拌)した。1000rpm、4℃、5分間遠心した後、細胞を0.5%BSA含有HBSS にて懸濁して、再度1000rpm、4℃、5分間遠心した。回収した細胞を80μl の0.5% BSA含有MACS buffer(脱気した2mM EDTA含有PBS緩衝液)で懸濁後、ヤギ抗ラットIgG 磁気ビーズ (Goat Anti-Rat IgG Microbeads、Miltenyi Biotec社製)を20μl加え、4℃で15分間静置した。1000rpm、4℃、5分間遠心し、沈殿した細胞を1mlのMACS bufferで懸濁した。該懸濁液の細胞数が1×107個以下であれば MSカラム(MS Columns、Miltenyi Biotec社製)を、1×107個以上であればLSカラム(LS Columns、Miltenyi Biotec社製)を用いて以下の操作(MACS)を行った。先ず、選択したカラムを付属の磁気マグネットに設置し、500μl のMACS bufferを3回加えキァリブレーション(初期較正)した後、細胞懸濁液1mLをカラムに加え、500μlのMACS bufferで3回洗浄した。カラムをマグネットから外し、カラム内に残った磁気標識されたCD31陽性細胞を、カラムに付随しているシリンジを用い、1mLのMACS bufferで15mlチューブに押し出した。該細胞を血管内皮細胞専用培地EGM-2MV(Lonza社製)を用いて再懸濁し、細胞数を計測後、1.5%ゼラチン(SIGMA社製)含有PBSでコーティングした6 well plate (Nunc社製)に約2x105細胞/ wellの割合でまき、終濃度500ng/mlのジフテリア毒素(Calbiochem社)を含む20%FBS含有EGM-2MV培地で16時間培養後、ジフテリア毒素を含まない培地に変換し約2週間培養した。培養後の細胞を回収し、0.5%BSA含有HBSSにて再懸濁した後、上記CD31抗体の代わりにBS1-B4(Vector Laboratories社)を用いたMACSによってBS1-B4陽性細胞を分離・回収し、腫瘍血管内皮細胞として以下の実験に使用した。一方、正常血管内皮細胞は、腫瘍細胞を移植していないマウスの皮膚血管を出発材料とし、上記腫瘍血管内皮細胞の調製法と同様の操作で調製した。
【0104】
〔実施例4〕
マウス初代血管内皮細胞の培養
血管内皮細胞用増殖培地(ブレットキットEGM-2MV、Lonza社製)を用いて37℃、5% CO2条件下で培養した。継代の際は、フラスコから培地を吸引除去後、PBS(GIBCO社製)で1回洗浄し、0.05%トリプシン‐EDTA溶液(GIBCO社製)を添加後、37℃、5% CO2条件下3分で剥離した細胞を、10% FBS含有DMEM培地(ナカライテスク社製)を添加して懸濁・回収した。該細胞懸濁液を800rpmで室温、5分間遠心して細胞を回収し、EGM-2MV培地で希釈・懸濁して培養した。
【0105】
〔実施例5〕
マウス初代血管内皮細胞へのsiRNAトランスフェクション
0.8mlのEBM-2培地(Lonza社製)に10μMのsiRNA溶液1.44μlとLipofectamine RNAiMAX試薬(Invitrogen社製)8μlを添加して混和後、室温で10〜20分静置して以下に示すsiRNA(センス鎖のみを示す)とリポソームの複合体を形成させた。
mTMEM176B-1 siRNA:CCCUGGGACUAAGUCUCCGAAGUAU(配列番号17)
mTMEM176B-2 siRNA:UGCAAUCAAGCAUGGACCCUGGGUA(配列番号18)
【0106】
そこに、0.5%のFBSを含有するEBM-2培地で9x104細胞/mlに希釈した血管内皮細胞懸濁液を4ml添加し、混合した。該混合液を、RNA調製用として6穴プレート(旭テクノグラス社製)に1.5ml/ウェルで、遊走アッセイ用として6穴プレート(旭テクノグラス社製)に2.25ml/ウェルでそれぞれ分注した。37℃、5% CO2条件下で6時間培養後、等容のEGM-2MV培地(Lonza社製)をそれぞれ添加し、各アッセイを実施するまで37℃、5% CO2条件下で培養した。
尚、ここで用いたsiRNAは、Invitrogen社市販品である(mTMEM176B-1:TMEM176B Stealth Select RNAi siRNA (MSS227202)、およびmTMEM176B-2:TMEM176B Stealth Select RNAi siRNA (MSS227203)である。
【0107】
〔実施例6〕
遊走アッセイ
アンジオジェネシスシステム:血管内皮遊走アッセイ(ベクトン・ディッキンソン社製)を用いて測定した。即ち、siRNAトランスフェクション48時間後に、実施例5にて作成した遊走アッセイ用6穴プレートの培地を吸引除去し、PBS(GIBCO社製)で1回洗浄後、0.2% BSAを含有するEBM-2培地を1〜2ml/ウェルで添加して37℃、5% CO2条件下で2〜3時間培養した。ピペッティングにて細胞を剥離・懸濁させた後、0.2%トリパンブルー(GIBCO社)染色にて細胞数を計測した(10〜20x104細胞/ml程度になるよう、必要に応じて0.2% BSAを含有するEBM-2培地で希釈した)。室温に戻した遊走アッセイ用96穴プレート(ベクトン・ディッキンソン社製)の上部チャンバーに0.075ml/ウェルで上記細胞懸濁液を添加し、続いて、EBM-2培地で10倍希釈したEGM-2MV培地を0.225ml/ウェルで下部ウェルに添加し、CO2インキュベーター(37℃、5% CO2条件下)で16〜20時間培養した。上部チャンバー内の培養液を吸引除去後、HBSS(GIBCO社)にて4μg/mlの濃度に調製した Calcein AM(ベクトン・ディッキンソン社製)溶液0.225ml/ウェルで満たした別の96穴プレート(Falcon社製)に該チャンバーを浸し、そのままCO2インキュベーター(37℃、5% CO2条件下)で90分間培養して、チャンバーメンブレンを通過(遊走)した細胞を蛍光標識した。下方測光型蛍光プレートリーダー(CytoFluorII, PerSeptive Biosystems社製)で蛍光値を測定し(励起波長485nm/測定波長530nm)、上部チャンバーに撒きこんだ細胞数で補正して104細胞当たりの蛍光値を算出した。細胞を含まない培地のみ(ブランク)の測定値を0%、siRNAを含まないトランスフェクション試薬のみを添加した細胞(モック)の測定値を100%として、siRNAを導入した細胞の相対値(%)を計算した。以下の計算式にて遊走抑制率を計算した。
遊走抑制率=100%- siRNAを導入した細胞の相対値(%)
結果を表1に示した。
【0108】
【表1】

【0109】
以上の結果から、TMEM176B遺伝子のsiRNAをトランスフェクションしてTMEM176Bの遺伝子発現を抑制することにより、初代腫瘍血管内皮細胞及び初代正常血管内皮細胞の遊走が抑制された。このことから、TMEM176BのsiRNAは、血管内皮細胞の遊走抑制活性を有することがわかった。
【0110】
〔実施例7〕
定量的RT-PCR
(RNA調製)
実施例5記載の細胞から、QuickGene-800(富士フィルム社製)を用い、添付のプロトコールに従ってRNAを調製した。即ち、siRNAトランスフェクションの48時間後に、実施例5にて作成したRNA調製用6穴プレートの各ウェルから培地を吸引除去した後、QuickGene RNA cultured cell kit S(富士フィルム社製)添付のLRC溶解液に2-メルカプトエタノールを10μl/mlで添加した混合液を350μl/ウェルで添加し、細胞溶解液を調製した。70%エタノール溶液を350μl添加して混合後、10000rpmで室温、1分間遠心して混合液を回収し、回収した混合液全量をキット添付のカートリッジに添加した。該カートリッジをQuickGene-800の所定の場所にセット後、RNAモードを選択してRNAを自動調製した。調製したRNAはNanodrop-1000(Thermo scientific社製)で濃度を測定し、RT-PCR反応に供した。
(RT−PCR)
調製したRNAを鋳型としてTaqMan Reverse Transcription Reagents(ABI社製)を用いてcDNAを合成した。得られたcDNAを鋳型として定量しようとする遺伝子をコードする塩基配列領域を特異的に増幅できるように、一対のプライマー(上記cDNA(−鎖)に結合する正鎖、+鎖に結合する逆鎖)を設計し、通常の方法で合成した。マウスTMEM176Bを定量する際には下記に示される塩基配列からなるプライマー1および2を用いた。
マウスTMEM176B プライマー1:CTCCAAGTCTACTCCTCAAGCTCCA(配列番号19)
マウスTMEM176B プライマー2:CCAGAGTCCTACAGGAAAGCAGAGA(配列番号20)
18S ribosomal RNA プライマー1:GGGAGCCTGAGAAACGGC(配列番号21)
18S ribosomal RNA プライマー2:GGGTCGGGAGTGGGTAATTT(配列番号22)
【0111】
合成したプライマーおよびSYBR Green RT-PCR Reagents (Applied Biosystems 社製)を用いてプロトコールに従ってRT-PCR反応液を調製し、ABI PRIME 7900 Sequence Detection System (Applied Biosystems 社製)で反応させて、該反応物を検出、定量した。各サンプルにおけるマウスTMEM176Bの発現量を18SリボソームRNAの発現量で補正した値をそれぞれのサンプルにおけるTMEM176Bの発現レベルとし、通常、遺伝子発現抑制率は以下の計算式により求めた。
((対照細胞の発現レベル)−(siRNAを導入した細胞の発現レベル))/(対照細胞の発現レベル)×100
ここで対照細胞とは、siRNAを含まない、トランスフェクション試薬のみを添加した細胞(モック)を意味する。表2はマウスTMEM176B遺伝子の各siRNA(実施例5を参照)を、マウス初代腫瘍血管内皮細胞へ導入した際のマウスTMEM176Bの遺伝子発現抑制率を示す。
【0112】
【表2】

【0113】
以上の結果から、mTMEM176B-1、mTMEM176B-2の2種類のsiRNAにより、TMEM176Bの発現が抑制されていることがわかった。
【0114】
〔実施例8〕
マウス初代腫瘍血管内皮細胞での発現
実施例4で調製した細胞から実施例7に記載の方法でRNAを調製し、下記に示される塩基配列からなるプライマー3および4を用い、定量的RT-PCRを実施した。
マウスTMEM176B プライマー3:TGTTCCTAGCGTTCTGCATCATGC(配列番号23)
マウスTMEM176B プライマー4:CCGGCCATACATACTTCGGAGACTT(配列番号24)
その結果、TMEM176Bの発現は、マウス初代正常血管内皮細胞と比較して、マウス初代腫瘍血管内皮細胞で顕著に高いことが示された。(図1)
【0115】
〔実施例9〕
ヒトTMEM176Bの発現抑制
ヒトTMEM176Bに対するsiRNA配列(表3を参照)(19塩基対と2塩基の3'末端オーバーハングとからなる21塩基の二本鎖siRNA)を、アミダイトを用いたホスホロアミダイト法によりRNA合成機(ABI394)にて合成した。
1mlのOpti-MEM培地(GIBCO社製)あたりLipofectamine RNAiMAX試薬(Invitrogen社製)10μlを添加して混和後、6穴プレート(旭テクノグラス社製)に400μl/ウェルで分注した。該RNAiMAX希釈溶液400μlに10μMのsiRNA溶液2μlを添加あるいは非添加し、室温で20分間静置してsiRNAとリポソームの複合体を形成させた。そこに、10%のFBSを含有するDMEM培地(GIBCO社製)で1x105細胞/mlに調製したHEK293(ヒト胎児腎由来細胞株)の細胞懸濁液を1.6ml添加し、37℃、5% CO2条件下で一晩培養した。その後、6穴プレートの各ウェルから培地を吸引除去した後、QuickGene RNA cultured cell kit S(富士フィルム社製)添付のLRC溶解液に2-メルカプトエタノールを10μl/mlで添加した混合液を350μl添加し、細胞溶解液を調製した。以降、実施例7記載の方法でRNAを調製し、ヒトTMEM176Bに特異的なプライマーおよびヒトGAPDHに特異的なプライマーを用い、定量的RT-PCRを実施した。各サンプルにおけるヒトTMEM176Bの発現量をGAPDHの発現量で補正した値をそれぞれのサンプルにおけるTMEM176Bの発現レベルとし、実施例7に記載の方法で遺伝子発現抑制率を求めた。対照細胞としては、無処置の細胞を用いた。
使用したプライマーは以下のとおり。
ヒトTMEM176B プライマー1: CCAATGGCAGAAGGAGGAGTGTAGAG(配列番号25)
ヒトTMEM176B プライマー2: TGCTGTGAACAACTTCCTCAGCATCT(配列番号26)
ヒトGAPDH プライマー1:GCACCGTCAAGGCTGAGAAC(配列番号27)
ヒトGAPDH プライマー2:TGGTGAAGACGCCAGTGGA(配列番号28)
【0116】
各siRNAの配列と遺伝子発現抑制効果を表3に示した。尚、表3には、標的遺伝子のセンス鎖に相当する部分を表示しており、実際に調製したsiRNAは、表3に示した配列の3'末端にオーバーハング配列「dTdT」が付加されている。
【0117】
【表3】

【0118】
以上の結果から、製造したヒトTMEM176BのsiRNAは、ヒトTMEM176Bに対して遺伝子発現抑制効果を有することがわかった。
【産業上の利用可能性】
【0119】
本発明のTMEM176BまたはTMEM176B遺伝子の発現または機能を抑制する物質は、腫瘍血管内皮細胞の遊走抑制活性を示し、医薬、詳しくは癌の治療または予防薬として有用である。また、本発明のスクリーニング方法は、癌の治療または予防薬の候補物質となる、血管新生阻害剤を探索するために有用である。
【0120】
本発明を好ましい態様を強調して説明してきたが、好ましい態様が変更され得ることは当業者にとって自明であろう。本発明は、本発明が本明細書に詳細に記載された以外の方法で実施され得ることを意図する。したがって、本発明は添付の「請求の範囲」の精神および範囲に包含されるすべての変更を含むものである。
ここで述べられた特許および特許出願明細書を含む全ての刊行物に記載された内容は、ここに引用されたことによって、その全てが明示されたと同程度に本明細書に組み込まれるものである。
【配列表フリーテキスト】
【0121】
配列番号17〜18、および29〜43:siRNA
配列番号19〜28:PCRプライマー
【特許請求の範囲】
【請求項1】
TMEM176Bの発現または機能を抑制する物質を有効成分として含有する、抗腫瘍剤。
【請求項2】
物質が、TMEM176Bの発現を抑制する、以下の(1)〜(3)からなる群より選択される物質である、請求項1に記載の剤:
(1)TMEM176Bをコードする遺伝子の転写産物に対するアンチセンス核酸、
(2)TMEM176Bをコードする遺伝子の転写産物に対するリボザイム核酸、および
(3)TMEM176Bをコードする遺伝子の転写産物に対してRNAi活性を有する核酸もしくはその前駆体。
【請求項3】
物質が、TMEM176Bと結合する抗体である、請求項1に記載の剤。
【請求項4】
TMEM176Bが、以下の(a)〜(e)から選択されるアミノ酸配列からなるタンパク質である、請求項1〜3のいずれか1項に記載の剤:
(a)配列番号:2、4、6または8で示されるアミノ酸配列、
(b)配列番号:2、4、6または8で示されるアミノ酸配列において、1もしくは複数のアミノ酸が欠失、付加、挿入もしくは置換され、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(c)配列番号:2、4、6または8で示されるアミノ酸配列と60%以上の配列同一性を有し、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(d)配列番号:1、3、5または7で示される塩基配列を有するDNAによりコードされるアミノ酸配列、および
(e)配列番号:1、3、5または7で示される塩基配列を有するDNAに対し相補性を有するDNAと、ストリンジェントな条件下でハイブリダイズするDNAによりコードされ、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列。
【請求項5】
血管新生阻害剤である、請求項1〜4のいずれか1項に記載の剤。
【請求項6】
腫瘍血管新生阻害剤である、請求項5に記載の剤。
【請求項7】
腫瘍血管内皮細胞遊走抑制剤である、請求項1〜6のいずれか1項に記載の剤。
【請求項8】
TMEM176Bの発現量を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法。
【請求項9】
以下の(1)〜(3)の工程を含む、請求項8に記載のスクリーニング方法:
(1)TMEM176Bをコードする遺伝子もしくは該遺伝子の転写調節領域の制御下にあるレポータータンパク質をコードする核酸子を含む細胞に、被検物質を接触させる工程、
(2)前記細胞におけるTMEM176Bもしくはレポータータンパク質の発現量を測定する工程、および
(3)被検物質の非存在下において測定した場合と比較して、発現量を低下させる化合物を血管新生阻害剤の候補として選択する工程。
【請求項10】
TMEM176Bをコードする遺伝子の発現量を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法。
【請求項11】
TMEM176Bの機能を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法。
【請求項12】
癌を発症する危険性があるか否か、あるいは、癌に罹患しているか否かを判定する方法であって、以下の(1)および(2)の工程を含む方法:
(1)被験動物より採取した試料中の、TMEM176Bをコードする遺伝子もしくはTMEM176Bの発現量、またはTMEM176Bの機能を測定する工程、
(2)正常動物由来の試料において測定した場合と比較して、前記発現量もしくは機能が上昇している被験動物を、癌を発症する危険性があるか、癌に罹患していると判定する工程。
【請求項13】
以下の群:
(1)配列番号:29〜43で示される塩基配列、および
(2)配列番号:29〜43で示される塩基配列の3’末端に2〜4塩基が付加された塩基配列、
から選択されるいずれかの塩基配列からなるオリゴヌクレオチド。
【請求項14】
二重鎖RNA部分が、配列番号:29〜43から選択されるいずれかの配列番号で示される塩基配列からなる、siRNA。
【請求項15】
3’末端に2〜4塩基のオーバーハングが付加されていることを特徴とする、請求項14に記載のsiRNA。
【請求項16】
少なくとも1つの塩基が化学的に修飾されている請求項14または15に記載のsiRNA。
【請求項17】
少なくとも1つのホスホジエステル結合が化学的に修飾されている請求項14〜16のいずれか1項に記載のsiRNA。
【請求項18】
請求項14〜17のいずれか1項に記載のsiRNAを有効成分として含有する抗腫瘍剤。
【請求項1】
TMEM176Bの発現または機能を抑制する物質を有効成分として含有する、抗腫瘍剤。
【請求項2】
物質が、TMEM176Bの発現を抑制する、以下の(1)〜(3)からなる群より選択される物質である、請求項1に記載の剤:
(1)TMEM176Bをコードする遺伝子の転写産物に対するアンチセンス核酸、
(2)TMEM176Bをコードする遺伝子の転写産物に対するリボザイム核酸、および
(3)TMEM176Bをコードする遺伝子の転写産物に対してRNAi活性を有する核酸もしくはその前駆体。
【請求項3】
物質が、TMEM176Bと結合する抗体である、請求項1に記載の剤。
【請求項4】
TMEM176Bが、以下の(a)〜(e)から選択されるアミノ酸配列からなるタンパク質である、請求項1〜3のいずれか1項に記載の剤:
(a)配列番号:2、4、6または8で示されるアミノ酸配列、
(b)配列番号:2、4、6または8で示されるアミノ酸配列において、1もしくは複数のアミノ酸が欠失、付加、挿入もしくは置換され、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(c)配列番号:2、4、6または8で示されるアミノ酸配列と60%以上の配列同一性を有し、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列、
(d)配列番号:1、3、5または7で示される塩基配列を有するDNAによりコードされるアミノ酸配列、および
(e)配列番号:1、3、5または7で示される塩基配列を有するDNAに対し相補性を有するDNAと、ストリンジェントな条件下でハイブリダイズするDNAによりコードされ、かつ配列番号:2、4、6または8で示されるアミノ酸配列からなるタンパク質を特異的に認識する抗体によって認識され得るアミノ酸配列。
【請求項5】
血管新生阻害剤である、請求項1〜4のいずれか1項に記載の剤。
【請求項6】
腫瘍血管新生阻害剤である、請求項5に記載の剤。
【請求項7】
腫瘍血管内皮細胞遊走抑制剤である、請求項1〜6のいずれか1項に記載の剤。
【請求項8】
TMEM176Bの発現量を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法。
【請求項9】
以下の(1)〜(3)の工程を含む、請求項8に記載のスクリーニング方法:
(1)TMEM176Bをコードする遺伝子もしくは該遺伝子の転写調節領域の制御下にあるレポータータンパク質をコードする核酸子を含む細胞に、被検物質を接触させる工程、
(2)前記細胞におけるTMEM176Bもしくはレポータータンパク質の発現量を測定する工程、および
(3)被検物質の非存在下において測定した場合と比較して、発現量を低下させる化合物を血管新生阻害剤の候補として選択する工程。
【請求項10】
TMEM176Bをコードする遺伝子の発現量を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法。
【請求項11】
TMEM176Bの機能を低下させる化合物を選択することを特徴とする、血管新生阻害剤のスクリーニング方法。
【請求項12】
癌を発症する危険性があるか否か、あるいは、癌に罹患しているか否かを判定する方法であって、以下の(1)および(2)の工程を含む方法:
(1)被験動物より採取した試料中の、TMEM176Bをコードする遺伝子もしくはTMEM176Bの発現量、またはTMEM176Bの機能を測定する工程、
(2)正常動物由来の試料において測定した場合と比較して、前記発現量もしくは機能が上昇している被験動物を、癌を発症する危険性があるか、癌に罹患していると判定する工程。
【請求項13】
以下の群:
(1)配列番号:29〜43で示される塩基配列、および
(2)配列番号:29〜43で示される塩基配列の3’末端に2〜4塩基が付加された塩基配列、
から選択されるいずれかの塩基配列からなるオリゴヌクレオチド。
【請求項14】
二重鎖RNA部分が、配列番号:29〜43から選択されるいずれかの配列番号で示される塩基配列からなる、siRNA。
【請求項15】
3’末端に2〜4塩基のオーバーハングが付加されていることを特徴とする、請求項14に記載のsiRNA。
【請求項16】
少なくとも1つの塩基が化学的に修飾されている請求項14または15に記載のsiRNA。
【請求項17】
少なくとも1つのホスホジエステル結合が化学的に修飾されている請求項14〜16のいずれか1項に記載のsiRNA。
【請求項18】
請求項14〜17のいずれか1項に記載のsiRNAを有効成分として含有する抗腫瘍剤。
【図1】




【公開番号】特開2012−100629(P2012−100629A)
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願番号】特願2010−254205(P2010−254205)
【出願日】平成22年11月12日(2010.11.12)
【出願人】(000002912)大日本住友製薬株式会社 (332)
【出願人】(504173471)国立大学法人北海道大学 (971)
【Fターム(参考)】
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願日】平成22年11月12日(2010.11.12)
【出願人】(000002912)大日本住友製薬株式会社 (332)
【出願人】(504173471)国立大学法人北海道大学 (971)
【Fターム(参考)】
[ Back to top ]

