腸内細菌科菌群の細菌検出方法
【課題】 食品中の腸内細菌科菌群の検出において、非腸内細菌科菌の存在にもかかわらず腸内細菌科菌群の細菌の存否を正しく判断でき、しかも短時間で判定できる方法を提供する。
【解決手段】 キャップ7によって密閉できる全体が透明となった容器本体1に、増菌用の培地を遮断する二酸化炭素透過膜4で隔てられた培地収容部2と指示薬収容部3を構成し、前記培地収容部2に、E.E.ブロスのような腸内細菌科菌群の細菌増菌用成分と細菌増殖抑制成分である胆汁酸及び/又は胆汁酸塩とブリリアントグリーンを含み、他の細菌増殖抑制成分を実質的に含まないリン酸緩衝液からなる液体培地5を収容し、前記指示薬収容部3に二酸化酸素の呈色指示薬6を収容して、本発明の検査具とする。
【解決手段】 キャップ7によって密閉できる全体が透明となった容器本体1に、増菌用の培地を遮断する二酸化炭素透過膜4で隔てられた培地収容部2と指示薬収容部3を構成し、前記培地収容部2に、E.E.ブロスのような腸内細菌科菌群の細菌増菌用成分と細菌増殖抑制成分である胆汁酸及び/又は胆汁酸塩とブリリアントグリーンを含み、他の細菌増殖抑制成分を実質的に含まないリン酸緩衝液からなる液体培地5を収容し、前記指示薬収容部3に二酸化酸素の呈色指示薬6を収容して、本発明の検査具とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、腸内細菌科菌群の細菌検出方法、特に食品を対象とした腸内細菌科菌群の細菌検出方法に関する。
【背景技術】
【0002】
食品の品質管理項目の一つとして腸内細菌科菌群の検査項目がある。腸内細菌科菌群は一般に無芽胞のグラム陰性桿菌で好気性又は通性嫌気性の細菌群であって、食中毒の原因菌とされている病原性大腸菌やサルモネラ属菌などを腸内細菌科菌群の一群として包括的に把握することによって効率的なリスク管理を行っている。腸内細菌科菌群には、病原性大腸菌やサルモネラ属菌などの食中毒に関連する細菌が含まれるため、食品中において腸内細菌科菌群の存在を一定程度以下に管理することが求められている。
【0003】
腸内細菌科菌群の細菌の検出方法としてISO(21528−1:2004)に定める方法がある。この方法は、BPW培地(緩衝ペプトン水培地)により試料中に存在する細菌を非選択的に培養する工程と、その後にE.E.ブロスにより腸内細菌科菌群を選択的に培養する工程と、VRBG培地によりE.E.ブロス中の培養菌を分離平板上で生育させて判定する工程とからなる方法である。しかしながら、この方法では試験開始から判定までに、少なくとも72時間以上を要する。
【0004】
特許文献1(特開平11−178597号公報)や特許文献2(特開2001−178496号公報)には、容器内に液体培地と二酸化炭素の呈色指示薬とを、液体培地を遮断する二酸化炭素透過膜を隔てて収容した検査具が開示されている。当該検査具は販売名を「センシメディア(登録商標)」として商品化が図られ、腸内細菌科菌群の細菌を検出するための培地が収容された検査具が上市されている(非特許文献1)。
【0005】
この検査具では、液体培地中で細菌が増殖することによって発生した二酸化炭素が二酸化炭素の透過膜を透過して、呈色指示薬と反応することで呈色指示薬が呈色する。その呈色の濃度を検出し、検査対象試料を用いて求められた所定濃度の呈色に至るまでの時間と、菌数が既知である標準試料を用いて求められた所定濃度の呈色に至るまでの時間との対比から、検査対象試料中の菌数が推定される。この検査具を用いた場合には、培養の開始から24時間程度で菌数が求められ、菌数の限度値が設定されている場合には、推定陽性・陰性の判定が可能となる。
【0006】
例えば、牛乳専用に調製された腸内細菌科菌群用の検査具の場合には、腸内細菌科菌群を代表する数種類の標準菌株について、標準菌株ごとに液体培地に添加された菌数と所定濃度の呈色に至る時間との関係が予め求められており、試料を用いた場合における所定濃度の呈色に至るまでの時間から試料中の菌数が求められる。また、測定の開始より12時間が経過した際に所定濃度の呈色が認められない、つまり呈色の変化が認められない場合には、菌数がゼロであると判断される。
【0007】
また、この検査具では、細菌の増殖に伴って生じる二酸化炭素を利用しているために、検査対象である細菌以外の増菌を可能な限り抑制する必要がある。このために、例えば、特許文献2に記載されている大腸菌群用の検査具には、大腸菌群など検査対象である細菌の増殖に必要な成分の他に、他の細菌群の増菌を抑制する物質として、塩化ナトリウムが添加された液体培地や塩化ナトリウムに加えて胆汁酸又は/及び胆汁酸塩が添加された液体培地が用いられている。また、非特許文献1に記載された牛乳専用の検査具には、他の細菌群の増菌を抑制する物質として、塩化ナトリウムと抗生物質であるバンコマイシンが添加された液体培地が用いられている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平11−178597号公報
【特許文献2】特開2001−178496号公報
【非特許文献】
【0009】
【非特許文献1】マイクロバイオ株式会社、"SensiMedia"、[online]、[平成22年8月16日検索]、インターネット〈URL:http://www.microbio.co.jp/products/sensimedia.html〉
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、非特許文献1に記載された腸内細菌科菌群用の検査具では、増菌処理後の培養液を試料としてとして加えた場合には、エンテロコッカス属の細菌などの腸内細菌科菌群以外の細菌(非腸内細菌科菌群の細菌)によっても呈色が観察され、腸内細菌科菌群が推定陽性(偽陽性)であると判断される場合があった。また、腸内細菌科菌群の細菌の存在によって培地が変色し、当該変色の有無によっても腸内細菌科菌群の存否が判断できる。ところが、非腸内細菌科菌群の細菌の存在によって呈色指示薬の呈色による結果と培地の変色による結果とが一致しない場合があった。この場合には、腸内細菌科菌群による呈色であるのかどうか、さらに別の方法にて確定の判定を行わなければならず、製品の出荷管理上、出荷可能となるまでの保管期間が延びるという問題もあった。その一方、ISO法では陽性として判断されるが、非特許文献1に記載された腸内細菌科菌群用の検査具では陰性として判断されるようでは、出荷検査のための方法として採用することができない。
【0011】
また、特許文献2に記載の検査具は、目的とする細菌による所定量の二酸化炭素を排出するまでの時間が他の細菌による排出に要する時間に比べて短くなるような培地が用いられている。例えば大腸菌群の細菌であるO−157用の培地を用いた場合には、O−157の検出から遅れて、他の大腸菌などが検出されることになる。また、サルモネラ属菌用の培地を用いた場合には、サルモネラ属菌の検出から遅れて、他の大腸菌などが検出されることになる。従って、大腸菌群の細菌とサルモネラ属菌を腸内細菌科菌群として包括的に検出する検査具として用いるのは妥当ではない。
【0012】
本発明は上記背景技術に基づいてなされたものであって、本発明は食品中の腸内細菌科菌群の検出において、腸内細菌科菌群の細菌の有無を正しく判断できるだけでなく、しかも短時間で判定できる方法を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明の検査具は、前記の検査具において、前記液体培地は腸内細菌科菌群の細菌増菌用成分と細菌増殖抑制成分である胆汁酸及び/又は胆汁酸塩とブリリアントグリーンを含み、他の細菌増殖抑制成分を実質的に含まないリン酸緩衝液からなる液体培地を用いた検査具である。
【発明の効果】
【0014】
本発明によると、エンテロコッカス属の細菌による偽陽性の判定が少なくなり、主に乳製品などの食品における腸内細菌科菌群の細菌の存否を迅速に判断できる。
【図面の簡単な説明】
【0015】
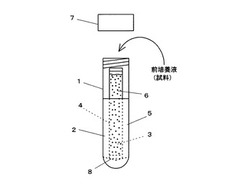
【図1】図1は本発明の一実施形態である検査具の側面図である。
【発明を実施するための形態】
【0016】
本発明の検査具は、密閉可能な容器内に、増菌用の培地を遮断する二酸化炭素透過膜で隔てて培地収容部と指示薬収容部とを備え、前記容器は外側から前記指示薬収容部の内部を見通せる透明部を備える。培地収容部には増菌用の培地が収容され、指示薬収容部には二酸化炭素の呈色指示薬が収容される。
【0017】
透明部は指示薬収容部の呈色が観察されればよく、容器全体が透明であっても容器の一部が透明であってもよい。また、透明部は無色であることが好ましい。呈色の変化を確実に観察するためである。容器は、例えば、図1に示すように、全体が透明となったプラスチック製の容器本体1に、キャップ7が螺合により脱着可能に取り付けられ、培地5及び呈色指示薬6が収納された後には、検査対象試料を入れるまで密閉状態で保管される。
【0018】
培地収容部2と指示薬収容部3は、増菌用の培地を遮断する二酸化炭素透過膜4で隔てられ、培地収容部2で発生した二酸化炭素が当該透過膜4を透過して指示薬収容部3に収容された呈色指示薬6と反応する。例えば、図1に示すように、指示薬収容部3を二酸化炭素透過膜4から構成した密閉した袋とし、指示薬収容部3で占められた空間以外の容器内空間を培地収容部2とすることや、図示はしないが、容器内部を二酸化酸素透過膜で上下に分割し、一方の空間を培地収容部とし、他方の空間を指示薬収容部とすることができる。また、図1に示すように、袋状からなる指示薬収容部3を構成した場合には、培地収容部2に収容された培地5の上面の高さよりも高い位置に指示薬収容部3に収容した呈色指示薬6の上面の高さが位置するように培地を収容するのが好ましい。培地5の着色に影響を受けずに呈色指示薬6の呈色を観察できるからである。また、容器内部を透過膜で上下に分割した場合には、二酸化炭素透過膜よりも下方を指示薬収容部とするのが好ましい。容器を開封して培地に試料を加えるためである。なお、図1に示す容器本体1の底の近くには、指示薬収容部3の下端部を支持する支持部材8が備えられている。この支持部材8はキャップ7の内面に設けられた支持部材(図示せず)と対をなして、呈色指示薬6の上面高さが培地5の上面高さよりも高い位置に位置するように指示薬収容部3を保持する。
【0019】
二酸化炭素透過膜4は、二酸化炭素は透過するが、イオン交換を生じずに培地と呈色指示薬を確実に分離できるものであれば、その材質は特に問われない。例えば、未延伸ポリプロピレン、延伸ポリプロピレン、低密度ポリエチレン、高密度ポリエチレンなどフィルムが用いられる。その他、シリコンゴムやポリアルキルスルホンからなる均質膜、ポリテトラフルオロエチレンやポリスルホンからなる多孔質膜、ポリプロピレンとシリコンとの複合膜、ポリプロピレンとポリアルキルスルホンとの複合膜を用いることができる。
【0020】
呈色指示薬は二酸化炭素と反応して呈色する指示薬であれば特に制約されず、二酸化炭素の反応剤とpH指示薬との混合液、例えば、水酸化ナトリウムとチモールフタレインの水溶液、水酸化ナトリウムとフェノールフタレインの水溶液、水酸化カルシウム水溶液、ヘモグロビンや赤血球、血液などのヘムを含む物質の水溶液の他、メチルバイオレットやメチルオレンジ、コンゴーレッド、メチルレッド、ブロムチモールブルー、フェノールレッド、クレゾールレッド、チモールブルーなど各種呈色指示薬の水溶液が挙げられる。なお、呈色は着色又は脱色のいずれであってもよい。
【0021】
検査対象試料に細菌が存在すると、増菌により二酸化炭素が生成される。本発明の検査具は、この二酸化炭素と指示薬収容部の呈色指示薬との反応により生じた呈色を利用する。すなわち、同じ培養条件下では、検査対象試料中の細菌数は、所定濃度の呈色を生じるに要する時間と相関関係がある。検査対象試料を検査具に直接加える場合には、検査対象試料中の細菌数が多ければ、所定濃度の呈色を生じるに要する時間は短くなり、少ないほど長くなる。従って、予め菌数が既知である数種類の試料(標準試料)を用いて、所定濃度の呈色を生じるに要した時間を測定し、菌数と時間との関係(感度特性)を求めておき、検査対象試料を用いて測定した所定濃度の呈色を生じるに要した時間と対比することにより、検査対象試料中の菌数を求めることができる。また、菌数が既知である数種類の試料を用いて、一定時間に生じる呈色濃度(濃度変化)を測定しておき、その時間を経過した際に、検査対象試料を用いて測定した呈色濃度から、おおよその菌数を求めることもできる。従って、例えば、希釈して理論上1×100の菌数を含む試料を用いて、測定開始から18時間あるいは24時間など一定時間経過後に呈色の濃度変化を予め測定しておき、検査対象試料を用いて測定した濃度変化が予め測定した前記濃度変化よりも小さい場合には、理論上1×100以下、すなわち当該細菌は検出されないという判定が行える。
【0022】
このような検査具として、例えば特許文献1や特許文献2に記載された種々の検査具が例示される。本発明の検査具は、このような検査具であって、偽陽性とされる細菌、すなわち、非腸内細菌科菌群による偽陽性の判断を少なくしたものである。
【0023】
本発明の検査具においては、増菌用の培地として、腸内細菌科菌群の細菌増菌用成分と細菌増殖抑制成分である胆汁酸及び/又は胆汁酸塩とブリリアントグリーンを含み、他の細菌増殖抑制成分を実質的に含まない緩衝系溶液からなる液体培地が用いられる。
【0024】
増菌用の培地成分として、大腸菌群増菌用の培地成分や腸内細菌科菌群増菌用の培地成分、サルモネラ属菌増菌用の培地成分として一般的に用いられる成分、例えば、乳糖、ブドウ糖、トリプトース、酵母エキス、カゼインペプトンなどの各種ペプトンが例示され、これらの1種若しくは2種以上が用いられる。
【0025】
細菌増殖抑制成分は、腸内細菌科菌群以外の細菌、例えばセレウス菌や黄色ブドウ球菌などの増殖を抑制する成分である。本発明では、胆汁酸及び/又は胆汁酸塩とブリリアントグリーンのみが用いられ、塩化ナトリウムなどこれ以外の細菌増殖抑制成分は実質的に含まない。胆汁酸や胆汁酸塩、ブリリアントグリーンは、ラウリル硫酸のような選択剤よりも、エンテロコッカス属菌などの腸内細菌科菌群以外の細菌に対する抑制能が強いとされているからである。ここで、実質的に含まないとは、腸内細菌科菌群の細菌の増殖を抑制しない程度に含まないことを意味し、例えば、胆汁酸塩の一部には少数の腸内細菌を抑制する成分が含まれたり、酵母エキスやペプトン中に含まれる塩化ナトリウムが混入したりする場合があるが、このような場合には、実質的に含まれていないと言える。従って、胆汁酸や胆汁酸塩は、精製された胆汁酸や胆汁酸塩、特にウシの胆汁酸を用いるのが好ましい。これらの細菌増殖抑制成分は、例えば18〜24時間の培養時間で非腸内細菌科菌群の細菌の増殖によって呈色反応を生じさせないように、培地中に配合される。なお、判定を行うまでの培養時間によって、この配合量は調整される。
【0026】
これらの成分はリン酸緩衝液に溶解される。リン酸緩衝液はリン酸とリン酸塩とから構成される緩衝液であり、リン酸水素二ナトリウムとリン酸二水素カリウムなどのようにpKa(酸解離定数)の異なる2種以上のリン酸塩を用いて構成されたり、リン酸とリン酸ニナトリウムなどのようにリン酸とその塩を用いて構成される。リン酸塩は、ナトリウム塩、カリウム塩、アンモニウム塩などいずれの塩でも差し支えない。このとき、液体培地のpHが7±0.5、好ましくは7.2±0.2に調整される。
【0027】
このように腸内細菌科菌群用の増殖培地と非腸内細菌科菌群の増殖抑制成分を含む培地として、培地1L中にペプトン10±1g、ブドウ糖5±0.5g、リン酸水素二ナトリウム(無水物)6.5±0.6g、リン酸二水素カリウム2±0.2g、精製ウシ胆汁酸20±2g、ブリリアントグリーン13±2mgを含む液体培地が好適に用いられる。この培地には、E.E.ブロス(E.E.ブイヨン)として市販されている培地(例えば、OXOID社製のE.Eブロスなど)をそのまま用いることができる。もっとも、検査対象試料が溶液である場合には、添加する試料の量に応じて、試料を添加した後の最終濃度が上記濃度となるようにした高濃度の組成の培地を、培地収納部に収容するのが好ましい。培地収容部には、1×108〜1×100cfuの細菌数が検出可能な程度の量の培地が収容される。培地の収容量は、容器当たり1〜20ml、好ましくは4〜5mlである。
【0028】
本発明の細菌検出方法は上記の検査具を用いる方法であって、上記検査具に収容された液体培地に検査対象試料を添加する工程と、前記容器を密閉して培養を開始し、培養の開始から定められた時間経過時に前記指示薬収納部の呈色の濃度を測定する工程を備え、定められた呈色の濃度との対比により、細菌の存否を判断する方法である。すなわち、本発明の検査方法では、一定時間培養した後に生じた呈色指示薬の呈色の濃度と予め定められた標準となる呈色の濃度との対比によって細菌の有無を判定する。
【0029】
その検出方法には、検査対象試料を検査具の培地収容部に直接入れる場合と、検査対象試料を予め非選択培地や水などの適当な媒体に溶かした溶液を培地収容部に入れる場合とがあり、検査対象試料の種類などによって適宜選択できる。また、本発明の検査方法においては、いわゆる前培養(増菌処理)として検査対象試料中の細菌を非選択培地で培養した後に、当該培養液を検査具の培地収容部に入れるのが好ましい。検査対象試料の製造工程などにおいて、何らかの要因で損傷を受けた損傷菌を回復させ、検査対象試料中に存在する腸内細菌科菌群の検出を確実に行うためである。
【0030】
非選択培地として、例えば、トリプトンソーヤブイヨン培地やBPW培地など公知の非選択培地が用いられる。ISO法による検査結果と高い相関を得るためにBPW培地が好ましく用いられる。培養は多種類の細菌が増殖できる条件下、好ましくは37±1℃の好気性条件下で、18〜24時間で行えばよい。
【0031】
検査対象試料には、食品(製品及び原材料などを含む)のみならず各種の食品の製造工程(機器表面、床面、壁面など)における拭き取りサンプルである環境試料なども該当する。また、食品の中でも、特に、牛乳、発酵乳、粉乳(乳を加熱して粉末にしたもの、全脂粉乳、脱脂粉乳、ホエイ粉など)、乳幼児用調製粉乳(栄養成分などが調製された乳幼児に与えられる粉乳:いわゆる粉ミルク)などの乳製品やベビーフードが好ましい対象であり、さらに望ましくはこれらの食品の中でも、粉乳、乳幼児用調製粉乳、ベビーフードが望ましい対象であると言える。
【0032】
水、乳製品などの食品中の大腸菌群の細菌の検出に用いられる選択培地としてラウリル硫酸ブイヨン(LST培地)が知られているが、このLST培地では、非腸内細菌科菌群の菌であるエンテロコッカス属菌を抑制できない(エンテロコッカス属菌の発育が中程度/良好である。)。しかしながら、E.E.ブロスでは、胆汁酸や胆汁酸塩とブリリアントグリーンによりエンテロコッカス属菌を抑制できる。そして、胆汁酸や胆汁酸塩では、エンテロコッカス属菌の一部に対して抑制能が十分ではないが、ブリリアントグリーンを加える(併用する)ことで、抑制能が十分に発揮される。ここで、例えば検査対象試料が牛乳の場合には、エンテロコッカス属菌は殺菌されるため、エンテロコッカス属菌への抑制能を勘案しなくても良いが、検査対象試料が粉乳、乳幼児用調製粉乳、ベビーフードなどの場合には、エンテロコッカス属菌が残存している可能性があり、エンテロコッカス属菌への抑制能は必要となる。そこで、検査対象試料が粉乳、乳幼児用調製粉乳、ベビーフードなどの場合には、ラウリル硫酸ブイヨンなどと比べて、E.E.ブロスを使用すること、特にブリリアントグリーンを使用することが優れていると言える。
【0033】
本発明の細菌検出方法により検査され、出荷の是非を判断された食品(牛乳、発酵乳、粉乳、乳幼児用調製粉乳などの乳製品やベビーフードなど)は、衛生的な環境下で適正に製造された製品とみなされる。
【0034】
検査対象試料の使用量は食品の種類や推定される非腸内細菌科菌群の細菌数、培地の使用量などによっても適宜調整される。検査対象試料の使用量が多いほど、腸内細菌科菌群の細菌を検出する確率が高くなり、検出精度の観点からは好ましいが、検査対象試料を検査具に直接加える場合には、検査対象試料の使用量が多いと、非腸内細菌科菌群が多量に存在した際に、偽陽性として判断される傾向にある。従って、1〜20mlの培地を収容した検査具であれば、0.01〜10gの個体試料又は0.01〜10mlの液体試料が使用される。また、前培養した場合には、1〜20mlの培地に対し0.1〜1mlの培養液が使用される。さらに望ましくは、4mlの液体培地に対して0.1mlの培養液が使用される。なお、前培養(増菌処理)してから、その一部を検査具に加える場合には、検査対象試料の使用量を多くする(増やす)ことが可能である。
【0035】
検査対象試料又は培養液が加えられた容器は密閉され、37℃付近で一定時間、好ましくは18〜24時間培養される。細菌が存在すると呈色指示薬が呈色し、呈色の濃度が時間とともに変化する。培養を終えた段階で呈色の濃度が測定される。
【0036】
対比される基準となる呈色の濃度は種々の方法によって定められる。例えば、培地に添加される検査対象試料又は培養液の代わりに、同量の無菌である培地や水を加えて培養して得られた呈色の濃度を基準にする方法、培養開始直後の提示指示薬による呈色の濃度を基準にする方法、さらには、菌数が既知である試料を培地に加えて培養して得られた呈色の濃度を基準にする方法が例示される。この中では、簡便に判定できる観点から、培養開始直後の提示指示薬による呈色の濃度を基準にする方法が好ましく採用される。呈色の変化を観察するだけでよいからである。
【0037】
そして、これらの基準となる呈色の濃度と、検査対象試料を用いて得られた呈色の濃度とを対比し、検査対象試料を用いて得られた呈色の濃度が基準となる呈色の濃度よりも同じか低いと判断されると、基準となる呈色の濃度が得られた菌数とほぼ同じか、それよりも少ない菌数の細菌が検査対象試料中に存在すること、若しくは細菌が検査対象試料中に存在しないと判定できる。このように本発明の細菌検出方法によれば、測定開始から18〜24時間あるいは前培養を含めると48時間以内で、検査対象試料中の腸内細菌科菌群の細菌の有無を判断できる。
【0038】
もっとも、特許文献1や特許文献2に記載されているように、検査対象試料を検査具に直接加える場合には、検査具による培養の開始から所定の呈色濃度が観察される時間を測定することによって、検査対象試料中に存在する菌数を測定できるのは言うまでもない。
【実施例1】
【0039】
次に、本発明について下記の実施例に基づいて説明する。なお、下記の実施例はあくまでも例示であって、本発明は下記の実施例に限られるものではない。
【0040】
(市販品を用いた検出)
乳児用の調製粉乳(商品名:ほほえみ(明治乳業(株)製))に、非腸内細菌科菌群の細菌を接種したものを検査対象試料として、市販の検査具であるセンシメディア腸内細菌用(SML016)及び同試料20ml添加用(SML016−20)を用いて、試料中の細菌の検出を行った。非腸内細菌科菌群の細菌として、調製粉乳の原料などから分離されたエンテロコッカス属菌(Enterococcus sp.)、セレウス菌(Bacillus cereus)、緑濃菌(Pseudomonas aerigonosa)の3つの菌種を用いた。
【0041】
調製粉乳10gに上記細菌を含む菌液(生理食塩水で希釈した菌液)10μLを接種して、BPW培地(メルク社製、カタログ番号1.07228.0500)90mlを加えてから、37℃、18〜24時間で培養を行い、前培養(増菌処理)を行った。これとは別に、細菌を含む菌液をSMA寒天培地(標準寒天培地:栄研化学社製)により、37℃、48時間で培養を行い、菌液に含まれる菌数を計測した。
【0042】
次に、表1に示す量の前培養液(BPW培養液:18時間で培養した培養液と24時間で培養した培養液)及び滅菌精製水を検査具の培地収容部に加えて、37℃、24時間で培養して、呈色指示薬の呈色の変化及び培地の色の変化を観察した。また、対比として、菌液を加えなかったサンプル(表中、番号4で示される)及びBPW培地を加えなかった検査具(表中、番号5で示される)についても同様に試験した。さらに、24時間の培養後の前培養液中の菌数を、VRBG寒天培地(OXOID社製、カタログ番号0485)及びSMA寒天培地を用いて測定した。なお、使用した市販の検査具では、牛乳をそれぞれ2.2ml及び20mlを加えるように培地成分が調整されているので、試験番号Aを除いては、牛乳の替わりに水と前培養液を添加した。
【0043】
これらの結果を表1に示す。表中、「センサー」として示されたカラムは呈色指示薬の呈色(黄変)による判定を、「培養液」として示されたカラムは培地の変色による判定を示し、「+」は陽性(変化があった)を、「−」は陰性(変化がなかった)、「+/−」は判定できない場合を示す。
【0044】
【表1】

【0045】
市販されている検査具を用いた場合には、非腸内細菌科菌であるエンテロコッカス属菌が偽陽性として判断される場合があった(表中に太線の枠囲みで示される。)。また、エンテロコッカス属菌やISO法による検出でも陽性として判断されることがあるシュードモナス属菌は、呈色による判定では陽性として判断されるが、変色による判定では陰性として判断され、呈色指示薬の呈色に基づく判定と培地の変色に基づく判定が異なるケースが見られた。
【0046】
(本発明の検査具を用いた検出)
次に市販の検査具であるセンシメディア腸内細菌用(SML016:容器容積約16ml)に使用されている培地の代わりに、市販のE.E.ブロス(OXOID社製 カタログ番号CM0317)を用いて、上記と同様の試験を行った。その結果を表2に示す。
【0047】
【表2】

【0048】
この試験では、呈色指示薬の呈色に基づく場合には、非腸内細菌科菌であるエンテロコッカス属菌が陽性として判定されるケース(表中に太線の枠囲みで示される)もあったが、培養液による変色に基づく場合には、すべて陰性として判断された。以上のように、増殖抑制成分として塩化ナトリウムとバンコマイシンを用いる場合(市販品を用いる場合)に比べて、胆汁酸とブリリアントグリーンを用いる場合の方が良好な結果が得られた。
【実施例2】
【0049】
実施例1において、E.E.ブロスを増菌用の培地として使用できる可能性が見いだせたので、さらに詳細な検討を行った。実施例1の結果から、前培養液を1ml添加した場合において、エンテロコッカス属菌が偽陽性として判断される可能性が考えられた。そこで、前培養液の添加量を、培地の成分濃度にほとんど影響を与えないと考えられる0.1mlに設定し、呈色指示薬の呈色を観察しやすくするために培地の収容量を4mlとして、実施例1と同様の実験を行った。なお、実施例2では、市販の検査具と比較すべく、センシメディアSML016に用いられている容器(容積約16ml)にE.E.ブロスを添加した。また、実施例2では、非腸内細菌科菌群の菌であるセレウス菌(Bacillus cereus)に替えて、腸内細菌科菌群の菌であるエンテロバクター属菌(Enterobacter cloacae)を用いた。その結果を表3及び表4に示す。表3は市販の検査具を用いた結果、表4は本発明の検査具を用いた結果である。対比として、ISO法(ISO21528-1)による検出も行った。
【0050】
【表3】

【0051】
【表4】

【0052】
これらの結果によると、市販の検査具を用いた場合には、ISO法で検出された腸内細菌科菌であるエンテロバクター属菌が検出されなかったが、本発明の検査具においては約10gの粉乳製品中に1cfuのエンテロバクター属菌でも検出できることが確認された。また、培地の呈色では検出できなかったエンテロバクター属菌は呈色指示薬の呈色によって判定できた。その一方、非腸内細菌科菌であるエンテロコッカス属菌では、呈色指示薬の呈色や培地の色の変化に基づく判定において双方とも陰性の判定が得られた。さらに、前培養は18時間でも24時間でも同じ判定が得られ、18〜24時間の前培養で十分に検出できることが確認された。
【実施例3】
【0053】
実施例2において、E.E.ブロス4mlに対して0.1mlの前培養液を添加することで良好な結果が得られた。そこで、実施例2で使用されたE.E.ブロス4mlを入れた本発明の検査具を用いて、菌選択性の確認試験を行った(「センシメディア法」と表記。以下同じ)。表5に示す腸内細菌科菌(EB菌)及び非腸内細菌科菌(非EB菌)について、BPW培地により24時間で前培養を行い、その0.1mlを検査具の培地に添加して、37℃、24時間で培養を行った。調製粉乳10g中に表5に示す菌数の菌が含まれるように菌を接種した。なお、サンプルの一部については、明確に呈色の変化が観察されるまでの時間も測定した。その結果を表5に示した。表5に示すように、偽陰性を示す腸内細菌科菌(No15)も見られたが、腸内細菌科菌30種類のうち29種類は陽性と判断され、ISO法と相違がなかった。一方、ISO法では非腸内細菌科菌も29種類中5種類は偽陽性と判断されたが、Acinetobacter baumannii/calcoaceticusにおいて、本発明の検査具を用いた場合には、陰性として正しく判定された。また、培養開始から3時間程度で呈色の変化が観察される菌株も存在した。このように、本発明の検査具にて24時間程度で培養すれば、ほぼ腸内細菌科菌群の菌は陽性として判定することができ、場合によっては2、3時間程度で陽性として判定できる。
【0054】
【表5】

【実施例4】
【0055】
粉乳中に含まれる可能性のある腸内細菌科菌であるサカザキ菌(Cronobacter sakazakii(Enterobactor Sakazakii(E.sakazakii)))を対象にして、調製粉乳における検出感度を調べた。表6に示す菌数のサカザキ菌を10gの調製粉乳(商品名:ほほえみ(明治乳業(株)製))に接種し、E.E.ブロス4mlを入れた本発明の検査具を用いて、同菌の検出を試みた。BPW培地により18〜24時間で前培養を行い、その0.1mlを培地に添加し、37℃、24時間で培養を行った。その結果を表6に示す。
【0056】
本発明の検査具を用いてもISO法と同じ結果が得られ、陽性の場合には、前培養の後から4時間程度の短時間で判定することができた。また、調製粉乳10g中に1cfuのサカザキ菌が存在すれば、調製粉乳中のサカザキ菌を検出することができた。
【0057】
【表6】

【実施例5】
【0058】
次に、共存菌存在下におけるサカザキ菌の検出感度を調べた。10gの調製粉乳(商品名:ほほえみ(明治乳業(株)製))に表7及び表8に示す菌数のサカザキ菌(E.sakazakii JCM1233T)と枯草菌(Bacillus subtilis)又はエンテロコッカス属菌(Enterococcus durans)を接種し、E.E.ブロス4mlを入れた本発明の検査具を用いて、サカザキ菌の検出を試みた。BPW培地により18〜24時間で前培養を行い、その0.1mlを培地に添加し、37℃、24時間で培養を行った。その結果を表7及び表8に示す。
【0059】
本発明の検査具を用いてもISO法と同じ結果が得られ、陽性の場合には4時間程度の短時間で判定することができた。また、調製粉乳10g中に1cfuのサカザキ菌が存在すれば、共存菌の存在下でも検出することができた。なお、エンテロコッカス属菌が共存した場合には、共存菌の存在により呈色の変化が観察されるまでの時間が長くなる傾向にあるが、24時間で培養を行うことにより確実に検出できると判断される。
【0060】
【表7】

【0061】
【表8】

【0062】
以上のように、既に上市されているE.E.ブロスを培地とした検査具を使用することによって、24時間程度の培養時間で腸内細菌科菌群の細菌を検出することができる。
特に、乳児用調製粉乳やベビーフードなどで問題となるサカザキ菌は、BPW培地により18〜24時間で前培養を行うことによって、粉乳10g当たり1cfuの細菌を確実に検出できる。このように、本発明によると前培養から遅くとも48時間以内で腸内細菌科菌群の検査を終えることができる。
【産業上の利用可能性】
【0063】
本発明によると、短時間で食品中の腸内細菌科菌群の細菌の存否を判断できる検査具及び検査方法が提供される。
【符号の説明】
【0064】
1 全体が透明である容器本体
2 培地収容部
3 指示薬収容部
4 二酸化炭素透過膜
【技術分野】
【0001】
本発明は、腸内細菌科菌群の細菌検出方法、特に食品を対象とした腸内細菌科菌群の細菌検出方法に関する。
【背景技術】
【0002】
食品の品質管理項目の一つとして腸内細菌科菌群の検査項目がある。腸内細菌科菌群は一般に無芽胞のグラム陰性桿菌で好気性又は通性嫌気性の細菌群であって、食中毒の原因菌とされている病原性大腸菌やサルモネラ属菌などを腸内細菌科菌群の一群として包括的に把握することによって効率的なリスク管理を行っている。腸内細菌科菌群には、病原性大腸菌やサルモネラ属菌などの食中毒に関連する細菌が含まれるため、食品中において腸内細菌科菌群の存在を一定程度以下に管理することが求められている。
【0003】
腸内細菌科菌群の細菌の検出方法としてISO(21528−1:2004)に定める方法がある。この方法は、BPW培地(緩衝ペプトン水培地)により試料中に存在する細菌を非選択的に培養する工程と、その後にE.E.ブロスにより腸内細菌科菌群を選択的に培養する工程と、VRBG培地によりE.E.ブロス中の培養菌を分離平板上で生育させて判定する工程とからなる方法である。しかしながら、この方法では試験開始から判定までに、少なくとも72時間以上を要する。
【0004】
特許文献1(特開平11−178597号公報)や特許文献2(特開2001−178496号公報)には、容器内に液体培地と二酸化炭素の呈色指示薬とを、液体培地を遮断する二酸化炭素透過膜を隔てて収容した検査具が開示されている。当該検査具は販売名を「センシメディア(登録商標)」として商品化が図られ、腸内細菌科菌群の細菌を検出するための培地が収容された検査具が上市されている(非特許文献1)。
【0005】
この検査具では、液体培地中で細菌が増殖することによって発生した二酸化炭素が二酸化炭素の透過膜を透過して、呈色指示薬と反応することで呈色指示薬が呈色する。その呈色の濃度を検出し、検査対象試料を用いて求められた所定濃度の呈色に至るまでの時間と、菌数が既知である標準試料を用いて求められた所定濃度の呈色に至るまでの時間との対比から、検査対象試料中の菌数が推定される。この検査具を用いた場合には、培養の開始から24時間程度で菌数が求められ、菌数の限度値が設定されている場合には、推定陽性・陰性の判定が可能となる。
【0006】
例えば、牛乳専用に調製された腸内細菌科菌群用の検査具の場合には、腸内細菌科菌群を代表する数種類の標準菌株について、標準菌株ごとに液体培地に添加された菌数と所定濃度の呈色に至る時間との関係が予め求められており、試料を用いた場合における所定濃度の呈色に至るまでの時間から試料中の菌数が求められる。また、測定の開始より12時間が経過した際に所定濃度の呈色が認められない、つまり呈色の変化が認められない場合には、菌数がゼロであると判断される。
【0007】
また、この検査具では、細菌の増殖に伴って生じる二酸化炭素を利用しているために、検査対象である細菌以外の増菌を可能な限り抑制する必要がある。このために、例えば、特許文献2に記載されている大腸菌群用の検査具には、大腸菌群など検査対象である細菌の増殖に必要な成分の他に、他の細菌群の増菌を抑制する物質として、塩化ナトリウムが添加された液体培地や塩化ナトリウムに加えて胆汁酸又は/及び胆汁酸塩が添加された液体培地が用いられている。また、非特許文献1に記載された牛乳専用の検査具には、他の細菌群の増菌を抑制する物質として、塩化ナトリウムと抗生物質であるバンコマイシンが添加された液体培地が用いられている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平11−178597号公報
【特許文献2】特開2001−178496号公報
【非特許文献】
【0009】
【非特許文献1】マイクロバイオ株式会社、"SensiMedia"、[online]、[平成22年8月16日検索]、インターネット〈URL:http://www.microbio.co.jp/products/sensimedia.html〉
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、非特許文献1に記載された腸内細菌科菌群用の検査具では、増菌処理後の培養液を試料としてとして加えた場合には、エンテロコッカス属の細菌などの腸内細菌科菌群以外の細菌(非腸内細菌科菌群の細菌)によっても呈色が観察され、腸内細菌科菌群が推定陽性(偽陽性)であると判断される場合があった。また、腸内細菌科菌群の細菌の存在によって培地が変色し、当該変色の有無によっても腸内細菌科菌群の存否が判断できる。ところが、非腸内細菌科菌群の細菌の存在によって呈色指示薬の呈色による結果と培地の変色による結果とが一致しない場合があった。この場合には、腸内細菌科菌群による呈色であるのかどうか、さらに別の方法にて確定の判定を行わなければならず、製品の出荷管理上、出荷可能となるまでの保管期間が延びるという問題もあった。その一方、ISO法では陽性として判断されるが、非特許文献1に記載された腸内細菌科菌群用の検査具では陰性として判断されるようでは、出荷検査のための方法として採用することができない。
【0011】
また、特許文献2に記載の検査具は、目的とする細菌による所定量の二酸化炭素を排出するまでの時間が他の細菌による排出に要する時間に比べて短くなるような培地が用いられている。例えば大腸菌群の細菌であるO−157用の培地を用いた場合には、O−157の検出から遅れて、他の大腸菌などが検出されることになる。また、サルモネラ属菌用の培地を用いた場合には、サルモネラ属菌の検出から遅れて、他の大腸菌などが検出されることになる。従って、大腸菌群の細菌とサルモネラ属菌を腸内細菌科菌群として包括的に検出する検査具として用いるのは妥当ではない。
【0012】
本発明は上記背景技術に基づいてなされたものであって、本発明は食品中の腸内細菌科菌群の検出において、腸内細菌科菌群の細菌の有無を正しく判断できるだけでなく、しかも短時間で判定できる方法を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明の検査具は、前記の検査具において、前記液体培地は腸内細菌科菌群の細菌増菌用成分と細菌増殖抑制成分である胆汁酸及び/又は胆汁酸塩とブリリアントグリーンを含み、他の細菌増殖抑制成分を実質的に含まないリン酸緩衝液からなる液体培地を用いた検査具である。
【発明の効果】
【0014】
本発明によると、エンテロコッカス属の細菌による偽陽性の判定が少なくなり、主に乳製品などの食品における腸内細菌科菌群の細菌の存否を迅速に判断できる。
【図面の簡単な説明】
【0015】
【図1】図1は本発明の一実施形態である検査具の側面図である。
【発明を実施するための形態】
【0016】
本発明の検査具は、密閉可能な容器内に、増菌用の培地を遮断する二酸化炭素透過膜で隔てて培地収容部と指示薬収容部とを備え、前記容器は外側から前記指示薬収容部の内部を見通せる透明部を備える。培地収容部には増菌用の培地が収容され、指示薬収容部には二酸化炭素の呈色指示薬が収容される。
【0017】
透明部は指示薬収容部の呈色が観察されればよく、容器全体が透明であっても容器の一部が透明であってもよい。また、透明部は無色であることが好ましい。呈色の変化を確実に観察するためである。容器は、例えば、図1に示すように、全体が透明となったプラスチック製の容器本体1に、キャップ7が螺合により脱着可能に取り付けられ、培地5及び呈色指示薬6が収納された後には、検査対象試料を入れるまで密閉状態で保管される。
【0018】
培地収容部2と指示薬収容部3は、増菌用の培地を遮断する二酸化炭素透過膜4で隔てられ、培地収容部2で発生した二酸化炭素が当該透過膜4を透過して指示薬収容部3に収容された呈色指示薬6と反応する。例えば、図1に示すように、指示薬収容部3を二酸化炭素透過膜4から構成した密閉した袋とし、指示薬収容部3で占められた空間以外の容器内空間を培地収容部2とすることや、図示はしないが、容器内部を二酸化酸素透過膜で上下に分割し、一方の空間を培地収容部とし、他方の空間を指示薬収容部とすることができる。また、図1に示すように、袋状からなる指示薬収容部3を構成した場合には、培地収容部2に収容された培地5の上面の高さよりも高い位置に指示薬収容部3に収容した呈色指示薬6の上面の高さが位置するように培地を収容するのが好ましい。培地5の着色に影響を受けずに呈色指示薬6の呈色を観察できるからである。また、容器内部を透過膜で上下に分割した場合には、二酸化炭素透過膜よりも下方を指示薬収容部とするのが好ましい。容器を開封して培地に試料を加えるためである。なお、図1に示す容器本体1の底の近くには、指示薬収容部3の下端部を支持する支持部材8が備えられている。この支持部材8はキャップ7の内面に設けられた支持部材(図示せず)と対をなして、呈色指示薬6の上面高さが培地5の上面高さよりも高い位置に位置するように指示薬収容部3を保持する。
【0019】
二酸化炭素透過膜4は、二酸化炭素は透過するが、イオン交換を生じずに培地と呈色指示薬を確実に分離できるものであれば、その材質は特に問われない。例えば、未延伸ポリプロピレン、延伸ポリプロピレン、低密度ポリエチレン、高密度ポリエチレンなどフィルムが用いられる。その他、シリコンゴムやポリアルキルスルホンからなる均質膜、ポリテトラフルオロエチレンやポリスルホンからなる多孔質膜、ポリプロピレンとシリコンとの複合膜、ポリプロピレンとポリアルキルスルホンとの複合膜を用いることができる。
【0020】
呈色指示薬は二酸化炭素と反応して呈色する指示薬であれば特に制約されず、二酸化炭素の反応剤とpH指示薬との混合液、例えば、水酸化ナトリウムとチモールフタレインの水溶液、水酸化ナトリウムとフェノールフタレインの水溶液、水酸化カルシウム水溶液、ヘモグロビンや赤血球、血液などのヘムを含む物質の水溶液の他、メチルバイオレットやメチルオレンジ、コンゴーレッド、メチルレッド、ブロムチモールブルー、フェノールレッド、クレゾールレッド、チモールブルーなど各種呈色指示薬の水溶液が挙げられる。なお、呈色は着色又は脱色のいずれであってもよい。
【0021】
検査対象試料に細菌が存在すると、増菌により二酸化炭素が生成される。本発明の検査具は、この二酸化炭素と指示薬収容部の呈色指示薬との反応により生じた呈色を利用する。すなわち、同じ培養条件下では、検査対象試料中の細菌数は、所定濃度の呈色を生じるに要する時間と相関関係がある。検査対象試料を検査具に直接加える場合には、検査対象試料中の細菌数が多ければ、所定濃度の呈色を生じるに要する時間は短くなり、少ないほど長くなる。従って、予め菌数が既知である数種類の試料(標準試料)を用いて、所定濃度の呈色を生じるに要した時間を測定し、菌数と時間との関係(感度特性)を求めておき、検査対象試料を用いて測定した所定濃度の呈色を生じるに要した時間と対比することにより、検査対象試料中の菌数を求めることができる。また、菌数が既知である数種類の試料を用いて、一定時間に生じる呈色濃度(濃度変化)を測定しておき、その時間を経過した際に、検査対象試料を用いて測定した呈色濃度から、おおよその菌数を求めることもできる。従って、例えば、希釈して理論上1×100の菌数を含む試料を用いて、測定開始から18時間あるいは24時間など一定時間経過後に呈色の濃度変化を予め測定しておき、検査対象試料を用いて測定した濃度変化が予め測定した前記濃度変化よりも小さい場合には、理論上1×100以下、すなわち当該細菌は検出されないという判定が行える。
【0022】
このような検査具として、例えば特許文献1や特許文献2に記載された種々の検査具が例示される。本発明の検査具は、このような検査具であって、偽陽性とされる細菌、すなわち、非腸内細菌科菌群による偽陽性の判断を少なくしたものである。
【0023】
本発明の検査具においては、増菌用の培地として、腸内細菌科菌群の細菌増菌用成分と細菌増殖抑制成分である胆汁酸及び/又は胆汁酸塩とブリリアントグリーンを含み、他の細菌増殖抑制成分を実質的に含まない緩衝系溶液からなる液体培地が用いられる。
【0024】
増菌用の培地成分として、大腸菌群増菌用の培地成分や腸内細菌科菌群増菌用の培地成分、サルモネラ属菌増菌用の培地成分として一般的に用いられる成分、例えば、乳糖、ブドウ糖、トリプトース、酵母エキス、カゼインペプトンなどの各種ペプトンが例示され、これらの1種若しくは2種以上が用いられる。
【0025】
細菌増殖抑制成分は、腸内細菌科菌群以外の細菌、例えばセレウス菌や黄色ブドウ球菌などの増殖を抑制する成分である。本発明では、胆汁酸及び/又は胆汁酸塩とブリリアントグリーンのみが用いられ、塩化ナトリウムなどこれ以外の細菌増殖抑制成分は実質的に含まない。胆汁酸や胆汁酸塩、ブリリアントグリーンは、ラウリル硫酸のような選択剤よりも、エンテロコッカス属菌などの腸内細菌科菌群以外の細菌に対する抑制能が強いとされているからである。ここで、実質的に含まないとは、腸内細菌科菌群の細菌の増殖を抑制しない程度に含まないことを意味し、例えば、胆汁酸塩の一部には少数の腸内細菌を抑制する成分が含まれたり、酵母エキスやペプトン中に含まれる塩化ナトリウムが混入したりする場合があるが、このような場合には、実質的に含まれていないと言える。従って、胆汁酸や胆汁酸塩は、精製された胆汁酸や胆汁酸塩、特にウシの胆汁酸を用いるのが好ましい。これらの細菌増殖抑制成分は、例えば18〜24時間の培養時間で非腸内細菌科菌群の細菌の増殖によって呈色反応を生じさせないように、培地中に配合される。なお、判定を行うまでの培養時間によって、この配合量は調整される。
【0026】
これらの成分はリン酸緩衝液に溶解される。リン酸緩衝液はリン酸とリン酸塩とから構成される緩衝液であり、リン酸水素二ナトリウムとリン酸二水素カリウムなどのようにpKa(酸解離定数)の異なる2種以上のリン酸塩を用いて構成されたり、リン酸とリン酸ニナトリウムなどのようにリン酸とその塩を用いて構成される。リン酸塩は、ナトリウム塩、カリウム塩、アンモニウム塩などいずれの塩でも差し支えない。このとき、液体培地のpHが7±0.5、好ましくは7.2±0.2に調整される。
【0027】
このように腸内細菌科菌群用の増殖培地と非腸内細菌科菌群の増殖抑制成分を含む培地として、培地1L中にペプトン10±1g、ブドウ糖5±0.5g、リン酸水素二ナトリウム(無水物)6.5±0.6g、リン酸二水素カリウム2±0.2g、精製ウシ胆汁酸20±2g、ブリリアントグリーン13±2mgを含む液体培地が好適に用いられる。この培地には、E.E.ブロス(E.E.ブイヨン)として市販されている培地(例えば、OXOID社製のE.Eブロスなど)をそのまま用いることができる。もっとも、検査対象試料が溶液である場合には、添加する試料の量に応じて、試料を添加した後の最終濃度が上記濃度となるようにした高濃度の組成の培地を、培地収納部に収容するのが好ましい。培地収容部には、1×108〜1×100cfuの細菌数が検出可能な程度の量の培地が収容される。培地の収容量は、容器当たり1〜20ml、好ましくは4〜5mlである。
【0028】
本発明の細菌検出方法は上記の検査具を用いる方法であって、上記検査具に収容された液体培地に検査対象試料を添加する工程と、前記容器を密閉して培養を開始し、培養の開始から定められた時間経過時に前記指示薬収納部の呈色の濃度を測定する工程を備え、定められた呈色の濃度との対比により、細菌の存否を判断する方法である。すなわち、本発明の検査方法では、一定時間培養した後に生じた呈色指示薬の呈色の濃度と予め定められた標準となる呈色の濃度との対比によって細菌の有無を判定する。
【0029】
その検出方法には、検査対象試料を検査具の培地収容部に直接入れる場合と、検査対象試料を予め非選択培地や水などの適当な媒体に溶かした溶液を培地収容部に入れる場合とがあり、検査対象試料の種類などによって適宜選択できる。また、本発明の検査方法においては、いわゆる前培養(増菌処理)として検査対象試料中の細菌を非選択培地で培養した後に、当該培養液を検査具の培地収容部に入れるのが好ましい。検査対象試料の製造工程などにおいて、何らかの要因で損傷を受けた損傷菌を回復させ、検査対象試料中に存在する腸内細菌科菌群の検出を確実に行うためである。
【0030】
非選択培地として、例えば、トリプトンソーヤブイヨン培地やBPW培地など公知の非選択培地が用いられる。ISO法による検査結果と高い相関を得るためにBPW培地が好ましく用いられる。培養は多種類の細菌が増殖できる条件下、好ましくは37±1℃の好気性条件下で、18〜24時間で行えばよい。
【0031】
検査対象試料には、食品(製品及び原材料などを含む)のみならず各種の食品の製造工程(機器表面、床面、壁面など)における拭き取りサンプルである環境試料なども該当する。また、食品の中でも、特に、牛乳、発酵乳、粉乳(乳を加熱して粉末にしたもの、全脂粉乳、脱脂粉乳、ホエイ粉など)、乳幼児用調製粉乳(栄養成分などが調製された乳幼児に与えられる粉乳:いわゆる粉ミルク)などの乳製品やベビーフードが好ましい対象であり、さらに望ましくはこれらの食品の中でも、粉乳、乳幼児用調製粉乳、ベビーフードが望ましい対象であると言える。
【0032】
水、乳製品などの食品中の大腸菌群の細菌の検出に用いられる選択培地としてラウリル硫酸ブイヨン(LST培地)が知られているが、このLST培地では、非腸内細菌科菌群の菌であるエンテロコッカス属菌を抑制できない(エンテロコッカス属菌の発育が中程度/良好である。)。しかしながら、E.E.ブロスでは、胆汁酸や胆汁酸塩とブリリアントグリーンによりエンテロコッカス属菌を抑制できる。そして、胆汁酸や胆汁酸塩では、エンテロコッカス属菌の一部に対して抑制能が十分ではないが、ブリリアントグリーンを加える(併用する)ことで、抑制能が十分に発揮される。ここで、例えば検査対象試料が牛乳の場合には、エンテロコッカス属菌は殺菌されるため、エンテロコッカス属菌への抑制能を勘案しなくても良いが、検査対象試料が粉乳、乳幼児用調製粉乳、ベビーフードなどの場合には、エンテロコッカス属菌が残存している可能性があり、エンテロコッカス属菌への抑制能は必要となる。そこで、検査対象試料が粉乳、乳幼児用調製粉乳、ベビーフードなどの場合には、ラウリル硫酸ブイヨンなどと比べて、E.E.ブロスを使用すること、特にブリリアントグリーンを使用することが優れていると言える。
【0033】
本発明の細菌検出方法により検査され、出荷の是非を判断された食品(牛乳、発酵乳、粉乳、乳幼児用調製粉乳などの乳製品やベビーフードなど)は、衛生的な環境下で適正に製造された製品とみなされる。
【0034】
検査対象試料の使用量は食品の種類や推定される非腸内細菌科菌群の細菌数、培地の使用量などによっても適宜調整される。検査対象試料の使用量が多いほど、腸内細菌科菌群の細菌を検出する確率が高くなり、検出精度の観点からは好ましいが、検査対象試料を検査具に直接加える場合には、検査対象試料の使用量が多いと、非腸内細菌科菌群が多量に存在した際に、偽陽性として判断される傾向にある。従って、1〜20mlの培地を収容した検査具であれば、0.01〜10gの個体試料又は0.01〜10mlの液体試料が使用される。また、前培養した場合には、1〜20mlの培地に対し0.1〜1mlの培養液が使用される。さらに望ましくは、4mlの液体培地に対して0.1mlの培養液が使用される。なお、前培養(増菌処理)してから、その一部を検査具に加える場合には、検査対象試料の使用量を多くする(増やす)ことが可能である。
【0035】
検査対象試料又は培養液が加えられた容器は密閉され、37℃付近で一定時間、好ましくは18〜24時間培養される。細菌が存在すると呈色指示薬が呈色し、呈色の濃度が時間とともに変化する。培養を終えた段階で呈色の濃度が測定される。
【0036】
対比される基準となる呈色の濃度は種々の方法によって定められる。例えば、培地に添加される検査対象試料又は培養液の代わりに、同量の無菌である培地や水を加えて培養して得られた呈色の濃度を基準にする方法、培養開始直後の提示指示薬による呈色の濃度を基準にする方法、さらには、菌数が既知である試料を培地に加えて培養して得られた呈色の濃度を基準にする方法が例示される。この中では、簡便に判定できる観点から、培養開始直後の提示指示薬による呈色の濃度を基準にする方法が好ましく採用される。呈色の変化を観察するだけでよいからである。
【0037】
そして、これらの基準となる呈色の濃度と、検査対象試料を用いて得られた呈色の濃度とを対比し、検査対象試料を用いて得られた呈色の濃度が基準となる呈色の濃度よりも同じか低いと判断されると、基準となる呈色の濃度が得られた菌数とほぼ同じか、それよりも少ない菌数の細菌が検査対象試料中に存在すること、若しくは細菌が検査対象試料中に存在しないと判定できる。このように本発明の細菌検出方法によれば、測定開始から18〜24時間あるいは前培養を含めると48時間以内で、検査対象試料中の腸内細菌科菌群の細菌の有無を判断できる。
【0038】
もっとも、特許文献1や特許文献2に記載されているように、検査対象試料を検査具に直接加える場合には、検査具による培養の開始から所定の呈色濃度が観察される時間を測定することによって、検査対象試料中に存在する菌数を測定できるのは言うまでもない。
【実施例1】
【0039】
次に、本発明について下記の実施例に基づいて説明する。なお、下記の実施例はあくまでも例示であって、本発明は下記の実施例に限られるものではない。
【0040】
(市販品を用いた検出)
乳児用の調製粉乳(商品名:ほほえみ(明治乳業(株)製))に、非腸内細菌科菌群の細菌を接種したものを検査対象試料として、市販の検査具であるセンシメディア腸内細菌用(SML016)及び同試料20ml添加用(SML016−20)を用いて、試料中の細菌の検出を行った。非腸内細菌科菌群の細菌として、調製粉乳の原料などから分離されたエンテロコッカス属菌(Enterococcus sp.)、セレウス菌(Bacillus cereus)、緑濃菌(Pseudomonas aerigonosa)の3つの菌種を用いた。
【0041】
調製粉乳10gに上記細菌を含む菌液(生理食塩水で希釈した菌液)10μLを接種して、BPW培地(メルク社製、カタログ番号1.07228.0500)90mlを加えてから、37℃、18〜24時間で培養を行い、前培養(増菌処理)を行った。これとは別に、細菌を含む菌液をSMA寒天培地(標準寒天培地:栄研化学社製)により、37℃、48時間で培養を行い、菌液に含まれる菌数を計測した。
【0042】
次に、表1に示す量の前培養液(BPW培養液:18時間で培養した培養液と24時間で培養した培養液)及び滅菌精製水を検査具の培地収容部に加えて、37℃、24時間で培養して、呈色指示薬の呈色の変化及び培地の色の変化を観察した。また、対比として、菌液を加えなかったサンプル(表中、番号4で示される)及びBPW培地を加えなかった検査具(表中、番号5で示される)についても同様に試験した。さらに、24時間の培養後の前培養液中の菌数を、VRBG寒天培地(OXOID社製、カタログ番号0485)及びSMA寒天培地を用いて測定した。なお、使用した市販の検査具では、牛乳をそれぞれ2.2ml及び20mlを加えるように培地成分が調整されているので、試験番号Aを除いては、牛乳の替わりに水と前培養液を添加した。
【0043】
これらの結果を表1に示す。表中、「センサー」として示されたカラムは呈色指示薬の呈色(黄変)による判定を、「培養液」として示されたカラムは培地の変色による判定を示し、「+」は陽性(変化があった)を、「−」は陰性(変化がなかった)、「+/−」は判定できない場合を示す。
【0044】
【表1】

【0045】
市販されている検査具を用いた場合には、非腸内細菌科菌であるエンテロコッカス属菌が偽陽性として判断される場合があった(表中に太線の枠囲みで示される。)。また、エンテロコッカス属菌やISO法による検出でも陽性として判断されることがあるシュードモナス属菌は、呈色による判定では陽性として判断されるが、変色による判定では陰性として判断され、呈色指示薬の呈色に基づく判定と培地の変色に基づく判定が異なるケースが見られた。
【0046】
(本発明の検査具を用いた検出)
次に市販の検査具であるセンシメディア腸内細菌用(SML016:容器容積約16ml)に使用されている培地の代わりに、市販のE.E.ブロス(OXOID社製 カタログ番号CM0317)を用いて、上記と同様の試験を行った。その結果を表2に示す。
【0047】
【表2】

【0048】
この試験では、呈色指示薬の呈色に基づく場合には、非腸内細菌科菌であるエンテロコッカス属菌が陽性として判定されるケース(表中に太線の枠囲みで示される)もあったが、培養液による変色に基づく場合には、すべて陰性として判断された。以上のように、増殖抑制成分として塩化ナトリウムとバンコマイシンを用いる場合(市販品を用いる場合)に比べて、胆汁酸とブリリアントグリーンを用いる場合の方が良好な結果が得られた。
【実施例2】
【0049】
実施例1において、E.E.ブロスを増菌用の培地として使用できる可能性が見いだせたので、さらに詳細な検討を行った。実施例1の結果から、前培養液を1ml添加した場合において、エンテロコッカス属菌が偽陽性として判断される可能性が考えられた。そこで、前培養液の添加量を、培地の成分濃度にほとんど影響を与えないと考えられる0.1mlに設定し、呈色指示薬の呈色を観察しやすくするために培地の収容量を4mlとして、実施例1と同様の実験を行った。なお、実施例2では、市販の検査具と比較すべく、センシメディアSML016に用いられている容器(容積約16ml)にE.E.ブロスを添加した。また、実施例2では、非腸内細菌科菌群の菌であるセレウス菌(Bacillus cereus)に替えて、腸内細菌科菌群の菌であるエンテロバクター属菌(Enterobacter cloacae)を用いた。その結果を表3及び表4に示す。表3は市販の検査具を用いた結果、表4は本発明の検査具を用いた結果である。対比として、ISO法(ISO21528-1)による検出も行った。
【0050】
【表3】

【0051】
【表4】

【0052】
これらの結果によると、市販の検査具を用いた場合には、ISO法で検出された腸内細菌科菌であるエンテロバクター属菌が検出されなかったが、本発明の検査具においては約10gの粉乳製品中に1cfuのエンテロバクター属菌でも検出できることが確認された。また、培地の呈色では検出できなかったエンテロバクター属菌は呈色指示薬の呈色によって判定できた。その一方、非腸内細菌科菌であるエンテロコッカス属菌では、呈色指示薬の呈色や培地の色の変化に基づく判定において双方とも陰性の判定が得られた。さらに、前培養は18時間でも24時間でも同じ判定が得られ、18〜24時間の前培養で十分に検出できることが確認された。
【実施例3】
【0053】
実施例2において、E.E.ブロス4mlに対して0.1mlの前培養液を添加することで良好な結果が得られた。そこで、実施例2で使用されたE.E.ブロス4mlを入れた本発明の検査具を用いて、菌選択性の確認試験を行った(「センシメディア法」と表記。以下同じ)。表5に示す腸内細菌科菌(EB菌)及び非腸内細菌科菌(非EB菌)について、BPW培地により24時間で前培養を行い、その0.1mlを検査具の培地に添加して、37℃、24時間で培養を行った。調製粉乳10g中に表5に示す菌数の菌が含まれるように菌を接種した。なお、サンプルの一部については、明確に呈色の変化が観察されるまでの時間も測定した。その結果を表5に示した。表5に示すように、偽陰性を示す腸内細菌科菌(No15)も見られたが、腸内細菌科菌30種類のうち29種類は陽性と判断され、ISO法と相違がなかった。一方、ISO法では非腸内細菌科菌も29種類中5種類は偽陽性と判断されたが、Acinetobacter baumannii/calcoaceticusにおいて、本発明の検査具を用いた場合には、陰性として正しく判定された。また、培養開始から3時間程度で呈色の変化が観察される菌株も存在した。このように、本発明の検査具にて24時間程度で培養すれば、ほぼ腸内細菌科菌群の菌は陽性として判定することができ、場合によっては2、3時間程度で陽性として判定できる。
【0054】
【表5】

【実施例4】
【0055】
粉乳中に含まれる可能性のある腸内細菌科菌であるサカザキ菌(Cronobacter sakazakii(Enterobactor Sakazakii(E.sakazakii)))を対象にして、調製粉乳における検出感度を調べた。表6に示す菌数のサカザキ菌を10gの調製粉乳(商品名:ほほえみ(明治乳業(株)製))に接種し、E.E.ブロス4mlを入れた本発明の検査具を用いて、同菌の検出を試みた。BPW培地により18〜24時間で前培養を行い、その0.1mlを培地に添加し、37℃、24時間で培養を行った。その結果を表6に示す。
【0056】
本発明の検査具を用いてもISO法と同じ結果が得られ、陽性の場合には、前培養の後から4時間程度の短時間で判定することができた。また、調製粉乳10g中に1cfuのサカザキ菌が存在すれば、調製粉乳中のサカザキ菌を検出することができた。
【0057】
【表6】

【実施例5】
【0058】
次に、共存菌存在下におけるサカザキ菌の検出感度を調べた。10gの調製粉乳(商品名:ほほえみ(明治乳業(株)製))に表7及び表8に示す菌数のサカザキ菌(E.sakazakii JCM1233T)と枯草菌(Bacillus subtilis)又はエンテロコッカス属菌(Enterococcus durans)を接種し、E.E.ブロス4mlを入れた本発明の検査具を用いて、サカザキ菌の検出を試みた。BPW培地により18〜24時間で前培養を行い、その0.1mlを培地に添加し、37℃、24時間で培養を行った。その結果を表7及び表8に示す。
【0059】
本発明の検査具を用いてもISO法と同じ結果が得られ、陽性の場合には4時間程度の短時間で判定することができた。また、調製粉乳10g中に1cfuのサカザキ菌が存在すれば、共存菌の存在下でも検出することができた。なお、エンテロコッカス属菌が共存した場合には、共存菌の存在により呈色の変化が観察されるまでの時間が長くなる傾向にあるが、24時間で培養を行うことにより確実に検出できると判断される。
【0060】
【表7】

【0061】
【表8】

【0062】
以上のように、既に上市されているE.E.ブロスを培地とした検査具を使用することによって、24時間程度の培養時間で腸内細菌科菌群の細菌を検出することができる。
特に、乳児用調製粉乳やベビーフードなどで問題となるサカザキ菌は、BPW培地により18〜24時間で前培養を行うことによって、粉乳10g当たり1cfuの細菌を確実に検出できる。このように、本発明によると前培養から遅くとも48時間以内で腸内細菌科菌群の検査を終えることができる。
【産業上の利用可能性】
【0063】
本発明によると、短時間で食品中の腸内細菌科菌群の細菌の存否を判断できる検査具及び検査方法が提供される。
【符号の説明】
【0064】
1 全体が透明である容器本体
2 培地収容部
3 指示薬収容部
4 二酸化炭素透過膜
【特許請求の範囲】
【請求項1】
密閉可能な容器内に、増菌用の培地を遮断する二酸化炭素透過膜で隔てられた培地収容部と指示薬収容部を備えた細菌検査具であって、
前記容器は外側から前記指示薬収容部の内部を見通せる透明部を備え、前記培地収容部に腸内細菌科菌群の細菌増菌用成分と細菌増殖抑制成分である胆汁酸及び/又は胆汁酸塩とブリリアントグリーンを含み、他の細菌増殖抑制成分を実質的に含まないリン酸緩衝液からなる液体培地が収容され、前記指示薬収容部に二酸化酸素の呈色指示薬が収容された細菌検査具。
【請求項2】
前記液体培地は、培地1L中にペプトン10±1g、ブドウ糖5±0.5g、リン酸水素二ナトリウム(無水物)6.5±0.6g、リン酸二水素カリウム2±0.2g、精製ウシ胆汁酸20±2g、ブリリアントグリーン13±2mgを含む液体培地である請求項1に記載の細菌検査具。
【請求項3】
添加される液体試料と液体培地の容量比が0.1:4となる量の前記液体培地が収容された請求項1又は2に記載の細菌検査具。
【請求項4】
食品中の腸内細菌科菌群の細菌検出方法であって、
請求項1又は2に記載の細菌検査具に収容した液体培地に検査対象試料を添加する工程と、
前記容器を密閉して培養を開始し、培養の開始から定められた時間経過時に前記指示薬収納部の呈色の濃度を測定する工程を備え、
予め定められた呈色の濃度との対比により細菌の存否を判断する細菌検出方法。
【請求項5】
食品中の腸内細菌科菌群の細菌検出方法であって、
検査対象試料を非選択培地に添加して増菌する工程と、
請求項1又は2に記載の細菌検査具に収容した液体培地に増菌後の非選択培地を添加する工程と、
前記容器を密閉して培養を開始し、培養の開始から定められた時間経過時に前記指示薬収納部の呈色の濃度を測定する工程を備え、
予め定められた呈色の濃度との対比により、細菌の存否を判断することを特徴とする細菌検出方法。
【請求項6】
前記非選択培地はBPW培地である請求項5に記載の細菌検出方法。
【請求項7】
4mlの前記液体培地に対して0.1mlの増菌後の非選択培地を加える請求項5又は6に記載の細菌検出方法。
【請求項8】
前記食品は、牛乳、粉乳、乳幼児用調整粉乳の何れかである請求項4〜7の何れか1項に記載の細菌検出方法。
【請求項1】
密閉可能な容器内に、増菌用の培地を遮断する二酸化炭素透過膜で隔てられた培地収容部と指示薬収容部を備えた細菌検査具であって、
前記容器は外側から前記指示薬収容部の内部を見通せる透明部を備え、前記培地収容部に腸内細菌科菌群の細菌増菌用成分と細菌増殖抑制成分である胆汁酸及び/又は胆汁酸塩とブリリアントグリーンを含み、他の細菌増殖抑制成分を実質的に含まないリン酸緩衝液からなる液体培地が収容され、前記指示薬収容部に二酸化酸素の呈色指示薬が収容された細菌検査具。
【請求項2】
前記液体培地は、培地1L中にペプトン10±1g、ブドウ糖5±0.5g、リン酸水素二ナトリウム(無水物)6.5±0.6g、リン酸二水素カリウム2±0.2g、精製ウシ胆汁酸20±2g、ブリリアントグリーン13±2mgを含む液体培地である請求項1に記載の細菌検査具。
【請求項3】
添加される液体試料と液体培地の容量比が0.1:4となる量の前記液体培地が収容された請求項1又は2に記載の細菌検査具。
【請求項4】
食品中の腸内細菌科菌群の細菌検出方法であって、
請求項1又は2に記載の細菌検査具に収容した液体培地に検査対象試料を添加する工程と、
前記容器を密閉して培養を開始し、培養の開始から定められた時間経過時に前記指示薬収納部の呈色の濃度を測定する工程を備え、
予め定められた呈色の濃度との対比により細菌の存否を判断する細菌検出方法。
【請求項5】
食品中の腸内細菌科菌群の細菌検出方法であって、
検査対象試料を非選択培地に添加して増菌する工程と、
請求項1又は2に記載の細菌検査具に収容した液体培地に増菌後の非選択培地を添加する工程と、
前記容器を密閉して培養を開始し、培養の開始から定められた時間経過時に前記指示薬収納部の呈色の濃度を測定する工程を備え、
予め定められた呈色の濃度との対比により、細菌の存否を判断することを特徴とする細菌検出方法。
【請求項6】
前記非選択培地はBPW培地である請求項5に記載の細菌検出方法。
【請求項7】
4mlの前記液体培地に対して0.1mlの増菌後の非選択培地を加える請求項5又は6に記載の細菌検出方法。
【請求項8】
前記食品は、牛乳、粉乳、乳幼児用調整粉乳の何れかである請求項4〜7の何れか1項に記載の細菌検出方法。
【図1】




【公開番号】特開2012−44911(P2012−44911A)
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願番号】特願2010−188930(P2010−188930)
【出願日】平成22年8月25日(2010.8.25)
【出願人】(000006138)株式会社明治 (265)
【出願人】(501354912)マイクロバイオ株式会社 (13)
【Fターム(参考)】
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願日】平成22年8月25日(2010.8.25)
【出願人】(000006138)株式会社明治 (265)
【出願人】(501354912)マイクロバイオ株式会社 (13)
【Fターム(参考)】
[ Back to top ]

