膣および外陰の委縮を治療するために使用するエストロゲン様抽出物
キバナオウギ(Astragalus membranaceus)、ナイモウオウギ(Astragalus mongholicus)、ハナスゲ(Anemarrhenae asphodeloides)およびイノコズチ(Achyranthes bidentata)のエストロゲン様抽出物が提供される。また、特にヒト、例えばヒトの女性でエストロゲン様効果を達成するためにこのような抽出物を用いる方法も提供される。いくつかの実施形態では、この方法は、更年期症状の治療を包含する。いくつかの実施形態では、この方法は骨粗鬆症の治療または予防を包含する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、植物抽出組成物およびさらに具体的には、キバナオウギ(Astragalus membranacens)、ナイモウオウギ(Astragalus mongholicus)、ハナスゲ(Anemarrhenae asphodeloides)およびイノコズチ(Achyranthes bidentata)という種に属する植物種の抽出物を含む組成物に関する。本発明はさらに、このような植物抽出組成物を用いる方法および作製する方法に関する。
【0002】
相互参照および優先権の主張
本出願は、米国特許法(合衆国法典35巻)第119条(e)に基づいて、その全体が参照によって本明細書に援用される米国特許仮出願番号61/050,925号から優先権を主張する。
【背景技術】
【0003】
閉経期の膣委縮の発現は、循環中のエストロゲンの低下に伴う。閉経期間から閉経後に、血清エストロゲンレベルは、約400pg/ml〜10pg/ml未満まで低下することが示されている。エストロゲン補充療法は、膣の乾燥の治療のために首尾よく用いられている。この効果は、外陰部および膣の管におけるエストロゲン受容体のアゴニスト刺激を介して達成されると仮説される。
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明者らは、エストロゲン受容体に関連する1つ以上の疾患状態の治療のために有用なエストロゲン組成物の必要性を認識している。本発明者らはまた、エストロゲン組成物を投与された患者がエストロゲン受容体と関連する別の疾患状態に罹患するリスクまたは確率を増大しないエストロゲン組成物の必要性を認識している。本発明者は同様に、別のエストロゲン受容体媒介性疾患状態を同時に治療しながら、1つ以上のエストロゲン受容体媒介性疾患状態のリスクを減らすエストロゲン組成物についての必要性を認識している。本発明者はまた、天然の供給源から容易に得られるエストロゲン様組成物の必要性、ならびにこのようなエストロゲン様組成物を作製および用いる方法の必要性を認識している。本明細書の開示は、このような要件を満たし、かつ同様に関連の利点も提供する。
【課題を解決するための手段】
【0005】
従って、いくつかの実施形態では、本発明は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量を含み、ここでこの抽出物が少なくとも1つの植物化学物質を含む、組成物を提供する。いくつかの実施形態では、この組成物は、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量を含む。いくつかの実施形態では、この組成物は、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量から本質的になる。いくつかの実施形態では、この組成物は、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量からなる。いくつかの実施形態では、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量は、1日あたり約1乾燥重量グラム〜約100乾燥重量グラムの抽出物である。いくつかの実施形態では、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量は、1日あたり約10乾燥重量グラム〜約100乾燥重量グラムの抽出物である。いくつかの実施形態では、上記植物化学物質はカリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。いくつかの実施形態では、この植物化学物質の精製された抽出物は、第1の抽出および第2の抽出を行うことによって得られる。いくつかの実施形態では、上記第1の抽出は以下の工程、(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、(b)この第1の混合物を加熱する工程と、(c)この第1の溶媒を除去して第2の抽出物を得る工程とを包含する。いくつかの実施形態では、上記第2の抽出は、以下の工程、(a)この第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、(b)この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、(c)この非水性層を収集する工程と、(d)いずれの非活性化合物も除去する工程と、(e)この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、上記第1の溶媒はエタノールおよび水の溶液である。いくつかの実施形態では、上記第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約2〜約6時間加熱される。いくつかの実施形態では、上記第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、上記第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、上記エバポレーションは約40℃〜約60℃の温度で起こる。いくつかの実施形態では、上記第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカは酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。いくつかの実施形態では、上記組成物はさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。
【0006】
本明細書に記載されるいくつかの実施形態では、植物種キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を単離するプロセスが提供される。いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。いくつかの実施形態では、上記植物化学物質の精製された抽出物は第1の抽出および第2の抽出を行うことによって得られる。いくつかの実施形態では、この第1の抽出は、(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、(b)この第1の混合物を加熱する工程と、(c)この第1の溶媒を除去して第1の抽出物を得る工程と、を包含する。いくつかの実施形態では、この第2の抽出は、(a)上記第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、(b)この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、(c)この非水性層を収集する工程と、(d)いずれの非活性化合物も除去する工程と、(e)この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程と、を包含する。いくつかの実施形態では、上記第1の溶媒はエタノールおよび水の溶液である。いくつかの実施形態では、上記第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約2時間〜約6時間加熱される。いくつかの実施形態では、上記第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、上記第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、上記エバポレーションは約40℃〜約60℃の温度で起こる。いくつかの実施形態では、上記第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物がシリカ上で乾燥非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカが酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。いくつかの実施形態では、この組成物はさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。
【0007】
本明細書に記載されるいくつかの実施形態は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物の治療上有効な量を含む組成物で治療可能であり得る障害を有する被検体を治療する方法を提供する。いくつかの実施形態では、この障害は、膣委縮、外陰部委縮、またはそのうち1つまたは両方の症状である(例えば、膣の乾燥、刺激、そう痒、出血および/または性交疼痛の増大)。いくつかの実施形態では、この障害は1つ以上の更年期症状(すなわち、閉経期間、閉経期または閉経後に関連する症状)である。いくつかの実施形態では、この組成物は、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量を含む。いくつかの実施形態では、この組成物は本質的に、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量からなる。いくつかの実施形態では、この組成物は、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量からなる。いくつかの実施形態では、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量は、1日あたり約1乾燥重量グラム〜約100乾燥重量グラムである。いくつかの実施形態では、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量は、1日あたり約10乾燥重量グラム〜約100乾燥重量グラムの抽出物である。いくつかの実施形態では、上記植物化学物質はカリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。いくつかの実施形態では、上記植物化学物質の精製された抽出物は第1の抽出および第2の抽出を行うことによって得られる。いくつかの実施形態では、上記第1の抽出は以下の工程、(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、(b)この第1の混合物を加熱する工程と、(c)この第1の溶媒を除去して第1の抽出物を得る工程とを包含する。いくつかの実施形態では、上記第2の抽出は、以下の工程、(a)この第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、(b)この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、(c)この非水性層を収集する工程と、(d)いずれの非活性化合物も除去する工程と、(e)この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、上記第1の溶媒はエタノールおよび水の溶液である。いくつかの実施形態では、上記第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約2〜約6時間加熱される。いくつかの実施形態では、上記第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、上記第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、上記エバポレーションは約40℃〜約60℃の温度で起こる。いくつかの実施形態では、上記第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で乾燥された非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカは酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。いくつかの実施形態では、上記組成物はさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。
【0008】
本明細書に記載のいくつかの実施形態では、エストロゲン応答要素の制御下で遺伝子を活性化する方法を提供し、この方法は、この遺伝子に作動可能に連結されたエストロゲン応答要素およびエストロゲン受容体を有する細胞に対して、ある量の組成物を投与することを包含し、この組成物は、Astragalus membranacens、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を含み、この植物化学物質の精製された抽出物が、この遺伝子を活性化するのに十分な量である。いくつかの実施形態では、上記植物化学物質はカリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。いくつかの実施形態では、上記細胞はインビトロである。いくつかの実施形態では、上記細胞はインビボである。いくつかの実施形態では、上記細胞はERα+乳房組織にある。いくつかの実施形態では、上記細胞はERβ+乳房組織にある。いくつかの実施形態では、上記細胞はERα/ERβ+乳房組織にある。いくつかの実施形態では、上記エストロゲン応答要素は形質転換された細胞で発現される。いくつかの実施形態では、上記エストロゲン応答要素および上記エストロゲン受容体の両方が上記細胞で発現される。いくつかの実施形態では、上記エストロゲン応答要素は上記細胞中で異種発現される。いくつかの実施形態では、上記エストロゲン応答要素およびエストロゲン受容体の両方が上記細胞中で異種発現される。いくつかの実施形態では、上記細胞はERE制御遺伝子で形質転換されたU937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される。いくつかの実施形態では、上記細胞はERαを発現する。いくつかの実施形態では、上記細胞はERβを発現する。いくつかの実施形態では、上記ERE制御遺伝子はERE−tk−Lucである。
【0009】
本明細書に記載されるいくつかの実施形態では、TNF RE制御遺伝子の発現を抑制するプロセスが提供され、このプロセスは、TNF応答要素の制御下の遺伝子およびエストロゲン受容体を含む細胞に対して、ある量の組成物を投与することを包含し、この組成物は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を含み、この植物化学物質の精製された抽出物は、このTNF RE制御遺伝子を抑制するのに十分な量である。いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。いくつかの実施形態では、上記TNF RE制御遺伝子はTNF−αである。いくつかの実施形態では、上記TNF RE制御遺伝子はTNF RE−Lucである。いくつかの実施形態では、上記細胞はインビトロである。いくつかの実施形態では、上記細胞はインビボである。いくつかの実施形態では、上記細胞はER+乳房組織にある。いくつかの実施形態では、上記細胞はERα+乳房組織にある。いくつかの実施形態では、上記細胞はERβ+乳房組織にある。いくつかの実施形態では、上記TNF応答要素は上記細胞で内因的に発現される。いくつかの実施形態では、上記TNF応答要素およびエストロゲン受容体の両方が上記細胞中で内因的に発現される。いくつかの実施形態では、上記TNF応答要素は上記細胞中で異種発現される。いくつかの実施形態では、上記TNF応答要素およびエストロゲン受容体の両方が上記細胞中で異種発現される。いくつかの実施形態では、上記細胞はエストロゲン受容体遺伝子を含み、TNF応答要素制御遺伝子で形質転換され、かつU937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される。いくつかの実施形態では、上記エストロゲン受容体遺伝子はERαを発現する遺伝子である。いくつかの実施形態では、上記エストロゲン受容体遺伝子はERβを発現する遺伝子である。
【0010】
参照による援用
本明細書で言及される全ての刊行物および特許出願は、あたかも各々の個々の刊行物または特許出願が参照によって援用されることが詳細にかつ個々に示されるのと同じ程度まで、参照によって本明細書に援用される。
【図面の簡単な説明】
【0011】
本発明の新規な特徴は、添付の特許請求で詳細に示される。本発明の特徴および利点のさらに良好な理解は、本発明の原理が利用される例示的な実施形態を示す以下の詳細な説明および以下の添付の図面を参照することによって得られるであろう。
【0012】
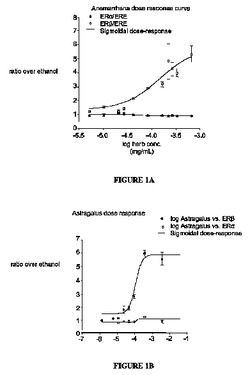
【図1A】U2OS骨肉腫細胞を、ERE−tk−LucおよびヒトERαまたはERβの発現ベクターを用いて同時トランスフェクトした。VG101中の草本抽出物およびそれらの活性な化学成分は、ERβでの、ただしERαではないERE−tk−Lucの用量依存性の活性化を生じた。図1A:ハナスゲ(Rhizomae Anemarrhenae asphodeloides Bunge)(ユリ科(Liliaceae))の効果。
【図1B】U2OS骨肉腫細胞を、ERE−tk−LucおよびヒトERαまたはERβの発現ベクターを用いて同時トランスフェクトした。VG101中の草本抽出物およびそれらの活性な化学成分は、ERβでの、ただしERαではないERE−tk−Lucの用量依存性の活性化を生じた。図1B:オウギ(Radix Astragali)(マメ科(Leguminosae/Fabaceae))。
【図1C】U2OS骨肉腫細胞を、ERE−tk−LucおよびヒトERαまたはERβの発現ベクターを用いて同時トランスフェクトした。VG101中の草本抽出物およびそれらの活性な化学成分は、ERβでの、ただしERαではないERE−tk−Lucの用量依存性の活性化を生じた。図1C:イノコズチ(Radix Achyranthes bidentata Bl.)(ヒユ科(Amarathaceae))。
【図2A】草本抽出物およびそれらの活性な化学成分は、10nMのエストラジオール(E2)に等価な活性化を生じた。ERアンタゴニストであるラロキシフェン(Ral)およびタモキシフェン(Tam)は以下による活性化をブロックした:ハナスゲ(ユリ科)の効果(図2A)。
【図2B】草本抽出物およびそれらの活性な化学成分は、10nMのエストラジオール(E2)に等価な活性化を生じた。ERアンタゴニストであるラロキシフェン(Ral)およびタモキシフェン(Tam)は以下による活性化をブロックした:オウギ(マメ科)(図2B)。
【図2C】草本抽出物およびそれらの活性な化学成分は、10nMのエストラジオール(E2)に等価な活性化を生じた。ERアンタゴニストであるラロキシフェン(Ral)およびタモキシフェン(Tam)は以下による活性化をブロックした:イノコズチ(ヒユ科)(図2C)。
【図2D】草本抽出物およびそれらの活性な化学成分は、10nMのエストラジオール(E2)に等価な活性化を生じた。ERアンタゴニストであるラロキシフェン(Ral)およびタモキシフェン(Tam)は以下による活性化をブロックした:二アソール(図2D)。
【図3A】エストラジオール(E2)または草本で処理したテトラサイクリン誘導性のERαまたはERβのU2OS細胞におけるTNFα遺伝子mRNAの発現。図3A:TNFαは、両方のU2OS−ERαでE2によって阻害されたTNFαのmRNAの大きい増大を生じた。草本抽出物およびVGl0l中のその活性化化学成分は、マウス異種移植片モデルでMCF−7細胞腫瘍形成も子宮増殖も刺激しない。
【図3B】エストラジオール(E2)または草本で処理したテトラサイクリン誘導性のERαまたはERβのU2OS細胞におけるTNFα遺伝子mRNAの発現。図3B:U2OS−ERβ。草本抽出物およびVGl0l中のその活性化化学成分は、マウス異種移植片モデルでMCF−7細胞腫瘍形成も子宮増殖も刺激しない。
【図3C】エストラジオール(E2)または草本で処理したテトラサイクリン誘導性のERαまたはERβのU2OS細胞におけるTNFα遺伝子mRNAの発現。図3C:ハナスゲ(ユリ科)の用量反応。草本抽出物およびVGl0l中のその活性化化学成分は、マウス異種移植片モデルでMCF−7細胞腫瘍形成も子宮増殖も刺激しない。
【図3D】エストラジオール(E2)または草本で処理したテトラサイクリン誘導性のERαまたはERβのU2OS細胞におけるTNFα遺伝子mRNAの発現。図3D:オウギ(マメ科)。草本抽出物およびVGl0l中のその活性化化学成分は、マウス異種移植片モデルでMCF−7細胞腫瘍形成も子宮増殖も刺激しない。
【図3E】エストラジオール(E2)または草本で処理したテトラサイクリン誘導性のERαまたはERβのU2OS細胞におけるTNFα遺伝子mRNAの発現。図3E:U2OS−ERαおよびU2OS−ERβ TNFα抑制に対するイノコズチ(ヒユ科)。草本抽出物およびVGl0l中のその活性化化学成分は、マウス異種移植片モデルでMCF−7細胞腫瘍形成も子宮増殖も刺激しない。
【図4A】草本抽出物を、BT474、ER+乳癌細胞およびMDA−MB−468、ER−乳癌細胞においてCyQuant細胞増殖アッセイ(Cell Proliferation Assay)を用いて試験した。その細胞を、草本抽出物を用いて48時間処理した。図4A:ハナスゲ(ユリ科)の効果。
【図4B】草本抽出物を、BT474、ER+乳癌細胞およびMDA−MB−468、ER−乳癌細胞においてCyQuant細胞増殖アッセイ(Cell Proliferation Assay)を用いて試験した。その細胞を、草本抽出物を用いて48時間処理した。図4B:オウギ(マメ科)。
【図4C】草本抽出物を、BT474、ER+乳癌細胞およびMDA−MB−468、ER−乳癌細胞においてCyQuant細胞増殖アッセイ(Cell Proliferation Assay)を用いて試験した。その細胞を、草本抽出物を用いて48時間処理した。図4C:イノコズチ(ヒユ科)。
【発明を実施するための形態】
【0013】
いくつかの実施形態では、本発明は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量を含む組成物を含む。
【0014】
いくつかの実施形態では、この植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。
【0015】
いくつかの実施形態では、この抽出物はカリコシン、ニアソールおよび四環系イソフラボンを含む。
【0016】
いくつかの実施形態では、この植物化学物質の精製された抽出物は、第1の抽出および第2の抽出を行うことによって得られる。
【0017】
いくつかの実施形態では、この第1の抽出は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを、第1の溶媒中で分散して、第1の混合物を形成する工程と、この第1の混合物を加熱する工程と、この第1の溶媒を除去して第1の抽出物を得る工程とを包含する。いくつかの実施形態では、上記第1の溶媒は、エタノールおよび水の溶液である。いくつかの実施形態では、この第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約2〜約6時間加熱される。いくつかの実施形態では、この第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、この第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、このエバポレーションは約40℃〜約60℃の温度で起こる。いくつかの実施形態では、この第2の抽出は、以下の工程、この第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、この非水性層を収集する工程と、いずれの非活性化合物も除去する工程と、この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、この第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で、乾燥された非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカは酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。
【0018】
いくつかの実施形態では、上記組成物はさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。
【0019】
いくつかの実施形態では、本発明はキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を単離する方法を包含する。
【0020】
いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。
【0021】
いくつかの実施形態では、上記植物化学物質の精製された抽出物は第1の抽出および第2の抽出を行うことによって得られる。
【0022】
いくつかの実施形態では、上記第1の抽出は、第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、この第1の混合物を加熱する工程と、この第1の溶媒を除去して第1の抽出物を得る工程とを包含する。いくつかの実施形態では、この第1の溶媒はエタノールおよび水の溶液である。いくつかの実施形態では、上記第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約2時間〜約6時間加熱される。いくつかの実施形態では、この第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、この第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、このエバポレーションは約40℃〜約60℃の温度で起こる。いくつかの実施形態では、上記第2の抽出は、以下の工程、この第1の抽出物と第2の溶媒とを混合して第2の混合物を形成する工程と、この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、この非水性層を収集する工程と、いずれの非活性化合物も除去する工程と、この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、上記第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で乾燥された非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカは酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、上記植物化学物質の精製された抽出物からエバポレーションによって除去される。
【0023】
いくつかの実施形態では、本発明は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量を含む組成物で治療可能であり得る障害を有する被検体を治療する方法を包含する。
【0024】
いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。
【0025】
いくつかの実施形態では、上記植物化学物質の精製された抽出物は、第1の抽出および第2の抽出を行うことによって得られる。
【0026】
いくつかの実施形態では、この第1の抽出は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを、第1の溶媒中で分散して、第1の混合物を形成する工程と、この第1の混合物を加熱する工程と、この第1の溶媒を除去して第1の抽出物を得る工程とを包含する。いくつかの実施形態では、この第1の溶媒は、エタノールおよび水の溶液である。いくつかの実施形態では、この第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約2〜約6時間加熱される。いくつかの実施形態では、この第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、この第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、このエバポレーションは約40℃〜約60℃の温度で起こる。
【0027】
いくつかの実施形態では、この第2の抽出は、以下の工程、この第1の抽出物と第2の溶媒とを混合して第2の混合物を形成する工程と、この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、この非水性層を収集する工程と、いずれの非活性化合物も除去する工程と、この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、この第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカは酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。
【0028】
いくつかの実施形態では、上記組成物はさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。
【0029】
いくつかの実施形態では、上記組成物は、固体経口剤形、液体経口剤形、ゼラチンカプセル剤形、膣坐剤、直腸坐剤またはスプレーからなる群より選択される剤形として投与される。
【0030】
いくつかの実施形態では、上記治療上有効な量は、エストロゲン様効果を誘発する量である。
【0031】
いくつかの実施形態では、上記エストロゲン様効果は、少なくとも1つの更年期症状を治療または予防すること、骨粗鬆症を治療または予防すること、またはそれらの任意の組み合わせからなる群より選択される。いくつかの実施形態では、上記エストロゲン様効果は少なくとも1つの更年期症状を治療または予防することである。いくつかの実施形態では、この更年期症状は、ほてり、不眠症、膣もしくは外陰の委縮、性欲減退、尿失禁、頭痛、抑うつまたはそれらの任意の組み合わせからなる群より選択される。いくつかの実施形態では、この更年期症状は膣または外陰の委縮である。いくつかの実施形態では、このエストロゲン様効果としては骨粗鬆症を治療または予防することが挙げられる。
【0032】
いくつかの実施形態では、本発明は、エストロゲン応答要素の制御下の遺伝子を活性化する方法を包含し、この方法は、この遺伝子に対して作動可能に連結されたエストロゲン応答要素およびエストロゲン受容体を有する細胞に対して、ある量の組成物を投与することを包含し、この組成物は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を含み、この抽出物は、この遺伝子を活性化するのに十分な量である。
【0033】
いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。
【0034】
いくつかの実施形態では、上記細胞はインビトロである。いくつかの実施形態では、上記細胞はインビボである。
【0035】
いくつかの実施形態では、上記細胞はERα+乳房組織にある。いくつかの実施形態では、この細胞はERβ+乳房組織にある。いくつかの実施形態では、この細胞はERα+/ERβ+乳房組織にある。
【0036】
いくつかの実施形態では、上記エストロゲン応答要素は形質転換された細胞で発現される。いくつかの実施形態では、上記エストロゲン応答要素およびエストロゲン受容体の両方がこの細胞中で発現される。いくつかの実施形態では、このエストロゲン応答要素はこの細胞中で異種発現される。いくつかの実施形態では、上記エストロゲン応答要素およびエストロゲン受容体の両方が上記細胞中で異種発現される。
【0037】
いくつかの実施形態では、上記細胞はERE制御遺伝子で形質転換されたU937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される。いくつかの実施形態では、この細胞はERαを発現する。いくつかの実施形態では、この細胞はERβを発現する。いくつかの実施形態では、このERβ制御遺伝子はERE−tk−Lucである。
【0038】
いくつかの実施形態では、本発明は、TNF RE制御遺伝子の発現を抑制する方法を包含し、この方法は、TNF応答要素の制御下の遺伝子およびエストロゲン受容体を含む細胞に対して、ある量の組成物を投与することを包含し、この組成物は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を含み、この抽出物は、TNF RE制御遺伝子を抑制するのに十分な量である。
【0039】
いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。
【0040】
いくつかの実施形態では、上記TNF RE制御遺伝子がTNF−αである。いくつかの実施形態では、このTNF RE制御遺伝子はTNF RE−Lucである。
【0041】
いくつかの実施形態では、上記細胞はインビトロである。いくつかの実施形態では、この細胞はインビボである。
【0042】
いくつかの実施形態では、この細胞はER+乳房組織にある。いくつかの実施形態では、この細胞はERα+乳房組織にある。いくつかの実施形態では、この細胞はERβ+乳房組織にある。
【0043】
いくつかの実施形態では、上記TNF応答要素は細胞中で内因性に発現される。いくつかの実施形態では、このTNF応答要素およびエストロゲン受容体の両方がこの細胞中で内因性に発現される。いくつかの実施形態では、このTNF応答要素はこの細胞中で異種発現される。いくつかの実施形態では、このTNF応答要素およびエストロゲン受容体の両方が上記細胞中で異種発現される。
【0044】
いくつかの実施形態では、上記細胞はエストロゲン受容体遺伝子を含み、TNF応答要素制御遺伝子で形質転換され、U937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される。いくつかの実施形態では、このエストロゲン受容体遺伝子は、ERαを発現する遺伝子である。いくつかの実施形態では、このエストロゲン受容体遺伝子は、ERβを発現する遺伝子である。
【0045】
定義
本明細書において用いる場合、抽出物とは、植物物質由来の1つ以上の植物化学物質化合物を抽出媒体中に引きだすために適切な条件下でこの植物物質と溶媒とを接触させて溶液を形成すること、および必要に応じてこの溶液を希釈、分画さらに精製および/または濃縮して抽出物を形成することによって調製される物質の組成物である。本発明のいくつかの実施形態では、この植物物質は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの混合物である。従って、「抽出物」という用語は、抽出媒体を用いた植物物質(キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ)の抽出から得られる溶液を乾燥残渣のみが残るまで濃縮(例えば、エバポレーションによる)した時に残っている乾燥残渣を包含する。「抽出物」という用語はまた、抽出媒体を用いた植物物質の抽出、続いて溶液の濃縮(例えば、エバポレーションによる)から生じる濃縮溶液を包含する。「抽出物」という用語はまた、抽出媒体と植物物質との接触によって生成される溶液を含む希釈された溶液および1つ以上の希釈液を包含する。「抽出物」という用語はさらに、抽出工程とそれに続く1つ以上の精製および/または分画工程の産物を包含し得る。
【0046】
「インビボ」という用語は、生きている生物体、例えば、生きているヒトまたは他の哺乳動物、例えばマウスもしくはラットと接触しているかまたはその体内での治療を指す。
【0047】
本明細書において用いる場合、「治療する」、「治療すること」および「治療」という用語は、膣委縮またはその1つ以上の症状を緩和する(alleviating)方法を指す。
【0048】
本明細書において用いる場合、予防法とは、疾患状態の1つ以上の症状の発現の遅延、重症度の軽減および/または頻度の減少を指す。従って、予防法は、疾患または疾患状態の絶対的な予防ととらえるつもりはない。予防法は、疾患状態の発現の予防を意味するつもりもないが、予防法はいくつかの実施形態では、以下の目的で本明細書に記載される抽出物を含んでいる組成物の投与を包含する。患者が特定の症状または症状の集合に罹患する確率を低下すること、症状または症状の集合に罹患していると既に診断されているかまたはそのリスクがあると判定されている患者においてその症状または症状の集合の重症度または頻度を低減すること。
【0049】
詳細には、閉経期の治療としては、閉経期、閉経期間または閉経後の1つ以上の症状の重症度を緩和、軽減および/または頻度を低下することが挙げられる。さらに、これには、1つ以上の閉経期症状の発現を遅延する、閉経期症状の重症度または頻度を無視できるレベルまで低減する、またはその両方の目的および/または効果での本発明の組成物および抽出物の予防的投与を挙げることができる。
【0050】
本明細書において用いる場合、苦痛緩和(palliation)とは、疾患、障害、症候群、病態または症状の重症度、数および/または発生頻度の低減を包含する。
【0051】
本明細書において用いる場合、「E2」とは、天然に存在するエストロゲンであるエストラジオールを指す。
【0052】
本明細書において用いる場合、「投与する」、「投与すること」または「投与」とは、膣萎縮の治療のために適切な方式での患者への本発明の抽出物(単数または複数)の送達または本発明の抽出物(単数または複数)を含む薬学的組成物の送達を指す。この用語は、自己投与および医療専門家または他の介護者による投与を包含する。
【0053】
本明細書における「患者」とは特に、膣委縮に罹患しているか、または膣委縮を発症する可能性が高いと適格な医療従事者から判定されている閉経期または閉経時期の女性をさす。
【0054】
本明細書において用いる場合、「治療上有効な量」という用語は、膣委縮を治療するために適切な抽出物の量を指す。
【0055】
本明細書において用いる場合、「薬学的組成物」とは、本明細書に記載される抽出物のうちの1つ以上と他の化学的成分、例えば、生理学的に許容可能な担体および賦形剤との混合物を指す。薬学的組成物の目的は、患者に対する本発明の抽出物(単数または複数)の投与を容易にすることである。
【0056】
本明細書において用いる場合、「薬学的に許容可能な」という用語は、言及される薬剤または賦形剤が薬学的組成物における使用に適切であると一般にみなされることを意味する。
【0057】
本明細書において用いる場合、「生理学的に許容可能な担体」とは、生物体に対して有意な刺激を生じず、かつ投与される組成物の生物学的活性および特性を抑制することも過度に妨害することもない担体または希釈剤を指す。いくつかの実施形態では、生理学的に許容可能な担体は、患者における薬効をそれ自体が生じる必要ももたらす必要もなく、本発明の抽出物の1つ以上の成分の取り込みを増強し得る。
【0058】
本明細書において用いる場合、「賦形剤」とは、本発明の抽出物の投与を容易にする薬学的組成物における不活性物質を指す。従って、この「賦形剤」という用語は詳細には他の活性成分、例えば、具体的には、他の閉経期−または膣委縮−治療剤、例えば、ホルモンを除外する。不活性な賦形剤の例示的な、非限定的な例としては、香味剤、味覚マスキング剤、甘味料、結合剤、錠剤分解物質、流動促進剤、希釈剤およびそれらの2つ以上の組み合わせが挙げられる。
【0059】
本明細書において用いる場合、「含む、含んでいる(comprising)」、「含む、包含する(comprises、comprise)」およびそれらの文法上の変形は、包括的であるかまたは制限が無く、追加、未言及の要素も方法工程も排除しない。「含む、包含する(include、includes)」、「含む、包含する(contain、contains)」、「含んでいる、含有する(containing)」という用語およびその文法的変形は同様に包括的である。
【0060】
本明細書において用いる場合、「〜からなる(consisting of)」という句は、その文章のそれ以降の部分で特定されてない任意の要素、工程または成分を排除する。
【0061】
本明細書において用いる場合、「本質的に〜からなる(consisting essentially of)」という句は、その文章のそれ以降の部分の範囲を特定の物質または工程、および本発明の特許請求の範囲の基本的かつ新規な特徴(単数または複数)に物質的に影響しないものに対して限定する。
【0062】
本明細書において用いる場合、「1日あたりの乾燥重量グラム」(「乾燥重量グラム」とも)という用語は、本発明に従う抽出物を参照して、ある量の草本が抽出された後および例えば、エバポレーションまたは凍結乾燥によって抽出媒体が除去された後、残渣の乾燥重量のグラム数を意味する。
【0063】
本明細書において用いる場合、「四環系イソフラボン」(「TCIF」)とは、以下の構造:
【化1】

を有する化合物、またはその薬学的に許容可能な塩を意味する。
【0064】
エストロゲン
【0065】
エストロゲンは、一群のステロイド化合物である。最も広く天然に存在するエストロゲンはエストラジオール、エストリオールおよびエストロンである。閉経期を通じて、エストロゲンは17β−エストラジオールが最も一般的である。閉経後の女性ではエストロンが最も一般的である。
【0066】
卵巣における卵胞、黄体および胎盤は、雌性の身体で産生されるエストロゲンのほとんどを担う。さらに、肝臓、副腎および乳房がごく少量ではあるがエストロゲンを産生する。閉経期の間、および後に、これらの二次的な供給源は、エストロゲンの産生に優勢な部位となる。
【0067】
エストロゲンは特定の遺伝子の転写を活性化または抑制し得る。遺伝子転写の活性化のためには古典的なERE(エストロゲン応答要素)経路およびAP−1経路という2つの特徴的な経路がある。
エストロゲン受容体
2つの公知のエストロゲン受容体、ERαおよびERβがあり、これらは、ステロイド核受容体スーパーファミリーのメンバーである。ERαは最初1986年にクローニングされ;約10年後に当該分野ではERβと呼ばれる第2のERが発見された。
【0068】
ERの構造
【0069】
両方の受容体が、複数のドメインから構成されたモジュラータンパク質である。アミノ末端ドメイン(A/Bドメイン)は、最小保存領域であり、ERαとERβとの間で15%の相同性しか呈さない。このドメインは、エストラジオールの非存在下で遺伝子転写活性化を活性化し得る活性化機能(AF−1)を保有している。
【0070】
ERの中央領域は、標的遺伝子のプロモーターに位置する3つのヌクレオチドによって隔てられる逆位パリンドローム反復配列(inverted palindromic repeat sequence)に結合する2つのジンクフィンガーモチーフを含む。
【0071】
ERαおよびERβ中のDNA結合ドメイン(DBD)は事実上同一であって、95%の相同性を呈する。
【0072】
カルボキシ末端ドメインは、いくつかの必須の機能を実行するリガンド結合ドメイン(LBD)を含む。LBDはエストロゲン化合物が結合する大きい疎水性ポケットを形成する領域、およびER二量体化に関与する領域を含む。LBDはまた、同時調節タンパク質と相互作用する第2の活性化機能(AF−2)を含む。AF−2は、エストロゲン活性化および遺伝子転写の抑制の両方に必要である。ERαおよびERβのLBDは約55%相同でしかない。
【0073】
ERαおよびERβのLBDのアミノ酸組成の顕著な相違は、別個の転写的役割を有するERを作製することに発展し得る。これによってERαおよびERβが異なる遺伝子の活性を調節すること、ならびに異なる生理学的効果を誘発することが可能になるであろう。この概念はERαおよびERβのノックアウトマウスの研究によって支持される。例えば、ERαノックアウトマウスは未発達の乳腺および子宮の発達があるが、ERβノックアウトマウスは正常な乳腺および子宮の発達である。これらの観察によって、これらの組織の発達にはERαしか必要でないことが示される。さらに、ERαは遺伝子を活性化するのにERβよりも効果的であるが、ERβは遺伝子を抑制するのにERαよりも効果的である。
【0074】
作用の方法
エストロゲン受容体は多くの組織に存在し、かつ種々の生理学的な調節効果および発達効果に関与している。異なる組織は、ERαおよびERβという2つの公知のエストロゲン受容体サブタイプの発現の種々のレベルを有する。両方のエストロゲン受容体は、膣、骨、脳、および乳房組織で発現されるが、ほとんど子宮がERαを発現する。
【0075】
機能的には、エストロゲンは両方の受容体上で遺伝子転写を活性化しかつ抑制するが、それが調節する遺伝子のうちERαおよびERβについて同じなのは24%だけである。エストロゲンは、ERαのみを含有するMCF−7乳癌細胞の増殖を有意に増大する。同じMCF−7乳癌細胞がERβで感染されるとき、これはその細胞の増殖を阻害しそれらの成長を停止する。さらに、ERβ感染したMCF−7乳癌細胞のエストロゲン処理は結果として増殖をさらに阻害する。
【0076】
エストロゲンは遺伝子転写を活性化または抑制し得る。遺伝子転写の活性化には、古典的なERE(エストロゲン応答要素)経路およびAP−1経路という2つの特徴的な経路がある。遺伝子の転写を調節するエストロゲンに必須の少なくとも3つの本質的な構成要素がある。ER類(ERαおよび/またはERβ)、標的遺伝子中のプロモーターエレメントおよび同時調節性タンパク質。ERに対するエストラジオールの結合は、立体配置変化をもたらし、これが転写経路を開始するいくつかの重要な工程を生じる。第一に、E2とERとの相互作用は、シャペロンタンパク質の解離をもたらす。これは、ER二量体化表面およびDNA結合ドメインを露出する。シャペロンタンパク質の喪失によって、ERは二量体化して、標的遺伝子のプロモーター領域でEREに結合することが可能になる。
【0077】
第二に、E2の結合は、ERのLEDのヘリックス12を動かして、ERのAF−2機能をアセンブルする表面を作製する。AF−2は、ステロイド受容体コアクチベータ−1(SRC−1)または糖質コルチコイド受容体相互作用タンパク質1(GRIP1)などのp160クラスのコアクチベータタンパク質(コアクチベータ類)の結合表面を一緒になって形成する、ERのヘリックス3、5および12から構成される保存的疎水性ポケットからなる。コアクチベータ(「共調節因子(coregulators)」としても公知)はAF−2のヘリックスによって囲まれる疎水性のクレフト(cleft)中に突出するLXXLLから構成されるいくつかの繰り返しのアミノ酸モチーフを含む。このコアクチベータはヒストンアセチラーゼ活性を保有する。遺伝子活性化はERおよびコアクチベータタンパク質がERE上に複合体を形成した後に生じ、これがDNAに結合したヒストンタンパク質のアセチル化を生じると考えられる。ヒストンの活性化は、クロマチン構造を変化し、その結果ER/共調節因子複合体がEREと基本的転写タンパク質との間に架橋を形成し得、これが標的遺伝子のTATAボックス領域でアセンブルされて遺伝子転写を開始する。
【0078】
エストロゲン補充療法
ごく最近まで、閉経後エストロゲン補充は膣委縮の症状を治療するために広く用いられていた。全身のエストロゲン調製物、例えば、経口エストロゲン丸剤および経皮エストロゲンパッチは、他の閉経期症状、例えば、ほてりを緩和すること、または閉経後の骨密度損失を防ぐことを追究することに向けられてきた。しかし、過去10年間にわたって、無作為化臨床試験では結論として、全身のエストロゲン補充は、子宮内膜増殖症およびエストロゲン反応性の癌に加えて、心血管系および静脈血栓性疾患のリスクを増大することが示されている。さらに、エストロゲン補充療法は、膣委縮を有している高齢の女性ですでに広がっている尿失禁などの他の泌尿生殖器の問題のリスクを増大するようである。例えば、Women’s Health Initiative trialsでは、拮抗無しで(unopposed)エストロゲンを投与されている女性は、プラセボに比較して尿失禁を発症するリスクが52%高く、併用してエストロゲンに加えてプロゲスチンを投与されている女性は、プラセボに比較してリスクが39%高かった。
【0079】
膣クリーム、膣リングおよび徐放性膣錠剤の形態での膣のエストロゲン療法はまた、膣の乾燥を治療するのに有効であることが示されている。これらの治療は全身のエストロゲン調製物よりも低い血清エストラジオールレベルを生じるので、それらは心血管系疾患、静脈血栓塞栓症、浸潤性乳癌および子宮内膜増殖症のリスクが低くなると考えられる。にもかかわらず、エストロゲンの全身吸収は膣エストロゲン投与とともに、特に治療の開始時に、膣上皮が薄くかつ委縮するとき生じる。結果として、膣エストロゲン(1日あたり100〜400μgのエストラジオール)を用いる女性は、同時にプロゲスチンをとって、子宮内膜増殖症を防がなければならない。
【0080】
低用量の膣エストロゲン療法(1日あたり10〜100μgのエストラジオール)は血清エストラジオールレベルにごくわずかな変化を生じると考えられるが、数人の研究者らは、「初回通過」効果が生じ得、ここでは膣エストロゲンは、局所の静脈を介して子宮に移動し、全身の送達で生じる効果よりも大きい効果を発揮すると信じている。結果として、多くの臨床家は依然として、子宮内膜癌を発症するリスクが平均よりも高い女性ではこれらの治療の長期の使用を避けることを好む。いくつかの小規模の研究では、低用量の膣エストロゲンで治療された女性で子宮内膜増殖が生じ得るが、他のトライアルではこれらの治療での増殖を証明していないことが示唆されている。
【0081】
選択的エストロゲン補充モジュレーター(Selective Replacement Modulators)(SERMs)
公知のSERMは、エストロゲン受容体の作用をアンタゴナイズおよびアゴナイズする。それらの固有の薬理学的作用によって別個のSERMが組織選択性を通じてその作用を発揮することが可能になり、ここでそれらは、乳房組織の場合のようにアンタゴナイズするか、または骨組織の場合のようにアゴナイズする。それらの作用は両方のエストロゲン受容体を通じ、2つの公知のエストロゲン受容体のうちの1つに対して選択性を呈する現在利用可能なSERMというのはない。
【0082】
選択的エストロゲン受容体モジュレーター(SERM)は、骨または子宮に対してエストロゲン様効果を有するだけでなく、膣または外陰の委縮の症状および合併症に潜在的な治療としても探究されている。SERMラロキシフェンの1つの二重盲検のプラセボコントロール治験では、薬物対プラセボで治療した女性のうちわずかな割合が泌尿生殖器の脱出のために手術を要することが見出された。いくつかの小型の無作為化治験で、プラセボに対してSERMのラソフォキシフェン(lasofoxifene)を投与されている女性では膣成熟指数および膣pHの改善が見出された。いくつかのSERMでは泌尿生殖器管におけるエストロゲン受容体の下方制御が生じるので、それらはまた膣または外陰の委縮の症状を悪化させる可能性がある。さらに、SERMは、ほてりのような他の困難な閉経期症状の重症度を悪化し得、このためにSERMは閉経期女性に対して膣委縮の治療にはあまり魅力的ではない。
【0083】
ERE経路におけるSERMの効果
エストロゲンとは異なり、SERMはERE経路を活性化しない。その代わりに、SERMはERE経路に対するエストロゲンの効果を競合的にブロックする。エストロゲンと同様に、SERMはERαおよびERβに対して高い親和性で結合し、シャペロンタンパク質の解離、ERの二量体化およびEREへのERの結合を引き起こす。従って、SERMのアンタゴニスト作用は、プロモーター領域へのERの結合に対して遠位の段階で起こる。SERMのアンタゴニスト作用の分子的機構は、ERαおよびERβのLBDの結晶化によって明らかになっている。E2、タモキシフェン、およびラロキシフェンが同じ結合ポケットに結合することは、ERのLBDの構造から明らかである。しかしながら、タモキシフェンおよびラロキシフェンは、E2では欠失している嵩高い側鎖を含んでいる。ERのX線構造によって、SERMの嵩高い側鎖が、LBDの移動を妨げ、これが機能的なAF−2表面の形成を防ぐことが明らかになった。意外にも、SERMがLXXLLモチーフと類似であるヘリックス12におけるERα配列(LXXML)と結合するとき、AF−2表面の疎水性クレフトと相互作用してコアクチベータ認識部位を塞ぐ。したがって、エストロゲンとは異なり、SERMは機能的なAF−2表面を作製しない。このことはコアクチベータの結合を妨げる。コアクチベータタンパク質はSERM存在下ではAF−2表面と結合しないため、活性化経路は急激に停止される。補充されるコアクチベータの代わりに、SERMと配位したERはN−CoRなどのコリプレッサーを補充する。
【0084】
これらの研究によって、SERMのアンタゴニスト特性が少なくとも3つの要因に起因することが実証された。第一に、SERMはエストロゲンと同一の結合ポケットに結合し、エストロゲンのERへの結合を競合的にブロックする。第二に、SERMは、ERE経路の転写活性化に必要なコアクチベータタンパク質とのERの相互作用を妨げる。第三に、SERMは、遺伝子の転写活性化を防ぐコリプレッサーを補充する。SERMのこれらの作用が、ラロキシフェンおよびタモキシフェンが乳房細胞中でアンタゴニストとして作用して乳癌の発症を阻害する方法を説明する可能性が最も高い。
【0085】
SERMはまた、AP−1エレメントを有する遺伝子の活性化ではE2より効果的である。実際、E2はAP−1エレメントのSERM媒介による活性化のアンタゴニストである。SERMはAP−1経路活性化により、骨および子宮内膜などの組織においてアゴニスト作用を呈すると想定される。興味深いことに、SERMはERβ存在下ではAP−1経路の活性化にさらに強力であって、このことはSERMがERβを豊富に含む組織中でより効率的にAP−1経路の引き金になるであろうことを示す。エストロゲンはSERMに比べてAP−1経路の活性化にはかなり弱いため、エストロゲン媒介性の乳癌発生におけるAP−1経路の役割は不明瞭である。しかしながら、AP−1経路は、乳腺腫瘍におけるタモキシフェン抵抗性に関わる場合があると提唱されている。
【0086】
本発明の態様に従い、以下を実証する研究を行った。ERE−tk−Lucの活性化に、ERβはERαより弱く、TNF−RE−tk−Lucの抑制に、ERβはERαより効果的である。そして、ERβはERE−tk−LucのERα媒介性の転写活性化を阻害する。詳細な実験は本明細書において以降の実施例の節で考察する。
膣および外陰部の委縮
【0087】
閉経期膣委縮の発現は、循環中のエストロゲンの低下と関連している。閉経期間から閉経後へ、血清エストロゲンのレベルは、約400pg/mlから10pg/ml未満まで低下することが示されている。エストロゲン補充療法は膣乾燥の治療に首尾よく用いられている。その効果は外陰部および膣の管におけるエストロゲン受容体のアゴニスト性刺激を介して達成されると仮定される。
【0088】
定義および疫学
膣の症状、例としては、乾燥、刺激、そう痒、出血および性交疼痛は、女性が閉経期に移行するにつれて増大し、閉経時期および閉経後早期の女性のうち約30%、閉経後後期の女性では最大47%がこれらの愁訴を示す。膣の愁訴の自然な病歴は完全には明らかでないが、他の閉経期の症状、例えば、経時的に徐々に改善するほてりとは異なり、これらの症状は一般に永続して加齢とともに悪化する場合さえある。
【0089】
閉経後の膣の症状は一般に、膣粘膜の蒼白、乾燥、脆弱性およびシワの減少を含む理学的検査所見をともなう。閉経前女性に比較して、膣の症状を有する閉経後の女性は一般に、膣の血流および分泌、コラーゲンのヒアリン化、エラスチンの断片化、および膣結合組織の増殖が低下している。膣上皮細胞は、成熟の障害およびグリコーゲンを貯蔵し水素イオンを分泌してpHのレベルを低く維持する能力の低下を示す。定量的な膣上皮細胞の細胞学では一般に、傍基底(未熟)である膣上皮細胞の割合が閉経前女性での5%未満に比較して20%を超えるということが明らかになっている。閉経前女性で酸性である膣液は、典型的には5.0未満のpHで、より中性になる。
【0090】
さらに高齢の女性で観察される症状、理学的所見および他の変化の集合は一般に膣委縮または萎縮性膣炎と呼ばれる。泌尿器症状、例えば、尿意切迫および排尿障害はまた、膣委縮が泌尿器管下部の隣接組織の委縮または炎症(膣または外陰部の委縮)を伴う場合に生じる。エストロゲンでの治療は、膣で多くの細胞学的および生理学的変化を改善し、このことはエストロゲン不足がこれらの変化の病因に主要な役割を果たすことを示唆している。しかし、血清エストロゲンのレベルが低いことは膣の症状に相関するが、エストロゲンレベルは、膣の保湿剤を含むエストロゲン以外の使用で改善され得る閉経後の膣の細胞学的および生理学的変化のいくつかとは相関しない。
【0091】
他の閉経期症状、例えば、ほてりおよび寝汗とは異なり、膣の症状は閉経期の発現の5年より後に発症して、女性が規則的な月経周期を失った後数十年持続する場合が多い。疫学的な研究によって、膣の乾燥は閉経前女性の3%〜22%、閉経時期の女性の7%〜39%、および閉経後の女性の17%〜47%に影響することが示唆される。膣委縮に対する多くの研究は、白人の女性で行われているが、膣乾燥の罹患率は黒人女性およびラテン系女性ではさらに高い場合がある。
【0092】
病態生理学
生殖年齢の間には、エストロゲンは、膣上皮細胞によるプロトン分泌促進によって膣液の酸性度を維持するのに重要な役割を果たすことが示されている。エストロゲンが膣上皮細胞を刺激してグリコーゲンを産生かつ貯蔵し、グリコーゲンが次に正常には膣壁にコロニー形成する乳酸菌によって乳酸に代謝されることも示されている。結果として得られた低い膣のpH(<5.0)は、膣および尿管の感染のリザーバーとして機能する病原性グラム陰性細菌の増殖を阻害するように機能する。エストロゲンはまた、膣の壁の結合組織のコラーゲンの組成および架橋を維持するのに役割を果たすと考えられるが、この正確な機序は十分理解されてはいない。
【0093】
循環中のエストロゲンレベルの有意な低下を伴う閉経期および他の状態(例えば、卵巣摘出術、抗エストロゲン療法、免疫学的障害)の間、膣上皮細胞の正常な機能が乱される。グリコーゲン産生およびプロトン分泌の低下の状況では、膣のpHは6.0〜7.0に増大する。エストロゲン欠乏または加齢のいずれかに関連する、膣粘膜における他の変化としては、結合組織の増殖、エラスチンの断片化、およびコラーゲンのヒアリン化が挙げられ、これが膣壁の脆弱性の増大を生じる。
【0094】
キバナオウギおよびナイモウオウギ
キバナオウギおよびナイモウオウギという植物は総称してオウギ(Radix astragali)と呼ばれる。オウギはキバナオウギ(ナイモウオウギ)の乾燥された根である。この草木はまた、中国名(Huang Qi:ホアン・チー)および一般名黄耆、ホアン・キー(huang ky)、ホアン・キー(huang−chi)、ホアンゴー(huangggoi)、ホアンキー(huangqi)、hwanggi(ホワンギィ)、膜性ミルクベッチ(membranous milk vetch)、ミルクベッチ(milkvetch)、モンゴリアンミルクベッチ(Mongolian milk−vetch)、ネイモン・ホアンキー(neimeng huangqi)、オギ(ogi)、オウギ(ougi)およびゾンフェンマオマイトン(zhongfengmaomaitong)とも呼ばれる。
【0095】
オウギは約16〜36インチの高さの多年生植物である。オウギは、中国、朝鮮民主主義人民共和国、モンゴルおよびシベリアに自生する。この植物は、中国北部および朝鮮民主主義人民共和国で商業的に栽培され、春と秋に収穫される。この根はひげ根および根茎を取り除かれ、次に日光で乾燥される。
【0096】
この根は円柱状であって、比較的太い長さ30〜90cm、径が1〜3cmのいくつかの分岐がある。この根の表面の色は淡い黄褐色または淡褐色から濃褐色であって、不規則な、縦方向のシワまたは溝がある。この質感は硬く粘りが強く、破砕が困難で、裂け目は極めて線維性であって、デンプン質である。樹皮は黄白色である。この樹は淡黄色で放射状の条線および亀裂がある。この樹の中心はコルク様で、腐った木の様な外見、黒褐色または空洞の場合もある。
【0097】
ハナスゲ
ユリ(ユリ科)(別名、ツルボラン(Asphodelaceae)科のハナスゲ(Rhizomae Anemarrhenae asphoeloides Bunge)はまた、中国名ジ・ムー(Zhi Mu)とも呼ばれる。その他の一般名は特定されていない。ハナスゲは0.5m×1mまで成長する多年生の常緑植物である。8月から9月までが花の時期である。この花は雌雄同花である(雄性器官および雌性器官の両方を有する)。
【0098】
この植物は河北省、陝西省および内モンゴルという中国北部の省で商業的に栽培されている。この植物は、商業的に栽培されており、かつ春と秋に収穫される。根茎が細根から取り除かれ、次に日光で乾燥される。
【0099】
この根は長く、平らで、曲がっており、2〜3の分岐がある。根の表面の色は淡褐色から濃褐色であって、根の中心には細長い溝があって、これは堅い節で終わっている。この根は黄色っぽい線維性の葉脚を有し、1つはわずかに持ち上がって、シワおよびまだらな根および線維性の瘢痕がある。この質感は硬く脆弱で、破砕が容易で、裂け目は極めて線維性であって、デンプン質である。この樹は象牙色である。この樹の中心はコルク様である。
【0100】
イノコズチ
ヒユ(Amarathaceae)科のイノコズチ(Radix Achyranthes bidentata Bl)はまた、中国名ホワイ・ニウ・シイ(Huai Niu Xi)および一般名、二鋸歯状アマランス(two−toothed amaranthus)および牛膝(ごしつ)(oxknee)としても公知である。イノコズチは直立の多年生植物であって、細長くまとまりのない枝、楕円形の葉、および緑白色の花が末端の刺の上にあり、1mの高さまで育つ。
【0101】
イノコズチは、主に河南省で栽培される。この植物は夏に収穫される。地上部が根から切断されて、根だけが用いられる。この根が日光で乾燥される。
【0102】
この根は長さ15〜50cm、径が0.4〜1cmの円柱状である。表面の色は灰黄色で細長いシワおよび小さく長い皮目がある。その質感は硬く脆弱で、破砕が容易である。樹皮は黄白色である。この断面は滑らかでかつ黄褐色で中心に髄がある。維管束が断面中に見える。
【0103】
【化2】

【0104】
カリコシンは選択的エストロゲン受容体β活性を有するイソフラボノイドである。これは、キバナオウギおよびナイモウオウギから抽出される。カリコシンの化学式はC16H12O5である。カリコシンの分子量は284であると測定された。研究によって、カリコシンは、ERβ選択的転写活性を生じ、いずれの受容体にもアンタゴニスト様の効果は有さないことが示された。カリコシンは薬学的組成物中に薬学的に許容可能な塩の形態で存在してもよいが、カリコシンは、その遊離型で(塩ではなく)十分な溶解度のものであると考えられ、特定の好ましい実施形態では、カリコシンが組成物中に塩型で存在する必要性はないと考えられる。それにもかかわらず、「カリコシン」が本明細書で出現する場合、その用語は特段明記しない限り、遊離型および塩型の両方を包含するものとする。
【0105】
【化3】

【0106】
ニアソールは選択的エストロゲン受容体β活性を有するフェニルプロパノイドである。これは、ハナスゲから単離される。ニアソールの化学式はC17H16O2である。ニアソールの分子量は252であると測定された。研究によって、ニアソールは、両方のエストロゲン受容体のサブタイプに等しい親和性で結合するが、これはERβ転写活性のみを生じることが示された。さらに、ニアソールはいずれの受容体にもアンタゴニスト様の効果は有さないことが示された。ニアソールは薬学的組成物中に薬学的に許容可能な塩の形態で存在してもよいが、ニアソールは、その遊離型で(塩ではなく)十分な溶解度のものであると考えられ、特定の好ましい実施形態では、ニアソールが組成物中に塩型で存在する必要性はないと考えられる。それにもかかわらず、「ニアソール」が本明細書で出現する場合、その用語は特段明記しない限り、遊離型および塩型の両方を包含するものとする。
【0107】
四環系イソフラボン(TCIF)
【化4】

【0108】
TCIFは選択的エストロゲン受容体β活性を有するイソフラボノイドである。これは、イノコズチから抽出される。TCIFの化学式はC16H10O7である。TCIFの分子量は314であると測定された。研究によって、TCIFは、エストロゲン受容体β(ERβ)選択的転写活性も生じることが示された。さらにTCIFはいずれの受容体にもアンタゴニスト様の効果は有さないことが示されている。TCIF(四環系イソフラボン)は薬学的組成物中に薬学的に許容可能な塩の形態で存在してもよいが、四環系イソフラボンは、その遊離型で(塩ではなく)十分な溶解度のものであると考えられ、特定の好ましい実施形態では、四環系イソフラボンが組成物中に塩型で存在する必要性はないと考えられる。それにもかかわらず、「四環系イソフラボン」(すなわち「TCIF」)が本明細書で出現する場合、その用語は特段明記しない限り、遊離型および塩型の両方を包含するものとする。
【0109】
抽出の方法
いくつかの実施形態では、本発明はキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチという植物種から植物化学物質の精製された抽出物を単離する方法を包含する。いくつかの実施形態では、植物化学物質の精製された抽出物は、第1の抽出および第2の抽出を行うことによって得られる。
【0110】
いくつかの実施形態では、この第1の抽出は以下の工程、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを、第1の溶媒中で分散して、第1の混合物を形成する工程と、この第1の混合物を加熱する工程と、この第1の溶媒を除去して第1の抽出物を得る工程とを包含する。いくつかの実施形態では、この第1の溶媒は、エタノールおよび水の溶液である。
【0111】
この植物が第1の溶媒中に分散されるとき、本発明は、植物全体または植物の任意の一部(単数または複数)、例えば、根、樹皮、木部、葉、花々(すなわち花、例えば、萼片、花弁、雄しべ、雌しべなど)、果実、種子および/または任意の前述の一部もしくは混合物の使用を意図する。さらに、この植物またはその一部は、新鮮な切り取りであっても、乾燥されていても(例としては、凍結乾燥)、凍結であっても、その他であってもよい。さらに、本発明は、必要に応じて、植物種を最初に粉砕してその容積に対する表面積の比を増大し、同時に抽出プロセスの効率を増大することを包含する。植物を粉砕する方法としては、粉砕(grinding)、寸断(chopping)、混合(blending)、破砕(shredding)、製粉(pulvering)、粉砕(triturating)などが挙げられる。
【0112】
いくつかの実施形態では、この第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約20℃〜約40℃の温度まで加熱される。当業者は、一方の抽出効率と他方での物理化学的安定性との間に適切なバランスが導かれるべきであることを理解するであろう。
【0113】
溶媒と植物物質が一旦組み合されれば、それらは必要に応じて、植物物質から抽出媒体へのエストロゲン様化合物の十分な交換が確実になるように攪拌され、そしてその植物物質から抽出媒体への有用な量の植物化合物の抽出に十分な時間接触させられる。いくつかの実施形態では、この第1の混合物は約2〜約6時間加熱される。いくつかの実施形態では、この第1の混合物は約 〜約4時間加熱される。この後に、第1の抽出物を植物物質から分離する。このような分離は当該分野で認識される方法によって、例えば、濾過、デカントなどによって達成される。
【0114】
いくつかの実施形態では、この第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、このエバポレーションは約40℃〜約60℃の温度で起こる。
【0115】
いくつかの実施形態では、この第2の抽出は、以下の工程、この第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、この非水性層を収集する工程と、いずれの非活性化合物も除去する工程と、この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、この第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、この非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で、乾燥された非水性層を濾過することによって除去される。いくつかの実施形態では、このシリカは酢酸エチル中に懸濁される。いくつかの実施形態では、この第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。
【0116】
水が抽出溶媒である場合、精製水が適切である。精製水としては蒸留水、脱イオン水、注射用水、限外濾過水およびその他の形態の精製水が挙げられる。
【0117】
本発明のいくつかの実施形態で使用されるエタノールは穀物エタノールである。詳細には、これは非変性エタノール(例えば、必要に応じてある程度の水、例えば、最大約10%の水を含む純エタノール)である。
【0118】
本発明のいくつかの実施形態で利用される酢酸エチルは、エタノールおよび酢酸由来のエステルである。これは好ましくは純粋な酢酸エチルであるが、ある程度の水を含んでもよい。
【0119】
いくつかの実施形態では、純粋な抽出物を1つ以上の有機溶媒と組み合わせてもよい。このような有機溶媒は、種々の極性の溶媒であってもよい。いくつかの実施形態では、適切な溶媒としては、エチル 酢酸エチル、アセトニトリル、ヘキサン、(C1−C4)アルコール(例えば、メタノール、エタノール、i−プロパノール、n−プロパノール、n−ブタノール、t−ブタノール、s−ブタノール、i−ブタノール、など)クロロホルム、アセトン、シクロヘキサン、シクロヘプタン、石油エーテルおよび他の溶媒、例としては、薬学的に許容可能な溶媒、およびヒトでの使用について安全食品認定(generally regarded as safe)(GRAS)されている溶媒が挙げられる。
【0120】
薬学的使用について抽出物を意図する場合、任意の追加の成分は薬学的に受容可能である。本発明による組成物をアッセイまたは生体に対する以外の他の用途での使用について意図する場合、追加の成分(単数または複数)は薬学的に受容可能であってもなくてもよい。
【0121】
組成物の処方
本発明による組成物は、発明の植物抽出物または本発明の発明植物抽出物を含む組成物を含む。このような実施形態では、本発明の組成物は必要に応じて、1つ以上の追加の成分を含む。このような追加の成分は不活性であっても活性であってもよい。不活性成分としては溶媒、賦形剤および他の担体が挙げられる。活性成分としては活性な薬学的成分(active pharmaceutical ingredient)(API)、例としては、本発明の植物抽出物と組み合わされて相乗活性を呈する成分が挙げられる。
【0122】
いくつかの実施形態では、この組成物は、純粋な抽出物または抽出物と1つ以上の追加の溶媒との組み合わせを含む。いくつかの実施形態では、この抽出物は、分配された抽出物またはさらに精製された抽出物を含む。分配または精製は、クロマトグラフィーを含めて種々の分離技術を用いて行われ得る。いくつかの実施形態では、この抽出物とは、抽出物中で活性剤をさらに濃縮するために陰イオン交換クロマトグラフィー、陽イオン交換クロマトグラフィー、逆相クロマトグラフィー、順相クロマトグラフィー、アフィニティークロマトグラフィー、または排除クロマトグラフィーによって得られる精製または分配された抽出物である。いくつかの実施形態では、この精製されるかまたは分配された抽出物は、高速液体クロマトグラフィー(HPLC)などの1つ以上の工程の液体クロマトグラフィーを介して得られる。いくつかの実施形態では、高速液体クロマトグラフィーは、実験規模高速液体クロマトグラフィーである。いくつかの実施形態では、HPLCは逆相クロマトグラフィーまたはイオン交換クロマトグラフィーである。分液漏斗または他の二相もしくは多相の分離機構における分離を含む、分離の他の手段も抽出物の精製または分配に用いられてもよい。
【0123】
いくつかの実施形態では、精製されるかまたは分配された抽出物は、溶媒、希釈液などの1つ以上の追加の活性成分または不活性成分と組み合されてもよい。いくつかの実施形態では、適切な溶媒としては、酢酸エチル、アセトニトリル、ヘキサン、(C1−C4)アルコール(例えば、メタノール、エタノール、i−プロパノール、n−プロパノール、n−ブタノール、t−ブタノール、s−ブタノール、i−ブタノールなど)、クロロホルム、アセトン、シクロヘキサン、シクロヘプタン、石油エーテルおよび他の溶媒、例としては、薬学的に許容可能な溶媒、およびヒトでの使用について安全食品認定(GRAS)されている溶媒が挙げられる。
【0124】
適切な追加の成分としては溶媒が挙げられる。溶媒は薬学的に許容可能な溶媒および薬学的に許容可能でない溶媒に細分され得る。この状況では、いくつかの薬学的に許容可能な溶媒としては、注射用水(WFI)が挙げられることが理解されるべきであり、この注射用水は、予め選択されたpHまたはpH範囲まで、例えば、約2〜約8、さらに具体的には約4.0〜約7.5、そしてさらに具体的には約4.9〜約7.2にpH調節されるかおよび/または緩衝化されてもよい。
【0125】
薬学的に許容可能な溶媒はさらに、1つ以上の薬学的に許容可能な酸、塩基、塩、または他の化合物、例えば、担体、賦形剤などを含んでもよい。薬学的に許容可能な酸としてはHCl、H2SO4、H3PO4、安息香酸などが挙げられる。薬学的に許容可能な塩基としては、NaOH、KOH、NaHCO3などが挙げられる。薬学的に許容可能な塩としてはNaCl、NaBr、KCl、などが挙げられる。酸および塩基は、特に、予め選択されたpHで、特に約2〜8の範囲のpHで、とりわけ約5.0〜約7.2の範囲で薬学的に許容可能な溶液を緩衝化するために適切な割合で添加され得る。
【0126】
いくつかの実施形態では、この組成物はさらに、活性な薬学的成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。着色剤の例としてはβカロテン、赤色2号および青色1号が挙げられる。防腐剤の例としてはステアリン酸、ステアリン酸アスコルビル、およびアスコルビル酸が挙げられる。矯味薬の例としてはメントールおよびシトラスの芳香が挙げられる。
【0127】
いくつかの実施形態では、本発明の薬物送達系は、吸収促進薬を含むことが有利である場合がある。「エンハンサー」という用語は、粘膜を横切る吸収を増大するか、および/またはバイオアベイラビリティを増大するように機能する任意の物質を意味する。いくつかの実施形態では、このような物質としては、粘液溶解剤、分解酵素インヒビター、および粘膜細胞膜の透過性を増大する化合物が挙げられる。所定の化合物が「エンハンサー」であるか否かは、インビボまたは良好なモデルの試験においてエンハンサーの有無で、薬物として関連しない小さい極性の分子を含む2つの処方物を比較することによって、およびその薬物の取り込みが臨床的に有意な程度まで増強されるか否かを決定することによって決定され得る。インビボでエンハンサーは、非刺激性であるか、および/またはなんら有意な刺激性の影響を有さない正常な細胞構成物に代謝されるはずなので、エンハンサーは、慢性毒性に関していかなる問題をも生じないはずである。
【0128】
いくつかの実施形態では、好ましい増強物質はリゾリン脂質、例えば、卵から入手可能なリゾホスファチジルコリンまたはダイズレシチンである。異なるアシル基を有する他のリゾホスファチジルコリン、ならびに同様の膜改変特性を有する、ホスファチジルエタノールアミンおよびホスファチジン酸から作製されるリゾ化合物を用いてもよい。アシルカルニチン(例えば、パルミトイル−dl−カルニチン−クロライド)が代替である。いくつかの実施形態では、適切な濃度は0.02〜20%(w/v)である。
【0129】
いくつかの実施形態では、適切な増強剤としては、キレート剤(EGTA、EDTA、アルギン酸塩)、界面活性剤(特に非イオン性物質)、アシルグリセロール、脂肪酸および塩、チロキサポールおよびSIGMAカタログ,1988、第316〜321頁(参照によって本明細書に援用される)に列挙される生物学的界面活性剤が挙げられる。また膜の流動性および透過性を改変する薬剤、例えば、エナミン(例えば、エチルアセトアセテートのフェニルアラニンエナミン)、マロン酸塩(例えば、ジエチレンオキシメチレンマロネート)、サリチル酸塩、胆汁塩および類似体およびフシジン酸塩が適切である。適切な濃度は最大20%(w/v)までである。
【0130】
アッセイでの組成物の使用
本発明による抽出物は、エストロゲン応答要素(ERE)の制御下で遺伝子のエストロゲン様活性を提供する。従って、いくつかの細胞では、本発明の抽出物はエストロゲン様の特性を保有する−すなわち、EREおよびER(ERα、ERβまたはその両方)を含んでいる細胞とEREの制御下で遺伝子の刺激を生じる本発明の抽出物とを接触させる。インビトロの細胞系では、本発明の抽出物によるERE媒介性の活性は、EREに作動可能に連結されている遺伝子の発現をもたらす。特定の実施形態では、ERと最小チミジンキナーゼプロモーターおよびルシフェラーゼ遺伝子に連結されたEREとのエストロゲン様相互作用は、ルシフェラーゼ発現の増強を生じる。従って、本発明の抽出物は、ルシフェラーゼのようなレポーター遺伝子に対して作動可能に連結されたERE含有プロモーターを有するERα+細胞株、ERβ+細胞株および/またはERα+/ERβ+細胞株を特定するために用いられ得る。本発明の抽出物はまた、ER+細胞株においてエストロゲン様効果を有する化合物を特定するための、アッセイ試薬として、例としては標準として用いられてもよい。
【0131】
このようなアッセイ方法の1つでは、本発明の抽出物は最初に、公知の活性または濃度で調製される。本発明の抽出物の定量化は都合の良いことには、容器を風袋測定すること、この容器内に容積が既知の抽出物を測定すること、エバポレーションまたは凍結乾燥によって抽出物を減らして、残渣を生じて、容器プラス抽出物の質量を得ることによって行う。容器プラス抽出物の質量と風袋の質量との間の質量の差がその抽出物の乾燥重量である。抽出物の容積に対する抽出物の乾燥質量の比が1単位容積あたりの濃度である。この抽出物を、その最初の形態で、前述の定量方法の結果を用いて使用し、その濃度を特定してもよい。その残滓をまた、水または別の適切な溶媒系の添加によって再構成して、濃度が既知の抽出物溶液を形成してもよい。
【0132】
一旦抽出物の濃度が判明すれば、検量線が作成される。一般にはER+細胞を、抽出物と接触させて、エストロゲン活性に関連するシグナルを記録する。具体的には、ER+細胞は、EREの制御下のレポーター遺伝子を有する。このER+細胞を、添加される抽出物の量に対する割合でレポーターシグナルを生じる本発明の抽出物と接触させる。この工程は複数のサンプルを同じ抽出物濃度で、異なる抽出物濃度で、またはその両方で用いることによって行われ得る。
【0133】
例としては、9つのサンプルを試験してもよい。最初の3つは最初の濃度、次の3つは最初のより半対数大きい濃度で、次の3つは最初によりも全対数大きい濃度である。次いでレポーターシグナルを観察し、記録して、得られたデータポイント(植物抽出物濃度対レポーターシグナル強度)を、従来の曲線あてはめ方法(例えば、最小二乗)によって検量線にあてはめる。
【0134】
抽出物のエストロゲン様効果を評価するために、抽出物を、EREの制御下にレポーター遺伝子を有するE+細胞と接触させる。このレポーター遺伝子シグナルを観察して、検量線と比較して、抽出物の相対的なエストロゲン様効果を定量化する。
【0135】
前述の方法で用いられるER+細胞株は、ERを天然に発現する細胞株、例えば、ヒト由来ER+乳房細胞癌細胞株であってもよい。いくつかの実施形態では、ER+組織は不死化ヒト細胞株、例えば、不死化骨髄または乳房細胞株である。例示的な細胞株としては、ヒト単球、骨芽細胞、悪性の乳癌および不死化乳房上皮細胞株が挙げられる。言及され得る特定の細胞株としてはU937、U2OS、MDA−MB−435およびMCF−7細胞株が挙げられる。他のER+細胞株(不死化細胞株を含めて)もまた用いられ得る。あるいは、ER+細胞株は、ERを天然には発現しない細胞株、例えば、ER発現ベクターで形質転換されている細菌細胞株であってもよい。
【0136】
ER+細胞株を、レポーター遺伝子を制御するEREを含んでいるプロモーターを有するベクターで形質転換する。例えば、ベクターとは、ERE、最小チミジンキナーゼプロモーター(tk)およびルシフェラーゼ遺伝子(Luc)を含んでいるウイルスベクターであってもよい。この構築物は、公知の方法によって標的細胞にトランスフェクトされ、ER−ERE−tk−Luk系の発現は、例えば、既知量のエストラジオール(E2)の存在下で推定のER+細胞に対して前述のアッセイを行うことによって確認される。ER+細胞の首尾よい形質転換を確認する他の方法としては、公知のER抗体での免疫染色法が挙げられる。
【0137】
ERE含有プロモーターとはERE配列およびプロモーター配列を含むDNAである。プロモーター配列は、最小チミジンキナーゼ(tk)プロモーター配列などの当該分野で認識されるプロモーター配列である。他のERE含有プロモーターが可能であって、本発明の範囲内である。EREおよびプロモーター配列は、一緒に作動してレポーター遺伝子の発現を制御する。本明細書に記載のとおり、エストロゲン様化合物(例えば、本発明の抽出物またはE2)は、ERに結合して、ER二量体を生じ、AF−2表面を形成する。次いでER二量体は、EREに結合し、プロモーターの制御下で遺伝子を活性化する。いくつかの実施形態では、EREはプロモーターの直接上流(5’側)であり、ここに直接連結される。
【0138】
レポーター遺伝子とは発現された場合検出可能なシグナルを生じる遺伝子である。ルシフェラーゼ遺伝子は、単一の試薬ルシフェリンの存在下で検出可能な光シグナルを生じるタンパク質ルシフェラーゼを生じるので、適切なレポーター遺伝子である。具体的には、ルシフェラーゼ遺伝子のcDNAは62kDaの酵素的タンパク質であるルシフェラーゼを生じるように発現される。このルシフェラーゼ酵素はMg2+および酸素の存在下でルシフェリンおよびATPの反応を触媒して、オキシフェリン、AMP、ピロリン酸塩(PPi)および放射光を形成する。放射光は、黄色−緑色(560nm)であり、標準的な光度計を用いて容易に検出できる。細胞内にはATP、O2およびMg2+が元々存在しているので、検出シグナル産生のために、このレポーター遺伝子は、ルシフェリン試薬の添加しか必要でなく、本発明のアッセイの使用には特に適している。当該分野で入手可能であると言える他のレポーター遺伝子としては、クロラムフェニコールアセチル基転移酵素(chloramphenicol transacetylase:CAT)、ネオマイシンホスホトランスフェラーゼ(neomycin phosphotransferase)(neo)、およびβ−グルクロニダーゼ(beta−glucuronidase)(GUS)が挙げられる。
【0139】
本発明のいくつかのアッセイ方法では、一種類以上のエストロゲン様化合物、SERMなどとの比較によって、抽出物をさらに特徴づけることが有用である。このようなアッセイ方法は本質的には前記のように実行され、この方法の適切な部分では本発明の抽出物の代わりに標準エストロゲン様化合物および/またはSERMの適切な置換を行う。
【0140】
本発明に従う抽出物はまた、TNF−RE媒介経路による遺伝子発現を抑制する。いくつかの場合は、本発明の抽出物は、特にTNF−REの制御下でレポーター遺伝子(例えばルシフェラーゼ(Luc)遺伝子)を有する細胞内で、インビトロでの遺伝子発現を抑制する。いくつかの場合は、本発明の抽出物は、単球およびマクロファージによって最初に産生されるサイトカインであるTNF−αの発現を抑制する。このサイトカインは、滑膜細胞および多様な組織中のマクロファージで見られ、かつ関節リウマチ(RA)に強く関係している。TNF−αは、他の炎症性疾患でも発現され、また細菌由来のエンドトキシンに対する応答としても発現される。TNF−REリプレッサー経路経由でのTNF発現のリプレッサーとして、本発明の抽出物はTNFの上昇したレベルに関連する炎症性障害の治療に関係する。
【0141】
本発明のいくつかの実施形態では、TNF REの制御下でレポーター遺伝子と同様、ERαおよびERβの一方、または両方を発現する細胞株を調製する。TNF REは一般的に、レポーター遺伝子の上流(5’側)であり、シグナル検出は本明細書で既に記載したとおり行われる。
【0142】
前述の細胞であるTNF REを含む細胞系はさらに、1コピー以上のER遺伝子、すなわちERα、ERβ、またはその両方を含む。前記方法に用いられるER+細胞株は、自然にERを発現する細胞株、例えばヒト由来ER+乳癌細胞株であってもよい。いくつかの実施形態では、ER+組織は、不死化ヒト細胞株、例えば、不死化骨髄細胞株、または乳房細胞株である。例示的な細胞株としては、ヒト単球、骨芽細胞、悪性乳癌、および不死化乳房上皮細胞株が挙げられる。言及することができる特定の細胞株としては、U937、U2OS、MDA−MB−435およびMCF−7細胞株が挙げられる。不死化細胞株を含む他のER+細胞株もまた用いてもよい。あるいは、ER+細胞株は、ER発現ベクターによって形質転換された細菌細胞株のような、自然にはERを発現しない細胞株であってもよい。
【0143】
予め決定した量のルシフェリン存在下で、かつエストロゲン様化合物、例えば、E2または本発明の抽出物の非存在下で、この細胞系は、「コントロール強度」または「ベースライン強度」と呼ばれる強度で、黄色の光(560nm)を放射する。560nmの光の放射は、光学密度ユニット(O.D.560nm)で簡便に定量化できる。エストロゲン様化合物、例えばE2または本発明の抽出物の一つの添加に際して、560nmの光放射の強度はコントロールに比べて減弱する。意外にも、タモキシフェンまたはラロキシフェンなどのSERMの存在下で、ルシフェラーゼ発現は増加し、560nmの光放射強度もまた増大する。したがって、本発明の抽出物は、エストロゲン様TNF REで制御された遺伝子発現の抑制を誘発し得る。
【0144】
TNF REを含む細胞系は、本発明に従ったアッセイ方法に使用できる。本発明のアッセイ方法では、ルシフェラーゼ活性の減弱(すなわち560nmの光放射の減少)は、エストロゲン様活性の増大と相関し、一方ルシフェラーゼ活性の活性化(すなわち560nmの光放射の増大)は、抗エストロゲン様活性と相関する。検量線は、本明細書中に記載したように既知量の本発明の抽出物を用いて作成してもよい。このような検量線は、他の公知のエストロゲン様標準、または抗エストロゲン様の標準、例えば、E2またはいくつかの他の公知のエストロゲン様化合物、および/または抗エストロゲン様SERM、例えば、タモキシフェンまたはラロキシフェンを用いてさらに補強できる。
【0145】
次いで、形質転換されたER+細胞株由来の細胞を、候補化合物に曝露して、ルシフェラーゼシグナルを観察し、そのシグナルを本明細書中に記載された事前に準備された検量線(単数または複数)と比較する。コントロール(ベースライン)に比較してルシフェラーゼ活性の増加を引き起こす化合物は、抗エストロゲン様SERMとして特徴づけられ、一方でコントロールに対してルシフェラーゼ活性の減少を引き起こす化合物は、エストロゲン様として分類されるであろう。このエストロゲン様効果、または抗エストロゲン様効果は、ルシフェラーゼ発現の減少または増加の程度を、本発明の抽出物によって引き起こされた減少と比較することにより、そしてE2、タモキシフェン、および/またはラロキシフェンによって引き起こされたそれぞれのシグナルの減少または増加に対する比較によって、定量化され得る。
【0146】
本発明は、本発明の組成物を用いるインビボでのエストロゲン様方法を提供する。通常、インビボでの方法は、被検体のエストロゲン様作用をもたらすために十分な量の本発明の抽出物をこの被検体へ投与することを包含する。インビボでの方法は、エストロゲン様のEREの制御下での遺伝子の活性化、TNF−REの制御下での遺伝子の抑制(例えばTNF−α抑制)、またはその両方を生じるであろう。従って、このインビボでの方法は、インビボで様々な正の表現型効果を生じるであろう。
【0147】
被検体は、マウス、ラット、ウサギ、サル、チンパンジー、イヌ、ネコ、またはヒツジのような哺乳動物であってもよく、一般的には雌性である。被検体はまた、ヒト、特にヒトの女性であってもよい。いくつかの実施形態では、被検体は、閉経後、または卵巣全摘出後の、エストロゲン治療が必要な女性である。このような場合、被検体は、ほてり、不眠症、膣の乾燥、性欲減退、尿失禁、および抑うつなどの更年期症状に罹患している場合がある。他の場合、被検体は、骨粗鬆症に感受性であるか、または罹患している場合がある。適切なインビボの方法としては、エストロゲン補充療法に応答性の医学的症例の治療および/または予防が挙げられる。
【0148】
組成物での治療
キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを含む本発明による薬学的組成物の投与は、1つ以上の抽出物がその経路を介して標的組織に利用できる限り、一般的に使用される投与経路を介して行われるであろう。言及することができるいくつかの投与経路としては、以下が挙げられる。経口、経鼻、口腔内、直腸、膣および/または局所的(経皮)。あるいは、投与は正所性、皮内、皮下、筋肉内、腹腔内、または静脈内注射によってもよい。このような組成物は、上記に記載された、薬剤として許容可能な組成物として、通常は投与される。
【0149】
疾患、障害、症候群、状態、または症状の治療(treatment)(およびその文法的な変形として、例えば治療する、治療すること、治療された、など)は、臨床医が、このような治療を受ける被検体を特定して、その被検体へ本発明の組成物を投与するという工程を包含する。従って、治療とは被検体へ本発明の抽出物を投与することによって寛解、苦痛緩和、そうでなければ改善される可能性が高い疾患、症候群、状態または症状の診断を包含する。治療とはさらに、このような疾患、障害、症候群、状態または症状を寛解、苦痛緩和、そうでなければ改善するために適切なある量のキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を患者に投与することを包含する。治療とはまた、この疾患、障害、症候群、状態、または症状の同時の寛解、苦痛緩和、そうでなければ改善も包含する。いくつかの実施形態では、治療とは、疾患、障害、症候群、状態または症状の発現の予防または遅延(すなわち予防法)、疾患、障害、症候群、状態、または症状の進行の予防または遅延、ならびに/あるいは疾患、障害、症候群、状態、または症状の重症度の低減を意味する。更年期症状の場合には、治療には、膣および/または外陰部の委縮を含めて、種々の症状の苦痛緩和を包含する。
【0150】
骨粗鬆症治療には、骨量減少のリスクがある閉経後女性などのヒトの特定、および本発明の植物抽出物をこの女性に投与して、それにより骨量減少の重症度を低減、発現を遅延、または予防することが挙げられる。いくつかの実施形態では、骨粗鬆症の治療とは骨量の増大を包含し得る。
【0151】
疾患、障害、症候群、状態、または症状の予防(prevention)(およびその文法的な変形)としては、疾患、障害、症候群、状態、または症状を発生するリスクがある被検体を同定すること、およびその被検体に対してこのような疾患、障害、症候群、状態、または症状の発現を除去または遅延すると考えられるのに十分な量の本発明の抽出物を投与することが包含される。いくつかの場合は、予防としては、適格な標準の医療を適用して、ホルモン補充療法の必要性があると臨床医が考える閉経後の女性を特定すること、および本発明の抽出物をその女性に投与して、それによって1つ以上の更年期症状がブロックされるかまたは遅延されることを包含する。いくつかの実施形態では、骨粗鬆症の予防には、適格な標準の医療を適用して、骨粗鬆症発症のリスクがあると臨床医が考える閉経後の女性を特定すること、および本発明の植物抽出物をその女性に投与し、それによって骨量減少の開始がブロックされるかまたは遅延されることを包含する。
【0152】
苦痛緩和としては、疾患、障害、症候群、状態または症状の重症度、および数および/または発生頻度の低減が包含される。更年期症状の苦痛緩和としては、ほてり、不眠症、尿失禁、抑うつなどの頻度および/または重症度を低減させることが挙げられる。
【0153】
キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の1日量
更年期症状、例えば膣および/または外陰部の委縮の治療のための本発明に従う組成物(キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を含む)の一日量は、患者の年齢、体重、健康状態および他の性質に依存して変化するであろう。一般に、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を含む組成物の一日量は、1日あたり約0.001〜約100gという抽出物の乾燥重量であろう。いくつかの実施形態では、この用量は、1日あたり約1〜約100gの乾燥重量、1日あたり約1〜約50gの乾燥重量、1日あたり約10〜約50gの乾燥重量、1日あたり約20〜約50gの乾燥重量、1日あたり約10gの乾燥重量、1日あたり約20gの乾燥重量、1日あたり約30gの乾燥重量、1日あたり約40gの乾燥重量、1日あたり約50gの乾燥重量、1日あたり約40〜約100gの乾燥重量、1日あたり約50gの乾燥重量、1日あたり約60gの乾燥重量、1日あたり約70gの乾燥重量、1日あたり約80gの乾燥重量、1日あたり約90gの乾燥重量、または1日あたり約100gの乾燥重量であろう。1日あたり100gを超える乾燥重量の用量、例えば、1日あたり約100〜約250gの乾燥重量も本発明のいくつかの実施形態では考えられる。しかし適切な応答は、1日あたり約20〜約80、特に約30〜約70グラムの乾燥重量の範囲の用量で得られるであろう。
【0154】
一日量は、単回単位で投与されてもよいし、または1日に2、3、4回以上投与される剤形を含む分割された一日量で投与されてもよい。現行の好ましい投薬計画は、1日1回(q.d.)または1日2回(b.i.d.)投与であって、例えば、初回の投与は朝食の前、同時または後に投与され、任意の第2の用量は、昼下がりから就寝時に、例えば、夕食時に投与される。いくつかの実施形態では、1日量は、1つ以上香味料、味覚マスキング剤および/または甘味料を必要に応じて含む、お茶として1日1回(q.d.)または1日2回(b.i.d.)のいずれかで摂取される。
【0155】
一日量は、他の形態で、特に経口投与に適切な他の物理的形態で投与されてもよい。いくつかの実施形態では、このような他の物理的形態としてはカプセルが挙げられる。本発明による組成物を投与するために適切な他の経口剤形としては錠剤(これは必要に応じて、1つ以上の賦形剤、例えば、結合剤、崩壊剤、希釈剤、流動促進剤またはそれらの2つ以上の組み合わせを含む)、カプセル(これは、錠剤とは異なる形状であるがそれ以外は組成は同じであることが理解される)、チュアブル錠、溶液または懸濁液用の散剤などが挙げられる。チュアブル錠および溶液または懸濁液用の散剤は、1つ以上の賦形剤、例えば、香味料、味覚マスキング剤、甘味料および/またはそれらの2つ以上の組み合わせを含んでもよい。
【実施例】
【0156】
本発明は、以下の図解および非限定的な実施例を参照することで、さらに完全に理解され得る。
【実施例1】
【0157】
ERβは、ERE−tk−Lucの活性化においてERαよりも弱い:E2の転写活性化に対する効果は、ルシフェラーゼレポーターcDNAに連結された最小チミジンキナーゼ(tk)プロモーターの上流の古典的なEREを含むプラスミド、およびERαまたはERβの発現ベクターをトランスフェクトすることによって検査された。E2は、ヒト単球U937細胞において、ERα存在下ではERβ存在下に比べてEREの活性化を10倍高くしたが、EC50値は同程度であった。
【実施例2】
【0158】
ERβは、TNF−RE−tk−Lucの抑制においてERαよりも効果的である:E2のERαおよびERβ媒介性転写抑制に対する効果を、腫瘍壊死因子応答要素(tumor necrosis factor−response element)(TNF−RE)として公知の、TNF−αプロモーター中の−125から−82の領域を用いて比較した。TNF−αは、tkプロモーターの上流のTNF−RE(−125〜−82)(TNF−RE−tk−Luc)の3コピーを5〜10倍活性化した。E2は、ERαおよびERβの存在下で、TNF−RE−tk−LucのTNF−α活性を60〜80%抑制した。しかしながら、ERβはERαに比べて、抑制におよそ20倍効果的であった(それぞれのIC50は、ERαで241pMであったのに対して、ERβで15pM)。天然の−1044〜+93のTNF−αプロモーターの抑制に、ERβはERαに比べてより効果的であることが見いだされた。従って、ERαはERβよりも転写活性にかなり効果的であり、一方でERβはERαよりも転写抑制に効果的である。E2と対照的に、抗エストロゲン剤であるタモキシフェン、ラロキシフェンおよびICI 182,780は、TNF−RE−tk−Lucを2倍活性化した。さらに、これらの抗エストロゲン剤はE2によって誘発された抑制を無効にした。
【実施例3】
【0159】
ERβは、ERE−tk−LucのERα媒介性転写活性化を阻害する:驚くべきことに、ERαまたはERβがU937細胞において同時発現された場合、ERαによる活性化が著しく阻害された。これらのデータは、ERβがERαによるERE−tk−Lucの活性化に対して抑制的効果を発揮することを示す。同様の結果が乳癌細胞株、MDA−MB−435で観察された。他の研究者は異なる細胞型で、ERβのERαのトランス活性化に対する同様の抑制効果を見いだしている。これらの研究は、ERαおよびERβのERE−tk−Lucに対する異なる活性化、ならびにERα媒介性転写に対するERβの抑制効果が細胞型特異的ではなく、ERの内因的の特質による結果であることを示す。二量体形成を防ぐERβのヘリックス11の変異がその抑制活性を阻害するので、ERβによるERαの抑制には、ERα/ERβヘテロ二量体の形成を必要とする。
【実施例4】
【0160】
VG101という薬物は3つの異なる植物種のエタノール水性抽出物の酢酸エチル部分の淡褐色から黄色の油状物である。VG101は種々の成分を含み、その3つはERβ選択的アンタゴニストであることが確認された。
【0161】
ニアソール、カリコシンおよび四環系イソフラボン(TCIF)はVG101中の既知の活性成分である。ニアソールはハナスゲ(ユリ科)の根茎から単離される;カリコシンは、キバナオウギおよびナイモウオウギ総称してオウギ,(マメ科)の根から単離される;そしてTCIFはイノコズチ(ヒユ科)の根から単離される。
【表1】

1.草木の名称は、国際植物命名規約(東京規約,1994)に従って記載する。
2.伝統的な中医学では指定された中国名は常に1つの特異的な植物種を指定するものではない。従って特定の種を定義することが重要である。
【0162】
VG101は、鍵の掛けられた冷暗所で保管しなければならない。
【実施例5】
【0163】
10日間0.5mg/日の用量で卵巣摘出マウスに対して膣内投与された場合、VG101は、正常な成熟の非角質化扁平上皮およびグリコーゲン豊富な空胞化細胞を上皮の上半分で生じた。最小の表在性の慢性炎症があったが、エストロゲン治療は、肥厚性の顆粒層を伴っている無核の角質化扁平細胞の表層によって特徴付けられる角化亢進を伴う扁平上皮を生じた。
【0164】
マウスモデルでは、コントロールと比較した場合、VG101は、分泌腺があり脱落膜化間質が弱い、さらに正常な黄体期子宮内膜を生じた。VG101投与は、子宮内膜腺の増殖を伴わないが、エストロゲン治療は、子宮内膜症(インサイチュの癌腫に気がかりな、女性での複雑な異型過形成と等価)を生じた。この腺は介在する間質なしに背中合わせに形成する。それらはまた、核小体を有する顕著な異型核という多数の有糸分裂像を示した。1つの領域では、この腺は広い茎および厚い線維性コアを有するポリプに見えるものを生じる。
【実施例6】
【0165】
VG101中の草木抽出物および活性な化合物がエストロゲン様活性を有するか否かを決定するために、最小チミジンキナーゼ(tk)プロモーター(ERE−tk−Luc)の上流のエストロゲン応答要素(ERE)の調節に対する効果を検査した。U2OS骨肉腫細胞をERE−tk−LucおよびヒトERαまたはERβの発現ベクターを用いて同時トランスフェクトした。VG101中の抽出物およびそれらの活性な化学的成分は、ERβではERE−tk−Lucの用量依存性活性化を生じたがERαでは生じなかった(図1A〜図1C)。VG101中の1〜125μg/mlの範囲におよぶ量の草木抽出物およびそれらの活性な成分の量は、10nMのエストラジオール(E2)に等しい活性を生じた(図1A〜図1C)。
【実施例7】
【0166】
ERアンタゴニストであるICI 182,780、ラロキシフェン(Ral)およびタモキシフェン(Tam)は、VG101中の草木抽出物およびそれらの活性な成分による活性化をブロックし(図2A〜図2D)、このことはVG101の効果がERβを通じて媒介されることを示している。
【実施例8】
【0167】
エストロゲンは、炎症性遺伝子の発現を抑制することによる抗炎症特性を保有する。TNFα遺伝子の抑制は、重要な機構であり得、ここでエストロゲンは炎症性状態を妨げる。VG101中の草木抽出物およびそれらの活性な化学的成分がTNFα遺伝子の発現を抑制するか否かを検討するため、テトラサイクリン誘導性のERαまたはERβ細胞をE2またはVG101中の草木抽出物およびそれらの活性な化学的成分で処置した。これらの遺伝子の基本的な発現は極めて低いので、抑制を観察するためにはこれらの遺伝子を、TNFαを用いて活性化することが必要である。TNFαはTNFαのmRNAの大きな増大を生じ(図3A〜3B)、これは、U2OS−ERα(図3A)およびU2OS−ERβ(図3B)の両方でエストラジオール(E2)によって阻害された。VG101中の草木抽出物およびそれらの活性な化学的成分は、U2OS−ER β細胞中でTNFα遺伝子のTNFα活性化を抑制したが(図3C〜3E)、しかしU2OS−ERα細胞中では抑制しなかった(図3C〜3E)。これらの研究によって、VG101中の草木抽出物およびそれらの活性な化学的成分がERβ−媒介性の転写経路を選択的に誘発することが示される。
【実施例9】
【0168】
閉経期症状についての別のエストロゲンの重要な特徴は、それが乳癌および子宮癌のリスクを増大しないということである。VG101中の草木抽出物およびそれらの活性な化学的成分がERαのみを発現するかまたはERαもERβも発現しない乳癌細胞で増殖促進特性を有するか否かを決定した。
【0169】
増殖効果はERαによって媒介され、ERβはERαの増殖効果を排する腫瘍抑制因子として作用する。これらの結果に基づいて、VG101中の草本抽出物およびそれらの活性な成分は、ERαのみを発現してERを発現しない乳癌細胞では増殖を促進しないはずである。なぜならVG101は乳癌細胞でERαもまたは他の増殖促進経路も活性化しないからである。E2とは異なり、VG101中の草本抽出物およびそれらの活性な化学的成分は、BT474細胞またはMDA−MB−468などのERを発現しない細胞の細胞増殖を刺激しなかった(図4A〜図4C)。
【実施例10】
【0170】
エストロゲン様疾患状態の治療について治験薬の有効性を示すために、以下の二重盲検を行う。
【0171】
本研究は、閉経期膣症状の治療のための経口VG101の最適用量を評価する、プロスペクティブ無作為プラセボコントロール盲検の用量漸増臨床試験において10例の健常な閉経後女性の4つのコホート(全部でN=40)を含む。10例の参加者が登録されて、最低用量のVG101に対してまたはプラセボに対して4:1の比で無作為化され、最大12週間まで治療される。治験の来診は4週、8週、および12週で行う。
【0172】
コホートが4週の治療を終了した後、独立したデータ安全性評価委員会(Data and Safety Monitoring Board)(DSMB)が、参加者のデータを検査して所定の安全性および停止の規則に従ってVG101の毒性を評価する。許容できない毒性がみられない場合、主要評価項目である最適用量に達するまで、または全ての4つのコホートが12週間の治療を完了するまで、さらに10例の女性で第二のさらに高用量などで治験を開始する。
【0173】
主要評価項目の指標は米国国立癌研究所(National Cancer Institute)(NCI)の有害事象共通毒性基準(Common Toxicity Criteria for Adverse Events)(CTCAE)バージョン3に基づいて規定された許容できない毒性である。許容できない毒性とは、DSMBによって決定される場合、治験薬に対して、あるいは治験薬に対して可能性として、おそらく、または明確に関連する任意の他の許容できない毒性に対して可能性として、おそらくまたは明確に関連するグレード3、4または5の毒性(NCI CTCAEバージョン3)の出現として定義される。
【0174】
任意の有害事象が各々の来診で記録される。副次的評価項目として、VG101の有効性が膣症状(自己報告Likertスケールを用いる)、クオリティ・オブ・ライフ(3つの確証された自己報告のアンケートを用いる)、理学的検査所見(臨床家の報告するLikertスケールを用いる)、膣液pH、乳酸菌の存在および傍基底膣上皮細胞の割合における、ベースラインから12週間の治療への変化によって測定される。治験薬に対する遵守は、各々の来診でアプリケーターカウントおよび投薬日誌によって決定される。
【0175】
治験集団および参加者の適格性
参加者は、経口の伝統的な中国の草木抽出物、特にVG101を用いる意思がある中度〜重度の閉経期膣症状を有する45〜65歳の約40例の閉経後女性である。
【0176】
参加基準:
・45〜65歳の女性
・以下によって証明される閉経後:a)少なくとも1年間無月経;b)40IU/mlを超える血清FSHをともなう6〜12カ月の無月経;c)子宮摘出術の有無の両側卵巣摘出術後6週間、またはd)40IU/mlを超える血清FSHをともなう子宮摘出術
・以下のリストからの外陰部または膣の委縮の少なくとも1つの中度〜重度の症状を自己報告する:
○膣乾燥(なし、軽度、中度または重度)
○膣および/または外陰部の不快感(なし、軽度、中度または重度)
○膣および/または外陰部の刺激(なし、軽度、中度または重度)
○膣のそう痒(なし、軽度、中度または重度)
○性的活動に関連する膣の疼痛(なし、軽度、中度または重度)
○膣細胞学的スメアで表面細胞が5%以下
○膣pHが5.0を超える。
・膣の症状の治療のために経口の伝統的な中国の漢方薬を使用する意思がある。
・保健医療の提供者から現在医学的ケアを受けている。
・インフォームドコンセントを提供する。
【0177】
除外基準
・乳癌、子宮癌もしくは卵巣癌、または黒色腫の既往歴。
・ここ9カ月内に癌が疑われる異常な乳房X線撮影または乳房の検査。
・ここ9カ月内に癌が疑われる異常なパップスメア(子宮頸部細胞診)または骨盤の検査。
・参加前6カ月内の任意の子宮または膣の出血(パップスメアのスクリーニング後は除く)。
・経膣超音波で測定した5mmを超える二重壁子宮内膜の厚さ。
・妊娠または授乳。
・スクリーニングの30日内の任意の膣保湿剤(Replens,KY Silk−E、Astroglide Silken Secret,Senselle)の使用。
・スクリーニングの30日内の任意の経口、経皮、膣または全身のエストロゲンまたはエストロゲン/プロゲスチン産物の使用。
・経口もしくは経皮の薬物については登録の3カ月内、またはインプラントもしくは注入の薬物については登録の6カ月内の、ほてりの治療のためにおそらく有効であることが公知の処方薬の使用。
・スクリーニングの12カ月内のラロキシフェン、タモキシフェンまたはアロマターゼインヒビターの使用。
・現在の尿路感染(白血球エステラーゼ(estrace)、亜硝酸塩、または血液が陽性のディップスティック尿検査)。
・活動期の虚血性心血管系疾患の臨床的な証拠または心血管系疾患の既往歴。
・抗凝血薬を要する深部静脈血栓または肺塞栓の既往歴。
・発作の既往歴。
・活動期の肝臓または胆嚢の疾患。
・重度の医薬アレルギーの既往歴。
・スクリーニングの12週内の別の治験薬の使用。
・治験医の見解で、アンケートまたは評価の完了、プロトコールの遵守またはトライアルの完了から参加者を除外する、任意の病状または精神状態であって、例としては、英語の読み書きが限定されていること、重病、引越しの予定、薬物乱用、重大な精神医学的問題、または認知症。
・電話方法がない。
【0178】
インフォームドコンセントおよび証拠資料
治験に参加する前に、全ての治験手順、時間要件、リスクおよび可能性のある利点を、情報をインフォームドコンセントの形式で用いて、各々の可能性のある治験参加者に説明する。可能性のある治験参加者は、インフォームドコンセントの書類を読み、質問に回答するのに十分な時間を与えられる。治験に参加するように選ばれた適格な参加者は、治験の治療を開始する前にIRBの承認した同意書にサインする。各々の参加者は、サインした書類のコピーを渡され、その原本は治験記録の一部となる。全ての治験の特別なデータは極秘であって、臨床施設で鍵をかけたファイルに保管される。
【0179】
治験デザイン
経口のVG101はゲルカプセルにパックされた3つの草本化合物の組み合わせからなる。経口のVG101は12週間にわたって1日2回自己投与される。この処方物は3つの中国の草本であるハナスゲ(発音:ジー・ムー(Zhi Mu))、キバナオウギ(Astragalus membranaceus Fisch.Bge.Var.mongholicus Bge.)(発音:ホアン・チー(Huang Qi))およびイノコズチ(発音:ホワイ・ニウ・シイ(Huai Niu Xi))に由来し、この治験の開始前にFDAの承認した治験薬(Investigational New Drug)(IND)の認可を受ける。
【0180】
原材料の標準化は、伝統的な漢方薬の専門家により正確な植物種の同定によって管理される。二次的な薬学的アセスメントは、FDAのINDの仕様に従って3つの草本の各々を抽出することを包含する。全ての植物剤は、Applied Biosystems API5000を用いて薄層クロマトグラフィー、活性成分のLC/MS/MS分析定量を介して分類標識に対して特定される。植物抽出物のバンドを特定する分類標識を、溶出液として酢酸エチルを用いて、シリカゲル上におき、その草木抽出物が90%を超える正確性で純粋な化合物に適合することを保証する。抽出物のLC/MSフィンガープリントがバッチ間で適合すれば抽出物の成分が一致することが保証される。
【0181】
VG101は純粋な化合物およびFDAの適正製造基準(Good Manufacturing Procedures)を用いて上記の成分で調製される。治験薬は、プラスチックのボトルにパッケージングされて、FDAのガイドラインに従って表示される。
【0182】
対応するプラセボは不活性成分で作製して、活性な薬物と色を合わせる。
【0183】
薬物の投与および投薬スケジュール
治験薬は、経口的に、1日2回、12週間投与される。参加者は、無作為の来診の夜に開始して全体で12週間の治験中、朝にゲルカプセルを1つ、夜に1つを摂取するように指示される。
【0184】
最初の10例の適格な参加者を無作為化し(4:1の無作為比)、25mgのPO BIDというVG101または同一のプラセボの出発用量で経口のVG101を投与する。募集および無作為化を続け、10例の適格な参加者の第二のコホートは125mgのPO BIDという用量に割り当て、第三のコホートは250mgのPO BIDに、そして最後のコホートは500mgのPO BIDに割り当てた。全ての参加者は、許容できない毒性が観察されない限り、割り当てられた用量を12週間継続するように求められる。
【表2】

【0185】
許容できない毒性および最適用量
許容できない毒性とは、治験薬に可能性として、おそらく、または明確に関連する、治験薬に可能性として、おそらく、または明確に関連する、NCI有害事象共通毒性基準(CTCAE)バージョン3を用いてグレード、3、4または5の出現として定義されるか、あるいは、治験薬に可能性として、おそらく、または明確に関連する、データ安全性評価委員会(Data and Safety Monitoring Board)によって特定される任意の他の許容できない毒性である。
【0186】
用量レベルは、以下の場合に終了される:1)12週間の治療の間任意の時点で任意のコホートで能動的な治療に割り当てられた8例の女性のうち1例以上において許容できない毒性が観察される場合。用量レベルが終了される場合、次の最低用量が最適用量に指定される。治療の12週間の間どのコホートでも許容できない毒性が観察されない場合、VG101の最高用量500mgのPO BIDが最適用量に指定される。
【0187】
有害事象
有害事象は、全身の臓器系で分類され、NCI−CTCAE、バージョン3による重症度(1〜5)に類別される。有害事象は各々の各々の来診で確認され、臨床現場の治験医によって報告される。その事象、期間、有害事象が重篤であるか否か、その事象の性質(単独のエピソード対複数のエピソード)、強度、治験薬に対する関係、みられた作用、臨床成績およびその有害事象が手術または別の手順で生じたか否かの説明を含む詳細な情報が各々の有害事象について収集される。
【0188】
NCI−CTCAEによる分類に加えて、有害事象はMedDRAソフトウェアを用いて好ましい用語および体組織に分類される。有害事象はまた、重症度、治験薬に対する関係およびその有害事象が治験薬の中断を生じたか否かによっても分類される。グレードIII以上に悪化するベースラインの実験室または医学的な状態は、それらがVG101療法に可能性として、おそらくまたは明確に関連すると記されるのでない限り、用量規定毒性とはならない。
【0189】
来診のスケジュール
最初のスクリーニング評価(電話)
治験の広告および通知に回答した女性は、その治験の全般的な概要を与えられ、もし興味がある場合は、簡単な電話調査を完了して最初の適格性(年齢、閉経状況、医薬の使用、膣乾燥の症状、最終の乳房X線撮影の日、および無作為トライアルに参加する意思)を確認される。的確な回答者は、適格性を確認するためにスクリーニング来診への参加を要請される。参加者は、来診に際して処方薬および市販薬を含めて全ての医薬を申告するように求められる。
【0190】
スクリーニングの来診
参加者は、診療所に来る前少なくとも12時間、性交しないように、膣洗浄も膣潤滑剤の使用などもしないように求められる。彼らは、任意の通常の薬物は摂取してもよい。スクリーニングの来診(単数または複数)では、女性は、治験の詳細および要件について情報を与えられ、インフォームドコンセントを与えられる。安全性および薬物動態の研究のために血液を採血して、尿を採取する。参加者は参加基準および除外基準、固体群統計学、簡易な病歴、手術歴、婦人科病歴および月経履歴、ならびに膣および外陰部の委縮の症状をカバーするアンケートの全項目に記入する。現在の薬物療法を再調査される。
【0191】
血圧、身長、体重、乳房および骨盤の試験を含めて簡易な理学的検査を完了する。膣の委縮は、膣の委縮および炎症を評価する膣健康スケール(Vaginal Health scale)を用いて評価される。子宮頸部および膣の細胞学的診断のための中央側方膣壁のパップスメア(Pap smear)および細胞サンプリングを行って、膣上皮細胞成熟および膣エストロゲン受容体の存在を確認する。膣のpHを測定して膣液の少量のサンプルを細菌分析のために得る。骨盤臓器脱の定量化(POP−Q)を行う。治験のスタッフはここ9カ月内に行った任意の乳房X線撮影の結果を入手するための同意を求める。参加者が9カ月内に乳房X線撮影をしていない場合、その参加者は無作為化の前に1回予定するものとする。経膣超音波スクリーニングを計画して、その結果を無作為化の前に再検討する。参加者は、スクリーニングの出血日報(Screening Daily Bleeding Diary)を与えられ、それを埋めるように指示される。参加者は次の来診まで完全な日報にするように要求される。
【0192】
無作為化来診
無作為化来診の前に臨床現場の治験医は全ての測定の結果を再検討する。パップスメアの性能によるものでなく出血日報で文書化された任意の出血によって、参加者は不適格になる。参加者は、彼らが全ての参加基準および除外基準を満たす場合に、適格であるとみなされる。適格な参加者は、治験薬の投与および可能性のある副作用について述べた口頭および書面の指示を受ける。参加者は、女性性機能指数Female Sexual Function Index)、閉経期特異的クオリティ・オブ・ライフ(Menopause Specific Quality of Life),SF36、および骨盤底影響アンケート(Pelvic Floor Impact questionnaires)および骨盤底苦痛一覧(Pelvic Floor Distress Inventory)の全項目に記入する。無作為の数を連続して割り当て、治験薬の供給を4週与える。参加者は、出血日報(Daily Bleeding Diary)を与えられ、次の来診までに全項目を記入した日報を戻すように求められる。
【0193】
トライアルに登録する全ての女性は、治験担当者への連絡方法の情報が与えられる。4週の来診で予約をする。
【0194】
2週および8週の来診(電話の往診)
治療の2週および8週で、コーディネーターは、薬物療法コンプライアンス、有害効果、併用薬、治験薬日報(Daily Study Medication Diary)および「出血日報」を再検討するように、そして任意の質問に回答するように治験参加者に伝える。これらの来診は、電話往診として予定される。しかし、参加者の要望で、これらの来診はまた、人が行う場合もある。
【0195】
4週の来診
治療の4週後、参加者は、任意の未使用の治験薬、および「治験薬日報」および「出血日報」を持参して診療所に戻る。治験コーディネーターは、未使用の治験薬をカウントして薬物コンプライアンスを推定する。治験コーディネーターは以下を再検討する。有害事象および新規の併用薬が記録される、および「治験薬日報」および「出血日報」。参加者は、ベースラインで行ったのと同じクオリティ・オブ・ライフのアンケートの全ての項目を記入する。さらに8週の治験薬が与えられる。
【0196】
12週の最終来診または治験の終了
最終の来診は、12週の治療後、または参加者がトライアルの参加の中止を決めた任意の時点で行う。最終の来診では、参加者は、「治験薬日報」および「出血日報」を持参する。安全性研究のために血液を採取して、尿を収集する。スクリーニングの時点で完了した全てのアンケート、理学検査、実験室の分析および膣の研究を、治験の完了時に繰り返す。2回目の経膣超音波を行って、二重壁子宮内膜厚みが5mmを超えるか、またはスクリーニングの時点から子宮内膜壁厚が2mmを超えて増大している治験参加者は子宮内膜の吸引生検を行う。全ての未使用の治験薬をこの時点で集める。
【0197】
16週の治験後の追跡電話往診または治験終了4週後
【0198】
参加者がトライアルの参加を中止した後16週または4週で追跡の電話往診を行う。参加者は、最後の来診以降の新しい有害効果を確認するため、および任意の進行中の有害効果を再検討するために治験コーディネーターから接触される。
【0199】
服薬不遵守、治験薬中断および治験初期の中断
全ての参加者は、安全性が懸念されない限り、全ての用量の治験薬を指示どおり使用するように促される。治験コーディネーターは、治験薬を遵守しない理由を確認し、参加者が遵守を改善する方法を見つける手助けに努める。治験薬を遵守していない参加者は全ての治験の来診に参加するように、かつ全ての治験の測定を計画どおり完了するように促される。治験薬での遵守は、各々の来診でアプリケーターカウントで測定され、治験薬カレンダー(Study Medication Calendar)でチェックされる。
【0200】
治験参加者が膣出血を報告した場合、その参加者は治験薬を継続されてもよいが、4週内に出血の評価を受けなければならない。もし評価が4週内に行われなければ、その参加者は、その評価が完了するまで治験薬を停止しなければならない。
【0201】
治験薬は、以下を有するいずれの参加者でも中断される。1)子宮内膜生検で子宮内膜過形成または癌、2)子宮癌または卵巣癌が疑われる異常な骨盤の検査、3)癌が疑われる乳房の検査または乳房X線撮影、4)深部静脈血栓、5)認知症の診断、ならびに6)臨床の治験医の判定でVGF101での治療に可能性として、おそらくまたは明確に関連する任意の重篤な有害事象。治験薬は、臨床現場の治験医の意見で、異常な症状、理学的所見または試験が十分に評価されて、良性であると判明した場合には再開されてもよい。
【0202】
参加者は、4週間もしくはそれ以上の間治験薬を摂取していないと報告した場合、またはもはやこのトライアルへの参加を望んでいないと告げた場合、永続的に治験を中止したとみなされる。この場合、治験完了の測定は可能であれば得られる。
【0203】
全ての参加者は全ての治験来診に出席するように、かつ全ての治験の測定を計画どおり完了するように促される。しかし、参加者は任意の時点でその治験の参加を中断してもよい。来診を怠った患者には、来診を再計画するため、およびその来診を完了することを手助けするように治験コーディネーターが連絡する。
【0204】
登録後、参加者は、72時間内にプロトコール治療を開始しなければならない。治療の遅延を生じる問題は、治験統括医と議論しなければならない。参加者が登録後のプロトコール治療を開始しない場合、参加者の治験登録は取り消されてもよい。
【0205】
予期せぬ利点または害のための治験の早期の終了は、データ安全性評価委員会(Data and Safety Monitor)からバイオノボ(Bionovo)および運営委員会(Steering Committee)に対して勧告される場合がある。
【0206】
成績の測定
一次膣委縮測定
ベースラインから12週の自己報告された最も困難な症状の変化、および膣委縮の症状における変化。膣委縮の症状は、ベースライン、4週、および12週または治験の終わりに、自己投与のアンケートによって評価される。アンケートは、膣乾燥、膣刺激、膣そう痒、性活動での膣疼痛、性活動での膣出血、排尿の際の疼痛または不快感(排尿障害)および頻尿(排尿頻度)を評価する7つの項目からなる。参加者は先月に症状があったか否か(ハイ=1、イイエ=0)、もしあれば、その症状がどの程度であったかを質問され、回答の選択肢としては、「全くない」(0)、「ごくわずか」(1)、「中度」(2)、「かなり」(3)、または「極度に」(4)が挙げられる。ベースラインでは、参加者は、膣委縮の最も困難な症状を特定する。膣乾燥の最も困難な症状についてのベースラインのスコア(1〜4の範囲)を12週での同じ症状についてのスコアと比較する。さらに、ベースラインでの膣乾燥の症状の複合スコア(範囲=0〜35)を12週と比較する。
【0207】
ベースラインから12週の表在性膣上皮細胞における変化のパーセント。Diagnostic Cytology Laboratories,Inc.は、膣上皮細胞の顕微鏡評価による膣粘膜の扁平上皮の成熟に関連するデータを提供する。異なる細胞タイプが優勢であることに基づいて膣成熟の3つの基本的パターン(未熟、中間および成熟)が識別され得る。
【表3】

【0208】
サンプルは、膣検査の間、ホルモン変化に最も感受性の上皮である、膣の側壁の中間から上部1/3から採取する。ホルモン評価のための満足な標本は、炎症、細菌または他の砕片がなく、実験指示に従って装着および固定されている。満足な標本のうち、200個の単一の細胞をカウントして、傍基底、中間および表在性の細胞の相対的な割合を注記する。無効とみなされるサンプル(例えば、炎症の細胞を含むサンプル)は、監督の細胞検査技師によるさらなる説明のために提出され、これらの事例は病理学者が再検査する必要がある場合もある。
【0209】
200個の扁平細胞をカウントした後、エストロゲン性のおおまかな評価である成熟値(Maturation Value)の数値を、各々の細胞型に対してポイント値(傍基底=0.0、中間=0.5および表在性=1.0)を割り当てること、および各々の細胞タイプカウントとそのポイント値を掛けることによって作製する。この結果は、低エストロゲン性(0〜49)、中エストロゲン性(50〜64)および高エストロゲン性(65〜100)として表される。さらに12週の表在性細胞の割合をベースラインでの表在性細胞の割合と比較する。
【0210】
ベースラインから12週への膣分泌のpHにおける変化。膣分泌物のpHは、ベースラインで記録して、治験の終わりの膣pHと比較する。コットン・チップのアプリケーターを用いて中央−側面の膣壁から膣液のサンプルを採取して、次にアプリケーターの先端を、2.5〜7.0の範囲のpHの0.3単位間の相違を識別できるpH指示ストリップに押し付ける。以前の研究では、pH指示ストリップで、pHマイクロ電極に比べて膣pHの正確な測定値が得られることが示唆されている。
【0211】
理学的検査に対する膣委縮の身体的徴候の変化。膣壁の医師による評価は、弾性、シワの多さ、湿度、点状出血および脆弱性の評価を含む。これらの範疇の各々における異常所見は、なし=0、中度=1または重度=2と格付けされる。理学検査スケールの複合スコアは0〜10におよぶ。1つ以上の範疇が変化する参加者の割合をベースラインから12週で比較する。また、ベースラインの複合スコアを治験終了時の複合スコアと比較する。さらに、理学検査のデータを用いて、点状出血の有無、膣壁の脆弱性、円錐切除術およびひだを注記し、0〜4というスコアに割り当て、ここで最高のスコアがさらに重度の委縮を示す、以前に確証された理学検査手段である改変グリーンデール(Greendale)膣委縮スコアを算出する。
【0212】
膣微生物叢の変化。側方膣壁由来の膣液標本を、グラム染色スメアのニュージェント(Nugent)スコアリングおよびLactobacilli,E.coliおよびE.coli以外のグラム陰性桿菌の定量培養を含み得る微生物検査のために、輸送媒体に送る。存在する微生物のタイプおよび量におけるベースラインから12週の変化を決定する。
【0213】
二次測定およびクオリティ・オブ・ライフの測定:
女性の性機能を評価する19項目の自己報告のアンケートである女性性機能指数(Female Sexual Function Index)(FSFI)を確証する。この指数は、臨床試験における使用のために設計されており、地域基盤集団および照会集団の両方で良好な試験−再試験の信頼性および内部整合性を有することが示されている。スコアリングのアルゴリズムは、全体的な手段についてならびに性機能の特定の分野、例えば、欲求、性的興奮、潤滑、オーガズム、満足感および疼痛の両方について利用可能である。複合スコアは2.0から36.0におよび、スコアが高いほど、全体的な性機能が良好であることを示す。次に、ベースラインから治療の4週および12週への複合スコアの変化のパーセント、および各々の分野のスコアの変化のパーセントが決定される。
【0214】
閉経期特異的なクオリティ・オブ・ライフ(Menopause−specific Quality of Life)(MENQOL)は、血管運動神経、理学的、心理社会的および性的な機能を含めて4つの分野の自己管理の30項目のアンケートである。各々のドメインを別々に1〜8のポイントスケールにスコア付けする。十分な試験−再試験の信頼性、良好な反応性および良好から優れた判別可能でかつ評価的な構築物の妥当性が実証されている。次に、治療のベースラインから4週までおよび12週までのMENQOLの各々の分野の割合の変化が決定される。
【0215】
閉経期症状のアンケート−簡易な閉経期症状のアンケート(Menopausal Symptom Questionnaire)によって、ほてり、乳房の圧痛、膣乾燥ならびに睡眠の中断および障害などの閉経期女性によって経験される典型的な症状の困難な症状に対する情報を確認する。このアンケートは閉経後エストロゲン−プロゲスチン介入トライアル(Postmenopausal Estroge−Progestin Interventions trial)、心臓およびエストロゲン/プロゲスチン補充研究(Heart and Estrogen/progestin Replacement Study)、および女性の健康イニシアチブトライアル(Women’s Health Initiative trials)を含めて複数の主要なトライアルで用いられ、確証されている。各々の症状は、0(困難な事態なし)から4(極めて困難)に格付けされた、5ポイントのLikertスケールで格付けする。次に、治療のベースラインから4週へおよび12週へのこれらのスコアの各々における変化のパーセントを評価する。
【0216】
SF−36 − これは、疾患および治療によって最も影響される健康の構成を測定するために設計された短縮型の非特異的健康調査である。SF−36は、集団中の疾患の相対的な負荷および治療に関連する健康利益を比較するために広く用いられている確証された手段である。SF−36は理学的および精神的な健康のサブスケールを有する。次に治療のベースラインから4週までおよび12週までの各々のサブスケール(身体および精神の健康)における変化の割合を測定する。
【0217】
骨盤臓器脱定量化(Pelvic Organ Prolapse Quantitation)(POP−Q)−骨盤臓器脱評価は、骨盤臓器脱定量(Organ Prolapse Quantification)(POP−Q)システムを用いて国際コンチネンス学会(International Continence Society)が確立したガイドラインに従って行う。この手順は、デューク大学(Duke University)の医療センター(Medical Center)で作製されてビデオテープで実証されたとおり標準化される。
【0218】
骨盤底障害を有する女性の2つの状態に特異的なクオリティ・オブ・ライフのアンケートの短縮バージョン、骨盤底苦痛一覧(Pelvic Floor Distress Inventory)(PFDI)−20および骨盤底影響アンケート(Pelvic Floor Impact Questionnaire)(PFIQ)−7は、骨盤底苦痛一覧および骨盤底影響アンケートの長型の開発と確証に寄与した100例の女性からのデータからBarberらによって開発された。
【0219】
骨盤底影響一覧(Pelvic Floor Distress Inventory)−このPFDIは、骨盤底障害を有する女性の苦痛の症状を3スケールで評価する:泌尿生殖器苦痛一覧(Urogenital Distress Inventory)、結腸直腸−肛門苦痛一覧(Colorectal−anal Distress Inventory)および骨盤臓器苦痛一覧(Pelvic Organ Distress Inventory)。
【0220】
骨盤底影響アンケート短型7−このPFIQは、生活への影響を3スケールで評価する:失禁影響アンケート(Incontinence Impact Questionnaire)、結腸直腸−肛門影響アンケート(Colorectal−anal Impact Questionnaire)および骨盤臓器脱影響アンケート(Pelvic Organ Prolapse Impact Questionnaire)。
【0221】
調査対象範囲(Coverables)
【0222】
以下のデータは、ベースラインで全ての参加者に対して収集される。
・個体群統計学:誕生日、人種、民族、関係状況、教育。
・投薬および外科の既往歴:婦人科手術(取り出した卵巣の数)、乳癌、卵巣癌、喫煙歴およびアルコール歴。
・生殖および閉経の履歴:妊娠、経産回数、最終月経期間、初潮年齢。
・現在の投薬:市販薬および栄養補助食品を含めて現在摂取しているまたは過去3ヶ月の間に摂取した医薬。
・閉経症状の履歴:閉経症状の出現の年齢、閉経症状に対する過去の治療。
【0223】
本発明の好ましい実施形態が示されており、本明細書に記載されているが、このような実施形態は例示として示されるだけであることが当業者には明白であろう。多数の改変、変化および置換がここで本発明から逸脱することなく当業者には思い浮かぶであろう。本明細書に記載される本発明の実施形態に対する種々の代替が本発明を実施するのに使用され得ることが理解されるべきである。添付の特許請求の範囲が本発明の範囲を規定し、これらの特許請求の範囲内の方法および構造ならびにそれらの等価物がそれによって包含されるものとする。
【技術分野】
【0001】
本発明は、植物抽出組成物およびさらに具体的には、キバナオウギ(Astragalus membranacens)、ナイモウオウギ(Astragalus mongholicus)、ハナスゲ(Anemarrhenae asphodeloides)およびイノコズチ(Achyranthes bidentata)という種に属する植物種の抽出物を含む組成物に関する。本発明はさらに、このような植物抽出組成物を用いる方法および作製する方法に関する。
【0002】
相互参照および優先権の主張
本出願は、米国特許法(合衆国法典35巻)第119条(e)に基づいて、その全体が参照によって本明細書に援用される米国特許仮出願番号61/050,925号から優先権を主張する。
【背景技術】
【0003】
閉経期の膣委縮の発現は、循環中のエストロゲンの低下に伴う。閉経期間から閉経後に、血清エストロゲンレベルは、約400pg/ml〜10pg/ml未満まで低下することが示されている。エストロゲン補充療法は、膣の乾燥の治療のために首尾よく用いられている。この効果は、外陰部および膣の管におけるエストロゲン受容体のアゴニスト刺激を介して達成されると仮説される。
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明者らは、エストロゲン受容体に関連する1つ以上の疾患状態の治療のために有用なエストロゲン組成物の必要性を認識している。本発明者らはまた、エストロゲン組成物を投与された患者がエストロゲン受容体と関連する別の疾患状態に罹患するリスクまたは確率を増大しないエストロゲン組成物の必要性を認識している。本発明者は同様に、別のエストロゲン受容体媒介性疾患状態を同時に治療しながら、1つ以上のエストロゲン受容体媒介性疾患状態のリスクを減らすエストロゲン組成物についての必要性を認識している。本発明者はまた、天然の供給源から容易に得られるエストロゲン様組成物の必要性、ならびにこのようなエストロゲン様組成物を作製および用いる方法の必要性を認識している。本明細書の開示は、このような要件を満たし、かつ同様に関連の利点も提供する。
【課題を解決するための手段】
【0005】
従って、いくつかの実施形態では、本発明は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量を含み、ここでこの抽出物が少なくとも1つの植物化学物質を含む、組成物を提供する。いくつかの実施形態では、この組成物は、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量を含む。いくつかの実施形態では、この組成物は、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量から本質的になる。いくつかの実施形態では、この組成物は、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量からなる。いくつかの実施形態では、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量は、1日あたり約1乾燥重量グラム〜約100乾燥重量グラムの抽出物である。いくつかの実施形態では、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量は、1日あたり約10乾燥重量グラム〜約100乾燥重量グラムの抽出物である。いくつかの実施形態では、上記植物化学物質はカリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。いくつかの実施形態では、この植物化学物質の精製された抽出物は、第1の抽出および第2の抽出を行うことによって得られる。いくつかの実施形態では、上記第1の抽出は以下の工程、(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、(b)この第1の混合物を加熱する工程と、(c)この第1の溶媒を除去して第2の抽出物を得る工程とを包含する。いくつかの実施形態では、上記第2の抽出は、以下の工程、(a)この第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、(b)この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、(c)この非水性層を収集する工程と、(d)いずれの非活性化合物も除去する工程と、(e)この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、上記第1の溶媒はエタノールおよび水の溶液である。いくつかの実施形態では、上記第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約2〜約6時間加熱される。いくつかの実施形態では、上記第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、上記第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、上記エバポレーションは約40℃〜約60℃の温度で起こる。いくつかの実施形態では、上記第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカは酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。いくつかの実施形態では、上記組成物はさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。
【0006】
本明細書に記載されるいくつかの実施形態では、植物種キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を単離するプロセスが提供される。いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。いくつかの実施形態では、上記植物化学物質の精製された抽出物は第1の抽出および第2の抽出を行うことによって得られる。いくつかの実施形態では、この第1の抽出は、(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、(b)この第1の混合物を加熱する工程と、(c)この第1の溶媒を除去して第1の抽出物を得る工程と、を包含する。いくつかの実施形態では、この第2の抽出は、(a)上記第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、(b)この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、(c)この非水性層を収集する工程と、(d)いずれの非活性化合物も除去する工程と、(e)この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程と、を包含する。いくつかの実施形態では、上記第1の溶媒はエタノールおよび水の溶液である。いくつかの実施形態では、上記第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約2時間〜約6時間加熱される。いくつかの実施形態では、上記第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、上記第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、上記エバポレーションは約40℃〜約60℃の温度で起こる。いくつかの実施形態では、上記第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物がシリカ上で乾燥非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカが酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。いくつかの実施形態では、この組成物はさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。
【0007】
本明細書に記載されるいくつかの実施形態は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物の治療上有効な量を含む組成物で治療可能であり得る障害を有する被検体を治療する方法を提供する。いくつかの実施形態では、この障害は、膣委縮、外陰部委縮、またはそのうち1つまたは両方の症状である(例えば、膣の乾燥、刺激、そう痒、出血および/または性交疼痛の増大)。いくつかの実施形態では、この障害は1つ以上の更年期症状(すなわち、閉経期間、閉経期または閉経後に関連する症状)である。いくつかの実施形態では、この組成物は、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量を含む。いくつかの実施形態では、この組成物は本質的に、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量からなる。いくつかの実施形態では、この組成物は、1つ以上の薬学的に許容可能な賦形剤、ならびにキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量からなる。いくつかの実施形態では、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量は、1日あたり約1乾燥重量グラム〜約100乾燥重量グラムである。いくつかの実施形態では、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量は、1日あたり約10乾燥重量グラム〜約100乾燥重量グラムの抽出物である。いくつかの実施形態では、上記植物化学物質はカリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。いくつかの実施形態では、上記植物化学物質の精製された抽出物は第1の抽出および第2の抽出を行うことによって得られる。いくつかの実施形態では、上記第1の抽出は以下の工程、(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、(b)この第1の混合物を加熱する工程と、(c)この第1の溶媒を除去して第1の抽出物を得る工程とを包含する。いくつかの実施形態では、上記第2の抽出は、以下の工程、(a)この第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、(b)この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、(c)この非水性層を収集する工程と、(d)いずれの非活性化合物も除去する工程と、(e)この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、上記第1の溶媒はエタノールおよび水の溶液である。いくつかの実施形態では、上記第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、上記第1の混合物は約2〜約6時間加熱される。いくつかの実施形態では、上記第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、上記第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、上記エバポレーションは約40℃〜約60℃の温度で起こる。いくつかの実施形態では、上記第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で乾燥された非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカは酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。いくつかの実施形態では、上記組成物はさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。
【0008】
本明細書に記載のいくつかの実施形態では、エストロゲン応答要素の制御下で遺伝子を活性化する方法を提供し、この方法は、この遺伝子に作動可能に連結されたエストロゲン応答要素およびエストロゲン受容体を有する細胞に対して、ある量の組成物を投与することを包含し、この組成物は、Astragalus membranacens、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を含み、この植物化学物質の精製された抽出物が、この遺伝子を活性化するのに十分な量である。いくつかの実施形態では、上記植物化学物質はカリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。いくつかの実施形態では、上記細胞はインビトロである。いくつかの実施形態では、上記細胞はインビボである。いくつかの実施形態では、上記細胞はERα+乳房組織にある。いくつかの実施形態では、上記細胞はERβ+乳房組織にある。いくつかの実施形態では、上記細胞はERα/ERβ+乳房組織にある。いくつかの実施形態では、上記エストロゲン応答要素は形質転換された細胞で発現される。いくつかの実施形態では、上記エストロゲン応答要素および上記エストロゲン受容体の両方が上記細胞で発現される。いくつかの実施形態では、上記エストロゲン応答要素は上記細胞中で異種発現される。いくつかの実施形態では、上記エストロゲン応答要素およびエストロゲン受容体の両方が上記細胞中で異種発現される。いくつかの実施形態では、上記細胞はERE制御遺伝子で形質転換されたU937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される。いくつかの実施形態では、上記細胞はERαを発現する。いくつかの実施形態では、上記細胞はERβを発現する。いくつかの実施形態では、上記ERE制御遺伝子はERE−tk−Lucである。
【0009】
本明細書に記載されるいくつかの実施形態では、TNF RE制御遺伝子の発現を抑制するプロセスが提供され、このプロセスは、TNF応答要素の制御下の遺伝子およびエストロゲン受容体を含む細胞に対して、ある量の組成物を投与することを包含し、この組成物は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を含み、この植物化学物質の精製された抽出物は、このTNF RE制御遺伝子を抑制するのに十分な量である。いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。いくつかの実施形態では、上記TNF RE制御遺伝子はTNF−αである。いくつかの実施形態では、上記TNF RE制御遺伝子はTNF RE−Lucである。いくつかの実施形態では、上記細胞はインビトロである。いくつかの実施形態では、上記細胞はインビボである。いくつかの実施形態では、上記細胞はER+乳房組織にある。いくつかの実施形態では、上記細胞はERα+乳房組織にある。いくつかの実施形態では、上記細胞はERβ+乳房組織にある。いくつかの実施形態では、上記TNF応答要素は上記細胞で内因的に発現される。いくつかの実施形態では、上記TNF応答要素およびエストロゲン受容体の両方が上記細胞中で内因的に発現される。いくつかの実施形態では、上記TNF応答要素は上記細胞中で異種発現される。いくつかの実施形態では、上記TNF応答要素およびエストロゲン受容体の両方が上記細胞中で異種発現される。いくつかの実施形態では、上記細胞はエストロゲン受容体遺伝子を含み、TNF応答要素制御遺伝子で形質転換され、かつU937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される。いくつかの実施形態では、上記エストロゲン受容体遺伝子はERαを発現する遺伝子である。いくつかの実施形態では、上記エストロゲン受容体遺伝子はERβを発現する遺伝子である。
【0010】
参照による援用
本明細書で言及される全ての刊行物および特許出願は、あたかも各々の個々の刊行物または特許出願が参照によって援用されることが詳細にかつ個々に示されるのと同じ程度まで、参照によって本明細書に援用される。
【図面の簡単な説明】
【0011】
本発明の新規な特徴は、添付の特許請求で詳細に示される。本発明の特徴および利点のさらに良好な理解は、本発明の原理が利用される例示的な実施形態を示す以下の詳細な説明および以下の添付の図面を参照することによって得られるであろう。
【0012】
【図1A】U2OS骨肉腫細胞を、ERE−tk−LucおよびヒトERαまたはERβの発現ベクターを用いて同時トランスフェクトした。VG101中の草本抽出物およびそれらの活性な化学成分は、ERβでの、ただしERαではないERE−tk−Lucの用量依存性の活性化を生じた。図1A:ハナスゲ(Rhizomae Anemarrhenae asphodeloides Bunge)(ユリ科(Liliaceae))の効果。
【図1B】U2OS骨肉腫細胞を、ERE−tk−LucおよびヒトERαまたはERβの発現ベクターを用いて同時トランスフェクトした。VG101中の草本抽出物およびそれらの活性な化学成分は、ERβでの、ただしERαではないERE−tk−Lucの用量依存性の活性化を生じた。図1B:オウギ(Radix Astragali)(マメ科(Leguminosae/Fabaceae))。
【図1C】U2OS骨肉腫細胞を、ERE−tk−LucおよびヒトERαまたはERβの発現ベクターを用いて同時トランスフェクトした。VG101中の草本抽出物およびそれらの活性な化学成分は、ERβでの、ただしERαではないERE−tk−Lucの用量依存性の活性化を生じた。図1C:イノコズチ(Radix Achyranthes bidentata Bl.)(ヒユ科(Amarathaceae))。
【図2A】草本抽出物およびそれらの活性な化学成分は、10nMのエストラジオール(E2)に等価な活性化を生じた。ERアンタゴニストであるラロキシフェン(Ral)およびタモキシフェン(Tam)は以下による活性化をブロックした:ハナスゲ(ユリ科)の効果(図2A)。
【図2B】草本抽出物およびそれらの活性な化学成分は、10nMのエストラジオール(E2)に等価な活性化を生じた。ERアンタゴニストであるラロキシフェン(Ral)およびタモキシフェン(Tam)は以下による活性化をブロックした:オウギ(マメ科)(図2B)。
【図2C】草本抽出物およびそれらの活性な化学成分は、10nMのエストラジオール(E2)に等価な活性化を生じた。ERアンタゴニストであるラロキシフェン(Ral)およびタモキシフェン(Tam)は以下による活性化をブロックした:イノコズチ(ヒユ科)(図2C)。
【図2D】草本抽出物およびそれらの活性な化学成分は、10nMのエストラジオール(E2)に等価な活性化を生じた。ERアンタゴニストであるラロキシフェン(Ral)およびタモキシフェン(Tam)は以下による活性化をブロックした:二アソール(図2D)。
【図3A】エストラジオール(E2)または草本で処理したテトラサイクリン誘導性のERαまたはERβのU2OS細胞におけるTNFα遺伝子mRNAの発現。図3A:TNFαは、両方のU2OS−ERαでE2によって阻害されたTNFαのmRNAの大きい増大を生じた。草本抽出物およびVGl0l中のその活性化化学成分は、マウス異種移植片モデルでMCF−7細胞腫瘍形成も子宮増殖も刺激しない。
【図3B】エストラジオール(E2)または草本で処理したテトラサイクリン誘導性のERαまたはERβのU2OS細胞におけるTNFα遺伝子mRNAの発現。図3B:U2OS−ERβ。草本抽出物およびVGl0l中のその活性化化学成分は、マウス異種移植片モデルでMCF−7細胞腫瘍形成も子宮増殖も刺激しない。
【図3C】エストラジオール(E2)または草本で処理したテトラサイクリン誘導性のERαまたはERβのU2OS細胞におけるTNFα遺伝子mRNAの発現。図3C:ハナスゲ(ユリ科)の用量反応。草本抽出物およびVGl0l中のその活性化化学成分は、マウス異種移植片モデルでMCF−7細胞腫瘍形成も子宮増殖も刺激しない。
【図3D】エストラジオール(E2)または草本で処理したテトラサイクリン誘導性のERαまたはERβのU2OS細胞におけるTNFα遺伝子mRNAの発現。図3D:オウギ(マメ科)。草本抽出物およびVGl0l中のその活性化化学成分は、マウス異種移植片モデルでMCF−7細胞腫瘍形成も子宮増殖も刺激しない。
【図3E】エストラジオール(E2)または草本で処理したテトラサイクリン誘導性のERαまたはERβのU2OS細胞におけるTNFα遺伝子mRNAの発現。図3E:U2OS−ERαおよびU2OS−ERβ TNFα抑制に対するイノコズチ(ヒユ科)。草本抽出物およびVGl0l中のその活性化化学成分は、マウス異種移植片モデルでMCF−7細胞腫瘍形成も子宮増殖も刺激しない。
【図4A】草本抽出物を、BT474、ER+乳癌細胞およびMDA−MB−468、ER−乳癌細胞においてCyQuant細胞増殖アッセイ(Cell Proliferation Assay)を用いて試験した。その細胞を、草本抽出物を用いて48時間処理した。図4A:ハナスゲ(ユリ科)の効果。
【図4B】草本抽出物を、BT474、ER+乳癌細胞およびMDA−MB−468、ER−乳癌細胞においてCyQuant細胞増殖アッセイ(Cell Proliferation Assay)を用いて試験した。その細胞を、草本抽出物を用いて48時間処理した。図4B:オウギ(マメ科)。
【図4C】草本抽出物を、BT474、ER+乳癌細胞およびMDA−MB−468、ER−乳癌細胞においてCyQuant細胞増殖アッセイ(Cell Proliferation Assay)を用いて試験した。その細胞を、草本抽出物を用いて48時間処理した。図4C:イノコズチ(ヒユ科)。
【発明を実施するための形態】
【0013】
いくつかの実施形態では、本発明は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量を含む組成物を含む。
【0014】
いくつかの実施形態では、この植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。
【0015】
いくつかの実施形態では、この抽出物はカリコシン、ニアソールおよび四環系イソフラボンを含む。
【0016】
いくつかの実施形態では、この植物化学物質の精製された抽出物は、第1の抽出および第2の抽出を行うことによって得られる。
【0017】
いくつかの実施形態では、この第1の抽出は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを、第1の溶媒中で分散して、第1の混合物を形成する工程と、この第1の混合物を加熱する工程と、この第1の溶媒を除去して第1の抽出物を得る工程とを包含する。いくつかの実施形態では、上記第1の溶媒は、エタノールおよび水の溶液である。いくつかの実施形態では、この第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約2〜約6時間加熱される。いくつかの実施形態では、この第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、この第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、このエバポレーションは約40℃〜約60℃の温度で起こる。いくつかの実施形態では、この第2の抽出は、以下の工程、この第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、この非水性層を収集する工程と、いずれの非活性化合物も除去する工程と、この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、この第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で、乾燥された非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカは酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。
【0018】
いくつかの実施形態では、上記組成物はさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。
【0019】
いくつかの実施形態では、本発明はキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を単離する方法を包含する。
【0020】
いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。
【0021】
いくつかの実施形態では、上記植物化学物質の精製された抽出物は第1の抽出および第2の抽出を行うことによって得られる。
【0022】
いくつかの実施形態では、上記第1の抽出は、第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、この第1の混合物を加熱する工程と、この第1の溶媒を除去して第1の抽出物を得る工程とを包含する。いくつかの実施形態では、この第1の溶媒はエタノールおよび水の溶液である。いくつかの実施形態では、上記第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約2時間〜約6時間加熱される。いくつかの実施形態では、この第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、この第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、このエバポレーションは約40℃〜約60℃の温度で起こる。いくつかの実施形態では、上記第2の抽出は、以下の工程、この第1の抽出物と第2の溶媒とを混合して第2の混合物を形成する工程と、この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、この非水性層を収集する工程と、いずれの非活性化合物も除去する工程と、この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、上記第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で乾燥された非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカは酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、上記植物化学物質の精製された抽出物からエバポレーションによって除去される。
【0023】
いくつかの実施形態では、本発明は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の治療上有効な量を含む組成物で治療可能であり得る障害を有する被検体を治療する方法を包含する。
【0024】
いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。
【0025】
いくつかの実施形態では、上記植物化学物質の精製された抽出物は、第1の抽出および第2の抽出を行うことによって得られる。
【0026】
いくつかの実施形態では、この第1の抽出は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを、第1の溶媒中で分散して、第1の混合物を形成する工程と、この第1の混合物を加熱する工程と、この第1の溶媒を除去して第1の抽出物を得る工程とを包含する。いくつかの実施形態では、この第1の溶媒は、エタノールおよび水の溶液である。いくつかの実施形態では、この第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約20℃〜約40℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約2〜約6時間加熱される。いくつかの実施形態では、この第1の混合物は約 〜約4時間加熱される。いくつかの実施形態では、この第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、このエバポレーションは約40℃〜約60℃の温度で起こる。
【0027】
いくつかの実施形態では、この第2の抽出は、以下の工程、この第1の抽出物と第2の溶媒とを混合して第2の混合物を形成する工程と、この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、この非水性層を収集する工程と、いずれの非活性化合物も除去する工程と、この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、この第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、上記非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で非水性層を濾過することによって除去される。いくつかの実施形態では、上記シリカは酢酸エチル中に懸濁される。いくつかの実施形態では、上記第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。
【0028】
いくつかの実施形態では、上記組成物はさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。
【0029】
いくつかの実施形態では、上記組成物は、固体経口剤形、液体経口剤形、ゼラチンカプセル剤形、膣坐剤、直腸坐剤またはスプレーからなる群より選択される剤形として投与される。
【0030】
いくつかの実施形態では、上記治療上有効な量は、エストロゲン様効果を誘発する量である。
【0031】
いくつかの実施形態では、上記エストロゲン様効果は、少なくとも1つの更年期症状を治療または予防すること、骨粗鬆症を治療または予防すること、またはそれらの任意の組み合わせからなる群より選択される。いくつかの実施形態では、上記エストロゲン様効果は少なくとも1つの更年期症状を治療または予防することである。いくつかの実施形態では、この更年期症状は、ほてり、不眠症、膣もしくは外陰の委縮、性欲減退、尿失禁、頭痛、抑うつまたはそれらの任意の組み合わせからなる群より選択される。いくつかの実施形態では、この更年期症状は膣または外陰の委縮である。いくつかの実施形態では、このエストロゲン様効果としては骨粗鬆症を治療または予防することが挙げられる。
【0032】
いくつかの実施形態では、本発明は、エストロゲン応答要素の制御下の遺伝子を活性化する方法を包含し、この方法は、この遺伝子に対して作動可能に連結されたエストロゲン応答要素およびエストロゲン受容体を有する細胞に対して、ある量の組成物を投与することを包含し、この組成物は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を含み、この抽出物は、この遺伝子を活性化するのに十分な量である。
【0033】
いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。
【0034】
いくつかの実施形態では、上記細胞はインビトロである。いくつかの実施形態では、上記細胞はインビボである。
【0035】
いくつかの実施形態では、上記細胞はERα+乳房組織にある。いくつかの実施形態では、この細胞はERβ+乳房組織にある。いくつかの実施形態では、この細胞はERα+/ERβ+乳房組織にある。
【0036】
いくつかの実施形態では、上記エストロゲン応答要素は形質転換された細胞で発現される。いくつかの実施形態では、上記エストロゲン応答要素およびエストロゲン受容体の両方がこの細胞中で発現される。いくつかの実施形態では、このエストロゲン応答要素はこの細胞中で異種発現される。いくつかの実施形態では、上記エストロゲン応答要素およびエストロゲン受容体の両方が上記細胞中で異種発現される。
【0037】
いくつかの実施形態では、上記細胞はERE制御遺伝子で形質転換されたU937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される。いくつかの実施形態では、この細胞はERαを発現する。いくつかの実施形態では、この細胞はERβを発現する。いくつかの実施形態では、このERβ制御遺伝子はERE−tk−Lucである。
【0038】
いくつかの実施形態では、本発明は、TNF RE制御遺伝子の発現を抑制する方法を包含し、この方法は、TNF応答要素の制御下の遺伝子およびエストロゲン受容体を含む細胞に対して、ある量の組成物を投与することを包含し、この組成物は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を含み、この抽出物は、TNF RE制御遺伝子を抑制するのに十分な量である。
【0039】
いくつかの実施形態では、上記植物化学物質は、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される。いくつかの実施形態では、上記抽出物は、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む。いくつかの実施形態では、この抽出物は、カリコシン、ニアソールおよび四環系イソフラボンを含む。
【0040】
いくつかの実施形態では、上記TNF RE制御遺伝子がTNF−αである。いくつかの実施形態では、このTNF RE制御遺伝子はTNF RE−Lucである。
【0041】
いくつかの実施形態では、上記細胞はインビトロである。いくつかの実施形態では、この細胞はインビボである。
【0042】
いくつかの実施形態では、この細胞はER+乳房組織にある。いくつかの実施形態では、この細胞はERα+乳房組織にある。いくつかの実施形態では、この細胞はERβ+乳房組織にある。
【0043】
いくつかの実施形態では、上記TNF応答要素は細胞中で内因性に発現される。いくつかの実施形態では、このTNF応答要素およびエストロゲン受容体の両方がこの細胞中で内因性に発現される。いくつかの実施形態では、このTNF応答要素はこの細胞中で異種発現される。いくつかの実施形態では、このTNF応答要素およびエストロゲン受容体の両方が上記細胞中で異種発現される。
【0044】
いくつかの実施形態では、上記細胞はエストロゲン受容体遺伝子を含み、TNF応答要素制御遺伝子で形質転換され、U937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される。いくつかの実施形態では、このエストロゲン受容体遺伝子は、ERαを発現する遺伝子である。いくつかの実施形態では、このエストロゲン受容体遺伝子は、ERβを発現する遺伝子である。
【0045】
定義
本明細書において用いる場合、抽出物とは、植物物質由来の1つ以上の植物化学物質化合物を抽出媒体中に引きだすために適切な条件下でこの植物物質と溶媒とを接触させて溶液を形成すること、および必要に応じてこの溶液を希釈、分画さらに精製および/または濃縮して抽出物を形成することによって調製される物質の組成物である。本発明のいくつかの実施形態では、この植物物質は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの混合物である。従って、「抽出物」という用語は、抽出媒体を用いた植物物質(キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ)の抽出から得られる溶液を乾燥残渣のみが残るまで濃縮(例えば、エバポレーションによる)した時に残っている乾燥残渣を包含する。「抽出物」という用語はまた、抽出媒体を用いた植物物質の抽出、続いて溶液の濃縮(例えば、エバポレーションによる)から生じる濃縮溶液を包含する。「抽出物」という用語はまた、抽出媒体と植物物質との接触によって生成される溶液を含む希釈された溶液および1つ以上の希釈液を包含する。「抽出物」という用語はさらに、抽出工程とそれに続く1つ以上の精製および/または分画工程の産物を包含し得る。
【0046】
「インビボ」という用語は、生きている生物体、例えば、生きているヒトまたは他の哺乳動物、例えばマウスもしくはラットと接触しているかまたはその体内での治療を指す。
【0047】
本明細書において用いる場合、「治療する」、「治療すること」および「治療」という用語は、膣委縮またはその1つ以上の症状を緩和する(alleviating)方法を指す。
【0048】
本明細書において用いる場合、予防法とは、疾患状態の1つ以上の症状の発現の遅延、重症度の軽減および/または頻度の減少を指す。従って、予防法は、疾患または疾患状態の絶対的な予防ととらえるつもりはない。予防法は、疾患状態の発現の予防を意味するつもりもないが、予防法はいくつかの実施形態では、以下の目的で本明細書に記載される抽出物を含んでいる組成物の投与を包含する。患者が特定の症状または症状の集合に罹患する確率を低下すること、症状または症状の集合に罹患していると既に診断されているかまたはそのリスクがあると判定されている患者においてその症状または症状の集合の重症度または頻度を低減すること。
【0049】
詳細には、閉経期の治療としては、閉経期、閉経期間または閉経後の1つ以上の症状の重症度を緩和、軽減および/または頻度を低下することが挙げられる。さらに、これには、1つ以上の閉経期症状の発現を遅延する、閉経期症状の重症度または頻度を無視できるレベルまで低減する、またはその両方の目的および/または効果での本発明の組成物および抽出物の予防的投与を挙げることができる。
【0050】
本明細書において用いる場合、苦痛緩和(palliation)とは、疾患、障害、症候群、病態または症状の重症度、数および/または発生頻度の低減を包含する。
【0051】
本明細書において用いる場合、「E2」とは、天然に存在するエストロゲンであるエストラジオールを指す。
【0052】
本明細書において用いる場合、「投与する」、「投与すること」または「投与」とは、膣萎縮の治療のために適切な方式での患者への本発明の抽出物(単数または複数)の送達または本発明の抽出物(単数または複数)を含む薬学的組成物の送達を指す。この用語は、自己投与および医療専門家または他の介護者による投与を包含する。
【0053】
本明細書における「患者」とは特に、膣委縮に罹患しているか、または膣委縮を発症する可能性が高いと適格な医療従事者から判定されている閉経期または閉経時期の女性をさす。
【0054】
本明細書において用いる場合、「治療上有効な量」という用語は、膣委縮を治療するために適切な抽出物の量を指す。
【0055】
本明細書において用いる場合、「薬学的組成物」とは、本明細書に記載される抽出物のうちの1つ以上と他の化学的成分、例えば、生理学的に許容可能な担体および賦形剤との混合物を指す。薬学的組成物の目的は、患者に対する本発明の抽出物(単数または複数)の投与を容易にすることである。
【0056】
本明細書において用いる場合、「薬学的に許容可能な」という用語は、言及される薬剤または賦形剤が薬学的組成物における使用に適切であると一般にみなされることを意味する。
【0057】
本明細書において用いる場合、「生理学的に許容可能な担体」とは、生物体に対して有意な刺激を生じず、かつ投与される組成物の生物学的活性および特性を抑制することも過度に妨害することもない担体または希釈剤を指す。いくつかの実施形態では、生理学的に許容可能な担体は、患者における薬効をそれ自体が生じる必要ももたらす必要もなく、本発明の抽出物の1つ以上の成分の取り込みを増強し得る。
【0058】
本明細書において用いる場合、「賦形剤」とは、本発明の抽出物の投与を容易にする薬学的組成物における不活性物質を指す。従って、この「賦形剤」という用語は詳細には他の活性成分、例えば、具体的には、他の閉経期−または膣委縮−治療剤、例えば、ホルモンを除外する。不活性な賦形剤の例示的な、非限定的な例としては、香味剤、味覚マスキング剤、甘味料、結合剤、錠剤分解物質、流動促進剤、希釈剤およびそれらの2つ以上の組み合わせが挙げられる。
【0059】
本明細書において用いる場合、「含む、含んでいる(comprising)」、「含む、包含する(comprises、comprise)」およびそれらの文法上の変形は、包括的であるかまたは制限が無く、追加、未言及の要素も方法工程も排除しない。「含む、包含する(include、includes)」、「含む、包含する(contain、contains)」、「含んでいる、含有する(containing)」という用語およびその文法的変形は同様に包括的である。
【0060】
本明細書において用いる場合、「〜からなる(consisting of)」という句は、その文章のそれ以降の部分で特定されてない任意の要素、工程または成分を排除する。
【0061】
本明細書において用いる場合、「本質的に〜からなる(consisting essentially of)」という句は、その文章のそれ以降の部分の範囲を特定の物質または工程、および本発明の特許請求の範囲の基本的かつ新規な特徴(単数または複数)に物質的に影響しないものに対して限定する。
【0062】
本明細書において用いる場合、「1日あたりの乾燥重量グラム」(「乾燥重量グラム」とも)という用語は、本発明に従う抽出物を参照して、ある量の草本が抽出された後および例えば、エバポレーションまたは凍結乾燥によって抽出媒体が除去された後、残渣の乾燥重量のグラム数を意味する。
【0063】
本明細書において用いる場合、「四環系イソフラボン」(「TCIF」)とは、以下の構造:
【化1】

を有する化合物、またはその薬学的に許容可能な塩を意味する。
【0064】
エストロゲン
【0065】
エストロゲンは、一群のステロイド化合物である。最も広く天然に存在するエストロゲンはエストラジオール、エストリオールおよびエストロンである。閉経期を通じて、エストロゲンは17β−エストラジオールが最も一般的である。閉経後の女性ではエストロンが最も一般的である。
【0066】
卵巣における卵胞、黄体および胎盤は、雌性の身体で産生されるエストロゲンのほとんどを担う。さらに、肝臓、副腎および乳房がごく少量ではあるがエストロゲンを産生する。閉経期の間、および後に、これらの二次的な供給源は、エストロゲンの産生に優勢な部位となる。
【0067】
エストロゲンは特定の遺伝子の転写を活性化または抑制し得る。遺伝子転写の活性化のためには古典的なERE(エストロゲン応答要素)経路およびAP−1経路という2つの特徴的な経路がある。
エストロゲン受容体
2つの公知のエストロゲン受容体、ERαおよびERβがあり、これらは、ステロイド核受容体スーパーファミリーのメンバーである。ERαは最初1986年にクローニングされ;約10年後に当該分野ではERβと呼ばれる第2のERが発見された。
【0068】
ERの構造
【0069】
両方の受容体が、複数のドメインから構成されたモジュラータンパク質である。アミノ末端ドメイン(A/Bドメイン)は、最小保存領域であり、ERαとERβとの間で15%の相同性しか呈さない。このドメインは、エストラジオールの非存在下で遺伝子転写活性化を活性化し得る活性化機能(AF−1)を保有している。
【0070】
ERの中央領域は、標的遺伝子のプロモーターに位置する3つのヌクレオチドによって隔てられる逆位パリンドローム反復配列(inverted palindromic repeat sequence)に結合する2つのジンクフィンガーモチーフを含む。
【0071】
ERαおよびERβ中のDNA結合ドメイン(DBD)は事実上同一であって、95%の相同性を呈する。
【0072】
カルボキシ末端ドメインは、いくつかの必須の機能を実行するリガンド結合ドメイン(LBD)を含む。LBDはエストロゲン化合物が結合する大きい疎水性ポケットを形成する領域、およびER二量体化に関与する領域を含む。LBDはまた、同時調節タンパク質と相互作用する第2の活性化機能(AF−2)を含む。AF−2は、エストロゲン活性化および遺伝子転写の抑制の両方に必要である。ERαおよびERβのLBDは約55%相同でしかない。
【0073】
ERαおよびERβのLBDのアミノ酸組成の顕著な相違は、別個の転写的役割を有するERを作製することに発展し得る。これによってERαおよびERβが異なる遺伝子の活性を調節すること、ならびに異なる生理学的効果を誘発することが可能になるであろう。この概念はERαおよびERβのノックアウトマウスの研究によって支持される。例えば、ERαノックアウトマウスは未発達の乳腺および子宮の発達があるが、ERβノックアウトマウスは正常な乳腺および子宮の発達である。これらの観察によって、これらの組織の発達にはERαしか必要でないことが示される。さらに、ERαは遺伝子を活性化するのにERβよりも効果的であるが、ERβは遺伝子を抑制するのにERαよりも効果的である。
【0074】
作用の方法
エストロゲン受容体は多くの組織に存在し、かつ種々の生理学的な調節効果および発達効果に関与している。異なる組織は、ERαおよびERβという2つの公知のエストロゲン受容体サブタイプの発現の種々のレベルを有する。両方のエストロゲン受容体は、膣、骨、脳、および乳房組織で発現されるが、ほとんど子宮がERαを発現する。
【0075】
機能的には、エストロゲンは両方の受容体上で遺伝子転写を活性化しかつ抑制するが、それが調節する遺伝子のうちERαおよびERβについて同じなのは24%だけである。エストロゲンは、ERαのみを含有するMCF−7乳癌細胞の増殖を有意に増大する。同じMCF−7乳癌細胞がERβで感染されるとき、これはその細胞の増殖を阻害しそれらの成長を停止する。さらに、ERβ感染したMCF−7乳癌細胞のエストロゲン処理は結果として増殖をさらに阻害する。
【0076】
エストロゲンは遺伝子転写を活性化または抑制し得る。遺伝子転写の活性化には、古典的なERE(エストロゲン応答要素)経路およびAP−1経路という2つの特徴的な経路がある。遺伝子の転写を調節するエストロゲンに必須の少なくとも3つの本質的な構成要素がある。ER類(ERαおよび/またはERβ)、標的遺伝子中のプロモーターエレメントおよび同時調節性タンパク質。ERに対するエストラジオールの結合は、立体配置変化をもたらし、これが転写経路を開始するいくつかの重要な工程を生じる。第一に、E2とERとの相互作用は、シャペロンタンパク質の解離をもたらす。これは、ER二量体化表面およびDNA結合ドメインを露出する。シャペロンタンパク質の喪失によって、ERは二量体化して、標的遺伝子のプロモーター領域でEREに結合することが可能になる。
【0077】
第二に、E2の結合は、ERのLEDのヘリックス12を動かして、ERのAF−2機能をアセンブルする表面を作製する。AF−2は、ステロイド受容体コアクチベータ−1(SRC−1)または糖質コルチコイド受容体相互作用タンパク質1(GRIP1)などのp160クラスのコアクチベータタンパク質(コアクチベータ類)の結合表面を一緒になって形成する、ERのヘリックス3、5および12から構成される保存的疎水性ポケットからなる。コアクチベータ(「共調節因子(coregulators)」としても公知)はAF−2のヘリックスによって囲まれる疎水性のクレフト(cleft)中に突出するLXXLLから構成されるいくつかの繰り返しのアミノ酸モチーフを含む。このコアクチベータはヒストンアセチラーゼ活性を保有する。遺伝子活性化はERおよびコアクチベータタンパク質がERE上に複合体を形成した後に生じ、これがDNAに結合したヒストンタンパク質のアセチル化を生じると考えられる。ヒストンの活性化は、クロマチン構造を変化し、その結果ER/共調節因子複合体がEREと基本的転写タンパク質との間に架橋を形成し得、これが標的遺伝子のTATAボックス領域でアセンブルされて遺伝子転写を開始する。
【0078】
エストロゲン補充療法
ごく最近まで、閉経後エストロゲン補充は膣委縮の症状を治療するために広く用いられていた。全身のエストロゲン調製物、例えば、経口エストロゲン丸剤および経皮エストロゲンパッチは、他の閉経期症状、例えば、ほてりを緩和すること、または閉経後の骨密度損失を防ぐことを追究することに向けられてきた。しかし、過去10年間にわたって、無作為化臨床試験では結論として、全身のエストロゲン補充は、子宮内膜増殖症およびエストロゲン反応性の癌に加えて、心血管系および静脈血栓性疾患のリスクを増大することが示されている。さらに、エストロゲン補充療法は、膣委縮を有している高齢の女性ですでに広がっている尿失禁などの他の泌尿生殖器の問題のリスクを増大するようである。例えば、Women’s Health Initiative trialsでは、拮抗無しで(unopposed)エストロゲンを投与されている女性は、プラセボに比較して尿失禁を発症するリスクが52%高く、併用してエストロゲンに加えてプロゲスチンを投与されている女性は、プラセボに比較してリスクが39%高かった。
【0079】
膣クリーム、膣リングおよび徐放性膣錠剤の形態での膣のエストロゲン療法はまた、膣の乾燥を治療するのに有効であることが示されている。これらの治療は全身のエストロゲン調製物よりも低い血清エストラジオールレベルを生じるので、それらは心血管系疾患、静脈血栓塞栓症、浸潤性乳癌および子宮内膜増殖症のリスクが低くなると考えられる。にもかかわらず、エストロゲンの全身吸収は膣エストロゲン投与とともに、特に治療の開始時に、膣上皮が薄くかつ委縮するとき生じる。結果として、膣エストロゲン(1日あたり100〜400μgのエストラジオール)を用いる女性は、同時にプロゲスチンをとって、子宮内膜増殖症を防がなければならない。
【0080】
低用量の膣エストロゲン療法(1日あたり10〜100μgのエストラジオール)は血清エストラジオールレベルにごくわずかな変化を生じると考えられるが、数人の研究者らは、「初回通過」効果が生じ得、ここでは膣エストロゲンは、局所の静脈を介して子宮に移動し、全身の送達で生じる効果よりも大きい効果を発揮すると信じている。結果として、多くの臨床家は依然として、子宮内膜癌を発症するリスクが平均よりも高い女性ではこれらの治療の長期の使用を避けることを好む。いくつかの小規模の研究では、低用量の膣エストロゲンで治療された女性で子宮内膜増殖が生じ得るが、他のトライアルではこれらの治療での増殖を証明していないことが示唆されている。
【0081】
選択的エストロゲン補充モジュレーター(Selective Replacement Modulators)(SERMs)
公知のSERMは、エストロゲン受容体の作用をアンタゴナイズおよびアゴナイズする。それらの固有の薬理学的作用によって別個のSERMが組織選択性を通じてその作用を発揮することが可能になり、ここでそれらは、乳房組織の場合のようにアンタゴナイズするか、または骨組織の場合のようにアゴナイズする。それらの作用は両方のエストロゲン受容体を通じ、2つの公知のエストロゲン受容体のうちの1つに対して選択性を呈する現在利用可能なSERMというのはない。
【0082】
選択的エストロゲン受容体モジュレーター(SERM)は、骨または子宮に対してエストロゲン様効果を有するだけでなく、膣または外陰の委縮の症状および合併症に潜在的な治療としても探究されている。SERMラロキシフェンの1つの二重盲検のプラセボコントロール治験では、薬物対プラセボで治療した女性のうちわずかな割合が泌尿生殖器の脱出のために手術を要することが見出された。いくつかの小型の無作為化治験で、プラセボに対してSERMのラソフォキシフェン(lasofoxifene)を投与されている女性では膣成熟指数および膣pHの改善が見出された。いくつかのSERMでは泌尿生殖器管におけるエストロゲン受容体の下方制御が生じるので、それらはまた膣または外陰の委縮の症状を悪化させる可能性がある。さらに、SERMは、ほてりのような他の困難な閉経期症状の重症度を悪化し得、このためにSERMは閉経期女性に対して膣委縮の治療にはあまり魅力的ではない。
【0083】
ERE経路におけるSERMの効果
エストロゲンとは異なり、SERMはERE経路を活性化しない。その代わりに、SERMはERE経路に対するエストロゲンの効果を競合的にブロックする。エストロゲンと同様に、SERMはERαおよびERβに対して高い親和性で結合し、シャペロンタンパク質の解離、ERの二量体化およびEREへのERの結合を引き起こす。従って、SERMのアンタゴニスト作用は、プロモーター領域へのERの結合に対して遠位の段階で起こる。SERMのアンタゴニスト作用の分子的機構は、ERαおよびERβのLBDの結晶化によって明らかになっている。E2、タモキシフェン、およびラロキシフェンが同じ結合ポケットに結合することは、ERのLBDの構造から明らかである。しかしながら、タモキシフェンおよびラロキシフェンは、E2では欠失している嵩高い側鎖を含んでいる。ERのX線構造によって、SERMの嵩高い側鎖が、LBDの移動を妨げ、これが機能的なAF−2表面の形成を防ぐことが明らかになった。意外にも、SERMがLXXLLモチーフと類似であるヘリックス12におけるERα配列(LXXML)と結合するとき、AF−2表面の疎水性クレフトと相互作用してコアクチベータ認識部位を塞ぐ。したがって、エストロゲンとは異なり、SERMは機能的なAF−2表面を作製しない。このことはコアクチベータの結合を妨げる。コアクチベータタンパク質はSERM存在下ではAF−2表面と結合しないため、活性化経路は急激に停止される。補充されるコアクチベータの代わりに、SERMと配位したERはN−CoRなどのコリプレッサーを補充する。
【0084】
これらの研究によって、SERMのアンタゴニスト特性が少なくとも3つの要因に起因することが実証された。第一に、SERMはエストロゲンと同一の結合ポケットに結合し、エストロゲンのERへの結合を競合的にブロックする。第二に、SERMは、ERE経路の転写活性化に必要なコアクチベータタンパク質とのERの相互作用を妨げる。第三に、SERMは、遺伝子の転写活性化を防ぐコリプレッサーを補充する。SERMのこれらの作用が、ラロキシフェンおよびタモキシフェンが乳房細胞中でアンタゴニストとして作用して乳癌の発症を阻害する方法を説明する可能性が最も高い。
【0085】
SERMはまた、AP−1エレメントを有する遺伝子の活性化ではE2より効果的である。実際、E2はAP−1エレメントのSERM媒介による活性化のアンタゴニストである。SERMはAP−1経路活性化により、骨および子宮内膜などの組織においてアゴニスト作用を呈すると想定される。興味深いことに、SERMはERβ存在下ではAP−1経路の活性化にさらに強力であって、このことはSERMがERβを豊富に含む組織中でより効率的にAP−1経路の引き金になるであろうことを示す。エストロゲンはSERMに比べてAP−1経路の活性化にはかなり弱いため、エストロゲン媒介性の乳癌発生におけるAP−1経路の役割は不明瞭である。しかしながら、AP−1経路は、乳腺腫瘍におけるタモキシフェン抵抗性に関わる場合があると提唱されている。
【0086】
本発明の態様に従い、以下を実証する研究を行った。ERE−tk−Lucの活性化に、ERβはERαより弱く、TNF−RE−tk−Lucの抑制に、ERβはERαより効果的である。そして、ERβはERE−tk−LucのERα媒介性の転写活性化を阻害する。詳細な実験は本明細書において以降の実施例の節で考察する。
膣および外陰部の委縮
【0087】
閉経期膣委縮の発現は、循環中のエストロゲンの低下と関連している。閉経期間から閉経後へ、血清エストロゲンのレベルは、約400pg/mlから10pg/ml未満まで低下することが示されている。エストロゲン補充療法は膣乾燥の治療に首尾よく用いられている。その効果は外陰部および膣の管におけるエストロゲン受容体のアゴニスト性刺激を介して達成されると仮定される。
【0088】
定義および疫学
膣の症状、例としては、乾燥、刺激、そう痒、出血および性交疼痛は、女性が閉経期に移行するにつれて増大し、閉経時期および閉経後早期の女性のうち約30%、閉経後後期の女性では最大47%がこれらの愁訴を示す。膣の愁訴の自然な病歴は完全には明らかでないが、他の閉経期の症状、例えば、経時的に徐々に改善するほてりとは異なり、これらの症状は一般に永続して加齢とともに悪化する場合さえある。
【0089】
閉経後の膣の症状は一般に、膣粘膜の蒼白、乾燥、脆弱性およびシワの減少を含む理学的検査所見をともなう。閉経前女性に比較して、膣の症状を有する閉経後の女性は一般に、膣の血流および分泌、コラーゲンのヒアリン化、エラスチンの断片化、および膣結合組織の増殖が低下している。膣上皮細胞は、成熟の障害およびグリコーゲンを貯蔵し水素イオンを分泌してpHのレベルを低く維持する能力の低下を示す。定量的な膣上皮細胞の細胞学では一般に、傍基底(未熟)である膣上皮細胞の割合が閉経前女性での5%未満に比較して20%を超えるということが明らかになっている。閉経前女性で酸性である膣液は、典型的には5.0未満のpHで、より中性になる。
【0090】
さらに高齢の女性で観察される症状、理学的所見および他の変化の集合は一般に膣委縮または萎縮性膣炎と呼ばれる。泌尿器症状、例えば、尿意切迫および排尿障害はまた、膣委縮が泌尿器管下部の隣接組織の委縮または炎症(膣または外陰部の委縮)を伴う場合に生じる。エストロゲンでの治療は、膣で多くの細胞学的および生理学的変化を改善し、このことはエストロゲン不足がこれらの変化の病因に主要な役割を果たすことを示唆している。しかし、血清エストロゲンのレベルが低いことは膣の症状に相関するが、エストロゲンレベルは、膣の保湿剤を含むエストロゲン以外の使用で改善され得る閉経後の膣の細胞学的および生理学的変化のいくつかとは相関しない。
【0091】
他の閉経期症状、例えば、ほてりおよび寝汗とは異なり、膣の症状は閉経期の発現の5年より後に発症して、女性が規則的な月経周期を失った後数十年持続する場合が多い。疫学的な研究によって、膣の乾燥は閉経前女性の3%〜22%、閉経時期の女性の7%〜39%、および閉経後の女性の17%〜47%に影響することが示唆される。膣委縮に対する多くの研究は、白人の女性で行われているが、膣乾燥の罹患率は黒人女性およびラテン系女性ではさらに高い場合がある。
【0092】
病態生理学
生殖年齢の間には、エストロゲンは、膣上皮細胞によるプロトン分泌促進によって膣液の酸性度を維持するのに重要な役割を果たすことが示されている。エストロゲンが膣上皮細胞を刺激してグリコーゲンを産生かつ貯蔵し、グリコーゲンが次に正常には膣壁にコロニー形成する乳酸菌によって乳酸に代謝されることも示されている。結果として得られた低い膣のpH(<5.0)は、膣および尿管の感染のリザーバーとして機能する病原性グラム陰性細菌の増殖を阻害するように機能する。エストロゲンはまた、膣の壁の結合組織のコラーゲンの組成および架橋を維持するのに役割を果たすと考えられるが、この正確な機序は十分理解されてはいない。
【0093】
循環中のエストロゲンレベルの有意な低下を伴う閉経期および他の状態(例えば、卵巣摘出術、抗エストロゲン療法、免疫学的障害)の間、膣上皮細胞の正常な機能が乱される。グリコーゲン産生およびプロトン分泌の低下の状況では、膣のpHは6.0〜7.0に増大する。エストロゲン欠乏または加齢のいずれかに関連する、膣粘膜における他の変化としては、結合組織の増殖、エラスチンの断片化、およびコラーゲンのヒアリン化が挙げられ、これが膣壁の脆弱性の増大を生じる。
【0094】
キバナオウギおよびナイモウオウギ
キバナオウギおよびナイモウオウギという植物は総称してオウギ(Radix astragali)と呼ばれる。オウギはキバナオウギ(ナイモウオウギ)の乾燥された根である。この草木はまた、中国名(Huang Qi:ホアン・チー)および一般名黄耆、ホアン・キー(huang ky)、ホアン・キー(huang−chi)、ホアンゴー(huangggoi)、ホアンキー(huangqi)、hwanggi(ホワンギィ)、膜性ミルクベッチ(membranous milk vetch)、ミルクベッチ(milkvetch)、モンゴリアンミルクベッチ(Mongolian milk−vetch)、ネイモン・ホアンキー(neimeng huangqi)、オギ(ogi)、オウギ(ougi)およびゾンフェンマオマイトン(zhongfengmaomaitong)とも呼ばれる。
【0095】
オウギは約16〜36インチの高さの多年生植物である。オウギは、中国、朝鮮民主主義人民共和国、モンゴルおよびシベリアに自生する。この植物は、中国北部および朝鮮民主主義人民共和国で商業的に栽培され、春と秋に収穫される。この根はひげ根および根茎を取り除かれ、次に日光で乾燥される。
【0096】
この根は円柱状であって、比較的太い長さ30〜90cm、径が1〜3cmのいくつかの分岐がある。この根の表面の色は淡い黄褐色または淡褐色から濃褐色であって、不規則な、縦方向のシワまたは溝がある。この質感は硬く粘りが強く、破砕が困難で、裂け目は極めて線維性であって、デンプン質である。樹皮は黄白色である。この樹は淡黄色で放射状の条線および亀裂がある。この樹の中心はコルク様で、腐った木の様な外見、黒褐色または空洞の場合もある。
【0097】
ハナスゲ
ユリ(ユリ科)(別名、ツルボラン(Asphodelaceae)科のハナスゲ(Rhizomae Anemarrhenae asphoeloides Bunge)はまた、中国名ジ・ムー(Zhi Mu)とも呼ばれる。その他の一般名は特定されていない。ハナスゲは0.5m×1mまで成長する多年生の常緑植物である。8月から9月までが花の時期である。この花は雌雄同花である(雄性器官および雌性器官の両方を有する)。
【0098】
この植物は河北省、陝西省および内モンゴルという中国北部の省で商業的に栽培されている。この植物は、商業的に栽培されており、かつ春と秋に収穫される。根茎が細根から取り除かれ、次に日光で乾燥される。
【0099】
この根は長く、平らで、曲がっており、2〜3の分岐がある。根の表面の色は淡褐色から濃褐色であって、根の中心には細長い溝があって、これは堅い節で終わっている。この根は黄色っぽい線維性の葉脚を有し、1つはわずかに持ち上がって、シワおよびまだらな根および線維性の瘢痕がある。この質感は硬く脆弱で、破砕が容易で、裂け目は極めて線維性であって、デンプン質である。この樹は象牙色である。この樹の中心はコルク様である。
【0100】
イノコズチ
ヒユ(Amarathaceae)科のイノコズチ(Radix Achyranthes bidentata Bl)はまた、中国名ホワイ・ニウ・シイ(Huai Niu Xi)および一般名、二鋸歯状アマランス(two−toothed amaranthus)および牛膝(ごしつ)(oxknee)としても公知である。イノコズチは直立の多年生植物であって、細長くまとまりのない枝、楕円形の葉、および緑白色の花が末端の刺の上にあり、1mの高さまで育つ。
【0101】
イノコズチは、主に河南省で栽培される。この植物は夏に収穫される。地上部が根から切断されて、根だけが用いられる。この根が日光で乾燥される。
【0102】
この根は長さ15〜50cm、径が0.4〜1cmの円柱状である。表面の色は灰黄色で細長いシワおよび小さく長い皮目がある。その質感は硬く脆弱で、破砕が容易である。樹皮は黄白色である。この断面は滑らかでかつ黄褐色で中心に髄がある。維管束が断面中に見える。
【0103】
【化2】

【0104】
カリコシンは選択的エストロゲン受容体β活性を有するイソフラボノイドである。これは、キバナオウギおよびナイモウオウギから抽出される。カリコシンの化学式はC16H12O5である。カリコシンの分子量は284であると測定された。研究によって、カリコシンは、ERβ選択的転写活性を生じ、いずれの受容体にもアンタゴニスト様の効果は有さないことが示された。カリコシンは薬学的組成物中に薬学的に許容可能な塩の形態で存在してもよいが、カリコシンは、その遊離型で(塩ではなく)十分な溶解度のものであると考えられ、特定の好ましい実施形態では、カリコシンが組成物中に塩型で存在する必要性はないと考えられる。それにもかかわらず、「カリコシン」が本明細書で出現する場合、その用語は特段明記しない限り、遊離型および塩型の両方を包含するものとする。
【0105】
【化3】

【0106】
ニアソールは選択的エストロゲン受容体β活性を有するフェニルプロパノイドである。これは、ハナスゲから単離される。ニアソールの化学式はC17H16O2である。ニアソールの分子量は252であると測定された。研究によって、ニアソールは、両方のエストロゲン受容体のサブタイプに等しい親和性で結合するが、これはERβ転写活性のみを生じることが示された。さらに、ニアソールはいずれの受容体にもアンタゴニスト様の効果は有さないことが示された。ニアソールは薬学的組成物中に薬学的に許容可能な塩の形態で存在してもよいが、ニアソールは、その遊離型で(塩ではなく)十分な溶解度のものであると考えられ、特定の好ましい実施形態では、ニアソールが組成物中に塩型で存在する必要性はないと考えられる。それにもかかわらず、「ニアソール」が本明細書で出現する場合、その用語は特段明記しない限り、遊離型および塩型の両方を包含するものとする。
【0107】
四環系イソフラボン(TCIF)
【化4】

【0108】
TCIFは選択的エストロゲン受容体β活性を有するイソフラボノイドである。これは、イノコズチから抽出される。TCIFの化学式はC16H10O7である。TCIFの分子量は314であると測定された。研究によって、TCIFは、エストロゲン受容体β(ERβ)選択的転写活性も生じることが示された。さらにTCIFはいずれの受容体にもアンタゴニスト様の効果は有さないことが示されている。TCIF(四環系イソフラボン)は薬学的組成物中に薬学的に許容可能な塩の形態で存在してもよいが、四環系イソフラボンは、その遊離型で(塩ではなく)十分な溶解度のものであると考えられ、特定の好ましい実施形態では、四環系イソフラボンが組成物中に塩型で存在する必要性はないと考えられる。それにもかかわらず、「四環系イソフラボン」(すなわち「TCIF」)が本明細書で出現する場合、その用語は特段明記しない限り、遊離型および塩型の両方を包含するものとする。
【0109】
抽出の方法
いくつかの実施形態では、本発明はキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチという植物種から植物化学物質の精製された抽出物を単離する方法を包含する。いくつかの実施形態では、植物化学物質の精製された抽出物は、第1の抽出および第2の抽出を行うことによって得られる。
【0110】
いくつかの実施形態では、この第1の抽出は以下の工程、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを、第1の溶媒中で分散して、第1の混合物を形成する工程と、この第1の混合物を加熱する工程と、この第1の溶媒を除去して第1の抽出物を得る工程とを包含する。いくつかの実施形態では、この第1の溶媒は、エタノールおよび水の溶液である。
【0111】
この植物が第1の溶媒中に分散されるとき、本発明は、植物全体または植物の任意の一部(単数または複数)、例えば、根、樹皮、木部、葉、花々(すなわち花、例えば、萼片、花弁、雄しべ、雌しべなど)、果実、種子および/または任意の前述の一部もしくは混合物の使用を意図する。さらに、この植物またはその一部は、新鮮な切り取りであっても、乾燥されていても(例としては、凍結乾燥)、凍結であっても、その他であってもよい。さらに、本発明は、必要に応じて、植物種を最初に粉砕してその容積に対する表面積の比を増大し、同時に抽出プロセスの効率を増大することを包含する。植物を粉砕する方法としては、粉砕(grinding)、寸断(chopping)、混合(blending)、破砕(shredding)、製粉(pulvering)、粉砕(triturating)などが挙げられる。
【0112】
いくつかの実施形態では、この第1の混合物は約10℃〜約60℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約15℃〜約50℃の温度まで加熱される。いくつかの実施形態では、この第1の混合物は約20℃〜約40℃の温度まで加熱される。当業者は、一方の抽出効率と他方での物理化学的安定性との間に適切なバランスが導かれるべきであることを理解するであろう。
【0113】
溶媒と植物物質が一旦組み合されれば、それらは必要に応じて、植物物質から抽出媒体へのエストロゲン様化合物の十分な交換が確実になるように攪拌され、そしてその植物物質から抽出媒体への有用な量の植物化合物の抽出に十分な時間接触させられる。いくつかの実施形態では、この第1の混合物は約2〜約6時間加熱される。いくつかの実施形態では、この第1の混合物は約 〜約4時間加熱される。この後に、第1の抽出物を植物物質から分離する。このような分離は当該分野で認識される方法によって、例えば、濾過、デカントなどによって達成される。
【0114】
いくつかの実施形態では、この第1の溶媒はエバポレーションによって第1の抽出物から除去される。いくつかの実施形態では、このエバポレーションは約40℃〜約60℃の温度で起こる。
【0115】
いくつかの実施形態では、この第2の抽出は、以下の工程、この第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、この第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、この非水性層を収集する工程と、いずれの非活性化合物も除去する工程と、この第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程とを包含する。いくつかの実施形態では、この第2の溶媒はエタノールおよび酢酸エチルの溶液である。いくつかの実施形態では、この非水性層は収集された後に乾燥される。いくつかの実施形態では、任意の非活性化合物はシリカ上で、乾燥された非水性層を濾過することによって除去される。いくつかの実施形態では、このシリカは酢酸エチル中に懸濁される。いくつかの実施形態では、この第2の溶媒は、植物化学物質の精製された抽出物からエバポレーションによって除去される。
【0116】
水が抽出溶媒である場合、精製水が適切である。精製水としては蒸留水、脱イオン水、注射用水、限外濾過水およびその他の形態の精製水が挙げられる。
【0117】
本発明のいくつかの実施形態で使用されるエタノールは穀物エタノールである。詳細には、これは非変性エタノール(例えば、必要に応じてある程度の水、例えば、最大約10%の水を含む純エタノール)である。
【0118】
本発明のいくつかの実施形態で利用される酢酸エチルは、エタノールおよび酢酸由来のエステルである。これは好ましくは純粋な酢酸エチルであるが、ある程度の水を含んでもよい。
【0119】
いくつかの実施形態では、純粋な抽出物を1つ以上の有機溶媒と組み合わせてもよい。このような有機溶媒は、種々の極性の溶媒であってもよい。いくつかの実施形態では、適切な溶媒としては、エチル 酢酸エチル、アセトニトリル、ヘキサン、(C1−C4)アルコール(例えば、メタノール、エタノール、i−プロパノール、n−プロパノール、n−ブタノール、t−ブタノール、s−ブタノール、i−ブタノール、など)クロロホルム、アセトン、シクロヘキサン、シクロヘプタン、石油エーテルおよび他の溶媒、例としては、薬学的に許容可能な溶媒、およびヒトでの使用について安全食品認定(generally regarded as safe)(GRAS)されている溶媒が挙げられる。
【0120】
薬学的使用について抽出物を意図する場合、任意の追加の成分は薬学的に受容可能である。本発明による組成物をアッセイまたは生体に対する以外の他の用途での使用について意図する場合、追加の成分(単数または複数)は薬学的に受容可能であってもなくてもよい。
【0121】
組成物の処方
本発明による組成物は、発明の植物抽出物または本発明の発明植物抽出物を含む組成物を含む。このような実施形態では、本発明の組成物は必要に応じて、1つ以上の追加の成分を含む。このような追加の成分は不活性であっても活性であってもよい。不活性成分としては溶媒、賦形剤および他の担体が挙げられる。活性成分としては活性な薬学的成分(active pharmaceutical ingredient)(API)、例としては、本発明の植物抽出物と組み合わされて相乗活性を呈する成分が挙げられる。
【0122】
いくつかの実施形態では、この組成物は、純粋な抽出物または抽出物と1つ以上の追加の溶媒との組み合わせを含む。いくつかの実施形態では、この抽出物は、分配された抽出物またはさらに精製された抽出物を含む。分配または精製は、クロマトグラフィーを含めて種々の分離技術を用いて行われ得る。いくつかの実施形態では、この抽出物とは、抽出物中で活性剤をさらに濃縮するために陰イオン交換クロマトグラフィー、陽イオン交換クロマトグラフィー、逆相クロマトグラフィー、順相クロマトグラフィー、アフィニティークロマトグラフィー、または排除クロマトグラフィーによって得られる精製または分配された抽出物である。いくつかの実施形態では、この精製されるかまたは分配された抽出物は、高速液体クロマトグラフィー(HPLC)などの1つ以上の工程の液体クロマトグラフィーを介して得られる。いくつかの実施形態では、高速液体クロマトグラフィーは、実験規模高速液体クロマトグラフィーである。いくつかの実施形態では、HPLCは逆相クロマトグラフィーまたはイオン交換クロマトグラフィーである。分液漏斗または他の二相もしくは多相の分離機構における分離を含む、分離の他の手段も抽出物の精製または分配に用いられてもよい。
【0123】
いくつかの実施形態では、精製されるかまたは分配された抽出物は、溶媒、希釈液などの1つ以上の追加の活性成分または不活性成分と組み合されてもよい。いくつかの実施形態では、適切な溶媒としては、酢酸エチル、アセトニトリル、ヘキサン、(C1−C4)アルコール(例えば、メタノール、エタノール、i−プロパノール、n−プロパノール、n−ブタノール、t−ブタノール、s−ブタノール、i−ブタノールなど)、クロロホルム、アセトン、シクロヘキサン、シクロヘプタン、石油エーテルおよび他の溶媒、例としては、薬学的に許容可能な溶媒、およびヒトでの使用について安全食品認定(GRAS)されている溶媒が挙げられる。
【0124】
適切な追加の成分としては溶媒が挙げられる。溶媒は薬学的に許容可能な溶媒および薬学的に許容可能でない溶媒に細分され得る。この状況では、いくつかの薬学的に許容可能な溶媒としては、注射用水(WFI)が挙げられることが理解されるべきであり、この注射用水は、予め選択されたpHまたはpH範囲まで、例えば、約2〜約8、さらに具体的には約4.0〜約7.5、そしてさらに具体的には約4.9〜約7.2にpH調節されるかおよび/または緩衝化されてもよい。
【0125】
薬学的に許容可能な溶媒はさらに、1つ以上の薬学的に許容可能な酸、塩基、塩、または他の化合物、例えば、担体、賦形剤などを含んでもよい。薬学的に許容可能な酸としてはHCl、H2SO4、H3PO4、安息香酸などが挙げられる。薬学的に許容可能な塩基としては、NaOH、KOH、NaHCO3などが挙げられる。薬学的に許容可能な塩としてはNaCl、NaBr、KCl、などが挙げられる。酸および塩基は、特に、予め選択されたpHで、特に約2〜8の範囲のpHで、とりわけ約5.0〜約7.2の範囲で薬学的に許容可能な溶液を緩衝化するために適切な割合で添加され得る。
【0126】
いくつかの実施形態では、この組成物はさらに、活性な薬学的成分、エンハンサー、賦形剤、ならびにpHを調節する、組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む。着色剤の例としてはβカロテン、赤色2号および青色1号が挙げられる。防腐剤の例としてはステアリン酸、ステアリン酸アスコルビル、およびアスコルビル酸が挙げられる。矯味薬の例としてはメントールおよびシトラスの芳香が挙げられる。
【0127】
いくつかの実施形態では、本発明の薬物送達系は、吸収促進薬を含むことが有利である場合がある。「エンハンサー」という用語は、粘膜を横切る吸収を増大するか、および/またはバイオアベイラビリティを増大するように機能する任意の物質を意味する。いくつかの実施形態では、このような物質としては、粘液溶解剤、分解酵素インヒビター、および粘膜細胞膜の透過性を増大する化合物が挙げられる。所定の化合物が「エンハンサー」であるか否かは、インビボまたは良好なモデルの試験においてエンハンサーの有無で、薬物として関連しない小さい極性の分子を含む2つの処方物を比較することによって、およびその薬物の取り込みが臨床的に有意な程度まで増強されるか否かを決定することによって決定され得る。インビボでエンハンサーは、非刺激性であるか、および/またはなんら有意な刺激性の影響を有さない正常な細胞構成物に代謝されるはずなので、エンハンサーは、慢性毒性に関していかなる問題をも生じないはずである。
【0128】
いくつかの実施形態では、好ましい増強物質はリゾリン脂質、例えば、卵から入手可能なリゾホスファチジルコリンまたはダイズレシチンである。異なるアシル基を有する他のリゾホスファチジルコリン、ならびに同様の膜改変特性を有する、ホスファチジルエタノールアミンおよびホスファチジン酸から作製されるリゾ化合物を用いてもよい。アシルカルニチン(例えば、パルミトイル−dl−カルニチン−クロライド)が代替である。いくつかの実施形態では、適切な濃度は0.02〜20%(w/v)である。
【0129】
いくつかの実施形態では、適切な増強剤としては、キレート剤(EGTA、EDTA、アルギン酸塩)、界面活性剤(特に非イオン性物質)、アシルグリセロール、脂肪酸および塩、チロキサポールおよびSIGMAカタログ,1988、第316〜321頁(参照によって本明細書に援用される)に列挙される生物学的界面活性剤が挙げられる。また膜の流動性および透過性を改変する薬剤、例えば、エナミン(例えば、エチルアセトアセテートのフェニルアラニンエナミン)、マロン酸塩(例えば、ジエチレンオキシメチレンマロネート)、サリチル酸塩、胆汁塩および類似体およびフシジン酸塩が適切である。適切な濃度は最大20%(w/v)までである。
【0130】
アッセイでの組成物の使用
本発明による抽出物は、エストロゲン応答要素(ERE)の制御下で遺伝子のエストロゲン様活性を提供する。従って、いくつかの細胞では、本発明の抽出物はエストロゲン様の特性を保有する−すなわち、EREおよびER(ERα、ERβまたはその両方)を含んでいる細胞とEREの制御下で遺伝子の刺激を生じる本発明の抽出物とを接触させる。インビトロの細胞系では、本発明の抽出物によるERE媒介性の活性は、EREに作動可能に連結されている遺伝子の発現をもたらす。特定の実施形態では、ERと最小チミジンキナーゼプロモーターおよびルシフェラーゼ遺伝子に連結されたEREとのエストロゲン様相互作用は、ルシフェラーゼ発現の増強を生じる。従って、本発明の抽出物は、ルシフェラーゼのようなレポーター遺伝子に対して作動可能に連結されたERE含有プロモーターを有するERα+細胞株、ERβ+細胞株および/またはERα+/ERβ+細胞株を特定するために用いられ得る。本発明の抽出物はまた、ER+細胞株においてエストロゲン様効果を有する化合物を特定するための、アッセイ試薬として、例としては標準として用いられてもよい。
【0131】
このようなアッセイ方法の1つでは、本発明の抽出物は最初に、公知の活性または濃度で調製される。本発明の抽出物の定量化は都合の良いことには、容器を風袋測定すること、この容器内に容積が既知の抽出物を測定すること、エバポレーションまたは凍結乾燥によって抽出物を減らして、残渣を生じて、容器プラス抽出物の質量を得ることによって行う。容器プラス抽出物の質量と風袋の質量との間の質量の差がその抽出物の乾燥重量である。抽出物の容積に対する抽出物の乾燥質量の比が1単位容積あたりの濃度である。この抽出物を、その最初の形態で、前述の定量方法の結果を用いて使用し、その濃度を特定してもよい。その残滓をまた、水または別の適切な溶媒系の添加によって再構成して、濃度が既知の抽出物溶液を形成してもよい。
【0132】
一旦抽出物の濃度が判明すれば、検量線が作成される。一般にはER+細胞を、抽出物と接触させて、エストロゲン活性に関連するシグナルを記録する。具体的には、ER+細胞は、EREの制御下のレポーター遺伝子を有する。このER+細胞を、添加される抽出物の量に対する割合でレポーターシグナルを生じる本発明の抽出物と接触させる。この工程は複数のサンプルを同じ抽出物濃度で、異なる抽出物濃度で、またはその両方で用いることによって行われ得る。
【0133】
例としては、9つのサンプルを試験してもよい。最初の3つは最初の濃度、次の3つは最初のより半対数大きい濃度で、次の3つは最初によりも全対数大きい濃度である。次いでレポーターシグナルを観察し、記録して、得られたデータポイント(植物抽出物濃度対レポーターシグナル強度)を、従来の曲線あてはめ方法(例えば、最小二乗)によって検量線にあてはめる。
【0134】
抽出物のエストロゲン様効果を評価するために、抽出物を、EREの制御下にレポーター遺伝子を有するE+細胞と接触させる。このレポーター遺伝子シグナルを観察して、検量線と比較して、抽出物の相対的なエストロゲン様効果を定量化する。
【0135】
前述の方法で用いられるER+細胞株は、ERを天然に発現する細胞株、例えば、ヒト由来ER+乳房細胞癌細胞株であってもよい。いくつかの実施形態では、ER+組織は不死化ヒト細胞株、例えば、不死化骨髄または乳房細胞株である。例示的な細胞株としては、ヒト単球、骨芽細胞、悪性の乳癌および不死化乳房上皮細胞株が挙げられる。言及され得る特定の細胞株としてはU937、U2OS、MDA−MB−435およびMCF−7細胞株が挙げられる。他のER+細胞株(不死化細胞株を含めて)もまた用いられ得る。あるいは、ER+細胞株は、ERを天然には発現しない細胞株、例えば、ER発現ベクターで形質転換されている細菌細胞株であってもよい。
【0136】
ER+細胞株を、レポーター遺伝子を制御するEREを含んでいるプロモーターを有するベクターで形質転換する。例えば、ベクターとは、ERE、最小チミジンキナーゼプロモーター(tk)およびルシフェラーゼ遺伝子(Luc)を含んでいるウイルスベクターであってもよい。この構築物は、公知の方法によって標的細胞にトランスフェクトされ、ER−ERE−tk−Luk系の発現は、例えば、既知量のエストラジオール(E2)の存在下で推定のER+細胞に対して前述のアッセイを行うことによって確認される。ER+細胞の首尾よい形質転換を確認する他の方法としては、公知のER抗体での免疫染色法が挙げられる。
【0137】
ERE含有プロモーターとはERE配列およびプロモーター配列を含むDNAである。プロモーター配列は、最小チミジンキナーゼ(tk)プロモーター配列などの当該分野で認識されるプロモーター配列である。他のERE含有プロモーターが可能であって、本発明の範囲内である。EREおよびプロモーター配列は、一緒に作動してレポーター遺伝子の発現を制御する。本明細書に記載のとおり、エストロゲン様化合物(例えば、本発明の抽出物またはE2)は、ERに結合して、ER二量体を生じ、AF−2表面を形成する。次いでER二量体は、EREに結合し、プロモーターの制御下で遺伝子を活性化する。いくつかの実施形態では、EREはプロモーターの直接上流(5’側)であり、ここに直接連結される。
【0138】
レポーター遺伝子とは発現された場合検出可能なシグナルを生じる遺伝子である。ルシフェラーゼ遺伝子は、単一の試薬ルシフェリンの存在下で検出可能な光シグナルを生じるタンパク質ルシフェラーゼを生じるので、適切なレポーター遺伝子である。具体的には、ルシフェラーゼ遺伝子のcDNAは62kDaの酵素的タンパク質であるルシフェラーゼを生じるように発現される。このルシフェラーゼ酵素はMg2+および酸素の存在下でルシフェリンおよびATPの反応を触媒して、オキシフェリン、AMP、ピロリン酸塩(PPi)および放射光を形成する。放射光は、黄色−緑色(560nm)であり、標準的な光度計を用いて容易に検出できる。細胞内にはATP、O2およびMg2+が元々存在しているので、検出シグナル産生のために、このレポーター遺伝子は、ルシフェリン試薬の添加しか必要でなく、本発明のアッセイの使用には特に適している。当該分野で入手可能であると言える他のレポーター遺伝子としては、クロラムフェニコールアセチル基転移酵素(chloramphenicol transacetylase:CAT)、ネオマイシンホスホトランスフェラーゼ(neomycin phosphotransferase)(neo)、およびβ−グルクロニダーゼ(beta−glucuronidase)(GUS)が挙げられる。
【0139】
本発明のいくつかのアッセイ方法では、一種類以上のエストロゲン様化合物、SERMなどとの比較によって、抽出物をさらに特徴づけることが有用である。このようなアッセイ方法は本質的には前記のように実行され、この方法の適切な部分では本発明の抽出物の代わりに標準エストロゲン様化合物および/またはSERMの適切な置換を行う。
【0140】
本発明に従う抽出物はまた、TNF−RE媒介経路による遺伝子発現を抑制する。いくつかの場合は、本発明の抽出物は、特にTNF−REの制御下でレポーター遺伝子(例えばルシフェラーゼ(Luc)遺伝子)を有する細胞内で、インビトロでの遺伝子発現を抑制する。いくつかの場合は、本発明の抽出物は、単球およびマクロファージによって最初に産生されるサイトカインであるTNF−αの発現を抑制する。このサイトカインは、滑膜細胞および多様な組織中のマクロファージで見られ、かつ関節リウマチ(RA)に強く関係している。TNF−αは、他の炎症性疾患でも発現され、また細菌由来のエンドトキシンに対する応答としても発現される。TNF−REリプレッサー経路経由でのTNF発現のリプレッサーとして、本発明の抽出物はTNFの上昇したレベルに関連する炎症性障害の治療に関係する。
【0141】
本発明のいくつかの実施形態では、TNF REの制御下でレポーター遺伝子と同様、ERαおよびERβの一方、または両方を発現する細胞株を調製する。TNF REは一般的に、レポーター遺伝子の上流(5’側)であり、シグナル検出は本明細書で既に記載したとおり行われる。
【0142】
前述の細胞であるTNF REを含む細胞系はさらに、1コピー以上のER遺伝子、すなわちERα、ERβ、またはその両方を含む。前記方法に用いられるER+細胞株は、自然にERを発現する細胞株、例えばヒト由来ER+乳癌細胞株であってもよい。いくつかの実施形態では、ER+組織は、不死化ヒト細胞株、例えば、不死化骨髄細胞株、または乳房細胞株である。例示的な細胞株としては、ヒト単球、骨芽細胞、悪性乳癌、および不死化乳房上皮細胞株が挙げられる。言及することができる特定の細胞株としては、U937、U2OS、MDA−MB−435およびMCF−7細胞株が挙げられる。不死化細胞株を含む他のER+細胞株もまた用いてもよい。あるいは、ER+細胞株は、ER発現ベクターによって形質転換された細菌細胞株のような、自然にはERを発現しない細胞株であってもよい。
【0143】
予め決定した量のルシフェリン存在下で、かつエストロゲン様化合物、例えば、E2または本発明の抽出物の非存在下で、この細胞系は、「コントロール強度」または「ベースライン強度」と呼ばれる強度で、黄色の光(560nm)を放射する。560nmの光の放射は、光学密度ユニット(O.D.560nm)で簡便に定量化できる。エストロゲン様化合物、例えばE2または本発明の抽出物の一つの添加に際して、560nmの光放射の強度はコントロールに比べて減弱する。意外にも、タモキシフェンまたはラロキシフェンなどのSERMの存在下で、ルシフェラーゼ発現は増加し、560nmの光放射強度もまた増大する。したがって、本発明の抽出物は、エストロゲン様TNF REで制御された遺伝子発現の抑制を誘発し得る。
【0144】
TNF REを含む細胞系は、本発明に従ったアッセイ方法に使用できる。本発明のアッセイ方法では、ルシフェラーゼ活性の減弱(すなわち560nmの光放射の減少)は、エストロゲン様活性の増大と相関し、一方ルシフェラーゼ活性の活性化(すなわち560nmの光放射の増大)は、抗エストロゲン様活性と相関する。検量線は、本明細書中に記載したように既知量の本発明の抽出物を用いて作成してもよい。このような検量線は、他の公知のエストロゲン様標準、または抗エストロゲン様の標準、例えば、E2またはいくつかの他の公知のエストロゲン様化合物、および/または抗エストロゲン様SERM、例えば、タモキシフェンまたはラロキシフェンを用いてさらに補強できる。
【0145】
次いで、形質転換されたER+細胞株由来の細胞を、候補化合物に曝露して、ルシフェラーゼシグナルを観察し、そのシグナルを本明細書中に記載された事前に準備された検量線(単数または複数)と比較する。コントロール(ベースライン)に比較してルシフェラーゼ活性の増加を引き起こす化合物は、抗エストロゲン様SERMとして特徴づけられ、一方でコントロールに対してルシフェラーゼ活性の減少を引き起こす化合物は、エストロゲン様として分類されるであろう。このエストロゲン様効果、または抗エストロゲン様効果は、ルシフェラーゼ発現の減少または増加の程度を、本発明の抽出物によって引き起こされた減少と比較することにより、そしてE2、タモキシフェン、および/またはラロキシフェンによって引き起こされたそれぞれのシグナルの減少または増加に対する比較によって、定量化され得る。
【0146】
本発明は、本発明の組成物を用いるインビボでのエストロゲン様方法を提供する。通常、インビボでの方法は、被検体のエストロゲン様作用をもたらすために十分な量の本発明の抽出物をこの被検体へ投与することを包含する。インビボでの方法は、エストロゲン様のEREの制御下での遺伝子の活性化、TNF−REの制御下での遺伝子の抑制(例えばTNF−α抑制)、またはその両方を生じるであろう。従って、このインビボでの方法は、インビボで様々な正の表現型効果を生じるであろう。
【0147】
被検体は、マウス、ラット、ウサギ、サル、チンパンジー、イヌ、ネコ、またはヒツジのような哺乳動物であってもよく、一般的には雌性である。被検体はまた、ヒト、特にヒトの女性であってもよい。いくつかの実施形態では、被検体は、閉経後、または卵巣全摘出後の、エストロゲン治療が必要な女性である。このような場合、被検体は、ほてり、不眠症、膣の乾燥、性欲減退、尿失禁、および抑うつなどの更年期症状に罹患している場合がある。他の場合、被検体は、骨粗鬆症に感受性であるか、または罹患している場合がある。適切なインビボの方法としては、エストロゲン補充療法に応答性の医学的症例の治療および/または予防が挙げられる。
【0148】
組成物での治療
キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを含む本発明による薬学的組成物の投与は、1つ以上の抽出物がその経路を介して標的組織に利用できる限り、一般的に使用される投与経路を介して行われるであろう。言及することができるいくつかの投与経路としては、以下が挙げられる。経口、経鼻、口腔内、直腸、膣および/または局所的(経皮)。あるいは、投与は正所性、皮内、皮下、筋肉内、腹腔内、または静脈内注射によってもよい。このような組成物は、上記に記載された、薬剤として許容可能な組成物として、通常は投与される。
【0149】
疾患、障害、症候群、状態、または症状の治療(treatment)(およびその文法的な変形として、例えば治療する、治療すること、治療された、など)は、臨床医が、このような治療を受ける被検体を特定して、その被検体へ本発明の組成物を投与するという工程を包含する。従って、治療とは被検体へ本発明の抽出物を投与することによって寛解、苦痛緩和、そうでなければ改善される可能性が高い疾患、症候群、状態または症状の診断を包含する。治療とはさらに、このような疾患、障害、症候群、状態または症状を寛解、苦痛緩和、そうでなければ改善するために適切なある量のキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を患者に投与することを包含する。治療とはまた、この疾患、障害、症候群、状態、または症状の同時の寛解、苦痛緩和、そうでなければ改善も包含する。いくつかの実施形態では、治療とは、疾患、障害、症候群、状態または症状の発現の予防または遅延(すなわち予防法)、疾患、障害、症候群、状態、または症状の進行の予防または遅延、ならびに/あるいは疾患、障害、症候群、状態、または症状の重症度の低減を意味する。更年期症状の場合には、治療には、膣および/または外陰部の委縮を含めて、種々の症状の苦痛緩和を包含する。
【0150】
骨粗鬆症治療には、骨量減少のリスクがある閉経後女性などのヒトの特定、および本発明の植物抽出物をこの女性に投与して、それにより骨量減少の重症度を低減、発現を遅延、または予防することが挙げられる。いくつかの実施形態では、骨粗鬆症の治療とは骨量の増大を包含し得る。
【0151】
疾患、障害、症候群、状態、または症状の予防(prevention)(およびその文法的な変形)としては、疾患、障害、症候群、状態、または症状を発生するリスクがある被検体を同定すること、およびその被検体に対してこのような疾患、障害、症候群、状態、または症状の発現を除去または遅延すると考えられるのに十分な量の本発明の抽出物を投与することが包含される。いくつかの場合は、予防としては、適格な標準の医療を適用して、ホルモン補充療法の必要性があると臨床医が考える閉経後の女性を特定すること、および本発明の抽出物をその女性に投与して、それによって1つ以上の更年期症状がブロックされるかまたは遅延されることを包含する。いくつかの実施形態では、骨粗鬆症の予防には、適格な標準の医療を適用して、骨粗鬆症発症のリスクがあると臨床医が考える閉経後の女性を特定すること、および本発明の植物抽出物をその女性に投与し、それによって骨量減少の開始がブロックされるかまたは遅延されることを包含する。
【0152】
苦痛緩和としては、疾患、障害、症候群、状態または症状の重症度、および数および/または発生頻度の低減が包含される。更年期症状の苦痛緩和としては、ほてり、不眠症、尿失禁、抑うつなどの頻度および/または重症度を低減させることが挙げられる。
【0153】
キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物の1日量
更年期症状、例えば膣および/または外陰部の委縮の治療のための本発明に従う組成物(キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を含む)の一日量は、患者の年齢、体重、健康状態および他の性質に依存して変化するであろう。一般に、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチの抽出物を含む組成物の一日量は、1日あたり約0.001〜約100gという抽出物の乾燥重量であろう。いくつかの実施形態では、この用量は、1日あたり約1〜約100gの乾燥重量、1日あたり約1〜約50gの乾燥重量、1日あたり約10〜約50gの乾燥重量、1日あたり約20〜約50gの乾燥重量、1日あたり約10gの乾燥重量、1日あたり約20gの乾燥重量、1日あたり約30gの乾燥重量、1日あたり約40gの乾燥重量、1日あたり約50gの乾燥重量、1日あたり約40〜約100gの乾燥重量、1日あたり約50gの乾燥重量、1日あたり約60gの乾燥重量、1日あたり約70gの乾燥重量、1日あたり約80gの乾燥重量、1日あたり約90gの乾燥重量、または1日あたり約100gの乾燥重量であろう。1日あたり100gを超える乾燥重量の用量、例えば、1日あたり約100〜約250gの乾燥重量も本発明のいくつかの実施形態では考えられる。しかし適切な応答は、1日あたり約20〜約80、特に約30〜約70グラムの乾燥重量の範囲の用量で得られるであろう。
【0154】
一日量は、単回単位で投与されてもよいし、または1日に2、3、4回以上投与される剤形を含む分割された一日量で投与されてもよい。現行の好ましい投薬計画は、1日1回(q.d.)または1日2回(b.i.d.)投与であって、例えば、初回の投与は朝食の前、同時または後に投与され、任意の第2の用量は、昼下がりから就寝時に、例えば、夕食時に投与される。いくつかの実施形態では、1日量は、1つ以上香味料、味覚マスキング剤および/または甘味料を必要に応じて含む、お茶として1日1回(q.d.)または1日2回(b.i.d.)のいずれかで摂取される。
【0155】
一日量は、他の形態で、特に経口投与に適切な他の物理的形態で投与されてもよい。いくつかの実施形態では、このような他の物理的形態としてはカプセルが挙げられる。本発明による組成物を投与するために適切な他の経口剤形としては錠剤(これは必要に応じて、1つ以上の賦形剤、例えば、結合剤、崩壊剤、希釈剤、流動促進剤またはそれらの2つ以上の組み合わせを含む)、カプセル(これは、錠剤とは異なる形状であるがそれ以外は組成は同じであることが理解される)、チュアブル錠、溶液または懸濁液用の散剤などが挙げられる。チュアブル錠および溶液または懸濁液用の散剤は、1つ以上の賦形剤、例えば、香味料、味覚マスキング剤、甘味料および/またはそれらの2つ以上の組み合わせを含んでもよい。
【実施例】
【0156】
本発明は、以下の図解および非限定的な実施例を参照することで、さらに完全に理解され得る。
【実施例1】
【0157】
ERβは、ERE−tk−Lucの活性化においてERαよりも弱い:E2の転写活性化に対する効果は、ルシフェラーゼレポーターcDNAに連結された最小チミジンキナーゼ(tk)プロモーターの上流の古典的なEREを含むプラスミド、およびERαまたはERβの発現ベクターをトランスフェクトすることによって検査された。E2は、ヒト単球U937細胞において、ERα存在下ではERβ存在下に比べてEREの活性化を10倍高くしたが、EC50値は同程度であった。
【実施例2】
【0158】
ERβは、TNF−RE−tk−Lucの抑制においてERαよりも効果的である:E2のERαおよびERβ媒介性転写抑制に対する効果を、腫瘍壊死因子応答要素(tumor necrosis factor−response element)(TNF−RE)として公知の、TNF−αプロモーター中の−125から−82の領域を用いて比較した。TNF−αは、tkプロモーターの上流のTNF−RE(−125〜−82)(TNF−RE−tk−Luc)の3コピーを5〜10倍活性化した。E2は、ERαおよびERβの存在下で、TNF−RE−tk−LucのTNF−α活性を60〜80%抑制した。しかしながら、ERβはERαに比べて、抑制におよそ20倍効果的であった(それぞれのIC50は、ERαで241pMであったのに対して、ERβで15pM)。天然の−1044〜+93のTNF−αプロモーターの抑制に、ERβはERαに比べてより効果的であることが見いだされた。従って、ERαはERβよりも転写活性にかなり効果的であり、一方でERβはERαよりも転写抑制に効果的である。E2と対照的に、抗エストロゲン剤であるタモキシフェン、ラロキシフェンおよびICI 182,780は、TNF−RE−tk−Lucを2倍活性化した。さらに、これらの抗エストロゲン剤はE2によって誘発された抑制を無効にした。
【実施例3】
【0159】
ERβは、ERE−tk−LucのERα媒介性転写活性化を阻害する:驚くべきことに、ERαまたはERβがU937細胞において同時発現された場合、ERαによる活性化が著しく阻害された。これらのデータは、ERβがERαによるERE−tk−Lucの活性化に対して抑制的効果を発揮することを示す。同様の結果が乳癌細胞株、MDA−MB−435で観察された。他の研究者は異なる細胞型で、ERβのERαのトランス活性化に対する同様の抑制効果を見いだしている。これらの研究は、ERαおよびERβのERE−tk−Lucに対する異なる活性化、ならびにERα媒介性転写に対するERβの抑制効果が細胞型特異的ではなく、ERの内因的の特質による結果であることを示す。二量体形成を防ぐERβのヘリックス11の変異がその抑制活性を阻害するので、ERβによるERαの抑制には、ERα/ERβヘテロ二量体の形成を必要とする。
【実施例4】
【0160】
VG101という薬物は3つの異なる植物種のエタノール水性抽出物の酢酸エチル部分の淡褐色から黄色の油状物である。VG101は種々の成分を含み、その3つはERβ選択的アンタゴニストであることが確認された。
【0161】
ニアソール、カリコシンおよび四環系イソフラボン(TCIF)はVG101中の既知の活性成分である。ニアソールはハナスゲ(ユリ科)の根茎から単離される;カリコシンは、キバナオウギおよびナイモウオウギ総称してオウギ,(マメ科)の根から単離される;そしてTCIFはイノコズチ(ヒユ科)の根から単離される。
【表1】

1.草木の名称は、国際植物命名規約(東京規約,1994)に従って記載する。
2.伝統的な中医学では指定された中国名は常に1つの特異的な植物種を指定するものではない。従って特定の種を定義することが重要である。
【0162】
VG101は、鍵の掛けられた冷暗所で保管しなければならない。
【実施例5】
【0163】
10日間0.5mg/日の用量で卵巣摘出マウスに対して膣内投与された場合、VG101は、正常な成熟の非角質化扁平上皮およびグリコーゲン豊富な空胞化細胞を上皮の上半分で生じた。最小の表在性の慢性炎症があったが、エストロゲン治療は、肥厚性の顆粒層を伴っている無核の角質化扁平細胞の表層によって特徴付けられる角化亢進を伴う扁平上皮を生じた。
【0164】
マウスモデルでは、コントロールと比較した場合、VG101は、分泌腺があり脱落膜化間質が弱い、さらに正常な黄体期子宮内膜を生じた。VG101投与は、子宮内膜腺の増殖を伴わないが、エストロゲン治療は、子宮内膜症(インサイチュの癌腫に気がかりな、女性での複雑な異型過形成と等価)を生じた。この腺は介在する間質なしに背中合わせに形成する。それらはまた、核小体を有する顕著な異型核という多数の有糸分裂像を示した。1つの領域では、この腺は広い茎および厚い線維性コアを有するポリプに見えるものを生じる。
【実施例6】
【0165】
VG101中の草木抽出物および活性な化合物がエストロゲン様活性を有するか否かを決定するために、最小チミジンキナーゼ(tk)プロモーター(ERE−tk−Luc)の上流のエストロゲン応答要素(ERE)の調節に対する効果を検査した。U2OS骨肉腫細胞をERE−tk−LucおよびヒトERαまたはERβの発現ベクターを用いて同時トランスフェクトした。VG101中の抽出物およびそれらの活性な化学的成分は、ERβではERE−tk−Lucの用量依存性活性化を生じたがERαでは生じなかった(図1A〜図1C)。VG101中の1〜125μg/mlの範囲におよぶ量の草木抽出物およびそれらの活性な成分の量は、10nMのエストラジオール(E2)に等しい活性を生じた(図1A〜図1C)。
【実施例7】
【0166】
ERアンタゴニストであるICI 182,780、ラロキシフェン(Ral)およびタモキシフェン(Tam)は、VG101中の草木抽出物およびそれらの活性な成分による活性化をブロックし(図2A〜図2D)、このことはVG101の効果がERβを通じて媒介されることを示している。
【実施例8】
【0167】
エストロゲンは、炎症性遺伝子の発現を抑制することによる抗炎症特性を保有する。TNFα遺伝子の抑制は、重要な機構であり得、ここでエストロゲンは炎症性状態を妨げる。VG101中の草木抽出物およびそれらの活性な化学的成分がTNFα遺伝子の発現を抑制するか否かを検討するため、テトラサイクリン誘導性のERαまたはERβ細胞をE2またはVG101中の草木抽出物およびそれらの活性な化学的成分で処置した。これらの遺伝子の基本的な発現は極めて低いので、抑制を観察するためにはこれらの遺伝子を、TNFαを用いて活性化することが必要である。TNFαはTNFαのmRNAの大きな増大を生じ(図3A〜3B)、これは、U2OS−ERα(図3A)およびU2OS−ERβ(図3B)の両方でエストラジオール(E2)によって阻害された。VG101中の草木抽出物およびそれらの活性な化学的成分は、U2OS−ER β細胞中でTNFα遺伝子のTNFα活性化を抑制したが(図3C〜3E)、しかしU2OS−ERα細胞中では抑制しなかった(図3C〜3E)。これらの研究によって、VG101中の草木抽出物およびそれらの活性な化学的成分がERβ−媒介性の転写経路を選択的に誘発することが示される。
【実施例9】
【0168】
閉経期症状についての別のエストロゲンの重要な特徴は、それが乳癌および子宮癌のリスクを増大しないということである。VG101中の草木抽出物およびそれらの活性な化学的成分がERαのみを発現するかまたはERαもERβも発現しない乳癌細胞で増殖促進特性を有するか否かを決定した。
【0169】
増殖効果はERαによって媒介され、ERβはERαの増殖効果を排する腫瘍抑制因子として作用する。これらの結果に基づいて、VG101中の草本抽出物およびそれらの活性な成分は、ERαのみを発現してERを発現しない乳癌細胞では増殖を促進しないはずである。なぜならVG101は乳癌細胞でERαもまたは他の増殖促進経路も活性化しないからである。E2とは異なり、VG101中の草本抽出物およびそれらの活性な化学的成分は、BT474細胞またはMDA−MB−468などのERを発現しない細胞の細胞増殖を刺激しなかった(図4A〜図4C)。
【実施例10】
【0170】
エストロゲン様疾患状態の治療について治験薬の有効性を示すために、以下の二重盲検を行う。
【0171】
本研究は、閉経期膣症状の治療のための経口VG101の最適用量を評価する、プロスペクティブ無作為プラセボコントロール盲検の用量漸増臨床試験において10例の健常な閉経後女性の4つのコホート(全部でN=40)を含む。10例の参加者が登録されて、最低用量のVG101に対してまたはプラセボに対して4:1の比で無作為化され、最大12週間まで治療される。治験の来診は4週、8週、および12週で行う。
【0172】
コホートが4週の治療を終了した後、独立したデータ安全性評価委員会(Data and Safety Monitoring Board)(DSMB)が、参加者のデータを検査して所定の安全性および停止の規則に従ってVG101の毒性を評価する。許容できない毒性がみられない場合、主要評価項目である最適用量に達するまで、または全ての4つのコホートが12週間の治療を完了するまで、さらに10例の女性で第二のさらに高用量などで治験を開始する。
【0173】
主要評価項目の指標は米国国立癌研究所(National Cancer Institute)(NCI)の有害事象共通毒性基準(Common Toxicity Criteria for Adverse Events)(CTCAE)バージョン3に基づいて規定された許容できない毒性である。許容できない毒性とは、DSMBによって決定される場合、治験薬に対して、あるいは治験薬に対して可能性として、おそらく、または明確に関連する任意の他の許容できない毒性に対して可能性として、おそらくまたは明確に関連するグレード3、4または5の毒性(NCI CTCAEバージョン3)の出現として定義される。
【0174】
任意の有害事象が各々の来診で記録される。副次的評価項目として、VG101の有効性が膣症状(自己報告Likertスケールを用いる)、クオリティ・オブ・ライフ(3つの確証された自己報告のアンケートを用いる)、理学的検査所見(臨床家の報告するLikertスケールを用いる)、膣液pH、乳酸菌の存在および傍基底膣上皮細胞の割合における、ベースラインから12週間の治療への変化によって測定される。治験薬に対する遵守は、各々の来診でアプリケーターカウントおよび投薬日誌によって決定される。
【0175】
治験集団および参加者の適格性
参加者は、経口の伝統的な中国の草木抽出物、特にVG101を用いる意思がある中度〜重度の閉経期膣症状を有する45〜65歳の約40例の閉経後女性である。
【0176】
参加基準:
・45〜65歳の女性
・以下によって証明される閉経後:a)少なくとも1年間無月経;b)40IU/mlを超える血清FSHをともなう6〜12カ月の無月経;c)子宮摘出術の有無の両側卵巣摘出術後6週間、またはd)40IU/mlを超える血清FSHをともなう子宮摘出術
・以下のリストからの外陰部または膣の委縮の少なくとも1つの中度〜重度の症状を自己報告する:
○膣乾燥(なし、軽度、中度または重度)
○膣および/または外陰部の不快感(なし、軽度、中度または重度)
○膣および/または外陰部の刺激(なし、軽度、中度または重度)
○膣のそう痒(なし、軽度、中度または重度)
○性的活動に関連する膣の疼痛(なし、軽度、中度または重度)
○膣細胞学的スメアで表面細胞が5%以下
○膣pHが5.0を超える。
・膣の症状の治療のために経口の伝統的な中国の漢方薬を使用する意思がある。
・保健医療の提供者から現在医学的ケアを受けている。
・インフォームドコンセントを提供する。
【0177】
除外基準
・乳癌、子宮癌もしくは卵巣癌、または黒色腫の既往歴。
・ここ9カ月内に癌が疑われる異常な乳房X線撮影または乳房の検査。
・ここ9カ月内に癌が疑われる異常なパップスメア(子宮頸部細胞診)または骨盤の検査。
・参加前6カ月内の任意の子宮または膣の出血(パップスメアのスクリーニング後は除く)。
・経膣超音波で測定した5mmを超える二重壁子宮内膜の厚さ。
・妊娠または授乳。
・スクリーニングの30日内の任意の膣保湿剤(Replens,KY Silk−E、Astroglide Silken Secret,Senselle)の使用。
・スクリーニングの30日内の任意の経口、経皮、膣または全身のエストロゲンまたはエストロゲン/プロゲスチン産物の使用。
・経口もしくは経皮の薬物については登録の3カ月内、またはインプラントもしくは注入の薬物については登録の6カ月内の、ほてりの治療のためにおそらく有効であることが公知の処方薬の使用。
・スクリーニングの12カ月内のラロキシフェン、タモキシフェンまたはアロマターゼインヒビターの使用。
・現在の尿路感染(白血球エステラーゼ(estrace)、亜硝酸塩、または血液が陽性のディップスティック尿検査)。
・活動期の虚血性心血管系疾患の臨床的な証拠または心血管系疾患の既往歴。
・抗凝血薬を要する深部静脈血栓または肺塞栓の既往歴。
・発作の既往歴。
・活動期の肝臓または胆嚢の疾患。
・重度の医薬アレルギーの既往歴。
・スクリーニングの12週内の別の治験薬の使用。
・治験医の見解で、アンケートまたは評価の完了、プロトコールの遵守またはトライアルの完了から参加者を除外する、任意の病状または精神状態であって、例としては、英語の読み書きが限定されていること、重病、引越しの予定、薬物乱用、重大な精神医学的問題、または認知症。
・電話方法がない。
【0178】
インフォームドコンセントおよび証拠資料
治験に参加する前に、全ての治験手順、時間要件、リスクおよび可能性のある利点を、情報をインフォームドコンセントの形式で用いて、各々の可能性のある治験参加者に説明する。可能性のある治験参加者は、インフォームドコンセントの書類を読み、質問に回答するのに十分な時間を与えられる。治験に参加するように選ばれた適格な参加者は、治験の治療を開始する前にIRBの承認した同意書にサインする。各々の参加者は、サインした書類のコピーを渡され、その原本は治験記録の一部となる。全ての治験の特別なデータは極秘であって、臨床施設で鍵をかけたファイルに保管される。
【0179】
治験デザイン
経口のVG101はゲルカプセルにパックされた3つの草本化合物の組み合わせからなる。経口のVG101は12週間にわたって1日2回自己投与される。この処方物は3つの中国の草本であるハナスゲ(発音:ジー・ムー(Zhi Mu))、キバナオウギ(Astragalus membranaceus Fisch.Bge.Var.mongholicus Bge.)(発音:ホアン・チー(Huang Qi))およびイノコズチ(発音:ホワイ・ニウ・シイ(Huai Niu Xi))に由来し、この治験の開始前にFDAの承認した治験薬(Investigational New Drug)(IND)の認可を受ける。
【0180】
原材料の標準化は、伝統的な漢方薬の専門家により正確な植物種の同定によって管理される。二次的な薬学的アセスメントは、FDAのINDの仕様に従って3つの草本の各々を抽出することを包含する。全ての植物剤は、Applied Biosystems API5000を用いて薄層クロマトグラフィー、活性成分のLC/MS/MS分析定量を介して分類標識に対して特定される。植物抽出物のバンドを特定する分類標識を、溶出液として酢酸エチルを用いて、シリカゲル上におき、その草木抽出物が90%を超える正確性で純粋な化合物に適合することを保証する。抽出物のLC/MSフィンガープリントがバッチ間で適合すれば抽出物の成分が一致することが保証される。
【0181】
VG101は純粋な化合物およびFDAの適正製造基準(Good Manufacturing Procedures)を用いて上記の成分で調製される。治験薬は、プラスチックのボトルにパッケージングされて、FDAのガイドラインに従って表示される。
【0182】
対応するプラセボは不活性成分で作製して、活性な薬物と色を合わせる。
【0183】
薬物の投与および投薬スケジュール
治験薬は、経口的に、1日2回、12週間投与される。参加者は、無作為の来診の夜に開始して全体で12週間の治験中、朝にゲルカプセルを1つ、夜に1つを摂取するように指示される。
【0184】
最初の10例の適格な参加者を無作為化し(4:1の無作為比)、25mgのPO BIDというVG101または同一のプラセボの出発用量で経口のVG101を投与する。募集および無作為化を続け、10例の適格な参加者の第二のコホートは125mgのPO BIDという用量に割り当て、第三のコホートは250mgのPO BIDに、そして最後のコホートは500mgのPO BIDに割り当てた。全ての参加者は、許容できない毒性が観察されない限り、割り当てられた用量を12週間継続するように求められる。
【表2】

【0185】
許容できない毒性および最適用量
許容できない毒性とは、治験薬に可能性として、おそらく、または明確に関連する、治験薬に可能性として、おそらく、または明確に関連する、NCI有害事象共通毒性基準(CTCAE)バージョン3を用いてグレード、3、4または5の出現として定義されるか、あるいは、治験薬に可能性として、おそらく、または明確に関連する、データ安全性評価委員会(Data and Safety Monitoring Board)によって特定される任意の他の許容できない毒性である。
【0186】
用量レベルは、以下の場合に終了される:1)12週間の治療の間任意の時点で任意のコホートで能動的な治療に割り当てられた8例の女性のうち1例以上において許容できない毒性が観察される場合。用量レベルが終了される場合、次の最低用量が最適用量に指定される。治療の12週間の間どのコホートでも許容できない毒性が観察されない場合、VG101の最高用量500mgのPO BIDが最適用量に指定される。
【0187】
有害事象
有害事象は、全身の臓器系で分類され、NCI−CTCAE、バージョン3による重症度(1〜5)に類別される。有害事象は各々の各々の来診で確認され、臨床現場の治験医によって報告される。その事象、期間、有害事象が重篤であるか否か、その事象の性質(単独のエピソード対複数のエピソード)、強度、治験薬に対する関係、みられた作用、臨床成績およびその有害事象が手術または別の手順で生じたか否かの説明を含む詳細な情報が各々の有害事象について収集される。
【0188】
NCI−CTCAEによる分類に加えて、有害事象はMedDRAソフトウェアを用いて好ましい用語および体組織に分類される。有害事象はまた、重症度、治験薬に対する関係およびその有害事象が治験薬の中断を生じたか否かによっても分類される。グレードIII以上に悪化するベースラインの実験室または医学的な状態は、それらがVG101療法に可能性として、おそらくまたは明確に関連すると記されるのでない限り、用量規定毒性とはならない。
【0189】
来診のスケジュール
最初のスクリーニング評価(電話)
治験の広告および通知に回答した女性は、その治験の全般的な概要を与えられ、もし興味がある場合は、簡単な電話調査を完了して最初の適格性(年齢、閉経状況、医薬の使用、膣乾燥の症状、最終の乳房X線撮影の日、および無作為トライアルに参加する意思)を確認される。的確な回答者は、適格性を確認するためにスクリーニング来診への参加を要請される。参加者は、来診に際して処方薬および市販薬を含めて全ての医薬を申告するように求められる。
【0190】
スクリーニングの来診
参加者は、診療所に来る前少なくとも12時間、性交しないように、膣洗浄も膣潤滑剤の使用などもしないように求められる。彼らは、任意の通常の薬物は摂取してもよい。スクリーニングの来診(単数または複数)では、女性は、治験の詳細および要件について情報を与えられ、インフォームドコンセントを与えられる。安全性および薬物動態の研究のために血液を採血して、尿を採取する。参加者は参加基準および除外基準、固体群統計学、簡易な病歴、手術歴、婦人科病歴および月経履歴、ならびに膣および外陰部の委縮の症状をカバーするアンケートの全項目に記入する。現在の薬物療法を再調査される。
【0191】
血圧、身長、体重、乳房および骨盤の試験を含めて簡易な理学的検査を完了する。膣の委縮は、膣の委縮および炎症を評価する膣健康スケール(Vaginal Health scale)を用いて評価される。子宮頸部および膣の細胞学的診断のための中央側方膣壁のパップスメア(Pap smear)および細胞サンプリングを行って、膣上皮細胞成熟および膣エストロゲン受容体の存在を確認する。膣のpHを測定して膣液の少量のサンプルを細菌分析のために得る。骨盤臓器脱の定量化(POP−Q)を行う。治験のスタッフはここ9カ月内に行った任意の乳房X線撮影の結果を入手するための同意を求める。参加者が9カ月内に乳房X線撮影をしていない場合、その参加者は無作為化の前に1回予定するものとする。経膣超音波スクリーニングを計画して、その結果を無作為化の前に再検討する。参加者は、スクリーニングの出血日報(Screening Daily Bleeding Diary)を与えられ、それを埋めるように指示される。参加者は次の来診まで完全な日報にするように要求される。
【0192】
無作為化来診
無作為化来診の前に臨床現場の治験医は全ての測定の結果を再検討する。パップスメアの性能によるものでなく出血日報で文書化された任意の出血によって、参加者は不適格になる。参加者は、彼らが全ての参加基準および除外基準を満たす場合に、適格であるとみなされる。適格な参加者は、治験薬の投与および可能性のある副作用について述べた口頭および書面の指示を受ける。参加者は、女性性機能指数Female Sexual Function Index)、閉経期特異的クオリティ・オブ・ライフ(Menopause Specific Quality of Life),SF36、および骨盤底影響アンケート(Pelvic Floor Impact questionnaires)および骨盤底苦痛一覧(Pelvic Floor Distress Inventory)の全項目に記入する。無作為の数を連続して割り当て、治験薬の供給を4週与える。参加者は、出血日報(Daily Bleeding Diary)を与えられ、次の来診までに全項目を記入した日報を戻すように求められる。
【0193】
トライアルに登録する全ての女性は、治験担当者への連絡方法の情報が与えられる。4週の来診で予約をする。
【0194】
2週および8週の来診(電話の往診)
治療の2週および8週で、コーディネーターは、薬物療法コンプライアンス、有害効果、併用薬、治験薬日報(Daily Study Medication Diary)および「出血日報」を再検討するように、そして任意の質問に回答するように治験参加者に伝える。これらの来診は、電話往診として予定される。しかし、参加者の要望で、これらの来診はまた、人が行う場合もある。
【0195】
4週の来診
治療の4週後、参加者は、任意の未使用の治験薬、および「治験薬日報」および「出血日報」を持参して診療所に戻る。治験コーディネーターは、未使用の治験薬をカウントして薬物コンプライアンスを推定する。治験コーディネーターは以下を再検討する。有害事象および新規の併用薬が記録される、および「治験薬日報」および「出血日報」。参加者は、ベースラインで行ったのと同じクオリティ・オブ・ライフのアンケートの全ての項目を記入する。さらに8週の治験薬が与えられる。
【0196】
12週の最終来診または治験の終了
最終の来診は、12週の治療後、または参加者がトライアルの参加の中止を決めた任意の時点で行う。最終の来診では、参加者は、「治験薬日報」および「出血日報」を持参する。安全性研究のために血液を採取して、尿を収集する。スクリーニングの時点で完了した全てのアンケート、理学検査、実験室の分析および膣の研究を、治験の完了時に繰り返す。2回目の経膣超音波を行って、二重壁子宮内膜厚みが5mmを超えるか、またはスクリーニングの時点から子宮内膜壁厚が2mmを超えて増大している治験参加者は子宮内膜の吸引生検を行う。全ての未使用の治験薬をこの時点で集める。
【0197】
16週の治験後の追跡電話往診または治験終了4週後
【0198】
参加者がトライアルの参加を中止した後16週または4週で追跡の電話往診を行う。参加者は、最後の来診以降の新しい有害効果を確認するため、および任意の進行中の有害効果を再検討するために治験コーディネーターから接触される。
【0199】
服薬不遵守、治験薬中断および治験初期の中断
全ての参加者は、安全性が懸念されない限り、全ての用量の治験薬を指示どおり使用するように促される。治験コーディネーターは、治験薬を遵守しない理由を確認し、参加者が遵守を改善する方法を見つける手助けに努める。治験薬を遵守していない参加者は全ての治験の来診に参加するように、かつ全ての治験の測定を計画どおり完了するように促される。治験薬での遵守は、各々の来診でアプリケーターカウントで測定され、治験薬カレンダー(Study Medication Calendar)でチェックされる。
【0200】
治験参加者が膣出血を報告した場合、その参加者は治験薬を継続されてもよいが、4週内に出血の評価を受けなければならない。もし評価が4週内に行われなければ、その参加者は、その評価が完了するまで治験薬を停止しなければならない。
【0201】
治験薬は、以下を有するいずれの参加者でも中断される。1)子宮内膜生検で子宮内膜過形成または癌、2)子宮癌または卵巣癌が疑われる異常な骨盤の検査、3)癌が疑われる乳房の検査または乳房X線撮影、4)深部静脈血栓、5)認知症の診断、ならびに6)臨床の治験医の判定でVGF101での治療に可能性として、おそらくまたは明確に関連する任意の重篤な有害事象。治験薬は、臨床現場の治験医の意見で、異常な症状、理学的所見または試験が十分に評価されて、良性であると判明した場合には再開されてもよい。
【0202】
参加者は、4週間もしくはそれ以上の間治験薬を摂取していないと報告した場合、またはもはやこのトライアルへの参加を望んでいないと告げた場合、永続的に治験を中止したとみなされる。この場合、治験完了の測定は可能であれば得られる。
【0203】
全ての参加者は全ての治験来診に出席するように、かつ全ての治験の測定を計画どおり完了するように促される。しかし、参加者は任意の時点でその治験の参加を中断してもよい。来診を怠った患者には、来診を再計画するため、およびその来診を完了することを手助けするように治験コーディネーターが連絡する。
【0204】
登録後、参加者は、72時間内にプロトコール治療を開始しなければならない。治療の遅延を生じる問題は、治験統括医と議論しなければならない。参加者が登録後のプロトコール治療を開始しない場合、参加者の治験登録は取り消されてもよい。
【0205】
予期せぬ利点または害のための治験の早期の終了は、データ安全性評価委員会(Data and Safety Monitor)からバイオノボ(Bionovo)および運営委員会(Steering Committee)に対して勧告される場合がある。
【0206】
成績の測定
一次膣委縮測定
ベースラインから12週の自己報告された最も困難な症状の変化、および膣委縮の症状における変化。膣委縮の症状は、ベースライン、4週、および12週または治験の終わりに、自己投与のアンケートによって評価される。アンケートは、膣乾燥、膣刺激、膣そう痒、性活動での膣疼痛、性活動での膣出血、排尿の際の疼痛または不快感(排尿障害)および頻尿(排尿頻度)を評価する7つの項目からなる。参加者は先月に症状があったか否か(ハイ=1、イイエ=0)、もしあれば、その症状がどの程度であったかを質問され、回答の選択肢としては、「全くない」(0)、「ごくわずか」(1)、「中度」(2)、「かなり」(3)、または「極度に」(4)が挙げられる。ベースラインでは、参加者は、膣委縮の最も困難な症状を特定する。膣乾燥の最も困難な症状についてのベースラインのスコア(1〜4の範囲)を12週での同じ症状についてのスコアと比較する。さらに、ベースラインでの膣乾燥の症状の複合スコア(範囲=0〜35)を12週と比較する。
【0207】
ベースラインから12週の表在性膣上皮細胞における変化のパーセント。Diagnostic Cytology Laboratories,Inc.は、膣上皮細胞の顕微鏡評価による膣粘膜の扁平上皮の成熟に関連するデータを提供する。異なる細胞タイプが優勢であることに基づいて膣成熟の3つの基本的パターン(未熟、中間および成熟)が識別され得る。
【表3】

【0208】
サンプルは、膣検査の間、ホルモン変化に最も感受性の上皮である、膣の側壁の中間から上部1/3から採取する。ホルモン評価のための満足な標本は、炎症、細菌または他の砕片がなく、実験指示に従って装着および固定されている。満足な標本のうち、200個の単一の細胞をカウントして、傍基底、中間および表在性の細胞の相対的な割合を注記する。無効とみなされるサンプル(例えば、炎症の細胞を含むサンプル)は、監督の細胞検査技師によるさらなる説明のために提出され、これらの事例は病理学者が再検査する必要がある場合もある。
【0209】
200個の扁平細胞をカウントした後、エストロゲン性のおおまかな評価である成熟値(Maturation Value)の数値を、各々の細胞型に対してポイント値(傍基底=0.0、中間=0.5および表在性=1.0)を割り当てること、および各々の細胞タイプカウントとそのポイント値を掛けることによって作製する。この結果は、低エストロゲン性(0〜49)、中エストロゲン性(50〜64)および高エストロゲン性(65〜100)として表される。さらに12週の表在性細胞の割合をベースラインでの表在性細胞の割合と比較する。
【0210】
ベースラインから12週への膣分泌のpHにおける変化。膣分泌物のpHは、ベースラインで記録して、治験の終わりの膣pHと比較する。コットン・チップのアプリケーターを用いて中央−側面の膣壁から膣液のサンプルを採取して、次にアプリケーターの先端を、2.5〜7.0の範囲のpHの0.3単位間の相違を識別できるpH指示ストリップに押し付ける。以前の研究では、pH指示ストリップで、pHマイクロ電極に比べて膣pHの正確な測定値が得られることが示唆されている。
【0211】
理学的検査に対する膣委縮の身体的徴候の変化。膣壁の医師による評価は、弾性、シワの多さ、湿度、点状出血および脆弱性の評価を含む。これらの範疇の各々における異常所見は、なし=0、中度=1または重度=2と格付けされる。理学検査スケールの複合スコアは0〜10におよぶ。1つ以上の範疇が変化する参加者の割合をベースラインから12週で比較する。また、ベースラインの複合スコアを治験終了時の複合スコアと比較する。さらに、理学検査のデータを用いて、点状出血の有無、膣壁の脆弱性、円錐切除術およびひだを注記し、0〜4というスコアに割り当て、ここで最高のスコアがさらに重度の委縮を示す、以前に確証された理学検査手段である改変グリーンデール(Greendale)膣委縮スコアを算出する。
【0212】
膣微生物叢の変化。側方膣壁由来の膣液標本を、グラム染色スメアのニュージェント(Nugent)スコアリングおよびLactobacilli,E.coliおよびE.coli以外のグラム陰性桿菌の定量培養を含み得る微生物検査のために、輸送媒体に送る。存在する微生物のタイプおよび量におけるベースラインから12週の変化を決定する。
【0213】
二次測定およびクオリティ・オブ・ライフの測定:
女性の性機能を評価する19項目の自己報告のアンケートである女性性機能指数(Female Sexual Function Index)(FSFI)を確証する。この指数は、臨床試験における使用のために設計されており、地域基盤集団および照会集団の両方で良好な試験−再試験の信頼性および内部整合性を有することが示されている。スコアリングのアルゴリズムは、全体的な手段についてならびに性機能の特定の分野、例えば、欲求、性的興奮、潤滑、オーガズム、満足感および疼痛の両方について利用可能である。複合スコアは2.0から36.0におよび、スコアが高いほど、全体的な性機能が良好であることを示す。次に、ベースラインから治療の4週および12週への複合スコアの変化のパーセント、および各々の分野のスコアの変化のパーセントが決定される。
【0214】
閉経期特異的なクオリティ・オブ・ライフ(Menopause−specific Quality of Life)(MENQOL)は、血管運動神経、理学的、心理社会的および性的な機能を含めて4つの分野の自己管理の30項目のアンケートである。各々のドメインを別々に1〜8のポイントスケールにスコア付けする。十分な試験−再試験の信頼性、良好な反応性および良好から優れた判別可能でかつ評価的な構築物の妥当性が実証されている。次に、治療のベースラインから4週までおよび12週までのMENQOLの各々の分野の割合の変化が決定される。
【0215】
閉経期症状のアンケート−簡易な閉経期症状のアンケート(Menopausal Symptom Questionnaire)によって、ほてり、乳房の圧痛、膣乾燥ならびに睡眠の中断および障害などの閉経期女性によって経験される典型的な症状の困難な症状に対する情報を確認する。このアンケートは閉経後エストロゲン−プロゲスチン介入トライアル(Postmenopausal Estroge−Progestin Interventions trial)、心臓およびエストロゲン/プロゲスチン補充研究(Heart and Estrogen/progestin Replacement Study)、および女性の健康イニシアチブトライアル(Women’s Health Initiative trials)を含めて複数の主要なトライアルで用いられ、確証されている。各々の症状は、0(困難な事態なし)から4(極めて困難)に格付けされた、5ポイントのLikertスケールで格付けする。次に、治療のベースラインから4週へおよび12週へのこれらのスコアの各々における変化のパーセントを評価する。
【0216】
SF−36 − これは、疾患および治療によって最も影響される健康の構成を測定するために設計された短縮型の非特異的健康調査である。SF−36は、集団中の疾患の相対的な負荷および治療に関連する健康利益を比較するために広く用いられている確証された手段である。SF−36は理学的および精神的な健康のサブスケールを有する。次に治療のベースラインから4週までおよび12週までの各々のサブスケール(身体および精神の健康)における変化の割合を測定する。
【0217】
骨盤臓器脱定量化(Pelvic Organ Prolapse Quantitation)(POP−Q)−骨盤臓器脱評価は、骨盤臓器脱定量(Organ Prolapse Quantification)(POP−Q)システムを用いて国際コンチネンス学会(International Continence Society)が確立したガイドラインに従って行う。この手順は、デューク大学(Duke University)の医療センター(Medical Center)で作製されてビデオテープで実証されたとおり標準化される。
【0218】
骨盤底障害を有する女性の2つの状態に特異的なクオリティ・オブ・ライフのアンケートの短縮バージョン、骨盤底苦痛一覧(Pelvic Floor Distress Inventory)(PFDI)−20および骨盤底影響アンケート(Pelvic Floor Impact Questionnaire)(PFIQ)−7は、骨盤底苦痛一覧および骨盤底影響アンケートの長型の開発と確証に寄与した100例の女性からのデータからBarberらによって開発された。
【0219】
骨盤底影響一覧(Pelvic Floor Distress Inventory)−このPFDIは、骨盤底障害を有する女性の苦痛の症状を3スケールで評価する:泌尿生殖器苦痛一覧(Urogenital Distress Inventory)、結腸直腸−肛門苦痛一覧(Colorectal−anal Distress Inventory)および骨盤臓器苦痛一覧(Pelvic Organ Distress Inventory)。
【0220】
骨盤底影響アンケート短型7−このPFIQは、生活への影響を3スケールで評価する:失禁影響アンケート(Incontinence Impact Questionnaire)、結腸直腸−肛門影響アンケート(Colorectal−anal Impact Questionnaire)および骨盤臓器脱影響アンケート(Pelvic Organ Prolapse Impact Questionnaire)。
【0221】
調査対象範囲(Coverables)
【0222】
以下のデータは、ベースラインで全ての参加者に対して収集される。
・個体群統計学:誕生日、人種、民族、関係状況、教育。
・投薬および外科の既往歴:婦人科手術(取り出した卵巣の数)、乳癌、卵巣癌、喫煙歴およびアルコール歴。
・生殖および閉経の履歴:妊娠、経産回数、最終月経期間、初潮年齢。
・現在の投薬:市販薬および栄養補助食品を含めて現在摂取しているまたは過去3ヶ月の間に摂取した医薬。
・閉経症状の履歴:閉経症状の出現の年齢、閉経症状に対する過去の治療。
【0223】
本発明の好ましい実施形態が示されており、本明細書に記載されているが、このような実施形態は例示として示されるだけであることが当業者には明白であろう。多数の改変、変化および置換がここで本発明から逸脱することなく当業者には思い浮かぶであろう。本明細書に記載される本発明の実施形態に対する種々の代替が本発明を実施するのに使用され得ることが理解されるべきである。添付の特許請求の範囲が本発明の範囲を規定し、これらの特許請求の範囲内の方法および構造ならびにそれらの等価物がそれによって包含されるものとする。
【特許請求の範囲】
【請求項1】
キバナオウギ(Astragalus membranaceus)、ナイモウオウギ(Astragalus mongholicus)、ハナスゲ(Anemarrhenae asphodeloides)およびイノコズチ(Achyranthes bidentata)の抽出物の治療上有効な量を含み、ここで該抽出物が少なくとも1つの植物化学物質を含む、組成物。
【請求項2】
1つ以上の薬学的に許容可能な賦形剤を含む、請求項1に記載の組成物。
【請求項3】
前記植物化学物質がカリコシン、ニアソールおよび四環系イソフラボンからなる群から選択される、請求項1に記載の組成物。
【請求項4】
前記抽出物がカリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む、請求項3に記載の組成物。
【請求項5】
前記抽出物がカリコシン、ニアソールおよび四環系イソフラボンを含む請求項3に記載の組成物。
【請求項6】
前記植物化学物質の精製された抽出物が第1の抽出および第2の抽出を行うことによって得られる、請求項1〜5の一項に記載の組成物。
【請求項7】
前記第1の抽出が、
(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、
(b)該第1の混合物を加熱する工程と、
(c)該第1の溶媒を除去して第1の抽出物を得る工程と、
を包含する、請求項6に記載の組成物。
【請求項8】
前記第2の抽出が、
(a)前記第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、
(b)該第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、
(c)該非水性層を収集する工程と、
(d)いずれの非活性化合物も除去する工程と、
(e)該第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程と、
を包含する、請求項7に記載の組成物。
【請求項9】
前記第1の溶媒がエタノールおよび水の溶液である、請求項8に記載の組成物。
【請求項10】
前記第1の混合物が約10℃〜約60℃の温度まで加熱される、請求項8に記載の組成物。
【請求項11】
前記第1の混合物が約15℃〜約50℃の温度まで加熱される、請求項10に記載の組成物。
【請求項12】
前記第1の混合物が約20℃〜約40℃の温度まで加熱される、請求項11に記載の組成物。
【請求項13】
前記第1の混合物が約2時間〜約6時間加熱される、請求項6に記載の組成物。
【請求項14】
前記第1の混合物が約 〜約4時間加熱される、請求項13に記載の組成物。
【請求項15】
前記第1の溶媒がエバポレーションによって前記第1の抽出物から除去される、請求項8に記載の組成物。
【請求項16】
前記エバポレーションが約40℃〜約60℃の温度で起こる、請求項15に記載の組成物。
【請求項17】
前記第2の溶媒がエタノールおよび酢酸エチルの溶液である、請求項8に記載の組成物。
【請求項18】
前記非水性層が収集された後に乾燥される、請求項8に記載の組成物。
【請求項19】
任意の非活性化合物がシリカ上で前記乾燥された非水性層を濾過することによって除去される、請求項8に記載の組成物。
【請求項20】
前記シリカが酢酸エチル中に懸濁される、請求項19に記載の組成物。
【請求項21】
前記第2の溶媒が、前記植物化学物質の精製された抽出物からエバポレーションによって除去される、請求項8に記載の組成物。
【請求項22】
前記組成物がさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、前記組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む、請求項1に記載の組成物。
【請求項23】
植物種キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を単離する方法。
【請求項24】
前記植物化学物質が、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される、請求項23に記載の方法。
【請求項25】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む、請求項24に記載の方法。
【請求項26】
前記抽出物がカリコシン、ニアソールおよび四環系イソフラボンを含む、請求項24に記載の方法。
【請求項27】
前記植物化学物質の精製された抽出物が第1の抽出および第2の抽出を行うことによって得られる、請求項23に記載の方法。
【請求項28】
前記第1の抽出が、
(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、
(b)該第1の混合物を加熱する工程と、
(c)該第1の溶媒を除去して第1の抽出物を得る工程と、
を包含する、請求項27に記載の組成物。
【請求項29】
前記第2の抽出が、
(a)前記第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、
(b)該第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、
(c)該非水性層を収集する工程と、
(d)いずれの非活性化合物も除去する工程と、
(e)該第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程と、
を包含する、請求項28に記載の方法。
【請求項30】
前記第1の溶媒がエタノールおよび水の溶液である、請求項28に記載の方法。
【請求項31】
前記第1の混合物が約10℃〜約60℃の温度まで加熱される、請求項28に記載の方法。
【請求項32】
前記第1の混合物が約15℃〜約50℃の温度まで加熱される、請求項31に記載の方法。
【請求項33】
前記第1の混合物が約20℃〜約40℃の温度まで加熱される、請求項31に記載の方法。
【請求項34】
前記第1の混合物が約2時間〜約6時間加熱される、請求項28に記載の方法。
【請求項35】
前記第1の混合物が約 〜約4時間加熱される、請求項34に記載の方法。
【請求項36】
前記第1の溶媒がエバポレーションによって前記第1の抽出物から除去される、請求項28に記載の方法。
【請求項37】
前記エバポレーションが約40℃〜約60℃の温度で起こる、請求項36に記載の方法。
【請求項38】
前記第2の溶媒がエタノールおよび酢酸エチルの溶液である、請求項29に記載の方法。
【請求項39】
前記非水性層が収集された後に乾燥される、請求項29に記載の方法。
【請求項40】
任意の非活性化合物がシリカ上で、前記乾燥された非水性層を濾過することによって除去される、請求項29に記載の方法。
【請求項41】
前記シリカが酢酸エチル中に懸濁される、請求項40に記載の方法。
【請求項42】
前記第2の溶媒が、前記植物化学物質の精製された抽出物からエバポレーションによって除去される、請求項29に記載の方法。
【請求項43】
キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物の治療上有効な量を含む組成物で治療可能であり得る障害を有する被検体を治療する方法。
【請求項44】
前記植物化学物質が、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される、請求項43に記載の方法。
【請求項45】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む、請求項44に記載の方法。
【請求項46】
前記抽出物がカリコシン、ニアソールおよび四環系イソフラボンを含む、請求項44に記載の方法。
【請求項47】
前記植物化学物質の精製された抽出物が第1の抽出および第2の抽出を行うことによって得られる、請求項44に記載の方法。
【請求項48】
前記第1の抽出が、
(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、
(b)該第1の混合物を加熱する工程と、
(c)該第1の溶媒を除去して第1の抽出物を得る工程と、
を包含する、請求項47に記載の方法。
【請求項49】
前記第2の抽出が、
(a)前記第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、
(b)該第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、
(c)該非水性層を収集する工程と、
(d)いずれの非活性化合物も除去する工程と、
(e)該第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程と、
を包含する、請求項47に記載の方法。
【請求項50】
前記第1の溶媒がエタノールおよび水の溶液である、請求項49に記載の方法。
【請求項51】
前記第1の混合物が約10℃〜約60℃の温度まで加熱される、請求項49に記載の方法。
【請求項52】
前記第1の混合物が約15℃〜約50℃の温度まで加熱される、請求項51に記載の方法。
【請求項53】
前記第1の混合物が約20℃〜約40℃の温度まで加熱される、請求項51に記載の方法。
【請求項54】
前記第1の混合物が約2時間〜約6時間加熱される、請求項48に記載の方法。
【請求項55】
前記第1の混合物が約 〜約4時間加熱される、請求項54に記載の方法。
【請求項56】
前記第1の溶媒がエバポレーションによって前記第1の抽出物から除去される、請求項48に記載の方法。
【請求項57】
前記エバポレーションが約40℃〜約60℃の温度で起こる、請求項56に記載の方法。
【請求項58】
前記溶媒がエタノールおよび酢酸エチルの溶液である、請求項49に記載の方法。
【請求項59】
前記非水性層が収集された後に乾燥される、請求項49に記載の方法。
【請求項60】
任意の非活性化合物がシリカ上で、前記乾燥された非水性層を濾過することによって除去される、請求項49に記載の方法。
【請求項61】
前記シリカが酢酸エチル中に懸濁される、請求項60に記載の方法。
【請求項62】
前記第2の溶媒が、前記植物化学物質の精製された抽出物からエバポレーションによって除去される、請求項49に記載の方法。
【請求項63】
前記組成物がさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、前記組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む、請求項46に記載の方法。
【請求項64】
前記組成物が、固体経口剤形、液体経口剤形、ゼラチンカプセル剤形、膣坐剤、直腸坐剤またはスプレーからなる群より選択される剤形によって投与される、請求項46に記載の方法。
【請求項65】
前記治療上有効な量が、エストロゲン様効果を誘発する量である、請求項46に記載の方法。
【請求項66】
前記エストロゲン様効果が、少なくとも1つの更年期症状を治療または予防すること、骨粗鬆症を治療または予防すること、またはそれらの任意の組み合わせからなる群より選択される、請求項65に記載の方法。
【請求項67】
前記エストロゲン様効果が、少なくとも1つの更年期症状を治療または予防することである、請求項66に記載の方法。
【請求項68】
前記更年期症状が、ほてり、不眠症、膣もしくは外陰の委縮、性欲減退、尿失禁、頭痛、抑うつまたはそれらの任意の組み合わせからなる群より選択される、請求項67に記載の方法。
【請求項69】
前記更年期症状が膣または外陰の委縮である、請求項68に記載の方法。
【請求項70】
前記エストロゲン様効果が骨粗鬆症を治療または予防することを包含する、請求項66に記載の方法。
【請求項71】
エストロゲン応答要素の制御下で遺伝子を活性化する方法であって、該遺伝子に作動可能に連結されたエストロゲン応答要素およびエストロゲン受容体を有する細胞に対して、ある量の組成物を投与することを包含し、該組成物は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を含み、該植物化学物質の精製された抽出物が、該遺伝子を活性化するのに十分な量である、方法。
【請求項72】
前記植物化学物質が、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される、請求項71に記載の方法。
【請求項73】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む、請求項71に記載の方法。
【請求項74】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンを含む、請求項71に記載の方法。
【請求項75】
前記細胞がインビトロである、請求項71に記載の方法。
【請求項76】
前記細胞がインビボである、請求項71に記載の方法。
【請求項77】
前記細胞がERα+乳房組織にある、請求項71に記載の方法。
【請求項78】
前記細胞がERβ+乳房組織にある、請求項71に記載の方法。
【請求項79】
前記細胞がERα/ERβ+乳房組織にある、請求項71に記載の方法。
【請求項80】
前記エストロゲン応答要素が形質転換された細胞で発現される、請求項71に記載の方法。
【請求項81】
前記エストロゲン応答要素および前記エストロゲン受容体の両方が前記細胞で発現される、請求項71に記載の方法。
【請求項82】
前記エストロゲン応答要素が前記細胞中で異種発現される、請求項71に記載の方法。
【請求項83】
前記エストロゲン応答要素およびエストロゲン受容体の両方が前記細胞中で異種発現される、請求項71に記載の方法。
【請求項84】
前記細胞がERE制御遺伝子で形質転換されたU937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される、請求項71に記載の方法。
【請求項85】
前記細胞がERαを発現する、請求項84に記載の方法。
【請求項86】
前記細胞がERβを発現する、請求項84に記載の方法。
【請求項87】
前記ERE制御遺伝子がERE−tk−Lucである、請求項84に記載の方法。
【請求項88】
TNF RE制御遺伝子の発現を抑制する方法であって、TNF応答要素の制御下の遺伝子およびエストロゲン受容体を含む細胞に対して、ある量の組成物を投与することを包含し、該組成物は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を含み、該植物化学物質の精製された抽出物が、該TNF RE制御遺伝子を抑制するのに十分な量である、方法。
【請求項89】
前記植物化学物質が、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される、請求項88に記載の方法。
【請求項90】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む、請求項88に記載の方法。
【請求項91】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンを含む、請求項88に記載の方法。
【請求項92】
前記TNF RE制御遺伝子がTNF−αである、請求項88に記載の方法。
【請求項93】
前記TNF RE制御遺伝子がTNF RE−Lucである、請求項88に記載の方法。
【請求項94】
前記細胞がインビトロである、請求項88に記載の方法。
【請求項95】
前記細胞がインビボである、請求項88に記載の方法。
【請求項96】
前記細胞がER+乳房組織にある、請求項88に記載の方法。
【請求項97】
前記細胞がERα+乳房組織にある、請求項88に記載の方法。
【請求項98】
前記細胞がERβ+乳房組織にある、請求項88に記載の方法。
【請求項99】
前記TNF応答要素が前記細胞で内因的に発現される、請求項88に記載の方法。
【請求項100】
前記TNF応答要素およびエストロゲン受容体の両方が前記細胞中で内因的に発現される、請求項99に記載の方法。
【請求項101】
前記TNF応答要素が前記細胞中で異種発現される、請求項88に記載の方法。
【請求項102】
前記TNF応答要素およびエストロゲン受容体の両方が前記細胞中で異種発現される、請求項88に記載の方法。
【請求項103】
前記細胞がエストロゲン受容体遺伝子を含み、TNF応答要素制御遺伝子で形質転換され、かつU937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される、請求項88に記載の方法。
【請求項104】
前記エストロゲン受容体遺伝子がERαを発現する遺伝子である、請求項103に記載の方法。
【請求項105】
前記エストロゲン受容体遺伝子がERβを発現する遺伝子である、請求項103に記載の方法。
【請求項1】
キバナオウギ(Astragalus membranaceus)、ナイモウオウギ(Astragalus mongholicus)、ハナスゲ(Anemarrhenae asphodeloides)およびイノコズチ(Achyranthes bidentata)の抽出物の治療上有効な量を含み、ここで該抽出物が少なくとも1つの植物化学物質を含む、組成物。
【請求項2】
1つ以上の薬学的に許容可能な賦形剤を含む、請求項1に記載の組成物。
【請求項3】
前記植物化学物質がカリコシン、ニアソールおよび四環系イソフラボンからなる群から選択される、請求項1に記載の組成物。
【請求項4】
前記抽出物がカリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む、請求項3に記載の組成物。
【請求項5】
前記抽出物がカリコシン、ニアソールおよび四環系イソフラボンを含む請求項3に記載の組成物。
【請求項6】
前記植物化学物質の精製された抽出物が第1の抽出および第2の抽出を行うことによって得られる、請求項1〜5の一項に記載の組成物。
【請求項7】
前記第1の抽出が、
(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、
(b)該第1の混合物を加熱する工程と、
(c)該第1の溶媒を除去して第1の抽出物を得る工程と、
を包含する、請求項6に記載の組成物。
【請求項8】
前記第2の抽出が、
(a)前記第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、
(b)該第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、
(c)該非水性層を収集する工程と、
(d)いずれの非活性化合物も除去する工程と、
(e)該第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程と、
を包含する、請求項7に記載の組成物。
【請求項9】
前記第1の溶媒がエタノールおよび水の溶液である、請求項8に記載の組成物。
【請求項10】
前記第1の混合物が約10℃〜約60℃の温度まで加熱される、請求項8に記載の組成物。
【請求項11】
前記第1の混合物が約15℃〜約50℃の温度まで加熱される、請求項10に記載の組成物。
【請求項12】
前記第1の混合物が約20℃〜約40℃の温度まで加熱される、請求項11に記載の組成物。
【請求項13】
前記第1の混合物が約2時間〜約6時間加熱される、請求項6に記載の組成物。
【請求項14】
前記第1の混合物が約 〜約4時間加熱される、請求項13に記載の組成物。
【請求項15】
前記第1の溶媒がエバポレーションによって前記第1の抽出物から除去される、請求項8に記載の組成物。
【請求項16】
前記エバポレーションが約40℃〜約60℃の温度で起こる、請求項15に記載の組成物。
【請求項17】
前記第2の溶媒がエタノールおよび酢酸エチルの溶液である、請求項8に記載の組成物。
【請求項18】
前記非水性層が収集された後に乾燥される、請求項8に記載の組成物。
【請求項19】
任意の非活性化合物がシリカ上で前記乾燥された非水性層を濾過することによって除去される、請求項8に記載の組成物。
【請求項20】
前記シリカが酢酸エチル中に懸濁される、請求項19に記載の組成物。
【請求項21】
前記第2の溶媒が、前記植物化学物質の精製された抽出物からエバポレーションによって除去される、請求項8に記載の組成物。
【請求項22】
前記組成物がさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、前記組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む、請求項1に記載の組成物。
【請求項23】
植物種キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を単離する方法。
【請求項24】
前記植物化学物質が、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される、請求項23に記載の方法。
【請求項25】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む、請求項24に記載の方法。
【請求項26】
前記抽出物がカリコシン、ニアソールおよび四環系イソフラボンを含む、請求項24に記載の方法。
【請求項27】
前記植物化学物質の精製された抽出物が第1の抽出および第2の抽出を行うことによって得られる、請求項23に記載の方法。
【請求項28】
前記第1の抽出が、
(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、
(b)該第1の混合物を加熱する工程と、
(c)該第1の溶媒を除去して第1の抽出物を得る工程と、
を包含する、請求項27に記載の組成物。
【請求項29】
前記第2の抽出が、
(a)前記第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、
(b)該第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、
(c)該非水性層を収集する工程と、
(d)いずれの非活性化合物も除去する工程と、
(e)該第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程と、
を包含する、請求項28に記載の方法。
【請求項30】
前記第1の溶媒がエタノールおよび水の溶液である、請求項28に記載の方法。
【請求項31】
前記第1の混合物が約10℃〜約60℃の温度まで加熱される、請求項28に記載の方法。
【請求項32】
前記第1の混合物が約15℃〜約50℃の温度まで加熱される、請求項31に記載の方法。
【請求項33】
前記第1の混合物が約20℃〜約40℃の温度まで加熱される、請求項31に記載の方法。
【請求項34】
前記第1の混合物が約2時間〜約6時間加熱される、請求項28に記載の方法。
【請求項35】
前記第1の混合物が約 〜約4時間加熱される、請求項34に記載の方法。
【請求項36】
前記第1の溶媒がエバポレーションによって前記第1の抽出物から除去される、請求項28に記載の方法。
【請求項37】
前記エバポレーションが約40℃〜約60℃の温度で起こる、請求項36に記載の方法。
【請求項38】
前記第2の溶媒がエタノールおよび酢酸エチルの溶液である、請求項29に記載の方法。
【請求項39】
前記非水性層が収集された後に乾燥される、請求項29に記載の方法。
【請求項40】
任意の非活性化合物がシリカ上で、前記乾燥された非水性層を濾過することによって除去される、請求項29に記載の方法。
【請求項41】
前記シリカが酢酸エチル中に懸濁される、請求項40に記載の方法。
【請求項42】
前記第2の溶媒が、前記植物化学物質の精製された抽出物からエバポレーションによって除去される、請求項29に記載の方法。
【請求項43】
キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物の治療上有効な量を含む組成物で治療可能であり得る障害を有する被検体を治療する方法。
【請求項44】
前記植物化学物質が、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される、請求項43に記載の方法。
【請求項45】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む、請求項44に記載の方法。
【請求項46】
前記抽出物がカリコシン、ニアソールおよび四環系イソフラボンを含む、請求項44に記載の方法。
【請求項47】
前記植物化学物質の精製された抽出物が第1の抽出および第2の抽出を行うことによって得られる、請求項44に記載の方法。
【請求項48】
前記第1の抽出が、
(a)第1の溶媒中にキバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチを分散させて第1の混合物を形成する工程と、
(b)該第1の混合物を加熱する工程と、
(c)該第1の溶媒を除去して第1の抽出物を得る工程と、
を包含する、請求項47に記載の方法。
【請求項49】
前記第2の抽出が、
(a)前記第1の抽出物と第2の溶媒とを混合して第2の混合物を作製する工程と、
(b)該第2の混合物を水性層中および非水性層中へ分配することを可能にする工程と、
(c)該非水性層を収集する工程と、
(d)いずれの非活性化合物も除去する工程と、
(e)該第2の溶媒を除去して植物化学物質の精製された抽出物を得る工程と、
を包含する、請求項47に記載の方法。
【請求項50】
前記第1の溶媒がエタノールおよび水の溶液である、請求項49に記載の方法。
【請求項51】
前記第1の混合物が約10℃〜約60℃の温度まで加熱される、請求項49に記載の方法。
【請求項52】
前記第1の混合物が約15℃〜約50℃の温度まで加熱される、請求項51に記載の方法。
【請求項53】
前記第1の混合物が約20℃〜約40℃の温度まで加熱される、請求項51に記載の方法。
【請求項54】
前記第1の混合物が約2時間〜約6時間加熱される、請求項48に記載の方法。
【請求項55】
前記第1の混合物が約 〜約4時間加熱される、請求項54に記載の方法。
【請求項56】
前記第1の溶媒がエバポレーションによって前記第1の抽出物から除去される、請求項48に記載の方法。
【請求項57】
前記エバポレーションが約40℃〜約60℃の温度で起こる、請求項56に記載の方法。
【請求項58】
前記溶媒がエタノールおよび酢酸エチルの溶液である、請求項49に記載の方法。
【請求項59】
前記非水性層が収集された後に乾燥される、請求項49に記載の方法。
【請求項60】
任意の非活性化合物がシリカ上で、前記乾燥された非水性層を濾過することによって除去される、請求項49に記載の方法。
【請求項61】
前記シリカが酢酸エチル中に懸濁される、請求項60に記載の方法。
【請求項62】
前記第2の溶媒が、前記植物化学物質の精製された抽出物からエバポレーションによって除去される、請求項49に記載の方法。
【請求項63】
前記組成物がさらに、活性な薬学的な成分、エンハンサー、賦形剤、ならびにpHを調節する、前記組成物を緩衝する、分解を妨げる、および外観、臭いまたは風味を改善するために用いられる薬剤からなる群より選択される少なくとも1つの追加の成分を含む、請求項46に記載の方法。
【請求項64】
前記組成物が、固体経口剤形、液体経口剤形、ゼラチンカプセル剤形、膣坐剤、直腸坐剤またはスプレーからなる群より選択される剤形によって投与される、請求項46に記載の方法。
【請求項65】
前記治療上有効な量が、エストロゲン様効果を誘発する量である、請求項46に記載の方法。
【請求項66】
前記エストロゲン様効果が、少なくとも1つの更年期症状を治療または予防すること、骨粗鬆症を治療または予防すること、またはそれらの任意の組み合わせからなる群より選択される、請求項65に記載の方法。
【請求項67】
前記エストロゲン様効果が、少なくとも1つの更年期症状を治療または予防することである、請求項66に記載の方法。
【請求項68】
前記更年期症状が、ほてり、不眠症、膣もしくは外陰の委縮、性欲減退、尿失禁、頭痛、抑うつまたはそれらの任意の組み合わせからなる群より選択される、請求項67に記載の方法。
【請求項69】
前記更年期症状が膣または外陰の委縮である、請求項68に記載の方法。
【請求項70】
前記エストロゲン様効果が骨粗鬆症を治療または予防することを包含する、請求項66に記載の方法。
【請求項71】
エストロゲン応答要素の制御下で遺伝子を活性化する方法であって、該遺伝子に作動可能に連結されたエストロゲン応答要素およびエストロゲン受容体を有する細胞に対して、ある量の組成物を投与することを包含し、該組成物は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を含み、該植物化学物質の精製された抽出物が、該遺伝子を活性化するのに十分な量である、方法。
【請求項72】
前記植物化学物質が、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される、請求項71に記載の方法。
【請求項73】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む、請求項71に記載の方法。
【請求項74】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンを含む、請求項71に記載の方法。
【請求項75】
前記細胞がインビトロである、請求項71に記載の方法。
【請求項76】
前記細胞がインビボである、請求項71に記載の方法。
【請求項77】
前記細胞がERα+乳房組織にある、請求項71に記載の方法。
【請求項78】
前記細胞がERβ+乳房組織にある、請求項71に記載の方法。
【請求項79】
前記細胞がERα/ERβ+乳房組織にある、請求項71に記載の方法。
【請求項80】
前記エストロゲン応答要素が形質転換された細胞で発現される、請求項71に記載の方法。
【請求項81】
前記エストロゲン応答要素および前記エストロゲン受容体の両方が前記細胞で発現される、請求項71に記載の方法。
【請求項82】
前記エストロゲン応答要素が前記細胞中で異種発現される、請求項71に記載の方法。
【請求項83】
前記エストロゲン応答要素およびエストロゲン受容体の両方が前記細胞中で異種発現される、請求項71に記載の方法。
【請求項84】
前記細胞がERE制御遺伝子で形質転換されたU937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される、請求項71に記載の方法。
【請求項85】
前記細胞がERαを発現する、請求項84に記載の方法。
【請求項86】
前記細胞がERβを発現する、請求項84に記載の方法。
【請求項87】
前記ERE制御遺伝子がERE−tk−Lucである、請求項84に記載の方法。
【請求項88】
TNF RE制御遺伝子の発現を抑制する方法であって、TNF応答要素の制御下の遺伝子およびエストロゲン受容体を含む細胞に対して、ある量の組成物を投与することを包含し、該組成物は、キバナオウギ、ナイモウオウギ、ハナスゲおよびイノコズチ由来の植物化学物質の精製された抽出物を含み、該植物化学物質の精製された抽出物が、該TNF RE制御遺伝子を抑制するのに十分な量である、方法。
【請求項89】
前記植物化学物質が、カリコシン、ニアソールおよび四環系イソフラボンからなる群より選択される、請求項88に記載の方法。
【請求項90】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンのうちの少なくとも2つを含む、請求項88に記載の方法。
【請求項91】
前記抽出物が、カリコシン、ニアソールおよび四環系イソフラボンを含む、請求項88に記載の方法。
【請求項92】
前記TNF RE制御遺伝子がTNF−αである、請求項88に記載の方法。
【請求項93】
前記TNF RE制御遺伝子がTNF RE−Lucである、請求項88に記載の方法。
【請求項94】
前記細胞がインビトロである、請求項88に記載の方法。
【請求項95】
前記細胞がインビボである、請求項88に記載の方法。
【請求項96】
前記細胞がER+乳房組織にある、請求項88に記載の方法。
【請求項97】
前記細胞がERα+乳房組織にある、請求項88に記載の方法。
【請求項98】
前記細胞がERβ+乳房組織にある、請求項88に記載の方法。
【請求項99】
前記TNF応答要素が前記細胞で内因的に発現される、請求項88に記載の方法。
【請求項100】
前記TNF応答要素およびエストロゲン受容体の両方が前記細胞中で内因的に発現される、請求項99に記載の方法。
【請求項101】
前記TNF応答要素が前記細胞中で異種発現される、請求項88に記載の方法。
【請求項102】
前記TNF応答要素およびエストロゲン受容体の両方が前記細胞中で異種発現される、請求項88に記載の方法。
【請求項103】
前記細胞がエストロゲン受容体遺伝子を含み、TNF応答要素制御遺伝子で形質転換され、かつU937、U2OS、MDA−MB−435およびMCF−7細胞からなる群より選択される、請求項88に記載の方法。
【請求項104】
前記エストロゲン受容体遺伝子がERαを発現する遺伝子である、請求項103に記載の方法。
【請求項105】
前記エストロゲン受容体遺伝子がERβを発現する遺伝子である、請求項103に記載の方法。
【図1A】


【図1B】


【図1C】


【図2A】


【図2B】


【図2C】


【図2D】


【図3A】


【図3B】


【図3C】


【図3D】


【図3E】


【図4A−4C】




【図1B】


【図1C】


【図2A】


【図2B】


【図2C】


【図2D】


【図3A】


【図3B】


【図3C】


【図3D】


【図3E】


【図4A−4C】


【公表番号】特表2011−519947(P2011−519947A)
【公表日】平成23年7月14日(2011.7.14)
【国際特許分類】
【出願番号】特願2011−508616(P2011−508616)
【出願日】平成21年5月5日(2009.5.5)
【国際出願番号】PCT/US2009/042915
【国際公開番号】WO2009/137534
【国際公開日】平成21年11月12日(2009.11.12)
【出願人】(507200569)バイオノボ・インコーポレーテッド (24)
【Fターム(参考)】
【公表日】平成23年7月14日(2011.7.14)
【国際特許分類】
【出願日】平成21年5月5日(2009.5.5)
【国際出願番号】PCT/US2009/042915
【国際公開番号】WO2009/137534
【国際公開日】平成21年11月12日(2009.11.12)
【出願人】(507200569)バイオノボ・インコーポレーテッド (24)
【Fターム(参考)】
[ Back to top ]

