膣ラクトバチルス薬
【課題】膣用の薬に有効なラクトバチルス属の細菌株を含む膣薬を提供すること。
【解決手段】膣薬は、(a)(i)50%以上の膣上皮細胞(VEC)への接着価と、(ii)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、を含む同定のための特徴を有するラクトバチルス属の単離菌株の純粋培養された細菌培養物と、(b)結合剤、抗酸化剤、多価アルコール、炭水化物、及び、スキムミルクとアルブミンとから構成される群より選択される物質、を含有する保存用基質と、を含有する。同基質は、インビトロにおいて12ヶ月以上の間、106個以上の生存可能な、純粋かつ遺伝的に安定な細胞を保持する基質である。
【解決手段】膣薬は、(a)(i)50%以上の膣上皮細胞(VEC)への接着価と、(ii)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、を含む同定のための特徴を有するラクトバチルス属の単離菌株の純粋培養された細菌培養物と、(b)結合剤、抗酸化剤、多価アルコール、炭水化物、及び、スキムミルクとアルブミンとから構成される群より選択される物質、を含有する保存用基質と、を含有する。同基質は、インビトロにおいて12ヶ月以上の間、106個以上の生存可能な、純粋かつ遺伝的に安定な細胞を保持する基質である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、膣薬での使用に好適な望ましい特性を有するラクトバチルス(Lactobacillus)属の細菌に関するものである。詳細には、本発明は、保存細菌細胞の実質的に純粋な培養物を有する膣薬、保存用基質、保存用基質中で細菌細胞を保存する方法;ならびに膣感染の予防・治療方法に関するものである。
【背景技術】
【0002】
本発明は一部、いずれも国立衛生研究所が提供するAI31448およびR43 AI36021−01、ならびに疾患管理センター(Center for Disease Control)が提供するCDC200−94−0189下での政府支援によって行われたものである。政府は、本発明に対してある一定の権利を有する。
【0003】
性病(STD)などの下部生殖管感染は、妊娠可能年齢の女性で最も一般的な臨床的問題に数えられる。米国では年間に、1000万件を超える病院来院が膣の愁訴によるものである。膣分泌物は、膣感染(酵母、細菌性膣炎およびトリコモナス)または子宮頸感染(淋病またはクラミジア)による場合がある。さらに、早産、低体重児および新生児死亡率と膣感染との間に関連性があることを示す証拠がある程度あり、それらは産科で直面している最も重要な問題に数えられている。細菌性膣炎は、妊娠における最も一般的な性器感染の一つである。妊娠の第2三ヶ月期中に細菌性膣炎と診断された女性は、細菌性膣炎のない女性と比較して、40%高い確率で、早産による低体重児を出産している。そのような出産をごくわずかな割合であっても予防すれば、大幅な費用節減と新生児の罹患率および死亡率を低下させることができると考えられる。
【0004】
ラクトバチルス類(Lactobacilli)は、ヒトの腸、および膣の細菌叢の一部を構成するグラム陽性桿菌である。膣ラクトバチルス類は、乳酸の産生および膣の酸性化により、あるいは過酸化水素H2O2などの他の抗菌物質の産生により、感染に対する抵抗性において重要な役割を果たすと考えられている。優勢な膣ラクトバチルス叢を有する女性は、淋病、クラミジア感染、トリコモナス症および細菌性膣炎の発生頻度が50%低いことが明らかになっている。膣におけるH2O2生産性ラクトバチルス類の存在は、細菌性膣炎、症候性酵母性膣炎ならびに淋菌(Neisseria gonorrhea)、トラコーマ病原体(Chlamydia trachomatis)および膣トリコモナス(Trichomonas vaginalis)などの性病病原体の頻度低下に関連していた。インビトロ試験から、H2O2産生性ラクトバチルス類が、膣病原体に対して、さらにはヒト免疫不全ウィルス(HIV)に対しても強力な殺菌性および殺ウィルス性を有することが明らかになっている。
【0005】
残念ながら、多くの妊娠可能年齢の女性で膣ラクトバチルス類が存在しない。膣の生態系は、投薬、全身の健康状態、性生活および避妊によって大きく影響される。多くの膣薬および全身薬によって、膣のラクトバチルス類が死ぬ可能性がある。従って、抗生物質による性病治療を行うと、その女性では該疾患を再度獲得する危険性が高くなる可能性がある。ラクトバチルス類が膣の健康を促進するという考えが広まったことと相まって、上記の所見から臨床医は、そのような女性では、膣に再度ラクトバチルス類をコロニー形成することで、生殖管感染の予防または治療を行うべきであるという示唆を得た。
【0006】
膣内または経口で使用するためのラクトバチルス製剤は、健康食品店で販売される「乳酸菌」製品の形で、そして食料品店で販売される乳酸菌ミルクまたはヨーグルト(例えば、それらの製品は代表的には、ラクトバチルス・アシドフィルス(Lactobacillus acidophilus)株を含むことを謳っている)の形で100年以上にわたって市販されている。それらの製品には、ヒト起源のラクトバチルス・アシドフィルスならびに各種栄養補助剤を含む膣坐剤などがあった。それらの製品は、膣に外因性のラクトバチルス類をコロニー形成しないため、ほとんど効果がなかった。そのように効果がないのは、市販品の品質が低いためであると考えられる。食品の一部として、あるいはラクトバチルス補給剤として販売されるラクトバチルス製品は、他の病原体で汚染されている場合が多いことが明らかになっている。さらに、ヨーグルトから得られるラクトバチルスは、膣の上皮細胞に結合できないことが明らかになっている。ラクトバチルスの上皮細胞への結合は、宿主生物のコロニー形成を確立する上で必要な段階である。従って、市販のラクトバチルス製品は、不適切な微生物株を含み(例えば、多くのものが膣からは希にしか採取されない菌株を含む)、微生物の生存力が低く、ないしは微生物が膣の上皮細胞に結合したり、コロニーを確立する能力を持たないのが普通であることから、そのような製品を使用しても、膣感染の予防や治療にはほとんど役立たないと考えられる。
【発明の概要】
【発明が解決しようとする課題】
【0007】
従って、厳密な条件下で製造することができ、インビボでの微生物特性、活性な付着力および有効な生存微生物力価を有する適切なヒトラクトバチルス株を用いる膣感染治療用の製品が望まれている。
【課題を解決するための手段】
【0008】
上述の目的を解決するために、請求項1に記載の発明は、(a)(i)50%以上の膣上皮細胞(VEC)への接着価と、(ii)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、を含む同定のための特徴を有するラクトバチルス属の単離菌株の純粋培養された細菌培養物と、(b)結合剤、抗酸化剤、多価アルコール、炭水化物、及び、スキムミルクとアルブミンとから構成される群より選択される物質、を含有する保存用基質と、を含有し、同基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能な、純粋かつ遺伝的に安定な細胞を保持する基質である膣薬を提供する。
【0009】
請求項2に記載の発明は、請求項1に記載の膣薬において、菌株が、有効な培養条件下において、10ppm以上のH2O2を生産する能力を有することをその要旨とする。
請求項3に記載の発明は、請求項1に記載の膣薬において、菌株が、1ヶ月以上の間、インビボにおいて膣上皮細胞へコロニーを形成し続けることをその要旨とする。
【0010】
請求項4に記載の発明は、請求項1に記載の膣薬において、菌株が、代謝が不活性な状態において膣上皮細胞に接着することをその要旨とする。
請求項5に記載の発明は、請求項1に記載の膣薬において、菌株の1つの細胞の幅が1μmから2μm、長さが2μmから4μmであることをその要旨とする。
【0011】
請求項6に記載の発明は、請求項1に記載の膣薬において、菌株は、有効な培養条件下において、0.75mg/100ml以上の乳酸を生産することをその要旨とする。
請求項7に記載の発明は、請求項1に記載の膣薬において、基質が、インビトロにおいて12ヶ月以上の間、107個以上の生存可能な細胞を保持する基質であることをその要旨とする。
【0012】
請求項8に記載の発明は、請求項1に記載の膣薬において、基質が、インビトロにおいて、4℃から6℃の温度で、12ヶ月以上の間、106個以上の生存可能な細胞を保持する基質であることをその要旨とする。
【0013】
請求項9に記載の発明は、請求項1に記載の膣薬において、基質が、インビトロにおいて、室温で、12ヶ月以上の間、106個以上の生存可能な細胞を保持する基質であることをその要旨とする。
【0014】
請求項10に記載の発明は、請求項1に記載の膣薬において、基質のpHが5.0から7.0までであることをその要旨とする。
請求項11に記載の発明は、請求項1に記載の膣薬において、菌株はラクトバチルス・クリスパトゥスであることをその要旨とする。
【0015】
請求項12に記載の発明は、請求項1に記載の膣薬において、菌株が、ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)であることをその要旨とする。
【0016】
請求項13に記載の発明は、請求項1に記載の膣薬において、菌株はラクトバチルス・イエンセンであることをその要旨とする。
請求項14に記載の発明は、請求項1に記載の膣薬において、同膣薬が不活性担体を更に含有することをその要旨とする。
【0017】
請求項15に記載の発明は、(a)50%以上の膣上皮細胞(VEC)への接着価と、(b)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、を含む同定のための特徴を有するラクトバチルス属の単離細菌株を提供する。
【0018】
請求項16に記載の発明は、請求項15に記載の単離細菌株において、菌株が、65%以上のVECへの接着価を有することをその要旨とする。
請求項17に記載の発明は、請求項15に記載の単離細菌株において、菌株が、有効な培養条件下において10ppm以上のH2O2を生産する能力を有することをその要旨とする。
【0019】
請求項18に記載の発明は、請求項15に記載の単離細菌株において、菌株が、代謝が不活性な状態において膣上皮細胞に接着することをその要旨とする。
請求項19に記載の発明は、請求項15に記載の単離細菌株において、菌株が、1ヶ月以上の間、インビボにおいて膣上皮細胞へコロニーを形成し続けることをその要旨とする。
【0020】
請求項20に記載の発明は、請求項15に記載の単離細菌株において、菌株が、24ヶ月以上の膣でのコロニー形成の間、インビボにおいて遺伝的に安定であることをその要旨とする。
【0021】
請求項21に記載の発明は、請求項15に記載の単離細菌株において、菌株は、有効な培養条件下において、0.75mg/100ml以上の乳酸を生産することをその要旨とする。
【0022】
請求項22に記載の発明は、請求項15に記載の単離細菌株において、菌株の1つの細胞の幅が1μmから2μm、長さが2μmから4μmであることをその要旨とする。
請求項23に記載の発明は、請求項15に記載の単離細菌株において、菌株はラクトバチルス・クリスパトゥスであることをその要旨とする。
【0023】
請求項24に記載の発明は、請求項15に記載の単離細菌株において、菌株が、ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)であることをその要旨とする。
【0024】
請求項25に記載の発明は、請求項15に記載の単離細菌株において、菌株はラクトバチルス・イエンセンであることをその要旨とする。
請求項26に記載の発明は、(a)(i)50%以上の膣上皮細胞(VEC)への接着価と、(ii)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、を含む同定のための特徴を有する2種類以上のラクトバチルス属の単離菌株の、純粋培養された細菌培養物と、(b)結合剤、抗酸化剤、多価アルコール、炭水化物、及び、スキムミルクとアルブミンとから構成される群より選択される物質、を含有する保存用基質と、を含有し、基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能な、純粋かつ遺伝的に安定な細胞を保持する基質である膣薬を提供する。
【0025】
請求項27に記載の発明は、請求項26の膣薬において、膣薬は、細菌性膣炎、症候性酵母膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染、尿路感染症、及び骨盤内炎症性疾患から成るグループより選択される2つ以上の膣感染症を治療するために使用されることをその要旨とする。
【0026】
請求項28に記載の発明は、請求項26の膣薬において、細菌培養物は、第1の膣の感染症に有効な、ラクトバチルス属の第1の菌株と、第2の膣の感染症の治療に有効な、ラクトバチルス属の第2の菌株とを含むことをその要旨とする。
【0027】
請求項29に記載の発明は、請求項28の膣薬において、第1の菌株はラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)であり、第2の菌株はラクトバチルス・イエンセンであることをその要旨とする。
【0028】
請求項30に記載の発明は、ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)からなる細菌菌株を提供する。
請求項31に記載の発明は、(a)単離されたラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)の純粋培養された細菌培養物と、(b)14%のゼラチン、0.5%のアスコルビン酸ナトリウム、2.5%のデキストロース、1.5%のスキムミルク、及び6%のキシリトールを含む保存用基質と、を含有する膣薬であって、基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能で遺伝的に安定な細胞を保持し、基質は前記ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)の望ましい特徴を保持し、同特徴は、代謝が不活性な状態において膣上皮細胞に接着する能力と、有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、膣上皮細胞(VEC)への接着価が50%以上であることとから成るグループより選択される、膣薬を提供する。
【0029】
本発明は、膣薬での使用に好適な所望の特性を有するラクトバチルス属の細菌に関する。詳細には本発明は、保存細菌細胞の実質的に純粋な基質を有する経膣薬、直腸薬および経口薬;保存用基質;ならびに膣感染の予防・治療方法に関するものである。
【0030】
インビボで投与する場合、本発明で開示のラクトバチルスの固有の菌株は、膣上皮細胞にコロニー形成および固着する。次に、それら固有菌株を、時間をかけて膣環境から回収することができる。そのような持続的コロニー形成およびラクトバチルス株の生存能力は、かなりの部分が、本発明で開示の新規保存用基質によるものである。本発明の保存用基質によって提供される保護により、ラクトバチルス株は、代謝的に不活性な状態で膣上皮細胞に付着し、その位置を確保しながら、機能性の阻害性副産物を産生できる活性状態に戻ることができる。微生物細胞用基質のそのような能力については、これまで認められていなかった。本発明の保存用基質はさらに、市販の坐剤製品の生産に各種乾燥方法を可能とするだけの柔軟性を提供するものである。
【0031】
本発明の1実施態様は、膣薬に関するものである。そのような薬には、(i)約50%以上の膣上皮細胞(VEC)接着パーセント値(以下に定義の通り)および(ii)有効な培養条件下で約0.5ppmより高いH2O2を産生する能力などの固有の特性を有するラクトバチルス属の単離株の実質的に純粋な細菌培養物などがある。本発明の膣薬はさらに、細菌培養物を含有・保存する保存用基質をも含むものである。そのような基質には、生理活性結合剤、酸化防止剤、多価アルコール、炭水化物および蛋白質材料が含まれる。1実施態様において、該基質は、約5.0〜約7.0のpHを有する。別の実施態様では、該基質は約7.0のpHを有する。本発明の保存用基質は、インビトロで約12ヶ月以上にわたって、約106個以上の遺伝的に安定な生存細胞を維持することができる。さらに別の実施態様では、該基質は、インビトロで約12ヶ月以上にわたって、約107個以上の生存細胞を維持し、より好ましくはインビトロで約12ヶ月以上にわたって、約108個以上の生存細胞を維持する。
【0032】
他の実施態様では、単離ラクトバチルス株は、約65%以上、より好ましくは約80%以上、さらに好ましくは約95%以上のVEC接着パーセント値を有する。さらに別の実施態様では、該単離株は、約10ppm以上のH2O2、より好ましくは約20ppm以上のH2O2を産生する能力を有する。
【0033】
前述のように、本発明の1実施態様は、代謝的に不活性な状態にある時に、膣上皮細胞に付着する前述のようなラクトバチルス株に関するものである。別の実施態様では、該単離株は、インビボで約1ヶ月以上にわたり、膣上皮細胞のコロニー形成を維持する。さらに別の実施態様では、該単離株は、インビボで約24ヶ月以上にわたり遺伝的安定性を維持する。単離株の1個の細胞は、約1μm〜約2μmの幅、約2μm〜約4μmの長さを有し、有効な培養条件下で、約0.75mg/100mL以上の乳酸を産生する。
【0034】
1実施態様では、本発明のラクトバチルス株は、ラクトバチルス・クリスパトゥス種のものであり、別の実施態様では、本発明のラクトバチルス株はラクトバチルス・イエンセン(Lactobacillus jensenii)種のものである。さらに別の実施態様では、本発明のラクトバチルス株は、本発明の好ましいラクトバチルス株であるラクトバチルス・クリスパトゥス(Lactobacillus crispatus)CTV−5の固有特性全てを有する。
【0035】
本発明の保存用基質は、約4℃〜約6℃の温度、好ましくは室温で、インビトロにて、約12ヶ月以上の期間にわたり、約106個以上の生存細胞を維持する。別の実施態様では、該基質は、インビトロで約18ヶ月以上、好ましくはインビトロで約24ヶ月以上の期間にわたり、約106個以上の生存細胞を維持する。
【0036】
本発明の膣薬は、マルトデキストリンビーズまたはゼラチンカプセルなど(これらに限定されるものではない)の不活性担体を有することができる。1実施態様においては、消化器薬には、(a)(i)約50%以上の膣上皮細胞(VEC)接着パーセント値(以下に定義の通り)および(ii)有効な培養条件下で約0.5ppmより高いH2O2を産生する能力などの固有特性を有するラクトバチルス属の単離株の実質的に純粋な細菌培養物;ならびに(b)生理活性結合剤、酸化防止剤、多価アルコール、炭水化物および蛋白質材料を含む保存用基質が含まれる。そのような基質は、インビトロで約12ヶ月以上の期間にわたり、約106個以上の実質的に純粋で遺伝的に安定な生存細胞を維持する。
【0037】
本発明の別の実施態様は、微生物細胞を保存するための保存用基質に関する。そのような基質は、(a)水溶性ガム、カルボキシメチルセルロースおよびゼラチンなどの生理活性結合剤;(b)酸化防止剤(好ましくはアスコルビン酸ナトリウム);(c)キシリトール、アドニトール、グリセリン、ダルシトール、イノシトール、マニトール、ソルビトールおよびアラビトールなどの多価アルコール;(d)ブドウ糖、ラクトース、マルトース、ショ糖、果糖ならびに他の単糖類、二糖類およびオリゴ糖類などの炭水化物;(e)スキムミルクおよびアルブミンなどの蛋白質材料を含む。そのような基質は、インビトロで約12ヶ月以上の期間にわたり、約106個以上の実質的に純粋で遺伝的に安定な生存細胞を維持する。
【0038】
別の実施態様では、生理活性結合剤は基質全体の約10重量%以上含まれ;酸化防止剤は基質全体の約0.1重量%以上含まれ;多価アルコールは基質全体の約1重量%以上含まれ;炭水化物は基質全体の約0.5重量%以上含まれ;蛋白質材料は基質全体の約0.5重量%以上含まれる。
【0039】
さらに別の実施態様では、生理活性結合剤は基質全体の約14重量%以上含まれ;酸化防止剤は基質全体の約0.5重量%以上含まれ;多価アルコールは基質全体の約6重量%以上含まれ;炭水化物は基質全体の約2.5重量%以上含まれ;蛋白質材料は基質全体の約1.5重量%以上含まれる。
【0040】
本発明の別の実施態様は、保存用基質の約14重量%のゼラチン、約0.5重量%のアスコルビン酸ナトリウム、約2.5重量%のブドウ糖、約1.5重量%のスキムミルク、約6重量%のキシリトールを含む微生物細胞保存用の保存用基質である。
【0041】
本発明のさらに別の実施態様は、微生物細胞の保存のための保存用基質の製造方法に関するものである。そのような方法は、(a)(i)水溶性ガム、カルボキシメチルセルロースおよびゼラチンなどの滅菌生理活性結合剤;(ii)スキムミルクおよびアルブミンなどの滅菌蛋白質材料;(iii)キシリトール、アドニトール、グリセリン、ダルシトール、イノシトール、マニトール、ソルビトールおよびアラビトールなどの滅菌多価アルコール;(iv)滅菌酸化防止剤;(v)ブドウ糖、ラクトース、マルトース、ショ糖、果糖ならびに他の単糖類、他の二糖類および他のオリゴ糖類などの滅菌炭水化物;(vi)水などの成分を提供する段階;ならびに(b)これら成分を共に混和して、溶液を形成する段階を有するものである。生理活性結合剤は、液体として提供することができる。
【0042】
本発明のさらに別の実施態様は、保存用基質内に微生物細胞を保存する方法に関するものである。そのような方法には、(a)約106個以上の微生物細胞の培養物を保存用基質に懸濁させて、細胞基質懸濁液を形成する段階;(b)該細胞基質懸濁液を不活性担体に加えることで、投与組成物を形成する段階;ならびに該投与組成物から水を除去する段階が含まれる。保存用基質には、上記のような成分が含まれる。1実施態様においては、該方法にはさらに、輸送および保存時に水分および酸素から投与組成物を保護する包装中に前記投与組成物を入れる段階が含まれる。
【0043】
1実施態様においては、前記不活性担体には、マルトデキストリンビーズなどがあり、その場合前記方法には、該ビーズ表面に細胞基質懸濁液をコーティングする段階および該ビーズを流動床乾燥によって乾燥することで水を除去する段階が含まれる。
【0044】
別の実施態様においては、不活性担体にはゼラチンカプセルがあり、その場合前記方法には、細胞懸濁液基質が非流体の基質を形成するまで該ゼラチンカプセルを冷却する段階、その次に該ゼラチンカプセルを乾燥室で乾燥させる段階が含まれる。前記乾燥段階には、約24℃〜約32℃で、約25%未満の水分、好ましくは約15%未満の水分、さらに好ましくは約5%未満の水分を含む乾燥空気を乾燥室に送り込む段階、ならびに湿った空気を乾燥室から排気する段階が含まれる。乾燥室には、コンプレッサ、1以上の炭化水素集塵フィルターおよび冷却空気コンプレッサがあっても良い。乾燥室にはさらに、乾燥剤カラムがあっても良い。
【0045】
本発明のさらに別の実施態様は、膣感染から女性を保護する方法に関するものである。該方法には、本明細書で前述したような本発明の膣薬を女性に投与する段階がある。別の実施態様は、膣感染の治療方法であって、本明細書で前述したような本発明の膣薬を女性に投与する段階を有する方法に関するものである。そのような医薬品が有用である膣感染には、細菌性膣炎、症候性酵母性膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染、尿道感染または骨盤内炎症性疾患などがある。
【0046】
本発明のさらに別の実施態様は、ヒト免疫不全ウィルス(HIV)によるヒトの感染の危険性を低減する方法であって、本明細書で前述したような本発明の膣薬をヒトに投与する段階を有する方法に関するものである。好ましい実施態様では、該医薬品に含まれるラクトバチルス株は、ラクトバチルス・クリスパトゥスCTV−5である。
【0047】
本発明の別の実施態様は、消化器感染によるヒトの感染を予防する方法であって、本明細書で前述したような本発明の膣薬をヒトに投与する段階を有する方法に関するものである。
【0048】
本発明の別の実施態様は、早産を予防する方法であって、本明細書で前述したような本発明の膣薬を妊婦に投与する段階を有する方法に関するものである。
本発明の1実施態様は、膣および腸におけるエストロゲンの代謝を促進する方法であって、本明細書で前述したような本発明の膣薬を女性に投与する段階を有する方法である。
【0049】
本発明のさらに別の実施態様は、(a)(i)約50%以上の膣上皮細胞(VEC)接着パーセント値(以下に定義の通り)および(ii)有効な培養条件下で約0.5ppmより高いH2O2を産生する能力などの固有特性を有するラクトバチルス属の2種類以上の単離株の実質的に純粋な細菌培養物;ならびに(b)生理活性結合剤、酸化防止剤、多価アルコール、炭水化物および蛋白質材料を含む保存用基質を含む膣薬に関するものである。そのような基質は、インビトロで約12ヶ月以上にわたって、約106個以上の実質的に純粋で遺伝的に安定な生存細胞を維持する。そのような医薬品は、細菌性膣炎、症候性酵母膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染、尿路感染症または骨盤内炎症性疾患などの2種類以上の膣感染の治療に用いることができる。1実施態様においては、細胞培養物には、第1の膣感染の治療に有効な第1の菌株および第2の膣感染の治療に有効な第2の菌株が含まれる。好ましい実施態様においては、第1の菌株はラクトバチルス・クリスパトゥスCTV−5であり、第2の菌株はラクトバチルス・イエンセン種である。
【0050】
本発明の別の実施態様は、(a)単離ラクトバチルス・クリスパトゥスCTV−5の実質的に純粋な細菌培養物;ならびに(b)約14重量%のゼラチン、約0.5重量%のアスコルビン酸ナトリウム、約2.5重量%のブドウ糖、約1.5重量%のスキムミルク、約6重量%のキシリトールを含む保存用基質を有する膣薬に関するものである。該基質は、インビトロで約12ヶ月以上にわたって、約106個以上の遺伝的に安定な生存細胞を維持し、ラクトバチルス・クリスパトゥスCTV−5の望ましい特性を保存する。そのような特性には、代謝的に不活性な状態で膣上皮細胞に付着する能力、効果的な培養条件下で約0.5ppmを超えるH2O2を産生する能力、約50%以上の膣上皮細胞(VEC)接着パーセント値などがある。
【図面の簡単な説明】
【0051】
【図1】ラクトバチルス株CTV−05の生存率の安定性に対する高温保存の効果を示すグラフである。
【図2】ラクトバチルス株CTV−05の生存率の安定性に対する長期室温および冷蔵保存の効果を示すグラフである。
【図3】本発明の風乾保存用基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【図4】風乾標準スキムミルク基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【図5】本発明の凍結乾燥保存用基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【図6】凍結乾燥標準スキムミルク基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【図7】マルトデキストリンで流動床乾燥した本発明の保存用基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【図8】本発明の懸濁基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【発明を実施するための形態】
【0052】
本発明は、膣感染の予防用の医薬品として、経口使用または膣内使用に好適な望ましい特性を有するラクトバチルス属のヒト菌株に関するものである。詳細には、その望ましい特性には、膣上皮細胞への付着およびコロニー形成を行う能力、過酸化水素の産生、特異的効力、貯蔵期間安定性、膣感染因子の阻害、乳酸の産生および個々の菌細胞の大きさなどがある。さらに本発明は、保存菌細胞の実質的に純粋な培養物を含む膣薬に関するものであり、さらには該菌細胞を医薬品内で保存することで、約12ヶ月以上の保存期間を通じて、純度、遺伝的安定性および上記の望ましい特性を維持する方法に関するものである。
【0053】
現在市販のラクトバチルス製品は多くの場合、汚染されているか、あるいはH2O2産生性のラクトバチルス類の適切な膣株を十分な量で含まない。さらに、現在市販のラクトバチルス株は、膣上皮細胞にコロニー形成できない場合が多い。十分な効力および株選択の問題に加えて、既存の製品では、それの商業的生産時に用いる保存方法のために、効力がない場合がある。多くの製品で、ラクトバチルス株が、インビトロで剥離膣上皮細胞に付着する能力、ならびにインビボで膣上皮細胞にコロニー形成する能力を持たない場合が多い。さらに、保存株の貯蔵期間は短い場合が多く、2〜3ヶ月で生存細胞数は急速に低下する。現在使用されている保存方法の中には、食品保存用に開発されたものもあり、微生物保存に最適ではない可能性が高い。保存方法は、細胞を保護し、細胞成長を一時停止させながら、代謝的に不活性な状態(すなわち、保存状態)で細胞を膣壁に付着させなければならないことから、それは非常に重大である。
【0054】
本発明は、現在使用可能な栄養補助食品および膣補給剤と比較して優れた利点をいくつか提供するものである。現代のDNAに基づく技術を用いることで、膣内の最も一般的なラクトバチルスは、現在の多くの栄養補助食品および膣治療薬が用いている菌種であるラクトバチルス・アシドフィルスではないことが示唆されるようになった。本発明者らは、膣薬用に現在市販されているものより優れたラクトバチルス・クリスパトゥスおよびラクトバチルス・イエンセンの新規菌株を同定・単離した。さらに本発明者らは、増殖、回収、保存、膣投与系への配置および保存の際に望ましい特性を失うことなく、少量および大量の両方で菌株を製造する至適条件を明らかにした。本発明者らはさらに、微生物の所望の特性を保存できるような形で微生物を保存する新規な保存用基質および方法をも提供するものである。さらに詳細には、本発明の保存用基質により、ラクトバチルス株は、インビボで代謝的に不活性な状態で膣上皮細胞に付着し、位置を保持しながら、機能性の阻害性副産物を産生することができる活性状態に戻ることができる。微生物/保存用基質の組み合わせにそのような能力のあることは、本発明以前には報告されていない。本発明の保存用基質はさらに、保存状態で長期間にわたり、室温または冷蔵温度で微生物を保存することができ、しかも市販の医薬品製造のための各種乾燥方法を使えるだけの柔軟性を提供するものである。そのような能力を有する保存用基質は本発明で初めて明らかにされるものである。インビトロおよびインビボのいずれにおいても、本発明の医薬品が示す効力と同等以上の効力を示す現在公知のラクトバチルスの膣薬があるという情報を本発明者らは得ていない。
【0055】
本発明によれば、「膣薬」という用語は、膣を通して身体に侵入し得る感染および疾患などの、膣に直接または間接的に関係する感染、疾患その他の障害を予防もしくは治療するのに使用される医薬品(すなわち、薬物または薬)である。本発明の膣薬については、主として膣感染に関係する用途が本明細書に記載されているが、そのような膣薬は、必ずしも膣感染に関係しない感染および状態の治療に使用できることは明らかであり、そのような例としては消化管感染があり、その場合、本発明の医薬品は消化器薬と称することができる。
【0056】
本発明の1実施態様は、(i)約50%以上の膣上皮細胞(VEC)接着パーセント値(以下に定義の通り)および(ii)約0.5ppmより高いH2O2を産生する能力などの固有特性を有するラクトバチルス属の単離株の実質的に純粋な細菌培養物を含む膣薬に関するものである。該膣薬には、細菌培養物を含有・保存する保存用基質も含まれる。そのような基質は、生理活性結合剤、酸化防止剤、多価アルコール、炭水化物および蛋白質材料を含む。該基質は、インビトロで約12ヶ月以上にわたって、約106個以上の遺伝的に安定な生存細胞を維持することができる。1実施態様において、膣薬は、マルトデキストリンビーズおよびゼラチンカプセルなどの不活性担体を有することができる。
【0057】
本発明によれば、微生物の単離株とは、該微生物の天然環境から取り出された株である。「単離」という用語自体は必ずしも、該微生物の精製程度を反映したものではない。それとは対照的に、微生物株の「実質的に純粋な培養物」という表現は、所望の微生物株(すなわち、「坐剤(suppository)株」または「医薬株」)以外の微生物を実質的に含まない培養物を指す。すなわち、微生物株の実質的に純粋な培養物は、細菌汚染物や望ましくない化学汚染物などの他の汚染物を実質的に含まない。
【0058】
培養物中に座薬株が存在し、汚染株が存在しないことは、培養物中の微生物について、(1)標識DNAプローブを用いてのDNA相同性、(2)DNAフィンガープリントおよび/または(3)細胞壁脂肪酸プロファイルを分析する等の方法によって明らかにすることができる。例えば、培養物内の株については、座薬株からのDNAへの厳密なハイブリダイゼーション条件下で、培養物からのDNAがハイブリダイゼーションするか否かを明らかにすることで、所望の座薬株とのDNA相同性を分析することができる。本明細書で使用する場合、厳密なハイブリダイゼーション条件とは、オリゴヌクレオチドなどの核酸分子を用いて、類似の核酸配列を有する分子を同定する標準的なハイブリダイゼーション条件を指す。厳密なハイブリダイゼーション条件によって、ハイブリダイゼーション反応でプローブとして使用される核酸分子と約70%以上の核酸配列同一性を有する核酸分子を単離することができるのが普通である。そのような標準的条件は、Sambrook et al.,1989,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Labs Pressに開示されている。該文献(Sambrook et al.,ibid.)は、引用によってその全体が本明細書に含まれるものとする。そのような条件の例として、例えば、5×SSPE、1%サルコシル(Sarkosyl)、5×デーンハルツ(Denhardts)および0.1mg/mLの変性サケ精子DNAを含む溶液中、37℃で約2〜12時間にわたって、代表的にはフィルター(例:ニトロセルロースフィルター)上に固定化した核酸分子(例:被験培養物からのDNA)に、長さ約18〜25ヌクレオチドおよびTm約50℃〜約65℃のオリゴヌクレオチドプローブ(例:座薬株からのDNA)をハイブリダイゼーションすることができる。次にフィルターを、5×SSPE、1%サルコシルを含む洗浄液にて3回、37℃で各15分間洗浄する。フィルターはさらに、2×SSPE、1%サルコシルを含む洗浄液にて、37℃で各15分間洗浄することができる。例えば、無作為に初回抗原刺激したDNAプローブを、5×SSPE、1%サルコシル、0.5%ブロット(Blotto;乾燥ミルクの水溶液)および0.1mg/mLの変性サケ精子DNAを含む溶液中、42℃で約2〜12時間にわたって、代表的にはフィルター(例:ニトロセルロースフィルター)上に固定化した核酸分子にハイブリダイゼーションすることができる。次にフィルターを、5×SSPE、1%サルコシルを含む洗浄液にて2回、42℃で各15分間洗浄し、それに続いて、2×SSPE、1%サルコシルを含む洗浄液にて2回、42℃で各15分間洗浄することができる。ただし、これらの条件に限定されるものではない。
【0059】
反復配列ポリメラーゼ連鎖反応(RepPCR)によるDNAフィンガープリンティングを用いるか、あるいは細胞壁脂肪酸分析を用いる座薬株の同定方法については、後述の実施例の箇所で詳細に説明する。
【0060】
本発明の医薬品での使用に好適なラクトバチルス株(すなわち、座薬株)は、上記の固有特性を有するいずれかのラクトバチルス株であることができる。ラクトバチルス株は、当業界で公知の適切なスクリーニング法を用いて、天然入手源から検出・単離することができる。本発明での使用に好適なラクトバチルス株の固有特性ならびにそれら特性に関するスクリーニング方法については、後に詳細に説明する。ラクトバチルスの好ましい種には、ラクトバチルス・アシドフィルス、ラクトバチルス・イエンセンおよびラクトバチルス・クリスパトゥスなどがあり、好ましくはラクトバチルス・クリスパトゥスである。好ましくは、好適なラクトバチルス株は、ヒトの膣から単離する。特に好ましいラクトバチルス株は、ラクトバチルス・クリスパトゥスCTV−5株の固有特性全てを有する株であり、ラクトバチルス・クリスパトゥスCTV−5が最も好ましい。
【0061】
ラクトバチルスの公知の種および株以外に、公知の株または新規に同定される株に由来する天然株および突然変異株から新たに同定される種および株を、本発明の医薬品に用いることができることは、本発明の範囲に含まれるものである。例えば、親株に対して、1サイクル以上の化学的突然変異生成および/または放射線突然変異生成を行って突然変異率を高めることで、所望の特性が改善された微生物を得る確率を高めることにより、本発明の医薬品での使用に好適なラクトバチルスの固有特性を有するラクトバチルス親株の天然の突然変異株を単離することができる。本発明の突然変異微生物には、例えばVEC接着パーセント値(以下に定義)の高い遺伝子工学微生物によって得ることができる微生物も含まれることは、当業者には明らかであろう。本明細書で使用する場合、「突然変異微生物」とは、自然発生の突然変異、突然変異原への曝露の結果である突然変異、あるいは遺伝子工学の結果である突然変異によって、微生物のヌクレオチド組成が変化した突然変異親微生物である。
【0062】
本発明の膣薬での使用に好適なラクトバチルスの固有特性の一つは、該ラクトバチルス株が、約50%以上、好ましくは約65%以上、さらに好ましくは約80%以上、最も好ましくは約95%以上の膣上皮細胞(VEC)接着パーセント値を有するというものである。本発明によれば、「接着」および「付着」という用語は互換的に使うことができる。膣上皮細胞への細菌細胞の付着は、コロニー形成および生理効果にとって必須である。本明細書で使用する場合、コロニー形成とは、必ずしも組織の侵襲や損傷を生じるとは限らない、細胞上または材料上での微生物増殖部位の形成を指す。膣上皮細胞への本発明のラクトバチルス細胞付着が奏功すれば、膣上皮細胞のコロニー形成が奏功することになろう。本発明によれば、「VEC接着パーセント値」とは、特定の群中のVEC総数中、1個以上のラクトバチルス細胞が付着しているVECのパーセントと定義される。それは、従来において普通に使用されてきた付着の別尺度である。従来、インビトロでの付着有効性は、染色標本で認められる第1の所定数(例:50個)の膣上皮細胞(VEC)について付着細菌細胞数をカウントし、VEC当たりの付着細菌細胞の平均を計算することで求めていた。これまでは、その平均値が特定の細菌株の有効性の指標として用いられていた。理論的に拘束されるものではないが、本発明者らは、上述のような「VEC接着パーセント」の測定の方が、有効性測定としては優れていると考えている。実務的な面を強調すれば、インビトロでの付着は、ヒト被験者でのインビボでの付着およびコロニー形成と相関するものでなければ何の意味も持たないと、本発明者らは考えている。従って、従来の総VEC数でのVEC当たりの付着細胞平均値をインビトロおよびインビボでの有効性の尺度として用いるのではなく、本発明者らは、総VEC数中で、1個以上の付着微細菌細胞を有するVEC細胞のパーセントを計算する(すなわち、VEC接着パーセント値)。その値は、有意な数のVECがインビトロおよびインビボで細菌細胞を受け入れるか否かを示す良好な指標であることから、かなり意味のある値であると考えている。それとは対照的に、従来の付着平均値を用いると、歪曲して理解され、有効性について誤った解釈に至る場合がある。例えば、50個のVEC群に付着した細菌細胞数を技術者がカウントする以下の3つの場合で、2種類の付着測定法(すなわち、平均付着率とVEC接着パーセント値)により、インビトロでの付着有効性の評価が驚くほど異なったものとなる。
【0063】
A.技術者のカウントによると、総数50個のVEC中10個のVECに1500個の細菌細胞が付着しており、細菌細胞が付着していないVECは40個(80%)である(この場合、10個のVECそれぞれに150個の細菌細胞がある)。従来の平均値計算によると、平均付着値は菌30個/細胞であり、VEC接着パーセント値は20%である。
【0064】
B.技術者のカウントによると、総数50個のVEC中50個のVECに1500個の細菌細胞が付着しており、細菌細胞が付着していないVECは0個(0%)である(この場合、50個のVECそれぞれに30個の細菌細胞がある)。従来の平均値計算によると、平均付着値はやはり菌30個/細胞であるが、VEC接着パーセント値は100%である。
【0065】
C.技術者のカウントによると、総数50個のVEC中40個のVECに600個の細菌細胞が付着しており、細菌細胞が付着していないVECは10個(20%)である(この場合、40個のVECそれぞれに15個の細菌細胞がある)。従来の平均値計算によると、平均付着値は菌12個/細胞であり、VEC接着パーセント値は80%である。
【0066】
従って、本発明の好ましい付着測定を用いると、VEC当たりに付着した平均細菌数は場合Aと場合Bの両方で同じであっても、場合Bの方が、細菌細胞を受け入れたVECが多いことから(100%と20%)、付着有効性に関しては、場合Aの細菌より、場合Bの細菌の方が選択されることになると考えられる。実際、平均付着値は、場合Aで菌30個/VECあるのに対して、場合Cの細菌では菌12個/VECであるとしても、場合Cの場合の方が、細菌細胞を受け入れたVEC数が多い(80%と20%)ことから、場合Aの細菌との比較であれば、場合Cで調べた細菌であっても選択されるものと考えられる。以上の場合を考慮すると、VEC接着パーセント値の方が、付着有効性の計算では感度が高く、妥当性が高い。
【0067】
特に、膣生態系でラクトバチルスによって示される自己調節プロセスを考慮すると、従来の平均付着値と比較して、「VEC接着パーセント」値の方が、インビボでの長期コロニー形成の指標としては優れていると、本発明者らは考えている。ラクトバチルス群が「過度に密集状態」になると、自己抑制によって膣でのH2O2産生ラクトバチルスの過剰成長が防止されることが示唆されている。そのような安全因子が組み込まれていることで、過剰数の膣ラクトバチルスによる有害効果が生じる可能性が小さくなる。この現象を考慮すると、本発明においては、相対的に広い範囲のVEC上に拡散する(例えば、高いVEC接着パーセント値を有する)座薬株の方が、ごく少数のVECに多数付着すると考えられる菌株より好ましい。後者の状況では、少数の過度に密集したVEC上でのH2O2産生性ラクトバチルスの自己抑制が起こって、該細菌の長期的な生存およびコロニー形成の可能性が低下する可能性がある。インビボでの長期コロニー形成が本発明の製品および方法の最終的な目的であり、より多くのVECに、より少数のラクトバチルス細胞が付着することで、その目的がより良好に達成されるものと考えられる。1実施態様においては、本発明で使用される単離ラクトバチルス株は、約1ヶ月以上にわたって膣上皮細胞のコロニー形成を維持する能力によって確認される。
【0068】
本発明の医薬品での使用に好適なラクトバチルスの別の固有特性は、過酸化水素(H2O2)産生能力である。前述のように、ラクトバチルスが他の微生物を殺す効果は、直接には過酸化水素によるものであることが明らかになっている。好ましくは、該ラクトバチルスは、通常の成長条件下で、約0.5ppmを超えるH2O2を産生することができる。より好ましくは、該ラクトバチルスは、H2O2の産生を促進することができる培地および条件と本明細書で定義されるような有効な成長条件下で、約10ppm以上のH2O2を産生することができ、さらに好ましくは、該ラクトバチルスは、約20ppm以上のH2O2を産生することができる。有効な成長条件には、インビトロ成長条件(例えば、有効な培地および条件)およびインビボ成長条件(例えば、膣上皮細胞のコロニー形成奏功)の両方がある。
【0069】
本発明のラクトバチルスの過酸化水素生成量は任意の過酸化水素測定法で定量できる。例えば、ラクトバチルスをテトラメチルベンジジン(TMB)培地へ接種し好気性条件下で培養し、青色を定量し過酸化水素生成量を測定できる。また市販の過酸化水素検出ストリップ(例、EMサイエンス社より入手可)を使用して過酸化水素量を測定できる。
【0070】
1実施形態において、本発明の薬の使用に適切なラクトバチルスのもう1つの有用な特徴はインビボおよびインビトロで時間経過しても遺伝子学的に安定であることである。本発明における遺伝子学的安定性とは母株と同一の遺伝子コードを十分に維持しながらラクトバチルス菌株を連続生成する能力を示す。つまり遺伝子学的に安定な菌株を連続生産すると時間が経過しても菌株のDNAに突然変異は起こらない。さらに重要なことは遺伝子学的に安定な菌株を連続生成すると時間が経過しても上述の特徴の1つについてDNAに大きな突然変異は起こらない。最も重要なことは遺伝子学的に安定な菌株を連続生成すると時間が経過してもこの明細書で述べる膣上皮細胞接着率、過酸化水素生成量又は代謝不活性状態の膣上皮細胞接着能力等の有用な特徴についてDNAに大きな突然変異(例、タンパク質コードの表現型を著しく変える変異)は起こらない。膣上皮細胞にインビボでコロニーを形成したラクトバチルス菌株は、好ましくは約12ヶ月間以上、さらに好ましくは約18ヶ月以上、最も好ましくは約24ヶ月間以上、膣コロニー内で遺伝子学的安定性を維持する。インビトロでは、本発明の膣薬における微生物の遺伝子学的安定性は培養条件、調製および貯蔵形態に影響される可能性がある。その条件の詳細を以下に説明する。本発明の保存用基質の優れた品質のおかげで、保存用基質に保存されるラクトバチルス菌株はインビトロで好ましくは約12ヶ月間以上、さらに好ましくは約18ヶ月以上、最も好ましくは約24ヶ月間以上、室温又は冷蔵(2〜8℃)で有用に遺伝子学的に安定である。遺伝子学的安定性は、突然変異を評価するいかなる方法又は選択型遺伝子マーカーで評価することが可能である。例えば、制限エンドヌクレアーゼパターンに基づく遺伝子マーカーを使用して、特定の培養株の特徴を確立しそれを母株と比較することができる。本発明の発明者は反復配列ポリメラーゼ鎖反応(Rep PCR)を適用し、40もの異なるラクトバチルス菌株を識別し、インビトロにおける貯蔵後およびインビボにおける膣上皮細胞コロニー形成後にラクトバチルス特定株の時間経過後の遺伝子学的安定性を確認している。
【0071】
1実施実施形態において、本発明の薬へ使用するのに適するラクトバチルスの有効な特徴は、乳酸を生成する能力である。乳酸はインビトロで病原菌の成長を阻害することが示されている。好ましくは、ラクトバチルスは約0.75mg/100ml以上、さらに好ましくは約4mg/100ml以上、最も好ましくは8.8mg/100ml以上の乳酸を有効な生育条件下で生成する。
【0072】
本発明の別の実施形態では、適切なラクトバチルス菌株の細胞寸法は比較的大きい。
バーギーズ・マニュアル・オブ・デターミネイティブ・バクテリオロジー(Bergey's Manual of Determinative Bacteriology)に記載されるラクトバチルスの一般的な細胞寸法は0.8〜1.6μm(幅)x2.3〜11μm(長さ)である。本発明に使用する好ましいラクトバチルス菌株の細胞寸法は幅約1〜2ミクロン、長さ約2〜4ミクロンである。理論にとらわれず、本発明ではラクトバチルス菌株の大きな細胞寸法によってより有効な生物学的競合な排除作用が得られ有効な保護剤が可能となったと信じる。ここで生物学的競合な排除作用とは座薬株又は本発明の菌株が不要な細菌の成長を競合的に阻害する機能を意味する。この排除作用は膣上皮細胞上の余分な空間を有効なラクトバチルス菌(例、座薬株)が占有し、病原菌又は不要な微生物細胞が接着するのを防御するために起こる。
【0073】
本発明の膣薬には保存用基質も含まれる。微生物細胞を保存のために保存用基質に懸濁し伝達物質中に封入し貯蔵する。本発明における該基質、微生物の培地、微生物細胞の採取方法及び保存プロセスが全て微生物の貯蔵期間中の生存細胞数および再水和(例、膣内での再水和)後の保存細胞の性能に大きな効果を与えている。本発明の保存用基質は前述の膣菌株の好ましい特徴を全て有している。
【0074】
本発明の保存用基質は、保存中に遭遇する損傷を最小限にし、機能的な特性を提供することのできる構成物質からなっている。次にその詳細を説明するが、本発明のラクトバチルス菌株を保存のため保存用基質に添加すると、代謝活性状態から代謝不活性状態へと転換する。本発明の膣薬に使用するラクトバチルス菌株のさらなる有効性は代謝不活性状態下でも膣上皮細胞へ接着することが可能な点である。本発明の保存用基質は最適の微生物細胞の回復力を維持するように設計されており、インビボで再水和後直ちに微生物細胞は遊離し膣上皮細胞へ接着し完全に遅延なく代謝活性状態に回復する。
【0075】
本発明の保存用基質には生物学的に活性な結合剤、抗酸化剤、多価アルコール、炭水化物およびタンパク質様物質が含まれる。ここで注意するがこの明細書において「ある物質」を示す場合、それは1つ以上の物質を示す。例えば「炭水化物」と記した場合は1つ以上の炭水化物又は最低限1つの炭水化物をさす。このように本明細書では「ある」、「1つ以上」および「最低限1つ」の言葉は互換性を有する。また「を有する」、「を含む」および「を持つ」にも同様に互換性があることにも注意していただきたい。
【0076】
本発明によると生物学的許容な結合剤とは、好ましくはインビボでの使用可能な(例、インビボで何らかの活性または毒性作用がない)タンパク質から構成される結合剤で保存プロセス中に細胞基質を不活性担体(以下に示す)に結合させ、微生物細胞の保存および貯蔵期間中を通じて保護効果(例、細胞生存数を維持しながら)を提供する。本発明の保存用基質に使用する好ましい生物学的許容な結合剤として水溶性ゴム、カルボキシメチルセルロースおよび/又はゼラチン等が挙げられるがこれに限らない。生物学的に許容な結合剤は一般的には保存用基質の重量を基準として約10〜20重量%、好ましくは約14重量%を占める。1実施形態では本発明の保存用基質はその約14重量%のゼラチンを含有している。
【0077】
本発明の保存用基質は抗酸化剤を有し、保存及び貯蔵中に微生物細胞が酸化による損傷を受けるのを遅延する。具体的に好ましい抗酸化剤はアスコルビン酸ナトリウムである。抗酸化剤は一般的に保存用基質の重量を基準として約0.1〜1.0重量%、好ましくは約0.5重量%を占める。本発明の1実施形態では、保存用基質は約0.5重量%のアスコルビン酸ナトリウムを有している。
【0078】
本発明の保存用基質は多価アルコール(例、多価アルコール)を有し、保存及び貯蔵期間中に細胞のタンパク質および膜が変形しないで原型を維持するために働く。具体的に多価アルコールは細胞膜と相互作用し、保存プロセスの脱水過程に有効な働きをする。好ましい多価アルコールには、キシリトール、アドニトール、グリセロール、ズルシトール、イノシトール、マニトール、ソルビトールおよび/又はアラビトール等が挙げられるがこれに限らない。一般的に多価アルコールは保存用基質の約1〜12重量%、好ましくは6重量%である。1実施形態では、保存用基質の約6重量%のキシリトールが含まれている。
【0079】
本発明の保存用基質は炭水化物を有し、保存及び貯蔵期間中に細胞のタンパク質および膜が原型を維持し変形を防ぐ。具体的に炭水化物は細胞膜の結合性を維持し保存プロセスの脱水過程に有効な働きをする。好ましい炭水化物にはデキストロース、ラクトース、マルトース、スクロース、フルクトースおよび/又はその他の単糖類、ニ糖類および多糖類であるがそれに限らない。一般的に炭水化物は保存用基質の約0.5〜5重量%、好ましくは2.5重量%である。1実施形態において、保存用基質は約2.5重量%のデキストロースを有している。
【0080】
本発明の保存用基質はタンパク質様物質を有し保存プロセス中の脱水過程中に微生物細胞をさらに保護する。好ましいタンパク質様物質にはスキムミルク及びアルブミンがあるがそれに限らない。一般的に、タンパク質様物質は保存用基質の約0.5〜5重量%、好ましくは1.5重量%を占める。1実施形態において、保存用基質の約1.5重量%のスキムミルクが含まれている。
【0081】
本発明の1実施形態において、保存用基質は、生理活性を有する結合剤を約10重量%、抗酸化剤を約0.1%、多価アルコールを約1重量%、炭水化物を約0.5%およびタンパク質様物質を約0.5重量%有している。
【0082】
本発明の具体的に好ましい保存用基質は、保存用基質の重量を基準として約14重量%のゼラチン、約0.5重量%のアスコルビン酸ナトリウム、約2.5重量%のデキストロース、約1.5重量%のスキムミルク、約6重量%キシリトールを有する。
【0083】
保存用基質のpHは保存微生物細胞の最適な安定性を確保するため特に重要である。保存用基質の最適なpHは、ラクトバチルス細胞を様々なpHに調節した基質中に懸濁し調製して決定できる。本発明の保存用基質のpHは一般的に約5.0〜7.0、好ましくは約7.0である。
【0084】
本発明の膣薬に使用する保存用基質には、上述の具体的な品質に加えて約106個以上の生存細胞を約12ヶ月以上の間、十分に純粋で遺伝子学的に安定な状態でインビトロで維持することが可能である。前述のように「十分に純粋な」状態とは微生物細胞の培養に他の不要な微生物が混入しない状態を示す(例、汚染物)。この細胞の遺伝子学的安定性の重要性については本明細書で前述した。本発明の好ましい実施形態では、保存用基質は生存細胞数約107個、より好ましくは108個の十分に純粋で遺伝子学的に安定なラクトバチルス細胞を約12ヶ月間以上維持することが可能である。
【0085】
また本発明の別の実施形態では、薬に使用する保存用基質は好ましくは生存細胞数約106個の十分に純粋で遺伝子学的に安定なラクトバチルス細胞を約18ヶ月以上、さらに好ましくは約24ヶ月維持することが可能である。
【0086】
本発明の膣薬は室温又は一般的には約4〜6℃の冷蔵温度で保存が可能である。さらに別の実施形態では本発明の薬に使用する保存用基質は、好ましくは生存細胞数約106個のラクトバチルスを十分に純粋で遺伝子学的に安定な状態で約12ヶ月間室温で維持することが可能である。また別の実施形態では本発明の薬に使用する保存用基質は、好ましくは生存細胞数約106個のラクトバチルスを十分に純粋な状態でかつ遺伝子学的に安定な状態で約12ヶ月間冷蔵温度で維持することが可能である。
【0087】
保存用基質が最低限の生存細胞を保存できる能力は、本発明の該薬の薬効にとって非常に重要であり、本発明の先行技術の膣治療で特に問題となっていた。さらに、薬単位(例、単型座薬又は錠剤)から伝達される十分に純粋で遺伝子学的安定な生存細胞数は、薬の力価に直接的に非常に重要な影響を与える。本明細書で述べる「薬効」とは座薬株が生物学的効果を発揮する能力を意味する(例、抗膣感染保護効果として統計的有意なレベルを示す)。「力価」は薬単位(単型座薬又は錠剤)が伝達する生存微生物細胞数に直接関係する。本発明によると生存細胞は成長し増殖することが可能である。ラクトバチルス薬がインビボで有効であるためには微生物細胞が最低約106個の力価で膣上皮細胞にコロニーを形成し生物学的効果(例、細菌性膣炎などの感染症の不在で証明)を示す必要がある。本発明では、座薬菌株がコロニーを形成可能な薬の力価と生物学的効果を発揮する薬の力価の間に違いがあることを発見した。また本発明では座薬菌株がコロニーを形成する能力に生物学的効果を発揮する特定な力価の条件が加わることが薬効のあるラクトバチルス薬において非常に重要であることを発見した。より具体的には座薬菌株が結果的に膣にコロニーを形成するためにはある一定の生存微生物細胞濃度が必要であるが、薬が薬効を発揮するためにはそれは十分でなくてもよい。例えば本発明のラクトバチルス菌株と保存形式を適用して大変低い力価(例、105個の微生物細胞)でも膣上皮細胞に良好なコロニーを形成することができる。しかし生物学的効果はこの力価では示されない。つまり生物学的効果を発揮するためには膣上皮細胞のコロニー形成が必要であるが、十分な力価のコロニー化だけでは生物学的効果を示す数値的優位性にはならない。本発明の保存用基質は今までに未確認であったラクトバチルス細胞の生物学的有効性に必要な力価を維持する能力についてインビトロでは長期間、インビボでは膣上皮細胞へ伝達から示している。
【0088】
本発明の別の実施形態は、本明細書に前述した保存用基質を生成する方法についてである。この方法には(i)水溶性ゴム、カルボキシメチルセルロース又はゼラチン等から構成される生理活性を有する滅菌結合剤、(ii)スキムミルク又はアルブミン等の滅菌タンパク質様物質、(iii)キシリトール、アドニトール、グリセロール、ズルシトール、イノシトール、マニトール、ソルビトール又はアラビトール等の滅菌多価アルコール、(iv)滅菌抗酸化剤、(v)デキストロース、ラクトース、マルトース、スクロース、フルクトースおよび/又は他の単糖類、二糖類および多糖類から構成される滅菌炭水化物、(vi)水などの(a)構成物質を提供し(b)該構成物質を共に混合し溶液を作る手順からなる。生理活性を有する結合剤は液体で提供され、室温では固体である傾向が強いので一般的には37℃まで加熱を必要とする。保存用基質の様々な構成物質と各々の好ましい量については詳細を前述した。保存用基質の構成物質は任意の適切な滅菌法で滅菌してよい。好ましい実施形態では、生理活性を有する結合剤およびタンパク質様物質はオートクレーブで滅菌し、多価アルコール、炭水化物および抗酸化剤は濾過法で滅菌している。構成物質を混合後、保存用基質溶液が生成され、該溶液は直ちに使用することが可能であり、また短期間は37℃で、冷凍では約−20℃で保存することが可能である。
【0089】
さらに好ましい実施形態では本発明の膣薬には不活性担体が含まれる。本発明によると不活性担体は任意の不活性物質であり、インビボでの使用に適し、本発明の細胞懸濁基質(例、微生物細胞の添加された保存用基質)を担持又は支持することが可能であり、その形態で当該細胞懸濁液基質をインビトロで保存および/又はインビボで投与することができる。
【0090】
不活性担体にはマルトデキストリンビーズ、ゼラチンカプセルがあるがこれに限らない。この担体については詳細を後述する。
本発明の膣薬についての1実施形態では、(a)十分に純粋なラクトバチルス・クリスパトゥス菌株CTV−05分離培養微生物(b)ゼラチン約14%、アスコルビン酸ナトリウム約0.5%、デキストロース約2.5%、スキムミルク約1.5%及びキシリトール約6%からなる保存用基質を有する膣薬についてである。保存用基質は最低約12ヶ月間、最低106個の生存細胞数を遺伝子学的安定にインビトロで維持可能である。さらに保存用基質はラクトバチルス・クリスパトゥス菌株CTV−05の好ましい性質を維持する。例えばこの性質には、代謝不活性状態で膣上皮細胞に接着する、有効な培養条件で約0.5ppm以上の過酸化水素を生成する、膣上皮細胞(VEC)接着率が最低約50%以上である等の機能がある。これらの性質の詳細は既に上述した。
【0091】
本発明の膣薬についての別の実施形態において、十分に純粋な最低2種類の異なる分離ラクトバチルス属菌株の培養細菌からなり(i)膣上皮細胞(VEC)接着率が最低約50%以上である、(ii)有効な培養条件で約0.5ppm以上の過酸化水素を生成する等の有効な特徴を持つ。当該膣薬には培養細菌を含有し保存する保存用基質が含まれる。この保存用基質には生理活性を有する結合剤、抗酸化剤、多価アルコール、炭水化物、タンパク質様物質が含まれる。該基質は遺伝子学的安定な約106個の生存細胞を最低12ヶ月間インビトロで維持することが可能である。1実施形態において、膣薬には不活性担体も含むことができる。
【0092】
本発明の1実施形態では、ラクトバチルス菌株をある特定の膣感染症の予防および/又は治療する能力によって各々選択し、薬に含まれる他のラクトバチルス菌株が予防および/又は治療するものによって異なる。感染症には、細菌性膣炎、症候性酵母膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染症、尿路感染症、骨盤炎症性疾患等があるがこれに限らない。例えば好ましい実施形態の膣薬は、まず細菌性膣炎の予防に有効な第1のラクトバチルス菌株を有しそして症候性酵母膣炎の予防に有効な第2のラクトバチルス菌株を有している。また別の好ましい実施形態では、第1のラクトバチルス菌株はラクトバチルス・クリスパトゥスCTV−05菌株で、第2はラクトバチルス・イエンセン菌株である。
【0093】
本発明の別の実施形態は、ラクトバチルス属の分離細菌株に関するものである。この菌株は(a)膣上皮細胞(VEC)接着率が最低約50%である(b)約0.5ppm以上の過酸化水素を生成する能力がある等の有利な特徴を有する。また別の実施形態では、分離菌株のVEC接着率は好ましくは約65%以上、さらに好ましくは約80%以上、最も好ましくは約95%以上である。また別の実施形態では、好ましくは約10ppm以上、さらに好ましくは、約20ppm以上該菌株は過酸化水素を生成する。
【0094】
本発明のラクトバチルス属の分離細菌株は1つ以上の他の好ましい特徴を持つことがある。そのような特徴については本明細書で前述した。具体的にある実施形態では、ラクトバチルス属分離細菌株は最低約1ヶ月間膣上皮細胞コロニーを維持することが可能である。さらに他の実施形態ではラクトバチルス属分離細菌株は、最低約24ヶ月間膣上皮細胞コロニーで遺伝子学的安定性を維持している。また別の実施形態ではこの菌株はそれらが代謝不活性状態(例、保存状態)の時でも膣上皮細胞へ接着する。さらにこの菌株の好ましい特徴として、好適生育条件下で菌株が最低約0.75mg/100mlの乳酸を生成することである。また別の実施形態ではこの菌株は幅約1〜2ミクロン、長さ約2〜4ミクロンの大きさである。
【0095】
さらに好ましい実施形態ではこの分離菌株はヒトの膣から分離されている。別の実施形態では、菌株はラクトバチルス・クリスパトゥスCTV−05菌株又はラクトバチルス・イエンセン菌株である。特に好ましい特徴はラクトバチルス・クリスパトゥスCTV−05菌株の有する特徴で、この菌株が最適な菌株である。
【0096】
本発明の別の実施形態では、ラクトバチルス・クリスパトゥスCTV−05菌株のほとんど全ての好ましい特徴を有するラクトバチルス細菌株についてである。該菌株は女性の膣感染症の予防に特に有用である。
【0097】
本発明の1実施形態は、微生物細胞を保存用基質に保存し、膣薬を生成する方法についてである。この方法は(a)最低約106個の微生物細胞数の培地を、生理活性を有する結合剤、抗酸化剤、多価アルコール、炭水化物及びタンパク質様物質からなる保存用基質に懸濁し細胞基質懸濁液を作成し(b)細胞基質懸濁液を不活性担体へ担持させ伝達組成物を形成し、伝達組成物から水を除去する手順からなる。
【0098】
この実施形態のさらなる様態では伝達組成物を梱包し、輸送及び貯蔵中の水分や酸素から保護することが可能である。この梱包材はマイラー膜又は金属膜等の任意の適切な材質の袋でよい。1実施形態において、伝達組成物を個々に梱包することができる。他の実施形態では複数の孔を有する梱包材に用量別などで並べて梱包することができる。
【0099】
微生物細胞を保存する従来の方法では通常空気乾燥法、噴霧乾燥法又は凍結乾燥法を適用している。空気乾燥法では乾燥に長時間が必要であり場合によっては温度上昇を伴う。噴霧乾燥法では、細胞を熱い空気、乱流および過剰な酸素へ曝露しなければならない。凍結乾燥法では、細胞は激しい温度変化に曝され氷晶を形成する固有のリスクがある。本発明の保存用基質の長所は、これを使用することによって従来の様々な乾燥方法を適用しても細胞への損害を最小にし、細胞から水を除去することが可能であることである。さらなる長所として、本発明では細胞の採取、調剤および保管を通じて膣薬を生成する方法として細胞への負荷が最も低いプロセス手順を適用しており、最終製品の有効期間を最長し、上述した好ましい特徴を有する座薬型ラクトバチルス菌株の生存細胞を最大限に伝達することが可能となる。ここで避けるべき細胞への負荷とは過剰なプロセス手順数、温度変動、真空の適用、水分への曝露及び長いプロセス期間などがある。さらに本プロセスでは汚染微生物の混入を防ぐ。この問題は現存の商用プロセスではラクトバチルス菌株の調製において共通の問題となっていた。保存用基質を使用した微生物細胞の保存方法の特に好ましい方法の詳細を以下に述べる。
【0100】
全ての微生物の保存には乾燥又は水分除去プロセスが必要となる。微生物には遊離および結合した状態共に水分が存在する。微生物の保存には十分な量の水分の除去が必要であるが、結合水を過剰に除去すると問題が生じる。その他の保存プロセスでの問題要因には細胞水分の除去に関わる時間量及びプロセス温度がある。一般的に水分は管理温度に注意を払い迅速に除去するのが好ましい。これは特に高温処理を行う場合にあてはまる。
【0101】
本発明は(1)微生物細胞を培地から採取後、直ちに保存用基質に添加可能な方法であり、細胞が(2)保存プロセス過程で40℃以上(3)氷晶(4)高低極端な温度変動(5)真空及び圧縮状態(6)汚染微生物を含む可能性のある空気に曝されず(7)保存期間が短く最適には4時間以下となるように設計された最適な微生物の保存方法を提供する。該保存法の目標は最終薬製品が膣内で直接再水和されることである。
【0102】
1実施形態において、保存用基質内で微生物細胞を保存する方法には、細胞基質懸濁液を好ましくはマルトデキストリンビーズの不活性担体へ被覆する方法が含まれる。次に好ましくは流動床乾燥法で被覆したビーズを乾燥させる。流動床乾燥法はこの分野の技術では良く知られる乾燥方法である。例えばマルトデキストリンビーズを流動床乾燥装置へ設置し33℃で乾燥する。空気圧力は96540Pa(14psi)へ設定し、細胞懸濁基質をビーズへ噴霧させ温度を38℃へ上昇させる。次に被覆したビーズをさらに時間をかけて乾燥させる。被覆マルトデキストリンビーズは粉末で貯蔵可能でありゼラチンカプセルへ封入するか圧縮して錠剤にできる。
【0103】
本発明の別の実施形態では、生存ラクトバチルス細胞を外側から膣内部へ伝達する簡便な座薬形態として硬ゼラチンカプセルを適用している。ゼラチンカプセルは市販されており、この分野では良く知られる技術である。本実施形態の上記保存方法にはさらに細胞懸濁基質をカプセルに調剤し、細胞懸濁液が非液状基質となるまでゼラチンカプセルを冷蔵し、ゼラチンカプセルの内壁にゲルを加え、乾燥室内でゼラチンカプセルを乾燥させる手順がある。調剤手順は手作業、半自動および自動方式を含むこの技術で知られる任意の方法で実施してよい。冷却手順は約4〜6℃で行う。ゼラチンカプセルの乾燥手順には、(i)乾燥室へ25%より低い水分量の乾燥空気を温度約24〜32℃で提供し、(ii)乾燥室から湿った空気を除去する手順が含まれる。
【0104】
本実施形態では乾燥プロセスは約1〜6時間進行させることが可能である。乾燥室には圧縮器、最低1個の炭化水素清浄フィルター、乾燥シリカゲル(又は他の適切な乾燥剤)カラム設置/未設置の冷却空気圧縮器を並べて設置可能である。好ましい1実施形態では、乾燥室に侵入する空気(乾燥空気)は約25%以下、より好ましくは約15%以下、最も好ましくは約5%以下からほとんどゼロの水分含有量である。好ましくは、乾燥空気は約24〜32℃の温度範囲である。好ましい空気流量は1分間に2空気交替量である。この方法によって室温の管理された環境で微生物細胞の短期間の保存が可能となる。また微生物細胞を座薬伝達容器へ直接調剤しそこでそのまま保存することが可能となり、微生物細胞の好ましい特徴を維持する能力が増加する。
【0105】
微生物細胞を基質に保存する方法の1つの手順には微生物細胞培養液を保存用基質に懸濁する手順がある。本発明では微生物細胞を培地から採取後直ちに保存用基質へ最適の細胞基質割合で懸濁することが可能である。最適には、採取及び懸濁プロセスはクラス100環境で行われるとよいがこれは必須ではない。
【0106】
本発明のラクトバチルス細胞は、汚染の心配がなく、遺伝子学的に安定で他の好ましい機能的な特徴の損失がなければ、微生物を効果的に培養できる任意の培地で培養することが可能である(本明細書で前述)。場合によっては本発明のラクトバチルス菌株をある一定の同化性有機炭素、同化性窒素及び適切な塩および少量の金属を加えた培地で培養することもできる。
【0107】
本発明のラクトバチルス菌株の好ましい培地はMRS培地である。MRS培地についての詳細は実施形態の章で詳細を述べる。本発明のラクトバチルス菌株を、寒天表面培養培地又は肉汁発酵培地など従来の培地で培養してもよいがこれに限らない。寒天表面培養法および肉汁発酵法は共にこの技術では良く知られた方法である。好ましくはラクトバチルス菌株を嫌気性又は微好気性条件で培養する。
【0108】
培地の温度はラクトバチルス菌株が生育できるのに適切な任意の温度でよい。例えば培地へ接種物を接種する前に培地を約20〜35℃の温度に維持する。より好ましい温度範囲は25〜35℃である。
【0109】
本発明の活発に生育するラクトバチルス菌株を培地へ接種させ、適切な生育期間を経て十分な細胞密度と量を達成し、保存用基質へ移管する。一般的な接種細胞密度は約106〜109CFUs/mlの範囲内であるが、細胞の乾燥重量に基づき好ましくは108〜109CFUs/mlである。次に細胞を培養し、細胞密度範囲を約107〜109CFUs/ml、さらに好ましくは約108CFUs/mlとする。この段階で細胞を採取し保存用基質で保存する。
【0110】
所定の細胞密度に達した後、本発明の実施形態の第一段階では好ましくは遠心分離法で微生物細胞を採取する。微生物細胞数約107個以上、より好ましくは約108個以上、最も好ましくは約109個以上の細胞を保存用基質で懸濁する。細胞を基質へ添加する前に食塩緩衝液中で細胞を洗浄してもよい。保存用基質および微生物細胞の混合物を本明細書では細胞懸濁基質としている。細胞懸濁基質は次の基質を不活性担体へ添加する手順の間、連続混合し一般的には約30〜40℃で保管する。ここで理解すべきことは本明細書で開示する当技術における基本的な培養、採取および懸濁手順の通常の方法では変動が生じやすく、本発明ではそのような変動を考慮していることである。
【0111】
さらに本発明の別の実施形態は女性を膣感染症から防御する方法についてである。この方法には膣薬を女性に投与する手順が含まれ、(i)VEC接着率が最低50%以上(ii)約0.5ppm以上の過酸化水素を生成できるなどの(a)有利な特徴を有する分離ラクトバチルス属菌株の十分に純粋な細菌を最低約106個培養する。薬には(b)生物学的に活性な結合剤、抗酸化剤、多価アルコール、炭水化物およびタンパク質様物質を有する保存用基質が含まれる。さらに別の実施形態では、膣薬には本明細書に前述したように不活性担体が含まれることもある。保存用基質は十分に純粋で遺伝子学的安定な最低約106個の生存細胞を最低約12ヶ月間インビトロで維持する。
【0112】
上記の実施形態については本明細書で詳細を前述した。本発明の膣薬は細菌性膣炎、症候性酵母膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染症、尿路感染症、骨盤炎症性疾患等の様々な感染症の予防に適用することが可能であるがこれに限らない。
【0113】
本発明において「女性を膣感染症から守る」とは女性が膣感染症を発現する可能性を低下させることを意味する。本発明の好ましい点は、薬が膣感染症の可能性を最適に低下させ、該膣薬への曝露に関して女性に不快感および/又は機能上の変化を与えないことである。例えば、本明細書において女性を膣感染症から守るとは、本発明の膣薬の能力を意味すると考えることが可能であり、薬を女性に投与すると膣感染症の発症又は再発を予防する。
【0114】
本発明の別の実施形態は膣感染症を有する女性に本発明の膣薬を投与し治療する方法についてである。本明細書において膣薬を使用し膣感染症の女性を治療するとは、女性の感染症を治療、又はその症状、徴候および原因を緩和する膣薬の能力を意味する。
【0115】
本発明の利点は、本発明の膣薬を膣感染症の予防又は治療のために女性へ単剤投与すると、最低約106個、より好ましくは最低約107個、最も好ましくは最低約108個の本明細書で前述した有利な特徴を有するラクトバチルスの生存細胞を十分に純粋でかつ遺伝子学的安定な状態で提供できることである。薬の用量および投与回数を含む好ましい薬投与のプロトコールは、当業者には容易に決定できるであろう。1実施形態では、単剤を最低1日に1回約2日間、また別の実施形態では、最低約1日に1回約3日間、さらに別の実施形態では最低約1日に2回約3日間投与している。必要であれば、例えば毎月単位でこの投与方法を再び行うことが可能である。本発明の膣薬は経口、経膣および経直腸投与が可能であり、微生物を希望する作用局部へ伝達するその他のいかなる投与形態も本明細書では可能である。好ましい投与形態は座薬投与である(例、錠剤又はカプセル型)。
【0116】
本発明の膣薬を膣感染症の他の予防薬又は治療薬と併用投与(例、同時投与、投与前、投与後投与)することが可能である。例えば、該膣薬は抗生物質と併用投与することが可能である。
【0117】
本発明の他の実施形態は、該薬を本明細書の記述に従ってヒトに投与し、ヒト免疫不全ウィルス(HIV)に感染するリスクを低下させる方法についてである。好ましくは、該薬はHIV感染症へのヒトの感染リスクを最低約2倍、さらに好ましくは約4倍、最も好ましくは約6倍低下させる。該薬の投与対象は男性および女性である。該薬は女性には経口、経膣および経直腸で、男性には経口および経直腸で投与することが可能である。好ましい実施形態では該薬の単剤を毎日2日間投与する。
【0118】
さらに本発明の他の実施形態は、本明細書の記述に従ってヒトに投与し症候性酵母膣炎を予防する方法についてである。好ましい実施形態では、薬にはラクトバチルス クリパトゥスCTV−05菌株が含まれる。
【0119】
さらに本発明の他の実施形態は、早産の予防方法についてである。本明細書で前述のように細菌性膣炎は妊娠期に最も多い陰部感染症の1つである。細菌性膣炎を羅患しなかった女性に比べて、妊娠期の第2トリメスター期間に細菌性膣炎と診断された女性のうち約40%は早産、出生時低体重を起こしやすい。本発明に従った早産の予防方法には(a)抗生物質および(b)本発明の薬を本明細書の記述にしたがって妊娠女性へ投与する手順からなる。好ましい投与方法ついては膣感染症予防のための薬投与についての箇所で上述した。本発明において抗生物質とは該膣薬と併用投与できる好ましい膣感染症の治療に有用な任意の抗生物質である。対象となる抗生物質はこの技術分野では良くしられている。
【0120】
本発明の別の実施形態には膣および直腸内でのエストロゲンの代謝を助ける方法が含まれている。高エストロゲニズムは女性の疾患であるが本発明の薬を使用して治療することが可能である。本発明のラクトバチルス菌株は膣および腸内のエストロゲンの正しい代謝を助ける。この方法には本明細書に示すように女性に本発明の薬を投与する手順が含まれる。この場合も該薬を経口、経膣および経直腸投与することが可能である。薬の用量の幅は本明細書に示す膣感染症の治療の場合とほとんど同じである。
【0121】
上述のとおり本発明の薬は主に膣感染症を治療するものであったが、本発明の薬は感染症および膣の治療に使用を限定するものではない。例えば本発明の薬を胃腸障害やその感染症に適用することも可能である。この場合には該薬を胃腸薬と呼ぶ。本発明の胃腸薬は純粋な分離ラクトバチルス属の純粋な培養微生物からなり(i)膣上皮細胞(VEC)接着率が最低約50%以上である、(ii)約0.5ppm以上の過酸化水素を生成する等の膣薬の有する有効な特徴を全て有する。別の実施形態では、胃腸感染症の治療に有効な初期の菌株のVEC接着率および/又は過酸化水素生成値は膣治療に有効な薬よりも低いが、胃腸薬として有効な品質を保持している。胃腸薬も細菌を含有し保存する保存用基質を有する。この保存用基質にも生物学的に活性な結合剤、抗酸化剤、多価アルコール、炭水化物およびタンパク質様物質が含まれている。該基質は遺伝子学的安定な最低約106個の生存細胞を最低12ヶ月間インビトロで維持することが可能である。胃腸薬にもマルトデキストリンビーズ又はゼラチンカプセルの不活性担体が含まれることがある。胃腸薬は薬内の微生物が局部へ到達し胃腸管の細胞に接着することのできる任意の経路で投与可能である。
【0122】
この投与形態には経口および経直腸投与があるがこれには限らない。
以下に例を詳細の説明のために示すが、本発明の範囲をこれに限定するものではない。
【実施例1】
【0123】
本発明に用いるのに適したラクトバチルス属の株を選定する方法を以下の実施例を用いて具体的に説明する。
性病歴のない6人の健康な女性の膣からおのおの分離した、6株の異なるラクトバチルスを望ましい特性に関して評価を行った。6株のラクトバチルスを純度、膣上皮細胞への接着性、遺伝子プロフィールの安定性、過酸化水素(H2O2)生産性と長期保存における増殖力安定性に関して評価した。適した株は、母株の純粋培養を十分に継続する能力があると判断される程度の純度(すなわち、微生物の汚染がない)、約80%以上の膣上皮細胞接着率、培養細胞の遺伝子プロフィールが母株と一致するかを同定することにより評価される遺伝子プロフィールの安定性、TMB培地で嫌気培養後の明白な青色素の形成による評価で良好な、もしくはEM試験紙で約20ppm以上の過酸化水素(H2O2)生産量、この発明の薬が摂氏4−6度と室温で約12ヶ月以上の間107−108のコロニー形成単位(CFUs)を継続する能力を持つかで評価される良好な増殖力安定性を持つことにより選定された。
【0124】
CTV−05株(ラクトバチルス・クリスパトゥス)は、接着性研究、病原性微生物に対するインビトロ阻害と、種々の条件下での保存状態における望ましい株形質の安定性(すなわち、代謝的に不活性状態での膣上皮細胞への接着能力)に基づき座薬株に最適として選択された。MRS培地上でCTV−05細胞は幅1−2ミクロン、長さ2−4ミクロンの面積に生育する。
【0125】
以下の特異的方法は本発明に適するラクトバチルス株に望ましい形質があるか否かを検討するために採用された。
(1.1)株の純度:座薬株の純度(すなわち、培養株に生物汚染がない)はDNAフィンガープリント法を用いて座薬株を他の株から特異的に識別する事により確認された。DNAフィンガープリント法は繰返し配列ポリメラーゼ連鎖反応(Rep PCR)を用いて行われた。Rep PCR法で座薬株(CTV−05)を内在性ラクトバチルス・クリスパトゥスから識別できるか決定するために、40株のラクトバチルス・クリスパトゥスを妊娠可能年令女性の膣から採取し、CTV−05と比較した。ラクトバチルス・クリスパトゥス種のアイデンティティは対象株ラクトバチルス・クリスパトゥス ATCC33197に対する総染色体DNAの相同性を用いて決定された。すべてのラクトバチルス・クリスパトゥス分離株は4072と1400塩基対に二重バンドが、3500,750,520,350と220塩基対に1重バンドがあり、これらの繰り返しDNA配列がすべてのラクトバチルス・クリスパトゥス株で共通であることを示唆している(データーは示されていない)。座薬株(CTV−05)は2500−1500塩基対領域に4個のバンドがあることにより他から識別される。この部位でのCTV−05のフィンガープリントは2500と1500塩基対での強いバンドと2000と1736塩基対でのやや弱いバンドからなる(データーは示されていない)。
【0126】
(1.2)膣上皮細胞への接着性(VECs):サンプル採取の直後に、膣上皮細胞をMEM組織培養液(pH7.2)に移し、シリンジ中で3回洗浄した後、細菌を通過させるが膣細胞を残す8μのフィルター(ミリポア社)を通過させる。計105個の洗浄膣細胞を109個毎ml(計数チャンバーで計数)のラクトバチルス縣濁液に加え、摂氏37度で2.5時間インキュベーションした。洗浄濾過により非接着ラクトバチルスを除去した後、膣細胞をグラム染色で染色した。上皮細胞に接着したラクトバチルスを、カメラを装備した光学顕微鏡を用いて計数、記録した。1VECあたり接着したラクトバチルス細胞の平均数(平均接着値)と前記のVEC接着百分率の両方を計算する。VEC接着値百分率は1つ以上のラクトバチルス細胞が接着したVECsの同群中のVEC総数に対する百分率と定義され、個々の株が望ましい特質を持っていて選択に値するかを決定するために用いられる。進行中の接着研究は膣上皮細胞の絶え間ない供給を必要とするので、膣上皮細胞は事前に洗浄され、使用時まで、摂氏−70度で保存される。この技術で有効時間1時間の新鮮膣上皮細胞に匹敵する結果が得られた。
【0127】
表1と2に最も一般的なABO血液型を代表する提供者からの凍結VECsを用いた試験管内接着研究の結果を示す。表1に活発に成長しているCTV−05株細胞のVECsへの接着性を証明する試験管内研究の結果を示す。CTV−05株(ロットLB−022)は実施例3で詳述される座薬用フォーマットで保存された。座薬は試験前5.5ヶ月間室温(RT)保存もしくは冷蔵庫温(Ref)で保存された。本研究で用いられたCTV−05株細胞は活発に成長している代謝状態ではないことが重要な点である。むしろCTV−05を含む座薬は菌体を事前に成長させて活性状態にすることなく、マクルヴェイン緩衝液(McIlvaine’s buffer)(pH4.5)に直接入れられる。次にその細胞は直接VECsに加えられる。結果は、(1)50VECsあたりの接着CTV−05の対数平均(X±1標準偏差)、(2)50VECsの総計数中 VEC毎に接着したCTV−05の実際の範囲、(3)VEC接着値百分率(%VEC ADH)として示される。以下は表1中の用語の説明である:1X±1STD=50VECあたりの接着LABの対数平均、±1標準偏差;2範囲=50VECsの総計数中のVECあたりに接着したLABの実際の範囲;3%VEC ADH=冷蔵庫温(Ref.)と/または室温(RT)で5.5ヶ月間保存されたCTV−05株のLAB、ロットLB−022,の接着がみられる50VECsの百分率;*授乳中の母親。
【0128】
【表1】

8人の提供者からのVECに対する室温で保存されたCTV−05株細胞の平均接着値は1VECあたり21.9細胞であった。冷蔵庫温で保存されたCTV−05株細胞の8人の提供者からのVECに対する平均接着値は1VECあたり24.3細胞であった。別々の提供者からのVECに対する接着値の範囲は非常に広い(すなわち、1VECあたり接着したCTV−05の範囲が0から200細胞以上)。しかし、座薬株の細胞が1つ以上接着したVECsの百分率(VEC接着値)はおのおの室温保存CTV−05では97%であり、冷蔵庫温で保存されたCTV−05では97.75%であった。
【0129】
これらの結果は、CTV−05株の細胞はインビトロで座薬から放出された後、代謝的には不活性状態であっても速やかにVECsに接着できるので、インビボでヒトVECにより定着しやすいことを示唆している。保存された細胞が一旦VECsに接着すると、膣環境から流し出される代わりに再生して増殖する事(すなわち定着)が予想される。
【0130】
表2は肉汁もしくは寒天培養から得られる不活性CTV−05をマクルヴェイン緩衝液(McIlvaine’s buffer)(pH4.5)中でVECsに直接加える研究の結果を示す。従って緩衝液は、提供者から得られたあらかじめ凍結されたVECsに直接加えられる。活発に成長しているCTV−05もまた事前凍結VECsに加えられた。表2のパラメーターは前記の表1のものと同じである。表2に示されている結果は不活性CTV−05(すなわち、保存状態より得られたもの)が、代謝的に活性な状態でVECsに加えられたCTV−05と同等かよりよく接着することを証明している。
【0131】
【表2】

(1.3)遺伝子プロフィールの安定性:制限酵素パターンに基づいた遺伝標識プロフィールが保存後の遺伝子プロフィールの安定性を確立し、インビボ人体試験中に座薬株が定着するのを確認し、市販製剤の株同定の手段として供する目的で適切な回数行われた。ラクトバチルスをブドウ糖、でんぷん、1%血清を補足したハート−インフュージョン−ブイヨン中で、中期対数期まで成長させる。50mM EDTAを含む10mmトリス緩衝液、ミュタノリジン マイルス ラボラトリーズ(Mutanolysin Miles Laboratories)社、イリノイ州ネーパヴィル所在(Naperville,IL)とリゾチーム、すなわち乳酸菌(ラクトバチルス・アヒドフィルス)に効果的と証明されているリジン溶液を用いて、DNAを抽出する。3種の制限酵素HindIII, BamHI,EcoRl(ベセスダ リサーチ ラボラトリーズ社(Bethesda Research Laboratories,Inc.)、メリーランド州、ガイザースバーグ所在(Gaithersburg,MD)が、各分離株にそれぞれ使用された。DNA断片を0.7%アガロースゲル(シーケム エムイー;エフエムエス社(Seakem−ME;FMS Corp.)、マリン コロイド部(Marine Colloids Division)、メーン州、ロックランド所在(Rockland,ME)中、25ボルトで15時間トリス硼酸緩衝液(pH8.3)を使って電気泳動した。ゲルを1μg/mlの臭化エチジウムで30分間染色した。DNA断片を短波長紫外線で可視化し撮影した。DNA電気泳動図間の制限酵素相似性度は以下の式で計算した:相似性度=100%−(NdX100)/Ns、ここでNsは比較する2つのDNA電気泳動図のバンドの総和であり、Ndは一つの電気泳動図のみに見られるバンドの数を表す。座薬株を同定するための株特異的マーカーを検知するDNAプローブを開発した。任意の時間で座薬株の存在を確認するためのDNA相同性研究も行った。
【0132】
(1.4)過酸化水素(H2O2)産生:株をテトラメチルベンジデン(Tetramethylbenzidine)培地(TMB)に接種し、嫌気条件下、摂氏37度で2−3日培養した。過酸化水素(H2O2)産生コロニーは大気にふれて青い色素を産生する。イーエム サイエンス社(EM Science)の過酸化水素(H2O2)検知試験紙を代替的に使用した。試験紙の試薬を浸透させた部分をラクトバチルスコロニーに接触させ、生じた青色の強さで過酸化水素(H2O2)濃度を定量した。
【0133】
(1.5)増殖安定性:評価された各株のサンプルを室温保存と冷蔵庫保存の有効期間研究用に保存する。選択された間隔で、MRS寒天を用いたプレート カウント法(Plate Count Method)で、サンプルのコロニー形成ユニット数を調べる。CTV−05株はゼラチン座薬カプセル中で摂氏55度、45度、35度、室温と冷蔵庫温で保存試験された。この研究は促進保存有効期間のモデルとして、市販製剤が地球規模の流通網で出荷された場合起こる可能性のある不利な条件下での安定性を証明するために行われた。図1は高温試験の結果を示し、図2は低温下での長期保存の結果である。冷蔵庫保存製品でのコロニー数は望ましい形質の損失がなく5ヶ月間安定で座薬あたり108個を保った。室温保存でのコロニー数は4週間安定で座薬あたり108個を保った。4−9週の間に座薬あたり9.8X107個に落ち、25ヶ月107個を保った。この期間過酸化水素(H2O2)産生も安定であった。微生物生存率に対する保存用基質の効果をpH4.0−7.0の範囲で評価した(データは示されていない)。これらのpH範囲はふつうの女性に見られるpH範囲(pH4.0−4.5)、細菌性膣炎の女性のpH範囲(pH5.0−6.0)と、月経中の女性のpH(pH7.0)を表す。微生物の生存はこのpH範囲で良好であり、pH7.0が最適である。
【実施例2】
【0134】
保存CTV−05株細胞の増殖カウントを高めるのに最適な細胞対保存用基質比の決定法を以下の実施例で示す。この実験では単位培地容積あたり異なる量のCTV−05株細胞を加えることにより、縣濁培地の保存能力を決定した。ラクトバチルスをMRS寒天プレート上で2平方インチに嫌気的に育成した。2平方インチの寒天は10mlの肉汁に相当する。予想されたプレートあたりの収量は2X109CFUsであった。接種された基質は30マイクロリットルに分割保存された。表3は48時間のCTV−05株細胞では8プレート/5ml基質比で最も良い結果が得られることを示している。データーは更に、最適の細胞対保存用基質比が保存CTV−05株細胞の増殖カウントを高めることを証明している。
【0135】
【表3】

【実施例3】
【0136】
本発明の膣薬を調製する詳細な方法を以下の実施例で説明する。
ここで説明されるすべての実験で使用されるMRS培地の組成は以下の通りである:バクト プロテオース ペプトン(Bacto Proteose Peptone)3番10g,バクト ビーフ エクストラクト(Bacto Beef Extract)10g、バクト イースト エクストラクト(Bacto Yeast Extract)5g、バクト デキストロース エクストラクト(Bacto Dextrose Extract)20g、トゥイーン80(Tween80)1g、クエン酸アンモニウム2g、酢酸ナトリウム5g、硫酸マグネシウム0.1g、硫酸マンガン0.05g、燐酸2カリウム2gを含む培地を試薬級の水(H2O)で1000mlとする。この混合物に10gの寒天を加えMRS寒天を調製する。培地は摂氏25度でpH6.5±0.2に調整する。
【0137】
保存用基質は以下のように調製する。2Xゼラチン(すなわち、試薬水500mlあたり137.5g)と4Xスキムミルク(すなわち、試薬水250mlあたり15g)を約摂氏121度で約15分間オートクレーブする。4Xキシリットール(すなわち、試薬水250mlあたり59g)と4Xデキストロース(すなわち、試薬水250mlあたり25g)を混合し、pH7.2−7.4に調整し、0.22ミクロン濾紙で滅菌濾過する。滅菌成分を混合して(ゼラチンベースの)単一溶液にして摂氏2−8度で保存する。5重量%アスコルビン酸溶液を調製し、0.22ミクロン濾紙で滅菌濾過し、製造のために適切な容積に分配した後、摂氏マイナス20度で保存する。膣薬調製時に、ゼラチンベースを溶かし、約摂氏35度になるまで練る。そして5%アスコルビン酸をゼラチンベースに1:10の比で加えて、保存用基質を調製する。
【0138】
膣薬を製造するために、MRS培地に約106から109CFUs/mlラクトバチルス株培養物を接種する。接種物を嫌気的もしくは微好気的に摂氏20−35度で培養物が107から109CFUs/mlの細胞濃度に達するまで培養する。
【0139】
細胞を1400−1600rpmで5分間遠心分離して集める。上清はデカンテーションで廃液入れに捨てるか、他の副生成物を得るために回収することもできる。細胞ペレットは燐酸緩衝食塩水(PBS)で再縣濁し再度1400−1600rpmで5分間遠心分離する。この洗浄過程での上清は捨てる。沈殿細胞は次に燐酸緩衝液1部と保存用基質10部とで再縣濁する。細胞基質縣濁液を穏やかに摂氏35±5度に保ちながら混合し続ける。
【0140】
完成品の膣薬を調製するには、滅菌部品からなる流動床乾燥機を組む。マルトデキストリンビーズを流動床乾燥機に配置し、十分乾燥するまで摂氏33度で乾燥する。次に空気圧を14psiに設定し細胞縣濁基質を蠕動ポンプでビーズにスプレーする。50%の細胞基質縣濁液をマルトデキストリンビーズにスプレーした後、加熱温度を摂氏38度に上げる。すべての細胞基質縣濁液をビーズにスプレーした後、コーティングされたビーズは更に約15−30分間摂氏38度で乾燥させることができる。コーティングされたビーズは凍結、粉末状で保存、ゼラチンカプセルに入れる、もしくは膣薬として使用するために圧縮して錠剤にすることもできる。
【実施例4】
【0141】
Rep PCRが異なるロットのラクトバチルス・クリスパトゥス座薬を評価するのに有効であることを以下の実施例で説明する。
2年間にわたって調製されたラクトバチルス・クリスパトゥスCTV−05の異なる6個のロットを純度と遺伝子フィンガープリントの安定性に関して評価した。すべてのロットは嫌気的に栄養強化細断肉肉汁中で培養された時点で汚染されていないと評価された。更に、小規模に調製されたラクトバチルス・クリスパトゥスの種々のロットと規模が大きくなったロットは同一フィンガープリントを持つ(データーは示されていない)。これらのデーターはラクトバチルス・クリスパトゥスCTV−05座薬が数年にわたる貯蔵に対しても増殖力、純度と遺伝的安定性を保っていることを示唆している。更に、座薬株のDNA「フィンガープリント」にロットごとの変化がなかった(データーは示されていない。)
【実施例5】
【0142】
本発明のラクトバチルスがインビボで健康な女性の膣にラクトバチルスを再定着するための座薬中で使用できることを以下の実施例で証明する。
この公開研究では、9人の女性がおよそ109個の成育可能で、過酸化水素(H2O2)産生ラクトバチルス・クリスパトゥスCTV−05株を含有するラクトバチルス座薬を1日2回3日間使用した。9人の女性は全員登録時に性器感染症に罹患していず、9人のうち8人には登録時に内在性ラクトバチルスが存在した。最後の座薬カプセルを使用した2−3日後の追跡ではすべての女性に座薬株が定着していた。9人のうち8人には1ヶ月目も定着していた。顕微鏡的にも炎症は見られず(すなわち、膣スミアで採取した白血球細胞の評価)、副作用の訴えもなかった。
【0143】
多くの女性の膣や直腸にはラクトバチルス 定着しているので、繰り返し配列ポリメラーゼ連鎖反応(Rep PCR)技術をラクトバチルス・クリスパトゥスの座薬株の「フィンガープリント」を採取しそしてそれによりラクトバチルスの座薬株を内在性株から識別するために用いる。最初の臨床予備研究から得られたフィンガープリント採集の結果でラクトバチルス・クリスパトゥスCTV−05座薬株の遺伝子フィンガープリントは数ヶ月にわたる膣定着の間保存されることが証明された。
【0144】
患者102号には登録時に非ラクトバチルス・クリスパトゥスが定着していた。座薬使用1週間後の受診時彼女には3種類のラクトバチルス株が定着していた。その中には(1)座薬株のラクトバチルス・クリスパトゥスCTV−05;(2)登録時に定着していたものと同じ株;(3)CTV−05でもなく登録時に存在していた株でもないラクトバチルスの新株が含まれる(データーは示されていない)。1ヶ月後の受診でも、ラクトバチルス・クリスパトゥスCTV−05が、定着していた。最初の追跡調査で存在していた株も、登録時から存在していた株も同じように定着していた(データーは示されていない)。その被験者は登録から1年後にも評価され、座薬株、ラクトバチルス・クリスパトゥスCTV−05、のみが排他的に定着していることがわかった。これらの研究結果により、本発明者のラクトバチルス・クリスパトゥスCTV−05の座薬株を「フィンガープリント」する能力が証明され、そしてこの遺伝子フィンガープリントが数ヶ月にわたる膣定着の間インビボで保存されることが証明された。
【0145】
患者103号は登録時ラクトバチルスが定着していたが、ラクトバチルス・クリスパトゥスは定着していなかった。CTV−05座薬を1日2回3日間使用した1週間後、もう1種類のラクトバチルスと同様に、CTV−05も定着していた(データーは示されていない)。4週間後この女性にはまだCTV−05と彼女が最初の追跡受診時に保有していたラクトバチルス株がともに定着していた(データーは示されていない)。
【実施例6】
【0146】
以下の実施例は 本発明のラクトバチルスが再発性膣炎を持つ女性の膣への再定着用座薬中にインビボで使用可能であることを証明するインビボ研究である。
本研究では再発性細菌性膣炎(BV)がある女性群2%クリンダマイシン(Clindamycin)クリームで1日1回、3日間治療し、引き続いてラクトバチルス・クリスパトゥスCTV−05株を含有するラクトバチルス座薬で1日2回3日間治療した。対照として同じ医院にかかっている再発性細菌性膣炎がある女性群を2%クリンダマイシンクリームのみで治療した。治療の終了後1週間目と、登録後1ヶ月と3−4ヶ月目に追跡調査した。患者は過酸化水素(H2O2)産生ラクトバチルスが膣に存在することと、細菌性膣炎感染がないという点で評価された。
【0147】
本研究の結果を表4に示す。表4により、再発性細菌性膣炎を持っていた女性のうちでクリンダマイシンクリームとラクトバチルス・クリスパトゥス(Lactobacillus crispatus)CTV−05座薬の両方を用いて治療した群には、クリンダマイシンクリームのみで治療された群と比較して、治療後の評価の各段階で著しく高い率で過酸化水素(H2O2)産生ラクトバチルスが定着していた。
【0148】
【表4】

座薬の特徴がパーオキサイド産生ラクトバチルスの存在に帰するのかを確認するため、これらのラクトバチルスから得られたDNAを座薬株から得られた精製DNAと非常に厳しい条件下でハイブリッドした。更に、各分離株は4−メチルウンベリフェリル(4−methylumbelliferyl)基質を用いて検知された既成酵素を基にフィンガープリントされた。クリンダマイシン治療のみを受けていた女性群では、座薬と同じラクトバチルス株を獲得したものはなかった。対照的に、クリンダマイシンに加えてラクトバチルス座薬で治療を受けた女性で、治療後ラクトバチルス株が定着していたものは全員座薬株を持っていた。表5より、クリンダマイシンのみで治療されていた女性で細菌性膣炎がなかったのは53%のみであったのに比較して、クリンダマイシンに加えてラクトバチルス・クリスパトゥスCTV−05座薬で治療されていた女性の100%が治療後1ヶ月目には細菌性膣炎がなかったことがわかる。同様に治療後3ヶ月には、クリンダマイシン治療のみの女性で細菌性膣炎がなかったのは26%であったのに対して、クリンダマイシンに加えてラクトバチルス・クリスパトゥスCTV−05座薬で治療されていた女性の54%に細菌性膣炎がなかった。このデーターは本発明のラクトバチルス・クリスパトゥスCTV−05座薬が細菌性膣炎の再発を減らす可能性があることを示唆している。
【0149】
【表5】

【実施例7】
【0150】
以下の実施例は、細菌性膣炎がある女性の膣への再定着用座薬中に本発明のラクトバチルスのインビボ使用が可能なことを証明するインビボ研究である。
本研究では、細菌性膣炎のある13人の女性がラクトバチルス・クリスパトゥスCTV−05座薬で1日2回7日間治療を受けた。本研究の目的はラクトバチルス座薬が、細菌性膣炎の治療に使えるか否かを評価することである。一週間後の追跡診療では、受診に現れた10人のうち1人だけが細菌性膣炎が治癒していた。しかしながら、ベースラインと追跡調査で行ったラクトバチルス培養では、細菌性膣炎がある10人の女性のうち7人に座薬株の定着が成功していることが示された(データーは示されていない)。ラクトバチルス・クリスパトゥスCTV−05座薬を使用したことによる副作用があった女性はいなかった。また、肉眼的にも、顕微鏡的にも炎症は見られなかった。
【0151】
実施例5,6,7の研究により本発明のラクトバチルスは膣にラクトバチルスを再定着させるための座薬中に使用可能なことが示された。ラクトバチルス・クリスパトゥスCTV−05座薬を使用した臨床試験には50人を越える女性が参加した。座薬で治療を受けた女性には座薬使用に伴う副作用は全く見られなかった。更にこれらの予備試験データーから好ましい形質を持つラクトバチルス・クリスパトゥスのCTV−05株は、ゼラチンカプセルの形で膣に挿入されると、(1)常在膣細菌がある膣によく定着し、80%を遙かに越える女性に1ヶ月後も定着している;(2)活発な細菌性膣炎のある女性に定着する事が可能;(3)細菌性膣炎治療後の膣に再定着可能;(4)結果として治療後の細菌性膣炎再発を減少する可能性がある(実施例5で細菌性膣炎の再発が治療後1ヶ月では100%減少している)。更に本発明者は人体試験におけるラクトバチルス・クリスパトゥスの座薬株の同定を可能にするフィンガープリント法を開発した。
【実施例8】
【0152】
本発明の保存用基質は、微生物の増殖力を貯蔵中と同様に保存過程でも保持できる点で工業基準のスキムミルク基質よりも優れていることを本実施例で証明する。
凍結乾燥法(フリーズドライ)は微生物の長期保存方法として長年にわたって採用されている。スキムミルクはアメリカン タイプ カルチャー コレクション(American Type Culture Collection)が使用している標準凍結保存用基質の1つであり、乳業では頻繁に使われている。以下の実験で、本発明者は本発明の保存用基質は、数個のパラメーターで定量される工業基準でスキムミルクより性能が優れていることを証明する。
【0153】
嫌気的条件下摂氏35度でインキュベートしてMRS寒天上で24時間生育させたラクトバチルス・クリスパトゥスCTV−05の細胞の縣濁液5mlをMRS肉汁500mlに接種する事により本細胞株を成長させる。嫌気的条件下摂氏35度で48時間接種肉汁をインキュベーションした後、ラクトバチルスを濃縮するため、肉汁を遠心分離する。
【0154】
500mlの肉汁から得られた全細胞は本発明の保存用基質50mlと混合するか、もしくは10%スキムミルク50mlと混ぜ、縣濁液を調製した。次に各縣濁液を2等分した。2分された各縣濁液の一方はシリカゲルを乾燥剤として用いて風乾した(LB107=保存用基質、LB109=スキムミルク)、そして各縣濁液の残部は凍結乾燥した(LB106=保存用基質、LB108=凍結乾燥)。
【0155】
保存前と保存後のコロニー形成ユニット(CFU)の計数は生成物をMRS肉汁中に縣濁かつ/もしくは再水和させた後MRS肉汁で10倍希釈する事により行う。3連続希釈溶液のスプレッドプレートをMRS寒天上に作成し、嫌気的条件下摂氏35度で48時間インキュベーションした。
【0156】
表6に示されるように、微生物が本発明の保存用基質中で保存された場合、どちらの保存過程でも著しい増殖力の低下は見られなかったが、工業基準のスキムミルクで保存した微生物は肉汁保存過程で1対数の増殖力の損失が見られた。
【0157】
【表6】

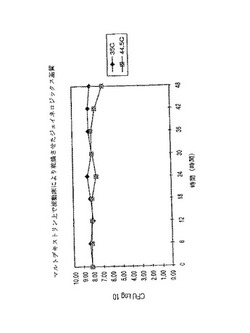
加速有効期間研究は前記の表に載せてある各ロットの等分した部分を摂氏35度と44.5度で保存することにより行う。6時間毎に前記のようにCUFを定量した。図8から11に結果を示す。実際のCUFsを表7に示す。作図のためにデーターは対数に変換されている。
【0158】
【表7】

図3はロット番号LB−107、細胞と本発明の保存用基質の縣濁液を風乾した場合の結果である。本ロットでは保存過程で増殖力の損失が見られず、摂氏35度で48時間保存した場合も増殖力の損失は見られなかった。しかし、摂氏44.5度で48時間保存した場合、2対数の増殖力の損失が見られた。
【0159】
図4はロット番号LB−109、細胞とスキムミルク縣濁液を風乾した場合の結果である。本ロットは保存過程で1対数の増殖力の損失が見られ、摂氏35度で48時間保存した場合増殖力は2対数以上損失した。摂氏44.5度で保存した場合、24−48時間までにほぼすべての増殖力が失われた。
【0160】
図5はロット番号LB−106、細胞と本発明の保存用基質の縣濁液を凍結乾燥した場合の結果である。本ロットでは保存過程で増殖力の損失が見られず、摂氏35度で18時間保存した場合も増殖力の損失が見られなかったが、摂氏35度で48時間までに1対数の増殖力の損失が見られた。摂氏44.5度で保存した場合、18時間までにほぼすべての増殖力が失われた。
【0161】
図6はロット番号LB−108、細胞とスキムミルク縣濁液を凍結乾燥した場合の結果である。本ロットは保存過程で1対数の増殖力の損失があり、摂氏35度で保存した場合48時間までに4対数以上の増殖力が失われた。摂氏44.5度で保存した場合、24−48時間までに増殖力がすべて失われた。
【0162】
要約すると、本発明の保存用基質を用いて作成したロットは風乾もしくは凍結乾燥のどちらの保存過程中でも工業基準スキムミルクを使ったロットより能力が優れていた。保存中増殖力はどちらの保存用基質ロットでも、スキムミルクのロットより優れていて、本発明の保存用基質が工業基準のスキムミルク基質より優れていることを証明している。
【実施例9】
【0163】
本発明の保存用基質を用いて保存した細胞が冷蔵庫保存、室温保存の条件でともに経時的に安定であることを証明するための促進保存実験とリアルタイム保存実験を以下の実施例を用いて説明する。本実施例は本発明の保存用基質の用途の広さも証明している。
【0164】
図7と表8は、実施例8で説明された細胞/保存用基質縣濁液を流動床乾燥機のマルトデキストリン上で、時間促進保存条件で保存する研究からえられたデーターを示す。これらの研究に対して、製品の安定性は製品放出基準に合うCFU値として定義される。好ましい値は座薬あたり106個から108個である。これらのデーターは本発明の保存用基質は摂氏35度で48時間保存中に増殖力の損失がなかったことを示している。摂氏44.5度で保存された製品は18時間安定であった。18から24時間の間に増殖力は1対数下がったが、42時間はおおよそ同じレベルであった。更に48時間までに増殖力は1対数失われた。本実験は流動乾燥過程によりマルトデキストリンにコーティングされた本発明の細胞/保存用基質縣濁液が摂氏35度と44.5度で保存された場合、実施例8の風乾または凍結乾燥懸濁用基質と比較して、最も安定な製品であることを示している。
【0165】
【表8】

これらのデーターはCTV−05株が本発明の保存用基質中で風乾により保存されるもう一つの促進有効期間試験から得られる促進データーとリアルタイムデーターによく相関する。表9より冷蔵庫保存(摂氏2−8度)では製品のCFU値は25ヶ月間108CFUで安定であった。室温(摂氏25±5度)で保存した生成物のCFU値は2ヶ月で108から107CFUに落ちたが、25ヶ月間107CFUで安定であった。図8は同じ製品の摂氏35,45,55度での促進有効期間試験の結果である。摂氏35度では約2.3日かけて失われた増殖力は1対数以下であった。摂氏45度では約2.3日かけて失われた増殖力は約2対数であった。摂氏55度では0.5日中に製品の増殖力は急速に失われた。これらの時間促進試験とリアルタイム有効期試験の比較から、摂氏35度で48時間安定な製品は、摂氏2−8度もしくは室温で保存した場合、25ヶ月間安定であるという仮定は合理的であることが証明される。
【0166】
【表9】

【実施例10】
【0167】
異なるラクトバチルス株の大きなサンプルから座薬株のラクトバチルスを特異的に同定するための細胞壁脂肪酸分析の使用について以下の実施例で説明する。
この実験では、膣から得られた242のラクトバチルス株を盲検法で評価した。細菌の全細胞壁は常套の手法で抽出する。次に細胞壁脂肪酸のメチルエステルをガスクロマトグラフィー分析する。次にMIDIコンピュータープログラムで既知の座薬株の細胞壁脂肪酸プロフィールに「最もよく合う」細胞脂肪酸のプロフィールを検索する。本コンピュータープログラムには本発明家により作成された膣株の特製ライブラリーがある。
【0168】
分析された242ラクトバチルス株で19ラクトバチルス・クリスパトゥス座薬株のうち19が正しく同定された(すなわち、分析は100%の感度を持つ)(データーは示されていない)。更に、40分離株は座薬―類似と同定された(すなわち、分析には82%の特異度がある)(データーは示されていない)。従って、細胞壁脂肪酸分析は、ラクトバチルス株のサンプル数が多い場合でも、座薬株を同定し、追跡するのに有効で、感度と特異性の高い方法である。
【実施例11】
【0169】
他のラクトバチルス分離株がカンジタ・アルビカン(Candida albicans)の臨床的分離株に対する阻害作用を持たないのに対し、ラクトバチルス・クリストゥスCTV−05が阻害作用を持つことを実施例11で証明する。
【0170】
MRS寒天培地を5mmの傾斜をつけて固める。ラクトバチルス・クリスパトゥスCTV−05をプレートの直径に沿ってすじ状に塗布し嫌気的条件下と大気条件下で24,48,72時間成長させる。対照株のラクトバチルス・イエンセンCTV−01、ラクトバチルス・クリスパトゥスCTV−02,ラクトバチルス・クリスパトゥスCTV−03,ラクトバチルス・クリスパトゥスCTV−04を同じ方法で成長させる。これらのプレートに10mM CNNaS(チオシアネイトナトリウム(sodium thiocyanate)、先に報告された酵母の成長阻害剤)を加えた、もしくは加えないYM寒天をかぶせる。かぶせた寒天にカンジタ・アルビカン ATCC60193(頸部から分離)もしくはカンジタ・アルビカン ATCC14053(ヒト血液から分離)のどちらかの株を接種し、阻害域を測定する。大気条件下で生育したラクトバチルス・クリスパトゥスCTV−05細胞はCNNaS存在時でも非存在時でも阻害作用が弱くどちらのカンジダ株も阻害できなかった。対照的に、嫌気的条件下で24,48,72時間生育したラクトバチルス・クリスパトゥスCTV−05細胞は両方のカンジダ株を効果的に阻害した。CNNaSの培地への添加は阻害の効率を上げなかった。従って、ラクトバチルス・クリスパトゥスCTV−05は酵母の成長をインビトロで阻害する。表10に5株の過酸化水素産生ラクトバチルス臨床分離株の 頸部分離カンジタ・アルビカンス ATCC60193に対する阻害能力試験の結果を示す。本発明のラクトバチルス株の特性を定義しているラクトバチルス・クリスパトゥスCTV−05が酵母生物の成長に対する阻害作用に関して他の分離株より優れていることは結果より明らかである。
【0171】
【表10】

本発明の種々の具体的な例が詳細に説明されている一方で、熟練者によりこれらの具体例が修正され翻案されるのは明らかである。しかしながらそのような修正、翻案は、次の請求項に述べる本発明の範囲内にあることは明白に理解されるべきである。
【技術分野】
【0001】
本発明は、膣薬での使用に好適な望ましい特性を有するラクトバチルス(Lactobacillus)属の細菌に関するものである。詳細には、本発明は、保存細菌細胞の実質的に純粋な培養物を有する膣薬、保存用基質、保存用基質中で細菌細胞を保存する方法;ならびに膣感染の予防・治療方法に関するものである。
【背景技術】
【0002】
本発明は一部、いずれも国立衛生研究所が提供するAI31448およびR43 AI36021−01、ならびに疾患管理センター(Center for Disease Control)が提供するCDC200−94−0189下での政府支援によって行われたものである。政府は、本発明に対してある一定の権利を有する。
【0003】
性病(STD)などの下部生殖管感染は、妊娠可能年齢の女性で最も一般的な臨床的問題に数えられる。米国では年間に、1000万件を超える病院来院が膣の愁訴によるものである。膣分泌物は、膣感染(酵母、細菌性膣炎およびトリコモナス)または子宮頸感染(淋病またはクラミジア)による場合がある。さらに、早産、低体重児および新生児死亡率と膣感染との間に関連性があることを示す証拠がある程度あり、それらは産科で直面している最も重要な問題に数えられている。細菌性膣炎は、妊娠における最も一般的な性器感染の一つである。妊娠の第2三ヶ月期中に細菌性膣炎と診断された女性は、細菌性膣炎のない女性と比較して、40%高い確率で、早産による低体重児を出産している。そのような出産をごくわずかな割合であっても予防すれば、大幅な費用節減と新生児の罹患率および死亡率を低下させることができると考えられる。
【0004】
ラクトバチルス類(Lactobacilli)は、ヒトの腸、および膣の細菌叢の一部を構成するグラム陽性桿菌である。膣ラクトバチルス類は、乳酸の産生および膣の酸性化により、あるいは過酸化水素H2O2などの他の抗菌物質の産生により、感染に対する抵抗性において重要な役割を果たすと考えられている。優勢な膣ラクトバチルス叢を有する女性は、淋病、クラミジア感染、トリコモナス症および細菌性膣炎の発生頻度が50%低いことが明らかになっている。膣におけるH2O2生産性ラクトバチルス類の存在は、細菌性膣炎、症候性酵母性膣炎ならびに淋菌(Neisseria gonorrhea)、トラコーマ病原体(Chlamydia trachomatis)および膣トリコモナス(Trichomonas vaginalis)などの性病病原体の頻度低下に関連していた。インビトロ試験から、H2O2産生性ラクトバチルス類が、膣病原体に対して、さらにはヒト免疫不全ウィルス(HIV)に対しても強力な殺菌性および殺ウィルス性を有することが明らかになっている。
【0005】
残念ながら、多くの妊娠可能年齢の女性で膣ラクトバチルス類が存在しない。膣の生態系は、投薬、全身の健康状態、性生活および避妊によって大きく影響される。多くの膣薬および全身薬によって、膣のラクトバチルス類が死ぬ可能性がある。従って、抗生物質による性病治療を行うと、その女性では該疾患を再度獲得する危険性が高くなる可能性がある。ラクトバチルス類が膣の健康を促進するという考えが広まったことと相まって、上記の所見から臨床医は、そのような女性では、膣に再度ラクトバチルス類をコロニー形成することで、生殖管感染の予防または治療を行うべきであるという示唆を得た。
【0006】
膣内または経口で使用するためのラクトバチルス製剤は、健康食品店で販売される「乳酸菌」製品の形で、そして食料品店で販売される乳酸菌ミルクまたはヨーグルト(例えば、それらの製品は代表的には、ラクトバチルス・アシドフィルス(Lactobacillus acidophilus)株を含むことを謳っている)の形で100年以上にわたって市販されている。それらの製品には、ヒト起源のラクトバチルス・アシドフィルスならびに各種栄養補助剤を含む膣坐剤などがあった。それらの製品は、膣に外因性のラクトバチルス類をコロニー形成しないため、ほとんど効果がなかった。そのように効果がないのは、市販品の品質が低いためであると考えられる。食品の一部として、あるいはラクトバチルス補給剤として販売されるラクトバチルス製品は、他の病原体で汚染されている場合が多いことが明らかになっている。さらに、ヨーグルトから得られるラクトバチルスは、膣の上皮細胞に結合できないことが明らかになっている。ラクトバチルスの上皮細胞への結合は、宿主生物のコロニー形成を確立する上で必要な段階である。従って、市販のラクトバチルス製品は、不適切な微生物株を含み(例えば、多くのものが膣からは希にしか採取されない菌株を含む)、微生物の生存力が低く、ないしは微生物が膣の上皮細胞に結合したり、コロニーを確立する能力を持たないのが普通であることから、そのような製品を使用しても、膣感染の予防や治療にはほとんど役立たないと考えられる。
【発明の概要】
【発明が解決しようとする課題】
【0007】
従って、厳密な条件下で製造することができ、インビボでの微生物特性、活性な付着力および有効な生存微生物力価を有する適切なヒトラクトバチルス株を用いる膣感染治療用の製品が望まれている。
【課題を解決するための手段】
【0008】
上述の目的を解決するために、請求項1に記載の発明は、(a)(i)50%以上の膣上皮細胞(VEC)への接着価と、(ii)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、を含む同定のための特徴を有するラクトバチルス属の単離菌株の純粋培養された細菌培養物と、(b)結合剤、抗酸化剤、多価アルコール、炭水化物、及び、スキムミルクとアルブミンとから構成される群より選択される物質、を含有する保存用基質と、を含有し、同基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能な、純粋かつ遺伝的に安定な細胞を保持する基質である膣薬を提供する。
【0009】
請求項2に記載の発明は、請求項1に記載の膣薬において、菌株が、有効な培養条件下において、10ppm以上のH2O2を生産する能力を有することをその要旨とする。
請求項3に記載の発明は、請求項1に記載の膣薬において、菌株が、1ヶ月以上の間、インビボにおいて膣上皮細胞へコロニーを形成し続けることをその要旨とする。
【0010】
請求項4に記載の発明は、請求項1に記載の膣薬において、菌株が、代謝が不活性な状態において膣上皮細胞に接着することをその要旨とする。
請求項5に記載の発明は、請求項1に記載の膣薬において、菌株の1つの細胞の幅が1μmから2μm、長さが2μmから4μmであることをその要旨とする。
【0011】
請求項6に記載の発明は、請求項1に記載の膣薬において、菌株は、有効な培養条件下において、0.75mg/100ml以上の乳酸を生産することをその要旨とする。
請求項7に記載の発明は、請求項1に記載の膣薬において、基質が、インビトロにおいて12ヶ月以上の間、107個以上の生存可能な細胞を保持する基質であることをその要旨とする。
【0012】
請求項8に記載の発明は、請求項1に記載の膣薬において、基質が、インビトロにおいて、4℃から6℃の温度で、12ヶ月以上の間、106個以上の生存可能な細胞を保持する基質であることをその要旨とする。
【0013】
請求項9に記載の発明は、請求項1に記載の膣薬において、基質が、インビトロにおいて、室温で、12ヶ月以上の間、106個以上の生存可能な細胞を保持する基質であることをその要旨とする。
【0014】
請求項10に記載の発明は、請求項1に記載の膣薬において、基質のpHが5.0から7.0までであることをその要旨とする。
請求項11に記載の発明は、請求項1に記載の膣薬において、菌株はラクトバチルス・クリスパトゥスであることをその要旨とする。
【0015】
請求項12に記載の発明は、請求項1に記載の膣薬において、菌株が、ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)であることをその要旨とする。
【0016】
請求項13に記載の発明は、請求項1に記載の膣薬において、菌株はラクトバチルス・イエンセンであることをその要旨とする。
請求項14に記載の発明は、請求項1に記載の膣薬において、同膣薬が不活性担体を更に含有することをその要旨とする。
【0017】
請求項15に記載の発明は、(a)50%以上の膣上皮細胞(VEC)への接着価と、(b)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、を含む同定のための特徴を有するラクトバチルス属の単離細菌株を提供する。
【0018】
請求項16に記載の発明は、請求項15に記載の単離細菌株において、菌株が、65%以上のVECへの接着価を有することをその要旨とする。
請求項17に記載の発明は、請求項15に記載の単離細菌株において、菌株が、有効な培養条件下において10ppm以上のH2O2を生産する能力を有することをその要旨とする。
【0019】
請求項18に記載の発明は、請求項15に記載の単離細菌株において、菌株が、代謝が不活性な状態において膣上皮細胞に接着することをその要旨とする。
請求項19に記載の発明は、請求項15に記載の単離細菌株において、菌株が、1ヶ月以上の間、インビボにおいて膣上皮細胞へコロニーを形成し続けることをその要旨とする。
【0020】
請求項20に記載の発明は、請求項15に記載の単離細菌株において、菌株が、24ヶ月以上の膣でのコロニー形成の間、インビボにおいて遺伝的に安定であることをその要旨とする。
【0021】
請求項21に記載の発明は、請求項15に記載の単離細菌株において、菌株は、有効な培養条件下において、0.75mg/100ml以上の乳酸を生産することをその要旨とする。
【0022】
請求項22に記載の発明は、請求項15に記載の単離細菌株において、菌株の1つの細胞の幅が1μmから2μm、長さが2μmから4μmであることをその要旨とする。
請求項23に記載の発明は、請求項15に記載の単離細菌株において、菌株はラクトバチルス・クリスパトゥスであることをその要旨とする。
【0023】
請求項24に記載の発明は、請求項15に記載の単離細菌株において、菌株が、ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)であることをその要旨とする。
【0024】
請求項25に記載の発明は、請求項15に記載の単離細菌株において、菌株はラクトバチルス・イエンセンであることをその要旨とする。
請求項26に記載の発明は、(a)(i)50%以上の膣上皮細胞(VEC)への接着価と、(ii)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、を含む同定のための特徴を有する2種類以上のラクトバチルス属の単離菌株の、純粋培養された細菌培養物と、(b)結合剤、抗酸化剤、多価アルコール、炭水化物、及び、スキムミルクとアルブミンとから構成される群より選択される物質、を含有する保存用基質と、を含有し、基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能な、純粋かつ遺伝的に安定な細胞を保持する基質である膣薬を提供する。
【0025】
請求項27に記載の発明は、請求項26の膣薬において、膣薬は、細菌性膣炎、症候性酵母膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染、尿路感染症、及び骨盤内炎症性疾患から成るグループより選択される2つ以上の膣感染症を治療するために使用されることをその要旨とする。
【0026】
請求項28に記載の発明は、請求項26の膣薬において、細菌培養物は、第1の膣の感染症に有効な、ラクトバチルス属の第1の菌株と、第2の膣の感染症の治療に有効な、ラクトバチルス属の第2の菌株とを含むことをその要旨とする。
【0027】
請求項29に記載の発明は、請求項28の膣薬において、第1の菌株はラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)であり、第2の菌株はラクトバチルス・イエンセンであることをその要旨とする。
【0028】
請求項30に記載の発明は、ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)からなる細菌菌株を提供する。
請求項31に記載の発明は、(a)単離されたラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)の純粋培養された細菌培養物と、(b)14%のゼラチン、0.5%のアスコルビン酸ナトリウム、2.5%のデキストロース、1.5%のスキムミルク、及び6%のキシリトールを含む保存用基質と、を含有する膣薬であって、基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能で遺伝的に安定な細胞を保持し、基質は前記ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)の望ましい特徴を保持し、同特徴は、代謝が不活性な状態において膣上皮細胞に接着する能力と、有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、膣上皮細胞(VEC)への接着価が50%以上であることとから成るグループより選択される、膣薬を提供する。
【0029】
本発明は、膣薬での使用に好適な所望の特性を有するラクトバチルス属の細菌に関する。詳細には本発明は、保存細菌細胞の実質的に純粋な基質を有する経膣薬、直腸薬および経口薬;保存用基質;ならびに膣感染の予防・治療方法に関するものである。
【0030】
インビボで投与する場合、本発明で開示のラクトバチルスの固有の菌株は、膣上皮細胞にコロニー形成および固着する。次に、それら固有菌株を、時間をかけて膣環境から回収することができる。そのような持続的コロニー形成およびラクトバチルス株の生存能力は、かなりの部分が、本発明で開示の新規保存用基質によるものである。本発明の保存用基質によって提供される保護により、ラクトバチルス株は、代謝的に不活性な状態で膣上皮細胞に付着し、その位置を確保しながら、機能性の阻害性副産物を産生できる活性状態に戻ることができる。微生物細胞用基質のそのような能力については、これまで認められていなかった。本発明の保存用基質はさらに、市販の坐剤製品の生産に各種乾燥方法を可能とするだけの柔軟性を提供するものである。
【0031】
本発明の1実施態様は、膣薬に関するものである。そのような薬には、(i)約50%以上の膣上皮細胞(VEC)接着パーセント値(以下に定義の通り)および(ii)有効な培養条件下で約0.5ppmより高いH2O2を産生する能力などの固有の特性を有するラクトバチルス属の単離株の実質的に純粋な細菌培養物などがある。本発明の膣薬はさらに、細菌培養物を含有・保存する保存用基質をも含むものである。そのような基質には、生理活性結合剤、酸化防止剤、多価アルコール、炭水化物および蛋白質材料が含まれる。1実施態様において、該基質は、約5.0〜約7.0のpHを有する。別の実施態様では、該基質は約7.0のpHを有する。本発明の保存用基質は、インビトロで約12ヶ月以上にわたって、約106個以上の遺伝的に安定な生存細胞を維持することができる。さらに別の実施態様では、該基質は、インビトロで約12ヶ月以上にわたって、約107個以上の生存細胞を維持し、より好ましくはインビトロで約12ヶ月以上にわたって、約108個以上の生存細胞を維持する。
【0032】
他の実施態様では、単離ラクトバチルス株は、約65%以上、より好ましくは約80%以上、さらに好ましくは約95%以上のVEC接着パーセント値を有する。さらに別の実施態様では、該単離株は、約10ppm以上のH2O2、より好ましくは約20ppm以上のH2O2を産生する能力を有する。
【0033】
前述のように、本発明の1実施態様は、代謝的に不活性な状態にある時に、膣上皮細胞に付着する前述のようなラクトバチルス株に関するものである。別の実施態様では、該単離株は、インビボで約1ヶ月以上にわたり、膣上皮細胞のコロニー形成を維持する。さらに別の実施態様では、該単離株は、インビボで約24ヶ月以上にわたり遺伝的安定性を維持する。単離株の1個の細胞は、約1μm〜約2μmの幅、約2μm〜約4μmの長さを有し、有効な培養条件下で、約0.75mg/100mL以上の乳酸を産生する。
【0034】
1実施態様では、本発明のラクトバチルス株は、ラクトバチルス・クリスパトゥス種のものであり、別の実施態様では、本発明のラクトバチルス株はラクトバチルス・イエンセン(Lactobacillus jensenii)種のものである。さらに別の実施態様では、本発明のラクトバチルス株は、本発明の好ましいラクトバチルス株であるラクトバチルス・クリスパトゥス(Lactobacillus crispatus)CTV−5の固有特性全てを有する。
【0035】
本発明の保存用基質は、約4℃〜約6℃の温度、好ましくは室温で、インビトロにて、約12ヶ月以上の期間にわたり、約106個以上の生存細胞を維持する。別の実施態様では、該基質は、インビトロで約18ヶ月以上、好ましくはインビトロで約24ヶ月以上の期間にわたり、約106個以上の生存細胞を維持する。
【0036】
本発明の膣薬は、マルトデキストリンビーズまたはゼラチンカプセルなど(これらに限定されるものではない)の不活性担体を有することができる。1実施態様においては、消化器薬には、(a)(i)約50%以上の膣上皮細胞(VEC)接着パーセント値(以下に定義の通り)および(ii)有効な培養条件下で約0.5ppmより高いH2O2を産生する能力などの固有特性を有するラクトバチルス属の単離株の実質的に純粋な細菌培養物;ならびに(b)生理活性結合剤、酸化防止剤、多価アルコール、炭水化物および蛋白質材料を含む保存用基質が含まれる。そのような基質は、インビトロで約12ヶ月以上の期間にわたり、約106個以上の実質的に純粋で遺伝的に安定な生存細胞を維持する。
【0037】
本発明の別の実施態様は、微生物細胞を保存するための保存用基質に関する。そのような基質は、(a)水溶性ガム、カルボキシメチルセルロースおよびゼラチンなどの生理活性結合剤;(b)酸化防止剤(好ましくはアスコルビン酸ナトリウム);(c)キシリトール、アドニトール、グリセリン、ダルシトール、イノシトール、マニトール、ソルビトールおよびアラビトールなどの多価アルコール;(d)ブドウ糖、ラクトース、マルトース、ショ糖、果糖ならびに他の単糖類、二糖類およびオリゴ糖類などの炭水化物;(e)スキムミルクおよびアルブミンなどの蛋白質材料を含む。そのような基質は、インビトロで約12ヶ月以上の期間にわたり、約106個以上の実質的に純粋で遺伝的に安定な生存細胞を維持する。
【0038】
別の実施態様では、生理活性結合剤は基質全体の約10重量%以上含まれ;酸化防止剤は基質全体の約0.1重量%以上含まれ;多価アルコールは基質全体の約1重量%以上含まれ;炭水化物は基質全体の約0.5重量%以上含まれ;蛋白質材料は基質全体の約0.5重量%以上含まれる。
【0039】
さらに別の実施態様では、生理活性結合剤は基質全体の約14重量%以上含まれ;酸化防止剤は基質全体の約0.5重量%以上含まれ;多価アルコールは基質全体の約6重量%以上含まれ;炭水化物は基質全体の約2.5重量%以上含まれ;蛋白質材料は基質全体の約1.5重量%以上含まれる。
【0040】
本発明の別の実施態様は、保存用基質の約14重量%のゼラチン、約0.5重量%のアスコルビン酸ナトリウム、約2.5重量%のブドウ糖、約1.5重量%のスキムミルク、約6重量%のキシリトールを含む微生物細胞保存用の保存用基質である。
【0041】
本発明のさらに別の実施態様は、微生物細胞の保存のための保存用基質の製造方法に関するものである。そのような方法は、(a)(i)水溶性ガム、カルボキシメチルセルロースおよびゼラチンなどの滅菌生理活性結合剤;(ii)スキムミルクおよびアルブミンなどの滅菌蛋白質材料;(iii)キシリトール、アドニトール、グリセリン、ダルシトール、イノシトール、マニトール、ソルビトールおよびアラビトールなどの滅菌多価アルコール;(iv)滅菌酸化防止剤;(v)ブドウ糖、ラクトース、マルトース、ショ糖、果糖ならびに他の単糖類、他の二糖類および他のオリゴ糖類などの滅菌炭水化物;(vi)水などの成分を提供する段階;ならびに(b)これら成分を共に混和して、溶液を形成する段階を有するものである。生理活性結合剤は、液体として提供することができる。
【0042】
本発明のさらに別の実施態様は、保存用基質内に微生物細胞を保存する方法に関するものである。そのような方法には、(a)約106個以上の微生物細胞の培養物を保存用基質に懸濁させて、細胞基質懸濁液を形成する段階;(b)該細胞基質懸濁液を不活性担体に加えることで、投与組成物を形成する段階;ならびに該投与組成物から水を除去する段階が含まれる。保存用基質には、上記のような成分が含まれる。1実施態様においては、該方法にはさらに、輸送および保存時に水分および酸素から投与組成物を保護する包装中に前記投与組成物を入れる段階が含まれる。
【0043】
1実施態様においては、前記不活性担体には、マルトデキストリンビーズなどがあり、その場合前記方法には、該ビーズ表面に細胞基質懸濁液をコーティングする段階および該ビーズを流動床乾燥によって乾燥することで水を除去する段階が含まれる。
【0044】
別の実施態様においては、不活性担体にはゼラチンカプセルがあり、その場合前記方法には、細胞懸濁液基質が非流体の基質を形成するまで該ゼラチンカプセルを冷却する段階、その次に該ゼラチンカプセルを乾燥室で乾燥させる段階が含まれる。前記乾燥段階には、約24℃〜約32℃で、約25%未満の水分、好ましくは約15%未満の水分、さらに好ましくは約5%未満の水分を含む乾燥空気を乾燥室に送り込む段階、ならびに湿った空気を乾燥室から排気する段階が含まれる。乾燥室には、コンプレッサ、1以上の炭化水素集塵フィルターおよび冷却空気コンプレッサがあっても良い。乾燥室にはさらに、乾燥剤カラムがあっても良い。
【0045】
本発明のさらに別の実施態様は、膣感染から女性を保護する方法に関するものである。該方法には、本明細書で前述したような本発明の膣薬を女性に投与する段階がある。別の実施態様は、膣感染の治療方法であって、本明細書で前述したような本発明の膣薬を女性に投与する段階を有する方法に関するものである。そのような医薬品が有用である膣感染には、細菌性膣炎、症候性酵母性膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染、尿道感染または骨盤内炎症性疾患などがある。
【0046】
本発明のさらに別の実施態様は、ヒト免疫不全ウィルス(HIV)によるヒトの感染の危険性を低減する方法であって、本明細書で前述したような本発明の膣薬をヒトに投与する段階を有する方法に関するものである。好ましい実施態様では、該医薬品に含まれるラクトバチルス株は、ラクトバチルス・クリスパトゥスCTV−5である。
【0047】
本発明の別の実施態様は、消化器感染によるヒトの感染を予防する方法であって、本明細書で前述したような本発明の膣薬をヒトに投与する段階を有する方法に関するものである。
【0048】
本発明の別の実施態様は、早産を予防する方法であって、本明細書で前述したような本発明の膣薬を妊婦に投与する段階を有する方法に関するものである。
本発明の1実施態様は、膣および腸におけるエストロゲンの代謝を促進する方法であって、本明細書で前述したような本発明の膣薬を女性に投与する段階を有する方法である。
【0049】
本発明のさらに別の実施態様は、(a)(i)約50%以上の膣上皮細胞(VEC)接着パーセント値(以下に定義の通り)および(ii)有効な培養条件下で約0.5ppmより高いH2O2を産生する能力などの固有特性を有するラクトバチルス属の2種類以上の単離株の実質的に純粋な細菌培養物;ならびに(b)生理活性結合剤、酸化防止剤、多価アルコール、炭水化物および蛋白質材料を含む保存用基質を含む膣薬に関するものである。そのような基質は、インビトロで約12ヶ月以上にわたって、約106個以上の実質的に純粋で遺伝的に安定な生存細胞を維持する。そのような医薬品は、細菌性膣炎、症候性酵母膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染、尿路感染症または骨盤内炎症性疾患などの2種類以上の膣感染の治療に用いることができる。1実施態様においては、細胞培養物には、第1の膣感染の治療に有効な第1の菌株および第2の膣感染の治療に有効な第2の菌株が含まれる。好ましい実施態様においては、第1の菌株はラクトバチルス・クリスパトゥスCTV−5であり、第2の菌株はラクトバチルス・イエンセン種である。
【0050】
本発明の別の実施態様は、(a)単離ラクトバチルス・クリスパトゥスCTV−5の実質的に純粋な細菌培養物;ならびに(b)約14重量%のゼラチン、約0.5重量%のアスコルビン酸ナトリウム、約2.5重量%のブドウ糖、約1.5重量%のスキムミルク、約6重量%のキシリトールを含む保存用基質を有する膣薬に関するものである。該基質は、インビトロで約12ヶ月以上にわたって、約106個以上の遺伝的に安定な生存細胞を維持し、ラクトバチルス・クリスパトゥスCTV−5の望ましい特性を保存する。そのような特性には、代謝的に不活性な状態で膣上皮細胞に付着する能力、効果的な培養条件下で約0.5ppmを超えるH2O2を産生する能力、約50%以上の膣上皮細胞(VEC)接着パーセント値などがある。
【図面の簡単な説明】
【0051】
【図1】ラクトバチルス株CTV−05の生存率の安定性に対する高温保存の効果を示すグラフである。
【図2】ラクトバチルス株CTV−05の生存率の安定性に対する長期室温および冷蔵保存の効果を示すグラフである。
【図3】本発明の風乾保存用基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【図4】風乾標準スキムミルク基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【図5】本発明の凍結乾燥保存用基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【図6】凍結乾燥標準スキムミルク基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【図7】マルトデキストリンで流動床乾燥した本発明の保存用基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【図8】本発明の懸濁基質で保存したラクトバチルス・クリスパトゥスCTV−05の経時的生存率を示す加速貯蔵期間試験の折線グラフである。
【発明を実施するための形態】
【0052】
本発明は、膣感染の予防用の医薬品として、経口使用または膣内使用に好適な望ましい特性を有するラクトバチルス属のヒト菌株に関するものである。詳細には、その望ましい特性には、膣上皮細胞への付着およびコロニー形成を行う能力、過酸化水素の産生、特異的効力、貯蔵期間安定性、膣感染因子の阻害、乳酸の産生および個々の菌細胞の大きさなどがある。さらに本発明は、保存菌細胞の実質的に純粋な培養物を含む膣薬に関するものであり、さらには該菌細胞を医薬品内で保存することで、約12ヶ月以上の保存期間を通じて、純度、遺伝的安定性および上記の望ましい特性を維持する方法に関するものである。
【0053】
現在市販のラクトバチルス製品は多くの場合、汚染されているか、あるいはH2O2産生性のラクトバチルス類の適切な膣株を十分な量で含まない。さらに、現在市販のラクトバチルス株は、膣上皮細胞にコロニー形成できない場合が多い。十分な効力および株選択の問題に加えて、既存の製品では、それの商業的生産時に用いる保存方法のために、効力がない場合がある。多くの製品で、ラクトバチルス株が、インビトロで剥離膣上皮細胞に付着する能力、ならびにインビボで膣上皮細胞にコロニー形成する能力を持たない場合が多い。さらに、保存株の貯蔵期間は短い場合が多く、2〜3ヶ月で生存細胞数は急速に低下する。現在使用されている保存方法の中には、食品保存用に開発されたものもあり、微生物保存に最適ではない可能性が高い。保存方法は、細胞を保護し、細胞成長を一時停止させながら、代謝的に不活性な状態(すなわち、保存状態)で細胞を膣壁に付着させなければならないことから、それは非常に重大である。
【0054】
本発明は、現在使用可能な栄養補助食品および膣補給剤と比較して優れた利点をいくつか提供するものである。現代のDNAに基づく技術を用いることで、膣内の最も一般的なラクトバチルスは、現在の多くの栄養補助食品および膣治療薬が用いている菌種であるラクトバチルス・アシドフィルスではないことが示唆されるようになった。本発明者らは、膣薬用に現在市販されているものより優れたラクトバチルス・クリスパトゥスおよびラクトバチルス・イエンセンの新規菌株を同定・単離した。さらに本発明者らは、増殖、回収、保存、膣投与系への配置および保存の際に望ましい特性を失うことなく、少量および大量の両方で菌株を製造する至適条件を明らかにした。本発明者らはさらに、微生物の所望の特性を保存できるような形で微生物を保存する新規な保存用基質および方法をも提供するものである。さらに詳細には、本発明の保存用基質により、ラクトバチルス株は、インビボで代謝的に不活性な状態で膣上皮細胞に付着し、位置を保持しながら、機能性の阻害性副産物を産生することができる活性状態に戻ることができる。微生物/保存用基質の組み合わせにそのような能力のあることは、本発明以前には報告されていない。本発明の保存用基質はさらに、保存状態で長期間にわたり、室温または冷蔵温度で微生物を保存することができ、しかも市販の医薬品製造のための各種乾燥方法を使えるだけの柔軟性を提供するものである。そのような能力を有する保存用基質は本発明で初めて明らかにされるものである。インビトロおよびインビボのいずれにおいても、本発明の医薬品が示す効力と同等以上の効力を示す現在公知のラクトバチルスの膣薬があるという情報を本発明者らは得ていない。
【0055】
本発明によれば、「膣薬」という用語は、膣を通して身体に侵入し得る感染および疾患などの、膣に直接または間接的に関係する感染、疾患その他の障害を予防もしくは治療するのに使用される医薬品(すなわち、薬物または薬)である。本発明の膣薬については、主として膣感染に関係する用途が本明細書に記載されているが、そのような膣薬は、必ずしも膣感染に関係しない感染および状態の治療に使用できることは明らかであり、そのような例としては消化管感染があり、その場合、本発明の医薬品は消化器薬と称することができる。
【0056】
本発明の1実施態様は、(i)約50%以上の膣上皮細胞(VEC)接着パーセント値(以下に定義の通り)および(ii)約0.5ppmより高いH2O2を産生する能力などの固有特性を有するラクトバチルス属の単離株の実質的に純粋な細菌培養物を含む膣薬に関するものである。該膣薬には、細菌培養物を含有・保存する保存用基質も含まれる。そのような基質は、生理活性結合剤、酸化防止剤、多価アルコール、炭水化物および蛋白質材料を含む。該基質は、インビトロで約12ヶ月以上にわたって、約106個以上の遺伝的に安定な生存細胞を維持することができる。1実施態様において、膣薬は、マルトデキストリンビーズおよびゼラチンカプセルなどの不活性担体を有することができる。
【0057】
本発明によれば、微生物の単離株とは、該微生物の天然環境から取り出された株である。「単離」という用語自体は必ずしも、該微生物の精製程度を反映したものではない。それとは対照的に、微生物株の「実質的に純粋な培養物」という表現は、所望の微生物株(すなわち、「坐剤(suppository)株」または「医薬株」)以外の微生物を実質的に含まない培養物を指す。すなわち、微生物株の実質的に純粋な培養物は、細菌汚染物や望ましくない化学汚染物などの他の汚染物を実質的に含まない。
【0058】
培養物中に座薬株が存在し、汚染株が存在しないことは、培養物中の微生物について、(1)標識DNAプローブを用いてのDNA相同性、(2)DNAフィンガープリントおよび/または(3)細胞壁脂肪酸プロファイルを分析する等の方法によって明らかにすることができる。例えば、培養物内の株については、座薬株からのDNAへの厳密なハイブリダイゼーション条件下で、培養物からのDNAがハイブリダイゼーションするか否かを明らかにすることで、所望の座薬株とのDNA相同性を分析することができる。本明細書で使用する場合、厳密なハイブリダイゼーション条件とは、オリゴヌクレオチドなどの核酸分子を用いて、類似の核酸配列を有する分子を同定する標準的なハイブリダイゼーション条件を指す。厳密なハイブリダイゼーション条件によって、ハイブリダイゼーション反応でプローブとして使用される核酸分子と約70%以上の核酸配列同一性を有する核酸分子を単離することができるのが普通である。そのような標準的条件は、Sambrook et al.,1989,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Labs Pressに開示されている。該文献(Sambrook et al.,ibid.)は、引用によってその全体が本明細書に含まれるものとする。そのような条件の例として、例えば、5×SSPE、1%サルコシル(Sarkosyl)、5×デーンハルツ(Denhardts)および0.1mg/mLの変性サケ精子DNAを含む溶液中、37℃で約2〜12時間にわたって、代表的にはフィルター(例:ニトロセルロースフィルター)上に固定化した核酸分子(例:被験培養物からのDNA)に、長さ約18〜25ヌクレオチドおよびTm約50℃〜約65℃のオリゴヌクレオチドプローブ(例:座薬株からのDNA)をハイブリダイゼーションすることができる。次にフィルターを、5×SSPE、1%サルコシルを含む洗浄液にて3回、37℃で各15分間洗浄する。フィルターはさらに、2×SSPE、1%サルコシルを含む洗浄液にて、37℃で各15分間洗浄することができる。例えば、無作為に初回抗原刺激したDNAプローブを、5×SSPE、1%サルコシル、0.5%ブロット(Blotto;乾燥ミルクの水溶液)および0.1mg/mLの変性サケ精子DNAを含む溶液中、42℃で約2〜12時間にわたって、代表的にはフィルター(例:ニトロセルロースフィルター)上に固定化した核酸分子にハイブリダイゼーションすることができる。次にフィルターを、5×SSPE、1%サルコシルを含む洗浄液にて2回、42℃で各15分間洗浄し、それに続いて、2×SSPE、1%サルコシルを含む洗浄液にて2回、42℃で各15分間洗浄することができる。ただし、これらの条件に限定されるものではない。
【0059】
反復配列ポリメラーゼ連鎖反応(RepPCR)によるDNAフィンガープリンティングを用いるか、あるいは細胞壁脂肪酸分析を用いる座薬株の同定方法については、後述の実施例の箇所で詳細に説明する。
【0060】
本発明の医薬品での使用に好適なラクトバチルス株(すなわち、座薬株)は、上記の固有特性を有するいずれかのラクトバチルス株であることができる。ラクトバチルス株は、当業界で公知の適切なスクリーニング法を用いて、天然入手源から検出・単離することができる。本発明での使用に好適なラクトバチルス株の固有特性ならびにそれら特性に関するスクリーニング方法については、後に詳細に説明する。ラクトバチルスの好ましい種には、ラクトバチルス・アシドフィルス、ラクトバチルス・イエンセンおよびラクトバチルス・クリスパトゥスなどがあり、好ましくはラクトバチルス・クリスパトゥスである。好ましくは、好適なラクトバチルス株は、ヒトの膣から単離する。特に好ましいラクトバチルス株は、ラクトバチルス・クリスパトゥスCTV−5株の固有特性全てを有する株であり、ラクトバチルス・クリスパトゥスCTV−5が最も好ましい。
【0061】
ラクトバチルスの公知の種および株以外に、公知の株または新規に同定される株に由来する天然株および突然変異株から新たに同定される種および株を、本発明の医薬品に用いることができることは、本発明の範囲に含まれるものである。例えば、親株に対して、1サイクル以上の化学的突然変異生成および/または放射線突然変異生成を行って突然変異率を高めることで、所望の特性が改善された微生物を得る確率を高めることにより、本発明の医薬品での使用に好適なラクトバチルスの固有特性を有するラクトバチルス親株の天然の突然変異株を単離することができる。本発明の突然変異微生物には、例えばVEC接着パーセント値(以下に定義)の高い遺伝子工学微生物によって得ることができる微生物も含まれることは、当業者には明らかであろう。本明細書で使用する場合、「突然変異微生物」とは、自然発生の突然変異、突然変異原への曝露の結果である突然変異、あるいは遺伝子工学の結果である突然変異によって、微生物のヌクレオチド組成が変化した突然変異親微生物である。
【0062】
本発明の膣薬での使用に好適なラクトバチルスの固有特性の一つは、該ラクトバチルス株が、約50%以上、好ましくは約65%以上、さらに好ましくは約80%以上、最も好ましくは約95%以上の膣上皮細胞(VEC)接着パーセント値を有するというものである。本発明によれば、「接着」および「付着」という用語は互換的に使うことができる。膣上皮細胞への細菌細胞の付着は、コロニー形成および生理効果にとって必須である。本明細書で使用する場合、コロニー形成とは、必ずしも組織の侵襲や損傷を生じるとは限らない、細胞上または材料上での微生物増殖部位の形成を指す。膣上皮細胞への本発明のラクトバチルス細胞付着が奏功すれば、膣上皮細胞のコロニー形成が奏功することになろう。本発明によれば、「VEC接着パーセント値」とは、特定の群中のVEC総数中、1個以上のラクトバチルス細胞が付着しているVECのパーセントと定義される。それは、従来において普通に使用されてきた付着の別尺度である。従来、インビトロでの付着有効性は、染色標本で認められる第1の所定数(例:50個)の膣上皮細胞(VEC)について付着細菌細胞数をカウントし、VEC当たりの付着細菌細胞の平均を計算することで求めていた。これまでは、その平均値が特定の細菌株の有効性の指標として用いられていた。理論的に拘束されるものではないが、本発明者らは、上述のような「VEC接着パーセント」の測定の方が、有効性測定としては優れていると考えている。実務的な面を強調すれば、インビトロでの付着は、ヒト被験者でのインビボでの付着およびコロニー形成と相関するものでなければ何の意味も持たないと、本発明者らは考えている。従って、従来の総VEC数でのVEC当たりの付着細胞平均値をインビトロおよびインビボでの有効性の尺度として用いるのではなく、本発明者らは、総VEC数中で、1個以上の付着微細菌細胞を有するVEC細胞のパーセントを計算する(すなわち、VEC接着パーセント値)。その値は、有意な数のVECがインビトロおよびインビボで細菌細胞を受け入れるか否かを示す良好な指標であることから、かなり意味のある値であると考えている。それとは対照的に、従来の付着平均値を用いると、歪曲して理解され、有効性について誤った解釈に至る場合がある。例えば、50個のVEC群に付着した細菌細胞数を技術者がカウントする以下の3つの場合で、2種類の付着測定法(すなわち、平均付着率とVEC接着パーセント値)により、インビトロでの付着有効性の評価が驚くほど異なったものとなる。
【0063】
A.技術者のカウントによると、総数50個のVEC中10個のVECに1500個の細菌細胞が付着しており、細菌細胞が付着していないVECは40個(80%)である(この場合、10個のVECそれぞれに150個の細菌細胞がある)。従来の平均値計算によると、平均付着値は菌30個/細胞であり、VEC接着パーセント値は20%である。
【0064】
B.技術者のカウントによると、総数50個のVEC中50個のVECに1500個の細菌細胞が付着しており、細菌細胞が付着していないVECは0個(0%)である(この場合、50個のVECそれぞれに30個の細菌細胞がある)。従来の平均値計算によると、平均付着値はやはり菌30個/細胞であるが、VEC接着パーセント値は100%である。
【0065】
C.技術者のカウントによると、総数50個のVEC中40個のVECに600個の細菌細胞が付着しており、細菌細胞が付着していないVECは10個(20%)である(この場合、40個のVECそれぞれに15個の細菌細胞がある)。従来の平均値計算によると、平均付着値は菌12個/細胞であり、VEC接着パーセント値は80%である。
【0066】
従って、本発明の好ましい付着測定を用いると、VEC当たりに付着した平均細菌数は場合Aと場合Bの両方で同じであっても、場合Bの方が、細菌細胞を受け入れたVECが多いことから(100%と20%)、付着有効性に関しては、場合Aの細菌より、場合Bの細菌の方が選択されることになると考えられる。実際、平均付着値は、場合Aで菌30個/VECあるのに対して、場合Cの細菌では菌12個/VECであるとしても、場合Cの場合の方が、細菌細胞を受け入れたVEC数が多い(80%と20%)ことから、場合Aの細菌との比較であれば、場合Cで調べた細菌であっても選択されるものと考えられる。以上の場合を考慮すると、VEC接着パーセント値の方が、付着有効性の計算では感度が高く、妥当性が高い。
【0067】
特に、膣生態系でラクトバチルスによって示される自己調節プロセスを考慮すると、従来の平均付着値と比較して、「VEC接着パーセント」値の方が、インビボでの長期コロニー形成の指標としては優れていると、本発明者らは考えている。ラクトバチルス群が「過度に密集状態」になると、自己抑制によって膣でのH2O2産生ラクトバチルスの過剰成長が防止されることが示唆されている。そのような安全因子が組み込まれていることで、過剰数の膣ラクトバチルスによる有害効果が生じる可能性が小さくなる。この現象を考慮すると、本発明においては、相対的に広い範囲のVEC上に拡散する(例えば、高いVEC接着パーセント値を有する)座薬株の方が、ごく少数のVECに多数付着すると考えられる菌株より好ましい。後者の状況では、少数の過度に密集したVEC上でのH2O2産生性ラクトバチルスの自己抑制が起こって、該細菌の長期的な生存およびコロニー形成の可能性が低下する可能性がある。インビボでの長期コロニー形成が本発明の製品および方法の最終的な目的であり、より多くのVECに、より少数のラクトバチルス細胞が付着することで、その目的がより良好に達成されるものと考えられる。1実施態様においては、本発明で使用される単離ラクトバチルス株は、約1ヶ月以上にわたって膣上皮細胞のコロニー形成を維持する能力によって確認される。
【0068】
本発明の医薬品での使用に好適なラクトバチルスの別の固有特性は、過酸化水素(H2O2)産生能力である。前述のように、ラクトバチルスが他の微生物を殺す効果は、直接には過酸化水素によるものであることが明らかになっている。好ましくは、該ラクトバチルスは、通常の成長条件下で、約0.5ppmを超えるH2O2を産生することができる。より好ましくは、該ラクトバチルスは、H2O2の産生を促進することができる培地および条件と本明細書で定義されるような有効な成長条件下で、約10ppm以上のH2O2を産生することができ、さらに好ましくは、該ラクトバチルスは、約20ppm以上のH2O2を産生することができる。有効な成長条件には、インビトロ成長条件(例えば、有効な培地および条件)およびインビボ成長条件(例えば、膣上皮細胞のコロニー形成奏功)の両方がある。
【0069】
本発明のラクトバチルスの過酸化水素生成量は任意の過酸化水素測定法で定量できる。例えば、ラクトバチルスをテトラメチルベンジジン(TMB)培地へ接種し好気性条件下で培養し、青色を定量し過酸化水素生成量を測定できる。また市販の過酸化水素検出ストリップ(例、EMサイエンス社より入手可)を使用して過酸化水素量を測定できる。
【0070】
1実施形態において、本発明の薬の使用に適切なラクトバチルスのもう1つの有用な特徴はインビボおよびインビトロで時間経過しても遺伝子学的に安定であることである。本発明における遺伝子学的安定性とは母株と同一の遺伝子コードを十分に維持しながらラクトバチルス菌株を連続生成する能力を示す。つまり遺伝子学的に安定な菌株を連続生産すると時間が経過しても菌株のDNAに突然変異は起こらない。さらに重要なことは遺伝子学的に安定な菌株を連続生成すると時間が経過しても上述の特徴の1つについてDNAに大きな突然変異は起こらない。最も重要なことは遺伝子学的に安定な菌株を連続生成すると時間が経過してもこの明細書で述べる膣上皮細胞接着率、過酸化水素生成量又は代謝不活性状態の膣上皮細胞接着能力等の有用な特徴についてDNAに大きな突然変異(例、タンパク質コードの表現型を著しく変える変異)は起こらない。膣上皮細胞にインビボでコロニーを形成したラクトバチルス菌株は、好ましくは約12ヶ月間以上、さらに好ましくは約18ヶ月以上、最も好ましくは約24ヶ月間以上、膣コロニー内で遺伝子学的安定性を維持する。インビトロでは、本発明の膣薬における微生物の遺伝子学的安定性は培養条件、調製および貯蔵形態に影響される可能性がある。その条件の詳細を以下に説明する。本発明の保存用基質の優れた品質のおかげで、保存用基質に保存されるラクトバチルス菌株はインビトロで好ましくは約12ヶ月間以上、さらに好ましくは約18ヶ月以上、最も好ましくは約24ヶ月間以上、室温又は冷蔵(2〜8℃)で有用に遺伝子学的に安定である。遺伝子学的安定性は、突然変異を評価するいかなる方法又は選択型遺伝子マーカーで評価することが可能である。例えば、制限エンドヌクレアーゼパターンに基づく遺伝子マーカーを使用して、特定の培養株の特徴を確立しそれを母株と比較することができる。本発明の発明者は反復配列ポリメラーゼ鎖反応(Rep PCR)を適用し、40もの異なるラクトバチルス菌株を識別し、インビトロにおける貯蔵後およびインビボにおける膣上皮細胞コロニー形成後にラクトバチルス特定株の時間経過後の遺伝子学的安定性を確認している。
【0071】
1実施実施形態において、本発明の薬へ使用するのに適するラクトバチルスの有効な特徴は、乳酸を生成する能力である。乳酸はインビトロで病原菌の成長を阻害することが示されている。好ましくは、ラクトバチルスは約0.75mg/100ml以上、さらに好ましくは約4mg/100ml以上、最も好ましくは8.8mg/100ml以上の乳酸を有効な生育条件下で生成する。
【0072】
本発明の別の実施形態では、適切なラクトバチルス菌株の細胞寸法は比較的大きい。
バーギーズ・マニュアル・オブ・デターミネイティブ・バクテリオロジー(Bergey's Manual of Determinative Bacteriology)に記載されるラクトバチルスの一般的な細胞寸法は0.8〜1.6μm(幅)x2.3〜11μm(長さ)である。本発明に使用する好ましいラクトバチルス菌株の細胞寸法は幅約1〜2ミクロン、長さ約2〜4ミクロンである。理論にとらわれず、本発明ではラクトバチルス菌株の大きな細胞寸法によってより有効な生物学的競合な排除作用が得られ有効な保護剤が可能となったと信じる。ここで生物学的競合な排除作用とは座薬株又は本発明の菌株が不要な細菌の成長を競合的に阻害する機能を意味する。この排除作用は膣上皮細胞上の余分な空間を有効なラクトバチルス菌(例、座薬株)が占有し、病原菌又は不要な微生物細胞が接着するのを防御するために起こる。
【0073】
本発明の膣薬には保存用基質も含まれる。微生物細胞を保存のために保存用基質に懸濁し伝達物質中に封入し貯蔵する。本発明における該基質、微生物の培地、微生物細胞の採取方法及び保存プロセスが全て微生物の貯蔵期間中の生存細胞数および再水和(例、膣内での再水和)後の保存細胞の性能に大きな効果を与えている。本発明の保存用基質は前述の膣菌株の好ましい特徴を全て有している。
【0074】
本発明の保存用基質は、保存中に遭遇する損傷を最小限にし、機能的な特性を提供することのできる構成物質からなっている。次にその詳細を説明するが、本発明のラクトバチルス菌株を保存のため保存用基質に添加すると、代謝活性状態から代謝不活性状態へと転換する。本発明の膣薬に使用するラクトバチルス菌株のさらなる有効性は代謝不活性状態下でも膣上皮細胞へ接着することが可能な点である。本発明の保存用基質は最適の微生物細胞の回復力を維持するように設計されており、インビボで再水和後直ちに微生物細胞は遊離し膣上皮細胞へ接着し完全に遅延なく代謝活性状態に回復する。
【0075】
本発明の保存用基質には生物学的に活性な結合剤、抗酸化剤、多価アルコール、炭水化物およびタンパク質様物質が含まれる。ここで注意するがこの明細書において「ある物質」を示す場合、それは1つ以上の物質を示す。例えば「炭水化物」と記した場合は1つ以上の炭水化物又は最低限1つの炭水化物をさす。このように本明細書では「ある」、「1つ以上」および「最低限1つ」の言葉は互換性を有する。また「を有する」、「を含む」および「を持つ」にも同様に互換性があることにも注意していただきたい。
【0076】
本発明によると生物学的許容な結合剤とは、好ましくはインビボでの使用可能な(例、インビボで何らかの活性または毒性作用がない)タンパク質から構成される結合剤で保存プロセス中に細胞基質を不活性担体(以下に示す)に結合させ、微生物細胞の保存および貯蔵期間中を通じて保護効果(例、細胞生存数を維持しながら)を提供する。本発明の保存用基質に使用する好ましい生物学的許容な結合剤として水溶性ゴム、カルボキシメチルセルロースおよび/又はゼラチン等が挙げられるがこれに限らない。生物学的に許容な結合剤は一般的には保存用基質の重量を基準として約10〜20重量%、好ましくは約14重量%を占める。1実施形態では本発明の保存用基質はその約14重量%のゼラチンを含有している。
【0077】
本発明の保存用基質は抗酸化剤を有し、保存及び貯蔵中に微生物細胞が酸化による損傷を受けるのを遅延する。具体的に好ましい抗酸化剤はアスコルビン酸ナトリウムである。抗酸化剤は一般的に保存用基質の重量を基準として約0.1〜1.0重量%、好ましくは約0.5重量%を占める。本発明の1実施形態では、保存用基質は約0.5重量%のアスコルビン酸ナトリウムを有している。
【0078】
本発明の保存用基質は多価アルコール(例、多価アルコール)を有し、保存及び貯蔵期間中に細胞のタンパク質および膜が変形しないで原型を維持するために働く。具体的に多価アルコールは細胞膜と相互作用し、保存プロセスの脱水過程に有効な働きをする。好ましい多価アルコールには、キシリトール、アドニトール、グリセロール、ズルシトール、イノシトール、マニトール、ソルビトールおよび/又はアラビトール等が挙げられるがこれに限らない。一般的に多価アルコールは保存用基質の約1〜12重量%、好ましくは6重量%である。1実施形態では、保存用基質の約6重量%のキシリトールが含まれている。
【0079】
本発明の保存用基質は炭水化物を有し、保存及び貯蔵期間中に細胞のタンパク質および膜が原型を維持し変形を防ぐ。具体的に炭水化物は細胞膜の結合性を維持し保存プロセスの脱水過程に有効な働きをする。好ましい炭水化物にはデキストロース、ラクトース、マルトース、スクロース、フルクトースおよび/又はその他の単糖類、ニ糖類および多糖類であるがそれに限らない。一般的に炭水化物は保存用基質の約0.5〜5重量%、好ましくは2.5重量%である。1実施形態において、保存用基質は約2.5重量%のデキストロースを有している。
【0080】
本発明の保存用基質はタンパク質様物質を有し保存プロセス中の脱水過程中に微生物細胞をさらに保護する。好ましいタンパク質様物質にはスキムミルク及びアルブミンがあるがそれに限らない。一般的に、タンパク質様物質は保存用基質の約0.5〜5重量%、好ましくは1.5重量%を占める。1実施形態において、保存用基質の約1.5重量%のスキムミルクが含まれている。
【0081】
本発明の1実施形態において、保存用基質は、生理活性を有する結合剤を約10重量%、抗酸化剤を約0.1%、多価アルコールを約1重量%、炭水化物を約0.5%およびタンパク質様物質を約0.5重量%有している。
【0082】
本発明の具体的に好ましい保存用基質は、保存用基質の重量を基準として約14重量%のゼラチン、約0.5重量%のアスコルビン酸ナトリウム、約2.5重量%のデキストロース、約1.5重量%のスキムミルク、約6重量%キシリトールを有する。
【0083】
保存用基質のpHは保存微生物細胞の最適な安定性を確保するため特に重要である。保存用基質の最適なpHは、ラクトバチルス細胞を様々なpHに調節した基質中に懸濁し調製して決定できる。本発明の保存用基質のpHは一般的に約5.0〜7.0、好ましくは約7.0である。
【0084】
本発明の膣薬に使用する保存用基質には、上述の具体的な品質に加えて約106個以上の生存細胞を約12ヶ月以上の間、十分に純粋で遺伝子学的に安定な状態でインビトロで維持することが可能である。前述のように「十分に純粋な」状態とは微生物細胞の培養に他の不要な微生物が混入しない状態を示す(例、汚染物)。この細胞の遺伝子学的安定性の重要性については本明細書で前述した。本発明の好ましい実施形態では、保存用基質は生存細胞数約107個、より好ましくは108個の十分に純粋で遺伝子学的に安定なラクトバチルス細胞を約12ヶ月間以上維持することが可能である。
【0085】
また本発明の別の実施形態では、薬に使用する保存用基質は好ましくは生存細胞数約106個の十分に純粋で遺伝子学的に安定なラクトバチルス細胞を約18ヶ月以上、さらに好ましくは約24ヶ月維持することが可能である。
【0086】
本発明の膣薬は室温又は一般的には約4〜6℃の冷蔵温度で保存が可能である。さらに別の実施形態では本発明の薬に使用する保存用基質は、好ましくは生存細胞数約106個のラクトバチルスを十分に純粋で遺伝子学的に安定な状態で約12ヶ月間室温で維持することが可能である。また別の実施形態では本発明の薬に使用する保存用基質は、好ましくは生存細胞数約106個のラクトバチルスを十分に純粋な状態でかつ遺伝子学的に安定な状態で約12ヶ月間冷蔵温度で維持することが可能である。
【0087】
保存用基質が最低限の生存細胞を保存できる能力は、本発明の該薬の薬効にとって非常に重要であり、本発明の先行技術の膣治療で特に問題となっていた。さらに、薬単位(例、単型座薬又は錠剤)から伝達される十分に純粋で遺伝子学的安定な生存細胞数は、薬の力価に直接的に非常に重要な影響を与える。本明細書で述べる「薬効」とは座薬株が生物学的効果を発揮する能力を意味する(例、抗膣感染保護効果として統計的有意なレベルを示す)。「力価」は薬単位(単型座薬又は錠剤)が伝達する生存微生物細胞数に直接関係する。本発明によると生存細胞は成長し増殖することが可能である。ラクトバチルス薬がインビボで有効であるためには微生物細胞が最低約106個の力価で膣上皮細胞にコロニーを形成し生物学的効果(例、細菌性膣炎などの感染症の不在で証明)を示す必要がある。本発明では、座薬菌株がコロニーを形成可能な薬の力価と生物学的効果を発揮する薬の力価の間に違いがあることを発見した。また本発明では座薬菌株がコロニーを形成する能力に生物学的効果を発揮する特定な力価の条件が加わることが薬効のあるラクトバチルス薬において非常に重要であることを発見した。より具体的には座薬菌株が結果的に膣にコロニーを形成するためにはある一定の生存微生物細胞濃度が必要であるが、薬が薬効を発揮するためにはそれは十分でなくてもよい。例えば本発明のラクトバチルス菌株と保存形式を適用して大変低い力価(例、105個の微生物細胞)でも膣上皮細胞に良好なコロニーを形成することができる。しかし生物学的効果はこの力価では示されない。つまり生物学的効果を発揮するためには膣上皮細胞のコロニー形成が必要であるが、十分な力価のコロニー化だけでは生物学的効果を示す数値的優位性にはならない。本発明の保存用基質は今までに未確認であったラクトバチルス細胞の生物学的有効性に必要な力価を維持する能力についてインビトロでは長期間、インビボでは膣上皮細胞へ伝達から示している。
【0088】
本発明の別の実施形態は、本明細書に前述した保存用基質を生成する方法についてである。この方法には(i)水溶性ゴム、カルボキシメチルセルロース又はゼラチン等から構成される生理活性を有する滅菌結合剤、(ii)スキムミルク又はアルブミン等の滅菌タンパク質様物質、(iii)キシリトール、アドニトール、グリセロール、ズルシトール、イノシトール、マニトール、ソルビトール又はアラビトール等の滅菌多価アルコール、(iv)滅菌抗酸化剤、(v)デキストロース、ラクトース、マルトース、スクロース、フルクトースおよび/又は他の単糖類、二糖類および多糖類から構成される滅菌炭水化物、(vi)水などの(a)構成物質を提供し(b)該構成物質を共に混合し溶液を作る手順からなる。生理活性を有する結合剤は液体で提供され、室温では固体である傾向が強いので一般的には37℃まで加熱を必要とする。保存用基質の様々な構成物質と各々の好ましい量については詳細を前述した。保存用基質の構成物質は任意の適切な滅菌法で滅菌してよい。好ましい実施形態では、生理活性を有する結合剤およびタンパク質様物質はオートクレーブで滅菌し、多価アルコール、炭水化物および抗酸化剤は濾過法で滅菌している。構成物質を混合後、保存用基質溶液が生成され、該溶液は直ちに使用することが可能であり、また短期間は37℃で、冷凍では約−20℃で保存することが可能である。
【0089】
さらに好ましい実施形態では本発明の膣薬には不活性担体が含まれる。本発明によると不活性担体は任意の不活性物質であり、インビボでの使用に適し、本発明の細胞懸濁基質(例、微生物細胞の添加された保存用基質)を担持又は支持することが可能であり、その形態で当該細胞懸濁液基質をインビトロで保存および/又はインビボで投与することができる。
【0090】
不活性担体にはマルトデキストリンビーズ、ゼラチンカプセルがあるがこれに限らない。この担体については詳細を後述する。
本発明の膣薬についての1実施形態では、(a)十分に純粋なラクトバチルス・クリスパトゥス菌株CTV−05分離培養微生物(b)ゼラチン約14%、アスコルビン酸ナトリウム約0.5%、デキストロース約2.5%、スキムミルク約1.5%及びキシリトール約6%からなる保存用基質を有する膣薬についてである。保存用基質は最低約12ヶ月間、最低106個の生存細胞数を遺伝子学的安定にインビトロで維持可能である。さらに保存用基質はラクトバチルス・クリスパトゥス菌株CTV−05の好ましい性質を維持する。例えばこの性質には、代謝不活性状態で膣上皮細胞に接着する、有効な培養条件で約0.5ppm以上の過酸化水素を生成する、膣上皮細胞(VEC)接着率が最低約50%以上である等の機能がある。これらの性質の詳細は既に上述した。
【0091】
本発明の膣薬についての別の実施形態において、十分に純粋な最低2種類の異なる分離ラクトバチルス属菌株の培養細菌からなり(i)膣上皮細胞(VEC)接着率が最低約50%以上である、(ii)有効な培養条件で約0.5ppm以上の過酸化水素を生成する等の有効な特徴を持つ。当該膣薬には培養細菌を含有し保存する保存用基質が含まれる。この保存用基質には生理活性を有する結合剤、抗酸化剤、多価アルコール、炭水化物、タンパク質様物質が含まれる。該基質は遺伝子学的安定な約106個の生存細胞を最低12ヶ月間インビトロで維持することが可能である。1実施形態において、膣薬には不活性担体も含むことができる。
【0092】
本発明の1実施形態では、ラクトバチルス菌株をある特定の膣感染症の予防および/又は治療する能力によって各々選択し、薬に含まれる他のラクトバチルス菌株が予防および/又は治療するものによって異なる。感染症には、細菌性膣炎、症候性酵母膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染症、尿路感染症、骨盤炎症性疾患等があるがこれに限らない。例えば好ましい実施形態の膣薬は、まず細菌性膣炎の予防に有効な第1のラクトバチルス菌株を有しそして症候性酵母膣炎の予防に有効な第2のラクトバチルス菌株を有している。また別の好ましい実施形態では、第1のラクトバチルス菌株はラクトバチルス・クリスパトゥスCTV−05菌株で、第2はラクトバチルス・イエンセン菌株である。
【0093】
本発明の別の実施形態は、ラクトバチルス属の分離細菌株に関するものである。この菌株は(a)膣上皮細胞(VEC)接着率が最低約50%である(b)約0.5ppm以上の過酸化水素を生成する能力がある等の有利な特徴を有する。また別の実施形態では、分離菌株のVEC接着率は好ましくは約65%以上、さらに好ましくは約80%以上、最も好ましくは約95%以上である。また別の実施形態では、好ましくは約10ppm以上、さらに好ましくは、約20ppm以上該菌株は過酸化水素を生成する。
【0094】
本発明のラクトバチルス属の分離細菌株は1つ以上の他の好ましい特徴を持つことがある。そのような特徴については本明細書で前述した。具体的にある実施形態では、ラクトバチルス属分離細菌株は最低約1ヶ月間膣上皮細胞コロニーを維持することが可能である。さらに他の実施形態ではラクトバチルス属分離細菌株は、最低約24ヶ月間膣上皮細胞コロニーで遺伝子学的安定性を維持している。また別の実施形態ではこの菌株はそれらが代謝不活性状態(例、保存状態)の時でも膣上皮細胞へ接着する。さらにこの菌株の好ましい特徴として、好適生育条件下で菌株が最低約0.75mg/100mlの乳酸を生成することである。また別の実施形態ではこの菌株は幅約1〜2ミクロン、長さ約2〜4ミクロンの大きさである。
【0095】
さらに好ましい実施形態ではこの分離菌株はヒトの膣から分離されている。別の実施形態では、菌株はラクトバチルス・クリスパトゥスCTV−05菌株又はラクトバチルス・イエンセン菌株である。特に好ましい特徴はラクトバチルス・クリスパトゥスCTV−05菌株の有する特徴で、この菌株が最適な菌株である。
【0096】
本発明の別の実施形態では、ラクトバチルス・クリスパトゥスCTV−05菌株のほとんど全ての好ましい特徴を有するラクトバチルス細菌株についてである。該菌株は女性の膣感染症の予防に特に有用である。
【0097】
本発明の1実施形態は、微生物細胞を保存用基質に保存し、膣薬を生成する方法についてである。この方法は(a)最低約106個の微生物細胞数の培地を、生理活性を有する結合剤、抗酸化剤、多価アルコール、炭水化物及びタンパク質様物質からなる保存用基質に懸濁し細胞基質懸濁液を作成し(b)細胞基質懸濁液を不活性担体へ担持させ伝達組成物を形成し、伝達組成物から水を除去する手順からなる。
【0098】
この実施形態のさらなる様態では伝達組成物を梱包し、輸送及び貯蔵中の水分や酸素から保護することが可能である。この梱包材はマイラー膜又は金属膜等の任意の適切な材質の袋でよい。1実施形態において、伝達組成物を個々に梱包することができる。他の実施形態では複数の孔を有する梱包材に用量別などで並べて梱包することができる。
【0099】
微生物細胞を保存する従来の方法では通常空気乾燥法、噴霧乾燥法又は凍結乾燥法を適用している。空気乾燥法では乾燥に長時間が必要であり場合によっては温度上昇を伴う。噴霧乾燥法では、細胞を熱い空気、乱流および過剰な酸素へ曝露しなければならない。凍結乾燥法では、細胞は激しい温度変化に曝され氷晶を形成する固有のリスクがある。本発明の保存用基質の長所は、これを使用することによって従来の様々な乾燥方法を適用しても細胞への損害を最小にし、細胞から水を除去することが可能であることである。さらなる長所として、本発明では細胞の採取、調剤および保管を通じて膣薬を生成する方法として細胞への負荷が最も低いプロセス手順を適用しており、最終製品の有効期間を最長し、上述した好ましい特徴を有する座薬型ラクトバチルス菌株の生存細胞を最大限に伝達することが可能となる。ここで避けるべき細胞への負荷とは過剰なプロセス手順数、温度変動、真空の適用、水分への曝露及び長いプロセス期間などがある。さらに本プロセスでは汚染微生物の混入を防ぐ。この問題は現存の商用プロセスではラクトバチルス菌株の調製において共通の問題となっていた。保存用基質を使用した微生物細胞の保存方法の特に好ましい方法の詳細を以下に述べる。
【0100】
全ての微生物の保存には乾燥又は水分除去プロセスが必要となる。微生物には遊離および結合した状態共に水分が存在する。微生物の保存には十分な量の水分の除去が必要であるが、結合水を過剰に除去すると問題が生じる。その他の保存プロセスでの問題要因には細胞水分の除去に関わる時間量及びプロセス温度がある。一般的に水分は管理温度に注意を払い迅速に除去するのが好ましい。これは特に高温処理を行う場合にあてはまる。
【0101】
本発明は(1)微生物細胞を培地から採取後、直ちに保存用基質に添加可能な方法であり、細胞が(2)保存プロセス過程で40℃以上(3)氷晶(4)高低極端な温度変動(5)真空及び圧縮状態(6)汚染微生物を含む可能性のある空気に曝されず(7)保存期間が短く最適には4時間以下となるように設計された最適な微生物の保存方法を提供する。該保存法の目標は最終薬製品が膣内で直接再水和されることである。
【0102】
1実施形態において、保存用基質内で微生物細胞を保存する方法には、細胞基質懸濁液を好ましくはマルトデキストリンビーズの不活性担体へ被覆する方法が含まれる。次に好ましくは流動床乾燥法で被覆したビーズを乾燥させる。流動床乾燥法はこの分野の技術では良く知られる乾燥方法である。例えばマルトデキストリンビーズを流動床乾燥装置へ設置し33℃で乾燥する。空気圧力は96540Pa(14psi)へ設定し、細胞懸濁基質をビーズへ噴霧させ温度を38℃へ上昇させる。次に被覆したビーズをさらに時間をかけて乾燥させる。被覆マルトデキストリンビーズは粉末で貯蔵可能でありゼラチンカプセルへ封入するか圧縮して錠剤にできる。
【0103】
本発明の別の実施形態では、生存ラクトバチルス細胞を外側から膣内部へ伝達する簡便な座薬形態として硬ゼラチンカプセルを適用している。ゼラチンカプセルは市販されており、この分野では良く知られる技術である。本実施形態の上記保存方法にはさらに細胞懸濁基質をカプセルに調剤し、細胞懸濁液が非液状基質となるまでゼラチンカプセルを冷蔵し、ゼラチンカプセルの内壁にゲルを加え、乾燥室内でゼラチンカプセルを乾燥させる手順がある。調剤手順は手作業、半自動および自動方式を含むこの技術で知られる任意の方法で実施してよい。冷却手順は約4〜6℃で行う。ゼラチンカプセルの乾燥手順には、(i)乾燥室へ25%より低い水分量の乾燥空気を温度約24〜32℃で提供し、(ii)乾燥室から湿った空気を除去する手順が含まれる。
【0104】
本実施形態では乾燥プロセスは約1〜6時間進行させることが可能である。乾燥室には圧縮器、最低1個の炭化水素清浄フィルター、乾燥シリカゲル(又は他の適切な乾燥剤)カラム設置/未設置の冷却空気圧縮器を並べて設置可能である。好ましい1実施形態では、乾燥室に侵入する空気(乾燥空気)は約25%以下、より好ましくは約15%以下、最も好ましくは約5%以下からほとんどゼロの水分含有量である。好ましくは、乾燥空気は約24〜32℃の温度範囲である。好ましい空気流量は1分間に2空気交替量である。この方法によって室温の管理された環境で微生物細胞の短期間の保存が可能となる。また微生物細胞を座薬伝達容器へ直接調剤しそこでそのまま保存することが可能となり、微生物細胞の好ましい特徴を維持する能力が増加する。
【0105】
微生物細胞を基質に保存する方法の1つの手順には微生物細胞培養液を保存用基質に懸濁する手順がある。本発明では微生物細胞を培地から採取後直ちに保存用基質へ最適の細胞基質割合で懸濁することが可能である。最適には、採取及び懸濁プロセスはクラス100環境で行われるとよいがこれは必須ではない。
【0106】
本発明のラクトバチルス細胞は、汚染の心配がなく、遺伝子学的に安定で他の好ましい機能的な特徴の損失がなければ、微生物を効果的に培養できる任意の培地で培養することが可能である(本明細書で前述)。場合によっては本発明のラクトバチルス菌株をある一定の同化性有機炭素、同化性窒素及び適切な塩および少量の金属を加えた培地で培養することもできる。
【0107】
本発明のラクトバチルス菌株の好ましい培地はMRS培地である。MRS培地についての詳細は実施形態の章で詳細を述べる。本発明のラクトバチルス菌株を、寒天表面培養培地又は肉汁発酵培地など従来の培地で培養してもよいがこれに限らない。寒天表面培養法および肉汁発酵法は共にこの技術では良く知られた方法である。好ましくはラクトバチルス菌株を嫌気性又は微好気性条件で培養する。
【0108】
培地の温度はラクトバチルス菌株が生育できるのに適切な任意の温度でよい。例えば培地へ接種物を接種する前に培地を約20〜35℃の温度に維持する。より好ましい温度範囲は25〜35℃である。
【0109】
本発明の活発に生育するラクトバチルス菌株を培地へ接種させ、適切な生育期間を経て十分な細胞密度と量を達成し、保存用基質へ移管する。一般的な接種細胞密度は約106〜109CFUs/mlの範囲内であるが、細胞の乾燥重量に基づき好ましくは108〜109CFUs/mlである。次に細胞を培養し、細胞密度範囲を約107〜109CFUs/ml、さらに好ましくは約108CFUs/mlとする。この段階で細胞を採取し保存用基質で保存する。
【0110】
所定の細胞密度に達した後、本発明の実施形態の第一段階では好ましくは遠心分離法で微生物細胞を採取する。微生物細胞数約107個以上、より好ましくは約108個以上、最も好ましくは約109個以上の細胞を保存用基質で懸濁する。細胞を基質へ添加する前に食塩緩衝液中で細胞を洗浄してもよい。保存用基質および微生物細胞の混合物を本明細書では細胞懸濁基質としている。細胞懸濁基質は次の基質を不活性担体へ添加する手順の間、連続混合し一般的には約30〜40℃で保管する。ここで理解すべきことは本明細書で開示する当技術における基本的な培養、採取および懸濁手順の通常の方法では変動が生じやすく、本発明ではそのような変動を考慮していることである。
【0111】
さらに本発明の別の実施形態は女性を膣感染症から防御する方法についてである。この方法には膣薬を女性に投与する手順が含まれ、(i)VEC接着率が最低50%以上(ii)約0.5ppm以上の過酸化水素を生成できるなどの(a)有利な特徴を有する分離ラクトバチルス属菌株の十分に純粋な細菌を最低約106個培養する。薬には(b)生物学的に活性な結合剤、抗酸化剤、多価アルコール、炭水化物およびタンパク質様物質を有する保存用基質が含まれる。さらに別の実施形態では、膣薬には本明細書に前述したように不活性担体が含まれることもある。保存用基質は十分に純粋で遺伝子学的安定な最低約106個の生存細胞を最低約12ヶ月間インビトロで維持する。
【0112】
上記の実施形態については本明細書で詳細を前述した。本発明の膣薬は細菌性膣炎、症候性酵母膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染症、尿路感染症、骨盤炎症性疾患等の様々な感染症の予防に適用することが可能であるがこれに限らない。
【0113】
本発明において「女性を膣感染症から守る」とは女性が膣感染症を発現する可能性を低下させることを意味する。本発明の好ましい点は、薬が膣感染症の可能性を最適に低下させ、該膣薬への曝露に関して女性に不快感および/又は機能上の変化を与えないことである。例えば、本明細書において女性を膣感染症から守るとは、本発明の膣薬の能力を意味すると考えることが可能であり、薬を女性に投与すると膣感染症の発症又は再発を予防する。
【0114】
本発明の別の実施形態は膣感染症を有する女性に本発明の膣薬を投与し治療する方法についてである。本明細書において膣薬を使用し膣感染症の女性を治療するとは、女性の感染症を治療、又はその症状、徴候および原因を緩和する膣薬の能力を意味する。
【0115】
本発明の利点は、本発明の膣薬を膣感染症の予防又は治療のために女性へ単剤投与すると、最低約106個、より好ましくは最低約107個、最も好ましくは最低約108個の本明細書で前述した有利な特徴を有するラクトバチルスの生存細胞を十分に純粋でかつ遺伝子学的安定な状態で提供できることである。薬の用量および投与回数を含む好ましい薬投与のプロトコールは、当業者には容易に決定できるであろう。1実施形態では、単剤を最低1日に1回約2日間、また別の実施形態では、最低約1日に1回約3日間、さらに別の実施形態では最低約1日に2回約3日間投与している。必要であれば、例えば毎月単位でこの投与方法を再び行うことが可能である。本発明の膣薬は経口、経膣および経直腸投与が可能であり、微生物を希望する作用局部へ伝達するその他のいかなる投与形態も本明細書では可能である。好ましい投与形態は座薬投与である(例、錠剤又はカプセル型)。
【0116】
本発明の膣薬を膣感染症の他の予防薬又は治療薬と併用投与(例、同時投与、投与前、投与後投与)することが可能である。例えば、該膣薬は抗生物質と併用投与することが可能である。
【0117】
本発明の他の実施形態は、該薬を本明細書の記述に従ってヒトに投与し、ヒト免疫不全ウィルス(HIV)に感染するリスクを低下させる方法についてである。好ましくは、該薬はHIV感染症へのヒトの感染リスクを最低約2倍、さらに好ましくは約4倍、最も好ましくは約6倍低下させる。該薬の投与対象は男性および女性である。該薬は女性には経口、経膣および経直腸で、男性には経口および経直腸で投与することが可能である。好ましい実施形態では該薬の単剤を毎日2日間投与する。
【0118】
さらに本発明の他の実施形態は、本明細書の記述に従ってヒトに投与し症候性酵母膣炎を予防する方法についてである。好ましい実施形態では、薬にはラクトバチルス クリパトゥスCTV−05菌株が含まれる。
【0119】
さらに本発明の他の実施形態は、早産の予防方法についてである。本明細書で前述のように細菌性膣炎は妊娠期に最も多い陰部感染症の1つである。細菌性膣炎を羅患しなかった女性に比べて、妊娠期の第2トリメスター期間に細菌性膣炎と診断された女性のうち約40%は早産、出生時低体重を起こしやすい。本発明に従った早産の予防方法には(a)抗生物質および(b)本発明の薬を本明細書の記述にしたがって妊娠女性へ投与する手順からなる。好ましい投与方法ついては膣感染症予防のための薬投与についての箇所で上述した。本発明において抗生物質とは該膣薬と併用投与できる好ましい膣感染症の治療に有用な任意の抗生物質である。対象となる抗生物質はこの技術分野では良くしられている。
【0120】
本発明の別の実施形態には膣および直腸内でのエストロゲンの代謝を助ける方法が含まれている。高エストロゲニズムは女性の疾患であるが本発明の薬を使用して治療することが可能である。本発明のラクトバチルス菌株は膣および腸内のエストロゲンの正しい代謝を助ける。この方法には本明細書に示すように女性に本発明の薬を投与する手順が含まれる。この場合も該薬を経口、経膣および経直腸投与することが可能である。薬の用量の幅は本明細書に示す膣感染症の治療の場合とほとんど同じである。
【0121】
上述のとおり本発明の薬は主に膣感染症を治療するものであったが、本発明の薬は感染症および膣の治療に使用を限定するものではない。例えば本発明の薬を胃腸障害やその感染症に適用することも可能である。この場合には該薬を胃腸薬と呼ぶ。本発明の胃腸薬は純粋な分離ラクトバチルス属の純粋な培養微生物からなり(i)膣上皮細胞(VEC)接着率が最低約50%以上である、(ii)約0.5ppm以上の過酸化水素を生成する等の膣薬の有する有効な特徴を全て有する。別の実施形態では、胃腸感染症の治療に有効な初期の菌株のVEC接着率および/又は過酸化水素生成値は膣治療に有効な薬よりも低いが、胃腸薬として有効な品質を保持している。胃腸薬も細菌を含有し保存する保存用基質を有する。この保存用基質にも生物学的に活性な結合剤、抗酸化剤、多価アルコール、炭水化物およびタンパク質様物質が含まれている。該基質は遺伝子学的安定な最低約106個の生存細胞を最低12ヶ月間インビトロで維持することが可能である。胃腸薬にもマルトデキストリンビーズ又はゼラチンカプセルの不活性担体が含まれることがある。胃腸薬は薬内の微生物が局部へ到達し胃腸管の細胞に接着することのできる任意の経路で投与可能である。
【0122】
この投与形態には経口および経直腸投与があるがこれには限らない。
以下に例を詳細の説明のために示すが、本発明の範囲をこれに限定するものではない。
【実施例1】
【0123】
本発明に用いるのに適したラクトバチルス属の株を選定する方法を以下の実施例を用いて具体的に説明する。
性病歴のない6人の健康な女性の膣からおのおの分離した、6株の異なるラクトバチルスを望ましい特性に関して評価を行った。6株のラクトバチルスを純度、膣上皮細胞への接着性、遺伝子プロフィールの安定性、過酸化水素(H2O2)生産性と長期保存における増殖力安定性に関して評価した。適した株は、母株の純粋培養を十分に継続する能力があると判断される程度の純度(すなわち、微生物の汚染がない)、約80%以上の膣上皮細胞接着率、培養細胞の遺伝子プロフィールが母株と一致するかを同定することにより評価される遺伝子プロフィールの安定性、TMB培地で嫌気培養後の明白な青色素の形成による評価で良好な、もしくはEM試験紙で約20ppm以上の過酸化水素(H2O2)生産量、この発明の薬が摂氏4−6度と室温で約12ヶ月以上の間107−108のコロニー形成単位(CFUs)を継続する能力を持つかで評価される良好な増殖力安定性を持つことにより選定された。
【0124】
CTV−05株(ラクトバチルス・クリスパトゥス)は、接着性研究、病原性微生物に対するインビトロ阻害と、種々の条件下での保存状態における望ましい株形質の安定性(すなわち、代謝的に不活性状態での膣上皮細胞への接着能力)に基づき座薬株に最適として選択された。MRS培地上でCTV−05細胞は幅1−2ミクロン、長さ2−4ミクロンの面積に生育する。
【0125】
以下の特異的方法は本発明に適するラクトバチルス株に望ましい形質があるか否かを検討するために採用された。
(1.1)株の純度:座薬株の純度(すなわち、培養株に生物汚染がない)はDNAフィンガープリント法を用いて座薬株を他の株から特異的に識別する事により確認された。DNAフィンガープリント法は繰返し配列ポリメラーゼ連鎖反応(Rep PCR)を用いて行われた。Rep PCR法で座薬株(CTV−05)を内在性ラクトバチルス・クリスパトゥスから識別できるか決定するために、40株のラクトバチルス・クリスパトゥスを妊娠可能年令女性の膣から採取し、CTV−05と比較した。ラクトバチルス・クリスパトゥス種のアイデンティティは対象株ラクトバチルス・クリスパトゥス ATCC33197に対する総染色体DNAの相同性を用いて決定された。すべてのラクトバチルス・クリスパトゥス分離株は4072と1400塩基対に二重バンドが、3500,750,520,350と220塩基対に1重バンドがあり、これらの繰り返しDNA配列がすべてのラクトバチルス・クリスパトゥス株で共通であることを示唆している(データーは示されていない)。座薬株(CTV−05)は2500−1500塩基対領域に4個のバンドがあることにより他から識別される。この部位でのCTV−05のフィンガープリントは2500と1500塩基対での強いバンドと2000と1736塩基対でのやや弱いバンドからなる(データーは示されていない)。
【0126】
(1.2)膣上皮細胞への接着性(VECs):サンプル採取の直後に、膣上皮細胞をMEM組織培養液(pH7.2)に移し、シリンジ中で3回洗浄した後、細菌を通過させるが膣細胞を残す8μのフィルター(ミリポア社)を通過させる。計105個の洗浄膣細胞を109個毎ml(計数チャンバーで計数)のラクトバチルス縣濁液に加え、摂氏37度で2.5時間インキュベーションした。洗浄濾過により非接着ラクトバチルスを除去した後、膣細胞をグラム染色で染色した。上皮細胞に接着したラクトバチルスを、カメラを装備した光学顕微鏡を用いて計数、記録した。1VECあたり接着したラクトバチルス細胞の平均数(平均接着値)と前記のVEC接着百分率の両方を計算する。VEC接着値百分率は1つ以上のラクトバチルス細胞が接着したVECsの同群中のVEC総数に対する百分率と定義され、個々の株が望ましい特質を持っていて選択に値するかを決定するために用いられる。進行中の接着研究は膣上皮細胞の絶え間ない供給を必要とするので、膣上皮細胞は事前に洗浄され、使用時まで、摂氏−70度で保存される。この技術で有効時間1時間の新鮮膣上皮細胞に匹敵する結果が得られた。
【0127】
表1と2に最も一般的なABO血液型を代表する提供者からの凍結VECsを用いた試験管内接着研究の結果を示す。表1に活発に成長しているCTV−05株細胞のVECsへの接着性を証明する試験管内研究の結果を示す。CTV−05株(ロットLB−022)は実施例3で詳述される座薬用フォーマットで保存された。座薬は試験前5.5ヶ月間室温(RT)保存もしくは冷蔵庫温(Ref)で保存された。本研究で用いられたCTV−05株細胞は活発に成長している代謝状態ではないことが重要な点である。むしろCTV−05を含む座薬は菌体を事前に成長させて活性状態にすることなく、マクルヴェイン緩衝液(McIlvaine’s buffer)(pH4.5)に直接入れられる。次にその細胞は直接VECsに加えられる。結果は、(1)50VECsあたりの接着CTV−05の対数平均(X±1標準偏差)、(2)50VECsの総計数中 VEC毎に接着したCTV−05の実際の範囲、(3)VEC接着値百分率(%VEC ADH)として示される。以下は表1中の用語の説明である:1X±1STD=50VECあたりの接着LABの対数平均、±1標準偏差;2範囲=50VECsの総計数中のVECあたりに接着したLABの実際の範囲;3%VEC ADH=冷蔵庫温(Ref.)と/または室温(RT)で5.5ヶ月間保存されたCTV−05株のLAB、ロットLB−022,の接着がみられる50VECsの百分率;*授乳中の母親。
【0128】
【表1】

8人の提供者からのVECに対する室温で保存されたCTV−05株細胞の平均接着値は1VECあたり21.9細胞であった。冷蔵庫温で保存されたCTV−05株細胞の8人の提供者からのVECに対する平均接着値は1VECあたり24.3細胞であった。別々の提供者からのVECに対する接着値の範囲は非常に広い(すなわち、1VECあたり接着したCTV−05の範囲が0から200細胞以上)。しかし、座薬株の細胞が1つ以上接着したVECsの百分率(VEC接着値)はおのおの室温保存CTV−05では97%であり、冷蔵庫温で保存されたCTV−05では97.75%であった。
【0129】
これらの結果は、CTV−05株の細胞はインビトロで座薬から放出された後、代謝的には不活性状態であっても速やかにVECsに接着できるので、インビボでヒトVECにより定着しやすいことを示唆している。保存された細胞が一旦VECsに接着すると、膣環境から流し出される代わりに再生して増殖する事(すなわち定着)が予想される。
【0130】
表2は肉汁もしくは寒天培養から得られる不活性CTV−05をマクルヴェイン緩衝液(McIlvaine’s buffer)(pH4.5)中でVECsに直接加える研究の結果を示す。従って緩衝液は、提供者から得られたあらかじめ凍結されたVECsに直接加えられる。活発に成長しているCTV−05もまた事前凍結VECsに加えられた。表2のパラメーターは前記の表1のものと同じである。表2に示されている結果は不活性CTV−05(すなわち、保存状態より得られたもの)が、代謝的に活性な状態でVECsに加えられたCTV−05と同等かよりよく接着することを証明している。
【0131】
【表2】

(1.3)遺伝子プロフィールの安定性:制限酵素パターンに基づいた遺伝標識プロフィールが保存後の遺伝子プロフィールの安定性を確立し、インビボ人体試験中に座薬株が定着するのを確認し、市販製剤の株同定の手段として供する目的で適切な回数行われた。ラクトバチルスをブドウ糖、でんぷん、1%血清を補足したハート−インフュージョン−ブイヨン中で、中期対数期まで成長させる。50mM EDTAを含む10mmトリス緩衝液、ミュタノリジン マイルス ラボラトリーズ(Mutanolysin Miles Laboratories)社、イリノイ州ネーパヴィル所在(Naperville,IL)とリゾチーム、すなわち乳酸菌(ラクトバチルス・アヒドフィルス)に効果的と証明されているリジン溶液を用いて、DNAを抽出する。3種の制限酵素HindIII, BamHI,EcoRl(ベセスダ リサーチ ラボラトリーズ社(Bethesda Research Laboratories,Inc.)、メリーランド州、ガイザースバーグ所在(Gaithersburg,MD)が、各分離株にそれぞれ使用された。DNA断片を0.7%アガロースゲル(シーケム エムイー;エフエムエス社(Seakem−ME;FMS Corp.)、マリン コロイド部(Marine Colloids Division)、メーン州、ロックランド所在(Rockland,ME)中、25ボルトで15時間トリス硼酸緩衝液(pH8.3)を使って電気泳動した。ゲルを1μg/mlの臭化エチジウムで30分間染色した。DNA断片を短波長紫外線で可視化し撮影した。DNA電気泳動図間の制限酵素相似性度は以下の式で計算した:相似性度=100%−(NdX100)/Ns、ここでNsは比較する2つのDNA電気泳動図のバンドの総和であり、Ndは一つの電気泳動図のみに見られるバンドの数を表す。座薬株を同定するための株特異的マーカーを検知するDNAプローブを開発した。任意の時間で座薬株の存在を確認するためのDNA相同性研究も行った。
【0132】
(1.4)過酸化水素(H2O2)産生:株をテトラメチルベンジデン(Tetramethylbenzidine)培地(TMB)に接種し、嫌気条件下、摂氏37度で2−3日培養した。過酸化水素(H2O2)産生コロニーは大気にふれて青い色素を産生する。イーエム サイエンス社(EM Science)の過酸化水素(H2O2)検知試験紙を代替的に使用した。試験紙の試薬を浸透させた部分をラクトバチルスコロニーに接触させ、生じた青色の強さで過酸化水素(H2O2)濃度を定量した。
【0133】
(1.5)増殖安定性:評価された各株のサンプルを室温保存と冷蔵庫保存の有効期間研究用に保存する。選択された間隔で、MRS寒天を用いたプレート カウント法(Plate Count Method)で、サンプルのコロニー形成ユニット数を調べる。CTV−05株はゼラチン座薬カプセル中で摂氏55度、45度、35度、室温と冷蔵庫温で保存試験された。この研究は促進保存有効期間のモデルとして、市販製剤が地球規模の流通網で出荷された場合起こる可能性のある不利な条件下での安定性を証明するために行われた。図1は高温試験の結果を示し、図2は低温下での長期保存の結果である。冷蔵庫保存製品でのコロニー数は望ましい形質の損失がなく5ヶ月間安定で座薬あたり108個を保った。室温保存でのコロニー数は4週間安定で座薬あたり108個を保った。4−9週の間に座薬あたり9.8X107個に落ち、25ヶ月107個を保った。この期間過酸化水素(H2O2)産生も安定であった。微生物生存率に対する保存用基質の効果をpH4.0−7.0の範囲で評価した(データは示されていない)。これらのpH範囲はふつうの女性に見られるpH範囲(pH4.0−4.5)、細菌性膣炎の女性のpH範囲(pH5.0−6.0)と、月経中の女性のpH(pH7.0)を表す。微生物の生存はこのpH範囲で良好であり、pH7.0が最適である。
【実施例2】
【0134】
保存CTV−05株細胞の増殖カウントを高めるのに最適な細胞対保存用基質比の決定法を以下の実施例で示す。この実験では単位培地容積あたり異なる量のCTV−05株細胞を加えることにより、縣濁培地の保存能力を決定した。ラクトバチルスをMRS寒天プレート上で2平方インチに嫌気的に育成した。2平方インチの寒天は10mlの肉汁に相当する。予想されたプレートあたりの収量は2X109CFUsであった。接種された基質は30マイクロリットルに分割保存された。表3は48時間のCTV−05株細胞では8プレート/5ml基質比で最も良い結果が得られることを示している。データーは更に、最適の細胞対保存用基質比が保存CTV−05株細胞の増殖カウントを高めることを証明している。
【0135】
【表3】

【実施例3】
【0136】
本発明の膣薬を調製する詳細な方法を以下の実施例で説明する。
ここで説明されるすべての実験で使用されるMRS培地の組成は以下の通りである:バクト プロテオース ペプトン(Bacto Proteose Peptone)3番10g,バクト ビーフ エクストラクト(Bacto Beef Extract)10g、バクト イースト エクストラクト(Bacto Yeast Extract)5g、バクト デキストロース エクストラクト(Bacto Dextrose Extract)20g、トゥイーン80(Tween80)1g、クエン酸アンモニウム2g、酢酸ナトリウム5g、硫酸マグネシウム0.1g、硫酸マンガン0.05g、燐酸2カリウム2gを含む培地を試薬級の水(H2O)で1000mlとする。この混合物に10gの寒天を加えMRS寒天を調製する。培地は摂氏25度でpH6.5±0.2に調整する。
【0137】
保存用基質は以下のように調製する。2Xゼラチン(すなわち、試薬水500mlあたり137.5g)と4Xスキムミルク(すなわち、試薬水250mlあたり15g)を約摂氏121度で約15分間オートクレーブする。4Xキシリットール(すなわち、試薬水250mlあたり59g)と4Xデキストロース(すなわち、試薬水250mlあたり25g)を混合し、pH7.2−7.4に調整し、0.22ミクロン濾紙で滅菌濾過する。滅菌成分を混合して(ゼラチンベースの)単一溶液にして摂氏2−8度で保存する。5重量%アスコルビン酸溶液を調製し、0.22ミクロン濾紙で滅菌濾過し、製造のために適切な容積に分配した後、摂氏マイナス20度で保存する。膣薬調製時に、ゼラチンベースを溶かし、約摂氏35度になるまで練る。そして5%アスコルビン酸をゼラチンベースに1:10の比で加えて、保存用基質を調製する。
【0138】
膣薬を製造するために、MRS培地に約106から109CFUs/mlラクトバチルス株培養物を接種する。接種物を嫌気的もしくは微好気的に摂氏20−35度で培養物が107から109CFUs/mlの細胞濃度に達するまで培養する。
【0139】
細胞を1400−1600rpmで5分間遠心分離して集める。上清はデカンテーションで廃液入れに捨てるか、他の副生成物を得るために回収することもできる。細胞ペレットは燐酸緩衝食塩水(PBS)で再縣濁し再度1400−1600rpmで5分間遠心分離する。この洗浄過程での上清は捨てる。沈殿細胞は次に燐酸緩衝液1部と保存用基質10部とで再縣濁する。細胞基質縣濁液を穏やかに摂氏35±5度に保ちながら混合し続ける。
【0140】
完成品の膣薬を調製するには、滅菌部品からなる流動床乾燥機を組む。マルトデキストリンビーズを流動床乾燥機に配置し、十分乾燥するまで摂氏33度で乾燥する。次に空気圧を14psiに設定し細胞縣濁基質を蠕動ポンプでビーズにスプレーする。50%の細胞基質縣濁液をマルトデキストリンビーズにスプレーした後、加熱温度を摂氏38度に上げる。すべての細胞基質縣濁液をビーズにスプレーした後、コーティングされたビーズは更に約15−30分間摂氏38度で乾燥させることができる。コーティングされたビーズは凍結、粉末状で保存、ゼラチンカプセルに入れる、もしくは膣薬として使用するために圧縮して錠剤にすることもできる。
【実施例4】
【0141】
Rep PCRが異なるロットのラクトバチルス・クリスパトゥス座薬を評価するのに有効であることを以下の実施例で説明する。
2年間にわたって調製されたラクトバチルス・クリスパトゥスCTV−05の異なる6個のロットを純度と遺伝子フィンガープリントの安定性に関して評価した。すべてのロットは嫌気的に栄養強化細断肉肉汁中で培養された時点で汚染されていないと評価された。更に、小規模に調製されたラクトバチルス・クリスパトゥスの種々のロットと規模が大きくなったロットは同一フィンガープリントを持つ(データーは示されていない)。これらのデーターはラクトバチルス・クリスパトゥスCTV−05座薬が数年にわたる貯蔵に対しても増殖力、純度と遺伝的安定性を保っていることを示唆している。更に、座薬株のDNA「フィンガープリント」にロットごとの変化がなかった(データーは示されていない。)
【実施例5】
【0142】
本発明のラクトバチルスがインビボで健康な女性の膣にラクトバチルスを再定着するための座薬中で使用できることを以下の実施例で証明する。
この公開研究では、9人の女性がおよそ109個の成育可能で、過酸化水素(H2O2)産生ラクトバチルス・クリスパトゥスCTV−05株を含有するラクトバチルス座薬を1日2回3日間使用した。9人の女性は全員登録時に性器感染症に罹患していず、9人のうち8人には登録時に内在性ラクトバチルスが存在した。最後の座薬カプセルを使用した2−3日後の追跡ではすべての女性に座薬株が定着していた。9人のうち8人には1ヶ月目も定着していた。顕微鏡的にも炎症は見られず(すなわち、膣スミアで採取した白血球細胞の評価)、副作用の訴えもなかった。
【0143】
多くの女性の膣や直腸にはラクトバチルス 定着しているので、繰り返し配列ポリメラーゼ連鎖反応(Rep PCR)技術をラクトバチルス・クリスパトゥスの座薬株の「フィンガープリント」を採取しそしてそれによりラクトバチルスの座薬株を内在性株から識別するために用いる。最初の臨床予備研究から得られたフィンガープリント採集の結果でラクトバチルス・クリスパトゥスCTV−05座薬株の遺伝子フィンガープリントは数ヶ月にわたる膣定着の間保存されることが証明された。
【0144】
患者102号には登録時に非ラクトバチルス・クリスパトゥスが定着していた。座薬使用1週間後の受診時彼女には3種類のラクトバチルス株が定着していた。その中には(1)座薬株のラクトバチルス・クリスパトゥスCTV−05;(2)登録時に定着していたものと同じ株;(3)CTV−05でもなく登録時に存在していた株でもないラクトバチルスの新株が含まれる(データーは示されていない)。1ヶ月後の受診でも、ラクトバチルス・クリスパトゥスCTV−05が、定着していた。最初の追跡調査で存在していた株も、登録時から存在していた株も同じように定着していた(データーは示されていない)。その被験者は登録から1年後にも評価され、座薬株、ラクトバチルス・クリスパトゥスCTV−05、のみが排他的に定着していることがわかった。これらの研究結果により、本発明者のラクトバチルス・クリスパトゥスCTV−05の座薬株を「フィンガープリント」する能力が証明され、そしてこの遺伝子フィンガープリントが数ヶ月にわたる膣定着の間インビボで保存されることが証明された。
【0145】
患者103号は登録時ラクトバチルスが定着していたが、ラクトバチルス・クリスパトゥスは定着していなかった。CTV−05座薬を1日2回3日間使用した1週間後、もう1種類のラクトバチルスと同様に、CTV−05も定着していた(データーは示されていない)。4週間後この女性にはまだCTV−05と彼女が最初の追跡受診時に保有していたラクトバチルス株がともに定着していた(データーは示されていない)。
【実施例6】
【0146】
以下の実施例は 本発明のラクトバチルスが再発性膣炎を持つ女性の膣への再定着用座薬中にインビボで使用可能であることを証明するインビボ研究である。
本研究では再発性細菌性膣炎(BV)がある女性群2%クリンダマイシン(Clindamycin)クリームで1日1回、3日間治療し、引き続いてラクトバチルス・クリスパトゥスCTV−05株を含有するラクトバチルス座薬で1日2回3日間治療した。対照として同じ医院にかかっている再発性細菌性膣炎がある女性群を2%クリンダマイシンクリームのみで治療した。治療の終了後1週間目と、登録後1ヶ月と3−4ヶ月目に追跡調査した。患者は過酸化水素(H2O2)産生ラクトバチルスが膣に存在することと、細菌性膣炎感染がないという点で評価された。
【0147】
本研究の結果を表4に示す。表4により、再発性細菌性膣炎を持っていた女性のうちでクリンダマイシンクリームとラクトバチルス・クリスパトゥス(Lactobacillus crispatus)CTV−05座薬の両方を用いて治療した群には、クリンダマイシンクリームのみで治療された群と比較して、治療後の評価の各段階で著しく高い率で過酸化水素(H2O2)産生ラクトバチルスが定着していた。
【0148】
【表4】

座薬の特徴がパーオキサイド産生ラクトバチルスの存在に帰するのかを確認するため、これらのラクトバチルスから得られたDNAを座薬株から得られた精製DNAと非常に厳しい条件下でハイブリッドした。更に、各分離株は4−メチルウンベリフェリル(4−methylumbelliferyl)基質を用いて検知された既成酵素を基にフィンガープリントされた。クリンダマイシン治療のみを受けていた女性群では、座薬と同じラクトバチルス株を獲得したものはなかった。対照的に、クリンダマイシンに加えてラクトバチルス座薬で治療を受けた女性で、治療後ラクトバチルス株が定着していたものは全員座薬株を持っていた。表5より、クリンダマイシンのみで治療されていた女性で細菌性膣炎がなかったのは53%のみであったのに比較して、クリンダマイシンに加えてラクトバチルス・クリスパトゥスCTV−05座薬で治療されていた女性の100%が治療後1ヶ月目には細菌性膣炎がなかったことがわかる。同様に治療後3ヶ月には、クリンダマイシン治療のみの女性で細菌性膣炎がなかったのは26%であったのに対して、クリンダマイシンに加えてラクトバチルス・クリスパトゥスCTV−05座薬で治療されていた女性の54%に細菌性膣炎がなかった。このデーターは本発明のラクトバチルス・クリスパトゥスCTV−05座薬が細菌性膣炎の再発を減らす可能性があることを示唆している。
【0149】
【表5】

【実施例7】
【0150】
以下の実施例は、細菌性膣炎がある女性の膣への再定着用座薬中に本発明のラクトバチルスのインビボ使用が可能なことを証明するインビボ研究である。
本研究では、細菌性膣炎のある13人の女性がラクトバチルス・クリスパトゥスCTV−05座薬で1日2回7日間治療を受けた。本研究の目的はラクトバチルス座薬が、細菌性膣炎の治療に使えるか否かを評価することである。一週間後の追跡診療では、受診に現れた10人のうち1人だけが細菌性膣炎が治癒していた。しかしながら、ベースラインと追跡調査で行ったラクトバチルス培養では、細菌性膣炎がある10人の女性のうち7人に座薬株の定着が成功していることが示された(データーは示されていない)。ラクトバチルス・クリスパトゥスCTV−05座薬を使用したことによる副作用があった女性はいなかった。また、肉眼的にも、顕微鏡的にも炎症は見られなかった。
【0151】
実施例5,6,7の研究により本発明のラクトバチルスは膣にラクトバチルスを再定着させるための座薬中に使用可能なことが示された。ラクトバチルス・クリスパトゥスCTV−05座薬を使用した臨床試験には50人を越える女性が参加した。座薬で治療を受けた女性には座薬使用に伴う副作用は全く見られなかった。更にこれらの予備試験データーから好ましい形質を持つラクトバチルス・クリスパトゥスのCTV−05株は、ゼラチンカプセルの形で膣に挿入されると、(1)常在膣細菌がある膣によく定着し、80%を遙かに越える女性に1ヶ月後も定着している;(2)活発な細菌性膣炎のある女性に定着する事が可能;(3)細菌性膣炎治療後の膣に再定着可能;(4)結果として治療後の細菌性膣炎再発を減少する可能性がある(実施例5で細菌性膣炎の再発が治療後1ヶ月では100%減少している)。更に本発明者は人体試験におけるラクトバチルス・クリスパトゥスの座薬株の同定を可能にするフィンガープリント法を開発した。
【実施例8】
【0152】
本発明の保存用基質は、微生物の増殖力を貯蔵中と同様に保存過程でも保持できる点で工業基準のスキムミルク基質よりも優れていることを本実施例で証明する。
凍結乾燥法(フリーズドライ)は微生物の長期保存方法として長年にわたって採用されている。スキムミルクはアメリカン タイプ カルチャー コレクション(American Type Culture Collection)が使用している標準凍結保存用基質の1つであり、乳業では頻繁に使われている。以下の実験で、本発明者は本発明の保存用基質は、数個のパラメーターで定量される工業基準でスキムミルクより性能が優れていることを証明する。
【0153】
嫌気的条件下摂氏35度でインキュベートしてMRS寒天上で24時間生育させたラクトバチルス・クリスパトゥスCTV−05の細胞の縣濁液5mlをMRS肉汁500mlに接種する事により本細胞株を成長させる。嫌気的条件下摂氏35度で48時間接種肉汁をインキュベーションした後、ラクトバチルスを濃縮するため、肉汁を遠心分離する。
【0154】
500mlの肉汁から得られた全細胞は本発明の保存用基質50mlと混合するか、もしくは10%スキムミルク50mlと混ぜ、縣濁液を調製した。次に各縣濁液を2等分した。2分された各縣濁液の一方はシリカゲルを乾燥剤として用いて風乾した(LB107=保存用基質、LB109=スキムミルク)、そして各縣濁液の残部は凍結乾燥した(LB106=保存用基質、LB108=凍結乾燥)。
【0155】
保存前と保存後のコロニー形成ユニット(CFU)の計数は生成物をMRS肉汁中に縣濁かつ/もしくは再水和させた後MRS肉汁で10倍希釈する事により行う。3連続希釈溶液のスプレッドプレートをMRS寒天上に作成し、嫌気的条件下摂氏35度で48時間インキュベーションした。
【0156】
表6に示されるように、微生物が本発明の保存用基質中で保存された場合、どちらの保存過程でも著しい増殖力の低下は見られなかったが、工業基準のスキムミルクで保存した微生物は肉汁保存過程で1対数の増殖力の損失が見られた。
【0157】
【表6】

加速有効期間研究は前記の表に載せてある各ロットの等分した部分を摂氏35度と44.5度で保存することにより行う。6時間毎に前記のようにCUFを定量した。図8から11に結果を示す。実際のCUFsを表7に示す。作図のためにデーターは対数に変換されている。
【0158】
【表7】

図3はロット番号LB−107、細胞と本発明の保存用基質の縣濁液を風乾した場合の結果である。本ロットでは保存過程で増殖力の損失が見られず、摂氏35度で48時間保存した場合も増殖力の損失は見られなかった。しかし、摂氏44.5度で48時間保存した場合、2対数の増殖力の損失が見られた。
【0159】
図4はロット番号LB−109、細胞とスキムミルク縣濁液を風乾した場合の結果である。本ロットは保存過程で1対数の増殖力の損失が見られ、摂氏35度で48時間保存した場合増殖力は2対数以上損失した。摂氏44.5度で保存した場合、24−48時間までにほぼすべての増殖力が失われた。
【0160】
図5はロット番号LB−106、細胞と本発明の保存用基質の縣濁液を凍結乾燥した場合の結果である。本ロットでは保存過程で増殖力の損失が見られず、摂氏35度で18時間保存した場合も増殖力の損失が見られなかったが、摂氏35度で48時間までに1対数の増殖力の損失が見られた。摂氏44.5度で保存した場合、18時間までにほぼすべての増殖力が失われた。
【0161】
図6はロット番号LB−108、細胞とスキムミルク縣濁液を凍結乾燥した場合の結果である。本ロットは保存過程で1対数の増殖力の損失があり、摂氏35度で保存した場合48時間までに4対数以上の増殖力が失われた。摂氏44.5度で保存した場合、24−48時間までに増殖力がすべて失われた。
【0162】
要約すると、本発明の保存用基質を用いて作成したロットは風乾もしくは凍結乾燥のどちらの保存過程中でも工業基準スキムミルクを使ったロットより能力が優れていた。保存中増殖力はどちらの保存用基質ロットでも、スキムミルクのロットより優れていて、本発明の保存用基質が工業基準のスキムミルク基質より優れていることを証明している。
【実施例9】
【0163】
本発明の保存用基質を用いて保存した細胞が冷蔵庫保存、室温保存の条件でともに経時的に安定であることを証明するための促進保存実験とリアルタイム保存実験を以下の実施例を用いて説明する。本実施例は本発明の保存用基質の用途の広さも証明している。
【0164】
図7と表8は、実施例8で説明された細胞/保存用基質縣濁液を流動床乾燥機のマルトデキストリン上で、時間促進保存条件で保存する研究からえられたデーターを示す。これらの研究に対して、製品の安定性は製品放出基準に合うCFU値として定義される。好ましい値は座薬あたり106個から108個である。これらのデーターは本発明の保存用基質は摂氏35度で48時間保存中に増殖力の損失がなかったことを示している。摂氏44.5度で保存された製品は18時間安定であった。18から24時間の間に増殖力は1対数下がったが、42時間はおおよそ同じレベルであった。更に48時間までに増殖力は1対数失われた。本実験は流動乾燥過程によりマルトデキストリンにコーティングされた本発明の細胞/保存用基質縣濁液が摂氏35度と44.5度で保存された場合、実施例8の風乾または凍結乾燥懸濁用基質と比較して、最も安定な製品であることを示している。
【0165】
【表8】

これらのデーターはCTV−05株が本発明の保存用基質中で風乾により保存されるもう一つの促進有効期間試験から得られる促進データーとリアルタイムデーターによく相関する。表9より冷蔵庫保存(摂氏2−8度)では製品のCFU値は25ヶ月間108CFUで安定であった。室温(摂氏25±5度)で保存した生成物のCFU値は2ヶ月で108から107CFUに落ちたが、25ヶ月間107CFUで安定であった。図8は同じ製品の摂氏35,45,55度での促進有効期間試験の結果である。摂氏35度では約2.3日かけて失われた増殖力は1対数以下であった。摂氏45度では約2.3日かけて失われた増殖力は約2対数であった。摂氏55度では0.5日中に製品の増殖力は急速に失われた。これらの時間促進試験とリアルタイム有効期試験の比較から、摂氏35度で48時間安定な製品は、摂氏2−8度もしくは室温で保存した場合、25ヶ月間安定であるという仮定は合理的であることが証明される。
【0166】
【表9】

【実施例10】
【0167】
異なるラクトバチルス株の大きなサンプルから座薬株のラクトバチルスを特異的に同定するための細胞壁脂肪酸分析の使用について以下の実施例で説明する。
この実験では、膣から得られた242のラクトバチルス株を盲検法で評価した。細菌の全細胞壁は常套の手法で抽出する。次に細胞壁脂肪酸のメチルエステルをガスクロマトグラフィー分析する。次にMIDIコンピュータープログラムで既知の座薬株の細胞壁脂肪酸プロフィールに「最もよく合う」細胞脂肪酸のプロフィールを検索する。本コンピュータープログラムには本発明家により作成された膣株の特製ライブラリーがある。
【0168】
分析された242ラクトバチルス株で19ラクトバチルス・クリスパトゥス座薬株のうち19が正しく同定された(すなわち、分析は100%の感度を持つ)(データーは示されていない)。更に、40分離株は座薬―類似と同定された(すなわち、分析には82%の特異度がある)(データーは示されていない)。従って、細胞壁脂肪酸分析は、ラクトバチルス株のサンプル数が多い場合でも、座薬株を同定し、追跡するのに有効で、感度と特異性の高い方法である。
【実施例11】
【0169】
他のラクトバチルス分離株がカンジタ・アルビカン(Candida albicans)の臨床的分離株に対する阻害作用を持たないのに対し、ラクトバチルス・クリストゥスCTV−05が阻害作用を持つことを実施例11で証明する。
【0170】
MRS寒天培地を5mmの傾斜をつけて固める。ラクトバチルス・クリスパトゥスCTV−05をプレートの直径に沿ってすじ状に塗布し嫌気的条件下と大気条件下で24,48,72時間成長させる。対照株のラクトバチルス・イエンセンCTV−01、ラクトバチルス・クリスパトゥスCTV−02,ラクトバチルス・クリスパトゥスCTV−03,ラクトバチルス・クリスパトゥスCTV−04を同じ方法で成長させる。これらのプレートに10mM CNNaS(チオシアネイトナトリウム(sodium thiocyanate)、先に報告された酵母の成長阻害剤)を加えた、もしくは加えないYM寒天をかぶせる。かぶせた寒天にカンジタ・アルビカン ATCC60193(頸部から分離)もしくはカンジタ・アルビカン ATCC14053(ヒト血液から分離)のどちらかの株を接種し、阻害域を測定する。大気条件下で生育したラクトバチルス・クリスパトゥスCTV−05細胞はCNNaS存在時でも非存在時でも阻害作用が弱くどちらのカンジダ株も阻害できなかった。対照的に、嫌気的条件下で24,48,72時間生育したラクトバチルス・クリスパトゥスCTV−05細胞は両方のカンジダ株を効果的に阻害した。CNNaSの培地への添加は阻害の効率を上げなかった。従って、ラクトバチルス・クリスパトゥスCTV−05は酵母の成長をインビトロで阻害する。表10に5株の過酸化水素産生ラクトバチルス臨床分離株の 頸部分離カンジタ・アルビカンス ATCC60193に対する阻害能力試験の結果を示す。本発明のラクトバチルス株の特性を定義しているラクトバチルス・クリスパトゥスCTV−05が酵母生物の成長に対する阻害作用に関して他の分離株より優れていることは結果より明らかである。
【0171】
【表10】

本発明の種々の具体的な例が詳細に説明されている一方で、熟練者によりこれらの具体例が修正され翻案されるのは明らかである。しかしながらそのような修正、翻案は、次の請求項に述べる本発明の範囲内にあることは明白に理解されるべきである。
【特許請求の範囲】
【請求項1】
(a)(i)50%以上の膣上皮細胞(VEC)への接着価と、
(ii)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、
を含む同定のための特徴を有するラクトバチルス属の単離菌株の純粋培養された細菌培養物と、
(b)結合剤、抗酸化剤、多価アルコール、炭水化物、及び、スキムミルクとアルブミンとから構成される群より選択される物質、を含有する保存用基質と
を含有し、
前記基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能な、純粋かつ遺伝的に安定な細胞を保持する基質である膣薬。
【請求項2】
前記菌株が、有効な培養条件下において、10ppm以上のH2O2を生産する能力を有する請求項1に記載の膣薬。
【請求項3】
前記菌株が、1ヶ月以上の間、インビボにおいて膣上皮細胞へコロニーを形成し続ける請求項1に記載の膣薬。
【請求項4】
前記菌株が、代謝が不活性な状態において膣上皮細胞に接着する請求項1に記載の膣薬。
【請求項5】
前記菌株の1つの細胞の幅が1μmから2μm、長さが2μmから4μmである請求項1に記載の膣薬。
【請求項6】
前記菌株は、有効な培養条件下において、0.75mg/100ml以上の乳酸を生産する請求項1に記載の膣薬。
【請求項7】
前記基質が、インビトロにおいて12ヶ月以上の間、107個以上の生存可能な細胞を保持する基質である請求項1に記載の膣薬。
【請求項8】
前記基質が、インビトロにおいて、4℃から6℃の温度で、12ヶ月以上の間、106個以上の生存可能な細胞を保持する基質である請求項1に記載の膣薬。
【請求項9】
前記基質が、インビトロにおいて、室温で、12ヶ月以上の間、106個以上の生存可能な細胞を保持する基質である請求項1に記載の膣薬。
【請求項10】
前記基質のpHが5.0から7.0までである請求項1に記載の膣薬。
【請求項11】
前記菌株はラクトバチルス・クリスパトゥスである請求項1に記載の膣薬。
【請求項12】
前記菌株が、ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)である請求項1に記載の膣薬。
【請求項13】
前記菌株はラクトバチルス・イエンセンである請求項1に記載の膣薬。
【請求項14】
前記薬が不活性担体を更に含有する請求項1に記載の膣薬。
【請求項15】
(a)50%以上の膣上皮細胞(VEC)への接着価と、
(b)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、
を含む同定のための特徴を有するラクトバチルス属の単離細菌株。
【請求項16】
前記菌株が、65%以上のVECへの接着価を有する請求項15に記載の単離細菌株。
【請求項17】
前記菌株が、有効な培養条件下において10ppm以上のH2O2を生産する能力を有する請求項15に記載の単離細菌株。
【請求項18】
前記菌株が、代謝が不活性な状態において膣上皮細胞に接着する請求項15に記載の単離細菌株。
【請求項19】
前記菌株が、1ヶ月以上の間、インビボにおいて膣上皮細胞へコロニーを形成し続ける請求項15に記載の単離細菌株。
【請求項20】
前記菌株が、24ヶ月以上の膣でのコロニー形成の間、インビボにおいて遺伝的に安定である請求項15に記載の単離細菌株。
【請求項21】
前記菌株は、有効な培養条件下において、0.75mg/100ml以上の乳酸を生産する請求項15に記載の単離細菌株。
【請求項22】
前記菌株の1つの細胞の幅が1μmから2μm、長さが2μmから4μmである請求項15に記載の単離細菌株。
【請求項23】
前記菌株はラクトバチルス・クリスパトゥスである請求項15に記載の単離細菌株。
【請求項24】
前記菌株が、ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)である請求項15に記載の単離細菌株。
【請求項25】
前記菌株はラクトバチルス・イエンセンである請求項15に記載の単離細菌株。
【請求項26】
(a)(i)50%以上の膣上皮細胞(VEC)への接着価と、
(ii)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、
を含む同定のための特徴を有する2種類以上のラクトバチルス属の単離菌株の、純粋培養された細菌培養物と、
(b)結合剤、抗酸化剤、多価アルコール、炭水化物、及び、スキムミルクとアルブミンとから構成される群より選択される物質、を含有する保存用基質と
を含有し、
前記基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能な、純粋かつ遺伝的に安定な細胞を保持する基質である膣薬。
【請求項27】
前記薬は、細菌性膣炎、症候性酵母膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染、尿路感染症、及び骨盤内炎症性疾患から成るグループより選択される2つ以上の膣感染症を治療するために使用される請求項26の膣薬。
【請求項28】
前記細菌培養物は、第1の膣の感染症に有効な、ラクトバチルス属の第1の菌株と、第2の膣の感染症の治療に有効な、ラクトバチルス属の第2の菌株とを含む請求項26の膣薬。
【請求項29】
前記第1の菌株はラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)であり、前記第2の菌株はラクトバチルス・イエンセンである請求項28の膣薬。
【請求項30】
ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)からなる細菌菌株。
【請求項31】
(a)単離されたラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)の純粋培養された細菌培養物と、
(b)14%のゼラチン、0.5%のアスコルビン酸ナトリウム、2.5%のデキストロース、1.5%のスキムミルク、及び6%のキシリトールを含む保存用基質と
を含有する膣薬であって、
前記基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能で遺伝的に安定な細胞を保持し、
前記基質は前記ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)の望ましい特徴を保持し、前記特徴は、代謝が不活性な状態において膣上皮細胞に接着する能力と、有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、膣上皮細胞(VEC)への接着価が50%以上であることとから成るグループより選択される、膣薬。
【請求項1】
(a)(i)50%以上の膣上皮細胞(VEC)への接着価と、
(ii)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、
を含む同定のための特徴を有するラクトバチルス属の単離菌株の純粋培養された細菌培養物と、
(b)結合剤、抗酸化剤、多価アルコール、炭水化物、及び、スキムミルクとアルブミンとから構成される群より選択される物質、を含有する保存用基質と
を含有し、
前記基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能な、純粋かつ遺伝的に安定な細胞を保持する基質である膣薬。
【請求項2】
前記菌株が、有効な培養条件下において、10ppm以上のH2O2を生産する能力を有する請求項1に記載の膣薬。
【請求項3】
前記菌株が、1ヶ月以上の間、インビボにおいて膣上皮細胞へコロニーを形成し続ける請求項1に記載の膣薬。
【請求項4】
前記菌株が、代謝が不活性な状態において膣上皮細胞に接着する請求項1に記載の膣薬。
【請求項5】
前記菌株の1つの細胞の幅が1μmから2μm、長さが2μmから4μmである請求項1に記載の膣薬。
【請求項6】
前記菌株は、有効な培養条件下において、0.75mg/100ml以上の乳酸を生産する請求項1に記載の膣薬。
【請求項7】
前記基質が、インビトロにおいて12ヶ月以上の間、107個以上の生存可能な細胞を保持する基質である請求項1に記載の膣薬。
【請求項8】
前記基質が、インビトロにおいて、4℃から6℃の温度で、12ヶ月以上の間、106個以上の生存可能な細胞を保持する基質である請求項1に記載の膣薬。
【請求項9】
前記基質が、インビトロにおいて、室温で、12ヶ月以上の間、106個以上の生存可能な細胞を保持する基質である請求項1に記載の膣薬。
【請求項10】
前記基質のpHが5.0から7.0までである請求項1に記載の膣薬。
【請求項11】
前記菌株はラクトバチルス・クリスパトゥスである請求項1に記載の膣薬。
【請求項12】
前記菌株が、ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)である請求項1に記載の膣薬。
【請求項13】
前記菌株はラクトバチルス・イエンセンである請求項1に記載の膣薬。
【請求項14】
前記薬が不活性担体を更に含有する請求項1に記載の膣薬。
【請求項15】
(a)50%以上の膣上皮細胞(VEC)への接着価と、
(b)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、
を含む同定のための特徴を有するラクトバチルス属の単離細菌株。
【請求項16】
前記菌株が、65%以上のVECへの接着価を有する請求項15に記載の単離細菌株。
【請求項17】
前記菌株が、有効な培養条件下において10ppm以上のH2O2を生産する能力を有する請求項15に記載の単離細菌株。
【請求項18】
前記菌株が、代謝が不活性な状態において膣上皮細胞に接着する請求項15に記載の単離細菌株。
【請求項19】
前記菌株が、1ヶ月以上の間、インビボにおいて膣上皮細胞へコロニーを形成し続ける請求項15に記載の単離細菌株。
【請求項20】
前記菌株が、24ヶ月以上の膣でのコロニー形成の間、インビボにおいて遺伝的に安定である請求項15に記載の単離細菌株。
【請求項21】
前記菌株は、有効な培養条件下において、0.75mg/100ml以上の乳酸を生産する請求項15に記載の単離細菌株。
【請求項22】
前記菌株の1つの細胞の幅が1μmから2μm、長さが2μmから4μmである請求項15に記載の単離細菌株。
【請求項23】
前記菌株はラクトバチルス・クリスパトゥスである請求項15に記載の単離細菌株。
【請求項24】
前記菌株が、ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)である請求項15に記載の単離細菌株。
【請求項25】
前記菌株はラクトバチルス・イエンセンである請求項15に記載の単離細菌株。
【請求項26】
(a)(i)50%以上の膣上皮細胞(VEC)への接着価と、
(ii)有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、
を含む同定のための特徴を有する2種類以上のラクトバチルス属の単離菌株の、純粋培養された細菌培養物と、
(b)結合剤、抗酸化剤、多価アルコール、炭水化物、及び、スキムミルクとアルブミンとから構成される群より選択される物質、を含有する保存用基質と
を含有し、
前記基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能な、純粋かつ遺伝的に安定な細胞を保持する基質である膣薬。
【請求項27】
前記薬は、細菌性膣炎、症候性酵母膣炎、淋病、クラミジア、トリコモナス症、ヒト免疫不全ウィルス感染、尿路感染症、及び骨盤内炎症性疾患から成るグループより選択される2つ以上の膣感染症を治療するために使用される請求項26の膣薬。
【請求項28】
前記細菌培養物は、第1の膣の感染症に有効な、ラクトバチルス属の第1の菌株と、第2の膣の感染症の治療に有効な、ラクトバチルス属の第2の菌株とを含む請求項26の膣薬。
【請求項29】
前記第1の菌株はラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)であり、前記第2の菌株はラクトバチルス・イエンセンである請求項28の膣薬。
【請求項30】
ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)からなる細菌菌株。
【請求項31】
(a)単離されたラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)の純粋培養された細菌培養物と、
(b)14%のゼラチン、0.5%のアスコルビン酸ナトリウム、2.5%のデキストロース、1.5%のスキムミルク、及び6%のキシリトールを含む保存用基質と
を含有する膣薬であって、
前記基質が、インビトロにおいて12ヶ月以上の間、106個以上の生存可能で遺伝的に安定な細胞を保持し、
前記基質は前記ラクトバチルス・クリスパトゥスCTV−05(寄託番号:ATCC202225号)の望ましい特徴を保持し、前記特徴は、代謝が不活性な状態において膣上皮細胞に接着する能力と、有効な培養条件下において0.5ppmよりも多くのH2O2を生産する能力と、膣上皮細胞(VEC)への接着価が50%以上であることとから成るグループより選択される、膣薬。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2010−31031(P2010−31031A)
【公開日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願番号】特願2009−230743(P2009−230743)
【出願日】平成21年10月2日(2009.10.2)
【分割の表示】特願平10−544222の分割
【原出願日】平成10年4月10日(1998.4.10)
【出願人】(509275057)オセル インコーポレイテッド (1)
【氏名又は名称原語表記】OSEL,INC.
【Fターム(参考)】
【公開日】平成22年2月12日(2010.2.12)
【国際特許分類】
【出願日】平成21年10月2日(2009.10.2)
【分割の表示】特願平10−544222の分割
【原出願日】平成10年4月10日(1998.4.10)
【出願人】(509275057)オセル インコーポレイテッド (1)
【氏名又は名称原語表記】OSEL,INC.
【Fターム(参考)】
[ Back to top ]

