膵β細胞株
【課題】インスリン分泌機構の解明に有用な細胞を提供する。また、インスリン分泌抑制剤を提供する
【解決手段】継代培養可能であり、グルコース濃度依存的に緑色蛍光タンパク質標識インスリンを分泌する膵β細胞株を提供する。また、塩化リチウムを含むインスリン分泌抑制剤、グリコーゲン合成酵素キナーゼ(GSK)3β発現抑制剤を含むインスリン分泌抑制剤、及びGSK3β−siRNAを含むインスリン分泌抑制剤を提供する。
【解決手段】継代培養可能であり、グルコース濃度依存的に緑色蛍光タンパク質標識インスリンを分泌する膵β細胞株を提供する。また、塩化リチウムを含むインスリン分泌抑制剤、グリコーゲン合成酵素キナーゼ(GSK)3β発現抑制剤を含むインスリン分泌抑制剤、及びGSK3β−siRNAを含むインスリン分泌抑制剤を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は細胞生物学及び分子生物学に係り、膵β細胞株に関する。
【背景技術】
【0002】
膵臓に存在するランゲルハンス島の膵β細胞は、血糖量を低下させるホルモンであるインスリンを分泌することで知られている。血中グルコース濃度の上昇により、膵β細胞は、急峻であるがインスリンの分泌時間が短い第一相のインスリン分泌と、緩やかにインスリンの分泌を増加させる第二相のインスリン分泌と、の二相性インスリン分泌を示す(例えば、非特許文献1参照。)。
【0003】
第一相のインスリン分泌は、以下の過程を経て生じると考えられている。すなわち、糖輸送体(GLUT2)により膵β細胞に取り込まれたグルコースがミトコンドリアで代謝され、膵β細胞内のアデノシン三リン酸(ATP)の濃度が上昇する。細胞質のATP/ADP比が上昇する結果、膵β細胞の細胞膜上のATP感受性K+チャネル(KATPチャネル)が閉じられ、細胞膜電位の脱分極が引き起こされる。そして、膜電位依存性Ca2+チャネル(Voltage−Dependent Ca2+ Channel:VDCC)が活性化されることで、膜電位依存性Ca2+チャネルからカルシウムが流入して細胞内カルシウム濃度が上昇し、インスリン顆粒の開口放出が誘導される。この一連の過程は、KATPチャネル依存性インスリン分泌と呼ばれる。
【0004】
一方、第二相のインスリン分泌は、KATPチャネルに依存せずに起こるが、その詳細な分子機構については不明である。しかし、第二相のインスリン分泌を起こす分子機構は、インスリン分泌顆粒が細胞膜へ移行する過程、及びインスリン分泌顆粒の開口放出の準備過程等に作用し、インスリン分泌を増強する効果に寄与していると考えられている。
【0005】
ここで、KATPチャネル開口薬であるジアゾオキシドによりKATPチャネルを開口させた状態、あるいはグリベンクラミド等のスルフォニル尿素薬によりKATPチャネルを閉口させた状態、つまり細胞質のATP/ADP比の変動によるKATPチャネルの制御機構を阻害した条件下でも、グルコースはインスリン分泌を促進する。このような条件下で観察されるKATPチャネルに依存しない分子機構が、第二相で見られるインスリン分泌の増強に寄与していると考えられている。
【0006】
また、グルコース刺激を繰り返すと、一度目のグルコース刺激によるインスリン分泌量よりも、二度目のグルコース刺激によるインスリン分泌量の方が多いという現象(time−dependent potentiation:TDP)が、古くから報告されている(例えば、非特許文献2参照。)。この現象も、KATPチャネルに依存しない分子機構によると考えられている。このように、KATPチャネルに依存しない分子機構が、グルコース誘発性インスリン分泌において、重要な役割を担っていると考えられている。
【0007】
次に、グリコーゲン合成酵素キナーゼ3(Glycogen synthase kinase−3:GSK3)は、セリン・スレオニンキナーゼであり、異なる遺伝子にコードされアミノ酸レベルで高い相同性を有するGSK3αとGSK3βのアイソフォームが存在する(例えば、非特許文献3参照。)。GSK−3は、糖質代謝を制御するリン酸化酵素として同定された。しかし、GSK−3のリン酸化基質に細胞骨化タンパク質、転写因子、及び代謝調節因子も含まれることから、GSK−3は、細胞構造、遺伝子発現、細胞分裂、細胞分化、及びアポトーシス等の様々な細胞機能を制御しうることが明らかになっている。
【0008】
ここで、近年、神経細胞特異的にインスリン受容体を欠損させたノックアウトマウスは、食欲制御異常、肥満、2型糖尿病、及び不妊を発症することが明らかになっている(例えば、非特許文献4参照。)。さらに、神経細胞におけるインスリン受容体を介したインスリンシグナル過程を阻害することにより、細胞内のGSK3βの活性が亢進し、タンパク質のリン酸化が過剰に引き起こされ、これがアルツハイマー病の発症の引き金になりうることが示唆されている(例えば、非特許文献5、6参照。)。また、実際のアルツハイマー病患者や糖尿病患者において、GSK3βの活性が亢進していることが知られているが(例えば、非特許文献7、8参照。)、その詳細な病態発症分子機構については不明な点が多い。
【先行技術文献】
【特許文献】
【0009】
【非特許文献1】Aizawa, T., Komatsu, M., Asanuma, N., Sato, Y., and Sharp, G. W. (1998). Glucose action 'beyond ionic events' in the pancreatic beta cell. Trends Pharmacol. Sci. 19, 496-499.
【非特許文献2】Grodsky, G. M., Curry, D., Landahl, H., and Bennett, L. (1969). Further studies on the dynamic aspects of insulin release in vitro with evidence for a two-compartmental storage system. Acta Diabetol. Lat. 6, 554-578
【非特許文献3】Sutherland, C., Leighton, I. A., and Cohen, P. (1993). Inactivation of glycogen synthase kinase-3 beta by phosphorylation: new kinase connections in insulin and growth-factor signaling. Biochem. J. 296, 15-19.
【非特許文献4】Bruning, J. C., Gautam, D., Burks, D. J., Gillette, J., Schubert, M., Orban, P. C., Klein, R., Krone, W., Muller-Wieland, D., and Kahn, C. R. (2000). Role of brain insulin receptor in control of body weight and reproduction. Science. 289, 2122-2125.
【非特許文献5】Pei, J. J., Braak, E., Braak, H., Grundke-Iqbal, I., Iqbal, K., Winblad, B., and Cowburn, R. F. (1999). Distribution of active glycogen synthase kinase 3beta (GSK-3beta) in brains staged for Alzheimer disease neurofibrillary changes. J. Neuropathol. Exp. Neurol. 58, 1010-1019.
【非特許文献6】Schubert, M., Holland, N. D., Escriva, H., Holland, L. Z., and Laudet, V. (2004). Retinoic acid influences anteroposterior positioning of epidermal sensory neurons and their gene expression in a developing chordate (amphioxus). Proc. Natl. Acad. Sci. U.S.A. 101, 10320-10325
【非特許文献7】Steen, E., Terry, B. M., Rivera, E. J., Cannon, J. L., Neely, T. R., Tavares, R., Xu, X. J., Wands, J. R., and de la Monte, S. M. (2005). Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease---is this type 3 diabetes ? J. Alzheimers. Dis. 7, 63-80.
【非特許文献8】Jolivalt, C. G., Lee, C. A., Beiswenger, K. K., Smith, J. L. Orlov, M., Torrance, M. A., and Masliah, E. (2008). Defective insulin signaling pathway and increased glycogen synthase kinase-3 activity in the brain of diabetic mice: Parallels with Alzheimer's disease and correction by insulin. J. Neurosci. Res. 86, 3265-3274.
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、インスリン分泌機構の解明に有用な細胞を提供することを目的の一つとする。また、本発明は、インスリン分泌抑制剤を提供することも目的の一つとする。
【課題を解決するための手段】
【0011】
本発明の態様は、継代培養可能であり、グルコース濃度依存的にGFP標識インスリンを分泌する膵β細胞(MIN6インスリン−GFP細胞)株であることを要旨とする。また、本発明の別の態様は、塩化リチウムを含む、インスリン分泌抑制剤であることを要旨とする。さらに、本発明の別の態様は、GSK3β発現抑制剤を含む、インスリン分泌抑制剤であることを要旨とする。またさらに本発明の別の態様は、GSK3β−siRNA(small interfering RNA)を含む、インスリン分泌抑制剤であることを要旨とする。
【発明の効果】
【0012】
本発明によれば、継代培養可能であり、グルコース濃度依存的に緑色蛍光タンパク質標識インスリンを分泌する膵β細胞株を提供可能である。また、本発明によれば、インスリン分泌抑制剤を提供可能である。
【図面の簡単な説明】
【0013】
【図1】本発明の第1の実施例に係るマウスpEGFP−プレプロインスリン・プラスミドの概念図である。
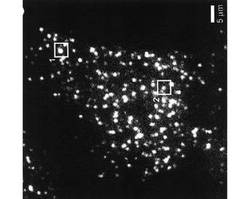
【図2】本発明の第1の実施例に係るMIN6インスリン−GFP細胞の全反射蛍光顕微鏡写真である。
【図3】本発明の第1の実施例に係る図2中の顆粒1,2のグルコース刺激前後の全反射顕蛍光微鏡連続写真である。
【図4】本発明の第1の実施例に係る図2中の顆粒1,2の蛍光強度の時間変化を示すグラフである。なお、グルコース刺激前の蛍光強度を100として正規化している。
【図5】本発明の第2の実施例に係る細胞膜直下のインスリン分泌顆粒分布を示す全反射蛍光顕微鏡写真である。なお、校正棒は10μmを示す。
【図6】本発明の第2の実施例に係る全反射蛍光顕微鏡で測定したインスリン分泌顆粒密度を示すグラフである。
【図7】本発明の第2の実施例に係る細胞膜内のインスリン分泌顆粒分布を示す共焦点蛍光顕微鏡写真である。なお、校正棒は10μmを示す。
【図8】本発明の第2の実施例に係る細胞外に分泌されたインスリン量を示すグラフである。
【図9】本発明の第3の実施例に係るグルコース刺激時のNAD(P)H濃度変化を示すグラフである。
【図10】本発明の第3の実施例に係るグルコース及び高カリウム刺激時の[Ca2+]i濃度変化を示すグラフである。
【図11】本発明の第4の実施例に係る細胞膜直下のインスリン分泌顆粒分布を示す全反射蛍光顕微鏡写真である。なお、校正棒は10μmを示す。
【図12】本発明の第4の実施例に係る全反射蛍光顕微鏡で測定したインスリン分泌顆粒密度を示すグラフである。
【図13】本発明の第4の実施例に係る細胞膜内のインスリン分泌顆粒分布を示す共焦点蛍光顕微鏡写真である。なお、校正棒は10μmを示す。
【図14】本発明の第4の実施例に係る細胞外に分泌されたインスリン量を示すグラフである。
【図15】本発明の第5の実施例に係る微小管構造の共焦点蛍光顕微鏡写真である。なお、校正棒は10μmを示す。
【図16】本発明の第5の実施例に係るCLASP2の細胞内局在を示す蛍光顕微鏡写真である。
【発明を実施するための形態】
【0014】
以下に本発明の実施の形態を説明する。
マウス膵β細胞由来MIN6細胞株は、グルコース及び分泌促進物質に対するインスリン分泌応答を維持している膵β細胞株である(Miyazaki, J., Araki, K., Yamato, E., Ikegami, H., Asano, T., Shibasaki, Y., Oka, Y., and Yamamura, K. (1990). Establishment of a Pancreatic β Cell Line That Retains Glucose-Inducible Insulin Secretion: Special Reference to Expression of Glucose Transporter Isoforms. Endocrinology 127, 126-132.)。本発明者らは、約3ヶ月という従来と比して長期にわたって継代培養可能であり、グルコース濃度依存的に緑色蛍光タンパク質(Green Fluorescent Protein:GFP)を融合したインスリンを発現するMIN6細胞(MIN6インスリン−GFP細胞)を初めて作製した。本発明の実施の形態に係るMIN6インスリン−GFP細胞は、MIN6細胞に、配列番号2のプレプロインスリン(preproinsulin)のcDNA領域を含む配列番号1の核酸を導入することにより、作製される。
【0015】
また、本発明者らは、GSK3βの活性状態を変化させ、その際のグルコース依存性インスリン分泌への影響を解析した。その結果、GSK3βの阻害剤である塩化リチウム(Klein, P. S., and Melton, D. A. (1996). A molecular mechanism for the effect of lithium on development. Proc. Natl. Acad. Sci. U. S. A. 93, 8455-8459)を投与すると、細胞膜近傍のインスリン分泌顆粒数が増加するにもかかわらず、グルコース及び脱分極刺激によるインスリン分泌が抑制されることを、本発明者らは見いだした。さらに、RNA干渉法により内在性GSK3βの発現を抑制することによっても、インスリン分泌が抑制されることを、本発明者らは見いだした。
【0016】
本発明者らの上記知見に基づき、本発明の実施の形態に係るインスリン分泌抑制剤は、塩化リチウムを含む。また、本発明の別の実施の形態に係るインスリン分泌抑制剤は、GSK3β−siRNAを含む。
【0017】
(第1の実施例:インスリン−GFP細胞株の樹立)
図1に示し、配列番号2のプレプロインスリンのcDNA領域を含む配列番号1の配列を有するマウスpEGFP−プレプロインスリン・プラスミドを、マウス膵βモデル細胞であるMIN6細胞にトランスフェクションした。トランスフェクションは、Lipofectamine Plus(Invitrogen)と、Lipofectamine reagent(Invitrogen)と、を用い、製造者のマニュアルに従って行った。トランスフェクションの翌日に、トリプシン溶液によって培養皿からMIN6細胞を剥がした。さらに、300ng/mlのGeneticin(Gibco BRL)を含むDMEM−10%非動化FBS培地中に剥がしたMIN6細胞を蒔き、培養した。その後、3日ごとにGeneticinを含む培地を交換した。
【0018】
7乃至10日後に、マウスpEGFP−プレプロインスリン・プラスミドが染色体内に組み込まれたため、Geneticin耐性となった細胞コロニーが出現したため、これらを24ウェルのプレート2枚に単離した。なお、2枚のプレートのうち1枚はマスタープレートとして用い、もう1枚は後述するグルコース依存的インスリンアッセイに用いた。培養液には、25mmol/Lグルコース、10v/v%胎仔血清、50μmol/Lメルカプトエタノール、100mg/Lストレプトマイシン、及び60.5mg/L硫酸ペニシリンを添加したDMEM培地(Invitrogen)を用いた。アッセイ用のプレート内の細胞コロニーの形成が成熟したところで、後述する全反射蛍光顕微鏡法により、GFP標識インスリンの分泌を生化学的又は形態学的に定量した。
【0019】
具体的には、細胞膜直下100nm以内におけるGFP標識インスリン顆粒の動態を、全反射顕微鏡により解析した。顕微鏡観察の30分前、クレブスーリンガー重炭酸塩緩衝液(KRH)緩衝液(NaCl 119mmol/L、KCl 4.74mmol/L、CaCl2 2.54mmol/L、MgCl2 1.19mmol/L、KH2PO4 1.19mmol/L、NaHCO3 25mmol/L、HEPES 10mmol/L、0.5%BSA、pH7.4)で、細胞を30分、37℃で培養した。全反射蛍光顕微鏡は、開口数1.45の100倍の対物レンズ(PlanAPO,TIRFM、オリンパス株式会社)を用いて構築した。蛍光像は、EM−CCDカメラ(C9100−02、浜松ホトニクス株式会社)を用いて撮影した。
【0020】
グルコース刺激の前では、図2に示すように、細胞膜上に多数の蛍光輝点が観察された。従来、電子顕微鏡解析より、細胞膜直下100nm以内に存在する顆粒は、「形態学的細胞膜上ドッキング分泌顆粒」と呼ばれている(Zenisek, D., Steyer, J. A., and Almers, W. (2000). Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature 406, 849-854, Rizzoli, S. O., and Betz, W. J. (2004). The structural organization of the readily releasable pool of synaptic vesicles. Science. 303, 2037-2039.)。全反射顕微鏡で観察された蛍光輝点は、細胞膜にドッキングしているGFP標識インスリン顆粒であると考えられる。
【0021】
次に、細胞に25mmol/Lの高グルコース刺激を与え、100ミリ秒間隔で単一のインスリン顆粒の全反射蛍光顕微鏡連続写真を撮影した。その結果、図2に示した領域1,2において、GFP標識インスリン顆粒の蛍光強度が、図3及び図4に示すように、一過的に急激に増大し、その後減少することが明らかになった。このような一過性の蛍光強度変化は、他の内分泌細胞や通常の膵β細胞でも観察されることから(Tsuboi, T. (2009). Molecular mechanism of attachment process of dense-core vesicles to the plasma membrane in neuroendocrine cells. Neurosci. Res. 63, 83-88)、グルコース刺激により、GFP標識インスリンが、細胞外に放出されたことを示している。
【0022】
また、単一のインスリン顆粒の動態を可視化解析した結果、分泌反応を示したGFP標識インスリン顆粒の多くは、細胞膜にドッキングしていた顆粒ではなく、新しく細胞膜に輸送されたばかりの顆粒であることが分かった。このように、全反射蛍光顕微鏡観察によりグルコース濃度依存的なGFP標識インスリン分泌能が確認され、繊維芽細胞様の形態を有するクローンを、MIN6インスリン−GFP細胞とした。なお、繊維芽細胞様の形態を有するクローンは、グルコース濃度依存的なGFP標識インスリン分泌能を示したが、繊維芽細胞様の形態を有さないクローンは、グルコース濃度依存的なGFP標識インスリン分泌能を示さなかった。
【0023】
MIN6インスリン−GFP細胞は、正常な膵ランゲルハンス島と同様に、ジアゾキシド、グリベンクラミド、アセチルコリン、及び高カリウム(70mmol/L KCl)刺激によっても、GFP標識インスリン分泌反応を示した。また、正常な膵ランゲルハンス島と同様に、cAMPホスホジエステラーゼ阻害剤(3−イソブチル−1−メチルキサンチン:IBMX)、アデニル酸シクラーゼの活性化剤(フォルスコリン)、及び膜透過性cAMP誘導体(8−Br−cAMP)の投与は、MIN6インスリン−GFP細胞のグルコース濃度依存的インスリン分泌を増強した。
【0024】
(第2の実施例:GSK3βの不活性化によるインスリン分泌抑制)
グリコーゲン合成酵素キナーゼ−3β(GSK3β)の活性状態がインスリン分泌へどのような影響を与えるかを検討するため、実施例1で得られたMIN6インスリン−GFP細胞に、GSK3βの阻害剤である20mmol/Lの塩化リチウムを2時間投与した。その後、細胞膜にドッキングしているGFP標識インスリン顆粒数を全反射蛍光顕微鏡で測定し、細胞内のGFP標識インスリン顆粒数を共焦点蛍光顕微鏡で測定した。その結果、図5及び図6に示すように、細胞膜にドッキングしているGFP標識インスリン顆粒は、塩化リチウムの投与により有意に増加していた。一方、図7に示すように、細胞内のGFP標識インスリン顆粒数には変化がなかったが、細胞膜近傍にGFP標識インスリン顆粒が集積している様子が観察された。
【0025】
次に、MIN6インスリン−GFP細胞を塩化リチウム処理した場合に、グルコース及び高カリウム刺激がインスリン分泌へ与える影響を測定した。その結果、塩化リチウム処理は、図8に示すように、グルコース及び高カリウム刺激依存性のインスリン分泌を強力に抑制することが明らかになった。以上の結果から、MIN6インスリン−GFP細胞への塩化リチウム処理が、ミトコンドリアの代謝機能や、細胞膜上のCa2+チャネルの機能を直接阻害している可能性が示された。
【0026】
(第3の実施例:塩化リチウムによるインスリン分泌の抑制機構)
塩化リチウム処理を行ったMIN6インスリン−GFP細胞にグルコース及び高カリウム刺激を与えた際の、NAD(P)H濃度及び[Ca2+]i濃度の変化を測定した。
【0027】
ミトコンドリアにおけるNAD(P)H濃度は、波長360nmの励起光を用い、フラビンの波長460nmの自家蛍光を倒立顕微鏡で測定することにより、測定した。MIN6インスリン−GFP細胞内の[Ca2+]i濃度は、次のように測定した。まず、MIN6インスリン−GFP細胞を、Fura Red−AM(2μmol/L、株式会社同仁化学研究所)を添加したKRH緩衝液で30分、37℃で培養した。その後、MIN6インスリン−GFP細胞を、KRH緩衝液で3回洗浄した。さらに、倒立顕微鏡上で培養液を37℃に保ち、40倍の対物レンズ(UApo)を用いて、MIN6インスリン−GFP細胞の落射蛍光像を得た。Fura Redからの蛍光は、DPSSレーザ(488nm、20mW、古河電気工業株式会社)を用いて、5秒間隔でEM−CCDカメラ(C9100−02、浜松ホトニクス株式会社)を用いて撮影した。
【0028】
その結果、図9に示すように、塩化リチウム処理の有無にかかわらず、グルコース刺激により、ミトコンドリア内のNAD(P)H産生量は上昇した。また、図10に示すように、塩化リチウム処理の有無にかかわらず、グルコース及び高カリウム刺激は、[Ca2+]i濃度変化に影響を与えなかった。よって、塩化リチウムは、細胞内シグナル伝達系を阻害するのではなく、インスリン分泌機構の最終段階、すなわち、インスリン分泌顆粒が細胞膜と融合する過程を阻害することが示唆された。
【0029】
(第4の実施例:内在性GSK3βのノックダウン)
Lipofectamine 2000(インビトロジェン)を用いて、10pmol/LのGSK3β−siRNAをMIN6インスリン−GFP細胞に導入し、内在性GSK3βをノックダウンした際のインスリン分泌を測定した。具体的には、Ambion社製 Pre−designed siRNA ID:74481を用いてGSK3β−siRNAをMIN6インスリン−GFP細胞に導入して48時間後、MIN6インスリン−GFP細胞をKRH緩衝液で洗浄した。さらに、KRH緩衝液を用いて、MIN6インスリン−GFP細胞を37℃で30分間培養した。その後、37℃におけるMIN6インスリン−GFP細胞を、全反射蛍光顕微鏡で観察した。
【0030】
その結果、GSK3βのノックダウンにより、図11の全反射蛍光顕微鏡写真及び図12のグラフに示すように、細胞膜にドッキングしているGFP標識インスリン顆粒は有意に増加した。しかし、図13の共焦点蛍光顕微鏡に示すように、細胞内のGFP標識インスリン顆粒数は変化せず、細胞膜近傍にGFP標識インスリン顆粒が集積していることが確認された。
【0031】
次に、GSK3βをノックダウンした場合における、グルコース及び高カリウム刺激がインスリン分泌へ与える影響を測定した。具体的には、グルコースを含むKRH緩衝液、又は50mmol/Lでカリウムを含むKRH緩衝液でMIN6インスリン−GFP細胞を3時間培養した。その後、培養液の上清を回収し、ヒトインスリン測定ELISAキット(株式会社森永生科学研究所)を用いて、インスリン分泌を測定した。その結果、図14に示すように、GSK3βをノックダウンすることにより、グルコース及び高カリウム刺激依存性のインスリン分泌が有意に抑制された。なお、Ambion社製 Pre−designed siRNAのうち、ID:74481が最もGSK3βの抑制効率が高く、約40%までGSK3βを抑制した。
【0032】
(第5の実施例:塩化リチウムによるβチューブリン及びCLASP2への影響)
細胞の微小管のプラス端には、微小管−小胞結合タンパク質CLIP(cytoplasumic linker protein)や、それに結合するCLASP(Cytoplasmic Linker Associated Protein)sと呼ばれるタンパク質群が局在している。これらのタンパク質は、微小管のプラス端が細胞膜の特定部位を探知して捕捉する“Search and Capture”機能に重要な役割を果たしており、アクチン繊維上の低分子量Gタンパク質であるRacのエフェクター分子であるIQGAP1と、APCと、に結合し、微小管を安定化させると考えられている。
【0033】
GSK3βは、CLASPsの中でもCLASP2をリン酸化し、微小管との結合を抑制する。そのため、GSK3βの活性の抑制は、微小管に沿って輸送されるインスリン分泌顆粒の細胞質から細胞膜上への受け渡しを抑制するのではないかと考えられる。そこで、20mmol/Lの塩化リチウム(シグマ−アルドリッチ)で3時間処理した後のMIN6インスリン−GFP細胞における、微小管及びCLASP2の細胞内局在を、蛍光免疫染色により確認した。
【0034】
具体的には、ポリL―リジンコートされたガラスボトムディッシュ上でMIN6インスリン−GFP細胞を48時間培養し、その後、MIN6インスリン−GFP細胞をアセトンを用いて室温で10分間固定した。次に、MIN6インスリン−GFP細胞を0.3%TritonX−100を含むPBSで3分間洗浄した。さらに3%ウシ血清アルブミンを含むブロッキングバッファを用いて室温で1時間、MIN6インスリン−GFP細胞を洗浄した。その後、MIN6インスリン−GFP細胞と、抗βチューブリン抗体又は抗CLASP2抗体(Molecular Probes)を含むブロッキングバッファと、を4℃で一晩反応させた。次に、MIN6インスリン−GFP細胞をPBSで3回洗浄し、MIN6インスリン−GFP細胞と、蛍光標識抗ウサギ抗体(Alexa−546 anti−Rabit、Molecular Probes)を含むブロッキングバッファと、を室温で1時間反応させた。染色したMIN6インスリン−GFP細胞は、蛍光褪色防止剤含有封入剤で固定し、共焦点レーザ顕微鏡(LSM−510、カールツァイス株式会社)で観察した。
【0035】
すると、塩化リチウム処理により微小管形成中心が破壊され、それに伴い、図15に示すように、GFP標識インスリン顆粒が細胞膜に集積することが明らかになった。また、塩化リチウム処理により、図16に示すように、CLASP2は、細胞膜上にも局在するようになることが明らかになった。以上の結果より、GSK3βは、微小管に沿って輸送されるインスリン分泌顆粒を細胞質から細胞膜へと受け渡すスイッチ的な役割をしていることが示唆された。
【産業上の利用可能性】
【0036】
本発明により、長期継代培養に耐え、グルコース濃度依存的にGFP標識インスリンを分泌するMIN6インスリン−GFP細胞が提供される。MIN6インスリン−GFP細胞の培養液を回収し、蛍光分光光度計や蛍光プレートリーダで蛍光測定を行うことで、MIN6インスリン−GFP細胞のインスリン分泌量は簡便に測定可能である。したがって、MIN6インスリン−GFP細胞は、新たな2型糖尿病治療薬候補化合物のハイスループットスクリーニング、及びインスリン分泌を制御する新規タンパク質の同定等に利用可能である。さらに、様々な臓器から抽出した機能が同定されていないペプチドをMIN6インスリン−GFP細胞に投与してインスリン分泌量を測定することで、新規生理活性物質の同定も可能となる。
【技術分野】
【0001】
本発明は細胞生物学及び分子生物学に係り、膵β細胞株に関する。
【背景技術】
【0002】
膵臓に存在するランゲルハンス島の膵β細胞は、血糖量を低下させるホルモンであるインスリンを分泌することで知られている。血中グルコース濃度の上昇により、膵β細胞は、急峻であるがインスリンの分泌時間が短い第一相のインスリン分泌と、緩やかにインスリンの分泌を増加させる第二相のインスリン分泌と、の二相性インスリン分泌を示す(例えば、非特許文献1参照。)。
【0003】
第一相のインスリン分泌は、以下の過程を経て生じると考えられている。すなわち、糖輸送体(GLUT2)により膵β細胞に取り込まれたグルコースがミトコンドリアで代謝され、膵β細胞内のアデノシン三リン酸(ATP)の濃度が上昇する。細胞質のATP/ADP比が上昇する結果、膵β細胞の細胞膜上のATP感受性K+チャネル(KATPチャネル)が閉じられ、細胞膜電位の脱分極が引き起こされる。そして、膜電位依存性Ca2+チャネル(Voltage−Dependent Ca2+ Channel:VDCC)が活性化されることで、膜電位依存性Ca2+チャネルからカルシウムが流入して細胞内カルシウム濃度が上昇し、インスリン顆粒の開口放出が誘導される。この一連の過程は、KATPチャネル依存性インスリン分泌と呼ばれる。
【0004】
一方、第二相のインスリン分泌は、KATPチャネルに依存せずに起こるが、その詳細な分子機構については不明である。しかし、第二相のインスリン分泌を起こす分子機構は、インスリン分泌顆粒が細胞膜へ移行する過程、及びインスリン分泌顆粒の開口放出の準備過程等に作用し、インスリン分泌を増強する効果に寄与していると考えられている。
【0005】
ここで、KATPチャネル開口薬であるジアゾオキシドによりKATPチャネルを開口させた状態、あるいはグリベンクラミド等のスルフォニル尿素薬によりKATPチャネルを閉口させた状態、つまり細胞質のATP/ADP比の変動によるKATPチャネルの制御機構を阻害した条件下でも、グルコースはインスリン分泌を促進する。このような条件下で観察されるKATPチャネルに依存しない分子機構が、第二相で見られるインスリン分泌の増強に寄与していると考えられている。
【0006】
また、グルコース刺激を繰り返すと、一度目のグルコース刺激によるインスリン分泌量よりも、二度目のグルコース刺激によるインスリン分泌量の方が多いという現象(time−dependent potentiation:TDP)が、古くから報告されている(例えば、非特許文献2参照。)。この現象も、KATPチャネルに依存しない分子機構によると考えられている。このように、KATPチャネルに依存しない分子機構が、グルコース誘発性インスリン分泌において、重要な役割を担っていると考えられている。
【0007】
次に、グリコーゲン合成酵素キナーゼ3(Glycogen synthase kinase−3:GSK3)は、セリン・スレオニンキナーゼであり、異なる遺伝子にコードされアミノ酸レベルで高い相同性を有するGSK3αとGSK3βのアイソフォームが存在する(例えば、非特許文献3参照。)。GSK−3は、糖質代謝を制御するリン酸化酵素として同定された。しかし、GSK−3のリン酸化基質に細胞骨化タンパク質、転写因子、及び代謝調節因子も含まれることから、GSK−3は、細胞構造、遺伝子発現、細胞分裂、細胞分化、及びアポトーシス等の様々な細胞機能を制御しうることが明らかになっている。
【0008】
ここで、近年、神経細胞特異的にインスリン受容体を欠損させたノックアウトマウスは、食欲制御異常、肥満、2型糖尿病、及び不妊を発症することが明らかになっている(例えば、非特許文献4参照。)。さらに、神経細胞におけるインスリン受容体を介したインスリンシグナル過程を阻害することにより、細胞内のGSK3βの活性が亢進し、タンパク質のリン酸化が過剰に引き起こされ、これがアルツハイマー病の発症の引き金になりうることが示唆されている(例えば、非特許文献5、6参照。)。また、実際のアルツハイマー病患者や糖尿病患者において、GSK3βの活性が亢進していることが知られているが(例えば、非特許文献7、8参照。)、その詳細な病態発症分子機構については不明な点が多い。
【先行技術文献】
【特許文献】
【0009】
【非特許文献1】Aizawa, T., Komatsu, M., Asanuma, N., Sato, Y., and Sharp, G. W. (1998). Glucose action 'beyond ionic events' in the pancreatic beta cell. Trends Pharmacol. Sci. 19, 496-499.
【非特許文献2】Grodsky, G. M., Curry, D., Landahl, H., and Bennett, L. (1969). Further studies on the dynamic aspects of insulin release in vitro with evidence for a two-compartmental storage system. Acta Diabetol. Lat. 6, 554-578
【非特許文献3】Sutherland, C., Leighton, I. A., and Cohen, P. (1993). Inactivation of glycogen synthase kinase-3 beta by phosphorylation: new kinase connections in insulin and growth-factor signaling. Biochem. J. 296, 15-19.
【非特許文献4】Bruning, J. C., Gautam, D., Burks, D. J., Gillette, J., Schubert, M., Orban, P. C., Klein, R., Krone, W., Muller-Wieland, D., and Kahn, C. R. (2000). Role of brain insulin receptor in control of body weight and reproduction. Science. 289, 2122-2125.
【非特許文献5】Pei, J. J., Braak, E., Braak, H., Grundke-Iqbal, I., Iqbal, K., Winblad, B., and Cowburn, R. F. (1999). Distribution of active glycogen synthase kinase 3beta (GSK-3beta) in brains staged for Alzheimer disease neurofibrillary changes. J. Neuropathol. Exp. Neurol. 58, 1010-1019.
【非特許文献6】Schubert, M., Holland, N. D., Escriva, H., Holland, L. Z., and Laudet, V. (2004). Retinoic acid influences anteroposterior positioning of epidermal sensory neurons and their gene expression in a developing chordate (amphioxus). Proc. Natl. Acad. Sci. U.S.A. 101, 10320-10325
【非特許文献7】Steen, E., Terry, B. M., Rivera, E. J., Cannon, J. L., Neely, T. R., Tavares, R., Xu, X. J., Wands, J. R., and de la Monte, S. M. (2005). Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease---is this type 3 diabetes ? J. Alzheimers. Dis. 7, 63-80.
【非特許文献8】Jolivalt, C. G., Lee, C. A., Beiswenger, K. K., Smith, J. L. Orlov, M., Torrance, M. A., and Masliah, E. (2008). Defective insulin signaling pathway and increased glycogen synthase kinase-3 activity in the brain of diabetic mice: Parallels with Alzheimer's disease and correction by insulin. J. Neurosci. Res. 86, 3265-3274.
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、インスリン分泌機構の解明に有用な細胞を提供することを目的の一つとする。また、本発明は、インスリン分泌抑制剤を提供することも目的の一つとする。
【課題を解決するための手段】
【0011】
本発明の態様は、継代培養可能であり、グルコース濃度依存的にGFP標識インスリンを分泌する膵β細胞(MIN6インスリン−GFP細胞)株であることを要旨とする。また、本発明の別の態様は、塩化リチウムを含む、インスリン分泌抑制剤であることを要旨とする。さらに、本発明の別の態様は、GSK3β発現抑制剤を含む、インスリン分泌抑制剤であることを要旨とする。またさらに本発明の別の態様は、GSK3β−siRNA(small interfering RNA)を含む、インスリン分泌抑制剤であることを要旨とする。
【発明の効果】
【0012】
本発明によれば、継代培養可能であり、グルコース濃度依存的に緑色蛍光タンパク質標識インスリンを分泌する膵β細胞株を提供可能である。また、本発明によれば、インスリン分泌抑制剤を提供可能である。
【図面の簡単な説明】
【0013】
【図1】本発明の第1の実施例に係るマウスpEGFP−プレプロインスリン・プラスミドの概念図である。
【図2】本発明の第1の実施例に係るMIN6インスリン−GFP細胞の全反射蛍光顕微鏡写真である。
【図3】本発明の第1の実施例に係る図2中の顆粒1,2のグルコース刺激前後の全反射顕蛍光微鏡連続写真である。
【図4】本発明の第1の実施例に係る図2中の顆粒1,2の蛍光強度の時間変化を示すグラフである。なお、グルコース刺激前の蛍光強度を100として正規化している。
【図5】本発明の第2の実施例に係る細胞膜直下のインスリン分泌顆粒分布を示す全反射蛍光顕微鏡写真である。なお、校正棒は10μmを示す。
【図6】本発明の第2の実施例に係る全反射蛍光顕微鏡で測定したインスリン分泌顆粒密度を示すグラフである。
【図7】本発明の第2の実施例に係る細胞膜内のインスリン分泌顆粒分布を示す共焦点蛍光顕微鏡写真である。なお、校正棒は10μmを示す。
【図8】本発明の第2の実施例に係る細胞外に分泌されたインスリン量を示すグラフである。
【図9】本発明の第3の実施例に係るグルコース刺激時のNAD(P)H濃度変化を示すグラフである。
【図10】本発明の第3の実施例に係るグルコース及び高カリウム刺激時の[Ca2+]i濃度変化を示すグラフである。
【図11】本発明の第4の実施例に係る細胞膜直下のインスリン分泌顆粒分布を示す全反射蛍光顕微鏡写真である。なお、校正棒は10μmを示す。
【図12】本発明の第4の実施例に係る全反射蛍光顕微鏡で測定したインスリン分泌顆粒密度を示すグラフである。
【図13】本発明の第4の実施例に係る細胞膜内のインスリン分泌顆粒分布を示す共焦点蛍光顕微鏡写真である。なお、校正棒は10μmを示す。
【図14】本発明の第4の実施例に係る細胞外に分泌されたインスリン量を示すグラフである。
【図15】本発明の第5の実施例に係る微小管構造の共焦点蛍光顕微鏡写真である。なお、校正棒は10μmを示す。
【図16】本発明の第5の実施例に係るCLASP2の細胞内局在を示す蛍光顕微鏡写真である。
【発明を実施するための形態】
【0014】
以下に本発明の実施の形態を説明する。
マウス膵β細胞由来MIN6細胞株は、グルコース及び分泌促進物質に対するインスリン分泌応答を維持している膵β細胞株である(Miyazaki, J., Araki, K., Yamato, E., Ikegami, H., Asano, T., Shibasaki, Y., Oka, Y., and Yamamura, K. (1990). Establishment of a Pancreatic β Cell Line That Retains Glucose-Inducible Insulin Secretion: Special Reference to Expression of Glucose Transporter Isoforms. Endocrinology 127, 126-132.)。本発明者らは、約3ヶ月という従来と比して長期にわたって継代培養可能であり、グルコース濃度依存的に緑色蛍光タンパク質(Green Fluorescent Protein:GFP)を融合したインスリンを発現するMIN6細胞(MIN6インスリン−GFP細胞)を初めて作製した。本発明の実施の形態に係るMIN6インスリン−GFP細胞は、MIN6細胞に、配列番号2のプレプロインスリン(preproinsulin)のcDNA領域を含む配列番号1の核酸を導入することにより、作製される。
【0015】
また、本発明者らは、GSK3βの活性状態を変化させ、その際のグルコース依存性インスリン分泌への影響を解析した。その結果、GSK3βの阻害剤である塩化リチウム(Klein, P. S., and Melton, D. A. (1996). A molecular mechanism for the effect of lithium on development. Proc. Natl. Acad. Sci. U. S. A. 93, 8455-8459)を投与すると、細胞膜近傍のインスリン分泌顆粒数が増加するにもかかわらず、グルコース及び脱分極刺激によるインスリン分泌が抑制されることを、本発明者らは見いだした。さらに、RNA干渉法により内在性GSK3βの発現を抑制することによっても、インスリン分泌が抑制されることを、本発明者らは見いだした。
【0016】
本発明者らの上記知見に基づき、本発明の実施の形態に係るインスリン分泌抑制剤は、塩化リチウムを含む。また、本発明の別の実施の形態に係るインスリン分泌抑制剤は、GSK3β−siRNAを含む。
【0017】
(第1の実施例:インスリン−GFP細胞株の樹立)
図1に示し、配列番号2のプレプロインスリンのcDNA領域を含む配列番号1の配列を有するマウスpEGFP−プレプロインスリン・プラスミドを、マウス膵βモデル細胞であるMIN6細胞にトランスフェクションした。トランスフェクションは、Lipofectamine Plus(Invitrogen)と、Lipofectamine reagent(Invitrogen)と、を用い、製造者のマニュアルに従って行った。トランスフェクションの翌日に、トリプシン溶液によって培養皿からMIN6細胞を剥がした。さらに、300ng/mlのGeneticin(Gibco BRL)を含むDMEM−10%非動化FBS培地中に剥がしたMIN6細胞を蒔き、培養した。その後、3日ごとにGeneticinを含む培地を交換した。
【0018】
7乃至10日後に、マウスpEGFP−プレプロインスリン・プラスミドが染色体内に組み込まれたため、Geneticin耐性となった細胞コロニーが出現したため、これらを24ウェルのプレート2枚に単離した。なお、2枚のプレートのうち1枚はマスタープレートとして用い、もう1枚は後述するグルコース依存的インスリンアッセイに用いた。培養液には、25mmol/Lグルコース、10v/v%胎仔血清、50μmol/Lメルカプトエタノール、100mg/Lストレプトマイシン、及び60.5mg/L硫酸ペニシリンを添加したDMEM培地(Invitrogen)を用いた。アッセイ用のプレート内の細胞コロニーの形成が成熟したところで、後述する全反射蛍光顕微鏡法により、GFP標識インスリンの分泌を生化学的又は形態学的に定量した。
【0019】
具体的には、細胞膜直下100nm以内におけるGFP標識インスリン顆粒の動態を、全反射顕微鏡により解析した。顕微鏡観察の30分前、クレブスーリンガー重炭酸塩緩衝液(KRH)緩衝液(NaCl 119mmol/L、KCl 4.74mmol/L、CaCl2 2.54mmol/L、MgCl2 1.19mmol/L、KH2PO4 1.19mmol/L、NaHCO3 25mmol/L、HEPES 10mmol/L、0.5%BSA、pH7.4)で、細胞を30分、37℃で培養した。全反射蛍光顕微鏡は、開口数1.45の100倍の対物レンズ(PlanAPO,TIRFM、オリンパス株式会社)を用いて構築した。蛍光像は、EM−CCDカメラ(C9100−02、浜松ホトニクス株式会社)を用いて撮影した。
【0020】
グルコース刺激の前では、図2に示すように、細胞膜上に多数の蛍光輝点が観察された。従来、電子顕微鏡解析より、細胞膜直下100nm以内に存在する顆粒は、「形態学的細胞膜上ドッキング分泌顆粒」と呼ばれている(Zenisek, D., Steyer, J. A., and Almers, W. (2000). Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature 406, 849-854, Rizzoli, S. O., and Betz, W. J. (2004). The structural organization of the readily releasable pool of synaptic vesicles. Science. 303, 2037-2039.)。全反射顕微鏡で観察された蛍光輝点は、細胞膜にドッキングしているGFP標識インスリン顆粒であると考えられる。
【0021】
次に、細胞に25mmol/Lの高グルコース刺激を与え、100ミリ秒間隔で単一のインスリン顆粒の全反射蛍光顕微鏡連続写真を撮影した。その結果、図2に示した領域1,2において、GFP標識インスリン顆粒の蛍光強度が、図3及び図4に示すように、一過的に急激に増大し、その後減少することが明らかになった。このような一過性の蛍光強度変化は、他の内分泌細胞や通常の膵β細胞でも観察されることから(Tsuboi, T. (2009). Molecular mechanism of attachment process of dense-core vesicles to the plasma membrane in neuroendocrine cells. Neurosci. Res. 63, 83-88)、グルコース刺激により、GFP標識インスリンが、細胞外に放出されたことを示している。
【0022】
また、単一のインスリン顆粒の動態を可視化解析した結果、分泌反応を示したGFP標識インスリン顆粒の多くは、細胞膜にドッキングしていた顆粒ではなく、新しく細胞膜に輸送されたばかりの顆粒であることが分かった。このように、全反射蛍光顕微鏡観察によりグルコース濃度依存的なGFP標識インスリン分泌能が確認され、繊維芽細胞様の形態を有するクローンを、MIN6インスリン−GFP細胞とした。なお、繊維芽細胞様の形態を有するクローンは、グルコース濃度依存的なGFP標識インスリン分泌能を示したが、繊維芽細胞様の形態を有さないクローンは、グルコース濃度依存的なGFP標識インスリン分泌能を示さなかった。
【0023】
MIN6インスリン−GFP細胞は、正常な膵ランゲルハンス島と同様に、ジアゾキシド、グリベンクラミド、アセチルコリン、及び高カリウム(70mmol/L KCl)刺激によっても、GFP標識インスリン分泌反応を示した。また、正常な膵ランゲルハンス島と同様に、cAMPホスホジエステラーゼ阻害剤(3−イソブチル−1−メチルキサンチン:IBMX)、アデニル酸シクラーゼの活性化剤(フォルスコリン)、及び膜透過性cAMP誘導体(8−Br−cAMP)の投与は、MIN6インスリン−GFP細胞のグルコース濃度依存的インスリン分泌を増強した。
【0024】
(第2の実施例:GSK3βの不活性化によるインスリン分泌抑制)
グリコーゲン合成酵素キナーゼ−3β(GSK3β)の活性状態がインスリン分泌へどのような影響を与えるかを検討するため、実施例1で得られたMIN6インスリン−GFP細胞に、GSK3βの阻害剤である20mmol/Lの塩化リチウムを2時間投与した。その後、細胞膜にドッキングしているGFP標識インスリン顆粒数を全反射蛍光顕微鏡で測定し、細胞内のGFP標識インスリン顆粒数を共焦点蛍光顕微鏡で測定した。その結果、図5及び図6に示すように、細胞膜にドッキングしているGFP標識インスリン顆粒は、塩化リチウムの投与により有意に増加していた。一方、図7に示すように、細胞内のGFP標識インスリン顆粒数には変化がなかったが、細胞膜近傍にGFP標識インスリン顆粒が集積している様子が観察された。
【0025】
次に、MIN6インスリン−GFP細胞を塩化リチウム処理した場合に、グルコース及び高カリウム刺激がインスリン分泌へ与える影響を測定した。その結果、塩化リチウム処理は、図8に示すように、グルコース及び高カリウム刺激依存性のインスリン分泌を強力に抑制することが明らかになった。以上の結果から、MIN6インスリン−GFP細胞への塩化リチウム処理が、ミトコンドリアの代謝機能や、細胞膜上のCa2+チャネルの機能を直接阻害している可能性が示された。
【0026】
(第3の実施例:塩化リチウムによるインスリン分泌の抑制機構)
塩化リチウム処理を行ったMIN6インスリン−GFP細胞にグルコース及び高カリウム刺激を与えた際の、NAD(P)H濃度及び[Ca2+]i濃度の変化を測定した。
【0027】
ミトコンドリアにおけるNAD(P)H濃度は、波長360nmの励起光を用い、フラビンの波長460nmの自家蛍光を倒立顕微鏡で測定することにより、測定した。MIN6インスリン−GFP細胞内の[Ca2+]i濃度は、次のように測定した。まず、MIN6インスリン−GFP細胞を、Fura Red−AM(2μmol/L、株式会社同仁化学研究所)を添加したKRH緩衝液で30分、37℃で培養した。その後、MIN6インスリン−GFP細胞を、KRH緩衝液で3回洗浄した。さらに、倒立顕微鏡上で培養液を37℃に保ち、40倍の対物レンズ(UApo)を用いて、MIN6インスリン−GFP細胞の落射蛍光像を得た。Fura Redからの蛍光は、DPSSレーザ(488nm、20mW、古河電気工業株式会社)を用いて、5秒間隔でEM−CCDカメラ(C9100−02、浜松ホトニクス株式会社)を用いて撮影した。
【0028】
その結果、図9に示すように、塩化リチウム処理の有無にかかわらず、グルコース刺激により、ミトコンドリア内のNAD(P)H産生量は上昇した。また、図10に示すように、塩化リチウム処理の有無にかかわらず、グルコース及び高カリウム刺激は、[Ca2+]i濃度変化に影響を与えなかった。よって、塩化リチウムは、細胞内シグナル伝達系を阻害するのではなく、インスリン分泌機構の最終段階、すなわち、インスリン分泌顆粒が細胞膜と融合する過程を阻害することが示唆された。
【0029】
(第4の実施例:内在性GSK3βのノックダウン)
Lipofectamine 2000(インビトロジェン)を用いて、10pmol/LのGSK3β−siRNAをMIN6インスリン−GFP細胞に導入し、内在性GSK3βをノックダウンした際のインスリン分泌を測定した。具体的には、Ambion社製 Pre−designed siRNA ID:74481を用いてGSK3β−siRNAをMIN6インスリン−GFP細胞に導入して48時間後、MIN6インスリン−GFP細胞をKRH緩衝液で洗浄した。さらに、KRH緩衝液を用いて、MIN6インスリン−GFP細胞を37℃で30分間培養した。その後、37℃におけるMIN6インスリン−GFP細胞を、全反射蛍光顕微鏡で観察した。
【0030】
その結果、GSK3βのノックダウンにより、図11の全反射蛍光顕微鏡写真及び図12のグラフに示すように、細胞膜にドッキングしているGFP標識インスリン顆粒は有意に増加した。しかし、図13の共焦点蛍光顕微鏡に示すように、細胞内のGFP標識インスリン顆粒数は変化せず、細胞膜近傍にGFP標識インスリン顆粒が集積していることが確認された。
【0031】
次に、GSK3βをノックダウンした場合における、グルコース及び高カリウム刺激がインスリン分泌へ与える影響を測定した。具体的には、グルコースを含むKRH緩衝液、又は50mmol/Lでカリウムを含むKRH緩衝液でMIN6インスリン−GFP細胞を3時間培養した。その後、培養液の上清を回収し、ヒトインスリン測定ELISAキット(株式会社森永生科学研究所)を用いて、インスリン分泌を測定した。その結果、図14に示すように、GSK3βをノックダウンすることにより、グルコース及び高カリウム刺激依存性のインスリン分泌が有意に抑制された。なお、Ambion社製 Pre−designed siRNAのうち、ID:74481が最もGSK3βの抑制効率が高く、約40%までGSK3βを抑制した。
【0032】
(第5の実施例:塩化リチウムによるβチューブリン及びCLASP2への影響)
細胞の微小管のプラス端には、微小管−小胞結合タンパク質CLIP(cytoplasumic linker protein)や、それに結合するCLASP(Cytoplasmic Linker Associated Protein)sと呼ばれるタンパク質群が局在している。これらのタンパク質は、微小管のプラス端が細胞膜の特定部位を探知して捕捉する“Search and Capture”機能に重要な役割を果たしており、アクチン繊維上の低分子量Gタンパク質であるRacのエフェクター分子であるIQGAP1と、APCと、に結合し、微小管を安定化させると考えられている。
【0033】
GSK3βは、CLASPsの中でもCLASP2をリン酸化し、微小管との結合を抑制する。そのため、GSK3βの活性の抑制は、微小管に沿って輸送されるインスリン分泌顆粒の細胞質から細胞膜上への受け渡しを抑制するのではないかと考えられる。そこで、20mmol/Lの塩化リチウム(シグマ−アルドリッチ)で3時間処理した後のMIN6インスリン−GFP細胞における、微小管及びCLASP2の細胞内局在を、蛍光免疫染色により確認した。
【0034】
具体的には、ポリL―リジンコートされたガラスボトムディッシュ上でMIN6インスリン−GFP細胞を48時間培養し、その後、MIN6インスリン−GFP細胞をアセトンを用いて室温で10分間固定した。次に、MIN6インスリン−GFP細胞を0.3%TritonX−100を含むPBSで3分間洗浄した。さらに3%ウシ血清アルブミンを含むブロッキングバッファを用いて室温で1時間、MIN6インスリン−GFP細胞を洗浄した。その後、MIN6インスリン−GFP細胞と、抗βチューブリン抗体又は抗CLASP2抗体(Molecular Probes)を含むブロッキングバッファと、を4℃で一晩反応させた。次に、MIN6インスリン−GFP細胞をPBSで3回洗浄し、MIN6インスリン−GFP細胞と、蛍光標識抗ウサギ抗体(Alexa−546 anti−Rabit、Molecular Probes)を含むブロッキングバッファと、を室温で1時間反応させた。染色したMIN6インスリン−GFP細胞は、蛍光褪色防止剤含有封入剤で固定し、共焦点レーザ顕微鏡(LSM−510、カールツァイス株式会社)で観察した。
【0035】
すると、塩化リチウム処理により微小管形成中心が破壊され、それに伴い、図15に示すように、GFP標識インスリン顆粒が細胞膜に集積することが明らかになった。また、塩化リチウム処理により、図16に示すように、CLASP2は、細胞膜上にも局在するようになることが明らかになった。以上の結果より、GSK3βは、微小管に沿って輸送されるインスリン分泌顆粒を細胞質から細胞膜へと受け渡すスイッチ的な役割をしていることが示唆された。
【産業上の利用可能性】
【0036】
本発明により、長期継代培養に耐え、グルコース濃度依存的にGFP標識インスリンを分泌するMIN6インスリン−GFP細胞が提供される。MIN6インスリン−GFP細胞の培養液を回収し、蛍光分光光度計や蛍光プレートリーダで蛍光測定を行うことで、MIN6インスリン−GFP細胞のインスリン分泌量は簡便に測定可能である。したがって、MIN6インスリン−GFP細胞は、新たな2型糖尿病治療薬候補化合物のハイスループットスクリーニング、及びインスリン分泌を制御する新規タンパク質の同定等に利用可能である。さらに、様々な臓器から抽出した機能が同定されていないペプチドをMIN6インスリン−GFP細胞に投与してインスリン分泌量を測定することで、新規生理活性物質の同定も可能となる。
【特許請求の範囲】
【請求項1】
継代培養可能であり、グルコース濃度依存的に緑色蛍光タンパク質標識インスリンを分泌する膵β細胞株。
【請求項2】
配列番号2の核酸が導入された、請求項1に記載の膵β細胞株。
【請求項3】
配列番号1の核酸が導入された、請求項1に記載の膵β細胞株。
【請求項4】
繊維芽細胞様の形態を有する、請求項1乃至3のいずれか1項に記載の膵β細胞株。
【請求項5】
マウスインスリノーマMIN6細胞を用意することと、
前記MIN6細胞に、配列番号2の核酸を導入することと、
を含む、継代培養可能であり、グルコース濃度依存的に緑色蛍光タンパク質標識インスリンを分泌する膵β細胞株の作製方法。
【請求項6】
塩化リチウムを含む、インスリン分泌抑制剤。
【請求項7】
グリコーゲン合成酵素キナーゼ3β発現抑制剤を含む、インスリン分泌抑制剤。
【請求項8】
グリコーゲン合成酵素キナーゼ3β−siRNAを含む、インスリン分泌抑制剤。
【請求項1】
継代培養可能であり、グルコース濃度依存的に緑色蛍光タンパク質標識インスリンを分泌する膵β細胞株。
【請求項2】
配列番号2の核酸が導入された、請求項1に記載の膵β細胞株。
【請求項3】
配列番号1の核酸が導入された、請求項1に記載の膵β細胞株。
【請求項4】
繊維芽細胞様の形態を有する、請求項1乃至3のいずれか1項に記載の膵β細胞株。
【請求項5】
マウスインスリノーマMIN6細胞を用意することと、
前記MIN6細胞に、配列番号2の核酸を導入することと、
を含む、継代培養可能であり、グルコース濃度依存的に緑色蛍光タンパク質標識インスリンを分泌する膵β細胞株の作製方法。
【請求項6】
塩化リチウムを含む、インスリン分泌抑制剤。
【請求項7】
グリコーゲン合成酵素キナーゼ3β発現抑制剤を含む、インスリン分泌抑制剤。
【請求項8】
グリコーゲン合成酵素キナーゼ3β−siRNAを含む、インスリン分泌抑制剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2012−115153(P2012−115153A)
【公開日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願番号】特願2010−265123(P2010−265123)
【出願日】平成22年11月29日(2010.11.29)
【出願人】(503318666)日京テクノス株式会社 (19)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願日】平成22年11月29日(2010.11.29)
【出願人】(503318666)日京テクノス株式会社 (19)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

