膵リパーゼ阻害剤およびその製造方法
【課題】治療剤を与えた際の数時間後(食後)の中性脂肪吸収を効果的に抑制することができる膵リパーゼ阻害剤の提供。
【解決手段】90℃以下で低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、得られた抽出物から分画した分子量300k以上の抽出画分からなる膵リパーゼ阻害剤とその製造方法。
【解決手段】90℃以下で低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、得られた抽出物から分画した分子量300k以上の抽出画分からなる膵リパーゼ阻害剤とその製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、食後の中性脂肪の吸収を効果的に抑制する膵リパーゼ阻害剤とその製造方法に関する。
【背景技術】
【0002】
脂肪の過剰摂取は肥満および高脂血症の原因となる。また、肥満ではインスリン抵抗性が惹起され、糖尿病、高血圧症、動脈硬化の発症率が高いことが知られている。このことから、食物中の脂肪の吸収を抑制する薬剤は、肥満や高脂血症の予防または改善に有効であるのみでなく、肥満に起因する糖尿病、高血圧症、動脈硬化などの発症を予防し、生活の質の向上に寄与すると考えられている。
【0003】
膵臓から分泌される膵リパーゼは腸管における中性脂肪の消化酵素であり、食事により摂取された中性脂肪は膵リパーゼによって脂肪酸とモノグリセライドに分解されて小腸から吸収される。従って、膵リパーゼの活性を抑制する組成物は、腸管からの脂肪吸収を阻害して、高脂血症及び肥満の予防または改善に有効であると考えられている。
【0004】
実際、欧米において発売されている医療用医薬品の膵リパーゼ阻害剤オルリスタットは食事中の脂肪吸収を抑制し、抗肥満作用および高脂血症改善作用を示すことが知られている。しかしながら胃腸障害や脂肪便等の副作用の報告も多いことから、作用が穏やかで、長期間にわたって摂取しても安全性の高い脂肪吸収抑制剤が求められている。
【0005】
安全性の高いリパーゼ阻害剤として、これまで各種植物抽出物、例えば各種香辛料の抽出物、ヤーコン抽出物、マテ葉抽出物などがリパーゼ阻害剤として開示されている。具体的には、例えば、以下の(1)〜(11)に示す技術が知られている。
(1)特願平11−237307号公報(特許文献1)
【0006】
本公報には高脂血症の治療剤としてエリンギを利用することが記載されており、エリンギ乾燥粉末を90℃の熱水で2時間抽出した抽出液または乾燥粉末をラードおよびコレステロールを添加した高脂肪食とともにラットに3週間与えることによって、体重増加の割合が高脂肪食のみを与えた群と比較して有意に抑制されること、血中のコレステロール、中性脂肪、GOT値およびGPT値も高脂肪食のみを与えた群と比較して低下することが記載されている。
(2)日本食品科学工学会誌53巻、p612−618、2006年(非特許文献1)
【0007】
本文献には、ラットに各キノコ乾燥粉末と、ラードおよびコレステロールを添加した高脂肪食を3週間与えると、いずれも体重増加の割合が高脂肪食のみを与えた群と比較して有意に抑制されたこと、いずれも血中のコレステロールは低下していたが中性脂肪は同程度であること、肝臓の中性脂肪はエリンギ、ヒラタケ、ハタケシメジ投与で有意に低下したことが記載されている。
(3)特願2004−158463号公報(特許文献2)
本公報には、ウーロン茶中に含まれるポリフェノールから、膵リパーゼ阻害活性を有する成分を単離している。
(4)特願2005−114294号公報(特許文献3)
【0008】
本公報には、ネジレフサマメノキの熱水抽出物には膵リパーゼ阻害活性があり、ラットに中性脂肪とともに経口投与すると、血中の中性脂肪の上昇が抑制されたことが記載されている。
(5)特願2003−412188号公報(特許文献4)
【0009】
本公報には、アスコフィラムノドサムの抽出物には膵リパーゼ阻害活性があり、マウスに中性脂肪とともに経口投与すると、血中の中性脂肪の上昇が抑制されたことが記載されている。
(6)特願平11−299329号公報(特許文献5)
【0010】
本公報には、レモングラス、オールスパイス、シナモン、クローブの少なくとも1種類以上の抽出物にリパーゼ阻害活性のあることが記載されている。
(7)特願2000−126043号公報(特許文献6)
【0011】
本公報には、ヤーコンの熱水抽出物にリパーゼ阻害活性のあることが記載されている。(8)特願2002−327865号公報(特許文献7)
【0012】
マテ茶抽出物にリパーゼ阻害活性があり、ラットに中性脂肪とともに経口投与すると、血中の中性脂肪の上昇が抑制されたこと、高脂肪食とともに抽出物を与えて4週間飼育すると、体重増加および血中中性脂肪の上昇が抑制されたことが記載されている。
(9)Int. J. Obes.、1999年、No.23、98頁〜105頁(非特許文献2)
【0013】
本文献には、乾燥ウーロン茶葉(Thea sinensis L)を高脂肪食とともにマウスに与えると、高脂肪食のみの群と比較して、体重増加および肝臓への中性脂肪蓄積が抑制されたこと、乾燥ウーロン茶葉を10倍量の沸騰水で1時間抽出した後、濃縮した抽出物を用いて、トリオレイン(中性脂肪)、レシチンおよびタウロコール酸を混合し、超音波処理して調整したエマルジョンを基質として、豚膵リパーゼ阻害活性を測定した結果が報告されている。また、ラットより単離した脂肪細胞にノルアドレナリンを添加し、さらに抽出物を添加すると、中性脂肪の分解がさらに促進され、その活性成分としてカフェインが単離されたことが記載されている。
(10)Int. J. Obes.、1999年、No.23、174頁〜179頁(非特許文献3)
【0014】
本文献には、キチン(20%)とキトサン(80%)の混合物を用いて膵リパーゼ阻害活性を測定した結果が報告されている。また、エマルジョン調製において、界面活性剤としてレシチンの代わりに、Triton X-100またはアラビアゴムを用いて同様に測定すると、いずれも阻害活性は見られず、膵リパーゼ阻害は直接には酵素活性を阻害するのではなく、酵素-基質の相互作用を阻害することが示唆されている。また、キチンキトサン混合物を高脂肪食とともにマウスに与えると、高脂肪食のみ与えた群と比較して、体重増加、肝臓重量増加、肝臓への中性脂肪蓄積、血清中性脂肪等が抑制されたことが報告されている。
(11)J. Nutr. Sci. Vitaminol.、2003年、No.49、340頁〜345頁(非特許文献4)
【0015】
本報告には、柑橘類のペクチンを用いて膵リパーゼ阻害活性を測定した結果が報告されている。また、ラットにコーン油(2.5 ml/kg)およびペクチン(250 mg/kg)を経口投与すると、2時間後の血中中性脂肪の上昇が、コントロール群と比較して抑制されたことが記載されている。さらに、エマルジョンにペクチンを添加し、再び油層と水層に分離し、各層の膵リパーゼ量を測定すると、ペクチン添加により、油層に接触する膵リパーゼ量が低下し、ペクチンは酵素と基質の相互作用を阻害することが示唆されている。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】特願平11−237307号公報
【特許文献2】特願2004−158463号公報
【特許文献3】特願2005−114294号公報
【特許文献4】特願2003−412188号公報
【特許文献5】特願平11−299329号公報
【特許文献6】特願2000−126043号公報
【特許文献7】特願2002−327865号公報
【非特許文献】
【0017】
【非特許文献1】日本食品科学工学会誌53巻、612頁〜618頁、2006年
【非特許文献2】Int. J. Obes.、1999年、No.23、98頁〜105頁
【非特許文献3】Int. J. Obes.、1999年、No.23、174頁〜179頁
【非特許文献4】J. Nutr. Sci. Vitaminol.、2003年、No.49、340頁〜345頁
【発明の開示】
【発明が解決しようとする課題】
【0018】
上記従来技術(1)の治療剤は、多量の中性脂肪を与えたときの、血中の中性脂肪量の上昇を抑制するものであるが、3週間与えた後の比較的長期間経過した場合について、血中の中性脂肪上昇の抑制に関するものであり、食後の中性脂肪上昇を抑制するかは不明である。また、中性脂肪の吸収を抑制しているかも不明である。中性脂肪の消費が早くなっている可能性もあれば、肝臓での合成が少なくなっている可能性などもあり、治療剤を与えた際の数時間後(食後)の中性脂肪上昇については不明であり、膵リパーゼ阻害活性についても明らかではない。
【0019】
上記従来技術(2)では肝臓の中性脂肪蓄積が抑制されたことによって中性脂肪の吸収を抑制しているかは不明であり、また食後の血中の中性脂肪上昇を抑制するかどうかも不明である。また、上記従来技術 (9)では膵リパーゼ阻害活性を測定しているが用いた酵素濃度が記載されておらず、上記従来技術(10)では膵リパーゼ阻害活性測定に用いた酵素濃度が違うために比較することができない。また、上記従来技術 (11)は膵リパーゼ阻害活性測定において、膵リパーゼとしてラット膵臓より調製したものを用いているので比較できない。一方、上記従来技術(3)〜 (8)に記載されている抽出物は何れも効果が低く、また一部のものは原料が入手し難く高価であり、あるいは呈味性の問題などから、日常的に継続摂取することは困難である。
本発明は、従来の治療剤ないし治療方法における上記問題を解決したものであり、治
【0020】
療剤を与えた際の数時間後(食後)の中性脂肪吸収を効果的に抑制することができる膵リ
パーゼ阻害剤およびその製造方法を提供する。
【課題を解決するための手段】
【0021】
本発明に係る発明は、請求項1〜2に示す構成によって従来の上記問題を解決したものであり、請求項1に記載の発明の特徴は、90℃以下で低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、得られた抽出物から分画した分子量300k以上の抽出画分からなる膵リパーゼ阻害剤にある。
【0022】
請求項2に記載の発明の特徴は、生のエリンギ子実体を乾燥の初期の温度を60℃以下とし、エリンギ子実体が過熱されることによって水分がきのこから垂れるようにでていかない状態まで乾燥が進んだ後に、90℃以下の温度に上昇させることにより低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、該抽出物から分子量300k以上の抽出画分を分画することを特徴とする膵リパーゼ阻害剤の製造方法にある。
【発明の効果】
【0023】
本発明に係る90℃以下で低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、得られた抽出物から分画した分子量300k以上の抽出画分からなる膵リパーゼ阻害剤は、食後の中性脂肪吸収を効果的に抑制することができ、食事の際に摂取することで、過剰な脂肪の吸収を抑制することができる。そのため、高脂血症、肥満の予防及び改善、さらには肥満に起因する糖尿病、高血圧症、動脈硬化の発症の予防効果が期待できる。
【0024】
また、本発明に係る上記エリンギ低温抽出物の膵リパーゼ阻害効果は熱によっては損なわれないため、他の食品に添加して調理したものもその効果を発揮できる。食品の形態としては特に制限はなく、飲料をはじめ、パンや菓子類、その他の加工食品の原料として用いることができる。さらには、ペットフードなどとして利用することも可能である。
【0025】
さらに食品以外にも経口投与される薬剤として用いることができる。例えば、ドリンク剤、錠剤、カプセル剤、顆粒剤、散剤、ドロップ剤などの形態で使用することができる。
【0026】
本発明に係るエリンギ低温抽出物を主成分とする膵リパーゼ阻害剤は、エリンギが持つビタミン類やトレハロース等の水溶性物質を含むため、それらの持つ薬理的効果も同時に働くことが期待できるが、本抽出物中の分子量が300k以上の分画で膵リパーゼの阻害効果が高いため、より発明の効果を高めるために分子量300k以上の抽出画分を上記食品等に使用することができる。この場合には、膵リパーゼ阻害活性の高い分画のみを使用するため各食品への本抽出物の添加量が少なくて済み、各食品の味や風味への影響が押さえられるという効果も生じる。
【図面の簡単な説明】
【0027】
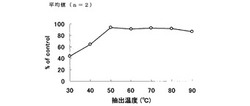
【図1】エリンギ抽出物量に対する相対活性の変化を示すグラフ。
【図2】抽出温度に対する相対活性の変化を示すグラフ。
【図3】加熱時間に対する相対活性の変化を示すグラフ。
【図4】各分子量画分での相対活性を示すグラフ。
【図5】レシチンなどによる相対活性の変化を示すグラフ。
【図6】血漿中の中性脂肪量の経時的変化を示すグラフ。
【図7】カイロミクロン中の中性脂肪量を示すグラフ。
【図8】LPL活性を示すグラフ。
【図9】臨床試験における中性脂肪の経時変化を示すグラフ。
【発明を実施するための最良の形態】
【0028】
以下、本発明を実施例と共に具体的に説明する。
【0029】
本発明の膵リパーゼ阻害剤はエリンギの低温抽出物を主成分とするものである。高脂血症、肥満等を予防するためには、作用が穏やかで、長期間にわたって摂取できる安価で安全性の高い膵リパーゼ阻害剤が求められている。このような膵リパーゼ阻害剤を得るためには、その原料として、安価で日常的に摂取されている食品の利用が考えられ、その一つとして食用キノコが挙げられる。食用キノコは日常的に摂取されているので、安全性も高い。
【0030】
本発明の膵リパーゼ阻害剤は食用キノコの一種であるエリンギを利用し、その低温抽出物を主成分としたものであり、優れたリパーゼ阻害活性を有し、以下に示すように食後の血中中性脂肪の上昇を効果的に抑制することができる。
【0031】
本発明のエリンギ低温抽出物を主成分とする膵リパーゼ阻害剤は、例えば、90℃以下で低温乾燥させたエリンギ子実体を粉末にし、水を加えて低温で水抽出することにより製造することができる。また、生のエリンギ子実体を低温で水抽出することによっても製造することができる。このエリンギの場合には、これを細断又は擂り潰したものに、水を加えて低温で水抽出してもよい。
【0032】
低温抽出温度は、実験によれば30℃〜40℃において好ましいリパーゼ阻害活性が得られた。抽出時間は、短ければ抽出量が少ないが、10分以上であればよく、30分以上が好ましい。
子実体の低温乾燥は、60℃以下であれば、天日干し、真空凍結乾燥等乾燥方法は問わない。
【0033】
しかし、加熱を伴う乾燥方法による場合は、まず乾燥の初期は、60℃以下とする。これは乾燥工程の初期から70℃以上に温度を上げると、エリンギ子実体が煮えたような状態になりまた、水分がきのこから垂れるようにでていくため、ロスが多くなることに起因する。更に90℃を越えて100℃になれば沸騰する。従って、40℃位から乾燥を始め、乾燥度が進むにつれて徐々に温度を上げて最終的に60℃位までとすることが好ましい。この乾燥工程は12時間程度で完了する。また、ある程度乾燥が進めば、即ち、エリンギ子実体が過熱されることによって水分がきのこから垂れるようにでていかない状態まで乾燥が進んだ後は、90℃程度まで上昇させてもよい。一方100℃を越えると焦げが生じる場合があり好ましくない。
【0034】
実施例に示すように、30℃付近で抽出したものは最も阻害活性が強く、抽出温度が30℃より高いと抽出効率が低下する。また、30℃付近で抽出したものは、沸騰水中で一定時間加熱しても、その阻害活性は失活しない。このことからエリンギに含まれる膵リパーゼ阻害物質は高温では抽出できず、50℃以下、特に30℃付近で抽出された阻害物質自身は熱に安定であることが分かる。
【0035】
本発明の膵リパーゼ阻害剤は、上記抽出液の状態で用いることができ、あるいは上記抽出液を凍結乾燥などによって乾燥し、固形の抽出物として用いることもできる。
【0036】
エリンギ子実体の乾燥粉末を低温で水抽出した抽出物からなる本発明の膵リパーゼ阻害剤は、これを有効量投与することによって、食後の中性脂肪の吸収を抑制する治療方法に用いることができる。有効投与量は例えば1回あたり0.1〜1000mg/kg程度が妥当である。
【0037】
本発明の膵リパーゼ阻害剤は、食後の脂肪吸収を抑制する。また、食前、食後、食間の何時でも酵素活性阻害は起こるので、本発明の膵リパーゼ阻害剤による効果は得られる。例えば、食前に本発明の膵リパーゼ阻害剤を摂取して酵素活性を抑止しておき、その後に食物(脂質)を摂取した場合でも膵リパーゼ阻害効果が期待できる。なお本発明の膵リパーゼ阻害剤の最も効果的な摂取方法は食事と同時に摂取することであり、飲料や加工食品に配合して摂取することがより効果的である。
【実施例】
【0038】
本発明のエリンギ低温抽出物を主成分とする膵リパーゼ阻害剤の調製及び該膵リパーゼ阻害剤を用いた膵リパーゼ活性の測定、および脂肪負荷試験の実施例を以下に示す。
〔膵リパーゼ阻害剤の調製〕
【0039】
60℃で一晩乾燥させたエリンギ子実体を粉末化し、15倍量の水を加えて室温で4時間抽出し、凍結乾燥して本発明に係る膵リパーゼ阻害剤であるエリンギ抽出物(以下、単に「エリンギ抽出物」と記す)を得た。
〔実施例1:膵リパーゼ活性の測定〕
【0040】
(1) 4-methylumbelliferyl oleateを、13 mM Tris-HCl、150 mM NaCl、1.3 mM CaCl2(pH 8)溶液で0.1mMに調製した溶液250μlに、エリンギ抽出物溶液を加えたもの、及びコントロールとしてエリンギ抽出物の代わりに水を125μl加えたものを調製し、それらに125μlのリパーゼ(Lipase:0.15mg/ml)を加え、25℃で30分反応させた。
【0041】
次いで、500μlの0.1M Sodium citrate(pH 4.2)を加えて反応を停止した後、Excitationを355nm、Emissionを460nmで蛍光を測定し、コントロールとして水を加えた際の活性を100%として、相対的活性を求めた。
【0042】
エリンギ抽出物量を変えたときの相対活性の変化を図1に示し、抽出温度を変えたときの相対活性の変化を図2示し、加熱時間を変えたときの相対活性の変化を図3示した。
【0043】
また、前記膵リパーゼ阻害剤の調製で得られたエリンギ抽出物を限外ろ過デバイス(PALL製品)を用いて、分子量3K以下、3〜30K、30〜300K、300K以上に分画し、各画分の相対活性を上記と同様の方法で相対活性を求めた結果を図4に示した。
〔実施例2:膵リパーゼ活性の測定〕
【0044】
(2) 9mlの0.1M NaClを含む0.1M TES buffer(pH 7)に、トリオレイン80mg、レシチン10mg、タウロコール酸5mgを超音波処理にて懸濁して基質とした。この基質100μlに50μlのリパーゼ(50μg/ml)および100μlのSample(上記エリンギ抽出物溶液)又は水を加えて、37℃で30分反応させた。次いで、3mlのヘプタン:クロロホルム:MeOH(49:49:2)で脂肪酸を抽出し、1mlの銅試薬を加えた。激しく混和後、遠心(2000×g, 10 min)して上層を200μl分取した。これに200μlの発色液(0.1%Bathcuproine, 0.05%3-t-butyl-4-hydroxyanisole in chloroform)を加え、波長480nmにおける吸光度を測定した。さらに、レシチンの代わりに、Triton X-100またはアラビアゴムを用いて同様に測定した。コントロールとして水を加えた際の活性を100%として、相対的活性を求めた。
レシチン、Triton X-100、アラビアゴムを用いたときの各々の相対活性の変化を図5に示した。
【0045】
図1に示すように、エリンギ抽出物は用量依存的に膵リパーゼを阻害した(図1、方法(1))。また、図2に示すように、各温度で抽出したところ、30℃および40℃の抽出物にリパーゼ阻害活性が認められた。特に30℃の抽出物に強いリパーゼ阻害活性が認められた。一方、50℃以上の抽出物にはほとんどリパーゼ阻害活性が認められず、30℃付近が最適抽出温度であることが判明した。
【0046】
また、30℃の抽出物は沸騰水中で一定時間加熱してもその阻害活性は失活しないことにより(図3)、エリンギに含まれる膵リパーゼ阻害物質は、50℃以上の高温では抽出されないが、30℃付近の低温で抽出されたリパーゼ阻害物質自身は熱に安定であることが判明した。さらに、エリンギ抽出物中に含まれるリパーゼ阻害活性物質は300K以上の高分子域にあることが判明した(図4)。
【0047】
さらに、方法(2)において、阻害活性を測定すると、エマルジョンを調製する界面活性剤の違いにより、阻害活性に違いが見られたことより、エリンギ抽出物は、膵リパーゼを直接阻害するのではなく、酵素と基質の相互作用を阻害することが示唆された。ちなみに、従来から医薬品として欧米では利用されているオルリスタットは、酵素の活性中心に結合して直接に阻害するので、エリンギ抽出物の作用とは異なる。なお、エリンギ抽出物と類似の作用で阻害するものには、キチンキトサン混合物、ペクチンなどがある。ここで、一般にペクチンの抽出は高温酸性条件下で行われ、また、キチンキトサンは水に不溶である。よって、低温で水抽出した本発明の膵リパーゼ阻害物質はこれらとは異なるものであることは明らかであることを付記しておく。
〔実施例3:脂肪負荷試験〕
【0048】
ICRマウス(雄、7週齢)を1週間馴らし飼育した後に実験に供した。20時間絶食させた後、コントロール群には水(2.5ml/kg)とコーン油(2.5ml/kg)を経口投与し、投与群には抽出物溶液(2.5ml/kg、抽出物250mg/kg)とコーン油(2.5ml/kg)を経口投与した。コーン油投与前、投与後1.5時間後、3時間後、4.5時間後、6時間後に尾静脈より採血し、血漿中の中性脂肪量を測定した(和光純薬のトリグリセライド−E−テストワコーを使用)。1週間回復期間を設けた後、投与物を交換して同様の試験を行った。
【0049】
食事由来の中性脂肪はタンパク質などと複合体を形成し、カイロミクロンとして血中を運搬される。そこで、上記と同様にして1.5時間後、3時間後に採血し、カイロミクロン中性脂肪量を、血漿1μlをタイタンジェルリポ蛋白(ヘレナ研究所製品)で分離後、コレトリコンボTG(ヘレナ研究所製品)で染色し、カイロミクロン画分をScion Imageによるデンシトメトリーによって定量した。
また、カイロミクロン中の中性脂肪はlipoprotein lipase(LPL)によって分解される。
【0050】
そこで、前述したICRマウスに対するコーン油投与と同様の脂肪負荷後、採血10分前にヘパリン(1 unit/g)を尾静脈投与し、脂肪負荷1.5時間後、3時間後に採血した。
【0051】
得られた血漿3μlに25 mM SDS(0.2 M Tris-HCl, pH 8.2)3μlを加え、26℃で1時間処理した。これに0.5μCi 3H-triolein、0.4 mg/ml triolein、20 mg/ml BSA、0.1% Triton X-100、20% FBS、0.1 M Tris−HCl(pH 8.6)を含む基質溶液100μlを加え、37℃で1時間反応させた。1.625 mlのクロロホルム:ヘプタン:MeOH(1:1.37:1.28)及び0.5 mlの0.1M K2CO3/H3BO3(pH 10.5)を加え混合し、3000 rpm、4℃、20分間遠心した。上清0.5 mlに5 mlのACS2を加え、液体シンチレーションカウンターにて測定し、活性を求めた。
【0052】
血漿中の中性脂肪量の経時的変化を図6に示し、カイロミクロン中の中性脂肪量を図7に示し、LPL活性を図8に示した。これらから抽出物投与によって血漿中の中性脂肪量増加の抑制は、吸収後の分解促進ではなく、腸管からの吸収が抑制される作用による効果であることが明らかとなった。
[実施例4:臨床試験]
【0053】
年齢が35歳以上59歳以下で、中性脂肪が110〜275 mg/dlの範囲、総コレステロールが300 mg/dl以下、空腹時血糖が125 mg/dl以下、HbA1cが6.4%以下、GOTが60IU/l以下、GPTが60IU/l以下、γ-GTPが105IU/l以下の全てに該当する25名(男性20名、女性5名)を対象に、臨床試験を行った。
【0054】
高脂肪食として、コーンスープ150 mlに無塩バター25 gとラード18 gを加えた飲料(脂肪含有量40 g,426 kcal )を調製した。試験食品には,さらにエリンギ抽出物を5 g を加えたものを調製した。
【0055】
被験者には,試験前夜の午後9時以降は絶食させ、翌朝空腹時に初回採血を行い、ただちにコントロール飲料あるいは試験飲料を摂取させた。試験開始から試験終了までは、少量の水以外は絶食とした。
【0056】
採血は脂肪負荷飲料の摂取直前ならびに摂取後5時間後までは1時間おきに計6回行い、血中の中性脂肪量測定を標準的な検査法で行った。また、曲線下面積(AUC:area under the curves)を、空腹時の値を基準として摂取後0〜5時間までの血中濃度から台形法により算出した。
【0057】
中性脂肪量の経時的変化を図9に示した。脂肪負荷後3時間および4時間後では、抽出物投与により、中性脂肪の上昇が抑制されていた(t検定、p<0.05)。また、曲線下面積においてもコントロールが286.2±25.3 mg・h/dl(平均値±SE)、抽出物投与が234.4±16.8 mg・h/dlであり、抽出物投与により有意に低下していた(t検定、p<0.05)。
【0058】
これらの結果から、ICRマウスでの効果と同様に、人間においても食後の血漿中の中性脂肪量の増加を有意に抑制することが判明した。
【技術分野】
【0001】
本発明は、食後の中性脂肪の吸収を効果的に抑制する膵リパーゼ阻害剤とその製造方法に関する。
【背景技術】
【0002】
脂肪の過剰摂取は肥満および高脂血症の原因となる。また、肥満ではインスリン抵抗性が惹起され、糖尿病、高血圧症、動脈硬化の発症率が高いことが知られている。このことから、食物中の脂肪の吸収を抑制する薬剤は、肥満や高脂血症の予防または改善に有効であるのみでなく、肥満に起因する糖尿病、高血圧症、動脈硬化などの発症を予防し、生活の質の向上に寄与すると考えられている。
【0003】
膵臓から分泌される膵リパーゼは腸管における中性脂肪の消化酵素であり、食事により摂取された中性脂肪は膵リパーゼによって脂肪酸とモノグリセライドに分解されて小腸から吸収される。従って、膵リパーゼの活性を抑制する組成物は、腸管からの脂肪吸収を阻害して、高脂血症及び肥満の予防または改善に有効であると考えられている。
【0004】
実際、欧米において発売されている医療用医薬品の膵リパーゼ阻害剤オルリスタットは食事中の脂肪吸収を抑制し、抗肥満作用および高脂血症改善作用を示すことが知られている。しかしながら胃腸障害や脂肪便等の副作用の報告も多いことから、作用が穏やかで、長期間にわたって摂取しても安全性の高い脂肪吸収抑制剤が求められている。
【0005】
安全性の高いリパーゼ阻害剤として、これまで各種植物抽出物、例えば各種香辛料の抽出物、ヤーコン抽出物、マテ葉抽出物などがリパーゼ阻害剤として開示されている。具体的には、例えば、以下の(1)〜(11)に示す技術が知られている。
(1)特願平11−237307号公報(特許文献1)
【0006】
本公報には高脂血症の治療剤としてエリンギを利用することが記載されており、エリンギ乾燥粉末を90℃の熱水で2時間抽出した抽出液または乾燥粉末をラードおよびコレステロールを添加した高脂肪食とともにラットに3週間与えることによって、体重増加の割合が高脂肪食のみを与えた群と比較して有意に抑制されること、血中のコレステロール、中性脂肪、GOT値およびGPT値も高脂肪食のみを与えた群と比較して低下することが記載されている。
(2)日本食品科学工学会誌53巻、p612−618、2006年(非特許文献1)
【0007】
本文献には、ラットに各キノコ乾燥粉末と、ラードおよびコレステロールを添加した高脂肪食を3週間与えると、いずれも体重増加の割合が高脂肪食のみを与えた群と比較して有意に抑制されたこと、いずれも血中のコレステロールは低下していたが中性脂肪は同程度であること、肝臓の中性脂肪はエリンギ、ヒラタケ、ハタケシメジ投与で有意に低下したことが記載されている。
(3)特願2004−158463号公報(特許文献2)
本公報には、ウーロン茶中に含まれるポリフェノールから、膵リパーゼ阻害活性を有する成分を単離している。
(4)特願2005−114294号公報(特許文献3)
【0008】
本公報には、ネジレフサマメノキの熱水抽出物には膵リパーゼ阻害活性があり、ラットに中性脂肪とともに経口投与すると、血中の中性脂肪の上昇が抑制されたことが記載されている。
(5)特願2003−412188号公報(特許文献4)
【0009】
本公報には、アスコフィラムノドサムの抽出物には膵リパーゼ阻害活性があり、マウスに中性脂肪とともに経口投与すると、血中の中性脂肪の上昇が抑制されたことが記載されている。
(6)特願平11−299329号公報(特許文献5)
【0010】
本公報には、レモングラス、オールスパイス、シナモン、クローブの少なくとも1種類以上の抽出物にリパーゼ阻害活性のあることが記載されている。
(7)特願2000−126043号公報(特許文献6)
【0011】
本公報には、ヤーコンの熱水抽出物にリパーゼ阻害活性のあることが記載されている。(8)特願2002−327865号公報(特許文献7)
【0012】
マテ茶抽出物にリパーゼ阻害活性があり、ラットに中性脂肪とともに経口投与すると、血中の中性脂肪の上昇が抑制されたこと、高脂肪食とともに抽出物を与えて4週間飼育すると、体重増加および血中中性脂肪の上昇が抑制されたことが記載されている。
(9)Int. J. Obes.、1999年、No.23、98頁〜105頁(非特許文献2)
【0013】
本文献には、乾燥ウーロン茶葉(Thea sinensis L)を高脂肪食とともにマウスに与えると、高脂肪食のみの群と比較して、体重増加および肝臓への中性脂肪蓄積が抑制されたこと、乾燥ウーロン茶葉を10倍量の沸騰水で1時間抽出した後、濃縮した抽出物を用いて、トリオレイン(中性脂肪)、レシチンおよびタウロコール酸を混合し、超音波処理して調整したエマルジョンを基質として、豚膵リパーゼ阻害活性を測定した結果が報告されている。また、ラットより単離した脂肪細胞にノルアドレナリンを添加し、さらに抽出物を添加すると、中性脂肪の分解がさらに促進され、その活性成分としてカフェインが単離されたことが記載されている。
(10)Int. J. Obes.、1999年、No.23、174頁〜179頁(非特許文献3)
【0014】
本文献には、キチン(20%)とキトサン(80%)の混合物を用いて膵リパーゼ阻害活性を測定した結果が報告されている。また、エマルジョン調製において、界面活性剤としてレシチンの代わりに、Triton X-100またはアラビアゴムを用いて同様に測定すると、いずれも阻害活性は見られず、膵リパーゼ阻害は直接には酵素活性を阻害するのではなく、酵素-基質の相互作用を阻害することが示唆されている。また、キチンキトサン混合物を高脂肪食とともにマウスに与えると、高脂肪食のみ与えた群と比較して、体重増加、肝臓重量増加、肝臓への中性脂肪蓄積、血清中性脂肪等が抑制されたことが報告されている。
(11)J. Nutr. Sci. Vitaminol.、2003年、No.49、340頁〜345頁(非特許文献4)
【0015】
本報告には、柑橘類のペクチンを用いて膵リパーゼ阻害活性を測定した結果が報告されている。また、ラットにコーン油(2.5 ml/kg)およびペクチン(250 mg/kg)を経口投与すると、2時間後の血中中性脂肪の上昇が、コントロール群と比較して抑制されたことが記載されている。さらに、エマルジョンにペクチンを添加し、再び油層と水層に分離し、各層の膵リパーゼ量を測定すると、ペクチン添加により、油層に接触する膵リパーゼ量が低下し、ペクチンは酵素と基質の相互作用を阻害することが示唆されている。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】特願平11−237307号公報
【特許文献2】特願2004−158463号公報
【特許文献3】特願2005−114294号公報
【特許文献4】特願2003−412188号公報
【特許文献5】特願平11−299329号公報
【特許文献6】特願2000−126043号公報
【特許文献7】特願2002−327865号公報
【非特許文献】
【0017】
【非特許文献1】日本食品科学工学会誌53巻、612頁〜618頁、2006年
【非特許文献2】Int. J. Obes.、1999年、No.23、98頁〜105頁
【非特許文献3】Int. J. Obes.、1999年、No.23、174頁〜179頁
【非特許文献4】J. Nutr. Sci. Vitaminol.、2003年、No.49、340頁〜345頁
【発明の開示】
【発明が解決しようとする課題】
【0018】
上記従来技術(1)の治療剤は、多量の中性脂肪を与えたときの、血中の中性脂肪量の上昇を抑制するものであるが、3週間与えた後の比較的長期間経過した場合について、血中の中性脂肪上昇の抑制に関するものであり、食後の中性脂肪上昇を抑制するかは不明である。また、中性脂肪の吸収を抑制しているかも不明である。中性脂肪の消費が早くなっている可能性もあれば、肝臓での合成が少なくなっている可能性などもあり、治療剤を与えた際の数時間後(食後)の中性脂肪上昇については不明であり、膵リパーゼ阻害活性についても明らかではない。
【0019】
上記従来技術(2)では肝臓の中性脂肪蓄積が抑制されたことによって中性脂肪の吸収を抑制しているかは不明であり、また食後の血中の中性脂肪上昇を抑制するかどうかも不明である。また、上記従来技術 (9)では膵リパーゼ阻害活性を測定しているが用いた酵素濃度が記載されておらず、上記従来技術(10)では膵リパーゼ阻害活性測定に用いた酵素濃度が違うために比較することができない。また、上記従来技術 (11)は膵リパーゼ阻害活性測定において、膵リパーゼとしてラット膵臓より調製したものを用いているので比較できない。一方、上記従来技術(3)〜 (8)に記載されている抽出物は何れも効果が低く、また一部のものは原料が入手し難く高価であり、あるいは呈味性の問題などから、日常的に継続摂取することは困難である。
本発明は、従来の治療剤ないし治療方法における上記問題を解決したものであり、治
【0020】
療剤を与えた際の数時間後(食後)の中性脂肪吸収を効果的に抑制することができる膵リ
パーゼ阻害剤およびその製造方法を提供する。
【課題を解決するための手段】
【0021】
本発明に係る発明は、請求項1〜2に示す構成によって従来の上記問題を解決したものであり、請求項1に記載の発明の特徴は、90℃以下で低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、得られた抽出物から分画した分子量300k以上の抽出画分からなる膵リパーゼ阻害剤にある。
【0022】
請求項2に記載の発明の特徴は、生のエリンギ子実体を乾燥の初期の温度を60℃以下とし、エリンギ子実体が過熱されることによって水分がきのこから垂れるようにでていかない状態まで乾燥が進んだ後に、90℃以下の温度に上昇させることにより低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、該抽出物から分子量300k以上の抽出画分を分画することを特徴とする膵リパーゼ阻害剤の製造方法にある。
【発明の効果】
【0023】
本発明に係る90℃以下で低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、得られた抽出物から分画した分子量300k以上の抽出画分からなる膵リパーゼ阻害剤は、食後の中性脂肪吸収を効果的に抑制することができ、食事の際に摂取することで、過剰な脂肪の吸収を抑制することができる。そのため、高脂血症、肥満の予防及び改善、さらには肥満に起因する糖尿病、高血圧症、動脈硬化の発症の予防効果が期待できる。
【0024】
また、本発明に係る上記エリンギ低温抽出物の膵リパーゼ阻害効果は熱によっては損なわれないため、他の食品に添加して調理したものもその効果を発揮できる。食品の形態としては特に制限はなく、飲料をはじめ、パンや菓子類、その他の加工食品の原料として用いることができる。さらには、ペットフードなどとして利用することも可能である。
【0025】
さらに食品以外にも経口投与される薬剤として用いることができる。例えば、ドリンク剤、錠剤、カプセル剤、顆粒剤、散剤、ドロップ剤などの形態で使用することができる。
【0026】
本発明に係るエリンギ低温抽出物を主成分とする膵リパーゼ阻害剤は、エリンギが持つビタミン類やトレハロース等の水溶性物質を含むため、それらの持つ薬理的効果も同時に働くことが期待できるが、本抽出物中の分子量が300k以上の分画で膵リパーゼの阻害効果が高いため、より発明の効果を高めるために分子量300k以上の抽出画分を上記食品等に使用することができる。この場合には、膵リパーゼ阻害活性の高い分画のみを使用するため各食品への本抽出物の添加量が少なくて済み、各食品の味や風味への影響が押さえられるという効果も生じる。
【図面の簡単な説明】
【0027】
【図1】エリンギ抽出物量に対する相対活性の変化を示すグラフ。
【図2】抽出温度に対する相対活性の変化を示すグラフ。
【図3】加熱時間に対する相対活性の変化を示すグラフ。
【図4】各分子量画分での相対活性を示すグラフ。
【図5】レシチンなどによる相対活性の変化を示すグラフ。
【図6】血漿中の中性脂肪量の経時的変化を示すグラフ。
【図7】カイロミクロン中の中性脂肪量を示すグラフ。
【図8】LPL活性を示すグラフ。
【図9】臨床試験における中性脂肪の経時変化を示すグラフ。
【発明を実施するための最良の形態】
【0028】
以下、本発明を実施例と共に具体的に説明する。
【0029】
本発明の膵リパーゼ阻害剤はエリンギの低温抽出物を主成分とするものである。高脂血症、肥満等を予防するためには、作用が穏やかで、長期間にわたって摂取できる安価で安全性の高い膵リパーゼ阻害剤が求められている。このような膵リパーゼ阻害剤を得るためには、その原料として、安価で日常的に摂取されている食品の利用が考えられ、その一つとして食用キノコが挙げられる。食用キノコは日常的に摂取されているので、安全性も高い。
【0030】
本発明の膵リパーゼ阻害剤は食用キノコの一種であるエリンギを利用し、その低温抽出物を主成分としたものであり、優れたリパーゼ阻害活性を有し、以下に示すように食後の血中中性脂肪の上昇を効果的に抑制することができる。
【0031】
本発明のエリンギ低温抽出物を主成分とする膵リパーゼ阻害剤は、例えば、90℃以下で低温乾燥させたエリンギ子実体を粉末にし、水を加えて低温で水抽出することにより製造することができる。また、生のエリンギ子実体を低温で水抽出することによっても製造することができる。このエリンギの場合には、これを細断又は擂り潰したものに、水を加えて低温で水抽出してもよい。
【0032】
低温抽出温度は、実験によれば30℃〜40℃において好ましいリパーゼ阻害活性が得られた。抽出時間は、短ければ抽出量が少ないが、10分以上であればよく、30分以上が好ましい。
子実体の低温乾燥は、60℃以下であれば、天日干し、真空凍結乾燥等乾燥方法は問わない。
【0033】
しかし、加熱を伴う乾燥方法による場合は、まず乾燥の初期は、60℃以下とする。これは乾燥工程の初期から70℃以上に温度を上げると、エリンギ子実体が煮えたような状態になりまた、水分がきのこから垂れるようにでていくため、ロスが多くなることに起因する。更に90℃を越えて100℃になれば沸騰する。従って、40℃位から乾燥を始め、乾燥度が進むにつれて徐々に温度を上げて最終的に60℃位までとすることが好ましい。この乾燥工程は12時間程度で完了する。また、ある程度乾燥が進めば、即ち、エリンギ子実体が過熱されることによって水分がきのこから垂れるようにでていかない状態まで乾燥が進んだ後は、90℃程度まで上昇させてもよい。一方100℃を越えると焦げが生じる場合があり好ましくない。
【0034】
実施例に示すように、30℃付近で抽出したものは最も阻害活性が強く、抽出温度が30℃より高いと抽出効率が低下する。また、30℃付近で抽出したものは、沸騰水中で一定時間加熱しても、その阻害活性は失活しない。このことからエリンギに含まれる膵リパーゼ阻害物質は高温では抽出できず、50℃以下、特に30℃付近で抽出された阻害物質自身は熱に安定であることが分かる。
【0035】
本発明の膵リパーゼ阻害剤は、上記抽出液の状態で用いることができ、あるいは上記抽出液を凍結乾燥などによって乾燥し、固形の抽出物として用いることもできる。
【0036】
エリンギ子実体の乾燥粉末を低温で水抽出した抽出物からなる本発明の膵リパーゼ阻害剤は、これを有効量投与することによって、食後の中性脂肪の吸収を抑制する治療方法に用いることができる。有効投与量は例えば1回あたり0.1〜1000mg/kg程度が妥当である。
【0037】
本発明の膵リパーゼ阻害剤は、食後の脂肪吸収を抑制する。また、食前、食後、食間の何時でも酵素活性阻害は起こるので、本発明の膵リパーゼ阻害剤による効果は得られる。例えば、食前に本発明の膵リパーゼ阻害剤を摂取して酵素活性を抑止しておき、その後に食物(脂質)を摂取した場合でも膵リパーゼ阻害効果が期待できる。なお本発明の膵リパーゼ阻害剤の最も効果的な摂取方法は食事と同時に摂取することであり、飲料や加工食品に配合して摂取することがより効果的である。
【実施例】
【0038】
本発明のエリンギ低温抽出物を主成分とする膵リパーゼ阻害剤の調製及び該膵リパーゼ阻害剤を用いた膵リパーゼ活性の測定、および脂肪負荷試験の実施例を以下に示す。
〔膵リパーゼ阻害剤の調製〕
【0039】
60℃で一晩乾燥させたエリンギ子実体を粉末化し、15倍量の水を加えて室温で4時間抽出し、凍結乾燥して本発明に係る膵リパーゼ阻害剤であるエリンギ抽出物(以下、単に「エリンギ抽出物」と記す)を得た。
〔実施例1:膵リパーゼ活性の測定〕
【0040】
(1) 4-methylumbelliferyl oleateを、13 mM Tris-HCl、150 mM NaCl、1.3 mM CaCl2(pH 8)溶液で0.1mMに調製した溶液250μlに、エリンギ抽出物溶液を加えたもの、及びコントロールとしてエリンギ抽出物の代わりに水を125μl加えたものを調製し、それらに125μlのリパーゼ(Lipase:0.15mg/ml)を加え、25℃で30分反応させた。
【0041】
次いで、500μlの0.1M Sodium citrate(pH 4.2)を加えて反応を停止した後、Excitationを355nm、Emissionを460nmで蛍光を測定し、コントロールとして水を加えた際の活性を100%として、相対的活性を求めた。
【0042】
エリンギ抽出物量を変えたときの相対活性の変化を図1に示し、抽出温度を変えたときの相対活性の変化を図2示し、加熱時間を変えたときの相対活性の変化を図3示した。
【0043】
また、前記膵リパーゼ阻害剤の調製で得られたエリンギ抽出物を限外ろ過デバイス(PALL製品)を用いて、分子量3K以下、3〜30K、30〜300K、300K以上に分画し、各画分の相対活性を上記と同様の方法で相対活性を求めた結果を図4に示した。
〔実施例2:膵リパーゼ活性の測定〕
【0044】
(2) 9mlの0.1M NaClを含む0.1M TES buffer(pH 7)に、トリオレイン80mg、レシチン10mg、タウロコール酸5mgを超音波処理にて懸濁して基質とした。この基質100μlに50μlのリパーゼ(50μg/ml)および100μlのSample(上記エリンギ抽出物溶液)又は水を加えて、37℃で30分反応させた。次いで、3mlのヘプタン:クロロホルム:MeOH(49:49:2)で脂肪酸を抽出し、1mlの銅試薬を加えた。激しく混和後、遠心(2000×g, 10 min)して上層を200μl分取した。これに200μlの発色液(0.1%Bathcuproine, 0.05%3-t-butyl-4-hydroxyanisole in chloroform)を加え、波長480nmにおける吸光度を測定した。さらに、レシチンの代わりに、Triton X-100またはアラビアゴムを用いて同様に測定した。コントロールとして水を加えた際の活性を100%として、相対的活性を求めた。
レシチン、Triton X-100、アラビアゴムを用いたときの各々の相対活性の変化を図5に示した。
【0045】
図1に示すように、エリンギ抽出物は用量依存的に膵リパーゼを阻害した(図1、方法(1))。また、図2に示すように、各温度で抽出したところ、30℃および40℃の抽出物にリパーゼ阻害活性が認められた。特に30℃の抽出物に強いリパーゼ阻害活性が認められた。一方、50℃以上の抽出物にはほとんどリパーゼ阻害活性が認められず、30℃付近が最適抽出温度であることが判明した。
【0046】
また、30℃の抽出物は沸騰水中で一定時間加熱してもその阻害活性は失活しないことにより(図3)、エリンギに含まれる膵リパーゼ阻害物質は、50℃以上の高温では抽出されないが、30℃付近の低温で抽出されたリパーゼ阻害物質自身は熱に安定であることが判明した。さらに、エリンギ抽出物中に含まれるリパーゼ阻害活性物質は300K以上の高分子域にあることが判明した(図4)。
【0047】
さらに、方法(2)において、阻害活性を測定すると、エマルジョンを調製する界面活性剤の違いにより、阻害活性に違いが見られたことより、エリンギ抽出物は、膵リパーゼを直接阻害するのではなく、酵素と基質の相互作用を阻害することが示唆された。ちなみに、従来から医薬品として欧米では利用されているオルリスタットは、酵素の活性中心に結合して直接に阻害するので、エリンギ抽出物の作用とは異なる。なお、エリンギ抽出物と類似の作用で阻害するものには、キチンキトサン混合物、ペクチンなどがある。ここで、一般にペクチンの抽出は高温酸性条件下で行われ、また、キチンキトサンは水に不溶である。よって、低温で水抽出した本発明の膵リパーゼ阻害物質はこれらとは異なるものであることは明らかであることを付記しておく。
〔実施例3:脂肪負荷試験〕
【0048】
ICRマウス(雄、7週齢)を1週間馴らし飼育した後に実験に供した。20時間絶食させた後、コントロール群には水(2.5ml/kg)とコーン油(2.5ml/kg)を経口投与し、投与群には抽出物溶液(2.5ml/kg、抽出物250mg/kg)とコーン油(2.5ml/kg)を経口投与した。コーン油投与前、投与後1.5時間後、3時間後、4.5時間後、6時間後に尾静脈より採血し、血漿中の中性脂肪量を測定した(和光純薬のトリグリセライド−E−テストワコーを使用)。1週間回復期間を設けた後、投与物を交換して同様の試験を行った。
【0049】
食事由来の中性脂肪はタンパク質などと複合体を形成し、カイロミクロンとして血中を運搬される。そこで、上記と同様にして1.5時間後、3時間後に採血し、カイロミクロン中性脂肪量を、血漿1μlをタイタンジェルリポ蛋白(ヘレナ研究所製品)で分離後、コレトリコンボTG(ヘレナ研究所製品)で染色し、カイロミクロン画分をScion Imageによるデンシトメトリーによって定量した。
また、カイロミクロン中の中性脂肪はlipoprotein lipase(LPL)によって分解される。
【0050】
そこで、前述したICRマウスに対するコーン油投与と同様の脂肪負荷後、採血10分前にヘパリン(1 unit/g)を尾静脈投与し、脂肪負荷1.5時間後、3時間後に採血した。
【0051】
得られた血漿3μlに25 mM SDS(0.2 M Tris-HCl, pH 8.2)3μlを加え、26℃で1時間処理した。これに0.5μCi 3H-triolein、0.4 mg/ml triolein、20 mg/ml BSA、0.1% Triton X-100、20% FBS、0.1 M Tris−HCl(pH 8.6)を含む基質溶液100μlを加え、37℃で1時間反応させた。1.625 mlのクロロホルム:ヘプタン:MeOH(1:1.37:1.28)及び0.5 mlの0.1M K2CO3/H3BO3(pH 10.5)を加え混合し、3000 rpm、4℃、20分間遠心した。上清0.5 mlに5 mlのACS2を加え、液体シンチレーションカウンターにて測定し、活性を求めた。
【0052】
血漿中の中性脂肪量の経時的変化を図6に示し、カイロミクロン中の中性脂肪量を図7に示し、LPL活性を図8に示した。これらから抽出物投与によって血漿中の中性脂肪量増加の抑制は、吸収後の分解促進ではなく、腸管からの吸収が抑制される作用による効果であることが明らかとなった。
[実施例4:臨床試験]
【0053】
年齢が35歳以上59歳以下で、中性脂肪が110〜275 mg/dlの範囲、総コレステロールが300 mg/dl以下、空腹時血糖が125 mg/dl以下、HbA1cが6.4%以下、GOTが60IU/l以下、GPTが60IU/l以下、γ-GTPが105IU/l以下の全てに該当する25名(男性20名、女性5名)を対象に、臨床試験を行った。
【0054】
高脂肪食として、コーンスープ150 mlに無塩バター25 gとラード18 gを加えた飲料(脂肪含有量40 g,426 kcal )を調製した。試験食品には,さらにエリンギ抽出物を5 g を加えたものを調製した。
【0055】
被験者には,試験前夜の午後9時以降は絶食させ、翌朝空腹時に初回採血を行い、ただちにコントロール飲料あるいは試験飲料を摂取させた。試験開始から試験終了までは、少量の水以外は絶食とした。
【0056】
採血は脂肪負荷飲料の摂取直前ならびに摂取後5時間後までは1時間おきに計6回行い、血中の中性脂肪量測定を標準的な検査法で行った。また、曲線下面積(AUC:area under the curves)を、空腹時の値を基準として摂取後0〜5時間までの血中濃度から台形法により算出した。
【0057】
中性脂肪量の経時的変化を図9に示した。脂肪負荷後3時間および4時間後では、抽出物投与により、中性脂肪の上昇が抑制されていた(t検定、p<0.05)。また、曲線下面積においてもコントロールが286.2±25.3 mg・h/dl(平均値±SE)、抽出物投与が234.4±16.8 mg・h/dlであり、抽出物投与により有意に低下していた(t検定、p<0.05)。
【0058】
これらの結果から、ICRマウスでの効果と同様に、人間においても食後の血漿中の中性脂肪量の増加を有意に抑制することが判明した。
【特許請求の範囲】
【請求項1】
90℃以下で低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、得られた抽出物から分画した分子量300k以上の抽出画分からなる膵リパーゼ阻害剤。
【請求項2】
生のエリンギ子実体を乾燥の初期の温度を60℃以下とし、エリンギ子実体が過熱されることによって水分がきのこから垂れるようにでていかない状態まで乾燥が進んだ後に、90℃以下の温度に上昇させることにより低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、該抽出物から分子量300k以上の抽出画分を分画することを特徴とする膵リパーゼ阻害剤の製造方法。
【請求項1】
90℃以下で低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、得られた抽出物から分画した分子量300k以上の抽出画分からなる膵リパーゼ阻害剤。
【請求項2】
生のエリンギ子実体を乾燥の初期の温度を60℃以下とし、エリンギ子実体が過熱されることによって水分がきのこから垂れるようにでていかない状態まで乾燥が進んだ後に、90℃以下の温度に上昇させることにより低温乾燥させた後、粉末にしたエリンギ子実体から30℃〜40℃の温度で水抽出し、該抽出物から分子量300k以上の抽出画分を分画することを特徴とする膵リパーゼ阻害剤の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−250989(P2012−250989A)
【公開日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願番号】特願2012−195737(P2012−195737)
【出願日】平成24年9月6日(2012.9.6)
【分割の表示】特願2008−158852(P2008−158852)の分割
【原出願日】平成20年6月18日(2008.6.18)
【出願人】(390034142)ホクト株式会社 (14)
【Fターム(参考)】
【公開日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願日】平成24年9月6日(2012.9.6)
【分割の表示】特願2008−158852(P2008−158852)の分割
【原出願日】平成20年6月18日(2008.6.18)
【出願人】(390034142)ホクト株式会社 (14)
【Fターム(参考)】
[ Back to top ]

