膵島イメージング用分子プローブ及びその前駆体、並びに、それらの使用
【課題】膵島イメージング用分子プローブ前駆体の提供。
【解決手段】下記式(1)〜(4)のいずれかで表されるポリペプチド又は相同性を有するポリペプチド。*-DLSK*QMEEEAVRLFIEWLK*NGGPSSGAPPPSK-NH2(1)*-LSK*QMEEEAVRLFIEWLK*NGGPSSGAPPPSK-NH2(2)*-SK*QMEEEAVRLFIEWLK*NGGPSSGAPPPSK-NH2(3)*-K*QMEEEAVRLFIEWLK*NGGPSSGAPPPSK-NH2(4)[上記式(1)〜(4)において、「*-」はN末端のα−アミノ基が保護基により保護されているか又は電荷を有さない修飾基により修飾されていることを示し、「K*」はリジン(lysine)の側鎖のアミノ基が保護基により保護されていることを示し、「-NH2」はC末端のカルボキシル基がアミド化されていることを示す。]
【解決手段】下記式(1)〜(4)のいずれかで表されるポリペプチド又は相同性を有するポリペプチド。*-DLSK*QMEEEAVRLFIEWLK*NGGPSSGAPPPSK-NH2(1)*-LSK*QMEEEAVRLFIEWLK*NGGPSSGAPPPSK-NH2(2)*-SK*QMEEEAVRLFIEWLK*NGGPSSGAPPPSK-NH2(3)*-K*QMEEEAVRLFIEWLK*NGGPSSGAPPPSK-NH2(4)[上記式(1)〜(4)において、「*-」はN末端のα−アミノ基が保護基により保護されているか又は電荷を有さない修飾基により修飾されていることを示し、「K*」はリジン(lysine)の側鎖のアミノ基が保護基により保護されていることを示し、「-NH2」はC末端のカルボキシル基がアミド化されていることを示す。]
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、膵島イメージング用分子プローブ及びその前駆体、並びに、それらの使用に関する。
【背景技術】
【0002】
現在、日本における2型糖尿病は推定820万人を越えて増加し続けている。この対策として耐糖能検査を基準とした糖尿病発症前の介入が行われているが、充分な成果が得られていない。その原因として、耐糖能検査で機能異常が明らかとなる境界型の段階では膵島の障害はすでに高度に進行しており、介入開始時期としては遅い可能性がある。
【0003】
すなわち、糖尿病の発症過程では、膵島量(とりわけ、膵β細胞量)が耐糖能異常に先行して減少するため、機能異常が検出・自覚される段階に至ってからでは、糖尿病はすでに治療が難しい段階となっている。一方、膵島量及び/又は膵β細胞量の減少を早期に発見することができれば、糖尿病を予防・治療できる可能性がある。したがって、糖尿病の予防・診断を行うために非侵襲の膵島イメージング技術、とりわけ膵島量及び又は膵β細胞量を測定するための非侵襲の膵島イメージング技術が望まれている。その中でも、膵島、好ましくは、膵β細胞のイメージングや膵β細胞量の測定を非侵襲的に可能とする分子プローブが特に望まれている。
【0004】
膵島のイメージング用分子プローブの設計において、β細胞に特異的な機能タンパク質を中心に膵島細胞における様々な標的分子が検討されている。中でも、標的分子として、膵β細胞に分布し、7回膜貫通型のG−タンパク質共役受容体であるGLP−1R(グルカゴン様ペプチド1受容体)が検討されている。そして、膵島β細胞のイメージング用分子プローブとして、例えば、GLP−1RアンタゴニストであるExendin−4(9−39)の誘導体が検討されている(例えば、非特許文献1)。
【0005】
また、その他にGLP−1Rのイメージング用プローブとしては、GLP−1R陽性の腫瘍をイメージングするために、GLP−1RアゴニストであるExendin−4の誘導体や、GLP−1RアンタゴニストであるExendin−4(9−39)の誘導体が検討されている(例えば、非特許文献2)。
【0006】
しかしながら、非侵襲的な膵島の三次元イメージングが可能なさらなる膵島イメージング用分子プローブが求められている。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】H. Kimura et al. Development of in vivo imaging agents targeting glucagons-like peptide-1 receptor (GLP-1R) in pancreatic islets. 2009 SNM Annual Meeting, abstract, Oral Presentations No.326
【非特許文献2】M. Beche et al. Are radiolabeled GLP-1 receptor antagonists useful for scintigraphy? 2009 SNM Annual Meeting, abstract, Oral Presentations No.327
【発明の概要】
【発明が解決しようとする課題】
【0008】
そこで、本発明は、非侵襲的な膵島の三次元イメージングが可能な膵島イメージング用分子プローブを提供する。
【課題を解決するための手段】
【0009】
本発明は、膵島のイメージングに用いられる分子プローブの前駆体であって、
下記式(1)〜(4)のいずれかで表されるポリペプチド、
下記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、
下記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチドを含み、
前記分子プローブは、膵島のイメージングに用いられる分子プローブである、膵島イメージング用分子プローブ前駆体に関する。
*-DLSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (1) (配列番号1)
*-LSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (2) (配列番号2)
*-SK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (3) (配列番号3)
*-K* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (4) (配列番号4)
[上記式(1)〜(4)において、「*-」は、N末端のα−アミノ基が、保護基により保護されているか、又は、電荷を有さない修飾基により修飾されていることを示し、「K*」は、リジン(lysine)の側鎖のアミノ基が保護基により保護されていることを示し、「-NH2」は、C末端のカルボキシル基がアミド化されていることを示す。]
【0010】
本発明は、その他の態様として、膵島イメージング用分子プローブであって、
下記式(5)〜(8)のいずれかで表されるポリペプチド、
下記式(5)〜(8)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって、膵島に結合可能なポリペプチド、又は、
下記式(5)〜(8)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって、膵島に結合可能なポリペプチドを含み、膵島イメージング用分子プローブに関する。
Z-DLSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (5) (配列番号5)
Z-LSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (6) (配列番号6)
Z-SKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (7) (配列番号7)
Z-KQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (8) (配列番号8)
[上記式(5)〜(8)において、「X」は、側鎖のアミノ基が放射性核種で標識されたリジン残基を示し、前記放射性核種は、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I又は131Iであり、「Z-」は、N末端のα−アミノ基が、非修飾であるか、又は、電荷を有さない修飾基により修飾されていることを示し、「-NH2」は、C末端のカルボキシル基がアミド化されていることを示す。]
【発明の効果】
【0011】
本発明によれば、例えば、ポジトロン放射断層撮影法(PET)やシングルフォトン放射線コンピュータ断層撮影法(SPECT)などにより、膵島のイメージング、好ましくは膵島の三次元イメージング、より好ましくは非侵襲の膵島イメージングが可能となる。
【図面の簡単な説明】
【0012】
【図1】図1A及びBは、本発明の分子プローブの体内分布の経時変化の結果の一例を示すグラフである。
【図2】図2A及びBは、参考例1の分子プローブの体内分布の経時変化の結果の一例を示すグラフである。
【図3】図3A及びBは、参考例2の分子プローブの体内分布の経時変化の結果の一例を示すグラフである。
【図4】図4は、実施例1の分子プローブを用いたblocking実験の結果の一例を示すグラフである。
【図5】図5は、実施例1の分子プローブを用いた膵臓切片のイメージング解析の結果の一例を示す画像である。
【図6】図6は、実施例1の分子プローブを用いた膵島イメージング(PET)の結果の一例を示すPET画像である。
【図7】図7A及びBは、本発明の分子プローブの体内分布の経時変化の結果のその他の例を示すグラフである。
【図8】図8は、実施例におけるBinding Assayの結果の一例を示すグラフである。
【図9】図9A及びBは、本発明の分子プローブの体内分布の経時変化の結果のその他の例を示すグラフである。
【図10】図10は、実施例3の分子プローブを用いた膵臓切片のイメージング解析の結果の一例を示す画像である。
【図11】図11は、実施例4の分子プローブを用いたSPECT画像の一例である。
【発明を実施するための形態】
【0013】
膵島の直径は、例えば、ヒトの場合、50〜500μm程度である。このような膵島を生体内において非侵襲的にイメージング化又は定量化するためには、例えば、膵島に特異的に集積して周囲臓器とのコントラストを生じさせることが可能な分子プローブが必要であると考えられている。このため、様々な分子プローブの研究・開発が行われている。
【0014】
例えば、非特許文献2では、GLP−1R陽性腫瘍細胞及び膵島細胞における、Exendin−4(9−39)の誘導体の誘導体であるLys40(Ahx−DTPA−111In)Exendin−4(9−39)のGLP−1R親和性の研究が行われている。そして、Lys40(Ahx−DTPA−111In)Exendin−4(9−39)の膵島への集積率は0.4%程度であり、GLP−1R陽性腫瘍細胞への集積率も7.5%程度であり、すなわち、Lys40(Ahx−DTPA−111In)Exendin−4(9−39)はGLP−1Rへの親和性が低いという結果が得られている。このため、例えば、膵島に特異的に集積して周囲臓器とのコントラストを生じさせることが可能な新たな分子プローブが求められていることが現状である。
【0015】
本発明は、上記イメージング用分子プローブ前駆体を標識化及び脱保護することにより得られる分子プローブ及び上記イメージング用分子プローブによれば、例えば、PETやSPECT等により非侵襲で膵島の三次元イメージングが可能となり、かつ定量性を確保できる、という知見に基づく。すなわち、本発明は、膵島の非侵襲的な三次元イメージングを可能にするという効果を好ましくは奏する。また、本発明は、好ましくは、非特許文献1及び2に記載されている分子プローブと比較して膵島により特異的に集積させることができるため、膵島の定量用イメージングを行うことができるという効果を奏する。
【0016】
また、上述したとおり、糖尿病の発症過程では、耐糖能異常に先行して膵島量が減少することが知られている。このため、膵島イメージング及び又は膵島量の測定を行うことにより、例えば、糖尿病の発症前や初期の状態で、膵島の微小な変化を見つけることができることから、糖尿病の超早期発見・診断が可能になる。このため、本発明のイメージング用分子プローブの前駆体は、糖尿病の予防・早期発見・診断、好ましくは糖尿病の超早期発見・診断に有用である。
【0017】
すなわち、本発明は、
[1] 膵島のイメージングに用いられる分子プローブの前駆体であって、下記式(1)〜(4)のいずれかで表されるポリペプチド、下記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、下記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチドを含み、前記分子プローブは、膵島のイメージングに用いられる分子プローブである、膵島イメージング用分子プローブ前駆体、
*-DLSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (1) (配列番号1)
*-LSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (2) (配列番号2)
*-SK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (3) (配列番号3)
*-K* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (4) (配列番号4)
[上記式(1)〜(4)において、「*-」はN末端のα−アミノ基が保護基により保護されているか又は電荷を有さない修飾基により修飾されていることを示し、「K*」はリジン(lysine)の側鎖のアミノ基が保護基により保護されていることを示し、「-NH2」はC末端のカルボキシル基がアミド化されていることを示す。];
[2] C末端のリジンの側鎖のアミノ基を、放射性核種を有する芳香環を含む標識化合物により標識化するための、[1]記載の膵島イメージング用分子プローブ前駆体;
[3] 前記電荷を有さない修飾基が、アセチル基、ベンジル基、ベンジルオキシメチル基、o−ブロモベンジルオキシカルボニル基、t−ブチル基、t−ブチルジメチルシリル基、2−クロロベンジル基、2,6−ジクロロベンジル基、シクロヘキシル基、シクロペンチル基、イソプロピル基、ピバリル基、テトラヒドロピラン−2−イル基、トシル基、トリメチルシリル基及びトリチル基からなる群から選択される、[1]又は[2]に記載の膵島イメージング用分子プローブ前駆体;
[4] 膵島イメージング用分子プローブの製造方法であって、[1]から[3]のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護することを含む、膵島イメージング用分子プローブの製造方法;
[5] 前記膵島イメージング用分子プローブ前駆体の標識化が、C末端のリジンの側鎖のアミノ基を放射性核種を有する芳香環を含む標識化合物により標識化することを含む、[4]記載の膵島イメージング用分子プローブの製造方法;
[6] 前記芳香環を含む標識化合物が、下記式(I)で表される基を含む、[5]記載の膵島イメージング用分子プローブの製造方法、
【化1】

[前記式(I)において、Aは芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R1は11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、111In、123I、124I、125I又は131Iを含む置換基を示し、R2は水素原子又はR1とは異なる1又は複数の置換基を示す。];
[7] 膵島イメージング用分子プローブであって、[4]から[6]のいずれかに記載の製造方法により得られうる、膵島イメージング用分子プローブ;
[8] 膵島イメージング用分子プローブであって、下記式(5)〜(8)のいずれかで表されるポリペプチド、下記式(5)〜(8)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって膵島に結合可能なポリペプチド、又は、下記式(5)〜(8)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって膵島に結合可能なポリペプチドを含む膵島イメージング用分子プローブ、
Z-DLSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (5) (配列番号5)
Z-LSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (6) (配列番号6)
Z-SKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (7) (配列番号7)
Z-KQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (8) (配列番号8)
[上記式(5)〜(8)において、「X」は側鎖のアミノ基が放射性核種で標識されたリジン残基を示し、前記放射性核種は11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I又は131Iであり、「Z-」はN末端のα−アミノ基が非修飾であるか又は電荷を有さない修飾基により修飾されていることを示し、「-NH2」はC末端のカルボキシル基がアミド化されていることを示す。];
[9] 前記放射性核種で標識されたリジンの側鎖のアミノ基が、下記式(III)で表される芳香環を含む基と結合している、[8]記載の膵島イメージング用分子プローブ、
【化2】

[前記式(III)において、Aは芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R4は11C、13N、15O、18F、75Br、76Br、77Br、123I、124I、125I又は131Iを含む置換基を示し、R5は水素原子又はR4とは異なる1又は複数の置換基を示し、R3は結合手、C1−C6アルキレン基及びC1−C6オキシアルキレン基のいずれかを示す。];
[10] 膵島イメージング用分子プローブを調製するためのキットであって、[1]から[3]のいずれかに記載の膵島イメージング用分子プローブ前駆体を含む、キット;
[11] さらに、前記膵島イメージング用分子プローブ前駆体の標識化に使用する化合物であって、ハロゲン又は放射性ハロゲンを有する芳香環を含む化合物を含む、[10]記載のキット;
[12] 前記芳香環を含む化合物が、下記式(IV)で表される基を有する化合物である、[11]記載のキット、
【化3】

[前記式(IV)において、Aは芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R6はハロゲン又は放射性ハロゲンを含む置換基を示し、R7は水素原子又はR6とは異なる1又は複数の置換基を示す。];
[13] 膵島のイメージングを行うためのキットであって、[7]から[9]のいずれかに記載の膵島イメージング用分子プローブを含むキット;
[14] [1]から[3]のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護することを含む、膵島のイメージング方法;
[15] [7]から[9]のいずれかに記載の膵島イメージング用分子プローブを投与された被検体から前記膵島イメージング用分子プローブのシグナルを検出することを含む、膵島のイメージング方法;
[16] さらに、前記分子プローブを用いた膵島イメージングの結果から膵島の状態を判定することを含む、[14]又は[15]に記載の膵島のイメージング方法;
[17] [1]から[3]のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護して膵島イメージング用分子プローブを調製すること、及び、
前記分子プローブを用いた膵島イメージングの結果から膵島量を算出することを含む、膵島量の測定方法;
[18] [7]から[9]のいずれかに記載の膵島イメージング用分子プローブを投与された被検体から前記膵島イメージング用分子プローブのシグナルを検出すること、及び、検出した膵島イメージング用分子プローブのシグナルから膵島量を算出することを含む膵島量の測定方法;
[19] さらに、算出した膵島量を提示することを含む、[17]又は[18]に記載の膵島量の測定方法;
に関する。
【0018】
[膵島イメージング]
本明細書において「膵島イメージング」とは、膵島の分子イメージング(molecular imaging)であって、in vivoの膵島の空間的及び/又は時間的分布を画像化することを含む。また、本発明において、膵島イメージングは、糖尿病に関する予防・治療・診断の観点から、膵β細胞を標的分子とすることが好ましく、より好ましくは膵島のGLP−1受容体を標的分子とすることである。さらに、本発明において、膵島イメージングは、膵島量の定量性及びヒトに適用するという観点から、非侵襲で三次元のイメージングであることが好ましい。イメージングの方法としては、非侵襲の膵島イメージングが可能な方法であれば特に制限されず、例えば、ポジトロン放射断層撮影法(PET)、シングルフォトン放射線コンピュータ断層撮影法(SPECT)、磁気共鳴映像法(MRI)、X線・可視光・蛍光・近赤外光・超音波などを利用する方法が挙げられる。これらの中でも、本発明の分子プローブ前駆体を利用し、膵島量の定量を行う観点からはPET及びSPECTが好ましい。
【0019】
[本発明の分子プローブ前駆体]
本発明の分子プローブ前駆体は、上記式(1)〜(4)のいずれかで表されるポリペプチド、上記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、上記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチドを含み、前記分子プローブは膵島のイメージングに用いられる分子プローブである膵島イメージング用分子プローブ前駆体であって、好ましくは上記式(1)〜(4)のいずれかで表されるポリペプチド、上記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、上記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチドからなり、前記分子プローブは膵島のイメージングに用いられる分子プローブである膵島イメージング用分子プローブ前駆体である。
【0020】
本発明の分子プローブ前駆体は、膵島イメージングに用いるポリペプチドであって、上記式(1)〜(4)のいずれかで表されるポリペプチドを含む。上記式(1)〜(4)のポリペプチドのアミノ酸配列は、それぞれ、配列表の配列番号1〜4に記載のアミノ酸配列である。上記式(1)のポリペプチドの第4番目及び第19番目のリジンの側鎖のアミノ基、上記式(2)のポリペプチドの第3番目及び第18番目のリジンの側鎖のアミノ基、上記式(3)のポリペプチドの第2番目及び第17番目のリジンの側鎖のアミノ基、上記式(4)のポリペプチドの第1番目及び第16番目のリジンの側鎖のアミノ基には、アミノ基を保護するための保護基が結合している。また、上記式(1)〜(4)のポリペプチドのN末端のα−アミノ基には、該アミノ基を保護するために保護基が結合しているか、又は、電荷を有さない修飾基により修飾されている。上記式(1)〜(4)のポリペプチドのC末端のカルボキシル基は、膵β細胞との結合性の向上の観点から、アミノ基によりアミド化されている。
【0021】
上記式(1)〜(4)のポリペプチドを含む本発明の分子プローブ前駆体を後述するアミノ基を標識化する標識システムで標識化すると、保護基により保護されていないC末端のリジンの側鎖のアミノ基が標識化されうる。すなわち、上記式(1)のポリペプチドの第32番目のリジンの側鎖のアミノ基、上記式(2)のポリペプチドの第31番目のリジンの側鎖のアミノ基、上記式(3)のポリペプチドの第30番目のリジンの側鎖のアミノ基、及び、上記式(4)のポリペプチドの第29番目のリジンの側鎖のアミノ基が標識化される。
【0022】
ここで、上記式(1)(配列表の配列番号1)における第1番目から第31番目のアミノ酸配列は、リジンの側鎖のアミノ基に結合する保護基及びN末端のα−アミノ基に結合する保護基又は修飾基を除けば、エキセンジン(9−39)のアミノ酸配列と一致する。エキセンジン(9−39)は、膵β細胞上に発現するGLP−1R(グルカゴン様ペプチド−1の受容体)に結合することが知られている。本発明の分子プローブ前駆体を標識化及び脱保護して得られる分子プローブ(以下、「本発明の分子プローブ」ともいう。)も、膵島、好ましくは膵β細胞に結合可能である。
【0023】
本発明の分子プローブ前駆体は、その他の実施形態として、膵島イメージングに用いるポリペプチドであって、上記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸配列が欠失、付加又は置換したポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチドを含み得る。ここで、前記1〜数個とは、1〜10、1〜9、1〜8、1〜7、1〜6、1〜5、1〜4、1〜3、1〜2、及び1個を含みうる。この実施形態の本発明の分子プローブ前駆体においても、上記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸配列が欠失、付加又は置換したポリペプチドである場合は、保護基によるN末端のα−アミノ基の保護又は修飾基によるN末端のα−アミノ基の修飾、及び、C末端のカルボキシル基のアミド化を含むことが好ましく、標識化されるリジンを1つ含み、その他のリジンを含む場合はその他のリジンの側鎖のアミノ基は保護基により保護されていることが好ましい。上記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸配列が欠失、付加又は置換したポリペプチドは、これらを標識化及び脱保護した後、上記式(1)〜(4)のポリペプチドを標識化及び脱保護して得られるポリペプチドと同様の作用効果を有することが好ましく、より好ましくは上記式(1)のポリペプチドを標識化及び脱保護して得られるポリペプチドと同様の作用効果を有することである。
【0024】
本発明の分子プローブ前駆体は、さらにその他の実施形態として、膵島イメージングに用いるポリペプチドであって、上記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチドを含み得る。ここで、前記相同性とは、当業者が通常用いるアルゴリズム、例えば、BLAST又はFASTAなどで算出されるものでよく、あるいは、比較する2つのポリペプチドの同一アミノ酸残基の数を一方のポリペプチド全長で除して得られる数に基づいてもよい。前記相同性は、85%以上、90%以上、95%以上を含みうる。この実施形態の本発明の分子プローブ前駆体においても、上記式(1)〜(4)のポリペプチドと80%以上の相同性を有するポリペプチドである場合は、保護基によるN末端のα−アミノ基の保護又は修飾基によるN末端のα−アミノ基の修飾、及び、C末端のカルボキシル基のアミド化を含むことが好ましく、標識化されるリジンを1つ含み、その他のリジンを含む場合はその他のリジンの側鎖のアミノ基は保護基により保護されていることが好ましい。上記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドは、これらを標識化及び脱保護した後、上記式(1)〜(4)のポリペプチドを標識化及び脱保護して得られるポリペプチドと同様の作用効果を有することが好ましく、より好ましくは上記式(1)のポリペプチドを標識化及び脱保護して得られるポリペプチドと同様の作用効果を有することである。
【0025】
本明細書において「膵島に結合可能」とは、膵島量の定量性及び検査・診断の用途の観点から、本発明の分子プローブが膵β細胞に結合可能であることが好ましく、少なくとも膵臓において膵β細胞に特異的であることがより好ましく、少なくともヒトに対する非侵襲的なイメージングにおけるシグナル検出において他の器官・組織とシグナルが重ならない程度に特異的であることがさらに好ましい。
【0026】
なお、本発明の分子プローブ前駆体は、例えば、Fmoc法等の定法に従ったペプチド合成により製造することができ、そのペプチド合成方法は特に制限されない。
【0027】
本発明の分子プローブ前駆体は、上記のとおり、膵島イメージングに用いられるものであって、ヒトの検査・診断の用途の観点から非侵襲性の膵島イメージングに用いられることが好ましく、同様の観点から膵島量を定量するための膵島イメージングに用いられることが好ましい。さらに、本発明の分子プローブ前駆体は、糖尿病の予防、治療又は診断のための膵島イメージングに用いられることが好ましい。これらの膵島イメージングは、例えば、PET又はSPECTにより行われてもよい。
【0028】
[保護基]
本発明の分子プローブ前駆体における保護基は、本発明の分子プローブの特定のアミノ基、すなわち、本発明の分子プローブ前駆体においてC末端側に位置するリジン側鎖のアミノ基を標識化する間に、その他のアミノ基を保護するものであって、そのような機能を果たせる公知の保護基を使用できる。前記保護基としては、特に制限されず、例えば、9−フルオレニルメチルオキシカルボニル基(Fmoc)、tert−ブトキシカルボニル基(Boc)、ベンジルオキシカルボニル基(Cbz)、2,2,2−トリクロロエトキシカルボニル基(Troc)、アリルオキシカルボニル基(Alloc)、アミノ基、3から20個の炭素のアルキル基、9−フルオレンアセチル基、1−フルオレンカルボン酸基、9−フルオレンカルボン酸基、9−フルオレノン−1−カルボン酸基、ベンジルオキシカルボニル基、キサンチル基(Xan)、トリチル基(Trt)、4−メチルトリチル基(Mtt)、4−メトキシトリチル基(Mmt)、4−メトキシ2,3,6−トリメチル−ベンゼンスルホニル基(Mtr)、メシチレン−2−スルホニル基(Mts)、4,4−ジメトキシベンゾヒドリル基(Mbh)、トシル基(Tos)、2,2,5,7,8−ペンタメチルクロマン−6−スルホニル基(Pmc)、4−メチルベンジル基(MeBzl)、4−メトキシベンジル基(MeOBzl)、ベンジルオキシ基(BzlO)、ベンジル基(Bzl)、ベンゾイル基(Bz)、3−ニトロ−2−ピリジンスルフェニル基(Npys)、1−(4,4−ジメチル−2,6−ジアキソシクロヘキシリデン)エチル基(Dde)、2,6−ジクロロベンジル基(2,6−DiCl−Bzl)、2−クロロベンジルオキシカルボニル基(2−Cl−Z)、2−ブロモベンジルオキシカルボニル基(2−Br−Z)、ベンジルオキシメチル基(Bom)、シクロヘキシルオキシ基(cHxO)、t−ブトキシメチル基(Bum)、t−ブトキシ基(tBuO)、t−ブチル基(tBu)、アセチル基(Ac)及びトリフルオロアセチル基(TFA)などが挙げられ、取扱いの点から、Fmoc及びBocが好ましい。これらの保護基の脱保護の方法は、それぞれ公知であって、当業者であれば適宜脱保護できる。
【0029】
[修飾基]
本発明の分子プローブ前駆体におけるN末端のα−アミノ基は、N末端のα−アミノ基の正電荷を打ち消して、本発明の分子プローブ前駆体を標識化及び脱保護して得られる分子プローブの腎臓への集積を抑制する点から、電荷を有さない修飾基で修飾されていてもよい。電荷を有さない修飾基としては、例えば、上記保護基として記載したものが使用できる。電荷を有さないその他の修飾基としては、例えば、o−ブロモベンジルオキシカルボニル基、t−ブチルジメチルシリル基、2−クロロベンジル(Cl−z)基、シクロヘキシル基、シクロペンチル基、イソプロピル基、ピバリル基、テトラヒドロピラン−2−イル基、トリメチルシリル基等が使用できる。中でも、修飾基としては、アセチル基、ベンジル基、ベンジルオキシメチル基、o−ブロモベンジルオキシカルボニル基、t−ブチル基、t−ブチルジメチルシリル基、2−クロロベンジル基、2,6−ジクロロベンジル基、シクロヘキシル基、シクロペンチル基、イソプロピル基、ピバリル基、テトラヒドロピラン−2−イル基、トシル基、トリメチルシリル基及びトリチル基が好ましい。また、N末端のα−アミノ基を修飾し、その正電荷を打ち消す観点からは、リジンの側鎖のアミノ基に使用した保護基と異なる保護基が好ましく、より好ましくはアセチル基である。
【0030】
[標識化合物]
本発明の分子プローブ前駆体は、C末端のリジンの側鎖のアミノ基を放射性核種を有する芳香環を含む標識化合物により標識化するための分子プローブ前駆体であることが好ましく、上記式(1)〜(4)のポリペプチドからなる本発明の分子プローブ前駆体においてC末端側に位置するリジン側鎖のアミノ基を該標識化合物により標識化するための分子プローブ前駆体であることが好ましい。
【0031】
放射性核種としては、例えば、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、82Rb、99mTc、111In、123I、124I、125I、131Iが挙げられる。PETを行う観点からは、放射性核種は、11C、13N、15O、18F、62Cu、64Cu、68Ga、75Br、76Br、82Rb、124Iなどのポジトロン放出核種が好ましい。SPECTを行う観点からは、放射性核種は、67Ga、99mTc、77Br、111In、123I、125Iなどのγ線放出核種が好ましい。これらの中でも、18F、75Br、76Br、77Br、123I、124Iなどの放射性ハロゲン核種がより好ましく、特に好ましくは18F、123I、124Iである。
【0032】
本明細書において「放射性核種を有する芳香環を含む化合物」とは、放射性核種と、芳香族炭化水素基又は芳香族複素環基とを有する化合物のことをいい、好ましくは下記式(I)で表される基を有する化合物が挙げられる。
【0033】
【化4】

【0034】
上記式(I)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示す。芳香族炭化水素基としては、炭素数6〜18の芳香族炭化水素基が好ましく、例えば、フェニル基、o−トリル基、m−トリル基、p−トリル基、2,4−キシリル基、p−クメニル基、メシチル基、1−ナフチル基、2−ナフチル基、1−アンスリル基、2−アンスリル基、9−アンスリル基、1−フェナンスリル基、9−フェナンスリル基、1−アセナフチル基、2−アズレニル基、1−ピレニル基、2−トリフェニレニル基、o−ビフェニリル基、m−ビフェニリル基、p−ビフェニリル基、ターフェニル基等が挙げられる。芳香族複素環基としては、窒素原子、酸素原子又は硫黄原子を1又は2個有し、かつ、5〜10員の複素環基が好ましく、例えば、トリアゾリル基、3−オキサジアゾリル基、2−フリル基、3−フリル基、2−チエニル基、3−チエニル基、1−ピローリル基、2−ピローリル基、3−ピローリル基、2−ピリジル基、3−ピリジル基、4−ピリジル基、2−ピラジル基、2−オキサゾリル基、3−イソオキサゾリル基、2−チアゾリル基、3−イソチアゾリル基、2−イミダゾリル基、3−ピラゾリル基、2−キノリル基、3−キノリル基、4−キノリル基、5−キノリル基、6−キノリル基、7−キノリル基、8−キノリル基、1−イソキノリル基、2−キノキサリニル基、2−ベンゾフリル基、2−ベンゾチエニル基、N−インドリル基、N−カルバゾリル基等が挙げられる。これらの中でも、Aは、フェニル基、トリアゾリル基、ピリジル基が好ましい。
【0035】
上記式(I)において、R1は、11C、13N、15O、64Cu、67Ga、68Ga、99mTc、又は放射性ハロゲンを含む置換基を示し、例えば、放射性ハロゲン原子、放射性ハロゲン化C1−C3アルキル基、放射性ハロゲン化C1−C3アルコキシ基等が挙げられる。放射性ハロゲンとしては、18F、75Br、76Br、77Br、123I、124I、125I、131I等が挙げられる。本明細書において「C1−C3アルキル基」とは、1〜3個の炭素原子を有するアルキル基のことをいい、メチル基、エチル基、プロピル基等が挙げられる。本明細書において「放射性ハロゲン化C1−C3アルキル基」とは、1〜3個の炭素原子を有し、かつ、水素原子が放射性ハロゲンによって置換されたアルキル基のことをいう。本明細書において「C1−C3アルコキシ基」とは、1〜3個の炭素原子を有するアルコキシ基のことをいい、メトキシ基、エトキシ基、プロポキシ基等が挙げられる。本明細書において「放射性ハロゲン化C1−C3アルコキシ基」とは、1〜3個の炭素原子を有し、かつ、水素原子が放射性ハロゲンによって置換されたアルコキシ基のことをいう。R1は、定量性の観点からは、オルト位、メタ位、パラ位のいずれかの置換基であることが好ましく、より好ましくはメタ位又はパラ位のいずれかの置換基である。
【0036】
上記式(I)において、R2は、水素原子、又は、R1とは異なる1又は複数の置換基を示す。R2は、水素原子であっても、置換基であってもよいが、水素原子であること、つまり、上記式(I)においてAはR1以外の置換基で置換されていないことが好ましい。R2が複数の置換基である場合、それらは、同一であっても良いし、異なっていてもよい。置換基としては、水酸基、電子求引性基、電子供与性基、C1−C6アルキル基、C2−C6アルケニル基、C2−C6アルキニル基等が挙げられる。電子求引性基としては、シアノ基、ニトロ基、ハロゲン原子、カルボニル基、スルホニル基、アセチル基、フェニル基等が挙げられる。ハロゲン原子としては、フッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられる。本明細書において「C1−C6アルキル基」とは、1〜6個の炭素原子を有するアルキル基のことをいい、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソペンチル基、ヘキシル基が挙げられる。本明細書において「C2−C6アルケニル基」とは、2〜6個の炭素原子を有するアルケニル基のことをいい、例えば、ビニル基、1−プロペニル基、2−プロペニル基、イソプロペニル基、1−ブテニル基、2−ブテニル基、3−ブテニル基が挙げられる。本明細書において「C2−C6アルキニル基」とは、2〜6個の炭素原子を有するアルキニル基のことをいい、例えば、エチニル基、1−プロピニル基、2−プロピニル基、1−ブチニル基、2−ブチニル基、3−ブチニル基が挙げられる。これらの中でも、置換基としては、水酸基及び電子求引性基が好ましい。
【0037】
放射性核種を有する芳香環を含む標識化合物としては、例えば、[18F]fluorobenzoyl基([18F]FB)、[123I]iodobenzoyl基([123I]IB)、[124I]iodobenzoyl基([124I]IB)、[125I]iodobenzoyl基([125I]IB)、[131I]iodobenzoyl基([131I]IB)、[123I]iodo p-hydroxyphenylpropionyl基、[124I]iodo p-hydroxyphenylpropionyl基、[125I]iodo p-hydroxyphenylpropionyl基又は[131I]iodo p-hydroxyphenylpropionyl基を有する化合物が好ましく、より好ましくは[18F]N-succinimidyl 4-fluorobenzoate([18F]SFB)、[123I]N-succinimidyl 3-iodobenzoate([123I]SIB)、[124I]N-succinimidyl 3-iodobenzoate([124I]SIB)、[123I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide ester、[124I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide esterである。
【0038】
本発明の分子プローブ前駆体は、64Cu、67Ga、68Ga、99mTc、111In等の金属放射性同位元素(金属核種)で標識化する観点からは、標識化されるC末端のリジンの側鎖のアミノ基に、例えば、上記金属放射性同位元素(金属核種)と結合可能なキレート部位や、ペプチドとの結合を担うリンカー部が結合していてもよい。キレート化合物としては、例えば、ジエチレントリアミン五酢酸(DTPA)、6−ヒドラジノピリジン−3−カルボン酸(HYNIC)、テトラアザシクロドデカン四酢酸(DOTA)、dithisosemicarbazone(DTS)、diaminedithiol(DADT)、mercaptoacetylglycylglycylglycine(MAG3)、monoamidemonoaminedithiol(MAMA)、diamidedithiol(DADS)、propylene diamine dioxime(PnAO)等が挙げられる。
【0039】
本発明の分子プローブ前駆体は、標識化及び脱保護して得られる分子プローブと膵島との親和性、好ましくは該分子プローブと膵β細胞との親和性、より好ましくは分子プローブと膵島のGLP−1受容体との親和性の点からは、ジエチレントリアミン五酢酸(DTPA)がC末端側に位置するリジン側鎖のアミノ基に結合していないことが好ましく、より好ましくは金属放射性同位元素(金属核種)と結合可能なキレート部位が結合していないことである。上記キレート部位を形成しうるその他のキレート化合物としては、例えば、6−ヒドラジノピリジン−3−カルボン酸(HYNIC)、テトラアザシクロドデカン四酢酸(DOTA)、dithisosemicarbazone(DTS)、diaminedithiol(DADT)、mercaptoacetylglycylglycylglycine(MAG3)、monoamidemonoaminedithiol(MAMA)、diamidedithiol(DADS)、propylene diamine dioxime(PnAO)等が挙げられる。
【0040】
[本発明の分子プローブの調製方法]
本発明の分子プローブは、本発明の分子プローブ前駆体を、イメージング方法に応じた標識化を行い、その後、保護基の脱保護をすることで調製することができる。標識化に用いられる放射性核種としては、例えば、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I、131I等が挙げられる。標識化の手順としては、例えば、PETを行う場合には11C、15O、18F、124Iなどのポジトロン放出核種を、SPECTを行う場合には99mTc、123I、125Iなどのγ線放出核種を、公知の方法により標識化することが挙げられる。18Fの場合は、例えば、[18F]SFB([18F]N-succinimidyl 4-fluorobenzoate)などを用いる方法により標識化することができる。123I及び124Iの場合は、例えば、[123/124I]SIB([123/124I]N-succinimidyl 3-iodobenzoate)及び[123/124I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide esterなどを用いる方法により標識化することができる。125I及び131Iの場合は、例えば、[125/131I]SIB([125/131I]N-succinimidyl 3-iodobenzoate)及び[125/131I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide esterなどを用いる方法により標識化することができる。また、金属核種を用いて標識化する場合は、例えば、上記キレート化合物を用いて標識化することが挙げられる。これらの方法で上記式(1)〜(4)のポリペプチドを標識すると、上記式(1)のポリペプチドの第32番目のリジンの側鎖のアミノ基、上記式(2)のポリペプチドの第31番目のリジンの側鎖のアミノ基、上記式(3)のポリペプチドの第30番目のリジンの側鎖のアミノ基及び上記式(4)のポリペプチドの第29番目のリジンの側鎖のアミノ基が標識される。但し、本発明における標識化の方法はこれらの方法に限定されない。標識後の脱保護は、保護基の種類に応じた公知の方法で行うことができる。したがって、本発明は、その他の態様として、本発明の分子プローブの製造方法であって、本発明の分子プローブ前駆体を標識化及び脱保護することを含む製造方法に関する。
【0041】
本発明の分子プローブの製造方法は、C末端のリジンの側鎖のアミノ基を、放射性核種を有する芳香環を含む標識化合物により標識化することを含むことが好ましい。前記芳香環を含む標識化合物は、上記式(I)で表される基を含むことが好ましい。
【0042】
本発明の分子プローブの製造方法において、放射性核種を有する芳香環を含む標識化合物は、上記式(I)で表される基が、エステル結合を介してスクシンイミドと結合したスクシンイミジルエステル化合物であることが好ましく、より好ましくは下記式(II)で表されるスクシンイミジルエステル化合物である。
【0043】
【化5】

【0044】
上記式(II)において、A、R1及びR2は上記式(I)と同様である。上記式(II)においてR3は、結合手、C1−C6アルキレン基又はC1−C6オキシアルキレン基であることが好ましい。本明細書において「C1−C6アルキレン基」とは、1〜6個の炭素原子を有するアルキレン基のことをいい、例えば、メチレン基、エチレン基、プロピレン基、ブチレン基、ペンチル基、ヘキシル基等の直鎖状または分岐状のアルキレン基が挙げられる。本明細書において「C1−C6オキシアルキレン基」とは、1〜6個の炭素原子を有するオキシアルキレン基のことをいい、例えば、オキシメチレン基、オキシエチレン基、オキシプロピレン基、オキシブチレン基、オキシペンチル基等が挙げられる。R3としては、分子プローブと膵島との親和性、好ましくは分子プローブと膵β細胞との親和性、より好ましくは分子プローブと膵島のGLP−1受容体との親和性の点から、結合手、メチレン基、エチレン基が好ましく、より好ましくは結合手である。
【0045】
また、放射性核種を有する芳香環を含む標識化合物は、[18F]fluorobenzoyl基([18F]FB)、[123I]iodobenzoyl基([123I]IB)、[124I]iodobenzoyl基([124I]IB)、[125I]iodobenzoyl基([125I]IB)、[131I]iodobenzoyl基([131I]IB)、[123I]iodo p-hydroxyphenylpropionyl基、[124I]iodo p-hydroxyphenylpropionyl基、[125I]iodo p-hydroxyphenylpropionyl基又は[131I]iodo p-hydroxyphenylpropionyl基を有する化合物が好ましく、より好ましくは[18F]N-succinimidyl 4-fluorobenzoate、[123I]N-succinimidyl 3-iodobenzoate、[124I]N-succinimidyl 3-iodobenzoate、[123I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide ester、[124I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide esterである。
【0046】
本発明の分子プローブの製造方法において、上記式(I)で表される基を有する標識化合物及び/又は上記放射性核種を有する芳香環を含む標識化合物の合成は、自動合成装置を用いて行ってもよく、また、上記式(I)で表される基を有する標識化合物及び/又は上記放射性核種を有する芳香環を含む標識化合物の合成、及び、該標識化合物を用いた本発明の分子プローブ前駆体の標識化及び脱保護を、1つの自動合成装置によって行ってもよい。
【0047】
[本発明の分子プローブ]
本発明は、さらにその他の態様として、本発明の分子プローブの製造方法により得られうる膵島イメージング用分子プローブに関する。本発明のイメージング用分子プローブによれば、膵島の三次元イメージング、好ましくは非侵襲的な膵島の三次元イメージングを行うことができる。本発明の分子プローブは、例えば、62Cu、64Cu、67Ga、68Ga、82Rb、99mTc等の金属核種や、11C、13N、15O、18F、75Br、76Br、77Br、123I、124I、125I、131I等の核種が結合していてもよく、好ましくは11C、13N、15O、18F、75Br、76Br、77Br、123I、124I等の放射性核種が結合していることであり、より好ましくは18F、123I、124I等の放射性核種が結合していることである。
【0048】
本発明の分子プローブは、腎臓への集積を抑制する点から、N末端のα−アミノ基が電荷を有さない修飾基によって修飾されていてもよい、電荷を有さない修飾基としては、上記のものが挙げられ、N末端のα−アミノ基を修飾し、その正電荷を打ち消す観点からは、アセチル基が好ましい。
【0049】
本発明の分子プローブは、分子プローブと膵島との親和性、好ましくは分子プローブと膵β細胞との親和性、より好ましくは分子プローブと膵島のGLP−1受容体との親和性の点から、DTPAが、C末端側に位置するリジン側鎖のアミノ基、すなわち、上記式(1)のポリペプチドの第32番目のリジンの側鎖のアミノ基、上記式(2)のポリペプチドの第31番目のリジンの側鎖のアミノ基、上記式(3)のポリペプチドの第30番目のリジンの側鎖のアミノ基又は上記式(4)のポリペプチドの第29番目のリジンの側鎖のアミノ基に結合していないことが好ましく、より好ましくは金属放射性同位元素(金属核種)と結合可能なキレート部位が上記リジンの側鎖のアミノ基に結合していないことである。
【0050】
本発明は、さらにその他の態様として、膵島イメージング用分子プローブであって、下記式(5)〜(8)のいずれかで表されるポリペプチド、下記式(5)〜(8)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって膵島に結合可能なポリペプチド、又は、下記式(5)〜(8)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって膵島に結合可能なポリペプチドを含む膵島イメージング用分子プローブに関し、好ましくは下記式(5)〜(8)のいずれかで表されるポリペプチド、下記式(5)〜(8)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって膵島に結合可能なポリペプチド、又は、下記式(5)〜(8)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって膵島に結合可能なポリペプチドからなる膵島イメージング用分子プローブに関する。
Z-DLSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (5) (配列番号5)
Z-LSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (6) (配列番号6)
Z-SKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (7) (配列番号7)
Z-KQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (8) (配列番号8)
[上記式(5)〜(8)において、「X」は側鎖のアミノ基が放射性核種で標識されたリジン残基を示し、前記放射性核種は11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I又は131Iであり、「Z-」はN末端のα−アミノ基が非修飾であるか、又は、電荷を有さない修飾基により修飾されていることを示し、「-NH2」はC末端のカルボキシル基がアミド化されていることを示す。]
【0051】
放射性核種は、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I又は131Iである。PETを行う観点からは、11C、13N、15O、18F、64Cu、68Ga、75/76Br、82Rb、124Iなどのポジトロンを放出する核種が好ましい。SPECTを行う観点からは、67Ga、99mTc、77Br、123Iなどのγ線などのシングルフォトンを放出する核種が好ましい。
【0052】
本発明の分子プローブのN末端のα−アミノ基は、非修飾、すなわち、アミノ基のままであるか、又は、電荷を有さない修飾基により修飾されている。膵島への集積を増加させ、かつ、膵島の周囲臓器への集積を抑制する点からは、N末端のα−アミノ基が非修飾、すなわち、アミノ基であることが好ましく、腎臓への集積を抑制する点からは、電荷を有さない修飾基で修飾されていることが好ましい。電荷を有さない修飾基は上記のとおりである。
【0053】
本発明の分子プローブは、膵島イメージングに用いるポリペプチドであって、上記式(5)〜(8)のいずれかで表されるポリペプチドを含む。上記式(5)〜(8)のポリペプチドのアミノ酸配列は、それぞれ、配列表の配列番号5〜8に記載のアミノ酸配列である。また、上記式(5)(配列表の配列番号5)における第1番目から第31番目のアミノ酸配列は、N末端のα−アミノ基が修飾基と結合している場合を除けば、エキセンジン(9−39)のアミノ酸配列と一致する。
【0054】
本発明の分子プローブにおいて、前記放射性核種で標識されたリジンの側鎖のアミノ基が、下記式(III)で表される芳香環を含む基と結合していることが好ましい。
【0055】
【化6】

【0056】
上記式(III)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示し、芳香族炭化水素基及び芳香族複素環基としては上記のとおりである。R5は、水素原子又はR4とは異なる1又は複数の置換基を示し、R2と同様のものが挙げられる。
【0057】
上記式(III)において、R4は、11C、13N、15O、18F、75Br、76Br、77Br、123I、124I、125I又は131Iを含む置換基を示す。R4としては、11C原子、13N原子、15O原子、18F原子、75Br原子、76Br原子、77Br原子、123I原子、124I原子、125I原子、131I原子、[18F]フッ素で置換されたC1−C3アルキル基、[18F]フッ素で置換されたC1−C3アルコキシ基、[123I]ヨウ素で置換されたC1−C3アルキル基、[124I]ヨウ素で置換されたC1−C3アルキル基、[125I]ヨウ素で置換されたC1−C3アルキル基、[131I]ヨウ素で置換されたC1−C3アルキル基、[123I]ヨウ素で置換されたC1−C3アルコキシ基、[124I]ヨウ素で置換されたC1−C3アルコキシ基、[125I]ヨウ素で置換されたC1−C3アルコキシ基、[131I]ヨウ素で置換されたC1−C3アルコキシ基等が挙げられる。C1−C3アルキル基としては、メチル基、エチル基、プロピル基等が挙げられる。C1−C3アルコキシ基としては、メトキシ基、エトキシ基、プロポキシ基等が挙げられる。R4は、定量性の観点からは、オルト位、メタ位、パラ位のいずれかの置換基であることが好ましく、より好ましくはメタ位又はパラ位のいずれかの置換基である。
【0058】
上記式(III)において、R3は、上記式(II)と同様に、結合手、C1−C6アルキレン基及びC1−C6オキシアルキレン基のいずれかであることが好ましく、膵島、好ましくは膵β細胞、より好ましくは膵島のGLP−1受容体との親和性の点から、結合手、メチレン基、エチレン基がより好ましく、さらに好ましくは結合手である。
【0059】
下記式(III)で表される芳香環を含む基は、膵島、好ましくは膵β細胞、より好ましくは膵島のGLP−1受容体との親和性の点から、炭素数が7以上20以下であることが好ましく、より好ましくは7以上13以下、さらに好ましくは7以上9以下である。
【0060】
本発明の分子プローブにおいて、放射性核種で標識されたリジンの側鎖のアミノ基に結合する放射性核種を有する基は、炭素数が13以下であることが好ましく、より好ましくは10以下であり、さらに好ましくは9以下である。また、その下限は、例えば、1以上であり、7以上が好ましい。したがって、放射性核種で標識されたリジンの側鎖のアミノ基に結合する放射性核種を有する基は、炭素数が1以上13以下であることが好ましく、より好ましくは7以上10以下であり、さらに好ましくは7以上9以下である。
【0061】
[イメージング方法]
本発明は、さらにその他の態様として、本発明の分子プローブ前駆体を標識化し、その後、保護基を脱保護することを含む膵島のイメージング方法に関する。本発明のイメージング方法は、本発明の分子プローブを用いて膵島をイメージングすることを含んでもよい。本発明のイメージング方法は、検査・診断の用途の観点から、膵β細胞のイメージング方法であることが好ましい。前駆体の標識化及び脱保護については上記のとおりであって、膵島イメージングについても上記のとおりである。また、本発明のイメージング方法は、さらに、前記分子プローブを用いた膵島イメージングの結果から膵島の状態を判定することを含んでもよい。分子プローブを用いた膵島イメージングの結果から膵島の状態を判定することは、例えば、膵島イメージングの画像を解析することにより膵島の有無を判断すること、膵島量の増減を判断すること等を含む。
【0062】
本発明は、さらにその他の態様として、予め被検体に投与された本発明のイメージング用分子プローブのシグナル及び又は予め膵島に結合させた本発明のイメージング用分子プローブのシグナルを検出することを含む、膵島のイメージング方法に関する。本発明のイメージング方法において、イメージングするために十分な量の本発明の分子プローブを投与された被検体から本発明の分子プローブのシグナルを検出することが好ましく、イメージングするために十分な量が予め膵島に結合させた本発明の分子プローブのシグナルを検出することがより好ましい。
【0063】
本発明の分子プローブのシグナルの検出は、例えば、PETを用いた測定及び/又はSPECTを用いた測定等により行うことができる。本発明のイメージング方法において、検出されたシグナルを再構成処理して画像データに変換し表示する工程を含んでいてもよい。PETを用いた測定及びSPECTを用いた測定には、例えば、イメージの撮影、膵島量の測定等を含む。
【0064】
SPECTを用いた測定は、例えば、本発明の分子プローブを投与された被検体(以下、「対象」ともいう)から放出されるγ線をガンマカメラにより測定することを含む。ガンマカメラによる測定は、例えば、本発明の分子プローブの標識に使用した上記放射性核種から放出される放射線(γ線)を一定時間単位で測定することを含み、好ましくは放射線が放出される方向及び放射線数量を一定時間単位で測定することを含む。本発明のイメージング方法は、さらに、放射線の測定により得られた測定された本発明の分子プローブの分布を断面画像として表すこと、及び、得られた断面画像を再構成することを含んでいてもよい。対象としては、ヒト及び又はヒト以外の哺乳類が挙げられる。
【0065】
PETを用いた測定は、例えば、本発明の分子プローブを投与された被検体から、ポジトロンと電子との結合により生成する1対の消滅放射線をPET用検出器で同時計数することを含み、さらに、計測した結果に基づきポジトロンを放出する放射性核種の位置の三次元分布を描写することを含んでいてもよい。
【0066】
本発明のイメージング方法において、SPECTの測定又はPETの測定とあわせて、X線CTやMRIの測定を行ってもよい。これにより、例えば、SPECTにより得られた画像又はPETにより得られた画像(機能画像)と、CTにより得られた画像又はMRIにより得られた画像(形態画像)とを融合させた融合画像を得ることができる。
【0067】
本発明のイメージング方法は、本発明の分子プローブを対象に投与すること、及び、分子プローブの投与から一定時間経過後、PET又はSPECT等の手段による測定を行うことを含むことができ、画像化のために所望のコントラストを得るために十分な量の本発明の分子プローブを投与することを含んでいてもよい。また、本発明のイメージング方法は、上述のように、本発明のプローブを被検体に投与し、一定時間経過後に行うことができるから、本発明のイメージング方法は、本発明の分子プローブを対象に投与することを含んでいなくてもよい。PET等による測定には、例えば、イメージの撮影、膵島量の測定等を含む。投与対象としては、ヒト及び又はヒト以外の哺乳類が挙げられる。対象への投与は、局所的であってもよく、全身的であってもよい。投与経路は、対象の状態等に応じて適宜決定できるが、例えば、静脈、動脈、皮内、腹腔内への注射又は輸液等が挙げられる。本発明の分子プローブは、担体とともに投与することが好ましい。担体としては、例えば、水性溶媒及び非水性溶媒が使用できる。水性溶媒としては、例えば、リン酸カリウム緩衝液、生理食塩水、リンゲル液、蒸留水等が挙げられる。非水性溶媒としては、例えば、ポリエチレングリコール、植物性油脂、エタノール、グリセリン、ジメチルスルホキサイド、プロピレングリコール等が挙げられる。膵島のイメージング又は膵島量の測定のための本発明の分子プローブの用量は、例えば、1μg以下とすることができる。投与から測定までの時間は、例えば、分子プローブの膵島への結合時間、分子プローブの種類及び分子プローブの分解時間等に応じて適宜決定できる。
【0068】
[膵島量の測定方法]
本発明は、さらにその他の態様として、膵島量の測定方法であって、本発明の分子プローブ前駆体を標識化及び脱保護して本発明の分子プローブを調製すること、及び、分子プローブを用いた膵島イメージングの結果から膵島量を算出することを含む膵島量の測定方法に関する。本発明の膵島量の測定方法は、調製した本発明の分子プローブを用いて膵島イメージングを行うことを含んでもよい。標識化及び脱保護については上記のとおりであって、膵島イメージングについても上記のとおりである。分子プローブを用いた膵島イメージングの結果からの膵島量の算出は、例えば、膵島イメージングの画像を解析すること等により行うことができる。また、イメージングの結果からイメージングの対象物の定量を行うことは、当業者であれば、例えば、検量線や適当なプログラムを用いて容易に行うことができる。本発明の膵島量の測定方法は、検査・診断の用途の観点から、膵β細胞量の測定方法であることが好ましい。
【0069】
本発明は、さらにその他の態様として、膵島量の測定方法であって、予め被検体に投与された本発明のイメージング用分子プローブのシグナル及び又は予め膵島に結合させた本発明のイメージング用分子プローブのシグナルを検出すること、及び、検出したイメージング用分子プローブのシグナルから膵島量を算出することを含む膵島量の測定方法に関する。
【0070】
本発明の膵島量の測定方法は、さらに、算出した膵島量を提示することを含んでいてもよい。算出した膵島量を提示することは、例えば、算出した膵島量を保存又は外部に出力することを含む。外部に出力することは、例えば、モニタに表示すること、及び、印字すること等を含む。
【0071】
[糖尿病の予防、治療、診断方法]
本発明は、さらにその他の態様として、糖尿病の予防又は治療又は診断方法に関する。本発明の糖尿病の予防又は治療又は診断方法は、具体的には、本発明のイメージング用分子プローブ前駆体を標識化及び脱保護して膵島イメージング用分子プローブを調製すること、前記膵島イメージング用分子プローブを用いて膵島のイメージングを行うこと、及び、得られた膵島の画像及び又は膵島量に基づき膵島の状態を判定して糖尿病の診断することを含み、前記診断に基づき糖尿病の予防又は治療することを含みうる。上述したとおり、糖尿病の発症過程では、膵島量(とりわけ、膵β細胞量)が耐糖能異常に先行して減少するが、機能異常が検出・自覚される段階に至ってからでは、糖尿病はすでに治療が難しい段階となっている。しかし、本発明の分子プローブ前駆体及び又は本発明の分子プローブを用いたイメージング方法及び又は膵島量の測定方法によれば、膵島量及び又は膵β細胞量の減少を早期に発見することができ、ひいては、新たな糖尿病の予防・治療・診断法が構築できる。糖尿病の予防・治療・診断の対象としては、ヒト及び又はヒト以外の哺乳類が挙げられる。例えば、本発明の糖尿病の予防方法は、定期的に膵島量の測定を行い、膵島量の減少傾向の有無をチェックすることが含むことができる。また、本発明の糖尿病の治療方法は、対象に対して行われる投薬や食事療法を含む治療効果を膵島量の変化に着目して評価することを含むことができる。そして、本発明の糖尿病の診断方法は、膵島のイメージング又は膵島量の測定を行い、基準となる大きさ又は量との比較、あるいは、糖尿病の進行度を判断することを含むことができる。
【0072】
本発明は、好ましいその他の態様として、糖尿病の超早期診断方法に関する。本発明の糖尿病の超早期診断方法は、例えば、人間ドック、健康診断において本発明の方法により膵島のイメージング及び又は膵島量の測定を行うこと、及び、得られた膵島の画像及び又は膵島量に基づき膵島の状態を判定することを含むことができる。また、本発明の糖尿病の治療方法は、本発明の方法により膵島のイメージング及び又は膵島量の測定を行うこと、及び、得られた膵島の画像及び又は膵島量に基づき膵島の機能回復を評価することを含むことができる。
【0073】
[本発明のキット]
本発明は、さらにその他の態様として、膵島イメージング用分子プローブの調製のためのキットであって、本発明の分子プローブ前駆体を含むキットに関する。本発明のキットの実施形態としては、本発明の分子プローブを調製するためのキット、本発明のイメージング方法を行うためのキット、本発明の膵島量の測定方法を行うためのキット、本発明の糖尿病の予防又は治療又は診断のキットなどが挙げられる。本発明のキットは、これらの各実施形態において、それぞれの形態に応じた取扱い説明書を含むことが好ましい。
【0074】
本発明のキットは、例えば、前記膵島イメージング用分子プローブ前駆体の標識化に使用する化合物であって、ハロゲン又は放射性ハロゲンを有する芳香環を含む化合物を含んでいてもよい。前記芳香環を含む化合物は、下記式(IV)で表される基を有する化合物であることが好ましい。
【0075】
【化7】

【0076】
上記式(IV)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示し、芳香族炭化水素基及び芳香族複素環基としては上記のとおりである。R7は、水素原子又はR6とは異なる1又は複数の置換基を示し、R2と同様のものが挙げられる。R6は、ハロゲン又は放射性ハロゲンを含む置換基を示す。ハロゲンを含む置換基としては、F原子、Br原子、I原子、フッ素で置換されたC1−C3アルキル基、フッ素で置換されたC1−C3アルコキシ基、ヨウ素で置換されたC1−C3アルキル基、ヨウ素で置換されたC1−C3アルコキシ基等が挙げられる。放射性ハロゲンを含む置換基としては、R1と同様のものが挙げられる。R6は、定量性の観点からは、オルト位、メタ位、パラ位のいずれかの置換基であることが好ましく、より好ましくはメタ位又はパラ位のいずれかの置換基である。
【0077】
放射性核種を有する芳香環を含む標識化合物は、上記式(IV)で表される基が、エステル結合を介してスクシンイミドと結合したスクシンイミジルエステル化合物であることが好ましく、より好ましくは下記式(V)で表されるスクシンイミジルエステル化合物である。
【0078】
【化8】

【0079】
上記式(V)において、A、R6及びR7は上記式(IV)と同様である。上記式(V)において、R3は、上記式(II)及び(III)と同様に、結合手、C1−C6アルキレン基及びC1−C6オキシアルキレン基のいずれかであることが好ましく、膵島、好ましくは膵β細胞、より好ましくは膵島のGLP−1受容体との親和性の点から、結合手、メチレン基、エチレン基がより好ましく、さらに好ましくは結合手である。
【0080】
また、放射性核種を有する芳香環を含む標識化合物は、例えば、[18F]fluorobenzoyl基、[123I]iodobenzoyl基、[124I]iodobenzoyl基、[125I]iodobenzoyl基、[131I]iodobenzoyl基、[123I]iodo p-hydroxyphenylpropionyl基、[124I]iodo p-hydroxyphenylpropionyl基、[125I]iodo p-hydroxyphenylpropionyl基、[131I]iodo p-hydroxyphenylpropionyl基を有する化合物が好ましく、より好ましくは[18F]N-succinimidyl 4-fluorobenzoate、[123I]N-succinimidyl 3-iodobenzoate、[124I]N-succinimidyl 3-iodobenzoate、[123I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide ester、[124I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide esterである。本発明のキットは、例えば、上記標識化合物及び/又は標識化合物を作成するための化合物を用いた本発明の分子プローブ前駆体の標識化方法が記載された取扱い説明書を含んでいてもよい。
【0081】
本発明のイメージング用分子プローブ前駆体を含むキットは、さらに、上記標識化合物の出発原料を含むことが好ましい。[18F]N-succinimidyl 4-fluorobenzoateの出発原料としては、例えば、ethyl 4-(trimethylammonium triflate) benzoate、ethyl 4-(tosyloxy)benzoate、ethyl 4-(methylsulfonyloxy)benzoate等が挙げられる。[123/124/125/131I]N-succinimidyl 3-iodobenzoateの出発原料としては、例えば、2,5-dioxopyrrolidin-1-yl 3-(tributylstannyl)benzoate等が挙げられる。
【0082】
本発明は、さらにその他の態様として、本発明の分子プローブを含むキットに関する。本形態のキットの実施形態としては、本発明のイメージング方法を行うためのキット、本発明の膵島量の測定方法を行うためのキット、本発明の糖尿病の予防又は治療又は診断のキットなどが挙げられる。これらの各実施形態において、それぞれの形態に応じた取扱い説明書を含むことが好ましい。
【0083】
本発明のキットにおいて、本発明のイメージング用分子プローブは、注射液の形態で含むことが好ましい。したがって、本発明のキットは、本発明のイメージング用分子プローブを含有する注射液を含むことが好ましい。注射液は、有効成分とする本発明のイメージング用分子プローブを含み、さらに、例えば、担体等の医薬品添加物を含んでいてもよい。本明細書において医薬品添加物は、日本薬局方、アメリカ薬局方、ヨーロッパ薬局方等で医薬品添加物として許認可を受けている化合物のことをいう。担体としては、例えば、水性溶媒及び非水性溶媒が挙げられる。水性溶媒としては、例えば、リン酸カリウム緩衝液、生理食塩水、リンゲル液、蒸留水等が挙げられる。非水性溶媒としては、例えば、ポリエチレングリコール、植物性油脂、エタノール、グリセリン、ジメチルスルホキサイド、プロピレングリコール等が挙げられる。また、本発明のキットは、本発明のイメージング用分子プローブを入れるための容器をさらに含んでいてもよく、本発明のイメージング用分子プローブ及び本発明のイメージング用分子プローブを含有する注射液が容器に充填されていてもよい。容器としては、例えば、シリンジやバイアル瓶等が挙げられる。
【0084】
本発明のキットは、例えば、バッファー、浸透圧調整剤等の分子プローブを調製するための成分や、注射器等の分子プローブの投与に使用する器具等をさらに含むことができる。
【0085】
本発明の分子プローブ前駆体を含むキットは、さらに、例えば、標識化合物の自動合成装置、及び、該標識化合物の自動合成装置を用いた上記式(I)で表される基を有する標識化合物及び/又は上記放射性核種を有する芳香環を含む標識化合物の合成方法が記載された取扱い説明書を含んでいてもよい。該自動合成装置は、標識化合物の合成に加えて、例えば、合成した標識化合物を用いた膵島イメージング用分子プローブ前駆体の標識化及び脱保護が可能な自動合成装置であってもよい。該キットは、さらに、標識化合物の合成に使用する放射性核種を含む試薬を含んでいてもよい。放射性核種を含む試薬としては、例えば、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、111In、123I、124I、125I又は131Iといった放射性同位元素を含む試薬が挙げられる。
【0086】
本発明は、さらにその他の態様として、本発明の分子プローブ前駆体を合成するための自動ペプチド合成装置、及び、上記式(I)で表される基を有する標識化合物及び/又は上記式(I)で表される基を有する標識化合物の自動合成装置を含むキットに関する。該自動合成装置は、標識化合物の合成に加えて、例えば、合成した標識化合物を用いた分子プローブ前駆体の標識化及び脱保護が可能な自動合成装置であってもよい。該キットは、本発明の分子プローブ前駆体の合成方法が記載された取扱い説明書を含んでいてもよい。該取扱い説明書には、さらに、例えば、上記式(I)で表される基を有する標識化合物の合成方法、それを用いた標識化方法、及び、脱保護方法等が記載されていてもよい。該キットは、さらに、標識化合物の合成に使用する放射性核種を含む試薬を含んでいてもよい。
【0087】
本発明は、さらにその他の態様として、本発明の分子プローブ前駆体の合成、上記標識化合物の合成、上記標識化合物を用いた膵島イメージング用分子プローブ前駆体の標識化及び脱保護を行う自動合成装置、及び、該自動合成装置を用いた本発明のイメージング用分子プローブの製造方法が記載された取扱い説明書を含むキットに関する。取扱い説明書には、例えば、分子プローブ前駆体の合成方法、上記標識化合物の合成方法、上記標識化合物を用いた分子プローブ前駆体の標識化及び脱保護方法等が記載されていることが好ましい。該キットは、さらに、標識化合物の合成に使用する放射性核種を含む試薬を含んでいてもよい。
【0088】
[本発明のイメージング用試薬]
本発明は、さらにその他の態様として、本発明の分子プローブを含むイメージング用試薬に関する。本発明のイメージング用試薬は、有効成分として本発明の分子プローブを含み、さらに、例えば、担体等の医薬品添加物を含んでいてもよい。担体は、上記のとおりである。
【0089】
[N末端のα−アミノ基が修飾された分子プローブ前駆体のその他の形態]
本発明は、一つの態様として、N末端のα−アミノ基が電荷を有さない修飾基により修飾された膵島イメージング用分子プローブの前駆体として、上記のように、上記式(1)〜(4)で表されるポリペプチドにおいてC末端のリジンのアミノ基が標識化される形態を含むが、その他の形態として、下記に示すような膵島イメージング用分子プローブの前駆体を提供し得る。すなわち、本発明は、その他の態様として、膵島のイメージングに用いられる分子プローブの前駆体であって、下記式(9)〜(16)のいずれかで表されるポリペプチド、下記式(9)〜(16)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、下記式(9)〜(16)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチドからなり、前記分子プローブは、膵島のイメージングに用いられる分子プローブである、膵島イメージング用分子プローブ前駆体を提供しうる。
Z*-DLSKQMEEEAVRLFIEWLK* NGGPSSGAPPPS-NH2 (9) (配列番号9)
Z*-LSKQMEEEAVRLFIEWLK* NGGPSSGAPPPS-NH2 (10) (配列番号10)
Z*-SKQMEEEAVRLFIEWLK* NGGPSSGAPPPS-NH2 (11) (配列番号11)
Z*-KQMEEEAVRLFIEWLK* NGGPSSGAPPPS-NH2 (12) (配列番号12)
Z*-DLSK* QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (13) (配列番号13)
Z*-LSK* QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (14) (配列番号14)
Z*-SK* QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (15) (配列番号15)
Z*-K* QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (16) (配列番号16)
[上記式(9)〜(16)において、「Z*-」はN末端のα−アミノ基が電荷を有さない修飾基により修飾されていることを示し、「K*」はリジンの側鎖のアミノ基が保護基により保護されていることを示し、「-NH2」はC末端のカルボキシル基がアミド化されていることを示す。]
【0090】
上記式(9)〜(16)のポリペプチドを含む本発明の分子プローブ前駆体によれば、N末端のα−アミノ基が電荷を有さない修飾基により修飾されているため、例えば、上記式(9)〜(16)のポリペプチドを含む分子プローブ前駆体を標識化及び脱保護して得られる分子プローブの腎臓への集積を抑制できるという効果を好ましくは奏する。上記式(9)〜(16)のポリペプチドを含む本発明の分子プローブ前駆体を上述するアミノ基を標識化する標識システムで標識化すると、保護基が結合していないリジンの側鎖のアミノ基が標識化されうる。修飾基、保護基、核種、標識化法等は上記のとおりである。また、上記式(9)〜(16)のポリペプチドを含む本発明の分子プローブ前駆体を用いたイメージング方法、膵島量の測定方法、糖尿病の予防、治療、診断方法等は、上述と同様に応用できる。
【0091】
本発明は、さらにその他の形態として、上記式(9)〜(16)のポリペプチドを含む本発明の分子プローブ前駆体から得られうる膵島イメージング用分子プローブを提供しうる。
【0092】
以下に、実施例及び参考例を用いて本発明をさらに説明する。但し、本発明は以下の実施例に限定して解釈されない。
【0093】
なお、本明細書の記載において、以下の略語を使用する。
OBu:ブチルエステル基
Boc:ブトキシカルボニル基
Trt:トリチル基
Pdf:2,2,4,6,7−ペンタメチルジヒドロベンゾフラン−5−スルホニル基
Mmt:4−メトキシトリチル基
Fmoc:9−フルオレニルメチルオキシカルボニル基
【実施例】
【0094】
(実施例1)
配列番号1のN末端のα−アミノ基並びに第4番目及び第19番目のリジン残基に保護基が結合し、かつ、C末端のカルボキシル基がアミド化されている上記式(1)の本発明の分子プローブ前駆体を用いてマウスの体内分布の測定を行った。まず、以下のようにして本発明の分子プローブを調製した。
【0095】
[分子プローブ前駆体の調製]
ポリペプチドの合成は、Applied Biosystems社製ペプチド自動合成機(433A型)を用いて、添付のソフトに従って行った。側鎖に官能基のあるアミノ酸はそれぞれAsp(OBu)、Ser(OBu)、Lys(Boc)、Gln(Trt)、Glu(OBu)、Arg(Pbf)、Asn(Trt)、Trp(Boc)を用いた。4番目及び19番目のリジンとしてはLys(Mmt)を使用した。Rink Amide MBHA(0.125mmol、0.34mmol/g)を出発樹脂とし、配列に従って逐次アミノ酸を延長し、下記式(17)の配列を有するポリペプチドを得た。なお、下記式(17)において、Lys(Mmt)以外は側鎖の保護基の表記を省略した。
Fmoc-DLSK(Mmt)QMEEEAVRLFIEWLK(Mmt)NGGPSSGAPPPSK-保護ペプチド樹脂 (17) (配列番号17)
1.5%TFA−5%TIS−93.55%CH2Cl2を用いた定法処理により、上記式(17)のポリペプチドから、まず、4番目及び19番目のリジン残基の側鎖の保護基(Mmt基)を除去し、遊離した4番目及び19番目のリジン残基の側鎖のアミノ基をFmoc化した。ついで、4番目及び19番目のリジン残基のFmoc基以外の全保護基の除去と樹脂からのペプチドの切り出しとを、92.5%TFA−2.5%TIS−2.5%H2O−2.5%エタンジチオールを用いた定法処理によって行った。反応終了後、ろ別により担体樹脂を取り除き、乾燥エーテルを加えて粗生成物を沈殿させ、ろ別した。得られた粗生成物は、島津製作所のLC8A分取装置(ODS カラム3cmx25cm)を用い、0.1%TFAを含むCH3CN−H2Oのリニアーグラジエントの系で精製し、フラクションコレクターを用いて目的の画分を集めた後、下記式(18)の分子プローブ前駆体を凍結乾燥白色粉末として得た。
Fmoc-DLSK(Fmoc)QMEEEAVRLFIEWLK(Fmoc)NGGPSSGAPPPSK-NH2 (18) (配列番号18)
【0096】
[分子プローブの調製]
得られた上記式(18)の分子プローブ前駆体(640μg)をBorate Buffer(pH7.8)に溶解させ、それに[18F]SFBを加え反応溶液をpH8.5〜9.0に調整し標識化を行った。その後、DMF、Piperidineを加えることで脱保護反応を行い、目的物(配列番号5の第32番目のリジン残基が標識化された分子プローブ)を得た。すなわち、得られた分子プローブは、配列番号5のアミノ酸配列において第32番目のリジンの側鎖のアミノ基に[18F]FB(フルオロベンゾイル基)が結合し、かつ、C末端のカルボキシル基がアミド化され、かつ、N末端のα−アミノ基が非修飾(アミノ基)である下記式(19)の分子プローブ(配列番号19)である。
【0097】
【化9】

【0098】
[体内分布]
調製した上記式(19)の分子プローブ(5.6μCi)を無麻酔下の6週齢ddYマウス(雄性、体重30g)に静脈注射(尾静脈)により投与した。投与5分後、15分後、30分後、60分後、120分後に各臓器を摘出した(n=5)。各臓器の重量と放射能とを測定し、単位重量あたりの放射能から集積量(%dose/g)を算出した。その結果の一例を下記表1、図1A及びBに示す。図1Aは、各臓器への分子プローブの集積の経時変化を示すグラフであり、図1Bは図1Aを拡大したグラフである。
【0099】
【表1】

【0100】
図1A及びBに示すとおり、本実施例1で調製した分子プローブ(上記式(19)で表される分子プローブ)の膵臓への集積は、投与後5分で9.3%dose/g、投与後15分で6.9%dose/g、投与後30分で9.7%dose/gであった。また、本実施例1で調製した分子プローブは、何れの時間帯においても、膵臓の隣接臓器である胃、腸、肝臓及び脾臓よりも膵臓に多く集積した。特に、投与後5〜60分の間における胃及び腸の集積量は2%dose/g前後と低く、投与後5〜30分の間における、胃及び腸への集積量に対する膵臓への集積量は約4倍又はそれ以上であった。また、投与後15分以降は肝臓への集積量を4%dose/g以下に抑えることができ、投与後30分以降は肝臓への集積量に対する膵臓への集積量は2.5倍以上であった。つまり、本実施例1で調製した分子プローブは、特異的に膵臓に集積したといえる。また、骨への放射能集積が低く、生体内で脱フッ素代謝を受けていないことが示唆された。これにより、本実施例1の分子プローブ(上記式(19)で表される分子プローブ)は、膵β細胞のイメージングに適していると考えられる。
【0101】
(参考例1)
参考例1として、配列番号20のN末端のα−アミノ基と第19番目のリジン残基に保護基(Fmoc)が結合し、C末端のカルボキシル基がアミド化されている下記式(20)の分子プローブ前駆体から分子プローブを調製し、その分子プローブを用いてマウスの体内分布の測定を行った。つまり、配列番号20のアミノ酸配列において第4番目のリジンの側鎖のアミノ基に[18F]FB(フルオロベンゾイル基)が結合し、かつ、C末端のカルボキシル基がアミド化された下記式(21)で表される分子プローブ(配列番号21)を用いてマウスの体内分布の測定を行った。分子プローブ前駆体及び分子プローブの調製並びに体内分布の測定は、実施例1と同様に行った。その結果の一例を下記表2、図2A及びBに示す。
Fmoc-DLSKQMEEEAVRLFIEWLK(Fmoc)NGGPSSGAPPPS-NH2 (20) (配列番号20)
【0102】
【化10】

【0103】
【表2】

【0104】
(参考例2)
参考例2として、配列番号22のN末端と第4番目のリジン残基に保護基(Fmoc)が結合し、C末端のカルボキシル基がアミド化されている下記式(22)の分子プローブ前駆体から分子プローブを調製し、その分子プローブを用いてマウスの体内分布の測定を行った。つまり、配列番号22のアミノ酸配列において第19番目のリジンの側鎖のアミノ基に[18F]FB(フルオロベンゾイル基)が結合し、かつ、C末端のカルボキシル基がアミド化された下記式(23)で表される分子プローブ(配列番号23)を用いてマウスの体内分布の測定を行った。分子プローブ前駆体及び分子プローブの調製並びに体内分布の測定は、実施例1と同様に行った。その結果の一例を下記表3、図3A及びBに示す。
Fmoc-DLSK(Fmoc)QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (22) (配列番号22)
【0105】
【化11】

【0106】
【表3】

【0107】
図1A及びB、図2A及びB並びに図3A及びBに示すとおり、本実施例1で調製した分子プローブ(上記式(19)で表される分子プローブ)は、上記式(20)の分子プローブ前駆体を用いて調製した参考例1の分子プローブ及び上記式(22)の分子プローブ前駆体を用いて調製した参考例2の分子プローブと比べて膵臓への集積量が多く、また、膵臓の隣接臓器である胃及び腸への集積量が少なかった。また、本実施例1で調製した分子プローブは、上記参考例1の分子プローブ及び上記参考例2の分子プローブと比べて肝臓及び腎臓への集積が低く、本実施例1で調製した分子プローブの腎臓への集積量は上記参考例1及び2の分子プローブの腎臓への集積量の半分以下であった。このことからも、本実施例1で調製した分子プローブは、特異的に膵臓に集積したといえる。
【0108】
実施例1の分子プローブ、参考例1の分子プローブ及び参考例2の分子プローブの体内分布実験により得られた集積量に基づき、各プローブについての膵臓/肝臓比(膵臓の集積量/肝臓の集積量)を下記表4に、膵臓/腎臓比(膵臓の集積量/腎臓の集積量)を下記表5に示す。
【0109】
【表4】

【0110】
【表5】

【0111】
上記表4及び5に示すように、実施例1の分子プローブは、参考例1の分子プローブ及び参考例2の分子プローブと比較して膵臓/肝臓比及び膵臓/腎臓比が高かった。このように膵臓の周辺臓器に対する膵臓への集積量の比率が高く、また、膵臓の周辺臓器の集積が少ない本実施例1の分子プローブによれば、イメージングした際に、明瞭な膵臓の画像が得られることが示唆された。
【0112】
上記参考例1の分子プローブをマウスに投与することにより、マウスの膵島の三次元イメージング画像が得られている。また、上記参考例2の分子プローブをマウスに投与することにより、マウスの膵島の非侵襲的な三次元イメージング画像が得られている。上記のとおり、C末端のリジンの側鎖を標識した本実施例1で調製した分子プローブは、上記式(20)の分子プローブ前駆体を用いて調製した参考例1の分子プローブ及び上記式(22)の分子プローブ前駆体を用いて調製した参考例2の分子プローブと比べて膵臓への集積量が多く、また、膵臓の隣接臓器である胃及び腸への集積量が少ないことから、本実施例1で調製した分子プローブにより、非侵襲的な膵島の三次元イメージングが可能なことが示唆された。
【0113】
これらの結果より、本発明の分子プローブ前駆体であれば、ヒトにおいて非侵襲的膵臓の三次元イメージング、とりわけ非侵襲的膵β細胞の三次元イメージングが可能なことが示唆された。
【0114】
[blocking実験]
実施例1で調製した分子プローブ(上記式(19)の分子プローブ)を用い、blocking実験を行った。マウスは、6週齢ddYマウス(雄性、体重約30g)を使用した。
【0115】
まず、無麻酔下のマウスに、標識化していないExendin(9−39)(コールドプローブ)を静脈注射により前投与した(0.5mg/mLを0.1mL)。前投与から30分後に、調製した上記式(19)の分子プローブ(5μCi)を静脈注射により投与した。分子プローブの投与から30分後に各臓器を摘出した(n=5)。各臓器の重量と放射能とを測定し、単位重量あたりの放射能から集積量(%dose/g)を算出した。その結果の一例を図4に示す。
【0116】
コントロールとして、コールドプローブを前投与することなく、調製した上記式(19)の分子プローブ(5μCi)を無麻酔下のマウスに静脈注射により投与した。投与から30分後に各臓器を摘出した(n=5)。各臓器の重量と放射能とを測定し、単位重量あたりの放射能から集積量(%dose/g)を算出した。その結果の一例を前投与した結果とあわせて図4に示す。
【0117】
図4は、前投与ありの集積量(%dose/g)及びコントロール(前投与なし)の集積量(%dose/g)を示すグラフである。図4に示すように、コールドプローブを前投与して受容体(GLP−1受容体)への結合を阻害することにより、上記式(19)の分子プローブの膵臓への取り込みが約75%阻害されたことが観察された。
【0118】
[2次元イメージング解析]
ICRマウスの遺伝的バックグラウンドを有し、かつ、MIP(mouse insulin I gene promoter)の制御下でGFP(green fluorescent protein)を発現するトランスジェニックマウス(以下、「MIP−GFPマウス」という)を使用し、2次元イメージング解析を行った。分子プローブは、実施例1で調製した上記式(19)の分子プローブを用いた。
【0119】
調製した上記式(19)の分子プローブを無麻酔のMIP−GFPマウス(雄性、体重20g)に静脈注射により投与し(約171μCiを200μL)、投与30分後に膵臓を摘出した(n=2)。摘出した膵臓から切片を切り出し、切片をスライドガラス上に置き、その上にカバーガラスを載せた。切片の蛍光及び放射能(オートラジオグラフィー)は、画像解析装置(商品名:Typhoon 9410、GEヘルスケア社製)を用いて測定した(露光時間:15時間)。その結果の一例を図5に示す。
【0120】
図5は、上記式(19)の分子プローブ投与後30分のMIP−GFPマウスの膵臓切片のイメージ解析の結果の一例を示し、(a)が蛍光シグナル、(b)が放射性シグナルを示す画像である。図5(a)及び(b)に示すように、MIP−GFPマウスの膵臓切片において画像解析装置によって蛍光GFPシグナル、及び、放射性シグナルがそれぞれ検出された。また、図5(a)及び(b)に示すように、標識化された上記式(19)の分子プローブから検出された放射性シグナルの局在性は、GFPシグナルと一致していた。このことから、上記式(19)の分子プローブが、膵β細胞に特異的に集積することが確認できた。
【0121】
[三次元イメージング]
調製した上記式(19)の分子プローブ(89μCi)を麻酔した6週齢ddYマウス(雄性、体重30g)に静脈注射により投与し、下記のPET装置及び条件で三次元イメージングを行った。
撮像装置:eXplore Vista(商品名、GE社製)
撮像方法:Static Scan
リコンストラクション:2DOSEM(Dynamic OS−EM)
【0122】
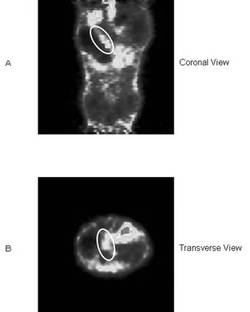
その結果の一例を図6に示す。画像は分子プローブ投与30分後のものである(積算時間:20分)。図6Aは、三次元イメージングの冠状断像(coronal view)であり、図6Bは、三次元イメージングの横断像(transverse view)である。図6A及びBにおける白丸が膵臓の位置を示す。なお、図6A及びBのコントラストは同一である。
【0123】
図6に示すとおり、上記式(19)の分子プローブを用いることによって、非侵襲的に膵臓の位置を明確に判別することができた。つまり、本発明の分子プローブによって非侵襲的な膵島の三次元イメージングが可能であることが確認できた。
【0124】
(実施例2)
配列番号1の第4番目及び第19番目のリジン残基に保護基が結合し、C末端のカルボキシル基がアミド化されている上記式(1)の本発明の分子プローブ前駆体において、N末端のα−アミノ基がアセチル化されている下記式(24)の本発明の分子プローブ前駆体(配列番号24)を用いてマウスの体内分布の測定を行った。まず、以下のようにして本発明の分子プローブを調製した。なお、リジン残基の保護基は、Fmocを使用した。
Ac-DLSK(Fmoc)QMEEEAVRLFIEWLK(Fmoc)NGGPSSGAPPPSK-NH2 (24) (配列番号24)
【0125】
[分子プローブの調製]
N末端のα−アミノ基の保護基(Fmoc)を脱保護し、アセチル化した以外は、実施例1と同様にして上記式(24)の分子プローブ前駆体を調製した。得られた上記式(24)の分子プローブ前駆体(540μg)をBorate Buffer(pH7.8)に溶解させ、それに[18F]SFBを加え反応溶液をpH8.5〜9.0に調整し標識化を行った。その後、DMF、Piperidineを加えることで脱保護反応を行い、目的物(配列番号5の第32番目のリジン残基が標識化された分子プローブ)を得た。すなわち、得られた分子プローブは、配列番号5のアミノ酸配列において第32番目のリジンの側鎖のアミノ基に[18F]FB(フルオロベンゾイル基)が結合し、かつ、N末端のα−アミノ基がアセチル化され、かつ、C末端のカルボキシル基がアミド化された下記式(25)の分子プローブ(配列番号25)である。なお、下記式(25)において「Ac」は、N末端のα−アミノ基がアセチル化されたことを示す。
【0126】
【化12】

【0127】
[体内分布]
調製した上記式(25)の分子プローブ(7μCi)を無麻酔下の6週齢ddYマウス(雄性、体重30g)に静脈注射(尾静脈)により投与した。投与5分後、15分後、30分後、60分後、120分後に各臓器を摘出した(n=5)。各臓器の重量と放射能とを測定し、単位重量あたりの放射能から集積量(%dose/g)を算出した。その結果の一例を下記表6、図7A及びBに示す。図7Aは、各臓器への分子プローブの集積の経時変化を示すグラフであり、図7Bは図7Aを拡大したグラフである。
【0128】
【表6】

【0129】
図7A及びBに示すとおり、本実施例2で調製した上記式(25)の分子プローブの膵臓への集積は、投与後5分で7.0%dose/g、投与後15分で6.5%dose/g、投与後30分で7.3%dose/gであった。また、本実施例2で調製した上記式(25)の分子プローブは、何れの時間帯においても、膵臓の隣接臓器である胃や腸よりも膵臓に多く集積した。特に、胃の集積量は何れの時間帯においても2%dose/g前後と低く、腸の集積量は何れの時間帯においても1.7%dose/g前後と低く、胃及び腸への集積量に対する膵臓への集積量は3倍以上であった。また、投与後15分からは肝臓への集積量を4%dose/g以下に抑えることができ、投与後30分からは肝臓への集積量に対する膵臓への集積量は2倍以上であった。つまり、本実施例2で調製した上記式(25)の分子プローブは、特異的に膵臓に集積したといえる。また、骨への放射能集積が低く、生体内で脱フッ素代謝を受けていないことが示唆された。これにより、上記式(25)の分子プローブは、膵β細胞のイメージングに適していると考えられる。
【0130】
また、図1A及びB並びに図7A及びBに示すとおり、N末端のα−アミノ基をアセチル化した本実施例2の分子プローブ(上記式(25)の分子プローブ)は、N末端のα−アミノ基がアセチル化されていない実施例1の分子プローブ(上記式(19)の分子プローブ)と比較して、腎臓への集積が抑制された。
【0131】
実施例2の分子プローブの体内分布実験により得られた集積量に基づき、膵臓/肝臓比(膵臓の集積量/肝臓の集積量)を上記表4に、膵臓/腎臓比(膵臓の集積量/腎臓の集積量)を上記表5に示す。上記表4及び5に示すように、実施例2の分子プローブは、参考例1の分子プローブ及び参考例2の分子プローブと比較して膵臓/肝臓比及び膵臓/腎臓比が高かった。このように膵臓の周辺臓器に対する膵臓への集積量の比率が高く、また、膵臓の周辺臓器の集積が少ない本実施例2の分子プローブによれば、イメージングした際に、明瞭な膵臓の画像が得られることが示唆された。
【0132】
図2A及びB、図3A及びB並びに図7A及びBに示すとおり、本実施例2で調製した上記式(25)の分子プローブは、上記参考例1の分子プローブ及び上記参考例2の分子プローブと比べて膵臓への集積量が多く、膵臓の隣接臓器である胃及び腸への集積量が少なかった。また、本実施例2で調製した上記式(25)の分子プローブは、上記参考例1及び2の分子プローブと比べて腎臓への集積が低く、本実施例2で調製した分子プローブの腎臓への集積量は上記参考例1の分子プローブ(上記式(21)の分子プローブ)及び上記参考例2の分子プローブ(上記式(23)の分子プローブ)の腎臓への集積量の半分以下であった。このことからも、つまり、本実施例2で調製した上記式(25)の分子プローブは、特異的に膵臓に集積したといえる。このため、本実施例2で調製した上記式(25)の分子プローブにより、非侵襲的な膵島の三次元イメージングが可能なことが示唆された。
【0133】
これらの結果より、本発明の分子プローブ前駆体であれば、ヒトにおいて非侵襲的膵臓の三次元イメージング、とりわけ非侵襲的膵β細胞の三次元イメージングが可能なことが示唆された。
【0134】
(実施例3)
[Binding Assay]
実施例1で調製した上記式(18)の分子プローブ前駆体を、[18F]SFBに替えて[127I]N-succinimidyl 3-iodobenzoate([127I]SIB)を使用した以外は実施例1と同様にして標識化及び脱保護を行い、下記式(26)の分子プローブ(配列番号26)を得た。
【0135】
【化13】

【0136】
マウスから単離した膵島を50mlチューブに回収し、遠心(2000rpm、2分)した後、冷PBS20mLで1回洗浄した。トリプシン−EDTA(トリプシン−EDTA(0.05%/0.53mM)3mLに、PBSを含む0.53mM EDTA(pH7.4(NaOH))12mLを加えたもの)を15mL加え、37℃で振とうしながら1分間インキュベートした後、直ちに氷上に置いた。ついで、スポイト付10mLピペットで泡立てることなく勢いよく20回ピペッティングした後、冷PBSを最終量が30mLになるように加えた。遠心(3000rpm、2分)した後、冷PBS 30mLで2回洗浄した。上清を除去して膵島細胞サンプルを得た。得られた膵島細胞サンプルは−80℃で保存した。
【0137】
100μL/チューブとなるように膵島細胞サンプルをBuffer(20mM HEPES(pH7.4)、1mM MgCl2、1mg/ml bacitracin、1mg/ml BSA)で懸濁した。ついでBuffer 880μL、上記式(26)の分子プローブを含む溶液(分子プローブの終濃度:0、1×10-6〜1×10-12M)10μL、[125I]Bolton−Hunter標識Exendin(9−39)を含む溶液([125I]Bolton−Hunter標識Exendin(9−39)(製品コード:NEX335、1.85MBq/mL=50μCi/mL,22.73pmol/mL=76.57ng/mL、Perkin Elmer社製)10μLにBuffer90μLを添加したもの)10μLを添加し、室温で60分インキュベーションした。なお、[125I]標識Exendin(9−39)の終濃度は0.05μCi/チューブとした。ついで予め湿らせたガラス繊維フィルタ(Whatman GF/C filter)をセットした吸引装置を用い、吸引によりB/F分離した後、フィルタを氷冷のPBS5mlで3回洗浄した。フィルタをチューブに入れ、γカウンターにより放射能の測定を行った。その結果を図8に示す。
【0138】
図8は、SigmaPlot11(商品名)で解析した結果の一例を示すグラフである。図8に示すように、上記式(26)の分子プローブは、GLP−1Rと[125I]標識Exendin(9−39)との結合を濃度依存的に阻害した。上記式(26)の分子プローブのIC50は3.52×10-9Mであり、上記式(26)の分子プローブは膵島のGLP−1受容体に対して高い親和性を示した。また、上記式(26)の分子プローブのIC50は、Exendin(9−39)(IC50:1.4×10-9M)に近い値であることから、上記式(26)の分子プローブは膵島のGLP−1受容体に対してGLP−1受容体拮抗薬であるExendin(9−39)と同程度の親和性を有しているといえる。
【0139】
つぎに、配列番号5のアミノ酸配列において、第32番目のリジン残基の側鎖のアミノ基が3−[125I]iodobenzoyl基で標識され(以下、「[125I]IB標識」ともいう)、C末端のカルボキシル基がアミド化され、N末端のα−アミノ基がアセチル化されていない下記式(27)の分子プローブ(配列番号27)を用いてマウスの体内分布の測定及び二次元イメージング解析を行った。下記式(27)の分子プローブは、[18F]SFBに替えて[125I]N-succinimidyl 3-iodobenzoate(SIB)を使用した以外は、実施例1と同様の方法で調製した。
【0140】
【化14】

【0141】
[体内分布]
調製した上記式(27)の分子プローブ(1μCi)を無麻酔下の6週齢ddYマウス(雄性、体重約30g)に静脈注射(尾静脈)により投与した。投与5分後、15分後、30分後、60分後、120分後に各臓器を摘出した(n=5)。各臓器の重量と放射能とを測定し、単位重量あたりの放射能から集積量(%dose/g)を算出した。その結果の一例を下記表7、図9A及びBに示す。図9Aは、各臓器への分子プローブの集積の経時変化を示すグラフであり、図9Bは図9Aを拡大したグラフである。
【0142】
【表7】

【0143】
図9A及びBに示すとおり、本実施例3で調製した上記式(27)の分子プローブの膵臓への集積は、投与後5分で7.7%dose/g、投与後15分で12.3%dose/g、投与後30分で8.7%dose/g、投与後60分で10.9%dose/gであった。また、上記式(27)の分子プローブは、何れの時間帯においても、膵臓の隣接臓器である胃や腸よりも膵臓に多く集積した。特に、投与後5〜30分の間における胃及び腸の集積量は4%dose/g以下と低く、この時間帯における、胃及び腸への集積量に対する膵臓への集積量は3倍以上であった。また、投与後30分以降における上記式(27)の分子プローブの肝臓への集積量は5%dose/g以下であった。以上のことから、上記式(27)の分子プローブは、特異的に膵臓に集積したといえる。また、首への集積に大きな変化が見られないことから、生体内で上記式(27)の分子プローブが脱ヨウ素代謝を受けていないことが示唆された。これにより、上記式(27)の分子プローブは、膵β細胞のイメージング、とりわけ、膵β細胞の非侵襲的イメージングに適していると考えられる。
【0144】
[2次元イメージング解析]
上記式(27)の分子プローブ(5μCi)を無麻酔のMIP−GFPマウス(雄性、体重20g)に静脈注射により投与し、投与30分後に膵臓を摘出した(n=2)。摘出した膵臓から切片を切り出し、切片をスライドガラス上に置き、その上にカバーガラスを載せた。切片の蛍光及び放射能(オートラジオグラフィー)は、画像解析装置(商品名:Typhoon 9410、GEヘルスケア社製)を用いて測定した(露光時間:18時間)。その結果の一例を図10に示す。
【0145】
コントロールとして、標識基が結合していない市販のexendin(9−39)(コールドプローブ)を無麻酔のMIP−GFPマウス(雄性、体重20g)に静脈注射により前投与した(50μg/100μL)。前投与から30分後に上記式(27)の分子プローブ(5μCi)を静脈注射により投与し、上記式(27)の分子プローブの投与から30分後に膵臓を摘出した(n=2)。摘出した膵臓から切片を切り出し、得られた切片について、上記と同様にして蛍光及び放射能の測定を行った。その結果の一例を、上記前投与なしの結果とあわせて図10に示す。
【0146】
図10は、上記式(27)の分子プローブを投与したMIP−GFPマウスの膵臓切片のイメージ解析の結果の一例であって、上記式(27)の分子プローブ投与後30分の切片についての蛍光シグナル(a)及び放射性シグナル(b)を示す画像を示す。
【0147】
図10(a)及び(b)に示すように、MIP−GFPマウスの膵臓切片において画像解析装置によって蛍光GFPシグナル、及び放射性シグナルがそれぞれ検出された。また、上記式(27)の分子プローブから検出された放射性シグナルの局在性は、GFPシグナルと一致していた。このことから、上記式(27)の分子プローブが、膵β細胞に特異的に集積することが確認できた。
【0148】
図10(b)に示すように、コールドプローブを前投与したコントロールの切片からは放射性シグナルはほとんど検出されなかった。このことから、コールドプローブを前投与してGLP−1受容体への結合を阻害することにより、上記式(27)の分子プローブの取り込みが阻害されたことが観察できた。このことから、上記式(27)の分子プローブが、膵β細胞のGLP−1受容体に結合していることが確認できた。
【0149】
ここで、125I、123I及び131Iはいずれもγ線放出核種である。さらに、125I及び123Iは核スピン数も同一である。これらのことから、上記式(27)の分子プローブの標識化に使用する放射性ヨウ素原子(125I)を、123I又は131Iとした場合であっても、上記式(27)の分子プローブとほぼ同様の挙動を示すことが推測される。また、124Iとした場合であっても、上記式(27)の分子プローブとほぼ同様の挙動を示すと推測される。したがって、上記式(27)の分子プローブの125Iを、123I、124I又は131Iとした分子プローブを使用することにより、例えば、SPECTやPET等での膵β細胞の非侵襲の三次元イメージング、好ましくは膵β細胞の定量が可能なことが示唆された。
【0150】
(実施例4)
配列番号5のアミノ酸配列において、第32番目のリジン残基の側鎖のアミノ基が3−[123I]iodobenzoyl基で標識され(以下、「[123I]IB標識」ともいう)、C末端のカルボキシル基がアミド化され、N末端のα−アミノ基がアセチル化されていない下記式(28)の分子プローブ(配列番号28)を調製した。下記式(28)の分子プローブは、[125I]SIBに替えて[123I]SIBを使用した以外は、実施例3と同様の方法で調製した。
【0151】
【化15】

【0152】
[三次元イメージング]
上記式(28)の分子プローブを用いてマウスのSPECT撮像を行った。上記式(28)の分子プローブ(243μCi/120μL)を麻酔した6週齢ddYマウス(雄性、体重約30g)に静脈注射により投与し、SPECT撮像を行った。SPECT撮像は、ガンマカメラ(製品名:SPECT2000H−40、日立メディコ製)を用いて下記の撮像条件で、分子プローブ投与後30分から32分間行った。得られた画像を、下記の再構成条件で再構成処理を行った。
撮像条件
コリメータ :LEPH pinholeコリメータ
検出器の収集角度:11.25°/60秒で360°
収集時間 :60秒×32フレーム、32分間
再構成条件
前処理フィルタ:Butterworthフィルタ(order:10、cutoff周波数:0.13)
【0153】
その結果の一例を図11に示す。画像は分子プローブ投与30分後のものである(積算時間:32分)。図11Aは横断像(transverse view)であり、図11Bは冠状断像(coronal view)であり、図11Cは矢状断像(sagittal view)である。図11B及びCにおける白丸が膵臓の位置を示す。なお、図11AからCのコントラストは同一である。
【0154】
図11AからCに示すとおり、上記式(28)の分子プローブを用いることによって、マウスにおいて非侵襲的に膵臓の位置を確認することができた。つまり、本発明の分子プローブによって非侵襲的な膵島の三次元イメージングが可能であることが確認できた。
【0155】
このように、ヒトよりも膵臓のサイズが小さく、かつ、臓器が密集しているマウスにおいて非侵襲的に膵臓の位置を確認できたことから、マウスよりも膵臓のサイズが大きく、かつ、臓器が密集していないヒトであれば、例えば、膵島の位置、膵臓のサイズをより明確に判別でき、さらには、膵臓におけるプローブの発現量を測定できることが示唆された。したがって、本発明のイメージング用分子プローブであれば、ヒトにおいて非侵襲的膵臓の三次元イメージング、とりわけ非侵襲的膵β細胞の三次元イメージングが可能なことが示唆された。
【産業上の利用可能性】
【0156】
以上説明したとおり、本発明は、例えば、医療分野、分子イメージングの分野、糖尿病に関する分野などで有用である。
【配列表フリーテキスト】
【0157】
配列番号1〜4:本発明の分子プローブ前駆体のアミノ酸配列
配列番号5〜8:本発明の分子プローブのアミノ酸配列
配列番号9〜16:本発明の分子プローブ前駆体のアミノ酸配列
配列番号17:実施例1の分子プローブ前駆体の製造に用いるポリペプチドのアミノ酸配列
配列番号18:実施例1の分子プローブ前駆体のアミノ酸配列
配列番号19:実施例1の分子プローブのアミノ酸配列
配列番号20:参考例1の分子プローブ前駆体のアミノ酸配列
配列番号21:参考例1の分子プローブのアミノ酸配列
配列番号22:参考例2の分子プローブ前駆体のアミノ酸配列
配列番号23:参考例2の分子プローブのアミノ酸配列
配列番号24:実施例2の分子プローブ前駆体のアミノ酸配列
配列番号25:実施例2の分子プローブのアミノ酸配列
配列番号26:Binding Assayに使用した分子プローブのアミノ酸配列
配列番号27:実施例3の分子プローブのアミノ酸配列
配列番号28:実施例4の分子プローブのアミノ酸配列
【技術分野】
【0001】
本発明は、膵島イメージング用分子プローブ及びその前駆体、並びに、それらの使用に関する。
【背景技術】
【0002】
現在、日本における2型糖尿病は推定820万人を越えて増加し続けている。この対策として耐糖能検査を基準とした糖尿病発症前の介入が行われているが、充分な成果が得られていない。その原因として、耐糖能検査で機能異常が明らかとなる境界型の段階では膵島の障害はすでに高度に進行しており、介入開始時期としては遅い可能性がある。
【0003】
すなわち、糖尿病の発症過程では、膵島量(とりわけ、膵β細胞量)が耐糖能異常に先行して減少するため、機能異常が検出・自覚される段階に至ってからでは、糖尿病はすでに治療が難しい段階となっている。一方、膵島量及び/又は膵β細胞量の減少を早期に発見することができれば、糖尿病を予防・治療できる可能性がある。したがって、糖尿病の予防・診断を行うために非侵襲の膵島イメージング技術、とりわけ膵島量及び又は膵β細胞量を測定するための非侵襲の膵島イメージング技術が望まれている。その中でも、膵島、好ましくは、膵β細胞のイメージングや膵β細胞量の測定を非侵襲的に可能とする分子プローブが特に望まれている。
【0004】
膵島のイメージング用分子プローブの設計において、β細胞に特異的な機能タンパク質を中心に膵島細胞における様々な標的分子が検討されている。中でも、標的分子として、膵β細胞に分布し、7回膜貫通型のG−タンパク質共役受容体であるGLP−1R(グルカゴン様ペプチド1受容体)が検討されている。そして、膵島β細胞のイメージング用分子プローブとして、例えば、GLP−1RアンタゴニストであるExendin−4(9−39)の誘導体が検討されている(例えば、非特許文献1)。
【0005】
また、その他にGLP−1Rのイメージング用プローブとしては、GLP−1R陽性の腫瘍をイメージングするために、GLP−1RアゴニストであるExendin−4の誘導体や、GLP−1RアンタゴニストであるExendin−4(9−39)の誘導体が検討されている(例えば、非特許文献2)。
【0006】
しかしながら、非侵襲的な膵島の三次元イメージングが可能なさらなる膵島イメージング用分子プローブが求められている。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】H. Kimura et al. Development of in vivo imaging agents targeting glucagons-like peptide-1 receptor (GLP-1R) in pancreatic islets. 2009 SNM Annual Meeting, abstract, Oral Presentations No.326
【非特許文献2】M. Beche et al. Are radiolabeled GLP-1 receptor antagonists useful for scintigraphy? 2009 SNM Annual Meeting, abstract, Oral Presentations No.327
【発明の概要】
【発明が解決しようとする課題】
【0008】
そこで、本発明は、非侵襲的な膵島の三次元イメージングが可能な膵島イメージング用分子プローブを提供する。
【課題を解決するための手段】
【0009】
本発明は、膵島のイメージングに用いられる分子プローブの前駆体であって、
下記式(1)〜(4)のいずれかで表されるポリペプチド、
下記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、
下記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチドを含み、
前記分子プローブは、膵島のイメージングに用いられる分子プローブである、膵島イメージング用分子プローブ前駆体に関する。
*-DLSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (1) (配列番号1)
*-LSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (2) (配列番号2)
*-SK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (3) (配列番号3)
*-K* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (4) (配列番号4)
[上記式(1)〜(4)において、「*-」は、N末端のα−アミノ基が、保護基により保護されているか、又は、電荷を有さない修飾基により修飾されていることを示し、「K*」は、リジン(lysine)の側鎖のアミノ基が保護基により保護されていることを示し、「-NH2」は、C末端のカルボキシル基がアミド化されていることを示す。]
【0010】
本発明は、その他の態様として、膵島イメージング用分子プローブであって、
下記式(5)〜(8)のいずれかで表されるポリペプチド、
下記式(5)〜(8)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって、膵島に結合可能なポリペプチド、又は、
下記式(5)〜(8)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって、膵島に結合可能なポリペプチドを含み、膵島イメージング用分子プローブに関する。
Z-DLSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (5) (配列番号5)
Z-LSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (6) (配列番号6)
Z-SKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (7) (配列番号7)
Z-KQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (8) (配列番号8)
[上記式(5)〜(8)において、「X」は、側鎖のアミノ基が放射性核種で標識されたリジン残基を示し、前記放射性核種は、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I又は131Iであり、「Z-」は、N末端のα−アミノ基が、非修飾であるか、又は、電荷を有さない修飾基により修飾されていることを示し、「-NH2」は、C末端のカルボキシル基がアミド化されていることを示す。]
【発明の効果】
【0011】
本発明によれば、例えば、ポジトロン放射断層撮影法(PET)やシングルフォトン放射線コンピュータ断層撮影法(SPECT)などにより、膵島のイメージング、好ましくは膵島の三次元イメージング、より好ましくは非侵襲の膵島イメージングが可能となる。
【図面の簡単な説明】
【0012】
【図1】図1A及びBは、本発明の分子プローブの体内分布の経時変化の結果の一例を示すグラフである。
【図2】図2A及びBは、参考例1の分子プローブの体内分布の経時変化の結果の一例を示すグラフである。
【図3】図3A及びBは、参考例2の分子プローブの体内分布の経時変化の結果の一例を示すグラフである。
【図4】図4は、実施例1の分子プローブを用いたblocking実験の結果の一例を示すグラフである。
【図5】図5は、実施例1の分子プローブを用いた膵臓切片のイメージング解析の結果の一例を示す画像である。
【図6】図6は、実施例1の分子プローブを用いた膵島イメージング(PET)の結果の一例を示すPET画像である。
【図7】図7A及びBは、本発明の分子プローブの体内分布の経時変化の結果のその他の例を示すグラフである。
【図8】図8は、実施例におけるBinding Assayの結果の一例を示すグラフである。
【図9】図9A及びBは、本発明の分子プローブの体内分布の経時変化の結果のその他の例を示すグラフである。
【図10】図10は、実施例3の分子プローブを用いた膵臓切片のイメージング解析の結果の一例を示す画像である。
【図11】図11は、実施例4の分子プローブを用いたSPECT画像の一例である。
【発明を実施するための形態】
【0013】
膵島の直径は、例えば、ヒトの場合、50〜500μm程度である。このような膵島を生体内において非侵襲的にイメージング化又は定量化するためには、例えば、膵島に特異的に集積して周囲臓器とのコントラストを生じさせることが可能な分子プローブが必要であると考えられている。このため、様々な分子プローブの研究・開発が行われている。
【0014】
例えば、非特許文献2では、GLP−1R陽性腫瘍細胞及び膵島細胞における、Exendin−4(9−39)の誘導体の誘導体であるLys40(Ahx−DTPA−111In)Exendin−4(9−39)のGLP−1R親和性の研究が行われている。そして、Lys40(Ahx−DTPA−111In)Exendin−4(9−39)の膵島への集積率は0.4%程度であり、GLP−1R陽性腫瘍細胞への集積率も7.5%程度であり、すなわち、Lys40(Ahx−DTPA−111In)Exendin−4(9−39)はGLP−1Rへの親和性が低いという結果が得られている。このため、例えば、膵島に特異的に集積して周囲臓器とのコントラストを生じさせることが可能な新たな分子プローブが求められていることが現状である。
【0015】
本発明は、上記イメージング用分子プローブ前駆体を標識化及び脱保護することにより得られる分子プローブ及び上記イメージング用分子プローブによれば、例えば、PETやSPECT等により非侵襲で膵島の三次元イメージングが可能となり、かつ定量性を確保できる、という知見に基づく。すなわち、本発明は、膵島の非侵襲的な三次元イメージングを可能にするという効果を好ましくは奏する。また、本発明は、好ましくは、非特許文献1及び2に記載されている分子プローブと比較して膵島により特異的に集積させることができるため、膵島の定量用イメージングを行うことができるという効果を奏する。
【0016】
また、上述したとおり、糖尿病の発症過程では、耐糖能異常に先行して膵島量が減少することが知られている。このため、膵島イメージング及び又は膵島量の測定を行うことにより、例えば、糖尿病の発症前や初期の状態で、膵島の微小な変化を見つけることができることから、糖尿病の超早期発見・診断が可能になる。このため、本発明のイメージング用分子プローブの前駆体は、糖尿病の予防・早期発見・診断、好ましくは糖尿病の超早期発見・診断に有用である。
【0017】
すなわち、本発明は、
[1] 膵島のイメージングに用いられる分子プローブの前駆体であって、下記式(1)〜(4)のいずれかで表されるポリペプチド、下記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、下記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチドを含み、前記分子プローブは、膵島のイメージングに用いられる分子プローブである、膵島イメージング用分子プローブ前駆体、
*-DLSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (1) (配列番号1)
*-LSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (2) (配列番号2)
*-SK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (3) (配列番号3)
*-K* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (4) (配列番号4)
[上記式(1)〜(4)において、「*-」はN末端のα−アミノ基が保護基により保護されているか又は電荷を有さない修飾基により修飾されていることを示し、「K*」はリジン(lysine)の側鎖のアミノ基が保護基により保護されていることを示し、「-NH2」はC末端のカルボキシル基がアミド化されていることを示す。];
[2] C末端のリジンの側鎖のアミノ基を、放射性核種を有する芳香環を含む標識化合物により標識化するための、[1]記載の膵島イメージング用分子プローブ前駆体;
[3] 前記電荷を有さない修飾基が、アセチル基、ベンジル基、ベンジルオキシメチル基、o−ブロモベンジルオキシカルボニル基、t−ブチル基、t−ブチルジメチルシリル基、2−クロロベンジル基、2,6−ジクロロベンジル基、シクロヘキシル基、シクロペンチル基、イソプロピル基、ピバリル基、テトラヒドロピラン−2−イル基、トシル基、トリメチルシリル基及びトリチル基からなる群から選択される、[1]又は[2]に記載の膵島イメージング用分子プローブ前駆体;
[4] 膵島イメージング用分子プローブの製造方法であって、[1]から[3]のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護することを含む、膵島イメージング用分子プローブの製造方法;
[5] 前記膵島イメージング用分子プローブ前駆体の標識化が、C末端のリジンの側鎖のアミノ基を放射性核種を有する芳香環を含む標識化合物により標識化することを含む、[4]記載の膵島イメージング用分子プローブの製造方法;
[6] 前記芳香環を含む標識化合物が、下記式(I)で表される基を含む、[5]記載の膵島イメージング用分子プローブの製造方法、
【化1】

[前記式(I)において、Aは芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R1は11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、111In、123I、124I、125I又は131Iを含む置換基を示し、R2は水素原子又はR1とは異なる1又は複数の置換基を示す。];
[7] 膵島イメージング用分子プローブであって、[4]から[6]のいずれかに記載の製造方法により得られうる、膵島イメージング用分子プローブ;
[8] 膵島イメージング用分子プローブであって、下記式(5)〜(8)のいずれかで表されるポリペプチド、下記式(5)〜(8)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって膵島に結合可能なポリペプチド、又は、下記式(5)〜(8)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって膵島に結合可能なポリペプチドを含む膵島イメージング用分子プローブ、
Z-DLSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (5) (配列番号5)
Z-LSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (6) (配列番号6)
Z-SKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (7) (配列番号7)
Z-KQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (8) (配列番号8)
[上記式(5)〜(8)において、「X」は側鎖のアミノ基が放射性核種で標識されたリジン残基を示し、前記放射性核種は11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I又は131Iであり、「Z-」はN末端のα−アミノ基が非修飾であるか又は電荷を有さない修飾基により修飾されていることを示し、「-NH2」はC末端のカルボキシル基がアミド化されていることを示す。];
[9] 前記放射性核種で標識されたリジンの側鎖のアミノ基が、下記式(III)で表される芳香環を含む基と結合している、[8]記載の膵島イメージング用分子プローブ、
【化2】

[前記式(III)において、Aは芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R4は11C、13N、15O、18F、75Br、76Br、77Br、123I、124I、125I又は131Iを含む置換基を示し、R5は水素原子又はR4とは異なる1又は複数の置換基を示し、R3は結合手、C1−C6アルキレン基及びC1−C6オキシアルキレン基のいずれかを示す。];
[10] 膵島イメージング用分子プローブを調製するためのキットであって、[1]から[3]のいずれかに記載の膵島イメージング用分子プローブ前駆体を含む、キット;
[11] さらに、前記膵島イメージング用分子プローブ前駆体の標識化に使用する化合物であって、ハロゲン又は放射性ハロゲンを有する芳香環を含む化合物を含む、[10]記載のキット;
[12] 前記芳香環を含む化合物が、下記式(IV)で表される基を有する化合物である、[11]記載のキット、
【化3】

[前記式(IV)において、Aは芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R6はハロゲン又は放射性ハロゲンを含む置換基を示し、R7は水素原子又はR6とは異なる1又は複数の置換基を示す。];
[13] 膵島のイメージングを行うためのキットであって、[7]から[9]のいずれかに記載の膵島イメージング用分子プローブを含むキット;
[14] [1]から[3]のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護することを含む、膵島のイメージング方法;
[15] [7]から[9]のいずれかに記載の膵島イメージング用分子プローブを投与された被検体から前記膵島イメージング用分子プローブのシグナルを検出することを含む、膵島のイメージング方法;
[16] さらに、前記分子プローブを用いた膵島イメージングの結果から膵島の状態を判定することを含む、[14]又は[15]に記載の膵島のイメージング方法;
[17] [1]から[3]のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護して膵島イメージング用分子プローブを調製すること、及び、
前記分子プローブを用いた膵島イメージングの結果から膵島量を算出することを含む、膵島量の測定方法;
[18] [7]から[9]のいずれかに記載の膵島イメージング用分子プローブを投与された被検体から前記膵島イメージング用分子プローブのシグナルを検出すること、及び、検出した膵島イメージング用分子プローブのシグナルから膵島量を算出することを含む膵島量の測定方法;
[19] さらに、算出した膵島量を提示することを含む、[17]又は[18]に記載の膵島量の測定方法;
に関する。
【0018】
[膵島イメージング]
本明細書において「膵島イメージング」とは、膵島の分子イメージング(molecular imaging)であって、in vivoの膵島の空間的及び/又は時間的分布を画像化することを含む。また、本発明において、膵島イメージングは、糖尿病に関する予防・治療・診断の観点から、膵β細胞を標的分子とすることが好ましく、より好ましくは膵島のGLP−1受容体を標的分子とすることである。さらに、本発明において、膵島イメージングは、膵島量の定量性及びヒトに適用するという観点から、非侵襲で三次元のイメージングであることが好ましい。イメージングの方法としては、非侵襲の膵島イメージングが可能な方法であれば特に制限されず、例えば、ポジトロン放射断層撮影法(PET)、シングルフォトン放射線コンピュータ断層撮影法(SPECT)、磁気共鳴映像法(MRI)、X線・可視光・蛍光・近赤外光・超音波などを利用する方法が挙げられる。これらの中でも、本発明の分子プローブ前駆体を利用し、膵島量の定量を行う観点からはPET及びSPECTが好ましい。
【0019】
[本発明の分子プローブ前駆体]
本発明の分子プローブ前駆体は、上記式(1)〜(4)のいずれかで表されるポリペプチド、上記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、上記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチドを含み、前記分子プローブは膵島のイメージングに用いられる分子プローブである膵島イメージング用分子プローブ前駆体であって、好ましくは上記式(1)〜(4)のいずれかで表されるポリペプチド、上記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、上記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチドからなり、前記分子プローブは膵島のイメージングに用いられる分子プローブである膵島イメージング用分子プローブ前駆体である。
【0020】
本発明の分子プローブ前駆体は、膵島イメージングに用いるポリペプチドであって、上記式(1)〜(4)のいずれかで表されるポリペプチドを含む。上記式(1)〜(4)のポリペプチドのアミノ酸配列は、それぞれ、配列表の配列番号1〜4に記載のアミノ酸配列である。上記式(1)のポリペプチドの第4番目及び第19番目のリジンの側鎖のアミノ基、上記式(2)のポリペプチドの第3番目及び第18番目のリジンの側鎖のアミノ基、上記式(3)のポリペプチドの第2番目及び第17番目のリジンの側鎖のアミノ基、上記式(4)のポリペプチドの第1番目及び第16番目のリジンの側鎖のアミノ基には、アミノ基を保護するための保護基が結合している。また、上記式(1)〜(4)のポリペプチドのN末端のα−アミノ基には、該アミノ基を保護するために保護基が結合しているか、又は、電荷を有さない修飾基により修飾されている。上記式(1)〜(4)のポリペプチドのC末端のカルボキシル基は、膵β細胞との結合性の向上の観点から、アミノ基によりアミド化されている。
【0021】
上記式(1)〜(4)のポリペプチドを含む本発明の分子プローブ前駆体を後述するアミノ基を標識化する標識システムで標識化すると、保護基により保護されていないC末端のリジンの側鎖のアミノ基が標識化されうる。すなわち、上記式(1)のポリペプチドの第32番目のリジンの側鎖のアミノ基、上記式(2)のポリペプチドの第31番目のリジンの側鎖のアミノ基、上記式(3)のポリペプチドの第30番目のリジンの側鎖のアミノ基、及び、上記式(4)のポリペプチドの第29番目のリジンの側鎖のアミノ基が標識化される。
【0022】
ここで、上記式(1)(配列表の配列番号1)における第1番目から第31番目のアミノ酸配列は、リジンの側鎖のアミノ基に結合する保護基及びN末端のα−アミノ基に結合する保護基又は修飾基を除けば、エキセンジン(9−39)のアミノ酸配列と一致する。エキセンジン(9−39)は、膵β細胞上に発現するGLP−1R(グルカゴン様ペプチド−1の受容体)に結合することが知られている。本発明の分子プローブ前駆体を標識化及び脱保護して得られる分子プローブ(以下、「本発明の分子プローブ」ともいう。)も、膵島、好ましくは膵β細胞に結合可能である。
【0023】
本発明の分子プローブ前駆体は、その他の実施形態として、膵島イメージングに用いるポリペプチドであって、上記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸配列が欠失、付加又は置換したポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチドを含み得る。ここで、前記1〜数個とは、1〜10、1〜9、1〜8、1〜7、1〜6、1〜5、1〜4、1〜3、1〜2、及び1個を含みうる。この実施形態の本発明の分子プローブ前駆体においても、上記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸配列が欠失、付加又は置換したポリペプチドである場合は、保護基によるN末端のα−アミノ基の保護又は修飾基によるN末端のα−アミノ基の修飾、及び、C末端のカルボキシル基のアミド化を含むことが好ましく、標識化されるリジンを1つ含み、その他のリジンを含む場合はその他のリジンの側鎖のアミノ基は保護基により保護されていることが好ましい。上記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸配列が欠失、付加又は置換したポリペプチドは、これらを標識化及び脱保護した後、上記式(1)〜(4)のポリペプチドを標識化及び脱保護して得られるポリペプチドと同様の作用効果を有することが好ましく、より好ましくは上記式(1)のポリペプチドを標識化及び脱保護して得られるポリペプチドと同様の作用効果を有することである。
【0024】
本発明の分子プローブ前駆体は、さらにその他の実施形態として、膵島イメージングに用いるポリペプチドであって、上記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチドを含み得る。ここで、前記相同性とは、当業者が通常用いるアルゴリズム、例えば、BLAST又はFASTAなどで算出されるものでよく、あるいは、比較する2つのポリペプチドの同一アミノ酸残基の数を一方のポリペプチド全長で除して得られる数に基づいてもよい。前記相同性は、85%以上、90%以上、95%以上を含みうる。この実施形態の本発明の分子プローブ前駆体においても、上記式(1)〜(4)のポリペプチドと80%以上の相同性を有するポリペプチドである場合は、保護基によるN末端のα−アミノ基の保護又は修飾基によるN末端のα−アミノ基の修飾、及び、C末端のカルボキシル基のアミド化を含むことが好ましく、標識化されるリジンを1つ含み、その他のリジンを含む場合はその他のリジンの側鎖のアミノ基は保護基により保護されていることが好ましい。上記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドは、これらを標識化及び脱保護した後、上記式(1)〜(4)のポリペプチドを標識化及び脱保護して得られるポリペプチドと同様の作用効果を有することが好ましく、より好ましくは上記式(1)のポリペプチドを標識化及び脱保護して得られるポリペプチドと同様の作用効果を有することである。
【0025】
本明細書において「膵島に結合可能」とは、膵島量の定量性及び検査・診断の用途の観点から、本発明の分子プローブが膵β細胞に結合可能であることが好ましく、少なくとも膵臓において膵β細胞に特異的であることがより好ましく、少なくともヒトに対する非侵襲的なイメージングにおけるシグナル検出において他の器官・組織とシグナルが重ならない程度に特異的であることがさらに好ましい。
【0026】
なお、本発明の分子プローブ前駆体は、例えば、Fmoc法等の定法に従ったペプチド合成により製造することができ、そのペプチド合成方法は特に制限されない。
【0027】
本発明の分子プローブ前駆体は、上記のとおり、膵島イメージングに用いられるものであって、ヒトの検査・診断の用途の観点から非侵襲性の膵島イメージングに用いられることが好ましく、同様の観点から膵島量を定量するための膵島イメージングに用いられることが好ましい。さらに、本発明の分子プローブ前駆体は、糖尿病の予防、治療又は診断のための膵島イメージングに用いられることが好ましい。これらの膵島イメージングは、例えば、PET又はSPECTにより行われてもよい。
【0028】
[保護基]
本発明の分子プローブ前駆体における保護基は、本発明の分子プローブの特定のアミノ基、すなわち、本発明の分子プローブ前駆体においてC末端側に位置するリジン側鎖のアミノ基を標識化する間に、その他のアミノ基を保護するものであって、そのような機能を果たせる公知の保護基を使用できる。前記保護基としては、特に制限されず、例えば、9−フルオレニルメチルオキシカルボニル基(Fmoc)、tert−ブトキシカルボニル基(Boc)、ベンジルオキシカルボニル基(Cbz)、2,2,2−トリクロロエトキシカルボニル基(Troc)、アリルオキシカルボニル基(Alloc)、アミノ基、3から20個の炭素のアルキル基、9−フルオレンアセチル基、1−フルオレンカルボン酸基、9−フルオレンカルボン酸基、9−フルオレノン−1−カルボン酸基、ベンジルオキシカルボニル基、キサンチル基(Xan)、トリチル基(Trt)、4−メチルトリチル基(Mtt)、4−メトキシトリチル基(Mmt)、4−メトキシ2,3,6−トリメチル−ベンゼンスルホニル基(Mtr)、メシチレン−2−スルホニル基(Mts)、4,4−ジメトキシベンゾヒドリル基(Mbh)、トシル基(Tos)、2,2,5,7,8−ペンタメチルクロマン−6−スルホニル基(Pmc)、4−メチルベンジル基(MeBzl)、4−メトキシベンジル基(MeOBzl)、ベンジルオキシ基(BzlO)、ベンジル基(Bzl)、ベンゾイル基(Bz)、3−ニトロ−2−ピリジンスルフェニル基(Npys)、1−(4,4−ジメチル−2,6−ジアキソシクロヘキシリデン)エチル基(Dde)、2,6−ジクロロベンジル基(2,6−DiCl−Bzl)、2−クロロベンジルオキシカルボニル基(2−Cl−Z)、2−ブロモベンジルオキシカルボニル基(2−Br−Z)、ベンジルオキシメチル基(Bom)、シクロヘキシルオキシ基(cHxO)、t−ブトキシメチル基(Bum)、t−ブトキシ基(tBuO)、t−ブチル基(tBu)、アセチル基(Ac)及びトリフルオロアセチル基(TFA)などが挙げられ、取扱いの点から、Fmoc及びBocが好ましい。これらの保護基の脱保護の方法は、それぞれ公知であって、当業者であれば適宜脱保護できる。
【0029】
[修飾基]
本発明の分子プローブ前駆体におけるN末端のα−アミノ基は、N末端のα−アミノ基の正電荷を打ち消して、本発明の分子プローブ前駆体を標識化及び脱保護して得られる分子プローブの腎臓への集積を抑制する点から、電荷を有さない修飾基で修飾されていてもよい。電荷を有さない修飾基としては、例えば、上記保護基として記載したものが使用できる。電荷を有さないその他の修飾基としては、例えば、o−ブロモベンジルオキシカルボニル基、t−ブチルジメチルシリル基、2−クロロベンジル(Cl−z)基、シクロヘキシル基、シクロペンチル基、イソプロピル基、ピバリル基、テトラヒドロピラン−2−イル基、トリメチルシリル基等が使用できる。中でも、修飾基としては、アセチル基、ベンジル基、ベンジルオキシメチル基、o−ブロモベンジルオキシカルボニル基、t−ブチル基、t−ブチルジメチルシリル基、2−クロロベンジル基、2,6−ジクロロベンジル基、シクロヘキシル基、シクロペンチル基、イソプロピル基、ピバリル基、テトラヒドロピラン−2−イル基、トシル基、トリメチルシリル基及びトリチル基が好ましい。また、N末端のα−アミノ基を修飾し、その正電荷を打ち消す観点からは、リジンの側鎖のアミノ基に使用した保護基と異なる保護基が好ましく、より好ましくはアセチル基である。
【0030】
[標識化合物]
本発明の分子プローブ前駆体は、C末端のリジンの側鎖のアミノ基を放射性核種を有する芳香環を含む標識化合物により標識化するための分子プローブ前駆体であることが好ましく、上記式(1)〜(4)のポリペプチドからなる本発明の分子プローブ前駆体においてC末端側に位置するリジン側鎖のアミノ基を該標識化合物により標識化するための分子プローブ前駆体であることが好ましい。
【0031】
放射性核種としては、例えば、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、82Rb、99mTc、111In、123I、124I、125I、131Iが挙げられる。PETを行う観点からは、放射性核種は、11C、13N、15O、18F、62Cu、64Cu、68Ga、75Br、76Br、82Rb、124Iなどのポジトロン放出核種が好ましい。SPECTを行う観点からは、放射性核種は、67Ga、99mTc、77Br、111In、123I、125Iなどのγ線放出核種が好ましい。これらの中でも、18F、75Br、76Br、77Br、123I、124Iなどの放射性ハロゲン核種がより好ましく、特に好ましくは18F、123I、124Iである。
【0032】
本明細書において「放射性核種を有する芳香環を含む化合物」とは、放射性核種と、芳香族炭化水素基又は芳香族複素環基とを有する化合物のことをいい、好ましくは下記式(I)で表される基を有する化合物が挙げられる。
【0033】
【化4】

【0034】
上記式(I)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示す。芳香族炭化水素基としては、炭素数6〜18の芳香族炭化水素基が好ましく、例えば、フェニル基、o−トリル基、m−トリル基、p−トリル基、2,4−キシリル基、p−クメニル基、メシチル基、1−ナフチル基、2−ナフチル基、1−アンスリル基、2−アンスリル基、9−アンスリル基、1−フェナンスリル基、9−フェナンスリル基、1−アセナフチル基、2−アズレニル基、1−ピレニル基、2−トリフェニレニル基、o−ビフェニリル基、m−ビフェニリル基、p−ビフェニリル基、ターフェニル基等が挙げられる。芳香族複素環基としては、窒素原子、酸素原子又は硫黄原子を1又は2個有し、かつ、5〜10員の複素環基が好ましく、例えば、トリアゾリル基、3−オキサジアゾリル基、2−フリル基、3−フリル基、2−チエニル基、3−チエニル基、1−ピローリル基、2−ピローリル基、3−ピローリル基、2−ピリジル基、3−ピリジル基、4−ピリジル基、2−ピラジル基、2−オキサゾリル基、3−イソオキサゾリル基、2−チアゾリル基、3−イソチアゾリル基、2−イミダゾリル基、3−ピラゾリル基、2−キノリル基、3−キノリル基、4−キノリル基、5−キノリル基、6−キノリル基、7−キノリル基、8−キノリル基、1−イソキノリル基、2−キノキサリニル基、2−ベンゾフリル基、2−ベンゾチエニル基、N−インドリル基、N−カルバゾリル基等が挙げられる。これらの中でも、Aは、フェニル基、トリアゾリル基、ピリジル基が好ましい。
【0035】
上記式(I)において、R1は、11C、13N、15O、64Cu、67Ga、68Ga、99mTc、又は放射性ハロゲンを含む置換基を示し、例えば、放射性ハロゲン原子、放射性ハロゲン化C1−C3アルキル基、放射性ハロゲン化C1−C3アルコキシ基等が挙げられる。放射性ハロゲンとしては、18F、75Br、76Br、77Br、123I、124I、125I、131I等が挙げられる。本明細書において「C1−C3アルキル基」とは、1〜3個の炭素原子を有するアルキル基のことをいい、メチル基、エチル基、プロピル基等が挙げられる。本明細書において「放射性ハロゲン化C1−C3アルキル基」とは、1〜3個の炭素原子を有し、かつ、水素原子が放射性ハロゲンによって置換されたアルキル基のことをいう。本明細書において「C1−C3アルコキシ基」とは、1〜3個の炭素原子を有するアルコキシ基のことをいい、メトキシ基、エトキシ基、プロポキシ基等が挙げられる。本明細書において「放射性ハロゲン化C1−C3アルコキシ基」とは、1〜3個の炭素原子を有し、かつ、水素原子が放射性ハロゲンによって置換されたアルコキシ基のことをいう。R1は、定量性の観点からは、オルト位、メタ位、パラ位のいずれかの置換基であることが好ましく、より好ましくはメタ位又はパラ位のいずれかの置換基である。
【0036】
上記式(I)において、R2は、水素原子、又は、R1とは異なる1又は複数の置換基を示す。R2は、水素原子であっても、置換基であってもよいが、水素原子であること、つまり、上記式(I)においてAはR1以外の置換基で置換されていないことが好ましい。R2が複数の置換基である場合、それらは、同一であっても良いし、異なっていてもよい。置換基としては、水酸基、電子求引性基、電子供与性基、C1−C6アルキル基、C2−C6アルケニル基、C2−C6アルキニル基等が挙げられる。電子求引性基としては、シアノ基、ニトロ基、ハロゲン原子、カルボニル基、スルホニル基、アセチル基、フェニル基等が挙げられる。ハロゲン原子としては、フッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられる。本明細書において「C1−C6アルキル基」とは、1〜6個の炭素原子を有するアルキル基のことをいい、例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基、イソペンチル基、ヘキシル基が挙げられる。本明細書において「C2−C6アルケニル基」とは、2〜6個の炭素原子を有するアルケニル基のことをいい、例えば、ビニル基、1−プロペニル基、2−プロペニル基、イソプロペニル基、1−ブテニル基、2−ブテニル基、3−ブテニル基が挙げられる。本明細書において「C2−C6アルキニル基」とは、2〜6個の炭素原子を有するアルキニル基のことをいい、例えば、エチニル基、1−プロピニル基、2−プロピニル基、1−ブチニル基、2−ブチニル基、3−ブチニル基が挙げられる。これらの中でも、置換基としては、水酸基及び電子求引性基が好ましい。
【0037】
放射性核種を有する芳香環を含む標識化合物としては、例えば、[18F]fluorobenzoyl基([18F]FB)、[123I]iodobenzoyl基([123I]IB)、[124I]iodobenzoyl基([124I]IB)、[125I]iodobenzoyl基([125I]IB)、[131I]iodobenzoyl基([131I]IB)、[123I]iodo p-hydroxyphenylpropionyl基、[124I]iodo p-hydroxyphenylpropionyl基、[125I]iodo p-hydroxyphenylpropionyl基又は[131I]iodo p-hydroxyphenylpropionyl基を有する化合物が好ましく、より好ましくは[18F]N-succinimidyl 4-fluorobenzoate([18F]SFB)、[123I]N-succinimidyl 3-iodobenzoate([123I]SIB)、[124I]N-succinimidyl 3-iodobenzoate([124I]SIB)、[123I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide ester、[124I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide esterである。
【0038】
本発明の分子プローブ前駆体は、64Cu、67Ga、68Ga、99mTc、111In等の金属放射性同位元素(金属核種)で標識化する観点からは、標識化されるC末端のリジンの側鎖のアミノ基に、例えば、上記金属放射性同位元素(金属核種)と結合可能なキレート部位や、ペプチドとの結合を担うリンカー部が結合していてもよい。キレート化合物としては、例えば、ジエチレントリアミン五酢酸(DTPA)、6−ヒドラジノピリジン−3−カルボン酸(HYNIC)、テトラアザシクロドデカン四酢酸(DOTA)、dithisosemicarbazone(DTS)、diaminedithiol(DADT)、mercaptoacetylglycylglycylglycine(MAG3)、monoamidemonoaminedithiol(MAMA)、diamidedithiol(DADS)、propylene diamine dioxime(PnAO)等が挙げられる。
【0039】
本発明の分子プローブ前駆体は、標識化及び脱保護して得られる分子プローブと膵島との親和性、好ましくは該分子プローブと膵β細胞との親和性、より好ましくは分子プローブと膵島のGLP−1受容体との親和性の点からは、ジエチレントリアミン五酢酸(DTPA)がC末端側に位置するリジン側鎖のアミノ基に結合していないことが好ましく、より好ましくは金属放射性同位元素(金属核種)と結合可能なキレート部位が結合していないことである。上記キレート部位を形成しうるその他のキレート化合物としては、例えば、6−ヒドラジノピリジン−3−カルボン酸(HYNIC)、テトラアザシクロドデカン四酢酸(DOTA)、dithisosemicarbazone(DTS)、diaminedithiol(DADT)、mercaptoacetylglycylglycylglycine(MAG3)、monoamidemonoaminedithiol(MAMA)、diamidedithiol(DADS)、propylene diamine dioxime(PnAO)等が挙げられる。
【0040】
[本発明の分子プローブの調製方法]
本発明の分子プローブは、本発明の分子プローブ前駆体を、イメージング方法に応じた標識化を行い、その後、保護基の脱保護をすることで調製することができる。標識化に用いられる放射性核種としては、例えば、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I、131I等が挙げられる。標識化の手順としては、例えば、PETを行う場合には11C、15O、18F、124Iなどのポジトロン放出核種を、SPECTを行う場合には99mTc、123I、125Iなどのγ線放出核種を、公知の方法により標識化することが挙げられる。18Fの場合は、例えば、[18F]SFB([18F]N-succinimidyl 4-fluorobenzoate)などを用いる方法により標識化することができる。123I及び124Iの場合は、例えば、[123/124I]SIB([123/124I]N-succinimidyl 3-iodobenzoate)及び[123/124I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide esterなどを用いる方法により標識化することができる。125I及び131Iの場合は、例えば、[125/131I]SIB([125/131I]N-succinimidyl 3-iodobenzoate)及び[125/131I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide esterなどを用いる方法により標識化することができる。また、金属核種を用いて標識化する場合は、例えば、上記キレート化合物を用いて標識化することが挙げられる。これらの方法で上記式(1)〜(4)のポリペプチドを標識すると、上記式(1)のポリペプチドの第32番目のリジンの側鎖のアミノ基、上記式(2)のポリペプチドの第31番目のリジンの側鎖のアミノ基、上記式(3)のポリペプチドの第30番目のリジンの側鎖のアミノ基及び上記式(4)のポリペプチドの第29番目のリジンの側鎖のアミノ基が標識される。但し、本発明における標識化の方法はこれらの方法に限定されない。標識後の脱保護は、保護基の種類に応じた公知の方法で行うことができる。したがって、本発明は、その他の態様として、本発明の分子プローブの製造方法であって、本発明の分子プローブ前駆体を標識化及び脱保護することを含む製造方法に関する。
【0041】
本発明の分子プローブの製造方法は、C末端のリジンの側鎖のアミノ基を、放射性核種を有する芳香環を含む標識化合物により標識化することを含むことが好ましい。前記芳香環を含む標識化合物は、上記式(I)で表される基を含むことが好ましい。
【0042】
本発明の分子プローブの製造方法において、放射性核種を有する芳香環を含む標識化合物は、上記式(I)で表される基が、エステル結合を介してスクシンイミドと結合したスクシンイミジルエステル化合物であることが好ましく、より好ましくは下記式(II)で表されるスクシンイミジルエステル化合物である。
【0043】
【化5】

【0044】
上記式(II)において、A、R1及びR2は上記式(I)と同様である。上記式(II)においてR3は、結合手、C1−C6アルキレン基又はC1−C6オキシアルキレン基であることが好ましい。本明細書において「C1−C6アルキレン基」とは、1〜6個の炭素原子を有するアルキレン基のことをいい、例えば、メチレン基、エチレン基、プロピレン基、ブチレン基、ペンチル基、ヘキシル基等の直鎖状または分岐状のアルキレン基が挙げられる。本明細書において「C1−C6オキシアルキレン基」とは、1〜6個の炭素原子を有するオキシアルキレン基のことをいい、例えば、オキシメチレン基、オキシエチレン基、オキシプロピレン基、オキシブチレン基、オキシペンチル基等が挙げられる。R3としては、分子プローブと膵島との親和性、好ましくは分子プローブと膵β細胞との親和性、より好ましくは分子プローブと膵島のGLP−1受容体との親和性の点から、結合手、メチレン基、エチレン基が好ましく、より好ましくは結合手である。
【0045】
また、放射性核種を有する芳香環を含む標識化合物は、[18F]fluorobenzoyl基([18F]FB)、[123I]iodobenzoyl基([123I]IB)、[124I]iodobenzoyl基([124I]IB)、[125I]iodobenzoyl基([125I]IB)、[131I]iodobenzoyl基([131I]IB)、[123I]iodo p-hydroxyphenylpropionyl基、[124I]iodo p-hydroxyphenylpropionyl基、[125I]iodo p-hydroxyphenylpropionyl基又は[131I]iodo p-hydroxyphenylpropionyl基を有する化合物が好ましく、より好ましくは[18F]N-succinimidyl 4-fluorobenzoate、[123I]N-succinimidyl 3-iodobenzoate、[124I]N-succinimidyl 3-iodobenzoate、[123I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide ester、[124I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide esterである。
【0046】
本発明の分子プローブの製造方法において、上記式(I)で表される基を有する標識化合物及び/又は上記放射性核種を有する芳香環を含む標識化合物の合成は、自動合成装置を用いて行ってもよく、また、上記式(I)で表される基を有する標識化合物及び/又は上記放射性核種を有する芳香環を含む標識化合物の合成、及び、該標識化合物を用いた本発明の分子プローブ前駆体の標識化及び脱保護を、1つの自動合成装置によって行ってもよい。
【0047】
[本発明の分子プローブ]
本発明は、さらにその他の態様として、本発明の分子プローブの製造方法により得られうる膵島イメージング用分子プローブに関する。本発明のイメージング用分子プローブによれば、膵島の三次元イメージング、好ましくは非侵襲的な膵島の三次元イメージングを行うことができる。本発明の分子プローブは、例えば、62Cu、64Cu、67Ga、68Ga、82Rb、99mTc等の金属核種や、11C、13N、15O、18F、75Br、76Br、77Br、123I、124I、125I、131I等の核種が結合していてもよく、好ましくは11C、13N、15O、18F、75Br、76Br、77Br、123I、124I等の放射性核種が結合していることであり、より好ましくは18F、123I、124I等の放射性核種が結合していることである。
【0048】
本発明の分子プローブは、腎臓への集積を抑制する点から、N末端のα−アミノ基が電荷を有さない修飾基によって修飾されていてもよい、電荷を有さない修飾基としては、上記のものが挙げられ、N末端のα−アミノ基を修飾し、その正電荷を打ち消す観点からは、アセチル基が好ましい。
【0049】
本発明の分子プローブは、分子プローブと膵島との親和性、好ましくは分子プローブと膵β細胞との親和性、より好ましくは分子プローブと膵島のGLP−1受容体との親和性の点から、DTPAが、C末端側に位置するリジン側鎖のアミノ基、すなわち、上記式(1)のポリペプチドの第32番目のリジンの側鎖のアミノ基、上記式(2)のポリペプチドの第31番目のリジンの側鎖のアミノ基、上記式(3)のポリペプチドの第30番目のリジンの側鎖のアミノ基又は上記式(4)のポリペプチドの第29番目のリジンの側鎖のアミノ基に結合していないことが好ましく、より好ましくは金属放射性同位元素(金属核種)と結合可能なキレート部位が上記リジンの側鎖のアミノ基に結合していないことである。
【0050】
本発明は、さらにその他の態様として、膵島イメージング用分子プローブであって、下記式(5)〜(8)のいずれかで表されるポリペプチド、下記式(5)〜(8)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって膵島に結合可能なポリペプチド、又は、下記式(5)〜(8)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって膵島に結合可能なポリペプチドを含む膵島イメージング用分子プローブに関し、好ましくは下記式(5)〜(8)のいずれかで表されるポリペプチド、下記式(5)〜(8)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって膵島に結合可能なポリペプチド、又は、下記式(5)〜(8)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって膵島に結合可能なポリペプチドからなる膵島イメージング用分子プローブに関する。
Z-DLSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (5) (配列番号5)
Z-LSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (6) (配列番号6)
Z-SKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (7) (配列番号7)
Z-KQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (8) (配列番号8)
[上記式(5)〜(8)において、「X」は側鎖のアミノ基が放射性核種で標識されたリジン残基を示し、前記放射性核種は11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I又は131Iであり、「Z-」はN末端のα−アミノ基が非修飾であるか、又は、電荷を有さない修飾基により修飾されていることを示し、「-NH2」はC末端のカルボキシル基がアミド化されていることを示す。]
【0051】
放射性核種は、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I又は131Iである。PETを行う観点からは、11C、13N、15O、18F、64Cu、68Ga、75/76Br、82Rb、124Iなどのポジトロンを放出する核種が好ましい。SPECTを行う観点からは、67Ga、99mTc、77Br、123Iなどのγ線などのシングルフォトンを放出する核種が好ましい。
【0052】
本発明の分子プローブのN末端のα−アミノ基は、非修飾、すなわち、アミノ基のままであるか、又は、電荷を有さない修飾基により修飾されている。膵島への集積を増加させ、かつ、膵島の周囲臓器への集積を抑制する点からは、N末端のα−アミノ基が非修飾、すなわち、アミノ基であることが好ましく、腎臓への集積を抑制する点からは、電荷を有さない修飾基で修飾されていることが好ましい。電荷を有さない修飾基は上記のとおりである。
【0053】
本発明の分子プローブは、膵島イメージングに用いるポリペプチドであって、上記式(5)〜(8)のいずれかで表されるポリペプチドを含む。上記式(5)〜(8)のポリペプチドのアミノ酸配列は、それぞれ、配列表の配列番号5〜8に記載のアミノ酸配列である。また、上記式(5)(配列表の配列番号5)における第1番目から第31番目のアミノ酸配列は、N末端のα−アミノ基が修飾基と結合している場合を除けば、エキセンジン(9−39)のアミノ酸配列と一致する。
【0054】
本発明の分子プローブにおいて、前記放射性核種で標識されたリジンの側鎖のアミノ基が、下記式(III)で表される芳香環を含む基と結合していることが好ましい。
【0055】
【化6】

【0056】
上記式(III)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示し、芳香族炭化水素基及び芳香族複素環基としては上記のとおりである。R5は、水素原子又はR4とは異なる1又は複数の置換基を示し、R2と同様のものが挙げられる。
【0057】
上記式(III)において、R4は、11C、13N、15O、18F、75Br、76Br、77Br、123I、124I、125I又は131Iを含む置換基を示す。R4としては、11C原子、13N原子、15O原子、18F原子、75Br原子、76Br原子、77Br原子、123I原子、124I原子、125I原子、131I原子、[18F]フッ素で置換されたC1−C3アルキル基、[18F]フッ素で置換されたC1−C3アルコキシ基、[123I]ヨウ素で置換されたC1−C3アルキル基、[124I]ヨウ素で置換されたC1−C3アルキル基、[125I]ヨウ素で置換されたC1−C3アルキル基、[131I]ヨウ素で置換されたC1−C3アルキル基、[123I]ヨウ素で置換されたC1−C3アルコキシ基、[124I]ヨウ素で置換されたC1−C3アルコキシ基、[125I]ヨウ素で置換されたC1−C3アルコキシ基、[131I]ヨウ素で置換されたC1−C3アルコキシ基等が挙げられる。C1−C3アルキル基としては、メチル基、エチル基、プロピル基等が挙げられる。C1−C3アルコキシ基としては、メトキシ基、エトキシ基、プロポキシ基等が挙げられる。R4は、定量性の観点からは、オルト位、メタ位、パラ位のいずれかの置換基であることが好ましく、より好ましくはメタ位又はパラ位のいずれかの置換基である。
【0058】
上記式(III)において、R3は、上記式(II)と同様に、結合手、C1−C6アルキレン基及びC1−C6オキシアルキレン基のいずれかであることが好ましく、膵島、好ましくは膵β細胞、より好ましくは膵島のGLP−1受容体との親和性の点から、結合手、メチレン基、エチレン基がより好ましく、さらに好ましくは結合手である。
【0059】
下記式(III)で表される芳香環を含む基は、膵島、好ましくは膵β細胞、より好ましくは膵島のGLP−1受容体との親和性の点から、炭素数が7以上20以下であることが好ましく、より好ましくは7以上13以下、さらに好ましくは7以上9以下である。
【0060】
本発明の分子プローブにおいて、放射性核種で標識されたリジンの側鎖のアミノ基に結合する放射性核種を有する基は、炭素数が13以下であることが好ましく、より好ましくは10以下であり、さらに好ましくは9以下である。また、その下限は、例えば、1以上であり、7以上が好ましい。したがって、放射性核種で標識されたリジンの側鎖のアミノ基に結合する放射性核種を有する基は、炭素数が1以上13以下であることが好ましく、より好ましくは7以上10以下であり、さらに好ましくは7以上9以下である。
【0061】
[イメージング方法]
本発明は、さらにその他の態様として、本発明の分子プローブ前駆体を標識化し、その後、保護基を脱保護することを含む膵島のイメージング方法に関する。本発明のイメージング方法は、本発明の分子プローブを用いて膵島をイメージングすることを含んでもよい。本発明のイメージング方法は、検査・診断の用途の観点から、膵β細胞のイメージング方法であることが好ましい。前駆体の標識化及び脱保護については上記のとおりであって、膵島イメージングについても上記のとおりである。また、本発明のイメージング方法は、さらに、前記分子プローブを用いた膵島イメージングの結果から膵島の状態を判定することを含んでもよい。分子プローブを用いた膵島イメージングの結果から膵島の状態を判定することは、例えば、膵島イメージングの画像を解析することにより膵島の有無を判断すること、膵島量の増減を判断すること等を含む。
【0062】
本発明は、さらにその他の態様として、予め被検体に投与された本発明のイメージング用分子プローブのシグナル及び又は予め膵島に結合させた本発明のイメージング用分子プローブのシグナルを検出することを含む、膵島のイメージング方法に関する。本発明のイメージング方法において、イメージングするために十分な量の本発明の分子プローブを投与された被検体から本発明の分子プローブのシグナルを検出することが好ましく、イメージングするために十分な量が予め膵島に結合させた本発明の分子プローブのシグナルを検出することがより好ましい。
【0063】
本発明の分子プローブのシグナルの検出は、例えば、PETを用いた測定及び/又はSPECTを用いた測定等により行うことができる。本発明のイメージング方法において、検出されたシグナルを再構成処理して画像データに変換し表示する工程を含んでいてもよい。PETを用いた測定及びSPECTを用いた測定には、例えば、イメージの撮影、膵島量の測定等を含む。
【0064】
SPECTを用いた測定は、例えば、本発明の分子プローブを投与された被検体(以下、「対象」ともいう)から放出されるγ線をガンマカメラにより測定することを含む。ガンマカメラによる測定は、例えば、本発明の分子プローブの標識に使用した上記放射性核種から放出される放射線(γ線)を一定時間単位で測定することを含み、好ましくは放射線が放出される方向及び放射線数量を一定時間単位で測定することを含む。本発明のイメージング方法は、さらに、放射線の測定により得られた測定された本発明の分子プローブの分布を断面画像として表すこと、及び、得られた断面画像を再構成することを含んでいてもよい。対象としては、ヒト及び又はヒト以外の哺乳類が挙げられる。
【0065】
PETを用いた測定は、例えば、本発明の分子プローブを投与された被検体から、ポジトロンと電子との結合により生成する1対の消滅放射線をPET用検出器で同時計数することを含み、さらに、計測した結果に基づきポジトロンを放出する放射性核種の位置の三次元分布を描写することを含んでいてもよい。
【0066】
本発明のイメージング方法において、SPECTの測定又はPETの測定とあわせて、X線CTやMRIの測定を行ってもよい。これにより、例えば、SPECTにより得られた画像又はPETにより得られた画像(機能画像)と、CTにより得られた画像又はMRIにより得られた画像(形態画像)とを融合させた融合画像を得ることができる。
【0067】
本発明のイメージング方法は、本発明の分子プローブを対象に投与すること、及び、分子プローブの投与から一定時間経過後、PET又はSPECT等の手段による測定を行うことを含むことができ、画像化のために所望のコントラストを得るために十分な量の本発明の分子プローブを投与することを含んでいてもよい。また、本発明のイメージング方法は、上述のように、本発明のプローブを被検体に投与し、一定時間経過後に行うことができるから、本発明のイメージング方法は、本発明の分子プローブを対象に投与することを含んでいなくてもよい。PET等による測定には、例えば、イメージの撮影、膵島量の測定等を含む。投与対象としては、ヒト及び又はヒト以外の哺乳類が挙げられる。対象への投与は、局所的であってもよく、全身的であってもよい。投与経路は、対象の状態等に応じて適宜決定できるが、例えば、静脈、動脈、皮内、腹腔内への注射又は輸液等が挙げられる。本発明の分子プローブは、担体とともに投与することが好ましい。担体としては、例えば、水性溶媒及び非水性溶媒が使用できる。水性溶媒としては、例えば、リン酸カリウム緩衝液、生理食塩水、リンゲル液、蒸留水等が挙げられる。非水性溶媒としては、例えば、ポリエチレングリコール、植物性油脂、エタノール、グリセリン、ジメチルスルホキサイド、プロピレングリコール等が挙げられる。膵島のイメージング又は膵島量の測定のための本発明の分子プローブの用量は、例えば、1μg以下とすることができる。投与から測定までの時間は、例えば、分子プローブの膵島への結合時間、分子プローブの種類及び分子プローブの分解時間等に応じて適宜決定できる。
【0068】
[膵島量の測定方法]
本発明は、さらにその他の態様として、膵島量の測定方法であって、本発明の分子プローブ前駆体を標識化及び脱保護して本発明の分子プローブを調製すること、及び、分子プローブを用いた膵島イメージングの結果から膵島量を算出することを含む膵島量の測定方法に関する。本発明の膵島量の測定方法は、調製した本発明の分子プローブを用いて膵島イメージングを行うことを含んでもよい。標識化及び脱保護については上記のとおりであって、膵島イメージングについても上記のとおりである。分子プローブを用いた膵島イメージングの結果からの膵島量の算出は、例えば、膵島イメージングの画像を解析すること等により行うことができる。また、イメージングの結果からイメージングの対象物の定量を行うことは、当業者であれば、例えば、検量線や適当なプログラムを用いて容易に行うことができる。本発明の膵島量の測定方法は、検査・診断の用途の観点から、膵β細胞量の測定方法であることが好ましい。
【0069】
本発明は、さらにその他の態様として、膵島量の測定方法であって、予め被検体に投与された本発明のイメージング用分子プローブのシグナル及び又は予め膵島に結合させた本発明のイメージング用分子プローブのシグナルを検出すること、及び、検出したイメージング用分子プローブのシグナルから膵島量を算出することを含む膵島量の測定方法に関する。
【0070】
本発明の膵島量の測定方法は、さらに、算出した膵島量を提示することを含んでいてもよい。算出した膵島量を提示することは、例えば、算出した膵島量を保存又は外部に出力することを含む。外部に出力することは、例えば、モニタに表示すること、及び、印字すること等を含む。
【0071】
[糖尿病の予防、治療、診断方法]
本発明は、さらにその他の態様として、糖尿病の予防又は治療又は診断方法に関する。本発明の糖尿病の予防又は治療又は診断方法は、具体的には、本発明のイメージング用分子プローブ前駆体を標識化及び脱保護して膵島イメージング用分子プローブを調製すること、前記膵島イメージング用分子プローブを用いて膵島のイメージングを行うこと、及び、得られた膵島の画像及び又は膵島量に基づき膵島の状態を判定して糖尿病の診断することを含み、前記診断に基づき糖尿病の予防又は治療することを含みうる。上述したとおり、糖尿病の発症過程では、膵島量(とりわけ、膵β細胞量)が耐糖能異常に先行して減少するが、機能異常が検出・自覚される段階に至ってからでは、糖尿病はすでに治療が難しい段階となっている。しかし、本発明の分子プローブ前駆体及び又は本発明の分子プローブを用いたイメージング方法及び又は膵島量の測定方法によれば、膵島量及び又は膵β細胞量の減少を早期に発見することができ、ひいては、新たな糖尿病の予防・治療・診断法が構築できる。糖尿病の予防・治療・診断の対象としては、ヒト及び又はヒト以外の哺乳類が挙げられる。例えば、本発明の糖尿病の予防方法は、定期的に膵島量の測定を行い、膵島量の減少傾向の有無をチェックすることが含むことができる。また、本発明の糖尿病の治療方法は、対象に対して行われる投薬や食事療法を含む治療効果を膵島量の変化に着目して評価することを含むことができる。そして、本発明の糖尿病の診断方法は、膵島のイメージング又は膵島量の測定を行い、基準となる大きさ又は量との比較、あるいは、糖尿病の進行度を判断することを含むことができる。
【0072】
本発明は、好ましいその他の態様として、糖尿病の超早期診断方法に関する。本発明の糖尿病の超早期診断方法は、例えば、人間ドック、健康診断において本発明の方法により膵島のイメージング及び又は膵島量の測定を行うこと、及び、得られた膵島の画像及び又は膵島量に基づき膵島の状態を判定することを含むことができる。また、本発明の糖尿病の治療方法は、本発明の方法により膵島のイメージング及び又は膵島量の測定を行うこと、及び、得られた膵島の画像及び又は膵島量に基づき膵島の機能回復を評価することを含むことができる。
【0073】
[本発明のキット]
本発明は、さらにその他の態様として、膵島イメージング用分子プローブの調製のためのキットであって、本発明の分子プローブ前駆体を含むキットに関する。本発明のキットの実施形態としては、本発明の分子プローブを調製するためのキット、本発明のイメージング方法を行うためのキット、本発明の膵島量の測定方法を行うためのキット、本発明の糖尿病の予防又は治療又は診断のキットなどが挙げられる。本発明のキットは、これらの各実施形態において、それぞれの形態に応じた取扱い説明書を含むことが好ましい。
【0074】
本発明のキットは、例えば、前記膵島イメージング用分子プローブ前駆体の標識化に使用する化合物であって、ハロゲン又は放射性ハロゲンを有する芳香環を含む化合物を含んでいてもよい。前記芳香環を含む化合物は、下記式(IV)で表される基を有する化合物であることが好ましい。
【0075】
【化7】

【0076】
上記式(IV)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示し、芳香族炭化水素基及び芳香族複素環基としては上記のとおりである。R7は、水素原子又はR6とは異なる1又は複数の置換基を示し、R2と同様のものが挙げられる。R6は、ハロゲン又は放射性ハロゲンを含む置換基を示す。ハロゲンを含む置換基としては、F原子、Br原子、I原子、フッ素で置換されたC1−C3アルキル基、フッ素で置換されたC1−C3アルコキシ基、ヨウ素で置換されたC1−C3アルキル基、ヨウ素で置換されたC1−C3アルコキシ基等が挙げられる。放射性ハロゲンを含む置換基としては、R1と同様のものが挙げられる。R6は、定量性の観点からは、オルト位、メタ位、パラ位のいずれかの置換基であることが好ましく、より好ましくはメタ位又はパラ位のいずれかの置換基である。
【0077】
放射性核種を有する芳香環を含む標識化合物は、上記式(IV)で表される基が、エステル結合を介してスクシンイミドと結合したスクシンイミジルエステル化合物であることが好ましく、より好ましくは下記式(V)で表されるスクシンイミジルエステル化合物である。
【0078】
【化8】

【0079】
上記式(V)において、A、R6及びR7は上記式(IV)と同様である。上記式(V)において、R3は、上記式(II)及び(III)と同様に、結合手、C1−C6アルキレン基及びC1−C6オキシアルキレン基のいずれかであることが好ましく、膵島、好ましくは膵β細胞、より好ましくは膵島のGLP−1受容体との親和性の点から、結合手、メチレン基、エチレン基がより好ましく、さらに好ましくは結合手である。
【0080】
また、放射性核種を有する芳香環を含む標識化合物は、例えば、[18F]fluorobenzoyl基、[123I]iodobenzoyl基、[124I]iodobenzoyl基、[125I]iodobenzoyl基、[131I]iodobenzoyl基、[123I]iodo p-hydroxyphenylpropionyl基、[124I]iodo p-hydroxyphenylpropionyl基、[125I]iodo p-hydroxyphenylpropionyl基、[131I]iodo p-hydroxyphenylpropionyl基を有する化合物が好ましく、より好ましくは[18F]N-succinimidyl 4-fluorobenzoate、[123I]N-succinimidyl 3-iodobenzoate、[124I]N-succinimidyl 3-iodobenzoate、[123I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide ester、[124I]iodo p-hydroxyphenylpropionic acid N-hydroxysuccinimide esterである。本発明のキットは、例えば、上記標識化合物及び/又は標識化合物を作成するための化合物を用いた本発明の分子プローブ前駆体の標識化方法が記載された取扱い説明書を含んでいてもよい。
【0081】
本発明のイメージング用分子プローブ前駆体を含むキットは、さらに、上記標識化合物の出発原料を含むことが好ましい。[18F]N-succinimidyl 4-fluorobenzoateの出発原料としては、例えば、ethyl 4-(trimethylammonium triflate) benzoate、ethyl 4-(tosyloxy)benzoate、ethyl 4-(methylsulfonyloxy)benzoate等が挙げられる。[123/124/125/131I]N-succinimidyl 3-iodobenzoateの出発原料としては、例えば、2,5-dioxopyrrolidin-1-yl 3-(tributylstannyl)benzoate等が挙げられる。
【0082】
本発明は、さらにその他の態様として、本発明の分子プローブを含むキットに関する。本形態のキットの実施形態としては、本発明のイメージング方法を行うためのキット、本発明の膵島量の測定方法を行うためのキット、本発明の糖尿病の予防又は治療又は診断のキットなどが挙げられる。これらの各実施形態において、それぞれの形態に応じた取扱い説明書を含むことが好ましい。
【0083】
本発明のキットにおいて、本発明のイメージング用分子プローブは、注射液の形態で含むことが好ましい。したがって、本発明のキットは、本発明のイメージング用分子プローブを含有する注射液を含むことが好ましい。注射液は、有効成分とする本発明のイメージング用分子プローブを含み、さらに、例えば、担体等の医薬品添加物を含んでいてもよい。本明細書において医薬品添加物は、日本薬局方、アメリカ薬局方、ヨーロッパ薬局方等で医薬品添加物として許認可を受けている化合物のことをいう。担体としては、例えば、水性溶媒及び非水性溶媒が挙げられる。水性溶媒としては、例えば、リン酸カリウム緩衝液、生理食塩水、リンゲル液、蒸留水等が挙げられる。非水性溶媒としては、例えば、ポリエチレングリコール、植物性油脂、エタノール、グリセリン、ジメチルスルホキサイド、プロピレングリコール等が挙げられる。また、本発明のキットは、本発明のイメージング用分子プローブを入れるための容器をさらに含んでいてもよく、本発明のイメージング用分子プローブ及び本発明のイメージング用分子プローブを含有する注射液が容器に充填されていてもよい。容器としては、例えば、シリンジやバイアル瓶等が挙げられる。
【0084】
本発明のキットは、例えば、バッファー、浸透圧調整剤等の分子プローブを調製するための成分や、注射器等の分子プローブの投与に使用する器具等をさらに含むことができる。
【0085】
本発明の分子プローブ前駆体を含むキットは、さらに、例えば、標識化合物の自動合成装置、及び、該標識化合物の自動合成装置を用いた上記式(I)で表される基を有する標識化合物及び/又は上記放射性核種を有する芳香環を含む標識化合物の合成方法が記載された取扱い説明書を含んでいてもよい。該自動合成装置は、標識化合物の合成に加えて、例えば、合成した標識化合物を用いた膵島イメージング用分子プローブ前駆体の標識化及び脱保護が可能な自動合成装置であってもよい。該キットは、さらに、標識化合物の合成に使用する放射性核種を含む試薬を含んでいてもよい。放射性核種を含む試薬としては、例えば、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、111In、123I、124I、125I又は131Iといった放射性同位元素を含む試薬が挙げられる。
【0086】
本発明は、さらにその他の態様として、本発明の分子プローブ前駆体を合成するための自動ペプチド合成装置、及び、上記式(I)で表される基を有する標識化合物及び/又は上記式(I)で表される基を有する標識化合物の自動合成装置を含むキットに関する。該自動合成装置は、標識化合物の合成に加えて、例えば、合成した標識化合物を用いた分子プローブ前駆体の標識化及び脱保護が可能な自動合成装置であってもよい。該キットは、本発明の分子プローブ前駆体の合成方法が記載された取扱い説明書を含んでいてもよい。該取扱い説明書には、さらに、例えば、上記式(I)で表される基を有する標識化合物の合成方法、それを用いた標識化方法、及び、脱保護方法等が記載されていてもよい。該キットは、さらに、標識化合物の合成に使用する放射性核種を含む試薬を含んでいてもよい。
【0087】
本発明は、さらにその他の態様として、本発明の分子プローブ前駆体の合成、上記標識化合物の合成、上記標識化合物を用いた膵島イメージング用分子プローブ前駆体の標識化及び脱保護を行う自動合成装置、及び、該自動合成装置を用いた本発明のイメージング用分子プローブの製造方法が記載された取扱い説明書を含むキットに関する。取扱い説明書には、例えば、分子プローブ前駆体の合成方法、上記標識化合物の合成方法、上記標識化合物を用いた分子プローブ前駆体の標識化及び脱保護方法等が記載されていることが好ましい。該キットは、さらに、標識化合物の合成に使用する放射性核種を含む試薬を含んでいてもよい。
【0088】
[本発明のイメージング用試薬]
本発明は、さらにその他の態様として、本発明の分子プローブを含むイメージング用試薬に関する。本発明のイメージング用試薬は、有効成分として本発明の分子プローブを含み、さらに、例えば、担体等の医薬品添加物を含んでいてもよい。担体は、上記のとおりである。
【0089】
[N末端のα−アミノ基が修飾された分子プローブ前駆体のその他の形態]
本発明は、一つの態様として、N末端のα−アミノ基が電荷を有さない修飾基により修飾された膵島イメージング用分子プローブの前駆体として、上記のように、上記式(1)〜(4)で表されるポリペプチドにおいてC末端のリジンのアミノ基が標識化される形態を含むが、その他の形態として、下記に示すような膵島イメージング用分子プローブの前駆体を提供し得る。すなわち、本発明は、その他の態様として、膵島のイメージングに用いられる分子プローブの前駆体であって、下記式(9)〜(16)のいずれかで表されるポリペプチド、下記式(9)〜(16)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、下記式(9)〜(16)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって標識化及び脱保護後に膵島に結合可能なポリペプチドからなり、前記分子プローブは、膵島のイメージングに用いられる分子プローブである、膵島イメージング用分子プローブ前駆体を提供しうる。
Z*-DLSKQMEEEAVRLFIEWLK* NGGPSSGAPPPS-NH2 (9) (配列番号9)
Z*-LSKQMEEEAVRLFIEWLK* NGGPSSGAPPPS-NH2 (10) (配列番号10)
Z*-SKQMEEEAVRLFIEWLK* NGGPSSGAPPPS-NH2 (11) (配列番号11)
Z*-KQMEEEAVRLFIEWLK* NGGPSSGAPPPS-NH2 (12) (配列番号12)
Z*-DLSK* QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (13) (配列番号13)
Z*-LSK* QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (14) (配列番号14)
Z*-SK* QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (15) (配列番号15)
Z*-K* QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (16) (配列番号16)
[上記式(9)〜(16)において、「Z*-」はN末端のα−アミノ基が電荷を有さない修飾基により修飾されていることを示し、「K*」はリジンの側鎖のアミノ基が保護基により保護されていることを示し、「-NH2」はC末端のカルボキシル基がアミド化されていることを示す。]
【0090】
上記式(9)〜(16)のポリペプチドを含む本発明の分子プローブ前駆体によれば、N末端のα−アミノ基が電荷を有さない修飾基により修飾されているため、例えば、上記式(9)〜(16)のポリペプチドを含む分子プローブ前駆体を標識化及び脱保護して得られる分子プローブの腎臓への集積を抑制できるという効果を好ましくは奏する。上記式(9)〜(16)のポリペプチドを含む本発明の分子プローブ前駆体を上述するアミノ基を標識化する標識システムで標識化すると、保護基が結合していないリジンの側鎖のアミノ基が標識化されうる。修飾基、保護基、核種、標識化法等は上記のとおりである。また、上記式(9)〜(16)のポリペプチドを含む本発明の分子プローブ前駆体を用いたイメージング方法、膵島量の測定方法、糖尿病の予防、治療、診断方法等は、上述と同様に応用できる。
【0091】
本発明は、さらにその他の形態として、上記式(9)〜(16)のポリペプチドを含む本発明の分子プローブ前駆体から得られうる膵島イメージング用分子プローブを提供しうる。
【0092】
以下に、実施例及び参考例を用いて本発明をさらに説明する。但し、本発明は以下の実施例に限定して解釈されない。
【0093】
なお、本明細書の記載において、以下の略語を使用する。
OBu:ブチルエステル基
Boc:ブトキシカルボニル基
Trt:トリチル基
Pdf:2,2,4,6,7−ペンタメチルジヒドロベンゾフラン−5−スルホニル基
Mmt:4−メトキシトリチル基
Fmoc:9−フルオレニルメチルオキシカルボニル基
【実施例】
【0094】
(実施例1)
配列番号1のN末端のα−アミノ基並びに第4番目及び第19番目のリジン残基に保護基が結合し、かつ、C末端のカルボキシル基がアミド化されている上記式(1)の本発明の分子プローブ前駆体を用いてマウスの体内分布の測定を行った。まず、以下のようにして本発明の分子プローブを調製した。
【0095】
[分子プローブ前駆体の調製]
ポリペプチドの合成は、Applied Biosystems社製ペプチド自動合成機(433A型)を用いて、添付のソフトに従って行った。側鎖に官能基のあるアミノ酸はそれぞれAsp(OBu)、Ser(OBu)、Lys(Boc)、Gln(Trt)、Glu(OBu)、Arg(Pbf)、Asn(Trt)、Trp(Boc)を用いた。4番目及び19番目のリジンとしてはLys(Mmt)を使用した。Rink Amide MBHA(0.125mmol、0.34mmol/g)を出発樹脂とし、配列に従って逐次アミノ酸を延長し、下記式(17)の配列を有するポリペプチドを得た。なお、下記式(17)において、Lys(Mmt)以外は側鎖の保護基の表記を省略した。
Fmoc-DLSK(Mmt)QMEEEAVRLFIEWLK(Mmt)NGGPSSGAPPPSK-保護ペプチド樹脂 (17) (配列番号17)
1.5%TFA−5%TIS−93.55%CH2Cl2を用いた定法処理により、上記式(17)のポリペプチドから、まず、4番目及び19番目のリジン残基の側鎖の保護基(Mmt基)を除去し、遊離した4番目及び19番目のリジン残基の側鎖のアミノ基をFmoc化した。ついで、4番目及び19番目のリジン残基のFmoc基以外の全保護基の除去と樹脂からのペプチドの切り出しとを、92.5%TFA−2.5%TIS−2.5%H2O−2.5%エタンジチオールを用いた定法処理によって行った。反応終了後、ろ別により担体樹脂を取り除き、乾燥エーテルを加えて粗生成物を沈殿させ、ろ別した。得られた粗生成物は、島津製作所のLC8A分取装置(ODS カラム3cmx25cm)を用い、0.1%TFAを含むCH3CN−H2Oのリニアーグラジエントの系で精製し、フラクションコレクターを用いて目的の画分を集めた後、下記式(18)の分子プローブ前駆体を凍結乾燥白色粉末として得た。
Fmoc-DLSK(Fmoc)QMEEEAVRLFIEWLK(Fmoc)NGGPSSGAPPPSK-NH2 (18) (配列番号18)
【0096】
[分子プローブの調製]
得られた上記式(18)の分子プローブ前駆体(640μg)をBorate Buffer(pH7.8)に溶解させ、それに[18F]SFBを加え反応溶液をpH8.5〜9.0に調整し標識化を行った。その後、DMF、Piperidineを加えることで脱保護反応を行い、目的物(配列番号5の第32番目のリジン残基が標識化された分子プローブ)を得た。すなわち、得られた分子プローブは、配列番号5のアミノ酸配列において第32番目のリジンの側鎖のアミノ基に[18F]FB(フルオロベンゾイル基)が結合し、かつ、C末端のカルボキシル基がアミド化され、かつ、N末端のα−アミノ基が非修飾(アミノ基)である下記式(19)の分子プローブ(配列番号19)である。
【0097】
【化9】

【0098】
[体内分布]
調製した上記式(19)の分子プローブ(5.6μCi)を無麻酔下の6週齢ddYマウス(雄性、体重30g)に静脈注射(尾静脈)により投与した。投与5分後、15分後、30分後、60分後、120分後に各臓器を摘出した(n=5)。各臓器の重量と放射能とを測定し、単位重量あたりの放射能から集積量(%dose/g)を算出した。その結果の一例を下記表1、図1A及びBに示す。図1Aは、各臓器への分子プローブの集積の経時変化を示すグラフであり、図1Bは図1Aを拡大したグラフである。
【0099】
【表1】

【0100】
図1A及びBに示すとおり、本実施例1で調製した分子プローブ(上記式(19)で表される分子プローブ)の膵臓への集積は、投与後5分で9.3%dose/g、投与後15分で6.9%dose/g、投与後30分で9.7%dose/gであった。また、本実施例1で調製した分子プローブは、何れの時間帯においても、膵臓の隣接臓器である胃、腸、肝臓及び脾臓よりも膵臓に多く集積した。特に、投与後5〜60分の間における胃及び腸の集積量は2%dose/g前後と低く、投与後5〜30分の間における、胃及び腸への集積量に対する膵臓への集積量は約4倍又はそれ以上であった。また、投与後15分以降は肝臓への集積量を4%dose/g以下に抑えることができ、投与後30分以降は肝臓への集積量に対する膵臓への集積量は2.5倍以上であった。つまり、本実施例1で調製した分子プローブは、特異的に膵臓に集積したといえる。また、骨への放射能集積が低く、生体内で脱フッ素代謝を受けていないことが示唆された。これにより、本実施例1の分子プローブ(上記式(19)で表される分子プローブ)は、膵β細胞のイメージングに適していると考えられる。
【0101】
(参考例1)
参考例1として、配列番号20のN末端のα−アミノ基と第19番目のリジン残基に保護基(Fmoc)が結合し、C末端のカルボキシル基がアミド化されている下記式(20)の分子プローブ前駆体から分子プローブを調製し、その分子プローブを用いてマウスの体内分布の測定を行った。つまり、配列番号20のアミノ酸配列において第4番目のリジンの側鎖のアミノ基に[18F]FB(フルオロベンゾイル基)が結合し、かつ、C末端のカルボキシル基がアミド化された下記式(21)で表される分子プローブ(配列番号21)を用いてマウスの体内分布の測定を行った。分子プローブ前駆体及び分子プローブの調製並びに体内分布の測定は、実施例1と同様に行った。その結果の一例を下記表2、図2A及びBに示す。
Fmoc-DLSKQMEEEAVRLFIEWLK(Fmoc)NGGPSSGAPPPS-NH2 (20) (配列番号20)
【0102】
【化10】

【0103】
【表2】

【0104】
(参考例2)
参考例2として、配列番号22のN末端と第4番目のリジン残基に保護基(Fmoc)が結合し、C末端のカルボキシル基がアミド化されている下記式(22)の分子プローブ前駆体から分子プローブを調製し、その分子プローブを用いてマウスの体内分布の測定を行った。つまり、配列番号22のアミノ酸配列において第19番目のリジンの側鎖のアミノ基に[18F]FB(フルオロベンゾイル基)が結合し、かつ、C末端のカルボキシル基がアミド化された下記式(23)で表される分子プローブ(配列番号23)を用いてマウスの体内分布の測定を行った。分子プローブ前駆体及び分子プローブの調製並びに体内分布の測定は、実施例1と同様に行った。その結果の一例を下記表3、図3A及びBに示す。
Fmoc-DLSK(Fmoc)QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2 (22) (配列番号22)
【0105】
【化11】

【0106】
【表3】

【0107】
図1A及びB、図2A及びB並びに図3A及びBに示すとおり、本実施例1で調製した分子プローブ(上記式(19)で表される分子プローブ)は、上記式(20)の分子プローブ前駆体を用いて調製した参考例1の分子プローブ及び上記式(22)の分子プローブ前駆体を用いて調製した参考例2の分子プローブと比べて膵臓への集積量が多く、また、膵臓の隣接臓器である胃及び腸への集積量が少なかった。また、本実施例1で調製した分子プローブは、上記参考例1の分子プローブ及び上記参考例2の分子プローブと比べて肝臓及び腎臓への集積が低く、本実施例1で調製した分子プローブの腎臓への集積量は上記参考例1及び2の分子プローブの腎臓への集積量の半分以下であった。このことからも、本実施例1で調製した分子プローブは、特異的に膵臓に集積したといえる。
【0108】
実施例1の分子プローブ、参考例1の分子プローブ及び参考例2の分子プローブの体内分布実験により得られた集積量に基づき、各プローブについての膵臓/肝臓比(膵臓の集積量/肝臓の集積量)を下記表4に、膵臓/腎臓比(膵臓の集積量/腎臓の集積量)を下記表5に示す。
【0109】
【表4】

【0110】
【表5】

【0111】
上記表4及び5に示すように、実施例1の分子プローブは、参考例1の分子プローブ及び参考例2の分子プローブと比較して膵臓/肝臓比及び膵臓/腎臓比が高かった。このように膵臓の周辺臓器に対する膵臓への集積量の比率が高く、また、膵臓の周辺臓器の集積が少ない本実施例1の分子プローブによれば、イメージングした際に、明瞭な膵臓の画像が得られることが示唆された。
【0112】
上記参考例1の分子プローブをマウスに投与することにより、マウスの膵島の三次元イメージング画像が得られている。また、上記参考例2の分子プローブをマウスに投与することにより、マウスの膵島の非侵襲的な三次元イメージング画像が得られている。上記のとおり、C末端のリジンの側鎖を標識した本実施例1で調製した分子プローブは、上記式(20)の分子プローブ前駆体を用いて調製した参考例1の分子プローブ及び上記式(22)の分子プローブ前駆体を用いて調製した参考例2の分子プローブと比べて膵臓への集積量が多く、また、膵臓の隣接臓器である胃及び腸への集積量が少ないことから、本実施例1で調製した分子プローブにより、非侵襲的な膵島の三次元イメージングが可能なことが示唆された。
【0113】
これらの結果より、本発明の分子プローブ前駆体であれば、ヒトにおいて非侵襲的膵臓の三次元イメージング、とりわけ非侵襲的膵β細胞の三次元イメージングが可能なことが示唆された。
【0114】
[blocking実験]
実施例1で調製した分子プローブ(上記式(19)の分子プローブ)を用い、blocking実験を行った。マウスは、6週齢ddYマウス(雄性、体重約30g)を使用した。
【0115】
まず、無麻酔下のマウスに、標識化していないExendin(9−39)(コールドプローブ)を静脈注射により前投与した(0.5mg/mLを0.1mL)。前投与から30分後に、調製した上記式(19)の分子プローブ(5μCi)を静脈注射により投与した。分子プローブの投与から30分後に各臓器を摘出した(n=5)。各臓器の重量と放射能とを測定し、単位重量あたりの放射能から集積量(%dose/g)を算出した。その結果の一例を図4に示す。
【0116】
コントロールとして、コールドプローブを前投与することなく、調製した上記式(19)の分子プローブ(5μCi)を無麻酔下のマウスに静脈注射により投与した。投与から30分後に各臓器を摘出した(n=5)。各臓器の重量と放射能とを測定し、単位重量あたりの放射能から集積量(%dose/g)を算出した。その結果の一例を前投与した結果とあわせて図4に示す。
【0117】
図4は、前投与ありの集積量(%dose/g)及びコントロール(前投与なし)の集積量(%dose/g)を示すグラフである。図4に示すように、コールドプローブを前投与して受容体(GLP−1受容体)への結合を阻害することにより、上記式(19)の分子プローブの膵臓への取り込みが約75%阻害されたことが観察された。
【0118】
[2次元イメージング解析]
ICRマウスの遺伝的バックグラウンドを有し、かつ、MIP(mouse insulin I gene promoter)の制御下でGFP(green fluorescent protein)を発現するトランスジェニックマウス(以下、「MIP−GFPマウス」という)を使用し、2次元イメージング解析を行った。分子プローブは、実施例1で調製した上記式(19)の分子プローブを用いた。
【0119】
調製した上記式(19)の分子プローブを無麻酔のMIP−GFPマウス(雄性、体重20g)に静脈注射により投与し(約171μCiを200μL)、投与30分後に膵臓を摘出した(n=2)。摘出した膵臓から切片を切り出し、切片をスライドガラス上に置き、その上にカバーガラスを載せた。切片の蛍光及び放射能(オートラジオグラフィー)は、画像解析装置(商品名:Typhoon 9410、GEヘルスケア社製)を用いて測定した(露光時間:15時間)。その結果の一例を図5に示す。
【0120】
図5は、上記式(19)の分子プローブ投与後30分のMIP−GFPマウスの膵臓切片のイメージ解析の結果の一例を示し、(a)が蛍光シグナル、(b)が放射性シグナルを示す画像である。図5(a)及び(b)に示すように、MIP−GFPマウスの膵臓切片において画像解析装置によって蛍光GFPシグナル、及び、放射性シグナルがそれぞれ検出された。また、図5(a)及び(b)に示すように、標識化された上記式(19)の分子プローブから検出された放射性シグナルの局在性は、GFPシグナルと一致していた。このことから、上記式(19)の分子プローブが、膵β細胞に特異的に集積することが確認できた。
【0121】
[三次元イメージング]
調製した上記式(19)の分子プローブ(89μCi)を麻酔した6週齢ddYマウス(雄性、体重30g)に静脈注射により投与し、下記のPET装置及び条件で三次元イメージングを行った。
撮像装置:eXplore Vista(商品名、GE社製)
撮像方法:Static Scan
リコンストラクション:2DOSEM(Dynamic OS−EM)
【0122】
その結果の一例を図6に示す。画像は分子プローブ投与30分後のものである(積算時間:20分)。図6Aは、三次元イメージングの冠状断像(coronal view)であり、図6Bは、三次元イメージングの横断像(transverse view)である。図6A及びBにおける白丸が膵臓の位置を示す。なお、図6A及びBのコントラストは同一である。
【0123】
図6に示すとおり、上記式(19)の分子プローブを用いることによって、非侵襲的に膵臓の位置を明確に判別することができた。つまり、本発明の分子プローブによって非侵襲的な膵島の三次元イメージングが可能であることが確認できた。
【0124】
(実施例2)
配列番号1の第4番目及び第19番目のリジン残基に保護基が結合し、C末端のカルボキシル基がアミド化されている上記式(1)の本発明の分子プローブ前駆体において、N末端のα−アミノ基がアセチル化されている下記式(24)の本発明の分子プローブ前駆体(配列番号24)を用いてマウスの体内分布の測定を行った。まず、以下のようにして本発明の分子プローブを調製した。なお、リジン残基の保護基は、Fmocを使用した。
Ac-DLSK(Fmoc)QMEEEAVRLFIEWLK(Fmoc)NGGPSSGAPPPSK-NH2 (24) (配列番号24)
【0125】
[分子プローブの調製]
N末端のα−アミノ基の保護基(Fmoc)を脱保護し、アセチル化した以外は、実施例1と同様にして上記式(24)の分子プローブ前駆体を調製した。得られた上記式(24)の分子プローブ前駆体(540μg)をBorate Buffer(pH7.8)に溶解させ、それに[18F]SFBを加え反応溶液をpH8.5〜9.0に調整し標識化を行った。その後、DMF、Piperidineを加えることで脱保護反応を行い、目的物(配列番号5の第32番目のリジン残基が標識化された分子プローブ)を得た。すなわち、得られた分子プローブは、配列番号5のアミノ酸配列において第32番目のリジンの側鎖のアミノ基に[18F]FB(フルオロベンゾイル基)が結合し、かつ、N末端のα−アミノ基がアセチル化され、かつ、C末端のカルボキシル基がアミド化された下記式(25)の分子プローブ(配列番号25)である。なお、下記式(25)において「Ac」は、N末端のα−アミノ基がアセチル化されたことを示す。
【0126】
【化12】

【0127】
[体内分布]
調製した上記式(25)の分子プローブ(7μCi)を無麻酔下の6週齢ddYマウス(雄性、体重30g)に静脈注射(尾静脈)により投与した。投与5分後、15分後、30分後、60分後、120分後に各臓器を摘出した(n=5)。各臓器の重量と放射能とを測定し、単位重量あたりの放射能から集積量(%dose/g)を算出した。その結果の一例を下記表6、図7A及びBに示す。図7Aは、各臓器への分子プローブの集積の経時変化を示すグラフであり、図7Bは図7Aを拡大したグラフである。
【0128】
【表6】

【0129】
図7A及びBに示すとおり、本実施例2で調製した上記式(25)の分子プローブの膵臓への集積は、投与後5分で7.0%dose/g、投与後15分で6.5%dose/g、投与後30分で7.3%dose/gであった。また、本実施例2で調製した上記式(25)の分子プローブは、何れの時間帯においても、膵臓の隣接臓器である胃や腸よりも膵臓に多く集積した。特に、胃の集積量は何れの時間帯においても2%dose/g前後と低く、腸の集積量は何れの時間帯においても1.7%dose/g前後と低く、胃及び腸への集積量に対する膵臓への集積量は3倍以上であった。また、投与後15分からは肝臓への集積量を4%dose/g以下に抑えることができ、投与後30分からは肝臓への集積量に対する膵臓への集積量は2倍以上であった。つまり、本実施例2で調製した上記式(25)の分子プローブは、特異的に膵臓に集積したといえる。また、骨への放射能集積が低く、生体内で脱フッ素代謝を受けていないことが示唆された。これにより、上記式(25)の分子プローブは、膵β細胞のイメージングに適していると考えられる。
【0130】
また、図1A及びB並びに図7A及びBに示すとおり、N末端のα−アミノ基をアセチル化した本実施例2の分子プローブ(上記式(25)の分子プローブ)は、N末端のα−アミノ基がアセチル化されていない実施例1の分子プローブ(上記式(19)の分子プローブ)と比較して、腎臓への集積が抑制された。
【0131】
実施例2の分子プローブの体内分布実験により得られた集積量に基づき、膵臓/肝臓比(膵臓の集積量/肝臓の集積量)を上記表4に、膵臓/腎臓比(膵臓の集積量/腎臓の集積量)を上記表5に示す。上記表4及び5に示すように、実施例2の分子プローブは、参考例1の分子プローブ及び参考例2の分子プローブと比較して膵臓/肝臓比及び膵臓/腎臓比が高かった。このように膵臓の周辺臓器に対する膵臓への集積量の比率が高く、また、膵臓の周辺臓器の集積が少ない本実施例2の分子プローブによれば、イメージングした際に、明瞭な膵臓の画像が得られることが示唆された。
【0132】
図2A及びB、図3A及びB並びに図7A及びBに示すとおり、本実施例2で調製した上記式(25)の分子プローブは、上記参考例1の分子プローブ及び上記参考例2の分子プローブと比べて膵臓への集積量が多く、膵臓の隣接臓器である胃及び腸への集積量が少なかった。また、本実施例2で調製した上記式(25)の分子プローブは、上記参考例1及び2の分子プローブと比べて腎臓への集積が低く、本実施例2で調製した分子プローブの腎臓への集積量は上記参考例1の分子プローブ(上記式(21)の分子プローブ)及び上記参考例2の分子プローブ(上記式(23)の分子プローブ)の腎臓への集積量の半分以下であった。このことからも、つまり、本実施例2で調製した上記式(25)の分子プローブは、特異的に膵臓に集積したといえる。このため、本実施例2で調製した上記式(25)の分子プローブにより、非侵襲的な膵島の三次元イメージングが可能なことが示唆された。
【0133】
これらの結果より、本発明の分子プローブ前駆体であれば、ヒトにおいて非侵襲的膵臓の三次元イメージング、とりわけ非侵襲的膵β細胞の三次元イメージングが可能なことが示唆された。
【0134】
(実施例3)
[Binding Assay]
実施例1で調製した上記式(18)の分子プローブ前駆体を、[18F]SFBに替えて[127I]N-succinimidyl 3-iodobenzoate([127I]SIB)を使用した以外は実施例1と同様にして標識化及び脱保護を行い、下記式(26)の分子プローブ(配列番号26)を得た。
【0135】
【化13】

【0136】
マウスから単離した膵島を50mlチューブに回収し、遠心(2000rpm、2分)した後、冷PBS20mLで1回洗浄した。トリプシン−EDTA(トリプシン−EDTA(0.05%/0.53mM)3mLに、PBSを含む0.53mM EDTA(pH7.4(NaOH))12mLを加えたもの)を15mL加え、37℃で振とうしながら1分間インキュベートした後、直ちに氷上に置いた。ついで、スポイト付10mLピペットで泡立てることなく勢いよく20回ピペッティングした後、冷PBSを最終量が30mLになるように加えた。遠心(3000rpm、2分)した後、冷PBS 30mLで2回洗浄した。上清を除去して膵島細胞サンプルを得た。得られた膵島細胞サンプルは−80℃で保存した。
【0137】
100μL/チューブとなるように膵島細胞サンプルをBuffer(20mM HEPES(pH7.4)、1mM MgCl2、1mg/ml bacitracin、1mg/ml BSA)で懸濁した。ついでBuffer 880μL、上記式(26)の分子プローブを含む溶液(分子プローブの終濃度:0、1×10-6〜1×10-12M)10μL、[125I]Bolton−Hunter標識Exendin(9−39)を含む溶液([125I]Bolton−Hunter標識Exendin(9−39)(製品コード:NEX335、1.85MBq/mL=50μCi/mL,22.73pmol/mL=76.57ng/mL、Perkin Elmer社製)10μLにBuffer90μLを添加したもの)10μLを添加し、室温で60分インキュベーションした。なお、[125I]標識Exendin(9−39)の終濃度は0.05μCi/チューブとした。ついで予め湿らせたガラス繊維フィルタ(Whatman GF/C filter)をセットした吸引装置を用い、吸引によりB/F分離した後、フィルタを氷冷のPBS5mlで3回洗浄した。フィルタをチューブに入れ、γカウンターにより放射能の測定を行った。その結果を図8に示す。
【0138】
図8は、SigmaPlot11(商品名)で解析した結果の一例を示すグラフである。図8に示すように、上記式(26)の分子プローブは、GLP−1Rと[125I]標識Exendin(9−39)との結合を濃度依存的に阻害した。上記式(26)の分子プローブのIC50は3.52×10-9Mであり、上記式(26)の分子プローブは膵島のGLP−1受容体に対して高い親和性を示した。また、上記式(26)の分子プローブのIC50は、Exendin(9−39)(IC50:1.4×10-9M)に近い値であることから、上記式(26)の分子プローブは膵島のGLP−1受容体に対してGLP−1受容体拮抗薬であるExendin(9−39)と同程度の親和性を有しているといえる。
【0139】
つぎに、配列番号5のアミノ酸配列において、第32番目のリジン残基の側鎖のアミノ基が3−[125I]iodobenzoyl基で標識され(以下、「[125I]IB標識」ともいう)、C末端のカルボキシル基がアミド化され、N末端のα−アミノ基がアセチル化されていない下記式(27)の分子プローブ(配列番号27)を用いてマウスの体内分布の測定及び二次元イメージング解析を行った。下記式(27)の分子プローブは、[18F]SFBに替えて[125I]N-succinimidyl 3-iodobenzoate(SIB)を使用した以外は、実施例1と同様の方法で調製した。
【0140】
【化14】

【0141】
[体内分布]
調製した上記式(27)の分子プローブ(1μCi)を無麻酔下の6週齢ddYマウス(雄性、体重約30g)に静脈注射(尾静脈)により投与した。投与5分後、15分後、30分後、60分後、120分後に各臓器を摘出した(n=5)。各臓器の重量と放射能とを測定し、単位重量あたりの放射能から集積量(%dose/g)を算出した。その結果の一例を下記表7、図9A及びBに示す。図9Aは、各臓器への分子プローブの集積の経時変化を示すグラフであり、図9Bは図9Aを拡大したグラフである。
【0142】
【表7】

【0143】
図9A及びBに示すとおり、本実施例3で調製した上記式(27)の分子プローブの膵臓への集積は、投与後5分で7.7%dose/g、投与後15分で12.3%dose/g、投与後30分で8.7%dose/g、投与後60分で10.9%dose/gであった。また、上記式(27)の分子プローブは、何れの時間帯においても、膵臓の隣接臓器である胃や腸よりも膵臓に多く集積した。特に、投与後5〜30分の間における胃及び腸の集積量は4%dose/g以下と低く、この時間帯における、胃及び腸への集積量に対する膵臓への集積量は3倍以上であった。また、投与後30分以降における上記式(27)の分子プローブの肝臓への集積量は5%dose/g以下であった。以上のことから、上記式(27)の分子プローブは、特異的に膵臓に集積したといえる。また、首への集積に大きな変化が見られないことから、生体内で上記式(27)の分子プローブが脱ヨウ素代謝を受けていないことが示唆された。これにより、上記式(27)の分子プローブは、膵β細胞のイメージング、とりわけ、膵β細胞の非侵襲的イメージングに適していると考えられる。
【0144】
[2次元イメージング解析]
上記式(27)の分子プローブ(5μCi)を無麻酔のMIP−GFPマウス(雄性、体重20g)に静脈注射により投与し、投与30分後に膵臓を摘出した(n=2)。摘出した膵臓から切片を切り出し、切片をスライドガラス上に置き、その上にカバーガラスを載せた。切片の蛍光及び放射能(オートラジオグラフィー)は、画像解析装置(商品名:Typhoon 9410、GEヘルスケア社製)を用いて測定した(露光時間:18時間)。その結果の一例を図10に示す。
【0145】
コントロールとして、標識基が結合していない市販のexendin(9−39)(コールドプローブ)を無麻酔のMIP−GFPマウス(雄性、体重20g)に静脈注射により前投与した(50μg/100μL)。前投与から30分後に上記式(27)の分子プローブ(5μCi)を静脈注射により投与し、上記式(27)の分子プローブの投与から30分後に膵臓を摘出した(n=2)。摘出した膵臓から切片を切り出し、得られた切片について、上記と同様にして蛍光及び放射能の測定を行った。その結果の一例を、上記前投与なしの結果とあわせて図10に示す。
【0146】
図10は、上記式(27)の分子プローブを投与したMIP−GFPマウスの膵臓切片のイメージ解析の結果の一例であって、上記式(27)の分子プローブ投与後30分の切片についての蛍光シグナル(a)及び放射性シグナル(b)を示す画像を示す。
【0147】
図10(a)及び(b)に示すように、MIP−GFPマウスの膵臓切片において画像解析装置によって蛍光GFPシグナル、及び放射性シグナルがそれぞれ検出された。また、上記式(27)の分子プローブから検出された放射性シグナルの局在性は、GFPシグナルと一致していた。このことから、上記式(27)の分子プローブが、膵β細胞に特異的に集積することが確認できた。
【0148】
図10(b)に示すように、コールドプローブを前投与したコントロールの切片からは放射性シグナルはほとんど検出されなかった。このことから、コールドプローブを前投与してGLP−1受容体への結合を阻害することにより、上記式(27)の分子プローブの取り込みが阻害されたことが観察できた。このことから、上記式(27)の分子プローブが、膵β細胞のGLP−1受容体に結合していることが確認できた。
【0149】
ここで、125I、123I及び131Iはいずれもγ線放出核種である。さらに、125I及び123Iは核スピン数も同一である。これらのことから、上記式(27)の分子プローブの標識化に使用する放射性ヨウ素原子(125I)を、123I又は131Iとした場合であっても、上記式(27)の分子プローブとほぼ同様の挙動を示すことが推測される。また、124Iとした場合であっても、上記式(27)の分子プローブとほぼ同様の挙動を示すと推測される。したがって、上記式(27)の分子プローブの125Iを、123I、124I又は131Iとした分子プローブを使用することにより、例えば、SPECTやPET等での膵β細胞の非侵襲の三次元イメージング、好ましくは膵β細胞の定量が可能なことが示唆された。
【0150】
(実施例4)
配列番号5のアミノ酸配列において、第32番目のリジン残基の側鎖のアミノ基が3−[123I]iodobenzoyl基で標識され(以下、「[123I]IB標識」ともいう)、C末端のカルボキシル基がアミド化され、N末端のα−アミノ基がアセチル化されていない下記式(28)の分子プローブ(配列番号28)を調製した。下記式(28)の分子プローブは、[125I]SIBに替えて[123I]SIBを使用した以外は、実施例3と同様の方法で調製した。
【0151】
【化15】

【0152】
[三次元イメージング]
上記式(28)の分子プローブを用いてマウスのSPECT撮像を行った。上記式(28)の分子プローブ(243μCi/120μL)を麻酔した6週齢ddYマウス(雄性、体重約30g)に静脈注射により投与し、SPECT撮像を行った。SPECT撮像は、ガンマカメラ(製品名:SPECT2000H−40、日立メディコ製)を用いて下記の撮像条件で、分子プローブ投与後30分から32分間行った。得られた画像を、下記の再構成条件で再構成処理を行った。
撮像条件
コリメータ :LEPH pinholeコリメータ
検出器の収集角度:11.25°/60秒で360°
収集時間 :60秒×32フレーム、32分間
再構成条件
前処理フィルタ:Butterworthフィルタ(order:10、cutoff周波数:0.13)
【0153】
その結果の一例を図11に示す。画像は分子プローブ投与30分後のものである(積算時間:32分)。図11Aは横断像(transverse view)であり、図11Bは冠状断像(coronal view)であり、図11Cは矢状断像(sagittal view)である。図11B及びCにおける白丸が膵臓の位置を示す。なお、図11AからCのコントラストは同一である。
【0154】
図11AからCに示すとおり、上記式(28)の分子プローブを用いることによって、マウスにおいて非侵襲的に膵臓の位置を確認することができた。つまり、本発明の分子プローブによって非侵襲的な膵島の三次元イメージングが可能であることが確認できた。
【0155】
このように、ヒトよりも膵臓のサイズが小さく、かつ、臓器が密集しているマウスにおいて非侵襲的に膵臓の位置を確認できたことから、マウスよりも膵臓のサイズが大きく、かつ、臓器が密集していないヒトであれば、例えば、膵島の位置、膵臓のサイズをより明確に判別でき、さらには、膵臓におけるプローブの発現量を測定できることが示唆された。したがって、本発明のイメージング用分子プローブであれば、ヒトにおいて非侵襲的膵臓の三次元イメージング、とりわけ非侵襲的膵β細胞の三次元イメージングが可能なことが示唆された。
【産業上の利用可能性】
【0156】
以上説明したとおり、本発明は、例えば、医療分野、分子イメージングの分野、糖尿病に関する分野などで有用である。
【配列表フリーテキスト】
【0157】
配列番号1〜4:本発明の分子プローブ前駆体のアミノ酸配列
配列番号5〜8:本発明の分子プローブのアミノ酸配列
配列番号9〜16:本発明の分子プローブ前駆体のアミノ酸配列
配列番号17:実施例1の分子プローブ前駆体の製造に用いるポリペプチドのアミノ酸配列
配列番号18:実施例1の分子プローブ前駆体のアミノ酸配列
配列番号19:実施例1の分子プローブのアミノ酸配列
配列番号20:参考例1の分子プローブ前駆体のアミノ酸配列
配列番号21:参考例1の分子プローブのアミノ酸配列
配列番号22:参考例2の分子プローブ前駆体のアミノ酸配列
配列番号23:参考例2の分子プローブのアミノ酸配列
配列番号24:実施例2の分子プローブ前駆体のアミノ酸配列
配列番号25:実施例2の分子プローブのアミノ酸配列
配列番号26:Binding Assayに使用した分子プローブのアミノ酸配列
配列番号27:実施例3の分子プローブのアミノ酸配列
配列番号28:実施例4の分子プローブのアミノ酸配列
【特許請求の範囲】
【請求項1】
膵島のイメージングに用いられる分子プローブの前駆体であって、
下記式(1)〜(4)のいずれかで表されるポリペプチド、
下記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、
下記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチドを含み、
前記分子プローブは、膵島のイメージングに用いられる分子プローブである、膵島イメージング用分子プローブ前駆体。
*-DLSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (1) (配列番号1)
*-LSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (2) (配列番号2)
*-SK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (3) (配列番号3)
*-K* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (4) (配列番号4)
[上記式(1)〜(4)において、「*-」は、N末端のα−アミノ基が、保護基により保護されているか、又は、電荷を有さない修飾基により修飾されていることを示し、「K*」は、リジン(lysine)の側鎖のアミノ基が保護基により保護されていることを示し、「-NH2」は、C末端のカルボキシル基がアミド化されていることを示す。]
【請求項2】
C末端のリジンの側鎖のアミノ基を、放射性核種を有する芳香環を含む標識化合物により標識化するための、請求項1記載の膵島イメージング用分子プローブ前駆体。
【請求項3】
前記電荷を有さない修飾基が、アセチル基、ベンジル基、ベンジルオキシメチル基、o−ブロモベンジルオキシカルボニル基、t−ブチル基、t−ブチルジメチルシリル基、2−クロロベンジル基、2,6−ジクロロベンジル基、シクロヘキシル基、シクロペンチル基、イソプロピル基、ピバリル基、テトラヒドロピラン−2−イル基、トシル基、トリメチルシリル基及びトリチル基からなる群から選択される、請求項1又は2に記載の膵島イメージング用分子プローブ前駆体。
【請求項4】
膵島イメージング用分子プローブの製造方法であって、請求項1から3のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護することを含む、膵島イメージング用分子プローブの製造方法。
【請求項5】
前記膵島イメージング用分子プローブ前駆体の標識化が、C末端のリジンの側鎖のアミノ基を放射性核種を有する芳香環を含む標識化合物により標識化することを含む、請求項4記載の膵島イメージング用分子プローブの製造方法。
【請求項6】
前記芳香環を含む標識化合物が、下記式(I)で表される基を含む、請求項5記載の膵島イメージング用分子プローブの製造方法。
【化1】

[前記式(I)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R1は、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、111In、123I、124I、125I又は131Iを含む置換基を示し、R2は、水素原子、又は、R1とは異なる1又は複数の置換基を示す。]
【請求項7】
膵島イメージング用分子プローブであって、請求項4から6のいずれかに記載の製造方法により得られうる、膵島イメージング用分子プローブ。
【請求項8】
膵島イメージング用分子プローブであって、
下記式(5)〜(8)のいずれかで表されるポリペプチド、
下記式(5)〜(8)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって、膵島に結合可能なポリペプチド、又は、
下記式(5)〜(8)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって、膵島に結合可能なポリペプチドを含む、膵島イメージング用分子プローブ。
Z-DLSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (5) (配列番号5)
Z-LSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (6) (配列番号6)
Z-SKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (7) (配列番号7)
Z-KQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (8) (配列番号8)
[上記式(5)〜(8)において、「X」は、側鎖のアミノ基が放射性核種で標識されたリジン残基を示し、前記放射性核種は、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I又は131Iであり、「Z-」は、N末端のα−アミノ基が、非修飾であるか、又は、電荷を有さない修飾基により修飾されていることを示し、「-NH2」は、C末端のカルボキシル基がアミド化されていることを示す。]
【請求項9】
前記放射性核種で標識されたリジンの側鎖のアミノ基が、下記式(III)で表される芳香環を含む基と結合している、請求項8記載の膵島イメージング用分子プローブ。
【化2】

[前記式(III)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R4は、11C、13N、15O、18F、75Br、76Br、77Br、123I、124I、125I又は131Iを含む置換基を示し、R5は、水素原子、又は、R4とは異なる1又は複数の置換基を示し、R3は、結合手、C1−C6アルキレン基及びC1−C6オキシアルキレン基のいずれかを示す。]
【請求項10】
膵島イメージング用分子プローブを調製するためのキットであって、請求項1から3のいずれかに記載の膵島イメージング用分子プローブ前駆体を含む、キット。
【請求項11】
さらに、前記膵島イメージング用分子プローブ前駆体の標識化に使用する化合物であって、ハロゲン又は放射性ハロゲンを有する芳香環を含む化合物を含む、請求項10記載のキット。
【請求項12】
前記芳香環を含む化合物が、下記式(IV)で表される基を有する化合物である、請求項11記載のキット。
【化3】

[前記式(IV)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R6は、ハロゲン又は放射性ハロゲンを含む置換基を示し、R7は、水素原子、又は、R6とは異なる1又は複数の置換基を示す。]
【請求項13】
膵島のイメージングを行うためのキットであって、請求項7から9のいずれかに記載の膵島イメージング用分子プローブを含む、キット。
【請求項14】
請求項1から3のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護することを含む、膵島のイメージング方法。
【請求項15】
請求項7から9のいずれかに記載の膵島イメージング用分子プローブを投与された被検体から前記膵島イメージング用分子プローブのシグナルを検出することを含む、膵島のイメージング方法。
【請求項16】
さらに、前記分子プローブを用いた膵島イメージングの結果から膵島の状態を判定することを含む、請求項14又は15に記載の膵島のイメージング方法。
【請求項17】
請求項1から3のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護して膵島イメージング用分子プローブを調製すること、及び、
前記分子プローブを用いた膵島イメージングの結果から膵島量を算出することを含む、膵島量の測定方法。
【請求項18】
請求項7から9のいずれかに記載の膵島イメージング用分子プローブを投与された被検体から前記膵島イメージング用分子プローブのシグナルを検出すること、及び、
検出した膵島イメージング用分子プローブのシグナルから膵島量を算出することを含む、膵島量の測定方法。
【請求項19】
さらに、算出した膵島量を提示することを含む、請求項17又は18に記載の膵島量の測定方法。
【請求項1】
膵島のイメージングに用いられる分子プローブの前駆体であって、
下記式(1)〜(4)のいずれかで表されるポリペプチド、
下記式(1)〜(4)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチド、又は、
下記式(1)〜(4)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって、標識化及び脱保護後に膵島に結合可能なポリペプチドを含み、
前記分子プローブは、膵島のイメージングに用いられる分子プローブである、膵島イメージング用分子プローブ前駆体。
*-DLSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (1) (配列番号1)
*-LSK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (2) (配列番号2)
*-SK* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (3) (配列番号3)
*-K* QMEEEAVRLFIEWLK* NGGPSSGAPPPSK-NH2 (4) (配列番号4)
[上記式(1)〜(4)において、「*-」は、N末端のα−アミノ基が、保護基により保護されているか、又は、電荷を有さない修飾基により修飾されていることを示し、「K*」は、リジン(lysine)の側鎖のアミノ基が保護基により保護されていることを示し、「-NH2」は、C末端のカルボキシル基がアミド化されていることを示す。]
【請求項2】
C末端のリジンの側鎖のアミノ基を、放射性核種を有する芳香環を含む標識化合物により標識化するための、請求項1記載の膵島イメージング用分子プローブ前駆体。
【請求項3】
前記電荷を有さない修飾基が、アセチル基、ベンジル基、ベンジルオキシメチル基、o−ブロモベンジルオキシカルボニル基、t−ブチル基、t−ブチルジメチルシリル基、2−クロロベンジル基、2,6−ジクロロベンジル基、シクロヘキシル基、シクロペンチル基、イソプロピル基、ピバリル基、テトラヒドロピラン−2−イル基、トシル基、トリメチルシリル基及びトリチル基からなる群から選択される、請求項1又は2に記載の膵島イメージング用分子プローブ前駆体。
【請求項4】
膵島イメージング用分子プローブの製造方法であって、請求項1から3のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護することを含む、膵島イメージング用分子プローブの製造方法。
【請求項5】
前記膵島イメージング用分子プローブ前駆体の標識化が、C末端のリジンの側鎖のアミノ基を放射性核種を有する芳香環を含む標識化合物により標識化することを含む、請求項4記載の膵島イメージング用分子プローブの製造方法。
【請求項6】
前記芳香環を含む標識化合物が、下記式(I)で表される基を含む、請求項5記載の膵島イメージング用分子プローブの製造方法。
【化1】

[前記式(I)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R1は、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、111In、123I、124I、125I又は131Iを含む置換基を示し、R2は、水素原子、又は、R1とは異なる1又は複数の置換基を示す。]
【請求項7】
膵島イメージング用分子プローブであって、請求項4から6のいずれかに記載の製造方法により得られうる、膵島イメージング用分子プローブ。
【請求項8】
膵島イメージング用分子プローブであって、
下記式(5)〜(8)のいずれかで表されるポリペプチド、
下記式(5)〜(8)のポリペプチドから1〜数個のアミノ酸が欠失、付加又は置換したポリペプチドであって、膵島に結合可能なポリペプチド、又は、
下記式(5)〜(8)のポリペプチドのアミノ酸配列と80%以上の相同性を有するポリペプチドであって、膵島に結合可能なポリペプチドを含む、膵島イメージング用分子プローブ。
Z-DLSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (5) (配列番号5)
Z-LSKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (6) (配列番号6)
Z-SKQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (7) (配列番号7)
Z-KQMEEEAVRLFIEWLKNGGPSSGAPPPSX-NH2 (8) (配列番号8)
[上記式(5)〜(8)において、「X」は、側鎖のアミノ基が放射性核種で標識されたリジン残基を示し、前記放射性核種は、11C、13N、15O、18F、64Cu、67Ga、68Ga、75Br、76Br、77Br、99mTc、123I、124I、125I又は131Iであり、「Z-」は、N末端のα−アミノ基が、非修飾であるか、又は、電荷を有さない修飾基により修飾されていることを示し、「-NH2」は、C末端のカルボキシル基がアミド化されていることを示す。]
【請求項9】
前記放射性核種で標識されたリジンの側鎖のアミノ基が、下記式(III)で表される芳香環を含む基と結合している、請求項8記載の膵島イメージング用分子プローブ。
【化2】

[前記式(III)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R4は、11C、13N、15O、18F、75Br、76Br、77Br、123I、124I、125I又は131Iを含む置換基を示し、R5は、水素原子、又は、R4とは異なる1又は複数の置換基を示し、R3は、結合手、C1−C6アルキレン基及びC1−C6オキシアルキレン基のいずれかを示す。]
【請求項10】
膵島イメージング用分子プローブを調製するためのキットであって、請求項1から3のいずれかに記載の膵島イメージング用分子プローブ前駆体を含む、キット。
【請求項11】
さらに、前記膵島イメージング用分子プローブ前駆体の標識化に使用する化合物であって、ハロゲン又は放射性ハロゲンを有する芳香環を含む化合物を含む、請求項10記載のキット。
【請求項12】
前記芳香環を含む化合物が、下記式(IV)で表される基を有する化合物である、請求項11記載のキット。
【化3】

[前記式(IV)において、Aは、芳香族炭化水素基及び芳香族複素環基のいずれかを示し、R6は、ハロゲン又は放射性ハロゲンを含む置換基を示し、R7は、水素原子、又は、R6とは異なる1又は複数の置換基を示す。]
【請求項13】
膵島のイメージングを行うためのキットであって、請求項7から9のいずれかに記載の膵島イメージング用分子プローブを含む、キット。
【請求項14】
請求項1から3のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護することを含む、膵島のイメージング方法。
【請求項15】
請求項7から9のいずれかに記載の膵島イメージング用分子プローブを投与された被検体から前記膵島イメージング用分子プローブのシグナルを検出することを含む、膵島のイメージング方法。
【請求項16】
さらに、前記分子プローブを用いた膵島イメージングの結果から膵島の状態を判定することを含む、請求項14又は15に記載の膵島のイメージング方法。
【請求項17】
請求項1から3のいずれかに記載の膵島イメージング用分子プローブ前駆体を標識化及び脱保護して膵島イメージング用分子プローブを調製すること、及び、
前記分子プローブを用いた膵島イメージングの結果から膵島量を算出することを含む、膵島量の測定方法。
【請求項18】
請求項7から9のいずれかに記載の膵島イメージング用分子プローブを投与された被検体から前記膵島イメージング用分子プローブのシグナルを検出すること、及び、
検出した膵島イメージング用分子プローブのシグナルから膵島量を算出することを含む、膵島量の測定方法。
【請求項19】
さらに、算出した膵島量を提示することを含む、請求項17又は18に記載の膵島量の測定方法。
【図1】


【図2】


【図3】


【図4】


【図7】


【図8】


【図9】


【図5】


【図6】


【図10】


【図11】




【図2】


【図3】


【図4】


【図7】


【図8】


【図9】


【図5】


【図6】


【図10】


【図11】


【公開番号】特開2011−219452(P2011−219452A)
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願番号】特願2010−178416(P2010−178416)
【出願日】平成22年8月9日(2010.8.9)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度独立行政法人新エネルギー・産業技術総合開発機構、「分子イメージング機器研究開発プロジェクト/悪性腫瘍等治療支援分子イメージング機器の開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504132272)国立大学法人京都大学 (1,269)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願日】平成22年8月9日(2010.8.9)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度独立行政法人新エネルギー・産業技術総合開発機構、「分子イメージング機器研究開発プロジェクト/悪性腫瘍等治療支援分子イメージング機器の開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504132272)国立大学法人京都大学 (1,269)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

