膵臓発生遺伝子に対する天然アンチセンス転写物の阻害による膵臓発生遺伝子疾患の治療
本発明は、膵臓発生遺伝子の発現および/または機能を調節、特に、膵臓発生遺伝子の天然のアンチセンスポリヌクレオチドを標的化することによって調節するアンチセンスオリゴヌクレオチドに関する。本発明はまた、それらのアンチセンスオリゴヌクレオチドの同定および膵臓発生遺伝子の発現に関連する疾病および障害の治療におけるそれらの使用にも関連する。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2010年1月6日に提出された米国仮特許出願第61/292,508号、2010年1月12日に提出された米国仮特許出願第61/294,129号、2010年1月25日に提出された米国仮特許出願第61/297,847号、2010年1月25日に提出された米国仮特許出願第61/297,863号、および2010年4月12日に提出された米国仮特許出願第61/323,027号の優先権を主張し、当該米国仮特許出願は、参照によりその全内容が本明細書に組み入れられる。
【0002】
本発明の実施形態は、膵臓発生遺伝子および関連分子の発現および/または機能を調節するオリゴヌクレオチドを含む。
【背景技術】
【0003】
DNA−RNAおよびRNA−RNAハイブリダイゼーションは、DNA複製、転写、および翻訳を含む、核酸の機能の多くの側面にとって重要である。ハイブリダイゼーションはまた、特定の核酸を検出するか、またはその発現を変化させるさまざまな技術の中心となる。アンチセンスヌクレオチドは、例えば、標的RNAにハイブリダイズし、RNAスプライシング、転写、翻訳、複製を妨害することによって遺伝子発現を阻害する。アンチセンスDNAは、DNA−RNAハイブリッドがほとんどの細胞型に存在している活性であるリボヌクレアーゼHよる消化の基質として機能するという付加的な特徴を備える。アンチセンス分子は、オリゴヌクレオチドの場合(ODN)に細胞内に送達することができ、またはRNA分子として内因性遺伝子から発現させることができる。FDAは最近、アンチセンスが治療的有用性を有する点を反映させた、(サイトメガロウイルス網膜炎の治療用の)アンチセンス薬、VITRAVENE(商標)を承認した。
【発明の概要】
【発明が解決しようとする課題】
【0004】
一実施形態において、本発明は、天然のアンチセンス転写物の作用を阻害するための方法であって、当該天然のアンチセンス転写物の任意の領域を標的としたアンチセンスオリゴヌクレオチドを用いることにより、対応するセンス遺伝子をアップレギュレートする、該方法を提供する。本出願においては、前記天然のアンチセンス転写物の阻害が、本発明の範囲に包含されると考えられるsiRNA、リボザイム、および小分子により達成され得ることも想定されている。
【0005】
一実施形態は、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、前記細胞または組織を、5〜30個のヌクレオチドの長さのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記オリゴヌクレオチドは、配列番号6の1番目〜1235番目のヌクレオチド、配列番号7の1番目〜17,964番目のヌクレオチド、配列番号8の1番目〜50,003番目のヌクレオチド、配列番号9の1番目〜486番目のヌクレオチド、配列番号10の1番目〜494番目のヌクレオチド、配列番号11の1番目〜1992番目のヌクレオチド、および配列番号12の1番目〜1767番目のヌクレオチドの範囲内の連続した5〜30個のヌクレオチドを含むポリヌクレオチドに対する逆相補配列と少なくとも50%の配列同一性を有する、該ステップを含み、それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法を提供する。
【0006】
別の実施形態では、オリゴヌクレオチドが、膵臓発生遺伝子ポリヌクレオチドの天然のアンチセンス配列、例えば配列番号6乃至12に記載のヌクレオチド、およびその変異型、アレル、ホモログ、突然変異体、誘導体、断片、および相補配列を標的とする。アンチセンスオリゴヌクレオチドの例としては、配列番号13乃至45に記載のものが挙げられる。
【0007】
別の実施形態は、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、前記細胞または組織を、5〜30個のヌクレオチドの長さのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスに対する逆相補配列と少なくとも50%の配列同一性を有する、該ステップを含み、それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法を提供する。
【0008】
別の実施形態は、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、前記細胞または組織を、5〜30個のヌクレオチドの長さのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記オリゴヌクレオチドは、膵臓発生遺伝子アンチセンスポリヌクレオチドのアンチセンスオリゴヌクレオチドと少なくとも50%の配列同一性を有する、該ステップを含み、それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法を提供する。
【0009】
一実施形態では、組成物が、センスおよび/またはアンチセンス膵臓発生遺伝子ポリヌクレオチドに結合する1以上のアンチセンスオリゴヌクレオチドを含む。
【0010】
別の実施形態では、前記オリゴヌクレオチドは、1以上の修飾または置換されたヌクレオチドを含む。
【0011】
別の実施形態では、前記オリゴヌクレオチドが、1以上の修飾された結合を含む。
【0012】
さらに別の実施形態では、前記修飾されたヌクレオチドが、ホスホロチオアート、メチルホスホナート、ペプチド核酸、2’−O−メチル、フルオロ−または炭素、メチレンまたは他のロックト核酸(LNA)分子を含む修飾塩基を含む。好ましくは、前記修飾されたヌクレオチドは、α−L−LNAを含む、ロックト核酸分子である。
【0013】
別の実施形態では、前記オリゴヌクレオチドは、患者に対し皮下に、筋肉内に、静脈内に、または腹腔内に投与される。
【0014】
別の実施形態では、前記オリゴヌクレオチドは、医薬組成物として投与される。治療レジメンは、患者に対して前記アンチセンス化合物を少なくとも1回投与することを含む。しかし、この処置は、一定期間にわたって複数回の投与を含むように改変することができる。この処置は、1種類以上の他の治療と併用することができる。
【0015】
別の実施形態では、前記オリゴヌクレオチドが、リポソームに包入されるか、担体分子(例えばコレステロール、TATペプチド)に付着される。
【0016】
他の態様は、以下に説明する。
【図面の簡単な説明】
【0017】
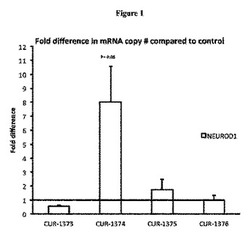
【図1】HepG2細胞をLipofectamine2000を用いて導入されたホスホロチオアートオリゴヌクレオチドで処置した後のNEUROD1のmRNAの対照と比較した倍率変化+標準偏差を示すリアルタイムPCRの結果のグラフである。リアルタイムPCRの結果は、HepG2細胞におけるNEUROD1のmRNAのレベルが、NEUROD1アンチセンスSteedo.aApr07に設計されたオリゴの1つで処置後48時間で有意に上昇していることを示している。CUR−1373、CUR−1374、CUR−1375、およびCUR−1376と付記されたバーは、それぞれ配列番号13−配列番号16で処置されたサンプルに対応する。
【図2】518A2細胞をLipofectamine2000を用いて導入されたホスホロチオアートオリゴヌクレオチドで処置した後のHNF4AのmRNAの対照と比較した倍率変化+標準偏差を示すリアルタイムPCRの結果のグラフである。CUR−1194、CUR−1195、CUR−1193、CUR−1192、CUR−1191、CUR−1190、CUR−1188、CUR−1189、CUR−1187、CUR−1186、CUR−1182、CUR−1183、CUR−1185、CUR−1184、およびCUR−1181と付記されたバーは、それぞれ配列番号17−配列番号31で処置されたサンプルに対応する。
【図3】HepG2細胞をLipofectamine2000を用いて導入されたホスホロチオアートオリゴヌクレオチドで処置した後のMAFAのmRNAの対照と比較した倍率変化+標準偏差を示すリアルタイムPCRの結果のグラフである。リアルタイムPCRの結果は、HepG2細胞におけるMAFAのmRNAのレベルが、MAFAアンチセンスBM127748に設計されたオリゴの1つで処置後48時間で有意に上昇していることを示している。CUR−1207、CUR−1209、CUR−1208、CUR−1210、およびCUR−1211と付記されたバーは、それぞれ配列番号32−配列番号36で処置されたサンプルに対応する。
【図4】HepG2細胞をLipofectamine2000を用いて導入されたホスホロチオアートオリゴヌクレオチドで処置した後のPDX1のmRNAの対照と比較した倍率変化+標準偏差を示すリアルタイムPCRの結果のグラフである。リアルタイムPCRの結果は、HepG2細胞におけるPDX1のmRNAのレベルが、MAFAアンチセンスHs.416201に設計されたオリゴのなかの2つで処置後48時間で有意に上昇していることを示している。CUR−1388、CUR−1389、CUR−1390、CUR−1391、およびCUR−1392と付記されたバーは、それぞれ配列番号37−配列番号41で処置されたサンプルに対応する。
【図5】MCF−7細胞をLipofectamine2000を用いて導入されたホスホロチオアートオリゴヌクレオチドで処置した後のNKX6−1のmRNAの対照と比較した倍率変化+標準偏差を示すリアルタイムPCRの結果のグラフである。CUR−1501乃至CUR−1504と付記されたバーは、それぞれ配列番号42−配列番号45で処置されたサンプルに対応する。
【発明を実施するための形態】
【0018】
[配列表の説明]
配列番号1:ヒト神経発生分化1(NEUROD1)、mRNA(NCBI登録番号:NM_002500)。配列番号2:ヒト肝細胞核因子4−α(HNFA)、転写物変異型2、mRNA(NCBI登録番号:NM_000457)。配列番号3:ヒトv−maf筋腱膜性線維肉腫癌遺伝子のホモログA(トリ)(MFFA)、mRNA(NCBI登録番号:NM_201589)。配列番号4:ヒト膵臓十二指腸ホメオボックス−1(PDX1)、mRNA(NCBI登録番号:NM_000209)。配列番号5:ヒトNK6ホメオボックス1(NKX6−1)、mRNA(NCBI登録番号:NM_006168)。配列番号6乃至配列番号12:配列番号6:天然NEUROD1アンチセンス配列(Steedo.aApr07);配列番号7:天然HNF4Aアンチセンス配列(AF143870);配列番号8:天然HNF4Aアンチセンス配列(BC071794);配列番号9:天然HNF4Aアンチセンス配列(BX099913);配列番号10:天然HNFAアンチセンス配列(BM127748);配列番号11:天然PDX1アンチセンス配列(Hs.416201);および配列番号12:天然NKX6−1アンチセンス配列(torsnaby.aApr07−unspliced(スプライシングされていないもの))。配列番号13乃至配列番号45:アンチセンスオリゴヌクレオチド。*はホスホチオエート結合を示す。
【0019】
[詳細な説明]
本発明のいくつかの態様について、例示のための応用例を参照して以下に説明する。種々の特定の細部、関係、および方法は、本発明の完全な理解のために記載されていることを理解されたい。しかし、本発明を、1以上の特定の細部を用いることなく、または他の方法を用いて実施できることは、当業者には容易に理解されよう。本発明は、行為や事象の順序によって限定されず、いくつかの行為は、異なる順序で、および/または他の作用または事象と同時に発生し得る。さらに、すべての例示された行為または事象は、本発明による方法を実施するために必ずしも必要ではない。
【0020】
本明細書に記載されるすべての遺伝子、遺伝子名、および遺伝子産物は、本明細書に記載される組成物および方法が適用される任意の種由来のホモログに対応するものとする。したがって、この用語は、以下に限定しないが、ヒトおよびマウス由来の遺伝子および遺伝子産物を包含する。特定の種に由来する遺伝子または遺伝子産物が開示される場合、この開示内容は、例示のみを意図するものであり、それが現れた文脈が明示的に示さない限り、限定として解釈すべきものではない。したがって、例えば、本明細書に開示する遺伝子であって、いくつかの実施形態においてそれが哺乳動物の核酸およびアミノ酸配列に関連するものは、以下に限定しないが、他の哺乳類、魚類、両生類、爬虫類、および鳥類を含む他の動物に由来するホモログおよび/またはオルソログ遺伝子および遺伝子産物を包含するものとする。いくつかの実施形態では、該遺伝子または核酸配列はヒト由来である。
【0021】
[定義]
本明細書で使用される用語の選択は、特定の実施形態を説明する目的でされたものであり、本発明を限定することを意図するものではない。本明細書で使用される場合、単数形の「a」、「an」、及び「the」は文脈において明らかに別記されない限り、複数形の内容も含むものとする。さらに、用語「含む」、「含める」、「有する」、「もつ」またはその変化形は、本明細書および/または添付の請求項において使用される場合、用語「包含する」と同様に非排他的な意味で用いられるものとする。
【0022】
用語「約」または「概ね」は、当業者が決定した特定の数値について許容される誤差範囲内にあることを意味し、当該誤差範囲は、部分的には、その数値がどのように測定または決定されたか、すなわち測定システムの限界に応じて決まる。例えば、「約」は、本技術分野での習慣に従って、1またはそれ以上の標準偏差内に収まっていることを意味し得る。あるいは、「約」は、所与の数値に対し、最大20%、好ましくは最大10%、より好ましくは最大5%、さらに好ましくは最大1%の範囲を意味し得る。あるいは、特に生物学的な系またはプロセスに関して、この用語は、ある数値に対し、1桁分(10倍)以内、より好ましくは5倍以内、さらに好ましくは2倍以内を意味し得る。特定の数値が本明細書および特許請求の範囲に記載される場合、特に別記されない限り、特定の数値の許容される誤差範囲ないであることを意味する用語「約」が仮定されるものとする。
【0023】
本明細書で使用される用語「mRNA」は、標的化された遺伝子の既知のmRNA転写物、および解明され得る他の転写物を意味する。
【0024】
「アンチセンスオリゴヌクレオチド」または「アンチセンス化合物」という表現によって、他のRNAまたはDNA(標的RNA、DNA)に結合するRNAまたはDNA分子を意味する。例えば、RNAオリゴヌクレオチドの場合、RNA−RNA相互作用によって他のRNA標的に結合し、その標的RNAの活性を変化させる。アンチセンスオリゴヌクレオチドは、特定のポリヌクレオチドの発現および/または機能をアップレギュレートまたはダウンレギュレートすることができる。この定義は、治療、診断、または他の観点から有用である任意の外来のRNAまたはDNA分子を含むことを意味する。そのような分子としては、例えば、標的核酸の少なくとも一部とハイブリダイズするアンチセンスRNAまたはDNA分子、干渉RNA(RNAi)、マイクロRNA、デコイRNA分子、siRNAは、酵素RNA、治療編集RNAおよびアゴニストおよびアンタゴニストのRNA、アンチセンスオリゴマー化合物、アンチセンスオリゴヌクレオチド、外部ガイド配列(EGS)オリゴヌクレオチド、選択的スプライサー、プライマー、プローブ、および他のオリゴマー化合物が挙げられる。このようなものとして、これらの化合物は、一本鎖の、二本鎖の、部分的一本鎖の、または環状オリゴマー化合物の形で導入し得る。
【0025】
本発明の文脈において、用語「オリゴヌクレオチド」は、リボ核酸(RNA)またはデオキシリボ核酸(DNA)またはその模倣物質のオリゴマーまたはポリマーを指す。用語「オリゴヌクレオチド」という用語はまた、デオキシリボヌクレオシド、リボヌクレオシド、その置換型またはαアノマー型、ペプチド核酸(PNA)、ロックト核酸(LNA)、ホスホロチオエート、メチルホスホナートなどを含む、天然および/または修飾されたモノマーまたは結合の直鎖状または環状のオリゴマーを含む。オリゴヌクレオチドは、ワトソン・クリック型塩基対、フーグスティーン型または逆フーグスティーン型塩基対などのモノマー−モノマー相互作用の規則的なパターンによって、標的ポリヌクレオチドに特異的に結合することができる。
【0026】
オリゴヌクレオチドは、「キメラ」すなわち異なる領域から構成されているものであってよい。本発明の文脈において、「キメラ」化合物は、例えば、DNA領域(S)、RNA領域(S)、PNA領域(S)などの2以上の化学領域を含むオリゴヌクレオチドである。各化学領域は、少なくとも1つのモノマー単位、すなわち、オリゴヌクレオチド化合物の場合ではヌクレオチドから構成されている。これらのオリゴヌクレオチドは、一般的には、そのオリゴヌクレオチドが1以上の所望の特性を発揮するべく修飾されている少なくとも1つの領域を含む。該オリゴヌクレオチドの所望の特性としては、以下に限定されないが、例えば、ヌクレアーゼ分解に対する高い抵抗性、高い細胞取り込み、および/または標的核酸に対する高い結合親和性などが挙げられる。したがって、オリゴヌクレオチドの異なる領域は、異なる特性を有し得る。本発明のキメラオリゴヌクレオチドは、上記のような、2以上のオリゴヌクレオチド、修飾オリゴヌクレオチド、オリゴヌクレオシド、および/またはオリゴヌクレオチドアナログの混合構造として形成することができる。
【0027】
オリゴヌクレオチドは、「位置を揃えた形」で(in ”register”)結合され得る複数の領域から構成されるものであり得、すなわちモノマーが連続して結合される場合、天然DNAの場合と同様に結合されるか、またはスペーサーを介して結合され得る。スペーサーは、領域間の共有結合「架橋」を構成することを意図し、いくつかの場合において炭素原子約100個を超えない長さを有する。スペーサーは、さまざまな機能(例えば正電荷または負電荷の含有)を保持でき、特殊な核酸結合特性(干渉物質、グルーブバインダー、毒素、フルオロフォアなど)を保持でき、親油性であり、例えばアルファヘリックスを誘導するアラニン含有ペプチドのように、特殊な2次構造を誘導する。
【0028】
本明細書において使用される「膵臓発生遺伝子群」および「膵臓発生遺伝子」は、ファミリーの全メンバー、変異体、アレル、断片、種、コード配列および非コード配列、センスおよびアンチセンスポリヌクレオチド鎖などを非排他的に包含する。
【0029】
本明細書において使用される用語「ヒト神経発生分化1」、「ヒト神経発生分化因子1」、NEUROD1、BETA2、BHF−1、bHLHa3、NeuroD、NEUROD、NeuroD1は、文献では同義のものとみなされ、本出願において互換的に使用される。
【0030】
本明細書において使用される用語「肝細胞核因子4−α」、「肝細胞核因子4α」、HNF4α;HNF4A、HNF−4α、MODY、MODY1、NR2A1、NR2A21、TCF、TCF14、転写因子14、APF、LFB1、およびHP1は、文献では同義のものとみなされ、本出願において互換的に使用される。
【0031】
本明細書において使用される用語「v−maf筋腱膜性線維肉腫癌遺伝子のホモログA」、MAFA、hMafA、v−maf、mafA、膵β細胞特異的転写活性化因子、RIPE3b1、転写因子MafA、転写因子RIPE3b1、V−maf筋腱膜線維肉腫癌遺伝子ホモログ(トリ)は、文献では同義のものとみなされ、本出願において互換的に使用される。
【0032】
本明細書において使用される用語「膵臓十二指腸ホメオボックス−1」、PDX1、PDX−1、グルコース感受性因子、GSF、IDX−1、インスリンプロモーター因子1、インスリンの上流因子1、IPF1、IPF−1、膵島/十二指腸ホメオボックス−1、IUF1、IUF−1、MODY4、膵臓/十二指腸ホメオボックスタンパク質1、ソマトスタチントランス活性化因子1、STF−1は、文献では同義のものとみなされ、本出願において互換的に使用される。
【0033】
本明細書において使用される用語、NK6ホメオボックス1、NKX6−1、ホメオボックスタンパク質NK−6ホモログA、ホメオボックスタンパク質Nkx−6.1、Nkx6.1、NKX6.1、およびNKX6Aは、文献では同義のものとみなされ、本出願において互換的に使用される。
【0034】
本明細書において使用される用語「に特異的なオリゴヌクレオチド」または「を標的にするオリゴヌクレオチド」は(i)標的遺伝子の一部分と安定な複合体を形成できる配列、または(ii)標的遺伝子のmRNA転写物の一部分と安定な2重鎖を形成できる配列を有するオリゴヌクレオチドを意味する。複合体および2重鎖の安定性は、理論計算および/または体外アッセイによって決定され得る。ハイブリダイゼーション複合体および2重鎖の安定性を決定するための典型的方法は、下記の実施例において記載される。
【0035】
本明細書において使用される用語「標的核酸」は、DNA、そのようなDNAから転写されたRNA(プレmRNAおよびmRNAを含む)、およびそのようなRNA、コード配列、非コード配列、センスまたはアンチセンスポリヌクレオチドに由来するcDNAも包含する。オリゴマー化合物のその標的核酸との特異的ハイブリダイゼーションは、核酸の通常の機能を妨げる。特異的にハイブリダイズする化合物による標的核酸の機能に対するこの調節は、通常「アンチセンス」と称される。干渉されるDNAの機能には、例えば複製および転写が含まれる。干渉されるRNAの機能として、例えばタンパク質翻訳部位へのRNAの転座、RNAからのタンパク質の翻訳、1つまたは複数のmRNA種を得るためのRNAのスプライシング、およびRNAが関与し得る、またはRNAによって促進され得る触媒活性などの全ての生体機能が挙げられる。標的核酸機能でのそのような干渉の全体的効果は、コードされる産物またはオリゴヌクレオチドの発現の調節である。
【0036】
RNA干渉「RNAi」は、「標的」核酸配列に配列特異的相同性を有する2本鎖RNA(dsRNA)分子によって介在される。本発明の特定の実施形態において介在物質は、5〜25ヌクレオチドの「低分子干渉」RNA2重鎖(siRNA)である。siRNAは、ダイサーとして周知のRNase酵素によるdsRNAのプロセシングに由来する。siRNA 2重鎖産物は、RISC(RNA Induced Silencing Complex、RNA誘導サイレンシング複合体)と称される多タンパク質siRNA複合体に入る。なんらかの特定の理論にも制約されることを言う意図はないが、次いでRISCは、siRNA 2重鎖が配列特異的方法で相互作用し、触媒的に切断を介在する標的核酸(適切にはmRNA)に導かれると考えられる。本発明により使用され得る低分子干渉RNAは、当技術分野において十分に周知であり、当業者によく知られている手順に従って合成および使用され得る。本発明の方法における使用のための低分子干渉RNAは、適切には約1〜約50の間のヌクレオチド(nt)を含む。非限定的実施形態の例において、siRNAは約5〜約40nt、約5〜約30nt、約10〜約30nt、約15〜約25ntまたは約20〜25ヌクレオチドを含み得る。
【0037】
適切なオリゴヌクレオチドの選択は、自動的に核酸配列のアラインメントをとり、同一または相同な領域を示すコンピュータープログラムを使用することによって容易になる。そのようなプログラムは、例えばGenBankなどのデータベースを検索することによって、またはPCR産物を配列決定することによって得られた核酸配列を比較するために使用される。さまざまな種由来の核酸配列の比較により、種の間で適切な程度の同一性を示す核酸配列の選択が可能になる。配列決定されていない遺伝子の場合は、標的種および他の種における遺伝子間での同一性の程度の決定を可能にするサザンブロットが実施される。当技術分野においてよく知られるように、種々の程度のストリンジェンシーでのサザンブロットを実施することによって、同一性の概算的測定値を得ることが可能である。これらの手順は、管理される対象における標的核酸配列に高い相補性を示し、他の種における対応する核酸配列に低い相補性を示すオリゴヌクレオチドの選択を可能にする。当業者であれば、本発明における使用のための遺伝子の適切な領域を選択することにおいては相当な許容範囲があることを理解されよう。
【0038】
「酵素的RNA」によって酵素活性を有するRNA分子が意味される。酵素的核酸(リボザイム)は、最初に標的RNAに結合することによって作用する。そのような結合は、標的RNAを切断するべく作用する分子の酵素的部分の近接に保持される酵素的核酸の標的結合部分を通じて生じる。したがって酵素的核酸は、最初に標的RNAを認識し、次いで塩基対形成を通じて結合し、一旦正しい部位に結合すると標的RNAを切断するべく酵素的に作用する。
【0039】
「デコイRNA」は、リガンドに対する天然結合ドメインを模倣するRNA分子を意味する。したがってデコイRNAは、特異的リガンドの結合に関して天然結合標的と競合する。例えば、HIVトランス活性化応答(TAR)RNAの過剰発現は、「デコイ」として作用することができ、HIV tatタンパク質に効率的に結合し、それによりHIV RNAにコードされるTAR配列へのその結合を阻害することが判明している(Sullengerら,(1990)Cell,63,601−608)。これは、具体例として挙げられている。当業者でれば、これが一例に過ぎず、他の実施形態が当技術分野において公知の技術を使用して容易に作成され得ることを理解されよう。
【0040】
本明細書において使用される用語「モノマー」は、典型的には、大きさで数個、例えば約3〜4個の単量体単位から約数百個の単量体単位までの範囲のオリゴヌクレオチドを形成するホスホジエステル結合またはその類似結合によって連結されたモノマーを示す。ホスホジエステル結合の類似として、ホスホロチオエート、ホスホロジチオエート、メチルホスホネート、ホスホロセレノエート、ホスホラミデートなどが挙げられ、後により詳細に記載される。
【0041】
用語「ヌクレオチド」は、非天然のヌクレオチドとともに天然のヌクレオチドを包含する。以前には「非天然に発生する」ものと考えられていた各種ヌクレオチドが、その後天然にも見出されたことがあるのは当業者には明らかなはずである。したがって、「ヌクレオチド」は、既知のプリンおよびピリミジンヘテロ環を含む分子だけでなく、ヘテロ環アナログおよびそれらの互変異性体も含む。他の種類のヌクレオチドの例としては、アデニン、グアニン、チミン、シトシン、ウラシル、プリン、キサンチン、ジアミノプリン、8−オキソ−N6−メチルアデニン、7−デアザキサンチン、7−デアザグアニン、N4,N4−エタノシトシン、N6,N6−エタノ−2,6−ジアミノプリン、5−メチルシトシン、5−(C3−C6)−アルキニルシトシン、5−フルオロウラシル、5−ブロモウラシル、シュードイソシトシン、2−ヒドロキシ−5−メチル−4−トリアゾロピリジン、イソシトシン、イソグアニン、イノシンおよび米国特許第5,432,272号に記載されている「非天然の」ヌクレオチドである。「ヌクレオチド」という用語は、これらの例のすべてに加えてそのアナログおよび互変異性体も包含するものとする。特に興味深いヌクレオチドは、アデニン、グアニン、チミン、シトシン、5−メチルシトシン、およびウラシルであり、これらはヒトにおける治療および診断の用途に関連して自然に生じるヌクレオチドと考えられる。ヌクレオチドは、例えばKornbergおよびBaker,DNA Replication,2nd Ed.(Freeman,San Francisco,1992)に記載の天然の2’−デオキシ糖および2’−ヒドロキシ糖ならびにそれらのアナログを含む。
【0042】
ヌクレオチドに関して「アナログ」は、修飾された塩基成分および/または修飾された糖部分を有する合成ヌクレオチドを含む。そのようなアナログは、結合特性、例えば2重鎖または3重鎖安定性、特異性などを増強するために設計された合成ヌクレオチドを含む。
【0043】
本明細書において使用される「ハイブリダイゼーション」は、オリゴマー化合物の実質的な相補鎖の対形成を意味する。対形成の1つの機序は、オリゴマー化合物の鎖の相補的ヌクレオシドまたはヌクレオチド塩基(ヌクレオチド)間でのワトソン−クリック型、フーグスティーン型または逆フーグスティーン型水素結合であり得る水素結合を含む。例えばアデニンおよびチミンは、水素結合の形成を通じて対形成する相補的ヌクレオチドである。ハイブリダイゼーションは、各種環境下で生じ得る。
【0044】
アンチセンス化合物は、標的核酸への化合物の結合が標的核酸の通常の機能に干渉して機能および/または活性の調節を生じ、特異的結合が望ましい条件下(すなわち生体内アッセイまたは治療的処置の場合での生理的条件下および対外アッセイの場合でのアッセイが実施される条件下)でアンチセンス化合物の非標的核酸配列への非特異的結合を避けるために十分な程度の相補性がある場合に「特異的にハイブリダイズできる」。
【0045】
本明細書において使用される表現「ストリンジェントなハイブリダイゼーション条件」または「ストリンジェントな条件」は、本発明の化合物がその標的配列にハイブリダイズし、最小限の他の配列にしかハイブリダイズしない条件を意味する。ストリンジェントな条件は、配列依存的であり、異なる環境下では異なっており、本発明の文脈においてオリゴマー化合物が標的配列にハイブリダイズする「ストリンジェントな条件」は、オリゴマー化合物の性質および組成物ならびにそれらが調査されるアッセイによって決定される。一般に、ストリンジェントなハイブリダイゼーション条件は、Na++またはK++などの無機陽イオン塩の低濃度(<0.15M)(すなわち低イオン強度)、20℃−25℃より高くオリゴマー化合物:標的配列複合体のTmより低い温度、およびホルムアミド、ジメチルホルムアミド、ジメチルスルホキシドなどの変性剤または界面活性剤ドデシル硫酸ナトリウム(SDS)の存在を含む。例えば、ハイブリダイゼーション率はホルムアミド1%ごとに1.1%低下する。高ストリンジェンシーなハイブリダイゼーション条件の例は、0.1×塩化ナトリウム−クエン酸ナトリウムバッファー(SSC)/0.1%(w/v)SDSで60℃、30分間である。
【0046】
本明細書において使用される「相補性」は、1つまたは2つのオリゴマー鎖上の2つのヌクレオチド間の正確な対形成の能力を意味する。例えばアンチセンス化合物の特定の位置の核酸塩基が標的核酸の特定の位置で核酸塩基と水素結合でき、前記標的核酸がDNA、RNAまたはオリゴヌクレオチド分子である場合、オリゴヌクレオチドと標的核酸との間の水素結合の位置は相補的位置であると考えられる。オリゴマー化合物とさらなるDNA、RNAまたはオリゴヌクレオチド分子とは、各分子における十分な数の相補的位置が相互に水素結合できるヌクレオチドによって占められる場合に相互に相補的である。したがって「特異的にハイブリダイズできる」および「相補的」は、オリゴマー化合物と標的核酸との間に安定かつ特異的な結合が生じるような十分な数のヌクレオチドにわたる十分な程度の正確な対形成すなわち相補性を示すために使用される用語である。
【0047】
オリゴマー化合物の配列は、特異的にハイブリダイズできるその標的核酸の配列に100%相補的である必要がないことは当技術分野において理解されることである。さらにオリゴヌクレオチドは、介在するまたは隣接するセグメントがハイブリダイゼーション事象に関与せずに(例えばループ構造、ミスマッチまたはヘアピン構造)1以上のセグメントにわたってハイブリダイズできる。本発明のオリゴマー化合物は、それらが標的化される標的核酸配列中の標的領域に対して、少なくとも約70%、または少なくとも約75%、または少なくとも約80%、または少なくとも約85%、または少なくとも約90%、または少なくとも約95%または少なくとも約99%の配列相補性を有する。例えば、アンチセンス化合物の20個のヌクレオチドのうちの18個が標的領域に相補的であり、したがって特異的にハイブリダイズするアンチセンス化合物は、90パーセントの相補性を示す。この例において残りの非相補的ヌクレオチドは、相補的ヌクレオチドと共に一群となっていても点在していても良く、相互にまたは相補的ヌクレオチドに近接している必要はない。そのように長さ18ヌクレオチドであり、標的核酸と完全に相補的な2つの領域によって隣接された4つ(4個)の非相補的ヌクレオチドを有するアンチセンス化合物は、標的核酸に全体で77.8%の相補性を有し、したがって本発明の範囲内に含まれる。アンチセンス化合物と標的核酸の領域との相補性百分率は、当技術分野において周知のBLASTプログラム(basic local alignment search tools)およびPowerBLASTプログラムを使用して通常通りに決定され得る。相同性百分率、配列同一性または相補性は、例えば、SmithおよびWatermanのアルゴリズム(Adv.Appl.Math.,(1981)2,482−489)を使用するGapプログラム(Wisconsin Sequence Analysis Package, Version 8 for Unix(登録商標),Genetics Computer Group,University Research Park,Madison Wis.)の初期設定を使用することによって決定され得る。
【0048】
本明細書において使用される用語「熱融点(Tm)」は、規定のイオン強度、pHおよび核酸濃度の下で、標的配列に相補的であるオリゴヌクレオチドの50%が平衡状態で標的配列にハイブリダイズする温度を意味する。典型的にはストリンジェントな条件は、塩濃度が少なくともNaイオン濃度(または他の塩)約0.01〜1.0M、pH7.0〜8.3であり、短いオリゴヌクレオチド(例えば10〜50ヌクレオチド)については温度が低くとも約30℃であるものである。ストリンジェントな条件は、ホルムアミドなどの不安定化剤の添加でも達成され得る。
【0049】
本明細書において使用される用語「調節」は、遺伝子の発現における増大(刺激)または減少(阻害)を意味する。
【0050】
ポリヌクレオチド配列の文脈において使用される場合に用語「変異型」は、野生型遺伝子に関連するポリヌクレオチド配列を包含する。この定義は、例えば「アレル」、「スプライス」、「種」または「多型」変異型も含み得る。スプライス変異型は、基準の分子と有意な同一性を有し得るが、一般にmRNAプロセシングの際のエクソンの選択的スプライシングによる、より多いまたは少ない数のポリヌクレオチドを有する。対応するポリペプチドは、追加的機能ドメインまたはドメインの欠損を有し得る。種の変異型は、1つの種から他の種へ変化するポリヌクレオチド配列である。本発明における特定の有用性は、野生型遺伝子産物の変異型である。変異型は、核酸配列における少なくとも1つの変異から生じることができ、変化したmRNAまたはその構造または機能が変化していても変化していなくてもよいポリペプチドを生じ得る。任意の所与の天然または組み換え遺伝子は、対立形態を有さない場合も、1つ有する場合も、多数有する場合もある。変異型を生じる通常の変異変化は、一般に天然の欠失、追加またはヌクレオチドの置換に帰する。これらの型の変化のそれぞれは、単独でまたは他との組み合わせで1回または複数回、所与の配列に生じ得る。
【0051】
得られたポリペプチドは、一般に相互に比較して顕著なアミノ酸同一性を有する。多型変異型は、所与の種の個体間での特定の遺伝子のポリヌクレオチド配列における変異型である。多型変異型は、「単一ヌクレオチド多型」(SNP)またはポリヌクレオチド配列が1塩基によって変化している単一塩基変異も包含できる。SNPの存在は、例えば、易罹患性対抵抗性である病態についてのある傾向を有する特定の集団についての指標であり得る。
【0052】
誘導体ポリヌクレオチドは、化学的修飾(例えば水素のアルキル、アシルまたはアミノ基での置換)に供された核酸を含む。誘導体、例えばオリゴヌクレオチド誘導体は、修飾された糖部分または糖間結合などの天然に存在しない部分を含み得る。これらにおける例は、ホスホロチオエートおよび当技術分野において周知の他のイオウ含有種である。誘導核酸は、放射性ヌクレオチド、酵素、蛍光剤、化学発光剤、発色剤、基質、補助因子、阻害因子、磁性粒子などが挙げられる標識も含み得る。
【0053】
「誘導体」ポリペプチドまたはペプチドは、例えばグリコシル化、ポリエチレングリコール化、リン酸化、硫酸化、還元/アルキル化、アシル化、化学的カップリングまたは穏やかなホルマリン処理によって修飾されたものである。誘導体は、以下に限定されないが放射性同位元素、蛍光または酵素標識を含む検出可能な標識を含むために直接または間接的のいずれかで修飾もされ得る。
【0054】
本明細書において使用される用語「動物」または「患者」とは、例えばヒト、ヒツジ、エルク、シカ、ミュールジカ、ミンク、哺乳動物、サル、ウマ、ウシ、ブタ、ヤギ、イヌ、ネコ、ラット、マウス、鳥類、ニワトリ、爬虫類、魚類、昆虫およびクモ類を含む意味である。
【0055】
「哺乳動物」は、典型的には医療的ケアの下にある温血哺乳動物(例えばヒトおよび家畜)を含む。例として、ヒトのみならず、ネコ、イヌ、ウマ、ウシおよびヒトが挙げられる。
【0056】
「治療」または「処置」は、(a)哺乳動物において病状が生じることを予防するステップ、具体的にはそのような哺乳動物が前病気状態におかれているが、病状が生じているとまだ診断されていない場合;(b)病状を抑制するステップ、例えばその進行を止めるステップ;および/または(c)病状を軽減するステップ、例えば病態の退行を所望の終点に至るまで生じさせるステップ、を含む哺乳動物における病気に対する処置を含む。治療は、疾患の症状の回復(例えば疼痛または不快感の緩和)も含み、そのような回復は、疾患に直接効果を与える場合または与えない場合がある(例えば原因、伝染、発現など)。
【0057】
本明細書において「癌」とは、哺乳動物においてみられるあらゆる種類の癌または新生物または悪性腫瘍を指し、以下に限定されないが、白血病、リンパ腫、黒色腫、癌腫、および肉腫が含まれる。癌は、「腫瘍」すなわち癌の悪性細胞を含む組織として現れる。腫瘍の例には肉腫および癌種が含まれ、例えば、以下に限定されないが、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮細胞肉腫、滑膜腫、中皮腫、ユーイング腫瘍、平滑筋肉腫、横紋筋肉腫、結腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭腺癌、嚢胞腺癌、髄様癌、気管支原性癌、腎細胞癌、肝癌、胆管癌、絨毛癌、精上皮腫、胎児性癌、ウィルムス腫瘍、子宮頸癌、精巣腫瘍、肺癌、小細胞肺癌、膀胱癌、上皮癌、神経膠腫、星状細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽腫、聴神経腫、乏突起膠腫、髄膜腫、黒色腫、神経芽細胞腫、および網膜芽細胞腫などが挙げられる。本明細書に開示する本発明の組成物によって治療できる他の癌としては、以下に限定されないが、例えば、ホジキン病、非ホジキンリンパ腫、多発性骨髄腫、神経芽細胞腫、乳癌、卵巣癌、肺癌、横紋筋肉腫、原発性血小板血症、原発性マクログロブリン血症、小細胞肺癌、原発性脳腫瘍、胃癌、大腸癌、悪性膵臓インスリノーマ、悪性カルチノイド、膀胱癌、前癌状態の皮膚病変、精巣癌、リンパ腫、甲状腺癌、神経芽細胞腫、食道癌、尿生殖路癌、悪性高カルシウム血症、子宮頸癌、子宮内膜癌、副腎皮質癌、および前立腺癌などが挙げられる。
【0058】
「神経疾患または障害」は、神経系および/または視覚系のあらゆる疾患または障害を指す。「神経疾患または障害」は、中枢神経系(脳、脳幹、小脳)、末梢神経系(脳神経を含む)、および自律神経系(その一部は中枢神経系および末梢神経系の両方に位置する)が関与する疾患または障害を含む。神経疾患の例としては、以下に限定されないが、頭痛、昏迷および昏睡、認知症、発作、睡眠障害、外傷、感染症、腫瘍、神経眼科障害、運動障害、脱髄疾患、脊髄疾患、および末梢神経、筋肉、ならびに神経筋接合部の障害が挙げられる。嗜癖および精神疾患としては、以下に限定されないが、双極性障害および統合失調症が挙げられ、これらは神経疾患の定義にも包含される。次に挙げるものは、本発明による組成物および方法を用いて治療できる神経の疾患、症状、徴候、および症候群のリストである:後天性てんかん性失語症、急性散在性脳脊髄炎、副腎白質ジストロフィー、加齢黄斑変性症、脳梁欠損症、失認症、アイカルディ症候群、アレクサンダー病、アルパース病、交代性片麻痺、脳血管性痴呆、筋萎縮性側索硬化症、無脳症、アンジェルマン症候群、血管腫症、無酸素症、失語症、失行症、くも膜嚢胞、くも膜炎、アーノルド・キアリ奇形、動静脈奇形、アスペルガー症候群、毛細血管拡張性運動失調症、注意欠陥多動性障害、自閉症、自律神経機能障害、背中の痛み、バッテン病、ベーチェット病、ベル麻痺、良性特発性眼瞼けいれん、良性限局性異常、筋萎縮症、良性頭蓋内圧亢進症、ビンスワンガー病、眼瞼けいれん、ブロッホ・サルズバーガー症候群、腕神経叢損傷、脳膿瘍、脳損傷、脳腫瘍(多形性膠芽腫を含む)、脊髄腫瘍、ブラウンセカール症候群、カナバン病、手根管症候群、カウザルギー、中枢性疼痛症候群、橋中心髄鞘崩壊、頭部の障害、脳動脈瘤、脳動脈硬化症、萎縮脳、脳性巨人症、脳性麻痺、シャルコー・マリー・トゥース病、化学療法誘発性神経障害と神経因性疼痛、キアリ奇形、舞踏病、慢性炎症性脱髄性多発神経障害、慢性疼痛、慢性局所疼痛症候群、コフィンローリー症候群、遷延性植物状態を含む昏睡状態、先天性顔面麻痺、大脳皮質基底核変性症、頭蓋の動脈炎、頭蓋骨早期癒合症、クロイツフェルト・ヤコブ病、蓄積外傷疾患、クッシング症候群、巨大細胞性封入体症、サイトメガロウイルス感染症、ダンシングアイズ・ダンシングフィート症候群(眼球クローヌス・ミオクローヌス運動失調)、ダンディ・ウォーカー症候群、ドーソン病、ド・モルシア症候群、デジェリン−クルムプケ麻痺、認知症、皮膚筋炎、糖尿病性神経障害、びまん性硬化症、自律神経障害、書字障害、失読症、ジストニア、早期乳児てんかん性脳症、エンプティセラ症候群、脳炎、脳瘤、脳三叉神経領域血管腫症、てんかん、エルブ麻痺、本態性振戦、ファブリー病、ファール症候群、失神、家族性けいれん性麻痺、熱性けいれん、フィッシャー症候群、フリードライヒ失調症、前頭側頭認知症およびその他の「タウオパチー」、ゴーシェ病、ゲルストマン症候群、巨細胞性動脈炎、巨細胞性封入体病、球様細胞白質萎縮症、ギラン・バレー症候群、HTLV−1関連脊髄症、ハレルフォルデンスパッツ病、頭部外傷、頭痛、片側顔面けいれん、遺伝性痙性対麻痺、遺伝性多発神経炎性失調、耳帯状疱疹、帯状疱疹、平山病、HIV関連認知症および神経障害(AIDSの神経学的症状も)、全前脳症、ハンチントン病および他のポリグルタミンリピート病、水無脳症、水頭症、副腎皮質機能亢進症、低酸素症、免疫介在性脳脊髄炎、封入体筋炎、色素失調症、幼児型フィタン酸蓄積症、乳児型レフサム病、乳児痙攣、炎症性筋疾患、頭蓋内の嚢胞、頭蓋内圧亢進、ジュベール症候群、カーンズ・セイヤー症候、ケネディ病、キンズボーン症候群、クリッペル・ファイル症候群、クラッベ病、クーゲル・ウエランダー病、クールー、ラフォラ病、ランバート・イートン症候群、ランドウ・クレフナー症候群、外側延髄(ウォレンバーグ)症候群、学習障害、リー病、レノックス・ガストー症候群、レッシュナイハン症候群、大脳白質萎縮症、レビー小体型認知症、滑脳症、閉じ込め症候群、ルー・ゲーリッグ病(すなわち運動ニューロン疾患または筋萎縮性側索硬化症)、腰椎椎間板疾患、ライム病−神経学的後遺症、マチャド・ジョセフ病、大脳症、巨大脳髄症、メルカーソン・ローゼンタール症候群、メニエール病、髄膜炎、メンケス病、異染性白質ジストロフィー、小頭症、片頭痛、ミラーフィッシャー症候群、軽度の脳卒中、ミトコンドリアミオパシー、メビウス症候群、モノマー性筋萎縮症、運動ニューロン疾患、もやもや病、ムコ多糖症、多発梗塞性痴呆、多巣性運動ニューロパチー、多発性硬化症および他の脱髄性疾患、起立性低血圧を伴う多系統萎縮症、筋ジストロフィー、重症筋無力症、ミエリン代謝異常によるびまん性硬化症、乳児型ミオクロニー脳症、ミオクローヌス、筋疾患、先天性ミオトニア、ナルコレプシー、神経線維腫症、悪性症候群、AIDSの神経学的症状、紅斑性狼瘡の神経学的後遺症、神経性筋緊張病、神経セロイドリポフスチン症、神経細胞遊走障害、ニーマン・ピック病、オサリバン・マクラウド症候群、後頭神経痛、潜在性脊椎閉鎖不全症、大田原症候群、オリーブ橋小脳萎縮症、オプソクローヌス・ミオクローヌス症候群、視神経炎、起立性低血圧、使い過ぎ症候群、感覚異常、神経変性疾患または障害(パーキンソン病、ハンチントン病、アルツハイマー病、筋萎縮性側索硬化症(ALS)、認知症、多発性硬化症、および神経細胞死に関連する他の疾患および障害)、先天性パラミオトニア、腫瘍随伴性疾患、発作、パリーロンベルク症候群、ペリツェウスメルツバッハー病、周期性麻痺、末梢神経障害、痛みを伴う神経障害および神経因性疼痛、遷延性植物状態、広汎性発達障害、光くしゃみ反射、フィタン酸蓄積症、ピック病、挟まれた神経、下垂体腫瘍、多発性筋炎、孔脳症、ポリオ後症候群、帯状疱疹後神経痛、感染後脳脊髄炎、起立性低血圧、プラダーウィリ症候群、原発性側索硬化症、プリオン病、進行性顔面半側萎縮症、進行性多巣性白質脳症、進行性硬化性ポリオジストロフィー、進行性核上性麻痺、偽脳腫瘍、ラムゼイ・ハント症候群(I型およびII型)、ラスムッセン脳炎、反射性交感神経性ジストロフィー症候群、レフサム病、反復運動障害、反復ストレス障害、むずむず脚症候群、レトロウイルス関連脊髄症、レット症候群、ライ症候群、舞踏病、サンドホフ病、シルダー病、裂脳症、中隔視神経異形成症、揺さぶられっ子症候群、帯状疱疹、シャイ・ドレーガー症候群、シェーグレン症候群、睡眠時無呼吸症候群、ソトス症候群、痙縮、二分脊椎、脊髄損傷、脊髄腫瘍、脊髄性筋萎縮症、スティッフパーソン症候群、脳卒中、スタージ・ウェーバー症候群、亜急性硬化性全脳炎、皮質下動脈硬化性脳症、シデナム舞踏病、失神、脊髄空洞症、遅発性ジスキネジア、テイ・サックス病、側頭動脈炎、係留脊髄症候群、トムセン病、胸郭出口症候群、疼痛チック、トッドの麻痺、トゥレット症候群、一過性脳虚血発作、伝達性海綿状脳症、横断性脊髄炎、外傷性脳損傷、振戦、三叉神経神経痛、熱帯性痙性不全対麻痺、結節性硬化症、血管性痴呆(多発梗塞性痴呆)、側頭動脈炎を含む脈管炎、フォンヒッペル・リンドウ病、ウォレンバーグ症候群、ウェルドニッヒ・ホフマン病、ウエスト症候群、むち打ち症、ウィリアムズ症候群、ウィルソン病、およびゼルウィガー症候群。
【0059】
「炎症」とは、全身の炎症性状態、ならびに単球、白血球および/または好中球の遊走および誘引に局所的に関連する状態を指す。炎症の例としては、以下に限定されないが、病原菌(グラム陽性菌、グラム陰性菌、ウイルス、真菌、および原虫や蠕虫などの寄生虫を含む)の感染症に起因する炎症、移植片拒絶反応(腎臓、肝臓、心臓、肺、および角膜などの固形臓器の拒絶反応、ならびに移植片対宿主病(GVHD)を含む骨髄移植の拒絶反応を含む)に起因する炎症、または局所性の慢性または急性の自己免疫またはアレルギー反応に起因する炎症が挙げられる。自己免疫疾患としては、急性糸球体腎炎、関節リウマチまたは反応性関節炎;慢性糸球体腎炎;クローン病、潰瘍性大腸炎、および壊死性腸炎などの炎症性腸疾患;顆粒球輸血関連症候群;接触性皮膚炎、アトピー性皮膚炎、および乾癬などの炎症性皮膚疾患;全身性エリテマトーデス(SLE)、自己免疫性甲状腺炎、多発性硬化症、いくつかの型の糖尿病、または被検体自身の免疫系による攻撃が病理学的組織破壊をもたらす他の自己免疫状態などが挙げられる。アレルギー反応には、アレルギー性喘息、慢性気管支炎、急性および遅延型過敏症が含まれる。全身の炎症疾患状態には、外傷、熱傷、虚血事象(例えば、心筋梗塞および脳卒中を含む心臓、脳、腸、または末梢血管系の血栓症)の後の再潅流、敗血症、急性呼吸窮迫症候群(ARDS)、多臓器不全症候群などが含まれる。炎症細胞の動員は、アテローム性動脈硬化プラークに発生する。炎症には、以下に限定されないが、非ホジキンリンパ腫、ウェゲナー肉芽腫症、橋本甲状腺炎、肝細胞癌、胸腺萎縮、慢性膵炎、関節リウマチ、反応性リンパ過形成、変形性関節症、潰瘍性大腸炎、乳頭癌、クローン病、潰瘍性大腸炎、急性胆嚢炎、慢性胆嚢炎、肝硬変、慢性唾液腺炎、腹膜炎、急性膵炎、慢性膵炎、慢性胃炎、腺筋症、子宮内膜症、急性子宮頸管炎、慢性子宮頸管炎、リンパ過形成、多発性硬化症、特発性血小板減少性紫斑病に続発する肥大、原発性IgA腎症、全身性エリテマトーデス、乾癬、肺気腫、慢性腎盂腎炎、および慢性膀胱炎などが含まれる。
【0060】
心血管疾患および障害には、虚血を引き起こし得る疾患か、心臓の再灌流によって引き起こされ得る疾患が含まれる。そのような疾患の例としては、以下に限定されないが、アテローム性動脈硬化症、冠動脈疾患、肉芽腫性心筋炎、慢性心筋炎(非肉芽腫性)、原発性肥大型心筋症、末梢動脈疾患(PAD)、脳卒中、狭心症、心筋梗塞、心停止に起因する心血管組織の損傷、心臓バイパスに起因する心血管組織の損傷、心原性ショック、当業者に公知のまたは心臓や血管系の機能不全や組織損傷を伴う関連する状態(特に、以下に限定しないが、膵臓発生遺伝子の活性化に関連する組織損傷)などが挙げられる。心血管(CVS)疾患には、以下に限定されないが、アテローム性動脈硬化症、肉芽腫性心筋炎、心筋梗塞、心臓弁膜症に続発する心筋線維症、心筋梗塞を伴わない心筋線維症、原発性肥大型心筋症、および慢性心筋炎(非肉芽腫性)などが含まれる。
【0061】
代謝性疾患または障害は、例えば、インスリン抵抗性、糖尿病、肥満、耐糖能障害、高い血中コレステロール値、高血糖症、高インスリン血症、脂質異常症、および脂質異常症などの広範囲にわたる内分泌系の疾患または障害を指す。
【0062】
[ポリヌクレオチドおよびオリゴヌクレオチド組成物および分子]
標的:一実施形態において、該標的は、限定することなく膵臓発生遺伝子に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、膵臓発生遺伝子の核酸配列を含む。
【0063】
一実施形態では、前記標的が、限定することなくNEUROD1遺伝子に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、NEUROD1の核酸配列を含む。
【0064】
一実施形態では、前記標的が、限定することなくHNF4A遺伝子に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、HNF4Aの核酸配列を含む。
【0065】
一実施形態では、前記標的が、限定することなくMAFA遺伝子に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、MAFAの核酸配列を含む。
【0066】
一実施形態では、前記標的が、限定することなくPDX1遺伝子に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、PDX1の核酸配列を含む。
【0067】
一実施形態では、前記標的が、限定することなくNKX6に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、NKX6の核酸配列を含む。
【0068】
BETA2/NeuroD1は、インスリン遺伝子発現をアップレギュレートする能力を有する組織特異的塩基性へリックスループへリックス転写因子である。BETA2/NeuroD1は、膵島β細胞における膵島の形態形成およびインスリンホルモン遺伝子の転写の重要な調節因子である。それはNeuroDという神経分化に必要な遺伝子としてクローニングされた。現在は、この遺伝子をBETA2/NeuroD1と称する。各種発生システムの調節に重要な役割を果たす多くのbHLHファミリーメンバーと同様に、BETA2/NeuroD1は、膵臓および脳の発生に不可欠である。
【0069】
HNF4Aは、肝細胞および膵臓の転写調節に重要な役割を持つ転写因子をコードしている。オーファン核内受容体および肝活性化因子である肝核因子−4(HNF−4)は、肝臓、膵臓の細胞における転写ネットワークの中心的な調節因子である。2つのプロモーターP1およびP2は、染色体20qの上で45.5kb離れた位置にある。肝臓でのHNF4A転写産物は主としてP1起源であるが、インスリン分泌とグルコース恒常性に関与する遺伝子を調節する場合には、P2プロモーターが膵臓での発現を誘導する。
【0070】
MAFAは、インスリン遺伝子のエンハンサー領域におけるRIPE3b1と呼ばれる保存されたシス調節エレメントに結合されている、β細胞特異的核内因子であり、インスリン遺伝子の重要なトランス活性化因子として機能する。MAFAは、RIPE3b1と呼ばれるシス調節エレメントを介してインスリン遺伝子のβ−細胞特異的発現を制御し、インスリン遺伝子の強力なトランス活性化因子としての機能する塩基性ロイシンジッパー(bLZ)転写因子である。MAFAはNEUROD1およびPDX1と相乗的に協働する。GSK3によるリン酸化は、その転写活性を増加させ、その発癌活性に必要である。
【0071】
膵臓十二指腸ホメオボックス1(PDX1)は、膵臓、十二指腸と幽門部の分化および発生において重要なホメオボックス遺伝子ファミリーの転写因子である。膵臓十二指腸ホメオボックス1(PDX−1)は、膵臓の発生において重要な役割を持つ転写因子である。PDX−1は膵臓の細胞の増殖と分化を調節し、この転写因子の発現の増加がヒト膵臓腺癌および細胞株において報告されている。PDX1は、β細胞の成熟にも必要である。すなわち発生するβ細胞のPDX1、Nkx6−1、インスリンを同時発現し、これがMafBのサイレンシングおよびMafAの発現をもたらすプロセス、β細胞の成熟に必要なスイッチとなる。Pdx1は、グルカゴンを抑制しながら、内分泌細胞の運命決定、インスリン、ソマトスタチンという2つの膵内分産物のコード化において一定の役割を果たすとみられる。したがって、Pdx1の発現は、明らかにグルカゴン+α細胞ではなく、インスリン+β細胞およびソマトスタチン+Δ細胞の生成を裏付ける。
【0072】
Nkx6.1は、膵臓の中で最もβ細胞特異的な転写因子として認識されている。Nkx6ホメオドメイン転写因子は、中枢神経系および膵臓における重要な発生上の役割を有する。Nkx6.1は、適切な運動ニューロンとオリゴデンドロサイトの発生、およびインスリン産生膵β細胞の発生および維持のために必要不可欠である。
【0073】
Nkx6.1は腹側神経前駆細胞で発現され、その後、側方運動ニューロン柱(LMCm)の中央において、およびShh発現細胞を外囲する間充組織(すなわち腹側脊髄髄膜、食道間充組織、および背側気管間充組織)において発現される。Nkx6.1は腹方部パターニングおよび脊椎動物の中枢神経系における神経運命決定に必要とされている。Nkx6.1は、運動ニューロンと腹側介在ニューロンの運命を制御する。Nkx6.1は、頭内えら運動ニューロンの移行および軸策経路探索を制御し、それが脊髄の体性運動ニューロン細胞前駆細胞の初期の特定のために必要となる。えら運動ニューロン(後脳)の初期の特定は、Nkx6.1の機能とは無関係であるが、その後の発生のためにそれが必要となる。Nkx6.1は、有糸分裂後のニューロンの発生およびえらの運動ニューロンの移動の制御のために必要である。特定の運動ニューロンプールにおけるNkx6.1の発現の状態は、筋肉の神経形成および個々の筋肉の神経支配分布のパターンを調節する。
【0074】
表1は、いくつかの膵臓発生遺伝子のリストを示す。
【0075】
下記の表1において、表示された遺伝子は、その遺伝子および現在時点で既知の変異型(遺伝子およびその変異型から生じ得る異なるmRNA転写物、解明される可能性のある別の遺伝子変異型、およびアンチセンス配列を含む)を意味する。このリストには、非コードRNA分子またはポリヌクレオチドの部分も含まれる。しかし、一般的に、そのような変異型は下記の表1に記載のいずれかのポリヌクレオチドの配列と有意な配列同一性を有するものであり、例えば、ある変異型は下記の表1中のいずれかの配列と少なくとも約70%の配列同一性を有するもの、典型的には、下記の表1中のいずれかの配列と少なくとも約75、80、85、90、95、97、98または99%の配列同一性を有するものである。変異体の配列同一性は、BLASTプログラム(ncbi.nclm.nih.gov/blast/)など、各種標準的な技術のいずれかによって決定することができる。
【表1】





【0076】
いくつかの実施形態では、膵臓発生遺伝子ファミリーメンバーに関連する疾病または障害を予防または治療するためにアンチセンスオリゴヌクレオチドを用いる。アンチセンス化合物を用いて得られた幹細胞から再生された細胞/組織で治療可能な、典型的な膵臓発生遺伝子が介在する疾患および障害としては、膵臓発生遺伝子の機能および/または発現の異常に関連する疾患または障害、表1に記載するいずれかの遺伝子の機能および/または発現の異常に関連する疾患または障害、心血管疾患または障害(例えば、鬱血性心不全、心筋梗塞、虚血性疾患、心房性または心室性不整脈、高血圧性血管疾患、末梢血管疾患、およびアテローム性動脈硬化症など)、炎症、胃腸疾患または障害(例えば、食道の疾患、アカラシア、活動性アカラシア、嚥下障害、輪状咽頭の協調不全、食道前嚥下障害、びまん性食道けいれん症、球感覚、バレット上皮化生、胃食道逆流など)、胃および/または十二指腸の疾患または障害(例えば、機能性消化不良、胃粘膜の炎症、胃炎、ストレス性胃炎、慢性びらん性胃炎、胃腺の萎縮、胃組織の化生、胃潰瘍、十二指腸潰瘍、胃の新生物)、膵臓の疾患または障害(例えば、急性または慢性膵炎、脂肪便症のような膵臓の外分泌または内分泌組織の機能不全、糖尿病など)、外分泌や内分泌膵臓の新生物(例えば、多発性内分泌腫瘍症候群、導管腺癌、嚢胞腺癌、膵島細胞腫瘍、インスリノーマ、ガストリノーマ、カルチノイド腫瘍、グルカゴノーマ、ゾリンジャー・エリソン症候群、VIP産生腫瘍症候群、吸収不良症候群など)、腸の疾患または障害(例えば、腸の慢性炎症性疾患、クローン病、腸閉塞、下痢および便秘、結腸無力症、巨大結腸、吸収不良症候群、潰瘍性大腸炎、機能性腸疾患、過敏性腸症候群など)、腸の新生物(例えば、家族性ポリポーシス、腺癌、原発性悪性リンパ腫、カルチノイド腫瘍、カポジ肉腫、ポリープ、結腸直腸癌など)、肝疾患または障害(例えば、ビリルビン代謝障害、黄疸、ジルベール症候群、クリーグラー・ナジャー病、デュビン・ジョンソン症候群およびローター症候群;肝内胆汁鬱滞、肝腫脹、門脈圧亢進症、腹水症、バッド・キアリ症候群、門脈体循環性脳症、脂肪肝、脂肪症、ライ症候群、アルコールによる肝臓病、アルコール性肝炎または肝硬変、線維症、肝硬変など)、代謝の先天性異常または外因性物質による肝臓の線維症および/または肝硬変、蓄積症または貯留疾患、ゴーシェ症候群、ツェルヴェーガー症候群、ウィルソン病、急性または慢性肝炎、ウイルス性肝炎およびその亜種;ウイルス、細菌、真菌、原虫、寄生虫による肝臓の炎症性疾患;肝臓の薬剤誘発性疾患または障害、原発性硬化性胆管炎などの慢性肝疾患、α1−アンチトリプシン欠損症、原発性胆汁性肝硬変、術後の肝内胆汁鬱滞などの術後の肝障害、肝肉芽腫、全身性疾患に関連する血管肝疾患または障害、肝臓の良性または悪性新生物、新生児または未熟児における肝臓の代謝障害、筋骨格疾患(例えば、骨粗鬆症、閉経後骨粗鬆症、老人性骨粗鬆症、続発性骨粗鬆症、特発性若年性骨粗鬆症、骨パジェット病、骨軟骨腫、骨軟骨外骨腫症など)、骨の腫瘍(例えば、良性の軟骨腫、軟骨芽細胞腫、軟骨線維腫、類骨骨腫、骨の巨細胞腫、多発性骨髄腫、骨肉腫(造骨組織の肉腫)、線維肉腫、悪性線維性組織球腫、軟骨肉腫、ユーイング腫瘍(ユーイング肉腫)、骨の悪性リンパ腫(細網肉腫、骨の転移性腫瘍)、変形性関節症、痛風および偽痛風、関節および結合組織の疾患(例えば、関節リウマチ、乾癬性関節炎、円板状エリテマトーデス、全身性エリテマトーデス、強皮症(全身性硬化症)、シェーグレン症候群、結合組織病、多発性筋炎および皮膚筋炎、再発性多発性軟骨炎、血管炎、結節性多発動脈炎、リウマチ性多発筋痛、側頭動脈炎、ウェゲナー肉芽腫症、ライター症候群、ベーチェット症候群、強直性脊椎炎、またはシャルコー関節(神経障害性関節疾患)など);骨および関節の感染症(例えば、骨髄炎、感染性関節炎);筋肉、嚢、および/または腱の疾患または障害(例えば、痙性斜頸、線維筋肉痛症候群(筋筋膜性疼痛症候群、線維筋炎)、滑液包炎、腱炎および腱滑膜炎)、足の問題(例えば、足首の捻挫、足骨折、踵骨骨棘、シバー病、後部アキレス腱滑液包炎、前部アキレス腱滑液包炎、後脛骨神経痛、(足指の間の神経またはつま先と足の間の関節の損傷によって引き起こされる)母指球の疼痛、爪甲真菌症、または足爪の変色)、癌、炎症性疾患または障害、I−IV型過敏性反応などの炎症性疾患(例えば、喘息を含む肺の過敏症、アトピー性疾患、アレルギー性鼻炎または結膜炎、眼瞼の血管性浮腫、遺伝性血管性浮腫、抗受容体過敏症反応および自己免疫疾患、橋本甲状腺炎、全身性エリテマトーデス、グッドパスチャー症候群、天疱瘡、重症筋無力症、グレーブスおよびレイノー病、インスリン抵抗性糖尿病B型、関節リウマチ、乾癬、クローン病、強皮症、混合性結合組織病、多発性筋炎、サルコイドーシス、糸球体腎炎、急性または慢性宿主対移植片反応);慢性閉塞性肺疾患(COPD)などの肺疾患または障害;女性および男性の泌尿生殖器系を構成する臓器の悪性疾患などの泌尿器系の疾患、急性または慢性腎不全などの腎疾患または障害、腎移植拒絶反応のような免疫介在性腎疾患、ループス腎炎、免疫複合体腎疾患、糸球体症、腎炎、中毒性腎症、良性前立腺過形成(BPH)のような閉塞性尿路疾患、神経因性膀胱症候群、切迫性尿失禁、緊張性尿失禁、または溢流性尿失禁のような尿失禁、骨盤痛、および勃起不全、内分泌性膵臓発生異常に関連する疾患または障害(例えば、2型糖尿病)、神経新生異常に関連する疾患または障害、神経変性疾患または障害(例えばアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症等);前庭および/または聴覚系の発生異常に関連する疾患または障害、視細胞の変性に関連する疾患または障害(例えば、視力の低下、加齢黄斑変性症など)、肥満症、肝臓の機能不全に関連する疾患または障害(例えば、肝不全)、粉状白内障、青色白内障、非症候性先天性白内障、先天性白内障−小角膜症候群、膵疾患または障害(例えば、糖尿病、成人発症型糖尿病(MODY)症候群、部分膵臓形成不全、慢性高血糖、膵β細胞の障害、グルコース毒性、耐糖能異常、メタボリックシンドロームXなど)、クローン病、心筋梗塞、高コレステロール血症、頭内動脈硬化症、脳梗塞、ヘルペスウイルス感染症、脂質代謝の障害に関連する疾患または障害、インスリン産生に関連する疾患または障害、セロトニン産生に関連する疾患または障害(例えば、鬱病および肥満症)、神経疾患または障害(神経の障害(例えば、運動ニューロンの障害、セロトニン産生ニューロンの障害、ドーパミンニューロンの障害、および前脳、中脳、後脳、ならびに脊髄の発達障害)に関連する疾患など)、
生殖器系の疾患、および糖尿病(例えば、2型糖尿病、インスリン非依存型糖尿病)などの代謝性疾患または障害などが挙げられる。
【0077】
別の実施形態では、アンチセンスオリゴヌクレオチドが、膵臓発生遺伝子に関連する疾患または障害を罹患しているまたは発症する危険のある患者における膵臓発生遺伝子の生体内発現量および/または機能を調節する。
【0078】
一実施形態では、オリゴヌクレオチドは、限定しないが非コード領域を含むものである膵臓発生遺伝子のポリヌクレオチドに特異的である。膵臓発生遺伝子標的は、膵臓発生遺伝子の変異型;SNPを含む膵臓発生遺伝子の突然変異体;膵臓発生遺伝子の非コード配列;アレル、断片などを含む。好ましくは、該オリゴヌクレオチドはアンチセンスRNA分子である。
【0079】
本発明の実施形態によれば、標的核酸分子は、膵臓発生遺伝子ポリヌクレオチドのみに限定されず、膵臓発生遺伝子の任意のアイソフォーム、受容体、ホモログ、非コード領域などにも及ぶ。
【0080】
別の実施形態では、オリゴヌクレオチドは、以下に限定されないが変異型、アレル、ホモログ、突然変異体、誘導体、断片およびそれらの相補配列を含む膵臓発生遺伝子標的の天然アンチセンス配列(コード領域および非コード領域の天然アンチセンス)を標的にする。好ましくは、該オリゴヌクレオチドはアンチセンスRNAまたはDNA分子である。
【0081】
ある実施形態では、本発明のオリゴマー化合物は、化合物における1以上のヌクレオチド位置に異なる塩基が存在する変異型も含む。例えば最初のヌクレオチドがアデニンである場合、この位置にチミジン、グアノシンまたはシチジンまたは他の天然もしくは非天然ヌクレオチドを有する変異型が作られ得る。これは、アンチセンス化合物の任意の位置において行うことができる。
【0082】
いくつかの実施形態において、アンチセンス化合物と標的との間の相同性、配列同一性または相補性は、約50%〜約60%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約60%〜約70%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約70%〜約80%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約80%〜約90%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約90%、約92%、約94%、約95%、約96%、約97%、約98%、約99%または約100%である。
【0083】
アンチセンス化合物は、化合物の標的核酸への結合が標的核酸の正常な機能に干渉して活性の消失を生じさせ、特異的な結合が望まれる条件下でアンチセンス化合物の非標的核酸配列への非特異的結合が回避されるのに十分な程度の相補性がある場合に特異的にハイブリダイズできる。そのような条件は、すなわち生体内アッセイおよび治療的処置の場合での生理的条件、および体外アッセイの場合でのアッセイが実施される条件を含む。
【0084】
アンチセンス化合物は、DNA、RNA、キメラ、置換物などにかかわらず、化合物の標的DNAまたはRNA分子への結合が標的DNAまたはRNAの正常な機能に干渉して有用性の消失を生じさせ、特異的な結合が望まれる条件下(すなわち生体内アッセイおよび治療的処置の場合での生理的条件、および体外アッセイの場合でのアッセイが実施される条件)でアンチセンス化合物の非標的配列への非特異的結合が回避されるのに十分な程度の相補性がある場合に、特異的にハイブリダイズできる。
【0085】
ある実施形態では、以下に限定しないが、例えばPCR、ハイブリダイゼーションなど用いて同定され伸張されたアンチセンス配列、配列番号6乃至12に記載される1以上の配列ほか、を含む膵臓発生遺伝子の標的化は、膵臓発生遺伝子の発現または機能を調節する。一実施形態において発現または機能は、対照と比較してアップレギュレートされる。他の好ましい実施形態において発現または機能は、対照と比較してダウンレギュレートされる。
【0086】
別の実施形態では、オリゴヌクレオチドは、PCR、ハイブリダイゼーションなどを使用して同定および増やされるアンチセンス配列を含む配列番号13乃至45に記載の核酸配列を含む。これらのオリゴヌクレオチドは、1つまたは複数の修飾されたヌクレオチド、より短いまたはより長い断片、修飾された結合などを含み得る。修飾された結合またはヌクレオチド間結合の例には、ホスホロチオエート、ホスホロジチオエートなどを含まれる。別の実施形態では、該ヌクレオチドは、リン誘導体を含む。本発明の修飾されたオリゴヌクレオチド中の糖部分または糖類似成分に結合できるリン誘導体(または修飾されたリン酸基)は、一リン酸塩、二リン酸塩、三リン酸塩、アルキルリン酸塩、アルカンリン酸塩、ホスホロチオエートなどであり得る。上に記載のリン酸類似体の調製およびそれらのヌクレオチド、修飾されたヌクレオチドおよびオリゴヌクレオチドへの組み込みそれ自体は、周知であり、本明細書で説明する必要はない。
【0087】
アンチセンスの特異性および感受性も、治療的使用のために当業者が利用する。アンチセンスオリゴヌクレオチドは、動物およびヒトでの病態の治療において治療用成分として使用されている。アンチセンスオリゴヌクレオチドは、安全にかつ効果的にヒトに投与されており、多数の臨床検査が現在進行中である。したがってオリゴヌクレオチドが、細胞、組織および動物、特にヒトの治療のための治療レジメンにおいて有用であるように構成され得る有用な治療方法であり得ることが確立されている。
【0088】
本発明の実施形態においてオリゴマーアンチセンス化合物、特にオリゴヌクレオチドは、標的核酸分子に結合し、標的遺伝子によってコードされる分子の発現および/または機能を調節する。干渉されるDNAの機能には、例えば複製および転写が含まれる。干渉されるRNAの機能には、例えばタンパク質翻訳部位へのRNAの転移、RNAからのタンパク質の翻訳、1以上のmRNA種を得るためのRNAのスプライシング、およびRNAが関与し得るまたはRNAによって促進され得る触媒活性などの全ての生体機能を含まれる。機能は、所望の機能に応じてアップレギュレートまたは抑制され得る。
【0089】
アンチセンス化合物は、アンチセンスオリゴマー化合物、アンチセンスオリゴヌクレオチド、外部ガイド配列(EGS)オリゴヌクレオチド、選択的スプライサー、プライマー、プローブおよび標的核酸の少なくとも一部分にハイブリダイズする他のオリゴマー化合物を含む。したがって、これらの化合物は1本鎖、2本鎖、部分的な1本鎖または環状オリゴマー化合物の形態に導入され得る。
【0090】
本発明の文脈においてアンチセンス化合物を特定の核酸分子に標的化することは、多段階プロセスであり得る。通常、このプロセスは、機能が調節される標的核酸の同定で始まる。この標的核酸は、例えばその発現が特定の障害もしくは病態に関連する細胞遺伝子(もしくは遺伝子から転写されたmRNA)または感染病原体由来の核酸分子であり得る。本発明において標的核酸は、膵臓発生遺伝子をコードする。
【0091】
通常、標的化プロセスは所望の効果、例えば発現の調節が得られるようなアンチセンス相互作用が生じる標的核酸中の少なくとも1つの標的領域、セグメントまたは部位の決定も含む。本発明の文脈において用語「領域」は、少なくとも1つの同定可能な構造、機能または特徴を有する標的核酸の一部分と定義される。標的核酸の領域内は、セグメントである。「セグメント」は、標的核酸内の領域のより小さな部分すなわちサブ部分と定義される。本発明において使用される「部位」は、標的核酸内の位置として定義される。
【0092】
一実施形態では、アンチセンスオリゴヌクレオチドは、膵臓発生遺伝子の天然アンチセンス配列に結合し、膵臓発生遺伝子(配列番号1乃至5)の発現および/または機能を調節する。アンチセンス配列の例は、配列番号6乃至45を含む。
【0093】
別の実施形態では、アンチセンスオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドの1以上のセグメントに結合し、膵臓発生遺伝子の発現および/または機能を調節する。セグメントは、膵臓発生遺伝子のセンスまたはアンチセンスポリヌクレオチドの少なくとも5個の連続するヌクレオチドを含む。
【0094】
別の実施形態では、アンチセンスオリゴヌクレオチドは、膵臓発生遺伝子の天然アンチセンス配列に特異的であり、該オリゴヌクレオチドの膵臓発生遺伝子の天然アンチセンス配列への結合は膵臓発生遺伝子の発現および/または機能を調節する。
【0095】
別の実施形態では、オリゴヌクレオチド化合物は配列番号13乃至45に記載の配列、例えばPCR、ハイブリダイゼーションなどを使用して同定および伸張されるアンチセンス配列を含む。これらのオリゴヌクレオチドは、1以上の修飾されたヌクレオチド、より短いまたはより長い断片、修飾された結合などを含み得る。修飾された結合またはヌクレオチド間結合の例には、ホスホロチオエート、ホスホロジチオエートなどを含む。他の実施形態においてヌクレオチドは、リン誘導体を含む。本発明の修飾されたオリゴヌクレオチド中の糖部分または糖類似成分に結合できるリン誘導体(または修飾されたリン酸基)は、一リン酸塩、二リン酸塩、三リン酸塩、アルキルリン酸塩、アルカンリン酸塩、ホスホロチオエートなどであり得る。上に記載のリン酸類似体の調製およびそれらのヌクレオチド、修飾されたヌクレオチドおよびオリゴヌクレオチドへの組み込みそれ自体は、周知であり、本明細書で説明する必要はない。
【0096】
当技術分野において周知であるとおり、翻訳開始コドンが典型的には5’−AUG(転写されたmRNA分子における場合;対応するDNA分子においては5’−ATG)であることから、翻訳開始コドンは、「AUGコドン」、「開始コドン」または「AUG開始コドン」とも称される。少数の遺伝子は、RNA配列5’−GUG、5’−UUGまたは5’−CUGを有する翻訳開始コドンを有し、5’−AUA、5’−ACGおよび5’−CUGは生体内において機能することが示されている。したがって用語「翻訳開始コドン」および「開始コドン」は、開始アミノ酸は各例において典型的にはメチオニン(真核生物において)またはホルミルメチオニン(原核生物において)であるが、多数のコドン配列を包含し得る。真核生物および原核生物の遺伝子は、2以上の選択的開始コドンを有し、そのいずれでも特定の細胞型または組織において、または特定の条件下で翻訳開始のために優先的に利用され得る。本発明の文脈において「開始コドン」および「翻訳開始コドン」は、そのようなコドンの配列にかかわらず膵臓発生遺伝子をコードする遺伝子から転写されたmRNAの翻訳を開始するために生体内で使用される1以上のコドンを意味する。遺伝子の翻訳終止コドン(または「終止コドン」)は、3つの配列、すなわち5’−UAA、5’−UAGおよび5’−UGA(対応するDNA配列は、それぞれ5’−TAA、5’−TAGおよび5’−TGAである)のうちの1つを有し得る。
【0097】
用語「開始コドン領域」および「翻訳開始コドン領域」は、翻訳開始コドンからいずれかの方向(すなわち5’または3’)での連続する約25から約50ヌクレオチドを包含するそのようなmRNAまたは遺伝子の一部分を指す。同様に、用語「終止コドン領域」および「翻訳終止コドン領域」は、翻訳終止コドンからいずれかの方向(すなわち5’または3’)での連続する約25から約50ヌクレオチドを包含するそのようなmRNAまたは遺伝子の一部分を指す。結局、「開始コドン領域」(または「翻訳開始コドン領域」)および「終止コドン領域」(または「翻訳終止コドン領域」)は、本発明のアンチセンス化合物で効果的に標的化され得る全ての領域である。
【0098】
当技術分野において翻訳開始コドンと翻訳終止コドンとの間の領域を意味することが周知のオープンリーディングフレーム(ORF)すなわち「コード領域」も、効果的に標的化され得る領域である。本発明の文脈において標的化された領域は、遺伝子のオープンリーディングフレーム(ORF)の翻訳開始または終止コドンを包含する遺伝子内領域である。
【0099】
他の標的領域は、当技術分野において翻訳開始コドンから5’方向にあるmRNAの一部分を意味することが周知の5’非翻訳領域(5’UTR)を含み、したがって5’キャップ部位とmRNA(または遺伝子上の対応するヌクレオチド)の翻訳開始コドンとの間のヌクレオチドを含む。さらに他の標的領域は、当技術分野において翻訳終止コドンから3’方向にあるmRNAの一部分を指すことが周知の3’非翻訳領域(3’UTR)を含み、したがって翻訳終止コドンとmRNA(または遺伝子上の対応するヌクレオチド)の3’末端との間のヌクレオチドを含む。mRNAの5’キャップ部位は、5’−5’トリリン酸結合を介してmRNAの最も5’側の残基に結合したN7−メチル化グアノシン残基を含む。mRNAの5’キャップ領域は、5’キャップ構造それ自体およびキャップ部位に隣接する最初の50ヌクレオチドを含むと考えられる。本発明の他の標的領域は、5’キャップ領域である。
【0100】
いくつかの真核生物mRNA転写物は、直接翻訳されるが、大部分は、それが翻訳される前に転写物から切除される「イントロン」として周知の1以上の領域を含む。残りの(したがって翻訳される)領域は「エクソン」として周知であり、連続的なmRNA配列を形成するように一緒にスプライスされる。一実施形態において標的スプライス部位、すなわちイントロン−エクソン接合部またはエクソン−イントロン接合部は、異常なスプライシングが疾患に関与するまたは特定のスプライス産物の過剰産生が疾患に関与する状況において特に有用である。再配置または欠失による異常な融合接合は、標的部位の他の実施形態である。異なる遺伝子源由来の2つ(またはそれ以上)のmRNAのスプライシングのプロセスを介して生成されたmRNA転写物は、「融合転写物」として周知である。イントロンは、例えばDNAまたはプレmRNAを標的化するアンチセンス化合物を使用して効果的に標的化され得る。
【0101】
別の実施形態では、アンチセンスオリゴヌクレオチドは、標的ポリヌクレオチドのコード領域および/または非コード領域に結合し、標的分子の発現および/または機能を調節する。
【0102】
別の実施形態では、アンチセンスオリゴヌクレオチドは、天然アンチセンスポリヌクレオチドに結合し、標的分子の発現および/または機能を調節する。
【0103】
別の実施形態では、アンチセンスオリゴヌクレオチドは、センスポリヌクレオチドに結合し、標的分子の発現および/または機能を調節する。
【0104】
選択的RNA転写物は、DNAの同じ遺伝子領域から生成され得る。これらの選択的転写物は、一般に「変異型」として周知である。より詳細には「プレmRNA変異型」は、同じゲノムDNAから生成される転写物であり、同じゲノムDNAから生成される他の転写物とはそれらの開始または終止位置のいずれかにおいて異なり、イントロンおよびエクソン配列の両方を含む。
【0105】
スプライシングでの1以上のエクソンもしくはイントロン領域またはそれらの一部分の切除において、プレmRNA変異型は、より小さな「mRNA変異型」を生成する。結果としてmRNA変異型は、プレmRNA変異型にプロセシングされ、それぞれ特有なプレmRNA変異型はスプライシングの結果として特有なmRNA変異型を常に生成する。これらのmRNA変異型は、「選択的スプライス変異型」としても周知である。プレmRNA変異型のスプライシングが生じない場合は、プレmRNA変異型はmRNA変異型と同一である。
【0106】
変異型は、転写を開始するまたは終止するための選択的シグナルの使用を通じても生成され得る。プレmRNAおよびmRNAは、2以上の開始コドンまたは終止コドンを有し得る。選択的開始コドンを使用するプレmRNAまたはmRNA由来の変異型は、プレmRNAまたはmRNAの「選択的開始変異型」として周知である。選択的終止コドンを使用するこれらの転写物は、プレmRNAまたはmRNAの「選択的終止変異型」として周知である。選択的終止変異型の特定の1種類は、機械的な転写による「ポリA終止シグナル」のうちの1つの代替選択から生じる、多数の転写物が生成される「ポリA変異型」であり、それにより特有なポリA部位で終結する転写物が生成される。本発明の文脈において、本明細書に記載される種類の変異型も標的核酸の実施形態である。
【0107】
アンチセンス化合物がハイブリダイズする標的核酸上の位置は、活性アンチセンス化合物が標的化される標的領域の少なくとも5ヌクレオチド長の部分として定義される。
【0108】
特定の典型的な標的セグメントの特定の配列が本明細書に記載されているが、当業者はこれらが本発明の範囲内の具体的実施形態を例示し説明するために利用できることを理解されよう。追加の標的セグメントは、本開示を考慮して当業者によって容易に特定される。
【0109】
例示的な標的セグメント内から選択された少なくとも5つ(5個)の連続的ヌクレオチド範囲を含む長さ5〜100ヌクレオチドの標的セグメントは、同様に標的化に適すると考えられる。
【0110】
標的セグメントは、例示的な標的セグメントの1つの5’末端由来の少なくとも5個の連続するヌクレオチドを含むDNAまたはRNA配列を含み得る(残りのヌクレオチドは、標的セグメントの5’末端のすぐ上流から始まり、DNAまたはRNAが約5〜約100ヌクレオチドを含むまで続く同じDNAまたはRNAの連続的範囲である)。同様に標的セグメントは、例示的な標的セグメントの1つの3’末端由来の少なくとも5個の連続するヌクレオチドを含むDNAまたはRNA配列によって表される(残りのヌクレオチドは、標的セグメントの3’末端のすぐ下流から始まり、DNAまたはRNAが約5〜約100ヌクレオチドを含むまで続く同じDNAまたはRNAの連続的範囲である)。本明細書において例示される標的セグメントを用いる当業者は、過度の実験を行うことなくさらなる標的セグメントを特定できよう。
【0111】
一旦1以上の標的領域、セグメントまたは部位が特定されると、所望の効果を得るために標的に十分に相補的である、すなわち十分にハイブリダイズし、かつ十分な特異性を有するアンチセンス化合物が選択される。
【0112】
本発明の実施形態において、オリゴヌクレオチドは、特定の標的のアンチセンス鎖に結合する。オリゴヌクレオチドは、長さ少なくとも5ヌクレオチドであり、各オリゴヌクレオチドが重複する配列を標的化するように合成することができ、したがってオリゴヌクレオチドは標的ポリヌクレオチドの長さ全体に及ぶように合成される。標的はコード領域および非コード領域も含む。
【0113】
一実施形態において、アンチセンスオリゴヌクレオチドによって特定の核酸を標的化する。特定の核酸に対するアンチセンス化合物の標的化は、多段階プロセスである。通常、このプロセスは、その機能が調節される核酸配列の同定で始まる。これは、例えばその発現が特定の障害もしくは病態に関連する細胞遺伝子(もしくは遺伝子から転写されるmRNA)または例えば非翻訳RNA(ncRNA)などの非翻訳ポリヌクレオチドであり得る。
【0114】
RNAは、(1)タンパク質に翻訳されるメッセンジャーRNA(mRNA)、および(2)非タンパク質コードRNA(ncRNA)に分類され得る。ncRNAはマイクロRNA、アンチセンス転写物および高密度の終止コドンを含んでおり、いかなる「オープンリーディングフレーム」も欠いている他の転写単位(TU)を含む。多くのncRNAは、タンパク質コード遺伝子座の3’非翻訳領域(3’UTR)中の開始部位から始まると考えられる。ncRNAはまれにしかなく、FANTOMコンソーシアムによって配列決定されているncRNAの少なくとも半分はポリアデニル化されていないと考えられている。明らかな理由により大部分の研究者は、プロセシングされ、細胞質に排出されるポリアデニル化されたmRNAに注目している。近年、一連のポリアデニル化されていない核内RNAが非常に多い場合があり、そのような転写物の多くが遺伝子間領域から生じることが示された。ncRNAが遺伝子発現を制御し得る機構は、標的転写物との塩基対形成によるものである。塩基対形成によって機能するRNAは、(1)作用するRNAと同じ遺伝子座だが反対の鎖上にコードされ、したがってそれらの標的に対して完全な相補性を示すシスコードの(cis−encoded)RNA、および(2)作用するRNAとは異なる染色体上の位置にコードされ、一般にそれらの標的と完全な塩基対形成可能性を示さないトランスコードの(trans−encoded)RNAに分類され得る。
【0115】
理論による束縛を意図しないが、本明細書に記載のアンチセンスオリゴヌクレオチドによるアンチセンスポリヌクレオチドの変化は、対応するセンスメッセンジャーRNAの発現を変化させ得る。しかしこの制御は、不調和性(アンチセンスノックダウンがセンスメッセンジャーRNAの増加を生じる)または調和性(アンチセンスノックダウンが付随するセンスメッセンジャーRNAの減少を生じる)のいずれであっても良い。これらの場合、アンチセンスオリゴヌクレオチドは、アンチセンス鎖の重複したまたは重複していない部分に標的化され得、そのノックダウンまたは隔離を生じる。コードおよび非コードアンチセンスは、同一の手段で標的化でき、どちらの分類も対応するセンス転写物を、調和性または不調和性の手段のいずれかで制御できる。標的に対する使用のための新規オリゴヌクレオチドを同定することに使用される戦略は、アンチセンスオリゴヌクレオチドによるアンチセンスRNA転写物のノックダウンまたは所望の標的を調節するための任意の他の手段に基づき得る。
【0116】
戦略1:不調和性調節の場合、アンチセンス転写のノックダウンが、通常の(センス)遺伝子の発現を増加させる。後者の遺伝子が周知のまたは推定上の薬物標的をコードする場合は、そのアンチセンス対応物のノックダウンは受容体アゴニストまたは酵素刺激物質の作用をおそらく模倣し得よう。
【0117】
戦略2:調和性調節の場合、アンチセンスおよびセンス転写物の両方を同時にノックダウンすることができ、従って通常の(センス)遺伝子発現の相乗的低減を達成する。例えばアンチセンスオリゴヌクレオチドがノックダウンを達成するために使用される場合、この戦略は、センス転写物に標的化された1つのアンチセンスオリゴヌクレオチドと対応するアンチセンス転写物に対する他のアンチセンスオリゴヌクレオチドとに、または重複しているセンスおよびアンチセンス転写物を同時に標的化する単一のエネルギー的に対称なアンチセンスオリゴヌクレオチドに適用するために使用することができる。
【0118】
本発明によれば、アンチセンス化合物は、アンチセンスオリゴヌクレオチド、リボザイム、外部ガイド配列(EGS)オリゴヌクレオチド、siRNA化合物、siRNA化合物などの1本鎖または2本鎖RNA干渉(RNAi)化合物、および標的核酸の少なくとも一部分にハイブリダイズし、その機能を調節する他のオリゴマー化合物を含む。したがってそれらはDNA、RNA、DNA様、RNA様、もしくはそれらの混合物であり得る、またはこれらの1つまたは複数の模倣物であり得る。これらの化合物は、1本鎖、2本鎖、環状またはヘアピンオリゴマー化合物であって良く、内部もしくは末端の膨隆部、ミスマッチまたはループなどの構造要素を含み得る。アンチセンス化合物は、通常は直鎖状に調製されるが、環状および/または分枝状に結合されるかまたはそうでなければ調製され得る。アンチセンス化合物は、例えば全体的もしくは部分的な2本鎖化合物を形成するようにハイブリダイズした2本の鎖、または全体的もしくは部分的な2本鎖化合物のハイブリダイゼーションおよび形成を可能にするために十分な自己相補性を有する1本鎖などの構築物を含み得る。2本鎖は、遊離の3’もしくは5’末端を残すように内部で結合され得るか、または連続的ヘアピン構造もしくはループを形成するように結合され得る。ヘアピン構造は、5’または3’末端のいずれかにオーバーハングを含み得、1本鎖形質の伸長を生じる。場合により2本鎖化合物は、両末端にオーバーハングを含み得る。さらなる修飾は、末端のうちの1つ、選択されたヌクレオチド位置、糖位置またはヌクレオチド間結合のうちの1つに結合した複合基を含み得る。あるいは、本鎖は、非核酸成分またはリンカー基を介して連結され得る。1本だけの鎖から形成される場合dsRNAは、2重鎖を形成するためにそれ自体の上に折りたたまれる自己相補性ヘアピン型分子の形態を取り得る。したがってdsRNAは、完全にまたは部分的に2本鎖であり得る。遺伝子発現の特異的な調節は、遺伝子導入細胞系におけるdsRNAヘアピンの安定な発現によって達成され得るが、いくつかの実施形態においては、遺伝子の発現または機能は、アップレギュレートされる。2本鎖、または2重鎖を形成するためにそれ自体の上に折りたたまれる自己相補性ヘアピン型分子の形態を取る1本鎖から形成される場合、2本鎖(または1本鎖の2重鎖形成領域)は、ワトソン−クリック型と同様に塩基対形成する相補的RNA鎖である。
【0119】
一旦系に導入されると本発明の化合物は、標的核酸の切断もしくは他の修飾に影響する1種以上の酵素もしくは構造タンパク質の作用を誘発できる、または占有に基づく機構を介して作用できる。一般に核酸(オリゴヌクレオチドを含む)は、「DNA様」(すなわち一般に1つまたは複数の2’−デオキシ糖を有し、一般にU塩基よりもT塩基を有する)または「RNA様」(すなわち一般に1つまたは複数の2’−ヒドロキシ糖または2’−修飾糖を有し、一般にT塩基よりもU塩基を有する)と記載され得る。核酸ヘリックスは、1つより多い種類の構造を、最も通例ではA−形態およびB−形態をとり得る。一般にB−形態様構造を有するオリゴヌクレオチドは「DNA様」であり、A−形態様構造を有するものは「RNA様」であると考えられる。いくつかの(キメラ)実施形態においてアンチセンス化合物は、A−およびB−形態領域の両方を含み得る。
【0120】
別の実施形態では、所望のオリゴヌクレオチドまたはアンチセンス化合物は、アンチセンスRNA、アンチセンスDNA、キメラアンチセンスオリゴヌクレオチド;修飾された結合を含むアンチセンスオリゴヌクレオチド;干渉RNA(RNAi)、低分子干渉RNA(siRNA);マイクロ干渉RNA(miRNA);低分子一過的RNA(stRNA);または低分子ヘアピンRNA(shRNA);低分子RNA誘導遺伝子活性化(RNAa);低分子活性化RNA(saRNA)またはこれらの組み合わせのうちの少なくとも1つを含む。
【0121】
dsRNAは、遺伝子発現、「低分子RNA誘導遺伝子活性化」またはRNAaと称されている機構も活性化できる。遺伝子プロモーターを標的化するdsRNAは、関連する遺伝子の強力な転写活性化を誘導する。RNAaは、合成dsRNAを使用してヒト細胞において実証され、「低分子活性化RNA」(saRNA)と称された。
【0122】
低分子干渉RNA(siRNA)およびマイクロRNA(miRNA)などの低分子2本鎖RNA(dsRNA)は、RNA干渉(RNAi)として周知の進化的に保存された機構のトリガであることが見出されている。RNAiは、遺伝子発現抑制を導く。しかし、下の実施例の節において詳細に記載される例においては、オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドおよびそれにコードされる産物の発現および/または機能を増加させることが示されている。dsRNAは低分子活性化RNA(saRNA)としても作用できる。理論に束縛されることなく、遺伝子プロモーター中の配列を標的化することによって、saRNAはdsRNA誘発転写活性化(RNAa)と称される現象において標的遺伝子発現を誘導する。
【0123】
さらなる実施形態において、本明細書において同定する「標的セグメント」は、膵臓発生遺伝子ポリヌクレオチドの発現を調節する追加的化合物の選別において使用され得る。「調節物質」は、膵臓発生遺伝子をコードする核酸分子の発現を減少または増加させ、標的セグメントに相補的である少なくとも5個のヌクレオチド部分を含む化合物である。選別方法は、膵臓発生遺伝子のセンスまたは天然アンチセンスポリヌクレオチドをコードする核酸分子の標的セグメントを1つまたは複数の候補調節物質に接触させるステップ、および膵臓発生遺伝子ポリヌクレオチド、例えば配列番号13乃至45をコードする核酸分子の発現を減少または増加させる1つまたは複数の候補修飾物質を選択するステップを含む。1以上の候補調節物質が、膵臓発生遺伝子ポリヌクレオチドをコードする核酸分子の発現を調節できる(例えば減少させるまたは増加させる)ことが一度示されれば、次いで調節物質は、膵臓発生遺伝子ポリヌクレオチドの機能のさらなる調査研究において、または本発明による研究、診断もしくは治療剤としての使用のために使用され得る。
【0124】
天然アンチセンス配列のターゲッティングは、標的遺伝子の機能を調節する。例えば、膵臓発生遺伝子(例えば受託番号NM_001025366、NM_001146274、NM_001048、NM_000346、NM_022454、NM_000340、NM_014276、NM_005349、NM_004160、NM_178161、NM_002722、NM_000307、NM_000209、NM_002585、NM_000280、NM_006193、NM_004498、NM_018055、NM_006168、NM_002509、NM_020999、NM_002500、NM_004535、NM_002467、NM_001165255、NM_031944、NM_005461、NM_201589、NM_002276、NM_145805、NM_002202、NM_002196、NM_000207、NM_001185097、NM_001185098、NM_000207、NM_001185097、NM_001185098、NM_002193、NM_000457.3、NM_000458.2、NM_002729.4、NM_005524、NM_001134941、NM_005811、NM_002054、NM_005257、NM_002052、NM_006350、NM_021784、NM_004496、NM_002006、NM_004465、NM_001868、NM_139058、NM_001008221、NM_001106、NM_001616)の機能を調節する。ある実施形態において、標的は、膵臓発生遺伝子のアンチセンスポリヌクレオチドである。ある実施形態において、アンチセンスオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチド(受託番号NM_001025366、NM_001146274、NM_001048、NM_000346、NM_022454、NM_000340、NM_014276、NM_005349、NM_004160、NM_178161、NM_002722、NM_000307、NM_000209、NM_002585、NM_000280、NM_006193、NM_004498、NM_018055、NM_006168、NM_002509、NM_020999、NM_002500、NM_004535、NM_002467、NM_001165255、NM_031944、NM_005461、NM_201589、NM_002276、NM_145805、NM_002202、NM_002196、NM_000207、NM_001185097、NM_001185098、NM_000207、NM_001185097、NM_001185098、NM_002193、NM_000457.3、NM_000458.2、NM_002729.4、NM_005524、NM_001134941、NM_005811、NM_002054、NM_005257、NM_002052、NM_006350、NM_021784、NM_004496、NM_002006、NM_004465、NM_001868、NM_139058、NM_001008221、NM_001106、NM_001616)のセンスおよび/または天然アンチセンス配列、変異型、アレル、アイソフォーム、ホモログ、突然変異体、誘導体、断片およびそれらの相補配列を標的化する。好ましくはオリゴヌクレオチドは、アンチセンス分子であり、標的はアンチセンスおよび/またはセンス膵臓発生遺伝子ポリヌクレオチドのコード領域および非コード領域を含む。
【0125】
本発明の標的セグメントは、本発明のそれぞれの相補的アンチセンス化合物と安定化された2本鎖(2重鎖)オリゴヌクレオチドを形成するように組み合わされ得る。
【0126】
そのような2本鎖オリゴヌクレオチド成分は、当技術分野において標的発現を調節し、アンチセンス機構を介して翻訳およびRNAプロセシングを制御すると示されている。さらに2本鎖成分は化学修飾に供され得る。例えばその様な2本鎖成分は、2重鎖アンチセンス鎖の標的への古典的ハイブリダイゼーションによって標的を抑制することが示されており、それにより標的の酵素的分解のトリガとなる。
【0127】
ある実施形態では、アンチセンスオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチド(例えば受託番号NM_001025366、NM_001146274、NM_001048、NM_000346、NM_022454、NM_000340、NM_014276、NM_005349、NM_004160、NM_178161、NM_002722、NM_000307、NM_000209、NM_002585、NM_000280、NM_006193、NM_004498、NM_018055、NM_006168、NM_002509、NM_020999、NM_002500、NM_004535、NM_002467、NM_001165255、NM_031944、NM_005461、NM_201589、NM_002276、NM_145805、NM_002202、NM_002196、NM_000207、NM_001185097、NM_001185098、NM_000207、NM_001185097、NM_001185098、NM_002193、NM_000457.3、NM_000458.2、NM_002729.4、NM_005524、NM_001134941、NM_005811、NM_002054、NM_005257、NM_002052、NM_006350、NM_021784、NM_004496、NM_002006、NM_004465、NM_001868、NM_139058、NM_001008221、NM_001106、NM_001616)、変異型、アレル、アイソフォーム、ホモログ、突然変異体、誘導体、断片およびそれらの相補配列を標的化する。好ましくはオリゴヌクレオチドはアンチセンス分子である。
【0128】
本発明の実施形態によれば、標的核酸分子は、膵臓発生遺伝子だけに限定されず、任意のアイソフォーム、受容体、ホモログおよび膵臓発生遺伝子分子に及ぶ。
【0129】
他の実施形態では、該オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドの天然アンチセンス配列、例えば配列番号6乃至12に記載のポリヌクレオチドおよび任意の変異型、アレル、ホモログ、突然変異体、誘導体、断片およびそれらの相補配列を標的化する。アンチセンスオリゴヌクレオチドの例は、配列番号13乃至45として記載されている。
【0130】
一実施形態では、該オリゴヌクレオチドは、これに限定しないが膵臓発生遺伝子ポリヌクレオチドに関連する非コードセンス配列および/またはアンチセンス配列が含まれる、膵臓発生遺伝子アンチセンスの核酸配列に相補的であるかまたは結合し、膵臓発生遺伝子分子の発現および/または機能を調節する。
【0131】
他の実施形態では、該オリゴヌクレオチドは、配列番号6乃至12に記載の膵臓発生遺伝子天然アンチセンスの核酸配列に相補的であるかまたは結合し、膵臓発生遺伝子分子の発現および/または機能を調節する。
【0132】
ある実施形態では、オリゴヌクレオチドは、配列番号13乃至45の少なくとも5個の連続する核酸塩基の配列を含み、膵臓発生遺伝子分子の発現および/または機能を調節する。
【0133】
ポリヌクレオチド標的は、そのファミリーメンバーを含めた膵臓発生遺伝子、膵臓発生遺伝子の変異型;SNPを含む膵臓発生遺伝子の突然変異体;膵臓発生遺伝子の非コード配列;膵臓発生遺伝子のアレル;種の変異型、断片などを含む。好ましくはオリゴヌクレオチドはアンチセンス分子である。
【0134】
他の実施形態では、膵臓発生遺伝子ポリヌクレオチドを標的化するオリゴヌクレオチドは、アンチセンスRNA、干渉RNA(RNAi)、低分子干渉RNA(siRNA);マイクロ干渉RNA(miRNA);低分子一過的RNA(stRNA);または短いヘアピンRNA(shRNA);低分子RNA誘導遺伝子活性化(RNAa);または低分子活性化RNA(saRNA)を含む。
【0135】
他の実施形態では、膵臓発生遺伝子ポリヌクレオチド、例えば配列番号6乃至12の標的化は、これらの標的の発現または機能を調節する。一実施形態において発現または機能は対照と比較してアップレギュレートされる。他の実施形態において、発現または機能は対照と比較してダウンレギュレートされる。
【0136】
他の実施形態では、アンチセンス化合物は、配列番号13乃至45に記載の配列を含む。これらのオリゴヌクレオチドは、1以上の修飾された核酸塩基、より短いまたはより長い断片、修飾された結合などを含み得る。
【0137】
他の実施形態では、配列番号13乃至45は、1つまたは複数のLNAヌクレオチドを含む。
【0138】
所望の標的核酸の調節は、当技術分野において周知のいくつかの方法において実施され得る。例えばアンチセンスオリゴヌクレオチド、siRNAなど。酵素的核酸分子(例えばリボザイム)は、ヌクレオチド塩基配列に特異的な方式で他の別々の核酸分子を繰り返し切断する能力を含む種々の反応の1以上を触媒できる核酸分子である。そのような酵素的核酸分子は、例えば実質的にいかなるRNA転写物を標的化するのにも使用され得る。
【0139】
それらの配列特異性により、トランス切断酵素的核酸分子は、ヒト疾患に対する治療剤としての有望さを示す。酵素的核酸分子は、細胞性RNA背景中で特定のRNA標的を切断するために設計され得る。そのような切断事象はmRNAを非機能的にし、かつそのRNAからのタンパク質発現を抑止する。このようにして、病態に関連するタンパク質の合成は選択的に抑制され得る。
【0140】
通常、RNA切断活性を有する酵素的核酸は、最初に標的RNAに結合することによって作用する。そのような結合は、標的RNAを切断するために作用する分子の酵素的部分に近接に保持される酵素的核酸の標的結合部分を通じて生じる。したがって酵素的核酸分子は、最初に標的RNAを認識し、次いで相補的塩基対形成を通じて結合し、一旦正確な部位に結合すると標的RNAを切断するために酵素的に作用する。そのような標的RNAの戦略的切断は、コードされているタンパク質の合成を方向付けるその能力を破壊する。酵素的核酸がそのRNA標的に結合および切断した後、それはRNAから解離し、別の標的を探して反復して新たな標的に結合し、切断できる。
【0141】
体外選択(進化的)戦略などのいくつかの手法が、ホスホジエステル結合およびアミド結合の切断および連結などの種々の反応を触媒できる新規核酸触媒を発展させるために使用されている。
【0142】
触媒活性のために最適なリボザイムの開発は、遺伝子発現制御の目的のためにRNA切断リボザイムを使用するいかなる戦略にも顕著に貢献する。例えばハンマーヘッド型リボザイムは、飽和(10mM)濃度のMg2+補助因子の存在下で触媒速度(kcat)約1分−1で機能する。人工的「RNAリガーゼ」リボザイムは、対応する自己修飾反応を約100分−1の速度で触媒することが示されている。加えてDNAから作られた基質結合腕を有するある種の修飾されたハンマーヘッド型リボザイムは、約100分−1に近い多重代謝回転速度でRNA切断を触媒することが周知である。最後にハンマーヘッドの触媒コア中の特定の残基の特定のヌクレオチド類似体での置換は、触媒速度に10倍程度の改善を示す修飾されたリボザイムをもたらす。これらの発見は、リボザイムが、ほとんどの天然の自己切断リボザイムによって体外で示されるものより顕著に大きな触媒速度での化学的形質転換を促進できることを示す。それにより、ある種の自己切断リボザイムの構造は、最大の触媒活性をもたらすように最適化され得る、またはRNAホスホジエステル切断について顕著に早い速度を示す完全に新規のRNAモチーフが作製され得ることが可能である。
【0143】
「ハンマーヘッド」モデルにあてはまるRNA触媒によるRNA基質の分子間切断は、1987年に最初に示された。RNA触媒は、回収され、複数のRNA分子と反応し、それが真に触媒作用的であることを示した。
【0144】
「ハンマーヘッド」モチーフに基づいて設計された触媒RNAは、標的配列に必要な塩基対形成を維持するために触媒RNA中に適切な塩基変更を作製することによって特定の標的配列を切断するために使用されている。これは、特定の標的配列を切断するための触媒RNAの使用を可能にし、「ハンマーヘッド」モデルによって設計された触媒RNAが生体内で特定の基質RNAを切断できる可能性があることを示している。
【0145】
RNA干渉(RNAi)は、哺乳動物および哺乳動物細胞における遺伝子発現を調節するための強力な手段になっている。この手法は、発現プラスミドまたはウイルスおよび、siRNAにプロセシングされる低分子ヘアピンRNAのコード配列を使用するRNAそれ自体としてまたはDNAとしてのいずれかでの低分子干渉RNA(siRNA)の送達を必要とする。この系は、プレsiRNAのそれらが活性である細胞質への効率的な輸送を可能にし、遺伝子発現のために制御された組織特異的なプロモーターの使用を可能にする。
【0146】
一実施形態では、オリゴヌクレオチドまたはアンチセンス化合物は、リボ核酸(RNA)および/もしくはデオキシリボ核酸(DNA)のオリゴマーもしくはポリマーまたはそれらの模倣物、キメラ、アナログもしくはホモログを含む。この用語は、天然に存在するヌクレオチド、糖およびヌクレオチド間(骨格)共有結合ならびに同様に機能する天然に存在しない部分を含むオリゴヌクレオチドからなるオリゴヌクレオチドを含む。そのような修飾されたまたは置換されたオリゴヌクレオチドは、例えば細胞への増強された取り込み、標的核酸に対する増強された親和性およびヌクレアーゼの存在下での増大した安定性などの望ましい特性からしばしば天然形態よりも望ましい。
【0147】
本発明により、オリゴヌクレオチドまたは「アンチセンス化合物」は、アンチセンスオリゴヌクレオチド(例えばRNA、DNA、それらの模倣物、キメラ、アナログまたはホモログ)、リボザイム、外部ガイド配列(EGS)オリゴヌクレオチド、siRNA化合物、siRNA化合物などの1本鎖または2本鎖RNA干渉(RNAi)化合物、saRNA、aRNAおよび標的核酸の少なくとも一部分にハイブリダイズしその機能を調節する他のオリゴマー化合物を含む。そのようにそれらは、DNA、RNA、DNA様、RNA様もしくはそれらの混合物であり得るか、またはこれらの1つまたは複数の模倣物でありえる。これらの化合物は、1本鎖、2本鎖、環状またはヘアピンオリゴマー化合物であることができ、内部もしくは末端の膨隆部、ミスマッチまたはループなどの構造要素を含み得る。アンチセンス化合物は、通常は直鎖状に調製されるが、環状および/または分枝状に結合されるかまたはそうでなければ調製され得る。アンチセンス化合物は、例えば全体的もしくは部分的な2本鎖化合物を形成するようにハイブリダイズした2本の鎖、または全体的もしくは部分的な2本鎖化合物のハイブリダイゼーションおよび形成を可能にするために十分な自己相補性を有する1本鎖などの構築物を含み得る。2本の鎖は、遊離の3’もしくは5’末端を残すように内部で結合され得るか、または連続的ヘアピン構造もしくはループを形成するように結合され得る。ヘアピン構造は、1本鎖形質の伸長を生じさせるために5’または3’末端のいずれかにオーバーハングを含有できる。場合により2本鎖化合物は、両末端にオーバーハングを含み得る。さらなる修飾は、末端のうちの1つ、選択されたヌクレオチド位置、糖位置またはヌクレオチド間結合のうちの1つに結合した複合基を含み得る。代替として2本の鎖は、非核酸成分またはリンカー基を介して結合できる。1本鎖だけから形成される場合dsRNAは、2重鎖を形成するためにそれ自体の上に折りたたまれる自己相補性ヘアピン型分子の形態を取り得る。したがってdsRNAは、完全にまたは部分的に2本鎖であり得る。遺伝子発現の特異的な調節は、遺伝子導入細胞系におけるdsRNAヘアピンの安定な発現によって達成され得る。2本鎖、または2重鎖を形成するためにそれ自体の上に折りたたまれる自己相補性ヘアピン型分子の形態をとる1本鎖から形成される場合、2本鎖(または1本鎖の2重鎖形成領域)は、ワトソン−クリック型の形で塩基対形成する自己相補的RNA鎖である。
【0148】
一旦系に導入されると本発明の化合物は、標的核酸の切断もしくは他の修飾をもたらす1種以上の酵素もしくは構造タンパク質の作用を誘発できる、または占有に基づく機構を介して作用できる。一般に核酸(オリゴヌクレオチドを含む)は、「DNA様」(すなわち一般に1以上の2’−デオキシ糖を有し、一般にU塩基よりもT塩基を有する)または「RNA様」(すなわち一般に1つまたは複数の2’−ヒドロキシ糖または2’−修飾糖を有し、一般にT塩基よりもU塩基を有する)と記載され得る。核酸ヘリックスは、2種以上の構造を、最も通例ではA−形態およびB−形態をとり得る。一般にB−形態様構造を有するオリゴヌクレオチドは「DNA様」であると、A−形態様構造を有するものは「RNA様」であると考えられる。いくつかの(キメラ)実施形態においてアンチセンス化合物は、A−およびB−形態領域の両方を含み得る。
【0149】
本発明によるアンチセンス化合物は、長さ約5〜約80ヌクレオチド(すなわち約5〜約80個連結したヌクレオシド)由来のアンチセンス部分を含み得る。これは、アンチセンス化合物のアンチセンス鎖または一部分の長さを意味する。言い換えると、本発明の1本鎖アンチセンス化合物は、5〜約80個のヌクレオチドを含み、本発明の2本鎖アンチセンス化合物(例えばdsRNAなど)は、長さ5〜約80ヌクレオチドのセンスおよびアンチセンス鎖または一部分を含む。当業者であれば、これが長さ5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、または80ヌクレオチドまたはこれらの範囲内の任意の長さのアンチセンス部分を内包することを理解されよう。
【0150】
一実施形態において本発明のアンチセンス化合物は、長さ10〜50ヌクレオチドのアンチセンス部分を有する。当業者であれば、これが長さ10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、または50ヌクレオチドまたはこれらの範囲内の任意の長さのアンチセンス部分を有するオリゴヌクレオチドを具体化することを理解されよう。いくつかの実施形態において、オリゴヌクレオチドは長さ15ヌクレオチドである。
【0151】
一実施形態において、本発明のアンチセンスまたはオリゴヌクレオチド化合物は、長さ12または13〜30ヌクレオチドのアンチセンス部分を有する。当業者であれば、これが長さ12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29もしくは30ヌクレオチドまたはこれらの範囲内の任意の長さのアンチセンス部分を有するアンチセンス化合物を具体化することを理解されよう。
【0152】
他の実施形態において、本発明のオリゴマー化合物は、化合物中の1以上のヌクレオチド位置に異なる塩基が存在する変異型も含む。例えば、最初のヌクレオチドがアデノシンである場合、この位置にチミジン、グアノシンまたはシチジンを含有する変異型が生成され得る。これは、アンチセンスまたはdsRNA化合物の任意の位置においてなされ得る。次いでこれらの化合物は、標的核酸の発現を抑制するそれらの能力を測定するために本明細書に記載の方法を使用して検査される。
【0153】
いくつかの実施形態において、アンチセンス化合物と標的との間の相同性、配列同一性または相補性は、約40%〜約60%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約60%〜約70%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約70%〜約80%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約80%〜約90%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約90%、約92%、約94%、約95%、約96%、約97%、約98%、約99%または約100%である。
【0154】
他の実施形態において、例えば配列番号6乃至45に記載の核酸分子などのアンチセンスオリゴヌクレオチドは、1以上の置換または修飾を含む。一実施形態においてヌクレオチドはロックト核酸(LNA)で置換される。
【0155】
他の実施形態において、オリゴヌクレオチドは、膵臓発生遺伝子に関連するコードおよび/または非コード配列ならびに配列番号1乃至12として記載の配列の、核酸分子センスおよび/またはアンチセンスの1以上の領域を標的化する。オリゴヌクレオチドは、配列番号1乃至12の重複領域にも標的化される。
【0156】
本発明の特定のオリゴヌクレオチドは、キメラオリゴヌクレオチドである。本発明の文脈において「キメラオリゴヌクレオチド」または「キメラ」は、それぞれ少なくとも1つのヌクレオチドからなる2つ以上の化学的に異なる領域を含むオリゴヌクレオチドである。これらのオリゴヌクレオチドは、1種以上の有益な特性(例えばヌクレアーゼ耐性の増大、細胞への取り込みの増大、標的に対する結合親和性の増大など)を付与する修飾されたヌクレオチドの少なくとも1つの領域、およびRNA:DNAまたはRNA:RNAハイブリッドを切断できる酵素の基質である領域を典型的には含む。例として、RNaseHは、RNA:DNA 2重鎖のRNA鎖を切断する細胞性エンドヌクレアーゼである。したがってRNase Hの活性化は、RNA標的の切断を生じ、それにより遺伝子発現のアンチセンス調節の効率を非常に増強する。結果としてキメラオリゴヌクレオチドが使用される場合、同じ標的領域にハイブリダイズするホスホロチオエートデオキシオリゴヌクレオチドと比較して低分子オリゴヌクレオチドで同程度の結果がしばしば得られる。RNA標的の切断は、ゲル電気泳動および必要に応じて当技術分野において周知の関連する核酸ハイブリダイゼーション技術によって通常通りに検出できる。一実施形態において、キメラオリゴヌクレオチドは、標的結合親和性を増大させる少なくとも1つの領域、およびRNase Hの基質として作用する領域を通常含む。オリゴヌクレオチドのその標的(この場合、rasをコードする核酸)に対する親和性は、オリゴヌクレオチド/標的対のTm(オリゴヌクレオチドと標的とが解離する温度であり、解離は分光光度的に検出される)を測定することによって通常通りに決定される。Tmが高くなるほど、標的に対するオリゴヌクレオチドの親和性は大きい。
【0157】
本発明のキメラアンチセンス化合物は、2つ以上のオリゴヌクレオチド、修飾されたオリゴヌクレオチド、上に記載のオリゴヌクレオシドおよび/またはオリゴヌクレオチド模倣物の複合構造として形成され得る。そのような化合物は、当技術分野においてハイブリッドまたはギャップマー(gapmer)とも称されている。そのようなハイブリッド構造の調製について記載した代表的な米国特許としては、以下に限定しないが、それぞれ参照により本明細書に組み込まれる米国特許第5,013,830号、第5,149,797号、第5,220,007号、第5,256,775号、第5,366,878号、第5,403,711号、第5,491,133号、第5,565,350号、第5,623,065号、第5,652,355号、第5,652,356号および第5,700,922号が挙げられる。
【0158】
他の実施形態では、修飾されたオリゴヌクレオチドの領域は、糖の2’位置で修飾された少なくとも1つのヌクレオチド、最も好ましくは2’−O−アルキル、2’−O−アルキル−O−アルキル、または2’フルオロ修飾ヌクレオチドを含む。他の実施形態においては、RNA修飾は、ピリミジン、脱塩基残基またはRNAの3’末端の反転塩基(inverted base)のリボース上の2’−フルオロ、2’−アミノおよび2’O−メチル修飾を含む。そのような修飾は、通常通りにオリゴヌクレオチドに組み込まれ、これらのオリゴヌクレオチドは、所与の標的に対して2’−デオキシオリゴヌクレオチドよりもより高いTm(すなわちより高い標的結合親和性)を有することが示されている。そのような増大した親和性の効果は、遺伝子発現のRNAiオリゴヌクレオチド抑制を非常に増強する。RNAse Hは、RNA:DNA 2重鎖のRNA鎖を切断する細胞性エンドヌクレアーゼであり、したがってこの酵素の活性化は、RNA標的の切断を生じ、それによりRNAi抑制の効率を非常に増強できる。RNA標的の切断は、ゲル電気泳動によって通常通り実証され得る。他の実施形態では、キメラオリゴヌクレオチドもヌクレアーゼ耐性を増強するべく修飾される。細胞は、核酸を分解できる種々のエキソ−およびエンド−ヌクレアーゼを含有する。多数のヌクレオチドおよびヌクレオシド修飾が、それが組み込まれるオリゴヌクレオチドを天然のオリゴヌクレオチドよりもヌクレアーゼ消化に対してより耐性にすることが示されている。ヌクレアーゼ耐性は、オリゴヌクレオチドを細胞抽出物または単離されたヌクレアーゼ溶液とインキュベートし、一定時間後に残っている未変化オリゴヌクレオチドの量を、通常は電気泳動によって、測定することにより通常通り測定される。ヌクレアーゼ耐性を増強するべく修飾されているオリゴヌクレオチドは、未修飾オリゴヌクレオチドよりも長時間未変化で残存する。種々のオリゴヌクレオチド修飾がヌクレアーゼ耐性を増強するまたは付与することが実証されている。現在のところ少なくとも1つのホスホロチオエート修飾を含有するオリゴヌクレオチドはより好ましい。いくつかの場合に標的結合親和性を増強するオリゴヌクレオチド修飾も、単独で、ヌクレアーゼ耐性を増強できる。いくつかの望ましい修飾は、De Mesmaekerら(1995)Acc.Chem.Res.,28:366−374に見出すことができる。
【0159】
本発明のために想定されるいくつかのオリゴヌクレオチドの具体的な例としては、修飾された骨格、例えばホスホロチオエート、リン酸トリエステル、メチルホスホネート、短鎖アルキルもしくはシクロアルキル糖部分間結合または短鎖ヘテロ原子もしくは複素環糖間結合を含むものが挙げられる。多くは、ホスホロチオエート骨格を有するオリゴヌクレオチドおよびヘテロ原子骨格、特にCH2−NH−O−CH2、CH、−N(CH3)−O−CH2[メチレン(メチルイミノ)またはMMI骨格として周知]、CH2−O−N(CH3)−CH2、CH2−N(CH3)−N(CH3)−CH2およびO−N(CH3)−CH2−CH2骨格、式中天然のホスホジエステル骨格はO−P−O−CHと表される)を有するものである。De Mesmaekerら(1995)Acc.Chem.Res.28:366−374)によって開示されたアミド骨格も挙げられる。同様に、モルホリノ骨格構造を有するオリゴヌクレオチドも挙げられる(SummertonおよびWeller、米国特許第5,034,506号)。他の実施形態において、ペプチド核酸(PNA)骨格、オリゴヌクレオチドのホスホジエステル骨格などは、ポリアミド骨格で置換され、ヌクレオチドは直接または間接的にポリアミド骨格のアザ窒素原子に結合される。オリゴヌクレオチドは、1以上の置換された糖部分も含み得る。オリゴヌクレオチドは、以下のもの:OH、SH、SCH3、F、OCN、OCH3OCH3、OCH3O(CH2)nCH3、O(CH2)nNH2またはO(CH2)nCH3(nは1〜約10);C1〜C10低級アルキル、アルコキシアルコキシ、置換された低級アルキル、アルカリルまたはアラルキル;Cl;Br;CN;CF3;OCF3;O−、S−、またはN−アルキル;O−、S−、またはN−アルケニル;SOCH3;SO2;CH3;ONO2;NO2;N3;NH2;ヘテロシクロアルキル;ヘテロシクロアルカリル;アミノアルキルアミノ;ポリアルキルアミノ;置換されたシリル;RNA切断基;レポーター基;干渉物質;オリゴヌクレオチドの薬物動態特性を改善する基;またはオリゴヌクレオチドの薬力学特性を改善する基および同様の特性を有する他の置換基のうちの1つを2’位置に含む。修飾は、2’−メトキシエトキシ[2’−O−CH2CH2OCH3、2’−O−(2−メトキシエチル)としても周知]を含む。他の修飾は2’−メトキシ(2’−O−CH3)、2’−プロポキシ(2’−OCH2CH2CH3)および2’−フルオロ(2’−F)を含む。同様に修飾は、オリゴヌクレオチドの他の位置、詳細には3’末端ヌクレオチドの糖の3’位および5’末端ヌクレオチドの5’位でも作製され得る。オリゴヌクレオチドは、ペントフラノシル基の代わりにシクロブチルなどの糖類似体も有し得る。
【0160】
オリゴヌクレオチドは、追加的または代替的に核酸塩基(当技術分野において単に「塩基」と称されることも多い)修飾または置換も含み得る。本明細書において使用される「未修飾」または「天然」ヌクレオチドは、アデニン(A)、グアニン(G)、チミン(T)、シトシン(C)およびウラシル(U)を含む。修飾されたヌクレオチドは、天然の核酸においてまれに、または一過的にだけ見出されるヌクレオチド、例えばヒポキサンチン、6−メチルアデニン、5−Meピリミジン、詳細には5−メチルシトシン(5−メチル−2’−デオキシシトシンとも称され、5−Me−Cとも当技術分野においてしばしば称される)、5−ヒドロキシメチルシトシン(HMC)、グリコシルHMCおよびゲントビオシルHMCならびに合成ヌクレオチド、例えば2−アミノアデニン、2−(メチルアミノ)アデニン、2−(イミダゾリルアルキル)アデニン、2−(アミノアルキルアミノ)アデニンまたは他のヘテロ置換アルキルアデニン、2−チオウラシル、2−チオチミン、5−ブロモウラシル、5−ヒドロキシメチルウラシル、8−アザグアニン、7−デアザグアニン、N6(6−アミノヘキシル)アデニンおよび2,6−ジアミノプリンを含む。当技術分野において周知の「ユニバーサル」塩基、例えばイノシン、も含まれ得る。5−Me−C置換は、核酸2重鎖の安定性を0.6〜1.2℃増大させることが示されており(Sanghvi,Y.S.,in Crooke,S.T.およびLebleu,B.,eds.,Antisense Research and Applications,CRC Press,Boca Raton,1993,pp.276−278)、現在用いられる塩基置換である。
【0161】
本発明のオリゴヌクレオチドの他の修飾は、オリゴヌクレオチドの活性または細胞への取り込みを増強する1以上の成分またはコンジュゲートのオリゴヌクレオチドへの化学的結合を含む。そのような成分として、以下に限定されないが、コレステロール成分、コレステリル成分、チオエーテル、例えばヘキシル−S−トリチルチオール、チオコレステロール、脂肪族鎖、例えばドデカンジオールまたはウンデシル残基、リン脂質、例えばジヘキサデシル−rac−グリセロールまたはトリエチル1,2−ジ−O−ヘキサデシル−racグリセロ−3−H−ホスホネート、ポリアミンまたはポリエチレングリコール鎖、あるいはアダマンタン酢酸などの脂質成分が含まれる。親油性成分を含むオリゴヌクレオチドおよびそのようなオリゴヌクレオチドを調製する方法は、当技術分野、例えば米国特許第5,138,045号、第5,218,105号および第5,459,255号において公知である。
【0162】
所与のオリゴヌクレオチドにおけるすべての位置が一律に修飾される必要はなく、実際に前述の修飾のうちの2種以上が単一のオリゴヌクレオチド中に、またはオリゴヌクレオチド中の単一のヌクレオシド中にさえも組み込まれ得る。本発明は、本明細書中以前に定義したキメラオリゴヌクレオチドであるオリゴヌクレオチドも含む。
【0163】
他の実施形態において本発明の核酸分子は、限定されないが脱塩基ヌクレオチド、ポリエーテル、ポリアミン、ポリアミド、ペプチド、炭水化物、脂質またはポリ炭化水素化合物を含む他の成分と結合される。当業者であれば、これらの分子が、糖、塩基またはリン酸基のいくつかの位置に核酸分子を含む1以上の任意のヌクレオチドに連結され得ることを理解されよう。
【0164】
本発明により使用されるオリゴヌクレオチドは、好都合におよび通常通り固相合成の十分に周知な技術を通じて作製される。そのような合成のための装置は、Applied Biosystemsを含むいくつかのベンダーから販売されている。そのような合成のための任意の他の手段も使用され得る;オリゴヌクレオチドの実際の合成は、十分に当業者の能力の範囲内である。ホスホロチオエートおよびアルキル化誘導体などの他のオリゴヌクレオチドを調製するために類似技術を使用することもよく知られている。類似技術ならびに商業的に入手可能な修飾されたアミダイトおよび多孔質ガラス(CPG)製品(ビオチン、フルオレセイン、アクリジンもしくはソラレン修飾アミダイトなど)および/または蛍光標識、ビオチン化もしくは、コレステロール修飾オリゴヌクレオチドなどの他の修飾オリゴヌクレオチドを合成するためのCPG(Glen Research,Sterling VAから入手可能)の使用もよく知られている。
【0165】
本発明により、強度、特異性および作用期間の増強のため、およびオリゴヌクレオチドの投与経路を拡げるためのLNAモノマーの利用などの修飾の使用には、MOE、ANA、FANA、PSなど現在のケミストリが含まれる。これは現在のオリゴヌクレオチド中のいくつかのモノマーのLNAモノマーによる置換によって達成され得る。LNA修飾オリゴヌクレオチドは、親化合物に類似する大きさを有する場合があり、またはより大きいものもよいが、好ましくは小さいものである。そのようなLNA修飾オリゴヌクレオチドが約70%より少ない、より好ましくは約60%より少ない、最も好ましくは約50%より少ないLNAモノマーを含むことは好ましく、それらの大きさは約5から25ヌクレオチドの間であることが好ましく、より好ましくは約12から20ヌクレオチドの間の大きさである。
【0166】
修飾されたオリゴヌクレオチド骨格は、以下に限定されないが、ホスホロチオエート、キラルホスホロチオエート、ホスホロジチオエート、ホスホトリエステル、アミノアルキルホスホトリエステル、メチルホスホネートおよび他のアルキルホスホネート(3’アルキレンホスホネートおよびキラルホスホネートを含む)、ホスフィネート、ホスホラミデート(3’アミノホスホラミデートおよびアミノアルキルホスホラミデートを含む)、チオノホスホラミデート、チオノアルキルホスホネート、チオノアルキルホスホトリエステルおよび通常の3’−5’結合を有するボラノホスフェート、これらの2’−5’結合類似体、および逆転した方向性を有する(ヌクレオチド単位の隣接する対が3’−5’から5’−3’にまたは2’−5’から5’−2’に連結している)ものを含む。種々の塩、塩混合物および遊離酸の形態も含まれる。
【0167】
上記のリン含有結合の作製を説明する代表的な米国特許としては、以下に限定されないが、米国特許第3,687,808号;4,469,863号;第4,476,301号;第5,023,243号;第5,177,196号;第5,188,897号;第5,264,423号;第5,276,019号;第5,278,302号;第5,286,717号;第5,321,131号;第5,399,676号;第5,405,939号;第5,453,496号;第5,455,233号;第5,466,677号;第5,476,925号;第5,519,126号;第5,536,821号;第5,541,306号;第5,550,111号;第5,563,253号;第5,571,799号;第5,587,361号;および第5,625,050号が挙げられ、それぞれが参照により本明細書に組み込まれる。
【0168】
修飾オリゴヌクレオチド骨格はリン原子を含まず、単鎖アルキルもしくはシクロアルキルヌクレオチド間結合、混合ヘテロ原子およびアルキルもしくはシクロアルキルヌクレオチド間結合、または1つもしくは複数の単鎖ヘテロ原子もしくは複素環ヌクレオチド間結合によって形成された骨格を有する。これらは、モルホリノ結合(ヌクレオシドの糖部分から部分的に形成される);シロキサン骨格;スルフィド、スルホキシドおよびスルホン骨格;ホルムアセチルおよびチオホルムアセチル骨格;メチレンホルムアセチルおよびチオホルムアセチル骨格;アルケン含有骨格;スルファメート骨格;メチレンイミノおよびメチレンヒドラジノ骨格;スルホネートおよびスルホンアミド骨格;アミド骨格;ならびに他のN、O、SおよびCH2が混合した構成成分部分を有するものを含む。
【0169】
上記のオリゴヌクレオチドの調製を説明する代表的な米国特許としては、以下に限定されないが、米国特許5,034,506号;第5,166,315号;第5,185,444号;第5,214,134号;第5,216,141号;第5,235,033号;第5,264,562号;第5,264,564号;第5,405,938号;第5,434,257号;第5,466,677号;第5,470,967号;第5,489,677号;第5,541,307号;第5,561,225号;第5,596,086号;第5,602,240号;第5,610,289号;第5,602,240号;第5,608,046号;第5,610,289号;第5,618,704号;第5,623,070号;第5,663,312号;第5,633,360号;第5,677,437号;および第5,677,439号が挙げられ、それぞれが参照により本明細書に組み込まれる。
【0170】
他のオリゴヌクレオチド模倣物において、ヌクレオチド単位の糖およびヌクレオチド間結合(すなわち骨格)の両方は新たな基で置換される。塩基単位は、適切な核酸ターゲッティング合物とのハイブリダイゼーションのために維持される。そのようなオリゴマー化合物の1つ、優れたハイブリダイゼーション特性を有することが判明しているオリゴヌクレオチド模倣物は、ペプチド核酸(PNA)と称される。PNA化合物において、オリゴヌクレオチドの糖骨格は、アミド含有骨格、詳細にはアミノエチルグリシン骨格で置換される。核酸塩基は、保持され、骨格のアミド部分のアザ窒素原子に直接または間接的に結合される。PNA化合物の調製について開示している代表的米国特許は、以下に限定されないが、米国特許第5,539,082号、米国特許第5,714,331号および米国特許第5,719,262号が挙げられ、それぞれ参照により本明細書に組み込まれる。PNA化合物のさらなる説明は、Nielsenら(1991)Science 254,1497−1500にみられる。
【0171】
本発明の他の実施形態において、ホスホロチオエート骨格を有するオリゴヌクレオチドおよびヘテロ原子骨格を有するオリゴヌクレオシド、特に、−CH2−NH−O−CH2−、−CH2−N(CH3)−O−CH2−(メチレン(メチルイミノ)またはMMI骨格として周知)、−CH2−O−N(CH3)−CH2、CH2N(CH3)−N(CH3)CH2−および−O−N(CH3)−CH2−CH2−(天然のホスホジエステル骨格は、以前に引用した米国特許第5,489,677号の−O−P−O−CH2−として表される)、および以前に引用した米国特許第5,602,240号のアミド骨格。同様に用いられるのは、以前に引用した米国特許第5,034,506号のモルホリノ骨格構造を有するオリゴヌクレオチドである。
【0172】
修飾されたオリゴヌクレオチドは、1つ以上の置換された糖部分を含み得る。オリゴヌクレオチドは、以下のもの:OH;F;O−、S−、もしくはN−アルキル;O−、S−、もしくはN−アルケニル;O−、S−もしくはN−アルキニル;またはOアルキル−O−アルキル(式中アルキル、アルケニルおよびアルキニルは、CからCOアルキルに、またはC2からCOアルケニルおよびアルキニルに、置換されるまたは置換されない場合がある)のうちの1つを2’位置に含む。特に挙げられるのは、O(CH2)nOmCH3、O(CH2)n、OCH3、O(CH2)nNH2、O(CH2)nCH3、O(CH2)nONH2およびO(CH2nON(CH2)nCH3)2であり、式中nおよびmは1から約10であり得る。他のオリゴヌクレオチドは、以下:CからCO、(低級アルキル、置換された低級アルキル、アルカリル、アラルキル、O−アルカリルもしくはO−アラルキル、SH、SCH3、OCN、Cl、Br、CN、CF3、OCF3、SOCH3、SO2CH3、ONO2、NO2、N3、NH2、ヘテロシクロアルキル、ヘテロシクロアルカリル、アミノアルキルアミノ、ポリアルキルアミノ、置換されたシリル、RNA切断基、レポーター基、干渉物質、オリゴヌクレオチドの薬物動態特性を改善する基、またはオリゴヌクレオチドの薬力学特性を改善する基および同様の特性を有する他の置換基のうちの1つを2’位置に含む。修飾は、2’−メトキシエトキシ(2’−O−CH2CH2OCH3、2’−O−(2−メトキシエチル)または2’−MOEとしても知られる)すなわちアルコキシアルコキシ基を含む。さらなる修飾は、2’−ジメチルアミノオキシエトキシ、すなわちO(CH2)2ON(CH3)2基、本明細書以下の実施例において記載のとおり2’−DMAOEとしても周知,ならびに2’−ジメチルアミノエトキシエトキシ(当技術分野において2’−O−ジメチルアミノエトキシエチルまたは2’−DMAEOEとしても当分野で周知)すなわち、2’−O−CH2−O−CH2−N(CH2)2を含む。
【0173】
他の修飾は、2’−メトキシ(2’−O CH3)、2’−アミノプロポキシ(2’−O CH2CH2CH2NH2)および2’−フルオロ(2’−F)を含む。同様の修飾は、オリゴヌクレオチドの他の位置、詳細には3’末端ヌクレオチドの糖の3’位置または2’−5’連結オリゴヌクレオチドおよび5’末端ヌクレオチドの5’位置にも作製され得る。オリゴヌクレオチドは、ペントフラノシル糖の代わりにシクロブチル成分などの糖類似体も有し得る。そのような修飾糖構造の調製について開示した代表的米国特許としては、以下に限定されないが、米国特許4,981,957号;第5,118,800号;第5,319,080号;第5,359,044号;第5,393,878号;第5,446,137号;第5,466,786号;第5,514,785号;第5,519,134号;第5,567,811号;第5,576,427号;第5,591,722号;第5,597,909号;第5,610,300号;第5,627,053号;第5,639,873号;第5,646,265号;第5,658,873号;第5,670,633号;および第5,700,920号などが挙げられ、それぞれが参照により本明細書に組み込まれる。
【0174】
オリゴヌクレオチドは、核酸塩基(当技術分野において単に「塩基」と称されることが多い)修飾または置換も含み得る。本明細書において使用される「未修飾」または「天然」ヌクレオチドは、プリン塩基アデニン(A)およびグアニン(G)、ならびにピリミジン塩基チミン(T)、シトシン(C)およびウラシル(U)を含む。修飾ヌクレオチドは、5−メチルシトシン(5−Me−C)、5−ヒドロキシメチルシトシン、キサンチン、ヒポキサンチン、2−アミノアデニン、アデニンおよびグアニンの6−メチルおよび他のアルキル誘導体、アデニンおよびグアニンの2−プロピルおよび他のアルキル誘導体、2−チオウラシル、2−チオチミンおよび2−チオシトシン、5−ハロウラシルおよびシトシン、5−プロピニルウラシルおよびシトシン、6−アゾウラシル、シトシンおよびチミン、5−ウラシル(シュードウラシル)、4−チオウラシル、8−ハロ、8−アミノ、8−チオール、8−チオアルキル、8−ヒドロキシルおよび他の8−置換アデニンおよびグアニン、5−ハロ特に5−臭化、5−トリフルオロメチルおよび他の5−置換ウラシルおよびシトシン、7−メチルグアニンおよび7−メチルアデニン、8−アザグアニンおよび8−アザアデニン、7−デアザグアニンおよび7−デアザアデニンならびに3−デアザグアニンおよび3−デアザアデニンなどの他の合成および天然ヌクレオチドを含む。
【0175】
さらに、ヌクレオチドは、米国特許第3,687,808号に開示のもの、’The Concise Encyclopedia of Polymer Science And Engineering’,pages858−859,Kroschwitz,J.I.,ed.John Wiley & Sons,1990に開示のもの、Englischら,’Angewandle Chemie,International Edition’,1991,30,page613に開示のもの、anghvi,Y.S.,Chapter15,’Antisense Research and Applications’,pages289−302,Crooke,S.T. and Lebleu,B.ea.,CRCPress,1993に開示のものを含む。特定のこれらのヌクレオチドは、本発明のオリゴマー化合物の結合親和性を増大させるために特に有用である。これらは、5−置換ピリミジン、6−アザピリミジンならびに、2−アミノプロピルアデニン、5−プロピニルウラシルおよび5−プロピニルシトシンを含むN−2、N−6およびO−6置換プリンを含む。5−メチルシトシン置換物は、0.6〜1.2℃の核酸2重鎖安定性における増大を示しており(Sanghvi,Y.S.,Crooke,S.T.およびLebleu,B.,eds,’Antisense Research and Applications’,CRC Press,Boca Raton,1993,pp.276−278)、現在のところ用いられる置換であり、2’−O−メトキシエチル糖修飾と組み合わされてよく用いられる。
【0176】
上記の修飾ヌクレオチドおよび他の修飾ヌクレオチドの作製について開示した代表的米国特許は、以下に限定されないが、米国特許第3,687,808号、ならびに同第4,845,205号;第5,130,302号;第5,134,066号;第5,175,273号;第5,367,066号;第5,432,272号;第5,457,187号;第5,459,255号;第5,484,908号;第5,502,177号;第5,525,711号;第5,552,540号;第5,587,469号;第5,596,091号;第5,614,617号;第5,750,692号,および第5,681,941号などが挙げられ、それぞれが参照により本明細書に組み込まれる。
【0177】
本発明のオリゴヌクレオチドの他の修飾は、活性、細胞性分布またはオリゴヌクレオチドの細胞への取り込みを増強する1以上の成分またはコンジュゲートのオリゴヌクレオチドへの化学的連結を含む。
【0178】
そのような成分としては、以下に限定されないが、コレステロール成分、コール酸、チオエーテル(例えばヘキシル−S−トリチルチオール)、チオコレステロール、脂肪族鎖(例えばドデカンジオールまたはウンデシル残基)、リン脂質(例えばジ−ヘキサデシル−rac−グリセロールまたはトリエチルアンモニウム1,2−ジ−O−ヘキサデシル−rac−グリセロ−3−H−ホスホネート)、ポリアミンまたはポリエチレングリコール鎖、またはアダマンタン酢酸、パルミチル成分、またはオクタデシルアミンもしくはヘキシルアミノ−カルボニル−tオキシコレステロール成分などが挙げられる。
【0179】
そのようなオリゴヌクレオチドコンジュゲートの作製について記載した代表的な米国特許としては、以下に限定されないが、米国特許第4,828,979号;第4,948,882号;第5,218,105号;第5,525,465号;第5,541,313号;第5,545,730号;第5,552,538号;第5,578,717、5,580,731号;第5,580,731号;第5,591,584号;第5,109,124号;第5,118,802号;第5,138,045号;第5,414,077号;第5,486,603号;第5,512,439号;第5,578,718号;第5,608,046号;第4,587,044号;第4,605,735号;第4,667,025号;第4,762,779号;第4,789,737号;第4,824,941号;第4,835,263号;第4,876,335号;第4,904,582号;第4,958,013号;第5,082,830号;第5,112,963号;第5,214,136号;第5,082,830号;第5,112,963号;第5,214,136号;第5,245,022号;第5,254,469号;第5,258,506号;第5,262,536号;第5,272,250号;第5,292,873号;第5,317,098号;第5,371,241、5,391,723号;第5,416,203、5,451,463号;第5,510,475号;第5,512,667号;第5,514,785号;第5,565,552号;第5,567,810号;第5,574,142号;第5,585,481号;第5,587,371号;第5,595,726号;第5,597,696号;第5,599,923号;第5,599,928号および第5,688,941号などがあり、それぞれが参照により本明細書に組み込まれる。
【0180】
[創薬]:本発明の化合物は、創薬および標的検証の分野にも応用され得る。本発明は、膵臓発生遺伝子ポリヌクレオチドと、病態、表現型または状態との間に存在する関係を解明するための創薬の試みにおける、本明細書において特定された化合物および標的セグメントの使用を包含する。これらの方法は、試料、組織、細胞または生体を本発明の化合物と接触させるステップ、膵臓発生遺伝子ポリヌクレオチドの核酸またはタンパク質レベルおよび/または関連する表現型もしくは化学的な評価項目を処置後のある時期に測定するステップ、ならびに選択に応じて測定値を未処置試料または本発明のさらなる化合物で処置した試料と比較するステップを含む、膵臓発生遺伝子ポリヌクレオチドの検出または調節を含む。これらの方法は、標的検証のプロセスのために未知の遺伝子の機能を決定するため、または特定の疾患、状態もしくは表現型の治療もしくは予防のための標的としての特定の遺伝子産物の妥当性を決定するために他の実験と並行して、または組み合わせて実施され得る。
【0181】
[遺伝子発現のアップレギュレートまたは阻害の評価]
外来性核酸の宿主細胞または生体内への輸送は、細胞中または生体中の核酸を直接検出するステップによって評価され得る。そのような検出は、当技術分野において周知のいくつかの方法によって達成し得る。例えば、外来性核酸の存在は、サザンブロットまたは核酸に関連するヌクレオチド配列を特異的に増幅するプライマーを使用するポリメラーゼ連鎖反応(PCR)技術によって検出し得る。外来性核酸の発現も遺伝子発現分析を含む従来の方法を使用して測定し得る。例えば外来性核酸から生成されるmRNAはノーザンブロットおよび逆転写PCR(RT−PCR)を使用して検出および定量し得る。
【0182】
外来性核酸からのRNAの発現も、酵素活性またはレポータータンパク質活性を測定することによって検出し得る。例えば、アンチセンス調節活性は、外来性核酸がエフェクターRNAを生成していることの指標としての標的核酸発現の増減により間接的に測定し得る。配列保存に基づいてプライマーは設計可能であり、標的遺伝子のコード領域を増幅するために使用し得る。任意の翻訳または非コード領域が使用され得るが、最初に各遺伝子から最も高く発現されるコード領域がモデル制御遺伝子を構築するために使用され得る。各制御遺伝子は、各コード領域をレポーターコード領域とそのポリ(A)シグナルとの間に挿入することによって組み立てられる。これらのプラスミドは、レポーター遺伝子を遺伝子の上流部分に、および潜在的RNAi標的を3’非コード領域に有するmRNAを生成する。個々のアンチセンスオリゴヌクレオチドの効果は、レポーター遺伝子の調節によって評価される。本発明の方法において有用なレポーター遺伝子としては、アセトヒドロキシ酸合成酵素(AHAS)、アルカリホスファターゼ(AP)、ベータガラクトシダーゼ(LacZ)、ベータグルクロニダーゼ(GUS)、クロラムフェニコールアセチル基転移酵素(CAT)、緑色蛍光タンパク質(GFP)、赤色蛍光タンパク質(RFP)、黄色蛍光タンパク質(YFP)、シアン蛍光タンパク質(CFP)、西洋わさびペルオキシダーゼ(HRP)、ルシフェラーゼ(Luc)、ノパリン合成酵素(NOS)、オクトピン合成酵素(OCS)、およびそれらの誘導体などが挙げられる。アンピシリン、ブレオマイシン、クロラムフェニコール、ゲンタマイシン、ハイグロマイシン、カナマイシン、リンコマイシン、メトトレキサート、ホスフィノトリシン、ピューロマイシンおよびテトラサイクリンに耐性を付与する多重選択マーカーを利用可能である。レポーター遺伝子の調節を測定するための方法は、当技術分野においてよく知られており、以下に限定されないが蛍光定量的方法(例えば蛍光分光法、蛍光励起細胞分取(FACS)、蛍光顕微鏡)、抗生物質耐性判別法が含まれる。
【0183】
NEUROD1、HNF4A、MAFA、PDX1、NKX6−1タンパク質およびmRNAの発現は、当業者に周知の本明細書の他の場所に記載する方法を用いてアッセイすることができる。例えば、ELISAなどのイムノアッセイを用いてタンパク質レベルを測定することができる。ELISA用の膵臓発生遺伝子抗体は、例えばR&D Systems(Minneapolis,MN)およびAbcam(Cambridge,MA)から市販されている。
【0184】
いくつかの実施形態では、本発明のアンチセンスオリゴヌクレオチドを用いて処置したサンプル(例えば生体内または体外の細胞または組織)中のNEUROD1、HNF4A、MAFA、PDX1、NKX6−1の発現(例えばmRNAの発現すなわちタンパク質)は、対照サンプルにおける膵臓発生遺伝子の発現との比較によって評価する。例えば、タンパク質すなわち核酸の発現を、当業者に周知の方法を用いて、擬似処置したすなわち未処置のサンプルにおける発現と比較することができる。あるいは、必要な情報に応じて、対照アンチセンスオリゴヌクレオチド(例えば、変化した配列すなわち異なる配列を有するもの)で処置したサンプルとの比較を行うことができる。別の実施形態では、処置したサンプル対未処置のサンプルにおける膵臓発生遺伝子タンパク質すなわち核酸の発現の差異を、処置したサンプル対未処置のサンプルにおける異なる核酸(研究者が適切とみなした任意の標準的な核酸、例えばハウスキーピング遺伝子)の発現の差異と比較することができる。
【0185】
観察された差異は、対照との比較に用いるために、望ましい形式、例えば比率すなわち割合の形式で表現することができる。いくつかの実施形態では、本発明のアンチセンスオリゴヌクレオチドで処置したサンプル中の膵臓発生遺伝子のmRNAの発現すなわちタンパク質のレベルは、未処置のサンプルまたは対照の核酸で処置したサンプルと比較して約1.25倍〜約10倍以上の割合で増減する。いくつかの実施形態では、膵臓発生遺伝子のmRNAの発現すなわちタンパク質のレベルは、少なくとも約1.25倍、少なくとも約1.3倍、少なくとも約1.4倍、少なくとも約1.5倍、少なくとも約1.6倍、少なくとも約1.7倍、少なくとも約1.8倍、少なくとも約2倍、少なくとも約2.5倍、少なくとも約3倍、少なくとも約3.5倍、少なくとも約4倍、少なくとも約4.5倍、少なくとも約5倍、少なくとも約5.5倍、少なくとも約6倍、少なくとも約6.5倍、少なくとも約7倍、少なくとも約7.5倍、少なくとも約8倍、少なくとも約8.5倍、少なくとも約9倍、少なくとも約9.5倍、少なくとも約10倍かそれ以上の割合で増減する。
【0186】
[キット、研究用試薬、診断、および治療]
本発明の化合物は、診断、治療および予防のためにならびに研究用試薬およびキットの構成要素として利用され得る。さらに、優れた特異性をもって遺伝子発現を阻害できるアンチセンスオリゴヌクレオチドは、当業者によって特定の遺伝子の機能を解明するため、または生物学的経路の種々のメンバー間の機能を区別するために使用されることが多い。
【0187】
キットおよび診断ならびに種々の生物学的系における使用のために、本発明の化合物は、単独でまたは他の化合物もしくは治療薬との併用のいずれかで、細胞中および組織中で発現される遺伝子の部分的または全体的な相補配列の発現パターンを解明するためのディファレンシャルおよび/またはコンビナトリアル解析でのツールとして有用である。
【0188】
本明細書において使用される用語「生物学的系」または「系」は、膵臓発生遺伝子の産物を発現するまたは発現できるようにされる任意の生体、細胞、細胞培養物または組織として定義される。これらは、以下に限定されないが、ヒト、遺伝子導入動物、細胞、細胞培養物、組織、異種移植片、移植物およびそれらの組み合わせを含む。
【0189】
非限定的な一例として、1以上のアンチセンス化合物で処置した細胞中または組織中の発現パターンを、アンチセンス化合物で処置していない対照細胞または組織と比較して、生じたパターンを遺伝子発現レベルの差異について分析する。それらが、例えば検査される遺伝子の疾患関連性、シグナル伝達経路、細胞内局在性、発現レベル、大きさ、構造または機能などに関連するからである。これらの分析は、刺激されたまたは刺激されていない細胞で、発現パターンに影響する他の化合物の存在下または非存在下で実施することができる。
【0190】
当技術分野において周知の遺伝子発現分析方法の例としては、DNAアレイまたはマイクロアレイ(BrazmaおよびVilo,(2000)FEBS Lett.,480,17−24;Celis,ら,(2000)FEBS Lett.,480,2−16)、SAGE(遺伝子発現の連続的分析)(Madden,ら,(2000)Drug Discov.Today,5,415−425)、READS(消化cDNAの制限酵素増幅)(PrasharおよびWeissman,(1999)Methods Enzymol.,303,258−72)、TOGA(総遺伝子発現分析)(Sutcliffe,ら,(2000)Proc.Natl.Acad.Sci.U.S.A.,97,1976−81)、タンパク質アレイおよびプロテオミクス(Celis,ら,(2000)FEBS Lett.,480,2−16;Jungblut,ら,Electrophoresis,1999,20,2100−10)、発現された配列タグ(EST)配列決定(Celis,ら,FEBS Lett.,2000,480,2−16;Larsson,ら,J.Biotechnol.,2000,80,143−57)、サブトラクティブRNAフィンガープリンティング(SuRF)(Fuchs,ら,(2000)Anal.Biochem.286,91−98;Larson,ら,(2000)Cytometry41,203−208)、サブトラクティブクローニング、ディファレンシャルディスプレイ(DD)(JurecicおよびBelmont,(2000)Curr.Opin.Microbiol.3,316−21)、比較ゲノムハイブリダイゼーション(Carulli,ら,(1998)J.Cell Biochem.Suppl.,31,286−96)、FISH(蛍光in situハイブリダイゼーション)技術(Going and Gusterson,(1999)Eur.J.Cancer,35,1895−904)および質量分析法(To,Comb.(2000)Chem.High Throughput Screen,3,235−41)などが挙げられる。
【0191】
本発明の化合物は、これらの化合物が膵臓発生遺伝子をコードする核酸にハイブリダイズすることから、研究および診断のために有用である。例えば、本明細書において開示のとおりの効率および条件下で効果的な膵臓発生遺伝子調節物質としてハイブリダイズするオリゴヌクレオチドは、遺伝子増幅または検出に好都合な条件下でそれぞれ効果的なプライマーまたはプローブである。これらのプライマーまたはプローブは、膵臓発生遺伝子をコードする核酸分子の特異的検出を必要とする方法において、および膵臓発生遺伝子のさらなる研究における検出または使用のための前記核酸分子の増幅のために有用である。膵臓発生遺伝子をコードする核酸と、本発明のアンチセンスオリゴヌクレオチド、詳細にはプライマーおよびプローブとのハイブリダイゼーションは当技術分野において周知の手段によって検出し得る。そのような手段としては、オリゴヌクレオチドへの酵素のコンジュゲーション、オリゴヌクレオチドの放射標識、または任意の他の適切な検出手段などを挙げることができる。試料中の膵臓発生遺伝子のレベルを検出するためにそのような検出手段を使用するキットも用意することができる。
【0192】
アンチセンスの特異性および感度は、治療用使用のために当業者によって利用される。アンチセンス化合物は、ヒトを含む動物の病態の治療における治療用成分として使用されてきた。アンチセンスオリゴヌクレオチド薬は、ヒトに安全かつ効果的に投与されており、多数の臨床試験が現在進行中である。したがって、アンチセンス化合物が細胞、組織および動物、特にヒトの治療用のための治療レジメンにおいて有用であるように構成され得る有用な治療方法となり得ることは確立されている。
【0193】
治療については、膵臓発生遺伝子ポリヌクレオチドの発現を調節することによって治療され得る疾患または障害を有すると疑われる動物(好ましくはヒト)は、本発明によるアンチセンス化合物を投与することによって治療される。例えば、限定を意図しない一実施形態において、該方法は、治療を必要とする動物に治療上有効な量の膵臓発生遺伝子調節物質を投与するステップを含む。本発明の膵臓発生遺伝子調節物質は、膵臓発生遺伝子の活性を効果的に調節するか、または膵臓発生遺伝子タンパク質の発現を調節する。一実施形態においては、動物における膵臓発生遺伝子の活性または発現は、対照と比較して約10%阻害される。好ましくは、動物における膵臓発生遺伝子の活性または発現が、約30%阻害される。より好ましくは動物における膵臓発生遺伝子の活性または発現が、50%またはそれを超えて阻害される。したがってオリゴマー化合物は、膵臓発生遺伝子mRNAの発現を対照と比較して少なくとも10%、少なくとも50%、少なくとも25%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%または100%調節する。
【0194】
一実施形態において、膵臓発生遺伝子の活性または発現および/または動物においては、対照と比較して少なくとも約10%増加する。好ましくは動物における膵臓発生遺伝子の活性または発現は、約30%増加する。より好ましくは動物における膵臓発生遺伝子の活性または発現は、約50%またはそれを超えて増加する。したがってオリゴマー化合物は、膵臓発生遺伝子のmRNAの発現を、対照と比較して少なくとも10%、少なくとも50%、少なくとも25%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%または100%調節する。
【0195】
例えば膵臓発生遺伝子の発現の低下は、動物の血清、血液、脂肪組織、肝臓または任意の他の体液、組織または器官において測定し得る。好ましくは、分析される前記体液、組織または器官中に含まれる細胞は、膵臓発生遺伝子ペプチドをコードする核酸分子および/または膵臓発生遺伝子タンパク質それ自体を含む。
【0196】
本発明の化合物は、有効量の化合物を適切な薬学的に許容される希釈剤または担体に加えることによって医薬組成物において利用され得る。本発明の化合物および方法の使用は、予防的にも有用であり得る。
【0197】
[コンジュゲート]
本発明のオリゴヌクレオチドの他の修飾は、オリゴヌクレオチドの活性、細胞分布または細胞への取り込みを増強する1以上の成分またはコンジュゲートへのオリゴヌクレオチドの化学的連結を含む。これらの成分またはコンジュゲートは、1級または2級ヒドロキシル基などの官能基に共有結合したコンジュゲート基を含み得る。本発明のコンジュゲート基は、干渉物質、レポーター分子、ポリアミン、ポリアミド、ポリエチレングリコール、ポリエーテル、オリゴマーの薬力学特性を増強する基、およびオリゴマーの薬物動態特性を増強する基を含む。典型的なコンジュゲート基は、コレステロール、脂質、リン脂質、ビオチン、フェナジン、葉酸、フェナントリジン、アントラキノン、アクリジン、フルオレセイン、ローダミン、クマリン、および色素を含む。本発明の文脈において薬力学特性を増強する基は、取り込みを改善し、分解への耐性を増強し、および/または標的核酸との配列特異的ハイブリダイゼーションを強化する基を含む。本発明の文脈において薬物動態特性を増強する基は、本発明の化合物の取り込み、分散、代謝または排出を改善する基を含む。代表的コンジュゲート基は、1992年10月23日出願の国際特許出願PCT/US92/09196および米国特許第6,287,860号、「Antisense inhibition of MEKK2 expression」において開示されており、これらはともに参照により本明細書に組み込まれる。コンジュゲート成分は、以下に限定されないが、コレステロール成分、コール酸、チオエーテル(例えばヘキシル−S−トリチルチオール)、チオコレステロール、脂肪族鎖(例えばドデカンジオールまたはウンデシル残基)、リン脂質(例えばジ−ヘキサデシル−rac−グリセロールまたはトリエチルアンモニウム1,2−ジ−O−ヘキサデシル−rac−グリセロ−3−H−ホスホネート)、ポリアミンまたはポリエチレングリコール鎖、あるいはアダマンタン酢酸、パルミチル成分、またはオクタデシルアミンもしくはヘキシルアミノ−カルボニル−オキシコレステロール成分などを含む。本発明のオリゴヌクレオチドは、活性原薬、例えばアスピリン、ワルファリン、フェニルブタゾン、イブプロフェン、スプロフェン、フェンブフェン、ケトプロフェン、(S)−(+)−プラノプロフェン、カプロフェン、ダンシルサルコシン、2,3,5−トリヨード安息香酸、フルフェナム酸、フォリン酸、ベンゾチアジアジド、クロロチアジド、ジアセピン、インドメチシン、バルビツール酸、セファロスポリン、サルファ剤、抗糖尿病薬、抗菌剤または抗生物質ともコンジュゲート形成され得る。
【0198】
そのようなオリゴヌクレオチドコンジュゲートの作製について記載した代表的米国特許としては、以下に限定されないが、米国特許第4,828,979号;第4,948,882号;第5,218,105号;第5,525,465号;第5,541,313号;第5,545,730号;第5,552,538号;第5,578,717、5,580,731号;第5,580,731号;第5,591,584号;第5,109,124号;第5,118,802号;第5,138,045号;第5,414,077号;第5,486,603号;第5,512,439号;第5,578,718号;第5,608,046号;第4,587,044号;第4,605,735号;第4,667,025号;第4,762,779号;第4,789,737号;第4,824,941号;第4,835,263号;第4,876,335号;第4,904,582号;第4,958,013号;第5,082,830号;第5,112,963号;第5,214,136号;第5,082,830号;第5,112,963号;第5,214,136号;第5,245,022号;第5,254,469号;第5,258,506号;第5,262,536号;第5,272,250号;第5,292,873号;第5,317,098号;第5,371,241、5,391,723号;第5,416,203、5,451,463号;第5,510,475号;第5,512,667号;第5,514,785号;第5,565,552号;第5,567,810号;第5,574,142号;第5,585,481号;第5,587,371号;第5,595,726号;第5,597,696号;第5,599,923号;第5,599,928号および第5,688,941号などが挙げられる。
【0199】
[製剤]
本発明の化合物は、取り込み、分散および/または吸収の補助ために、例えばリポソーム、受容体−標的分子、経口、直腸、局所または他の製剤として、他の分子、分子構造または化合物と、混合物と混合、封入、コンジュゲート化または他の方法で結合され得る。そのような取り込み、分散および/または吸収を補助する製剤の調製について記載した代表的米国特許としては、以下に限定されないが、米国特許第5,108,921号;第5,354,844号;第5,416,016号;第5,459,127号;第5,521,291号;第5,543,165号;第5,547,932号;第5,583,020号;第5,591,721号;第4,426,330号;第4,534,899号;第5,013,556号;第5,108,921号;第5,213,804号;第5,227,170号;第5,264,221号;第5,356,633号;第5,395,619号;第5,416,016号;第5,417,978号;第5,462,854号;第5,469,854号;第5,512,295号;第5,527,528号;第5,534,259号;第5,543,152号;第5,556,948号;第5,580,575号;および第5,595,756号が挙げられ、それぞれが本明細書に参照として組み込まれる。
【0200】
アンチセンスオリゴヌクレオチドは、標的の発現および/または機能を調節するためにベクターと関連付けられて投与される必要はないが、本発明の実施形態は、プロモーター、ハイブリッドプロモーター遺伝子配列を含み、強い構成的プロモーター活性または所望の場合に誘導され得るプロモーター活性を有する、アンチセンスオリゴヌクレオチドの発現のための発現ベクター構築物に関する。
【0201】
一実施形態においては、本発明の実施には、上述のアンチセンスオリゴヌクレオチドのうちの少なくとも1つを適切な核酸送達系と共に投与するステップが含まれる。一実施形態において、その系は、ポリヌクレオチドに機能的にリンクされた非ウイルス性ベクターを含む。そのような非ウイルス性ベクターの例としては、オリゴヌクレオチド単独(例えば、配列番号13−45のなかの任意のもの1つ以上)または適切なタンパク質、多糖類または脂質配合物との組み合わせが挙げられる。
【0202】
他の適切な核酸デリバリーシステムにはウイルスベクター、典型的にはアデノウイルス、アデノウイルス関連ウイルス(AAV)、ヘルパー依存性アデノウイルス、レトロウイルスまたはセンダイウイルス(HVJ)−リポソーム複合体の少なくとも1つに由来する配列のものが挙げられる。好ましくは、ウイルスベクターには、ポリヌクレオチドに機能的にリンクされた強力な真核生物プロモーター、例えばサイトメガロウイルス(CMV)プロモーターが含められる。
【0203】
他のベクターには、ウイルスベクター、融合タンパク質および化学的コンジュゲートが含まれる。レトロウイルスベクターには、モロニーマウス白血病ウイルスおよびHIVベースのウイルスが含まれる。HIVベースのウイルスベクターの1つは、gagおよびpol遺伝子がHIVゲノム由来であり、env遺伝子が他のウイルス由来である少なくとも2つのベクターを含む。DNAウイルス性ベクターが好ましい。これらのベクターには、オルソポックスベクターまたはトリポックスベクターなどのポックスベクター、単純ヘルペスIウイルス(HSV)ベクターなどのヘルペスウイルスベクター、アデノウイルスベクター、およびアデノ関連ウイルスベクターが含まれる。
【0204】
本発明のアンチセンス化合物は、ヒトを含む動物への投与において生物学的に活性な代謝産物またはその残渣を(直接または間接的に)提供できる、任意の薬学的に許容される塩、エステルもしくはそのようなエステルの塩、または任意の他の化合物を包含する。
【0205】
用語「薬学的に許容される塩」は、本発明の化合物の生理学的かつ薬学的に許容される塩:すなわち親化合物の所望の生物学的活性を保持しており、望ましくない毒物学的な効果を与えない塩を指す。オリゴヌクレオチドについて、薬学的に許容される塩の例およびそれらの使用は、米国特許第6,287,860号にさらに記載されており、これは参照により本明細書に組み込まれる。
【0206】
本発明は、本発明のアンチセンス化合物を含む医薬組成物および製剤も含む。本発明の医薬組成物は、局所または全身処置のいずれが望ましいかおよび治療される場所に応じて種々の方法で投与され得る。投与は、局所(点眼および膣および直腸を含む粘膜送達を含む)、肺、例えば噴霧吸入器による場合を含む粉末剤またはエアロゾルの吸入または吹送法によって;気管内、鼻腔内、上皮性および経皮性)、経口または非経口の投与であり得る。非経口投与は、静脈内、動脈内、皮下、腹腔内もしくは筋肉内注射もしくは注入;または頭蓋内、例えば髄腔内もしくは脳室内投与を含む。
【0207】
中枢神経系の組織の治療のために、例えば脳脊髄液への注射または注入によって投与を行うことができる。アンチセンスRNAの脳脊髄液への投与については、米国特許出願公開第2007/011777号、「Methods for slowing familial ALS disease progression」にも記載されており、この全内容は参照により本明細書に組み込まれる。
【0208】
本発明のアンチセンスオリゴヌクレオチドを中枢神経系の細胞に投与することが意図される場合、投与は、本発明のアンチセンスオリゴヌクレオチドの血液脳関門通過を促進できる1種以上の薬剤を用いて行うことができる。注射は、例えば嗅内皮質または海馬に対して行うことができる。筋肉組織の運動ニューロンへのアデノウイルスベクターの投与による神経栄養因子の送達は、例えば、米国特許第6,632,427号、「Adenoviral−vector−mediated gene transfer into medullary motor neurons」に記載されており、この全内容は参照により本明細書に組み込まれる。脳、例えば、線条体、視床、海馬、または黒質へのベクターの直接の送達については公知で、例えば米国特許第6,756,523号、「Adenovirus vectors for the transfer of foreign genes into cells of the central nervous system particularly in brain」に記載されており、これはその全内容が参照により本明細書に組み入れられる。投与は、注射により速やかに行うことも、あるいは遅い速度での注入または徐放製剤の投与によって一定時間にわたって行うこともできる。
【0209】
本発明のアンチセンスオリゴヌクレオチドはまた、望ましい医薬品や薬力学的特性を与える薬剤とリンクしたもの、または結合したものとすることができる。例えば、アンチセンスオリゴヌクレオチドを、トランスフェリン受容体に対する抗体などの血液脳関門の通過または輸送を促進するための当技術分野で公知の任意の物質に結合させて、静脈注射によって投与することができる。アンチセンス化合物は、例えば、アンチセンス化合物をより効果的にし、かつ/または血液脳関門を越えたアンチセンス化合物の輸送を増加させるウイルスベクターにリンクさせることができる。浸透圧による血液脳関門の破壊は、例えば、以下に限定されないが、メソエリスリトール、キシリトール、D(+)ガラクトース、D(+)ラクトース、D(+)キシロース、ズルシトール、ミオイノシトール、L(−)フルクトース、D(−)マンニトール、D(+)グルコース、D(+)アラビノース、D(−)アラビノース、セロビオース、D(+)マルトース、D(+)ラフィノース、L(+)ラムノース、D(+)メリビオース、D(−)リボース、アドニトール、D(+)アラビトール、L(−)アラビトール、D(+)フコース、L(−)フコース、D(−)リキソース、L(+)リキソース、およびL(−)リキソースを含む糖の注入、または、以下に限定されないが、グルタミン、リジン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン酸、グリシン、ヒスチジン、ロイシン、メチオニン、フェニルアラニン、プロリン、セリン、スレオニン、チロシン、バリン、タウリンを含むアミノ酸の注入によって達成することができる。血液脳関門の通過を容易にするための方法および材料は、例えば米国特許第4,866,042,号、「Method for the delivery of genetic material across the blood brain barrier」、第6,294,520号、「Material for passage through the blood−brain barrier」、および第6,936,589号、「Parenteral delivery systems」に記載されており、これらは参照によりその全内容が本明細書に組み入れられる。
【0210】
本発明のアンチセンス化合物は、その取り込み、分散および/または吸収を助けるため、他の分子、分子構造、または化合物の混合物(例えば、リポソーム、受容体を標的化した分子、経口製剤、直腸製剤、局所製剤、または他の製剤)と混合、カプセル化、結合、または会合させ得る。例えば、カチオン性脂質は、オリゴヌクレオチドの取り込みを容易にする製剤に含まれ得る。取り込みを容易にすることが判明している組成物の1つは、LIPOFECTIN(GIBCO−BRL、ベセスダ,Bethesda,MDから入手可能)である。
【0211】
少なくとも1つの2’−O−メトキシエチル修飾を有するオリゴヌクレオチドは、経口投与に特に有用であると考えられている。局所投与のための医薬組成物および製剤は、経皮パッチ、軟膏、ローション、クリーム、ゲル、滴薬、坐薬、噴霧剤、液薬および粉末剤を含み得る。従来の薬学的担体、液剤、粉末剤または油性基剤、増粘剤などは必要であるかまたは望ましい場合がある。コーティングされたコンドーム、手袋なども有用である場合がある。
【0212】
本発明の医薬製剤は、便利に単位投与の形態で提供されてもよく、製薬業界において周知の技術により調製され得る。そのような技術は、活性成分を、1種以上の薬学的担体または一種以上の賦形剤と結合させるステップを含む。一般に製剤は、活性成分を均一かつ均質に液体担体もしくは微粉化した固体担体またはその両方と結合させるステップ、次いで必要な場合は生成物を成形するステップによって製する。
【0213】
本発明の組成物は、以下に限定されないが、錠剤、カプセル、ゲルカプセル、液体シロップ、ソフトゲル、坐薬および浣腸などの任意の多くの可能な剤形に製剤され得る。本発明の組成物は、水性懸濁剤、非水性または混合媒体としても製剤され得る。水性懸濁剤は、例えばカルボキシメチルセルロースナトリウム、ソルビトールおよび/またはデキストランを含む懸濁剤の粘度を上げる物質をさらに含めることができる。懸濁剤は、安定剤も含み得る。
【0214】
本発明の医薬組成物は、限定しないが、液剤、乳剤、泡状製剤およびリポソーム含有製剤を含む。本発明の医薬組成物および製剤は、1以上の浸透促進剤、担体、賦形剤または他の活性成分もしくは不活性成分を含み得る。
【0215】
典型的には乳剤は、1つの液剤が他に通常直径0.1μmを超える液滴の形態で分散された不均一系である。乳剤は、分散相に加えて追加の成分を含有でき、活性剤は水相中、油相中またはそれ自体としての分離相中に溶液として存在できる。マイクロエマルジョンは、本発明の実施形態として含まれる。乳剤およびそれらの使用は、当技術分野においてよく知られており、米国特許第6,287,860号にさらに記載されている。
【0216】
本発明の製剤は、リポソーム製剤を含む。本発明において使用される用語「リポソーム」は、球状の1層以上の二重層に配置された両親媒性脂質から成る小胞を意味する。リポソームは、親油性物質および送達される組成物を含有する水性の内部から形成された膜を有する単層膜または多重膜ビヒクルである。カチオン性リポソームは、負に荷電したDNA分子と相互作用して安定な複合体を形成すると考えられる正に荷電したリポソームである。pH感受性または負に荷電したリポソームは、複合体化するよりもDNAを捕捉すると考えられる。カチオン性および非カチオン性の両方のリポソームは、DNAを細胞に送達するために使用されている。
【0217】
リポソームは、「立体的に安定化された」リポソームも含み、用語は本明細書における使用で1種以上の特殊な脂質を含むリポソームを意味する。リポソームに組み込まれた場合、これらの特殊化された脂質は、そのような特殊な脂質を欠いているリポソームと比較して増強された循環寿命を有するリポソームを生じる。立体的に安定化されたリポソームの例は、リポソームのビヒクル形成脂質部分の一部が1種以上の糖脂質を含むか、またはポリエチレングリコール(PEG)成分などの1種以上の親水性ポリマーで誘導体化されていたものである。リポソームおよびそれらの使用は、米国特許第6,287,860号にさらに記載されている。
【0218】
本発明の医薬製剤および組成物は、界面活性剤もさらに含み得る。薬剤製品、製剤および乳剤における界面活性剤の使用は、当技術分野においてよく知られている。界面活性剤およびのそれらの使用は、米国特許第6,287,860号にさらに記載され、これは、参照により本明細書に組み込まれる。
【0219】
一実施形態において本発明は、核酸、具体的にはオリゴヌクレオチドの効率的な送達を行うために各種浸透促進剤を使用する。非親油性薬剤の細胞膜を超える拡散の補助に加えて、浸透促進剤は親油性薬剤の浸透性も促進する。浸透促進剤は、5つの広いカテゴリ、すなわち界面活性剤、脂肪酸、胆汁酸塩、キレート剤および非キレート非界面活性剤のうちの1つに属するものとして分類され得る。浸透促進剤およびそれらの使用は、米国特許第6,287,860号にさらに記載されており、これは参照により本明細書に組み込まれる。
【0220】
当業者であれば、製剤がそれらの目的とする使用法、すなわち投与経路に応じて通常通り設計されることを理解されよう。
【0221】
局所投与のための好ましい製剤には、本発明のオリゴヌクレオチドが、脂質、リポソーム、脂肪酸、脂肪酸エステル、ステロイド、キレート剤および界面活性剤などの局所送達剤と混合されているものを含まれる。脂質およびリポソームには、中性のもの(例えばジオレオイル−ホスファチジルDOPEエタノールアミン、ジミリストイルホスファチジルコリンDMPC、ジステアロイルホスファチジルコリン)、陰性のもの(例えばジミリストイルホスファチジルグリセロールDMPG)、およびカチオン性のもの(例えばジオレオイルテトラメチルアミノプロピルDOTAPおよびジオレオイル−ホスファチジルエタノールアミンDOTMA)が含まれる。
【0222】
局所または他の投与のため、本発明のオリゴヌクレオチドを、リポソーム中に包入するか、またはそれらリポソーム、特にカチオン性リポソームと複合体を形成させ得る。あるいは、オリゴヌクレオチドを、脂質中に、具体的にはカチオン性脂質と複合体化させ得る。脂肪酸およびエステル、薬学的に許容されるそれらの塩ならびにそれらの使用は、米国特許第6,287,860号にさらに記載されている。
【0223】
経口投与用の組成物および製剤は、粉剤もしくは顆粒剤、微粒子剤、ナノ粒子剤、水溶液中もしくは非水溶液中の懸濁剤もしくは液剤、カプセル、ゲルカプセル、サシェ剤、錠剤またはミニ錠剤を含む。増粘剤、香味剤、希釈剤、乳化剤、分散補助剤または結合剤が、望ましい場合がある。経口製剤は、本発明のオリゴヌクレオチドが1種以上の浸透促進界面活性剤およびキレート剤と共に投与されるものである。界面活性剤は、脂肪酸および/またはエステル、またはそれらの塩、胆汁酸および/またはそれらの塩を含む。胆汁酸/塩および脂肪酸ならびにそれらの使用は、米国特許第6,287,860号にさらに記載されており、これは参照により本明細書に組み込まれる。同様に用いられるのは、浸透促進剤の組み合わせ、例えば胆汁酸/塩との組み合わせでの脂肪酸/塩である。特に用いられる組み合わせは、ラウリン酸ナトリウム塩、カプリン酸およびUDCAである。さらなる浸透促進剤は、ポリオキシエチレン−9−ラウリルエーテル、ポリオキシエチレン−20−セチルエーテルを含む。本発明のオリゴヌクレオチドは、噴霧乾燥された粒子を含む顆粒形態またはマイクロまたはナノ粒子を形成するように複合体化されて経口送達され得る。オリゴヌクレオチド複合剤およびそれらの使用は、米国特許第6,287,860号にさらに記載されており、これは参照により本明細書に組み込まれる。
【0224】
非経口、髄腔内または脳室内投与のための組成物および製剤は、バッファー剤、希釈剤および他の適切な添加剤(限定しないが浸透促進剤、担体化合物および他の薬学的に許容される担体または賦形剤など)も含んでいてもよい滅菌水性溶液を含み得る。
【0225】
本発明の特定の実施形態は、1種以上のオリゴマー化合物および非アンチセンス機構により機能発揮する1種以上の他の化学療法剤を含有する医薬組成物を提供する。そのような化学療法剤の例としては、以下に限定されないが、ダウノルビシン、ダウノマイシン、ダクチノマイシン、ドキソルビシン、エピルビシン、イダルビシン、エソルビシン、ブレオマイシン、マホスファミド、イホスファミド、シトシンアラビノシド、ビスクロロエチル−ニトロソウレア、ブスルファン、ミトマイシンC、アクチノマイシンD、ミトラマイシン、プレドニゾン、ヒドロキシプレゲステロン、テストステロン、タモキシフェン、ダカルバシン、プロカルバジン、ヘキサメチルメラミン、ペンタメチルメラミン、ミトキサントロン、アムサクリン、クロランブシル、メチルシクロヘキシルニトロソウレア、ナイトロジェンマスタード、メルファラン、シクロホスファミド、6−メルカプトプリン、6−チオグアニン、シタラビン、5−アザシチジン、ヒドロキシウレア、デオキシコホルマイシン、4−ヒドロキシペルオキシシクロ−ホスホラミド、5−フルオロウラシル(5−FU)、5−フルオロデオキシウリジン(5−FUdR)、メトトレキサート(MTX)、コルヒチン、タキソール、ビンクリスチン、ビンブラスチン、エトポシド(VP−16)、トリメトレキサート、イリノテカン、トポテカン、ゲムシタビン、テニポシド、シスプラチンおよびジエチルスチルベステロール(DES)などの癌化学療法剤が含まれる。本発明の化合物と併用する場合、そのような化学療法剤は、別々に(例えば、5−FUとオリゴヌクレオチド)、連続して(例えば、一定期間の5−FUとオリゴヌクレオチドに続いてMTXとオリゴヌクレオチド)、または1種以上のそのような化学療法と併用して(例えば、5−FU、MTXとオリゴヌクレオチドまたは5−FU、放射線療法とオリゴヌクレオチド)使用され得る。限定しないが非ステロイド性抗炎症剤および副腎皮質ステロイドを含む抗炎症剤、および限定しないがリビビリン(ribivirin)、ビダラビン、アシクロビルおよびガンシクロビルを含む抗ウイルス剤も本発明の組成物に組み合わせることができる。アンチセンス化合物と他の非アンチセンス剤との組み合わせも本発明の範囲内である。2種以上の組み合わされた化合物は、一緒にまたは連続的に使用することができる。
【0226】
他の関連する実施形態において、本発明の組成物は、第1の核酸に標的化される1以上のアンチセンス化合物、特にオリゴヌクレオチド、および第2の核酸標的に標的化される1以上の追加のアンチセンス化合物を含み得る。例えば、第1の標的は、膵臓発生遺伝子の特定のアンチセンス配列であり得、第2の標的は他のヌクレオチド配列由来の領域であり得る。あるいは、本発明の組成物は、同じ膵臓発生遺伝子核酸標的の異なる領域に標的化される2種以上のアンチセンス化合物を含有できる。アンチセンス化合物の多くの例は、本明細書中に例示され、他は当技術分野において周知の適切な化合物中から選択され得る。2種以上の組み合わされた化合物は、一緒にまたは連続的に使用することができる。
【0227】
[投薬]
治療用組成物の処方およびそれらの続く投与(投薬)は、当業者の技能の範囲内であると考えられる。投薬は、数日間から数カ月間継続する、または治療が効果的になるかもしくは病態の減退が達成されるまでの治療過程において、治療される病態の重症度および応答性に応じて決まる。最適な投薬レジメンは、患者の身体での薬剤蓄積の測定値から算出され得る。当業者であれば、最適投与量、投薬方法および反復頻度を容易に決定できる。最適な投与量は、個々のオリゴヌクレオチドの相対的効力に応じて変動し得、一般に体外および生体内動物モデルにおいて効果的であると判明したEC50に基づいて推定され得る。一般に投与量は、体重1kgあたり0.01μg〜100gであり、1日に、1週間に、1カ月にもしくは1年に1回もしくは複数回またはさらに2〜20年ごとに1回である場合がある。当業者であれば、測定された滞留時間および体液または組織における薬剤の濃度に基づいて投薬の反復頻度を容易に推定できる。治療の成功に続いて、病態の再発を予防するために患者に維持療法を受けさせることが望ましい場合があり、ここでオリゴヌクレオチドは維持投与において体重1kgあたり0.01μg〜100g、1日1回または複数回から20年ごとに1回の範囲で投与される。
【0228】
いくつかの実施形態では、患者は、体重1kg当たり少なくとも約1mg、少なくとも約2mg、少なくとも約3mg、少なくとも約4mg、少なくとも約5mg、少なくとも約6mg、少なくとも約7mg、少なくとも約8mg、少なくとも約9mg、少なくとも約10mg、少なくとも約15mg、少なくとも約20mg、少なくとも約25mg、少なくとも約30mg、少なくとも約35mg、少なくとも約40mg、少なくとも約45mg、少なくとも約50mg、少なくとも約60mg、少なくとも約70mg、少なくとも約80mg、少なくとも約90mg、または少なくとも約100mgの用量の薬剤で処置される。アンチセンスオリゴヌクレオチドの特定の注射用量については、米国特許第7,563,884号、「Antisense modulation of PTP1B expression」に記載されており、これは参照によりその全内容が本明細書に組み入れられる。
【0229】
本発明の種々の実施形態が上記されているが、それらは単に例示の目的で提示されたものであって、限定を意図したものでないことは理解されるべきである。本発明の精神および範囲から逸脱することなく本明細書における開示内容にもとづいて、開示された実施形態に対してさまざまな変更を加えることができる。したがって本発明の範囲は、上記の実施形態のいずれによっても限定されるべきではない。
【0230】
本明細書中で言及される全ての文書は、参照により本明細書に組み込まれる。本出願中で引用する全ての刊行物および特許文書は、それぞれ個々の刊行物または特許文書が個々に記載された場合と同程度にあらゆる目的のために参照により本明細書に組み込まれる。出願人らは、本明細書における種々の参考文献の引用によって、いずれかの特定の参考文献が出願人らの発明の「先行技術」であることを認めるものではない。発明の組成物および方法の実施形態は、以下の実施例において例示される。
【実施例】
【0231】
以下の限定を意図しない実施例は、本発明の選択された実施形態を例示するものである。提示される構成部分の要素の割合を変えることや代替物は当業者に明らかであり、本発明の実施形態の範囲内であることは理解されよう。
【0232】
[実施例1:膵臓発生遺伝子ポリヌクレオチドに対する核酸分子アンチセンスおよび/または膵臓発生遺伝子ポリヌクレオチドのセンス鎖に特異的なアンチセンスオリゴヌクレオチドの設計]
上記の通り用語「に特異的なオリゴヌクレオチド」または「オリゴヌクレオチド標的」は、(i)標的遺伝子の一部分と安定な複合体を形成できる配列、または(ii)標的遺伝子のmRNA転写物の一部分と安定な2重鎖を形成できる配列を有するオリゴヌクレオチドを指す。
【0233】
適切なオリゴヌクレオチドの選択は、核酸配列を自動的に配列比較し、同一または相同な領域を示すコンピュータープログラムを使用することによって容易に行える。そのようなプログラムは、例えばGenbankなどのデータベースを検索することによって、またはPCRの産物を配列決定することによって得られた核酸配列を比較するために使用される。さまざまな種由来の核酸配列の比較により、種の間で適切な程度の同一性を示す核酸配列の選択が可能になる。配列決定されていない遺伝子の場合は、標的種と他の種とでの遺伝子間の同一性の程度の決定を可能にするためにサザンブロットが実施される。さまざまな程度のストリンジェンシーでサザンブロットを実行することによって、当技術分野において周知であるとおり、同一性の近似測定値を得ることが可能である。これらの手順によって、制御される対象での標的核酸配列への高い程度の相補性、および他の種での対応する核酸配列への低い程度の相補性を示すオリゴヌクレオチドの選択が可能となる。当業者であれば、本発明における使用のために遺伝子の適切な領域を選択することには相当な自由度が存在することを理解されよう。
【0234】
アンチセンス化合物は、標的核酸への化合物の結合が標的核酸の通常の機能に干渉し、機能および/または活性の調節を生じる場合で、かつ特異的結合が望まれる条件下(すなわち生体内アッセイまたは治療的処置の場合での生理的条件下および体外アッセイの場合でのアッセイが実施される条件下)で、非標的核酸配列へのアンチセンス化合物の非特異的結合を回避するのに十分な程度の相補性がある場合に、「特異的にハイブリダイズ可能」である。
【0235】
本明細書において記載するオリゴヌクレオチドのハイブリダイゼーション特性は、当技術分野において周知の1以上の体外アッセイによって決定され得る。例えば本明細書に記載するオリゴヌクレオチドの特性は、標的天然アンチセンスと潜在的薬剤分子との間の結合強度を融解曲線アッセイを使用して測定することによって得られる。
【0236】
標的天然アンチセンスと潜在的薬剤分子(「分子」)との間の結合強度は、分子間相互作用の強度を測定する任意の確立された方法、例えば融解曲線アッセイを使用して推定することができる。
【0237】
融解曲線アッセイは、天然アンチセンス/「分子」複合体に関して2本鎖立体構造から1本鎖立体構造への急速な移行が生じる温度を決定する。この温度は、2分子間の相互作用強度の信頼できる測定値として広く認められている。
【0238】
融解曲線アッセイは、実際の天然アンチセンスRNA分子のcDNA複製物または「分子」の結合部位に対応する合成DNAもしくはRNAヌクレオチドを使用して実施され得る。このアッセイを実行するために必要な全ての試薬を含むマルチプルキットが利用可能である(例えば、Applied Biosystems Inc.MeltDoctor kit)。これらのキットは、2本鎖DNA(dsDNA)結合色素(ABI HRM dyes、SYBR Green、SYTOなど)の1つを含有する適切なバッファーを含む。dsDNA色素の特性は、それらは遊離形態ではほとんど蛍光を発光しないが、dsDNAに結合した場合は高度に蛍光性であるものである。
【0239】
アッセイを実施するために、cDNAまたは対応するオリゴヌクレオチドを「分子」と特定の製造者のプロトコルに定められた濃度で混合する。混合物をすでに形成された全てのdsDNA複合体を解離させるため95℃に加熱し、次いでDNA分子をアニールさせるために室温またはキット製造者によって定められた他の低い温度まで徐冷する。新たに形成された複合体を、次いで反応によって産生される蛍光量についてのデータを連続に収集しながら同時にゆっくりと95℃まで加熱する。蛍光強度は、反応物中に存在するdsDNAの量に反比例する。データは、キットに適合するリアルタイムPCR装置(例えば、ABIのStepOne Plus Real Time PCR SystemまたはLightTyper instrument、Roche Diagnostics、Lewes、UK)を使用して収集できる。
【0240】
融解ピークは、適切なソフトウエア(例えば、LightTyper(Roche)またはSDS Dissociation Curve、ABI)を使用して、温度に関する蛍光の負の微分係数(−d(蛍光)/dT)y軸)を温度(x軸)に対してプロットすることによって作図する。dsDNA複合体から単鎖分子への急速な移行の温度を特定するべくデータを分析する。この温度をTmと称し、2分子間の相互作用の強度に正比例する。典型的にはTmは40℃を超える。
【0241】
[実施例2:膵臓発生遺伝子ポリヌクレオチドの調節]
[HepG2細胞のアンチセンスオリゴヌクレオチドによる処置]
ATCC(cat#HB−8065)由来のHepG2細胞を増殖培地(MEM/EBSS(Hyclone cat#SH30024またはMediatech cat#MT−10−010−CV)+10%FBS(Mediatech cat#MT35−011−CV)+ペニシリン/ストレプトマイシン(Mediatech cat#MT30−002−CI))中、37℃、5%CO2で増殖させた。実験一日前に細胞を6穴プレートに1.5×105/mlの密度で再度プレートし、37℃、5%CO2でインキュベートした。実験当日に6穴プレートの培地を新鮮な増殖培地に交換した。全てのアンチセンスオリゴヌクレオチドを濃度20μMに希釈した。この溶液2μlをOpti−MEM培地(Gibco cat#31985−070)400μlおよびLipofectamine 2000(Invitrogen cat#11668019)4μlと室温で20分間インキュベートし、HepG2細胞を含む6穴プレートの各ウエルに添加した。該オリゴヌクレオチド溶液の代わりに水2μlを含む同様の混合物を偽トランスフェクト対照に使用した。37℃、5% CO2での3〜18時間のインキュベーション後、培地を新鮮増殖培地に交換した。アンチセンスオリゴヌクレオチドの添加の48時間後、培地を除去し、Promega製のSV Total RNA Isolation System(cat #Z3105)またはQiagen製のRNeasy Total RNA Isolation kit(cat #74181)を製造者の説明書に従って使用して、RNAを細胞から抽出した。600ngのRNAを、Thermo Scientific製のVerso cDNAキット(cat#AB1453B)またはHigh Capacity cDNA Reverse Transcriptionキット(cat#4368813)を製造者の説明書に記載のとおり使用して得た逆転写反応物に加えた。この逆転写反応からのcDNAを使用して、ABI Taqman gene Expression Mix(cat#4369510)およびABI(Applied Biosystems Taqman Gene Expression Assay:Hs01922995_s1、Hs01651425_s1、およびHs00426216_m1:Applied Biosystems Inc.,Foster City CA)によって設計されたプライマー/プローブを使用するリアルタイムPCRによって遺伝子発現をモニタリングした。使用したPCRサイクルは次の通り:50℃で2分間、95℃で10分間、(95℃で15秒間、60℃で1分間)を40サイクル、M×4000サーマルサイクラー(Stratagene)を使用。アンチセンスオリゴヌクレオチドで処置した後の遺伝子発現の変化率を、処置サンプルと偽トランスフェクトサンプルの間の18S標準化dCt値の差に基づいて計算した。
【0242】
[結果]:
リアルタイムPCR結果は、Lipofectamine 2000を用いて導入されたホスホロチオエートオリゴヌクレオチドによるHepG2細胞の処置の後のNeuroD1のmRNAレベルの、対照と比較した倍率変化+標準偏差を示した(図1)。
【0243】
リアルタイムPCR結果は、HepG2細胞中のMAFAのmRNAのレベルが、MAFAアンチセンスBM127748に対して設計されたオリゴの1つで処置した48時間後に有意に増大することを示している(図3)。
【0244】
リアルタイムPCR結果は、HepG2細胞中のPDX1のmRNAのレベルが、PDX1アンチセンスHs.416201に対して設計されたオリゴの1つで処置した48時間後に有意に増大することを示している(図4)。
【0245】
[518A2細胞のアンチセンスオリゴヌクレオチドによる処置]
Albert Einstein−Montefiore Cancer Center,NYから入手した518A2細胞を増殖培地(MEM/EBSS(Hyclone cat#SH30024またはMediatech cat#MT−10−010−CV)+10%FBS(Mediatech cat#MT35−011−CV)+ペニシリン/ストレプトマイシン(Mediatech cat#MT30−002−CI))中、37℃、5%CO2で増殖させた。実験の一日前に6穴プレートに1.5×105/mlの密度で再度プレートし、37℃でインキュベートした。実験当日に6穴プレートの培地を新鮮な増殖培地に交換した。全てのアンチセンスオリゴヌクレオチドを濃度20μMに希釈した。この溶液2μlをOpti−MEM培地(Gibco cat#31985−070)400μlおよびLipofectamine 2000(Invitrogen cat#11668019)4μlと室温で20分間インキュベートし、518A2細胞を含む6穴プレートの各ウエルに添加した。該オリゴヌクレオチド溶液の代わりに水2μlを含む同様の混合物を偽トランスフェクト対照に使用した。37℃、5% CO2での3〜18時間のインキュベーション後、培地を新鮮増殖培地に交換した。アンチセンスオリゴヌクレオチドの添加の48時間後、培地を除去し、Promega製のSV Total RNA Isolation System(cat #Z3105)またはQiagen製のRNeasy Total RNA Isolation kit(cat #74181)を製造者の説明書に従って使用して、RNAを細胞から抽出した。600ngのRNAを、Thermo Scientific製のVerso cDNAキット(cat#AB1453B)またはHigh Capacity cDNA Reverse Transcriptionキット(cat#4368813)を製造者の説明書に記載のとおり使用して得た逆転写反応物に加えた。この逆転写反応からのcDNAを使用して、ABI Taqman gene Expression Mix(cat#4369510)およびABI(Applied Biosystems Taqman Gene Expression Assay:Hs1023298_m1:Applied Biosystems Inc.,Foster City CA)によって設計されたプライマー/プローブを使用するリアルタイムPCRによって遺伝子発現をモニタリングした。使用したPCRサイクルは次の通り:50℃で2分間、95℃で10分間、(95℃で15秒間、60℃で1分間)を40サイクル、StepOne Plus Real Time PCR Machine(Applied Biosystems)を使用。アンチセンスオリゴヌクレオチドで処置した後の遺伝子発現の変化率を、処置サンプルと偽トランスフェクトサンプルの間の18S標準化dCt値の差に基づいて計算した。
【0246】
[結果]:
リアルタイムPCR結果は、518A2細胞におけるHNF4AのmRNAのレベルが、HNF4Aアンチセンス転写物BX099913、BC071794およびAF143870に対するオリゴで処置した48時間後に有意に増大することを示している(図2)。
【0247】
[MCF−7細胞のアンチセンスオリゴヌクレオチドによる処置]
ATCCから入手した(cat#HTB−22)MCF−7細胞を増殖培地(MEM/EBSS(Hyclone cat#SH30024またはMediatech cat#MT−10−010−CV)+10%FBS(Mediatech cat#MT35−011−CV)+ペニシリン/ストレプトマイシン(Mediatech cat#MT30−002−CI))中、37℃、5%CO2で増殖させた。実験の一日前に6穴ブレートに1.5×105/mlの密度で再度プレートし、37℃でインキュベートした。実験当日に6穴プレートの培地を新鮮な増殖培地に交換した。全てのアンチセンスオリゴヌクレオチドを濃度20μMに希釈した。この溶液2μlをOpti−MEM培地(Gibco cat#31985−070)400μlおよびLipofectamine 2000(Invitrogen cat#11668019)4μlと室温で20分間インキュベートし、MCF−7細胞を含む6穴プレートの各ウエルに添加した。該オリゴヌクレオチド溶液の代わりに水2μlを含む同様の混合物を偽トランスフェクト対照に使用した。37℃、5% CO2での3〜18時間のインキュベーション後、培地を新鮮増殖培地に交換した。アンチセンスオリゴヌクレオチドの添加の48時間後、培地を除去し、Promega製のSV Total RNA Isolation System(cat #Z3105)またはQiagen製のRNeasy Total RNA Isolation kit(cat #74181)を製造者の説明書に従って使用して、RNAを細胞から抽出した。600ngのRNAを、Thermo Scientific製のVerso cDNAキット(cat#AB1453B)またはHigh Capacity cDNA Reverse Transcriptionキット(cat#4368813)を製造者の説明書に記載のとおり使用して得た逆転写反応物に加えた。この逆転写反応からのcDNAを使用して、ABI Taqman gene Expression Mix(cat#4369510)およびABI(Applied Biosystems Taqman Gene Expression Assay:Hs00232355_m1によって設計されたプライマー/プローブを使用するリアルタイムPCRによって遺伝子発現をモニタリングした。使用したPCRサイクルは次の通り:50℃で2分間、95℃で10分間、(95℃で15秒間、60℃で1分間)を40サイクル、StepOne Plus Real Time PCR Machine(Applied Biosystems)を使用。
【0248】
アンチセンスオリゴヌクレオチドで処置した後の遺伝子発現の変化率を、処置サンプルとモックトランスフェクトサンプルとの間の18S標準化dCt値の差に基づいて計算した。
【0249】
[結果]:
リアルタイムPCR結果は、MCF−7細胞中のNKX6−1のmRNAのレベルが、NKX6−1アンチセンスtorsnaby.aApr07−unspliced(スプライシングされていないもの)に対して設計されたオリゴの1つで処置した48時間後に有意に増大することを示している(図5)。
【0250】
本発明は、1以上の実施形態に関して例示および説明してきたが、本明細書および添付図面の解釈および理解にもとづき当業者は均等な変更および改変に想到できよう。加えて、本発明の特定の特性がいくつかの実施形態のうちの1つにだけ関連して開示されている場合があるが、そのような特性は、他の実施形態の1以上の他の特性と、任意の所与のまたは特定の用途のために望ましくかつ有利であり得るように組み合わせることができる。
【0251】
開示内容の要約により、技術的開示内容の性質を読者が速やかに確認できるであろう。この要約は、以下の特許請求の範囲の範囲または意味を解釈または限定するために使用されないとの理解を前提として提示されたものである。
【技術分野】
【0001】
本出願は、2010年1月6日に提出された米国仮特許出願第61/292,508号、2010年1月12日に提出された米国仮特許出願第61/294,129号、2010年1月25日に提出された米国仮特許出願第61/297,847号、2010年1月25日に提出された米国仮特許出願第61/297,863号、および2010年4月12日に提出された米国仮特許出願第61/323,027号の優先権を主張し、当該米国仮特許出願は、参照によりその全内容が本明細書に組み入れられる。
【0002】
本発明の実施形態は、膵臓発生遺伝子および関連分子の発現および/または機能を調節するオリゴヌクレオチドを含む。
【背景技術】
【0003】
DNA−RNAおよびRNA−RNAハイブリダイゼーションは、DNA複製、転写、および翻訳を含む、核酸の機能の多くの側面にとって重要である。ハイブリダイゼーションはまた、特定の核酸を検出するか、またはその発現を変化させるさまざまな技術の中心となる。アンチセンスヌクレオチドは、例えば、標的RNAにハイブリダイズし、RNAスプライシング、転写、翻訳、複製を妨害することによって遺伝子発現を阻害する。アンチセンスDNAは、DNA−RNAハイブリッドがほとんどの細胞型に存在している活性であるリボヌクレアーゼHよる消化の基質として機能するという付加的な特徴を備える。アンチセンス分子は、オリゴヌクレオチドの場合(ODN)に細胞内に送達することができ、またはRNA分子として内因性遺伝子から発現させることができる。FDAは最近、アンチセンスが治療的有用性を有する点を反映させた、(サイトメガロウイルス網膜炎の治療用の)アンチセンス薬、VITRAVENE(商標)を承認した。
【発明の概要】
【発明が解決しようとする課題】
【0004】
一実施形態において、本発明は、天然のアンチセンス転写物の作用を阻害するための方法であって、当該天然のアンチセンス転写物の任意の領域を標的としたアンチセンスオリゴヌクレオチドを用いることにより、対応するセンス遺伝子をアップレギュレートする、該方法を提供する。本出願においては、前記天然のアンチセンス転写物の阻害が、本発明の範囲に包含されると考えられるsiRNA、リボザイム、および小分子により達成され得ることも想定されている。
【0005】
一実施形態は、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、前記細胞または組織を、5〜30個のヌクレオチドの長さのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記オリゴヌクレオチドは、配列番号6の1番目〜1235番目のヌクレオチド、配列番号7の1番目〜17,964番目のヌクレオチド、配列番号8の1番目〜50,003番目のヌクレオチド、配列番号9の1番目〜486番目のヌクレオチド、配列番号10の1番目〜494番目のヌクレオチド、配列番号11の1番目〜1992番目のヌクレオチド、および配列番号12の1番目〜1767番目のヌクレオチドの範囲内の連続した5〜30個のヌクレオチドを含むポリヌクレオチドに対する逆相補配列と少なくとも50%の配列同一性を有する、該ステップを含み、それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法を提供する。
【0006】
別の実施形態では、オリゴヌクレオチドが、膵臓発生遺伝子ポリヌクレオチドの天然のアンチセンス配列、例えば配列番号6乃至12に記載のヌクレオチド、およびその変異型、アレル、ホモログ、突然変異体、誘導体、断片、および相補配列を標的とする。アンチセンスオリゴヌクレオチドの例としては、配列番号13乃至45に記載のものが挙げられる。
【0007】
別の実施形態は、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、前記細胞または組織を、5〜30個のヌクレオチドの長さのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスに対する逆相補配列と少なくとも50%の配列同一性を有する、該ステップを含み、それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法を提供する。
【0008】
別の実施形態は、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、前記細胞または組織を、5〜30個のヌクレオチドの長さのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記オリゴヌクレオチドは、膵臓発生遺伝子アンチセンスポリヌクレオチドのアンチセンスオリゴヌクレオチドと少なくとも50%の配列同一性を有する、該ステップを含み、それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法を提供する。
【0009】
一実施形態では、組成物が、センスおよび/またはアンチセンス膵臓発生遺伝子ポリヌクレオチドに結合する1以上のアンチセンスオリゴヌクレオチドを含む。
【0010】
別の実施形態では、前記オリゴヌクレオチドは、1以上の修飾または置換されたヌクレオチドを含む。
【0011】
別の実施形態では、前記オリゴヌクレオチドが、1以上の修飾された結合を含む。
【0012】
さらに別の実施形態では、前記修飾されたヌクレオチドが、ホスホロチオアート、メチルホスホナート、ペプチド核酸、2’−O−メチル、フルオロ−または炭素、メチレンまたは他のロックト核酸(LNA)分子を含む修飾塩基を含む。好ましくは、前記修飾されたヌクレオチドは、α−L−LNAを含む、ロックト核酸分子である。
【0013】
別の実施形態では、前記オリゴヌクレオチドは、患者に対し皮下に、筋肉内に、静脈内に、または腹腔内に投与される。
【0014】
別の実施形態では、前記オリゴヌクレオチドは、医薬組成物として投与される。治療レジメンは、患者に対して前記アンチセンス化合物を少なくとも1回投与することを含む。しかし、この処置は、一定期間にわたって複数回の投与を含むように改変することができる。この処置は、1種類以上の他の治療と併用することができる。
【0015】
別の実施形態では、前記オリゴヌクレオチドが、リポソームに包入されるか、担体分子(例えばコレステロール、TATペプチド)に付着される。
【0016】
他の態様は、以下に説明する。
【図面の簡単な説明】
【0017】
【図1】HepG2細胞をLipofectamine2000を用いて導入されたホスホロチオアートオリゴヌクレオチドで処置した後のNEUROD1のmRNAの対照と比較した倍率変化+標準偏差を示すリアルタイムPCRの結果のグラフである。リアルタイムPCRの結果は、HepG2細胞におけるNEUROD1のmRNAのレベルが、NEUROD1アンチセンスSteedo.aApr07に設計されたオリゴの1つで処置後48時間で有意に上昇していることを示している。CUR−1373、CUR−1374、CUR−1375、およびCUR−1376と付記されたバーは、それぞれ配列番号13−配列番号16で処置されたサンプルに対応する。
【図2】518A2細胞をLipofectamine2000を用いて導入されたホスホロチオアートオリゴヌクレオチドで処置した後のHNF4AのmRNAの対照と比較した倍率変化+標準偏差を示すリアルタイムPCRの結果のグラフである。CUR−1194、CUR−1195、CUR−1193、CUR−1192、CUR−1191、CUR−1190、CUR−1188、CUR−1189、CUR−1187、CUR−1186、CUR−1182、CUR−1183、CUR−1185、CUR−1184、およびCUR−1181と付記されたバーは、それぞれ配列番号17−配列番号31で処置されたサンプルに対応する。
【図3】HepG2細胞をLipofectamine2000を用いて導入されたホスホロチオアートオリゴヌクレオチドで処置した後のMAFAのmRNAの対照と比較した倍率変化+標準偏差を示すリアルタイムPCRの結果のグラフである。リアルタイムPCRの結果は、HepG2細胞におけるMAFAのmRNAのレベルが、MAFAアンチセンスBM127748に設計されたオリゴの1つで処置後48時間で有意に上昇していることを示している。CUR−1207、CUR−1209、CUR−1208、CUR−1210、およびCUR−1211と付記されたバーは、それぞれ配列番号32−配列番号36で処置されたサンプルに対応する。
【図4】HepG2細胞をLipofectamine2000を用いて導入されたホスホロチオアートオリゴヌクレオチドで処置した後のPDX1のmRNAの対照と比較した倍率変化+標準偏差を示すリアルタイムPCRの結果のグラフである。リアルタイムPCRの結果は、HepG2細胞におけるPDX1のmRNAのレベルが、MAFAアンチセンスHs.416201に設計されたオリゴのなかの2つで処置後48時間で有意に上昇していることを示している。CUR−1388、CUR−1389、CUR−1390、CUR−1391、およびCUR−1392と付記されたバーは、それぞれ配列番号37−配列番号41で処置されたサンプルに対応する。
【図5】MCF−7細胞をLipofectamine2000を用いて導入されたホスホロチオアートオリゴヌクレオチドで処置した後のNKX6−1のmRNAの対照と比較した倍率変化+標準偏差を示すリアルタイムPCRの結果のグラフである。CUR−1501乃至CUR−1504と付記されたバーは、それぞれ配列番号42−配列番号45で処置されたサンプルに対応する。
【発明を実施するための形態】
【0018】
[配列表の説明]
配列番号1:ヒト神経発生分化1(NEUROD1)、mRNA(NCBI登録番号:NM_002500)。配列番号2:ヒト肝細胞核因子4−α(HNFA)、転写物変異型2、mRNA(NCBI登録番号:NM_000457)。配列番号3:ヒトv−maf筋腱膜性線維肉腫癌遺伝子のホモログA(トリ)(MFFA)、mRNA(NCBI登録番号:NM_201589)。配列番号4:ヒト膵臓十二指腸ホメオボックス−1(PDX1)、mRNA(NCBI登録番号:NM_000209)。配列番号5:ヒトNK6ホメオボックス1(NKX6−1)、mRNA(NCBI登録番号:NM_006168)。配列番号6乃至配列番号12:配列番号6:天然NEUROD1アンチセンス配列(Steedo.aApr07);配列番号7:天然HNF4Aアンチセンス配列(AF143870);配列番号8:天然HNF4Aアンチセンス配列(BC071794);配列番号9:天然HNF4Aアンチセンス配列(BX099913);配列番号10:天然HNFAアンチセンス配列(BM127748);配列番号11:天然PDX1アンチセンス配列(Hs.416201);および配列番号12:天然NKX6−1アンチセンス配列(torsnaby.aApr07−unspliced(スプライシングされていないもの))。配列番号13乃至配列番号45:アンチセンスオリゴヌクレオチド。*はホスホチオエート結合を示す。
【0019】
[詳細な説明]
本発明のいくつかの態様について、例示のための応用例を参照して以下に説明する。種々の特定の細部、関係、および方法は、本発明の完全な理解のために記載されていることを理解されたい。しかし、本発明を、1以上の特定の細部を用いることなく、または他の方法を用いて実施できることは、当業者には容易に理解されよう。本発明は、行為や事象の順序によって限定されず、いくつかの行為は、異なる順序で、および/または他の作用または事象と同時に発生し得る。さらに、すべての例示された行為または事象は、本発明による方法を実施するために必ずしも必要ではない。
【0020】
本明細書に記載されるすべての遺伝子、遺伝子名、および遺伝子産物は、本明細書に記載される組成物および方法が適用される任意の種由来のホモログに対応するものとする。したがって、この用語は、以下に限定しないが、ヒトおよびマウス由来の遺伝子および遺伝子産物を包含する。特定の種に由来する遺伝子または遺伝子産物が開示される場合、この開示内容は、例示のみを意図するものであり、それが現れた文脈が明示的に示さない限り、限定として解釈すべきものではない。したがって、例えば、本明細書に開示する遺伝子であって、いくつかの実施形態においてそれが哺乳動物の核酸およびアミノ酸配列に関連するものは、以下に限定しないが、他の哺乳類、魚類、両生類、爬虫類、および鳥類を含む他の動物に由来するホモログおよび/またはオルソログ遺伝子および遺伝子産物を包含するものとする。いくつかの実施形態では、該遺伝子または核酸配列はヒト由来である。
【0021】
[定義]
本明細書で使用される用語の選択は、特定の実施形態を説明する目的でされたものであり、本発明を限定することを意図するものではない。本明細書で使用される場合、単数形の「a」、「an」、及び「the」は文脈において明らかに別記されない限り、複数形の内容も含むものとする。さらに、用語「含む」、「含める」、「有する」、「もつ」またはその変化形は、本明細書および/または添付の請求項において使用される場合、用語「包含する」と同様に非排他的な意味で用いられるものとする。
【0022】
用語「約」または「概ね」は、当業者が決定した特定の数値について許容される誤差範囲内にあることを意味し、当該誤差範囲は、部分的には、その数値がどのように測定または決定されたか、すなわち測定システムの限界に応じて決まる。例えば、「約」は、本技術分野での習慣に従って、1またはそれ以上の標準偏差内に収まっていることを意味し得る。あるいは、「約」は、所与の数値に対し、最大20%、好ましくは最大10%、より好ましくは最大5%、さらに好ましくは最大1%の範囲を意味し得る。あるいは、特に生物学的な系またはプロセスに関して、この用語は、ある数値に対し、1桁分(10倍)以内、より好ましくは5倍以内、さらに好ましくは2倍以内を意味し得る。特定の数値が本明細書および特許請求の範囲に記載される場合、特に別記されない限り、特定の数値の許容される誤差範囲ないであることを意味する用語「約」が仮定されるものとする。
【0023】
本明細書で使用される用語「mRNA」は、標的化された遺伝子の既知のmRNA転写物、および解明され得る他の転写物を意味する。
【0024】
「アンチセンスオリゴヌクレオチド」または「アンチセンス化合物」という表現によって、他のRNAまたはDNA(標的RNA、DNA)に結合するRNAまたはDNA分子を意味する。例えば、RNAオリゴヌクレオチドの場合、RNA−RNA相互作用によって他のRNA標的に結合し、その標的RNAの活性を変化させる。アンチセンスオリゴヌクレオチドは、特定のポリヌクレオチドの発現および/または機能をアップレギュレートまたはダウンレギュレートすることができる。この定義は、治療、診断、または他の観点から有用である任意の外来のRNAまたはDNA分子を含むことを意味する。そのような分子としては、例えば、標的核酸の少なくとも一部とハイブリダイズするアンチセンスRNAまたはDNA分子、干渉RNA(RNAi)、マイクロRNA、デコイRNA分子、siRNAは、酵素RNA、治療編集RNAおよびアゴニストおよびアンタゴニストのRNA、アンチセンスオリゴマー化合物、アンチセンスオリゴヌクレオチド、外部ガイド配列(EGS)オリゴヌクレオチド、選択的スプライサー、プライマー、プローブ、および他のオリゴマー化合物が挙げられる。このようなものとして、これらの化合物は、一本鎖の、二本鎖の、部分的一本鎖の、または環状オリゴマー化合物の形で導入し得る。
【0025】
本発明の文脈において、用語「オリゴヌクレオチド」は、リボ核酸(RNA)またはデオキシリボ核酸(DNA)またはその模倣物質のオリゴマーまたはポリマーを指す。用語「オリゴヌクレオチド」という用語はまた、デオキシリボヌクレオシド、リボヌクレオシド、その置換型またはαアノマー型、ペプチド核酸(PNA)、ロックト核酸(LNA)、ホスホロチオエート、メチルホスホナートなどを含む、天然および/または修飾されたモノマーまたは結合の直鎖状または環状のオリゴマーを含む。オリゴヌクレオチドは、ワトソン・クリック型塩基対、フーグスティーン型または逆フーグスティーン型塩基対などのモノマー−モノマー相互作用の規則的なパターンによって、標的ポリヌクレオチドに特異的に結合することができる。
【0026】
オリゴヌクレオチドは、「キメラ」すなわち異なる領域から構成されているものであってよい。本発明の文脈において、「キメラ」化合物は、例えば、DNA領域(S)、RNA領域(S)、PNA領域(S)などの2以上の化学領域を含むオリゴヌクレオチドである。各化学領域は、少なくとも1つのモノマー単位、すなわち、オリゴヌクレオチド化合物の場合ではヌクレオチドから構成されている。これらのオリゴヌクレオチドは、一般的には、そのオリゴヌクレオチドが1以上の所望の特性を発揮するべく修飾されている少なくとも1つの領域を含む。該オリゴヌクレオチドの所望の特性としては、以下に限定されないが、例えば、ヌクレアーゼ分解に対する高い抵抗性、高い細胞取り込み、および/または標的核酸に対する高い結合親和性などが挙げられる。したがって、オリゴヌクレオチドの異なる領域は、異なる特性を有し得る。本発明のキメラオリゴヌクレオチドは、上記のような、2以上のオリゴヌクレオチド、修飾オリゴヌクレオチド、オリゴヌクレオシド、および/またはオリゴヌクレオチドアナログの混合構造として形成することができる。
【0027】
オリゴヌクレオチドは、「位置を揃えた形」で(in ”register”)結合され得る複数の領域から構成されるものであり得、すなわちモノマーが連続して結合される場合、天然DNAの場合と同様に結合されるか、またはスペーサーを介して結合され得る。スペーサーは、領域間の共有結合「架橋」を構成することを意図し、いくつかの場合において炭素原子約100個を超えない長さを有する。スペーサーは、さまざまな機能(例えば正電荷または負電荷の含有)を保持でき、特殊な核酸結合特性(干渉物質、グルーブバインダー、毒素、フルオロフォアなど)を保持でき、親油性であり、例えばアルファヘリックスを誘導するアラニン含有ペプチドのように、特殊な2次構造を誘導する。
【0028】
本明細書において使用される「膵臓発生遺伝子群」および「膵臓発生遺伝子」は、ファミリーの全メンバー、変異体、アレル、断片、種、コード配列および非コード配列、センスおよびアンチセンスポリヌクレオチド鎖などを非排他的に包含する。
【0029】
本明細書において使用される用語「ヒト神経発生分化1」、「ヒト神経発生分化因子1」、NEUROD1、BETA2、BHF−1、bHLHa3、NeuroD、NEUROD、NeuroD1は、文献では同義のものとみなされ、本出願において互換的に使用される。
【0030】
本明細書において使用される用語「肝細胞核因子4−α」、「肝細胞核因子4α」、HNF4α;HNF4A、HNF−4α、MODY、MODY1、NR2A1、NR2A21、TCF、TCF14、転写因子14、APF、LFB1、およびHP1は、文献では同義のものとみなされ、本出願において互換的に使用される。
【0031】
本明細書において使用される用語「v−maf筋腱膜性線維肉腫癌遺伝子のホモログA」、MAFA、hMafA、v−maf、mafA、膵β細胞特異的転写活性化因子、RIPE3b1、転写因子MafA、転写因子RIPE3b1、V−maf筋腱膜線維肉腫癌遺伝子ホモログ(トリ)は、文献では同義のものとみなされ、本出願において互換的に使用される。
【0032】
本明細書において使用される用語「膵臓十二指腸ホメオボックス−1」、PDX1、PDX−1、グルコース感受性因子、GSF、IDX−1、インスリンプロモーター因子1、インスリンの上流因子1、IPF1、IPF−1、膵島/十二指腸ホメオボックス−1、IUF1、IUF−1、MODY4、膵臓/十二指腸ホメオボックスタンパク質1、ソマトスタチントランス活性化因子1、STF−1は、文献では同義のものとみなされ、本出願において互換的に使用される。
【0033】
本明細書において使用される用語、NK6ホメオボックス1、NKX6−1、ホメオボックスタンパク質NK−6ホモログA、ホメオボックスタンパク質Nkx−6.1、Nkx6.1、NKX6.1、およびNKX6Aは、文献では同義のものとみなされ、本出願において互換的に使用される。
【0034】
本明細書において使用される用語「に特異的なオリゴヌクレオチド」または「を標的にするオリゴヌクレオチド」は(i)標的遺伝子の一部分と安定な複合体を形成できる配列、または(ii)標的遺伝子のmRNA転写物の一部分と安定な2重鎖を形成できる配列を有するオリゴヌクレオチドを意味する。複合体および2重鎖の安定性は、理論計算および/または体外アッセイによって決定され得る。ハイブリダイゼーション複合体および2重鎖の安定性を決定するための典型的方法は、下記の実施例において記載される。
【0035】
本明細書において使用される用語「標的核酸」は、DNA、そのようなDNAから転写されたRNA(プレmRNAおよびmRNAを含む)、およびそのようなRNA、コード配列、非コード配列、センスまたはアンチセンスポリヌクレオチドに由来するcDNAも包含する。オリゴマー化合物のその標的核酸との特異的ハイブリダイゼーションは、核酸の通常の機能を妨げる。特異的にハイブリダイズする化合物による標的核酸の機能に対するこの調節は、通常「アンチセンス」と称される。干渉されるDNAの機能には、例えば複製および転写が含まれる。干渉されるRNAの機能として、例えばタンパク質翻訳部位へのRNAの転座、RNAからのタンパク質の翻訳、1つまたは複数のmRNA種を得るためのRNAのスプライシング、およびRNAが関与し得る、またはRNAによって促進され得る触媒活性などの全ての生体機能が挙げられる。標的核酸機能でのそのような干渉の全体的効果は、コードされる産物またはオリゴヌクレオチドの発現の調節である。
【0036】
RNA干渉「RNAi」は、「標的」核酸配列に配列特異的相同性を有する2本鎖RNA(dsRNA)分子によって介在される。本発明の特定の実施形態において介在物質は、5〜25ヌクレオチドの「低分子干渉」RNA2重鎖(siRNA)である。siRNAは、ダイサーとして周知のRNase酵素によるdsRNAのプロセシングに由来する。siRNA 2重鎖産物は、RISC(RNA Induced Silencing Complex、RNA誘導サイレンシング複合体)と称される多タンパク質siRNA複合体に入る。なんらかの特定の理論にも制約されることを言う意図はないが、次いでRISCは、siRNA 2重鎖が配列特異的方法で相互作用し、触媒的に切断を介在する標的核酸(適切にはmRNA)に導かれると考えられる。本発明により使用され得る低分子干渉RNAは、当技術分野において十分に周知であり、当業者によく知られている手順に従って合成および使用され得る。本発明の方法における使用のための低分子干渉RNAは、適切には約1〜約50の間のヌクレオチド(nt)を含む。非限定的実施形態の例において、siRNAは約5〜約40nt、約5〜約30nt、約10〜約30nt、約15〜約25ntまたは約20〜25ヌクレオチドを含み得る。
【0037】
適切なオリゴヌクレオチドの選択は、自動的に核酸配列のアラインメントをとり、同一または相同な領域を示すコンピュータープログラムを使用することによって容易になる。そのようなプログラムは、例えばGenBankなどのデータベースを検索することによって、またはPCR産物を配列決定することによって得られた核酸配列を比較するために使用される。さまざまな種由来の核酸配列の比較により、種の間で適切な程度の同一性を示す核酸配列の選択が可能になる。配列決定されていない遺伝子の場合は、標的種および他の種における遺伝子間での同一性の程度の決定を可能にするサザンブロットが実施される。当技術分野においてよく知られるように、種々の程度のストリンジェンシーでのサザンブロットを実施することによって、同一性の概算的測定値を得ることが可能である。これらの手順は、管理される対象における標的核酸配列に高い相補性を示し、他の種における対応する核酸配列に低い相補性を示すオリゴヌクレオチドの選択を可能にする。当業者であれば、本発明における使用のための遺伝子の適切な領域を選択することにおいては相当な許容範囲があることを理解されよう。
【0038】
「酵素的RNA」によって酵素活性を有するRNA分子が意味される。酵素的核酸(リボザイム)は、最初に標的RNAに結合することによって作用する。そのような結合は、標的RNAを切断するべく作用する分子の酵素的部分の近接に保持される酵素的核酸の標的結合部分を通じて生じる。したがって酵素的核酸は、最初に標的RNAを認識し、次いで塩基対形成を通じて結合し、一旦正しい部位に結合すると標的RNAを切断するべく酵素的に作用する。
【0039】
「デコイRNA」は、リガンドに対する天然結合ドメインを模倣するRNA分子を意味する。したがってデコイRNAは、特異的リガンドの結合に関して天然結合標的と競合する。例えば、HIVトランス活性化応答(TAR)RNAの過剰発現は、「デコイ」として作用することができ、HIV tatタンパク質に効率的に結合し、それによりHIV RNAにコードされるTAR配列へのその結合を阻害することが判明している(Sullengerら,(1990)Cell,63,601−608)。これは、具体例として挙げられている。当業者でれば、これが一例に過ぎず、他の実施形態が当技術分野において公知の技術を使用して容易に作成され得ることを理解されよう。
【0040】
本明細書において使用される用語「モノマー」は、典型的には、大きさで数個、例えば約3〜4個の単量体単位から約数百個の単量体単位までの範囲のオリゴヌクレオチドを形成するホスホジエステル結合またはその類似結合によって連結されたモノマーを示す。ホスホジエステル結合の類似として、ホスホロチオエート、ホスホロジチオエート、メチルホスホネート、ホスホロセレノエート、ホスホラミデートなどが挙げられ、後により詳細に記載される。
【0041】
用語「ヌクレオチド」は、非天然のヌクレオチドとともに天然のヌクレオチドを包含する。以前には「非天然に発生する」ものと考えられていた各種ヌクレオチドが、その後天然にも見出されたことがあるのは当業者には明らかなはずである。したがって、「ヌクレオチド」は、既知のプリンおよびピリミジンヘテロ環を含む分子だけでなく、ヘテロ環アナログおよびそれらの互変異性体も含む。他の種類のヌクレオチドの例としては、アデニン、グアニン、チミン、シトシン、ウラシル、プリン、キサンチン、ジアミノプリン、8−オキソ−N6−メチルアデニン、7−デアザキサンチン、7−デアザグアニン、N4,N4−エタノシトシン、N6,N6−エタノ−2,6−ジアミノプリン、5−メチルシトシン、5−(C3−C6)−アルキニルシトシン、5−フルオロウラシル、5−ブロモウラシル、シュードイソシトシン、2−ヒドロキシ−5−メチル−4−トリアゾロピリジン、イソシトシン、イソグアニン、イノシンおよび米国特許第5,432,272号に記載されている「非天然の」ヌクレオチドである。「ヌクレオチド」という用語は、これらの例のすべてに加えてそのアナログおよび互変異性体も包含するものとする。特に興味深いヌクレオチドは、アデニン、グアニン、チミン、シトシン、5−メチルシトシン、およびウラシルであり、これらはヒトにおける治療および診断の用途に関連して自然に生じるヌクレオチドと考えられる。ヌクレオチドは、例えばKornbergおよびBaker,DNA Replication,2nd Ed.(Freeman,San Francisco,1992)に記載の天然の2’−デオキシ糖および2’−ヒドロキシ糖ならびにそれらのアナログを含む。
【0042】
ヌクレオチドに関して「アナログ」は、修飾された塩基成分および/または修飾された糖部分を有する合成ヌクレオチドを含む。そのようなアナログは、結合特性、例えば2重鎖または3重鎖安定性、特異性などを増強するために設計された合成ヌクレオチドを含む。
【0043】
本明細書において使用される「ハイブリダイゼーション」は、オリゴマー化合物の実質的な相補鎖の対形成を意味する。対形成の1つの機序は、オリゴマー化合物の鎖の相補的ヌクレオシドまたはヌクレオチド塩基(ヌクレオチド)間でのワトソン−クリック型、フーグスティーン型または逆フーグスティーン型水素結合であり得る水素結合を含む。例えばアデニンおよびチミンは、水素結合の形成を通じて対形成する相補的ヌクレオチドである。ハイブリダイゼーションは、各種環境下で生じ得る。
【0044】
アンチセンス化合物は、標的核酸への化合物の結合が標的核酸の通常の機能に干渉して機能および/または活性の調節を生じ、特異的結合が望ましい条件下(すなわち生体内アッセイまたは治療的処置の場合での生理的条件下および対外アッセイの場合でのアッセイが実施される条件下)でアンチセンス化合物の非標的核酸配列への非特異的結合を避けるために十分な程度の相補性がある場合に「特異的にハイブリダイズできる」。
【0045】
本明細書において使用される表現「ストリンジェントなハイブリダイゼーション条件」または「ストリンジェントな条件」は、本発明の化合物がその標的配列にハイブリダイズし、最小限の他の配列にしかハイブリダイズしない条件を意味する。ストリンジェントな条件は、配列依存的であり、異なる環境下では異なっており、本発明の文脈においてオリゴマー化合物が標的配列にハイブリダイズする「ストリンジェントな条件」は、オリゴマー化合物の性質および組成物ならびにそれらが調査されるアッセイによって決定される。一般に、ストリンジェントなハイブリダイゼーション条件は、Na++またはK++などの無機陽イオン塩の低濃度(<0.15M)(すなわち低イオン強度)、20℃−25℃より高くオリゴマー化合物:標的配列複合体のTmより低い温度、およびホルムアミド、ジメチルホルムアミド、ジメチルスルホキシドなどの変性剤または界面活性剤ドデシル硫酸ナトリウム(SDS)の存在を含む。例えば、ハイブリダイゼーション率はホルムアミド1%ごとに1.1%低下する。高ストリンジェンシーなハイブリダイゼーション条件の例は、0.1×塩化ナトリウム−クエン酸ナトリウムバッファー(SSC)/0.1%(w/v)SDSで60℃、30分間である。
【0046】
本明細書において使用される「相補性」は、1つまたは2つのオリゴマー鎖上の2つのヌクレオチド間の正確な対形成の能力を意味する。例えばアンチセンス化合物の特定の位置の核酸塩基が標的核酸の特定の位置で核酸塩基と水素結合でき、前記標的核酸がDNA、RNAまたはオリゴヌクレオチド分子である場合、オリゴヌクレオチドと標的核酸との間の水素結合の位置は相補的位置であると考えられる。オリゴマー化合物とさらなるDNA、RNAまたはオリゴヌクレオチド分子とは、各分子における十分な数の相補的位置が相互に水素結合できるヌクレオチドによって占められる場合に相互に相補的である。したがって「特異的にハイブリダイズできる」および「相補的」は、オリゴマー化合物と標的核酸との間に安定かつ特異的な結合が生じるような十分な数のヌクレオチドにわたる十分な程度の正確な対形成すなわち相補性を示すために使用される用語である。
【0047】
オリゴマー化合物の配列は、特異的にハイブリダイズできるその標的核酸の配列に100%相補的である必要がないことは当技術分野において理解されることである。さらにオリゴヌクレオチドは、介在するまたは隣接するセグメントがハイブリダイゼーション事象に関与せずに(例えばループ構造、ミスマッチまたはヘアピン構造)1以上のセグメントにわたってハイブリダイズできる。本発明のオリゴマー化合物は、それらが標的化される標的核酸配列中の標的領域に対して、少なくとも約70%、または少なくとも約75%、または少なくとも約80%、または少なくとも約85%、または少なくとも約90%、または少なくとも約95%または少なくとも約99%の配列相補性を有する。例えば、アンチセンス化合物の20個のヌクレオチドのうちの18個が標的領域に相補的であり、したがって特異的にハイブリダイズするアンチセンス化合物は、90パーセントの相補性を示す。この例において残りの非相補的ヌクレオチドは、相補的ヌクレオチドと共に一群となっていても点在していても良く、相互にまたは相補的ヌクレオチドに近接している必要はない。そのように長さ18ヌクレオチドであり、標的核酸と完全に相補的な2つの領域によって隣接された4つ(4個)の非相補的ヌクレオチドを有するアンチセンス化合物は、標的核酸に全体で77.8%の相補性を有し、したがって本発明の範囲内に含まれる。アンチセンス化合物と標的核酸の領域との相補性百分率は、当技術分野において周知のBLASTプログラム(basic local alignment search tools)およびPowerBLASTプログラムを使用して通常通りに決定され得る。相同性百分率、配列同一性または相補性は、例えば、SmithおよびWatermanのアルゴリズム(Adv.Appl.Math.,(1981)2,482−489)を使用するGapプログラム(Wisconsin Sequence Analysis Package, Version 8 for Unix(登録商標),Genetics Computer Group,University Research Park,Madison Wis.)の初期設定を使用することによって決定され得る。
【0048】
本明細書において使用される用語「熱融点(Tm)」は、規定のイオン強度、pHおよび核酸濃度の下で、標的配列に相補的であるオリゴヌクレオチドの50%が平衡状態で標的配列にハイブリダイズする温度を意味する。典型的にはストリンジェントな条件は、塩濃度が少なくともNaイオン濃度(または他の塩)約0.01〜1.0M、pH7.0〜8.3であり、短いオリゴヌクレオチド(例えば10〜50ヌクレオチド)については温度が低くとも約30℃であるものである。ストリンジェントな条件は、ホルムアミドなどの不安定化剤の添加でも達成され得る。
【0049】
本明細書において使用される用語「調節」は、遺伝子の発現における増大(刺激)または減少(阻害)を意味する。
【0050】
ポリヌクレオチド配列の文脈において使用される場合に用語「変異型」は、野生型遺伝子に関連するポリヌクレオチド配列を包含する。この定義は、例えば「アレル」、「スプライス」、「種」または「多型」変異型も含み得る。スプライス変異型は、基準の分子と有意な同一性を有し得るが、一般にmRNAプロセシングの際のエクソンの選択的スプライシングによる、より多いまたは少ない数のポリヌクレオチドを有する。対応するポリペプチドは、追加的機能ドメインまたはドメインの欠損を有し得る。種の変異型は、1つの種から他の種へ変化するポリヌクレオチド配列である。本発明における特定の有用性は、野生型遺伝子産物の変異型である。変異型は、核酸配列における少なくとも1つの変異から生じることができ、変化したmRNAまたはその構造または機能が変化していても変化していなくてもよいポリペプチドを生じ得る。任意の所与の天然または組み換え遺伝子は、対立形態を有さない場合も、1つ有する場合も、多数有する場合もある。変異型を生じる通常の変異変化は、一般に天然の欠失、追加またはヌクレオチドの置換に帰する。これらの型の変化のそれぞれは、単独でまたは他との組み合わせで1回または複数回、所与の配列に生じ得る。
【0051】
得られたポリペプチドは、一般に相互に比較して顕著なアミノ酸同一性を有する。多型変異型は、所与の種の個体間での特定の遺伝子のポリヌクレオチド配列における変異型である。多型変異型は、「単一ヌクレオチド多型」(SNP)またはポリヌクレオチド配列が1塩基によって変化している単一塩基変異も包含できる。SNPの存在は、例えば、易罹患性対抵抗性である病態についてのある傾向を有する特定の集団についての指標であり得る。
【0052】
誘導体ポリヌクレオチドは、化学的修飾(例えば水素のアルキル、アシルまたはアミノ基での置換)に供された核酸を含む。誘導体、例えばオリゴヌクレオチド誘導体は、修飾された糖部分または糖間結合などの天然に存在しない部分を含み得る。これらにおける例は、ホスホロチオエートおよび当技術分野において周知の他のイオウ含有種である。誘導核酸は、放射性ヌクレオチド、酵素、蛍光剤、化学発光剤、発色剤、基質、補助因子、阻害因子、磁性粒子などが挙げられる標識も含み得る。
【0053】
「誘導体」ポリペプチドまたはペプチドは、例えばグリコシル化、ポリエチレングリコール化、リン酸化、硫酸化、還元/アルキル化、アシル化、化学的カップリングまたは穏やかなホルマリン処理によって修飾されたものである。誘導体は、以下に限定されないが放射性同位元素、蛍光または酵素標識を含む検出可能な標識を含むために直接または間接的のいずれかで修飾もされ得る。
【0054】
本明細書において使用される用語「動物」または「患者」とは、例えばヒト、ヒツジ、エルク、シカ、ミュールジカ、ミンク、哺乳動物、サル、ウマ、ウシ、ブタ、ヤギ、イヌ、ネコ、ラット、マウス、鳥類、ニワトリ、爬虫類、魚類、昆虫およびクモ類を含む意味である。
【0055】
「哺乳動物」は、典型的には医療的ケアの下にある温血哺乳動物(例えばヒトおよび家畜)を含む。例として、ヒトのみならず、ネコ、イヌ、ウマ、ウシおよびヒトが挙げられる。
【0056】
「治療」または「処置」は、(a)哺乳動物において病状が生じることを予防するステップ、具体的にはそのような哺乳動物が前病気状態におかれているが、病状が生じているとまだ診断されていない場合;(b)病状を抑制するステップ、例えばその進行を止めるステップ;および/または(c)病状を軽減するステップ、例えば病態の退行を所望の終点に至るまで生じさせるステップ、を含む哺乳動物における病気に対する処置を含む。治療は、疾患の症状の回復(例えば疼痛または不快感の緩和)も含み、そのような回復は、疾患に直接効果を与える場合または与えない場合がある(例えば原因、伝染、発現など)。
【0057】
本明細書において「癌」とは、哺乳動物においてみられるあらゆる種類の癌または新生物または悪性腫瘍を指し、以下に限定されないが、白血病、リンパ腫、黒色腫、癌腫、および肉腫が含まれる。癌は、「腫瘍」すなわち癌の悪性細胞を含む組織として現れる。腫瘍の例には肉腫および癌種が含まれ、例えば、以下に限定されないが、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮細胞肉腫、滑膜腫、中皮腫、ユーイング腫瘍、平滑筋肉腫、横紋筋肉腫、結腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭腺癌、嚢胞腺癌、髄様癌、気管支原性癌、腎細胞癌、肝癌、胆管癌、絨毛癌、精上皮腫、胎児性癌、ウィルムス腫瘍、子宮頸癌、精巣腫瘍、肺癌、小細胞肺癌、膀胱癌、上皮癌、神経膠腫、星状細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽腫、聴神経腫、乏突起膠腫、髄膜腫、黒色腫、神経芽細胞腫、および網膜芽細胞腫などが挙げられる。本明細書に開示する本発明の組成物によって治療できる他の癌としては、以下に限定されないが、例えば、ホジキン病、非ホジキンリンパ腫、多発性骨髄腫、神経芽細胞腫、乳癌、卵巣癌、肺癌、横紋筋肉腫、原発性血小板血症、原発性マクログロブリン血症、小細胞肺癌、原発性脳腫瘍、胃癌、大腸癌、悪性膵臓インスリノーマ、悪性カルチノイド、膀胱癌、前癌状態の皮膚病変、精巣癌、リンパ腫、甲状腺癌、神経芽細胞腫、食道癌、尿生殖路癌、悪性高カルシウム血症、子宮頸癌、子宮内膜癌、副腎皮質癌、および前立腺癌などが挙げられる。
【0058】
「神経疾患または障害」は、神経系および/または視覚系のあらゆる疾患または障害を指す。「神経疾患または障害」は、中枢神経系(脳、脳幹、小脳)、末梢神経系(脳神経を含む)、および自律神経系(その一部は中枢神経系および末梢神経系の両方に位置する)が関与する疾患または障害を含む。神経疾患の例としては、以下に限定されないが、頭痛、昏迷および昏睡、認知症、発作、睡眠障害、外傷、感染症、腫瘍、神経眼科障害、運動障害、脱髄疾患、脊髄疾患、および末梢神経、筋肉、ならびに神経筋接合部の障害が挙げられる。嗜癖および精神疾患としては、以下に限定されないが、双極性障害および統合失調症が挙げられ、これらは神経疾患の定義にも包含される。次に挙げるものは、本発明による組成物および方法を用いて治療できる神経の疾患、症状、徴候、および症候群のリストである:後天性てんかん性失語症、急性散在性脳脊髄炎、副腎白質ジストロフィー、加齢黄斑変性症、脳梁欠損症、失認症、アイカルディ症候群、アレクサンダー病、アルパース病、交代性片麻痺、脳血管性痴呆、筋萎縮性側索硬化症、無脳症、アンジェルマン症候群、血管腫症、無酸素症、失語症、失行症、くも膜嚢胞、くも膜炎、アーノルド・キアリ奇形、動静脈奇形、アスペルガー症候群、毛細血管拡張性運動失調症、注意欠陥多動性障害、自閉症、自律神経機能障害、背中の痛み、バッテン病、ベーチェット病、ベル麻痺、良性特発性眼瞼けいれん、良性限局性異常、筋萎縮症、良性頭蓋内圧亢進症、ビンスワンガー病、眼瞼けいれん、ブロッホ・サルズバーガー症候群、腕神経叢損傷、脳膿瘍、脳損傷、脳腫瘍(多形性膠芽腫を含む)、脊髄腫瘍、ブラウンセカール症候群、カナバン病、手根管症候群、カウザルギー、中枢性疼痛症候群、橋中心髄鞘崩壊、頭部の障害、脳動脈瘤、脳動脈硬化症、萎縮脳、脳性巨人症、脳性麻痺、シャルコー・マリー・トゥース病、化学療法誘発性神経障害と神経因性疼痛、キアリ奇形、舞踏病、慢性炎症性脱髄性多発神経障害、慢性疼痛、慢性局所疼痛症候群、コフィンローリー症候群、遷延性植物状態を含む昏睡状態、先天性顔面麻痺、大脳皮質基底核変性症、頭蓋の動脈炎、頭蓋骨早期癒合症、クロイツフェルト・ヤコブ病、蓄積外傷疾患、クッシング症候群、巨大細胞性封入体症、サイトメガロウイルス感染症、ダンシングアイズ・ダンシングフィート症候群(眼球クローヌス・ミオクローヌス運動失調)、ダンディ・ウォーカー症候群、ドーソン病、ド・モルシア症候群、デジェリン−クルムプケ麻痺、認知症、皮膚筋炎、糖尿病性神経障害、びまん性硬化症、自律神経障害、書字障害、失読症、ジストニア、早期乳児てんかん性脳症、エンプティセラ症候群、脳炎、脳瘤、脳三叉神経領域血管腫症、てんかん、エルブ麻痺、本態性振戦、ファブリー病、ファール症候群、失神、家族性けいれん性麻痺、熱性けいれん、フィッシャー症候群、フリードライヒ失調症、前頭側頭認知症およびその他の「タウオパチー」、ゴーシェ病、ゲルストマン症候群、巨細胞性動脈炎、巨細胞性封入体病、球様細胞白質萎縮症、ギラン・バレー症候群、HTLV−1関連脊髄症、ハレルフォルデンスパッツ病、頭部外傷、頭痛、片側顔面けいれん、遺伝性痙性対麻痺、遺伝性多発神経炎性失調、耳帯状疱疹、帯状疱疹、平山病、HIV関連認知症および神経障害(AIDSの神経学的症状も)、全前脳症、ハンチントン病および他のポリグルタミンリピート病、水無脳症、水頭症、副腎皮質機能亢進症、低酸素症、免疫介在性脳脊髄炎、封入体筋炎、色素失調症、幼児型フィタン酸蓄積症、乳児型レフサム病、乳児痙攣、炎症性筋疾患、頭蓋内の嚢胞、頭蓋内圧亢進、ジュベール症候群、カーンズ・セイヤー症候、ケネディ病、キンズボーン症候群、クリッペル・ファイル症候群、クラッベ病、クーゲル・ウエランダー病、クールー、ラフォラ病、ランバート・イートン症候群、ランドウ・クレフナー症候群、外側延髄(ウォレンバーグ)症候群、学習障害、リー病、レノックス・ガストー症候群、レッシュナイハン症候群、大脳白質萎縮症、レビー小体型認知症、滑脳症、閉じ込め症候群、ルー・ゲーリッグ病(すなわち運動ニューロン疾患または筋萎縮性側索硬化症)、腰椎椎間板疾患、ライム病−神経学的後遺症、マチャド・ジョセフ病、大脳症、巨大脳髄症、メルカーソン・ローゼンタール症候群、メニエール病、髄膜炎、メンケス病、異染性白質ジストロフィー、小頭症、片頭痛、ミラーフィッシャー症候群、軽度の脳卒中、ミトコンドリアミオパシー、メビウス症候群、モノマー性筋萎縮症、運動ニューロン疾患、もやもや病、ムコ多糖症、多発梗塞性痴呆、多巣性運動ニューロパチー、多発性硬化症および他の脱髄性疾患、起立性低血圧を伴う多系統萎縮症、筋ジストロフィー、重症筋無力症、ミエリン代謝異常によるびまん性硬化症、乳児型ミオクロニー脳症、ミオクローヌス、筋疾患、先天性ミオトニア、ナルコレプシー、神経線維腫症、悪性症候群、AIDSの神経学的症状、紅斑性狼瘡の神経学的後遺症、神経性筋緊張病、神経セロイドリポフスチン症、神経細胞遊走障害、ニーマン・ピック病、オサリバン・マクラウド症候群、後頭神経痛、潜在性脊椎閉鎖不全症、大田原症候群、オリーブ橋小脳萎縮症、オプソクローヌス・ミオクローヌス症候群、視神経炎、起立性低血圧、使い過ぎ症候群、感覚異常、神経変性疾患または障害(パーキンソン病、ハンチントン病、アルツハイマー病、筋萎縮性側索硬化症(ALS)、認知症、多発性硬化症、および神経細胞死に関連する他の疾患および障害)、先天性パラミオトニア、腫瘍随伴性疾患、発作、パリーロンベルク症候群、ペリツェウスメルツバッハー病、周期性麻痺、末梢神経障害、痛みを伴う神経障害および神経因性疼痛、遷延性植物状態、広汎性発達障害、光くしゃみ反射、フィタン酸蓄積症、ピック病、挟まれた神経、下垂体腫瘍、多発性筋炎、孔脳症、ポリオ後症候群、帯状疱疹後神経痛、感染後脳脊髄炎、起立性低血圧、プラダーウィリ症候群、原発性側索硬化症、プリオン病、進行性顔面半側萎縮症、進行性多巣性白質脳症、進行性硬化性ポリオジストロフィー、進行性核上性麻痺、偽脳腫瘍、ラムゼイ・ハント症候群(I型およびII型)、ラスムッセン脳炎、反射性交感神経性ジストロフィー症候群、レフサム病、反復運動障害、反復ストレス障害、むずむず脚症候群、レトロウイルス関連脊髄症、レット症候群、ライ症候群、舞踏病、サンドホフ病、シルダー病、裂脳症、中隔視神経異形成症、揺さぶられっ子症候群、帯状疱疹、シャイ・ドレーガー症候群、シェーグレン症候群、睡眠時無呼吸症候群、ソトス症候群、痙縮、二分脊椎、脊髄損傷、脊髄腫瘍、脊髄性筋萎縮症、スティッフパーソン症候群、脳卒中、スタージ・ウェーバー症候群、亜急性硬化性全脳炎、皮質下動脈硬化性脳症、シデナム舞踏病、失神、脊髄空洞症、遅発性ジスキネジア、テイ・サックス病、側頭動脈炎、係留脊髄症候群、トムセン病、胸郭出口症候群、疼痛チック、トッドの麻痺、トゥレット症候群、一過性脳虚血発作、伝達性海綿状脳症、横断性脊髄炎、外傷性脳損傷、振戦、三叉神経神経痛、熱帯性痙性不全対麻痺、結節性硬化症、血管性痴呆(多発梗塞性痴呆)、側頭動脈炎を含む脈管炎、フォンヒッペル・リンドウ病、ウォレンバーグ症候群、ウェルドニッヒ・ホフマン病、ウエスト症候群、むち打ち症、ウィリアムズ症候群、ウィルソン病、およびゼルウィガー症候群。
【0059】
「炎症」とは、全身の炎症性状態、ならびに単球、白血球および/または好中球の遊走および誘引に局所的に関連する状態を指す。炎症の例としては、以下に限定されないが、病原菌(グラム陽性菌、グラム陰性菌、ウイルス、真菌、および原虫や蠕虫などの寄生虫を含む)の感染症に起因する炎症、移植片拒絶反応(腎臓、肝臓、心臓、肺、および角膜などの固形臓器の拒絶反応、ならびに移植片対宿主病(GVHD)を含む骨髄移植の拒絶反応を含む)に起因する炎症、または局所性の慢性または急性の自己免疫またはアレルギー反応に起因する炎症が挙げられる。自己免疫疾患としては、急性糸球体腎炎、関節リウマチまたは反応性関節炎;慢性糸球体腎炎;クローン病、潰瘍性大腸炎、および壊死性腸炎などの炎症性腸疾患;顆粒球輸血関連症候群;接触性皮膚炎、アトピー性皮膚炎、および乾癬などの炎症性皮膚疾患;全身性エリテマトーデス(SLE)、自己免疫性甲状腺炎、多発性硬化症、いくつかの型の糖尿病、または被検体自身の免疫系による攻撃が病理学的組織破壊をもたらす他の自己免疫状態などが挙げられる。アレルギー反応には、アレルギー性喘息、慢性気管支炎、急性および遅延型過敏症が含まれる。全身の炎症疾患状態には、外傷、熱傷、虚血事象(例えば、心筋梗塞および脳卒中を含む心臓、脳、腸、または末梢血管系の血栓症)の後の再潅流、敗血症、急性呼吸窮迫症候群(ARDS)、多臓器不全症候群などが含まれる。炎症細胞の動員は、アテローム性動脈硬化プラークに発生する。炎症には、以下に限定されないが、非ホジキンリンパ腫、ウェゲナー肉芽腫症、橋本甲状腺炎、肝細胞癌、胸腺萎縮、慢性膵炎、関節リウマチ、反応性リンパ過形成、変形性関節症、潰瘍性大腸炎、乳頭癌、クローン病、潰瘍性大腸炎、急性胆嚢炎、慢性胆嚢炎、肝硬変、慢性唾液腺炎、腹膜炎、急性膵炎、慢性膵炎、慢性胃炎、腺筋症、子宮内膜症、急性子宮頸管炎、慢性子宮頸管炎、リンパ過形成、多発性硬化症、特発性血小板減少性紫斑病に続発する肥大、原発性IgA腎症、全身性エリテマトーデス、乾癬、肺気腫、慢性腎盂腎炎、および慢性膀胱炎などが含まれる。
【0060】
心血管疾患および障害には、虚血を引き起こし得る疾患か、心臓の再灌流によって引き起こされ得る疾患が含まれる。そのような疾患の例としては、以下に限定されないが、アテローム性動脈硬化症、冠動脈疾患、肉芽腫性心筋炎、慢性心筋炎(非肉芽腫性)、原発性肥大型心筋症、末梢動脈疾患(PAD)、脳卒中、狭心症、心筋梗塞、心停止に起因する心血管組織の損傷、心臓バイパスに起因する心血管組織の損傷、心原性ショック、当業者に公知のまたは心臓や血管系の機能不全や組織損傷を伴う関連する状態(特に、以下に限定しないが、膵臓発生遺伝子の活性化に関連する組織損傷)などが挙げられる。心血管(CVS)疾患には、以下に限定されないが、アテローム性動脈硬化症、肉芽腫性心筋炎、心筋梗塞、心臓弁膜症に続発する心筋線維症、心筋梗塞を伴わない心筋線維症、原発性肥大型心筋症、および慢性心筋炎(非肉芽腫性)などが含まれる。
【0061】
代謝性疾患または障害は、例えば、インスリン抵抗性、糖尿病、肥満、耐糖能障害、高い血中コレステロール値、高血糖症、高インスリン血症、脂質異常症、および脂質異常症などの広範囲にわたる内分泌系の疾患または障害を指す。
【0062】
[ポリヌクレオチドおよびオリゴヌクレオチド組成物および分子]
標的:一実施形態において、該標的は、限定することなく膵臓発生遺伝子に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、膵臓発生遺伝子の核酸配列を含む。
【0063】
一実施形態では、前記標的が、限定することなくNEUROD1遺伝子に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、NEUROD1の核酸配列を含む。
【0064】
一実施形態では、前記標的が、限定することなくHNF4A遺伝子に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、HNF4Aの核酸配列を含む。
【0065】
一実施形態では、前記標的が、限定することなくMAFA遺伝子に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、MAFAの核酸配列を含む。
【0066】
一実施形態では、前記標的が、限定することなくPDX1遺伝子に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、PDX1の核酸配列を含む。
【0067】
一実施形態では、前記標的が、限定することなくNKX6に関連するセンスおよび/またはアンチセンスの非コードおよび/またはコード配列を含めた、NKX6の核酸配列を含む。
【0068】
BETA2/NeuroD1は、インスリン遺伝子発現をアップレギュレートする能力を有する組織特異的塩基性へリックスループへリックス転写因子である。BETA2/NeuroD1は、膵島β細胞における膵島の形態形成およびインスリンホルモン遺伝子の転写の重要な調節因子である。それはNeuroDという神経分化に必要な遺伝子としてクローニングされた。現在は、この遺伝子をBETA2/NeuroD1と称する。各種発生システムの調節に重要な役割を果たす多くのbHLHファミリーメンバーと同様に、BETA2/NeuroD1は、膵臓および脳の発生に不可欠である。
【0069】
HNF4Aは、肝細胞および膵臓の転写調節に重要な役割を持つ転写因子をコードしている。オーファン核内受容体および肝活性化因子である肝核因子−4(HNF−4)は、肝臓、膵臓の細胞における転写ネットワークの中心的な調節因子である。2つのプロモーターP1およびP2は、染色体20qの上で45.5kb離れた位置にある。肝臓でのHNF4A転写産物は主としてP1起源であるが、インスリン分泌とグルコース恒常性に関与する遺伝子を調節する場合には、P2プロモーターが膵臓での発現を誘導する。
【0070】
MAFAは、インスリン遺伝子のエンハンサー領域におけるRIPE3b1と呼ばれる保存されたシス調節エレメントに結合されている、β細胞特異的核内因子であり、インスリン遺伝子の重要なトランス活性化因子として機能する。MAFAは、RIPE3b1と呼ばれるシス調節エレメントを介してインスリン遺伝子のβ−細胞特異的発現を制御し、インスリン遺伝子の強力なトランス活性化因子としての機能する塩基性ロイシンジッパー(bLZ)転写因子である。MAFAはNEUROD1およびPDX1と相乗的に協働する。GSK3によるリン酸化は、その転写活性を増加させ、その発癌活性に必要である。
【0071】
膵臓十二指腸ホメオボックス1(PDX1)は、膵臓、十二指腸と幽門部の分化および発生において重要なホメオボックス遺伝子ファミリーの転写因子である。膵臓十二指腸ホメオボックス1(PDX−1)は、膵臓の発生において重要な役割を持つ転写因子である。PDX−1は膵臓の細胞の増殖と分化を調節し、この転写因子の発現の増加がヒト膵臓腺癌および細胞株において報告されている。PDX1は、β細胞の成熟にも必要である。すなわち発生するβ細胞のPDX1、Nkx6−1、インスリンを同時発現し、これがMafBのサイレンシングおよびMafAの発現をもたらすプロセス、β細胞の成熟に必要なスイッチとなる。Pdx1は、グルカゴンを抑制しながら、内分泌細胞の運命決定、インスリン、ソマトスタチンという2つの膵内分産物のコード化において一定の役割を果たすとみられる。したがって、Pdx1の発現は、明らかにグルカゴン+α細胞ではなく、インスリン+β細胞およびソマトスタチン+Δ細胞の生成を裏付ける。
【0072】
Nkx6.1は、膵臓の中で最もβ細胞特異的な転写因子として認識されている。Nkx6ホメオドメイン転写因子は、中枢神経系および膵臓における重要な発生上の役割を有する。Nkx6.1は、適切な運動ニューロンとオリゴデンドロサイトの発生、およびインスリン産生膵β細胞の発生および維持のために必要不可欠である。
【0073】
Nkx6.1は腹側神経前駆細胞で発現され、その後、側方運動ニューロン柱(LMCm)の中央において、およびShh発現細胞を外囲する間充組織(すなわち腹側脊髄髄膜、食道間充組織、および背側気管間充組織)において発現される。Nkx6.1は腹方部パターニングおよび脊椎動物の中枢神経系における神経運命決定に必要とされている。Nkx6.1は、運動ニューロンと腹側介在ニューロンの運命を制御する。Nkx6.1は、頭内えら運動ニューロンの移行および軸策経路探索を制御し、それが脊髄の体性運動ニューロン細胞前駆細胞の初期の特定のために必要となる。えら運動ニューロン(後脳)の初期の特定は、Nkx6.1の機能とは無関係であるが、その後の発生のためにそれが必要となる。Nkx6.1は、有糸分裂後のニューロンの発生およびえらの運動ニューロンの移動の制御のために必要である。特定の運動ニューロンプールにおけるNkx6.1の発現の状態は、筋肉の神経形成および個々の筋肉の神経支配分布のパターンを調節する。
【0074】
表1は、いくつかの膵臓発生遺伝子のリストを示す。
【0075】
下記の表1において、表示された遺伝子は、その遺伝子および現在時点で既知の変異型(遺伝子およびその変異型から生じ得る異なるmRNA転写物、解明される可能性のある別の遺伝子変異型、およびアンチセンス配列を含む)を意味する。このリストには、非コードRNA分子またはポリヌクレオチドの部分も含まれる。しかし、一般的に、そのような変異型は下記の表1に記載のいずれかのポリヌクレオチドの配列と有意な配列同一性を有するものであり、例えば、ある変異型は下記の表1中のいずれかの配列と少なくとも約70%の配列同一性を有するもの、典型的には、下記の表1中のいずれかの配列と少なくとも約75、80、85、90、95、97、98または99%の配列同一性を有するものである。変異体の配列同一性は、BLASTプログラム(ncbi.nclm.nih.gov/blast/)など、各種標準的な技術のいずれかによって決定することができる。
【表1】





【0076】
いくつかの実施形態では、膵臓発生遺伝子ファミリーメンバーに関連する疾病または障害を予防または治療するためにアンチセンスオリゴヌクレオチドを用いる。アンチセンス化合物を用いて得られた幹細胞から再生された細胞/組織で治療可能な、典型的な膵臓発生遺伝子が介在する疾患および障害としては、膵臓発生遺伝子の機能および/または発現の異常に関連する疾患または障害、表1に記載するいずれかの遺伝子の機能および/または発現の異常に関連する疾患または障害、心血管疾患または障害(例えば、鬱血性心不全、心筋梗塞、虚血性疾患、心房性または心室性不整脈、高血圧性血管疾患、末梢血管疾患、およびアテローム性動脈硬化症など)、炎症、胃腸疾患または障害(例えば、食道の疾患、アカラシア、活動性アカラシア、嚥下障害、輪状咽頭の協調不全、食道前嚥下障害、びまん性食道けいれん症、球感覚、バレット上皮化生、胃食道逆流など)、胃および/または十二指腸の疾患または障害(例えば、機能性消化不良、胃粘膜の炎症、胃炎、ストレス性胃炎、慢性びらん性胃炎、胃腺の萎縮、胃組織の化生、胃潰瘍、十二指腸潰瘍、胃の新生物)、膵臓の疾患または障害(例えば、急性または慢性膵炎、脂肪便症のような膵臓の外分泌または内分泌組織の機能不全、糖尿病など)、外分泌や内分泌膵臓の新生物(例えば、多発性内分泌腫瘍症候群、導管腺癌、嚢胞腺癌、膵島細胞腫瘍、インスリノーマ、ガストリノーマ、カルチノイド腫瘍、グルカゴノーマ、ゾリンジャー・エリソン症候群、VIP産生腫瘍症候群、吸収不良症候群など)、腸の疾患または障害(例えば、腸の慢性炎症性疾患、クローン病、腸閉塞、下痢および便秘、結腸無力症、巨大結腸、吸収不良症候群、潰瘍性大腸炎、機能性腸疾患、過敏性腸症候群など)、腸の新生物(例えば、家族性ポリポーシス、腺癌、原発性悪性リンパ腫、カルチノイド腫瘍、カポジ肉腫、ポリープ、結腸直腸癌など)、肝疾患または障害(例えば、ビリルビン代謝障害、黄疸、ジルベール症候群、クリーグラー・ナジャー病、デュビン・ジョンソン症候群およびローター症候群;肝内胆汁鬱滞、肝腫脹、門脈圧亢進症、腹水症、バッド・キアリ症候群、門脈体循環性脳症、脂肪肝、脂肪症、ライ症候群、アルコールによる肝臓病、アルコール性肝炎または肝硬変、線維症、肝硬変など)、代謝の先天性異常または外因性物質による肝臓の線維症および/または肝硬変、蓄積症または貯留疾患、ゴーシェ症候群、ツェルヴェーガー症候群、ウィルソン病、急性または慢性肝炎、ウイルス性肝炎およびその亜種;ウイルス、細菌、真菌、原虫、寄生虫による肝臓の炎症性疾患;肝臓の薬剤誘発性疾患または障害、原発性硬化性胆管炎などの慢性肝疾患、α1−アンチトリプシン欠損症、原発性胆汁性肝硬変、術後の肝内胆汁鬱滞などの術後の肝障害、肝肉芽腫、全身性疾患に関連する血管肝疾患または障害、肝臓の良性または悪性新生物、新生児または未熟児における肝臓の代謝障害、筋骨格疾患(例えば、骨粗鬆症、閉経後骨粗鬆症、老人性骨粗鬆症、続発性骨粗鬆症、特発性若年性骨粗鬆症、骨パジェット病、骨軟骨腫、骨軟骨外骨腫症など)、骨の腫瘍(例えば、良性の軟骨腫、軟骨芽細胞腫、軟骨線維腫、類骨骨腫、骨の巨細胞腫、多発性骨髄腫、骨肉腫(造骨組織の肉腫)、線維肉腫、悪性線維性組織球腫、軟骨肉腫、ユーイング腫瘍(ユーイング肉腫)、骨の悪性リンパ腫(細網肉腫、骨の転移性腫瘍)、変形性関節症、痛風および偽痛風、関節および結合組織の疾患(例えば、関節リウマチ、乾癬性関節炎、円板状エリテマトーデス、全身性エリテマトーデス、強皮症(全身性硬化症)、シェーグレン症候群、結合組織病、多発性筋炎および皮膚筋炎、再発性多発性軟骨炎、血管炎、結節性多発動脈炎、リウマチ性多発筋痛、側頭動脈炎、ウェゲナー肉芽腫症、ライター症候群、ベーチェット症候群、強直性脊椎炎、またはシャルコー関節(神経障害性関節疾患)など);骨および関節の感染症(例えば、骨髄炎、感染性関節炎);筋肉、嚢、および/または腱の疾患または障害(例えば、痙性斜頸、線維筋肉痛症候群(筋筋膜性疼痛症候群、線維筋炎)、滑液包炎、腱炎および腱滑膜炎)、足の問題(例えば、足首の捻挫、足骨折、踵骨骨棘、シバー病、後部アキレス腱滑液包炎、前部アキレス腱滑液包炎、後脛骨神経痛、(足指の間の神経またはつま先と足の間の関節の損傷によって引き起こされる)母指球の疼痛、爪甲真菌症、または足爪の変色)、癌、炎症性疾患または障害、I−IV型過敏性反応などの炎症性疾患(例えば、喘息を含む肺の過敏症、アトピー性疾患、アレルギー性鼻炎または結膜炎、眼瞼の血管性浮腫、遺伝性血管性浮腫、抗受容体過敏症反応および自己免疫疾患、橋本甲状腺炎、全身性エリテマトーデス、グッドパスチャー症候群、天疱瘡、重症筋無力症、グレーブスおよびレイノー病、インスリン抵抗性糖尿病B型、関節リウマチ、乾癬、クローン病、強皮症、混合性結合組織病、多発性筋炎、サルコイドーシス、糸球体腎炎、急性または慢性宿主対移植片反応);慢性閉塞性肺疾患(COPD)などの肺疾患または障害;女性および男性の泌尿生殖器系を構成する臓器の悪性疾患などの泌尿器系の疾患、急性または慢性腎不全などの腎疾患または障害、腎移植拒絶反応のような免疫介在性腎疾患、ループス腎炎、免疫複合体腎疾患、糸球体症、腎炎、中毒性腎症、良性前立腺過形成(BPH)のような閉塞性尿路疾患、神経因性膀胱症候群、切迫性尿失禁、緊張性尿失禁、または溢流性尿失禁のような尿失禁、骨盤痛、および勃起不全、内分泌性膵臓発生異常に関連する疾患または障害(例えば、2型糖尿病)、神経新生異常に関連する疾患または障害、神経変性疾患または障害(例えばアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症等);前庭および/または聴覚系の発生異常に関連する疾患または障害、視細胞の変性に関連する疾患または障害(例えば、視力の低下、加齢黄斑変性症など)、肥満症、肝臓の機能不全に関連する疾患または障害(例えば、肝不全)、粉状白内障、青色白内障、非症候性先天性白内障、先天性白内障−小角膜症候群、膵疾患または障害(例えば、糖尿病、成人発症型糖尿病(MODY)症候群、部分膵臓形成不全、慢性高血糖、膵β細胞の障害、グルコース毒性、耐糖能異常、メタボリックシンドロームXなど)、クローン病、心筋梗塞、高コレステロール血症、頭内動脈硬化症、脳梗塞、ヘルペスウイルス感染症、脂質代謝の障害に関連する疾患または障害、インスリン産生に関連する疾患または障害、セロトニン産生に関連する疾患または障害(例えば、鬱病および肥満症)、神経疾患または障害(神経の障害(例えば、運動ニューロンの障害、セロトニン産生ニューロンの障害、ドーパミンニューロンの障害、および前脳、中脳、後脳、ならびに脊髄の発達障害)に関連する疾患など)、
生殖器系の疾患、および糖尿病(例えば、2型糖尿病、インスリン非依存型糖尿病)などの代謝性疾患または障害などが挙げられる。
【0077】
別の実施形態では、アンチセンスオリゴヌクレオチドが、膵臓発生遺伝子に関連する疾患または障害を罹患しているまたは発症する危険のある患者における膵臓発生遺伝子の生体内発現量および/または機能を調節する。
【0078】
一実施形態では、オリゴヌクレオチドは、限定しないが非コード領域を含むものである膵臓発生遺伝子のポリヌクレオチドに特異的である。膵臓発生遺伝子標的は、膵臓発生遺伝子の変異型;SNPを含む膵臓発生遺伝子の突然変異体;膵臓発生遺伝子の非コード配列;アレル、断片などを含む。好ましくは、該オリゴヌクレオチドはアンチセンスRNA分子である。
【0079】
本発明の実施形態によれば、標的核酸分子は、膵臓発生遺伝子ポリヌクレオチドのみに限定されず、膵臓発生遺伝子の任意のアイソフォーム、受容体、ホモログ、非コード領域などにも及ぶ。
【0080】
別の実施形態では、オリゴヌクレオチドは、以下に限定されないが変異型、アレル、ホモログ、突然変異体、誘導体、断片およびそれらの相補配列を含む膵臓発生遺伝子標的の天然アンチセンス配列(コード領域および非コード領域の天然アンチセンス)を標的にする。好ましくは、該オリゴヌクレオチドはアンチセンスRNAまたはDNA分子である。
【0081】
ある実施形態では、本発明のオリゴマー化合物は、化合物における1以上のヌクレオチド位置に異なる塩基が存在する変異型も含む。例えば最初のヌクレオチドがアデニンである場合、この位置にチミジン、グアノシンまたはシチジンまたは他の天然もしくは非天然ヌクレオチドを有する変異型が作られ得る。これは、アンチセンス化合物の任意の位置において行うことができる。
【0082】
いくつかの実施形態において、アンチセンス化合物と標的との間の相同性、配列同一性または相補性は、約50%〜約60%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約60%〜約70%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約70%〜約80%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約80%〜約90%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約90%、約92%、約94%、約95%、約96%、約97%、約98%、約99%または約100%である。
【0083】
アンチセンス化合物は、化合物の標的核酸への結合が標的核酸の正常な機能に干渉して活性の消失を生じさせ、特異的な結合が望まれる条件下でアンチセンス化合物の非標的核酸配列への非特異的結合が回避されるのに十分な程度の相補性がある場合に特異的にハイブリダイズできる。そのような条件は、すなわち生体内アッセイおよび治療的処置の場合での生理的条件、および体外アッセイの場合でのアッセイが実施される条件を含む。
【0084】
アンチセンス化合物は、DNA、RNA、キメラ、置換物などにかかわらず、化合物の標的DNAまたはRNA分子への結合が標的DNAまたはRNAの正常な機能に干渉して有用性の消失を生じさせ、特異的な結合が望まれる条件下(すなわち生体内アッセイおよび治療的処置の場合での生理的条件、および体外アッセイの場合でのアッセイが実施される条件)でアンチセンス化合物の非標的配列への非特異的結合が回避されるのに十分な程度の相補性がある場合に、特異的にハイブリダイズできる。
【0085】
ある実施形態では、以下に限定しないが、例えばPCR、ハイブリダイゼーションなど用いて同定され伸張されたアンチセンス配列、配列番号6乃至12に記載される1以上の配列ほか、を含む膵臓発生遺伝子の標的化は、膵臓発生遺伝子の発現または機能を調節する。一実施形態において発現または機能は、対照と比較してアップレギュレートされる。他の好ましい実施形態において発現または機能は、対照と比較してダウンレギュレートされる。
【0086】
別の実施形態では、オリゴヌクレオチドは、PCR、ハイブリダイゼーションなどを使用して同定および増やされるアンチセンス配列を含む配列番号13乃至45に記載の核酸配列を含む。これらのオリゴヌクレオチドは、1つまたは複数の修飾されたヌクレオチド、より短いまたはより長い断片、修飾された結合などを含み得る。修飾された結合またはヌクレオチド間結合の例には、ホスホロチオエート、ホスホロジチオエートなどを含まれる。別の実施形態では、該ヌクレオチドは、リン誘導体を含む。本発明の修飾されたオリゴヌクレオチド中の糖部分または糖類似成分に結合できるリン誘導体(または修飾されたリン酸基)は、一リン酸塩、二リン酸塩、三リン酸塩、アルキルリン酸塩、アルカンリン酸塩、ホスホロチオエートなどであり得る。上に記載のリン酸類似体の調製およびそれらのヌクレオチド、修飾されたヌクレオチドおよびオリゴヌクレオチドへの組み込みそれ自体は、周知であり、本明細書で説明する必要はない。
【0087】
アンチセンスの特異性および感受性も、治療的使用のために当業者が利用する。アンチセンスオリゴヌクレオチドは、動物およびヒトでの病態の治療において治療用成分として使用されている。アンチセンスオリゴヌクレオチドは、安全にかつ効果的にヒトに投与されており、多数の臨床検査が現在進行中である。したがってオリゴヌクレオチドが、細胞、組織および動物、特にヒトの治療のための治療レジメンにおいて有用であるように構成され得る有用な治療方法であり得ることが確立されている。
【0088】
本発明の実施形態においてオリゴマーアンチセンス化合物、特にオリゴヌクレオチドは、標的核酸分子に結合し、標的遺伝子によってコードされる分子の発現および/または機能を調節する。干渉されるDNAの機能には、例えば複製および転写が含まれる。干渉されるRNAの機能には、例えばタンパク質翻訳部位へのRNAの転移、RNAからのタンパク質の翻訳、1以上のmRNA種を得るためのRNAのスプライシング、およびRNAが関与し得るまたはRNAによって促進され得る触媒活性などの全ての生体機能を含まれる。機能は、所望の機能に応じてアップレギュレートまたは抑制され得る。
【0089】
アンチセンス化合物は、アンチセンスオリゴマー化合物、アンチセンスオリゴヌクレオチド、外部ガイド配列(EGS)オリゴヌクレオチド、選択的スプライサー、プライマー、プローブおよび標的核酸の少なくとも一部分にハイブリダイズする他のオリゴマー化合物を含む。したがって、これらの化合物は1本鎖、2本鎖、部分的な1本鎖または環状オリゴマー化合物の形態に導入され得る。
【0090】
本発明の文脈においてアンチセンス化合物を特定の核酸分子に標的化することは、多段階プロセスであり得る。通常、このプロセスは、機能が調節される標的核酸の同定で始まる。この標的核酸は、例えばその発現が特定の障害もしくは病態に関連する細胞遺伝子(もしくは遺伝子から転写されたmRNA)または感染病原体由来の核酸分子であり得る。本発明において標的核酸は、膵臓発生遺伝子をコードする。
【0091】
通常、標的化プロセスは所望の効果、例えば発現の調節が得られるようなアンチセンス相互作用が生じる標的核酸中の少なくとも1つの標的領域、セグメントまたは部位の決定も含む。本発明の文脈において用語「領域」は、少なくとも1つの同定可能な構造、機能または特徴を有する標的核酸の一部分と定義される。標的核酸の領域内は、セグメントである。「セグメント」は、標的核酸内の領域のより小さな部分すなわちサブ部分と定義される。本発明において使用される「部位」は、標的核酸内の位置として定義される。
【0092】
一実施形態では、アンチセンスオリゴヌクレオチドは、膵臓発生遺伝子の天然アンチセンス配列に結合し、膵臓発生遺伝子(配列番号1乃至5)の発現および/または機能を調節する。アンチセンス配列の例は、配列番号6乃至45を含む。
【0093】
別の実施形態では、アンチセンスオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドの1以上のセグメントに結合し、膵臓発生遺伝子の発現および/または機能を調節する。セグメントは、膵臓発生遺伝子のセンスまたはアンチセンスポリヌクレオチドの少なくとも5個の連続するヌクレオチドを含む。
【0094】
別の実施形態では、アンチセンスオリゴヌクレオチドは、膵臓発生遺伝子の天然アンチセンス配列に特異的であり、該オリゴヌクレオチドの膵臓発生遺伝子の天然アンチセンス配列への結合は膵臓発生遺伝子の発現および/または機能を調節する。
【0095】
別の実施形態では、オリゴヌクレオチド化合物は配列番号13乃至45に記載の配列、例えばPCR、ハイブリダイゼーションなどを使用して同定および伸張されるアンチセンス配列を含む。これらのオリゴヌクレオチドは、1以上の修飾されたヌクレオチド、より短いまたはより長い断片、修飾された結合などを含み得る。修飾された結合またはヌクレオチド間結合の例には、ホスホロチオエート、ホスホロジチオエートなどを含む。他の実施形態においてヌクレオチドは、リン誘導体を含む。本発明の修飾されたオリゴヌクレオチド中の糖部分または糖類似成分に結合できるリン誘導体(または修飾されたリン酸基)は、一リン酸塩、二リン酸塩、三リン酸塩、アルキルリン酸塩、アルカンリン酸塩、ホスホロチオエートなどであり得る。上に記載のリン酸類似体の調製およびそれらのヌクレオチド、修飾されたヌクレオチドおよびオリゴヌクレオチドへの組み込みそれ自体は、周知であり、本明細書で説明する必要はない。
【0096】
当技術分野において周知であるとおり、翻訳開始コドンが典型的には5’−AUG(転写されたmRNA分子における場合;対応するDNA分子においては5’−ATG)であることから、翻訳開始コドンは、「AUGコドン」、「開始コドン」または「AUG開始コドン」とも称される。少数の遺伝子は、RNA配列5’−GUG、5’−UUGまたは5’−CUGを有する翻訳開始コドンを有し、5’−AUA、5’−ACGおよび5’−CUGは生体内において機能することが示されている。したがって用語「翻訳開始コドン」および「開始コドン」は、開始アミノ酸は各例において典型的にはメチオニン(真核生物において)またはホルミルメチオニン(原核生物において)であるが、多数のコドン配列を包含し得る。真核生物および原核生物の遺伝子は、2以上の選択的開始コドンを有し、そのいずれでも特定の細胞型または組織において、または特定の条件下で翻訳開始のために優先的に利用され得る。本発明の文脈において「開始コドン」および「翻訳開始コドン」は、そのようなコドンの配列にかかわらず膵臓発生遺伝子をコードする遺伝子から転写されたmRNAの翻訳を開始するために生体内で使用される1以上のコドンを意味する。遺伝子の翻訳終止コドン(または「終止コドン」)は、3つの配列、すなわち5’−UAA、5’−UAGおよび5’−UGA(対応するDNA配列は、それぞれ5’−TAA、5’−TAGおよび5’−TGAである)のうちの1つを有し得る。
【0097】
用語「開始コドン領域」および「翻訳開始コドン領域」は、翻訳開始コドンからいずれかの方向(すなわち5’または3’)での連続する約25から約50ヌクレオチドを包含するそのようなmRNAまたは遺伝子の一部分を指す。同様に、用語「終止コドン領域」および「翻訳終止コドン領域」は、翻訳終止コドンからいずれかの方向(すなわち5’または3’)での連続する約25から約50ヌクレオチドを包含するそのようなmRNAまたは遺伝子の一部分を指す。結局、「開始コドン領域」(または「翻訳開始コドン領域」)および「終止コドン領域」(または「翻訳終止コドン領域」)は、本発明のアンチセンス化合物で効果的に標的化され得る全ての領域である。
【0098】
当技術分野において翻訳開始コドンと翻訳終止コドンとの間の領域を意味することが周知のオープンリーディングフレーム(ORF)すなわち「コード領域」も、効果的に標的化され得る領域である。本発明の文脈において標的化された領域は、遺伝子のオープンリーディングフレーム(ORF)の翻訳開始または終止コドンを包含する遺伝子内領域である。
【0099】
他の標的領域は、当技術分野において翻訳開始コドンから5’方向にあるmRNAの一部分を意味することが周知の5’非翻訳領域(5’UTR)を含み、したがって5’キャップ部位とmRNA(または遺伝子上の対応するヌクレオチド)の翻訳開始コドンとの間のヌクレオチドを含む。さらに他の標的領域は、当技術分野において翻訳終止コドンから3’方向にあるmRNAの一部分を指すことが周知の3’非翻訳領域(3’UTR)を含み、したがって翻訳終止コドンとmRNA(または遺伝子上の対応するヌクレオチド)の3’末端との間のヌクレオチドを含む。mRNAの5’キャップ部位は、5’−5’トリリン酸結合を介してmRNAの最も5’側の残基に結合したN7−メチル化グアノシン残基を含む。mRNAの5’キャップ領域は、5’キャップ構造それ自体およびキャップ部位に隣接する最初の50ヌクレオチドを含むと考えられる。本発明の他の標的領域は、5’キャップ領域である。
【0100】
いくつかの真核生物mRNA転写物は、直接翻訳されるが、大部分は、それが翻訳される前に転写物から切除される「イントロン」として周知の1以上の領域を含む。残りの(したがって翻訳される)領域は「エクソン」として周知であり、連続的なmRNA配列を形成するように一緒にスプライスされる。一実施形態において標的スプライス部位、すなわちイントロン−エクソン接合部またはエクソン−イントロン接合部は、異常なスプライシングが疾患に関与するまたは特定のスプライス産物の過剰産生が疾患に関与する状況において特に有用である。再配置または欠失による異常な融合接合は、標的部位の他の実施形態である。異なる遺伝子源由来の2つ(またはそれ以上)のmRNAのスプライシングのプロセスを介して生成されたmRNA転写物は、「融合転写物」として周知である。イントロンは、例えばDNAまたはプレmRNAを標的化するアンチセンス化合物を使用して効果的に標的化され得る。
【0101】
別の実施形態では、アンチセンスオリゴヌクレオチドは、標的ポリヌクレオチドのコード領域および/または非コード領域に結合し、標的分子の発現および/または機能を調節する。
【0102】
別の実施形態では、アンチセンスオリゴヌクレオチドは、天然アンチセンスポリヌクレオチドに結合し、標的分子の発現および/または機能を調節する。
【0103】
別の実施形態では、アンチセンスオリゴヌクレオチドは、センスポリヌクレオチドに結合し、標的分子の発現および/または機能を調節する。
【0104】
選択的RNA転写物は、DNAの同じ遺伝子領域から生成され得る。これらの選択的転写物は、一般に「変異型」として周知である。より詳細には「プレmRNA変異型」は、同じゲノムDNAから生成される転写物であり、同じゲノムDNAから生成される他の転写物とはそれらの開始または終止位置のいずれかにおいて異なり、イントロンおよびエクソン配列の両方を含む。
【0105】
スプライシングでの1以上のエクソンもしくはイントロン領域またはそれらの一部分の切除において、プレmRNA変異型は、より小さな「mRNA変異型」を生成する。結果としてmRNA変異型は、プレmRNA変異型にプロセシングされ、それぞれ特有なプレmRNA変異型はスプライシングの結果として特有なmRNA変異型を常に生成する。これらのmRNA変異型は、「選択的スプライス変異型」としても周知である。プレmRNA変異型のスプライシングが生じない場合は、プレmRNA変異型はmRNA変異型と同一である。
【0106】
変異型は、転写を開始するまたは終止するための選択的シグナルの使用を通じても生成され得る。プレmRNAおよびmRNAは、2以上の開始コドンまたは終止コドンを有し得る。選択的開始コドンを使用するプレmRNAまたはmRNA由来の変異型は、プレmRNAまたはmRNAの「選択的開始変異型」として周知である。選択的終止コドンを使用するこれらの転写物は、プレmRNAまたはmRNAの「選択的終止変異型」として周知である。選択的終止変異型の特定の1種類は、機械的な転写による「ポリA終止シグナル」のうちの1つの代替選択から生じる、多数の転写物が生成される「ポリA変異型」であり、それにより特有なポリA部位で終結する転写物が生成される。本発明の文脈において、本明細書に記載される種類の変異型も標的核酸の実施形態である。
【0107】
アンチセンス化合物がハイブリダイズする標的核酸上の位置は、活性アンチセンス化合物が標的化される標的領域の少なくとも5ヌクレオチド長の部分として定義される。
【0108】
特定の典型的な標的セグメントの特定の配列が本明細書に記載されているが、当業者はこれらが本発明の範囲内の具体的実施形態を例示し説明するために利用できることを理解されよう。追加の標的セグメントは、本開示を考慮して当業者によって容易に特定される。
【0109】
例示的な標的セグメント内から選択された少なくとも5つ(5個)の連続的ヌクレオチド範囲を含む長さ5〜100ヌクレオチドの標的セグメントは、同様に標的化に適すると考えられる。
【0110】
標的セグメントは、例示的な標的セグメントの1つの5’末端由来の少なくとも5個の連続するヌクレオチドを含むDNAまたはRNA配列を含み得る(残りのヌクレオチドは、標的セグメントの5’末端のすぐ上流から始まり、DNAまたはRNAが約5〜約100ヌクレオチドを含むまで続く同じDNAまたはRNAの連続的範囲である)。同様に標的セグメントは、例示的な標的セグメントの1つの3’末端由来の少なくとも5個の連続するヌクレオチドを含むDNAまたはRNA配列によって表される(残りのヌクレオチドは、標的セグメントの3’末端のすぐ下流から始まり、DNAまたはRNAが約5〜約100ヌクレオチドを含むまで続く同じDNAまたはRNAの連続的範囲である)。本明細書において例示される標的セグメントを用いる当業者は、過度の実験を行うことなくさらなる標的セグメントを特定できよう。
【0111】
一旦1以上の標的領域、セグメントまたは部位が特定されると、所望の効果を得るために標的に十分に相補的である、すなわち十分にハイブリダイズし、かつ十分な特異性を有するアンチセンス化合物が選択される。
【0112】
本発明の実施形態において、オリゴヌクレオチドは、特定の標的のアンチセンス鎖に結合する。オリゴヌクレオチドは、長さ少なくとも5ヌクレオチドであり、各オリゴヌクレオチドが重複する配列を標的化するように合成することができ、したがってオリゴヌクレオチドは標的ポリヌクレオチドの長さ全体に及ぶように合成される。標的はコード領域および非コード領域も含む。
【0113】
一実施形態において、アンチセンスオリゴヌクレオチドによって特定の核酸を標的化する。特定の核酸に対するアンチセンス化合物の標的化は、多段階プロセスである。通常、このプロセスは、その機能が調節される核酸配列の同定で始まる。これは、例えばその発現が特定の障害もしくは病態に関連する細胞遺伝子(もしくは遺伝子から転写されるmRNA)または例えば非翻訳RNA(ncRNA)などの非翻訳ポリヌクレオチドであり得る。
【0114】
RNAは、(1)タンパク質に翻訳されるメッセンジャーRNA(mRNA)、および(2)非タンパク質コードRNA(ncRNA)に分類され得る。ncRNAはマイクロRNA、アンチセンス転写物および高密度の終止コドンを含んでおり、いかなる「オープンリーディングフレーム」も欠いている他の転写単位(TU)を含む。多くのncRNAは、タンパク質コード遺伝子座の3’非翻訳領域(3’UTR)中の開始部位から始まると考えられる。ncRNAはまれにしかなく、FANTOMコンソーシアムによって配列決定されているncRNAの少なくとも半分はポリアデニル化されていないと考えられている。明らかな理由により大部分の研究者は、プロセシングされ、細胞質に排出されるポリアデニル化されたmRNAに注目している。近年、一連のポリアデニル化されていない核内RNAが非常に多い場合があり、そのような転写物の多くが遺伝子間領域から生じることが示された。ncRNAが遺伝子発現を制御し得る機構は、標的転写物との塩基対形成によるものである。塩基対形成によって機能するRNAは、(1)作用するRNAと同じ遺伝子座だが反対の鎖上にコードされ、したがってそれらの標的に対して完全な相補性を示すシスコードの(cis−encoded)RNA、および(2)作用するRNAとは異なる染色体上の位置にコードされ、一般にそれらの標的と完全な塩基対形成可能性を示さないトランスコードの(trans−encoded)RNAに分類され得る。
【0115】
理論による束縛を意図しないが、本明細書に記載のアンチセンスオリゴヌクレオチドによるアンチセンスポリヌクレオチドの変化は、対応するセンスメッセンジャーRNAの発現を変化させ得る。しかしこの制御は、不調和性(アンチセンスノックダウンがセンスメッセンジャーRNAの増加を生じる)または調和性(アンチセンスノックダウンが付随するセンスメッセンジャーRNAの減少を生じる)のいずれであっても良い。これらの場合、アンチセンスオリゴヌクレオチドは、アンチセンス鎖の重複したまたは重複していない部分に標的化され得、そのノックダウンまたは隔離を生じる。コードおよび非コードアンチセンスは、同一の手段で標的化でき、どちらの分類も対応するセンス転写物を、調和性または不調和性の手段のいずれかで制御できる。標的に対する使用のための新規オリゴヌクレオチドを同定することに使用される戦略は、アンチセンスオリゴヌクレオチドによるアンチセンスRNA転写物のノックダウンまたは所望の標的を調節するための任意の他の手段に基づき得る。
【0116】
戦略1:不調和性調節の場合、アンチセンス転写のノックダウンが、通常の(センス)遺伝子の発現を増加させる。後者の遺伝子が周知のまたは推定上の薬物標的をコードする場合は、そのアンチセンス対応物のノックダウンは受容体アゴニストまたは酵素刺激物質の作用をおそらく模倣し得よう。
【0117】
戦略2:調和性調節の場合、アンチセンスおよびセンス転写物の両方を同時にノックダウンすることができ、従って通常の(センス)遺伝子発現の相乗的低減を達成する。例えばアンチセンスオリゴヌクレオチドがノックダウンを達成するために使用される場合、この戦略は、センス転写物に標的化された1つのアンチセンスオリゴヌクレオチドと対応するアンチセンス転写物に対する他のアンチセンスオリゴヌクレオチドとに、または重複しているセンスおよびアンチセンス転写物を同時に標的化する単一のエネルギー的に対称なアンチセンスオリゴヌクレオチドに適用するために使用することができる。
【0118】
本発明によれば、アンチセンス化合物は、アンチセンスオリゴヌクレオチド、リボザイム、外部ガイド配列(EGS)オリゴヌクレオチド、siRNA化合物、siRNA化合物などの1本鎖または2本鎖RNA干渉(RNAi)化合物、および標的核酸の少なくとも一部分にハイブリダイズし、その機能を調節する他のオリゴマー化合物を含む。したがってそれらはDNA、RNA、DNA様、RNA様、もしくはそれらの混合物であり得る、またはこれらの1つまたは複数の模倣物であり得る。これらの化合物は、1本鎖、2本鎖、環状またはヘアピンオリゴマー化合物であって良く、内部もしくは末端の膨隆部、ミスマッチまたはループなどの構造要素を含み得る。アンチセンス化合物は、通常は直鎖状に調製されるが、環状および/または分枝状に結合されるかまたはそうでなければ調製され得る。アンチセンス化合物は、例えば全体的もしくは部分的な2本鎖化合物を形成するようにハイブリダイズした2本の鎖、または全体的もしくは部分的な2本鎖化合物のハイブリダイゼーションおよび形成を可能にするために十分な自己相補性を有する1本鎖などの構築物を含み得る。2本鎖は、遊離の3’もしくは5’末端を残すように内部で結合され得るか、または連続的ヘアピン構造もしくはループを形成するように結合され得る。ヘアピン構造は、5’または3’末端のいずれかにオーバーハングを含み得、1本鎖形質の伸長を生じる。場合により2本鎖化合物は、両末端にオーバーハングを含み得る。さらなる修飾は、末端のうちの1つ、選択されたヌクレオチド位置、糖位置またはヌクレオチド間結合のうちの1つに結合した複合基を含み得る。あるいは、本鎖は、非核酸成分またはリンカー基を介して連結され得る。1本だけの鎖から形成される場合dsRNAは、2重鎖を形成するためにそれ自体の上に折りたたまれる自己相補性ヘアピン型分子の形態を取り得る。したがってdsRNAは、完全にまたは部分的に2本鎖であり得る。遺伝子発現の特異的な調節は、遺伝子導入細胞系におけるdsRNAヘアピンの安定な発現によって達成され得るが、いくつかの実施形態においては、遺伝子の発現または機能は、アップレギュレートされる。2本鎖、または2重鎖を形成するためにそれ自体の上に折りたたまれる自己相補性ヘアピン型分子の形態を取る1本鎖から形成される場合、2本鎖(または1本鎖の2重鎖形成領域)は、ワトソン−クリック型と同様に塩基対形成する相補的RNA鎖である。
【0119】
一旦系に導入されると本発明の化合物は、標的核酸の切断もしくは他の修飾に影響する1種以上の酵素もしくは構造タンパク質の作用を誘発できる、または占有に基づく機構を介して作用できる。一般に核酸(オリゴヌクレオチドを含む)は、「DNA様」(すなわち一般に1つまたは複数の2’−デオキシ糖を有し、一般にU塩基よりもT塩基を有する)または「RNA様」(すなわち一般に1つまたは複数の2’−ヒドロキシ糖または2’−修飾糖を有し、一般にT塩基よりもU塩基を有する)と記載され得る。核酸ヘリックスは、1つより多い種類の構造を、最も通例ではA−形態およびB−形態をとり得る。一般にB−形態様構造を有するオリゴヌクレオチドは「DNA様」であり、A−形態様構造を有するものは「RNA様」であると考えられる。いくつかの(キメラ)実施形態においてアンチセンス化合物は、A−およびB−形態領域の両方を含み得る。
【0120】
別の実施形態では、所望のオリゴヌクレオチドまたはアンチセンス化合物は、アンチセンスRNA、アンチセンスDNA、キメラアンチセンスオリゴヌクレオチド;修飾された結合を含むアンチセンスオリゴヌクレオチド;干渉RNA(RNAi)、低分子干渉RNA(siRNA);マイクロ干渉RNA(miRNA);低分子一過的RNA(stRNA);または低分子ヘアピンRNA(shRNA);低分子RNA誘導遺伝子活性化(RNAa);低分子活性化RNA(saRNA)またはこれらの組み合わせのうちの少なくとも1つを含む。
【0121】
dsRNAは、遺伝子発現、「低分子RNA誘導遺伝子活性化」またはRNAaと称されている機構も活性化できる。遺伝子プロモーターを標的化するdsRNAは、関連する遺伝子の強力な転写活性化を誘導する。RNAaは、合成dsRNAを使用してヒト細胞において実証され、「低分子活性化RNA」(saRNA)と称された。
【0122】
低分子干渉RNA(siRNA)およびマイクロRNA(miRNA)などの低分子2本鎖RNA(dsRNA)は、RNA干渉(RNAi)として周知の進化的に保存された機構のトリガであることが見出されている。RNAiは、遺伝子発現抑制を導く。しかし、下の実施例の節において詳細に記載される例においては、オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドおよびそれにコードされる産物の発現および/または機能を増加させることが示されている。dsRNAは低分子活性化RNA(saRNA)としても作用できる。理論に束縛されることなく、遺伝子プロモーター中の配列を標的化することによって、saRNAはdsRNA誘発転写活性化(RNAa)と称される現象において標的遺伝子発現を誘導する。
【0123】
さらなる実施形態において、本明細書において同定する「標的セグメント」は、膵臓発生遺伝子ポリヌクレオチドの発現を調節する追加的化合物の選別において使用され得る。「調節物質」は、膵臓発生遺伝子をコードする核酸分子の発現を減少または増加させ、標的セグメントに相補的である少なくとも5個のヌクレオチド部分を含む化合物である。選別方法は、膵臓発生遺伝子のセンスまたは天然アンチセンスポリヌクレオチドをコードする核酸分子の標的セグメントを1つまたは複数の候補調節物質に接触させるステップ、および膵臓発生遺伝子ポリヌクレオチド、例えば配列番号13乃至45をコードする核酸分子の発現を減少または増加させる1つまたは複数の候補修飾物質を選択するステップを含む。1以上の候補調節物質が、膵臓発生遺伝子ポリヌクレオチドをコードする核酸分子の発現を調節できる(例えば減少させるまたは増加させる)ことが一度示されれば、次いで調節物質は、膵臓発生遺伝子ポリヌクレオチドの機能のさらなる調査研究において、または本発明による研究、診断もしくは治療剤としての使用のために使用され得る。
【0124】
天然アンチセンス配列のターゲッティングは、標的遺伝子の機能を調節する。例えば、膵臓発生遺伝子(例えば受託番号NM_001025366、NM_001146274、NM_001048、NM_000346、NM_022454、NM_000340、NM_014276、NM_005349、NM_004160、NM_178161、NM_002722、NM_000307、NM_000209、NM_002585、NM_000280、NM_006193、NM_004498、NM_018055、NM_006168、NM_002509、NM_020999、NM_002500、NM_004535、NM_002467、NM_001165255、NM_031944、NM_005461、NM_201589、NM_002276、NM_145805、NM_002202、NM_002196、NM_000207、NM_001185097、NM_001185098、NM_000207、NM_001185097、NM_001185098、NM_002193、NM_000457.3、NM_000458.2、NM_002729.4、NM_005524、NM_001134941、NM_005811、NM_002054、NM_005257、NM_002052、NM_006350、NM_021784、NM_004496、NM_002006、NM_004465、NM_001868、NM_139058、NM_001008221、NM_001106、NM_001616)の機能を調節する。ある実施形態において、標的は、膵臓発生遺伝子のアンチセンスポリヌクレオチドである。ある実施形態において、アンチセンスオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチド(受託番号NM_001025366、NM_001146274、NM_001048、NM_000346、NM_022454、NM_000340、NM_014276、NM_005349、NM_004160、NM_178161、NM_002722、NM_000307、NM_000209、NM_002585、NM_000280、NM_006193、NM_004498、NM_018055、NM_006168、NM_002509、NM_020999、NM_002500、NM_004535、NM_002467、NM_001165255、NM_031944、NM_005461、NM_201589、NM_002276、NM_145805、NM_002202、NM_002196、NM_000207、NM_001185097、NM_001185098、NM_000207、NM_001185097、NM_001185098、NM_002193、NM_000457.3、NM_000458.2、NM_002729.4、NM_005524、NM_001134941、NM_005811、NM_002054、NM_005257、NM_002052、NM_006350、NM_021784、NM_004496、NM_002006、NM_004465、NM_001868、NM_139058、NM_001008221、NM_001106、NM_001616)のセンスおよび/または天然アンチセンス配列、変異型、アレル、アイソフォーム、ホモログ、突然変異体、誘導体、断片およびそれらの相補配列を標的化する。好ましくはオリゴヌクレオチドは、アンチセンス分子であり、標的はアンチセンスおよび/またはセンス膵臓発生遺伝子ポリヌクレオチドのコード領域および非コード領域を含む。
【0125】
本発明の標的セグメントは、本発明のそれぞれの相補的アンチセンス化合物と安定化された2本鎖(2重鎖)オリゴヌクレオチドを形成するように組み合わされ得る。
【0126】
そのような2本鎖オリゴヌクレオチド成分は、当技術分野において標的発現を調節し、アンチセンス機構を介して翻訳およびRNAプロセシングを制御すると示されている。さらに2本鎖成分は化学修飾に供され得る。例えばその様な2本鎖成分は、2重鎖アンチセンス鎖の標的への古典的ハイブリダイゼーションによって標的を抑制することが示されており、それにより標的の酵素的分解のトリガとなる。
【0127】
ある実施形態では、アンチセンスオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチド(例えば受託番号NM_001025366、NM_001146274、NM_001048、NM_000346、NM_022454、NM_000340、NM_014276、NM_005349、NM_004160、NM_178161、NM_002722、NM_000307、NM_000209、NM_002585、NM_000280、NM_006193、NM_004498、NM_018055、NM_006168、NM_002509、NM_020999、NM_002500、NM_004535、NM_002467、NM_001165255、NM_031944、NM_005461、NM_201589、NM_002276、NM_145805、NM_002202、NM_002196、NM_000207、NM_001185097、NM_001185098、NM_000207、NM_001185097、NM_001185098、NM_002193、NM_000457.3、NM_000458.2、NM_002729.4、NM_005524、NM_001134941、NM_005811、NM_002054、NM_005257、NM_002052、NM_006350、NM_021784、NM_004496、NM_002006、NM_004465、NM_001868、NM_139058、NM_001008221、NM_001106、NM_001616)、変異型、アレル、アイソフォーム、ホモログ、突然変異体、誘導体、断片およびそれらの相補配列を標的化する。好ましくはオリゴヌクレオチドはアンチセンス分子である。
【0128】
本発明の実施形態によれば、標的核酸分子は、膵臓発生遺伝子だけに限定されず、任意のアイソフォーム、受容体、ホモログおよび膵臓発生遺伝子分子に及ぶ。
【0129】
他の実施形態では、該オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドの天然アンチセンス配列、例えば配列番号6乃至12に記載のポリヌクレオチドおよび任意の変異型、アレル、ホモログ、突然変異体、誘導体、断片およびそれらの相補配列を標的化する。アンチセンスオリゴヌクレオチドの例は、配列番号13乃至45として記載されている。
【0130】
一実施形態では、該オリゴヌクレオチドは、これに限定しないが膵臓発生遺伝子ポリヌクレオチドに関連する非コードセンス配列および/またはアンチセンス配列が含まれる、膵臓発生遺伝子アンチセンスの核酸配列に相補的であるかまたは結合し、膵臓発生遺伝子分子の発現および/または機能を調節する。
【0131】
他の実施形態では、該オリゴヌクレオチドは、配列番号6乃至12に記載の膵臓発生遺伝子天然アンチセンスの核酸配列に相補的であるかまたは結合し、膵臓発生遺伝子分子の発現および/または機能を調節する。
【0132】
ある実施形態では、オリゴヌクレオチドは、配列番号13乃至45の少なくとも5個の連続する核酸塩基の配列を含み、膵臓発生遺伝子分子の発現および/または機能を調節する。
【0133】
ポリヌクレオチド標的は、そのファミリーメンバーを含めた膵臓発生遺伝子、膵臓発生遺伝子の変異型;SNPを含む膵臓発生遺伝子の突然変異体;膵臓発生遺伝子の非コード配列;膵臓発生遺伝子のアレル;種の変異型、断片などを含む。好ましくはオリゴヌクレオチドはアンチセンス分子である。
【0134】
他の実施形態では、膵臓発生遺伝子ポリヌクレオチドを標的化するオリゴヌクレオチドは、アンチセンスRNA、干渉RNA(RNAi)、低分子干渉RNA(siRNA);マイクロ干渉RNA(miRNA);低分子一過的RNA(stRNA);または短いヘアピンRNA(shRNA);低分子RNA誘導遺伝子活性化(RNAa);または低分子活性化RNA(saRNA)を含む。
【0135】
他の実施形態では、膵臓発生遺伝子ポリヌクレオチド、例えば配列番号6乃至12の標的化は、これらの標的の発現または機能を調節する。一実施形態において発現または機能は対照と比較してアップレギュレートされる。他の実施形態において、発現または機能は対照と比較してダウンレギュレートされる。
【0136】
他の実施形態では、アンチセンス化合物は、配列番号13乃至45に記載の配列を含む。これらのオリゴヌクレオチドは、1以上の修飾された核酸塩基、より短いまたはより長い断片、修飾された結合などを含み得る。
【0137】
他の実施形態では、配列番号13乃至45は、1つまたは複数のLNAヌクレオチドを含む。
【0138】
所望の標的核酸の調節は、当技術分野において周知のいくつかの方法において実施され得る。例えばアンチセンスオリゴヌクレオチド、siRNAなど。酵素的核酸分子(例えばリボザイム)は、ヌクレオチド塩基配列に特異的な方式で他の別々の核酸分子を繰り返し切断する能力を含む種々の反応の1以上を触媒できる核酸分子である。そのような酵素的核酸分子は、例えば実質的にいかなるRNA転写物を標的化するのにも使用され得る。
【0139】
それらの配列特異性により、トランス切断酵素的核酸分子は、ヒト疾患に対する治療剤としての有望さを示す。酵素的核酸分子は、細胞性RNA背景中で特定のRNA標的を切断するために設計され得る。そのような切断事象はmRNAを非機能的にし、かつそのRNAからのタンパク質発現を抑止する。このようにして、病態に関連するタンパク質の合成は選択的に抑制され得る。
【0140】
通常、RNA切断活性を有する酵素的核酸は、最初に標的RNAに結合することによって作用する。そのような結合は、標的RNAを切断するために作用する分子の酵素的部分に近接に保持される酵素的核酸の標的結合部分を通じて生じる。したがって酵素的核酸分子は、最初に標的RNAを認識し、次いで相補的塩基対形成を通じて結合し、一旦正確な部位に結合すると標的RNAを切断するために酵素的に作用する。そのような標的RNAの戦略的切断は、コードされているタンパク質の合成を方向付けるその能力を破壊する。酵素的核酸がそのRNA標的に結合および切断した後、それはRNAから解離し、別の標的を探して反復して新たな標的に結合し、切断できる。
【0141】
体外選択(進化的)戦略などのいくつかの手法が、ホスホジエステル結合およびアミド結合の切断および連結などの種々の反応を触媒できる新規核酸触媒を発展させるために使用されている。
【0142】
触媒活性のために最適なリボザイムの開発は、遺伝子発現制御の目的のためにRNA切断リボザイムを使用するいかなる戦略にも顕著に貢献する。例えばハンマーヘッド型リボザイムは、飽和(10mM)濃度のMg2+補助因子の存在下で触媒速度(kcat)約1分−1で機能する。人工的「RNAリガーゼ」リボザイムは、対応する自己修飾反応を約100分−1の速度で触媒することが示されている。加えてDNAから作られた基質結合腕を有するある種の修飾されたハンマーヘッド型リボザイムは、約100分−1に近い多重代謝回転速度でRNA切断を触媒することが周知である。最後にハンマーヘッドの触媒コア中の特定の残基の特定のヌクレオチド類似体での置換は、触媒速度に10倍程度の改善を示す修飾されたリボザイムをもたらす。これらの発見は、リボザイムが、ほとんどの天然の自己切断リボザイムによって体外で示されるものより顕著に大きな触媒速度での化学的形質転換を促進できることを示す。それにより、ある種の自己切断リボザイムの構造は、最大の触媒活性をもたらすように最適化され得る、またはRNAホスホジエステル切断について顕著に早い速度を示す完全に新規のRNAモチーフが作製され得ることが可能である。
【0143】
「ハンマーヘッド」モデルにあてはまるRNA触媒によるRNA基質の分子間切断は、1987年に最初に示された。RNA触媒は、回収され、複数のRNA分子と反応し、それが真に触媒作用的であることを示した。
【0144】
「ハンマーヘッド」モチーフに基づいて設計された触媒RNAは、標的配列に必要な塩基対形成を維持するために触媒RNA中に適切な塩基変更を作製することによって特定の標的配列を切断するために使用されている。これは、特定の標的配列を切断するための触媒RNAの使用を可能にし、「ハンマーヘッド」モデルによって設計された触媒RNAが生体内で特定の基質RNAを切断できる可能性があることを示している。
【0145】
RNA干渉(RNAi)は、哺乳動物および哺乳動物細胞における遺伝子発現を調節するための強力な手段になっている。この手法は、発現プラスミドまたはウイルスおよび、siRNAにプロセシングされる低分子ヘアピンRNAのコード配列を使用するRNAそれ自体としてまたはDNAとしてのいずれかでの低分子干渉RNA(siRNA)の送達を必要とする。この系は、プレsiRNAのそれらが活性である細胞質への効率的な輸送を可能にし、遺伝子発現のために制御された組織特異的なプロモーターの使用を可能にする。
【0146】
一実施形態では、オリゴヌクレオチドまたはアンチセンス化合物は、リボ核酸(RNA)および/もしくはデオキシリボ核酸(DNA)のオリゴマーもしくはポリマーまたはそれらの模倣物、キメラ、アナログもしくはホモログを含む。この用語は、天然に存在するヌクレオチド、糖およびヌクレオチド間(骨格)共有結合ならびに同様に機能する天然に存在しない部分を含むオリゴヌクレオチドからなるオリゴヌクレオチドを含む。そのような修飾されたまたは置換されたオリゴヌクレオチドは、例えば細胞への増強された取り込み、標的核酸に対する増強された親和性およびヌクレアーゼの存在下での増大した安定性などの望ましい特性からしばしば天然形態よりも望ましい。
【0147】
本発明により、オリゴヌクレオチドまたは「アンチセンス化合物」は、アンチセンスオリゴヌクレオチド(例えばRNA、DNA、それらの模倣物、キメラ、アナログまたはホモログ)、リボザイム、外部ガイド配列(EGS)オリゴヌクレオチド、siRNA化合物、siRNA化合物などの1本鎖または2本鎖RNA干渉(RNAi)化合物、saRNA、aRNAおよび標的核酸の少なくとも一部分にハイブリダイズしその機能を調節する他のオリゴマー化合物を含む。そのようにそれらは、DNA、RNA、DNA様、RNA様もしくはそれらの混合物であり得るか、またはこれらの1つまたは複数の模倣物でありえる。これらの化合物は、1本鎖、2本鎖、環状またはヘアピンオリゴマー化合物であることができ、内部もしくは末端の膨隆部、ミスマッチまたはループなどの構造要素を含み得る。アンチセンス化合物は、通常は直鎖状に調製されるが、環状および/または分枝状に結合されるかまたはそうでなければ調製され得る。アンチセンス化合物は、例えば全体的もしくは部分的な2本鎖化合物を形成するようにハイブリダイズした2本の鎖、または全体的もしくは部分的な2本鎖化合物のハイブリダイゼーションおよび形成を可能にするために十分な自己相補性を有する1本鎖などの構築物を含み得る。2本の鎖は、遊離の3’もしくは5’末端を残すように内部で結合され得るか、または連続的ヘアピン構造もしくはループを形成するように結合され得る。ヘアピン構造は、1本鎖形質の伸長を生じさせるために5’または3’末端のいずれかにオーバーハングを含有できる。場合により2本鎖化合物は、両末端にオーバーハングを含み得る。さらなる修飾は、末端のうちの1つ、選択されたヌクレオチド位置、糖位置またはヌクレオチド間結合のうちの1つに結合した複合基を含み得る。代替として2本の鎖は、非核酸成分またはリンカー基を介して結合できる。1本鎖だけから形成される場合dsRNAは、2重鎖を形成するためにそれ自体の上に折りたたまれる自己相補性ヘアピン型分子の形態を取り得る。したがってdsRNAは、完全にまたは部分的に2本鎖であり得る。遺伝子発現の特異的な調節は、遺伝子導入細胞系におけるdsRNAヘアピンの安定な発現によって達成され得る。2本鎖、または2重鎖を形成するためにそれ自体の上に折りたたまれる自己相補性ヘアピン型分子の形態をとる1本鎖から形成される場合、2本鎖(または1本鎖の2重鎖形成領域)は、ワトソン−クリック型の形で塩基対形成する自己相補的RNA鎖である。
【0148】
一旦系に導入されると本発明の化合物は、標的核酸の切断もしくは他の修飾をもたらす1種以上の酵素もしくは構造タンパク質の作用を誘発できる、または占有に基づく機構を介して作用できる。一般に核酸(オリゴヌクレオチドを含む)は、「DNA様」(すなわち一般に1以上の2’−デオキシ糖を有し、一般にU塩基よりもT塩基を有する)または「RNA様」(すなわち一般に1つまたは複数の2’−ヒドロキシ糖または2’−修飾糖を有し、一般にT塩基よりもU塩基を有する)と記載され得る。核酸ヘリックスは、2種以上の構造を、最も通例ではA−形態およびB−形態をとり得る。一般にB−形態様構造を有するオリゴヌクレオチドは「DNA様」であると、A−形態様構造を有するものは「RNA様」であると考えられる。いくつかの(キメラ)実施形態においてアンチセンス化合物は、A−およびB−形態領域の両方を含み得る。
【0149】
本発明によるアンチセンス化合物は、長さ約5〜約80ヌクレオチド(すなわち約5〜約80個連結したヌクレオシド)由来のアンチセンス部分を含み得る。これは、アンチセンス化合物のアンチセンス鎖または一部分の長さを意味する。言い換えると、本発明の1本鎖アンチセンス化合物は、5〜約80個のヌクレオチドを含み、本発明の2本鎖アンチセンス化合物(例えばdsRNAなど)は、長さ5〜約80ヌクレオチドのセンスおよびアンチセンス鎖または一部分を含む。当業者であれば、これが長さ5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、または80ヌクレオチドまたはこれらの範囲内の任意の長さのアンチセンス部分を内包することを理解されよう。
【0150】
一実施形態において本発明のアンチセンス化合物は、長さ10〜50ヌクレオチドのアンチセンス部分を有する。当業者であれば、これが長さ10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、または50ヌクレオチドまたはこれらの範囲内の任意の長さのアンチセンス部分を有するオリゴヌクレオチドを具体化することを理解されよう。いくつかの実施形態において、オリゴヌクレオチドは長さ15ヌクレオチドである。
【0151】
一実施形態において、本発明のアンチセンスまたはオリゴヌクレオチド化合物は、長さ12または13〜30ヌクレオチドのアンチセンス部分を有する。当業者であれば、これが長さ12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29もしくは30ヌクレオチドまたはこれらの範囲内の任意の長さのアンチセンス部分を有するアンチセンス化合物を具体化することを理解されよう。
【0152】
他の実施形態において、本発明のオリゴマー化合物は、化合物中の1以上のヌクレオチド位置に異なる塩基が存在する変異型も含む。例えば、最初のヌクレオチドがアデノシンである場合、この位置にチミジン、グアノシンまたはシチジンを含有する変異型が生成され得る。これは、アンチセンスまたはdsRNA化合物の任意の位置においてなされ得る。次いでこれらの化合物は、標的核酸の発現を抑制するそれらの能力を測定するために本明細書に記載の方法を使用して検査される。
【0153】
いくつかの実施形態において、アンチセンス化合物と標的との間の相同性、配列同一性または相補性は、約40%〜約60%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約60%〜約70%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約70%〜約80%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約80%〜約90%である。いくつかの実施形態において、相同性、配列同一性または相補性は、約90%、約92%、約94%、約95%、約96%、約97%、約98%、約99%または約100%である。
【0154】
他の実施形態において、例えば配列番号6乃至45に記載の核酸分子などのアンチセンスオリゴヌクレオチドは、1以上の置換または修飾を含む。一実施形態においてヌクレオチドはロックト核酸(LNA)で置換される。
【0155】
他の実施形態において、オリゴヌクレオチドは、膵臓発生遺伝子に関連するコードおよび/または非コード配列ならびに配列番号1乃至12として記載の配列の、核酸分子センスおよび/またはアンチセンスの1以上の領域を標的化する。オリゴヌクレオチドは、配列番号1乃至12の重複領域にも標的化される。
【0156】
本発明の特定のオリゴヌクレオチドは、キメラオリゴヌクレオチドである。本発明の文脈において「キメラオリゴヌクレオチド」または「キメラ」は、それぞれ少なくとも1つのヌクレオチドからなる2つ以上の化学的に異なる領域を含むオリゴヌクレオチドである。これらのオリゴヌクレオチドは、1種以上の有益な特性(例えばヌクレアーゼ耐性の増大、細胞への取り込みの増大、標的に対する結合親和性の増大など)を付与する修飾されたヌクレオチドの少なくとも1つの領域、およびRNA:DNAまたはRNA:RNAハイブリッドを切断できる酵素の基質である領域を典型的には含む。例として、RNaseHは、RNA:DNA 2重鎖のRNA鎖を切断する細胞性エンドヌクレアーゼである。したがってRNase Hの活性化は、RNA標的の切断を生じ、それにより遺伝子発現のアンチセンス調節の効率を非常に増強する。結果としてキメラオリゴヌクレオチドが使用される場合、同じ標的領域にハイブリダイズするホスホロチオエートデオキシオリゴヌクレオチドと比較して低分子オリゴヌクレオチドで同程度の結果がしばしば得られる。RNA標的の切断は、ゲル電気泳動および必要に応じて当技術分野において周知の関連する核酸ハイブリダイゼーション技術によって通常通りに検出できる。一実施形態において、キメラオリゴヌクレオチドは、標的結合親和性を増大させる少なくとも1つの領域、およびRNase Hの基質として作用する領域を通常含む。オリゴヌクレオチドのその標的(この場合、rasをコードする核酸)に対する親和性は、オリゴヌクレオチド/標的対のTm(オリゴヌクレオチドと標的とが解離する温度であり、解離は分光光度的に検出される)を測定することによって通常通りに決定される。Tmが高くなるほど、標的に対するオリゴヌクレオチドの親和性は大きい。
【0157】
本発明のキメラアンチセンス化合物は、2つ以上のオリゴヌクレオチド、修飾されたオリゴヌクレオチド、上に記載のオリゴヌクレオシドおよび/またはオリゴヌクレオチド模倣物の複合構造として形成され得る。そのような化合物は、当技術分野においてハイブリッドまたはギャップマー(gapmer)とも称されている。そのようなハイブリッド構造の調製について記載した代表的な米国特許としては、以下に限定しないが、それぞれ参照により本明細書に組み込まれる米国特許第5,013,830号、第5,149,797号、第5,220,007号、第5,256,775号、第5,366,878号、第5,403,711号、第5,491,133号、第5,565,350号、第5,623,065号、第5,652,355号、第5,652,356号および第5,700,922号が挙げられる。
【0158】
他の実施形態では、修飾されたオリゴヌクレオチドの領域は、糖の2’位置で修飾された少なくとも1つのヌクレオチド、最も好ましくは2’−O−アルキル、2’−O−アルキル−O−アルキル、または2’フルオロ修飾ヌクレオチドを含む。他の実施形態においては、RNA修飾は、ピリミジン、脱塩基残基またはRNAの3’末端の反転塩基(inverted base)のリボース上の2’−フルオロ、2’−アミノおよび2’O−メチル修飾を含む。そのような修飾は、通常通りにオリゴヌクレオチドに組み込まれ、これらのオリゴヌクレオチドは、所与の標的に対して2’−デオキシオリゴヌクレオチドよりもより高いTm(すなわちより高い標的結合親和性)を有することが示されている。そのような増大した親和性の効果は、遺伝子発現のRNAiオリゴヌクレオチド抑制を非常に増強する。RNAse Hは、RNA:DNA 2重鎖のRNA鎖を切断する細胞性エンドヌクレアーゼであり、したがってこの酵素の活性化は、RNA標的の切断を生じ、それによりRNAi抑制の効率を非常に増強できる。RNA標的の切断は、ゲル電気泳動によって通常通り実証され得る。他の実施形態では、キメラオリゴヌクレオチドもヌクレアーゼ耐性を増強するべく修飾される。細胞は、核酸を分解できる種々のエキソ−およびエンド−ヌクレアーゼを含有する。多数のヌクレオチドおよびヌクレオシド修飾が、それが組み込まれるオリゴヌクレオチドを天然のオリゴヌクレオチドよりもヌクレアーゼ消化に対してより耐性にすることが示されている。ヌクレアーゼ耐性は、オリゴヌクレオチドを細胞抽出物または単離されたヌクレアーゼ溶液とインキュベートし、一定時間後に残っている未変化オリゴヌクレオチドの量を、通常は電気泳動によって、測定することにより通常通り測定される。ヌクレアーゼ耐性を増強するべく修飾されているオリゴヌクレオチドは、未修飾オリゴヌクレオチドよりも長時間未変化で残存する。種々のオリゴヌクレオチド修飾がヌクレアーゼ耐性を増強するまたは付与することが実証されている。現在のところ少なくとも1つのホスホロチオエート修飾を含有するオリゴヌクレオチドはより好ましい。いくつかの場合に標的結合親和性を増強するオリゴヌクレオチド修飾も、単独で、ヌクレアーゼ耐性を増強できる。いくつかの望ましい修飾は、De Mesmaekerら(1995)Acc.Chem.Res.,28:366−374に見出すことができる。
【0159】
本発明のために想定されるいくつかのオリゴヌクレオチドの具体的な例としては、修飾された骨格、例えばホスホロチオエート、リン酸トリエステル、メチルホスホネート、短鎖アルキルもしくはシクロアルキル糖部分間結合または短鎖ヘテロ原子もしくは複素環糖間結合を含むものが挙げられる。多くは、ホスホロチオエート骨格を有するオリゴヌクレオチドおよびヘテロ原子骨格、特にCH2−NH−O−CH2、CH、−N(CH3)−O−CH2[メチレン(メチルイミノ)またはMMI骨格として周知]、CH2−O−N(CH3)−CH2、CH2−N(CH3)−N(CH3)−CH2およびO−N(CH3)−CH2−CH2骨格、式中天然のホスホジエステル骨格はO−P−O−CHと表される)を有するものである。De Mesmaekerら(1995)Acc.Chem.Res.28:366−374)によって開示されたアミド骨格も挙げられる。同様に、モルホリノ骨格構造を有するオリゴヌクレオチドも挙げられる(SummertonおよびWeller、米国特許第5,034,506号)。他の実施形態において、ペプチド核酸(PNA)骨格、オリゴヌクレオチドのホスホジエステル骨格などは、ポリアミド骨格で置換され、ヌクレオチドは直接または間接的にポリアミド骨格のアザ窒素原子に結合される。オリゴヌクレオチドは、1以上の置換された糖部分も含み得る。オリゴヌクレオチドは、以下のもの:OH、SH、SCH3、F、OCN、OCH3OCH3、OCH3O(CH2)nCH3、O(CH2)nNH2またはO(CH2)nCH3(nは1〜約10);C1〜C10低級アルキル、アルコキシアルコキシ、置換された低級アルキル、アルカリルまたはアラルキル;Cl;Br;CN;CF3;OCF3;O−、S−、またはN−アルキル;O−、S−、またはN−アルケニル;SOCH3;SO2;CH3;ONO2;NO2;N3;NH2;ヘテロシクロアルキル;ヘテロシクロアルカリル;アミノアルキルアミノ;ポリアルキルアミノ;置換されたシリル;RNA切断基;レポーター基;干渉物質;オリゴヌクレオチドの薬物動態特性を改善する基;またはオリゴヌクレオチドの薬力学特性を改善する基および同様の特性を有する他の置換基のうちの1つを2’位置に含む。修飾は、2’−メトキシエトキシ[2’−O−CH2CH2OCH3、2’−O−(2−メトキシエチル)としても周知]を含む。他の修飾は2’−メトキシ(2’−O−CH3)、2’−プロポキシ(2’−OCH2CH2CH3)および2’−フルオロ(2’−F)を含む。同様に修飾は、オリゴヌクレオチドの他の位置、詳細には3’末端ヌクレオチドの糖の3’位および5’末端ヌクレオチドの5’位でも作製され得る。オリゴヌクレオチドは、ペントフラノシル基の代わりにシクロブチルなどの糖類似体も有し得る。
【0160】
オリゴヌクレオチドは、追加的または代替的に核酸塩基(当技術分野において単に「塩基」と称されることも多い)修飾または置換も含み得る。本明細書において使用される「未修飾」または「天然」ヌクレオチドは、アデニン(A)、グアニン(G)、チミン(T)、シトシン(C)およびウラシル(U)を含む。修飾されたヌクレオチドは、天然の核酸においてまれに、または一過的にだけ見出されるヌクレオチド、例えばヒポキサンチン、6−メチルアデニン、5−Meピリミジン、詳細には5−メチルシトシン(5−メチル−2’−デオキシシトシンとも称され、5−Me−Cとも当技術分野においてしばしば称される)、5−ヒドロキシメチルシトシン(HMC)、グリコシルHMCおよびゲントビオシルHMCならびに合成ヌクレオチド、例えば2−アミノアデニン、2−(メチルアミノ)アデニン、2−(イミダゾリルアルキル)アデニン、2−(アミノアルキルアミノ)アデニンまたは他のヘテロ置換アルキルアデニン、2−チオウラシル、2−チオチミン、5−ブロモウラシル、5−ヒドロキシメチルウラシル、8−アザグアニン、7−デアザグアニン、N6(6−アミノヘキシル)アデニンおよび2,6−ジアミノプリンを含む。当技術分野において周知の「ユニバーサル」塩基、例えばイノシン、も含まれ得る。5−Me−C置換は、核酸2重鎖の安定性を0.6〜1.2℃増大させることが示されており(Sanghvi,Y.S.,in Crooke,S.T.およびLebleu,B.,eds.,Antisense Research and Applications,CRC Press,Boca Raton,1993,pp.276−278)、現在用いられる塩基置換である。
【0161】
本発明のオリゴヌクレオチドの他の修飾は、オリゴヌクレオチドの活性または細胞への取り込みを増強する1以上の成分またはコンジュゲートのオリゴヌクレオチドへの化学的結合を含む。そのような成分として、以下に限定されないが、コレステロール成分、コレステリル成分、チオエーテル、例えばヘキシル−S−トリチルチオール、チオコレステロール、脂肪族鎖、例えばドデカンジオールまたはウンデシル残基、リン脂質、例えばジヘキサデシル−rac−グリセロールまたはトリエチル1,2−ジ−O−ヘキサデシル−racグリセロ−3−H−ホスホネート、ポリアミンまたはポリエチレングリコール鎖、あるいはアダマンタン酢酸などの脂質成分が含まれる。親油性成分を含むオリゴヌクレオチドおよびそのようなオリゴヌクレオチドを調製する方法は、当技術分野、例えば米国特許第5,138,045号、第5,218,105号および第5,459,255号において公知である。
【0162】
所与のオリゴヌクレオチドにおけるすべての位置が一律に修飾される必要はなく、実際に前述の修飾のうちの2種以上が単一のオリゴヌクレオチド中に、またはオリゴヌクレオチド中の単一のヌクレオシド中にさえも組み込まれ得る。本発明は、本明細書中以前に定義したキメラオリゴヌクレオチドであるオリゴヌクレオチドも含む。
【0163】
他の実施形態において本発明の核酸分子は、限定されないが脱塩基ヌクレオチド、ポリエーテル、ポリアミン、ポリアミド、ペプチド、炭水化物、脂質またはポリ炭化水素化合物を含む他の成分と結合される。当業者であれば、これらの分子が、糖、塩基またはリン酸基のいくつかの位置に核酸分子を含む1以上の任意のヌクレオチドに連結され得ることを理解されよう。
【0164】
本発明により使用されるオリゴヌクレオチドは、好都合におよび通常通り固相合成の十分に周知な技術を通じて作製される。そのような合成のための装置は、Applied Biosystemsを含むいくつかのベンダーから販売されている。そのような合成のための任意の他の手段も使用され得る;オリゴヌクレオチドの実際の合成は、十分に当業者の能力の範囲内である。ホスホロチオエートおよびアルキル化誘導体などの他のオリゴヌクレオチドを調製するために類似技術を使用することもよく知られている。類似技術ならびに商業的に入手可能な修飾されたアミダイトおよび多孔質ガラス(CPG)製品(ビオチン、フルオレセイン、アクリジンもしくはソラレン修飾アミダイトなど)および/または蛍光標識、ビオチン化もしくは、コレステロール修飾オリゴヌクレオチドなどの他の修飾オリゴヌクレオチドを合成するためのCPG(Glen Research,Sterling VAから入手可能)の使用もよく知られている。
【0165】
本発明により、強度、特異性および作用期間の増強のため、およびオリゴヌクレオチドの投与経路を拡げるためのLNAモノマーの利用などの修飾の使用には、MOE、ANA、FANA、PSなど現在のケミストリが含まれる。これは現在のオリゴヌクレオチド中のいくつかのモノマーのLNAモノマーによる置換によって達成され得る。LNA修飾オリゴヌクレオチドは、親化合物に類似する大きさを有する場合があり、またはより大きいものもよいが、好ましくは小さいものである。そのようなLNA修飾オリゴヌクレオチドが約70%より少ない、より好ましくは約60%より少ない、最も好ましくは約50%より少ないLNAモノマーを含むことは好ましく、それらの大きさは約5から25ヌクレオチドの間であることが好ましく、より好ましくは約12から20ヌクレオチドの間の大きさである。
【0166】
修飾されたオリゴヌクレオチド骨格は、以下に限定されないが、ホスホロチオエート、キラルホスホロチオエート、ホスホロジチオエート、ホスホトリエステル、アミノアルキルホスホトリエステル、メチルホスホネートおよび他のアルキルホスホネート(3’アルキレンホスホネートおよびキラルホスホネートを含む)、ホスフィネート、ホスホラミデート(3’アミノホスホラミデートおよびアミノアルキルホスホラミデートを含む)、チオノホスホラミデート、チオノアルキルホスホネート、チオノアルキルホスホトリエステルおよび通常の3’−5’結合を有するボラノホスフェート、これらの2’−5’結合類似体、および逆転した方向性を有する(ヌクレオチド単位の隣接する対が3’−5’から5’−3’にまたは2’−5’から5’−2’に連結している)ものを含む。種々の塩、塩混合物および遊離酸の形態も含まれる。
【0167】
上記のリン含有結合の作製を説明する代表的な米国特許としては、以下に限定されないが、米国特許第3,687,808号;4,469,863号;第4,476,301号;第5,023,243号;第5,177,196号;第5,188,897号;第5,264,423号;第5,276,019号;第5,278,302号;第5,286,717号;第5,321,131号;第5,399,676号;第5,405,939号;第5,453,496号;第5,455,233号;第5,466,677号;第5,476,925号;第5,519,126号;第5,536,821号;第5,541,306号;第5,550,111号;第5,563,253号;第5,571,799号;第5,587,361号;および第5,625,050号が挙げられ、それぞれが参照により本明細書に組み込まれる。
【0168】
修飾オリゴヌクレオチド骨格はリン原子を含まず、単鎖アルキルもしくはシクロアルキルヌクレオチド間結合、混合ヘテロ原子およびアルキルもしくはシクロアルキルヌクレオチド間結合、または1つもしくは複数の単鎖ヘテロ原子もしくは複素環ヌクレオチド間結合によって形成された骨格を有する。これらは、モルホリノ結合(ヌクレオシドの糖部分から部分的に形成される);シロキサン骨格;スルフィド、スルホキシドおよびスルホン骨格;ホルムアセチルおよびチオホルムアセチル骨格;メチレンホルムアセチルおよびチオホルムアセチル骨格;アルケン含有骨格;スルファメート骨格;メチレンイミノおよびメチレンヒドラジノ骨格;スルホネートおよびスルホンアミド骨格;アミド骨格;ならびに他のN、O、SおよびCH2が混合した構成成分部分を有するものを含む。
【0169】
上記のオリゴヌクレオチドの調製を説明する代表的な米国特許としては、以下に限定されないが、米国特許5,034,506号;第5,166,315号;第5,185,444号;第5,214,134号;第5,216,141号;第5,235,033号;第5,264,562号;第5,264,564号;第5,405,938号;第5,434,257号;第5,466,677号;第5,470,967号;第5,489,677号;第5,541,307号;第5,561,225号;第5,596,086号;第5,602,240号;第5,610,289号;第5,602,240号;第5,608,046号;第5,610,289号;第5,618,704号;第5,623,070号;第5,663,312号;第5,633,360号;第5,677,437号;および第5,677,439号が挙げられ、それぞれが参照により本明細書に組み込まれる。
【0170】
他のオリゴヌクレオチド模倣物において、ヌクレオチド単位の糖およびヌクレオチド間結合(すなわち骨格)の両方は新たな基で置換される。塩基単位は、適切な核酸ターゲッティング合物とのハイブリダイゼーションのために維持される。そのようなオリゴマー化合物の1つ、優れたハイブリダイゼーション特性を有することが判明しているオリゴヌクレオチド模倣物は、ペプチド核酸(PNA)と称される。PNA化合物において、オリゴヌクレオチドの糖骨格は、アミド含有骨格、詳細にはアミノエチルグリシン骨格で置換される。核酸塩基は、保持され、骨格のアミド部分のアザ窒素原子に直接または間接的に結合される。PNA化合物の調製について開示している代表的米国特許は、以下に限定されないが、米国特許第5,539,082号、米国特許第5,714,331号および米国特許第5,719,262号が挙げられ、それぞれ参照により本明細書に組み込まれる。PNA化合物のさらなる説明は、Nielsenら(1991)Science 254,1497−1500にみられる。
【0171】
本発明の他の実施形態において、ホスホロチオエート骨格を有するオリゴヌクレオチドおよびヘテロ原子骨格を有するオリゴヌクレオシド、特に、−CH2−NH−O−CH2−、−CH2−N(CH3)−O−CH2−(メチレン(メチルイミノ)またはMMI骨格として周知)、−CH2−O−N(CH3)−CH2、CH2N(CH3)−N(CH3)CH2−および−O−N(CH3)−CH2−CH2−(天然のホスホジエステル骨格は、以前に引用した米国特許第5,489,677号の−O−P−O−CH2−として表される)、および以前に引用した米国特許第5,602,240号のアミド骨格。同様に用いられるのは、以前に引用した米国特許第5,034,506号のモルホリノ骨格構造を有するオリゴヌクレオチドである。
【0172】
修飾されたオリゴヌクレオチドは、1つ以上の置換された糖部分を含み得る。オリゴヌクレオチドは、以下のもの:OH;F;O−、S−、もしくはN−アルキル;O−、S−、もしくはN−アルケニル;O−、S−もしくはN−アルキニル;またはOアルキル−O−アルキル(式中アルキル、アルケニルおよびアルキニルは、CからCOアルキルに、またはC2からCOアルケニルおよびアルキニルに、置換されるまたは置換されない場合がある)のうちの1つを2’位置に含む。特に挙げられるのは、O(CH2)nOmCH3、O(CH2)n、OCH3、O(CH2)nNH2、O(CH2)nCH3、O(CH2)nONH2およびO(CH2nON(CH2)nCH3)2であり、式中nおよびmは1から約10であり得る。他のオリゴヌクレオチドは、以下:CからCO、(低級アルキル、置換された低級アルキル、アルカリル、アラルキル、O−アルカリルもしくはO−アラルキル、SH、SCH3、OCN、Cl、Br、CN、CF3、OCF3、SOCH3、SO2CH3、ONO2、NO2、N3、NH2、ヘテロシクロアルキル、ヘテロシクロアルカリル、アミノアルキルアミノ、ポリアルキルアミノ、置換されたシリル、RNA切断基、レポーター基、干渉物質、オリゴヌクレオチドの薬物動態特性を改善する基、またはオリゴヌクレオチドの薬力学特性を改善する基および同様の特性を有する他の置換基のうちの1つを2’位置に含む。修飾は、2’−メトキシエトキシ(2’−O−CH2CH2OCH3、2’−O−(2−メトキシエチル)または2’−MOEとしても知られる)すなわちアルコキシアルコキシ基を含む。さらなる修飾は、2’−ジメチルアミノオキシエトキシ、すなわちO(CH2)2ON(CH3)2基、本明細書以下の実施例において記載のとおり2’−DMAOEとしても周知,ならびに2’−ジメチルアミノエトキシエトキシ(当技術分野において2’−O−ジメチルアミノエトキシエチルまたは2’−DMAEOEとしても当分野で周知)すなわち、2’−O−CH2−O−CH2−N(CH2)2を含む。
【0173】
他の修飾は、2’−メトキシ(2’−O CH3)、2’−アミノプロポキシ(2’−O CH2CH2CH2NH2)および2’−フルオロ(2’−F)を含む。同様の修飾は、オリゴヌクレオチドの他の位置、詳細には3’末端ヌクレオチドの糖の3’位置または2’−5’連結オリゴヌクレオチドおよび5’末端ヌクレオチドの5’位置にも作製され得る。オリゴヌクレオチドは、ペントフラノシル糖の代わりにシクロブチル成分などの糖類似体も有し得る。そのような修飾糖構造の調製について開示した代表的米国特許としては、以下に限定されないが、米国特許4,981,957号;第5,118,800号;第5,319,080号;第5,359,044号;第5,393,878号;第5,446,137号;第5,466,786号;第5,514,785号;第5,519,134号;第5,567,811号;第5,576,427号;第5,591,722号;第5,597,909号;第5,610,300号;第5,627,053号;第5,639,873号;第5,646,265号;第5,658,873号;第5,670,633号;および第5,700,920号などが挙げられ、それぞれが参照により本明細書に組み込まれる。
【0174】
オリゴヌクレオチドは、核酸塩基(当技術分野において単に「塩基」と称されることが多い)修飾または置換も含み得る。本明細書において使用される「未修飾」または「天然」ヌクレオチドは、プリン塩基アデニン(A)およびグアニン(G)、ならびにピリミジン塩基チミン(T)、シトシン(C)およびウラシル(U)を含む。修飾ヌクレオチドは、5−メチルシトシン(5−Me−C)、5−ヒドロキシメチルシトシン、キサンチン、ヒポキサンチン、2−アミノアデニン、アデニンおよびグアニンの6−メチルおよび他のアルキル誘導体、アデニンおよびグアニンの2−プロピルおよび他のアルキル誘導体、2−チオウラシル、2−チオチミンおよび2−チオシトシン、5−ハロウラシルおよびシトシン、5−プロピニルウラシルおよびシトシン、6−アゾウラシル、シトシンおよびチミン、5−ウラシル(シュードウラシル)、4−チオウラシル、8−ハロ、8−アミノ、8−チオール、8−チオアルキル、8−ヒドロキシルおよび他の8−置換アデニンおよびグアニン、5−ハロ特に5−臭化、5−トリフルオロメチルおよび他の5−置換ウラシルおよびシトシン、7−メチルグアニンおよび7−メチルアデニン、8−アザグアニンおよび8−アザアデニン、7−デアザグアニンおよび7−デアザアデニンならびに3−デアザグアニンおよび3−デアザアデニンなどの他の合成および天然ヌクレオチドを含む。
【0175】
さらに、ヌクレオチドは、米国特許第3,687,808号に開示のもの、’The Concise Encyclopedia of Polymer Science And Engineering’,pages858−859,Kroschwitz,J.I.,ed.John Wiley & Sons,1990に開示のもの、Englischら,’Angewandle Chemie,International Edition’,1991,30,page613に開示のもの、anghvi,Y.S.,Chapter15,’Antisense Research and Applications’,pages289−302,Crooke,S.T. and Lebleu,B.ea.,CRCPress,1993に開示のものを含む。特定のこれらのヌクレオチドは、本発明のオリゴマー化合物の結合親和性を増大させるために特に有用である。これらは、5−置換ピリミジン、6−アザピリミジンならびに、2−アミノプロピルアデニン、5−プロピニルウラシルおよび5−プロピニルシトシンを含むN−2、N−6およびO−6置換プリンを含む。5−メチルシトシン置換物は、0.6〜1.2℃の核酸2重鎖安定性における増大を示しており(Sanghvi,Y.S.,Crooke,S.T.およびLebleu,B.,eds,’Antisense Research and Applications’,CRC Press,Boca Raton,1993,pp.276−278)、現在のところ用いられる置換であり、2’−O−メトキシエチル糖修飾と組み合わされてよく用いられる。
【0176】
上記の修飾ヌクレオチドおよび他の修飾ヌクレオチドの作製について開示した代表的米国特許は、以下に限定されないが、米国特許第3,687,808号、ならびに同第4,845,205号;第5,130,302号;第5,134,066号;第5,175,273号;第5,367,066号;第5,432,272号;第5,457,187号;第5,459,255号;第5,484,908号;第5,502,177号;第5,525,711号;第5,552,540号;第5,587,469号;第5,596,091号;第5,614,617号;第5,750,692号,および第5,681,941号などが挙げられ、それぞれが参照により本明細書に組み込まれる。
【0177】
本発明のオリゴヌクレオチドの他の修飾は、活性、細胞性分布またはオリゴヌクレオチドの細胞への取り込みを増強する1以上の成分またはコンジュゲートのオリゴヌクレオチドへの化学的連結を含む。
【0178】
そのような成分としては、以下に限定されないが、コレステロール成分、コール酸、チオエーテル(例えばヘキシル−S−トリチルチオール)、チオコレステロール、脂肪族鎖(例えばドデカンジオールまたはウンデシル残基)、リン脂質(例えばジ−ヘキサデシル−rac−グリセロールまたはトリエチルアンモニウム1,2−ジ−O−ヘキサデシル−rac−グリセロ−3−H−ホスホネート)、ポリアミンまたはポリエチレングリコール鎖、またはアダマンタン酢酸、パルミチル成分、またはオクタデシルアミンもしくはヘキシルアミノ−カルボニル−tオキシコレステロール成分などが挙げられる。
【0179】
そのようなオリゴヌクレオチドコンジュゲートの作製について記載した代表的な米国特許としては、以下に限定されないが、米国特許第4,828,979号;第4,948,882号;第5,218,105号;第5,525,465号;第5,541,313号;第5,545,730号;第5,552,538号;第5,578,717、5,580,731号;第5,580,731号;第5,591,584号;第5,109,124号;第5,118,802号;第5,138,045号;第5,414,077号;第5,486,603号;第5,512,439号;第5,578,718号;第5,608,046号;第4,587,044号;第4,605,735号;第4,667,025号;第4,762,779号;第4,789,737号;第4,824,941号;第4,835,263号;第4,876,335号;第4,904,582号;第4,958,013号;第5,082,830号;第5,112,963号;第5,214,136号;第5,082,830号;第5,112,963号;第5,214,136号;第5,245,022号;第5,254,469号;第5,258,506号;第5,262,536号;第5,272,250号;第5,292,873号;第5,317,098号;第5,371,241、5,391,723号;第5,416,203、5,451,463号;第5,510,475号;第5,512,667号;第5,514,785号;第5,565,552号;第5,567,810号;第5,574,142号;第5,585,481号;第5,587,371号;第5,595,726号;第5,597,696号;第5,599,923号;第5,599,928号および第5,688,941号などがあり、それぞれが参照により本明細書に組み込まれる。
【0180】
[創薬]:本発明の化合物は、創薬および標的検証の分野にも応用され得る。本発明は、膵臓発生遺伝子ポリヌクレオチドと、病態、表現型または状態との間に存在する関係を解明するための創薬の試みにおける、本明細書において特定された化合物および標的セグメントの使用を包含する。これらの方法は、試料、組織、細胞または生体を本発明の化合物と接触させるステップ、膵臓発生遺伝子ポリヌクレオチドの核酸またはタンパク質レベルおよび/または関連する表現型もしくは化学的な評価項目を処置後のある時期に測定するステップ、ならびに選択に応じて測定値を未処置試料または本発明のさらなる化合物で処置した試料と比較するステップを含む、膵臓発生遺伝子ポリヌクレオチドの検出または調節を含む。これらの方法は、標的検証のプロセスのために未知の遺伝子の機能を決定するため、または特定の疾患、状態もしくは表現型の治療もしくは予防のための標的としての特定の遺伝子産物の妥当性を決定するために他の実験と並行して、または組み合わせて実施され得る。
【0181】
[遺伝子発現のアップレギュレートまたは阻害の評価]
外来性核酸の宿主細胞または生体内への輸送は、細胞中または生体中の核酸を直接検出するステップによって評価され得る。そのような検出は、当技術分野において周知のいくつかの方法によって達成し得る。例えば、外来性核酸の存在は、サザンブロットまたは核酸に関連するヌクレオチド配列を特異的に増幅するプライマーを使用するポリメラーゼ連鎖反応(PCR)技術によって検出し得る。外来性核酸の発現も遺伝子発現分析を含む従来の方法を使用して測定し得る。例えば外来性核酸から生成されるmRNAはノーザンブロットおよび逆転写PCR(RT−PCR)を使用して検出および定量し得る。
【0182】
外来性核酸からのRNAの発現も、酵素活性またはレポータータンパク質活性を測定することによって検出し得る。例えば、アンチセンス調節活性は、外来性核酸がエフェクターRNAを生成していることの指標としての標的核酸発現の増減により間接的に測定し得る。配列保存に基づいてプライマーは設計可能であり、標的遺伝子のコード領域を増幅するために使用し得る。任意の翻訳または非コード領域が使用され得るが、最初に各遺伝子から最も高く発現されるコード領域がモデル制御遺伝子を構築するために使用され得る。各制御遺伝子は、各コード領域をレポーターコード領域とそのポリ(A)シグナルとの間に挿入することによって組み立てられる。これらのプラスミドは、レポーター遺伝子を遺伝子の上流部分に、および潜在的RNAi標的を3’非コード領域に有するmRNAを生成する。個々のアンチセンスオリゴヌクレオチドの効果は、レポーター遺伝子の調節によって評価される。本発明の方法において有用なレポーター遺伝子としては、アセトヒドロキシ酸合成酵素(AHAS)、アルカリホスファターゼ(AP)、ベータガラクトシダーゼ(LacZ)、ベータグルクロニダーゼ(GUS)、クロラムフェニコールアセチル基転移酵素(CAT)、緑色蛍光タンパク質(GFP)、赤色蛍光タンパク質(RFP)、黄色蛍光タンパク質(YFP)、シアン蛍光タンパク質(CFP)、西洋わさびペルオキシダーゼ(HRP)、ルシフェラーゼ(Luc)、ノパリン合成酵素(NOS)、オクトピン合成酵素(OCS)、およびそれらの誘導体などが挙げられる。アンピシリン、ブレオマイシン、クロラムフェニコール、ゲンタマイシン、ハイグロマイシン、カナマイシン、リンコマイシン、メトトレキサート、ホスフィノトリシン、ピューロマイシンおよびテトラサイクリンに耐性を付与する多重選択マーカーを利用可能である。レポーター遺伝子の調節を測定するための方法は、当技術分野においてよく知られており、以下に限定されないが蛍光定量的方法(例えば蛍光分光法、蛍光励起細胞分取(FACS)、蛍光顕微鏡)、抗生物質耐性判別法が含まれる。
【0183】
NEUROD1、HNF4A、MAFA、PDX1、NKX6−1タンパク質およびmRNAの発現は、当業者に周知の本明細書の他の場所に記載する方法を用いてアッセイすることができる。例えば、ELISAなどのイムノアッセイを用いてタンパク質レベルを測定することができる。ELISA用の膵臓発生遺伝子抗体は、例えばR&D Systems(Minneapolis,MN)およびAbcam(Cambridge,MA)から市販されている。
【0184】
いくつかの実施形態では、本発明のアンチセンスオリゴヌクレオチドを用いて処置したサンプル(例えば生体内または体外の細胞または組織)中のNEUROD1、HNF4A、MAFA、PDX1、NKX6−1の発現(例えばmRNAの発現すなわちタンパク質)は、対照サンプルにおける膵臓発生遺伝子の発現との比較によって評価する。例えば、タンパク質すなわち核酸の発現を、当業者に周知の方法を用いて、擬似処置したすなわち未処置のサンプルにおける発現と比較することができる。あるいは、必要な情報に応じて、対照アンチセンスオリゴヌクレオチド(例えば、変化した配列すなわち異なる配列を有するもの)で処置したサンプルとの比較を行うことができる。別の実施形態では、処置したサンプル対未処置のサンプルにおける膵臓発生遺伝子タンパク質すなわち核酸の発現の差異を、処置したサンプル対未処置のサンプルにおける異なる核酸(研究者が適切とみなした任意の標準的な核酸、例えばハウスキーピング遺伝子)の発現の差異と比較することができる。
【0185】
観察された差異は、対照との比較に用いるために、望ましい形式、例えば比率すなわち割合の形式で表現することができる。いくつかの実施形態では、本発明のアンチセンスオリゴヌクレオチドで処置したサンプル中の膵臓発生遺伝子のmRNAの発現すなわちタンパク質のレベルは、未処置のサンプルまたは対照の核酸で処置したサンプルと比較して約1.25倍〜約10倍以上の割合で増減する。いくつかの実施形態では、膵臓発生遺伝子のmRNAの発現すなわちタンパク質のレベルは、少なくとも約1.25倍、少なくとも約1.3倍、少なくとも約1.4倍、少なくとも約1.5倍、少なくとも約1.6倍、少なくとも約1.7倍、少なくとも約1.8倍、少なくとも約2倍、少なくとも約2.5倍、少なくとも約3倍、少なくとも約3.5倍、少なくとも約4倍、少なくとも約4.5倍、少なくとも約5倍、少なくとも約5.5倍、少なくとも約6倍、少なくとも約6.5倍、少なくとも約7倍、少なくとも約7.5倍、少なくとも約8倍、少なくとも約8.5倍、少なくとも約9倍、少なくとも約9.5倍、少なくとも約10倍かそれ以上の割合で増減する。
【0186】
[キット、研究用試薬、診断、および治療]
本発明の化合物は、診断、治療および予防のためにならびに研究用試薬およびキットの構成要素として利用され得る。さらに、優れた特異性をもって遺伝子発現を阻害できるアンチセンスオリゴヌクレオチドは、当業者によって特定の遺伝子の機能を解明するため、または生物学的経路の種々のメンバー間の機能を区別するために使用されることが多い。
【0187】
キットおよび診断ならびに種々の生物学的系における使用のために、本発明の化合物は、単独でまたは他の化合物もしくは治療薬との併用のいずれかで、細胞中および組織中で発現される遺伝子の部分的または全体的な相補配列の発現パターンを解明するためのディファレンシャルおよび/またはコンビナトリアル解析でのツールとして有用である。
【0188】
本明細書において使用される用語「生物学的系」または「系」は、膵臓発生遺伝子の産物を発現するまたは発現できるようにされる任意の生体、細胞、細胞培養物または組織として定義される。これらは、以下に限定されないが、ヒト、遺伝子導入動物、細胞、細胞培養物、組織、異種移植片、移植物およびそれらの組み合わせを含む。
【0189】
非限定的な一例として、1以上のアンチセンス化合物で処置した細胞中または組織中の発現パターンを、アンチセンス化合物で処置していない対照細胞または組織と比較して、生じたパターンを遺伝子発現レベルの差異について分析する。それらが、例えば検査される遺伝子の疾患関連性、シグナル伝達経路、細胞内局在性、発現レベル、大きさ、構造または機能などに関連するからである。これらの分析は、刺激されたまたは刺激されていない細胞で、発現パターンに影響する他の化合物の存在下または非存在下で実施することができる。
【0190】
当技術分野において周知の遺伝子発現分析方法の例としては、DNAアレイまたはマイクロアレイ(BrazmaおよびVilo,(2000)FEBS Lett.,480,17−24;Celis,ら,(2000)FEBS Lett.,480,2−16)、SAGE(遺伝子発現の連続的分析)(Madden,ら,(2000)Drug Discov.Today,5,415−425)、READS(消化cDNAの制限酵素増幅)(PrasharおよびWeissman,(1999)Methods Enzymol.,303,258−72)、TOGA(総遺伝子発現分析)(Sutcliffe,ら,(2000)Proc.Natl.Acad.Sci.U.S.A.,97,1976−81)、タンパク質アレイおよびプロテオミクス(Celis,ら,(2000)FEBS Lett.,480,2−16;Jungblut,ら,Electrophoresis,1999,20,2100−10)、発現された配列タグ(EST)配列決定(Celis,ら,FEBS Lett.,2000,480,2−16;Larsson,ら,J.Biotechnol.,2000,80,143−57)、サブトラクティブRNAフィンガープリンティング(SuRF)(Fuchs,ら,(2000)Anal.Biochem.286,91−98;Larson,ら,(2000)Cytometry41,203−208)、サブトラクティブクローニング、ディファレンシャルディスプレイ(DD)(JurecicおよびBelmont,(2000)Curr.Opin.Microbiol.3,316−21)、比較ゲノムハイブリダイゼーション(Carulli,ら,(1998)J.Cell Biochem.Suppl.,31,286−96)、FISH(蛍光in situハイブリダイゼーション)技術(Going and Gusterson,(1999)Eur.J.Cancer,35,1895−904)および質量分析法(To,Comb.(2000)Chem.High Throughput Screen,3,235−41)などが挙げられる。
【0191】
本発明の化合物は、これらの化合物が膵臓発生遺伝子をコードする核酸にハイブリダイズすることから、研究および診断のために有用である。例えば、本明細書において開示のとおりの効率および条件下で効果的な膵臓発生遺伝子調節物質としてハイブリダイズするオリゴヌクレオチドは、遺伝子増幅または検出に好都合な条件下でそれぞれ効果的なプライマーまたはプローブである。これらのプライマーまたはプローブは、膵臓発生遺伝子をコードする核酸分子の特異的検出を必要とする方法において、および膵臓発生遺伝子のさらなる研究における検出または使用のための前記核酸分子の増幅のために有用である。膵臓発生遺伝子をコードする核酸と、本発明のアンチセンスオリゴヌクレオチド、詳細にはプライマーおよびプローブとのハイブリダイゼーションは当技術分野において周知の手段によって検出し得る。そのような手段としては、オリゴヌクレオチドへの酵素のコンジュゲーション、オリゴヌクレオチドの放射標識、または任意の他の適切な検出手段などを挙げることができる。試料中の膵臓発生遺伝子のレベルを検出するためにそのような検出手段を使用するキットも用意することができる。
【0192】
アンチセンスの特異性および感度は、治療用使用のために当業者によって利用される。アンチセンス化合物は、ヒトを含む動物の病態の治療における治療用成分として使用されてきた。アンチセンスオリゴヌクレオチド薬は、ヒトに安全かつ効果的に投与されており、多数の臨床試験が現在進行中である。したがって、アンチセンス化合物が細胞、組織および動物、特にヒトの治療用のための治療レジメンにおいて有用であるように構成され得る有用な治療方法となり得ることは確立されている。
【0193】
治療については、膵臓発生遺伝子ポリヌクレオチドの発現を調節することによって治療され得る疾患または障害を有すると疑われる動物(好ましくはヒト)は、本発明によるアンチセンス化合物を投与することによって治療される。例えば、限定を意図しない一実施形態において、該方法は、治療を必要とする動物に治療上有効な量の膵臓発生遺伝子調節物質を投与するステップを含む。本発明の膵臓発生遺伝子調節物質は、膵臓発生遺伝子の活性を効果的に調節するか、または膵臓発生遺伝子タンパク質の発現を調節する。一実施形態においては、動物における膵臓発生遺伝子の活性または発現は、対照と比較して約10%阻害される。好ましくは、動物における膵臓発生遺伝子の活性または発現が、約30%阻害される。より好ましくは動物における膵臓発生遺伝子の活性または発現が、50%またはそれを超えて阻害される。したがってオリゴマー化合物は、膵臓発生遺伝子mRNAの発現を対照と比較して少なくとも10%、少なくとも50%、少なくとも25%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%または100%調節する。
【0194】
一実施形態において、膵臓発生遺伝子の活性または発現および/または動物においては、対照と比較して少なくとも約10%増加する。好ましくは動物における膵臓発生遺伝子の活性または発現は、約30%増加する。より好ましくは動物における膵臓発生遺伝子の活性または発現は、約50%またはそれを超えて増加する。したがってオリゴマー化合物は、膵臓発生遺伝子のmRNAの発現を、対照と比較して少なくとも10%、少なくとも50%、少なくとも25%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%または100%調節する。
【0195】
例えば膵臓発生遺伝子の発現の低下は、動物の血清、血液、脂肪組織、肝臓または任意の他の体液、組織または器官において測定し得る。好ましくは、分析される前記体液、組織または器官中に含まれる細胞は、膵臓発生遺伝子ペプチドをコードする核酸分子および/または膵臓発生遺伝子タンパク質それ自体を含む。
【0196】
本発明の化合物は、有効量の化合物を適切な薬学的に許容される希釈剤または担体に加えることによって医薬組成物において利用され得る。本発明の化合物および方法の使用は、予防的にも有用であり得る。
【0197】
[コンジュゲート]
本発明のオリゴヌクレオチドの他の修飾は、オリゴヌクレオチドの活性、細胞分布または細胞への取り込みを増強する1以上の成分またはコンジュゲートへのオリゴヌクレオチドの化学的連結を含む。これらの成分またはコンジュゲートは、1級または2級ヒドロキシル基などの官能基に共有結合したコンジュゲート基を含み得る。本発明のコンジュゲート基は、干渉物質、レポーター分子、ポリアミン、ポリアミド、ポリエチレングリコール、ポリエーテル、オリゴマーの薬力学特性を増強する基、およびオリゴマーの薬物動態特性を増強する基を含む。典型的なコンジュゲート基は、コレステロール、脂質、リン脂質、ビオチン、フェナジン、葉酸、フェナントリジン、アントラキノン、アクリジン、フルオレセイン、ローダミン、クマリン、および色素を含む。本発明の文脈において薬力学特性を増強する基は、取り込みを改善し、分解への耐性を増強し、および/または標的核酸との配列特異的ハイブリダイゼーションを強化する基を含む。本発明の文脈において薬物動態特性を増強する基は、本発明の化合物の取り込み、分散、代謝または排出を改善する基を含む。代表的コンジュゲート基は、1992年10月23日出願の国際特許出願PCT/US92/09196および米国特許第6,287,860号、「Antisense inhibition of MEKK2 expression」において開示されており、これらはともに参照により本明細書に組み込まれる。コンジュゲート成分は、以下に限定されないが、コレステロール成分、コール酸、チオエーテル(例えばヘキシル−S−トリチルチオール)、チオコレステロール、脂肪族鎖(例えばドデカンジオールまたはウンデシル残基)、リン脂質(例えばジ−ヘキサデシル−rac−グリセロールまたはトリエチルアンモニウム1,2−ジ−O−ヘキサデシル−rac−グリセロ−3−H−ホスホネート)、ポリアミンまたはポリエチレングリコール鎖、あるいはアダマンタン酢酸、パルミチル成分、またはオクタデシルアミンもしくはヘキシルアミノ−カルボニル−オキシコレステロール成分などを含む。本発明のオリゴヌクレオチドは、活性原薬、例えばアスピリン、ワルファリン、フェニルブタゾン、イブプロフェン、スプロフェン、フェンブフェン、ケトプロフェン、(S)−(+)−プラノプロフェン、カプロフェン、ダンシルサルコシン、2,3,5−トリヨード安息香酸、フルフェナム酸、フォリン酸、ベンゾチアジアジド、クロロチアジド、ジアセピン、インドメチシン、バルビツール酸、セファロスポリン、サルファ剤、抗糖尿病薬、抗菌剤または抗生物質ともコンジュゲート形成され得る。
【0198】
そのようなオリゴヌクレオチドコンジュゲートの作製について記載した代表的米国特許としては、以下に限定されないが、米国特許第4,828,979号;第4,948,882号;第5,218,105号;第5,525,465号;第5,541,313号;第5,545,730号;第5,552,538号;第5,578,717、5,580,731号;第5,580,731号;第5,591,584号;第5,109,124号;第5,118,802号;第5,138,045号;第5,414,077号;第5,486,603号;第5,512,439号;第5,578,718号;第5,608,046号;第4,587,044号;第4,605,735号;第4,667,025号;第4,762,779号;第4,789,737号;第4,824,941号;第4,835,263号;第4,876,335号;第4,904,582号;第4,958,013号;第5,082,830号;第5,112,963号;第5,214,136号;第5,082,830号;第5,112,963号;第5,214,136号;第5,245,022号;第5,254,469号;第5,258,506号;第5,262,536号;第5,272,250号;第5,292,873号;第5,317,098号;第5,371,241、5,391,723号;第5,416,203、5,451,463号;第5,510,475号;第5,512,667号;第5,514,785号;第5,565,552号;第5,567,810号;第5,574,142号;第5,585,481号;第5,587,371号;第5,595,726号;第5,597,696号;第5,599,923号;第5,599,928号および第5,688,941号などが挙げられる。
【0199】
[製剤]
本発明の化合物は、取り込み、分散および/または吸収の補助ために、例えばリポソーム、受容体−標的分子、経口、直腸、局所または他の製剤として、他の分子、分子構造または化合物と、混合物と混合、封入、コンジュゲート化または他の方法で結合され得る。そのような取り込み、分散および/または吸収を補助する製剤の調製について記載した代表的米国特許としては、以下に限定されないが、米国特許第5,108,921号;第5,354,844号;第5,416,016号;第5,459,127号;第5,521,291号;第5,543,165号;第5,547,932号;第5,583,020号;第5,591,721号;第4,426,330号;第4,534,899号;第5,013,556号;第5,108,921号;第5,213,804号;第5,227,170号;第5,264,221号;第5,356,633号;第5,395,619号;第5,416,016号;第5,417,978号;第5,462,854号;第5,469,854号;第5,512,295号;第5,527,528号;第5,534,259号;第5,543,152号;第5,556,948号;第5,580,575号;および第5,595,756号が挙げられ、それぞれが本明細書に参照として組み込まれる。
【0200】
アンチセンスオリゴヌクレオチドは、標的の発現および/または機能を調節するためにベクターと関連付けられて投与される必要はないが、本発明の実施形態は、プロモーター、ハイブリッドプロモーター遺伝子配列を含み、強い構成的プロモーター活性または所望の場合に誘導され得るプロモーター活性を有する、アンチセンスオリゴヌクレオチドの発現のための発現ベクター構築物に関する。
【0201】
一実施形態においては、本発明の実施には、上述のアンチセンスオリゴヌクレオチドのうちの少なくとも1つを適切な核酸送達系と共に投与するステップが含まれる。一実施形態において、その系は、ポリヌクレオチドに機能的にリンクされた非ウイルス性ベクターを含む。そのような非ウイルス性ベクターの例としては、オリゴヌクレオチド単独(例えば、配列番号13−45のなかの任意のもの1つ以上)または適切なタンパク質、多糖類または脂質配合物との組み合わせが挙げられる。
【0202】
他の適切な核酸デリバリーシステムにはウイルスベクター、典型的にはアデノウイルス、アデノウイルス関連ウイルス(AAV)、ヘルパー依存性アデノウイルス、レトロウイルスまたはセンダイウイルス(HVJ)−リポソーム複合体の少なくとも1つに由来する配列のものが挙げられる。好ましくは、ウイルスベクターには、ポリヌクレオチドに機能的にリンクされた強力な真核生物プロモーター、例えばサイトメガロウイルス(CMV)プロモーターが含められる。
【0203】
他のベクターには、ウイルスベクター、融合タンパク質および化学的コンジュゲートが含まれる。レトロウイルスベクターには、モロニーマウス白血病ウイルスおよびHIVベースのウイルスが含まれる。HIVベースのウイルスベクターの1つは、gagおよびpol遺伝子がHIVゲノム由来であり、env遺伝子が他のウイルス由来である少なくとも2つのベクターを含む。DNAウイルス性ベクターが好ましい。これらのベクターには、オルソポックスベクターまたはトリポックスベクターなどのポックスベクター、単純ヘルペスIウイルス(HSV)ベクターなどのヘルペスウイルスベクター、アデノウイルスベクター、およびアデノ関連ウイルスベクターが含まれる。
【0204】
本発明のアンチセンス化合物は、ヒトを含む動物への投与において生物学的に活性な代謝産物またはその残渣を(直接または間接的に)提供できる、任意の薬学的に許容される塩、エステルもしくはそのようなエステルの塩、または任意の他の化合物を包含する。
【0205】
用語「薬学的に許容される塩」は、本発明の化合物の生理学的かつ薬学的に許容される塩:すなわち親化合物の所望の生物学的活性を保持しており、望ましくない毒物学的な効果を与えない塩を指す。オリゴヌクレオチドについて、薬学的に許容される塩の例およびそれらの使用は、米国特許第6,287,860号にさらに記載されており、これは参照により本明細書に組み込まれる。
【0206】
本発明は、本発明のアンチセンス化合物を含む医薬組成物および製剤も含む。本発明の医薬組成物は、局所または全身処置のいずれが望ましいかおよび治療される場所に応じて種々の方法で投与され得る。投与は、局所(点眼および膣および直腸を含む粘膜送達を含む)、肺、例えば噴霧吸入器による場合を含む粉末剤またはエアロゾルの吸入または吹送法によって;気管内、鼻腔内、上皮性および経皮性)、経口または非経口の投与であり得る。非経口投与は、静脈内、動脈内、皮下、腹腔内もしくは筋肉内注射もしくは注入;または頭蓋内、例えば髄腔内もしくは脳室内投与を含む。
【0207】
中枢神経系の組織の治療のために、例えば脳脊髄液への注射または注入によって投与を行うことができる。アンチセンスRNAの脳脊髄液への投与については、米国特許出願公開第2007/011777号、「Methods for slowing familial ALS disease progression」にも記載されており、この全内容は参照により本明細書に組み込まれる。
【0208】
本発明のアンチセンスオリゴヌクレオチドを中枢神経系の細胞に投与することが意図される場合、投与は、本発明のアンチセンスオリゴヌクレオチドの血液脳関門通過を促進できる1種以上の薬剤を用いて行うことができる。注射は、例えば嗅内皮質または海馬に対して行うことができる。筋肉組織の運動ニューロンへのアデノウイルスベクターの投与による神経栄養因子の送達は、例えば、米国特許第6,632,427号、「Adenoviral−vector−mediated gene transfer into medullary motor neurons」に記載されており、この全内容は参照により本明細書に組み込まれる。脳、例えば、線条体、視床、海馬、または黒質へのベクターの直接の送達については公知で、例えば米国特許第6,756,523号、「Adenovirus vectors for the transfer of foreign genes into cells of the central nervous system particularly in brain」に記載されており、これはその全内容が参照により本明細書に組み入れられる。投与は、注射により速やかに行うことも、あるいは遅い速度での注入または徐放製剤の投与によって一定時間にわたって行うこともできる。
【0209】
本発明のアンチセンスオリゴヌクレオチドはまた、望ましい医薬品や薬力学的特性を与える薬剤とリンクしたもの、または結合したものとすることができる。例えば、アンチセンスオリゴヌクレオチドを、トランスフェリン受容体に対する抗体などの血液脳関門の通過または輸送を促進するための当技術分野で公知の任意の物質に結合させて、静脈注射によって投与することができる。アンチセンス化合物は、例えば、アンチセンス化合物をより効果的にし、かつ/または血液脳関門を越えたアンチセンス化合物の輸送を増加させるウイルスベクターにリンクさせることができる。浸透圧による血液脳関門の破壊は、例えば、以下に限定されないが、メソエリスリトール、キシリトール、D(+)ガラクトース、D(+)ラクトース、D(+)キシロース、ズルシトール、ミオイノシトール、L(−)フルクトース、D(−)マンニトール、D(+)グルコース、D(+)アラビノース、D(−)アラビノース、セロビオース、D(+)マルトース、D(+)ラフィノース、L(+)ラムノース、D(+)メリビオース、D(−)リボース、アドニトール、D(+)アラビトール、L(−)アラビトール、D(+)フコース、L(−)フコース、D(−)リキソース、L(+)リキソース、およびL(−)リキソースを含む糖の注入、または、以下に限定されないが、グルタミン、リジン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン酸、グリシン、ヒスチジン、ロイシン、メチオニン、フェニルアラニン、プロリン、セリン、スレオニン、チロシン、バリン、タウリンを含むアミノ酸の注入によって達成することができる。血液脳関門の通過を容易にするための方法および材料は、例えば米国特許第4,866,042,号、「Method for the delivery of genetic material across the blood brain barrier」、第6,294,520号、「Material for passage through the blood−brain barrier」、および第6,936,589号、「Parenteral delivery systems」に記載されており、これらは参照によりその全内容が本明細書に組み入れられる。
【0210】
本発明のアンチセンス化合物は、その取り込み、分散および/または吸収を助けるため、他の分子、分子構造、または化合物の混合物(例えば、リポソーム、受容体を標的化した分子、経口製剤、直腸製剤、局所製剤、または他の製剤)と混合、カプセル化、結合、または会合させ得る。例えば、カチオン性脂質は、オリゴヌクレオチドの取り込みを容易にする製剤に含まれ得る。取り込みを容易にすることが判明している組成物の1つは、LIPOFECTIN(GIBCO−BRL、ベセスダ,Bethesda,MDから入手可能)である。
【0211】
少なくとも1つの2’−O−メトキシエチル修飾を有するオリゴヌクレオチドは、経口投与に特に有用であると考えられている。局所投与のための医薬組成物および製剤は、経皮パッチ、軟膏、ローション、クリーム、ゲル、滴薬、坐薬、噴霧剤、液薬および粉末剤を含み得る。従来の薬学的担体、液剤、粉末剤または油性基剤、増粘剤などは必要であるかまたは望ましい場合がある。コーティングされたコンドーム、手袋なども有用である場合がある。
【0212】
本発明の医薬製剤は、便利に単位投与の形態で提供されてもよく、製薬業界において周知の技術により調製され得る。そのような技術は、活性成分を、1種以上の薬学的担体または一種以上の賦形剤と結合させるステップを含む。一般に製剤は、活性成分を均一かつ均質に液体担体もしくは微粉化した固体担体またはその両方と結合させるステップ、次いで必要な場合は生成物を成形するステップによって製する。
【0213】
本発明の組成物は、以下に限定されないが、錠剤、カプセル、ゲルカプセル、液体シロップ、ソフトゲル、坐薬および浣腸などの任意の多くの可能な剤形に製剤され得る。本発明の組成物は、水性懸濁剤、非水性または混合媒体としても製剤され得る。水性懸濁剤は、例えばカルボキシメチルセルロースナトリウム、ソルビトールおよび/またはデキストランを含む懸濁剤の粘度を上げる物質をさらに含めることができる。懸濁剤は、安定剤も含み得る。
【0214】
本発明の医薬組成物は、限定しないが、液剤、乳剤、泡状製剤およびリポソーム含有製剤を含む。本発明の医薬組成物および製剤は、1以上の浸透促進剤、担体、賦形剤または他の活性成分もしくは不活性成分を含み得る。
【0215】
典型的には乳剤は、1つの液剤が他に通常直径0.1μmを超える液滴の形態で分散された不均一系である。乳剤は、分散相に加えて追加の成分を含有でき、活性剤は水相中、油相中またはそれ自体としての分離相中に溶液として存在できる。マイクロエマルジョンは、本発明の実施形態として含まれる。乳剤およびそれらの使用は、当技術分野においてよく知られており、米国特許第6,287,860号にさらに記載されている。
【0216】
本発明の製剤は、リポソーム製剤を含む。本発明において使用される用語「リポソーム」は、球状の1層以上の二重層に配置された両親媒性脂質から成る小胞を意味する。リポソームは、親油性物質および送達される組成物を含有する水性の内部から形成された膜を有する単層膜または多重膜ビヒクルである。カチオン性リポソームは、負に荷電したDNA分子と相互作用して安定な複合体を形成すると考えられる正に荷電したリポソームである。pH感受性または負に荷電したリポソームは、複合体化するよりもDNAを捕捉すると考えられる。カチオン性および非カチオン性の両方のリポソームは、DNAを細胞に送達するために使用されている。
【0217】
リポソームは、「立体的に安定化された」リポソームも含み、用語は本明細書における使用で1種以上の特殊な脂質を含むリポソームを意味する。リポソームに組み込まれた場合、これらの特殊化された脂質は、そのような特殊な脂質を欠いているリポソームと比較して増強された循環寿命を有するリポソームを生じる。立体的に安定化されたリポソームの例は、リポソームのビヒクル形成脂質部分の一部が1種以上の糖脂質を含むか、またはポリエチレングリコール(PEG)成分などの1種以上の親水性ポリマーで誘導体化されていたものである。リポソームおよびそれらの使用は、米国特許第6,287,860号にさらに記載されている。
【0218】
本発明の医薬製剤および組成物は、界面活性剤もさらに含み得る。薬剤製品、製剤および乳剤における界面活性剤の使用は、当技術分野においてよく知られている。界面活性剤およびのそれらの使用は、米国特許第6,287,860号にさらに記載され、これは、参照により本明細書に組み込まれる。
【0219】
一実施形態において本発明は、核酸、具体的にはオリゴヌクレオチドの効率的な送達を行うために各種浸透促進剤を使用する。非親油性薬剤の細胞膜を超える拡散の補助に加えて、浸透促進剤は親油性薬剤の浸透性も促進する。浸透促進剤は、5つの広いカテゴリ、すなわち界面活性剤、脂肪酸、胆汁酸塩、キレート剤および非キレート非界面活性剤のうちの1つに属するものとして分類され得る。浸透促進剤およびそれらの使用は、米国特許第6,287,860号にさらに記載されており、これは参照により本明細書に組み込まれる。
【0220】
当業者であれば、製剤がそれらの目的とする使用法、すなわち投与経路に応じて通常通り設計されることを理解されよう。
【0221】
局所投与のための好ましい製剤には、本発明のオリゴヌクレオチドが、脂質、リポソーム、脂肪酸、脂肪酸エステル、ステロイド、キレート剤および界面活性剤などの局所送達剤と混合されているものを含まれる。脂質およびリポソームには、中性のもの(例えばジオレオイル−ホスファチジルDOPEエタノールアミン、ジミリストイルホスファチジルコリンDMPC、ジステアロイルホスファチジルコリン)、陰性のもの(例えばジミリストイルホスファチジルグリセロールDMPG)、およびカチオン性のもの(例えばジオレオイルテトラメチルアミノプロピルDOTAPおよびジオレオイル−ホスファチジルエタノールアミンDOTMA)が含まれる。
【0222】
局所または他の投与のため、本発明のオリゴヌクレオチドを、リポソーム中に包入するか、またはそれらリポソーム、特にカチオン性リポソームと複合体を形成させ得る。あるいは、オリゴヌクレオチドを、脂質中に、具体的にはカチオン性脂質と複合体化させ得る。脂肪酸およびエステル、薬学的に許容されるそれらの塩ならびにそれらの使用は、米国特許第6,287,860号にさらに記載されている。
【0223】
経口投与用の組成物および製剤は、粉剤もしくは顆粒剤、微粒子剤、ナノ粒子剤、水溶液中もしくは非水溶液中の懸濁剤もしくは液剤、カプセル、ゲルカプセル、サシェ剤、錠剤またはミニ錠剤を含む。増粘剤、香味剤、希釈剤、乳化剤、分散補助剤または結合剤が、望ましい場合がある。経口製剤は、本発明のオリゴヌクレオチドが1種以上の浸透促進界面活性剤およびキレート剤と共に投与されるものである。界面活性剤は、脂肪酸および/またはエステル、またはそれらの塩、胆汁酸および/またはそれらの塩を含む。胆汁酸/塩および脂肪酸ならびにそれらの使用は、米国特許第6,287,860号にさらに記載されており、これは参照により本明細書に組み込まれる。同様に用いられるのは、浸透促進剤の組み合わせ、例えば胆汁酸/塩との組み合わせでの脂肪酸/塩である。特に用いられる組み合わせは、ラウリン酸ナトリウム塩、カプリン酸およびUDCAである。さらなる浸透促進剤は、ポリオキシエチレン−9−ラウリルエーテル、ポリオキシエチレン−20−セチルエーテルを含む。本発明のオリゴヌクレオチドは、噴霧乾燥された粒子を含む顆粒形態またはマイクロまたはナノ粒子を形成するように複合体化されて経口送達され得る。オリゴヌクレオチド複合剤およびそれらの使用は、米国特許第6,287,860号にさらに記載されており、これは参照により本明細書に組み込まれる。
【0224】
非経口、髄腔内または脳室内投与のための組成物および製剤は、バッファー剤、希釈剤および他の適切な添加剤(限定しないが浸透促進剤、担体化合物および他の薬学的に許容される担体または賦形剤など)も含んでいてもよい滅菌水性溶液を含み得る。
【0225】
本発明の特定の実施形態は、1種以上のオリゴマー化合物および非アンチセンス機構により機能発揮する1種以上の他の化学療法剤を含有する医薬組成物を提供する。そのような化学療法剤の例としては、以下に限定されないが、ダウノルビシン、ダウノマイシン、ダクチノマイシン、ドキソルビシン、エピルビシン、イダルビシン、エソルビシン、ブレオマイシン、マホスファミド、イホスファミド、シトシンアラビノシド、ビスクロロエチル−ニトロソウレア、ブスルファン、ミトマイシンC、アクチノマイシンD、ミトラマイシン、プレドニゾン、ヒドロキシプレゲステロン、テストステロン、タモキシフェン、ダカルバシン、プロカルバジン、ヘキサメチルメラミン、ペンタメチルメラミン、ミトキサントロン、アムサクリン、クロランブシル、メチルシクロヘキシルニトロソウレア、ナイトロジェンマスタード、メルファラン、シクロホスファミド、6−メルカプトプリン、6−チオグアニン、シタラビン、5−アザシチジン、ヒドロキシウレア、デオキシコホルマイシン、4−ヒドロキシペルオキシシクロ−ホスホラミド、5−フルオロウラシル(5−FU)、5−フルオロデオキシウリジン(5−FUdR)、メトトレキサート(MTX)、コルヒチン、タキソール、ビンクリスチン、ビンブラスチン、エトポシド(VP−16)、トリメトレキサート、イリノテカン、トポテカン、ゲムシタビン、テニポシド、シスプラチンおよびジエチルスチルベステロール(DES)などの癌化学療法剤が含まれる。本発明の化合物と併用する場合、そのような化学療法剤は、別々に(例えば、5−FUとオリゴヌクレオチド)、連続して(例えば、一定期間の5−FUとオリゴヌクレオチドに続いてMTXとオリゴヌクレオチド)、または1種以上のそのような化学療法と併用して(例えば、5−FU、MTXとオリゴヌクレオチドまたは5−FU、放射線療法とオリゴヌクレオチド)使用され得る。限定しないが非ステロイド性抗炎症剤および副腎皮質ステロイドを含む抗炎症剤、および限定しないがリビビリン(ribivirin)、ビダラビン、アシクロビルおよびガンシクロビルを含む抗ウイルス剤も本発明の組成物に組み合わせることができる。アンチセンス化合物と他の非アンチセンス剤との組み合わせも本発明の範囲内である。2種以上の組み合わされた化合物は、一緒にまたは連続的に使用することができる。
【0226】
他の関連する実施形態において、本発明の組成物は、第1の核酸に標的化される1以上のアンチセンス化合物、特にオリゴヌクレオチド、および第2の核酸標的に標的化される1以上の追加のアンチセンス化合物を含み得る。例えば、第1の標的は、膵臓発生遺伝子の特定のアンチセンス配列であり得、第2の標的は他のヌクレオチド配列由来の領域であり得る。あるいは、本発明の組成物は、同じ膵臓発生遺伝子核酸標的の異なる領域に標的化される2種以上のアンチセンス化合物を含有できる。アンチセンス化合物の多くの例は、本明細書中に例示され、他は当技術分野において周知の適切な化合物中から選択され得る。2種以上の組み合わされた化合物は、一緒にまたは連続的に使用することができる。
【0227】
[投薬]
治療用組成物の処方およびそれらの続く投与(投薬)は、当業者の技能の範囲内であると考えられる。投薬は、数日間から数カ月間継続する、または治療が効果的になるかもしくは病態の減退が達成されるまでの治療過程において、治療される病態の重症度および応答性に応じて決まる。最適な投薬レジメンは、患者の身体での薬剤蓄積の測定値から算出され得る。当業者であれば、最適投与量、投薬方法および反復頻度を容易に決定できる。最適な投与量は、個々のオリゴヌクレオチドの相対的効力に応じて変動し得、一般に体外および生体内動物モデルにおいて効果的であると判明したEC50に基づいて推定され得る。一般に投与量は、体重1kgあたり0.01μg〜100gであり、1日に、1週間に、1カ月にもしくは1年に1回もしくは複数回またはさらに2〜20年ごとに1回である場合がある。当業者であれば、測定された滞留時間および体液または組織における薬剤の濃度に基づいて投薬の反復頻度を容易に推定できる。治療の成功に続いて、病態の再発を予防するために患者に維持療法を受けさせることが望ましい場合があり、ここでオリゴヌクレオチドは維持投与において体重1kgあたり0.01μg〜100g、1日1回または複数回から20年ごとに1回の範囲で投与される。
【0228】
いくつかの実施形態では、患者は、体重1kg当たり少なくとも約1mg、少なくとも約2mg、少なくとも約3mg、少なくとも約4mg、少なくとも約5mg、少なくとも約6mg、少なくとも約7mg、少なくとも約8mg、少なくとも約9mg、少なくとも約10mg、少なくとも約15mg、少なくとも約20mg、少なくとも約25mg、少なくとも約30mg、少なくとも約35mg、少なくとも約40mg、少なくとも約45mg、少なくとも約50mg、少なくとも約60mg、少なくとも約70mg、少なくとも約80mg、少なくとも約90mg、または少なくとも約100mgの用量の薬剤で処置される。アンチセンスオリゴヌクレオチドの特定の注射用量については、米国特許第7,563,884号、「Antisense modulation of PTP1B expression」に記載されており、これは参照によりその全内容が本明細書に組み入れられる。
【0229】
本発明の種々の実施形態が上記されているが、それらは単に例示の目的で提示されたものであって、限定を意図したものでないことは理解されるべきである。本発明の精神および範囲から逸脱することなく本明細書における開示内容にもとづいて、開示された実施形態に対してさまざまな変更を加えることができる。したがって本発明の範囲は、上記の実施形態のいずれによっても限定されるべきではない。
【0230】
本明細書中で言及される全ての文書は、参照により本明細書に組み込まれる。本出願中で引用する全ての刊行物および特許文書は、それぞれ個々の刊行物または特許文書が個々に記載された場合と同程度にあらゆる目的のために参照により本明細書に組み込まれる。出願人らは、本明細書における種々の参考文献の引用によって、いずれかの特定の参考文献が出願人らの発明の「先行技術」であることを認めるものではない。発明の組成物および方法の実施形態は、以下の実施例において例示される。
【実施例】
【0231】
以下の限定を意図しない実施例は、本発明の選択された実施形態を例示するものである。提示される構成部分の要素の割合を変えることや代替物は当業者に明らかであり、本発明の実施形態の範囲内であることは理解されよう。
【0232】
[実施例1:膵臓発生遺伝子ポリヌクレオチドに対する核酸分子アンチセンスおよび/または膵臓発生遺伝子ポリヌクレオチドのセンス鎖に特異的なアンチセンスオリゴヌクレオチドの設計]
上記の通り用語「に特異的なオリゴヌクレオチド」または「オリゴヌクレオチド標的」は、(i)標的遺伝子の一部分と安定な複合体を形成できる配列、または(ii)標的遺伝子のmRNA転写物の一部分と安定な2重鎖を形成できる配列を有するオリゴヌクレオチドを指す。
【0233】
適切なオリゴヌクレオチドの選択は、核酸配列を自動的に配列比較し、同一または相同な領域を示すコンピュータープログラムを使用することによって容易に行える。そのようなプログラムは、例えばGenbankなどのデータベースを検索することによって、またはPCRの産物を配列決定することによって得られた核酸配列を比較するために使用される。さまざまな種由来の核酸配列の比較により、種の間で適切な程度の同一性を示す核酸配列の選択が可能になる。配列決定されていない遺伝子の場合は、標的種と他の種とでの遺伝子間の同一性の程度の決定を可能にするためにサザンブロットが実施される。さまざまな程度のストリンジェンシーでサザンブロットを実行することによって、当技術分野において周知であるとおり、同一性の近似測定値を得ることが可能である。これらの手順によって、制御される対象での標的核酸配列への高い程度の相補性、および他の種での対応する核酸配列への低い程度の相補性を示すオリゴヌクレオチドの選択が可能となる。当業者であれば、本発明における使用のために遺伝子の適切な領域を選択することには相当な自由度が存在することを理解されよう。
【0234】
アンチセンス化合物は、標的核酸への化合物の結合が標的核酸の通常の機能に干渉し、機能および/または活性の調節を生じる場合で、かつ特異的結合が望まれる条件下(すなわち生体内アッセイまたは治療的処置の場合での生理的条件下および体外アッセイの場合でのアッセイが実施される条件下)で、非標的核酸配列へのアンチセンス化合物の非特異的結合を回避するのに十分な程度の相補性がある場合に、「特異的にハイブリダイズ可能」である。
【0235】
本明細書において記載するオリゴヌクレオチドのハイブリダイゼーション特性は、当技術分野において周知の1以上の体外アッセイによって決定され得る。例えば本明細書に記載するオリゴヌクレオチドの特性は、標的天然アンチセンスと潜在的薬剤分子との間の結合強度を融解曲線アッセイを使用して測定することによって得られる。
【0236】
標的天然アンチセンスと潜在的薬剤分子(「分子」)との間の結合強度は、分子間相互作用の強度を測定する任意の確立された方法、例えば融解曲線アッセイを使用して推定することができる。
【0237】
融解曲線アッセイは、天然アンチセンス/「分子」複合体に関して2本鎖立体構造から1本鎖立体構造への急速な移行が生じる温度を決定する。この温度は、2分子間の相互作用強度の信頼できる測定値として広く認められている。
【0238】
融解曲線アッセイは、実際の天然アンチセンスRNA分子のcDNA複製物または「分子」の結合部位に対応する合成DNAもしくはRNAヌクレオチドを使用して実施され得る。このアッセイを実行するために必要な全ての試薬を含むマルチプルキットが利用可能である(例えば、Applied Biosystems Inc.MeltDoctor kit)。これらのキットは、2本鎖DNA(dsDNA)結合色素(ABI HRM dyes、SYBR Green、SYTOなど)の1つを含有する適切なバッファーを含む。dsDNA色素の特性は、それらは遊離形態ではほとんど蛍光を発光しないが、dsDNAに結合した場合は高度に蛍光性であるものである。
【0239】
アッセイを実施するために、cDNAまたは対応するオリゴヌクレオチドを「分子」と特定の製造者のプロトコルに定められた濃度で混合する。混合物をすでに形成された全てのdsDNA複合体を解離させるため95℃に加熱し、次いでDNA分子をアニールさせるために室温またはキット製造者によって定められた他の低い温度まで徐冷する。新たに形成された複合体を、次いで反応によって産生される蛍光量についてのデータを連続に収集しながら同時にゆっくりと95℃まで加熱する。蛍光強度は、反応物中に存在するdsDNAの量に反比例する。データは、キットに適合するリアルタイムPCR装置(例えば、ABIのStepOne Plus Real Time PCR SystemまたはLightTyper instrument、Roche Diagnostics、Lewes、UK)を使用して収集できる。
【0240】
融解ピークは、適切なソフトウエア(例えば、LightTyper(Roche)またはSDS Dissociation Curve、ABI)を使用して、温度に関する蛍光の負の微分係数(−d(蛍光)/dT)y軸)を温度(x軸)に対してプロットすることによって作図する。dsDNA複合体から単鎖分子への急速な移行の温度を特定するべくデータを分析する。この温度をTmと称し、2分子間の相互作用の強度に正比例する。典型的にはTmは40℃を超える。
【0241】
[実施例2:膵臓発生遺伝子ポリヌクレオチドの調節]
[HepG2細胞のアンチセンスオリゴヌクレオチドによる処置]
ATCC(cat#HB−8065)由来のHepG2細胞を増殖培地(MEM/EBSS(Hyclone cat#SH30024またはMediatech cat#MT−10−010−CV)+10%FBS(Mediatech cat#MT35−011−CV)+ペニシリン/ストレプトマイシン(Mediatech cat#MT30−002−CI))中、37℃、5%CO2で増殖させた。実験一日前に細胞を6穴プレートに1.5×105/mlの密度で再度プレートし、37℃、5%CO2でインキュベートした。実験当日に6穴プレートの培地を新鮮な増殖培地に交換した。全てのアンチセンスオリゴヌクレオチドを濃度20μMに希釈した。この溶液2μlをOpti−MEM培地(Gibco cat#31985−070)400μlおよびLipofectamine 2000(Invitrogen cat#11668019)4μlと室温で20分間インキュベートし、HepG2細胞を含む6穴プレートの各ウエルに添加した。該オリゴヌクレオチド溶液の代わりに水2μlを含む同様の混合物を偽トランスフェクト対照に使用した。37℃、5% CO2での3〜18時間のインキュベーション後、培地を新鮮増殖培地に交換した。アンチセンスオリゴヌクレオチドの添加の48時間後、培地を除去し、Promega製のSV Total RNA Isolation System(cat #Z3105)またはQiagen製のRNeasy Total RNA Isolation kit(cat #74181)を製造者の説明書に従って使用して、RNAを細胞から抽出した。600ngのRNAを、Thermo Scientific製のVerso cDNAキット(cat#AB1453B)またはHigh Capacity cDNA Reverse Transcriptionキット(cat#4368813)を製造者の説明書に記載のとおり使用して得た逆転写反応物に加えた。この逆転写反応からのcDNAを使用して、ABI Taqman gene Expression Mix(cat#4369510)およびABI(Applied Biosystems Taqman Gene Expression Assay:Hs01922995_s1、Hs01651425_s1、およびHs00426216_m1:Applied Biosystems Inc.,Foster City CA)によって設計されたプライマー/プローブを使用するリアルタイムPCRによって遺伝子発現をモニタリングした。使用したPCRサイクルは次の通り:50℃で2分間、95℃で10分間、(95℃で15秒間、60℃で1分間)を40サイクル、M×4000サーマルサイクラー(Stratagene)を使用。アンチセンスオリゴヌクレオチドで処置した後の遺伝子発現の変化率を、処置サンプルと偽トランスフェクトサンプルの間の18S標準化dCt値の差に基づいて計算した。
【0242】
[結果]:
リアルタイムPCR結果は、Lipofectamine 2000を用いて導入されたホスホロチオエートオリゴヌクレオチドによるHepG2細胞の処置の後のNeuroD1のmRNAレベルの、対照と比較した倍率変化+標準偏差を示した(図1)。
【0243】
リアルタイムPCR結果は、HepG2細胞中のMAFAのmRNAのレベルが、MAFAアンチセンスBM127748に対して設計されたオリゴの1つで処置した48時間後に有意に増大することを示している(図3)。
【0244】
リアルタイムPCR結果は、HepG2細胞中のPDX1のmRNAのレベルが、PDX1アンチセンスHs.416201に対して設計されたオリゴの1つで処置した48時間後に有意に増大することを示している(図4)。
【0245】
[518A2細胞のアンチセンスオリゴヌクレオチドによる処置]
Albert Einstein−Montefiore Cancer Center,NYから入手した518A2細胞を増殖培地(MEM/EBSS(Hyclone cat#SH30024またはMediatech cat#MT−10−010−CV)+10%FBS(Mediatech cat#MT35−011−CV)+ペニシリン/ストレプトマイシン(Mediatech cat#MT30−002−CI))中、37℃、5%CO2で増殖させた。実験の一日前に6穴プレートに1.5×105/mlの密度で再度プレートし、37℃でインキュベートした。実験当日に6穴プレートの培地を新鮮な増殖培地に交換した。全てのアンチセンスオリゴヌクレオチドを濃度20μMに希釈した。この溶液2μlをOpti−MEM培地(Gibco cat#31985−070)400μlおよびLipofectamine 2000(Invitrogen cat#11668019)4μlと室温で20分間インキュベートし、518A2細胞を含む6穴プレートの各ウエルに添加した。該オリゴヌクレオチド溶液の代わりに水2μlを含む同様の混合物を偽トランスフェクト対照に使用した。37℃、5% CO2での3〜18時間のインキュベーション後、培地を新鮮増殖培地に交換した。アンチセンスオリゴヌクレオチドの添加の48時間後、培地を除去し、Promega製のSV Total RNA Isolation System(cat #Z3105)またはQiagen製のRNeasy Total RNA Isolation kit(cat #74181)を製造者の説明書に従って使用して、RNAを細胞から抽出した。600ngのRNAを、Thermo Scientific製のVerso cDNAキット(cat#AB1453B)またはHigh Capacity cDNA Reverse Transcriptionキット(cat#4368813)を製造者の説明書に記載のとおり使用して得た逆転写反応物に加えた。この逆転写反応からのcDNAを使用して、ABI Taqman gene Expression Mix(cat#4369510)およびABI(Applied Biosystems Taqman Gene Expression Assay:Hs1023298_m1:Applied Biosystems Inc.,Foster City CA)によって設計されたプライマー/プローブを使用するリアルタイムPCRによって遺伝子発現をモニタリングした。使用したPCRサイクルは次の通り:50℃で2分間、95℃で10分間、(95℃で15秒間、60℃で1分間)を40サイクル、StepOne Plus Real Time PCR Machine(Applied Biosystems)を使用。アンチセンスオリゴヌクレオチドで処置した後の遺伝子発現の変化率を、処置サンプルと偽トランスフェクトサンプルの間の18S標準化dCt値の差に基づいて計算した。
【0246】
[結果]:
リアルタイムPCR結果は、518A2細胞におけるHNF4AのmRNAのレベルが、HNF4Aアンチセンス転写物BX099913、BC071794およびAF143870に対するオリゴで処置した48時間後に有意に増大することを示している(図2)。
【0247】
[MCF−7細胞のアンチセンスオリゴヌクレオチドによる処置]
ATCCから入手した(cat#HTB−22)MCF−7細胞を増殖培地(MEM/EBSS(Hyclone cat#SH30024またはMediatech cat#MT−10−010−CV)+10%FBS(Mediatech cat#MT35−011−CV)+ペニシリン/ストレプトマイシン(Mediatech cat#MT30−002−CI))中、37℃、5%CO2で増殖させた。実験の一日前に6穴ブレートに1.5×105/mlの密度で再度プレートし、37℃でインキュベートした。実験当日に6穴プレートの培地を新鮮な増殖培地に交換した。全てのアンチセンスオリゴヌクレオチドを濃度20μMに希釈した。この溶液2μlをOpti−MEM培地(Gibco cat#31985−070)400μlおよびLipofectamine 2000(Invitrogen cat#11668019)4μlと室温で20分間インキュベートし、MCF−7細胞を含む6穴プレートの各ウエルに添加した。該オリゴヌクレオチド溶液の代わりに水2μlを含む同様の混合物を偽トランスフェクト対照に使用した。37℃、5% CO2での3〜18時間のインキュベーション後、培地を新鮮増殖培地に交換した。アンチセンスオリゴヌクレオチドの添加の48時間後、培地を除去し、Promega製のSV Total RNA Isolation System(cat #Z3105)またはQiagen製のRNeasy Total RNA Isolation kit(cat #74181)を製造者の説明書に従って使用して、RNAを細胞から抽出した。600ngのRNAを、Thermo Scientific製のVerso cDNAキット(cat#AB1453B)またはHigh Capacity cDNA Reverse Transcriptionキット(cat#4368813)を製造者の説明書に記載のとおり使用して得た逆転写反応物に加えた。この逆転写反応からのcDNAを使用して、ABI Taqman gene Expression Mix(cat#4369510)およびABI(Applied Biosystems Taqman Gene Expression Assay:Hs00232355_m1によって設計されたプライマー/プローブを使用するリアルタイムPCRによって遺伝子発現をモニタリングした。使用したPCRサイクルは次の通り:50℃で2分間、95℃で10分間、(95℃で15秒間、60℃で1分間)を40サイクル、StepOne Plus Real Time PCR Machine(Applied Biosystems)を使用。
【0248】
アンチセンスオリゴヌクレオチドで処置した後の遺伝子発現の変化率を、処置サンプルとモックトランスフェクトサンプルとの間の18S標準化dCt値の差に基づいて計算した。
【0249】
[結果]:
リアルタイムPCR結果は、MCF−7細胞中のNKX6−1のmRNAのレベルが、NKX6−1アンチセンスtorsnaby.aApr07−unspliced(スプライシングされていないもの)に対して設計されたオリゴの1つで処置した48時間後に有意に増大することを示している(図5)。
【0250】
本発明は、1以上の実施形態に関して例示および説明してきたが、本明細書および添付図面の解釈および理解にもとづき当業者は均等な変更および改変に想到できよう。加えて、本発明の特定の特性がいくつかの実施形態のうちの1つにだけ関連して開示されている場合があるが、そのような特性は、他の実施形態の1以上の他の特性と、任意の所与のまたは特定の用途のために望ましくかつ有利であり得るように組み合わせることができる。
【0251】
開示内容の要約により、技術的開示内容の性質を読者が速やかに確認できるであろう。この要約は、以下の特許請求の範囲の範囲または意味を解釈または限定するために使用されないとの理解を前提として提示されたものである。
【特許請求の範囲】
【請求項1】
生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、
前記細胞または組織を、5〜30個のヌクレオチドの長さの少なくとも1つのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記少なくとも1つのオリゴヌクレオチドは、配列番号6の1番目〜1235番目のヌクレオチド、配列番号7の1番目〜17,964番目のヌクレオチド、配列番号8の1番目〜50,003番目のヌクレオチド、配列番号9の1番目〜486番目のヌクレオチド、配列番号10の1番目〜494番目のヌクレオチド、配列番号11の1番目〜1992番目のヌクレオチド、および配列番号12の1番目〜1767番目のヌクレオチドの範囲内の連続した5〜30個のヌクレオチドを含むポリヌクレオチドに対する逆相補配列と少なくとも50%の配列同一性を有する、該ステップを含み、
それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法。
【請求項2】
生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、
前記細胞または組織を、5〜30個のヌクレオチドの長さの少なくとも1つのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記少なくとも1つのオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドの天然のアンチセンスに対する逆相補配列と少なくとも50%の配列同一性を有する、該ステップを含み、
それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法。
【請求項3】
生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、
前記細胞または組織を、5〜30個のヌクレオチドの長さの少なくとも1つのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスオリゴヌクレオチドと少なくとも50%の配列同一性を有する、該ステップを含み、
それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法。
【請求項4】
生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、
前記細胞または組織を、少なくとも1つのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記少なくとも1つのオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドの天然のアンチセンスオリゴヌクレオチドの1つの領域を標的とする、該ステップを含み、
それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法。
【請求項5】
膵臓発生遺伝子の機能および/または発現が、対照と比較して生体内または体外で増加する、請求項4に記載の方法。
【請求項6】
前記少なくとも1つのアンチセンスオリゴヌクレオチドが、膵臓発生遺伝子ポリペプチドの天然のアンチセンス配列を標的とする、請求項4に記載の方法。
【請求項7】
前記少なくとも1つのアンチセンスオリゴヌクレオチドが、膵臓発生遺伝子ポリペプチドのコード核酸配列および/または非コード核酸配列を含む核酸配列を標的とする、請求項4に記載の方法。
【請求項8】
前記少なくとも1つのアンチセンスオリゴヌクレオチドが、膵臓発生遺伝子ポリヌクレオチドの重複配列および/または非重複配列を標的とする、請求項4に記載の方法。
【請求項9】
前記少なくとも1つのアンチセンスオリゴヌクレオチドが、少なくとも1つの修飾糖部分、少なくとも1つの修飾ヌクレオチド間結合、少なくとも1つの修飾ヌクレオチド、およびそれらの組み合わせから選択された1以上の修飾を含む、請求項4に記載の方法。
【請求項10】
前記1以上の修飾が、2’−O−メトキシエチル修飾糖部分、2’−メトキシ修飾糖部分、2’−O−アルキル修飾糖部分、二環糖部分、およびそれらの組み合わせから選択された、少なくとも1つの修飾糖部分を含む、請求項9に記載の方法。
【請求項11】
前記1以上の修飾は、ホスホロチオアート、2’−O−メトキシエチル(MOE)、2’−フルオロ、アルキルホスホナート、ホスホロジチオエート、アルキルホスホノチオアート、ホスホルアミダート、カルバメート、炭酸塩、リン酸トリエステル、アセトアミダート、カルボキシメチルエステル、およびそれらの組み合わせから選択された少なくとも1つの修飾ヌクレオチド間結合を含む、請求項9に記載の方法。
【請求項12】
前記1以上の修飾が、ペプチド核酸(PNA)、ロックト核酸(LNA)、アラビノ核酸(FANA),類似体、誘導体、およびそれらの組み合わせから選択された少なくとも1つの修飾ヌクレオチドを含む、請求項9に記載の方法。
【請求項13】
前記少なくとも1つのオリゴヌクレオチドが、配列番号13乃至45に記載するオリゴヌクレオチド配列を少なくとも1つ含む、請求項1に記載の方法。
【請求項14】
生体内または体外で哺乳動物の細胞または組織における膵臓発生遺伝子遺伝子の機能および/または発現を調節する方法であって、
前記細胞または組織を、5〜30個のヌクレオチドの長さの少なくとも1つの低分子干渉RNA(siRNA)オリゴヌクレオチドと接触させるステップであって、前記少なくとも1つのsiRNAオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスポリヌクレオチドに対して特異的であり、前記少なくとも1つのsiRNAオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスおよび/またはセンス核酸分子の少なくとも5個の連続した核酸の相補的配列と少なくとも50%の配列同一性を有する、該ステップを含み、
生体内または体外で哺乳動物の細胞または組織における膵臓発生遺伝子の機能および/または発現を調節する、方法。
【請求項15】
前記オリゴヌクレオチドが、膵臓発生遺伝子ポリヌクレオチドのアンチセンス核酸分子および/またはセンス核酸分子に相補的な連続した少なくとも5個の核酸の配列と、少なくとも80%の配列同一性を有する、請求項14に記載の方法。
【請求項16】
生体内または体外で哺乳動物の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、
前記細胞または組織を、約5〜30個のヌクレオチドの長さの少なくとも1つのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記少なくとも1つのオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのセンスおよび/またはアンチセンス鎖の非コード配列および/またはコード配列に対して特異的であり、前記少なくとも1つのアンチセンスオリゴヌクレオチドは、配列番号1乃至12の配列の少なくとも1つの核酸配列と少なくとも50%の配列同一性を有する、該ステップと、
生体内または体外で哺乳動物の細胞または組織における膵臓発生遺伝子の機能および/または発現を調節するステップとを含む、方法。
【請求項17】
少なくとも1つの修飾を含む合成された修飾オリゴヌクレオチドであって、
前記少なくとも1つの修飾が、少なくとも1つの修飾糖部分、少なくとも1つの修飾ヌクレオチド間結合、少なくとも1つの修飾ヌクレオチド、およびそれらの組み合わせから選択されたものであり、
前記オリゴヌクレオチドは、生体内または体外で膵臓発生遺伝子にハイブリダイズし、通常の対照と比較してその機能および/または発現を調節するアンチセンス化合物である、オリゴヌクレオチド。
【請求項18】
前記少なくとも1つの修飾は、ホスホロチオアート、アルキルホスホナート、ホスホロジチオアート、アルキルホスホノチオアート、ホスホルアミダート、カルバメート、炭酸塩、リン酸トリエステル、アセトアミダート、カルボキシメチルエステル、およびそれらの組み合わせから選択されたヌクレオチド間結合を含む、請求項17に記載のオリゴヌクレオチド。
【請求項19】
前記オリゴヌクレオチドが、少なくとも1つのホスホロチオアートヌクレオチド間結合を含む、請求項17に記載のオリゴヌクレオチド。
【請求項20】
前記オリゴヌクレオチドが、ホスホロチオアートヌクレオチド間結合の骨格を含む、請求項17に記載のオリゴヌクレオチド。
【請求項21】
前記オリゴヌクレオチドは、少なくとも1つの修飾されたヌクレオチドを含み、該修飾されたヌクレオチドは、ペプチド核酸、ロックト核酸(LNA)、類似体、誘導体、およびそれらの組み合わせから選択されたものである、請求項17に記載のオリゴヌクレオチド。
【請求項22】
前記オリゴヌクレオチドは、複数の修飾を含み、前記修飾は、ホスホロチオアート、アルキルホスホナート、ホスホロジチオアート、アルキルホスホノチオアート、ホスホラミダート、カルバメート、炭酸塩、リン酸トリエステル、アセトアミダート、カルボキシメチルエステル、およびそれらの組み合わせから選択された修飾ヌクレオチドを含む、請求項17に記載のオリゴヌクレオチド。
【請求項23】
前記オリゴヌクレオチドは複数の修飾を含み、前記複数の修飾は、ペプチド核酸、ロックト核酸(LNA)、類似体、誘導体、およびそれらの組み合わせから選択された修飾ヌクレオチドを含む、請求項17に記載のオリゴヌクレオチド。
【請求項24】
前記オリゴヌクレオチドが、2’−O−メトキシエチル修飾糖部分、2’−メトキシ修飾糖部分、2’−O−アルキル修飾糖部分、二環糖部分、およびそれらの組み合わせから選択された、少なくとも1つの修飾糖部分を含む、請求項17に記載のオリゴヌクレオチド。
【請求項25】
前記オリゴヌクレオチドは複数の修飾を含み、前記複数の修飾は、2’−O−メトキシエチル修飾糖部分、2’−メトキシ修飾糖部分、2’−O−アルキル修飾糖部分、二環糖部分、およびそれらの組み合わせから選択された修飾糖部分を含む、請求項17に記載のオリゴヌクレオチド。
【請求項26】
前記オリゴヌクレオチドは約5〜30個のヌクレオチドの長さを有し、膵臓発生遺伝子ポリヌクレオチドのアンチセンスおよび/またはセンス鎖にハイブリダイズし、
前記オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスおよび/またはセンスコード核酸配列および/または非コード核酸配列の連続した少なくとも5個の核酸の配列に相補的な配列に対して、少なくとも約20%配列同一性を有する、請求項17に記載のオリゴヌクレオチド。
【請求項27】
前記オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスおよび/またはセンスコード核酸配列および/または非コード核酸配列の連続した少なくとも5個の核酸の配列に相補的な配列に対して、少なくとも約80%配列同一性を有する、請求項17に記載のオリゴヌクレオチド。
【請求項28】
前記オリゴヌクレオチドは、生体内または体外で膵臓発生遺伝子にハイブリダイズし、通常の対照と比較してその機能および/または発現を調節する、請求項17に記載のオリゴヌクレオチド。
【請求項29】
前記オリゴヌクレオチドは、配列番号13乃至45に記載する配列を含む、請求項17に記載のオリゴヌクレオチド。
【請求項30】
1以上の膵臓発生遺伝子ポリヌクレオチドに特異的な1以上のオリゴヌクレオチドを含む組成物であって、
前記ポリヌクレオチドは、アンチセンス配列、相補配列、アレル、ホモログ、アイソフォーム、変異型、誘導体、突然変異体、断片、またはそれらの組み合わせを含む、組成物。
【請求項31】
前記オリゴヌクレオチドは、配列番号13乃至45に記載する配列のいずれかと比較して、少なくとも約40%の配列同一性を有する、請求項30に記載の組成物。
【請求項32】
前記オリゴヌクレオチドは、配列番号13乃至45に記載するヌクレオチド配列を含む、請求項30に記載の組成物。
【請求項33】
配列番号13乃至45に記載する配列の前記オリゴヌクレオチドは、1以上の修飾または置換を含む、請求項32に記載の組成物。
【請求項34】
前記1以上の修飾は、ホスホロチオアート、メチルホスホナート、ペプチド核酸、ロックト核酸(LNA)分子、およびそれらの組み合わせから選択されたものである、請求項33に記載の組成物。
【請求項35】
少なくとも1つの膵臓発生遺伝子および/または少なくとも1つのそのコードされた生成物に関連する疾病を予防または治療する方法であって、
患者に対し、前記少なくとも1つの膵臓発生遺伝子ポリヌクレオチドの天然のアンチセンス配列に結合し、かつ前記少なくとも1つの膵臓発生遺伝子ポリヌクレオチドの発現を調節する、少なくとも1つのアンチセンスオリゴヌクレオチドを治療上有効な用量投与するステップを含み、
それによって、前記少なくとも1つの膵臓発生遺伝子ポリヌクレオチドおよび/または少なくとも1つのそのコードされた生成物に関連する疾病を予防または治療する、方法。
【請求項36】
膵臓発生遺伝子の少なくとも1つが関連する疾病は、膵臓発生遺伝子の機能および/または発現の異常に関連する疾患または障害、表1に記載するいずれかの遺伝子の機能および/または発現の異常に関連する疾患または障害、心血管疾患または障害(例えば、鬱血性心不全、心筋梗塞、虚血性疾患、心房性または心室性不整脈、高血圧性血管疾患、末梢血管疾患、およびアテローム性動脈硬化症など)、炎症、胃腸疾患または障害(例えば、食道の疾患、アカラシア、活動性アカラシア、嚥下障害、輪状咽頭の協調不全、食道前嚥下障害、びまん性食道けいれん症、球感覚、バレット上皮化生、胃食道逆流など)、胃および/または十二指腸の疾患または障害(例えば、機能性消化不良、胃粘膜の炎症、胃炎、ストレス性胃炎、慢性びらん性胃炎、胃腺の萎縮、胃組織の化生、胃潰瘍、十二指腸潰瘍、胃の新生物)、膵臓の疾患または障害(例えば、急性または慢性膵炎、脂肪便症のような膵臓の外分泌または内分泌組織の機能不全、糖尿病など)、外分泌や内分泌膵臓の新生物(例えば、多発性内分泌腫瘍症候群、導管腺癌、嚢胞腺癌、膵島細胞腫瘍、インスリノーマ、ガストリノーマ、カルチノイド腫瘍、グルカゴノーマ、ゾリンジャー・エリソン症候群、VIP産生腫瘍症候群、吸収不良症候群など)、腸の疾患または障害(例えば、腸の慢性炎症性疾患、クローン病、腸閉塞、下痢および便秘、結腸無力症、巨大結腸、吸収不良症候群、潰瘍性大腸炎、機能性腸疾患、過敏性腸症候群など)、腸の新生物(例えば、家族性ポリポーシス、腺癌、原発性悪性リンパ腫、カルチノイド腫瘍、カポジ肉腫、ポリープ、結腸直腸癌など)、肝疾患または障害(例えば、ビリルビン代謝障害、黄疸、ジルベール症候群、クリーグラー・ナジャー病、デュビン・ジョンソン症候群およびローター症候群;肝内胆汁鬱滞、肝腫脹、門脈圧亢進症、腹水症、バッド・キアリ症候群、門脈体循環性脳症、脂肪肝、脂肪症、ライ症候群、アルコールによる肝臓病、アルコール性肝炎または肝硬変、線維症、肝硬変など)、代謝の先天性異常または外因性物質による肝臓の線維症および/または肝硬変、蓄積症または貯留疾患、ゴーシェ症候群、ツェルヴェーガー症候群、ウィルソン病、急性または慢性肝炎、ウイルス性肝炎およびその亜種;ウイルス、細菌、真菌、原虫、寄生虫による肝臓の炎症性疾患;肝臓の薬剤誘発性疾患または障害、原発性硬化性胆管炎などの慢性肝疾患、α1−アンチトリプシン欠損症、原発性胆汁性肝硬変、術後の肝内胆汁鬱滞などの術後の肝障害、肝肉芽腫、全身性疾患に関連する血管肝疾患または障害、肝臓の良性または悪性新生物、新生児または未熟児における肝臓の代謝障害、筋骨格疾患(例えば、骨粗鬆症、閉経後骨粗鬆症、老人性骨粗鬆症、続発性骨粗鬆症、特発性若年性骨粗鬆症、骨パジェット病、骨軟骨腫、骨軟骨外骨腫症など)、骨の腫瘍(例えば、良性の軟骨腫、軟骨芽細胞腫、軟骨線維腫、類骨骨腫、骨の巨細胞腫、多発性骨髄腫、骨肉腫(造骨組織の肉腫)、線維肉腫、悪性線維性組織球腫、軟骨肉腫、ユーイング腫瘍(ユーイング肉腫)、骨の悪性リンパ腫(細網肉腫、骨の転移性腫瘍)、変形性関節症、痛風および偽痛風、関節および結合組織の疾患(例えば、関節リウマチ、乾癬性関節炎、円板状エリテマトーデス、全身性エリテマトーデス、強皮症(全身性硬化症)、シェーグレン症候群、結合組織病、多発性筋炎および皮膚筋炎、再発性多発性軟骨炎、血管炎、結節性多発動脈炎、リウマチ性多発筋痛、側頭動脈炎、ウェゲナー肉芽腫症、ライター症候群、ベーチェット症候群、強直性脊椎炎、またはシャルコー関節(神経障害性関節疾患)など);骨および関節の感染症(例えば、骨髄炎、感染性関節炎);筋肉、嚢、および/または腱の疾患または障害(例えば、痙性斜頸、線維筋肉痛症候群(筋筋膜性疼痛症候群、線維筋炎)、滑液包炎、腱炎および腱滑膜炎)、足の問題(例えば、足首の捻挫、足骨折、踵骨骨棘、シバー病、後部アキレス腱滑液包炎、前部アキレス腱滑液包炎、後脛骨神経痛、(足指の間の神経またはつま先と足の間の関節の損傷によって引き起こされる)母指球の疼痛、爪甲真菌症、または足爪の変色)、癌、炎症性疾患または障害、I−IV型過敏性反応などの炎症性疾患(例えば、喘息を含む肺の過敏症、アトピー性疾患、アレルギー性鼻炎または結膜炎、眼瞼の血管性浮腫、遺伝性血管性浮腫、抗受容体過敏症反応および自己免疫疾患、橋本甲状腺炎、全身性エリテマトーデス、グッドパスチャー症候群、天疱瘡、重症筋無力症、グレーブスおよびレイノー病、インスリン抵抗性糖尿病B型、関節リウマチ、乾癬、クローン病、強皮症、混合性結合組織病、多発性筋炎、サルコイドーシス、糸球体腎炎、急性または慢性宿主対移植片反応);慢性閉塞性肺疾患(COPD)などの肺疾患または障害;女性および男性の泌尿生殖器系を構成する臓器の悪性疾患などの泌尿器系の疾患、急性または慢性腎不全などの腎疾患または障害、腎移植拒絶反応のような免疫介在性腎疾患、ループス腎炎、免疫複合体腎疾患、糸球体症、腎炎、中毒性腎症、良性前立腺過形成(BPH)のような閉塞性尿路疾患、神経因性膀胱症候群、切迫性尿失禁、緊張性尿失禁、または溢流性尿失禁のような尿失禁、骨盤痛、および勃起不全、内分泌性膵臓発生異常に関連する疾患または障害(例えば、2型糖尿病)、神経新生異常に関連する疾患または障害、神経変性疾患または障害(例えばアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症等);前庭および/または聴覚系の発達異常に関連する疾患または障害、視細胞の変性に関連する疾患または障害(例えば、視力の低下、加齢黄斑変性症など)、肥満症、肝臓の機能不全に関連する疾患または障害(例えば、肝不全)、粉状白内障、青色白内障、非症候性先天性白内障、先天性白内障−小角膜症候群、膵疾患または障害(例えば、糖尿病、成人発症型糖尿病(MODY)症候群、部分膵臓形成不全、慢性高血糖、膵β細胞の障害、グルコース毒性、耐糖能異常、メタボリックシンドロームXなど)、クローン病、心筋梗塞、高コレステロール血症、頭内動脈硬化症、脳梗塞、ヘルペスウイルス感染症、脂質代謝の障害に関連する疾患または障害、インスリン産生に関連する疾患または障害、セロトニン産生に関連する疾患または障害(例えば、鬱病および肥満症)、生殖器系の疾患、および糖尿病(例えば、2型糖尿病、インスリン非依存型糖尿病)などの代謝性疾患または障害から選択されたものである、請求項35に記載の方法。
【請求項37】
生体内投与のための少なくとも1つのオリゴヌクレオチドを特定し、選択する方法であって、
疾病状態に関連する標的ポリヌクレオチドを選択するステップと、
選択された標的ポリヌクレオチドに対して、または選択された標的ポリヌクレオチドに相補的なポリヌクレオチドに対して相補的な、少なくとも5個の連続したヌクレオチドを含む、少なくとも1つのオリゴヌクレオチドを特定するステップと、
ストリンジェントなハイブリダイゼーション条件の下での、前記標的ポリヌクレオチドまたは選択された標的ポリヌクレオチドに対するアンチセンスであるポリヌクレオチドとアンチセンスオリゴヌクレオチドとのハイブリッドの熱融解温度を測定するステップと、
得られた情報に基づいて、生体内投与のための少なくとも1つのオリゴヌクレオチドを選択するステップとを含む、方法。
【請求項1】
生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、
前記細胞または組織を、5〜30個のヌクレオチドの長さの少なくとも1つのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記少なくとも1つのオリゴヌクレオチドは、配列番号6の1番目〜1235番目のヌクレオチド、配列番号7の1番目〜17,964番目のヌクレオチド、配列番号8の1番目〜50,003番目のヌクレオチド、配列番号9の1番目〜486番目のヌクレオチド、配列番号10の1番目〜494番目のヌクレオチド、配列番号11の1番目〜1992番目のヌクレオチド、および配列番号12の1番目〜1767番目のヌクレオチドの範囲内の連続した5〜30個のヌクレオチドを含むポリヌクレオチドに対する逆相補配列と少なくとも50%の配列同一性を有する、該ステップを含み、
それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法。
【請求項2】
生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、
前記細胞または組織を、5〜30個のヌクレオチドの長さの少なくとも1つのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記少なくとも1つのオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドの天然のアンチセンスに対する逆相補配列と少なくとも50%の配列同一性を有する、該ステップを含み、
それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法。
【請求項3】
生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、
前記細胞または組織を、5〜30個のヌクレオチドの長さの少なくとも1つのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスオリゴヌクレオチドと少なくとも50%の配列同一性を有する、該ステップを含み、
それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法。
【請求項4】
生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、
前記細胞または組織を、少なくとも1つのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記少なくとも1つのオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドの天然のアンチセンスオリゴヌクレオチドの1つの領域を標的とする、該ステップを含み、
それによって、生体内または体外で患者の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する、方法。
【請求項5】
膵臓発生遺伝子の機能および/または発現が、対照と比較して生体内または体外で増加する、請求項4に記載の方法。
【請求項6】
前記少なくとも1つのアンチセンスオリゴヌクレオチドが、膵臓発生遺伝子ポリペプチドの天然のアンチセンス配列を標的とする、請求項4に記載の方法。
【請求項7】
前記少なくとも1つのアンチセンスオリゴヌクレオチドが、膵臓発生遺伝子ポリペプチドのコード核酸配列および/または非コード核酸配列を含む核酸配列を標的とする、請求項4に記載の方法。
【請求項8】
前記少なくとも1つのアンチセンスオリゴヌクレオチドが、膵臓発生遺伝子ポリヌクレオチドの重複配列および/または非重複配列を標的とする、請求項4に記載の方法。
【請求項9】
前記少なくとも1つのアンチセンスオリゴヌクレオチドが、少なくとも1つの修飾糖部分、少なくとも1つの修飾ヌクレオチド間結合、少なくとも1つの修飾ヌクレオチド、およびそれらの組み合わせから選択された1以上の修飾を含む、請求項4に記載の方法。
【請求項10】
前記1以上の修飾が、2’−O−メトキシエチル修飾糖部分、2’−メトキシ修飾糖部分、2’−O−アルキル修飾糖部分、二環糖部分、およびそれらの組み合わせから選択された、少なくとも1つの修飾糖部分を含む、請求項9に記載の方法。
【請求項11】
前記1以上の修飾は、ホスホロチオアート、2’−O−メトキシエチル(MOE)、2’−フルオロ、アルキルホスホナート、ホスホロジチオエート、アルキルホスホノチオアート、ホスホルアミダート、カルバメート、炭酸塩、リン酸トリエステル、アセトアミダート、カルボキシメチルエステル、およびそれらの組み合わせから選択された少なくとも1つの修飾ヌクレオチド間結合を含む、請求項9に記載の方法。
【請求項12】
前記1以上の修飾が、ペプチド核酸(PNA)、ロックト核酸(LNA)、アラビノ核酸(FANA),類似体、誘導体、およびそれらの組み合わせから選択された少なくとも1つの修飾ヌクレオチドを含む、請求項9に記載の方法。
【請求項13】
前記少なくとも1つのオリゴヌクレオチドが、配列番号13乃至45に記載するオリゴヌクレオチド配列を少なくとも1つ含む、請求項1に記載の方法。
【請求項14】
生体内または体外で哺乳動物の細胞または組織における膵臓発生遺伝子遺伝子の機能および/または発現を調節する方法であって、
前記細胞または組織を、5〜30個のヌクレオチドの長さの少なくとも1つの低分子干渉RNA(siRNA)オリゴヌクレオチドと接触させるステップであって、前記少なくとも1つのsiRNAオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスポリヌクレオチドに対して特異的であり、前記少なくとも1つのsiRNAオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスおよび/またはセンス核酸分子の少なくとも5個の連続した核酸の相補的配列と少なくとも50%の配列同一性を有する、該ステップを含み、
生体内または体外で哺乳動物の細胞または組織における膵臓発生遺伝子の機能および/または発現を調節する、方法。
【請求項15】
前記オリゴヌクレオチドが、膵臓発生遺伝子ポリヌクレオチドのアンチセンス核酸分子および/またはセンス核酸分子に相補的な連続した少なくとも5個の核酸の配列と、少なくとも80%の配列同一性を有する、請求項14に記載の方法。
【請求項16】
生体内または体外で哺乳動物の細胞または組織における膵臓発生遺伝子ポリヌクレオチドの機能および/または発現を調節する方法であって、
前記細胞または組織を、約5〜30個のヌクレオチドの長さの少なくとも1つのアンチセンスオリゴヌクレオチドと接触させるステップであって、前記少なくとも1つのオリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのセンスおよび/またはアンチセンス鎖の非コード配列および/またはコード配列に対して特異的であり、前記少なくとも1つのアンチセンスオリゴヌクレオチドは、配列番号1乃至12の配列の少なくとも1つの核酸配列と少なくとも50%の配列同一性を有する、該ステップと、
生体内または体外で哺乳動物の細胞または組織における膵臓発生遺伝子の機能および/または発現を調節するステップとを含む、方法。
【請求項17】
少なくとも1つの修飾を含む合成された修飾オリゴヌクレオチドであって、
前記少なくとも1つの修飾が、少なくとも1つの修飾糖部分、少なくとも1つの修飾ヌクレオチド間結合、少なくとも1つの修飾ヌクレオチド、およびそれらの組み合わせから選択されたものであり、
前記オリゴヌクレオチドは、生体内または体外で膵臓発生遺伝子にハイブリダイズし、通常の対照と比較してその機能および/または発現を調節するアンチセンス化合物である、オリゴヌクレオチド。
【請求項18】
前記少なくとも1つの修飾は、ホスホロチオアート、アルキルホスホナート、ホスホロジチオアート、アルキルホスホノチオアート、ホスホルアミダート、カルバメート、炭酸塩、リン酸トリエステル、アセトアミダート、カルボキシメチルエステル、およびそれらの組み合わせから選択されたヌクレオチド間結合を含む、請求項17に記載のオリゴヌクレオチド。
【請求項19】
前記オリゴヌクレオチドが、少なくとも1つのホスホロチオアートヌクレオチド間結合を含む、請求項17に記載のオリゴヌクレオチド。
【請求項20】
前記オリゴヌクレオチドが、ホスホロチオアートヌクレオチド間結合の骨格を含む、請求項17に記載のオリゴヌクレオチド。
【請求項21】
前記オリゴヌクレオチドは、少なくとも1つの修飾されたヌクレオチドを含み、該修飾されたヌクレオチドは、ペプチド核酸、ロックト核酸(LNA)、類似体、誘導体、およびそれらの組み合わせから選択されたものである、請求項17に記載のオリゴヌクレオチド。
【請求項22】
前記オリゴヌクレオチドは、複数の修飾を含み、前記修飾は、ホスホロチオアート、アルキルホスホナート、ホスホロジチオアート、アルキルホスホノチオアート、ホスホラミダート、カルバメート、炭酸塩、リン酸トリエステル、アセトアミダート、カルボキシメチルエステル、およびそれらの組み合わせから選択された修飾ヌクレオチドを含む、請求項17に記載のオリゴヌクレオチド。
【請求項23】
前記オリゴヌクレオチドは複数の修飾を含み、前記複数の修飾は、ペプチド核酸、ロックト核酸(LNA)、類似体、誘導体、およびそれらの組み合わせから選択された修飾ヌクレオチドを含む、請求項17に記載のオリゴヌクレオチド。
【請求項24】
前記オリゴヌクレオチドが、2’−O−メトキシエチル修飾糖部分、2’−メトキシ修飾糖部分、2’−O−アルキル修飾糖部分、二環糖部分、およびそれらの組み合わせから選択された、少なくとも1つの修飾糖部分を含む、請求項17に記載のオリゴヌクレオチド。
【請求項25】
前記オリゴヌクレオチドは複数の修飾を含み、前記複数の修飾は、2’−O−メトキシエチル修飾糖部分、2’−メトキシ修飾糖部分、2’−O−アルキル修飾糖部分、二環糖部分、およびそれらの組み合わせから選択された修飾糖部分を含む、請求項17に記載のオリゴヌクレオチド。
【請求項26】
前記オリゴヌクレオチドは約5〜30個のヌクレオチドの長さを有し、膵臓発生遺伝子ポリヌクレオチドのアンチセンスおよび/またはセンス鎖にハイブリダイズし、
前記オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスおよび/またはセンスコード核酸配列および/または非コード核酸配列の連続した少なくとも5個の核酸の配列に相補的な配列に対して、少なくとも約20%配列同一性を有する、請求項17に記載のオリゴヌクレオチド。
【請求項27】
前記オリゴヌクレオチドは、膵臓発生遺伝子ポリヌクレオチドのアンチセンスおよび/またはセンスコード核酸配列および/または非コード核酸配列の連続した少なくとも5個の核酸の配列に相補的な配列に対して、少なくとも約80%配列同一性を有する、請求項17に記載のオリゴヌクレオチド。
【請求項28】
前記オリゴヌクレオチドは、生体内または体外で膵臓発生遺伝子にハイブリダイズし、通常の対照と比較してその機能および/または発現を調節する、請求項17に記載のオリゴヌクレオチド。
【請求項29】
前記オリゴヌクレオチドは、配列番号13乃至45に記載する配列を含む、請求項17に記載のオリゴヌクレオチド。
【請求項30】
1以上の膵臓発生遺伝子ポリヌクレオチドに特異的な1以上のオリゴヌクレオチドを含む組成物であって、
前記ポリヌクレオチドは、アンチセンス配列、相補配列、アレル、ホモログ、アイソフォーム、変異型、誘導体、突然変異体、断片、またはそれらの組み合わせを含む、組成物。
【請求項31】
前記オリゴヌクレオチドは、配列番号13乃至45に記載する配列のいずれかと比較して、少なくとも約40%の配列同一性を有する、請求項30に記載の組成物。
【請求項32】
前記オリゴヌクレオチドは、配列番号13乃至45に記載するヌクレオチド配列を含む、請求項30に記載の組成物。
【請求項33】
配列番号13乃至45に記載する配列の前記オリゴヌクレオチドは、1以上の修飾または置換を含む、請求項32に記載の組成物。
【請求項34】
前記1以上の修飾は、ホスホロチオアート、メチルホスホナート、ペプチド核酸、ロックト核酸(LNA)分子、およびそれらの組み合わせから選択されたものである、請求項33に記載の組成物。
【請求項35】
少なくとも1つの膵臓発生遺伝子および/または少なくとも1つのそのコードされた生成物に関連する疾病を予防または治療する方法であって、
患者に対し、前記少なくとも1つの膵臓発生遺伝子ポリヌクレオチドの天然のアンチセンス配列に結合し、かつ前記少なくとも1つの膵臓発生遺伝子ポリヌクレオチドの発現を調節する、少なくとも1つのアンチセンスオリゴヌクレオチドを治療上有効な用量投与するステップを含み、
それによって、前記少なくとも1つの膵臓発生遺伝子ポリヌクレオチドおよび/または少なくとも1つのそのコードされた生成物に関連する疾病を予防または治療する、方法。
【請求項36】
膵臓発生遺伝子の少なくとも1つが関連する疾病は、膵臓発生遺伝子の機能および/または発現の異常に関連する疾患または障害、表1に記載するいずれかの遺伝子の機能および/または発現の異常に関連する疾患または障害、心血管疾患または障害(例えば、鬱血性心不全、心筋梗塞、虚血性疾患、心房性または心室性不整脈、高血圧性血管疾患、末梢血管疾患、およびアテローム性動脈硬化症など)、炎症、胃腸疾患または障害(例えば、食道の疾患、アカラシア、活動性アカラシア、嚥下障害、輪状咽頭の協調不全、食道前嚥下障害、びまん性食道けいれん症、球感覚、バレット上皮化生、胃食道逆流など)、胃および/または十二指腸の疾患または障害(例えば、機能性消化不良、胃粘膜の炎症、胃炎、ストレス性胃炎、慢性びらん性胃炎、胃腺の萎縮、胃組織の化生、胃潰瘍、十二指腸潰瘍、胃の新生物)、膵臓の疾患または障害(例えば、急性または慢性膵炎、脂肪便症のような膵臓の外分泌または内分泌組織の機能不全、糖尿病など)、外分泌や内分泌膵臓の新生物(例えば、多発性内分泌腫瘍症候群、導管腺癌、嚢胞腺癌、膵島細胞腫瘍、インスリノーマ、ガストリノーマ、カルチノイド腫瘍、グルカゴノーマ、ゾリンジャー・エリソン症候群、VIP産生腫瘍症候群、吸収不良症候群など)、腸の疾患または障害(例えば、腸の慢性炎症性疾患、クローン病、腸閉塞、下痢および便秘、結腸無力症、巨大結腸、吸収不良症候群、潰瘍性大腸炎、機能性腸疾患、過敏性腸症候群など)、腸の新生物(例えば、家族性ポリポーシス、腺癌、原発性悪性リンパ腫、カルチノイド腫瘍、カポジ肉腫、ポリープ、結腸直腸癌など)、肝疾患または障害(例えば、ビリルビン代謝障害、黄疸、ジルベール症候群、クリーグラー・ナジャー病、デュビン・ジョンソン症候群およびローター症候群;肝内胆汁鬱滞、肝腫脹、門脈圧亢進症、腹水症、バッド・キアリ症候群、門脈体循環性脳症、脂肪肝、脂肪症、ライ症候群、アルコールによる肝臓病、アルコール性肝炎または肝硬変、線維症、肝硬変など)、代謝の先天性異常または外因性物質による肝臓の線維症および/または肝硬変、蓄積症または貯留疾患、ゴーシェ症候群、ツェルヴェーガー症候群、ウィルソン病、急性または慢性肝炎、ウイルス性肝炎およびその亜種;ウイルス、細菌、真菌、原虫、寄生虫による肝臓の炎症性疾患;肝臓の薬剤誘発性疾患または障害、原発性硬化性胆管炎などの慢性肝疾患、α1−アンチトリプシン欠損症、原発性胆汁性肝硬変、術後の肝内胆汁鬱滞などの術後の肝障害、肝肉芽腫、全身性疾患に関連する血管肝疾患または障害、肝臓の良性または悪性新生物、新生児または未熟児における肝臓の代謝障害、筋骨格疾患(例えば、骨粗鬆症、閉経後骨粗鬆症、老人性骨粗鬆症、続発性骨粗鬆症、特発性若年性骨粗鬆症、骨パジェット病、骨軟骨腫、骨軟骨外骨腫症など)、骨の腫瘍(例えば、良性の軟骨腫、軟骨芽細胞腫、軟骨線維腫、類骨骨腫、骨の巨細胞腫、多発性骨髄腫、骨肉腫(造骨組織の肉腫)、線維肉腫、悪性線維性組織球腫、軟骨肉腫、ユーイング腫瘍(ユーイング肉腫)、骨の悪性リンパ腫(細網肉腫、骨の転移性腫瘍)、変形性関節症、痛風および偽痛風、関節および結合組織の疾患(例えば、関節リウマチ、乾癬性関節炎、円板状エリテマトーデス、全身性エリテマトーデス、強皮症(全身性硬化症)、シェーグレン症候群、結合組織病、多発性筋炎および皮膚筋炎、再発性多発性軟骨炎、血管炎、結節性多発動脈炎、リウマチ性多発筋痛、側頭動脈炎、ウェゲナー肉芽腫症、ライター症候群、ベーチェット症候群、強直性脊椎炎、またはシャルコー関節(神経障害性関節疾患)など);骨および関節の感染症(例えば、骨髄炎、感染性関節炎);筋肉、嚢、および/または腱の疾患または障害(例えば、痙性斜頸、線維筋肉痛症候群(筋筋膜性疼痛症候群、線維筋炎)、滑液包炎、腱炎および腱滑膜炎)、足の問題(例えば、足首の捻挫、足骨折、踵骨骨棘、シバー病、後部アキレス腱滑液包炎、前部アキレス腱滑液包炎、後脛骨神経痛、(足指の間の神経またはつま先と足の間の関節の損傷によって引き起こされる)母指球の疼痛、爪甲真菌症、または足爪の変色)、癌、炎症性疾患または障害、I−IV型過敏性反応などの炎症性疾患(例えば、喘息を含む肺の過敏症、アトピー性疾患、アレルギー性鼻炎または結膜炎、眼瞼の血管性浮腫、遺伝性血管性浮腫、抗受容体過敏症反応および自己免疫疾患、橋本甲状腺炎、全身性エリテマトーデス、グッドパスチャー症候群、天疱瘡、重症筋無力症、グレーブスおよびレイノー病、インスリン抵抗性糖尿病B型、関節リウマチ、乾癬、クローン病、強皮症、混合性結合組織病、多発性筋炎、サルコイドーシス、糸球体腎炎、急性または慢性宿主対移植片反応);慢性閉塞性肺疾患(COPD)などの肺疾患または障害;女性および男性の泌尿生殖器系を構成する臓器の悪性疾患などの泌尿器系の疾患、急性または慢性腎不全などの腎疾患または障害、腎移植拒絶反応のような免疫介在性腎疾患、ループス腎炎、免疫複合体腎疾患、糸球体症、腎炎、中毒性腎症、良性前立腺過形成(BPH)のような閉塞性尿路疾患、神経因性膀胱症候群、切迫性尿失禁、緊張性尿失禁、または溢流性尿失禁のような尿失禁、骨盤痛、および勃起不全、内分泌性膵臓発生異常に関連する疾患または障害(例えば、2型糖尿病)、神経新生異常に関連する疾患または障害、神経変性疾患または障害(例えばアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症等);前庭および/または聴覚系の発達異常に関連する疾患または障害、視細胞の変性に関連する疾患または障害(例えば、視力の低下、加齢黄斑変性症など)、肥満症、肝臓の機能不全に関連する疾患または障害(例えば、肝不全)、粉状白内障、青色白内障、非症候性先天性白内障、先天性白内障−小角膜症候群、膵疾患または障害(例えば、糖尿病、成人発症型糖尿病(MODY)症候群、部分膵臓形成不全、慢性高血糖、膵β細胞の障害、グルコース毒性、耐糖能異常、メタボリックシンドロームXなど)、クローン病、心筋梗塞、高コレステロール血症、頭内動脈硬化症、脳梗塞、ヘルペスウイルス感染症、脂質代謝の障害に関連する疾患または障害、インスリン産生に関連する疾患または障害、セロトニン産生に関連する疾患または障害(例えば、鬱病および肥満症)、生殖器系の疾患、および糖尿病(例えば、2型糖尿病、インスリン非依存型糖尿病)などの代謝性疾患または障害から選択されたものである、請求項35に記載の方法。
【請求項37】
生体内投与のための少なくとも1つのオリゴヌクレオチドを特定し、選択する方法であって、
疾病状態に関連する標的ポリヌクレオチドを選択するステップと、
選択された標的ポリヌクレオチドに対して、または選択された標的ポリヌクレオチドに相補的なポリヌクレオチドに対して相補的な、少なくとも5個の連続したヌクレオチドを含む、少なくとも1つのオリゴヌクレオチドを特定するステップと、
ストリンジェントなハイブリダイゼーション条件の下での、前記標的ポリヌクレオチドまたは選択された標的ポリヌクレオチドに対するアンチセンスであるポリヌクレオチドとアンチセンスオリゴヌクレオチドとのハイブリッドの熱融解温度を測定するステップと、
得られた情報に基づいて、生体内投与のための少なくとも1つのオリゴヌクレオチドを選択するステップとを含む、方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公表番号】特表2013−516191(P2013−516191A)
【公表日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願番号】特願2012−548109(P2012−548109)
【出願日】平成23年1月6日(2011.1.6)
【国際出願番号】PCT/US2011/020321
【国際公開番号】WO2011/085066
【国際公開日】平成23年7月14日(2011.7.14)
【出願人】(512156578)カッパーアールエヌエー,インコーポレイテッド (16)
【Fターム(参考)】
【公表日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願日】平成23年1月6日(2011.1.6)
【国際出願番号】PCT/US2011/020321
【国際公開番号】WO2011/085066
【国際公開日】平成23年7月14日(2011.7.14)
【出願人】(512156578)カッパーアールエヌエー,インコーポレイテッド (16)
【Fターム(参考)】
[ Back to top ]

