臓器および組織の脱細胞化および再細胞化
【課題】固形臓器を脱細胞化する方法および材料、ならびにそのような脱細胞化された臓器を再細胞化することで固形臓器を作製する方法および材料の提供。
【解決手段】臓器の脱細胞化された細胞外マトリックスを含む、脱細胞化された哺乳類臓器であって、該細胞外マトリックスが外表面を含み、血管樹(vascular tree)を含む該細胞外マトリックスが、脱細胞化前の該細胞外マトリックスの形態を実質的に保持し、かつ該外表面が、実質的にインタクトである、脱細胞化された哺乳類臓器を提供する段階、ならびに再生細胞が、該脱細胞化された臓器の内部もしくは表面で生着、増殖、および/または分化する条件下で、該脱細胞化された臓器に該再生細胞の集団を接触させる段階を含む、臓器を作製する方法。
【解決手段】臓器の脱細胞化された細胞外マトリックスを含む、脱細胞化された哺乳類臓器であって、該細胞外マトリックスが外表面を含み、血管樹(vascular tree)を含む該細胞外マトリックスが、脱細胞化前の該細胞外マトリックスの形態を実質的に保持し、かつ該外表面が、実質的にインタクトである、脱細胞化された哺乳類臓器を提供する段階、ならびに再生細胞が、該脱細胞化された臓器の内部もしくは表面で生着、増殖、および/または分化する条件下で、該脱細胞化された臓器に該再生細胞の集団を接触させる段階を含む、臓器を作製する方法。
【発明の詳細な説明】
【技術分野】
【0001】
技術分野
本発明は、臓器および組織に関し、より詳細には、臓器および組織を脱細胞化および再細胞化する方法および材料に関する。
【背景技術】
【0002】
背景
生物由来のマトリックスは、組織工学および再生用に開発されている。しかしながら、これまで開発されたマトリックスは一般に、弱いマトリックス構造を有し、かつ/または臓器もしくは組織の有効な再生を可能とする血管床を示さない。本開示は、臓器および組織の脱細胞化および再細胞化の方法について記載する。
【発明の概要】
【0003】
概要
本発明は、臓器または組織を脱細胞化する方法および材料、ならびに脱細胞化された臓器または組織を再細胞化する方法および材料を提供する。
【0004】
1つの局面では本発明は、脱細胞化された哺乳類心臓を提供する。脱細胞化された哺乳類心臓は、外表面を有する心臓の脱細胞化された細胞外マトリックスを含む。脱細胞化された心臓の細胞外マトリックスは、脱細胞化前の細胞外マトリックスの形態を実質的に保持し、かつ細胞外マトリックスの外表面は実質的にインタクトである。
【0005】
代表的な心臓は、齧歯類の心臓、ブタの心臓、ウサギの心臓、ウシの心臓、ヒツジの心臓、またはイヌの心臓を含むが、これらに限定されない。別の代表的な心臓はヒトの心臓である。脱細胞化された心臓は、死体の心臓の場合もある。いくつかの態様では、脱細胞化された心臓は、心臓全体の一部である。例えば、心臓全体の一部は、心臓パッチ(cardiac patch)、大動脈弁、僧帽弁、肺動脈弁、三尖弁、右心房、左心房、右心室、左心室、中隔、冠動脈血管、肺動脈、または肺静脈を含む場合があるが、これらに限定されない。
【0006】
別の局面では、本発明は固形臓器を提供する。本明細書に記載された固形臓器は、上記の脱細胞化された心臓、およびこれに付着する再生細胞の集団を含む。いくつかの態様では、再生細胞は多能性細胞である。いくつかの態様では、再生細胞は、胚性幹細胞、臍帯細胞、成体由来の幹細胞もしくは前駆細胞、骨髄由来細胞、血液由来細胞、間葉系幹細胞(MSC)、骨格筋由来細胞、多能性成体前駆細胞(MAPC)、心臓幹細胞(CSC)、または多能性成体心臓由来幹細胞である。いくつかの態様では、再生細胞は、心臓線維芽細胞、心臓微小血管細胞、または大動脈内皮細胞である。
【0007】
一般に、脱細胞化された心臓に付着する再生細胞の数は、少なくとも約1,000個である。いくつかの態様では、脱細胞化された心臓に付着する再生細胞の数は、約1,000細胞/mg組織(湿重量;すなわち脱細胞化前の重量)〜約10,000,000細胞/mg組織(湿重量)である。いくつかの態様では、再生細胞は、脱細胞化された心臓に対して異種である。さらにいくつかの態様では、固形臓器は患者に移植され、かつ再生細胞は患者に対して自家である。
【0008】
さらに別の局面では、本発明は、固形臓器を作製する方法を提供する。このような方法は一般に、本明細書に記載された脱細胞化された心臓を提供する段階、ならびに脱細胞化された心臓の内部もしくは表面で再生細胞が生着、増殖、および/または分化する条件下で、脱細胞化された心臓に再生細胞の集団を接触させる段階を含む。1つの態様では、再生細胞は、脱細胞化された心臓に注入されるか、または灌流される。
【0009】
さらに別の局面では、本発明は、心臓を脱細胞化する方法を提供する。このような方法は、心臓を提供する段階、1か所もしくは複数の腔、血管、および/または管において心臓にカニューレを挿入して、カニューレが挿入された心臓を作製する段階、ならびにカニューレが挿入された心臓に第1の細胞破壊媒体を1か所もしくは複数のカニューレ挿入を介して灌流する段階を含む。例えば灌流は、カニューレが挿入される各々の腔、血管、および/または管から多方向とすることができる。典型的には、細胞破壊媒体は、SDS、PEG、またはTriton Xなどの、少なくとも1種類の界面活性剤を含む。
【0010】
このような方法は、カニューレが挿入された心臓に第2の細胞破壊媒体を複数のカニューレ挿入を介して灌流する段階も含む。一般に、第1の細胞破壊媒体は、SDSなどの陰イオン性界面活性剤であってよく、第2の細胞破壊媒体は、Triton Xなどのイオン性界面活性剤であってよい。このような方法では、灌流は、心組織1 g(湿重量)あたり約2〜12時間とすることができる。
【0011】
特に明記した部分を除いて、本明細書で使用される全ての技術的および科学的用語は、本発明が属する技術分野の当業者により一般に理解される表現と同じ意味を有する。本明細書に記載された方法および材料と類似または同等の方法および材料を、本発明の実施または試験に使用することができるが、適切な方法および材料について以下に説明する。加えて、材料、方法、および実施例は、説明となるのみであり、制限する意図はない。本明細書で言及された全ての出版物、特許出願、特許、および他の参考文献は、参照により、それらの全体が本明細書に組み入れられる。矛盾が生じた場合は、定義を含む本明細書を優先する。
【0012】
本発明の1つもしくは複数の態様の詳細は、添付の図面および以下の記述に記載されている。本発明の他の特徴、対象、および利点は、図面および詳細な説明から、ならびに特許請求の範囲から明らかになる。
【図面の簡単な説明】
【0013】
複数の図面における同様の参照符号は、同様の構成要素を意味する。
【0014】
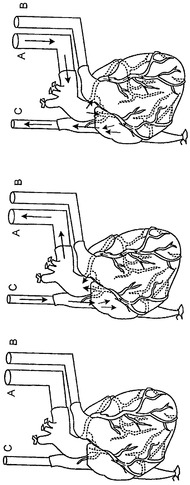
【図1】心臓の脱細胞化の初期調製を示す略図。大動脈、肺動脈、および上大静脈にカニューレが挿入されており(それぞれA、B、C)、ならびに下大静脈、腕頭動脈、左総頸動脈、および左鎖骨下動脈が結紮されている。矢印は、順行性および逆行性の灌流方向を示す。
【図2】脱細胞化/再細胞化装置の1つの態様の略図。
【発明を実施するための形態】
【0015】
詳細な説明
固形臓器は一般に、細胞外マトリックス(ECM)、これに埋没した状態の細胞、および血管床の3つの主要な構成要素を有する。本明細書に記載された固形臓器の脱細胞化では、細胞成分の大半または全体が除去されつつ、細胞外マトリックス(ECM)および血管床が実質的に保存される。脱細胞化された固形臓器は後に、再細胞化用の足場として使用することができる。固形臓器の入手先と成り得る哺乳類は、齧歯類、ブタ、ウサギ、ウシ、ヒツジ、イヌ、およびヒトを含むが、これらに限定されない。本明細書に記載された方法に使用される臓器および組織は、死体の臓器および組織の場合がある。
【0016】
本明細書に記載された固形臓器は、心臓、肝臓、肺、骨格筋、脳、膵臓、脾臓、腎臓、子宮、および膀胱を含むが、これらに限定されない。本明細書で用いる固形臓器は、「実質的に閉鎖した」脈管系を有する臓器を意味する。臓器に関する「実質的に閉鎖した」脈管系は、主要血管にカニューレが挿入され、結紮され、または制限される場合において、液体による灌流時に、該液体の大半が固形臓器内に入っており、かつ固形臓器から漏れ出さないことを意味する。「実質的に閉鎖した」脈管系を有するにもかかわらず、上記の固形臓器の多くは、灌流中における臓器全体への液体の導入または移動に有用な「入口」および「出口」の血管を規定する。
【0017】
上記の固形臓器に加えて、例えば関節(例えば、膝、肩、もしくは股関節)、気管、または脊髄の全体もしくは一部などの他のタイプの脈管化した臓器もしくは組織を、本明細書に記載された方法で脱細胞化することができる。さらに、本明細書に記載された方法で、例えば軟骨や角膜などの無血管組織を脱細胞化することもできる。
【0018】
本明細書に記載された脱細胞化された臓器もしくは組織(例えば心臓や肝臓)、またはこれらの任意の一部(例えば、大動脈弁、僧帽弁、肺動脈弁、三尖弁、肺静脈、肺動脈、冠動脈血管、中隔、右心房、左心房、右心室、もしくは左心室)を、再細胞化の実施如何にかかわらず、患者への移植に使用することができる。または、本明細書に記載された再細胞化された臓器もしくは組織を、例えば臓器もしくは組織の分化を進行中の細胞を調べるため、および/または臓器もしくは組織の細胞構造を調べるために使用することができる。
【0019】
臓器または組織の脱細胞化
本発明は、哺乳類の臓器または組織を脱細胞化する方法および材料を提供する。臓器または組織を脱細胞化する最初の段階は、臓器または組織に、可能であればカニューレを挿入することである。臓器もしくは組織の血管、管、および/または腔に、当技術分野で既知の方法および材料を用いてカニューレを挿入することができる。臓器または組織を脱細胞化する次の段階は、カニューレが挿入された臓器または組織に細胞破壊媒体を灌流することである。臓器の灌流は多方向とすることができる(例えば順行性および逆行性)。
【0020】
心臓のランゲンドルフ灌流は、生理学的な灌流として、当技術分野で常用の手法である(4チャンバーワーキングモード灌流(four chamber working mode perfusion)としても知られる)。これについては例えば、Dehnert, The Isolated Perfused Warm-Blooded Heart According to Langendorff, Methods in Experimental Physiology and Pharmacology: Biological Measurement Techniques V. Biomesstechnik-Verlag March GmbH, West Germany, 1988を参照されたい。簡単に説明すると、ランゲンドルフ灌流では、大動脈にカニューレが挿入され、細胞破壊媒体を含むリザーバーに結合される。細胞破壊媒体は、大動脈を下降するように逆方向に定流速で、例えば注入もしくはローラーポンプによって、または定常的な静水圧によって送り込むことができる。いずれの場合も、大動脈弁は強制的に閉鎖され、灌流液は冠動脈口内に向けられ(このため心室全体を灌流する)、これが冠静脈洞を介して右心房中に排出される。ワーキングモードによる灌流の場合、第2のカニューレが左心房に接続され、灌流が逆行から順行に変更可能である。
【0021】
他の臓器または組織を灌流する方法は当技術分野で既知である。例として、以下の参考文献に、肺、肝臓、腎臓、脳、および肢の灌流について記載されている。Van Putte et al., 2002, Ann. Thorac. Surg., 74(3):893-8;den Butter et al., 1995, Transpl. Int., 8:466-71;Firth et al., 1989, Clin. Sci. (Lond.), 77(6):657-61;Mazzetti et al., 2004, Brain Res., 999(1):81-90;Wagner et al., 2003, J. Artif. Organs, 6(3):183-91。
【0022】
1種類もしくは複数の細胞破壊媒体を、臓器または組織の脱細胞化に使用することができる。細胞破壊媒体は一般に、SDS、PEG、またはTriton Xなどの、少なくとも1種類の界面活性剤を含む。細胞破壊媒体には、溶媒が浸透圧的に細胞と適合しないように、水を含めることができる。または細胞破壊媒体は、細胞と浸透圧を合わせるために緩衝液(例えばPBS)を含む場合がある。細胞破壊媒体は、限定されないが、1種類もしくは複数のコラゲナーゼ、1種類もしくは複数のジスパーゼ、1種類もしくは複数のDNase、またはトリプシンなどのプロテアーゼなどの酵素を含む場合もある。場合によっては細胞破壊媒体は、1種類もしくは複数の酵素の阻害剤(例えばプロテアーゼ阻害剤、ヌクレアーゼ阻害剤、および/またはコラゲナーゼ阻害剤)を追加的もしくは代替的に含む場合がある。
【0023】
ある態様では、カニューレが挿入された臓器または組織を、2種類の異なる細胞破壊媒体で連続的に灌流することができる。例えば、第1の細胞破壊媒体には、SDSなどの陰イオン性界面活性剤を含めることが可能であり、および第2の細胞破壊媒体には、Triton Xなどのイオン性界面活性剤を含めることが可能である。少なくとも1種類の細胞破壊媒体による灌流に続いて、カニューレが挿入された臓器または組織を、例えば洗浄液、および/または本明細書に記載されたような1種類もしくは複数の酵素を含む溶液で灌流することができる。
【0024】
灌流方向(例えば順行性および逆行性)を変更することで、臓器または組織の全体の効率的な脱細胞化が容易となる。本明細書に記載された脱細胞化は、本質的に臓器を完全に脱細胞化し、ECMに極めてわずかな損傷しか生じない。臓器または組織は4〜40℃の適切な温度で脱細胞化することができる。臓器または組織のサイズおよび重量、ならびに細胞破壊媒体中の個々の界面活性剤および界面活性剤の濃度に依存して、臓器または組織は一般に、固形臓器または組織1 gあたり約2〜約12時間にわたって細胞破壊媒体で灌流される。洗浄を含めて、臓器を組織1 gあたり最長約12〜約72時間にわたって灌流することができる。灌流は一般に、脈動流、脈拍、および脈動圧を含む生理学的条件に調整される。
【0025】
本明細書に示すように、脱細胞化された臓器または組織は本質的に、血管樹(vascular tree)のECM成分を含む、臓器または組織の全体もしくは大半の領域の細胞外マトリックス(ECM)成分からなる。ECM成分には、基底層などの特定の構造として器質化された状態で残る場合のある、以下の一部または全てを含めることができる:フィブロネクチン、フィブリリン、ラミニン、エラスチン、コラーゲンファミリーのメンバー(例えばコラーゲンI、コラーゲンIII、およびコラーゲンIV)、グリコサミノグリカン、基質、細網繊維、およびトロンボスポンジン。脱細胞化の成功は、標準的な組織学的染色手順による、組織切片中における検出可能な筋フィラメント、内皮細胞、平滑筋細胞、および核の非存在と定義される。好ましくは、残存細胞片も、脱細胞化された臓器または組織から除去されるが、これは必ずしも必要ではない。
【0026】
臓器または組織の効果的な再細胞化および作製には、脱細胞化の過程中および過程後にECMの形態および構造が維持される(すなわち実質的にインタクトな状態のまま残る)ことが重要である。本明細書で用いる「形態」は、臓器もしくは組織の、またはECMの全体的な形状を意味し、また本明細書で用いる「構造」は、外表面、内表面、およびこれらの間にあるECMを意味する。
【0027】
ECMの形態および構造は肉眼で、および/または組織学的に調べることができる。例えば、固形臓器の外表面上の基底膜、または臓器もしくは組織の脈管内の基底層は、脱細胞化によって除去されるべきではないか、または有意に損なわれるべきではない。加えてECMの原繊維は、脱細胞化されていない臓器または組織の原繊維と同様であるか、または有意に変化していない状態であるべきである。
【0028】
1種類もしくは複数の化合物を、例えば、脱細胞化された臓器を保護するために、または脱細胞化された臓器もしくは組織を再細胞化用に調製するために、および/または細胞を再細胞化過程中に補助もしくは刺激するために、脱細胞化された臓器もしくは組織の内部もしくは表面に添加することができる。このような化合物は、1種類もしくは複数の成長因子(例えばVEGF、DKK-1、FGF、BMP-1、BMP-4、SDF-1、IGF、およびHGF)、免疫調節物質(例えばサイトカイン、グルココルチコイド、IL2Rアンタゴニスト、ロイコトリエンアンタゴニスト)、および/または凝固カスケードを調節する因子(例えばアスピリン、ヘパリン結合タンパク質、およびヘパリン)を含むが、これらに限定されない。加えて、脱細胞化された臓器もしくは組織を例えば、脱細胞化された臓器もしくは組織の内部もしくは表面に残存する任意のタイプの微生物の存在を減少させるか、または除去するために、照射(例えばUV、ガンマ線)により処理することができる。
【0029】
臓器または組織の再細胞化
本発明は、臓器または組織を作製するための材料および方法を提供する。臓器または組織は、本明細書に記載された脱細胞化された臓器または組織に再生細胞の集団を接触させることで作製することができる。本発明で使用される再生細胞は、脱細胞化された臓器または組織の再細胞化に使用される任意の細胞である。再生細胞は、全能性細胞、多能性細胞(pluripotent cell)、または多能性細胞(multipotent cell)の場合があり、かつ拘束されていないかもしくは拘束されている場合がある。再生細胞は1つの系統の細胞の場合もある。加えて再生細胞は、未分化の細胞、部分的に分化した細胞、または完全に分化した細胞の場合がある。本発明で使用される再生細胞は、胚性幹細胞(National Institute of Health(NIH)の定義による;例えばワールドワイドウェブ上のstemcells.nih.govにある用語集を参照)を含む。再生細胞は、始原細胞、前駆細胞、ならびに臍帯細胞および胎児幹細胞を含む「成体」由来の幹細胞も含む。
【0030】
臓器または組織を再細胞化する際に使用可能な再生細胞の例は、胚性幹細胞、臍帯血細胞、組織由来の幹細胞もしくは始原細胞、骨髄由来の幹細胞もしくは始原細胞、血液由来の幹細胞もしくは始原細胞、間葉系幹細胞(MSC)、骨格筋由来細胞、または多能性成体前駆細胞(MAPC)を含むが、これらに限定されない。使用可能な他の再生細胞は、心臓幹細胞(CSC)、多能性成体心臓由来幹細胞、心臓線維芽細胞、心臓微小血管内皮細胞、または大動脈内皮細胞を含む。骨髄単核球細胞(BM-MNC)などの骨髄由来の幹細胞、内皮もしくは血管の幹細胞もしくは前駆細胞、および内皮前駆細胞(EPC)などの末梢血由来幹細胞を再生細胞として使用することもできる。
【0031】
臓器または組織を作製するために、脱細胞化された臓器の内部または表面に導入される再生細胞の数は、臓器(例えば、臓器の種類、臓器のサイズおよび重量)または組織と、再生細胞のタイプおよび発生段階との両方に依存する。異なるタイプの細胞は、それらの細胞が達する集団密度に関して異なる傾向を有する場合がある。同様に、異なる臓器または組織は、異なる密度で細胞化する場合がある。例として、脱細胞化された臓器または組織に、少なくとも約1,000個(例えば少なくとも10,000個、100,000個、1,000,000個、10,000,000個、または100,000,000個)の再生細胞を「播種」することができる;または約1,000細胞/mg組織(湿重量、すなわち脱細胞化前)〜約10,000,000細胞/mg組織(湿重量)を付着させることができる。
【0032】
再生細胞は、脱細胞化された臓器または組織中に、1か所もしくは複数の部位への注射によって導入する(「播種する」)ことができる。さらに、複数のタイプの細胞(すなわち細胞のカクテル)を、脱細胞化された臓器または組織に導入することができる。例えば、細胞のカクテルを、脱細胞化された臓器または組織中の複数の部位に注入してもよく、または異なるタイプの細胞を、脱細胞化された臓器または組織の異なる部分に注入してもよい。注射に代えて、または注射に加えて、再生細胞または細胞のカクテルを灌流によって、カニューレが挿入された脱細胞化された臓器または組織中に導入することができる。例えば再生細胞を、脱細胞化された臓器内に、後に再生細胞の成長および/または分化を誘導するために増殖用および/または分化用の溶媒に変更可能な灌流溶媒を使用して灌流することが可能である。
【0033】
再細胞化中に、臓器または組織は、再生細胞の少なくとも一部が、脱細胞化された臓器もしくは組織の内部もしくは表面で増殖および/または分化可能な条件で維持される。このような条件は、適切な温度および/または圧力、電気的および/または機械的な活性、力、O2および/またはCO2の適切な量、適度の湿度、ならびに無菌条件もしくはほぼ無菌の条件を含むが、これらに限定されない。再細胞化中に、脱細胞化された臓器または組織、およびこれに付着する再生細胞は、適切な環境で維持される。例えば再生細胞は、栄養(例えば栄養分、および/またはグルコースなどの炭素源)の補給、外因性のホルモンもしくは成長因子、および/または特定のpHを必要とする場合がある。
【0034】
再生細胞は、脱細胞化された臓器または組織に対して同種であってもよく(例えば、ヒトの再生細胞が播種されたヒトの脱細胞化された臓器もしくは組織)、再生細胞は、脱細胞化された臓器または組織に対して異種であってもよい(例えば、ヒトの再生細胞が播種されたブタの脱細胞化された臓器もしくは組織)。本明細書で用いる「同種」とは、臓器または組織が由来する種と同じ種(例えば、血縁関係にある個体もしくは血縁関係にない個体)から得られる細胞を意味し、また本明細書で用いる「異種」とは、臓器または組織が由来する種とは異なる種から得られる細胞を意味する。
【0035】
場合によっては、本明細書に記載された方法で作られた臓器または組織は患者に移植される。このような場合、脱細胞化された臓器または組織の再細胞化に用いられる再生細胞は、再生細胞が患者に対して「自家」であるようにその患者から得られる。患者由来の再生細胞は、例えば血液、骨髄、組織、または臓器から、生涯のさまざまな時期(例えば出生前、新生児期もしくは周産期、青年期、または成人期)において、当技術分野で既知の方法で得られる。または、脱細胞化された臓器もしくは組織の再細胞化に用いられる再生細胞は、患者に対して同系(すなわち一卵性双生児に由来する)であってもよく、再生細胞は、例えば患者の血縁者か、または患者と血縁関係にないヒトリンパ球抗原(HLA)がマッチした個体に由来する、HLAにマッチする細胞であってもよく、または再生細胞は、例えばHLAがマッチしないドナーに由来する、患者に対して同種の細胞であってもよい。
【0036】
再生細胞の供給源(例えば自家か否か)に関わらず、脱細胞化された固形臓器は、患者に対して自家、同種、または異種の場合がある。
【0037】
場合によっては、脱細胞化された臓器は、インビボで(例えば臓器または組織が個体に移植された後に)、細胞によって再細胞化される場合がある。インビボにおける再細胞化は、例えば本明細書に記載された任意の再生細胞を使用する上記の手順(例えば注入および/または灌流)で実施することができる。代替的または追加的に、インビボにおける、脱細胞化された臓器または組織への内在性細胞の播種は、天然に生じる場合もあり、また再細胞化組織に輸送された因子を介する場合もある。
【0038】
再生細胞の経過は、再細胞化中にモニタリングすることができる。例えば、臓器または組織の表面もしくは内部における細胞の数は、再細胞化中の1つもしくは複数の時点で生検を行うことで評価することができる。加えて、再生細胞が起こした分化の程度を、多様なマーカーが1つの細胞中または細胞集団中に存在するか否かを判定することでモニタリングできる。このような細胞タイプに対する、様々な細胞タイプおよび様々な分化の段階と関連するマーカーは当技術分野で既知であり、抗体および標準的な免疫アッセイ法を使用して容易に検出することができる。これについては例えば、Current Protocol in Immunology, 2005, Coligan et al., Eds., John Wiley & Sonsの第3章および第11章を参照されたい。再細胞化は、核酸のアッセイ法、ならびに形態学的評価および/または組織学的評価によってモニタリングすることができる。
【0039】
臓器もしくは組織を脱細胞化および/または再細胞化するための制御系
本発明は、臓器もしくは組織を脱細胞化および/または再細胞化するための系(例えばバイオリアクター)も提供する。このような系は一般に、臓器または組織にカニューレを挿入するための少なくとも1つのカニューレ挿入装置、臓器または組織をカニューレを介して灌流するための灌流装置、および臓器または組織を無菌環境に維持するための手段(例えば封じ込め系(containment system))を含む。カニューレ挿入および灌流は、当技術分野で周知の手法である。カニューレ挿入装置は一般に、臓器もしくは組織の血管、管、および/または腔への導入用の適切なサイズの中空管を含む。典型的には、臓器には1か所もしくは複数の血管、管、および/または腔にカニューレが挿入される。灌流装置は、液体(例えば細胞破壊媒体)の保持用容器、および液体を1か所もしくは複数のカニューレを介して臓器内で動かすための機構(例えばポンプ、空気圧、重力)を含む場合がある。脱細胞化および/または再細胞化中における臓器もしくは組織の無菌性は、気流の制御および濾過、および/または例えば、望ましくない微生物の増殖を防ぐための抗生物質、抗真菌剤、または他の抗微生物剤による灌流などの、当技術分野で既知のさまざまな手法を用いて維持することが可能である。
【0040】
本明細書に記載された、臓器または組織を脱細胞化および再細胞化するための系は、特定の灌流特性(例えば圧力、容量、流れのパターン、温度、気体、pH)、機械的な力(例えば心室壁の運動および応力)、ならびに電気刺激(例えばぺーシング)をモニタリングする能力を有する場合がある。冠血管床は、脱細胞化および再細胞化の過程で変化するので(例えば血管の耐性、容積)、圧力制御型の灌流装置が、大きな変動を避けるために有用である。灌流の有効性は、流出物および組織切片において評価することができる。灌流容量、流れのパターン、温度、O2分圧およびCO2分圧、ならびにpHは、標準的な方法でモニタリングすることができる。
【0041】
センサーを使用して、系(例えばバイオリアクター)、および/または臓器もしくは組織をモニタリングすることができる。ソノマイクロメトリー(sonomicrometry)、マイクロマノメトリー(micromanometry)、および/またはコンダクタンス測定によって、心筋壁の運動および能力に対する、圧力-容積、もしくは前負荷動員一回仕事量に関する情報を得ることができる。例えば、センサーを使用して、カニューレが挿入された臓器もしくは組織中を移動する液体の圧力;系内の周囲温度、および/または臓器もしくは組織の温度;カニューレが挿入された臓器もしくは組織中を動く液体のpHおよび/または流速;ならびに/または再細胞化中の臓器もしくは組織の生物学的活性をモニタリングすることができる。このような特性をモニタリングするためのセンサーを有することに加えて、臓器もしくは組織を脱細胞化および/または再細胞化する系には、このような特性を維持または調整する手段を含めることもできる。このような特性を維持または調整する手段は、温度計、サーモスタット、電極、圧力センサー、オーバーフローバルブ、液体の流速を変化させるためのバルブ、溶液のpHを変化させるために使用される液体への流体接続の開閉用バルブ、バルーン、体外式ペースメーカー、および/またはコンプライアンスチャンバーなどの構成要素を含む場合がある。安定した状態(例えば温度)を確実なものとすることを助けるために、チャンバー、リザーバー、およびチューブ類に水ジャケットを取り付けることができる。
【0042】
再細胞化中に臓器またはこれに付着する細胞に機械的負荷を加えることが有用な場合がある。一例として、左心房経由で左心室中に挿入されたバルーンを、心臓に機械的応力を加えるために使用することができる。容積および速度の調整を可能とするピストンポンプをバルーンに接続することで、左室壁の運動および応力をシミュレートすることができる。壁の運動および応力をモニタリングするためには、左室壁の運動および圧力をマイクロマノメトリーおよび/またはソノマイクロメトリーを用いて測定することができる。いくつかの態様では、体外式ペースメーカーをピストンポンプに接続して、心室のバルーンの各収縮と同期した刺激(収縮期と等しい)を提供することができる。末梢ECGを心臓表面から記録することで、ぺーシング電圧の調整、脱分極および再分極のモニタリングが可能となり、ならびに再細胞化しているまたは再細胞化された心臓の単純化された表面マップが提供される。
【0043】
機械的な心室の拡張は、蠕動ポンプを左心房経由で左心室に挿入されたカニューレに接続することでも達成可能である。バルーンを伴う上記の手順と同様に、カニューレを介した周期的な流体の運動(例えば脈動流)によって達成される心室の拡張を電気刺激によって同期させることができる。
【0044】
本明細書に開示された方法および材料を使用して、哺乳類の心臓を脱細胞化および再細胞化することが可能であり、ならびに適切な条件で維持することで、収縮機能を起こし、かつぺーシング刺激および/または薬物に反応する機能性心臓を作製することができる。この再細胞化された機能性の心臓を哺乳類に移植して、一定の期間、機能させることができる。
【0045】
図2は、臓器もしくは組織を脱細胞化および/または再細胞化するための系(例えばバイオリアクター)の1つの態様を示す。示された態様は、心臓を脱細胞化および再細胞化するためのバイオリアクターである。この態様は、速度および容積を調節可能な蠕動ポンプ(A);心室内のバルーンに接続された速度および容積を調節可能なピストンポンプ(B);電圧、周波数、および振幅を調整可能な外部ペースメーカー(C);ECG記録装置(D);「動脈経路」内の圧力(冠動脈圧に相当)センサー(E);「静脈」経路内の圧力(冠静脈洞圧に等しい)センサー(F);ならびにペースメーカーとピストンポンプとの間の同期(G)を有する。
【0046】
臓器または組織を作製するための系は、プログラム可能なプロセッサーと組み合わされた、コンピュータで読み取り可能な保存媒体によって制御することができる(例えば本明細書で使用される、コンピュータで読み取り可能な保存媒体は、プログラム可能なプロセッサーを特定の段階を実施するように稼働させるために、それ上に保存された指示を有する)。例えば、プログラム可能なプロセッサーを組み合わせた、このような保存媒体は、情報を1つもしくは複数のセンサーから受け取って処理することができる。プログラム可能なプロセッサーと併用される、このような保存媒体は、バイオリアクターおよび/または臓器もしくは組織に戻る情報および指示の伝達も可能である。
【0047】
再細胞化を起こす臓器または組織を、生物学的活性に関してモニタリングすることができる。生物学的活性は、臓器もしくは組織の電気的活性、機械的活性、機械的圧力、収縮性、および/または壁応力などの、臓器もしくは組織そのものの活性の場合がある。加えて、臓器または組織に付着した細胞の生物学的活性を、例えば、イオン輸送/交換の活性、細胞分裂、および/または細胞の生存度に関してモニタリングすることができる。これについては例えば、Laboratory Textbook of Anatomy and Physiology (2001, Wood, Prentice Hall)、およびCurrent Protocols in Cell Biology (2001, Bonifacino et al., Eds, John Wiley & Sons)を参照されたい。上述したように、再細胞化中に臓器に加わる能動負荷をシミュレートすることが有用な場合がある。本発明のコンピュータで読み取り可能な保存媒体は、プログラム可能なプロセッサーと組み合わせることで、臓器または組織に加わる能動負荷のモニタリングおよび維持に必要な構成要素に同調させるために使用することができる。
【0048】
1つの態様では、臓器または組織の重量を、プログラム可能なプロセッサーと組み合わせることでその特定の臓器または組織に関する曝露時間および灌流圧を計算可能な、本明細書に記載されたコンピュータで読み取り可能な保存媒体に入力することができる。このような保存媒体は、前負荷および後負荷(それぞれ灌流の前もしくは後における圧力)、ならびに流速を記録することができる。この態様では例えば、プログラム可能なプロセッサーと組み合わせた、コンピュータで読み取り可能な保存媒体は、灌流圧、灌流方向、および/または灌流液のタイプを、1つもしくは複数のポンプおよび/またはバルブによる制御を介して調節することができる。
【0049】
本発明では、当技術分野に含まれる従来の分子生物学、微生物学、生化学、および細胞生物学の手法を使用することができる。こうした手法は文献に詳細に説明されている。本発明をさらに、特許請求の範囲に記載された本発明の範囲を制限しない以下の実施例によって説明する。
【実施例】
【0050】
実施例
セクションA.脱細胞化(パートI)
実施例1−脱細胞化用の固形臓器の調製
死後の血栓形成を避けるため、ドナーラットを、400 Uのヘパリン/ドナー体重(kg)で全身ヘパリン化した。ヘパリン化に続いて、心臓および隣接する大血管を慎重に摘出した。
【0051】
ヘパリン(2000 U/ml)を含む生理食塩液(0.9%)中に前記心臓を置き、さらなる処理を行うまで5℃で維持した。無菌条件下で心臓および大血管から結合組織を除去した。下大静脈および左右の肺静脈を左右の心房の遠位から、Monofil社製の非吸収性の結紮糸を用いて結紮した。
【0052】
実施例2−カニューレの挿入および固形臓器の灌流
心臓を、灌流するために脱細胞化装置上にマウントした(図1)。胸部下行動脈(descending thoracic artery)にカニューレを挿入し、逆行性の冠灌流を可能とした(図1、カニューレA)。胸動脈の分枝(例えば腕頭動脈、左総頸動脈、左鎖骨下動脈)を結紮した。肺動脈にカニューレを、その分枝が左右の肺動脈に入るまで挿入した(図1、カニューレB)。上大静脈にカニューレを挿入した(図1、カニューレC)。この配置により、逆行性と順行性の両方の冠灌流が可能となる。
【0053】
大動脈カニューレ(A)に陽圧が加わると、灌流が、冠動脈から毛細血管床を介して冠静脈系を通り、右心房および上大静脈へと生じた(C)。上大静脈カニューレ(C)に陽圧が加わると、灌流が、右心房、冠静脈洞、および冠静脈から、毛細血管床を介して冠動脈および大動脈カニューレ(A)へと生じた。
【0054】
実施例3−脱細胞化
心臓を脱細胞化装置にマウントした後に、定常的な冠血流を再び確立するために、灌流液1 Lあたり1〜5 mmolのアデノシンを含む、カルシウム非含有の冷たいヘパリン化リン酸緩衝液によって順行性の灌流を開始した。冠灌流圧および流量を測定し、ならびに冠血管抵抗(coronary resistance)を計算することで冠血流を評価した。安定した冠血流を15分間流した後に、界面活性剤をベースとした脱細胞化処理を開始した。
【0055】
手順の詳細は以下に記載するが、簡単に説明すると、心臓を界面活性剤で順行的に灌流した。灌流後に、該心臓を緩衝液(例えばPBS)で逆行的に洗い流すことができる。次に該心臓を、抗生物質を含むPBSで、および続いてDNase Iを含むPBSで灌流した。次に該心臓を、微生物の混入を抑えるために、および後の微生物の混入を防ぐために1%塩化ベンザルコニウムで灌流し、ならびに続いてPBSで灌流して、臓器から任意の残存性の細胞成分、酵素、または界面活性剤を洗い流した。
【0056】
実施例4−ラットの死体の心臓の脱細胞化
雄のヌードラット(250〜300 g)8匹から心臓を摘出した。切開直後に大動脈弓にカニューレを挿入し、該心臓を所定の界面活性剤で逆行的に灌流した。4種類の異なる界面活性剤をベースとした脱細胞化プロトコル(後述)を、(a)細胞成分の除去、ならびに(b)血管構造の保存の可能性および有効性に関して比較した。
【0057】
脱細胞化は一般に、以下の段階を含むようにした:固形臓器の安定化、固形臓器の脱細胞化、固形臓器の再生および/または中和、固形臓器の洗浄、臓器表面に残存する任意のDNAの分解、臓器の殺菌、ならびに臓器の恒常性維持。
【0058】
(A)脱細胞化プロトコル#1(PEG)
心臓を、100 U/mlのペニシリン、0.1 mg/mlのストレプトマイシン、および0.25μg/mlのアムホテリシンBを含む200 mlのPBSで、再循環せずに洗浄した。次に該心臓を、35 mlのポリエチレングリコール(PEG;1 g/ml)で最長30分間、手動で再循環しながら脱細胞化した。次にこの臓器を500 mlのPBSで最長24時間、再循環用ポンプを使用して洗浄した。洗浄段階を少なくとも2回(各回少なくとも24時間)繰り返した。該心臓を35 mlのDNase I(70 U/ml)に少なくとも1時間、手動で再循環しながら曝露した。この臓器を再度、500 mlのPBSで少なくとも24時間にわたって洗浄した。
【0059】
(B)脱細胞化プロトコル#2(Triton Xおよびトリプシン)
心臓を、100 U/mlのペニシリン、0.1 mg/mlのストレプトマイシン、および0.25μg/mlのアムホテリシンBを含む200 mlのPBSで少なくとも約20分間、再循環せずに洗浄した。次に該心臓を、0.05%トリプシンで30分間かけて脱細胞化した後に、5% Triton-Xおよび0.1%水酸化アンモニウムを含む500 mlのPBSで約6時間かけて灌流した。該心臓を脱イオン水で約1時間にわたって灌流した後に、PBSで12時間にわたって灌流した。次に該心臓を3回(各24時間)、再循環用ポンプを使用して500 mlのPBSで洗浄した。該心臓を35 mlのDNase I(70 U/ml)で1時間かけて手動で再循環しながら灌流し、さらに500 mlのPBSで2回(各回少なくとも約24時間)、再循環用ポンプを使用して洗浄した。
【0060】
(C)脱細胞化プロトコル#3(1% SDS)
心臓を、100 U/mlのペニシリン、0.1 mg/mlのストレプトマイシン、および0.25μg/mlのアムホテリシンBを含む200 mlのPBSで少なくとも約20分間、再循環せずに洗浄した。該心臓を、再循環用ポンプを使用して、1% SDSを含む500 mlの水で少なくとも約6時間かけて脱細胞化した。次に該心臓を脱イオン水で約1時間洗浄し、およびPBSで約12時間洗浄した。該心臓を500 mlのPBSで3回(各回少なくとも約24時間)、再循環用ポンプを使用して洗浄した。次に該心臓を35 mlのDNase I(70 U/ml)で約1時間、手動で再循環しながら灌流し、および500 mlのPBSで3回(各回少なくとも約24時間)、再循環用ポンプを使用して洗浄した。
【0061】
(D)脱細胞化プロトコル#4(Triton X)
心臓を、100 U/mlのペニシリン、0.1 mg/mlのストレプトマイシン、および0.25μg/mlのアムホテリシンBを含む200 mlのPBSで少なくとも約20分間、再循環せずに洗浄した。次に該心臓を、再循環用ポンプを使用して、5% Triton Xおよび0.1%水酸化アンモニウムを含む500 mlの水で少なくとも6時間かけて脱細胞化した。次に該心臓を脱イオン水で約1時間、続いてPBSで約12時間にわたって灌流した。該心臓を500 mlのPBSで3回(各回少なくとも24時間)、再循環用ポンプを使用して灌流することで洗浄した。次に該心臓を35 mlのDNase I(70 U/ml)で約1時間、手動で再循環しながら灌流し、および500 mlのPBSで3回(各回約24時間)、洗浄した。
【0062】
最初の実験では、脱細胞化装置を層流フード内に据えた。心臓を60 cm H2Oの冠灌流圧で灌流した。必須ではないものの、上記の実験で記載された心臓を脱細胞化用チャンバー内にマウントし、抗生物質を含むPBSに完全に浸して再循環モードで72時間にわたって5 ml/分の連続流で灌流し、細胞成分および界面活性剤を可能な限り洗い流した。
【0063】
脱細胞化の成功は、組織切片中における筋フィラメントおよび核の不在と定義した。血管構造の保存の成功は、2%エバンスブルーによる灌流と、これに続く組織切片の包埋によって評価した。
【0064】
極めて効率のよい脱細胞化は、最初に心臓を、脱イオン水に溶解したイオン性界面活性剤(1%ドデシル硫酸ナトリウム(SDS)、約0.03 M)で順行的に定常冠灌流圧で灌流し、続いて非イオン性界面活性剤(1% Triton X-100)で順行的に灌流してSDSを除去し、およびおそらく、細胞外マトリックス(ECM)タンパク質が再生することで生じた。心臓を間欠的にリン酸緩衝液で逆行的に灌流することで、閉塞した毛細血管および小血管を通した。
【0065】
実施例5−脱細胞化された臓器の評価
脱細胞化後に血管構造が損なわれていないことを証明すべく、血管基底膜を染色して大血管および微小血管の密度を定量するために、脱細胞化された心臓をランゲンドルフ灌流を介してエバンスブルーによって染色する。さらに、ポリスチレン粒子を心臓中に、および心臓を通って灌流することで、血管漏出のレベルを示す冠動脈容積(coronary volume)を定量することが可能であり、かつ冠動脈流出液(coronary effluent)および組織切片を解析することで灌流の分布を評価できる。以下の3つの基準の組み合わせを評価し、摘出された脱細胞化されていない心臓を比較する:(1)ポリスチレン粒子の均一な分布、(2)あるレベルにおける漏出の有意な変化、(3)微小血管密度。
【0066】
繊維の方向を、一軸または二軸の応力が加わる試料にリアルタイムで応用可能な、Tower et al. (2002, Fiber alignment imaging during mechanical testing of soft tissues, Ann Biomed Eng., 30(10):1221-33)の偏光顕微鏡法によって評価する。ランゲンドルフ灌流中に、脱細胞化されたECMの基本的な機械的特性(コンプライアンス、弾性、破裂圧)を記録し、および摘出直後の心臓と比較する。
【0067】
セクションB.脱細胞化(パートII)
実施例1−ラット心臓の脱細胞化
12週齢の雄のF344フィッシャーラット(Harlan Labs, PO Box 29176 Indianapolis, IN 46229)に、100 mg/kgのケタミン(Phoenix Pharmaceutical, Inc., St. Joseph, MO)、および10 mg/kgのキシラジン(Phoenix Pharmaceutical, Inc., St. Joseph, MO)を腹腔内注射して麻酔した。左大腿静脈を介した全身ヘパリン化(American Pharmaceutical Partners, Inc., Schaumberg, IL)後に胸骨正中切開術を行って心膜を開いた。胸骨後方の脂肪体を除去し、上行性胸部大動脈を切開して、その分枝を結紮した。大静脈および肺静脈、肺動脈および胸部大動脈を切断し、胸部から心臓を摘出した。充填済みの1.8 mmの大動脈カニューレ(Radnoti Glass, Monrovia, CA)を上行大動脈に挿入することで、逆行性の冠灌流(ランゲンドルフ)を可能とした。心臓を、10μMのアデノシンを含むヘパリン化PBS(HyClone, Logan, UT)による75 cm H2Oの冠灌流圧における15分間の灌流後に、1%ドデシル硫酸ナトリウム(SDS)または1%ポリエチレングリコール1000(PEG 1000)(EMD Biosciences, La Jolla, Germany)、または脱イオン水を溶媒とする1% Triton-X 100(Sigma, St. Louis, MO)で2〜15時間かけて灌流した。続いて、脱イオン水による15分間の灌流、および脱イオン水を溶媒とする1% Triton-X (Sigma, St. Louis, MO)による30分間の灌流を行った。次に心臓を、抗生物質を含むPBS(100 U/mlのペニシリン-G(Gibco, Carlsbad, CA)、100 U/mlのストレプトマイシン(Gibco, Carlsbad, CA)、および0.25μg/mlのアムホテリシンB(Sigma, St. Louis, MO))で124時間かけて連続的に灌流した。
【0068】
1% PEG、1% Triton-X 100、または1% SDSのいずれかによる逆行性の灌流の420分後に、PEGおよびTriton-X 100による灌流は、浮腫状の不透明な外観を誘導したが、SDSによる灌流は、より劇的な変化を生じ、不透明な要素を穏やかに洗い流すことで、ほぼ半透明の移植片が得られた。3つ全てのプロトコルが行われた心臓は、肉眼的にはインタクトであり、(77.4 mmHgの定常冠灌流圧における)灌流プロトコル中に、冠動脈の破損または大動脈弁不全の証拠は認められなかった。冠血流は、全3通りのプロトコルにおいて、灌流の最初の60分間は低下し、後にSDSによる灌流中に正常に戻ったが、Triton-X 100およびPEGによる灌流では上昇したままであった。SDSによる灌流は、計算された冠血管抵抗(最大250 mmHg.s.ml-1)の最高の初期上昇を誘導し、Triton-XおよびPEGによる灌流では、それぞれ最大200 mmHg.s.ml-1および最大150 mmHg.s.ml-1であった。
【0069】
界面活性剤で灌流した心組織の組織切片を使用したところ、観察時間中における脱細胞化は、PEGとTriton-X 100で処理した心臓の両方において不完全なことが判明し;ヘマトキシリン・エオジン(H&E)染色により、核および横紋のある繊維の存在が明らかとなった。これとは対照的に、核または収縮性のフィラメントはSDS灌流心臓の切片中に検出されなかった。しかしながら、血管構造およびECM繊維の方向は、SDSで処理した心臓では保存されていた。
【0070】
初期の脱細胞化後にECMからイオン性のSDSを除去するために、臓器をTriton-X 100で30分間かけて灌流した。加えて、全ての界面活性剤を完全に洗い流すために、および生理学的pHを再び確立するために、脱細胞化された臓器を、脱イオン水およびPBSで124時間にわたって十分に灌流した。
【0071】
実施例2−ラット腎臓の脱細胞化
腎臓の摘出に際しては、全ての腹膜内容物を湿らせたガーゼで包み、後腹膜腔が露出するように慎重に側方に動かした。腸間膜血管を結紮して切断した。腹部大動脈を結紮し、腎動脈の起始部(take off)の下部で切断した。胸部大動脈を横隔膜のすぐ上で切断し、1.8 mmの大動脈カニューレ(Radnoti Glass, Monrovia, CA)を使用してカニューレを挿入した。後腹膜から腎臓を慎重に摘出し、腎動脈に加わる張力を最小限に抑えるために無菌のPBS(HyClone, Logan, UT)に浸した。ヘパリン化PBSによる15分間の灌流後に、脱イオン水を溶媒とする1% SDS(Invitrogen, Carlsbad, CA)による2〜16時間の灌流、および脱イオン水を溶媒とする1% Triton-X(Sigma, St. Louis, MO)による30分間の灌流を行った。次に肝臓を、抗生物質を含むPBS(100 U/mlのペニシリン-G(Gibco, Carlsbad, CA)、100 U/mlのストレプトマイシン(Gibco, Carlsbad, CA)、0.25μg/mlのアムホテリシンB(Sigma, St. Louis, MO))で124時間にわたって連続的に灌流した。
【0072】
SDSによる420分間の灌流と、これに続くTriton-X 100による灌流によって、腎ECMの足場が、血管系および臓器の構造は損なわれずに完全に脱細胞化された。エバンスブルーによる灌流によって、血管系が、脱細胞化された心臓ECMと同様にインタクトであることが確認された。脱細胞化された腎皮質をモバット・ペンタクローム(Movat pentachrome)によって染色した結果、インタクトな細胞または核は存在せず、糸球体ならびに近位および遠位の曲尿細管の基底膜はインタクトであることが判明した。脱細胞化された腎髄質の染色の結果、尿細管および集合管の基底膜がインタクトであることが判明した。脱細胞化された腎皮質のSEMでは、糸球体および尿細管の基底膜がインタクトであることが確認された。糸球体内における周囲の近位および遠位の尿細管と糸球体の毛細血管基底膜との間に糸球体の輪郭を形成するボーマン嚢などの特徴的な構造は保たれていた。脱細胞化された腎髄質のSEM画像から、腎盂内に至る髄質の錐体は損なわれておらず、腎乳頭に至る集合管の基底膜はインタクトであることが判明した。したがって、腎臓の主要な超微細構造の全ては、脱細胞化後にインタクトであった。
【0073】
実施例3−ラット肺の脱細胞化
肺(気管を含む)を胸部から慎重に摘出し、肺動脈に加わる張力を最低限に抑えるために、滅菌済みのPBS(HyClone, Logan, UT)に浸した。ヘパリン化PBSによる15分間の灌流後に、脱イオン水を溶媒とする1% SDS(Invitrogen, Carlsbad, CA)による2〜12時間の灌流、および脱イオン水を溶媒とする1% Triton-X(Sigma, St. Louis, MO)による15分間の灌流を行った。次に肺を、抗生物質を含むPBS(100 U/mlのペニシリン-G(Gibco, Carlsbad, CA)、100 U/mlのストレプトマイシン(Gibco, Carlsbad, CA)、0.25μg/mlのアムホテリシンB(Sigma, St. Louis, MO))で124時間にわたって連続的に灌流した。
【0074】
SDSによる180分間の灌流と、これに続くTriton-X 100による灌流によって、気道および血管が損なわれていない、完全に脱細胞化された肺のECM足場が得られた。組織切片をモバット・ペンタクロームで染色したところ、コラーゲンやエラスチンなどの主要構造タンパク質を含む肺のECM成分に加えて、プロテオグリカンなどの可溶性成分の存在も確認された。しかしながら、核またはインタクトな細胞は保持されていなかった。気道は、主要分枝から終末細気管支〜呼吸細気管支、肺胞管および肺胞に至るまで保存されていた。毛細血管レベルに下降する肺動脈、および肺静脈に由来する血管床はインタクトなままであった。脱細胞化された肺のSEM顕微鏡写真から、気管支、肺胞、および血管基底膜が保存されており、細胞が保持された証拠はないことがわかった。肺胞間中隔ならびに中隔基底膜に主要な構造支持体を提供する弾性繊維および細網繊維の網目構造は、肺間質内の毛細血管の密な網を含めてインタクトであった。
【0075】
脱細胞化された気管のSEM顕微鏡写真から、ECM構造が、脱細胞化された硝子軟骨輪、および気道上皮を含まない粗い管腔基底膜を伴い、インタクトであることが判明した。
【0076】
実施例4−ラット肝臓の脱細胞化
肝臓の摘出に関しては、大静脈を腹部正中切開によって露出させ、切開し、マウスの大動脈カニューレ(Radnoti Glass, Monrovia, CA)を使用してカニューレを挿入した。肝動脈および肝静脈、ならびに胆管を切断し、ならびに肝臓を腹部から慎重に摘出し、および門脈に加わる張力を最小限とするために無菌PBS(HyClone, Logan, UT)に浸した。ヘパリン化PBSによる15分間の灌流に続いて、脱イオン水を溶媒とする1% SDS(Invitrogen, Carlsbad, CA)による2〜12時間の灌流、および脱イオン水を溶媒とする1% Triton-X(Sigma, St. Louis, MO)による15分間の灌流を行った。次に肝臓を、抗生物質を含むPBS(100 U/mlのペニシリン-G(Gibco, Carlsbad, CA)、100 U/mlのストレプトマイシン(Gibco, Carlsbad, CA)、0.25μg/mlのアムホテリシンB(Sigma, St. Louis, MO))で124時間、連続的に灌流した。
【0077】
SDSによる120分間の灌流と、これに続くにTriton-X 100よる灌流は、完全に脱細胞化された肝臓を生じるのに十分であった。脱細胞化された肝臓をモバット・ペンタクローム染色することによって、中心静脈、ならびに肝動脈、胆管、および門脈を含む門脈空間(portal space)を伴う特徴的な肝臓構造の保持が確認された。
【0078】
実施例5−脱細胞化臓器の評価に使用される方法および材料
組織学および免疫蛍光法
パラフィン包埋された脱細胞化組織を対象に、製造業者(American Mastertech Scientific, Lodi, CA)の指示書通りにモバット・ペンタクローム染色を行った。簡単に説明すると、脱パラフィン化済みのスライドを、Verhoeffの弾性染色液で染色し、洗浄し、2%塩化第二鉄で区別し、洗浄し、5%チオ硫酸ナトリウム中に配置し、洗浄し、3%氷酢酸でブロックし、1%アルシアンブルー溶液で染色し、洗浄し、クロセインスカーレット−酸性フクシンで染色し、洗浄し、1%氷酢酸に浸し、5%リンタングステン酸で脱染し、1%氷酢酸に浸し、脱水し、アルコール性サフラン溶液に浸し、脱水し、マウントし、さらにカバーで覆った。
【0079】
脱細胞化組織を対象に免疫蛍光染色を行った。凍結切片(脱細胞化組織)ではなく、パラフィン包埋組織(再細胞化組織)を対象に、以下の手順で抗原賦活化を行った:パラフィン切片を脱ろうし、連続的なアルコール勾配に従ってキシレンを2回(各5分間)交換して再水和し、さらに冷水道流水で洗浄した。次にスライドを抗原賦活化溶液(2.94 gのクエン酸三ナトリウム、22 mlの0.2 M塩酸溶液、978 mlの超純水、およびpH 6.0に調整)中に配置し、30分間煮沸した。水道水の流水による10分間の洗浄後に免疫染色を開始した。凍結切片を1X PBS(Mediatech, Herndon, VA)を溶媒とする4%パラホルムアルデヒド(Electron Microscopy Sciences, Hatfield, PA)で室温で15分間かけて固定した後に染色した。スライドを、1X PBSを溶媒とする4%ウシ胎児血清(FBS; HyClone, Logan, UT)で、室温で30分間かけてブロックした。試料を室温で1時間、希釈した一次抗体(Ab)および二次抗体と連続的にインキュベートした。各段階間に、スライドを1X PBSで3回(各5〜10間)洗浄した。コラーゲンI(ヤギポリクローナルIgG(Cat. No. sc-8788), Santa Cruz Biotechnology Inc., Santa Cruz, CA)、コラーゲンIII(ヤギポリクローナルIgG(Cat. No. sc-2405), Santa Cruz Biotechnology Inc., Santa Cruz, CA)、フィブロネクチン(ヤギポリクローナルIgG(Cat. No. sc-6953), Santa Cruz Biotechnology Inc., Santa Cruz, CA)、およびラミニン(ウサギポリクローナルIgG(Cat. No. sc-20142), Santa Cruz Biotechnology Inc., Santa Cruz, CA)に対する一次Abをブロッキング緩衝液との1:40の希釈率で使用した。二次抗体のウシ抗ヤギIgGフィコエリシン(phycoerythin)(Cat. No. sc-3747, Santa Cruz Biotechnology Inc., Santa Cruz, CA)、およびウシ抗ウサギIgGフィコエリシン(Cat. No. sc-3750, Santa Cruz Biotechnology Inc., Santa Cruz, CA)をブロッキング緩衝液との1:80の希釈率で使用した。スライドを、4',6-ジアミジノ-2-フェニルインドール(DAPI)(Vectashield、Vector Laboratories, Inc., Burlingame, CA)を含む硬化マウント用(hardening mounting)溶媒中でカバーガラス(Fisherbrand 22 x 60, Pittsburgh, PA)で覆った。画像を、Nikon Eclipse TE200倒立顕微鏡(Fryer Co. Inc., Huntley, IL)に接続したImagePro Plus 4.5.1(Mediacybernetics, Silver Spring, MD)を使用して、ImagePro Plus 4.5.1(Mediacybernetics, Silver Spring, MD)を使用して記録した。
【0080】
走査型電子顕微鏡による観察
正常組織および脱細胞化組織を灌流し、0.1 Mカコジル酸緩衝液(Electron Microscopy Sciences, Hatfield, PA)を溶媒とする2.5%グルタルアルデヒド(Electron Microscopy Sciences, Hatfield, PA)で15分間かけて固定した。次に組織を0.1 Mカコジル酸緩衝液で2回、15分間かけて洗浄した。固定後の処理を、1%四酸化オスミウム(Electron Microscopy Sciences, Hatfield, PA)を使用して60分間かけて行った。次に組織試料を、EtOH濃度を上昇させながら(50%で10分間、70%で10分間を2回、80%で10分間、95%で10分間を2回、100%で10分間を2回)、脱水した。次に組織試料を対象に、Tousimis Samdri-780A(Tousimis, Rockville, MD)で臨界点乾燥を行った。Denton DV-502A真空蒸着装置(Denton Vacuum, Moorestown, NJ)内で30秒間の金/パラジウムのスパッターコーティングによってコーティングを行った。走査型電子顕微鏡の画像を、Hitachi S4700電界放射型走査型電子顕微鏡(Hitachi High Technologies America, Pleasanton, CA)を使用して得た。
【0081】
機械的試験
ラットの左心室から心筋組織の断面を、中心領域が約5 mm x 5 mmとなるように、かつ断面の軸が心臓の外周方向および長軸方向に配置されるように切り出した。組織断面の初期厚をマイクロメーターで測定したところ、組織断面の中心部で3.59±0.14 mmであった。断面を、脱細胞化されたラット左心室組織からも、同じ方向で、かつ同じ中心領域のサイズとなるように切り出した。脱細胞化された試料の初期厚は238.5±38.9μmであった。加えて、フィブリンゲルの機械的特性を試験し、別の組織工学用足場を、血管組織および心臓組織の作製に使用した。フィブリンゲルを十字型の鋳型に最終濃度が6.6 mgのフィブリン/mlとなるように流し込んだ。フィブリンゲルの平均的な厚みは165.2±67.3μmであった。全ての試料を、2軸性の機械的試験装置(mechanical testing machine)(Instron Corporation, Norwood, MA)に鉗子を介して固定し、PBSに浸し、さらに40%のひずみに等二軸的(equibiaxially)に伸ばした。静的で受動的な機械的特性を正確に探すために、試料を4%のひずみの増分で伸ばし、各ひずみ値で少なくとも60秒間、弛緩するようにした。力の値を特定の軸方向(5 mm x初期厚)の断面積によって規格化することで、力を工学的応力に変換した。工学的応力を、初期の長さによって規格化される変位として計算した。2つの軸間のデータ、ならびに試料群間のデータを比較するために、接線係数を以下の式によって計算した:
[T(ε=ひずみ40%)-T(ε=ひずみ36%)]/ひずみ4%
上式で、Tは工学的応力であり、εは工学的ひずみである。接線係数の値の平均をとり、2つの軸(外周方向および長軸方向)間で、ならびに群間で比較した。
【0082】
実施例6−脱細胞化臓器の生体適合性の評価
生体適合性を評価するために、1 ccの標準増殖培地(イスコフ改変ダルベッコ培地(Gibco, Carlsbad, CA)、10%ウシ胎児血清(HyClone, Logan, UT)、100 U/mlペニシリン-G(Gibco, Carlsbad, CA)、100 U/mlストレプトマイシン(Gibco, Carlsbad, CA)、2 mmol/L L-グルタミン(Invitrogen, Carlsbad, CA)、0.1 mmol/L 2-メルカプトエタノール(Gibco, Carlsbad, CA))に懸濁した100,000個のマウス胚性幹細胞(mESC)を、ECM切片上に、および対照プレート上に、特定の成長因子による刺激またはフィーダー細胞による支持を行うことなく播種した。4',6-ジアミジノ-2-フェニルインドール(DAPI)を10μg/mlの濃度で細胞培養用の培地に添加して細胞核を標識することで、細胞の付着および増殖の定量が可能となった。画像をUV光下で、およびベースラインと、その24時間後、48時間後、および72時間における位相差を、Nikon Eclipse TE200倒立顕微鏡(Fryer Co. Inc., Huntley, IL)に接続したImagePro Plus 4.5.1(Mediacybernetics, Silver Spring, MD)を使用して記録した。
【0083】
脱細胞化されたECMは、細胞の生存、付着、および増殖に適合性であった。播種されたmESCはECM足場上に生着し、マトリックスへの浸潤を細胞播種の72時間以内に開始した。
【0084】
実施例7−脱細胞化臓器の評価
SDSによって脱細胞化されたしたラット心臓の冠動脈血管床の大動脈弁の能力および完全性を、2%エバンスブルー色素によるランゲンドルフ灌流で評価した。左心室への色素の充満は観察されず、大動脈弁が損なわれていないことがわかった。巨視的には、冠動脈の最大4番目の分岐点までの充満が、色素の漏れの徴候なしに確認された。組織切片については、大動脈および大静脈(150μm)ならびに小動脈および小静脈(20μm)の灌流が、後のエバンスブルーで染色された血管基底膜の赤色蛍光によって確認された。
【0085】
心臓の主要ECM成分の保持を確認するために、SDSで脱細胞化されたECM足場の免疫蛍光染色を行った。この染色によって、コラーゲンIおよびIII、フィブロネクチン、ならびにラミニンなどの、心臓の主要ECM成分の存在が確認されたが、インタクトな核、または心臓ミオシン重鎖もしくはサルコメアのαアクチンを含む収縮性要素の保持の証拠は認められなかった。
【0086】
SDSによって脱細胞化された心臓ECMの走査型電子顕微鏡(SEM)による観察では、繊維の方向および組成が、組織の厚み全体にわたって、細胞の存在しない大動脈壁および大動脈弁の弁尖で保存されていることが判明した。脱細胞化された左右の心室壁は、ECM繊維の組成物(網(weave)、柱(strut)、コイル)および方向を保持していたが、筋繊維は完全に除去されていた。両心室の保持されたECM内に、内皮細胞または平滑筋細胞のない異なる直径のインタクトな血管基底膜が観察された。さらに、インタクトな心外膜基底層の下部の緻密な心外膜繊維の薄層は保持されていた。
【0087】
脱細胞化された心組織の機械的特性を評価するために、2軸試験を実施して、心臓の組織工学における人工的なECM足場として高頻度で使用されるフィブリンゲルと比較した。正常なラットの心室組織および脱細胞化試料は、応力-ひずみ挙動に関して高度に異方性を示した。逆にフィブリンゲル試料では、応力-ひずみ特性は2つの主要な方向間で極めて類似していた。応力-ひずみ挙動の方向依存性は、正常ラットの心室および脱細胞化群の全試料に見られ、かつ応力-ひずみ特性の等方性は、フィブリンゲル群の全試料について典型的であった。
【0088】
これら2群間における、また心臓の主軸間における応力-ひずみ特性を比較するために、外周方向と長軸方向の両方について、ひずみ率40%における接線係数を計算した(方程式については実施例5を参照)。いずれの方向についても、脱細胞化試料群は、正常ラットの心室およびフィブリンゲルの試料群より有意に高い係数を示したことに注目されたい。しかしながら、正常ラットの心室と脱細胞化マトリックスの両方に関しては、2方向の係数間に有意差があったが、フィブリンゲルに関しては有意差はなかった。
【0089】
インタクトな左心室組織の場合、40%ひずみにおける応力は、長軸方向では5〜14 kPaを、および外周方向では15〜24 kPaを変動し、以前に公開されているデータと矛盾しなかった。ラットの心室組織も、ラットの脱細胞化された心室組織も、外周方向は長軸方向より堅く、これは心臓の筋繊維の方向に起因する可能性が極めて高い。繊維の方向は、心臓組織の厚みを通して変化するが、繊維の大部分は外周方向を向いているために、この方向が堅くなると考えられる。脱細胞化組織は、インタクトな組織より有意に堅かった。これも、細胞外マトリックスが細胞そのものより堅く、かつECMと細胞の組み合わせがECM単独の場合ほど堅くないと考えられることから推定される。脱細胞化組織の接線係数の値は、比較的大きく見えるが、精製エラスチンのヤング係数の値(約600 kPa)よりわずかに大きいだけであり、1本のコラーゲン繊維のヤング係数(5 Mpa)より小さく、よって本明細書で決定された値は妥当な範囲内にある。
【0090】
実施例8−他の臓器または組織の脱細胞化
ラットの心臓、肺、腎臓、および肝臓に加えて、本明細書に記載された灌流脱細胞化プロトコルを、骨格筋、膵臓、小腸および大腸、食道、胃、脾臓、脳、脊髄、および骨格に応用することで同様の結果が得られた。
【0091】
実施例9−ブタ腎臓の脱細胞化
ブタの腎臓を、ヘパリン化した雄の個体から摘出した。摘出臓器の灌流を可能とするために、腎動脈にカニューレを挿入し、15分間PBSで灌流して血液を洗い流した。脱イオン水を溶媒とする27 Lの1% SDSによる灌流を35.5時間かけて50〜100 mmHgの圧力で行った。脱イオン水を溶媒とする1% Triton-Xによる灌流を、ECM足場からSDSを除去するために開始した。次に、脱細胞化された腎臓の洗浄および緩衝を、抗生物質を含むPBSによる120時間の灌流により行って界面活性剤を除去し、生体適合性のあるpHを得た。
【0092】
臓器の清澄化は、灌流開始から2時間以内に観察された。灌流の12時間で、透明な白色が優勢となった。臓器が半透明の白色になった時点で脱細胞化を終了した。
【0093】
実施例10−脱細胞化心臓の移植
F344ラットの心臓を、Ao弁から遠位の大動脈にカニューレを挿入して、他の全ての大血管および肺静脈を結紮することで準備した(ただし、肺動脈幹の左の分枝(二分岐部から遠位)および下大静脈(IVC)は除く)。ランゲンドルフ逆行性冠灌流、および2リットルの1% SDSによる12〜16時間の灌流によって、脱細胞化が達成された。次に心臓を、35 mLの1% Triton-Xで30〜40分間かけて再生後、抗生物質および抗真菌剤を含むPBSで72時間かけて洗浄した。IVCを結紮後に移植を行った。
【0094】
大型(380〜400 g)のRNUラットを、脱細胞化心臓の受入用に準備した。鈍角のモスキート鉗子を、宿主個体のIVCと腹部Aoの両方にあて、吻合領域が確実に摘出されるようにした。脱細胞化心臓の大動脈を、宿主の腹部大動脈に、腎分岐部の近位かつ下部に8-0縫合用絹糸を使用して吻合した。脱細胞化心臓の肺動脈幹の左枝を、肺動脈幹に加わる物理的応力を最小限に抑えるために、宿主のIVCの最も近い領域に吻合した。
【0095】
両血管を宿主個体に縫合後に鉗子を解放し、脱細胞化心臓を宿主個体の血液で満たした。レシピエント個体の腹部大動脈圧が、脱細胞化された心臓および大動脈中について視覚的に観察された。脱細胞化心臓は膨張し、血液によって赤味が生じた。吻合部位で出血はほとんど見られなかった。鉗子の解放(灌流の開始)の3分後にヘパリンを投与し、心臓を撮影して腹部内に配置し、吻合部位に加わる応力を最小限に抑えた。腹部を無菌的に閉鎖して個体の回復をモニタリングした。移植の55時間後に個体を安楽死させ、脱細胞化心臓を外植して観察した。ヘパリンが投与されなかった個体には、切開時および評価時に大きな血栓がLVに見られた。血液は心臓の左右の冠動脈にも観察された。
【0096】
他の移植実験では、両血管を宿主個体に縫合後に鉗子を解放し、脱細胞化心臓を宿主個体の血液で満たした。レシピエント個体の腹部大動脈圧を、脱細胞化された心臓および大動脈について肉眼で観察した。脱細胞化心臓は膨張して赤味を示し、出血は吻合部位でほとんど見られなかった。鉗子の解放(灌流の開始)の3分後にヘパリンをIP注射で投与した(3000 IU)。心臓を撮影し、吻合部位に加わる応力を最小限に抑えるように腹部内に配置した。腹部を無菌的に閉鎖し、個体の回復をモニタリングした。個体が、移植から約48時間後に出血により死んでいることを確認した。移植時間は現在、55〜70分の範囲にある。
【0097】
セクションC.再細胞化
実施例1−心臓ECM切片の再細胞化
脱細胞化されたECMの生体適合性を評価するために、1つの脱細胞化心臓の1 mm厚の切片を、筋原繊維細胞および内皮細胞株とともに培養した。2 x 105個のラットの骨格筋芽細胞、C2C12マウスの筋芽細胞、ヒトの臍帯内皮細胞(HUVEC)、およびウシの肺内皮細胞(BPEC)を組織切片上に播種し、ならびに標準的な条件で7日間にわたって共培養した。筋原細胞はECMを通して移動し、およびECM内で拡大し、ならびに繊維の当初の方向に並んでいた。これらの筋原細胞には、増殖の増加、およびECM切片の十分に再集団化した大きな部分が見られた。内皮細胞株には、浸潤性の低い増殖パターンが見られ、移植片の表面上に単層を形成していた。これらの条件では、検出可能な抗増殖性作用は認められなかった。
【0098】
実施例2−冠灌流による心臓ECMの再細胞化
冠灌流による脱細胞化された心臓ECMの表面および内部への再生細胞の播種の効率を決定するため、脱細胞化された心臓を臓器チャンバーに移し、酸素付加培養用培地で、細胞培養条件(5% CO2、湿度60%、37℃)で連続的に灌流した。120 x 106個のPKH標識HUVEC(50 mlの内皮細胞成長培地に懸濁)を40 cm H2Oの冠灌流圧で注入した。冠流出液を採取して細胞数をカウントした。次に流出液を再循環させ、再び灌流して最大数の細胞を送り込んだ。再循環を2回繰り返した。3回目の後に、約90 x 106個の細胞が心臓内に保持されていた。心臓を、500 mlの再循環用の酸素付加内皮細胞培養用培地で120時間かけて連続的に灌流した。次に心臓を摘出し、凍結切片用に包埋した。HUVECは、心臓全体で動脈および静脈の残渣に限局していたが、血管外ECMの全体に完全に分散してはいなかった。
【0099】
実施例3−新生ラットの心臓細胞による脱細胞化ラット心臓の再細胞化
新生ラットの心筋細胞の単離および調製
1日目に、1〜3日齢のSPFフィッシャー344の新生仔(Harlan Labs, Indianapolis, IN)8〜10匹に、5%イソフルレン(Abbott Laboratories, North Chicago, IL)を吸入させ、70% EtOHを噴霧して鎮静させ、さらに胸骨切開を無菌的に速やかに行った。心臓を摘出後に直ちに、HBSS;新生仔の心筋細胞単離系に由来する試薬#1(Worthington Biochemical Corporation, Lakewood, NJ)を含む氷上の50 mlコニカルチューブ内に移した。上清を除去し、心臓全体を冷HBSSで1回、激しく攪拌しながら洗浄した。この心臓を、5 mlの冷HBSSを含む100 mmの培養皿に移し、付着組織を除去し、残存する組織を1 mm2未満の小片に刻んだ。さらにHBSSを添加して、総プレート容量を9 mlとし、これに1 mlのトリプシン(試薬#2、Worthingtonキット)を添加して最終濃度を50μg/mlとした。プレートを5℃の冷却器内で一晩、インキュベートした。
【0100】
2日目に、プレートを冷却器から取り出し、無菌フード内で氷上に置いた。組織およびトリプシンを含む緩衝液を、氷上の50 mlコニカルチューブに広口ピペットを使用して移した。トリプシン阻害剤(試薬#3)を1 mlのHBSS(試薬#1)で再構成し、50 mlのコニカルチューブに加えて穏やかに混合した。この組織に、液体の表面上に60〜90秒間空気を通すことで酸素を添加した。次に、この組織を37℃に加温し、および5 mlのリーボビッツ(Leibovitz)L-15で再構成したコラゲナーゼ(300単位/ml)をゆっくりと加えた。この組織を、37℃に加温した振盪浴中に45分間置いた。次に、10 mlのピペットを使用してこの組織を10回滴定して(3 ml/秒)、細胞を遊離させ、次に0.22μmのフィルターで濾過した。この組織をさらに5 mlのL-15培地で洗浄し、2回目の滴定を行い、同じ50 mlのコニカルチューブ中に回収した。次に細胞溶液を室温で20分間インキュベートし、50 xgで5分間、遠心分離して細胞を沈殿させた。上清を穏やかに除去し、細胞を、Neonatal-Cardiomyocyte培地を使用して所望の容積に再懸濁した。
【0101】
培地および溶液
全ての培地を滅菌濾過し、5℃の冷却器内で暗条件で保存した。Worthington単離キットは、推奨培地であるリーボビッツL-15を培養用に含む。この培地は、2日目の組織処理のみに使用した。プレーティング時は、本明細書に記載された交代性のカルシウム含有培地を使用した。
WorthingtonリーボビッツL-15培地:リーボビッツ培地の粉末を、1 Lの細胞培養グレードの水を使用して再生した。リーボビッツL-15培地は、140 mg/mlのCaCl、93.68 mg/mlのMgCl、および97.67 mg/mlのMgSを含む。
新生仔心筋細胞培地:イスコフ改変ダルベッコ培地(Gibco, Cat. No. 12440-053)に、10%ウシ胎児血清(HyClone)、100 U/mlペニシリン-G(Gibco)、100 U/mlストレプトマイシン(Gibco)、2 mmol/L L-グルタミン(Invitrogen)、および0.1 mmol/L 2-メルカプトエタノール(Gibco, Cat. No. 21985-023)を加え、使用前に無菌処理した。必要に応じて、アムホテリシン-Bを添加した(最終濃度0.25μg/ml)。この培地を、1.2 mMのCaCl(Fisher Scientific, Cat. No. C614-500)、および0.8 mMのMgCl(Sigma, Cat. No. M-0250)で強化した。
【0102】
再細胞化のインビトロ培養解析
生体人工心臓の作製の第一歩として、単離されたECMを、新生仔の心臓由来の細胞で再細胞化した。完全に脱細胞化された心臓(本明細書に記載された手順で作製)に、50 x 106個の新たに単離したラット新生仔の心筋細胞、線維芽細胞、内皮細胞、および平滑筋細胞を組み合わせて注入した。次に心組織を切片化し、切片をインビトロで培養して、脱細胞化されたECMの生体適合性、および結果として得られた構築物の心筋環(myocardium ring)形成能力を試験した。
【0103】
結果として生じた環の内部において、わずかな収縮が、24時間後に微視的に認められ、移植された細胞が、脱細胞化ECMに付着して生着可能なことが証明された。微視的には、細胞はECM繊維の方向に沿って配向していた。免疫蛍光染色によって、心臓ミオシン重鎖を発現する心筋細胞の生存および生着が確認された。4日以内に、収縮性の細胞パッチ(cell patch)の塊が脱細胞化マトリックス上に観察され、これは8日目には同期的に収縮する組織環(tissue ring)に進行した。
【0104】
10日目に、これらの環を2本のロッドの間にマウントし、収縮力をさまざまな前負荷条件で測定した。環は、4 Hzの頻度に電気的にペースアップ可能であり、最大0.65 gの前負荷の下で最大3 mNの収縮力を生じた。したがって、この再細胞化のインビトロ組織培養法では、人工ECM構築物を使用して最適化された人工心組織の環によって生じる力と同等に有効な力を生じる収縮性組織が得られた。
【0105】
灌流による脱細胞化心臓の再細胞化
再細胞化された(50 x 106個の単離直後の新生ラットの心筋細胞、線維芽細胞、内皮細胞、および平滑筋細胞)の足場を、前負荷および後負荷(1日目:前負荷4〜12 mmHg、後負荷3〜7 mmHg)、拍動性冠血流(1日目:7 ml/分)、および無菌の心臓組織培養条件(5% CO2、60% H2O、37℃)における電気刺激(2日目:1 Hz)の漸進的な増加による拍動性の左心室の膨満を含む、ラットの心臓生理学を模した、灌流可能なバイオリアクター(n=10)内にマウントした。灌流後の臓器の培養は、1〜4週間維持した。圧力、流量、およびEKGを、培養時間の全体を通じて、15分毎に30秒間記録した。新生期の生体人工心臓の映像を、細胞播種の4日後、6日後、および10日後に記録した。
【0106】
細胞播種から10日後に、左心室圧(LVP)の記録用の左心室への圧力プローブの挿入を含む、より詳細な機能評価を行い、刺激周波数を0.1 Hz〜10 Hzに次第に上昇させながら壁の運動を映像で記録し、さらにフェニレフリン(PE)による薬理学的刺激を行った。再細胞化された心臓は、1回のペースに対して自発的な収縮を伴う収縮性の反応を示し、続いてLVPの対応する上昇を伴うペース収縮を示した。1回のペースの後、心臓は3回の自発的な収縮を示し、次に細動状態へと変換した。刺激による収縮と同様に、自発的な脱分極は、LVPの対応する上昇と、安定的な伝導パタ−ンの発生の形成をおそらく示す記録可能なQRS波とを生じた。
【0107】
刺激頻度を0.4 Hzに高めると、平均2回の自発的な収縮が各誘導収縮後に生じ;1 Hzまでのぺーシング頻度では1回のみの自発的な収縮が生じ;および5 Hzのぺーシング頻度では、自発的な収縮は生じなかった。最大捕捉率(maximum capture rate)は、成熟心筋の場合の250 msの不応期と一致する5 Hzであった。100μMのPEによる灌流後、通常の自発的な脱分極が1.7 Hzの頻度で生じ、LVPにおける対応する上昇とカップリングしていた。
【0108】
10日目における組織学的解析によって、細胞の分散および生着が、左室壁の層全体(0.5〜1.2 mm)にわたることが明らかとなった。心筋細胞は、心室の繊維の方向に並び、かつ成熟心筋に類似した緻密な器質化した移植片の領域、および発生中の心筋と類似した、それほど稠密でない未成熟の移植片の領域を形成した。心臓ミオシン重鎖の免疫蛍光染色によって、心筋細胞の表現型が確認された。高い毛細血管密度が、新たに発生した心筋の全体にわたって維持されており、毛細血管間の平均距離は約20μmであり、これは成熟ラット心筋について報告された値と同等であった。内皮細胞の表現型は、フォンビルブラント因子(vWF)に関する免疫蛍光染色で確認された。細胞の生存は、移植片の全層を通じて維持されており、冠灌流の全体に酸素および栄養が十分に供給されていることがわかった。
【0109】
その他の態様
本発明を、本発明の詳細な説明と関連して説明したが、以上の説明は説明目的であって、添付の特許請求の範囲によって規定される本発明の範囲を制限する意図はないと理解されたい。他の局面、利点、および改変は、添付の特許請求の範囲に含まれる。
【技術分野】
【0001】
技術分野
本発明は、臓器および組織に関し、より詳細には、臓器および組織を脱細胞化および再細胞化する方法および材料に関する。
【背景技術】
【0002】
背景
生物由来のマトリックスは、組織工学および再生用に開発されている。しかしながら、これまで開発されたマトリックスは一般に、弱いマトリックス構造を有し、かつ/または臓器もしくは組織の有効な再生を可能とする血管床を示さない。本開示は、臓器および組織の脱細胞化および再細胞化の方法について記載する。
【発明の概要】
【0003】
概要
本発明は、臓器または組織を脱細胞化する方法および材料、ならびに脱細胞化された臓器または組織を再細胞化する方法および材料を提供する。
【0004】
1つの局面では本発明は、脱細胞化された哺乳類心臓を提供する。脱細胞化された哺乳類心臓は、外表面を有する心臓の脱細胞化された細胞外マトリックスを含む。脱細胞化された心臓の細胞外マトリックスは、脱細胞化前の細胞外マトリックスの形態を実質的に保持し、かつ細胞外マトリックスの外表面は実質的にインタクトである。
【0005】
代表的な心臓は、齧歯類の心臓、ブタの心臓、ウサギの心臓、ウシの心臓、ヒツジの心臓、またはイヌの心臓を含むが、これらに限定されない。別の代表的な心臓はヒトの心臓である。脱細胞化された心臓は、死体の心臓の場合もある。いくつかの態様では、脱細胞化された心臓は、心臓全体の一部である。例えば、心臓全体の一部は、心臓パッチ(cardiac patch)、大動脈弁、僧帽弁、肺動脈弁、三尖弁、右心房、左心房、右心室、左心室、中隔、冠動脈血管、肺動脈、または肺静脈を含む場合があるが、これらに限定されない。
【0006】
別の局面では、本発明は固形臓器を提供する。本明細書に記載された固形臓器は、上記の脱細胞化された心臓、およびこれに付着する再生細胞の集団を含む。いくつかの態様では、再生細胞は多能性細胞である。いくつかの態様では、再生細胞は、胚性幹細胞、臍帯細胞、成体由来の幹細胞もしくは前駆細胞、骨髄由来細胞、血液由来細胞、間葉系幹細胞(MSC)、骨格筋由来細胞、多能性成体前駆細胞(MAPC)、心臓幹細胞(CSC)、または多能性成体心臓由来幹細胞である。いくつかの態様では、再生細胞は、心臓線維芽細胞、心臓微小血管細胞、または大動脈内皮細胞である。
【0007】
一般に、脱細胞化された心臓に付着する再生細胞の数は、少なくとも約1,000個である。いくつかの態様では、脱細胞化された心臓に付着する再生細胞の数は、約1,000細胞/mg組織(湿重量;すなわち脱細胞化前の重量)〜約10,000,000細胞/mg組織(湿重量)である。いくつかの態様では、再生細胞は、脱細胞化された心臓に対して異種である。さらにいくつかの態様では、固形臓器は患者に移植され、かつ再生細胞は患者に対して自家である。
【0008】
さらに別の局面では、本発明は、固形臓器を作製する方法を提供する。このような方法は一般に、本明細書に記載された脱細胞化された心臓を提供する段階、ならびに脱細胞化された心臓の内部もしくは表面で再生細胞が生着、増殖、および/または分化する条件下で、脱細胞化された心臓に再生細胞の集団を接触させる段階を含む。1つの態様では、再生細胞は、脱細胞化された心臓に注入されるか、または灌流される。
【0009】
さらに別の局面では、本発明は、心臓を脱細胞化する方法を提供する。このような方法は、心臓を提供する段階、1か所もしくは複数の腔、血管、および/または管において心臓にカニューレを挿入して、カニューレが挿入された心臓を作製する段階、ならびにカニューレが挿入された心臓に第1の細胞破壊媒体を1か所もしくは複数のカニューレ挿入を介して灌流する段階を含む。例えば灌流は、カニューレが挿入される各々の腔、血管、および/または管から多方向とすることができる。典型的には、細胞破壊媒体は、SDS、PEG、またはTriton Xなどの、少なくとも1種類の界面活性剤を含む。
【0010】
このような方法は、カニューレが挿入された心臓に第2の細胞破壊媒体を複数のカニューレ挿入を介して灌流する段階も含む。一般に、第1の細胞破壊媒体は、SDSなどの陰イオン性界面活性剤であってよく、第2の細胞破壊媒体は、Triton Xなどのイオン性界面活性剤であってよい。このような方法では、灌流は、心組織1 g(湿重量)あたり約2〜12時間とすることができる。
【0011】
特に明記した部分を除いて、本明細書で使用される全ての技術的および科学的用語は、本発明が属する技術分野の当業者により一般に理解される表現と同じ意味を有する。本明細書に記載された方法および材料と類似または同等の方法および材料を、本発明の実施または試験に使用することができるが、適切な方法および材料について以下に説明する。加えて、材料、方法、および実施例は、説明となるのみであり、制限する意図はない。本明細書で言及された全ての出版物、特許出願、特許、および他の参考文献は、参照により、それらの全体が本明細書に組み入れられる。矛盾が生じた場合は、定義を含む本明細書を優先する。
【0012】
本発明の1つもしくは複数の態様の詳細は、添付の図面および以下の記述に記載されている。本発明の他の特徴、対象、および利点は、図面および詳細な説明から、ならびに特許請求の範囲から明らかになる。
【図面の簡単な説明】
【0013】
複数の図面における同様の参照符号は、同様の構成要素を意味する。
【0014】
【図1】心臓の脱細胞化の初期調製を示す略図。大動脈、肺動脈、および上大静脈にカニューレが挿入されており(それぞれA、B、C)、ならびに下大静脈、腕頭動脈、左総頸動脈、および左鎖骨下動脈が結紮されている。矢印は、順行性および逆行性の灌流方向を示す。
【図2】脱細胞化/再細胞化装置の1つの態様の略図。
【発明を実施するための形態】
【0015】
詳細な説明
固形臓器は一般に、細胞外マトリックス(ECM)、これに埋没した状態の細胞、および血管床の3つの主要な構成要素を有する。本明細書に記載された固形臓器の脱細胞化では、細胞成分の大半または全体が除去されつつ、細胞外マトリックス(ECM)および血管床が実質的に保存される。脱細胞化された固形臓器は後に、再細胞化用の足場として使用することができる。固形臓器の入手先と成り得る哺乳類は、齧歯類、ブタ、ウサギ、ウシ、ヒツジ、イヌ、およびヒトを含むが、これらに限定されない。本明細書に記載された方法に使用される臓器および組織は、死体の臓器および組織の場合がある。
【0016】
本明細書に記載された固形臓器は、心臓、肝臓、肺、骨格筋、脳、膵臓、脾臓、腎臓、子宮、および膀胱を含むが、これらに限定されない。本明細書で用いる固形臓器は、「実質的に閉鎖した」脈管系を有する臓器を意味する。臓器に関する「実質的に閉鎖した」脈管系は、主要血管にカニューレが挿入され、結紮され、または制限される場合において、液体による灌流時に、該液体の大半が固形臓器内に入っており、かつ固形臓器から漏れ出さないことを意味する。「実質的に閉鎖した」脈管系を有するにもかかわらず、上記の固形臓器の多くは、灌流中における臓器全体への液体の導入または移動に有用な「入口」および「出口」の血管を規定する。
【0017】
上記の固形臓器に加えて、例えば関節(例えば、膝、肩、もしくは股関節)、気管、または脊髄の全体もしくは一部などの他のタイプの脈管化した臓器もしくは組織を、本明細書に記載された方法で脱細胞化することができる。さらに、本明細書に記載された方法で、例えば軟骨や角膜などの無血管組織を脱細胞化することもできる。
【0018】
本明細書に記載された脱細胞化された臓器もしくは組織(例えば心臓や肝臓)、またはこれらの任意の一部(例えば、大動脈弁、僧帽弁、肺動脈弁、三尖弁、肺静脈、肺動脈、冠動脈血管、中隔、右心房、左心房、右心室、もしくは左心室)を、再細胞化の実施如何にかかわらず、患者への移植に使用することができる。または、本明細書に記載された再細胞化された臓器もしくは組織を、例えば臓器もしくは組織の分化を進行中の細胞を調べるため、および/または臓器もしくは組織の細胞構造を調べるために使用することができる。
【0019】
臓器または組織の脱細胞化
本発明は、哺乳類の臓器または組織を脱細胞化する方法および材料を提供する。臓器または組織を脱細胞化する最初の段階は、臓器または組織に、可能であればカニューレを挿入することである。臓器もしくは組織の血管、管、および/または腔に、当技術分野で既知の方法および材料を用いてカニューレを挿入することができる。臓器または組織を脱細胞化する次の段階は、カニューレが挿入された臓器または組織に細胞破壊媒体を灌流することである。臓器の灌流は多方向とすることができる(例えば順行性および逆行性)。
【0020】
心臓のランゲンドルフ灌流は、生理学的な灌流として、当技術分野で常用の手法である(4チャンバーワーキングモード灌流(four chamber working mode perfusion)としても知られる)。これについては例えば、Dehnert, The Isolated Perfused Warm-Blooded Heart According to Langendorff, Methods in Experimental Physiology and Pharmacology: Biological Measurement Techniques V. Biomesstechnik-Verlag March GmbH, West Germany, 1988を参照されたい。簡単に説明すると、ランゲンドルフ灌流では、大動脈にカニューレが挿入され、細胞破壊媒体を含むリザーバーに結合される。細胞破壊媒体は、大動脈を下降するように逆方向に定流速で、例えば注入もしくはローラーポンプによって、または定常的な静水圧によって送り込むことができる。いずれの場合も、大動脈弁は強制的に閉鎖され、灌流液は冠動脈口内に向けられ(このため心室全体を灌流する)、これが冠静脈洞を介して右心房中に排出される。ワーキングモードによる灌流の場合、第2のカニューレが左心房に接続され、灌流が逆行から順行に変更可能である。
【0021】
他の臓器または組織を灌流する方法は当技術分野で既知である。例として、以下の参考文献に、肺、肝臓、腎臓、脳、および肢の灌流について記載されている。Van Putte et al., 2002, Ann. Thorac. Surg., 74(3):893-8;den Butter et al., 1995, Transpl. Int., 8:466-71;Firth et al., 1989, Clin. Sci. (Lond.), 77(6):657-61;Mazzetti et al., 2004, Brain Res., 999(1):81-90;Wagner et al., 2003, J. Artif. Organs, 6(3):183-91。
【0022】
1種類もしくは複数の細胞破壊媒体を、臓器または組織の脱細胞化に使用することができる。細胞破壊媒体は一般に、SDS、PEG、またはTriton Xなどの、少なくとも1種類の界面活性剤を含む。細胞破壊媒体には、溶媒が浸透圧的に細胞と適合しないように、水を含めることができる。または細胞破壊媒体は、細胞と浸透圧を合わせるために緩衝液(例えばPBS)を含む場合がある。細胞破壊媒体は、限定されないが、1種類もしくは複数のコラゲナーゼ、1種類もしくは複数のジスパーゼ、1種類もしくは複数のDNase、またはトリプシンなどのプロテアーゼなどの酵素を含む場合もある。場合によっては細胞破壊媒体は、1種類もしくは複数の酵素の阻害剤(例えばプロテアーゼ阻害剤、ヌクレアーゼ阻害剤、および/またはコラゲナーゼ阻害剤)を追加的もしくは代替的に含む場合がある。
【0023】
ある態様では、カニューレが挿入された臓器または組織を、2種類の異なる細胞破壊媒体で連続的に灌流することができる。例えば、第1の細胞破壊媒体には、SDSなどの陰イオン性界面活性剤を含めることが可能であり、および第2の細胞破壊媒体には、Triton Xなどのイオン性界面活性剤を含めることが可能である。少なくとも1種類の細胞破壊媒体による灌流に続いて、カニューレが挿入された臓器または組織を、例えば洗浄液、および/または本明細書に記載されたような1種類もしくは複数の酵素を含む溶液で灌流することができる。
【0024】
灌流方向(例えば順行性および逆行性)を変更することで、臓器または組織の全体の効率的な脱細胞化が容易となる。本明細書に記載された脱細胞化は、本質的に臓器を完全に脱細胞化し、ECMに極めてわずかな損傷しか生じない。臓器または組織は4〜40℃の適切な温度で脱細胞化することができる。臓器または組織のサイズおよび重量、ならびに細胞破壊媒体中の個々の界面活性剤および界面活性剤の濃度に依存して、臓器または組織は一般に、固形臓器または組織1 gあたり約2〜約12時間にわたって細胞破壊媒体で灌流される。洗浄を含めて、臓器を組織1 gあたり最長約12〜約72時間にわたって灌流することができる。灌流は一般に、脈動流、脈拍、および脈動圧を含む生理学的条件に調整される。
【0025】
本明細書に示すように、脱細胞化された臓器または組織は本質的に、血管樹(vascular tree)のECM成分を含む、臓器または組織の全体もしくは大半の領域の細胞外マトリックス(ECM)成分からなる。ECM成分には、基底層などの特定の構造として器質化された状態で残る場合のある、以下の一部または全てを含めることができる:フィブロネクチン、フィブリリン、ラミニン、エラスチン、コラーゲンファミリーのメンバー(例えばコラーゲンI、コラーゲンIII、およびコラーゲンIV)、グリコサミノグリカン、基質、細網繊維、およびトロンボスポンジン。脱細胞化の成功は、標準的な組織学的染色手順による、組織切片中における検出可能な筋フィラメント、内皮細胞、平滑筋細胞、および核の非存在と定義される。好ましくは、残存細胞片も、脱細胞化された臓器または組織から除去されるが、これは必ずしも必要ではない。
【0026】
臓器または組織の効果的な再細胞化および作製には、脱細胞化の過程中および過程後にECMの形態および構造が維持される(すなわち実質的にインタクトな状態のまま残る)ことが重要である。本明細書で用いる「形態」は、臓器もしくは組織の、またはECMの全体的な形状を意味し、また本明細書で用いる「構造」は、外表面、内表面、およびこれらの間にあるECMを意味する。
【0027】
ECMの形態および構造は肉眼で、および/または組織学的に調べることができる。例えば、固形臓器の外表面上の基底膜、または臓器もしくは組織の脈管内の基底層は、脱細胞化によって除去されるべきではないか、または有意に損なわれるべきではない。加えてECMの原繊維は、脱細胞化されていない臓器または組織の原繊維と同様であるか、または有意に変化していない状態であるべきである。
【0028】
1種類もしくは複数の化合物を、例えば、脱細胞化された臓器を保護するために、または脱細胞化された臓器もしくは組織を再細胞化用に調製するために、および/または細胞を再細胞化過程中に補助もしくは刺激するために、脱細胞化された臓器もしくは組織の内部もしくは表面に添加することができる。このような化合物は、1種類もしくは複数の成長因子(例えばVEGF、DKK-1、FGF、BMP-1、BMP-4、SDF-1、IGF、およびHGF)、免疫調節物質(例えばサイトカイン、グルココルチコイド、IL2Rアンタゴニスト、ロイコトリエンアンタゴニスト)、および/または凝固カスケードを調節する因子(例えばアスピリン、ヘパリン結合タンパク質、およびヘパリン)を含むが、これらに限定されない。加えて、脱細胞化された臓器もしくは組織を例えば、脱細胞化された臓器もしくは組織の内部もしくは表面に残存する任意のタイプの微生物の存在を減少させるか、または除去するために、照射(例えばUV、ガンマ線)により処理することができる。
【0029】
臓器または組織の再細胞化
本発明は、臓器または組織を作製するための材料および方法を提供する。臓器または組織は、本明細書に記載された脱細胞化された臓器または組織に再生細胞の集団を接触させることで作製することができる。本発明で使用される再生細胞は、脱細胞化された臓器または組織の再細胞化に使用される任意の細胞である。再生細胞は、全能性細胞、多能性細胞(pluripotent cell)、または多能性細胞(multipotent cell)の場合があり、かつ拘束されていないかもしくは拘束されている場合がある。再生細胞は1つの系統の細胞の場合もある。加えて再生細胞は、未分化の細胞、部分的に分化した細胞、または完全に分化した細胞の場合がある。本発明で使用される再生細胞は、胚性幹細胞(National Institute of Health(NIH)の定義による;例えばワールドワイドウェブ上のstemcells.nih.govにある用語集を参照)を含む。再生細胞は、始原細胞、前駆細胞、ならびに臍帯細胞および胎児幹細胞を含む「成体」由来の幹細胞も含む。
【0030】
臓器または組織を再細胞化する際に使用可能な再生細胞の例は、胚性幹細胞、臍帯血細胞、組織由来の幹細胞もしくは始原細胞、骨髄由来の幹細胞もしくは始原細胞、血液由来の幹細胞もしくは始原細胞、間葉系幹細胞(MSC)、骨格筋由来細胞、または多能性成体前駆細胞(MAPC)を含むが、これらに限定されない。使用可能な他の再生細胞は、心臓幹細胞(CSC)、多能性成体心臓由来幹細胞、心臓線維芽細胞、心臓微小血管内皮細胞、または大動脈内皮細胞を含む。骨髄単核球細胞(BM-MNC)などの骨髄由来の幹細胞、内皮もしくは血管の幹細胞もしくは前駆細胞、および内皮前駆細胞(EPC)などの末梢血由来幹細胞を再生細胞として使用することもできる。
【0031】
臓器または組織を作製するために、脱細胞化された臓器の内部または表面に導入される再生細胞の数は、臓器(例えば、臓器の種類、臓器のサイズおよび重量)または組織と、再生細胞のタイプおよび発生段階との両方に依存する。異なるタイプの細胞は、それらの細胞が達する集団密度に関して異なる傾向を有する場合がある。同様に、異なる臓器または組織は、異なる密度で細胞化する場合がある。例として、脱細胞化された臓器または組織に、少なくとも約1,000個(例えば少なくとも10,000個、100,000個、1,000,000個、10,000,000個、または100,000,000個)の再生細胞を「播種」することができる;または約1,000細胞/mg組織(湿重量、すなわち脱細胞化前)〜約10,000,000細胞/mg組織(湿重量)を付着させることができる。
【0032】
再生細胞は、脱細胞化された臓器または組織中に、1か所もしくは複数の部位への注射によって導入する(「播種する」)ことができる。さらに、複数のタイプの細胞(すなわち細胞のカクテル)を、脱細胞化された臓器または組織に導入することができる。例えば、細胞のカクテルを、脱細胞化された臓器または組織中の複数の部位に注入してもよく、または異なるタイプの細胞を、脱細胞化された臓器または組織の異なる部分に注入してもよい。注射に代えて、または注射に加えて、再生細胞または細胞のカクテルを灌流によって、カニューレが挿入された脱細胞化された臓器または組織中に導入することができる。例えば再生細胞を、脱細胞化された臓器内に、後に再生細胞の成長および/または分化を誘導するために増殖用および/または分化用の溶媒に変更可能な灌流溶媒を使用して灌流することが可能である。
【0033】
再細胞化中に、臓器または組織は、再生細胞の少なくとも一部が、脱細胞化された臓器もしくは組織の内部もしくは表面で増殖および/または分化可能な条件で維持される。このような条件は、適切な温度および/または圧力、電気的および/または機械的な活性、力、O2および/またはCO2の適切な量、適度の湿度、ならびに無菌条件もしくはほぼ無菌の条件を含むが、これらに限定されない。再細胞化中に、脱細胞化された臓器または組織、およびこれに付着する再生細胞は、適切な環境で維持される。例えば再生細胞は、栄養(例えば栄養分、および/またはグルコースなどの炭素源)の補給、外因性のホルモンもしくは成長因子、および/または特定のpHを必要とする場合がある。
【0034】
再生細胞は、脱細胞化された臓器または組織に対して同種であってもよく(例えば、ヒトの再生細胞が播種されたヒトの脱細胞化された臓器もしくは組織)、再生細胞は、脱細胞化された臓器または組織に対して異種であってもよい(例えば、ヒトの再生細胞が播種されたブタの脱細胞化された臓器もしくは組織)。本明細書で用いる「同種」とは、臓器または組織が由来する種と同じ種(例えば、血縁関係にある個体もしくは血縁関係にない個体)から得られる細胞を意味し、また本明細書で用いる「異種」とは、臓器または組織が由来する種とは異なる種から得られる細胞を意味する。
【0035】
場合によっては、本明細書に記載された方法で作られた臓器または組織は患者に移植される。このような場合、脱細胞化された臓器または組織の再細胞化に用いられる再生細胞は、再生細胞が患者に対して「自家」であるようにその患者から得られる。患者由来の再生細胞は、例えば血液、骨髄、組織、または臓器から、生涯のさまざまな時期(例えば出生前、新生児期もしくは周産期、青年期、または成人期)において、当技術分野で既知の方法で得られる。または、脱細胞化された臓器もしくは組織の再細胞化に用いられる再生細胞は、患者に対して同系(すなわち一卵性双生児に由来する)であってもよく、再生細胞は、例えば患者の血縁者か、または患者と血縁関係にないヒトリンパ球抗原(HLA)がマッチした個体に由来する、HLAにマッチする細胞であってもよく、または再生細胞は、例えばHLAがマッチしないドナーに由来する、患者に対して同種の細胞であってもよい。
【0036】
再生細胞の供給源(例えば自家か否か)に関わらず、脱細胞化された固形臓器は、患者に対して自家、同種、または異種の場合がある。
【0037】
場合によっては、脱細胞化された臓器は、インビボで(例えば臓器または組織が個体に移植された後に)、細胞によって再細胞化される場合がある。インビボにおける再細胞化は、例えば本明細書に記載された任意の再生細胞を使用する上記の手順(例えば注入および/または灌流)で実施することができる。代替的または追加的に、インビボにおける、脱細胞化された臓器または組織への内在性細胞の播種は、天然に生じる場合もあり、また再細胞化組織に輸送された因子を介する場合もある。
【0038】
再生細胞の経過は、再細胞化中にモニタリングすることができる。例えば、臓器または組織の表面もしくは内部における細胞の数は、再細胞化中の1つもしくは複数の時点で生検を行うことで評価することができる。加えて、再生細胞が起こした分化の程度を、多様なマーカーが1つの細胞中または細胞集団中に存在するか否かを判定することでモニタリングできる。このような細胞タイプに対する、様々な細胞タイプおよび様々な分化の段階と関連するマーカーは当技術分野で既知であり、抗体および標準的な免疫アッセイ法を使用して容易に検出することができる。これについては例えば、Current Protocol in Immunology, 2005, Coligan et al., Eds., John Wiley & Sonsの第3章および第11章を参照されたい。再細胞化は、核酸のアッセイ法、ならびに形態学的評価および/または組織学的評価によってモニタリングすることができる。
【0039】
臓器もしくは組織を脱細胞化および/または再細胞化するための制御系
本発明は、臓器もしくは組織を脱細胞化および/または再細胞化するための系(例えばバイオリアクター)も提供する。このような系は一般に、臓器または組織にカニューレを挿入するための少なくとも1つのカニューレ挿入装置、臓器または組織をカニューレを介して灌流するための灌流装置、および臓器または組織を無菌環境に維持するための手段(例えば封じ込め系(containment system))を含む。カニューレ挿入および灌流は、当技術分野で周知の手法である。カニューレ挿入装置は一般に、臓器もしくは組織の血管、管、および/または腔への導入用の適切なサイズの中空管を含む。典型的には、臓器には1か所もしくは複数の血管、管、および/または腔にカニューレが挿入される。灌流装置は、液体(例えば細胞破壊媒体)の保持用容器、および液体を1か所もしくは複数のカニューレを介して臓器内で動かすための機構(例えばポンプ、空気圧、重力)を含む場合がある。脱細胞化および/または再細胞化中における臓器もしくは組織の無菌性は、気流の制御および濾過、および/または例えば、望ましくない微生物の増殖を防ぐための抗生物質、抗真菌剤、または他の抗微生物剤による灌流などの、当技術分野で既知のさまざまな手法を用いて維持することが可能である。
【0040】
本明細書に記載された、臓器または組織を脱細胞化および再細胞化するための系は、特定の灌流特性(例えば圧力、容量、流れのパターン、温度、気体、pH)、機械的な力(例えば心室壁の運動および応力)、ならびに電気刺激(例えばぺーシング)をモニタリングする能力を有する場合がある。冠血管床は、脱細胞化および再細胞化の過程で変化するので(例えば血管の耐性、容積)、圧力制御型の灌流装置が、大きな変動を避けるために有用である。灌流の有効性は、流出物および組織切片において評価することができる。灌流容量、流れのパターン、温度、O2分圧およびCO2分圧、ならびにpHは、標準的な方法でモニタリングすることができる。
【0041】
センサーを使用して、系(例えばバイオリアクター)、および/または臓器もしくは組織をモニタリングすることができる。ソノマイクロメトリー(sonomicrometry)、マイクロマノメトリー(micromanometry)、および/またはコンダクタンス測定によって、心筋壁の運動および能力に対する、圧力-容積、もしくは前負荷動員一回仕事量に関する情報を得ることができる。例えば、センサーを使用して、カニューレが挿入された臓器もしくは組織中を移動する液体の圧力;系内の周囲温度、および/または臓器もしくは組織の温度;カニューレが挿入された臓器もしくは組織中を動く液体のpHおよび/または流速;ならびに/または再細胞化中の臓器もしくは組織の生物学的活性をモニタリングすることができる。このような特性をモニタリングするためのセンサーを有することに加えて、臓器もしくは組織を脱細胞化および/または再細胞化する系には、このような特性を維持または調整する手段を含めることもできる。このような特性を維持または調整する手段は、温度計、サーモスタット、電極、圧力センサー、オーバーフローバルブ、液体の流速を変化させるためのバルブ、溶液のpHを変化させるために使用される液体への流体接続の開閉用バルブ、バルーン、体外式ペースメーカー、および/またはコンプライアンスチャンバーなどの構成要素を含む場合がある。安定した状態(例えば温度)を確実なものとすることを助けるために、チャンバー、リザーバー、およびチューブ類に水ジャケットを取り付けることができる。
【0042】
再細胞化中に臓器またはこれに付着する細胞に機械的負荷を加えることが有用な場合がある。一例として、左心房経由で左心室中に挿入されたバルーンを、心臓に機械的応力を加えるために使用することができる。容積および速度の調整を可能とするピストンポンプをバルーンに接続することで、左室壁の運動および応力をシミュレートすることができる。壁の運動および応力をモニタリングするためには、左室壁の運動および圧力をマイクロマノメトリーおよび/またはソノマイクロメトリーを用いて測定することができる。いくつかの態様では、体外式ペースメーカーをピストンポンプに接続して、心室のバルーンの各収縮と同期した刺激(収縮期と等しい)を提供することができる。末梢ECGを心臓表面から記録することで、ぺーシング電圧の調整、脱分極および再分極のモニタリングが可能となり、ならびに再細胞化しているまたは再細胞化された心臓の単純化された表面マップが提供される。
【0043】
機械的な心室の拡張は、蠕動ポンプを左心房経由で左心室に挿入されたカニューレに接続することでも達成可能である。バルーンを伴う上記の手順と同様に、カニューレを介した周期的な流体の運動(例えば脈動流)によって達成される心室の拡張を電気刺激によって同期させることができる。
【0044】
本明細書に開示された方法および材料を使用して、哺乳類の心臓を脱細胞化および再細胞化することが可能であり、ならびに適切な条件で維持することで、収縮機能を起こし、かつぺーシング刺激および/または薬物に反応する機能性心臓を作製することができる。この再細胞化された機能性の心臓を哺乳類に移植して、一定の期間、機能させることができる。
【0045】
図2は、臓器もしくは組織を脱細胞化および/または再細胞化するための系(例えばバイオリアクター)の1つの態様を示す。示された態様は、心臓を脱細胞化および再細胞化するためのバイオリアクターである。この態様は、速度および容積を調節可能な蠕動ポンプ(A);心室内のバルーンに接続された速度および容積を調節可能なピストンポンプ(B);電圧、周波数、および振幅を調整可能な外部ペースメーカー(C);ECG記録装置(D);「動脈経路」内の圧力(冠動脈圧に相当)センサー(E);「静脈」経路内の圧力(冠静脈洞圧に等しい)センサー(F);ならびにペースメーカーとピストンポンプとの間の同期(G)を有する。
【0046】
臓器または組織を作製するための系は、プログラム可能なプロセッサーと組み合わされた、コンピュータで読み取り可能な保存媒体によって制御することができる(例えば本明細書で使用される、コンピュータで読み取り可能な保存媒体は、プログラム可能なプロセッサーを特定の段階を実施するように稼働させるために、それ上に保存された指示を有する)。例えば、プログラム可能なプロセッサーを組み合わせた、このような保存媒体は、情報を1つもしくは複数のセンサーから受け取って処理することができる。プログラム可能なプロセッサーと併用される、このような保存媒体は、バイオリアクターおよび/または臓器もしくは組織に戻る情報および指示の伝達も可能である。
【0047】
再細胞化を起こす臓器または組織を、生物学的活性に関してモニタリングすることができる。生物学的活性は、臓器もしくは組織の電気的活性、機械的活性、機械的圧力、収縮性、および/または壁応力などの、臓器もしくは組織そのものの活性の場合がある。加えて、臓器または組織に付着した細胞の生物学的活性を、例えば、イオン輸送/交換の活性、細胞分裂、および/または細胞の生存度に関してモニタリングすることができる。これについては例えば、Laboratory Textbook of Anatomy and Physiology (2001, Wood, Prentice Hall)、およびCurrent Protocols in Cell Biology (2001, Bonifacino et al., Eds, John Wiley & Sons)を参照されたい。上述したように、再細胞化中に臓器に加わる能動負荷をシミュレートすることが有用な場合がある。本発明のコンピュータで読み取り可能な保存媒体は、プログラム可能なプロセッサーと組み合わせることで、臓器または組織に加わる能動負荷のモニタリングおよび維持に必要な構成要素に同調させるために使用することができる。
【0048】
1つの態様では、臓器または組織の重量を、プログラム可能なプロセッサーと組み合わせることでその特定の臓器または組織に関する曝露時間および灌流圧を計算可能な、本明細書に記載されたコンピュータで読み取り可能な保存媒体に入力することができる。このような保存媒体は、前負荷および後負荷(それぞれ灌流の前もしくは後における圧力)、ならびに流速を記録することができる。この態様では例えば、プログラム可能なプロセッサーと組み合わせた、コンピュータで読み取り可能な保存媒体は、灌流圧、灌流方向、および/または灌流液のタイプを、1つもしくは複数のポンプおよび/またはバルブによる制御を介して調節することができる。
【0049】
本発明では、当技術分野に含まれる従来の分子生物学、微生物学、生化学、および細胞生物学の手法を使用することができる。こうした手法は文献に詳細に説明されている。本発明をさらに、特許請求の範囲に記載された本発明の範囲を制限しない以下の実施例によって説明する。
【実施例】
【0050】
実施例
セクションA.脱細胞化(パートI)
実施例1−脱細胞化用の固形臓器の調製
死後の血栓形成を避けるため、ドナーラットを、400 Uのヘパリン/ドナー体重(kg)で全身ヘパリン化した。ヘパリン化に続いて、心臓および隣接する大血管を慎重に摘出した。
【0051】
ヘパリン(2000 U/ml)を含む生理食塩液(0.9%)中に前記心臓を置き、さらなる処理を行うまで5℃で維持した。無菌条件下で心臓および大血管から結合組織を除去した。下大静脈および左右の肺静脈を左右の心房の遠位から、Monofil社製の非吸収性の結紮糸を用いて結紮した。
【0052】
実施例2−カニューレの挿入および固形臓器の灌流
心臓を、灌流するために脱細胞化装置上にマウントした(図1)。胸部下行動脈(descending thoracic artery)にカニューレを挿入し、逆行性の冠灌流を可能とした(図1、カニューレA)。胸動脈の分枝(例えば腕頭動脈、左総頸動脈、左鎖骨下動脈)を結紮した。肺動脈にカニューレを、その分枝が左右の肺動脈に入るまで挿入した(図1、カニューレB)。上大静脈にカニューレを挿入した(図1、カニューレC)。この配置により、逆行性と順行性の両方の冠灌流が可能となる。
【0053】
大動脈カニューレ(A)に陽圧が加わると、灌流が、冠動脈から毛細血管床を介して冠静脈系を通り、右心房および上大静脈へと生じた(C)。上大静脈カニューレ(C)に陽圧が加わると、灌流が、右心房、冠静脈洞、および冠静脈から、毛細血管床を介して冠動脈および大動脈カニューレ(A)へと生じた。
【0054】
実施例3−脱細胞化
心臓を脱細胞化装置にマウントした後に、定常的な冠血流を再び確立するために、灌流液1 Lあたり1〜5 mmolのアデノシンを含む、カルシウム非含有の冷たいヘパリン化リン酸緩衝液によって順行性の灌流を開始した。冠灌流圧および流量を測定し、ならびに冠血管抵抗(coronary resistance)を計算することで冠血流を評価した。安定した冠血流を15分間流した後に、界面活性剤をベースとした脱細胞化処理を開始した。
【0055】
手順の詳細は以下に記載するが、簡単に説明すると、心臓を界面活性剤で順行的に灌流した。灌流後に、該心臓を緩衝液(例えばPBS)で逆行的に洗い流すことができる。次に該心臓を、抗生物質を含むPBSで、および続いてDNase Iを含むPBSで灌流した。次に該心臓を、微生物の混入を抑えるために、および後の微生物の混入を防ぐために1%塩化ベンザルコニウムで灌流し、ならびに続いてPBSで灌流して、臓器から任意の残存性の細胞成分、酵素、または界面活性剤を洗い流した。
【0056】
実施例4−ラットの死体の心臓の脱細胞化
雄のヌードラット(250〜300 g)8匹から心臓を摘出した。切開直後に大動脈弓にカニューレを挿入し、該心臓を所定の界面活性剤で逆行的に灌流した。4種類の異なる界面活性剤をベースとした脱細胞化プロトコル(後述)を、(a)細胞成分の除去、ならびに(b)血管構造の保存の可能性および有効性に関して比較した。
【0057】
脱細胞化は一般に、以下の段階を含むようにした:固形臓器の安定化、固形臓器の脱細胞化、固形臓器の再生および/または中和、固形臓器の洗浄、臓器表面に残存する任意のDNAの分解、臓器の殺菌、ならびに臓器の恒常性維持。
【0058】
(A)脱細胞化プロトコル#1(PEG)
心臓を、100 U/mlのペニシリン、0.1 mg/mlのストレプトマイシン、および0.25μg/mlのアムホテリシンBを含む200 mlのPBSで、再循環せずに洗浄した。次に該心臓を、35 mlのポリエチレングリコール(PEG;1 g/ml)で最長30分間、手動で再循環しながら脱細胞化した。次にこの臓器を500 mlのPBSで最長24時間、再循環用ポンプを使用して洗浄した。洗浄段階を少なくとも2回(各回少なくとも24時間)繰り返した。該心臓を35 mlのDNase I(70 U/ml)に少なくとも1時間、手動で再循環しながら曝露した。この臓器を再度、500 mlのPBSで少なくとも24時間にわたって洗浄した。
【0059】
(B)脱細胞化プロトコル#2(Triton Xおよびトリプシン)
心臓を、100 U/mlのペニシリン、0.1 mg/mlのストレプトマイシン、および0.25μg/mlのアムホテリシンBを含む200 mlのPBSで少なくとも約20分間、再循環せずに洗浄した。次に該心臓を、0.05%トリプシンで30分間かけて脱細胞化した後に、5% Triton-Xおよび0.1%水酸化アンモニウムを含む500 mlのPBSで約6時間かけて灌流した。該心臓を脱イオン水で約1時間にわたって灌流した後に、PBSで12時間にわたって灌流した。次に該心臓を3回(各24時間)、再循環用ポンプを使用して500 mlのPBSで洗浄した。該心臓を35 mlのDNase I(70 U/ml)で1時間かけて手動で再循環しながら灌流し、さらに500 mlのPBSで2回(各回少なくとも約24時間)、再循環用ポンプを使用して洗浄した。
【0060】
(C)脱細胞化プロトコル#3(1% SDS)
心臓を、100 U/mlのペニシリン、0.1 mg/mlのストレプトマイシン、および0.25μg/mlのアムホテリシンBを含む200 mlのPBSで少なくとも約20分間、再循環せずに洗浄した。該心臓を、再循環用ポンプを使用して、1% SDSを含む500 mlの水で少なくとも約6時間かけて脱細胞化した。次に該心臓を脱イオン水で約1時間洗浄し、およびPBSで約12時間洗浄した。該心臓を500 mlのPBSで3回(各回少なくとも約24時間)、再循環用ポンプを使用して洗浄した。次に該心臓を35 mlのDNase I(70 U/ml)で約1時間、手動で再循環しながら灌流し、および500 mlのPBSで3回(各回少なくとも約24時間)、再循環用ポンプを使用して洗浄した。
【0061】
(D)脱細胞化プロトコル#4(Triton X)
心臓を、100 U/mlのペニシリン、0.1 mg/mlのストレプトマイシン、および0.25μg/mlのアムホテリシンBを含む200 mlのPBSで少なくとも約20分間、再循環せずに洗浄した。次に該心臓を、再循環用ポンプを使用して、5% Triton Xおよび0.1%水酸化アンモニウムを含む500 mlの水で少なくとも6時間かけて脱細胞化した。次に該心臓を脱イオン水で約1時間、続いてPBSで約12時間にわたって灌流した。該心臓を500 mlのPBSで3回(各回少なくとも24時間)、再循環用ポンプを使用して灌流することで洗浄した。次に該心臓を35 mlのDNase I(70 U/ml)で約1時間、手動で再循環しながら灌流し、および500 mlのPBSで3回(各回約24時間)、洗浄した。
【0062】
最初の実験では、脱細胞化装置を層流フード内に据えた。心臓を60 cm H2Oの冠灌流圧で灌流した。必須ではないものの、上記の実験で記載された心臓を脱細胞化用チャンバー内にマウントし、抗生物質を含むPBSに完全に浸して再循環モードで72時間にわたって5 ml/分の連続流で灌流し、細胞成分および界面活性剤を可能な限り洗い流した。
【0063】
脱細胞化の成功は、組織切片中における筋フィラメントおよび核の不在と定義した。血管構造の保存の成功は、2%エバンスブルーによる灌流と、これに続く組織切片の包埋によって評価した。
【0064】
極めて効率のよい脱細胞化は、最初に心臓を、脱イオン水に溶解したイオン性界面活性剤(1%ドデシル硫酸ナトリウム(SDS)、約0.03 M)で順行的に定常冠灌流圧で灌流し、続いて非イオン性界面活性剤(1% Triton X-100)で順行的に灌流してSDSを除去し、およびおそらく、細胞外マトリックス(ECM)タンパク質が再生することで生じた。心臓を間欠的にリン酸緩衝液で逆行的に灌流することで、閉塞した毛細血管および小血管を通した。
【0065】
実施例5−脱細胞化された臓器の評価
脱細胞化後に血管構造が損なわれていないことを証明すべく、血管基底膜を染色して大血管および微小血管の密度を定量するために、脱細胞化された心臓をランゲンドルフ灌流を介してエバンスブルーによって染色する。さらに、ポリスチレン粒子を心臓中に、および心臓を通って灌流することで、血管漏出のレベルを示す冠動脈容積(coronary volume)を定量することが可能であり、かつ冠動脈流出液(coronary effluent)および組織切片を解析することで灌流の分布を評価できる。以下の3つの基準の組み合わせを評価し、摘出された脱細胞化されていない心臓を比較する:(1)ポリスチレン粒子の均一な分布、(2)あるレベルにおける漏出の有意な変化、(3)微小血管密度。
【0066】
繊維の方向を、一軸または二軸の応力が加わる試料にリアルタイムで応用可能な、Tower et al. (2002, Fiber alignment imaging during mechanical testing of soft tissues, Ann Biomed Eng., 30(10):1221-33)の偏光顕微鏡法によって評価する。ランゲンドルフ灌流中に、脱細胞化されたECMの基本的な機械的特性(コンプライアンス、弾性、破裂圧)を記録し、および摘出直後の心臓と比較する。
【0067】
セクションB.脱細胞化(パートII)
実施例1−ラット心臓の脱細胞化
12週齢の雄のF344フィッシャーラット(Harlan Labs, PO Box 29176 Indianapolis, IN 46229)に、100 mg/kgのケタミン(Phoenix Pharmaceutical, Inc., St. Joseph, MO)、および10 mg/kgのキシラジン(Phoenix Pharmaceutical, Inc., St. Joseph, MO)を腹腔内注射して麻酔した。左大腿静脈を介した全身ヘパリン化(American Pharmaceutical Partners, Inc., Schaumberg, IL)後に胸骨正中切開術を行って心膜を開いた。胸骨後方の脂肪体を除去し、上行性胸部大動脈を切開して、その分枝を結紮した。大静脈および肺静脈、肺動脈および胸部大動脈を切断し、胸部から心臓を摘出した。充填済みの1.8 mmの大動脈カニューレ(Radnoti Glass, Monrovia, CA)を上行大動脈に挿入することで、逆行性の冠灌流(ランゲンドルフ)を可能とした。心臓を、10μMのアデノシンを含むヘパリン化PBS(HyClone, Logan, UT)による75 cm H2Oの冠灌流圧における15分間の灌流後に、1%ドデシル硫酸ナトリウム(SDS)または1%ポリエチレングリコール1000(PEG 1000)(EMD Biosciences, La Jolla, Germany)、または脱イオン水を溶媒とする1% Triton-X 100(Sigma, St. Louis, MO)で2〜15時間かけて灌流した。続いて、脱イオン水による15分間の灌流、および脱イオン水を溶媒とする1% Triton-X (Sigma, St. Louis, MO)による30分間の灌流を行った。次に心臓を、抗生物質を含むPBS(100 U/mlのペニシリン-G(Gibco, Carlsbad, CA)、100 U/mlのストレプトマイシン(Gibco, Carlsbad, CA)、および0.25μg/mlのアムホテリシンB(Sigma, St. Louis, MO))で124時間かけて連続的に灌流した。
【0068】
1% PEG、1% Triton-X 100、または1% SDSのいずれかによる逆行性の灌流の420分後に、PEGおよびTriton-X 100による灌流は、浮腫状の不透明な外観を誘導したが、SDSによる灌流は、より劇的な変化を生じ、不透明な要素を穏やかに洗い流すことで、ほぼ半透明の移植片が得られた。3つ全てのプロトコルが行われた心臓は、肉眼的にはインタクトであり、(77.4 mmHgの定常冠灌流圧における)灌流プロトコル中に、冠動脈の破損または大動脈弁不全の証拠は認められなかった。冠血流は、全3通りのプロトコルにおいて、灌流の最初の60分間は低下し、後にSDSによる灌流中に正常に戻ったが、Triton-X 100およびPEGによる灌流では上昇したままであった。SDSによる灌流は、計算された冠血管抵抗(最大250 mmHg.s.ml-1)の最高の初期上昇を誘導し、Triton-XおよびPEGによる灌流では、それぞれ最大200 mmHg.s.ml-1および最大150 mmHg.s.ml-1であった。
【0069】
界面活性剤で灌流した心組織の組織切片を使用したところ、観察時間中における脱細胞化は、PEGとTriton-X 100で処理した心臓の両方において不完全なことが判明し;ヘマトキシリン・エオジン(H&E)染色により、核および横紋のある繊維の存在が明らかとなった。これとは対照的に、核または収縮性のフィラメントはSDS灌流心臓の切片中に検出されなかった。しかしながら、血管構造およびECM繊維の方向は、SDSで処理した心臓では保存されていた。
【0070】
初期の脱細胞化後にECMからイオン性のSDSを除去するために、臓器をTriton-X 100で30分間かけて灌流した。加えて、全ての界面活性剤を完全に洗い流すために、および生理学的pHを再び確立するために、脱細胞化された臓器を、脱イオン水およびPBSで124時間にわたって十分に灌流した。
【0071】
実施例2−ラット腎臓の脱細胞化
腎臓の摘出に際しては、全ての腹膜内容物を湿らせたガーゼで包み、後腹膜腔が露出するように慎重に側方に動かした。腸間膜血管を結紮して切断した。腹部大動脈を結紮し、腎動脈の起始部(take off)の下部で切断した。胸部大動脈を横隔膜のすぐ上で切断し、1.8 mmの大動脈カニューレ(Radnoti Glass, Monrovia, CA)を使用してカニューレを挿入した。後腹膜から腎臓を慎重に摘出し、腎動脈に加わる張力を最小限に抑えるために無菌のPBS(HyClone, Logan, UT)に浸した。ヘパリン化PBSによる15分間の灌流後に、脱イオン水を溶媒とする1% SDS(Invitrogen, Carlsbad, CA)による2〜16時間の灌流、および脱イオン水を溶媒とする1% Triton-X(Sigma, St. Louis, MO)による30分間の灌流を行った。次に肝臓を、抗生物質を含むPBS(100 U/mlのペニシリン-G(Gibco, Carlsbad, CA)、100 U/mlのストレプトマイシン(Gibco, Carlsbad, CA)、0.25μg/mlのアムホテリシンB(Sigma, St. Louis, MO))で124時間にわたって連続的に灌流した。
【0072】
SDSによる420分間の灌流と、これに続くTriton-X 100による灌流によって、腎ECMの足場が、血管系および臓器の構造は損なわれずに完全に脱細胞化された。エバンスブルーによる灌流によって、血管系が、脱細胞化された心臓ECMと同様にインタクトであることが確認された。脱細胞化された腎皮質をモバット・ペンタクローム(Movat pentachrome)によって染色した結果、インタクトな細胞または核は存在せず、糸球体ならびに近位および遠位の曲尿細管の基底膜はインタクトであることが判明した。脱細胞化された腎髄質の染色の結果、尿細管および集合管の基底膜がインタクトであることが判明した。脱細胞化された腎皮質のSEMでは、糸球体および尿細管の基底膜がインタクトであることが確認された。糸球体内における周囲の近位および遠位の尿細管と糸球体の毛細血管基底膜との間に糸球体の輪郭を形成するボーマン嚢などの特徴的な構造は保たれていた。脱細胞化された腎髄質のSEM画像から、腎盂内に至る髄質の錐体は損なわれておらず、腎乳頭に至る集合管の基底膜はインタクトであることが判明した。したがって、腎臓の主要な超微細構造の全ては、脱細胞化後にインタクトであった。
【0073】
実施例3−ラット肺の脱細胞化
肺(気管を含む)を胸部から慎重に摘出し、肺動脈に加わる張力を最低限に抑えるために、滅菌済みのPBS(HyClone, Logan, UT)に浸した。ヘパリン化PBSによる15分間の灌流後に、脱イオン水を溶媒とする1% SDS(Invitrogen, Carlsbad, CA)による2〜12時間の灌流、および脱イオン水を溶媒とする1% Triton-X(Sigma, St. Louis, MO)による15分間の灌流を行った。次に肺を、抗生物質を含むPBS(100 U/mlのペニシリン-G(Gibco, Carlsbad, CA)、100 U/mlのストレプトマイシン(Gibco, Carlsbad, CA)、0.25μg/mlのアムホテリシンB(Sigma, St. Louis, MO))で124時間にわたって連続的に灌流した。
【0074】
SDSによる180分間の灌流と、これに続くTriton-X 100による灌流によって、気道および血管が損なわれていない、完全に脱細胞化された肺のECM足場が得られた。組織切片をモバット・ペンタクロームで染色したところ、コラーゲンやエラスチンなどの主要構造タンパク質を含む肺のECM成分に加えて、プロテオグリカンなどの可溶性成分の存在も確認された。しかしながら、核またはインタクトな細胞は保持されていなかった。気道は、主要分枝から終末細気管支〜呼吸細気管支、肺胞管および肺胞に至るまで保存されていた。毛細血管レベルに下降する肺動脈、および肺静脈に由来する血管床はインタクトなままであった。脱細胞化された肺のSEM顕微鏡写真から、気管支、肺胞、および血管基底膜が保存されており、細胞が保持された証拠はないことがわかった。肺胞間中隔ならびに中隔基底膜に主要な構造支持体を提供する弾性繊維および細網繊維の網目構造は、肺間質内の毛細血管の密な網を含めてインタクトであった。
【0075】
脱細胞化された気管のSEM顕微鏡写真から、ECM構造が、脱細胞化された硝子軟骨輪、および気道上皮を含まない粗い管腔基底膜を伴い、インタクトであることが判明した。
【0076】
実施例4−ラット肝臓の脱細胞化
肝臓の摘出に関しては、大静脈を腹部正中切開によって露出させ、切開し、マウスの大動脈カニューレ(Radnoti Glass, Monrovia, CA)を使用してカニューレを挿入した。肝動脈および肝静脈、ならびに胆管を切断し、ならびに肝臓を腹部から慎重に摘出し、および門脈に加わる張力を最小限とするために無菌PBS(HyClone, Logan, UT)に浸した。ヘパリン化PBSによる15分間の灌流に続いて、脱イオン水を溶媒とする1% SDS(Invitrogen, Carlsbad, CA)による2〜12時間の灌流、および脱イオン水を溶媒とする1% Triton-X(Sigma, St. Louis, MO)による15分間の灌流を行った。次に肝臓を、抗生物質を含むPBS(100 U/mlのペニシリン-G(Gibco, Carlsbad, CA)、100 U/mlのストレプトマイシン(Gibco, Carlsbad, CA)、0.25μg/mlのアムホテリシンB(Sigma, St. Louis, MO))で124時間、連続的に灌流した。
【0077】
SDSによる120分間の灌流と、これに続くにTriton-X 100よる灌流は、完全に脱細胞化された肝臓を生じるのに十分であった。脱細胞化された肝臓をモバット・ペンタクローム染色することによって、中心静脈、ならびに肝動脈、胆管、および門脈を含む門脈空間(portal space)を伴う特徴的な肝臓構造の保持が確認された。
【0078】
実施例5−脱細胞化臓器の評価に使用される方法および材料
組織学および免疫蛍光法
パラフィン包埋された脱細胞化組織を対象に、製造業者(American Mastertech Scientific, Lodi, CA)の指示書通りにモバット・ペンタクローム染色を行った。簡単に説明すると、脱パラフィン化済みのスライドを、Verhoeffの弾性染色液で染色し、洗浄し、2%塩化第二鉄で区別し、洗浄し、5%チオ硫酸ナトリウム中に配置し、洗浄し、3%氷酢酸でブロックし、1%アルシアンブルー溶液で染色し、洗浄し、クロセインスカーレット−酸性フクシンで染色し、洗浄し、1%氷酢酸に浸し、5%リンタングステン酸で脱染し、1%氷酢酸に浸し、脱水し、アルコール性サフラン溶液に浸し、脱水し、マウントし、さらにカバーで覆った。
【0079】
脱細胞化組織を対象に免疫蛍光染色を行った。凍結切片(脱細胞化組織)ではなく、パラフィン包埋組織(再細胞化組織)を対象に、以下の手順で抗原賦活化を行った:パラフィン切片を脱ろうし、連続的なアルコール勾配に従ってキシレンを2回(各5分間)交換して再水和し、さらに冷水道流水で洗浄した。次にスライドを抗原賦活化溶液(2.94 gのクエン酸三ナトリウム、22 mlの0.2 M塩酸溶液、978 mlの超純水、およびpH 6.0に調整)中に配置し、30分間煮沸した。水道水の流水による10分間の洗浄後に免疫染色を開始した。凍結切片を1X PBS(Mediatech, Herndon, VA)を溶媒とする4%パラホルムアルデヒド(Electron Microscopy Sciences, Hatfield, PA)で室温で15分間かけて固定した後に染色した。スライドを、1X PBSを溶媒とする4%ウシ胎児血清(FBS; HyClone, Logan, UT)で、室温で30分間かけてブロックした。試料を室温で1時間、希釈した一次抗体(Ab)および二次抗体と連続的にインキュベートした。各段階間に、スライドを1X PBSで3回(各5〜10間)洗浄した。コラーゲンI(ヤギポリクローナルIgG(Cat. No. sc-8788), Santa Cruz Biotechnology Inc., Santa Cruz, CA)、コラーゲンIII(ヤギポリクローナルIgG(Cat. No. sc-2405), Santa Cruz Biotechnology Inc., Santa Cruz, CA)、フィブロネクチン(ヤギポリクローナルIgG(Cat. No. sc-6953), Santa Cruz Biotechnology Inc., Santa Cruz, CA)、およびラミニン(ウサギポリクローナルIgG(Cat. No. sc-20142), Santa Cruz Biotechnology Inc., Santa Cruz, CA)に対する一次Abをブロッキング緩衝液との1:40の希釈率で使用した。二次抗体のウシ抗ヤギIgGフィコエリシン(phycoerythin)(Cat. No. sc-3747, Santa Cruz Biotechnology Inc., Santa Cruz, CA)、およびウシ抗ウサギIgGフィコエリシン(Cat. No. sc-3750, Santa Cruz Biotechnology Inc., Santa Cruz, CA)をブロッキング緩衝液との1:80の希釈率で使用した。スライドを、4',6-ジアミジノ-2-フェニルインドール(DAPI)(Vectashield、Vector Laboratories, Inc., Burlingame, CA)を含む硬化マウント用(hardening mounting)溶媒中でカバーガラス(Fisherbrand 22 x 60, Pittsburgh, PA)で覆った。画像を、Nikon Eclipse TE200倒立顕微鏡(Fryer Co. Inc., Huntley, IL)に接続したImagePro Plus 4.5.1(Mediacybernetics, Silver Spring, MD)を使用して、ImagePro Plus 4.5.1(Mediacybernetics, Silver Spring, MD)を使用して記録した。
【0080】
走査型電子顕微鏡による観察
正常組織および脱細胞化組織を灌流し、0.1 Mカコジル酸緩衝液(Electron Microscopy Sciences, Hatfield, PA)を溶媒とする2.5%グルタルアルデヒド(Electron Microscopy Sciences, Hatfield, PA)で15分間かけて固定した。次に組織を0.1 Mカコジル酸緩衝液で2回、15分間かけて洗浄した。固定後の処理を、1%四酸化オスミウム(Electron Microscopy Sciences, Hatfield, PA)を使用して60分間かけて行った。次に組織試料を、EtOH濃度を上昇させながら(50%で10分間、70%で10分間を2回、80%で10分間、95%で10分間を2回、100%で10分間を2回)、脱水した。次に組織試料を対象に、Tousimis Samdri-780A(Tousimis, Rockville, MD)で臨界点乾燥を行った。Denton DV-502A真空蒸着装置(Denton Vacuum, Moorestown, NJ)内で30秒間の金/パラジウムのスパッターコーティングによってコーティングを行った。走査型電子顕微鏡の画像を、Hitachi S4700電界放射型走査型電子顕微鏡(Hitachi High Technologies America, Pleasanton, CA)を使用して得た。
【0081】
機械的試験
ラットの左心室から心筋組織の断面を、中心領域が約5 mm x 5 mmとなるように、かつ断面の軸が心臓の外周方向および長軸方向に配置されるように切り出した。組織断面の初期厚をマイクロメーターで測定したところ、組織断面の中心部で3.59±0.14 mmであった。断面を、脱細胞化されたラット左心室組織からも、同じ方向で、かつ同じ中心領域のサイズとなるように切り出した。脱細胞化された試料の初期厚は238.5±38.9μmであった。加えて、フィブリンゲルの機械的特性を試験し、別の組織工学用足場を、血管組織および心臓組織の作製に使用した。フィブリンゲルを十字型の鋳型に最終濃度が6.6 mgのフィブリン/mlとなるように流し込んだ。フィブリンゲルの平均的な厚みは165.2±67.3μmであった。全ての試料を、2軸性の機械的試験装置(mechanical testing machine)(Instron Corporation, Norwood, MA)に鉗子を介して固定し、PBSに浸し、さらに40%のひずみに等二軸的(equibiaxially)に伸ばした。静的で受動的な機械的特性を正確に探すために、試料を4%のひずみの増分で伸ばし、各ひずみ値で少なくとも60秒間、弛緩するようにした。力の値を特定の軸方向(5 mm x初期厚)の断面積によって規格化することで、力を工学的応力に変換した。工学的応力を、初期の長さによって規格化される変位として計算した。2つの軸間のデータ、ならびに試料群間のデータを比較するために、接線係数を以下の式によって計算した:
[T(ε=ひずみ40%)-T(ε=ひずみ36%)]/ひずみ4%
上式で、Tは工学的応力であり、εは工学的ひずみである。接線係数の値の平均をとり、2つの軸(外周方向および長軸方向)間で、ならびに群間で比較した。
【0082】
実施例6−脱細胞化臓器の生体適合性の評価
生体適合性を評価するために、1 ccの標準増殖培地(イスコフ改変ダルベッコ培地(Gibco, Carlsbad, CA)、10%ウシ胎児血清(HyClone, Logan, UT)、100 U/mlペニシリン-G(Gibco, Carlsbad, CA)、100 U/mlストレプトマイシン(Gibco, Carlsbad, CA)、2 mmol/L L-グルタミン(Invitrogen, Carlsbad, CA)、0.1 mmol/L 2-メルカプトエタノール(Gibco, Carlsbad, CA))に懸濁した100,000個のマウス胚性幹細胞(mESC)を、ECM切片上に、および対照プレート上に、特定の成長因子による刺激またはフィーダー細胞による支持を行うことなく播種した。4',6-ジアミジノ-2-フェニルインドール(DAPI)を10μg/mlの濃度で細胞培養用の培地に添加して細胞核を標識することで、細胞の付着および増殖の定量が可能となった。画像をUV光下で、およびベースラインと、その24時間後、48時間後、および72時間における位相差を、Nikon Eclipse TE200倒立顕微鏡(Fryer Co. Inc., Huntley, IL)に接続したImagePro Plus 4.5.1(Mediacybernetics, Silver Spring, MD)を使用して記録した。
【0083】
脱細胞化されたECMは、細胞の生存、付着、および増殖に適合性であった。播種されたmESCはECM足場上に生着し、マトリックスへの浸潤を細胞播種の72時間以内に開始した。
【0084】
実施例7−脱細胞化臓器の評価
SDSによって脱細胞化されたしたラット心臓の冠動脈血管床の大動脈弁の能力および完全性を、2%エバンスブルー色素によるランゲンドルフ灌流で評価した。左心室への色素の充満は観察されず、大動脈弁が損なわれていないことがわかった。巨視的には、冠動脈の最大4番目の分岐点までの充満が、色素の漏れの徴候なしに確認された。組織切片については、大動脈および大静脈(150μm)ならびに小動脈および小静脈(20μm)の灌流が、後のエバンスブルーで染色された血管基底膜の赤色蛍光によって確認された。
【0085】
心臓の主要ECM成分の保持を確認するために、SDSで脱細胞化されたECM足場の免疫蛍光染色を行った。この染色によって、コラーゲンIおよびIII、フィブロネクチン、ならびにラミニンなどの、心臓の主要ECM成分の存在が確認されたが、インタクトな核、または心臓ミオシン重鎖もしくはサルコメアのαアクチンを含む収縮性要素の保持の証拠は認められなかった。
【0086】
SDSによって脱細胞化された心臓ECMの走査型電子顕微鏡(SEM)による観察では、繊維の方向および組成が、組織の厚み全体にわたって、細胞の存在しない大動脈壁および大動脈弁の弁尖で保存されていることが判明した。脱細胞化された左右の心室壁は、ECM繊維の組成物(網(weave)、柱(strut)、コイル)および方向を保持していたが、筋繊維は完全に除去されていた。両心室の保持されたECM内に、内皮細胞または平滑筋細胞のない異なる直径のインタクトな血管基底膜が観察された。さらに、インタクトな心外膜基底層の下部の緻密な心外膜繊維の薄層は保持されていた。
【0087】
脱細胞化された心組織の機械的特性を評価するために、2軸試験を実施して、心臓の組織工学における人工的なECM足場として高頻度で使用されるフィブリンゲルと比較した。正常なラットの心室組織および脱細胞化試料は、応力-ひずみ挙動に関して高度に異方性を示した。逆にフィブリンゲル試料では、応力-ひずみ特性は2つの主要な方向間で極めて類似していた。応力-ひずみ挙動の方向依存性は、正常ラットの心室および脱細胞化群の全試料に見られ、かつ応力-ひずみ特性の等方性は、フィブリンゲル群の全試料について典型的であった。
【0088】
これら2群間における、また心臓の主軸間における応力-ひずみ特性を比較するために、外周方向と長軸方向の両方について、ひずみ率40%における接線係数を計算した(方程式については実施例5を参照)。いずれの方向についても、脱細胞化試料群は、正常ラットの心室およびフィブリンゲルの試料群より有意に高い係数を示したことに注目されたい。しかしながら、正常ラットの心室と脱細胞化マトリックスの両方に関しては、2方向の係数間に有意差があったが、フィブリンゲルに関しては有意差はなかった。
【0089】
インタクトな左心室組織の場合、40%ひずみにおける応力は、長軸方向では5〜14 kPaを、および外周方向では15〜24 kPaを変動し、以前に公開されているデータと矛盾しなかった。ラットの心室組織も、ラットの脱細胞化された心室組織も、外周方向は長軸方向より堅く、これは心臓の筋繊維の方向に起因する可能性が極めて高い。繊維の方向は、心臓組織の厚みを通して変化するが、繊維の大部分は外周方向を向いているために、この方向が堅くなると考えられる。脱細胞化組織は、インタクトな組織より有意に堅かった。これも、細胞外マトリックスが細胞そのものより堅く、かつECMと細胞の組み合わせがECM単独の場合ほど堅くないと考えられることから推定される。脱細胞化組織の接線係数の値は、比較的大きく見えるが、精製エラスチンのヤング係数の値(約600 kPa)よりわずかに大きいだけであり、1本のコラーゲン繊維のヤング係数(5 Mpa)より小さく、よって本明細書で決定された値は妥当な範囲内にある。
【0090】
実施例8−他の臓器または組織の脱細胞化
ラットの心臓、肺、腎臓、および肝臓に加えて、本明細書に記載された灌流脱細胞化プロトコルを、骨格筋、膵臓、小腸および大腸、食道、胃、脾臓、脳、脊髄、および骨格に応用することで同様の結果が得られた。
【0091】
実施例9−ブタ腎臓の脱細胞化
ブタの腎臓を、ヘパリン化した雄の個体から摘出した。摘出臓器の灌流を可能とするために、腎動脈にカニューレを挿入し、15分間PBSで灌流して血液を洗い流した。脱イオン水を溶媒とする27 Lの1% SDSによる灌流を35.5時間かけて50〜100 mmHgの圧力で行った。脱イオン水を溶媒とする1% Triton-Xによる灌流を、ECM足場からSDSを除去するために開始した。次に、脱細胞化された腎臓の洗浄および緩衝を、抗生物質を含むPBSによる120時間の灌流により行って界面活性剤を除去し、生体適合性のあるpHを得た。
【0092】
臓器の清澄化は、灌流開始から2時間以内に観察された。灌流の12時間で、透明な白色が優勢となった。臓器が半透明の白色になった時点で脱細胞化を終了した。
【0093】
実施例10−脱細胞化心臓の移植
F344ラットの心臓を、Ao弁から遠位の大動脈にカニューレを挿入して、他の全ての大血管および肺静脈を結紮することで準備した(ただし、肺動脈幹の左の分枝(二分岐部から遠位)および下大静脈(IVC)は除く)。ランゲンドルフ逆行性冠灌流、および2リットルの1% SDSによる12〜16時間の灌流によって、脱細胞化が達成された。次に心臓を、35 mLの1% Triton-Xで30〜40分間かけて再生後、抗生物質および抗真菌剤を含むPBSで72時間かけて洗浄した。IVCを結紮後に移植を行った。
【0094】
大型(380〜400 g)のRNUラットを、脱細胞化心臓の受入用に準備した。鈍角のモスキート鉗子を、宿主個体のIVCと腹部Aoの両方にあて、吻合領域が確実に摘出されるようにした。脱細胞化心臓の大動脈を、宿主の腹部大動脈に、腎分岐部の近位かつ下部に8-0縫合用絹糸を使用して吻合した。脱細胞化心臓の肺動脈幹の左枝を、肺動脈幹に加わる物理的応力を最小限に抑えるために、宿主のIVCの最も近い領域に吻合した。
【0095】
両血管を宿主個体に縫合後に鉗子を解放し、脱細胞化心臓を宿主個体の血液で満たした。レシピエント個体の腹部大動脈圧が、脱細胞化された心臓および大動脈中について視覚的に観察された。脱細胞化心臓は膨張し、血液によって赤味が生じた。吻合部位で出血はほとんど見られなかった。鉗子の解放(灌流の開始)の3分後にヘパリンを投与し、心臓を撮影して腹部内に配置し、吻合部位に加わる応力を最小限に抑えた。腹部を無菌的に閉鎖して個体の回復をモニタリングした。移植の55時間後に個体を安楽死させ、脱細胞化心臓を外植して観察した。ヘパリンが投与されなかった個体には、切開時および評価時に大きな血栓がLVに見られた。血液は心臓の左右の冠動脈にも観察された。
【0096】
他の移植実験では、両血管を宿主個体に縫合後に鉗子を解放し、脱細胞化心臓を宿主個体の血液で満たした。レシピエント個体の腹部大動脈圧を、脱細胞化された心臓および大動脈について肉眼で観察した。脱細胞化心臓は膨張して赤味を示し、出血は吻合部位でほとんど見られなかった。鉗子の解放(灌流の開始)の3分後にヘパリンをIP注射で投与した(3000 IU)。心臓を撮影し、吻合部位に加わる応力を最小限に抑えるように腹部内に配置した。腹部を無菌的に閉鎖し、個体の回復をモニタリングした。個体が、移植から約48時間後に出血により死んでいることを確認した。移植時間は現在、55〜70分の範囲にある。
【0097】
セクションC.再細胞化
実施例1−心臓ECM切片の再細胞化
脱細胞化されたECMの生体適合性を評価するために、1つの脱細胞化心臓の1 mm厚の切片を、筋原繊維細胞および内皮細胞株とともに培養した。2 x 105個のラットの骨格筋芽細胞、C2C12マウスの筋芽細胞、ヒトの臍帯内皮細胞(HUVEC)、およびウシの肺内皮細胞(BPEC)を組織切片上に播種し、ならびに標準的な条件で7日間にわたって共培養した。筋原細胞はECMを通して移動し、およびECM内で拡大し、ならびに繊維の当初の方向に並んでいた。これらの筋原細胞には、増殖の増加、およびECM切片の十分に再集団化した大きな部分が見られた。内皮細胞株には、浸潤性の低い増殖パターンが見られ、移植片の表面上に単層を形成していた。これらの条件では、検出可能な抗増殖性作用は認められなかった。
【0098】
実施例2−冠灌流による心臓ECMの再細胞化
冠灌流による脱細胞化された心臓ECMの表面および内部への再生細胞の播種の効率を決定するため、脱細胞化された心臓を臓器チャンバーに移し、酸素付加培養用培地で、細胞培養条件(5% CO2、湿度60%、37℃)で連続的に灌流した。120 x 106個のPKH標識HUVEC(50 mlの内皮細胞成長培地に懸濁)を40 cm H2Oの冠灌流圧で注入した。冠流出液を採取して細胞数をカウントした。次に流出液を再循環させ、再び灌流して最大数の細胞を送り込んだ。再循環を2回繰り返した。3回目の後に、約90 x 106個の細胞が心臓内に保持されていた。心臓を、500 mlの再循環用の酸素付加内皮細胞培養用培地で120時間かけて連続的に灌流した。次に心臓を摘出し、凍結切片用に包埋した。HUVECは、心臓全体で動脈および静脈の残渣に限局していたが、血管外ECMの全体に完全に分散してはいなかった。
【0099】
実施例3−新生ラットの心臓細胞による脱細胞化ラット心臓の再細胞化
新生ラットの心筋細胞の単離および調製
1日目に、1〜3日齢のSPFフィッシャー344の新生仔(Harlan Labs, Indianapolis, IN)8〜10匹に、5%イソフルレン(Abbott Laboratories, North Chicago, IL)を吸入させ、70% EtOHを噴霧して鎮静させ、さらに胸骨切開を無菌的に速やかに行った。心臓を摘出後に直ちに、HBSS;新生仔の心筋細胞単離系に由来する試薬#1(Worthington Biochemical Corporation, Lakewood, NJ)を含む氷上の50 mlコニカルチューブ内に移した。上清を除去し、心臓全体を冷HBSSで1回、激しく攪拌しながら洗浄した。この心臓を、5 mlの冷HBSSを含む100 mmの培養皿に移し、付着組織を除去し、残存する組織を1 mm2未満の小片に刻んだ。さらにHBSSを添加して、総プレート容量を9 mlとし、これに1 mlのトリプシン(試薬#2、Worthingtonキット)を添加して最終濃度を50μg/mlとした。プレートを5℃の冷却器内で一晩、インキュベートした。
【0100】
2日目に、プレートを冷却器から取り出し、無菌フード内で氷上に置いた。組織およびトリプシンを含む緩衝液を、氷上の50 mlコニカルチューブに広口ピペットを使用して移した。トリプシン阻害剤(試薬#3)を1 mlのHBSS(試薬#1)で再構成し、50 mlのコニカルチューブに加えて穏やかに混合した。この組織に、液体の表面上に60〜90秒間空気を通すことで酸素を添加した。次に、この組織を37℃に加温し、および5 mlのリーボビッツ(Leibovitz)L-15で再構成したコラゲナーゼ(300単位/ml)をゆっくりと加えた。この組織を、37℃に加温した振盪浴中に45分間置いた。次に、10 mlのピペットを使用してこの組織を10回滴定して(3 ml/秒)、細胞を遊離させ、次に0.22μmのフィルターで濾過した。この組織をさらに5 mlのL-15培地で洗浄し、2回目の滴定を行い、同じ50 mlのコニカルチューブ中に回収した。次に細胞溶液を室温で20分間インキュベートし、50 xgで5分間、遠心分離して細胞を沈殿させた。上清を穏やかに除去し、細胞を、Neonatal-Cardiomyocyte培地を使用して所望の容積に再懸濁した。
【0101】
培地および溶液
全ての培地を滅菌濾過し、5℃の冷却器内で暗条件で保存した。Worthington単離キットは、推奨培地であるリーボビッツL-15を培養用に含む。この培地は、2日目の組織処理のみに使用した。プレーティング時は、本明細書に記載された交代性のカルシウム含有培地を使用した。
WorthingtonリーボビッツL-15培地:リーボビッツ培地の粉末を、1 Lの細胞培養グレードの水を使用して再生した。リーボビッツL-15培地は、140 mg/mlのCaCl、93.68 mg/mlのMgCl、および97.67 mg/mlのMgSを含む。
新生仔心筋細胞培地:イスコフ改変ダルベッコ培地(Gibco, Cat. No. 12440-053)に、10%ウシ胎児血清(HyClone)、100 U/mlペニシリン-G(Gibco)、100 U/mlストレプトマイシン(Gibco)、2 mmol/L L-グルタミン(Invitrogen)、および0.1 mmol/L 2-メルカプトエタノール(Gibco, Cat. No. 21985-023)を加え、使用前に無菌処理した。必要に応じて、アムホテリシン-Bを添加した(最終濃度0.25μg/ml)。この培地を、1.2 mMのCaCl(Fisher Scientific, Cat. No. C614-500)、および0.8 mMのMgCl(Sigma, Cat. No. M-0250)で強化した。
【0102】
再細胞化のインビトロ培養解析
生体人工心臓の作製の第一歩として、単離されたECMを、新生仔の心臓由来の細胞で再細胞化した。完全に脱細胞化された心臓(本明細書に記載された手順で作製)に、50 x 106個の新たに単離したラット新生仔の心筋細胞、線維芽細胞、内皮細胞、および平滑筋細胞を組み合わせて注入した。次に心組織を切片化し、切片をインビトロで培養して、脱細胞化されたECMの生体適合性、および結果として得られた構築物の心筋環(myocardium ring)形成能力を試験した。
【0103】
結果として生じた環の内部において、わずかな収縮が、24時間後に微視的に認められ、移植された細胞が、脱細胞化ECMに付着して生着可能なことが証明された。微視的には、細胞はECM繊維の方向に沿って配向していた。免疫蛍光染色によって、心臓ミオシン重鎖を発現する心筋細胞の生存および生着が確認された。4日以内に、収縮性の細胞パッチ(cell patch)の塊が脱細胞化マトリックス上に観察され、これは8日目には同期的に収縮する組織環(tissue ring)に進行した。
【0104】
10日目に、これらの環を2本のロッドの間にマウントし、収縮力をさまざまな前負荷条件で測定した。環は、4 Hzの頻度に電気的にペースアップ可能であり、最大0.65 gの前負荷の下で最大3 mNの収縮力を生じた。したがって、この再細胞化のインビトロ組織培養法では、人工ECM構築物を使用して最適化された人工心組織の環によって生じる力と同等に有効な力を生じる収縮性組織が得られた。
【0105】
灌流による脱細胞化心臓の再細胞化
再細胞化された(50 x 106個の単離直後の新生ラットの心筋細胞、線維芽細胞、内皮細胞、および平滑筋細胞)の足場を、前負荷および後負荷(1日目:前負荷4〜12 mmHg、後負荷3〜7 mmHg)、拍動性冠血流(1日目:7 ml/分)、および無菌の心臓組織培養条件(5% CO2、60% H2O、37℃)における電気刺激(2日目:1 Hz)の漸進的な増加による拍動性の左心室の膨満を含む、ラットの心臓生理学を模した、灌流可能なバイオリアクター(n=10)内にマウントした。灌流後の臓器の培養は、1〜4週間維持した。圧力、流量、およびEKGを、培養時間の全体を通じて、15分毎に30秒間記録した。新生期の生体人工心臓の映像を、細胞播種の4日後、6日後、および10日後に記録した。
【0106】
細胞播種から10日後に、左心室圧(LVP)の記録用の左心室への圧力プローブの挿入を含む、より詳細な機能評価を行い、刺激周波数を0.1 Hz〜10 Hzに次第に上昇させながら壁の運動を映像で記録し、さらにフェニレフリン(PE)による薬理学的刺激を行った。再細胞化された心臓は、1回のペースに対して自発的な収縮を伴う収縮性の反応を示し、続いてLVPの対応する上昇を伴うペース収縮を示した。1回のペースの後、心臓は3回の自発的な収縮を示し、次に細動状態へと変換した。刺激による収縮と同様に、自発的な脱分極は、LVPの対応する上昇と、安定的な伝導パタ−ンの発生の形成をおそらく示す記録可能なQRS波とを生じた。
【0107】
刺激頻度を0.4 Hzに高めると、平均2回の自発的な収縮が各誘導収縮後に生じ;1 Hzまでのぺーシング頻度では1回のみの自発的な収縮が生じ;および5 Hzのぺーシング頻度では、自発的な収縮は生じなかった。最大捕捉率(maximum capture rate)は、成熟心筋の場合の250 msの不応期と一致する5 Hzであった。100μMのPEによる灌流後、通常の自発的な脱分極が1.7 Hzの頻度で生じ、LVPにおける対応する上昇とカップリングしていた。
【0108】
10日目における組織学的解析によって、細胞の分散および生着が、左室壁の層全体(0.5〜1.2 mm)にわたることが明らかとなった。心筋細胞は、心室の繊維の方向に並び、かつ成熟心筋に類似した緻密な器質化した移植片の領域、および発生中の心筋と類似した、それほど稠密でない未成熟の移植片の領域を形成した。心臓ミオシン重鎖の免疫蛍光染色によって、心筋細胞の表現型が確認された。高い毛細血管密度が、新たに発生した心筋の全体にわたって維持されており、毛細血管間の平均距離は約20μmであり、これは成熟ラット心筋について報告された値と同等であった。内皮細胞の表現型は、フォンビルブラント因子(vWF)に関する免疫蛍光染色で確認された。細胞の生存は、移植片の全層を通じて維持されており、冠灌流の全体に酸素および栄養が十分に供給されていることがわかった。
【0109】
その他の態様
本発明を、本発明の詳細な説明と関連して説明したが、以上の説明は説明目的であって、添付の特許請求の範囲によって規定される本発明の範囲を制限する意図はないと理解されたい。他の局面、利点、および改変は、添付の特許請求の範囲に含まれる。
【特許請求の範囲】
【請求項1】
臓器の脱細胞化された細胞外マトリックスを含む、脱細胞化された哺乳類臓器であって、
該細胞外マトリックスが外表面を含み、
血管樹(vascular tree)を含む該細胞外マトリックスが、脱細胞化前の該細胞外マトリックスの形態を実質的に保持し、かつ
該外表面が、実質的にインタクトである、
脱細胞化された哺乳類臓器。
【請求項2】
死体の臓器である、請求項1記載の脱細胞化された臓器。
【請求項3】
心臓である、請求項1記載の脱細胞化された臓器。
【請求項4】
心臓が、齧歯類の心臓、ブタの心臓、ウサギの心臓、ウシの心臓、ヒツジの心臓、またはイヌの心臓である、請求項3記載の脱細胞化された臓器。
【請求項5】
心臓がヒトの心臓である、請求項4記載の脱細胞化された臓器。
【請求項6】
心臓が心臓全体の一部である、請求項3記載の脱細胞化された臓器。
【請求項7】
心臓全体の一部が、大動脈弁、僧帽弁、肺動脈弁、三尖弁、右心房、左心房、右心室、左心室、心臓パッチ(cardiac patch)、中隔、冠血管、肺動脈、および肺静脈である、請求項6記載の脱細胞化された臓器。
【請求項8】
腎臓である、請求項1記載の脱細胞化された臓器。
【請求項9】
腎臓が、実質的にインタクトな糸球体構造を含む、請求項8記載の脱細胞化された臓器。
【請求項10】
請求項1記載の脱細胞化された臓器、およびこれに付着する再生細胞の集団を含む固形臓器。
【請求項11】
血管を含む多数の組織学的構造を含む、請求項10記載の固形臓器。
【請求項12】
脱細胞化された臓器が、心臓、腎臓、肝臓、または肺である、請求項10記載の固形臓器。
【請求項13】
脱細胞化された臓器が心臓である、請求項10記載の固形臓器。
【請求項14】
収縮活性を示す、請求項13記載の固形臓器。
【請求項15】
脱細胞化された臓器に付着する再生細胞の数が少なくとも約1,000個である、請求項10記載の固形臓器。
【請求項16】
脱細胞化された臓器に付着する再生細胞の数が、約1,000細胞/mg組織〜約10,000,000細胞/mg組織である、請求項10記載の固形臓器。
【請求項17】
再生細胞が多能性細胞である、請求項10記載の固形臓器。
【請求項18】
再生細胞が、胚性幹細胞もしくはそのサブセット、臍帯細胞もしくはそのサブセット、骨髄細胞もしくはそのサブセット、末梢血細胞もしくはそのサブセット、成体由来の幹細胞もしくは前駆細胞またはそのサブセット、組織由来の幹細胞もしくは前駆細胞またはそのサブセット、間葉系幹細胞(MSC)もしくはそのサブセット、骨格筋由来の幹細胞もしくは前駆細胞またはそのサブセット、多能性成体前駆細胞(MAPC)もしくはそのサブセット、心臓幹細胞(CSC)もしくはそのサブセット、または多能性成体心臓由来幹細胞もしくはそのサブセットである、請求項10記載の固形臓器。
【請求項19】
再生細胞が、心臓線維芽細胞、心臓微小血管系内皮細胞、または大動脈内皮細胞である、請求項10記載の固形臓器。
【請求項20】
再生細胞が、脱細胞化された臓器に対して同種または異種である、請求項10記載の固形臓器。
【請求項21】
固形臓器が患者に移植され、かつ再生細胞が該患者に対して自家である、請求項10記載の固形臓器。
【請求項22】
固形臓器が患者に移植され、かつ脱細胞化された臓器が該患者に対して同種または異種である、請求項10記載の固形臓器。
【請求項23】
請求項1記載の脱細胞化された臓器を提供する段階、ならびに
再生細胞が、該脱細胞化された臓器の内部もしくは表面で生着、増殖、および/または分化する条件下で、該脱細胞化された臓器に該再生細胞の集団を接触させる段階を含む、
臓器を作製する方法。
【請求項24】
再生細胞が、脱細胞化された臓器に注入される、請求項23記載の方法。
【請求項25】
脱細胞化された臓器が、心臓、腎臓、肝臓、脾臓、膵臓、または肺である、請求項23記載の方法。
【請求項26】
以下の段階を含む、臓器を脱細胞化する方法:
臓器を提供する段階;
1か所もしくは複数の腔、血管、および/または管において、カニューレを該臓器に挿入することで、カニューレが挿入された臓器を作製する段階;ならびに
カニューレが挿入された該臓器に第1の細胞破壊媒体を、1か所もしくは複数のカニューレ挿入を介して灌流する段階。
【請求項27】
血管樹の全体に第1の細胞破壊媒体を本質的に接触させる、請求項26記載の方法。
【請求項28】
臓器が、心臓、腎臓、肝臓、脾臓、膵臓、または肺である、請求項26記載の方法。
【請求項29】
灌流が、カニューレが挿入された各々の腔、血管、および/または管から多方向へ向かう、請求項26記載の方法。
【請求項30】
細胞破壊媒体が少なくとも1種類の界面活性剤を含む、請求項26記載の方法。
【請求項31】
界面活性剤が、SDS、PEG、またはTriton Xからなる群より選択される、請求項30記載の方法。
【請求項32】
カニューレが挿入された臓器に第2の細胞破壊媒体を、1か所もしくは複数のカニューレ挿入を介して灌流する段階をさらに含む、請求項26記載の方法。
【請求項33】
第1の細胞破壊媒体が陰イオン性界面活性剤であり、第2の細胞破壊媒体がイオン性界面活性剤である、請求項32記載の方法。
【請求項34】
陰イオン性界面活性剤がSDSであり、イオン性界面活性剤がTriton Xである、請求項33記載の方法。
【請求項35】
灌流段階が、臓器組織1 gあたり約2〜12時間にわたる、請求項26記載の方法。
【請求項36】
組織の脱細胞化された細胞外マトリックスを含む、脱細胞化された血管性の哺乳類組織であって、
該細胞外マトリックスが外表面を含み、
血管樹を含む該細胞外マトリックスが、脱細胞化前の該細胞外マトリックスの形態を実質的に保持し、かつ
該外表面が、実質的にインタクトである、
脱細胞化された血管性の哺乳類組織。
【請求項37】
死体の組織である、請求項36記載の脱細胞化された組織。
【請求項38】
脊髄、気管、もしくは関節、またはこれらの一部である、請求項36記載の脱細胞化された組織。
【請求項39】
組織の脱細胞化された細胞外マトリックスを含む、脱細胞化された無血管性の哺乳類組織であって、
該細胞外マトリックスが外表面を含み、
該細胞外マトリックスが、脱細胞化前の該細胞外マトリックスの形態を実質的に保持し、かつ
該外表面が実質的にインタクトである、
脱細胞化された無血管性の哺乳類組織。
【請求項40】
軟骨または角膜である、請求項39記載の脱細胞化された組織。
【請求項41】
死体の組織である、請求項39記載の脱細胞化された組織。
【請求項1】
臓器の脱細胞化された細胞外マトリックスを含む、脱細胞化された哺乳類臓器であって、
該細胞外マトリックスが外表面を含み、
血管樹(vascular tree)を含む該細胞外マトリックスが、脱細胞化前の該細胞外マトリックスの形態を実質的に保持し、かつ
該外表面が、実質的にインタクトである、
脱細胞化された哺乳類臓器。
【請求項2】
死体の臓器である、請求項1記載の脱細胞化された臓器。
【請求項3】
心臓である、請求項1記載の脱細胞化された臓器。
【請求項4】
心臓が、齧歯類の心臓、ブタの心臓、ウサギの心臓、ウシの心臓、ヒツジの心臓、またはイヌの心臓である、請求項3記載の脱細胞化された臓器。
【請求項5】
心臓がヒトの心臓である、請求項4記載の脱細胞化された臓器。
【請求項6】
心臓が心臓全体の一部である、請求項3記載の脱細胞化された臓器。
【請求項7】
心臓全体の一部が、大動脈弁、僧帽弁、肺動脈弁、三尖弁、右心房、左心房、右心室、左心室、心臓パッチ(cardiac patch)、中隔、冠血管、肺動脈、および肺静脈である、請求項6記載の脱細胞化された臓器。
【請求項8】
腎臓である、請求項1記載の脱細胞化された臓器。
【請求項9】
腎臓が、実質的にインタクトな糸球体構造を含む、請求項8記載の脱細胞化された臓器。
【請求項10】
請求項1記載の脱細胞化された臓器、およびこれに付着する再生細胞の集団を含む固形臓器。
【請求項11】
血管を含む多数の組織学的構造を含む、請求項10記載の固形臓器。
【請求項12】
脱細胞化された臓器が、心臓、腎臓、肝臓、または肺である、請求項10記載の固形臓器。
【請求項13】
脱細胞化された臓器が心臓である、請求項10記載の固形臓器。
【請求項14】
収縮活性を示す、請求項13記載の固形臓器。
【請求項15】
脱細胞化された臓器に付着する再生細胞の数が少なくとも約1,000個である、請求項10記載の固形臓器。
【請求項16】
脱細胞化された臓器に付着する再生細胞の数が、約1,000細胞/mg組織〜約10,000,000細胞/mg組織である、請求項10記載の固形臓器。
【請求項17】
再生細胞が多能性細胞である、請求項10記載の固形臓器。
【請求項18】
再生細胞が、胚性幹細胞もしくはそのサブセット、臍帯細胞もしくはそのサブセット、骨髄細胞もしくはそのサブセット、末梢血細胞もしくはそのサブセット、成体由来の幹細胞もしくは前駆細胞またはそのサブセット、組織由来の幹細胞もしくは前駆細胞またはそのサブセット、間葉系幹細胞(MSC)もしくはそのサブセット、骨格筋由来の幹細胞もしくは前駆細胞またはそのサブセット、多能性成体前駆細胞(MAPC)もしくはそのサブセット、心臓幹細胞(CSC)もしくはそのサブセット、または多能性成体心臓由来幹細胞もしくはそのサブセットである、請求項10記載の固形臓器。
【請求項19】
再生細胞が、心臓線維芽細胞、心臓微小血管系内皮細胞、または大動脈内皮細胞である、請求項10記載の固形臓器。
【請求項20】
再生細胞が、脱細胞化された臓器に対して同種または異種である、請求項10記載の固形臓器。
【請求項21】
固形臓器が患者に移植され、かつ再生細胞が該患者に対して自家である、請求項10記載の固形臓器。
【請求項22】
固形臓器が患者に移植され、かつ脱細胞化された臓器が該患者に対して同種または異種である、請求項10記載の固形臓器。
【請求項23】
請求項1記載の脱細胞化された臓器を提供する段階、ならびに
再生細胞が、該脱細胞化された臓器の内部もしくは表面で生着、増殖、および/または分化する条件下で、該脱細胞化された臓器に該再生細胞の集団を接触させる段階を含む、
臓器を作製する方法。
【請求項24】
再生細胞が、脱細胞化された臓器に注入される、請求項23記載の方法。
【請求項25】
脱細胞化された臓器が、心臓、腎臓、肝臓、脾臓、膵臓、または肺である、請求項23記載の方法。
【請求項26】
以下の段階を含む、臓器を脱細胞化する方法:
臓器を提供する段階;
1か所もしくは複数の腔、血管、および/または管において、カニューレを該臓器に挿入することで、カニューレが挿入された臓器を作製する段階;ならびに
カニューレが挿入された該臓器に第1の細胞破壊媒体を、1か所もしくは複数のカニューレ挿入を介して灌流する段階。
【請求項27】
血管樹の全体に第1の細胞破壊媒体を本質的に接触させる、請求項26記載の方法。
【請求項28】
臓器が、心臓、腎臓、肝臓、脾臓、膵臓、または肺である、請求項26記載の方法。
【請求項29】
灌流が、カニューレが挿入された各々の腔、血管、および/または管から多方向へ向かう、請求項26記載の方法。
【請求項30】
細胞破壊媒体が少なくとも1種類の界面活性剤を含む、請求項26記載の方法。
【請求項31】
界面活性剤が、SDS、PEG、またはTriton Xからなる群より選択される、請求項30記載の方法。
【請求項32】
カニューレが挿入された臓器に第2の細胞破壊媒体を、1か所もしくは複数のカニューレ挿入を介して灌流する段階をさらに含む、請求項26記載の方法。
【請求項33】
第1の細胞破壊媒体が陰イオン性界面活性剤であり、第2の細胞破壊媒体がイオン性界面活性剤である、請求項32記載の方法。
【請求項34】
陰イオン性界面活性剤がSDSであり、イオン性界面活性剤がTriton Xである、請求項33記載の方法。
【請求項35】
灌流段階が、臓器組織1 gあたり約2〜12時間にわたる、請求項26記載の方法。
【請求項36】
組織の脱細胞化された細胞外マトリックスを含む、脱細胞化された血管性の哺乳類組織であって、
該細胞外マトリックスが外表面を含み、
血管樹を含む該細胞外マトリックスが、脱細胞化前の該細胞外マトリックスの形態を実質的に保持し、かつ
該外表面が、実質的にインタクトである、
脱細胞化された血管性の哺乳類組織。
【請求項37】
死体の組織である、請求項36記載の脱細胞化された組織。
【請求項38】
脊髄、気管、もしくは関節、またはこれらの一部である、請求項36記載の脱細胞化された組織。
【請求項39】
組織の脱細胞化された細胞外マトリックスを含む、脱細胞化された無血管性の哺乳類組織であって、
該細胞外マトリックスが外表面を含み、
該細胞外マトリックスが、脱細胞化前の該細胞外マトリックスの形態を実質的に保持し、かつ
該外表面が実質的にインタクトである、
脱細胞化された無血管性の哺乳類組織。
【請求項40】
軟骨または角膜である、請求項39記載の脱細胞化された組織。
【請求項41】
死体の組織である、請求項39記載の脱細胞化された組織。
【図1】


【図2】




【図2】


【公開番号】特開2013−56183(P2013−56183A)
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−248398(P2012−248398)
【出願日】平成24年11月12日(2012.11.12)
【分割の表示】特願2008−528231(P2008−528231)の分割
【原出願日】平成18年8月28日(2006.8.28)
【出願人】(507197708)リージェンツ オブ ザ ユニバーシティ オブ ミネソタ (8)
【Fターム(参考)】
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願番号】特願2012−248398(P2012−248398)
【出願日】平成24年11月12日(2012.11.12)
【分割の表示】特願2008−528231(P2008−528231)の分割
【原出願日】平成18年8月28日(2006.8.28)
【出願人】(507197708)リージェンツ オブ ザ ユニバーシティ オブ ミネソタ (8)
【Fターム(参考)】
[ Back to top ]

