臨床検査システム,臨床検査法方法及び前処理用器材
【課題】濾液を一時回収することなく固相の抽出が可能な臨床検査システム,臨床検査法方法及び前処理用器材を提供することにある。
【解決手段】臨床検査システムは、生体試料から測定対象成分を抽出する前処理部100と、前処理部により抽出された測定対象成分を質量分析する質量分析部200とを有する。前処理部100において、カートリッジテーブル120には、上流側のフィルター部を有するフィルターユニット112と下流側の固相抽出剤を有する固相抽出ユニット114が連結した前処理用器材110を、複数の設置される。分注機構132は、カートリッジテーブルに設置された前処理用器材に対して所定の溶液を供給する。圧力付加機構134は、カートリッジテーブルに設置された前処理用器材の内部の溶液に圧力を付加する。撹拌機構136は、カートリッジテーブルに設置された前処理用器材の内部の溶液を撹拌する。
【解決手段】臨床検査システムは、生体試料から測定対象成分を抽出する前処理部100と、前処理部により抽出された測定対象成分を質量分析する質量分析部200とを有する。前処理部100において、カートリッジテーブル120には、上流側のフィルター部を有するフィルターユニット112と下流側の固相抽出剤を有する固相抽出ユニット114が連結した前処理用器材110を、複数の設置される。分注機構132は、カートリッジテーブルに設置された前処理用器材に対して所定の溶液を供給する。圧力付加機構134は、カートリッジテーブルに設置された前処理用器材の内部の溶液に圧力を付加する。撹拌機構136は、カートリッジテーブルに設置された前処理用器材の内部の溶液を撹拌する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、臨床検査システム,臨床検査法方法及び前処理用器材に係り、特に、臨床検査向けの検体前処理に好適な臨床検査システム,臨床検査法方法及び前処理用器材に関する。
【背景技術】
【0002】
混合試料からの目的成分抽出には、目的成分のサイズ、重量、形状のような物理的性質や、溶解性、親和性のような生化学的な性質を指標とした様々な技術が知られている。特に、血液のような生体試料中の微量成分の抽出に関しては、クロマトグラフィーによる分離技術が発達しており、目的成分に適した充填剤の開発やメソッドの至適化がなされている。しかしながら、このような高度な分離技術を用いる場合であっても、様々な細胞や異なった諸性質を示す多成分で構成される血液から目的の微量成分を効率良く抽出するためには、抽出可能な状態にするための試料調製や粗精製が必須となる。
【0003】
血液中の微量成分を測定する臨床検査方法として、血中治療薬物モニタリング(TDM:Therapeutic Drug Monitoring)が挙げられる。TDMは、薬効を示す治療域が狭い薬剤等に適用され、投薬後の患者血液中の薬剤濃度を経時的に確認することにより、患者ごとに適正な投与設計を実践するために必要な検査である。
【0004】
TDMの対象薬剤として、抗てんかん剤、抗菌剤、免疫抑制剤、抗不整脈剤、抗精神剤等が挙げられる。多くの薬剤は血清中に分布するが、例えば臓器移植患者等に投与される免疫抑制剤は脂溶性が高く、血球移行性があるため、その血中濃度を測定する場合には、全血を用いて、その全血を溶血させて血球内容物を取り出した後にタンパク質等に吸着している薬剤を抽出する前処理が必要となる。
【0005】
溶血には、化学的、物理的、生物学的な原理を応用して実施することができる。例えば、化学的な方法としては、各種溶媒や界面活性剤により細胞膜を構成する脂質を溶解あるいは損傷させることにより溶血を引き起こす方法がある。物理学的な方法としては、圧力、遠心力、撹拌、凍結融解、低張化等がある。生物学的な方法としては、血球への抗体や補体結合に起因する膜貫通タンパク質複合体形成や病原性細菌が産生する溶血素(ヘモリジン)による血球細胞膜への孔形成等がある。
【0006】
特に、低張化による血球バーストは原理的に単純であり、血液の塩濃度をH2O等で希釈することにより血球周囲の浸透圧を下げ、血球内に過剰に水分を取り込ませることにより細胞膜を破裂させる方法である。一般的な生理食塩水濃度は、0.9%NaCl相当であるが、0.5〜0.35%NaCl相当まで希釈すると溶血現象を起こすことが知られている。
【0007】
例えば、臨床現場では検体ごとに血液の組成が異なり、高脂血症患者のように粘性が著しく高い検体も存在する。血液をH2Oで希釈することは、溶血効果だけでなく、検体の粘性を緩和する効果もあり、溶血後の成分抽出プロセスを容易にすることにも有効である。
【0008】
また、亜鉛のキレーティング効果を応用することにより、γグロブリンのような血液中に多量に存在する主要タンパク質を凝集させ、沈殿させることができる。この目的のため、H2Oの代わりにZTT検査(Zinc sulfate Turbidity Test,:硫酸亜鉛混濁試験)にも用いられている硫酸亜鉛水溶液を血液に添加することにより、溶血と同時に除タンパク質をも合わせて行う方法も一般的に行われている。
【0009】
一方、血液中のタンパク質に吸着している目的成分を回収する方法として、除タンパク質処理あるいは液/液抽出がある。溶血処理したサンプルに有機溶媒を添加することにより、目的成分を有機溶媒側に抽出するとともに、タンパク質を変性させ、一般的には遠心分離することによって凝集タンパク質と上清を分離した後、上清分を回収している。除タンパク質処理は、血中に多種多様かつ大量に含まれているタンパク質を凝集させることによって除去する工程であり、このような処理を施すことによってはじめて全血由来の試料を血清あるいは血漿検体と同等に扱える状態になる。
【0010】
有機溶媒は、前述のように溶血効果もあるため、直接血液に添加して溶血、液/液抽出、除タンパク質を行う方法もある。また、そのときに除タンパク質効果を補足するため、前述の硫酸亜鉛を添加する方法もある。
【0011】
全血検体に前記のような処理を施すことによって、血球移行性の薬剤を溶液状態で回収することができるため、例えば、固相抽出処理や液体クロマトグラフィー分離等のような精製操作に供試することが可能となる。一般的には、液/液抽出後の回収上清はドライアップした後、適切な容量の溶解液で再溶解することにより、液量の低減と目的成分の濃縮を行う。その後、例えば、再溶解物を液体クロマトグラフィー質量分析計(LCMS:Liquid Chromatograph Mass Spectrometer)等に供試することにより、濃縮後の目的成分の分離精製と検出を行い、目的成分の同定や定量解析を実施する。
【0012】
このような全血検体を対象とした溶血処理や除タンパク質処理は、従来より用手方法で一般的に行われているが、自動化した装置は知られていない。特に、TDMに関しては、患者個別に治療域の狭い薬剤の投与設計を行うために、試料調製は高い再現性で実現できることが求められる。
【0013】
ここで、従来、複数の多孔性支持層と固相抽出媒体とを含む、固相抽出に使用する一体型多層品を用い、多孔性支持層が熱機械的取り付け場所に熱機械的に取り付けられ、多孔性支持層の少なくとも一方は前置フィルター層にすることができるものが知られている(例えば、特許文献1参照)。これは、固相抽出ディスクに相当するものであり、例えば、固相抽出媒体としては、PTFE(Polytetrafluoroethylene)ウェッブ内に逆相シリカ粒子を導入したメンブレン状固相抽出剤が用いている。
【0014】
また、固相抽出カラムとしては、例えばシリンジ状の容器に固相抽出剤を充填したものであり、その充填剤を保持するために充填剤の上流と下流をフィルター(フリット)で挟んだ構造のものが知られている(例えば、特許文献2参照)。
【0015】
さらに、生体試料中の夾雑物や微細成分を濾過するフィルターが知られている(例えば、特許文献3参照)。
【0016】
また、LCに用いる分離あるいは分取カラムも、固相抽出カラムと同様に充填剤をフリット(フィルター部を有する部品)で挟み込んだ構造であることが知られている(例えば、特許文献4参照)。
【先行技術文献】
【特許文献】
【0017】
【特許文献1】特表2002−524243号公報
【特許文献2】特許第4062637号公報
【特許文献3】特開2007−199050号公報
【特許文献4】特許第4219564号号公報
【発明の概要】
【発明が解決しようとする課題】
【0018】
しかしながら、特許文献1記載のものは、固相抽出媒体が平面状になるため、微容量試料中の微量成分の抽出には適さない構造である。すなわち、このような微量成分を微量な充填剤を用いて効率良く抽出するためには、微量成分と固相抽出媒体との接触効率を高める必要があり、平面状ではなく細管状に充填した固相抽出媒体に供試することが望ましい。その場合、多孔性支持層が熱機械的取り付け場所に熱機械的に取り付けることを実現することは構造的に困難である。
【0019】
また、特許文献2記載のものは、構成的には、試料はフィルターを介して固相抽出剤に移行するため、血液等の夾雑物を多量に含んだ試料や除タンパク質処理後の凝集タンパク質を含んだ試料を直接固相抽出に供試しても、フィルターは目詰まりを起こし、目的の上清成分を回収することはできないものである。
【0020】
さらに、特許文献3記載のフィルターでは、濾液を一時回収する工程が必要となる。濾液を一時回収する場合には、回収した溶液から再度試料を分注する工程が必要となり、その際、回収した溶液を100%は分注できないため、試料のロスが発生し、試料の微量化を図ることができないものである。
【0021】
また、特許文献4に記載のようなLCに用いる分離あるいは分取カラムの場合は流路が細いため、前処理なしに生体試料を直接供試することは原理的に不可能である。
【0022】
本発明の目的は、濾液を一時回収することなく固相の抽出が可能な臨床検査システム,臨床検査法方法及び前処理用器材を提供することにある。
【課題を解決するための手段】
【0023】
(1)上記目的を達成するために、本発明は、生体試料から測定対象成分を抽出する前処理部と、該前処理部により抽出された測定対象成分を質量分析する質量分析部とを有する臨床検査システムであって、前記前処理部は、上流側のフィルター部を有するフィルターユニットと下流側の固相抽出剤を有する固相抽出ユニットが連結した前処理用器材を、複数設置するカートリッジテーブルと、該カートリッジテーブルに設置された前記前処理用器材に対して所定の溶液を供給する複数の分注機構と、前記カートリッジテーブルに設置された前記前処理用器材の内部の溶液に圧力を付加する複数の圧力付加機構と、前記カートリッジテーブルに設置された前記前処理用器材の内部の溶液を撹拌する複数の撹拌機構とを備えるようにしたものである。
かかる構成により、濾液を一時回収することなく固相の抽出が可能となる。
【0024】
(2)上記(1)において、好ましくは、前記前処理用器材の前記フィルターユニットと前記固相抽出ユニットとは、脱着可能に連結されており、前記カートリッジテーブルに設置された前記前処理容器材の前記フィルターユニットを取り外す前処理用器材移動機構を備えるようにしたものである。
【0025】
(3)また、上記目的を達成するために、本発明は、生体試料から測定対象成分を抽出し、分析する臨床検査方法であって、上流側に位置し、フィルター部を有するフィルターユニットと下流側に位置し、固相抽出剤を有する固相抽出ユニットが連結した前処理用器材を用い、前記フィルターユニット内で試料と試薬を反応させ、反応産物を前記フィルター部による濾過処理により濾液と残渣に分別し、残渣をフィルターユニット側に残した状態を保ちながら、濾液の一時回収操作なしに直接濾液を固相抽出ユニットに供給し、測定対象成分を前記固相抽出ニットの固相抽出充填剤に捕捉させるとともに非吸着成分を固相抽出充填剤から素通りさせることで廃棄し、前記固相抽出充填剤に非特異的あるいは弱く吸着した前記測定対象成分とは異なる不要な夾雑成分を洗浄除去し、最後に前記測定対象成分を特異的に前記固相抽出充填剤から溶出可能な条件下で回収し、回収した前記測定対象成分を質量分析するようにしたものである。
かかる方法により、濾液を一時回収することなく固相の抽出が可能となる。
【0026】
(4)上記(3)において、好ましくは、前記生体試料は全血であり、前記フィルター部における濾過処理時の除タンパク質処理に用いる溶液,前記固相抽出剤による固相抽出時に用いる溶液として、濃度50%以上のメタノールを用いるようにしたものである。
【0027】
(5)上記(3)において、好ましくは、前記測定対象成分は、免疫抑制剤成分である。
【0028】
(6)さらに、上記目的を達成するために、本発明は、臨床検査システムの前処理に用いられる前処理用器材であって、上流側のフィルター部を有するフィルターユニットと、該フィルターユニットに連結され、固相抽出剤を有する固相抽出ユニットとを備えるようにしたものである。
かかる構成により、濾液を一時回収することなく固相の抽出が可能となる。
【0029】
(7)上記(6)において、好ましくは、前記フィルターユニットと前記固相抽出ユニットとは、脱着可能に連結されているものである。
【0030】
(8)上記(6)において、好ましくは、前記フィルターユニットと前記固相抽出ユニットとは、一体的に連結されているとともに、前記フィルターユニットの前記フィルター材は、前記固相抽出ユニットの前記固相抽出剤の上流側のフリットを兼用するようにしたものである。
【0031】
(9)上記(6)において、好ましくは、前記フィルターユニットの前記フィルター材の面積は、前記固相抽出ユニットの前記固相抽出剤の上流側のフリット以上の面積を有するものである。
【0032】
(10)上記(6)において、好ましくは、前記固相抽出ユニットの前記固相抽出剤の充填高が、前記固相抽出ユニットの前記固相抽出剤の上流側のフリットの直径以上である。
【発明の効果】
【0033】
本発明によれば、濾液を一時回収することなく固相の抽出が可能となる。
【図面の簡単な説明】
【0034】
【図1】本発明の第1の実施形態による臨床分析システムの全体構成を示すブロック図である。
【図2】本発明の第1の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【図3】本発明の第1の実施形態による臨床分析システムの分析処理の内容の説明図である。
【図4】本発明の第1の実施形態による臨床分析システムで分析する免疫抑制剤のメタノール溶解性の説明図である。
【図5】本発明の第2の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【図6】本発明の第3の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【発明を実施するための形態】
【0035】
以下、図1〜図4を用いて、本発明の第1の実施形態による臨床分析システムの構成及び動作について説明する。
【0036】
最初に、図1を用いて、本実施形態による臨床分析システムの全体構成について説明する。
【0037】
図1は、本発明の第1の実施形態による臨床分析システムの全体構成を示すブロック図である。
【0038】
図1に示す本実施形態の臨床分析システムは、血液成分の臨床分析システムであって、全血および血清・血漿の前処理を行う前処理部100と、前処理のされたサンプルを質量分析する質量分析部200と、制御部300とからなる。なお、本実施例でいう前処理は、質量分析部へ導入する前段までの工程またはその工程の各要素のことである。
【0039】
最初に、前処理部100の構成について説明する。前処理部100は、カートリッジテーブル120と、カートリッジテーブル120の周囲に配置された2カ所のカートリッジ移動機構130,130Bと、8カ所の分注機構132A,…,132Hと、6カ所の圧力付加機構134A,…,134Fと、3カ所の撹拌機構136A,136B,136Cとから構成される。
【0040】
質量分析部200は、質量分析装置202と、イオン化部204と、前処理サンプル導入機構206とから構成される。
【0041】
制御部300は、前処理部100の各部及び質量分析部200の各部を制御する。
【0042】
カートリッジテーブル120は、無限軌道上に19個のカートリッジ(前処理器材)110を設置できる。カートリッジテーブル120は、無限軌道上を一定のピッチで回転することで、各工程の作業位置にカートリッジ110を移送し効率良く前処理を行うことができる。本例では、カートリッジテーブル120は、円形であり、一定時間毎に、時計回りに約19度(=360度/19)の角度回転する。カートリッジテーブル120が約19度回転すると、その位置で暫く停止し、一定時間経過すると、さらに、約19度回転する動作を繰り返す。
【0043】
なお、本例ではカートリッジ間の間隔は一定でなくてもよく、その場合にはピッチのスピードを調整することになる。
【0044】
カートリッジ110は、図2を用いて後述するように、フィルターユニットと固相抽出ユニットが連結された構成である。
【0045】
カートリッジ移動機構130は、カートリッジテーブル120の位置Aにおいて、新しいカートリッジ110をカートリッジテーブル120に設置し、また、使用済みのカートリッジ110を除去して廃棄する。
【0046】
分注機構132A,…,132Hは、カートリッジテーブル120の位置B,D,F,G,I,M,P,Rに配置されている。位置Bにおいて、分注機構132Aは、カートリッジ110に有機溶媒(メタノール等)を分注する。位置Dにおいて、分注機構132Bは、カートリッジ110に水を分注する。位置Fにおいて、分注機構132Cは、カートリッジ110に全血の検体を分注する。位置Gにおいて、分注機構132Dは、カートリッジ110に溶血処理液(硫酸亜鉛水溶液等)を分注する。位置Iにおいて、分注機構132Eは、カートリッジ110に除タンパク質液(メタノール等)を分注する。位置Mにおいて、分注機構132Fは、カートリッジ110に内部標準物質を分注する。位置Pにおいて、分注機構132Gは、カートリッジ110に洗浄液(水等)を分注する。位置Rにおいて、分注機構132Hは、カートリッジ110に溶出液(メタノール等)を分注する。必要に応じて、分注機構132Fは、分注機構132Cに併設してもよいものである。
【0047】
圧力付加機構134A,…,134Fは、カートリッジテーブル120の位置C,E,K,O,Q,Sに配置されている。それぞれの位置で、圧力付加機構134A,…,134Fは、圧力付加時にはカートリッジ110の上部と密着し、圧力を印加する。圧力付加機構134A,…,134Fは、シリンジのように空気を圧縮することで加圧を行うが、油圧式のように液体を圧縮してもよいものである。あるいは、必要に応じて、加圧式ではなく、カートリッジ下端を陰圧にすることでカートリッジ内の溶液を移送させてもよいものである。
【0048】
撹拌機構136A,136B,136Cは、カートリッジテーブル120の位置H,J,Nに配置されている。撹拌機構136A,136B,136Cは、カートリッジテーブル120の位置H,J,Nに保持されているカートリッジ110の内部の溶液を撹拌する。撹拌機構136A,136B,136Cは、本例では撹拌棒で撹拌を行うものである。なお、撹拌機構136A,136B,136Cは、としては、超音波で撹拌を行うものや、撹拌子を超音波で回転させて撹拌を行うものや、ピペッティングにより攪拌を行うものや、カートリッジ自体を振動させ撹拌を行うものを用いることもできる。
【0049】
次に、質量分析部200について説明する。
【0050】
質量分析装置202は、検査対象物質を質量分析する。本例では、質量分析装置として三連四重極質型量分析計を用いている。なお、質量分析装置として、四重極型質量分析計、イオントラップ型質量分析計、飛行時間型質量分析計およびフーリエ変換イオンサイクロトロン共鳴型質量分析計やそれらを2段に組合わせMS/MSを行う質量分析計を用いてもよいものである。なお、質量分析計の他に、高速液体クロマトフィー(HPLC)、超高速液体クロマトフィー、ガスクロマトグラフィーまたはキャピラリー電気泳動等の検出技術を用いることもできる。
【0051】
イオン源204は、電圧を付加することでサンプルのイオン化を行う。サンプルは液体状態でイオン源204に供給される。イオン源204としては、LC−MSに用いられるイオン化方式を用いることができる。
【0052】
前処理サンプル導入機構206は、カートリッジテーブル120の位置Sにおいてカートリッジ110から抽出された、前処理の行われたサンプルを吸引し、イオン源204に導入する。前処理サンプル導入機構206は、ポンプにより押し出された液体中に、カップから吸引された液体を導入するものであり、オートサンプラーの機構を用いることができる。あるいは、吸引した前処理済みのサンプルを直接イオン源204にスプレーする方式でもよいものである。
【0053】
制御部300は、カートリッジテーブル120の回転動作、カートリッジ移動機構130及び後述するカートリッジ移動機構130Bの移動動作と、分注機構132A,…,132Hの分注動作と、圧力付加機構134A,…,134Fの圧力付加動作、撹拌機構136A,136B,136Cの撹拌動作、質量分析装置200の分析動作、イオン源204のイオン化動作、前処理サンプル導入機構206のサンプル導入動作を制御する。
【0054】
次に、図2を用いて、本実施形態による臨床分析システムに用いるカートリッジ110の構成について説明する。
【0055】
図2は、本発明の第1の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【0056】
カートリッジ110は、フィルターユニット112と固相抽出ユニット114が連結され、一体化された構造を有している。カートリッジ110は、上流側にフィルターユニット112、下流側に固相抽出ユニット114が配置され、フィルターユニット112からの濾液を一時回収することなしに直接固相抽出ユニット114に供試する構成となっている。
【0057】
樹脂製のホルダ116は、円筒形状であり、上部の直径R1が、下部の直径R2に比べて大きくなっている。フィルターユニット112は、ホルダ116の内部に固定されたフィルター部112Aと、ホルダ116の内部であり、フィルター部112Aの上部の空間であるフィルターリザーバー112Bとで構成される。ここで、ホルダ116の上部の直径R1を大きくすることで、フィルター部112Aの直径を大きくでき、夾雑成分の目詰まりを回避できる。
【0058】
また、固相抽出ユニット114は、ホルダ116の内部であって、フィルター部112Aの下方の直径の大きな部分に形成される固相抽出リザーバー114Dと、固相抽出充填剤114Aと、固相抽出充填剤114Aを固相抽出ユニット114の内部に保持する上流側フリット114B及び下流側フリット114Cで構成される。
【0059】
フィルターユニット112におけるフィルター部112Aの素材は、濾過機能を有するものであり、生体試料の前処理等で使用されるものを適用している。フィルターユニット112内における反応で生成される凝集物量は、検体の種類、由来、量等に大きく依存するが、フィルター部の目詰まりを避けるために、固相抽出ユニット114における上流側フリット底面積113よりもフィルター部上流側底面積111は大きくしている。また、フィルター部112Aのポアサイズは生体試料中の夾雑微細成分を捕捉するために、ポアサイズ(フィルタ径)0.22〜2.0μm程度であるものが使用可能であるが、0.45〜1.0μm程度であるものが望ましい。フィルター部112Aの上部には、凝集したたんぱく質を含む懸濁液が保持されている。懸濁液は、懸濁体と溶存体との混合物であるが、ここで、懸濁体の径は0.45μm以上である。そこで、フィルター部112Aのフィルタ径は、0.45μm以上とする。一方、フィルター部112Aのフィルタ径が大きすぎると、懸濁体がフィルター部112Aにより捕捉されず、透過するため、例えば、フィルター部112Aのフィルタ径は、2.0μm以下とする。なお、フィルタ径0.22〜2.0μmの範囲でも、0.22μmに近いと、フィルタが目詰まりしやすく、2.0μmに近いと透過する懸濁体が増えやすいので、その点から、0.45〜1.0μm程度が好ましい。
【0060】
フィルターユニット112におけるフィルターリザーバー112Bは、添加する試薬分の容量を満たすために、少なくとも供試するサンプル量の8倍以上の許容量を有することが望ましい。これは、後述するように、サンプルである全血を50μlとすると、溶血のために用いる硫酸亜鉛溶液の量は150μlであり、除タンパク質処理に用いるメタノールの量が200μlであるため、全量の400μlは、サンプル量の8倍となるからである。
【0061】
ホルダ116の素材としては、樹脂の他に、生体試料の前処理等で使用される金属を用いることができる。なお、図1に示す例では、ホルダ116は一体構成のものであるが、フィルターユニット112と固相抽出ユニット114とのホルダを別体とした上で、樹脂製のホルダの場合には接着剤により接着固定し、金属製のホルダの場合には溶接等により固定して、一体化してもよいものである。
【0062】
固相抽出ユニット114における固相抽出充填剤114Aは、対象成分の抽出に適した性能を有するものを適用する。固相抽出充填剤114Aとしては、疎水性相互作用により血液試料溶液中の免役抑制剤を吸着する作用がある、一般に逆相系と呼ばれる充填剤を用いることができる。例えば、日立ハイテクノロジーズ社製NOBIAS RP−OD1のような有機高分子表面にオクタデシル基を付加した微小粒子を用いることができる。固相抽出充填剤114Aの充填形状は、例えば細管状円柱状としているが、円錐状であってもよいものである。充填部の構造は、充填する固相抽出充填剤の性能や仕様に大きく依存するが、微容量試料中の微量成分の抽出効率を保つために、充填高H1は、上流側フリット114Bの底面113の直径R2と同等以上としている。
【0063】
固相抽出ユニット114における上流側フリット114B及び下流側フリット114Cは、濾過機能を有するものであり、生体試料の前処理等で使用されるものを適用している。なお、上流側フリット114Bの底面積と下流側フリット114Cの底面積の大きさは必ずしも同一である必要はないものである。
【0064】
固相抽出ユニット114における固相抽出リザーバー114Dの容量は、添加する試薬分の容量を満たすために、少なくとも供試するサンプル量と同等以上の許容量を有している。
【0065】
次に、図3及び図4を用いて、本実施形態による臨床分析システムの分析処理の内容について説明する。
【0066】
図3は、本発明の第1の実施形態による臨床分析システムの分析処理の内容の説明図である。図4は、本発明の第1の実施形態による臨床分析システムで分析する免疫抑制剤のメタノール溶解性の説明図である。
【0067】
最初に、全血を用いた免疫抑制剤の固相抽出処理について説明する。臓器移植患者に対して投与する免疫抑制剤の血中濃度測定は、全血を用いて行われる。
【0068】
例えば、タクロリムス、シロリムス(ラパマイシン)、エベロリムス、シクロスポリンのような免疫抑制剤は疎水性が高く、水系の溶液には溶解し難い性質を有する。これら薬剤のメタノールに対する溶解性を検討したところ、50%以上のメタノール存在下でなければ安定して溶解しない傾向が認められた。
【0069】
ここで、図4を用いて、エベロリムス(図4の実線X1)およびシクロスポリン(図4の実線X2)のメタノール溶解性について説明する。図4から理解されるように、これら薬剤を抽出対象とする場合は、除タンパク質処理時および固相抽出充填剤114Aへの試料供試時の有機溶媒の終濃度に注意する必要があり、少なくともメタノールを用いる場合は50%以上であることが望ましいことを示している。
【0070】
従って、濃度50%以上のメタノールを用いることで、除タンパク質処理用のフィルターユニットと固相抽出用の固相抽出ユニットを連結した構成とした場合もで、除タンパク質処理と固相抽出処理とを連続して行うことができる。
【0071】
評価用の試料として患者全血検体がない場合、擬似的な患者全血検体を調製して用いることが可能である。擬似患者全血検体は、健常人から採血した全血検体に対して、例えば50%メタノールで溶解した免疫抑制剤標品を終濃度が各免疫抑制剤の治療域濃度程度になるように添加することで調製できる。さらに、調製した擬似患者全血検体を37℃で緩やかに転倒混和しながら30minインキュベートすることにより、各免疫抑制剤の血球移行を再現することも可能である。
【0072】
以下、図3を用いて、擬似患者全血検体中の免疫抑制剤の抽出および定量について示す。
【0073】
従来は、全血に対して溶血し、タンパク質を除去する第1の工程の後、第1の工程の回収産物を、改めて固相抽出処理する第2の工程が必要であり、2段階の作業が必要であった。それに対して、本実施形態では、フィルターユニットと固相抽出ユニットを連結した構成のカートリッジを用いることで、両操作を一括して実施することができる。
【0074】
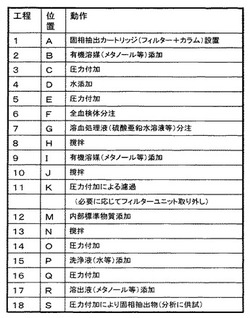
最初に、工程1において、図1に示したカートリッジテーブル120の位置Aに、カートリッジ移動機構130を用いて、未使用のカートリッジ110を設置する。その後、位置Bまでカートリッジテーブル120が回転する。
【0075】
次に、固相抽出充填剤114Aのコンディショニングについて説明する。この場合、固相抽出充填剤114Aは逆相モードとする。
【0076】
工程2において、図1に示したカートリッジテーブル120の位置Bにおいて、分注機構132Aを用いて、カートリッジ110のフィルターユニット112に100%メタノールを100μl添加する。その後、位置Cまでカートリッジテーブル120が移動する。次に、工程3において、図1に示した圧力付加機構134Aを用いた圧力付加操作により、メタノールを固相抽出ユニット114に移行させ、さらに固相抽出充填剤114Aの全体を経由させた後、固相抽出ユニット114から排出させる。その後、位置Dまでカートリッジテーブル120が移動する。
【0077】
次に、工程4において、図1に示した分注機構132Bを用いて、フィルターユニット112にH2Oを100μl添加し、その後、位置Eまでカートリッジテーブル120が移動する。次に、工程5において、図1に示した圧力付加機構134Bを用いた圧力付加操作により、水を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114Aの全体を経由させた後、固相抽出ユニット114から排出させる。その後、位置Fまでカートリッジテーブル120が移動する。
【0078】
この一連の操作により、固相抽出ユニット114に充填した固相抽出充填剤114Aのコンディショニングが行なわれる。
【0079】
次に、溶血後の除タンパク質処理について説明する。
【0080】
工程6において、図1に示した分注機構132Cを用いて、フィルターユニット112に前述のように調製した擬似患者全血検体を50μl添加する。その後、位置Gまでカートリッジテーブル120が移動する。そして、工程7において、図1に示した分注機構132Dを用いて、溶血処理液である0.5M硫酸亜鉛水溶液を150μl添加し、その後、位置Hまでカートリッジテーブル120が移動する。次に、工程8において、図1に示した撹拌機構136Aを用いて、十分に撹拌することにより、溶血処理を促す。この操作により、血球中に移行した免疫抑制剤を取り出すことができる。その後、位置Iまでカートリッジテーブル120が移動する。
【0081】
次に、工程9において、図1に示した分注機構132Eを用いて、溶血処理後の試料に100%メタノールを200μl添加し、その後、位置Jにカートリッジテーブル120が移動する。次に、工程10において、図1に示した撹拌機構136Bを用いて、十分に撹拌することにより、除タンパク質処理を行う。この操作により全血由来のタンパク質が凝集し、免疫抑制剤は上清側に抽出された状態になる。その後、位置Kに、カートリッジテーブル120が移動する。
【0082】
次に、工程11において、凝集したタンパク質を取り除くため、図1に示した圧力付加機構134Cを用いて圧力付加操作を行い、濾液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。この操作により、濾液を一時回収することなしに直接固相抽出充填剤114Aに供試でき、免疫抑制剤を固相抽出充填剤114Aに吸着させる操作までを一括して完了させることができる。その後、位置Lにカートリッジテーブル120が移動する。
【0083】
なお、位置Lに設けたカートリッジ移動機構130Bについては、後述する。
【0084】
次に、固相抽出処理について説明する。
【0085】
工程12において、位置Mにおいて、図1に示した分注機構132Fを用いて、試料に内部標準物質を添加し、その後、位置Nにカートリッジテーブル120が移動する。次に、工程13において、図1に示した撹拌機構136Cを用いて、十分に撹拌する。その後、位置Oに、カートリッジテーブル120が移動する。そして、工程14において、図1に示した圧力付加機構134Dを用いて圧力付加操作を行い、濾液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。
【0086】
次に、工程15において、位置Pで、図1に示した分注機構132Gを用いて、フィルターユニット112に固相抽出充填剤洗浄用の洗浄液,例えば、H2Oや5%メタノール等を50μl添加し、その後、位置Qにカートリッジテーブル120が移動する。次に、工程16において、図1に示した圧力付加機構134Eの圧力付加操作により同洗浄液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。これにより、固相抽出充填剤114Aに免疫抑制剤を吸着させたまま、その他の夾雑成分を除去する。その後、位置Rにカートリッジテーブル120が移動する。
【0087】
次に、工程17において、図1に示した分注機構132Hを用いて、フィルターユニット112に溶出液,例えば、100%メタノール等を50μl添加し、その後位置Sにカートリッジテーブル120が移動する。次に、工程18において、図1に示した圧力付加機構134Fの圧力付加操作により、溶出液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。これにより、固相抽出充填剤114Aに吸着した免疫抑制剤を溶出回収する。
【0088】
位置Rで回収された抽出物は、前処理サンプル導入機構206を用いて、質量分析部200のイオン源204から質量分析装置202に導入され、目的成分の定量データを出力する。質量分析装置202は、例えば三連四重極型の質量分析装置で、MRM(Multiple Reaction Monitoring)分析することにより、免疫抑制剤の分離およびピーク面積値からの定量を行う。その際、検体に対して内部標準物質を一定量添加しておくことにより、前処理を含めた精度管理や比率計算から定量値を割り出すことができる。
【0089】
次に、血清や尿等の全血以外の血清・血漿などの生体試料を対象としたときの実施例について説明する。この場合、生体試料の除タンパク質を行った後、測定対象成分の固相抽出を行うため、図3に示した工程のうち、溶血工程(図3の工程7,8:溶血処理液添加および撹拌)を省略することになる。ただし、除タンパク質効果を高めるために硫酸亜鉛水溶液を添加する工程7を実施してもよいものである。
【0090】
まず、固相抽出充填剤114Aのコンディショニングについて示す。この場合、固相抽出充填剤114Aは逆相モードとする。カートリッジ110のフィルターユニット112に100%メタノールを100μl添加し、圧力付加操作によりメタノールを固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。引き続いて、同様にフィルターユニット112にH2Oを同量添加し、同操作により固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。この一連の操作により、固相抽出ユニット114に充填した固相抽出充填剤114Aのコンディショニングを行う。
【0091】
次に、フィルターユニット114に生体試料を50μl添加する。これに対して、除タンパク質用の100%メタノールを50μl添加した後、十分に撹拌することにより、除タンパク質処理を行う。この操作により生体試料由来のタンパク質が凝集し、測定対象成分は上清側に抽出された状態になる。
【0092】
タンパク質凝集後の試料に対して、必要に応じてメタノールを希釈する。例えば、親水性が高い測定対象成分の抽出については、有機溶媒濃度が高いと固相抽出充填剤への吸着効率が低下するため、濾過処理前に希釈しておくことが望ましい。
【0093】
凝集したタンパク質を取り除くため、圧力付加操作を行い、濾液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。この操作により、濾液を一時回収することなしに直接固相抽出充填剤114Aに供試でき、測定対象成分を充填剤に吸着させる操作までを一括して完了させることができる。
【0094】
次に、試料に内部標準物質を添加し、十分に撹拌する。そして、圧力付加操作を行い、濾液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。
【0095】
次に、フィルターユニット112に固相抽出充填剤洗浄用の洗浄液,例えば、H2O等を50μl添加し、圧力付加操作により同洗浄液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。これにより、固相抽出充填剤114Aに薬剤成分を吸着させたまま、その他の夾雑成分を除去する。
【0096】
次に、フィルターユニット112に溶出液,例えば、100%メタノール等測定対象成分の物性に応じて設定を50μl添加し、圧力付加操作により同溶出液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。これにより、固相抽出充填剤114Aに吸着した測定対象成分を溶出回収する。
【0097】
以上の前処理で得られた抽出物は、例えば三連四重極型の質量分析装置でMRM分析することにより、測定対象成分の分離およびピーク面積値からの定量を行う。その際、検体に対して内部標準物質を一定量添加しておくことにより、前処理を含めた精度管理や比率計算から定量値を割り出すことができる。
【0098】
以上説明したように、本実施形態によれば、免疫抑制剤のような脂溶性の高い薬剤の全血処理と固相抽出処理を行う際に、薬剤の物性溶解性を活かし、全血処理産物の一時回収なしに直接固相抽出処理に移行できる凝集タンパク質除去と固相抽出カラムへのサンプルロードを一括して実施できる。
【0099】
また、血清や尿等の生体試料中の測定対象成分を粗精製するため、除タンパク質処理と固相抽出処理を1個の前処理用器材カートリッジで実現し、除タンパク質処理後の濾液を一時回収なしに直接固相抽出ユニットに供試できる。
【0100】
さらに、血液のような夾雑成分の多い生体試料を前処理なしに直接同器材に供試することが可能であり、同器材で処理して得られた抽出物を直接MS等の分析装置に供試することができる。
【0101】
これらにより、濾液の一時回収工程の省略により、工程およびTATの短縮化が図れる。
【0102】
また、濾液の一時回収および一時回収した濾液の固相抽出ユニットへの供試に関わる機構の省略を図ることが可能となり、同前処理用器材カートリッジを用いて自動処理するシステムの簡素化および低コスト化が実現できる。
【0103】
さらに、一時回収工程の省略により、一時回収用の容器が不要となるため、消耗品点数およびそのコストを削減することが可能となるとともに、一時回収工程で生じるサンプルロスおよびキャリーオーバーを回避できる。
【0104】
固相抽出ターンテーブル上でランダムに多種多数の検査項目に対して自動処理全血向け、血清向けを実現できる。
【0105】
また、ホルダの上部の直径を大きくすることで、フィルターユニットフィルター部の直径を大きくでき、夾雑成分の目詰まりを回避できる。
【0106】
次に、図5を用いて、本発明の第2の実施形態による臨床分析システムの構成及び動作について説明する。なお、本実施形態による臨床分析システムの全体構成は、図1に示したものと同様である。また、本実施形態による臨床分析システムの分析処理の内容は、図3に示したものと同様である。
【0107】
図5は、本発明の第2の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【0108】
カートリッジ110Aは、フィルターユニット112と固相抽出ユニット114が連結され、脱着可能な構造を有している。カートリッジ110Aは、上流側にフィルターユニット112、下流側に固相抽出ユニット114が配置され、フィルターユニット112からの濾液を一時回収することなしに直接固相抽出ユニット114に供試する構成となっている。
【0109】
フィルターユニット112のホルダ116Aと、固相抽出ユニット114のホルダ116Bとは、別体であり、連結部116Cにより脱着可能に連結されている。連結部116は、図示にように、ホルダ116Aに形成された雄ねじと、ホルダ116Bに形成された雌ねじとにより形成されている。なお、雄雌ねじにより結合に代わりに、一方を他方に挿入した後、ねじ込んでロックできるルアーロックなどを用いることもできる。
【0110】
樹脂製のホルダ116A、116Bは、円筒形状である。ホルダ116Bの上部の直径R1は、ホルダ116Aの直径と等しく、下部の直径R2に比べて大きくなっている。フィルターユニット112は、ホルダ116Aの内部に固定されたフィルター部112Aと、ホルダ116Aの内部であり、フィルター部112Aの上部の空間であるフィルターリザーバー112Bとで構成される。ここで、ホルダ116Aの直径R1を大きくすることで、フィルター部112Aの直径を大きくでき、夾雑成分の目詰まりを回避できる。
【0111】
また、固相抽出ユニット114は、ホルダ116Bの内部であって、フィルター部112Aの下方の直径の大きな部分に形成される固相抽出リザーバー114Dと、固相抽出充填剤114Aと、固相抽出充填剤114Aを固相抽出ユニット114の内部に保持する上流側フリット114B及び下流側フリット114Cで構成される。
【0112】
その他の構成は、図2に示したものと同様である。
【0113】
図3の説明では、カートリッジ110Aのフィルターユニット112のリザーバー112Bには、凝集したタンパク質PRTが残留したまま、その後の処理が進められているが、固相抽出処理によって使用される溶剤によって、凝集したタンパク質に吸着している夾雑成分が溶解し、フィルターユニット112のフィルター部112Aを透過する恐れがある場合には、除タンパク質処理後に、カートリッジ110Aの上部のフィルターユニット112を取り外すようにできる。
【0114】
そのため、図1に示した位置Lにおいて、カートリッジ移動機構130Bは、上部のフィルターユニットを取り外すために備えられている。
【0115】
以上説明したように、本実施形態によっても、濾液を一時回収することなく固相の抽出が可能となる。
【0116】
次に、図6を用いて、本発明の第3の実施形態による臨床分析システムの構成及び動作について説明する。なお、本実施形態による臨床分析システムの全体構成は、図1に示したものと同様である。また、本実施形態による臨床分析システムの分析処理の内容は、図3に示したものと同様である。
【0117】
図6は、本発明の第3の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【0118】
カートリッジ110Bは、フィルターユニット112と固相抽出ユニット114が連結され、一体化された構造を有している。カートリッジ110Bは、上流側にフィルターユニット112、下流側に固相抽出ユニット114が配置され、フィルターユニット112からの濾液を一時回収することなしに直接固相抽出ユニット114に供試する構成となっている。
【0119】
樹脂製のホルダ116は、円筒形状であり、上部の直径R1が、下部の直径R2に比べて大きくなっている。フィルターユニット112は、ホルダ116の内部に固定されたフィルター部112Aと、ホルダ116の内部であり、フィルター部112Aの上部の空間であるフィルターリザーバー112Bとで構成される。ここで、ホルダ116の上部の直径R1を大きくすることで、フィルター部112Aの直径を大きくでき、夾雑成分の目詰まりを回避できる。
【0120】
また、固相抽出ユニット114は、固相抽出充填剤114Aと、固相抽出充填剤114Aを固相抽出ユニット114の内部に保持する下流側フリット114Cで構成される。なお、図2に示した上流側フリット114Bは、フィルター部112Aが兼用している。したがって、フィルターユニット112と固相抽出ユニット114は互いに切り離せないように接合された構造を取るため、両ユニットを脱着できないものである。フィルター部112Aの構造は、固相抽出充填剤114Aに接する下流側に向かってテーパー状になっていてもよいものである。
【0121】
その他の構成は、図2に示したものと同様である。
【0122】
以上説明したように、本実施形態によっても、濾液を一時回収することなく固相の抽出が可能となる。
【0123】
なお、本発明は、臨床検査分野だけでなく、目的成分検出に夾雑成分からの精製を要する分析分野に幅広く応用可能である。例えば、環境、食品、医用、公安テロ対策/違法薬物等の分野への実用およびそのための基礎/応用研究に利用可能である。
【符号の説明】
【0124】
100…前処理部
110…カートリッジ
112…フィルターユニット
112A…フィルター部
112B…フィルターリザーバー
114…固相抽出ユニット
114A…固相抽出充填剤
114B…上流側フリット
114C…下流側フリット
114D…固相抽出リザーバー
116…ホルダ
120…カートリッジテーブル
130…カートリッジ移動機構
132…分注機構
134…圧力付加機構
136…撹拌機構
200…質量分析部
202…質量分析装置
204…イオン化部
206…前処理サンプル導入機構
300…制御演算部
【技術分野】
【0001】
本発明は、臨床検査システム,臨床検査法方法及び前処理用器材に係り、特に、臨床検査向けの検体前処理に好適な臨床検査システム,臨床検査法方法及び前処理用器材に関する。
【背景技術】
【0002】
混合試料からの目的成分抽出には、目的成分のサイズ、重量、形状のような物理的性質や、溶解性、親和性のような生化学的な性質を指標とした様々な技術が知られている。特に、血液のような生体試料中の微量成分の抽出に関しては、クロマトグラフィーによる分離技術が発達しており、目的成分に適した充填剤の開発やメソッドの至適化がなされている。しかしながら、このような高度な分離技術を用いる場合であっても、様々な細胞や異なった諸性質を示す多成分で構成される血液から目的の微量成分を効率良く抽出するためには、抽出可能な状態にするための試料調製や粗精製が必須となる。
【0003】
血液中の微量成分を測定する臨床検査方法として、血中治療薬物モニタリング(TDM:Therapeutic Drug Monitoring)が挙げられる。TDMは、薬効を示す治療域が狭い薬剤等に適用され、投薬後の患者血液中の薬剤濃度を経時的に確認することにより、患者ごとに適正な投与設計を実践するために必要な検査である。
【0004】
TDMの対象薬剤として、抗てんかん剤、抗菌剤、免疫抑制剤、抗不整脈剤、抗精神剤等が挙げられる。多くの薬剤は血清中に分布するが、例えば臓器移植患者等に投与される免疫抑制剤は脂溶性が高く、血球移行性があるため、その血中濃度を測定する場合には、全血を用いて、その全血を溶血させて血球内容物を取り出した後にタンパク質等に吸着している薬剤を抽出する前処理が必要となる。
【0005】
溶血には、化学的、物理的、生物学的な原理を応用して実施することができる。例えば、化学的な方法としては、各種溶媒や界面活性剤により細胞膜を構成する脂質を溶解あるいは損傷させることにより溶血を引き起こす方法がある。物理学的な方法としては、圧力、遠心力、撹拌、凍結融解、低張化等がある。生物学的な方法としては、血球への抗体や補体結合に起因する膜貫通タンパク質複合体形成や病原性細菌が産生する溶血素(ヘモリジン)による血球細胞膜への孔形成等がある。
【0006】
特に、低張化による血球バーストは原理的に単純であり、血液の塩濃度をH2O等で希釈することにより血球周囲の浸透圧を下げ、血球内に過剰に水分を取り込ませることにより細胞膜を破裂させる方法である。一般的な生理食塩水濃度は、0.9%NaCl相当であるが、0.5〜0.35%NaCl相当まで希釈すると溶血現象を起こすことが知られている。
【0007】
例えば、臨床現場では検体ごとに血液の組成が異なり、高脂血症患者のように粘性が著しく高い検体も存在する。血液をH2Oで希釈することは、溶血効果だけでなく、検体の粘性を緩和する効果もあり、溶血後の成分抽出プロセスを容易にすることにも有効である。
【0008】
また、亜鉛のキレーティング効果を応用することにより、γグロブリンのような血液中に多量に存在する主要タンパク質を凝集させ、沈殿させることができる。この目的のため、H2Oの代わりにZTT検査(Zinc sulfate Turbidity Test,:硫酸亜鉛混濁試験)にも用いられている硫酸亜鉛水溶液を血液に添加することにより、溶血と同時に除タンパク質をも合わせて行う方法も一般的に行われている。
【0009】
一方、血液中のタンパク質に吸着している目的成分を回収する方法として、除タンパク質処理あるいは液/液抽出がある。溶血処理したサンプルに有機溶媒を添加することにより、目的成分を有機溶媒側に抽出するとともに、タンパク質を変性させ、一般的には遠心分離することによって凝集タンパク質と上清を分離した後、上清分を回収している。除タンパク質処理は、血中に多種多様かつ大量に含まれているタンパク質を凝集させることによって除去する工程であり、このような処理を施すことによってはじめて全血由来の試料を血清あるいは血漿検体と同等に扱える状態になる。
【0010】
有機溶媒は、前述のように溶血効果もあるため、直接血液に添加して溶血、液/液抽出、除タンパク質を行う方法もある。また、そのときに除タンパク質効果を補足するため、前述の硫酸亜鉛を添加する方法もある。
【0011】
全血検体に前記のような処理を施すことによって、血球移行性の薬剤を溶液状態で回収することができるため、例えば、固相抽出処理や液体クロマトグラフィー分離等のような精製操作に供試することが可能となる。一般的には、液/液抽出後の回収上清はドライアップした後、適切な容量の溶解液で再溶解することにより、液量の低減と目的成分の濃縮を行う。その後、例えば、再溶解物を液体クロマトグラフィー質量分析計(LCMS:Liquid Chromatograph Mass Spectrometer)等に供試することにより、濃縮後の目的成分の分離精製と検出を行い、目的成分の同定や定量解析を実施する。
【0012】
このような全血検体を対象とした溶血処理や除タンパク質処理は、従来より用手方法で一般的に行われているが、自動化した装置は知られていない。特に、TDMに関しては、患者個別に治療域の狭い薬剤の投与設計を行うために、試料調製は高い再現性で実現できることが求められる。
【0013】
ここで、従来、複数の多孔性支持層と固相抽出媒体とを含む、固相抽出に使用する一体型多層品を用い、多孔性支持層が熱機械的取り付け場所に熱機械的に取り付けられ、多孔性支持層の少なくとも一方は前置フィルター層にすることができるものが知られている(例えば、特許文献1参照)。これは、固相抽出ディスクに相当するものであり、例えば、固相抽出媒体としては、PTFE(Polytetrafluoroethylene)ウェッブ内に逆相シリカ粒子を導入したメンブレン状固相抽出剤が用いている。
【0014】
また、固相抽出カラムとしては、例えばシリンジ状の容器に固相抽出剤を充填したものであり、その充填剤を保持するために充填剤の上流と下流をフィルター(フリット)で挟んだ構造のものが知られている(例えば、特許文献2参照)。
【0015】
さらに、生体試料中の夾雑物や微細成分を濾過するフィルターが知られている(例えば、特許文献3参照)。
【0016】
また、LCに用いる分離あるいは分取カラムも、固相抽出カラムと同様に充填剤をフリット(フィルター部を有する部品)で挟み込んだ構造であることが知られている(例えば、特許文献4参照)。
【先行技術文献】
【特許文献】
【0017】
【特許文献1】特表2002−524243号公報
【特許文献2】特許第4062637号公報
【特許文献3】特開2007−199050号公報
【特許文献4】特許第4219564号号公報
【発明の概要】
【発明が解決しようとする課題】
【0018】
しかしながら、特許文献1記載のものは、固相抽出媒体が平面状になるため、微容量試料中の微量成分の抽出には適さない構造である。すなわち、このような微量成分を微量な充填剤を用いて効率良く抽出するためには、微量成分と固相抽出媒体との接触効率を高める必要があり、平面状ではなく細管状に充填した固相抽出媒体に供試することが望ましい。その場合、多孔性支持層が熱機械的取り付け場所に熱機械的に取り付けることを実現することは構造的に困難である。
【0019】
また、特許文献2記載のものは、構成的には、試料はフィルターを介して固相抽出剤に移行するため、血液等の夾雑物を多量に含んだ試料や除タンパク質処理後の凝集タンパク質を含んだ試料を直接固相抽出に供試しても、フィルターは目詰まりを起こし、目的の上清成分を回収することはできないものである。
【0020】
さらに、特許文献3記載のフィルターでは、濾液を一時回収する工程が必要となる。濾液を一時回収する場合には、回収した溶液から再度試料を分注する工程が必要となり、その際、回収した溶液を100%は分注できないため、試料のロスが発生し、試料の微量化を図ることができないものである。
【0021】
また、特許文献4に記載のようなLCに用いる分離あるいは分取カラムの場合は流路が細いため、前処理なしに生体試料を直接供試することは原理的に不可能である。
【0022】
本発明の目的は、濾液を一時回収することなく固相の抽出が可能な臨床検査システム,臨床検査法方法及び前処理用器材を提供することにある。
【課題を解決するための手段】
【0023】
(1)上記目的を達成するために、本発明は、生体試料から測定対象成分を抽出する前処理部と、該前処理部により抽出された測定対象成分を質量分析する質量分析部とを有する臨床検査システムであって、前記前処理部は、上流側のフィルター部を有するフィルターユニットと下流側の固相抽出剤を有する固相抽出ユニットが連結した前処理用器材を、複数設置するカートリッジテーブルと、該カートリッジテーブルに設置された前記前処理用器材に対して所定の溶液を供給する複数の分注機構と、前記カートリッジテーブルに設置された前記前処理用器材の内部の溶液に圧力を付加する複数の圧力付加機構と、前記カートリッジテーブルに設置された前記前処理用器材の内部の溶液を撹拌する複数の撹拌機構とを備えるようにしたものである。
かかる構成により、濾液を一時回収することなく固相の抽出が可能となる。
【0024】
(2)上記(1)において、好ましくは、前記前処理用器材の前記フィルターユニットと前記固相抽出ユニットとは、脱着可能に連結されており、前記カートリッジテーブルに設置された前記前処理容器材の前記フィルターユニットを取り外す前処理用器材移動機構を備えるようにしたものである。
【0025】
(3)また、上記目的を達成するために、本発明は、生体試料から測定対象成分を抽出し、分析する臨床検査方法であって、上流側に位置し、フィルター部を有するフィルターユニットと下流側に位置し、固相抽出剤を有する固相抽出ユニットが連結した前処理用器材を用い、前記フィルターユニット内で試料と試薬を反応させ、反応産物を前記フィルター部による濾過処理により濾液と残渣に分別し、残渣をフィルターユニット側に残した状態を保ちながら、濾液の一時回収操作なしに直接濾液を固相抽出ユニットに供給し、測定対象成分を前記固相抽出ニットの固相抽出充填剤に捕捉させるとともに非吸着成分を固相抽出充填剤から素通りさせることで廃棄し、前記固相抽出充填剤に非特異的あるいは弱く吸着した前記測定対象成分とは異なる不要な夾雑成分を洗浄除去し、最後に前記測定対象成分を特異的に前記固相抽出充填剤から溶出可能な条件下で回収し、回収した前記測定対象成分を質量分析するようにしたものである。
かかる方法により、濾液を一時回収することなく固相の抽出が可能となる。
【0026】
(4)上記(3)において、好ましくは、前記生体試料は全血であり、前記フィルター部における濾過処理時の除タンパク質処理に用いる溶液,前記固相抽出剤による固相抽出時に用いる溶液として、濃度50%以上のメタノールを用いるようにしたものである。
【0027】
(5)上記(3)において、好ましくは、前記測定対象成分は、免疫抑制剤成分である。
【0028】
(6)さらに、上記目的を達成するために、本発明は、臨床検査システムの前処理に用いられる前処理用器材であって、上流側のフィルター部を有するフィルターユニットと、該フィルターユニットに連結され、固相抽出剤を有する固相抽出ユニットとを備えるようにしたものである。
かかる構成により、濾液を一時回収することなく固相の抽出が可能となる。
【0029】
(7)上記(6)において、好ましくは、前記フィルターユニットと前記固相抽出ユニットとは、脱着可能に連結されているものである。
【0030】
(8)上記(6)において、好ましくは、前記フィルターユニットと前記固相抽出ユニットとは、一体的に連結されているとともに、前記フィルターユニットの前記フィルター材は、前記固相抽出ユニットの前記固相抽出剤の上流側のフリットを兼用するようにしたものである。
【0031】
(9)上記(6)において、好ましくは、前記フィルターユニットの前記フィルター材の面積は、前記固相抽出ユニットの前記固相抽出剤の上流側のフリット以上の面積を有するものである。
【0032】
(10)上記(6)において、好ましくは、前記固相抽出ユニットの前記固相抽出剤の充填高が、前記固相抽出ユニットの前記固相抽出剤の上流側のフリットの直径以上である。
【発明の効果】
【0033】
本発明によれば、濾液を一時回収することなく固相の抽出が可能となる。
【図面の簡単な説明】
【0034】
【図1】本発明の第1の実施形態による臨床分析システムの全体構成を示すブロック図である。
【図2】本発明の第1の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【図3】本発明の第1の実施形態による臨床分析システムの分析処理の内容の説明図である。
【図4】本発明の第1の実施形態による臨床分析システムで分析する免疫抑制剤のメタノール溶解性の説明図である。
【図5】本発明の第2の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【図6】本発明の第3の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【発明を実施するための形態】
【0035】
以下、図1〜図4を用いて、本発明の第1の実施形態による臨床分析システムの構成及び動作について説明する。
【0036】
最初に、図1を用いて、本実施形態による臨床分析システムの全体構成について説明する。
【0037】
図1は、本発明の第1の実施形態による臨床分析システムの全体構成を示すブロック図である。
【0038】
図1に示す本実施形態の臨床分析システムは、血液成分の臨床分析システムであって、全血および血清・血漿の前処理を行う前処理部100と、前処理のされたサンプルを質量分析する質量分析部200と、制御部300とからなる。なお、本実施例でいう前処理は、質量分析部へ導入する前段までの工程またはその工程の各要素のことである。
【0039】
最初に、前処理部100の構成について説明する。前処理部100は、カートリッジテーブル120と、カートリッジテーブル120の周囲に配置された2カ所のカートリッジ移動機構130,130Bと、8カ所の分注機構132A,…,132Hと、6カ所の圧力付加機構134A,…,134Fと、3カ所の撹拌機構136A,136B,136Cとから構成される。
【0040】
質量分析部200は、質量分析装置202と、イオン化部204と、前処理サンプル導入機構206とから構成される。
【0041】
制御部300は、前処理部100の各部及び質量分析部200の各部を制御する。
【0042】
カートリッジテーブル120は、無限軌道上に19個のカートリッジ(前処理器材)110を設置できる。カートリッジテーブル120は、無限軌道上を一定のピッチで回転することで、各工程の作業位置にカートリッジ110を移送し効率良く前処理を行うことができる。本例では、カートリッジテーブル120は、円形であり、一定時間毎に、時計回りに約19度(=360度/19)の角度回転する。カートリッジテーブル120が約19度回転すると、その位置で暫く停止し、一定時間経過すると、さらに、約19度回転する動作を繰り返す。
【0043】
なお、本例ではカートリッジ間の間隔は一定でなくてもよく、その場合にはピッチのスピードを調整することになる。
【0044】
カートリッジ110は、図2を用いて後述するように、フィルターユニットと固相抽出ユニットが連結された構成である。
【0045】
カートリッジ移動機構130は、カートリッジテーブル120の位置Aにおいて、新しいカートリッジ110をカートリッジテーブル120に設置し、また、使用済みのカートリッジ110を除去して廃棄する。
【0046】
分注機構132A,…,132Hは、カートリッジテーブル120の位置B,D,F,G,I,M,P,Rに配置されている。位置Bにおいて、分注機構132Aは、カートリッジ110に有機溶媒(メタノール等)を分注する。位置Dにおいて、分注機構132Bは、カートリッジ110に水を分注する。位置Fにおいて、分注機構132Cは、カートリッジ110に全血の検体を分注する。位置Gにおいて、分注機構132Dは、カートリッジ110に溶血処理液(硫酸亜鉛水溶液等)を分注する。位置Iにおいて、分注機構132Eは、カートリッジ110に除タンパク質液(メタノール等)を分注する。位置Mにおいて、分注機構132Fは、カートリッジ110に内部標準物質を分注する。位置Pにおいて、分注機構132Gは、カートリッジ110に洗浄液(水等)を分注する。位置Rにおいて、分注機構132Hは、カートリッジ110に溶出液(メタノール等)を分注する。必要に応じて、分注機構132Fは、分注機構132Cに併設してもよいものである。
【0047】
圧力付加機構134A,…,134Fは、カートリッジテーブル120の位置C,E,K,O,Q,Sに配置されている。それぞれの位置で、圧力付加機構134A,…,134Fは、圧力付加時にはカートリッジ110の上部と密着し、圧力を印加する。圧力付加機構134A,…,134Fは、シリンジのように空気を圧縮することで加圧を行うが、油圧式のように液体を圧縮してもよいものである。あるいは、必要に応じて、加圧式ではなく、カートリッジ下端を陰圧にすることでカートリッジ内の溶液を移送させてもよいものである。
【0048】
撹拌機構136A,136B,136Cは、カートリッジテーブル120の位置H,J,Nに配置されている。撹拌機構136A,136B,136Cは、カートリッジテーブル120の位置H,J,Nに保持されているカートリッジ110の内部の溶液を撹拌する。撹拌機構136A,136B,136Cは、本例では撹拌棒で撹拌を行うものである。なお、撹拌機構136A,136B,136Cは、としては、超音波で撹拌を行うものや、撹拌子を超音波で回転させて撹拌を行うものや、ピペッティングにより攪拌を行うものや、カートリッジ自体を振動させ撹拌を行うものを用いることもできる。
【0049】
次に、質量分析部200について説明する。
【0050】
質量分析装置202は、検査対象物質を質量分析する。本例では、質量分析装置として三連四重極質型量分析計を用いている。なお、質量分析装置として、四重極型質量分析計、イオントラップ型質量分析計、飛行時間型質量分析計およびフーリエ変換イオンサイクロトロン共鳴型質量分析計やそれらを2段に組合わせMS/MSを行う質量分析計を用いてもよいものである。なお、質量分析計の他に、高速液体クロマトフィー(HPLC)、超高速液体クロマトフィー、ガスクロマトグラフィーまたはキャピラリー電気泳動等の検出技術を用いることもできる。
【0051】
イオン源204は、電圧を付加することでサンプルのイオン化を行う。サンプルは液体状態でイオン源204に供給される。イオン源204としては、LC−MSに用いられるイオン化方式を用いることができる。
【0052】
前処理サンプル導入機構206は、カートリッジテーブル120の位置Sにおいてカートリッジ110から抽出された、前処理の行われたサンプルを吸引し、イオン源204に導入する。前処理サンプル導入機構206は、ポンプにより押し出された液体中に、カップから吸引された液体を導入するものであり、オートサンプラーの機構を用いることができる。あるいは、吸引した前処理済みのサンプルを直接イオン源204にスプレーする方式でもよいものである。
【0053】
制御部300は、カートリッジテーブル120の回転動作、カートリッジ移動機構130及び後述するカートリッジ移動機構130Bの移動動作と、分注機構132A,…,132Hの分注動作と、圧力付加機構134A,…,134Fの圧力付加動作、撹拌機構136A,136B,136Cの撹拌動作、質量分析装置200の分析動作、イオン源204のイオン化動作、前処理サンプル導入機構206のサンプル導入動作を制御する。
【0054】
次に、図2を用いて、本実施形態による臨床分析システムに用いるカートリッジ110の構成について説明する。
【0055】
図2は、本発明の第1の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【0056】
カートリッジ110は、フィルターユニット112と固相抽出ユニット114が連結され、一体化された構造を有している。カートリッジ110は、上流側にフィルターユニット112、下流側に固相抽出ユニット114が配置され、フィルターユニット112からの濾液を一時回収することなしに直接固相抽出ユニット114に供試する構成となっている。
【0057】
樹脂製のホルダ116は、円筒形状であり、上部の直径R1が、下部の直径R2に比べて大きくなっている。フィルターユニット112は、ホルダ116の内部に固定されたフィルター部112Aと、ホルダ116の内部であり、フィルター部112Aの上部の空間であるフィルターリザーバー112Bとで構成される。ここで、ホルダ116の上部の直径R1を大きくすることで、フィルター部112Aの直径を大きくでき、夾雑成分の目詰まりを回避できる。
【0058】
また、固相抽出ユニット114は、ホルダ116の内部であって、フィルター部112Aの下方の直径の大きな部分に形成される固相抽出リザーバー114Dと、固相抽出充填剤114Aと、固相抽出充填剤114Aを固相抽出ユニット114の内部に保持する上流側フリット114B及び下流側フリット114Cで構成される。
【0059】
フィルターユニット112におけるフィルター部112Aの素材は、濾過機能を有するものであり、生体試料の前処理等で使用されるものを適用している。フィルターユニット112内における反応で生成される凝集物量は、検体の種類、由来、量等に大きく依存するが、フィルター部の目詰まりを避けるために、固相抽出ユニット114における上流側フリット底面積113よりもフィルター部上流側底面積111は大きくしている。また、フィルター部112Aのポアサイズは生体試料中の夾雑微細成分を捕捉するために、ポアサイズ(フィルタ径)0.22〜2.0μm程度であるものが使用可能であるが、0.45〜1.0μm程度であるものが望ましい。フィルター部112Aの上部には、凝集したたんぱく質を含む懸濁液が保持されている。懸濁液は、懸濁体と溶存体との混合物であるが、ここで、懸濁体の径は0.45μm以上である。そこで、フィルター部112Aのフィルタ径は、0.45μm以上とする。一方、フィルター部112Aのフィルタ径が大きすぎると、懸濁体がフィルター部112Aにより捕捉されず、透過するため、例えば、フィルター部112Aのフィルタ径は、2.0μm以下とする。なお、フィルタ径0.22〜2.0μmの範囲でも、0.22μmに近いと、フィルタが目詰まりしやすく、2.0μmに近いと透過する懸濁体が増えやすいので、その点から、0.45〜1.0μm程度が好ましい。
【0060】
フィルターユニット112におけるフィルターリザーバー112Bは、添加する試薬分の容量を満たすために、少なくとも供試するサンプル量の8倍以上の許容量を有することが望ましい。これは、後述するように、サンプルである全血を50μlとすると、溶血のために用いる硫酸亜鉛溶液の量は150μlであり、除タンパク質処理に用いるメタノールの量が200μlであるため、全量の400μlは、サンプル量の8倍となるからである。
【0061】
ホルダ116の素材としては、樹脂の他に、生体試料の前処理等で使用される金属を用いることができる。なお、図1に示す例では、ホルダ116は一体構成のものであるが、フィルターユニット112と固相抽出ユニット114とのホルダを別体とした上で、樹脂製のホルダの場合には接着剤により接着固定し、金属製のホルダの場合には溶接等により固定して、一体化してもよいものである。
【0062】
固相抽出ユニット114における固相抽出充填剤114Aは、対象成分の抽出に適した性能を有するものを適用する。固相抽出充填剤114Aとしては、疎水性相互作用により血液試料溶液中の免役抑制剤を吸着する作用がある、一般に逆相系と呼ばれる充填剤を用いることができる。例えば、日立ハイテクノロジーズ社製NOBIAS RP−OD1のような有機高分子表面にオクタデシル基を付加した微小粒子を用いることができる。固相抽出充填剤114Aの充填形状は、例えば細管状円柱状としているが、円錐状であってもよいものである。充填部の構造は、充填する固相抽出充填剤の性能や仕様に大きく依存するが、微容量試料中の微量成分の抽出効率を保つために、充填高H1は、上流側フリット114Bの底面113の直径R2と同等以上としている。
【0063】
固相抽出ユニット114における上流側フリット114B及び下流側フリット114Cは、濾過機能を有するものであり、生体試料の前処理等で使用されるものを適用している。なお、上流側フリット114Bの底面積と下流側フリット114Cの底面積の大きさは必ずしも同一である必要はないものである。
【0064】
固相抽出ユニット114における固相抽出リザーバー114Dの容量は、添加する試薬分の容量を満たすために、少なくとも供試するサンプル量と同等以上の許容量を有している。
【0065】
次に、図3及び図4を用いて、本実施形態による臨床分析システムの分析処理の内容について説明する。
【0066】
図3は、本発明の第1の実施形態による臨床分析システムの分析処理の内容の説明図である。図4は、本発明の第1の実施形態による臨床分析システムで分析する免疫抑制剤のメタノール溶解性の説明図である。
【0067】
最初に、全血を用いた免疫抑制剤の固相抽出処理について説明する。臓器移植患者に対して投与する免疫抑制剤の血中濃度測定は、全血を用いて行われる。
【0068】
例えば、タクロリムス、シロリムス(ラパマイシン)、エベロリムス、シクロスポリンのような免疫抑制剤は疎水性が高く、水系の溶液には溶解し難い性質を有する。これら薬剤のメタノールに対する溶解性を検討したところ、50%以上のメタノール存在下でなければ安定して溶解しない傾向が認められた。
【0069】
ここで、図4を用いて、エベロリムス(図4の実線X1)およびシクロスポリン(図4の実線X2)のメタノール溶解性について説明する。図4から理解されるように、これら薬剤を抽出対象とする場合は、除タンパク質処理時および固相抽出充填剤114Aへの試料供試時の有機溶媒の終濃度に注意する必要があり、少なくともメタノールを用いる場合は50%以上であることが望ましいことを示している。
【0070】
従って、濃度50%以上のメタノールを用いることで、除タンパク質処理用のフィルターユニットと固相抽出用の固相抽出ユニットを連結した構成とした場合もで、除タンパク質処理と固相抽出処理とを連続して行うことができる。
【0071】
評価用の試料として患者全血検体がない場合、擬似的な患者全血検体を調製して用いることが可能である。擬似患者全血検体は、健常人から採血した全血検体に対して、例えば50%メタノールで溶解した免疫抑制剤標品を終濃度が各免疫抑制剤の治療域濃度程度になるように添加することで調製できる。さらに、調製した擬似患者全血検体を37℃で緩やかに転倒混和しながら30minインキュベートすることにより、各免疫抑制剤の血球移行を再現することも可能である。
【0072】
以下、図3を用いて、擬似患者全血検体中の免疫抑制剤の抽出および定量について示す。
【0073】
従来は、全血に対して溶血し、タンパク質を除去する第1の工程の後、第1の工程の回収産物を、改めて固相抽出処理する第2の工程が必要であり、2段階の作業が必要であった。それに対して、本実施形態では、フィルターユニットと固相抽出ユニットを連結した構成のカートリッジを用いることで、両操作を一括して実施することができる。
【0074】
最初に、工程1において、図1に示したカートリッジテーブル120の位置Aに、カートリッジ移動機構130を用いて、未使用のカートリッジ110を設置する。その後、位置Bまでカートリッジテーブル120が回転する。
【0075】
次に、固相抽出充填剤114Aのコンディショニングについて説明する。この場合、固相抽出充填剤114Aは逆相モードとする。
【0076】
工程2において、図1に示したカートリッジテーブル120の位置Bにおいて、分注機構132Aを用いて、カートリッジ110のフィルターユニット112に100%メタノールを100μl添加する。その後、位置Cまでカートリッジテーブル120が移動する。次に、工程3において、図1に示した圧力付加機構134Aを用いた圧力付加操作により、メタノールを固相抽出ユニット114に移行させ、さらに固相抽出充填剤114Aの全体を経由させた後、固相抽出ユニット114から排出させる。その後、位置Dまでカートリッジテーブル120が移動する。
【0077】
次に、工程4において、図1に示した分注機構132Bを用いて、フィルターユニット112にH2Oを100μl添加し、その後、位置Eまでカートリッジテーブル120が移動する。次に、工程5において、図1に示した圧力付加機構134Bを用いた圧力付加操作により、水を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114Aの全体を経由させた後、固相抽出ユニット114から排出させる。その後、位置Fまでカートリッジテーブル120が移動する。
【0078】
この一連の操作により、固相抽出ユニット114に充填した固相抽出充填剤114Aのコンディショニングが行なわれる。
【0079】
次に、溶血後の除タンパク質処理について説明する。
【0080】
工程6において、図1に示した分注機構132Cを用いて、フィルターユニット112に前述のように調製した擬似患者全血検体を50μl添加する。その後、位置Gまでカートリッジテーブル120が移動する。そして、工程7において、図1に示した分注機構132Dを用いて、溶血処理液である0.5M硫酸亜鉛水溶液を150μl添加し、その後、位置Hまでカートリッジテーブル120が移動する。次に、工程8において、図1に示した撹拌機構136Aを用いて、十分に撹拌することにより、溶血処理を促す。この操作により、血球中に移行した免疫抑制剤を取り出すことができる。その後、位置Iまでカートリッジテーブル120が移動する。
【0081】
次に、工程9において、図1に示した分注機構132Eを用いて、溶血処理後の試料に100%メタノールを200μl添加し、その後、位置Jにカートリッジテーブル120が移動する。次に、工程10において、図1に示した撹拌機構136Bを用いて、十分に撹拌することにより、除タンパク質処理を行う。この操作により全血由来のタンパク質が凝集し、免疫抑制剤は上清側に抽出された状態になる。その後、位置Kに、カートリッジテーブル120が移動する。
【0082】
次に、工程11において、凝集したタンパク質を取り除くため、図1に示した圧力付加機構134Cを用いて圧力付加操作を行い、濾液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。この操作により、濾液を一時回収することなしに直接固相抽出充填剤114Aに供試でき、免疫抑制剤を固相抽出充填剤114Aに吸着させる操作までを一括して完了させることができる。その後、位置Lにカートリッジテーブル120が移動する。
【0083】
なお、位置Lに設けたカートリッジ移動機構130Bについては、後述する。
【0084】
次に、固相抽出処理について説明する。
【0085】
工程12において、位置Mにおいて、図1に示した分注機構132Fを用いて、試料に内部標準物質を添加し、その後、位置Nにカートリッジテーブル120が移動する。次に、工程13において、図1に示した撹拌機構136Cを用いて、十分に撹拌する。その後、位置Oに、カートリッジテーブル120が移動する。そして、工程14において、図1に示した圧力付加機構134Dを用いて圧力付加操作を行い、濾液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。
【0086】
次に、工程15において、位置Pで、図1に示した分注機構132Gを用いて、フィルターユニット112に固相抽出充填剤洗浄用の洗浄液,例えば、H2Oや5%メタノール等を50μl添加し、その後、位置Qにカートリッジテーブル120が移動する。次に、工程16において、図1に示した圧力付加機構134Eの圧力付加操作により同洗浄液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。これにより、固相抽出充填剤114Aに免疫抑制剤を吸着させたまま、その他の夾雑成分を除去する。その後、位置Rにカートリッジテーブル120が移動する。
【0087】
次に、工程17において、図1に示した分注機構132Hを用いて、フィルターユニット112に溶出液,例えば、100%メタノール等を50μl添加し、その後位置Sにカートリッジテーブル120が移動する。次に、工程18において、図1に示した圧力付加機構134Fの圧力付加操作により、溶出液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。これにより、固相抽出充填剤114Aに吸着した免疫抑制剤を溶出回収する。
【0088】
位置Rで回収された抽出物は、前処理サンプル導入機構206を用いて、質量分析部200のイオン源204から質量分析装置202に導入され、目的成分の定量データを出力する。質量分析装置202は、例えば三連四重極型の質量分析装置で、MRM(Multiple Reaction Monitoring)分析することにより、免疫抑制剤の分離およびピーク面積値からの定量を行う。その際、検体に対して内部標準物質を一定量添加しておくことにより、前処理を含めた精度管理や比率計算から定量値を割り出すことができる。
【0089】
次に、血清や尿等の全血以外の血清・血漿などの生体試料を対象としたときの実施例について説明する。この場合、生体試料の除タンパク質を行った後、測定対象成分の固相抽出を行うため、図3に示した工程のうち、溶血工程(図3の工程7,8:溶血処理液添加および撹拌)を省略することになる。ただし、除タンパク質効果を高めるために硫酸亜鉛水溶液を添加する工程7を実施してもよいものである。
【0090】
まず、固相抽出充填剤114Aのコンディショニングについて示す。この場合、固相抽出充填剤114Aは逆相モードとする。カートリッジ110のフィルターユニット112に100%メタノールを100μl添加し、圧力付加操作によりメタノールを固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。引き続いて、同様にフィルターユニット112にH2Oを同量添加し、同操作により固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。この一連の操作により、固相抽出ユニット114に充填した固相抽出充填剤114Aのコンディショニングを行う。
【0091】
次に、フィルターユニット114に生体試料を50μl添加する。これに対して、除タンパク質用の100%メタノールを50μl添加した後、十分に撹拌することにより、除タンパク質処理を行う。この操作により生体試料由来のタンパク質が凝集し、測定対象成分は上清側に抽出された状態になる。
【0092】
タンパク質凝集後の試料に対して、必要に応じてメタノールを希釈する。例えば、親水性が高い測定対象成分の抽出については、有機溶媒濃度が高いと固相抽出充填剤への吸着効率が低下するため、濾過処理前に希釈しておくことが望ましい。
【0093】
凝集したタンパク質を取り除くため、圧力付加操作を行い、濾液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。この操作により、濾液を一時回収することなしに直接固相抽出充填剤114Aに供試でき、測定対象成分を充填剤に吸着させる操作までを一括して完了させることができる。
【0094】
次に、試料に内部標準物質を添加し、十分に撹拌する。そして、圧力付加操作を行い、濾液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。
【0095】
次に、フィルターユニット112に固相抽出充填剤洗浄用の洗浄液,例えば、H2O等を50μl添加し、圧力付加操作により同洗浄液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。これにより、固相抽出充填剤114Aに薬剤成分を吸着させたまま、その他の夾雑成分を除去する。
【0096】
次に、フィルターユニット112に溶出液,例えば、100%メタノール等測定対象成分の物性に応じて設定を50μl添加し、圧力付加操作により同溶出液を固相抽出ユニット114に移行させ、さらに固相抽出充填剤114A全体を経由させた後、固相抽出ユニット114から排出させる。これにより、固相抽出充填剤114Aに吸着した測定対象成分を溶出回収する。
【0097】
以上の前処理で得られた抽出物は、例えば三連四重極型の質量分析装置でMRM分析することにより、測定対象成分の分離およびピーク面積値からの定量を行う。その際、検体に対して内部標準物質を一定量添加しておくことにより、前処理を含めた精度管理や比率計算から定量値を割り出すことができる。
【0098】
以上説明したように、本実施形態によれば、免疫抑制剤のような脂溶性の高い薬剤の全血処理と固相抽出処理を行う際に、薬剤の物性溶解性を活かし、全血処理産物の一時回収なしに直接固相抽出処理に移行できる凝集タンパク質除去と固相抽出カラムへのサンプルロードを一括して実施できる。
【0099】
また、血清や尿等の生体試料中の測定対象成分を粗精製するため、除タンパク質処理と固相抽出処理を1個の前処理用器材カートリッジで実現し、除タンパク質処理後の濾液を一時回収なしに直接固相抽出ユニットに供試できる。
【0100】
さらに、血液のような夾雑成分の多い生体試料を前処理なしに直接同器材に供試することが可能であり、同器材で処理して得られた抽出物を直接MS等の分析装置に供試することができる。
【0101】
これらにより、濾液の一時回収工程の省略により、工程およびTATの短縮化が図れる。
【0102】
また、濾液の一時回収および一時回収した濾液の固相抽出ユニットへの供試に関わる機構の省略を図ることが可能となり、同前処理用器材カートリッジを用いて自動処理するシステムの簡素化および低コスト化が実現できる。
【0103】
さらに、一時回収工程の省略により、一時回収用の容器が不要となるため、消耗品点数およびそのコストを削減することが可能となるとともに、一時回収工程で生じるサンプルロスおよびキャリーオーバーを回避できる。
【0104】
固相抽出ターンテーブル上でランダムに多種多数の検査項目に対して自動処理全血向け、血清向けを実現できる。
【0105】
また、ホルダの上部の直径を大きくすることで、フィルターユニットフィルター部の直径を大きくでき、夾雑成分の目詰まりを回避できる。
【0106】
次に、図5を用いて、本発明の第2の実施形態による臨床分析システムの構成及び動作について説明する。なお、本実施形態による臨床分析システムの全体構成は、図1に示したものと同様である。また、本実施形態による臨床分析システムの分析処理の内容は、図3に示したものと同様である。
【0107】
図5は、本発明の第2の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【0108】
カートリッジ110Aは、フィルターユニット112と固相抽出ユニット114が連結され、脱着可能な構造を有している。カートリッジ110Aは、上流側にフィルターユニット112、下流側に固相抽出ユニット114が配置され、フィルターユニット112からの濾液を一時回収することなしに直接固相抽出ユニット114に供試する構成となっている。
【0109】
フィルターユニット112のホルダ116Aと、固相抽出ユニット114のホルダ116Bとは、別体であり、連結部116Cにより脱着可能に連結されている。連結部116は、図示にように、ホルダ116Aに形成された雄ねじと、ホルダ116Bに形成された雌ねじとにより形成されている。なお、雄雌ねじにより結合に代わりに、一方を他方に挿入した後、ねじ込んでロックできるルアーロックなどを用いることもできる。
【0110】
樹脂製のホルダ116A、116Bは、円筒形状である。ホルダ116Bの上部の直径R1は、ホルダ116Aの直径と等しく、下部の直径R2に比べて大きくなっている。フィルターユニット112は、ホルダ116Aの内部に固定されたフィルター部112Aと、ホルダ116Aの内部であり、フィルター部112Aの上部の空間であるフィルターリザーバー112Bとで構成される。ここで、ホルダ116Aの直径R1を大きくすることで、フィルター部112Aの直径を大きくでき、夾雑成分の目詰まりを回避できる。
【0111】
また、固相抽出ユニット114は、ホルダ116Bの内部であって、フィルター部112Aの下方の直径の大きな部分に形成される固相抽出リザーバー114Dと、固相抽出充填剤114Aと、固相抽出充填剤114Aを固相抽出ユニット114の内部に保持する上流側フリット114B及び下流側フリット114Cで構成される。
【0112】
その他の構成は、図2に示したものと同様である。
【0113】
図3の説明では、カートリッジ110Aのフィルターユニット112のリザーバー112Bには、凝集したタンパク質PRTが残留したまま、その後の処理が進められているが、固相抽出処理によって使用される溶剤によって、凝集したタンパク質に吸着している夾雑成分が溶解し、フィルターユニット112のフィルター部112Aを透過する恐れがある場合には、除タンパク質処理後に、カートリッジ110Aの上部のフィルターユニット112を取り外すようにできる。
【0114】
そのため、図1に示した位置Lにおいて、カートリッジ移動機構130Bは、上部のフィルターユニットを取り外すために備えられている。
【0115】
以上説明したように、本実施形態によっても、濾液を一時回収することなく固相の抽出が可能となる。
【0116】
次に、図6を用いて、本発明の第3の実施形態による臨床分析システムの構成及び動作について説明する。なお、本実施形態による臨床分析システムの全体構成は、図1に示したものと同様である。また、本実施形態による臨床分析システムの分析処理の内容は、図3に示したものと同様である。
【0117】
図6は、本発明の第3の実施形態による臨床分析システムに用いるカートリッジの構成を示す断面図である。
【0118】
カートリッジ110Bは、フィルターユニット112と固相抽出ユニット114が連結され、一体化された構造を有している。カートリッジ110Bは、上流側にフィルターユニット112、下流側に固相抽出ユニット114が配置され、フィルターユニット112からの濾液を一時回収することなしに直接固相抽出ユニット114に供試する構成となっている。
【0119】
樹脂製のホルダ116は、円筒形状であり、上部の直径R1が、下部の直径R2に比べて大きくなっている。フィルターユニット112は、ホルダ116の内部に固定されたフィルター部112Aと、ホルダ116の内部であり、フィルター部112Aの上部の空間であるフィルターリザーバー112Bとで構成される。ここで、ホルダ116の上部の直径R1を大きくすることで、フィルター部112Aの直径を大きくでき、夾雑成分の目詰まりを回避できる。
【0120】
また、固相抽出ユニット114は、固相抽出充填剤114Aと、固相抽出充填剤114Aを固相抽出ユニット114の内部に保持する下流側フリット114Cで構成される。なお、図2に示した上流側フリット114Bは、フィルター部112Aが兼用している。したがって、フィルターユニット112と固相抽出ユニット114は互いに切り離せないように接合された構造を取るため、両ユニットを脱着できないものである。フィルター部112Aの構造は、固相抽出充填剤114Aに接する下流側に向かってテーパー状になっていてもよいものである。
【0121】
その他の構成は、図2に示したものと同様である。
【0122】
以上説明したように、本実施形態によっても、濾液を一時回収することなく固相の抽出が可能となる。
【0123】
なお、本発明は、臨床検査分野だけでなく、目的成分検出に夾雑成分からの精製を要する分析分野に幅広く応用可能である。例えば、環境、食品、医用、公安テロ対策/違法薬物等の分野への実用およびそのための基礎/応用研究に利用可能である。
【符号の説明】
【0124】
100…前処理部
110…カートリッジ
112…フィルターユニット
112A…フィルター部
112B…フィルターリザーバー
114…固相抽出ユニット
114A…固相抽出充填剤
114B…上流側フリット
114C…下流側フリット
114D…固相抽出リザーバー
116…ホルダ
120…カートリッジテーブル
130…カートリッジ移動機構
132…分注機構
134…圧力付加機構
136…撹拌機構
200…質量分析部
202…質量分析装置
204…イオン化部
206…前処理サンプル導入機構
300…制御演算部
【特許請求の範囲】
【請求項1】
生体試料から測定対象成分を抽出する前処理部と、該前処理部により抽出された測定対象成分を質量分析する質量分析部とを有する臨床検査システムであって、
前記前処理部は、
上流側のフィルター部を有するフィルターユニットと下流側の固相抽出剤を有する固相抽出ユニットが連結した前処理用器材を、複数設置するカートリッジテーブルと、
該カートリッジテーブルに設置された前記前処理用器材に対して所定の溶液を供給する複数の分注機構と、
前記カートリッジテーブルに設置された前記前処理用器材の内部の溶液に圧力を付加する複数の圧力付加機構と、
前記カートリッジテーブルに設置された前記前処理用器材の内部の溶液を撹拌する複数の撹拌機構とを備えることを特徴とする臨床検査システム。
【請求項2】
請求項1記載の臨床検査システムにおいて、
前記前処理用器材の前記フィルターユニットと前記固相抽出ユニットとは、脱着可能に連結されており、
前記カートリッジテーブルに設置された前記前処理容器材の前記フィルターユニットを取り外す前処理用器材移動機構を備えることを特徴とする前処理用器材。
【請求項3】
生体試料から測定対象成分を抽出し、分析する臨床検査方法であって、
上流側に位置し、フィルター部を有するフィルターユニットと下流側に位置し、固相抽出剤を有する固相抽出ユニットが連結した前処理用器材を用い、
前記フィルターユニット内で試料と試薬を反応させ、反応産物を前記フィルター部による濾過処理により濾液と残渣に分別し、残渣をフィルターユニット側に残した状態を保ちながら、濾液の一時回収操作なしに直接濾液を固相抽出ユニットに供給し、
測定対象成分を前記固相抽出ニットの固相抽出充填剤に捕捉させるとともに非吸着成分を固相抽出充填剤から素通りさせることで廃棄し、
前記固相抽出充填剤に非特異的あるいは弱く吸着した前記測定対象成分とは異なる不要な夾雑成分を洗浄除去し、
最後に前記測定対象成分を特異的に前記固相抽出充填剤から溶出可能な条件下で回収し、
回収した前記測定対象成分を質量分析することを特徴とする臨床検査方法。
【請求項4】
請求項3記載の臨床検査方法において、
前記生体試料は全血であり、
前記フィルター部における濾過処理時の除タンパク質処理に用いる溶液,前記固相抽出剤による固相抽出時に用いる溶液として、濃度50%以上のメタノールを用いることを特徴とする臨床検査方法。
【請求項5】
請求項3記載の臨床検査方法において、
前記測定対象成分は、免疫抑制剤成分であることを特徴とする臨床検査方法。
【請求項6】
臨床検査システムの前処理に用いられる前処理用器材であって、
上流側のフィルター部を有するフィルターユニットと、
該フィルターユニットに連結され、固相抽出剤を有する固相抽出ユニットとを備えることを特徴とする前処理用器材。
【請求項7】
請求項6記載の前処理用器材において、
前記フィルターユニットと前記固相抽出ユニットとは、脱着可能に連結されていることを特徴とする前処理用器材。
【請求項8】
請求項6記載の前処理用器材において、
前記フィルターユニットと前記固相抽出ユニットとは、一体的に連結されているとともに、
前記フィルターユニットの前記フィルター材は、前記固相抽出ユニットの前記固相抽出剤の上流側のフリットを兼用することを特徴とする前処理用器材。
【請求項9】
請求項6記載の前処理用器材において、
前記フィルターユニットの前記フィルター材の面積は、前記固相抽出ユニットの前記固相抽出剤の上流側のフリット以上の面積を有することを特徴とする前処理用器材。
【請求項10】
請求項6記載の前処理用器材において、
前記固相抽出ユニットの前記固相抽出剤の充填高が、前記固相抽出ユニットの前記固相抽出剤の上流側のフリットの直径以上であることを特徴とする前処理用器材。
【請求項1】
生体試料から測定対象成分を抽出する前処理部と、該前処理部により抽出された測定対象成分を質量分析する質量分析部とを有する臨床検査システムであって、
前記前処理部は、
上流側のフィルター部を有するフィルターユニットと下流側の固相抽出剤を有する固相抽出ユニットが連結した前処理用器材を、複数設置するカートリッジテーブルと、
該カートリッジテーブルに設置された前記前処理用器材に対して所定の溶液を供給する複数の分注機構と、
前記カートリッジテーブルに設置された前記前処理用器材の内部の溶液に圧力を付加する複数の圧力付加機構と、
前記カートリッジテーブルに設置された前記前処理用器材の内部の溶液を撹拌する複数の撹拌機構とを備えることを特徴とする臨床検査システム。
【請求項2】
請求項1記載の臨床検査システムにおいて、
前記前処理用器材の前記フィルターユニットと前記固相抽出ユニットとは、脱着可能に連結されており、
前記カートリッジテーブルに設置された前記前処理容器材の前記フィルターユニットを取り外す前処理用器材移動機構を備えることを特徴とする前処理用器材。
【請求項3】
生体試料から測定対象成分を抽出し、分析する臨床検査方法であって、
上流側に位置し、フィルター部を有するフィルターユニットと下流側に位置し、固相抽出剤を有する固相抽出ユニットが連結した前処理用器材を用い、
前記フィルターユニット内で試料と試薬を反応させ、反応産物を前記フィルター部による濾過処理により濾液と残渣に分別し、残渣をフィルターユニット側に残した状態を保ちながら、濾液の一時回収操作なしに直接濾液を固相抽出ユニットに供給し、
測定対象成分を前記固相抽出ニットの固相抽出充填剤に捕捉させるとともに非吸着成分を固相抽出充填剤から素通りさせることで廃棄し、
前記固相抽出充填剤に非特異的あるいは弱く吸着した前記測定対象成分とは異なる不要な夾雑成分を洗浄除去し、
最後に前記測定対象成分を特異的に前記固相抽出充填剤から溶出可能な条件下で回収し、
回収した前記測定対象成分を質量分析することを特徴とする臨床検査方法。
【請求項4】
請求項3記載の臨床検査方法において、
前記生体試料は全血であり、
前記フィルター部における濾過処理時の除タンパク質処理に用いる溶液,前記固相抽出剤による固相抽出時に用いる溶液として、濃度50%以上のメタノールを用いることを特徴とする臨床検査方法。
【請求項5】
請求項3記載の臨床検査方法において、
前記測定対象成分は、免疫抑制剤成分であることを特徴とする臨床検査方法。
【請求項6】
臨床検査システムの前処理に用いられる前処理用器材であって、
上流側のフィルター部を有するフィルターユニットと、
該フィルターユニットに連結され、固相抽出剤を有する固相抽出ユニットとを備えることを特徴とする前処理用器材。
【請求項7】
請求項6記載の前処理用器材において、
前記フィルターユニットと前記固相抽出ユニットとは、脱着可能に連結されていることを特徴とする前処理用器材。
【請求項8】
請求項6記載の前処理用器材において、
前記フィルターユニットと前記固相抽出ユニットとは、一体的に連結されているとともに、
前記フィルターユニットの前記フィルター材は、前記固相抽出ユニットの前記固相抽出剤の上流側のフリットを兼用することを特徴とする前処理用器材。
【請求項9】
請求項6記載の前処理用器材において、
前記フィルターユニットの前記フィルター材の面積は、前記固相抽出ユニットの前記固相抽出剤の上流側のフリット以上の面積を有することを特徴とする前処理用器材。
【請求項10】
請求項6記載の前処理用器材において、
前記固相抽出ユニットの前記固相抽出剤の充填高が、前記固相抽出ユニットの前記固相抽出剤の上流側のフリットの直径以上であることを特徴とする前処理用器材。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−95069(P2011−95069A)
【公開日】平成23年5月12日(2011.5.12)
【国際特許分類】
【出願番号】特願2009−248364(P2009−248364)
【出願日】平成21年10月29日(2009.10.29)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成23年5月12日(2011.5.12)
【国際特許分類】
【出願日】平成21年10月29日(2009.10.29)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

