自動分析装置
【課題】既存のシステムを変更することなく、反応容器洗浄後に残存する血球を検出することで、反応容器キャリーオーバーの低減および反応容器洗浄の効率化を図ることにある。
【解決手段】通常の洗浄を終えた反応容器に蒸留水等を分注し、残存した血球が浸透圧の違いによって自己溶血する作用を利用し、人血球溶血液で吸収のある波長と吸収のない別の波長を2波長測光することにより、その吸光度差から反応容器内の血球の残存量を判定する。
【解決手段】通常の洗浄を終えた反応容器に蒸留水等を分注し、残存した血球が浸透圧の違いによって自己溶血する作用を利用し、人血球溶血液で吸収のある波長と吸収のない別の波長を2波長測光することにより、その吸光度差から反応容器内の血球の残存量を判定する。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、生体試料の定性・定量分析を行う自動分析装置に係り、特に、測光に使用する反応容器で血球成分の溶血処理を行う自動分析装置における血球残存の判定方法に関する。
【背景技術】
【0002】
臨床化学分析において、血液や尿などの生体試料中の無機イオン,たんぱく,含窒素成分,糖質,脂質,酵素,ホルモン,薬物など生化学成分のうちの大部分は、自動分析装置によって分析されている。この自動分析装置で使用される反応容器は、一部の装置でディスポーザブル(使い捨て)反応キュベットを用いるが、ランニングコストを下げるためなどの理由により、大部分の装置では使用後の反応キュベットを洗浄することで繰返し使用している。
【0003】
従来の反応キュベットの洗浄方法としては、一回の分析ごとに蒸留水などによる自動洗浄を行う方法や、洗剤を反応キュベットに注入して洗浄する方法がある。特許文献1には、洗浄後の反応容器のスペクトルから汚れの原因,程度を判定して、反応容器洗浄に用いる洗剤の種類,濃度を決定する方法が記載されている。
【0004】
また、洗浄後の反応容器の汚れチェック方法としては、次の測定の前に実施する水ブランク測定時に吸光度をチェックする方法、あるいは、反応容器すべてを対象に反応容器の特殊洗浄を実施したのち、次の測定に使用する前に実施する水ブランク測定時に吸光度をチェックする方法があった。
【0005】
一方で、平成20年4月より実施されているメタボリックシンドローム(内臓脂肪症候群)検診の測定項目にはHbA1c測定が含まれており、今後HbA1c測定検体は増加することが見込まれ、大量検体を迅速に処理できるHbA1c測定が可能な汎用自動分析装置が望まれている。しかしながら、HbA1cは赤血球に存在する成分であるため、測定には血液を遠心分離処理して得られる血球を溶血させる必要がある。しかし、血球成分は、高粘性の液体(場合により、ゲル状の物質)であり、反応容器に血球を分注して溶血させた場合には、通常の反応容器洗浄方法では、反応容器に残る血球を洗浄しきれず、血球が次の分析にキャリーオーバーする恐れがあるため、従来の自動分析装置では分析が難しかった。
【0006】
HbA1c測定を可能にする自動分析装置を実現するためには、(1)血球と血漿(血清)に含有される成分濃度の差、(2)ヘモグロビンの吸収波長が400〜500nmの比色波長として反応に重なることによる測定誤差、(3)血球の成分が反応に直接影響を与える可能性、などを考慮する必要がある。
【0007】
上記従来の自動分析装置の反応容器洗浄方法は、主に尿,血清,血漿といった比較的粘性の小さい試料を想定したものであり、粘性の高い血球に十分対応できるものとは言い切れなかった。そのため、反応容器の洗浄不良から血球キャリーオーバーが生じ、正確性を欠いた測定結果から誤診へと繋がりかねないという懸念があり、血球キャリーオーバーを回避する反応容器の洗浄方法や反応容器に残存する血球の検出方法が必要とされているといえる。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平5−164762号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
上記従来の自動分析装置のセル汚れチェック方法では、次の測定に使用する二つの波長についてのみ反応セルの汚れをチェックしていたため、次の測定に血球に対する吸収がある波長が選択されている場合には血球の残存を検出できるが、それ以外の場合には血球残りを検知することは難しかった。
【0010】
また、引用文献1に記載されている方法では、波形のピーク位置及び波形の形状から汚れの有無を検出するため、従来の光度計に加えて装置上に吸収スペクトルを測定するための光度計を搭載する必要があり、装置のコストアップに繋がりかねない。
【0011】
本発明の目的は、既存のシステムを変更することなく、反応容器に残存する血球の有無を判定することで、溶血処理に用いた反応容器を介する血球成分のキャリーオーバー低減、および溶血処理に用いた反応容器洗浄の効率化を図ることにある。
【課題を解決するための手段】
【0012】
上記目的を達成するために、通常の洗浄を終えた反応容器に蒸留水等を分注することで、該反応容器に残存した血球を浸透圧の違いによって自己溶血させ、ヒト血球溶血液に吸収のある波長と吸収のない別の波長の2波長の吸光度の差分から反応容器内の血球の残存有無を判定する。
【発明の効果】
【0013】
洗浄後の反応容器に残存する血球の有無を判定することで、反応容器を介した血球キャリーオーバーを低減し、反応容器洗浄の効率化を図ることができる。
【図面の簡単な説明】
【0014】
【図1】本発明の実施形態に係わる自動分析装置の構成図である。
【図2】本発明の実施形態に係わる動作フローである。
【発明を実施するための形態】
【0015】
以下、図面を用いて本発明の実施例を説明する。
【実施例1】
【0016】
図1は、本実施例で示す自動分析装置の動作原理図であり、次にその基本動作を示す。分光光度計10と光源26の間には、測定対象を収容する反応ディスク3が配置される。この反応ディスク3の外周上には、例えば、160個といった、多数の反応容器4が設けられている。また、反応ディスク3の全体は、恒温槽9によって、所定の温度に保持されている。
【0017】
サンプルディスク機構1には、多数の試料容器25が配置されている。試料容器25内の試料は、試料サンプリング機構2のサンプルノズル27によって吸引され、所定の位置の反応容器4に注入される。
【0018】
試薬ディスク機構5は、多数の試薬容器6を備えている。また、この試薬ディスク機構5には、試薬ピペッティング機構7が配置されており、試薬は、この試薬ピペッティング機構7の試薬ノズル28によって吸引され、所定の位置の反応容器4に注入される。吸光度は反応容器4が分光光度計10と光源26との間を横切ったタイミングで取り込まれ、濃度値に換算された後にハードディスク22に保存したり、プリンタ20に出力されたりする。また、CRT21に検査データとして表示させることもできる。
【0019】
測定終了後は、洗浄機構11が反応容器4内に収容した測定対象を吸引排出して、洗浄水や洗浄液などで内部を洗浄するなどして反応容器4を洗浄し、その後反応容器4は新たな分析に対して供されることとなる。
【0020】
その他の自動分析装置の機構としては、マイクロコンピュータ19,インターフェース23,Log変換器およびA/D変換器18,試薬用ピペッタ17,洗浄水ポンプ16,試料用ピペッタ15,操作パネル24、なども必要に応じて備えている。
【0021】
上述の構成において、操作者は、操作パネル24を用いて分析依頼情報の入力を行う。操作者が入力した分析依頼情報は、マイクロコンピュータ19内のメモリに記憶される。試料容器25に入れられ、サンプルディスク機構1の所定の位置にセットされた測定対象試料はマイクロコンピュータ19のメモリに記憶された分析依頼情報に従って、試料用ピペッタ15および試料サンプリング機構2のサンプルノズル27によって、反応容器に所定量分注される。試料分注後のサンプルノズル27は次の試料を吸引する前に水洗浄され、試料間キャリーオーバーを防止する。測定対象試料を収容した当該反応容器に試薬ピペッティング機構7の試薬ノズル28によって、所定量の試薬が分注される。試薬分注後の試薬ノズル28は水洗浄された後、次の試料のための試薬を分注する。試料と試薬の混合液は、撹拌機構8の撹拌棒29により撹拌される。攪拌後の撹拌棒29は水洗浄された後、次の反応容器の混合液を撹拌する。
【0022】
反応容器4は恒温槽9により一定温度に保持されているため、反応と測光の両方の用途に用いられる。反応過程では一定時間ごとに分光光度計10によって、設定された波長を用いて混合液の吸光度が測定される。測定された吸光度はLog変換器およびA/D変換器18,インターフェース23を介してマイクロコンピュータ19に取り込まれる。
【0023】
次に本発明における反応容器4の洗浄工程について述べる。上述の測定が終了した反応容器4は洗浄機構11により通常の洗浄が実行された後、蒸留水等が注入される。蒸留水が注入されることによって、当該反応容器4に血球成分が残存していた場合には浸透圧による自己溶血の作用が生じ、血球成分が残存していない反応容器4における蒸留水と比べて吸光スペクトルに違いが現れる。この違いを検知するため、蒸留水が満たされた反応容器4に対し分光光度計10の光軸を横切るタイミングで吸光度を測定する。
【0024】
吸光度の測定にあたっては、2波長測光ではヒトの血球溶血液に吸収をもつ570nm近傍、およびヒトの血球溶血液には吸収を持たない700nm近傍の吸光度を測定し、その差分を算出することが考えられる。2波長に対する吸光度を同時に測定することで、光源26由来の測定値変動が相殺され、安定な測光が可能となるためである。
【0025】
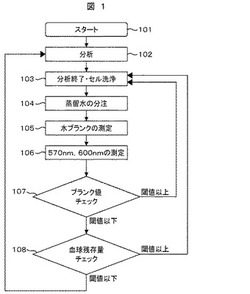
図2は、上述の方法によって得られた測定値を用いて血球残存を判定するフローチャートの一例である。測定された吸光度はLog変換器およびA/D変換器18,インターフェース23を介してマイクロコンピュータ19に取り込まれる。そして、マイクロコンピュータ19によって、反応容器の汚れの程度を確認するためのブランク値チェック、および反応容器内における血球の残存程度をチェックし、反応容器が測定に使用できるかどうか決定される。
【0026】
図2のステップ101から104において、試料の分析が終了し、反応容器が洗浄され、蒸留水が注入されると、ステップ105では蒸留水が注入されたすべての反応容器に対してブランク値として蒸留水の吸光度が測定される。さらに、ステップ102で溶血のために使用された反応容器に関しては、ステップ106で、血球成分に吸収の有る波長および血球成分に吸収の無い波長の2波長に対して吸光度が測定される。2波長は、例えば血球成分に吸収の有る波長として570nm、血球成分に吸収の無い波長として700nmを採用することが考えられるが、他の波長の組み合わせであってもよい。
【0027】
ステップ107では、ブランク値をチェックしてセルの汚れ(セル壁に対する血清成分の付着など)を検出し、次の測定に使用できるか否か判断される。ブランク値の吸光度が予め計測しておいたブランク値と比較して閾値以上の場合にはセル汚れが十分に落ちていないと判断して、ステップ103に戻り再度セルの洗浄を実施する。ブランク値が予め計測しておいた閾値以下であれば、セル汚れは洗浄によって十分に落とせたと判断される。
【0028】
ステップ102で溶血のために使用された反応容器であって、ステップ106で2波長に対する吸光度が測定されている反応容器は、ステップ108に進む。それ以外の反応容器は、次の分析で使用するためにステップ102へと戻る。ステップ108では、ステップ106で計測した570nmと700nmの2波長の吸光度差をチェックし、反応容器中に血球の残存が無く、次の測定に使用できるか否かが判断される。ステップ106で得られた2波長の吸光度差が閾値以上の場合は、血球残存があると判断して、ステップ103に戻り再度反応容器の洗浄を実施する。
【0029】
ステップ108において、2波長の吸光度差が閾値より小さい場合には血球残存が無いものと判断して、次回の測定に使用できる反応容器として、ステップ102の測定に使用する。ステップ108における閾値は、例えば0.03Abs程度であると考えられる。この閾値はHb濃度が約5000mg/dLのときに波長570nmで2.3Abs程度の吸収があるとの実験結果に基づき、反応容器内に許容できるHb濃度を約50mg/dLとしたときの値を設定した。
【0030】
なお、本フローチャートでは前回測定時に溶血のために使用された反応容器について、残存血球チェックを行うが、例えば、装置が何らかのトラブルで緊急停止し、停止前に何の測定に使用したか装置が記憶していない場合などは、全セルに対して血球残存チェックを行うように制御しても良い。
【符号の説明】
【0031】
1 サンプルディスク
2 試料サンプリング機構
3 反応ディスク
4 反応容器
5 試薬ディスク
6 試薬容器
7 試薬ピペッティング機構
8 攪拌機構
9 恒温槽
10 分光光度計
11 洗浄機構
12 吸引ノズル
13 洗浄剤
14 洗剤注入ノズル
15 試料用ピペッタ
16 洗浄水ポンプ
17 試薬用ピペッタ
18 Log変換器およびA/D変換器
19 マイクロコンピュータ
20 プリンタ
21 CRT
22 ハードディスク
23 インターフェース
24 操作パネル
25 試料容器
26 光源
27 サンプルプローブ
28 試薬プローブ
29 攪拌棒
30 第2試薬用バーコードリーダ
31 第1試薬用バーコードリーダ
【技術分野】
【0001】
この発明は、生体試料の定性・定量分析を行う自動分析装置に係り、特に、測光に使用する反応容器で血球成分の溶血処理を行う自動分析装置における血球残存の判定方法に関する。
【背景技術】
【0002】
臨床化学分析において、血液や尿などの生体試料中の無機イオン,たんぱく,含窒素成分,糖質,脂質,酵素,ホルモン,薬物など生化学成分のうちの大部分は、自動分析装置によって分析されている。この自動分析装置で使用される反応容器は、一部の装置でディスポーザブル(使い捨て)反応キュベットを用いるが、ランニングコストを下げるためなどの理由により、大部分の装置では使用後の反応キュベットを洗浄することで繰返し使用している。
【0003】
従来の反応キュベットの洗浄方法としては、一回の分析ごとに蒸留水などによる自動洗浄を行う方法や、洗剤を反応キュベットに注入して洗浄する方法がある。特許文献1には、洗浄後の反応容器のスペクトルから汚れの原因,程度を判定して、反応容器洗浄に用いる洗剤の種類,濃度を決定する方法が記載されている。
【0004】
また、洗浄後の反応容器の汚れチェック方法としては、次の測定の前に実施する水ブランク測定時に吸光度をチェックする方法、あるいは、反応容器すべてを対象に反応容器の特殊洗浄を実施したのち、次の測定に使用する前に実施する水ブランク測定時に吸光度をチェックする方法があった。
【0005】
一方で、平成20年4月より実施されているメタボリックシンドローム(内臓脂肪症候群)検診の測定項目にはHbA1c測定が含まれており、今後HbA1c測定検体は増加することが見込まれ、大量検体を迅速に処理できるHbA1c測定が可能な汎用自動分析装置が望まれている。しかしながら、HbA1cは赤血球に存在する成分であるため、測定には血液を遠心分離処理して得られる血球を溶血させる必要がある。しかし、血球成分は、高粘性の液体(場合により、ゲル状の物質)であり、反応容器に血球を分注して溶血させた場合には、通常の反応容器洗浄方法では、反応容器に残る血球を洗浄しきれず、血球が次の分析にキャリーオーバーする恐れがあるため、従来の自動分析装置では分析が難しかった。
【0006】
HbA1c測定を可能にする自動分析装置を実現するためには、(1)血球と血漿(血清)に含有される成分濃度の差、(2)ヘモグロビンの吸収波長が400〜500nmの比色波長として反応に重なることによる測定誤差、(3)血球の成分が反応に直接影響を与える可能性、などを考慮する必要がある。
【0007】
上記従来の自動分析装置の反応容器洗浄方法は、主に尿,血清,血漿といった比較的粘性の小さい試料を想定したものであり、粘性の高い血球に十分対応できるものとは言い切れなかった。そのため、反応容器の洗浄不良から血球キャリーオーバーが生じ、正確性を欠いた測定結果から誤診へと繋がりかねないという懸念があり、血球キャリーオーバーを回避する反応容器の洗浄方法や反応容器に残存する血球の検出方法が必要とされているといえる。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平5−164762号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
上記従来の自動分析装置のセル汚れチェック方法では、次の測定に使用する二つの波長についてのみ反応セルの汚れをチェックしていたため、次の測定に血球に対する吸収がある波長が選択されている場合には血球の残存を検出できるが、それ以外の場合には血球残りを検知することは難しかった。
【0010】
また、引用文献1に記載されている方法では、波形のピーク位置及び波形の形状から汚れの有無を検出するため、従来の光度計に加えて装置上に吸収スペクトルを測定するための光度計を搭載する必要があり、装置のコストアップに繋がりかねない。
【0011】
本発明の目的は、既存のシステムを変更することなく、反応容器に残存する血球の有無を判定することで、溶血処理に用いた反応容器を介する血球成分のキャリーオーバー低減、および溶血処理に用いた反応容器洗浄の効率化を図ることにある。
【課題を解決するための手段】
【0012】
上記目的を達成するために、通常の洗浄を終えた反応容器に蒸留水等を分注することで、該反応容器に残存した血球を浸透圧の違いによって自己溶血させ、ヒト血球溶血液に吸収のある波長と吸収のない別の波長の2波長の吸光度の差分から反応容器内の血球の残存有無を判定する。
【発明の効果】
【0013】
洗浄後の反応容器に残存する血球の有無を判定することで、反応容器を介した血球キャリーオーバーを低減し、反応容器洗浄の効率化を図ることができる。
【図面の簡単な説明】
【0014】
【図1】本発明の実施形態に係わる自動分析装置の構成図である。
【図2】本発明の実施形態に係わる動作フローである。
【発明を実施するための形態】
【0015】
以下、図面を用いて本発明の実施例を説明する。
【実施例1】
【0016】
図1は、本実施例で示す自動分析装置の動作原理図であり、次にその基本動作を示す。分光光度計10と光源26の間には、測定対象を収容する反応ディスク3が配置される。この反応ディスク3の外周上には、例えば、160個といった、多数の反応容器4が設けられている。また、反応ディスク3の全体は、恒温槽9によって、所定の温度に保持されている。
【0017】
サンプルディスク機構1には、多数の試料容器25が配置されている。試料容器25内の試料は、試料サンプリング機構2のサンプルノズル27によって吸引され、所定の位置の反応容器4に注入される。
【0018】
試薬ディスク機構5は、多数の試薬容器6を備えている。また、この試薬ディスク機構5には、試薬ピペッティング機構7が配置されており、試薬は、この試薬ピペッティング機構7の試薬ノズル28によって吸引され、所定の位置の反応容器4に注入される。吸光度は反応容器4が分光光度計10と光源26との間を横切ったタイミングで取り込まれ、濃度値に換算された後にハードディスク22に保存したり、プリンタ20に出力されたりする。また、CRT21に検査データとして表示させることもできる。
【0019】
測定終了後は、洗浄機構11が反応容器4内に収容した測定対象を吸引排出して、洗浄水や洗浄液などで内部を洗浄するなどして反応容器4を洗浄し、その後反応容器4は新たな分析に対して供されることとなる。
【0020】
その他の自動分析装置の機構としては、マイクロコンピュータ19,インターフェース23,Log変換器およびA/D変換器18,試薬用ピペッタ17,洗浄水ポンプ16,試料用ピペッタ15,操作パネル24、なども必要に応じて備えている。
【0021】
上述の構成において、操作者は、操作パネル24を用いて分析依頼情報の入力を行う。操作者が入力した分析依頼情報は、マイクロコンピュータ19内のメモリに記憶される。試料容器25に入れられ、サンプルディスク機構1の所定の位置にセットされた測定対象試料はマイクロコンピュータ19のメモリに記憶された分析依頼情報に従って、試料用ピペッタ15および試料サンプリング機構2のサンプルノズル27によって、反応容器に所定量分注される。試料分注後のサンプルノズル27は次の試料を吸引する前に水洗浄され、試料間キャリーオーバーを防止する。測定対象試料を収容した当該反応容器に試薬ピペッティング機構7の試薬ノズル28によって、所定量の試薬が分注される。試薬分注後の試薬ノズル28は水洗浄された後、次の試料のための試薬を分注する。試料と試薬の混合液は、撹拌機構8の撹拌棒29により撹拌される。攪拌後の撹拌棒29は水洗浄された後、次の反応容器の混合液を撹拌する。
【0022】
反応容器4は恒温槽9により一定温度に保持されているため、反応と測光の両方の用途に用いられる。反応過程では一定時間ごとに分光光度計10によって、設定された波長を用いて混合液の吸光度が測定される。測定された吸光度はLog変換器およびA/D変換器18,インターフェース23を介してマイクロコンピュータ19に取り込まれる。
【0023】
次に本発明における反応容器4の洗浄工程について述べる。上述の測定が終了した反応容器4は洗浄機構11により通常の洗浄が実行された後、蒸留水等が注入される。蒸留水が注入されることによって、当該反応容器4に血球成分が残存していた場合には浸透圧による自己溶血の作用が生じ、血球成分が残存していない反応容器4における蒸留水と比べて吸光スペクトルに違いが現れる。この違いを検知するため、蒸留水が満たされた反応容器4に対し分光光度計10の光軸を横切るタイミングで吸光度を測定する。
【0024】
吸光度の測定にあたっては、2波長測光ではヒトの血球溶血液に吸収をもつ570nm近傍、およびヒトの血球溶血液には吸収を持たない700nm近傍の吸光度を測定し、その差分を算出することが考えられる。2波長に対する吸光度を同時に測定することで、光源26由来の測定値変動が相殺され、安定な測光が可能となるためである。
【0025】
図2は、上述の方法によって得られた測定値を用いて血球残存を判定するフローチャートの一例である。測定された吸光度はLog変換器およびA/D変換器18,インターフェース23を介してマイクロコンピュータ19に取り込まれる。そして、マイクロコンピュータ19によって、反応容器の汚れの程度を確認するためのブランク値チェック、および反応容器内における血球の残存程度をチェックし、反応容器が測定に使用できるかどうか決定される。
【0026】
図2のステップ101から104において、試料の分析が終了し、反応容器が洗浄され、蒸留水が注入されると、ステップ105では蒸留水が注入されたすべての反応容器に対してブランク値として蒸留水の吸光度が測定される。さらに、ステップ102で溶血のために使用された反応容器に関しては、ステップ106で、血球成分に吸収の有る波長および血球成分に吸収の無い波長の2波長に対して吸光度が測定される。2波長は、例えば血球成分に吸収の有る波長として570nm、血球成分に吸収の無い波長として700nmを採用することが考えられるが、他の波長の組み合わせであってもよい。
【0027】
ステップ107では、ブランク値をチェックしてセルの汚れ(セル壁に対する血清成分の付着など)を検出し、次の測定に使用できるか否か判断される。ブランク値の吸光度が予め計測しておいたブランク値と比較して閾値以上の場合にはセル汚れが十分に落ちていないと判断して、ステップ103に戻り再度セルの洗浄を実施する。ブランク値が予め計測しておいた閾値以下であれば、セル汚れは洗浄によって十分に落とせたと判断される。
【0028】
ステップ102で溶血のために使用された反応容器であって、ステップ106で2波長に対する吸光度が測定されている反応容器は、ステップ108に進む。それ以外の反応容器は、次の分析で使用するためにステップ102へと戻る。ステップ108では、ステップ106で計測した570nmと700nmの2波長の吸光度差をチェックし、反応容器中に血球の残存が無く、次の測定に使用できるか否かが判断される。ステップ106で得られた2波長の吸光度差が閾値以上の場合は、血球残存があると判断して、ステップ103に戻り再度反応容器の洗浄を実施する。
【0029】
ステップ108において、2波長の吸光度差が閾値より小さい場合には血球残存が無いものと判断して、次回の測定に使用できる反応容器として、ステップ102の測定に使用する。ステップ108における閾値は、例えば0.03Abs程度であると考えられる。この閾値はHb濃度が約5000mg/dLのときに波長570nmで2.3Abs程度の吸収があるとの実験結果に基づき、反応容器内に許容できるHb濃度を約50mg/dLとしたときの値を設定した。
【0030】
なお、本フローチャートでは前回測定時に溶血のために使用された反応容器について、残存血球チェックを行うが、例えば、装置が何らかのトラブルで緊急停止し、停止前に何の測定に使用したか装置が記憶していない場合などは、全セルに対して血球残存チェックを行うように制御しても良い。
【符号の説明】
【0031】
1 サンプルディスク
2 試料サンプリング機構
3 反応ディスク
4 反応容器
5 試薬ディスク
6 試薬容器
7 試薬ピペッティング機構
8 攪拌機構
9 恒温槽
10 分光光度計
11 洗浄機構
12 吸引ノズル
13 洗浄剤
14 洗剤注入ノズル
15 試料用ピペッタ
16 洗浄水ポンプ
17 試薬用ピペッタ
18 Log変換器およびA/D変換器
19 マイクロコンピュータ
20 プリンタ
21 CRT
22 ハードディスク
23 インターフェース
24 操作パネル
25 試料容器
26 光源
27 サンプルプローブ
28 試薬プローブ
29 攪拌棒
30 第2試薬用バーコードリーダ
31 第1試薬用バーコードリーダ
【特許請求の範囲】
【請求項1】
少なくとも血液を遠心分離して得られる血球試料を含む、生体試料を収容する複数の反応容器と、
前記反応容器中の試料の光学特性を分析する光学特性測定手段と、
分析終了後の当該反応容器の内部を洗浄する洗浄手段と、
を備えた自動分析装置の制御方法において、
前記洗浄手段による洗浄後の前記反応容器に対して判定液を注入する第一のステップと、
当該反応容器中の判定液に対して異なる二波長における光学特性を測定する第二のステップと、
前記第二のステップにて測定された光学特性から、前記反応容器における血球成分の残存の有無を判定する第三のステップと、を有することを特徴とする自動分析装置の制御方法。
【請求項2】
請求項1記載の自動分析装置の制御方法において、
前記第三のステップで血球成分の残存があると判定された前記反応容器を、前記洗浄手段により再度反応容器を洗浄させる第四のステップと、
前記第三のステップで血球成分の残存が予め定めた閾値よりも小さいと判定された前記反応容器は、次回の分析に使用可能であると判断してフラグを付加する第五のステップと、
を有することを特徴とする自動分析装置の制御方法。
【請求項3】
請求項1記載の自動分析装置の制御方法において、
前記第二のステップでは、前記第一のステップより前に終了した分析で血球成分を用いた分析を実施した前記反応容器に対しては、
前記血球成分に吸収の大きい第一の波長と、
前記第一の波長と比べて血球成分に吸収の小さい第二の波長と、を用いて光学特性の測定を行うことを特徴とする自動分析装置の制御方法。
【請求項4】
請求項1記載の自動分析装置の制御方法において、
前記第二のステップでは、前記第一のステップの前に終了した分析の種類に関らず、全ての反応容器に対して、前記血球成分を検出する光学特性の測定を行うことを特徴とする自動分析装置の制御方法。
【請求項5】
請求項1の自動分析装置の制御方法において、
前記第二のステップにおいて、光学特性の分析は前記反応容器が前記光学特性測定部の測定ポジションを通過するタイミングで行うことを特徴とする自動分析装置の制御方法。
【請求項1】
少なくとも血液を遠心分離して得られる血球試料を含む、生体試料を収容する複数の反応容器と、
前記反応容器中の試料の光学特性を分析する光学特性測定手段と、
分析終了後の当該反応容器の内部を洗浄する洗浄手段と、
を備えた自動分析装置の制御方法において、
前記洗浄手段による洗浄後の前記反応容器に対して判定液を注入する第一のステップと、
当該反応容器中の判定液に対して異なる二波長における光学特性を測定する第二のステップと、
前記第二のステップにて測定された光学特性から、前記反応容器における血球成分の残存の有無を判定する第三のステップと、を有することを特徴とする自動分析装置の制御方法。
【請求項2】
請求項1記載の自動分析装置の制御方法において、
前記第三のステップで血球成分の残存があると判定された前記反応容器を、前記洗浄手段により再度反応容器を洗浄させる第四のステップと、
前記第三のステップで血球成分の残存が予め定めた閾値よりも小さいと判定された前記反応容器は、次回の分析に使用可能であると判断してフラグを付加する第五のステップと、
を有することを特徴とする自動分析装置の制御方法。
【請求項3】
請求項1記載の自動分析装置の制御方法において、
前記第二のステップでは、前記第一のステップより前に終了した分析で血球成分を用いた分析を実施した前記反応容器に対しては、
前記血球成分に吸収の大きい第一の波長と、
前記第一の波長と比べて血球成分に吸収の小さい第二の波長と、を用いて光学特性の測定を行うことを特徴とする自動分析装置の制御方法。
【請求項4】
請求項1記載の自動分析装置の制御方法において、
前記第二のステップでは、前記第一のステップの前に終了した分析の種類に関らず、全ての反応容器に対して、前記血球成分を検出する光学特性の測定を行うことを特徴とする自動分析装置の制御方法。
【請求項5】
請求項1の自動分析装置の制御方法において、
前記第二のステップにおいて、光学特性の分析は前記反応容器が前記光学特性測定部の測定ポジションを通過するタイミングで行うことを特徴とする自動分析装置の制御方法。
【図1】


【図2】




【図2】


【公開番号】特開2011−149831(P2011−149831A)
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願番号】特願2010−11561(P2010−11561)
【出願日】平成22年1月22日(2010.1.22)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願日】平成22年1月22日(2010.1.22)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

