自己免疫疾患の治療方法
【課題】還元イソアルファ酸、ビタミン及びミネラルの組成物と自己免疫疾患の治療のために当該組成物を用いる方法を開示する。他の化合物を含む他の組み合わせもまた意図される。相乗効果特性及び当該相乗効果を用いる方法もまた開示する。
【発明の詳細な説明】
【技術分野】
【0001】
(0001)関連出願の参照
本特許出願は2004年6月10日に出願された米国第10/866,315号の一部継続出願であり、当該出願は2003年10月20日に出願された米国出願第10/689,856号の一部継続出願であり、当該出願は2003年6月18日に出願された米国出願第10/464,410号であり、当該出願は2003年3月26日に出願された米国出願第10/400,293号及び2003年3月26日に出願された米国出願第10/401,283号の一部継続出願であり、両出願は2003年2月25日に出願された仮出願第60/450,237号及び2002年10月21日に出願された仮出願第60/420,383号に対する米国特許法第119条(e)の利益を請求するものであり;及び2003年6月18日に出願された米国出願第10/464,834号の一部継続出願であり、当該出願は2003年3月26日に出願された米国出願第10/400,293号及び2003年3月26日に出願された米国出願第10/401,283号の一部継続出願であり、両出願は2003年2月25日に出願された仮出願第60/450,237号及び2002年10月21日に出願された仮出願第60/420,383号に対する米国特許法第119条(e)の利益を請求するものである。本出願はまた2001年6月20日に出願された米国出願第09/885,721号の一部継続出願である。当該先願の内容は本明細書で引用された場合は、その全体が参照することにより本明細書に組み込まれる。
【0002】
(0002)技術分野
本発明は、概して自己免疫疾患の治療に有用な組成物及び方法に関する。より具体的には、本発明は還元アルファ酸、ミネラル及びビタミンの組成物に関する。
【背景技術】
【0003】
(0003)自己免疫疾患及び障害は身体の防御免疫系が自己破壊的になる場合におこる。自己免疫相互作用の標的は、細胞レベル(例えば、多角性硬化症におけるミエリン塩基性タンパク質又はバセドウ病におけるチロトロピン受容体)から、関節リウマチ又はクローン病における影響が特異的である器官又は全身性エリテマトーデスでみられるように影響が広い系まで幅広い範囲としうる。自己免疫疾患の原因で想定されてきた事象のあるものとしては、例えば、炎症性大腸炎におけるTNF−α、IL−2若しくはIL−2受容体等のサイトカイン過発現、又はサイトカイン発現の低下(1型糖尿病におけるIL−10の弱発現)、アリル発現障害(強直性脊髄炎におけるHLAクラスI B27)、アポトーシスタンパク質の発現の変化(1型自己免疫リンパ球増殖症候群(ALPS1)におけるFas発現の低下)があげられる。自己免疫疾患の他の情報についてはHarrison’s Principles of Internal Medicine. 16th ed., McGraw-Hill, New York, 2005; Chapter 295を参照のこと。
【0004】
(0004)炎症は多くの自己免疫疾患の原因ではないが、それにもかかわらず、例えば、関節リウマチ、炎症性大腸炎、クローン病又は潰瘍性大腸炎等の自己免疫疾患及び障害にしばしば関連する症状である。そして、抗炎症剤が、一時的な治療方法の手段として多くの自己免疫治療方法にしばしば組み込まれている。
【0005】
(0005)プロスタグランジン(PG)の産生を阻害する化合物は痛み及び炎症の制御における重要な薬剤となってきた。集合的にこれらの薬剤は、骨関節炎及び関節リウマチに主に適応する非ステロイド系抗炎症薬(NSAIDs)として知られる。アラキドン酸は全てのPGの生合成の主要な基質として機能する。PGは、急速な細胞環境における無数の生理学的変化に影響する傍分泌の及び自己分泌のメディエーターとして機能するユビキタスホルモンである。PGの多様な生理学的効果としては、関節リウマチ及び骨関節炎、血圧制御、血小板凝集、陣痛及び痛みの悪化の誘発及び発熱等の炎症反応があげられる。
【0006】
(0006)プロスタグランジンに加え、最近の研究では、亜鉛及びセレンの微量金属のレベルが骨関節炎及び関節リウマチの病因や発症に機能する可能性があることが示されてきた。健常者に比べて関節リウマチ患者では、Cu濃度は極めて高いが、血漿液及び滑液のSe濃度は極めて低いことが見出された(各p<0.05及びp<0.05)。研究者はさらに関節リウマチ患者での滑液でのSe−Cu値とZn−Fe値の間に著しい正の相関性があることを同定した(Yazar, M., et al., Biol. Trace Elem Res 106(2): 123-132, 2005; McConnell, K.P., et al., J. Nutr. 105(8) : 1026-1031, 1975を参照のこと)。これは、微量金属を補充すると当該微量元素のレベルが通常のレベルになるため、関節リウマチに関連するいくつかの症状を改善するのに有利でありうることを示唆する。
【0007】
(0007)さらに、マクロファージは免疫反応の潜在的なメディエーターであること、及び、関節リウマチは活性化した食細胞(及び他の免疫反応細胞)を滑膜及び関節周囲組織に移動させることにより特定されることが以前から知られていた。活性化食細胞は滑液に到達すると、リウマチ様疾患を悪化させ持続させるように思われる、巨大な介在物質を放出する。亜鉛の薬理学的用量によりマクロファージが固定されて、滑膜への移動が防止又は制限され、関節リウマチにおける関節の特異的な炎症を軽減するための潜在的な手段が提供される。例えば、Aaseth, J., et al., Analyst 123(1): 3-6, 1998を参照のこと。さらに、マクロファージの固定化はマクロファージの相互作用及び活性化を減退させて、自己免疫反応の関与の可能性又は増強を低下させる機能がありうる。
【発明の開示】
【発明が解決しようとする課題】
【0008】
(0008)それゆえ、プロスタグランジンレベルを調節するか又はマクロファージ活性を制御し、それにより多くの自己免疫疾患に関連する炎症反応を調節する組成物及び方法を同定することは有用であろう。当該調節及び使用は慢性状態では連続的に用いる必要があるか又は必要に応じて断続的に用いられる必要がありうる。加えて、選択微量金属を補充することは、より正常な免疫機能を回復する手段ともなり、それにより、自己免疫疾患の診療に他の手段を提供することになる。本発明は、生活の質の向上の亢進に伴う症状に関連する炎症及び自己免疫疾患を治療する化合物, 組成物並びに方法を記載する。
【課題を解決するための手段】
【0009】
(0009)本発明は、炎症及び自己免疫疾患の治療に有用な新規な方法並びに生活の質の向上の亢進に伴う関連する症状に関する。
【0010】
(0010)本発明の側面は、還元イソアルファ酸化合物、ミネラル及びビタミンを含む組成物に関する。意図される還元イソアルファ酸化合物としては、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンがあげられる。還元アルファ酸はまた「ρ(rho)」イソアルファ酸としても知られる部分も含む。
【0011】
(0011)別の側面では、本発明はまた自己免疫疾患の治療に当該組成物を用いる方法を提供する。本発明の本側面では、哺乳動物は、還元イソアルファ酸化合物、 ミネラル及びビタミンを含む組成物を治療的有効量投与することで治療されうる。意図される還元イソアルファ酸化合物としては、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンがあげられる。還元アルファ酸はまた「ρ」イソアルファ酸としても知られる部分も含む。
【発明を実施するための最良の形態】
【0012】
(0015)本発明は、自己免疫疾患の治療に有効であることが見出された、還元アルファ酸、ミネラル及びビタミンを組み合わせた組成物の同定に関する。
【0013】
(0016)本発明のある側面は、(i)還元イソアルファ酸化合物、(ii)ミネラル及び(iii)ビタミン各々を1又はそれ以上含む組成物に関する。
【0014】
(0017)本明細書及び添付の請求の範囲において、単数形には、その内容が明らかに他のことを示していない限り、複数の指示対象も含む。本明細書で用いられている、「1の(a)」、「1の(an)」及び「当該(the)」はまた、特に、その内容が明らかに他のことを示していない限り、それらが言及する用語の複数形のものが含まれる。本明細書において、特定のものを示していない限り、単語「又は」は、「及び/又は」という「包括的な」意味で用いられるのであり、「〜か〜か/又は」という「排他的な」意味で用いられるのではない。請求の範囲の移行句又は前文であっても、本明細書で用いられる、用語「含む(comprise(s))」及び「含んでいる(comprising)」は、制限がない(open−ended)意味に解釈される。これは、当該用語が「少なくとも有する(having)」又は「少なくとも含む(including)」という節と同意的に解釈されるべきである。方法の内容で用いられる場合、用語「含む」は、少なくとも記載された工程を含む方法を意味するもので、その他の工程を含みうる。化合物又は組成物の内容物について用いる場合、化合物又は組成物を意味する用語「含む」には、少なくとも記載された特性又成分が含まれ、他の特性又成分もまた含む。
【0015】
(0018)本明細書中で用いられている技術的及び科学的用語は、特に定義されない限り、本発明に関連する当業者が一般的に理解する意味である。文献(reference)は当業者に公知の様々な方法論及び材料について構成される。一般的な医学の原理を説明する標準文献には、Harrison’s Principles of Internal Medicine, 16th ed., McGraw-Hill, New York, 2005があげられる。一般的な薬理学の原理を説明する標準文献には、Goodman and Gilman's The Pharmacological Basis of treatments, 10th Ed., McGraw Hill Companies Inc., New York (2001) があげられる。
【0016】
(0019)本明細書で言及される特許、公開公報及び科学文献は当業者の知識を構築し、各々がその全体が参照することにより本明細書に組み込まれるために、特異的及び個別に示される程度にその全体が参照することにより本明細書に組み込まれる。本明細書で引用された文献が本明細書の特定の教唆と一致しない場合は後者を支持することになる。同様に、単語や節が当業界で理解されている定義と本明細書で教唆されている単語や節の定義が一致しない場合は後者を支持することになる。
【0017】
(0020)用語「還元アルファ酸」とは、ホップ植物産物から単離され、その後、異性化され、還元されたアルファ酸をいい、シス体及びトランス体を含む。還元アルファ酸(「RIAA」)の例としては、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンがあげられるがこれらに限定されない。
【0018】
(0021)本明細書において、用語「テトラ−ヒドロイソアルファ酸」は還元アルファ酸のあるクラスをいう。テトラ−ヒドロイソアルファ酸(「THIAA」)の例としては、限定されないが、テトラ−ヒドロ−イソフムロン、テトラ−ヒドロ−イソコフムロン及びテトラヒドロ−アドフムロンがあげられる。本明細書において、用語「ヘキサ−ヒドロイソアルファ酸」とは、あるクラスの還元アルファ酸をいう。ヘキサ−ヒドロイソアルファ酸(「HHIAA」)の例としては、限定されないが、ヘキサ−ヒドロ−イソフムロン、ヘキサ−ヒドロ−イソコフムロン及びヘキサ−ヒドロ−アドフムロンがあげられる。
【0019】
(0022)本発明の還元イソアルファ酸化合物は、合成されてもよく、又は、ホップ若しくは消費ホップから単離され、抽出され、得られた分画又は化合物として得てもよい(Verzele, M. and De Keukeleire, D., Developments in Food Science 27: Chemistry and analysis of hop and Beer Bitter Acids, Elsevier Science Pub. Co., 1991, New York, USAを参照のこと、ホップ化学の詳細な議論について、その全体が参照することにより本明細書に組み込まれる)。
【0020】
(0023)本明細書において、用語「ホップ抽出物」とは、(1)ホップ植物産物を溶媒にさらすこと;(2)ホップ植物産物から溶媒を分離すること;及び(3)溶媒を除去すること;で得られる固体材料をいう。本明細書において、用語「溶媒」とは、ホップ植物産物から固体材料を抽出するのに必要な性質を有する水性又は有機天然液体をいう。溶媒の例としては、限定されないが、水、蒸気、過熱水、メタノール、エタノール、ヘキサン、クロロホルム、液体二酸化酸素、液体窒素又は当該材料の組合わせがあげられる。本明細書において、用語「二酸化酸素抽出物」とは、液体又は超臨界二酸化酸素調製物にホップ植物産物をさらし、二酸化酸素を除去することにより得られる固体材料をいう。本明細書において、用語「消費ホップ」とは、ホップの抽出による固体及び親水性残渣をいう。
【0021】
(0024)還元アルファ酸はまた、「ρ」イソアルファ酸として知られる部分を含む。組成物はすなわち、イソアルファ酸化合物を含み得る。本明細書において、「ρ」とは、還元が4−メチル−3−ペンテノイル側鎖のカルボニル基の還元である還元アルファ酸をいう。還元アルファ酸の本サブセットには、以下に示す上属の構造の部分である化合物であればいかなる化合物が含まれる:
【0022】
【化1】

【0023】
(上属)
[式中R’は、カルボニル、ヒドロキシル、OR及びOCORからなる群より選択され、式中Rはアルキルであり;式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択され;そして式中R、T、X、及びZは独立して、H、F、Cl、Br、I、及びπ軌道からなる群より選択されるが、ただしR、T、X、又はZの1つがπ軌道である場合には、隣接するR、T、X、又はZもまたπ軌道であり、それにより二重結合を形成する]。
【0024】
(0025)本発明のある態様としては、属A構造:
【0025】
【化2】

【0026】
(属A)
[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]の範囲に含まれる、1又はそれ以上の還元アルファ酸化合物があげられる。
【0027】
(0026)還元イソアルファ酸化合物としてはまた、属B構造:
【0028】
【化3】

【0029】
(属B)
[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]の範囲に含まれる化合物があげられる。
【0030】
(0027)本発明に有用なミネラルとしては、カルシウム、セレン、亜鉛、銅、鉄、クロム、マグネシウム、マンガン、バナジウム、モリブデン及びホウ素があげられる。本明細書に示された限定されない例示では、ミネラルは亜鉛及びセレンである。
【0031】
(0028)本発明に有用なビタミンとしては、ビタミンA、ビタミンB、ビタミンC、ビタミンD、ビタミンE、ビタミンK、ビオチン、葉酸、パントテン酸、パラ−アミノベンゼン酸、ベタインがあげられる。本明細書に示された限定されない例示では、ビタミンはビタミンDである。
【0032】
(0029)本発明組成物は、(a)1又はそれ以上の還元アルファ酸(ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロン)、(b)1又はそれ以上の上記に示し記載した式を有する上属のρ還元イソアルファ酸化合物;及び(c)ビタミン及び(d)ミネラルを含む。ある態様では、ρ還元イソアルファ酸化合物は、上記に示し記載した式を有する属Aの一部である。さらに他の態様では、ρ還元イソアルファ酸化合物は、上記に示し記載した式を有する属Bの一部である。当該組成物のミネラル及びビタミンは上記のとおりである。本明細書に例示された本発明の代表的で非限定の態様では、ミネラルは亜鉛及びセレンであり、ビタミンはビタミンDである。
【0033】
(0030)他の態様は、さらに患者の利益になりうる他の成分を含む組成物に関する。すなわち、本発明の組成物はさらに、ローズマリー、ローズマリー由来の抽出物又は化合物、トリテルペンの種若しくは誘導体又はその複合体、ジテルペンラクトンの種若しくは誘導体又はその複合体及びトリプタントリン(tryptanthrin)又はその複合体からなる群から選択される少なくとも1のメンバーを含んでもよい。本明細書において、用語「誘導体」又は状況「由来する(derived)」は、構造的に他の物質に構造的に関連し、それから理論的に得られる化学物質をいい、すなわち、他の物質から作製されうる物質をいう。誘導体としては化学反応を介して得られる化合物があげられる。用語、化合物の「複合体」は、モノ−又はジ−サッカライド、アミノ酸、硫酸、コハク酸エステル、酢酸及びグルタチンからなる群から選択される1のメンバーと共有結合又は複合する化合物を意味する。好ましくは、モノ−又はジ−サッカライドは、グルコース、マンノース、リボース、ガラクトース、ラムノース、アラビノース、マルト−ス及びフルクトースからなる群から選択される1のメンバーである。
【0034】
(0031)組成物中の還元イソアルファ酸化合物の量は、約0.5〜約10,000mgであってもよい。ある態様では、還元イソアルファ酸化合物の量は約50〜約7,500mgである。ある態様では、本明細書で例示されているように、単位用量には、225mgの還元アルファ酸、500IUのビタミンD(コレカルシフェロールとして)、5mgの亜鉛(クエン酸亜鉛として)及び50μgのセレン(セレノメチオニンとして)が含まれる。本明細書において、変数の数的範囲の記載は、本発明が当該範囲内のいかなる値と同等な変数で実行されうることを表すことを意図する。すなわち、本質的に不連続である変数の場合は、当該変数は、当該変数の終点を含む、数的範囲のいかなる整数値と同等でありうる。同様に、変数が本質的に連続的である変数のため、当該変数は当該範囲の終点を含む、いかなる実値の数的範囲と同等でありうる。例えば、0〜2の値であると記載された変数は、本質的に不連続である変数の場合は0、1及び2でありえ、本質的に連続する変数の場合は0.0、0.1、0.01、0.001又は他の実値でありうる。
【0035】
(0032)本発明の組成物は、さらに医薬的に許容される担体を含んでもよい。当業者に公知のいかなる適当な材料及び/又は方法を、本発明を行うのに用いることができる。しかしながら、好ましい材料及び方法を記載する。明記しない限り、以下の記載及び実施例で記載する材料、試薬等は商業的供給源から得られる。
【0036】
(0033)本発明の化合物は、場合によっては、医薬的に許容されるベヒクル中で希釈剤及び賦形剤を含むいかなる周知の医薬的に許容される担体と処方される(Remington's Pharmaceutical Sciences, 18th Ed., Gennaro, Mack Publishing Co., Easton, PA 1990 and Remington: The Science and Practice of Pharmacy. Lippincott, Williams & Wilkins, 1995を参照)。本発明の組成物を生成するのに用いられる医薬的に許容される担体/ベヒクルのタイプは、哺乳動物への当該組成物の投与形態に依存して多様でありうるが、一般的に、医薬的に許容される担体は生理学的に不活性で非毒性である。本発明の組成物の製剤は、本発明の化合物の1以上のタイプ及び治療される症状/状態の治療に有用ないかなる他の薬理的活性成分を含みうる。
【0037】
(0034)本明細書において、用語「組成物」としては本発明に含まれる、組合わせ投与に適するいかなる及び全ての可能性のある組成物があげられ、すなわち、例えば、健康補助食品組成物及び、一般的には、栄養薬及び医薬の組成物があげられる。
【0038】
(0035)同様に本発明を用いる組成物及び方法は、PGE2の阻害に有効であることが見出されている。すなわち、本発明はPGE2を阻害する組成物及び方法を提供する。出願人は、当該組成物及び方法が、いかなる1の作用メカニズムに拘束されることを望まずに、PGE2が介在するメカニズムによる炎症及び自己免疫疾患の治療に有効であることを前提とする。すなわち、本発明の組成物は、プロスタグランジンレベルを調節し、及び/又は、マクロファージ活性を制御することにより、自己免疫疾患に関連する炎症反応を調節すると信じられている。
【0039】
(0036)他の側面では、本発明はまた生活の質を同時に向上させる患者における炎症及び自己免疫疾患及び関連する症状の治療のための当該組成物を用いる方法を提供する。
【0040】
(0037)本明細書において、「自己免疫障害」とは、危険にさらされた疾患、疾病又は状態をいう。自己免疫疾患の代表的な例として、円形脱毛症、強直性脊髄炎、関節炎、抗リン脂質症候群、自己免疫アジソン病、自己免疫溶血性貧血、自己免疫内耳疾患(メニエール病としても知られる)、自己免疫リンパ球増殖症候群(ALPS)、自己免疫血小板減少性紫斑病、自己免疫溶血性貧血、自己免疫肝炎、ベーチェット病、クローン病、1型真性糖尿病、糸球体腎炎、バセドウ病、ギランバレー症候群、炎症性大腸炎、ループス腎炎、多角性硬化症、重症筋無力症、天疱瘡、悪性貧血、 多発性筋炎、初期胆汁性肝硬変、乾癬、レイノー症候群、リウマチ熱、関節リウマチ、強皮症、シェ−グレン症候群、全身性エリテマトーデス、潰瘍性大腸炎、白斑及びウェグナー肉芽腫症があげられるがこれらに限定されない。
【0041】
(0038)本発明の方法は、本発明の方法の利益を受けうるいかなる哺乳動物への使用をも意図する。本発明はヒトに限定する意図はないが、主要な当該哺乳動物はヒトであり、家畜への使用に適用される。すなわち、本発明によれば、「哺乳動物」又は「必要とする哺乳動物」としてはヒト及び非ヒト哺乳動物があげられるが、特に、ネコ、イヌ及びウマを含む家畜動物であるが、これらに限定されない。
【0042】
(0039)本発明の本側面では、哺乳動物は、還元イソアルファ酸化合物、ミネラル及びビタミンを含む組成物の治療的有効量を投与することにより治療されうる。
【0043】
(0040)本発明の本側面の治療に有用な組成物には、(i)還元イソアルファ酸化合物、(ii)ミネラル及び(iii)ビタミンを各々1又はそれ以上含む組成物が含まれる。
【0044】
(0041)本発明の方法に有用な組成物組成物は、上記し、第1の本発明の側面として示した上属の構造のρ還元アルファ酸を含んでもよい。同様に、組成物は、上記し、第1の本発明の側面として示した化学式を有する属A及び/又は属Bの還元アルファ酸を含んでもよい。
【0045】
(0042)本発明の方法に適する組成物としては、(a)1又はそれ以上の還元アルファ酸(ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロン);(b)1又はそれ以上の、上記に示した式を有する上属のρ還元イソアルファ酸化合物;(c)ビタミン及び(d)ミネラルがあげられる。ある態様では、還元イソアルファ酸化合物は、上記に示した化学式を有する属Aの部分である。さらに他の態様では、ρ還元イソアルファ酸化合物は、上記に示した化学式を有する属Bの部分である。当該組成物のミネラル及びビタミンは上記した。本明細書で例示された本発明の代表的な態様としては、ミネラルは亜鉛及びセレン並びにビタミンはビタミンDであるが、これらに限定されない。
【0046】
(0043)他の態様は、患者に利益をもたらしうる他の成分をさらに含む組成物を投与する方法に関する。すなわち、本発明の組成物としては、ローズマリー、ローズマリー由来の抽出物又は化合物、トリテルペンの種若しくは誘導体又はその複合体、ジテルペンラクトンの種若しくは誘導体又はその複合体及びトリプタントリン又はその複合体からなる群から選択される少なくとも1のメンバーがあげられる。ローズマリー抽出物、ローズマリー由来の化合物、トリテルペン種(誘導体又はその複合体を含む)、ジテルペンラクトン種若しくは誘導体又はその複合体及びトリプタントリン又はその複合体の記載については、例えば、その全体が本明細書に組み込まれる、米国特許第10/689,856号を参照のこと。
【0047】
(0044)本明細書において、用語「有効量」とは、選択した結果を得るのに必要な量を意味する。当該量は当業者であれば過度の負担なく容易に決定することができる。本明細書において、用語「実質的」とは、特定されたもの全てではなく広いことを意味する。
【0048】
(0045)理論に拘束されるわけではないが、本発明者は、本明細書で意図される組合わせは、プロスタグランジンの放出を選択的に阻害するように機能しうると考える。本組成物によるプロスタグランジン阻害は、炎症のダウンレギュレーションをもたらすと仮定される。
【0049】
(0046)本明細書で例示されるように、本発明の組成物は以下の図3に示すような相乗効果を産生することが見出された。本明細書で用いられるように、用語「相乗」及び「相乗効果」とは、全体として投与された会合化合物から産生された効果が、全ての会合物を共投与した場合よりもその効果が低い化合物を組合わせた場合に産生される効果に基づいて予想される効果よりも高いことを示す。
【0050】
(0047)選択された用量レベルは、特定の組成物の活性、投与経路、治療又は予防される状態の重症度並びに治療される患者の状態及び以前の治療記録に依存するはずである。しかしながら、所望の治療効果を達成するために必要なレベルより低いレベルで組成物の投与を始めること及び所望の効果が得られるまで用量を段階的に増加させることは当業界の技術の範囲内である。必要な場合、有効1日量は投与の目的により複数の投与に分けること、例えば、1日あたり2〜4回に別個に投与することもできる。しかしながら、いかなる特定の患者のための特定の用量レベルは、体重、相対的な健康、食事、投与の時間及び経路、他の組成物との組合わせ及び治療若しくは予防する特定の状態の重症度に依存するであろうことは理解される。
【0051】
(0048)ある態様としては、他の活性成分と還元アルファ酸の有効量を送達することがあげられる。好ましくは、好ましい組成物は、1日あたり約0.5〜10,000mgの還元アルファ酸を送達するように処方されるであろう。より好ましくは、好ましい組成物の有効1日量は、1日あたり約50〜7,500mgの還元アルファ酸を送達するように処方されるであろう。好ましくは、有効1日量は1日あたり1回又は2回投与される。約0.5〜約800mgの還元アルファ酸の1日投与量は、より好ましくは、1日あたり約50〜400mgの還元アルファ酸が発明者により意図される。他のある態様では、1日あたり約10〜3,000mgの還元アルファ酸、より好ましくは、1日あたり約50〜2,000mgの還元アルファ酸を含む組成物が供給される。
【0052】
(0049)好ましい態様としては、有効量のトリプタントリン又はその複合体を単独で又は他の活性成分と組合わせて送達することがあげられる。好ましくは、好ましい組成物の1日量は、1日あたり約0.0005〜50mgのトリプタントリン/体重kgを送達するように処方されるであろう。より好ましくは、好ましい組成物の有効1日量は、1日あたり約0.01〜10mgのトリプタントリン/体重kgを送達するように処方されるであろう。好ましくは、好ましい組成物の1日量は、1日あたり約0.035〜3500mgのトリプタントリンを送達するように処方されるであろう。より好ましくは、好ましい組成物の有効1日量は、1日あたり約0.7〜700mgのトリプタントリンを送達するように処方されるであろう。好ましくは、有効1日量は1日あたり1回又は2回投与される。
【0053】
(0050)好ましい態様としては、ローズマリー又はローズマリー由来の抽出物若しくは化合物の有効量を他の活性成分と組合わせて送達することがあげられる。好ましくは、好ましい組成物の1日量は、ローズマリー、ローズマリー抽出物又はローズマリー由来の化合物を1日あたり約0.5〜5,000mgで送達するように処方できる。より好ましくは、好ましい組成物の有効1日量は、ローズマリー、ローズマリー抽出物又はローズマリー由来の化合物を1日あたり約5〜2,000mgで送達するように処方できる。好ましくは、当該有効1日量は1日1回又は2回投与される。ある態様では、1日1回又は2回投与される、約75mgのローズマリー抽出物又はローズマリー由来の化合物又は誘導体を含む組成物を提供する。
【0054】
(0051)好ましい態様では、トリテルペン及びジテルペンラクトンの種若しくは誘導体又はその複合体の有効量を他の活性成分と組合わせて送達することがあげられる。好ましくは、好ましい組成物の1日量は、1日あたり、約0.0005〜50mgのトリテルペン又はジテルペンラクトン/体重kgで送達するように処方されるはずである。より好ましくは、好ましい組成物の1日量は、1日あたり、約0.01〜10mgのトリテルペン又はジテルペンラクトン/体重kgで送達するように処方されるはずである。好ましくは、好ましい組成物の1日量は、1日あたり、約0.035〜3,500mgのトリテルペン又はジテルペンラクトン種を送達するように処方されるはずである。より好ましくは、好ましい組成物の1日量は、1日あたり、約0.7〜700mgのトリテルペン又はジテルペンラクトン種を送達するように処方されるはずである。好ましくは、当該有効1日量は1日1回又は2回投与される。
【0055】
(0052)好ましくは、ある態様は、オレアノール酸等のローズマリー及びトリテルペンの抽出物を還元アルファ酸又はトリプタントリン若しくはその複合体等の活性成分と共に含有する組成物を提供する。好ましくは、ある態様は、約0.01〜500mgのローズマリー抽出物及び約0.01〜500mgのオレアノール酸を含む組成物を提供する。好ましくは、ある態様は、標的組織中の濃度が、ローズマリー抽出物が0.1〜10μg/組織g及びオレアノール酸が約0.1〜25μg/組織gになるような組成物を提供する。
【0056】
(0053)局所適用に好ましい態様の組成物は、還元アルファ酸若しくは誘導体又はトリプタントリン若しくはその複合体を約0.001〜10重量パーセント、好ましくは、約0.1〜1重量パーセント含有することになる。好ましい態様では、還元アルファ酸又はトリプタントリン若しくはその複合体の血清濃度が約0.0001〜10μMの範囲、好ましくは、約0.01〜1μMである。局所適用に好ましい態様は、さらに、ローズマリー、ローズマリー由来の抽出物又は化合物、トリテルペンの種若しくは誘導体又はその複合体、ジテルペンラクトンの種若しくは誘導体又はその複合体、ホップから単離又は由来する分画及びトリプタントリン又はその複合体から選択された他の成分を、各成分が0.001〜10重量パーセント、好ましくは、0.1〜1重量パーセントの濃度で含みうる。好ましい態様では、血清濃度が約0の範囲になるはずである。
【0057】
(0054)好ましい組成物は、健康補助食品又は治療組成物の形で投与されうる。組成物は、所望の適当な用量単位で、経口、局所的、経皮的、経粘膜的、非経口又は直腸的に投与される。
【0058】
(0055)食品に適用するための好ましい組成物としては、中間代謝物の他の天然成分、ビタミン及びミネラル等の様々な添加物並びに錠剤及びカプセルの製造における標準的な賦形剤であるタルク及びステアリン酸マグネシウム等の不活性成分があげられる。例えば、1の態様は、グルコサミン又はコンドロイチン硫酸と組み合わせた好ましい組成物の活性成分を含む。
【0059】
(0056)本明細書において、「医薬的に許容される担体」には、いかなる及びすべての、溶媒、分散剤媒体、コーティング剤、等張剤及び吸収遅延剤、甘味料等があげられる。当該医薬的に許容される担体は、希釈剤、結合剤及び接着剤、潤滑剤、崩壊剤、着色剤、増量剤、香味料、甘味剤並びに特定の治療組成物を調製するために必要でありうる緩衝剤及び吸収剤等の多種多様な材料を含むがこれらに限定されない幅広い材料から調製されうる。医薬的に活性物質に当該媒体及び剤を用いることは当業界で周知である。いかなる標準的な媒体及び剤が活性成分と適合しない場合を除いて、好ましい組成物におけるその使用が意図される。1の態様では、タルク及びステアリン酸マグネシウムが製剤に含まれる。食事バー(dietary bar)又は機能性食品として本組成物を製造する場合に影響することが知られている他の成分としては、香味料、糖、アミノ糖、タンパク質及び/又は加工スターチ並びに脂肪及び油があげられる。
【0060】
(0057)好ましい態様の健康補助食品、ローション又は治療組成物は、当業者に公知の態様で処方される。1の態様では、組成物は当業者が利用できる技術を用いてカプセル又は錠剤に製剤化される。カプセル又は錠剤の形で、成人のヒト又は動物の1日量としては、好ましくは、1〜6個のカプセル又は錠剤を含有することが推奨される。しかしながら、好ましい組成物はまた、注射用の溶液又は懸濁液、スプレー用の溶液又は懸濁液、ローション、ガム、トローチ、食品又はスナックのアイテム等の他の都合のよい剤型に製剤化される。食品、スナック、ガム又はトローチのアイテムとしては、甘味料、風味料、油、スターチ、タンパク質、果物又は果物抽出物、野菜又は野菜抽出物、穀物、動物性の脂肪又はタンパク質を含む、いかなる体内摂取可能な成分もあげられる。すなわち、好ましい組成物はシリアル;チップス、バー、ガムドロップ、チュ−イングキャンディー等のスナックアイテム又は遅効性溶解トローチに製剤化される。好ましい態様は、すべてのタイプの急性及び慢性の炎症ベースの疾患の治療を意図する。好ましい製剤は炎症反応を軽減し、罹患した組織を治癒し、予防し、さらに損傷する。医薬的に許容される担体はまた、好ましい組成物及び製剤でも用いられる。
【0061】
(0058)以下の実施例は、本発明のある好ましい態様をさらに例示することを意図するもので、これらに限定するものではない。当業者であれば、本明細書に記載のルーチンの実験、特定の物質の多数の同等物及び手順を用いることを、認識でき、解明できるはずである。
【実施例1】
【0062】
RIAA、セレン、亜鉛及びビタミンD3によるPGE2の阻害
(0059)本実施例は、プロスタグランジンE2(PGE2)放出における、還元アルファ酸(RIAA)、亜鉛、セレン及びビタミンD3の組合わせの効果を示す。本実施例では、マウスのマクロファージRAW264.7細胞を、RIAA、亜鉛、セレン及びビタミンD3を様々に組合わせたものの存在下で24時間LPSで刺激し、PGE2分泌物を酵素免疫測定法(ELISA)手法で測定した。
【0063】
(0060)方法
材料−試験化合物をジメチルスルホキシド(DMSO)中で調製した。RIAA及び亜セレン酸ナトリウムをMetagenics(San Clemente, CA)で供給した。塩化亜鉛及び1−α,25−ジヒドロキシビタミンD3をEMD Biosciences(San Diego, CA)から購入した。リポポリサッカライドをSigma-Aldrich(St. Louis, MO)から購入した。
【0064】
(0061)細胞培養−マウスマクロファージRAW264.7細胞系をATCC(Manassas, VA)から購入し、指示に従って維持した。亜セレン酸ナトリウム(2μM)か塩化亜鉛(169nM)のどちらかで処理した細胞を96穴プレートに播種する前の2日間T−75フラスコ中血清富化培地(10%FBS)で生育した。細胞を1穴あたり1×105細胞の密度で96穴プレートで継代培養して、密集度を90%に至らせる。RIAA(20〜1μg/ml)及びビタミンD3(355nM)を終末濃度が0.1%DMSOになるように非血清培地中の細胞に加えた。次の1時間、試験化合物、LPS(1ug/mL)又はPBSのみを細胞培地に加えてインキュベーションし、その後24時間インキュベーションを続けた。
【0065】
(0062)PGE2の測定−PGE2の定量には市販の非放射性手段を用いた(Cayman Chemical, Ann Arbor, MI)。製造者が推奨する方法を用い、改良は行わなかった。簡潔には、PGE2標準試料を連続希釈したものを加えた50μlの培地を、適当量のPGE2−アセチルコチンエステラーゼトレーサー複合体と混合して、4℃で一晩インキュベートした。新鮮なエルマン液(Ellman's)を調製し、発色反応を室温で75分間展開した。吸光度を405nmで測定した。PGE2濃度を標準曲線から算出してmlあたりピコグラムで表した。4つのウェルの平均値を処置ごとに決定した。
【0066】
(0063)統計学的解析−PGE2の産生阻害を、以下の状態:a)RIAA及びビタミンD3に試験材料は加えない;b)2μM亜セレン酸ナトリウムで2日間プレインキュベート;c)169nM塩化亜鉛で2日間プレインキュベート;又はd)2μM亜セレン酸ナトリウム及び169nM塩化亜鉛で2日間プレインキュベート;の条件で24時間LPS刺激の有無で生成したPGE2を比較することにより測定した。LPSで刺激した場合より高いか又は等しい値は0%阻害とみなし、LPSで刺激しない場合より低いか又は等しい値は100%阻害とみなすようにデータをクリップ(clip)した。PGE2阻害の比率を算出した。
【0067】
(0064)中央値有効算出(Median Effect Calculations)−中央値有効算出をCalcuSyn(Biosoft, Ferguson, MO)を用いて行った。本プログラムは、Chou及びTalalay(Adv Enzym Regul (1984) 22:27-55)の中央値効果のモデルを適用して及び以下の方程式:
【数1】

【0068】
[faは反応の(factional)阻害である。]
に適合させる。4つの濃度の最小値を用量反応曲線及び50%阻害濃度(IC50)を測定するのに用いた。
【0069】
(0065)結果
RAW264.7細胞を、LPS(1μg/mL)と様々な濃度のRIAA、亜セレン酸ナトリウム、塩化亜鉛又はビタミンD3で24時間刺激処理した。細胞培養した培地を採取して、PGE2の分泌濃度をELISAで決定した。その後、PGE2の阻害比率を決定した。当該値はpg/mlのPGE2量及び標準偏差(SD)で示した4つのウェルの平均と共に表1にみることができる。図3は阻害比率のグラフと算出したIC50(μg/ml)値を示す。
【0070】
(0066)結果は、24時間刺激後のRAW264.7細胞モデルにおけるPGE2阻害のIC50値の以下のランクを示す:RIAA+VD3(17.54μg/ml)>RIAA(9.83μg/ml)>RIAA+亜鉛(5.06μg/ml)>RIAA+セレン+亜鉛(4.55μg/ml)>RIAA+セレン(3.23μg/ml)>RIAA+セレン+VD3(1.84)>RIAA+亜鉛+VD3(1.38μg/ml)>RIAA+セレン+亜鉛+VD3(1.35μg/ml)。
【0071】
【表1】

【実施例2】
【0072】
クローン病患者の症状におけるRIAA、ビタミンD3、亜鉛及びセレンの効果
(0067)本実施例の目的は、クローン病患者の症状に関連した疾患におけるRIAA、ビタミンD3、亜鉛及びセレン組成物(以下、「KaprexAI」と記載する場合がある)の効果を示すことである。
患者A(ケース概要#096CDl105)
患者の表示及び病歴
(0068)61歳の女性がクローン病(CD)のマネジメントを提示した。彼女のGI出現は大学時代に始まり、結腸の部分切除を行った。数年後にCDと診断された。結腸の切除を繰り返さなければならず、その結果、実質的に結腸の2/3及び小腸の1/2を切除した。患者は最近、BMの前後に時として腹部全体に関する腹部膨張及び腹部の疼痛が伴う症状が極めて進んだ。痛みはオキシコドンで処置した。下痢が3〜6回/日おきた。彼女は、高用量のプレドニゾンに関連した、疲労、軽い吐き気及び大腿部に顕著な筋肉低下を訴えた。
【0073】
(0069)試験開始時の患者は、以下の処方箋:フォルテオ(Forteo)(商標)(テリパラチド(teriparatide))1日1回20mcg皮下投与;ディルスドール(Dirsdol)(登録商標)(エルゴラルシフェロール(ergocalciferol)ビタミンD2)毎月50,000IU投与;オキシコンチン(登録商標)(オキシコドンHCl)1日3回50mg;プレドニゾン、1日1回40mg;シンバルタ(Cymbalta)(登録商標)(duloxetineHCl)1日1回60mg;ネクシウム(Nexium)(登録商標)(エソメプラゾール(esomeprazole))1日2回40mg;フロセミド(furosemide)1日2回40mg;KCl10mEq、1日1回3カプセル;バギフェム(Vagifem)(登録商標)(エストラジオール)週2回1錠;プロパノロール(propanolol)1日2回20mg;ロラゼパム(Lorazepam)必要に応じて1日2回0.5mg;オキシコドン−5mg、必要に応じて2錠剤;フェネルガン(Phenergan)(登録商標)(プロメタジン(promethazine))必要に応じて25mg;アンビエン(Ambien)(登録商標)(ゾルピデン(Zolpidem))必要に応じて就寝時5mg;フレクゼリル(Flexeril)(登録商標)(シクロベンザプリン(cyclobenzaprine)HCl)、必要に応じて4〜6時間毎に10mg;必要に応じて腰部の滑液包炎にコルチソン(cortisone)注射;ベナドリル(Benadryl)(登録商標)(ジフェンヒドラミン(dyphenhydramine)HCl)必要に応じて25mg;アレグラ(Allegra)(登録商標)(フェキソフェナジン(fexofenadine)HCl)必要に応じて180mg/日;の投薬を受けていた。
【0074】
(0070)彼女は以下の非処方箋薬剤及び栄養補助食品:炭酸カルシウム1日2回600mg;マルチビタミンW/鉄1日1回1個;ビタミンB複合体1日1回1個;ビタミンB122週間毎1000mgIM;EPA−DHA 720,2カプセル/日;グルコン酸第1鉄1日1回324mg;ビタミンC1日1回500mg;アスピリン1日1回81mg;必要に応じてマーロックス(Maalox)(登録商標)(水酸化アルミナ及び水酸化マグネシウム);を続けた。
治療計画
(0071)当該患者はホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えた炎症調節医療食品を実際に1日2回2匙まで摂取することを指示された。
3〜5週目の結果
(0072)3週間目の通院で、患者はBMが10/日からわずか1/日にまで減少したことに言及した。患者は、常時疲労し続けており、低度の四肢の膨張があった。患者は現在の医療食品の摂取を中止して、ウルトラインフラムX(UltralnflamX)(登録商標)医療食品を1日2回2匙、200mgのRIAAを含む栄養補助食品を当該医療食品と共に1日2回1錠及び2000IUビタミンD(IsoD3)を含有する他の錠剤1日1回1錠の摂取を指示された。患者はまた、ラクトビデン(LactoViden)1日2回1カプセルの摂取を始めた。5週間後、患者は、特に作業後及び晩に多大に発汗することを報告した。患者は、ビタミンD及びRIAA栄養補助食品の摂取を中止して、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAI(カプレックスAI))を1日2回1錠摂取することを指示された。患者は、ウルトラインフラムX(UltralnflamX)(登録商標)医療食品1日2回2匙及びラクトビデン1日2回1カプセルを摂取を続けること並びにエストロファクターズ(EstroFactors)1日1回3錠剤を追加摂取することを指示された。患者はまた、EPA/DHA 720の摂取を中止してEPA−DHA ES(腸溶性コーティング)1日3回2カプセルの摂取を命じられた。患者は除外食を始めた。
7〜12週目の結果
(0073)7週間目の通院で、患者は、一貫して有形便があったがそれ以上は改善がみられないことに言及した。便試験はグルテン感受性であった。カプレックスAIを午前中に1個及び夕食時に2個増加して、患者はオーツの摂取を中止するように指示された。9週間後、患者は活力に明らかな違いがあったことに言及した。患者の頭脳は明晰に感じられて、より行動的に感じられた。BMは良好で通常0−1/日を継続していた。患者は処方されたプロトコールを継続して、組合わせ栄養補助食品の用量を1日2回2錠剤まで増加するように指示された。患者はまた、DHEAスプレー(BioSom)を1日2回1スプレーで始めた。12週間後、患者はプロトコール開始時から50−75%改善したように感じた。腹部膨張は消滅し、痛みは全体的により改善したため、患者は軽度の突出痛の治療を用いていた。患者は、胃逆流のため、BioSomに耐えられなかった。疲労は存続した。
結果(表2)
(0074)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSeを組合わせたプロトコール並びに標準食事を加えた場合に、より利益が改良されたことを示す。
【0075】
【表2】

【0076】
患者B(ケース概要#O92CD1105)
患者の表示及び病歴
(0075)以前クローン病と診断された57歳の女性が現れた。患者は、大腸内視鏡検査で回腸末端に潰瘍が見つかる8年前に貧血と診断され、その2年後にクローン病と診断された。患者はスルファサラザンを摂取したが、胃逆流のため使用をやめた。2年後に症状が再発して貧血が悪化した後、再度の大腸内視鏡検査で回腸に潰瘍が見つかった。患者はメラサミンの摂取を開始して症状は改善され、その後、ブデソニドの摂取を加えた。患者の体調はよくなり、排泄頻度が2〜3回/日未満になることはなかった。プレゼンテ−ションの4ヶ月前、患者は高繊維質食の摂取を始めてすぐに嘔吐、下痢及び血便が伴うひどい病気になった。患者は入院してIVステロイド及び抗生物質を投与されて、アザチオプリン(azathioprine)の摂取を始めて、ブデソニドの3ヶ月間投与を始めた。
【0077】
(0076)患者は現在以下の処方箋:クローン病用にメサラミン(Mesalamine)1日3回1600mg及びアザチオプリン1日1回100mg;火照り用にベンラファクシン(venlafaxine)HCl1日1回112.5mg;骨減少症用にアレンドロネート(alendronate)1週間に70mg;高コレステロール血症用にアトルバスタチン(atorvastatin)1日1回10mg;関節痛用に必要に応じて、プロポキシフェン(propoxyphene)+アセトアミノフェン(acetaminophen)の組合わせ薬;の投薬を受けており、患者は30年間毎日ASAを摂取していた。患者は以下の非処方箋薬剤及び栄養補助食品:必要に応じてイブプロフェン又はアスピリン;マルチビタミン1日1回1錠;クエン酸カルシウム630mg+400ビタミンD1日2回;ラクトース酵素;を摂取した。
治療計画
(0077)患者は全ての現在の栄養補助食品の摂取を中止して、ホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えた栄養補助食品を1日2回2匙まで摂取するように指示された。
3〜7週目の結果
(0078)3週間目の通院で、患者は医療食品の摂取を始めてすぐに正常なBMが形成され、大経の排泄が1〜2BM/日がおこり始めたことを報告した。その後、排泄はだんだん柔らかくなり、また頻度も多くなり、患者は、1日あたり4〜5回の少量のガスを含む柔らかいBMがあり、不快感もなくなった。患者は火照りにより睡眠が妨げられた。火照りには、昼食時に組合わせイソフラボン栄養補助食品(EstroFactors)を3錠剤を加えた。グルテン感受性排泄試験は陽性で、患者は非グルテン食を始めた。5週間後、患者のBMは正常になった。患者は、現在の医療食品の処方を中止して、200mgRIAA含有栄養補助食品を1日2回1錠及び他のビタミンD(IsoD3)2000IU含有錠剤を1日1回1錠と共にウルトラインフラムX(登録商標)医療食品1日2回2匙摂取することを指示された。患者はまた除外食を摂取した。7週間目の通院までに、火照りは以前は20/日で激しい症状だったのが、現在は10−14/日で緩慢な症状に改善された。患者はプログラムの開始から全体的に25%の割合で改善された。ウルトラインフラムX医療食品及び組合わせイソフラボンを処方した用量で引き続き摂取して、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAI)の1日2回1錠と医療食品の摂取を始めるように指示された。患者はまた、貧血用に、EPA−DHA(600mg+400mg)及びビタミンE(20IU)の組合わせを1日3回2軟質カプセル、乳製品非含有プロビオティック栄養補助食品(ラクトバシラスアシドフィルスNCFM株、ビヒドバクテリウムラクティス)(ウルトラフローラ(UltraFlora)IB)1日2回1カプセル及び抗貧血処方栄養補助食品(高吸収鉄分、ビタミンB6及びB12、チアミン、葉酸、コハク酸、グリシン)(Hemagenics)1日2回1錠の摂取を始めた。
9〜16週目の結果
(0079)患者プロトコールを開始してから9及び13週後に再び診察を受けた。2回の診察ともに、患者のBMは正常で火照りの症状も軽減して、病状は改良されたと報告した。患者は除外食を続けて食品を再導入した。16週間目の通院で、患者は、形成された1BM/日があり、下痢もおこらず、他の異常もないとコメントした。患者は著しい程度の活力が得られて関節痛もないことを報告した。実験結果によれば、糞便カルプロテクチン(calprotectin)及びエシノフィル(Eosinophil)タンパク質X、IgMカンジダ及びIgG大腸菌が正常であることが示された。患者は処方された計画を継続するように指示された。
結果(表3)
(0080)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSe並びに食事を組合わせたプロトコールが、クローン病及び免疫炎症状態に関連するいくつかの他の症状の病歴がある患者に陽性効果をもたらすことを示す。
【0078】
【表3】

【実施例3】
【0079】
関節リウマチ患者の病状におけるRIAA、ビタミンD3、亜鉛及びセレンの効果
(0081)本実施例の目的は、関節リウマチ患者の病状に関連した疾患におけるRIAA、ビタミンD3、亜鉛及びセレンの効果を示すことである。
患者A(ケース概要#090RA1105)
患者の表示及び病歴
(0082)以前関節リウマチ(RA)の診断を受けた51歳の女性があらわれた。患者は、膝の腫れ、筋肉痛及び間欠的な吐き気及び疲労を訴えた。患者はまた、手足の裏が熱いことにも言及した。
評価及び計画
(0083)負のリウマチ因子のRA。肥満。鉄分不足。患者はホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えた栄養補助食品(ウルトラインフラムX AI)を1日2回2匙まで摂取を始めることを指示された。
5〜7週目の結果
(0084)5週間目の通院で、患者は、体調がよいことを報告し、活力が増したことに言及した。患者は、再度問題なく歩行をし、より簡易に階段の昇降ができるようになった。患者は21日間の除外食を始めた後、慎重に食品を再摂取した。7週間後、患者は関節痛を2〜3のレベル(1〜10のスケール)に評価したが、プロトコールを開始する以前の6〜7よりも下がった。患者は前を向いて階段の昇降ができるようになったが、以前は横向きで下降しなければならなかった。患者は、時折、肘、膝及び手に問題があったが、精神的には明瞭で、体調もよかった。患者は、現在の医療食品の処方を中止して、ウルトラインフラムX(登録商標)医療食品を1日2回2匙を200mgRIAA含有栄養補助食品を1日2回1錠及び2000IUビタミンD(IsoD3)を含有する他の錠剤を1日1回1錠摂取するように指示された。
9〜3週目の結果
(0085)プログラムの9週目、患者はとても従順で、関節痛の症状はかなり改善されたことを報告した。患者は吐き気又は疲労がないことを言及した。この2週間は足の熱感もなかった。筋肉痛も消滅した。患者は4週間除外食を摂取しており、100%それに従ったことを報告した。患者はRIAA及びビタミンD栄養補助食品の摂取を中止して、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAI)を1日2回1錠の摂取を開始することを指示された。13週間目の通院では、改善が持続していた。患者はより活動的で、活力を感じ、もはや疲労はなかった。患者は、唯一の例外は重労働であることに言及し、ナプロキセン(naproxen)をその前の5〜6週間摂取していないことを報告した。
【0080】
(0086)患者は、組合わせ栄養補助食品を1日2回2錠剤に増やし、ウルトラインフラムX医療食品を1日2回2匙は継続して摂取して、EPA−DHA(600mg+400mg)とビタミンE(20IU)の組合わせを1日3回2軟質カプセル追加摂取することを指示された。
結果(表4及び5)
(0087)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSe並びに食事を組合わせたプロトコールが、関節リウマチ及び他の炎症関連症状の患者に陽性効果をもたらすことを示す。
【0081】
【表4】

【0082】
【表5】

【0083】
患者B(ケース概要#091RA1105)
患者の表示及び病歴
(0088)以前関節リウマチ(RA)と診断された52歳の女性が2005年の9月にあらわれた。診察にくる約3年前、患者は2週間に25mgのエンブレル(Enbrel)(登録商標)(etanercept)に切り替えた。患者は投薬により改善されたにもかかわらず、足、手及び、関節の痛みは持続していた。患者は未だに疲労しており、手足は腫れを繰り返していた。診察の約5〜6週間前、患者は手術をして患者のくるぶしを安定させていたピンを左足から除去する手術をうけたが、そのピンはそれより2〜3年前に埋め込まれたものであった。
評価及び計画
(0089)高RFを伴うRA。RAに続く疲労。甲状腺機能低下。グルテン感受性。正常な低ビタミンD。患者は、ウルトラインフラムX(登録商標)医療食品1日2回2匙までの摂取を開始することを指示された。患者はまた、200mgのRIAAを含有する栄養補助食品を1日2回1錠摂取した。
2週目の結果
(0090)2週間目の通院で、患者は、関節痛が軽減しなかったことを報告した。患者は疲労症状が変化しないことに言及した。加えて、患者は、日夜緩慢な火照りがあった。患者は、ウルトラインフラムXの摂取を続け、RIAAの摂取を中止し、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAI)1日2回1錠の摂取を開始することを指示された。加えて、患者は魚油濃縮物の摂取を中止し、EPA−DHA(600mg+400mg)及びビタミンE(20IU)の組合わせ栄養補助食品(EPA−DHA ES)を1日3回2軟質カプセルの摂取を開始し、組合わせイソフラボン栄養補助食品(EstroFactors)を毎日3錠剤摂取することを開始し、非グルテン食を摂取することを開始するように指示された。
4週目の結果
(0091)4週間後、患者は疲労も軽減して体調がよくなったが、関節の腫れは改善されず、便秘になった。火照りは著しく軽減した。排泄分析では、腸内ビフィズス菌が消滅したことが示され、女性ホルモン健康評価では、エストリオールの比率が上昇するに従って、DHEA−S、2(OH)エストロン及び2/16(OH)エストロゲン比率が低下することが示された。患者は、ウルトラインフラムX医療食品、RIAA/ビタミンD/Zn/Se組合わせ栄養補助食品、魚油栄養補助食品を続けて摂取するようにアドバイスされた。患者は、イソフラボン栄養補助食品を夕食時に3錠剤摂取するように指示された。患者はI3C(メタI3C)を1日2回1錠を摂取して、液体DHEAスプレー(BioSom)を1日2回噴霧することを開始した。患者は便秘にウルトラインフラムXに小匙1杯の亜麻仁油を添加するようにアドバイスされた。
6週目の結果
(0092)患者は、プロトコールを開始して5週間後に関節痛が実質的に改善されたことを報告した。膝の痛みは消滅して、患者は手を例えば、庭仕事などで長時間使った場合に緩慢な不快感が残ることのみに言及した。患者はまた、小麦を摂取した場合には、手がより痛むことに言及した。患者の疲労症状は改善し、完全の消滅したわけではなかったが、活力は増進した。火照りは緩慢で、もはやそれにより目覚めることはなくなった。沈降速度は正常化したが、リウマチ因子はとても上昇した。患者は、ウルトラインフラムX医療食品を1日2回2匙、RIAA/ビタミンD/Zn/Se組合わせ栄養補助食品を1日2回1錠、組合わせイソフラボン栄養補助食品を昼食時に3錠剤、魚油1日3回2軟質カプセル、BC1日2回1錠、DHEAスプレー1日2回1噴霧することを続けるようにアドバイスされた。
結果(表6及び7)
(0093)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSe並びに食事を組合わせたプロトコールが、免疫炎症状態に関連するいくつかの症状の患者に陽性効果をもたらすことを示す。
【0084】
【表6】

【0085】
【表7】

【0086】
患者C(ケース概要#093RA1105)
患者の表示及び病歴
(0094)3年間持続して主として関節痛を訴えてきた51歳の女性があらわれた。患者は現在、中庸な足の腫れ;関節痛、変形、赤み及び凝り;筋肉痛、疼痛及び弱度及び緩慢な筋痙攣に罹患しており、これら全ては、イブプロフェン及びある栄養補助食品に部分的に反応する。2003年の6月に関節リウマチ(RA)と診断されて、患者は血液型食事及び栄養補助食品を摂取した。患者の症状は本プロトコールで50%が改善されたが、結局、患者は当該プロトコールを中止し、健康は再度悪化した。
評価及び計画
(0095)患者はホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えて(ウルトラインフラムX AI)1日2回2匙まで摂取することを始めるように指示された。患者はまた、2週間後に始めた除外食を摂取した。
4〜7週目の結果
(0096)4週間目の通院で、患者は、体調がよくなったことを報告した。患者は以前ほど疲労しなくなり、痛みも軽減し、再発もなかった。患者は除外食に不満があり、3lbを失った。わずかな腸内環境異常(dysbiosis)が示された2週間前に排泄解析を行った。患者は処方された医療食品の摂取を続けること、及び以下の:RIAAの200mg錠剤を1日2回1錠;2000IUのビタミンD3とイソフラボンを含有する栄養補助食品(IsoD3)を1日1回1錠;EPA−DHA(600mg+400mg)及びビタミンE(20IU)の組合わせ栄養補助食品(EPA−DAH ES)を1日2回2軟質カプセル;の摂取を開始することを指示された。7週間目の通院で、患者は、食品の再導入プロトコールの結果として、患者の手の疲労と痛みの悪化を引き起こす小麦に不寛容であることを発見したことに言及した。RIAA及びビタミンD栄養補助食品を、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAT)を1日2回1錠と医療食品に置き換えた。
9週目の結果
(0097)プログラムの9週目に、患者の痛みの症状が持続して改善され、患者は食品にチャレンジすることを続けた。患者は極めて活力を得て、改善して満足であった。加えて、患者の血圧は、開始時の151/95から120/84まで正常になった。患者は、食品の再導入、処方用量の医療食品、組合わせ栄養補助食品及び魚油栄養補助食品を続けるよう指示された。起床時及び就寝時各々1カプセルを摂取する2つの乳製品非含有プロビオティック栄養補助食品(ラクトビデン及びビフォビデン(BifoViden))は、患者の腸内細菌バランスをさらに改善した。患者はまた、ビタミンB12、葉酸及び内因性因子の組合わせ栄養補助食品を午前中に1錠摂取した。
結果
(0098)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSe並びに食事を組合わせたプロトコールが、免疫炎症状態に関連するいくつかの症状の患者に陽性効果をもたらすことを示す。
【0087】
【表8】

【0088】
【表9】

【実施例4】
【0089】
レイノー症候群患者の病状におけるRIAA、ビタミンD3、亜鉛及びセレンの効果
(0099)本実施例の目的は、レイノー症候群患者の病状に関連した疾患におけるRIAA、ビタミンD3、亜鉛及びセレン組成物の効果を示すことである。
患者A(ケース概要#094RD1105)
患者の表示及び病歴
(0100)長期にわたり手と指にレイノー病を患っている54歳の白人女性があらわれた。
評価及び計画
(0101)患者は、ホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えた栄養補助食品(ウルトラインフラムX AI)を1日2回2匙までの摂取を開始することを指示された。
2〜4週目の結果
(0102)2週間目の通院で、患者は症状に変化がなかったことを報告し、食品不寛容の可能性を判断するために除外食を摂取した。2/16α−ヒドロキシエストロン低比率であることを示した実験結果に基づき、患者は、150mgのインドール−3−カルビノール(I3C)を含有する栄養補助食品を1日2回1錠を食事と共に摂取することを始めた(MetaI3C)。4週間後、患者は指先が以前より寒さに敏感でなくなったことを報告し、膝の関節炎の症状が極めて改善されたことに言及した。患者は還元RIAA及びビタミンDを添加した医療食品の摂取を中止して、ウルトラインフラムX(登録商標)医療食品を1日2回2匙摂取することを開始するようにアドバイスされた。200mgのRIAAを含有する錠剤を加えて、1日分の医療食品と共に1日2回摂取した。患者はまた、2000IUのビタミンD3とイソフラボンを含有する栄養補助食品(IsoD3)を1日あたり1カプレット摂取することを指示された。ビフィズス菌が不足していることを示した排泄解析に基づき、患者はまた、生菌を独自にブレンドした2つのプロビオティック栄養補助食品(ビフォビデン及びラクトビデン)を各々1日2回(起床時及び夕食時)1カプセルずつ摂取した。
6〜8週目の結果
(0103)6週間目の通院で、患者は、気温が下がった秋期の気候が始まっても手は温かいようであり、指の不快感の程度はプロトコールを開始する前よりも軽減したと言及した。患者は、ウルトラインフラムX医療食品を1日2回2匙と、プロビオティック及びI3Cの摂取を継続し、RIAA及びビタミンD3栄養補助食品の摂取は中止して、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAT)を1日2回1錠摂取することを指示された。
【0090】
(0104)8週間後、患者は、レイノー及び関節炎の症状が改善したことを続けて報告し、今後も処方されたプロトコールを摂取するように指示された。
結果(表10)
(0105)本ケースでは、自覚的な評価が変化したことにより、炎症調節医療食品、RIAA、ビタミンD、Zn及びSeを組合わせたプロトコールが、レイノー病等の免疫炎症状態の患者の栄養補助に有効でありうることを示唆する。
【0091】
【表10】

【0092】
患者B(ケース概要#O95EM1105)
患者の表示及び病歴
(0106)足が火照った痛みを伴う肢端紅痛症及び指が冷えた痛みを伴うレイノー症候群の病歴を有する44歳の白色人種女性があらわれた。
評価及び計画
(0107)肢端紅痛症。レイノー症候群。腸内環境異常。おそらく睡眠時無呼吸及び下肢静止不能症候群に基づく疲労。食品アレルギーにより悪化した可能性がある喘息及び片頭痛。患者は、ホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えた栄養補助食品(ウルトラインフラムX AI)を1日2回2匙まで摂取することを開始するように指示された。
2〜5週目の結果
(0108)2週間目の通院で、患者は症状が50%改善されたこと及びそれほど疲労がなくなったことを報告した。肩の痛みは軽減した。患者は処方された医療食品の摂取を中止し、ウルトラインフラムX(登録商標)を1日2回2匙、200mgRIAAを1日2回1錠;2000IUのビタミンD3及びイソフラボン(IsoD3)を含有する栄養補助食品を1日1回1錠;EPA−DHA(600mg+400mg)及びビタミンE(20IU)の組合わせ栄養補助食品(EPA−DHA ES)を1日2回2軟質カプセル;及びビタミンB12、葉酸及び内因性因子(IntrinsiB12/葉酸)の組合わせ栄養補助食品について1日1回1錠の摂取を開始することを指示された。患者はまた、除外食の摂取を開始した。5週間後、患者は手の痛みが100%軽減し、足の腫れ及び赤みが軽減したことに言及した。患者は、片頭痛はなく、ごくたまに頭痛があるが、活力レベルは高くなり、睡眠と腸内ガス分解が改善された。実験結果により、筋肉膜抗体陽性、抗グリアジン抗体陽性及びトランスグルタミナーゼ抗体陽性、好酸球タンパク質X及びカルプロテクチンの上昇、及び有用なラクトバシラス菌及びビフィズス菌が腸内で生育していないことが示された。患者は、200mgRIAAからRIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAI)に変更した以外は処方された栄養補助食品を1日2回1錠の摂取を継続するよう指示された。その他、患者は生菌を独自にブレンドした2つのプロビオティック栄養補助食品(ビフォビデン及びラクトビデン)を各々1日2回(起床時及び夕食時)1カプセルずつ摂取し、グルタミン、脱グリチルリチン化(deglycyrrhinized)甘草(DGL)及びアルエ抽出物の組合わせ(3500mg/500mg/50mg)茶匙1杯を当該医療食品シェイク(Glutagenics)に加えることを指示された。患者は非グルテン食を開始した。
8〜12週目の結果
(0109)8週間後、患者はもはや鬱のためのシタロプラム及び睡眠障害のためのプラミペキソールの摂取は必要ないと感じ、摂取を共に止めた。患者は疼痛が強まることがなくなったので、1日あたりガバペンチン用量を9錠から3錠剤へ減量した。健康診断により、わずかな紅班が認められたが極めて正常な手であること、感触がわずかにひんやりしていたが紅班はなかったことが示された。患者は、処方されたプログラムを継続することを指示された。12週間目の通院で、患者は実際に足に痛みが全くなく起立できたことを報告した。患者は全ての薬の投薬を中止し、疼痛もなかった。患者は未だにいくつかのレイノー症状がみられた。実験では、ホモシステインが正常であり、腸内透過性が改善され、腸管免疫学的マーカーが改善されたことが示された。糞便真菌はカンジダ アルビカンスに陽性であった。患者は、医療食品、魚油、プロビオティック及びDGL/アロエの摂取を継続し、RIAA/ビタミンD/Zn/Se栄養補助食品の摂取を1日3回1錠に増やし、ビタミンD/イソフラボン栄養補助食品の1日4回1錠の摂取を再度開始し、腸内環境異常にベルベリンを含有する薬草製剤(Candibactin−BR)1日2回2錠の摂取を開始することを指示された。
結果(表11)
(0110)自覚的な評価が変化したことにより、炎症調節医療食品、RIAA、ビタミンD、Zn、Se及び食事を組合わせたプロトコールが、肢端紅痛症及びレイノー病改善に有効でありうることを示唆する。
【0093】
【表11】

【実施例5】
【0094】
全身性エリテマトーデス患者の症状におけるRIAA、ビタミンD3、亜鉛及びセレンの効果
(0111)本実施例の目的は、全身性エリテマトーデス患者の病状に関連した疾患におけるRIAA、ビタミンD3、亜鉛及びセレン組成物の効果を示すことである。.
患者A(ケース概要#O98SLE1105)
(0112)SLE及びレイノー症候群と以前に診断された40歳の女性があらわれた。治療計画
(0113)患者は、ウルトラインフラムX(登録商標)医療食品を1日2回2匙を、2つの栄養補助食品である200mgRIAAを1日2回1錠と2000IUビタミンD(IsoD3)を1日1回1錠と共に摂取することを開始するよう指示された。
3〜5週目の結果
(0114)3週間目の通院で、患者の体調はよくなり、活力が増した。患者の腸管は改善されて、腫脹も他の症状もなかった。患者は少々筋肉に痛みがあり、筋肉に痙攣が起きたが、それは特に晩に生じた。患者は、医療食品を1日2回2匙摂取することを続け、RIAA200mg及びビタミンD栄養補助食品の摂取を中止し、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)の組合わせ栄養補助食品(カプレックスAI)を1日2回1錠摂取することを開始するように指示された。患者はまた、EPA−DHA(600mg+400mg)及びビタミンE(20IU)の組合わせを1日3回2軟質カプセルで摂取すること及び除外食を始めるように指示された。
【0095】
(0115)5週間後、患者は筋肉が良好になり、筋肉の凝り及び痛みは和らいだように感じた。レイノー症候群は対して変化せず、1〜10段階の評価で3の不快感を示したが、場合によっては9を示した。患者は、起床時と就寝時にマググリシネート(MagGlycinate)1錠、起床時と就寝時に乳製品非含有栄養補助食品(ビフィドビデン)1カプセル及びインドール−3−カルビノール150mg(MetaI3C)1日3回1錠をプロトコールに加えた。患者はまた、食事に食品の段階的再導入をするように指示された。
7〜9週目の結果
(0116)7週間後、プログラムを開始してから、患者の体調は改善され、関節痛が50%和らぎ、活力が50%改善したことに言及した。患者は、症状の発現が約1回/日おこりレイノーの症状に変化はないようだった。患者は、副作用なく食品の摂取に取り組み続けた。
【0096】
(0117)プログラムを開始してから9週間後、患者は、全体的に体調が良好であると報告した。患者は、トレッドミルの間も、もはや筋肉、関節の痛みはなく、腰痛もなかった。患者の活力のレベルも改善し続けた。IBS症状は解消し、GI管も非常に良好になった。レイノーは改善しなかった。
【0097】
(0118)1:320の希釈濃度でのANA評価(screen)は継続して陽性であったことを示した。度重なる25(OH)ビタミンDのレベルの不足を考慮して、2000IUビタミンD3とイソフラボンを含有する栄養補助食品(IsoD3)を毎朝1錠患者のプロトコールに加えた。患者を1ヵ月ごとに管理した。
結果(表12)
(0119)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSe並びに食事を組合わせたプロトコールが、SLE及びGI症状に関連する病歴の患者に陽性効果をもたらすことを示す。
【0098】
【表12】

【実施例6】
【0099】
ホップ(Humulus lupulus)化合物及びその誘導体により刺激されたマウスマクロファージ及び非刺激マウスマクロファージにおけるPGE2合成阻害
(0120)概要−本実施例は、マウスマクロファージモデルにおいて、ホップの分画及び誘導体がPGE2のCOX−2合成をPGE2のCOX−1合成に優先して阻害する可能性を示す。
【0100】
(0121)化学物質及び試薬−微生物性リポポリサッカライド(LPS;B大腸菌055:B5)をSigma(St. Louis, MO)から得た。ホップ分画(1)αホップ(1%アルファ酸;AA)、(2)アロマホップOE(10%ベータ酸及び2%異性化アルファ酸、(3)イソホップ(異性化アルファ酸;IAA)、(4)ベータ酸溶液(ベータ酸BA)、(5)ヘキサホップゴールド(ヘキサヒドロ異性化アルファ酸;HHIAA)、(6)レディホップ(還元異性化アルファ酸;RIAA)、(7)テトラホップ(テトラヒドロ−イソ−アルファ酸THIAA)及び(8)消費ホップをBetatech hop Products (Washington, D.C., U.S.A.)から得た。消費ホップを等量の無水エタノールで2回抽出した。エタノールを厚い茶色の残渣が残るまで40℃で加熱して除去した。当該残渣をRAW264.7細胞で試験するためにDMSOに溶解した。他に言及しない限り、全ての試薬はSigma (St. Louis, MO)から得たが、それらは市販されているものでは純度が最も高かった。
【0101】
(0122)細胞培養−American Type Culture Collection(Catalog#TIB−71,Manassas, VA)から得たRAW264.7細胞は、ダルベッコ改良イーグル培地(DMEM、Mediatech, Herndon, VA)で生育させて対数期で維持した。DMEM成長培地を、50mLの熱不活性化FBS及び5mLのペニシリン/ストレプトマイシンを500mLボトルのDMEMに加えて作製し、4℃で保存した。当該成長培地は使用前に37℃の水槽で温めた。
【0102】
(0123)試験1日目の午前中に、96穴組織培養プレートに0.2mLの成長培地を添加した1ウェルごとに対数期のRAW264.7細胞を8×104細胞で播種した。1日の終わりに(プレーティング後6〜8時間)、各ウェルから100μLの成長培地を除去して、100μLの新しい培地と交換した。
【0103】
(0124)1.0mg/mLのLPS保存溶液をRAW264.7細胞におけるCOX−2の発現の誘導に用いて、1mLのDMSOで1.0mgのLPSを溶解した。溶解するまでボルテックスして、4℃で保存した。使用前に、室温又は37℃の水槽で溶解した。
【0104】
(0125)試験開始2日目、試験材料をDMSO中で1000Xストックとして調製した。1.7mLマイクロフュ−ジチューブに、非FBS DMEMを1mL加えて、0.05、0.10、0.5及び1.0μg/mLの試験濃度にした。試験材料の2μLの1000X DMSOストックを1mLの非FBS培地に加えた。試験材料を終末濃度で含むチューブを2倍に濃縮し、当該チューブを10分間インキュベーター内で、37℃で平衡にした。
【0105】
(0126)PGE2合成に関連するCOX−2について、培地100μLを第1日目に調製した細胞プレートの各ウェルから取り出し、100μLの平衡化させた2X終末濃度の試験化合物と取り換えた。その後、細胞を90分間インキュベートした。20μLのLPSを各ウェルの細胞に加えて終末濃度が1μgLPS/mLになるように刺激し、細胞を4時間インキュベートした。細胞をさらに5μMアラキドン酸で15分間インキュベートした。各ウェルから25μLの上清培地を取り出して、きれいなマイクロフュ−ジチューブに移して、培地に放出されたPGE2を測定した。
【0106】
(0127)LPS刺激の後、細胞の外観を観察して、実施例2に記載したように生存能力を測定した。でも試験したどの化合物も最高濃度でも毒性は観察されなかった。各ウェルから25μLの上清培地を取り出して、きれいなマイクロフュ−ジチューブに移して、培地に放出されたPGE2を測定した。PGE2を上記実施例1で記載したように測定し報告した。
【0107】
(0128)PGE2合成に関連するCOX−1について、培地100μLを第1日目に調製した細胞プレートの各ウェルから取り出し、100μLの平衡化させた2X終末濃度の試験化合物と取り換えた。その後、細胞を90分間インキュベートした。次に、LPSの代わりに、細胞を100μMアラキドン酸で15分間インキュベートした。各ウェルから25μLの上清培地を取り出して、きれいなマイクロフュ−ジチューブに移して、培地に放出されたPGE2を測定した。細胞の外観を観察して、実施例2に記載したように生存能力を測定した。試験したどの化合物も最高濃度でも毒性は観察されなかった。各ウェルから25μLの上清培地を取り出して、きれいなマイクロフュ−ジチューブに移して、培地に放出されたPGE2を測定した。PGE2を上記実施例1で記載したように測定し報告した。COX−2及びCOX−1のPGE2合成の50%阻害濃度(IC50)は実施例2に記載したように算出した。
【0108】
【表13】

【0109】
表13に示したように、本標的マクロファージモデルにおいては、全てのホップ分画及び誘導体は選択的にCOX−1よりもCOX−2を阻害した。これは、新規かつ及び予期せぬ知見であった。ホップ誘導体IAA及びRIAAに対するCOX−2の選択性の程度は各々144倍及び87倍であり、これは予期せぬ値であった。このようなCOX−2の低い50%阻害濃度と結びついた高選択性は、他の資源由来の天然産物では以前は報告がなかった。
【実施例7】
【0110】
ホップ化合物及び誘導体は直接的なシクロオキシゲナーゼ酵素阻害剤ではない
(0129)概要−本実施例は、WHMA−COX−2プロトコールを用いて試験した場合は、ホップ化合物及び誘導体は、生理学的に関連する濃度でA549肺上皮細胞においてPGE2の合成を阻害しないことを例示する。
化学物質−本実施例で用いたホップ及びホップ誘導体は、上記したとおりである。
【0111】
(0130)細胞−A549(ヒト肺上皮)細胞をAmericanTypeCultureCollection(Manassas, VA)から得て、供給者の指示に従って継代培養した。細胞を50単位のペニシリン/mL、50μgストレプトマイシン/mL、5%ピルビン酸ナトリウム及び5%L−グルタミンと10%FBSを含有するRPMI1640中で5%二酸化酸素で37℃でルーチンに培養した。実験をする日に、指数関数的に増えた細胞を集菌して、非血清RPMI1640で洗浄した。
【0112】
(0131)対数期のA549細胞を、96穴組織培養プレート中の各ウェルあたり0.2mLの成長培地に8×104細胞ずつ播種した。試験化合物によるPGE2阻害の測定には、WHMA−COX−2プロトコールとしても知られているWarnerら[(1999) Nonsteroid drug selectivities for cyclo-oxygenase-1 rather than cyclo-oxygenase-2 are associated with human gastrointestinal toxicity: a full in vitro assay. Proc Natl Acad Sci U S A 96, 7563-7568]の手順を改変せずに用いた。簡潔には、A549細胞の播種24時間後、インターロイキン−1β(10ng/mL)を加えてCOX−2の発現を誘導した。24時間後、細胞を非血清RPMI1640で洗浄し、DMSO及び非血清RPMIに溶解した試験材料をウェルに加えて、終末濃度を25、5.0、0.5及び0.05μg/mLにした。各濃度を2重に試験した。DMSOをコントロールウェルに試験ウェルに含まれる量と等量加えた。60分間後、A23187(50μM)をウェルに加えて、アラキドン酸を放出させた。30分間後に培地25μLをウェルから取り出してPGE2を測定した。
【0113】
(0132)細胞生存能力を評価した。試験したどの化合物も最高濃度のものでも毒性は観察されなかった。上清培地中のPGE2を測定し報告した。PGE2合成の50%阻害濃度(IC50)を算出した。
【0114】
(0133)結果−試験した用量では、上記実験プロトコールでは、いかなるホップ抽出物又は誘導体の50%効果濃度も獲得することができなかった。プロトコールでは、試験化合物を添加する前にCOX−2発現を刺激しなければならなかったため、試験材料がPGE2合成を阻害できなかったことに対するありうる答えとしては、それらの作用メカニズムがCOX−2アイソザイムの発現を阻害するのであり、直接的な活性ではないというものである。WHMA−COX−2プロトコールを用いると幾つかの直接阻害が観察されうるが、本手順は、ホップ化合物又はホップ化合物の誘導体の抗炎症特性を評価するには適していない。
【実施例8】
【0115】
ホップ(Humulus lupulus)化合物及び誘導体による胃粘膜細胞におけるPGE2合成阻害の欠如
(0134)概要−本実施例は、ホップ分画がPGE2阻害をしないこと及び当該化合物がAGSヒト胃粘膜細胞系において低胃腸刺激性であることを暗示することを例示する。
【0116】
(0135)AGS細胞を培養して、試験するホップ化合物及び誘導体に用いた。実施例1に記載したように、PGE2を測定し、報告した。AGS細胞でのPGE2合成の50%阻害濃度(IC50)を算出した。
【0117】
【表14】

【0118】
表14で見られるように、AGS胃粘膜細胞系では、試験した最高濃度の50%又はそれ以上の濃度では、全てのホップ分画及び誘導体は、PGE2合成を阻害できなかった。標的マクロファージにおける当該分画により示された抗炎症の可能性に基づくと、これは新規かつ予期せぬ知見であった。
【実施例9】
【0119】
イエダニアレルゲンは、A549肺細胞におけるPGE2生合成を活性化する
(0136)概要−本実施例は、家のイエダニアレルゲンが肺上皮細胞におけるPGE2生合成を誘導しうることを例示する。
【0120】
(0137)背景 アレルゲンに対する感受性は、消費者数が増加している問題である。本事項は、過去数年にわたり喘息の劇的な増加により複雑になっている。喘息患者は空中浮遊アレルゲンに特に感受性である。アレルギーの率はまた上昇している。これにより、アレルギー症状の原因及び関連する障害をどのように軽減するかという認識が高まる。人口のおよそ10%が、様々な環境源からの抗原に暴露されて過敏(アレルギー)になっている。迅速性又は遅延性の過敏症を誘導する当該抗原はアレルゲンとして知られる。アレルゲンとしては、草、木、海藻、動物性鱗屑、昆虫、食品、薬及び化学物質があげられる。個人の遺伝的素因は、花粉症、喘息及び蕁麻疹等の症状を含むアトピー及び過敏症等の急性アレルギー反応の進行に関連すると信じられている。
【0121】
(0138)多くのアレルゲンはタンパク質ベースの分子であり、当該タンパク質アレルゲンは、多くの原因に由来する。家の中の最も日常的なアレルゲン源の一つは、イエダニ由来のものであることが以前より知られてきた。もちろん、全てのアレルゲンがある場合であっても、ある人々のみがイエダニアレルゲンに対してアレルギーである。しかし、このような人々のグループが多くの領域、特に、高温多湿な領域で、極めて広いことはありうる。例えば、アメリカ合衆国の西南部は、一年の多くが高温及び多湿であり、一般住人におけるイエダニアレルギーの発生が25%程度である。イエダニはビロードのカーペット、張りぐるみの掛け布、柔らかいベッド布団等で繁殖する。
方法
(0139)イエダニアレルゲンの単離−コナヒョウヒダニ(Dermatophagoides farinae)は、アメリカのイエダニである。コナヒョウヒダニを、Purina Laboratory Chow(Ralston Purina, Co, St. Louis, MO)及びFleischmann粒状乾燥酵母(標準 Brands, Inc. New York, NY)を1:1の比率で、室温で及び湿度75%で培養した。生存しているダニを培地から移した培養陽気から吸引し、凍結して殺傷し、湿度0%で凍結乾燥した。イエダニのアレルゲン成分を周囲温度で水で抽出した。500mgのダニ粉末を15mLのコニカル遠心チューブ(VWR, Rochester, NY)中で5mLの水(1:10w/v)に加えて、1分間振って、周囲温度で一晩放置した。翌日、水層を0.2μmの使い捨てシリンジフィルターを用いて濾過した(Nalgene, Rochester, NY)。濾過物をイエダニアレルゲンとして、A549肺上皮細胞におけるPGE2生合成の誘導試験に用いた。
【0122】
(0140)細胞培養及び処置−本試験は、ヒト気管上皮細胞系A549(American Type Culture Collection, Bethesda, MD)を用いる。細胞を培養して処置した。ダニアレルゲンを培地に加えて終末濃度を1000ng/mLにした。24時間後、培地をPGE2濃度の測定のためにサンプリングした。
【0123】
(0141)PGE2検定−培地中のPGE2の測定は、実施例1で記載したように行った。
【0124】
(0142)統計学的解析−処置ごとに8検体ごとの平均値をエクセル(登録商標)表計算ソフト(Microsoft, Redmond, WA)を用いてコンピューター解析した。
結果
(0142)ダニアレルゲン処置により、A549細胞では、溶媒処置したコントロールと比較して6倍もPGE2生合成が高まった(図2)。
【実施例10】
【0125】
ホップ誘導体がA549肺細胞におけるPGE2生合成のイエダニアレルゲン活性化を阻害する
(0144)概要−本実施例は、ホップ誘導体がA549肺細胞におけるイエダニアレルゲンのPGE2刺激効果を阻害できることを例示する。
方法
(0145)細胞系及び試験手順は実施例9に記載したとおりである。イエダニアレルゲンに加えて、試験材料は、ホップ分画(1)αホップ(1%アルファ酸;AA)、(2)アロマホップOE(10%ベータ酸及び2%異性化アルファ酸)、(3)イソホップ(異性化アルファ酸;IAA)、(4)ベータ酸溶液(ベータ酸BA)、(5)ヘキサホップゴールド(ヘキサヒドロ異性化アルファ酸;HHIAA)、(6)レディホップ(還元異性化アルファ酸;RIAA)及び(7)テトラホップ(テトラヒドロ−イソ−アルファ酸THIAA)を含む。イエダニアレルゲンを添加する前に、試験材料を終末濃度10μg/mLで60分間加えた。
結果
(0146)表15は、イエダニアレルゲンで刺激されたA549肺細胞中のホップ誘導体によるPGE2の生合成阻害の程度を示す。ホップ誘導体は全てイエダニアレルゲンの刺激効果を著しく阻害することができた。
【0126】
【表15】

【0127】
(0147)結論として、それはまた、COX−2の発現を阻害し、標的細胞においてプロスタグランジン合成を選択的に阻害するか又は標的細胞において炎症反応を選択的に阻害するであろう化合物の天然製剤を同定するのに有用であろう。
【0128】
(0148)好ましい態様には、ホップ(Humulus lupulus)から単離され又は由来する少なくとも1の分画を含有する組成物を含む。ホップから単離され又は由来する少なくとも1の分画の例は、アルファ酸、イソアルファ酸、還元アルファ酸、テトラ−ヒドロイソアルファ酸、ヘキサ−ヒドロイソアルファ酸、ベータ酸及び消費ホップである。ホップから単離され又は由来する好ましい化合物としては、フムロン、コフムロン、アドフムロン、イソフムロン、イソコフムロン、イソアドフムロン、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンがあげられるがこれらに限定されない。好ましい化合物には又はロゲン、エーテル及びエステル等の置換体も生じうる。他の態様は、トリプタントリン及びその複合体を含有する組成物を含む。
【0129】
(0149)他の態様は成分の組合わせに関する。1の態様は、第1の成分としてホップ抽出物から単離又は由来する活性成分、及び、第2成分として、ローズマリー、ローズマリー由来の抽出物又は化合物、トリテルペンの種若しくは誘導体又はその複合体及びトリプタントリン又はその複合体からなる群から選択される少なくとも1のメンバーを含む組成物に関する。他の態様は、第1の成分としてトリプタントリン又はその複合体、及び、第2成分として、ホップ抽出物から単離又は由来する活性成分、ローズマリー、ローズマリー由来の抽出物又は化合物、トリテルペンの種若しくは誘導体又はその複合体からなる群から選択される少なくとも1のメンバーを含む組成物に関する。
【0130】
(0150)明白な本質の様々な変更及び改良が本発明の精神を逸脱することなくなされること及び当該全ての変更及び改良は、以下の請求項で特定される本発明の範囲内にあると考慮されることは当業者には、容易に明らかである。当該変更及び改良としては、ビタミン、ハーブ、調味剤及び担体同様の工程で製造されるカプセル、錠剤、ローション、食品又はバーに影響を与える初期成分があげられるがこれらに限定されない。他の当該変更及び改良としては、上記の好ましい態様の組合わせを含有する他のハーブ又は植物製品の使用があげられる。本願明細書に記載された態様の多くの他の改良及び変動は、当業者に明らかなように当該範囲から逸脱することなくなされる。本願明細書に記載された特定の態様は、実施例のみの目的で提供される。
【図面の簡単な説明】
【0131】
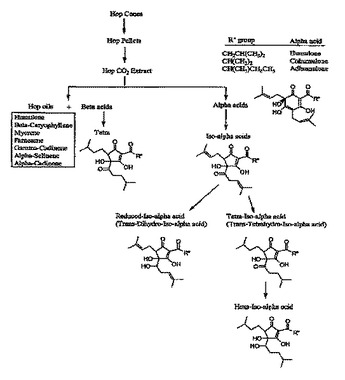
【図1】図1は、ホップから得られた分画及び化合物の概要を示す。
【図2】図2のうち、[A]は、アルファ酸属(AA)及びその代表的な種である、フムロン(R=−CH2CH(CH3)2)、コフムロン(R=−CH(CH3)2)及びアドフムロン(R=−CH(CH3)CH2CH3);[B]は、イソアルファ酸属(IAA)及びその代表的な種である、イソフムロン(R=−CH2CH(CH3)2)、イソコフムロン(R=−CH(CH3)2)及びイソアドフムロン(R=−CH(CH3)CH2CH3);[C]は、還元異性化イソアルファ酸属(RIAA)及びその代表的な種であるジヒドロ−イソフムロン(R=−CH2CH(CH3)2)、ジヒドロ−イソコフムロン(R=−CH(CH3)2)及びジヒドロ−アドフムロン(R=−CH(CH3)CH2CH3);[D]は、テトラ−ヒドロイソアルファ酸属(THIAA)及びその代表的な種である、テトラ−ヒドロ−イソフムロン(R=−CH2CH(CH3)2)、テトラ−ヒドロ−イソコフムロン((R=−CH(CH3)2)及びテトラ−ヒドロ−アドフムロン(R=−CH(CH3)CH2CH3);及び[E]は、ヘキサ−ヒドロイソアルファ酸(HHIAA)属とその代表的な種である、ヘキサ−ヒドロ−イソフムロン(R=−CH2CH(CH3)2)、ヘキサ−ヒドロ−イソコフムロン(R=−CH(CH3)2)及びヘキサ−ヒドロ−アドフムロン(R=−CH(CH3)CH2CH3)を示す。
【図3】図3は、還元アルファ酸(「RIAA」)、ビタミンD、亜鉛及びセレンの様々な組み合わせによりRAW264.7細胞を刺激したLPSにおけるPGE2分泌阻害を示すグラフである。
【技術分野】
【0001】
(0001)関連出願の参照
本特許出願は2004年6月10日に出願された米国第10/866,315号の一部継続出願であり、当該出願は2003年10月20日に出願された米国出願第10/689,856号の一部継続出願であり、当該出願は2003年6月18日に出願された米国出願第10/464,410号であり、当該出願は2003年3月26日に出願された米国出願第10/400,293号及び2003年3月26日に出願された米国出願第10/401,283号の一部継続出願であり、両出願は2003年2月25日に出願された仮出願第60/450,237号及び2002年10月21日に出願された仮出願第60/420,383号に対する米国特許法第119条(e)の利益を請求するものであり;及び2003年6月18日に出願された米国出願第10/464,834号の一部継続出願であり、当該出願は2003年3月26日に出願された米国出願第10/400,293号及び2003年3月26日に出願された米国出願第10/401,283号の一部継続出願であり、両出願は2003年2月25日に出願された仮出願第60/450,237号及び2002年10月21日に出願された仮出願第60/420,383号に対する米国特許法第119条(e)の利益を請求するものである。本出願はまた2001年6月20日に出願された米国出願第09/885,721号の一部継続出願である。当該先願の内容は本明細書で引用された場合は、その全体が参照することにより本明細書に組み込まれる。
【0002】
(0002)技術分野
本発明は、概して自己免疫疾患の治療に有用な組成物及び方法に関する。より具体的には、本発明は還元アルファ酸、ミネラル及びビタミンの組成物に関する。
【背景技術】
【0003】
(0003)自己免疫疾患及び障害は身体の防御免疫系が自己破壊的になる場合におこる。自己免疫相互作用の標的は、細胞レベル(例えば、多角性硬化症におけるミエリン塩基性タンパク質又はバセドウ病におけるチロトロピン受容体)から、関節リウマチ又はクローン病における影響が特異的である器官又は全身性エリテマトーデスでみられるように影響が広い系まで幅広い範囲としうる。自己免疫疾患の原因で想定されてきた事象のあるものとしては、例えば、炎症性大腸炎におけるTNF−α、IL−2若しくはIL−2受容体等のサイトカイン過発現、又はサイトカイン発現の低下(1型糖尿病におけるIL−10の弱発現)、アリル発現障害(強直性脊髄炎におけるHLAクラスI B27)、アポトーシスタンパク質の発現の変化(1型自己免疫リンパ球増殖症候群(ALPS1)におけるFas発現の低下)があげられる。自己免疫疾患の他の情報についてはHarrison’s Principles of Internal Medicine. 16th ed., McGraw-Hill, New York, 2005; Chapter 295を参照のこと。
【0004】
(0004)炎症は多くの自己免疫疾患の原因ではないが、それにもかかわらず、例えば、関節リウマチ、炎症性大腸炎、クローン病又は潰瘍性大腸炎等の自己免疫疾患及び障害にしばしば関連する症状である。そして、抗炎症剤が、一時的な治療方法の手段として多くの自己免疫治療方法にしばしば組み込まれている。
【0005】
(0005)プロスタグランジン(PG)の産生を阻害する化合物は痛み及び炎症の制御における重要な薬剤となってきた。集合的にこれらの薬剤は、骨関節炎及び関節リウマチに主に適応する非ステロイド系抗炎症薬(NSAIDs)として知られる。アラキドン酸は全てのPGの生合成の主要な基質として機能する。PGは、急速な細胞環境における無数の生理学的変化に影響する傍分泌の及び自己分泌のメディエーターとして機能するユビキタスホルモンである。PGの多様な生理学的効果としては、関節リウマチ及び骨関節炎、血圧制御、血小板凝集、陣痛及び痛みの悪化の誘発及び発熱等の炎症反応があげられる。
【0006】
(0006)プロスタグランジンに加え、最近の研究では、亜鉛及びセレンの微量金属のレベルが骨関節炎及び関節リウマチの病因や発症に機能する可能性があることが示されてきた。健常者に比べて関節リウマチ患者では、Cu濃度は極めて高いが、血漿液及び滑液のSe濃度は極めて低いことが見出された(各p<0.05及びp<0.05)。研究者はさらに関節リウマチ患者での滑液でのSe−Cu値とZn−Fe値の間に著しい正の相関性があることを同定した(Yazar, M., et al., Biol. Trace Elem Res 106(2): 123-132, 2005; McConnell, K.P., et al., J. Nutr. 105(8) : 1026-1031, 1975を参照のこと)。これは、微量金属を補充すると当該微量元素のレベルが通常のレベルになるため、関節リウマチに関連するいくつかの症状を改善するのに有利でありうることを示唆する。
【0007】
(0007)さらに、マクロファージは免疫反応の潜在的なメディエーターであること、及び、関節リウマチは活性化した食細胞(及び他の免疫反応細胞)を滑膜及び関節周囲組織に移動させることにより特定されることが以前から知られていた。活性化食細胞は滑液に到達すると、リウマチ様疾患を悪化させ持続させるように思われる、巨大な介在物質を放出する。亜鉛の薬理学的用量によりマクロファージが固定されて、滑膜への移動が防止又は制限され、関節リウマチにおける関節の特異的な炎症を軽減するための潜在的な手段が提供される。例えば、Aaseth, J., et al., Analyst 123(1): 3-6, 1998を参照のこと。さらに、マクロファージの固定化はマクロファージの相互作用及び活性化を減退させて、自己免疫反応の関与の可能性又は増強を低下させる機能がありうる。
【発明の開示】
【発明が解決しようとする課題】
【0008】
(0008)それゆえ、プロスタグランジンレベルを調節するか又はマクロファージ活性を制御し、それにより多くの自己免疫疾患に関連する炎症反応を調節する組成物及び方法を同定することは有用であろう。当該調節及び使用は慢性状態では連続的に用いる必要があるか又は必要に応じて断続的に用いられる必要がありうる。加えて、選択微量金属を補充することは、より正常な免疫機能を回復する手段ともなり、それにより、自己免疫疾患の診療に他の手段を提供することになる。本発明は、生活の質の向上の亢進に伴う症状に関連する炎症及び自己免疫疾患を治療する化合物, 組成物並びに方法を記載する。
【課題を解決するための手段】
【0009】
(0009)本発明は、炎症及び自己免疫疾患の治療に有用な新規な方法並びに生活の質の向上の亢進に伴う関連する症状に関する。
【0010】
(0010)本発明の側面は、還元イソアルファ酸化合物、ミネラル及びビタミンを含む組成物に関する。意図される還元イソアルファ酸化合物としては、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンがあげられる。還元アルファ酸はまた「ρ(rho)」イソアルファ酸としても知られる部分も含む。
【0011】
(0011)別の側面では、本発明はまた自己免疫疾患の治療に当該組成物を用いる方法を提供する。本発明の本側面では、哺乳動物は、還元イソアルファ酸化合物、 ミネラル及びビタミンを含む組成物を治療的有効量投与することで治療されうる。意図される還元イソアルファ酸化合物としては、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンがあげられる。還元アルファ酸はまた「ρ」イソアルファ酸としても知られる部分も含む。
【発明を実施するための最良の形態】
【0012】
(0015)本発明は、自己免疫疾患の治療に有効であることが見出された、還元アルファ酸、ミネラル及びビタミンを組み合わせた組成物の同定に関する。
【0013】
(0016)本発明のある側面は、(i)還元イソアルファ酸化合物、(ii)ミネラル及び(iii)ビタミン各々を1又はそれ以上含む組成物に関する。
【0014】
(0017)本明細書及び添付の請求の範囲において、単数形には、その内容が明らかに他のことを示していない限り、複数の指示対象も含む。本明細書で用いられている、「1の(a)」、「1の(an)」及び「当該(the)」はまた、特に、その内容が明らかに他のことを示していない限り、それらが言及する用語の複数形のものが含まれる。本明細書において、特定のものを示していない限り、単語「又は」は、「及び/又は」という「包括的な」意味で用いられるのであり、「〜か〜か/又は」という「排他的な」意味で用いられるのではない。請求の範囲の移行句又は前文であっても、本明細書で用いられる、用語「含む(comprise(s))」及び「含んでいる(comprising)」は、制限がない(open−ended)意味に解釈される。これは、当該用語が「少なくとも有する(having)」又は「少なくとも含む(including)」という節と同意的に解釈されるべきである。方法の内容で用いられる場合、用語「含む」は、少なくとも記載された工程を含む方法を意味するもので、その他の工程を含みうる。化合物又は組成物の内容物について用いる場合、化合物又は組成物を意味する用語「含む」には、少なくとも記載された特性又成分が含まれ、他の特性又成分もまた含む。
【0015】
(0018)本明細書中で用いられている技術的及び科学的用語は、特に定義されない限り、本発明に関連する当業者が一般的に理解する意味である。文献(reference)は当業者に公知の様々な方法論及び材料について構成される。一般的な医学の原理を説明する標準文献には、Harrison’s Principles of Internal Medicine, 16th ed., McGraw-Hill, New York, 2005があげられる。一般的な薬理学の原理を説明する標準文献には、Goodman and Gilman's The Pharmacological Basis of treatments, 10th Ed., McGraw Hill Companies Inc., New York (2001) があげられる。
【0016】
(0019)本明細書で言及される特許、公開公報及び科学文献は当業者の知識を構築し、各々がその全体が参照することにより本明細書に組み込まれるために、特異的及び個別に示される程度にその全体が参照することにより本明細書に組み込まれる。本明細書で引用された文献が本明細書の特定の教唆と一致しない場合は後者を支持することになる。同様に、単語や節が当業界で理解されている定義と本明細書で教唆されている単語や節の定義が一致しない場合は後者を支持することになる。
【0017】
(0020)用語「還元アルファ酸」とは、ホップ植物産物から単離され、その後、異性化され、還元されたアルファ酸をいい、シス体及びトランス体を含む。還元アルファ酸(「RIAA」)の例としては、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンがあげられるがこれらに限定されない。
【0018】
(0021)本明細書において、用語「テトラ−ヒドロイソアルファ酸」は還元アルファ酸のあるクラスをいう。テトラ−ヒドロイソアルファ酸(「THIAA」)の例としては、限定されないが、テトラ−ヒドロ−イソフムロン、テトラ−ヒドロ−イソコフムロン及びテトラヒドロ−アドフムロンがあげられる。本明細書において、用語「ヘキサ−ヒドロイソアルファ酸」とは、あるクラスの還元アルファ酸をいう。ヘキサ−ヒドロイソアルファ酸(「HHIAA」)の例としては、限定されないが、ヘキサ−ヒドロ−イソフムロン、ヘキサ−ヒドロ−イソコフムロン及びヘキサ−ヒドロ−アドフムロンがあげられる。
【0019】
(0022)本発明の還元イソアルファ酸化合物は、合成されてもよく、又は、ホップ若しくは消費ホップから単離され、抽出され、得られた分画又は化合物として得てもよい(Verzele, M. and De Keukeleire, D., Developments in Food Science 27: Chemistry and analysis of hop and Beer Bitter Acids, Elsevier Science Pub. Co., 1991, New York, USAを参照のこと、ホップ化学の詳細な議論について、その全体が参照することにより本明細書に組み込まれる)。
【0020】
(0023)本明細書において、用語「ホップ抽出物」とは、(1)ホップ植物産物を溶媒にさらすこと;(2)ホップ植物産物から溶媒を分離すること;及び(3)溶媒を除去すること;で得られる固体材料をいう。本明細書において、用語「溶媒」とは、ホップ植物産物から固体材料を抽出するのに必要な性質を有する水性又は有機天然液体をいう。溶媒の例としては、限定されないが、水、蒸気、過熱水、メタノール、エタノール、ヘキサン、クロロホルム、液体二酸化酸素、液体窒素又は当該材料の組合わせがあげられる。本明細書において、用語「二酸化酸素抽出物」とは、液体又は超臨界二酸化酸素調製物にホップ植物産物をさらし、二酸化酸素を除去することにより得られる固体材料をいう。本明細書において、用語「消費ホップ」とは、ホップの抽出による固体及び親水性残渣をいう。
【0021】
(0024)還元アルファ酸はまた、「ρ」イソアルファ酸として知られる部分を含む。組成物はすなわち、イソアルファ酸化合物を含み得る。本明細書において、「ρ」とは、還元が4−メチル−3−ペンテノイル側鎖のカルボニル基の還元である還元アルファ酸をいう。還元アルファ酸の本サブセットには、以下に示す上属の構造の部分である化合物であればいかなる化合物が含まれる:
【0022】
【化1】

【0023】
(上属)
[式中R’は、カルボニル、ヒドロキシル、OR及びOCORからなる群より選択され、式中Rはアルキルであり;式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択され;そして式中R、T、X、及びZは独立して、H、F、Cl、Br、I、及びπ軌道からなる群より選択されるが、ただしR、T、X、又はZの1つがπ軌道である場合には、隣接するR、T、X、又はZもまたπ軌道であり、それにより二重結合を形成する]。
【0024】
(0025)本発明のある態様としては、属A構造:
【0025】
【化2】

【0026】
(属A)
[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]の範囲に含まれる、1又はそれ以上の還元アルファ酸化合物があげられる。
【0027】
(0026)還元イソアルファ酸化合物としてはまた、属B構造:
【0028】
【化3】

【0029】
(属B)
[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]の範囲に含まれる化合物があげられる。
【0030】
(0027)本発明に有用なミネラルとしては、カルシウム、セレン、亜鉛、銅、鉄、クロム、マグネシウム、マンガン、バナジウム、モリブデン及びホウ素があげられる。本明細書に示された限定されない例示では、ミネラルは亜鉛及びセレンである。
【0031】
(0028)本発明に有用なビタミンとしては、ビタミンA、ビタミンB、ビタミンC、ビタミンD、ビタミンE、ビタミンK、ビオチン、葉酸、パントテン酸、パラ−アミノベンゼン酸、ベタインがあげられる。本明細書に示された限定されない例示では、ビタミンはビタミンDである。
【0032】
(0029)本発明組成物は、(a)1又はそれ以上の還元アルファ酸(ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロン)、(b)1又はそれ以上の上記に示し記載した式を有する上属のρ還元イソアルファ酸化合物;及び(c)ビタミン及び(d)ミネラルを含む。ある態様では、ρ還元イソアルファ酸化合物は、上記に示し記載した式を有する属Aの一部である。さらに他の態様では、ρ還元イソアルファ酸化合物は、上記に示し記載した式を有する属Bの一部である。当該組成物のミネラル及びビタミンは上記のとおりである。本明細書に例示された本発明の代表的で非限定の態様では、ミネラルは亜鉛及びセレンであり、ビタミンはビタミンDである。
【0033】
(0030)他の態様は、さらに患者の利益になりうる他の成分を含む組成物に関する。すなわち、本発明の組成物はさらに、ローズマリー、ローズマリー由来の抽出物又は化合物、トリテルペンの種若しくは誘導体又はその複合体、ジテルペンラクトンの種若しくは誘導体又はその複合体及びトリプタントリン(tryptanthrin)又はその複合体からなる群から選択される少なくとも1のメンバーを含んでもよい。本明細書において、用語「誘導体」又は状況「由来する(derived)」は、構造的に他の物質に構造的に関連し、それから理論的に得られる化学物質をいい、すなわち、他の物質から作製されうる物質をいう。誘導体としては化学反応を介して得られる化合物があげられる。用語、化合物の「複合体」は、モノ−又はジ−サッカライド、アミノ酸、硫酸、コハク酸エステル、酢酸及びグルタチンからなる群から選択される1のメンバーと共有結合又は複合する化合物を意味する。好ましくは、モノ−又はジ−サッカライドは、グルコース、マンノース、リボース、ガラクトース、ラムノース、アラビノース、マルト−ス及びフルクトースからなる群から選択される1のメンバーである。
【0034】
(0031)組成物中の還元イソアルファ酸化合物の量は、約0.5〜約10,000mgであってもよい。ある態様では、還元イソアルファ酸化合物の量は約50〜約7,500mgである。ある態様では、本明細書で例示されているように、単位用量には、225mgの還元アルファ酸、500IUのビタミンD(コレカルシフェロールとして)、5mgの亜鉛(クエン酸亜鉛として)及び50μgのセレン(セレノメチオニンとして)が含まれる。本明細書において、変数の数的範囲の記載は、本発明が当該範囲内のいかなる値と同等な変数で実行されうることを表すことを意図する。すなわち、本質的に不連続である変数の場合は、当該変数は、当該変数の終点を含む、数的範囲のいかなる整数値と同等でありうる。同様に、変数が本質的に連続的である変数のため、当該変数は当該範囲の終点を含む、いかなる実値の数的範囲と同等でありうる。例えば、0〜2の値であると記載された変数は、本質的に不連続である変数の場合は0、1及び2でありえ、本質的に連続する変数の場合は0.0、0.1、0.01、0.001又は他の実値でありうる。
【0035】
(0032)本発明の組成物は、さらに医薬的に許容される担体を含んでもよい。当業者に公知のいかなる適当な材料及び/又は方法を、本発明を行うのに用いることができる。しかしながら、好ましい材料及び方法を記載する。明記しない限り、以下の記載及び実施例で記載する材料、試薬等は商業的供給源から得られる。
【0036】
(0033)本発明の化合物は、場合によっては、医薬的に許容されるベヒクル中で希釈剤及び賦形剤を含むいかなる周知の医薬的に許容される担体と処方される(Remington's Pharmaceutical Sciences, 18th Ed., Gennaro, Mack Publishing Co., Easton, PA 1990 and Remington: The Science and Practice of Pharmacy. Lippincott, Williams & Wilkins, 1995を参照)。本発明の組成物を生成するのに用いられる医薬的に許容される担体/ベヒクルのタイプは、哺乳動物への当該組成物の投与形態に依存して多様でありうるが、一般的に、医薬的に許容される担体は生理学的に不活性で非毒性である。本発明の組成物の製剤は、本発明の化合物の1以上のタイプ及び治療される症状/状態の治療に有用ないかなる他の薬理的活性成分を含みうる。
【0037】
(0034)本明細書において、用語「組成物」としては本発明に含まれる、組合わせ投与に適するいかなる及び全ての可能性のある組成物があげられ、すなわち、例えば、健康補助食品組成物及び、一般的には、栄養薬及び医薬の組成物があげられる。
【0038】
(0035)同様に本発明を用いる組成物及び方法は、PGE2の阻害に有効であることが見出されている。すなわち、本発明はPGE2を阻害する組成物及び方法を提供する。出願人は、当該組成物及び方法が、いかなる1の作用メカニズムに拘束されることを望まずに、PGE2が介在するメカニズムによる炎症及び自己免疫疾患の治療に有効であることを前提とする。すなわち、本発明の組成物は、プロスタグランジンレベルを調節し、及び/又は、マクロファージ活性を制御することにより、自己免疫疾患に関連する炎症反応を調節すると信じられている。
【0039】
(0036)他の側面では、本発明はまた生活の質を同時に向上させる患者における炎症及び自己免疫疾患及び関連する症状の治療のための当該組成物を用いる方法を提供する。
【0040】
(0037)本明細書において、「自己免疫障害」とは、危険にさらされた疾患、疾病又は状態をいう。自己免疫疾患の代表的な例として、円形脱毛症、強直性脊髄炎、関節炎、抗リン脂質症候群、自己免疫アジソン病、自己免疫溶血性貧血、自己免疫内耳疾患(メニエール病としても知られる)、自己免疫リンパ球増殖症候群(ALPS)、自己免疫血小板減少性紫斑病、自己免疫溶血性貧血、自己免疫肝炎、ベーチェット病、クローン病、1型真性糖尿病、糸球体腎炎、バセドウ病、ギランバレー症候群、炎症性大腸炎、ループス腎炎、多角性硬化症、重症筋無力症、天疱瘡、悪性貧血、 多発性筋炎、初期胆汁性肝硬変、乾癬、レイノー症候群、リウマチ熱、関節リウマチ、強皮症、シェ−グレン症候群、全身性エリテマトーデス、潰瘍性大腸炎、白斑及びウェグナー肉芽腫症があげられるがこれらに限定されない。
【0041】
(0038)本発明の方法は、本発明の方法の利益を受けうるいかなる哺乳動物への使用をも意図する。本発明はヒトに限定する意図はないが、主要な当該哺乳動物はヒトであり、家畜への使用に適用される。すなわち、本発明によれば、「哺乳動物」又は「必要とする哺乳動物」としてはヒト及び非ヒト哺乳動物があげられるが、特に、ネコ、イヌ及びウマを含む家畜動物であるが、これらに限定されない。
【0042】
(0039)本発明の本側面では、哺乳動物は、還元イソアルファ酸化合物、ミネラル及びビタミンを含む組成物の治療的有効量を投与することにより治療されうる。
【0043】
(0040)本発明の本側面の治療に有用な組成物には、(i)還元イソアルファ酸化合物、(ii)ミネラル及び(iii)ビタミンを各々1又はそれ以上含む組成物が含まれる。
【0044】
(0041)本発明の方法に有用な組成物組成物は、上記し、第1の本発明の側面として示した上属の構造のρ還元アルファ酸を含んでもよい。同様に、組成物は、上記し、第1の本発明の側面として示した化学式を有する属A及び/又は属Bの還元アルファ酸を含んでもよい。
【0045】
(0042)本発明の方法に適する組成物としては、(a)1又はそれ以上の還元アルファ酸(ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロン);(b)1又はそれ以上の、上記に示した式を有する上属のρ還元イソアルファ酸化合物;(c)ビタミン及び(d)ミネラルがあげられる。ある態様では、還元イソアルファ酸化合物は、上記に示した化学式を有する属Aの部分である。さらに他の態様では、ρ還元イソアルファ酸化合物は、上記に示した化学式を有する属Bの部分である。当該組成物のミネラル及びビタミンは上記した。本明細書で例示された本発明の代表的な態様としては、ミネラルは亜鉛及びセレン並びにビタミンはビタミンDであるが、これらに限定されない。
【0046】
(0043)他の態様は、患者に利益をもたらしうる他の成分をさらに含む組成物を投与する方法に関する。すなわち、本発明の組成物としては、ローズマリー、ローズマリー由来の抽出物又は化合物、トリテルペンの種若しくは誘導体又はその複合体、ジテルペンラクトンの種若しくは誘導体又はその複合体及びトリプタントリン又はその複合体からなる群から選択される少なくとも1のメンバーがあげられる。ローズマリー抽出物、ローズマリー由来の化合物、トリテルペン種(誘導体又はその複合体を含む)、ジテルペンラクトン種若しくは誘導体又はその複合体及びトリプタントリン又はその複合体の記載については、例えば、その全体が本明細書に組み込まれる、米国特許第10/689,856号を参照のこと。
【0047】
(0044)本明細書において、用語「有効量」とは、選択した結果を得るのに必要な量を意味する。当該量は当業者であれば過度の負担なく容易に決定することができる。本明細書において、用語「実質的」とは、特定されたもの全てではなく広いことを意味する。
【0048】
(0045)理論に拘束されるわけではないが、本発明者は、本明細書で意図される組合わせは、プロスタグランジンの放出を選択的に阻害するように機能しうると考える。本組成物によるプロスタグランジン阻害は、炎症のダウンレギュレーションをもたらすと仮定される。
【0049】
(0046)本明細書で例示されるように、本発明の組成物は以下の図3に示すような相乗効果を産生することが見出された。本明細書で用いられるように、用語「相乗」及び「相乗効果」とは、全体として投与された会合化合物から産生された効果が、全ての会合物を共投与した場合よりもその効果が低い化合物を組合わせた場合に産生される効果に基づいて予想される効果よりも高いことを示す。
【0050】
(0047)選択された用量レベルは、特定の組成物の活性、投与経路、治療又は予防される状態の重症度並びに治療される患者の状態及び以前の治療記録に依存するはずである。しかしながら、所望の治療効果を達成するために必要なレベルより低いレベルで組成物の投与を始めること及び所望の効果が得られるまで用量を段階的に増加させることは当業界の技術の範囲内である。必要な場合、有効1日量は投与の目的により複数の投与に分けること、例えば、1日あたり2〜4回に別個に投与することもできる。しかしながら、いかなる特定の患者のための特定の用量レベルは、体重、相対的な健康、食事、投与の時間及び経路、他の組成物との組合わせ及び治療若しくは予防する特定の状態の重症度に依存するであろうことは理解される。
【0051】
(0048)ある態様としては、他の活性成分と還元アルファ酸の有効量を送達することがあげられる。好ましくは、好ましい組成物は、1日あたり約0.5〜10,000mgの還元アルファ酸を送達するように処方されるであろう。より好ましくは、好ましい組成物の有効1日量は、1日あたり約50〜7,500mgの還元アルファ酸を送達するように処方されるであろう。好ましくは、有効1日量は1日あたり1回又は2回投与される。約0.5〜約800mgの還元アルファ酸の1日投与量は、より好ましくは、1日あたり約50〜400mgの還元アルファ酸が発明者により意図される。他のある態様では、1日あたり約10〜3,000mgの還元アルファ酸、より好ましくは、1日あたり約50〜2,000mgの還元アルファ酸を含む組成物が供給される。
【0052】
(0049)好ましい態様としては、有効量のトリプタントリン又はその複合体を単独で又は他の活性成分と組合わせて送達することがあげられる。好ましくは、好ましい組成物の1日量は、1日あたり約0.0005〜50mgのトリプタントリン/体重kgを送達するように処方されるであろう。より好ましくは、好ましい組成物の有効1日量は、1日あたり約0.01〜10mgのトリプタントリン/体重kgを送達するように処方されるであろう。好ましくは、好ましい組成物の1日量は、1日あたり約0.035〜3500mgのトリプタントリンを送達するように処方されるであろう。より好ましくは、好ましい組成物の有効1日量は、1日あたり約0.7〜700mgのトリプタントリンを送達するように処方されるであろう。好ましくは、有効1日量は1日あたり1回又は2回投与される。
【0053】
(0050)好ましい態様としては、ローズマリー又はローズマリー由来の抽出物若しくは化合物の有効量を他の活性成分と組合わせて送達することがあげられる。好ましくは、好ましい組成物の1日量は、ローズマリー、ローズマリー抽出物又はローズマリー由来の化合物を1日あたり約0.5〜5,000mgで送達するように処方できる。より好ましくは、好ましい組成物の有効1日量は、ローズマリー、ローズマリー抽出物又はローズマリー由来の化合物を1日あたり約5〜2,000mgで送達するように処方できる。好ましくは、当該有効1日量は1日1回又は2回投与される。ある態様では、1日1回又は2回投与される、約75mgのローズマリー抽出物又はローズマリー由来の化合物又は誘導体を含む組成物を提供する。
【0054】
(0051)好ましい態様では、トリテルペン及びジテルペンラクトンの種若しくは誘導体又はその複合体の有効量を他の活性成分と組合わせて送達することがあげられる。好ましくは、好ましい組成物の1日量は、1日あたり、約0.0005〜50mgのトリテルペン又はジテルペンラクトン/体重kgで送達するように処方されるはずである。より好ましくは、好ましい組成物の1日量は、1日あたり、約0.01〜10mgのトリテルペン又はジテルペンラクトン/体重kgで送達するように処方されるはずである。好ましくは、好ましい組成物の1日量は、1日あたり、約0.035〜3,500mgのトリテルペン又はジテルペンラクトン種を送達するように処方されるはずである。より好ましくは、好ましい組成物の1日量は、1日あたり、約0.7〜700mgのトリテルペン又はジテルペンラクトン種を送達するように処方されるはずである。好ましくは、当該有効1日量は1日1回又は2回投与される。
【0055】
(0052)好ましくは、ある態様は、オレアノール酸等のローズマリー及びトリテルペンの抽出物を還元アルファ酸又はトリプタントリン若しくはその複合体等の活性成分と共に含有する組成物を提供する。好ましくは、ある態様は、約0.01〜500mgのローズマリー抽出物及び約0.01〜500mgのオレアノール酸を含む組成物を提供する。好ましくは、ある態様は、標的組織中の濃度が、ローズマリー抽出物が0.1〜10μg/組織g及びオレアノール酸が約0.1〜25μg/組織gになるような組成物を提供する。
【0056】
(0053)局所適用に好ましい態様の組成物は、還元アルファ酸若しくは誘導体又はトリプタントリン若しくはその複合体を約0.001〜10重量パーセント、好ましくは、約0.1〜1重量パーセント含有することになる。好ましい態様では、還元アルファ酸又はトリプタントリン若しくはその複合体の血清濃度が約0.0001〜10μMの範囲、好ましくは、約0.01〜1μMである。局所適用に好ましい態様は、さらに、ローズマリー、ローズマリー由来の抽出物又は化合物、トリテルペンの種若しくは誘導体又はその複合体、ジテルペンラクトンの種若しくは誘導体又はその複合体、ホップから単離又は由来する分画及びトリプタントリン又はその複合体から選択された他の成分を、各成分が0.001〜10重量パーセント、好ましくは、0.1〜1重量パーセントの濃度で含みうる。好ましい態様では、血清濃度が約0の範囲になるはずである。
【0057】
(0054)好ましい組成物は、健康補助食品又は治療組成物の形で投与されうる。組成物は、所望の適当な用量単位で、経口、局所的、経皮的、経粘膜的、非経口又は直腸的に投与される。
【0058】
(0055)食品に適用するための好ましい組成物としては、中間代謝物の他の天然成分、ビタミン及びミネラル等の様々な添加物並びに錠剤及びカプセルの製造における標準的な賦形剤であるタルク及びステアリン酸マグネシウム等の不活性成分があげられる。例えば、1の態様は、グルコサミン又はコンドロイチン硫酸と組み合わせた好ましい組成物の活性成分を含む。
【0059】
(0056)本明細書において、「医薬的に許容される担体」には、いかなる及びすべての、溶媒、分散剤媒体、コーティング剤、等張剤及び吸収遅延剤、甘味料等があげられる。当該医薬的に許容される担体は、希釈剤、結合剤及び接着剤、潤滑剤、崩壊剤、着色剤、増量剤、香味料、甘味剤並びに特定の治療組成物を調製するために必要でありうる緩衝剤及び吸収剤等の多種多様な材料を含むがこれらに限定されない幅広い材料から調製されうる。医薬的に活性物質に当該媒体及び剤を用いることは当業界で周知である。いかなる標準的な媒体及び剤が活性成分と適合しない場合を除いて、好ましい組成物におけるその使用が意図される。1の態様では、タルク及びステアリン酸マグネシウムが製剤に含まれる。食事バー(dietary bar)又は機能性食品として本組成物を製造する場合に影響することが知られている他の成分としては、香味料、糖、アミノ糖、タンパク質及び/又は加工スターチ並びに脂肪及び油があげられる。
【0060】
(0057)好ましい態様の健康補助食品、ローション又は治療組成物は、当業者に公知の態様で処方される。1の態様では、組成物は当業者が利用できる技術を用いてカプセル又は錠剤に製剤化される。カプセル又は錠剤の形で、成人のヒト又は動物の1日量としては、好ましくは、1〜6個のカプセル又は錠剤を含有することが推奨される。しかしながら、好ましい組成物はまた、注射用の溶液又は懸濁液、スプレー用の溶液又は懸濁液、ローション、ガム、トローチ、食品又はスナックのアイテム等の他の都合のよい剤型に製剤化される。食品、スナック、ガム又はトローチのアイテムとしては、甘味料、風味料、油、スターチ、タンパク質、果物又は果物抽出物、野菜又は野菜抽出物、穀物、動物性の脂肪又はタンパク質を含む、いかなる体内摂取可能な成分もあげられる。すなわち、好ましい組成物はシリアル;チップス、バー、ガムドロップ、チュ−イングキャンディー等のスナックアイテム又は遅効性溶解トローチに製剤化される。好ましい態様は、すべてのタイプの急性及び慢性の炎症ベースの疾患の治療を意図する。好ましい製剤は炎症反応を軽減し、罹患した組織を治癒し、予防し、さらに損傷する。医薬的に許容される担体はまた、好ましい組成物及び製剤でも用いられる。
【0061】
(0058)以下の実施例は、本発明のある好ましい態様をさらに例示することを意図するもので、これらに限定するものではない。当業者であれば、本明細書に記載のルーチンの実験、特定の物質の多数の同等物及び手順を用いることを、認識でき、解明できるはずである。
【実施例1】
【0062】
RIAA、セレン、亜鉛及びビタミンD3によるPGE2の阻害
(0059)本実施例は、プロスタグランジンE2(PGE2)放出における、還元アルファ酸(RIAA)、亜鉛、セレン及びビタミンD3の組合わせの効果を示す。本実施例では、マウスのマクロファージRAW264.7細胞を、RIAA、亜鉛、セレン及びビタミンD3を様々に組合わせたものの存在下で24時間LPSで刺激し、PGE2分泌物を酵素免疫測定法(ELISA)手法で測定した。
【0063】
(0060)方法
材料−試験化合物をジメチルスルホキシド(DMSO)中で調製した。RIAA及び亜セレン酸ナトリウムをMetagenics(San Clemente, CA)で供給した。塩化亜鉛及び1−α,25−ジヒドロキシビタミンD3をEMD Biosciences(San Diego, CA)から購入した。リポポリサッカライドをSigma-Aldrich(St. Louis, MO)から購入した。
【0064】
(0061)細胞培養−マウスマクロファージRAW264.7細胞系をATCC(Manassas, VA)から購入し、指示に従って維持した。亜セレン酸ナトリウム(2μM)か塩化亜鉛(169nM)のどちらかで処理した細胞を96穴プレートに播種する前の2日間T−75フラスコ中血清富化培地(10%FBS)で生育した。細胞を1穴あたり1×105細胞の密度で96穴プレートで継代培養して、密集度を90%に至らせる。RIAA(20〜1μg/ml)及びビタミンD3(355nM)を終末濃度が0.1%DMSOになるように非血清培地中の細胞に加えた。次の1時間、試験化合物、LPS(1ug/mL)又はPBSのみを細胞培地に加えてインキュベーションし、その後24時間インキュベーションを続けた。
【0065】
(0062)PGE2の測定−PGE2の定量には市販の非放射性手段を用いた(Cayman Chemical, Ann Arbor, MI)。製造者が推奨する方法を用い、改良は行わなかった。簡潔には、PGE2標準試料を連続希釈したものを加えた50μlの培地を、適当量のPGE2−アセチルコチンエステラーゼトレーサー複合体と混合して、4℃で一晩インキュベートした。新鮮なエルマン液(Ellman's)を調製し、発色反応を室温で75分間展開した。吸光度を405nmで測定した。PGE2濃度を標準曲線から算出してmlあたりピコグラムで表した。4つのウェルの平均値を処置ごとに決定した。
【0066】
(0063)統計学的解析−PGE2の産生阻害を、以下の状態:a)RIAA及びビタミンD3に試験材料は加えない;b)2μM亜セレン酸ナトリウムで2日間プレインキュベート;c)169nM塩化亜鉛で2日間プレインキュベート;又はd)2μM亜セレン酸ナトリウム及び169nM塩化亜鉛で2日間プレインキュベート;の条件で24時間LPS刺激の有無で生成したPGE2を比較することにより測定した。LPSで刺激した場合より高いか又は等しい値は0%阻害とみなし、LPSで刺激しない場合より低いか又は等しい値は100%阻害とみなすようにデータをクリップ(clip)した。PGE2阻害の比率を算出した。
【0067】
(0064)中央値有効算出(Median Effect Calculations)−中央値有効算出をCalcuSyn(Biosoft, Ferguson, MO)を用いて行った。本プログラムは、Chou及びTalalay(Adv Enzym Regul (1984) 22:27-55)の中央値効果のモデルを適用して及び以下の方程式:
【数1】

【0068】
[faは反応の(factional)阻害である。]
に適合させる。4つの濃度の最小値を用量反応曲線及び50%阻害濃度(IC50)を測定するのに用いた。
【0069】
(0065)結果
RAW264.7細胞を、LPS(1μg/mL)と様々な濃度のRIAA、亜セレン酸ナトリウム、塩化亜鉛又はビタミンD3で24時間刺激処理した。細胞培養した培地を採取して、PGE2の分泌濃度をELISAで決定した。その後、PGE2の阻害比率を決定した。当該値はpg/mlのPGE2量及び標準偏差(SD)で示した4つのウェルの平均と共に表1にみることができる。図3は阻害比率のグラフと算出したIC50(μg/ml)値を示す。
【0070】
(0066)結果は、24時間刺激後のRAW264.7細胞モデルにおけるPGE2阻害のIC50値の以下のランクを示す:RIAA+VD3(17.54μg/ml)>RIAA(9.83μg/ml)>RIAA+亜鉛(5.06μg/ml)>RIAA+セレン+亜鉛(4.55μg/ml)>RIAA+セレン(3.23μg/ml)>RIAA+セレン+VD3(1.84)>RIAA+亜鉛+VD3(1.38μg/ml)>RIAA+セレン+亜鉛+VD3(1.35μg/ml)。
【0071】
【表1】

【実施例2】
【0072】
クローン病患者の症状におけるRIAA、ビタミンD3、亜鉛及びセレンの効果
(0067)本実施例の目的は、クローン病患者の症状に関連した疾患におけるRIAA、ビタミンD3、亜鉛及びセレン組成物(以下、「KaprexAI」と記載する場合がある)の効果を示すことである。
患者A(ケース概要#096CDl105)
患者の表示及び病歴
(0068)61歳の女性がクローン病(CD)のマネジメントを提示した。彼女のGI出現は大学時代に始まり、結腸の部分切除を行った。数年後にCDと診断された。結腸の切除を繰り返さなければならず、その結果、実質的に結腸の2/3及び小腸の1/2を切除した。患者は最近、BMの前後に時として腹部全体に関する腹部膨張及び腹部の疼痛が伴う症状が極めて進んだ。痛みはオキシコドンで処置した。下痢が3〜6回/日おきた。彼女は、高用量のプレドニゾンに関連した、疲労、軽い吐き気及び大腿部に顕著な筋肉低下を訴えた。
【0073】
(0069)試験開始時の患者は、以下の処方箋:フォルテオ(Forteo)(商標)(テリパラチド(teriparatide))1日1回20mcg皮下投与;ディルスドール(Dirsdol)(登録商標)(エルゴラルシフェロール(ergocalciferol)ビタミンD2)毎月50,000IU投与;オキシコンチン(登録商標)(オキシコドンHCl)1日3回50mg;プレドニゾン、1日1回40mg;シンバルタ(Cymbalta)(登録商標)(duloxetineHCl)1日1回60mg;ネクシウム(Nexium)(登録商標)(エソメプラゾール(esomeprazole))1日2回40mg;フロセミド(furosemide)1日2回40mg;KCl10mEq、1日1回3カプセル;バギフェム(Vagifem)(登録商標)(エストラジオール)週2回1錠;プロパノロール(propanolol)1日2回20mg;ロラゼパム(Lorazepam)必要に応じて1日2回0.5mg;オキシコドン−5mg、必要に応じて2錠剤;フェネルガン(Phenergan)(登録商標)(プロメタジン(promethazine))必要に応じて25mg;アンビエン(Ambien)(登録商標)(ゾルピデン(Zolpidem))必要に応じて就寝時5mg;フレクゼリル(Flexeril)(登録商標)(シクロベンザプリン(cyclobenzaprine)HCl)、必要に応じて4〜6時間毎に10mg;必要に応じて腰部の滑液包炎にコルチソン(cortisone)注射;ベナドリル(Benadryl)(登録商標)(ジフェンヒドラミン(dyphenhydramine)HCl)必要に応じて25mg;アレグラ(Allegra)(登録商標)(フェキソフェナジン(fexofenadine)HCl)必要に応じて180mg/日;の投薬を受けていた。
【0074】
(0070)彼女は以下の非処方箋薬剤及び栄養補助食品:炭酸カルシウム1日2回600mg;マルチビタミンW/鉄1日1回1個;ビタミンB複合体1日1回1個;ビタミンB122週間毎1000mgIM;EPA−DHA 720,2カプセル/日;グルコン酸第1鉄1日1回324mg;ビタミンC1日1回500mg;アスピリン1日1回81mg;必要に応じてマーロックス(Maalox)(登録商標)(水酸化アルミナ及び水酸化マグネシウム);を続けた。
治療計画
(0071)当該患者はホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えた炎症調節医療食品を実際に1日2回2匙まで摂取することを指示された。
3〜5週目の結果
(0072)3週間目の通院で、患者はBMが10/日からわずか1/日にまで減少したことに言及した。患者は、常時疲労し続けており、低度の四肢の膨張があった。患者は現在の医療食品の摂取を中止して、ウルトラインフラムX(UltralnflamX)(登録商標)医療食品を1日2回2匙、200mgのRIAAを含む栄養補助食品を当該医療食品と共に1日2回1錠及び2000IUビタミンD(IsoD3)を含有する他の錠剤1日1回1錠の摂取を指示された。患者はまた、ラクトビデン(LactoViden)1日2回1カプセルの摂取を始めた。5週間後、患者は、特に作業後及び晩に多大に発汗することを報告した。患者は、ビタミンD及びRIAA栄養補助食品の摂取を中止して、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAI(カプレックスAI))を1日2回1錠摂取することを指示された。患者は、ウルトラインフラムX(UltralnflamX)(登録商標)医療食品1日2回2匙及びラクトビデン1日2回1カプセルを摂取を続けること並びにエストロファクターズ(EstroFactors)1日1回3錠剤を追加摂取することを指示された。患者はまた、EPA/DHA 720の摂取を中止してEPA−DHA ES(腸溶性コーティング)1日3回2カプセルの摂取を命じられた。患者は除外食を始めた。
7〜12週目の結果
(0073)7週間目の通院で、患者は、一貫して有形便があったがそれ以上は改善がみられないことに言及した。便試験はグルテン感受性であった。カプレックスAIを午前中に1個及び夕食時に2個増加して、患者はオーツの摂取を中止するように指示された。9週間後、患者は活力に明らかな違いがあったことに言及した。患者の頭脳は明晰に感じられて、より行動的に感じられた。BMは良好で通常0−1/日を継続していた。患者は処方されたプロトコールを継続して、組合わせ栄養補助食品の用量を1日2回2錠剤まで増加するように指示された。患者はまた、DHEAスプレー(BioSom)を1日2回1スプレーで始めた。12週間後、患者はプロトコール開始時から50−75%改善したように感じた。腹部膨張は消滅し、痛みは全体的により改善したため、患者は軽度の突出痛の治療を用いていた。患者は、胃逆流のため、BioSomに耐えられなかった。疲労は存続した。
結果(表2)
(0074)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSeを組合わせたプロトコール並びに標準食事を加えた場合に、より利益が改良されたことを示す。
【0075】
【表2】

【0076】
患者B(ケース概要#O92CD1105)
患者の表示及び病歴
(0075)以前クローン病と診断された57歳の女性が現れた。患者は、大腸内視鏡検査で回腸末端に潰瘍が見つかる8年前に貧血と診断され、その2年後にクローン病と診断された。患者はスルファサラザンを摂取したが、胃逆流のため使用をやめた。2年後に症状が再発して貧血が悪化した後、再度の大腸内視鏡検査で回腸に潰瘍が見つかった。患者はメラサミンの摂取を開始して症状は改善され、その後、ブデソニドの摂取を加えた。患者の体調はよくなり、排泄頻度が2〜3回/日未満になることはなかった。プレゼンテ−ションの4ヶ月前、患者は高繊維質食の摂取を始めてすぐに嘔吐、下痢及び血便が伴うひどい病気になった。患者は入院してIVステロイド及び抗生物質を投与されて、アザチオプリン(azathioprine)の摂取を始めて、ブデソニドの3ヶ月間投与を始めた。
【0077】
(0076)患者は現在以下の処方箋:クローン病用にメサラミン(Mesalamine)1日3回1600mg及びアザチオプリン1日1回100mg;火照り用にベンラファクシン(venlafaxine)HCl1日1回112.5mg;骨減少症用にアレンドロネート(alendronate)1週間に70mg;高コレステロール血症用にアトルバスタチン(atorvastatin)1日1回10mg;関節痛用に必要に応じて、プロポキシフェン(propoxyphene)+アセトアミノフェン(acetaminophen)の組合わせ薬;の投薬を受けており、患者は30年間毎日ASAを摂取していた。患者は以下の非処方箋薬剤及び栄養補助食品:必要に応じてイブプロフェン又はアスピリン;マルチビタミン1日1回1錠;クエン酸カルシウム630mg+400ビタミンD1日2回;ラクトース酵素;を摂取した。
治療計画
(0077)患者は全ての現在の栄養補助食品の摂取を中止して、ホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えた栄養補助食品を1日2回2匙まで摂取するように指示された。
3〜7週目の結果
(0078)3週間目の通院で、患者は医療食品の摂取を始めてすぐに正常なBMが形成され、大経の排泄が1〜2BM/日がおこり始めたことを報告した。その後、排泄はだんだん柔らかくなり、また頻度も多くなり、患者は、1日あたり4〜5回の少量のガスを含む柔らかいBMがあり、不快感もなくなった。患者は火照りにより睡眠が妨げられた。火照りには、昼食時に組合わせイソフラボン栄養補助食品(EstroFactors)を3錠剤を加えた。グルテン感受性排泄試験は陽性で、患者は非グルテン食を始めた。5週間後、患者のBMは正常になった。患者は、現在の医療食品の処方を中止して、200mgRIAA含有栄養補助食品を1日2回1錠及び他のビタミンD(IsoD3)2000IU含有錠剤を1日1回1錠と共にウルトラインフラムX(登録商標)医療食品1日2回2匙摂取することを指示された。患者はまた除外食を摂取した。7週間目の通院までに、火照りは以前は20/日で激しい症状だったのが、現在は10−14/日で緩慢な症状に改善された。患者はプログラムの開始から全体的に25%の割合で改善された。ウルトラインフラムX医療食品及び組合わせイソフラボンを処方した用量で引き続き摂取して、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAI)の1日2回1錠と医療食品の摂取を始めるように指示された。患者はまた、貧血用に、EPA−DHA(600mg+400mg)及びビタミンE(20IU)の組合わせを1日3回2軟質カプセル、乳製品非含有プロビオティック栄養補助食品(ラクトバシラスアシドフィルスNCFM株、ビヒドバクテリウムラクティス)(ウルトラフローラ(UltraFlora)IB)1日2回1カプセル及び抗貧血処方栄養補助食品(高吸収鉄分、ビタミンB6及びB12、チアミン、葉酸、コハク酸、グリシン)(Hemagenics)1日2回1錠の摂取を始めた。
9〜16週目の結果
(0079)患者プロトコールを開始してから9及び13週後に再び診察を受けた。2回の診察ともに、患者のBMは正常で火照りの症状も軽減して、病状は改良されたと報告した。患者は除外食を続けて食品を再導入した。16週間目の通院で、患者は、形成された1BM/日があり、下痢もおこらず、他の異常もないとコメントした。患者は著しい程度の活力が得られて関節痛もないことを報告した。実験結果によれば、糞便カルプロテクチン(calprotectin)及びエシノフィル(Eosinophil)タンパク質X、IgMカンジダ及びIgG大腸菌が正常であることが示された。患者は処方された計画を継続するように指示された。
結果(表3)
(0080)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSe並びに食事を組合わせたプロトコールが、クローン病及び免疫炎症状態に関連するいくつかの他の症状の病歴がある患者に陽性効果をもたらすことを示す。
【0078】
【表3】

【実施例3】
【0079】
関節リウマチ患者の病状におけるRIAA、ビタミンD3、亜鉛及びセレンの効果
(0081)本実施例の目的は、関節リウマチ患者の病状に関連した疾患におけるRIAA、ビタミンD3、亜鉛及びセレンの効果を示すことである。
患者A(ケース概要#090RA1105)
患者の表示及び病歴
(0082)以前関節リウマチ(RA)の診断を受けた51歳の女性があらわれた。患者は、膝の腫れ、筋肉痛及び間欠的な吐き気及び疲労を訴えた。患者はまた、手足の裏が熱いことにも言及した。
評価及び計画
(0083)負のリウマチ因子のRA。肥満。鉄分不足。患者はホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えた栄養補助食品(ウルトラインフラムX AI)を1日2回2匙まで摂取を始めることを指示された。
5〜7週目の結果
(0084)5週間目の通院で、患者は、体調がよいことを報告し、活力が増したことに言及した。患者は、再度問題なく歩行をし、より簡易に階段の昇降ができるようになった。患者は21日間の除外食を始めた後、慎重に食品を再摂取した。7週間後、患者は関節痛を2〜3のレベル(1〜10のスケール)に評価したが、プロトコールを開始する以前の6〜7よりも下がった。患者は前を向いて階段の昇降ができるようになったが、以前は横向きで下降しなければならなかった。患者は、時折、肘、膝及び手に問題があったが、精神的には明瞭で、体調もよかった。患者は、現在の医療食品の処方を中止して、ウルトラインフラムX(登録商標)医療食品を1日2回2匙を200mgRIAA含有栄養補助食品を1日2回1錠及び2000IUビタミンD(IsoD3)を含有する他の錠剤を1日1回1錠摂取するように指示された。
9〜3週目の結果
(0085)プログラムの9週目、患者はとても従順で、関節痛の症状はかなり改善されたことを報告した。患者は吐き気又は疲労がないことを言及した。この2週間は足の熱感もなかった。筋肉痛も消滅した。患者は4週間除外食を摂取しており、100%それに従ったことを報告した。患者はRIAA及びビタミンD栄養補助食品の摂取を中止して、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAI)を1日2回1錠の摂取を開始することを指示された。13週間目の通院では、改善が持続していた。患者はより活動的で、活力を感じ、もはや疲労はなかった。患者は、唯一の例外は重労働であることに言及し、ナプロキセン(naproxen)をその前の5〜6週間摂取していないことを報告した。
【0080】
(0086)患者は、組合わせ栄養補助食品を1日2回2錠剤に増やし、ウルトラインフラムX医療食品を1日2回2匙は継続して摂取して、EPA−DHA(600mg+400mg)とビタミンE(20IU)の組合わせを1日3回2軟質カプセル追加摂取することを指示された。
結果(表4及び5)
(0087)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSe並びに食事を組合わせたプロトコールが、関節リウマチ及び他の炎症関連症状の患者に陽性効果をもたらすことを示す。
【0081】
【表4】

【0082】
【表5】

【0083】
患者B(ケース概要#091RA1105)
患者の表示及び病歴
(0088)以前関節リウマチ(RA)と診断された52歳の女性が2005年の9月にあらわれた。診察にくる約3年前、患者は2週間に25mgのエンブレル(Enbrel)(登録商標)(etanercept)に切り替えた。患者は投薬により改善されたにもかかわらず、足、手及び、関節の痛みは持続していた。患者は未だに疲労しており、手足は腫れを繰り返していた。診察の約5〜6週間前、患者は手術をして患者のくるぶしを安定させていたピンを左足から除去する手術をうけたが、そのピンはそれより2〜3年前に埋め込まれたものであった。
評価及び計画
(0089)高RFを伴うRA。RAに続く疲労。甲状腺機能低下。グルテン感受性。正常な低ビタミンD。患者は、ウルトラインフラムX(登録商標)医療食品1日2回2匙までの摂取を開始することを指示された。患者はまた、200mgのRIAAを含有する栄養補助食品を1日2回1錠摂取した。
2週目の結果
(0090)2週間目の通院で、患者は、関節痛が軽減しなかったことを報告した。患者は疲労症状が変化しないことに言及した。加えて、患者は、日夜緩慢な火照りがあった。患者は、ウルトラインフラムXの摂取を続け、RIAAの摂取を中止し、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAI)1日2回1錠の摂取を開始することを指示された。加えて、患者は魚油濃縮物の摂取を中止し、EPA−DHA(600mg+400mg)及びビタミンE(20IU)の組合わせ栄養補助食品(EPA−DHA ES)を1日3回2軟質カプセルの摂取を開始し、組合わせイソフラボン栄養補助食品(EstroFactors)を毎日3錠剤摂取することを開始し、非グルテン食を摂取することを開始するように指示された。
4週目の結果
(0091)4週間後、患者は疲労も軽減して体調がよくなったが、関節の腫れは改善されず、便秘になった。火照りは著しく軽減した。排泄分析では、腸内ビフィズス菌が消滅したことが示され、女性ホルモン健康評価では、エストリオールの比率が上昇するに従って、DHEA−S、2(OH)エストロン及び2/16(OH)エストロゲン比率が低下することが示された。患者は、ウルトラインフラムX医療食品、RIAA/ビタミンD/Zn/Se組合わせ栄養補助食品、魚油栄養補助食品を続けて摂取するようにアドバイスされた。患者は、イソフラボン栄養補助食品を夕食時に3錠剤摂取するように指示された。患者はI3C(メタI3C)を1日2回1錠を摂取して、液体DHEAスプレー(BioSom)を1日2回噴霧することを開始した。患者は便秘にウルトラインフラムXに小匙1杯の亜麻仁油を添加するようにアドバイスされた。
6週目の結果
(0092)患者は、プロトコールを開始して5週間後に関節痛が実質的に改善されたことを報告した。膝の痛みは消滅して、患者は手を例えば、庭仕事などで長時間使った場合に緩慢な不快感が残ることのみに言及した。患者はまた、小麦を摂取した場合には、手がより痛むことに言及した。患者の疲労症状は改善し、完全の消滅したわけではなかったが、活力は増進した。火照りは緩慢で、もはやそれにより目覚めることはなくなった。沈降速度は正常化したが、リウマチ因子はとても上昇した。患者は、ウルトラインフラムX医療食品を1日2回2匙、RIAA/ビタミンD/Zn/Se組合わせ栄養補助食品を1日2回1錠、組合わせイソフラボン栄養補助食品を昼食時に3錠剤、魚油1日3回2軟質カプセル、BC1日2回1錠、DHEAスプレー1日2回1噴霧することを続けるようにアドバイスされた。
結果(表6及び7)
(0093)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSe並びに食事を組合わせたプロトコールが、免疫炎症状態に関連するいくつかの症状の患者に陽性効果をもたらすことを示す。
【0084】
【表6】

【0085】
【表7】

【0086】
患者C(ケース概要#093RA1105)
患者の表示及び病歴
(0094)3年間持続して主として関節痛を訴えてきた51歳の女性があらわれた。患者は現在、中庸な足の腫れ;関節痛、変形、赤み及び凝り;筋肉痛、疼痛及び弱度及び緩慢な筋痙攣に罹患しており、これら全ては、イブプロフェン及びある栄養補助食品に部分的に反応する。2003年の6月に関節リウマチ(RA)と診断されて、患者は血液型食事及び栄養補助食品を摂取した。患者の症状は本プロトコールで50%が改善されたが、結局、患者は当該プロトコールを中止し、健康は再度悪化した。
評価及び計画
(0095)患者はホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えて(ウルトラインフラムX AI)1日2回2匙まで摂取することを始めるように指示された。患者はまた、2週間後に始めた除外食を摂取した。
4〜7週目の結果
(0096)4週間目の通院で、患者は、体調がよくなったことを報告した。患者は以前ほど疲労しなくなり、痛みも軽減し、再発もなかった。患者は除外食に不満があり、3lbを失った。わずかな腸内環境異常(dysbiosis)が示された2週間前に排泄解析を行った。患者は処方された医療食品の摂取を続けること、及び以下の:RIAAの200mg錠剤を1日2回1錠;2000IUのビタミンD3とイソフラボンを含有する栄養補助食品(IsoD3)を1日1回1錠;EPA−DHA(600mg+400mg)及びビタミンE(20IU)の組合わせ栄養補助食品(EPA−DAH ES)を1日2回2軟質カプセル;の摂取を開始することを指示された。7週間目の通院で、患者は、食品の再導入プロトコールの結果として、患者の手の疲労と痛みの悪化を引き起こす小麦に不寛容であることを発見したことに言及した。RIAA及びビタミンD栄養補助食品を、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAT)を1日2回1錠と医療食品に置き換えた。
9週目の結果
(0097)プログラムの9週目に、患者の痛みの症状が持続して改善され、患者は食品にチャレンジすることを続けた。患者は極めて活力を得て、改善して満足であった。加えて、患者の血圧は、開始時の151/95から120/84まで正常になった。患者は、食品の再導入、処方用量の医療食品、組合わせ栄養補助食品及び魚油栄養補助食品を続けるよう指示された。起床時及び就寝時各々1カプセルを摂取する2つの乳製品非含有プロビオティック栄養補助食品(ラクトビデン及びビフォビデン(BifoViden))は、患者の腸内細菌バランスをさらに改善した。患者はまた、ビタミンB12、葉酸及び内因性因子の組合わせ栄養補助食品を午前中に1錠摂取した。
結果
(0098)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSe並びに食事を組合わせたプロトコールが、免疫炎症状態に関連するいくつかの症状の患者に陽性効果をもたらすことを示す。
【0087】
【表8】

【0088】
【表9】

【実施例4】
【0089】
レイノー症候群患者の病状におけるRIAA、ビタミンD3、亜鉛及びセレンの効果
(0099)本実施例の目的は、レイノー症候群患者の病状に関連した疾患におけるRIAA、ビタミンD3、亜鉛及びセレン組成物の効果を示すことである。
患者A(ケース概要#094RD1105)
患者の表示及び病歴
(0100)長期にわたり手と指にレイノー病を患っている54歳の白人女性があらわれた。
評価及び計画
(0101)患者は、ホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えた栄養補助食品(ウルトラインフラムX AI)を1日2回2匙までの摂取を開始することを指示された。
2〜4週目の結果
(0102)2週間目の通院で、患者は症状に変化がなかったことを報告し、食品不寛容の可能性を判断するために除外食を摂取した。2/16α−ヒドロキシエストロン低比率であることを示した実験結果に基づき、患者は、150mgのインドール−3−カルビノール(I3C)を含有する栄養補助食品を1日2回1錠を食事と共に摂取することを始めた(MetaI3C)。4週間後、患者は指先が以前より寒さに敏感でなくなったことを報告し、膝の関節炎の症状が極めて改善されたことに言及した。患者は還元RIAA及びビタミンDを添加した医療食品の摂取を中止して、ウルトラインフラムX(登録商標)医療食品を1日2回2匙摂取することを開始するようにアドバイスされた。200mgのRIAAを含有する錠剤を加えて、1日分の医療食品と共に1日2回摂取した。患者はまた、2000IUのビタミンD3とイソフラボンを含有する栄養補助食品(IsoD3)を1日あたり1カプレット摂取することを指示された。ビフィズス菌が不足していることを示した排泄解析に基づき、患者はまた、生菌を独自にブレンドした2つのプロビオティック栄養補助食品(ビフォビデン及びラクトビデン)を各々1日2回(起床時及び夕食時)1カプセルずつ摂取した。
6〜8週目の結果
(0103)6週間目の通院で、患者は、気温が下がった秋期の気候が始まっても手は温かいようであり、指の不快感の程度はプロトコールを開始する前よりも軽減したと言及した。患者は、ウルトラインフラムX医療食品を1日2回2匙と、プロビオティック及びI3Cの摂取を継続し、RIAA及びビタミンD3栄養補助食品の摂取は中止して、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAT)を1日2回1錠摂取することを指示された。
【0090】
(0104)8週間後、患者は、レイノー及び関節炎の症状が改善したことを続けて報告し、今後も処方されたプロトコールを摂取するように指示された。
結果(表10)
(0105)本ケースでは、自覚的な評価が変化したことにより、炎症調節医療食品、RIAA、ビタミンD、Zn及びSeを組合わせたプロトコールが、レイノー病等の免疫炎症状態の患者の栄養補助に有効でありうることを示唆する。
【0091】
【表10】

【0092】
患者B(ケース概要#O95EM1105)
患者の表示及び病歴
(0106)足が火照った痛みを伴う肢端紅痛症及び指が冷えた痛みを伴うレイノー症候群の病歴を有する44歳の白色人種女性があらわれた。
評価及び計画
(0107)肢端紅痛症。レイノー症候群。腸内環境異常。おそらく睡眠時無呼吸及び下肢静止不能症候群に基づく疲労。食品アレルギーにより悪化した可能性がある喘息及び片頭痛。患者は、ホップ由来の還元アルファ酸(RIAA)及びビタミンDを加えた栄養補助食品(ウルトラインフラムX AI)を1日2回2匙まで摂取することを開始するように指示された。
2〜5週目の結果
(0108)2週間目の通院で、患者は症状が50%改善されたこと及びそれほど疲労がなくなったことを報告した。肩の痛みは軽減した。患者は処方された医療食品の摂取を中止し、ウルトラインフラムX(登録商標)を1日2回2匙、200mgRIAAを1日2回1錠;2000IUのビタミンD3及びイソフラボン(IsoD3)を含有する栄養補助食品を1日1回1錠;EPA−DHA(600mg+400mg)及びビタミンE(20IU)の組合わせ栄養補助食品(EPA−DHA ES)を1日2回2軟質カプセル;及びビタミンB12、葉酸及び内因性因子(IntrinsiB12/葉酸)の組合わせ栄養補助食品について1日1回1錠の摂取を開始することを指示された。患者はまた、除外食の摂取を開始した。5週間後、患者は手の痛みが100%軽減し、足の腫れ及び赤みが軽減したことに言及した。患者は、片頭痛はなく、ごくたまに頭痛があるが、活力レベルは高くなり、睡眠と腸内ガス分解が改善された。実験結果により、筋肉膜抗体陽性、抗グリアジン抗体陽性及びトランスグルタミナーゼ抗体陽性、好酸球タンパク質X及びカルプロテクチンの上昇、及び有用なラクトバシラス菌及びビフィズス菌が腸内で生育していないことが示された。患者は、200mgRIAAからRIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)を組合わせた栄養補助食品(カプレックスAI)に変更した以外は処方された栄養補助食品を1日2回1錠の摂取を継続するよう指示された。その他、患者は生菌を独自にブレンドした2つのプロビオティック栄養補助食品(ビフォビデン及びラクトビデン)を各々1日2回(起床時及び夕食時)1カプセルずつ摂取し、グルタミン、脱グリチルリチン化(deglycyrrhinized)甘草(DGL)及びアルエ抽出物の組合わせ(3500mg/500mg/50mg)茶匙1杯を当該医療食品シェイク(Glutagenics)に加えることを指示された。患者は非グルテン食を開始した。
8〜12週目の結果
(0109)8週間後、患者はもはや鬱のためのシタロプラム及び睡眠障害のためのプラミペキソールの摂取は必要ないと感じ、摂取を共に止めた。患者は疼痛が強まることがなくなったので、1日あたりガバペンチン用量を9錠から3錠剤へ減量した。健康診断により、わずかな紅班が認められたが極めて正常な手であること、感触がわずかにひんやりしていたが紅班はなかったことが示された。患者は、処方されたプログラムを継続することを指示された。12週間目の通院で、患者は実際に足に痛みが全くなく起立できたことを報告した。患者は全ての薬の投薬を中止し、疼痛もなかった。患者は未だにいくつかのレイノー症状がみられた。実験では、ホモシステインが正常であり、腸内透過性が改善され、腸管免疫学的マーカーが改善されたことが示された。糞便真菌はカンジダ アルビカンスに陽性であった。患者は、医療食品、魚油、プロビオティック及びDGL/アロエの摂取を継続し、RIAA/ビタミンD/Zn/Se栄養補助食品の摂取を1日3回1錠に増やし、ビタミンD/イソフラボン栄養補助食品の1日4回1錠の摂取を再度開始し、腸内環境異常にベルベリンを含有する薬草製剤(Candibactin−BR)1日2回2錠の摂取を開始することを指示された。
結果(表11)
(0110)自覚的な評価が変化したことにより、炎症調節医療食品、RIAA、ビタミンD、Zn、Se及び食事を組合わせたプロトコールが、肢端紅痛症及びレイノー病改善に有効でありうることを示唆する。
【0093】
【表11】

【実施例5】
【0094】
全身性エリテマトーデス患者の症状におけるRIAA、ビタミンD3、亜鉛及びセレンの効果
(0111)本実施例の目的は、全身性エリテマトーデス患者の病状に関連した疾患におけるRIAA、ビタミンD3、亜鉛及びセレン組成物の効果を示すことである。.
患者A(ケース概要#O98SLE1105)
(0112)SLE及びレイノー症候群と以前に診断された40歳の女性があらわれた。治療計画
(0113)患者は、ウルトラインフラムX(登録商標)医療食品を1日2回2匙を、2つの栄養補助食品である200mgRIAAを1日2回1錠と2000IUビタミンD(IsoD3)を1日1回1錠と共に摂取することを開始するよう指示された。
3〜5週目の結果
(0114)3週間目の通院で、患者の体調はよくなり、活力が増した。患者の腸管は改善されて、腫脹も他の症状もなかった。患者は少々筋肉に痛みがあり、筋肉に痙攣が起きたが、それは特に晩に生じた。患者は、医療食品を1日2回2匙摂取することを続け、RIAA200mg及びビタミンD栄養補助食品の摂取を中止し、RIAA(225mg)、ビタミンD(500IU)、亜鉛(5mg)及びセレン(50mcg)の組合わせ栄養補助食品(カプレックスAI)を1日2回1錠摂取することを開始するように指示された。患者はまた、EPA−DHA(600mg+400mg)及びビタミンE(20IU)の組合わせを1日3回2軟質カプセルで摂取すること及び除外食を始めるように指示された。
【0095】
(0115)5週間後、患者は筋肉が良好になり、筋肉の凝り及び痛みは和らいだように感じた。レイノー症候群は対して変化せず、1〜10段階の評価で3の不快感を示したが、場合によっては9を示した。患者は、起床時と就寝時にマググリシネート(MagGlycinate)1錠、起床時と就寝時に乳製品非含有栄養補助食品(ビフィドビデン)1カプセル及びインドール−3−カルビノール150mg(MetaI3C)1日3回1錠をプロトコールに加えた。患者はまた、食事に食品の段階的再導入をするように指示された。
7〜9週目の結果
(0116)7週間後、プログラムを開始してから、患者の体調は改善され、関節痛が50%和らぎ、活力が50%改善したことに言及した。患者は、症状の発現が約1回/日おこりレイノーの症状に変化はないようだった。患者は、副作用なく食品の摂取に取り組み続けた。
【0096】
(0117)プログラムを開始してから9週間後、患者は、全体的に体調が良好であると報告した。患者は、トレッドミルの間も、もはや筋肉、関節の痛みはなく、腰痛もなかった。患者の活力のレベルも改善し続けた。IBS症状は解消し、GI管も非常に良好になった。レイノーは改善しなかった。
【0097】
(0118)1:320の希釈濃度でのANA評価(screen)は継続して陽性であったことを示した。度重なる25(OH)ビタミンDのレベルの不足を考慮して、2000IUビタミンD3とイソフラボンを含有する栄養補助食品(IsoD3)を毎朝1錠患者のプロトコールに加えた。患者を1ヵ月ごとに管理した。
結果(表12)
(0119)本ケースでは、炎症調節医療食品、RIAA、ビタミンD、Zn及びSe並びに食事を組合わせたプロトコールが、SLE及びGI症状に関連する病歴の患者に陽性効果をもたらすことを示す。
【0098】
【表12】

【実施例6】
【0099】
ホップ(Humulus lupulus)化合物及びその誘導体により刺激されたマウスマクロファージ及び非刺激マウスマクロファージにおけるPGE2合成阻害
(0120)概要−本実施例は、マウスマクロファージモデルにおいて、ホップの分画及び誘導体がPGE2のCOX−2合成をPGE2のCOX−1合成に優先して阻害する可能性を示す。
【0100】
(0121)化学物質及び試薬−微生物性リポポリサッカライド(LPS;B大腸菌055:B5)をSigma(St. Louis, MO)から得た。ホップ分画(1)αホップ(1%アルファ酸;AA)、(2)アロマホップOE(10%ベータ酸及び2%異性化アルファ酸、(3)イソホップ(異性化アルファ酸;IAA)、(4)ベータ酸溶液(ベータ酸BA)、(5)ヘキサホップゴールド(ヘキサヒドロ異性化アルファ酸;HHIAA)、(6)レディホップ(還元異性化アルファ酸;RIAA)、(7)テトラホップ(テトラヒドロ−イソ−アルファ酸THIAA)及び(8)消費ホップをBetatech hop Products (Washington, D.C., U.S.A.)から得た。消費ホップを等量の無水エタノールで2回抽出した。エタノールを厚い茶色の残渣が残るまで40℃で加熱して除去した。当該残渣をRAW264.7細胞で試験するためにDMSOに溶解した。他に言及しない限り、全ての試薬はSigma (St. Louis, MO)から得たが、それらは市販されているものでは純度が最も高かった。
【0101】
(0122)細胞培養−American Type Culture Collection(Catalog#TIB−71,Manassas, VA)から得たRAW264.7細胞は、ダルベッコ改良イーグル培地(DMEM、Mediatech, Herndon, VA)で生育させて対数期で維持した。DMEM成長培地を、50mLの熱不活性化FBS及び5mLのペニシリン/ストレプトマイシンを500mLボトルのDMEMに加えて作製し、4℃で保存した。当該成長培地は使用前に37℃の水槽で温めた。
【0102】
(0123)試験1日目の午前中に、96穴組織培養プレートに0.2mLの成長培地を添加した1ウェルごとに対数期のRAW264.7細胞を8×104細胞で播種した。1日の終わりに(プレーティング後6〜8時間)、各ウェルから100μLの成長培地を除去して、100μLの新しい培地と交換した。
【0103】
(0124)1.0mg/mLのLPS保存溶液をRAW264.7細胞におけるCOX−2の発現の誘導に用いて、1mLのDMSOで1.0mgのLPSを溶解した。溶解するまでボルテックスして、4℃で保存した。使用前に、室温又は37℃の水槽で溶解した。
【0104】
(0125)試験開始2日目、試験材料をDMSO中で1000Xストックとして調製した。1.7mLマイクロフュ−ジチューブに、非FBS DMEMを1mL加えて、0.05、0.10、0.5及び1.0μg/mLの試験濃度にした。試験材料の2μLの1000X DMSOストックを1mLの非FBS培地に加えた。試験材料を終末濃度で含むチューブを2倍に濃縮し、当該チューブを10分間インキュベーター内で、37℃で平衡にした。
【0105】
(0126)PGE2合成に関連するCOX−2について、培地100μLを第1日目に調製した細胞プレートの各ウェルから取り出し、100μLの平衡化させた2X終末濃度の試験化合物と取り換えた。その後、細胞を90分間インキュベートした。20μLのLPSを各ウェルの細胞に加えて終末濃度が1μgLPS/mLになるように刺激し、細胞を4時間インキュベートした。細胞をさらに5μMアラキドン酸で15分間インキュベートした。各ウェルから25μLの上清培地を取り出して、きれいなマイクロフュ−ジチューブに移して、培地に放出されたPGE2を測定した。
【0106】
(0127)LPS刺激の後、細胞の外観を観察して、実施例2に記載したように生存能力を測定した。でも試験したどの化合物も最高濃度でも毒性は観察されなかった。各ウェルから25μLの上清培地を取り出して、きれいなマイクロフュ−ジチューブに移して、培地に放出されたPGE2を測定した。PGE2を上記実施例1で記載したように測定し報告した。
【0107】
(0128)PGE2合成に関連するCOX−1について、培地100μLを第1日目に調製した細胞プレートの各ウェルから取り出し、100μLの平衡化させた2X終末濃度の試験化合物と取り換えた。その後、細胞を90分間インキュベートした。次に、LPSの代わりに、細胞を100μMアラキドン酸で15分間インキュベートした。各ウェルから25μLの上清培地を取り出して、きれいなマイクロフュ−ジチューブに移して、培地に放出されたPGE2を測定した。細胞の外観を観察して、実施例2に記載したように生存能力を測定した。試験したどの化合物も最高濃度でも毒性は観察されなかった。各ウェルから25μLの上清培地を取り出して、きれいなマイクロフュ−ジチューブに移して、培地に放出されたPGE2を測定した。PGE2を上記実施例1で記載したように測定し報告した。COX−2及びCOX−1のPGE2合成の50%阻害濃度(IC50)は実施例2に記載したように算出した。
【0108】
【表13】

【0109】
表13に示したように、本標的マクロファージモデルにおいては、全てのホップ分画及び誘導体は選択的にCOX−1よりもCOX−2を阻害した。これは、新規かつ及び予期せぬ知見であった。ホップ誘導体IAA及びRIAAに対するCOX−2の選択性の程度は各々144倍及び87倍であり、これは予期せぬ値であった。このようなCOX−2の低い50%阻害濃度と結びついた高選択性は、他の資源由来の天然産物では以前は報告がなかった。
【実施例7】
【0110】
ホップ化合物及び誘導体は直接的なシクロオキシゲナーゼ酵素阻害剤ではない
(0129)概要−本実施例は、WHMA−COX−2プロトコールを用いて試験した場合は、ホップ化合物及び誘導体は、生理学的に関連する濃度でA549肺上皮細胞においてPGE2の合成を阻害しないことを例示する。
化学物質−本実施例で用いたホップ及びホップ誘導体は、上記したとおりである。
【0111】
(0130)細胞−A549(ヒト肺上皮)細胞をAmericanTypeCultureCollection(Manassas, VA)から得て、供給者の指示に従って継代培養した。細胞を50単位のペニシリン/mL、50μgストレプトマイシン/mL、5%ピルビン酸ナトリウム及び5%L−グルタミンと10%FBSを含有するRPMI1640中で5%二酸化酸素で37℃でルーチンに培養した。実験をする日に、指数関数的に増えた細胞を集菌して、非血清RPMI1640で洗浄した。
【0112】
(0131)対数期のA549細胞を、96穴組織培養プレート中の各ウェルあたり0.2mLの成長培地に8×104細胞ずつ播種した。試験化合物によるPGE2阻害の測定には、WHMA−COX−2プロトコールとしても知られているWarnerら[(1999) Nonsteroid drug selectivities for cyclo-oxygenase-1 rather than cyclo-oxygenase-2 are associated with human gastrointestinal toxicity: a full in vitro assay. Proc Natl Acad Sci U S A 96, 7563-7568]の手順を改変せずに用いた。簡潔には、A549細胞の播種24時間後、インターロイキン−1β(10ng/mL)を加えてCOX−2の発現を誘導した。24時間後、細胞を非血清RPMI1640で洗浄し、DMSO及び非血清RPMIに溶解した試験材料をウェルに加えて、終末濃度を25、5.0、0.5及び0.05μg/mLにした。各濃度を2重に試験した。DMSOをコントロールウェルに試験ウェルに含まれる量と等量加えた。60分間後、A23187(50μM)をウェルに加えて、アラキドン酸を放出させた。30分間後に培地25μLをウェルから取り出してPGE2を測定した。
【0113】
(0132)細胞生存能力を評価した。試験したどの化合物も最高濃度のものでも毒性は観察されなかった。上清培地中のPGE2を測定し報告した。PGE2合成の50%阻害濃度(IC50)を算出した。
【0114】
(0133)結果−試験した用量では、上記実験プロトコールでは、いかなるホップ抽出物又は誘導体の50%効果濃度も獲得することができなかった。プロトコールでは、試験化合物を添加する前にCOX−2発現を刺激しなければならなかったため、試験材料がPGE2合成を阻害できなかったことに対するありうる答えとしては、それらの作用メカニズムがCOX−2アイソザイムの発現を阻害するのであり、直接的な活性ではないというものである。WHMA−COX−2プロトコールを用いると幾つかの直接阻害が観察されうるが、本手順は、ホップ化合物又はホップ化合物の誘導体の抗炎症特性を評価するには適していない。
【実施例8】
【0115】
ホップ(Humulus lupulus)化合物及び誘導体による胃粘膜細胞におけるPGE2合成阻害の欠如
(0134)概要−本実施例は、ホップ分画がPGE2阻害をしないこと及び当該化合物がAGSヒト胃粘膜細胞系において低胃腸刺激性であることを暗示することを例示する。
【0116】
(0135)AGS細胞を培養して、試験するホップ化合物及び誘導体に用いた。実施例1に記載したように、PGE2を測定し、報告した。AGS細胞でのPGE2合成の50%阻害濃度(IC50)を算出した。
【0117】
【表14】

【0118】
表14で見られるように、AGS胃粘膜細胞系では、試験した最高濃度の50%又はそれ以上の濃度では、全てのホップ分画及び誘導体は、PGE2合成を阻害できなかった。標的マクロファージにおける当該分画により示された抗炎症の可能性に基づくと、これは新規かつ予期せぬ知見であった。
【実施例9】
【0119】
イエダニアレルゲンは、A549肺細胞におけるPGE2生合成を活性化する
(0136)概要−本実施例は、家のイエダニアレルゲンが肺上皮細胞におけるPGE2生合成を誘導しうることを例示する。
【0120】
(0137)背景 アレルゲンに対する感受性は、消費者数が増加している問題である。本事項は、過去数年にわたり喘息の劇的な増加により複雑になっている。喘息患者は空中浮遊アレルゲンに特に感受性である。アレルギーの率はまた上昇している。これにより、アレルギー症状の原因及び関連する障害をどのように軽減するかという認識が高まる。人口のおよそ10%が、様々な環境源からの抗原に暴露されて過敏(アレルギー)になっている。迅速性又は遅延性の過敏症を誘導する当該抗原はアレルゲンとして知られる。アレルゲンとしては、草、木、海藻、動物性鱗屑、昆虫、食品、薬及び化学物質があげられる。個人の遺伝的素因は、花粉症、喘息及び蕁麻疹等の症状を含むアトピー及び過敏症等の急性アレルギー反応の進行に関連すると信じられている。
【0121】
(0138)多くのアレルゲンはタンパク質ベースの分子であり、当該タンパク質アレルゲンは、多くの原因に由来する。家の中の最も日常的なアレルゲン源の一つは、イエダニ由来のものであることが以前より知られてきた。もちろん、全てのアレルゲンがある場合であっても、ある人々のみがイエダニアレルゲンに対してアレルギーである。しかし、このような人々のグループが多くの領域、特に、高温多湿な領域で、極めて広いことはありうる。例えば、アメリカ合衆国の西南部は、一年の多くが高温及び多湿であり、一般住人におけるイエダニアレルギーの発生が25%程度である。イエダニはビロードのカーペット、張りぐるみの掛け布、柔らかいベッド布団等で繁殖する。
方法
(0139)イエダニアレルゲンの単離−コナヒョウヒダニ(Dermatophagoides farinae)は、アメリカのイエダニである。コナヒョウヒダニを、Purina Laboratory Chow(Ralston Purina, Co, St. Louis, MO)及びFleischmann粒状乾燥酵母(標準 Brands, Inc. New York, NY)を1:1の比率で、室温で及び湿度75%で培養した。生存しているダニを培地から移した培養陽気から吸引し、凍結して殺傷し、湿度0%で凍結乾燥した。イエダニのアレルゲン成分を周囲温度で水で抽出した。500mgのダニ粉末を15mLのコニカル遠心チューブ(VWR, Rochester, NY)中で5mLの水(1:10w/v)に加えて、1分間振って、周囲温度で一晩放置した。翌日、水層を0.2μmの使い捨てシリンジフィルターを用いて濾過した(Nalgene, Rochester, NY)。濾過物をイエダニアレルゲンとして、A549肺上皮細胞におけるPGE2生合成の誘導試験に用いた。
【0122】
(0140)細胞培養及び処置−本試験は、ヒト気管上皮細胞系A549(American Type Culture Collection, Bethesda, MD)を用いる。細胞を培養して処置した。ダニアレルゲンを培地に加えて終末濃度を1000ng/mLにした。24時間後、培地をPGE2濃度の測定のためにサンプリングした。
【0123】
(0141)PGE2検定−培地中のPGE2の測定は、実施例1で記載したように行った。
【0124】
(0142)統計学的解析−処置ごとに8検体ごとの平均値をエクセル(登録商標)表計算ソフト(Microsoft, Redmond, WA)を用いてコンピューター解析した。
結果
(0142)ダニアレルゲン処置により、A549細胞では、溶媒処置したコントロールと比較して6倍もPGE2生合成が高まった(図2)。
【実施例10】
【0125】
ホップ誘導体がA549肺細胞におけるPGE2生合成のイエダニアレルゲン活性化を阻害する
(0144)概要−本実施例は、ホップ誘導体がA549肺細胞におけるイエダニアレルゲンのPGE2刺激効果を阻害できることを例示する。
方法
(0145)細胞系及び試験手順は実施例9に記載したとおりである。イエダニアレルゲンに加えて、試験材料は、ホップ分画(1)αホップ(1%アルファ酸;AA)、(2)アロマホップOE(10%ベータ酸及び2%異性化アルファ酸)、(3)イソホップ(異性化アルファ酸;IAA)、(4)ベータ酸溶液(ベータ酸BA)、(5)ヘキサホップゴールド(ヘキサヒドロ異性化アルファ酸;HHIAA)、(6)レディホップ(還元異性化アルファ酸;RIAA)及び(7)テトラホップ(テトラヒドロ−イソ−アルファ酸THIAA)を含む。イエダニアレルゲンを添加する前に、試験材料を終末濃度10μg/mLで60分間加えた。
結果
(0146)表15は、イエダニアレルゲンで刺激されたA549肺細胞中のホップ誘導体によるPGE2の生合成阻害の程度を示す。ホップ誘導体は全てイエダニアレルゲンの刺激効果を著しく阻害することができた。
【0126】
【表15】

【0127】
(0147)結論として、それはまた、COX−2の発現を阻害し、標的細胞においてプロスタグランジン合成を選択的に阻害するか又は標的細胞において炎症反応を選択的に阻害するであろう化合物の天然製剤を同定するのに有用であろう。
【0128】
(0148)好ましい態様には、ホップ(Humulus lupulus)から単離され又は由来する少なくとも1の分画を含有する組成物を含む。ホップから単離され又は由来する少なくとも1の分画の例は、アルファ酸、イソアルファ酸、還元アルファ酸、テトラ−ヒドロイソアルファ酸、ヘキサ−ヒドロイソアルファ酸、ベータ酸及び消費ホップである。ホップから単離され又は由来する好ましい化合物としては、フムロン、コフムロン、アドフムロン、イソフムロン、イソコフムロン、イソアドフムロン、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンがあげられるがこれらに限定されない。好ましい化合物には又はロゲン、エーテル及びエステル等の置換体も生じうる。他の態様は、トリプタントリン及びその複合体を含有する組成物を含む。
【0129】
(0149)他の態様は成分の組合わせに関する。1の態様は、第1の成分としてホップ抽出物から単離又は由来する活性成分、及び、第2成分として、ローズマリー、ローズマリー由来の抽出物又は化合物、トリテルペンの種若しくは誘導体又はその複合体及びトリプタントリン又はその複合体からなる群から選択される少なくとも1のメンバーを含む組成物に関する。他の態様は、第1の成分としてトリプタントリン又はその複合体、及び、第2成分として、ホップ抽出物から単離又は由来する活性成分、ローズマリー、ローズマリー由来の抽出物又は化合物、トリテルペンの種若しくは誘導体又はその複合体からなる群から選択される少なくとも1のメンバーを含む組成物に関する。
【0130】
(0150)明白な本質の様々な変更及び改良が本発明の精神を逸脱することなくなされること及び当該全ての変更及び改良は、以下の請求項で特定される本発明の範囲内にあると考慮されることは当業者には、容易に明らかである。当該変更及び改良としては、ビタミン、ハーブ、調味剤及び担体同様の工程で製造されるカプセル、錠剤、ローション、食品又はバーに影響を与える初期成分があげられるがこれらに限定されない。他の当該変更及び改良としては、上記の好ましい態様の組合わせを含有する他のハーブ又は植物製品の使用があげられる。本願明細書に記載された態様の多くの他の改良及び変動は、当業者に明らかなように当該範囲から逸脱することなくなされる。本願明細書に記載された特定の態様は、実施例のみの目的で提供される。
【図面の簡単な説明】
【0131】
【図1】図1は、ホップから得られた分画及び化合物の概要を示す。
【図2】図2のうち、[A]は、アルファ酸属(AA)及びその代表的な種である、フムロン(R=−CH2CH(CH3)2)、コフムロン(R=−CH(CH3)2)及びアドフムロン(R=−CH(CH3)CH2CH3);[B]は、イソアルファ酸属(IAA)及びその代表的な種である、イソフムロン(R=−CH2CH(CH3)2)、イソコフムロン(R=−CH(CH3)2)及びイソアドフムロン(R=−CH(CH3)CH2CH3);[C]は、還元異性化イソアルファ酸属(RIAA)及びその代表的な種であるジヒドロ−イソフムロン(R=−CH2CH(CH3)2)、ジヒドロ−イソコフムロン(R=−CH(CH3)2)及びジヒドロ−アドフムロン(R=−CH(CH3)CH2CH3);[D]は、テトラ−ヒドロイソアルファ酸属(THIAA)及びその代表的な種である、テトラ−ヒドロ−イソフムロン(R=−CH2CH(CH3)2)、テトラ−ヒドロ−イソコフムロン((R=−CH(CH3)2)及びテトラ−ヒドロ−アドフムロン(R=−CH(CH3)CH2CH3);及び[E]は、ヘキサ−ヒドロイソアルファ酸(HHIAA)属とその代表的な種である、ヘキサ−ヒドロ−イソフムロン(R=−CH2CH(CH3)2)、ヘキサ−ヒドロ−イソコフムロン(R=−CH(CH3)2)及びヘキサ−ヒドロ−アドフムロン(R=−CH(CH3)CH2CH3)を示す。
【図3】図3は、還元アルファ酸(「RIAA」)、ビタミンD、亜鉛及びセレンの様々な組み合わせによりRAW264.7細胞を刺激したLPSにおけるPGE2分泌阻害を示すグラフである。
【特許請求の範囲】
【請求項1】
少なくとも1の還元イソアルファ酸化合物、ミネラル及びビタミンを含む組成物。
【請求項2】
還元イソアルファ酸化合物が、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される、請求項1記載の組成物。
【請求項3】
還元イソアルファ酸化合物が、以下の式:
【化1】

[式中R’は、カルボニル、ヒドロキシル、OR及びOCORからなる群より選択され、式中Rはアルキルであり;
式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択され;
そして式中R、T、X、及びZは独立して、H、F、Cl、Br、I、及びπ軌道からなる群より選択されるが、ただしR、T、X、又はZの1つがπ軌道である場合には、隣接するR、T、X、又はZもまたπ軌道であり、それにより二重結合を形成する]
を有する上属の化合物である、請求項1記載の組成物。
【請求項4】
還元イソアルファ酸化合物が以下の式:
【化2】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Aの化合物である、請求項1記載の組成物。
【請求項5】
還元イソアルファ酸化合物が以下の式:
【化3】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Bの化合物である、請求項1記載の組成物。
【請求項6】
以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化4】

[式中R’は、カルボニル、ヒドロキシル、OR及びOCORからなる群より選択され、式中Rはアルキルであり;
式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択され;
そして式中R、T、X、及びZは独立して、H、F、Cl、Br、I、及びπ軌道からなる群より選択されるが、ただしR、T、X、又はZの1つがπ軌道である場合には、隣接するR、T、X、又はZもまたπ軌道であり、それにより二重結合を形成する]
を有する上属の少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、組成物。
【請求項7】
以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化5】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Aの少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、組成物。
【請求項8】
以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化6】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Bの少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、組成物。
【請求項9】
ミネラルが、カルシウム、セレン、亜鉛、銅、鉄、クロム、マグネシウム、マンガン、バナジウム、モリブデン及びホウ素からなる群から選択される、請求項1〜6いずれか1項記載の組成物。
【請求項10】
ミネラルがセレン及び亜鉛である、請求項1〜6いずれか1項記載の組成物。
【請求項11】
ビタミンが、ビタミンA、ビタミンB、ビタミンC、ビタミンD、ビタミンE、ビタミンK、ビオチン、葉酸、パントテン酸、パラ-アミノベンゼン酸、ベタインからなる群から選択される、請求項1〜6いずれか1項記載の組成物。
【請求項12】
ビタミンがビタミンDである、請求項1〜6いずれか1項記載の組成物。
【請求項13】
組成物が約0.5〜10,000mgの還元イソアルファ酸化合物を含む、請求項1〜6いずれか1項記載の組成物。
【請求項14】
組成物が約50〜7,500mgの還元イソアルファ酸化合物を含む、請求項1〜6いずれか1項記載の組成物。
【請求項15】
組成物がさらに医薬的に許容される担体を含む、請求項1〜6いずれか1項記載の組成物。
【請求項16】
少なくとも1の還元イソアルファ酸化合物、ミネラル及びビタミンを含む組成物を治療的に有効な量を哺乳動物に投与する工程を含む、自己免疫疾患の治療方法。
【請求項17】
自己免疫疾患が、円形脱毛症、強直性脊髄炎、関節炎、抗リン脂質症候群、自己免疫アジソン病、自己免疫溶血性貧血、自己免疫内耳疾患(メニエール病としても知られる)、自己免疫リンパ球増殖症候群(ALPS)、自己免疫血小板減少性紫斑病、自己免疫溶血性貧血、自己免疫肝炎、ベーチェット病、クローン病、1型真性糖尿病、糸球体腎炎、バセドウ病、ギランバレー症候群、炎症性大腸炎、ループス腎炎、多角性硬化症、重症筋無力症、天疱瘡、悪性貧血、 多発性筋炎、初期胆汁性肝硬変、乾癬、レイノー症候群、リウマチ熱、関節リウマチ、強皮症、シェ−グレン症候群、全身性エリテマトーデス、潰瘍性大腸炎、白斑及びウェグナー肉芽腫症からなる群から選択される、請求項16記載の方法。
【請求項18】
自己免疫疾患が、クローン病、レイノー症候群、関節リウマチ及び全身性エリテマトーデスからなる群から選択される、請求項16記載の方法。
【請求項19】
還元イソアルファ酸化合物が、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される、請求項16記載の方法。
【請求項20】
還元イソアルファ酸化合物が、以下の式:
【化7】

[式中R’は、カルボニル、ヒドロキシル、OR及びOCORからなる群より選択され、式中Rはアルキルであり;
式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択され;
そして式中R、T、X、及びZは独立して、H、F、Cl、Br、I、及びπ軌道からなる群より選択されるが、ただしR、T、X、又はZの1つがπ軌道である場合には、隣接するR、T、X、又はZもまたπ軌道であり、それにより二重結合を形成する]
を有する上属の化合物である、請求項16記載の方法。
【請求項21】
還元イソアルファ酸化合物が以下の式:
【化8】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Aの化合物である、請求項16記載の方法。
【請求項22】
還元イソアルファ酸化合物が以下の式:
【化9】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Bの化合物である、請求項16記載の方法。
【請求項23】
組成物が以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化10】

[式中R’は、カルボニル、ヒドロキシル、OR及びOCORからなる群より選択され、式中Rはアルキルであり;
式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択され;
そして式中R、T、X、及びZは独立して、H、F、Cl、Br、I、及びπ軌道からなる群より選択されるが、ただしR、T、X、又はZの1つがπ軌道である場合には、隣接するR、T、X、又はZもまたπ軌道であり、それにより二重結合を形成する]
を有する上属の少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、請求項16記載の方法。
【請求項24】
組成物が以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化11】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Aの少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、請求項16記載の方法。
【請求項25】
組成物が以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化12】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Bの少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、請求項16記載の方法。
【請求項26】
ミネラルが、カルシウム、セレン、亜鉛、銅、鉄、クロム、マグネシウム、マンガン、バナジウム、モリブデン及びホウ素からなる群から選択される、請求項16記載の方法。
【請求項27】
ビタミンが、ビタミンA、ビタミンB、ビタミンC、ビタミンD、ビタミンE、ビタミンK、ビオチン、葉酸、パントテン酸、パラ-アミノベンゼン酸、ベタインからなる群から選択される、請求項16記載の方法。
【請求項28】
組成物が約0.5〜10,000mgの還元イソアルファ酸化合物を含む、請求項16記載の方法。
【請求項29】
組成物が約50〜7,500mgの還元イソアルファ酸化合物を含む、請求項16記載の方法。
【請求項30】
組成物がさらに医薬的に許容される担体を含む、請求項16記載の方法。
【請求項31】
組成物が、経口、局所的、非経口又は直腸的に投与される、請求項16記載の方法。
【請求項1】
少なくとも1の還元イソアルファ酸化合物、ミネラル及びビタミンを含む組成物。
【請求項2】
還元イソアルファ酸化合物が、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される、請求項1記載の組成物。
【請求項3】
還元イソアルファ酸化合物が、以下の式:
【化1】

[式中R’は、カルボニル、ヒドロキシル、OR及びOCORからなる群より選択され、式中Rはアルキルであり;
式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択され;
そして式中R、T、X、及びZは独立して、H、F、Cl、Br、I、及びπ軌道からなる群より選択されるが、ただしR、T、X、又はZの1つがπ軌道である場合には、隣接するR、T、X、又はZもまたπ軌道であり、それにより二重結合を形成する]
を有する上属の化合物である、請求項1記載の組成物。
【請求項4】
還元イソアルファ酸化合物が以下の式:
【化2】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Aの化合物である、請求項1記載の組成物。
【請求項5】
還元イソアルファ酸化合物が以下の式:
【化3】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Bの化合物である、請求項1記載の組成物。
【請求項6】
以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化4】

[式中R’は、カルボニル、ヒドロキシル、OR及びOCORからなる群より選択され、式中Rはアルキルであり;
式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択され;
そして式中R、T、X、及びZは独立して、H、F、Cl、Br、I、及びπ軌道からなる群より選択されるが、ただしR、T、X、又はZの1つがπ軌道である場合には、隣接するR、T、X、又はZもまたπ軌道であり、それにより二重結合を形成する]
を有する上属の少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、組成物。
【請求項7】
以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化5】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Aの少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、組成物。
【請求項8】
以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化6】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Bの少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、組成物。
【請求項9】
ミネラルが、カルシウム、セレン、亜鉛、銅、鉄、クロム、マグネシウム、マンガン、バナジウム、モリブデン及びホウ素からなる群から選択される、請求項1〜6いずれか1項記載の組成物。
【請求項10】
ミネラルがセレン及び亜鉛である、請求項1〜6いずれか1項記載の組成物。
【請求項11】
ビタミンが、ビタミンA、ビタミンB、ビタミンC、ビタミンD、ビタミンE、ビタミンK、ビオチン、葉酸、パントテン酸、パラ-アミノベンゼン酸、ベタインからなる群から選択される、請求項1〜6いずれか1項記載の組成物。
【請求項12】
ビタミンがビタミンDである、請求項1〜6いずれか1項記載の組成物。
【請求項13】
組成物が約0.5〜10,000mgの還元イソアルファ酸化合物を含む、請求項1〜6いずれか1項記載の組成物。
【請求項14】
組成物が約50〜7,500mgの還元イソアルファ酸化合物を含む、請求項1〜6いずれか1項記載の組成物。
【請求項15】
組成物がさらに医薬的に許容される担体を含む、請求項1〜6いずれか1項記載の組成物。
【請求項16】
少なくとも1の還元イソアルファ酸化合物、ミネラル及びビタミンを含む組成物を治療的に有効な量を哺乳動物に投与する工程を含む、自己免疫疾患の治療方法。
【請求項17】
自己免疫疾患が、円形脱毛症、強直性脊髄炎、関節炎、抗リン脂質症候群、自己免疫アジソン病、自己免疫溶血性貧血、自己免疫内耳疾患(メニエール病としても知られる)、自己免疫リンパ球増殖症候群(ALPS)、自己免疫血小板減少性紫斑病、自己免疫溶血性貧血、自己免疫肝炎、ベーチェット病、クローン病、1型真性糖尿病、糸球体腎炎、バセドウ病、ギランバレー症候群、炎症性大腸炎、ループス腎炎、多角性硬化症、重症筋無力症、天疱瘡、悪性貧血、 多発性筋炎、初期胆汁性肝硬変、乾癬、レイノー症候群、リウマチ熱、関節リウマチ、強皮症、シェ−グレン症候群、全身性エリテマトーデス、潰瘍性大腸炎、白斑及びウェグナー肉芽腫症からなる群から選択される、請求項16記載の方法。
【請求項18】
自己免疫疾患が、クローン病、レイノー症候群、関節リウマチ及び全身性エリテマトーデスからなる群から選択される、請求項16記載の方法。
【請求項19】
還元イソアルファ酸化合物が、ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される、請求項16記載の方法。
【請求項20】
還元イソアルファ酸化合物が、以下の式:
【化7】

[式中R’は、カルボニル、ヒドロキシル、OR及びOCORからなる群より選択され、式中Rはアルキルであり;
式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択され;
そして式中R、T、X、及びZは独立して、H、F、Cl、Br、I、及びπ軌道からなる群より選択されるが、ただしR、T、X、又はZの1つがπ軌道である場合には、隣接するR、T、X、又はZもまたπ軌道であり、それにより二重結合を形成する]
を有する上属の化合物である、請求項16記載の方法。
【請求項21】
還元イソアルファ酸化合物が以下の式:
【化8】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Aの化合物である、請求項16記載の方法。
【請求項22】
還元イソアルファ酸化合物が以下の式:
【化9】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Bの化合物である、請求項16記載の方法。
【請求項23】
組成物が以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化10】

[式中R’は、カルボニル、ヒドロキシル、OR及びOCORからなる群より選択され、式中Rはアルキルであり;
式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択され;
そして式中R、T、X、及びZは独立して、H、F、Cl、Br、I、及びπ軌道からなる群より選択されるが、ただしR、T、X、又はZの1つがπ軌道である場合には、隣接するR、T、X、又はZもまたπ軌道であり、それにより二重結合を形成する]
を有する上属の少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、請求項16記載の方法。
【請求項24】
組成物が以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化11】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Aの少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、請求項16記載の方法。
【請求項25】
組成物が以下の:
(a)ジヒドロ−イソフムロン、ジヒドロ−イソコフムロン、ジヒドロ−アドフムロン、テトラヒドロ−イソフムロン、テトラヒドロ−イソコフムロン、テトラヒドロ−アドフムロン、ヘキサヒドロ−イソフムロン、ヘキサヒドロ−イソコフムロン及びヘキサヒドロ−アドフムロンからなる群から選択される少なくとも1の化合物;
(b)以下の式:
【化12】

[式中R’は、カルボニル、ヒドロキシル、又は、及びOCORからなる群より選択され、式中Rはアルキルであり;
そして式中R”は、CH(CH3)2、CH2CH(CH3)2、及びCH(CH3)CH2CH3からなる群より選択される]
を有する属Bの少なくとも1の化合物;
(c)ビタミン;及び
(d)ミネラル
を含む、請求項16記載の方法。
【請求項26】
ミネラルが、カルシウム、セレン、亜鉛、銅、鉄、クロム、マグネシウム、マンガン、バナジウム、モリブデン及びホウ素からなる群から選択される、請求項16記載の方法。
【請求項27】
ビタミンが、ビタミンA、ビタミンB、ビタミンC、ビタミンD、ビタミンE、ビタミンK、ビオチン、葉酸、パントテン酸、パラ-アミノベンゼン酸、ベタインからなる群から選択される、請求項16記載の方法。
【請求項28】
組成物が約0.5〜10,000mgの還元イソアルファ酸化合物を含む、請求項16記載の方法。
【請求項29】
組成物が約50〜7,500mgの還元イソアルファ酸化合物を含む、請求項16記載の方法。
【請求項30】
組成物がさらに医薬的に許容される担体を含む、請求項16記載の方法。
【請求項31】
組成物が、経口、局所的、非経口又は直腸的に投与される、請求項16記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2009−525952(P2009−525952A)
【公表日】平成21年7月16日(2009.7.16)
【国際特許分類】
【出願番号】特願2008−549542(P2008−549542)
【出願日】平成19年1月4日(2007.1.4)
【国際出願番号】PCT/US2007/000082
【国際公開番号】WO2007/081710
【国際公開日】平成19年7月19日(2007.7.19)
【出願人】(503465937)メタプロテオミクス, エルエルシー (19)
【Fターム(参考)】
【公表日】平成21年7月16日(2009.7.16)
【国際特許分類】
【出願日】平成19年1月4日(2007.1.4)
【国際出願番号】PCT/US2007/000082
【国際公開番号】WO2007/081710
【国際公開日】平成19年7月19日(2007.7.19)
【出願人】(503465937)メタプロテオミクス, エルエルシー (19)
【Fターム(参考)】
[ Back to top ]

