致死性の予測および重大な疾患の検出
【課題】ST2および/またはIL-33の循環血中レベルを、単独で、または他のバイオマーカーと組み合わせて測定することによって、致死性(mortality)を予測するため、および重大な疾患の存在を検出するための方法を提供する。
【解決手段】対象からの試料におけるST2、IL-33またはその両方のバイオマーカーレベルを決定する段階;および、試料におけるバイオマーカーレベルを参照標準(reference)バイオマーカーレベルと比較する段階を含む、対象に関して、特定された期間内での死亡のリスクを評価するための方法であって、参照標準バイオマーカーレベルと比較した、試料におけるバイオマーカーレベルにより、特定された期間内での対象の死亡のリスクが示される。
【解決手段】対象からの試料におけるST2、IL-33またはその両方のバイオマーカーレベルを決定する段階;および、試料におけるバイオマーカーレベルを参照標準(reference)バイオマーカーレベルと比較する段階を含む、対象に関して、特定された期間内での死亡のリスクを評価するための方法であって、参照標準バイオマーカーレベルと比較した、試料におけるバイオマーカーレベルにより、特定された期間内での対象の死亡のリスクが示される。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は、ST2および/またはIL-33の循環血中レベルを、単独で、または他のバイオマーカーと組み合わせて測定することによって、致死性(mortality)を予測するため、および重大な疾患の存在を検出するための方法に関する。
【背景技術】
【0002】
背景
対象、特に胸痛または不快感、息切れ、悪心、嘔吐、曖気、発汗、心悸亢進、頭のふらつき、倦怠感または失神といった非特異的な症状を有する者の臨床的評価は、対象の病状の原因および重症度が常に明らかとは限らないため、大きな難題となっている。対象を積極的に治療するかそれとも保存的に治療するか、または対象を入院患者として受け入れるかそれとも自宅に帰すかに関する決断は、時に、個人の実際の病状に関する医師の臨床的判断または「直感」のみに基づいて行われる。有害な転帰、例えば致死性、および/または重大な疾患の存在に関する対象の尤度を示すバイオマーカーは、医師が、十分に情報を得た上で治療上の決断を下す能力を大きく高めると考えられる。
【発明の概要】
【0003】
概要
本発明は、少なくとも一部には、バイオマーカーST2(増殖刺激発現遺伝子2(Growth Stimulation-Expressed Gene 2)、これはインターロイキン1受容体様物質1(Interleukin 1 Receptor Like 1)(IL1RL-1)としても知られる)の血清レベルを、症状の基礎をなす原因または最終的診断にかかわらず、臨床転帰、例えば30日、3もしくは6カ月、または1年またはそれ以上といった特定の期間内での死亡を予測するため、または重大な疾患の存在を検出するために用いうるという発見に基づく。また、ST2のレベルの経時的な、例えば数日またはそれ以上の期間での変化を、例えば、急性イベント後に入院した患者における臨床転帰を予測するために用いることもできる。
【0004】
本明細書に記載した方法は、患者、例えば、非特異的な症状を有する患者、例えば急性呼吸困難の患者および胸痛を有する者の診断的および予後的評価を得るために、ST2レベルを測定する段階、およびST2レベルの経時的な変化(例えば、比)をモニターする段階を含む。
【0005】
IL-33は、ST2に対するリガンドとして同定されている。したがって、本発明は、ST2および/またはIL-33レベル、さらにはST2/IL-33複合体といったバイオマーカーレベル、ならびにST2:IL-33複合体と遊離ST2および/またはIL-33との比をモニターすることによって、患者を評価するための方法を含む。
【0006】
加えて、本方法は、臓器機能、ならびに/または、例えばトロポニン(Tn、例えば、TnIまたはTnT)、脳性ナトリウム利尿ペプチド(BNP)、プロBNP、NT-プロBNP、心房性ナトリウム利尿ペプチド(ANP)、NT-プロANP、プロANP、C反応性ペプチド(CRP)、血中尿素窒素(BUN)、Dダイマー(架橋フィブリンの分解産物であり、そのレベルは血塊形成後に上昇する)、アルブミン、肝機能酵素、腎機能の指標(例えば、クレアチニン、クレアチニンクリアランス値または糸球体濾過値)および/もしくは細菌エンドトキシンといった補助的バイオマーカーのレベルを評価する段階を含む、さらなる診断方法も含みうる。いくつかの態様において、本方法は、BUN、NT-プロBNPまたはBNP、および/またはTnIに加えて、ST2および/または経時的なST2レベルの変化を測定する段階を含む。
【0007】
したがって、1つの局面において、本発明は、対象に関して、30、60、90もしくは180日(例えば、1、2、3もしくは6カ月)または1、2もしくは5年といった特定の期間内での、死亡または再入院のリスクを評価するための方法を特徴とする。本方法は、血液、血清、血漿、尿または体組織といった試料を対象から入手する段階;試料におけるST2および/またはIL-33のバイオマーカーレベルを決定する段階;ならびに試料におけるST2および/またはIL-33のバイオマーカーレベルをST2および/またはIL-33の参照標準(reference)レベルと比較する段階を含む。試料におけるST2および/またはIL-33のバイオマーカーレベルと参照標準との比較により、対象の、特定の期間内での死亡または再入院のリスクが示される。いくつかの態様において、特定の期間は1年である。
【0008】
いくつかの態様において、参照標準レベルは、1年以内での死亡のリスクが低い対象におけるレベルに相当する。例えば、実施例1に記載したように、例えば、ST2のバイオマーカーレベルが固相酵素免疫アッセイ(ELISA)などのイムノアッセイを用いて測定されるいくつかの態様において、ST2の参照標準レベルは約0.2〜0.3ng/ml血清であり、例えば、レベルは0.20、0.23、0.25、0.27または0.29ng/ml血清であってよく、試料におけるレベルが参照標準レベルよりも高いかそれと等しいことにより、対象の、1年以内の死亡のリスクが高いこと、すなわち統計学的に有意に高いことが示される。実施例1に記載したELISA以外の分析手法を用いるならば、参照標準ST2レベルは本明細書に記載したものとは異なる可能性がある;本明細書に挙げた具体的な数値は、他の分析手法を用いて生み出される対応する数値と等価であるとみなされるべきである。いくつかの態様において、死亡のリスクの高さは少なくともより20%高く、例えば、より30%、40%または50%高い。
【0009】
もう1つの局面において、本発明は、対象における、1つまたは複数の疾患の重症度、例えば、疾患の現在の重症度を決定するための方法を特徴とする。本方法は、対象から試料を入手する段階;試料におけるST2および/またはIL-33のバイオマーカーレベルを決定する段階;ならびに試料におけるST2および/またはIL-33のバイオマーカーレベルをST2および/またはIL-33の参照標準レベルと比較する段階を含む。参照標準と比較した、試料におけるST2および/またはIL-33のバイオマーカーレベルにより、対象が有する1つまたは複数の疾患が重大であるか否か、例えば、命にかかわるか否かが示される。
【0010】
さらなる局面において、本発明は、例えば、対象が改善したか否か、例えば、病院から退院できる程度に十分に改善したか否かを判断するために、対象の病状をモニターするための方法を含む。本方法は、対象におけるST2および/またはIL-33の第1のバイオマーカーレベル、例えばベースラインレベルを決定する段階;ならびに対象におけるST2および/またはIL-33の少なくとも1つの以後のバイオマーカーレベル、例えば、治療下レベル(treatment level)を決定する段階を含む。続いて、第1のレベルと以後のレベルを比較する。第1のレベルから以後のレベルまでに、ST2および/またはIL-33のバイオマーカーレベルが十分に低下しているならば、例えば、統計学的に有意に、または少なくとも5%、10%、15%、20%もしくはそれ以上低下しているならば、対象の病状は改善しつつある可能性が高く、一方または両方のレベルが十分に低いならば、例えば、選択した閾値よりも下であるならば、対象を、例えば外来治療のために、退院させることができる。
【0011】
いくつかの態様において、本方法は、対象のリスクを指し示すST2のレベルを決定する段階、および任意で、第1のST2レベル、例えばベースラインレベルと、第2のST2レベル、例えばある程度の時間の後に、例えば1、2、3、4日後またはそれよりも後に取得したレベルとの比に基づいて、対象に対する治療を選択または修正する段階を含む。例えば、もしST2の第2のレベルが第1のレベルの選択したパーセンテージを上回るならば、対象は高いリスクを有しており、より積極的に治療されるべきである;もし対象がすでに治療を受けているならば、対象は現在の治療に対して順調には反応しておらず、新たな治療、すなわち患者がより順調に反応する可能性のある代替的な治療を選択すべきである。1つの例として、もし第2のレベルが第1のレベルの約85%またはそれ以上である(すなわち、約15%またはそれ未満の低下がある)ならば、対象は改善しておらず、依然として死亡のリスクが高い。
【0012】
いくつかの態様においては、例えば、本明細書に記載したようにELISAを用いて測定する場合に、対象におけるST2のレベルを、重大な疾患を有しない対象、例えば、疾患を有しないか急性の重大な疾患を有しない対象に相当する参照標準レベルと比較する。ST2の参照標準レベルは約0.2〜0.3ng/mlであってよく、例えば、レベルは約0.20、0.23、0.25、0.27もしくは0.29ng/ml血清または血漿(上述した通り、本明細書に挙げた閾値は、本明細書に記載したようなELISA法を用いる場合に当てはまる;異なる方法を用いて決定された場合には、他の閾値の数値をこれらの数値と等価であるとみなすことができる)。参照標準レベルよりも高いかそれと等しい、試料におけるレベルは、対象が1つまたは複数の重大な疾患、例えば、現在の疾患を有することを示す。
【0013】
いくつかの態様において、参照標準レベルは、ある特定の予後を有する対象に相当する。例えば、ST2のレベルを、例えば実施例1に記載したようにELISAを用いて測定する場合には、参照標準レベルを以下のように利用して予後を判定することができる:約0.2または0.23ng/ml未満のST2は、対象の予後が良好であること、例えば回復する可能性が高いことを示す;約0.2または0.23ng/ml〜0.7ng/ml(またはその等価物)であるST2は、対象の予後が不良であること、例えば、回復する可能性がより低いことを示す。さらに、0.7ng/mlを上回るST2は、予後が極めて不良であること、例えば、対象が回復する可能性が低いことを示す。この態様において、不良な予後とは、患者に、おそらく入院を要する、1年以内の死亡またはより重大な疾患の発症のリスクがあることを示すと考えられる。極めて不良な予後とは、患者に、おそらく入院を要する、90日以内の死亡またはより重大な疾患の発症のリスクがあることを示す。1件の研究では、ST2レベルが0.7ng/mlを上回る患者では死亡率が30%を超えた。
【0014】
いくつかの態様において、対象は、例えば、胸痛または不快感、息切れ(呼吸困難)、悪心、嘔吐、曖気、発汗、心悸亢進、頭のふらつき、倦怠感および失神といった、1つまたは複数の非特異的な症状を呈する。いくつかの態様において、症状は呼吸困難または胸痛である。
【0015】
いくつかの態様において、対象は心血管疾患を有しない。さまざまな態様において、対象は、肺疾患、例えば、急性感染症(例えば、肺炎)、慢性閉塞性肺疾患(COPD)および肺塞栓を有する。
【0016】
ある態様において、対象は肝疾患、例えば、標準的な肝機能臨床検査によって判定されるような、化学療法、アルコール毒性または薬物毒性に伴う肝疾患を有する。
【0017】
いくつかの態様において、本方法はさらに、試料における、例えばトロポニン、NT-プロBNP、BNP、プロBNP、NT-プロANP、プロANP、ANP、CRP、Dダイマー、BUN、アルブミン、肝機能酵素、腎機能の指標、例えばクレアチニン、クレアチニンクリアランス値もしくは糸球体濾過値、および/または細菌エンドトキシンといった補助的(非ST2性、非IL-33性)バイオマーカーのレベルを決定する段階;ならびに試料における補助的バイオマーカーのレベルを補助的バイオマーカーの参照標準レベルと比較する段階を含む。参照標準と比較した試料における補助的バイオマーカーのレベルと、ST2参照標準レベルと比較した試料におけるST2のレベルとの組み合わせにより、対象が、特定の期間内での死亡のリスクが高いこと、および/または現在の重大な疾患を有することが示される。いくつかの態様において、本方法は、第1のレベル、例えばベースラインレベルを、第2のレベル、例えばある程度の時間の後に、例えば1、2、3、4日後またはそれよりも後に取得したレベルと比較することによって、補助的バイオマーカーに関する経時的なレベルの変化(例えば、比)を決定する段階を含む。ST2の比が算出される態様において、補助的バイオマーカーの比を、例えば、ST2の比と同じ期間に基づいて算出することもできる。
【0018】
いくつかの態様において、対象はBMI 25〜29である、BMI 30以上である、または腎機能不全を有し、例えば、対象は、BMI 25〜29である、BMI 30以上である、または腎機能不全を有することに基づいて選択される。
【0019】
いくつかの態様において、本方法は、試料におけるST2のレベルおよびIL-33のレベルを決定する段階;試料におけるST2:IL-33の比を決定する段階;ならびにST2:IL-33の比を参照標準比と比較する段階を含む。参照標準比と比較した、試料におけるST2:IL-33の比により、対象が、特定の期間内での死亡のリスクが高いか否か、および/または現在の重大な疾患を有するか否かが示される。
【0020】
もう1つの局面において、本発明は、例えば、1つまたは複数の非特異的な症状を呈する対象に関して、30、60、90もしくは180日(6カ月)、または1、2もしくは5年といった特定の期間内での死亡のリスクを評価するための方法を提供する。本方法は、試料を対象から入手する段階;試料におけるST2および/またはIL-33のバイオマーカーレベル、ならびに任意で、試料におけるNT-プロBNP、プロBNPまたはBNPのレベルを決定する段階;ならびに試料におけるST2および/またはIL-33のレベルならびに試料におけるNT-プロBNPのレベル(決定されていれば)を、対応する参照標準レベルと比較する段階を含む。各々の参照標準レベルと比較した、試料におけるST2および/またはIL-33のレベル、ならびに試料におけるNT-プロBNP、プロBNPまたはBNPのレベルにより、特定の期間内での対象の死亡のリスクが示される。
【0021】
いくつかの態様において、本方法は、試料における(i)NT-プロBNP、プロBNPまたはBNP、および(ii)ST2のレベルを決定する段階を含む。いくつかの態様において、対象の1年以内の死亡のリスクは以下の通りである。

【0022】
ある態様において、対象の死亡または病院再入院のリスクが非常に高いならば、対象は積極的に治療される。
【0023】
さらなる局面において、本発明は、例えば、対象が改善したか否か、例えば、病院から退院できる程度に十分に改善したか否かを判断するために、対象の病状をモニターするための方法を含む。本方法は、対象における(i)ST2でないバイオマーカー、例えば、NT-プロBNP、プロBNPまたはBNP、ならびに(ii)ST2および/またはIL-33の第1のレベル、例えばベースラインレベルを決定する段階;ならびに対象における(i)ST2でないバイオマーカー、例えば、NT-プロBNP、プロBNPまたはBNP、ならびに(ii)ST2および/またはIL-33の少なくとも1つの以後のレベル、例えば治療下レベルを決定する段階を含む。続いて、第1のレベルと以後のレベルを比較する。、第1のレベルから以後のレベルまでに、ST2および/またはIL-33のレベルが低下しているならば、対象は改善しつつある可能性が高く、レベルが十分に低いならば、対象は改善している、例えば、対象は、例えば外来治療のために十分に退院させられる程度に改善している。いくつかの態様において、本方法は、対象における(i)ST2でないバイオマーカー、例えば、NT-プロBNP、プロBNPまたはBNP、ならびに(ii)ST2および/またはIL-33の少なくとも第1、第2および第3のレベルを決定する段階、ならびにレベルを比較する段階を含む。レベルの間に差があることにより、対象が十分に退院させられる程度に改善しているか否かが示される。したがって、例えば、退院させるか入院させたままで治療を継続するかに関する決断を、以下の通りに行うことができる。

【0024】
いくつかの態様において、ST2に関する閾値は0.2ng/mlであり、BNPに関する閾値は986pg/mlである。
【0025】
同様に、本明細書において提供されるのは、ST2と特異的に結合する1つもしくは複数の抗体、ならびに/またはIL-33と特異的に結合する1つもしくは複数の抗体、ならびに本明細書に記載した方法の1つまたは複数を実施するための説明書を含むキットである。
【0026】
1つのさらなる局面において、本発明は、対象の病状を評価するための方法を含む。本方法は、対象から試料を入手する段階;試料におけるST2および/またはIL-33のバイオマーカーレベルを決定する段階、ならびに以下の他のバイオマーカーのうち1つまたは複数、例えばすべての存在またはレベルを決定する段階:
(i)NT-プロBNP、プロBNPまたはBNP;
(ii)NT-プロANP、プロANPまたはANP;
(iii)心筋トロポニン(cTn)、例えば、cTnI;
(iv)Dダイマー;
(v)C反応性タンパク質(CRP);
(vi)クレアチニン、クレアチニンクリアランス値または糸球体濾過値;
(vii)血中尿素窒素(BUN);
(viii)細菌エンドトキシン;
(ix)1つまたは複数の肝機能酵素;ならびに、試料におけるST2および/またはIL-33のレベルならびに試料における1つまたは複数の他のバイオマーカーのレベルを、対応する参照標準レベルと比較する段階を含む。参照標準レベルと比較した、試料におけるST2および/またはIL-33のレベルならびに試料における他のバイオマーカーのレベルにより、対象の病状の重症度が示される。
【0027】
いくつかの態様において、本明細書に記載した方法は、ST2および/またはIL-33のレベルまたは比を、BNPもしくはNT-プロBNPと組み合わせて;トロポニン、例えば、TnIもしくはTnTと組み合わせて;または腎機能の指標、例えば、クレアチニン、クレアチニンクリアランス値もしくは糸球体濾過値と組み合わせて、測定する段階を含む。
【0028】
もう1つの局面において、本発明は、対象における治療の有効性を評価するための方法を含む。本方法は、対象における循環血中ST2および/またはIL-33の第1の(例えば、ベースライン)レベルを決定する段階;対象における循環血中ST2および/またはIL-33の第1のレベルを所定の参照標準レベルと比較する段階;第1のST2のレベルが所定の参照標準レベルを上回るならばその対象を選択する段階;対象に治療を施す段階;対象における循環血中ST2および/またはIL-33の第2のレベルを決定する段階;ならびに循環血中ST2および/またはIL-33の第1および第2のレベルを比較する段階を含む。循環血中ST2および/またはIL-33の第1および第2のレベル間に差があることは、対象における治療の有効性を示す。例えば、循環血中ST2および/またはIL-33の第2のレベルが第1のレベルよりも低いことは、治療が有効であることを示す。
【0029】
本明細書で用いる場合、「試料」には、任意の体液または組織、例えば、血液、血清、血漿、尿および体組織のうち1つまたは複数が含まれる。ある態様において、試料は血清、血漿または血液試料である。
【0030】
抗原と「特異的に結合する」抗体は、他のタンパク質を含む試料中の抗原と選好的に結合する。
【0031】
本明細書に記載した方法およびキットには多くの利点がある。例えば、本方法は、確定診断が下されているか否かにかかわらず、患者をさらなる判定のために入院させるべきか、またはそのまま入院患者としておくべきかを決定するために用いることができる。例えば、本方法は、例えば、対象に対して適切な治療の積極性のレベルに関する決断を、そのST2レベルに基づいて下すための、所与の対象のリスク層別化のために用いることができる。より優れた治療上の決断は、有病率および死亡率の低下、ならびに乏しい医療資源のより優れた割り振りを導くことができる。本明細書に記載した方法は、具体的な診断を下すために患者をさらに検査すべきか否かに関する一般的な判定を行うために用いることができる。本明細書に記載した方法はまた、例えば、臨床的成績、または治療的介入に対して予想される反応に関する情報を得るための、患者集団のリスク層別化のために用いることもできる。本明細書に記載した方法は、基礎をなす原因または最終的な診断にかかわらず用いることができ、そのため特定の適応症には限定されない。
【0032】
別に定義する場合を除き、本明細書で用いるすべての技術用語および科学用語は、本発明が属する当業者が一般に理解しているものと同じ意味を持つ。方法および材料が本発明における使用のために記載されている;当技術分野で公知の他の適した方法を用いることもできる。材料、方法および実施例は例証的なものに過ぎず、限定を意図したものではない。本明細書で言及したすべての刊行物、特許出願、特許、配列、データベース項目および他の参考文献は、その全体が参照により本明細書に組み入れられる。対立が生じた場合には、定義を含め、本明細書が支配的であるものとする。
【0033】
本発明の他の特徴および利点は、以下の詳細な説明および図面、ならびに特許請求の範囲から明らかであると考えられる。
【図面の簡単な説明】
【0034】
【図1】ST2および1年以内の死亡に関する受診者動作特性分析を図示したグラフである。曲線下面積(AUC)の大きさによって示されるように、ST2はこの目的に有用であった。
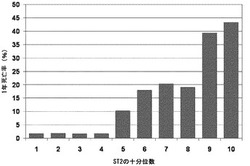
【図2】救急部における呼吸困難に関するプロBNPの調査(ProBNP Investigation of Dyspnea in the Emergency Department)(PRIDE)試験のコホートにおける、ST2の十分位数毎の粗死亡率を図示した棒グラフである。この特定のアッセイに関してST2濃度0.23ng/mlに対応する、第5十分位で明らかな閾値効果が認められる。
【図3】図3Aおよび3Bは、ST2濃度の関数として層別化した、呼吸困難を有する患者における、受診時から1年間の追跡時までの死亡率を表した一対のKaplan-Meierハザード曲線である。ST2濃度が0.20ng/ml以上である呼吸困難患者では、受診日から数日以内に高い死亡率が認められ、これは受診後1年まで続いて認められた。死亡率は、急性心不全を有する者(3A)および有しない者(3B)とも同程度であった(いずれもログランクp値<0.001)。
【図4】NT-プロBNPおよびST-2に関するマーカー濃度の関数として死亡率を図示した棒グラフである。
【図5】ST2の変化(薄いグレーの線)およびBNPの変化(濃色の線)に関して、特異度と感度とを対比した受診者動作特性曲線(ROC)である。
【図6】棒グラフと折れ線グラフを組み合わせたものである。バーは、BUNおよびST2の比が表記レベルであった集団における死亡率を図示している。線は各カテゴリーの患者数を示している。
【図7A】入院中の各日における、生存者(薄いグレーの四角形)および非生存者(濃色の菱形)に関する平均ST2値の折れ線グラフである。
【図7B】ST2レベルの第25および第75パーセンタイルを枠で囲み、時間(入院6日間にわたる)に対してプロットした、ホイスカーボックスプロット(whisker box plot)である;S=生存者、D=死亡者。
【図7C】BNP濃度の第25および第75パーセンタイルを枠で囲み、時間(入院6日間にわたる)に対してプロットした、ホイスカーボックスプロット(whisker box plot)である;S=生存者、D=死亡者。
【図7D】NT-プロBNPの第25および第75パーセンタイルを枠で囲み、時間(入院6日間にわたる)に対してプロットした、ホイスカーボックスプロット(whisker box plot)である;S=生存者、D=死亡者。
【図8】入院中の各日における、ベースライン(入院前後)と比較した、生存者(薄いグレーの四角形)および非生存者(濃色の菱形)に関するST2値の比の折れ線グラフである。
【図9】肺に関する診断が下されたPRIDE被験者における1年までの死亡を予測する、ST2の能力に関するROCである。ROC下面積=0.73;95%CI=0.62-0.83;P<0.0001;至適カット点:0.20ng/ml;感度88%、特異度52%;PPV=22%;NPV=96%。
【図10】肺に関する診断が下されたPRIDE被験者におけるST2濃度と1年以内の死亡のリスクとの相関を図示したボックスグラフである。
【図11】肺に関する診断が下されたPRIDE被験者におけるST2濃度の関数としての死亡率を図示した折れ線グラフである。P<0.001。
【図12】図12A〜Bは、中等症ないし重症の腎機能不全を有する対象133例の集団における平均糸球体濾過値(GFR、12A)およびST2レベル(12B)を図示したボックスグラフである。
【図13】実施例8に記載した集団におけるST2レベルの分布を図示した棒グラフである。
【発明を実施するための形態】
【0035】
詳細な説明
患者、特に呼吸困難または胸痛などの非特異的な症状を有する患者の臨床的評価は、往々にして難題である。本明細書に記載した結果は、ST2が患者の予後評価において、それらの疾患の基礎をなす原因にかかわらず有用であるという証拠を提供する。本明細書において、全く異なる症状を有するいくつかの全く異なる集団で実証されているように、ST2は重大な疾患および差し迫った死亡に関する強い指標である(実施例1〜6参照)。
【0036】
致死性の予測
ST2濃度の高値は、1年以内の死亡に関する明らかな予後指標となり、基礎をなす診断にかかわらず、受診直後にST2が高値である者については生存曲線において著しい相違がみられる。1つの例として、ST2の高値と、呼吸困難による受診後1年以内の致死性に関するリスクとの間には著しい関連性がある。ST2と呼吸困難患者における死亡との関連性は、診断にも、炎症、筋壊死、腎機能障害に関する他のマーカー、とりわけ、この集団における死亡を予測するために有意義として最近記載されたマーカーであるNT-プロBNPを含む、この状況において致死性に関して疑われる他のすべてのバイオマーカー予測変数にも依存しなかった(Januzzi et al., Arch. Intern. Med. 2006;166(3):315-20)。実際に、この研究における死亡の大半は、受診時にST2レベルが高値であった対象に集中していた;しかし、ST2およびNT-プロBNPの高値の組み合わせでは、1年以内の死亡率が最も高かった。
【0037】
リスク層別化のためのこのような多マーカーアプローチは、急性冠症候群の患者に対して提唱されている(Sabatine et al., Circulation 2002;105(15):1760-3)が、未鑑別の呼吸困難または一般的な愁訴である胸痛といった非特異的な症状を有する患者の評価に関しては、そのような戦略はまだ提唱されていない。
【0038】
疾患の重症度の判定
ST2濃度の高値は、疾患の基礎をなす原因にかかわらず、対象における重大な疾患の存在と相関づけられている。1つの例として、胸痛を呈する患者の集団において、最も高レベルの疾患は、慢性閉塞性肺疾患(COPD)、リンパ腫、敗血症、アルコール乱用および肺塞栓を含む重大な疾患と関連していた(実施例5参照)。
【0039】
したがって、診断されていない対象に対して、本明細書に記載した方法を、どの程度積極的に診断を求めるべきかを決定するために用いることができる;高いST2レベルは、重大な疾患の存在を示すとともに、対象を高リスク症例として治療すべきであることを示唆する。診断が判明している対象に対して、本明細書に記載した方法は、基礎をなす病態の重症度を決定するのを補助するために用いることができる;この場合も、ST2レベルが高いほど、より重大な疾患と関連している。
【0040】
一般的方法
一般に、本明細書に記載した方法は、対象、例えば哺乳動物、例えばヒトにおける、ST2および/またはIL-33の循環血中レベル(例えば、血液、血清、血漿、尿または体組織におけるレベル)を評価する段階を含む。これらのレベルは、対象が、有害な転帰、例えば、30日、60日、90日、6カ月、1年、2年、3年または5年といった特定の期間内での死亡を経験する尤度に関する情報を与える。これらのレベルはまた、対象における疾患の重症度に関する情報も与える。いくつかの態様において、ST2および/またはIL-33のレベルは、例えば受診時に1回決定される。いくつかの態様において、ST2および/またはIL-33のレベルは、症状の発現から2、4、6、8、12、18および/もしくは24時間後、ならびに/または1〜7日後に決定される。複数のレベルを決定する場合には、対象におけるST2のレベルが上昇したか低下したか、およびそれがどの程度であるかを数量化する、ST2の比を算出することができる。
【0041】
いくつかの態様において、ST2および/またはIL-33のレベルは複数回決定される;その場合には、より高い測定値、または最も最近の測定値を用いることができる。ST2および/またはIL-33のレベルを複数回決定する態様においては、最も高いレベルを用いることもでき、またはレベル間の差(すなわち、差の大きさおよび方向)を決定して用いることもできる。したがって、ST2レベルの経時的な、例えば、数日、例えば3日もしくはそれ以上の過程にわたる、または数週間もしくは数カ月の過程にわたる変化(例えば、大きさおよび方向、例えば、上昇または低下)を表す、ST2の比を決定することができる;この比は対象のリスクのレベルおよび重大な疾患の存在の指標となる。また、治療に対する対象の反応を評価するために、ST2および/またはIL-33のレベルを複数回決定することもできる。例えば、治療の投与後、例えば治療の1つまたは複数の投薬またはサイクルの後に取得したST2および/またはIL-33のバイオマーカーレベルを、治療を開始する前のST2および/またはIL-33のレベルと比較することができる。ST2レベル間の差により、治療が有効であったことが示されると考えられる;例えば、ST2レベルの低下は治療が有効であったことを示すと考えられる。また、ST2レベル間の差を、例えば、対象が改善しつつあるか否か、例えば、病院から退院できる、より積極的でない治療を行える、またはより長い時間間隔で経過観察できるといった程度に十分に改善しつつあるか否かを判定するために、対象の病状をモニターするために用いることもできる。
【0042】
対象におけるST2および/またはIL-33の循環血中レベルを評価することは、典型的には、生物試料、例えば、血清、血漿または血液を対象から入手する段階を含む。試料におけるST2および/またはIL-33のレベルは、試料におけるポリペプチドのレベルを、固相酵素免疫アッセイ(ELISA)などのイムノアッセイといった、当技術分野で公知のおよび/または本明細書に記載した方法を用いて測定することによって決定することができる。または、ST2および/またはIL-33のmRNAのレベルを、同じく、例えば定量的PCRまたはノーザンブロット分析といった、当技術分野で公知のおよび/または本明細書に記載した方法を用いて測定することもできる。
【0043】
ひとたびST2および/またはIL-33のレベルまたは比が決定されれば、そのレベルまたは比を参照標準レベルまたは参照標準比と比較することができる。例えば、ST2のレベルを、例えば実施例1に記載したようにELISAを用いて測定する、いくつかの態様において、参照標準レベルは、それを上回れば対象は死亡のリスクが高い、および/または重大な疾患を有するという閾値レベルに相当する。選択される参照標準レベルは、ST2のレベルを測定するために用いる方法に依存すると考えられる。例えば、本明細書に記載したように、可溶性ST2の循環血中レベルをイムノアッセイを用いて決定するいくつかの態様において、参照標準レベルは約0.20、0.23または0.29ng/ml血清であり、その参照標準レベルを上回るST2のレベルは、対象は死亡のリスクが高い、および/または重大な疾患を有することを示す。
【0044】
例えば、ST2の第1および第2の測定値を用いて、比を決定する場合には、参照標準比は、対象が死亡のリスクが高いか否かおよび/または重大な疾患を有するか否かを示す、変化の量および方向に相当すると考えられる。1つの例として、第1の測定値、例えば、対象が治療のために例えばEDを訪れた時点に取得したベースライン測定値、および第2の測定値、例えば3日〜4日後に取得した測定値に基づいて、ST2比を算出することができる。経時的な第1および第2のST2レベルの比が約0.85またはそれ以上であるならば、すなわち、ST2レベルの低下が約15%未満である(または同じままである、もしくは上昇した)ならば、対象は差し迫った死亡のリスクが極めて高い。約0.85未満である比(ST2レベルが約15%を超えて低下)は、対象の差し迫った死亡のリスクはより低いことを示す。
【0045】
この情報は、医師が、より正確な治療上の決断を下すことを可能にする;例えば、決定の結果から、対象が参照標準レベルと等しいかそれを上回る、例えば、約0.20ng/ml、0.23ng/mlもしくは0.29ng/ml血清を上回るレベル、または参照標準比を上回る比を有することが示された場合には、対象を、入院患者として病院に、例えば急性期治療部門または集中治療部門に入院させることが考えられる。いくつかの態様において、ST2と参照標準レベルまたは参照標準比との比較は対象の予後を判定するために用いることができる。例えば、本明細書において実施例1に記載したように、ST2のレベルをELISAを用いて測定する場合には、参照標準レベルを以下のように利用して予後を判定することができる:約0.20ng/mlまたは0.23ng/ml未満のST2は、対象の予後が良好であること、例えば回復する可能性が高いことを示す;約0.20ng/mlまたは0.23ng/ml〜約0.7ng/mlであるST2は、対象の予後が不良であること、例えば、回復する可能性がより低いことを示す。さらに、約0.7ng/mlを上回るST2は、予後が極めて不良であること、例えば、対象が回復する可能性が低いことを示す。もう1つの例として、経時的な第1および第2のST2レベルの比が約0.85を上回れば予後が不良なことを示し、比が約0.85またはそれ未満であれば予後が良好であることを示す。
【0046】
対象の実際の病状を判定するために追加的な検査を行ってもよい。追加的な検査の前または後に、より積極的な治療を投与してもよい。例えば、MIが疑われる場合には、対象をより詳細な画像検査および/または心臓カテーテル検査に送ってもよい。
【0047】
いくつかの態様においては、ST2およびIL-33の両方のレベルを決定し、両方のバイオマーカーとその各々の参照標準レベルとの比較からの情報により、対象における死亡のリスクの増大、および/または重大な疾患の存在に関する累積情報が与えられる。いくつかの態様においては、ST2とIL-33との比を決定し、その比を、それを上回れば対象は死亡のリスクが高い、および/または重大な疾患を有するという閾値比に相当する参照標準比と比較することができる。いくつかの態様においては、IL-33/ST2複合体の存在を検出し、そのような複合体のレベルが、死亡のリスクおよび/または重大な疾患の存在に関する指標となる。
【0048】
いくつかの態様において、本方法は、基礎をなす病態を同定するための追加的な診断方法の使用を含む。当技術分野で公知の任意の診断方法を用いることができ、当業者は対象の症状に対して適切な診断方法を選択することができる。いくつかの態様において、本明細書に記載した方法は、他のバイオマーカーの測定に加えて、またはそれに代わる選択肢として、例えば、当技術分野で公知であるような肺機能または心機能の身体計測といった他の診断方法を含む。
【0049】
例えば、本明細書に記載した方法は、ST2および/またはIL-33のレベル、および対象の診断の一助となる1つまたは複数の追加的なバイオマーカーを測定する段階を含む。1つの例として、胸痛または呼吸困難を有する対象については、心疾患の指標となるバイオマーカー、例えば、心筋トロポニン(cTn)、例えばcTnI、BNP、および/またはANPを測定することができる;代替的または追加的に、肺疾患のバイオマーカー、例えば、肺塞栓に関するDダイマーなどを測定することもできる。したがって、MIを鑑別診断に含む症状を呈する対象において、本方法は、対象がMIを有するか否かを判定するために、ST2および/またはIL-33に加えて、cTnI、BNPまたはNT-プロBNPまたはプロBNPのレベルを測定する段階を含みうる。心不全(HF)を鑑別診断に含む症状を呈する対象において、本方法は、対象がHFを有するか否かを判定するために、ST2および/またはIL-33に加えて、BNPまたはNT-プロBNPまたはプロBNPのレベルを測定する段階を含みうる。COPDを鑑別診断に含む症状を呈する対象において、本方法は、対象がCOPDを有するか否かを判定するために、ST2および/またはIL-33のレベルに加えて、肺機能を測定する段階を含みうる。当業者は、状況および対象の病状に応じて、適用しうる追加的な診断方法は数多くあることを理解しているであろう。いくつかの態様において、本方法は、BUNのレベルを測定する段階を含み、BUN高値およびST2高値の存在により、対象は高リスクのカテゴリーに入れられる。
【0050】
ST2
ST2遺伝子はインターロイキン-1受容体ファミリーのメンバーであり、そのタンパク質産物は膜貫通型、ならびに血清中に検出されうる可溶性受容体の両方として存在する(Kieser et al., FEBS Lett. 372(2-3):189-93 (1995);Kumar et al., J. Biol. Chem. 270(46):27905-13 (1995);Yanagisawa et al., FEBS Lett. 302(1):51-3 (1992);Kuroiwa et al., Hybridoma 19(2):151-9 (2000))。ST2は最近、心不全の実験モデルにおいて顕著にアップレギュレートされることが記載されており(Weinberg et al., Circulation 106(23):2961-6 (2002))、予備的な結果から、慢性重症HFの例(Weinberg et al., Circulation 107(5):721-6 (2003))ならびに急性心筋梗塞(MI)の例(Shimpo et al., Circulation 109(18):2186-90 (2004))では、ST2濃度が上昇している可能性が示唆されている。
【0051】
膜貫通型のST2は、Tヘルパー2型細胞の応答の調節に役割を果たすと考えられており(Lohning et al., Proc. Natl. Acad. Sci. U. S. A. 95(12):6930-5 (1998);Schmitz et al., Immunity 23(5):479-90 (2005))、高度または慢性的な炎症の状態における寛容性の発達に役割を果たしている可能性もあり(Brint et al., Nat. Immunol. 5(4):373-9 (2004))、一方、可溶型のST2は増殖刺激を受けた線維芽細胞でアップレギュレートされる(Yanagisawa et al., 1992、前記)。実験データから、ST2遺伝子は、筋細胞の伸展状態において、BNP遺伝子の誘導と類似した様式で(Bruneau et al., Cardiovasc. Res. 28(10):1519-25 (1994))、顕著にアップレギュレートされることが示唆されている(Weinberg et al., 2002、前記)。
【0052】
Tominaga, FEBS Lett. 258:301-304 (1989)は、BALB/c-3T3細胞において増殖刺激によって特異的に発現されるマウス遺伝子を単離した;彼らはこれらの遺伝子の1つをSt2(Growth Stimulation-Expressed Gene 2の略として)と命名した。St2遺伝子は以下の2つのタンパク質産物をコードする:ST2、これは可溶性分泌型である;およびST2L、これはインターロイキン-1受容体と非常に類似した膜貫通型受容体である。HUGO Nomenclature Committeeは、そのヒト相同体をインターロイキン1受容体様物質1(IL1RL1)と命名しており、そのクローニングはTominaga et al., Biochim. Biophys. Acta. 1171:215-218 (1992)に記載されている。この2つの用語は本明細書において互換的に用いられる。
【0053】
ヒトST2の短い方である可溶性アイソフォームのmRNA配列はGenBank Acc. No. NM_003856.2に見ることができ、ポリペプチド配列はGenBank Acc. No. NP_003847.2にある;ヒトST2の長い方の型に対するmRNA配列はGenBank Acc. No. NM_016232.4にある;ポリペプチド配列はGenBank Acc. No. NP_057316.3にある。そのほかの情報は、公開データベース中のGeneID:9173;MIM ID # 601203およびUniGene No. Hs.66で入手可能である。一般に、本明細書に記載した方法では、可溶型のST2ポリペプチドを測定する。
【0054】
ST2を検出および測定するための方法は、例えば、米国特許公開第2003/0124624号、第2004/0048286号および第2005/0130136号に記載されているように、当技術分野で公知であり、それらの内容はすべて参照により本明細書に組み入れられる。例えば、Medical & Biological Laboratories Co., Ltd.(MBL International Corp., Woburn, MA)により製造されたST2 ELISA Kit、no. 7638のように、ST2ポリペプチドを測定するためのキットも市販されている。加えて、ST2および他のバイオマーカーを測定するためのデバイスは米国特許公開第2005/0250156号にも記載されている。
【0055】
いくつかの態様において、本方法は、RefSNP ID:rs1041973のヌクレオチド配列の実体を決定する段階を含む。
【0056】
IL-33
IL-33はST2のリガンドとして最近同定され、さまざまな炎症性疾患におけるIL-33のレベルの上昇の存在が記載されている(Schmitz et al., Immunity 23(5):479-90 (2005);米国特許公開第2005/0203046号を参照)。本明細書に記載した方法では、IL-33を、ST2の代わりに、またはそれに加えて測定することができる。ST2とIL-33との比を決定することもできる。
【0057】
IL-33の核酸配列はGenBank Acc. No. NM_033439.2に見ることができ、ポリペプチド配列はGenBank Acc. No. NP_254274.1にある。そのほかの情報は、そのほかの情報は、公開データベース中のGeneID:90865、MIM ID # *608678およびUniGene No. Hs.348390で入手可能である。IL-33は第9染色体オープンリーディングフレーム26(Chromosome 9 Open Reading Frame 26)(C9ORF26);高内皮性小静脈由来の核因子(Nuclear Factor from High Endothelial Venules)(NFHEV);およびインターロイキン33としても知られる。Baekkevold et al., Am. J. Path. 163:69-79 (2003)も参照のこと。
【0058】
IL-33のレベルを測定するための方法は当技術分野で公知であり、例えば、Schmitz et al., Immunity. 23(5):479-90 (2005)、および米国特許公開第2005/0203046号を参照されたい。
【0059】
その他のバイオマーカー
本明細書に記載した方法は、ST2および/またはIL-33に加えて、他のバイオマーカーのレベルを測定する段階も含みうる。適したバイオマーカーには、プロBNP、NT-プロBNP、BNP、NT-プロANP、プロANP、ANP、トロポニン、CRP、IL-6、Dダイマー、BUN、肝機能酵素、アルブミン、腎機能の指標、例えばクレアチニン、クレアチニンクリアランス値もしくは糸球体濾過値、および/または細菌エンドトキシンが含まれる。これらのバイオマーカーを測定するための方法は当技術分野で公知であり、例えば、Leeらに対する米国特許公開第2004/0048286号および第2005/0130136号;Dhalla et al., Mol. Cell. Biochem. 87:85-92 (1989);Moe et al., Am. Heart. J. 139:587-95 (2000);Januzzi et al., Eur. Heart J. 27(3):330-7 (2006);Maisel et al., J. Am. Coll. Cardiol. 44(6):1328-33(2004);およびMaisel et al., N. Engl. J. Med. 347(3):161-7 (2002)が含まれ、その内容はすべて参照により本明細書に組み入れられる。肝機能酵素には、アラニントランスアミナーゼ(ALT);アスパラギン酸トランスアミナーゼ(AST);アルカリホスファターゼ(ALP);および総ビリルビン(TBIL)が含まれる。
【0060】
これらの態様においては、ST2および/またはIL-33、ならびに1つまたは複数の追加的なバイオマーカーのレベルを決定し、バイオマーカーとその各々の参照標準レベルとの比較からの情報により、対象の死亡のリスクおよび/または対象における重大な疾患の存在に関する累積情報が与えられ、それは対象のリスクに関するより正確で具体的な情報を与えると思われる。続いてそれらのレベルを、それを上回れば対象は死亡のリスクが高い、および/または重大な疾患を有するという閾値比に相当する参照標準比と比較することができる。
【0061】
1つの例として、本方法は、NT-プロBNPおよびST2のレベルを決定する段階を含む。これらのレベルは、例えば表1Aに示されているように、対象の死亡のリスクを示す。
【0062】
(表1A) NT-プロBNPおよびST2の循環血中レベルに基づく死亡のリスク

【0063】
表1Aに示されているように、例えば正常患者または健常個体における死亡のリスクを上回らないといった、最も低い死亡リスクは、ST2およびNT-プロBNPの両方のレベルが低い場合に生じ、低いおよび最も高い死亡リスク、すなわち、低いおよび最も高い死亡リスク、すなわち、正常患者または健常個体よりも統計学的に有意に高いリスク、例えば、より20%高い死亡のリスク、例えば、より30、40または50%高いリスクは、ST2およびNT-プロBNPの両方のレベルが高い場合に生じる。
【0064】
もう1つの例として、本方法は、ST2およびBUNのレベルを決定する段階を含む。これらのレベルは、例えば表1Bに示されているように、対象の死亡のリスクを示す。
【0065】
(表1B) BUNおよびST2の循環血中レベルに基づく死亡のリスク

【0066】
表1Bに示されているように、例えば正常患者または健常個体における死亡のリスクを上回らないといった、最も低い死亡リスクは、ST2およびBUNの両方のレベルが低い場合に生じ、低いおよび最も高い死亡リスク、すなわち、正常患者または健常個体よりも統計学的に有意に高いリスク、例えば、30、40または50%より高いリスクは、ST2およびBUNの両方のレベルが高い場合に生じる。
【0067】
治療の選択‐積極的か保存的か
ひとたび対象のST2および/またはIL-33の循環血中レベルが所定の参照標準レベルを上回ることが決定されれば、その情報はさまざまなやり方で用いることができる。例えば、対象のST2レベルが、例えば参照標準レベルと比較して高値であれば、積極的に治療するという決断を下すことができ、対象を例えば、入院患者としての治療のために病院に、例えば急性期治療部門または集中治療部門に入院させることができる。携帯型検査キットは、対象をEDに搬送すべきか否かを判定するために、救急医療従事者が現場で対象を評価することを可能にすると考えられる。または、例えばEDまたは他の臨床環境におけるトリアージ上の決断を、本明細書に記載した方法によって得られる情報に基づいて下すこともできる。ST2および/またはIL-33のレベルが高い患者を、ST2またはIL-33のレベルがより低い者よりも優先することができる。
【0068】
本明細書に記載した方法はまた、対象が改善しつつあるか否か、例えば、治療に反応しているか、例えば、入院した対象が、退院させて外来ベースで経過観察できる程度に十分に改善したか否かに関する情報も提供する。一般に、これらの方法は、対象におけるST2および/またはIL-33のレベルを複数回決定する段階を含む。経時的なST2および/またはIL-33のレベルの低下は、対象が改善しつつある可能性が高いことを示す。また、対象が退院させられる程度に十分に改善したか否かを判定するために、本明細書に記載したように、最も最近のST2および/またはIL-33のレベルを閾値と比較することもできる。
【0069】
対象が、例えば相対的に高いリスクを伴う治療などの、臨床試験への組み入れに関して検討される場合も考えられる。その対象は、例えば、差し迫った死亡、例えば受診から30日以内または1年以内での死亡のリスクがより低い者に対して適切と考えられるよりも、相対的に高いリスクを伴うレジメンによって治療することができる。
【0070】
臨床環境にとどまらず、対象のST2および/またはIL-33に関する情報は、例えば、第三者支払人による支払いの決断のため、または保険提供者による医療もしくは生命保険料の設定のためといった、他のやり方に用いることができる。例えば、ST2および/またはIL-33の高いレベル、例えば、所定の閾値レベルを上回るレベルを利用して、対象に対する保険料を増額させるように決断することができる。
【0071】
患者集団
本明細書に記載した方法は、非常にさまざまな臨床的状況において有用である。例えば、本方法は、例えば、病院および外来診療所ならびにEDにおける医師によるスクリーニングを含む、一般集団のスクリーニングのために用いることができる。1つの例として、ST2および/またはIL-33のレベルを任意の時点で決定することができ、ST2および/またはIL-33のレベルが上昇しているならば、医師が適切に行動することができる。
【0072】
本明細書に記載した方法は任意の対象に対して任意の時点で用いうるが、それらは病状の診断または重症度を判定することが難しい対象に対して特に有用である。例えば、そのような対象は、非特異的な症状、例えば、特定の診断を示さない症状を呈する。非特異的な症状には、胸痛または不快感、息切れ、悪心、嘔吐、曖気、発汗、心悸亢進、頭のふらつき、倦怠感および失神が非限定的に含まれる。それぞれの症状にはさまざまな病因の可能性がある。
【0073】
胸痛
胸痛は外来受診の約1〜2パーセントを占める主訴であり、その原因は多くの場合は心臓性ではないものの、心疾患は依然として米国における死亡の主因である。このため、胸痛の重篤な原因と良性原因とを鑑別することが極めて重要である。本明細書に記載した方法は、この判定を下すのに有用である。
【0074】
胸痛を訴えてEDを受診する対象は、食道痛、潰瘍、肺塞栓(PE)(致命の恐れあり)などの急性肺疾患、瘤の破裂または解離(致命率が高い)、胆嚢発作、心嚢炎(心臓周囲の嚢の炎症)、狭心症(損傷を伴わない心臓痛)またはMI(致命の恐れあり)を有する可能性がある。正しい診断を直ちに下すのは難しい場合もあるが、対象を入院させるか、それとも彼らを保存的に治療するかに関する決断は一般に直ちに下されるべきである。本明細書に記載した方法が、対象の有害な臨床転帰、例えば差し迫った死亡または重大な疾患のリスクが高いことを示しているならば、その有害な転帰を防げるように、対象を積極的に治療するという決断を下すことができる。
【0075】
胸痛の治療および診断に関するそのほかの情報は、例えば、Cayley, Am. Fam. Phys. 72(10):2012-2028 (2005)に記載がある。
【0076】
呼吸困難
呼吸困難または息切れ(異常または不快な呼吸とも定義される)は、EDを受診する対象に一般的な症状である。呼吸困難に関する鑑別診断には、4つの一般的なカテゴリーが含まれる:(1)心臓性、(2)肺性、(3)心臓性と肺性の混合、および(4)心臓性でも肺性でもない。
【0077】
呼吸困難の心臓性原因には、結果的に収縮機能障害を伴う右室、左室または両心室のうっ血性心不全、冠動脈疾患、最近または陳旧性の心筋梗塞、心筋症、弁機能不全、結果的に拡張機能不全を伴う左室肥大、非対称性中隔肥厚、心嚢炎および不整脈が含まれる。
【0078】
肺性原因には、閉塞性プロセス(例えば、慢性閉塞性肺疾患(COPD)および喘息)および拘束性プロセス(例えば、肥満、脊柱または胸壁変形といった肺外の原因、および間質線維化、塵肺症、肉芽腫性疾患または膠原血管病といった肺固有の病態)が含まれる。
【0079】
心臓性と肺性の混合型の疾患には、肺高血圧および肺性心を伴うCOPD、デコンディショニング、肺塞栓ならびに外傷が含まれる。
【0080】
心臓性でも肺性でもない疾患には、貧血、糖尿病性ケトアシドーシスおよび代謝性アシドーシスの他のより一般的でない原因といった代謝性疾患、胸壁または体内の別の場所での疼痛、ならびに多発性硬化症および筋ジストロフィーなどの神経筋疾患が含まれる。閉塞性の鼻咽頭障害には、ポリープまたは鼻中隔弯曲による鼻閉塞、扁桃腺肥大、および声門上部または声門下部の気道狭窄が含まれる。
【0081】
結果的に過呼吸を伴う不安障害のように、呼吸困難が精神疾患の身体症状として現れることもある。
【0082】
呼吸困難の評価および治療に関するそのほかの情報は、例えば、Morgan and Hodge, Am. Fam. Phys. 57(4):711-718 (1998)に記載がある。
【0083】
特殊な集団
ある種の対象の集団は、本明細書に記載した方法によって特に恩恵を受けると考えられる。これらの対象には、腎機能に障害のある例(Anwaruddin et al., J. Am. Coll. Cardiol. 47(1):91-7 (2006);McCullough et al., Am. J. Kidney Dis. 41(3):571-9 (2003))、または過体重(体格指数(BMI)が25〜29)もしくは肥満(BMI>30)の例(Krauser et al., Am. Heart J. 149(4):744-50 (2005);McCord et al., Arch. Intern. Med. 164(20):2247-52 (2004))のように、BNPまたはNT-プロBNPがそれほど有用でない人々が含まれる。この分野では、疾患の程度が同じ場合に、BMIが高い患者では通常、ナトリウム利尿ペプチドのレベルが、体容量が正常な患者で予想されるよりも低いことが公知であり、受け入れられている;この現象の正確な機序は不明である。ST2の循環血中レベルはBMIによって影響されないことが示されているため、BMIの高い対象において、ST2レベルの決定はナトリウム利尿ペプチドレベルよりも有用である。したがって、本明細書に記載した方法は、対象のBMIを決定する段階を含み、対象が過体重または肥満であれば、本明細書に記載したように、患者をST2および/またはIL-33レベルの決定のために選択する。
【実施例】
【0084】
実施例
本発明について以下の実施例でさらに説明するが、これらは特許請求の範囲に記載された本発明の範囲を限定するものではない。
【0085】
実施例1:サンドイッチELISAアッセイ
本実施例は、Medical & Biological Laboratories Co., Ltd.(MBL International Corp., Woburn, MA)により製造されたST2 ELISA Kit、no. 7638.を使用する。このキットは、捕捉および検出の両方のためにモノクローナル抗体を利用するサンドイッチELISAアッセイである。この手順は、1:3の希釈係数で複数件ずつアッセイした試料の全プレートを分析することを意図しており、製造元のプロトコールに厳密に従う。キットは使用時まで4℃で保存すべきである。本実施例に記載した手順は、クエン酸またはEDTA抗凝固剤入りのチューブ内に収集したヒト血清または血漿に対して最適化されている。ヘパリンはST2と結合してこのELISAプロトコールによる測定の妨げになるため、ヘパリン抗凝固剤入りのチューブ内に収集した血漿はこのアッセイに用いるべきではない。血漿または血清試料は新鮮なまま用いてもよく、凍結保存してもよい。このアッセイは、血漿試料の最大3回までの凍結解凍サイクルによっては有害な影響を受けない。
【0086】
試薬は、アッセイを行う直前に新しいキットから新たに調製すべきである。使用前にキットを室温に対して平衡化させる。以下で明示的に考察していない試薬は、直ちに使える状態で製造元によって提供される。
【0087】
1.洗浄溶液‐洗浄溶液は製造元により10倍濃縮溶液として提供される。1リットルの洗浄溶液を作製するためには、提供された100mlの10倍濃縮液を900mlの蒸留水で希釈する。
【0088】
2.検出薬溶液‐検出薬溶液は、検出薬濃縮液を検出薬希釈液で1:101に希釈することによって調製する。96ウェルプレート全体の試料に対しては10mlの検出薬溶液が必要になる。10mlの検出薬溶液 を調製するためには、ピペットを用いて10mlの青色の検出薬希釈液を15mlのオレンジトップポリプロピレン製チューブに移す。検出薬濃縮液の100μlをこの容積の検出薬希釈液に添加する。
a.注:この試薬は、第1のアッセイのインキュベーション段階の間に調製すべきである。
【0089】
3.キャリブレータ貯蔵液‐キャリブレータタンパク質を再構成し、凍結乾燥させたタンパク質を、このロット製造のために製造元によって定められた量の蒸留水で希釈して、8ng/mlの貯蔵溶液を生じさせる。この容積の規定は製品の挿入物に含まれている。
【0090】
標準物質および試料の調製:
・以下のものはすべて、ラベル表示した1.5mlポリプロピレン製チューブ内で調製した上で、P200ピペッターを用いてアッセイプレートに移すべきである。
【0091】
標準物質:
標準曲線は、8ng/ml貯蔵溶液の2倍系列希釈を作成することによって調製する。
【0092】
1.P1000ピペットを用いて、250μlのアッセイ希釈液を、S1〜S8とラベル表示した8個の1.5mlポリプロピレン製チューブに移す。
【0093】
2.同じP1000ピペットを用いて、8ng/mlのキャリブレータ貯蔵溶液の250μlをチューブS1に移す。このチューブはこの時点で4ng/mlのキャリブレータタンパク質を有する。
a.泡を生じさせないように注意しながら3回穏やかにピペッティングすることによって十分に混合する。
【0094】
3.同じP1000ピペットを用い、以下のそれぞれに対して新たなチップを用いて、チューブS1の中の試薬250μlをチューブS2に移して混合を繰り返す。
【0095】
4.段階3を、S2からS3に、S3からS4に、S4からS5に、S5からS6、さらにS6からS7へと繰り返す。S8は試薬なしとするため、このウェルにはキャリブレータタンパク質を移さない。
a.チューブS1〜S6およびS8はこの時点で試薬250μlを有すると考えられ、チューブS7は450μlを有すると考えられる。
【0096】
試料:
プレートを、各試料が1:3希釈として2件ずつ分析されるように設定する。
【0097】
1.1.5mlポリプロピレン製チューブを各試料用にラベル表示する。
【0098】
2.P200ピペットを用いて160μlのアッセイ希釈液を各チューブに移す。
【0099】
3.P200ピペットを用いて、試料1からの80μlの血清または血漿をチューブ1に移す。泡が生じないように3回ピペッティングすることによって注意深く混合する。
【0100】
4.各試料について段階2を繰り返すことにより、試料を試料用チューブに移すことを繰り返す。
【0101】
手順:
1.P200ピペットを用いて、表2に示されているように、標準物質および希釈した血清試料を96ウェルアッセイプレートに迅速に添加する。
a.P200ピペットを100μlに設定する。
b.標準曲線用希釈物100μlを、アッセイプレート中のカラム1および2に移す。
c.血清試料のそれぞれの100μlを、アッセイプレートに対して、以下のプレートマップに示されたのと全く同じ位置に移す。
【0102】
2.アッセイプレートを用意された遮蔽物で覆い、室温で60分間インキュベートする。
【0103】
3.プレート自動洗浄器を用いてプレートを4回洗浄する。
【0104】
4.検出薬:8チャンネルのマルチチャンネルピペットを用いて、100μlの検出薬溶液を各ウェルに添加し、室温で60分間インキュベートする。
a.注:この試薬は第1のインキュベーション段階の間に調製することとした。
b.注:この試薬の添加のためには使い捨て式の試薬容器を用いる。各試薬に対して常に新たな使い捨て式の試薬容器を用いる。この段階の間にピケットチップを交換することは必要でない。
【0105】
5.段階3と同じようにプレートを洗浄する。
【0106】
6.基質:8チャンネルのマルチチャンネルピペットを用いて、100μlの基質を各ウェルに添加し、室温で30分間インキュベートする。
a.基質試薬は、直ちに使える状態で製造元によって提供される。
【0107】
7.停止:基質インキュベーションの完了時に、8チャンネルのマルチチャンネルピペットを用いて100μlの停止溶液を各ウェルに添加する。
a.停止溶液の試薬は、直ちに使える状態で製造元によって提供される。
【0108】
8.プレートを450nmで読み取り、620nmでバックグラウンド補正を行う。
a.プレートは反応を停止させた後に30分以内に読み取るべきである。
【0109】
9.吸光度の読み取り値を、用意された分析用のスプレッドシートに入力する。
【0110】
(表2) 例示的な96ウェルアッセイプレートのマップ

【0111】
表2は、例示的な96ウェルアッセイプレートのマップであり、列1には対照反応が用意されており、各試料1〜40は列3〜12で繰り返して分析される。
【0112】
実施例2 急性呼吸困難を有する患者の評価のための可溶性ST2濃度の測定
本実施例では、呼吸困難患者の評価のためのST2測定の有用性を評価した。
【0113】
本実施例で用いた対象は、救急部における呼吸困難に関するプロBNPの調査(ProBNP Investigation of Dyspnea in the Emergency Department)(PRIDE)試験に参加しており、これは、Massachusetts General HospitalのEDを受診した呼吸困難の対象599例に関する前向き盲検下試験であり、NT-プロBNP検査の診断的および予後判定的な利用の妥当性評価を目的として行われた。PRIDE試験の結果は最近報告されている(Januzzi et al., Am. J. Cardiol. 95(8):948-54 (2005))。
【0114】
急性HFの診断に関する至適基準(gold standard)は、NT-プロBNP値に関して盲検化され、受診時から60日間の追跡調査までの入手可能なすべての情報を得た、審査した医師の印象を基にした;診断が不確実であった少数の患者については、Framingham Heart Study(McKee et al., N. Engl. J. Med. 285(26):1441-6(1971))によって報告されたガイドラインを利用するように審査者が指導した。
【0115】
報告されている通り、PRIDE試験における対象のうち209例(35%)は、急性不安定化HFに起因する呼吸困難と判定され、そのうち17例はNew York Heart Association(NYHA)分類による軽症(クラスII)の症状を有し、80例は中等症(クラスIII)の症状を有し、112例は重症(クラスIVの症状)を有した。急性HFを有しなかった者の中で最も頻度の高かった診断は、閉塞性気道疾患の増悪であった(n=150;慢性閉塞性肺疾患の増悪(n=120)および喘息(n=30)ならびに急性肺炎(n=64)を含む。
【0116】
1年の終わりの時点で、各患者を管理する医師は、患者の生命の状態を確認するために接触した。報告されている通り、1年時の追跡調査は全体で597例の対象が終えた(Januzzi et al., Arch Intern Med 2006;166(3):315-20)。
【0117】
PRIDE試験では、NT-プロBNPは、市販のイムノアッセイ(ELECSYS(登録商標)プロBNPアッセイ、Roche Diagnostics, Indianapolis, IN)を確立された方法で用いることで測定された。PRIDE試験において、アッセイの試行間の変動係数は0.9%であった。受診時に収集した血液を、その後、本明細書の実施例1に記載したように、固相酵素免疫アッセイ(Medical & Biological Laboratories Co., Ltd.)を用いてST2の濃度に関して分析した。このアッセイは、ヒトST2に対するモノクローナル抗体を捕捉および検出の両方のために利用し、本分析における相対的な差のパーセンテージは17.5%であった。本試験のために用いた血漿は、以前に単一の凍結解凍サイクルに供せられていた。
【0118】
群間の比較
患者間の臨床的特性の比較を、カテゴリーデータに対するカイ二乗検定および連続データに対するWilcoxonの順位和検定を利用して行った。診断名、New York Heart Association(NYHA)症状クラスおよび転帰のカテゴリーの間でのST2濃度の比較は、ノンパラメトリック検定を用いて行った。
【0119】
相関
ST2およびNT-プロBNPの結果を、正規分布を成立させるために対数変換した。これらの対数変換した変数間の相関を、Spearman相関係数を用いて評価した。全対象(r=0.58、p<0.001)、急性HFを有しない例(r=0.47、p<0.001)および急性HFの例(r=0.40、p<0.001)のいずれにおいても、対数変換ST2およびlog-NT-プロBNPの濃度の間には弱い相関が認められた。
【0120】
カット点解析
0.20ng/mlを上回るか下回るかというST2濃度の関数としての患者特性は、偶発性HFの診断に合致する要因に関する有病率の期待値を示した表3に詳述されている。
【0121】
(表3) ST2濃度の関数としての試験対象の特性

【0122】
これらの結果は、ST2が一般的にはBMIとは相関しないが、血清クレアチニンレベルおよびクリアランス値、うっ血性心不全の既往ならびに糖尿病を含む、数多くの他の指標とは関連性があることを示している。
【0123】
実施例3 急性呼吸困難を有する患者における死亡のリスクの判定のための可溶性ST2濃度の測定
実施例2に記載した集団において、呼吸困難による受診後の1年以内の致死性を予測させる要因に関して評価した。候補となるST2の診断上のカット点を、STATA SWBOOTプログラムを用いるブートストラップ法を用いることによって評価した;続いて多変量ロジスティック回帰分析を行った。推算手順のそれぞれをプログラム言語でコード化し、続いて10件のブートストラップ反復ランダム標本に対するSTATAブートストラッププレフィクスコマンド(prefix command)にかけ、その後に初期解析で選択された変数に対して100回の反復を行った。ブートストラップの標本数は593とした(全データセットの数)。解析に入れた要因には、過去および現在の病歴、症状および徴候、薬剤の使用、ならびに放射線検査、心電図検査、血液学検査および血液化学検査を含む診断検査の結果からの要素を含めた。腎機能の指標には、血清クレアチニンの結果ならびに推算糸球体濾過値を含めた(Levey et al., Ann. Intern. Med. 130(6):461-70 (1999))。続いて、致死性に関する予測変数の候補(すなわち、ブートストラップ反復における選択が70回を上回るもの)を、多変量ロジスティック回帰分析に投入し、急性HFを従属変数とした。それぞれのロジスティック回帰に関して、結果は、セットを投入するための末端確率をp=0.01とし、回帰から効果を除外するためのものをp=0.02とする単回前向きステップ(single forward step)として投入し、適合度をHosmer-Lemeshow検定を用いて評価した。
【0124】
NT-プロBNPを含む致死性の解析において、この変数は、以前に特定されている通りに(Januzzi et al., 2006、前記)、1年以内の死亡を予測するための閾値を986pg/mlとした上で、二項対立的にモデル化された。SWBOOT試行の後に、その結果得られた妥当性が検証された独立変数の候補を、Cox比例ハザードモデルに段階的に投入した;このモデルに関して比率を確かめたところ、適切であることが見いだされた。1年までの死亡に関するそれぞれの独立予測変数に関して、ハザード比(HR)を95% CI(信頼区間)とともに求めた。
【0125】
ST2濃度(ならびに診断)の関数として分けた群における1年以内での死亡率を比較するために、死亡率の有意性を比較するためのログランク検定を用いて、Kaplan-Meier生存曲線を作成した。
【0126】
すべての統計分析に関して、SPSS(Chicago, IL, USA)またはSTATA(College Station, TX)ソフトウエアを用いた;p値はすべて両側性とし、合成の結果が0.05未満を有意とみなした。
【0127】
1年以内に、93例の対象(15.7%)が死亡した。ST2濃度の中央値は、死亡者(1.03ng/ml、IQR(四分位範囲)=0.38〜2.43)の方が生存者(0.18ng/ml、IQR=0.08〜0.51;p<0.001)よりも有意に高かった。死亡者でST2濃度がより高いというこのパターンは、対象を急性HFのない者(1.14対0.13ng/ml;p<0.001)、ならびに急性HFを有する者(0.90対0.45ng/ml;p<0.001)の関数と考えた場合も同じく保たれた。
【0128】
ST2に関して、Analyse-Itソフトウエア(Analyse-It, Ltd, Leeds, UK)を用いた受診者動作特性(ROC)曲線分析を、HFの至適基準による診断または1年以内の生存を参照標準として用いて行い、曲線下面積(AUC)を推算した;続いて、診断および予後の両方に関して有望なカット点を特定し、それらの感度、特異度、ならびに陽性適中率および陰性適中率(PPV、NPV)を推算した。至適ROC-至適カット点の有用性をさらに評価するために、患者をそのST2濃度に基づく十分位数にも分け、死亡の度数に対するST2閾値効果について評価した。
【0129】
ROC分析により、ST2および1年での致死性に関するAUCは0.80(95% CI=0.75〜0.84、p<0.001)であることが示された(図1);ROCによって特定された至適カット点は0.29ng/mlであり、これは感度87%(95% CI=79〜93%)、特異度63%(95% CI=58〜67%)であり、PPVは30%、NPVは96%であった。十分位数分析において、致死性に関する閾値効果はST2の中央値0.20ng/mlで認められた(図2)。ST2濃度と死亡の尤度との間の段階的な関係も見いだされ、ST2濃度が中央値未満であった対象(n=236)は死亡率が最も低く(2%)、これに対して最上位の2つの十分位数(n=117)は1年以内の死亡率が42%であり、HRは43.0(95% CI=15.0〜123.0、p<0.001)であった。
【0130】
1年以内の死亡の予測のための最後のブートストラップモデルにおいては(表4)、0.20ng/ml以上のST2濃度が100回の反復のうち96回で選択され、息切れの患者において1年以内の死亡の予測変数が最も強力であった(HR=5.6、95% CI=2.2〜14.2;p<0.001)。注目されることとして、NT-プロBNPをモデルに含めた場合であっても、0.20ng/ml以上のST2はブートストラップ反復において最も選択された変数であり(100回の選択のうち86回)、依然として、1年以内の死亡に関する最も強い予測変数であった(HR=4.6、95% CI=1.8〜11.8;p=0.002)。
【0131】
(表4) 呼吸困難の対象における1年以内の死亡に関する独立予測変数の同定

【0132】
表4の結果は、100回のブートストラップ反復に続いて、多変量Cox比例ハザード分析を行ったものに基づき、NT-プロBNPの結果がモデルに存在する場合と存在しない場合が示されている。ブートストラップ反復において100回のうち70回を超えて選択された変数のみを示している。
【0133】
Kaplan-Meierハザード曲線は、ST2濃度が0.20ng/ml以上であった対象では死亡率が組み入れ時から急に上昇し、1年以内を通して上昇し続けることを示している。(図3A;ログランクp値<0.001)。受診時に急性HFと診断されなかった者および診断された者においても、0.20ng/ml以上のST2値に関して同様の関係がみられる(図3B;ログランクp値はいずれも<0.001)。
【0134】
したがって、ST2レベルは致死性に関する優れた予測変数である。
【0135】
実施例4 急性呼吸困難を有する患者における死亡のリスクの判定のための可溶性ST2およびNT-プロBNP濃度の測定
【0136】
ST2およびNT-プロBNPが両方とも1年以内の死亡に関する独立した予測変数であったことから、ST2およびNT-プロBNP濃度の関数としての対象における粗死亡率について、上記の方法を用いて検討した。各カテゴリーにおける死亡した対象のパーセンテージを表5に示している。
【0137】
(表5) PRIDE試験におけるNT-プロBNPおよびST2濃度の関数としての死亡率

【0138】
PRIDE試験における対象の死亡の大半は、ST2のレベル(0.20ng/mlと等しいかそれ以上)およびNT-プロBNPのレベル(986pg/mlと等しいかそれ以上)が高値であった者に起こった(表5および図4)。
【0139】
したがって、NT-プロBNPおよびST2のレベルの組み合わせは、死亡のリスクの予測に有用である。
【0140】
実施例5 MIが存在しない患者におけるST2濃度の上昇
胸痛でEDを受診した350例の患者の集団において、以上の実施例1のようにST2濃度を決定した。血清試料を入手し、ほとんどの患者に関してST2測定をベースライン時ならびに90分後および180分後に行った。同じくほとんどの患者に関して、ベースライン時の試料は症状の発現から2時間以内に収集した。
【0141】
17例の患者は最終診断がMIと下され、このうち5例はST2が0.23以上であった(0.25〜0.65)。これらの患者のうち2例はトロポニン陰性であった。11例の患者はST2レベルが非常に高値であったが(0.97〜9.22)、これらの患者はいずれもMIとは最終診断されず、ただし全例がCOPD、リンパ腫、敗血症、アルコール乱用および肺塞栓を含む重大な疾患を有した。これらの11例の患者に関する診断名を表6に示している;ST2 1はベースラインレベルであり、ST2 2は90分後、ST2 3は180分後である。
【0142】
(表6) ST2レベルが高かった非MI患者

【0143】
これらの結果は、ST2高値が、基礎をなす病態にかかわらず、重大な疾患と関連があることを実証している。
【0144】
実施例6 急性非代償性心不全(ADHF)で入院した患者におけるST2濃度の連続分析
急性非代償性心不全(ADHF)と診断されてSan Diego Veterans' Administration Hospitalに入院した150例の対象の集団において、以上の実施例1のようにST2濃度、さらにBUN、NT-プロ-BNPおよびBNPの濃度を決定した。患者の中にはADHFと新たに診断された者もおり、既存の心不全の急性増悪を有した者もあった。すべての患者で毎日試料が得られたわけではなかったが、多くの患者で試料を連日採取した。これらの患者に関する入院日数(LOS)は1〜24日の範囲であり、平均5日であった。表7はこの集団の特性を示している;予想された通り、この集団がSan Diego Veteran's Hospitalから得られたことを考えると、この集団は圧倒的に男性および白人が優位であった。
【0145】
(表7) 患者特性の度数

* NYHA=New York Heart Associationによる心不全のステージ:
クラスI:身体活動の制限なし。通常の身体活動は過度の倦怠感、心悸亢進および呼吸困難(息切れ)を引き起こさない。
クラスII:身体活動の軽度の制限。安静時は楽であるが、通常の身体活動は倦怠感、心悸亢進または呼吸困難をもたらす。
クラスIII:身体活動の著しい制限。安静時は楽であるが、通常程度を下回る活動で倦怠感、心悸亢進または呼吸困難を引き起こす。
クラスIV:不快感を伴わずにいかなる身体活動も行うことができない。安静時に心不全の症状がある。いかなる身体活動を行っても不快感が増す。
【0146】
この患者の集団を少なくとも90日追跡し、有害イベントを表にまとめた。イベントの概要は表8に示されている。
【0147】
(表8) イベントの概要

* 90日の転帰の度数は、それ以前の時点に起こったすべてのイベントの累積である。
【0148】
入院時および退院時のBNP、NT-プロBNPおよびST2のレベルの相関に関して、本明細書に記載したように、受診者動作特性および曲線下面積(AUC)を決定し、有害事象とともに表8に一覧にして示した。結果は表9に示されている。最初から最後までのST2の変化に関するAUC=0.820である。
【0149】
(表9) ROCの概要(AUC)

【0150】
この小規模かつ極めて均一な集団において、報告されたイベントを最も正確に予測したバイオマーカーには、30日および90日での死亡に関するST2の変化、ならびに30日および90日での死亡に関する退院時のNT-プロBNPレベルが含まれた。予想された通り、このコホートの均一性のため、各バイオマーカーに関する入院時の測定を用いたAUCは、PRIDEコホートで(実施例2〜3に記載)で観察されたものよりも小さかった。PRIDEコホートでは心不全と診断されなかった患者が多数に上ったことが、入院時測定でのST2の高い鑑別力をもたらした。すべての患者がすでに心不全と診断されているという、この特化したコホートでは、入院時のST2レベルは幾分上昇していることが予想される;その結果として、一般的集団をより代表する不均一なコホートと比較して、以後のイベントの予測力が幾分減じられる。
【0151】
90日での死亡に関する予測変数の単変量モデルを、同じマーカー、ならびに腎機能のマーカーであるBUNおよびクレアチニンクリアランス値を用いて解析した。その結果は表10に示されている。
【0152】
(表10) 90日での致死性に関する単変量予測変数

【0153】
この解析では、二項変数(BUNおよびクレアチニンを除くすべて)に関して、オッズ比は、検査陽性と検査陰性との比較で、90日以内の死亡のオッズの増加を表す。連続変数(BUNおよびクレアチニン)に関して、オッズ比は、1mg/dLの上昇毎に90日以内の死亡のオッズの増加を表す。表10に示されているように、ST2の変化は、90日での致死性に関する最も優れた指標であり、ORは11.55(p=0.002)であった。
【0154】
BNP、NT-プロBNP、BUNおよびクレアチニンクリアランス値のレベルをST2の変化とともに含めた多変量モデルも構築した。その結果は表11に示されている。
【0155】
(表11) ST2の変化と併せた、90日での致死性に関する予測変数

【0156】
ST2の変化(ST2レベル間の差)のみを考慮した場合、モデルに関するR2は0.223であった。表11に見てとれるように、各々の場合で、ST2の変化はp値がより小さいことからより強力な予測変数であった。さらに、ST2の変化を上回るさらなる予測性を与え、統計学的な有意性(p<0.05)を達成したのは、入院時NT-プロBNP、退院時NT-プロBNPおよび入院時BUNのみであり(太字のR2値を参照)、一方、退院時BNPは弱い統計学的有意性を達成した(p=0.07)。
【0157】
次に、ROCを、BNPの変化およびST2の変化に関して比較した。図5に示されているように、入院期間中のBNPの変化に関するAUCは0.67であり、一方、ST2の変化に関するAUCは0.78と有意に高く、このことはST2の変化が、90日での致死性に関してBNPよりもはるかにより正確な予測変数であることを示している。
【0158】
ST2の変化をBUNレベルとともに分析し、この2つのマーカーを一緒に用いた場合にさらなる予測情報が得られるか否かについて判定した。図6に示された結果は、BUNレベル、およびST2レベルの変化は、患者をリスク別にカテゴリー化するために用いうることを実証している:BUNのレベルが低く(40mg/dL未満)、かつST2のレベルの低下が15%またはそれ以上であった患者は、リスクのレベルが最も低かった;BUNがより高く、ST2のレベルの低下が15%未満であった(または上昇した、もしくは変わらず保たれた)患者は、リスクのレベルが最も高く、一方、BUNが高値かつST2の低下が少なくとも15%である対象、またはBUNが低値かつST2の低下が15%もしくはそれ以上である対象は、リスクのレベルが中等度であった(それでも最もリスクの低いカテゴリーよりははるかに高かった、図6参照)。
【0159】
第1および第2のST2測定の間の至適な時間の長さを決定するために、経時的なST2レベルの変化を時間差的に評価した。表11Aおよび11Bに示された結果は、ST2の第1および第2の測定の間の、少なくとも2日かつ4日以内という時間差により、90日以内の死亡の尤度に関して最も優れた情報が与えられることを示している。
【0160】
(表11A) 経時的なST2値の概要

【0161】
(表11B) ST2値と90日以内の致死性との相関

【0162】
表11Bにおいて、「N>0.85」は、指定の時間にわたるST2の低下が15%未満(このため第2のレベルは第1のレベルの85%またはそれ以上である)であった人々の数を示している。少なくとも2日後には、比が0.85またはそれ以上であって死亡した人々のパーセンテージは20%を上回り、一方、比が0.85未満であって死亡した患者のパーセンテージは最初に低下し、低いまま保たれた。
【0163】
経時的な平均ST2値をこの集団で追跡したところ、表12Aならびに図7Aおよび7Bに示されているように、最初の測定を行ってから3〜4日後に、90日以内の死亡のリスクの相関の明らかな増加が認められた。第25および第75パーセンタイルを枠で囲んだホイスカーボックスプロットである図7Bは、生存者と死亡者との鑑別がST2値によって明らかに分離して得られることを示している。ST2の結果は、BNPまたはNT-プロBNPのいずれかをこれらと同じ治療日に関して比較することによって得られる結果とは対照的である。図7Cおよび7Dに示されているように、これらのマーカーのそれぞれに関する平均値は生存者と死亡者との間で異なるものの、これらの群は統計学的に互いに明確に異なるわけではない。ST2とは異なり、BNPおよびNT-プロBNPに関する生存者群と死亡者群は第一四分位数(25パーセンタイル)と第三四分位数(75パーセンタイル)との間でかなり重なる。この解析において、ST2は、入院期間中の経時的な変化の関数として死亡率を予測する上で、BNPまたはNT-プロBNPの単独よりも正確なマーカーである。
【0164】
ST2の平均比を算出したところ、この場合も有意差が認められた;その結果は表12Bおよび図8に示されている。
【0165】
(表12A) 経時的な平均ST2値

【0166】
(表12B) 経時的なST2の変化

【0167】
また、表12Cに示されているように、これらの患者のリスク層別化をさらに精緻化するために、2×2マトリックス解析でST2の比をNT-プロBNPの比とともに用いることも可能である.
【0168】
(表12C) リスク層別化のためのST2の変化およびNT-プロBNPの変化

【0169】
これらの結果は、経時的なST2の変化が、単変量または多変量のいずれの予測分析においても、例えば90日以内の致死性に関する強力な予測変数であることを実証している;ST2の変化はこの集団における患者転帰に関する最も強い単変量予測変数であることが示され、至適適中率は入院3日後に認められた。ST2の変化のデータを腎機能の指標(例えば、BUN)と組み合わせることにより、さらなる適中率が得られ、ST2の変化とともにNT-プロBNPの測定を含めた場合も同様であった。
【0170】
実施例7 肺疾患を有する患者におけるリスク層別化のためのST2濃度
PRIDEの集団(実施例2および3に記載)における599例の対象のうち、209例は急性非代償性心不全(ADHF)を有した。残りの390例の対象のうち、236例は「肺疾患」を有した;データが入手可能な者のうち、5例は合併症のない気管支炎を有し;18例は肺塞栓(PE)を有し;64例は肺炎を有し;149例はCOPD/喘息を有した。COPD/喘息を有する149例のうち、69例は喘息を有し;67例は気腫を有し;13例は慢性気管支炎を有した。
【0171】
これらの患者におけるリスクのマーカーとしてのST2の有用性を評価するために、ST2レベルを各診断カテゴリーにおいて判定した。各診断カテゴリーに関する濃度を表13に示している。
【0172】
(表13) 診断名別のST2濃度

【0173】
ST2濃度を1年時点での死亡に関してROC分析を用いて評価し、死亡者および1年時点の生存者における濃度を比較した。死亡率をST2濃度の関数として1年時まで分析した。その結果は表14および図9〜11に示されている。
【0174】
(表14) 診断名別の死亡率

【0175】
これらの結果は、図9に示されているように、ST2濃度が優れた特異度および感度を示したことを実証している(ROC下面積=0.73;95% CI=0.62〜0.83;P<0.0001)。至適カット点は0.20ng/mlであり、感度88%、特異度52%であった(PPV=22%;NPV=96%)。図10はこの要点をさらに例証している。1年時点で生存していた対象に関するST2濃度の中央値は0.19ng/mlであった(IQR 0.08〜0.59、n=211);一方、1年以内に死亡した対象における濃度の中央値は1.19ng/mlであった(IQR 0.28〜2.2、n=25)。さらに、図11に示されているように、0.2ng/ml閾値を用いたところ、死亡率はST2濃度の関数として劇的に増加した。
【0176】
1年時点での死亡に関する独立予測変数を同定するために、多変量Cox比例ハザード分析を用いた;その結果は表15に示している。
【0177】
(表15) 肺疾患における死亡に関する独立予測変数

【0178】
これらのデータは、呼吸困難を呈する対象において、基礎をなす病態にかかわらず、ST2レベルが1年以内の死亡に関する優れた予測変数であることを実証している。
【0179】
実施例8 ST2濃度は腎機能不全によっては影響されない
中等症ないし重症の腎機能不全を有する135例の患者の集団において、ST2濃度に対する腎障害の影響を評価した。いずれの患者も透析を受けておらず、過去にCVDと診断された例も皆無であった。患者はすべて、腎機能の指標として、腎疾患における食事の修正(Modification of Diet in Renal Disease)(MDRD)法によって判定された糸球体濾過値(GFR、ml/分単位)を用いて評価された。潜在性CVDを検出するために、各対象に対して心エコー検査および冠動脈カルシウム(CAC)測定も行った。複数のバイオマーカーについても評価した。
【0180】
このコホートに関する記述統計量を表16に示している;平均GFRおよびST2は、図12A〜Bにグラフ表示されている。
【0181】
(表16) 糸球体濾過値(GFR)およびST2レベル

【0182】
安定した慢性疾患を有するこの患者コホートにおいて、ST2レベルが0.2を上回ったのは10例(8%)のみであり、最も高かったのは0.476ng/mlであった。ST2値の分布は図13に示されている。このことは、管理下にある慢性腎機能不全を有するこの対象の集団において予想された通りであった;極めて高いST2レベルが認められると予想する者はいないであろう。
【0183】
ST2レベルとGFRとの間に相関があるか否かを判定するために、この集団においてピアソン相関分析を行った。その結果は表17および18に示されている。
【0184】
(表17) ピアソン相関の結果‐GFRおよびST2

【0185】
(表18) ピアソン相関の結果‐クレアチニンクリアランス値およびST2

【0186】
これらの結果は、管理下にある慢性腎機能不全を有するこの対象の集団において予想された通り、この集団では、ST2レベルとGFR(p=0.75)との間にも、クレアチニンクリアランス値(p=0.851)との間にも相関はみられなかった。このことは、腎機能不全がそれ自体ではST2レベルの上昇を引き起こさないことを示している。
【0187】
同じ分析を、San Diego Veteran's Administration Hospitalの139例の対象の集団にも行った。対象はすべて過去に急性非代償性心不全(ADHF)と診断されており、平均ST2レベルは、慢性腎機能不全を有するがHFは有しない患者の集団の約2倍であった(表17〜18を参照)。腎機能不全と心不全との間には遍在的な相関がみられ、ステージIII/IVのHFを有する患者のほぼ80%は、腎機能に障害がある者と重なる(Fonarow and Heywood, Am. J. Med. (2006) 119(12A):S17-S25。したがって、ADHFはST2レベルと相関することから、腎機能不全(GFRにより計測)とST2レベルとの間には相関がみられると期待される。表19および20に示されているように、このことがまさに認められた。
【0188】
(表19) ピアソン相関の結果‐ADHFにおけるGFRおよびST2

【0189】
(表20) ピアソン相関の結果‐ADHFにおけるGFRおよびST2比

【0190】
これらの結果は、ADHFを有する対象では、ST2値が、単一のレベルまたは比のいずれとして表されるかにかかわらず、腎機能不全の指標と相関しており、しかしながら腎機能不全とは独立していることを実証している。
【0191】
実施例9 死亡のリスクはST2濃度と相関する
PRIDE試験に参加した対象および実施例8に記載した集団の退役軍人において、死亡のリスクの増大について評価した。
【0192】
0.2および0.7ng/mlという両方のST2閾値を、集団全体(表21)およびADHFサブセットのみ(表22)を対象に評価した。この2つの閾値の最大の違いは、いずれの患者セットにおいても0.7ng/mlの閾値の方がPPVが増加し、NPVが減少することであった。
【0193】
(表21) PRIDEコホートにおけるST2レベル別の死亡率

【0194】
この集団において、0.2ng/mlに関するNPVは98.2%であり、0.7ng/mlに関するものは90.8%である。
【0195】
(表22) ADHFを有する対象におけるST2レベル別の死亡率

【0196】
このコホートにおいて、0.2ng/mlに関するNPVは97.6%であり、0.7ng/mlに関するものは79.5%である。
【0197】
VET試験からのST2比に関する結果は表23に示されている。
【0198】
(表23) 慢性腎不全を有する対象における死亡率

【0199】
この測定に関してNPVは96.2%である。
【0200】
その他の態様
本発明をその詳細な記載とともに説明してきたが、以上の説明は本発明を例示するためのものであって、その範囲を制限するものではなく、それは添付する特許請求の範囲によって規定されることが理解される必要がある。その他の局面、利点および修正は本発明の範囲に含まれる。
【技術分野】
【0001】
発明の分野
本発明は、ST2および/またはIL-33の循環血中レベルを、単独で、または他のバイオマーカーと組み合わせて測定することによって、致死性(mortality)を予測するため、および重大な疾患の存在を検出するための方法に関する。
【背景技術】
【0002】
背景
対象、特に胸痛または不快感、息切れ、悪心、嘔吐、曖気、発汗、心悸亢進、頭のふらつき、倦怠感または失神といった非特異的な症状を有する者の臨床的評価は、対象の病状の原因および重症度が常に明らかとは限らないため、大きな難題となっている。対象を積極的に治療するかそれとも保存的に治療するか、または対象を入院患者として受け入れるかそれとも自宅に帰すかに関する決断は、時に、個人の実際の病状に関する医師の臨床的判断または「直感」のみに基づいて行われる。有害な転帰、例えば致死性、および/または重大な疾患の存在に関する対象の尤度を示すバイオマーカーは、医師が、十分に情報を得た上で治療上の決断を下す能力を大きく高めると考えられる。
【発明の概要】
【0003】
概要
本発明は、少なくとも一部には、バイオマーカーST2(増殖刺激発現遺伝子2(Growth Stimulation-Expressed Gene 2)、これはインターロイキン1受容体様物質1(Interleukin 1 Receptor Like 1)(IL1RL-1)としても知られる)の血清レベルを、症状の基礎をなす原因または最終的診断にかかわらず、臨床転帰、例えば30日、3もしくは6カ月、または1年またはそれ以上といった特定の期間内での死亡を予測するため、または重大な疾患の存在を検出するために用いうるという発見に基づく。また、ST2のレベルの経時的な、例えば数日またはそれ以上の期間での変化を、例えば、急性イベント後に入院した患者における臨床転帰を予測するために用いることもできる。
【0004】
本明細書に記載した方法は、患者、例えば、非特異的な症状を有する患者、例えば急性呼吸困難の患者および胸痛を有する者の診断的および予後的評価を得るために、ST2レベルを測定する段階、およびST2レベルの経時的な変化(例えば、比)をモニターする段階を含む。
【0005】
IL-33は、ST2に対するリガンドとして同定されている。したがって、本発明は、ST2および/またはIL-33レベル、さらにはST2/IL-33複合体といったバイオマーカーレベル、ならびにST2:IL-33複合体と遊離ST2および/またはIL-33との比をモニターすることによって、患者を評価するための方法を含む。
【0006】
加えて、本方法は、臓器機能、ならびに/または、例えばトロポニン(Tn、例えば、TnIまたはTnT)、脳性ナトリウム利尿ペプチド(BNP)、プロBNP、NT-プロBNP、心房性ナトリウム利尿ペプチド(ANP)、NT-プロANP、プロANP、C反応性ペプチド(CRP)、血中尿素窒素(BUN)、Dダイマー(架橋フィブリンの分解産物であり、そのレベルは血塊形成後に上昇する)、アルブミン、肝機能酵素、腎機能の指標(例えば、クレアチニン、クレアチニンクリアランス値または糸球体濾過値)および/もしくは細菌エンドトキシンといった補助的バイオマーカーのレベルを評価する段階を含む、さらなる診断方法も含みうる。いくつかの態様において、本方法は、BUN、NT-プロBNPまたはBNP、および/またはTnIに加えて、ST2および/または経時的なST2レベルの変化を測定する段階を含む。
【0007】
したがって、1つの局面において、本発明は、対象に関して、30、60、90もしくは180日(例えば、1、2、3もしくは6カ月)または1、2もしくは5年といった特定の期間内での、死亡または再入院のリスクを評価するための方法を特徴とする。本方法は、血液、血清、血漿、尿または体組織といった試料を対象から入手する段階;試料におけるST2および/またはIL-33のバイオマーカーレベルを決定する段階;ならびに試料におけるST2および/またはIL-33のバイオマーカーレベルをST2および/またはIL-33の参照標準(reference)レベルと比較する段階を含む。試料におけるST2および/またはIL-33のバイオマーカーレベルと参照標準との比較により、対象の、特定の期間内での死亡または再入院のリスクが示される。いくつかの態様において、特定の期間は1年である。
【0008】
いくつかの態様において、参照標準レベルは、1年以内での死亡のリスクが低い対象におけるレベルに相当する。例えば、実施例1に記載したように、例えば、ST2のバイオマーカーレベルが固相酵素免疫アッセイ(ELISA)などのイムノアッセイを用いて測定されるいくつかの態様において、ST2の参照標準レベルは約0.2〜0.3ng/ml血清であり、例えば、レベルは0.20、0.23、0.25、0.27または0.29ng/ml血清であってよく、試料におけるレベルが参照標準レベルよりも高いかそれと等しいことにより、対象の、1年以内の死亡のリスクが高いこと、すなわち統計学的に有意に高いことが示される。実施例1に記載したELISA以外の分析手法を用いるならば、参照標準ST2レベルは本明細書に記載したものとは異なる可能性がある;本明細書に挙げた具体的な数値は、他の分析手法を用いて生み出される対応する数値と等価であるとみなされるべきである。いくつかの態様において、死亡のリスクの高さは少なくともより20%高く、例えば、より30%、40%または50%高い。
【0009】
もう1つの局面において、本発明は、対象における、1つまたは複数の疾患の重症度、例えば、疾患の現在の重症度を決定するための方法を特徴とする。本方法は、対象から試料を入手する段階;試料におけるST2および/またはIL-33のバイオマーカーレベルを決定する段階;ならびに試料におけるST2および/またはIL-33のバイオマーカーレベルをST2および/またはIL-33の参照標準レベルと比較する段階を含む。参照標準と比較した、試料におけるST2および/またはIL-33のバイオマーカーレベルにより、対象が有する1つまたは複数の疾患が重大であるか否か、例えば、命にかかわるか否かが示される。
【0010】
さらなる局面において、本発明は、例えば、対象が改善したか否か、例えば、病院から退院できる程度に十分に改善したか否かを判断するために、対象の病状をモニターするための方法を含む。本方法は、対象におけるST2および/またはIL-33の第1のバイオマーカーレベル、例えばベースラインレベルを決定する段階;ならびに対象におけるST2および/またはIL-33の少なくとも1つの以後のバイオマーカーレベル、例えば、治療下レベル(treatment level)を決定する段階を含む。続いて、第1のレベルと以後のレベルを比較する。第1のレベルから以後のレベルまでに、ST2および/またはIL-33のバイオマーカーレベルが十分に低下しているならば、例えば、統計学的に有意に、または少なくとも5%、10%、15%、20%もしくはそれ以上低下しているならば、対象の病状は改善しつつある可能性が高く、一方または両方のレベルが十分に低いならば、例えば、選択した閾値よりも下であるならば、対象を、例えば外来治療のために、退院させることができる。
【0011】
いくつかの態様において、本方法は、対象のリスクを指し示すST2のレベルを決定する段階、および任意で、第1のST2レベル、例えばベースラインレベルと、第2のST2レベル、例えばある程度の時間の後に、例えば1、2、3、4日後またはそれよりも後に取得したレベルとの比に基づいて、対象に対する治療を選択または修正する段階を含む。例えば、もしST2の第2のレベルが第1のレベルの選択したパーセンテージを上回るならば、対象は高いリスクを有しており、より積極的に治療されるべきである;もし対象がすでに治療を受けているならば、対象は現在の治療に対して順調には反応しておらず、新たな治療、すなわち患者がより順調に反応する可能性のある代替的な治療を選択すべきである。1つの例として、もし第2のレベルが第1のレベルの約85%またはそれ以上である(すなわち、約15%またはそれ未満の低下がある)ならば、対象は改善しておらず、依然として死亡のリスクが高い。
【0012】
いくつかの態様においては、例えば、本明細書に記載したようにELISAを用いて測定する場合に、対象におけるST2のレベルを、重大な疾患を有しない対象、例えば、疾患を有しないか急性の重大な疾患を有しない対象に相当する参照標準レベルと比較する。ST2の参照標準レベルは約0.2〜0.3ng/mlであってよく、例えば、レベルは約0.20、0.23、0.25、0.27もしくは0.29ng/ml血清または血漿(上述した通り、本明細書に挙げた閾値は、本明細書に記載したようなELISA法を用いる場合に当てはまる;異なる方法を用いて決定された場合には、他の閾値の数値をこれらの数値と等価であるとみなすことができる)。参照標準レベルよりも高いかそれと等しい、試料におけるレベルは、対象が1つまたは複数の重大な疾患、例えば、現在の疾患を有することを示す。
【0013】
いくつかの態様において、参照標準レベルは、ある特定の予後を有する対象に相当する。例えば、ST2のレベルを、例えば実施例1に記載したようにELISAを用いて測定する場合には、参照標準レベルを以下のように利用して予後を判定することができる:約0.2または0.23ng/ml未満のST2は、対象の予後が良好であること、例えば回復する可能性が高いことを示す;約0.2または0.23ng/ml〜0.7ng/ml(またはその等価物)であるST2は、対象の予後が不良であること、例えば、回復する可能性がより低いことを示す。さらに、0.7ng/mlを上回るST2は、予後が極めて不良であること、例えば、対象が回復する可能性が低いことを示す。この態様において、不良な予後とは、患者に、おそらく入院を要する、1年以内の死亡またはより重大な疾患の発症のリスクがあることを示すと考えられる。極めて不良な予後とは、患者に、おそらく入院を要する、90日以内の死亡またはより重大な疾患の発症のリスクがあることを示す。1件の研究では、ST2レベルが0.7ng/mlを上回る患者では死亡率が30%を超えた。
【0014】
いくつかの態様において、対象は、例えば、胸痛または不快感、息切れ(呼吸困難)、悪心、嘔吐、曖気、発汗、心悸亢進、頭のふらつき、倦怠感および失神といった、1つまたは複数の非特異的な症状を呈する。いくつかの態様において、症状は呼吸困難または胸痛である。
【0015】
いくつかの態様において、対象は心血管疾患を有しない。さまざまな態様において、対象は、肺疾患、例えば、急性感染症(例えば、肺炎)、慢性閉塞性肺疾患(COPD)および肺塞栓を有する。
【0016】
ある態様において、対象は肝疾患、例えば、標準的な肝機能臨床検査によって判定されるような、化学療法、アルコール毒性または薬物毒性に伴う肝疾患を有する。
【0017】
いくつかの態様において、本方法はさらに、試料における、例えばトロポニン、NT-プロBNP、BNP、プロBNP、NT-プロANP、プロANP、ANP、CRP、Dダイマー、BUN、アルブミン、肝機能酵素、腎機能の指標、例えばクレアチニン、クレアチニンクリアランス値もしくは糸球体濾過値、および/または細菌エンドトキシンといった補助的(非ST2性、非IL-33性)バイオマーカーのレベルを決定する段階;ならびに試料における補助的バイオマーカーのレベルを補助的バイオマーカーの参照標準レベルと比較する段階を含む。参照標準と比較した試料における補助的バイオマーカーのレベルと、ST2参照標準レベルと比較した試料におけるST2のレベルとの組み合わせにより、対象が、特定の期間内での死亡のリスクが高いこと、および/または現在の重大な疾患を有することが示される。いくつかの態様において、本方法は、第1のレベル、例えばベースラインレベルを、第2のレベル、例えばある程度の時間の後に、例えば1、2、3、4日後またはそれよりも後に取得したレベルと比較することによって、補助的バイオマーカーに関する経時的なレベルの変化(例えば、比)を決定する段階を含む。ST2の比が算出される態様において、補助的バイオマーカーの比を、例えば、ST2の比と同じ期間に基づいて算出することもできる。
【0018】
いくつかの態様において、対象はBMI 25〜29である、BMI 30以上である、または腎機能不全を有し、例えば、対象は、BMI 25〜29である、BMI 30以上である、または腎機能不全を有することに基づいて選択される。
【0019】
いくつかの態様において、本方法は、試料におけるST2のレベルおよびIL-33のレベルを決定する段階;試料におけるST2:IL-33の比を決定する段階;ならびにST2:IL-33の比を参照標準比と比較する段階を含む。参照標準比と比較した、試料におけるST2:IL-33の比により、対象が、特定の期間内での死亡のリスクが高いか否か、および/または現在の重大な疾患を有するか否かが示される。
【0020】
もう1つの局面において、本発明は、例えば、1つまたは複数の非特異的な症状を呈する対象に関して、30、60、90もしくは180日(6カ月)、または1、2もしくは5年といった特定の期間内での死亡のリスクを評価するための方法を提供する。本方法は、試料を対象から入手する段階;試料におけるST2および/またはIL-33のバイオマーカーレベル、ならびに任意で、試料におけるNT-プロBNP、プロBNPまたはBNPのレベルを決定する段階;ならびに試料におけるST2および/またはIL-33のレベルならびに試料におけるNT-プロBNPのレベル(決定されていれば)を、対応する参照標準レベルと比較する段階を含む。各々の参照標準レベルと比較した、試料におけるST2および/またはIL-33のレベル、ならびに試料におけるNT-プロBNP、プロBNPまたはBNPのレベルにより、特定の期間内での対象の死亡のリスクが示される。
【0021】
いくつかの態様において、本方法は、試料における(i)NT-プロBNP、プロBNPまたはBNP、および(ii)ST2のレベルを決定する段階を含む。いくつかの態様において、対象の1年以内の死亡のリスクは以下の通りである。

【0022】
ある態様において、対象の死亡または病院再入院のリスクが非常に高いならば、対象は積極的に治療される。
【0023】
さらなる局面において、本発明は、例えば、対象が改善したか否か、例えば、病院から退院できる程度に十分に改善したか否かを判断するために、対象の病状をモニターするための方法を含む。本方法は、対象における(i)ST2でないバイオマーカー、例えば、NT-プロBNP、プロBNPまたはBNP、ならびに(ii)ST2および/またはIL-33の第1のレベル、例えばベースラインレベルを決定する段階;ならびに対象における(i)ST2でないバイオマーカー、例えば、NT-プロBNP、プロBNPまたはBNP、ならびに(ii)ST2および/またはIL-33の少なくとも1つの以後のレベル、例えば治療下レベルを決定する段階を含む。続いて、第1のレベルと以後のレベルを比較する。、第1のレベルから以後のレベルまでに、ST2および/またはIL-33のレベルが低下しているならば、対象は改善しつつある可能性が高く、レベルが十分に低いならば、対象は改善している、例えば、対象は、例えば外来治療のために十分に退院させられる程度に改善している。いくつかの態様において、本方法は、対象における(i)ST2でないバイオマーカー、例えば、NT-プロBNP、プロBNPまたはBNP、ならびに(ii)ST2および/またはIL-33の少なくとも第1、第2および第3のレベルを決定する段階、ならびにレベルを比較する段階を含む。レベルの間に差があることにより、対象が十分に退院させられる程度に改善しているか否かが示される。したがって、例えば、退院させるか入院させたままで治療を継続するかに関する決断を、以下の通りに行うことができる。

【0024】
いくつかの態様において、ST2に関する閾値は0.2ng/mlであり、BNPに関する閾値は986pg/mlである。
【0025】
同様に、本明細書において提供されるのは、ST2と特異的に結合する1つもしくは複数の抗体、ならびに/またはIL-33と特異的に結合する1つもしくは複数の抗体、ならびに本明細書に記載した方法の1つまたは複数を実施するための説明書を含むキットである。
【0026】
1つのさらなる局面において、本発明は、対象の病状を評価するための方法を含む。本方法は、対象から試料を入手する段階;試料におけるST2および/またはIL-33のバイオマーカーレベルを決定する段階、ならびに以下の他のバイオマーカーのうち1つまたは複数、例えばすべての存在またはレベルを決定する段階:
(i)NT-プロBNP、プロBNPまたはBNP;
(ii)NT-プロANP、プロANPまたはANP;
(iii)心筋トロポニン(cTn)、例えば、cTnI;
(iv)Dダイマー;
(v)C反応性タンパク質(CRP);
(vi)クレアチニン、クレアチニンクリアランス値または糸球体濾過値;
(vii)血中尿素窒素(BUN);
(viii)細菌エンドトキシン;
(ix)1つまたは複数の肝機能酵素;ならびに、試料におけるST2および/またはIL-33のレベルならびに試料における1つまたは複数の他のバイオマーカーのレベルを、対応する参照標準レベルと比較する段階を含む。参照標準レベルと比較した、試料におけるST2および/またはIL-33のレベルならびに試料における他のバイオマーカーのレベルにより、対象の病状の重症度が示される。
【0027】
いくつかの態様において、本明細書に記載した方法は、ST2および/またはIL-33のレベルまたは比を、BNPもしくはNT-プロBNPと組み合わせて;トロポニン、例えば、TnIもしくはTnTと組み合わせて;または腎機能の指標、例えば、クレアチニン、クレアチニンクリアランス値もしくは糸球体濾過値と組み合わせて、測定する段階を含む。
【0028】
もう1つの局面において、本発明は、対象における治療の有効性を評価するための方法を含む。本方法は、対象における循環血中ST2および/またはIL-33の第1の(例えば、ベースライン)レベルを決定する段階;対象における循環血中ST2および/またはIL-33の第1のレベルを所定の参照標準レベルと比較する段階;第1のST2のレベルが所定の参照標準レベルを上回るならばその対象を選択する段階;対象に治療を施す段階;対象における循環血中ST2および/またはIL-33の第2のレベルを決定する段階;ならびに循環血中ST2および/またはIL-33の第1および第2のレベルを比較する段階を含む。循環血中ST2および/またはIL-33の第1および第2のレベル間に差があることは、対象における治療の有効性を示す。例えば、循環血中ST2および/またはIL-33の第2のレベルが第1のレベルよりも低いことは、治療が有効であることを示す。
【0029】
本明細書で用いる場合、「試料」には、任意の体液または組織、例えば、血液、血清、血漿、尿および体組織のうち1つまたは複数が含まれる。ある態様において、試料は血清、血漿または血液試料である。
【0030】
抗原と「特異的に結合する」抗体は、他のタンパク質を含む試料中の抗原と選好的に結合する。
【0031】
本明細書に記載した方法およびキットには多くの利点がある。例えば、本方法は、確定診断が下されているか否かにかかわらず、患者をさらなる判定のために入院させるべきか、またはそのまま入院患者としておくべきかを決定するために用いることができる。例えば、本方法は、例えば、対象に対して適切な治療の積極性のレベルに関する決断を、そのST2レベルに基づいて下すための、所与の対象のリスク層別化のために用いることができる。より優れた治療上の決断は、有病率および死亡率の低下、ならびに乏しい医療資源のより優れた割り振りを導くことができる。本明細書に記載した方法は、具体的な診断を下すために患者をさらに検査すべきか否かに関する一般的な判定を行うために用いることができる。本明細書に記載した方法はまた、例えば、臨床的成績、または治療的介入に対して予想される反応に関する情報を得るための、患者集団のリスク層別化のために用いることもできる。本明細書に記載した方法は、基礎をなす原因または最終的な診断にかかわらず用いることができ、そのため特定の適応症には限定されない。
【0032】
別に定義する場合を除き、本明細書で用いるすべての技術用語および科学用語は、本発明が属する当業者が一般に理解しているものと同じ意味を持つ。方法および材料が本発明における使用のために記載されている;当技術分野で公知の他の適した方法を用いることもできる。材料、方法および実施例は例証的なものに過ぎず、限定を意図したものではない。本明細書で言及したすべての刊行物、特許出願、特許、配列、データベース項目および他の参考文献は、その全体が参照により本明細書に組み入れられる。対立が生じた場合には、定義を含め、本明細書が支配的であるものとする。
【0033】
本発明の他の特徴および利点は、以下の詳細な説明および図面、ならびに特許請求の範囲から明らかであると考えられる。
【図面の簡単な説明】
【0034】
【図1】ST2および1年以内の死亡に関する受診者動作特性分析を図示したグラフである。曲線下面積(AUC)の大きさによって示されるように、ST2はこの目的に有用であった。
【図2】救急部における呼吸困難に関するプロBNPの調査(ProBNP Investigation of Dyspnea in the Emergency Department)(PRIDE)試験のコホートにおける、ST2の十分位数毎の粗死亡率を図示した棒グラフである。この特定のアッセイに関してST2濃度0.23ng/mlに対応する、第5十分位で明らかな閾値効果が認められる。
【図3】図3Aおよび3Bは、ST2濃度の関数として層別化した、呼吸困難を有する患者における、受診時から1年間の追跡時までの死亡率を表した一対のKaplan-Meierハザード曲線である。ST2濃度が0.20ng/ml以上である呼吸困難患者では、受診日から数日以内に高い死亡率が認められ、これは受診後1年まで続いて認められた。死亡率は、急性心不全を有する者(3A)および有しない者(3B)とも同程度であった(いずれもログランクp値<0.001)。
【図4】NT-プロBNPおよびST-2に関するマーカー濃度の関数として死亡率を図示した棒グラフである。
【図5】ST2の変化(薄いグレーの線)およびBNPの変化(濃色の線)に関して、特異度と感度とを対比した受診者動作特性曲線(ROC)である。
【図6】棒グラフと折れ線グラフを組み合わせたものである。バーは、BUNおよびST2の比が表記レベルであった集団における死亡率を図示している。線は各カテゴリーの患者数を示している。
【図7A】入院中の各日における、生存者(薄いグレーの四角形)および非生存者(濃色の菱形)に関する平均ST2値の折れ線グラフである。
【図7B】ST2レベルの第25および第75パーセンタイルを枠で囲み、時間(入院6日間にわたる)に対してプロットした、ホイスカーボックスプロット(whisker box plot)である;S=生存者、D=死亡者。
【図7C】BNP濃度の第25および第75パーセンタイルを枠で囲み、時間(入院6日間にわたる)に対してプロットした、ホイスカーボックスプロット(whisker box plot)である;S=生存者、D=死亡者。
【図7D】NT-プロBNPの第25および第75パーセンタイルを枠で囲み、時間(入院6日間にわたる)に対してプロットした、ホイスカーボックスプロット(whisker box plot)である;S=生存者、D=死亡者。
【図8】入院中の各日における、ベースライン(入院前後)と比較した、生存者(薄いグレーの四角形)および非生存者(濃色の菱形)に関するST2値の比の折れ線グラフである。
【図9】肺に関する診断が下されたPRIDE被験者における1年までの死亡を予測する、ST2の能力に関するROCである。ROC下面積=0.73;95%CI=0.62-0.83;P<0.0001;至適カット点:0.20ng/ml;感度88%、特異度52%;PPV=22%;NPV=96%。
【図10】肺に関する診断が下されたPRIDE被験者におけるST2濃度と1年以内の死亡のリスクとの相関を図示したボックスグラフである。
【図11】肺に関する診断が下されたPRIDE被験者におけるST2濃度の関数としての死亡率を図示した折れ線グラフである。P<0.001。
【図12】図12A〜Bは、中等症ないし重症の腎機能不全を有する対象133例の集団における平均糸球体濾過値(GFR、12A)およびST2レベル(12B)を図示したボックスグラフである。
【図13】実施例8に記載した集団におけるST2レベルの分布を図示した棒グラフである。
【発明を実施するための形態】
【0035】
詳細な説明
患者、特に呼吸困難または胸痛などの非特異的な症状を有する患者の臨床的評価は、往々にして難題である。本明細書に記載した結果は、ST2が患者の予後評価において、それらの疾患の基礎をなす原因にかかわらず有用であるという証拠を提供する。本明細書において、全く異なる症状を有するいくつかの全く異なる集団で実証されているように、ST2は重大な疾患および差し迫った死亡に関する強い指標である(実施例1〜6参照)。
【0036】
致死性の予測
ST2濃度の高値は、1年以内の死亡に関する明らかな予後指標となり、基礎をなす診断にかかわらず、受診直後にST2が高値である者については生存曲線において著しい相違がみられる。1つの例として、ST2の高値と、呼吸困難による受診後1年以内の致死性に関するリスクとの間には著しい関連性がある。ST2と呼吸困難患者における死亡との関連性は、診断にも、炎症、筋壊死、腎機能障害に関する他のマーカー、とりわけ、この集団における死亡を予測するために有意義として最近記載されたマーカーであるNT-プロBNPを含む、この状況において致死性に関して疑われる他のすべてのバイオマーカー予測変数にも依存しなかった(Januzzi et al., Arch. Intern. Med. 2006;166(3):315-20)。実際に、この研究における死亡の大半は、受診時にST2レベルが高値であった対象に集中していた;しかし、ST2およびNT-プロBNPの高値の組み合わせでは、1年以内の死亡率が最も高かった。
【0037】
リスク層別化のためのこのような多マーカーアプローチは、急性冠症候群の患者に対して提唱されている(Sabatine et al., Circulation 2002;105(15):1760-3)が、未鑑別の呼吸困難または一般的な愁訴である胸痛といった非特異的な症状を有する患者の評価に関しては、そのような戦略はまだ提唱されていない。
【0038】
疾患の重症度の判定
ST2濃度の高値は、疾患の基礎をなす原因にかかわらず、対象における重大な疾患の存在と相関づけられている。1つの例として、胸痛を呈する患者の集団において、最も高レベルの疾患は、慢性閉塞性肺疾患(COPD)、リンパ腫、敗血症、アルコール乱用および肺塞栓を含む重大な疾患と関連していた(実施例5参照)。
【0039】
したがって、診断されていない対象に対して、本明細書に記載した方法を、どの程度積極的に診断を求めるべきかを決定するために用いることができる;高いST2レベルは、重大な疾患の存在を示すとともに、対象を高リスク症例として治療すべきであることを示唆する。診断が判明している対象に対して、本明細書に記載した方法は、基礎をなす病態の重症度を決定するのを補助するために用いることができる;この場合も、ST2レベルが高いほど、より重大な疾患と関連している。
【0040】
一般的方法
一般に、本明細書に記載した方法は、対象、例えば哺乳動物、例えばヒトにおける、ST2および/またはIL-33の循環血中レベル(例えば、血液、血清、血漿、尿または体組織におけるレベル)を評価する段階を含む。これらのレベルは、対象が、有害な転帰、例えば、30日、60日、90日、6カ月、1年、2年、3年または5年といった特定の期間内での死亡を経験する尤度に関する情報を与える。これらのレベルはまた、対象における疾患の重症度に関する情報も与える。いくつかの態様において、ST2および/またはIL-33のレベルは、例えば受診時に1回決定される。いくつかの態様において、ST2および/またはIL-33のレベルは、症状の発現から2、4、6、8、12、18および/もしくは24時間後、ならびに/または1〜7日後に決定される。複数のレベルを決定する場合には、対象におけるST2のレベルが上昇したか低下したか、およびそれがどの程度であるかを数量化する、ST2の比を算出することができる。
【0041】
いくつかの態様において、ST2および/またはIL-33のレベルは複数回決定される;その場合には、より高い測定値、または最も最近の測定値を用いることができる。ST2および/またはIL-33のレベルを複数回決定する態様においては、最も高いレベルを用いることもでき、またはレベル間の差(すなわち、差の大きさおよび方向)を決定して用いることもできる。したがって、ST2レベルの経時的な、例えば、数日、例えば3日もしくはそれ以上の過程にわたる、または数週間もしくは数カ月の過程にわたる変化(例えば、大きさおよび方向、例えば、上昇または低下)を表す、ST2の比を決定することができる;この比は対象のリスクのレベルおよび重大な疾患の存在の指標となる。また、治療に対する対象の反応を評価するために、ST2および/またはIL-33のレベルを複数回決定することもできる。例えば、治療の投与後、例えば治療の1つまたは複数の投薬またはサイクルの後に取得したST2および/またはIL-33のバイオマーカーレベルを、治療を開始する前のST2および/またはIL-33のレベルと比較することができる。ST2レベル間の差により、治療が有効であったことが示されると考えられる;例えば、ST2レベルの低下は治療が有効であったことを示すと考えられる。また、ST2レベル間の差を、例えば、対象が改善しつつあるか否か、例えば、病院から退院できる、より積極的でない治療を行える、またはより長い時間間隔で経過観察できるといった程度に十分に改善しつつあるか否かを判定するために、対象の病状をモニターするために用いることもできる。
【0042】
対象におけるST2および/またはIL-33の循環血中レベルを評価することは、典型的には、生物試料、例えば、血清、血漿または血液を対象から入手する段階を含む。試料におけるST2および/またはIL-33のレベルは、試料におけるポリペプチドのレベルを、固相酵素免疫アッセイ(ELISA)などのイムノアッセイといった、当技術分野で公知のおよび/または本明細書に記載した方法を用いて測定することによって決定することができる。または、ST2および/またはIL-33のmRNAのレベルを、同じく、例えば定量的PCRまたはノーザンブロット分析といった、当技術分野で公知のおよび/または本明細書に記載した方法を用いて測定することもできる。
【0043】
ひとたびST2および/またはIL-33のレベルまたは比が決定されれば、そのレベルまたは比を参照標準レベルまたは参照標準比と比較することができる。例えば、ST2のレベルを、例えば実施例1に記載したようにELISAを用いて測定する、いくつかの態様において、参照標準レベルは、それを上回れば対象は死亡のリスクが高い、および/または重大な疾患を有するという閾値レベルに相当する。選択される参照標準レベルは、ST2のレベルを測定するために用いる方法に依存すると考えられる。例えば、本明細書に記載したように、可溶性ST2の循環血中レベルをイムノアッセイを用いて決定するいくつかの態様において、参照標準レベルは約0.20、0.23または0.29ng/ml血清であり、その参照標準レベルを上回るST2のレベルは、対象は死亡のリスクが高い、および/または重大な疾患を有することを示す。
【0044】
例えば、ST2の第1および第2の測定値を用いて、比を決定する場合には、参照標準比は、対象が死亡のリスクが高いか否かおよび/または重大な疾患を有するか否かを示す、変化の量および方向に相当すると考えられる。1つの例として、第1の測定値、例えば、対象が治療のために例えばEDを訪れた時点に取得したベースライン測定値、および第2の測定値、例えば3日〜4日後に取得した測定値に基づいて、ST2比を算出することができる。経時的な第1および第2のST2レベルの比が約0.85またはそれ以上であるならば、すなわち、ST2レベルの低下が約15%未満である(または同じままである、もしくは上昇した)ならば、対象は差し迫った死亡のリスクが極めて高い。約0.85未満である比(ST2レベルが約15%を超えて低下)は、対象の差し迫った死亡のリスクはより低いことを示す。
【0045】
この情報は、医師が、より正確な治療上の決断を下すことを可能にする;例えば、決定の結果から、対象が参照標準レベルと等しいかそれを上回る、例えば、約0.20ng/ml、0.23ng/mlもしくは0.29ng/ml血清を上回るレベル、または参照標準比を上回る比を有することが示された場合には、対象を、入院患者として病院に、例えば急性期治療部門または集中治療部門に入院させることが考えられる。いくつかの態様において、ST2と参照標準レベルまたは参照標準比との比較は対象の予後を判定するために用いることができる。例えば、本明細書において実施例1に記載したように、ST2のレベルをELISAを用いて測定する場合には、参照標準レベルを以下のように利用して予後を判定することができる:約0.20ng/mlまたは0.23ng/ml未満のST2は、対象の予後が良好であること、例えば回復する可能性が高いことを示す;約0.20ng/mlまたは0.23ng/ml〜約0.7ng/mlであるST2は、対象の予後が不良であること、例えば、回復する可能性がより低いことを示す。さらに、約0.7ng/mlを上回るST2は、予後が極めて不良であること、例えば、対象が回復する可能性が低いことを示す。もう1つの例として、経時的な第1および第2のST2レベルの比が約0.85を上回れば予後が不良なことを示し、比が約0.85またはそれ未満であれば予後が良好であることを示す。
【0046】
対象の実際の病状を判定するために追加的な検査を行ってもよい。追加的な検査の前または後に、より積極的な治療を投与してもよい。例えば、MIが疑われる場合には、対象をより詳細な画像検査および/または心臓カテーテル検査に送ってもよい。
【0047】
いくつかの態様においては、ST2およびIL-33の両方のレベルを決定し、両方のバイオマーカーとその各々の参照標準レベルとの比較からの情報により、対象における死亡のリスクの増大、および/または重大な疾患の存在に関する累積情報が与えられる。いくつかの態様においては、ST2とIL-33との比を決定し、その比を、それを上回れば対象は死亡のリスクが高い、および/または重大な疾患を有するという閾値比に相当する参照標準比と比較することができる。いくつかの態様においては、IL-33/ST2複合体の存在を検出し、そのような複合体のレベルが、死亡のリスクおよび/または重大な疾患の存在に関する指標となる。
【0048】
いくつかの態様において、本方法は、基礎をなす病態を同定するための追加的な診断方法の使用を含む。当技術分野で公知の任意の診断方法を用いることができ、当業者は対象の症状に対して適切な診断方法を選択することができる。いくつかの態様において、本明細書に記載した方法は、他のバイオマーカーの測定に加えて、またはそれに代わる選択肢として、例えば、当技術分野で公知であるような肺機能または心機能の身体計測といった他の診断方法を含む。
【0049】
例えば、本明細書に記載した方法は、ST2および/またはIL-33のレベル、および対象の診断の一助となる1つまたは複数の追加的なバイオマーカーを測定する段階を含む。1つの例として、胸痛または呼吸困難を有する対象については、心疾患の指標となるバイオマーカー、例えば、心筋トロポニン(cTn)、例えばcTnI、BNP、および/またはANPを測定することができる;代替的または追加的に、肺疾患のバイオマーカー、例えば、肺塞栓に関するDダイマーなどを測定することもできる。したがって、MIを鑑別診断に含む症状を呈する対象において、本方法は、対象がMIを有するか否かを判定するために、ST2および/またはIL-33に加えて、cTnI、BNPまたはNT-プロBNPまたはプロBNPのレベルを測定する段階を含みうる。心不全(HF)を鑑別診断に含む症状を呈する対象において、本方法は、対象がHFを有するか否かを判定するために、ST2および/またはIL-33に加えて、BNPまたはNT-プロBNPまたはプロBNPのレベルを測定する段階を含みうる。COPDを鑑別診断に含む症状を呈する対象において、本方法は、対象がCOPDを有するか否かを判定するために、ST2および/またはIL-33のレベルに加えて、肺機能を測定する段階を含みうる。当業者は、状況および対象の病状に応じて、適用しうる追加的な診断方法は数多くあることを理解しているであろう。いくつかの態様において、本方法は、BUNのレベルを測定する段階を含み、BUN高値およびST2高値の存在により、対象は高リスクのカテゴリーに入れられる。
【0050】
ST2
ST2遺伝子はインターロイキン-1受容体ファミリーのメンバーであり、そのタンパク質産物は膜貫通型、ならびに血清中に検出されうる可溶性受容体の両方として存在する(Kieser et al., FEBS Lett. 372(2-3):189-93 (1995);Kumar et al., J. Biol. Chem. 270(46):27905-13 (1995);Yanagisawa et al., FEBS Lett. 302(1):51-3 (1992);Kuroiwa et al., Hybridoma 19(2):151-9 (2000))。ST2は最近、心不全の実験モデルにおいて顕著にアップレギュレートされることが記載されており(Weinberg et al., Circulation 106(23):2961-6 (2002))、予備的な結果から、慢性重症HFの例(Weinberg et al., Circulation 107(5):721-6 (2003))ならびに急性心筋梗塞(MI)の例(Shimpo et al., Circulation 109(18):2186-90 (2004))では、ST2濃度が上昇している可能性が示唆されている。
【0051】
膜貫通型のST2は、Tヘルパー2型細胞の応答の調節に役割を果たすと考えられており(Lohning et al., Proc. Natl. Acad. Sci. U. S. A. 95(12):6930-5 (1998);Schmitz et al., Immunity 23(5):479-90 (2005))、高度または慢性的な炎症の状態における寛容性の発達に役割を果たしている可能性もあり(Brint et al., Nat. Immunol. 5(4):373-9 (2004))、一方、可溶型のST2は増殖刺激を受けた線維芽細胞でアップレギュレートされる(Yanagisawa et al., 1992、前記)。実験データから、ST2遺伝子は、筋細胞の伸展状態において、BNP遺伝子の誘導と類似した様式で(Bruneau et al., Cardiovasc. Res. 28(10):1519-25 (1994))、顕著にアップレギュレートされることが示唆されている(Weinberg et al., 2002、前記)。
【0052】
Tominaga, FEBS Lett. 258:301-304 (1989)は、BALB/c-3T3細胞において増殖刺激によって特異的に発現されるマウス遺伝子を単離した;彼らはこれらの遺伝子の1つをSt2(Growth Stimulation-Expressed Gene 2の略として)と命名した。St2遺伝子は以下の2つのタンパク質産物をコードする:ST2、これは可溶性分泌型である;およびST2L、これはインターロイキン-1受容体と非常に類似した膜貫通型受容体である。HUGO Nomenclature Committeeは、そのヒト相同体をインターロイキン1受容体様物質1(IL1RL1)と命名しており、そのクローニングはTominaga et al., Biochim. Biophys. Acta. 1171:215-218 (1992)に記載されている。この2つの用語は本明細書において互換的に用いられる。
【0053】
ヒトST2の短い方である可溶性アイソフォームのmRNA配列はGenBank Acc. No. NM_003856.2に見ることができ、ポリペプチド配列はGenBank Acc. No. NP_003847.2にある;ヒトST2の長い方の型に対するmRNA配列はGenBank Acc. No. NM_016232.4にある;ポリペプチド配列はGenBank Acc. No. NP_057316.3にある。そのほかの情報は、公開データベース中のGeneID:9173;MIM ID # 601203およびUniGene No. Hs.66で入手可能である。一般に、本明細書に記載した方法では、可溶型のST2ポリペプチドを測定する。
【0054】
ST2を検出および測定するための方法は、例えば、米国特許公開第2003/0124624号、第2004/0048286号および第2005/0130136号に記載されているように、当技術分野で公知であり、それらの内容はすべて参照により本明細書に組み入れられる。例えば、Medical & Biological Laboratories Co., Ltd.(MBL International Corp., Woburn, MA)により製造されたST2 ELISA Kit、no. 7638のように、ST2ポリペプチドを測定するためのキットも市販されている。加えて、ST2および他のバイオマーカーを測定するためのデバイスは米国特許公開第2005/0250156号にも記載されている。
【0055】
いくつかの態様において、本方法は、RefSNP ID:rs1041973のヌクレオチド配列の実体を決定する段階を含む。
【0056】
IL-33
IL-33はST2のリガンドとして最近同定され、さまざまな炎症性疾患におけるIL-33のレベルの上昇の存在が記載されている(Schmitz et al., Immunity 23(5):479-90 (2005);米国特許公開第2005/0203046号を参照)。本明細書に記載した方法では、IL-33を、ST2の代わりに、またはそれに加えて測定することができる。ST2とIL-33との比を決定することもできる。
【0057】
IL-33の核酸配列はGenBank Acc. No. NM_033439.2に見ることができ、ポリペプチド配列はGenBank Acc. No. NP_254274.1にある。そのほかの情報は、そのほかの情報は、公開データベース中のGeneID:90865、MIM ID # *608678およびUniGene No. Hs.348390で入手可能である。IL-33は第9染色体オープンリーディングフレーム26(Chromosome 9 Open Reading Frame 26)(C9ORF26);高内皮性小静脈由来の核因子(Nuclear Factor from High Endothelial Venules)(NFHEV);およびインターロイキン33としても知られる。Baekkevold et al., Am. J. Path. 163:69-79 (2003)も参照のこと。
【0058】
IL-33のレベルを測定するための方法は当技術分野で公知であり、例えば、Schmitz et al., Immunity. 23(5):479-90 (2005)、および米国特許公開第2005/0203046号を参照されたい。
【0059】
その他のバイオマーカー
本明細書に記載した方法は、ST2および/またはIL-33に加えて、他のバイオマーカーのレベルを測定する段階も含みうる。適したバイオマーカーには、プロBNP、NT-プロBNP、BNP、NT-プロANP、プロANP、ANP、トロポニン、CRP、IL-6、Dダイマー、BUN、肝機能酵素、アルブミン、腎機能の指標、例えばクレアチニン、クレアチニンクリアランス値もしくは糸球体濾過値、および/または細菌エンドトキシンが含まれる。これらのバイオマーカーを測定するための方法は当技術分野で公知であり、例えば、Leeらに対する米国特許公開第2004/0048286号および第2005/0130136号;Dhalla et al., Mol. Cell. Biochem. 87:85-92 (1989);Moe et al., Am. Heart. J. 139:587-95 (2000);Januzzi et al., Eur. Heart J. 27(3):330-7 (2006);Maisel et al., J. Am. Coll. Cardiol. 44(6):1328-33(2004);およびMaisel et al., N. Engl. J. Med. 347(3):161-7 (2002)が含まれ、その内容はすべて参照により本明細書に組み入れられる。肝機能酵素には、アラニントランスアミナーゼ(ALT);アスパラギン酸トランスアミナーゼ(AST);アルカリホスファターゼ(ALP);および総ビリルビン(TBIL)が含まれる。
【0060】
これらの態様においては、ST2および/またはIL-33、ならびに1つまたは複数の追加的なバイオマーカーのレベルを決定し、バイオマーカーとその各々の参照標準レベルとの比較からの情報により、対象の死亡のリスクおよび/または対象における重大な疾患の存在に関する累積情報が与えられ、それは対象のリスクに関するより正確で具体的な情報を与えると思われる。続いてそれらのレベルを、それを上回れば対象は死亡のリスクが高い、および/または重大な疾患を有するという閾値比に相当する参照標準比と比較することができる。
【0061】
1つの例として、本方法は、NT-プロBNPおよびST2のレベルを決定する段階を含む。これらのレベルは、例えば表1Aに示されているように、対象の死亡のリスクを示す。
【0062】
(表1A) NT-プロBNPおよびST2の循環血中レベルに基づく死亡のリスク

【0063】
表1Aに示されているように、例えば正常患者または健常個体における死亡のリスクを上回らないといった、最も低い死亡リスクは、ST2およびNT-プロBNPの両方のレベルが低い場合に生じ、低いおよび最も高い死亡リスク、すなわち、低いおよび最も高い死亡リスク、すなわち、正常患者または健常個体よりも統計学的に有意に高いリスク、例えば、より20%高い死亡のリスク、例えば、より30、40または50%高いリスクは、ST2およびNT-プロBNPの両方のレベルが高い場合に生じる。
【0064】
もう1つの例として、本方法は、ST2およびBUNのレベルを決定する段階を含む。これらのレベルは、例えば表1Bに示されているように、対象の死亡のリスクを示す。
【0065】
(表1B) BUNおよびST2の循環血中レベルに基づく死亡のリスク

【0066】
表1Bに示されているように、例えば正常患者または健常個体における死亡のリスクを上回らないといった、最も低い死亡リスクは、ST2およびBUNの両方のレベルが低い場合に生じ、低いおよび最も高い死亡リスク、すなわち、正常患者または健常個体よりも統計学的に有意に高いリスク、例えば、30、40または50%より高いリスクは、ST2およびBUNの両方のレベルが高い場合に生じる。
【0067】
治療の選択‐積極的か保存的か
ひとたび対象のST2および/またはIL-33の循環血中レベルが所定の参照標準レベルを上回ることが決定されれば、その情報はさまざまなやり方で用いることができる。例えば、対象のST2レベルが、例えば参照標準レベルと比較して高値であれば、積極的に治療するという決断を下すことができ、対象を例えば、入院患者としての治療のために病院に、例えば急性期治療部門または集中治療部門に入院させることができる。携帯型検査キットは、対象をEDに搬送すべきか否かを判定するために、救急医療従事者が現場で対象を評価することを可能にすると考えられる。または、例えばEDまたは他の臨床環境におけるトリアージ上の決断を、本明細書に記載した方法によって得られる情報に基づいて下すこともできる。ST2および/またはIL-33のレベルが高い患者を、ST2またはIL-33のレベルがより低い者よりも優先することができる。
【0068】
本明細書に記載した方法はまた、対象が改善しつつあるか否か、例えば、治療に反応しているか、例えば、入院した対象が、退院させて外来ベースで経過観察できる程度に十分に改善したか否かに関する情報も提供する。一般に、これらの方法は、対象におけるST2および/またはIL-33のレベルを複数回決定する段階を含む。経時的なST2および/またはIL-33のレベルの低下は、対象が改善しつつある可能性が高いことを示す。また、対象が退院させられる程度に十分に改善したか否かを判定するために、本明細書に記載したように、最も最近のST2および/またはIL-33のレベルを閾値と比較することもできる。
【0069】
対象が、例えば相対的に高いリスクを伴う治療などの、臨床試験への組み入れに関して検討される場合も考えられる。その対象は、例えば、差し迫った死亡、例えば受診から30日以内または1年以内での死亡のリスクがより低い者に対して適切と考えられるよりも、相対的に高いリスクを伴うレジメンによって治療することができる。
【0070】
臨床環境にとどまらず、対象のST2および/またはIL-33に関する情報は、例えば、第三者支払人による支払いの決断のため、または保険提供者による医療もしくは生命保険料の設定のためといった、他のやり方に用いることができる。例えば、ST2および/またはIL-33の高いレベル、例えば、所定の閾値レベルを上回るレベルを利用して、対象に対する保険料を増額させるように決断することができる。
【0071】
患者集団
本明細書に記載した方法は、非常にさまざまな臨床的状況において有用である。例えば、本方法は、例えば、病院および外来診療所ならびにEDにおける医師によるスクリーニングを含む、一般集団のスクリーニングのために用いることができる。1つの例として、ST2および/またはIL-33のレベルを任意の時点で決定することができ、ST2および/またはIL-33のレベルが上昇しているならば、医師が適切に行動することができる。
【0072】
本明細書に記載した方法は任意の対象に対して任意の時点で用いうるが、それらは病状の診断または重症度を判定することが難しい対象に対して特に有用である。例えば、そのような対象は、非特異的な症状、例えば、特定の診断を示さない症状を呈する。非特異的な症状には、胸痛または不快感、息切れ、悪心、嘔吐、曖気、発汗、心悸亢進、頭のふらつき、倦怠感および失神が非限定的に含まれる。それぞれの症状にはさまざまな病因の可能性がある。
【0073】
胸痛
胸痛は外来受診の約1〜2パーセントを占める主訴であり、その原因は多くの場合は心臓性ではないものの、心疾患は依然として米国における死亡の主因である。このため、胸痛の重篤な原因と良性原因とを鑑別することが極めて重要である。本明細書に記載した方法は、この判定を下すのに有用である。
【0074】
胸痛を訴えてEDを受診する対象は、食道痛、潰瘍、肺塞栓(PE)(致命の恐れあり)などの急性肺疾患、瘤の破裂または解離(致命率が高い)、胆嚢発作、心嚢炎(心臓周囲の嚢の炎症)、狭心症(損傷を伴わない心臓痛)またはMI(致命の恐れあり)を有する可能性がある。正しい診断を直ちに下すのは難しい場合もあるが、対象を入院させるか、それとも彼らを保存的に治療するかに関する決断は一般に直ちに下されるべきである。本明細書に記載した方法が、対象の有害な臨床転帰、例えば差し迫った死亡または重大な疾患のリスクが高いことを示しているならば、その有害な転帰を防げるように、対象を積極的に治療するという決断を下すことができる。
【0075】
胸痛の治療および診断に関するそのほかの情報は、例えば、Cayley, Am. Fam. Phys. 72(10):2012-2028 (2005)に記載がある。
【0076】
呼吸困難
呼吸困難または息切れ(異常または不快な呼吸とも定義される)は、EDを受診する対象に一般的な症状である。呼吸困難に関する鑑別診断には、4つの一般的なカテゴリーが含まれる:(1)心臓性、(2)肺性、(3)心臓性と肺性の混合、および(4)心臓性でも肺性でもない。
【0077】
呼吸困難の心臓性原因には、結果的に収縮機能障害を伴う右室、左室または両心室のうっ血性心不全、冠動脈疾患、最近または陳旧性の心筋梗塞、心筋症、弁機能不全、結果的に拡張機能不全を伴う左室肥大、非対称性中隔肥厚、心嚢炎および不整脈が含まれる。
【0078】
肺性原因には、閉塞性プロセス(例えば、慢性閉塞性肺疾患(COPD)および喘息)および拘束性プロセス(例えば、肥満、脊柱または胸壁変形といった肺外の原因、および間質線維化、塵肺症、肉芽腫性疾患または膠原血管病といった肺固有の病態)が含まれる。
【0079】
心臓性と肺性の混合型の疾患には、肺高血圧および肺性心を伴うCOPD、デコンディショニング、肺塞栓ならびに外傷が含まれる。
【0080】
心臓性でも肺性でもない疾患には、貧血、糖尿病性ケトアシドーシスおよび代謝性アシドーシスの他のより一般的でない原因といった代謝性疾患、胸壁または体内の別の場所での疼痛、ならびに多発性硬化症および筋ジストロフィーなどの神経筋疾患が含まれる。閉塞性の鼻咽頭障害には、ポリープまたは鼻中隔弯曲による鼻閉塞、扁桃腺肥大、および声門上部または声門下部の気道狭窄が含まれる。
【0081】
結果的に過呼吸を伴う不安障害のように、呼吸困難が精神疾患の身体症状として現れることもある。
【0082】
呼吸困難の評価および治療に関するそのほかの情報は、例えば、Morgan and Hodge, Am. Fam. Phys. 57(4):711-718 (1998)に記載がある。
【0083】
特殊な集団
ある種の対象の集団は、本明細書に記載した方法によって特に恩恵を受けると考えられる。これらの対象には、腎機能に障害のある例(Anwaruddin et al., J. Am. Coll. Cardiol. 47(1):91-7 (2006);McCullough et al., Am. J. Kidney Dis. 41(3):571-9 (2003))、または過体重(体格指数(BMI)が25〜29)もしくは肥満(BMI>30)の例(Krauser et al., Am. Heart J. 149(4):744-50 (2005);McCord et al., Arch. Intern. Med. 164(20):2247-52 (2004))のように、BNPまたはNT-プロBNPがそれほど有用でない人々が含まれる。この分野では、疾患の程度が同じ場合に、BMIが高い患者では通常、ナトリウム利尿ペプチドのレベルが、体容量が正常な患者で予想されるよりも低いことが公知であり、受け入れられている;この現象の正確な機序は不明である。ST2の循環血中レベルはBMIによって影響されないことが示されているため、BMIの高い対象において、ST2レベルの決定はナトリウム利尿ペプチドレベルよりも有用である。したがって、本明細書に記載した方法は、対象のBMIを決定する段階を含み、対象が過体重または肥満であれば、本明細書に記載したように、患者をST2および/またはIL-33レベルの決定のために選択する。
【実施例】
【0084】
実施例
本発明について以下の実施例でさらに説明するが、これらは特許請求の範囲に記載された本発明の範囲を限定するものではない。
【0085】
実施例1:サンドイッチELISAアッセイ
本実施例は、Medical & Biological Laboratories Co., Ltd.(MBL International Corp., Woburn, MA)により製造されたST2 ELISA Kit、no. 7638.を使用する。このキットは、捕捉および検出の両方のためにモノクローナル抗体を利用するサンドイッチELISAアッセイである。この手順は、1:3の希釈係数で複数件ずつアッセイした試料の全プレートを分析することを意図しており、製造元のプロトコールに厳密に従う。キットは使用時まで4℃で保存すべきである。本実施例に記載した手順は、クエン酸またはEDTA抗凝固剤入りのチューブ内に収集したヒト血清または血漿に対して最適化されている。ヘパリンはST2と結合してこのELISAプロトコールによる測定の妨げになるため、ヘパリン抗凝固剤入りのチューブ内に収集した血漿はこのアッセイに用いるべきではない。血漿または血清試料は新鮮なまま用いてもよく、凍結保存してもよい。このアッセイは、血漿試料の最大3回までの凍結解凍サイクルによっては有害な影響を受けない。
【0086】
試薬は、アッセイを行う直前に新しいキットから新たに調製すべきである。使用前にキットを室温に対して平衡化させる。以下で明示的に考察していない試薬は、直ちに使える状態で製造元によって提供される。
【0087】
1.洗浄溶液‐洗浄溶液は製造元により10倍濃縮溶液として提供される。1リットルの洗浄溶液を作製するためには、提供された100mlの10倍濃縮液を900mlの蒸留水で希釈する。
【0088】
2.検出薬溶液‐検出薬溶液は、検出薬濃縮液を検出薬希釈液で1:101に希釈することによって調製する。96ウェルプレート全体の試料に対しては10mlの検出薬溶液が必要になる。10mlの検出薬溶液 を調製するためには、ピペットを用いて10mlの青色の検出薬希釈液を15mlのオレンジトップポリプロピレン製チューブに移す。検出薬濃縮液の100μlをこの容積の検出薬希釈液に添加する。
a.注:この試薬は、第1のアッセイのインキュベーション段階の間に調製すべきである。
【0089】
3.キャリブレータ貯蔵液‐キャリブレータタンパク質を再構成し、凍結乾燥させたタンパク質を、このロット製造のために製造元によって定められた量の蒸留水で希釈して、8ng/mlの貯蔵溶液を生じさせる。この容積の規定は製品の挿入物に含まれている。
【0090】
標準物質および試料の調製:
・以下のものはすべて、ラベル表示した1.5mlポリプロピレン製チューブ内で調製した上で、P200ピペッターを用いてアッセイプレートに移すべきである。
【0091】
標準物質:
標準曲線は、8ng/ml貯蔵溶液の2倍系列希釈を作成することによって調製する。
【0092】
1.P1000ピペットを用いて、250μlのアッセイ希釈液を、S1〜S8とラベル表示した8個の1.5mlポリプロピレン製チューブに移す。
【0093】
2.同じP1000ピペットを用いて、8ng/mlのキャリブレータ貯蔵溶液の250μlをチューブS1に移す。このチューブはこの時点で4ng/mlのキャリブレータタンパク質を有する。
a.泡を生じさせないように注意しながら3回穏やかにピペッティングすることによって十分に混合する。
【0094】
3.同じP1000ピペットを用い、以下のそれぞれに対して新たなチップを用いて、チューブS1の中の試薬250μlをチューブS2に移して混合を繰り返す。
【0095】
4.段階3を、S2からS3に、S3からS4に、S4からS5に、S5からS6、さらにS6からS7へと繰り返す。S8は試薬なしとするため、このウェルにはキャリブレータタンパク質を移さない。
a.チューブS1〜S6およびS8はこの時点で試薬250μlを有すると考えられ、チューブS7は450μlを有すると考えられる。
【0096】
試料:
プレートを、各試料が1:3希釈として2件ずつ分析されるように設定する。
【0097】
1.1.5mlポリプロピレン製チューブを各試料用にラベル表示する。
【0098】
2.P200ピペットを用いて160μlのアッセイ希釈液を各チューブに移す。
【0099】
3.P200ピペットを用いて、試料1からの80μlの血清または血漿をチューブ1に移す。泡が生じないように3回ピペッティングすることによって注意深く混合する。
【0100】
4.各試料について段階2を繰り返すことにより、試料を試料用チューブに移すことを繰り返す。
【0101】
手順:
1.P200ピペットを用いて、表2に示されているように、標準物質および希釈した血清試料を96ウェルアッセイプレートに迅速に添加する。
a.P200ピペットを100μlに設定する。
b.標準曲線用希釈物100μlを、アッセイプレート中のカラム1および2に移す。
c.血清試料のそれぞれの100μlを、アッセイプレートに対して、以下のプレートマップに示されたのと全く同じ位置に移す。
【0102】
2.アッセイプレートを用意された遮蔽物で覆い、室温で60分間インキュベートする。
【0103】
3.プレート自動洗浄器を用いてプレートを4回洗浄する。
【0104】
4.検出薬:8チャンネルのマルチチャンネルピペットを用いて、100μlの検出薬溶液を各ウェルに添加し、室温で60分間インキュベートする。
a.注:この試薬は第1のインキュベーション段階の間に調製することとした。
b.注:この試薬の添加のためには使い捨て式の試薬容器を用いる。各試薬に対して常に新たな使い捨て式の試薬容器を用いる。この段階の間にピケットチップを交換することは必要でない。
【0105】
5.段階3と同じようにプレートを洗浄する。
【0106】
6.基質:8チャンネルのマルチチャンネルピペットを用いて、100μlの基質を各ウェルに添加し、室温で30分間インキュベートする。
a.基質試薬は、直ちに使える状態で製造元によって提供される。
【0107】
7.停止:基質インキュベーションの完了時に、8チャンネルのマルチチャンネルピペットを用いて100μlの停止溶液を各ウェルに添加する。
a.停止溶液の試薬は、直ちに使える状態で製造元によって提供される。
【0108】
8.プレートを450nmで読み取り、620nmでバックグラウンド補正を行う。
a.プレートは反応を停止させた後に30分以内に読み取るべきである。
【0109】
9.吸光度の読み取り値を、用意された分析用のスプレッドシートに入力する。
【0110】
(表2) 例示的な96ウェルアッセイプレートのマップ

【0111】
表2は、例示的な96ウェルアッセイプレートのマップであり、列1には対照反応が用意されており、各試料1〜40は列3〜12で繰り返して分析される。
【0112】
実施例2 急性呼吸困難を有する患者の評価のための可溶性ST2濃度の測定
本実施例では、呼吸困難患者の評価のためのST2測定の有用性を評価した。
【0113】
本実施例で用いた対象は、救急部における呼吸困難に関するプロBNPの調査(ProBNP Investigation of Dyspnea in the Emergency Department)(PRIDE)試験に参加しており、これは、Massachusetts General HospitalのEDを受診した呼吸困難の対象599例に関する前向き盲検下試験であり、NT-プロBNP検査の診断的および予後判定的な利用の妥当性評価を目的として行われた。PRIDE試験の結果は最近報告されている(Januzzi et al., Am. J. Cardiol. 95(8):948-54 (2005))。
【0114】
急性HFの診断に関する至適基準(gold standard)は、NT-プロBNP値に関して盲検化され、受診時から60日間の追跡調査までの入手可能なすべての情報を得た、審査した医師の印象を基にした;診断が不確実であった少数の患者については、Framingham Heart Study(McKee et al., N. Engl. J. Med. 285(26):1441-6(1971))によって報告されたガイドラインを利用するように審査者が指導した。
【0115】
報告されている通り、PRIDE試験における対象のうち209例(35%)は、急性不安定化HFに起因する呼吸困難と判定され、そのうち17例はNew York Heart Association(NYHA)分類による軽症(クラスII)の症状を有し、80例は中等症(クラスIII)の症状を有し、112例は重症(クラスIVの症状)を有した。急性HFを有しなかった者の中で最も頻度の高かった診断は、閉塞性気道疾患の増悪であった(n=150;慢性閉塞性肺疾患の増悪(n=120)および喘息(n=30)ならびに急性肺炎(n=64)を含む。
【0116】
1年の終わりの時点で、各患者を管理する医師は、患者の生命の状態を確認するために接触した。報告されている通り、1年時の追跡調査は全体で597例の対象が終えた(Januzzi et al., Arch Intern Med 2006;166(3):315-20)。
【0117】
PRIDE試験では、NT-プロBNPは、市販のイムノアッセイ(ELECSYS(登録商標)プロBNPアッセイ、Roche Diagnostics, Indianapolis, IN)を確立された方法で用いることで測定された。PRIDE試験において、アッセイの試行間の変動係数は0.9%であった。受診時に収集した血液を、その後、本明細書の実施例1に記載したように、固相酵素免疫アッセイ(Medical & Biological Laboratories Co., Ltd.)を用いてST2の濃度に関して分析した。このアッセイは、ヒトST2に対するモノクローナル抗体を捕捉および検出の両方のために利用し、本分析における相対的な差のパーセンテージは17.5%であった。本試験のために用いた血漿は、以前に単一の凍結解凍サイクルに供せられていた。
【0118】
群間の比較
患者間の臨床的特性の比較を、カテゴリーデータに対するカイ二乗検定および連続データに対するWilcoxonの順位和検定を利用して行った。診断名、New York Heart Association(NYHA)症状クラスおよび転帰のカテゴリーの間でのST2濃度の比較は、ノンパラメトリック検定を用いて行った。
【0119】
相関
ST2およびNT-プロBNPの結果を、正規分布を成立させるために対数変換した。これらの対数変換した変数間の相関を、Spearman相関係数を用いて評価した。全対象(r=0.58、p<0.001)、急性HFを有しない例(r=0.47、p<0.001)および急性HFの例(r=0.40、p<0.001)のいずれにおいても、対数変換ST2およびlog-NT-プロBNPの濃度の間には弱い相関が認められた。
【0120】
カット点解析
0.20ng/mlを上回るか下回るかというST2濃度の関数としての患者特性は、偶発性HFの診断に合致する要因に関する有病率の期待値を示した表3に詳述されている。
【0121】
(表3) ST2濃度の関数としての試験対象の特性

【0122】
これらの結果は、ST2が一般的にはBMIとは相関しないが、血清クレアチニンレベルおよびクリアランス値、うっ血性心不全の既往ならびに糖尿病を含む、数多くの他の指標とは関連性があることを示している。
【0123】
実施例3 急性呼吸困難を有する患者における死亡のリスクの判定のための可溶性ST2濃度の測定
実施例2に記載した集団において、呼吸困難による受診後の1年以内の致死性を予測させる要因に関して評価した。候補となるST2の診断上のカット点を、STATA SWBOOTプログラムを用いるブートストラップ法を用いることによって評価した;続いて多変量ロジスティック回帰分析を行った。推算手順のそれぞれをプログラム言語でコード化し、続いて10件のブートストラップ反復ランダム標本に対するSTATAブートストラッププレフィクスコマンド(prefix command)にかけ、その後に初期解析で選択された変数に対して100回の反復を行った。ブートストラップの標本数は593とした(全データセットの数)。解析に入れた要因には、過去および現在の病歴、症状および徴候、薬剤の使用、ならびに放射線検査、心電図検査、血液学検査および血液化学検査を含む診断検査の結果からの要素を含めた。腎機能の指標には、血清クレアチニンの結果ならびに推算糸球体濾過値を含めた(Levey et al., Ann. Intern. Med. 130(6):461-70 (1999))。続いて、致死性に関する予測変数の候補(すなわち、ブートストラップ反復における選択が70回を上回るもの)を、多変量ロジスティック回帰分析に投入し、急性HFを従属変数とした。それぞれのロジスティック回帰に関して、結果は、セットを投入するための末端確率をp=0.01とし、回帰から効果を除外するためのものをp=0.02とする単回前向きステップ(single forward step)として投入し、適合度をHosmer-Lemeshow検定を用いて評価した。
【0124】
NT-プロBNPを含む致死性の解析において、この変数は、以前に特定されている通りに(Januzzi et al., 2006、前記)、1年以内の死亡を予測するための閾値を986pg/mlとした上で、二項対立的にモデル化された。SWBOOT試行の後に、その結果得られた妥当性が検証された独立変数の候補を、Cox比例ハザードモデルに段階的に投入した;このモデルに関して比率を確かめたところ、適切であることが見いだされた。1年までの死亡に関するそれぞれの独立予測変数に関して、ハザード比(HR)を95% CI(信頼区間)とともに求めた。
【0125】
ST2濃度(ならびに診断)の関数として分けた群における1年以内での死亡率を比較するために、死亡率の有意性を比較するためのログランク検定を用いて、Kaplan-Meier生存曲線を作成した。
【0126】
すべての統計分析に関して、SPSS(Chicago, IL, USA)またはSTATA(College Station, TX)ソフトウエアを用いた;p値はすべて両側性とし、合成の結果が0.05未満を有意とみなした。
【0127】
1年以内に、93例の対象(15.7%)が死亡した。ST2濃度の中央値は、死亡者(1.03ng/ml、IQR(四分位範囲)=0.38〜2.43)の方が生存者(0.18ng/ml、IQR=0.08〜0.51;p<0.001)よりも有意に高かった。死亡者でST2濃度がより高いというこのパターンは、対象を急性HFのない者(1.14対0.13ng/ml;p<0.001)、ならびに急性HFを有する者(0.90対0.45ng/ml;p<0.001)の関数と考えた場合も同じく保たれた。
【0128】
ST2に関して、Analyse-Itソフトウエア(Analyse-It, Ltd, Leeds, UK)を用いた受診者動作特性(ROC)曲線分析を、HFの至適基準による診断または1年以内の生存を参照標準として用いて行い、曲線下面積(AUC)を推算した;続いて、診断および予後の両方に関して有望なカット点を特定し、それらの感度、特異度、ならびに陽性適中率および陰性適中率(PPV、NPV)を推算した。至適ROC-至適カット点の有用性をさらに評価するために、患者をそのST2濃度に基づく十分位数にも分け、死亡の度数に対するST2閾値効果について評価した。
【0129】
ROC分析により、ST2および1年での致死性に関するAUCは0.80(95% CI=0.75〜0.84、p<0.001)であることが示された(図1);ROCによって特定された至適カット点は0.29ng/mlであり、これは感度87%(95% CI=79〜93%)、特異度63%(95% CI=58〜67%)であり、PPVは30%、NPVは96%であった。十分位数分析において、致死性に関する閾値効果はST2の中央値0.20ng/mlで認められた(図2)。ST2濃度と死亡の尤度との間の段階的な関係も見いだされ、ST2濃度が中央値未満であった対象(n=236)は死亡率が最も低く(2%)、これに対して最上位の2つの十分位数(n=117)は1年以内の死亡率が42%であり、HRは43.0(95% CI=15.0〜123.0、p<0.001)であった。
【0130】
1年以内の死亡の予測のための最後のブートストラップモデルにおいては(表4)、0.20ng/ml以上のST2濃度が100回の反復のうち96回で選択され、息切れの患者において1年以内の死亡の予測変数が最も強力であった(HR=5.6、95% CI=2.2〜14.2;p<0.001)。注目されることとして、NT-プロBNPをモデルに含めた場合であっても、0.20ng/ml以上のST2はブートストラップ反復において最も選択された変数であり(100回の選択のうち86回)、依然として、1年以内の死亡に関する最も強い予測変数であった(HR=4.6、95% CI=1.8〜11.8;p=0.002)。
【0131】
(表4) 呼吸困難の対象における1年以内の死亡に関する独立予測変数の同定

【0132】
表4の結果は、100回のブートストラップ反復に続いて、多変量Cox比例ハザード分析を行ったものに基づき、NT-プロBNPの結果がモデルに存在する場合と存在しない場合が示されている。ブートストラップ反復において100回のうち70回を超えて選択された変数のみを示している。
【0133】
Kaplan-Meierハザード曲線は、ST2濃度が0.20ng/ml以上であった対象では死亡率が組み入れ時から急に上昇し、1年以内を通して上昇し続けることを示している。(図3A;ログランクp値<0.001)。受診時に急性HFと診断されなかった者および診断された者においても、0.20ng/ml以上のST2値に関して同様の関係がみられる(図3B;ログランクp値はいずれも<0.001)。
【0134】
したがって、ST2レベルは致死性に関する優れた予測変数である。
【0135】
実施例4 急性呼吸困難を有する患者における死亡のリスクの判定のための可溶性ST2およびNT-プロBNP濃度の測定
【0136】
ST2およびNT-プロBNPが両方とも1年以内の死亡に関する独立した予測変数であったことから、ST2およびNT-プロBNP濃度の関数としての対象における粗死亡率について、上記の方法を用いて検討した。各カテゴリーにおける死亡した対象のパーセンテージを表5に示している。
【0137】
(表5) PRIDE試験におけるNT-プロBNPおよびST2濃度の関数としての死亡率

【0138】
PRIDE試験における対象の死亡の大半は、ST2のレベル(0.20ng/mlと等しいかそれ以上)およびNT-プロBNPのレベル(986pg/mlと等しいかそれ以上)が高値であった者に起こった(表5および図4)。
【0139】
したがって、NT-プロBNPおよびST2のレベルの組み合わせは、死亡のリスクの予測に有用である。
【0140】
実施例5 MIが存在しない患者におけるST2濃度の上昇
胸痛でEDを受診した350例の患者の集団において、以上の実施例1のようにST2濃度を決定した。血清試料を入手し、ほとんどの患者に関してST2測定をベースライン時ならびに90分後および180分後に行った。同じくほとんどの患者に関して、ベースライン時の試料は症状の発現から2時間以内に収集した。
【0141】
17例の患者は最終診断がMIと下され、このうち5例はST2が0.23以上であった(0.25〜0.65)。これらの患者のうち2例はトロポニン陰性であった。11例の患者はST2レベルが非常に高値であったが(0.97〜9.22)、これらの患者はいずれもMIとは最終診断されず、ただし全例がCOPD、リンパ腫、敗血症、アルコール乱用および肺塞栓を含む重大な疾患を有した。これらの11例の患者に関する診断名を表6に示している;ST2 1はベースラインレベルであり、ST2 2は90分後、ST2 3は180分後である。
【0142】
(表6) ST2レベルが高かった非MI患者

【0143】
これらの結果は、ST2高値が、基礎をなす病態にかかわらず、重大な疾患と関連があることを実証している。
【0144】
実施例6 急性非代償性心不全(ADHF)で入院した患者におけるST2濃度の連続分析
急性非代償性心不全(ADHF)と診断されてSan Diego Veterans' Administration Hospitalに入院した150例の対象の集団において、以上の実施例1のようにST2濃度、さらにBUN、NT-プロ-BNPおよびBNPの濃度を決定した。患者の中にはADHFと新たに診断された者もおり、既存の心不全の急性増悪を有した者もあった。すべての患者で毎日試料が得られたわけではなかったが、多くの患者で試料を連日採取した。これらの患者に関する入院日数(LOS)は1〜24日の範囲であり、平均5日であった。表7はこの集団の特性を示している;予想された通り、この集団がSan Diego Veteran's Hospitalから得られたことを考えると、この集団は圧倒的に男性および白人が優位であった。
【0145】
(表7) 患者特性の度数

* NYHA=New York Heart Associationによる心不全のステージ:
クラスI:身体活動の制限なし。通常の身体活動は過度の倦怠感、心悸亢進および呼吸困難(息切れ)を引き起こさない。
クラスII:身体活動の軽度の制限。安静時は楽であるが、通常の身体活動は倦怠感、心悸亢進または呼吸困難をもたらす。
クラスIII:身体活動の著しい制限。安静時は楽であるが、通常程度を下回る活動で倦怠感、心悸亢進または呼吸困難を引き起こす。
クラスIV:不快感を伴わずにいかなる身体活動も行うことができない。安静時に心不全の症状がある。いかなる身体活動を行っても不快感が増す。
【0146】
この患者の集団を少なくとも90日追跡し、有害イベントを表にまとめた。イベントの概要は表8に示されている。
【0147】
(表8) イベントの概要

* 90日の転帰の度数は、それ以前の時点に起こったすべてのイベントの累積である。
【0148】
入院時および退院時のBNP、NT-プロBNPおよびST2のレベルの相関に関して、本明細書に記載したように、受診者動作特性および曲線下面積(AUC)を決定し、有害事象とともに表8に一覧にして示した。結果は表9に示されている。最初から最後までのST2の変化に関するAUC=0.820である。
【0149】
(表9) ROCの概要(AUC)

【0150】
この小規模かつ極めて均一な集団において、報告されたイベントを最も正確に予測したバイオマーカーには、30日および90日での死亡に関するST2の変化、ならびに30日および90日での死亡に関する退院時のNT-プロBNPレベルが含まれた。予想された通り、このコホートの均一性のため、各バイオマーカーに関する入院時の測定を用いたAUCは、PRIDEコホートで(実施例2〜3に記載)で観察されたものよりも小さかった。PRIDEコホートでは心不全と診断されなかった患者が多数に上ったことが、入院時測定でのST2の高い鑑別力をもたらした。すべての患者がすでに心不全と診断されているという、この特化したコホートでは、入院時のST2レベルは幾分上昇していることが予想される;その結果として、一般的集団をより代表する不均一なコホートと比較して、以後のイベントの予測力が幾分減じられる。
【0151】
90日での死亡に関する予測変数の単変量モデルを、同じマーカー、ならびに腎機能のマーカーであるBUNおよびクレアチニンクリアランス値を用いて解析した。その結果は表10に示されている。
【0152】
(表10) 90日での致死性に関する単変量予測変数

【0153】
この解析では、二項変数(BUNおよびクレアチニンを除くすべて)に関して、オッズ比は、検査陽性と検査陰性との比較で、90日以内の死亡のオッズの増加を表す。連続変数(BUNおよびクレアチニン)に関して、オッズ比は、1mg/dLの上昇毎に90日以内の死亡のオッズの増加を表す。表10に示されているように、ST2の変化は、90日での致死性に関する最も優れた指標であり、ORは11.55(p=0.002)であった。
【0154】
BNP、NT-プロBNP、BUNおよびクレアチニンクリアランス値のレベルをST2の変化とともに含めた多変量モデルも構築した。その結果は表11に示されている。
【0155】
(表11) ST2の変化と併せた、90日での致死性に関する予測変数

【0156】
ST2の変化(ST2レベル間の差)のみを考慮した場合、モデルに関するR2は0.223であった。表11に見てとれるように、各々の場合で、ST2の変化はp値がより小さいことからより強力な予測変数であった。さらに、ST2の変化を上回るさらなる予測性を与え、統計学的な有意性(p<0.05)を達成したのは、入院時NT-プロBNP、退院時NT-プロBNPおよび入院時BUNのみであり(太字のR2値を参照)、一方、退院時BNPは弱い統計学的有意性を達成した(p=0.07)。
【0157】
次に、ROCを、BNPの変化およびST2の変化に関して比較した。図5に示されているように、入院期間中のBNPの変化に関するAUCは0.67であり、一方、ST2の変化に関するAUCは0.78と有意に高く、このことはST2の変化が、90日での致死性に関してBNPよりもはるかにより正確な予測変数であることを示している。
【0158】
ST2の変化をBUNレベルとともに分析し、この2つのマーカーを一緒に用いた場合にさらなる予測情報が得られるか否かについて判定した。図6に示された結果は、BUNレベル、およびST2レベルの変化は、患者をリスク別にカテゴリー化するために用いうることを実証している:BUNのレベルが低く(40mg/dL未満)、かつST2のレベルの低下が15%またはそれ以上であった患者は、リスクのレベルが最も低かった;BUNがより高く、ST2のレベルの低下が15%未満であった(または上昇した、もしくは変わらず保たれた)患者は、リスクのレベルが最も高く、一方、BUNが高値かつST2の低下が少なくとも15%である対象、またはBUNが低値かつST2の低下が15%もしくはそれ以上である対象は、リスクのレベルが中等度であった(それでも最もリスクの低いカテゴリーよりははるかに高かった、図6参照)。
【0159】
第1および第2のST2測定の間の至適な時間の長さを決定するために、経時的なST2レベルの変化を時間差的に評価した。表11Aおよび11Bに示された結果は、ST2の第1および第2の測定の間の、少なくとも2日かつ4日以内という時間差により、90日以内の死亡の尤度に関して最も優れた情報が与えられることを示している。
【0160】
(表11A) 経時的なST2値の概要

【0161】
(表11B) ST2値と90日以内の致死性との相関

【0162】
表11Bにおいて、「N>0.85」は、指定の時間にわたるST2の低下が15%未満(このため第2のレベルは第1のレベルの85%またはそれ以上である)であった人々の数を示している。少なくとも2日後には、比が0.85またはそれ以上であって死亡した人々のパーセンテージは20%を上回り、一方、比が0.85未満であって死亡した患者のパーセンテージは最初に低下し、低いまま保たれた。
【0163】
経時的な平均ST2値をこの集団で追跡したところ、表12Aならびに図7Aおよび7Bに示されているように、最初の測定を行ってから3〜4日後に、90日以内の死亡のリスクの相関の明らかな増加が認められた。第25および第75パーセンタイルを枠で囲んだホイスカーボックスプロットである図7Bは、生存者と死亡者との鑑別がST2値によって明らかに分離して得られることを示している。ST2の結果は、BNPまたはNT-プロBNPのいずれかをこれらと同じ治療日に関して比較することによって得られる結果とは対照的である。図7Cおよび7Dに示されているように、これらのマーカーのそれぞれに関する平均値は生存者と死亡者との間で異なるものの、これらの群は統計学的に互いに明確に異なるわけではない。ST2とは異なり、BNPおよびNT-プロBNPに関する生存者群と死亡者群は第一四分位数(25パーセンタイル)と第三四分位数(75パーセンタイル)との間でかなり重なる。この解析において、ST2は、入院期間中の経時的な変化の関数として死亡率を予測する上で、BNPまたはNT-プロBNPの単独よりも正確なマーカーである。
【0164】
ST2の平均比を算出したところ、この場合も有意差が認められた;その結果は表12Bおよび図8に示されている。
【0165】
(表12A) 経時的な平均ST2値

【0166】
(表12B) 経時的なST2の変化

【0167】
また、表12Cに示されているように、これらの患者のリスク層別化をさらに精緻化するために、2×2マトリックス解析でST2の比をNT-プロBNPの比とともに用いることも可能である.
【0168】
(表12C) リスク層別化のためのST2の変化およびNT-プロBNPの変化

【0169】
これらの結果は、経時的なST2の変化が、単変量または多変量のいずれの予測分析においても、例えば90日以内の致死性に関する強力な予測変数であることを実証している;ST2の変化はこの集団における患者転帰に関する最も強い単変量予測変数であることが示され、至適適中率は入院3日後に認められた。ST2の変化のデータを腎機能の指標(例えば、BUN)と組み合わせることにより、さらなる適中率が得られ、ST2の変化とともにNT-プロBNPの測定を含めた場合も同様であった。
【0170】
実施例7 肺疾患を有する患者におけるリスク層別化のためのST2濃度
PRIDEの集団(実施例2および3に記載)における599例の対象のうち、209例は急性非代償性心不全(ADHF)を有した。残りの390例の対象のうち、236例は「肺疾患」を有した;データが入手可能な者のうち、5例は合併症のない気管支炎を有し;18例は肺塞栓(PE)を有し;64例は肺炎を有し;149例はCOPD/喘息を有した。COPD/喘息を有する149例のうち、69例は喘息を有し;67例は気腫を有し;13例は慢性気管支炎を有した。
【0171】
これらの患者におけるリスクのマーカーとしてのST2の有用性を評価するために、ST2レベルを各診断カテゴリーにおいて判定した。各診断カテゴリーに関する濃度を表13に示している。
【0172】
(表13) 診断名別のST2濃度

【0173】
ST2濃度を1年時点での死亡に関してROC分析を用いて評価し、死亡者および1年時点の生存者における濃度を比較した。死亡率をST2濃度の関数として1年時まで分析した。その結果は表14および図9〜11に示されている。
【0174】
(表14) 診断名別の死亡率

【0175】
これらの結果は、図9に示されているように、ST2濃度が優れた特異度および感度を示したことを実証している(ROC下面積=0.73;95% CI=0.62〜0.83;P<0.0001)。至適カット点は0.20ng/mlであり、感度88%、特異度52%であった(PPV=22%;NPV=96%)。図10はこの要点をさらに例証している。1年時点で生存していた対象に関するST2濃度の中央値は0.19ng/mlであった(IQR 0.08〜0.59、n=211);一方、1年以内に死亡した対象における濃度の中央値は1.19ng/mlであった(IQR 0.28〜2.2、n=25)。さらに、図11に示されているように、0.2ng/ml閾値を用いたところ、死亡率はST2濃度の関数として劇的に増加した。
【0176】
1年時点での死亡に関する独立予測変数を同定するために、多変量Cox比例ハザード分析を用いた;その結果は表15に示している。
【0177】
(表15) 肺疾患における死亡に関する独立予測変数

【0178】
これらのデータは、呼吸困難を呈する対象において、基礎をなす病態にかかわらず、ST2レベルが1年以内の死亡に関する優れた予測変数であることを実証している。
【0179】
実施例8 ST2濃度は腎機能不全によっては影響されない
中等症ないし重症の腎機能不全を有する135例の患者の集団において、ST2濃度に対する腎障害の影響を評価した。いずれの患者も透析を受けておらず、過去にCVDと診断された例も皆無であった。患者はすべて、腎機能の指標として、腎疾患における食事の修正(Modification of Diet in Renal Disease)(MDRD)法によって判定された糸球体濾過値(GFR、ml/分単位)を用いて評価された。潜在性CVDを検出するために、各対象に対して心エコー検査および冠動脈カルシウム(CAC)測定も行った。複数のバイオマーカーについても評価した。
【0180】
このコホートに関する記述統計量を表16に示している;平均GFRおよびST2は、図12A〜Bにグラフ表示されている。
【0181】
(表16) 糸球体濾過値(GFR)およびST2レベル

【0182】
安定した慢性疾患を有するこの患者コホートにおいて、ST2レベルが0.2を上回ったのは10例(8%)のみであり、最も高かったのは0.476ng/mlであった。ST2値の分布は図13に示されている。このことは、管理下にある慢性腎機能不全を有するこの対象の集団において予想された通りであった;極めて高いST2レベルが認められると予想する者はいないであろう。
【0183】
ST2レベルとGFRとの間に相関があるか否かを判定するために、この集団においてピアソン相関分析を行った。その結果は表17および18に示されている。
【0184】
(表17) ピアソン相関の結果‐GFRおよびST2

【0185】
(表18) ピアソン相関の結果‐クレアチニンクリアランス値およびST2

【0186】
これらの結果は、管理下にある慢性腎機能不全を有するこの対象の集団において予想された通り、この集団では、ST2レベルとGFR(p=0.75)との間にも、クレアチニンクリアランス値(p=0.851)との間にも相関はみられなかった。このことは、腎機能不全がそれ自体ではST2レベルの上昇を引き起こさないことを示している。
【0187】
同じ分析を、San Diego Veteran's Administration Hospitalの139例の対象の集団にも行った。対象はすべて過去に急性非代償性心不全(ADHF)と診断されており、平均ST2レベルは、慢性腎機能不全を有するがHFは有しない患者の集団の約2倍であった(表17〜18を参照)。腎機能不全と心不全との間には遍在的な相関がみられ、ステージIII/IVのHFを有する患者のほぼ80%は、腎機能に障害がある者と重なる(Fonarow and Heywood, Am. J. Med. (2006) 119(12A):S17-S25。したがって、ADHFはST2レベルと相関することから、腎機能不全(GFRにより計測)とST2レベルとの間には相関がみられると期待される。表19および20に示されているように、このことがまさに認められた。
【0188】
(表19) ピアソン相関の結果‐ADHFにおけるGFRおよびST2

【0189】
(表20) ピアソン相関の結果‐ADHFにおけるGFRおよびST2比

【0190】
これらの結果は、ADHFを有する対象では、ST2値が、単一のレベルまたは比のいずれとして表されるかにかかわらず、腎機能不全の指標と相関しており、しかしながら腎機能不全とは独立していることを実証している。
【0191】
実施例9 死亡のリスクはST2濃度と相関する
PRIDE試験に参加した対象および実施例8に記載した集団の退役軍人において、死亡のリスクの増大について評価した。
【0192】
0.2および0.7ng/mlという両方のST2閾値を、集団全体(表21)およびADHFサブセットのみ(表22)を対象に評価した。この2つの閾値の最大の違いは、いずれの患者セットにおいても0.7ng/mlの閾値の方がPPVが増加し、NPVが減少することであった。
【0193】
(表21) PRIDEコホートにおけるST2レベル別の死亡率

【0194】
この集団において、0.2ng/mlに関するNPVは98.2%であり、0.7ng/mlに関するものは90.8%である。
【0195】
(表22) ADHFを有する対象におけるST2レベル別の死亡率

【0196】
このコホートにおいて、0.2ng/mlに関するNPVは97.6%であり、0.7ng/mlに関するものは79.5%である。
【0197】
VET試験からのST2比に関する結果は表23に示されている。
【0198】
(表23) 慢性腎不全を有する対象における死亡率

【0199】
この測定に関してNPVは96.2%である。
【0200】
その他の態様
本発明をその詳細な記載とともに説明してきたが、以上の説明は本発明を例示するためのものであって、その範囲を制限するものではなく、それは添付する特許請求の範囲によって規定されることが理解される必要がある。その他の局面、利点および修正は本発明の範囲に含まれる。
【特許請求の範囲】
【請求項1】
対象からの試料におけるST2、IL-33またはその両方のバイオマーカーレベルを決定する段階;および
試料におけるバイオマーカーレベルを参照標準(reference)バイオマーカーレベルと比較する段階
を含む、 対象に関して、特定された期間内での死亡のリスクを評価するための方法であって、
参照標準バイオマーカーレベルと比較した、試料におけるバイオマーカーレベルにより、特定された期間内での対象の死亡のリスクが示される、方法。
【請求項2】
対象からの試料におけるST2、IL-33またはその両方のバイオマーカーレベルを決定する段階;および
試料におけるバイオマーカーレベルを参照標準バイオマーカーレベルと比較する段階
を含む、対象における疾患の重症度を決定するための方法であって、
参照標準バイオマーカーレベルと比較した、試料におけるバイオマーカーレベルにより、対象が重大な疾患を有するか否かが示される、方法。
【請求項3】
特定された期間が1年である、請求項1記載の方法。
【請求項4】
対象が1つまたは複数の非特異的な症状を呈する、請求項1または2記載の方法。
【請求項5】
1つまたは複数の非特異的な症状が、胸痛または不快感、息切れ、悪心、嘔吐、曖気、発汗、心悸亢進、頭のふらつき、倦怠感、および失神からなる群より選択される、請求項4記載の方法。
【請求項6】
参照標準バイオマーカーレベルが、1年以内の死亡のリスクが低いことに対応するレベルに相当する、請求項1記載の方法。
【請求項7】
参照標準バイオマーカーレベルが、重大な疾患を有しない対象に対応するレベルに相当する、請求項2記載の方法。
【請求項8】
試料が血清、血液、血漿、尿または体組織を含む、請求項1または2記載の方法。
【請求項9】
バイオマーカーがST2であり、参照標準レベルが約0.2〜0.3ng/ml血清であり、試料におけるレベルが参照標準レベルよりも高いかそれと等しいことにより、ST2レベルが参照標準レベル未満である対象と比較して、対象の1年以内の死亡のリスクが高いことが示される、請求項1または2記載の方法。
【請求項10】
対象が心血管疾患を有しない、請求項1または2記載の方法。
【請求項11】
対象が肺疾患を有する、請求項1または2記載の方法。
【請求項12】
対象が肝疾患を有する、請求項1または2記載の方法。
【請求項13】
参照標準と比較した、試料におけるバイオマーカーレベルにより、対象が特定された期間内に病院に再入院すると考えられるか否かが示される、請求項2記載の方法。
【請求項14】
試料における補助的バイオマーカーのレベルを決定する段階;および
試料における補助的バイオマーカーのレベルを補助的バイオマーカー参照標準レベルと比較する段階
をさらに含む方法であって、
補助的バイオマーカー参照標準レベルと比較した、試料における補助的バイオマーカーのレベルと、バイオマーカー参照標準レベルと比較した、試料におけるバイオマーカーのレベルとの組み合わせにより、対象の死亡のリスクが高いか否かが示される、請求項1記載の方法。
【請求項15】
試料における補助的バイオマーカーのレベルを決定する段階;および
試料における補助的バイオマーカーのレベルを補助的バイオマーカー参照標準レベルと比較する段階
をさらに含む方法であって、
補助的バイオマーカー参照標準レベルと比較した、試料における補助的バイオマーカーのレベルと、バイオマーカー参照標準レベルと比較した、試料におけるバイオマーカーのレベルとの組み合わせにより、対象が重大な疾患を有するか否かが示される、請求項2記載の方法。
【請求項16】
補助的バイオマーカーが、トロポニン、脳性ナトリウム利尿ペプチド(BNP)、プロBNP、NT-プロBNP、心房性ナトリウム利尿ペプチド(ANP)、NT-プロANP、プロANP、C反応性ペプチド(CRP)、クレアチニン、クレアチニンクリアランス値、糸球体濾過値(GFR)、Dダイマー、血中尿素窒素(BUN)、アルブミン、肝機能酵素、細菌エンドトキシン、および上記の2つまたはそれ以上の任意の組み合わせからなる群より選択される、請求項14または15記載の方法。
【請求項17】
対象がBMI 25〜29である、BMI 30以上である、または腎機能不全を有する、請求項1または2記載の方法。
【請求項18】
試料におけるST2のレベルおよびIL-33のレベルを決定する段階;
試料におけるST2:IL-33の比を決定する段階;ならびに
ST2:IL-33の比を参照標準比と比較する段階
を含む方法であって、
参照標準比と比較した、試料におけるST2:IL-33の比により、対象が重大な疾患を有するか否かが示される、請求項2記載の方法。
【請求項19】
参照標準比と比較した、試料におけるST2:IL-33の比により、対象が1年以内に病院に入院または再入院する尤度が高いことが示される、請求項18記載の方法。
【請求項20】
試料におけるST2のレベルおよびIL-33のレベルを決定する段階;
試料におけるST2:IL-33の比を決定する段階;ならびに
ST2:IL-33の比を参照標準比と比較する段階
を含む方法であって、
参照標準比と比較した、試料におけるST2:IL-33の比により、対象の死亡のリスクが高いか否かが示される、請求項1記載の方法。
【請求項21】
特定の期間が1年である、請求項20記載の方法。
【請求項22】
試料における(i)NT-プロBNP、プロBNPまたはBNP、および(ii)ST2のレベルを決定する段階を含む、請求項21記載の方法。
【請求項23】
試料における(i)NT-プロBNPおよび(ii)ST2のレベルを決定する段階を含む方法であって、対象の1年以内の死亡のリスクが以下の表:

に従って決定される、請求項21記載の方法。
【請求項24】
試料における(i)BUNおよび(ii)ST2のレベルを決定する段階を含む方法であって、対象の1年以内の死亡のリスクが以下の表:

に従って決定される、請求項21記載の方法。
【請求項25】
対象におけるST2、IL-33またはその両方の第1のバイオマーカーレベルを入手する段階;
第2の時点で対象における同じバイオマーカーの第2のレベルを入手する段階;ならびに
第1および第2のバイオマーカーレベルを比較する段階
を含む、対象を評価する方法であって、
第1および第2のバイオマーカーレベルの間の差により、対象の病状が示される、方法。
【請求項26】
第1のST2のレベルが所定の参照標準を上回る場合その対象を選択する段階をさらに含む、請求項25記載の方法。
【請求項27】
第1のバイオマーカーレベルを入手した後、かつ第2のバイオマーカーレベルを入手する前に、対象に対して治療を施す段階をさらに含む、請求項25記載の方法。
【請求項28】
第2のバイオマーカーレベルが第1のバイオマーカーレベルよりも低いことにより、治療が有効であることが示される、請求項27記載の方法。
【請求項29】
第1から第2へのバイオマーカーレベルの低下により、対象の病状が改善したことが示される、請求項25記載の方法。
【請求項30】
第1から第2へのバイオマーカーレベルの有意でない低下、変化がないこと、または上昇により、対象が重大な疾患を有することが示される、請求項25記載の方法。
【請求項31】
第1から第2へのバイオマーカーレベルの有意でない低下、変化がないこと、または上昇により、対象が特定された期間内に病院に再入院する尤度が高いことが示される、請求項25記載の方法。
【請求項32】
バイオマーカがST2であり、ST2レベルの低下が15%未満であることにより、対象が重大な疾患を有することが示される、請求項25記載の方法。
【請求項33】
少なくとも第1の補助的バイオマーカーレベルを入手する段階;および
試料における補助的バイオマーカーのレベルを補助的バイオマーカーの参照標準レベルと比較する段階
をさらに含む方法であって、
参照標準と比較した、試料における補助的バイオマーカーのレベルと、ST2のレベル間の差との組み合わせにより、対象の死亡のリスクが高いか否かが示される、請求項25記載の方法。
【請求項34】
補助的バイオマーカーが、NT-プロBNP、プロBNPおよびBNPからなる群より選択される、請求項33記載の方法。
【請求項35】
補助的バイオマーカーがBNPであり、退院させるか入院患者として治療を継続するかに関する決断が、以下の表:

に従って行われる、請求項33記載の方法。
【請求項36】
対象における少なくとも第1、第2および第3のバイオマーカーレベルを決定する段階、ならびにレベルを比較する段階を含む、請求項25記載の方法。
【請求項37】
対象が1つまたは複数の非特異的な症状を呈する、請求項25記載の方法。
【請求項38】
1つまたは複数の非特異的な症状が、胸痛または不快感、息切れ、悪心、嘔吐、曖気、発汗、心悸亢進、頭のふらつき、倦怠感、および失神からなる群より選択される、請求項37記載の方法。
【請求項39】
試料が血清、血液、血漿、尿または体組織を含む、請求項25記載の方法。
【請求項40】
第1および第2のバイオマーカーレベルの間の差により、対象に関して、特定された期間内での対象の死亡のリスクが示される、請求項25記載の方法。
【請求項41】
特定された期間が1年である、請求項40記載の方法。
【請求項42】
バイオマーカーがST2であり、ST2レベルの有意でない低下、変化がないこと、または上昇により、対象の1年以内の死亡のリスクが高いことが示される、請求項41記載の方法。
【請求項43】
バイオマーカーがST2であり、ST2レベルの15%未満の低下により、対象の1年以内の死亡のリスクが高いことが示される、請求項41記載の方法。
【請求項44】
対象が心血管疾患を有しない、請求項25記載の方法。
【請求項45】
対象が肺疾患を有する、請求項25記載の方法。
【請求項46】
対象が肝疾患を有する、請求項25記載の方法。
【請求項47】
試料における第1の補助的バイオマーカーのレベルを入手する段階;
試料における少なくとも第2の補助的バイオマーカーのレベルを入手する段階;ならびに
補助的バイオマーカーの第1および第2のレベルを比較する段階
をさらに含む方法であって、
試料における補助的バイオマーカーのレベルの差と、ST2のレベル間の差との組み合わせにより、対象の病状が示される、請求項25記載の方法。
【請求項48】
第1および第2のバイオマーカーレベルを入手する間に少なくとも2日間が経過している、請求項25記載の方法。
【請求項49】
第1の血清試料を対象から入手する段階;
第1の試料におけるST2のレベルおよび第1の試料におけるBUNのレベルを決定する段階;
第2の血清試料を対象から入手する段階;
第2の試料におけるST2のレベルを決定する段階;
第1および第2の試料におけるST2のレベルを比較して、ST2の比を決定する段階;
第1の試料におけるBUNのレベルを、事前に選択した参照標準レベルと比較する段階;ならびに
ST2の比を参照標準比と比較する段階
を含む、1つまたは複数の非特異的な症状を呈する対象に関して、特定の期間内での死亡のリスクを評価するための方法であって、
参照標準比および参照標準レベルと比較した、第1および第2の試料におけるST2の比、ならびに第1の試料におけるBUNのレベルにより、対象の死亡のリスクが示される、方法。
【請求項50】
特定の期間が1年である、請求項49記載の方法。
【請求項51】
対象の1年以内の死亡のリスクが以下の表:

に従って決定される、請求項49記載の方法。
【請求項52】
ST2に対する抗体およびIL-33に対する抗体のうち一方または両方、ならびに請求項1〜51のいずれか一項記載の方法を実施するための説明書を含む、キット。
【請求項1】
対象からの試料におけるST2、IL-33またはその両方のバイオマーカーレベルを決定する段階;および
試料におけるバイオマーカーレベルを参照標準(reference)バイオマーカーレベルと比較する段階
を含む、 対象に関して、特定された期間内での死亡のリスクを評価するための方法であって、
参照標準バイオマーカーレベルと比較した、試料におけるバイオマーカーレベルにより、特定された期間内での対象の死亡のリスクが示される、方法。
【請求項2】
対象からの試料におけるST2、IL-33またはその両方のバイオマーカーレベルを決定する段階;および
試料におけるバイオマーカーレベルを参照標準バイオマーカーレベルと比較する段階
を含む、対象における疾患の重症度を決定するための方法であって、
参照標準バイオマーカーレベルと比較した、試料におけるバイオマーカーレベルにより、対象が重大な疾患を有するか否かが示される、方法。
【請求項3】
特定された期間が1年である、請求項1記載の方法。
【請求項4】
対象が1つまたは複数の非特異的な症状を呈する、請求項1または2記載の方法。
【請求項5】
1つまたは複数の非特異的な症状が、胸痛または不快感、息切れ、悪心、嘔吐、曖気、発汗、心悸亢進、頭のふらつき、倦怠感、および失神からなる群より選択される、請求項4記載の方法。
【請求項6】
参照標準バイオマーカーレベルが、1年以内の死亡のリスクが低いことに対応するレベルに相当する、請求項1記載の方法。
【請求項7】
参照標準バイオマーカーレベルが、重大な疾患を有しない対象に対応するレベルに相当する、請求項2記載の方法。
【請求項8】
試料が血清、血液、血漿、尿または体組織を含む、請求項1または2記載の方法。
【請求項9】
バイオマーカーがST2であり、参照標準レベルが約0.2〜0.3ng/ml血清であり、試料におけるレベルが参照標準レベルよりも高いかそれと等しいことにより、ST2レベルが参照標準レベル未満である対象と比較して、対象の1年以内の死亡のリスクが高いことが示される、請求項1または2記載の方法。
【請求項10】
対象が心血管疾患を有しない、請求項1または2記載の方法。
【請求項11】
対象が肺疾患を有する、請求項1または2記載の方法。
【請求項12】
対象が肝疾患を有する、請求項1または2記載の方法。
【請求項13】
参照標準と比較した、試料におけるバイオマーカーレベルにより、対象が特定された期間内に病院に再入院すると考えられるか否かが示される、請求項2記載の方法。
【請求項14】
試料における補助的バイオマーカーのレベルを決定する段階;および
試料における補助的バイオマーカーのレベルを補助的バイオマーカー参照標準レベルと比較する段階
をさらに含む方法であって、
補助的バイオマーカー参照標準レベルと比較した、試料における補助的バイオマーカーのレベルと、バイオマーカー参照標準レベルと比較した、試料におけるバイオマーカーのレベルとの組み合わせにより、対象の死亡のリスクが高いか否かが示される、請求項1記載の方法。
【請求項15】
試料における補助的バイオマーカーのレベルを決定する段階;および
試料における補助的バイオマーカーのレベルを補助的バイオマーカー参照標準レベルと比較する段階
をさらに含む方法であって、
補助的バイオマーカー参照標準レベルと比較した、試料における補助的バイオマーカーのレベルと、バイオマーカー参照標準レベルと比較した、試料におけるバイオマーカーのレベルとの組み合わせにより、対象が重大な疾患を有するか否かが示される、請求項2記載の方法。
【請求項16】
補助的バイオマーカーが、トロポニン、脳性ナトリウム利尿ペプチド(BNP)、プロBNP、NT-プロBNP、心房性ナトリウム利尿ペプチド(ANP)、NT-プロANP、プロANP、C反応性ペプチド(CRP)、クレアチニン、クレアチニンクリアランス値、糸球体濾過値(GFR)、Dダイマー、血中尿素窒素(BUN)、アルブミン、肝機能酵素、細菌エンドトキシン、および上記の2つまたはそれ以上の任意の組み合わせからなる群より選択される、請求項14または15記載の方法。
【請求項17】
対象がBMI 25〜29である、BMI 30以上である、または腎機能不全を有する、請求項1または2記載の方法。
【請求項18】
試料におけるST2のレベルおよびIL-33のレベルを決定する段階;
試料におけるST2:IL-33の比を決定する段階;ならびに
ST2:IL-33の比を参照標準比と比較する段階
を含む方法であって、
参照標準比と比較した、試料におけるST2:IL-33の比により、対象が重大な疾患を有するか否かが示される、請求項2記載の方法。
【請求項19】
参照標準比と比較した、試料におけるST2:IL-33の比により、対象が1年以内に病院に入院または再入院する尤度が高いことが示される、請求項18記載の方法。
【請求項20】
試料におけるST2のレベルおよびIL-33のレベルを決定する段階;
試料におけるST2:IL-33の比を決定する段階;ならびに
ST2:IL-33の比を参照標準比と比較する段階
を含む方法であって、
参照標準比と比較した、試料におけるST2:IL-33の比により、対象の死亡のリスクが高いか否かが示される、請求項1記載の方法。
【請求項21】
特定の期間が1年である、請求項20記載の方法。
【請求項22】
試料における(i)NT-プロBNP、プロBNPまたはBNP、および(ii)ST2のレベルを決定する段階を含む、請求項21記載の方法。
【請求項23】
試料における(i)NT-プロBNPおよび(ii)ST2のレベルを決定する段階を含む方法であって、対象の1年以内の死亡のリスクが以下の表:

に従って決定される、請求項21記載の方法。
【請求項24】
試料における(i)BUNおよび(ii)ST2のレベルを決定する段階を含む方法であって、対象の1年以内の死亡のリスクが以下の表:

に従って決定される、請求項21記載の方法。
【請求項25】
対象におけるST2、IL-33またはその両方の第1のバイオマーカーレベルを入手する段階;
第2の時点で対象における同じバイオマーカーの第2のレベルを入手する段階;ならびに
第1および第2のバイオマーカーレベルを比較する段階
を含む、対象を評価する方法であって、
第1および第2のバイオマーカーレベルの間の差により、対象の病状が示される、方法。
【請求項26】
第1のST2のレベルが所定の参照標準を上回る場合その対象を選択する段階をさらに含む、請求項25記載の方法。
【請求項27】
第1のバイオマーカーレベルを入手した後、かつ第2のバイオマーカーレベルを入手する前に、対象に対して治療を施す段階をさらに含む、請求項25記載の方法。
【請求項28】
第2のバイオマーカーレベルが第1のバイオマーカーレベルよりも低いことにより、治療が有効であることが示される、請求項27記載の方法。
【請求項29】
第1から第2へのバイオマーカーレベルの低下により、対象の病状が改善したことが示される、請求項25記載の方法。
【請求項30】
第1から第2へのバイオマーカーレベルの有意でない低下、変化がないこと、または上昇により、対象が重大な疾患を有することが示される、請求項25記載の方法。
【請求項31】
第1から第2へのバイオマーカーレベルの有意でない低下、変化がないこと、または上昇により、対象が特定された期間内に病院に再入院する尤度が高いことが示される、請求項25記載の方法。
【請求項32】
バイオマーカがST2であり、ST2レベルの低下が15%未満であることにより、対象が重大な疾患を有することが示される、請求項25記載の方法。
【請求項33】
少なくとも第1の補助的バイオマーカーレベルを入手する段階;および
試料における補助的バイオマーカーのレベルを補助的バイオマーカーの参照標準レベルと比較する段階
をさらに含む方法であって、
参照標準と比較した、試料における補助的バイオマーカーのレベルと、ST2のレベル間の差との組み合わせにより、対象の死亡のリスクが高いか否かが示される、請求項25記載の方法。
【請求項34】
補助的バイオマーカーが、NT-プロBNP、プロBNPおよびBNPからなる群より選択される、請求項33記載の方法。
【請求項35】
補助的バイオマーカーがBNPであり、退院させるか入院患者として治療を継続するかに関する決断が、以下の表:

に従って行われる、請求項33記載の方法。
【請求項36】
対象における少なくとも第1、第2および第3のバイオマーカーレベルを決定する段階、ならびにレベルを比較する段階を含む、請求項25記載の方法。
【請求項37】
対象が1つまたは複数の非特異的な症状を呈する、請求項25記載の方法。
【請求項38】
1つまたは複数の非特異的な症状が、胸痛または不快感、息切れ、悪心、嘔吐、曖気、発汗、心悸亢進、頭のふらつき、倦怠感、および失神からなる群より選択される、請求項37記載の方法。
【請求項39】
試料が血清、血液、血漿、尿または体組織を含む、請求項25記載の方法。
【請求項40】
第1および第2のバイオマーカーレベルの間の差により、対象に関して、特定された期間内での対象の死亡のリスクが示される、請求項25記載の方法。
【請求項41】
特定された期間が1年である、請求項40記載の方法。
【請求項42】
バイオマーカーがST2であり、ST2レベルの有意でない低下、変化がないこと、または上昇により、対象の1年以内の死亡のリスクが高いことが示される、請求項41記載の方法。
【請求項43】
バイオマーカーがST2であり、ST2レベルの15%未満の低下により、対象の1年以内の死亡のリスクが高いことが示される、請求項41記載の方法。
【請求項44】
対象が心血管疾患を有しない、請求項25記載の方法。
【請求項45】
対象が肺疾患を有する、請求項25記載の方法。
【請求項46】
対象が肝疾患を有する、請求項25記載の方法。
【請求項47】
試料における第1の補助的バイオマーカーのレベルを入手する段階;
試料における少なくとも第2の補助的バイオマーカーのレベルを入手する段階;ならびに
補助的バイオマーカーの第1および第2のレベルを比較する段階
をさらに含む方法であって、
試料における補助的バイオマーカーのレベルの差と、ST2のレベル間の差との組み合わせにより、対象の病状が示される、請求項25記載の方法。
【請求項48】
第1および第2のバイオマーカーレベルを入手する間に少なくとも2日間が経過している、請求項25記載の方法。
【請求項49】
第1の血清試料を対象から入手する段階;
第1の試料におけるST2のレベルおよび第1の試料におけるBUNのレベルを決定する段階;
第2の血清試料を対象から入手する段階;
第2の試料におけるST2のレベルを決定する段階;
第1および第2の試料におけるST2のレベルを比較して、ST2の比を決定する段階;
第1の試料におけるBUNのレベルを、事前に選択した参照標準レベルと比較する段階;ならびに
ST2の比を参照標準比と比較する段階
を含む、1つまたは複数の非特異的な症状を呈する対象に関して、特定の期間内での死亡のリスクを評価するための方法であって、
参照標準比および参照標準レベルと比較した、第1および第2の試料におけるST2の比、ならびに第1の試料におけるBUNのレベルにより、対象の死亡のリスクが示される、方法。
【請求項50】
特定の期間が1年である、請求項49記載の方法。
【請求項51】
対象の1年以内の死亡のリスクが以下の表:

に従って決定される、請求項49記載の方法。
【請求項52】
ST2に対する抗体およびIL-33に対する抗体のうち一方または両方、ならびに請求項1〜51のいずれか一項記載の方法を実施するための説明書を含む、キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2012−181200(P2012−181200A)
【公開日】平成24年9月20日(2012.9.20)
【国際特許分類】
【出願番号】特願2012−100940(P2012−100940)
【出願日】平成24年4月26日(2012.4.26)
【分割の表示】特願2009−507931(P2009−507931)の分割
【原出願日】平成19年4月24日(2007.4.24)
【出願人】(508317295)クリティカル ケア ダイアグノスティクス インコーポレイテッド (6)
【Fターム(参考)】
【公開日】平成24年9月20日(2012.9.20)
【国際特許分類】
【出願日】平成24年4月26日(2012.4.26)
【分割の表示】特願2009−507931(P2009−507931)の分割
【原出願日】平成19年4月24日(2007.4.24)
【出願人】(508317295)クリティカル ケア ダイアグノスティクス インコーポレイテッド (6)
【Fターム(参考)】
[ Back to top ]

