舌下フェンタニルスプレー
【課題】有効な疼痛管理に適合する、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む舌下処方物の提供。
【解決手段】本発明は、患者に投与するのに適合する、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含有する舌下処方物、および前記処方物を用いて処置する方法に関する。本発明により、例えば、薬学的に受容可能な液体キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴を含むフェンタニル舌下処方物であって、該液滴は少なくとも約10ミクロンの平均径を有する、フェンタニル舌下処方物が提供される。
【解決手段】本発明は、患者に投与するのに適合する、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含有する舌下処方物、および前記処方物を用いて処置する方法に関する。本発明により、例えば、薬学的に受容可能な液体キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴を含むフェンタニル舌下処方物であって、該液滴は少なくとも約10ミクロンの平均径を有する、フェンタニル舌下処方物が提供される。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、ヒトに投与するために適合する、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含有する舌下処方物、および前記舌下処方物を用いて処置するための方法に関する。
【背景技術】
【0002】
(発明の背景)
フェンタニルは、モルヒネの約80〜100倍の鎮痛効力を備えるμ−オピオイドレセプターアゴニストである。臨床状況では、フェンタニルは、中枢神経系に対して主要な薬理学的作用を発揮する。その主要な作用は、鎮痛および鎮静である。
【0003】
フェンタニルの鎮痛作用は、その薬物の血中レベルと関連している。一般に、最小有効濃度および毒性が発生する濃度は、ありとあらゆるオピオイドに対する耐性の増加に伴って上昇する。耐性の発生速度は、個体間で極めて広範囲に相違する可能性がある。フェンタニルを含むすべてのμレセプターアゴニストは、用量依存性呼吸抑制を生じさせる。呼吸抑制の危険性は、典型的には呼吸抑制に対する耐性およびその他のオピオイド作用を発生させる長期オピオイド療法を受けている患者においては低い。重篤もしくは致死性の呼吸抑制は、脆弱な個体においては、推奨用量でさえ発生する場合がある。
【0004】
経口投与されたフェンタニルは初回通過効果代謝に供されるが、これは経口投与されたフェンタニルの50%以上は吸収されないからである。そこでフェンタニルに対するこの初回通過効果を減少させるか、または回避するために、非経口、口腔、および経皮などの他の送達形態が利用されてきた。
【0005】
フェンタニルは、現在は、ロゼンジ剤(例えば、Actiq(登録商標))、および経皮系(例えば、Duragesic(登録商標)(25、50、75、および100μg/時間のフェンタニル))として注射形態で利用できる。Duragesic(登録商標)は、約72時間にわたりフェンタニルの持続的全身性送達を提供する。Duragesic(登録商標)は、例えば、アセトアミノフェン−オピオイドの併用、非ステロイド系鎮痛薬、または速効型オピオイドのprn(必要に応じた)投与などのより効力の小さな手段では最適には管理されない疼痛に対する持続的オピオイド鎮痛法を必要とする患者における慢性疼痛の管理において適応である。Duragesic(登録商標)は、典型的にはパッチを通してのフェンタニルの吸収における遅延のために急性疼痛、または重篤もしくは生命を脅かす低喚起が生じる可能性がある術後疼痛を経験している患者には適合しない。
【0006】
Actiq(登録商標)は、経口経粘膜投与が企図される、クエン酸フェンタニルの固形処方物である。Actiq(登録商標)は、形状が棒付きキャンディに類似する握り棒に取り付けられたロゼンジ剤である。握り棒のおかげで投与中に過剰なオピオイド作用が出現した場合はActiq(登録商標)ユニットを口から取り出せると言われている。Actiq(登録商標)は、基礎に持続性の癌性疼痛があるために既にオピオイド療法を受けていてオピオイド療法に対して耐性である悪性腫瘍を有する患者における癌性突出痛を管理するために適応である。Actiq(登録商標)は、急性もしくは術後疼痛の管理においては禁忌である。
【0007】
急性疼痛もしくは突出痛に対して使用できる舌下錠およびロゼンジ剤(例えば、Actiq(登録商標))には、特定の短所がある。とりわけ、1つの短所は、摂取後には、これらの薬学的因子中の活性薬剤を溶解形態で吸収できるようになる前にまず遊離させて分散させなければならない点にある。さらに、Actiq(登録商標)からのフェンタニルの吸収動態は、口腔粘膜を通して吸収される用量の画分および嚥下される用量の画分に依存して変動する可能性がある。さらに、特定のロゼンジ剤は、医学的監督を必要とし、そして超音波検査上の問題が生じるキャンディの形状にある。
【発明の概要】
【発明が解決しようとする課題】
【0008】
当該分野には、有効な疼痛管理に適合する、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む舌下処方物に対する必要性が存在する。
【課題を解決するための手段】
【0009】
(発明の概要および目的)
本発明の目的は、有効な疼痛管理のための、舌下投与に適合するフェンタニル処方物を提供することである。
【0010】
本発明の所定の実施形態の1つの目的は、鎮静、鎮痛、および/または麻酔の状態を迅速に誘導できる方法および組成物を提供することである。
【0011】
本発明の所定の実施形態のまた別の目的は、フェンタニル療法を必要とする患者への過少投与および/または過量投与を最小限に抑える、フェンタニル投与のための方法および組成物を提供することである。
【0012】
本発明の所定の実施形態のまた別の目的は、慢性疼痛処置を受けている患者において突出痛を処置するために適合する方法および組成物を提供することである。
【0013】
本発明の所定の実施形態のまた別の目的は、疼痛を処置するための制御された量で、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を舌下投与するための方法を提供することである。
【0014】
本発明の所定の実施形態のまた別の目的は、投与量がレシピエントの肺へ通過する実質的な危険性を伴わずに、実質的な舌下吸収を引き起こすであろう方法で舌下に投与できる投薬形態のオピオイド鎮痛薬を提供することである。
【0015】
上述した目的およびその他は本発明によって達成されるが、本方法は、一部には、即効性緩和を提供するために、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の実質的部分が患者の肺へ通過しないであろう処方物でフェンタニル、その薬学的に受容可能な塩、またはその誘導体を舌下投与するための方法に関する。
【0016】
所定の実施形態では、本発明は、有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む個々の液滴を含むフェンタニル舌下処方物であって、前記液滴は、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有するフェンタニル舌下処方物に関する。
【0017】
所定の実施形態では、本発明は、薬学的に受容可能な液体キャリア中にフェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴を含むフェンタニル舌下処方物であって、前記液滴は約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有するフェンタニル舌下処方物に関する。
【0018】
所定の好ましい実施形態では、舌下投与後にフェンタニル、その薬学的に受容可能な塩、またはその誘導体を肺へ送達することを可能にする径を有している粒子はない。
【0019】
所定の実施形態では、本発明は、単位用量のフェンタニル舌下処方物であって、前記単位用量は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む個々の液滴、および薬学的に受容可能な液状キャリアを含んでおり、前記液滴は、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有するフェンタニル舌下処方物に関する。
【0020】
所定の実施形態では、本発明は、単位用量のフェンタニル舌下処方物であって、前記単位用量は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴、および薬学的に受容可能な液状キャリアを含んでおり、前記液滴は約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有するフェンタニル舌下処方物に関する。
【0021】
所定の実施形態では、本発明は、疼痛を処置する方法であって、疼痛を経験しているヒト患者に、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは少なくとも約20〜約200ミクロンの平均径を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含み、前記液体スプレー処方物は、薬学的に受容可能な液状キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む方法に関する。
【0022】
所定の実施形態では、本発明は、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含む疼痛を処置する方法であって、前記液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む方法に関する。
【0023】
所定の実施形態では、本発明は、薬学的に受容可能な液状キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む単位用量の液体処方物を含有するリザーバーを備えるデバイスであって、前記デバイスは、作動させると、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有する液滴の形状にある単位用量の液体処方物を送達するアクチュエーターを有するデバイスに関する。好ましくは、前記デバイスは、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する液滴の形状にある治療有効用量の液体処方物を送達する。
【0024】
所定の実施形態では、本発明は、薬学的に受容可能な液状キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体処方物を含有するリザーバーを備える複数回用量デバイスであって、前記デバイスは、作動させると、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有する液滴の形状にある治療有効量の液体処方物を送達するアクチュエーターを有するデバイスに関する。好ましくは、前記デバイスは、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する液滴の形状にある治療有効量の液体処方物を送達する。
【0025】
所定の実施形態では、本発明は、疼痛を処置する方法であって、薬学的に受容可能な液状キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体処方物を含むリザーバーと;作動させると、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有する治療有効量の液滴を送達するアクチュエーターとを備えるスプレーデバイスを利用する工程を含む方法に関する。
【0026】
所定の実施形態では、本発明は、疼痛を処置する方法であって、フェンタニル、その薬学的に受容可能な塩、またはその誘導体、および薬学的に受容可能な液体キャリアを含むリザーバーと;作動させると約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する治療有効量の液滴を送達するアクチュエーターとを備えるスプレーデバイスを利用する工程を含む方法に関する。
【0027】
所定の実施形態では、本発明は、突出痛を処置する方法であって、ヒト患者に、前記ヒト患者が経験した突出痛を処置するために、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体スプレー処方物を舌下投与する工程を含む方法に関する。
【0028】
所定の実施形態では、本発明は、突出痛を処置する方法であって、慢性疼痛処置を受けており、そして突出痛を経験しているヒト患者に、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体スプレー処方物を舌下投与する工程を含む方法に関する。
【0029】
所定の実施形態では、本発明は、突出痛を処置するための患者間変動性を減少させる方法であって、突出痛を経験しているヒト患者に、フェンタニル、その薬学的に受容可能な塩、またはその誘導体、および薬学的に受容可能な液体キャリアを含む液体スプレー処方物中のある用量のフェンタニルを舌下投与する工程を含み、前記液体スプレー処方物は、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有する個々の液滴として投与される方法に関する。
【0030】
所定の実施形態では、本発明は、突出痛を処置するために患者間変動性を減少させる方法であって、突出痛を経験しているヒト患者に、フェンタニル、その薬学的に受容可能な塩、またはその誘導体、および薬学的に受容可能な液体キャリアを含む液体スプレー処方物中のある用量のフェンタニルを舌下投与する工程を含み、前記液体スプレー処方物は、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロンのサイズ分布を有する個々の液滴として投与される方法に関する。
【0031】
所定の好ましい実施形態では、液体スプレー処方物は、薬学的に受容可能な溶媒をさらに含む。好ましくは、前記薬学的に受容可能な溶媒は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を溶解させるために適合する量で含まれる有機溶媒である。
【0032】
所定の好ましい実施形態では、本発明の処方物は、ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する。
【0033】
所定の好ましい実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する。
【0034】
本発明の所定の好ましい実施形態では、本発明の処方物は、噴射剤を含んでいない。
【0035】
所定の実施形態では、本発明の処方物は、例えば口腔粘膜(buccal)投与を含む、経粘膜投与のために適合する。
【0036】
所定の実施形態では、本発明は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体をヒトに経粘膜投与する方法であって、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の実質的部分が患者の肺には通過しない処方物で即効性疼痛軽減を提供するための方法に関する。所定の好ましい実施形態では、経粘膜領域は、ヒトの口腔粘膜領域である。
【0037】
所定の実施形態では、本発明は、鎮痛薬として、急性疼痛および/または突出痛を処置するための麻酔前投薬として、麻酔を誘導するための鎮静剤として、および/または不安を処置するための医薬を使用するための製造するために上記に規定した処方物の使用にも関する。
【0038】
本発明は、薬学的に受容可能な液体キャリア中のフェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴を含むフェンタニル舌下処方物であって、前記液滴は、少なくとも約10ミクロンの平均径を有しており、ヒト患者に投与されると、個々の液滴の少なくとも約90%は約9μm以上の平均径を有するフェンタニル舌下処方物にも関する。他の実施形態では、9μmよりも小さい平均径を有しているのは個々の液滴の約5%以下である。さらに他の実施形態では、本処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量(respirable dose)を提供する。
【0039】
本発明は、疼痛を処置する方法であって、疼痛を経験しているヒト患者に、少なくとも約10ミクロンの平均径を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含み、個々の液滴の少なくとも約90%はヒト患者に投与されると約9μm以上の平均径を有しており、前記液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む方法にも関する。所定の他の実施形態では、9μmよりも小さい平均径を有しているのは個々の液滴の約5%以下である。他の実施形態では、本処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する。
【0040】
本発明は、薬学的に受容可能な液体キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、または誘導体を含む単位用量(unit dose)または2回用量(bi−dose)の液体処方物を含有するリザーバーを備える、薬物を舌下投与するための単位用量デバイスまたは2回用量デバイスであって、前記デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する液滴の形状にある単位用量の液体処方物を送達するアクチュエーターを有しており、このときヒト患者に投与されると、個々の液滴の少なくとも約90%が約9μm以上の平均径を有する、デバイスにも関する。
【0041】
他の実施形態では、9μmよりも小さい平均径を有しているのは個々の液滴の約5%以下である。さらに他の実施形態では、本処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する。
【0042】
例えば癌を有する多くの患者は、慢性的な鎮痛療法を受けているにもかかわらず中等度から重度の疼痛を経験し続けており、これは頻回には患者の活動水準の増加に起因する間欠的突出痛として発生することがある。持効性処方物の鎮痛薬の用量を増量することでこのタイプの疼痛に対抗しようとする試みは、鎮痛の遅い開始や鎮静の望ましくない副作用である、便秘もしくは悪心および嘔吐を生じさせることが多い。しかし、所定の実施形態では、本発明は、必要な時間にわたって突出痛などの疼痛を減少させる、好ましくは即効性の強力な鎮痛を提供し、その後に、好ましくはかなり迅速に消失するので、それによってフェンタニル、その薬学的に受容可能な塩、またはその誘導体の副作用を最小限に抑える処方物に関する。
【0043】
本発明のためには、フェンタニルの誘導体には、スフェンタニル、カーフェンタニル、ロフェンタニル、アルフェンタニルなどが含まれる。
【0044】
本発明のためには、「突出痛」は、認識できる不快症状を引き起こす、患者における閾値を超える疼痛を意味するが、このとき患者が経験する疼痛は、他の場合には典型的には例えば慢性的な鎮痛療法によって制御され、そして我慢されている。例えば、癌などの医学的疾病に関連する疼痛は、典型的には揺動し、そして患者は頻回に認識できる不快感(例えば、突出痛)の経験を報告している。典型的には、突出痛は、現在は薬剤が吸収されるために約45分間以上を要するので、突出痛の緩和の遅延を生じさせる可能性がある即時放出性経口投薬形態を用いて処置されており、これは投与のほぼ直後に突出痛を緩和し始める本発明の液体スプレー処方物とは対照的である。
【0045】
本発明のためには、「慢性的な疼痛処置」は、1日1回または24時間の疼痛処置を意味する。慢性疼痛処置は、経口、非経口、経皮、またはその他の適切な投与手段であってよい。
【0046】
本発明のためには、「舌下」は、本明細書では舌の下方または舌の下の領域に関すると規定されている。
【0047】
本発明のためには、用語「舌下投与」は、本明細書では舌の下への薬学的組成物の治療的投与であると規定されている。
【0048】
本発明のためには、薬物の「有効量」は、薬物の所望の活性を示すために有効な量である。本発明によると、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の治療有効量は、患者における疼痛を処置する(例えば顕著に減少させる)ために有効な量である。
【0049】
本発明のためには、用語「滴」および「粒子」は、互換的に使用できる。
例えば、本願発明は以下の項目を提供する。
(項目1)
薬学的に受容可能な液体キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴を含むフェンタニル舌下処方物であって、該液滴は少なくとも約10ミクロンの平均径を有する、フェンタニル舌下処方物。
(項目2)
前記液滴は、少なくとも約20ミクロンの平均径を有する、項目1に記載のフェンタニル舌下処方物。
(項目3)
前記液滴は、約5ミクロン〜約500ミクロンのサイズ分布を有する、項目1に記載のフェンタニル舌下処方物。
(項目4)
前記液滴は、少なくとも約10ミクロン〜約200ミクロンのサイズ分布を有する、項目1に記載のフェンタニル舌下処方物。
(項目5)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、約0.05mg/ml〜約15mg/mlの濃度で前記処方物中に含まれている、項目1に記載のフェンタニル舌下処方物。
(項目6)
ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目7)
ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目8)
ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目9)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目10)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約142pg/ml〜約195pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目11)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約158pg/ml〜約177pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目12)
有機溶媒をさらに含む、項目1に記載のフェンタニル舌下処方物。
(項目13)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、前記有機溶媒中に溶解されている、項目12に記載のフェンタニル舌下処方物。
(項目14)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、前記薬学的に受容可能な液体キャリア中に分散されている、項目1に記載のフェンタニル舌下処方物。
(項目15)
吸収増強因子をさらに含む、項目1に記載のフェンタニル舌下処方物。
(項目16)
前記吸収増強因子は、トリアセチンである、項目15に記載のフェンタニル舌下処方物。
(項目17)
前記吸収増強因子は、前記処方物の約0.001重量%〜約10重量%の量にある、項目15または16に記載のフェンタニル舌下処方物。
(項目18)
噴射剤非含有処方物である、項目1に記載のフェンタニル舌下処方物。
(項目19)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、舌下投与後にヒト患者の肺に進入しないか、または実質的に進入しない、項目1に記載のフェンタニル舌下処方物。
(項目20)
舌下スプレー投与のために適切な薬学的に受容可能な液体キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴を含むフェンタニル舌下処方物の単位用量であって、前記液滴は、少なくとも約10ミクロンの平均径を有する、フェンタニル舌下処方物の単位用量。
(項目21)
前記液体スプレー処方物は、少なくとも約20ミクロンの平均径を有する液滴粒子を含む、項目20に記載の単位用量。
(項目22)
前記液体スプレー処方物は、約5ミクロン〜約500ミクロンのサイズ分布を有する液滴粒子を含む、項目20に記載の単位用量。
(項目23)
前記液体スプレー処方物は、約10ミクロン〜約200ミクロンのサイズ分布を有する液滴粒子を含む、項目20に記載の単位用量。
(項目24)
約10μg〜約10mgの前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目20に記載の単位用量。
(項目25)
約25μg〜約5mgの前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目20に記載の単位用量。
(項目26)
約50μg〜約1600μgの前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目20に記載の単位用量。
(項目27)
ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目20に記載の単位用量。
(項目28)
ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目20に記載の単位用量。
(項目29)
ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目20に記載の単位用量。
(項目30)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目20に記載の単位用量。
(項目31)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約142pg/ml〜約195pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目20に記載の単位用量。
(項目32)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約158pg/ml〜約177pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目20に記載の単位用量。
(項目33)
前記処方物は、噴射剤非含有処方物である、項目20に記載の単位用量。
(項目34)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、舌下投与後にヒト患者の肺に進入しないか、または実質的に進入しない、項目20に記載の単位用量。
(項目35)
疼痛を処置する方法であって、疼痛を経験しているヒト患者に、少なくとも約10ミクロンの平均径を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含み、該液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、方法。
(項目36)
前記液滴は、少なくとも約20ミクロンの平均径を有する、項目35に記載の方法。
(項目37)
疼痛を処置する方法であって、疼痛を経験しているヒト患者に、約5ミクロン〜約500ミクロンのサイズ分布を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含み、該液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、方法。
(項目38)
前記サイズ分布は、約10ミクロン〜約200ミクロンである、項目37に記載の方法。
(項目39)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、約0.05mg/ml〜約15mg/mlの濃度で前記液体スプレー処方物中に含まれる、項目35〜37、または38に記載の方法。
(項目40)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、約10μg〜約10mgの量で前記ヒト患者に投与される、項目35〜37、または38に記載の方法。
(項目41)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、約25μg〜約5mgの量で前記ヒト患者に投与される、項目35〜37、または38に記載の方法。
(項目42)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、約50μg〜約1600μgの量で前記ヒト患者に投与される、項目35〜37、または38に記載の方法。
(項目43)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目35〜37、または38に記載の方法。
(項目44)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目35〜37、または38に記載の方法。
(項目45)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目35〜37、または38に記載の方法。
(項目46)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目35〜37、または38に記載の方法。
(項目47)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約142pg/ml〜約195pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目35〜37、または38に記載の方法。
(項目48)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約158pg/ml〜約177pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目35〜37、または38に記載の方法。
(項目49)
前記ヒト患者は、前記疼痛を引き起こす癌を有する、項目35〜37、または38に記載の方法。
(項目50)
前記スプレー処方物は、有機溶媒をさらに含む、項目35〜37、または38に記載の方法。
(項目51)
前記有機溶媒は、エタノールである、項目51に記載の方法。
(項目52)
前記有機溶媒は、エタノール、プロピレングリコール、ポリエチレングリコール、ラブロソール(labrosol)、ラブラフィル、トランスカトール、またはそれらの組み合わせを含む共溶媒である、項目50に記載の方法。
(項目53)
前記キャリアは、水である、項目35〜37、または38に記載の方法。
(項目54)
前記キャリアは、ミグリオールである、項目35〜37、または38に記載の方法。
(項目55)
前記スプレー処方物は、吸収増強因子をさらに含む、項目35〜37、または38に記載の方法。
(項目56)
前記吸収増強因子は、トリアセチンである、項目55に記載の方法。
(項目57)
前記吸収増強因子は、前記スプレー処方物中に、該処方物の約0.001重量%〜約10重量%の量で含まれる、項目55に記載の方法。
(項目58)
前記液体スプレー処方物のいずれもか、または実質的にいずれもが、投与後に前記ヒト患者の肺に進入しない、項目35〜37、または38に記載の方法。
(項目59)
突出痛を処置する方法であって、
慢性疼痛処置を受けており、そして突出痛を経験しているヒト患者に、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体スプレー処方物を舌下投与する工程を含む、方法。
(項目60)
前記液体スプレー処方物は、約10ミクロンよりも大きい平均径を有する個々の液滴の形状で投与される、項目59に記載の方法。
(項目61)
前記液体スプレー処方物は、約20ミクロンよりも大きい平均径を有する個々の液滴の形状で投与される、項目59に記載の方法。
(項目62)
前記液体スプレー処方物は、約5ミクロン〜約500ミクロンのサイズ分布を有する個々の液滴の形状で投与される、項目59に記載の方法。
(項目63)
前記液体スプレー処方物は、約10ミクロン〜約200ミクロンのサイズ分布を有する個々の液滴の形状で投与される、項目59に記載の方法。
(項目64)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、前記液体スプレー処方物中に0.05mg/ml〜約15mg/mlの濃度で含まれる、項目59に記載の方法。
(項目65)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目59に記載の方法。
(項目66)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目59に記載の方法。
(項目67)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目59に記載の方法。
(項目68)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目59に記載の方法。
(項目69)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約142pg/ml〜約195pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目59に記載の方法。
(項目70)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約158pg/ml〜約177pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目59に記載の方法。
(項目71)
前記ヒト患者は、前記疼痛を引き起こす癌を有する、項目59に記載の方法。
(項目72)
前記スプレー処方物は、有機溶媒をさらに含む、項目59に記載の方法。
(項目73)
前記有機溶媒は、エタノールである、項目72に記載の方法。
(項目74)
前記有機溶媒は、エタノール、プロピレングリコール、ポリエチレングリコール、ラブロソール(labrosol)、ラブラフィル、トランスカトール、またはそれらの組み合わせを含む共溶媒である、項目72に記載の方法。
(項目75)
前記キャリアは、水である、項目59に記載の方法。
(項目76)
前記キャリアは、ミグリオールである、項目59に記載の方法。
(項目77)
前記スプレー処方物は、噴射剤非含有処方物である、項目59に記載の方法。
(項目78)
前記液体スプレー処方物のいずれもか、または実質的にいずれもが、投与後に前記ヒト患者の肺に進入しない、項目59に記載の方法。
(項目79)
薬学的に受容可能な液体キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む単位用量または2回用量の液体処方物を含有するリザーバー;を備える、薬物を舌下投与するための単位用量デバイスまたは2回用量デバイスであって、該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する液滴の形状にある該単位用量の該液体処方物を送達するアクチュエーターを有する、デバイス。
(項目80)
前記送達される単位用量は、約10μg〜約10mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目79に記載の単位用量デバイスまたは2回用量デバイス。
(項目81)
前記送達される単位用量は、約25μg〜約5mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目79に記載の単位用量デバイスまたは2回用量デバイス。
(項目82)
前記送達される単位用量は、約50μg〜約1600μgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目79に記載の単位用量デバイスまたは2回用量デバイス。
(項目83)
前記デバイスは、前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体の吸収を妨害するか、または実質的に妨害する材料を含むストッパーをさらに備える、項目79に記載の単位用量デバイスまたは2回用量デバイス。
(項目84)
前記ストッパーは、前記液体処方物のスプレー特性に影響を及ぼす前記デバイスの一次包装の構成成分である、項目83に記載の単位用量デバイスまたは2回用量デバイス。
(項目85)
前記ストッパーは、以下:a)エラストマー:ブロモブチルおよび/またはクロロブチル;b)強化剤:不活性材料:不活性ミネラル;ならびにc)硬化系:の非従来型の組成および特徴を有する、項目83に記載の単位用量デバイスまたは2回用量デバイス。
(項目86)
薬学的に受容可能な液体キャリア中にフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体処方物を含有するリザーバー;
を備える、薬物を舌下投与するための複数回用量デバイスであって、該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する液滴の形状にある治療有効用量の該液体処方物を送達するアクチュエーターを有する、デバイス。
(項目87)
前記治療有効用量は、約10μg〜約10mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目86に記載の複数回用量デバイス。
(項目88)
前記治療有効用量は、約25μg〜約5mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目86に記載の複数回用量デバイス。
(項目89)
前記治療有効用量は、約50μg〜約1600μgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目86に記載の複数回用量デバイス。
(項目90)
前記デバイスは、前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体の吸収を妨害するか、または実質的に妨害する材料を含むガスケットをさらに備える、項目86に記載の複数回用量デバイス。
(項目91)
前記ガスケットは、以下:a)エラストマー:ブロモブチルおよび/またはクロロブチル;b)強化剤:不活性材料:不活性ミネラル;ならびにc)硬化系:の非従来型の組成および特徴を有する、項目86に記載のデバイス。
(項目92)
前記液滴は、少なくとも約20ミクロンの平均径を有する、項目79〜90、または91に記載のデバイス。
(項目93)
前記液滴は、約5ミクロン〜約500ミクロンのサイズ分布を有する、項目79〜90、または91に記載のデバイス。
(項目94)
前記液滴は、約10ミクロン〜約200ミクロンのサイズ分布を有する、項目79〜90、または91に記載のデバイス。
(項目95)
前記用量は、ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目79〜90、または91に記載のデバイス。
(項目96)
前記用量は、ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目79〜90、または91に記載のデバイス。
(項目97)
前記用量は、ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目79〜90、または91に記載のデバイス。
(項目98)
前記液体処方物は、噴射剤非含有処方物である、項目79〜90、または91に記載のデバイス。
(項目99)
前記液体スプレー処方物のいずれもか、または実質的にいずれもが、舌下投与後にヒト患者の肺に進入しない、項目79〜90、または91に記載のデバイス。
(項目100)
前記単位用量が送達された後、前記デバイスは、実質的に空である、項目79に記載のデバイス。
(項目101)
前記デバイスは、前記単位用量が送達された後に、使い捨て可能である、項目79に記載のデバイス。
(項目102)
2用量の前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含有する、項目86に記載のデバイス。
(項目103)
前記デバイスは、前記2用量が送達された後に、実質的に空である、項目102に記載のデバイス。
(項目104)
前記デバイスは、前記2用量が送達された後に、使い捨て可能である、項目103に記載のデバイス。
(項目105)
1用量の投与を許容し、特定の期間にわたってさらなる投与をロックアウトするロックアウト機構をさらに備える、項目86に記載のデバイス。
(項目106)
薬学的に受容可能な液体キャリア中にフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体処方物を含有するリザーバーを備える舌下スプレーデバイスを利用する工程を含む、疼痛を処置する方法であって;該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する、該デバイスから噴霧される治療有効量の液滴を送達するアクチュエーターを有する、方法。
(項目107)
前記液滴は、約20ミクロンよりも大きい平均径を有する、項目106に記載の方法。
(項目108)
前記液滴は、約5ミクロン〜約500ミクロンのサイズ分布を有する、項目106に記載の方法。
(項目109)
前記液滴は、約10ミクロン〜約200ミクロンのサイズ分布を有する、項目106に記載の方法。
(項目110)
前記治療有効量は、約10μg〜約10mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目106に記載の方法。
(項目111)
前記治療有効量は、約25μg〜約5mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目106に記載の方法。
(項目112)
前記治療有効量は、約50μg〜約1600μgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目106に記載の方法。
(項目113)
前記治療有効量は、ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目106に記載の方法。
(項目114)
前記治療有効量は、ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目106に記載の方法。
(項目115)
前記治療有効量は、ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目106に記載の方法。
(項目116)
治療有効量は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目106に記載の方法。
(項目117)
前記液体処方物は、噴射剤非含有処方物である、項目106に記載の方法。
(項目118)
前記液体スプレー処方物のいずれもか、または実質的にいずれもが、舌下投与後にヒト患者の肺に進入しない、項目106に記載の方法。
(項目119)
薬学的に受容可能な液体キャリア中で治療的に活性な薬剤の混合物を調製する工程と、
少なくとも1つの治療用量を提供するために十分な量の該混合物を単位用量デバイス中へ組み込む工程と
を含む、舌下投与するための薬学的組成物を調製する方法であって、該デバイスは、少なくとも約10ミクロンの平均径を有する前記少なくとも該1つの治療用量の液滴をヒトの舌下領域に送達するために作動させることができる、方法。
(項目120)
薬学的に受容可能な液体キャリア中に有効量の治療的に活性な薬剤の個々の液滴を含む薬学的舌下処方物であって、該液滴は、少なくとも約10ミクロンの平均径を有する、薬学的舌下処方物。
(項目121)
舌下スプレー投与のために適切な薬学的に受容可能な液体キャリア中に有効量の治療的に活性な薬剤の個々の液滴を含む単位用量の薬学的舌下処方物であって、該液滴は、少なくとも約10ミクロンの平均径を有する、薬学的舌下処方物。
(項目122)
ヒト患者に少なくとも約10ミクロンの平均径を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含む、ヒト患者を処置する方法であって、該液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量の治療的に活性な薬剤を含む、方法。
(項目123)
約5ミクロン〜約500ミクロンのサイズ分布を有する個々の液滴の形状にある液体スプレー処方物をヒト患者に舌下投与する工程を含む、ヒト患者を処置する方法であって、該液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量の治療的に活性な薬剤を含む、方法。
(項目124)
薬学的に受容可能な液体キャリア中に有効量の治療的に活性な薬剤を含む単位用量または2回用量の液体処方物を含有するリザーバー;
を備える、薬物を舌下投与するための単位用量デバイスまたは2回用量デバイスであって、該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する液滴の形状にある該単位用量の該液体処方物を送達するアクチュエーターを有する、デバイス。
(項目125)
治療的に活性な薬剤を含む液体処方物を含有するリザーバー;
を備える、薬物を舌下投与するための複数回用量デバイスであって、該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する液滴の形状にある治療有効用量の該液体処方物を送達するアクチュエーターを有する、デバイス。
(項目126)
薬学的に受容可能な液体キャリア中の治療的に活性な薬剤を含む液体処方物を含有するリザーバーを備える舌下スプレーデバイスを利用する工程;
を含む、ヒト患者を処置する方法であって、該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する、該デバイスから噴霧される治療有効量の液体処方物を送達するアクチュエーターを有する、方法。
(項目127)
ヒト患者に対する投与の際に、前記個々の液滴の少なくとも約90%は、約9μm以上の平均径を有する、項目1に記載のフェンタニル処方物。
(項目128)
前記個々の液滴の約5%以下は、9μmよりも小さい平均径を有する、項目127に記載のフェンタニル処方物。
(項目129)
前記処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する、項目127に記載のフェンタニル処方物。
(項目130)
ヒト患者に対する投与の際に、前記個々の液滴の少なくとも約90%は、約9μm以上の平均径を有する、項目35に記載の処置方法。
(項目131)
前記個々の液滴の約5%以下は、9μmよりも小さい平均径を有する、項目35に記載の処置方法。
(項目132)
前記処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する、項目35に記載の処置方法。
(項目133)
ヒト患者に対する投与の際に、前記個々の液滴の少なくとも約90%は、約9μm以上の平均径を有する、項目79に記載のデバイス。
(項目134)
前記個々の液滴の約5%以下は、9μmよりも小さい平均径を有する、項目79に記載のデバイス。
(項目135)
前記処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する、項目79に記載のデバイス。
(項目136)
ヒト患者に対する投与の際に、前記個々の液滴の少なくとも約90%は、約9μm以上の平均径を有する、項目86に記載のデバイス。
(項目137)
前記個々の液滴の約5%以下は、9μmよりも小さい平均径を有する、項目86に記載のデバイス。
(項目138)
前記処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する、項目86に記載のデバイス。
【図面の簡単な説明】
【0050】
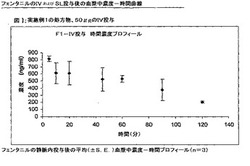
【図1】図1は、実施例6の試験における実施例1のフェンタニルの静脈内投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図2】図2は、実施例6の試験における実施例1のフェンタニルの舌下投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図3】図3は、実施例6の試験における実施例2のフェンタニルの静脈内投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図4】図4は、実施例6の試験における実施例2のフェンタニルの舌下投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図5】図5は、実施例6の試験における実施例3のフェンタニルの静脈内投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図6】図6は、実施例6の試験における実施例3のフェンタニルの舌下投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図7】図7は、実施例6の試験における実施例4のフェンタニルの静脈内投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図8】図8は、実施例6の試験における実施例4のフェンタニルの舌下投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図9】図9は、実施例6の試験における実施例5のフェンタニルの静脈内投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図10】図10は、実施例6の試験における実施例5のフェンタニルの舌下投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図11】図11は、ビネット試験の結果についての配置距離に対するDv10、Dv50、Dv90、およびプルーム記録値をグラフで示した要約である。
【図12】図12は、排気孔試験の結果についてのデバイス−レーザービーム間距離を4cmにした配置に対するDv10値、Dv50値、およびDv90値をグラフで示した要約である。
【図13】図13は、排気孔試験の結果についてのデバイス−レーザービーム間距離を7cmにした配置に対するDv10値、Dv50値、およびDv90値をグラフで示した要約である。
【図14】図14は、デバイス−レーザービーム間距離に対するDv10値、Dv50値、およびDv90値についてのデバイス−レーザービーム間の距離の配置の結果をグラフで示した要約である。
【発明を実施するための形態】
【0051】
(発明の詳細な説明)
薬理学的因子の最も単純で最も普及している投与経路は、経口である。この方法を使用するためには、薬理学的因子は、典型的には錠剤、カプセル剤、または液体基剤中に組み込まれる。薬物の経口投与は、極めて便宜的であり、多数の薬物のために、最適な方法であり続けるであろう。
【0052】
錠剤を嚥下した後の血流内への薬物の吸収は、患者間で変動する可能性がある。薬物の吸収は、典型的には胃から小腸および大腸への移動、ならびにこれらの器官からの分泌物の作用に左右される。さらに、フェンタニルなどの薬物の経口投与を用いると、フェンタニルは患者の血流に腸を経由して進入し、全身を通して分布する前に患者の肝臓を通過するので、フェンタニルの50%以上が患者の血流から除去される可能性がある。この「初回通過効果」は、経口投与経路をフェンタニルには非実用的にさせる。
【0053】
経口投与後の血流内へのフェンタニルもしくはその薬学的に受容可能な塩の吸収は、初回通過効果によって有意に減少させられる。このため、経口投与経路は、フェンタニルにとって非実用的である。フェンタニルに対するこの初回通過効果を減少させるか、または回避するために、非経口送達、口腔粘膜送達、および経皮送達などの他の送達形態が利用されてきた。しかし、これらの他の送達形態には、それらに結び付いた一定の短所がある。例えば、非経口投与は、シリンジおよび注射針を使用する注射を必要とし、薬剤の筋肉内投与に付随することがある壊死を引き起こすことがある;クエン酸フェンタニルの経粘膜ロゼンジ処方物であるActiq(登録商標)は、有効な疼痛緩和を得るために握り棒(棒付きキャンディに類似する)に取り付けられたロゼンジ剤を患者が絶えずしゃぶっている必要がある;およびフェンタニルの経皮送達デバイスであるDuragesic(登録商標)は、慢性疼痛を管理するためには適合するが、急性疼痛もしくは突出痛に対しては適応ではない。
【0054】
口腔は、オピオイド系鎮痛薬投与の単純な無痛法を提供する。口腔内には、活性薬剤の一般に認識された3種の、つまり局所、口腔および舌下の投与経路がある。
【0055】
局所送達は、主として例えば口内びらんなどの口腔自体内で発生する崩壊状態に関連する適用に限定される。
【0056】
口腔粘膜領域は、口腔の内層の粘膜を含む。しかし口腔粘膜は、舌下領域より低透過性である。活性薬剤の口腔粘膜送達に関連する大きな短所の1つは、それによって活性薬剤の低バイオアベイラビリティを生じさせる、粘膜上皮を越える活性薬剤の通過がかなり少ないことであり、これは各用量中で使用できる活性薬剤の実質的消失と言い換えられる。
【0057】
舌下送達は、口底部を内張りしている粘膜を通して達成される。高透過性および豊富な血液供給のために、舌下経路を介しての輸送は迅速な作用開始を生じさせ、短い送達期間要件および頻回ではない投与レジメンを備える高透過性薬物のために適切な送達経路を提供する。
【0058】
本発明の舌下処方物は、中等度から重度の疼痛の処置において有用である。好ましくは、本発明の舌下処方物は、突出痛の処置のために有用である。例えば、本発明の処方物は、好ましくは、突出痛を経験し、急性疼痛緩和を必要とする、慢性疼痛処置を受けている患者のために適切である。
【0059】
本発明の舌下処方物は、ショック、手足の切断、重度の化学的火傷もしくは熱傷、捻挫、靱帯裂傷、骨折、創傷ならびにその他の組織傷害、歯科の手術、処置および疾患、陣痛および出産、理学療法中、術後疼痛、放射線中毒、癌、後天性免疫不全症候群(AIDS)、硬膜外(もしくは硬膜周囲)線維症、腰部手術および椎弓切除術、坐骨神経痛、有痛性鎌状赤血球発症、関節炎、自己免疫疾患、難治性膀胱痛などを含むがそれらに限定されない多数の原因による疼痛を緩和するために使用できる。本発明のフェンタニル、その薬学的に受容可能な塩、またはその誘導体の処方物の舌下投与は、さらにまた好ましくは、ホスピスでの使用、詳細には癌およびAIDS患者の看護を専門とするホスピスに適応である。
【0060】
所定の好ましい実施形態では、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下投与は、慢性疼痛状態において発生する可能性がある急性突出痛のエピソードを緩和もしくは軽減することができる。また別の実施形態では、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下投与は、突出痛を軽減するために慢性疼痛状態のための従来型の治療レジメンの補助療法として使用できる。所定の実施形態では、本発明は、麻酔を誘導するための麻酔前投薬として使用するため、鎮静剤として使用するため、および/または不安を処置するための処方物をさらに提供する。
【0061】
本発明によるフェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下投与は、悪心および嘔吐、疾患の結果としての嚥下困難のために経口投与を許容できないか、または静脈アクセスの低下、衰弱、または凝固障害のために非経口投与を許容できない癌を有する患者において特に有益な可能性がある。本発明によるフェンタニルの舌下投与は、好ましくは、いっそうの使用の容易さおよび疼痛緩和作用の迅速な開始という潜在的利点を有している。さらに、舌下静脈排出は門脈性よりむしろ全身性であるので、肝初回通過排除を回避できる。本発明は、好ましくは、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の溶液を舌下スプレーポンプによって送達するための処置的な処方物および方法を提供する。
【0062】
所定の好ましい実施形態では、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下投与は、シリンジおよび注射針を使用する注射を必要としない、薬物の筋肉内投与に付随する可能性がある壊死を回避し、そしてロゼンジもしくは棒付きキャンディを絶えずしゃぶり続ける必要を回避する点で、他の投与形態に比して有益である。好ましくは、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下投与は、本発明によると、自己投与のために適合する。
【0063】
好ましい所定の実施形態では、本発明の処方物は、患者の舌下にフェンタニル、その薬学的に受容可能な塩、またはその誘導体を送達するために、例えば揮発性クロロフルオロカーボン(例えば、噴射剤12)、揮発性ヒドロフルオロアルカン(例えば、1,1,1,2−テトラフルオロエタンおよび1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパン)および揮発性アルカン(例えば、プロパン、ブタン)などのヒドロフルオロカーボン噴射剤などの噴射剤が必要とされないという点で有益である。
【0064】
好ましくは、本発明の処方物は、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロン、より好ましくは約20〜約200ミクロンの平均系を有する液滴として送達される。最も好ましくは、本処方物は、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する液滴として送達される。
【0065】
好ましくは、スプレーによる舌下粘膜への本発明の処方物の送達は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の処置作用の迅速な開始を生じさせる。例えば、所定の実施形態では、本発明の処方物は、ヒトへの舌下投与後の約5分〜約120分間、好ましくは約10〜60分間、およびより好ましくは約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する。
【0066】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/ml、好ましくは100μgのフェンタニルあたり約142pg/ml〜約195pg/ml、より好ましくは100μgのフェンタニルあたり約158pg/ml〜約177pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する。
【0067】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニル用量に基づいて約137pg/ml〜約207pg/ml、好ましくは100μgのフェンタニル用量に基づいて約154pg/ml〜約190pg/ml、より好ましくは100μgのフェンタニル用量に基づいて約163pg/ml〜約181pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する。
【0068】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、400μgのフェンタニル用量に基づいて約566pg/ml〜約850pg/ml、好ましくは400μgのフェンタニル用量に基づいて約637pg/ml〜約779pg/ml、より好ましくは400μgのフェンタニル用量に基づいて約672pg/ml〜約744pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する。
【0069】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、800μgのフェンタニルに基づいて約1016pg/ml〜約1525pg/ml、好ましくは800μgのフェンタニル用量に基づいて約1143pg/ml〜約1398pg/ml、より好ましくは800μgのフェンタニル用量に基づいて約1206pg/ml〜約1334pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する。
【0070】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約572pg・時間/ml〜約1273pg・時間/ml、好ましくは100μgのフェンタニルあたり約644pg・時間/ml〜約1167pg・時間/ml、より好ましくは100μgのフェンタニルあたり約715pg・時間/ml〜約1061pg・時間/mlのフェンタニルの無限大への血漿中濃度時間曲線下面積(AUC∞)を提供する。
【0071】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニル用量に基づいて約654pg・時間/ml〜約982pg・時間/ml、好ましくは100μgのフェンタニル用量に基づいて約736pg・時間/ml〜約900pg・時間/ml、より好ましくは100μgのフェンタニル用量に基づいて約777pg・時間/ml〜約859pg・時間/mlのフェンタニルの無限大への血漿中濃度時間曲線下面積(AUC∞)を提供する。
【0072】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、400μgのフェンタニル用量に基づいて約3394pg・時間/ml〜約5092pg・時間/ml、好ましくは400μgのフェンタニル用量に基づいて約3818pg・時間/ml〜約4667pg・時間/ml、より好ましくは400μgのフェンタニル用量に基づいて約4030pg・時間/ml〜約4455pg・時間/mlのフェンタニルの無限大への血漿中濃度時間曲線下面積(AUC∞)を提供する。
【0073】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、800μgのフェンタニル用量に基づいて約4581pg・時間/ml〜約6873pg・時間/ml、好ましくは800μgのフェンタニル用量に基づいて約5154pg・時間/mL〜約6300pg・時間/ml、より好ましくは800μgのフェンタニル用量に基づいて約5440pg・時間/ml〜約6014pg・時間/mlのフェンタニルの無限大への血漿中濃度時間曲線下面積(AUC∞)を提供する。
【0074】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニル用量に基づいて約378pg・時間/ml〜約1067pg・時間/ml、好ましくは100μgのフェンタニル用量に基づいて約425pg・時間/ml〜約978pg・時間/ml、より好ましくは100μgのフェンタニル用量に基づいて約472pg・時間/ml〜約889pg・時間/mlのフェンタニルのゼロ時点から最終定量可能血漿中濃度時点までの血漿中濃度曲線下面積(AUCT)を提供する。
【0075】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニル用量に基づいて約378pg・時間/ml〜約568pg・時間/ml、好ましくは100μgのフェンタニル用量に基づいて約425pg・時間/ml〜約520pg・時間/ml、より好ましくは100μgのフェンタニル用量に基づいて約448pg・時間/ml〜約497pg・時間/mlのフェンタニルのゼロ時点から最終定量可能血漿中濃度時点までの血漿中濃度時間曲線下面積(AUCT)を提供する。
【0076】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、400μgのフェンタニル用量に基づいて約2844pg・時間/ml〜約4268pg・時間/ml、好ましくは400μgのフェンタニル用量に基づいて約3200pg・時間/ml〜約3912pg・時間/ml、より好ましくは400μgのフェンタニル用量に基づいて約3378pg・時間/ml〜約3734pg・時間/mlのフェンタニルのゼロ時点から最終定量可能血漿中濃度時点までの血漿中濃度時間曲線下面積(AUCT)を提供する。
【0077】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、800μgのフェンタニル用量に基づいて約4333pg・時間/ml〜約6501pg・時間/ml、好ましくは800μgのフェンタニル用量に基づいて約4875pg・時間/ml〜約5960pg・時間/ml、より好ましくは800μgのフェンタニル用量に基づいて約5146pg・時間/ml〜約5689pg・時間/mlのフェンタニルのゼロ時点から最終定量可能血漿中濃度時点までの血漿中濃度時間曲線下面積(AUCT)を提供する。
【0078】
好ましくは、フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、有機溶媒中に溶解される。例えば水などのキャリア中のフェンタニル、その薬学的に受容可能な塩の溶解度を増強するために使用できる有機溶媒の例には、例えば、そして制限なく:例えば、メタノール、エタノール、プロピルアルコール、もしくはブチルアルコールなどの低級アルコール(例えば、C1−4アルコール);2つまたは3つのヒドロキシル基を有する、好ましくはグリセロール、プロピレングリコールもしくはブチレングリコールなどのC2−8アルコール;および例えばPEG200およびPEG400などのポリエチレングリコールが含まれる。上記の溶媒の任意の混合物を使用できる。所定の実施形態では、溶媒は、非極性炭化水素、好ましくは直鎖状もしくは分枝状構成のC7−18炭化水素、そのアルコール、脂肪酸エステル、およびミグリオール(Miglyol)などのトリグリセリドである。所定の好ましい実施形態では、有機溶媒は、エタノール、プロピレングリコール、ポリエチレングリコール、またはそれらの組み合わせである。
【0079】
好ましくは、本処方物に包含するための有機溶媒の量は、少なくともフェンタニル、その薬学的に受容可能な塩、またはその誘導体を、フェンタニルが溶液中に残留して沈殿しないように適切に可溶化するために必要な有機溶媒の量である。
【0080】
所定の実施形態では、有機溶媒は、処方物の重量の約0%〜約99.9%、好ましくは処方物の重量の少なくとも約10%〜約80%、より好ましくは処方物の重量の約20%〜約60%の量で処方物中に含まれる。
【0081】
所定の実施形態では、本組成物は、上述した有機溶媒に加えて、例えばプロピレングリコールなどのC2−8アルコール、または200〜4000の平均モル重量のポリエチレングリコールおよび/またはポリプロピレングリコール、またはそれらの混合物を含む。C2−8アルコールは、有機溶媒を組み合わせて共溶媒として作用できる。Carbowax(登録商標)(例えば、分子量300のCarbowax 300)として市販で入手できるポリエチレングリコールを使用できる。
【0082】
所定の実施形態では、本溶媒は、本明細書で言及した溶媒のいずれかを含む共溶媒である。所定の好ましい実施形態では、共溶媒は、エタノール、プロピレングリコール、ポリエチレングリコール、ラブラソール(labrasol)、ラブラフィル(labrafil)、トランスカトール(transcutol)またはそれらの組み合わせを含む。
【0083】
所定の好ましい実施形態では、本発明による組成物は、約0.0001重量%〜約20重量%のフェンタニル、その薬学的に受容可能な塩、またはその誘導体;約1重量%〜約99重量%の有機溶媒;および約0.01重量%〜約50重量%のC2−8アルコールを含む。
【0084】
所定の好ましい実施形態では、本発明による組成物は、約0.001重量%〜約15重量%のフェンタニル、その薬学的に受容可能な塩、またはその誘導体;約5重量%〜約90重量%のエタノール;および約0.1重量%〜約40重量%のプロピレングリコールを含む。
【0085】
所定の好ましい実施形態では、本発明による組成物は、約0.01重量%〜約10重量%のフェンタニル、その薬学的に受容可能な塩、またはその誘導体;約10重量%〜約80重量%のエタノール;および約1重量%〜約30重量%のプロピレングリコールを含む。
【0086】
所定の好ましい実施形態では、本発明による組成物は、約0.1重量%〜約0.8重量%のフェンタニル、その薬学的に受容可能な塩、またはその誘導体;約20重量%〜約60重量%のエタノール;および約4重量%〜約6重量%のプロピレングリコールを含む。
【0087】
所定の好ましい実施形態では、本発明による組成物は、1mLの容量中に、約100μg/mL〜約800μg/mLのフェンタニル塩基、約50%のエタノール、約5.2%のプロピレングリコール、および1mLまでに十分量の水を含む。
【0088】
所定の実施形態では、フェンタニルは、薬学的に受容可能な塩の形状で使用される。本発明によって使用するためのフェンタニルの適切な塩形の例には、例えば、そして制限なく、塩酸塩、塩化物、硫酸塩、酒石酸塩、またはクエン酸塩の形態が含まれる。所定の好ましい実施形態では、フェンタニルは、本発明の処方物中の遊離塩基として使用される。
【0089】
所定の好ましい実施形態では、フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、処方物中で約0.05mg/mL〜約15mg/mL、好ましくは約0.1mg/mL〜約10mg/mL、より好ましくは約1mg/mL〜約8mg/mL(このとき重量はフェンタニル遊離塩基の重量として表示されている)の濃度で使用されるであろう。
【0090】
所定の好ましい実施形態では、単位用量あたりに送達されるフェンタニル、その薬学的に受容可能な塩、またはその誘導体の量は、約10μg〜約10mg、好ましくは約25μg〜約5mg、より好ましくは約50μg〜約1600μgである。
【0091】
本発明の好ましい実施形態では、処方物は、溶液である。所定のまた別の実施形態では、処方物は、懸濁液である。本発明の処方物が懸濁液である場合は、スプレー噴霧前に組成物を振盪することが必要な場合がある。
【0092】
所定の好ましい実施形態では、フェンタニル、その薬学的に受容可能な塩、またはその誘導体が有機溶媒中に溶解させられる前は、処方物は、好ましくはスプレーデバイスを介してフェンタニル、その薬学的に受容可能な塩、またはその誘導体を送達するために液体キャリア中に含められる。
【0093】
薬学的に受容可能なキャリアには、水、緩衝液、食塩液、緩衝食塩液、デキストロース液、プロピレングリコール、ポリエチレングリコール、ミグリオールなどが含まれるが、それらに限定されない。特定の実施形態では、本発明の薬学的処方物に使用できるキャリアは、リン酸緩衝食塩液、または緩衝食塩液である。所定の好ましい実施形態では、キャリアは水である。所定の実施形態では、処方物中の水は、水性緩衝液の形状で存在する。緩衝液は、好ましくは、処方物のpHを、約5〜約12のpHで、好ましくは約6〜約10のpHで、より好ましくは約8〜約9.5のpHで安定化させるように適合させられる。本発明によって使用するための緩衝液系には、例えば、そして制限なく、酢酸ナトリウム/酢酸、酢酸アンモニウム/エデト酸(edentate)二ナトリウム、ホウ酸/水酸化ナトリウム、オルトリン酸/水酸化ナトリウム、オルトリン酸水素二ナトリウム/クエン酸などが含まれる。
【0094】
例えば保存料、酸化防止剤、界面活性剤、吸収増強因子、増粘剤もしくはフィルム形成ポリマー、増量剤、希釈剤、着色剤、香味剤、pH調整剤、甘味料または味覚マスキング剤などの他の構成成分もまた本組成物中に組み込むことができる。適切な着色剤には、赤色、黒色および黄色酸化鉄ならびに例えばFD&C Blue No.2、FD&C Red No.40などのFD&C色素が含まれる。適切な香味料には、ミント、ラズベリー、カンゾウ、オレンジ、レモン、グレープフルーツ、キャラメル、バニラ、チェリー、グレープのフレーバー、それらの組み合わせなどが含まれる。適切なpH調整剤には、クエン酸、酒石酸、リン酸、塩酸、マレイン酸、水酸化ナトリウムなどが含まれる。適切な甘味料には、アスパルテーム、アセサルフェームK、ターメリックなどが含まれる。適切な味覚マスキング剤には、重炭酸ナトリウム、イオン交換樹脂、シクロデキストリン包接化合物、アスコルビン酸塩などが含まれる。
【0095】
本発明によって使用するための吸収増強因子には、例えば、ポリソルベート、ソルビタンエステル、Poloxamerブロックコポリマー、PEG−35ヒマシ油、PEG−40硬化ヒマシ油、カプリロカプロイルマクロゴール−8グリセリド、PEG−8カプリル酸/カプリン酸グリセリド、ラウリル硫酸ナトリウム、スルホコハク酸ジオクチル、ポリエチレンラウリルエーテル、エトキシジグリコール、プロピレングリコールモノ−ジ−カプリン酸塩、モノカプリル酸グリセロール、エトキシ化(C8−C18)脂肪酸グリセリル、オレイン酸、リノール酸、カプリル酸/カプリン酸グリセリル、モノオレイン酸グリセリル、モノラウリン酸グリセリル、カプリル酸/カプリン酸トリグリセリド、エトキシ化ノニルフェノール、PEG−(8−50)ステアリン酸塩、オリーブ油PEG−6エステル、トリオレインPEG−6エステル、レシチン、d−αトコフェリルポリエチレングリコール1000コハク酸塩、ポリカーボネート、グリココール酸ナトリウム、タウロコール酸ナトリウム、シクロデキストリン、クエン酸、クエン酸ナトリウム、トリアセチン、それらの組み合わせなどが含まれる。所定の好ましい実施形態では、吸収増強因子は、トリアセチンである。吸収増強因子が処方物中に含まれている所定の好ましい実施形態では、吸収増強因子は、処方物の約0.001重量%〜約10重量%、好ましくは処方物の約0.01重量%〜約5重量%の量で含まれている。
【0096】
本発明によって使用するための増量剤には、例えば、微結晶性セルロース、マンニトール、キシリトール、デンプンなどが含まれる。所定の好ましい実施形態では、増量剤は、マンニトールである。増量剤が処方物中に含まれている所定の好ましい実施形態では、増量剤は、処方物の約0.001重量%〜約10重量%、好ましくは処方物の約0.01重量%〜約5重量%の量で含まれている。
【0097】
本発明によって使用するためのフィルム形成ポリマーは、組成物の粘度を上昇させることによってスプレーの微粉度、スプレー角度および好ましくは拡散を減少させるために役立つことができる。フィルム形成ポリマーとしては、ゲランガム、キサンタンガム、カルボキシメチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルメチルセルロース、メチルセルロース、エチルセルロース、gelucire、poloxamer、アルギン酸、プロピレングリコールエステル、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)、PVP/PVAコポリマー、lubrajel、カルボキビニルポリマー、アクリル酸ポリマーおよびコポリマー、メタクリル酸、アクリル酸メチル、アクリル酸エチル、メタクリル酸メチル、メタクリル酸エチル、それらの組み合わせなどを使用できる。所定の実施形態では、フィルム形成ポリマーなどを用いた溶液の粘度上昇は、スプレーデバイスから投与された場合の液滴サイズの増加を提供する。ポリマーの化学的性質およびポリマーの分子量もまた、液滴の径に影響を及ぼすことがある。
【0098】
所定の実施形態では、本発明による処方物は、好ましくは定量ポンプを装備した密封容器を含むポンプスプレーシステム内の複数回用量(multi−dose)を含有するバルク溶液として包装される。
【0099】
所定のまた別の実施形態では、本発明による処方物は、好ましくはポンプを装備した密封容器を含む単位用量ポンプスプレーシステム内の単位用量溶液として包装される。
【0100】
典型的には、患者は、スプレーポンプから1〜2回の作動による舌下投与によって処置される。舌下スプレー送達のまた別の長所は、単一作動によって必要に応じて1用量もしくは2用量で患者を容易に滴定できる能力である。これは、典型的には他の薬剤送達形態(パッチ、ロゼンジ剤、錠剤、坐剤)には当てはまらない。
【0101】
ポンプ作動スプレーは、作動させるために、例えば外部の手動、機械的もしくは電気的に開始される圧力のような外部圧力の適用が必要なことが特徴である。これは、作動が典型的には例えば弁の制御開放によるような圧力の制御放出によって達成される、噴射剤駆動式エーロゾルスプレーのような加圧システムとは対照的である。
【0102】
所定の実施形態では、ポンプスプレーは、本発明の処方物を備えるポンプスプレーは少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径を有する、より好ましくは約20〜約200ミクロンの平均径を有する、および/または好ましくは約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する液滴もしくは粒子の投与を可能にするので好ましい。これは、5ミクロン未満の粒子を生じさせる可能性がある加圧システムとは対照的である。約5ミクロン未満の径を有する液滴もしくは粒子は、投与されるとヒトの肺に進入する可能性を有する。そのような肺への進入は、フェンタニルの吸収における患者間変動性の増加を引き起こすであろう。さらに、肺内へのフェンタニルの吸収は、吸収の増加および致死性となることのある呼吸抑制を含む副作用の増加を引き起こすであろう。
【0103】
所定の好ましい実施形態では、送達される処方物の液滴サイズは、例えばスポイトを用いて舌下に配置することとは対照的に、舌下にスプレーすることによる表面積の増加をさらに提供する。
【0104】
所定の好ましい実施形態では、送達デバイスは、米国特許第6,866,566号;同第6,877,672号;同第6,772,915号;同第6,725,857号;同第6,705,493号;同第6,679,248号;同第6,578,741号;同第6,527,144号;同第6,484,715号;同第6,478,196号;同第6,461,322号;同第6,446,839号;同第6,427,878号;同第6,367.473号;同第6,364,166号;同第6,321,942号;同第6,234,366号;同第6,227,413号;同第6,059,151号;同第6,059,150号;同第6,055,979号;同第5,944,222号;同第5,901,883号;同第5,813,570号;同第4,565,302号;同第4,532,967号;同第6,964,381号;同第6,860,411号;同第6,824,020号;同第6,817,490号;同第6,585,172号;同第6,443,370号;同第6,427,680号;同第6,425,499号;同第6,401,987号;同第6,398,074号;同第6,264,065号;同第5,950,877号;同第5,328,099号;同第5,301,846号に記載されたデバイスおよび経鼻投与のために適合すると所定の実施形態で記載されたデバイスなどである。
【0105】
本発明の処方物によって使用するために適合するその他のデバイスは、米国特許第6,808,085号;同第6,736,293号;同第6,732,955号;同第6,708,846号;同第6,626,379号;同第6,626,330号;同第6,626,328号;同第6,454,185号;同第6,427,876号;同第6,427,684号;同第6,419,167号;同第6,405,903号;同第6,352,181号;同第6,308,867号;同第6,257,461号;同第6,257,454号;同第6,250,509号;同第6,227,415号;同第6,209,760号;同第6,179,164号;同第6,109,547号;同第6,062,430号;同第6,026,992号;同第5,992,704号;同第5,992,703号;同第5,988,449号;同第5,967,369号;同第5,964,417号;同第5,950,879号;同第5,938,125号;同第5,927,559号;同第5,921,444号;同第5,893,484号;同第5,875,938号;同第5,862,962号;同第5,860,567号;同第5,816,504号;同第5,813,570号;同第5,803,311号;同第5,791,518号;同第5,692,650号;同第5,655,689号;同第5,584,417号;同第5,520,337号;同第5,519,980号;同第5,482,193号;同第5,469,989号;同第5,443,185号;同第5,439,177号;同第5,437,398号;同第5,427,280号;同第5,395,032号;同第5,375,745号;同第5,368,201号;同第5,366,122号;同第5,366,122号;同第5,335,823号;同第5,326,000号;同第5,323,936号;同第5,316,198号;同第5,301,841号;同第5,295,628号;同第5,289,946号;同第5,277,334号;同第5,257,726号;同第5,228,586号;同第5,209,375号;同第5,203,840号;同第5,147,087号;同第5,115,980号;同第5,110,052号;同第5,011,046号;同第4,958,752号;同第4,946,069号;同第4,944,430号;同第4,934,568号;同第4,921,142号;同第4,871,092号;同第4,830,284号;同第4,826,048号;同第4,823,991号;同第4,821,923号;同第4,817,829号;同第4,776,498号;同第4,762,475号;同第4,728,008号;同第4,726,747号;同第4,694,977号;同第4,694,976号;同第4,566,611号;同第6,851,583号;同第6,824,021号;同第6,779,690号;同第6,776,312号;同第6,971,559号;同第6,948,640号;同第6,945,473号;同第6,938,802号;同第6,933,850号;同第6,929,156号;同第6,918,514号;同第6,913,205号;同第6,866,168号;同第6,832,072号;同第6,830,163号;同第6,817,490号;同第6,817,489号;同第6,811,060号;同第6,811,057号;同第6,805,301号;同第6,805,263号;同第6,789,750号;同第6,789,706号;同第6,786,369号;同第6,783,035号;同第6,772,913号;同第6,769,579号;同第6,758,371号;同第6,752,298号;同第6,742,677号;同第6,705,062号;同第6,698,627号;同第6,698,623号;同第6,663,019号;同第6,659,314号;同第6,659,307号;同第6,655,550号;同第6,655,549号;同第6,651,846号;同第6,601,735号;同第6,595,395号;同第6,592,010号;同第6,588,629号;同第6,581,852号;同第6,571,991号;同第6,554,160号;同第6,536,635号;同第6,527,149号;同第6,527,148号;同第6,488,185号;同第6,471,097号;同第6,460,781号;同第6,460,740号;同第6,460,738号;同第6,446,841号;同第6,422,429号;同第6,409,049号;同第6,398,079号;同第6,360,919号;同第6,349,856号;同第6,345,737号;同第6,343,722号;同第6,662,561号;同第6,315,169号;同第6,273,303号;同第6,273,300号;同第6,261,274号;同第6,257,457号;同第6,234,363号;同第6,234,168号;同第6,221,054号;同第6,209,759号;同第6,189,741号;同第6,186,371号;同第6,155,496号;同第6,119,897号;同第6,105,826号;同第6,021,930号;同第6,012,615号;同第5,988,496号;同第5,950,871号;同第5,931,386号;同第5,850,948号;同第5,803,318号;同第5,799,810号;同第5,769,325号;同第RE35,683号;同第5,692,492号;同第5,568,884号;同第5,566,865号;同第5,511,698号;同第5,482,188号;同第5,476,198号;同第5,366,115号;同第5,337,923号;同第5,249,713号;同第5,237,797号;同第5,234,135号;同第5,226,563号;同第5,190,192号;同第5,176,296号;同第5,127,548号;同第4,966,313号;同第4,91,840号;同第4,245,967号;同第4,030,667号などに記載されている。
【0106】
本明細書に言及した特許はすべてが、全体として参照して本明細書に組み込まれる。上述した特許において開示された送達デバイスは経鼻もしくは吸入投与のためには適合する可能性があるが、本発明の所定の実施形態によると、本送達デバイスは、液体処方物の舌下投与のために適合するように特別に適合させられている。所定の実施形態では、本発明を実行するために利用されるデバイスには、Pfeiffer of America社によって製造された構成成分、例えばPfeiffer of America社製の舌下単位用量投与デバイス(製品番号72772)が含まれる。他の実施形態では、本デバイスはPfeiffer of America社製の舌下単位用量投与用アプリケーターアセンブリである。
【0107】
好ましくは、本発明によるデバイスは、好ましくは少なくとも約10ミクロン、好ましくは少なくとも約20ミクロン、より好ましくは約20〜約200ミクロンの平均径を有する液滴だけが患者に送達されるような制御方法で舌下処方物を舌下に送達するように適合させられる。より好ましくは、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンの範囲内のサイズ分布を有する液滴だけ。
【0108】
好ましくは、ディスペンサーは、指か、または片手の3本の指で持つことができ、同時かつ確実に作動できるような、そして例えば舌下スプレーの方法で使用できるように構築される。ディスペンサーは、媒体チャンバーが空になった後に再充填する必要のない、したがって側面図では大まかにはT形もしくはY形であってよいアウターケーシング内にポンプ、処方物、チャネル、および必要に応じて弁もしくはクロージャー(closure)を受容する単純な標準的な構成成分として構築できる使い捨て型ディスペンサーとして構築できる。
【0109】
ディスペンサーを連続して分割して押すポンプストロークか、または1度に1回のポンプストロークで空にして、再充填されない場合は、ディスペンサーは、開始位置で外部に対して実質的に緊密に閉鎖することができる。
【0110】
所定の好ましい実施形態では、送達デバイス(例えば、スプレーポンプデバイス)はロックアウト機構を含む。好ましくは、ロックアウト機構は、1回の単位用量だけの投与を許容し、そして好ましくは、単位用量の投与だけを許容して、その後の所定および/または規定時間にわたるさらなる投与をロックアウト(lock out)ことによって、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の乱用を防止する。所定の実施形態では、1回以上の作動周期後に、アクチュエーターは自動的にロック位置に移動させることができるので、その後の作動周期を実施するためには、無作為もしくは意図的に解除が発生しなければならない。ロック(locking)は、出発位置、作動位置および/または中間位置で発生することができ、作動に抵抗して、復帰もしくはこれらの移動単独の1つに抵抗しての両方に作用することができ、そして同一もしくは相違するロック作動に伴う数種のロック位置が可能である。
【0111】
所定の実施形態では、デバイスは事前計量型であっても、デバイスはデバイス計量型であってよい。事前計量型デバイスは、好ましくは、事前に計量された用量または、製造中にデバイス内に、または使用前に患者によって含めることのできる同一タイプの単位での用量画分(例えば、単位用量の溶液、単一ブリスターもしくは複数ブリスター、または他の空間)を含有している。典型的なデバイス計量型ユニットは、患者が活性化させるとデバイス自体によって定量スプレーとして送達される複数回投与のために十分な処方物を含有するリザーバーを備える。
【0112】
本デバイスの製造に関して検討すべき重要な因子は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下への送達に影響を及ぼす可能性がある用量の再現性、スプレープルーム、および粒子/液滴サイズ分布である。使用期間内を通してこれらのパラメーターの再現性を維持すること、そして患者の使用条件下でその寿命を通して本デバイスの機能性(例えば、スプレー機構、電子的特性、センサー)を保証することは重要であるが、それはこれらのパラメーターにおけるいずれかの変化は投薬および吸収における変動性を引き起こし、これは潜在的副作用を引き起こす可能性があるからである。
【0113】
スプレー薬処方物の投与される用量は、容器密封システムの設計、再現性、および性能特徴に左右される可能性がある。所望の液滴/粒径分布を提供する適切なデバイスは、フェンタニル処方物の正しい性能のために重要な要素である。本デバイスに関しては、作動パラメーター(例えば、力、速度、保持時間および再実行時間)についてもまた検討するべきである。さらに、本デバイスは、処方物構成成分と適合しなければならない。さらに、本デバイスは、患者用の使用説明書にしたがって使用した場合に、フェンタニル、その薬学的に受容可能な塩、またはその誘導体、処方物の部分的計量を防止するように設計されなければならない。
【0114】
典型的なデバイスには、基本ユニット、放出アクチュエーター、デバイスから処方物を放出するための開口部、および媒体リザーバーを含む。好ましくは、分注チャンバーとして本デバイスの製造時には既に充填されているリザーバーが用意される。媒体リザーバーは、好ましくは、1回の能動化の際に、放出されるフェンタニル、その薬学的に受容可能な塩、またはその誘導体の測定された含量を規定する。
【0115】
本発明の所定の実施形態によると、リザーバー、または媒体を受け入れるその空間は、好ましくはリザーバー本体の周囲および全長にわたって一定である壁厚を有する好ましくは細長い形状である。リザーバー本体は、その製造が極めて単純であるように、単純に、プラスチック、例えばステンレス鋼などの鋼、例えばガラスなどの透明材料の円筒形中空の区間によって形成されてよい。
【0116】
好ましくは、アクチュエーター本体は、放出を活性化するための開口部に対して可動性である、本デバイスのユニット上に提供される。この本体は、作動運動の進行に伴って、例えば穿刺によって、チャンバーの閉鎖を開く。このチャンバー内の空間は、リザーバー内の媒体に直接的に隣接していてよく、開口本体もしくはリザーバーに少なくとも一部には適応することができ、そして開放前には高圧状態にある圧力空間として構成される。開口本体は、リザーバーによって直接的に形成されてよい。
【0117】
好ましくは、出発位置後の一作動動程中に、高圧が作り上げられる。同一方向に継続する作動性の移動のその後の一部分において、媒体は、側辺の一つで圧力から開放され、この側辺上にある媒体開口部へ移動させられる。そこで、側辺に作用する圧力のために、媒体はリザーバーから開口部を通して押し出される。
【0118】
典型的には液体処方物が開口部を離れるにつれて、液滴は、デバイスの開口部の形状によって影響される軌道に従う。所定の実施形態では、液滴サイズ、スプレー形状およびスプレーパターンは、ポンプの設計および/または処方物の特性に依存する。所定の実施形態では、アクチュエーターの位置付け、ポンプの設計、および処方物の特性がスプレーの対称性および形状に影響を及ぼすであろう。
【0119】
所定の実施形態では、本発明のデバイスは、ストッパーをさらに含む。好ましくは、ストッパーは、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の吸収を妨害するか、または実質的に妨害する材料を含む。本発明のデバイスによって使用するために適合するストッパーは、例えば、West Pharmaceutical Services社によって市販されているストッパーである。所定の好ましい実施形態では、ストッパーは、以下:1)エラストマー系:ブロモブチルおよび/またはクロロブチル;2)強化系:不活性材料;および3)硬化系:の非従来型の組成および特徴を有している。
【0120】
所定の実施形態では、本デバイスは、ガスケットをさらに備える。好ましくは、ガスケットは、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の吸収を妨害するか、または実質的に妨害する材料を含む。本発明のデバイスによって使用するために適合するガスケットは、例えば、West Pharmaceutical Services社によって市販されているストッパーである。所定の好ましい実施形態では、ガスケットは、以下の:1)エラストマー系:ブロモブチルおよび/またはクロロブチル;2)強化系:不活性材料;および3)硬化系:の非従来型の組成および特徴を有している。
【0121】
液滴サイズ分布は、当業者に公知である任意の信頼できる方法を利用することによって決定できる。1つのそのような方法は、例えばRT Sizerソフトウェアを使用するMalvern Spraytec(登録商標)などのレーザー回折デバイスを使用する。サイズ分布を決定するためには、Malvern Instruments(英国)社製のMalvern Mastersizer Sデバイスもまた使用できる。Malvern Mastersize Sは、測定多様性を提供するモジュラー式粒径分析デバイスである。このデバイスは、スプレー液滴のサイズならびに湿性および乾性サンプルを測定することができる。Malvern Mastersizer Sを用いると、1ミクロン未満から数ミリメートルまでの粒子を測定できる。
【0122】
さらに、液滴サイズ分布を決定する場合は、手動作動に関連する変動性を減少させるためのインビトロ生物学的等価性試験または他の試験において比較するための自動作動ステーションもまた使用できる。当業者に公知である任意の自動作動ステーションは、本発明を実行する際に適用できる。そのような1つのデバイスの例は、Innova Systems社によるMightyRunt作動ステーションである。好ましい実施形態では、MightyRuntには、換気扇アタッチメントが装備されている。また別の実施形態では、MightyRuntにはさらにMettler Toledo天秤AT201型が装備されている。
【0123】
(その他の活性薬剤)
本明細書に記載した本発明はフェンタニル、その薬学的に受容可能な塩、またはその誘導体に関連して説明してきたが、その他の活性な薬学的因子、詳細には舌下投与に適合する薬学的因子を本発明によって使用できることは企図されている。例えば、所定の実施形態では、舌下投与のために適合する他のオピオイド系鎮痛薬は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の代りに使用できる。本発明によって使用するための所定のオピオイド系鎮痛薬には、例えば、そして制限なく、アルフェンタニル、スフェンタニル、ブプレノルフィン、ブトルファノール、コデイン、ヒドロコドン、ヒドロモルホン、レボルファノール、メペリジン、メタドン、モルヒネ、ナルブフィン、オキシコドン、オキシモルホン、プロポキシフェン、トラマドールなどが含まれる。
【0124】
所定の実施形態では、活性化合物は、鎮痛薬、オピオイドアンタゴニスト、偏頭痛治療薬、制吐薬、抗てんかん薬、抗高血圧薬、麻酔薬、カンナビノイド、カンナビノイドアンタゴニスト、カンナビノイドのインバースアゴニスト、内在性カンナビノイド、エンケファリン、それらのアナログもしくは誘導体、またはそれらの混合物である。
【0125】
本発明において有用な鎮痛薬には、アルフェンタニル、ブプレノルフィン、ブトルファノール、コデイン、フェンピプラミド、ヒドロコドン、ヒドロモルホン、レボルファノール、メペリジン、メタドン、モルヒネ、ナルブフィン、オキシコドン、オキシモルホン、ペンタゾシン、ピリトラミド、プロポキシフェン、スフェンタニル、チリジン、トラマドール、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0126】
本発明において有用なオピオイドアンタゴニストには、ナロキソン、ナルトレキソン、ナルメフェン、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0127】
本発明において有用な偏頭痛治療薬には、アルモトリプタン、エレトリプタン、フロバトリプタン、ナラトリプタン、リザトリプタン、スマトリプタン、ゾルミトリプタン、麦角アルカロイド、プロキシバルバール、リスリド、メチセルジド、クロニジン、ピゾチフェン、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0128】
本発明において有用な制吐薬には、ブロモプリド、ドンペリドン、グラニセトロン、オンダセトロン、トロピセトロン、メトクロプラミド、ピリドキシン、スコポラミン、チエチルペラジン、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0129】
本発明において有用な抗てんかん薬には、バルビツレート、カルバマゼピン、エトスクシミド、メスクシミド、フェニトイン、プリミドン、ズルチアム、バルプロ酸、ビガバトリン(vigabatrine)、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0130】
本発明において有用な抗高血圧薬には、ジルチアゼム、クロニジン、ニフェジピン、ベラパミル、イソソルビド−5−モノニトレート、有機硝酸塩、心臓障害の処置に使用される薬剤、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0131】
本発明において有用な麻酔薬には、ベンゾカイン、ブピバカイン、ジブカイン、エチドカイン、レボブピバカイン、リドカイン、メピバカイン、オキシブプロカイン、ピペロカイン、プリロカイン、プロカイン、プロパラカイン、ロピバカイン、テトラカイン、キシロカイン、デスフルラン、エンフルラン、イソフルラン、セボフルラン、ベンゾナテート、ジクロニン、ケタミン、フェノール、プロポフォール、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0132】
本発明において有用なカンナビノイドには、δ−8−テトラヒドロカンナビノール、δ−9−テトラヒドロカンナビノール、カンナビドール、オリーブトール、カンナビノール、カンナビグレロール、ナビロン、δ−9−テトラヒドロカンナビノイド酸(cannabinotic acid)、非向精神性カンナビノイド3-ジメチルネプチ11カルボ
ン酸ホモロギン(homologine)8、δ−8−テトラヒドロカンナビノール、それらの薬学的に受容可能な塩、それらの複合体、それらの誘導体、またはそれらの混合物が含まれるがそれらに限定されない。特に好ましいカンナビノイドは、ドロナビノールとしても知られている、δ−9−テトラヒドロカンナビノールである。
【0133】
さらに、狭い治療指数もしくは治療範囲を有する活性薬剤(例えば、薬剤の血中レベルにおける小さな変動は、その薬剤の有効性または毒性における変化を引き起こす)は、本発明によって使用するために特に適合するであろう。そのような活性薬剤には、例えば、そして制限なく、ジゴキシン、レボチロキシン、アミノ配糖体(例えば、ゲンタマイシン、トブラマイシン)、抗不整脈薬(例えば、プロカインアミド、キニジン)、テオフィリン、抗腫瘍薬、ブスルファン、メトトレキセート、6−MP、カルボプラチン、抗うつ薬(例えば、リチウム)、抗痙攣薬(例えば、フェニトイン、カルバマゼピン、バルプロ酸ナトリウム、)、抗精神病薬、抗凝固薬(例えば、ワルファリン)、シクロスポリンなどが含まれる。
【0134】
以下では、添付の実施例を参照しながら本発明をより十分に説明する。しかし、以下の説明は例示することだけを目的としており、上述した本発明の普遍性への制限であるとは決して見なされるではない。
【実施例】
【0135】
(好ましい実施形態の詳細な説明)
(実施例1)
実施例1では、0.5mg/mLの濃度を有するフェンタニル舌下処方物を調製した。本処方物は、以下の表1に列挙した:
【0136】
【表1】

(実施例2)
実施例2では、0.5mg/mLの濃度を有するフェンタニル舌下処方物を調製した。本処方物は、以下の表2に列挙した:
【0137】
【表2】

0.5mg/mLのフェンタニル塩基と同等のクエン酸フェンタニルを含有している。
【0138】
(実施例3)
実施例3では、0.5mg/mLの濃度を有するフェンタニル舌下処方物を調製した。本処方物は、以下の表3に列挙した:
【0139】
【表3】

(実施例4)
実施例4では、0.5mg/mLの濃度を有するフェンタニル舌下処方物を調製した。本処方物は、以下の表4に列挙した:
【0140】
【表4】

(実施例5)
実施例5では、0.5mg/mLの濃度を有するフェンタニル舌下処方物を調製した。本処方物は、以下の表5に列挙した:
【0141】
【表5】

処方物の調製(実施例1〜5)
1.風袋を計量したガラス容器中に計算した量のフェンタニル塩基もしくはクエン酸フェンタニルを測り入れた。
2.計算した量のアルコールを容器に加え、フェンタニルを溶解させるために混合した。3.プロピレングリコールを計量し、上記フェンタニル溶液に加えた。
4.水もしくは緩衝液もしくはミグリオールを計量し、フェンタニル溶液に加え、2分間混合した。
5.不活性成分(マンニトール、トリアセチン、もしくはTW80)を最後に加え、十分に混合した。
6.最終溶液は3分間にわたりボルテックスミキサーにかけた。混合後、その処方物を、その後の試験のために冷蔵庫に保存した。
【0142】
(実施例6)
実施例6では、体重が2〜3kgの3匹のウサギを使用して、参照物質としての本処方物のIV注射と比較して、実施例1〜5の舌下投与のバイオアベイラビリティを試験した。ウサギには、最初に、約15〜20分間にわたりウサギを固定したままにする必要に応じてイソフルレンガスによる麻酔を実施した。
【0143】
各処方物について、試験ウサギは、舌下およびIV投与によって0.1mL(50μgのフェンタニル塩基と同等)の単回投与を受けた。舌下試験のためには、スプレーボトルを用いて用量の液体処方物を舌の下方に投与した。血液サンプル(1サンプルに付き1mL)は、耳静脈の内側に挿入したカテーテルを通して入手した。
【0144】
血液サンプルはベースライン時のゼロ時点および単回投与の5、10、20、45、60および120分後に採血した。サンプルは即時に冷却し、採血から2〜3時間以内に遠心分離により血漿を分離した。サンプルは、分析時まで−20℃で保存した。動物は、麻酔から回復した後にケージに戻した。これらの動物は、その後の試験のために再使用できるようになるまで少なくとも5〜7日間にわたりケージ内で休息させた。
【0145】
(血漿の収集および分離)
血液は、7.5% EDTAを含有する3mLチューブ内にウサギから採血し、血球およびその他の不溶性材料を除去するために15分間にわたり3000RPMで遠心した。血漿は、シラン処理チューブ内にデカンテーションし、分析時まで−20℃で冷凍保存した。
【0146】
(血漿の抽出)
各血漿サンプル(0.5mL)に対して、100μLのスフェンタニル(IS)および100μLの5M NaOH(タンパク質変性のため)を加えた。フェンタニルは、1mLの1−クロロブタンを用いて15分間にわたりボルテックスミキサーにかけることによって抽出した。5分間にわたり12000RPMで遠心し、10分間にわたり凍結乾燥(すべてのエマルジョンを破壊するため)させた後、上部の有機相をデカンテーションし、穏やかな窒素流を用いて乾燥するまで蒸発させた。抽出残留物は100μLのメタノールを用いて再構成し、その後に5分間にわたりボルテックスミキサーにかけ、3分間にわたり超音波処理し、次に3μLの量をGC−MSシステム内に注入した。
【0147】
(結果および考察)
(血漿中濃度対時間プロフィール)
0.1mL(50μgのフェンタニル塩基と同等)のIVおよび舌下投与後のウサギにおけるフェンタニルの血漿中濃度−時間プロフィールは、以下の表(表6A〜10B)に表示した。
【0148】
表6Aおよび6Bは、実施例1についての血漿中濃度−時間プロフィールを提供する。
【0149】
【表6A】

【0150】
【表6B】

表7Aおよび7Bでは、実施例2についての血漿中濃度−時間プロフィールである。
【0151】
【表7A】

【0152】
【表7B】

表8Aおよび8Bでは、実施例3についての血漿中濃度−時間プロフィールである。
【0153】
【表8A】

【0154】
【表8B】

表9Aおよび9Bでは、実施例4についての血漿中濃度−時間プロフィールである。
【0155】
【表9A】

【0156】
【表9B】

表10Aおよび10Bでは、実施例5についての血漿中濃度−時間プロフィールである。
【0157】
【表10A】

【0158】
【表10B】

(薬物動態パラメーター)
薬物の舌下もしくはIV投与後に入手した最高血漿中濃度(Cmax)、Cmax到達時間(Tmax)、半減期(t1/2)、曲線下面積(AUC)、およ全身クリアランス(CL)は、以下の表(表11〜15)に一覧にした。同様に、フェンタニルのIVおよび舌下用量の投与後の血漿中濃度−時間曲線を、図1〜10に示す。
【0159】
【表11】

【0160】
【表12】

【0161】
【表13】

【0162】
【表14】

【0163】
【表15】

舌下投与後には、全処方物について約20分後に最高濃度に到達した。どちらの投与経路によっても相当に大きな個体間変動性が見られた。舌下投与後の測定可能な血漿中濃度は、大多数の処方物試験において120分後に証明可能であった。これらをまとめると、フェンタニルの舌下投与は、IVに比較して良好な吸収プロフィールを示した。
【0164】
(実施例7)
実施例7では、絶食条件下にある健常志願者において舌下投与量を増量した後に、実施例1によって調製した処方物の薬物動態を決定する試験を実施した。さらにまた実施例1によって調製したフェンタニル舌下スプレーのヒトにおける安全性および許容性を決定するための試験もまた実施した。
【0165】
本試験は、健常男性被験体における単一施設、単回投与、単一盲験、連続的増量および反復設計であった。以下の処置は、絶食条件下で投与する必要があった:
処置A(試験1):1回のフェンタニル1mg/mL(舌下スプレー)(1×100μg用量)
処置B(試験2):1回のフェンタニル4mg/mL(舌下スプレー)(1×400μg用量)
処置C(試験2):2回のフェンタニル4mg/mL(舌下スプレー)(1×800μg用量)
処置D(プラセボ試験1):1回のプラセボ1mg/mL(舌下スプレー)(1×100μg用量)
処置E(プラセボ試験2):1回のプラセボ4mg/mL(舌下スプレー)(1×400μg用量)
処置F(プラセボ試験2):2回のプラセボ4mg/mL(舌下スプレー)(1×800μg用量)
これらの処方物は、以下の表16に記載の設計にしたがって9例の健常男性志願者に投与する予定であった:
【0166】
【表16】

各期間において、被験体は投与の少なくとも10時間前に臨床試験施設に到着することになっていた。監視下での一晩にわたる絶食後に、単回経口用量の割り付けられた処方物が午前中に経口投与されることになっていた。被験体は、24時間にわたる採血後には臨床試験施設を離れることが許された。ウォッシュアウト期間は、少なくとも14日間とされた;本試験の期間は約5〜6週間であると予測された。プロトコールによると、各連続投与は、測定対象の成分の予想半減期の10倍以上に対応する少なくとも14日間のウォッシュアウトによって分離されることになっていた。しかし、試験中には、第1期間および第2期間は15日間のウォッシュアウトによって分離され、第2期間および第3期間は13日間のウォッシュアウトによって分離された。フェンタニルの予想半減期は約6.4時間であると予想されると報告されているので、これらのウォッシュアウト偏差は試験の結論に影響を及ぼさないと判定されている。さらに、第2および第3期間の開始時に持ち越し(carry−over)は観察されなかった。
【0167】
(薬物動態的評価)
薬物動態測定のための血液サンプルは、各薬物投与の前および投与24時間後まで(連続サンプリング)収集した。試験処方物の投与によって生じた薬物濃度を使用して以下の表17および18に列挙した薬物動態パラメーターを引き出した。
【0168】
統計的分析には6例の被験体を含めた。非標準化薬物動態パラメーターの要約を表17に提示し、標準化薬物動態パラメーターの要約を表18に提示した。試験処方物の投与によって生成した平均測定血漿中濃度対時間プロフィールを図11に示し、変形平均濃度対時間プロフィールを図12に提示する。
【0169】
本試験の対象の薬物動態パラメーターは、Cmax、AUC∞、AUCT、AUCT/∞、Kel、Tmax、T1/2el、Cl/FおよびVZ/Fであった。
【0170】
【表17】

Tmaxについては中央値が提示されており、統計的分析は順位に基づいている。
【0171】
【表18】

Tmaxについては中央値が提示されており、統計的分析は順位に基づいている。
1=試験1と相違する(p<0.05)
2=試験1と相違する(p<0.01)
N.S.=有意ではない(p>0.05)
薬物動態パラメーターの定義
Cmax:最高血漿中濃度(ng/mL)
Tmax:最高測定血漿中濃度到達時間;それが1回よりも多い時点で発生する場合、Tmaxはこの数値を示した最初の時点(時間)であると規定されている。
CLQC:最終定量可能濃度(ng/mL)。
TLQC:最終定量可能血漿中濃度到達時間(時間)。
AUCT:台形法を用いて、および以下の方程式:
【0172】
【数1】

(式中、NTLQCは、TLQCに関連するサンプルの数である)によって計算された、0〜TLQCまでの計算された累積血漿中濃度時間曲線下面積(ng・時間/mL)。
AUC∞:無限大までの外挿血漿中濃度時間曲線下面積(ng・時間/mL)。
【0173】
【数2】

AUCT/∞:AUC∞に対するAUCTの相対比率(%)。
【0174】
【数3】

TLIN:対数線形排出が始まる時点(時間)。
Kel:非線形最小二乗回帰分析によって推定された見掛けの平均排出速度定数;濃度時間曲線の最後に必要とされる最小限3つの数値(時間−1)。
T1/2el:排出半減期(時間)。
【0175】
【数4】

Cl/F:見掛けのクリアランス(mL/時間/kg)
【0176】
【数5】

Vz/F:見掛けの分布容積(mL/kg)
【0177】
【数6】

*体重(kg)当たりで表示した用量
表11に記載したように、100μg用量と標準化400μg用量との間で統計的有意差が観察されたパラメーターは、AUCT、ln(AUCT)およびAUCT/∞であり、100μg用量と800μg用量との間で統計的有意差が観察されたパラメーターは、AUCT/∞であった。試験下の他の薬物動態パラメーターのいずれについても、統計的有意差は観察されなかった。
【0178】
100μg用量の平均Cmax値は172.0pg/mLであったが、400μg用量については708.0pg/mLであり、800μg用量については1270.4pg/mLであった。100μg用量に標準化すると、400μg用量の平均Cmax値は177.0pg/mLとなり、800μg用量については158.8pg/mLとなった。
【0179】
メジアンTmaxは、100μg用量および400μg用量については0.50時間、そして800μg用量については0.75時間であった。
【0180】
100μg用量の平均AUCT値は472.6pg・時間/mLであったが、400μg用量については3556.1pg・時間/mLであり、800μg用量については5,417.3pg・時間/mLであった。100μg用量に標準化すると、400μg用量の平均AUCT値は889.0pg・時間/mLとなり、800μg用量については677.2pg・時間/mLとなった。
【0181】
100μg用量の平均AUC∞値は817.9pg・時間/mLであったが、400μg用量については4242.6pg・時間/mLであり、800μg用量については5726.8pg・時間/mLであった。100μg用量に標準化すると、400μg用量の平均AUC∞値は1060.7pg・時間/mLとなり、800μg用量については715.9pg・時間/mLとなった。
【0182】
AUCT/∞比は、100μg用量については約55%であり、400μg用量については81%、そして800μg用量については94%であった。
【0183】
平均Kel値は、100μg用量については0.2008時間−1、400μg用量については0.1593時間−1、そして800μg用量については0.1782時間−1であったが、他方平均T1/2elは、同一順序で3.70時間、5.20時間および3.89時間であった。
【0184】
平均Cl/F値は、100μg用量については1718.8mL/時間/kg、400μg用量については1532.2mL/時間/kg、そして800μg用量については1837.3mL/時間/kgであったが、平均Vz/F値は、100μg用量については9070.2mL/kg、400μgについては10470.4mL/kg、そして800μg用量については10307.7mL/kgであった。
【0185】
被験体内変動は、Cmax、AUCT、およびAUC∞に対して、各々36.79%、37.05%および28.88%であった。
【0186】
(安全性の評価)
安全性パラメーターは、有害作用の発生、バイタルサインの測定値、呼吸数、指パルスオキシメトリーによる血液の酸素飽和度、ECGおよび臨床検査パラメーターを含んでいた。
【0187】
すべての有害事象は、健常志願者によって自発的に報告された、治験責任医師(または代表者)によって観察されたか、または臨床スタッフによる一般的質問によって引き出された。有害事象は、さらにまた投与後に正確に記入された書式「被験体への投薬アンケートの経験」の完了後にも報告された。本試験のためには、各個別被験体についての観察期間は、被験体がインフォームドコンセントを提出した時点から最終薬物投与後7日間以内までに及んだ。
【0188】
(安全性試験の結果)
全9例の被験体は、本試験中に、計127例の有害事象を経験した。重篤な有害事象は、本試験では記録されなかった。試験1(A)処方物の単位用量投与後には20例の有害事象(8種の相違するタイプ)が報告され、試験2(B)処方物の単位用量投与後には56例の有害事象(26種の相違するタイプ)が報告され、試験2(C)処方物の単位用量投与後には22例の有害事象(19種の相違するタイプ)が報告され、プラセボ試験1(D)処方物の単位用量投与後には10例の有害事象(8種の相違するタイプ)が報告され、プラセボ試験2(E)処方物の単位用量投与後には12例の有害事象(8種の相違するタイプ)が報告され、そしてプラセボ試験2(F)処方物の単位用量投与後には12例の有害事象(8種の相違するタイプ)が報告された。試験後検査室試験結果と関連する2例の有害事象は3種の処方物に帰属した。
【0189】
試験1(A)処方物の投与後には6例の被験体(100%)が有害事象を報告し、試験2(B)処方物の投与後には6例の被験体(100%)が有害事象を報告し、試験2(C)処方物の投与後には2例の被験体(100%)が有害事象を報告し、プラセボ試験1(D)処方物の投与後には3例の被験体(100%)が有害事象を報告し、プラセボ試験2(E)処方物の投与後には3例の被験体(100%)が有害事象を報告し、そしてプラセボ試験2(F)処方物の投与後には3例の被験体(100%)が有害事象を報告した。器官別大分類(System Organ Class)による有害事象は表19に列挙し
た。
【0190】
事象の腹部膨満、腹痛、上腹部痛、不安、抑うつ気分、下痢、注意障害、めまい(11例中10例のエピソード)、口渇、乾燥肌、味覚異常、頭痛、疲労(7例中6例のエピソード)、寒気、酩酊感、リラックスした気持ち、ホットフラッシュ、多汗症、口腔感覚鈍麻、感覚鈍麻、鼻閉、悪心、口腔不快感、蒼白、口腔感覚障害、掻痒、重苦しさの感覚、傾眠、言語障害、舌苔および嘔吐は薬物に関連する可能性があると評価された。その他の事象である咳、めまい(11例中1例のエピソード)、疲労(7例中1例のエピソード)、筋骨格痛、鼻漏および喉の炎症は、試験薬とは関連しないと評価された。その他の事象である鼻咽頭炎は、おそらく試験薬とは関連しないと評価された。
【0191】
【表19−1】

【0192】
【表19−2】

【0193】
【表19−3】

【0194】
【表19−4】

(結論)
本試験で投与された3種の用量(100μg、400μgおよび800μg)について、薬物動態パラメーターは明確に規定された。CmaxおよびAUC∞は比例していると思われ、AUCTは、400μg〜800μgの間での用量比例関係と一致している。さらに、本試験中に投与されたフェンタニルの2種の処方物(100μg、400μgおよび800μgの用量での1mg/mLおよび4mg/mLの舌下スプレー)は、大多数の被験体において良好に許容された。本臨床試験に参加していた被験体で、本試験の進行中に重篤な有害事象を報告した患者は1例もなかった。
【0195】
(実施例8〜12)
(インビトロ透過実験)
フェンタニル処方物の透過特性は、EpiOral組織(ORL−100)を用いて試験した。MatTek Corp社のEpiOralは、薬学的処方物の舌下薬物吸収をスクリーニングするためのモデルとして使用した。MatTek社製のEpiOral組織は、正常なヒト由来上皮細胞から構成された。細胞は、ヒト口腔(EpiOral)表現型の多層上の高度に分化したモデルを形成するために培養されている。EpiOral組織モデルは、一様で高度に再現性であるインビボ様形態学的特性および成長特性を示している。形態学的に、この組織モデルはヒト天然組織と非常に似ているので、したがって舌下粘膜を横切る薬学的処方物のインビトロ透過性を評価するための有用なインビトロ手段を提供する。
【0196】
Teflon製の裏張り膜を備える細胞培養挿入物上で増殖させたEpiOral組織は、火曜日の朝に配達するために月曜日にMatTek Corp社によって発送された。全組織は、透過性実験において発送後72時間以内に使用された。組織を含有する挿入物は、透過性実験の開始前に蒸留水を用いてリンスした。ORL−100のための組織面積は、0.6cm2であった。
【0197】
レシーバー区画(ウエル)は、pH6.6の0.3mLのリン酸クエン酸緩衝液(レシーバー溶液)を受容した。ドナー区画(組織挿入物)をウエル内に配置し、0.5mLの薬物溶液(ドナー溶液)を充填した。
【0198】
挿入物を、所定の間隔(2、5、7、9、11、13、15、30、45、60、90、および120分間)で、ウエルから新鮮レシーバー液を含有するウエルへ移動させた。透過試験後、ドナー液およびレシーバー液は、HPLCによる分析のためにバイアル中に収集した。各透過時間間隔にわたるレシーバー溶液およびドナー溶液の濃度および流束を決定した。
【0199】
(実施例8)
実施例8では、フェンタニル塩基の透過をクエン酸フェンタニルの透過と比較した。処方物および2時間で透過した%を、以下の表に列挙した。
【0200】
【表20】

(実施例9)
実施例9では、フェンタニル塩基処方物の透過にアルコールが及ぼす作用を試験した。処方物および2時間で透過した%は、以下の表に列挙した:
【0201】
【表21】

(実施例10)
実施例10では、フェンタニル処方物にPG(プロピレングリコール)が及ぼす作用を試験した。処方物および2時間で透過した%は、以下の表に列挙した:
【0202】
【表22】

(実施例11)
実施例11では、フェンタニル処方物にpHが及ぼす作用を試験した。処方物および2時間で透過した%を、以下の表に列挙した。表に示したように、口腔粘膜組織を横切るフェンタニルの透過は、処方物のpHに依存した。フェンタニルは試験したpH範囲内でpKa値(7.3および8.4)を有しているので、そのイオン化の程度は、処方物のpHが変化するにつれて変化した。以下の表に示した結果は、8と9との間のpHに調整した処方物がより良好な透過性および物理的安定性を示すことを示している。
【0203】
【表23】

(実施例12)
実施例12では、ヒドロキシプロピルβシクロデキストリン(HPBCD)、マンニトール、ポリビニルピロリドン(PVP)、プロピレンカーボネート(PC)、グリココール酸ナトリウム(SG)、ラウリル硫酸ナトリウム(SLS)、トリアセチン、クエン酸トリエチルおよびtween 80(TW80)を個別かまたは組み合わせてかのいずれかで本処方物に添加し、それらが透過性および溶液安定性に及ぼす作用について試験した。表24〜36に、処方物ならびに上記の賦形剤を含有する緩衝化された処方物および水処方物の透過試験結果を要約した。
【0204】
【表24】

表24に示した結果は、低透過性を示した0.3%のTween 80を含有する緩衝化された処方物を除いて、緩衝化された処方物の全部がコントロール処方物と類似の透過性特性を有していたことを示している。全ての水処方物は、緩衝化された処方物よりも低い透過性を示した。
【0205】
【表25】

【0206】
【表26】

【0207】
【表27】

【0208】
【表28】

【0209】
【表29】

【0210】
【表30】

【0211】
【表31】

【0212】
【表32】

【0213】
【表33】

【0214】
【表34】

【0215】
【表35】

【0216】
【表36】

結果は、処方物へのHPBCD(表25)、PVP(表27)、PC(表28)、クエン酸トリエチル(表31)およびTween 80(表32)を含む個々の賦形剤の添加が、賦形剤の濃度とは無関係にMatTek口腔粘膜を横切るフェンタニルの透過性を減少させたことを示している。表26および表30に示したように、0.3%のマンニトールを含有する処方物および0.5%のトリアセチンを含有する処方物は、コントロール処方物に類似する透過性特性を示したが、処方物中のこれらの個々の賦形剤の濃度が増加するにつれて透過性は減少した。安定性試験は、それらを安定性に維持するためには緩衝液処方物および水処方物の各々に最小で0.45%および0.5%のマンニトール濃度を添加すべきであることを示した。トリアセチンの場合、0.5%以上の濃度のトリアセチンを含有する処方物が安定性であることが見いだされた。
【0217】
SGを含有する処方物からのフェンタニルの透過はコントロール処方物の透過より高かった(表29)。また、本発明者らは、フェンタニルの透過が処方物中のSG濃度の増加に伴って増加することを観察した。
【0218】
賦形剤の組み合わせを含有する処方物からMatTek口腔粘膜組織を横切るフェンタニルの透過試験の結果は、表33〜36に示した。処方物へのLabrasolの添加は、安定性を向上させたが、MatTek口腔粘膜組織を横切るフェンタニルの透過を減少させた。LabrasolおよびSLSを含有する処方物を用いた場合も、類似の試験結果が観察された。賦形剤の組み合わせを含有する全処方物中で、2種の処方物である実施例12−uu(0.15%のマンニトール、0.4%のトリアセチン)および実施例12−bbb(0.2%のマンニトールおよび0.2%のTW80)は、コントロール処方物に比較して高い透過性を示した。本発明者らは、トリアセチン処方物中のマンニトールの存在が透過において全く改善を示さないことを観察した。そこで、さらなる試験のために、0.5%のトリアセチン(表30)を含有する処方物を選択した。実施例12−bbbの処方物は良好な透過性を示したが、処方物の安定性を向上させるためにマンニトール濃度を0.3%へ上昇させた。
【0219】
クエン酸フェンタニル処方物およびフェンタニル塩基処方物はどちらも、試験した全温度で安定であった。インビトロ組織透過試験からのデータは、表3に示したように、フェンタニル塩基処方物からのフェンタニルの透過は、クエン酸フェンタニル処方物からの透過の約10倍高いことを示した。水処方物および緩衝化された処方物は、口腔粘膜組織を横切るフェンタニル塩基の透過において有意差を全く示さなかった。本発明者らの試験は、ミグリオールを含有するフェンタニル塩基処方物が極めて低い透過性を有することもまた証明した。賦形剤の中では、0.2%のTW80と組み合わせた0.5%のトリアセチンおよび0.3%のマンニトールが、良好な透過性および安定性を示した。
【0220】
口腔粘膜組織を横切るフェンタニルの輸送は、処方物中のエチルアルコール(エタノール)濃度およびプロピレングリコール(PG)濃度に依存していた。エタノールは、水性ベースの処方物中にフェンタニル塩基を可溶化するために共溶媒として使用した。この試験では、本発明者らは、20%よりも少ないエタノールを含有する処方物(1mg/mLのフェンタニル塩基)が冷凍保存条件で沈殿することを観察した。また、本発明者らは、口腔粘膜組織を横切るフェンタニルの透過は、処方物中のエタノール濃度に間接的に比例することを観察した(表21)。類似の結果がPGを用いて観察された(表22)。PGは、水溶液中でフェンタニル塩基の溶解性を増加させること、およびまた、口腔粘膜組織を横切るフェンタニル塩基の透過を増強させることに役立った。5%よりも多いPGを含有する処方物は、フェンタニルの透過における有意な改善を示さなかったが、しかし溶液粘度はPGの濃度に比例して増加した。5%よりも多いPGを含有する処方物は、良好なスプレー特性を示さなかった。
【0221】
(実施例13)
実施例13では、表37中の以下の成分を有する処方物を試験した。本処方物はフェンタニルを含んでいなかった。
【0222】
【表37】

ニュージャージー州プリンストンに所在するPfeiffer of America社による0.10mLの複数回用量鼻腔スプレーポンプを用いて本処方物を噴霧し、Malvern Instruments社によるMalvern Mastersizer
Sデバイスを用いて液滴を測定した。舌下スプレーポンプを1回押すとプルームが生成されたので、これをスプレー粒子について分析した。投与用量、スプレーパターン、および液滴サイズ分布についてのサンプルサイズは、25例のスプレーであった。
【0223】
(液滴容量)
液滴容量の評価では、25例のスプレーサンプルを、各スプレーサンプルについて、相違する5種のストローク数を用いて評価し、以下の結果が測定された:
総平均値=100.4μL
最高単回実効値=103.2μL
最低単回実効値=95.3μL
標準偏差=1.1
範囲=7.9
変動係数=1.1%
(スプレーパターン)
スプレーパターンの評価では、標的から30mmでの手動作動を用いて25例のスプレーサンプルを評価した。本処方物はメチレンブルーを用いて染色し、以下のスプレーパターンの結果が測定された:
最小径[mm]
最小値:35.4
平均値:50.6
最大値:62
s: :7.00
最大径[mm]
最小値:40
平均値:56.9
最大値:67
s: :6.01
スプレー角度
最小値:64°
平均値:83.3°
最大値:94°
s: :7.03
比率(最大/最小径)
最小値:1.04
平均値:1.13
最大値:1.33
s: :0.073
(液滴サイズ分布)
液滴サイズ分布の評価では、標的から30mmでの手動作動を用いて25例のスプレーサンプルを評価した。以下の液滴サイズ分布の結果が測定された:
10μmの液滴径の占有率[%]
最小値:0.65
平均値:1.66
最大値:2.70
s: :0.527
液滴径の10%が指示値より小さい[μm]
最小値:15
平均値:18.2
最大値:23
s: :1.91
液滴径の50%が指示値より小さい[μm]
最小値:35
平均値:44.7
最大値:65
s: :7.52
液滴径の90%が指示値より小さい[μm]
最小値:96
平均値:154.4
最大値:349
s: :64.42
(実施例14)
実施例14では、表38中の以下の成分を有する処方物について試験した。本処方物はフェンタニルを含んでいなかった。
【0224】
【表38】

本処方物は、ニュージャージー州プリンストンに所在するPfeiffer of America社による0.10mLの複数回用量鼻腔スプレーポンプを用いて噴霧し、Malvern Instruments社によるMalvern Mastersizer Sデバイスを用いて液滴を測定した。舌下スプレーポンプを1回押すとプルームが生成されたので、これを次にスプレー粒子について分析した。投与用量、スプレーパターン、および液滴サイズ分布についてのサンプルサイズは、25例のスプレーであった。
【0225】
(液滴容量)
液滴容量の評価では、25例のスプレーサンプルを、5種の相違するストローク数を用いて評価し、以下の結果が測定された:
総平均値=101.5μL
最大単回実効値=103.7μL
最小単回実効値=96.1μL
標準偏差=1.3
範囲=7.6
変動係数=1.2%
スプレーパターン
スプレーパターンの評価では、標的から30mmでの手動作動を用いて25例のスプレーサンプルを評価した。本処方物はメチレンブルーを用いて染色し、以下のスプレーパターンの結果が測定された:
最小径[mm]
最小値:29
平均値:34.0
最大値:46
s: :3.47
最大径
最小値:35
平均値:40.8
最大値:55
s: :4.13
スプレー角度
最小値:58°
平均値:63.8°
最大値:80°
s: :4.65
比率(最大/最小径)
最小値:1.08
平均値:1.20
最大値:1.50
s: :0.092
(液滴サイズ分布)
液滴サイズ分布の評価では、標的から30mmでの手動作動を用いて25例のスプレーサンプルを評価した。以下の液滴サイズの結果が測定された:
10μmの液滴径の占有率[%]
最小値:0.24
平均値:0.68
最大値:1.28
s: :0.278
液滴径の10%が指示値より小さい[μm]
最小値:22
平均値:26.7
最大値:35
s: :2.95
液滴径の50%が指示値より小さい[μm]
最小値:61
平均値:83.3
最大値:114
s: :11.41
液滴径の90%が指示値より小さい[μm]
最小値:192
平均値:294.6
最大値:440
s: :53.32
(実施例15)
実施例15では、溶液中でフェンタニルの0.1μg/mL〜5μg/mLの作用濃度を含む1、2、4、6、および8mg/mLのフェンタニル舌下スプレーサンプルにおいてフェンタニルについてのアッセイ方法を実施した。本方法は、GMP要件を順守して開発され、適格性確認された。本方法は、フェンタニルの0.05μg/mL〜7.83μg/mLの濃度範囲にわたって線形であると決定された。フェンタニル作用標準溶液は、冷蔵および周囲条件で、容積測定ガラス製品およびHPLCアンバーバイアル中で7日間にわたって安定性であった。
【0226】
このプロセスに利用したデバイスおよび補給品は、ポンプ、可変波長検出器、およびオートサンプラーもしくは等価物を装備したHPLCシステム、Waters Symmetry HPLCカラム(C18、4.6×75mm、粒径3.5μm)、0.45μm、47mmナイロン製フィルター(Gelman Nylaflo(登録商標)P/N 66608もしくは等価物)、アセトニトリル(HPLCグレード)、一塩基性リン酸カリウム(ACSグレード)、リン酸(ACSグレード)、脱イオン水、アルコール(無水エタノール)、およびフェンタニル塩基参照標準を含んでいた。
【0227】
溶液調製物は、以下に記載するように調製したが、必要に応じてスケーリングできる。
【0228】
各1リットルのリン酸緩衝液(50mMのKH2PO4(pH2.8))のためには、6.8gの一塩基性リン酸カリウムおよび1リットルの水を適切な容器中で合わせ、十分に混合した。溶液のpHは、リン酸を滴下することにより2.8に調整した。この溶液を0.45μmのナイロン製フィルターに通して濾過した。この溶液の有効期限は1カ月間である。
【0229】
各1リットルの移動相(25% ACN、75%リン酸緩衝液)溶液のためには、750mLのリン酸緩衝液を適切な容器中で250mLのアセトニトリルと結合し、十分に混合した。この系を、必要に応じて使用前に適切な方法によって脱ガスした。この溶液の有効期限は、1カ月間である。
【0230】
各1リットルのストック希釈(95/5、エタノール/アセトニトリル)溶液のためには、950mLのエタノールおよび50mLのアセトニトリルを適切な容器中で合わせ、十分に混合した。この溶液の有効期限は、1カ月間である。
【0231】
ストック標準I(40μg/mL)(「SSI」)を、約10.0mgのフェンタニル参照標準を計量することによって調製し、250mLのメスフラスコに加えた。約200mLのストック希釈液を加え、固体材料を溶解させるために旋回させた。この混合物を、ストック希釈液を用いて所望の容量に希釈し、十分に混合した。
【0232】
ストック標準II(40μg/mL)(「SSII」)を、約10.0mgのフェンタニル参照標準を計量することによって調製し、250mLのメスフラスコに加えた。約200mLのストック希釈液を加え、固体材料を溶解させるために旋回させた。この混合物を、ストック希釈液を用いて所望の容量に希釈し、十分に混合した。
【0233】
作用標準I(2.4μg/mL)(「WSI」)を、3.0mLのストック標準Iを50mLのメスフラスコに移すことによって調製した。この混合物を、移動相溶液を用いて所望の容量に希釈し、十分に混合した。この溶液の有効期限は、7日間である。
【0234】
作用標準II(2.4μg/mL)(「WSII」)を、3.0mLのストック標準IIを50mLのメスフラスコに移すことによって調製した。この混合物を、移動相溶液を用いて所望の容量に希釈し、十分に混合した。この溶液の有効期限は、7日間である。
【0235】
HPLC方法のためのクロマトグラフィー条件を、以下に規定する:
カラム:HPLC Column Waters Symmetry C18、4.6×75mm、粒径3.5μm
UV検出:214nm
流量:2.0mL/分
注入量:50μL
温度:周囲温度(温度は25℃に制御され得る)
収集時間:13分間
(HPLC手順)
系の適合性が確立された後は、作業標準の間に最高12のサンプル溶液を注入できる。典型的な順序は、下記の通りである:
2×移動相(ブランク)
2×作業標準II
5×作業標準I
1×サンプル(12回までの注入)
1×作業標準I
1×サンプル(12回までの注入)
1×作業標準I
(系の適合性)
移動相ブランク注入においては、保持時間にフェンタニルの有意な干渉ピークが存在していてはならない。注入の精度に関して、作業標準Iの5回の反復注入についてのフェンタニルのRSDは、2.0%を超えてはならない。標準の一致に関して、最初の5回の作業標準の注入と2回の作業標準IIの注入についての平均ピーク応答間の一致は98〜102%でなければならない。作用標準IとIIとの間の一致は、標準の有効期限中に1回のみ証明する必要がある。最初の作業標準Iの注入におけるフェンタニルについての5%ピーク高さでのテーリング係数は、0.8〜1.5でなければならない。全ランにわたる標準精度に関しては、実行にわたる(OTR)作業標準Iの注入におけるフェンタニルについてのピーク面積のRSDが、2.0%を超えてはならない。
【0236】
計算を、以下に示す通りに実施する。
【0237】
作業標準濃度を、以下の通りに計算する:
【0238】
【数7】

反応係数(Rf)、以下の通りに計算する:
【0239】
【数8】

標準の一致、以下の通りに計算する:
【0240】
【数9】

(実施例16)
実施例16では、Malvern社製のSpraytecデバイスを用いてレーザー回折によるフェンタニル舌下スプレーの液滴サイズ分布を決定する方法を実施した。
【0241】
もたらされ、そして本報告内に記載した全データは、GMP(医薬品製造管理および品質管理基準(21 CFR第210部および第211部)を遵守して精査した。
【0242】
この計画の目的は、フェンタニル舌下スプレー処方物およびプラセボとともに使用するためのレーザー回折による液滴サイズ分布測定法を開発し、確認することであった。この計画の第1部では、Innova Systems社によるMightyRunt作動ステーションとともに使用される適正に自動化された作動パラメーターを決定するために、製品評価を実施した。自動作動ステーションを用いる、舌下用製品についての液滴サイズ分布測定法の開発は、ビネット試験、排気孔配置試験、およびデバイス配置試験を含んでいた。
【0243】
本方法の確認は、開発された方法を実施した2人の分析者間の中間精度を評価した。すべての方法開発および適格性確認の活動は、プラセボを用いて実施した。
【0244】
サンプルを、Pfeiffer社製の単位用量ガラスバイアル、Pfeiffer社製の単位用量VIストッパー、Pfeiffer社製のバイアルホルダー、およびPfeiffer社製の単位用量アプリケーターを用いて調製した。本試験で利用した装置は、Malvern Instruments社製の200mmレンズを備えたSpraytec、排気ファンアタッチメントを装備したInnova Systems製のMightyRunt作動ステーション、およびMettler Toledo社製の天秤AT201型を含む。
【0245】
(作動パラメーター試験)
プルーム持続時間および液滴サイズ分布を追跡するためにSpraytecを使用して、手動作動によって生成されたプルーム持続時間、液滴サイズ分布、および射出重量を複製するためにMightyRunt作動ステーション(MightyRunt社)についての作動パラメーターを最適化した。手動作動を用いた6つのデバイスからの結果であるDv10(液滴径の10%が指示値より小さい)、Dv50(液滴径の50%が指示値より小さい)、およびDv90(液滴径の90%が指示値より小さい)を自動作動による6つのデバイスからの結果と比較した。
【0246】
(合格基準)
自動作動についての個々の射出重量は、全部が手動作動の平均射出重量の75%〜125%の範囲内に入らなければならない。自動作動のDv10、Dv50およびDv90の平均値の結果は、手動作動のDv10、Dv50およびDv90の平均値の結果の75%〜125%に入らなければならない。
【0247】
統計分析は、2セットの液滴サイズ分布試験結果についてのスチューデントt検定の遂行を含まなければならない。スチューデントt検定の結果は、データの手動セット対自動セットが統計的に同等であることを示さなければならない。
【0248】
(方法の開発)
方法の開発は、Spraytecを利用するビネット試験および排気孔試験を含んでいた。作動は、MightyRuntおよび先に決定されたパラメーターを用いて実施した。ビネットは、レーザー回折分析中に、スプレープルームの小滴がレンジレンズによって捕捉されるには過度に急勾配な角度でレーザーを散乱させた場合に発生する。散乱光のすべてを捕捉するために、デバイスをレンジレンズ上には置かずにレンジレンズの十分近位に配置することが極めて重要である。ビネット試験では、分析用に適切なレンジレンズと適切なデバイスからレンジレンズまでの距離とを決定した。
【0249】
排気孔の配置は、プルームの動程に影響を及ぼす。プルーム速度は、排気孔の引込みによっては加速されてはならず、レーザー経路を通って移動する間に大きな液滴が落下してはならない。排気孔試験は、レーザー経路を通過した後の適正なプルーム捕捉を保証するために、スプレーのプルームの背後の適切な位置を決定した。本方法は、液滴サイズ分布をより完全に特性解析するために、分析用のノズルチップからレーザー経路までの2つの距離を含んでいた。
【0250】
(方法の確認)
確認は、方法の精度および堅牢性を決定する工程から構成された。この確認は、単一ロットのプラセボ由来の計24のデバイスを使用した。1人の分析者は、各距離で6回の作動を試験した。堅牢性を証明するために、第2の分析者が分析を反復した。Dv10、Dv50、およびDv90の結果を比較した。
【0251】
(合格基準)
分析者1についての個々の射出重量は、全部が分析者2についての平均射出重量の75%〜125%の範囲内に含まれなければならない。分析者1についてのDv10、Dv50およびDv90の平均値の結果は、分析者2についてのDv10、Dv50およびDv90の平均値の結果の75%〜125%の範囲内に含まれなければならない。
【0252】
最終的な実験手順を、以下に示す。
【0253】
分析前に、バックグラウンドおよび散乱プロフィールを分析のために適切に検証した。
【0254】
サンプルボトルをノズルホルダー内に挿入した。微調整のためには、コースターを使用してプラットフォームを持ち上げた。デバイスホルダーに取り付けたコースターは、調整に使用したコースターの上部に配置した。
【0255】
ボトルおよび排気ファンを備えたMightyRuntは、分析のために適切な位置に配置した。MightyRuntは、実験室用ジャッキを用いてレーザー経路の正面の中心に配置されたノズルと共に持ち上げた。調整後に、MightyRuntが確実に水平になるようにした。2つのボトル−レーザー間の距離を、ポンプチップからレーザー経路の中心までを測定して7cmおよび4cmであると評価した。全分析のために、ボトルを、レンジレンズ支持構造からポンプチップまでが14cmの場所に配置した。
【0256】
排気ファンのスイッチを入れ、レーザー経路の中心から排気シールドの先端までを測定して、デバイスの背部の中心に置いた、レーザー経路の3cm後方の実験室用ジャッキ上に配置した。排気ファンは、液滴が付着する衝突面、すなわち液滴の経路に配置されたチーズクロスを有していた。約4.5インチ四方に折りたたまれた、18×36インチの1/8シートのチーズクロス(4層のチーズクロス)は、十分な衝突面であり、ファンの流れを妨害しないであろう。
【0257】
本デバイスを、MightyRuntステーションを用いて作動させ、分析のために適切な距離で各個別の射出についての液滴サイズ分布を収集した。
【0258】
全プルーム持続時間およびプルームプラトーについての報告書を印刷した。
【0259】
(データの報告)
各作動についてのD10、D50、D90、およびSpan値についてのデータが報告されている。平均値および精度(%RSD)(相対標準偏差率)をD10、D50、およびD90について計算した。備考:Spanは、(D90−D10)/D50と規定されている。個々の液滴サイズ分布の結果(μm)およびスパン値(単位なし)は、X.XXであると報告された。全平均液滴サイズ分布の結果は、X.Xμmであると報告されなければならない。全RSD値は、X.X%であると報告されなければならない。
【0260】
統計分析は、2セットの液滴サイズ分布試験結果のスチューデントt検定の遂行を含んでいた。スチューデントt検定の結果は、データの分析者セットが統計的に同等であることを指示したはずである。
【0261】
(結果および考察)
全スプレープルームは、3つの段階を有する。第1段階である「発生」は、可変性の液滴およびレーザーの透過の減少を特徴とした。第2段階である「安定性」は、安定な液滴分布および液滴伝達を特徴とした。可変性の液滴および伝達の増加が最終段階である「消散」を特徴付けた。液滴サイズ分布の全比較には、プルームの「安定性」段階を使用した。
【0262】
(作動パラメーター試験)
MightyRuntについての作動パラメーターの最適化の間に、Spraytecを用いた手動作動および自動作動からのプルームを測定した。自動作動パラメーターを最適化するために、Dv10、Dv50、およびDv90の結果を比較した。本試験で調査したデバイスのタイプは、典型的な鼻腔スプレーとは顕著に相違していた。タブを破るか、またはデバイスを作動させるために必要とされたのは、作動を開始して薬物を送達するために一貫した力を必要とするバネではなく、ある量の力であった。この力は、タブが一旦破られた場合にデバイスから薬物を送達するために必要とされる力とは相違する量の力であった。このデバイスはバネを備えていないので、重要なパラメーターは、作動力、力上昇時間、および最小動程距離であった。最終確認されたMightyRuntパラメーターを以下の表39に列挙し、利用したSpraytecの設定を以下の表40に列挙する。
【0263】
【表39】

【0264】
【表40】

手動作動および自動作動の比較を、手動作動を行う6つのデバイスおよび自動作動を行う6つのデバイスを用いて実施した。液滴サイズ分布および射出重量の試験結果を、以下の表41に要約した。
【0265】
【表41】

(合格基準)
自動作動についての射出重量の試験結果は、手動作動についての平均射出重量の75%〜125%の合格基準を満たし、手動作動についての平均値の75%〜100%の範囲であった。自動作動についてのDv10平均値は、手動作動についてのDv10平均値の81%であった。自動作動についてのDv50平均値は、手動作動についてのDv50平均値の83%であった。自動作動についてのDv90平均値は、手動作動についてのDv90平均値の81%であった。これらのパラメーターの各々は、手動作動についての平均値の75%〜125%の合格基準を満たした。スチューデントt検定は、小さなデータセットのためには必ずしも適切ではなかったが、手動作動および自動作動についてのデータセットがDv10については同等であるが、Dv50またはDv90については同等ではないことを示した。MightyRuntを用いて手動作動からの液滴サイズ分布を正確に複製することは可能ではなかった。タブを確実に破ってデバイスを作動させるために必要な力は、手動作動より小さな液滴を含む分布をもたらした。より大きな液滴サイズを生成するはずであるより急速(aggressive)ではない作動パラメーターは、デバイスの一貫した作動のためには十分ではなかった。Spraytec法の開発を、プロトコールに規定した合格基準を満たさないにもかかわらずこれらのパラメーターを用いて進めた。
【0266】
(方法の開発)
方法の開発は、Spraytecを利用するビネット試験、デバイス配置試験および排気孔配置試験を含んでいた。作動を、MightyRuntおよび先に適格性確認されたパラメーターを用いて実施した。全試験について、デバイスはレーザービーム経路の正面に配置され、プルームはレーザー経路を通って移動し、プルームはレーザービームの背部に配置された排気孔マニフォールド内で収集された。
【0267】
ビネット実験は、装置の正面と整列させたデバイス(ビームから約10cm)を用いて、デバイスからレンジレンズまでの配置についての距離を変化させて実施した。結果を、図42に要約する。
【0268】
【表42】

配置に対するDv10、Dv50、Dv90、およびプルームの記録値のプロットは、図11に明記した。データは、全範囲の配置にわたって有意な傾向を示さなかった。試験中のレンジレンズ上へ液滴が沈着する可能性を最小限にするために、14cm(レーザーとレンジレンズ支持体との間のほぼ中心)の配置を選択し、その後の全試験のために使用した。
【0269】
試験中のプルームに対して排気孔配置が及ぼす作用を評価するために、4つの排気孔からレーザービームまでの距離でPSD(粒径)データを収集かつ評価した。結果を、以下の図43に要約する。
【0270】
【表43】

配置に対するDv10値、Dv50値、およびDv90値の要約のグラフ表示は、図12に含まれている。排気孔なしについてのDv10値、Dv50値、Dv90値もしくはプルーム持続時間、またはビームの1cm、3cm、5cm、もしくは7cm後ろにある排気孔を用いて収集されたプルームについてのDv10値、Dv50値、Dv90値もしくはプルーム持続時間に、有意な変化は見られなかった。レーザービーム背部への排気孔の配置に、7cmのデバイスからビームまでの距離で行われたスプレーのファンハウジングの外側への沈着の機会を減少させるために3cmを選択した。
【0271】
本方法は、液滴サイズ分布をより完全に特性解析するために、分析のためにデバイス先端からレーザー経路までの2つの距離を含まなければならなかった。4つの距離を評価し、結果は以下の表44に含めた。
【0272】
【表44】

配置に対するDv10値、Dv50値、およびDv90値の要約のグラフ表示は、図3に含まれている。様々な高さからのデータにおいて、観察可能な傾向は見られなかった。舌下スプレーについての指針文書はないが、FDA指針文書「Bioequivalence and Bioavailability Studies for Nasal
Aerosols and Nasal Sprays for Local Action」は、3〜7cmの2つの距離を規定している。より十分に発生したプルームを特性解析するために、ビームからのより長い距離の対(4cmおよび7cm)を選択した。
【0273】
(方法の確認)
1人の分析者は、4cmおよび7cmの両方の距離で6つのデバイスを試験した。第2の分析者は、第2日に各デバイスからプライミングした後に、次なる作動を用いて両方の距離での分析を反復した。確認の結果を、Dv10、Dv50、およびDv90の結果を比較している以下の表45および46に要約する。
【0274】
【表45】

【0275】
【表46】

(合格基準)
分析者1の射出重量の試験結果は、4cmの距離については分析者2の平均値の76%〜103%の範囲内、そして7cmの距離については99%〜106%の範囲内に含まれ、75%〜125%の合格基準を満たしていた。分析者1についてのDv10平均値は、4cmの距離については分析者2の129%であり、7cmの距離については128%であった。分析者1についてのDv50平均値は、4cmの距離については分析者2の109%であり、7cmの距離については112%であった。分析者1についてのDv90平均値は、4cmの距離については分析者2の95%であり、7cmの距離については103%であった。Dv10は、75%〜125%の合格基準を満たさなかったが、これは、プルームにおける最小液滴の測定値であり、より高度の変動性は、予想外ではない。Dv50およびDv90についての結果は、75〜125%の合格基準を満たした。小さなデータセットに対しては必ずしも適切ではないが、スチューデントt検定は、分析者1および分析者2についてのデータセットは両方の距離でDv90については同等であるが、Dv10またはDv50についてはいずれの距離でも同等ではないことを示した。
【0276】
(結論)
フェンタニル舌下スプレーを用いて使用するためのレーザー回折による液滴サイズ分布分析についての方法を開発し、引き続き適格性確認を実施した。スチューデントt検定を用いた統計分析に基づく合格基準は、小さなデータセットについては不適切であると考えられた。分析者1および2の一致についての方法確認合格基準は、プルームにおける最小液滴(Dv10)の測定と関連する高変動性については狭すぎると決定された。これらの基準は満たされなかったが、本方法は、使用するために許容できると見なされた。本方法は、本明細書に規定した作動パラメーター内で使用するために適合する。
【0277】
(実施例17)
実施例17では、溶液中で0.1μg/mL〜5μg/mLのフェンタニルの作用濃度を備える1、2、4、6、および8mg/mLのフェンタニル舌下スプレーサンプル中のフェンタニルの9μm未満の呼吸用量を決定するために実施した。使用した方法は、GMP要件を順守して適格性確認された。サンプル溶液は、冷蔵および周囲条件下で、容積測定用ガラス製品およびHPLCアンバーバイアル中で7日間にわたって安定性であると決定された。
【0278】
HPLCプロセスは、上記の実施例15に記載したプロセスと一致していた。本試験で利用した材料および補給品は、アセトニトリル(HPLCグレード)、一塩基性リン酸カリウム(ACSグレード)、リン酸(ACSグレード)、脱イオン水、アルコール(無水エタノール)、そして5リットルの膨張チャンバー、誘導ポート、ステージ0、1、2、およびアフターフィルターから構成されるShort Stack Andersen Cascade Impactorセットアップ、真空源、インライン流量計(Sierra Top−Trackまたは等価物)、VWR無菌サンプリングバッグ、ガラス繊維フィルター(8.1cm)、外部校正流量計(Dry−Cal流量計または等価物)、および空気圧式アクチュエーター(Innova Systems MightyRuntまたは等価物)を含んだ。
【0279】
(溶液の調製)
溶液調製物を、上記の実施例15に記載した方法によって調製したが、必要に応じてスケーリングできる。
【0280】
抽出溶液は、50:50(95/5、エタノール/アセトニトリル:水)であった。各1リットルの調製溶液のためには、475mLのエタノール、25mLのアセトニトリルおよび500mLの水を適切な容器内で合わせ、十分に混合した。この溶液の有効期限は、1カ月間である。
【0281】
リン酸緩衝液を、濃度が50mMのKH2PO4(pH2.8)中で調製した。各1リットルの調製溶液のためには、6.8gの一塩基性リン酸カリウムおよび1リットルの水を適切な容器内で合わせ、十分に混合した。溶液のpHを、リン酸を滴下することによってpH2.8に調整した。この溶液を0.45μmのナイロンに通して濾過した。この溶液の有効期限は1カ月間である。
【0282】
インパクターのセットアップは、以下の手順に従って調製された5リットルの膨張チャンバー、誘導ポート、ステージ0、1、2、およびフィルターからなる。
【0283】
フィルターステージを、インパクターの台座上に配置した。
【0284】
8.1cmのガラス繊維フィルターを、アフターフィルターステージ内に配置し、清潔なゴム製oリングによって固定した。
【0285】
固体プレートを、フィルターステージの上部に配置し、次にステージ2を、正位置に配置した。
【0286】
中心孔の切り抜きを備えるプレートを、ステージ2の上部に配置し、次にステージ1を、正位置に配置した。
【0287】
中心孔の切り抜きを備えるプレートを、ステージ1の上部に配置し、次にステージ0を、正位置に配置した。
【0288】
コーンを、正位置に配置し、インパクターを、押し下げクランプによって固定した。
【0289】
誘導ポートを、コーンに固定し、5Lの膨張チャンバーを、誘導ポートの上部に配置した。
【0290】
(試験の準備)
試験機器は、真空源と適切なチュービングを備えたカスケードインパクターとの間にインライン流量計を配置することによってセットアップした。インパクター上で漏れ試験(leak test)を実施した。真空源を開放することによってインパクターを通る流れを開始させ、その流れを、約28.3L/分に調整した。膨張チャンバー上のスプレー作動ポートの上方に、手をおいた。インライン流量計上に指示された流量は、ゼロに降下すると予測された。流れがさらに記録されると、インパクターaリングの状態をチェックし、試験を繰り返した。流量を設定するために、膨張チャンバーを誘導ポートから取り外し、外部校正流量計を誘導ポートに取り付け、流れを開始させた。流れを、外部校正流量計を用いて28.3±1L/分に調整し、試験手順中に使用するためにインライン流量計上に表示された測定値を、記録した。
【0291】
(試験手順)
各アッセイ結果を得るために、1mg/mLの製品強度に対して2つのデバイスを作動させた。2、4、6、および8mg/mLの製品強度に対しては1つのデバイスを作動させた。膨張チャンバーを正位置において、真空を開始させ、流れを、試験の準備中に入手した測定値に調整した。
【0292】
デバイスの作動前重量(g)は小数点第4位まで記録した。デバイスを、スプレーが作動ポートとは反対側の壁に直接向かって移動するように配置した。舌下スプレーデバイスを、表47に列挙した自動空気圧式アクチュエーター法パラメーターを用いて膨張チャンバー内へ作動させた。
【0293】
【表47】

デバイスの作動後重量(g)を、小数点第4位まで記録した。
【0294】
(抽出手順)
抽出は、インパクターのセットアップを解体し、以下の手順によって各構成成分を抽出することによって実施した:
プレートおよびフィルターを、各々、10.0mLの抽出溶液を含むバッグ内で個別に抽出した。サンプルを、少なくとも1分間にわたる手動での振盪および捏和によって抽出した。6.0mLの抽出サンプルを10mLのメスフラスコへ移し、リン酸緩衝液を用いて容量まで希釈し、十分に混合した。これはサンプル溶液である。この溶液の有効期限は7日間である。
【0295】
膨張チャンバーを、反転させ、ホルダー内に配置した。誘導ポートおよびコーンを、膨張チャンバーのすりガラス連結管内に挿入した。約40mLの抽出溶液を、コーンおよび誘導ポートに通して膨張チャンバー内にリンスした。全内面を抽出するために、溶液を膨張チャンバー内で旋回させた。その溶液を、200mLのメスフラスコ内へデカンテーションした。リンスを、約120mLの総リンス容量についてさらに2回反復した。フラスコにリン酸緩衝液を容量まで充填し、十分に混合した。これがサンプル溶液である。この溶液の有効期限は7日間である。
【0296】
(アッセイ)
サンプル溶液を、上記の実施例15に記載した手順に従ってアッセイする。計算を、以下の通りに実施する。
【0297】
【数10】

プレートサンプルおよびフィルターサンプル中のフェンタニルを、以下の計算にしたがって決定する:
【0298】
【数11】

Asamp=サンプル調製物中のフェンタニルの面積
Df=フェンタニルサンプル溶液調製物の希釈係数(10.0mL×10.0mL/6.0mL)
WSI Rf OTR=実行にわたる作業標準Iの応答係数
コーン、誘導ポートおよび膨張チャンバー内のフェンタニルを、以下の計算によって決定する:
【0299】
【数12】

Asamp=サンプル調製物中のフェンタニルの面積
Vsamp=サンプル溶液調製物中のフェンタニルの容量(200mL)
WSI Rf OTR=実行にわたる作業標準Iの応答係数
2、4、6、および8mg/mLについての呼吸用量を、以下の通りに計算する:
呼吸用量(μg)=9μm未満の粒径画分中の薬物質量の合計(μg)
1mg/mLについての呼吸用量を、以下の通りに計算する:
【0300】
【数13】

呼吸画分を、以下の通りに計算する:
【0301】
【数14】

報告のための粒径カットオフ径を、以下の表48に記載する。
【0302】
【表48】

フェンタニルサンプルのアッセイ結果(μg)、9μm未満の粒径画分中の呼吸用量(表48による)(μg)、および小数点第1位までの9μm未満の呼吸用量率(%)が報告された。
【0303】
呼吸用量(1mg/mL)を、決定するための分析証明書を、以下の表49に記載する。
【0304】
【表49】

本発明の多数の他の変形は、当業者には明白であり、そして本明細書に添付の特許請求項の範囲内に含まれることが意図され、それらは、特定の単位用量デバイスもしくは2回用量デバイスおよび生成されたフェンタニルの粒径範囲ならびに実施例に記載された他の数的パラメーター、およびそれらの任意の組み合わせを含むが、それらに限定されない。
【技術分野】
【0001】
(発明の分野)
本発明は、ヒトに投与するために適合する、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含有する舌下処方物、および前記舌下処方物を用いて処置するための方法に関する。
【背景技術】
【0002】
(発明の背景)
フェンタニルは、モルヒネの約80〜100倍の鎮痛効力を備えるμ−オピオイドレセプターアゴニストである。臨床状況では、フェンタニルは、中枢神経系に対して主要な薬理学的作用を発揮する。その主要な作用は、鎮痛および鎮静である。
【0003】
フェンタニルの鎮痛作用は、その薬物の血中レベルと関連している。一般に、最小有効濃度および毒性が発生する濃度は、ありとあらゆるオピオイドに対する耐性の増加に伴って上昇する。耐性の発生速度は、個体間で極めて広範囲に相違する可能性がある。フェンタニルを含むすべてのμレセプターアゴニストは、用量依存性呼吸抑制を生じさせる。呼吸抑制の危険性は、典型的には呼吸抑制に対する耐性およびその他のオピオイド作用を発生させる長期オピオイド療法を受けている患者においては低い。重篤もしくは致死性の呼吸抑制は、脆弱な個体においては、推奨用量でさえ発生する場合がある。
【0004】
経口投与されたフェンタニルは初回通過効果代謝に供されるが、これは経口投与されたフェンタニルの50%以上は吸収されないからである。そこでフェンタニルに対するこの初回通過効果を減少させるか、または回避するために、非経口、口腔、および経皮などの他の送達形態が利用されてきた。
【0005】
フェンタニルは、現在は、ロゼンジ剤(例えば、Actiq(登録商標))、および経皮系(例えば、Duragesic(登録商標)(25、50、75、および100μg/時間のフェンタニル))として注射形態で利用できる。Duragesic(登録商標)は、約72時間にわたりフェンタニルの持続的全身性送達を提供する。Duragesic(登録商標)は、例えば、アセトアミノフェン−オピオイドの併用、非ステロイド系鎮痛薬、または速効型オピオイドのprn(必要に応じた)投与などのより効力の小さな手段では最適には管理されない疼痛に対する持続的オピオイド鎮痛法を必要とする患者における慢性疼痛の管理において適応である。Duragesic(登録商標)は、典型的にはパッチを通してのフェンタニルの吸収における遅延のために急性疼痛、または重篤もしくは生命を脅かす低喚起が生じる可能性がある術後疼痛を経験している患者には適合しない。
【0006】
Actiq(登録商標)は、経口経粘膜投与が企図される、クエン酸フェンタニルの固形処方物である。Actiq(登録商標)は、形状が棒付きキャンディに類似する握り棒に取り付けられたロゼンジ剤である。握り棒のおかげで投与中に過剰なオピオイド作用が出現した場合はActiq(登録商標)ユニットを口から取り出せると言われている。Actiq(登録商標)は、基礎に持続性の癌性疼痛があるために既にオピオイド療法を受けていてオピオイド療法に対して耐性である悪性腫瘍を有する患者における癌性突出痛を管理するために適応である。Actiq(登録商標)は、急性もしくは術後疼痛の管理においては禁忌である。
【0007】
急性疼痛もしくは突出痛に対して使用できる舌下錠およびロゼンジ剤(例えば、Actiq(登録商標))には、特定の短所がある。とりわけ、1つの短所は、摂取後には、これらの薬学的因子中の活性薬剤を溶解形態で吸収できるようになる前にまず遊離させて分散させなければならない点にある。さらに、Actiq(登録商標)からのフェンタニルの吸収動態は、口腔粘膜を通して吸収される用量の画分および嚥下される用量の画分に依存して変動する可能性がある。さらに、特定のロゼンジ剤は、医学的監督を必要とし、そして超音波検査上の問題が生じるキャンディの形状にある。
【発明の概要】
【発明が解決しようとする課題】
【0008】
当該分野には、有効な疼痛管理に適合する、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む舌下処方物に対する必要性が存在する。
【課題を解決するための手段】
【0009】
(発明の概要および目的)
本発明の目的は、有効な疼痛管理のための、舌下投与に適合するフェンタニル処方物を提供することである。
【0010】
本発明の所定の実施形態の1つの目的は、鎮静、鎮痛、および/または麻酔の状態を迅速に誘導できる方法および組成物を提供することである。
【0011】
本発明の所定の実施形態のまた別の目的は、フェンタニル療法を必要とする患者への過少投与および/または過量投与を最小限に抑える、フェンタニル投与のための方法および組成物を提供することである。
【0012】
本発明の所定の実施形態のまた別の目的は、慢性疼痛処置を受けている患者において突出痛を処置するために適合する方法および組成物を提供することである。
【0013】
本発明の所定の実施形態のまた別の目的は、疼痛を処置するための制御された量で、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を舌下投与するための方法を提供することである。
【0014】
本発明の所定の実施形態のまた別の目的は、投与量がレシピエントの肺へ通過する実質的な危険性を伴わずに、実質的な舌下吸収を引き起こすであろう方法で舌下に投与できる投薬形態のオピオイド鎮痛薬を提供することである。
【0015】
上述した目的およびその他は本発明によって達成されるが、本方法は、一部には、即効性緩和を提供するために、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の実質的部分が患者の肺へ通過しないであろう処方物でフェンタニル、その薬学的に受容可能な塩、またはその誘導体を舌下投与するための方法に関する。
【0016】
所定の実施形態では、本発明は、有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む個々の液滴を含むフェンタニル舌下処方物であって、前記液滴は、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有するフェンタニル舌下処方物に関する。
【0017】
所定の実施形態では、本発明は、薬学的に受容可能な液体キャリア中にフェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴を含むフェンタニル舌下処方物であって、前記液滴は約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有するフェンタニル舌下処方物に関する。
【0018】
所定の好ましい実施形態では、舌下投与後にフェンタニル、その薬学的に受容可能な塩、またはその誘導体を肺へ送達することを可能にする径を有している粒子はない。
【0019】
所定の実施形態では、本発明は、単位用量のフェンタニル舌下処方物であって、前記単位用量は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む個々の液滴、および薬学的に受容可能な液状キャリアを含んでおり、前記液滴は、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有するフェンタニル舌下処方物に関する。
【0020】
所定の実施形態では、本発明は、単位用量のフェンタニル舌下処方物であって、前記単位用量は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴、および薬学的に受容可能な液状キャリアを含んでおり、前記液滴は約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有するフェンタニル舌下処方物に関する。
【0021】
所定の実施形態では、本発明は、疼痛を処置する方法であって、疼痛を経験しているヒト患者に、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは少なくとも約20〜約200ミクロンの平均径を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含み、前記液体スプレー処方物は、薬学的に受容可能な液状キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む方法に関する。
【0022】
所定の実施形態では、本発明は、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含む疼痛を処置する方法であって、前記液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む方法に関する。
【0023】
所定の実施形態では、本発明は、薬学的に受容可能な液状キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む単位用量の液体処方物を含有するリザーバーを備えるデバイスであって、前記デバイスは、作動させると、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有する液滴の形状にある単位用量の液体処方物を送達するアクチュエーターを有するデバイスに関する。好ましくは、前記デバイスは、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する液滴の形状にある治療有効用量の液体処方物を送達する。
【0024】
所定の実施形態では、本発明は、薬学的に受容可能な液状キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体処方物を含有するリザーバーを備える複数回用量デバイスであって、前記デバイスは、作動させると、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有する液滴の形状にある治療有効量の液体処方物を送達するアクチュエーターを有するデバイスに関する。好ましくは、前記デバイスは、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する液滴の形状にある治療有効量の液体処方物を送達する。
【0025】
所定の実施形態では、本発明は、疼痛を処置する方法であって、薬学的に受容可能な液状キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体処方物を含むリザーバーと;作動させると、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有する治療有効量の液滴を送達するアクチュエーターとを備えるスプレーデバイスを利用する工程を含む方法に関する。
【0026】
所定の実施形態では、本発明は、疼痛を処置する方法であって、フェンタニル、その薬学的に受容可能な塩、またはその誘導体、および薬学的に受容可能な液体キャリアを含むリザーバーと;作動させると約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する治療有効量の液滴を送達するアクチュエーターとを備えるスプレーデバイスを利用する工程を含む方法に関する。
【0027】
所定の実施形態では、本発明は、突出痛を処置する方法であって、ヒト患者に、前記ヒト患者が経験した突出痛を処置するために、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体スプレー処方物を舌下投与する工程を含む方法に関する。
【0028】
所定の実施形態では、本発明は、突出痛を処置する方法であって、慢性疼痛処置を受けており、そして突出痛を経験しているヒト患者に、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体スプレー処方物を舌下投与する工程を含む方法に関する。
【0029】
所定の実施形態では、本発明は、突出痛を処置するための患者間変動性を減少させる方法であって、突出痛を経験しているヒト患者に、フェンタニル、その薬学的に受容可能な塩、またはその誘導体、および薬学的に受容可能な液体キャリアを含む液体スプレー処方物中のある用量のフェンタニルを舌下投与する工程を含み、前記液体スプレー処方物は、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径、より好ましくは約20〜約200ミクロンの平均径を有する個々の液滴として投与される方法に関する。
【0030】
所定の実施形態では、本発明は、突出痛を処置するために患者間変動性を減少させる方法であって、突出痛を経験しているヒト患者に、フェンタニル、その薬学的に受容可能な塩、またはその誘導体、および薬学的に受容可能な液体キャリアを含む液体スプレー処方物中のある用量のフェンタニルを舌下投与する工程を含み、前記液体スプレー処方物は、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロンのサイズ分布を有する個々の液滴として投与される方法に関する。
【0031】
所定の好ましい実施形態では、液体スプレー処方物は、薬学的に受容可能な溶媒をさらに含む。好ましくは、前記薬学的に受容可能な溶媒は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体を溶解させるために適合する量で含まれる有機溶媒である。
【0032】
所定の好ましい実施形態では、本発明の処方物は、ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する。
【0033】
所定の好ましい実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する。
【0034】
本発明の所定の好ましい実施形態では、本発明の処方物は、噴射剤を含んでいない。
【0035】
所定の実施形態では、本発明の処方物は、例えば口腔粘膜(buccal)投与を含む、経粘膜投与のために適合する。
【0036】
所定の実施形態では、本発明は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体をヒトに経粘膜投与する方法であって、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の実質的部分が患者の肺には通過しない処方物で即効性疼痛軽減を提供するための方法に関する。所定の好ましい実施形態では、経粘膜領域は、ヒトの口腔粘膜領域である。
【0037】
所定の実施形態では、本発明は、鎮痛薬として、急性疼痛および/または突出痛を処置するための麻酔前投薬として、麻酔を誘導するための鎮静剤として、および/または不安を処置するための医薬を使用するための製造するために上記に規定した処方物の使用にも関する。
【0038】
本発明は、薬学的に受容可能な液体キャリア中のフェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴を含むフェンタニル舌下処方物であって、前記液滴は、少なくとも約10ミクロンの平均径を有しており、ヒト患者に投与されると、個々の液滴の少なくとも約90%は約9μm以上の平均径を有するフェンタニル舌下処方物にも関する。他の実施形態では、9μmよりも小さい平均径を有しているのは個々の液滴の約5%以下である。さらに他の実施形態では、本処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量(respirable dose)を提供する。
【0039】
本発明は、疼痛を処置する方法であって、疼痛を経験しているヒト患者に、少なくとも約10ミクロンの平均径を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含み、個々の液滴の少なくとも約90%はヒト患者に投与されると約9μm以上の平均径を有しており、前記液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む方法にも関する。所定の他の実施形態では、9μmよりも小さい平均径を有しているのは個々の液滴の約5%以下である。他の実施形態では、本処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する。
【0040】
本発明は、薬学的に受容可能な液体キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、または誘導体を含む単位用量(unit dose)または2回用量(bi−dose)の液体処方物を含有するリザーバーを備える、薬物を舌下投与するための単位用量デバイスまたは2回用量デバイスであって、前記デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する液滴の形状にある単位用量の液体処方物を送達するアクチュエーターを有しており、このときヒト患者に投与されると、個々の液滴の少なくとも約90%が約9μm以上の平均径を有する、デバイスにも関する。
【0041】
他の実施形態では、9μmよりも小さい平均径を有しているのは個々の液滴の約5%以下である。さらに他の実施形態では、本処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する。
【0042】
例えば癌を有する多くの患者は、慢性的な鎮痛療法を受けているにもかかわらず中等度から重度の疼痛を経験し続けており、これは頻回には患者の活動水準の増加に起因する間欠的突出痛として発生することがある。持効性処方物の鎮痛薬の用量を増量することでこのタイプの疼痛に対抗しようとする試みは、鎮痛の遅い開始や鎮静の望ましくない副作用である、便秘もしくは悪心および嘔吐を生じさせることが多い。しかし、所定の実施形態では、本発明は、必要な時間にわたって突出痛などの疼痛を減少させる、好ましくは即効性の強力な鎮痛を提供し、その後に、好ましくはかなり迅速に消失するので、それによってフェンタニル、その薬学的に受容可能な塩、またはその誘導体の副作用を最小限に抑える処方物に関する。
【0043】
本発明のためには、フェンタニルの誘導体には、スフェンタニル、カーフェンタニル、ロフェンタニル、アルフェンタニルなどが含まれる。
【0044】
本発明のためには、「突出痛」は、認識できる不快症状を引き起こす、患者における閾値を超える疼痛を意味するが、このとき患者が経験する疼痛は、他の場合には典型的には例えば慢性的な鎮痛療法によって制御され、そして我慢されている。例えば、癌などの医学的疾病に関連する疼痛は、典型的には揺動し、そして患者は頻回に認識できる不快感(例えば、突出痛)の経験を報告している。典型的には、突出痛は、現在は薬剤が吸収されるために約45分間以上を要するので、突出痛の緩和の遅延を生じさせる可能性がある即時放出性経口投薬形態を用いて処置されており、これは投与のほぼ直後に突出痛を緩和し始める本発明の液体スプレー処方物とは対照的である。
【0045】
本発明のためには、「慢性的な疼痛処置」は、1日1回または24時間の疼痛処置を意味する。慢性疼痛処置は、経口、非経口、経皮、またはその他の適切な投与手段であってよい。
【0046】
本発明のためには、「舌下」は、本明細書では舌の下方または舌の下の領域に関すると規定されている。
【0047】
本発明のためには、用語「舌下投与」は、本明細書では舌の下への薬学的組成物の治療的投与であると規定されている。
【0048】
本発明のためには、薬物の「有効量」は、薬物の所望の活性を示すために有効な量である。本発明によると、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の治療有効量は、患者における疼痛を処置する(例えば顕著に減少させる)ために有効な量である。
【0049】
本発明のためには、用語「滴」および「粒子」は、互換的に使用できる。
例えば、本願発明は以下の項目を提供する。
(項目1)
薬学的に受容可能な液体キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴を含むフェンタニル舌下処方物であって、該液滴は少なくとも約10ミクロンの平均径を有する、フェンタニル舌下処方物。
(項目2)
前記液滴は、少なくとも約20ミクロンの平均径を有する、項目1に記載のフェンタニル舌下処方物。
(項目3)
前記液滴は、約5ミクロン〜約500ミクロンのサイズ分布を有する、項目1に記載のフェンタニル舌下処方物。
(項目4)
前記液滴は、少なくとも約10ミクロン〜約200ミクロンのサイズ分布を有する、項目1に記載のフェンタニル舌下処方物。
(項目5)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、約0.05mg/ml〜約15mg/mlの濃度で前記処方物中に含まれている、項目1に記載のフェンタニル舌下処方物。
(項目6)
ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目7)
ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目8)
ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目9)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目10)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約142pg/ml〜約195pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目11)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約158pg/ml〜約177pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目1に記載のフェンタニル舌下処方物。
(項目12)
有機溶媒をさらに含む、項目1に記載のフェンタニル舌下処方物。
(項目13)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、前記有機溶媒中に溶解されている、項目12に記載のフェンタニル舌下処方物。
(項目14)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、前記薬学的に受容可能な液体キャリア中に分散されている、項目1に記載のフェンタニル舌下処方物。
(項目15)
吸収増強因子をさらに含む、項目1に記載のフェンタニル舌下処方物。
(項目16)
前記吸収増強因子は、トリアセチンである、項目15に記載のフェンタニル舌下処方物。
(項目17)
前記吸収増強因子は、前記処方物の約0.001重量%〜約10重量%の量にある、項目15または16に記載のフェンタニル舌下処方物。
(項目18)
噴射剤非含有処方物である、項目1に記載のフェンタニル舌下処方物。
(項目19)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、舌下投与後にヒト患者の肺に進入しないか、または実質的に進入しない、項目1に記載のフェンタニル舌下処方物。
(項目20)
舌下スプレー投与のために適切な薬学的に受容可能な液体キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体の個々の液滴を含むフェンタニル舌下処方物の単位用量であって、前記液滴は、少なくとも約10ミクロンの平均径を有する、フェンタニル舌下処方物の単位用量。
(項目21)
前記液体スプレー処方物は、少なくとも約20ミクロンの平均径を有する液滴粒子を含む、項目20に記載の単位用量。
(項目22)
前記液体スプレー処方物は、約5ミクロン〜約500ミクロンのサイズ分布を有する液滴粒子を含む、項目20に記載の単位用量。
(項目23)
前記液体スプレー処方物は、約10ミクロン〜約200ミクロンのサイズ分布を有する液滴粒子を含む、項目20に記載の単位用量。
(項目24)
約10μg〜約10mgの前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目20に記載の単位用量。
(項目25)
約25μg〜約5mgの前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目20に記載の単位用量。
(項目26)
約50μg〜約1600μgの前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目20に記載の単位用量。
(項目27)
ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目20に記載の単位用量。
(項目28)
ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目20に記載の単位用量。
(項目29)
ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目20に記載の単位用量。
(項目30)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目20に記載の単位用量。
(項目31)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約142pg/ml〜約195pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目20に記載の単位用量。
(項目32)
ヒトへの舌下投与後に、100μgのフェンタニルあたり約158pg/ml〜約177pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目20に記載の単位用量。
(項目33)
前記処方物は、噴射剤非含有処方物である、項目20に記載の単位用量。
(項目34)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、舌下投与後にヒト患者の肺に進入しないか、または実質的に進入しない、項目20に記載の単位用量。
(項目35)
疼痛を処置する方法であって、疼痛を経験しているヒト患者に、少なくとも約10ミクロンの平均径を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含み、該液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、方法。
(項目36)
前記液滴は、少なくとも約20ミクロンの平均径を有する、項目35に記載の方法。
(項目37)
疼痛を処置する方法であって、疼痛を経験しているヒト患者に、約5ミクロン〜約500ミクロンのサイズ分布を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含み、該液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、方法。
(項目38)
前記サイズ分布は、約10ミクロン〜約200ミクロンである、項目37に記載の方法。
(項目39)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、約0.05mg/ml〜約15mg/mlの濃度で前記液体スプレー処方物中に含まれる、項目35〜37、または38に記載の方法。
(項目40)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、約10μg〜約10mgの量で前記ヒト患者に投与される、項目35〜37、または38に記載の方法。
(項目41)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、約25μg〜約5mgの量で前記ヒト患者に投与される、項目35〜37、または38に記載の方法。
(項目42)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、約50μg〜約1600μgの量で前記ヒト患者に投与される、項目35〜37、または38に記載の方法。
(項目43)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目35〜37、または38に記載の方法。
(項目44)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目35〜37、または38に記載の方法。
(項目45)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目35〜37、または38に記載の方法。
(項目46)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目35〜37、または38に記載の方法。
(項目47)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約142pg/ml〜約195pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目35〜37、または38に記載の方法。
(項目48)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約158pg/ml〜約177pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目35〜37、または38に記載の方法。
(項目49)
前記ヒト患者は、前記疼痛を引き起こす癌を有する、項目35〜37、または38に記載の方法。
(項目50)
前記スプレー処方物は、有機溶媒をさらに含む、項目35〜37、または38に記載の方法。
(項目51)
前記有機溶媒は、エタノールである、項目51に記載の方法。
(項目52)
前記有機溶媒は、エタノール、プロピレングリコール、ポリエチレングリコール、ラブロソール(labrosol)、ラブラフィル、トランスカトール、またはそれらの組み合わせを含む共溶媒である、項目50に記載の方法。
(項目53)
前記キャリアは、水である、項目35〜37、または38に記載の方法。
(項目54)
前記キャリアは、ミグリオールである、項目35〜37、または38に記載の方法。
(項目55)
前記スプレー処方物は、吸収増強因子をさらに含む、項目35〜37、または38に記載の方法。
(項目56)
前記吸収増強因子は、トリアセチンである、項目55に記載の方法。
(項目57)
前記吸収増強因子は、前記スプレー処方物中に、該処方物の約0.001重量%〜約10重量%の量で含まれる、項目55に記載の方法。
(項目58)
前記液体スプレー処方物のいずれもか、または実質的にいずれもが、投与後に前記ヒト患者の肺に進入しない、項目35〜37、または38に記載の方法。
(項目59)
突出痛を処置する方法であって、
慢性疼痛処置を受けており、そして突出痛を経験しているヒト患者に、薬学的に受容可能な液体キャリア中に分散された有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体スプレー処方物を舌下投与する工程を含む、方法。
(項目60)
前記液体スプレー処方物は、約10ミクロンよりも大きい平均径を有する個々の液滴の形状で投与される、項目59に記載の方法。
(項目61)
前記液体スプレー処方物は、約20ミクロンよりも大きい平均径を有する個々の液滴の形状で投与される、項目59に記載の方法。
(項目62)
前記液体スプレー処方物は、約5ミクロン〜約500ミクロンのサイズ分布を有する個々の液滴の形状で投与される、項目59に記載の方法。
(項目63)
前記液体スプレー処方物は、約10ミクロン〜約200ミクロンのサイズ分布を有する個々の液滴の形状で投与される、項目59に記載の方法。
(項目64)
前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、前記液体スプレー処方物中に0.05mg/ml〜約15mg/mlの濃度で含まれる、項目59に記載の方法。
(項目65)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目59に記載の方法。
(項目66)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目59に記載の方法。
(項目67)
前記液体スプレー処方物は、ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目59に記載の方法。
(項目68)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目59に記載の方法。
(項目69)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約142pg/ml〜約195pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目59に記載の方法。
(項目70)
前記液体スプレー処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約158pg/ml〜約177pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目59に記載の方法。
(項目71)
前記ヒト患者は、前記疼痛を引き起こす癌を有する、項目59に記載の方法。
(項目72)
前記スプレー処方物は、有機溶媒をさらに含む、項目59に記載の方法。
(項目73)
前記有機溶媒は、エタノールである、項目72に記載の方法。
(項目74)
前記有機溶媒は、エタノール、プロピレングリコール、ポリエチレングリコール、ラブロソール(labrosol)、ラブラフィル、トランスカトール、またはそれらの組み合わせを含む共溶媒である、項目72に記載の方法。
(項目75)
前記キャリアは、水である、項目59に記載の方法。
(項目76)
前記キャリアは、ミグリオールである、項目59に記載の方法。
(項目77)
前記スプレー処方物は、噴射剤非含有処方物である、項目59に記載の方法。
(項目78)
前記液体スプレー処方物のいずれもか、または実質的にいずれもが、投与後に前記ヒト患者の肺に進入しない、項目59に記載の方法。
(項目79)
薬学的に受容可能な液体キャリア中に有効量のフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む単位用量または2回用量の液体処方物を含有するリザーバー;を備える、薬物を舌下投与するための単位用量デバイスまたは2回用量デバイスであって、該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する液滴の形状にある該単位用量の該液体処方物を送達するアクチュエーターを有する、デバイス。
(項目80)
前記送達される単位用量は、約10μg〜約10mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目79に記載の単位用量デバイスまたは2回用量デバイス。
(項目81)
前記送達される単位用量は、約25μg〜約5mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目79に記載の単位用量デバイスまたは2回用量デバイス。
(項目82)
前記送達される単位用量は、約50μg〜約1600μgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目79に記載の単位用量デバイスまたは2回用量デバイス。
(項目83)
前記デバイスは、前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体の吸収を妨害するか、または実質的に妨害する材料を含むストッパーをさらに備える、項目79に記載の単位用量デバイスまたは2回用量デバイス。
(項目84)
前記ストッパーは、前記液体処方物のスプレー特性に影響を及ぼす前記デバイスの一次包装の構成成分である、項目83に記載の単位用量デバイスまたは2回用量デバイス。
(項目85)
前記ストッパーは、以下:a)エラストマー:ブロモブチルおよび/またはクロロブチル;b)強化剤:不活性材料:不活性ミネラル;ならびにc)硬化系:の非従来型の組成および特徴を有する、項目83に記載の単位用量デバイスまたは2回用量デバイス。
(項目86)
薬学的に受容可能な液体キャリア中にフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体処方物を含有するリザーバー;
を備える、薬物を舌下投与するための複数回用量デバイスであって、該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する液滴の形状にある治療有効用量の該液体処方物を送達するアクチュエーターを有する、デバイス。
(項目87)
前記治療有効用量は、約10μg〜約10mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目86に記載の複数回用量デバイス。
(項目88)
前記治療有効用量は、約25μg〜約5mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目86に記載の複数回用量デバイス。
(項目89)
前記治療有効用量は、約50μg〜約1600μgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目86に記載の複数回用量デバイス。
(項目90)
前記デバイスは、前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体の吸収を妨害するか、または実質的に妨害する材料を含むガスケットをさらに備える、項目86に記載の複数回用量デバイス。
(項目91)
前記ガスケットは、以下:a)エラストマー:ブロモブチルおよび/またはクロロブチル;b)強化剤:不活性材料:不活性ミネラル;ならびにc)硬化系:の非従来型の組成および特徴を有する、項目86に記載のデバイス。
(項目92)
前記液滴は、少なくとも約20ミクロンの平均径を有する、項目79〜90、または91に記載のデバイス。
(項目93)
前記液滴は、約5ミクロン〜約500ミクロンのサイズ分布を有する、項目79〜90、または91に記載のデバイス。
(項目94)
前記液滴は、約10ミクロン〜約200ミクロンのサイズ分布を有する、項目79〜90、または91に記載のデバイス。
(項目95)
前記用量は、ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目79〜90、または91に記載のデバイス。
(項目96)
前記用量は、ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目79〜90、または91に記載のデバイス。
(項目97)
前記用量は、ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目79〜90、または91に記載のデバイス。
(項目98)
前記液体処方物は、噴射剤非含有処方物である、項目79〜90、または91に記載のデバイス。
(項目99)
前記液体スプレー処方物のいずれもか、または実質的にいずれもが、舌下投与後にヒト患者の肺に進入しない、項目79〜90、または91に記載のデバイス。
(項目100)
前記単位用量が送達された後、前記デバイスは、実質的に空である、項目79に記載のデバイス。
(項目101)
前記デバイスは、前記単位用量が送達された後に、使い捨て可能である、項目79に記載のデバイス。
(項目102)
2用量の前記フェンタニル、その薬学的に受容可能な塩、またはその誘導体を含有する、項目86に記載のデバイス。
(項目103)
前記デバイスは、前記2用量が送達された後に、実質的に空である、項目102に記載のデバイス。
(項目104)
前記デバイスは、前記2用量が送達された後に、使い捨て可能である、項目103に記載のデバイス。
(項目105)
1用量の投与を許容し、特定の期間にわたってさらなる投与をロックアウトするロックアウト機構をさらに備える、項目86に記載のデバイス。
(項目106)
薬学的に受容可能な液体キャリア中にフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む液体処方物を含有するリザーバーを備える舌下スプレーデバイスを利用する工程を含む、疼痛を処置する方法であって;該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する、該デバイスから噴霧される治療有効量の液滴を送達するアクチュエーターを有する、方法。
(項目107)
前記液滴は、約20ミクロンよりも大きい平均径を有する、項目106に記載の方法。
(項目108)
前記液滴は、約5ミクロン〜約500ミクロンのサイズ分布を有する、項目106に記載の方法。
(項目109)
前記液滴は、約10ミクロン〜約200ミクロンのサイズ分布を有する、項目106に記載の方法。
(項目110)
前記治療有効量は、約10μg〜約10mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目106に記載の方法。
(項目111)
前記治療有効量は、約25μg〜約5mgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目106に記載の方法。
(項目112)
前記治療有効量は、約50μg〜約1600μgのフェンタニル、その薬学的に受容可能な塩、またはその誘導体を含む、項目106に記載の方法。
(項目113)
前記治療有効量は、ヒトへの舌下投与後に、約5分間〜約120分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目106に記載の方法。
(項目114)
前記治療有効量は、ヒトへの舌下投与後に、約10分間〜約60分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目106に記載の方法。
(項目115)
前記治療有効量は、ヒトへの舌下投与後に、約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する、項目106に記載の方法。
(項目116)
治療有効量は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する、項目106に記載の方法。
(項目117)
前記液体処方物は、噴射剤非含有処方物である、項目106に記載の方法。
(項目118)
前記液体スプレー処方物のいずれもか、または実質的にいずれもが、舌下投与後にヒト患者の肺に進入しない、項目106に記載の方法。
(項目119)
薬学的に受容可能な液体キャリア中で治療的に活性な薬剤の混合物を調製する工程と、
少なくとも1つの治療用量を提供するために十分な量の該混合物を単位用量デバイス中へ組み込む工程と
を含む、舌下投与するための薬学的組成物を調製する方法であって、該デバイスは、少なくとも約10ミクロンの平均径を有する前記少なくとも該1つの治療用量の液滴をヒトの舌下領域に送達するために作動させることができる、方法。
(項目120)
薬学的に受容可能な液体キャリア中に有効量の治療的に活性な薬剤の個々の液滴を含む薬学的舌下処方物であって、該液滴は、少なくとも約10ミクロンの平均径を有する、薬学的舌下処方物。
(項目121)
舌下スプレー投与のために適切な薬学的に受容可能な液体キャリア中に有効量の治療的に活性な薬剤の個々の液滴を含む単位用量の薬学的舌下処方物であって、該液滴は、少なくとも約10ミクロンの平均径を有する、薬学的舌下処方物。
(項目122)
ヒト患者に少なくとも約10ミクロンの平均径を有する個々の液滴の形状にある液体スプレー処方物を舌下投与する工程を含む、ヒト患者を処置する方法であって、該液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量の治療的に活性な薬剤を含む、方法。
(項目123)
約5ミクロン〜約500ミクロンのサイズ分布を有する個々の液滴の形状にある液体スプレー処方物をヒト患者に舌下投与する工程を含む、ヒト患者を処置する方法であって、該液体スプレー処方物は、薬学的に受容可能な液体キャリア中に分散された有効量の治療的に活性な薬剤を含む、方法。
(項目124)
薬学的に受容可能な液体キャリア中に有効量の治療的に活性な薬剤を含む単位用量または2回用量の液体処方物を含有するリザーバー;
を備える、薬物を舌下投与するための単位用量デバイスまたは2回用量デバイスであって、該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する液滴の形状にある該単位用量の該液体処方物を送達するアクチュエーターを有する、デバイス。
(項目125)
治療的に活性な薬剤を含む液体処方物を含有するリザーバー;
を備える、薬物を舌下投与するための複数回用量デバイスであって、該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する液滴の形状にある治療有効用量の該液体処方物を送達するアクチュエーターを有する、デバイス。
(項目126)
薬学的に受容可能な液体キャリア中の治療的に活性な薬剤を含む液体処方物を含有するリザーバーを備える舌下スプレーデバイスを利用する工程;
を含む、ヒト患者を処置する方法であって、該デバイスは、作動させると、少なくとも約10ミクロンの平均径を有する、該デバイスから噴霧される治療有効量の液体処方物を送達するアクチュエーターを有する、方法。
(項目127)
ヒト患者に対する投与の際に、前記個々の液滴の少なくとも約90%は、約9μm以上の平均径を有する、項目1に記載のフェンタニル処方物。
(項目128)
前記個々の液滴の約5%以下は、9μmよりも小さい平均径を有する、項目127に記載のフェンタニル処方物。
(項目129)
前記処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する、項目127に記載のフェンタニル処方物。
(項目130)
ヒト患者に対する投与の際に、前記個々の液滴の少なくとも約90%は、約9μm以上の平均径を有する、項目35に記載の処置方法。
(項目131)
前記個々の液滴の約5%以下は、9μmよりも小さい平均径を有する、項目35に記載の処置方法。
(項目132)
前記処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する、項目35に記載の処置方法。
(項目133)
ヒト患者に対する投与の際に、前記個々の液滴の少なくとも約90%は、約9μm以上の平均径を有する、項目79に記載のデバイス。
(項目134)
前記個々の液滴の約5%以下は、9μmよりも小さい平均径を有する、項目79に記載のデバイス。
(項目135)
前記処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する、項目79に記載のデバイス。
(項目136)
ヒト患者に対する投与の際に、前記個々の液滴の少なくとも約90%は、約9μm以上の平均径を有する、項目86に記載のデバイス。
(項目137)
前記個々の液滴の約5%以下は、9μmよりも小さい平均径を有する、項目86に記載のデバイス。
(項目138)
前記処方物は、含有される全フェンタニル用量の約5%以下の呼吸用量を提供する、項目86に記載のデバイス。
【図面の簡単な説明】
【0050】
【図1】図1は、実施例6の試験における実施例1のフェンタニルの静脈内投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図2】図2は、実施例6の試験における実施例1のフェンタニルの舌下投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図3】図3は、実施例6の試験における実施例2のフェンタニルの静脈内投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図4】図4は、実施例6の試験における実施例2のフェンタニルの舌下投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図5】図5は、実施例6の試験における実施例3のフェンタニルの静脈内投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図6】図6は、実施例6の試験における実施例3のフェンタニルの舌下投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図7】図7は、実施例6の試験における実施例4のフェンタニルの静脈内投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図8】図8は、実施例6の試験における実施例4のフェンタニルの舌下投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図9】図9は、実施例6の試験における実施例5のフェンタニルの静脈内投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図10】図10は、実施例6の試験における実施例5のフェンタニルの舌下投与(n=3)後の平均(±S.E.)血漿中濃度−時間プロフィールを示す。
【図11】図11は、ビネット試験の結果についての配置距離に対するDv10、Dv50、Dv90、およびプルーム記録値をグラフで示した要約である。
【図12】図12は、排気孔試験の結果についてのデバイス−レーザービーム間距離を4cmにした配置に対するDv10値、Dv50値、およびDv90値をグラフで示した要約である。
【図13】図13は、排気孔試験の結果についてのデバイス−レーザービーム間距離を7cmにした配置に対するDv10値、Dv50値、およびDv90値をグラフで示した要約である。
【図14】図14は、デバイス−レーザービーム間距離に対するDv10値、Dv50値、およびDv90値についてのデバイス−レーザービーム間の距離の配置の結果をグラフで示した要約である。
【発明を実施するための形態】
【0051】
(発明の詳細な説明)
薬理学的因子の最も単純で最も普及している投与経路は、経口である。この方法を使用するためには、薬理学的因子は、典型的には錠剤、カプセル剤、または液体基剤中に組み込まれる。薬物の経口投与は、極めて便宜的であり、多数の薬物のために、最適な方法であり続けるであろう。
【0052】
錠剤を嚥下した後の血流内への薬物の吸収は、患者間で変動する可能性がある。薬物の吸収は、典型的には胃から小腸および大腸への移動、ならびにこれらの器官からの分泌物の作用に左右される。さらに、フェンタニルなどの薬物の経口投与を用いると、フェンタニルは患者の血流に腸を経由して進入し、全身を通して分布する前に患者の肝臓を通過するので、フェンタニルの50%以上が患者の血流から除去される可能性がある。この「初回通過効果」は、経口投与経路をフェンタニルには非実用的にさせる。
【0053】
経口投与後の血流内へのフェンタニルもしくはその薬学的に受容可能な塩の吸収は、初回通過効果によって有意に減少させられる。このため、経口投与経路は、フェンタニルにとって非実用的である。フェンタニルに対するこの初回通過効果を減少させるか、または回避するために、非経口送達、口腔粘膜送達、および経皮送達などの他の送達形態が利用されてきた。しかし、これらの他の送達形態には、それらに結び付いた一定の短所がある。例えば、非経口投与は、シリンジおよび注射針を使用する注射を必要とし、薬剤の筋肉内投与に付随することがある壊死を引き起こすことがある;クエン酸フェンタニルの経粘膜ロゼンジ処方物であるActiq(登録商標)は、有効な疼痛緩和を得るために握り棒(棒付きキャンディに類似する)に取り付けられたロゼンジ剤を患者が絶えずしゃぶっている必要がある;およびフェンタニルの経皮送達デバイスであるDuragesic(登録商標)は、慢性疼痛を管理するためには適合するが、急性疼痛もしくは突出痛に対しては適応ではない。
【0054】
口腔は、オピオイド系鎮痛薬投与の単純な無痛法を提供する。口腔内には、活性薬剤の一般に認識された3種の、つまり局所、口腔および舌下の投与経路がある。
【0055】
局所送達は、主として例えば口内びらんなどの口腔自体内で発生する崩壊状態に関連する適用に限定される。
【0056】
口腔粘膜領域は、口腔の内層の粘膜を含む。しかし口腔粘膜は、舌下領域より低透過性である。活性薬剤の口腔粘膜送達に関連する大きな短所の1つは、それによって活性薬剤の低バイオアベイラビリティを生じさせる、粘膜上皮を越える活性薬剤の通過がかなり少ないことであり、これは各用量中で使用できる活性薬剤の実質的消失と言い換えられる。
【0057】
舌下送達は、口底部を内張りしている粘膜を通して達成される。高透過性および豊富な血液供給のために、舌下経路を介しての輸送は迅速な作用開始を生じさせ、短い送達期間要件および頻回ではない投与レジメンを備える高透過性薬物のために適切な送達経路を提供する。
【0058】
本発明の舌下処方物は、中等度から重度の疼痛の処置において有用である。好ましくは、本発明の舌下処方物は、突出痛の処置のために有用である。例えば、本発明の処方物は、好ましくは、突出痛を経験し、急性疼痛緩和を必要とする、慢性疼痛処置を受けている患者のために適切である。
【0059】
本発明の舌下処方物は、ショック、手足の切断、重度の化学的火傷もしくは熱傷、捻挫、靱帯裂傷、骨折、創傷ならびにその他の組織傷害、歯科の手術、処置および疾患、陣痛および出産、理学療法中、術後疼痛、放射線中毒、癌、後天性免疫不全症候群(AIDS)、硬膜外(もしくは硬膜周囲)線維症、腰部手術および椎弓切除術、坐骨神経痛、有痛性鎌状赤血球発症、関節炎、自己免疫疾患、難治性膀胱痛などを含むがそれらに限定されない多数の原因による疼痛を緩和するために使用できる。本発明のフェンタニル、その薬学的に受容可能な塩、またはその誘導体の処方物の舌下投与は、さらにまた好ましくは、ホスピスでの使用、詳細には癌およびAIDS患者の看護を専門とするホスピスに適応である。
【0060】
所定の好ましい実施形態では、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下投与は、慢性疼痛状態において発生する可能性がある急性突出痛のエピソードを緩和もしくは軽減することができる。また別の実施形態では、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下投与は、突出痛を軽減するために慢性疼痛状態のための従来型の治療レジメンの補助療法として使用できる。所定の実施形態では、本発明は、麻酔を誘導するための麻酔前投薬として使用するため、鎮静剤として使用するため、および/または不安を処置するための処方物をさらに提供する。
【0061】
本発明によるフェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下投与は、悪心および嘔吐、疾患の結果としての嚥下困難のために経口投与を許容できないか、または静脈アクセスの低下、衰弱、または凝固障害のために非経口投与を許容できない癌を有する患者において特に有益な可能性がある。本発明によるフェンタニルの舌下投与は、好ましくは、いっそうの使用の容易さおよび疼痛緩和作用の迅速な開始という潜在的利点を有している。さらに、舌下静脈排出は門脈性よりむしろ全身性であるので、肝初回通過排除を回避できる。本発明は、好ましくは、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の溶液を舌下スプレーポンプによって送達するための処置的な処方物および方法を提供する。
【0062】
所定の好ましい実施形態では、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下投与は、シリンジおよび注射針を使用する注射を必要としない、薬物の筋肉内投与に付随する可能性がある壊死を回避し、そしてロゼンジもしくは棒付きキャンディを絶えずしゃぶり続ける必要を回避する点で、他の投与形態に比して有益である。好ましくは、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下投与は、本発明によると、自己投与のために適合する。
【0063】
好ましい所定の実施形態では、本発明の処方物は、患者の舌下にフェンタニル、その薬学的に受容可能な塩、またはその誘導体を送達するために、例えば揮発性クロロフルオロカーボン(例えば、噴射剤12)、揮発性ヒドロフルオロアルカン(例えば、1,1,1,2−テトラフルオロエタンおよび1,1,1,2,3,3,3−ヘプタフルオロ−n−プロパン)および揮発性アルカン(例えば、プロパン、ブタン)などのヒドロフルオロカーボン噴射剤などの噴射剤が必要とされないという点で有益である。
【0064】
好ましくは、本発明の処方物は、少なくとも約10ミクロン、好ましくは少なくとも約20ミクロン、より好ましくは約20〜約200ミクロンの平均系を有する液滴として送達される。最も好ましくは、本処方物は、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する液滴として送達される。
【0065】
好ましくは、スプレーによる舌下粘膜への本発明の処方物の送達は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の処置作用の迅速な開始を生じさせる。例えば、所定の実施形態では、本発明の処方物は、ヒトへの舌下投与後の約5分〜約120分間、好ましくは約10〜60分間、およびより好ましくは約15分間〜約35分間のフェンタニルの平均最高血漿中濃度到達時間(Tmax)を提供する。
【0066】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約127pg/ml〜約213pg/ml、好ましくは100μgのフェンタニルあたり約142pg/ml〜約195pg/ml、より好ましくは100μgのフェンタニルあたり約158pg/ml〜約177pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する。
【0067】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニル用量に基づいて約137pg/ml〜約207pg/ml、好ましくは100μgのフェンタニル用量に基づいて約154pg/ml〜約190pg/ml、より好ましくは100μgのフェンタニル用量に基づいて約163pg/ml〜約181pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する。
【0068】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、400μgのフェンタニル用量に基づいて約566pg/ml〜約850pg/ml、好ましくは400μgのフェンタニル用量に基づいて約637pg/ml〜約779pg/ml、より好ましくは400μgのフェンタニル用量に基づいて約672pg/ml〜約744pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する。
【0069】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、800μgのフェンタニルに基づいて約1016pg/ml〜約1525pg/ml、好ましくは800μgのフェンタニル用量に基づいて約1143pg/ml〜約1398pg/ml、より好ましくは800μgのフェンタニル用量に基づいて約1206pg/ml〜約1334pg/mlのフェンタニルの平均最高血漿中濃度(Cmax)を提供する。
【0070】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニルあたり約572pg・時間/ml〜約1273pg・時間/ml、好ましくは100μgのフェンタニルあたり約644pg・時間/ml〜約1167pg・時間/ml、より好ましくは100μgのフェンタニルあたり約715pg・時間/ml〜約1061pg・時間/mlのフェンタニルの無限大への血漿中濃度時間曲線下面積(AUC∞)を提供する。
【0071】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニル用量に基づいて約654pg・時間/ml〜約982pg・時間/ml、好ましくは100μgのフェンタニル用量に基づいて約736pg・時間/ml〜約900pg・時間/ml、より好ましくは100μgのフェンタニル用量に基づいて約777pg・時間/ml〜約859pg・時間/mlのフェンタニルの無限大への血漿中濃度時間曲線下面積(AUC∞)を提供する。
【0072】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、400μgのフェンタニル用量に基づいて約3394pg・時間/ml〜約5092pg・時間/ml、好ましくは400μgのフェンタニル用量に基づいて約3818pg・時間/ml〜約4667pg・時間/ml、より好ましくは400μgのフェンタニル用量に基づいて約4030pg・時間/ml〜約4455pg・時間/mlのフェンタニルの無限大への血漿中濃度時間曲線下面積(AUC∞)を提供する。
【0073】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、800μgのフェンタニル用量に基づいて約4581pg・時間/ml〜約6873pg・時間/ml、好ましくは800μgのフェンタニル用量に基づいて約5154pg・時間/mL〜約6300pg・時間/ml、より好ましくは800μgのフェンタニル用量に基づいて約5440pg・時間/ml〜約6014pg・時間/mlのフェンタニルの無限大への血漿中濃度時間曲線下面積(AUC∞)を提供する。
【0074】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニル用量に基づいて約378pg・時間/ml〜約1067pg・時間/ml、好ましくは100μgのフェンタニル用量に基づいて約425pg・時間/ml〜約978pg・時間/ml、より好ましくは100μgのフェンタニル用量に基づいて約472pg・時間/ml〜約889pg・時間/mlのフェンタニルのゼロ時点から最終定量可能血漿中濃度時点までの血漿中濃度曲線下面積(AUCT)を提供する。
【0075】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、100μgのフェンタニル用量に基づいて約378pg・時間/ml〜約568pg・時間/ml、好ましくは100μgのフェンタニル用量に基づいて約425pg・時間/ml〜約520pg・時間/ml、より好ましくは100μgのフェンタニル用量に基づいて約448pg・時間/ml〜約497pg・時間/mlのフェンタニルのゼロ時点から最終定量可能血漿中濃度時点までの血漿中濃度時間曲線下面積(AUCT)を提供する。
【0076】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、400μgのフェンタニル用量に基づいて約2844pg・時間/ml〜約4268pg・時間/ml、好ましくは400μgのフェンタニル用量に基づいて約3200pg・時間/ml〜約3912pg・時間/ml、より好ましくは400μgのフェンタニル用量に基づいて約3378pg・時間/ml〜約3734pg・時間/mlのフェンタニルのゼロ時点から最終定量可能血漿中濃度時点までの血漿中濃度時間曲線下面積(AUCT)を提供する。
【0077】
所定のまた別の実施形態では、本発明の処方物は、ヒトへの舌下投与後に、800μgのフェンタニル用量に基づいて約4333pg・時間/ml〜約6501pg・時間/ml、好ましくは800μgのフェンタニル用量に基づいて約4875pg・時間/ml〜約5960pg・時間/ml、より好ましくは800μgのフェンタニル用量に基づいて約5146pg・時間/ml〜約5689pg・時間/mlのフェンタニルのゼロ時点から最終定量可能血漿中濃度時点までの血漿中濃度時間曲線下面積(AUCT)を提供する。
【0078】
好ましくは、フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、有機溶媒中に溶解される。例えば水などのキャリア中のフェンタニル、その薬学的に受容可能な塩の溶解度を増強するために使用できる有機溶媒の例には、例えば、そして制限なく:例えば、メタノール、エタノール、プロピルアルコール、もしくはブチルアルコールなどの低級アルコール(例えば、C1−4アルコール);2つまたは3つのヒドロキシル基を有する、好ましくはグリセロール、プロピレングリコールもしくはブチレングリコールなどのC2−8アルコール;および例えばPEG200およびPEG400などのポリエチレングリコールが含まれる。上記の溶媒の任意の混合物を使用できる。所定の実施形態では、溶媒は、非極性炭化水素、好ましくは直鎖状もしくは分枝状構成のC7−18炭化水素、そのアルコール、脂肪酸エステル、およびミグリオール(Miglyol)などのトリグリセリドである。所定の好ましい実施形態では、有機溶媒は、エタノール、プロピレングリコール、ポリエチレングリコール、またはそれらの組み合わせである。
【0079】
好ましくは、本処方物に包含するための有機溶媒の量は、少なくともフェンタニル、その薬学的に受容可能な塩、またはその誘導体を、フェンタニルが溶液中に残留して沈殿しないように適切に可溶化するために必要な有機溶媒の量である。
【0080】
所定の実施形態では、有機溶媒は、処方物の重量の約0%〜約99.9%、好ましくは処方物の重量の少なくとも約10%〜約80%、より好ましくは処方物の重量の約20%〜約60%の量で処方物中に含まれる。
【0081】
所定の実施形態では、本組成物は、上述した有機溶媒に加えて、例えばプロピレングリコールなどのC2−8アルコール、または200〜4000の平均モル重量のポリエチレングリコールおよび/またはポリプロピレングリコール、またはそれらの混合物を含む。C2−8アルコールは、有機溶媒を組み合わせて共溶媒として作用できる。Carbowax(登録商標)(例えば、分子量300のCarbowax 300)として市販で入手できるポリエチレングリコールを使用できる。
【0082】
所定の実施形態では、本溶媒は、本明細書で言及した溶媒のいずれかを含む共溶媒である。所定の好ましい実施形態では、共溶媒は、エタノール、プロピレングリコール、ポリエチレングリコール、ラブラソール(labrasol)、ラブラフィル(labrafil)、トランスカトール(transcutol)またはそれらの組み合わせを含む。
【0083】
所定の好ましい実施形態では、本発明による組成物は、約0.0001重量%〜約20重量%のフェンタニル、その薬学的に受容可能な塩、またはその誘導体;約1重量%〜約99重量%の有機溶媒;および約0.01重量%〜約50重量%のC2−8アルコールを含む。
【0084】
所定の好ましい実施形態では、本発明による組成物は、約0.001重量%〜約15重量%のフェンタニル、その薬学的に受容可能な塩、またはその誘導体;約5重量%〜約90重量%のエタノール;および約0.1重量%〜約40重量%のプロピレングリコールを含む。
【0085】
所定の好ましい実施形態では、本発明による組成物は、約0.01重量%〜約10重量%のフェンタニル、その薬学的に受容可能な塩、またはその誘導体;約10重量%〜約80重量%のエタノール;および約1重量%〜約30重量%のプロピレングリコールを含む。
【0086】
所定の好ましい実施形態では、本発明による組成物は、約0.1重量%〜約0.8重量%のフェンタニル、その薬学的に受容可能な塩、またはその誘導体;約20重量%〜約60重量%のエタノール;および約4重量%〜約6重量%のプロピレングリコールを含む。
【0087】
所定の好ましい実施形態では、本発明による組成物は、1mLの容量中に、約100μg/mL〜約800μg/mLのフェンタニル塩基、約50%のエタノール、約5.2%のプロピレングリコール、および1mLまでに十分量の水を含む。
【0088】
所定の実施形態では、フェンタニルは、薬学的に受容可能な塩の形状で使用される。本発明によって使用するためのフェンタニルの適切な塩形の例には、例えば、そして制限なく、塩酸塩、塩化物、硫酸塩、酒石酸塩、またはクエン酸塩の形態が含まれる。所定の好ましい実施形態では、フェンタニルは、本発明の処方物中の遊離塩基として使用される。
【0089】
所定の好ましい実施形態では、フェンタニル、その薬学的に受容可能な塩、またはその誘導体は、処方物中で約0.05mg/mL〜約15mg/mL、好ましくは約0.1mg/mL〜約10mg/mL、より好ましくは約1mg/mL〜約8mg/mL(このとき重量はフェンタニル遊離塩基の重量として表示されている)の濃度で使用されるであろう。
【0090】
所定の好ましい実施形態では、単位用量あたりに送達されるフェンタニル、その薬学的に受容可能な塩、またはその誘導体の量は、約10μg〜約10mg、好ましくは約25μg〜約5mg、より好ましくは約50μg〜約1600μgである。
【0091】
本発明の好ましい実施形態では、処方物は、溶液である。所定のまた別の実施形態では、処方物は、懸濁液である。本発明の処方物が懸濁液である場合は、スプレー噴霧前に組成物を振盪することが必要な場合がある。
【0092】
所定の好ましい実施形態では、フェンタニル、その薬学的に受容可能な塩、またはその誘導体が有機溶媒中に溶解させられる前は、処方物は、好ましくはスプレーデバイスを介してフェンタニル、その薬学的に受容可能な塩、またはその誘導体を送達するために液体キャリア中に含められる。
【0093】
薬学的に受容可能なキャリアには、水、緩衝液、食塩液、緩衝食塩液、デキストロース液、プロピレングリコール、ポリエチレングリコール、ミグリオールなどが含まれるが、それらに限定されない。特定の実施形態では、本発明の薬学的処方物に使用できるキャリアは、リン酸緩衝食塩液、または緩衝食塩液である。所定の好ましい実施形態では、キャリアは水である。所定の実施形態では、処方物中の水は、水性緩衝液の形状で存在する。緩衝液は、好ましくは、処方物のpHを、約5〜約12のpHで、好ましくは約6〜約10のpHで、より好ましくは約8〜約9.5のpHで安定化させるように適合させられる。本発明によって使用するための緩衝液系には、例えば、そして制限なく、酢酸ナトリウム/酢酸、酢酸アンモニウム/エデト酸(edentate)二ナトリウム、ホウ酸/水酸化ナトリウム、オルトリン酸/水酸化ナトリウム、オルトリン酸水素二ナトリウム/クエン酸などが含まれる。
【0094】
例えば保存料、酸化防止剤、界面活性剤、吸収増強因子、増粘剤もしくはフィルム形成ポリマー、増量剤、希釈剤、着色剤、香味剤、pH調整剤、甘味料または味覚マスキング剤などの他の構成成分もまた本組成物中に組み込むことができる。適切な着色剤には、赤色、黒色および黄色酸化鉄ならびに例えばFD&C Blue No.2、FD&C Red No.40などのFD&C色素が含まれる。適切な香味料には、ミント、ラズベリー、カンゾウ、オレンジ、レモン、グレープフルーツ、キャラメル、バニラ、チェリー、グレープのフレーバー、それらの組み合わせなどが含まれる。適切なpH調整剤には、クエン酸、酒石酸、リン酸、塩酸、マレイン酸、水酸化ナトリウムなどが含まれる。適切な甘味料には、アスパルテーム、アセサルフェームK、ターメリックなどが含まれる。適切な味覚マスキング剤には、重炭酸ナトリウム、イオン交換樹脂、シクロデキストリン包接化合物、アスコルビン酸塩などが含まれる。
【0095】
本発明によって使用するための吸収増強因子には、例えば、ポリソルベート、ソルビタンエステル、Poloxamerブロックコポリマー、PEG−35ヒマシ油、PEG−40硬化ヒマシ油、カプリロカプロイルマクロゴール−8グリセリド、PEG−8カプリル酸/カプリン酸グリセリド、ラウリル硫酸ナトリウム、スルホコハク酸ジオクチル、ポリエチレンラウリルエーテル、エトキシジグリコール、プロピレングリコールモノ−ジ−カプリン酸塩、モノカプリル酸グリセロール、エトキシ化(C8−C18)脂肪酸グリセリル、オレイン酸、リノール酸、カプリル酸/カプリン酸グリセリル、モノオレイン酸グリセリル、モノラウリン酸グリセリル、カプリル酸/カプリン酸トリグリセリド、エトキシ化ノニルフェノール、PEG−(8−50)ステアリン酸塩、オリーブ油PEG−6エステル、トリオレインPEG−6エステル、レシチン、d−αトコフェリルポリエチレングリコール1000コハク酸塩、ポリカーボネート、グリココール酸ナトリウム、タウロコール酸ナトリウム、シクロデキストリン、クエン酸、クエン酸ナトリウム、トリアセチン、それらの組み合わせなどが含まれる。所定の好ましい実施形態では、吸収増強因子は、トリアセチンである。吸収増強因子が処方物中に含まれている所定の好ましい実施形態では、吸収増強因子は、処方物の約0.001重量%〜約10重量%、好ましくは処方物の約0.01重量%〜約5重量%の量で含まれている。
【0096】
本発明によって使用するための増量剤には、例えば、微結晶性セルロース、マンニトール、キシリトール、デンプンなどが含まれる。所定の好ましい実施形態では、増量剤は、マンニトールである。増量剤が処方物中に含まれている所定の好ましい実施形態では、増量剤は、処方物の約0.001重量%〜約10重量%、好ましくは処方物の約0.01重量%〜約5重量%の量で含まれている。
【0097】
本発明によって使用するためのフィルム形成ポリマーは、組成物の粘度を上昇させることによってスプレーの微粉度、スプレー角度および好ましくは拡散を減少させるために役立つことができる。フィルム形成ポリマーとしては、ゲランガム、キサンタンガム、カルボキシメチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルメチルセルロース、メチルセルロース、エチルセルロース、gelucire、poloxamer、アルギン酸、プロピレングリコールエステル、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)、PVP/PVAコポリマー、lubrajel、カルボキビニルポリマー、アクリル酸ポリマーおよびコポリマー、メタクリル酸、アクリル酸メチル、アクリル酸エチル、メタクリル酸メチル、メタクリル酸エチル、それらの組み合わせなどを使用できる。所定の実施形態では、フィルム形成ポリマーなどを用いた溶液の粘度上昇は、スプレーデバイスから投与された場合の液滴サイズの増加を提供する。ポリマーの化学的性質およびポリマーの分子量もまた、液滴の径に影響を及ぼすことがある。
【0098】
所定の実施形態では、本発明による処方物は、好ましくは定量ポンプを装備した密封容器を含むポンプスプレーシステム内の複数回用量(multi−dose)を含有するバルク溶液として包装される。
【0099】
所定のまた別の実施形態では、本発明による処方物は、好ましくはポンプを装備した密封容器を含む単位用量ポンプスプレーシステム内の単位用量溶液として包装される。
【0100】
典型的には、患者は、スプレーポンプから1〜2回の作動による舌下投与によって処置される。舌下スプレー送達のまた別の長所は、単一作動によって必要に応じて1用量もしくは2用量で患者を容易に滴定できる能力である。これは、典型的には他の薬剤送達形態(パッチ、ロゼンジ剤、錠剤、坐剤)には当てはまらない。
【0101】
ポンプ作動スプレーは、作動させるために、例えば外部の手動、機械的もしくは電気的に開始される圧力のような外部圧力の適用が必要なことが特徴である。これは、作動が典型的には例えば弁の制御開放によるような圧力の制御放出によって達成される、噴射剤駆動式エーロゾルスプレーのような加圧システムとは対照的である。
【0102】
所定の実施形態では、ポンプスプレーは、本発明の処方物を備えるポンプスプレーは少なくとも約10ミクロン、好ましくは少なくとも約20ミクロンの平均径を有する、より好ましくは約20〜約200ミクロンの平均径を有する、および/または好ましくは約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンのサイズ分布を有する液滴もしくは粒子の投与を可能にするので好ましい。これは、5ミクロン未満の粒子を生じさせる可能性がある加圧システムとは対照的である。約5ミクロン未満の径を有する液滴もしくは粒子は、投与されるとヒトの肺に進入する可能性を有する。そのような肺への進入は、フェンタニルの吸収における患者間変動性の増加を引き起こすであろう。さらに、肺内へのフェンタニルの吸収は、吸収の増加および致死性となることのある呼吸抑制を含む副作用の増加を引き起こすであろう。
【0103】
所定の好ましい実施形態では、送達される処方物の液滴サイズは、例えばスポイトを用いて舌下に配置することとは対照的に、舌下にスプレーすることによる表面積の増加をさらに提供する。
【0104】
所定の好ましい実施形態では、送達デバイスは、米国特許第6,866,566号;同第6,877,672号;同第6,772,915号;同第6,725,857号;同第6,705,493号;同第6,679,248号;同第6,578,741号;同第6,527,144号;同第6,484,715号;同第6,478,196号;同第6,461,322号;同第6,446,839号;同第6,427,878号;同第6,367.473号;同第6,364,166号;同第6,321,942号;同第6,234,366号;同第6,227,413号;同第6,059,151号;同第6,059,150号;同第6,055,979号;同第5,944,222号;同第5,901,883号;同第5,813,570号;同第4,565,302号;同第4,532,967号;同第6,964,381号;同第6,860,411号;同第6,824,020号;同第6,817,490号;同第6,585,172号;同第6,443,370号;同第6,427,680号;同第6,425,499号;同第6,401,987号;同第6,398,074号;同第6,264,065号;同第5,950,877号;同第5,328,099号;同第5,301,846号に記載されたデバイスおよび経鼻投与のために適合すると所定の実施形態で記載されたデバイスなどである。
【0105】
本発明の処方物によって使用するために適合するその他のデバイスは、米国特許第6,808,085号;同第6,736,293号;同第6,732,955号;同第6,708,846号;同第6,626,379号;同第6,626,330号;同第6,626,328号;同第6,454,185号;同第6,427,876号;同第6,427,684号;同第6,419,167号;同第6,405,903号;同第6,352,181号;同第6,308,867号;同第6,257,461号;同第6,257,454号;同第6,250,509号;同第6,227,415号;同第6,209,760号;同第6,179,164号;同第6,109,547号;同第6,062,430号;同第6,026,992号;同第5,992,704号;同第5,992,703号;同第5,988,449号;同第5,967,369号;同第5,964,417号;同第5,950,879号;同第5,938,125号;同第5,927,559号;同第5,921,444号;同第5,893,484号;同第5,875,938号;同第5,862,962号;同第5,860,567号;同第5,816,504号;同第5,813,570号;同第5,803,311号;同第5,791,518号;同第5,692,650号;同第5,655,689号;同第5,584,417号;同第5,520,337号;同第5,519,980号;同第5,482,193号;同第5,469,989号;同第5,443,185号;同第5,439,177号;同第5,437,398号;同第5,427,280号;同第5,395,032号;同第5,375,745号;同第5,368,201号;同第5,366,122号;同第5,366,122号;同第5,335,823号;同第5,326,000号;同第5,323,936号;同第5,316,198号;同第5,301,841号;同第5,295,628号;同第5,289,946号;同第5,277,334号;同第5,257,726号;同第5,228,586号;同第5,209,375号;同第5,203,840号;同第5,147,087号;同第5,115,980号;同第5,110,052号;同第5,011,046号;同第4,958,752号;同第4,946,069号;同第4,944,430号;同第4,934,568号;同第4,921,142号;同第4,871,092号;同第4,830,284号;同第4,826,048号;同第4,823,991号;同第4,821,923号;同第4,817,829号;同第4,776,498号;同第4,762,475号;同第4,728,008号;同第4,726,747号;同第4,694,977号;同第4,694,976号;同第4,566,611号;同第6,851,583号;同第6,824,021号;同第6,779,690号;同第6,776,312号;同第6,971,559号;同第6,948,640号;同第6,945,473号;同第6,938,802号;同第6,933,850号;同第6,929,156号;同第6,918,514号;同第6,913,205号;同第6,866,168号;同第6,832,072号;同第6,830,163号;同第6,817,490号;同第6,817,489号;同第6,811,060号;同第6,811,057号;同第6,805,301号;同第6,805,263号;同第6,789,750号;同第6,789,706号;同第6,786,369号;同第6,783,035号;同第6,772,913号;同第6,769,579号;同第6,758,371号;同第6,752,298号;同第6,742,677号;同第6,705,062号;同第6,698,627号;同第6,698,623号;同第6,663,019号;同第6,659,314号;同第6,659,307号;同第6,655,550号;同第6,655,549号;同第6,651,846号;同第6,601,735号;同第6,595,395号;同第6,592,010号;同第6,588,629号;同第6,581,852号;同第6,571,991号;同第6,554,160号;同第6,536,635号;同第6,527,149号;同第6,527,148号;同第6,488,185号;同第6,471,097号;同第6,460,781号;同第6,460,740号;同第6,460,738号;同第6,446,841号;同第6,422,429号;同第6,409,049号;同第6,398,079号;同第6,360,919号;同第6,349,856号;同第6,345,737号;同第6,343,722号;同第6,662,561号;同第6,315,169号;同第6,273,303号;同第6,273,300号;同第6,261,274号;同第6,257,457号;同第6,234,363号;同第6,234,168号;同第6,221,054号;同第6,209,759号;同第6,189,741号;同第6,186,371号;同第6,155,496号;同第6,119,897号;同第6,105,826号;同第6,021,930号;同第6,012,615号;同第5,988,496号;同第5,950,871号;同第5,931,386号;同第5,850,948号;同第5,803,318号;同第5,799,810号;同第5,769,325号;同第RE35,683号;同第5,692,492号;同第5,568,884号;同第5,566,865号;同第5,511,698号;同第5,482,188号;同第5,476,198号;同第5,366,115号;同第5,337,923号;同第5,249,713号;同第5,237,797号;同第5,234,135号;同第5,226,563号;同第5,190,192号;同第5,176,296号;同第5,127,548号;同第4,966,313号;同第4,91,840号;同第4,245,967号;同第4,030,667号などに記載されている。
【0106】
本明細書に言及した特許はすべてが、全体として参照して本明細書に組み込まれる。上述した特許において開示された送達デバイスは経鼻もしくは吸入投与のためには適合する可能性があるが、本発明の所定の実施形態によると、本送達デバイスは、液体処方物の舌下投与のために適合するように特別に適合させられている。所定の実施形態では、本発明を実行するために利用されるデバイスには、Pfeiffer of America社によって製造された構成成分、例えばPfeiffer of America社製の舌下単位用量投与デバイス(製品番号72772)が含まれる。他の実施形態では、本デバイスはPfeiffer of America社製の舌下単位用量投与用アプリケーターアセンブリである。
【0107】
好ましくは、本発明によるデバイスは、好ましくは少なくとも約10ミクロン、好ましくは少なくとも約20ミクロン、より好ましくは約20〜約200ミクロンの平均径を有する液滴だけが患者に送達されるような制御方法で舌下処方物を舌下に送達するように適合させられる。より好ましくは、約5ミクロン〜約500ミクロン、好ましくは約10ミクロン〜約200ミクロン、好ましくは約20ミクロン〜約100ミクロン、より好ましくは約30ミクロン〜約70ミクロンの範囲内のサイズ分布を有する液滴だけ。
【0108】
好ましくは、ディスペンサーは、指か、または片手の3本の指で持つことができ、同時かつ確実に作動できるような、そして例えば舌下スプレーの方法で使用できるように構築される。ディスペンサーは、媒体チャンバーが空になった後に再充填する必要のない、したがって側面図では大まかにはT形もしくはY形であってよいアウターケーシング内にポンプ、処方物、チャネル、および必要に応じて弁もしくはクロージャー(closure)を受容する単純な標準的な構成成分として構築できる使い捨て型ディスペンサーとして構築できる。
【0109】
ディスペンサーを連続して分割して押すポンプストロークか、または1度に1回のポンプストロークで空にして、再充填されない場合は、ディスペンサーは、開始位置で外部に対して実質的に緊密に閉鎖することができる。
【0110】
所定の好ましい実施形態では、送達デバイス(例えば、スプレーポンプデバイス)はロックアウト機構を含む。好ましくは、ロックアウト機構は、1回の単位用量だけの投与を許容し、そして好ましくは、単位用量の投与だけを許容して、その後の所定および/または規定時間にわたるさらなる投与をロックアウト(lock out)ことによって、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の乱用を防止する。所定の実施形態では、1回以上の作動周期後に、アクチュエーターは自動的にロック位置に移動させることができるので、その後の作動周期を実施するためには、無作為もしくは意図的に解除が発生しなければならない。ロック(locking)は、出発位置、作動位置および/または中間位置で発生することができ、作動に抵抗して、復帰もしくはこれらの移動単独の1つに抵抗しての両方に作用することができ、そして同一もしくは相違するロック作動に伴う数種のロック位置が可能である。
【0111】
所定の実施形態では、デバイスは事前計量型であっても、デバイスはデバイス計量型であってよい。事前計量型デバイスは、好ましくは、事前に計量された用量または、製造中にデバイス内に、または使用前に患者によって含めることのできる同一タイプの単位での用量画分(例えば、単位用量の溶液、単一ブリスターもしくは複数ブリスター、または他の空間)を含有している。典型的なデバイス計量型ユニットは、患者が活性化させるとデバイス自体によって定量スプレーとして送達される複数回投与のために十分な処方物を含有するリザーバーを備える。
【0112】
本デバイスの製造に関して検討すべき重要な因子は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の舌下への送達に影響を及ぼす可能性がある用量の再現性、スプレープルーム、および粒子/液滴サイズ分布である。使用期間内を通してこれらのパラメーターの再現性を維持すること、そして患者の使用条件下でその寿命を通して本デバイスの機能性(例えば、スプレー機構、電子的特性、センサー)を保証することは重要であるが、それはこれらのパラメーターにおけるいずれかの変化は投薬および吸収における変動性を引き起こし、これは潜在的副作用を引き起こす可能性があるからである。
【0113】
スプレー薬処方物の投与される用量は、容器密封システムの設計、再現性、および性能特徴に左右される可能性がある。所望の液滴/粒径分布を提供する適切なデバイスは、フェンタニル処方物の正しい性能のために重要な要素である。本デバイスに関しては、作動パラメーター(例えば、力、速度、保持時間および再実行時間)についてもまた検討するべきである。さらに、本デバイスは、処方物構成成分と適合しなければならない。さらに、本デバイスは、患者用の使用説明書にしたがって使用した場合に、フェンタニル、その薬学的に受容可能な塩、またはその誘導体、処方物の部分的計量を防止するように設計されなければならない。
【0114】
典型的なデバイスには、基本ユニット、放出アクチュエーター、デバイスから処方物を放出するための開口部、および媒体リザーバーを含む。好ましくは、分注チャンバーとして本デバイスの製造時には既に充填されているリザーバーが用意される。媒体リザーバーは、好ましくは、1回の能動化の際に、放出されるフェンタニル、その薬学的に受容可能な塩、またはその誘導体の測定された含量を規定する。
【0115】
本発明の所定の実施形態によると、リザーバー、または媒体を受け入れるその空間は、好ましくはリザーバー本体の周囲および全長にわたって一定である壁厚を有する好ましくは細長い形状である。リザーバー本体は、その製造が極めて単純であるように、単純に、プラスチック、例えばステンレス鋼などの鋼、例えばガラスなどの透明材料の円筒形中空の区間によって形成されてよい。
【0116】
好ましくは、アクチュエーター本体は、放出を活性化するための開口部に対して可動性である、本デバイスのユニット上に提供される。この本体は、作動運動の進行に伴って、例えば穿刺によって、チャンバーの閉鎖を開く。このチャンバー内の空間は、リザーバー内の媒体に直接的に隣接していてよく、開口本体もしくはリザーバーに少なくとも一部には適応することができ、そして開放前には高圧状態にある圧力空間として構成される。開口本体は、リザーバーによって直接的に形成されてよい。
【0117】
好ましくは、出発位置後の一作動動程中に、高圧が作り上げられる。同一方向に継続する作動性の移動のその後の一部分において、媒体は、側辺の一つで圧力から開放され、この側辺上にある媒体開口部へ移動させられる。そこで、側辺に作用する圧力のために、媒体はリザーバーから開口部を通して押し出される。
【0118】
典型的には液体処方物が開口部を離れるにつれて、液滴は、デバイスの開口部の形状によって影響される軌道に従う。所定の実施形態では、液滴サイズ、スプレー形状およびスプレーパターンは、ポンプの設計および/または処方物の特性に依存する。所定の実施形態では、アクチュエーターの位置付け、ポンプの設計、および処方物の特性がスプレーの対称性および形状に影響を及ぼすであろう。
【0119】
所定の実施形態では、本発明のデバイスは、ストッパーをさらに含む。好ましくは、ストッパーは、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の吸収を妨害するか、または実質的に妨害する材料を含む。本発明のデバイスによって使用するために適合するストッパーは、例えば、West Pharmaceutical Services社によって市販されているストッパーである。所定の好ましい実施形態では、ストッパーは、以下:1)エラストマー系:ブロモブチルおよび/またはクロロブチル;2)強化系:不活性材料;および3)硬化系:の非従来型の組成および特徴を有している。
【0120】
所定の実施形態では、本デバイスは、ガスケットをさらに備える。好ましくは、ガスケットは、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の吸収を妨害するか、または実質的に妨害する材料を含む。本発明のデバイスによって使用するために適合するガスケットは、例えば、West Pharmaceutical Services社によって市販されているストッパーである。所定の好ましい実施形態では、ガスケットは、以下の:1)エラストマー系:ブロモブチルおよび/またはクロロブチル;2)強化系:不活性材料;および3)硬化系:の非従来型の組成および特徴を有している。
【0121】
液滴サイズ分布は、当業者に公知である任意の信頼できる方法を利用することによって決定できる。1つのそのような方法は、例えばRT Sizerソフトウェアを使用するMalvern Spraytec(登録商標)などのレーザー回折デバイスを使用する。サイズ分布を決定するためには、Malvern Instruments(英国)社製のMalvern Mastersizer Sデバイスもまた使用できる。Malvern Mastersize Sは、測定多様性を提供するモジュラー式粒径分析デバイスである。このデバイスは、スプレー液滴のサイズならびに湿性および乾性サンプルを測定することができる。Malvern Mastersizer Sを用いると、1ミクロン未満から数ミリメートルまでの粒子を測定できる。
【0122】
さらに、液滴サイズ分布を決定する場合は、手動作動に関連する変動性を減少させるためのインビトロ生物学的等価性試験または他の試験において比較するための自動作動ステーションもまた使用できる。当業者に公知である任意の自動作動ステーションは、本発明を実行する際に適用できる。そのような1つのデバイスの例は、Innova Systems社によるMightyRunt作動ステーションである。好ましい実施形態では、MightyRuntには、換気扇アタッチメントが装備されている。また別の実施形態では、MightyRuntにはさらにMettler Toledo天秤AT201型が装備されている。
【0123】
(その他の活性薬剤)
本明細書に記載した本発明はフェンタニル、その薬学的に受容可能な塩、またはその誘導体に関連して説明してきたが、その他の活性な薬学的因子、詳細には舌下投与に適合する薬学的因子を本発明によって使用できることは企図されている。例えば、所定の実施形態では、舌下投与のために適合する他のオピオイド系鎮痛薬は、フェンタニル、その薬学的に受容可能な塩、またはその誘導体の代りに使用できる。本発明によって使用するための所定のオピオイド系鎮痛薬には、例えば、そして制限なく、アルフェンタニル、スフェンタニル、ブプレノルフィン、ブトルファノール、コデイン、ヒドロコドン、ヒドロモルホン、レボルファノール、メペリジン、メタドン、モルヒネ、ナルブフィン、オキシコドン、オキシモルホン、プロポキシフェン、トラマドールなどが含まれる。
【0124】
所定の実施形態では、活性化合物は、鎮痛薬、オピオイドアンタゴニスト、偏頭痛治療薬、制吐薬、抗てんかん薬、抗高血圧薬、麻酔薬、カンナビノイド、カンナビノイドアンタゴニスト、カンナビノイドのインバースアゴニスト、内在性カンナビノイド、エンケファリン、それらのアナログもしくは誘導体、またはそれらの混合物である。
【0125】
本発明において有用な鎮痛薬には、アルフェンタニル、ブプレノルフィン、ブトルファノール、コデイン、フェンピプラミド、ヒドロコドン、ヒドロモルホン、レボルファノール、メペリジン、メタドン、モルヒネ、ナルブフィン、オキシコドン、オキシモルホン、ペンタゾシン、ピリトラミド、プロポキシフェン、スフェンタニル、チリジン、トラマドール、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0126】
本発明において有用なオピオイドアンタゴニストには、ナロキソン、ナルトレキソン、ナルメフェン、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0127】
本発明において有用な偏頭痛治療薬には、アルモトリプタン、エレトリプタン、フロバトリプタン、ナラトリプタン、リザトリプタン、スマトリプタン、ゾルミトリプタン、麦角アルカロイド、プロキシバルバール、リスリド、メチセルジド、クロニジン、ピゾチフェン、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0128】
本発明において有用な制吐薬には、ブロモプリド、ドンペリドン、グラニセトロン、オンダセトロン、トロピセトロン、メトクロプラミド、ピリドキシン、スコポラミン、チエチルペラジン、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0129】
本発明において有用な抗てんかん薬には、バルビツレート、カルバマゼピン、エトスクシミド、メスクシミド、フェニトイン、プリミドン、ズルチアム、バルプロ酸、ビガバトリン(vigabatrine)、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0130】
本発明において有用な抗高血圧薬には、ジルチアゼム、クロニジン、ニフェジピン、ベラパミル、イソソルビド−5−モノニトレート、有機硝酸塩、心臓障害の処置に使用される薬剤、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0131】
本発明において有用な麻酔薬には、ベンゾカイン、ブピバカイン、ジブカイン、エチドカイン、レボブピバカイン、リドカイン、メピバカイン、オキシブプロカイン、ピペロカイン、プリロカイン、プロカイン、プロパラカイン、ロピバカイン、テトラカイン、キシロカイン、デスフルラン、エンフルラン、イソフルラン、セボフルラン、ベンゾナテート、ジクロニン、ケタミン、フェノール、プロポフォール、それらのアナログもしくは誘導体、またはそれらの混合物が含まれるがそれらに限定されない。
【0132】
本発明において有用なカンナビノイドには、δ−8−テトラヒドロカンナビノール、δ−9−テトラヒドロカンナビノール、カンナビドール、オリーブトール、カンナビノール、カンナビグレロール、ナビロン、δ−9−テトラヒドロカンナビノイド酸(cannabinotic acid)、非向精神性カンナビノイド3-ジメチルネプチ11カルボ
ン酸ホモロギン(homologine)8、δ−8−テトラヒドロカンナビノール、それらの薬学的に受容可能な塩、それらの複合体、それらの誘導体、またはそれらの混合物が含まれるがそれらに限定されない。特に好ましいカンナビノイドは、ドロナビノールとしても知られている、δ−9−テトラヒドロカンナビノールである。
【0133】
さらに、狭い治療指数もしくは治療範囲を有する活性薬剤(例えば、薬剤の血中レベルにおける小さな変動は、その薬剤の有効性または毒性における変化を引き起こす)は、本発明によって使用するために特に適合するであろう。そのような活性薬剤には、例えば、そして制限なく、ジゴキシン、レボチロキシン、アミノ配糖体(例えば、ゲンタマイシン、トブラマイシン)、抗不整脈薬(例えば、プロカインアミド、キニジン)、テオフィリン、抗腫瘍薬、ブスルファン、メトトレキセート、6−MP、カルボプラチン、抗うつ薬(例えば、リチウム)、抗痙攣薬(例えば、フェニトイン、カルバマゼピン、バルプロ酸ナトリウム、)、抗精神病薬、抗凝固薬(例えば、ワルファリン)、シクロスポリンなどが含まれる。
【0134】
以下では、添付の実施例を参照しながら本発明をより十分に説明する。しかし、以下の説明は例示することだけを目的としており、上述した本発明の普遍性への制限であるとは決して見なされるではない。
【実施例】
【0135】
(好ましい実施形態の詳細な説明)
(実施例1)
実施例1では、0.5mg/mLの濃度を有するフェンタニル舌下処方物を調製した。本処方物は、以下の表1に列挙した:
【0136】
【表1】

(実施例2)
実施例2では、0.5mg/mLの濃度を有するフェンタニル舌下処方物を調製した。本処方物は、以下の表2に列挙した:
【0137】
【表2】

0.5mg/mLのフェンタニル塩基と同等のクエン酸フェンタニルを含有している。
【0138】
(実施例3)
実施例3では、0.5mg/mLの濃度を有するフェンタニル舌下処方物を調製した。本処方物は、以下の表3に列挙した:
【0139】
【表3】

(実施例4)
実施例4では、0.5mg/mLの濃度を有するフェンタニル舌下処方物を調製した。本処方物は、以下の表4に列挙した:
【0140】
【表4】

(実施例5)
実施例5では、0.5mg/mLの濃度を有するフェンタニル舌下処方物を調製した。本処方物は、以下の表5に列挙した:
【0141】
【表5】

処方物の調製(実施例1〜5)
1.風袋を計量したガラス容器中に計算した量のフェンタニル塩基もしくはクエン酸フェンタニルを測り入れた。
2.計算した量のアルコールを容器に加え、フェンタニルを溶解させるために混合した。3.プロピレングリコールを計量し、上記フェンタニル溶液に加えた。
4.水もしくは緩衝液もしくはミグリオールを計量し、フェンタニル溶液に加え、2分間混合した。
5.不活性成分(マンニトール、トリアセチン、もしくはTW80)を最後に加え、十分に混合した。
6.最終溶液は3分間にわたりボルテックスミキサーにかけた。混合後、その処方物を、その後の試験のために冷蔵庫に保存した。
【0142】
(実施例6)
実施例6では、体重が2〜3kgの3匹のウサギを使用して、参照物質としての本処方物のIV注射と比較して、実施例1〜5の舌下投与のバイオアベイラビリティを試験した。ウサギには、最初に、約15〜20分間にわたりウサギを固定したままにする必要に応じてイソフルレンガスによる麻酔を実施した。
【0143】
各処方物について、試験ウサギは、舌下およびIV投与によって0.1mL(50μgのフェンタニル塩基と同等)の単回投与を受けた。舌下試験のためには、スプレーボトルを用いて用量の液体処方物を舌の下方に投与した。血液サンプル(1サンプルに付き1mL)は、耳静脈の内側に挿入したカテーテルを通して入手した。
【0144】
血液サンプルはベースライン時のゼロ時点および単回投与の5、10、20、45、60および120分後に採血した。サンプルは即時に冷却し、採血から2〜3時間以内に遠心分離により血漿を分離した。サンプルは、分析時まで−20℃で保存した。動物は、麻酔から回復した後にケージに戻した。これらの動物は、その後の試験のために再使用できるようになるまで少なくとも5〜7日間にわたりケージ内で休息させた。
【0145】
(血漿の収集および分離)
血液は、7.5% EDTAを含有する3mLチューブ内にウサギから採血し、血球およびその他の不溶性材料を除去するために15分間にわたり3000RPMで遠心した。血漿は、シラン処理チューブ内にデカンテーションし、分析時まで−20℃で冷凍保存した。
【0146】
(血漿の抽出)
各血漿サンプル(0.5mL)に対して、100μLのスフェンタニル(IS)および100μLの5M NaOH(タンパク質変性のため)を加えた。フェンタニルは、1mLの1−クロロブタンを用いて15分間にわたりボルテックスミキサーにかけることによって抽出した。5分間にわたり12000RPMで遠心し、10分間にわたり凍結乾燥(すべてのエマルジョンを破壊するため)させた後、上部の有機相をデカンテーションし、穏やかな窒素流を用いて乾燥するまで蒸発させた。抽出残留物は100μLのメタノールを用いて再構成し、その後に5分間にわたりボルテックスミキサーにかけ、3分間にわたり超音波処理し、次に3μLの量をGC−MSシステム内に注入した。
【0147】
(結果および考察)
(血漿中濃度対時間プロフィール)
0.1mL(50μgのフェンタニル塩基と同等)のIVおよび舌下投与後のウサギにおけるフェンタニルの血漿中濃度−時間プロフィールは、以下の表(表6A〜10B)に表示した。
【0148】
表6Aおよび6Bは、実施例1についての血漿中濃度−時間プロフィールを提供する。
【0149】
【表6A】

【0150】
【表6B】

表7Aおよび7Bでは、実施例2についての血漿中濃度−時間プロフィールである。
【0151】
【表7A】

【0152】
【表7B】

表8Aおよび8Bでは、実施例3についての血漿中濃度−時間プロフィールである。
【0153】
【表8A】

【0154】
【表8B】

表9Aおよび9Bでは、実施例4についての血漿中濃度−時間プロフィールである。
【0155】
【表9A】

【0156】
【表9B】

表10Aおよび10Bでは、実施例5についての血漿中濃度−時間プロフィールである。
【0157】
【表10A】

【0158】
【表10B】

(薬物動態パラメーター)
薬物の舌下もしくはIV投与後に入手した最高血漿中濃度(Cmax)、Cmax到達時間(Tmax)、半減期(t1/2)、曲線下面積(AUC)、およ全身クリアランス(CL)は、以下の表(表11〜15)に一覧にした。同様に、フェンタニルのIVおよび舌下用量の投与後の血漿中濃度−時間曲線を、図1〜10に示す。
【0159】
【表11】

【0160】
【表12】

【0161】
【表13】

【0162】
【表14】

【0163】
【表15】

舌下投与後には、全処方物について約20分後に最高濃度に到達した。どちらの投与経路によっても相当に大きな個体間変動性が見られた。舌下投与後の測定可能な血漿中濃度は、大多数の処方物試験において120分後に証明可能であった。これらをまとめると、フェンタニルの舌下投与は、IVに比較して良好な吸収プロフィールを示した。
【0164】
(実施例7)
実施例7では、絶食条件下にある健常志願者において舌下投与量を増量した後に、実施例1によって調製した処方物の薬物動態を決定する試験を実施した。さらにまた実施例1によって調製したフェンタニル舌下スプレーのヒトにおける安全性および許容性を決定するための試験もまた実施した。
【0165】
本試験は、健常男性被験体における単一施設、単回投与、単一盲験、連続的増量および反復設計であった。以下の処置は、絶食条件下で投与する必要があった:
処置A(試験1):1回のフェンタニル1mg/mL(舌下スプレー)(1×100μg用量)
処置B(試験2):1回のフェンタニル4mg/mL(舌下スプレー)(1×400μg用量)
処置C(試験2):2回のフェンタニル4mg/mL(舌下スプレー)(1×800μg用量)
処置D(プラセボ試験1):1回のプラセボ1mg/mL(舌下スプレー)(1×100μg用量)
処置E(プラセボ試験2):1回のプラセボ4mg/mL(舌下スプレー)(1×400μg用量)
処置F(プラセボ試験2):2回のプラセボ4mg/mL(舌下スプレー)(1×800μg用量)
これらの処方物は、以下の表16に記載の設計にしたがって9例の健常男性志願者に投与する予定であった:
【0166】
【表16】

各期間において、被験体は投与の少なくとも10時間前に臨床試験施設に到着することになっていた。監視下での一晩にわたる絶食後に、単回経口用量の割り付けられた処方物が午前中に経口投与されることになっていた。被験体は、24時間にわたる採血後には臨床試験施設を離れることが許された。ウォッシュアウト期間は、少なくとも14日間とされた;本試験の期間は約5〜6週間であると予測された。プロトコールによると、各連続投与は、測定対象の成分の予想半減期の10倍以上に対応する少なくとも14日間のウォッシュアウトによって分離されることになっていた。しかし、試験中には、第1期間および第2期間は15日間のウォッシュアウトによって分離され、第2期間および第3期間は13日間のウォッシュアウトによって分離された。フェンタニルの予想半減期は約6.4時間であると予想されると報告されているので、これらのウォッシュアウト偏差は試験の結論に影響を及ぼさないと判定されている。さらに、第2および第3期間の開始時に持ち越し(carry−over)は観察されなかった。
【0167】
(薬物動態的評価)
薬物動態測定のための血液サンプルは、各薬物投与の前および投与24時間後まで(連続サンプリング)収集した。試験処方物の投与によって生じた薬物濃度を使用して以下の表17および18に列挙した薬物動態パラメーターを引き出した。
【0168】
統計的分析には6例の被験体を含めた。非標準化薬物動態パラメーターの要約を表17に提示し、標準化薬物動態パラメーターの要約を表18に提示した。試験処方物の投与によって生成した平均測定血漿中濃度対時間プロフィールを図11に示し、変形平均濃度対時間プロフィールを図12に提示する。
【0169】
本試験の対象の薬物動態パラメーターは、Cmax、AUC∞、AUCT、AUCT/∞、Kel、Tmax、T1/2el、Cl/FおよびVZ/Fであった。
【0170】
【表17】

Tmaxについては中央値が提示されており、統計的分析は順位に基づいている。
【0171】
【表18】

Tmaxについては中央値が提示されており、統計的分析は順位に基づいている。
1=試験1と相違する(p<0.05)
2=試験1と相違する(p<0.01)
N.S.=有意ではない(p>0.05)
薬物動態パラメーターの定義
Cmax:最高血漿中濃度(ng/mL)
Tmax:最高測定血漿中濃度到達時間;それが1回よりも多い時点で発生する場合、Tmaxはこの数値を示した最初の時点(時間)であると規定されている。
CLQC:最終定量可能濃度(ng/mL)。
TLQC:最終定量可能血漿中濃度到達時間(時間)。
AUCT:台形法を用いて、および以下の方程式:
【0172】
【数1】

(式中、NTLQCは、TLQCに関連するサンプルの数である)によって計算された、0〜TLQCまでの計算された累積血漿中濃度時間曲線下面積(ng・時間/mL)。
AUC∞:無限大までの外挿血漿中濃度時間曲線下面積(ng・時間/mL)。
【0173】
【数2】

AUCT/∞:AUC∞に対するAUCTの相対比率(%)。
【0174】
【数3】

TLIN:対数線形排出が始まる時点(時間)。
Kel:非線形最小二乗回帰分析によって推定された見掛けの平均排出速度定数;濃度時間曲線の最後に必要とされる最小限3つの数値(時間−1)。
T1/2el:排出半減期(時間)。
【0175】
【数4】

Cl/F:見掛けのクリアランス(mL/時間/kg)
【0176】
【数5】

Vz/F:見掛けの分布容積(mL/kg)
【0177】
【数6】

*体重(kg)当たりで表示した用量
表11に記載したように、100μg用量と標準化400μg用量との間で統計的有意差が観察されたパラメーターは、AUCT、ln(AUCT)およびAUCT/∞であり、100μg用量と800μg用量との間で統計的有意差が観察されたパラメーターは、AUCT/∞であった。試験下の他の薬物動態パラメーターのいずれについても、統計的有意差は観察されなかった。
【0178】
100μg用量の平均Cmax値は172.0pg/mLであったが、400μg用量については708.0pg/mLであり、800μg用量については1270.4pg/mLであった。100μg用量に標準化すると、400μg用量の平均Cmax値は177.0pg/mLとなり、800μg用量については158.8pg/mLとなった。
【0179】
メジアンTmaxは、100μg用量および400μg用量については0.50時間、そして800μg用量については0.75時間であった。
【0180】
100μg用量の平均AUCT値は472.6pg・時間/mLであったが、400μg用量については3556.1pg・時間/mLであり、800μg用量については5,417.3pg・時間/mLであった。100μg用量に標準化すると、400μg用量の平均AUCT値は889.0pg・時間/mLとなり、800μg用量については677.2pg・時間/mLとなった。
【0181】
100μg用量の平均AUC∞値は817.9pg・時間/mLであったが、400μg用量については4242.6pg・時間/mLであり、800μg用量については5726.8pg・時間/mLであった。100μg用量に標準化すると、400μg用量の平均AUC∞値は1060.7pg・時間/mLとなり、800μg用量については715.9pg・時間/mLとなった。
【0182】
AUCT/∞比は、100μg用量については約55%であり、400μg用量については81%、そして800μg用量については94%であった。
【0183】
平均Kel値は、100μg用量については0.2008時間−1、400μg用量については0.1593時間−1、そして800μg用量については0.1782時間−1であったが、他方平均T1/2elは、同一順序で3.70時間、5.20時間および3.89時間であった。
【0184】
平均Cl/F値は、100μg用量については1718.8mL/時間/kg、400μg用量については1532.2mL/時間/kg、そして800μg用量については1837.3mL/時間/kgであったが、平均Vz/F値は、100μg用量については9070.2mL/kg、400μgについては10470.4mL/kg、そして800μg用量については10307.7mL/kgであった。
【0185】
被験体内変動は、Cmax、AUCT、およびAUC∞に対して、各々36.79%、37.05%および28.88%であった。
【0186】
(安全性の評価)
安全性パラメーターは、有害作用の発生、バイタルサインの測定値、呼吸数、指パルスオキシメトリーによる血液の酸素飽和度、ECGおよび臨床検査パラメーターを含んでいた。
【0187】
すべての有害事象は、健常志願者によって自発的に報告された、治験責任医師(または代表者)によって観察されたか、または臨床スタッフによる一般的質問によって引き出された。有害事象は、さらにまた投与後に正確に記入された書式「被験体への投薬アンケートの経験」の完了後にも報告された。本試験のためには、各個別被験体についての観察期間は、被験体がインフォームドコンセントを提出した時点から最終薬物投与後7日間以内までに及んだ。
【0188】
(安全性試験の結果)
全9例の被験体は、本試験中に、計127例の有害事象を経験した。重篤な有害事象は、本試験では記録されなかった。試験1(A)処方物の単位用量投与後には20例の有害事象(8種の相違するタイプ)が報告され、試験2(B)処方物の単位用量投与後には56例の有害事象(26種の相違するタイプ)が報告され、試験2(C)処方物の単位用量投与後には22例の有害事象(19種の相違するタイプ)が報告され、プラセボ試験1(D)処方物の単位用量投与後には10例の有害事象(8種の相違するタイプ)が報告され、プラセボ試験2(E)処方物の単位用量投与後には12例の有害事象(8種の相違するタイプ)が報告され、そしてプラセボ試験2(F)処方物の単位用量投与後には12例の有害事象(8種の相違するタイプ)が報告された。試験後検査室試験結果と関連する2例の有害事象は3種の処方物に帰属した。
【0189】
試験1(A)処方物の投与後には6例の被験体(100%)が有害事象を報告し、試験2(B)処方物の投与後には6例の被験体(100%)が有害事象を報告し、試験2(C)処方物の投与後には2例の被験体(100%)が有害事象を報告し、プラセボ試験1(D)処方物の投与後には3例の被験体(100%)が有害事象を報告し、プラセボ試験2(E)処方物の投与後には3例の被験体(100%)が有害事象を報告し、そしてプラセボ試験2(F)処方物の投与後には3例の被験体(100%)が有害事象を報告した。器官別大分類(System Organ Class)による有害事象は表19に列挙し
た。
【0190】
事象の腹部膨満、腹痛、上腹部痛、不安、抑うつ気分、下痢、注意障害、めまい(11例中10例のエピソード)、口渇、乾燥肌、味覚異常、頭痛、疲労(7例中6例のエピソード)、寒気、酩酊感、リラックスした気持ち、ホットフラッシュ、多汗症、口腔感覚鈍麻、感覚鈍麻、鼻閉、悪心、口腔不快感、蒼白、口腔感覚障害、掻痒、重苦しさの感覚、傾眠、言語障害、舌苔および嘔吐は薬物に関連する可能性があると評価された。その他の事象である咳、めまい(11例中1例のエピソード)、疲労(7例中1例のエピソード)、筋骨格痛、鼻漏および喉の炎症は、試験薬とは関連しないと評価された。その他の事象である鼻咽頭炎は、おそらく試験薬とは関連しないと評価された。
【0191】
【表19−1】

【0192】
【表19−2】

【0193】
【表19−3】

【0194】
【表19−4】

(結論)
本試験で投与された3種の用量(100μg、400μgおよび800μg)について、薬物動態パラメーターは明確に規定された。CmaxおよびAUC∞は比例していると思われ、AUCTは、400μg〜800μgの間での用量比例関係と一致している。さらに、本試験中に投与されたフェンタニルの2種の処方物(100μg、400μgおよび800μgの用量での1mg/mLおよび4mg/mLの舌下スプレー)は、大多数の被験体において良好に許容された。本臨床試験に参加していた被験体で、本試験の進行中に重篤な有害事象を報告した患者は1例もなかった。
【0195】
(実施例8〜12)
(インビトロ透過実験)
フェンタニル処方物の透過特性は、EpiOral組織(ORL−100)を用いて試験した。MatTek Corp社のEpiOralは、薬学的処方物の舌下薬物吸収をスクリーニングするためのモデルとして使用した。MatTek社製のEpiOral組織は、正常なヒト由来上皮細胞から構成された。細胞は、ヒト口腔(EpiOral)表現型の多層上の高度に分化したモデルを形成するために培養されている。EpiOral組織モデルは、一様で高度に再現性であるインビボ様形態学的特性および成長特性を示している。形態学的に、この組織モデルはヒト天然組織と非常に似ているので、したがって舌下粘膜を横切る薬学的処方物のインビトロ透過性を評価するための有用なインビトロ手段を提供する。
【0196】
Teflon製の裏張り膜を備える細胞培養挿入物上で増殖させたEpiOral組織は、火曜日の朝に配達するために月曜日にMatTek Corp社によって発送された。全組織は、透過性実験において発送後72時間以内に使用された。組織を含有する挿入物は、透過性実験の開始前に蒸留水を用いてリンスした。ORL−100のための組織面積は、0.6cm2であった。
【0197】
レシーバー区画(ウエル)は、pH6.6の0.3mLのリン酸クエン酸緩衝液(レシーバー溶液)を受容した。ドナー区画(組織挿入物)をウエル内に配置し、0.5mLの薬物溶液(ドナー溶液)を充填した。
【0198】
挿入物を、所定の間隔(2、5、7、9、11、13、15、30、45、60、90、および120分間)で、ウエルから新鮮レシーバー液を含有するウエルへ移動させた。透過試験後、ドナー液およびレシーバー液は、HPLCによる分析のためにバイアル中に収集した。各透過時間間隔にわたるレシーバー溶液およびドナー溶液の濃度および流束を決定した。
【0199】
(実施例8)
実施例8では、フェンタニル塩基の透過をクエン酸フェンタニルの透過と比較した。処方物および2時間で透過した%を、以下の表に列挙した。
【0200】
【表20】

(実施例9)
実施例9では、フェンタニル塩基処方物の透過にアルコールが及ぼす作用を試験した。処方物および2時間で透過した%は、以下の表に列挙した:
【0201】
【表21】

(実施例10)
実施例10では、フェンタニル処方物にPG(プロピレングリコール)が及ぼす作用を試験した。処方物および2時間で透過した%は、以下の表に列挙した:
【0202】
【表22】

(実施例11)
実施例11では、フェンタニル処方物にpHが及ぼす作用を試験した。処方物および2時間で透過した%を、以下の表に列挙した。表に示したように、口腔粘膜組織を横切るフェンタニルの透過は、処方物のpHに依存した。フェンタニルは試験したpH範囲内でpKa値(7.3および8.4)を有しているので、そのイオン化の程度は、処方物のpHが変化するにつれて変化した。以下の表に示した結果は、8と9との間のpHに調整した処方物がより良好な透過性および物理的安定性を示すことを示している。
【0203】
【表23】

(実施例12)
実施例12では、ヒドロキシプロピルβシクロデキストリン(HPBCD)、マンニトール、ポリビニルピロリドン(PVP)、プロピレンカーボネート(PC)、グリココール酸ナトリウム(SG)、ラウリル硫酸ナトリウム(SLS)、トリアセチン、クエン酸トリエチルおよびtween 80(TW80)を個別かまたは組み合わせてかのいずれかで本処方物に添加し、それらが透過性および溶液安定性に及ぼす作用について試験した。表24〜36に、処方物ならびに上記の賦形剤を含有する緩衝化された処方物および水処方物の透過試験結果を要約した。
【0204】
【表24】

表24に示した結果は、低透過性を示した0.3%のTween 80を含有する緩衝化された処方物を除いて、緩衝化された処方物の全部がコントロール処方物と類似の透過性特性を有していたことを示している。全ての水処方物は、緩衝化された処方物よりも低い透過性を示した。
【0205】
【表25】

【0206】
【表26】

【0207】
【表27】

【0208】
【表28】

【0209】
【表29】

【0210】
【表30】

【0211】
【表31】

【0212】
【表32】

【0213】
【表33】

【0214】
【表34】

【0215】
【表35】

【0216】
【表36】

結果は、処方物へのHPBCD(表25)、PVP(表27)、PC(表28)、クエン酸トリエチル(表31)およびTween 80(表32)を含む個々の賦形剤の添加が、賦形剤の濃度とは無関係にMatTek口腔粘膜を横切るフェンタニルの透過性を減少させたことを示している。表26および表30に示したように、0.3%のマンニトールを含有する処方物および0.5%のトリアセチンを含有する処方物は、コントロール処方物に類似する透過性特性を示したが、処方物中のこれらの個々の賦形剤の濃度が増加するにつれて透過性は減少した。安定性試験は、それらを安定性に維持するためには緩衝液処方物および水処方物の各々に最小で0.45%および0.5%のマンニトール濃度を添加すべきであることを示した。トリアセチンの場合、0.5%以上の濃度のトリアセチンを含有する処方物が安定性であることが見いだされた。
【0217】
SGを含有する処方物からのフェンタニルの透過はコントロール処方物の透過より高かった(表29)。また、本発明者らは、フェンタニルの透過が処方物中のSG濃度の増加に伴って増加することを観察した。
【0218】
賦形剤の組み合わせを含有する処方物からMatTek口腔粘膜組織を横切るフェンタニルの透過試験の結果は、表33〜36に示した。処方物へのLabrasolの添加は、安定性を向上させたが、MatTek口腔粘膜組織を横切るフェンタニルの透過を減少させた。LabrasolおよびSLSを含有する処方物を用いた場合も、類似の試験結果が観察された。賦形剤の組み合わせを含有する全処方物中で、2種の処方物である実施例12−uu(0.15%のマンニトール、0.4%のトリアセチン)および実施例12−bbb(0.2%のマンニトールおよび0.2%のTW80)は、コントロール処方物に比較して高い透過性を示した。本発明者らは、トリアセチン処方物中のマンニトールの存在が透過において全く改善を示さないことを観察した。そこで、さらなる試験のために、0.5%のトリアセチン(表30)を含有する処方物を選択した。実施例12−bbbの処方物は良好な透過性を示したが、処方物の安定性を向上させるためにマンニトール濃度を0.3%へ上昇させた。
【0219】
クエン酸フェンタニル処方物およびフェンタニル塩基処方物はどちらも、試験した全温度で安定であった。インビトロ組織透過試験からのデータは、表3に示したように、フェンタニル塩基処方物からのフェンタニルの透過は、クエン酸フェンタニル処方物からの透過の約10倍高いことを示した。水処方物および緩衝化された処方物は、口腔粘膜組織を横切るフェンタニル塩基の透過において有意差を全く示さなかった。本発明者らの試験は、ミグリオールを含有するフェンタニル塩基処方物が極めて低い透過性を有することもまた証明した。賦形剤の中では、0.2%のTW80と組み合わせた0.5%のトリアセチンおよび0.3%のマンニトールが、良好な透過性および安定性を示した。
【0220】
口腔粘膜組織を横切るフェンタニルの輸送は、処方物中のエチルアルコール(エタノール)濃度およびプロピレングリコール(PG)濃度に依存していた。エタノールは、水性ベースの処方物中にフェンタニル塩基を可溶化するために共溶媒として使用した。この試験では、本発明者らは、20%よりも少ないエタノールを含有する処方物(1mg/mLのフェンタニル塩基)が冷凍保存条件で沈殿することを観察した。また、本発明者らは、口腔粘膜組織を横切るフェンタニルの透過は、処方物中のエタノール濃度に間接的に比例することを観察した(表21)。類似の結果がPGを用いて観察された(表22)。PGは、水溶液中でフェンタニル塩基の溶解性を増加させること、およびまた、口腔粘膜組織を横切るフェンタニル塩基の透過を増強させることに役立った。5%よりも多いPGを含有する処方物は、フェンタニルの透過における有意な改善を示さなかったが、しかし溶液粘度はPGの濃度に比例して増加した。5%よりも多いPGを含有する処方物は、良好なスプレー特性を示さなかった。
【0221】
(実施例13)
実施例13では、表37中の以下の成分を有する処方物を試験した。本処方物はフェンタニルを含んでいなかった。
【0222】
【表37】

ニュージャージー州プリンストンに所在するPfeiffer of America社による0.10mLの複数回用量鼻腔スプレーポンプを用いて本処方物を噴霧し、Malvern Instruments社によるMalvern Mastersizer
Sデバイスを用いて液滴を測定した。舌下スプレーポンプを1回押すとプルームが生成されたので、これをスプレー粒子について分析した。投与用量、スプレーパターン、および液滴サイズ分布についてのサンプルサイズは、25例のスプレーであった。
【0223】
(液滴容量)
液滴容量の評価では、25例のスプレーサンプルを、各スプレーサンプルについて、相違する5種のストローク数を用いて評価し、以下の結果が測定された:
総平均値=100.4μL
最高単回実効値=103.2μL
最低単回実効値=95.3μL
標準偏差=1.1
範囲=7.9
変動係数=1.1%
(スプレーパターン)
スプレーパターンの評価では、標的から30mmでの手動作動を用いて25例のスプレーサンプルを評価した。本処方物はメチレンブルーを用いて染色し、以下のスプレーパターンの結果が測定された:
最小径[mm]
最小値:35.4
平均値:50.6
最大値:62
s: :7.00
最大径[mm]
最小値:40
平均値:56.9
最大値:67
s: :6.01
スプレー角度
最小値:64°
平均値:83.3°
最大値:94°
s: :7.03
比率(最大/最小径)
最小値:1.04
平均値:1.13
最大値:1.33
s: :0.073
(液滴サイズ分布)
液滴サイズ分布の評価では、標的から30mmでの手動作動を用いて25例のスプレーサンプルを評価した。以下の液滴サイズ分布の結果が測定された:
10μmの液滴径の占有率[%]
最小値:0.65
平均値:1.66
最大値:2.70
s: :0.527
液滴径の10%が指示値より小さい[μm]
最小値:15
平均値:18.2
最大値:23
s: :1.91
液滴径の50%が指示値より小さい[μm]
最小値:35
平均値:44.7
最大値:65
s: :7.52
液滴径の90%が指示値より小さい[μm]
最小値:96
平均値:154.4
最大値:349
s: :64.42
(実施例14)
実施例14では、表38中の以下の成分を有する処方物について試験した。本処方物はフェンタニルを含んでいなかった。
【0224】
【表38】

本処方物は、ニュージャージー州プリンストンに所在するPfeiffer of America社による0.10mLの複数回用量鼻腔スプレーポンプを用いて噴霧し、Malvern Instruments社によるMalvern Mastersizer Sデバイスを用いて液滴を測定した。舌下スプレーポンプを1回押すとプルームが生成されたので、これを次にスプレー粒子について分析した。投与用量、スプレーパターン、および液滴サイズ分布についてのサンプルサイズは、25例のスプレーであった。
【0225】
(液滴容量)
液滴容量の評価では、25例のスプレーサンプルを、5種の相違するストローク数を用いて評価し、以下の結果が測定された:
総平均値=101.5μL
最大単回実効値=103.7μL
最小単回実効値=96.1μL
標準偏差=1.3
範囲=7.6
変動係数=1.2%
スプレーパターン
スプレーパターンの評価では、標的から30mmでの手動作動を用いて25例のスプレーサンプルを評価した。本処方物はメチレンブルーを用いて染色し、以下のスプレーパターンの結果が測定された:
最小径[mm]
最小値:29
平均値:34.0
最大値:46
s: :3.47
最大径
最小値:35
平均値:40.8
最大値:55
s: :4.13
スプレー角度
最小値:58°
平均値:63.8°
最大値:80°
s: :4.65
比率(最大/最小径)
最小値:1.08
平均値:1.20
最大値:1.50
s: :0.092
(液滴サイズ分布)
液滴サイズ分布の評価では、標的から30mmでの手動作動を用いて25例のスプレーサンプルを評価した。以下の液滴サイズの結果が測定された:
10μmの液滴径の占有率[%]
最小値:0.24
平均値:0.68
最大値:1.28
s: :0.278
液滴径の10%が指示値より小さい[μm]
最小値:22
平均値:26.7
最大値:35
s: :2.95
液滴径の50%が指示値より小さい[μm]
最小値:61
平均値:83.3
最大値:114
s: :11.41
液滴径の90%が指示値より小さい[μm]
最小値:192
平均値:294.6
最大値:440
s: :53.32
(実施例15)
実施例15では、溶液中でフェンタニルの0.1μg/mL〜5μg/mLの作用濃度を含む1、2、4、6、および8mg/mLのフェンタニル舌下スプレーサンプルにおいてフェンタニルについてのアッセイ方法を実施した。本方法は、GMP要件を順守して開発され、適格性確認された。本方法は、フェンタニルの0.05μg/mL〜7.83μg/mLの濃度範囲にわたって線形であると決定された。フェンタニル作用標準溶液は、冷蔵および周囲条件で、容積測定ガラス製品およびHPLCアンバーバイアル中で7日間にわたって安定性であった。
【0226】
このプロセスに利用したデバイスおよび補給品は、ポンプ、可変波長検出器、およびオートサンプラーもしくは等価物を装備したHPLCシステム、Waters Symmetry HPLCカラム(C18、4.6×75mm、粒径3.5μm)、0.45μm、47mmナイロン製フィルター(Gelman Nylaflo(登録商標)P/N 66608もしくは等価物)、アセトニトリル(HPLCグレード)、一塩基性リン酸カリウム(ACSグレード)、リン酸(ACSグレード)、脱イオン水、アルコール(無水エタノール)、およびフェンタニル塩基参照標準を含んでいた。
【0227】
溶液調製物は、以下に記載するように調製したが、必要に応じてスケーリングできる。
【0228】
各1リットルのリン酸緩衝液(50mMのKH2PO4(pH2.8))のためには、6.8gの一塩基性リン酸カリウムおよび1リットルの水を適切な容器中で合わせ、十分に混合した。溶液のpHは、リン酸を滴下することにより2.8に調整した。この溶液を0.45μmのナイロン製フィルターに通して濾過した。この溶液の有効期限は1カ月間である。
【0229】
各1リットルの移動相(25% ACN、75%リン酸緩衝液)溶液のためには、750mLのリン酸緩衝液を適切な容器中で250mLのアセトニトリルと結合し、十分に混合した。この系を、必要に応じて使用前に適切な方法によって脱ガスした。この溶液の有効期限は、1カ月間である。
【0230】
各1リットルのストック希釈(95/5、エタノール/アセトニトリル)溶液のためには、950mLのエタノールおよび50mLのアセトニトリルを適切な容器中で合わせ、十分に混合した。この溶液の有効期限は、1カ月間である。
【0231】
ストック標準I(40μg/mL)(「SSI」)を、約10.0mgのフェンタニル参照標準を計量することによって調製し、250mLのメスフラスコに加えた。約200mLのストック希釈液を加え、固体材料を溶解させるために旋回させた。この混合物を、ストック希釈液を用いて所望の容量に希釈し、十分に混合した。
【0232】
ストック標準II(40μg/mL)(「SSII」)を、約10.0mgのフェンタニル参照標準を計量することによって調製し、250mLのメスフラスコに加えた。約200mLのストック希釈液を加え、固体材料を溶解させるために旋回させた。この混合物を、ストック希釈液を用いて所望の容量に希釈し、十分に混合した。
【0233】
作用標準I(2.4μg/mL)(「WSI」)を、3.0mLのストック標準Iを50mLのメスフラスコに移すことによって調製した。この混合物を、移動相溶液を用いて所望の容量に希釈し、十分に混合した。この溶液の有効期限は、7日間である。
【0234】
作用標準II(2.4μg/mL)(「WSII」)を、3.0mLのストック標準IIを50mLのメスフラスコに移すことによって調製した。この混合物を、移動相溶液を用いて所望の容量に希釈し、十分に混合した。この溶液の有効期限は、7日間である。
【0235】
HPLC方法のためのクロマトグラフィー条件を、以下に規定する:
カラム:HPLC Column Waters Symmetry C18、4.6×75mm、粒径3.5μm
UV検出:214nm
流量:2.0mL/分
注入量:50μL
温度:周囲温度(温度は25℃に制御され得る)
収集時間:13分間
(HPLC手順)
系の適合性が確立された後は、作業標準の間に最高12のサンプル溶液を注入できる。典型的な順序は、下記の通りである:
2×移動相(ブランク)
2×作業標準II
5×作業標準I
1×サンプル(12回までの注入)
1×作業標準I
1×サンプル(12回までの注入)
1×作業標準I
(系の適合性)
移動相ブランク注入においては、保持時間にフェンタニルの有意な干渉ピークが存在していてはならない。注入の精度に関して、作業標準Iの5回の反復注入についてのフェンタニルのRSDは、2.0%を超えてはならない。標準の一致に関して、最初の5回の作業標準の注入と2回の作業標準IIの注入についての平均ピーク応答間の一致は98〜102%でなければならない。作用標準IとIIとの間の一致は、標準の有効期限中に1回のみ証明する必要がある。最初の作業標準Iの注入におけるフェンタニルについての5%ピーク高さでのテーリング係数は、0.8〜1.5でなければならない。全ランにわたる標準精度に関しては、実行にわたる(OTR)作業標準Iの注入におけるフェンタニルについてのピーク面積のRSDが、2.0%を超えてはならない。
【0236】
計算を、以下に示す通りに実施する。
【0237】
作業標準濃度を、以下の通りに計算する:
【0238】
【数7】

反応係数(Rf)、以下の通りに計算する:
【0239】
【数8】

標準の一致、以下の通りに計算する:
【0240】
【数9】

(実施例16)
実施例16では、Malvern社製のSpraytecデバイスを用いてレーザー回折によるフェンタニル舌下スプレーの液滴サイズ分布を決定する方法を実施した。
【0241】
もたらされ、そして本報告内に記載した全データは、GMP(医薬品製造管理および品質管理基準(21 CFR第210部および第211部)を遵守して精査した。
【0242】
この計画の目的は、フェンタニル舌下スプレー処方物およびプラセボとともに使用するためのレーザー回折による液滴サイズ分布測定法を開発し、確認することであった。この計画の第1部では、Innova Systems社によるMightyRunt作動ステーションとともに使用される適正に自動化された作動パラメーターを決定するために、製品評価を実施した。自動作動ステーションを用いる、舌下用製品についての液滴サイズ分布測定法の開発は、ビネット試験、排気孔配置試験、およびデバイス配置試験を含んでいた。
【0243】
本方法の確認は、開発された方法を実施した2人の分析者間の中間精度を評価した。すべての方法開発および適格性確認の活動は、プラセボを用いて実施した。
【0244】
サンプルを、Pfeiffer社製の単位用量ガラスバイアル、Pfeiffer社製の単位用量VIストッパー、Pfeiffer社製のバイアルホルダー、およびPfeiffer社製の単位用量アプリケーターを用いて調製した。本試験で利用した装置は、Malvern Instruments社製の200mmレンズを備えたSpraytec、排気ファンアタッチメントを装備したInnova Systems製のMightyRunt作動ステーション、およびMettler Toledo社製の天秤AT201型を含む。
【0245】
(作動パラメーター試験)
プルーム持続時間および液滴サイズ分布を追跡するためにSpraytecを使用して、手動作動によって生成されたプルーム持続時間、液滴サイズ分布、および射出重量を複製するためにMightyRunt作動ステーション(MightyRunt社)についての作動パラメーターを最適化した。手動作動を用いた6つのデバイスからの結果であるDv10(液滴径の10%が指示値より小さい)、Dv50(液滴径の50%が指示値より小さい)、およびDv90(液滴径の90%が指示値より小さい)を自動作動による6つのデバイスからの結果と比較した。
【0246】
(合格基準)
自動作動についての個々の射出重量は、全部が手動作動の平均射出重量の75%〜125%の範囲内に入らなければならない。自動作動のDv10、Dv50およびDv90の平均値の結果は、手動作動のDv10、Dv50およびDv90の平均値の結果の75%〜125%に入らなければならない。
【0247】
統計分析は、2セットの液滴サイズ分布試験結果についてのスチューデントt検定の遂行を含まなければならない。スチューデントt検定の結果は、データの手動セット対自動セットが統計的に同等であることを示さなければならない。
【0248】
(方法の開発)
方法の開発は、Spraytecを利用するビネット試験および排気孔試験を含んでいた。作動は、MightyRuntおよび先に決定されたパラメーターを用いて実施した。ビネットは、レーザー回折分析中に、スプレープルームの小滴がレンジレンズによって捕捉されるには過度に急勾配な角度でレーザーを散乱させた場合に発生する。散乱光のすべてを捕捉するために、デバイスをレンジレンズ上には置かずにレンジレンズの十分近位に配置することが極めて重要である。ビネット試験では、分析用に適切なレンジレンズと適切なデバイスからレンジレンズまでの距離とを決定した。
【0249】
排気孔の配置は、プルームの動程に影響を及ぼす。プルーム速度は、排気孔の引込みによっては加速されてはならず、レーザー経路を通って移動する間に大きな液滴が落下してはならない。排気孔試験は、レーザー経路を通過した後の適正なプルーム捕捉を保証するために、スプレーのプルームの背後の適切な位置を決定した。本方法は、液滴サイズ分布をより完全に特性解析するために、分析用のノズルチップからレーザー経路までの2つの距離を含んでいた。
【0250】
(方法の確認)
確認は、方法の精度および堅牢性を決定する工程から構成された。この確認は、単一ロットのプラセボ由来の計24のデバイスを使用した。1人の分析者は、各距離で6回の作動を試験した。堅牢性を証明するために、第2の分析者が分析を反復した。Dv10、Dv50、およびDv90の結果を比較した。
【0251】
(合格基準)
分析者1についての個々の射出重量は、全部が分析者2についての平均射出重量の75%〜125%の範囲内に含まれなければならない。分析者1についてのDv10、Dv50およびDv90の平均値の結果は、分析者2についてのDv10、Dv50およびDv90の平均値の結果の75%〜125%の範囲内に含まれなければならない。
【0252】
最終的な実験手順を、以下に示す。
【0253】
分析前に、バックグラウンドおよび散乱プロフィールを分析のために適切に検証した。
【0254】
サンプルボトルをノズルホルダー内に挿入した。微調整のためには、コースターを使用してプラットフォームを持ち上げた。デバイスホルダーに取り付けたコースターは、調整に使用したコースターの上部に配置した。
【0255】
ボトルおよび排気ファンを備えたMightyRuntは、分析のために適切な位置に配置した。MightyRuntは、実験室用ジャッキを用いてレーザー経路の正面の中心に配置されたノズルと共に持ち上げた。調整後に、MightyRuntが確実に水平になるようにした。2つのボトル−レーザー間の距離を、ポンプチップからレーザー経路の中心までを測定して7cmおよび4cmであると評価した。全分析のために、ボトルを、レンジレンズ支持構造からポンプチップまでが14cmの場所に配置した。
【0256】
排気ファンのスイッチを入れ、レーザー経路の中心から排気シールドの先端までを測定して、デバイスの背部の中心に置いた、レーザー経路の3cm後方の実験室用ジャッキ上に配置した。排気ファンは、液滴が付着する衝突面、すなわち液滴の経路に配置されたチーズクロスを有していた。約4.5インチ四方に折りたたまれた、18×36インチの1/8シートのチーズクロス(4層のチーズクロス)は、十分な衝突面であり、ファンの流れを妨害しないであろう。
【0257】
本デバイスを、MightyRuntステーションを用いて作動させ、分析のために適切な距離で各個別の射出についての液滴サイズ分布を収集した。
【0258】
全プルーム持続時間およびプルームプラトーについての報告書を印刷した。
【0259】
(データの報告)
各作動についてのD10、D50、D90、およびSpan値についてのデータが報告されている。平均値および精度(%RSD)(相対標準偏差率)をD10、D50、およびD90について計算した。備考:Spanは、(D90−D10)/D50と規定されている。個々の液滴サイズ分布の結果(μm)およびスパン値(単位なし)は、X.XXであると報告された。全平均液滴サイズ分布の結果は、X.Xμmであると報告されなければならない。全RSD値は、X.X%であると報告されなければならない。
【0260】
統計分析は、2セットの液滴サイズ分布試験結果のスチューデントt検定の遂行を含んでいた。スチューデントt検定の結果は、データの分析者セットが統計的に同等であることを指示したはずである。
【0261】
(結果および考察)
全スプレープルームは、3つの段階を有する。第1段階である「発生」は、可変性の液滴およびレーザーの透過の減少を特徴とした。第2段階である「安定性」は、安定な液滴分布および液滴伝達を特徴とした。可変性の液滴および伝達の増加が最終段階である「消散」を特徴付けた。液滴サイズ分布の全比較には、プルームの「安定性」段階を使用した。
【0262】
(作動パラメーター試験)
MightyRuntについての作動パラメーターの最適化の間に、Spraytecを用いた手動作動および自動作動からのプルームを測定した。自動作動パラメーターを最適化するために、Dv10、Dv50、およびDv90の結果を比較した。本試験で調査したデバイスのタイプは、典型的な鼻腔スプレーとは顕著に相違していた。タブを破るか、またはデバイスを作動させるために必要とされたのは、作動を開始して薬物を送達するために一貫した力を必要とするバネではなく、ある量の力であった。この力は、タブが一旦破られた場合にデバイスから薬物を送達するために必要とされる力とは相違する量の力であった。このデバイスはバネを備えていないので、重要なパラメーターは、作動力、力上昇時間、および最小動程距離であった。最終確認されたMightyRuntパラメーターを以下の表39に列挙し、利用したSpraytecの設定を以下の表40に列挙する。
【0263】
【表39】

【0264】
【表40】

手動作動および自動作動の比較を、手動作動を行う6つのデバイスおよび自動作動を行う6つのデバイスを用いて実施した。液滴サイズ分布および射出重量の試験結果を、以下の表41に要約した。
【0265】
【表41】

(合格基準)
自動作動についての射出重量の試験結果は、手動作動についての平均射出重量の75%〜125%の合格基準を満たし、手動作動についての平均値の75%〜100%の範囲であった。自動作動についてのDv10平均値は、手動作動についてのDv10平均値の81%であった。自動作動についてのDv50平均値は、手動作動についてのDv50平均値の83%であった。自動作動についてのDv90平均値は、手動作動についてのDv90平均値の81%であった。これらのパラメーターの各々は、手動作動についての平均値の75%〜125%の合格基準を満たした。スチューデントt検定は、小さなデータセットのためには必ずしも適切ではなかったが、手動作動および自動作動についてのデータセットがDv10については同等であるが、Dv50またはDv90については同等ではないことを示した。MightyRuntを用いて手動作動からの液滴サイズ分布を正確に複製することは可能ではなかった。タブを確実に破ってデバイスを作動させるために必要な力は、手動作動より小さな液滴を含む分布をもたらした。より大きな液滴サイズを生成するはずであるより急速(aggressive)ではない作動パラメーターは、デバイスの一貫した作動のためには十分ではなかった。Spraytec法の開発を、プロトコールに規定した合格基準を満たさないにもかかわらずこれらのパラメーターを用いて進めた。
【0266】
(方法の開発)
方法の開発は、Spraytecを利用するビネット試験、デバイス配置試験および排気孔配置試験を含んでいた。作動を、MightyRuntおよび先に適格性確認されたパラメーターを用いて実施した。全試験について、デバイスはレーザービーム経路の正面に配置され、プルームはレーザー経路を通って移動し、プルームはレーザービームの背部に配置された排気孔マニフォールド内で収集された。
【0267】
ビネット実験は、装置の正面と整列させたデバイス(ビームから約10cm)を用いて、デバイスからレンジレンズまでの配置についての距離を変化させて実施した。結果を、図42に要約する。
【0268】
【表42】

配置に対するDv10、Dv50、Dv90、およびプルームの記録値のプロットは、図11に明記した。データは、全範囲の配置にわたって有意な傾向を示さなかった。試験中のレンジレンズ上へ液滴が沈着する可能性を最小限にするために、14cm(レーザーとレンジレンズ支持体との間のほぼ中心)の配置を選択し、その後の全試験のために使用した。
【0269】
試験中のプルームに対して排気孔配置が及ぼす作用を評価するために、4つの排気孔からレーザービームまでの距離でPSD(粒径)データを収集かつ評価した。結果を、以下の図43に要約する。
【0270】
【表43】

配置に対するDv10値、Dv50値、およびDv90値の要約のグラフ表示は、図12に含まれている。排気孔なしについてのDv10値、Dv50値、Dv90値もしくはプルーム持続時間、またはビームの1cm、3cm、5cm、もしくは7cm後ろにある排気孔を用いて収集されたプルームについてのDv10値、Dv50値、Dv90値もしくはプルーム持続時間に、有意な変化は見られなかった。レーザービーム背部への排気孔の配置に、7cmのデバイスからビームまでの距離で行われたスプレーのファンハウジングの外側への沈着の機会を減少させるために3cmを選択した。
【0271】
本方法は、液滴サイズ分布をより完全に特性解析するために、分析のためにデバイス先端からレーザー経路までの2つの距離を含まなければならなかった。4つの距離を評価し、結果は以下の表44に含めた。
【0272】
【表44】

配置に対するDv10値、Dv50値、およびDv90値の要約のグラフ表示は、図3に含まれている。様々な高さからのデータにおいて、観察可能な傾向は見られなかった。舌下スプレーについての指針文書はないが、FDA指針文書「Bioequivalence and Bioavailability Studies for Nasal
Aerosols and Nasal Sprays for Local Action」は、3〜7cmの2つの距離を規定している。より十分に発生したプルームを特性解析するために、ビームからのより長い距離の対(4cmおよび7cm)を選択した。
【0273】
(方法の確認)
1人の分析者は、4cmおよび7cmの両方の距離で6つのデバイスを試験した。第2の分析者は、第2日に各デバイスからプライミングした後に、次なる作動を用いて両方の距離での分析を反復した。確認の結果を、Dv10、Dv50、およびDv90の結果を比較している以下の表45および46に要約する。
【0274】
【表45】

【0275】
【表46】

(合格基準)
分析者1の射出重量の試験結果は、4cmの距離については分析者2の平均値の76%〜103%の範囲内、そして7cmの距離については99%〜106%の範囲内に含まれ、75%〜125%の合格基準を満たしていた。分析者1についてのDv10平均値は、4cmの距離については分析者2の129%であり、7cmの距離については128%であった。分析者1についてのDv50平均値は、4cmの距離については分析者2の109%であり、7cmの距離については112%であった。分析者1についてのDv90平均値は、4cmの距離については分析者2の95%であり、7cmの距離については103%であった。Dv10は、75%〜125%の合格基準を満たさなかったが、これは、プルームにおける最小液滴の測定値であり、より高度の変動性は、予想外ではない。Dv50およびDv90についての結果は、75〜125%の合格基準を満たした。小さなデータセットに対しては必ずしも適切ではないが、スチューデントt検定は、分析者1および分析者2についてのデータセットは両方の距離でDv90については同等であるが、Dv10またはDv50についてはいずれの距離でも同等ではないことを示した。
【0276】
(結論)
フェンタニル舌下スプレーを用いて使用するためのレーザー回折による液滴サイズ分布分析についての方法を開発し、引き続き適格性確認を実施した。スチューデントt検定を用いた統計分析に基づく合格基準は、小さなデータセットについては不適切であると考えられた。分析者1および2の一致についての方法確認合格基準は、プルームにおける最小液滴(Dv10)の測定と関連する高変動性については狭すぎると決定された。これらの基準は満たされなかったが、本方法は、使用するために許容できると見なされた。本方法は、本明細書に規定した作動パラメーター内で使用するために適合する。
【0277】
(実施例17)
実施例17では、溶液中で0.1μg/mL〜5μg/mLのフェンタニルの作用濃度を備える1、2、4、6、および8mg/mLのフェンタニル舌下スプレーサンプル中のフェンタニルの9μm未満の呼吸用量を決定するために実施した。使用した方法は、GMP要件を順守して適格性確認された。サンプル溶液は、冷蔵および周囲条件下で、容積測定用ガラス製品およびHPLCアンバーバイアル中で7日間にわたって安定性であると決定された。
【0278】
HPLCプロセスは、上記の実施例15に記載したプロセスと一致していた。本試験で利用した材料および補給品は、アセトニトリル(HPLCグレード)、一塩基性リン酸カリウム(ACSグレード)、リン酸(ACSグレード)、脱イオン水、アルコール(無水エタノール)、そして5リットルの膨張チャンバー、誘導ポート、ステージ0、1、2、およびアフターフィルターから構成されるShort Stack Andersen Cascade Impactorセットアップ、真空源、インライン流量計(Sierra Top−Trackまたは等価物)、VWR無菌サンプリングバッグ、ガラス繊維フィルター(8.1cm)、外部校正流量計(Dry−Cal流量計または等価物)、および空気圧式アクチュエーター(Innova Systems MightyRuntまたは等価物)を含んだ。
【0279】
(溶液の調製)
溶液調製物を、上記の実施例15に記載した方法によって調製したが、必要に応じてスケーリングできる。
【0280】
抽出溶液は、50:50(95/5、エタノール/アセトニトリル:水)であった。各1リットルの調製溶液のためには、475mLのエタノール、25mLのアセトニトリルおよび500mLの水を適切な容器内で合わせ、十分に混合した。この溶液の有効期限は、1カ月間である。
【0281】
リン酸緩衝液を、濃度が50mMのKH2PO4(pH2.8)中で調製した。各1リットルの調製溶液のためには、6.8gの一塩基性リン酸カリウムおよび1リットルの水を適切な容器内で合わせ、十分に混合した。溶液のpHを、リン酸を滴下することによってpH2.8に調整した。この溶液を0.45μmのナイロンに通して濾過した。この溶液の有効期限は1カ月間である。
【0282】
インパクターのセットアップは、以下の手順に従って調製された5リットルの膨張チャンバー、誘導ポート、ステージ0、1、2、およびフィルターからなる。
【0283】
フィルターステージを、インパクターの台座上に配置した。
【0284】
8.1cmのガラス繊維フィルターを、アフターフィルターステージ内に配置し、清潔なゴム製oリングによって固定した。
【0285】
固体プレートを、フィルターステージの上部に配置し、次にステージ2を、正位置に配置した。
【0286】
中心孔の切り抜きを備えるプレートを、ステージ2の上部に配置し、次にステージ1を、正位置に配置した。
【0287】
中心孔の切り抜きを備えるプレートを、ステージ1の上部に配置し、次にステージ0を、正位置に配置した。
【0288】
コーンを、正位置に配置し、インパクターを、押し下げクランプによって固定した。
【0289】
誘導ポートを、コーンに固定し、5Lの膨張チャンバーを、誘導ポートの上部に配置した。
【0290】
(試験の準備)
試験機器は、真空源と適切なチュービングを備えたカスケードインパクターとの間にインライン流量計を配置することによってセットアップした。インパクター上で漏れ試験(leak test)を実施した。真空源を開放することによってインパクターを通る流れを開始させ、その流れを、約28.3L/分に調整した。膨張チャンバー上のスプレー作動ポートの上方に、手をおいた。インライン流量計上に指示された流量は、ゼロに降下すると予測された。流れがさらに記録されると、インパクターaリングの状態をチェックし、試験を繰り返した。流量を設定するために、膨張チャンバーを誘導ポートから取り外し、外部校正流量計を誘導ポートに取り付け、流れを開始させた。流れを、外部校正流量計を用いて28.3±1L/分に調整し、試験手順中に使用するためにインライン流量計上に表示された測定値を、記録した。
【0291】
(試験手順)
各アッセイ結果を得るために、1mg/mLの製品強度に対して2つのデバイスを作動させた。2、4、6、および8mg/mLの製品強度に対しては1つのデバイスを作動させた。膨張チャンバーを正位置において、真空を開始させ、流れを、試験の準備中に入手した測定値に調整した。
【0292】
デバイスの作動前重量(g)は小数点第4位まで記録した。デバイスを、スプレーが作動ポートとは反対側の壁に直接向かって移動するように配置した。舌下スプレーデバイスを、表47に列挙した自動空気圧式アクチュエーター法パラメーターを用いて膨張チャンバー内へ作動させた。
【0293】
【表47】

デバイスの作動後重量(g)を、小数点第4位まで記録した。
【0294】
(抽出手順)
抽出は、インパクターのセットアップを解体し、以下の手順によって各構成成分を抽出することによって実施した:
プレートおよびフィルターを、各々、10.0mLの抽出溶液を含むバッグ内で個別に抽出した。サンプルを、少なくとも1分間にわたる手動での振盪および捏和によって抽出した。6.0mLの抽出サンプルを10mLのメスフラスコへ移し、リン酸緩衝液を用いて容量まで希釈し、十分に混合した。これはサンプル溶液である。この溶液の有効期限は7日間である。
【0295】
膨張チャンバーを、反転させ、ホルダー内に配置した。誘導ポートおよびコーンを、膨張チャンバーのすりガラス連結管内に挿入した。約40mLの抽出溶液を、コーンおよび誘導ポートに通して膨張チャンバー内にリンスした。全内面を抽出するために、溶液を膨張チャンバー内で旋回させた。その溶液を、200mLのメスフラスコ内へデカンテーションした。リンスを、約120mLの総リンス容量についてさらに2回反復した。フラスコにリン酸緩衝液を容量まで充填し、十分に混合した。これがサンプル溶液である。この溶液の有効期限は7日間である。
【0296】
(アッセイ)
サンプル溶液を、上記の実施例15に記載した手順に従ってアッセイする。計算を、以下の通りに実施する。
【0297】
【数10】

プレートサンプルおよびフィルターサンプル中のフェンタニルを、以下の計算にしたがって決定する:
【0298】
【数11】

Asamp=サンプル調製物中のフェンタニルの面積
Df=フェンタニルサンプル溶液調製物の希釈係数(10.0mL×10.0mL/6.0mL)
WSI Rf OTR=実行にわたる作業標準Iの応答係数
コーン、誘導ポートおよび膨張チャンバー内のフェンタニルを、以下の計算によって決定する:
【0299】
【数12】

Asamp=サンプル調製物中のフェンタニルの面積
Vsamp=サンプル溶液調製物中のフェンタニルの容量(200mL)
WSI Rf OTR=実行にわたる作業標準Iの応答係数
2、4、6、および8mg/mLについての呼吸用量を、以下の通りに計算する:
呼吸用量(μg)=9μm未満の粒径画分中の薬物質量の合計(μg)
1mg/mLについての呼吸用量を、以下の通りに計算する:
【0300】
【数13】

呼吸画分を、以下の通りに計算する:
【0301】
【数14】

報告のための粒径カットオフ径を、以下の表48に記載する。
【0302】
【表48】

フェンタニルサンプルのアッセイ結果(μg)、9μm未満の粒径画分中の呼吸用量(表48による)(μg)、および小数点第1位までの9μm未満の呼吸用量率(%)が報告された。
【0303】
呼吸用量(1mg/mL)を、決定するための分析証明書を、以下の表49に記載する。
【0304】
【表49】

本発明の多数の他の変形は、当業者には明白であり、そして本明細書に添付の特許請求項の範囲内に含まれることが意図され、それらは、特定の単位用量デバイスもしくは2回用量デバイスおよび生成されたフェンタニルの粒径範囲ならびに実施例に記載された他の数的パラメーター、およびそれらの任意の組み合わせを含むが、それらに限定されない。
【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2013−56928(P2013−56928A)
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−256454(P2012−256454)
【出願日】平成24年11月22日(2012.11.22)
【分割の表示】特願2008−552436(P2008−552436)の分割
【原出願日】平成19年1月25日(2007.1.25)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.TEFLON
【出願人】(508223583)インシス セラピューティクス インコーポレイテッド (2)
【Fターム(参考)】
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願番号】特願2012−256454(P2012−256454)
【出願日】平成24年11月22日(2012.11.22)
【分割の表示】特願2008−552436(P2008−552436)の分割
【原出願日】平成19年1月25日(2007.1.25)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.TEFLON
【出願人】(508223583)インシス セラピューティクス インコーポレイテッド (2)
【Fターム(参考)】
[ Back to top ]

