芳香族アルコールの酸化方法
【課題】金属系の酸化剤や触媒を使用することなく、アルデヒド又はケトンを効率よく製造できる芳香族アルコールの酸化方法を提供する。
【解決手段】本発明に係る芳香族アルコールの酸化方法は、比表面積が20m2/g以上の炭素材料、酸素含有ガス及び硝酸又はアルカリ金属水酸化物の存在下で、芳香族アルコールを酸化する方法である。
【解決手段】本発明に係る芳香族アルコールの酸化方法は、比表面積が20m2/g以上の炭素材料、酸素含有ガス及び硝酸又はアルカリ金属水酸化物の存在下で、芳香族アルコールを酸化する方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、芳香族アルコールの酸化方法に関し、特に、アルデヒド及びケトンの効率的な製造に関する。
【背景技術】
【0002】
アルコールからアルデヒド又はケトンを生成する酸化反応は、有機合成において重要な化学反応の一つである。従来、この酸化反応を実施する方法として、例えば、重金属酸化物を酸化剤又は触媒として使用する方法があった(例えば、特許文献1参照)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2003−261493号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、重金属酸化物の使用は、その毒性や反応後の処理において問題があった。一方、重金属酸化物を使用することなく、第一級アルコールの酸化によりアルデヒドを選択的に生成することは難しかった。
【0005】
本発明は、上記課題に鑑みて為されたものであり、重金属酸化物を使用することなく、アルデヒド又はケトンを効率よく製造できる芳香族アルコールの酸化方法を提供することをその目的の一つとする。
【課題を解決するための手段】
【0006】
上記課題を解決するための本発明の一実施形態に係る芳香族アルコールの酸化方法は、比表面積が20m2/g以上の炭素材料、酸素含有ガス及び硝酸又はアルカリ金属水酸化物の存在下で、芳香族アルコールを酸化することを特徴とする。
【0007】
また、前記芳香族アルコールは、下記の一般式(I)で表されることとしてもよい。
【化1】

(一般式(I)において、R1は、置換基を有してもよい芳香族炭化水素基を表し、R2は、水素原子、置換基を有してもよい脂肪族炭化水素基、置換基を有してもよい芳香族炭化水素基又は置換基を有してもよい脂環式炭化水素基を表す。)
【0008】
また、前記芳香族アルコールは、第一級芳香族アルコールであり、前記第一級芳香族アルコールを酸化することにより、アルデヒドを製造することとしてもよい。さらに、この場合、前記第一級芳香族アルコールの変換率が50%以上であり、且つ前記アルデヒドの選択率が40%以上であることとしてもよい。また、前記芳香族アルコールは、第二級芳香族アルコールであり、前記第二級芳香族アルコールを酸化することにより、ケトンを製造することとしてもよい。
【0009】
また、前記芳香族アルコールの酸化方法は、前記炭素材料、酸素含有ガス及び硝酸の存在下で、前記芳香族アルコールを酸化する方法であって、前記硝酸は、前記芳香族アルコールに対して1当量未満であることとしてもよい。
【0010】
また、前記炭素材料は、カーボンアロイ触媒、活性炭又はカーボンブラックであることとしてもよい。さらに、この場合、前記炭素材料は、前記カーボンアロイ触媒であり、前記カーボンアロイ触媒は、樹脂及び金属を含有する原料を加熱して炭素化することにより得られる炭素触媒であることとしてもよい。
【発明の効果】
【0011】
本発明によれば、重金属酸化物を使用することなく、アルデヒド又はケトンを効率よく製造できる芳香族アルコールの酸化方法を提供することができる。
【図面の簡単な説明】
【0012】
【図1】本発明の一実施形態に係る芳香族アルコールの酸化方法において、異なる複数の条件で第一級芳香族アルコールの酸化反応を実施した結果の一例を示す説明図である。
【図2】本発明の一実施形態に係る芳香族アルコールの酸化方法において、異なる置換基を有する複数の第一級芳香族アルコールの酸化反応を実施した結果の一例を示す説明図である。
【図3】本発明の一実施形態に係る芳香族アルコールの酸化方法において、硝酸に対して大過剰の第一級芳香族アルコールを使用した結果の一例を示す説明図である。
【図4】本発明の一実施形態に係る芳香族アルコールの酸化方法において、種々の炭素材料を使用して第一級芳香族アルコールの酸化反応を実施した結果の一例を示す説明図である。
【図5】本発明の一実施形態に係る芳香族アルコールの酸化方法において、第二級芳香族アルコールの酸化反応を実施した結果の一例を示す説明図である。
【図6】本発明の一実施形態に係る芳香族アルコールの酸化方法において、異なる置換基を有する複数の第一級芳香族アルコールの酸化反応を実施した結果の他の例を示す説明図である。
【発明を実施するための形態】
【0013】
以下に、本発明の一実施形態に係る芳香族アルコールの酸化方法(以下、「本方法」という。)について説明する。なお、本発明は本実施形態で示す例に限られない。
【0014】
本方法は、比表面積が20m2/g以上の炭素材料、酸素含有ガス及び硝酸又はアルカリ金属水酸化物の存在下で、芳香族アルコールを酸化する方法である。すなわち、本方法においては、芳香族アルコール、炭素材料、酸素含有ガス及び硝酸又はアルカリ金属水酸化物を互いに接触させた状態で、当該芳香族アルコールを酸化する。
【0015】
本方法において基質として使用する芳香族アルコールは、側鎖に水酸基(OH)が結合している芳香族化合物である。すなわち、この芳香族アルコールは、例えば、下記の一般式(I)で表されるアルコールである。
【化2】

【0016】
ここで、一般式(I)において、R1は、置換基を有してもよい芳香族炭化水素基を表し、R2は、水素原子、置換基を有してもよい脂肪族炭化水素基、置換基を有してもよい芳香族炭化水素基又は置換基を有してもよい脂環式炭化水素基を表す。
【0017】
具体的に、R1に係る芳香族炭化水素基は、例えば、フェニル基又はナフチル基である。また、この芳香族炭化水素基は、1つ又は複数の置換基を有することができる。この場合、置換基は、例えば、炭素数が1〜20のアルキル基(例えば、メチル基、エチル基、n−プロピル基、n−ブチル基、へキシル基、ドデシル基等の直鎖アルキル基や、イソプロピル基、t−ブチル基等の分岐アルキル基)、1つ又は複数の置換基を有してもよい芳香族炭化水素基、炭素数が1〜20のアルコキシ基(例えば、メトキシ基、エトキシ基、プロポキシ基)、ハロゲン原子(例えば、塩素原子(Cl)、フッ素原子(F)、臭素原子(Br)、ヨウ素原子(I))、ニトロ基、カルボキシル基、スルホン酸基、ジ置換アミノ基とすることができる。なお、ジ置換アミノ基は、一般式NR3R4で表わされ、R3、R4はそれぞれ独立に炭素数が1〜20のアルキル基を示す。置換基の位置は特に限られないが、例えば、R1がフェニル基の場合、当該フェニル基の4位に置換基を有することができる。
【0018】
R2に係る脂肪族炭化水素基は、飽和脂肪族炭化水素基であり、例えば、炭素数が1〜20のアルキル基(例えば、メチル基、エチル基、n−プロピル基、n−ブチル基、へキシル基、ドデシル基等の直鎖アルキル基や、イソプロピル基、t−ブチル基等の分岐アルキル基)とすることができる。また、R2に係る芳香族炭化水素基は、例えば、フェニル基又はナフチル基である。また、R2に係る脂環式炭化水素基は、例えば、シクロペンチル基、シクロへキシル基である。
【0019】
R2に係る脂肪族炭化水素基、芳香族炭化水素基又は脂環式炭化水素基は、それぞれ1つ又は複数の置換基を有することができる。この場合、置換基は、例えば、炭素数が1〜20のアルコキシ基(例えば、メトキシ基、エトキシ基、プロポキシ基)、ハロゲン原子(例えば、塩素原子(Cl)、フッ素原子(F)、臭素原子(Br)、ヨウ素原子(I))、ニトロ基、カルボキシル基、スルホン酸基、ジ置換アミノ基とすることができる。
【0020】
また、芳香族アルコールとしては、1価又は多価の第一級芳香族アルコールを使用することができる。すなわち、例えば、上記の一般式(I)で表される第一級芳香族アルコールを使用することができる。
【0021】
この場合、一般式(I)において、R1は、置換基を有してもよい芳香族炭化水素基を表し、R2は、水素原子を表す。そして、R1に係る芳香族炭化水素基は、例えば、置換基を有してもよいフェニル基又はナフチル基とすることができる。
【0022】
すなわち、この芳香族炭化水素基は、置換基を有しないフェニル基又はナフチル基とすることができ、また、置換基として炭素数が1〜20のアルキル基、1つ又は複数の置換基を有してもよい芳香族炭化水素基、炭素数が1〜20のアルコキシ基、ハロゲン原子、ニトロ基、カルボキシル基、スルホン酸基、ジ置換アミノ基を有するフェニル基又はナフチル基とすることができる。
【0023】
また、芳香族アルコールとしては、1価又は多価の第二級芳香族アルコールを使用することができる。すなわち、例えば、上記の一般式(I)で表される第二級芳香族アルコールを使用することができる。
【0024】
この場合、一般式(I)において、R1は、置換基を有してもよい芳香族炭化水素基を表し、R2は、置換基を有してもよい脂肪族炭化水素基、置換基を有してもよい芳香族炭化水素基又は置換基を有してもよい脂環式炭化水素基を表す。
【0025】
そして、R1に係る芳香族炭化水素基は、例えば、置換基を有してもよいフェニル基又はナフチル基とすることができる。すなわち、この芳香族炭化水素基は、例えば、置換基を有しないフェニル基又はナフチル基とすることができ、また、置換基として炭素数が1〜20のアルキル基、1つ又は複数の置換基を有してもよい芳香族炭化水素基、炭素数が1〜20のアルコキシ基、ハロゲン原子、ニトロ基、カルボキシル基、スルホン酸基、ジ置換アミノ基を有するフェニル基又はナフチル基とすることができる。
【0026】
一方、R2に係る脂肪族炭化水素基は、例えば、置換基を有してもよい炭素数が1〜20のアルキル基(例えば、メチル基、エチル基、n−プロピル基、n−ブチル基、へキシル基、ドデシル基等の直鎖アルキル基や、イソプロピル基、t−ブチル基等の分岐アルキル基)とすることができる。また、R2に係る芳香族炭化水素基は、例えば、置換基を有してもよいフェニル基又はナフチル基とすることができる。
【0027】
本方法において使用する炭素材料は、その炭素構造の少なくとも一部に、炭素の六角網面を含む炭素網面を1層又は2層以上有し、比表面積が20m2/g以上の炭素材料である。
【0028】
この炭素材料としては、例えば、カーボンアロイ触媒を使用することができる。カーボンアロイ触媒は、樹脂及び金属を含有する原料を加熱して炭素化することにより得られる炭素触媒である。
【0029】
樹脂は、炭素化できるものであれば特に限られないが、例えば、熱硬化性樹脂を好ましく使用することができる。具体的に、例えば、フェノール樹脂、メラミン樹脂、エポキシ樹脂、フラン樹脂、不飽和ポリエステル樹脂、芳香族ポリアミド、芳香族ポリイミド、ポリアニリン、ポリピロール、ポリフルフリルアルコ−ルからなる群より選択される1種又は2種以上を使用することができる。
【0030】
金属は、当該カーボンアロイ触媒の活性を阻害しないものであれば特に限られないが、例えば、遷移金属を好ましく使用することができ、周期表の3族から12族の第4周期に属する金属を好ましく用いることができる。具体的に、例えば、コバルト、鉄、ニッケル、マンガン、亜鉛、銅、チタン、クロムからなる群より選択される1種又は2種以上を好ましく用いることができ、コバルト、鉄を特に好ましく用いることができる。
【0031】
また、金属としては、当該金属の単体又は当該金属の化合物を用いることができる。金属化合物としては、例えば、金属塩、金属水酸化物、金属酸化物、金属窒化物、金属硫化物、金属炭素化物、金属錯体を好ましく用いることができ、金属塩化物、金属酸化物、金属錯体を特に好ましく用いることができる。金属錯体としては、例えば、フタロシアニンの金属錯体、ポルフィリンの金属錯体、アセチルアセトナトの金属錯体、メタロセンの金属錯体を好ましく使用することができる。
【0032】
また、カーボンアロイ触媒は、窒素を含有することもできる。この場合、カーボンアロイ触媒は、窒素を含有する原料を加熱して炭素化することにより得られる。具体的に、例えば、原料の一部として、窒素を含有する金属錯体や窒素を含有する樹脂を使用することができる。窒素含有金属錯体としては、例えば、フタロシアニンの金属錯体やポルフィリンの金属錯体を使用することができる。また、窒素含有樹脂としては、例えば、メラミン樹脂、ポリアクリロニトリル、ポリアミド、ポリイミド、ポリアクリルアミド、ポリピロ−ルを使用することができる。また、例えば、アンモニア等の窒素含有ガスで処理することにより窒素ドープしたカーボンアロイ触媒を使用することもできる。
【0033】
このような、カーボンアロイ触媒としては、例えば、特開2007−26746号公報に記載されているように、熱硬化性樹脂、遷移金属及び窒素を含有する原料を炭素化することにより得られる炭素触媒を使用することもできる。
【0034】
また、カーボンアロイ触媒としては、上述したような原料を炭素化して得られた炭素触媒であって、当該炭素化後にさらに金属を除去する処理が施されたものを使用することができる。この金属が除去されたカーボンアロイ触媒としては、例えば、炭素化により得られた金属を含有する炭素触媒を、塩酸等の酸により洗浄することにより得られる炭素触媒を使用することができる。
【0035】
また、カーボンアロイ触媒は、その炭素構造の一部として、炭素の六角網面を含む炭素網面を1層又は2層以上有している。この炭素構造は、炭素網面が屈曲し又は途切れることにより形成される当該炭素網面のエッジ部分を有することができる。そして、カーボンアロイ触媒は、このような炭素構造に窒素原子がドープされた炭素触媒とすることができる。
【0036】
また、炭素材料としては、カーボンブラックを使用することもできる。カーボンブラックとしては、例えば、アセチレンブラック、チャンネルブラック、ファーネスブラック、サーマルブラックを使用することができる。具体的には、例えば、ケッチェンブラック、バルカン(登録商標)(キャボット株式会社)、トーカブラック(東海カーボン株式会社)、デンカブラック(登録商標)(電気化学工業株式会社)を用いることができる。
【0037】
また、炭素材料としては、活性炭を使用することができる。活性炭としては、有機化合物の炭素化物に活性化処理又は賦活処理が施されたものであれば特に限られない。
【0038】
炭素材料の比表面積は、20m2/g以上であれば特に限られないが、例えば、好ましくは25m2/g以上であり、より好ましくは30m2/g以上である。より具体的に、炭素材料の比表面積は、20〜3000m2/gの範囲とすることができ、好ましくは20〜2500m2/gの範囲とすることができ、より好ましくは20〜2000m2/gの範囲とすることができる。
【0039】
上述したカーボンアロイ触媒の比表面積は、例えば、20〜3000m2/gの範囲とすることができ、好ましくは25〜2500m2/gの範囲とすることができる。また、カーボンブラックの比表面積は、20〜3000m2/gの範囲とすることができ、好ましくは25〜2500m2/gの範囲とすることができる。また、活性炭の比表面積は、20〜3000m2/gの範囲とすることができ、好ましくは25〜2500m2/gの範囲とすることができる。なお、比表面積は、例えばBET法により測定することができる。
【0040】
炭素材料としては、上述のとおり、カーボンアロイ触媒、カーボンブラック及び活性炭を使用することができるが、中でも芳香族アルコールからアルデヒド又はケトンを特に効率よく製造できるカーボンアロイ触媒を好ましく使用することができる。
【0041】
本方法においては、炭素材料に加えて、添加剤として、硝酸又はアルカリ金属水酸化物を使用する。添加剤として硝酸を使用する場合には、硝酸の水溶液を好ましく使用することができる。すなわち、例えば、硝酸を30〜80w/w%の範囲で含有する水溶液を使用することができる。
【0042】
硝酸の水溶液を使用する場合、本方法においては、上述したような芳香族アルコール及び炭素材料と、当該硝酸水溶液と、を含有する混合溶液を調製し、当該混合溶液中で当該芳香族アルコールの酸化反応を行う。この場合、混合溶液に含有される硝酸の濃度は、例えば、0.01〜10mmol/mLの範囲とすることができ、好ましくは0.1〜3mmol/mLの範囲とすることができる。
【0043】
また、本方法において硝酸を使用する場合、当該硝酸は、芳香族アルコールに対して1当量未満とすることができる。すなわち、例えば、硝酸に対して大過剰の芳香族アルコールを使用することができる。なお、芳香族アルコールに対して1当量以上の硝酸を使用することもできる。
【0044】
一方、添加剤としてアルカリ金属水酸化物を使用する場合、当該アルカリ金属水酸化物の粉末又は水溶液を使用することができる。このアルカリ金属水酸化物としては、例えば、水酸化カリウム(KOH)、水酸化ナトリウム(NaOH)を好ましく使用することができる。
【0045】
また、本方法においては、溶媒を使用することもできる。すなわち、この場合、芳香族アルコール、炭素材料、添加剤(硝酸又はアルカリ金属水酸化物)及び溶媒を含有する混合溶液を調製し、当該混合溶液中で当該芳香族アルコールの酸化反応を行う。
【0046】
使用する溶媒は特に限られず、例えば、芳香族アルコールや添加剤の特性に応じて任意の1種又は2種以上の溶媒を適宜選択して使用することができる。すなわち、例えば、添加剤として硝酸又はアルカリ金属水酸化物の水溶液を使用する場合には、水に対する溶解度が比較的高い有機溶媒(例えば、1,4−ジオキサン)を好ましく使用することができる。また、例えば、添加剤としてアルカリ金属水酸化物の粉末を使用する場合には、当該粉末を溶解して十分に分散可能な有機溶媒(例えば、キシレン)を好ましく使用することができる。なお、本方法においては、溶媒を使用しない無溶媒系にて酸化反応を行うこともできる。
【0047】
そして、本方法においては、芳香族アルコールを炭素材料及び添加剤(硝酸又はアルカリ金属水酸化物)と接触させながら、さらに当該芳香族アルコールを分子状酸素と接触させることにより、当該芳香族アルコールを酸化する。
【0048】
反応系に対する分子状酸素の供給は、酸素含有ガスを使用して行う。酸素含有ガスは、酸素ガス又は酸素と他のガスとの混合ガスである。混合ガスとしては、例えば、空気や、酸素と不活性ガス(窒素やヘリウム等)との混合ガスを使用することができる。
【0049】
芳香族アルコールと分子状酸素とを接触させる方法は特に限られず、例えば、芳香族アルコールを含有する混合溶液中に酸素含有ガスを吹き込む方法や、当該混合溶液が接する気相に酸素含有ガスを流通させる方法を使用することができる。
【0050】
また、本方法における酸化は、加熱下で好ましく実施することができる。すなわち、本方法は、炭素材料、酸素含有ガス及び添加剤(硝酸又はアルカリ金属水酸化物)の存在下で、芳香族アルコールを加熱しながら酸化する方法とすることができる。
【0051】
加熱温度は、例えば、芳香族アルコール又は当該芳香族アルコールを含有する混合溶液の沸点より低く、且つ酸化反応が速やかに進行する範囲で適宜設定することができる。具体的に、加熱温度は、例えば、30〜200℃の範囲とすることができ、好ましくは50〜150℃の範囲とすることができる。また、加熱時の圧力は特に限られず、常圧で実施することもできる。すなわち、圧力は、例えば、1〜10気圧の範囲とすることができる。
【0052】
本方法によれば、重金属酸化物を使用することなく、アルデヒド又はケトンを効率よく製造することができる。例えば、本方法において、基質として第一級芳香族アルコールを使用した場合には、対応するアルデヒドを選択的に且つ効率よく生成することができる。
【0053】
すなわち、第一級芳香族アルコールを効率よく酸化して、アルデヒドを速やかに生成させるとともに、当該アルデヒドの酸化によるカルボン酸の生成は効果的に抑制することができる。したがって、本方法によれば、第一級芳香族アルコールからアルデヒドへの選択的な酸化反応を簡便且つ確実に実現することができる。
【0054】
具体的に、本方法によれば、例えば、第一級芳香族アルコールの変換率が50%以上であり、且つアルデヒドの選択率が40%以上である選択的酸化反応を実現することができる。なお、この変換率は、反応系に供給された当初の第一級芳香族アルコールの量に対する、酸化反応により他の化合物に変換された当該第一級芳香族アルコールの量の割合(%)を示す。また、選択率は、他の化合物に変換された第一級芳香族アルコールの量に対する、酸化反応により生成されたアルデヒドの量の割合(%)を示す。
【0055】
このように、本方法においては、第一級芳香族アルコールを、炭素材料、添加剤及び分子状酸素と接触して加熱するだけで、当該第一級芳香族アルコールの酸化反応をアルデヒドの生成で効果的に止める選択的酸化反応を確実に実現できる。
【0056】
また、本方法において、基質として第二級芳香族アルコールを使用した場合には、対応するケトンを効率よく生成することができる。具体的に、本方法によれば、例えば、第二級芳香族アルコールの変換率が50%以上であり、且つケトンの収率が40%以上である酸化反応を実現することができる。なお、この収率は、反応系に供給された当初の第二級芳香族アルコールの全量がケトンに変換された場合に生成される当該ケトンの理論的な量に対する、実際に生成されたケトンの量の割合(%)を示す。
【0057】
このように、本方法においては、酸化剤や触媒として従来使用されていた重金属酸化物を使用することなく、芳香族アルコールの酸化によるアルデヒド又はケトンの製造を効果的に行うことができる。
【0058】
また、本方法における酸化反応は、炭素材料からなる固体触媒を使用した不均一系の酸化反応である。このため、本方法においては、例えば、反応系からの炭素材料の除去や、当該炭素材料の再利用等の操作を簡便に行うことができる。
【0059】
また、上述のとおり、本方法において、添加剤として硝酸を使用する場合には、当該硝酸の使用量を、芳香族アルコールに対する1当量未満とすることができる。すなわち、少量の硝酸を使用して、大量の芳香族アルコールを効率よく酸化することができる。
【0060】
また、酸性の条件下で酸化することが好ましくない芳香族アルコールを基質として使用する場合には、添加剤としてアルカリ金属水酸化物を使用することにより、当該芳香族アルコールを効率よく酸化することができる。
【実施例1】
【0061】
[カーボンアロイ触媒の調製]熱硬化性樹脂と、鉄又はコバルトのフタロシアニン錯体と、を含有する原料を炭素化することにより、カーボンアロイ触媒を調製した。すなわち、まずフェノ−ル樹脂(PSK−2320、群栄化学工業株式会社)3.275gをアセトン300mLに溶解させた。その後、この溶液にフタロシアニン鉄(東京化成工業株式会社)1.0gを加え超音波に30分かけ、紺色溶液を得た。次にこの紺色溶液をエバポレ−タ−にセットし、溶媒を除去した。その後、80℃で真空乾燥して、フタロシアニン鉄錯体が添加されたフェノ−ル樹脂組成物(以下、「鉄化合物添加フェノ−ル」という。)を得た。
【0062】
次に炭素化処理を行った。すなわち、まず上述の方法で得られた鉄化合物添加フェノ−ルを石英管に入れ、楕円面反射型赤外線ゴ−ルドイメ−ジ炉にて、20分間窒素ガスをパ−ジし、10℃/分の昇温速度で室温から800℃まで昇温した。その後、石英管を800℃で1時間保持した。このようにして、鉄化合物添加フェノ−ルの炭素化処理を行った。
【0063】
さらに粉砕処理を行った。すなわち、上述のように炭素化処理を行った鉄化合物添加フェノ−ルを、遊星ボ−ルミル(P−7、フリッチュジャパン株式会社)内に1.5mm径のジルコニアボ−ルと共にセットした。そして、回転速度800rpmで90分間粉砕した。その後、粉砕された鉄化合物添加フェノ−ルを遊星ボ−ルミルから取り出して、目開き106μmの篩にかけた。この篩を通過したものを、フタロシアニン鉄錯体由来のカ−ボンアロイ触媒(以下、「FePc」という。))として使用した。
【0064】
また、こうして得られたFePcの一部を取り出し、当該FePcに対して、鉄を除去するための酸洗い処理を施した。すなわちFePcに37%のHClを加えて2時間撹拌した後、静置して上澄み液をデカンテ−ションした。この操作を3回行った。そして、このFePcを吸引ろ過後、さらに蒸留水で洗浄し、次いで煮沸を行った。こうして、フタロシアニン鉄錯体由来であって金属除去処理が施されたカ−ボンアロイ触媒(以下、「wFePc」という。)を得た。
【0065】
また、上述のフタロシアニン鉄に替えてフタロシアニンコバルト(東京化成工業株式会社)を用いた以外は同じ方法にて、フタロシアニンコバルト錯体が添加されたフェノ−ル樹脂組成物を得た。
【0066】
さらに炭素化処理は、上述のように室温から800℃まで昇温し、800℃で1時間保持することに替えて、室温から900℃まで昇温し900℃で1時間保持すること以外は同じ方法にて行った。
【0067】
そして、上述と同じ粉砕処理を行い、フタロシアニンコバルト錯体由来のカ−ボンアロイ触媒(以下、「CoPc」という。)を得た。
【0068】
こうして得られたFePc、wFePc及びCoPcの比表面積をBET法により測定したところ、いずれの比表面積も約300m2/gであった。
【0069】
[芳香族アルコールの酸化]基質としてベンジルアルコールを使用し、互いに異なる複数の条件で、下記の反応式(II)に示すような酸化反応(アルデヒドの製造)を行った。
【化3】

【0070】
炭素材料としては、上述のようにして調製した3種類のカーボンアロイ触媒(FePc、wFePc、CoPc)のうちいずれかを使用した。添加剤としては硝酸を使用した。溶媒としては1,4−ジオキサンを使用した。
【0071】
第一の例(例1−1)では、ベンジルアルコール54mg(0.5mmol)と、カーボンアロイ触媒(FePc)10mgと、硝酸の67%水溶液0.067mL(硝酸約1.0mmol)と、1,4−ジオキサン2mLと、を三口フラスコに入れて混合した。そして、この三口フラスコ内の混合溶液中にキャピラリー状ガス導入口から酸素ガスを吹き込みながら、オイルバスによる加熱を開始し、当該混合溶液を90℃で5時間加熱撹拌した。このようにして、カーボンアロイ触媒、酸素ガス及び硝酸の存在下で、ベンジルアルコールの酸化を行った。
【0072】
その後、ナフタレン1molを1,4−ジオキサンに溶解して調製した溶液0.1mLを混合溶液に加えた。この混合溶液を、穴径が45nmのテフロン(登録商標)製ろ紙で濾過した。そして、ろ液をガスクロマトグラフ質量分析計(GCMS)により分析し、当該ろ液に含有されるベンジルアルコール、ベンズアルデヒド及び安息香酸の量をそれぞれ測定した。
【0073】
なお、GCMS分析においては、ナフタレンを内部標準として用いた。すなわち、ナフタレンに対する、ベンジルアルコール、ベンズアルデヒド及び安息香酸の標準曲線(検量線)を予め作成しておき、当該標準曲線を用いて、当該ベンジルアルコール、ベンズアルデヒド及び安息香酸を定量した。
【0074】
第二の例(例1−2)では、カーボンアロイ触媒としてwFePcを使用した以外は上記例1−1と同様の条件で酸化反応を行った。第三の例(例1−3)では、基質としてベンジルアルコールを1.0mmol使用し、カーボンアロイ触媒としてwFePcを使用した以外は上記例1−1と同様の条件で酸化反応を行った。
【0075】
第四の例(例1−4)では、カーボンアロイ触媒としてCoPcを使用した以外は上記例1−1と同様の条件で酸化反応を行った。第五の例(例1−5)では、ベンジルアルコールを19mmol使用し、カーボンアロイ触媒としてCoPcを使用し、添加剤として40%硝酸水溶液を0.25mL(硝酸約2.0mmol)使用し、溶媒を使用しない以外は上記例1−1と同様の条件で酸化反応を行った。第六の例(例1−6)では、ベンジルアルコールを19mmol使用し、カーボンアロイ触媒としてCoPcを使用し、添加剤として40%硝酸水溶液を0.30mL(硝酸約2.5mmol)使用し、溶媒を使用せず、加熱時間を7.5時間とした以外は上記例1−1と同様の条件で酸化反応を行った。
【0076】
第七の例(例1−7)では、カーボンアロイ触媒を使用しない以外は上記例1−1と同様の条件で酸化反応を行った。第八の例(例1−8)では、基質としてベンジルアルコールを1.0mmol使用し、カーボンアロイ触媒を使用しない以外は上記例1−1と同様の条件で酸化反応を行った。第九の例(例1−9)では、ベンジルアルコールを19mmol使用し、カーボンアロイ触媒を使用せず、添加剤として40%硝酸水溶液を0.25mL(硝酸約2.0mmol)使用し、溶媒を使用しない以外は上記例1−1と同様の条件で酸化反応を行った。第十の例(例1−10)では、カーボンアロイ触媒としてwFePcを使用し、添加剤を使用しない以外は上記例1−1と同様の条件で酸化反応を行った。
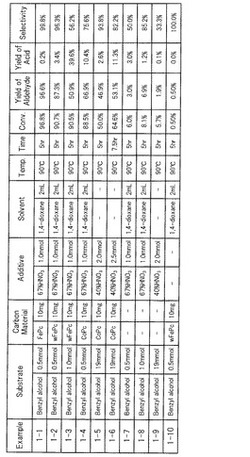
【0077】
図1には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。すなわち、図1には、反応条件として、使用された基質、炭素材料、添加剤及び溶媒の種類と、加熱条件(温度及び時間)と、が示されている。また、分析結果として、ベンジルアルコールの変換率(Conv.)、ベンズアルデヒド及び安息香酸の収率(Yield)、ベンズアルデヒドの選択率(Selectivity)が示されている。
【0078】
なお、変換率は、当初のベンジルアルコールの量に対する、酸化反応後に消失したベンジルアルコールの量(酸化により他の化合物に変換されたベンジルアルコールの量)の割合(%)を示す。また、ベンズアルデヒドの収率は、当初のベンジルアルコールの全量がベンズアルデヒドに変換された場合に生成される当該ベンズアルデヒドの理論的な量に対する、実際に生成されたベンズアルデヒドの量の割合(%)を示す。安息香酸の収率も同様に、当初の量のベンジルアルコールの全てが安息香酸に変換された場合に生成される当該安息香酸の理論的な量に対する、実際に生成された安息香酸の量の割合(%)を示す。また、ベンズアルデヒドの選択率は、酸化反応により消失したベンジルアルコールの量に対する、実際に生成されたベンズアルデヒドの量の割合(%)を示し、ベンジルアルコールの変換率及びベンズアルデヒドの収率から算出された。
【0079】
図1に示すように、炭素材料としてカーボンアロイ触媒を使用し、添加剤として硝酸を使用した例1−1〜例1−6では、ベンジルアルコールを酸素ガスの存在下で効率よく酸化して、高い選択率でアルデヒドを製造することができた。
【0080】
特に、例1−1及び例1−2では、ベンジルアルコールの変換率がそれぞれ96.8%及び90.7%、且つベンズアルデヒドの選択率がそれぞれ99.8%及び96.3%という極めて優れた結果が得られた。なお、溶媒を使用しない例1−5及び例1−6においても、変換率50%以上、且つ選択率80%以上という結果が得られた。
【0081】
これに対し、カーボンアロイ触媒を使用しない例1−7〜例1−9では、添加剤を使用してもベンジルアルコールの酸化反応はほとんど進行しなかった。また、添加剤を使用しない例1−10では、カーボンアロイ触媒を使用してもベンジルアルコールの酸化反応はほとんど進行しなかった。
【0082】
また、上述の反応系と同様の条件で、基質として脂肪族アルコールである1−ヘキサノールを使用した場合には、その変換率は10%未満であった。また、基質として脂環式アルコールであるシクロヘキサノールを使用した場合にも、その変換率は10%未満であり、条件を調整して変換率を高めても、アルデヒド又はカルボン酸以外の副生成物が生成されるのみであった。
【0083】
また、上述の反応系と同様の条件で、添加剤としてトリメチルアミンを使用した場合には、酸化反応はほとんど進行せず、硫酸又は過塩素酸を使用した場合には多量の副生成物が生成し、メタンスルホン酸を使用した場合には変換率が20%未満であり、トリフルオロメタンスルホン酸を使用した場合には多量のエーテルが生成した。これに対し、添加剤として硝酸を使用した場合には、上述のとおり、高い変換率及び選択率が得られた。
【実施例2】
【0084】
基質としてベンジルアルコール以外の5種類の第一級芳香族アルコールを使用し、上述の実施例1と同様の操作により酸化反応を行った。
【0085】
すなわち、第一の例(例2−1)では、基質として、ベンジルアルコールのフェニル基の4位にニトロ基が結合した4−ニトロベンジルアルコール0.5mmolを使用し、炭素材料としてカーボンアロイ触媒(wFePc)10mgを使用し、添加剤として硝酸1.0mmol(67%硝酸水溶液)を使用し、溶媒として1,4−ジオキサン2mLを使用し、これらの混合溶液を90℃で5時間、酸素ガスを吹き込みながら加熱撹拌して、当該4−ニトロベンジルアルコールを酸化した。
【0086】
第二の例(例2−2)では、基質として、ベンジルアルコールのフェニル基の4位にメチル基が結合した4−メチルベンジルアルコールを使用した以外は上記例2−1と同様の条件で酸化反応を行った。第三の例(例2−3)では、基質として、ベンジルアルコールのフェニル基の4位に塩素原子が結合した4−クロロベンジルアルコールを使用した以外は上記例2−1と同様の条件で酸化反応を行った。第四の例(例2−4)では、基質として4−クロロベンジルアルコールを使用し、加熱時間を7時間とした以外は上記例2−1と同様の条件で酸化反応を行った。
【0087】
第五の例(例2−5)では、基質として、ベンジルアルコールのフェニル基の4位にメトキシ基が結合した4−メトキシベンジルアルコールを使用し、加熱時間を1時間とした以外は上記例2−1と同様の条件で酸化反応を行った。第六の例(例2−6)では、基質として4−メトキシベンジルアルコールを使用し、加熱時間を2時間とした以外は上記例2−1と同様の条件で酸化反応を行った。第七の例(例2−7)では、基質として4−メトキシベンジルアルコールを使用し、加熱時間を3時間とした以外は上記例2−1と同様の条件で酸化反応を行った。第八の例(例2−8)では、基質として4−メトキシベンジルアルコールを使用し、加熱時間を5時間とした以外は上記例2−1と同様の条件で酸化反応を行った。
【0088】
第九の例(例2−9)では、基質として、ベンジルアルコールのフェニル基に代えてナフチル基を有する2−ナフタレンメタノールを使用した以外は上記例2−1と同様の条件で酸化反応を行った。
【0089】
図2には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。図2に示すように、炭素材料としてカーボンアロイ触媒を使用し、酸素ガス及び添加剤として硝酸を使用することにより、フェニル基に種々の置換基を有するベンジルアルコール及び2−ナフタレンメタノールを酸素ガスの存在下で効率よく酸化して、高い選択率でアルデヒドを製造することができた。
【0090】
また、ベンジルアルコールが置換基として電子吸引基(ニトロ基、塩素原子)を有する場合(例2−1、2−3、2−4)には、特に高い選択率が得られる傾向があった。一方、ベンジルアルコールが置換基として電子供与基(メチル基、メトキシ基)を有する場合(例2−2、2−5〜2−8)には、特に高い変換率が得られる傾向があった。
【実施例3】
【0091】
硝酸に対して大過剰の基質を使用し、上述の実施例1と同様の操作により酸化反応を行った。すなわち、第一の例(例3−1)では、基質として4−メトキシベンジルアルコール5.0mmolを使用し、炭素材料としてカーボンアロイ触媒(wFePc)10mgを使用し、添加剤として硝酸1.0mmol(67%硝酸水溶液)を使用し、溶媒として1,4−ジオキサン2mLを使用し、これらの混合溶液を90℃で1時間、酸素ガスを吹き込みながら加熱撹拌して、当該4−メトキシベンジルアルコールを酸化した。
【0092】
第二の例(例3−2)では、加熱時間を2時間とした以外は上記例3−1と同様の条件で酸化反応を行った。第三の例(例3−3)では、加熱時間を4時間とした以外は上記例3−1と同様の条件で酸化反応を行った。
【0093】
図3には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。図3に示すように、硝酸に対して大過剰の4−メトキシベンジルアルコールを使用した場合であっても、加熱時間を長くすることにより変換率は増加し、高い選択率でアルデヒドを製造することができた。すなわち、4−メトキシベンジルアルコールに対して、1当量未満の硝酸を使用した場合であっても、高い変換率及び選択率を達成できた。
【0094】
ここで、4−メトキシベンジルアルコールが硝酸により酸化されている(すなわち、硝酸が酸化剤である)とすると、理論上、1モルの硝酸は1モルの4−メトキシベンジルアルコールを酸化できるに過ぎない。このため、反応系には、4−メトキシベンジルアルコールに対して、1当量以上の硝酸を供給する必要があるはずである。
【0095】
しかしながら、図3に示すように、反応系に供給された硝酸が4−メトキシベンジルアルコールに対する1当量未満であっても、当該4−メトキシベンジルアルコールの酸化反応は十分に進行し、高い変換率が得られた。したがって、本方法に係る酸化反応は、硝酸を酸化剤として消費する反応ではないと考えられた。
【0096】
また、結果は図示しないが、次のような知見も得られた。すなわち、酸化反応の前後で硝酸の量が変化するかどうかを検討した。具体的に、まず、ベンジルアルコール0.5mmol、硝酸1.0mmol、カーボンアロイ触媒(wFePc)10mg、1,4−ジオキサン2mLを用い、酸素気流下に90℃で5時間酸化反応を行った。反応溶液の1mLを計りとり、これを精製水39mLで希釈した混合溶液のpHを測定したところ1.92であった。このpHの値が硝酸から由来したものであるとすると、酸化反応後の反応溶液に含まれる硝酸は0.96mmolと算出された。したがって、酸化反応によって硝酸はほとんど消費されていないと考えられた。
【実施例4】
【0097】
カーボンアロイ触媒以外の炭素材料を使用し、上述の実施例1と同様の操作により酸化反応を行った。すなわち、第一の例(例4−1)及び第二の例(例4−2)では、基質としてベンジルアルコール0.5mmolを使用し、炭素材料として、比表面積が1000m2/gの活性炭(活性炭素、和光純薬工業株式会社)10mgを使用し、添加剤として硝酸1.0mmol(67%硝酸水溶液)を使用し、溶媒として1,4−ジオキサン2mLを使用し、これらの混合溶液を90℃で5時間、酸素ガスを吹き込みながら加熱撹拌して、当該ベンジルアルコールを酸化した。
【0098】
第三の例(例4−3)及び第四の例(例4−4)では、炭素材料として、比表面積が254m2/gのカーボンブラック(Vulcan(登録商標) XC72、キャボット株式会社)を使用した以外は上記例4−1及び例4−2と同様の条件で酸化反応を行った。
【0099】
第五の例(例4−5)及び第六の例(例4−6)では、炭素材料として、気相法で合成された比表面積が13m2/gのカーボンナノファイバー(VGCF(登録商標)、昭和電工株式会社)を使用した以外は上記例4−1及び例4−2と同様の条件で酸化反応を行った。
【0100】
図4には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。図4に示すように、炭素材料として比表面積が1000m2/gの活性炭及び比表面積が254m2/gのカーボンブラックを使用した場合には、ベンジルアルコールを効率よく酸化して、高い選択率でアルデヒドを製造することができた。これに対し、炭素材料として比表面積が13m2/gのカーボンナノファイバーを使用した場合には、変換率が極めて低かった。
【実施例5】
【0101】
基質として第二級芳香族アルコールを使用し、上述の実施例1と同様の操作により、下記の反応式(III)及び反応式(IV)に示すような酸化反応(ケトンの製造)を行った。
【化4】

【化5】

【0102】
すなわち、第一の例(例5−1)では、基質としてジフェニルメタノール0.5mmolを使用し、炭素材料としてカーボンアロイ触媒(FePc)10mgを使用し、添加剤として硝酸1.0mmol(67%硝酸水溶液)を使用し、溶媒として1,4−ジオキサン2mLを使用し、これらの混合溶液を90℃で4時間、酸素ガスを吹き込みながら加熱撹拌し、当該ジフェニルメタノールを酸化した。
【0103】
第二の例(例5−2)では、添加剤として、粉末状の水酸化カリウム(KOH)0.5mmolを使用し、溶媒としてキシレン5mLを使用し、加熱条件を140℃で1時間とした以外は上記例5−1と同様の条件で酸化反応を行った。第三の例(例5−3)では、基質として1−フェニルエタノール0.5mmolを使用し、加熱条件を90℃で5時間とした以外は上記例5−1と同様の条件で酸化反応を行った。
【0104】
図5には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。図5に示す第二級芳香族アルコールの変換率(Conv.)は、当初の第二級芳香族アルコールの量に対する、酸化反応後に消失した第二級芳香族アルコールの量(酸化により他の化合物に変換された第二級芳香族アルコールの量)の割合(%)を示す。また、ケトンの収率(Yield)は、当初の第二級芳香族アルコールの全量がケトンに変換された場合に生成される当該ケトンの理論的な量に対する、実際に生成されたケトンの量の割合(%)を示す。
【0105】
図5に示すように、炭素材料としてカーボンアロイ触媒を使用し、酸素ガス及び添加剤として硝酸又は水酸化カリウムを使用することにより、第二級芳香族アルコールを酸素ガスの存在下で効率よく酸化して、高い収率でケトンを製造することができた。
【実施例6】
【0106】
基質として4種類の第一級芳香族アルコールを使用し、上述の実施例1と同様の操作により酸化反応を行った。
【0107】
すなわち、第一の例(例6−1)では、基質として、4−メチルベンジルアルコール0.5mmolを使用し、炭素材料としてカーボンアロイ触媒(wFePc)10mgを使用し、添加剤として硝酸1.0mmol(67%硝酸水溶液)を使用し、溶媒として1,4−ジオキサン2mLを使用し、これらの混合溶液を90℃、大気圧下で4時間、酸素ガスを10〜20mL/分の流量で吹き込みながら加熱撹拌して、当該4−メチルベンジルアルコールを酸化した。
【0108】
第二の例(例6−2)では、基質として、ベンジルアルコールのフェニル基の4位にフェニル基が結合した4−フェニルベンジルアルコールを使用し、加熱時間を2時間とした以外は上記例6−1と同様の条件で酸化反応を行った。
【0109】
第三の例(例6−3)では、基質として、4−クロロベンジルアルコール1.0mmolを使用し、加熱温度を100℃とした以外は上記例6−1と同様の条件で酸化反応を行った。第四の例(例6−4)では、基質として、4−ニトロベンジルアルコール1.0mmolを使用し、加熱温度を100℃とし、加熱時間を5時間とした以外は上記例6−1と同様の条件で酸化反応を行った。
【0110】
図6には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。すなわち、図6には、反応条件として、使用された基質及び生成されたアルデヒドの構造式と、加熱時間と、が示されている。また、分析結果として、基質の変換率及びアルデヒドの選択率が示されている。
【0111】
図6に示すように、炭素材料としてカーボンアロイ触媒を使用し、添加剤として硝酸を使用することにより、4種類の第一級芳香族アルコールの全てを酸素ガスの存在下で効率よく酸化して、高い選択率でアルデヒドを製造することができた。
【技術分野】
【0001】
本発明は、芳香族アルコールの酸化方法に関し、特に、アルデヒド及びケトンの効率的な製造に関する。
【背景技術】
【0002】
アルコールからアルデヒド又はケトンを生成する酸化反応は、有機合成において重要な化学反応の一つである。従来、この酸化反応を実施する方法として、例えば、重金属酸化物を酸化剤又は触媒として使用する方法があった(例えば、特許文献1参照)。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開2003−261493号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
しかしながら、重金属酸化物の使用は、その毒性や反応後の処理において問題があった。一方、重金属酸化物を使用することなく、第一級アルコールの酸化によりアルデヒドを選択的に生成することは難しかった。
【0005】
本発明は、上記課題に鑑みて為されたものであり、重金属酸化物を使用することなく、アルデヒド又はケトンを効率よく製造できる芳香族アルコールの酸化方法を提供することをその目的の一つとする。
【課題を解決するための手段】
【0006】
上記課題を解決するための本発明の一実施形態に係る芳香族アルコールの酸化方法は、比表面積が20m2/g以上の炭素材料、酸素含有ガス及び硝酸又はアルカリ金属水酸化物の存在下で、芳香族アルコールを酸化することを特徴とする。
【0007】
また、前記芳香族アルコールは、下記の一般式(I)で表されることとしてもよい。
【化1】

(一般式(I)において、R1は、置換基を有してもよい芳香族炭化水素基を表し、R2は、水素原子、置換基を有してもよい脂肪族炭化水素基、置換基を有してもよい芳香族炭化水素基又は置換基を有してもよい脂環式炭化水素基を表す。)
【0008】
また、前記芳香族アルコールは、第一級芳香族アルコールであり、前記第一級芳香族アルコールを酸化することにより、アルデヒドを製造することとしてもよい。さらに、この場合、前記第一級芳香族アルコールの変換率が50%以上であり、且つ前記アルデヒドの選択率が40%以上であることとしてもよい。また、前記芳香族アルコールは、第二級芳香族アルコールであり、前記第二級芳香族アルコールを酸化することにより、ケトンを製造することとしてもよい。
【0009】
また、前記芳香族アルコールの酸化方法は、前記炭素材料、酸素含有ガス及び硝酸の存在下で、前記芳香族アルコールを酸化する方法であって、前記硝酸は、前記芳香族アルコールに対して1当量未満であることとしてもよい。
【0010】
また、前記炭素材料は、カーボンアロイ触媒、活性炭又はカーボンブラックであることとしてもよい。さらに、この場合、前記炭素材料は、前記カーボンアロイ触媒であり、前記カーボンアロイ触媒は、樹脂及び金属を含有する原料を加熱して炭素化することにより得られる炭素触媒であることとしてもよい。
【発明の効果】
【0011】
本発明によれば、重金属酸化物を使用することなく、アルデヒド又はケトンを効率よく製造できる芳香族アルコールの酸化方法を提供することができる。
【図面の簡単な説明】
【0012】
【図1】本発明の一実施形態に係る芳香族アルコールの酸化方法において、異なる複数の条件で第一級芳香族アルコールの酸化反応を実施した結果の一例を示す説明図である。
【図2】本発明の一実施形態に係る芳香族アルコールの酸化方法において、異なる置換基を有する複数の第一級芳香族アルコールの酸化反応を実施した結果の一例を示す説明図である。
【図3】本発明の一実施形態に係る芳香族アルコールの酸化方法において、硝酸に対して大過剰の第一級芳香族アルコールを使用した結果の一例を示す説明図である。
【図4】本発明の一実施形態に係る芳香族アルコールの酸化方法において、種々の炭素材料を使用して第一級芳香族アルコールの酸化反応を実施した結果の一例を示す説明図である。
【図5】本発明の一実施形態に係る芳香族アルコールの酸化方法において、第二級芳香族アルコールの酸化反応を実施した結果の一例を示す説明図である。
【図6】本発明の一実施形態に係る芳香族アルコールの酸化方法において、異なる置換基を有する複数の第一級芳香族アルコールの酸化反応を実施した結果の他の例を示す説明図である。
【発明を実施するための形態】
【0013】
以下に、本発明の一実施形態に係る芳香族アルコールの酸化方法(以下、「本方法」という。)について説明する。なお、本発明は本実施形態で示す例に限られない。
【0014】
本方法は、比表面積が20m2/g以上の炭素材料、酸素含有ガス及び硝酸又はアルカリ金属水酸化物の存在下で、芳香族アルコールを酸化する方法である。すなわち、本方法においては、芳香族アルコール、炭素材料、酸素含有ガス及び硝酸又はアルカリ金属水酸化物を互いに接触させた状態で、当該芳香族アルコールを酸化する。
【0015】
本方法において基質として使用する芳香族アルコールは、側鎖に水酸基(OH)が結合している芳香族化合物である。すなわち、この芳香族アルコールは、例えば、下記の一般式(I)で表されるアルコールである。
【化2】

【0016】
ここで、一般式(I)において、R1は、置換基を有してもよい芳香族炭化水素基を表し、R2は、水素原子、置換基を有してもよい脂肪族炭化水素基、置換基を有してもよい芳香族炭化水素基又は置換基を有してもよい脂環式炭化水素基を表す。
【0017】
具体的に、R1に係る芳香族炭化水素基は、例えば、フェニル基又はナフチル基である。また、この芳香族炭化水素基は、1つ又は複数の置換基を有することができる。この場合、置換基は、例えば、炭素数が1〜20のアルキル基(例えば、メチル基、エチル基、n−プロピル基、n−ブチル基、へキシル基、ドデシル基等の直鎖アルキル基や、イソプロピル基、t−ブチル基等の分岐アルキル基)、1つ又は複数の置換基を有してもよい芳香族炭化水素基、炭素数が1〜20のアルコキシ基(例えば、メトキシ基、エトキシ基、プロポキシ基)、ハロゲン原子(例えば、塩素原子(Cl)、フッ素原子(F)、臭素原子(Br)、ヨウ素原子(I))、ニトロ基、カルボキシル基、スルホン酸基、ジ置換アミノ基とすることができる。なお、ジ置換アミノ基は、一般式NR3R4で表わされ、R3、R4はそれぞれ独立に炭素数が1〜20のアルキル基を示す。置換基の位置は特に限られないが、例えば、R1がフェニル基の場合、当該フェニル基の4位に置換基を有することができる。
【0018】
R2に係る脂肪族炭化水素基は、飽和脂肪族炭化水素基であり、例えば、炭素数が1〜20のアルキル基(例えば、メチル基、エチル基、n−プロピル基、n−ブチル基、へキシル基、ドデシル基等の直鎖アルキル基や、イソプロピル基、t−ブチル基等の分岐アルキル基)とすることができる。また、R2に係る芳香族炭化水素基は、例えば、フェニル基又はナフチル基である。また、R2に係る脂環式炭化水素基は、例えば、シクロペンチル基、シクロへキシル基である。
【0019】
R2に係る脂肪族炭化水素基、芳香族炭化水素基又は脂環式炭化水素基は、それぞれ1つ又は複数の置換基を有することができる。この場合、置換基は、例えば、炭素数が1〜20のアルコキシ基(例えば、メトキシ基、エトキシ基、プロポキシ基)、ハロゲン原子(例えば、塩素原子(Cl)、フッ素原子(F)、臭素原子(Br)、ヨウ素原子(I))、ニトロ基、カルボキシル基、スルホン酸基、ジ置換アミノ基とすることができる。
【0020】
また、芳香族アルコールとしては、1価又は多価の第一級芳香族アルコールを使用することができる。すなわち、例えば、上記の一般式(I)で表される第一級芳香族アルコールを使用することができる。
【0021】
この場合、一般式(I)において、R1は、置換基を有してもよい芳香族炭化水素基を表し、R2は、水素原子を表す。そして、R1に係る芳香族炭化水素基は、例えば、置換基を有してもよいフェニル基又はナフチル基とすることができる。
【0022】
すなわち、この芳香族炭化水素基は、置換基を有しないフェニル基又はナフチル基とすることができ、また、置換基として炭素数が1〜20のアルキル基、1つ又は複数の置換基を有してもよい芳香族炭化水素基、炭素数が1〜20のアルコキシ基、ハロゲン原子、ニトロ基、カルボキシル基、スルホン酸基、ジ置換アミノ基を有するフェニル基又はナフチル基とすることができる。
【0023】
また、芳香族アルコールとしては、1価又は多価の第二級芳香族アルコールを使用することができる。すなわち、例えば、上記の一般式(I)で表される第二級芳香族アルコールを使用することができる。
【0024】
この場合、一般式(I)において、R1は、置換基を有してもよい芳香族炭化水素基を表し、R2は、置換基を有してもよい脂肪族炭化水素基、置換基を有してもよい芳香族炭化水素基又は置換基を有してもよい脂環式炭化水素基を表す。
【0025】
そして、R1に係る芳香族炭化水素基は、例えば、置換基を有してもよいフェニル基又はナフチル基とすることができる。すなわち、この芳香族炭化水素基は、例えば、置換基を有しないフェニル基又はナフチル基とすることができ、また、置換基として炭素数が1〜20のアルキル基、1つ又は複数の置換基を有してもよい芳香族炭化水素基、炭素数が1〜20のアルコキシ基、ハロゲン原子、ニトロ基、カルボキシル基、スルホン酸基、ジ置換アミノ基を有するフェニル基又はナフチル基とすることができる。
【0026】
一方、R2に係る脂肪族炭化水素基は、例えば、置換基を有してもよい炭素数が1〜20のアルキル基(例えば、メチル基、エチル基、n−プロピル基、n−ブチル基、へキシル基、ドデシル基等の直鎖アルキル基や、イソプロピル基、t−ブチル基等の分岐アルキル基)とすることができる。また、R2に係る芳香族炭化水素基は、例えば、置換基を有してもよいフェニル基又はナフチル基とすることができる。
【0027】
本方法において使用する炭素材料は、その炭素構造の少なくとも一部に、炭素の六角網面を含む炭素網面を1層又は2層以上有し、比表面積が20m2/g以上の炭素材料である。
【0028】
この炭素材料としては、例えば、カーボンアロイ触媒を使用することができる。カーボンアロイ触媒は、樹脂及び金属を含有する原料を加熱して炭素化することにより得られる炭素触媒である。
【0029】
樹脂は、炭素化できるものであれば特に限られないが、例えば、熱硬化性樹脂を好ましく使用することができる。具体的に、例えば、フェノール樹脂、メラミン樹脂、エポキシ樹脂、フラン樹脂、不飽和ポリエステル樹脂、芳香族ポリアミド、芳香族ポリイミド、ポリアニリン、ポリピロール、ポリフルフリルアルコ−ルからなる群より選択される1種又は2種以上を使用することができる。
【0030】
金属は、当該カーボンアロイ触媒の活性を阻害しないものであれば特に限られないが、例えば、遷移金属を好ましく使用することができ、周期表の3族から12族の第4周期に属する金属を好ましく用いることができる。具体的に、例えば、コバルト、鉄、ニッケル、マンガン、亜鉛、銅、チタン、クロムからなる群より選択される1種又は2種以上を好ましく用いることができ、コバルト、鉄を特に好ましく用いることができる。
【0031】
また、金属としては、当該金属の単体又は当該金属の化合物を用いることができる。金属化合物としては、例えば、金属塩、金属水酸化物、金属酸化物、金属窒化物、金属硫化物、金属炭素化物、金属錯体を好ましく用いることができ、金属塩化物、金属酸化物、金属錯体を特に好ましく用いることができる。金属錯体としては、例えば、フタロシアニンの金属錯体、ポルフィリンの金属錯体、アセチルアセトナトの金属錯体、メタロセンの金属錯体を好ましく使用することができる。
【0032】
また、カーボンアロイ触媒は、窒素を含有することもできる。この場合、カーボンアロイ触媒は、窒素を含有する原料を加熱して炭素化することにより得られる。具体的に、例えば、原料の一部として、窒素を含有する金属錯体や窒素を含有する樹脂を使用することができる。窒素含有金属錯体としては、例えば、フタロシアニンの金属錯体やポルフィリンの金属錯体を使用することができる。また、窒素含有樹脂としては、例えば、メラミン樹脂、ポリアクリロニトリル、ポリアミド、ポリイミド、ポリアクリルアミド、ポリピロ−ルを使用することができる。また、例えば、アンモニア等の窒素含有ガスで処理することにより窒素ドープしたカーボンアロイ触媒を使用することもできる。
【0033】
このような、カーボンアロイ触媒としては、例えば、特開2007−26746号公報に記載されているように、熱硬化性樹脂、遷移金属及び窒素を含有する原料を炭素化することにより得られる炭素触媒を使用することもできる。
【0034】
また、カーボンアロイ触媒としては、上述したような原料を炭素化して得られた炭素触媒であって、当該炭素化後にさらに金属を除去する処理が施されたものを使用することができる。この金属が除去されたカーボンアロイ触媒としては、例えば、炭素化により得られた金属を含有する炭素触媒を、塩酸等の酸により洗浄することにより得られる炭素触媒を使用することができる。
【0035】
また、カーボンアロイ触媒は、その炭素構造の一部として、炭素の六角網面を含む炭素網面を1層又は2層以上有している。この炭素構造は、炭素網面が屈曲し又は途切れることにより形成される当該炭素網面のエッジ部分を有することができる。そして、カーボンアロイ触媒は、このような炭素構造に窒素原子がドープされた炭素触媒とすることができる。
【0036】
また、炭素材料としては、カーボンブラックを使用することもできる。カーボンブラックとしては、例えば、アセチレンブラック、チャンネルブラック、ファーネスブラック、サーマルブラックを使用することができる。具体的には、例えば、ケッチェンブラック、バルカン(登録商標)(キャボット株式会社)、トーカブラック(東海カーボン株式会社)、デンカブラック(登録商標)(電気化学工業株式会社)を用いることができる。
【0037】
また、炭素材料としては、活性炭を使用することができる。活性炭としては、有機化合物の炭素化物に活性化処理又は賦活処理が施されたものであれば特に限られない。
【0038】
炭素材料の比表面積は、20m2/g以上であれば特に限られないが、例えば、好ましくは25m2/g以上であり、より好ましくは30m2/g以上である。より具体的に、炭素材料の比表面積は、20〜3000m2/gの範囲とすることができ、好ましくは20〜2500m2/gの範囲とすることができ、より好ましくは20〜2000m2/gの範囲とすることができる。
【0039】
上述したカーボンアロイ触媒の比表面積は、例えば、20〜3000m2/gの範囲とすることができ、好ましくは25〜2500m2/gの範囲とすることができる。また、カーボンブラックの比表面積は、20〜3000m2/gの範囲とすることができ、好ましくは25〜2500m2/gの範囲とすることができる。また、活性炭の比表面積は、20〜3000m2/gの範囲とすることができ、好ましくは25〜2500m2/gの範囲とすることができる。なお、比表面積は、例えばBET法により測定することができる。
【0040】
炭素材料としては、上述のとおり、カーボンアロイ触媒、カーボンブラック及び活性炭を使用することができるが、中でも芳香族アルコールからアルデヒド又はケトンを特に効率よく製造できるカーボンアロイ触媒を好ましく使用することができる。
【0041】
本方法においては、炭素材料に加えて、添加剤として、硝酸又はアルカリ金属水酸化物を使用する。添加剤として硝酸を使用する場合には、硝酸の水溶液を好ましく使用することができる。すなわち、例えば、硝酸を30〜80w/w%の範囲で含有する水溶液を使用することができる。
【0042】
硝酸の水溶液を使用する場合、本方法においては、上述したような芳香族アルコール及び炭素材料と、当該硝酸水溶液と、を含有する混合溶液を調製し、当該混合溶液中で当該芳香族アルコールの酸化反応を行う。この場合、混合溶液に含有される硝酸の濃度は、例えば、0.01〜10mmol/mLの範囲とすることができ、好ましくは0.1〜3mmol/mLの範囲とすることができる。
【0043】
また、本方法において硝酸を使用する場合、当該硝酸は、芳香族アルコールに対して1当量未満とすることができる。すなわち、例えば、硝酸に対して大過剰の芳香族アルコールを使用することができる。なお、芳香族アルコールに対して1当量以上の硝酸を使用することもできる。
【0044】
一方、添加剤としてアルカリ金属水酸化物を使用する場合、当該アルカリ金属水酸化物の粉末又は水溶液を使用することができる。このアルカリ金属水酸化物としては、例えば、水酸化カリウム(KOH)、水酸化ナトリウム(NaOH)を好ましく使用することができる。
【0045】
また、本方法においては、溶媒を使用することもできる。すなわち、この場合、芳香族アルコール、炭素材料、添加剤(硝酸又はアルカリ金属水酸化物)及び溶媒を含有する混合溶液を調製し、当該混合溶液中で当該芳香族アルコールの酸化反応を行う。
【0046】
使用する溶媒は特に限られず、例えば、芳香族アルコールや添加剤の特性に応じて任意の1種又は2種以上の溶媒を適宜選択して使用することができる。すなわち、例えば、添加剤として硝酸又はアルカリ金属水酸化物の水溶液を使用する場合には、水に対する溶解度が比較的高い有機溶媒(例えば、1,4−ジオキサン)を好ましく使用することができる。また、例えば、添加剤としてアルカリ金属水酸化物の粉末を使用する場合には、当該粉末を溶解して十分に分散可能な有機溶媒(例えば、キシレン)を好ましく使用することができる。なお、本方法においては、溶媒を使用しない無溶媒系にて酸化反応を行うこともできる。
【0047】
そして、本方法においては、芳香族アルコールを炭素材料及び添加剤(硝酸又はアルカリ金属水酸化物)と接触させながら、さらに当該芳香族アルコールを分子状酸素と接触させることにより、当該芳香族アルコールを酸化する。
【0048】
反応系に対する分子状酸素の供給は、酸素含有ガスを使用して行う。酸素含有ガスは、酸素ガス又は酸素と他のガスとの混合ガスである。混合ガスとしては、例えば、空気や、酸素と不活性ガス(窒素やヘリウム等)との混合ガスを使用することができる。
【0049】
芳香族アルコールと分子状酸素とを接触させる方法は特に限られず、例えば、芳香族アルコールを含有する混合溶液中に酸素含有ガスを吹き込む方法や、当該混合溶液が接する気相に酸素含有ガスを流通させる方法を使用することができる。
【0050】
また、本方法における酸化は、加熱下で好ましく実施することができる。すなわち、本方法は、炭素材料、酸素含有ガス及び添加剤(硝酸又はアルカリ金属水酸化物)の存在下で、芳香族アルコールを加熱しながら酸化する方法とすることができる。
【0051】
加熱温度は、例えば、芳香族アルコール又は当該芳香族アルコールを含有する混合溶液の沸点より低く、且つ酸化反応が速やかに進行する範囲で適宜設定することができる。具体的に、加熱温度は、例えば、30〜200℃の範囲とすることができ、好ましくは50〜150℃の範囲とすることができる。また、加熱時の圧力は特に限られず、常圧で実施することもできる。すなわち、圧力は、例えば、1〜10気圧の範囲とすることができる。
【0052】
本方法によれば、重金属酸化物を使用することなく、アルデヒド又はケトンを効率よく製造することができる。例えば、本方法において、基質として第一級芳香族アルコールを使用した場合には、対応するアルデヒドを選択的に且つ効率よく生成することができる。
【0053】
すなわち、第一級芳香族アルコールを効率よく酸化して、アルデヒドを速やかに生成させるとともに、当該アルデヒドの酸化によるカルボン酸の生成は効果的に抑制することができる。したがって、本方法によれば、第一級芳香族アルコールからアルデヒドへの選択的な酸化反応を簡便且つ確実に実現することができる。
【0054】
具体的に、本方法によれば、例えば、第一級芳香族アルコールの変換率が50%以上であり、且つアルデヒドの選択率が40%以上である選択的酸化反応を実現することができる。なお、この変換率は、反応系に供給された当初の第一級芳香族アルコールの量に対する、酸化反応により他の化合物に変換された当該第一級芳香族アルコールの量の割合(%)を示す。また、選択率は、他の化合物に変換された第一級芳香族アルコールの量に対する、酸化反応により生成されたアルデヒドの量の割合(%)を示す。
【0055】
このように、本方法においては、第一級芳香族アルコールを、炭素材料、添加剤及び分子状酸素と接触して加熱するだけで、当該第一級芳香族アルコールの酸化反応をアルデヒドの生成で効果的に止める選択的酸化反応を確実に実現できる。
【0056】
また、本方法において、基質として第二級芳香族アルコールを使用した場合には、対応するケトンを効率よく生成することができる。具体的に、本方法によれば、例えば、第二級芳香族アルコールの変換率が50%以上であり、且つケトンの収率が40%以上である酸化反応を実現することができる。なお、この収率は、反応系に供給された当初の第二級芳香族アルコールの全量がケトンに変換された場合に生成される当該ケトンの理論的な量に対する、実際に生成されたケトンの量の割合(%)を示す。
【0057】
このように、本方法においては、酸化剤や触媒として従来使用されていた重金属酸化物を使用することなく、芳香族アルコールの酸化によるアルデヒド又はケトンの製造を効果的に行うことができる。
【0058】
また、本方法における酸化反応は、炭素材料からなる固体触媒を使用した不均一系の酸化反応である。このため、本方法においては、例えば、反応系からの炭素材料の除去や、当該炭素材料の再利用等の操作を簡便に行うことができる。
【0059】
また、上述のとおり、本方法において、添加剤として硝酸を使用する場合には、当該硝酸の使用量を、芳香族アルコールに対する1当量未満とすることができる。すなわち、少量の硝酸を使用して、大量の芳香族アルコールを効率よく酸化することができる。
【0060】
また、酸性の条件下で酸化することが好ましくない芳香族アルコールを基質として使用する場合には、添加剤としてアルカリ金属水酸化物を使用することにより、当該芳香族アルコールを効率よく酸化することができる。
【実施例1】
【0061】
[カーボンアロイ触媒の調製]熱硬化性樹脂と、鉄又はコバルトのフタロシアニン錯体と、を含有する原料を炭素化することにより、カーボンアロイ触媒を調製した。すなわち、まずフェノ−ル樹脂(PSK−2320、群栄化学工業株式会社)3.275gをアセトン300mLに溶解させた。その後、この溶液にフタロシアニン鉄(東京化成工業株式会社)1.0gを加え超音波に30分かけ、紺色溶液を得た。次にこの紺色溶液をエバポレ−タ−にセットし、溶媒を除去した。その後、80℃で真空乾燥して、フタロシアニン鉄錯体が添加されたフェノ−ル樹脂組成物(以下、「鉄化合物添加フェノ−ル」という。)を得た。
【0062】
次に炭素化処理を行った。すなわち、まず上述の方法で得られた鉄化合物添加フェノ−ルを石英管に入れ、楕円面反射型赤外線ゴ−ルドイメ−ジ炉にて、20分間窒素ガスをパ−ジし、10℃/分の昇温速度で室温から800℃まで昇温した。その後、石英管を800℃で1時間保持した。このようにして、鉄化合物添加フェノ−ルの炭素化処理を行った。
【0063】
さらに粉砕処理を行った。すなわち、上述のように炭素化処理を行った鉄化合物添加フェノ−ルを、遊星ボ−ルミル(P−7、フリッチュジャパン株式会社)内に1.5mm径のジルコニアボ−ルと共にセットした。そして、回転速度800rpmで90分間粉砕した。その後、粉砕された鉄化合物添加フェノ−ルを遊星ボ−ルミルから取り出して、目開き106μmの篩にかけた。この篩を通過したものを、フタロシアニン鉄錯体由来のカ−ボンアロイ触媒(以下、「FePc」という。))として使用した。
【0064】
また、こうして得られたFePcの一部を取り出し、当該FePcに対して、鉄を除去するための酸洗い処理を施した。すなわちFePcに37%のHClを加えて2時間撹拌した後、静置して上澄み液をデカンテ−ションした。この操作を3回行った。そして、このFePcを吸引ろ過後、さらに蒸留水で洗浄し、次いで煮沸を行った。こうして、フタロシアニン鉄錯体由来であって金属除去処理が施されたカ−ボンアロイ触媒(以下、「wFePc」という。)を得た。
【0065】
また、上述のフタロシアニン鉄に替えてフタロシアニンコバルト(東京化成工業株式会社)を用いた以外は同じ方法にて、フタロシアニンコバルト錯体が添加されたフェノ−ル樹脂組成物を得た。
【0066】
さらに炭素化処理は、上述のように室温から800℃まで昇温し、800℃で1時間保持することに替えて、室温から900℃まで昇温し900℃で1時間保持すること以外は同じ方法にて行った。
【0067】
そして、上述と同じ粉砕処理を行い、フタロシアニンコバルト錯体由来のカ−ボンアロイ触媒(以下、「CoPc」という。)を得た。
【0068】
こうして得られたFePc、wFePc及びCoPcの比表面積をBET法により測定したところ、いずれの比表面積も約300m2/gであった。
【0069】
[芳香族アルコールの酸化]基質としてベンジルアルコールを使用し、互いに異なる複数の条件で、下記の反応式(II)に示すような酸化反応(アルデヒドの製造)を行った。
【化3】

【0070】
炭素材料としては、上述のようにして調製した3種類のカーボンアロイ触媒(FePc、wFePc、CoPc)のうちいずれかを使用した。添加剤としては硝酸を使用した。溶媒としては1,4−ジオキサンを使用した。
【0071】
第一の例(例1−1)では、ベンジルアルコール54mg(0.5mmol)と、カーボンアロイ触媒(FePc)10mgと、硝酸の67%水溶液0.067mL(硝酸約1.0mmol)と、1,4−ジオキサン2mLと、を三口フラスコに入れて混合した。そして、この三口フラスコ内の混合溶液中にキャピラリー状ガス導入口から酸素ガスを吹き込みながら、オイルバスによる加熱を開始し、当該混合溶液を90℃で5時間加熱撹拌した。このようにして、カーボンアロイ触媒、酸素ガス及び硝酸の存在下で、ベンジルアルコールの酸化を行った。
【0072】
その後、ナフタレン1molを1,4−ジオキサンに溶解して調製した溶液0.1mLを混合溶液に加えた。この混合溶液を、穴径が45nmのテフロン(登録商標)製ろ紙で濾過した。そして、ろ液をガスクロマトグラフ質量分析計(GCMS)により分析し、当該ろ液に含有されるベンジルアルコール、ベンズアルデヒド及び安息香酸の量をそれぞれ測定した。
【0073】
なお、GCMS分析においては、ナフタレンを内部標準として用いた。すなわち、ナフタレンに対する、ベンジルアルコール、ベンズアルデヒド及び安息香酸の標準曲線(検量線)を予め作成しておき、当該標準曲線を用いて、当該ベンジルアルコール、ベンズアルデヒド及び安息香酸を定量した。
【0074】
第二の例(例1−2)では、カーボンアロイ触媒としてwFePcを使用した以外は上記例1−1と同様の条件で酸化反応を行った。第三の例(例1−3)では、基質としてベンジルアルコールを1.0mmol使用し、カーボンアロイ触媒としてwFePcを使用した以外は上記例1−1と同様の条件で酸化反応を行った。
【0075】
第四の例(例1−4)では、カーボンアロイ触媒としてCoPcを使用した以外は上記例1−1と同様の条件で酸化反応を行った。第五の例(例1−5)では、ベンジルアルコールを19mmol使用し、カーボンアロイ触媒としてCoPcを使用し、添加剤として40%硝酸水溶液を0.25mL(硝酸約2.0mmol)使用し、溶媒を使用しない以外は上記例1−1と同様の条件で酸化反応を行った。第六の例(例1−6)では、ベンジルアルコールを19mmol使用し、カーボンアロイ触媒としてCoPcを使用し、添加剤として40%硝酸水溶液を0.30mL(硝酸約2.5mmol)使用し、溶媒を使用せず、加熱時間を7.5時間とした以外は上記例1−1と同様の条件で酸化反応を行った。
【0076】
第七の例(例1−7)では、カーボンアロイ触媒を使用しない以外は上記例1−1と同様の条件で酸化反応を行った。第八の例(例1−8)では、基質としてベンジルアルコールを1.0mmol使用し、カーボンアロイ触媒を使用しない以外は上記例1−1と同様の条件で酸化反応を行った。第九の例(例1−9)では、ベンジルアルコールを19mmol使用し、カーボンアロイ触媒を使用せず、添加剤として40%硝酸水溶液を0.25mL(硝酸約2.0mmol)使用し、溶媒を使用しない以外は上記例1−1と同様の条件で酸化反応を行った。第十の例(例1−10)では、カーボンアロイ触媒としてwFePcを使用し、添加剤を使用しない以外は上記例1−1と同様の条件で酸化反応を行った。
【0077】
図1には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。すなわち、図1には、反応条件として、使用された基質、炭素材料、添加剤及び溶媒の種類と、加熱条件(温度及び時間)と、が示されている。また、分析結果として、ベンジルアルコールの変換率(Conv.)、ベンズアルデヒド及び安息香酸の収率(Yield)、ベンズアルデヒドの選択率(Selectivity)が示されている。
【0078】
なお、変換率は、当初のベンジルアルコールの量に対する、酸化反応後に消失したベンジルアルコールの量(酸化により他の化合物に変換されたベンジルアルコールの量)の割合(%)を示す。また、ベンズアルデヒドの収率は、当初のベンジルアルコールの全量がベンズアルデヒドに変換された場合に生成される当該ベンズアルデヒドの理論的な量に対する、実際に生成されたベンズアルデヒドの量の割合(%)を示す。安息香酸の収率も同様に、当初の量のベンジルアルコールの全てが安息香酸に変換された場合に生成される当該安息香酸の理論的な量に対する、実際に生成された安息香酸の量の割合(%)を示す。また、ベンズアルデヒドの選択率は、酸化反応により消失したベンジルアルコールの量に対する、実際に生成されたベンズアルデヒドの量の割合(%)を示し、ベンジルアルコールの変換率及びベンズアルデヒドの収率から算出された。
【0079】
図1に示すように、炭素材料としてカーボンアロイ触媒を使用し、添加剤として硝酸を使用した例1−1〜例1−6では、ベンジルアルコールを酸素ガスの存在下で効率よく酸化して、高い選択率でアルデヒドを製造することができた。
【0080】
特に、例1−1及び例1−2では、ベンジルアルコールの変換率がそれぞれ96.8%及び90.7%、且つベンズアルデヒドの選択率がそれぞれ99.8%及び96.3%という極めて優れた結果が得られた。なお、溶媒を使用しない例1−5及び例1−6においても、変換率50%以上、且つ選択率80%以上という結果が得られた。
【0081】
これに対し、カーボンアロイ触媒を使用しない例1−7〜例1−9では、添加剤を使用してもベンジルアルコールの酸化反応はほとんど進行しなかった。また、添加剤を使用しない例1−10では、カーボンアロイ触媒を使用してもベンジルアルコールの酸化反応はほとんど進行しなかった。
【0082】
また、上述の反応系と同様の条件で、基質として脂肪族アルコールである1−ヘキサノールを使用した場合には、その変換率は10%未満であった。また、基質として脂環式アルコールであるシクロヘキサノールを使用した場合にも、その変換率は10%未満であり、条件を調整して変換率を高めても、アルデヒド又はカルボン酸以外の副生成物が生成されるのみであった。
【0083】
また、上述の反応系と同様の条件で、添加剤としてトリメチルアミンを使用した場合には、酸化反応はほとんど進行せず、硫酸又は過塩素酸を使用した場合には多量の副生成物が生成し、メタンスルホン酸を使用した場合には変換率が20%未満であり、トリフルオロメタンスルホン酸を使用した場合には多量のエーテルが生成した。これに対し、添加剤として硝酸を使用した場合には、上述のとおり、高い変換率及び選択率が得られた。
【実施例2】
【0084】
基質としてベンジルアルコール以外の5種類の第一級芳香族アルコールを使用し、上述の実施例1と同様の操作により酸化反応を行った。
【0085】
すなわち、第一の例(例2−1)では、基質として、ベンジルアルコールのフェニル基の4位にニトロ基が結合した4−ニトロベンジルアルコール0.5mmolを使用し、炭素材料としてカーボンアロイ触媒(wFePc)10mgを使用し、添加剤として硝酸1.0mmol(67%硝酸水溶液)を使用し、溶媒として1,4−ジオキサン2mLを使用し、これらの混合溶液を90℃で5時間、酸素ガスを吹き込みながら加熱撹拌して、当該4−ニトロベンジルアルコールを酸化した。
【0086】
第二の例(例2−2)では、基質として、ベンジルアルコールのフェニル基の4位にメチル基が結合した4−メチルベンジルアルコールを使用した以外は上記例2−1と同様の条件で酸化反応を行った。第三の例(例2−3)では、基質として、ベンジルアルコールのフェニル基の4位に塩素原子が結合した4−クロロベンジルアルコールを使用した以外は上記例2−1と同様の条件で酸化反応を行った。第四の例(例2−4)では、基質として4−クロロベンジルアルコールを使用し、加熱時間を7時間とした以外は上記例2−1と同様の条件で酸化反応を行った。
【0087】
第五の例(例2−5)では、基質として、ベンジルアルコールのフェニル基の4位にメトキシ基が結合した4−メトキシベンジルアルコールを使用し、加熱時間を1時間とした以外は上記例2−1と同様の条件で酸化反応を行った。第六の例(例2−6)では、基質として4−メトキシベンジルアルコールを使用し、加熱時間を2時間とした以外は上記例2−1と同様の条件で酸化反応を行った。第七の例(例2−7)では、基質として4−メトキシベンジルアルコールを使用し、加熱時間を3時間とした以外は上記例2−1と同様の条件で酸化反応を行った。第八の例(例2−8)では、基質として4−メトキシベンジルアルコールを使用し、加熱時間を5時間とした以外は上記例2−1と同様の条件で酸化反応を行った。
【0088】
第九の例(例2−9)では、基質として、ベンジルアルコールのフェニル基に代えてナフチル基を有する2−ナフタレンメタノールを使用した以外は上記例2−1と同様の条件で酸化反応を行った。
【0089】
図2には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。図2に示すように、炭素材料としてカーボンアロイ触媒を使用し、酸素ガス及び添加剤として硝酸を使用することにより、フェニル基に種々の置換基を有するベンジルアルコール及び2−ナフタレンメタノールを酸素ガスの存在下で効率よく酸化して、高い選択率でアルデヒドを製造することができた。
【0090】
また、ベンジルアルコールが置換基として電子吸引基(ニトロ基、塩素原子)を有する場合(例2−1、2−3、2−4)には、特に高い選択率が得られる傾向があった。一方、ベンジルアルコールが置換基として電子供与基(メチル基、メトキシ基)を有する場合(例2−2、2−5〜2−8)には、特に高い変換率が得られる傾向があった。
【実施例3】
【0091】
硝酸に対して大過剰の基質を使用し、上述の実施例1と同様の操作により酸化反応を行った。すなわち、第一の例(例3−1)では、基質として4−メトキシベンジルアルコール5.0mmolを使用し、炭素材料としてカーボンアロイ触媒(wFePc)10mgを使用し、添加剤として硝酸1.0mmol(67%硝酸水溶液)を使用し、溶媒として1,4−ジオキサン2mLを使用し、これらの混合溶液を90℃で1時間、酸素ガスを吹き込みながら加熱撹拌して、当該4−メトキシベンジルアルコールを酸化した。
【0092】
第二の例(例3−2)では、加熱時間を2時間とした以外は上記例3−1と同様の条件で酸化反応を行った。第三の例(例3−3)では、加熱時間を4時間とした以外は上記例3−1と同様の条件で酸化反応を行った。
【0093】
図3には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。図3に示すように、硝酸に対して大過剰の4−メトキシベンジルアルコールを使用した場合であっても、加熱時間を長くすることにより変換率は増加し、高い選択率でアルデヒドを製造することができた。すなわち、4−メトキシベンジルアルコールに対して、1当量未満の硝酸を使用した場合であっても、高い変換率及び選択率を達成できた。
【0094】
ここで、4−メトキシベンジルアルコールが硝酸により酸化されている(すなわち、硝酸が酸化剤である)とすると、理論上、1モルの硝酸は1モルの4−メトキシベンジルアルコールを酸化できるに過ぎない。このため、反応系には、4−メトキシベンジルアルコールに対して、1当量以上の硝酸を供給する必要があるはずである。
【0095】
しかしながら、図3に示すように、反応系に供給された硝酸が4−メトキシベンジルアルコールに対する1当量未満であっても、当該4−メトキシベンジルアルコールの酸化反応は十分に進行し、高い変換率が得られた。したがって、本方法に係る酸化反応は、硝酸を酸化剤として消費する反応ではないと考えられた。
【0096】
また、結果は図示しないが、次のような知見も得られた。すなわち、酸化反応の前後で硝酸の量が変化するかどうかを検討した。具体的に、まず、ベンジルアルコール0.5mmol、硝酸1.0mmol、カーボンアロイ触媒(wFePc)10mg、1,4−ジオキサン2mLを用い、酸素気流下に90℃で5時間酸化反応を行った。反応溶液の1mLを計りとり、これを精製水39mLで希釈した混合溶液のpHを測定したところ1.92であった。このpHの値が硝酸から由来したものであるとすると、酸化反応後の反応溶液に含まれる硝酸は0.96mmolと算出された。したがって、酸化反応によって硝酸はほとんど消費されていないと考えられた。
【実施例4】
【0097】
カーボンアロイ触媒以外の炭素材料を使用し、上述の実施例1と同様の操作により酸化反応を行った。すなわち、第一の例(例4−1)及び第二の例(例4−2)では、基質としてベンジルアルコール0.5mmolを使用し、炭素材料として、比表面積が1000m2/gの活性炭(活性炭素、和光純薬工業株式会社)10mgを使用し、添加剤として硝酸1.0mmol(67%硝酸水溶液)を使用し、溶媒として1,4−ジオキサン2mLを使用し、これらの混合溶液を90℃で5時間、酸素ガスを吹き込みながら加熱撹拌して、当該ベンジルアルコールを酸化した。
【0098】
第三の例(例4−3)及び第四の例(例4−4)では、炭素材料として、比表面積が254m2/gのカーボンブラック(Vulcan(登録商標) XC72、キャボット株式会社)を使用した以外は上記例4−1及び例4−2と同様の条件で酸化反応を行った。
【0099】
第五の例(例4−5)及び第六の例(例4−6)では、炭素材料として、気相法で合成された比表面積が13m2/gのカーボンナノファイバー(VGCF(登録商標)、昭和電工株式会社)を使用した以外は上記例4−1及び例4−2と同様の条件で酸化反応を行った。
【0100】
図4には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。図4に示すように、炭素材料として比表面積が1000m2/gの活性炭及び比表面積が254m2/gのカーボンブラックを使用した場合には、ベンジルアルコールを効率よく酸化して、高い選択率でアルデヒドを製造することができた。これに対し、炭素材料として比表面積が13m2/gのカーボンナノファイバーを使用した場合には、変換率が極めて低かった。
【実施例5】
【0101】
基質として第二級芳香族アルコールを使用し、上述の実施例1と同様の操作により、下記の反応式(III)及び反応式(IV)に示すような酸化反応(ケトンの製造)を行った。
【化4】

【化5】

【0102】
すなわち、第一の例(例5−1)では、基質としてジフェニルメタノール0.5mmolを使用し、炭素材料としてカーボンアロイ触媒(FePc)10mgを使用し、添加剤として硝酸1.0mmol(67%硝酸水溶液)を使用し、溶媒として1,4−ジオキサン2mLを使用し、これらの混合溶液を90℃で4時間、酸素ガスを吹き込みながら加熱撹拌し、当該ジフェニルメタノールを酸化した。
【0103】
第二の例(例5−2)では、添加剤として、粉末状の水酸化カリウム(KOH)0.5mmolを使用し、溶媒としてキシレン5mLを使用し、加熱条件を140℃で1時間とした以外は上記例5−1と同様の条件で酸化反応を行った。第三の例(例5−3)では、基質として1−フェニルエタノール0.5mmolを使用し、加熱条件を90℃で5時間とした以外は上記例5−1と同様の条件で酸化反応を行った。
【0104】
図5には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。図5に示す第二級芳香族アルコールの変換率(Conv.)は、当初の第二級芳香族アルコールの量に対する、酸化反応後に消失した第二級芳香族アルコールの量(酸化により他の化合物に変換された第二級芳香族アルコールの量)の割合(%)を示す。また、ケトンの収率(Yield)は、当初の第二級芳香族アルコールの全量がケトンに変換された場合に生成される当該ケトンの理論的な量に対する、実際に生成されたケトンの量の割合(%)を示す。
【0105】
図5に示すように、炭素材料としてカーボンアロイ触媒を使用し、酸素ガス及び添加剤として硝酸又は水酸化カリウムを使用することにより、第二級芳香族アルコールを酸素ガスの存在下で効率よく酸化して、高い収率でケトンを製造することができた。
【実施例6】
【0106】
基質として4種類の第一級芳香族アルコールを使用し、上述の実施例1と同様の操作により酸化反応を行った。
【0107】
すなわち、第一の例(例6−1)では、基質として、4−メチルベンジルアルコール0.5mmolを使用し、炭素材料としてカーボンアロイ触媒(wFePc)10mgを使用し、添加剤として硝酸1.0mmol(67%硝酸水溶液)を使用し、溶媒として1,4−ジオキサン2mLを使用し、これらの混合溶液を90℃、大気圧下で4時間、酸素ガスを10〜20mL/分の流量で吹き込みながら加熱撹拌して、当該4−メチルベンジルアルコールを酸化した。
【0108】
第二の例(例6−2)では、基質として、ベンジルアルコールのフェニル基の4位にフェニル基が結合した4−フェニルベンジルアルコールを使用し、加熱時間を2時間とした以外は上記例6−1と同様の条件で酸化反応を行った。
【0109】
第三の例(例6−3)では、基質として、4−クロロベンジルアルコール1.0mmolを使用し、加熱温度を100℃とした以外は上記例6−1と同様の条件で酸化反応を行った。第四の例(例6−4)では、基質として、4−ニトロベンジルアルコール1.0mmolを使用し、加熱温度を100℃とし、加熱時間を5時間とした以外は上記例6−1と同様の条件で酸化反応を行った。
【0110】
図6には、各例における酸化反応の条件及びGCMSによる分析の結果を示す。すなわち、図6には、反応条件として、使用された基質及び生成されたアルデヒドの構造式と、加熱時間と、が示されている。また、分析結果として、基質の変換率及びアルデヒドの選択率が示されている。
【0111】
図6に示すように、炭素材料としてカーボンアロイ触媒を使用し、添加剤として硝酸を使用することにより、4種類の第一級芳香族アルコールの全てを酸素ガスの存在下で効率よく酸化して、高い選択率でアルデヒドを製造することができた。
【特許請求の範囲】
【請求項1】
比表面積が20m2/g以上の炭素材料、酸素含有ガス及び硝酸又はアルカリ金属水酸化物の存在下で、芳香族アルコールを酸化する
ことを特徴とする芳香族アルコールの酸化方法。
【請求項2】
前記芳香族アルコールは、下記の一般式(I)で表される
【化1】

(一般式(I)において、R1は、置換基を有してもよい芳香族炭化水素基を表し、R2は、水素原子、置換基を有してもよい脂肪族炭化水素基、置換基を有してもよい芳香族炭化水素基又は置換基を有してもよい脂環式炭化水素基を表す。)
ことを特徴とする請求項1記載の芳香族アルコールの酸化方法。
【請求項3】
前記芳香族アルコールは、第一級芳香族アルコールであり、
前記第一級芳香族アルコールを酸化することにより、アルデヒドを製造する
ことを特徴とする請求項1又は2記載の芳香族アルコールの酸化方法。
【請求項4】
前記第一級芳香族アルコールの変換率が50%以上であり、且つ前記アルデヒドの選択率が40%以上である
ことを特徴とする請求項3記載の芳香族アルコールの酸化方法。
【請求項5】
前記芳香族アルコールは、第二級芳香族アルコールであり、
前記第二級芳香族アルコールを酸化することにより、ケトンを製造する
ことを特徴とする請求項1又は2記載の芳香族アルコールの酸化方法。
【請求項6】
前記炭素材料、酸素含有ガス及び硝酸の存在下で、前記芳香族アルコールを酸化する方法であって、
前記硝酸は、前記芳香族アルコールに対して1当量未満である
ことを特徴とする請求項1乃至5のいずれかに記載の芳香族アルコールの酸化方法。
【請求項7】
前記炭素材料は、カーボンアロイ触媒、活性炭又はカーボンブラックである
ことを特徴とする請求項1乃至6のいずれかに記載の芳香族アルコールの酸化方法。
【請求項8】
前記炭素材料は、前記カーボンアロイ触媒であり、
前記カーボンアロイ触媒は、樹脂及び金属を含有する原料を加熱して炭素化することにより得られる炭素触媒である
ことを特徴とする請求項7記載の芳香族アルコールの酸化方法。
【請求項1】
比表面積が20m2/g以上の炭素材料、酸素含有ガス及び硝酸又はアルカリ金属水酸化物の存在下で、芳香族アルコールを酸化する
ことを特徴とする芳香族アルコールの酸化方法。
【請求項2】
前記芳香族アルコールは、下記の一般式(I)で表される
【化1】

(一般式(I)において、R1は、置換基を有してもよい芳香族炭化水素基を表し、R2は、水素原子、置換基を有してもよい脂肪族炭化水素基、置換基を有してもよい芳香族炭化水素基又は置換基を有してもよい脂環式炭化水素基を表す。)
ことを特徴とする請求項1記載の芳香族アルコールの酸化方法。
【請求項3】
前記芳香族アルコールは、第一級芳香族アルコールであり、
前記第一級芳香族アルコールを酸化することにより、アルデヒドを製造する
ことを特徴とする請求項1又は2記載の芳香族アルコールの酸化方法。
【請求項4】
前記第一級芳香族アルコールの変換率が50%以上であり、且つ前記アルデヒドの選択率が40%以上である
ことを特徴とする請求項3記載の芳香族アルコールの酸化方法。
【請求項5】
前記芳香族アルコールは、第二級芳香族アルコールであり、
前記第二級芳香族アルコールを酸化することにより、ケトンを製造する
ことを特徴とする請求項1又は2記載の芳香族アルコールの酸化方法。
【請求項6】
前記炭素材料、酸素含有ガス及び硝酸の存在下で、前記芳香族アルコールを酸化する方法であって、
前記硝酸は、前記芳香族アルコールに対して1当量未満である
ことを特徴とする請求項1乃至5のいずれかに記載の芳香族アルコールの酸化方法。
【請求項7】
前記炭素材料は、カーボンアロイ触媒、活性炭又はカーボンブラックである
ことを特徴とする請求項1乃至6のいずれかに記載の芳香族アルコールの酸化方法。
【請求項8】
前記炭素材料は、前記カーボンアロイ触媒であり、
前記カーボンアロイ触媒は、樹脂及び金属を含有する原料を加熱して炭素化することにより得られる炭素触媒である
ことを特徴とする請求項7記載の芳香族アルコールの酸化方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2010−184906(P2010−184906A)
【公開日】平成22年8月26日(2010.8.26)
【国際特許分類】
【出願番号】特願2009−31092(P2009−31092)
【出願日】平成21年2月13日(2009.2.13)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【出願人】(504145364)国立大学法人群馬大学 (352)
【出願人】(000004374)日清紡ホールディングス株式会社 (370)
【Fターム(参考)】
【公開日】平成22年8月26日(2010.8.26)
【国際特許分類】
【出願日】平成21年2月13日(2009.2.13)
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【出願人】(504145364)国立大学法人群馬大学 (352)
【出願人】(000004374)日清紡ホールディングス株式会社 (370)
【Fターム(参考)】
[ Back to top ]

