葉の水分蒸散を調節する方法、及び植物の耐乾燥性を向上させる方法
【課題】葉の水分蒸散を調節する方法、植物の耐乾燥性を向上させる方法、さらには、植物の耐乾燥性を向上させる物質のスクリーニング方法などを提供すること。
【解決手段】本発明は、植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を制御することによって葉の水分蒸散を調節する方法、とりわけ、植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制することによって葉の水分蒸散を抑制する方法、を提供する。スフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制することによって気孔からの水分蒸散を抑え、植物の耐乾燥性を高めることができるので、本発明は、例えば鑑賞植物の長寿命化に利用したり、乾燥環境(乾燥ストレス)に強い植物の創出などに利用可能である。
【解決手段】本発明は、植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を制御することによって葉の水分蒸散を調節する方法、とりわけ、植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制することによって葉の水分蒸散を抑制する方法、を提供する。スフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制することによって気孔からの水分蒸散を抑え、植物の耐乾燥性を高めることができるので、本発明は、例えば鑑賞植物の長寿命化に利用したり、乾燥環境(乾燥ストレス)に強い植物の創出などに利用可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、葉の水分蒸散を調節する方法、及び植物の耐乾燥性を向上させる方法に関し、例えば、鑑賞植物の長寿命化、鑑賞植物および農作物の生産地域の拡大、砂漠の緑化用耐乾燥性植物の創出などの分野において利用可能である。
【背景技術】
【0002】
陸上植物において、植物体からの水分消失のおよそ95 %以上は気孔からの蒸散によるため、葉の気孔開閉を制御することによって例えば水分蒸散を抑え、植物の耐乾燥性を高めることが期待できる。
【0003】
スフィンゴ脂質に属するスフィンゴシン 1-リン酸は、気孔の閉鎖を促進するアブシジン酸のシグナル伝達経路に関与する脂質メディエーターである。スフィンゴ脂質は、酵母から植物、動物細胞に至るまで広く保存された膜成分であり、スフィンゴイド塩基(長鎖塩基、long-chain baseともいう)を構造骨格としてもつ脂質の総称である。当初、スフィンゴ脂質は主に膜の構造維持の役割を担っていると考えられていたが、最近の研究により、スフィンゴ脂質やそれらの代謝中間体が、細胞認識、細胞成長や分化の調節、細胞間連絡そしてシグナル伝達経路を仲介する高度な生理活性物質であることが分かってきた(Hannun et al. 1989, Merrill et al. 1991, Hakomori 1981, Riboni et al. 1997)。
【0004】
動物細胞のスフィンゴ脂質の骨格は主にスフィンゴシンであるが、植物や真菌では主にファイトスフィンゴシンである。天然に存在するスフィンゴイド塩基の炭素数は一般に18であり、また、C-2,3位の立体化学構造はD-erythro型である。現在考えられている主要スフィンゴ脂質の生合成経路について説明すると、スフィンゴシンの生合成はまず小胞体(endoplasmic reticulum ; ER)において、パルミトイルCoAとセリンが縮合することによって、3-ケトジヒドロスフィンゴシンが生成されることから始まる。3-ケトジヒドロスフィンゴシンはさらに3-ケトジヒドロスフィンゴシンレダクターゼによりジヒドロスフィンゴシンへと変換され、酵母および植物ではジヒドロスフィンゴシンはさらにスフィンゴイド塩基C-4ヒドロキシラーゼによりファイトスフィンゴシンになる(HaaK et al. 1997, Sperling et al. 2001)。また、ジヒドロスフィンゴシンは動物および植物ではスフィンゴイド塩基 C-4不飽和化酵素によってスフィンゴシンへと変換される。これらのスフィンゴイド塩基からセラミド合成酵素によってそれぞれ、ジヒドロセラミド、ファイトセラミド、セラミドが合成される。セラミドはその後、ゴルジ体においてスフィンゴミエリンあるいはスフィンゴ糖脂質へ変換され、細胞膜表面に輸送される。また、スフィンゴイド塩基はスフィンゴイド塩基リン酸化酵素によってスフィンゴイド塩基 1-リン酸に変換され、脱リン酸化酵素あるいは分解酵素によって分解される。
【0005】
これらの生合成、代謝経路により産生されるセラミド、スフィンゴシン、スフィンゴシン 1-リン酸などの脂質が、細胞の生存、増殖、アポトーシスといった様々な細胞機能に関与することが示唆されてきた。1986 年にスフィンゴシンがin vitroでプロテインキナーゼC(PKC)の強力な阻害剤となることが明らかにされたのをきっかけに(Hannun 1986)、スフィンゴ脂質が細胞内シグナル伝達物質として注目されるようになり、そのシグナル機構について研究が盛んに行われるようになった。1993 年、Hannunらが神経細胞のtumor necrosis factor (TNF)-αによるプログラム細胞死において、セラミドが情報伝達物質である可能性を示した (Obeid et al. 1993)。現在までに動物や酵母においてセラミドは高温ストレスの応答(Dickson et al. 1997)や、アポトーシスを誘導するCaspaseの活性化をする重要な調節因子であることが報告されている(Jenkins et al. 2002)。また、スフィンゴシンもセラミドとは異なる独自のアポトーシス誘導機能を持つことが明らかとなっている(Sweeney et al. 1996, Nakamura et al. 1996, Kim et al. 2001)。そして酵母において、スフィンゴイド塩基はエンドサイトーシスの制御に関わることや(Zanolari et al. 2000, Friant et al. 2000)、アミノ酸の取り込みを阻害することが報告されている(Skrzypek et al. 2000, Chung et al. 2001)。
【0006】
これまでセラミドやスフィンゴイド塩基の生理活性について述べたが、特にスフィンゴシン 1-リン酸(以下、略して「S1P」ともいう)は細胞内セカンドメッセンジャーとしてだけでなく、細胞間シグナル伝達物質としてもはたらく新しいタイプの生理活性脂質として注目を集めている。細胞内で作られたS1Pは細胞外へ放出後、細胞間シグナル伝達物質として、細胞増殖、細胞運動制御、分化など様々な細胞応答を引き起こす(Pyne et al. 2000)。動物細胞においては、S1Pの細胞間シグナル伝達物質としての役割は、7 回膜貫通領域を持つG-タンパク質結合型EDG (endothelial differentiation growth)受容体を介して行われている(Pyne et al. 2000, Spiegel et al. 2000a, Spiegel et al. 2000b, An et al. 2000)。一方、細胞内セカンドメッセンジャーとしてのS1Pは、カルシウム動員、ホスホリパーゼDの活性化、アポトーシスを抑制し、細胞増殖を促進することが報告された(Igarashi 1997, Spiegel 1999, Birchwood at al. 2001)。このように、多くの重要なイベントのシグナル伝達物質であるS1Pの細胞内レベルは厳密に制御されており、スフィンゴシンカイネース(SPHK)により合成され、スフィンゴシン-1-リン酸ホスファターゼ(sphingosine 1-phosphate phosphatase: 以下、略して「SPP」ともいう)によって脱リン酸化される。また、スフィンゴシン-1-リン酸リアーゼ(sphingosine 1-phosphate lyase: 以下、略して「SPL」ともいう)によってホスホエタノールアミンとC16のアルデヒドへと分解される。これらの酵素について、酵母や動物では遺伝子のクローニングや機能解析がなされている。酵母において、ジヒドロスフィンゴシン-1-リン酸ホスファターゼ(LCB3: 酵母にはスフィンゴイド塩基 C-4不飽和化酵素がないためスフィンゴシンがなく、ジヒドロスフィンゴシン-1-リン酸が動物細胞におけるS1Pと類似の細胞応答を引き起こしている)の欠損株Δlcb3や、ジヒドロスフィンゴシン-1-リン酸リアーゼ(DPL1)の欠損株Δdpl1では野生株の数倍、Δlcb3Δdpl1二重欠損株では数百倍のスフィンゴイド塩基 1-リン酸が細胞内に蓄積している(Kim et al. 2000)。また、生育段階において、野生株は定常期に達するとG1期で増殖を停止するが、Δdpl1では定常期での成育停止が大幅に遅れ、野生株で定常期にみられる細胞濃度の約2 倍に達して生育を停止する(Gottlieb et al. 1999)。以上の報告より、これらの酵素の働きによって細胞内スフィンゴイド塩基 1-リン酸レベルは制御されていると考えられる。
【0007】
植物におけるS1Pの働きは、酵母や動物と比べるとまだ研究は進んでいないが、2000 年にNishiuraらによって植物では初めてシロイヌナズナ(Arabidopsis thaliana: 以下、「A. thaliana」ともいう)からスフィンゴシンカイネースの遺伝子(AtLCBK1)がクローニングされ、機能解析がなされている(Nishiura et al. 2000, Imai et al. 2005)。さらに、2001 年にNgらによって、S1Pが植物でカルシウムの移動を起こし、アブシジン酸(以下、「ABA」ともいう)による気孔孔辺細胞の膨圧の調節に関与するシグナル伝達分子であることが報告され(Ng et al. 2001)、また、S1Pを生産する酵素スフィンゴシンキナーゼがA. thalianaでABAにより活性化され、ABAによる気孔開口抑制および気孔閉鎖促進の両方に関与していることが明らかにされた(Coursol et al. 2003)。特に、これらのS1Pによる役割は、ジヒドロスフィンゴシン 1-リン酸では全く作用がないことが興味深い。現在主に知られている乾燥ストレス応答の気孔閉鎖のメカニズムは以下のとおりである。通常、ABAは葉肉細胞のクロロプラスト内に蓄積しており、乾燥ストレスを感じると解離型になり孔辺細胞へ放出される。ABAが受容体に結合すると、セカンドメッセンジャーであるイノシトール1, 4, 5-3リン酸がERカルシウムプールよりカルシウムイオン(Ca2+)を放出させる。細胞質内のCa2+濃度が上昇することで陰イオンチャネルが活性化され、リンゴ酸イオンや塩素イオンが細胞外へ放出されて膜電位の脱分極が起こる。さらにカリウムイオン排出チャネルが活性化され、カリウムイオンの排出が促進されることで孔辺細胞の浸透圧が低下し、膨圧が下がることで気孔が閉じる(Schroeder et al. 2001)。しかしながら、このメカニズムとS1Pがどの段階で関わってくるか、または、独自の伝達経路があるか等はあまりよく分かっていない。
【0008】
植物における細胞内S1Pレベルの調節については、合成酵素であるAtLCBK1が同定されているだけで、分解系については全く調べられていない。酵母や動物細胞において、S1Pを分解する酵素は、脱リン酸化酵素である前記SPPと、S1Pを完全に分解する前記SPLとが挙げられる。1969 年、Stoffelらのラットの肝臓を用いた実験で、SPLの活性がミクロソーム画分とミトコンドリア膜画分に確認され、ピリドキサル 5’-リン酸を補酵素として必要とし、スフィンゴイド塩基 1-リン酸のC2-3の結合を切断する酵素であることが初めて報告された(Stoffel et al. 1969)。しかし、1991 年にVan Veldhovenらにより、ミトコンドリア画分の活性はミクロソーム画分のコンタミであることが確認され、SPLは完全な膜タンパク質であり、活性部位を細胞質側に露出していることが報告された(Van Veldhoven et al. 1991, Van Veldhoven 1999)。その後、Saccharomyces cerevisiaeにおいてはじめてクローニングおよび機能解析が行われ(Saba et al. 1997)、マウス、ヒト、粘菌、ショウジョウバエ、線虫と次々にクローニング、機能解析が行われた(Zhou et al. 1997, Van Veldhoven et al. 2000, Li et al. 2001, Herr et al. 2003, Mendel et al. 2003)。これらの報告では、様々な生物でスフィンゴシン-1-リン酸リアーゼ(SPL)が細胞内S1Pレベルを調節しており、線虫のSPL欠損体においては胚発生が正常にできず、器官の分化や発達が異常であるためセミリーサルであった。
【0009】
脱リン酸化酵素である前記SPPについて、酵母Saccharomyces cerevisiaeはLCB3p/YSR2p/Lbp1pとYSR3/Lbp2p/YSR2-1pという二つのSPPをもっている。この2つはホモログであるが、その活性の大部分を占めているのはLCB3p/YSR2p/Lbp1pである。これらのタンパク質はERに局在している。また、哺乳類のSPPも2つのホモログであるSPP(SPP1とSPP2)をもっていて、酵母と同様にERに局在し、その活性の大部分を占めているのはSPP1であると考えられている。
【0010】
Lipid phosphate ホスファターゼはSPP(S1P phosphohydorase)ファミリーとLPP(type2 lipid phosphate phosphohydrolase)ファミリーとに分けられる。これらの2つは配列・生物的性質も異なる。中でも最も異なる点は、SPPファミリーはS1P、dihydroS1P、phytoS1Pに高い基質特異性を示すが、LPPファミリーはS1P、phosphatidate(PA)、lysophosphatidate (LPA)、ceramide-1-phosphateやdiacylglucerol-pyrophosphateなど、広い基質を持っている点である。SPPとLPPの両方のタンパク質は次のような3つのモチーフを持っている。即ち、モチーフ1:KXXXXXXRP、モチーフ2:PSGH、モチーフ3:SRXXXXXHXXXDである。これらのモチーフは他のホスファターゼスーパーファミリー(lipid phosphatases、glucose-6-phosphatases、バクテリア非特異的酸ホスファターゼ、クロロペルオキシダーゼなど)でも発見されている。また、クロロペルオキシダーゼの結晶構造は、この3つのモチーフが近接していることを示し、コファクターであるバナジウム酸エステルの結合ポケットを形成しているのはこの3つのモチーフであることを明らかにした。そして、この3つの保存された領域の突然変異体の解析から、酵素活性の中心がここであることが示された。
【0011】
一方、植物の葉からの水分蒸散を抑制することで、植物の耐乾燥性を向上させることが研究されている。例えば、切花の鮮度を保持するために、葉からの水分蒸散を抑制する物質としてアミン化合物が使用されている(例えば、特許文献1)。しかしながら、この方法は、植物自体に耐乾燥性を持たせる方法ではない。
【0012】
【特許文献1】特開2002−53402号公報
【発明の開示】
【発明が解決しようとする課題】
【0013】
本発明は、以上の様な状況下なされたものであり、その課題・目的は、植物における細胞内スフィンゴシン 1-リン酸レベルの制御機構について研究を進め、産業上有用な葉の水分蒸散を調節する方法、植物の耐乾燥性を向上させる方法、さらには、植物の耐乾燥性を向上させる物質のスクリーニング方法などを提供することにある。
【課題を解決するための手段】
【0014】
本発明者は、上記の課題を解決するため、特に前記スフィンゴシン-1-リン酸ホスファターゼ(SPP)に着目し、SPPは植物においてスフィンゴシン 1-リン酸(S1P)の細胞内レベルを調節する上で重要な役割を果たし、S1Pによる気孔機能の調節機構に関与しているのではないかと考えた。そのため、A. thalianaよりSPP 遺伝子としてAtSPP1(以下、単に「SPP1」ともいう)遺伝子をクローニングし、酵素機能の解析および植物内でのSPPによる細胞内S1Pレベルの制御機構について鋭意検討を行った。さらに、SPP1遺伝子を欠損させたSPP1欠損体において水分蒸散量が抑制され、SPP遺伝子発現の抑制が植物の葉の水分調節に関与していること等を見出し、本発明を完成するに至った。
【0015】
即ち、本発明は第1に、植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を制御することによって葉の水分蒸散を調節する方法、とりわけ、植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制することによって葉の水分蒸散を抑制する方法、を提供するものである。
【0016】
後述の実施例にも示すように、スフィンゴシン-1-リン酸ホスファターゼ(SPP1)を欠損させたSPP1欠損体においては、野生株よりも水分蒸散量が有意に低下、抑制されている。また、植物に乾燥ストレスを与えるとSPP1遺伝子の転写レベルが低下するという後述の結果をあわせて考慮すると、SPP遺伝子は葉の水分蒸散を正に制御する機能をもった遺伝子であり、乾燥ストレス下ではその転写レベルが低下するものと考えられる。
【0017】
したがって、SPPの遺伝子発現または活性を制御することによって、植物の葉の水分蒸散を抑制し、あるいは促進することが可能である。すなわち、SPPは、植物においてスフィンゴシン 1-リン酸(S1P)の細胞内レベルの調節に関与して植物の気孔開閉のシグナル伝達を制御していると考えられるので、SPPの遺伝子発現または活性を制御することによって気孔開閉を制御し、葉の水分蒸散の調整、調節に利用することができる。
【0018】
また、SPPの遺伝子発現または活性を抑制することによって気孔からの水分蒸散を抑え、植物の耐乾燥性を高めることができる。これにより、例えば植物をしおれにくくし、つまり日持ちを良くして鑑賞植物の長寿命化に利用したり、従来生産困難であった乾燥地域での生産を可能にすることによって、鑑賞植物および農作物の生産地域の拡大に利用することができる。さらに、水分環境が十分ではない乾燥環境(乾燥ストレス)に強い植物を創出することができるので、砂漠の緑化用耐乾燥性植物の創出などに利用することも可能である。
【0019】
さらに、前記スフィンゴシン-1-リン酸リアーゼ(SPL)の遺伝子発現または活性を制御することによって、気孔からの水分蒸散を調節し、また植物の耐乾燥性を向上できることが本発明者によって見出されている(特願2005−234607号)。したがって、同号明細書記載の方法と組み合わせて、SPPの遺伝子発現(又はその活性)の制御と共に、SPLの遺伝子発現(又はその活性)を制御する方法は、気孔からの水分蒸散を更に良好に調節し、植物の耐乾燥性をより向上することが期待できる好ましい方法である。
【0020】
SPPの遺伝子発現または活性を抑制する方法については、特に制限されるものではない。SPP遺伝子の発現量を抑制する方法としては、SPPゲノムを改変する方法(例えば後述のノックアウト法)、転写後に抑制する方法(例えば後述のRNAi法によるノックダウン法)が例示される。その他、SPP遺伝子の転写を選択的に阻害・抑制する方法であってもよいし、SPPのスプライシング,翻訳、翻訳後修飾の何れかのプロセスを選択的に阻害し、SPP蛋白の発現を特異的に抑制する方法であってもよい。後述の「スフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制する物質」としては、SPPの酵素活性を阻害・抑制する作用を持つ物質のほか、このようにSPP蛋白の発現を特異的に抑制する作用を持つ物質であってもよい。本発明は、このような物質を植物細胞、組織または植物個体に投与することによってSPPの発現または活性を抑制する方法も含まれる。
【0021】
SPP遺伝子の発現量を特異的に抑制する方法として、RNAi法を用いてもよい。例えば、人工的に作製したsiRNAを植物細胞内に導入する方法や、SPP特異的RNAi発現ベクターを作製し、これを植物細胞内に導入する方法などが例示される。SPP特異的RNAi発現ベクターは、(1)1本のRNAで適当な長さのヘアピン構造をもつdsRNAを対象細胞内で発現させるように設計されたもの、(2)センス鎖、アンチセンス鎖それぞれを対象細胞内で発現させ、会合させるように設計されたもの、のいずれであってもよい。RNAi発現ベクターを使用することにより、植物細胞においてSPP遺伝子の細胞内発現を持続的・安定的に抑制することができる。本発明は、このようなsiRNAやRNAi発現ベクターを植物細胞に導入することによってSPPの発現を特異的に抑制し、植物の耐乾燥性を高める方法、つまり、SPP発現を特異的に抑制するsiRNAやRNAi発現ベクターを植物の耐乾燥性向上剤として利用する方法をも含むものである。
【0022】
なお、本発明において植物細胞でのSPPの発現を抑制する方法としては、野生型と比べてSPPの発現量を実質的に低下させる方法であればよく、SPPの発現を完全に抑制するものでなくてもよい。
【0023】
siRNAやRNAi発現ベクターの配列は特に限定されるものではなく、対象植物のSPP遺伝子配列をもとに公知の方法にしたがって任意に設計すればよい。例えば、シロイヌナズナのSPP1遺伝子について、配列表の配列番号1および図10にはそのcDNA配列が示される。この配列をもとに、シロイヌナズナのSPP1遺伝子の発現を特異的に抑制するsiRNAやRNAi発現ベクターを設計することが可能である。
【0024】
SPP遺伝子の発現を特異的に抑制するその他の方法としては、例えば、アンチセンスオリゴヌクレオチド、リボザイム、低分子化合物などを対象となる植物細胞、組織または植物個体に投与する方法が挙げられる。なお、本発明における「植物」の範疇には、植物個体のほか、植物の根、茎、葉、生殖器官(花器官および種子を含む)などの各種器官(特に葉)、各種組織、植物細胞などが含まれ、さらにはプロトプラスト、スフェロプラスト、誘導カルス、再生個体およびその子孫、なども含まれるものとする。また、本発明は双子葉植物に限らず、単子葉植物に適用してもよい。
【0025】
SPP遺伝子の発現を特異的に抑制する更に他の方法として、ノックアウト(遺伝子破壊)法を挙げることができる。この方法はT-DNA、トランスポゾン等を利用してタグライン(遺伝子破壊株の集団)を作製し、この中からPCR等でSPP遺伝子が破壊された系統を選抜することにより、ゲノム中のSPP遺伝子がノックアウトされた変異体を得るものである(例えば、「細胞工学別冊 植物細胞工学シリーズ14 植物のゲノム研究プロトコール」(秀潤社)66−67頁、82−84頁参照)。
【0026】
SPP遺伝子を破壊するためのT-DNA、トランスポゾンの挿入位置としては、SPPの発現・活性を欠損または野生型に比べて著しく低下させることができれば、イントロン領域であってもよいしエクソン領域であってもよいし、あるいはプロモーター領域であってもよい。また、SPPの発現・活性を著しく低下させることができれば、SPPホモ欠損体に限らず、SPPヘテロ欠損体であってもよい。「著しく低下させる」とは、例えば野生型の発現または活性を100としたときに、SPPの発現または活性が80%以下、好ましくは50%以下、更に好ましくは30%以下になることを意味する。
【0027】
SPP遺伝子がノックアウトされたミュータントの選抜方法としては、使用するT-DNA等の塩基配列とSPP遺伝子の塩基配列とに基づいて、SPP遺伝子の領域にT-DNA等が挿入されたものを選抜することによって行うことができるが(後述の実施例参照)、この方法に限定されるものではない。得られたミュータントのカルスを再分化させることによりミュータントの植物個体を得ることができる。
【0028】
上記ノックアウト(遺伝子破壊)法以外に、ゲノム中のSPP遺伝子の配列を人為的に改変することによって、植物細胞でのSPP遺伝子の発現を抑制してもよい。例えば、部位特異的変異導入法(Site-Directed Mutagenesis)等によってSPPの酵素活性に重要な領域に点変異などの変異を導入し、本来の活性を失ったSPP変異蛋白を発現するように改変する方法などが挙げられる。
【0029】
本発明は、前述のようにSPPの機能解析の結果その機能に着目し、植物細胞でのSPPの発現又はその活性を制御することにより、葉の水分蒸散を調節する方法であり、発現・活性の制御は、発現・活性を抑制することと亢進することとの両方を含む意味である。SPPの発現又はその活性を亢進する方法としては、例えば、SPP発現ベクターを植物細胞内に導入してSPPを過剰発現させる方法や、SPPを活性化する薬剤を投与する方法などが挙げられる。SPPの発現・活性を高め、水分蒸散を促進することによって、植物の発育・生長を促進し、鑑賞植物等の生産力向上などに利用することが考えられる。
【0030】
勿論、これまで説明した上記例示の方法に限らず、従来公知の種々の方法を適用してSPPの発現および活性を制御することができる。また、本発明以降に新たに開発された方法を使用するものであってもよい。
【0031】
前述のように、植物細胞でのSPPの発現又はその活性を抑制することによって気孔からの水分蒸散を抑え、植物の耐乾燥性を高めることができるので、スフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制する物質は、植物の耐乾燥性向上剤として有用であり、そのスクリーニング方法も本発明に含まれる。
【0032】
本発明のスクリーニング方法としては、遺伝子・蛋白の発現量、酵素の活性変化等を調べる従来公知の種々の方法を適用することができ、特に限定されるものではない。また、本発明以降に新たに開発されたスクリーニング方法を使用するものであってもよい。in vitro及びin vivoスクリーニング系のいずれであってもよいし、cell-free systemでスクリーニングを行ってもよい。また、SPP遺伝子・蛋白は、シロイヌナズナ由来のもののほか、他の植物由来のものを使用してもよい。勿論、SPP蛋白の高次構造の情報を利用してスクリーニングを行ってもよい。
【実施例】
【0033】
以下、図面を参照しながら本発明の実施例について説明するが、本発明は下記実施例によって何ら限定されるものではない。
【0034】
[本実施例の要旨]
Arabidopsis thalianaからSPP遺伝子を単離し、植物においてSPPの機能解析を行った。まず酵母YSR2とのアミノ酸配列によるBLASTサーチを行い、A. thalianaのSPP1であると推定される遺伝子(AtSPP1)を見出し、クローニングした。単離した遺伝子がA. thaliana SPP1であることを証明するために、S. cerevisiaeのDPL 欠損株(Δdpl1)においてA. thaliana SPP1遺伝子を導入し、発現させることでDPL活性を相補するか調べた。スフィンゴシン存在下でΔdpl1はS1Pの蓄積により成長阻害される。一方、A. thaliana SPP1を発現させたΔdpl1は成長阻害を受けなかった。また、これらの形質転換体からスフィンゴシンおよびスフィンゴシン1-リン酸を抽出し、HPLCにより分析することでスフィンゴイドシン1-リン酸の脱リン酸化を確認した。これらのことから、今回単離した遺伝子が機能的にA. thaliana SPP1をコードしていることが示された。SPP1のA. thalianaにおける役割を調べるために、半定量的RT-PCR法を用いて、各器官の転写レベルを分析した。その結果、SPP1遺伝子は花で特にmRNA蓄積レベルが高かった。乾燥ストレスを与えたA. thalianaから経時的にmRNAを抽出し、半定量的RT-PCR法によって分析した結果、乾燥ストレスの時間が増加するに従ってSPP1遺伝子のmRNAの蓄積レベルが低下していた。SPP1のA. thaliana内での気孔開閉に関わる役割を検討するために、A. thaliana SPP1欠損体の水分蒸散量を調べた。その結果、SPP1欠損体では野生株よりも水分の蒸散量が約1/3に減少していた。これらの結果は、A. thalianaにおいてSPP1の発現制御が細胞内S1Pレベルを調節し、さらにこの調節を介して気孔開閉を制御し得ることを植物において実証するものである。
【0035】
[実験材料と方法]
[I]AtSPP1遺伝子の単離と機能活性
材料
シロイヌナズナ(Arabidopsis thaliana) T87培養細胞は独立行政法人理化学研究所 バイオリソースセンターから購入した。この培養細胞からmRNAを抽出しcDNAとし、それをテンプレートにクローニングを行った。酵母Saccharomyces cerevisiae BY4741株、Δdpl1株(DPL:dihydro-sphingosin-1-phosphate 欠損株)はInvitrogen社から購入した。
【0036】
培養細胞からのRNAの抽出とcDNAの作製
1週間培養したT87培養細胞 0.1gを使用した。QIAGEN RNeasy Plant Mini Kit(50)を使用しRNAを抽出した。これをテンプレートに全RNAからcDNAを作製した。また、余分なRNAを除くためにRNaseH(Invitrogen)処理をした。
【0037】
酵母からのRNAの抽出とcDNAの作製
YPD培地で16時間前培養したBY4741株をovernight本培養し、T87培養細胞と同様にRNAを抽出した。これをテンプレートに上記と同様にcDNAを作製し、RNaseH処理をした。
【0038】
インサートとベクターの調製
上記A. thalianaとBY4741のcDNAをテンプレートにN末端側領域とC末端側領域をPCRした。使用したプライマーは、下記表1のAtLCB3-F、AtLCB3-R2、YSR2-FおよびYSR2-R2である。
【表1】

【0039】
PCR産物を1%アガロースゲルで90分間電気泳動し、エチジウムブロマイドで染色し、共に約1200 bp付近のバンドを抽出した。また、pYES2ベクターを用いて大腸菌JM109への形質転換を行い、アンピシリンを含む液体培地で培養し、WizardTM Plus Minipreps(Promega)を用いてプラスミドDNAを調製した。こうして得られた2つのDNA溶液とプラスミドDNAを制限酵素Hind IIIとNot IでDouble Digestionを行った。
制限酵素処理後に10×loading bufferを加え、そのうちの5μLを0.5×TBE中で1%アガロースゲルで90分間電気泳動を行い、エチヂウムブロマイドで染色した。バンドをゲルから切り出し、GeneEluteTM MINUS EtBr SPIN COLUMN(SIGMA)を用いてDNAを精製した。
【0040】
ライゲーション反応
調製したインサートとベクターを、DNA ligation Kit Ver.2 SolutionI(TaKaRa)を使い16℃、2時間ライゲーション反応させた。
【0041】
大腸菌への形質転換
ライゲーション反応液を使い、大腸菌JM109へのヒートショックによる形質転換を行った。形質転換体はアンピシリンを含むLB培地で37℃、16時間培養し、得られたコロニーを選抜しN末端側領域とC末端側領域(pYES2-F、pYES2-R)を用いたダイレクトPCRによりインサートの有無を確認した。インサートの存在が確認されたポジティブクローンは培養後WizardTM Plus Minipreps(Promega)を用いてプラスミドDNAを精製した。
【0042】
シークエンスによるインサートの確認
精製したプラスミドDNA(0.20μg/μL)のインサート配列のシークエンスを行った。これによってインサートがAtSPP1とYSR2の正確な配列をしており、かつ正確に挿入されていることを確認した。使用したプライマーは、pYES2-F、pYES2-R、AtLCB3-F、AtLCB3-R2、SEQ-AtLCB3、YSR2-F、YSR2-R2、SEQ-YSR2-FおよびSEQ-YSR2-Rである。
【0043】
pYES2-AtSPP1とpYES2-YSR2の酵母Δdpl1への形質転換
上記pYES2-AtSPP1、pYES2-YSR2、およびpYES2(空ベクター)をそれぞれΔdpl1株に酢酸リチウム法で導入し、形質転換させた。これにより得られた形質転換体をそれぞれ、Δdpl1-pYES2-AtSPP1、Δdpl1-pYES2-YSR2、およびΔdpl1-pYES2とする。
上記形質転換体を用いて、10μM sphingosineを含む培地でAtSPP1による機能的相補性実験を行った。YPD培地(-ガラクトース,-スフィンゴシン)、最小培地(-ガラクトース,+10μMスフィンゴシン)および最小培地(+ガラクトース,+10μMスフィンゴシン)にそれぞれ、野生株(BY4741)、Δdpl1、Δdpl1-pYES2-AtSPP1、Δdpl1-pYES2-YSR2およびΔdpl1-pYES2をストリークし、28℃で培養した。Δdpl1は10μMスフィンゴシンにより成長阻害されるSphingoid basesリアーゼ欠損株であり、pYES2ベクターはガラクトースで誘導されるGal1プロモーターを持つ。
【0044】
HPLCによるAtSPP1の活性測定
相補が確認された酵母形質転換株をそれぞれ50μMスフィンゴシンで2時間処理し、洗浄後、細胞を破砕しスフィンゴシンおよびスフィンゴシン1-リン酸を抽出した。C18カラムで逆相クロマトグラフィー分析を行った。
【0045】
[II]A. thaliana内におけるAtSPP1の解析
各器官におけるmRNA蓄積レベルの解析
本実施例で使用したA.thalianaはColumbia株である。MS寒天培地上で23℃、2,000lux(National FL 20S-PG 植物育成用ランプ)、明期16時間、暗期8時間の長日条件下で栽培した。根・茎・葉・花の各試料は上記条件で4週間栽培したものをそれぞれ100 mg使用した。QIAGEN RNeasy Plant Mini Kit(50)を使用しRNAを抽出した。これをテンプレートにcDNAを作製し、PCRを行った。はじめに、mRNAの転写量をそろえるために全組織で同程度に発現しているアクチン(Act2)遺伝子増幅用プライマー(At-Act2-FとAt-Act2-R)を使ってPCRを行った。その後、At-Act2のシグナル強度が一致した各器官のテンプレート量で、AtLCB3-FとAtLCB3-R2を使ってPCRを行い、AtSPP1のシグナル強度を測定し、根、茎、葉、花におけるmRNA蓄積レベルの違いを分析した。
【0046】
乾燥ストレスによるAtSPP1 mRNA蓄積レベルの変化
植物体への乾燥ストレスの与え方は吉田らの方法に従って、乾燥ストレスにより発現誘導がかかるSRK2Eをポジティブコントロールとして以下のように行った(Yoshida et al. 2002)。MSプレート培地で育てた播種後4 週間のA. thalianaを用い、インキュベーター内でプレートの蓋を開けて放置することで乾燥ストレスを与えた。0、1、2、3 時間それぞれ経時的にストレスを与えたA. thalianaの葉から全RNAを抽出し、cDNAをそれぞれ調製した。コントロールをAt-Act2とし、ストレスを与えた各時間のAt-Act2のシグナル強度が一致する条件でAtSPP1のmRNA蓄積レベルの変化を分析した。
【0047】
[III]AtSPP1欠損A. thalianaを用いた機能解析
AtSPP1欠損体の単離
Salk Institute Genomic Analysis Laboratory によるシロイヌナズナの遺伝子破壊株の集団の中から、At3g58490にT-DNAが挿入されている種子を複数見出した(SALK_0489081、SALK_035202およびSALK_027084)。これらの種子をMS-カナマイシン培地(カナマイシン25 mg/ml)プレートに蒔き、カナマイシン耐性の個体の葉からゲノムDNAを調製した。これを鋳型として、AtSPP1ゲノム内の配列をもとに作製した下記プライマーI(primerI)とプライマーII(primerII)を用いたPCR、及び、プライマーI(primerI)とT-DNAのレフトボーダープライマーであるプライマーIII(primerIII)を用いたPCRを行った(図8)。そして、前者のPCRで増幅産物が得られず、後者のPCRで増幅産物が得られた3種類のAtSPP1欠損体(Int、Ex1、Ex2)を単離した。さらに、これらのAtSPP1欠損体の葉から全RNAを抽出し、RT-PCRを行ってmRNAの発現がないことを確認した。
primerI : 5’-ATGAAGAAGATTCTAGAAAGATC-3’ (14) Int,Ex1の場合
5’-CTACAAGTTAACGTAAGAGAATAGT-3’(15) Ex2の場合
primerII : 5’-CTACAAGTTAACGTAAGAGAATAGT-3’(15) Int,Ex1の場合
5’-ATGAAGAAGATTCTAGAAAGATC-3’ (14) Ex2の場合
primerIII: 5’-TGGTTCACGTAGTGGGCCATCG-3’ (16)
かっこ内の数字は配列表の配列番号を示す。
【0048】
AtSPP1欠損体における蒸散率測定
野生株およびAtSPP1欠損体の蒸散率は以下のように測定した。発芽日をそろえるためにMS培地に播種した。発芽後3週目に植物体をバーミキュライトへ植え替え、乾燥ストレスがかからないように、3日間湿度を高く保った。その後通常の育成条件に戻し、発芽後4週後の植物体の根を切り離し、光の影響などを受けないようにインキュベーター内で地上部の蒸散量を経時的に測定した。
【0049】
[実験結果及び考察]
[I]Arabidopsis thaliana SPP1 (AtSPP1)遺伝子の単離および構造解析
酵母Saccharomyces cerevisiaeのYSR2 (accession number NC_001142)とのアミノ酸配列によるBLASTサーチを行い、モデル植物であるシロイヌナズナ(Arabidopsis thaliana)より、スフィンゴシン-1-リン酸ホスファターゼ遺伝子(AtSPP1)をクローニングした。
クローニングしたAtSPP1 cDNAの塩基配列、およびそのコードするアミノ酸配列を図10(並びに配列表の配列番号1・2)に示す。AtSPP1のORFは1251bpであり、416アミノ酸残基からなり、等電点は8.23のタンパク質をコードしていた。また、AtSPP1ゲノムは第3染色体上に位置し、8個のエクソンからなる。
このAtSPP1アミノ酸配列と、既にクローニング、機能解析が行われている酵母やヒトのSPP1アミノ酸配列とのアライメントを行った結果を図1に示す。アライメント結果より、AtSPP1は、酵母やヒトのSPP1と同様にホスファターゼ活性に重要な3つのモチーフ(motif1:KXXXXXXRD、motif2:PSGH、motif3:SRXXXXHXXXD)を持っていた。これらのモチーフはバナジウム酸エステル結合モチーフである。AtSPP1は他のSPPとアミノ酸レベルでの相同性はIdentityが26.7%、Similaritiesが38.8%であった。相同性はあまり高いものではなかったが、酵母とヒト、または酵母とマウスなどを比べた場合も同様の傾向がある。
また、AtSPP1のハイドロパシー分析の結果を図2に示す。同図に示すように、AtSPP1においても、酵母のYSR2と同様にバナジウム酸エステル結合モチーフが確認され、また、膜貫通型の酵素であると考えられる。AtSPP1では、N末端側の約75個のアミノ酸がAtSPP1に特異的であった。さらに、AtSPP1の系統解析を行った結果、図3に示すように、AtSPP1は、SIPのみを基質にするSPP Familyに属すると判断された。
【0050】
[II]AtSPP1の酵母内における発現及び機能解析
AtSPP1による機能的相補性実験
A. thalianaのSPP1をコードしていると予想されるAtSPP1遺伝子のcDNAをクローニングしたが、この遺伝子がコードするタンパク質が機能的にSPP活性を持つことを、酵母のリアーゼミュータント(Δdpl1)を用いて確認した。Δdpl1はリアーゼ活性がないため、スフィンゴシンが含まれる培地ではS1Pが分解されずに蓄積するため成長阻害される。そこで、クローニングしてきたcDNAをΔdpl1に遺伝子導入し、タンパク質を発現させることで酵母のDPL活性を補うことができるか実験した。
【0051】
Δdpl1は10μM スフィンゴシンで成長阻害をうけた。しかし、pYES2-AtSPP1、pYES2-YSR2形質転換体は、ガラクトースによるGAL1プロモーターの発現誘導をかけると10μM スフィンゴシンを含む培地で生えてきた。一方、pYES2のみの空ベクターとΔdpl1は生えてこなかった(図4)。このことから、pYES2-AtSPP1とpYES2-YSR2の形質転換体はS1P感受性の形質を相補したといえる。S1Pを分解するSPLの形質が相補されたということは、AtSPP1がS1Pを分解する酵素活性を有していることを示している。さらに配列の相同性などの点から、クローニングしたAtSPP1は、S1Pホスファターゼ遺伝子と判断された。
【0052】
HPLCによるAtSPP1の活性測定
Δdpl1においてAtSPP1を発現させ、sphingosine耐性を与えたことで機能的相補を確認したが、実際にS1Pを脱リン酸化していることを確認するためにHPLCを用いた活性測定を行った。Δdpl1-pYES2、Δdpl1-pYES2-YSR2(Δdpl1-YSR2)およびΔdpl1-pYES2-AtSPP1(Δdpl1-AtSPP1)からスフィンゴ脂質を抽出する前に、50 mM sphingosine培地で2 時間培養することによりsphingosineを吸収させた。酵母はsphingosineタイプのスフィンゴイド塩基を持たないため、sphingosineを吸収させることでS1Pを蓄積させ、SPPによるS1Pの脱リン酸化を確認するためにこの操作を行った。この結果を図5に示す。図示のように、Δdpl1-AtSPP1では、S1Pを脱リン酸化することができた。以上のAtSPP1における機能的相補試験およびHPLCを用いたin vivoでの分析により、AtSPP1がスフィンゴイド塩基 1-リン酸を脱リン酸化し、さらにS1Pを基質とすることが分かった。
【0053】
[III]A. thaliana内におけるAtSPP1の機能解析
各器官におけるmRNA蓄積レベルの解析
A. thalianaにおけるAtSPP1の発現解析のために、各器官のmRNA蓄積レベルをsemi-quantitative RT-PCR法により分析した。At-Act2のシグナル強度が一致した根、茎、葉、花のテンプレート量でAtSPP1について分析した。この結果を図6に示す。図示のように、全ての器官でmRNAの発現はみられたが、根、茎、葉においてはAtSPP1のmRNA蓄積レベルに目立った差はなかった。しかし、花においては、根の約5 倍のAtSPP1のmRNAの蓄積が見られた。
【0054】
乾燥ストレスによるAtSPP1 mRNA蓄積レベルの変化
次に、AtSPP1が細胞内S1Pレベルを調節することにより、気孔閉鎖のメカニズムの過程でどのように関わっているのかを調べるために、乾燥ストレスを与えることによるAtSPP1 mRNAの蓄積レベルを上記と同様の方法で調べた。この結果を図7に示す。図示のように、AtSPP1においては、乾燥ストレスを与える時間が増加するに従ってmRNA蓄積レベルは低下していった。この結果から、S1Pがシグナル伝達物質として作用する気孔閉鎖メカニズムにAtSPP1が関与し、細胞内S1P量を調節していることが考えられる。
【0055】
[IV]AtSPP1欠損A. thalianaを用いた機能解析
AtSPP1欠損体の単離
乾燥ストレスによるmRNA蓄積レベルの変化を調べた結果より、AtSPP1が欠損した植物体はS1Pが通常よりも蓄積すると考えられるため、乾燥ストレスに強い植物体になるのではと考えた。そこで、SALK種子を用いてAtSPP1が欠損している個体をスクリーニングした。その結果、3種類のAtSPP1欠損体(Int、Ex1、Ex2)が得られた(図8)。
即ち、WTと各AtSPP1欠損体から抽出したゲノムをテンプレートとして図8に各位置を示すプライマーでPCRを行った。その結果、プライマーI(primerI)とプライマーII(primerII)で行ったPCRでは、WTのみに約2,027 bpのシグナルが確認できた。また、プライマーI(primerI)とT-DNAのLBプライマー(primerIII)で行ったPCRでは、各AtSPP1欠損体(Int、Ex1、Ex2)のみに増幅バンドが確認できた。この結果より、各AtSPP1欠損体はホモでAtSPL1遺伝子が破壊されているといえる。また、シークエンス解析の結果、T-DNAは、Intでは第1イントロンに、Ex1では第2エクソンに、Ex2では第3エクソンにそれぞれ挿入されていることが分かった。
【0056】
AtSPL1欠損体における蒸散率測定
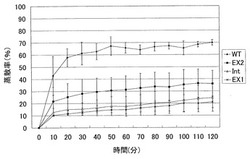
WTおよび各AtSPP1欠損体の蒸散率を調べた結果を図9に示す。WTと各AtSPP1欠損体とでは、その形態に相違は認められなかった。しかし、図9に示すように、WTは2 時間後には約70 %もの水分を蒸散により失っていた。一方、各AtSPP1欠損体では測定開始直後から明らかにWTよりも蒸散量は低い状態を維持し、例えばEx1では、2 時間後でも20 %程度の蒸散率であった。他のAtSPP1欠損体(Ex2及びInt)についても同様に蒸散率は低い状態を維持した。
AtSPP1欠損体ではSPP1がノックアウトされているため、WTよりもS1Pが植物体内に蓄積していると考えられる。したがって、測定開始直後から明らかな差が出たと考えられる。また、閉じていなかった気孔もS1Pが初めから多く存在しているため、結果的にWTよりも早く、そしてより多くの気孔を閉じることができたと考えられる。これらのことから例えばAtSPP1欠損体Ex1では最終的にWTよりも蒸散率が約3分の1減少するという結果がでたと考えられる。
【0057】
以上の結果より、今回初めて植物においてA. thalianaからAtSPP1を単離し、Δdpl1を用いた機能的相補実験およびHPLCによるin vivoでの分析によりSPP酵素活性を確認した。植物内では花においてAtSPP1のmRNA蓄積レベルが高かった。また、乾燥ストレスにより、AtSPP1のmRNAの蓄積が低下する。AtSPP1欠損体を用いた分析では、AtSPP1欠損体はWTよりも蒸散率が約3分の1減少するという結果を得た。これらのことから、SPPは動物細胞や酵母と同様に植物において細胞内S1Pレベルを調節しており、気孔開閉を調節していることが示唆された。
【0058】
以上のように、スフィンゴシン-1-リン酸ホスファターゼ(SPP)ホモ欠損体においてはS1Pが多く蓄積しているためにWTよりも気孔をより多く閉じていると考えられる。この結果から、SPPは気孔開閉の調節機構に関与し、SPPの発現量や活性を変化させることによって、水分量が十分にある環境下では気孔をできるだけ開かせて光合成を促進することに利用する一方、水分環境が十分ではない環境においては気孔閉鎖を促進させて乾燥ストレスに強い植物の創出などに利用できると考えられる。
【産業上の利用可能性】
【0059】
以上のように、本発明は、植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を制御することによって葉の水分蒸散を調節する方法、及び植物の耐乾燥性を向上させる方法に関するものであり、前述したとおり、鑑賞植物の長寿命化、鑑賞植物および農作物の生産地域の拡大、砂漠の緑化用耐乾燥性植物の創出などの分野において利用できるほか、産業上種々の分野への利用が可能である。
【0060】
[参考文献]
An, S., Zheng, Y., and Bleu, T. (2000) Sphingosine 1-phosphate-induced cell proliferation, survival, and related signaling events mediated by G protein-coupled receptors Edg3 and Edg5. J Biol Chem. 275:288-296.
Birchwood, C. J., Saba, J. D., Dickson, R. C., and Cunningham, K. W. (2001) Calcium influx and signaling in yeast Stimulated by intracellular sphingosine 1-phosphate accumulation. J Biol Chem. 276:11712-11718.
Caligan, T. B., Peters, K., Ou, J., Wang, E., Saba, J., and Merrill, A. H. Jr. (2000) A high-performance liquid chromatographic method to measure sphingosine 1-phosphate and related compounds from sphingosine kinase assays and other biological samples. Anal. Biochem. 218:36-44.
Chung, N., Mao, C., Heitman, J., Hannun, Y. A., and Obeid, L. M. (2001) Phytosphingosine as a specific inhibitor of growth and nutrient import in Saccharomyces cerevisiae . J Biol Chem. 276:35614-35621.
Coursol, S., Fan, L. M., Le, S. H., Spiegel, S., Gilroy, S., and Assmann, S. M. (2003) Sphingolipid signaling in Arabidopsis guard cells involves heterotrimeric G proteins. Nature. 423:651-654.
Gottlieb, D., Heideman, W., and Saba, J. D. (1999) The DPL1 gene is involved in mediating the response to nutrient deprivation in Saccharomyces cerevisiae. Mol Cell Biol Res Commun. 1:66-71.
Jenkins, G. M., Cowart, L. A., Signorelli, P., Pettus, B. J., Chalfant, C. E., Hannun, Y. A. (2002) Acute activation of de novo sphingolipid biosynthesis upon heat shock causes an accumulation of ceramide and subsequent dephosphorylation of SR proteins. J Biol Chem. 277:42572-42578.
Haak, D., Gable, K., Beeler, T., and Dunn, T. (1997) Hydroxylation of Saccharomyces cerevisiae ceramides requires Sur2p and Scs7p. J Biol Chem. 272:29704-29710.
Hakomori, S. (1981) Glycosphingolipids in cellular interaction, differentiation, and oncogenesis. Annu Rev Biochem. 50:733-764.
Hannun, Y. A. (1986) Sphingosine inhibition of protein kinase C activity and phorbol dibutyrate binding in vitro and human platelets. Science. 243:500-507.
Hannun, Y. A., and Bell, R. M. (1989) Functions of sphingolipids and sphingolipid breakdown products in cellular regulation. J Biol Chem. 261:12604-12609.
Herr, D. R., Fyrst, H., Phan, V., Heinecke, K., Georges, R., Harris, G. L., and Saba, J. D. (2003) Sply regulation of sphingolipid signaling molecules is essential for Drosophila development. Development. 130:2443-2453.
Igarashi, Y. (1997) Functional roles of sphingosine, sphingosine 1-phosphate, and methylsphingosines: in regard to memblane sphingolipid signaling pathways. J. Biochem. 122:1080-1087.
Imai, H., and Nishiura, H. (2005) Phosphorylation of sphingoid long-chain bases in Arabidopsis: functional characterization and expression of the first sphingoid long-chain base kinase gene in plants. Plant Cell Physiol. In press.
Kandasamy, M. K., McKinney, E. C., and Meagher, R. B. (2002) Functional nonequiv
alency of actin isovariants in Arabidopsis. Mol Biol Cell. 13:251-261.
Kim, S., Fyrst, H., and Saba, J. (2000) Accumulation of phosphorylated sphingoid long chain bases results in cell growth inhibition in Saccharomyces cerevisiae. Genetics. 156:1519-1529.
Kim, M. S., Lee, D. Y., Wang, T, and Schroeder, J. J. (2001) Fumonisin B(1) induces apoptosis in LLC-PK(1) renal epithelial cells via a sphinganine- and calmodulin-dependent pathway. Toxicol Appl Pharmacol. 176:118-126.
Li, G., Foote, C., Alexander, S., and Alexander, H. (2001) sphingosine-1-phosphate lyase has a central role in the development of Dictyostelium discoideum. Development. 128:3473-3483.
Mendel, J., Heinecke, K., Fyrst, H., and Saba, J. D. (2003) Sphingosine phosphate lyase expression is essential for normal development in Caenorhabditis elegans. J Biol Chem. 278:22341-22349.
Merrill, A. H., Jr. (1991) Cell regulation by sphingosine and more complex sphingolipids. J Bioenerg Biomembr. 23:83-104.
Nakamura, S., Kozutsumi, Y., Sun, Y., Miyake, Y., Fujita, T., and Kawasaki, T. (1996) Dual roles of sphingolipids in signaling of the escape from and onset of apoptosis in a mouse cytotoxic T-cell line, CTLL-2. J Biol Chem. 273:19437-19442.
Ng, C. K.-Y., Carr, K., McAinsh, M. R., Powell, B., and Hetherington, A. M. (2001) Drought-induced guard cell signal transduction involves sphingosine 1-phosphate. Nature. 410:596-599.
Nishiura, H., Tamura, K., Morimoto, Y., and Imai, H. (2000) Characterization of sphingolipid long-chain base kinase in Arabidopsis thaliana. Biochem Soc Trans. 28:747-748.
Riboni, L., P. Viani, R. Bassi, A.Prinetti and G.tettamanti. (1997) The role of sphingolipids in the process of signal transduction. Prog. Lipid Res. 36: 153-195.
Obeid, L. M., Linardic, C. M., Karolak, L. A., and Hannun, Y. A. (1993) Programmed cell death induced by ceramide. Science. 259:1769-1771.
Ohashi Y, Oka A, Rodrigues-Pousada R, Possenti M, Ruberti I, Morelli G, Aoyama T. (2003) Modulation of phospholipid signaling by GLABRA2 in root-hair pattern formation. Science. 300:1427-30.
Orlati, S., Porcelli, A. M., Hrelia, S., Van Brocklyn, J. R., Spiegel, S., and Rugolo, M. (2000) Sphingosine-1-phosphate activates phospholipase D in human airway epithelial cells via a G protein-coupled receptor. Arch Biochem Biophys. 375:69-77.
Pyne, S., and Pyne, N. J. (200) Sphingosine 1-phosphate signaling in mammalian cells. Biochem. J. 349:385-402.
Saba, J. D., Nara, F. Bielawska, A., Garrett, S., and Hannun, Y. A. (1997) The BST1 gene of Saccharomyces cerevisiae is the sphingosine-1-phosphate lyase. J Biol Chem. 272:26087-26090.
Schroeder, J. I., Kwak, J. M., and Allen, G. J. (2001) Guard cell abscisic acid signaling and engineering drought hardiness in plants. Nature. 410:327-330.
Skrzypek, M., Lester, R. L., and Dickson, R. C., (1997) Suppressor gene analysis reveals an essential role for sphingolipids in transport of glycosylphosphatidylinositol-anchored proteins in Saccharomyces cerevisiae. J Bacteriol. 179:1513-1520.
Sperling, P., Ternes, P., Moll, H., Franke, S., Zahringer, U., and Heinz, E. (2001) Functional characterization of sphingolipid C4-hydroxylase genes from Arabidopsis thliana. FEBS Lett. 494:90-94.
Spiegel, S. (1999) Sphingosine 1-phosphate: a prototype of a new class of second messengers. J. Leukoc. Biol. 65:341-344.
Spiegel, S., and Milstien, S. (2000a) Functions of a new family of sphingosine-1-phosphate recepters. Biochim. Biophys. Acta 1484:107-116.
Spiegel, S., and Milstien, S. (2000b) Sphingosine-1-phosphate: signaling inside and out. FEBS Lett. 476:55-57.
Stoffel, W., and Scheid, A. (1969) Metabolism of sphingosine bases. XII. Eicosasphinganine (eicosadihydrosphingosine) and 3-dehydroeicosasphinganine (3-dehydroeicosadihydrosphingosine). Hoppe Seylers Z Physiol Chem. 350:1593-1604.
Sweeney, E. A., Sakakura, C., Shirahama, T., Masamune, A., Ohta, H., Hakomori,S., and Igarashi, Y. (1996) Sphingosine and its methylated derivative N,N-dimethylsphingosine (DMS) induce apoptosis in a variety of human cancer cell lines. Int J Cancer. 66:358-366.
Van Veldhoven, P. P (1999) Sphingosine-1-phosphate lyase. Methods Enzymol. 311:244-254.
Van Veldhoven, P. P., and Mannaerts, G. P. (1991) Subcellular localization and membrane topology of sphingosine-1-phosphate lyase in rat liver. J Biol Chem. 266:12502-12507.
Yoshida, R., Hobo, T., Ichimura, K., Mizoguchi, T., Takahashi, F., Aronso, J., Ecker, J. R., and Shinozaki, K. (2002) ABA-activated SnRK2 protein kinase is required for dehydration stress signaling in Arabidopsis. Plant Cell Physiol. 43:1473-1483.
Zhang, W., Qin, C., Zhao, J., and Wang, X. (2004) Phospholipase Da1-derived phosphatidic acid interacts with ABI1 phosphatase 2C and regulates abscisic acid signaling. Proc. Natl. Acad. Sci. USA 101:9508-9513.
Zhou, J., and Saba, J. D. (1997) Identification of the first mammalian sphingosine phosphate lyase gene and its functional expression in yeast. Biochem. Biophys. Res. Commun. 242:502-507.
Chie Ogawa,Akio Kihara,Maiko Gokoh and Yasuyuki Igarashi (2003) Identification and characterization of a novel human sphingosine-1-phosphate phosphohydrolase,hSPP2.J. Biol.Chem.278,1268-1272.
Akio kihara,Takamitu Sano,Souichiro Iwaki and Yasuyuki Igarashi (2003) Transmembrane topology of sphingoid long-chain base-1-phosphate phosphatase,Lcb3p.Genes to Cells.8,525-535.
Cungui Mao,Martha Wadleigh,Gary M.Jenkins,Yusuf A.Hannun and Lina M.Obeid (1997) Identification and characterization of Saccharomyces cerevisiae dyhydroshingosine-1-phosphate phosphatase.J.Biol.Chem.272,28690-28694.
【図面の簡単な説明】
【0061】
【図1】AtSPP1と他のホスファターゼとのアライメントを示す図である。
【図2】AtSPP1と酵母YSR2とのハイドロパシーの比較を示す図である。
【図3】Lipid phosphate phosphatase系統解析結果を示す図である。
【図4】酵母△dpl1株における機能的相補試験の結果を示す図である。
【図5】AtSPP1の活性を測定した結果を示すグラフである。
【図6】シロイヌナズナの各器官におけるAtSPP1のmRNAの蓄積量を示すグラフである。
【図7】乾燥ストレス条件下でのAtSPP1のmRNAの蓄積量を示すグラフである。
【図8】AtSPP1欠損体の単離を示す図である。
【図9】AtSPP1欠損体と野生型における蒸散率の変化を示す図である。
【図10】AtSPP1の塩基配列とアミノ酸配列を示す図である。下線部分は、バナジウム酸エステル結合モチーフを示す。
【技術分野】
【0001】
本発明は、葉の水分蒸散を調節する方法、及び植物の耐乾燥性を向上させる方法に関し、例えば、鑑賞植物の長寿命化、鑑賞植物および農作物の生産地域の拡大、砂漠の緑化用耐乾燥性植物の創出などの分野において利用可能である。
【背景技術】
【0002】
陸上植物において、植物体からの水分消失のおよそ95 %以上は気孔からの蒸散によるため、葉の気孔開閉を制御することによって例えば水分蒸散を抑え、植物の耐乾燥性を高めることが期待できる。
【0003】
スフィンゴ脂質に属するスフィンゴシン 1-リン酸は、気孔の閉鎖を促進するアブシジン酸のシグナル伝達経路に関与する脂質メディエーターである。スフィンゴ脂質は、酵母から植物、動物細胞に至るまで広く保存された膜成分であり、スフィンゴイド塩基(長鎖塩基、long-chain baseともいう)を構造骨格としてもつ脂質の総称である。当初、スフィンゴ脂質は主に膜の構造維持の役割を担っていると考えられていたが、最近の研究により、スフィンゴ脂質やそれらの代謝中間体が、細胞認識、細胞成長や分化の調節、細胞間連絡そしてシグナル伝達経路を仲介する高度な生理活性物質であることが分かってきた(Hannun et al. 1989, Merrill et al. 1991, Hakomori 1981, Riboni et al. 1997)。
【0004】
動物細胞のスフィンゴ脂質の骨格は主にスフィンゴシンであるが、植物や真菌では主にファイトスフィンゴシンである。天然に存在するスフィンゴイド塩基の炭素数は一般に18であり、また、C-2,3位の立体化学構造はD-erythro型である。現在考えられている主要スフィンゴ脂質の生合成経路について説明すると、スフィンゴシンの生合成はまず小胞体(endoplasmic reticulum ; ER)において、パルミトイルCoAとセリンが縮合することによって、3-ケトジヒドロスフィンゴシンが生成されることから始まる。3-ケトジヒドロスフィンゴシンはさらに3-ケトジヒドロスフィンゴシンレダクターゼによりジヒドロスフィンゴシンへと変換され、酵母および植物ではジヒドロスフィンゴシンはさらにスフィンゴイド塩基C-4ヒドロキシラーゼによりファイトスフィンゴシンになる(HaaK et al. 1997, Sperling et al. 2001)。また、ジヒドロスフィンゴシンは動物および植物ではスフィンゴイド塩基 C-4不飽和化酵素によってスフィンゴシンへと変換される。これらのスフィンゴイド塩基からセラミド合成酵素によってそれぞれ、ジヒドロセラミド、ファイトセラミド、セラミドが合成される。セラミドはその後、ゴルジ体においてスフィンゴミエリンあるいはスフィンゴ糖脂質へ変換され、細胞膜表面に輸送される。また、スフィンゴイド塩基はスフィンゴイド塩基リン酸化酵素によってスフィンゴイド塩基 1-リン酸に変換され、脱リン酸化酵素あるいは分解酵素によって分解される。
【0005】
これらの生合成、代謝経路により産生されるセラミド、スフィンゴシン、スフィンゴシン 1-リン酸などの脂質が、細胞の生存、増殖、アポトーシスといった様々な細胞機能に関与することが示唆されてきた。1986 年にスフィンゴシンがin vitroでプロテインキナーゼC(PKC)の強力な阻害剤となることが明らかにされたのをきっかけに(Hannun 1986)、スフィンゴ脂質が細胞内シグナル伝達物質として注目されるようになり、そのシグナル機構について研究が盛んに行われるようになった。1993 年、Hannunらが神経細胞のtumor necrosis factor (TNF)-αによるプログラム細胞死において、セラミドが情報伝達物質である可能性を示した (Obeid et al. 1993)。現在までに動物や酵母においてセラミドは高温ストレスの応答(Dickson et al. 1997)や、アポトーシスを誘導するCaspaseの活性化をする重要な調節因子であることが報告されている(Jenkins et al. 2002)。また、スフィンゴシンもセラミドとは異なる独自のアポトーシス誘導機能を持つことが明らかとなっている(Sweeney et al. 1996, Nakamura et al. 1996, Kim et al. 2001)。そして酵母において、スフィンゴイド塩基はエンドサイトーシスの制御に関わることや(Zanolari et al. 2000, Friant et al. 2000)、アミノ酸の取り込みを阻害することが報告されている(Skrzypek et al. 2000, Chung et al. 2001)。
【0006】
これまでセラミドやスフィンゴイド塩基の生理活性について述べたが、特にスフィンゴシン 1-リン酸(以下、略して「S1P」ともいう)は細胞内セカンドメッセンジャーとしてだけでなく、細胞間シグナル伝達物質としてもはたらく新しいタイプの生理活性脂質として注目を集めている。細胞内で作られたS1Pは細胞外へ放出後、細胞間シグナル伝達物質として、細胞増殖、細胞運動制御、分化など様々な細胞応答を引き起こす(Pyne et al. 2000)。動物細胞においては、S1Pの細胞間シグナル伝達物質としての役割は、7 回膜貫通領域を持つG-タンパク質結合型EDG (endothelial differentiation growth)受容体を介して行われている(Pyne et al. 2000, Spiegel et al. 2000a, Spiegel et al. 2000b, An et al. 2000)。一方、細胞内セカンドメッセンジャーとしてのS1Pは、カルシウム動員、ホスホリパーゼDの活性化、アポトーシスを抑制し、細胞増殖を促進することが報告された(Igarashi 1997, Spiegel 1999, Birchwood at al. 2001)。このように、多くの重要なイベントのシグナル伝達物質であるS1Pの細胞内レベルは厳密に制御されており、スフィンゴシンカイネース(SPHK)により合成され、スフィンゴシン-1-リン酸ホスファターゼ(sphingosine 1-phosphate phosphatase: 以下、略して「SPP」ともいう)によって脱リン酸化される。また、スフィンゴシン-1-リン酸リアーゼ(sphingosine 1-phosphate lyase: 以下、略して「SPL」ともいう)によってホスホエタノールアミンとC16のアルデヒドへと分解される。これらの酵素について、酵母や動物では遺伝子のクローニングや機能解析がなされている。酵母において、ジヒドロスフィンゴシン-1-リン酸ホスファターゼ(LCB3: 酵母にはスフィンゴイド塩基 C-4不飽和化酵素がないためスフィンゴシンがなく、ジヒドロスフィンゴシン-1-リン酸が動物細胞におけるS1Pと類似の細胞応答を引き起こしている)の欠損株Δlcb3や、ジヒドロスフィンゴシン-1-リン酸リアーゼ(DPL1)の欠損株Δdpl1では野生株の数倍、Δlcb3Δdpl1二重欠損株では数百倍のスフィンゴイド塩基 1-リン酸が細胞内に蓄積している(Kim et al. 2000)。また、生育段階において、野生株は定常期に達するとG1期で増殖を停止するが、Δdpl1では定常期での成育停止が大幅に遅れ、野生株で定常期にみられる細胞濃度の約2 倍に達して生育を停止する(Gottlieb et al. 1999)。以上の報告より、これらの酵素の働きによって細胞内スフィンゴイド塩基 1-リン酸レベルは制御されていると考えられる。
【0007】
植物におけるS1Pの働きは、酵母や動物と比べるとまだ研究は進んでいないが、2000 年にNishiuraらによって植物では初めてシロイヌナズナ(Arabidopsis thaliana: 以下、「A. thaliana」ともいう)からスフィンゴシンカイネースの遺伝子(AtLCBK1)がクローニングされ、機能解析がなされている(Nishiura et al. 2000, Imai et al. 2005)。さらに、2001 年にNgらによって、S1Pが植物でカルシウムの移動を起こし、アブシジン酸(以下、「ABA」ともいう)による気孔孔辺細胞の膨圧の調節に関与するシグナル伝達分子であることが報告され(Ng et al. 2001)、また、S1Pを生産する酵素スフィンゴシンキナーゼがA. thalianaでABAにより活性化され、ABAによる気孔開口抑制および気孔閉鎖促進の両方に関与していることが明らかにされた(Coursol et al. 2003)。特に、これらのS1Pによる役割は、ジヒドロスフィンゴシン 1-リン酸では全く作用がないことが興味深い。現在主に知られている乾燥ストレス応答の気孔閉鎖のメカニズムは以下のとおりである。通常、ABAは葉肉細胞のクロロプラスト内に蓄積しており、乾燥ストレスを感じると解離型になり孔辺細胞へ放出される。ABAが受容体に結合すると、セカンドメッセンジャーであるイノシトール1, 4, 5-3リン酸がERカルシウムプールよりカルシウムイオン(Ca2+)を放出させる。細胞質内のCa2+濃度が上昇することで陰イオンチャネルが活性化され、リンゴ酸イオンや塩素イオンが細胞外へ放出されて膜電位の脱分極が起こる。さらにカリウムイオン排出チャネルが活性化され、カリウムイオンの排出が促進されることで孔辺細胞の浸透圧が低下し、膨圧が下がることで気孔が閉じる(Schroeder et al. 2001)。しかしながら、このメカニズムとS1Pがどの段階で関わってくるか、または、独自の伝達経路があるか等はあまりよく分かっていない。
【0008】
植物における細胞内S1Pレベルの調節については、合成酵素であるAtLCBK1が同定されているだけで、分解系については全く調べられていない。酵母や動物細胞において、S1Pを分解する酵素は、脱リン酸化酵素である前記SPPと、S1Pを完全に分解する前記SPLとが挙げられる。1969 年、Stoffelらのラットの肝臓を用いた実験で、SPLの活性がミクロソーム画分とミトコンドリア膜画分に確認され、ピリドキサル 5’-リン酸を補酵素として必要とし、スフィンゴイド塩基 1-リン酸のC2-3の結合を切断する酵素であることが初めて報告された(Stoffel et al. 1969)。しかし、1991 年にVan Veldhovenらにより、ミトコンドリア画分の活性はミクロソーム画分のコンタミであることが確認され、SPLは完全な膜タンパク質であり、活性部位を細胞質側に露出していることが報告された(Van Veldhoven et al. 1991, Van Veldhoven 1999)。その後、Saccharomyces cerevisiaeにおいてはじめてクローニングおよび機能解析が行われ(Saba et al. 1997)、マウス、ヒト、粘菌、ショウジョウバエ、線虫と次々にクローニング、機能解析が行われた(Zhou et al. 1997, Van Veldhoven et al. 2000, Li et al. 2001, Herr et al. 2003, Mendel et al. 2003)。これらの報告では、様々な生物でスフィンゴシン-1-リン酸リアーゼ(SPL)が細胞内S1Pレベルを調節しており、線虫のSPL欠損体においては胚発生が正常にできず、器官の分化や発達が異常であるためセミリーサルであった。
【0009】
脱リン酸化酵素である前記SPPについて、酵母Saccharomyces cerevisiaeはLCB3p/YSR2p/Lbp1pとYSR3/Lbp2p/YSR2-1pという二つのSPPをもっている。この2つはホモログであるが、その活性の大部分を占めているのはLCB3p/YSR2p/Lbp1pである。これらのタンパク質はERに局在している。また、哺乳類のSPPも2つのホモログであるSPP(SPP1とSPP2)をもっていて、酵母と同様にERに局在し、その活性の大部分を占めているのはSPP1であると考えられている。
【0010】
Lipid phosphate ホスファターゼはSPP(S1P phosphohydorase)ファミリーとLPP(type2 lipid phosphate phosphohydrolase)ファミリーとに分けられる。これらの2つは配列・生物的性質も異なる。中でも最も異なる点は、SPPファミリーはS1P、dihydroS1P、phytoS1Pに高い基質特異性を示すが、LPPファミリーはS1P、phosphatidate(PA)、lysophosphatidate (LPA)、ceramide-1-phosphateやdiacylglucerol-pyrophosphateなど、広い基質を持っている点である。SPPとLPPの両方のタンパク質は次のような3つのモチーフを持っている。即ち、モチーフ1:KXXXXXXRP、モチーフ2:PSGH、モチーフ3:SRXXXXXHXXXDである。これらのモチーフは他のホスファターゼスーパーファミリー(lipid phosphatases、glucose-6-phosphatases、バクテリア非特異的酸ホスファターゼ、クロロペルオキシダーゼなど)でも発見されている。また、クロロペルオキシダーゼの結晶構造は、この3つのモチーフが近接していることを示し、コファクターであるバナジウム酸エステルの結合ポケットを形成しているのはこの3つのモチーフであることを明らかにした。そして、この3つの保存された領域の突然変異体の解析から、酵素活性の中心がここであることが示された。
【0011】
一方、植物の葉からの水分蒸散を抑制することで、植物の耐乾燥性を向上させることが研究されている。例えば、切花の鮮度を保持するために、葉からの水分蒸散を抑制する物質としてアミン化合物が使用されている(例えば、特許文献1)。しかしながら、この方法は、植物自体に耐乾燥性を持たせる方法ではない。
【0012】
【特許文献1】特開2002−53402号公報
【発明の開示】
【発明が解決しようとする課題】
【0013】
本発明は、以上の様な状況下なされたものであり、その課題・目的は、植物における細胞内スフィンゴシン 1-リン酸レベルの制御機構について研究を進め、産業上有用な葉の水分蒸散を調節する方法、植物の耐乾燥性を向上させる方法、さらには、植物の耐乾燥性を向上させる物質のスクリーニング方法などを提供することにある。
【課題を解決するための手段】
【0014】
本発明者は、上記の課題を解決するため、特に前記スフィンゴシン-1-リン酸ホスファターゼ(SPP)に着目し、SPPは植物においてスフィンゴシン 1-リン酸(S1P)の細胞内レベルを調節する上で重要な役割を果たし、S1Pによる気孔機能の調節機構に関与しているのではないかと考えた。そのため、A. thalianaよりSPP 遺伝子としてAtSPP1(以下、単に「SPP1」ともいう)遺伝子をクローニングし、酵素機能の解析および植物内でのSPPによる細胞内S1Pレベルの制御機構について鋭意検討を行った。さらに、SPP1遺伝子を欠損させたSPP1欠損体において水分蒸散量が抑制され、SPP遺伝子発現の抑制が植物の葉の水分調節に関与していること等を見出し、本発明を完成するに至った。
【0015】
即ち、本発明は第1に、植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を制御することによって葉の水分蒸散を調節する方法、とりわけ、植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制することによって葉の水分蒸散を抑制する方法、を提供するものである。
【0016】
後述の実施例にも示すように、スフィンゴシン-1-リン酸ホスファターゼ(SPP1)を欠損させたSPP1欠損体においては、野生株よりも水分蒸散量が有意に低下、抑制されている。また、植物に乾燥ストレスを与えるとSPP1遺伝子の転写レベルが低下するという後述の結果をあわせて考慮すると、SPP遺伝子は葉の水分蒸散を正に制御する機能をもった遺伝子であり、乾燥ストレス下ではその転写レベルが低下するものと考えられる。
【0017】
したがって、SPPの遺伝子発現または活性を制御することによって、植物の葉の水分蒸散を抑制し、あるいは促進することが可能である。すなわち、SPPは、植物においてスフィンゴシン 1-リン酸(S1P)の細胞内レベルの調節に関与して植物の気孔開閉のシグナル伝達を制御していると考えられるので、SPPの遺伝子発現または活性を制御することによって気孔開閉を制御し、葉の水分蒸散の調整、調節に利用することができる。
【0018】
また、SPPの遺伝子発現または活性を抑制することによって気孔からの水分蒸散を抑え、植物の耐乾燥性を高めることができる。これにより、例えば植物をしおれにくくし、つまり日持ちを良くして鑑賞植物の長寿命化に利用したり、従来生産困難であった乾燥地域での生産を可能にすることによって、鑑賞植物および農作物の生産地域の拡大に利用することができる。さらに、水分環境が十分ではない乾燥環境(乾燥ストレス)に強い植物を創出することができるので、砂漠の緑化用耐乾燥性植物の創出などに利用することも可能である。
【0019】
さらに、前記スフィンゴシン-1-リン酸リアーゼ(SPL)の遺伝子発現または活性を制御することによって、気孔からの水分蒸散を調節し、また植物の耐乾燥性を向上できることが本発明者によって見出されている(特願2005−234607号)。したがって、同号明細書記載の方法と組み合わせて、SPPの遺伝子発現(又はその活性)の制御と共に、SPLの遺伝子発現(又はその活性)を制御する方法は、気孔からの水分蒸散を更に良好に調節し、植物の耐乾燥性をより向上することが期待できる好ましい方法である。
【0020】
SPPの遺伝子発現または活性を抑制する方法については、特に制限されるものではない。SPP遺伝子の発現量を抑制する方法としては、SPPゲノムを改変する方法(例えば後述のノックアウト法)、転写後に抑制する方法(例えば後述のRNAi法によるノックダウン法)が例示される。その他、SPP遺伝子の転写を選択的に阻害・抑制する方法であってもよいし、SPPのスプライシング,翻訳、翻訳後修飾の何れかのプロセスを選択的に阻害し、SPP蛋白の発現を特異的に抑制する方法であってもよい。後述の「スフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制する物質」としては、SPPの酵素活性を阻害・抑制する作用を持つ物質のほか、このようにSPP蛋白の発現を特異的に抑制する作用を持つ物質であってもよい。本発明は、このような物質を植物細胞、組織または植物個体に投与することによってSPPの発現または活性を抑制する方法も含まれる。
【0021】
SPP遺伝子の発現量を特異的に抑制する方法として、RNAi法を用いてもよい。例えば、人工的に作製したsiRNAを植物細胞内に導入する方法や、SPP特異的RNAi発現ベクターを作製し、これを植物細胞内に導入する方法などが例示される。SPP特異的RNAi発現ベクターは、(1)1本のRNAで適当な長さのヘアピン構造をもつdsRNAを対象細胞内で発現させるように設計されたもの、(2)センス鎖、アンチセンス鎖それぞれを対象細胞内で発現させ、会合させるように設計されたもの、のいずれであってもよい。RNAi発現ベクターを使用することにより、植物細胞においてSPP遺伝子の細胞内発現を持続的・安定的に抑制することができる。本発明は、このようなsiRNAやRNAi発現ベクターを植物細胞に導入することによってSPPの発現を特異的に抑制し、植物の耐乾燥性を高める方法、つまり、SPP発現を特異的に抑制するsiRNAやRNAi発現ベクターを植物の耐乾燥性向上剤として利用する方法をも含むものである。
【0022】
なお、本発明において植物細胞でのSPPの発現を抑制する方法としては、野生型と比べてSPPの発現量を実質的に低下させる方法であればよく、SPPの発現を完全に抑制するものでなくてもよい。
【0023】
siRNAやRNAi発現ベクターの配列は特に限定されるものではなく、対象植物のSPP遺伝子配列をもとに公知の方法にしたがって任意に設計すればよい。例えば、シロイヌナズナのSPP1遺伝子について、配列表の配列番号1および図10にはそのcDNA配列が示される。この配列をもとに、シロイヌナズナのSPP1遺伝子の発現を特異的に抑制するsiRNAやRNAi発現ベクターを設計することが可能である。
【0024】
SPP遺伝子の発現を特異的に抑制するその他の方法としては、例えば、アンチセンスオリゴヌクレオチド、リボザイム、低分子化合物などを対象となる植物細胞、組織または植物個体に投与する方法が挙げられる。なお、本発明における「植物」の範疇には、植物個体のほか、植物の根、茎、葉、生殖器官(花器官および種子を含む)などの各種器官(特に葉)、各種組織、植物細胞などが含まれ、さらにはプロトプラスト、スフェロプラスト、誘導カルス、再生個体およびその子孫、なども含まれるものとする。また、本発明は双子葉植物に限らず、単子葉植物に適用してもよい。
【0025】
SPP遺伝子の発現を特異的に抑制する更に他の方法として、ノックアウト(遺伝子破壊)法を挙げることができる。この方法はT-DNA、トランスポゾン等を利用してタグライン(遺伝子破壊株の集団)を作製し、この中からPCR等でSPP遺伝子が破壊された系統を選抜することにより、ゲノム中のSPP遺伝子がノックアウトされた変異体を得るものである(例えば、「細胞工学別冊 植物細胞工学シリーズ14 植物のゲノム研究プロトコール」(秀潤社)66−67頁、82−84頁参照)。
【0026】
SPP遺伝子を破壊するためのT-DNA、トランスポゾンの挿入位置としては、SPPの発現・活性を欠損または野生型に比べて著しく低下させることができれば、イントロン領域であってもよいしエクソン領域であってもよいし、あるいはプロモーター領域であってもよい。また、SPPの発現・活性を著しく低下させることができれば、SPPホモ欠損体に限らず、SPPヘテロ欠損体であってもよい。「著しく低下させる」とは、例えば野生型の発現または活性を100としたときに、SPPの発現または活性が80%以下、好ましくは50%以下、更に好ましくは30%以下になることを意味する。
【0027】
SPP遺伝子がノックアウトされたミュータントの選抜方法としては、使用するT-DNA等の塩基配列とSPP遺伝子の塩基配列とに基づいて、SPP遺伝子の領域にT-DNA等が挿入されたものを選抜することによって行うことができるが(後述の実施例参照)、この方法に限定されるものではない。得られたミュータントのカルスを再分化させることによりミュータントの植物個体を得ることができる。
【0028】
上記ノックアウト(遺伝子破壊)法以外に、ゲノム中のSPP遺伝子の配列を人為的に改変することによって、植物細胞でのSPP遺伝子の発現を抑制してもよい。例えば、部位特異的変異導入法(Site-Directed Mutagenesis)等によってSPPの酵素活性に重要な領域に点変異などの変異を導入し、本来の活性を失ったSPP変異蛋白を発現するように改変する方法などが挙げられる。
【0029】
本発明は、前述のようにSPPの機能解析の結果その機能に着目し、植物細胞でのSPPの発現又はその活性を制御することにより、葉の水分蒸散を調節する方法であり、発現・活性の制御は、発現・活性を抑制することと亢進することとの両方を含む意味である。SPPの発現又はその活性を亢進する方法としては、例えば、SPP発現ベクターを植物細胞内に導入してSPPを過剰発現させる方法や、SPPを活性化する薬剤を投与する方法などが挙げられる。SPPの発現・活性を高め、水分蒸散を促進することによって、植物の発育・生長を促進し、鑑賞植物等の生産力向上などに利用することが考えられる。
【0030】
勿論、これまで説明した上記例示の方法に限らず、従来公知の種々の方法を適用してSPPの発現および活性を制御することができる。また、本発明以降に新たに開発された方法を使用するものであってもよい。
【0031】
前述のように、植物細胞でのSPPの発現又はその活性を抑制することによって気孔からの水分蒸散を抑え、植物の耐乾燥性を高めることができるので、スフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制する物質は、植物の耐乾燥性向上剤として有用であり、そのスクリーニング方法も本発明に含まれる。
【0032】
本発明のスクリーニング方法としては、遺伝子・蛋白の発現量、酵素の活性変化等を調べる従来公知の種々の方法を適用することができ、特に限定されるものではない。また、本発明以降に新たに開発されたスクリーニング方法を使用するものであってもよい。in vitro及びin vivoスクリーニング系のいずれであってもよいし、cell-free systemでスクリーニングを行ってもよい。また、SPP遺伝子・蛋白は、シロイヌナズナ由来のもののほか、他の植物由来のものを使用してもよい。勿論、SPP蛋白の高次構造の情報を利用してスクリーニングを行ってもよい。
【実施例】
【0033】
以下、図面を参照しながら本発明の実施例について説明するが、本発明は下記実施例によって何ら限定されるものではない。
【0034】
[本実施例の要旨]
Arabidopsis thalianaからSPP遺伝子を単離し、植物においてSPPの機能解析を行った。まず酵母YSR2とのアミノ酸配列によるBLASTサーチを行い、A. thalianaのSPP1であると推定される遺伝子(AtSPP1)を見出し、クローニングした。単離した遺伝子がA. thaliana SPP1であることを証明するために、S. cerevisiaeのDPL 欠損株(Δdpl1)においてA. thaliana SPP1遺伝子を導入し、発現させることでDPL活性を相補するか調べた。スフィンゴシン存在下でΔdpl1はS1Pの蓄積により成長阻害される。一方、A. thaliana SPP1を発現させたΔdpl1は成長阻害を受けなかった。また、これらの形質転換体からスフィンゴシンおよびスフィンゴシン1-リン酸を抽出し、HPLCにより分析することでスフィンゴイドシン1-リン酸の脱リン酸化を確認した。これらのことから、今回単離した遺伝子が機能的にA. thaliana SPP1をコードしていることが示された。SPP1のA. thalianaにおける役割を調べるために、半定量的RT-PCR法を用いて、各器官の転写レベルを分析した。その結果、SPP1遺伝子は花で特にmRNA蓄積レベルが高かった。乾燥ストレスを与えたA. thalianaから経時的にmRNAを抽出し、半定量的RT-PCR法によって分析した結果、乾燥ストレスの時間が増加するに従ってSPP1遺伝子のmRNAの蓄積レベルが低下していた。SPP1のA. thaliana内での気孔開閉に関わる役割を検討するために、A. thaliana SPP1欠損体の水分蒸散量を調べた。その結果、SPP1欠損体では野生株よりも水分の蒸散量が約1/3に減少していた。これらの結果は、A. thalianaにおいてSPP1の発現制御が細胞内S1Pレベルを調節し、さらにこの調節を介して気孔開閉を制御し得ることを植物において実証するものである。
【0035】
[実験材料と方法]
[I]AtSPP1遺伝子の単離と機能活性
材料
シロイヌナズナ(Arabidopsis thaliana) T87培養細胞は独立行政法人理化学研究所 バイオリソースセンターから購入した。この培養細胞からmRNAを抽出しcDNAとし、それをテンプレートにクローニングを行った。酵母Saccharomyces cerevisiae BY4741株、Δdpl1株(DPL:dihydro-sphingosin-1-phosphate 欠損株)はInvitrogen社から購入した。
【0036】
培養細胞からのRNAの抽出とcDNAの作製
1週間培養したT87培養細胞 0.1gを使用した。QIAGEN RNeasy Plant Mini Kit(50)を使用しRNAを抽出した。これをテンプレートに全RNAからcDNAを作製した。また、余分なRNAを除くためにRNaseH(Invitrogen)処理をした。
【0037】
酵母からのRNAの抽出とcDNAの作製
YPD培地で16時間前培養したBY4741株をovernight本培養し、T87培養細胞と同様にRNAを抽出した。これをテンプレートに上記と同様にcDNAを作製し、RNaseH処理をした。
【0038】
インサートとベクターの調製
上記A. thalianaとBY4741のcDNAをテンプレートにN末端側領域とC末端側領域をPCRした。使用したプライマーは、下記表1のAtLCB3-F、AtLCB3-R2、YSR2-FおよびYSR2-R2である。
【表1】

【0039】
PCR産物を1%アガロースゲルで90分間電気泳動し、エチジウムブロマイドで染色し、共に約1200 bp付近のバンドを抽出した。また、pYES2ベクターを用いて大腸菌JM109への形質転換を行い、アンピシリンを含む液体培地で培養し、WizardTM Plus Minipreps(Promega)を用いてプラスミドDNAを調製した。こうして得られた2つのDNA溶液とプラスミドDNAを制限酵素Hind IIIとNot IでDouble Digestionを行った。
制限酵素処理後に10×loading bufferを加え、そのうちの5μLを0.5×TBE中で1%アガロースゲルで90分間電気泳動を行い、エチヂウムブロマイドで染色した。バンドをゲルから切り出し、GeneEluteTM MINUS EtBr SPIN COLUMN(SIGMA)を用いてDNAを精製した。
【0040】
ライゲーション反応
調製したインサートとベクターを、DNA ligation Kit Ver.2 SolutionI(TaKaRa)を使い16℃、2時間ライゲーション反応させた。
【0041】
大腸菌への形質転換
ライゲーション反応液を使い、大腸菌JM109へのヒートショックによる形質転換を行った。形質転換体はアンピシリンを含むLB培地で37℃、16時間培養し、得られたコロニーを選抜しN末端側領域とC末端側領域(pYES2-F、pYES2-R)を用いたダイレクトPCRによりインサートの有無を確認した。インサートの存在が確認されたポジティブクローンは培養後WizardTM Plus Minipreps(Promega)を用いてプラスミドDNAを精製した。
【0042】
シークエンスによるインサートの確認
精製したプラスミドDNA(0.20μg/μL)のインサート配列のシークエンスを行った。これによってインサートがAtSPP1とYSR2の正確な配列をしており、かつ正確に挿入されていることを確認した。使用したプライマーは、pYES2-F、pYES2-R、AtLCB3-F、AtLCB3-R2、SEQ-AtLCB3、YSR2-F、YSR2-R2、SEQ-YSR2-FおよびSEQ-YSR2-Rである。
【0043】
pYES2-AtSPP1とpYES2-YSR2の酵母Δdpl1への形質転換
上記pYES2-AtSPP1、pYES2-YSR2、およびpYES2(空ベクター)をそれぞれΔdpl1株に酢酸リチウム法で導入し、形質転換させた。これにより得られた形質転換体をそれぞれ、Δdpl1-pYES2-AtSPP1、Δdpl1-pYES2-YSR2、およびΔdpl1-pYES2とする。
上記形質転換体を用いて、10μM sphingosineを含む培地でAtSPP1による機能的相補性実験を行った。YPD培地(-ガラクトース,-スフィンゴシン)、最小培地(-ガラクトース,+10μMスフィンゴシン)および最小培地(+ガラクトース,+10μMスフィンゴシン)にそれぞれ、野生株(BY4741)、Δdpl1、Δdpl1-pYES2-AtSPP1、Δdpl1-pYES2-YSR2およびΔdpl1-pYES2をストリークし、28℃で培養した。Δdpl1は10μMスフィンゴシンにより成長阻害されるSphingoid basesリアーゼ欠損株であり、pYES2ベクターはガラクトースで誘導されるGal1プロモーターを持つ。
【0044】
HPLCによるAtSPP1の活性測定
相補が確認された酵母形質転換株をそれぞれ50μMスフィンゴシンで2時間処理し、洗浄後、細胞を破砕しスフィンゴシンおよびスフィンゴシン1-リン酸を抽出した。C18カラムで逆相クロマトグラフィー分析を行った。
【0045】
[II]A. thaliana内におけるAtSPP1の解析
各器官におけるmRNA蓄積レベルの解析
本実施例で使用したA.thalianaはColumbia株である。MS寒天培地上で23℃、2,000lux(National FL 20S-PG 植物育成用ランプ)、明期16時間、暗期8時間の長日条件下で栽培した。根・茎・葉・花の各試料は上記条件で4週間栽培したものをそれぞれ100 mg使用した。QIAGEN RNeasy Plant Mini Kit(50)を使用しRNAを抽出した。これをテンプレートにcDNAを作製し、PCRを行った。はじめに、mRNAの転写量をそろえるために全組織で同程度に発現しているアクチン(Act2)遺伝子増幅用プライマー(At-Act2-FとAt-Act2-R)を使ってPCRを行った。その後、At-Act2のシグナル強度が一致した各器官のテンプレート量で、AtLCB3-FとAtLCB3-R2を使ってPCRを行い、AtSPP1のシグナル強度を測定し、根、茎、葉、花におけるmRNA蓄積レベルの違いを分析した。
【0046】
乾燥ストレスによるAtSPP1 mRNA蓄積レベルの変化
植物体への乾燥ストレスの与え方は吉田らの方法に従って、乾燥ストレスにより発現誘導がかかるSRK2Eをポジティブコントロールとして以下のように行った(Yoshida et al. 2002)。MSプレート培地で育てた播種後4 週間のA. thalianaを用い、インキュベーター内でプレートの蓋を開けて放置することで乾燥ストレスを与えた。0、1、2、3 時間それぞれ経時的にストレスを与えたA. thalianaの葉から全RNAを抽出し、cDNAをそれぞれ調製した。コントロールをAt-Act2とし、ストレスを与えた各時間のAt-Act2のシグナル強度が一致する条件でAtSPP1のmRNA蓄積レベルの変化を分析した。
【0047】
[III]AtSPP1欠損A. thalianaを用いた機能解析
AtSPP1欠損体の単離
Salk Institute Genomic Analysis Laboratory によるシロイヌナズナの遺伝子破壊株の集団の中から、At3g58490にT-DNAが挿入されている種子を複数見出した(SALK_0489081、SALK_035202およびSALK_027084)。これらの種子をMS-カナマイシン培地(カナマイシン25 mg/ml)プレートに蒔き、カナマイシン耐性の個体の葉からゲノムDNAを調製した。これを鋳型として、AtSPP1ゲノム内の配列をもとに作製した下記プライマーI(primerI)とプライマーII(primerII)を用いたPCR、及び、プライマーI(primerI)とT-DNAのレフトボーダープライマーであるプライマーIII(primerIII)を用いたPCRを行った(図8)。そして、前者のPCRで増幅産物が得られず、後者のPCRで増幅産物が得られた3種類のAtSPP1欠損体(Int、Ex1、Ex2)を単離した。さらに、これらのAtSPP1欠損体の葉から全RNAを抽出し、RT-PCRを行ってmRNAの発現がないことを確認した。
primerI : 5’-ATGAAGAAGATTCTAGAAAGATC-3’ (14) Int,Ex1の場合
5’-CTACAAGTTAACGTAAGAGAATAGT-3’(15) Ex2の場合
primerII : 5’-CTACAAGTTAACGTAAGAGAATAGT-3’(15) Int,Ex1の場合
5’-ATGAAGAAGATTCTAGAAAGATC-3’ (14) Ex2の場合
primerIII: 5’-TGGTTCACGTAGTGGGCCATCG-3’ (16)
かっこ内の数字は配列表の配列番号を示す。
【0048】
AtSPP1欠損体における蒸散率測定
野生株およびAtSPP1欠損体の蒸散率は以下のように測定した。発芽日をそろえるためにMS培地に播種した。発芽後3週目に植物体をバーミキュライトへ植え替え、乾燥ストレスがかからないように、3日間湿度を高く保った。その後通常の育成条件に戻し、発芽後4週後の植物体の根を切り離し、光の影響などを受けないようにインキュベーター内で地上部の蒸散量を経時的に測定した。
【0049】
[実験結果及び考察]
[I]Arabidopsis thaliana SPP1 (AtSPP1)遺伝子の単離および構造解析
酵母Saccharomyces cerevisiaeのYSR2 (accession number NC_001142)とのアミノ酸配列によるBLASTサーチを行い、モデル植物であるシロイヌナズナ(Arabidopsis thaliana)より、スフィンゴシン-1-リン酸ホスファターゼ遺伝子(AtSPP1)をクローニングした。
クローニングしたAtSPP1 cDNAの塩基配列、およびそのコードするアミノ酸配列を図10(並びに配列表の配列番号1・2)に示す。AtSPP1のORFは1251bpであり、416アミノ酸残基からなり、等電点は8.23のタンパク質をコードしていた。また、AtSPP1ゲノムは第3染色体上に位置し、8個のエクソンからなる。
このAtSPP1アミノ酸配列と、既にクローニング、機能解析が行われている酵母やヒトのSPP1アミノ酸配列とのアライメントを行った結果を図1に示す。アライメント結果より、AtSPP1は、酵母やヒトのSPP1と同様にホスファターゼ活性に重要な3つのモチーフ(motif1:KXXXXXXRD、motif2:PSGH、motif3:SRXXXXHXXXD)を持っていた。これらのモチーフはバナジウム酸エステル結合モチーフである。AtSPP1は他のSPPとアミノ酸レベルでの相同性はIdentityが26.7%、Similaritiesが38.8%であった。相同性はあまり高いものではなかったが、酵母とヒト、または酵母とマウスなどを比べた場合も同様の傾向がある。
また、AtSPP1のハイドロパシー分析の結果を図2に示す。同図に示すように、AtSPP1においても、酵母のYSR2と同様にバナジウム酸エステル結合モチーフが確認され、また、膜貫通型の酵素であると考えられる。AtSPP1では、N末端側の約75個のアミノ酸がAtSPP1に特異的であった。さらに、AtSPP1の系統解析を行った結果、図3に示すように、AtSPP1は、SIPのみを基質にするSPP Familyに属すると判断された。
【0050】
[II]AtSPP1の酵母内における発現及び機能解析
AtSPP1による機能的相補性実験
A. thalianaのSPP1をコードしていると予想されるAtSPP1遺伝子のcDNAをクローニングしたが、この遺伝子がコードするタンパク質が機能的にSPP活性を持つことを、酵母のリアーゼミュータント(Δdpl1)を用いて確認した。Δdpl1はリアーゼ活性がないため、スフィンゴシンが含まれる培地ではS1Pが分解されずに蓄積するため成長阻害される。そこで、クローニングしてきたcDNAをΔdpl1に遺伝子導入し、タンパク質を発現させることで酵母のDPL活性を補うことができるか実験した。
【0051】
Δdpl1は10μM スフィンゴシンで成長阻害をうけた。しかし、pYES2-AtSPP1、pYES2-YSR2形質転換体は、ガラクトースによるGAL1プロモーターの発現誘導をかけると10μM スフィンゴシンを含む培地で生えてきた。一方、pYES2のみの空ベクターとΔdpl1は生えてこなかった(図4)。このことから、pYES2-AtSPP1とpYES2-YSR2の形質転換体はS1P感受性の形質を相補したといえる。S1Pを分解するSPLの形質が相補されたということは、AtSPP1がS1Pを分解する酵素活性を有していることを示している。さらに配列の相同性などの点から、クローニングしたAtSPP1は、S1Pホスファターゼ遺伝子と判断された。
【0052】
HPLCによるAtSPP1の活性測定
Δdpl1においてAtSPP1を発現させ、sphingosine耐性を与えたことで機能的相補を確認したが、実際にS1Pを脱リン酸化していることを確認するためにHPLCを用いた活性測定を行った。Δdpl1-pYES2、Δdpl1-pYES2-YSR2(Δdpl1-YSR2)およびΔdpl1-pYES2-AtSPP1(Δdpl1-AtSPP1)からスフィンゴ脂質を抽出する前に、50 mM sphingosine培地で2 時間培養することによりsphingosineを吸収させた。酵母はsphingosineタイプのスフィンゴイド塩基を持たないため、sphingosineを吸収させることでS1Pを蓄積させ、SPPによるS1Pの脱リン酸化を確認するためにこの操作を行った。この結果を図5に示す。図示のように、Δdpl1-AtSPP1では、S1Pを脱リン酸化することができた。以上のAtSPP1における機能的相補試験およびHPLCを用いたin vivoでの分析により、AtSPP1がスフィンゴイド塩基 1-リン酸を脱リン酸化し、さらにS1Pを基質とすることが分かった。
【0053】
[III]A. thaliana内におけるAtSPP1の機能解析
各器官におけるmRNA蓄積レベルの解析
A. thalianaにおけるAtSPP1の発現解析のために、各器官のmRNA蓄積レベルをsemi-quantitative RT-PCR法により分析した。At-Act2のシグナル強度が一致した根、茎、葉、花のテンプレート量でAtSPP1について分析した。この結果を図6に示す。図示のように、全ての器官でmRNAの発現はみられたが、根、茎、葉においてはAtSPP1のmRNA蓄積レベルに目立った差はなかった。しかし、花においては、根の約5 倍のAtSPP1のmRNAの蓄積が見られた。
【0054】
乾燥ストレスによるAtSPP1 mRNA蓄積レベルの変化
次に、AtSPP1が細胞内S1Pレベルを調節することにより、気孔閉鎖のメカニズムの過程でどのように関わっているのかを調べるために、乾燥ストレスを与えることによるAtSPP1 mRNAの蓄積レベルを上記と同様の方法で調べた。この結果を図7に示す。図示のように、AtSPP1においては、乾燥ストレスを与える時間が増加するに従ってmRNA蓄積レベルは低下していった。この結果から、S1Pがシグナル伝達物質として作用する気孔閉鎖メカニズムにAtSPP1が関与し、細胞内S1P量を調節していることが考えられる。
【0055】
[IV]AtSPP1欠損A. thalianaを用いた機能解析
AtSPP1欠損体の単離
乾燥ストレスによるmRNA蓄積レベルの変化を調べた結果より、AtSPP1が欠損した植物体はS1Pが通常よりも蓄積すると考えられるため、乾燥ストレスに強い植物体になるのではと考えた。そこで、SALK種子を用いてAtSPP1が欠損している個体をスクリーニングした。その結果、3種類のAtSPP1欠損体(Int、Ex1、Ex2)が得られた(図8)。
即ち、WTと各AtSPP1欠損体から抽出したゲノムをテンプレートとして図8に各位置を示すプライマーでPCRを行った。その結果、プライマーI(primerI)とプライマーII(primerII)で行ったPCRでは、WTのみに約2,027 bpのシグナルが確認できた。また、プライマーI(primerI)とT-DNAのLBプライマー(primerIII)で行ったPCRでは、各AtSPP1欠損体(Int、Ex1、Ex2)のみに増幅バンドが確認できた。この結果より、各AtSPP1欠損体はホモでAtSPL1遺伝子が破壊されているといえる。また、シークエンス解析の結果、T-DNAは、Intでは第1イントロンに、Ex1では第2エクソンに、Ex2では第3エクソンにそれぞれ挿入されていることが分かった。
【0056】
AtSPL1欠損体における蒸散率測定
WTおよび各AtSPP1欠損体の蒸散率を調べた結果を図9に示す。WTと各AtSPP1欠損体とでは、その形態に相違は認められなかった。しかし、図9に示すように、WTは2 時間後には約70 %もの水分を蒸散により失っていた。一方、各AtSPP1欠損体では測定開始直後から明らかにWTよりも蒸散量は低い状態を維持し、例えばEx1では、2 時間後でも20 %程度の蒸散率であった。他のAtSPP1欠損体(Ex2及びInt)についても同様に蒸散率は低い状態を維持した。
AtSPP1欠損体ではSPP1がノックアウトされているため、WTよりもS1Pが植物体内に蓄積していると考えられる。したがって、測定開始直後から明らかな差が出たと考えられる。また、閉じていなかった気孔もS1Pが初めから多く存在しているため、結果的にWTよりも早く、そしてより多くの気孔を閉じることができたと考えられる。これらのことから例えばAtSPP1欠損体Ex1では最終的にWTよりも蒸散率が約3分の1減少するという結果がでたと考えられる。
【0057】
以上の結果より、今回初めて植物においてA. thalianaからAtSPP1を単離し、Δdpl1を用いた機能的相補実験およびHPLCによるin vivoでの分析によりSPP酵素活性を確認した。植物内では花においてAtSPP1のmRNA蓄積レベルが高かった。また、乾燥ストレスにより、AtSPP1のmRNAの蓄積が低下する。AtSPP1欠損体を用いた分析では、AtSPP1欠損体はWTよりも蒸散率が約3分の1減少するという結果を得た。これらのことから、SPPは動物細胞や酵母と同様に植物において細胞内S1Pレベルを調節しており、気孔開閉を調節していることが示唆された。
【0058】
以上のように、スフィンゴシン-1-リン酸ホスファターゼ(SPP)ホモ欠損体においてはS1Pが多く蓄積しているためにWTよりも気孔をより多く閉じていると考えられる。この結果から、SPPは気孔開閉の調節機構に関与し、SPPの発現量や活性を変化させることによって、水分量が十分にある環境下では気孔をできるだけ開かせて光合成を促進することに利用する一方、水分環境が十分ではない環境においては気孔閉鎖を促進させて乾燥ストレスに強い植物の創出などに利用できると考えられる。
【産業上の利用可能性】
【0059】
以上のように、本発明は、植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を制御することによって葉の水分蒸散を調節する方法、及び植物の耐乾燥性を向上させる方法に関するものであり、前述したとおり、鑑賞植物の長寿命化、鑑賞植物および農作物の生産地域の拡大、砂漠の緑化用耐乾燥性植物の創出などの分野において利用できるほか、産業上種々の分野への利用が可能である。
【0060】
[参考文献]
An, S., Zheng, Y., and Bleu, T. (2000) Sphingosine 1-phosphate-induced cell proliferation, survival, and related signaling events mediated by G protein-coupled receptors Edg3 and Edg5. J Biol Chem. 275:288-296.
Birchwood, C. J., Saba, J. D., Dickson, R. C., and Cunningham, K. W. (2001) Calcium influx and signaling in yeast Stimulated by intracellular sphingosine 1-phosphate accumulation. J Biol Chem. 276:11712-11718.
Caligan, T. B., Peters, K., Ou, J., Wang, E., Saba, J., and Merrill, A. H. Jr. (2000) A high-performance liquid chromatographic method to measure sphingosine 1-phosphate and related compounds from sphingosine kinase assays and other biological samples. Anal. Biochem. 218:36-44.
Chung, N., Mao, C., Heitman, J., Hannun, Y. A., and Obeid, L. M. (2001) Phytosphingosine as a specific inhibitor of growth and nutrient import in Saccharomyces cerevisiae . J Biol Chem. 276:35614-35621.
Coursol, S., Fan, L. M., Le, S. H., Spiegel, S., Gilroy, S., and Assmann, S. M. (2003) Sphingolipid signaling in Arabidopsis guard cells involves heterotrimeric G proteins. Nature. 423:651-654.
Gottlieb, D., Heideman, W., and Saba, J. D. (1999) The DPL1 gene is involved in mediating the response to nutrient deprivation in Saccharomyces cerevisiae. Mol Cell Biol Res Commun. 1:66-71.
Jenkins, G. M., Cowart, L. A., Signorelli, P., Pettus, B. J., Chalfant, C. E., Hannun, Y. A. (2002) Acute activation of de novo sphingolipid biosynthesis upon heat shock causes an accumulation of ceramide and subsequent dephosphorylation of SR proteins. J Biol Chem. 277:42572-42578.
Haak, D., Gable, K., Beeler, T., and Dunn, T. (1997) Hydroxylation of Saccharomyces cerevisiae ceramides requires Sur2p and Scs7p. J Biol Chem. 272:29704-29710.
Hakomori, S. (1981) Glycosphingolipids in cellular interaction, differentiation, and oncogenesis. Annu Rev Biochem. 50:733-764.
Hannun, Y. A. (1986) Sphingosine inhibition of protein kinase C activity and phorbol dibutyrate binding in vitro and human platelets. Science. 243:500-507.
Hannun, Y. A., and Bell, R. M. (1989) Functions of sphingolipids and sphingolipid breakdown products in cellular regulation. J Biol Chem. 261:12604-12609.
Herr, D. R., Fyrst, H., Phan, V., Heinecke, K., Georges, R., Harris, G. L., and Saba, J. D. (2003) Sply regulation of sphingolipid signaling molecules is essential for Drosophila development. Development. 130:2443-2453.
Igarashi, Y. (1997) Functional roles of sphingosine, sphingosine 1-phosphate, and methylsphingosines: in regard to memblane sphingolipid signaling pathways. J. Biochem. 122:1080-1087.
Imai, H., and Nishiura, H. (2005) Phosphorylation of sphingoid long-chain bases in Arabidopsis: functional characterization and expression of the first sphingoid long-chain base kinase gene in plants. Plant Cell Physiol. In press.
Kandasamy, M. K., McKinney, E. C., and Meagher, R. B. (2002) Functional nonequiv
alency of actin isovariants in Arabidopsis. Mol Biol Cell. 13:251-261.
Kim, S., Fyrst, H., and Saba, J. (2000) Accumulation of phosphorylated sphingoid long chain bases results in cell growth inhibition in Saccharomyces cerevisiae. Genetics. 156:1519-1529.
Kim, M. S., Lee, D. Y., Wang, T, and Schroeder, J. J. (2001) Fumonisin B(1) induces apoptosis in LLC-PK(1) renal epithelial cells via a sphinganine- and calmodulin-dependent pathway. Toxicol Appl Pharmacol. 176:118-126.
Li, G., Foote, C., Alexander, S., and Alexander, H. (2001) sphingosine-1-phosphate lyase has a central role in the development of Dictyostelium discoideum. Development. 128:3473-3483.
Mendel, J., Heinecke, K., Fyrst, H., and Saba, J. D. (2003) Sphingosine phosphate lyase expression is essential for normal development in Caenorhabditis elegans. J Biol Chem. 278:22341-22349.
Merrill, A. H., Jr. (1991) Cell regulation by sphingosine and more complex sphingolipids. J Bioenerg Biomembr. 23:83-104.
Nakamura, S., Kozutsumi, Y., Sun, Y., Miyake, Y., Fujita, T., and Kawasaki, T. (1996) Dual roles of sphingolipids in signaling of the escape from and onset of apoptosis in a mouse cytotoxic T-cell line, CTLL-2. J Biol Chem. 273:19437-19442.
Ng, C. K.-Y., Carr, K., McAinsh, M. R., Powell, B., and Hetherington, A. M. (2001) Drought-induced guard cell signal transduction involves sphingosine 1-phosphate. Nature. 410:596-599.
Nishiura, H., Tamura, K., Morimoto, Y., and Imai, H. (2000) Characterization of sphingolipid long-chain base kinase in Arabidopsis thaliana. Biochem Soc Trans. 28:747-748.
Riboni, L., P. Viani, R. Bassi, A.Prinetti and G.tettamanti. (1997) The role of sphingolipids in the process of signal transduction. Prog. Lipid Res. 36: 153-195.
Obeid, L. M., Linardic, C. M., Karolak, L. A., and Hannun, Y. A. (1993) Programmed cell death induced by ceramide. Science. 259:1769-1771.
Ohashi Y, Oka A, Rodrigues-Pousada R, Possenti M, Ruberti I, Morelli G, Aoyama T. (2003) Modulation of phospholipid signaling by GLABRA2 in root-hair pattern formation. Science. 300:1427-30.
Orlati, S., Porcelli, A. M., Hrelia, S., Van Brocklyn, J. R., Spiegel, S., and Rugolo, M. (2000) Sphingosine-1-phosphate activates phospholipase D in human airway epithelial cells via a G protein-coupled receptor. Arch Biochem Biophys. 375:69-77.
Pyne, S., and Pyne, N. J. (200) Sphingosine 1-phosphate signaling in mammalian cells. Biochem. J. 349:385-402.
Saba, J. D., Nara, F. Bielawska, A., Garrett, S., and Hannun, Y. A. (1997) The BST1 gene of Saccharomyces cerevisiae is the sphingosine-1-phosphate lyase. J Biol Chem. 272:26087-26090.
Schroeder, J. I., Kwak, J. M., and Allen, G. J. (2001) Guard cell abscisic acid signaling and engineering drought hardiness in plants. Nature. 410:327-330.
Skrzypek, M., Lester, R. L., and Dickson, R. C., (1997) Suppressor gene analysis reveals an essential role for sphingolipids in transport of glycosylphosphatidylinositol-anchored proteins in Saccharomyces cerevisiae. J Bacteriol. 179:1513-1520.
Sperling, P., Ternes, P., Moll, H., Franke, S., Zahringer, U., and Heinz, E. (2001) Functional characterization of sphingolipid C4-hydroxylase genes from Arabidopsis thliana. FEBS Lett. 494:90-94.
Spiegel, S. (1999) Sphingosine 1-phosphate: a prototype of a new class of second messengers. J. Leukoc. Biol. 65:341-344.
Spiegel, S., and Milstien, S. (2000a) Functions of a new family of sphingosine-1-phosphate recepters. Biochim. Biophys. Acta 1484:107-116.
Spiegel, S., and Milstien, S. (2000b) Sphingosine-1-phosphate: signaling inside and out. FEBS Lett. 476:55-57.
Stoffel, W., and Scheid, A. (1969) Metabolism of sphingosine bases. XII. Eicosasphinganine (eicosadihydrosphingosine) and 3-dehydroeicosasphinganine (3-dehydroeicosadihydrosphingosine). Hoppe Seylers Z Physiol Chem. 350:1593-1604.
Sweeney, E. A., Sakakura, C., Shirahama, T., Masamune, A., Ohta, H., Hakomori,S., and Igarashi, Y. (1996) Sphingosine and its methylated derivative N,N-dimethylsphingosine (DMS) induce apoptosis in a variety of human cancer cell lines. Int J Cancer. 66:358-366.
Van Veldhoven, P. P (1999) Sphingosine-1-phosphate lyase. Methods Enzymol. 311:244-254.
Van Veldhoven, P. P., and Mannaerts, G. P. (1991) Subcellular localization and membrane topology of sphingosine-1-phosphate lyase in rat liver. J Biol Chem. 266:12502-12507.
Yoshida, R., Hobo, T., Ichimura, K., Mizoguchi, T., Takahashi, F., Aronso, J., Ecker, J. R., and Shinozaki, K. (2002) ABA-activated SnRK2 protein kinase is required for dehydration stress signaling in Arabidopsis. Plant Cell Physiol. 43:1473-1483.
Zhang, W., Qin, C., Zhao, J., and Wang, X. (2004) Phospholipase Da1-derived phosphatidic acid interacts with ABI1 phosphatase 2C and regulates abscisic acid signaling. Proc. Natl. Acad. Sci. USA 101:9508-9513.
Zhou, J., and Saba, J. D. (1997) Identification of the first mammalian sphingosine phosphate lyase gene and its functional expression in yeast. Biochem. Biophys. Res. Commun. 242:502-507.
Chie Ogawa,Akio Kihara,Maiko Gokoh and Yasuyuki Igarashi (2003) Identification and characterization of a novel human sphingosine-1-phosphate phosphohydrolase,hSPP2.J. Biol.Chem.278,1268-1272.
Akio kihara,Takamitu Sano,Souichiro Iwaki and Yasuyuki Igarashi (2003) Transmembrane topology of sphingoid long-chain base-1-phosphate phosphatase,Lcb3p.Genes to Cells.8,525-535.
Cungui Mao,Martha Wadleigh,Gary M.Jenkins,Yusuf A.Hannun and Lina M.Obeid (1997) Identification and characterization of Saccharomyces cerevisiae dyhydroshingosine-1-phosphate phosphatase.J.Biol.Chem.272,28690-28694.
【図面の簡単な説明】
【0061】
【図1】AtSPP1と他のホスファターゼとのアライメントを示す図である。
【図2】AtSPP1と酵母YSR2とのハイドロパシーの比較を示す図である。
【図3】Lipid phosphate phosphatase系統解析結果を示す図である。
【図4】酵母△dpl1株における機能的相補試験の結果を示す図である。
【図5】AtSPP1の活性を測定した結果を示すグラフである。
【図6】シロイヌナズナの各器官におけるAtSPP1のmRNAの蓄積量を示すグラフである。
【図7】乾燥ストレス条件下でのAtSPP1のmRNAの蓄積量を示すグラフである。
【図8】AtSPP1欠損体の単離を示す図である。
【図9】AtSPP1欠損体と野生型における蒸散率の変化を示す図である。
【図10】AtSPP1の塩基配列とアミノ酸配列を示す図である。下線部分は、バナジウム酸エステル結合モチーフを示す。
【特許請求の範囲】
【請求項1】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を制御することによって、葉の水分蒸散を調節する方法。
【請求項2】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制することによって、葉の水分蒸散を抑制する方法。
【請求項3】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制することによって、植物の耐乾燥性を向上させる方法。
【請求項4】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を制御すると共に、スフィンゴシン-1-リン酸リアーゼの発現または活性を制御することによって、葉の水分蒸散を調節する方法。
【請求項5】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制すると共に、スフィンゴシン-1-リン酸リアーゼの発現または活性を抑制することによって、葉の水分蒸散を抑制する方法。
【請求項6】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制すると共に、スフィンゴシン-1-リン酸リアーゼの発現または活性を抑制することによって、植物の耐乾燥性を向上させる方法。
【請求項7】
ゲノム中のスフィンゴシン-1-リン酸ホスファターゼ遺伝子をノックアウトすることによって、あるいは他の方法で当該遺伝子配列を改変することによって、スフィンゴシン-1-リン酸ホスファターゼの発現を抑制する、請求項2,3,5又は6記載の方法。
【請求項8】
スフィンゴシン-1-リン酸ホスファターゼの発現を特異的に抑制するRNAを植物細胞に導入することによって、スフィンゴシン-1-リン酸ホスファターゼの発現を抑制する、請求項2,3,5又は6記載の方法。
【請求項9】
スフィンゴシン-1-リン酸ホスファターゼの発現を特異的に抑制するRNA、または当該RNAを植物細胞で発現するよう構築されたRNAi発現ベクターを含む、植物の耐乾燥性向上剤。
【請求項10】
スフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制する物質を探索することを特徴とする、植物の耐乾燥性を向上させる物質のスクリーニング方法。
【請求項1】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を制御することによって、葉の水分蒸散を調節する方法。
【請求項2】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制することによって、葉の水分蒸散を抑制する方法。
【請求項3】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制することによって、植物の耐乾燥性を向上させる方法。
【請求項4】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を制御すると共に、スフィンゴシン-1-リン酸リアーゼの発現または活性を制御することによって、葉の水分蒸散を調節する方法。
【請求項5】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制すると共に、スフィンゴシン-1-リン酸リアーゼの発現または活性を抑制することによって、葉の水分蒸散を抑制する方法。
【請求項6】
植物細胞でのスフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制すると共に、スフィンゴシン-1-リン酸リアーゼの発現または活性を抑制することによって、植物の耐乾燥性を向上させる方法。
【請求項7】
ゲノム中のスフィンゴシン-1-リン酸ホスファターゼ遺伝子をノックアウトすることによって、あるいは他の方法で当該遺伝子配列を改変することによって、スフィンゴシン-1-リン酸ホスファターゼの発現を抑制する、請求項2,3,5又は6記載の方法。
【請求項8】
スフィンゴシン-1-リン酸ホスファターゼの発現を特異的に抑制するRNAを植物細胞に導入することによって、スフィンゴシン-1-リン酸ホスファターゼの発現を抑制する、請求項2,3,5又は6記載の方法。
【請求項9】
スフィンゴシン-1-リン酸ホスファターゼの発現を特異的に抑制するRNA、または当該RNAを植物細胞で発現するよう構築されたRNAi発現ベクターを含む、植物の耐乾燥性向上剤。
【請求項10】
スフィンゴシン-1-リン酸ホスファターゼの発現または活性を抑制する物質を探索することを特徴とする、植物の耐乾燥性を向上させる物質のスクリーニング方法。
【図2】


【図3】


【図5】


【図6】


【図7】


【図9】


【図10】


【図1】


【図4】


【図8】




【図3】


【図5】


【図6】


【図7】


【図9】


【図10】


【図1】


【図4】


【図8】


【公開番号】特開2008−67636(P2008−67636A)
【公開日】平成20年3月27日(2008.3.27)
【国際特許分類】
【出願番号】特願2006−248762(P2006−248762)
【出願日】平成18年9月13日(2006.9.13)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年3月 第47回日本植物生理学会年会委員会発行の「第47回日本植物生理学会年会要旨集」に発表
【出願人】(397022911)学校法人甲南学園 (18)
【Fターム(参考)】
【公開日】平成20年3月27日(2008.3.27)
【国際特許分類】
【出願日】平成18年9月13日(2006.9.13)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年3月 第47回日本植物生理学会年会委員会発行の「第47回日本植物生理学会年会要旨集」に発表
【出願人】(397022911)学校法人甲南学園 (18)
【Fターム(参考)】
[ Back to top ]

