薬、薬の誘導装置、体内動態検知器及び薬の設計方法
【課題】経口投与が容易であり、磁性を有する巨大な担体分子をキャリアーとして用いる
ことなく、薬剤分子との結合強度、親和性においても従来の技術的問題を解決でき、実用
化が容易な金属錯体医薬品及びそれを利用するドラッグ・デリバリシステムを提供する。
【解決手段】有機化合物または抗がん性を有する金属錯体である無機化合物から構成され
、側鎖の修飾または/及び側鎖間の架橋により磁性を有する医薬化合物。該医薬化合物の
磁性を利用して所定の患部に誘導する医薬化合物の誘導装置。該医薬化合物の磁性を検出
する磁気検出装置である体内動態検知器。
ことなく、薬剤分子との結合強度、親和性においても従来の技術的問題を解決でき、実用
化が容易な金属錯体医薬品及びそれを利用するドラッグ・デリバリシステムを提供する。
【解決手段】有機化合物または抗がん性を有する金属錯体である無機化合物から構成され
、側鎖の修飾または/及び側鎖間の架橋により磁性を有する医薬化合物。該医薬化合物の
磁性を利用して所定の患部に誘導する医薬化合物の誘導装置。該医薬化合物の磁性を検出
する磁気検出装置である体内動態検知器。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、薬、薬の誘導装置、体内動態検知器及び薬の設計方法に関する。
【背景技術】
【0002】
一般に薬剤は生体に投与され患部に到達し、その患部局所において薬理効果を発揮する
ことで治療効果を引き起こすが、薬剤が患部以外の組織(つまり正常組織)に到達しても
治療にはならない。したがって、いかにして効率的に患部に薬剤を誘導するかが治療戦略
上重要となる。このように薬剤を患部に誘導する技術はドラッグ・デリバリと呼ばれ、近
年研究開発が盛んに行なわれている。このドラッグ・デリバリには少なくとも二つのメリ
ットがある。一つは患部組織において十分に高い薬剤濃度が得られることである。薬理効
果は患部における薬剤濃度が一定以上でないと現れず、低い濃度では治療効果が望めない
からである。二つ目は薬剤を患部組織のみに誘導して、不必要に正常組織に誘導させない
ことである。これにより副作用を抑制することができる。
【0003】
このようなドラッグ・デリバリが最も効果を発揮するのが抗がん剤によるがん治療であ
る。抗がん剤は細胞分裂の活発ながん細胞の細胞増殖を抑制するものが大半であるため、
正常組織においても細胞分裂の活発な組織、例えば骨髄あるいは毛根、消化管粘膜などの
細胞増殖を抑制してしまう。このため抗がん剤の投与を受けたがん患者には貧血、抜け毛
、嘔吐などの副作用が発生する。これら副作用は患者にとって大きな負担となるため投薬
量を制限しなければならず、抗がん剤の薬理効果を十分に得ることができないという問題
がある。さらに最悪の場合、副作用によって患者が死亡してしまう恐れがある。そこで、
ドラッグ・デリバリによって抗がん剤をがん細胞まで誘導し、がん細胞に集中して薬理効
果を発揮させることによって、副作用を抑えつつ効果的にがん治療を行うことができると
期待されている。
【0004】
ドラッグ・デリバリの具体的な手法としては、例えば担体(キャリア)を用いた患部組
織へ誘導が検討されている。これは患部に集中しやすい担体に薬剤を乗せて、担体に薬剤
を患部まで運ばせようというものである。担体としては各種抗体やマイクロスフェア、あ
るいは磁性体を使用することが検討されている。なかでも有力視されているのが磁性体で
あり、薬剤に磁性体である担体を付着させ、磁場によって患部に集積させる方法が検討さ
れている(例えば下記特許文献1参照)。この方法は誘導方法の簡便性と患部を標的にし
た治療が可能であることから、細胞毒性の高い抗がん剤にはとりわけ有効な手法として考
えられている。
【特許文献1】特開2001−10978号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながら、上述したように、磁性体である担体をキャリアとして用いる場合、経口
投与が困難なこと、担体分子が一般的に巨大であること、あるいは薬剤分子との結合強度
、親和性に技術的な問題が指摘されており、実用化が困難であった。
【0006】
本発明は、上述した事情に鑑みてなされたものであり、従来の技術的問題を解決でき、
実用化が容易なドラッグ・デリバリシステムを実現することを目的とする。
【課題を解決するための手段】
【0007】
上記目的を達成するために、本発明では、薬に係る第1の解決手段として、無機化合物
から構成され、側鎖の修飾または/及び側鎖間の架橋により磁性を有することを特徴とす
る。
【0008】
また、本発明では、薬に係る第2の解決手段として、上記第1の解決手段において、前
記無機化合物は、抗がん性を有する金属錯体であることを特徴とする。
【0009】
また、本発明では、薬に係る第3の解決手段として、上記第1の解決手段において、前
記金属錯体は、鉄錯体であることを特徴とする。
【0010】
また、本発明では、薬に係る第4の解決手段として、上記第1の解決手段において、前
記金属錯体は、コバルト(Co)錯体であることを特徴とする。
【0011】
また、本発明では、薬の誘導装置に係る第1の解決手段として、体内に投与された上記
第1〜第4のいずれかの解決手段を有する薬を、当該薬の磁性を利用して所定の患部に誘
導することを特徴とする。
【0012】
また、本発明では、体内動態検知器に係る第1の解決手段として、体内に投与された上
記第1〜4のいずれかの解決手段を有する薬の磁性を検出する磁気検出装置を備えること
を特徴とする。
【0013】
また、本発明では、薬の設計方法に係る第1の解決手段として、薬として用いられる無
機化合物に対し、側鎖の修飾または/及び側鎖間の架橋を行った分子モデルを設定し、当
該分子モデルについて数値計算により求めたスピン電荷密度分布から前記分子モデルが磁
性を有するか否かを判定し、磁性を有すると判定した分子モデルに基づいて薬を設計する
ことを特徴とする。
【発明の効果】
【0014】
本発明によれば、薬そのものに磁性を持たせるため、従来のように磁性体からなる担体
を用いることなく、薬自体が有する磁性を利用して体内の患部まで薬を誘導することがで
きる。その結果、従来における、経口投与が困難なこと、担体分子が一般的に巨大である
こと、あるいは薬剤分子との結合強度、親和性に技術的な問題があること等を解決するこ
とができ、実用化が容易なドラッグ・デリバリシステムを実現することが可能である。
【発明を実施するための最良の形態】
【0015】
以下、図面を参照して、本発明の一実施形態について説明する。
〔第1実施形態〕
まず、第1実施形態として、有機化合物、より具体的には薬候補剤としてのフォルスコ
リンを用いて説明する。図1は、図1、フォルスコリンの基本分子構造モデル図である。
この図において、R6、R7及びR13はフォルスコリンの側鎖を修飾するための原子ま
たは分子が結合する位置を示しており、当該位置にどのような原子または分子が結合する
かによってフォルスコリンの物性が変化する。この図において、R6にH、R7にCH3
、R13にCH=CH2が結合したものが、自然界に存在するフォルスコリンであり、人
工的に側鎖の構造を変える、つまりR6、R7及びR13を修飾する原子または分子を変
えることで生成されたフォルスコリンをフォルスコリン誘導体という。なお、図1におい
て、C1〜C13は、炭素原子(C)を示す。
【0016】
図2は、磁性(フェリ磁性)を有するフォルスコリン誘導体Aの基本分子構造モデル図
である。この図に示すように、フォルスコリン誘導体Aは、上記のような自然界に存在す
るフォルスコリンのR6をCOCH2CH2NCH3に、R7をCH2に変えると共に、
C9に結合している酸素原子(O)と、C13に結合している炭素原子とを架橋したもの
である。
【0017】
図3に、第一原理分子動力学法に基づくコンピュータ・シミュレーションにより求めた
、上記フォルスコリン誘導体Aの3次元的な分子構造及びスピン電荷密度分布を示す。図
3において、領域1は下向きのスピン電荷密度を示し、領域2〜5は上向きのスピン電荷
密度を示す。よって、フォルスコリン誘導体Aは、図2に示すような下向きのスピン状態
1’と、上向きのスピン状態2’〜5’とが混在するのでフェリ磁性体であることがわか
る。
【0018】
一方、図4は、磁性(強磁性)を有するフォルスコリン誘導体Bの基本分子構造モデル
図である。この図に示すように、フォルスコリン誘導体Bは、上記のような自然界に存在
するフォルスコリンのR6をCOCH2CH2NCH3に、R7をCH2に、R13をC
H−CH3に変えると共に、C9に結合している酸素原子と、C13に結合している炭素
原子とを架橋したものである。
【0019】
図5に、上記と同様に、第一原理分子動力学法に基づくコンピュータ・シミュレーショ
ンにより求めた、フォルスコリン誘導体Bの3次元的な分子構造及びスピン電荷密度分布
を示す。図5において、領域10〜12は上向きのスピン電荷密度を示す。よって、フォ
ルスコリン誘導体Bは、図4に示すような上向きのスピン状態10’〜12’のみが存在
するので強磁性体であることがわかる。
【0020】
このように、フォルスコリンの側鎖を所定の原子または分子で修飾すると共に、所定の
箇所に存在する側鎖間を架橋することにより磁性を有するフォルスコリン誘導体、つまり
薬を生成することができる。では、このような磁性を有する薬の設計方法について以下説
明する。図6は、本薬の設計方法の処理手順を示すフローチャートである。なお、以下で
説明する処理は、第一原理分子動力学法に基づくコンピュータ・シミュレーション上で行
われるものである。
【0021】
まず、薬として用いられるフォルスコリン誘導体には200以上もの種類があるので、
その中から評価対象とするフォルスコリン誘導体を選定し、その化学式をコンピュータ・
シミュレーションに入力する(ステップS1)。ここで、フォルスコリン誘導体として上
述したフォルスコリン誘導体Aを選定した場合を想定して以下説明する。
【0022】
続いて、フォルスコリン誘導体Aの化学式に基づいて上向きのスピン(スピンアップ)
波動関数Φ↑(r)、下向きのスピン(スピンダウン)波動関数Φ↓(r)、スピンアッ
プ有効ポテンシャルV↑(r)、スピンダウン有効ポテンシャルV↓(r)、スピンアッ
プ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の初期値を設定する(ステッ
プS2)。なお、rは3次元空間上の座標を示す変数である。
【0023】
スピンアップ波動関数Φ↑(r)の初期値は、フォルスコリン誘導体Aを構成する各原
子が孤立原子として3次元空間上に存在する場合のスピンアップ波動関数Φ↑(r)を各
原子毎に求め、このように求めたスピンアップ波動関数Φ↑(r)を全て加算したもので
ある。同様に、スピンダウン波動関数Φ↓(r)の初期値は、各原子が孤立原子として3
次元空間上に存在する場合のスピンダウン波動関数Φ↓(r)を各原子毎に求め、全て加
算したものである。また、スピンアップ有効ポテンシャルV↑(r)の初期値は、フォル
スコリン誘導体Aを構成する各原子が孤立原子として3次元空間上に存在する場合のスピ
ンアップ波動関数Φ↑(r)に基づいてスピンアップ有効ポテンシャルV↑(r)を各原
子毎に求め、当該各原子毎に求めたスピンアップ有効ポテンシャルV↑(r)を全て加算
したものである。同様に、有効ポテンシャルV↓(r)の初期値は、各原子が孤立原子と
して3次元空間上に存在する場合のスピンダウン波動関数Φ↓(r)に基づいてスピンダ
ウン有効ポテンシャルV↓(r)を各原子毎に求め、当該各原子毎に求めたスピンダウン
有効ポテンシャルV↓(r)を全て加算したものである。また、スピンアップ電荷密度ρ
↑(r)の初期値は、上記のように各原子毎に求めたスピンアップ波動関数Φ↑(r)を
下記演算式(1)に代入することによって求める。また、スピンダウン電荷密度ρ↓(r
)の初期値は、各原子毎に求めたスピンダウン波動関数Φ↓(r)を下記演算式(2)に
代入することによって求める。なお、下記演算式(1)において、Φ↑*(r)は、スピ
ンアップ波動関数Φ↑(r)の共役複素数であり、下記演算式(2)において、Φ↓*(
r)は、スピンダウン波動関数Φ↓(r)の共役複素数である。
【0024】
【数1】

【0025】
次に、上記スピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポテンシャ
ルV↓(r)の初期値と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ
↓(r)の初期値に基づいて下記Kohn Sham方程式(3)、(4)を解くことにより、フ
ォルスコリン誘導体Aのスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓
(r)と、スピンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓を算出
する(ステップS3)。
【0026】
【数2】

【0027】
そして、ステップS3で求めたフォルスコリン誘導体Aのスピンアップ波動関数Φ↑(
r)及びスピンダウン波動関数Φ↓に基づいてフォルスコリン誘導体Aのスピンアップ電
荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)と、スピンアップ有効ポテンシャ
ルV↑(r)及びスピンダウン有効ポテンシャルV↓(r)とを算出し(ステップS4)
、このスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)と当該スピ
ンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値、つまりここ
では初期値とが等しいか否かを判断する(ステップS5)。このステップS5において、
「NO」、すなわちスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)
の前回値(初期値)と、ステップS4で求めた今回値とが等しくないと判断された場合、
ステップS4で求めたスピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポ
テンシャルV↓(r)と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ
↓(r)とを新たな初期値と設定し(ステップS6)、ステップS3に移行して、再度Ko
hn Sham方程式(3)、(4)を解くことにより、新たなスピンアップ波動関数Φ↑(r
)及びスピンダウン波動関数Φ↓と、スピンアップエネルギ固有値ε↑及びスピンダウン
エネルギ固有値ε↓とを算出する。すなわち、ステップS5において、スピンアップ電荷
密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値と今回値とが等しくなるま
でステップS3〜S6の処理を繰り返すことにより、Kohn Sham方程式(3)、(4)を
満足するスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)と、スピ
ンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓(r)とが求まる。
【0028】
一方、ステップS5において、「YES」、すなわちスピンアップ電荷密度ρ↑(r)及
びスピンダウン電荷密度ρ↓(r)の前回値と今回値とが等しいと判断された場合、上記
のようにKohn Sham方程式(3)、(4)を満足するスピンアップ波動関数Φ↑(r)及
びスピンダウン波動関数Φ↓(r)と、スピンアップエネルギ固有値ε↑及びスピンダウ
ンエネルギ固有値ε↓(r)とに基づいて各原子に働く原子間力を算出すると共に、フォ
ルスコリン誘導体Aの構造の最適化を行う(ステップS7)。つまり、ステップS3〜S
6の繰り返しによって求めたスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数
Φ↓(r)等は、あくまで図2に示すような2次元平面上のモデルにおいて最適な値であ
って、実際には3次元空間上におけるフォルスコリン誘導体Aの構造を考慮する必要があ
る。
【0029】
具体的には、ステップS7では、フォルスコリン誘導体Aを構成する各原子を、3次元
空間上においてスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)か
ら推測される最適な方向に所定の距離だけ移動させ、その時の各原子に働く原子間力を算
出する。この時の原子間力が0になり、各原子が動かなくなった場合にフォルスコリン誘
導体Aの構造が最適化されたと判断できる。よって、移動後の各原子に働く原子間力を算
出し、該原子間力が0になったか否かを判断する(ステップS8)。このステップS8に
おいて、「NO」、すなわち原子間力が0ではなく、構造が最適化されていない場合、各原
子の移動後の構造におけるスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ
↓(r)を求めると共に、当該スピンアップ波動関数Φ↑(r)及びスピンダウン波動関
数Φ↓(r)から求めたスピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効
ポテンシャルV↓(r)と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度
ρ↓(r)とを新たな初期値と設定し(ステップS9)、ステップS3〜S8の処理を繰
り返す。ここで、ステップS3に戻るのは、各原子の移動後の構造変化によってスピンア
ップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)が変化するためである。ま
た、各原子の移動後の構造は記憶されており、再度ステップS7を行う時には、前回の構
造から各原子を再び所定の距離だけ移動させることになる。
【0030】
このようなフォルスコリン誘導体Aの構造を最適化する際に、図2に示すように、C9
に結合している酸素原子と、C13に結合している炭素原子とを架橋させるように、強制
的に3次元構造を変化させる。なお、このような架橋させるために選択する原子は任意に
変更可能である。
【0031】
一方、このステップS8において、「YES」、すなわち各原子に働く原子間力が0にな
り、フォルスコリン誘導体Aの構造が最適化された場合、その最適化された構造における
スピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)に基づいて、図3
に示すようなスピン電荷密度分布を求める(ステップS10)。
【0032】
ここで、評価対象として選定したフォルスコリン誘導体によっては、図3に示す領域1
〜5のようなスピン電荷密度分布が生じない、若しくはスピン電荷密度分布は生じるが、
そのスピン電荷密度の大きさ(つまり磁性の強度)が非常に小さいものが存在する。この
ようなフォルスコリン誘導体は、磁性を有するとは判定することができない。従って、ス
ピン電荷密度分布に基づいて、まず評価対象として選定したフォルスコリン誘導体が磁性
を有するか否かを判断する(ステップS11)。
【0033】
ステップS11において、「NO」、すなわち、評価対象として選定したフォルスコリン
誘導体が磁性を有しない場合、ステップS1に移行し、他のフォルスコリン誘導体を新た
に選定して再度磁性評価を行う。一方、ステップS11において、「YES」、すなわち評
価対象として選定したフォルスコリン誘導体が磁性を有する場合、スピン電荷密度分布に
基づいて強磁性かフェリ磁性かを判断する(ステップS12)。上述したように、スピン
電荷密度分布は、スピンアップ電荷密度とスピンダウン電荷密度との分布を示すものであ
るので、これらスピンアップ電荷密度及びスピンダウン電荷密度が混在している場合は、
フェリ磁性を有すると判断でき、スピンアップ電荷密度またはスピンダウン電荷密度のど
ちらか一方のみが存在する場合は、強磁性を有すると判断することができる。
【0034】
フォルスコリン誘導体Aは、図3に示すようにスピンアップ電荷密度(領域2〜5)及
びスピンダウン電荷密度(領域1)が混在するので、フェリ磁性フォルスコリン誘導体と
判定する(ステップS13)。一方、例えば選定したフォルスコリン誘導体がフォルスコ
リン誘導体Bであれば、図5に示すように、スピンアップ電荷密度(領域10〜12)の
みが存在するので、強磁性フォルスコリン誘導体と判定する(ステップS14)。なお、
スピン電荷密度分布に基づいて磁性の強度を求めることも可能である。
【0035】
以上のように、本薬の設計方法によれば、様々な原子または分子で側鎖を修飾し、さら
に側鎖間を任意に架橋したフォルスコリン誘導体の磁性を判定することができ、磁性を有
すると判定された分子モデルを基にフォルスコリン誘導体を生成することにより、磁性を
有する薬を製造することができる。よって、従来のように磁性体からなる担体(キャリア
)を用いることなく、薬自体が有する磁性を利用して体内の患部まで薬を誘導することが
できる。その結果、従来における、経口投与が困難なこと、担体分子が一般的に巨大であ
ること、あるいは薬剤分子との結合強度、親和性に技術的な問題があること等を解決する
ことができ、実用化が容易なドラッグ・デリバリシステムを実現することが可能である。
【0036】
なお、上記第1実施形態では、フォルスコリン誘導体A及びB共に、C9に結合してい
る酸素原子と、C13に結合している炭素原子とを架橋させるように、強制的に3次元構
造を変化させたが、これに限らず、架橋させる原子は他を選択しても良い。また、架橋を
行なわず、側鎖を修飾する原子または分子を変更するだけで磁性を有するか否かを判定し
ても良い。
【0037】
〔第2実施形態〕
次に、第2実施形態として、無機化合物、より具体的には抗がん剤としての鉄錯体及び
コバルト(Co)錯体について説明する。
【0038】
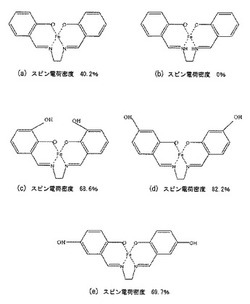
図7(a)〜(e)は、鉄錯体にそれぞれ側鎖修飾を施した鉄錯体誘導体の分子構造モ
デル図である。これらの鉄錯体誘導体は、文献「Sylvain Routier, Herve Vezin, Eric L
amour, Jean-Luc Bernier, Jean-Pierre Catteau and Christian Bailly, Nucleic Acids
Resear ch, 27 (1999) 4160-4166」に記載されているように、抗がん作用のあることが確
認されている。
【0039】
また、図8(a)及び(b)は、コバルト錯体に側鎖修飾を施したコバルト錯体誘導体
の分子構造モデル図である。図8(a)は、〔Co(NH3)2Cl2〕のシス幾何異性体であり、
図8(b)は、〔Co(NH3)2Cl2〕のトランス幾何異性体である。これらのコバルト錯体誘
導体は、文献「M. D. Astudillo, M. V. Alvarez and G. Pinillos, Arch Farmac Toxico
l, 6 (1980) 265-276」に記載されているように、抗がん作用のあることが確認されてい
る。
【0040】
薬の磁性が強ければ強い程、より効率よく患部に薬を誘導することができ、薬理効果の
増大及び副作用の抑制を期待できる。そこで、本願発明者は、上述した本薬の設計方法に
おけるコンピュータ・シミュレーションによって、上記鉄錯体誘導体及びコバルト錯体誘
導体について磁性強度の解析を行った。以下、その解析結果について説明する。なお、磁
性強度はスピン電荷密度と比例関係にあるため、これら鉄錯体誘導体及びコバルト錯体誘
導体におけるスピン電荷密度の解析を行った。
【0041】
まず、リファレンスとして、マグネタイト(Fe3O4)の結晶から総原子数101個、一
辺8Å程度の微粒子を切り出したものを分子モデルに設定し、上記コンピュータ・シミュ
レーションによって、電子状態と構造の最適化を行なった後、スピン電荷密度解析を行な
った。そして、上記マグネタイトのスピン電荷密度を基準にし、鉄錯体誘導体及びコバル
ト錯体誘導体について同様にスピン電荷密度の解析を行った。
【0042】
その結果、図7(a)に示す鉄錯体誘導体は、マグネタイトと比較して約40.2%(
マグネタイトのスピン電荷密度を100%とする)のスピン電荷密度を有していた。また
、図7(b)に示す鉄錯体誘導体は、マグネタイトと比較して約0%のスピン電荷密度を
有していた。また、図7(c)に示す鉄錯体誘導体は、マグネタイトと比較して約68.
6%のスピン電荷密度を有していた。また、図7(d)に示す鉄錯体誘導体は、マグネタ
イトと比較して約82.2%のスピン電荷密度を有していた。さらに、図7(e)に示す
鉄錯体誘導体は、マグネタイトと比較して約69.7%のスピン電荷密度を有していた。
一方、図8(a)に示すコバルト錯体誘導体は、マグネタイトと比較して約118.5%
のスピン電荷密度を有していた。また、図8(b)に示すコバルト錯体誘導体は、マグネ
タイトと比較して約118.1%のスピン電荷密度を有していた。
【0043】
これらの結果より、図7(b)に示す鉄錯体誘導体は、スピン電荷密度(つまり磁性強
度)が非常に小さく、磁性薬として大きな効果はないことが確認された。また、他の鉄錯
体誘導体は、マグネタイトと比較して約40%以上のスピン電荷密度を有しており、磁性
薬として有効であることが確認された。特に図7(d)に示す鉄錯体誘導体は、マグネタ
イトと比較して約80%以上ものスピン電荷密度を有しており、磁性薬として非常に有効
であることがわかった。一方、図8(a)及び(b)に示すコバルト錯体誘導体は、どち
らもマグネタイト以上の磁性強度を有しており、磁性薬として非常に有効であることがわ
かった。
【0044】
次に、図7(a)に示す鉄錯体誘導体の試料を用意し、当該試料の磁性測定を行なった
。磁性測定は測定対象物に磁場を印加し、その測定対象物の周囲に磁場が発生するかどう
かを測定する。一般的に磁性測定には、力学的方法、電磁誘導法、あるいは磁気共鳴法、
超伝導の量子効果などの方法が考えられる。本実施形態では、そのうち最も精度が高い超
伝導量子干渉素子(SQUID: Superconducting Quantum Interference Devices)を使
用した。このSQUIDは高感度の磁化測定装置であり、試料を動かしたときに生じる、
Josephson接合を持った超伝導ループ素子を貫く磁束の微弱な変化を、接合を通るトンネ
ル電流の変化として測定し試料の磁化の値を求める。この方法により最大7テスラ(T)
の強磁場と高精度(1 x 10-8emu)の条件で温度と磁性の関係についての測定が可能になる
。
【0045】
図9は、上記SQUIDによって測定した、図7(a)に示す鉄錯体誘導体の試料の磁
化−磁場特性曲線である。図9(b)は、図9(a)の特性曲線におけるヒステリシス部
分を拡大した図である。なお、測定温度は310K、つまりほぼ体温に近い温度である。
この図9に示すように、体温に近い温度下で、図7(a)に示す鉄錯体誘導体は磁性を有
し、さらにヒステリシスが生じるので強磁性体であることが確認された。
【0046】
また、図7(a)に示す鉄錯体誘導体の試料と1テスラの永久磁石を用いて簡易磁場誘
導実験を行なった。まず、試料を薬包紙にのせて下から永久磁石で磁場誘導したところ試
料が磁場誘導されることを確認した。次に、水を入れたビーカーに試料を混入し、ビーカ
ーの下から永久磁石で磁場誘導したところ試料が磁場誘導できたことを確認した。
【0047】
なお、上記実施形態では、抗がん剤として鉄錯体誘導体とコバルト錯体誘導体について
説明したが、シスプラチン誘導体のような白金錯体や、白金錯体の白金(Pt)をパラジウ
ム(Pd)、ロジウム(Rh)、イリジウム(Ir)、金(Au)、ニッケル(Ni)、銀(Ag)、
銅(Cu)に置換した各種金属錯体の誘導体についても抗がん作用があることが知られてお
り、これら各種金属錯体の誘導体で磁性を有するものを磁性薬として使用しても良い。
【0048】
以上のように、本実施形態における薬の設計方法によれば、有機化合物のみならず無機
化合物からなる薬についても、その分子モデルから磁性を有するか否かを解析することが
でき、磁性強度の高い(つまり薬効の高い)薬を事前に調査することにより、有効な薬を
非常に効率良く設計することが可能となる。
【0049】
続いて、上述したような磁性を有する薬を、患部に誘導する誘導装置について説明する
。この誘導装置は、磁界を発生するものであれば良く、様々な形態の装置が考えられる。
例えば、その一例として、磁気共鳴画像診断装置(MRI:Magnetic Resonance Imaging)
の応用が考えられ、人体に磁界を放射し、当該磁界を薬が患部に誘導されるようにコント
ロールするような構成にすれば良い。また、例えば、磁石等の磁気を発生するものを患部
の皮膚表面に貼りつけても良い。これにより、患部の近くに到達した薬は、患部に誘導さ
れると共に、患部に集中して留まるため、他の正常な細胞に副作用を起こすこともない。
以上のような誘導装置によれば、磁性を持つ薬を選択的且つ集中的に患部に誘導すること
が可能である。
【0050】
さらに、体内に投与された薬の磁性を利用して、その薬の体内動態を調べることもでき
る。より具体的には、体内に投与された薬の磁性を検出する磁気検出装置を備えた体内動
態検知器を使用し、磁性を有する薬をトレーサとし、磁気検出装置により薬から発生する
磁気をトレースすることで薬の体内動態を調べる。このような体内動態検知器により、薬
が体内に投与されてから患部に到達するまでの時間などの体内動態を調べることができ、
薬の研究・開発に寄与することができる。
【図面の簡単な説明】
【0051】
【図1】本発明の一実施形態におけるフォルスコリンの基本分子構造モデル図である。
【図2】本発明の一実施形態におけるフェリ磁性を持つフォルスコリン誘導体Aの分子構造モデル図である。
【図3】本発明の一実施形態におけるフォルスコリン誘導体Aの3次元的分子構造モデル及びスピン電荷密度分布を示す図である。
【図4】本発明の一実施形態における強磁性を持つフォルスコリン誘導体Bの分子構造モデル図である。
【図5】本発明の一実施形態におけるフォルスコリン誘導体Bの3次元的分子構造モデル及びスピン電荷密度分布を示す図である。
【図6】本発明の一実施形態における薬の設計方法のフローチャートである。
【図7】本発明の一実施形態における鉄錯体誘導体の分子構造モデル図である。
【図8】本発明の一実施形態におけるコバルト錯体誘導体の分子構造モデル図である。
【図9】本発明の一実施形態における鉄錯体誘導体の磁性測定結果である。
【符号の説明】
【0052】
A、B…フォルスコリン誘導体
【技術分野】
【0001】
本発明は、薬、薬の誘導装置、体内動態検知器及び薬の設計方法に関する。
【背景技術】
【0002】
一般に薬剤は生体に投与され患部に到達し、その患部局所において薬理効果を発揮する
ことで治療効果を引き起こすが、薬剤が患部以外の組織(つまり正常組織)に到達しても
治療にはならない。したがって、いかにして効率的に患部に薬剤を誘導するかが治療戦略
上重要となる。このように薬剤を患部に誘導する技術はドラッグ・デリバリと呼ばれ、近
年研究開発が盛んに行なわれている。このドラッグ・デリバリには少なくとも二つのメリ
ットがある。一つは患部組織において十分に高い薬剤濃度が得られることである。薬理効
果は患部における薬剤濃度が一定以上でないと現れず、低い濃度では治療効果が望めない
からである。二つ目は薬剤を患部組織のみに誘導して、不必要に正常組織に誘導させない
ことである。これにより副作用を抑制することができる。
【0003】
このようなドラッグ・デリバリが最も効果を発揮するのが抗がん剤によるがん治療であ
る。抗がん剤は細胞分裂の活発ながん細胞の細胞増殖を抑制するものが大半であるため、
正常組織においても細胞分裂の活発な組織、例えば骨髄あるいは毛根、消化管粘膜などの
細胞増殖を抑制してしまう。このため抗がん剤の投与を受けたがん患者には貧血、抜け毛
、嘔吐などの副作用が発生する。これら副作用は患者にとって大きな負担となるため投薬
量を制限しなければならず、抗がん剤の薬理効果を十分に得ることができないという問題
がある。さらに最悪の場合、副作用によって患者が死亡してしまう恐れがある。そこで、
ドラッグ・デリバリによって抗がん剤をがん細胞まで誘導し、がん細胞に集中して薬理効
果を発揮させることによって、副作用を抑えつつ効果的にがん治療を行うことができると
期待されている。
【0004】
ドラッグ・デリバリの具体的な手法としては、例えば担体(キャリア)を用いた患部組
織へ誘導が検討されている。これは患部に集中しやすい担体に薬剤を乗せて、担体に薬剤
を患部まで運ばせようというものである。担体としては各種抗体やマイクロスフェア、あ
るいは磁性体を使用することが検討されている。なかでも有力視されているのが磁性体で
あり、薬剤に磁性体である担体を付着させ、磁場によって患部に集積させる方法が検討さ
れている(例えば下記特許文献1参照)。この方法は誘導方法の簡便性と患部を標的にし
た治療が可能であることから、細胞毒性の高い抗がん剤にはとりわけ有効な手法として考
えられている。
【特許文献1】特開2001−10978号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながら、上述したように、磁性体である担体をキャリアとして用いる場合、経口
投与が困難なこと、担体分子が一般的に巨大であること、あるいは薬剤分子との結合強度
、親和性に技術的な問題が指摘されており、実用化が困難であった。
【0006】
本発明は、上述した事情に鑑みてなされたものであり、従来の技術的問題を解決でき、
実用化が容易なドラッグ・デリバリシステムを実現することを目的とする。
【課題を解決するための手段】
【0007】
上記目的を達成するために、本発明では、薬に係る第1の解決手段として、無機化合物
から構成され、側鎖の修飾または/及び側鎖間の架橋により磁性を有することを特徴とす
る。
【0008】
また、本発明では、薬に係る第2の解決手段として、上記第1の解決手段において、前
記無機化合物は、抗がん性を有する金属錯体であることを特徴とする。
【0009】
また、本発明では、薬に係る第3の解決手段として、上記第1の解決手段において、前
記金属錯体は、鉄錯体であることを特徴とする。
【0010】
また、本発明では、薬に係る第4の解決手段として、上記第1の解決手段において、前
記金属錯体は、コバルト(Co)錯体であることを特徴とする。
【0011】
また、本発明では、薬の誘導装置に係る第1の解決手段として、体内に投与された上記
第1〜第4のいずれかの解決手段を有する薬を、当該薬の磁性を利用して所定の患部に誘
導することを特徴とする。
【0012】
また、本発明では、体内動態検知器に係る第1の解決手段として、体内に投与された上
記第1〜4のいずれかの解決手段を有する薬の磁性を検出する磁気検出装置を備えること
を特徴とする。
【0013】
また、本発明では、薬の設計方法に係る第1の解決手段として、薬として用いられる無
機化合物に対し、側鎖の修飾または/及び側鎖間の架橋を行った分子モデルを設定し、当
該分子モデルについて数値計算により求めたスピン電荷密度分布から前記分子モデルが磁
性を有するか否かを判定し、磁性を有すると判定した分子モデルに基づいて薬を設計する
ことを特徴とする。
【発明の効果】
【0014】
本発明によれば、薬そのものに磁性を持たせるため、従来のように磁性体からなる担体
を用いることなく、薬自体が有する磁性を利用して体内の患部まで薬を誘導することがで
きる。その結果、従来における、経口投与が困難なこと、担体分子が一般的に巨大である
こと、あるいは薬剤分子との結合強度、親和性に技術的な問題があること等を解決するこ
とができ、実用化が容易なドラッグ・デリバリシステムを実現することが可能である。
【発明を実施するための最良の形態】
【0015】
以下、図面を参照して、本発明の一実施形態について説明する。
〔第1実施形態〕
まず、第1実施形態として、有機化合物、より具体的には薬候補剤としてのフォルスコ
リンを用いて説明する。図1は、図1、フォルスコリンの基本分子構造モデル図である。
この図において、R6、R7及びR13はフォルスコリンの側鎖を修飾するための原子ま
たは分子が結合する位置を示しており、当該位置にどのような原子または分子が結合する
かによってフォルスコリンの物性が変化する。この図において、R6にH、R7にCH3
、R13にCH=CH2が結合したものが、自然界に存在するフォルスコリンであり、人
工的に側鎖の構造を変える、つまりR6、R7及びR13を修飾する原子または分子を変
えることで生成されたフォルスコリンをフォルスコリン誘導体という。なお、図1におい
て、C1〜C13は、炭素原子(C)を示す。
【0016】
図2は、磁性(フェリ磁性)を有するフォルスコリン誘導体Aの基本分子構造モデル図
である。この図に示すように、フォルスコリン誘導体Aは、上記のような自然界に存在す
るフォルスコリンのR6をCOCH2CH2NCH3に、R7をCH2に変えると共に、
C9に結合している酸素原子(O)と、C13に結合している炭素原子とを架橋したもの
である。
【0017】
図3に、第一原理分子動力学法に基づくコンピュータ・シミュレーションにより求めた
、上記フォルスコリン誘導体Aの3次元的な分子構造及びスピン電荷密度分布を示す。図
3において、領域1は下向きのスピン電荷密度を示し、領域2〜5は上向きのスピン電荷
密度を示す。よって、フォルスコリン誘導体Aは、図2に示すような下向きのスピン状態
1’と、上向きのスピン状態2’〜5’とが混在するのでフェリ磁性体であることがわか
る。
【0018】
一方、図4は、磁性(強磁性)を有するフォルスコリン誘導体Bの基本分子構造モデル
図である。この図に示すように、フォルスコリン誘導体Bは、上記のような自然界に存在
するフォルスコリンのR6をCOCH2CH2NCH3に、R7をCH2に、R13をC
H−CH3に変えると共に、C9に結合している酸素原子と、C13に結合している炭素
原子とを架橋したものである。
【0019】
図5に、上記と同様に、第一原理分子動力学法に基づくコンピュータ・シミュレーショ
ンにより求めた、フォルスコリン誘導体Bの3次元的な分子構造及びスピン電荷密度分布
を示す。図5において、領域10〜12は上向きのスピン電荷密度を示す。よって、フォ
ルスコリン誘導体Bは、図4に示すような上向きのスピン状態10’〜12’のみが存在
するので強磁性体であることがわかる。
【0020】
このように、フォルスコリンの側鎖を所定の原子または分子で修飾すると共に、所定の
箇所に存在する側鎖間を架橋することにより磁性を有するフォルスコリン誘導体、つまり
薬を生成することができる。では、このような磁性を有する薬の設計方法について以下説
明する。図6は、本薬の設計方法の処理手順を示すフローチャートである。なお、以下で
説明する処理は、第一原理分子動力学法に基づくコンピュータ・シミュレーション上で行
われるものである。
【0021】
まず、薬として用いられるフォルスコリン誘導体には200以上もの種類があるので、
その中から評価対象とするフォルスコリン誘導体を選定し、その化学式をコンピュータ・
シミュレーションに入力する(ステップS1)。ここで、フォルスコリン誘導体として上
述したフォルスコリン誘導体Aを選定した場合を想定して以下説明する。
【0022】
続いて、フォルスコリン誘導体Aの化学式に基づいて上向きのスピン(スピンアップ)
波動関数Φ↑(r)、下向きのスピン(スピンダウン)波動関数Φ↓(r)、スピンアッ
プ有効ポテンシャルV↑(r)、スピンダウン有効ポテンシャルV↓(r)、スピンアッ
プ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の初期値を設定する(ステッ
プS2)。なお、rは3次元空間上の座標を示す変数である。
【0023】
スピンアップ波動関数Φ↑(r)の初期値は、フォルスコリン誘導体Aを構成する各原
子が孤立原子として3次元空間上に存在する場合のスピンアップ波動関数Φ↑(r)を各
原子毎に求め、このように求めたスピンアップ波動関数Φ↑(r)を全て加算したもので
ある。同様に、スピンダウン波動関数Φ↓(r)の初期値は、各原子が孤立原子として3
次元空間上に存在する場合のスピンダウン波動関数Φ↓(r)を各原子毎に求め、全て加
算したものである。また、スピンアップ有効ポテンシャルV↑(r)の初期値は、フォル
スコリン誘導体Aを構成する各原子が孤立原子として3次元空間上に存在する場合のスピ
ンアップ波動関数Φ↑(r)に基づいてスピンアップ有効ポテンシャルV↑(r)を各原
子毎に求め、当該各原子毎に求めたスピンアップ有効ポテンシャルV↑(r)を全て加算
したものである。同様に、有効ポテンシャルV↓(r)の初期値は、各原子が孤立原子と
して3次元空間上に存在する場合のスピンダウン波動関数Φ↓(r)に基づいてスピンダ
ウン有効ポテンシャルV↓(r)を各原子毎に求め、当該各原子毎に求めたスピンダウン
有効ポテンシャルV↓(r)を全て加算したものである。また、スピンアップ電荷密度ρ
↑(r)の初期値は、上記のように各原子毎に求めたスピンアップ波動関数Φ↑(r)を
下記演算式(1)に代入することによって求める。また、スピンダウン電荷密度ρ↓(r
)の初期値は、各原子毎に求めたスピンダウン波動関数Φ↓(r)を下記演算式(2)に
代入することによって求める。なお、下記演算式(1)において、Φ↑*(r)は、スピ
ンアップ波動関数Φ↑(r)の共役複素数であり、下記演算式(2)において、Φ↓*(
r)は、スピンダウン波動関数Φ↓(r)の共役複素数である。
【0024】
【数1】

【0025】
次に、上記スピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポテンシャ
ルV↓(r)の初期値と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ
↓(r)の初期値に基づいて下記Kohn Sham方程式(3)、(4)を解くことにより、フ
ォルスコリン誘導体Aのスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓
(r)と、スピンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓を算出
する(ステップS3)。
【0026】
【数2】

【0027】
そして、ステップS3で求めたフォルスコリン誘導体Aのスピンアップ波動関数Φ↑(
r)及びスピンダウン波動関数Φ↓に基づいてフォルスコリン誘導体Aのスピンアップ電
荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)と、スピンアップ有効ポテンシャ
ルV↑(r)及びスピンダウン有効ポテンシャルV↓(r)とを算出し(ステップS4)
、このスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)と当該スピ
ンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値、つまりここ
では初期値とが等しいか否かを判断する(ステップS5)。このステップS5において、
「NO」、すなわちスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)
の前回値(初期値)と、ステップS4で求めた今回値とが等しくないと判断された場合、
ステップS4で求めたスピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポ
テンシャルV↓(r)と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ
↓(r)とを新たな初期値と設定し(ステップS6)、ステップS3に移行して、再度Ko
hn Sham方程式(3)、(4)を解くことにより、新たなスピンアップ波動関数Φ↑(r
)及びスピンダウン波動関数Φ↓と、スピンアップエネルギ固有値ε↑及びスピンダウン
エネルギ固有値ε↓とを算出する。すなわち、ステップS5において、スピンアップ電荷
密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値と今回値とが等しくなるま
でステップS3〜S6の処理を繰り返すことにより、Kohn Sham方程式(3)、(4)を
満足するスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)と、スピ
ンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓(r)とが求まる。
【0028】
一方、ステップS5において、「YES」、すなわちスピンアップ電荷密度ρ↑(r)及
びスピンダウン電荷密度ρ↓(r)の前回値と今回値とが等しいと判断された場合、上記
のようにKohn Sham方程式(3)、(4)を満足するスピンアップ波動関数Φ↑(r)及
びスピンダウン波動関数Φ↓(r)と、スピンアップエネルギ固有値ε↑及びスピンダウ
ンエネルギ固有値ε↓(r)とに基づいて各原子に働く原子間力を算出すると共に、フォ
ルスコリン誘導体Aの構造の最適化を行う(ステップS7)。つまり、ステップS3〜S
6の繰り返しによって求めたスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数
Φ↓(r)等は、あくまで図2に示すような2次元平面上のモデルにおいて最適な値であ
って、実際には3次元空間上におけるフォルスコリン誘導体Aの構造を考慮する必要があ
る。
【0029】
具体的には、ステップS7では、フォルスコリン誘導体Aを構成する各原子を、3次元
空間上においてスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)か
ら推測される最適な方向に所定の距離だけ移動させ、その時の各原子に働く原子間力を算
出する。この時の原子間力が0になり、各原子が動かなくなった場合にフォルスコリン誘
導体Aの構造が最適化されたと判断できる。よって、移動後の各原子に働く原子間力を算
出し、該原子間力が0になったか否かを判断する(ステップS8)。このステップS8に
おいて、「NO」、すなわち原子間力が0ではなく、構造が最適化されていない場合、各原
子の移動後の構造におけるスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ
↓(r)を求めると共に、当該スピンアップ波動関数Φ↑(r)及びスピンダウン波動関
数Φ↓(r)から求めたスピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効
ポテンシャルV↓(r)と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度
ρ↓(r)とを新たな初期値と設定し(ステップS9)、ステップS3〜S8の処理を繰
り返す。ここで、ステップS3に戻るのは、各原子の移動後の構造変化によってスピンア
ップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)が変化するためである。ま
た、各原子の移動後の構造は記憶されており、再度ステップS7を行う時には、前回の構
造から各原子を再び所定の距離だけ移動させることになる。
【0030】
このようなフォルスコリン誘導体Aの構造を最適化する際に、図2に示すように、C9
に結合している酸素原子と、C13に結合している炭素原子とを架橋させるように、強制
的に3次元構造を変化させる。なお、このような架橋させるために選択する原子は任意に
変更可能である。
【0031】
一方、このステップS8において、「YES」、すなわち各原子に働く原子間力が0にな
り、フォルスコリン誘導体Aの構造が最適化された場合、その最適化された構造における
スピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)に基づいて、図3
に示すようなスピン電荷密度分布を求める(ステップS10)。
【0032】
ここで、評価対象として選定したフォルスコリン誘導体によっては、図3に示す領域1
〜5のようなスピン電荷密度分布が生じない、若しくはスピン電荷密度分布は生じるが、
そのスピン電荷密度の大きさ(つまり磁性の強度)が非常に小さいものが存在する。この
ようなフォルスコリン誘導体は、磁性を有するとは判定することができない。従って、ス
ピン電荷密度分布に基づいて、まず評価対象として選定したフォルスコリン誘導体が磁性
を有するか否かを判断する(ステップS11)。
【0033】
ステップS11において、「NO」、すなわち、評価対象として選定したフォルスコリン
誘導体が磁性を有しない場合、ステップS1に移行し、他のフォルスコリン誘導体を新た
に選定して再度磁性評価を行う。一方、ステップS11において、「YES」、すなわち評
価対象として選定したフォルスコリン誘導体が磁性を有する場合、スピン電荷密度分布に
基づいて強磁性かフェリ磁性かを判断する(ステップS12)。上述したように、スピン
電荷密度分布は、スピンアップ電荷密度とスピンダウン電荷密度との分布を示すものであ
るので、これらスピンアップ電荷密度及びスピンダウン電荷密度が混在している場合は、
フェリ磁性を有すると判断でき、スピンアップ電荷密度またはスピンダウン電荷密度のど
ちらか一方のみが存在する場合は、強磁性を有すると判断することができる。
【0034】
フォルスコリン誘導体Aは、図3に示すようにスピンアップ電荷密度(領域2〜5)及
びスピンダウン電荷密度(領域1)が混在するので、フェリ磁性フォルスコリン誘導体と
判定する(ステップS13)。一方、例えば選定したフォルスコリン誘導体がフォルスコ
リン誘導体Bであれば、図5に示すように、スピンアップ電荷密度(領域10〜12)の
みが存在するので、強磁性フォルスコリン誘導体と判定する(ステップS14)。なお、
スピン電荷密度分布に基づいて磁性の強度を求めることも可能である。
【0035】
以上のように、本薬の設計方法によれば、様々な原子または分子で側鎖を修飾し、さら
に側鎖間を任意に架橋したフォルスコリン誘導体の磁性を判定することができ、磁性を有
すると判定された分子モデルを基にフォルスコリン誘導体を生成することにより、磁性を
有する薬を製造することができる。よって、従来のように磁性体からなる担体(キャリア
)を用いることなく、薬自体が有する磁性を利用して体内の患部まで薬を誘導することが
できる。その結果、従来における、経口投与が困難なこと、担体分子が一般的に巨大であ
ること、あるいは薬剤分子との結合強度、親和性に技術的な問題があること等を解決する
ことができ、実用化が容易なドラッグ・デリバリシステムを実現することが可能である。
【0036】
なお、上記第1実施形態では、フォルスコリン誘導体A及びB共に、C9に結合してい
る酸素原子と、C13に結合している炭素原子とを架橋させるように、強制的に3次元構
造を変化させたが、これに限らず、架橋させる原子は他を選択しても良い。また、架橋を
行なわず、側鎖を修飾する原子または分子を変更するだけで磁性を有するか否かを判定し
ても良い。
【0037】
〔第2実施形態〕
次に、第2実施形態として、無機化合物、より具体的には抗がん剤としての鉄錯体及び
コバルト(Co)錯体について説明する。
【0038】
図7(a)〜(e)は、鉄錯体にそれぞれ側鎖修飾を施した鉄錯体誘導体の分子構造モ
デル図である。これらの鉄錯体誘導体は、文献「Sylvain Routier, Herve Vezin, Eric L
amour, Jean-Luc Bernier, Jean-Pierre Catteau and Christian Bailly, Nucleic Acids
Resear ch, 27 (1999) 4160-4166」に記載されているように、抗がん作用のあることが確
認されている。
【0039】
また、図8(a)及び(b)は、コバルト錯体に側鎖修飾を施したコバルト錯体誘導体
の分子構造モデル図である。図8(a)は、〔Co(NH3)2Cl2〕のシス幾何異性体であり、
図8(b)は、〔Co(NH3)2Cl2〕のトランス幾何異性体である。これらのコバルト錯体誘
導体は、文献「M. D. Astudillo, M. V. Alvarez and G. Pinillos, Arch Farmac Toxico
l, 6 (1980) 265-276」に記載されているように、抗がん作用のあることが確認されてい
る。
【0040】
薬の磁性が強ければ強い程、より効率よく患部に薬を誘導することができ、薬理効果の
増大及び副作用の抑制を期待できる。そこで、本願発明者は、上述した本薬の設計方法に
おけるコンピュータ・シミュレーションによって、上記鉄錯体誘導体及びコバルト錯体誘
導体について磁性強度の解析を行った。以下、その解析結果について説明する。なお、磁
性強度はスピン電荷密度と比例関係にあるため、これら鉄錯体誘導体及びコバルト錯体誘
導体におけるスピン電荷密度の解析を行った。
【0041】
まず、リファレンスとして、マグネタイト(Fe3O4)の結晶から総原子数101個、一
辺8Å程度の微粒子を切り出したものを分子モデルに設定し、上記コンピュータ・シミュ
レーションによって、電子状態と構造の最適化を行なった後、スピン電荷密度解析を行な
った。そして、上記マグネタイトのスピン電荷密度を基準にし、鉄錯体誘導体及びコバル
ト錯体誘導体について同様にスピン電荷密度の解析を行った。
【0042】
その結果、図7(a)に示す鉄錯体誘導体は、マグネタイトと比較して約40.2%(
マグネタイトのスピン電荷密度を100%とする)のスピン電荷密度を有していた。また
、図7(b)に示す鉄錯体誘導体は、マグネタイトと比較して約0%のスピン電荷密度を
有していた。また、図7(c)に示す鉄錯体誘導体は、マグネタイトと比較して約68.
6%のスピン電荷密度を有していた。また、図7(d)に示す鉄錯体誘導体は、マグネタ
イトと比較して約82.2%のスピン電荷密度を有していた。さらに、図7(e)に示す
鉄錯体誘導体は、マグネタイトと比較して約69.7%のスピン電荷密度を有していた。
一方、図8(a)に示すコバルト錯体誘導体は、マグネタイトと比較して約118.5%
のスピン電荷密度を有していた。また、図8(b)に示すコバルト錯体誘導体は、マグネ
タイトと比較して約118.1%のスピン電荷密度を有していた。
【0043】
これらの結果より、図7(b)に示す鉄錯体誘導体は、スピン電荷密度(つまり磁性強
度)が非常に小さく、磁性薬として大きな効果はないことが確認された。また、他の鉄錯
体誘導体は、マグネタイトと比較して約40%以上のスピン電荷密度を有しており、磁性
薬として有効であることが確認された。特に図7(d)に示す鉄錯体誘導体は、マグネタ
イトと比較して約80%以上ものスピン電荷密度を有しており、磁性薬として非常に有効
であることがわかった。一方、図8(a)及び(b)に示すコバルト錯体誘導体は、どち
らもマグネタイト以上の磁性強度を有しており、磁性薬として非常に有効であることがわ
かった。
【0044】
次に、図7(a)に示す鉄錯体誘導体の試料を用意し、当該試料の磁性測定を行なった
。磁性測定は測定対象物に磁場を印加し、その測定対象物の周囲に磁場が発生するかどう
かを測定する。一般的に磁性測定には、力学的方法、電磁誘導法、あるいは磁気共鳴法、
超伝導の量子効果などの方法が考えられる。本実施形態では、そのうち最も精度が高い超
伝導量子干渉素子(SQUID: Superconducting Quantum Interference Devices)を使
用した。このSQUIDは高感度の磁化測定装置であり、試料を動かしたときに生じる、
Josephson接合を持った超伝導ループ素子を貫く磁束の微弱な変化を、接合を通るトンネ
ル電流の変化として測定し試料の磁化の値を求める。この方法により最大7テスラ(T)
の強磁場と高精度(1 x 10-8emu)の条件で温度と磁性の関係についての測定が可能になる
。
【0045】
図9は、上記SQUIDによって測定した、図7(a)に示す鉄錯体誘導体の試料の磁
化−磁場特性曲線である。図9(b)は、図9(a)の特性曲線におけるヒステリシス部
分を拡大した図である。なお、測定温度は310K、つまりほぼ体温に近い温度である。
この図9に示すように、体温に近い温度下で、図7(a)に示す鉄錯体誘導体は磁性を有
し、さらにヒステリシスが生じるので強磁性体であることが確認された。
【0046】
また、図7(a)に示す鉄錯体誘導体の試料と1テスラの永久磁石を用いて簡易磁場誘
導実験を行なった。まず、試料を薬包紙にのせて下から永久磁石で磁場誘導したところ試
料が磁場誘導されることを確認した。次に、水を入れたビーカーに試料を混入し、ビーカ
ーの下から永久磁石で磁場誘導したところ試料が磁場誘導できたことを確認した。
【0047】
なお、上記実施形態では、抗がん剤として鉄錯体誘導体とコバルト錯体誘導体について
説明したが、シスプラチン誘導体のような白金錯体や、白金錯体の白金(Pt)をパラジウ
ム(Pd)、ロジウム(Rh)、イリジウム(Ir)、金(Au)、ニッケル(Ni)、銀(Ag)、
銅(Cu)に置換した各種金属錯体の誘導体についても抗がん作用があることが知られてお
り、これら各種金属錯体の誘導体で磁性を有するものを磁性薬として使用しても良い。
【0048】
以上のように、本実施形態における薬の設計方法によれば、有機化合物のみならず無機
化合物からなる薬についても、その分子モデルから磁性を有するか否かを解析することが
でき、磁性強度の高い(つまり薬効の高い)薬を事前に調査することにより、有効な薬を
非常に効率良く設計することが可能となる。
【0049】
続いて、上述したような磁性を有する薬を、患部に誘導する誘導装置について説明する
。この誘導装置は、磁界を発生するものであれば良く、様々な形態の装置が考えられる。
例えば、その一例として、磁気共鳴画像診断装置(MRI:Magnetic Resonance Imaging)
の応用が考えられ、人体に磁界を放射し、当該磁界を薬が患部に誘導されるようにコント
ロールするような構成にすれば良い。また、例えば、磁石等の磁気を発生するものを患部
の皮膚表面に貼りつけても良い。これにより、患部の近くに到達した薬は、患部に誘導さ
れると共に、患部に集中して留まるため、他の正常な細胞に副作用を起こすこともない。
以上のような誘導装置によれば、磁性を持つ薬を選択的且つ集中的に患部に誘導すること
が可能である。
【0050】
さらに、体内に投与された薬の磁性を利用して、その薬の体内動態を調べることもでき
る。より具体的には、体内に投与された薬の磁性を検出する磁気検出装置を備えた体内動
態検知器を使用し、磁性を有する薬をトレーサとし、磁気検出装置により薬から発生する
磁気をトレースすることで薬の体内動態を調べる。このような体内動態検知器により、薬
が体内に投与されてから患部に到達するまでの時間などの体内動態を調べることができ、
薬の研究・開発に寄与することができる。
【図面の簡単な説明】
【0051】
【図1】本発明の一実施形態におけるフォルスコリンの基本分子構造モデル図である。
【図2】本発明の一実施形態におけるフェリ磁性を持つフォルスコリン誘導体Aの分子構造モデル図である。
【図3】本発明の一実施形態におけるフォルスコリン誘導体Aの3次元的分子構造モデル及びスピン電荷密度分布を示す図である。
【図4】本発明の一実施形態における強磁性を持つフォルスコリン誘導体Bの分子構造モデル図である。
【図5】本発明の一実施形態におけるフォルスコリン誘導体Bの3次元的分子構造モデル及びスピン電荷密度分布を示す図である。
【図6】本発明の一実施形態における薬の設計方法のフローチャートである。
【図7】本発明の一実施形態における鉄錯体誘導体の分子構造モデル図である。
【図8】本発明の一実施形態におけるコバルト錯体誘導体の分子構造モデル図である。
【図9】本発明の一実施形態における鉄錯体誘導体の磁性測定結果である。
【符号の説明】
【0052】
A、B…フォルスコリン誘導体
【特許請求の範囲】
【請求項1】
有機化合物または無機化合物から構成され、側鎖の修飾または/及び側鎖間の架橋によ
り磁性を有することを特徴とする薬。
【請求項2】
前記無機化合物は、抗がん性を有する金属錯体であることを特徴とする請求項1記載の
薬。
【請求項3】
前記金属錯体は、鉄錯体であることを特徴とする請求項2記載の薬。
【請求項4】
前記金属錯体は、コバルト(Co)錯体であることを特徴とする請求項2記載の薬。
【請求項5】
体内に投与した請求項1〜4のいずれか一項に記載の薬を、当該薬の磁性を利用して所
定の患部に誘導することを特徴とする薬の誘導装置。
【請求項6】
体内に投与した請求項1〜4のいずれか一項に記載の薬の磁性を検出する磁気検出装置
を備えることを特徴とする体内動態検知器。
【請求項7】
薬として用いられる無機化合物に対し、側鎖の修飾または/及び側鎖間の架橋を行った
分子モデルを設定し、当該分子モデルについて数値計算により求めたスピン電荷密度分布
から前記分子モデルが磁性を有するか否かを判定し、磁性を有すると判定した分子モデル
に基づいて薬を設計することを特徴とする薬の設計方法。
【請求項1】
有機化合物または無機化合物から構成され、側鎖の修飾または/及び側鎖間の架橋によ
り磁性を有することを特徴とする薬。
【請求項2】
前記無機化合物は、抗がん性を有する金属錯体であることを特徴とする請求項1記載の
薬。
【請求項3】
前記金属錯体は、鉄錯体であることを特徴とする請求項2記載の薬。
【請求項4】
前記金属錯体は、コバルト(Co)錯体であることを特徴とする請求項2記載の薬。
【請求項5】
体内に投与した請求項1〜4のいずれか一項に記載の薬を、当該薬の磁性を利用して所
定の患部に誘導することを特徴とする薬の誘導装置。
【請求項6】
体内に投与した請求項1〜4のいずれか一項に記載の薬の磁性を検出する磁気検出装置
を備えることを特徴とする体内動態検知器。
【請求項7】
薬として用いられる無機化合物に対し、側鎖の修飾または/及び側鎖間の架橋を行った
分子モデルを設定し、当該分子モデルについて数値計算により求めたスピン電荷密度分布
から前記分子モデルが磁性を有するか否かを判定し、磁性を有すると判定した分子モデル
に基づいて薬を設計することを特徴とする薬の設計方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−246307(P2012−246307A)
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願番号】特願2012−185940(P2012−185940)
【出願日】平成24年8月24日(2012.8.24)
【分割の表示】特願2006−301564(P2006−301564)の分割
【原出願日】平成18年11月7日(2006.11.7)
【出願人】(000000099)株式会社IHI (5,014)
【出願人】(505328683)
【Fターム(参考)】
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願日】平成24年8月24日(2012.8.24)
【分割の表示】特願2006−301564(P2006−301564)の分割
【原出願日】平成18年11月7日(2006.11.7)
【出願人】(000000099)株式会社IHI (5,014)
【出願人】(505328683)

【Fターム(参考)】
[ Back to top ]

