薬、薬の誘導装置、磁気検出装置及び薬の設計方法
【課題】磁性体である担体をキャリアとして用いる場合、経口投与が困難なこと、あるいは薬剤分子との結合強度、親和性に技術的な問題が指摘されている、これらを解決し、実用化が容易なドラッグ・デリバリシステムを提供する。
【解決手段】第一の解決手段として有機化合物または無機化合物から構成され、側鎖の修飾または/及び側鎖間の架橋により磁性を有する。第二は有機化合物としてフォルスコリン、無機化合物として金属錯体であるシスプラチンである。
【解決手段】第一の解決手段として有機化合物または無機化合物から構成され、側鎖の修飾または/及び側鎖間の架橋により磁性を有する。第二は有機化合物としてフォルスコリン、無機化合物として金属錯体であるシスプラチンである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、薬、薬の誘導装置、磁気検出装置及び薬の設計方法に関する。
【背景技術】
【0002】
一般に薬剤は生体に投与され患部に到達し、その患部局所において薬理効果を発揮することで治療効果を引き起こすが、薬剤が患部以外の組織(つまり正常組織)に到達しても治療にはならない。したがって、いかにして効率的に患部に薬剤を誘導するかが治療戦略上重要となる。このように薬剤を患部に誘導する技術はドラッグ・デリバリと呼ばれ、近年研究開発が盛んに行なわれている。このドラッグ・デリバリには少なくとも二つのメリットがある。一つは患部組織において十分に高い薬剤濃度が得られることである。薬理効果は患部における薬剤濃度が一定以上でないと現れず、低い濃度では治療効果が望めないからである。二つ目は薬剤を患部組織のみに誘導して、不必要に正常組織に誘導させないことである。これにより副作用を抑制することができる。
【0003】
このようなドラッグ・デリバリが最も効果を発揮するのが抗がん剤によるがん治療である。抗がん剤は細胞分裂の活発ながん細胞の細胞増殖を抑制するものが大半であるため、正常組織においても細胞分裂の活発な組織、例えば骨髄あるいは毛根、消化管粘膜などの細胞増殖を抑制してしまう。このため抗がん剤の投与を受けたがん患者には貧血、抜け毛、嘔吐などの副作用が発生する。これら副作用は患者にとって大きな負担となるため投薬量を制限しなければならず、抗がん剤の薬理効果を十分に得ることができないという問題がある。さらに最悪の場合、副作用によって患者が死亡してしまう恐れがある。そこで、ドラッグ・デリバリによって抗がん剤をがん細胞まで誘導し、がん細胞に集中して薬理効果を発揮させることによって、副作用を抑えつつ効果的にがん治療を行うことができると期待されている。
【0004】
抗がん剤以外では、例えば男性勃起不全治療薬への応用が考えられる。男性勃起不全治療薬は、ニトロ製剤との併用により重篤な全身低血圧を引き起こし死亡にいたる例があり、とりわけ中高年以上の心疾患をもつ男性に問題となる。これは勃起不全治療薬が必ずしも患部に集中せず、全身の血管に作用してニトロ製剤のもつ血管拡張作用を増幅してしまうためである。そこで、ドラッグ・デリバリによって男性勃起不全治療薬を患部まで誘導し、患部に集中して薬理効果を発揮させることによって、ニトロ製剤との併用による副作用の発生を抑えることができると考えられる。
【0005】
ドラッグ・デリバリの具体的な手法としては、例えば担体(キャリア)を用いた患部組織へ誘導が検討されているが、これは患部に集中しやすい担体に薬剤を乗せて、担体に薬剤を患部まで運ばせようというものである。担体としては各種抗体やマイクロスフェア、あるいは磁性体を使用することが検討されている。なかでも有力視されているのが磁性体であり、薬剤に磁性体である担体を付着させ、磁場によって患部に集積させる方法が検討されている(例えば下記特許文献1参照)。この方法は誘導方法の簡便性と患部を標的にした治療が可能であることから、細胞毒性の高い抗がん剤にはとりわけ有効な手法として考えられている。
【特許文献1】特開2001−10978号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、上述したように、磁性体である担体をキャリアとして用いる場合、経口投与が困難なこと、担体分子が一般的に巨大であること、あるいは薬剤分子との結合強度、親和性に技術的な問題が指摘されており、実用化が困難であった。
【0007】
本発明は、上述した事情に鑑みてなされたものであり、従来の技術的問題を解決でき、実用化が容易なドラッグ・デリバリシステムを実現することを目的とする。
【課題を解決するための手段】
【0008】
上記目的を達成するために、本発明では、薬に係る第1の解決手段として、有機化合物または無機化合物から構成され、側鎖の修飾または/及び側鎖間の架橋により磁性を有することを特徴とする。
【0009】
また、本発明では、薬に係る第2の解決手段として、上記第1の解決手段において、前記有機化合物は、フォルスコリンであることを特徴とする。
【0010】
また、本発明では、薬に係る第3の解決手段として、上記第1の解決手段において、前記有機化合物は、男性勃起不全治療に効果のある組成物であることを特徴とする。
【0011】
また、本発明では、薬に係る第4の解決手段として、上記第1の解決手段において、前記無機化合物は、金属錯体であることを特徴とする。
【0012】
また、本発明では、薬に係る第5の解決手段として、上記第4の解決手段において、前記金属錯体は、抗がん性を有するシス幾何異性体であることを特徴とする。
【0013】
また、本発明では、薬に係る第6の解決手段として、上記第5の解決手段において、前記シス幾何異性体は、シスプラチンであることを特徴とする。
【0014】
また、本発明では、薬の誘導装置に係る第1の解決手段として、体内に投与された上記第1〜6のいずれかの解決手段を有する薬を、当該薬の磁性を利用して所定の患部に誘導することを特徴とする。
【0015】
また、本発明では、磁気検出装置に係る第1の解決手段として、体内に投与された上記第1〜6のいずれかの解決手段を有する薬の磁性を検出することで、当該薬の体内動態を検知することを特徴とする。
【0016】
また、本発明では、薬の設計方法に係る第1の解決手段として、薬として用いられる有機化合物または無機化合物に対し、側鎖の修飾または/及び側鎖間の架橋を行った分子モデルを設定し、当該分子モデルについて数値計算により求めたスピン電荷密度分布から前記分子モデルが磁性を有するか否かを判定し、磁性を有すると判定した分子モデルに基づいて薬を設計することを特徴とする。
【0017】
また、本発明では、薬の設計方法に係る第2の解決手段として、上記第1の解決手段において、前記スピン電荷密度分布に基づいて前記分子モデルが強磁性かフェリ磁性かを判定することを特徴とする。
【0018】
また、本発明では、薬の設計方法に係る第3の解決手段として、上記第1または2の解決手段において、前記スピン電荷密度分布に基づいて前記分子モデルの磁性の強度を判定することを特徴とする。
【発明の効果】
【0019】
本発明によれば、薬そのものに磁性を持たせるため、従来のように磁性体からなる担体を用いることなく、薬自体が有する磁性を利用して体内の患部まで薬を誘導することができる。その結果、従来における、経口投与が困難なこと、担体分子が一般的に巨大であること、あるいは薬剤分子との結合強度、親和性に技術的な問題があること等を解決することができ、実用化が容易なドラッグ・デリバリシステムを実現することが可能である。
【発明を実施するための最良の形態】
【0020】
以下、図面を参照して、本発明の一実施形態について説明する。〔第1実施形態〕 まず、第1実施形態として、有機化合物、より具体的には薬候補剤としてのフォルスコリンを用いて説明する。図1は、フォルスコリンの基本分子構造モデル図である。この図において、R6、R7及びR13はフォルスコリンの側鎖を修飾するための原子または分子が結合する位置を示しており、当該位置にどのような原子または分子が結合するかによってフォルスコリンの物性が変化する。この図において、R6にH、R7にCH3、R13にCH=CH2が結合したものが、自然界に存在するフォルスコリンであり、人工的に側鎖の構造を変える、つまりR6、R7及びR13を修飾する原子または分子を変えることで生成されたフォルスコリンをフォルスコリン誘導体という。なお、図1において、C1〜C13は、炭素原子(C)を示す。
【0021】
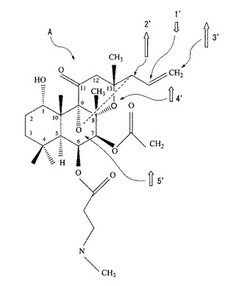
図2は、磁性(フェリ磁性)を有するフォルスコリン誘導体Aの基本分子構造モデル図である。この図に示すように、フォルスコリン誘導体Aは、上記のような自然界に存在するフォルスコリンのR6をCOCH2CH2NCH3に、R7をCH2に変えると共に、C9に結合している酸素原子(O)と、C13に結合している炭素原子とを架橋したものである。
【0022】
図3に、第一原理分子動力学法に基づくコンピュータ・シミュレーションにより求めた、上記フォルスコリン誘導体Aの3次元的な分子構造及びスピン電荷密度分布を示す。図3において、領域1は下向きのスピン電荷密度を示し、領域2〜5は上向きのスピン電荷密度を示す。よって、フォルスコリン誘導体Aは、図2に示すような下向きのスピン状態1’と、上向きのスピン状態2’〜5’とが混在するのでフェリ磁性体であることがわかる。
【0023】
一方、図4は、磁性(強磁性)を有するフォルスコリン誘導体Bの基本分子構造
モデル図である。この図に示すように、フォルスコリン誘導体Bは、上記のような自然界に存在するフォルスコリンのR6をCOCH2CH2NCH3に、R7をCH2に、R13をCH−CH3に変えると共に、C9に結合している酸素原子と、C13に結合している炭素原子とを架橋したものである。
【0024】
図5に、上記と同様に、第一原理分子動力学法に基づくコンピュータ・シミュレーションにより求めた、フォルスコリン誘導体Bの3次元的な分子構造及びスピン電荷密度分布を示す。図5において、領域10〜12は上向きのスピン電荷密度を示す。よって、フォルスコリン誘導体Bは、図4に示すような上向きのスピン状態10’〜12’のみが存在するので強磁性体であることがわかる。
【0025】
このように、フォルスコリンの側鎖を所定の原子または分子で修飾すると共に、所定の箇所に存在する側鎖間を架橋することにより磁性を有するフォルスコリン誘導体、つまり薬を生成することができる。では、このような磁性を有する薬の設計方法について以下説明する。図6は、本薬の設計方法の処理手順を示すフローチャートである。なお、以下で説明する処理は、第一原理分子動力学法に基づくコンピュータ・シミュレーション上で行われるものである。
【0026】
まず、薬として用いられるフォルスコリン誘導体には200以上もの種類があるので、その中から評価対象とするフォルスコリン誘導体を選定し、その化学式をコンピュータ・シミュレーションに入力する(ステップS1)。ここで、フォルスコリン誘導体として上述したフォルスコリン誘導体Aを選定した場合を想定して以下説明する。
【0027】
続いて、フォルスコリン誘導体Aの化学式に基づいて上向きのスピン(スピンアップ)波動関数Φ↑(r)、下向きのスピン(スピンダウン)波動関数Φ↓(r)、スピンアップ有効ポテンシャルV↑(r)、スピンダウン有効ポテンシャルV↓(r)、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の初期値を設定する(ステップS2)。なお、rは3次元空間上の座標を示す変数である。
【0028】
スピンアップ波動関数Φ↑(r)の初期値は、フォルスコリン誘導体Aを構成する各原子が孤立原子として3次元空間上に存在する場合のスピンアップ波動関数Φ↑(r)を各原子毎に求め、このように求めたスピンアップ波動関数Φ↑(r)を全て加算したものである。同様に、スピンダウン波動関数Φ↓(r)の初期値は、各原子が孤立原子として3次元空間上に存在する場合のスピンダウン波動関数Φ↓(r)を各原子毎に求め、全て加算したものである。また、スピンアップ有効ポテンシャルV↑(r)の初期値は、フォルスコリン誘導体Aを構成する各原子が孤立原子として3次元空間上に存在する場合のスピンアップ波動関数Φ↑(r)に基づいてスピンアップ有効ポテンシャルV↑(r)を各原子毎に求め、当該各原子毎に求めたスピンアップ有効ポテンシャルV↑(r)を全て加算したものである。同様に、有効ポテンシャルV↓(r)の初期値は、各原子が孤立原子として3次元空間上に存在する場合のスピンダウン波動関数Φ↓(r)に基づいてスピンダウン有効ポテンシャルV↓(r)を各原子毎に求め、当該各原子毎に求めたスピンダウン有効ポテンシャルV↓(r)を全て加算したものである。また、スピンアップ電荷密度ρ↑(r)の初期値は、上記のように各原子毎に求めたスピンアップ波動関数Φ↑(r)を下記演算式(1)に代入することによって求める。また、スピンダウン電荷密度ρ↓(r)の初期値は、各原子毎に求めたスピンダウン波動関数Φ↓(r)を下記演算式(2)に代入することによって求める。なお、下記演算式(1)において、Φ↑*(r)は、スピンアップ波動関数Φ↑(r)の共役複素数であり、下記演算式(2)において、Φ↓*(r)は、スピンダウン波動関数Φ↓(r)の共役複素数である。
【0029】
【数1】

【0030】
次に、上記スピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポテンシャルV↓(r)の初期値と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の初期値に基づいて下記Kohn Sham方程式(3)、(4)を解くことにより、フォルスコリン誘導体Aのスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)と、スピンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓を算出する(ステップS3)。
【0031】
【数2】

【0032】
そして、ステップS3で求めたフォルスコリン誘導体Aのスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)に基づいてフォルスコリン誘導体Aのスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)と、スピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポテンシャルV↓(r)とを算出し(ステップS4)、このスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)と当該スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値、つまりここでは初期値とが等しいか否かを判断する(ステップS5)。このステップS5において、「NO」、すなわちスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値(初期値)と、ステップS4で求めた今回値とが等しくないと判断された場合、ステップS4で求めたスピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポテンシャルV↓(r)と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)とを新たな初期値と設定し(ステップS6)、ステップS3に移行して、再度Kohn Sham方程式(3)、(4)を解くことにより、新たなスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)と、スピンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓とを算出する。すなわち、ステップS5において、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値と今回値とが等しくなるまでステップS3〜S6の処理を繰り返すことにより、Kohn Sham方程式(3)、(4)を満足するスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)と、スピンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓とが求まる。
【0033】
一方、ステップS5において、「YES」、すなわちスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値と今回値とが等しいと判断された場合、上記のようにKohn Sham方程式(3)、(4)を満足するスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)と、スピンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓とに基づいて各原子に働く原子間力を算出すると共に、フォルスコリン誘導体Aの構造の最適化を行う(ステップS7)。つまり、ステップS3〜S6の繰り返しによって求めたスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)等は、あくまで図2に示すような2次元平面上のモデルにおいて最適な値であって、実際には3次元空間上におけるフォルスコリン誘導体Aの構造を考慮する必要がある。
【0034】
具体的には、ステップS7では、フォルスコリン誘導体Aを構成する各原子を、3次元空間上においてスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)から推測される最適な方向に所定の距離だけ移動させ、その時の各原子に働く原子間力を算出する。この時の原子間力が0になり、各原子が動かなくなった場合にフォルスコリン誘導体Aの構造が最適化されたと判断できる。よって、移動後の各原子に働く原子間力を算出し、該原子間力が0になったか否かを判断する(ステップS8)。このステップS8において、「NO」、すなわち原子間力が0ではなく、構造が最適化されていない場合、各原子の移動後の構造におけるスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)を求めると共に、当該スピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)から求めたスピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポテンシャルV↓(r)と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)とを新たな初期値と設定し(ステップS9)、ステップS3〜S8の処理を繰り返す。ここで、ステップS3に戻るのは、各原子の移動後の構造変化によってスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)が変化するためである。また、各原子の移動後の構造は記憶されており、再度ステップS7を行う時には、前回の構造から各原子を再び所定の距離だけ移動させることになる。
【0035】
このようなフォルスコリン誘導体Aの構造を最適化する際に、図2に示すように、C9に結合している酸素原子と、C13に結合している炭素原子とを架橋させるように、強制的に3次元構造を変化させる。なお、このような架橋させるために選択する原子は任意に変更可能である。
【0036】
一方、このステップS8において、「YES」、すなわち各原子に働く原子間力が0になり、フォルスコリン誘導体Aの構造が最適化された場合、その最適化された構造におけるスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)に基づいて、図3に示すようなスピン電荷密度分布を求める(ステップS10)。
【0037】
ここで、評価対象として選定したフォルスコリン誘導体によっては、図3に示す領域1〜5のようなスピン電荷密度分布が生じない、若しくはスピン電荷密度分布は生じるが、そのスピン電荷密度の大きさ(つまり磁性の強度)が非常に小さいものが存在する。このようなフォルスコリン誘導体は、磁性を有するとは判定することができない。従って、スピン電荷密度分布に基づいて、まず評価対象として選定したフォルスコリン誘導体が磁性を有するか否かを判断する(ステップS11)。
【0038】
ステップS11において、「NO」、すなわち、評価対象として選定したフォルスコリン誘導体が磁性を有しない場合、ステップS1に移行し、他のフォルスコリン誘導体を新たに選定して再度磁性評価を行う。一方、ステップS11において、「YES」、すなわち評価対象として選定したフォルスコリン誘導体が磁性を有する場合、スピン電荷密度分
布に基づいて強磁性かフェリ磁性かを判断する(ステップS12)。上述したように、スピン電荷密度分布は、スピンアップ電荷密度とスピンダウン電荷密度との分布を示すものであるので、これらスピンアップ電荷密度及びスピンダウン電荷密度が混在している場合は、フェリ磁性を有すると判断でき、スピンアップ電荷密度またはスピンダウン電荷密度のどちらか一方のみが存在する場合は、強磁性を有すると判断することができる。
【0039】
フォルスコリン誘導体Aは、図3に示すようにスピンアップ電荷密度(領域2〜5)及びスピンダウン電荷密度(領域1)が混在するので、フェリ磁性フォルスコリン誘導体と判定する(ステップS13)。一方、例えば選定したフォルスコリン誘導体がフォルスコリン誘導体Bであれば、図5に示すように、スピンアップ電荷密度(領域10〜12)のみが存在するので、強磁性フォルスコリン誘導体と判定する(ステップS14)。なお、スピン電荷密度分布に基づいて磁性の強度を求めることも可能である。
【0040】
以上のように、本薬の設計方法によれば、様々な原子または分子で側鎖を修飾し、さらに側鎖間を任意に架橋したフォルスコリン誘導体の磁性を判定することができ、磁性を有すると判定された分子モデルを基にフォルスコリン誘導体を生成することにより、磁性を有する薬を製造することができる。よって、従来のように磁性体からなる担体(キャリア)を用いることなく、薬自体が有する磁性を利用して体内の患部まで薬を誘導することができる。その結果、従来における、経口投与が困難なこと、担体分子が一般的に巨大であること、あるいは薬剤分子との結合強度、親和性に技術的な問題があること等を解決することができ、実用化が容易なドラッグ・デリバリシステムを実現することが可能である。
【0041】
なお、上記第1実施形態では、フォルスコリン誘導体A及びB共に、C9に結合している酸素原子と、C13に結合している炭素原子とを架橋させるように、強制的に3次元構造を変化させたが、これに限らず、架橋させる原子は他を選択しても良い。また、架橋を行なわず、側鎖を修飾する原子または分子を変更するだけで磁性を有するか否かを判定しても良い。
【0042】
また、上記第1実施形態では、有機化合物としてフォルスコリンを用いて説明したが、これに限らず、他の有機化合物を用いても良い。以下では、他の有機化合物として、男性勃起不全治療に効果のある組成物、より具体的には、PDE5(ホスホジエステラーゼ5)の発生を阻害する組成物(以下、PDE5阻害剤と称す)について説明する。なお、このPDE5阻害剤を有効成分とする薬は、いわゆるバイアグラ等の男性勃起不全治療薬として使用される。
【0043】
図7(a)は標準組成のPDE5阻害剤の基本分子構造モデル図であり、図7(b)は上述した薬の設計方法におけるコンピュータ・シミュレーションにより求めた、標準組成のPDE5阻害剤の3次元的な分子構造及びスピン電荷密度分布を示すものである。一方、図8(a)は標準組成のPDE5阻害剤に側鎖修飾を施したPDE5阻害剤誘導体の基本分子構造モデル図であり、図8(b)は上記コンピュータ・シミュレーションにより求めた、PDE5阻害剤誘導体の3次元的な分子構造及びスピン電荷密度分布を示すものである。図8(b)において、領域20〜23は上向きのスピン電荷密度を示し、領域24〜26は下向きのスピン電荷密度を示す。よって、PDE5阻害剤誘導体は、図8(a)に示すような上向きのスピン状態20’〜23’と、下向きのスピン状態24’〜26’とが混在するフェリ磁性体である。
【0044】
すなわち、これら図7及び図8に示すように、標準組成のPDE5阻害剤は磁性を有していないが、側鎖修飾によって生成されるPDE5阻害剤誘導体は磁性を有することが確認された。従って、このような磁性を有するPDE5阻害剤誘導体を有効成分とする男性勃起不全治療薬を使用することにより、患部に集中して薬理効果を発揮させることができ、ニトロ製剤との併用による副作用の発生を抑えることができる。
【0045】
〔第2実施形態〕次に、第2実施形態として、無機化合物、より具体的には抗がん剤としてのシスプラチンを用いて説明する。シスプラチンは金属錯体(白金錯体)であり、抗がん剤のなかでも白金製剤に分類される。
【0046】
図9は、標準組成のシスプラチンの基本分子構造モデル図である。第1実施形態で説明した薬の設計方法におけるコンピュータ・シミュレーションによって、この標準組成のシスプラチンは磁性を有していないことが確認された。一方、図10(a)は標準組成のシスプラチンに側鎖修飾を施したシスプラチン誘導体(Cis-Pt-a3)の基本分子構造モデル図であり、図10(b)は上記コンピュータ・シミュレーションにより求めた、シスプラチン誘導体(Cis-Pt-a3)の3次元的な分子構造及びスピン電荷密度分布を示すものである。
【0047】
図10(b)において、領域30〜32は上向きのスピン電荷密度を示している。よって、シスプラチン誘導体(Cis-Pt-a3)は、図10(a)に示すような上向きのスピン状態30’〜32’が存在する強磁性体であることがわかる。すなわち、本薬の設計方法におけるコンピュータ・シミュレーションによって、シスプラチン誘導体(Cis-Pt-a3)が磁性を有することが確認された。従って、このような磁性を有するシスプラチン誘導体(Cis-Pt-a3)を有効成分とする抗がん剤を使用することにより、がん組織に集中して薬理効果を発揮させることができ、副作用の発生を抑制することができる。
【0048】
ところで、薬の磁性が強ければ強い程、より効率よく患部に薬を誘導することができ、薬理効果の増大及び副作用の抑制を期待できる。そこで、本願発明者は、本薬の設計方法におけるコンピュータ・シミュレーションによって、種々のシスプラチン誘導体について磁性強度の解析を行なった。以下、その解析結果について説明する。なお、磁性強度はスピン電荷密度と比例関係にあるため、本実施形態では種々のシスプラチン誘導体におけるスピン電荷密度の解析を行なった。
【0049】
まず、リファレンスとして、マグネタイト(Fe3O4)の結晶から総原子数101個、一辺8Å程度の微粒子を切り出したものを分子モデルに設定し、上記コンピュータ・シミュレーションによって、電子状態と構造の最適化を行なった後、スピン電荷密度解析を行なった。そして、上記マグネタイトのスピン電荷密度を基準にし、種々のシスプラチン誘導体について同様にスピン電荷密度の解析を行なった。
【0050】
さらに、シスプラチン誘導体の他に、白金(Pt)をパラジウム(Pd)、ロジウム(Rh)、イリジウム(Ir)、金(Au)、ニッケル(Ni)、銀(Ag)、銅(Cu)、コバルト(Co)に置換した各種誘導体についても同様にスピン電荷密度の解析を行なった。このように、シスプラチン誘導体の白金を上述した金属元素に置換することで生成される誘導体には、シスプラチンやシスプラチン誘導体と同様に、がん細胞の増殖に関わるDNAを阻害する効果があることが知られている。
【0051】
図11は、マグネタイトのスピン電荷密度を「1」に規格化した場合における、各種シスプラチン誘導体、及びシスプラチン誘導体の白金(Pt)をパラジウム(Pd)、ロジウム(Rh)、イリジウム(Ir)、金(Au)、ニッケル(Ni)、銀(Ag)、銅(Cu)、コバルト(Co)に置換した各種誘導体のスピン電荷密度の解析結果を示すものである。
【0052】
この図11に示すように、シスプラチン誘導体の内、NK121がマグネタイトと比較して約60%のスピン電荷密度を有しており、他のシスプラチン誘導体と比べて磁性薬として有効であることがわかった。このシスプラチン誘導体NK121は、かつて安全性試験を経て臨床開発に及ぶことができたが、抗がん作用がシスプラチンと同程度であったため、シスプラチンを上回るメリットはないと判断され開発中止になったものである。従って、このシスプラチン誘導体NK121を服用し磁場による薬の患部への誘導を行えば、薬効は増大し、副作用も大幅に抑えることができる。なお、図12にシスプラチン誘導体NK121の基本分子構造モデル図を示す。この図に示すように、シスプラチン誘導体NK121は、上向きのスピン状態40’〜42’が存在する強磁性体である。
【0053】
また、シスプラチン誘導体の白金(Pt)をパラジウム(Pd)に置換した誘導体もある程度のスピン電荷密度を有し、磁性体であることが確認された。また、シスプラチン誘導体の白金(Pt)をロジウム(Rh)に置換した誘導体の内、Cis-Rh-a3がマグネタイトと比較して約50%のスピン電荷密度を有しており、磁性薬として有効であることがわかった。また、シスプラチン誘導体の白金(Pt)をイリジウム(Ir)に置換した誘導体は、スピン電荷密度が非常に小さく、磁性薬として大きな効果はないことが確認された。また、シスプラチン誘導体の白金(Pt)を金(Au)に置換した誘導体もある程度のスピン電荷密度を有し、磁性体であることが確認された。
【0054】
また、シスプラチン誘導体の白金(Pt)をニッケル(Ni)に置換した誘導体は、全般的にマグネタイトと比較して約50%前後のスピン電荷密度を有しており、磁性薬として有効であることがわかった。また、シスプラチン誘導体の白金(Pt)を銀(Ag)に置換した誘導体もある程度のスピン電荷密度を有し、磁性体であることが確認された。また、シスプラチン誘導体の白金(Pt)を銅(Cu)に置換した誘導体もある程度のスピン電荷密度を有し、磁性体であることが確認された。さらに、シスプラチン誘導体の白金(Pt)をコバルト(Co)に置換した誘導体は、マグネタイトと比較して高いもので約95%、全般的にみても非常に高いスピン電荷密度を有しており、磁性薬として非常に有効であることがわかった。
【0055】
以上のように、本実施形態における薬の設計方法によれば、有機化合物のみならず無機化合物からなる薬についても、その分子モデルから磁性を有するか否かを解析することができ、磁性強度の高い(つまり薬効の高い)薬を事前に調査することにより、有効な薬を非常に効率良く設計することが可能となる。
【0056】
なお、上記で説明したシスプラチン誘導体や、シスプラチン誘導体の白金を他の金属元素に置換した誘導体はシス幾何異性体である。このようなシス幾何異性体は、がん細胞の増殖に関わるDNAを阻害する効果がトランス幾何異性体よりも高いため、抗がん剤として利用されている。しかしながら、本実施形態における薬の設計方法によれば、対象となる薬は抗がん剤などのシス幾何異性体に限らず、トランス幾何異性体からなる金属錯体、または他の無機化合物であっても、磁性を有するか否かを解析することが可能である。従って、トランス幾何異性体からなる金属錯体、または他の無機化合物からなり、磁性を有する薬を設計することも可能である。
【0057】
続いて、上述したような磁性を有する薬を、患部に誘導する誘導装置について説明する。この誘導装置は、磁界を発生するものであれば良く、様々な形態の装置が考えられる。例えば、その一例として、磁気共鳴画像診断装置(MRI:Magnetic Resonance Imaging)の応用が考えられ、人体に磁界を放射し、当該磁界を薬が患部に誘導されるようにコントロールするような構成にすれば良い。また、例えば、磁石等の磁気を発生するものを患部の皮膚表面に貼りつけても良い。これにより、患部の近くに到達した薬は、患部に誘導されると共に、患部に集中して留まるため、他の正常な細胞に副作用を起こすこともない。以上のような誘導装置によれば、磁性を持つ薬を選択的且つ集中的に患部に誘導することが可能である。
【0058】
さらに、体内に投与された薬の磁性を利用して、その薬の体内動態を調べることもできる。より具体的には、磁性を有する薬をトレーサとし、磁気検出装置により薬から発生する磁気をトレースすることで薬の体内動態を調べる。このような磁気検出装置により、薬が体内に投与されてから患部に到達するまでの時間などの体内動態を調べることができ、薬の研究・開発に寄与す
ることができる。
【0059】
ところで、図9に示す標準組成のシスプラチンは、体内に投与されると図13に示す反応1〜3までの加水分解プロセスによって加水分解され、最終的にシスプラチンの加水分解物〔Pt(OH2)2(dien)〕2+が生成されることが知られている。上述したように図9に示す標準組成のシスプラチンは磁性を有しないが、本願発明者は、本薬の設計方法に基づき、このシスプラチンの加水分解物〔Pt(OH2)2(dien)〕2+が磁性体であることを発見した。図14は、シスプラチンの加水分解物〔Pt(OH2)2(dien)〕2+の3次元的な分子構造及びスピン電荷密度分布を示すものである。この図に示すように、シスプラチンの加水分解物〔Pt(OH2)2(dien)〕2+は、上向きのスピン電荷密度の領域50、51を有しているので、強磁性体であることがわかる。
【0060】
よって、標準組成のシスプラチンであっても、体内に投与した後に磁性を有するので、上述した誘導装置によって患部まで誘導することができ、また、磁気検出装置によって体内動態を調べることができる。
【図面の簡単な説明】
【0061】
【図1】本発明の一実施形態におけるフォルスコリンの基本分子構造モデル図である。
【図2】本発明の一実施形態におけるフェリ磁性を持つフォルスコリン誘導体Aの分子構造モデル図である。
【図3】本発明の一実施形態におけるフォルスコリン誘導体Aの3次元的分子構造モデル及びスピン電荷密度分布を示す図である。
【図4】本発明の一実施形態における強磁性を持つフォルスコリン誘導体Bの分子構造モデル図である。
【図5】本発明の一実施形態におけるフォルスコリン誘導体Bの3次元的分子構造モデル及びスピン電荷密度分布を示す図である。
【図6】本発明の一実施形態における薬の設計方法のフローチャートである。
【図7】本発明の一実施形態における標準組成のPDE5阻害剤の基本分子構造モデル図、及び3次元的な分子構造モデル及びスピン電荷密度分布である。
【図8】本発明の一実施形態におけるPDE5阻害剤誘導体の基本分子構造モデル図、及び3次元的な分子構造モデル及びスピン電荷密度分布である。
【図9】本発明の一実施形態におけるシスプラチンの基本分子構造モデル図である。
【図10】本発明の一実施形態におけるシスプラチン誘導体(Cis-Pt-a3)基本分子構造モデル図、及び3次元的な分子構造モデル及びスピン電荷密度分布である。
【図11】本発明の一実施形態におけるシスプラチン誘導体、及びシスプラチン誘導体の白金を他の金属元素に置換した誘導体のスピン電荷密度の解析結果である。
【図12】本発明の一実施形態におけるシスプラチン誘導体NK121の基本分子構造モデル図、及び3次元的な分子構造モデル及びスピン電荷密度分布である。
【図13】本発明の一実施形態におけるシスプラチンの体内における加水分解プロセスを示す図である。
【図14】本発明の一実施形態におけるシスプラチン加水分解物〔Pt(OH2)2(dien)〕2+の3次元的な分子構造モデル及びスピン電荷密度分布である。
【符号の説明】
【0062】
A、B…フォルスコリン誘導体
【技術分野】
【0001】
本発明は、薬、薬の誘導装置、磁気検出装置及び薬の設計方法に関する。
【背景技術】
【0002】
一般に薬剤は生体に投与され患部に到達し、その患部局所において薬理効果を発揮することで治療効果を引き起こすが、薬剤が患部以外の組織(つまり正常組織)に到達しても治療にはならない。したがって、いかにして効率的に患部に薬剤を誘導するかが治療戦略上重要となる。このように薬剤を患部に誘導する技術はドラッグ・デリバリと呼ばれ、近年研究開発が盛んに行なわれている。このドラッグ・デリバリには少なくとも二つのメリットがある。一つは患部組織において十分に高い薬剤濃度が得られることである。薬理効果は患部における薬剤濃度が一定以上でないと現れず、低い濃度では治療効果が望めないからである。二つ目は薬剤を患部組織のみに誘導して、不必要に正常組織に誘導させないことである。これにより副作用を抑制することができる。
【0003】
このようなドラッグ・デリバリが最も効果を発揮するのが抗がん剤によるがん治療である。抗がん剤は細胞分裂の活発ながん細胞の細胞増殖を抑制するものが大半であるため、正常組織においても細胞分裂の活発な組織、例えば骨髄あるいは毛根、消化管粘膜などの細胞増殖を抑制してしまう。このため抗がん剤の投与を受けたがん患者には貧血、抜け毛、嘔吐などの副作用が発生する。これら副作用は患者にとって大きな負担となるため投薬量を制限しなければならず、抗がん剤の薬理効果を十分に得ることができないという問題がある。さらに最悪の場合、副作用によって患者が死亡してしまう恐れがある。そこで、ドラッグ・デリバリによって抗がん剤をがん細胞まで誘導し、がん細胞に集中して薬理効果を発揮させることによって、副作用を抑えつつ効果的にがん治療を行うことができると期待されている。
【0004】
抗がん剤以外では、例えば男性勃起不全治療薬への応用が考えられる。男性勃起不全治療薬は、ニトロ製剤との併用により重篤な全身低血圧を引き起こし死亡にいたる例があり、とりわけ中高年以上の心疾患をもつ男性に問題となる。これは勃起不全治療薬が必ずしも患部に集中せず、全身の血管に作用してニトロ製剤のもつ血管拡張作用を増幅してしまうためである。そこで、ドラッグ・デリバリによって男性勃起不全治療薬を患部まで誘導し、患部に集中して薬理効果を発揮させることによって、ニトロ製剤との併用による副作用の発生を抑えることができると考えられる。
【0005】
ドラッグ・デリバリの具体的な手法としては、例えば担体(キャリア)を用いた患部組織へ誘導が検討されているが、これは患部に集中しやすい担体に薬剤を乗せて、担体に薬剤を患部まで運ばせようというものである。担体としては各種抗体やマイクロスフェア、あるいは磁性体を使用することが検討されている。なかでも有力視されているのが磁性体であり、薬剤に磁性体である担体を付着させ、磁場によって患部に集積させる方法が検討されている(例えば下記特許文献1参照)。この方法は誘導方法の簡便性と患部を標的にした治療が可能であることから、細胞毒性の高い抗がん剤にはとりわけ有効な手法として考えられている。
【特許文献1】特開2001−10978号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、上述したように、磁性体である担体をキャリアとして用いる場合、経口投与が困難なこと、担体分子が一般的に巨大であること、あるいは薬剤分子との結合強度、親和性に技術的な問題が指摘されており、実用化が困難であった。
【0007】
本発明は、上述した事情に鑑みてなされたものであり、従来の技術的問題を解決でき、実用化が容易なドラッグ・デリバリシステムを実現することを目的とする。
【課題を解決するための手段】
【0008】
上記目的を達成するために、本発明では、薬に係る第1の解決手段として、有機化合物または無機化合物から構成され、側鎖の修飾または/及び側鎖間の架橋により磁性を有することを特徴とする。
【0009】
また、本発明では、薬に係る第2の解決手段として、上記第1の解決手段において、前記有機化合物は、フォルスコリンであることを特徴とする。
【0010】
また、本発明では、薬に係る第3の解決手段として、上記第1の解決手段において、前記有機化合物は、男性勃起不全治療に効果のある組成物であることを特徴とする。
【0011】
また、本発明では、薬に係る第4の解決手段として、上記第1の解決手段において、前記無機化合物は、金属錯体であることを特徴とする。
【0012】
また、本発明では、薬に係る第5の解決手段として、上記第4の解決手段において、前記金属錯体は、抗がん性を有するシス幾何異性体であることを特徴とする。
【0013】
また、本発明では、薬に係る第6の解決手段として、上記第5の解決手段において、前記シス幾何異性体は、シスプラチンであることを特徴とする。
【0014】
また、本発明では、薬の誘導装置に係る第1の解決手段として、体内に投与された上記第1〜6のいずれかの解決手段を有する薬を、当該薬の磁性を利用して所定の患部に誘導することを特徴とする。
【0015】
また、本発明では、磁気検出装置に係る第1の解決手段として、体内に投与された上記第1〜6のいずれかの解決手段を有する薬の磁性を検出することで、当該薬の体内動態を検知することを特徴とする。
【0016】
また、本発明では、薬の設計方法に係る第1の解決手段として、薬として用いられる有機化合物または無機化合物に対し、側鎖の修飾または/及び側鎖間の架橋を行った分子モデルを設定し、当該分子モデルについて数値計算により求めたスピン電荷密度分布から前記分子モデルが磁性を有するか否かを判定し、磁性を有すると判定した分子モデルに基づいて薬を設計することを特徴とする。
【0017】
また、本発明では、薬の設計方法に係る第2の解決手段として、上記第1の解決手段において、前記スピン電荷密度分布に基づいて前記分子モデルが強磁性かフェリ磁性かを判定することを特徴とする。
【0018】
また、本発明では、薬の設計方法に係る第3の解決手段として、上記第1または2の解決手段において、前記スピン電荷密度分布に基づいて前記分子モデルの磁性の強度を判定することを特徴とする。
【発明の効果】
【0019】
本発明によれば、薬そのものに磁性を持たせるため、従来のように磁性体からなる担体を用いることなく、薬自体が有する磁性を利用して体内の患部まで薬を誘導することができる。その結果、従来における、経口投与が困難なこと、担体分子が一般的に巨大であること、あるいは薬剤分子との結合強度、親和性に技術的な問題があること等を解決することができ、実用化が容易なドラッグ・デリバリシステムを実現することが可能である。
【発明を実施するための最良の形態】
【0020】
以下、図面を参照して、本発明の一実施形態について説明する。〔第1実施形態〕 まず、第1実施形態として、有機化合物、より具体的には薬候補剤としてのフォルスコリンを用いて説明する。図1は、フォルスコリンの基本分子構造モデル図である。この図において、R6、R7及びR13はフォルスコリンの側鎖を修飾するための原子または分子が結合する位置を示しており、当該位置にどのような原子または分子が結合するかによってフォルスコリンの物性が変化する。この図において、R6にH、R7にCH3、R13にCH=CH2が結合したものが、自然界に存在するフォルスコリンであり、人工的に側鎖の構造を変える、つまりR6、R7及びR13を修飾する原子または分子を変えることで生成されたフォルスコリンをフォルスコリン誘導体という。なお、図1において、C1〜C13は、炭素原子(C)を示す。
【0021】
図2は、磁性(フェリ磁性)を有するフォルスコリン誘導体Aの基本分子構造モデル図である。この図に示すように、フォルスコリン誘導体Aは、上記のような自然界に存在するフォルスコリンのR6をCOCH2CH2NCH3に、R7をCH2に変えると共に、C9に結合している酸素原子(O)と、C13に結合している炭素原子とを架橋したものである。
【0022】
図3に、第一原理分子動力学法に基づくコンピュータ・シミュレーションにより求めた、上記フォルスコリン誘導体Aの3次元的な分子構造及びスピン電荷密度分布を示す。図3において、領域1は下向きのスピン電荷密度を示し、領域2〜5は上向きのスピン電荷密度を示す。よって、フォルスコリン誘導体Aは、図2に示すような下向きのスピン状態1’と、上向きのスピン状態2’〜5’とが混在するのでフェリ磁性体であることがわかる。
【0023】
一方、図4は、磁性(強磁性)を有するフォルスコリン誘導体Bの基本分子構造
モデル図である。この図に示すように、フォルスコリン誘導体Bは、上記のような自然界に存在するフォルスコリンのR6をCOCH2CH2NCH3に、R7をCH2に、R13をCH−CH3に変えると共に、C9に結合している酸素原子と、C13に結合している炭素原子とを架橋したものである。
【0024】
図5に、上記と同様に、第一原理分子動力学法に基づくコンピュータ・シミュレーションにより求めた、フォルスコリン誘導体Bの3次元的な分子構造及びスピン電荷密度分布を示す。図5において、領域10〜12は上向きのスピン電荷密度を示す。よって、フォルスコリン誘導体Bは、図4に示すような上向きのスピン状態10’〜12’のみが存在するので強磁性体であることがわかる。
【0025】
このように、フォルスコリンの側鎖を所定の原子または分子で修飾すると共に、所定の箇所に存在する側鎖間を架橋することにより磁性を有するフォルスコリン誘導体、つまり薬を生成することができる。では、このような磁性を有する薬の設計方法について以下説明する。図6は、本薬の設計方法の処理手順を示すフローチャートである。なお、以下で説明する処理は、第一原理分子動力学法に基づくコンピュータ・シミュレーション上で行われるものである。
【0026】
まず、薬として用いられるフォルスコリン誘導体には200以上もの種類があるので、その中から評価対象とするフォルスコリン誘導体を選定し、その化学式をコンピュータ・シミュレーションに入力する(ステップS1)。ここで、フォルスコリン誘導体として上述したフォルスコリン誘導体Aを選定した場合を想定して以下説明する。
【0027】
続いて、フォルスコリン誘導体Aの化学式に基づいて上向きのスピン(スピンアップ)波動関数Φ↑(r)、下向きのスピン(スピンダウン)波動関数Φ↓(r)、スピンアップ有効ポテンシャルV↑(r)、スピンダウン有効ポテンシャルV↓(r)、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の初期値を設定する(ステップS2)。なお、rは3次元空間上の座標を示す変数である。
【0028】
スピンアップ波動関数Φ↑(r)の初期値は、フォルスコリン誘導体Aを構成する各原子が孤立原子として3次元空間上に存在する場合のスピンアップ波動関数Φ↑(r)を各原子毎に求め、このように求めたスピンアップ波動関数Φ↑(r)を全て加算したものである。同様に、スピンダウン波動関数Φ↓(r)の初期値は、各原子が孤立原子として3次元空間上に存在する場合のスピンダウン波動関数Φ↓(r)を各原子毎に求め、全て加算したものである。また、スピンアップ有効ポテンシャルV↑(r)の初期値は、フォルスコリン誘導体Aを構成する各原子が孤立原子として3次元空間上に存在する場合のスピンアップ波動関数Φ↑(r)に基づいてスピンアップ有効ポテンシャルV↑(r)を各原子毎に求め、当該各原子毎に求めたスピンアップ有効ポテンシャルV↑(r)を全て加算したものである。同様に、有効ポテンシャルV↓(r)の初期値は、各原子が孤立原子として3次元空間上に存在する場合のスピンダウン波動関数Φ↓(r)に基づいてスピンダウン有効ポテンシャルV↓(r)を各原子毎に求め、当該各原子毎に求めたスピンダウン有効ポテンシャルV↓(r)を全て加算したものである。また、スピンアップ電荷密度ρ↑(r)の初期値は、上記のように各原子毎に求めたスピンアップ波動関数Φ↑(r)を下記演算式(1)に代入することによって求める。また、スピンダウン電荷密度ρ↓(r)の初期値は、各原子毎に求めたスピンダウン波動関数Φ↓(r)を下記演算式(2)に代入することによって求める。なお、下記演算式(1)において、Φ↑*(r)は、スピンアップ波動関数Φ↑(r)の共役複素数であり、下記演算式(2)において、Φ↓*(r)は、スピンダウン波動関数Φ↓(r)の共役複素数である。
【0029】
【数1】

【0030】
次に、上記スピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポテンシャルV↓(r)の初期値と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の初期値に基づいて下記Kohn Sham方程式(3)、(4)を解くことにより、フォルスコリン誘導体Aのスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)と、スピンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓を算出する(ステップS3)。
【0031】
【数2】

【0032】
そして、ステップS3で求めたフォルスコリン誘導体Aのスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)に基づいてフォルスコリン誘導体Aのスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)と、スピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポテンシャルV↓(r)とを算出し(ステップS4)、このスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)と当該スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値、つまりここでは初期値とが等しいか否かを判断する(ステップS5)。このステップS5において、「NO」、すなわちスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値(初期値)と、ステップS4で求めた今回値とが等しくないと判断された場合、ステップS4で求めたスピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポテンシャルV↓(r)と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)とを新たな初期値と設定し(ステップS6)、ステップS3に移行して、再度Kohn Sham方程式(3)、(4)を解くことにより、新たなスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)と、スピンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓とを算出する。すなわち、ステップS5において、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値と今回値とが等しくなるまでステップS3〜S6の処理を繰り返すことにより、Kohn Sham方程式(3)、(4)を満足するスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)と、スピンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓とが求まる。
【0033】
一方、ステップS5において、「YES」、すなわちスピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)の前回値と今回値とが等しいと判断された場合、上記のようにKohn Sham方程式(3)、(4)を満足するスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)と、スピンアップエネルギ固有値ε↑及びスピンダウンエネルギ固有値ε↓とに基づいて各原子に働く原子間力を算出すると共に、フォルスコリン誘導体Aの構造の最適化を行う(ステップS7)。つまり、ステップS3〜S6の繰り返しによって求めたスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)等は、あくまで図2に示すような2次元平面上のモデルにおいて最適な値であって、実際には3次元空間上におけるフォルスコリン誘導体Aの構造を考慮する必要がある。
【0034】
具体的には、ステップS7では、フォルスコリン誘導体Aを構成する各原子を、3次元空間上においてスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)から推測される最適な方向に所定の距離だけ移動させ、その時の各原子に働く原子間力を算出する。この時の原子間力が0になり、各原子が動かなくなった場合にフォルスコリン誘導体Aの構造が最適化されたと判断できる。よって、移動後の各原子に働く原子間力を算出し、該原子間力が0になったか否かを判断する(ステップS8)。このステップS8において、「NO」、すなわち原子間力が0ではなく、構造が最適化されていない場合、各原子の移動後の構造におけるスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)を求めると共に、当該スピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)から求めたスピンアップ有効ポテンシャルV↑(r)及びスピンダウン有効ポテンシャルV↓(r)と、スピンアップ電荷密度ρ↑(r)及びスピンダウン電荷密度ρ↓(r)とを新たな初期値と設定し(ステップS9)、ステップS3〜S8の処理を繰り返す。ここで、ステップS3に戻るのは、各原子の移動後の構造変化によってスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)が変化するためである。また、各原子の移動後の構造は記憶されており、再度ステップS7を行う時には、前回の構造から各原子を再び所定の距離だけ移動させることになる。
【0035】
このようなフォルスコリン誘導体Aの構造を最適化する際に、図2に示すように、C9に結合している酸素原子と、C13に結合している炭素原子とを架橋させるように、強制的に3次元構造を変化させる。なお、このような架橋させるために選択する原子は任意に変更可能である。
【0036】
一方、このステップS8において、「YES」、すなわち各原子に働く原子間力が0になり、フォルスコリン誘導体Aの構造が最適化された場合、その最適化された構造におけるスピンアップ波動関数Φ↑(r)及びスピンダウン波動関数Φ↓(r)に基づいて、図3に示すようなスピン電荷密度分布を求める(ステップS10)。
【0037】
ここで、評価対象として選定したフォルスコリン誘導体によっては、図3に示す領域1〜5のようなスピン電荷密度分布が生じない、若しくはスピン電荷密度分布は生じるが、そのスピン電荷密度の大きさ(つまり磁性の強度)が非常に小さいものが存在する。このようなフォルスコリン誘導体は、磁性を有するとは判定することができない。従って、スピン電荷密度分布に基づいて、まず評価対象として選定したフォルスコリン誘導体が磁性を有するか否かを判断する(ステップS11)。
【0038】
ステップS11において、「NO」、すなわち、評価対象として選定したフォルスコリン誘導体が磁性を有しない場合、ステップS1に移行し、他のフォルスコリン誘導体を新たに選定して再度磁性評価を行う。一方、ステップS11において、「YES」、すなわち評価対象として選定したフォルスコリン誘導体が磁性を有する場合、スピン電荷密度分
布に基づいて強磁性かフェリ磁性かを判断する(ステップS12)。上述したように、スピン電荷密度分布は、スピンアップ電荷密度とスピンダウン電荷密度との分布を示すものであるので、これらスピンアップ電荷密度及びスピンダウン電荷密度が混在している場合は、フェリ磁性を有すると判断でき、スピンアップ電荷密度またはスピンダウン電荷密度のどちらか一方のみが存在する場合は、強磁性を有すると判断することができる。
【0039】
フォルスコリン誘導体Aは、図3に示すようにスピンアップ電荷密度(領域2〜5)及びスピンダウン電荷密度(領域1)が混在するので、フェリ磁性フォルスコリン誘導体と判定する(ステップS13)。一方、例えば選定したフォルスコリン誘導体がフォルスコリン誘導体Bであれば、図5に示すように、スピンアップ電荷密度(領域10〜12)のみが存在するので、強磁性フォルスコリン誘導体と判定する(ステップS14)。なお、スピン電荷密度分布に基づいて磁性の強度を求めることも可能である。
【0040】
以上のように、本薬の設計方法によれば、様々な原子または分子で側鎖を修飾し、さらに側鎖間を任意に架橋したフォルスコリン誘導体の磁性を判定することができ、磁性を有すると判定された分子モデルを基にフォルスコリン誘導体を生成することにより、磁性を有する薬を製造することができる。よって、従来のように磁性体からなる担体(キャリア)を用いることなく、薬自体が有する磁性を利用して体内の患部まで薬を誘導することができる。その結果、従来における、経口投与が困難なこと、担体分子が一般的に巨大であること、あるいは薬剤分子との結合強度、親和性に技術的な問題があること等を解決することができ、実用化が容易なドラッグ・デリバリシステムを実現することが可能である。
【0041】
なお、上記第1実施形態では、フォルスコリン誘導体A及びB共に、C9に結合している酸素原子と、C13に結合している炭素原子とを架橋させるように、強制的に3次元構造を変化させたが、これに限らず、架橋させる原子は他を選択しても良い。また、架橋を行なわず、側鎖を修飾する原子または分子を変更するだけで磁性を有するか否かを判定しても良い。
【0042】
また、上記第1実施形態では、有機化合物としてフォルスコリンを用いて説明したが、これに限らず、他の有機化合物を用いても良い。以下では、他の有機化合物として、男性勃起不全治療に効果のある組成物、より具体的には、PDE5(ホスホジエステラーゼ5)の発生を阻害する組成物(以下、PDE5阻害剤と称す)について説明する。なお、このPDE5阻害剤を有効成分とする薬は、いわゆるバイアグラ等の男性勃起不全治療薬として使用される。
【0043】
図7(a)は標準組成のPDE5阻害剤の基本分子構造モデル図であり、図7(b)は上述した薬の設計方法におけるコンピュータ・シミュレーションにより求めた、標準組成のPDE5阻害剤の3次元的な分子構造及びスピン電荷密度分布を示すものである。一方、図8(a)は標準組成のPDE5阻害剤に側鎖修飾を施したPDE5阻害剤誘導体の基本分子構造モデル図であり、図8(b)は上記コンピュータ・シミュレーションにより求めた、PDE5阻害剤誘導体の3次元的な分子構造及びスピン電荷密度分布を示すものである。図8(b)において、領域20〜23は上向きのスピン電荷密度を示し、領域24〜26は下向きのスピン電荷密度を示す。よって、PDE5阻害剤誘導体は、図8(a)に示すような上向きのスピン状態20’〜23’と、下向きのスピン状態24’〜26’とが混在するフェリ磁性体である。
【0044】
すなわち、これら図7及び図8に示すように、標準組成のPDE5阻害剤は磁性を有していないが、側鎖修飾によって生成されるPDE5阻害剤誘導体は磁性を有することが確認された。従って、このような磁性を有するPDE5阻害剤誘導体を有効成分とする男性勃起不全治療薬を使用することにより、患部に集中して薬理効果を発揮させることができ、ニトロ製剤との併用による副作用の発生を抑えることができる。
【0045】
〔第2実施形態〕次に、第2実施形態として、無機化合物、より具体的には抗がん剤としてのシスプラチンを用いて説明する。シスプラチンは金属錯体(白金錯体)であり、抗がん剤のなかでも白金製剤に分類される。
【0046】
図9は、標準組成のシスプラチンの基本分子構造モデル図である。第1実施形態で説明した薬の設計方法におけるコンピュータ・シミュレーションによって、この標準組成のシスプラチンは磁性を有していないことが確認された。一方、図10(a)は標準組成のシスプラチンに側鎖修飾を施したシスプラチン誘導体(Cis-Pt-a3)の基本分子構造モデル図であり、図10(b)は上記コンピュータ・シミュレーションにより求めた、シスプラチン誘導体(Cis-Pt-a3)の3次元的な分子構造及びスピン電荷密度分布を示すものである。
【0047】
図10(b)において、領域30〜32は上向きのスピン電荷密度を示している。よって、シスプラチン誘導体(Cis-Pt-a3)は、図10(a)に示すような上向きのスピン状態30’〜32’が存在する強磁性体であることがわかる。すなわち、本薬の設計方法におけるコンピュータ・シミュレーションによって、シスプラチン誘導体(Cis-Pt-a3)が磁性を有することが確認された。従って、このような磁性を有するシスプラチン誘導体(Cis-Pt-a3)を有効成分とする抗がん剤を使用することにより、がん組織に集中して薬理効果を発揮させることができ、副作用の発生を抑制することができる。
【0048】
ところで、薬の磁性が強ければ強い程、より効率よく患部に薬を誘導することができ、薬理効果の増大及び副作用の抑制を期待できる。そこで、本願発明者は、本薬の設計方法におけるコンピュータ・シミュレーションによって、種々のシスプラチン誘導体について磁性強度の解析を行なった。以下、その解析結果について説明する。なお、磁性強度はスピン電荷密度と比例関係にあるため、本実施形態では種々のシスプラチン誘導体におけるスピン電荷密度の解析を行なった。
【0049】
まず、リファレンスとして、マグネタイト(Fe3O4)の結晶から総原子数101個、一辺8Å程度の微粒子を切り出したものを分子モデルに設定し、上記コンピュータ・シミュレーションによって、電子状態と構造の最適化を行なった後、スピン電荷密度解析を行なった。そして、上記マグネタイトのスピン電荷密度を基準にし、種々のシスプラチン誘導体について同様にスピン電荷密度の解析を行なった。
【0050】
さらに、シスプラチン誘導体の他に、白金(Pt)をパラジウム(Pd)、ロジウム(Rh)、イリジウム(Ir)、金(Au)、ニッケル(Ni)、銀(Ag)、銅(Cu)、コバルト(Co)に置換した各種誘導体についても同様にスピン電荷密度の解析を行なった。このように、シスプラチン誘導体の白金を上述した金属元素に置換することで生成される誘導体には、シスプラチンやシスプラチン誘導体と同様に、がん細胞の増殖に関わるDNAを阻害する効果があることが知られている。
【0051】
図11は、マグネタイトのスピン電荷密度を「1」に規格化した場合における、各種シスプラチン誘導体、及びシスプラチン誘導体の白金(Pt)をパラジウム(Pd)、ロジウム(Rh)、イリジウム(Ir)、金(Au)、ニッケル(Ni)、銀(Ag)、銅(Cu)、コバルト(Co)に置換した各種誘導体のスピン電荷密度の解析結果を示すものである。
【0052】
この図11に示すように、シスプラチン誘導体の内、NK121がマグネタイトと比較して約60%のスピン電荷密度を有しており、他のシスプラチン誘導体と比べて磁性薬として有効であることがわかった。このシスプラチン誘導体NK121は、かつて安全性試験を経て臨床開発に及ぶことができたが、抗がん作用がシスプラチンと同程度であったため、シスプラチンを上回るメリットはないと判断され開発中止になったものである。従って、このシスプラチン誘導体NK121を服用し磁場による薬の患部への誘導を行えば、薬効は増大し、副作用も大幅に抑えることができる。なお、図12にシスプラチン誘導体NK121の基本分子構造モデル図を示す。この図に示すように、シスプラチン誘導体NK121は、上向きのスピン状態40’〜42’が存在する強磁性体である。
【0053】
また、シスプラチン誘導体の白金(Pt)をパラジウム(Pd)に置換した誘導体もある程度のスピン電荷密度を有し、磁性体であることが確認された。また、シスプラチン誘導体の白金(Pt)をロジウム(Rh)に置換した誘導体の内、Cis-Rh-a3がマグネタイトと比較して約50%のスピン電荷密度を有しており、磁性薬として有効であることがわかった。また、シスプラチン誘導体の白金(Pt)をイリジウム(Ir)に置換した誘導体は、スピン電荷密度が非常に小さく、磁性薬として大きな効果はないことが確認された。また、シスプラチン誘導体の白金(Pt)を金(Au)に置換した誘導体もある程度のスピン電荷密度を有し、磁性体であることが確認された。
【0054】
また、シスプラチン誘導体の白金(Pt)をニッケル(Ni)に置換した誘導体は、全般的にマグネタイトと比較して約50%前後のスピン電荷密度を有しており、磁性薬として有効であることがわかった。また、シスプラチン誘導体の白金(Pt)を銀(Ag)に置換した誘導体もある程度のスピン電荷密度を有し、磁性体であることが確認された。また、シスプラチン誘導体の白金(Pt)を銅(Cu)に置換した誘導体もある程度のスピン電荷密度を有し、磁性体であることが確認された。さらに、シスプラチン誘導体の白金(Pt)をコバルト(Co)に置換した誘導体は、マグネタイトと比較して高いもので約95%、全般的にみても非常に高いスピン電荷密度を有しており、磁性薬として非常に有効であることがわかった。
【0055】
以上のように、本実施形態における薬の設計方法によれば、有機化合物のみならず無機化合物からなる薬についても、その分子モデルから磁性を有するか否かを解析することができ、磁性強度の高い(つまり薬効の高い)薬を事前に調査することにより、有効な薬を非常に効率良く設計することが可能となる。
【0056】
なお、上記で説明したシスプラチン誘導体や、シスプラチン誘導体の白金を他の金属元素に置換した誘導体はシス幾何異性体である。このようなシス幾何異性体は、がん細胞の増殖に関わるDNAを阻害する効果がトランス幾何異性体よりも高いため、抗がん剤として利用されている。しかしながら、本実施形態における薬の設計方法によれば、対象となる薬は抗がん剤などのシス幾何異性体に限らず、トランス幾何異性体からなる金属錯体、または他の無機化合物であっても、磁性を有するか否かを解析することが可能である。従って、トランス幾何異性体からなる金属錯体、または他の無機化合物からなり、磁性を有する薬を設計することも可能である。
【0057】
続いて、上述したような磁性を有する薬を、患部に誘導する誘導装置について説明する。この誘導装置は、磁界を発生するものであれば良く、様々な形態の装置が考えられる。例えば、その一例として、磁気共鳴画像診断装置(MRI:Magnetic Resonance Imaging)の応用が考えられ、人体に磁界を放射し、当該磁界を薬が患部に誘導されるようにコントロールするような構成にすれば良い。また、例えば、磁石等の磁気を発生するものを患部の皮膚表面に貼りつけても良い。これにより、患部の近くに到達した薬は、患部に誘導されると共に、患部に集中して留まるため、他の正常な細胞に副作用を起こすこともない。以上のような誘導装置によれば、磁性を持つ薬を選択的且つ集中的に患部に誘導することが可能である。
【0058】
さらに、体内に投与された薬の磁性を利用して、その薬の体内動態を調べることもできる。より具体的には、磁性を有する薬をトレーサとし、磁気検出装置により薬から発生する磁気をトレースすることで薬の体内動態を調べる。このような磁気検出装置により、薬が体内に投与されてから患部に到達するまでの時間などの体内動態を調べることができ、薬の研究・開発に寄与す
ることができる。
【0059】
ところで、図9に示す標準組成のシスプラチンは、体内に投与されると図13に示す反応1〜3までの加水分解プロセスによって加水分解され、最終的にシスプラチンの加水分解物〔Pt(OH2)2(dien)〕2+が生成されることが知られている。上述したように図9に示す標準組成のシスプラチンは磁性を有しないが、本願発明者は、本薬の設計方法に基づき、このシスプラチンの加水分解物〔Pt(OH2)2(dien)〕2+が磁性体であることを発見した。図14は、シスプラチンの加水分解物〔Pt(OH2)2(dien)〕2+の3次元的な分子構造及びスピン電荷密度分布を示すものである。この図に示すように、シスプラチンの加水分解物〔Pt(OH2)2(dien)〕2+は、上向きのスピン電荷密度の領域50、51を有しているので、強磁性体であることがわかる。
【0060】
よって、標準組成のシスプラチンであっても、体内に投与した後に磁性を有するので、上述した誘導装置によって患部まで誘導することができ、また、磁気検出装置によって体内動態を調べることができる。
【図面の簡単な説明】
【0061】
【図1】本発明の一実施形態におけるフォルスコリンの基本分子構造モデル図である。
【図2】本発明の一実施形態におけるフェリ磁性を持つフォルスコリン誘導体Aの分子構造モデル図である。
【図3】本発明の一実施形態におけるフォルスコリン誘導体Aの3次元的分子構造モデル及びスピン電荷密度分布を示す図である。
【図4】本発明の一実施形態における強磁性を持つフォルスコリン誘導体Bの分子構造モデル図である。
【図5】本発明の一実施形態におけるフォルスコリン誘導体Bの3次元的分子構造モデル及びスピン電荷密度分布を示す図である。
【図6】本発明の一実施形態における薬の設計方法のフローチャートである。
【図7】本発明の一実施形態における標準組成のPDE5阻害剤の基本分子構造モデル図、及び3次元的な分子構造モデル及びスピン電荷密度分布である。
【図8】本発明の一実施形態におけるPDE5阻害剤誘導体の基本分子構造モデル図、及び3次元的な分子構造モデル及びスピン電荷密度分布である。
【図9】本発明の一実施形態におけるシスプラチンの基本分子構造モデル図である。
【図10】本発明の一実施形態におけるシスプラチン誘導体(Cis-Pt-a3)基本分子構造モデル図、及び3次元的な分子構造モデル及びスピン電荷密度分布である。
【図11】本発明の一実施形態におけるシスプラチン誘導体、及びシスプラチン誘導体の白金を他の金属元素に置換した誘導体のスピン電荷密度の解析結果である。
【図12】本発明の一実施形態におけるシスプラチン誘導体NK121の基本分子構造モデル図、及び3次元的な分子構造モデル及びスピン電荷密度分布である。
【図13】本発明の一実施形態におけるシスプラチンの体内における加水分解プロセスを示す図である。
【図14】本発明の一実施形態におけるシスプラチン加水分解物〔Pt(OH2)2(dien)〕2+の3次元的な分子構造モデル及びスピン電荷密度分布である。
【符号の説明】
【0062】
A、B…フォルスコリン誘導体
【特許請求の範囲】
【請求項1】
有機化合物または無機化合物から構成され、側鎖の修飾または/及び側鎖間の架橋により磁性を有することを特徴とする薬。
【請求項2】
前記有機化合物は、フォルスコリンであることを特徴とする請求項1記載の薬。
【請求項3】
前記有機化合物は、男性勃起不全治療に効果のある組成物であることを特徴とする請求項1記載の薬。
【請求項4】
前記無機化合物は、金属錯体であることを特徴とする請求項1記載の薬。
【請求項5】
前記金属錯体は、抗がん性を有するシス幾何異性体であることを特徴とする請求項4記載の薬。
【請求項6】
前記シス幾何異性体は、シスプラチンであることを特徴とする請求項5記載の薬。
【請求項7】
体内に投与した請求項1〜6のいずれか一項に記載の薬を、当該薬の磁性を利用して所定の患部に誘導することを特徴とする薬の誘導装置。
【請求項8】
体内に投与した請求項1〜6のいずれか一項に記載の薬の磁性を検出することで、当該薬の体内動態を検知することを特徴とする磁気検出装置。
【請求項9】
薬として用いられる有機化合物または無機化合物に対し、側鎖の修飾または/及び側鎖間の架橋を行った分子モデルを設定し、当該分子モデルについて数値計算により求めたスピン電荷密度分布から前記分子モデルが磁性を有するか否かを判定し、磁性を有すると判定した分子モデルに基づいて薬を設計することを特徴とする薬の設計方法。
【請求項10】
前記スピン電荷密度分布に基づいて前記分子モデルが強磁性かフェリ磁性かを判定することを特徴とする請求項9記載の薬の設計方法。
【請求項11】
前記スピン電荷密度分布に基づいて前記分子モデルの磁性の強度を判定することを特徴とする請求項9または10記載の薬の設計方法。
【請求項1】
有機化合物または無機化合物から構成され、側鎖の修飾または/及び側鎖間の架橋により磁性を有することを特徴とする薬。
【請求項2】
前記有機化合物は、フォルスコリンであることを特徴とする請求項1記載の薬。
【請求項3】
前記有機化合物は、男性勃起不全治療に効果のある組成物であることを特徴とする請求項1記載の薬。
【請求項4】
前記無機化合物は、金属錯体であることを特徴とする請求項1記載の薬。
【請求項5】
前記金属錯体は、抗がん性を有するシス幾何異性体であることを特徴とする請求項4記載の薬。
【請求項6】
前記シス幾何異性体は、シスプラチンであることを特徴とする請求項5記載の薬。
【請求項7】
体内に投与した請求項1〜6のいずれか一項に記載の薬を、当該薬の磁性を利用して所定の患部に誘導することを特徴とする薬の誘導装置。
【請求項8】
体内に投与した請求項1〜6のいずれか一項に記載の薬の磁性を検出することで、当該薬の体内動態を検知することを特徴とする磁気検出装置。
【請求項9】
薬として用いられる有機化合物または無機化合物に対し、側鎖の修飾または/及び側鎖間の架橋を行った分子モデルを設定し、当該分子モデルについて数値計算により求めたスピン電荷密度分布から前記分子モデルが磁性を有するか否かを判定し、磁性を有すると判定した分子モデルに基づいて薬を設計することを特徴とする薬の設計方法。
【請求項10】
前記スピン電荷密度分布に基づいて前記分子モデルが強磁性かフェリ磁性かを判定することを特徴とする請求項9記載の薬の設計方法。
【請求項11】
前記スピン電荷密度分布に基づいて前記分子モデルの磁性の強度を判定することを特徴とする請求項9または10記載の薬の設計方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2009−108068(P2009−108068A)
【公開日】平成21年5月21日(2009.5.21)
【国際特許分類】
【出願番号】特願2008−280773(P2008−280773)
【出願日】平成20年10月31日(2008.10.31)
【分割の表示】特願2007−170909(P2007−170909)の分割
【原出願日】平成18年6月28日(2006.6.28)
【出願人】(000000099)株式会社IHI (5,014)
【出願人】(505328683)
【Fターム(参考)】
【公開日】平成21年5月21日(2009.5.21)
【国際特許分類】
【出願日】平成20年10月31日(2008.10.31)
【分割の表示】特願2007−170909(P2007−170909)の分割
【原出願日】平成18年6月28日(2006.6.28)
【出願人】(000000099)株式会社IHI (5,014)
【出願人】(505328683)

【Fターム(参考)】
[ Back to top ]

