薬剤の浸透促進方法
【課題】電位勾配を用いる薬剤の浸透促進方法でありながら、直流電源(電池)を利用しないで水溶性の薬剤を皮膚の外から適用して浸透を促進させる方法を開発する。
【解決手段】本発明は、水溶液中で電離する薬剤の浸透促進方法を提供する。本発明の方法は、前記薬剤を皮膚に適用するステップと、該ステップの後で、前記電離した薬剤に対して水溶液中で反発する荷電を有する粒子と、前記薬剤との混合液を皮膚に適用するステップとを含む。本発明の方法において、前記薬剤は4−メトキシサリチル酸又はその塩の場合がある。本発明は、水溶液中で陰性荷電を有する薬剤及び粒子の混合物と、前記薬剤とを含むキットであって、皮膚のバリア機能を一時的に低減する処理を施した後で、前記薬剤の水溶液を皮膚に適用し、その後、前記混合物の水溶液を皮膚に適用することによって本発明の方法を実施するためのキットを提供する。
【解決手段】本発明は、水溶液中で電離する薬剤の浸透促進方法を提供する。本発明の方法は、前記薬剤を皮膚に適用するステップと、該ステップの後で、前記電離した薬剤に対して水溶液中で反発する荷電を有する粒子と、前記薬剤との混合液を皮膚に適用するステップとを含む。本発明の方法において、前記薬剤は4−メトキシサリチル酸又はその塩の場合がある。本発明は、水溶液中で陰性荷電を有する薬剤及び粒子の混合物と、前記薬剤とを含むキットであって、皮膚のバリア機能を一時的に低減する処理を施した後で、前記薬剤の水溶液を皮膚に適用し、その後、前記混合物の水溶液を皮膚に適用することによって本発明の方法を実施するためのキットを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、薬剤の浸透促進方法、具体的には、電気的反発を利用する薬剤の浸透促進方法に関する。
【背景技術】
【0002】
医薬品や化粧料の成分である薬剤を皮膚の表面から投与する際には、従来は薬剤の濃度勾配による単純な濃度拡散に依存していた。つまり、皮膚透過性を向上させるために基剤中の薬物濃度を増大させたり、経皮吸収促進剤を使用するのが一般的であった。しかし、薬物濃度を増大させたり、経皮吸収促進剤を使用すると副作用も発生する。そのため、近年、濃度勾配に加えて皮膚の内外に電位差を発生させて電位勾配を利用して薬剤の皮膚透過を促進する技術が開発された。
【0003】
電位勾配を用いる薬剤の浸透促進方法としては、イオントフォレーシスがよく知られている。イオントフォレーシスの装置はマイナス極の電極およびプラス極の電極を有する2つのリザーバーと電源からなり、アニオン性薬物はマイナス極のリザーバーに、カチオン性薬物はプラス極のリザーバーに封入される。薬物を含有するリザーバーを施術部位に他方のリザーバーを他の皮膚に貼付し皮膚を介した回路を形成し電流を適用すると、アニオン性薬物はマイナス極において、カチオン性薬物はプラス極において電荷反発(以下、electrorepulsion)により皮膚への透過が促進される。
【非特許文献1】Siddiqui Oら、(1987)J Pharm Sci. 76:341−5.
【非特許文献2】Guy RHら、(2000)J Control Release 64:129−132.
【非特許文献3】杉林堅次(2001)ファルマシア 37:385−388.
【非特許文献4】森大輔ら、(2002)BME 16:8−13.
【発明の開示】
【発明が解決しようとする課題】
【0004】
電位勾配を用いる薬剤の浸透促進方法では、直流電源(電池)を用いるのが一般的である。しかし、電池を用いる場合には感電の危険がある。そこで、電位勾配を用いる薬剤の浸透促進方法でありながら、直流電源(電池)を利用しないで水溶性の薬剤を皮膚の外から適用して浸透を促進させる方法を開発する必要がある。
【課題を解決するための手段】
【0005】
本発明は、水溶液中で電離する薬剤の浸透促進方法を提供する。本発明の方法は、前記薬剤を皮膚に適用するステップと、該ステップの後で、前記電離した薬剤に対して水溶液中で反発する荷電を有する粒子と、前記薬剤との混合液を皮膚に適用するステップとを含む。
【0006】
本発明の方法において、前記薬剤と、前記粒子とは、ともに水溶液中で陰性荷電を有する場合がある。
【0007】
本発明の方法において、前記薬剤を皮膚に適用するステップの前に、皮膚のバリア機能を一時的に低減するステップを含む場合がある。
【0008】
本発明の方法において、前記皮膚のバリア機能を一時的に低減するステップは、エレクトロポレーション処理によって実施される場合がある。
【0009】
本発明の方法において、前記皮膚のバリア機能を一時的に低減するステップは、マイクロニードルアレイ処理によって実施される場合がある。
【0010】
本発明の方法において、前記皮膚のバリア機能を一時的に低減するステップは、角層剥離処理によって実施される場合がある。
【0011】
本発明の方法において、前記粒子は、25°Cの水溶液中のpHが2.5のシリカゾル粒子か、硫酸基で修飾されたポリスチレン粒子かの場合がある。
【0012】
本発明の方法において、前記薬剤はアルコキシサリチル酸又はその塩であり、前記粒子は硫酸基で修飾されたポリスチレン粒子の場合がある。
【0013】
本発明の方法において、前前記薬剤は4−メトキシサリチル酸又はその塩の場合がある。
【0014】
本発明は、本発明の方法を実施するためのキットを提供する。本発明のキットは、水溶液中で陰性荷電を有する薬剤及び粒子の混合物と、前記薬剤とを含み、皮膚のバリア機能を一時的に低減する処理を施した後で、前記薬剤の水溶液を皮膚に適用し、その後、前記混合物の水溶液を皮膚に適用することによって本発明の方法を実施するためのキットである。
【0015】
本発明のキットにおいて、前記粒子は、25°Cの水溶液中のpHが2.5のシリカゾル粒子か、硫酸基で修飾されたポリスチレン粒子かの場合がある。
【0016】
本発明のキットにおいて、前記薬剤はアルコキシサリチル酸又はその塩であり、前記粒子は硫酸基で修飾されたポリスチレン粒子の場合がある。
【0017】
本発明のキットにおいて、前記薬剤は4−メトキシサリチル酸又はその塩の場合がある。
【0018】
本発明のキットは、マイクロニードルアレイテープを含む場合がある。
【0019】
本発明のキットは、皮膚角層を剥離するための器具を含む場合がある。
【0020】
本発明の方法において、薬剤を皮膚に適用するステップと、その後で、前記電離した薬剤に対して水溶液中で反発する荷電を有する粒子と、前記薬剤との混合液とを皮膚に適用するステップとは、少なくとも15分、30分、1時間、1.5時間又は2時間の間隔をおいて実行される。
【0021】
本発明の方法又はキットにおいて、前記薬剤及び前記粒子はともに陰性荷電を有する、すなわち、アニオン性物質の場合がある。あるいは、前記薬剤及び前記粒子はともに陽性荷電を有する、すなわち、カチオン性物質の場合がある。
【0022】
本明細書において、皮膚のバリア機能は、水分蒸散量測定装置により経皮水分蒸散量(TEWL)を指標として評価することにより、定量的又は定性的に測定することができる。。TEWLの測定は、エバポリメーター、テヴァメーター、ミーコ水分測定機などの市販の機器によって従来公知の一般的な方法で行うことができ、特開2000−159666号明細書に記載される。代替策として、皮膚の通電電気特性に基づいて皮膚のバリア機能を測定する場合もある。角層のバリア機能を低下させる方法としては、角層を除去する方法と角層自身の性質を変える方法がある。角層を除去する方法としては、酸化アルミナや塩化ナトリウムなどの微結晶を皮膚に吹き付け、吸引しながら角層表面を表面から削る方法が知られている。また、セロハンテープなどの粘着テープを角層に貼付してはがすことで角層の一部を除去することができる。角層のバリア機能を低下させる方法としては、グリコール酸や乳酸などの水溶液で角層を処理する方法(ケミカルピーリング)やSDSや不飽和脂肪酸など角層細胞間脂質を一時的に乱す方法、角層を水和させる方法などがある。皮膚のバリア機能の低減は、角層剥離後のTEWLが、角層剥離前の皮膚のTEWLより大きい値になることにより評価できる。本発明における皮膚のバリア機能の低減の程度は、本発明の薬剤の皮膚浸透速度が角層剥離の前にくらべて角層剥離後に増大することを条件として、エレクトロポレーション処理、マイクロアレイニードル処理その他のいかなるやり方で行ってもかまわない。また、皮膚のバリア機能を一時的に低減するとは、皮膚のバリア機能が低減してから1ないし6時間後にバリア機能が回復することをいう。
【0023】
エレクトロポレーション(electroporation:電気穿孔法)は、主として遺伝子導入に使用されている方法であり、皮膚や細胞膜などの生体膜に対して瞬時に高電圧を負荷することにより生体膜に短時間小孔を生じさせ(すなわち膜構造の組織を開き)、それが修復される前に細胞内へDNA等を導入するものである。そして近年、この技術は経皮、或いは経粘膜からの薬物の送達に応用することも検討、研究されている(特公表平3ー502416号、Proc.Natl.Acad.Sci.USA,90:p.10504−10508(1993))。また、エレクトロポレーション用の電極は分極性電極及び非分極性電極のいずれをもちいてもかまわない。エレクトロポレーションの印加電界強度は10〜2000V/cmの範囲であり、好ましくは50〜1000V/cm、さらに好ましくは50〜500V/cmである。エレクトロポレーションのパルス波形は指数対数型又は矩形型が好ましい。本明細書において、エレクトロポレーションは、短時間の電気ショックによって皮膚角層に水溶性の物質の透過を促進する細孔を穿つことができるいかなる条件で行ってもかまわない。例えば、皮膚表面に縦型フランツセルを取り付ける際に、ドナーセルの底面に長さ5cm、幅5mmの板状の銀電極2枚を電極間距離が6mmとなるように平行に貼り付け、生理食塩水の存在下で、エレクトロポレーション装置(エレクトロスクエアポレーターT820、BTX社製)を用いて、50V、10m秒のパルス電圧を1秒間隔で10回印加することによって実行される場合がある。電極の配置、印加する電気パルスの電圧、電流、パルス波形、印加回数、印加間隔その他の条件は目的とする薬剤及び荷電粒子の種類及び/又は量に応じて当業者が適宜選択することができる。
【0024】
本明細書において、マイクロニードルアレイ処理は、複数の針を同時に穿刺することによって皮膚のバリア機能を一時的に低減することができるいずれかの器具によって実行される場合がある(例えば、Wu, X.M.ら、(2006)J.Control Release、118:189−195を参照せよ。)。例えば、シリコーンシート(1.0×20×20mm)に16本の鍼針を配したマイクロニードルアレイテープ(haruhari(登録商標)、大宝医科協業株式会社)を0.5kg/cm2の圧力で10秒間押し付けることによって実行される場合がある。
【0025】
本発明において、皮膚角層を剥離するための器具は、皮膚角層を剥離して、皮膚バリア機能を一時的に低減することができるいかなる器具でもかまわない。例えば、酸化アルミナや塩化ナトリウムなどの微結晶を皮膚に吹き付け、吸引しながら角層表面を表面から削る器具、角層に貼付してはがすことで角層の一部を除去することができる、セロハンテープのような粘着テープ、ケミカルピーリングのために、グリコール酸、乳酸等の水溶液を適用する器具、角層細胞間脂質を一時的に乱すSDSや不飽和脂肪酸等の溶液を適用する器具等を含むが、これらに限られない。
【0026】
本発明の薬剤の浸透促進方法に用いられる薬剤は、経皮送達による投与が好ましいか、必要とされる医薬品組成物及び/又は化粧料組成物であればいかなるものでもかまわない。例えば、サイトカイン、アディポカインその他の水溶性タンパク質と、コラーゲン、ヒアルロン酸その他の細胞外マトリクスを構成する生体分子と、外来遺伝子発現又はRNA干渉のための核酸又はその誘導体と、4−メトキシサリチル酸を含むアルコキシサリチル酸又はその塩、アスコルビン酸誘導体、トラネキサム酸のような皮膚の美容又は健康を保全又は促進するための化合物とを含むが、これらに限定されない。
【0027】
本発明の粒子は、水溶液中で陰性又は陽性の荷電を有し、かつ、本発明の薬剤と電気的反発を起こすものであればいかなる粒子でもかまわない。本発明の粒子は、ポリスチレン、シリカゾルその他の不溶性固体であって、荷電性原子団を有するものを含む。本発明の粒子の粒子径は、例えば、PSMSで0.20μm、シリカドール30Eで18.5nmであった。
【発明の効果】
【0028】
本発明の薬剤の浸透促進方法に用いられる粒子は、本発明の薬剤と水溶液中で反発する荷電を有する。すなわち、本発明の薬剤が水溶液中で陰性の荷電を有する場合には本発明の粒子も水溶液中で陰性の荷電を有する。本発明の薬剤が水溶液中で陽性の荷電を有する場合には本発明の粒子も水溶液中で陽性の荷電を有する。本発明の方法では、本発明の薬剤を予め皮膚に適用し、その後、本発明の薬剤と本発明の粒子との混合液を皮膚に適用する。皮膚表層に配置された本発明の粒子が本発明の薬剤と電気的反発を起こし、その結果、前記薬剤の皮膚透過を促進させる効果が得られたのではないかと考えられる。
【発明を実施するための最良の形態】
【0029】
以下の実施例によって本発明について詳細な説明を行なうが、本発明はこれらの実施例により何ら制限されるものではない。
【実施例1】
【0030】
負電荷のポリスチレンマイクロ粒子であるPSMS(Polybead(登録商標) sulfate microspheres、粒子径0.20μm)を用い、電気的反発を利用したカルセインの皮膚吸収促進効果について検討した。PSMSの化学構造を以下の化学式1に示す。
【0031】
【化1】

【0032】
カルセインの皮膚透過量の測定
縦型フランツセル(有効透過面積:3.14cm2、レシーバーセル容量:18.0mL)を雄性へアレスラット(WBN/ILA−Ht、体重約250g)の腹部皮膚に皮膚表面がドナー側になるように取り付けた。前記縦型フランツセルにドナー液として1.0mM カルセインナトリウム水溶液を適用して、経時的にレシーバー側をサンプリングし、蛍光分光光度計(RF−5300PC、島津製作所製)を用いてカルセインの皮膚透過量を測定した。なお、前記縦型フランツセルのレシーバー液には、1.0mM EDTA含有等張緩衝液(pH7.4)を用いた。
【0033】
荷電粒子処理
皮膚透過量の測定開始から2時間経過後、ドナー液を0.2% PSMS(Polybead(登録商標)sulfate microspheres、粒子径0.20μm、Polysciences, Inc.、米国、ペンシルバニア州)含有カルセインナトリウム水溶液に置換し、さらに4時間カルセインの皮膚透過量を経時的に測定した。
【0034】
エレクトロポレーションによる処理
エレクトロポレーションによる処理を行う場合には、前記縦型フランツセルを取り付ける際に、ドナーセルの底面に長さ5cm、幅5mmの板状の銀電極2枚を電極間距離が6mmとなるように平行に貼り付け、生理食塩水の存在下で、エレクトロポレーション装置(エレクトロスクエアポレーターT820、BTX社製)を用いて、50V、10m秒のパルス電圧を1秒間隔で10回印加することによるエレクトロポレーション処理を行った。皮膚のエレクトロポレーション処理の後、1.0mM カルセインナトリウム水溶液をドナー液として適用してカルセインの皮膚透過量の測定を開始した。
【0035】
マイクロニードルアレイによる処理
マイクロニードルアレイによる処理を行う場合には、前記縦型フランツセルを取り付ける前に、へアレスラット腹部皮膚にシリコーンシート(1.0×20×20mm)に16本の鍼針を配したマイクロニードルアレイテープ(haruhari(登録商標)、大宝医科協業株式会社)を0.5kg/cm2の圧力で10秒間押し付けることによるマイクロニードルアレイテープ処理を行った。マイクロニードルアレイテープによる処理の後、前記縦型フランツセルを取り付け、1.0mM カルセインナトリウム水溶液をドナー液として適用してカルセインの皮膚透過量の測定を開始した。
【0036】
結果
図1及び2はそれぞれエレクトロポレーション処理及びマイクロニードルテープ処理後の皮膚にカルセインナトリウム水溶液を適用して2時間後にPSMS含有カルセインナトリウム水溶液に置換した場合の皮膚1cm2あたりのカルセインの透過量(左のグラフ、単位:ナノモル/cm2)と、カルセインの透過速度(右のグラフ、単位:ナノモル/cm2/時)の経時変化を示す。図1及び2に示すように、エレクトロポレーション処理及びマイクロニードルアレイテープ処理のいずれの処理を行った場合でも、ドナー液を0.2% PSMS含有カルセインナトリウム水溶液に置換すると、これらの処理を行わない場合と比較して透過量及び透過速度がともに著しく増加した。
【0037】
これらの結果より、皮膚にエレクトロポレーション処理、マイクロニードルアレイテープ処理といった物理的な処理を行った場合、負電荷を有するカルセインの皮膚透過性はPSMSを適用することによってさらに促進したことから、PSMSは負電荷を有する薬物や化粧品有効成分の皮膚吸収促進効果を得るために有効な材料であることが確認された。
【実施例2】
【0038】
4−メトキシサリチル酸カリウム塩(4MSK)の皮膚吸収促進効果
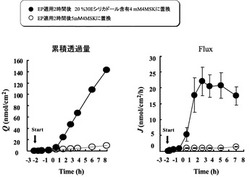
シリカドールを用い、電気的反発を利用した美白有効成分である4−メトキシサリチル酸カリウム塩(4MSK)の皮膚吸収促進効果について検討した。実施例1と同様にして8週齢へアレスラットにエレクトロポレーション処理を行った後、縦型フランツセルにドナー液として5mM 水溶液を適用して、経時的にレシーバ側をサンプリングし、蛍光分光光度計を用いて4MSKの皮膚透過量を測定した。測定開始から2時間経過後、ドナー液をシリカドール30E(BET法による粒子径18.5nm、25°CでのpH2.5、濃度20%、日本化学工業株式会社)2mLに5mM 4MSK水溶液を加えて10mLとして調製したシリカドール含有4mM 4MSK水溶液に置換し、さらに4時間皮膚透過量を経時的に測定した。
【0039】
結果
図3はエレクトロポレーション処理後の皮膚にシリカドール含有液に置換した場合の皮膚1cm2あたりの4MSKの透過量(単位:μg/cm2)の経時変化を示す。図3に示すように、ドナー液をシリカドール含有4MSK水溶液に置換するとシリカドール不含4MSK水溶液と比較して4MSKの皮膚透過量が著しく増加した。
【図面の簡単な説明】
【0040】
【図1】エレクトロポレーション処理後の皮膚にカルセインナトリウム水溶液を適用して2時間後にPSMS含有カルセインナトリウム水溶液に置換した場合の皮膚1cm2あたりのカルセインの透過量(左のグラフ、単位:ナノモル/cm2)と、カルセインの透過速度(右のグラフ、単位:ナノモル/cm2/時)の経時変化を示すグラフ。
【図2】マイクロニードルテープ処理後の皮膚にカルセインナトリウム水溶液を適用して2時間後にPSMS含有カルセインナトリウム水溶液に置換した場合の皮膚1cm2あたりのカルセインの透過量(左のグラフ、単位:ナノモル/cm2)と、カルセインの透過速度(右のグラフ、単位:ナノモル/cm2/時)の経時変化を示すグラフ。
【図3】エレクトロポレーション処理後の皮膚にシリカドール含有液に置換した場合の皮膚1cm2あたりの4MSKの透過量(単位:μg/cm2)の経時変化を示すグラフ。
【技術分野】
【0001】
本発明は、薬剤の浸透促進方法、具体的には、電気的反発を利用する薬剤の浸透促進方法に関する。
【背景技術】
【0002】
医薬品や化粧料の成分である薬剤を皮膚の表面から投与する際には、従来は薬剤の濃度勾配による単純な濃度拡散に依存していた。つまり、皮膚透過性を向上させるために基剤中の薬物濃度を増大させたり、経皮吸収促進剤を使用するのが一般的であった。しかし、薬物濃度を増大させたり、経皮吸収促進剤を使用すると副作用も発生する。そのため、近年、濃度勾配に加えて皮膚の内外に電位差を発生させて電位勾配を利用して薬剤の皮膚透過を促進する技術が開発された。
【0003】
電位勾配を用いる薬剤の浸透促進方法としては、イオントフォレーシスがよく知られている。イオントフォレーシスの装置はマイナス極の電極およびプラス極の電極を有する2つのリザーバーと電源からなり、アニオン性薬物はマイナス極のリザーバーに、カチオン性薬物はプラス極のリザーバーに封入される。薬物を含有するリザーバーを施術部位に他方のリザーバーを他の皮膚に貼付し皮膚を介した回路を形成し電流を適用すると、アニオン性薬物はマイナス極において、カチオン性薬物はプラス極において電荷反発(以下、electrorepulsion)により皮膚への透過が促進される。
【非特許文献1】Siddiqui Oら、(1987)J Pharm Sci. 76:341−5.
【非特許文献2】Guy RHら、(2000)J Control Release 64:129−132.
【非特許文献3】杉林堅次(2001)ファルマシア 37:385−388.
【非特許文献4】森大輔ら、(2002)BME 16:8−13.
【発明の開示】
【発明が解決しようとする課題】
【0004】
電位勾配を用いる薬剤の浸透促進方法では、直流電源(電池)を用いるのが一般的である。しかし、電池を用いる場合には感電の危険がある。そこで、電位勾配を用いる薬剤の浸透促進方法でありながら、直流電源(電池)を利用しないで水溶性の薬剤を皮膚の外から適用して浸透を促進させる方法を開発する必要がある。
【課題を解決するための手段】
【0005】
本発明は、水溶液中で電離する薬剤の浸透促進方法を提供する。本発明の方法は、前記薬剤を皮膚に適用するステップと、該ステップの後で、前記電離した薬剤に対して水溶液中で反発する荷電を有する粒子と、前記薬剤との混合液を皮膚に適用するステップとを含む。
【0006】
本発明の方法において、前記薬剤と、前記粒子とは、ともに水溶液中で陰性荷電を有する場合がある。
【0007】
本発明の方法において、前記薬剤を皮膚に適用するステップの前に、皮膚のバリア機能を一時的に低減するステップを含む場合がある。
【0008】
本発明の方法において、前記皮膚のバリア機能を一時的に低減するステップは、エレクトロポレーション処理によって実施される場合がある。
【0009】
本発明の方法において、前記皮膚のバリア機能を一時的に低減するステップは、マイクロニードルアレイ処理によって実施される場合がある。
【0010】
本発明の方法において、前記皮膚のバリア機能を一時的に低減するステップは、角層剥離処理によって実施される場合がある。
【0011】
本発明の方法において、前記粒子は、25°Cの水溶液中のpHが2.5のシリカゾル粒子か、硫酸基で修飾されたポリスチレン粒子かの場合がある。
【0012】
本発明の方法において、前記薬剤はアルコキシサリチル酸又はその塩であり、前記粒子は硫酸基で修飾されたポリスチレン粒子の場合がある。
【0013】
本発明の方法において、前前記薬剤は4−メトキシサリチル酸又はその塩の場合がある。
【0014】
本発明は、本発明の方法を実施するためのキットを提供する。本発明のキットは、水溶液中で陰性荷電を有する薬剤及び粒子の混合物と、前記薬剤とを含み、皮膚のバリア機能を一時的に低減する処理を施した後で、前記薬剤の水溶液を皮膚に適用し、その後、前記混合物の水溶液を皮膚に適用することによって本発明の方法を実施するためのキットである。
【0015】
本発明のキットにおいて、前記粒子は、25°Cの水溶液中のpHが2.5のシリカゾル粒子か、硫酸基で修飾されたポリスチレン粒子かの場合がある。
【0016】
本発明のキットにおいて、前記薬剤はアルコキシサリチル酸又はその塩であり、前記粒子は硫酸基で修飾されたポリスチレン粒子の場合がある。
【0017】
本発明のキットにおいて、前記薬剤は4−メトキシサリチル酸又はその塩の場合がある。
【0018】
本発明のキットは、マイクロニードルアレイテープを含む場合がある。
【0019】
本発明のキットは、皮膚角層を剥離するための器具を含む場合がある。
【0020】
本発明の方法において、薬剤を皮膚に適用するステップと、その後で、前記電離した薬剤に対して水溶液中で反発する荷電を有する粒子と、前記薬剤との混合液とを皮膚に適用するステップとは、少なくとも15分、30分、1時間、1.5時間又は2時間の間隔をおいて実行される。
【0021】
本発明の方法又はキットにおいて、前記薬剤及び前記粒子はともに陰性荷電を有する、すなわち、アニオン性物質の場合がある。あるいは、前記薬剤及び前記粒子はともに陽性荷電を有する、すなわち、カチオン性物質の場合がある。
【0022】
本明細書において、皮膚のバリア機能は、水分蒸散量測定装置により経皮水分蒸散量(TEWL)を指標として評価することにより、定量的又は定性的に測定することができる。。TEWLの測定は、エバポリメーター、テヴァメーター、ミーコ水分測定機などの市販の機器によって従来公知の一般的な方法で行うことができ、特開2000−159666号明細書に記載される。代替策として、皮膚の通電電気特性に基づいて皮膚のバリア機能を測定する場合もある。角層のバリア機能を低下させる方法としては、角層を除去する方法と角層自身の性質を変える方法がある。角層を除去する方法としては、酸化アルミナや塩化ナトリウムなどの微結晶を皮膚に吹き付け、吸引しながら角層表面を表面から削る方法が知られている。また、セロハンテープなどの粘着テープを角層に貼付してはがすことで角層の一部を除去することができる。角層のバリア機能を低下させる方法としては、グリコール酸や乳酸などの水溶液で角層を処理する方法(ケミカルピーリング)やSDSや不飽和脂肪酸など角層細胞間脂質を一時的に乱す方法、角層を水和させる方法などがある。皮膚のバリア機能の低減は、角層剥離後のTEWLが、角層剥離前の皮膚のTEWLより大きい値になることにより評価できる。本発明における皮膚のバリア機能の低減の程度は、本発明の薬剤の皮膚浸透速度が角層剥離の前にくらべて角層剥離後に増大することを条件として、エレクトロポレーション処理、マイクロアレイニードル処理その他のいかなるやり方で行ってもかまわない。また、皮膚のバリア機能を一時的に低減するとは、皮膚のバリア機能が低減してから1ないし6時間後にバリア機能が回復することをいう。
【0023】
エレクトロポレーション(electroporation:電気穿孔法)は、主として遺伝子導入に使用されている方法であり、皮膚や細胞膜などの生体膜に対して瞬時に高電圧を負荷することにより生体膜に短時間小孔を生じさせ(すなわち膜構造の組織を開き)、それが修復される前に細胞内へDNA等を導入するものである。そして近年、この技術は経皮、或いは経粘膜からの薬物の送達に応用することも検討、研究されている(特公表平3ー502416号、Proc.Natl.Acad.Sci.USA,90:p.10504−10508(1993))。また、エレクトロポレーション用の電極は分極性電極及び非分極性電極のいずれをもちいてもかまわない。エレクトロポレーションの印加電界強度は10〜2000V/cmの範囲であり、好ましくは50〜1000V/cm、さらに好ましくは50〜500V/cmである。エレクトロポレーションのパルス波形は指数対数型又は矩形型が好ましい。本明細書において、エレクトロポレーションは、短時間の電気ショックによって皮膚角層に水溶性の物質の透過を促進する細孔を穿つことができるいかなる条件で行ってもかまわない。例えば、皮膚表面に縦型フランツセルを取り付ける際に、ドナーセルの底面に長さ5cm、幅5mmの板状の銀電極2枚を電極間距離が6mmとなるように平行に貼り付け、生理食塩水の存在下で、エレクトロポレーション装置(エレクトロスクエアポレーターT820、BTX社製)を用いて、50V、10m秒のパルス電圧を1秒間隔で10回印加することによって実行される場合がある。電極の配置、印加する電気パルスの電圧、電流、パルス波形、印加回数、印加間隔その他の条件は目的とする薬剤及び荷電粒子の種類及び/又は量に応じて当業者が適宜選択することができる。
【0024】
本明細書において、マイクロニードルアレイ処理は、複数の針を同時に穿刺することによって皮膚のバリア機能を一時的に低減することができるいずれかの器具によって実行される場合がある(例えば、Wu, X.M.ら、(2006)J.Control Release、118:189−195を参照せよ。)。例えば、シリコーンシート(1.0×20×20mm)に16本の鍼針を配したマイクロニードルアレイテープ(haruhari(登録商標)、大宝医科協業株式会社)を0.5kg/cm2の圧力で10秒間押し付けることによって実行される場合がある。
【0025】
本発明において、皮膚角層を剥離するための器具は、皮膚角層を剥離して、皮膚バリア機能を一時的に低減することができるいかなる器具でもかまわない。例えば、酸化アルミナや塩化ナトリウムなどの微結晶を皮膚に吹き付け、吸引しながら角層表面を表面から削る器具、角層に貼付してはがすことで角層の一部を除去することができる、セロハンテープのような粘着テープ、ケミカルピーリングのために、グリコール酸、乳酸等の水溶液を適用する器具、角層細胞間脂質を一時的に乱すSDSや不飽和脂肪酸等の溶液を適用する器具等を含むが、これらに限られない。
【0026】
本発明の薬剤の浸透促進方法に用いられる薬剤は、経皮送達による投与が好ましいか、必要とされる医薬品組成物及び/又は化粧料組成物であればいかなるものでもかまわない。例えば、サイトカイン、アディポカインその他の水溶性タンパク質と、コラーゲン、ヒアルロン酸その他の細胞外マトリクスを構成する生体分子と、外来遺伝子発現又はRNA干渉のための核酸又はその誘導体と、4−メトキシサリチル酸を含むアルコキシサリチル酸又はその塩、アスコルビン酸誘導体、トラネキサム酸のような皮膚の美容又は健康を保全又は促進するための化合物とを含むが、これらに限定されない。
【0027】
本発明の粒子は、水溶液中で陰性又は陽性の荷電を有し、かつ、本発明の薬剤と電気的反発を起こすものであればいかなる粒子でもかまわない。本発明の粒子は、ポリスチレン、シリカゾルその他の不溶性固体であって、荷電性原子団を有するものを含む。本発明の粒子の粒子径は、例えば、PSMSで0.20μm、シリカドール30Eで18.5nmであった。
【発明の効果】
【0028】
本発明の薬剤の浸透促進方法に用いられる粒子は、本発明の薬剤と水溶液中で反発する荷電を有する。すなわち、本発明の薬剤が水溶液中で陰性の荷電を有する場合には本発明の粒子も水溶液中で陰性の荷電を有する。本発明の薬剤が水溶液中で陽性の荷電を有する場合には本発明の粒子も水溶液中で陽性の荷電を有する。本発明の方法では、本発明の薬剤を予め皮膚に適用し、その後、本発明の薬剤と本発明の粒子との混合液を皮膚に適用する。皮膚表層に配置された本発明の粒子が本発明の薬剤と電気的反発を起こし、その結果、前記薬剤の皮膚透過を促進させる効果が得られたのではないかと考えられる。
【発明を実施するための最良の形態】
【0029】
以下の実施例によって本発明について詳細な説明を行なうが、本発明はこれらの実施例により何ら制限されるものではない。
【実施例1】
【0030】
負電荷のポリスチレンマイクロ粒子であるPSMS(Polybead(登録商標) sulfate microspheres、粒子径0.20μm)を用い、電気的反発を利用したカルセインの皮膚吸収促進効果について検討した。PSMSの化学構造を以下の化学式1に示す。
【0031】
【化1】

【0032】
カルセインの皮膚透過量の測定
縦型フランツセル(有効透過面積:3.14cm2、レシーバーセル容量:18.0mL)を雄性へアレスラット(WBN/ILA−Ht、体重約250g)の腹部皮膚に皮膚表面がドナー側になるように取り付けた。前記縦型フランツセルにドナー液として1.0mM カルセインナトリウム水溶液を適用して、経時的にレシーバー側をサンプリングし、蛍光分光光度計(RF−5300PC、島津製作所製)を用いてカルセインの皮膚透過量を測定した。なお、前記縦型フランツセルのレシーバー液には、1.0mM EDTA含有等張緩衝液(pH7.4)を用いた。
【0033】
荷電粒子処理
皮膚透過量の測定開始から2時間経過後、ドナー液を0.2% PSMS(Polybead(登録商標)sulfate microspheres、粒子径0.20μm、Polysciences, Inc.、米国、ペンシルバニア州)含有カルセインナトリウム水溶液に置換し、さらに4時間カルセインの皮膚透過量を経時的に測定した。
【0034】
エレクトロポレーションによる処理
エレクトロポレーションによる処理を行う場合には、前記縦型フランツセルを取り付ける際に、ドナーセルの底面に長さ5cm、幅5mmの板状の銀電極2枚を電極間距離が6mmとなるように平行に貼り付け、生理食塩水の存在下で、エレクトロポレーション装置(エレクトロスクエアポレーターT820、BTX社製)を用いて、50V、10m秒のパルス電圧を1秒間隔で10回印加することによるエレクトロポレーション処理を行った。皮膚のエレクトロポレーション処理の後、1.0mM カルセインナトリウム水溶液をドナー液として適用してカルセインの皮膚透過量の測定を開始した。
【0035】
マイクロニードルアレイによる処理
マイクロニードルアレイによる処理を行う場合には、前記縦型フランツセルを取り付ける前に、へアレスラット腹部皮膚にシリコーンシート(1.0×20×20mm)に16本の鍼針を配したマイクロニードルアレイテープ(haruhari(登録商標)、大宝医科協業株式会社)を0.5kg/cm2の圧力で10秒間押し付けることによるマイクロニードルアレイテープ処理を行った。マイクロニードルアレイテープによる処理の後、前記縦型フランツセルを取り付け、1.0mM カルセインナトリウム水溶液をドナー液として適用してカルセインの皮膚透過量の測定を開始した。
【0036】
結果
図1及び2はそれぞれエレクトロポレーション処理及びマイクロニードルテープ処理後の皮膚にカルセインナトリウム水溶液を適用して2時間後にPSMS含有カルセインナトリウム水溶液に置換した場合の皮膚1cm2あたりのカルセインの透過量(左のグラフ、単位:ナノモル/cm2)と、カルセインの透過速度(右のグラフ、単位:ナノモル/cm2/時)の経時変化を示す。図1及び2に示すように、エレクトロポレーション処理及びマイクロニードルアレイテープ処理のいずれの処理を行った場合でも、ドナー液を0.2% PSMS含有カルセインナトリウム水溶液に置換すると、これらの処理を行わない場合と比較して透過量及び透過速度がともに著しく増加した。
【0037】
これらの結果より、皮膚にエレクトロポレーション処理、マイクロニードルアレイテープ処理といった物理的な処理を行った場合、負電荷を有するカルセインの皮膚透過性はPSMSを適用することによってさらに促進したことから、PSMSは負電荷を有する薬物や化粧品有効成分の皮膚吸収促進効果を得るために有効な材料であることが確認された。
【実施例2】
【0038】
4−メトキシサリチル酸カリウム塩(4MSK)の皮膚吸収促進効果
シリカドールを用い、電気的反発を利用した美白有効成分である4−メトキシサリチル酸カリウム塩(4MSK)の皮膚吸収促進効果について検討した。実施例1と同様にして8週齢へアレスラットにエレクトロポレーション処理を行った後、縦型フランツセルにドナー液として5mM 水溶液を適用して、経時的にレシーバ側をサンプリングし、蛍光分光光度計を用いて4MSKの皮膚透過量を測定した。測定開始から2時間経過後、ドナー液をシリカドール30E(BET法による粒子径18.5nm、25°CでのpH2.5、濃度20%、日本化学工業株式会社)2mLに5mM 4MSK水溶液を加えて10mLとして調製したシリカドール含有4mM 4MSK水溶液に置換し、さらに4時間皮膚透過量を経時的に測定した。
【0039】
結果
図3はエレクトロポレーション処理後の皮膚にシリカドール含有液に置換した場合の皮膚1cm2あたりの4MSKの透過量(単位:μg/cm2)の経時変化を示す。図3に示すように、ドナー液をシリカドール含有4MSK水溶液に置換するとシリカドール不含4MSK水溶液と比較して4MSKの皮膚透過量が著しく増加した。
【図面の簡単な説明】
【0040】
【図1】エレクトロポレーション処理後の皮膚にカルセインナトリウム水溶液を適用して2時間後にPSMS含有カルセインナトリウム水溶液に置換した場合の皮膚1cm2あたりのカルセインの透過量(左のグラフ、単位:ナノモル/cm2)と、カルセインの透過速度(右のグラフ、単位:ナノモル/cm2/時)の経時変化を示すグラフ。
【図2】マイクロニードルテープ処理後の皮膚にカルセインナトリウム水溶液を適用して2時間後にPSMS含有カルセインナトリウム水溶液に置換した場合の皮膚1cm2あたりのカルセインの透過量(左のグラフ、単位:ナノモル/cm2)と、カルセインの透過速度(右のグラフ、単位:ナノモル/cm2/時)の経時変化を示すグラフ。
【図3】エレクトロポレーション処理後の皮膚にシリカドール含有液に置換した場合の皮膚1cm2あたりの4MSKの透過量(単位:μg/cm2)の経時変化を示すグラフ。
【特許請求の範囲】
【請求項1】
水溶液中で電離する薬剤の浸透促進方法であって、前記薬剤を皮膚に適用するステップと、該ステップの後で、前記電離した薬剤に対して水溶液中で反発する荷電を有する粒子と、前記薬剤との混合液を皮膚に適用するステップとを含むことを特徴とする、薬剤の浸透促進方法。
【請求項2】
前記薬剤と、前記粒子とは、ともに水溶液中で陰性荷電を有することを特徴とする、請求項1に記載の薬剤の浸透促進方法。
【請求項3】
前記薬剤を皮膚に適用するステップの前に、皮膚のバリア機能を一時的に低減するステップを含むことを特徴とする、請求項1又は2に記載の薬剤の浸透促進方法。
【請求項4】
前記皮膚のバリア機能を一時的に低減するステップは、エレクトロポレーション処理によって実施されることを特徴とする、請求項3に記載の薬剤の浸透促進方法。
【請求項5】
前記皮膚のバリア機能を一時的に低減するステップは、マイクロニードルアレイ処理によって実施されることを特徴とする、請求項3に記載の薬剤の浸透促進方法。
【請求項6】
前記皮膚のバリア機能を一時的に低減するステップは、角層剥離処理によって実施されることを特徴とする、請求項3に記載の薬剤の浸透促進方法。
【請求項7】
前記粒子は、25°Cの水溶液中のpHが2.5のシリカゾル粒子か、硫酸基で修飾されたポリスチレン粒子かであることを特徴とする、請求項1ないし6のいずれかに記載の薬剤の浸透促進方法。
【請求項8】
前記薬剤はアルコキシサリチル酸又はその塩であり、前記粒子は硫酸基で修飾されたポリスチレン粒子であることを特徴とする、請求項3ないし6のいずれかに記載の薬剤の浸透促進方法。
【請求項9】
前記薬剤は4−メトキシサリチル酸又はその塩であることを特徴とする、請求項8に記載の薬剤の浸透促進方法。
【請求項10】
水溶液中で陰性荷電を有する薬剤及び粒子の混合物と、前記薬剤とを含むキットであって、皮膚のバリア機能を一時的に低減する処理を施した後で、前記薬剤の水溶液を皮膚に適用し、その後、前記混合物の水溶液を皮膚に適用することによって請求項3ないし6に記載のいずれかの方法を実施するためのキット。
【請求項11】
前記粒子は、25°Cの水溶液中のpHが2.5のシリカゾル粒子か、硫酸基で修飾されたポリスチレン粒子かであることを特徴とする、請求項10に記載のキット。
【請求項12】
前記薬剤はアルコキシサリチル酸又はその塩であり、前記粒子は硫酸基で修飾されたポリスチレン粒子であることを特徴とする、請求項11に記載のキット。
【請求項13】
前記薬剤は4−メトキシサリチル酸又はその塩であることを特徴とする、請求項12に記載のキット。
【請求項14】
マイクロニードルアレイテープを含むことを特徴とする、請求項10ないし13のいずれかに記載のキット。
【請求項15】
皮膚角層を剥離するための器具を含むことを特徴とする、請求項10ないし13のいずれかに記載のキット。
【請求項1】
水溶液中で電離する薬剤の浸透促進方法であって、前記薬剤を皮膚に適用するステップと、該ステップの後で、前記電離した薬剤に対して水溶液中で反発する荷電を有する粒子と、前記薬剤との混合液を皮膚に適用するステップとを含むことを特徴とする、薬剤の浸透促進方法。
【請求項2】
前記薬剤と、前記粒子とは、ともに水溶液中で陰性荷電を有することを特徴とする、請求項1に記載の薬剤の浸透促進方法。
【請求項3】
前記薬剤を皮膚に適用するステップの前に、皮膚のバリア機能を一時的に低減するステップを含むことを特徴とする、請求項1又は2に記載の薬剤の浸透促進方法。
【請求項4】
前記皮膚のバリア機能を一時的に低減するステップは、エレクトロポレーション処理によって実施されることを特徴とする、請求項3に記載の薬剤の浸透促進方法。
【請求項5】
前記皮膚のバリア機能を一時的に低減するステップは、マイクロニードルアレイ処理によって実施されることを特徴とする、請求項3に記載の薬剤の浸透促進方法。
【請求項6】
前記皮膚のバリア機能を一時的に低減するステップは、角層剥離処理によって実施されることを特徴とする、請求項3に記載の薬剤の浸透促進方法。
【請求項7】
前記粒子は、25°Cの水溶液中のpHが2.5のシリカゾル粒子か、硫酸基で修飾されたポリスチレン粒子かであることを特徴とする、請求項1ないし6のいずれかに記載の薬剤の浸透促進方法。
【請求項8】
前記薬剤はアルコキシサリチル酸又はその塩であり、前記粒子は硫酸基で修飾されたポリスチレン粒子であることを特徴とする、請求項3ないし6のいずれかに記載の薬剤の浸透促進方法。
【請求項9】
前記薬剤は4−メトキシサリチル酸又はその塩であることを特徴とする、請求項8に記載の薬剤の浸透促進方法。
【請求項10】
水溶液中で陰性荷電を有する薬剤及び粒子の混合物と、前記薬剤とを含むキットであって、皮膚のバリア機能を一時的に低減する処理を施した後で、前記薬剤の水溶液を皮膚に適用し、その後、前記混合物の水溶液を皮膚に適用することによって請求項3ないし6に記載のいずれかの方法を実施するためのキット。
【請求項11】
前記粒子は、25°Cの水溶液中のpHが2.5のシリカゾル粒子か、硫酸基で修飾されたポリスチレン粒子かであることを特徴とする、請求項10に記載のキット。
【請求項12】
前記薬剤はアルコキシサリチル酸又はその塩であり、前記粒子は硫酸基で修飾されたポリスチレン粒子であることを特徴とする、請求項11に記載のキット。
【請求項13】
前記薬剤は4−メトキシサリチル酸又はその塩であることを特徴とする、請求項12に記載のキット。
【請求項14】
マイクロニードルアレイテープを含むことを特徴とする、請求項10ないし13のいずれかに記載のキット。
【請求項15】
皮膚角層を剥離するための器具を含むことを特徴とする、請求項10ないし13のいずれかに記載のキット。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−37214(P2010−37214A)
【公開日】平成22年2月18日(2010.2.18)
【国際特許分類】
【出願番号】特願2008−198406(P2008−198406)
【出願日】平成20年7月31日(2008.7.31)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り ホームページノアドレス http://nenkai.pharm.or.jp/128/pc/ipdfview.asp?i=986 掲載日 2008年2月1日
【出願人】(000001959)株式会社資生堂 (1,748)
【Fターム(参考)】
【公開日】平成22年2月18日(2010.2.18)
【国際特許分類】
【出願日】平成20年7月31日(2008.7.31)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り ホームページノアドレス http://nenkai.pharm.or.jp/128/pc/ipdfview.asp?i=986 掲載日 2008年2月1日
【出願人】(000001959)株式会社資生堂 (1,748)
【Fターム(参考)】
[ Back to top ]

