薬剤及びその製造方法
【課題】ポリマーを包接したCDに対し様々な有効成分を含有することが可能であって、作製が容易で、さまざまな薬物に応用可能な薬剤及びその製造方法を提供すること。
【解決手段】シクロデキストリン誘導体と、シクロデキストリン誘導体を貫通する鎖状高分子と、シクロデキストリン誘導体に外部包接される有効成分と、を含む薬剤とする。また、シクロデキストリン誘導体に鎖状高分子を貫通させる工程、シクロデキストリン誘導体に有効成分を外部包接させる工程と、を有する薬剤の製造方法とする。
【解決手段】シクロデキストリン誘導体と、シクロデキストリン誘導体を貫通する鎖状高分子と、シクロデキストリン誘導体に外部包接される有効成分と、を含む薬剤とする。また、シクロデキストリン誘導体に鎖状高分子を貫通させる工程、シクロデキストリン誘導体に有効成分を外部包接させる工程と、を有する薬剤の製造方法とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は薬剤及びその製造方法に関する。
【背景技術】
【0002】
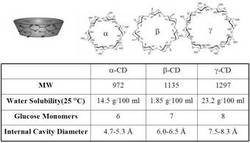
シクロデキストリン(以下単に「CD」という。)とは、複数のグルコースが環状に結合した分子であり、グルコースが6個環状に結合した分子はα−CD、7個環状に結合した分子はβ−CD、8個環状に結合した分子はγ−CDと分類される。
【0003】
CDは、その環状構造の中心に一定の大きさの空孔が形成されており、その空孔に適切な大きさの物質(有効成分)を包接させることが可能である。このCDの空孔は疎水性を有するため、この空孔に薬剤の有効成分を包接させると、有効成分の水への溶解性や反応性を調節することが可能となり、薬剤の効果の生ずる時間の調整ができると期待されている。
【0004】
上記CDに関する報告として、例えば下記非特許文献1及び下記非特許文献2がある。
【0005】
下記非特許文献1には、ケージ型の結晶構造を有するジメチル−β−CDに対してp−ニトロフェノールを外部包接させた技術が開示されている。
【0006】
また、下記非特許文献2には、カラム型の結晶構造を有するα−CDの内部及び外部にm−ニトロフェノールを包接させた技術が開示されている。
【0007】
また一方で、下記非特許文献3には、上記複数のCDの空孔を鎖状ポリエチレングリコールで貫通させ、この鎖状ポリエチレングリコールに共有結合によりインスリンを附加させた技術が開示されている。
【非特許文献1】K. Harata、The Structure of the Cyclodextrin Complex. XXI. Crystal Structures of Hepatakis(2,6−di−O−methyl)−β−cyclodextrin Complexes with p−Iodophenol and p−Nitorphenol、Bull. Chem. Soc. Jpn.、61、1939−1944 (1988)
【非特許文献2】K. Harata、H. Uedaira and Jiro Tanaka、The structure of the Cyclodextrin Complex. VI. The Crystal Strucutre of α−Cyclodextrin−m−Nitrophenol(1:2) Complex、Bull.Chem.Soc. Jpn.、51、1627−1634 (1978)
【非特許文献3】T.Higashi, F.Hirayaam, S.Misumi, H.Arima andK.Uekama, Design and evaluation of polypseudorotaxanes of pegylated insulin with cyclodextrins as sutained release system,Biomaterials,2008, 29, 3866−3871
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、上記非特許文献1に記載の技術では、ケージ型の結晶構造を有するβ−CDに有効成分を貫通させることについて記載はない。
【0009】
また、上記非特許文献2に記載の技術では、内部及び外部に包接させる技術が開示されているが、外部と内部に包接させる有効成分が同じものであり、異なる有効成分を入れる技術については何ら検討されていない。
【0010】
また、上記非特許文献3に記載の技術では、鎖状高分子に共有結合でインスリンを付しており、作製が非常に困難で高価であるとともに、共有結合させた化合物であるため新規化合物として医薬品申請等をしなければならない、また調製できるものがインスリンに限られている等の課題がある。
【0011】
そこで本発明は上記課題を鑑み、ポリマーを包接したCDに対し様々な有効成分を含有することが可能であって、作製が容易で、さまざまな薬物に応用可能な薬剤及びその製造方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
上記課題を解決する本発明の第一の手段としての薬剤は、CD誘導体と、CD誘導体を貫通する鎖状高分子と、CD誘導体に外部包接される有効成分と、を含む。
【0013】
また、本発明の他の手段としての薬剤の製造方法は、CD誘導体に鎖状高分子を貫通させる工程、CD誘導体に有効成分を外部包接させる工程と、を有する。
【発明の効果】
【0014】
以上本発明によりポリマーを含有したCDに対し様々な有効成分をより多く含有することが可能であって、作製が容易で、水素結合あるいはvan der Waals力などの弱い結合をしていることから医薬品申請の際にも新規化合物として申請する必要がない、さまざまな薬物に応用可能な薬剤及びその製造方法を提供することができる。
【発明を実施するための最良の形態】
【0015】
以下、本発明を実施するための最良の形態について図面を用いて詳細に説明する。
【0016】
本実施形態に係る薬剤の製造方法は、CD誘導体に鎖状高分子を貫通させる工程、CD誘導体に有効成分を外部包接させる工程と、を有する。
【0017】
本実施形態において、CDとは、複数のグルコース(例えば6、7又は8個)が環状に結合した分子であり、例えば図1で示されるような構造を有していると考えられている。本図で示すとおりCDは空孔を有するすり鉢状となっていると考えられ、この空孔に有効成分を包接させることができると考えられる。また本実施形態において「CD誘導体」とは、CDそのものも含み、CDを構成するグルコースの水酸基の少なくともいずれかを他の官能基例えばメチル基、ヒドロキシル基,アセチル基,モノクロロトリアジノ基,スルフォブチル基で修飾したものも含む。
【0018】
本実施形態において「鎖状高分子」とは、一方向に延伸した分岐鎖を有する高分子であって、CD誘導体の空孔を貫通し、複数のCD誘導体を規則的に配置させることの出来るものである。また「有効成分」とは、CD誘導体に対し包接させる有効成分を意味し、具体的にはCDの空孔の外に包接(外部包接)させる有効成分をいう。
【0019】
鎖状高分子の例としては、ポリエチレングリコール、ポリプロピレングリコール、ポリテトラヒドロフラン、ポリ−ε−カプロラクトン、ポリ(L−乳酸)、ポリビニルアルコール、ポリビニルアセテート、ポリカルボネート、ポリメタクリル酸メチル樹脂、ポリエチレンテレフタレート、ポリイソブチレン、ポリブタジエン、ポリジメチルシロキサン、ポリロイシン、Silk fibroin、ナイロン6、ポリアニリン、ポリエチレングリコール−ポリプロピレングリコール−ポリエチレングリコール共重合体、及びこれら2種以上の混合物を例示することができる。なお、ポリエチレングリコールの分子量としては、限定されるわけではないが、数平均分子量で1000以上10000以下であることが好ましく、より好ましくは1000以上4000以下である。
【0020】
また、有効成分の例としては、CD誘導体間の空孔に入る(外部包接される)大きさを有する限りにおいて限定されるわけではないが、昇華性を有する有効成分であることが好ましく、例えばサリチル酸誘導体、ニトロフェニル誘導体、プロピオン酸誘導体、アントラニル酸誘導体、キサンチン誘導体、安息香酸誘導体及びこれら2種以上の混合物を例示することができる。また、サリチル酸誘導体の場合、サリチル酸、サリチル酸アミド、アセチルサリチル酸を例示することができ、ニトロフェニル誘導体の場合、p−ニトロフェノール、m−ニトロフェノール及びこれら2種以上の混合物を例示することができ、プロピオン酸誘導体の場合、ナプロキセンを例示することができ、アントラニル酸誘導体の場合メフェナム酸を例示することができ、キサンチン誘導体の場合、カフェインを例示することができ、安息香酸誘導体の場合アミノ安息香酸を例示することができる。
【0021】
また本実施形態において、CD誘導体に鎖状高分子を貫通させる工程は、限定されるわけではないが、いわゆる共沈法、混合粉砕法、凍結乾燥法、溶媒留去法、混練法、溶融法を採用することができる。ここで「共沈法」とは、CD誘導体を溶解した第一の溶液と、鎖状高分子を溶解した第二の溶液とを混合及び攪拌した後静置し、鎖状高分子が貫通したCD誘導体を沈殿、回収する方法をいい、「混合粉砕法」とは固体のCD誘導体と固体の鎖状高分子を混合した後、粉砕を行い鎖状高分子が貫通したCD誘導体を回収する方法をいい、「凍結乾燥法」はCD誘導体を溶解した第一の溶液と、鎖状高分子を溶解した第二の溶液とを混合及び攪拌した後凍結し乾燥することで、鎖状高分子が内部包接したCD誘導体を回収する方法をいい、「溶媒留去法」はCD誘導体を溶解した第一の溶液と、鎖状高分子を溶解した第二の溶液とを混合及び攪拌した後エバポレーター等で溶媒を蒸発させ、鎖状高分子が内部包接したCD誘導体を回収する方法をいい、「混練法」とはCD誘導体と鎖状高分子の混合末に徐々に溶媒を加えながら乳棒乳鉢等で練合した後溶媒を乾燥し鎖状高分子が内部包接したCD誘導体を回収する方法する方法をいう。「溶融法」とはCD誘導体と鎖状高分子の混合末を加熱融解させたのち室温まで冷却し鎖状高分子が内部包接したCD誘導体を回収する方法する方法をいう。
【0022】
また本実施形態におけるCD誘導体に鎖状高分子を貫通させる工程において、CD誘導体と鎖状高分子の比率としては、鎖状高分子の種類、分子量等により適宜調整可能であるが、CD誘導体を1モルとした場合、理想的には1モル〜6モル(CD誘導体1分子あたりポリマーの一つのユニット1〜6分子が内部包接されると考えられる場合)であることが好ましいが、余裕を持った範囲としては理想的に1モルの場合0.2モル以上10モル以下の範囲である。
【0023】
本実施形態におけるCD誘導体に鎖状高分子を貫通させる工程は、後のCD誘導体に有効成分を外部包接させる工程のために、溶媒を使用しない工程である又は溶媒を除去する工程を含むことが好ましい。なおここで実際上溶媒を完全に使用しない又は完全に除去するということは極めて困難であるため、ここでは「溶媒の添加を必須としない方法」及び「溶媒を一定量以下の割合になるまで除去する方法」を含む概念である。なお溶媒を一定量以下の割合になるまで除去する方法において一定量以下としては、限定されるわけではないが、例えば重量10%以下、より好ましくは5%以下、更に好ましくは1%以下である。
【0024】
また本実施形態において、CD誘導体に有効成分を外部包接させる工程としては、限定されるわけではないが有効成分を昇華させる工程であることが好ましく、この具体的な手段として、密封加熱法であることはより好ましい。なおここで密封加熱法とは、CD誘導体と有効成分とを密封した容器に封入し、その後当該容器を加熱する方法をいう。
【0025】
以上本方法により、鎖状高分子がCD誘導体の空孔を貫通し、有効成分が外部包接したCD誘導体を含む薬剤を製造することができる。特に、本実施形態によると、CD誘導体は難溶性を示すため、有効成分の溶出を調整することができる、有効成分の安定性を向上することができる、昇華性のある物質の昇華抑制ができる、流動性・成型性等の粉末特性を向上させることができる、といった利点があり、更に、上記公知の技術に比べ、作製が極めて容易となる、水素結合あるいはvan der Waals力などの弱い結合をしていることから医薬品申請の際にも新規化合物として申請する必要がない、さまざまな薬物に応用可能といった効果がある。
【0026】
なお、本実施形態による薬剤の製造方法における原理については推論の部分もあるが以下のようになっていると考えられる。
【0027】
まず、CD誘導体に鎖状高分子を貫通させる工程により、CD誘導体の内部に鎖状高分子をCD誘導体の空孔に貫通させて複数のCD誘導体に規則的な構造を形成する。この際、溶媒を用いている場合CD誘導体はテトラゴナル−カラム型の結晶構造を主たる構造となると考えられる(図2参照)。なお採用する工程にもよるが溶媒を用いる場合、溶媒はCD誘導体の外部側に存在していると考えられる。
【0028】
次に、このテトラゴナル−カラム型のCD誘導体に対し溶媒を除去する工程を行なう。後述の工程の際に溶媒を残しておくと、CD誘導体及び有効成分が分解してしまう可能性があるためである。なお溶媒の除去量は、上記記載の範囲、すなわち例えば重量10%以下であることが好ましく、より好ましくは5%以下、更に好ましくは1%以下である。なお、ここではテトラゴナル−カラム型のCD誘導体において、溶媒を除去すると、テトラゴナル−カラム型を維持する場合もあるし、モノクリニック−カラム型に変化する場合もあるし、ヘキサゴナル−カラム型(図3参照)に変化する場合もある。また、採用する工程にもよるが、CD誘導体に鎖状高分子を貫通させる場合に溶媒を用いない工程を採用した場合、直接モノクリニック−カラム型またはヘキサゴナル−カラム型の結晶構造を有するCD誘導体とすることもできる場合がある。
【0029】
なお、ヘキサゴナル−カラム型の結晶構造を有するCD誘導体となった場合、有効成分を外部に包接させるとモノクリニック−カラム型の結晶構造を有するCD誘導体になると考えられ、モノクリニック−カラム型の結晶構造を有するCD誘導体となった場合は、この構造を維持したまま有効成分を外部に包接させることができる(図4参照)。この包接においては、上述の通り、有効成分は昇華性を有するものであることが好ましい。昇華性を有する有効成分とすることで、CD誘導体の結晶構造を分解させてしまうことなく有効成分をCD分子同士で形成される空隙に封入することが可能となり、有効成分を外部包接させることができると考えられる。
【0030】
なお、この有効成分を包接したモノクリニック−カラム型の結晶構造を有するCD誘導体を得た場合、溶媒を加える工程を入れると、CD誘導体の結晶構造は再びテトラゴナル−カラム型の結晶構造に変化することができ(図5参照)、更に溶媒を除去してもテトラゴナル−カラム型の結晶構造を維持することができる(図6参照)。すなわち、鎖状高分子が内部包接し、有効成分が外部包接したCD誘導体においては、テトラゴナル−カラム型の結晶構造及びモノクリニック−カラム型の結晶構造のいずれも作成することができ、薬剤としての効能に応じ好ましい結晶構造を採用することができる。
【0031】
以上、本実施形態に係る薬剤の製造方法によると、ポリマーを包接したCDに対しより様々な有効成分を含有することが可能な薬剤及びその製造方法を提供することができる。
【実施例】
【0032】
上記実施形態に係る薬剤の製造方法について、実際に薬剤を製造しその効果を確認した。以下に説明する。
【0033】
(実施例1)
まず、10wt%のγ−CD溶液(50ml)と、10wt%のポリエチレングリコール(数平均分子量2000、以下「PEG」)溶液(50ml)を加え、25℃で2日間攪拌した後、25℃で一日静置し、懸濁液中に分散する固体をゆっくりと沈殿させた。そしてその後この沈殿物をろ過し、沈殿物を得た。この沈殿物の粉末X線回折測定およびNMR測定による定量の結果を図7及び図8に示す。この結果、γ−CDにPEGのエチレングリコールユニットがモル比1:4で内部包接したものであることが確認でき、更に、この沈殿物はテトラゴナル−カラム型となっていることが確認できた。
【0034】
次に、この沈殿物に対し、減圧乾燥処理を行い、水分含量を1%以下に除去した。この乾燥物の粉末X線回折測定の結果を図9に示す。この結果、この乾燥物はγ−CDにPEGが内部包接したものであることが確認でき、この主構造がヘキサゴナル−カラム型又はモノクリニック−カラム型となっていることが確認できた。
【0035】
次に、この沈殿物と、サリチル酸をモル比で1:2あるいは1:3となるようにして調製した混合物200mgを2mlのアンプルに挿入、封止し、更にこれを150℃15分間加熱し、サリチル酸を昇華させ、結果物を得た。なおこの結果物の粉末X線回折測定の結果を図10に示す。モル比1:2で調製した試料のX線回折測定の結果においては新たにモノクリニック−カラム型の構造を持つ複合体形成に由来するピークのみが観察されたのに対して、1:3で調製した試料の回折パターンにおいては、複合体形成に由来するピークに加えてSA結晶に由来するピークの残存が観察された。この結果より、SA:(PEG/γ−CD包接化合物)=2:1SHにおいてはγ−CDの結晶格子中にSA及びPEGが封入されていることが確認でき、γ−CDの内部にPEG及び外部にサリチル酸が包接されていることが確認された。
【0036】
なお、この後、水蒸気を吸着させる工程を加えると、得られた結果物の結晶構造は再びテトラゴナル−カラム型の結晶構造に変化することが観察され(図11参照)、更に水分を除去してもテトラゴナル−カラム型の結晶構造を維持することができた。すなわち、PEGが内部包接し、サリチル酸が外部包接したγ−CDにおいては、テトラゴナル−カラム型の結晶構造及びモノクリニック−カラム型の結晶構造のいずれも作製することができ、薬剤としての効能に応じ好ましい結晶構造を採用することができると考えられる。
【0037】
以上、本実施例により、シクロデキストリン誘導体と、シクロデキストリン誘導体を貫通する鎖状高分子と、シクロデキストリン誘導体に外部包接される有効成分を含む薬剤となり、CDに対しより多くの有効成分を含有することが可能な薬剤及びその製造方法を提供できることを確認した。
【0038】
(実施例2)
その他同様の実験をSAの代わりの有効成分として、サリチル酸アミド、アセトアミノフェン、p−アミノ安息香酸、ナプロキセン、カフェイン、メフェナム酸を用いた場合にも同様にγ−CDの内部にPEG及び外部に有効成分が包接されている複合体を調製することができた。但し、複合体のモル比率は有効成分の分子サイズに応じて有効成分:(PEG/γ−CD包接化合物)=2〜0.7:1の間で変化した(図12参照)。
【産業上の利用可能性】
【0039】
本発明は、薬剤及びその製造方法として産業上の利用可能性がある。
【図面の簡単な説明】
【0040】
【図1】CDの構造を示す図である。
【図2】CD誘導体のテトラゴナル−カラム型の結晶構造を示す図である。
【図3】CD誘導体のヘキサゴナル−カラム型、モノクリニック−カラム型の結晶構造を示す図である。
【図4】CD誘導体がモノクリニック−カラム型の結晶構造を有する場合に、有効成分を外部に包接させた場合の構造を示す図である。
【図5】CD誘導体の結晶構造が再びテトラゴナル−カラム型の結晶構造に変化する場合の図である。
【図6】CD誘導体が溶媒を除去してもテトラゴナル−カラム型の結晶構造を維持することができることについての説明図である。
【図7】実施例1において得られた沈殿物の粉末X線回折測定の結果を示す図である。
【図8】実施例1において得られた沈殿物のNMR測定による定量の結果を示す図である。
【図9】実施例1において得られた粉末X線回折測定の結果を示す図である。
【図10】実施例1により得られた結果物の粉末X線回折測定の結果を示す図である。
【図11】実施例1により得られた結果物の結晶構造について説明する図である。
【図12】他の実施例における結果を示す図である。
【技術分野】
【0001】
本発明は薬剤及びその製造方法に関する。
【背景技術】
【0002】
シクロデキストリン(以下単に「CD」という。)とは、複数のグルコースが環状に結合した分子であり、グルコースが6個環状に結合した分子はα−CD、7個環状に結合した分子はβ−CD、8個環状に結合した分子はγ−CDと分類される。
【0003】
CDは、その環状構造の中心に一定の大きさの空孔が形成されており、その空孔に適切な大きさの物質(有効成分)を包接させることが可能である。このCDの空孔は疎水性を有するため、この空孔に薬剤の有効成分を包接させると、有効成分の水への溶解性や反応性を調節することが可能となり、薬剤の効果の生ずる時間の調整ができると期待されている。
【0004】
上記CDに関する報告として、例えば下記非特許文献1及び下記非特許文献2がある。
【0005】
下記非特許文献1には、ケージ型の結晶構造を有するジメチル−β−CDに対してp−ニトロフェノールを外部包接させた技術が開示されている。
【0006】
また、下記非特許文献2には、カラム型の結晶構造を有するα−CDの内部及び外部にm−ニトロフェノールを包接させた技術が開示されている。
【0007】
また一方で、下記非特許文献3には、上記複数のCDの空孔を鎖状ポリエチレングリコールで貫通させ、この鎖状ポリエチレングリコールに共有結合によりインスリンを附加させた技術が開示されている。
【非特許文献1】K. Harata、The Structure of the Cyclodextrin Complex. XXI. Crystal Structures of Hepatakis(2,6−di−O−methyl)−β−cyclodextrin Complexes with p−Iodophenol and p−Nitorphenol、Bull. Chem. Soc. Jpn.、61、1939−1944 (1988)
【非特許文献2】K. Harata、H. Uedaira and Jiro Tanaka、The structure of the Cyclodextrin Complex. VI. The Crystal Strucutre of α−Cyclodextrin−m−Nitrophenol(1:2) Complex、Bull.Chem.Soc. Jpn.、51、1627−1634 (1978)
【非特許文献3】T.Higashi, F.Hirayaam, S.Misumi, H.Arima andK.Uekama, Design and evaluation of polypseudorotaxanes of pegylated insulin with cyclodextrins as sutained release system,Biomaterials,2008, 29, 3866−3871
【発明の開示】
【発明が解決しようとする課題】
【0008】
しかしながら、上記非特許文献1に記載の技術では、ケージ型の結晶構造を有するβ−CDに有効成分を貫通させることについて記載はない。
【0009】
また、上記非特許文献2に記載の技術では、内部及び外部に包接させる技術が開示されているが、外部と内部に包接させる有効成分が同じものであり、異なる有効成分を入れる技術については何ら検討されていない。
【0010】
また、上記非特許文献3に記載の技術では、鎖状高分子に共有結合でインスリンを付しており、作製が非常に困難で高価であるとともに、共有結合させた化合物であるため新規化合物として医薬品申請等をしなければならない、また調製できるものがインスリンに限られている等の課題がある。
【0011】
そこで本発明は上記課題を鑑み、ポリマーを包接したCDに対し様々な有効成分を含有することが可能であって、作製が容易で、さまざまな薬物に応用可能な薬剤及びその製造方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
上記課題を解決する本発明の第一の手段としての薬剤は、CD誘導体と、CD誘導体を貫通する鎖状高分子と、CD誘導体に外部包接される有効成分と、を含む。
【0013】
また、本発明の他の手段としての薬剤の製造方法は、CD誘導体に鎖状高分子を貫通させる工程、CD誘導体に有効成分を外部包接させる工程と、を有する。
【発明の効果】
【0014】
以上本発明によりポリマーを含有したCDに対し様々な有効成分をより多く含有することが可能であって、作製が容易で、水素結合あるいはvan der Waals力などの弱い結合をしていることから医薬品申請の際にも新規化合物として申請する必要がない、さまざまな薬物に応用可能な薬剤及びその製造方法を提供することができる。
【発明を実施するための最良の形態】
【0015】
以下、本発明を実施するための最良の形態について図面を用いて詳細に説明する。
【0016】
本実施形態に係る薬剤の製造方法は、CD誘導体に鎖状高分子を貫通させる工程、CD誘導体に有効成分を外部包接させる工程と、を有する。
【0017】
本実施形態において、CDとは、複数のグルコース(例えば6、7又は8個)が環状に結合した分子であり、例えば図1で示されるような構造を有していると考えられている。本図で示すとおりCDは空孔を有するすり鉢状となっていると考えられ、この空孔に有効成分を包接させることができると考えられる。また本実施形態において「CD誘導体」とは、CDそのものも含み、CDを構成するグルコースの水酸基の少なくともいずれかを他の官能基例えばメチル基、ヒドロキシル基,アセチル基,モノクロロトリアジノ基,スルフォブチル基で修飾したものも含む。
【0018】
本実施形態において「鎖状高分子」とは、一方向に延伸した分岐鎖を有する高分子であって、CD誘導体の空孔を貫通し、複数のCD誘導体を規則的に配置させることの出来るものである。また「有効成分」とは、CD誘導体に対し包接させる有効成分を意味し、具体的にはCDの空孔の外に包接(外部包接)させる有効成分をいう。
【0019】
鎖状高分子の例としては、ポリエチレングリコール、ポリプロピレングリコール、ポリテトラヒドロフラン、ポリ−ε−カプロラクトン、ポリ(L−乳酸)、ポリビニルアルコール、ポリビニルアセテート、ポリカルボネート、ポリメタクリル酸メチル樹脂、ポリエチレンテレフタレート、ポリイソブチレン、ポリブタジエン、ポリジメチルシロキサン、ポリロイシン、Silk fibroin、ナイロン6、ポリアニリン、ポリエチレングリコール−ポリプロピレングリコール−ポリエチレングリコール共重合体、及びこれら2種以上の混合物を例示することができる。なお、ポリエチレングリコールの分子量としては、限定されるわけではないが、数平均分子量で1000以上10000以下であることが好ましく、より好ましくは1000以上4000以下である。
【0020】
また、有効成分の例としては、CD誘導体間の空孔に入る(外部包接される)大きさを有する限りにおいて限定されるわけではないが、昇華性を有する有効成分であることが好ましく、例えばサリチル酸誘導体、ニトロフェニル誘導体、プロピオン酸誘導体、アントラニル酸誘導体、キサンチン誘導体、安息香酸誘導体及びこれら2種以上の混合物を例示することができる。また、サリチル酸誘導体の場合、サリチル酸、サリチル酸アミド、アセチルサリチル酸を例示することができ、ニトロフェニル誘導体の場合、p−ニトロフェノール、m−ニトロフェノール及びこれら2種以上の混合物を例示することができ、プロピオン酸誘導体の場合、ナプロキセンを例示することができ、アントラニル酸誘導体の場合メフェナム酸を例示することができ、キサンチン誘導体の場合、カフェインを例示することができ、安息香酸誘導体の場合アミノ安息香酸を例示することができる。
【0021】
また本実施形態において、CD誘導体に鎖状高分子を貫通させる工程は、限定されるわけではないが、いわゆる共沈法、混合粉砕法、凍結乾燥法、溶媒留去法、混練法、溶融法を採用することができる。ここで「共沈法」とは、CD誘導体を溶解した第一の溶液と、鎖状高分子を溶解した第二の溶液とを混合及び攪拌した後静置し、鎖状高分子が貫通したCD誘導体を沈殿、回収する方法をいい、「混合粉砕法」とは固体のCD誘導体と固体の鎖状高分子を混合した後、粉砕を行い鎖状高分子が貫通したCD誘導体を回収する方法をいい、「凍結乾燥法」はCD誘導体を溶解した第一の溶液と、鎖状高分子を溶解した第二の溶液とを混合及び攪拌した後凍結し乾燥することで、鎖状高分子が内部包接したCD誘導体を回収する方法をいい、「溶媒留去法」はCD誘導体を溶解した第一の溶液と、鎖状高分子を溶解した第二の溶液とを混合及び攪拌した後エバポレーター等で溶媒を蒸発させ、鎖状高分子が内部包接したCD誘導体を回収する方法をいい、「混練法」とはCD誘導体と鎖状高分子の混合末に徐々に溶媒を加えながら乳棒乳鉢等で練合した後溶媒を乾燥し鎖状高分子が内部包接したCD誘導体を回収する方法する方法をいう。「溶融法」とはCD誘導体と鎖状高分子の混合末を加熱融解させたのち室温まで冷却し鎖状高分子が内部包接したCD誘導体を回収する方法する方法をいう。
【0022】
また本実施形態におけるCD誘導体に鎖状高分子を貫通させる工程において、CD誘導体と鎖状高分子の比率としては、鎖状高分子の種類、分子量等により適宜調整可能であるが、CD誘導体を1モルとした場合、理想的には1モル〜6モル(CD誘導体1分子あたりポリマーの一つのユニット1〜6分子が内部包接されると考えられる場合)であることが好ましいが、余裕を持った範囲としては理想的に1モルの場合0.2モル以上10モル以下の範囲である。
【0023】
本実施形態におけるCD誘導体に鎖状高分子を貫通させる工程は、後のCD誘導体に有効成分を外部包接させる工程のために、溶媒を使用しない工程である又は溶媒を除去する工程を含むことが好ましい。なおここで実際上溶媒を完全に使用しない又は完全に除去するということは極めて困難であるため、ここでは「溶媒の添加を必須としない方法」及び「溶媒を一定量以下の割合になるまで除去する方法」を含む概念である。なお溶媒を一定量以下の割合になるまで除去する方法において一定量以下としては、限定されるわけではないが、例えば重量10%以下、より好ましくは5%以下、更に好ましくは1%以下である。
【0024】
また本実施形態において、CD誘導体に有効成分を外部包接させる工程としては、限定されるわけではないが有効成分を昇華させる工程であることが好ましく、この具体的な手段として、密封加熱法であることはより好ましい。なおここで密封加熱法とは、CD誘導体と有効成分とを密封した容器に封入し、その後当該容器を加熱する方法をいう。
【0025】
以上本方法により、鎖状高分子がCD誘導体の空孔を貫通し、有効成分が外部包接したCD誘導体を含む薬剤を製造することができる。特に、本実施形態によると、CD誘導体は難溶性を示すため、有効成分の溶出を調整することができる、有効成分の安定性を向上することができる、昇華性のある物質の昇華抑制ができる、流動性・成型性等の粉末特性を向上させることができる、といった利点があり、更に、上記公知の技術に比べ、作製が極めて容易となる、水素結合あるいはvan der Waals力などの弱い結合をしていることから医薬品申請の際にも新規化合物として申請する必要がない、さまざまな薬物に応用可能といった効果がある。
【0026】
なお、本実施形態による薬剤の製造方法における原理については推論の部分もあるが以下のようになっていると考えられる。
【0027】
まず、CD誘導体に鎖状高分子を貫通させる工程により、CD誘導体の内部に鎖状高分子をCD誘導体の空孔に貫通させて複数のCD誘導体に規則的な構造を形成する。この際、溶媒を用いている場合CD誘導体はテトラゴナル−カラム型の結晶構造を主たる構造となると考えられる(図2参照)。なお採用する工程にもよるが溶媒を用いる場合、溶媒はCD誘導体の外部側に存在していると考えられる。
【0028】
次に、このテトラゴナル−カラム型のCD誘導体に対し溶媒を除去する工程を行なう。後述の工程の際に溶媒を残しておくと、CD誘導体及び有効成分が分解してしまう可能性があるためである。なお溶媒の除去量は、上記記載の範囲、すなわち例えば重量10%以下であることが好ましく、より好ましくは5%以下、更に好ましくは1%以下である。なお、ここではテトラゴナル−カラム型のCD誘導体において、溶媒を除去すると、テトラゴナル−カラム型を維持する場合もあるし、モノクリニック−カラム型に変化する場合もあるし、ヘキサゴナル−カラム型(図3参照)に変化する場合もある。また、採用する工程にもよるが、CD誘導体に鎖状高分子を貫通させる場合に溶媒を用いない工程を採用した場合、直接モノクリニック−カラム型またはヘキサゴナル−カラム型の結晶構造を有するCD誘導体とすることもできる場合がある。
【0029】
なお、ヘキサゴナル−カラム型の結晶構造を有するCD誘導体となった場合、有効成分を外部に包接させるとモノクリニック−カラム型の結晶構造を有するCD誘導体になると考えられ、モノクリニック−カラム型の結晶構造を有するCD誘導体となった場合は、この構造を維持したまま有効成分を外部に包接させることができる(図4参照)。この包接においては、上述の通り、有効成分は昇華性を有するものであることが好ましい。昇華性を有する有効成分とすることで、CD誘導体の結晶構造を分解させてしまうことなく有効成分をCD分子同士で形成される空隙に封入することが可能となり、有効成分を外部包接させることができると考えられる。
【0030】
なお、この有効成分を包接したモノクリニック−カラム型の結晶構造を有するCD誘導体を得た場合、溶媒を加える工程を入れると、CD誘導体の結晶構造は再びテトラゴナル−カラム型の結晶構造に変化することができ(図5参照)、更に溶媒を除去してもテトラゴナル−カラム型の結晶構造を維持することができる(図6参照)。すなわち、鎖状高分子が内部包接し、有効成分が外部包接したCD誘導体においては、テトラゴナル−カラム型の結晶構造及びモノクリニック−カラム型の結晶構造のいずれも作成することができ、薬剤としての効能に応じ好ましい結晶構造を採用することができる。
【0031】
以上、本実施形態に係る薬剤の製造方法によると、ポリマーを包接したCDに対しより様々な有効成分を含有することが可能な薬剤及びその製造方法を提供することができる。
【実施例】
【0032】
上記実施形態に係る薬剤の製造方法について、実際に薬剤を製造しその効果を確認した。以下に説明する。
【0033】
(実施例1)
まず、10wt%のγ−CD溶液(50ml)と、10wt%のポリエチレングリコール(数平均分子量2000、以下「PEG」)溶液(50ml)を加え、25℃で2日間攪拌した後、25℃で一日静置し、懸濁液中に分散する固体をゆっくりと沈殿させた。そしてその後この沈殿物をろ過し、沈殿物を得た。この沈殿物の粉末X線回折測定およびNMR測定による定量の結果を図7及び図8に示す。この結果、γ−CDにPEGのエチレングリコールユニットがモル比1:4で内部包接したものであることが確認でき、更に、この沈殿物はテトラゴナル−カラム型となっていることが確認できた。
【0034】
次に、この沈殿物に対し、減圧乾燥処理を行い、水分含量を1%以下に除去した。この乾燥物の粉末X線回折測定の結果を図9に示す。この結果、この乾燥物はγ−CDにPEGが内部包接したものであることが確認でき、この主構造がヘキサゴナル−カラム型又はモノクリニック−カラム型となっていることが確認できた。
【0035】
次に、この沈殿物と、サリチル酸をモル比で1:2あるいは1:3となるようにして調製した混合物200mgを2mlのアンプルに挿入、封止し、更にこれを150℃15分間加熱し、サリチル酸を昇華させ、結果物を得た。なおこの結果物の粉末X線回折測定の結果を図10に示す。モル比1:2で調製した試料のX線回折測定の結果においては新たにモノクリニック−カラム型の構造を持つ複合体形成に由来するピークのみが観察されたのに対して、1:3で調製した試料の回折パターンにおいては、複合体形成に由来するピークに加えてSA結晶に由来するピークの残存が観察された。この結果より、SA:(PEG/γ−CD包接化合物)=2:1SHにおいてはγ−CDの結晶格子中にSA及びPEGが封入されていることが確認でき、γ−CDの内部にPEG及び外部にサリチル酸が包接されていることが確認された。
【0036】
なお、この後、水蒸気を吸着させる工程を加えると、得られた結果物の結晶構造は再びテトラゴナル−カラム型の結晶構造に変化することが観察され(図11参照)、更に水分を除去してもテトラゴナル−カラム型の結晶構造を維持することができた。すなわち、PEGが内部包接し、サリチル酸が外部包接したγ−CDにおいては、テトラゴナル−カラム型の結晶構造及びモノクリニック−カラム型の結晶構造のいずれも作製することができ、薬剤としての効能に応じ好ましい結晶構造を採用することができると考えられる。
【0037】
以上、本実施例により、シクロデキストリン誘導体と、シクロデキストリン誘導体を貫通する鎖状高分子と、シクロデキストリン誘導体に外部包接される有効成分を含む薬剤となり、CDに対しより多くの有効成分を含有することが可能な薬剤及びその製造方法を提供できることを確認した。
【0038】
(実施例2)
その他同様の実験をSAの代わりの有効成分として、サリチル酸アミド、アセトアミノフェン、p−アミノ安息香酸、ナプロキセン、カフェイン、メフェナム酸を用いた場合にも同様にγ−CDの内部にPEG及び外部に有効成分が包接されている複合体を調製することができた。但し、複合体のモル比率は有効成分の分子サイズに応じて有効成分:(PEG/γ−CD包接化合物)=2〜0.7:1の間で変化した(図12参照)。
【産業上の利用可能性】
【0039】
本発明は、薬剤及びその製造方法として産業上の利用可能性がある。
【図面の簡単な説明】
【0040】
【図1】CDの構造を示す図である。
【図2】CD誘導体のテトラゴナル−カラム型の結晶構造を示す図である。
【図3】CD誘導体のヘキサゴナル−カラム型、モノクリニック−カラム型の結晶構造を示す図である。
【図4】CD誘導体がモノクリニック−カラム型の結晶構造を有する場合に、有効成分を外部に包接させた場合の構造を示す図である。
【図5】CD誘導体の結晶構造が再びテトラゴナル−カラム型の結晶構造に変化する場合の図である。
【図6】CD誘導体が溶媒を除去してもテトラゴナル−カラム型の結晶構造を維持することができることについての説明図である。
【図7】実施例1において得られた沈殿物の粉末X線回折測定の結果を示す図である。
【図8】実施例1において得られた沈殿物のNMR測定による定量の結果を示す図である。
【図9】実施例1において得られた粉末X線回折測定の結果を示す図である。
【図10】実施例1により得られた結果物の粉末X線回折測定の結果を示す図である。
【図11】実施例1により得られた結果物の結晶構造について説明する図である。
【図12】他の実施例における結果を示す図である。
【特許請求の範囲】
【請求項1】
シクロデキストリン誘導体と、
前記シクロデキストリン誘導体を貫通する鎖状高分子と、
前記シクロデキストリン誘導体に外部包接される有効成分と、を含む薬剤。
【請求項2】
前記鎖状高分子はポリエチレングリコール、ポリプロピレングリコール、ポリテトラヒドロフラン、ポリ−ε−カプロラクトン、ポリ(L−乳酸)、ポリビニルアルコール、ポリビニルアセテート、ポリカルボネート、ポリメタクリル酸メチル樹脂、ポリエチレンテレフタレート、ポリイソブチレン、ポリブタジエン、ポリジメチルシロキサン、ポリロイシン、Silk fibroin、ナイロン6、ポリアニリン、及び、ポリエチレングリコール−ポリプロピレングリコール−ポリエチレングリコール共重合体、の少なくともいずれかを含み、前記有効成分はサリチル酸誘導体、ニトロフェノール誘導体、プロピオン酸誘導体、ピラゾロン誘導体、インドール酸誘導体、アントラニル酸誘導体、フェニル酢酸誘導体、オキシカム誘導体、アニリン誘導体、ピラゾロン誘導体、キサンチン誘導体、及び、安息香酸誘導体の少なくともいずれかを含む請求項1記載の薬剤。
【請求項3】
前記鎖状高分子はポリエチレングリコール、ポリプロピレングリコール、及びポリイソブチレンの少なくともいずれかを含み、前記有効成分はサリチル酸、サリチル酸アミド、アセトアミノフェン、p−アミノ安息香酸、ナプロキセン、カフェイン、及び、メフェナム酸の少なくともいずれかを含む請求項1記載の薬剤。
【請求項4】
前記シクロデキストリン誘導体は、モノクリニック−カラム型又はテトラゴナル−カラム型を主たる構造とする請求項1記載の薬剤。
【請求項5】
シクロデキストリン誘導体に鎖状高分子を貫通させる工程、
前記シクロデキストリン誘導体に有効成分を外部包接させる工程と、を有する薬剤の製造方法。
【請求項6】
前記鎖状高分子はポリエチレングリコール、ポリプロピレングリコール、ポリテトラヒドロフラン、ポリ−ε−カプロラクトン、ポリ(L−乳酸)、ポリビニルアルコール、ポリビニルアセテート、ポリカルボネート、ポリメタクリル酸メチル樹脂、ポリエチレンテレフタレート、ポリイソブチレン、ポリブタジエン、ポリジメチルシロキサン、ポリロイシン、Silk fibroin、ナイロン6、ポリアニリン、ポリエチレングリコール−ポリプロピレングリコール−ポリエチレングリコール共重合体、の少なくともいずれかを含み、前記有効成分はサリチル酸誘導体、ベンズアミド誘導体、プロピオン酸誘導体、ピラゾロン誘導体、インドール酸誘導体、アントラニル酸誘導体、フェニル酢酸誘導体、オキシカム誘導体、アニリン誘導体、ピラゾロン誘導体、キサンチン誘導体、及び、安息香酸誘導体の少なくともいずれかを含む請求項5記載の薬剤の製造方法。
【請求項7】
前記鎖状高分子はポリエチレングリコールを含み、前記有効成分はサリチル酸、サリチル酸アミド、アセトアミノフェン、p−アミノ安息香酸、ナプロキセン、カフェイン、及び、メフェナム酸の少なくともいずれかを含む請求項5記載の薬剤の製造方法。
【請求項8】
前記シクロデキストリン誘導体に有効成分を外部包接させる工程は、前記有効成分を昇華させることを含む、請求項5記載の薬剤の製造方法。
【請求項9】
前記シクロデキストリン誘導体に有効成分を外部包接させる工程は、密封加熱法を含む、請求項5記載の薬剤の製造方法。
【請求項10】
前記シクロデキストリン誘導体に鎖状高分子を貫通させる工程は、溶媒を使用しない工程又は溶媒を除去する工程を含む、請求項5記載の薬剤の製造方法。
【請求項11】
前記シクロデキストリン誘導体に鎖状高分子を貫通させる工程は、共沈法と、前記共沈法において用いた溶媒を除去する工程を含む、請求項5記載の薬剤の製造方法。
【請求項1】
シクロデキストリン誘導体と、
前記シクロデキストリン誘導体を貫通する鎖状高分子と、
前記シクロデキストリン誘導体に外部包接される有効成分と、を含む薬剤。
【請求項2】
前記鎖状高分子はポリエチレングリコール、ポリプロピレングリコール、ポリテトラヒドロフラン、ポリ−ε−カプロラクトン、ポリ(L−乳酸)、ポリビニルアルコール、ポリビニルアセテート、ポリカルボネート、ポリメタクリル酸メチル樹脂、ポリエチレンテレフタレート、ポリイソブチレン、ポリブタジエン、ポリジメチルシロキサン、ポリロイシン、Silk fibroin、ナイロン6、ポリアニリン、及び、ポリエチレングリコール−ポリプロピレングリコール−ポリエチレングリコール共重合体、の少なくともいずれかを含み、前記有効成分はサリチル酸誘導体、ニトロフェノール誘導体、プロピオン酸誘導体、ピラゾロン誘導体、インドール酸誘導体、アントラニル酸誘導体、フェニル酢酸誘導体、オキシカム誘導体、アニリン誘導体、ピラゾロン誘導体、キサンチン誘導体、及び、安息香酸誘導体の少なくともいずれかを含む請求項1記載の薬剤。
【請求項3】
前記鎖状高分子はポリエチレングリコール、ポリプロピレングリコール、及びポリイソブチレンの少なくともいずれかを含み、前記有効成分はサリチル酸、サリチル酸アミド、アセトアミノフェン、p−アミノ安息香酸、ナプロキセン、カフェイン、及び、メフェナム酸の少なくともいずれかを含む請求項1記載の薬剤。
【請求項4】
前記シクロデキストリン誘導体は、モノクリニック−カラム型又はテトラゴナル−カラム型を主たる構造とする請求項1記載の薬剤。
【請求項5】
シクロデキストリン誘導体に鎖状高分子を貫通させる工程、
前記シクロデキストリン誘導体に有効成分を外部包接させる工程と、を有する薬剤の製造方法。
【請求項6】
前記鎖状高分子はポリエチレングリコール、ポリプロピレングリコール、ポリテトラヒドロフラン、ポリ−ε−カプロラクトン、ポリ(L−乳酸)、ポリビニルアルコール、ポリビニルアセテート、ポリカルボネート、ポリメタクリル酸メチル樹脂、ポリエチレンテレフタレート、ポリイソブチレン、ポリブタジエン、ポリジメチルシロキサン、ポリロイシン、Silk fibroin、ナイロン6、ポリアニリン、ポリエチレングリコール−ポリプロピレングリコール−ポリエチレングリコール共重合体、の少なくともいずれかを含み、前記有効成分はサリチル酸誘導体、ベンズアミド誘導体、プロピオン酸誘導体、ピラゾロン誘導体、インドール酸誘導体、アントラニル酸誘導体、フェニル酢酸誘導体、オキシカム誘導体、アニリン誘導体、ピラゾロン誘導体、キサンチン誘導体、及び、安息香酸誘導体の少なくともいずれかを含む請求項5記載の薬剤の製造方法。
【請求項7】
前記鎖状高分子はポリエチレングリコールを含み、前記有効成分はサリチル酸、サリチル酸アミド、アセトアミノフェン、p−アミノ安息香酸、ナプロキセン、カフェイン、及び、メフェナム酸の少なくともいずれかを含む請求項5記載の薬剤の製造方法。
【請求項8】
前記シクロデキストリン誘導体に有効成分を外部包接させる工程は、前記有効成分を昇華させることを含む、請求項5記載の薬剤の製造方法。
【請求項9】
前記シクロデキストリン誘導体に有効成分を外部包接させる工程は、密封加熱法を含む、請求項5記載の薬剤の製造方法。
【請求項10】
前記シクロデキストリン誘導体に鎖状高分子を貫通させる工程は、溶媒を使用しない工程又は溶媒を除去する工程を含む、請求項5記載の薬剤の製造方法。
【請求項11】
前記シクロデキストリン誘導体に鎖状高分子を貫通させる工程は、共沈法と、前記共沈法において用いた溶媒を除去する工程を含む、請求項5記載の薬剤の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2010−173976(P2010−173976A)
【公開日】平成22年8月12日(2010.8.12)
【国際特許分類】
【出願番号】特願2009−19182(P2009−19182)
【出願日】平成21年1月30日(2009.1.30)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【Fターム(参考)】
【公開日】平成22年8月12日(2010.8.12)
【国際特許分類】
【出願日】平成21年1月30日(2009.1.30)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【Fターム(参考)】
[ Back to top ]

