薬剤徐放体
【課題】 本発明の課題は、薬剤が担持されて成り、生体に埋設すると薬剤が放出される薬剤徐放体を提供することであり、特に、大きな荷重のかかる部位の人工骨として使用される場合には、元の骨に近い力学的特性を有する薬剤徐放体を提供することである。
【解決手段】 この薬剤徐放体は、プラスチックにより形成され、実質部とその表面に形成され、かつ、小径気孔及び大径気孔を有する表面層とを備え、前記小径気孔及び前記大径気孔の一部は前記表面層の表面に開口する開気孔を形成しており、前記開気孔は平均開気孔径が5μm以下の小径開気孔と平均開気孔径が10〜200μmの大径開気孔とを有し、前記大径開気孔の内壁面に前記小径気孔及び前記大径気孔と連通する連通孔が形成されて成る表面発泡体が、その表面層に薬剤を担持している。
【解決手段】 この薬剤徐放体は、プラスチックにより形成され、実質部とその表面に形成され、かつ、小径気孔及び大径気孔を有する表面層とを備え、前記小径気孔及び前記大径気孔の一部は前記表面層の表面に開口する開気孔を形成しており、前記開気孔は平均開気孔径が5μm以下の小径開気孔と平均開気孔径が10〜200μmの大径開気孔とを有し、前記大径開気孔の内壁面に前記小径気孔及び前記大径気孔と連通する連通孔が形成されて成る表面発泡体が、その表面層に薬剤を担持している。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、薬剤徐放体に関し、特に薬剤が担持されて成り、生体に埋設すると薬剤が放出される薬剤徐放体に関する。
【背景技術】
【0002】
医療分野や再生医工学の分野においては、薬剤を局所的に投与する手段として、あるいは失った組織を再生する手段として、多孔質体に薬剤を含浸させて成る薬剤徐放体を患部に埋入することが提案されている。
【0003】
例えば、特許文献1には、多孔質リン酸カルシウム系焼結体ブロックに薬剤を含浸する方法が記載され、特許文献2及び3には、セラミックス多孔体内部の気孔に生体吸収性ポリマーと共に薬剤を担持する人工骨が記載されている。また、特許文献4には、多孔質リン酸カルシウム系化合物顆粒の孔内に薬剤を含浸し、顆粒表面に可溶性の有機化合物から成るコーティング層を有する薬剤徐放顆粒が記載され、特許文献5には、セラミックス多孔体顆粒の内部に薬剤溶液を保持する中空部を有する徐放剤用担体が記載されている。さらに、特許文献6には、薬物を含有するリン酸カルシウムセメントと液剤とからなる薬物徐放性リン酸カルシウムセメントが記載されている。これらはいずれも生体骨と比較すると強度が低いので、例えば人工骨として用いる場合には、荷重のかからない部位でのみ使用するといった、使用部位の制限があると考えられる。
【0004】
特許文献7には、高分子から成る医療用多孔質体において、医療用多孔質体の製造時に薬剤を担持させる医療用多孔質体の製造方法が開示されている。しかし、この医療用多孔質体は構造全体が多孔質であることから、上記した特許文献に記載の薬剤徐放体と同様に、人工骨として用いた場合には、使用部位が制限されてしまうと考えられる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平10−279471号公報
【特許文献2】特表2007−222611号公報
【特許文献3】特開2004−159971号公報
【特許文献4】特許第2842647号公報
【特許文献5】特許第3152665号公報
【特許文献6】特許第2927007号公報
【特許文献7】特開2005−80927号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の課題は、薬剤が担持されて成り、生体に埋設すると薬剤が放出される薬剤徐放体を提供することであり、特に、大きな荷重のかかる部位の人工骨として使用される場合には、元の骨に近い力学的特性を有する薬剤徐放体を提供することである。
【0007】
本発明の他の課題は、複雑な形状を有する薬剤徐放体を簡易な方法で製造可能な薬剤徐放体の製造方法を提供することである。
【課題を解決するための手段】
【0008】
前記課題を解決するための手段として、
(1)プラスチックにより形成され、
実質部とその表面に形成され、かつ、小径気孔及び大径気孔を有する表面層とを備え、
前記小径気孔及び前記大径気孔の一部は前記表面層の表面に開口する開気孔を形成しており、
前記開気孔は平均開気孔径が5μm以下の小径開気孔と平均開気孔径が10〜200μmの大径開気孔とを有し、
前記大径開気孔の内壁面に前記小径気孔及び前記大径気孔と連通する連通孔が形成されて成る表面発泡体が、その表面層に薬剤を担持していることを特徴とする薬剤徐放体である。
【発明の効果】
【0009】
本発明に係る薬剤徐放体は、プラスチックにより形成され、実質部とその表面に形成され、かつ、小径気孔及び大径気孔を有する表面層とを備え、前記小径気孔及び前記大径気孔の一部は前記表面層の表面に開口する開気孔を形成しており、前記開気孔は平均開気孔径が5μm以下の小径開気孔と平均開気孔径が10〜200μmの大径開気孔とを有し、前記大径開気孔の内壁面に前記小径気孔及び前記大径気孔と連通する連通孔が形成されて成る表面発泡体が、その表面層に薬剤を担持している。したがって、この薬剤徐放体を生体内に埋設した場合には、薬剤が長期間に渡って徐放される。また、この薬剤徐放体が人工骨として使用される場合には、薬剤が長期間に渡って徐放されると共に、骨組織を表面層の内部に侵入させることができる。その結果、例えば抗炎症剤及び骨形成誘導因子といった薬剤を徐放しながら表面層の内部に存在する空間を充填するように新たな骨が形成されるので、生体骨と薬剤徐放体とを強固に結合させることができる。また、本発明に係る薬剤徐放体は、全体積に気孔を有するのではなく、その表面に多数の気孔を有するので、適用部位に合わせた強度を保持することが容易である。
【0010】
また、この薬剤徐放体が、エンジニアリングプラスチック、特にポリエーテルエーテルケトンで形成されると、高い機械的強度を有する薬剤徐放体を提供することができる。したがって、この薬剤徐放体が、骨との結合が必要で、かつ大きな荷重が連続的に長期間かかるような部位に人工骨として適用される場合には、ストレスシールディング、すなわち骨に加わる応力の遮蔽によって起こる可能性のある骨減少及び骨密度の低下などが生じることを防止することができる。
【0011】
さらに、この薬剤徐放体が、薬剤徐放体の表面層の表面及び/又は前記小径開気孔及び大径開気孔の内壁面に、例えば水酸アパタイト等の生体活性物質を有していると、この薬剤徐放体が人工骨として使用される場合には、この生体活性物質と生体の骨組織との化学的な反応が始まり、新たな骨の形成が速やかに行われるので、骨と人工骨とを早期に結合させることができる。この薬剤徐放体が経皮デバイスとして使用される場合には、生体活性物質は多くの生体分子を吸着する性質を有することから、皮膚と薬剤徐放体との密着性を向上させることができる。その結果、皮膚と経皮デバイスとの間に生じた隙間から細菌感染が起こるといったことを防止することができる。また、この生体活性物質が薬剤と生体活性物質とを含む薬剤粒子又は薬剤層であると、より一層薬剤が長期間に渡って徐放される。
【0012】
本発明に係る薬剤徐放体の製造方法は、ほとんどの工程が液相中において処理することのできる方法であるので、特別な装置を使用する必要がなく、また複雑な形状を有する薬剤徐放体であっても容易に製造することができる。
【図面の簡単な説明】
【0013】
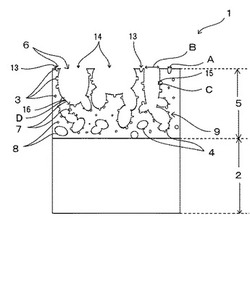
【図1】図1は、本発明に係る薬剤徐放体における表面発泡体の一実施例を示す模式図である。
【図2】図2(a)、図2(b)は、生体活性物質を有して成る薬剤徐放体の一実施例を示す模式図である。
【図3】図3は、実施例1における表面発泡体の表面を撮影した走査型電子顕微鏡写真である。
【発明を実施するための形態】
【0014】
図1は、本発明に係る薬剤徐放体を構成する表面発泡体の一実施例を示す模式図である。図1に示すように、この表面発泡体1は、実質部2とその表面に形成され、かつ、小径気孔3及び大径気孔4を有する表面層5とを備え、前記小径気孔3及び前記大径気孔4の一部は前記表面層5の表面に開口する開気孔6を形成しており、前記開気孔6は平均開気孔径Aが5μm以下の小径開気孔13と平均開気孔径Bが10〜200μmの大径開気孔14とを有し、前記大径開気孔14は、その内壁面に前記小径気孔3及び前記大径気孔4と連通する連通孔7が形成されている。本発明に係る薬剤徐放体は、この表面発泡体1の表面層5に薬剤が担持されている。
【0015】
表面層5は、大きさの異なる小径気孔3及び大径気孔4を複数有しており、これらの気孔は、独立して形成されている独立気孔8及び2つ以上の独立気孔8が連通して形成されている連通気孔9を形成している。一部の小径気孔3及び大径気孔4は表面層5の表面に開口する開気孔6を形成しており、この開気孔6は平均開気孔径Aが5μm以下、好ましくは3μm以下の小径開気孔13と平均開気孔径Bが10〜200μm、好ましくは30〜150μmの大径開気孔14とを有している。この大径開気孔14の内壁面には、小径気孔3及び大径気孔4と連通して形成される連通孔7が形成されている。この連通孔7は、一つの開気孔6に対して複数の連通孔7が形成されているのが好ましく、小径気孔3と連通して形成される小径連通孔径Cが5μm以下、好ましくは3μm以下の小径連通孔15と大径気孔4と連通して形成される大径連通孔径Dが10〜200μm、好ましくは30〜150μmの大径連通孔16とにより形成されている。小径気孔3及び大径気孔4は、球状及び/又は扁球状及び/又は長球状及び/又はこれらの形状が組み合わされてなる形状を有する。表面層5がこのような気孔を有するので、この薬剤徐放体が生体内に埋設されると、薬剤が長期間に渡って徐放される。また、この薬剤徐放体が人工骨として使用される場合には、薬剤が長期間に渡って徐放されると共に、骨組織を表面層の内部に侵入させることができる。その結果、抗炎症剤及び骨形成誘導因子といった薬剤を徐放しながら表面層の内部に存在する空間を充填するように新たな骨が形成されるので、生体骨と薬剤徐放体とを強固に結合させることができる。また、大径気孔4により形成されている大径開気孔14の内壁面に連通孔7、特に大径連通孔16が多数形成されている程、骨組織を表面層5の表面から深部まで到達させることができ、表面層5の深部において新たな骨を形成させることができるので、骨と生体インプラントとをより強固に結合させることができる。
【0016】
表面層5の表面に開口する小径開気孔13の平均開気孔径と大径開気孔14の平均開気孔径は、表面層5の表面を走査型電子顕微鏡で観察し、表面層5の表面を示す画像を利用して求めることができる。
【0017】
まず、表面層5の表面を走査型電子顕微鏡により、所定の倍率、例えば300倍に設定したSEM画像を得る。次いで、前記SEM画像の全視野における比較的大型の最表面部の開気孔、例えば平均径が約10μm以上の開気孔の長径と短径とを測定する。次いで、これらの測定値の算術平均を算出することにより、大径開気孔14の平均開気孔径を求めることができる。
【0018】
小径開気孔13は、通常、大径開気孔14と大径開気孔14との間の骨格部分に存在する。小径開気孔13の平均開気孔径を測定する場合には、測定誤差を小さくするために、さらに走査型電子顕微鏡の倍率を上げるのが好ましい。例えば、走査型電子顕微鏡を3000倍に設定したSEM画像を得る。次いで、骨格部分に形成されている開気孔の長径と短径とを測定する。すなわち、先に測定した大径開気孔14を除くすべての開気孔の長径と短径とを測定する。次いで、これらの測定値の算術平均を算出することにより、小径開気孔13の平均開気孔径を求めることができる。
【0019】
SEM画像上の大径開気孔14又は小径開気孔13の数が多い場合、例えば50個以上の場合、SEM画像上を横断するようにランダムに5本の直線を引き、この直線上にある大径開気孔14又は小径開気孔13を上述の基準で選択し、長径と短径とを測定する。次いで、これらの測定値の算術平均を算出することにより、大径開気孔14と小径開気孔13との平均開気孔径を求めることができる。
【0020】
表面層5の表面に開口する開気孔6に小径気孔3及び大径気孔4が連通して形成されている連通孔7の孔径は、上記と同様に、所定の倍率で撮影したSEM画像から求めることができ、その他の方法として、水銀ポロシメータを使用して求めることもできる。
【0021】
表面層5の最表面を投影した場合の小径開気孔13及び大径開気孔14それぞれの面積割合は、特に限定されず、薬剤の徐放量及び徐放期間等を考慮して適宜調整することができる。本発明に係る薬剤徐放体が、例えば人工骨として使用される場合には、小径開気孔13と大径開気孔14との面積を合算した面積割合が99%以下になる範囲で、小径開気孔13の面積割合は、5〜90%であるのが好ましく、15〜80%であるのが特に好ましく、大径開気孔14の面積割合は、10〜95%であるのが好ましく、20〜85%であるのが特に好ましい。小径開気孔13の面積割合が、前記範囲内にあると、薬剤を十分に担持させることができると共に、薬剤徐放体を生体内に埋設した後に、長期間に渡って薬剤を放出させることができる。特に、小径開気孔13が多数形成されていると、薬剤徐放体の表面が平らに形成されている場合に比べて、表面層5に担持されている薬剤が少しずつ放出されされる。その理由としては、開気孔の気孔径が小さいほど体液が気孔内に浸入し難くなるので、気孔内に担持されている薬剤が体液に接触し難くなることから、薬剤が放出され難くなるためであると推定される。したがって、小径開気孔13の平均開気孔径Aが小さく、小径開気孔13の面積割合が大きいほど、より一層長期間に渡って薬剤が放出される。また、大径開気孔14の面積割合が、前記範囲内にあると、骨組織を表面層5の内部に浸入させることができるので、表面層5の内部に新たな骨が形成され、その結果、骨と結合させることのできる薬剤徐放体を提供することができる。
【0022】
表面層5の最表面を投影した場合の小径開気孔13及び大径開気孔14の面積割合は、表面層5の表面を走査型電子顕微鏡により撮影した写真を画像解析ソフト(例えば、Scion社製 Scion Image)を使用して、小径開気孔13及び大径開気孔14の面積をそれぞれ算出することにより求めることができる。なお、上述した平均開気孔径を算出する場合と同様にして、走査型電子顕微鏡画像は、小径開気孔13及び大径開気孔14の面積を測定するのに適度な倍率で表示する。画像全体の面積Sに対する大径開気孔の面積から大径開気孔の面積割合が、画像全体の面積Sに対する小径開気孔の面積から小径開気孔の面積割合が算出される。
【0023】
表面層5における小径気孔3及び大径気孔4の気孔率は、特に限定されず、薬剤の徐放量及び徐放期間等を考慮して適宜調整することができる。本発明に係る薬剤徐放体が、例えば人工骨として使用される場合には、小径気孔3と大径気孔4とを合算した気孔率が99%以下になる範囲で、小径気孔3の気孔率は5〜50%であるのが好ましく、10〜40%であるのが特に好ましく、大径気孔4の気孔率は20〜90%であるのが好ましく、30〜80%であるのが特に好ましい。小径気孔3の気孔率が、前記範囲内にあると、骨形成に関与するタンパク質や細胞等が付着する足場を多く確保できるため、新たな骨が表面層の内部に形成されやすく、薬剤徐放体と骨とを強固に結合することができる。大径気孔4の気孔率が、前記範囲にあると、骨組織が表面層5の内部に侵入した後保持されやすくなると共に、新たな骨が形成される空間が十分に確保され、この空間を埋めるように新たな骨が形成されるので、より一層強固に骨と生体インプラントとを結合させることができる。また、小径気孔3と大径気孔4との気孔率が前記範囲内にあると、表面層5に担持された薬剤を適度な徐放速度で、すなわち所望の量の薬剤を所望の期間に渡って放出することができる。
【0024】
前記表面層5の小径気孔3の気孔率及び大径気孔4の気孔率は、表面層5の表面に直交する断面を走査型電子顕微鏡により撮影した画像を画像解析ソフト(例えば、Scion社製Scion Image)を使用して、大径気孔4及び小径気孔3の面積をそれぞれ算出することにより求めることができる。すなわち、上述した小径開気孔及び大径開気孔の面積割合を算出するのと同様にして、小径気孔3及び大径気孔4それぞれの面積割合を求めることにより、それぞれの気孔率を推定できる。
【0025】
表面層5の厚さは、本発明に係る薬剤徐放体を適用する部位及び薬剤の徐放量及び徐放期間等を考慮して適宜調整することができる。本発明に係る薬剤徐放体が、例えば人工骨として使用される場合には、10〜1000μmであるのが好ましく、20〜200μmであるのが特に好ましい。前記範囲内であると、表面層5に適度な量の薬剤を担持させることができるので、所望の量の薬剤を所望の期間に渡って放出させることができる。また、この薬剤徐放体を体内に埋設した後に、表面層5の表面に開口している多数の開気孔6及びこの開気孔6と表面層5の内部に形成されている小径気孔3及び大径気孔4とが連通することにより形成される連通孔7を通じて、骨組織を表面層5の内部に侵入させることができる。その結果、表面層5の内部に新たな骨が形成されるので、生体骨と結合させることのできる薬剤徐放体を提供することができる。
【0026】
本発明に係る薬剤徐放体は、一般に使用されているプラスチックにより形成されて成り、この薬剤徐放体が使用される部位により適宜のプラスチックを選択することができる。る。本発明に係る薬剤徐放体が人工骨又は人工歯根として使用される場合には、薬剤徐放体を形成する物質は、力学的特性が骨に近いプラスチック、すなわち、弾性率が1〜50GPa、曲げ強度は100MPa以上であることが好ましい。
【0027】
力学的特性が骨又は歯に近いプラスチックとしては、エンジニアリングプラスチック又は繊維強化プラスチック等が挙げられる。エンジニアリングプラスチックとしては、例えば、ポリアミド、ポリアセタール、ポリカーボネート、ポリフェニレンエーテル、ポリエステル、ポリフェニリンオキサイド、ポリブチレンテレフタラート、ポリエチレンテレフタレート、ポリスルホン、ポリエーテルスルホン、ポリフェニレンスルフィド、ポリアリレート、ポリエーテルイミド、ポリエーテルエーテルケトン、ポリアミドイミド、ポリイミド、フッ素樹脂、エチレンビニルアルコール共重合体、ポリメチルペンテン、フェノール樹脂、エポキシ樹脂、シリコーン樹脂、ジアリルフタレート樹脂、ポリオキシメチレン、ポリ四フッ化エチレン等が挙げられる。
【0028】
繊維強化プラスチックのマトリックスとなるプラスチックとしては、前記エンジニアリングプラスチックに加えて、例えば、ポリエチレン、ポリ塩化ビニル、ポリプロピレン、EVA樹脂、EEA樹脂、4−メチルペンテン−1樹脂、ABS樹脂、AS樹脂、ACS樹脂、メタクリル酸メチル樹脂、エチレン塩化ビニル共重合体、プロピレン塩化ビニル共重合体、塩化ビニリデン樹脂、ポリビニルアルコール、ポリビニルホルマール、ポリビニルアセトアセタール、ポリフッ化エチレンプロピレン、ポリ三フッ化塩化エチレン、メタクリル樹脂、リノル樹脂、ポリアリルエーテルケトン、ポリエーテルスルホン、ポリケトンスルフィド、ポリスチレン、ポリアミノビスマレイミド、ユリア樹脂、メラミン樹脂、キシレン樹脂、イソフタル酸系樹脂、アニリン樹脂、フラン樹脂、ポリウレタン、アルキルベンゼン樹脂、グアナミン樹脂、ポリジフェニルエーテル樹脂等が挙げられる。
【0029】
本発明に係る薬剤徐放体が人工骨又は人工歯根として使用される場合には、薬剤徐放体を形成する物質としては、これらの中でもポリエーテルエーテルケトン(PEEK)が特に好ましい。PEEKにより形成されて成る薬剤徐放体を大きな荷重が連続的に長期間かかるような部位に埋設した場合に、PEEKは、生体適合性を有し力学的特性が骨と近いので、ストレスシールディング、すなわち骨に加わる応力の遮蔽によって起こる可能性のある骨減少及び骨密度の低下などが生じることを防止することができる。
【0030】
前記繊維強化プラスチックにおける繊維としては、炭素繊維、ガラス繊維、セラミック繊維、金属繊維又は有機繊維が挙げられる。
炭素繊維については、ここではカーボンナノチューブも含まれる。
ガラス繊維としては、ホウケイ酸ガラス(Eガラス)、高強度ガラス(Sガラス)、高弾性ガラス(YM−31Aガラス)等の繊維、
セラミック繊維としては、炭化ケイ素、窒化ケイ素、アルミナ、チタン酸カリウム、炭化ホウ素、酸化マグネシウム、酸化亜鉛、ホウ酸アルミニウム、ホウ素等の繊維、
金属繊維としては、タングステン、モリブデン、ステンレス、スチール、タンタル等の繊維、
有機繊維としては、ポリビニルアルコール、ポリアミド、ポリエチレンテレフタレート、ポリエステル、アラミド等の繊維、又はこれらの混合物を用いることができる。
【0031】
また薬剤徐放体を形成する物質中に、必要に応じて帯電防止剤、酸化防止剤、ヒンダードアミン系化合物などの光安定剤、滑剤、ブロッキング防止剤、紫外線吸収剤、無機充填剤、顔料などの着色料、等の各種添加剤が含有されていても良い。
【0032】
本発明に係る薬剤徐放体は、その表面層5に薬剤を担持している。この薬剤は、本発明に係る薬剤徐放体の要求される機能により種々の薬剤を使用することができる。薬剤としては、例えば、抗炎症剤、抗生物質、抗血栓剤、抗腫瘍剤、抗凝血剤、血管細胞成長促進剤、血管細胞成長阻害剤、抗癌剤、血管拡張剤、及び骨形成誘導因子等を挙げることができる。骨形成誘導因子としては、骨組織からの抽出成分である各種の骨形成関連タンパク質を用いることができ、例えば、骨形成因子(BMP)、形質転換成長因子(TFG−β)、軟骨由来形成因子(CDMP)、骨誘導因子(OIF)、インスリン様成長因子(IGF)、血小板由来成長因子(PDFG)、繊維芽細胞増殖因子(FGF)等を挙げることができる。これらの薬剤は、相互に反応するものでなければ、これらの中から選択される2種以上の薬剤が表面層5に担持されてもよい。
【0033】
本発明に係る薬剤徐放体は、その表面層の表面及び/又は小径気孔及び大径気孔の内壁面に、生体活性物質を有しているのが好ましく、生体活性物質と薬剤とを含む、薬剤粒子及び/又は薬剤層を有しているのが特に好ましい。ここでは、薬剤を担持した生体活性物質が粒子状に形成されている場合に、これを薬剤粒子と称し、薬剤を担持した生体活性物質が層状に形成されている場合に、これを薬剤層と称するが、これらは厳密に区別されない。薬剤徐放体が、生体活性物質、薬剤粒子及び/又は薬剤層を有していると、生体活性物質は骨との結合性や生体分子を吸着する性質を有するので、この薬剤徐放体が骨や皮膚等の生体組織との接合性が必要な部位に使用される場合に特に有効である。例えば、薬剤徐放体が人工骨として使用される場合には、骨と結合し易くなり、経皮デバイスとして使用される場合には、皮膚と密着し易くなる。さらに、薬剤徐放体が、薬剤粒子及び/又は薬剤層を有していると、薬剤が長期間に渡って放出されるので、その薬剤の種類に応じた効果が長期間に渡って得られる。
【0034】
図2(a)、(b)に、生体活性物質、薬剤粒子、及び/又は薬剤層を有する薬剤徐放体の一実施例である薬剤徐放体の模式図を示す。以下においては、生体活性物質、薬剤粒子及び薬剤層を単に生体活性物質と称して説明する。図2(a)に示すように、生体活性物質210aは、表面層205aにおける開気孔206aの内壁面211aと表面層205aの表面との全面に形成されていても良い。あるいは、図2(b)に示すように、生体活性物質210bは、開気孔206bの内壁面211bの一部及び/又は表面層205bの表面の一部に形成されていても良い。ただし、薬剤徐放体212a、212bが、生体活性物質を有する薬剤粒子又は薬剤層ではなく、薬剤のみを有する場合には、薬剤は表面発泡体のみから放出されることになるので、表面発泡体に担持された薬剤を放出し易くするために、図2(b)に示されるように、開気孔206bの内壁面211bの一部及び/又は表面層205bの表面の一部に生体活性物質210bが形成されているのが好ましい。また、開気孔206a、206bの内壁面211a、211bに生体活性物質210a、210bが形成されている場合には、生体活性物質210a、210bが開気孔206a、206bをすべて埋めてしまうように形成されているのではなく、図2(a)、(b)に示すように、表面層205a、205bの表面に開口する開気孔206a、206bの内壁面211a、211bの一部又は全面に生体活性物質210a、210bが形成されているのが好ましい。例えば、図2(a)に示すように、小径開気孔213aが生体活性物質210aによってすべて埋められていても良いが、大径開気孔214aは、大径開気孔214aの容積を保持した状態で内壁面211aに生体活性物質210aが形成されているのが好ましい。さらに大径気孔204aと連通して形成される大径連通孔216aも生体活性物質210aにより閉塞されることなく、生体組織を侵入させたり、薬剤を放出させたりすることができる程度の大径連通孔径Dを有する大径連通孔216aが形成されているのが好ましい。表面層205aに開気孔206aが形成され、さらに開気孔206aに連通する大径連通孔216aが形成されていると、薬剤徐放体212aを生体内に埋設した後に、開気孔206aから表面層205aの内部に生体組織を侵入させたり、薬剤を表面層205aの内部から放出させたりすることができる。その結果、開気孔206aの内壁面211aに存在する生体活性物質210aと骨及び皮膚等の生体組織との化学的な反応が始まるので、生体組織との接合性をさらに向上させることができる。
【0035】
表面層205a、205bを投影した場合の生体活性物質210a、210bの面積割合は、少なくとも5%以上であるのが好ましく、20%以上であるのが特に好ましい。上記生体活性物質210a、210bは、表面層205a、205bの表面に存在する生体活性物質210a、210bだけでなく、開気孔206a、206bの内壁面211a、211bに存在し、かつ表面層205a、205bの外側から視認できる生体活性物質210a、210bも含む。生体活性物質210a、210bが、表面層205a、205bにおける開気孔206a、206bの内壁面211a、211b及び/又は表面層205a、205bの表面に、前記範囲内で存在すると、薬剤徐放体212a、212bを生体内に埋設した後に、この生体活性物質210a、210bと生体組織との化学的な反応が始まるので、骨及び皮膚等の生体組織と薬剤徐放体212a、212bとの接合性を向上させることができる。生体活性物質210a、210bが、生体活性物質と薬剤とを含む、薬剤粒子及び/又は薬剤層であると、薬剤が長期間に渡って放出されるので、その薬剤の種類に応じた効果が長期間に渡って得られる。
【0036】
表面層205a、205bを投影した場合の生体活性物質210a、210bの面積割合は、表面層205a、205bの表面を走査型電子顕微鏡により撮影した画像を画像解析ソフト(例えば、Scion社製 Scion Image)を使用して、生体活性物質210a、210bとそれ以外の部分とに2値化し、次いで画像全体の面積に対する生体活性物質の面積割合を算出することにより、求めることができる。
【0037】
生体活性物質210a、210bは、表面層205a、205bの体積に対して0.5〜30%含有するのが好ましい。生体活性物質210a、210bは、表面層205a、205bにおける開気孔206a、206bの内壁面211a、211b及び/又は表面層205a、205bの表面及び/又は表面層205a、205bの内部に独立した状態及び/又はこれらの生体活性物質210a、210bが結合して樹枝状に表面層205a、205b内部に張り巡らされた状態で存在する。前記範囲内の生体活性物質210a、210bが表面層205a、205bに存在すると、薬剤徐放体212a、212bを生体内に埋設した後に、この生体活性物質210a、210bと生体組織との化学的な反応が始まるので、骨及び皮膚等の生体組織と薬剤徐放体212a、212bとの接合性を向上させることができる。生体活性物質210a、210bが、薬剤粒子及び/又は薬剤層であると、薬剤が長期間に渡って放出されるので、その薬剤の種類に応じた効果が長期間に渡って得られる。
【0038】
表面層205a、205bに含まれる生体活性物質210a、210bの体積割合は、上述した生体活性物質210a、210bの面積割合を測定する方法と同様にして求めることができる。つまり、表面層205a、205bの表面に直交する断面における生体活性物質210a、210bの面積割合を算出することができれば、この算出値から生体活性物質210a、210bの体積割合を推定することができる。
【0039】
生体活性物質210a、210bは、生体との親和性が高く、歯を含む骨組織及び皮膚等と化学的に反応する性質を有する物質であれば特に限定されず、例えば、リン酸カルシウム系材料、バイオガラス、結晶化ガラス(ガラスセラミックスとも称する。)、炭酸カルシウム等の無機材料が挙げられる。リン酸カルシウム系材料としては、例えば、リン酸水素カルシウム、リン酸水素カルシウム水和物、リン酸二水素カルシウム、リン酸二水素カルシウム水和物、α型リン酸三カルシウム、β型リン酸三カルシウム、ドロマイト、リン酸四カルシウム、リン酸八カルシウム、水酸アパタイト、フッ素アパタイト、炭酸アパタイト及び塩素アパタイト等が挙げられる。バイオガラスとしては、例えば、SiO2−CaO−Na2O−P2O5系ガラス、SiO2−CaO−Na2O−P2O5−K2O−MgO系ガラス、及び、SiO2−CaO−Al2O3−P2O5系ガラス等が挙げられる。結晶化ガラスとしては、例えば、SiO2−CaO−MgO−P2O5系ガラス(アパタイトウォラストナイト結晶化ガラスとも称する。)、及び、CaO−Al2O3−P2O5系ガラス等が挙げられる。これらのリン酸カルシウム系材料、バイオガラス及び結晶化ガラスは、例えば、「化学便覧 応用化学編 第6版」(日本化学会、平成15年1月30日発行、丸善株式会社)、「バイオセラミックスの開発と臨床」(青木秀希ら編著、1987年4月10日発行、クインテッセンス出版株式会社)等に詳述されている。
【0040】
生体活性物質210a、210bとしては、これらの中でも生体活性に優れる点でリン酸カルシウム系材料が好ましく、さらに、実際の骨と組成や構造、性質が似ているので体内環境における安定性が優れており、体内で顕著な溶解性を示さないことから水酸アパタイトが特に好ましい。
【0041】
また、生体活性物質210a、210bは、低結晶性であることが好ましい。ここでいう低結晶性とは、結晶の発達程度が低い状態を意味し、水酸アパタイトを例にすると、粉末X線回折測定において2θ=25.878°、面間隔(d値)=3.44Åの回折線における半価幅が0.2°以上のものを示す。薬剤徐放体を人工骨として使用する場合には、生体活性物質を骨の水酸アパタイト(上記条件下における半価幅:0.4°程度)と同程度の結晶性(同条件下における半価幅:0.2〜1.0°)にすると、薬剤徐放体と骨とを速やかに結合させることができる。
【0042】
生体活性物質210a、210bの結晶性は、例えば、生体活性物質をカルシウム及び/又はリンを含有する溶液に浸漬する方法により形成させる場合は、この溶液の組成成分の種類や組成比率及び/又は浸漬温度により調整することができる。
【0043】
次に、本発明における「薬剤徐放体の製造方法」の一実施例を説明する。
【0044】
工程1として、所望の形状に成型させて成るプラスチック製の基材の表面に多数の微小気孔を有する微小気孔基材を作製する。プラスチック製の基材の表面に微小気孔を形成させる方法としては、公知の方法を採用することができ、例えば、プラスチック製の基材を、濃硫酸、濃硝酸、又はクロム酸等の腐食性溶液に所定時間浸漬し、次いで、この基材をプラスチックが溶出しない洗浄用溶液、例えば純水に浸漬させる方法を挙げることができる。プラスチックとして、例えばポリエーテルエーテルケトン(PEEK)を採用した場合には、濃硫酸にPEEKを所定時間浸漬させ、次いで、純水に浸漬させることにより微小気孔を形成させることができる。
【0045】
プラスチック製の基材の表面に形成される微小気孔の気孔径は、工程2において使用される発泡剤をプラスチック製の基材内に浸入させることのできる気孔径を有していれば良く、発泡剤の種類により適宜選択することができる。発泡剤として、例えば炭酸ナトリウムを採用した場合には、微小気孔の気孔径は、0.1〜200μmであるのが好ましい。プラスチック製の基材の表面に形成されている微小気孔の気孔率は、工程2において使用される発泡剤を十分に保持することができれば良く、例えば、発泡剤として炭酸ナトリウムを採用した場合には、プラスチック製の基材の微小気孔が形成されている層の気孔率は、10〜90%であるのが好ましい。前記気孔率の範囲の内、気孔率が低い範囲にある場合には、例えばプラスチック製の基材の表面から内部方向に気孔が連通して形成されているか又はプラスチック製の基材の表面から内部方向に垂直に柱状の孔が形成されているなど、発泡剤がプラスチック製の基材の表面から所望の深さまで保持されるように孔が形成されているのが好ましい。多数の微小気孔が形成されている層の厚さは、最終生成物である表面発泡体における表面層と同等の厚さがあれば良く、10〜1000μmであるのが好ましい。この多数の微小気孔を有する層の厚さ、気孔径及び気孔率は、PEEKの腐食性溶液として例えば濃硫酸を採用する場合には、PEEKを濃硫酸に浸漬する時間及び/又は温度などにより層の厚さを調整することができる。また、濃硫酸に浸漬した後に続いて浸漬する洗浄用溶液の種類及び/又は温度などによって気孔径や気孔率を調整することができる。
【0046】
次いで、工程2として、工程1で得られた微小気孔基材を、発泡剤を含有する溶液に所定時間浸漬させて、多数の微小気孔を有する微小気孔基材の表面に発泡剤が保持されて成る発泡剤保持基材を作製する。発泡剤としては、プラスチック製の基材の表面に所望の多孔質構造を形成させることのできる物質であれば良く、そのような発泡剤として、炭酸塩、アルミニウム粉末などの無機系発泡剤や、アゾ化合物、イソシアネート化合物などの有機系発泡剤を挙げることができる。特に発泡剤は生体に悪影響を与えない物質であるのが好ましく、そのような発泡剤としては炭酸塩が好ましく、例えば、炭酸水素ナトリウム、炭酸ナトリウム、炭酸カリウムを挙げることができる。
【0047】
次いで、工程3として、工程2で得られた発泡剤保持基材を、プラスチックを膨潤させ、かつ、発泡剤を発泡させる発泡溶液に所定時間浸漬させて、プラスチックの膨潤と発泡剤の発泡とを同時に進行させることにより形成されて成る発泡基材を作製する。前記発泡溶液としては、例えば、濃硫酸、塩酸及び硝酸などの酸性溶液を挙げることができる。発泡剤保持基材を形成する材料がPEEKであり、発泡剤が炭酸塩である場合には、前記発泡溶液としては、濃度が90%以上の濃硫酸が好ましい。
【0048】
次いで、工程4として、工程3で得られた発泡基材を、膨潤したプラスチックを凝固させる凝固溶液に浸漬することにより表面発泡体を作製する。前記凝固溶液、すなわちプラスチックが溶出しない溶液としては、例えば、水、アセトン、エタノールなどの水性溶液を挙げることができる。発泡基材を形成する材料がPEEKである場合には、上記に挙げた凝固溶液の他に、濃度が90%未満の硫酸、硝酸、リン酸、塩酸等の無機酸水溶液、水溶性有機溶剤を挙げることができる。水溶性有機溶剤としては、例えばN−メチル−2−ピロリドン、ジメチルホルムアミド、ジメチルアセトアミド、ジメチルスルホキサイド、テトラヒドロフラン、エチレングリコ−ル、ジエチレングリコ−ル、トリエトレングリコ−ル、プロピレングリコ−ル、ジプロピレングリコ−ル、グリセリンエタノ−ル、プロパノ−ル、ブタノ−ル、ペンタノ−ル、ヘキサノ−ル等のアルコ−ル及びこれらの水溶液、ポリエチレングリコ−ル、ポリプロピレングリコ−ル、ポリビニルピロリドン等液状高分子またはそれらの水溶液及びこれらの混合物を挙げることができる。
【0049】
工程3で得られた発泡基材は、凝固溶液として使用できる複数種類の溶液から選択される少なくとも1つの溶液に浸漬すれば良く、複数種類の溶液に順次浸漬しても良い。また、少なくとも2つの種類の溶液を混合して使用しても良い。
【0050】
工程4の後には、表面発泡体に残存している発泡剤及び凝固溶液等を純水で洗浄するのが好ましい。
【0051】
プラスチック製の基材の表面に形成される多孔質構造、すなわち表面発泡体の表面層の多孔質構造を規定する大径開気孔径、小径開気孔径、連通孔径、気孔率などは、発泡剤の種類及び濃度、発泡溶液の種類及び濃度、発泡溶液への浸漬時間、凝固溶液の種類及び濃度、凝固溶液への浸漬時間、各工程における温度などを適宜選択することにより調整することができる。
【0052】
これらの中でも特に、凝固溶液の種類と、凝固溶液の濃度と、凝固溶液への浸漬時間とから選択される少なくとも1つを変化させることにより、表面発泡体の表面層が所望の多孔質構造を有する表面発泡体を、容易に得ることができる。これらのパラメータを変化させることにより、発泡基材の表面における膨潤したプラスチックの凝固速度を制御することができる。凝固溶液の種類及び濃度としては、水と、膨潤したプラスチックを凝固させるのに水よりも長時間を要する低凝固溶液の少なくとも1つを適宜選択するのが好ましい。発泡基材を形成する材料がPEEKである場合には、低凝固溶液として、濃度が90%未満の硫酸を挙げることができる。
【0053】
例えば、PEEKにより形成される発泡基材を、低凝固溶液として濃度が86%の硫酸に浸漬すると、水に浸漬する場合に比べて緩やかにPEEKが凝固する。すなわち、凝固速度が遅くなる。そのため、発泡基材を低凝固溶液に浸漬する時間の経過に従って、発泡基材の表面の多孔質構造は変化する。
【0054】
以下に、発泡基材の低凝固溶液への浸漬時間の違いによる、発泡基材の表面の構造の変化を、上述の表面発泡体1において定義した、大径気孔4と大径気孔4が連通して形成される大径連通孔16と小径気孔3とに分けて説明する。
【0055】
大径気孔4が表面に開口する大径開気孔14と大径連通孔16との孔径は、浸漬時間の経過に従って次第に大きくなる。所定時間以上経過すると、これらの孔径は逆に小さくなる。また、大径開気孔14と大径連通孔16との数は、浸漬時間の経過に従って次第に少なくなる。浸漬時間の経過に従って、孔径が大きくなるのは、発泡剤により形成された複数の孔が、膨潤したPEEKが緩やかに凝固する間に連結して大きくなるものと理解される。一方、所定時間以上経過すると孔径が小さくなってしまうのは、膨潤したPEEKが緩やかに凝固する間に、発泡剤の効力が弱まってしまい、連結して大きくなった孔も含めて、全ての孔が小径化してしまうと考えられる。また、浸漬時間の経過に従って、大径開気孔14と大径連通孔16の数が少なくなるのは、膨潤したPEEKが緩やかに凝固する間に、複数の大径開気孔14及び大径連通孔16が連結して統合されてしまうためであると理解される。
【0056】
小径気孔3が表面に開口する小径開気孔13の孔径及び気孔率は、浸漬時間の経過に従って次第に小さくなる。大径気孔が発泡剤の作用により形成されるのに対し、小径気孔3は膨潤したPEEKの相分離現象に基づき形成されていると考えられる。膨潤したPEEKは、緩やかに凝固が進行する低凝固溶液との間では相分離が生じにくく、低凝固溶液の浸漬時間が長いほど、膨潤したPEEKと低凝固溶液とが均質化しながら凝固が進行するため、小径開気孔13の数や孔径が小さくなると共に、気孔率も低下すると考えられる。
【0057】
以上に説明したように、発泡基材の低凝固溶液への浸漬時間の違いにより、表面発泡体1の表面層5の多孔質構造が異なる表面発泡体1を得ることができる。特に、大径開気孔14及び大径連通孔16の孔径が最大となる時間に、水などに浸漬することにより速やかに凝固を完了させれば、表面層5の内部まで連通性が良好な表面発泡体1を提供することができる。
【0058】
上記においては、低凝固溶液として濃度が86%の硫酸を例として説明したが、さらに低濃度の硫酸を低凝固溶液として使用した場合には、発泡基材の表面の構造の時間経過による変化の有様は、相違する。例えば、さらに低濃度の硫酸を使用すると、濃度が86%の硫酸を使用する場合よりも短時間で膨潤したPEEKが凝固するので、発泡剤の効力が弱まる前に、大径気孔4が凝固することがある。その場合には、発泡基材を低凝固溶液に長時間浸漬しておいても、大径開気孔14及び大径連通孔16の孔径が小さくなったり、数が少なくなったりすることがない。
【0059】
低凝固溶液の種類及び濃度により、上述したように、浸漬時間の経過に伴う、発泡基材の表面の構造の変化の仕方は相違する。従って、所望の低凝固溶液を選択し、所定時間発泡基材を浸漬して、発泡基材の表面の構造が所望の多孔質構造を有する時間になったら、水に浸漬すれば、速やかに膨潤したプラスチックを凝固させることができるので、表面層5が所望の多孔質構造を有する表面発泡体を得ることができる。なお、膨潤したプラスチックを凝固させるために、発泡基材を水に浸漬させることの他に、膨潤したプラスチックが凝固するのに十分な時間だけ低凝固溶液に浸漬させておいても良い。
【0060】
次に、工程5(a)として、工程4で得られた表面発泡体を所定時間薬剤を含む溶液に浸漬して、表面発泡体の表面層に薬剤を担持している薬剤徐放体を作製する。薬剤は、要求される機能により適宜選択することができ、例えば、前述した薬剤の中から少なくとも1つの薬剤を選択することができる。薬剤が、液体薬剤の場合には、そのままあるいは希釈した希釈液が用いられ、固体薬剤の場合には、適宜の溶剤に溶解又は懸濁させた薬液が用いられる。希釈液及び薬液の濃度は、使用する薬剤の有効濃度以上であって、生体に害を及ぼさない範囲で適宜調整される。表面発泡体を薬剤を含む溶液に浸漬する時間は、表面発泡体の表面層に薬剤が担持される限り特に限定されず、10分以上浸漬するのが好ましい。
【0061】
工程5(a)においては、表面発泡体を薬剤を含む溶液に浸漬しながら脱泡処理をするのが好ましい。脱泡処理をすることにより、表面発泡体の気孔内まで薬剤を浸入させることができる。また、表面発泡体を薬剤を含む溶液に浸漬させる時間も短縮することができる。
【0062】
表面発泡体を薬剤を含む溶液から取り出した後には、常温にて十分に乾燥させるのが好ましい。
【0063】
次に、本発明における「薬剤徐放体の製造方法」の他の一実施例を説明する。この薬剤徐放体の製造方法は、薬剤徐放体がその表面層の表面及び/又は開気孔の内壁面に生体活性物質と薬剤とを含む、薬剤粒子及び/又は薬剤層を有する場合の例である。
【0064】
まず、上述した工程1〜4により、表面発泡体を作製する。
次いで、工程5(I)として、工程4で得られた表面発泡体を、少なくとも10mMのカルシウムイオンを含むカルシウム溶液及び少なくとも10mMのリン酸イオンを含むリン酸溶液の両方に浸漬する。カルシウム溶液及びリン酸溶液の少なくとも一方には薬剤が含まれている。また、表面発泡体は、カルシウム溶液及びリン酸溶液のいずれから先に浸漬されてもよい。以下においては、表面発泡体をカルシウム溶液に先に浸漬させた場合について説明する。
【0065】
まず、表面発泡体を、少なくとも10mMのカルシウムイオンを含むカルシウム溶液に所定時間浸漬する。このカルシウム溶液は、少なくともカルシウムイオンを含んでいれば良く、ナトリウムイオン、カリウムイオン、マグネシウムイオン、炭酸イオン、ケイ酸イオン、硫酸イオン、硝酸イオン、塩素イオン、水素イオンなどを含んでいても良いが、リン酸イオンは実質的に含まないほうが好ましい。カルシウム溶液としては、通常、水溶性が高く、人体に悪影響を与えない化合物の水溶液を挙げることができ、例えば、塩化カルシウム、水酸化カルシウム、硝酸カルシウム、蟻酸カルシウム、酢酸カルシウム、プロピオン酸カルシウム、酪酸カルシウム、乳酸カルシウム、およびこれらの混合溶液等が挙げられ、塩化カルシウムの水溶液が好ましい。
【0066】
カルシウム溶液に所定時間浸漬した後に、表面発泡体を、少なくとも10mMのリン酸イオンを含むリン酸溶液に浸漬する。このリン酸溶液は、少なくともリン酸イオンを含んでいればよく、ナトリウムイオン、カリウムイオン、マグネシウムイオン、炭酸イオン、ケイ酸イオン、硫酸イオン、硝酸イオン、塩素イオン、水素イオンなどを含んでいても良いが、カルシウムイオンは実質的に含まないほうが好ましい。リン酸溶液としては、通常、水溶性が高く、人体に悪影響を与えない化合物の水溶液を挙げることができ、例えば、リン酸、リン酸水素二ナトリウム、リン酸二水素ナトリウム、リン酸水素二カリウム、リン酸二水素カリウム、およびこれらの混合溶液等が挙げられ、リン酸水素二カリウムの水溶液が好ましい。
【0067】
薬剤は、カルシウム溶液及びリン酸溶液の少なくとも一方に含まれる。薬剤は、要求される機能により適宜選択することができ、例えば、前述した薬剤の中から少なくとも1つの薬剤を選択することができる。薬剤の濃度は、使用する薬剤の有効濃度以上であって、生体に害を及ぼさない範囲で適宜調整される。
【0068】
表面発泡体を、上記2種類の水溶液に浸漬する順序は、特に限定されないが、例えば生体活性物質として水酸アパタイトを表面層の内部、すなわち多孔質構造内に生成させる場合は、水酸アパタイトの溶解度がより低いアルカリ域で生成反応が進むことが生成量の面から好ましく、そのため、後半に浸漬する溶液のpHがpH8〜10のアルカリ域であることが好ましい。
【0069】
カルシウム溶液及びリン酸溶液に、表面発泡体を浸漬する時間は、1分以上浸漬するのが好ましく、3分以上浸漬するのが特に好ましい。前記範囲内であれば、十分にカルシウムイオン、リン酸イオン及び薬剤が表面発泡体の内部まで染み込み、表面発泡体の表面層における開気孔及び連通気孔の内壁面に生体活性物質と薬剤とを共沈させることができる。また、生体活性物質の生成量を増やしたい場合には、各溶液に浸漬する操作を複数回繰り返しても良い。
【0070】
工程5(I)においては、表面発泡体をカルシウム溶液及びリン酸溶液のそれぞれに浸漬しながら脱泡処理をするのが好ましい。脱泡処理をすることにより、表面発泡体の気孔内までカルシウムイオン、リン酸イオン及び薬剤を十分に浸入させることができる。また、表面発泡体をカルシウム溶液及びリン酸溶液に浸漬させる時間も短縮することができる。
【0071】
表面発泡体をカルシウム溶液及びリン酸溶液から取り出した後には、常温にて十分に乾燥させるのが好ましい。
【0072】
次に、本発明における「薬剤徐放体の製造方法」のまた別の一実施例を説明する。この薬剤徐放体の製造方法は、薬剤徐放体がその表面層の表面及び/又は開気孔の内壁面に生体活性物質と薬剤とを含む、薬剤粒子及び/又は薬剤層を有する場合の他の例である。
【0073】
まず、上述した工程1〜4により、表面発泡体を作製する。
次いで、工程5(i)として、工程4で得られた表面発泡体を、少なくとも10mMのカルシウムイオンを含むカルシウム溶液及び少なくとも10mMのリン酸イオンを含むリン酸溶液の両方に浸漬する。このカルシウム溶液及びリン酸溶液には薬剤が含まれていない。すなわち、カルシウム溶液及びリン酸溶液に薬剤が含まれていないこと以外は、工程5(I)と同様の手順により、表面層の表面及び/又は開気孔の内壁面に生体活性物質を有する生体活性物質保持体を作製する。
【0074】
次いで、工程5(ii)として、工程5(i)で得られた生体活性物質保持体を薬剤を含有する擬似体液に浸漬する。擬似体液とは、人の血漿とほぼ等しい無機イオン濃度を有し、アパタイトに対して過飽和な溶液であり、詳細は、大槻ら「Mechanizm of apatite formation on CaO−SiO2−P2O5 glasses in a simulated body fluid」、ジャーナル オブ ノン−クリスタリン ソリッド(Jornal of Non−Crystaline Solides)、第143巻、84〜92頁、1992年の論文に記載されている。
【0075】
薬剤は、要求される機能により適宜選択することができ、例えば、前述した薬剤の中から少なくとも1つの薬剤を選択することができる。薬剤の濃度は、使用する薬剤の有効濃度以上であって、生体に害を及ぼさない範囲で適宜調整される。
【0076】
生体活性物質保持体を薬剤を含有する擬似体液に浸漬する時間は、1時間以上浸漬するのが好ましく、3時間以上浸漬するのが特に好ましい。前記範囲で生体活性物質保持体を薬剤を含有する擬似体液に浸漬すると、表面発泡体の表面層及び生体活性物質に薬剤を十分に担持させることができる。また、擬似体液は、生体と同程度の温度、すなわち37℃前後の温度に維持しておくのが好ましい。
【0077】
工程5(ii)においては、生体活性物質保持体を薬剤を含有する擬似体液に浸漬する際に脱泡処理をするのが好ましい。脱泡処理をすることにより、生体活性物質保持体の気孔内まで薬剤を含有する擬似体液を十分に浸入させることができる。
【0078】
生体活性物質及び薬剤を表面発泡体の表面層に担持させる方法は、上記の方法に限られず種々の方法を採用することができる。例えば表面発泡体を、あらかじめ薬剤と多量の生体活性物質とを含む溶液に浸漬し、これを乾燥させることにより、表面発泡体における多孔質構造を有する表面層内部に生体活性物質と薬剤とを固定させた薬剤徐放体を得ることもできる。
【0079】
本発明に係る薬剤徐放体は、各種用途を有し、例えば、生体組織と結合することが必要とされる医療用材料に好適に利用することができ、特に人工骨、人工歯根及び経皮デバイス等に利用することができる。人工骨としては、例えば、骨補填材、人工関節、骨接合材、人工椎体、椎体間スペーサ、椎体ケージとして適用することができる。経皮デバイスは、体外から体内に皮膚を貫通し、栄養補給、薬液注入及び血液循環等を担う医療用具であり、あらゆる人工臓器に付随している。前記薬剤徐放体は、その使用方法及び生体内の使用部位に合わせて様々な形状、例えば、粒子状、繊維状、ブロック状、フィルム状等で用いられる。
【0080】
前記薬剤徐放体は、PEEKなどのプラスチックを所望の形状に成形、整形及び/又は調製した後に、プラスチック製の基材の表面部に多孔質構造を有する表面層を形成させることもできるし、プラスチック製の基材の表面に多孔質構造を有する表面層を形成させた後に、表面発泡体を所望の形状に成形、整形及び/又は調製することもできる。前述した製造方法によるとほとんどの工程が液相中で処理することができるので、PEEKなどのプラスチックを、複雑な形状に成形、整形及び/又は調製した後に、プラスチック製の基材の表面部に多孔質構造を有する表面層を形成させることを、容易にすることができる。
【0081】
前記表面層は、プラスチック製の基材の全表面部に形成させても良いし、骨、歯又は皮膚等の生体組織との結合又は密着が必要な面のみに形成させても良い。また、表面層における少なくとも開気孔の内壁面及び/又は前記表面層の表面に生体活性物質と薬剤とを含む、薬剤粒子及び/又は薬剤層を有していると、より一層生体組織との結合性又は密着性が向上するので好ましい。
【実施例】
【0082】
次に、この発明を実施例を挙げて説明するが、この発明は、以下の実施例に限定されない。
【0083】
(実施例1)
この実施例は、薬剤徐放体を形成する物質としてPEEKを使用した場合の実施例である。薬剤徐放体を以下の手順にしたがって作製した。
【0084】
まず、工程1として、PEEKで形成される円盤体(直径10mm、厚さ2mm、Victrex社製450G)の表面をサンドペーパー(#1000)で研磨し、濃硫酸(濃度:97%)に5分間浸漬した。濃硫酸から引き上げた円盤体を純水に5分間浸漬し、その後純水のpHが中性になるまで繰り返し洗浄し、表面に微小気孔を有する微小気孔基材を得た。この微小気孔基材の表面を走査型電子顕微鏡にて観察したところ、多数の気孔を有し、これらの気孔の気孔径は1〜2μmであり、内部は網目構造となっていた。
【0085】
次いで、工程2として、この微小気孔基材を炭酸カリウム水溶液(濃度:3M)に60分間浸漬することにより、微小気孔基材の表面に炭酸カリウムを保持させて発泡剤保持基材を得た。
【0086】
次いで、工程3として、この発泡剤保持基材を発泡溶液である濃硫酸(濃度:97%)に1分間浸漬することにより、発泡剤保持基材におけるPEEKの表面を膨潤させるのと同時に発泡剤保持基材における炭酸カリウムを発泡させて発泡基材を得た。
【0087】
次いで、工程4として、この発泡基材を濃硫酸から引き上げて純水に10分間浸漬することによりPEEKの表面を凝固させ、純水のpHが中性になるまで繰り返し洗浄した後に、120℃で3時間乾燥させて表面発泡体を得た。
【0088】
作製した表面発泡体の表面を走査型電子顕微鏡で観察した結果を図3に示す(拡大率300倍)。表面発泡体の表面には開気孔径が1〜4μmの小径気孔により形成された小径開気孔と開気孔径が100〜200μmの大径気孔により形成された大径開気孔とが多数確認された。また、大径気孔により形成された大径開気孔の内壁面には小径気孔及び大径気孔と連通することにより形成される小径連通孔と大径連通孔とが多数確認された。
【0089】
拡大率3000倍及び300倍で撮影した各写真を利用して、上述したように大径開気孔及び小径開気孔の各長径及び短径を測定し、これらの測定値の算術平均を算出したところ、小径開気孔の平均開気孔径は2.4μm、大径開気孔の平均開気孔径は106μmであった。
【0090】
表面発泡体の表面を走査型電子顕微鏡により撮影した写真を画像解析ソフト(Scion社製 Scion Image)を使用して、大径開気孔とそれ以外の部分とに2値化することにより、上述したように写真全体の面積に対する小径開気孔と大径開気孔との面積割合を算出したところ、それぞれ、16%と64%であった。
【0091】
作製した表面発泡体の表面に直交する断面を走査型電子顕微鏡で観察したところ、表面発泡体の表面には多数の気孔を有する厚さ約70μmの層が確認された。
【0092】
作製した表面発泡体における多数の気孔が形成されて成る表面層について、表面発泡体の表面に直交する断面を走査型電子顕微鏡により拡大率300倍と拡大率3000倍とで撮影した写真を、画像解析ソフト(Scion社製 Scion Image)を使用して、小径気孔と大径気孔との面積をそれぞれ算出した。上述したように、写真全体の面積に対する小径気孔及び大径気孔の面積割合から、小径気孔の気孔率及び大径気孔の気孔率を算出したところ、それぞれ、12%と58%とであった。
【0093】
作製した表面発泡体における多数の気孔が形成されて成る表面層について、水銀ポロシメータにより連通孔の孔径を測定したところ、孔径1〜100μmの間において未処理のPEEKよりも水銀の圧入が多く認められた。従って、この範囲の間に広い孔径分布で連通孔が形成されていることが分かった。これは走査型電子顕微鏡での表面層の観察結果と一致した。
【0094】
次いで、工程5(a)として、得られた表面発泡体をバンコマイシンの5質量%水溶液に浸漬しながら、真空デシケータ内にて10分間脱泡処理をした。なお、バイコマイシンは抗生物質である。この後、バンコマイシン水溶液から取り出し、自然乾燥させて、表面発泡体の表面層にバンコマイシンを担持して成る薬剤徐放体を得た。
【0095】
(実施例2)
この実施例は、薬剤徐放体を形成する物質としてPEEKを使用し、薬剤徐放体の表面層に水酸アパタイトと薬剤とを含む、薬剤粒子及び/又は薬剤層を担持させた薬剤徐放体を示す実施例である。薬剤徐放体を以下の手順にしたがって作製した。
【0096】
まず、実施例1と同様にして工程1〜4により表面発泡体を得た。
次いで、工程5(I)として、得られた表面発泡体を、バンコマイシンを5質量%と塩化カルシウムとを含むカルシウム水溶液(カルシウムイオン濃度:100mM)に浸漬しながら、真空デシケータ内にて10分間脱泡処理をした。引き続きバンコマイシンを5質量%とリン酸水素二カリウムとを含むリン酸水溶液(リン酸イオン濃度:100mM)に浸漬しながら、真空デシケータ内にて10分間脱泡処理をした。この操作を3回繰り返した後に、リン酸水溶液から取り出し、自然乾燥させて、表面発泡体の表面層内に水酸アパタイトとバンコマイシンとを共沈させて成る薬剤徐放体を得た。
【0097】
(実施例3)
この実施例は、薬剤徐放体を形成する物質としてPEEKを使用し、薬剤徐放体の表面層に水酸アパタイトと薬剤とを含む、薬剤粒子及び/又は薬剤層を担持させた薬剤徐放体を示す他の実施例である。薬剤徐放体を以下の手順にしたがって作製した。
【0098】
まず、実施例1と同様にして工程1〜4により表面発泡体を得た。
次いで、工程5(i)として、得られた表面発泡体を、塩化カルシウムを含むカルシウム水溶液(カルシウムイオン濃度:100mM)に浸漬しながら、真空デシケータ内にて10分間脱泡処理をした。引き続きリン酸水素二カリウムを含むリン酸水溶液(リン酸イオン濃度:100mM)に浸漬しながら、真空デシケータ内にて10分間脱泡処理をした。この後、リン酸水溶液から取り出し、120℃で3時間乾燥させて、表面発泡体の表面層内にリン酸カルシウムの微結晶が形成されて成るリン酸カルシウム保持体を得た。
【0099】
次いで、工程5(ii)として、得られたリン酸カルシウム保持体をバンコマイシンを5質量%含む擬似体液に浸漬して、37℃で3日間保持した。その後、擬似体液から取り出し、自然乾燥させて、表面発泡体の表面層内にバンコマイシンを担持して成る水酸アパタイトを有する薬剤徐放体を得た。
【符号の説明】
【0100】
1 表面発泡体
2、202a、202b 実質部
3、203a、203b 小径気孔
4、204a、204b 大径気孔
5、205a、205b 表面層
6、206a、206b 開気孔
7、207a、207b 連通孔
8 独立気孔
9 連通気孔
13、213a、213b 小径開気孔
14、214a、214b 大径開気孔
15 小径連通孔
16、216a、216b 大径連通孔
210a、210b 生体活性物質
211a、211b 内壁面
212a、212b 薬剤徐放体
A 小径気孔の平均開気孔径
B 大径気孔の平均開気孔径
C 小径連通孔径
D 大径連通孔径
【技術分野】
【0001】
本発明は、薬剤徐放体に関し、特に薬剤が担持されて成り、生体に埋設すると薬剤が放出される薬剤徐放体に関する。
【背景技術】
【0002】
医療分野や再生医工学の分野においては、薬剤を局所的に投与する手段として、あるいは失った組織を再生する手段として、多孔質体に薬剤を含浸させて成る薬剤徐放体を患部に埋入することが提案されている。
【0003】
例えば、特許文献1には、多孔質リン酸カルシウム系焼結体ブロックに薬剤を含浸する方法が記載され、特許文献2及び3には、セラミックス多孔体内部の気孔に生体吸収性ポリマーと共に薬剤を担持する人工骨が記載されている。また、特許文献4には、多孔質リン酸カルシウム系化合物顆粒の孔内に薬剤を含浸し、顆粒表面に可溶性の有機化合物から成るコーティング層を有する薬剤徐放顆粒が記載され、特許文献5には、セラミックス多孔体顆粒の内部に薬剤溶液を保持する中空部を有する徐放剤用担体が記載されている。さらに、特許文献6には、薬物を含有するリン酸カルシウムセメントと液剤とからなる薬物徐放性リン酸カルシウムセメントが記載されている。これらはいずれも生体骨と比較すると強度が低いので、例えば人工骨として用いる場合には、荷重のかからない部位でのみ使用するといった、使用部位の制限があると考えられる。
【0004】
特許文献7には、高分子から成る医療用多孔質体において、医療用多孔質体の製造時に薬剤を担持させる医療用多孔質体の製造方法が開示されている。しかし、この医療用多孔質体は構造全体が多孔質であることから、上記した特許文献に記載の薬剤徐放体と同様に、人工骨として用いた場合には、使用部位が制限されてしまうと考えられる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開平10−279471号公報
【特許文献2】特表2007−222611号公報
【特許文献3】特開2004−159971号公報
【特許文献4】特許第2842647号公報
【特許文献5】特許第3152665号公報
【特許文献6】特許第2927007号公報
【特許文献7】特開2005−80927号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の課題は、薬剤が担持されて成り、生体に埋設すると薬剤が放出される薬剤徐放体を提供することであり、特に、大きな荷重のかかる部位の人工骨として使用される場合には、元の骨に近い力学的特性を有する薬剤徐放体を提供することである。
【0007】
本発明の他の課題は、複雑な形状を有する薬剤徐放体を簡易な方法で製造可能な薬剤徐放体の製造方法を提供することである。
【課題を解決するための手段】
【0008】
前記課題を解決するための手段として、
(1)プラスチックにより形成され、
実質部とその表面に形成され、かつ、小径気孔及び大径気孔を有する表面層とを備え、
前記小径気孔及び前記大径気孔の一部は前記表面層の表面に開口する開気孔を形成しており、
前記開気孔は平均開気孔径が5μm以下の小径開気孔と平均開気孔径が10〜200μmの大径開気孔とを有し、
前記大径開気孔の内壁面に前記小径気孔及び前記大径気孔と連通する連通孔が形成されて成る表面発泡体が、その表面層に薬剤を担持していることを特徴とする薬剤徐放体である。
【発明の効果】
【0009】
本発明に係る薬剤徐放体は、プラスチックにより形成され、実質部とその表面に形成され、かつ、小径気孔及び大径気孔を有する表面層とを備え、前記小径気孔及び前記大径気孔の一部は前記表面層の表面に開口する開気孔を形成しており、前記開気孔は平均開気孔径が5μm以下の小径開気孔と平均開気孔径が10〜200μmの大径開気孔とを有し、前記大径開気孔の内壁面に前記小径気孔及び前記大径気孔と連通する連通孔が形成されて成る表面発泡体が、その表面層に薬剤を担持している。したがって、この薬剤徐放体を生体内に埋設した場合には、薬剤が長期間に渡って徐放される。また、この薬剤徐放体が人工骨として使用される場合には、薬剤が長期間に渡って徐放されると共に、骨組織を表面層の内部に侵入させることができる。その結果、例えば抗炎症剤及び骨形成誘導因子といった薬剤を徐放しながら表面層の内部に存在する空間を充填するように新たな骨が形成されるので、生体骨と薬剤徐放体とを強固に結合させることができる。また、本発明に係る薬剤徐放体は、全体積に気孔を有するのではなく、その表面に多数の気孔を有するので、適用部位に合わせた強度を保持することが容易である。
【0010】
また、この薬剤徐放体が、エンジニアリングプラスチック、特にポリエーテルエーテルケトンで形成されると、高い機械的強度を有する薬剤徐放体を提供することができる。したがって、この薬剤徐放体が、骨との結合が必要で、かつ大きな荷重が連続的に長期間かかるような部位に人工骨として適用される場合には、ストレスシールディング、すなわち骨に加わる応力の遮蔽によって起こる可能性のある骨減少及び骨密度の低下などが生じることを防止することができる。
【0011】
さらに、この薬剤徐放体が、薬剤徐放体の表面層の表面及び/又は前記小径開気孔及び大径開気孔の内壁面に、例えば水酸アパタイト等の生体活性物質を有していると、この薬剤徐放体が人工骨として使用される場合には、この生体活性物質と生体の骨組織との化学的な反応が始まり、新たな骨の形成が速やかに行われるので、骨と人工骨とを早期に結合させることができる。この薬剤徐放体が経皮デバイスとして使用される場合には、生体活性物質は多くの生体分子を吸着する性質を有することから、皮膚と薬剤徐放体との密着性を向上させることができる。その結果、皮膚と経皮デバイスとの間に生じた隙間から細菌感染が起こるといったことを防止することができる。また、この生体活性物質が薬剤と生体活性物質とを含む薬剤粒子又は薬剤層であると、より一層薬剤が長期間に渡って徐放される。
【0012】
本発明に係る薬剤徐放体の製造方法は、ほとんどの工程が液相中において処理することのできる方法であるので、特別な装置を使用する必要がなく、また複雑な形状を有する薬剤徐放体であっても容易に製造することができる。
【図面の簡単な説明】
【0013】
【図1】図1は、本発明に係る薬剤徐放体における表面発泡体の一実施例を示す模式図である。
【図2】図2(a)、図2(b)は、生体活性物質を有して成る薬剤徐放体の一実施例を示す模式図である。
【図3】図3は、実施例1における表面発泡体の表面を撮影した走査型電子顕微鏡写真である。
【発明を実施するための形態】
【0014】
図1は、本発明に係る薬剤徐放体を構成する表面発泡体の一実施例を示す模式図である。図1に示すように、この表面発泡体1は、実質部2とその表面に形成され、かつ、小径気孔3及び大径気孔4を有する表面層5とを備え、前記小径気孔3及び前記大径気孔4の一部は前記表面層5の表面に開口する開気孔6を形成しており、前記開気孔6は平均開気孔径Aが5μm以下の小径開気孔13と平均開気孔径Bが10〜200μmの大径開気孔14とを有し、前記大径開気孔14は、その内壁面に前記小径気孔3及び前記大径気孔4と連通する連通孔7が形成されている。本発明に係る薬剤徐放体は、この表面発泡体1の表面層5に薬剤が担持されている。
【0015】
表面層5は、大きさの異なる小径気孔3及び大径気孔4を複数有しており、これらの気孔は、独立して形成されている独立気孔8及び2つ以上の独立気孔8が連通して形成されている連通気孔9を形成している。一部の小径気孔3及び大径気孔4は表面層5の表面に開口する開気孔6を形成しており、この開気孔6は平均開気孔径Aが5μm以下、好ましくは3μm以下の小径開気孔13と平均開気孔径Bが10〜200μm、好ましくは30〜150μmの大径開気孔14とを有している。この大径開気孔14の内壁面には、小径気孔3及び大径気孔4と連通して形成される連通孔7が形成されている。この連通孔7は、一つの開気孔6に対して複数の連通孔7が形成されているのが好ましく、小径気孔3と連通して形成される小径連通孔径Cが5μm以下、好ましくは3μm以下の小径連通孔15と大径気孔4と連通して形成される大径連通孔径Dが10〜200μm、好ましくは30〜150μmの大径連通孔16とにより形成されている。小径気孔3及び大径気孔4は、球状及び/又は扁球状及び/又は長球状及び/又はこれらの形状が組み合わされてなる形状を有する。表面層5がこのような気孔を有するので、この薬剤徐放体が生体内に埋設されると、薬剤が長期間に渡って徐放される。また、この薬剤徐放体が人工骨として使用される場合には、薬剤が長期間に渡って徐放されると共に、骨組織を表面層の内部に侵入させることができる。その結果、抗炎症剤及び骨形成誘導因子といった薬剤を徐放しながら表面層の内部に存在する空間を充填するように新たな骨が形成されるので、生体骨と薬剤徐放体とを強固に結合させることができる。また、大径気孔4により形成されている大径開気孔14の内壁面に連通孔7、特に大径連通孔16が多数形成されている程、骨組織を表面層5の表面から深部まで到達させることができ、表面層5の深部において新たな骨を形成させることができるので、骨と生体インプラントとをより強固に結合させることができる。
【0016】
表面層5の表面に開口する小径開気孔13の平均開気孔径と大径開気孔14の平均開気孔径は、表面層5の表面を走査型電子顕微鏡で観察し、表面層5の表面を示す画像を利用して求めることができる。
【0017】
まず、表面層5の表面を走査型電子顕微鏡により、所定の倍率、例えば300倍に設定したSEM画像を得る。次いで、前記SEM画像の全視野における比較的大型の最表面部の開気孔、例えば平均径が約10μm以上の開気孔の長径と短径とを測定する。次いで、これらの測定値の算術平均を算出することにより、大径開気孔14の平均開気孔径を求めることができる。
【0018】
小径開気孔13は、通常、大径開気孔14と大径開気孔14との間の骨格部分に存在する。小径開気孔13の平均開気孔径を測定する場合には、測定誤差を小さくするために、さらに走査型電子顕微鏡の倍率を上げるのが好ましい。例えば、走査型電子顕微鏡を3000倍に設定したSEM画像を得る。次いで、骨格部分に形成されている開気孔の長径と短径とを測定する。すなわち、先に測定した大径開気孔14を除くすべての開気孔の長径と短径とを測定する。次いで、これらの測定値の算術平均を算出することにより、小径開気孔13の平均開気孔径を求めることができる。
【0019】
SEM画像上の大径開気孔14又は小径開気孔13の数が多い場合、例えば50個以上の場合、SEM画像上を横断するようにランダムに5本の直線を引き、この直線上にある大径開気孔14又は小径開気孔13を上述の基準で選択し、長径と短径とを測定する。次いで、これらの測定値の算術平均を算出することにより、大径開気孔14と小径開気孔13との平均開気孔径を求めることができる。
【0020】
表面層5の表面に開口する開気孔6に小径気孔3及び大径気孔4が連通して形成されている連通孔7の孔径は、上記と同様に、所定の倍率で撮影したSEM画像から求めることができ、その他の方法として、水銀ポロシメータを使用して求めることもできる。
【0021】
表面層5の最表面を投影した場合の小径開気孔13及び大径開気孔14それぞれの面積割合は、特に限定されず、薬剤の徐放量及び徐放期間等を考慮して適宜調整することができる。本発明に係る薬剤徐放体が、例えば人工骨として使用される場合には、小径開気孔13と大径開気孔14との面積を合算した面積割合が99%以下になる範囲で、小径開気孔13の面積割合は、5〜90%であるのが好ましく、15〜80%であるのが特に好ましく、大径開気孔14の面積割合は、10〜95%であるのが好ましく、20〜85%であるのが特に好ましい。小径開気孔13の面積割合が、前記範囲内にあると、薬剤を十分に担持させることができると共に、薬剤徐放体を生体内に埋設した後に、長期間に渡って薬剤を放出させることができる。特に、小径開気孔13が多数形成されていると、薬剤徐放体の表面が平らに形成されている場合に比べて、表面層5に担持されている薬剤が少しずつ放出されされる。その理由としては、開気孔の気孔径が小さいほど体液が気孔内に浸入し難くなるので、気孔内に担持されている薬剤が体液に接触し難くなることから、薬剤が放出され難くなるためであると推定される。したがって、小径開気孔13の平均開気孔径Aが小さく、小径開気孔13の面積割合が大きいほど、より一層長期間に渡って薬剤が放出される。また、大径開気孔14の面積割合が、前記範囲内にあると、骨組織を表面層5の内部に浸入させることができるので、表面層5の内部に新たな骨が形成され、その結果、骨と結合させることのできる薬剤徐放体を提供することができる。
【0022】
表面層5の最表面を投影した場合の小径開気孔13及び大径開気孔14の面積割合は、表面層5の表面を走査型電子顕微鏡により撮影した写真を画像解析ソフト(例えば、Scion社製 Scion Image)を使用して、小径開気孔13及び大径開気孔14の面積をそれぞれ算出することにより求めることができる。なお、上述した平均開気孔径を算出する場合と同様にして、走査型電子顕微鏡画像は、小径開気孔13及び大径開気孔14の面積を測定するのに適度な倍率で表示する。画像全体の面積Sに対する大径開気孔の面積から大径開気孔の面積割合が、画像全体の面積Sに対する小径開気孔の面積から小径開気孔の面積割合が算出される。
【0023】
表面層5における小径気孔3及び大径気孔4の気孔率は、特に限定されず、薬剤の徐放量及び徐放期間等を考慮して適宜調整することができる。本発明に係る薬剤徐放体が、例えば人工骨として使用される場合には、小径気孔3と大径気孔4とを合算した気孔率が99%以下になる範囲で、小径気孔3の気孔率は5〜50%であるのが好ましく、10〜40%であるのが特に好ましく、大径気孔4の気孔率は20〜90%であるのが好ましく、30〜80%であるのが特に好ましい。小径気孔3の気孔率が、前記範囲内にあると、骨形成に関与するタンパク質や細胞等が付着する足場を多く確保できるため、新たな骨が表面層の内部に形成されやすく、薬剤徐放体と骨とを強固に結合することができる。大径気孔4の気孔率が、前記範囲にあると、骨組織が表面層5の内部に侵入した後保持されやすくなると共に、新たな骨が形成される空間が十分に確保され、この空間を埋めるように新たな骨が形成されるので、より一層強固に骨と生体インプラントとを結合させることができる。また、小径気孔3と大径気孔4との気孔率が前記範囲内にあると、表面層5に担持された薬剤を適度な徐放速度で、すなわち所望の量の薬剤を所望の期間に渡って放出することができる。
【0024】
前記表面層5の小径気孔3の気孔率及び大径気孔4の気孔率は、表面層5の表面に直交する断面を走査型電子顕微鏡により撮影した画像を画像解析ソフト(例えば、Scion社製Scion Image)を使用して、大径気孔4及び小径気孔3の面積をそれぞれ算出することにより求めることができる。すなわち、上述した小径開気孔及び大径開気孔の面積割合を算出するのと同様にして、小径気孔3及び大径気孔4それぞれの面積割合を求めることにより、それぞれの気孔率を推定できる。
【0025】
表面層5の厚さは、本発明に係る薬剤徐放体を適用する部位及び薬剤の徐放量及び徐放期間等を考慮して適宜調整することができる。本発明に係る薬剤徐放体が、例えば人工骨として使用される場合には、10〜1000μmであるのが好ましく、20〜200μmであるのが特に好ましい。前記範囲内であると、表面層5に適度な量の薬剤を担持させることができるので、所望の量の薬剤を所望の期間に渡って放出させることができる。また、この薬剤徐放体を体内に埋設した後に、表面層5の表面に開口している多数の開気孔6及びこの開気孔6と表面層5の内部に形成されている小径気孔3及び大径気孔4とが連通することにより形成される連通孔7を通じて、骨組織を表面層5の内部に侵入させることができる。その結果、表面層5の内部に新たな骨が形成されるので、生体骨と結合させることのできる薬剤徐放体を提供することができる。
【0026】
本発明に係る薬剤徐放体は、一般に使用されているプラスチックにより形成されて成り、この薬剤徐放体が使用される部位により適宜のプラスチックを選択することができる。る。本発明に係る薬剤徐放体が人工骨又は人工歯根として使用される場合には、薬剤徐放体を形成する物質は、力学的特性が骨に近いプラスチック、すなわち、弾性率が1〜50GPa、曲げ強度は100MPa以上であることが好ましい。
【0027】
力学的特性が骨又は歯に近いプラスチックとしては、エンジニアリングプラスチック又は繊維強化プラスチック等が挙げられる。エンジニアリングプラスチックとしては、例えば、ポリアミド、ポリアセタール、ポリカーボネート、ポリフェニレンエーテル、ポリエステル、ポリフェニリンオキサイド、ポリブチレンテレフタラート、ポリエチレンテレフタレート、ポリスルホン、ポリエーテルスルホン、ポリフェニレンスルフィド、ポリアリレート、ポリエーテルイミド、ポリエーテルエーテルケトン、ポリアミドイミド、ポリイミド、フッ素樹脂、エチレンビニルアルコール共重合体、ポリメチルペンテン、フェノール樹脂、エポキシ樹脂、シリコーン樹脂、ジアリルフタレート樹脂、ポリオキシメチレン、ポリ四フッ化エチレン等が挙げられる。
【0028】
繊維強化プラスチックのマトリックスとなるプラスチックとしては、前記エンジニアリングプラスチックに加えて、例えば、ポリエチレン、ポリ塩化ビニル、ポリプロピレン、EVA樹脂、EEA樹脂、4−メチルペンテン−1樹脂、ABS樹脂、AS樹脂、ACS樹脂、メタクリル酸メチル樹脂、エチレン塩化ビニル共重合体、プロピレン塩化ビニル共重合体、塩化ビニリデン樹脂、ポリビニルアルコール、ポリビニルホルマール、ポリビニルアセトアセタール、ポリフッ化エチレンプロピレン、ポリ三フッ化塩化エチレン、メタクリル樹脂、リノル樹脂、ポリアリルエーテルケトン、ポリエーテルスルホン、ポリケトンスルフィド、ポリスチレン、ポリアミノビスマレイミド、ユリア樹脂、メラミン樹脂、キシレン樹脂、イソフタル酸系樹脂、アニリン樹脂、フラン樹脂、ポリウレタン、アルキルベンゼン樹脂、グアナミン樹脂、ポリジフェニルエーテル樹脂等が挙げられる。
【0029】
本発明に係る薬剤徐放体が人工骨又は人工歯根として使用される場合には、薬剤徐放体を形成する物質としては、これらの中でもポリエーテルエーテルケトン(PEEK)が特に好ましい。PEEKにより形成されて成る薬剤徐放体を大きな荷重が連続的に長期間かかるような部位に埋設した場合に、PEEKは、生体適合性を有し力学的特性が骨と近いので、ストレスシールディング、すなわち骨に加わる応力の遮蔽によって起こる可能性のある骨減少及び骨密度の低下などが生じることを防止することができる。
【0030】
前記繊維強化プラスチックにおける繊維としては、炭素繊維、ガラス繊維、セラミック繊維、金属繊維又は有機繊維が挙げられる。
炭素繊維については、ここではカーボンナノチューブも含まれる。
ガラス繊維としては、ホウケイ酸ガラス(Eガラス)、高強度ガラス(Sガラス)、高弾性ガラス(YM−31Aガラス)等の繊維、
セラミック繊維としては、炭化ケイ素、窒化ケイ素、アルミナ、チタン酸カリウム、炭化ホウ素、酸化マグネシウム、酸化亜鉛、ホウ酸アルミニウム、ホウ素等の繊維、
金属繊維としては、タングステン、モリブデン、ステンレス、スチール、タンタル等の繊維、
有機繊維としては、ポリビニルアルコール、ポリアミド、ポリエチレンテレフタレート、ポリエステル、アラミド等の繊維、又はこれらの混合物を用いることができる。
【0031】
また薬剤徐放体を形成する物質中に、必要に応じて帯電防止剤、酸化防止剤、ヒンダードアミン系化合物などの光安定剤、滑剤、ブロッキング防止剤、紫外線吸収剤、無機充填剤、顔料などの着色料、等の各種添加剤が含有されていても良い。
【0032】
本発明に係る薬剤徐放体は、その表面層5に薬剤を担持している。この薬剤は、本発明に係る薬剤徐放体の要求される機能により種々の薬剤を使用することができる。薬剤としては、例えば、抗炎症剤、抗生物質、抗血栓剤、抗腫瘍剤、抗凝血剤、血管細胞成長促進剤、血管細胞成長阻害剤、抗癌剤、血管拡張剤、及び骨形成誘導因子等を挙げることができる。骨形成誘導因子としては、骨組織からの抽出成分である各種の骨形成関連タンパク質を用いることができ、例えば、骨形成因子(BMP)、形質転換成長因子(TFG−β)、軟骨由来形成因子(CDMP)、骨誘導因子(OIF)、インスリン様成長因子(IGF)、血小板由来成長因子(PDFG)、繊維芽細胞増殖因子(FGF)等を挙げることができる。これらの薬剤は、相互に反応するものでなければ、これらの中から選択される2種以上の薬剤が表面層5に担持されてもよい。
【0033】
本発明に係る薬剤徐放体は、その表面層の表面及び/又は小径気孔及び大径気孔の内壁面に、生体活性物質を有しているのが好ましく、生体活性物質と薬剤とを含む、薬剤粒子及び/又は薬剤層を有しているのが特に好ましい。ここでは、薬剤を担持した生体活性物質が粒子状に形成されている場合に、これを薬剤粒子と称し、薬剤を担持した生体活性物質が層状に形成されている場合に、これを薬剤層と称するが、これらは厳密に区別されない。薬剤徐放体が、生体活性物質、薬剤粒子及び/又は薬剤層を有していると、生体活性物質は骨との結合性や生体分子を吸着する性質を有するので、この薬剤徐放体が骨や皮膚等の生体組織との接合性が必要な部位に使用される場合に特に有効である。例えば、薬剤徐放体が人工骨として使用される場合には、骨と結合し易くなり、経皮デバイスとして使用される場合には、皮膚と密着し易くなる。さらに、薬剤徐放体が、薬剤粒子及び/又は薬剤層を有していると、薬剤が長期間に渡って放出されるので、その薬剤の種類に応じた効果が長期間に渡って得られる。
【0034】
図2(a)、(b)に、生体活性物質、薬剤粒子、及び/又は薬剤層を有する薬剤徐放体の一実施例である薬剤徐放体の模式図を示す。以下においては、生体活性物質、薬剤粒子及び薬剤層を単に生体活性物質と称して説明する。図2(a)に示すように、生体活性物質210aは、表面層205aにおける開気孔206aの内壁面211aと表面層205aの表面との全面に形成されていても良い。あるいは、図2(b)に示すように、生体活性物質210bは、開気孔206bの内壁面211bの一部及び/又は表面層205bの表面の一部に形成されていても良い。ただし、薬剤徐放体212a、212bが、生体活性物質を有する薬剤粒子又は薬剤層ではなく、薬剤のみを有する場合には、薬剤は表面発泡体のみから放出されることになるので、表面発泡体に担持された薬剤を放出し易くするために、図2(b)に示されるように、開気孔206bの内壁面211bの一部及び/又は表面層205bの表面の一部に生体活性物質210bが形成されているのが好ましい。また、開気孔206a、206bの内壁面211a、211bに生体活性物質210a、210bが形成されている場合には、生体活性物質210a、210bが開気孔206a、206bをすべて埋めてしまうように形成されているのではなく、図2(a)、(b)に示すように、表面層205a、205bの表面に開口する開気孔206a、206bの内壁面211a、211bの一部又は全面に生体活性物質210a、210bが形成されているのが好ましい。例えば、図2(a)に示すように、小径開気孔213aが生体活性物質210aによってすべて埋められていても良いが、大径開気孔214aは、大径開気孔214aの容積を保持した状態で内壁面211aに生体活性物質210aが形成されているのが好ましい。さらに大径気孔204aと連通して形成される大径連通孔216aも生体活性物質210aにより閉塞されることなく、生体組織を侵入させたり、薬剤を放出させたりすることができる程度の大径連通孔径Dを有する大径連通孔216aが形成されているのが好ましい。表面層205aに開気孔206aが形成され、さらに開気孔206aに連通する大径連通孔216aが形成されていると、薬剤徐放体212aを生体内に埋設した後に、開気孔206aから表面層205aの内部に生体組織を侵入させたり、薬剤を表面層205aの内部から放出させたりすることができる。その結果、開気孔206aの内壁面211aに存在する生体活性物質210aと骨及び皮膚等の生体組織との化学的な反応が始まるので、生体組織との接合性をさらに向上させることができる。
【0035】
表面層205a、205bを投影した場合の生体活性物質210a、210bの面積割合は、少なくとも5%以上であるのが好ましく、20%以上であるのが特に好ましい。上記生体活性物質210a、210bは、表面層205a、205bの表面に存在する生体活性物質210a、210bだけでなく、開気孔206a、206bの内壁面211a、211bに存在し、かつ表面層205a、205bの外側から視認できる生体活性物質210a、210bも含む。生体活性物質210a、210bが、表面層205a、205bにおける開気孔206a、206bの内壁面211a、211b及び/又は表面層205a、205bの表面に、前記範囲内で存在すると、薬剤徐放体212a、212bを生体内に埋設した後に、この生体活性物質210a、210bと生体組織との化学的な反応が始まるので、骨及び皮膚等の生体組織と薬剤徐放体212a、212bとの接合性を向上させることができる。生体活性物質210a、210bが、生体活性物質と薬剤とを含む、薬剤粒子及び/又は薬剤層であると、薬剤が長期間に渡って放出されるので、その薬剤の種類に応じた効果が長期間に渡って得られる。
【0036】
表面層205a、205bを投影した場合の生体活性物質210a、210bの面積割合は、表面層205a、205bの表面を走査型電子顕微鏡により撮影した画像を画像解析ソフト(例えば、Scion社製 Scion Image)を使用して、生体活性物質210a、210bとそれ以外の部分とに2値化し、次いで画像全体の面積に対する生体活性物質の面積割合を算出することにより、求めることができる。
【0037】
生体活性物質210a、210bは、表面層205a、205bの体積に対して0.5〜30%含有するのが好ましい。生体活性物質210a、210bは、表面層205a、205bにおける開気孔206a、206bの内壁面211a、211b及び/又は表面層205a、205bの表面及び/又は表面層205a、205bの内部に独立した状態及び/又はこれらの生体活性物質210a、210bが結合して樹枝状に表面層205a、205b内部に張り巡らされた状態で存在する。前記範囲内の生体活性物質210a、210bが表面層205a、205bに存在すると、薬剤徐放体212a、212bを生体内に埋設した後に、この生体活性物質210a、210bと生体組織との化学的な反応が始まるので、骨及び皮膚等の生体組織と薬剤徐放体212a、212bとの接合性を向上させることができる。生体活性物質210a、210bが、薬剤粒子及び/又は薬剤層であると、薬剤が長期間に渡って放出されるので、その薬剤の種類に応じた効果が長期間に渡って得られる。
【0038】
表面層205a、205bに含まれる生体活性物質210a、210bの体積割合は、上述した生体活性物質210a、210bの面積割合を測定する方法と同様にして求めることができる。つまり、表面層205a、205bの表面に直交する断面における生体活性物質210a、210bの面積割合を算出することができれば、この算出値から生体活性物質210a、210bの体積割合を推定することができる。
【0039】
生体活性物質210a、210bは、生体との親和性が高く、歯を含む骨組織及び皮膚等と化学的に反応する性質を有する物質であれば特に限定されず、例えば、リン酸カルシウム系材料、バイオガラス、結晶化ガラス(ガラスセラミックスとも称する。)、炭酸カルシウム等の無機材料が挙げられる。リン酸カルシウム系材料としては、例えば、リン酸水素カルシウム、リン酸水素カルシウム水和物、リン酸二水素カルシウム、リン酸二水素カルシウム水和物、α型リン酸三カルシウム、β型リン酸三カルシウム、ドロマイト、リン酸四カルシウム、リン酸八カルシウム、水酸アパタイト、フッ素アパタイト、炭酸アパタイト及び塩素アパタイト等が挙げられる。バイオガラスとしては、例えば、SiO2−CaO−Na2O−P2O5系ガラス、SiO2−CaO−Na2O−P2O5−K2O−MgO系ガラス、及び、SiO2−CaO−Al2O3−P2O5系ガラス等が挙げられる。結晶化ガラスとしては、例えば、SiO2−CaO−MgO−P2O5系ガラス(アパタイトウォラストナイト結晶化ガラスとも称する。)、及び、CaO−Al2O3−P2O5系ガラス等が挙げられる。これらのリン酸カルシウム系材料、バイオガラス及び結晶化ガラスは、例えば、「化学便覧 応用化学編 第6版」(日本化学会、平成15年1月30日発行、丸善株式会社)、「バイオセラミックスの開発と臨床」(青木秀希ら編著、1987年4月10日発行、クインテッセンス出版株式会社)等に詳述されている。
【0040】
生体活性物質210a、210bとしては、これらの中でも生体活性に優れる点でリン酸カルシウム系材料が好ましく、さらに、実際の骨と組成や構造、性質が似ているので体内環境における安定性が優れており、体内で顕著な溶解性を示さないことから水酸アパタイトが特に好ましい。
【0041】
また、生体活性物質210a、210bは、低結晶性であることが好ましい。ここでいう低結晶性とは、結晶の発達程度が低い状態を意味し、水酸アパタイトを例にすると、粉末X線回折測定において2θ=25.878°、面間隔(d値)=3.44Åの回折線における半価幅が0.2°以上のものを示す。薬剤徐放体を人工骨として使用する場合には、生体活性物質を骨の水酸アパタイト(上記条件下における半価幅:0.4°程度)と同程度の結晶性(同条件下における半価幅:0.2〜1.0°)にすると、薬剤徐放体と骨とを速やかに結合させることができる。
【0042】
生体活性物質210a、210bの結晶性は、例えば、生体活性物質をカルシウム及び/又はリンを含有する溶液に浸漬する方法により形成させる場合は、この溶液の組成成分の種類や組成比率及び/又は浸漬温度により調整することができる。
【0043】
次に、本発明における「薬剤徐放体の製造方法」の一実施例を説明する。
【0044】
工程1として、所望の形状に成型させて成るプラスチック製の基材の表面に多数の微小気孔を有する微小気孔基材を作製する。プラスチック製の基材の表面に微小気孔を形成させる方法としては、公知の方法を採用することができ、例えば、プラスチック製の基材を、濃硫酸、濃硝酸、又はクロム酸等の腐食性溶液に所定時間浸漬し、次いで、この基材をプラスチックが溶出しない洗浄用溶液、例えば純水に浸漬させる方法を挙げることができる。プラスチックとして、例えばポリエーテルエーテルケトン(PEEK)を採用した場合には、濃硫酸にPEEKを所定時間浸漬させ、次いで、純水に浸漬させることにより微小気孔を形成させることができる。
【0045】
プラスチック製の基材の表面に形成される微小気孔の気孔径は、工程2において使用される発泡剤をプラスチック製の基材内に浸入させることのできる気孔径を有していれば良く、発泡剤の種類により適宜選択することができる。発泡剤として、例えば炭酸ナトリウムを採用した場合には、微小気孔の気孔径は、0.1〜200μmであるのが好ましい。プラスチック製の基材の表面に形成されている微小気孔の気孔率は、工程2において使用される発泡剤を十分に保持することができれば良く、例えば、発泡剤として炭酸ナトリウムを採用した場合には、プラスチック製の基材の微小気孔が形成されている層の気孔率は、10〜90%であるのが好ましい。前記気孔率の範囲の内、気孔率が低い範囲にある場合には、例えばプラスチック製の基材の表面から内部方向に気孔が連通して形成されているか又はプラスチック製の基材の表面から内部方向に垂直に柱状の孔が形成されているなど、発泡剤がプラスチック製の基材の表面から所望の深さまで保持されるように孔が形成されているのが好ましい。多数の微小気孔が形成されている層の厚さは、最終生成物である表面発泡体における表面層と同等の厚さがあれば良く、10〜1000μmであるのが好ましい。この多数の微小気孔を有する層の厚さ、気孔径及び気孔率は、PEEKの腐食性溶液として例えば濃硫酸を採用する場合には、PEEKを濃硫酸に浸漬する時間及び/又は温度などにより層の厚さを調整することができる。また、濃硫酸に浸漬した後に続いて浸漬する洗浄用溶液の種類及び/又は温度などによって気孔径や気孔率を調整することができる。
【0046】
次いで、工程2として、工程1で得られた微小気孔基材を、発泡剤を含有する溶液に所定時間浸漬させて、多数の微小気孔を有する微小気孔基材の表面に発泡剤が保持されて成る発泡剤保持基材を作製する。発泡剤としては、プラスチック製の基材の表面に所望の多孔質構造を形成させることのできる物質であれば良く、そのような発泡剤として、炭酸塩、アルミニウム粉末などの無機系発泡剤や、アゾ化合物、イソシアネート化合物などの有機系発泡剤を挙げることができる。特に発泡剤は生体に悪影響を与えない物質であるのが好ましく、そのような発泡剤としては炭酸塩が好ましく、例えば、炭酸水素ナトリウム、炭酸ナトリウム、炭酸カリウムを挙げることができる。
【0047】
次いで、工程3として、工程2で得られた発泡剤保持基材を、プラスチックを膨潤させ、かつ、発泡剤を発泡させる発泡溶液に所定時間浸漬させて、プラスチックの膨潤と発泡剤の発泡とを同時に進行させることにより形成されて成る発泡基材を作製する。前記発泡溶液としては、例えば、濃硫酸、塩酸及び硝酸などの酸性溶液を挙げることができる。発泡剤保持基材を形成する材料がPEEKであり、発泡剤が炭酸塩である場合には、前記発泡溶液としては、濃度が90%以上の濃硫酸が好ましい。
【0048】
次いで、工程4として、工程3で得られた発泡基材を、膨潤したプラスチックを凝固させる凝固溶液に浸漬することにより表面発泡体を作製する。前記凝固溶液、すなわちプラスチックが溶出しない溶液としては、例えば、水、アセトン、エタノールなどの水性溶液を挙げることができる。発泡基材を形成する材料がPEEKである場合には、上記に挙げた凝固溶液の他に、濃度が90%未満の硫酸、硝酸、リン酸、塩酸等の無機酸水溶液、水溶性有機溶剤を挙げることができる。水溶性有機溶剤としては、例えばN−メチル−2−ピロリドン、ジメチルホルムアミド、ジメチルアセトアミド、ジメチルスルホキサイド、テトラヒドロフラン、エチレングリコ−ル、ジエチレングリコ−ル、トリエトレングリコ−ル、プロピレングリコ−ル、ジプロピレングリコ−ル、グリセリンエタノ−ル、プロパノ−ル、ブタノ−ル、ペンタノ−ル、ヘキサノ−ル等のアルコ−ル及びこれらの水溶液、ポリエチレングリコ−ル、ポリプロピレングリコ−ル、ポリビニルピロリドン等液状高分子またはそれらの水溶液及びこれらの混合物を挙げることができる。
【0049】
工程3で得られた発泡基材は、凝固溶液として使用できる複数種類の溶液から選択される少なくとも1つの溶液に浸漬すれば良く、複数種類の溶液に順次浸漬しても良い。また、少なくとも2つの種類の溶液を混合して使用しても良い。
【0050】
工程4の後には、表面発泡体に残存している発泡剤及び凝固溶液等を純水で洗浄するのが好ましい。
【0051】
プラスチック製の基材の表面に形成される多孔質構造、すなわち表面発泡体の表面層の多孔質構造を規定する大径開気孔径、小径開気孔径、連通孔径、気孔率などは、発泡剤の種類及び濃度、発泡溶液の種類及び濃度、発泡溶液への浸漬時間、凝固溶液の種類及び濃度、凝固溶液への浸漬時間、各工程における温度などを適宜選択することにより調整することができる。
【0052】
これらの中でも特に、凝固溶液の種類と、凝固溶液の濃度と、凝固溶液への浸漬時間とから選択される少なくとも1つを変化させることにより、表面発泡体の表面層が所望の多孔質構造を有する表面発泡体を、容易に得ることができる。これらのパラメータを変化させることにより、発泡基材の表面における膨潤したプラスチックの凝固速度を制御することができる。凝固溶液の種類及び濃度としては、水と、膨潤したプラスチックを凝固させるのに水よりも長時間を要する低凝固溶液の少なくとも1つを適宜選択するのが好ましい。発泡基材を形成する材料がPEEKである場合には、低凝固溶液として、濃度が90%未満の硫酸を挙げることができる。
【0053】
例えば、PEEKにより形成される発泡基材を、低凝固溶液として濃度が86%の硫酸に浸漬すると、水に浸漬する場合に比べて緩やかにPEEKが凝固する。すなわち、凝固速度が遅くなる。そのため、発泡基材を低凝固溶液に浸漬する時間の経過に従って、発泡基材の表面の多孔質構造は変化する。
【0054】
以下に、発泡基材の低凝固溶液への浸漬時間の違いによる、発泡基材の表面の構造の変化を、上述の表面発泡体1において定義した、大径気孔4と大径気孔4が連通して形成される大径連通孔16と小径気孔3とに分けて説明する。
【0055】
大径気孔4が表面に開口する大径開気孔14と大径連通孔16との孔径は、浸漬時間の経過に従って次第に大きくなる。所定時間以上経過すると、これらの孔径は逆に小さくなる。また、大径開気孔14と大径連通孔16との数は、浸漬時間の経過に従って次第に少なくなる。浸漬時間の経過に従って、孔径が大きくなるのは、発泡剤により形成された複数の孔が、膨潤したPEEKが緩やかに凝固する間に連結して大きくなるものと理解される。一方、所定時間以上経過すると孔径が小さくなってしまうのは、膨潤したPEEKが緩やかに凝固する間に、発泡剤の効力が弱まってしまい、連結して大きくなった孔も含めて、全ての孔が小径化してしまうと考えられる。また、浸漬時間の経過に従って、大径開気孔14と大径連通孔16の数が少なくなるのは、膨潤したPEEKが緩やかに凝固する間に、複数の大径開気孔14及び大径連通孔16が連結して統合されてしまうためであると理解される。
【0056】
小径気孔3が表面に開口する小径開気孔13の孔径及び気孔率は、浸漬時間の経過に従って次第に小さくなる。大径気孔が発泡剤の作用により形成されるのに対し、小径気孔3は膨潤したPEEKの相分離現象に基づき形成されていると考えられる。膨潤したPEEKは、緩やかに凝固が進行する低凝固溶液との間では相分離が生じにくく、低凝固溶液の浸漬時間が長いほど、膨潤したPEEKと低凝固溶液とが均質化しながら凝固が進行するため、小径開気孔13の数や孔径が小さくなると共に、気孔率も低下すると考えられる。
【0057】
以上に説明したように、発泡基材の低凝固溶液への浸漬時間の違いにより、表面発泡体1の表面層5の多孔質構造が異なる表面発泡体1を得ることができる。特に、大径開気孔14及び大径連通孔16の孔径が最大となる時間に、水などに浸漬することにより速やかに凝固を完了させれば、表面層5の内部まで連通性が良好な表面発泡体1を提供することができる。
【0058】
上記においては、低凝固溶液として濃度が86%の硫酸を例として説明したが、さらに低濃度の硫酸を低凝固溶液として使用した場合には、発泡基材の表面の構造の時間経過による変化の有様は、相違する。例えば、さらに低濃度の硫酸を使用すると、濃度が86%の硫酸を使用する場合よりも短時間で膨潤したPEEKが凝固するので、発泡剤の効力が弱まる前に、大径気孔4が凝固することがある。その場合には、発泡基材を低凝固溶液に長時間浸漬しておいても、大径開気孔14及び大径連通孔16の孔径が小さくなったり、数が少なくなったりすることがない。
【0059】
低凝固溶液の種類及び濃度により、上述したように、浸漬時間の経過に伴う、発泡基材の表面の構造の変化の仕方は相違する。従って、所望の低凝固溶液を選択し、所定時間発泡基材を浸漬して、発泡基材の表面の構造が所望の多孔質構造を有する時間になったら、水に浸漬すれば、速やかに膨潤したプラスチックを凝固させることができるので、表面層5が所望の多孔質構造を有する表面発泡体を得ることができる。なお、膨潤したプラスチックを凝固させるために、発泡基材を水に浸漬させることの他に、膨潤したプラスチックが凝固するのに十分な時間だけ低凝固溶液に浸漬させておいても良い。
【0060】
次に、工程5(a)として、工程4で得られた表面発泡体を所定時間薬剤を含む溶液に浸漬して、表面発泡体の表面層に薬剤を担持している薬剤徐放体を作製する。薬剤は、要求される機能により適宜選択することができ、例えば、前述した薬剤の中から少なくとも1つの薬剤を選択することができる。薬剤が、液体薬剤の場合には、そのままあるいは希釈した希釈液が用いられ、固体薬剤の場合には、適宜の溶剤に溶解又は懸濁させた薬液が用いられる。希釈液及び薬液の濃度は、使用する薬剤の有効濃度以上であって、生体に害を及ぼさない範囲で適宜調整される。表面発泡体を薬剤を含む溶液に浸漬する時間は、表面発泡体の表面層に薬剤が担持される限り特に限定されず、10分以上浸漬するのが好ましい。
【0061】
工程5(a)においては、表面発泡体を薬剤を含む溶液に浸漬しながら脱泡処理をするのが好ましい。脱泡処理をすることにより、表面発泡体の気孔内まで薬剤を浸入させることができる。また、表面発泡体を薬剤を含む溶液に浸漬させる時間も短縮することができる。
【0062】
表面発泡体を薬剤を含む溶液から取り出した後には、常温にて十分に乾燥させるのが好ましい。
【0063】
次に、本発明における「薬剤徐放体の製造方法」の他の一実施例を説明する。この薬剤徐放体の製造方法は、薬剤徐放体がその表面層の表面及び/又は開気孔の内壁面に生体活性物質と薬剤とを含む、薬剤粒子及び/又は薬剤層を有する場合の例である。
【0064】
まず、上述した工程1〜4により、表面発泡体を作製する。
次いで、工程5(I)として、工程4で得られた表面発泡体を、少なくとも10mMのカルシウムイオンを含むカルシウム溶液及び少なくとも10mMのリン酸イオンを含むリン酸溶液の両方に浸漬する。カルシウム溶液及びリン酸溶液の少なくとも一方には薬剤が含まれている。また、表面発泡体は、カルシウム溶液及びリン酸溶液のいずれから先に浸漬されてもよい。以下においては、表面発泡体をカルシウム溶液に先に浸漬させた場合について説明する。
【0065】
まず、表面発泡体を、少なくとも10mMのカルシウムイオンを含むカルシウム溶液に所定時間浸漬する。このカルシウム溶液は、少なくともカルシウムイオンを含んでいれば良く、ナトリウムイオン、カリウムイオン、マグネシウムイオン、炭酸イオン、ケイ酸イオン、硫酸イオン、硝酸イオン、塩素イオン、水素イオンなどを含んでいても良いが、リン酸イオンは実質的に含まないほうが好ましい。カルシウム溶液としては、通常、水溶性が高く、人体に悪影響を与えない化合物の水溶液を挙げることができ、例えば、塩化カルシウム、水酸化カルシウム、硝酸カルシウム、蟻酸カルシウム、酢酸カルシウム、プロピオン酸カルシウム、酪酸カルシウム、乳酸カルシウム、およびこれらの混合溶液等が挙げられ、塩化カルシウムの水溶液が好ましい。
【0066】
カルシウム溶液に所定時間浸漬した後に、表面発泡体を、少なくとも10mMのリン酸イオンを含むリン酸溶液に浸漬する。このリン酸溶液は、少なくともリン酸イオンを含んでいればよく、ナトリウムイオン、カリウムイオン、マグネシウムイオン、炭酸イオン、ケイ酸イオン、硫酸イオン、硝酸イオン、塩素イオン、水素イオンなどを含んでいても良いが、カルシウムイオンは実質的に含まないほうが好ましい。リン酸溶液としては、通常、水溶性が高く、人体に悪影響を与えない化合物の水溶液を挙げることができ、例えば、リン酸、リン酸水素二ナトリウム、リン酸二水素ナトリウム、リン酸水素二カリウム、リン酸二水素カリウム、およびこれらの混合溶液等が挙げられ、リン酸水素二カリウムの水溶液が好ましい。
【0067】
薬剤は、カルシウム溶液及びリン酸溶液の少なくとも一方に含まれる。薬剤は、要求される機能により適宜選択することができ、例えば、前述した薬剤の中から少なくとも1つの薬剤を選択することができる。薬剤の濃度は、使用する薬剤の有効濃度以上であって、生体に害を及ぼさない範囲で適宜調整される。
【0068】
表面発泡体を、上記2種類の水溶液に浸漬する順序は、特に限定されないが、例えば生体活性物質として水酸アパタイトを表面層の内部、すなわち多孔質構造内に生成させる場合は、水酸アパタイトの溶解度がより低いアルカリ域で生成反応が進むことが生成量の面から好ましく、そのため、後半に浸漬する溶液のpHがpH8〜10のアルカリ域であることが好ましい。
【0069】
カルシウム溶液及びリン酸溶液に、表面発泡体を浸漬する時間は、1分以上浸漬するのが好ましく、3分以上浸漬するのが特に好ましい。前記範囲内であれば、十分にカルシウムイオン、リン酸イオン及び薬剤が表面発泡体の内部まで染み込み、表面発泡体の表面層における開気孔及び連通気孔の内壁面に生体活性物質と薬剤とを共沈させることができる。また、生体活性物質の生成量を増やしたい場合には、各溶液に浸漬する操作を複数回繰り返しても良い。
【0070】
工程5(I)においては、表面発泡体をカルシウム溶液及びリン酸溶液のそれぞれに浸漬しながら脱泡処理をするのが好ましい。脱泡処理をすることにより、表面発泡体の気孔内までカルシウムイオン、リン酸イオン及び薬剤を十分に浸入させることができる。また、表面発泡体をカルシウム溶液及びリン酸溶液に浸漬させる時間も短縮することができる。
【0071】
表面発泡体をカルシウム溶液及びリン酸溶液から取り出した後には、常温にて十分に乾燥させるのが好ましい。
【0072】
次に、本発明における「薬剤徐放体の製造方法」のまた別の一実施例を説明する。この薬剤徐放体の製造方法は、薬剤徐放体がその表面層の表面及び/又は開気孔の内壁面に生体活性物質と薬剤とを含む、薬剤粒子及び/又は薬剤層を有する場合の他の例である。
【0073】
まず、上述した工程1〜4により、表面発泡体を作製する。
次いで、工程5(i)として、工程4で得られた表面発泡体を、少なくとも10mMのカルシウムイオンを含むカルシウム溶液及び少なくとも10mMのリン酸イオンを含むリン酸溶液の両方に浸漬する。このカルシウム溶液及びリン酸溶液には薬剤が含まれていない。すなわち、カルシウム溶液及びリン酸溶液に薬剤が含まれていないこと以外は、工程5(I)と同様の手順により、表面層の表面及び/又は開気孔の内壁面に生体活性物質を有する生体活性物質保持体を作製する。
【0074】
次いで、工程5(ii)として、工程5(i)で得られた生体活性物質保持体を薬剤を含有する擬似体液に浸漬する。擬似体液とは、人の血漿とほぼ等しい無機イオン濃度を有し、アパタイトに対して過飽和な溶液であり、詳細は、大槻ら「Mechanizm of apatite formation on CaO−SiO2−P2O5 glasses in a simulated body fluid」、ジャーナル オブ ノン−クリスタリン ソリッド(Jornal of Non−Crystaline Solides)、第143巻、84〜92頁、1992年の論文に記載されている。
【0075】
薬剤は、要求される機能により適宜選択することができ、例えば、前述した薬剤の中から少なくとも1つの薬剤を選択することができる。薬剤の濃度は、使用する薬剤の有効濃度以上であって、生体に害を及ぼさない範囲で適宜調整される。
【0076】
生体活性物質保持体を薬剤を含有する擬似体液に浸漬する時間は、1時間以上浸漬するのが好ましく、3時間以上浸漬するのが特に好ましい。前記範囲で生体活性物質保持体を薬剤を含有する擬似体液に浸漬すると、表面発泡体の表面層及び生体活性物質に薬剤を十分に担持させることができる。また、擬似体液は、生体と同程度の温度、すなわち37℃前後の温度に維持しておくのが好ましい。
【0077】
工程5(ii)においては、生体活性物質保持体を薬剤を含有する擬似体液に浸漬する際に脱泡処理をするのが好ましい。脱泡処理をすることにより、生体活性物質保持体の気孔内まで薬剤を含有する擬似体液を十分に浸入させることができる。
【0078】
生体活性物質及び薬剤を表面発泡体の表面層に担持させる方法は、上記の方法に限られず種々の方法を採用することができる。例えば表面発泡体を、あらかじめ薬剤と多量の生体活性物質とを含む溶液に浸漬し、これを乾燥させることにより、表面発泡体における多孔質構造を有する表面層内部に生体活性物質と薬剤とを固定させた薬剤徐放体を得ることもできる。
【0079】
本発明に係る薬剤徐放体は、各種用途を有し、例えば、生体組織と結合することが必要とされる医療用材料に好適に利用することができ、特に人工骨、人工歯根及び経皮デバイス等に利用することができる。人工骨としては、例えば、骨補填材、人工関節、骨接合材、人工椎体、椎体間スペーサ、椎体ケージとして適用することができる。経皮デバイスは、体外から体内に皮膚を貫通し、栄養補給、薬液注入及び血液循環等を担う医療用具であり、あらゆる人工臓器に付随している。前記薬剤徐放体は、その使用方法及び生体内の使用部位に合わせて様々な形状、例えば、粒子状、繊維状、ブロック状、フィルム状等で用いられる。
【0080】
前記薬剤徐放体は、PEEKなどのプラスチックを所望の形状に成形、整形及び/又は調製した後に、プラスチック製の基材の表面部に多孔質構造を有する表面層を形成させることもできるし、プラスチック製の基材の表面に多孔質構造を有する表面層を形成させた後に、表面発泡体を所望の形状に成形、整形及び/又は調製することもできる。前述した製造方法によるとほとんどの工程が液相中で処理することができるので、PEEKなどのプラスチックを、複雑な形状に成形、整形及び/又は調製した後に、プラスチック製の基材の表面部に多孔質構造を有する表面層を形成させることを、容易にすることができる。
【0081】
前記表面層は、プラスチック製の基材の全表面部に形成させても良いし、骨、歯又は皮膚等の生体組織との結合又は密着が必要な面のみに形成させても良い。また、表面層における少なくとも開気孔の内壁面及び/又は前記表面層の表面に生体活性物質と薬剤とを含む、薬剤粒子及び/又は薬剤層を有していると、より一層生体組織との結合性又は密着性が向上するので好ましい。
【実施例】
【0082】
次に、この発明を実施例を挙げて説明するが、この発明は、以下の実施例に限定されない。
【0083】
(実施例1)
この実施例は、薬剤徐放体を形成する物質としてPEEKを使用した場合の実施例である。薬剤徐放体を以下の手順にしたがって作製した。
【0084】
まず、工程1として、PEEKで形成される円盤体(直径10mm、厚さ2mm、Victrex社製450G)の表面をサンドペーパー(#1000)で研磨し、濃硫酸(濃度:97%)に5分間浸漬した。濃硫酸から引き上げた円盤体を純水に5分間浸漬し、その後純水のpHが中性になるまで繰り返し洗浄し、表面に微小気孔を有する微小気孔基材を得た。この微小気孔基材の表面を走査型電子顕微鏡にて観察したところ、多数の気孔を有し、これらの気孔の気孔径は1〜2μmであり、内部は網目構造となっていた。
【0085】
次いで、工程2として、この微小気孔基材を炭酸カリウム水溶液(濃度:3M)に60分間浸漬することにより、微小気孔基材の表面に炭酸カリウムを保持させて発泡剤保持基材を得た。
【0086】
次いで、工程3として、この発泡剤保持基材を発泡溶液である濃硫酸(濃度:97%)に1分間浸漬することにより、発泡剤保持基材におけるPEEKの表面を膨潤させるのと同時に発泡剤保持基材における炭酸カリウムを発泡させて発泡基材を得た。
【0087】
次いで、工程4として、この発泡基材を濃硫酸から引き上げて純水に10分間浸漬することによりPEEKの表面を凝固させ、純水のpHが中性になるまで繰り返し洗浄した後に、120℃で3時間乾燥させて表面発泡体を得た。
【0088】
作製した表面発泡体の表面を走査型電子顕微鏡で観察した結果を図3に示す(拡大率300倍)。表面発泡体の表面には開気孔径が1〜4μmの小径気孔により形成された小径開気孔と開気孔径が100〜200μmの大径気孔により形成された大径開気孔とが多数確認された。また、大径気孔により形成された大径開気孔の内壁面には小径気孔及び大径気孔と連通することにより形成される小径連通孔と大径連通孔とが多数確認された。
【0089】
拡大率3000倍及び300倍で撮影した各写真を利用して、上述したように大径開気孔及び小径開気孔の各長径及び短径を測定し、これらの測定値の算術平均を算出したところ、小径開気孔の平均開気孔径は2.4μm、大径開気孔の平均開気孔径は106μmであった。
【0090】
表面発泡体の表面を走査型電子顕微鏡により撮影した写真を画像解析ソフト(Scion社製 Scion Image)を使用して、大径開気孔とそれ以外の部分とに2値化することにより、上述したように写真全体の面積に対する小径開気孔と大径開気孔との面積割合を算出したところ、それぞれ、16%と64%であった。
【0091】
作製した表面発泡体の表面に直交する断面を走査型電子顕微鏡で観察したところ、表面発泡体の表面には多数の気孔を有する厚さ約70μmの層が確認された。
【0092】
作製した表面発泡体における多数の気孔が形成されて成る表面層について、表面発泡体の表面に直交する断面を走査型電子顕微鏡により拡大率300倍と拡大率3000倍とで撮影した写真を、画像解析ソフト(Scion社製 Scion Image)を使用して、小径気孔と大径気孔との面積をそれぞれ算出した。上述したように、写真全体の面積に対する小径気孔及び大径気孔の面積割合から、小径気孔の気孔率及び大径気孔の気孔率を算出したところ、それぞれ、12%と58%とであった。
【0093】
作製した表面発泡体における多数の気孔が形成されて成る表面層について、水銀ポロシメータにより連通孔の孔径を測定したところ、孔径1〜100μmの間において未処理のPEEKよりも水銀の圧入が多く認められた。従って、この範囲の間に広い孔径分布で連通孔が形成されていることが分かった。これは走査型電子顕微鏡での表面層の観察結果と一致した。
【0094】
次いで、工程5(a)として、得られた表面発泡体をバンコマイシンの5質量%水溶液に浸漬しながら、真空デシケータ内にて10分間脱泡処理をした。なお、バイコマイシンは抗生物質である。この後、バンコマイシン水溶液から取り出し、自然乾燥させて、表面発泡体の表面層にバンコマイシンを担持して成る薬剤徐放体を得た。
【0095】
(実施例2)
この実施例は、薬剤徐放体を形成する物質としてPEEKを使用し、薬剤徐放体の表面層に水酸アパタイトと薬剤とを含む、薬剤粒子及び/又は薬剤層を担持させた薬剤徐放体を示す実施例である。薬剤徐放体を以下の手順にしたがって作製した。
【0096】
まず、実施例1と同様にして工程1〜4により表面発泡体を得た。
次いで、工程5(I)として、得られた表面発泡体を、バンコマイシンを5質量%と塩化カルシウムとを含むカルシウム水溶液(カルシウムイオン濃度:100mM)に浸漬しながら、真空デシケータ内にて10分間脱泡処理をした。引き続きバンコマイシンを5質量%とリン酸水素二カリウムとを含むリン酸水溶液(リン酸イオン濃度:100mM)に浸漬しながら、真空デシケータ内にて10分間脱泡処理をした。この操作を3回繰り返した後に、リン酸水溶液から取り出し、自然乾燥させて、表面発泡体の表面層内に水酸アパタイトとバンコマイシンとを共沈させて成る薬剤徐放体を得た。
【0097】
(実施例3)
この実施例は、薬剤徐放体を形成する物質としてPEEKを使用し、薬剤徐放体の表面層に水酸アパタイトと薬剤とを含む、薬剤粒子及び/又は薬剤層を担持させた薬剤徐放体を示す他の実施例である。薬剤徐放体を以下の手順にしたがって作製した。
【0098】
まず、実施例1と同様にして工程1〜4により表面発泡体を得た。
次いで、工程5(i)として、得られた表面発泡体を、塩化カルシウムを含むカルシウム水溶液(カルシウムイオン濃度:100mM)に浸漬しながら、真空デシケータ内にて10分間脱泡処理をした。引き続きリン酸水素二カリウムを含むリン酸水溶液(リン酸イオン濃度:100mM)に浸漬しながら、真空デシケータ内にて10分間脱泡処理をした。この後、リン酸水溶液から取り出し、120℃で3時間乾燥させて、表面発泡体の表面層内にリン酸カルシウムの微結晶が形成されて成るリン酸カルシウム保持体を得た。
【0099】
次いで、工程5(ii)として、得られたリン酸カルシウム保持体をバンコマイシンを5質量%含む擬似体液に浸漬して、37℃で3日間保持した。その後、擬似体液から取り出し、自然乾燥させて、表面発泡体の表面層内にバンコマイシンを担持して成る水酸アパタイトを有する薬剤徐放体を得た。
【符号の説明】
【0100】
1 表面発泡体
2、202a、202b 実質部
3、203a、203b 小径気孔
4、204a、204b 大径気孔
5、205a、205b 表面層
6、206a、206b 開気孔
7、207a、207b 連通孔
8 独立気孔
9 連通気孔
13、213a、213b 小径開気孔
14、214a、214b 大径開気孔
15 小径連通孔
16、216a、216b 大径連通孔
210a、210b 生体活性物質
211a、211b 内壁面
212a、212b 薬剤徐放体
A 小径気孔の平均開気孔径
B 大径気孔の平均開気孔径
C 小径連通孔径
D 大径連通孔径
【特許請求の範囲】
【請求項1】
プラスチックにより形成され、
実質部とその表面に形成され、かつ、小径気孔及び大径気孔を有する表面層とを備え、
前記小径気孔及び前記大径気孔の一部は前記表面層の表面に開口する開気孔を形成しており、
前記開気孔は平均開気孔径が5μm以下の小径開気孔と平均開気孔径が10〜200μmの大径開気孔とを有し、
前記大径開気孔の内壁面に前記小径気孔及び前記大径気孔と連通する連通孔が形成されて成る表面発泡体が、その表面層に薬剤を担持していることを特徴とする薬剤徐放体。
【請求項1】
プラスチックにより形成され、
実質部とその表面に形成され、かつ、小径気孔及び大径気孔を有する表面層とを備え、
前記小径気孔及び前記大径気孔の一部は前記表面層の表面に開口する開気孔を形成しており、
前記開気孔は平均開気孔径が5μm以下の小径開気孔と平均開気孔径が10〜200μmの大径開気孔とを有し、
前記大径開気孔の内壁面に前記小径気孔及び前記大径気孔と連通する連通孔が形成されて成る表面発泡体が、その表面層に薬剤を担持していることを特徴とする薬剤徐放体。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−167040(P2010−167040A)
【公開日】平成22年8月5日(2010.8.5)
【国際特許分類】
【出願番号】特願2009−11289(P2009−11289)
【出願日】平成21年1月21日(2009.1.21)
【出願人】(000004547)日本特殊陶業株式会社 (2,912)
【Fターム(参考)】
【公開日】平成22年8月5日(2010.8.5)
【国際特許分類】
【出願日】平成21年1月21日(2009.1.21)
【出願人】(000004547)日本特殊陶業株式会社 (2,912)
【Fターム(参考)】
[ Back to top ]

