薬剤徐放部材および医療機器
【課題】長期間の薬剤徐放を可能とし、且つ使用開始直後の過剰な薬剤放出を避けることが可能であり、薬剤徐放部材、および体内に長期間留置されても、炎症反応や線維化等を起こしにくい医療機器を提供する。
【解決手段】薬剤徐放部材1は、生体適合性基材2と、薬剤3とが混合されて形成された第一層10と、生体適合性基材2と薬剤3とが混合されて形成され、薬剤3の密度が第一層10よりも低い第二層20とを、備える構成とする。
【解決手段】薬剤徐放部材1は、生体適合性基材2と、薬剤3とが混合されて形成された第一層10と、生体適合性基材2と薬剤3とが混合されて形成され、薬剤3の密度が第一層10よりも低い第二層20とを、備える構成とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、内部に含まれる薬剤が徐々に放出される薬剤徐放部材、およびこれを用いた医療機器に関する。
【背景技術】
【0002】
従来、体内に留置されて疾病の治療や予防に使用される様々な医療機器が知られている。これらの医療機器は、基本的に生体にとって異物であるため、体内に留置された場合に、炎症や免疫反応を誘発する場合がある。生体はこれに対応するため、当該医療機器の周囲をコラーゲンなどで被包して、線維化により組織と隔離することがある。当該医療機器がペースメーカーのような電気的パルスを発生する治療機器の場合には、機器の周囲で線維化が進行すると、治療に必要な電圧値が上昇する結果、治療が困難になるという問題がある。
【0003】
この問題に対して、医療機器を構成する部材に抗炎症作用や免疫抑制作用を有する薬物を混入し、留置後に当該薬物が体内に徐放されることにより炎症や線維化等を抑制することが試みられている。
例えば、特許文献1には、体液或いは血液に対する溶解性の異なる2種類の薬剤を所定の比率で基材を成すシリコーンゴム中に混入させた薬剤徐放性材料の製法と、当該薬剤徐放性材料を用いたデバイスを開示している。
【0004】
特許文献1に記載の技術では、共通なデキサメタゾン核を有する2種類のステロイド剤として、リン酸デキサメタゾンと酢酸デキサメタゾンを或る比率でシリコーンゴム中に混合して徐放性材料を形成している。この材料が体液或いは血液との接触する初期段階においては、水溶性のリン酸デキサメタゾンが主に溶出し、その後、水に対する溶解性の低い酢酸デキサメタゾンが長期に渡って溶出したとされている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許第4545315号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、本発明人の行った実験では、酢酸デキサメタゾンの粉末を医療用グレードシリコーンゴム(Dow Corning Silastic Q7-4840)に混合し硬化させたサンプルを、生理的食塩水に浸漬して37℃の温度環境下かつ還流を行わない条件下で同薬剤の溶出量を計測したところ、浸漬後24時間で総溶出量の60%が溶け出し、1週間以降は溶出がほぼ止まることが確認された。
【0007】
すなわち、治療用デバイスの少なくとも一部を構成するシリコーンゴムにステロイド剤を混入し、所望の抗炎症効果を得ようとする場合、ステロイド剤の溶出は、ステロイド剤自身の体液や血液に対する溶解性と、シリコーンゴム表面近傍での密度に主に依存することになる。したがって、より長い期間ステロイドを放出させようとして、ステロイド−シリコーンゴム混合物の厚さを増すだけでは溶出時間を延ばすことには繋がらないことがわかった。また、単純にステロイドの混合比を高めることは、初期の溶出量を増やすだけであり、薬剤量が過剰となることによる副作用の懸念を伴うことになるという問題もある。
したがって、特許文献1に記載の手法をもって、水に溶け難い薬剤を混入して長期間の放出を目論んでも、結果的に基材の表層付近の薬剤が水溶性の薬剤に遅れて溶解するだけで、例えば1週間を超える期間の薬剤放出を期待することは難しく、上記問題を完全に解決することは難しいことがわかった。
【0008】
本発明は、上述したような事情に鑑みてなされたものであって、長期間の薬剤徐放を可能とし、且つ使用開始直後の過剰な薬剤放出を避けることが可能な、薬剤徐放部材を提供することを目的とする。
本発明の他の目的は、体内に長期間留置されても、炎症反応や線維化等を起こしにくい医療機器を提供することである。
【課題を解決するための手段】
【0009】
本発明の第一の態様である薬剤徐放部材は、生体適合性基材と薬剤とが混合されて形成された第一層と、生体適合性基材と前記薬剤とが混合されて形成され、前記薬剤の密度が前記第一層よりも低い第二層とを備えることを特徴とする。
【0010】
前記第一層の薬剤密度は、前記第二層の薬剤密度の2倍以上であってもよい。
また、前記第一層の表面全体が前記第二層に被覆されていてもよい。
【0011】
本発明の第二の態様である医療機器は、本発明の薬剤徐放部材を備える医療機器であって、前記薬剤徐放部材が、前記医療機器のうち、生体組織に接触する部位の少なくとも一部に配置されていることを特徴とする。
【発明の効果】
【0012】
本発明の薬剤徐放部材によれば、長期間の薬剤徐放を可能とし、且つ使用開始直後の過剰な薬剤放出を避けることができる。
本発明の医療機器によれば、体内に長期間留置されても、炎症反応や線維化等を起こしにくい医療機器医療機器とすることができる。
【図面の簡単な説明】
【0013】
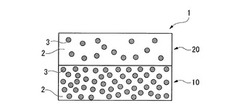
【図1】本発明の第一実施形態の薬剤徐放部材を示す模式図である。
【図2】医療機器の表面に同薬剤徐放部材の第一層を接触させて取り付けた状態を示す図である。
【図3】同薬剤徐放部材における薬剤の放出態様を示す図である。
【図4】本発明の第二実施形態の薬剤徐放部材を示す模式図である。
【図5】本発明の第三実施形態の除細動システムを示す斜視図である。
【図6】同除細動システムの電極部の設置態様を示す図である。
【図7】同電極部の第一電極を示す拡大図である。
【図8】同電極部の絶縁部材の拡大断面図である。
【発明を実施するための形態】
【0014】
本発明の第一実施形態について、図1から図3を参照して説明する。図1は、本実施形態の薬剤徐放部材1を示す模式図である。なお、本願の図面では、構造をわかりやすくするため、薬剤の粒子等を実際の寸法よりも大きく示している。
【0015】
薬剤徐放部材1は、生体適合性基材2と徐放させる薬剤3とを混合して形成されており、薬剤3の密度が相対的に高い第一層10と、薬剤3の密度が相対的に低い第二層20とを備えている。
生体適合性基材2としては、例えば医療用グレードの液状シリコーンゴム(LSR)或いは高粘度シリコーンゴム(HCR)が使用可能である。例えばダウ・コーニング社の商品名Silastic Q7などが利用可能である。薬剤徐放部材1の体内留置時における体液や血液の浸透と、これらの水性液との接触をより容易に得ようとするならば、より分子量が低く、架橋密度の低いシリコーンゴムの選択が好適である。例えば、薬剤デリバリー用として市販されているNuSil Technology社のDDU-4330やDDU-4340などのシリコーンゴムの選択により、Silastic Q7などのシリコーンゴムに対して、水性液の透水率(透水量に対する材料の重量比)を、70%程度向上させることが期待できるため、より容易に薬剤徐放部材1を製造することができる。
【0016】
徐放させる薬剤は、留置時に得ようとする効果により適宜決定される。例えば、炎症や線維化反応を抑制する目的であれば、ステロイド剤、免疫抑制剤、抗生物質等から適宜選択すればよい。
ステロイド剤としては、公知の各種化合物を用いることができる。具体例としては、デキサメタゾン、ベクロメタゾン、べタメタゾン、メチルプレドニゾロン、プレドニゾロン、トリアムシロン、パラメタゾン、フルオシノロンアセトニド、クロベタゾン、ジフロラゾン、ジフルコルトロン、フルオシノニド、ヒドロコルチゾン、ジフルプレドナード、ヒドロコルチゾン、フルオキシノロン、アルクロメタゾン、アムシノニド、クロコルトロン、デスオキシメタゾン等が挙げられる。
例えばリン酸デキサメタゾンや酢酸デキサメタゾン、ジプロピオン酸ベクロメタゾンのように、前述の薬剤をリン酸塩、酢酸塩、硫酸塩などの形で使用すると、水に対する溶解性が変化し、溶出速度の調節が可能である。
【0017】
免疫抑制剤としては、例えば、シロリムス、タクロリムス水和物、アザチオプリン、シクロスポリン、ミコフェノール酸モフェチル、塩酸グスペリウム、ミゾリビン等を挙げることができる。
抗生物質としては、例えば、ゲンタマイシン、マイトマイシンC、塩酸ドキソルビシン、アクチノマイシンD、塩酸ダウノルビシン、塩酸イダルビシン、塩酸ピラルビシン、塩酸アクラルビシン、塩酸エピルビシン、塩酸ペプロマイシン、ジノスタンチスチマラマー等を挙げることができる。
【0018】
薬剤徐放部材1が血液と接触する医療機器に適用される場合は、当該医療機器表面での血栓形成を抑制する目的でヘパリンナトリウムなどの抗凝固作用や抗血栓作用を有する薬剤を混合してもよい。ヘパリンナトリウムは熱にあまり強くないが、常温硬化型のシリコーンゴムを選択することによって、薬効を損なうことなく、本発明の薬剤徐放部材に適用することが可能である。
医療機器が血管内或いは心臓内に留置される場合には、当該医療機器表面から溶出した薬剤は血流によって医療機器表面から流失し、例えば医療機器表面での血栓形成を抑制する目的で抗凝固薬等をシリコーンゴムに混入しても、所望の効果が得られないことになるが、本発明の構成によって、抗凝固薬等を長期にわたって放出することが可能となる。
【0019】
第一層10および第二層20は、生体適合性基材と、粉体または結晶状の薬剤とを混練等により混合した後、硬化処理を行ってシート状等の所定の形状に成形することにより、作製することができる。
上述したシリコーンゴムは、いずれも硬化処理において概ね160℃前後まで加熱されるが、例えば、分解温度が200℃を超えるリン酸デキサメタゾンや酢酸デキサメタゾン等であれば、混合して硬化処理を行っても、その薬効が損なわれることはない。
【0020】
分解温度が比較的低く、高温に弱い薬剤を使用する場合は、室温硬化型(RTV)のシリコーンゴムを基材として用いればよい。このようなシリコーンゴムとしては例えばNuSil Technology社のDDU-4351やDDU-4340等を挙げることができる。これらのシリコーンRTVゴムは、硬化温度が23℃と低く、高温に弱い薬剤でも問題なく混合できる。また、担持された薬剤が硬化したシリコーンゴム分子の網目を通過して放出されやすいため、短時間により多くの薬剤放出が望まれる場合等に適している。
【0021】
第一層10と第二層20とは、基材2に対する薬剤3の混合比率(薬剤密度)のみ異なっており、生体適合性基材2およびその製造手順は同一である。作成した第一層10と第二層20とを加熱処理等により一体に接合すると、薬剤徐放部材1が完成する。また、公知の二色成形技術等により、第一層10および第二層20を一体的に形成してもよい。
【0022】
薬剤徐放部材1は、いずれか一方の層を医療機器に接触させて貼り付け、当該医療機器の表面を被覆することにより、当該医療機器の生体適合性を高めたり、血栓形成を抑制したりすることができる。また、詳しくは後述するが、薬剤徐放部材を用いて医療機器の一部を形成することも可能である。
【0023】
薬剤徐放部材1の作用について説明する。図2は、医療機器MDの表面に、薬剤徐放部材1の第一層10を接触させて取り付けた状態を示している。この場合は、第一層10は深部に配置されて直接組織、体液、血液等(以下、「体液等」と総称することがある。)には接触せず、第二層20が医療機器MDの体内留置時に体液等と接触する。すると、まず、第二層20に混合された薬剤3が、表層に近いものから順に溶出し、医療機器MDの周囲で薬効を発揮する。
【0024】
シリコーンゴム等の生体適合性基材2に体液等が浸透する場合、通常は、生体適合性基材の分子の隙間を通過して深部に到達していくが、薬剤徐放部材1では、第二層20内の薬剤3が溶出すると、図3に示すように、当該薬剤が第二層20内で占有していた空間が間隙Gとなり、溶出後は間隙Gを通って体液等の一部が浸透する。すなわち、第二層20内に配置された薬剤3は、第二層に混合された薬剤の溶出が終わるまでは第一層10への体液等の到達を抑制する抑制部材としても機能する。
【0025】
第二層20内の薬剤が概ね溶出し終わると、体液等は、第二層20に形成された間隙Gと生体適合性基材2の分子の隙間との両方を経路として第一層10内に到達し、第一層10内の薬剤3と接触してこれを溶解する。溶解した薬剤3は、間隙Gと生体適合性基材2の分子の隙間との両方を経路として第二層20を通過して溶出される。
【0026】
本実施形態の薬剤徐放部材1によれば、体液等に先に接触する一方の層(本実施形態における第二層20)が、当該一方の層に混合された薬剤が溶出するまでは、間隙Gを塞ぐ栓として他方の層(本実施形態における第一層10)の薬剤の溶出を抑制し、一方の層に混合された薬剤が溶出した後は、生体適合性基材2に間隙Gが形成され、他方の層の溶出速度を制御するオリフィスとして機能する。
したがって、第一層と第二層のそれぞれにおける薬剤の混合比率やそれぞれの厚さ寸法等を適宜設定することにより、薬剤が溶出される期間や、時系列ごとの溶出量の推移等を所望のパターンに調節することができる。その結果、比較的多量の薬剤を含有しながらも長期間の薬剤徐放を可能とし、且つ使用開始直後の過剰な薬剤放出を避けることができる。
【0027】
一般に、シリコーンエラストマーを基材に使うドラッグデリバリー部材は、マトリックス型とリザーバー型の2つの形態に大別できるとされている。マトリックス型部材は、初期に混合した薬剤の殆どを放出した後、放出量は減少し、さらに漸減する徐放特性を示し、リザーバー型は、初期に急峻な薬剤放出(spike)があり、その後の溶出量が一定となる徐放特性を示すと言われている。
本発明の薬剤徐放部材では、第一層および第二層の構成を適切に設定することにより、上述したマトリックス型の徐放特性とリザーバー型の徐放特性とを併せ持つような薬剤放出特性を得ることも可能になる。
【0028】
本実施形態では、生体適合性基材と粉体または結晶状の薬剤とを混合する例を説明したが、これに代えて、生体適合性基材を多孔体として形成した後に溶液状の薬剤を浸透させ、乾燥することによって基材の孔部内に粉体または結晶状の薬剤を配置することも可能である。
【0029】
生体適合性基材を多孔化して形成する場合には、公知の適宜手段を用いることができるが、一例を挙げると、塩化ナトリウムの粒子を混入した生体適合性基材を硬化させた後に、塩化ナトリウムを洗浄除去する方法がある(例えば、特開2004−195694号公報参照)。
また、レーザー加工によって、硬化済みの生体適合性基材に多数の貫通した細孔を形成しても良い。このような細孔は確実に生体適合性基材を厚さ方向に貫通しているため、より高精度に薬剤の溶出動態等を調節することができる。
【0030】
また、この場合、例えば酢酸デキサメタゾンのように水に溶け難い薬剤を選択するときは、溶解可能な溶媒を選択して溶液状とすればよい。例えばアセトンで当該薬剤を溶解し、多孔化された生体適合性基材の孔内に当該薬剤を留置することができる。このとき、減圧下で生体適合性基材を溶解液に浸漬し、溶媒を充分に揮散させることにより、孔内に結晶体として当該薬剤を配置してもよい。
【0031】
本発明の第二実施形態について、図4を参照して説明する。本実施形態の薬剤徐放部材31と第一実施形態の薬剤徐放部材1との異なるところは、第一層と第二層とで薬剤の粒径(平均粒径)が異なる点である。なお、以降の説明において、既に説明したものと共通する構成については、同一の符号を付して重複する説明を省略する。
【0032】
図4は、薬剤徐放部材31を示す模式図である。第一層32に含まれる薬剤3Aは、第二層20に混合された薬剤3と同一の成分であるが、薬剤3よりも粒径が大きい。第一層32は、上述した方法で第一実施形態の第一層10と同様に形成することができる。
【0033】
本実施形態の薬剤徐放部材31においても、第一実施形態の薬剤徐放部材1と同様に、第一層32と第二層20それぞれにおける薬剤の混合比率やそれぞれの厚さ寸法等を適宜設定することにより、薬剤が溶出される期間や、時系列ごとの溶出量の推移等を所望のパターンに調節することができる。
本実施形態では、第一層の薬剤の粒径がより大きい例を説明したが、第二層の薬剤の粒径がより大きくされてもよい。
【0034】
上述した各実施形態の薬剤徐放部材は、第一層、第二層のいずれが体液等に先に触れるように設置されてもよい。薬剤密度が相対的に低い第二層を体液等に先に触れる外面側にすると、薬剤放出量の立ち上がりが比較的ゆっくりし、放出を長期間持続させやすくなる。一方、薬剤密度が相対的に高いい第一層を外面側にすると、留置後早期に比較的高い薬剤放出量のピークが発生し、放出期間は短くなる傾向を示す。このような放出パターンは、例えば留置後早期に癒着や再狭窄等のリスクが高い時期があり、その後、留置部位の組織が安定してくるような場合に適している。
【0035】
次に、本発明の第三実施形態について、図5から図8を参照して説明する。この実施形態では、本発明の薬剤徐放部材が使用された医療機器の例について説明する。
【0036】
図5は、本実施形態の医療機器である除細動システム51の概略構成を示す図である。除細動システム51は、本発明の薬剤徐放部材が用いられた医療機器であり、除細動のための電気エネルギーを発生する除細動器40と、心臓Htに取り付けられる電極部60と、除細動器40と電極部60とを接続するリード70とを備えている。
【0037】
除細動器40は、電源としての電池、電気エネルギーを蓄えるコンデンサ、心電図を検出する検出回路、心電図にもとづいて心臓の状態を判定する判定回路、コンデンサからのエネルギーを放出する除細動駆動回路等の各種構成(いずれも不図示)を内部に備える。
【0038】
電極部60は、同一の構造を有する第一電極61および第二電極62を備える。図6に示すように、第一電極61は、右室側の心嚢膜Pc上に設置され、第二電極62は、第一電極61と心臓Htを挟んで対向するように、左室側の心嚢膜Pc上に設置される。
【0039】
図7は、第一電極61の拡大図である。第一電極61は、シート状の絶縁部材63と、絶縁部材63に取り付けられた印加リード64とを備えている。
絶縁部材63は、生体適合性の高いシリコーンゴム等からなり、厚さが例えば0.5ミリメートル(mm)程度となるように設定されている。本実施形態では、絶縁部材63は、略小判型に形成されているが、その形状には特に制限はない。
【0040】
印加リード64は、白金系材料、好ましくは白金イリジウム合金の拠線で形成されており、リード70と電気的に接続されている。本実施形態の印加リード64は、心臓の拍動に伴う心嚢膜の絶え間ない形状変化に対応できる程度の可撓性を有するように、例えば、線径φ0.2mm程度の拠線構造とされている。印加リード64は、4箇所の直線部64Aと、曲線部64Bとを有し、直線部64Aが絶縁部材63の一方の面に露出し、曲線部64Bが絶縁部材63内に埋没して体内の臓器に対して絶縁されるように絶縁部材63に取り付けられている。各直線部64Aは、それぞれ4本の拠線からなり、互いに平行に配置されている。直線部64Aを構成するすべての拠線は、曲線部64Bに接続されており、一本の拠線が断線した場合にも、確実に電気エネルギーを心臓に供給できる構成となっている。
【0041】
絶縁部材63において、4箇所の直線部64A間の領域には、絶縁部材の可撓性を高めるとともに心嚢膜との接触面積を減少させるための複数の貫通穴63Aが設けられている。本実施形態では、図2に示すように貫通穴は円形であるが、その形状に制限はない。また、第一電極61や第二電極62が電極として必要な一定の強度を保持できている限り、貫通穴23Aの個数にも制限はない。
第二電極62は、リード70の接続位置等を除き第一電極とほぼ同一の構造であるため、説明を省略するが、上記のように構成された第一電極61および第二電極62は、全体として非常に柔軟性に富んでおり、心嚢膜Pc上に設置されても、心臓Htの拍動を妨げて不整脈を誘発する危険性が少ない硬さとなっている。
【0042】
第一電極61および第二電極62は、心嚢膜Pc上の所望の位置に定位させるために、縫合糸によって、心臓Htの表面を傷つけないように、直線部64Aが露出した面を心嚢膜Pc側に向けた状態で心嚢膜Pcに縫い付けられ係止される。そのため絶縁部材63の外周付近には縫合糸を通すための縫合穴65が4箇所設けられている。
【0043】
図8は、絶縁部材63の拡大断面図である。絶縁部材63の両面には、薬剤徐放部材1が、それぞれ第一層10を絶縁部材63に向けて接合されている。本実施形態における薬剤徐放部材1は、例えば第一層10および第二層20の厚さがそれぞれ0.1mmであり、第一層10と第二層20との薬剤密度の比は、5:1とされている。
薬剤徐放部材1は、直線部64Aが露出する下面側においては縫合孔65の周囲を除く領域を被覆するように接合されており、反対側の上面側においては、絶縁部材63の全面を覆うように取り付けられている。これは、縫合糸によって心嚢膜Pcに縫い付けられた縫合穴65周囲の領域においては、絶縁部材63と心嚢膜Pcとの癒着を妨げないことにより、縫合穴65周囲の領域が心嚢膜Pcと癒着することによる第一電極61および第二電極62の留置状態の安定化を狙うものであるが、これに代えて、縫合穴65周囲の領域にも薬剤徐放部材を配置、縫合に起因する炎症や線維化等の反応を極力抑制することにより留置状態の安定化を狙うアプローチをとることも可能である。
【0044】
リード70は、電気的な絶縁を保って除細動器40から電極部60に電気エネルギーを伝達できるものであれば、その構成は特に限定されない。本実施形態では、例えば、外径φが2mm程度のポリウレタンチューブ内に、中心に銀41%含有の芯線を有するMP35N合金線がコイル状に巻かれた構成となっている。このような構成では、MP35N合金がコイル形状に整形されているため、強い引張り強度と繰返し曲げ強度が実現される。
【0045】
図7に示すように、リード70は、絶縁部材63のうち、上面側から印加リード64の曲線部64Bに接続されている。リード70と印加リード64とは、溶接や機械的なカシメ接続等により強固に固定されており、当該接続部位は、絶縁部材63に被覆されて露出しないようにされている。
【0046】
以上のように構成された除細動システム51においては、心嚢膜Pc上に留置された第一電極61および第二電極62において、絶縁部材63に接合された薬剤徐放部材1から、設定された所定の放出パターンで薬剤3が放出される。放出された薬剤3は、下面側においては、心嚢膜Pcの線維化等を抑制してインピーダンスの上昇による治療に必要な電圧値の上昇を防ぎ、上面側においては肺との繰り返し接触による癒着等を好適に抑制して心臓の拍動に対する悪影響を防ぐ。その結果、体内に長期間留置されても、炎症反応や線維化等を起こしにくく、安全に体内に留置されて確実な治療効果を発揮することができる。
発明者が行った動物実験では、薬剤として酢酸デキサメタゾンを混合した薬剤徐放部材を用いて第一電極と同一の構造を有する構造物を作製し、体内に留置したところ、炎症や線維化の発生を大幅に抑制できることが確認された。
【0047】
本実施形態においては、薬剤を含まない絶縁部材の両面に同一の薬剤徐放部材が貼り付けられた例を説明したが、これに代えて、肺と接する上面側には、親水性を呈するリン脂質系ポリマーやポリビニリルピロリドン、ポリエチレングリコール等が薬剤として混合された薬剤徐放部材を取り付けてもよい。
また、薬剤を含まない絶縁部材を使用する代わりに、第一層の構造を有するシート状の材料で第一電極等の外形を作成し、この両面に第二層の構造を有するシート状の材料を接合してもよい。さらに、第一層を中心部に配置し、側面を含む外面全体が第一層によって被覆された薬剤徐放部材を用いて第一電極等が構成されてもよい。
【0048】
以上、本発明の各実施形態を説明したが、本発明の技術範囲は上記実施形態に限定されるものではなく、本発明の趣旨を逸脱しない範囲において種々の変更を加えることが可能である。
【0049】
例えば、上述の各実施形態では、第一層と第二層とからなる二層構造の薬剤徐放部材を説明したが、三層以上の多層構造とされてもよい。
また、第一層と第二層の生体適合性基材が異なっていてもよい。
【0050】
さらに、上述の各実施形態で説明した各構成の具体的態様は、本発明の趣旨を逸脱しない範囲において構成要素の組み合わせを変えたり、各構成要素に種々の変更を加えたり、削除したりすることが可能である。
【符号の説明】
【0051】
1、31 薬剤徐放部材
2 、3A 薬剤
10、32 第一層
20 第二層
51 除細動システム(医療機器)
【技術分野】
【0001】
本発明は、内部に含まれる薬剤が徐々に放出される薬剤徐放部材、およびこれを用いた医療機器に関する。
【背景技術】
【0002】
従来、体内に留置されて疾病の治療や予防に使用される様々な医療機器が知られている。これらの医療機器は、基本的に生体にとって異物であるため、体内に留置された場合に、炎症や免疫反応を誘発する場合がある。生体はこれに対応するため、当該医療機器の周囲をコラーゲンなどで被包して、線維化により組織と隔離することがある。当該医療機器がペースメーカーのような電気的パルスを発生する治療機器の場合には、機器の周囲で線維化が進行すると、治療に必要な電圧値が上昇する結果、治療が困難になるという問題がある。
【0003】
この問題に対して、医療機器を構成する部材に抗炎症作用や免疫抑制作用を有する薬物を混入し、留置後に当該薬物が体内に徐放されることにより炎症や線維化等を抑制することが試みられている。
例えば、特許文献1には、体液或いは血液に対する溶解性の異なる2種類の薬剤を所定の比率で基材を成すシリコーンゴム中に混入させた薬剤徐放性材料の製法と、当該薬剤徐放性材料を用いたデバイスを開示している。
【0004】
特許文献1に記載の技術では、共通なデキサメタゾン核を有する2種類のステロイド剤として、リン酸デキサメタゾンと酢酸デキサメタゾンを或る比率でシリコーンゴム中に混合して徐放性材料を形成している。この材料が体液或いは血液との接触する初期段階においては、水溶性のリン酸デキサメタゾンが主に溶出し、その後、水に対する溶解性の低い酢酸デキサメタゾンが長期に渡って溶出したとされている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許第4545315号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、本発明人の行った実験では、酢酸デキサメタゾンの粉末を医療用グレードシリコーンゴム(Dow Corning Silastic Q7-4840)に混合し硬化させたサンプルを、生理的食塩水に浸漬して37℃の温度環境下かつ還流を行わない条件下で同薬剤の溶出量を計測したところ、浸漬後24時間で総溶出量の60%が溶け出し、1週間以降は溶出がほぼ止まることが確認された。
【0007】
すなわち、治療用デバイスの少なくとも一部を構成するシリコーンゴムにステロイド剤を混入し、所望の抗炎症効果を得ようとする場合、ステロイド剤の溶出は、ステロイド剤自身の体液や血液に対する溶解性と、シリコーンゴム表面近傍での密度に主に依存することになる。したがって、より長い期間ステロイドを放出させようとして、ステロイド−シリコーンゴム混合物の厚さを増すだけでは溶出時間を延ばすことには繋がらないことがわかった。また、単純にステロイドの混合比を高めることは、初期の溶出量を増やすだけであり、薬剤量が過剰となることによる副作用の懸念を伴うことになるという問題もある。
したがって、特許文献1に記載の手法をもって、水に溶け難い薬剤を混入して長期間の放出を目論んでも、結果的に基材の表層付近の薬剤が水溶性の薬剤に遅れて溶解するだけで、例えば1週間を超える期間の薬剤放出を期待することは難しく、上記問題を完全に解決することは難しいことがわかった。
【0008】
本発明は、上述したような事情に鑑みてなされたものであって、長期間の薬剤徐放を可能とし、且つ使用開始直後の過剰な薬剤放出を避けることが可能な、薬剤徐放部材を提供することを目的とする。
本発明の他の目的は、体内に長期間留置されても、炎症反応や線維化等を起こしにくい医療機器を提供することである。
【課題を解決するための手段】
【0009】
本発明の第一の態様である薬剤徐放部材は、生体適合性基材と薬剤とが混合されて形成された第一層と、生体適合性基材と前記薬剤とが混合されて形成され、前記薬剤の密度が前記第一層よりも低い第二層とを備えることを特徴とする。
【0010】
前記第一層の薬剤密度は、前記第二層の薬剤密度の2倍以上であってもよい。
また、前記第一層の表面全体が前記第二層に被覆されていてもよい。
【0011】
本発明の第二の態様である医療機器は、本発明の薬剤徐放部材を備える医療機器であって、前記薬剤徐放部材が、前記医療機器のうち、生体組織に接触する部位の少なくとも一部に配置されていることを特徴とする。
【発明の効果】
【0012】
本発明の薬剤徐放部材によれば、長期間の薬剤徐放を可能とし、且つ使用開始直後の過剰な薬剤放出を避けることができる。
本発明の医療機器によれば、体内に長期間留置されても、炎症反応や線維化等を起こしにくい医療機器医療機器とすることができる。
【図面の簡単な説明】
【0013】
【図1】本発明の第一実施形態の薬剤徐放部材を示す模式図である。
【図2】医療機器の表面に同薬剤徐放部材の第一層を接触させて取り付けた状態を示す図である。
【図3】同薬剤徐放部材における薬剤の放出態様を示す図である。
【図4】本発明の第二実施形態の薬剤徐放部材を示す模式図である。
【図5】本発明の第三実施形態の除細動システムを示す斜視図である。
【図6】同除細動システムの電極部の設置態様を示す図である。
【図7】同電極部の第一電極を示す拡大図である。
【図8】同電極部の絶縁部材の拡大断面図である。
【発明を実施するための形態】
【0014】
本発明の第一実施形態について、図1から図3を参照して説明する。図1は、本実施形態の薬剤徐放部材1を示す模式図である。なお、本願の図面では、構造をわかりやすくするため、薬剤の粒子等を実際の寸法よりも大きく示している。
【0015】
薬剤徐放部材1は、生体適合性基材2と徐放させる薬剤3とを混合して形成されており、薬剤3の密度が相対的に高い第一層10と、薬剤3の密度が相対的に低い第二層20とを備えている。
生体適合性基材2としては、例えば医療用グレードの液状シリコーンゴム(LSR)或いは高粘度シリコーンゴム(HCR)が使用可能である。例えばダウ・コーニング社の商品名Silastic Q7などが利用可能である。薬剤徐放部材1の体内留置時における体液や血液の浸透と、これらの水性液との接触をより容易に得ようとするならば、より分子量が低く、架橋密度の低いシリコーンゴムの選択が好適である。例えば、薬剤デリバリー用として市販されているNuSil Technology社のDDU-4330やDDU-4340などのシリコーンゴムの選択により、Silastic Q7などのシリコーンゴムに対して、水性液の透水率(透水量に対する材料の重量比)を、70%程度向上させることが期待できるため、より容易に薬剤徐放部材1を製造することができる。
【0016】
徐放させる薬剤は、留置時に得ようとする効果により適宜決定される。例えば、炎症や線維化反応を抑制する目的であれば、ステロイド剤、免疫抑制剤、抗生物質等から適宜選択すればよい。
ステロイド剤としては、公知の各種化合物を用いることができる。具体例としては、デキサメタゾン、ベクロメタゾン、べタメタゾン、メチルプレドニゾロン、プレドニゾロン、トリアムシロン、パラメタゾン、フルオシノロンアセトニド、クロベタゾン、ジフロラゾン、ジフルコルトロン、フルオシノニド、ヒドロコルチゾン、ジフルプレドナード、ヒドロコルチゾン、フルオキシノロン、アルクロメタゾン、アムシノニド、クロコルトロン、デスオキシメタゾン等が挙げられる。
例えばリン酸デキサメタゾンや酢酸デキサメタゾン、ジプロピオン酸ベクロメタゾンのように、前述の薬剤をリン酸塩、酢酸塩、硫酸塩などの形で使用すると、水に対する溶解性が変化し、溶出速度の調節が可能である。
【0017】
免疫抑制剤としては、例えば、シロリムス、タクロリムス水和物、アザチオプリン、シクロスポリン、ミコフェノール酸モフェチル、塩酸グスペリウム、ミゾリビン等を挙げることができる。
抗生物質としては、例えば、ゲンタマイシン、マイトマイシンC、塩酸ドキソルビシン、アクチノマイシンD、塩酸ダウノルビシン、塩酸イダルビシン、塩酸ピラルビシン、塩酸アクラルビシン、塩酸エピルビシン、塩酸ペプロマイシン、ジノスタンチスチマラマー等を挙げることができる。
【0018】
薬剤徐放部材1が血液と接触する医療機器に適用される場合は、当該医療機器表面での血栓形成を抑制する目的でヘパリンナトリウムなどの抗凝固作用や抗血栓作用を有する薬剤を混合してもよい。ヘパリンナトリウムは熱にあまり強くないが、常温硬化型のシリコーンゴムを選択することによって、薬効を損なうことなく、本発明の薬剤徐放部材に適用することが可能である。
医療機器が血管内或いは心臓内に留置される場合には、当該医療機器表面から溶出した薬剤は血流によって医療機器表面から流失し、例えば医療機器表面での血栓形成を抑制する目的で抗凝固薬等をシリコーンゴムに混入しても、所望の効果が得られないことになるが、本発明の構成によって、抗凝固薬等を長期にわたって放出することが可能となる。
【0019】
第一層10および第二層20は、生体適合性基材と、粉体または結晶状の薬剤とを混練等により混合した後、硬化処理を行ってシート状等の所定の形状に成形することにより、作製することができる。
上述したシリコーンゴムは、いずれも硬化処理において概ね160℃前後まで加熱されるが、例えば、分解温度が200℃を超えるリン酸デキサメタゾンや酢酸デキサメタゾン等であれば、混合して硬化処理を行っても、その薬効が損なわれることはない。
【0020】
分解温度が比較的低く、高温に弱い薬剤を使用する場合は、室温硬化型(RTV)のシリコーンゴムを基材として用いればよい。このようなシリコーンゴムとしては例えばNuSil Technology社のDDU-4351やDDU-4340等を挙げることができる。これらのシリコーンRTVゴムは、硬化温度が23℃と低く、高温に弱い薬剤でも問題なく混合できる。また、担持された薬剤が硬化したシリコーンゴム分子の網目を通過して放出されやすいため、短時間により多くの薬剤放出が望まれる場合等に適している。
【0021】
第一層10と第二層20とは、基材2に対する薬剤3の混合比率(薬剤密度)のみ異なっており、生体適合性基材2およびその製造手順は同一である。作成した第一層10と第二層20とを加熱処理等により一体に接合すると、薬剤徐放部材1が完成する。また、公知の二色成形技術等により、第一層10および第二層20を一体的に形成してもよい。
【0022】
薬剤徐放部材1は、いずれか一方の層を医療機器に接触させて貼り付け、当該医療機器の表面を被覆することにより、当該医療機器の生体適合性を高めたり、血栓形成を抑制したりすることができる。また、詳しくは後述するが、薬剤徐放部材を用いて医療機器の一部を形成することも可能である。
【0023】
薬剤徐放部材1の作用について説明する。図2は、医療機器MDの表面に、薬剤徐放部材1の第一層10を接触させて取り付けた状態を示している。この場合は、第一層10は深部に配置されて直接組織、体液、血液等(以下、「体液等」と総称することがある。)には接触せず、第二層20が医療機器MDの体内留置時に体液等と接触する。すると、まず、第二層20に混合された薬剤3が、表層に近いものから順に溶出し、医療機器MDの周囲で薬効を発揮する。
【0024】
シリコーンゴム等の生体適合性基材2に体液等が浸透する場合、通常は、生体適合性基材の分子の隙間を通過して深部に到達していくが、薬剤徐放部材1では、第二層20内の薬剤3が溶出すると、図3に示すように、当該薬剤が第二層20内で占有していた空間が間隙Gとなり、溶出後は間隙Gを通って体液等の一部が浸透する。すなわち、第二層20内に配置された薬剤3は、第二層に混合された薬剤の溶出が終わるまでは第一層10への体液等の到達を抑制する抑制部材としても機能する。
【0025】
第二層20内の薬剤が概ね溶出し終わると、体液等は、第二層20に形成された間隙Gと生体適合性基材2の分子の隙間との両方を経路として第一層10内に到達し、第一層10内の薬剤3と接触してこれを溶解する。溶解した薬剤3は、間隙Gと生体適合性基材2の分子の隙間との両方を経路として第二層20を通過して溶出される。
【0026】
本実施形態の薬剤徐放部材1によれば、体液等に先に接触する一方の層(本実施形態における第二層20)が、当該一方の層に混合された薬剤が溶出するまでは、間隙Gを塞ぐ栓として他方の層(本実施形態における第一層10)の薬剤の溶出を抑制し、一方の層に混合された薬剤が溶出した後は、生体適合性基材2に間隙Gが形成され、他方の層の溶出速度を制御するオリフィスとして機能する。
したがって、第一層と第二層のそれぞれにおける薬剤の混合比率やそれぞれの厚さ寸法等を適宜設定することにより、薬剤が溶出される期間や、時系列ごとの溶出量の推移等を所望のパターンに調節することができる。その結果、比較的多量の薬剤を含有しながらも長期間の薬剤徐放を可能とし、且つ使用開始直後の過剰な薬剤放出を避けることができる。
【0027】
一般に、シリコーンエラストマーを基材に使うドラッグデリバリー部材は、マトリックス型とリザーバー型の2つの形態に大別できるとされている。マトリックス型部材は、初期に混合した薬剤の殆どを放出した後、放出量は減少し、さらに漸減する徐放特性を示し、リザーバー型は、初期に急峻な薬剤放出(spike)があり、その後の溶出量が一定となる徐放特性を示すと言われている。
本発明の薬剤徐放部材では、第一層および第二層の構成を適切に設定することにより、上述したマトリックス型の徐放特性とリザーバー型の徐放特性とを併せ持つような薬剤放出特性を得ることも可能になる。
【0028】
本実施形態では、生体適合性基材と粉体または結晶状の薬剤とを混合する例を説明したが、これに代えて、生体適合性基材を多孔体として形成した後に溶液状の薬剤を浸透させ、乾燥することによって基材の孔部内に粉体または結晶状の薬剤を配置することも可能である。
【0029】
生体適合性基材を多孔化して形成する場合には、公知の適宜手段を用いることができるが、一例を挙げると、塩化ナトリウムの粒子を混入した生体適合性基材を硬化させた後に、塩化ナトリウムを洗浄除去する方法がある(例えば、特開2004−195694号公報参照)。
また、レーザー加工によって、硬化済みの生体適合性基材に多数の貫通した細孔を形成しても良い。このような細孔は確実に生体適合性基材を厚さ方向に貫通しているため、より高精度に薬剤の溶出動態等を調節することができる。
【0030】
また、この場合、例えば酢酸デキサメタゾンのように水に溶け難い薬剤を選択するときは、溶解可能な溶媒を選択して溶液状とすればよい。例えばアセトンで当該薬剤を溶解し、多孔化された生体適合性基材の孔内に当該薬剤を留置することができる。このとき、減圧下で生体適合性基材を溶解液に浸漬し、溶媒を充分に揮散させることにより、孔内に結晶体として当該薬剤を配置してもよい。
【0031】
本発明の第二実施形態について、図4を参照して説明する。本実施形態の薬剤徐放部材31と第一実施形態の薬剤徐放部材1との異なるところは、第一層と第二層とで薬剤の粒径(平均粒径)が異なる点である。なお、以降の説明において、既に説明したものと共通する構成については、同一の符号を付して重複する説明を省略する。
【0032】
図4は、薬剤徐放部材31を示す模式図である。第一層32に含まれる薬剤3Aは、第二層20に混合された薬剤3と同一の成分であるが、薬剤3よりも粒径が大きい。第一層32は、上述した方法で第一実施形態の第一層10と同様に形成することができる。
【0033】
本実施形態の薬剤徐放部材31においても、第一実施形態の薬剤徐放部材1と同様に、第一層32と第二層20それぞれにおける薬剤の混合比率やそれぞれの厚さ寸法等を適宜設定することにより、薬剤が溶出される期間や、時系列ごとの溶出量の推移等を所望のパターンに調節することができる。
本実施形態では、第一層の薬剤の粒径がより大きい例を説明したが、第二層の薬剤の粒径がより大きくされてもよい。
【0034】
上述した各実施形態の薬剤徐放部材は、第一層、第二層のいずれが体液等に先に触れるように設置されてもよい。薬剤密度が相対的に低い第二層を体液等に先に触れる外面側にすると、薬剤放出量の立ち上がりが比較的ゆっくりし、放出を長期間持続させやすくなる。一方、薬剤密度が相対的に高いい第一層を外面側にすると、留置後早期に比較的高い薬剤放出量のピークが発生し、放出期間は短くなる傾向を示す。このような放出パターンは、例えば留置後早期に癒着や再狭窄等のリスクが高い時期があり、その後、留置部位の組織が安定してくるような場合に適している。
【0035】
次に、本発明の第三実施形態について、図5から図8を参照して説明する。この実施形態では、本発明の薬剤徐放部材が使用された医療機器の例について説明する。
【0036】
図5は、本実施形態の医療機器である除細動システム51の概略構成を示す図である。除細動システム51は、本発明の薬剤徐放部材が用いられた医療機器であり、除細動のための電気エネルギーを発生する除細動器40と、心臓Htに取り付けられる電極部60と、除細動器40と電極部60とを接続するリード70とを備えている。
【0037】
除細動器40は、電源としての電池、電気エネルギーを蓄えるコンデンサ、心電図を検出する検出回路、心電図にもとづいて心臓の状態を判定する判定回路、コンデンサからのエネルギーを放出する除細動駆動回路等の各種構成(いずれも不図示)を内部に備える。
【0038】
電極部60は、同一の構造を有する第一電極61および第二電極62を備える。図6に示すように、第一電極61は、右室側の心嚢膜Pc上に設置され、第二電極62は、第一電極61と心臓Htを挟んで対向するように、左室側の心嚢膜Pc上に設置される。
【0039】
図7は、第一電極61の拡大図である。第一電極61は、シート状の絶縁部材63と、絶縁部材63に取り付けられた印加リード64とを備えている。
絶縁部材63は、生体適合性の高いシリコーンゴム等からなり、厚さが例えば0.5ミリメートル(mm)程度となるように設定されている。本実施形態では、絶縁部材63は、略小判型に形成されているが、その形状には特に制限はない。
【0040】
印加リード64は、白金系材料、好ましくは白金イリジウム合金の拠線で形成されており、リード70と電気的に接続されている。本実施形態の印加リード64は、心臓の拍動に伴う心嚢膜の絶え間ない形状変化に対応できる程度の可撓性を有するように、例えば、線径φ0.2mm程度の拠線構造とされている。印加リード64は、4箇所の直線部64Aと、曲線部64Bとを有し、直線部64Aが絶縁部材63の一方の面に露出し、曲線部64Bが絶縁部材63内に埋没して体内の臓器に対して絶縁されるように絶縁部材63に取り付けられている。各直線部64Aは、それぞれ4本の拠線からなり、互いに平行に配置されている。直線部64Aを構成するすべての拠線は、曲線部64Bに接続されており、一本の拠線が断線した場合にも、確実に電気エネルギーを心臓に供給できる構成となっている。
【0041】
絶縁部材63において、4箇所の直線部64A間の領域には、絶縁部材の可撓性を高めるとともに心嚢膜との接触面積を減少させるための複数の貫通穴63Aが設けられている。本実施形態では、図2に示すように貫通穴は円形であるが、その形状に制限はない。また、第一電極61や第二電極62が電極として必要な一定の強度を保持できている限り、貫通穴23Aの個数にも制限はない。
第二電極62は、リード70の接続位置等を除き第一電極とほぼ同一の構造であるため、説明を省略するが、上記のように構成された第一電極61および第二電極62は、全体として非常に柔軟性に富んでおり、心嚢膜Pc上に設置されても、心臓Htの拍動を妨げて不整脈を誘発する危険性が少ない硬さとなっている。
【0042】
第一電極61および第二電極62は、心嚢膜Pc上の所望の位置に定位させるために、縫合糸によって、心臓Htの表面を傷つけないように、直線部64Aが露出した面を心嚢膜Pc側に向けた状態で心嚢膜Pcに縫い付けられ係止される。そのため絶縁部材63の外周付近には縫合糸を通すための縫合穴65が4箇所設けられている。
【0043】
図8は、絶縁部材63の拡大断面図である。絶縁部材63の両面には、薬剤徐放部材1が、それぞれ第一層10を絶縁部材63に向けて接合されている。本実施形態における薬剤徐放部材1は、例えば第一層10および第二層20の厚さがそれぞれ0.1mmであり、第一層10と第二層20との薬剤密度の比は、5:1とされている。
薬剤徐放部材1は、直線部64Aが露出する下面側においては縫合孔65の周囲を除く領域を被覆するように接合されており、反対側の上面側においては、絶縁部材63の全面を覆うように取り付けられている。これは、縫合糸によって心嚢膜Pcに縫い付けられた縫合穴65周囲の領域においては、絶縁部材63と心嚢膜Pcとの癒着を妨げないことにより、縫合穴65周囲の領域が心嚢膜Pcと癒着することによる第一電極61および第二電極62の留置状態の安定化を狙うものであるが、これに代えて、縫合穴65周囲の領域にも薬剤徐放部材を配置、縫合に起因する炎症や線維化等の反応を極力抑制することにより留置状態の安定化を狙うアプローチをとることも可能である。
【0044】
リード70は、電気的な絶縁を保って除細動器40から電極部60に電気エネルギーを伝達できるものであれば、その構成は特に限定されない。本実施形態では、例えば、外径φが2mm程度のポリウレタンチューブ内に、中心に銀41%含有の芯線を有するMP35N合金線がコイル状に巻かれた構成となっている。このような構成では、MP35N合金がコイル形状に整形されているため、強い引張り強度と繰返し曲げ強度が実現される。
【0045】
図7に示すように、リード70は、絶縁部材63のうち、上面側から印加リード64の曲線部64Bに接続されている。リード70と印加リード64とは、溶接や機械的なカシメ接続等により強固に固定されており、当該接続部位は、絶縁部材63に被覆されて露出しないようにされている。
【0046】
以上のように構成された除細動システム51においては、心嚢膜Pc上に留置された第一電極61および第二電極62において、絶縁部材63に接合された薬剤徐放部材1から、設定された所定の放出パターンで薬剤3が放出される。放出された薬剤3は、下面側においては、心嚢膜Pcの線維化等を抑制してインピーダンスの上昇による治療に必要な電圧値の上昇を防ぎ、上面側においては肺との繰り返し接触による癒着等を好適に抑制して心臓の拍動に対する悪影響を防ぐ。その結果、体内に長期間留置されても、炎症反応や線維化等を起こしにくく、安全に体内に留置されて確実な治療効果を発揮することができる。
発明者が行った動物実験では、薬剤として酢酸デキサメタゾンを混合した薬剤徐放部材を用いて第一電極と同一の構造を有する構造物を作製し、体内に留置したところ、炎症や線維化の発生を大幅に抑制できることが確認された。
【0047】
本実施形態においては、薬剤を含まない絶縁部材の両面に同一の薬剤徐放部材が貼り付けられた例を説明したが、これに代えて、肺と接する上面側には、親水性を呈するリン脂質系ポリマーやポリビニリルピロリドン、ポリエチレングリコール等が薬剤として混合された薬剤徐放部材を取り付けてもよい。
また、薬剤を含まない絶縁部材を使用する代わりに、第一層の構造を有するシート状の材料で第一電極等の外形を作成し、この両面に第二層の構造を有するシート状の材料を接合してもよい。さらに、第一層を中心部に配置し、側面を含む外面全体が第一層によって被覆された薬剤徐放部材を用いて第一電極等が構成されてもよい。
【0048】
以上、本発明の各実施形態を説明したが、本発明の技術範囲は上記実施形態に限定されるものではなく、本発明の趣旨を逸脱しない範囲において種々の変更を加えることが可能である。
【0049】
例えば、上述の各実施形態では、第一層と第二層とからなる二層構造の薬剤徐放部材を説明したが、三層以上の多層構造とされてもよい。
また、第一層と第二層の生体適合性基材が異なっていてもよい。
【0050】
さらに、上述の各実施形態で説明した各構成の具体的態様は、本発明の趣旨を逸脱しない範囲において構成要素の組み合わせを変えたり、各構成要素に種々の変更を加えたり、削除したりすることが可能である。
【符号の説明】
【0051】
1、31 薬剤徐放部材
2 、3A 薬剤
10、32 第一層
20 第二層
51 除細動システム(医療機器)
【特許請求の範囲】
【請求項1】
生体適合性基材と薬剤とが混合されて形成された第一層と、
生体適合性基材と前記薬剤とが混合されて形成され、前記薬剤の密度が前記第一層よりも低い第二層と、
を備えることを特徴とする薬剤徐放部材。
【請求項2】
前記第一層の薬剤密度は、前記第二層の薬剤密度の2倍以上であることを特徴とする請求項1に記載の薬剤徐放部材。
【請求項3】
前記第一層の表面全体が前記第二層に被覆されていることを特徴とする請求項1または2に記載の薬剤徐放部材。
【請求項4】
請求項1から3のいずれか一項に記載の薬剤徐放部材を備える医療機器であって、
前記薬剤徐放部材は、前記医療機器のうち、生体組織に接触する部位の少なくとも一部に配置されていることを特徴とする医療機器。
【請求項1】
生体適合性基材と薬剤とが混合されて形成された第一層と、
生体適合性基材と前記薬剤とが混合されて形成され、前記薬剤の密度が前記第一層よりも低い第二層と、
を備えることを特徴とする薬剤徐放部材。
【請求項2】
前記第一層の薬剤密度は、前記第二層の薬剤密度の2倍以上であることを特徴とする請求項1に記載の薬剤徐放部材。
【請求項3】
前記第一層の表面全体が前記第二層に被覆されていることを特徴とする請求項1または2に記載の薬剤徐放部材。
【請求項4】
請求項1から3のいずれか一項に記載の薬剤徐放部材を備える医療機器であって、
前記薬剤徐放部材は、前記医療機器のうち、生体組織に接触する部位の少なくとも一部に配置されていることを特徴とする医療機器。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−224585(P2012−224585A)
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願番号】特願2011−94292(P2011−94292)
【出願日】平成23年4月20日(2011.4.20)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願日】平成23年4月20日(2011.4.20)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

