薬剤感受性試験方法及び装置
【課題】対象とする細胞の活性を抑制する効果のない薬剤を排除するのに有効なだけではなく、効果のある薬剤を選択するのを容易とすることのできる薬剤感受性試験方法及び装置を提供する。
【解決手段】薬剤感受性試験方法は、測定容器内に収容された培地中に配置された複数の電極のうち少なくとも1つの電極の表面において細胞を培養すると共に、該培養の間に複数の電極間に所定の電圧を印加してインピーダンスに係る情報を連続的に測定することを、次の条件、(a)培養の間における培地への試験対象薬剤の添加量、(b)培地に添加する試験対象薬剤の種類、(c)前記培養の開始から前記培地への試験対象薬剤の添加までの経過時間、(d)前記培養の間において前記培地へ順に添加する複数種類の試験対象薬剤の添加順序、のうちの少なくとも1つ異ならせてそれぞれ行い、当該条件の違いによる前記インピーダンスに係る情報の経時変化の差異を明示するようにする。
【解決手段】薬剤感受性試験方法は、測定容器内に収容された培地中に配置された複数の電極のうち少なくとも1つの電極の表面において細胞を培養すると共に、該培養の間に複数の電極間に所定の電圧を印加してインピーダンスに係る情報を連続的に測定することを、次の条件、(a)培養の間における培地への試験対象薬剤の添加量、(b)培地に添加する試験対象薬剤の種類、(c)前記培養の開始から前記培地への試験対象薬剤の添加までの経過時間、(d)前記培養の間において前記培地へ順に添加する複数種類の試験対象薬剤の添加順序、のうちの少なくとも1つ異ならせてそれぞれ行い、当該条件の違いによる前記インピーダンスに係る情報の経時変化の差異を明示するようにする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、薬剤感受性試験方法及び装置に関するものであり、より詳細には、インピーダンス測定に基づき細胞の増殖過程の変化を連続的に測定することによって、例えば、抗がん剤感受性などの細胞の薬剤感受性を試験する薬剤感受性試験方法及び装置に関するものである。
【背景技術】
【0002】
従来、がんの治療薬として抗がん剤が使用されている。現状では、殆どの場合、投与される抗がん剤の種類や量、又はその投与時間などの決定は、学術的な一般見解と担当医の経験によるところが大きい。しかし、抗がん剤の効果は個人差により大きく違うことがあり、一般的に使用されている抗がん剤が、特定の患者において効かない場合も多い。
【0003】
そこで、高度先進医療として、患者に抗がん剤を投与する前に「抗がん剤感受性試験」を行うケースがある。患者から摘出したがん細胞を培養しながら、様々な抗がん剤と反応させ、より効く抗がん剤を選択しようと考えられた方法である。
【0004】
従来の一般的な抗がん剤感受性試験方法は、抗がん剤とがん細胞とを決められた時間反応させ、その間に死んだ細胞の割合で薬の効きを評価している。
【0005】
即ち、既存の抗がん剤感受性試験であるSDI(Succinic Dehydrogenase Inhibition:コハク酸脱水素酵素活性)法、HDRA(Histoculture Drug Response Assay:固形がん組織培養薬剤感受性試験)法、CD−DST(Collagen Gel Droplet Embedded Culture Drug Sensitivity Test:コラーゲンゲル包埋培養薬剤感受性試験)法などでは、がん細胞(がん組織)と抗がん剤との反応を、エンドポイント(薬と細胞の反応後)で評価している(例えば、特許文献1)。
【0006】
従来の抗がん剤感受性試験の手順の概略を示せば次の通りである。
1.患者からがん組織を採取する。
2.必要に応じてがん組織をばらばらにし、がん細胞とする。
3.培養プレートにがん細胞を播種し、接着・伸展するまで細胞を培養する。
4.培養後、数種類の抗がん剤を細胞に曝露させ数日間培養する。
5.反応終了後、抗がん剤の効果を、試薬を用いてがん細胞の生存率を測定することで判定する。
【0007】
抗がん剤感受性試験を行うことで、対象とするがん細胞に効かない抗がん剤を排除することができる。
【0008】
一方、従来、インピーダンス測定に基づいて細胞の増殖などの細胞の活性を測定する方法がある(特許文献2)。
【特許文献1】特開2003−9853号公報
【特許文献2】特開2005−80522号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
従来の抗がん剤感受性試験では、対象とするがん細胞に効かない抗がん剤は排除できるが、効く薬を選択することは難しいと言われている。対象とするがん細胞に効かない抗がん剤は実験後のがん細胞の生存数から判明するが、途中経過から抗がん剤の効果を評価することができないためである。
【0010】
つまり、従来の抗がん剤感受性試験は、全てエンドポイント(細胞と抗がん剤との反応が終了した時点での値)のみで評価するものであり、薬の効く時間や効き方(すぐに効くのかゆっくり効くのか)などを調べることは困難であった。
【0011】
又、一般に、抗がん剤感受性試験において使用する抗がん剤の濃度は、実際に人に使用する体内濃度と大きく異なっているため、このことからも、従来の抗がん剤感受性試験では、対象とするがん細胞に効く抗がん剤を見つけることが難しくなっている。
【0012】
従って、本発明の目的は、対象とする細胞の活性を抑制する効果のない薬剤を排除するのに有効なだけではなく、効果のある薬剤を選択するのを容易とすることのできる薬剤感受性試験方法及び装置を提供することである。
【課題を解決するための手段】
【0013】
上記目的は本発明に係る薬剤感受性試験方法及び装置にて達成される。要約すれば、本発明は、測定容器内に収容された培地中に配置された複数の電極のうち少なくとも1つの電極の表面において細胞を培養すると共に、該培養の間に前記複数の電極間に所定の電圧を印加してインピーダンスに係る情報を連続的に測定することを、次の条件、(a)前記培養の間における前記培地への試験対象薬剤の添加量、(b)前記培地に添加する試験対象薬剤の種類、(c)前記培養の開始から前記培地への試験対象薬剤の添加までの経過時間、(d)前記培養の間において前記培地へ順に添加する複数種類の試験対象薬剤の添加順序、のうちの少なくとも1つを異ならせてそれぞれ行い、当該条件の違いによる前記インピーダンスに係る情報の経時変化の差異を明示することを特徴とする薬剤感受性試験方法である。
【0014】
本発明の他の態様によると、複数の電極が配置された測定容器と;前記複数の電極間に電圧を印加してインピーダンスに係る情報を検出する検出器と;前記検出器の検出結果に基づいて前記インピーダンスに係る情報を記憶する記憶手段と;前記記憶手段に記憶された前記インピーダンスに係る情報に基づいて処理を実行する処理装置と;前記処理装置による処理結果を出力するための出力手段と;を有し、前記処理装置は、前記測定容器内に収容された培地中に配置された前記複数の電極のうち少なくとも1つの電極の表面において細胞を培養している間に前記検出器によって連続的に測定されて前記記憶手段に記憶された前記インピーダンスに係る情報であって、次の条件、(a)前記培養の間における前記培地への試験対象薬剤の添加量、(b)前記培地に添加する試験対象薬剤の種類(c)前記培養の開始から前記培地への試験対象薬剤の添加までの経過時間、(d)前記培養の間において前記培地へ順に添加する複数種類の試験対象薬剤の添加順序、のうちの少なくとも1つを異ならせてそれぞれ記憶された情報に基づいて、当該条件の違いによる前記インピーダンスに係る情報の経時変化の差異を明示するための処理を実行することを特徴とする薬剤感受性試験装置が提供される。
【0015】
本発明の一実施態様によると、前記インピーダンスに係る情報の経時変化を示す曲線を対比可能なように出力することにより前記差異を明示することができる。
【0016】
本発明の他の実施態様によると、前記インピーダンスに係る情報の経時変化の差異として、前記インピーダンスに係る情報の経時変化を示す曲線における、所定時間経過後の傾きの差異を明示する。この場合、前記傾きを対比可能なように出力することにより前記差異を明示することができる。
【0017】
典型的な一実施態様では、前記細胞は、がん細胞であり、又、前記試験対象薬剤は、抗がん剤である。
【発明の効果】
【0018】
本発明によれば、対象とする細胞の活性を抑制する効果のない薬剤を排除するのに有効なだけではなく、効果のある薬剤を選択するのを容易とすることができる。
【発明を実施するための最良の形態】
【0019】
以下、本発明に係る薬剤感受性試験方法及び装置を図面に則して更に詳しく説明する。
【0020】
実施例1
(1)薬剤感受性試験方法
本発明によれば、概して、薬剤による細胞の増殖過程の変化を、インピーダンス測定に基づいて連続的に測定できるようにする。
【0021】
つまり、本発明の薬剤感受性試験方法では、測定容器内に収容された培地中に配置された複数の電極のうち少なくとも1つの電極の表面において細胞を培養すると共に、該培養の間に複数の電極間に所定の電圧を印加してインピーダンスに係る情報を連続的に測定する。このような測定を、次の条件、(a)培養の間における培地への試験対象薬剤の添加量、(b)培地に添加する試験対象薬剤の種類、(c)培養の開始から培地への試験対象薬剤の添加までの経過時間、(d)培養の間において培地へ順に添加する複数種類の試験対象薬剤の添加順序、のうちの少なくとも1つを異ならせてそれぞれ行う。そして、当該条件の違いによる上記インピーダンスに係る情報の経時変化の差異を明示する。
【0022】
ここで、典型的には、試験対象薬剤の添加量の違いとして、少なくとも薬剤を添加しない場合(即ち、添加量はゼロ)と、ある量の薬剤を添加した場合とについての上記インピーダンスに係る情報の経時変化の差異を明示する。又、試験対象薬剤のゼロではない添加量を変更して、そのゼロではない添加量の違いによる上記インピーダンスに係る情報の経時変化の差異を明示することができる。又、複数種類の試験対象薬剤を用いて測定を行うことによって、試験対象薬剤の種類の違いによる上記インピーダンスに係る情報の経時変化の差異を明示することができる。更に、試験対象薬剤を添加するまでの時間や複数種類の試験対象薬剤の添加順序を異ならせて、その違いによるインピーダンスに係る情報の経時変化の差異を明示することができる。
【0023】
インピーダンスに係る情報の経時変化の差異の明示としては、測定結果に係る数値自体を対比可能なように出力すること、測定結果に係る数値をグラフ化して対比可能なように出力することが含まれる。典型的には、単にインピーダンスに係る情報の経時変化を示す曲線をグラフ化して対比可能なように出力することによって斯かる差異を明示することができる。又、インピーダンスに係る情報の経時変化を示す曲線における、所定時間経過後の傾きの差異を、その傾きを示す数値自体を対比可能なように出力すること、或いはその傾きを示す直線などをグラフ化して対比可能なように出力することなどによって、インピーダンスに係る情報の経時変化の差異として明示することができる。上記出力としては、ディスプレイ装置での表示、プリンタによる印刷(プリンタ)などを好適に用いることができる。
【0024】
試験に用いられる細胞は、典型的には、生体内(より詳細にはヒトを含む哺乳動物体内)で増殖した臓器、組織などの生体組織に由来する細胞であって、好ましくは、がん細胞である。しかし、試験に用いられる細胞は、正常組織に由来する細胞であってもよい。特に、本発明では、細胞を電極の表面に接着させて培養し、培養を行っている間にその電極を介して検出されるインピーダンスに係る情報の変化を連続的に測定することから、試験に用いられる細胞は、接着依存性増殖をするものである。
【0025】
がん細胞としては、臨床的にはヒトの細胞が用いられるが、薬剤スクリーニングなどの前臨床的目的でマウス、ラットなどの動物細胞を用いることもできる。がん細胞としては、限定されるものではないが、肝臓がん、肺がん、胃がん、大腸がん、卵巣がん、脳腫瘍、乳がん、前立腺がん、皮膚がん及び白血病細胞(血液がん)などのがん細胞が挙げられる。
【0026】
又、試験対象となる薬剤は、典型的には、試験に用いられる細胞の活性を抑制する効果が期待される薬剤であって、特に、試験に用いられる細胞ががん細胞である場合には、抗がん剤である。抗がん剤には、抗がん作用、即ち、がん細胞の増殖活性を抑制する(がん細胞を殺す)効果が期待される、既知の又は未知の薬剤が広く含まれる。抗がん剤としては、作用機序によって様々なものが知られているが、本発明はいずれのものにも適用することができる。
【0027】
尚、効果が期待される薬剤には、実際に同種の細胞に対して効果が得られた実績のある薬剤のみならず、当該効果の有無を確認するために試験される薬剤をも含まれる。
【0028】
試験に使用される細胞は、典型的には、生体から採取された臓器、組織などの生体組織の一部から取り出される。生体から採用した生体組織の一部は、必要に応じて、細かくして液体中に分散させる分散処理、目的の細胞以外の細胞や妨害物質を除去する分離処理などを施すことができる。目的の細胞は、これら分散処理や分離処理によって生体組織から分離される。試験に供される試料は、単離された細胞であることが好ましいが、試験の目的、精度などとの関係で許容し得る範囲において、生体組織に由来するその他の成分を含んでいてもよい。
【0029】
分散処理や分離処理は、通常の細胞培養において行われているものと同様の方法であってよい。分離処理としては、限定されるものではないが、ハサミ、ピンセット、カミソリなどを用いて、生体から摘出された生体組織の一部を細かく分割するなどの機械的処理を行うことができる。分散処理としては、限定されるものではないが、目的の細胞以外の細胞や細胞間質を除去する処理、試験の阻害要因となり得る物質を除去する処理を、酵素的分散処理などによって行うことができる。
【0030】
尚、目的の細胞を予め予備培養して増やしてから試験に用いることもできる。予備培養には、単層培養などの通常の培養方法を用いることができる。又、試験に用いられる細胞は、初代培養細胞だけでなく、継代培養細胞であってもよい。
【0031】
目的の細胞を含む試料の播種及び培養する方法としては、一般的な細胞培養法、特に、本発明では、細胞を電極の表面に接着させて培養し、培養を行っている間にその電極を介して検出されるインピーダンスに係る情報の変化を連続的に測定することから、一般的な単層培養と同様の方法を用いることができる。即ち、培地、より詳細には、目的の細胞の増殖に必要な栄養分を含んだ溶液(培養液)を測定容器(培養器)内に収容し、この培地中に目的の細胞を含む試料(通常、目的の細胞を所定の細胞数(播種濃度)で含む液体試料)を播く。培地は、目的の細胞に応じて、斯界における通常の方法に従って、適宜選択することができる。培地には、概して、細胞の増殖作用、生理活性維持作用、更には必要に応じて接着作用に必要な成分が含まれる。より詳細には、培地には、無機塩類、各種アミノ酸、糖類、ビタミン類、動物の血清(ホルモン、細胞増殖因子、細胞接着因子などを含む)などが含まれる。測定容器に試料と培地とを収容して、インキュベータ内で所定の環境条件(所定の温度、湿度、二酸化炭素濃度)に維持しておくことにより、目的の細胞が、測定容器の底部、より詳細には、そこに配置された少なくとも1つの電極の表面に接着し、伸展して、単層を形成する。
【0032】
そして、詳しくは後述するように、本発明によれば、上述のようにして目的の細胞の培養を行っている間に、試験対象薬剤の存在・非存在、その試験対象薬剤の濃度、試験対象薬剤の種類、試験対象薬剤を添加するまでの時間、或いは複数種類の試験対象薬剤の添加順序による細胞の増殖過程の変化を、インピーダンス測定に基づいて連続的に測定し、細胞の薬剤感受性を試験する。
【0033】
(2)抗がん剤感受性試験方法
以下、薬剤感受性試験としてがん細胞の抗がん剤感受性試験を行う場合のより具体的な例について説明する。
【0034】
(2−1)全体的処理工程
本実施例の抗がん剤感受性試験を行うための全体的な処理工程の一例の概略は、次に示す通りである。
1.患者からがん組織を採取する(採取工程)。
2.がん組織をばらばらにし細胞単位にする(分散工程・分離工程)。
3.測定容器に配置されている電極に細胞を播種する(播種工程)。
4.電極に接着するまで細胞を培養する(培養工程)。
5.細胞が接着した電極を備えた測定容器などのセンサ部を検出器にセットし、引き続き細胞の培養を行いながら、細胞の増殖過程をインピーダンス変化として連続的に測定する。この測定を、典型的には、少なくとも抗がん剤を添加しない場合と添加した場合について測定を行う。更に、必要に応じて、抗がん剤の濃度、抗がん剤の種類、培養開始から抗がん剤の添加までの時間、或いは複数種類の抗がん剤を順に添加する場合の添加順序を変化させて測定を行う(測定工程)。
6.測定されたインピーダンス変化の、抗がん剤の添加の有無などの条件の違いによる差異を、グラフ化するなどして対比可能なように出力する(出力工程)。
【0035】
上述のように、細胞に対する抗がん剤の曝露の有無、抗がん剤の濃度の違い、抗がん剤の種類、培養開始から抗がん剤の添加までの時間、複数種類の抗がん剤を順に添加する場合の添加順序の違いなど条件を変えて、細胞の増殖過程の変化をインピーダンス測定に基づいて連続的に測定する。これにより、細胞増殖が阻害される抗がん剤、細胞増殖の阻害に有効な抗がん剤の濃度、細胞増殖の阻害に関する抗がん剤の添加タイミングによる効果の違い、細胞増殖の阻害に関する複数種類の抗がん剤の添加順序による効果の違いを検出することができる。これにより、適正な抗がん剤を、適正な濃度、適正なタイミング、適正な手順で患者に使用することによる、副作用を抑えた、効果のある投与方法を予測することができる。
【0036】
(2−2)薬剤感受性試験装置
図1は、本実施例の抗がん剤感受性試験方法の実施のために使用することのできる薬剤感受性試験装置(以下、単に「試験装置」という。)の一例の概略断面構成を示す。図2は、図1の試験装置が備える測定容器近傍を拡大斜視図である。
【0037】
本実施例の試験装置1は、作用電極2、シリンダー3、対電極4、参照電極5、2本の引出電極6及び7、電極固定器8、インキュベータ9、薬剤添加装置10、検出器11、及びコンピュータ12を備えて構成されている。
【0038】
作用電極、対電極、参照電極、及び引出電極の材料は、金属、高分子、炭素など導電性を持つ物質を少なくとも1種類用いていれば如何なるものであってもよい。典型的には、電気化学測定において用いられる一般的なものであってよく、例えば、金、銀、白金、炭素などが挙げられる。又、本実施例では、基材(基板)上に形成される作用電極は、基材(基板)上に容易に形成できる材料が好ましく、又、透過式の顕微鏡で細胞を観察するためには、作用電極は透明であることが好ましい。従って、本実施例では、作用電極としてはITO(インジウム−酸化スズ)電極を用い、又、対電極、参照電極及び引出電極としては白金電極を用いた。各電極のサイズ及び形状は、目的の細胞が培養できる限り、任意のものを用いることができる。
【0039】
ITO電極2は、基材としてのガラス板2aの片面全体にITOが蒸着されて構成されている。このガラス板2aは、一例として、縦横の寸法が1.5cm×1.5cmとされている。又、ITO電極2のITO蒸着面には、直線状の白金ワイヤが引出電極6として連結されている。
【0040】
ここで、基材の材料としては、本実施例ではガラスを用いたが、十分な物理的強度を有し、表面に電極が形成できるものであれば、プラスティック、石英、ガラスなど任意の材料を用いることができる。但し、透過式の顕微鏡で細胞を観察するためには、基板は透明であることが好ましい。従って、本実施例では、基材としてはガラスを用いた。
【0041】
シリンダー3は、一例として外径、内径、高さがそれぞれ1.2cm、1.0cm、1.0cmに形成された、円筒状ガラスリングで構成されている。図2においては、理解を容易にするために、シリンダー3の高さを実際よりも低く表している。又、シリンダー3は、ITO電極2におけるITO蒸着面の中央に、一方の端部側が、接着剤としてのエポキシ系接着剤で接着されて固定されている。これにより、シリンダー3は、ITO電極2と共に、一例として、底面積0.785cm2、体積0.785cm3の測定容器13を構成する。
【0042】
対電極4は、一例として、直径1mmの白金ワイヤを用いて、内径が6.4mmのリング体に形成されている。対電極4は、図示のように断面矩形の板状のリング体であってもよいし、断面円形若しくは楕円形のリング体であってもよい。又、対電極4には、対電極4と直交するように直線状の白金ワイヤが引出電極7として連結されている。更に、対電極4は、絶縁材料で形成された電極固定器8に引出電極7が固定されることにより、シリンダー3の内部におけるITO電極2の上方において、ITO電極2と平行で、且つ、ITO電極2との間に所定の距離L1を有して配設されている。本実施例では、距離L1は、一例として、1.0mmとされている。
【0043】
参照電極5は、直線状の白金ワイヤで構成されている。又、参照電極5は、電極固定器8に固定されることにより、ITO電極2の上方における対電極4の中心軸線上に配設されると共に、ITO電極2側の端部とITO電極2との間に所定の距離L2を有して配設されている。本実施例では、距離L2は、一例として、0.5mmとされている。
【0044】
又、ITO電極2、シリンダー3、引出電極6、参照電極5、対電極4、引出電極7、電極固定器8は、金属製の載置台9a上に載置されて、インキュベータ9内に配設されている。
【0045】
薬剤添加装置10は、一例として、注入器10a、注入管10b及びチューブ10cを備えている。注入器10aは、インキュベータ9の外部に配設されると共に、電極固定器8に固定された注入管10bにチューブ10cを介して連結されている。これにより、薬剤添加装置10は、インキュベータ9の外部から所定濃度の薬剤を測定容器13内に添加可能に構成されている。
【0046】
尚、薬剤を測定容器13に添加するための薬剤添加装置10を試験装置1に設けることなく、ピペットやディスペンサーなどを用いて手動にて薬剤を測定容器13に添加することも当然可能である。
【0047】
検出器11は、インキュベータ9の外部に配設されると共に、リード11a、11b、11cを介して参照電極5、引出電極6、引出電極7にそれぞれ接続されている。
【0048】
そして、本実施例では、検出器11は、引出電極6と引出電極7との間(つまり、ITO電極2と対電極4との間)にリード11b、11cを介して任意の周波数の交流電圧(交流信号)Vを供給(印加)しつつ、参照電極5と引出電極6との間(つまり、参照電極5とITO電極2との間)を流れる交流電流Iをリード11a、11bを介して検出する。これにより、検出器11は、測定容器13の底面(ITO電極2の表面)に接着した細胞14のインピーダンスZを3端子法によって測定可能なように構成されている。又、本実施例では、検出器11は、交流電流Iと交流電圧Vとの位相差θを測定する機能も備えている。
【0049】
コンピュータ12は、検出器11の検出結果に基づいてインピーダンスZに係る情報を記憶する記憶手段12bと、記憶手段12bに記憶されたインピーダンスZに係る情報をその経時変化を示す形態に処理する処理装置12aと、処理装置12aの処理結果を出力する出力手段12cと、を有する。記憶手段12bとしては、限定されるものではないが、ハードディスクや電子的なメモリを好適に用いることができる。処理装置12aとしては、制御部、演算部、記憶部を備えた一般的な演算制御回路を用いることができる。又、出力手段12cとしては、処理結果を表示するディスプレイ装置を好適に用いることができる。更に、処理装置12aには、入力手段12dとしてキーボードなどが接続されている。本実施例では、これら処理装置12a、記憶手段12b、出力手段12cとしてのディスプレイ装置、及び入力手段12dを備えたコンピュータ12が検出器11に接続されている。尚、出力手段12cとして、処理結果を印刷(プリント)するプリンタを上記ディスプレイ装置の代わりに或いはディスプレイ装置に加えて用いてもよい。そして、本実施例では、コンピュータ12の処理装置12aは、検出器11を制御してインピーダンスZの測定動作を実行させると共に、検出器11によって測定されたインピーダンスZと位相差θとが入力されて、これを記憶手段12bに記憶させる。
【0050】
(2−3)インピーダンス測定
次に、試験装置1を用いたインピーダンス測定について説明する。
【0051】
先ず、測定容器13の内部において細胞14を培養する。具体的には、目的の細胞に応じた適当な培地を収容した測定容器13の底面(ITO電極2の表面)に、適当な播種濃度で細胞14を播種し、適当なCO2濃度、湿度、温度に制御されたインキュベータ9内で単層培養する。このとき、リード11a、11b、11cは、検出器11に接続されていてもよいが、接続されていなくてもよい。
【0052】
細胞14の形態観察を顕微鏡で定期的に行い、ITO電極2上の細胞14が接着するまで培養する。続いて、リード11a、11b、11cを検出器11に接続して、検出器11を作動させて、所定の測定周波数の交流電圧Vを細胞14に供給することにより、細胞14についてのインピーダンスZの測定を開始する。その後、適当な時間、好ましくは、インピーダンスZの値が安定するのを待って、試験対象の抗がん剤を含む試験薬剤溶液(所定濃度の抗がん剤を含むか、コントロールとして抗がん剤を含まない緩衝溶液など)を測定容器13に添加する。続いて、細胞14のインピーダンスZの測定と、交流電流I及び交流電圧Vの位相差θについての測定とを、所定時間(測定間隔)毎に、所定の測定周波数の交流電圧Vを印加しつつ、予め決められた時間(測定時間)だけ実施する。上記測定間隔は、細胞の薬剤応答性により任意に決定することができ、例えば、心筋細胞の場合は、1分間に約60回拍動するので、測定間隔は0.01秒〜0.1秒が好ましい。又、血管細胞の場合は、30分程度で収縮反応が終わるので、測定間隔は10秒程度が好ましい。又、がん細胞の場合は、48時間〜72時間と長期反応のため、測定間隔は2分〜5分が好ましい。但し、薬剤の添加直後に大きな形態変化が予想される場合は、短いサンプリングが必要なことがある。本実施例では、測定間隔を1分とし、上記測定時間を96時間とした。この際に、コンピュータ12は、検出器11によって測定されて処理装置12aに入力されたインピーダンスZと位相差θとを、互いに対応させて記憶手段12bに記憶させる。
【0053】
続いて、処理装置12aは、記憶手段12bに記憶された、試験薬剤溶液の添加直後からの上記測定間隔毎のインピーダンスZのリアクタンス成分X(t)を、インピーダンスZとそれに対応する位相差θとに基づいてすべて計算すると共に、記憶手段12bに記憶させる。
【0054】
次いで、処理装置12aは、試験薬剤溶液の添加直後のリアクタンス成分を基準として、試験薬剤溶液の添加直後からの上記測定間隔毎のリアクタンス成分を正規化する、即ち、試験薬剤溶液の添加直後のリアクタンスに対するリアクタンス比を求める。そして、求めた上記測定間隔毎のリアクタンス比を記憶手段12bに記憶させる。
【0055】
即ち、本実施例では、インピーダンスを示す情報の経時変化として、試験薬剤溶液の添加直後のインピーダンスのリアクタンス成分に対する、測定間隔毎のインピーダンスのリアクタンス成分の比(リアクタンス比)の経時変化を測定する。
【0056】
尚、本実施例では、各電極5、6、7とインピーダンス測定装置11との間に生じる接触抵抗や、添加した試験薬剤溶液の添加量(濃度)のばらつきなどの外部誤差要因をキャンセルして、微小なリアクタンス成分の時間的変化を感度よく測定するために、測定したリアクタンス成分を、試験薬剤溶液の添加直後に測定したリアクタンス成分で正規化する。しかし、例えば、接触抵抗が極めて小さく、且つ、試験薬剤溶液をばらつきの少ない状態で添加できる場合などには、測定したリアクタンス成分を正規化することなく、そのリアクタンス成分の時間的変化をインピーダンスに係る情報の経時変化として利用することができる。
【0057】
上述の各工程を、少なくとも、試験薬剤溶液として抗がん剤を含有するものと、抗がん剤を含まないもの(コントロール)を添加した場合についてそれぞれ実施する。好ましくは、試験薬剤として抗がん剤を含有するものについては、抗がん剤の濃度が異なる複数の測定を実施する。更に、必要に応じて、異なる種類の抗がん剤を用いるなど条件を変えて、上記同様の測定を行う。
【0058】
このようにして、細胞が複数の電極のうち少なくとも1つとしてITO電極(作用電極)2上を覆う変化をインピーダンスとして検出することができる。
【0059】
尚、電極間に供給する交流電圧の最適な周波数は、特定の細胞、特定の試験対象薬剤に応じて、予め求めておくことができる。即ち、特定の細胞を培養しながら、周波数を所定の範囲(例えば100Hz〜1MHz)で変更しつつ交流電圧を電極間に供給してインピーダンス、位相差を測定する動作を、所定の測定間隔毎に所定の測定時間にわたって実施する。そして、例えば、特定の抗がん剤を添加した所定時間後のインピーダンスのリアクタンス成分の、その添加直後のリアクタンス成分に対する変化量が最大となる周波数を選択する。又、特定の細胞、特定の試験対象薬剤に対する交流電圧の最適な周波数を予め求めておかなくても、各測定間隔毎に交流電圧の周波数をスイープさせて、各周波数毎のインピーダンス、位相差を測定し、記憶しておくことで、例えば、測定時間の全体にわたって測定値が得られたときに、上記同様にして最適な周波数を選択すると共に、測定間隔毎に各周波数に対して得られた測定値のうち、選択した周波数に対する測定値をその後の処理に用いることができる。
【0060】
このように、本実施例の試験装置1は、複数の電極2、4、5が配置された測定容器13と、複数の電極間に電圧を印加してインピーダンスに係る情報を検出する検出器11と、検出器11の検出結果に基づいて上記インピーダンスに係る情報を記憶する記憶手段12bと、記憶手段12に記憶された上記インピーダンスに係る情報に基づいて処理を実行する処理装置12aと、処理装置12aによる処理結果を出力するための出力手段12cと、を有する。そして、処理装置12aは、測定容器13内に収容された培地中に配置された複数の電極のうち少なくとも1つの電極である作用電極2の表面において細胞を培養している間に検出器11によって連続的に測定されて記憶手段12bに記憶された上記インピーダンスに係る情報であって、次の条件、(a)培養の間における培地への試験対象薬剤の添加量、(b)培地に添加する試験対象薬剤の種類、(c)培養の開始から培地への試験対象薬剤の添加までの経過時間、(d)培養の間において培地へ順に添加する複数種類の試験対象薬剤の添加順序、のうちの少なくとも1つを異ならせてそれぞれ記憶された情報に基づいて、当該条件の違いによる上記インピーダンスに係る情報の経時変化の差異を明示するための処理を実行する。又、出力手段12cは、処理装置12aによる上記インピーダンスに係る情報の経時変化の差異を明示する処理結果を出力する。
【0061】
処理装置12aは、上記インピーダンスに係る情報の経時変化の差異を明示するための上述のような各種方法に係る処理を実行する。即ち、上記インピーダンスに係る情報の経時変化を示す曲線、該曲線の所定部分の傾きなどを出力装置によって出力(ディスプレイ装置での表示、プリンタによる印刷など)させるための処理を実行する。又、処理装置12aは、上述のように、試験対象薬剤の種類の違いなどによる上記インピーダンスを示す情報の経時変化の差異を明示するための処理を実行することもできる。
【0062】
尚、本実施例では、測定容器13は、ガラス板2a上に形成されたITO電極2とシリンダー3とで形成されるものとしたが、本発明はこれに限定されるものではない。例えば、ガラス、樹脂形成された容器の底部に、例えばガラスなどの基材上に電極が形成された電極部材を配置するようになっていてもよい。
【0063】
又、本実施例では、説明を容易とするために、試験装置1には、単独の測定容器13が設けられているものとしたが、本発明はこれに限定されるものではない。当業者には周知の複数のウェル(試料収容部,培養容器)を備えた細胞培養用の培養プレートのように複数の測定容器13を配列し、各測定容器13内に本実施例と同様に複数の電極を配置することができる。この場合、検出器11は、各測定容器13に配置された電極からの信号を、それぞれの測定容器13に関係付けて検出し、検出結果をそれぞれの測定容器13に関係付けて処理装置12aに入力する。そして、処理装置12aは、記憶手段12aへの情報の記憶、インピーダンスを示す情報の経時変化の差異を明示する処理を、それぞれの測定容器13に関係付けて行うようにする。これにより、典型的には、同一種類の試験対象薬剤の複数の異なる濃度、複数種類の試験対象薬剤、又は複数種類の試験対象薬剤のそれぞれの複数の異なる濃度についての試験などを同時に行うことができる。そして、それぞれの測定容器13に関する測定結果は、ディスプレイ装置での表示、プリンタによる印刷などにより、同時に又は逐次に行うことができる。
【0064】
(2−4)抗がん剤感受性の評価方法
上述のようにして得られたリアクタンス比の経時変化から、目的の細胞の試験対象である抗がん剤に対する感受性を評価する。
【0065】
ここで、従来の抗がん剤感受性試験方法では、抗がん剤と反応した後のがん細胞の状態を、抗がん剤の無い場合と比較している。しかしながら、実際は、がん細胞は時々刻々変化している。そのため、従来の抗がん剤感受性試験方法では、ある時間で細胞が本当に死んでいるのか、弱っているのかを評価することはできなかった。
【0066】
そこで、本発明によれば、インピーダンス測定法を用いて細胞の増殖過程を連続的に測定し、がん細胞の抗がん剤に対する感受性を評価する。連続的に細胞の増殖を測定できるので、実際に薬が効いているのか、既に効かなくなっているのかを、測定されたインピーダンスを示す情報の経時変化を示す曲線の傾きで判断することができる。
【0067】
更に説明すると、従来、一般に、抗がん剤の添加後40時間〜50時間後のがん細胞の状態を、例えばSDI法によって測定することが行われている。
【0068】
図3(a)は、がん細胞の抗がん剤との反応前後の状態を評価する従来の抗がん剤感受性試験方法に準じて、抗がん剤の添加時及び添加の所定時間後のリアクタンス比を測定した結果をグラフ化して示したものである。図3(a)では、抗がん剤の添加によって、所定時間後にがん細胞の増殖が抑制される(がん細胞が死んでいる)ように見える。
【0069】
一方、図3(b)は、図3(a)の場合と同じ系において、本発明に従ってインピーダンス測定を行った場合のリアクタンス比の経時変化をグラフ化して示したものである。図3(b)から、この例では、実際には、抗がん剤は、その添加後約10時間後から25時間後までの間に一時的に効いているだけで、添加後約30時間以降は再びがん細胞の増殖が始まっていることが分かる。
【0070】
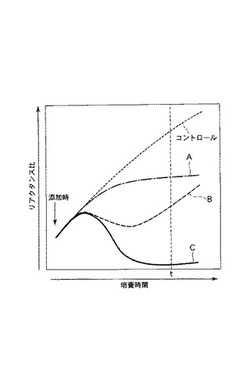
次に、図4を参照して、本発明に従う抗がん剤感受性の評価方法について更に説明する。図4は、本実施例に従って測定されたリアクタンス比の経時変化の典型的な形態を示すものである。
【0071】
ここで、図4中、抗がん剤A、B、Cは、例えば、種類の異なる抗がん剤、又は濃度の異なる同一種類の抗がん剤であるものとする。又、図4中コントロールは、抗がん剤を添加しない場合を示す。
【0072】
図4に示すように、コントロール、並びに、抗がん剤A、B、Cについてのリアクタンス比の経時変化をグラフ化して表示することによって、測定時間の全体にわたるがん細胞の増殖の様子の違いを判別することができる。
【0073】
例えば、図4に示す例において、コントロールでは、時間経過と共にほぼ一定の割合でリアクタンス比が増加していることが分かる。これに対して、抗がん剤Aでは、測定時間内において、その添加から一定時間が経過した後にリアクタンス比の増加が飽和に達することが分かる。又、抗がん剤Bでは、測定時間内において、その添加から一定時間が経過するまではリアクタンス比は増加するが、その後減少し、更にその後再び増加が始まることが分かる。又、抗がん剤Cでは、測定時間内において、その添加から一定時間が経過するまではリアクタンス比は増加するが、その後減少を始め、ついにはその減少が止まることが分かる。このような対比表示は、グラフ化をせずに数値自体で行うこともできるが、それぞれの場合のリアクタンス比の経時変化の差異を容易に把握できることから、グラフ化する方がより好ましい表示形態である。
【0074】
又、図4に示すような、それぞれの場合のリアクタンス比の経時変化において、抗がん剤を添加してから所定時間後(図4中の時間t)における傾き、即ち、リアクタンス比の時間経過に対する変化の割合を求めて表示することができる。この傾きの対比表示を行うには、それぞれの場合における傾きの数値自体を対比表示したり、グラフ中に傾きを表す直線を合わせて表示したりすることができる。
【0075】
尚、この傾きの表示に加えて、当該抗がん剤を添加してからの所定時間後におけるインピーダンスに係る情報自体、即ち、ここではリアクタンス比の値自体を表示することも有効である。これにより、当該所定時間後までのがん細胞の増殖(又は死滅)の様子が分かると共に、その後の増殖(又は死滅)の様子を推測することができる。
【0076】
この場合の、抗がん剤を添加してから所定時間後としては、従来一般に抗がん剤感受性を評価するのに用いられている、40〜50時間後(例えば48時間後)を好ましく採用することができるが、これに限定されるものではない。より具体的には、抗がん剤を添加してから所定時間後における曲線の傾きは、その前後の複数の測定値から直線近似することなどによって求めることができる。このような方法自体は当業者にとって自明であり、又利用可能な如何なる方法をも採用することができる。
【0077】
例えば、図4に示す例において、コントロールでは、時間tにおける傾きは正であり、時間tにおけるリアクタンス比(添加時に対して正規化されている)は1より大きい。これに対して、抗がん剤Aでは、時間tにおける傾きはほぼゼロであり、時間tにおけるリアクタンス比は1より大きいがコントロールにおける値よりも小さい。即ち、抗がん剤Aでは、時間t以降のがん細胞の増殖は抑制されることが予測される。又、抗がん剤Bでは、時間tにおけるリアクタンス比は1より大きくコントロールにおける値よりも小さいが、時間tにおける傾きは正であり、コントロールにおける傾きとほぼ同じである。即ち、抗がん剤Bでは、時間t以降におけるがん細胞の増殖が予測される。又、抗がん剤Cでは、時間tにおける傾きはほぼゼロであり、時間tにおけるリアクタンス比は1より小さい。即ち、時間t以降のがん細胞の増殖は抑制されることが予測される。
【0078】
このように、傾きを対比するに当たっては、典型的には、次の形態が考えられる。
1.試験対象薬剤を添加した場合の試験対象薬剤の添加から(或いは培養開始から)所定時間経過後の傾きと、試験対象薬剤を添加しない場合の対応する所定時間経過後の傾きとを比較する。
2.異なる濃度の同一種類の試験対象薬剤を添加した場合の、各濃度における試験対象薬剤の添加から(或いは培養開始から)所定時間経過後の傾きを比較する。
3.異なる種類の試験対象薬剤を同一濃度で添加した場合の、各種類の試験対象薬剤における所定時間経過後の傾きを比較する。
4.培養開始から同一種類の試験対象薬剤の添加までの時間を異ならせた場合の、それぞれの添加時間までの時間における、試験対象薬剤の添加から(或いは培養開始から)所定時間経過後の傾きを比較する。
5.1つの試料に対して順に添加する複数種類の試験対象薬剤の添加順序を異ならせた場合の、それぞれの順序における、最後に添加する試験対象薬剤の添加から(或いは培養開始から)所定時間後の傾きを比較する。
【0079】
尚、インピーダンスの経時変化の差異を検出するための測定において、上述のような試験対象薬剤の添加量(存在・非存在、濃度)、試験対象薬剤の種類、試験対象薬剤を添加するまでの時間、複数種類の試験対象薬剤の添加順序といった条件のうち複数の条件を複合的に変化させてもよい。変化させる条件の組み合わせは、入手したい情報に応じて、適宜、選択することができる。例えば、試験対象薬剤の濃度と種類、試験対象薬剤の種類とそれを添加するまで時間、添加順序と各順序で添加する試験対象薬剤の濃度、などを同時に異ならせることができる。
【0080】
試験装置1において、コンピュータ12の処理装置12aは、上述のようにインピーダンスを示す情報の経時変化の差異を出力するための処理を実行することに加えて、例えば、上述のような傾きの対比結果から、抗がん剤の種類による有効性、抗がん剤の効き方(すぐに効くのかゆっくり効くのか)、抗がん剤の有効量などの、抗がん剤の使用方法を判断するのに有用な情報を出力するための処理を実行することもできる。
【0081】
例えば、図4に示す結果から判断する限りにおいては、抗がん剤Cが抗がん剤A、B、Cのうちで最も効果的であることが分かる。即ち、例えば、抗がん剤A、B、Cが異なる種類のものである場合には、抗がん剤Cの種類が最も効果的であり、抗がん剤A、B、Cが異なる濃度の同一種類のものである場合には、抗がん剤Cの濃度が最も効果的であることが分かる。
【0082】
このように、本発明によれば、がん細胞に対して効かない抗がん剤を見つけられるばかりでなく、例えば、一見効くようでも経時的に耐性ができて効かなくなってしまう抗がん剤を見つけることができる。
【0083】
又、がん細胞に抗がん剤を曝露させた後、何時間で抗がん剤が効き始めるかなどの抗がん剤の効き方が分かるため、患者の体内動態を適切に管理し、最適な投与時間を予測することを助けることができる。
【0084】
又、添加する抗がん剤の濃度を変更した複数の測定を行うことによって、抗がん剤の濃度による効果の違いを確認することができる。そのため、副作用を限りなく抑えて、最大の効果を得られるような投与方法を予測することを助けることができる。
【0085】
又、培養開始から抗がん剤の添加までの時間を変更した複数の測定(例えば、播種直後に添加、播種から5分後に添加、播種から30分後に添加などの違い)を行うことによって、抗がん剤の投与タイミングや投与間隔が適正かどうかを評価することを助けることができる。
【0086】
又、1つの試料に複数種類の抗がん剤を順に添加する場合における添加順序を変更した複数の測定(例えば、2種類の抗がん剤A、Bを順に添加する場合に、抗がん剤Aを先に添加する場合と、抗がん剤Bを先に添加する場合)を行うことによって、複数の抗がん剤の投与順序が適正かどうかを評価することを助けることができる。
【0087】
(2−5)具体例
次に、本実施例に従う抗がん剤感受性試験を適用した具体例について説明する。
【0088】
ここでは、特定のがん細胞に対して複数種類の抗がん剤を反応させた場合の例を示す。がん細胞としては、肝臓由来のがん細胞であるHepG2を用いた。そして、本実施例に従って、当該がん細胞を培養すると共に、培地に対して血液がん用の抗がん剤であるビンクリスチンと、肝臓がん用の抗がん剤である5−FU(5−フルオロウラシル)とをそれぞれ添加し、それぞれの場合におけるがん細胞の増殖過程をインピーダンス測定に基づくリアクタンス比の経時変化の違いとして測定した。培養条件、測定条件、抗がん剤の添加条件、及び結果は以下の通りである。
・培養条件
播種濃度:5万個/well(ウェル)
インキュベータ内環境:CO25%、湿度100%、温度37℃
培地:DMEM培地+10%FBS含有
・測定条件
測定周波数:100kHz
測定間隔:1分
測定時間:96時間
・抗がん剤添加条件
抗がん剤濃度:ビンクリスチン 200μg/ml
5−FU 5μg/ml
コントロール:培地を300μl
・結果
図5(a)は、血液がん用の抗がん剤であるビンクリスチンを添加した場合と、添加しなかった場合(コントロール)についての、リアクタンス比の経時変化を示す。又、図5(b)は、肝臓がん用の抗がん剤である5−FUを添加した場合と、添加しなかった場合(コントロール)についての、リアクタンス比の経時変化を示す。
【0089】
図5(a)から、血液がん用の抗がん剤は、一時的に肝臓由来のがん細胞の増殖を阻害するが、ある程度時間が経つと(添加後約20時間)、がん細胞の増殖が再開しているのが分かる。例えば、測定開始から40時間経過後において、抗がん剤を添加した場合のリアクタンス比はコントロールに比べて小さくなっているが、その時の抗がん剤を添加した場合の曲線の傾きはコントロールのほぼ半分程度の正の傾きを有している。従って、当該がん細胞に対して、血液がん用の抗がん剤の効果は一時的なものであり、一定時間経過後にはがん細胞は再び増殖を続けるものと予測できる。
【0090】
一方、肝臓がん用の抗がん剤は、効くまでに時間がかかるが(添加後約10時間)、その後は確実にがん細胞を殺していることが分かる。例えば、測定開始から30時間経過後において、抗がん剤を添加した場合のリアクタンス比はコントロールに比べて小さくなっており、且つ、その時の抗がん剤を添加した場合の曲線の傾きは、ほぼゼロである。又、測定開始から40時間経過後において、抗がん剤を添加した場合の傾きは負になっている。従って、肝臓がん用の抗がん剤は、一定時間経過後に、当該がん細胞の増殖を有効に阻害するものと予測できる。
【0091】
このように、あるポイントだけでの評価では、その時点での細胞の「弱り具合」は分からないが、本実施例に従ってインピーダンスの連続測定を行うことにより、傾きとして細胞の「弱り具合」を検出することができる。
【0092】
以上説明したように、本発明によれば、対象とする細胞の増殖などの細胞活性を抑制する効果のない薬剤を排除するのに有効であるだけではなく、効果のある薬剤を選択するのを容易とすることができる。
【図面の簡単な説明】
【0093】
【図1】本発明に係る薬剤感受性試験装置の一実施例の概略構成図である。
【図2】図1の薬剤感受性試験装置の測定容器近傍を拡大して示す斜視図である。
【図3】本発明に係る薬剤感受性試験方法の原理を説明するためのグラフ図である。
【図4】本発明に係る薬剤感受性試験方法の実施形態を説明するためのグラフ図である。
【図5】本発明に従って測定されたがん細胞の抗がん剤感受性の試験結果を示すグラフ図である。
【符号の説明】
【0094】
1 薬剤感受性試験装置
2 ITO電極(作用電極)
3 シリンダー
4 対電極
5 参照電極
11 検出器
12 コンピュータ
12a 処理装置
12b 記憶手段
12c ディスプレイ装置(出力手段)
13 測定容器
【技術分野】
【0001】
本発明は、薬剤感受性試験方法及び装置に関するものであり、より詳細には、インピーダンス測定に基づき細胞の増殖過程の変化を連続的に測定することによって、例えば、抗がん剤感受性などの細胞の薬剤感受性を試験する薬剤感受性試験方法及び装置に関するものである。
【背景技術】
【0002】
従来、がんの治療薬として抗がん剤が使用されている。現状では、殆どの場合、投与される抗がん剤の種類や量、又はその投与時間などの決定は、学術的な一般見解と担当医の経験によるところが大きい。しかし、抗がん剤の効果は個人差により大きく違うことがあり、一般的に使用されている抗がん剤が、特定の患者において効かない場合も多い。
【0003】
そこで、高度先進医療として、患者に抗がん剤を投与する前に「抗がん剤感受性試験」を行うケースがある。患者から摘出したがん細胞を培養しながら、様々な抗がん剤と反応させ、より効く抗がん剤を選択しようと考えられた方法である。
【0004】
従来の一般的な抗がん剤感受性試験方法は、抗がん剤とがん細胞とを決められた時間反応させ、その間に死んだ細胞の割合で薬の効きを評価している。
【0005】
即ち、既存の抗がん剤感受性試験であるSDI(Succinic Dehydrogenase Inhibition:コハク酸脱水素酵素活性)法、HDRA(Histoculture Drug Response Assay:固形がん組織培養薬剤感受性試験)法、CD−DST(Collagen Gel Droplet Embedded Culture Drug Sensitivity Test:コラーゲンゲル包埋培養薬剤感受性試験)法などでは、がん細胞(がん組織)と抗がん剤との反応を、エンドポイント(薬と細胞の反応後)で評価している(例えば、特許文献1)。
【0006】
従来の抗がん剤感受性試験の手順の概略を示せば次の通りである。
1.患者からがん組織を採取する。
2.必要に応じてがん組織をばらばらにし、がん細胞とする。
3.培養プレートにがん細胞を播種し、接着・伸展するまで細胞を培養する。
4.培養後、数種類の抗がん剤を細胞に曝露させ数日間培養する。
5.反応終了後、抗がん剤の効果を、試薬を用いてがん細胞の生存率を測定することで判定する。
【0007】
抗がん剤感受性試験を行うことで、対象とするがん細胞に効かない抗がん剤を排除することができる。
【0008】
一方、従来、インピーダンス測定に基づいて細胞の増殖などの細胞の活性を測定する方法がある(特許文献2)。
【特許文献1】特開2003−9853号公報
【特許文献2】特開2005−80522号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
従来の抗がん剤感受性試験では、対象とするがん細胞に効かない抗がん剤は排除できるが、効く薬を選択することは難しいと言われている。対象とするがん細胞に効かない抗がん剤は実験後のがん細胞の生存数から判明するが、途中経過から抗がん剤の効果を評価することができないためである。
【0010】
つまり、従来の抗がん剤感受性試験は、全てエンドポイント(細胞と抗がん剤との反応が終了した時点での値)のみで評価するものであり、薬の効く時間や効き方(すぐに効くのかゆっくり効くのか)などを調べることは困難であった。
【0011】
又、一般に、抗がん剤感受性試験において使用する抗がん剤の濃度は、実際に人に使用する体内濃度と大きく異なっているため、このことからも、従来の抗がん剤感受性試験では、対象とするがん細胞に効く抗がん剤を見つけることが難しくなっている。
【0012】
従って、本発明の目的は、対象とする細胞の活性を抑制する効果のない薬剤を排除するのに有効なだけではなく、効果のある薬剤を選択するのを容易とすることのできる薬剤感受性試験方法及び装置を提供することである。
【課題を解決するための手段】
【0013】
上記目的は本発明に係る薬剤感受性試験方法及び装置にて達成される。要約すれば、本発明は、測定容器内に収容された培地中に配置された複数の電極のうち少なくとも1つの電極の表面において細胞を培養すると共に、該培養の間に前記複数の電極間に所定の電圧を印加してインピーダンスに係る情報を連続的に測定することを、次の条件、(a)前記培養の間における前記培地への試験対象薬剤の添加量、(b)前記培地に添加する試験対象薬剤の種類、(c)前記培養の開始から前記培地への試験対象薬剤の添加までの経過時間、(d)前記培養の間において前記培地へ順に添加する複数種類の試験対象薬剤の添加順序、のうちの少なくとも1つを異ならせてそれぞれ行い、当該条件の違いによる前記インピーダンスに係る情報の経時変化の差異を明示することを特徴とする薬剤感受性試験方法である。
【0014】
本発明の他の態様によると、複数の電極が配置された測定容器と;前記複数の電極間に電圧を印加してインピーダンスに係る情報を検出する検出器と;前記検出器の検出結果に基づいて前記インピーダンスに係る情報を記憶する記憶手段と;前記記憶手段に記憶された前記インピーダンスに係る情報に基づいて処理を実行する処理装置と;前記処理装置による処理結果を出力するための出力手段と;を有し、前記処理装置は、前記測定容器内に収容された培地中に配置された前記複数の電極のうち少なくとも1つの電極の表面において細胞を培養している間に前記検出器によって連続的に測定されて前記記憶手段に記憶された前記インピーダンスに係る情報であって、次の条件、(a)前記培養の間における前記培地への試験対象薬剤の添加量、(b)前記培地に添加する試験対象薬剤の種類(c)前記培養の開始から前記培地への試験対象薬剤の添加までの経過時間、(d)前記培養の間において前記培地へ順に添加する複数種類の試験対象薬剤の添加順序、のうちの少なくとも1つを異ならせてそれぞれ記憶された情報に基づいて、当該条件の違いによる前記インピーダンスに係る情報の経時変化の差異を明示するための処理を実行することを特徴とする薬剤感受性試験装置が提供される。
【0015】
本発明の一実施態様によると、前記インピーダンスに係る情報の経時変化を示す曲線を対比可能なように出力することにより前記差異を明示することができる。
【0016】
本発明の他の実施態様によると、前記インピーダンスに係る情報の経時変化の差異として、前記インピーダンスに係る情報の経時変化を示す曲線における、所定時間経過後の傾きの差異を明示する。この場合、前記傾きを対比可能なように出力することにより前記差異を明示することができる。
【0017】
典型的な一実施態様では、前記細胞は、がん細胞であり、又、前記試験対象薬剤は、抗がん剤である。
【発明の効果】
【0018】
本発明によれば、対象とする細胞の活性を抑制する効果のない薬剤を排除するのに有効なだけではなく、効果のある薬剤を選択するのを容易とすることができる。
【発明を実施するための最良の形態】
【0019】
以下、本発明に係る薬剤感受性試験方法及び装置を図面に則して更に詳しく説明する。
【0020】
実施例1
(1)薬剤感受性試験方法
本発明によれば、概して、薬剤による細胞の増殖過程の変化を、インピーダンス測定に基づいて連続的に測定できるようにする。
【0021】
つまり、本発明の薬剤感受性試験方法では、測定容器内に収容された培地中に配置された複数の電極のうち少なくとも1つの電極の表面において細胞を培養すると共に、該培養の間に複数の電極間に所定の電圧を印加してインピーダンスに係る情報を連続的に測定する。このような測定を、次の条件、(a)培養の間における培地への試験対象薬剤の添加量、(b)培地に添加する試験対象薬剤の種類、(c)培養の開始から培地への試験対象薬剤の添加までの経過時間、(d)培養の間において培地へ順に添加する複数種類の試験対象薬剤の添加順序、のうちの少なくとも1つを異ならせてそれぞれ行う。そして、当該条件の違いによる上記インピーダンスに係る情報の経時変化の差異を明示する。
【0022】
ここで、典型的には、試験対象薬剤の添加量の違いとして、少なくとも薬剤を添加しない場合(即ち、添加量はゼロ)と、ある量の薬剤を添加した場合とについての上記インピーダンスに係る情報の経時変化の差異を明示する。又、試験対象薬剤のゼロではない添加量を変更して、そのゼロではない添加量の違いによる上記インピーダンスに係る情報の経時変化の差異を明示することができる。又、複数種類の試験対象薬剤を用いて測定を行うことによって、試験対象薬剤の種類の違いによる上記インピーダンスに係る情報の経時変化の差異を明示することができる。更に、試験対象薬剤を添加するまでの時間や複数種類の試験対象薬剤の添加順序を異ならせて、その違いによるインピーダンスに係る情報の経時変化の差異を明示することができる。
【0023】
インピーダンスに係る情報の経時変化の差異の明示としては、測定結果に係る数値自体を対比可能なように出力すること、測定結果に係る数値をグラフ化して対比可能なように出力することが含まれる。典型的には、単にインピーダンスに係る情報の経時変化を示す曲線をグラフ化して対比可能なように出力することによって斯かる差異を明示することができる。又、インピーダンスに係る情報の経時変化を示す曲線における、所定時間経過後の傾きの差異を、その傾きを示す数値自体を対比可能なように出力すること、或いはその傾きを示す直線などをグラフ化して対比可能なように出力することなどによって、インピーダンスに係る情報の経時変化の差異として明示することができる。上記出力としては、ディスプレイ装置での表示、プリンタによる印刷(プリンタ)などを好適に用いることができる。
【0024】
試験に用いられる細胞は、典型的には、生体内(より詳細にはヒトを含む哺乳動物体内)で増殖した臓器、組織などの生体組織に由来する細胞であって、好ましくは、がん細胞である。しかし、試験に用いられる細胞は、正常組織に由来する細胞であってもよい。特に、本発明では、細胞を電極の表面に接着させて培養し、培養を行っている間にその電極を介して検出されるインピーダンスに係る情報の変化を連続的に測定することから、試験に用いられる細胞は、接着依存性増殖をするものである。
【0025】
がん細胞としては、臨床的にはヒトの細胞が用いられるが、薬剤スクリーニングなどの前臨床的目的でマウス、ラットなどの動物細胞を用いることもできる。がん細胞としては、限定されるものではないが、肝臓がん、肺がん、胃がん、大腸がん、卵巣がん、脳腫瘍、乳がん、前立腺がん、皮膚がん及び白血病細胞(血液がん)などのがん細胞が挙げられる。
【0026】
又、試験対象となる薬剤は、典型的には、試験に用いられる細胞の活性を抑制する効果が期待される薬剤であって、特に、試験に用いられる細胞ががん細胞である場合には、抗がん剤である。抗がん剤には、抗がん作用、即ち、がん細胞の増殖活性を抑制する(がん細胞を殺す)効果が期待される、既知の又は未知の薬剤が広く含まれる。抗がん剤としては、作用機序によって様々なものが知られているが、本発明はいずれのものにも適用することができる。
【0027】
尚、効果が期待される薬剤には、実際に同種の細胞に対して効果が得られた実績のある薬剤のみならず、当該効果の有無を確認するために試験される薬剤をも含まれる。
【0028】
試験に使用される細胞は、典型的には、生体から採取された臓器、組織などの生体組織の一部から取り出される。生体から採用した生体組織の一部は、必要に応じて、細かくして液体中に分散させる分散処理、目的の細胞以外の細胞や妨害物質を除去する分離処理などを施すことができる。目的の細胞は、これら分散処理や分離処理によって生体組織から分離される。試験に供される試料は、単離された細胞であることが好ましいが、試験の目的、精度などとの関係で許容し得る範囲において、生体組織に由来するその他の成分を含んでいてもよい。
【0029】
分散処理や分離処理は、通常の細胞培養において行われているものと同様の方法であってよい。分離処理としては、限定されるものではないが、ハサミ、ピンセット、カミソリなどを用いて、生体から摘出された生体組織の一部を細かく分割するなどの機械的処理を行うことができる。分散処理としては、限定されるものではないが、目的の細胞以外の細胞や細胞間質を除去する処理、試験の阻害要因となり得る物質を除去する処理を、酵素的分散処理などによって行うことができる。
【0030】
尚、目的の細胞を予め予備培養して増やしてから試験に用いることもできる。予備培養には、単層培養などの通常の培養方法を用いることができる。又、試験に用いられる細胞は、初代培養細胞だけでなく、継代培養細胞であってもよい。
【0031】
目的の細胞を含む試料の播種及び培養する方法としては、一般的な細胞培養法、特に、本発明では、細胞を電極の表面に接着させて培養し、培養を行っている間にその電極を介して検出されるインピーダンスに係る情報の変化を連続的に測定することから、一般的な単層培養と同様の方法を用いることができる。即ち、培地、より詳細には、目的の細胞の増殖に必要な栄養分を含んだ溶液(培養液)を測定容器(培養器)内に収容し、この培地中に目的の細胞を含む試料(通常、目的の細胞を所定の細胞数(播種濃度)で含む液体試料)を播く。培地は、目的の細胞に応じて、斯界における通常の方法に従って、適宜選択することができる。培地には、概して、細胞の増殖作用、生理活性維持作用、更には必要に応じて接着作用に必要な成分が含まれる。より詳細には、培地には、無機塩類、各種アミノ酸、糖類、ビタミン類、動物の血清(ホルモン、細胞増殖因子、細胞接着因子などを含む)などが含まれる。測定容器に試料と培地とを収容して、インキュベータ内で所定の環境条件(所定の温度、湿度、二酸化炭素濃度)に維持しておくことにより、目的の細胞が、測定容器の底部、より詳細には、そこに配置された少なくとも1つの電極の表面に接着し、伸展して、単層を形成する。
【0032】
そして、詳しくは後述するように、本発明によれば、上述のようにして目的の細胞の培養を行っている間に、試験対象薬剤の存在・非存在、その試験対象薬剤の濃度、試験対象薬剤の種類、試験対象薬剤を添加するまでの時間、或いは複数種類の試験対象薬剤の添加順序による細胞の増殖過程の変化を、インピーダンス測定に基づいて連続的に測定し、細胞の薬剤感受性を試験する。
【0033】
(2)抗がん剤感受性試験方法
以下、薬剤感受性試験としてがん細胞の抗がん剤感受性試験を行う場合のより具体的な例について説明する。
【0034】
(2−1)全体的処理工程
本実施例の抗がん剤感受性試験を行うための全体的な処理工程の一例の概略は、次に示す通りである。
1.患者からがん組織を採取する(採取工程)。
2.がん組織をばらばらにし細胞単位にする(分散工程・分離工程)。
3.測定容器に配置されている電極に細胞を播種する(播種工程)。
4.電極に接着するまで細胞を培養する(培養工程)。
5.細胞が接着した電極を備えた測定容器などのセンサ部を検出器にセットし、引き続き細胞の培養を行いながら、細胞の増殖過程をインピーダンス変化として連続的に測定する。この測定を、典型的には、少なくとも抗がん剤を添加しない場合と添加した場合について測定を行う。更に、必要に応じて、抗がん剤の濃度、抗がん剤の種類、培養開始から抗がん剤の添加までの時間、或いは複数種類の抗がん剤を順に添加する場合の添加順序を変化させて測定を行う(測定工程)。
6.測定されたインピーダンス変化の、抗がん剤の添加の有無などの条件の違いによる差異を、グラフ化するなどして対比可能なように出力する(出力工程)。
【0035】
上述のように、細胞に対する抗がん剤の曝露の有無、抗がん剤の濃度の違い、抗がん剤の種類、培養開始から抗がん剤の添加までの時間、複数種類の抗がん剤を順に添加する場合の添加順序の違いなど条件を変えて、細胞の増殖過程の変化をインピーダンス測定に基づいて連続的に測定する。これにより、細胞増殖が阻害される抗がん剤、細胞増殖の阻害に有効な抗がん剤の濃度、細胞増殖の阻害に関する抗がん剤の添加タイミングによる効果の違い、細胞増殖の阻害に関する複数種類の抗がん剤の添加順序による効果の違いを検出することができる。これにより、適正な抗がん剤を、適正な濃度、適正なタイミング、適正な手順で患者に使用することによる、副作用を抑えた、効果のある投与方法を予測することができる。
【0036】
(2−2)薬剤感受性試験装置
図1は、本実施例の抗がん剤感受性試験方法の実施のために使用することのできる薬剤感受性試験装置(以下、単に「試験装置」という。)の一例の概略断面構成を示す。図2は、図1の試験装置が備える測定容器近傍を拡大斜視図である。
【0037】
本実施例の試験装置1は、作用電極2、シリンダー3、対電極4、参照電極5、2本の引出電極6及び7、電極固定器8、インキュベータ9、薬剤添加装置10、検出器11、及びコンピュータ12を備えて構成されている。
【0038】
作用電極、対電極、参照電極、及び引出電極の材料は、金属、高分子、炭素など導電性を持つ物質を少なくとも1種類用いていれば如何なるものであってもよい。典型的には、電気化学測定において用いられる一般的なものであってよく、例えば、金、銀、白金、炭素などが挙げられる。又、本実施例では、基材(基板)上に形成される作用電極は、基材(基板)上に容易に形成できる材料が好ましく、又、透過式の顕微鏡で細胞を観察するためには、作用電極は透明であることが好ましい。従って、本実施例では、作用電極としてはITO(インジウム−酸化スズ)電極を用い、又、対電極、参照電極及び引出電極としては白金電極を用いた。各電極のサイズ及び形状は、目的の細胞が培養できる限り、任意のものを用いることができる。
【0039】
ITO電極2は、基材としてのガラス板2aの片面全体にITOが蒸着されて構成されている。このガラス板2aは、一例として、縦横の寸法が1.5cm×1.5cmとされている。又、ITO電極2のITO蒸着面には、直線状の白金ワイヤが引出電極6として連結されている。
【0040】
ここで、基材の材料としては、本実施例ではガラスを用いたが、十分な物理的強度を有し、表面に電極が形成できるものであれば、プラスティック、石英、ガラスなど任意の材料を用いることができる。但し、透過式の顕微鏡で細胞を観察するためには、基板は透明であることが好ましい。従って、本実施例では、基材としてはガラスを用いた。
【0041】
シリンダー3は、一例として外径、内径、高さがそれぞれ1.2cm、1.0cm、1.0cmに形成された、円筒状ガラスリングで構成されている。図2においては、理解を容易にするために、シリンダー3の高さを実際よりも低く表している。又、シリンダー3は、ITO電極2におけるITO蒸着面の中央に、一方の端部側が、接着剤としてのエポキシ系接着剤で接着されて固定されている。これにより、シリンダー3は、ITO電極2と共に、一例として、底面積0.785cm2、体積0.785cm3の測定容器13を構成する。
【0042】
対電極4は、一例として、直径1mmの白金ワイヤを用いて、内径が6.4mmのリング体に形成されている。対電極4は、図示のように断面矩形の板状のリング体であってもよいし、断面円形若しくは楕円形のリング体であってもよい。又、対電極4には、対電極4と直交するように直線状の白金ワイヤが引出電極7として連結されている。更に、対電極4は、絶縁材料で形成された電極固定器8に引出電極7が固定されることにより、シリンダー3の内部におけるITO電極2の上方において、ITO電極2と平行で、且つ、ITO電極2との間に所定の距離L1を有して配設されている。本実施例では、距離L1は、一例として、1.0mmとされている。
【0043】
参照電極5は、直線状の白金ワイヤで構成されている。又、参照電極5は、電極固定器8に固定されることにより、ITO電極2の上方における対電極4の中心軸線上に配設されると共に、ITO電極2側の端部とITO電極2との間に所定の距離L2を有して配設されている。本実施例では、距離L2は、一例として、0.5mmとされている。
【0044】
又、ITO電極2、シリンダー3、引出電極6、参照電極5、対電極4、引出電極7、電極固定器8は、金属製の載置台9a上に載置されて、インキュベータ9内に配設されている。
【0045】
薬剤添加装置10は、一例として、注入器10a、注入管10b及びチューブ10cを備えている。注入器10aは、インキュベータ9の外部に配設されると共に、電極固定器8に固定された注入管10bにチューブ10cを介して連結されている。これにより、薬剤添加装置10は、インキュベータ9の外部から所定濃度の薬剤を測定容器13内に添加可能に構成されている。
【0046】
尚、薬剤を測定容器13に添加するための薬剤添加装置10を試験装置1に設けることなく、ピペットやディスペンサーなどを用いて手動にて薬剤を測定容器13に添加することも当然可能である。
【0047】
検出器11は、インキュベータ9の外部に配設されると共に、リード11a、11b、11cを介して参照電極5、引出電極6、引出電極7にそれぞれ接続されている。
【0048】
そして、本実施例では、検出器11は、引出電極6と引出電極7との間(つまり、ITO電極2と対電極4との間)にリード11b、11cを介して任意の周波数の交流電圧(交流信号)Vを供給(印加)しつつ、参照電極5と引出電極6との間(つまり、参照電極5とITO電極2との間)を流れる交流電流Iをリード11a、11bを介して検出する。これにより、検出器11は、測定容器13の底面(ITO電極2の表面)に接着した細胞14のインピーダンスZを3端子法によって測定可能なように構成されている。又、本実施例では、検出器11は、交流電流Iと交流電圧Vとの位相差θを測定する機能も備えている。
【0049】
コンピュータ12は、検出器11の検出結果に基づいてインピーダンスZに係る情報を記憶する記憶手段12bと、記憶手段12bに記憶されたインピーダンスZに係る情報をその経時変化を示す形態に処理する処理装置12aと、処理装置12aの処理結果を出力する出力手段12cと、を有する。記憶手段12bとしては、限定されるものではないが、ハードディスクや電子的なメモリを好適に用いることができる。処理装置12aとしては、制御部、演算部、記憶部を備えた一般的な演算制御回路を用いることができる。又、出力手段12cとしては、処理結果を表示するディスプレイ装置を好適に用いることができる。更に、処理装置12aには、入力手段12dとしてキーボードなどが接続されている。本実施例では、これら処理装置12a、記憶手段12b、出力手段12cとしてのディスプレイ装置、及び入力手段12dを備えたコンピュータ12が検出器11に接続されている。尚、出力手段12cとして、処理結果を印刷(プリント)するプリンタを上記ディスプレイ装置の代わりに或いはディスプレイ装置に加えて用いてもよい。そして、本実施例では、コンピュータ12の処理装置12aは、検出器11を制御してインピーダンスZの測定動作を実行させると共に、検出器11によって測定されたインピーダンスZと位相差θとが入力されて、これを記憶手段12bに記憶させる。
【0050】
(2−3)インピーダンス測定
次に、試験装置1を用いたインピーダンス測定について説明する。
【0051】
先ず、測定容器13の内部において細胞14を培養する。具体的には、目的の細胞に応じた適当な培地を収容した測定容器13の底面(ITO電極2の表面)に、適当な播種濃度で細胞14を播種し、適当なCO2濃度、湿度、温度に制御されたインキュベータ9内で単層培養する。このとき、リード11a、11b、11cは、検出器11に接続されていてもよいが、接続されていなくてもよい。
【0052】
細胞14の形態観察を顕微鏡で定期的に行い、ITO電極2上の細胞14が接着するまで培養する。続いて、リード11a、11b、11cを検出器11に接続して、検出器11を作動させて、所定の測定周波数の交流電圧Vを細胞14に供給することにより、細胞14についてのインピーダンスZの測定を開始する。その後、適当な時間、好ましくは、インピーダンスZの値が安定するのを待って、試験対象の抗がん剤を含む試験薬剤溶液(所定濃度の抗がん剤を含むか、コントロールとして抗がん剤を含まない緩衝溶液など)を測定容器13に添加する。続いて、細胞14のインピーダンスZの測定と、交流電流I及び交流電圧Vの位相差θについての測定とを、所定時間(測定間隔)毎に、所定の測定周波数の交流電圧Vを印加しつつ、予め決められた時間(測定時間)だけ実施する。上記測定間隔は、細胞の薬剤応答性により任意に決定することができ、例えば、心筋細胞の場合は、1分間に約60回拍動するので、測定間隔は0.01秒〜0.1秒が好ましい。又、血管細胞の場合は、30分程度で収縮反応が終わるので、測定間隔は10秒程度が好ましい。又、がん細胞の場合は、48時間〜72時間と長期反応のため、測定間隔は2分〜5分が好ましい。但し、薬剤の添加直後に大きな形態変化が予想される場合は、短いサンプリングが必要なことがある。本実施例では、測定間隔を1分とし、上記測定時間を96時間とした。この際に、コンピュータ12は、検出器11によって測定されて処理装置12aに入力されたインピーダンスZと位相差θとを、互いに対応させて記憶手段12bに記憶させる。
【0053】
続いて、処理装置12aは、記憶手段12bに記憶された、試験薬剤溶液の添加直後からの上記測定間隔毎のインピーダンスZのリアクタンス成分X(t)を、インピーダンスZとそれに対応する位相差θとに基づいてすべて計算すると共に、記憶手段12bに記憶させる。
【0054】
次いで、処理装置12aは、試験薬剤溶液の添加直後のリアクタンス成分を基準として、試験薬剤溶液の添加直後からの上記測定間隔毎のリアクタンス成分を正規化する、即ち、試験薬剤溶液の添加直後のリアクタンスに対するリアクタンス比を求める。そして、求めた上記測定間隔毎のリアクタンス比を記憶手段12bに記憶させる。
【0055】
即ち、本実施例では、インピーダンスを示す情報の経時変化として、試験薬剤溶液の添加直後のインピーダンスのリアクタンス成分に対する、測定間隔毎のインピーダンスのリアクタンス成分の比(リアクタンス比)の経時変化を測定する。
【0056】
尚、本実施例では、各電極5、6、7とインピーダンス測定装置11との間に生じる接触抵抗や、添加した試験薬剤溶液の添加量(濃度)のばらつきなどの外部誤差要因をキャンセルして、微小なリアクタンス成分の時間的変化を感度よく測定するために、測定したリアクタンス成分を、試験薬剤溶液の添加直後に測定したリアクタンス成分で正規化する。しかし、例えば、接触抵抗が極めて小さく、且つ、試験薬剤溶液をばらつきの少ない状態で添加できる場合などには、測定したリアクタンス成分を正規化することなく、そのリアクタンス成分の時間的変化をインピーダンスに係る情報の経時変化として利用することができる。
【0057】
上述の各工程を、少なくとも、試験薬剤溶液として抗がん剤を含有するものと、抗がん剤を含まないもの(コントロール)を添加した場合についてそれぞれ実施する。好ましくは、試験薬剤として抗がん剤を含有するものについては、抗がん剤の濃度が異なる複数の測定を実施する。更に、必要に応じて、異なる種類の抗がん剤を用いるなど条件を変えて、上記同様の測定を行う。
【0058】
このようにして、細胞が複数の電極のうち少なくとも1つとしてITO電極(作用電極)2上を覆う変化をインピーダンスとして検出することができる。
【0059】
尚、電極間に供給する交流電圧の最適な周波数は、特定の細胞、特定の試験対象薬剤に応じて、予め求めておくことができる。即ち、特定の細胞を培養しながら、周波数を所定の範囲(例えば100Hz〜1MHz)で変更しつつ交流電圧を電極間に供給してインピーダンス、位相差を測定する動作を、所定の測定間隔毎に所定の測定時間にわたって実施する。そして、例えば、特定の抗がん剤を添加した所定時間後のインピーダンスのリアクタンス成分の、その添加直後のリアクタンス成分に対する変化量が最大となる周波数を選択する。又、特定の細胞、特定の試験対象薬剤に対する交流電圧の最適な周波数を予め求めておかなくても、各測定間隔毎に交流電圧の周波数をスイープさせて、各周波数毎のインピーダンス、位相差を測定し、記憶しておくことで、例えば、測定時間の全体にわたって測定値が得られたときに、上記同様にして最適な周波数を選択すると共に、測定間隔毎に各周波数に対して得られた測定値のうち、選択した周波数に対する測定値をその後の処理に用いることができる。
【0060】
このように、本実施例の試験装置1は、複数の電極2、4、5が配置された測定容器13と、複数の電極間に電圧を印加してインピーダンスに係る情報を検出する検出器11と、検出器11の検出結果に基づいて上記インピーダンスに係る情報を記憶する記憶手段12bと、記憶手段12に記憶された上記インピーダンスに係る情報に基づいて処理を実行する処理装置12aと、処理装置12aによる処理結果を出力するための出力手段12cと、を有する。そして、処理装置12aは、測定容器13内に収容された培地中に配置された複数の電極のうち少なくとも1つの電極である作用電極2の表面において細胞を培養している間に検出器11によって連続的に測定されて記憶手段12bに記憶された上記インピーダンスに係る情報であって、次の条件、(a)培養の間における培地への試験対象薬剤の添加量、(b)培地に添加する試験対象薬剤の種類、(c)培養の開始から培地への試験対象薬剤の添加までの経過時間、(d)培養の間において培地へ順に添加する複数種類の試験対象薬剤の添加順序、のうちの少なくとも1つを異ならせてそれぞれ記憶された情報に基づいて、当該条件の違いによる上記インピーダンスに係る情報の経時変化の差異を明示するための処理を実行する。又、出力手段12cは、処理装置12aによる上記インピーダンスに係る情報の経時変化の差異を明示する処理結果を出力する。
【0061】
処理装置12aは、上記インピーダンスに係る情報の経時変化の差異を明示するための上述のような各種方法に係る処理を実行する。即ち、上記インピーダンスに係る情報の経時変化を示す曲線、該曲線の所定部分の傾きなどを出力装置によって出力(ディスプレイ装置での表示、プリンタによる印刷など)させるための処理を実行する。又、処理装置12aは、上述のように、試験対象薬剤の種類の違いなどによる上記インピーダンスを示す情報の経時変化の差異を明示するための処理を実行することもできる。
【0062】
尚、本実施例では、測定容器13は、ガラス板2a上に形成されたITO電極2とシリンダー3とで形成されるものとしたが、本発明はこれに限定されるものではない。例えば、ガラス、樹脂形成された容器の底部に、例えばガラスなどの基材上に電極が形成された電極部材を配置するようになっていてもよい。
【0063】
又、本実施例では、説明を容易とするために、試験装置1には、単独の測定容器13が設けられているものとしたが、本発明はこれに限定されるものではない。当業者には周知の複数のウェル(試料収容部,培養容器)を備えた細胞培養用の培養プレートのように複数の測定容器13を配列し、各測定容器13内に本実施例と同様に複数の電極を配置することができる。この場合、検出器11は、各測定容器13に配置された電極からの信号を、それぞれの測定容器13に関係付けて検出し、検出結果をそれぞれの測定容器13に関係付けて処理装置12aに入力する。そして、処理装置12aは、記憶手段12aへの情報の記憶、インピーダンスを示す情報の経時変化の差異を明示する処理を、それぞれの測定容器13に関係付けて行うようにする。これにより、典型的には、同一種類の試験対象薬剤の複数の異なる濃度、複数種類の試験対象薬剤、又は複数種類の試験対象薬剤のそれぞれの複数の異なる濃度についての試験などを同時に行うことができる。そして、それぞれの測定容器13に関する測定結果は、ディスプレイ装置での表示、プリンタによる印刷などにより、同時に又は逐次に行うことができる。
【0064】
(2−4)抗がん剤感受性の評価方法
上述のようにして得られたリアクタンス比の経時変化から、目的の細胞の試験対象である抗がん剤に対する感受性を評価する。
【0065】
ここで、従来の抗がん剤感受性試験方法では、抗がん剤と反応した後のがん細胞の状態を、抗がん剤の無い場合と比較している。しかしながら、実際は、がん細胞は時々刻々変化している。そのため、従来の抗がん剤感受性試験方法では、ある時間で細胞が本当に死んでいるのか、弱っているのかを評価することはできなかった。
【0066】
そこで、本発明によれば、インピーダンス測定法を用いて細胞の増殖過程を連続的に測定し、がん細胞の抗がん剤に対する感受性を評価する。連続的に細胞の増殖を測定できるので、実際に薬が効いているのか、既に効かなくなっているのかを、測定されたインピーダンスを示す情報の経時変化を示す曲線の傾きで判断することができる。
【0067】
更に説明すると、従来、一般に、抗がん剤の添加後40時間〜50時間後のがん細胞の状態を、例えばSDI法によって測定することが行われている。
【0068】
図3(a)は、がん細胞の抗がん剤との反応前後の状態を評価する従来の抗がん剤感受性試験方法に準じて、抗がん剤の添加時及び添加の所定時間後のリアクタンス比を測定した結果をグラフ化して示したものである。図3(a)では、抗がん剤の添加によって、所定時間後にがん細胞の増殖が抑制される(がん細胞が死んでいる)ように見える。
【0069】
一方、図3(b)は、図3(a)の場合と同じ系において、本発明に従ってインピーダンス測定を行った場合のリアクタンス比の経時変化をグラフ化して示したものである。図3(b)から、この例では、実際には、抗がん剤は、その添加後約10時間後から25時間後までの間に一時的に効いているだけで、添加後約30時間以降は再びがん細胞の増殖が始まっていることが分かる。
【0070】
次に、図4を参照して、本発明に従う抗がん剤感受性の評価方法について更に説明する。図4は、本実施例に従って測定されたリアクタンス比の経時変化の典型的な形態を示すものである。
【0071】
ここで、図4中、抗がん剤A、B、Cは、例えば、種類の異なる抗がん剤、又は濃度の異なる同一種類の抗がん剤であるものとする。又、図4中コントロールは、抗がん剤を添加しない場合を示す。
【0072】
図4に示すように、コントロール、並びに、抗がん剤A、B、Cについてのリアクタンス比の経時変化をグラフ化して表示することによって、測定時間の全体にわたるがん細胞の増殖の様子の違いを判別することができる。
【0073】
例えば、図4に示す例において、コントロールでは、時間経過と共にほぼ一定の割合でリアクタンス比が増加していることが分かる。これに対して、抗がん剤Aでは、測定時間内において、その添加から一定時間が経過した後にリアクタンス比の増加が飽和に達することが分かる。又、抗がん剤Bでは、測定時間内において、その添加から一定時間が経過するまではリアクタンス比は増加するが、その後減少し、更にその後再び増加が始まることが分かる。又、抗がん剤Cでは、測定時間内において、その添加から一定時間が経過するまではリアクタンス比は増加するが、その後減少を始め、ついにはその減少が止まることが分かる。このような対比表示は、グラフ化をせずに数値自体で行うこともできるが、それぞれの場合のリアクタンス比の経時変化の差異を容易に把握できることから、グラフ化する方がより好ましい表示形態である。
【0074】
又、図4に示すような、それぞれの場合のリアクタンス比の経時変化において、抗がん剤を添加してから所定時間後(図4中の時間t)における傾き、即ち、リアクタンス比の時間経過に対する変化の割合を求めて表示することができる。この傾きの対比表示を行うには、それぞれの場合における傾きの数値自体を対比表示したり、グラフ中に傾きを表す直線を合わせて表示したりすることができる。
【0075】
尚、この傾きの表示に加えて、当該抗がん剤を添加してからの所定時間後におけるインピーダンスに係る情報自体、即ち、ここではリアクタンス比の値自体を表示することも有効である。これにより、当該所定時間後までのがん細胞の増殖(又は死滅)の様子が分かると共に、その後の増殖(又は死滅)の様子を推測することができる。
【0076】
この場合の、抗がん剤を添加してから所定時間後としては、従来一般に抗がん剤感受性を評価するのに用いられている、40〜50時間後(例えば48時間後)を好ましく採用することができるが、これに限定されるものではない。より具体的には、抗がん剤を添加してから所定時間後における曲線の傾きは、その前後の複数の測定値から直線近似することなどによって求めることができる。このような方法自体は当業者にとって自明であり、又利用可能な如何なる方法をも採用することができる。
【0077】
例えば、図4に示す例において、コントロールでは、時間tにおける傾きは正であり、時間tにおけるリアクタンス比(添加時に対して正規化されている)は1より大きい。これに対して、抗がん剤Aでは、時間tにおける傾きはほぼゼロであり、時間tにおけるリアクタンス比は1より大きいがコントロールにおける値よりも小さい。即ち、抗がん剤Aでは、時間t以降のがん細胞の増殖は抑制されることが予測される。又、抗がん剤Bでは、時間tにおけるリアクタンス比は1より大きくコントロールにおける値よりも小さいが、時間tにおける傾きは正であり、コントロールにおける傾きとほぼ同じである。即ち、抗がん剤Bでは、時間t以降におけるがん細胞の増殖が予測される。又、抗がん剤Cでは、時間tにおける傾きはほぼゼロであり、時間tにおけるリアクタンス比は1より小さい。即ち、時間t以降のがん細胞の増殖は抑制されることが予測される。
【0078】
このように、傾きを対比するに当たっては、典型的には、次の形態が考えられる。
1.試験対象薬剤を添加した場合の試験対象薬剤の添加から(或いは培養開始から)所定時間経過後の傾きと、試験対象薬剤を添加しない場合の対応する所定時間経過後の傾きとを比較する。
2.異なる濃度の同一種類の試験対象薬剤を添加した場合の、各濃度における試験対象薬剤の添加から(或いは培養開始から)所定時間経過後の傾きを比較する。
3.異なる種類の試験対象薬剤を同一濃度で添加した場合の、各種類の試験対象薬剤における所定時間経過後の傾きを比較する。
4.培養開始から同一種類の試験対象薬剤の添加までの時間を異ならせた場合の、それぞれの添加時間までの時間における、試験対象薬剤の添加から(或いは培養開始から)所定時間経過後の傾きを比較する。
5.1つの試料に対して順に添加する複数種類の試験対象薬剤の添加順序を異ならせた場合の、それぞれの順序における、最後に添加する試験対象薬剤の添加から(或いは培養開始から)所定時間後の傾きを比較する。
【0079】
尚、インピーダンスの経時変化の差異を検出するための測定において、上述のような試験対象薬剤の添加量(存在・非存在、濃度)、試験対象薬剤の種類、試験対象薬剤を添加するまでの時間、複数種類の試験対象薬剤の添加順序といった条件のうち複数の条件を複合的に変化させてもよい。変化させる条件の組み合わせは、入手したい情報に応じて、適宜、選択することができる。例えば、試験対象薬剤の濃度と種類、試験対象薬剤の種類とそれを添加するまで時間、添加順序と各順序で添加する試験対象薬剤の濃度、などを同時に異ならせることができる。
【0080】
試験装置1において、コンピュータ12の処理装置12aは、上述のようにインピーダンスを示す情報の経時変化の差異を出力するための処理を実行することに加えて、例えば、上述のような傾きの対比結果から、抗がん剤の種類による有効性、抗がん剤の効き方(すぐに効くのかゆっくり効くのか)、抗がん剤の有効量などの、抗がん剤の使用方法を判断するのに有用な情報を出力するための処理を実行することもできる。
【0081】
例えば、図4に示す結果から判断する限りにおいては、抗がん剤Cが抗がん剤A、B、Cのうちで最も効果的であることが分かる。即ち、例えば、抗がん剤A、B、Cが異なる種類のものである場合には、抗がん剤Cの種類が最も効果的であり、抗がん剤A、B、Cが異なる濃度の同一種類のものである場合には、抗がん剤Cの濃度が最も効果的であることが分かる。
【0082】
このように、本発明によれば、がん細胞に対して効かない抗がん剤を見つけられるばかりでなく、例えば、一見効くようでも経時的に耐性ができて効かなくなってしまう抗がん剤を見つけることができる。
【0083】
又、がん細胞に抗がん剤を曝露させた後、何時間で抗がん剤が効き始めるかなどの抗がん剤の効き方が分かるため、患者の体内動態を適切に管理し、最適な投与時間を予測することを助けることができる。
【0084】
又、添加する抗がん剤の濃度を変更した複数の測定を行うことによって、抗がん剤の濃度による効果の違いを確認することができる。そのため、副作用を限りなく抑えて、最大の効果を得られるような投与方法を予測することを助けることができる。
【0085】
又、培養開始から抗がん剤の添加までの時間を変更した複数の測定(例えば、播種直後に添加、播種から5分後に添加、播種から30分後に添加などの違い)を行うことによって、抗がん剤の投与タイミングや投与間隔が適正かどうかを評価することを助けることができる。
【0086】
又、1つの試料に複数種類の抗がん剤を順に添加する場合における添加順序を変更した複数の測定(例えば、2種類の抗がん剤A、Bを順に添加する場合に、抗がん剤Aを先に添加する場合と、抗がん剤Bを先に添加する場合)を行うことによって、複数の抗がん剤の投与順序が適正かどうかを評価することを助けることができる。
【0087】
(2−5)具体例
次に、本実施例に従う抗がん剤感受性試験を適用した具体例について説明する。
【0088】
ここでは、特定のがん細胞に対して複数種類の抗がん剤を反応させた場合の例を示す。がん細胞としては、肝臓由来のがん細胞であるHepG2を用いた。そして、本実施例に従って、当該がん細胞を培養すると共に、培地に対して血液がん用の抗がん剤であるビンクリスチンと、肝臓がん用の抗がん剤である5−FU(5−フルオロウラシル)とをそれぞれ添加し、それぞれの場合におけるがん細胞の増殖過程をインピーダンス測定に基づくリアクタンス比の経時変化の違いとして測定した。培養条件、測定条件、抗がん剤の添加条件、及び結果は以下の通りである。
・培養条件
播種濃度:5万個/well(ウェル)
インキュベータ内環境:CO25%、湿度100%、温度37℃
培地:DMEM培地+10%FBS含有
・測定条件
測定周波数:100kHz
測定間隔:1分
測定時間:96時間
・抗がん剤添加条件
抗がん剤濃度:ビンクリスチン 200μg/ml
5−FU 5μg/ml
コントロール:培地を300μl
・結果
図5(a)は、血液がん用の抗がん剤であるビンクリスチンを添加した場合と、添加しなかった場合(コントロール)についての、リアクタンス比の経時変化を示す。又、図5(b)は、肝臓がん用の抗がん剤である5−FUを添加した場合と、添加しなかった場合(コントロール)についての、リアクタンス比の経時変化を示す。
【0089】
図5(a)から、血液がん用の抗がん剤は、一時的に肝臓由来のがん細胞の増殖を阻害するが、ある程度時間が経つと(添加後約20時間)、がん細胞の増殖が再開しているのが分かる。例えば、測定開始から40時間経過後において、抗がん剤を添加した場合のリアクタンス比はコントロールに比べて小さくなっているが、その時の抗がん剤を添加した場合の曲線の傾きはコントロールのほぼ半分程度の正の傾きを有している。従って、当該がん細胞に対して、血液がん用の抗がん剤の効果は一時的なものであり、一定時間経過後にはがん細胞は再び増殖を続けるものと予測できる。
【0090】
一方、肝臓がん用の抗がん剤は、効くまでに時間がかかるが(添加後約10時間)、その後は確実にがん細胞を殺していることが分かる。例えば、測定開始から30時間経過後において、抗がん剤を添加した場合のリアクタンス比はコントロールに比べて小さくなっており、且つ、その時の抗がん剤を添加した場合の曲線の傾きは、ほぼゼロである。又、測定開始から40時間経過後において、抗がん剤を添加した場合の傾きは負になっている。従って、肝臓がん用の抗がん剤は、一定時間経過後に、当該がん細胞の増殖を有効に阻害するものと予測できる。
【0091】
このように、あるポイントだけでの評価では、その時点での細胞の「弱り具合」は分からないが、本実施例に従ってインピーダンスの連続測定を行うことにより、傾きとして細胞の「弱り具合」を検出することができる。
【0092】
以上説明したように、本発明によれば、対象とする細胞の増殖などの細胞活性を抑制する効果のない薬剤を排除するのに有効であるだけではなく、効果のある薬剤を選択するのを容易とすることができる。
【図面の簡単な説明】
【0093】
【図1】本発明に係る薬剤感受性試験装置の一実施例の概略構成図である。
【図2】図1の薬剤感受性試験装置の測定容器近傍を拡大して示す斜視図である。
【図3】本発明に係る薬剤感受性試験方法の原理を説明するためのグラフ図である。
【図4】本発明に係る薬剤感受性試験方法の実施形態を説明するためのグラフ図である。
【図5】本発明に従って測定されたがん細胞の抗がん剤感受性の試験結果を示すグラフ図である。
【符号の説明】
【0094】
1 薬剤感受性試験装置
2 ITO電極(作用電極)
3 シリンダー
4 対電極
5 参照電極
11 検出器
12 コンピュータ
12a 処理装置
12b 記憶手段
12c ディスプレイ装置(出力手段)
13 測定容器
【特許請求の範囲】
【請求項1】
測定容器内に収容された培地中に配置された複数の電極のうち少なくとも1つの電極の表面において細胞を培養すると共に、該培養の間に前記複数の電極間に所定の電圧を印加してインピーダンスに係る情報を連続的に測定することを、次の条件、
(a)前記培養の間における前記培地への試験対象薬剤の添加量、
(b)前記培地に添加する試験対象薬剤の種類、
(c)前記培養の開始から前記培地への試験対象薬剤の添加までの経過時間、
(d)前記培養の間において前記培地へ順に添加する複数種類の試験対象薬剤の添加順序、
のうちの少なくとも1つを異ならせてそれぞれ行い、当該条件の違いによる前記インピーダンスに係る情報の経時変化の差異を明示することを特徴とする薬剤感受性試験方法。
【請求項2】
前記インピーダンスに係る情報の経時変化の差異として、前記インピーダンスに係る情報の経時変化を示す曲線における、所定時間経過後の傾きの差異を明示することを特徴とする請求項1に記載の薬剤感受性試験方法。
【請求項3】
前記インピーダンスに係る情報の経時変化を示す曲線を対比可能なように出力することにより前記差異を明示することを特徴とする請求項1に記載の薬剤感受性試験方法。
【請求項4】
前記傾きを対比可能なように出力することにより前記差異を明示することを特徴とする請求項2に記載の薬剤感受性試験方法。
【請求項5】
前記細胞は、がん細胞であることを特徴とする請求項1〜4のいずれかの項に記載の薬剤感受性試験方法。
【請求項6】
前記試験対象薬剤は、抗がん剤であることを特徴とする請求項1〜5のいずれかの項に記載の薬剤感受性試験方法。
【請求項7】
複数の電極が配置された測定容器と、
前記複数の電極間に電圧を印加してインピーダンスに係る情報を検出する検出器と、
前記検出器の検出結果に基づいて前記インピーダンスに係る情報を記憶する記憶手段と、
前記記憶手段に記憶された前記インピーダンスに係る情報に基づいて処理を実行する処理装置と、
前記処理装置による処理結果を出力するための出力手段と、
を有し、
前記処理装置は、前記測定容器内に収容された培地中に配置された前記複数の電極のうち少なくとも1つの電極の表面において細胞を培養している間に前記検出器によって連続的に測定されて前記記憶手段に記憶された前記インピーダンスに係る情報であって、次の条件、
(a)前記培養の間における前記培地への試験対象薬剤の添加量、
(b)前記培地に添加する試験対象薬剤の種類、
(c)前記培養の開始から前記培地への試験対象薬剤の添加までの経過時間、
(d)前記培養の間において前記培地へ順に添加する複数種類の試験対象薬剤の添加順序、
のうちの少なくとも1つを異ならせてそれぞれ記憶された情報に基づいて、当該条件の違いによる前記インピーダンスに係る情報の経時変化の差異を明示するための処理を実行することを特徴とする薬剤感受性試験装置。
【請求項8】
前記処理装置は、前記インピーダンスに係る情報の経時変化の差異として、前記インピーダンスに係る情報の経時変化を示す曲線における、所定時間経過後の傾きの差異を明示するための処理を行うことを特徴とする請求項7に記載の薬剤感受性試験装置。
【請求項9】
前記処理装置は、前記差異を明示するための処理として、前記インピーダンスに係る情報の経時変化を示す曲線を対比可能なように出力するための処理を実行することを特徴とする請求項7に記載の薬剤感受性試験装置。
【請求項10】
前記処理装置は、前記差異を明示するための処理として、前記傾きを対比可能なように出力するための処理を実行することを特徴とする請求項8に記載の薬剤感受性試験装置。
【請求項11】
前記細胞は、がん細胞であることを特徴とする請求項7〜10のいずれかの項に記載の薬剤感受性試験装置。
【請求項12】
前記試験対象薬剤は、抗がん剤であることを特徴とする請求項7〜11のいずれかの項に記載の薬剤感受性試験装置。
【請求項1】
測定容器内に収容された培地中に配置された複数の電極のうち少なくとも1つの電極の表面において細胞を培養すると共に、該培養の間に前記複数の電極間に所定の電圧を印加してインピーダンスに係る情報を連続的に測定することを、次の条件、
(a)前記培養の間における前記培地への試験対象薬剤の添加量、
(b)前記培地に添加する試験対象薬剤の種類、
(c)前記培養の開始から前記培地への試験対象薬剤の添加までの経過時間、
(d)前記培養の間において前記培地へ順に添加する複数種類の試験対象薬剤の添加順序、
のうちの少なくとも1つを異ならせてそれぞれ行い、当該条件の違いによる前記インピーダンスに係る情報の経時変化の差異を明示することを特徴とする薬剤感受性試験方法。
【請求項2】
前記インピーダンスに係る情報の経時変化の差異として、前記インピーダンスに係る情報の経時変化を示す曲線における、所定時間経過後の傾きの差異を明示することを特徴とする請求項1に記載の薬剤感受性試験方法。
【請求項3】
前記インピーダンスに係る情報の経時変化を示す曲線を対比可能なように出力することにより前記差異を明示することを特徴とする請求項1に記載の薬剤感受性試験方法。
【請求項4】
前記傾きを対比可能なように出力することにより前記差異を明示することを特徴とする請求項2に記載の薬剤感受性試験方法。
【請求項5】
前記細胞は、がん細胞であることを特徴とする請求項1〜4のいずれかの項に記載の薬剤感受性試験方法。
【請求項6】
前記試験対象薬剤は、抗がん剤であることを特徴とする請求項1〜5のいずれかの項に記載の薬剤感受性試験方法。
【請求項7】
複数の電極が配置された測定容器と、
前記複数の電極間に電圧を印加してインピーダンスに係る情報を検出する検出器と、
前記検出器の検出結果に基づいて前記インピーダンスに係る情報を記憶する記憶手段と、
前記記憶手段に記憶された前記インピーダンスに係る情報に基づいて処理を実行する処理装置と、
前記処理装置による処理結果を出力するための出力手段と、
を有し、
前記処理装置は、前記測定容器内に収容された培地中に配置された前記複数の電極のうち少なくとも1つの電極の表面において細胞を培養している間に前記検出器によって連続的に測定されて前記記憶手段に記憶された前記インピーダンスに係る情報であって、次の条件、
(a)前記培養の間における前記培地への試験対象薬剤の添加量、
(b)前記培地に添加する試験対象薬剤の種類、
(c)前記培養の開始から前記培地への試験対象薬剤の添加までの経過時間、
(d)前記培養の間において前記培地へ順に添加する複数種類の試験対象薬剤の添加順序、
のうちの少なくとも1つを異ならせてそれぞれ記憶された情報に基づいて、当該条件の違いによる前記インピーダンスに係る情報の経時変化の差異を明示するための処理を実行することを特徴とする薬剤感受性試験装置。
【請求項8】
前記処理装置は、前記インピーダンスに係る情報の経時変化の差異として、前記インピーダンスに係る情報の経時変化を示す曲線における、所定時間経過後の傾きの差異を明示するための処理を行うことを特徴とする請求項7に記載の薬剤感受性試験装置。
【請求項9】
前記処理装置は、前記差異を明示するための処理として、前記インピーダンスに係る情報の経時変化を示す曲線を対比可能なように出力するための処理を実行することを特徴とする請求項7に記載の薬剤感受性試験装置。
【請求項10】
前記処理装置は、前記差異を明示するための処理として、前記傾きを対比可能なように出力するための処理を実行することを特徴とする請求項8に記載の薬剤感受性試験装置。
【請求項11】
前記細胞は、がん細胞であることを特徴とする請求項7〜10のいずれかの項に記載の薬剤感受性試験装置。
【請求項12】
前記試験対象薬剤は、抗がん剤であることを特徴とする請求項7〜11のいずれかの項に記載の薬剤感受性試験装置。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2009−244197(P2009−244197A)
【公開日】平成21年10月22日(2009.10.22)
【国際特許分類】
【出願番号】特願2008−93348(P2008−93348)
【出願日】平成20年3月31日(2008.3.31)
【出願人】(000227180)日置電機株式会社 (982)
【Fターム(参考)】
【公開日】平成21年10月22日(2009.10.22)
【国際特許分類】
【出願日】平成20年3月31日(2008.3.31)
【出願人】(000227180)日置電機株式会社 (982)
【Fターム(参考)】
[ Back to top ]

