薬剤耐性かつ温度感受性変異株の解析に基づく、抗菌活性を有する薬剤の標的たんぱく質の同定方法
【課題】抗生物質等の「抗菌活性を有する薬剤」の標的たんぱく質を同定する方法を提供すること、及び、薬剤耐性を得る原因になった塩基置換の同定方法を提供すること。
【解決手段】抗菌活性を有する薬剤の標的たんぱく質を同定する方法であって、該薬剤に対する薬剤耐性変異株の中から温度感受性変異株を単離し、該温度感受性変異株におけるアミノ酸変異が導入されたたんぱく質を同定し、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定することを特徴とする標的たんぱく質の同定方法。
【解決手段】抗菌活性を有する薬剤の標的たんぱく質を同定する方法であって、該薬剤に対する薬剤耐性変異株の中から温度感受性変異株を単離し、該温度感受性変異株におけるアミノ酸変異が導入されたたんぱく質を同定し、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定することを特徴とする標的たんぱく質の同定方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗菌活性を有する薬剤の標的たんぱく質を同定する方法に関し、更に詳しくは、抗生物質等の「抗菌活性を有する薬剤」に対し薬剤耐性であり、かつ温度感受性である変異株を解析することに基づいた、該「抗菌活性を有する薬剤」の標的たんぱく質を同定する方法に関するものである。
【背景技術】
【0002】
抗生物質等の「抗菌活性を有する薬剤」は、様々な細菌感染症の治療薬として用いられている。かかる抗菌活性を有する薬剤は、通常、細菌等の特定の機能を阻害するものであり、これまでに、DNA複製、RNA合成、リボソームの形成、細胞壁生合成機構等を阻害する「抗菌活性を有する薬剤」が開発されており、臨床においても使用されている。
【0003】
抗生物質等の開発においては、当然、抗菌活性の有無を指標として、抗生物質である薬剤がスクリーニングされる。そして、該薬剤の標的たんぱく質を同定する方法としては、例えば、その薬剤に対する薬剤耐性菌を用い、遺伝子の差異を特定することによって、該抗生物質等の薬剤の標的分子を同定する方法がある。
しかしながら、多くの場合、その薬剤の標的たんぱく質を同定することは極めて難しい。
【0004】
一般に、薬剤耐性菌の薬剤耐性機構は、増殖に必要な標的たんぱく質分子の変化、薬剤排出トランスポーターの生成、修飾酵素・分解酵素による薬剤の分解若しくは不活性化、細胞表面の変質による薬剤透過性の変化(菌への取り込み阻害)等、多岐にわたっている。
【0005】
従って、薬剤の標的たんぱく質を同定することが極めて難しい原因のひとつとして、薬剤耐性菌を用いて遺伝学的に「抗菌活性を有する薬剤」の標的分子を同定する際に、細菌の増殖抑制に直接寄与する標的分子ではない、例えば、上記した薬剤排出トランスポーター等が候補として取れてしまうという問題点が挙げられる。すなわち、薬剤排出トランスポーター等に係る遺伝子部分が差異部分として認識されてしまい、該「抗菌活性を有する薬剤」が標的とする増殖に必要な化合物分子、すなわち標的たんぱく質のみを同定することは難しかった。
【0006】
本発明者は、温度感受性変異株の単離による「黄色ブドウ球菌の増殖に必要な遺伝子」の同定に成功している(非特許文献1〜7)。
それによると、温度感受性変異株においては、増殖に必要な遺伝子にアミノ酸変異を導く塩基置換変異が起こっている。そのため、高温になると(変異株でない場合には正常に増殖を維持できる程度の温度であっても)、変異が導入されたたんぱく質は、正常に働けなくなる。
【0007】
一方、抗生物質の一種であるリファンピシン(Rifampicin)において、薬剤耐性菌は、リファンピシンとの結合部位にアミノ酸置換変異が導入されることにより、ファンピシン耐性となることが報告されている(非特許文献8)。
【0008】
このように、特定の抗生物質においては、耐性菌の有するたんぱく質にアミノ酸置換変異が起こっているものが知られており、その場合には、該抗生物質の標的たんぱく質が同定されているが、一般的に広く利用・適用が可能な方法としての「抗菌活性を有する薬剤の標的たんぱく質を同定する方法」は知られていなかった。
【0009】
近年、薬剤耐性の、特に多剤耐性の黄色ブドウ球菌や緑膿菌が病院等で分離され、重篤な敗血症等を引き起こす事例が多数報告されている。
そこで、一般的に広く利用・適用・応用が可能な「抗菌活性を有する薬剤の標的たんぱく質を同定する方法」が望まれており、更には、標的たんぱく質が同定されたことによる、新たな作用機序の抗生物質等の薬剤の開発促進が望まれている。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Li Y, Kurokawa K, ReutimannL, Mizumura H, Matsuo M, SekimizuK., Microbiology. 2007 Oct;153(Pt 10):3370-9.
【非特許文献2】Ishibashi M, Kurokawa K, Nishida S, Ueno K, Matsuo M, Sekimizu K., FEMS Microbiol Lett. 2007 Sep;274(2):204-9. Epub2007 Jun 30.
【非特許文献3】Murai N, Kurokawa K, Ichihashi N, MatsuoM, Sekimizu K., FEMS MicrobiolLett. 2006 Jan;254(1):19-26.
【非特許文献4】Li Y, Kurokawa K, Matsuo M, Fukuhara N, Murakami K, SekimizuK., Mol Genet Genomics. 2004 May;271(4):447-57.
【非特許文献5】Matsuo M, Kurokawa K, Nishida S, Li Y, Takimura H, Kaito C, Fukuhara N, Maki H, Miura K, Murakami K, Sekimizu K., FEMS Microbiol Lett. 2003 May 16;222(1):107-13.
【非特許文献6】Kaito C, Kurokawa K, Hossain MS, AkimitsuN, Sekimizu K., FEMS MicrobiolLett. 2002 Apr 23;210(1):157-64.
【非特許文献7】Inoue R, Kaito C, Tanabe M, Kamura K, Akimitsu N, Sekimizu K.,Mol Genet Genomics. 2001 Dec;266(4):564-71.
【非特許文献8】Campbell EA, Korzheva N, Mustaev A, Murakami K, Nair S, Goldfarb A, Darst SA., Cell. 2001 Mar 23;104(6):901-12.
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は上記背景技術に鑑みてなされたものであり、その課題は、抗生物質等の「抗菌活性を有する薬剤」の標的たんぱく質を同定する方法を提供することにある。
【課題を解決するための手段】
【0012】
本発明者は、上記の課題を解決すべく鋭意検討を重ねた結果、薬剤耐性かつ熱感受性となった株では、増殖に必要な標的遺伝子に変異が導入されているのではないかと考え、薬剤耐性株の中から、温度感受性変異株が単離できるのではないかと考えた。そして、薬剤耐性変異株の中から温度感受性変異株を単離すれば、その変異は、増殖に必要なたんぱく質にアミノ酸変異が導入された結果もたらされたものであるから、そのたんぱく質が標的たんぱく質であるといえることを見出した。
【0013】
温度感受性変異株となる割合は、変異株全体に対しては、通常は約1/1000であるが、約6種類の薬剤の薬剤耐性変異株のそれぞれについて温度感受性試験を実施した結果、同時に温度感受性変異株ともなっている割合は、驚くべきことに、薬剤耐性変異株全体に対しては、全て約1/15に極端に上昇していることを見出した。
このことは、温度感受性となる原因であるアミノ酸変異が起こっているたんぱく質が、標的たんぱく質である可能性が高いからであると考え、下記するように実際に検証した結果、本発明に至った。
すなわち、単離された変異株の温度感受性に寄与する遺伝子(変異株でない場合には正常に増殖を維持できる程度の温度であっても、正常な増殖を維持できなくなる性質の原因となる遺伝子)の変異部位を同定することにより、菌の増殖に必要な、「抗生物質等の『抗菌活性を有する薬剤』の標的たんぱく質」が同定できることを見出し、本発明に至った。
【0014】
本発明を用いて、抗生物質の一種であるリファンピシンの標的たんぱく質として既に知られているrpoBの同定が行えることが検証された。すなわち、本発明の有効性が、既知の「抗生物質−標的たんぱく質」の系で立証された。
【0015】
更に、本発明を用いて、抗菌活性を有する化合物である#18(図11の化学構造を示す。標的たんぱく質は知られていない。)の標的たんぱく質の候補として、HMG−CoAレダクターゼであるMvaAを同定し、新規の系で本発明の有効性を立証した。
【0016】
すなわち、本発明は、抗菌活性を有する薬剤の標的たんぱく質を同定する方法であって、該薬剤に対する薬剤耐性変異株の中から温度感受性変異株を単離し、該温度感受性変異株におけるアミノ酸変異が導入されたたんぱく質を同定し、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定することを特徴とする標的たんぱく質の同定方法を提供するものである。
【0017】
また、本発明は、上記単離された温度感受性変異株の温度感受性に寄与する遺伝子の変異部位を同定することにより、上記アミノ酸変異が導入されたたんぱく質を同定する上記の標的たんぱく質の同定方法を提供するものである。
【0018】
また、本発明は、以下の工程1乃至工程4を有する上記の標的たんぱく質の同定方法を提供するものである。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:該遺伝子領域Aでコードされるたんぱく質を、上記薬剤の標的たんぱく質であると同定する。
【0019】
また、本発明は、薬剤耐性変異株が、該薬剤耐性を得る原因になった「標的たんぱく質のアミノ酸置換を導く塩基置換」の同定方法であって、以下の工程1乃至工程4を有することを特徴とする薬剤耐性を得る原因になった塩基置換の同定方法を提供するものである。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:薬剤耐性かつ温度感受性変異株の該遺伝子領域Aを配列決定(sequence determination)してアミノ酸置換を導く塩基置換を同定する。
【0020】
また、本発明は、上記の「標的たんぱく質の同定方法」を使用して同定された標的たんぱく質を標的とみなして改めて新たにスクリーニングすることを特徴とする抗菌活性を有する薬剤のスクリーニング方法を提供するものである。
【0021】
また、本発明は、上記の「標的たんぱく質の同定方法」を使用して同定された標的たんぱく質を標的とみなして改めて新たにスクリーニングする工程を有することを特徴とする抗菌活性を有する薬剤の製造方法を提供するものである。
【0022】
また、本発明は、上記の「標的たんぱく質の同定方法」を使用して同定された標的たんぱく質を標的とする薬剤であって、該標的たんぱく質の同定方法に用いた抗菌活性を有する薬剤以外の薬剤であることを特徴とする抗菌活性を有する薬剤を提供するものである。
【発明の効果】
【0023】
本発明によれば、前記問題点や課題を解決し、一般的に広く利用・適用・応用が可能な「抗生物質等の『抗菌活性を有する薬剤』の標的たんぱく質を同定する方法」を提供することができる。
また、本発明によれば、例えば、薬剤排出トランスポーター等の菌の増殖に関わらない物質が候補として取れる可能性がないので、的確に標的たんぱく質を同定することができる。
また、本発明によれば、通常は数年かかる標的たんぱく質の同定が、極めて短期間で可能となる。
また、本発明によれば、温度感受性の抑圧を指標とするので、標的たんぱく質の遺伝子の同定が容易である。
【0024】
更に、本発明の「増殖に必要な標的たんぱく質の同定方法」や「薬剤耐性を得る原因になったアミノ酸置換を導く塩基置換の同定方法」が、一般的に広く適用可能なものであるため、本発明の同定方法は、抗菌活性を有する薬剤の作用機序を解明する方法としても一般的であり広く有用なものである。
【0025】
更には、標的たんぱく質や、薬剤耐性を得る原因になったアミノ酸置換を導く塩基置換が同定されることで該薬剤の作用機序(抗菌活性を示すメカニズム)が明らかになれば、「細菌にのみ効く」等の好ましいメカニズムと、「副作用等をもたらす可能性の高い」等の好ましくないメカニズムが予め判明するので、薬剤の探索・開発や薬剤の実用化への指針になる。
また、本発明の同定方法を使用して得られた結果は、薬剤としての承認を得るためにも有用となる。
【0026】
更には、標的たんぱく質や塩基置換を同定することによって、新たな作用機序が分かり、その新たな作用機序に基づく「抗菌活性を有する薬剤」の開発方法、スクリーニング方法又は製造方法を提供することができる。
【図面の簡単な説明】
【0027】
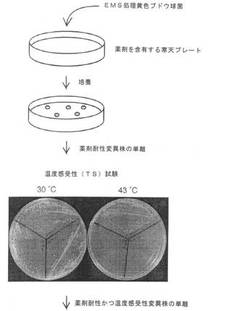
【図1】薬剤耐性変異株の中から温度感受性変異株を単離するまでの工程の一例を示す流れ図である。
【図2】薬剤耐性かつ温度感受性変異株(以下、「RifR TS mutant」と略記する場合がある)の単離から、標的たんぱく質の同定及び薬剤耐性を得る原因になった塩基置換の同定までの工程の一例を示す流れ図である。
【図3】RifR TS mutantにゲノムライブラリーを導入して、rpoB遺伝子を含むプラスミドが単離されたことを示す図である。
【図4】rpoB遺伝子の導入により、RifR TS mutantの高温感受性が抑圧されたことを示す図である。 「RN4220」は野生株、「RifRTS」はリファンピシン耐性かつ温度感受性変異株(RifR TS mutant)を示す。
【図5】RifR TS mutantのゲノム中のrpoB遺伝子に、アミノ酸置換を導く1塩基置換変異が見いだされたことを示す図である。
【図6】#18耐性かつ温度感受性変異株(以下、「#18R TS mutant」と略記する場合がある)の単離について示す図である。
【図7】#18R TS mutantにゲノムライブラリーを導入して、MvaA遺伝子を含むプラスミドが複数単離されたことを示す図である。
【図8】MvaA遺伝子の導入により、#18R TS mutantの高温感受性が抑圧されたことを示す図である。
【図9】#18R TS mutantのゲノム中のMvaA遺伝子に、アミノ酸置換を導く1塩基置換変異が見いだされたことを示す図である。
【図10】メバロン酸によって、MvaA遺伝子変異株の温度感受性が抑圧されたことを示す図である。 「LB0」は培地、「LB0+Mev(1mM)」はメバロン酸1mMを添加した培地、「RN4220」は野生株、「#18R,TS」は#18耐性かつ温度感受性変異株(#18R TS mutant)を示す。
【図11】#18、MvaAの基質であるHMG−CoA、並びに、HMG−CoAレダクターゼ阻害薬であるシンバスタチン(simvastatin)及びフルバスタチン(fluvastatin)の化学構造を示した図である。
【図12】#18による黄色ブドウ球菌細胞質画分のMvaA活性の阻害効果を示すグラフである。
【発明を実施するための形態】
【0028】
以下、本発明について説明するが、本発明は、以下の具体的態様に限定されるものではなく、技術的思想の範囲内で任意に変形することができる。
【0029】
本発明は、抗菌活性を有する薬剤の標的たんぱく質を同定する方法であって、該薬剤に対する薬剤耐性変異株の中から温度感受性変異株を単離し、該温度感受性変異株におけるアミノ酸変異が導入されたたんぱく質を同定し、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定することを特徴とする標的たんぱく質の同定方法である。
【0030】
本発明において、「抗菌活性を有する薬剤の標的たんぱく質」とは、抗菌活性を有する薬剤が変異を生じさせる「菌中の菌の増殖に必要なたんぱく質」をいい、特に、抗菌活性を有する薬剤が、タンパク質のアミノ酸変異を生じさせる「菌の増殖に必要な菌中のたんぱく質」をいう。
本発明において、「アミノ酸変異」とは、たんぱく質を構成するアミノ酸のうち、1つ又は2つ以上のアミノ酸が、別のアミノ酸に入れ替わる、除かれる、又は、追加されることをいう。本発明における「アミノ酸変異」は、別のアミノ酸に入れ替わることが多い。
【0031】
本発明において、「温度感受性」とは、野生株であれば正常に増殖を維持できる程度の温度であっても、正常な増殖を維持できなくなっている性質のことをいい、「温度感受性変異株」とは、温度感受性を有する変異株のことをいう。
かかる温度としては、特に限定はないが、30℃〜50℃が、一般の病原性細菌の増殖可能温度等の点から好ましく、40℃〜43℃が特に好ましい。
以下、「温度感受性」を単に「TS」と略記することがある。
【0032】
本発明は、抗菌活性を有する薬剤の標的たんぱく質の同定方法であり、また、薬剤耐性を得る原因になった「標的たんぱく質分子内で起こった塩基置換」の同定方法である。
抗菌の対象となる菌は、特に限定はないが、細菌であることが好ましく、細菌であれば、技術常識から何れの菌でも本発明の対象となり得る。中でも、黄色ブドウ球菌、大腸菌、緑膿菌、アシネトバクター、結核菌等の細菌は、実際に本発明が適用できることが確かめられている、又は、技術常識から、当然に適用でき得るものである。
【0033】
本発明の同定方法の一例を工程に沿って示した流れ図を、図1及び図2に示した。
まず、本発明においては、薬剤に対する薬剤耐性変異株の中から温度感受性変異株を単離する。ここで、培養方法、培地等は特に限定はなく公知のものが使用される。また、培養温度、圧力、光、環境気体、培養期間等の培養条件も特に限定はない。
菌は、特に限定はないが、種々の方法で変異誘導されることも好ましい。変異誘導剤としては特に限定はなく公知のものが使用できる。
【0034】
培養した株の中から、まず薬剤耐性変異株を単離する。単離方法も特に限定はなく公知の方法で行われる。
単離された複数の薬剤耐性変異株を上記した温度で培養して、その中から、正常な増殖を維持できなくなっている温度感受性変異株、すなわち、温度感受性を有する変異株を単離する(これを「温度感受性試験」と略記することがある)。この工程で単離された変異株は、薬剤耐性かつ温度感受性変異株である。
【0035】
例えば、図1における温度感受性試験において、30℃では3個の薬剤耐性変異株は何れも増殖したが、43℃では、右下と左下の2個の薬剤耐性変異株は温度感受性を示し、43℃では増殖できなかったことを示している。
【0036】
薬剤耐性変異株ではない変異株について温度感受性試験を実施した場合、温度感受性変異株となっている割合は、通常は約1/1000である。
しかしながら、驚くべきことに、薬剤耐性変異株について温度感受性試験を実施した場合、同時に温度感受性変異株ともなっている割合は、後記の表1に示した通り、1/13〜1/15に上昇していることが新たに分かった。
このことは、温度感受性となる原因であるアミノ酸変異が起こっているたんぱく質が、標的たんぱく質であることを示唆している。
【0037】
次いで、単離された該温度感受性変異株、すなわち、単離された「薬剤耐性かつ温度感受性変異株」における「アミノ酸変異が導入されたたんぱく質」を同定し、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定する。
「アミノ酸変異が導入されたたんぱく質」の同定方法は、特に限定はなく公知の方法が用いられ、例えば、以下の方法が挙げられる。
【0038】
すなわち、上記の「薬剤耐性かつ温度感受性変異株」に、ゲノムライブラリー(例えば、プラスミドライブラリー)を導入した後に培養し、温度感受性が抑制された株、すなわち、例えば43℃で増殖するようになった株を単離する。
次いで、該プラスミドをシークエンスして、プラスミド中の遺伝子又は遺伝子領域を同定する。この遺伝子(領域)でコードされるたんぱく質が標的たんぱく質である。
【0039】
「薬剤耐性かつ温度感受性変異株」の上記遺伝子又は遺伝子領域を配列決定(sequence determination)すれば、単離された株において、特定のたんぱく質分子(標的たんぱく質分子)においてアミノ酸置換を導く塩基置換が導入されている。
【0040】
本発明の標的たんぱく質の同定方法の典型的な好ましい工程で示すと以下である。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:該遺伝子領域Aでコードされるたんぱく質を、上記薬剤の標的たんぱく質であると同定する。
【0041】
工程1及び工程2の一例を図1に示した。工程1では、変異誘導した菌を薬剤の存在下で培養することも好ましい。工程2で、薬剤耐性かつ温度感受性変異株を単離する。
【0042】
工程3の一例を図2に示した。工程3では、「薬剤耐性かつ温度感受性変異株」に、ゲノムライブラリー(例えば、プラスミドライブラリー)を導入し、温度感受性ではなくなった変異株(温度感受性が抑制された変異株)を単離する。導入方法は公知の方法が可能である。
【0043】
工程4の一例も図2に示した。工程4では、プラスミドをシークエンス(配列決定(sequence determination)し、プラスミド中の挿入配列を求める。ある遺伝子領域を含んでいるので、その遺伝子領域でコードされるたんぱく質を同定できる。シークエンス(配列決定)の方法は特に限定されず、公知の方法が用いられる。
工程5の一例も図2に示した。工程5では、上記遺伝子領域Aでコードされるたんぱく質を、上記薬剤の標的たんぱく質であると同定する。
【0044】
本発明の、薬剤耐性変異株が薬剤耐性を得る原因になった「たんぱく質のアミノ酸置換を導く塩基置換」の同定方法を工程で示すと以下である。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:薬剤耐性かつ温度感受性変異株の該遺伝子領域Aを配列決定(sequence determination)してアミノ酸置換を導く塩基置換を同定する。
【0045】
工程1〜4は、前記した「本発明の標的たんぱく質の同定方法」の工程と同一である。
工程5は、図2にその一例を記載したように、薬剤耐性かつ温度感受性変異株の該遺伝子領域Aを配列決定(sequence determination)してアミノ酸置換を導く塩基置換を同定する工程である。
【0046】
本発明は、薬剤耐性かつ温度感受性変異株を用いて、抗生物質等の標的を同定する新たな方法である。本発明の効果は前記した通りである。
【0047】
実際に、本発明の「標的たんぱく質の同定方法」を使用して、リファンピシン(Rifampicin)の直接の標的たんぱく質であるrpoBが同定できた。
同定された変異部位であるrpoBのD471、H481、R484は、結晶構造解析から、リファンピシンとの結合に重要な役割を果たすアミノ酸であることが報告されている(非特許文献8)。
よって、本発明の方法を用いて、抗生物質であるリファンピシンの標的たんぱく質を同定できること、及び、標的たんぱく質内において、リファンピシンとの結合に必要なアミノ酸の同定ができることが示された。
【0048】
更に、本発明の有用性を検証するために、標的が不明な薬剤の標的たんぱく質が同定できるか否かを検討した。
実施例で詳述するが、化合物#18は、化合物ライブラリーから同定された抗生物質であり、標的たんぱく質も抗菌性を示す作用機序も不明であった。本発明の方法を用いて、#18の標的たんぱく質として黄色ブドウ球菌のHMG−CoAレダクターゼが同定された。
【0049】
#18の添加により、Vmaxは変わらないが、Kmが増加したことから、#18がMvaA活性を競合的に阻害することが分かった。
黄色ブドウ球菌のMvaA遺伝子は、増殖に必要であることが報告されている。
また、黄色ブドウ球菌のHMG−CoAレダクターゼは、真核生物のHMG−CoAと基質特異性が異なり、statinが効かないことが報告されている。
よって、細菌のHMG−CoAレダクターゼ阻害剤として、#18は、新たな作用機序の抗生物質として新しいシーズである可能性があることが分かった。
【0050】
本研究は、抗菌活性を有すが、標的が不明であった抗生物質等の「抗菌活性を有する薬剤」の作用機序を解明することに貢献できる。また、作用機序が不明な抗生物質を用いた温度感受性変異株の網羅的取得により、増殖に必要な新たな遺伝子の同定ができる可能性がある。
【0051】
少なくとも、#18の標的たんぱく質として黄色ブドウ球菌のHMG−CoAレダクターゼが新たに同定されたことは、本発明の標的たんぱく質の同定方法が有用であることを示している。
また、本発明の標的たんぱく質の同定方法を使用して同定された標的たんぱく質(HMG−CoAレダクターゼ)を標的として、抗菌活性を有する薬剤をスクリーニングすることによって、新たな抗菌活性を有する薬剤をスクリーニングできる可能性があることは明らかである。
【0052】
本発明の方法を使用して同定された標的たんぱく質を標的とみなして、改めて新たにスクリーニングすれば、新たな抗菌活性を有する薬剤がスクリーニングでき、新たな抗菌活性を有する薬剤が製造できる。
【0053】
上記のスクリーニング方法で選択された、又は、上記方法で製造された薬剤、すなわち、本発明の同定方法を使用して同定された標的たんぱく質を標的とする薬剤(本発明の標的たんぱく質の同定方法の確立に使用した抗菌活性を有する薬剤は新規な薬剤ではないので除かれる)は有用である。
【実施例】
【0054】
以下に、実施例及び比較例を挙げて本発明を更に具体的に説明するが、本発明は、その要旨を超えない限りこれらの実施例に限定されるものではない。
【0055】
実施例1
<用いた細菌>
黄色ブドウ球菌RN4220株(Novick et.al.,1993)は、Luria-Bertani(LB) medium(1% Bactotryptone(BD), 0.5% yeast extract(BD), and 1%NaCl)で培養された。温度感受性の表現型は、NaCl-depleted LB mediumを用いて実験された。
【0056】
<細菌株とプラスミド>
薬剤耐性変異株は、薬剤添加TSB培地上でコロニーを形成したEtylmethansulfonate(EMS; Sigma, St. Louis, MO, USA)0.2%で処理したRN4220から単離された。
Plasmid pSR515は、大腸菌と黄色ブドウ球菌で複製可能なシャトルベクターである。
ゲノムDNAライブラリーは、黄色ブドウ球菌RN4220株のゲノムDNAフラグメントを、SspI、又はDNaseIで処理し、pSR515のSmaIサイトに挿入された。
遺伝子の同定は、プラスミドの内部配列及び黄色ブドウ球菌のゲノムをシークエンスして決定した。
【0057】
<本発明である、薬剤耐性変異株の中から温度感受性変異株を単離することによる標的たんぱく質の同定方法の確立>
薬剤耐性かつ高温感受性変異株(以下、「DrugR TS mutant」と略記する場合がある)を単離する方法を図1に示す。
まず、変異誘導剤であるメタンスルホン酸エチル(ethyl methanesulfonate)(以下、「EMS」と略記する場合がある)で処理した黄色ブドウ球菌を、薬剤を含有する寒天プレートで培養し、薬剤耐性変異株を複数分離した。
【0058】
次いで、温度感受性テスト(Temperature sensitive test)(以下、「TSテスト」と略記する場合がある)を行なった。
すなわち、薬剤耐性変異株の中で、43℃という高温状態で生育できない変異株(温度感受性変異株)を単離した。43℃は、野生株では増殖を阻害されない温度である。
本実施例では、「温度感受性」とは、43℃で生育できないことを言い、「温度感受性が抑圧された」とは、43℃で生育できるようになったことを言う。
【0059】
薬剤耐性かつ温度感受性を得る原因になった塩基置換の同定、標的たんぱく質(の塩基配列)の同定、薬剤耐性を得る原因になった塩基配列の同定の方法を図2に示す。
【0060】
黄色ブドウ球菌ゲノムライブラリーを導入して、すなわちプラスミドが導入されて温度感受性が抑制された変異株を単離した。
シークエンスして(配列決定して)、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子(領域)を同定した。薬剤耐性かつ温度感受性変異株のゲノム中に変異が導入されているかを確認し、その塩基配列の変異に対応したアミノ酸変異が導入されたたんぱく質を同定した。
そして、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定した。
【0061】
実施例2
<既知の抗生物質であるリファンピシンの既知の標的たんぱく質が、本発明の方法で同定できたことの実施例>
上記した「標的たんぱく質の同定方法」を用いて、公知の「抗菌活性を有する薬剤」の既に知られている標的たんぱく質の同定ができるか否かを、公知の抗生物質であるリファンピシンを使って検証した。
リファンピシンは、RNAポリメラーゼのBサブユニットであるrpoBを標的たんぱく質に直接結合し、酵素活性を阻害することが報告されている(非特許文献8)。また、rpoB遺伝子に変異が入ることにより、リファンピシン耐性となることが知られている(非特許文献8)。
【0062】
まず、リファンピシン耐性株の中から、温度感受性の株が分離できるか否かを検討した。変異誘導剤であるEMSに暴露された黄色ブドウ球菌を、リファンピシン含有寒天培地に塗布した。リファンピシン含有寒天培地上で生育した282株の温度感受性を試験した結果、21株が43℃で生育できなかった(表1参照)。
【0063】
【表1】

【0064】
リファンピシン耐性かつ温度感受性変異株(以下、「RifR TS mutant」と略記する場合がある)に、黄色ブドウ球菌のゲノムライブラリー(プラスミドライブラリー)を導入し、温度感受性が抑圧された株を単離した。
シークエンスした結果(配列決定(sequence determination)した結果)、プラスミド中の挿入配列は、rpoB遺伝子領域を含んでいた(図3)。
【0065】
リファンピシン耐性かつ温度感受性変異株において、アミノ酸変異が導入されたたんぱく質であって標的たんぱく質であると同定されたたんぱく質が、既にリファンピシンの標的たんぱく質として知られたrpoBであった。このことから、本発明の有効性が示された。
このことは、更に、分離されたリファンピシン耐性かつ温度感受性変異株(RifR TS mutant)に、rpoB遺伝子を導入する(図4における「RifRTS/pSrpoB」)ことにより、温度感受性が抑圧されたことにより確認された(図4)。
【0066】
リファンピシン耐性かつ温度感受性変異株(RifR TS mutant)のゲノム中のrpoB遺伝子領域を配列決定(sequence determination)した結果、分離された株のすべてで、アミノ酸置換を導く塩基置換が導入されていた(図5)。
【0067】
同定されたrpoB遺伝子の変異は、3種類(D471N、H481Y、R484H)であった。結晶構造解析から、rpoBのD471、H481、R484は、リファンピシンとの結合に重要な役割を果たすアミノ酸であることが報告されており、これらのアミノ酸変異がリファンピシン耐性を導くことが報告されている(非特許文献8)。
【0068】
以上の結果から、本発明の「標的たんぱく質の同定方法」を用いて、抗生物質であるリファンピシンの標的たんぱく質を同定でき、このようにして同定された標的たんぱく質は、報告されている標的タンパク質と同一であった。これにより、本発明の「標的たんぱく質の同定方法」を用いれば、抗菌活性を有する薬剤の標的たんぱく質を同定することができることが示された。
【0069】
また、リファンピシン耐性の原因になったアミノ酸変異も同定され、本発明の「薬剤耐性を得る原因になった塩基置換の同定方法」も有効であることが分かった。
【0070】
実施例3
<新規抗生物質の未知の標的たんぱく質が、本発明により同定できたことを示す実施例>
<<本発明が標的たんぱく質の同定に有用であることを、新規の例を挙げて立証>>
本発明の「標的たんぱく質の同定方法」を用いて、これまで標的たんぱく質が不明であった抗生物質の標的たんぱく質を同定できるか否かを検討した。
これまでに、本発明者らは、103,873個の化合物から、黄色ブドウ球菌に対して抗菌活性を有する抗菌化合物を3,383個得ている。
その中から、既存の抗生物質の骨格を有していない抗生物質である「#18」に着目した。
【0071】
変異誘導剤であるEMSに暴露された黄色ブドウ球菌を#18含有寒天培地に塗布し、生育した耐性株から、温度感受性変異株を分離した(図6)。
なお、この#18耐性かつ温度感受性変異株(以下、「#18R TS mutant」と略記する場合がある)は、#18に耐性であったが、他の抗生物質に対しては耐性を示さなかった。
【0072】
#18耐性かつ温度感受性変異株(#18R TS mutant)に、黄色ブドウ球菌のゲノムライブラリー(プラスミドライブラリー)を導入し、温度感受性が抑圧された株を単離した。シークエンスした結果(配列決定(sequence determination)した結果)、プラスミド中の挿入配列は、HMG−CoAレダクターゼをコードするMvaA遺伝子領域を含んでいた(図7)。
【0073】
分離された#18耐性かつ温度感受性変異株(#18R TS mutant)に、MvaA遺伝子を導入することにより、温度感受性は抑圧された(図8、3.〜7.)。
【0074】
#18耐性かつ温度感受性変異株(#18R TS mutant)のMvaA遺伝子領域をシークエンスした結果、M77にアミノ酸置換を導く塩基置換が導入されていた(図9)。
【0075】
また、寒天培地に、HMG−CoAレダクターゼの生成物であるメバロン酸を存在させることにより、#18耐性かつ温度感受性変異株(#18R TS mutant)の温度感受性は抑圧された(図10)。
このとき、リファンピシン耐性かつ温度感受性変異株(RifR TS mutant)の温度感受性は抑圧されなかった。
以上の結果から、抗生物質である#18の標的たんぱく質として、黄色ブドウ球菌のHMG−CoAレダクターゼであるMvaAを同定できた。
【0076】
実施例4
次に、#18の構造、MvaAの基質であるHMG−CoAの構造、並びに、真核生物のHMG−CoAレダクターゼ阻害薬であるシンバスタチン(simvastatin)及びフルバスタチン(fluvastatin)の構造を比較した。
その結果、#18は、シンバスタチンが有するclosed type statin構造を分子内に含んでいることが分かった(図11)。
【0077】
そこで、#18が、黄色ブドウ球菌のHMG−CoAレダクターゼ活性を阻害するか否か検討した。
黄色ブドウ球菌の野生株(RN4220)の細胞質画分中のHMG−CoAレダクターゼ活性を測定した。#18の添加により、このMvaA活性は競合的に阻害された(図12)。このときの阻害定数(KI)は、250μMであった。
#18耐性かつ温度感受性変異株(#18R TS mutant)の細胞質画分のMvaA活性は、#18では阻害されなかった。
【0078】
以上の結果から、本発明の標的たんぱく質の同定方法を用いることによって、抗菌活性を有する薬剤である抗生物質#18の標的たんぱく質は、黄色ブドウ球菌のHMG−CoAレダクターゼであることが分かった。
すなわち、本発明の標的たんぱく質の同定方法は、抗菌活性を有する薬剤の標的たんぱく質を同定する方法として確立していること及び新たな薬剤探索の指標を得るのに有用であることが示された。
【0079】
また、本発明の標的たんぱく質の同定方法を使用して同定された標的たんぱく質を標的とみなして、改めて新たにスクリーニングすることによって、新たな「抗菌活性を有する薬剤」をスクリーニングできる可能性や、新たな「抗菌活性を有する薬剤」の製造方法となる可能性が認められた。
【産業上の利用可能性】
【0080】
本発明の同定方法を使用して、抗菌活性を有する薬剤の標的たんぱく質や、薬剤耐性を得る原因になった「標的たんぱく質のアミノ酸置換を導く塩基置換」が同定されれば、新たな抗菌活性の作用機序の発見に結びつき、その新たな作用機序に基づく抗生物質等の探索に広く利用されるものである。
【技術分野】
【0001】
本発明は、抗菌活性を有する薬剤の標的たんぱく質を同定する方法に関し、更に詳しくは、抗生物質等の「抗菌活性を有する薬剤」に対し薬剤耐性であり、かつ温度感受性である変異株を解析することに基づいた、該「抗菌活性を有する薬剤」の標的たんぱく質を同定する方法に関するものである。
【背景技術】
【0002】
抗生物質等の「抗菌活性を有する薬剤」は、様々な細菌感染症の治療薬として用いられている。かかる抗菌活性を有する薬剤は、通常、細菌等の特定の機能を阻害するものであり、これまでに、DNA複製、RNA合成、リボソームの形成、細胞壁生合成機構等を阻害する「抗菌活性を有する薬剤」が開発されており、臨床においても使用されている。
【0003】
抗生物質等の開発においては、当然、抗菌活性の有無を指標として、抗生物質である薬剤がスクリーニングされる。そして、該薬剤の標的たんぱく質を同定する方法としては、例えば、その薬剤に対する薬剤耐性菌を用い、遺伝子の差異を特定することによって、該抗生物質等の薬剤の標的分子を同定する方法がある。
しかしながら、多くの場合、その薬剤の標的たんぱく質を同定することは極めて難しい。
【0004】
一般に、薬剤耐性菌の薬剤耐性機構は、増殖に必要な標的たんぱく質分子の変化、薬剤排出トランスポーターの生成、修飾酵素・分解酵素による薬剤の分解若しくは不活性化、細胞表面の変質による薬剤透過性の変化(菌への取り込み阻害)等、多岐にわたっている。
【0005】
従って、薬剤の標的たんぱく質を同定することが極めて難しい原因のひとつとして、薬剤耐性菌を用いて遺伝学的に「抗菌活性を有する薬剤」の標的分子を同定する際に、細菌の増殖抑制に直接寄与する標的分子ではない、例えば、上記した薬剤排出トランスポーター等が候補として取れてしまうという問題点が挙げられる。すなわち、薬剤排出トランスポーター等に係る遺伝子部分が差異部分として認識されてしまい、該「抗菌活性を有する薬剤」が標的とする増殖に必要な化合物分子、すなわち標的たんぱく質のみを同定することは難しかった。
【0006】
本発明者は、温度感受性変異株の単離による「黄色ブドウ球菌の増殖に必要な遺伝子」の同定に成功している(非特許文献1〜7)。
それによると、温度感受性変異株においては、増殖に必要な遺伝子にアミノ酸変異を導く塩基置換変異が起こっている。そのため、高温になると(変異株でない場合には正常に増殖を維持できる程度の温度であっても)、変異が導入されたたんぱく質は、正常に働けなくなる。
【0007】
一方、抗生物質の一種であるリファンピシン(Rifampicin)において、薬剤耐性菌は、リファンピシンとの結合部位にアミノ酸置換変異が導入されることにより、ファンピシン耐性となることが報告されている(非特許文献8)。
【0008】
このように、特定の抗生物質においては、耐性菌の有するたんぱく質にアミノ酸置換変異が起こっているものが知られており、その場合には、該抗生物質の標的たんぱく質が同定されているが、一般的に広く利用・適用が可能な方法としての「抗菌活性を有する薬剤の標的たんぱく質を同定する方法」は知られていなかった。
【0009】
近年、薬剤耐性の、特に多剤耐性の黄色ブドウ球菌や緑膿菌が病院等で分離され、重篤な敗血症等を引き起こす事例が多数報告されている。
そこで、一般的に広く利用・適用・応用が可能な「抗菌活性を有する薬剤の標的たんぱく質を同定する方法」が望まれており、更には、標的たんぱく質が同定されたことによる、新たな作用機序の抗生物質等の薬剤の開発促進が望まれている。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Li Y, Kurokawa K, ReutimannL, Mizumura H, Matsuo M, SekimizuK., Microbiology. 2007 Oct;153(Pt 10):3370-9.
【非特許文献2】Ishibashi M, Kurokawa K, Nishida S, Ueno K, Matsuo M, Sekimizu K., FEMS Microbiol Lett. 2007 Sep;274(2):204-9. Epub2007 Jun 30.
【非特許文献3】Murai N, Kurokawa K, Ichihashi N, MatsuoM, Sekimizu K., FEMS MicrobiolLett. 2006 Jan;254(1):19-26.
【非特許文献4】Li Y, Kurokawa K, Matsuo M, Fukuhara N, Murakami K, SekimizuK., Mol Genet Genomics. 2004 May;271(4):447-57.
【非特許文献5】Matsuo M, Kurokawa K, Nishida S, Li Y, Takimura H, Kaito C, Fukuhara N, Maki H, Miura K, Murakami K, Sekimizu K., FEMS Microbiol Lett. 2003 May 16;222(1):107-13.
【非特許文献6】Kaito C, Kurokawa K, Hossain MS, AkimitsuN, Sekimizu K., FEMS MicrobiolLett. 2002 Apr 23;210(1):157-64.
【非特許文献7】Inoue R, Kaito C, Tanabe M, Kamura K, Akimitsu N, Sekimizu K.,Mol Genet Genomics. 2001 Dec;266(4):564-71.
【非特許文献8】Campbell EA, Korzheva N, Mustaev A, Murakami K, Nair S, Goldfarb A, Darst SA., Cell. 2001 Mar 23;104(6):901-12.
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は上記背景技術に鑑みてなされたものであり、その課題は、抗生物質等の「抗菌活性を有する薬剤」の標的たんぱく質を同定する方法を提供することにある。
【課題を解決するための手段】
【0012】
本発明者は、上記の課題を解決すべく鋭意検討を重ねた結果、薬剤耐性かつ熱感受性となった株では、増殖に必要な標的遺伝子に変異が導入されているのではないかと考え、薬剤耐性株の中から、温度感受性変異株が単離できるのではないかと考えた。そして、薬剤耐性変異株の中から温度感受性変異株を単離すれば、その変異は、増殖に必要なたんぱく質にアミノ酸変異が導入された結果もたらされたものであるから、そのたんぱく質が標的たんぱく質であるといえることを見出した。
【0013】
温度感受性変異株となる割合は、変異株全体に対しては、通常は約1/1000であるが、約6種類の薬剤の薬剤耐性変異株のそれぞれについて温度感受性試験を実施した結果、同時に温度感受性変異株ともなっている割合は、驚くべきことに、薬剤耐性変異株全体に対しては、全て約1/15に極端に上昇していることを見出した。
このことは、温度感受性となる原因であるアミノ酸変異が起こっているたんぱく質が、標的たんぱく質である可能性が高いからであると考え、下記するように実際に検証した結果、本発明に至った。
すなわち、単離された変異株の温度感受性に寄与する遺伝子(変異株でない場合には正常に増殖を維持できる程度の温度であっても、正常な増殖を維持できなくなる性質の原因となる遺伝子)の変異部位を同定することにより、菌の増殖に必要な、「抗生物質等の『抗菌活性を有する薬剤』の標的たんぱく質」が同定できることを見出し、本発明に至った。
【0014】
本発明を用いて、抗生物質の一種であるリファンピシンの標的たんぱく質として既に知られているrpoBの同定が行えることが検証された。すなわち、本発明の有効性が、既知の「抗生物質−標的たんぱく質」の系で立証された。
【0015】
更に、本発明を用いて、抗菌活性を有する化合物である#18(図11の化学構造を示す。標的たんぱく質は知られていない。)の標的たんぱく質の候補として、HMG−CoAレダクターゼであるMvaAを同定し、新規の系で本発明の有効性を立証した。
【0016】
すなわち、本発明は、抗菌活性を有する薬剤の標的たんぱく質を同定する方法であって、該薬剤に対する薬剤耐性変異株の中から温度感受性変異株を単離し、該温度感受性変異株におけるアミノ酸変異が導入されたたんぱく質を同定し、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定することを特徴とする標的たんぱく質の同定方法を提供するものである。
【0017】
また、本発明は、上記単離された温度感受性変異株の温度感受性に寄与する遺伝子の変異部位を同定することにより、上記アミノ酸変異が導入されたたんぱく質を同定する上記の標的たんぱく質の同定方法を提供するものである。
【0018】
また、本発明は、以下の工程1乃至工程4を有する上記の標的たんぱく質の同定方法を提供するものである。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:該遺伝子領域Aでコードされるたんぱく質を、上記薬剤の標的たんぱく質であると同定する。
【0019】
また、本発明は、薬剤耐性変異株が、該薬剤耐性を得る原因になった「標的たんぱく質のアミノ酸置換を導く塩基置換」の同定方法であって、以下の工程1乃至工程4を有することを特徴とする薬剤耐性を得る原因になった塩基置換の同定方法を提供するものである。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:薬剤耐性かつ温度感受性変異株の該遺伝子領域Aを配列決定(sequence determination)してアミノ酸置換を導く塩基置換を同定する。
【0020】
また、本発明は、上記の「標的たんぱく質の同定方法」を使用して同定された標的たんぱく質を標的とみなして改めて新たにスクリーニングすることを特徴とする抗菌活性を有する薬剤のスクリーニング方法を提供するものである。
【0021】
また、本発明は、上記の「標的たんぱく質の同定方法」を使用して同定された標的たんぱく質を標的とみなして改めて新たにスクリーニングする工程を有することを特徴とする抗菌活性を有する薬剤の製造方法を提供するものである。
【0022】
また、本発明は、上記の「標的たんぱく質の同定方法」を使用して同定された標的たんぱく質を標的とする薬剤であって、該標的たんぱく質の同定方法に用いた抗菌活性を有する薬剤以外の薬剤であることを特徴とする抗菌活性を有する薬剤を提供するものである。
【発明の効果】
【0023】
本発明によれば、前記問題点や課題を解決し、一般的に広く利用・適用・応用が可能な「抗生物質等の『抗菌活性を有する薬剤』の標的たんぱく質を同定する方法」を提供することができる。
また、本発明によれば、例えば、薬剤排出トランスポーター等の菌の増殖に関わらない物質が候補として取れる可能性がないので、的確に標的たんぱく質を同定することができる。
また、本発明によれば、通常は数年かかる標的たんぱく質の同定が、極めて短期間で可能となる。
また、本発明によれば、温度感受性の抑圧を指標とするので、標的たんぱく質の遺伝子の同定が容易である。
【0024】
更に、本発明の「増殖に必要な標的たんぱく質の同定方法」や「薬剤耐性を得る原因になったアミノ酸置換を導く塩基置換の同定方法」が、一般的に広く適用可能なものであるため、本発明の同定方法は、抗菌活性を有する薬剤の作用機序を解明する方法としても一般的であり広く有用なものである。
【0025】
更には、標的たんぱく質や、薬剤耐性を得る原因になったアミノ酸置換を導く塩基置換が同定されることで該薬剤の作用機序(抗菌活性を示すメカニズム)が明らかになれば、「細菌にのみ効く」等の好ましいメカニズムと、「副作用等をもたらす可能性の高い」等の好ましくないメカニズムが予め判明するので、薬剤の探索・開発や薬剤の実用化への指針になる。
また、本発明の同定方法を使用して得られた結果は、薬剤としての承認を得るためにも有用となる。
【0026】
更には、標的たんぱく質や塩基置換を同定することによって、新たな作用機序が分かり、その新たな作用機序に基づく「抗菌活性を有する薬剤」の開発方法、スクリーニング方法又は製造方法を提供することができる。
【図面の簡単な説明】
【0027】
【図1】薬剤耐性変異株の中から温度感受性変異株を単離するまでの工程の一例を示す流れ図である。
【図2】薬剤耐性かつ温度感受性変異株(以下、「RifR TS mutant」と略記する場合がある)の単離から、標的たんぱく質の同定及び薬剤耐性を得る原因になった塩基置換の同定までの工程の一例を示す流れ図である。
【図3】RifR TS mutantにゲノムライブラリーを導入して、rpoB遺伝子を含むプラスミドが単離されたことを示す図である。
【図4】rpoB遺伝子の導入により、RifR TS mutantの高温感受性が抑圧されたことを示す図である。 「RN4220」は野生株、「RifRTS」はリファンピシン耐性かつ温度感受性変異株(RifR TS mutant)を示す。
【図5】RifR TS mutantのゲノム中のrpoB遺伝子に、アミノ酸置換を導く1塩基置換変異が見いだされたことを示す図である。
【図6】#18耐性かつ温度感受性変異株(以下、「#18R TS mutant」と略記する場合がある)の単離について示す図である。
【図7】#18R TS mutantにゲノムライブラリーを導入して、MvaA遺伝子を含むプラスミドが複数単離されたことを示す図である。
【図8】MvaA遺伝子の導入により、#18R TS mutantの高温感受性が抑圧されたことを示す図である。
【図9】#18R TS mutantのゲノム中のMvaA遺伝子に、アミノ酸置換を導く1塩基置換変異が見いだされたことを示す図である。
【図10】メバロン酸によって、MvaA遺伝子変異株の温度感受性が抑圧されたことを示す図である。 「LB0」は培地、「LB0+Mev(1mM)」はメバロン酸1mMを添加した培地、「RN4220」は野生株、「#18R,TS」は#18耐性かつ温度感受性変異株(#18R TS mutant)を示す。
【図11】#18、MvaAの基質であるHMG−CoA、並びに、HMG−CoAレダクターゼ阻害薬であるシンバスタチン(simvastatin)及びフルバスタチン(fluvastatin)の化学構造を示した図である。
【図12】#18による黄色ブドウ球菌細胞質画分のMvaA活性の阻害効果を示すグラフである。
【発明を実施するための形態】
【0028】
以下、本発明について説明するが、本発明は、以下の具体的態様に限定されるものではなく、技術的思想の範囲内で任意に変形することができる。
【0029】
本発明は、抗菌活性を有する薬剤の標的たんぱく質を同定する方法であって、該薬剤に対する薬剤耐性変異株の中から温度感受性変異株を単離し、該温度感受性変異株におけるアミノ酸変異が導入されたたんぱく質を同定し、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定することを特徴とする標的たんぱく質の同定方法である。
【0030】
本発明において、「抗菌活性を有する薬剤の標的たんぱく質」とは、抗菌活性を有する薬剤が変異を生じさせる「菌中の菌の増殖に必要なたんぱく質」をいい、特に、抗菌活性を有する薬剤が、タンパク質のアミノ酸変異を生じさせる「菌の増殖に必要な菌中のたんぱく質」をいう。
本発明において、「アミノ酸変異」とは、たんぱく質を構成するアミノ酸のうち、1つ又は2つ以上のアミノ酸が、別のアミノ酸に入れ替わる、除かれる、又は、追加されることをいう。本発明における「アミノ酸変異」は、別のアミノ酸に入れ替わることが多い。
【0031】
本発明において、「温度感受性」とは、野生株であれば正常に増殖を維持できる程度の温度であっても、正常な増殖を維持できなくなっている性質のことをいい、「温度感受性変異株」とは、温度感受性を有する変異株のことをいう。
かかる温度としては、特に限定はないが、30℃〜50℃が、一般の病原性細菌の増殖可能温度等の点から好ましく、40℃〜43℃が特に好ましい。
以下、「温度感受性」を単に「TS」と略記することがある。
【0032】
本発明は、抗菌活性を有する薬剤の標的たんぱく質の同定方法であり、また、薬剤耐性を得る原因になった「標的たんぱく質分子内で起こった塩基置換」の同定方法である。
抗菌の対象となる菌は、特に限定はないが、細菌であることが好ましく、細菌であれば、技術常識から何れの菌でも本発明の対象となり得る。中でも、黄色ブドウ球菌、大腸菌、緑膿菌、アシネトバクター、結核菌等の細菌は、実際に本発明が適用できることが確かめられている、又は、技術常識から、当然に適用でき得るものである。
【0033】
本発明の同定方法の一例を工程に沿って示した流れ図を、図1及び図2に示した。
まず、本発明においては、薬剤に対する薬剤耐性変異株の中から温度感受性変異株を単離する。ここで、培養方法、培地等は特に限定はなく公知のものが使用される。また、培養温度、圧力、光、環境気体、培養期間等の培養条件も特に限定はない。
菌は、特に限定はないが、種々の方法で変異誘導されることも好ましい。変異誘導剤としては特に限定はなく公知のものが使用できる。
【0034】
培養した株の中から、まず薬剤耐性変異株を単離する。単離方法も特に限定はなく公知の方法で行われる。
単離された複数の薬剤耐性変異株を上記した温度で培養して、その中から、正常な増殖を維持できなくなっている温度感受性変異株、すなわち、温度感受性を有する変異株を単離する(これを「温度感受性試験」と略記することがある)。この工程で単離された変異株は、薬剤耐性かつ温度感受性変異株である。
【0035】
例えば、図1における温度感受性試験において、30℃では3個の薬剤耐性変異株は何れも増殖したが、43℃では、右下と左下の2個の薬剤耐性変異株は温度感受性を示し、43℃では増殖できなかったことを示している。
【0036】
薬剤耐性変異株ではない変異株について温度感受性試験を実施した場合、温度感受性変異株となっている割合は、通常は約1/1000である。
しかしながら、驚くべきことに、薬剤耐性変異株について温度感受性試験を実施した場合、同時に温度感受性変異株ともなっている割合は、後記の表1に示した通り、1/13〜1/15に上昇していることが新たに分かった。
このことは、温度感受性となる原因であるアミノ酸変異が起こっているたんぱく質が、標的たんぱく質であることを示唆している。
【0037】
次いで、単離された該温度感受性変異株、すなわち、単離された「薬剤耐性かつ温度感受性変異株」における「アミノ酸変異が導入されたたんぱく質」を同定し、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定する。
「アミノ酸変異が導入されたたんぱく質」の同定方法は、特に限定はなく公知の方法が用いられ、例えば、以下の方法が挙げられる。
【0038】
すなわち、上記の「薬剤耐性かつ温度感受性変異株」に、ゲノムライブラリー(例えば、プラスミドライブラリー)を導入した後に培養し、温度感受性が抑制された株、すなわち、例えば43℃で増殖するようになった株を単離する。
次いで、該プラスミドをシークエンスして、プラスミド中の遺伝子又は遺伝子領域を同定する。この遺伝子(領域)でコードされるたんぱく質が標的たんぱく質である。
【0039】
「薬剤耐性かつ温度感受性変異株」の上記遺伝子又は遺伝子領域を配列決定(sequence determination)すれば、単離された株において、特定のたんぱく質分子(標的たんぱく質分子)においてアミノ酸置換を導く塩基置換が導入されている。
【0040】
本発明の標的たんぱく質の同定方法の典型的な好ましい工程で示すと以下である。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:該遺伝子領域Aでコードされるたんぱく質を、上記薬剤の標的たんぱく質であると同定する。
【0041】
工程1及び工程2の一例を図1に示した。工程1では、変異誘導した菌を薬剤の存在下で培養することも好ましい。工程2で、薬剤耐性かつ温度感受性変異株を単離する。
【0042】
工程3の一例を図2に示した。工程3では、「薬剤耐性かつ温度感受性変異株」に、ゲノムライブラリー(例えば、プラスミドライブラリー)を導入し、温度感受性ではなくなった変異株(温度感受性が抑制された変異株)を単離する。導入方法は公知の方法が可能である。
【0043】
工程4の一例も図2に示した。工程4では、プラスミドをシークエンス(配列決定(sequence determination)し、プラスミド中の挿入配列を求める。ある遺伝子領域を含んでいるので、その遺伝子領域でコードされるたんぱく質を同定できる。シークエンス(配列決定)の方法は特に限定されず、公知の方法が用いられる。
工程5の一例も図2に示した。工程5では、上記遺伝子領域Aでコードされるたんぱく質を、上記薬剤の標的たんぱく質であると同定する。
【0044】
本発明の、薬剤耐性変異株が薬剤耐性を得る原因になった「たんぱく質のアミノ酸置換を導く塩基置換」の同定方法を工程で示すと以下である。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:薬剤耐性かつ温度感受性変異株の該遺伝子領域Aを配列決定(sequence determination)してアミノ酸置換を導く塩基置換を同定する。
【0045】
工程1〜4は、前記した「本発明の標的たんぱく質の同定方法」の工程と同一である。
工程5は、図2にその一例を記載したように、薬剤耐性かつ温度感受性変異株の該遺伝子領域Aを配列決定(sequence determination)してアミノ酸置換を導く塩基置換を同定する工程である。
【0046】
本発明は、薬剤耐性かつ温度感受性変異株を用いて、抗生物質等の標的を同定する新たな方法である。本発明の効果は前記した通りである。
【0047】
実際に、本発明の「標的たんぱく質の同定方法」を使用して、リファンピシン(Rifampicin)の直接の標的たんぱく質であるrpoBが同定できた。
同定された変異部位であるrpoBのD471、H481、R484は、結晶構造解析から、リファンピシンとの結合に重要な役割を果たすアミノ酸であることが報告されている(非特許文献8)。
よって、本発明の方法を用いて、抗生物質であるリファンピシンの標的たんぱく質を同定できること、及び、標的たんぱく質内において、リファンピシンとの結合に必要なアミノ酸の同定ができることが示された。
【0048】
更に、本発明の有用性を検証するために、標的が不明な薬剤の標的たんぱく質が同定できるか否かを検討した。
実施例で詳述するが、化合物#18は、化合物ライブラリーから同定された抗生物質であり、標的たんぱく質も抗菌性を示す作用機序も不明であった。本発明の方法を用いて、#18の標的たんぱく質として黄色ブドウ球菌のHMG−CoAレダクターゼが同定された。
【0049】
#18の添加により、Vmaxは変わらないが、Kmが増加したことから、#18がMvaA活性を競合的に阻害することが分かった。
黄色ブドウ球菌のMvaA遺伝子は、増殖に必要であることが報告されている。
また、黄色ブドウ球菌のHMG−CoAレダクターゼは、真核生物のHMG−CoAと基質特異性が異なり、statinが効かないことが報告されている。
よって、細菌のHMG−CoAレダクターゼ阻害剤として、#18は、新たな作用機序の抗生物質として新しいシーズである可能性があることが分かった。
【0050】
本研究は、抗菌活性を有すが、標的が不明であった抗生物質等の「抗菌活性を有する薬剤」の作用機序を解明することに貢献できる。また、作用機序が不明な抗生物質を用いた温度感受性変異株の網羅的取得により、増殖に必要な新たな遺伝子の同定ができる可能性がある。
【0051】
少なくとも、#18の標的たんぱく質として黄色ブドウ球菌のHMG−CoAレダクターゼが新たに同定されたことは、本発明の標的たんぱく質の同定方法が有用であることを示している。
また、本発明の標的たんぱく質の同定方法を使用して同定された標的たんぱく質(HMG−CoAレダクターゼ)を標的として、抗菌活性を有する薬剤をスクリーニングすることによって、新たな抗菌活性を有する薬剤をスクリーニングできる可能性があることは明らかである。
【0052】
本発明の方法を使用して同定された標的たんぱく質を標的とみなして、改めて新たにスクリーニングすれば、新たな抗菌活性を有する薬剤がスクリーニングでき、新たな抗菌活性を有する薬剤が製造できる。
【0053】
上記のスクリーニング方法で選択された、又は、上記方法で製造された薬剤、すなわち、本発明の同定方法を使用して同定された標的たんぱく質を標的とする薬剤(本発明の標的たんぱく質の同定方法の確立に使用した抗菌活性を有する薬剤は新規な薬剤ではないので除かれる)は有用である。
【実施例】
【0054】
以下に、実施例及び比較例を挙げて本発明を更に具体的に説明するが、本発明は、その要旨を超えない限りこれらの実施例に限定されるものではない。
【0055】
実施例1
<用いた細菌>
黄色ブドウ球菌RN4220株(Novick et.al.,1993)は、Luria-Bertani(LB) medium(1% Bactotryptone(BD), 0.5% yeast extract(BD), and 1%NaCl)で培養された。温度感受性の表現型は、NaCl-depleted LB mediumを用いて実験された。
【0056】
<細菌株とプラスミド>
薬剤耐性変異株は、薬剤添加TSB培地上でコロニーを形成したEtylmethansulfonate(EMS; Sigma, St. Louis, MO, USA)0.2%で処理したRN4220から単離された。
Plasmid pSR515は、大腸菌と黄色ブドウ球菌で複製可能なシャトルベクターである。
ゲノムDNAライブラリーは、黄色ブドウ球菌RN4220株のゲノムDNAフラグメントを、SspI、又はDNaseIで処理し、pSR515のSmaIサイトに挿入された。
遺伝子の同定は、プラスミドの内部配列及び黄色ブドウ球菌のゲノムをシークエンスして決定した。
【0057】
<本発明である、薬剤耐性変異株の中から温度感受性変異株を単離することによる標的たんぱく質の同定方法の確立>
薬剤耐性かつ高温感受性変異株(以下、「DrugR TS mutant」と略記する場合がある)を単離する方法を図1に示す。
まず、変異誘導剤であるメタンスルホン酸エチル(ethyl methanesulfonate)(以下、「EMS」と略記する場合がある)で処理した黄色ブドウ球菌を、薬剤を含有する寒天プレートで培養し、薬剤耐性変異株を複数分離した。
【0058】
次いで、温度感受性テスト(Temperature sensitive test)(以下、「TSテスト」と略記する場合がある)を行なった。
すなわち、薬剤耐性変異株の中で、43℃という高温状態で生育できない変異株(温度感受性変異株)を単離した。43℃は、野生株では増殖を阻害されない温度である。
本実施例では、「温度感受性」とは、43℃で生育できないことを言い、「温度感受性が抑圧された」とは、43℃で生育できるようになったことを言う。
【0059】
薬剤耐性かつ温度感受性を得る原因になった塩基置換の同定、標的たんぱく質(の塩基配列)の同定、薬剤耐性を得る原因になった塩基配列の同定の方法を図2に示す。
【0060】
黄色ブドウ球菌ゲノムライブラリーを導入して、すなわちプラスミドが導入されて温度感受性が抑制された変異株を単離した。
シークエンスして(配列決定して)、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子(領域)を同定した。薬剤耐性かつ温度感受性変異株のゲノム中に変異が導入されているかを確認し、その塩基配列の変異に対応したアミノ酸変異が導入されたたんぱく質を同定した。
そして、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定した。
【0061】
実施例2
<既知の抗生物質であるリファンピシンの既知の標的たんぱく質が、本発明の方法で同定できたことの実施例>
上記した「標的たんぱく質の同定方法」を用いて、公知の「抗菌活性を有する薬剤」の既に知られている標的たんぱく質の同定ができるか否かを、公知の抗生物質であるリファンピシンを使って検証した。
リファンピシンは、RNAポリメラーゼのBサブユニットであるrpoBを標的たんぱく質に直接結合し、酵素活性を阻害することが報告されている(非特許文献8)。また、rpoB遺伝子に変異が入ることにより、リファンピシン耐性となることが知られている(非特許文献8)。
【0062】
まず、リファンピシン耐性株の中から、温度感受性の株が分離できるか否かを検討した。変異誘導剤であるEMSに暴露された黄色ブドウ球菌を、リファンピシン含有寒天培地に塗布した。リファンピシン含有寒天培地上で生育した282株の温度感受性を試験した結果、21株が43℃で生育できなかった(表1参照)。
【0063】
【表1】

【0064】
リファンピシン耐性かつ温度感受性変異株(以下、「RifR TS mutant」と略記する場合がある)に、黄色ブドウ球菌のゲノムライブラリー(プラスミドライブラリー)を導入し、温度感受性が抑圧された株を単離した。
シークエンスした結果(配列決定(sequence determination)した結果)、プラスミド中の挿入配列は、rpoB遺伝子領域を含んでいた(図3)。
【0065】
リファンピシン耐性かつ温度感受性変異株において、アミノ酸変異が導入されたたんぱく質であって標的たんぱく質であると同定されたたんぱく質が、既にリファンピシンの標的たんぱく質として知られたrpoBであった。このことから、本発明の有効性が示された。
このことは、更に、分離されたリファンピシン耐性かつ温度感受性変異株(RifR TS mutant)に、rpoB遺伝子を導入する(図4における「RifRTS/pSrpoB」)ことにより、温度感受性が抑圧されたことにより確認された(図4)。
【0066】
リファンピシン耐性かつ温度感受性変異株(RifR TS mutant)のゲノム中のrpoB遺伝子領域を配列決定(sequence determination)した結果、分離された株のすべてで、アミノ酸置換を導く塩基置換が導入されていた(図5)。
【0067】
同定されたrpoB遺伝子の変異は、3種類(D471N、H481Y、R484H)であった。結晶構造解析から、rpoBのD471、H481、R484は、リファンピシンとの結合に重要な役割を果たすアミノ酸であることが報告されており、これらのアミノ酸変異がリファンピシン耐性を導くことが報告されている(非特許文献8)。
【0068】
以上の結果から、本発明の「標的たんぱく質の同定方法」を用いて、抗生物質であるリファンピシンの標的たんぱく質を同定でき、このようにして同定された標的たんぱく質は、報告されている標的タンパク質と同一であった。これにより、本発明の「標的たんぱく質の同定方法」を用いれば、抗菌活性を有する薬剤の標的たんぱく質を同定することができることが示された。
【0069】
また、リファンピシン耐性の原因になったアミノ酸変異も同定され、本発明の「薬剤耐性を得る原因になった塩基置換の同定方法」も有効であることが分かった。
【0070】
実施例3
<新規抗生物質の未知の標的たんぱく質が、本発明により同定できたことを示す実施例>
<<本発明が標的たんぱく質の同定に有用であることを、新規の例を挙げて立証>>
本発明の「標的たんぱく質の同定方法」を用いて、これまで標的たんぱく質が不明であった抗生物質の標的たんぱく質を同定できるか否かを検討した。
これまでに、本発明者らは、103,873個の化合物から、黄色ブドウ球菌に対して抗菌活性を有する抗菌化合物を3,383個得ている。
その中から、既存の抗生物質の骨格を有していない抗生物質である「#18」に着目した。
【0071】
変異誘導剤であるEMSに暴露された黄色ブドウ球菌を#18含有寒天培地に塗布し、生育した耐性株から、温度感受性変異株を分離した(図6)。
なお、この#18耐性かつ温度感受性変異株(以下、「#18R TS mutant」と略記する場合がある)は、#18に耐性であったが、他の抗生物質に対しては耐性を示さなかった。
【0072】
#18耐性かつ温度感受性変異株(#18R TS mutant)に、黄色ブドウ球菌のゲノムライブラリー(プラスミドライブラリー)を導入し、温度感受性が抑圧された株を単離した。シークエンスした結果(配列決定(sequence determination)した結果)、プラスミド中の挿入配列は、HMG−CoAレダクターゼをコードするMvaA遺伝子領域を含んでいた(図7)。
【0073】
分離された#18耐性かつ温度感受性変異株(#18R TS mutant)に、MvaA遺伝子を導入することにより、温度感受性は抑圧された(図8、3.〜7.)。
【0074】
#18耐性かつ温度感受性変異株(#18R TS mutant)のMvaA遺伝子領域をシークエンスした結果、M77にアミノ酸置換を導く塩基置換が導入されていた(図9)。
【0075】
また、寒天培地に、HMG−CoAレダクターゼの生成物であるメバロン酸を存在させることにより、#18耐性かつ温度感受性変異株(#18R TS mutant)の温度感受性は抑圧された(図10)。
このとき、リファンピシン耐性かつ温度感受性変異株(RifR TS mutant)の温度感受性は抑圧されなかった。
以上の結果から、抗生物質である#18の標的たんぱく質として、黄色ブドウ球菌のHMG−CoAレダクターゼであるMvaAを同定できた。
【0076】
実施例4
次に、#18の構造、MvaAの基質であるHMG−CoAの構造、並びに、真核生物のHMG−CoAレダクターゼ阻害薬であるシンバスタチン(simvastatin)及びフルバスタチン(fluvastatin)の構造を比較した。
その結果、#18は、シンバスタチンが有するclosed type statin構造を分子内に含んでいることが分かった(図11)。
【0077】
そこで、#18が、黄色ブドウ球菌のHMG−CoAレダクターゼ活性を阻害するか否か検討した。
黄色ブドウ球菌の野生株(RN4220)の細胞質画分中のHMG−CoAレダクターゼ活性を測定した。#18の添加により、このMvaA活性は競合的に阻害された(図12)。このときの阻害定数(KI)は、250μMであった。
#18耐性かつ温度感受性変異株(#18R TS mutant)の細胞質画分のMvaA活性は、#18では阻害されなかった。
【0078】
以上の結果から、本発明の標的たんぱく質の同定方法を用いることによって、抗菌活性を有する薬剤である抗生物質#18の標的たんぱく質は、黄色ブドウ球菌のHMG−CoAレダクターゼであることが分かった。
すなわち、本発明の標的たんぱく質の同定方法は、抗菌活性を有する薬剤の標的たんぱく質を同定する方法として確立していること及び新たな薬剤探索の指標を得るのに有用であることが示された。
【0079】
また、本発明の標的たんぱく質の同定方法を使用して同定された標的たんぱく質を標的とみなして、改めて新たにスクリーニングすることによって、新たな「抗菌活性を有する薬剤」をスクリーニングできる可能性や、新たな「抗菌活性を有する薬剤」の製造方法となる可能性が認められた。
【産業上の利用可能性】
【0080】
本発明の同定方法を使用して、抗菌活性を有する薬剤の標的たんぱく質や、薬剤耐性を得る原因になった「標的たんぱく質のアミノ酸置換を導く塩基置換」が同定されれば、新たな抗菌活性の作用機序の発見に結びつき、その新たな作用機序に基づく抗生物質等の探索に広く利用されるものである。
【特許請求の範囲】
【請求項1】
抗菌活性を有する薬剤の標的たんぱく質を同定する方法であって、該薬剤に対する薬剤耐性変異株の中から温度感受性変異株を単離し、該温度感受性変異株におけるアミノ酸変異が導入されたたんぱく質を同定し、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定することを特徴とする標的たんぱく質の同定方法。
【請求項2】
上記単離された温度感受性変異株の温度感受性に寄与する遺伝子の変異部位を同定することにより、上記アミノ酸変異が導入されたたんぱく質を同定する請求項1に記載の標的たんぱく質の同定方法。
【請求項3】
以下の工程1乃至工程4を有する請求項1又は請求項2に記載の標的たんぱく質の同定方法。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:該遺伝子領域Aでコードされるたんぱく質を、上記薬剤の標的たんぱく質であると同定する。
【請求項4】
薬剤耐性変異株が、該薬剤耐性を得る原因になった「標的たんぱく質のアミノ酸置換を導く塩基置換」の同定方法であって、以下の工程1乃至工程4を有することを特徴とする薬剤耐性を得る原因になった塩基置換の同定方法。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:薬剤耐性かつ温度感受性変異株の該遺伝子領域Aを配列決定(sequence determination)してアミノ酸置換を導く塩基置換を同定する。
【請求項5】
請求項1乃至請求項3の何れかの請求項に記載の標的たんぱく質の同定方法を使用して同定された標的たんぱく質を標的とみなして改めて新たにスクリーニングすることを特徴とする抗菌活性を有する薬剤のスクリーニング方法。
【請求項6】
請求項1乃至請求項3の何れかの請求項に記載の同定方法を使用して同定された標的たんぱく質を標的とみなして改めて新たにスクリーニングする工程を有することを特徴とする抗菌活性を有する薬剤の製造方法。
【請求項7】
請求項1乃至請求項3の何れかの請求項に記載の同定方法を使用して同定された標的たんぱく質を標的とする薬剤であって、該標的たんぱく質の同定方法の確立に使用した抗菌活性を有する薬剤以外の薬剤であることを特徴とする抗菌活性を有する薬剤。
【請求項1】
抗菌活性を有する薬剤の標的たんぱく質を同定する方法であって、該薬剤に対する薬剤耐性変異株の中から温度感受性変異株を単離し、該温度感受性変異株におけるアミノ酸変異が導入されたたんぱく質を同定し、該アミノ酸変異が導入される前のたんぱく質を、該抗菌活性を有する薬剤の標的たんぱく質であると同定することを特徴とする標的たんぱく質の同定方法。
【請求項2】
上記単離された温度感受性変異株の温度感受性に寄与する遺伝子の変異部位を同定することにより、上記アミノ酸変異が導入されたたんぱく質を同定する請求項1に記載の標的たんぱく質の同定方法。
【請求項3】
以下の工程1乃至工程4を有する請求項1又は請求項2に記載の標的たんぱく質の同定方法。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:該遺伝子領域Aでコードされるたんぱく質を、上記薬剤の標的たんぱく質であると同定する。
【請求項4】
薬剤耐性変異株が、該薬剤耐性を得る原因になった「標的たんぱく質のアミノ酸置換を導く塩基置換」の同定方法であって、以下の工程1乃至工程4を有することを特徴とする薬剤耐性を得る原因になった塩基置換の同定方法。
工程1:菌を薬剤の存在下で培養し、薬剤耐性変異株を単離する。
工程2:工程1で単離された薬剤耐性変異株の中から、温度感受性変異株を単離する。
工程3:工程2で単離された薬剤耐性かつ温度感受性変異株に、上記菌のゲノムライブラリーを導入して、温度感受性が抑圧された株を単離する。
工程4:配列決定(sequence determination)して、薬剤耐性かつ温度感受性変異株の温度感受性を抑圧する遺伝子領域Aを同定する。
工程5:薬剤耐性かつ温度感受性変異株の該遺伝子領域Aを配列決定(sequence determination)してアミノ酸置換を導く塩基置換を同定する。
【請求項5】
請求項1乃至請求項3の何れかの請求項に記載の標的たんぱく質の同定方法を使用して同定された標的たんぱく質を標的とみなして改めて新たにスクリーニングすることを特徴とする抗菌活性を有する薬剤のスクリーニング方法。
【請求項6】
請求項1乃至請求項3の何れかの請求項に記載の同定方法を使用して同定された標的たんぱく質を標的とみなして改めて新たにスクリーニングする工程を有することを特徴とする抗菌活性を有する薬剤の製造方法。
【請求項7】
請求項1乃至請求項3の何れかの請求項に記載の同定方法を使用して同定された標的たんぱく質を標的とする薬剤であって、該標的たんぱく質の同定方法の確立に使用した抗菌活性を有する薬剤以外の薬剤であることを特徴とする抗菌活性を有する薬剤。
【図2】


【図3】


【図5】


【図7】


【図9】


【図11】


【図12】


【図1】


【図4】


【図6】


【図8】


【図10】




【図3】


【図5】


【図7】


【図9】


【図11】


【図12】


【図1】


【図4】


【図6】


【図8】


【図10】


【公開番号】特開2012−249567(P2012−249567A)
【公開日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願番号】特願2011−124011(P2011−124011)
【出願日】平成23年6月2日(2011.6.2)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 東京大学大学院薬学研究科修士論文発表要旨集 第105〜106ページ (発行日:平成23年2月22日)
【出願人】(501481492)株式会社ゲノム創薬研究所 (25)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願日】平成23年6月2日(2011.6.2)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 東京大学大学院薬学研究科修士論文発表要旨集 第105〜106ページ (発行日:平成23年2月22日)
【出願人】(501481492)株式会社ゲノム創薬研究所 (25)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

