薬剤耐性EGFR突然変異体を検出するための方法および組成物
【課題】上皮増殖因子受容体(EGFR)遺伝子またはEGFRタンパクにおける突然変異体であって、EGFRの抑制を目的とするある種の癌治療に対する耐性の根本的原因となっている突然変異体の有無を試験する方法の提供。
【解決手段】EGFR突然変異EGFR cDNAの塩基2369に対応する位置において検出するように指向されるポリメラーゼ連鎖反応プライマーおよび方法。EGFRポリペプチドの位置790においてトレオニンのメチオニンによる置換をコードする、EGFR遺伝子の突然変異に対し各鎖の5′側ポリヌクレオチド鎖に対し、適切なPCR条件下でハイブリダイズするPCRプライマー。EGFR cDNAの塩基2369に対応する位置において突然変異を含む配列にはハイブリダイズするが、野生型を含む第2のEGFRポリヌクレオチドに対してはハイブリダイズしないPCRプライマー。
【解決手段】EGFR突然変異EGFR cDNAの塩基2369に対応する位置において検出するように指向されるポリメラーゼ連鎖反応プライマーおよび方法。EGFRポリペプチドの位置790においてトレオニンのメチオニンによる置換をコードする、EGFR遺伝子の突然変異に対し各鎖の5′側ポリヌクレオチド鎖に対し、適切なPCR条件下でハイブリダイズするPCRプライマー。EGFR cDNAの塩基2369に対応する位置において突然変異を含む配列にはハイブリダイズするが、野生型を含む第2のEGFRポリヌクレオチドに対してはハイブリダイズしないPCRプライマー。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、上皮増殖因子受容体(EGFR)遺伝子またはEGFRタンパクにおける突然変異体であって、EGFRの抑制を目的とするある種の癌治療に対する耐性の根本的原因となっている突然変異体の有無を試験する方法に関する。本発明はさらに、前記突然変異EGFRを抑制する新規治療の開発法に関する。
【背景技術】
【0002】
(発明の背景)
上皮増殖因子受容体(EGFR)は、癌細胞の増殖および生存において重要な細胞機能の制御に与っているので、従来から硬組織腫瘍の治療における関連標的として特定されている。EGFRは、種々の腫瘍において広く発現されるが、発現が高いと、多くの場合予後不良に結びつく。EGFRの抑制を目的とする、新しいクラスの標的治療薬、チロシンキナーゼ阻害剤が出現した。例えばゲフィチニブ(イレッサ)およびエルロチニブ(タルセバ)の二つが知られている。これらの治療薬に対しある患者では初期に反応があるにも拘らず、未知の機序によって耐性が「獲得」され、最終的に患者の病気が進行する。
【0003】
EGFRは、肺癌において重要な役割を果たすと考えられている。しかしながら、非小細胞型肺癌(NSCLC)症例のほんの一部にしかイレッサまたはタルセバ(構造については図1を参照)に反応しない。チロシンキナーゼ阻害剤であるゲフィチニブまたはエルロチニブに対して反応する患者の肺腺癌には、通常、EGFRのチロシンキナーゼドメインをコードするエキソンの中に機能増強型体細胞突然変異体が見られる。このような突然変異体は、アメリカのNSCLC症例の約10%に認められるが[非特許文献1、非特許文献2、非特許文献3]、東アジアではさらに高い発生率となっている[非特許文献2、非特許文献4、非特許文献5、非特許文献6]。NSCLC関連突然変異体の約90%は下記の内のいずれかである。すなわち、一つは、4個のアミノ酸Leu−Arg−Glu−Alaの除去を含むエキソン19におけるマルチヌクレオチドのインフレーム欠失であり、もう一つは、エキソン21のヌクレオチド2573における単一ヌクレオチド置換(T→G)であり、これは、位置858においてロイシンに代わるアルギニンの置換をもたらす(L858R)。これらの突然変異体は両方とも、小型分子のキナーゼ阻害剤であるゲフィチニブまたはエルロチニブに対する感受性と関連する[非特許文献1、非特許文献2、非特許文献3]。残念ながら、これらの薬剤に対して著明な改善が見られた患者のほとんど全てで症状が進む結果となる。KRAS(v−Ki−ras2、Kirstenラット肉腫ウィルス癌遺伝子相同体、RASファミリーの一員)突然変異体が、ゲフィチニブまたはエルロチニブに対する一次耐性のいくつかのケースと関連することが示されているが[非特許文献7]、「獲得」または「二次的」耐性の原因となる機序は未知である。
【0004】
従って、この耐性の根本的な原因を特定し、それによって、診断テストの開発を可能とし、より効果的な治療の提供を可能とすることが従来技術において求められている。さらに、現行のEGFR阻害剤に対し初期に反応があったにも拘らず癌の進行または再発を示す患者に対し、その治療を可能とする新規化合物が従来技術において求められている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Lynch TJ、Bell DW、Sordella R、Gurubhagavatula S、Okimoto RAら、(2004)Activating mutations in the epidermal growth factor receptor underlying responsiveness of non−small−cell lung cancer to gefitinib.N Engl J Med 350: 2129−2139
【非特許文献2】Paez JG、Janne PA、Lee JC、Tracy S、Greulich Hら、(2004)EGFR mutations in lung cancer: Correlation with clinical response to gefitinib therapy. Science 304: 1497− 1500
【非特許文献3】Pao W、Miller V、Zakowski M、Doherty J、Politi Kら、(2004)EGF receptor gene mutations are common in lung cancers from 「never smokers」 and are associated with sensitivity of tumors to gefitinib and erlotinib.Proc Natl Acad Sci U S A 101:13306− 13311
【非特許文献4】Huang SF、Liu HP、Li LH、Ku YC、Fu YNら、(2004) High frequency of epidermal growth factor receptor mutations with complex patterns in non−small cell lung cancers related to gefitinib responsiveness in Taiwan. Clin Cancer Res 10:8195−8203
【非特許文献5】Kosaka T、Yatabe Y、Endoh H、Kuwano H、Takahashi Tら、(2004)Mutations of the epidermal growth factor receptor gene in lung cancer: Biological and clinical implications.Cancer Res 64: 8919−8923
【非特許文献6】Shigematsu H、Lin L、Takahashi T、Nomura M、Suzuki Mら、(2004)Clinical and biological features of epidermal growth factor receptor mutations in lung cancers.J Natl Cancer Inst.In press
【非特許文献7】Pao W、Wang TY、Riely GJ、Miller VA、Pan Qら、(2005)KRAS mutations and primary resistance of lung adenocarcinomas to gefitinib or erlotinib. PLoS Medicine 2:el7
【発明の概要】
【発明が解決しようとする課題】
【0006】
(発明の要旨)
本発明は、EGFR cDNAの塩基2369に対応する位置におけるEGFR突然変異C→Tの検出に向けたポリメラーゼ連鎖反応のプライマーを提供する。この突然変異体は、EGFRタンパクの位置790において、野生型におけるトレオニンから変異種におけるメチオニンへの変化をコードする。この突然変異体は、ゲフィチニブまたはエルロチニブによる治療前、または治療の初期段階の患者ではごく僅かであることが明らかにされている。しかしながら、この突然変異体が、これらの薬剤に対する感受性を打ち消してしまうので、この突然変異体を宿す癌細胞が有利に選択され、結果、患者はさらなる治療に対して不応となる。本発明はさらに、患者において該突然変異体を検出する方法であって、その最終目的は、代替治療を開始可能とするために、不応症例を早期に特定するための方法を提供する。
【0007】
第1局面では、本発明は、EGFRポリペプチドの位置790においてトレオニンのメチオニンによる置換をコードするEGFR遺伝子突然変異体に対し、各鎖の5′側のポリヌクレオチド鎖のセンス鎖またはアンチセンス鎖に対し、適切なPCR条件下でハイブリダイズするPCRプライマーであって、前記突然変異体の200ヌクレオチド以内に結合する、PCRプライマーを提供する。全体的プライマー構造は、配列番号4−7および12−15に基づいて与えられるが、これらの特定配列よりも大きい場合も、小さい場合もあり得る。その外、配列番号4−7および12−15によって示される配列中のいくつかの塩基が他の塩基によって置換される配列を持つプライマーも提供される。
【0008】
もう一つの局面では、本発明は、適切なPCR条件下において、野生型EGFRポリペプチドをコードする第1ポリヌクレオチド、またはそのポリヌクレオチド断片にハイブリダイズするPCRプライマーを提供する。その際、プライマーは、EGFR cDNAの塩基2369に対応する位置において野生型Cを含む、センス鎖配列またはアンチセンス鎖配列にはハイブリダイズするが、プライマーは、PCR条件下、位置2369において突然変異Tを含む、第2EGFRポリヌクレオチドに対しては僅かしか、または全くハイブリダイズしない。
【0009】
さらに別の実施態様では、本発明は、適切なPCR条件下で、突然変異EGFRポリペプチドをコードする第1ポリヌクレオチドまたはそのポリヌクレオチド断片に対してハイブリダイズするPCRプライマーを提供する。その際、該プライマーは、EGFR cDNAの塩基2369に対応する位置において突然変異Tを含む、センス鎖配列またはアンチセンス鎖配列にはハイブリダイズするが、該プライマーは、PCR条件下、位置2369において野生型Cを含む、第2EGFRポリヌクレオチドに対しては僅かしか、または全くハイブリダイズしない。全体的プライマー構造は、配列番号12および13に基づいて与えられるが、これらの特定配列よりも大きい場合も、小さい場合もあり得る。その外、配列番号12および13によって示される配列中のいくつかの塩基が他の塩基によって置換される配列を持つプライマーも提供される。
【0010】
さらに別の局面では、本発明は、サンプルにおいて上皮増殖因子受容体(EGFR)突然変異遺伝子を検出するための方法であって、EGFR cDNAの塩基2369に対応する位置において突然変異Tを含むヌクレオチド配列を選択的に検出する手段によってサンプルを探査すること、および、前記位置における塩基がTであることを特定すること、を含む方法を提供する。ある重要な実施態様では、この手段は、前記位置における突然変異Tと野生型Cの検出を区別する。
【0011】
一般的実施態様では、サンプルは、癌であるかまたは悪性であるか、あるいは、癌または悪性を疑われる組織または細胞を含む。このようなサンプルは、癌または悪性腫瘍を持つか、または持つことを疑われる被験体に起因し、バイオプシーまたは同様の外科処置によって得られる。
【0012】
本方法のいくつかの優勢な実施態様では、探査は、
a)所望される場合、サンプルを処理してその中に含まれる核酸を放出させること;
b)EGFR cDNAの塩基2369に対応する位置において突然変異Tを含む、センス鎖配列またはアンチセンス鎖配列にはハイブリダイズするが、PCR条件下、位置2369において野生型Cを含む、第2EGFRポリヌクレオチドに対しては僅かしか、または全くハイブリダイズしない第1PCRプライマーを含む組成物に、サンプルから得られた核酸を接触させること;および、
c)第2PCRプライマーの存在下にPCR反応を実行し、塩基2369に対応する位置において突然変異Tを含むPCRアンプリコンを得ること、
から成る諸工程を含む。
PCR反応では、PCRアンプリコン中に標識を組み込むと有利である。こうすると特定工程は、該標識を検出することを含むことが可能になる。
【0013】
本方法のしばしば用いられる別の実施態様では、探査は、
a)所望される場合、サンプルを処理してその中に含まれる核酸を放出させること;
b)適切なPCR条件下で、EGFRポリペプチドをコードするポリヌクレオチドに対してハイブリダイズする一対のポリメラーゼ連鎖反応(PCR)プライマーであって、EGFR cDNAの塩基2369に対応する位置を挟持することによってPCR混合物を与える一対のプライマーを含む組成物に、サンプルから得られた核酸を接触させること;
c)該混合物に対してPCR反応を実行して、塩基2369に対応する位置を含むPCRアンプリコンを得ること;および、
d)アンプリコンを切断手段に接触させることから成る諸工程を含み、接触手段は、
i)塩基2369に対応する位置に突然変異Tを持つアンプリコンを、該位置の6塩基内で切断するが、ただし該位置に野生型Cを持つアンプリコンはそのように切断せず、または、
ii)塩基2369に対応する位置に野生型Cを持つアンプリコンを、該位置の6塩基内で切断するが、ただし該位置に突然変異Tを持つアンプリコンはそのように切断しない。
PCR反応では、PCRアンプリコン中に標識を組み込むと有利である。こうすると特定工程は、切断標識ポリヌクレオチドについて長さ多型を検出することを含むことが可能になる。
【0014】
本発明の一般的な、さらに別の実施態様では、探査は、
a)所望される場合、サンプルを処理してその中に含まれる核酸を放出させること;
b)固相支持体の上にサンプルから得られた核酸の少なくとも一部を固定すること;
c)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドであって、該プローブの配列は、適切なハイブリダイゼーション条件下において、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含むが、位置2369において野生型Cを含むポリヌクレオチドに対しては、僅かしかまたは全くハイブリダイズしないプローブ・オリゴヌクレオチドに、固定された核酸を接触させること、
から成る諸工程を含む。
【0015】
上述のものとは逆の方法の一般的実施態様では、探査は、
a)所望される場合、サンプルを処理してその中に含まれる核酸を放出させること;
b)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドであって、該プローブの配列は、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含むが、位置2369において野生型Cを含むポリヌクレオチドに対しては、僅かしかまたは全くハイブリダイズしないプローブ・オリゴヌクレオチドを、固相支持体に固定すること;および、
c)適切なハイブリダイゼーション条件下に、サンプルから得られた核酸の少なくとも一部を固定されたプローブに接触させること、
から成る諸工程を含む。
固相支持体を含むこれらの実施態様では、固定されたパートナーに結合する成分は標識を含み、特定工程は該標識の検出を含む。
【0016】
さらに別の局面では、本発明は、癌に罹患しているか、または癌が疑われる被験体においてゲフィチニブまたはエルロチニブの治療作用に対する耐性を予測する方法を提供する。この方法は、先行パラグラフに記載された、サンプルにおいて上皮増殖因子受容体(EGFR)遺伝子突然変異を検出する方法に記載される工程を用い、位置2369において突然変異があることを陽性に見出した場合、該被験体は、ゲフィチニブまたはエルロチニブによる治療に対して耐性を持つと予測されると結論する。
【0017】
さらに別の局面で、本発明は、少なくとも1個の容器、および、該容器に含まれる、先行パラグラフの中に記載された少なくとも1個のPCRプライマーを含む組成物を含むキットを提供する。ある実施態様では、キットはさらに、切断手段であって、
a)EGFR cDNAの塩基2369に対応する位置に突然変異Tを持つポリヌクレオチドを、該位置の6塩基内で切断することによって、ただし該位置に野生型Cを持つポリヌクレオチドはそのように切断せず、または、
b)EGFR cDNAの塩基2369に対応する位置に野生型Cを持つポリヌクレオチドを、該位置の6塩基内で切断することによって、ただし該位置に突然変異Tを持つポリペプチドはそのように切断せず、
EGFRポリヌクレオチドを切断する切断手段を含む。
本発明はまた、以下の項目を提供する。
(項目1)
上皮増殖因子受容体(EGFR)の位置790において、トレオニンのメチオニンによる置換をコードするEGFR遺伝子の突然変異に対し、5′側のポリヌクレオチド配列のセンス鎖またはアンチセンス鎖に対して適切なPCR条件下でハイブリダイズするポリメラーゼ連鎖反応(PCR)プライマーであって、該PCRプライマーは、該突然変異位置の200ヌクレオチド以内に結合する、PCRプライマー。
(項目2)
長さが200ヌクレオチド以下の項目1に記載のPCRプライマーであって、該PCRプライマーは、第1ヌクレオチド配列を含み、該第一ヌクレオチド配列は、
a)配列番号4−7および12−15から成る群から選ばれる配列;
b)パラグラフa)において与えられる配列の断片であって、少なくとも11ヌクレオチド長の連続塩基配列から成り、該選ばれた配列よりもたかだか1塩基短い断片;
c)パラグラフa)において与えられる配列と最大5ヌクレオチド異なる配列;または、
d)a)−c)において与えられる配列の相補体、
から成る、項目1に記載のPCRプライマー。
(項目3)
野生型上皮増殖因子受容体(EGFR)ポリペプチドをコードする第1ポリヌクレオチド、またはそのポリヌクレオチド断片に対して、適切なPCR条件下でハイブリダイズするPCRプライマーであって、該プライマーは、EGFR cDNAの塩基2369に対応する位置において野生型Cを含むセンス鎖またはアンチセンス鎖に対してはハイブリダイズし、該PCR条件下で、位置2369において突然変異Tを含む第2EGFRポリヌクレオチドに対しては僅かにしかハイブリダイズしないかしかハイブリダイズしないかまたは全くハイブリダイズしない、PCRプライマー。
(項目4)
長さが200ヌクレオチド以下の項目3に記載のPCRプライマーであって、該プライマーは第一ヌクレオチド配列を含み、該第一ヌクレオチド配列は、
a)配列番号14および15から成る群から選ばれる配列;
b)パラグラフa)において与えられる配列の断片であって、少なくとも11ヌクレオチド長の連続塩基配列から成り、該選ばれた配列よりもたかだか1塩基短い断片;
c)パラグラフa)において与えられる配列と最大5ヌクレオチド異なる配列;または、
d)a)−c)において与えられる配列の相補体、
から成る、PCRプライマー。
(項目5)
突然変異型上皮増殖因子受容体(EGFR)ポリペプチドをコードする第1ポリヌクレオチドまたはそのポリヌクレオチド断片に対して、適切なPCR条件下でハイブリダイズするPCRプライマーであって、EGFR cDNAの塩基2369に対応する位置において突然変異Tを含むセンス鎖配列またはアンチセンス鎖配列に対してはハイブリダイズするが、該PCR条件下で、位置2369において野生型Cを含む第2EGFRポリヌクレオチドに対しては僅かにしかハイブリダイズしないかまたは全くハイブリダイズしない、PCRプライマー。
(項目6)
長さが200ヌクレオチド以下の項目5に記載のPCRプライマーであって、該プライマーは、第一ヌクレオチド配列を含み、該第一ヌクレオチド配列は、
a)配列番号12および13から成る群から選ばれる配列;
b)パラグラフa)において与えられる配列の断片であって、少なくとも11ヌクレオチド長の連続塩基配列から成り、該選ばれた配列よりもたかだか1塩基短い断片;
c)パラグラフa)において与えられる配列と最大5ヌクレオチド異なる配列;または、
d)a)−c)において与えられる配列の相補体、
から成る、項目5に記載のPCRプライマー。
(項目7)
サンプルにおいて上皮増殖因子受容体(EGFR)突然変異遺伝子を検出する方法であって、EGFR cDNAの塩基2369に対応する位置において突然変異Tを含むヌクレオチド配列を選択的に検出する手段によって該サンプルを探査すること、および、該位置における塩基がTであることを特定すること、を含む、方法。
(項目8)
上記手段が、上記位置における突然変異Tの検出と野生型Cの検出とを区別する、項目7に記載の方法。
(項目9)
上記サンプルが、癌または悪性であるか、あるいはそれが疑われる組織または細胞を含む、項目7に記載の方法。
(項目10)
上記サンプルまたはその一部が、上記探査前に拡大される、項目7に記載の方法。
(項目11)
上記サンプルまたはその一部の核酸が、上記探査前に増幅される、項目7に記載の方法。
(項目12)
上記探査が、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EGFR cDNAの塩基2369に対応する位置において上記突然変異Tを含む、上記センス鎖配列または上記アンチセンス鎖配列にはハイブリダイズするが、上記PCR条件下で、位置2369において野生型Cを含む第2EGFRポリヌクレオチドに対しては僅かしかハイブリダイズしないかまたは全くハイブリダイズしない第1ポリメラーゼ連鎖反応(PCR)プライマーを含む組成物に、該サンプルから得られた該核酸を接触させること;および、
c)第2PCRプライマーの存在下でPCR反応を実行し、塩基2369に対応する位置において突然変異Tを含むPCRアンプリコンを得ること、
を含む、項目7に記載の方法。
(項目13)
上記PCR反応が、上記PCRアンプリコン中に標識を組み込み、上記特定が、該標識を検出することを含む、項目12に記載の方法。
(項目14)
上記探査は、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EGFRポリペプチドをコードするポリヌクレオチドに対して適切なPCR条件下でハイブリダイズする一対のポリメラーゼ連鎖反応(PCR)プライマーであって、EGFR cDNAの塩基2369に対応する位置を挟持することによってPCR混合物を与える一対のプライマーを含む組成物に、該サンプルから得られた該核酸を接触させること;
c)該混合物に対してPCR反応を実行して、塩基2369に対応する位置を含むPCRアンプリコンを得ること;および、
d)以下:
i)塩基2369に対応する位置に突然変異Tを持つアンプリコンを、該位置の6塩基内で切断するが、該位置に野生型Cを持つアンプリコンについてはそのように切断しないことによってか、または、
ii)塩基2369に対応する位置に野生型Cを持つアンプリコンを、該位置の6塩基内で切断するが、該位置に突然変異Tを持つアンプリコンについてはそのように切断しないことによって、
のいずれかによって該アンプリコンを切断する切断手段に、該アンプリコンを接触させること、
を含む、項目7に記載の方法。
(項目15)
上記PCR反応が、上記PCRアンプリコン中に標識を組み込み、上記特定が、切断され標識された該ポリヌクレオチドについて長さ多型を検出することを含む、項目14に記載の方法。
(項目16)
上記探査が、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)固相支持体の上に、該サンプルから得られた該核酸の少なくとも一部を固定すること;および、
c)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドに、該固定された核酸を接触さること、ここで、該プローブの配列は、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含み、かつ、適切なハイブリダイゼーション条件下で、該プローブは、位置2369において野生型Cを含むポリヌクレオチドに対して、僅かにしかハイブリダイズしないかまたは全くハイブリダイズしない、
を含む、項目7に記載の方法。
(項目17)
上記プローブオリゴヌクレオチドが標識を含み、上記特定が該標識を検出することを含む、項目16に記載の方法。
(項目18)
上記探査は、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドを固相支持体に固定すること、ここで、該プローブの配列は、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含み、該プローブは、位置2369において野生型Cを含むポリヌクレオチドに対し、僅かにしかハイブリダイズしないかまたは全くハイブリダイズしないこと;および、
c)適切なハイブリダイゼーション条件下において、上記固定されたプローブに、該サンプルから得られた該核酸の少なくとも一部を接触させること
を含む、項目7に記載の方法。
(項目19)
上記核酸が標識を含み、上記特定が該標識を検出することを含む、項目18に記載の方法。
(項目20)
癌を患っているか、または癌が疑われる被験体においてゲフィチニブまたはエルロチニブの治療作用に対する耐性を予測する方法であって、
a)該被験体からサンプルを得ること;
b)EGFR cDNAの塩基2369に対応する位置に突然変異Tを含むヌクレオチド配列を選択的に検出する手段によって該サンプルを探査すること;
c)該位置における塩基がTであることを特定すること;
を含み、それによって、該被験体は、ゲフィチニブまたはエルロチニブによる治療に対して耐性を持つと予測される、上記方法。
(項目21)
上記手段が、上記位置における突然変異Tの検出と野生型Cの検出とを区別する、項目20に記載の方法。
(項目22)
上記サンプルが、癌または悪性であるか、それが疑われる組織または細胞を含む、項目20に記載の方法。
(項目23)
上記サンプルまたはその一部が、上記探査の前に拡大される、項目20に記載の方法。
(項目24)
上記サンプルまたはその一部の中の核酸が、上記探査の前に増幅される、項目20に記載の方法。
(項目25)
上記探査が、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EFGR cDNAの塩基2369に対応する位置において上記突然変異Tを含む、上記センス鎖配列または上記アンチセンス鎖配列に対してハイブリダイズする第1ポリメラーゼ連鎖反応(PCR)プライマーであって、上記PCR条件下において、位置2369において野生型Cを含む第2EGFRポリヌクレオチドに対しては、僅かしかハイブリダイズしないかまたは全くハイブリダイズしない第1PCRプライマーを含む組成物に、該サンプルから得られた該核酸を接触させること;および、
c)第2PCRプライマーの存在下においてPCR反応を実行し、塩基2369に対応する位置において突然変異Tを含むPCRアンプリコンを得ること、
を含む、項目20に記載の方法。
(項目26)
上記PCR反応が、上記PCRアンプリコンの中に標識を組み込み、上記特定が該標識を検出することを含む、項目25に記載の方法。
(項目27)
上記探査は、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EGFRポリペプチドをコードするポリヌクレオチドに対して適切なPCR条件下でハイブリダイズする一対のポリメラーゼ連鎖反応(PCR)プライマーであって、EGFR cDNAの塩基2369に対応する位置を挟持することによってPCR混合物を与える一対のプライマーを含む組成物に、該サンプルから得られた該核酸を接触させること;
c)該混合物に対してPCR反応を実行して、塩基2369に対応する位置を含むPCRアンプリコンを得ること;および、
d)以下、
i)塩基2369に対応する位置に突然変異Tを持つアンプリコンを、該位置の6塩基内で切断するが、該位置に野生型Cを持つアンプリコンについてはそのように切断せしないこと、または、
ii)塩基2369に対応する位置に野生型Cを持つアンプリコンを、該位置の6塩基内で切断するが、ただし該位置に突然変異Tを持つアンプリコンについてはそのように切断しないこと
のいじれかによってアンプリコンを切断する切断手段に、該アンプリコンを接触させること、
を含む、項目20に記載の方法。
(項目28)
上記PCR反応が、上記PCRアンプリコンの中に標識を組み込み、上記特定が、切断され標識された該ポリヌクレオチドの長さ多型を検出することを含む、項目27に記載の方法。
(項目29)
上記探査は、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)固相支持体の上に該サンプルから得られた該核酸の少なくとも一部を固定すること;および、
c)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドに該固定された核酸を接触させることであって、ここで、該プローブの配列は、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含み、適切なハイブリダイゼーション条件下で、該プローブは、位置2369において野生型Cを含むポリヌクレオチドに対して、僅かにしかハイブリダイズしないかまたは全くハイブリダイズしないこと、
を含む、項目20に記載の方法。
(項目30)
上記プローブ・オリゴヌクレオチドが標識を含み、上記特定が該標識を検出することを含む、項目28に記載の方法。
(項目31)
上記探査は、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドを固相支持体に固定することであって、該プローブの配列は、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含み、かつ位置2369において野生型Cを含むポリヌクレオチドに対し、僅かにしかハイブリダイズしないかまたは全くハイブリダイズしないこと、;および、
c)適切なハイブリダイゼーション条件下において、該固定されたプローブに、該サンプルから得られた該核酸の少なくとも一部を接触させること
を含む、項目20に記載の方法。
(項目32)
上記核酸が標識を含み、上記特定工程が、該標識を検出することを含む、項目31に記載の方法。
(項目33)
癌に罹患しているか、または癌が疑われる被験体においてゲフィチニブまたはエルロチニブの治療作用に対する耐性を予測するためのキットの製造における、EGFR cDNAの塩基2369に対応する位置に突然変異Tを含むヌクレオチド配列を選択的に検出する手段の使用。
(項目34)
少なくとも1個の容器と、該容器に含まれる、少なくとも1個のポリメラーゼ連鎖反応(PCR)プライマーを含む組成物とを含むキットであって、該PCRプライマーは、上皮増殖因子受容体(EGFR)の位置790においてトレオニンのメチオニンによる置換をコードするEGFR遺伝子の突然変異に対し5′側のポリヌクレオチド配列のセンス鎖またはアンチセンス鎖にハイブリダイズし、ここで、該プライマーは、該突然変異位置の200ヌクレオチド以内に結合する、キット。
(項目35)
以下、
a)EGFR cDNAの塩基2369に対応する位置に突然変異Tを持つポリヌクレオチドを、該位置の6塩基内で切断するが、該位置に野生型Cを持つポリヌクレオチドについてはそのように切断しないこと、または、
b)EGFR cDNAの塩基2369に対応する位置に野生型Cを持つポリヌクレオチドを、該位置の6塩基内で切断するが、該位置に突然変異Tを持つポリペプチドについてはそのように切断しないこと、
のいずれかによってEGFRポリヌクレオチドを切断する切断手段をさらに含む、項目34に記載のキット。
(項目36)
少なくとも1個の容器と、該容器に含まれ、PCRプライマーを含む組成物とを含むキットであって、該PCRプライマーは、適切なPCR条件下において、突然変異上皮増殖因子受容体(EGFR)ポリペプチドをコードする第1ポリヌクレオチドまたはそのポリヌクレオチド断片にハイブリダイズし、該プライマーは、EFGR cDNAの塩基2369に対応する位置において突然変異Tを含むセンス鎖配列またはアンチセンス鎖配列に対してはハイブリダイズし、かつ該プライマーは、該PCR条件下で、位置2369において野生型Cを含む第2EGFRポリヌクレオチドに対しては、僅かにしかハイブリダイズしないかまたは全くハイブリダイズしない、キット。
【図面の簡単な説明】
【0018】
【図1】ゲフィチニブおよびエルロチニブの化学構造。
【図2】本発明のポリヌクレオチドの各種実施態様の模式図。長さは200ヌクレオチド以下で、11ヌクレオチド以上。c)では、影付き垂直バーは、置換されたヌクレオチドを模式的に表す。
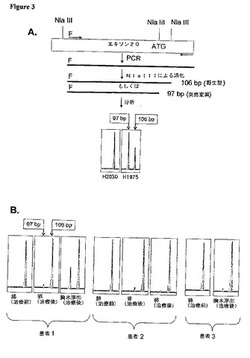
【図3】新規PCR−RFLPアッセイは、EGFRキナーゼドメインのエキソン20におけるT790M突然変異体の存在を独立に確認する (A)アッセイの設計(詳細については本文参照)。“F”は蛍光標識、例えばFAMを示す。このパネルの最下部において、本アッセイは、97−bpのNlaIII切断産物をもって、H1975細胞系統においてT790M突然変異体の存在を実証する。この産物は、H2030 DNAには存在しない。野生型EGFRの消化では106−bpのNlaIII産物が生成される。(B)このPCR−RFLPアッセイは、3人の患者から得られた薬剤投与前サンプルは、検出可能なレベルの突然変異97−bp産物を欠くのに対し、一方、病気進行後に得られた標本は、T790M突然変異体を含むことを示す。Ptは患者。
【図4】患者1、2、および3から得られた画像所見 (A)患者1.ゲフィチニブ治療前(0日目)、および治療中(14日、および9ヶ月)における胸部X線撮影の連続記録。画像は、初期の反応と、その後の進行を示す。(B)患者2.エルロチニブ治療前(0日目)、および治療中(4ヶ月、および25ヶ月)におけるCT所見の連続記録。画像は、初期の反応と、その後の進行を示す。(C)患者3.肉学的に目視可能な病巣の完全な摘出後における、補足的ゲフィチニブ治療前(0日目)、および治療中(3ヶ月)における胸部X線撮影の連続記録。3ヶ月において見られた、左側の胸水滲出が4ヵ月後再発した。この時点で、分子分析のために液を採取した。
【図5】再試バイオプシー実験。バイオプシー針を白抜き矢印で示す。(A)患者1.ゲフィチニブ治療10ヶ月後における、進行性肺病巣のCT誘導バイオプシー。2ヶ月後、右側胸水滲出からの液(右パネル)を、分子分析のために採取した。(B)患者2.進行性胸椎病巣のCT誘導バイオプシー(左パネル)および、進行性肺病巣のX線透視誘導バイオプシー(右パネル)。
【図6A】患者1および2において特定されたEGFRエキソン19および21突然変異体を有する配列クロマトグラム。(A)患者1の腫瘍標本におけるEGFRエキソン21の状態。増殖性肺病巣および胸水滲出から得られたDNAは、位置2573において、通常のL858Rアミノ酸置換をもたらすT→Gヘテロ突然変異を示した。
【図6B】患者1および2において特定されたEGFRエキソン19および21突然変異体を有する配列クロマトグラム。(B)患者2の3個の標本は全て、同じエキソン19のヘテロの欠失であって、残基747−749を除去し、位置750におけるアラニンをプロリンに変える欠失を示した。元の四色カラー配列トレースを白黒トレースに変換した。
【図7−1】各種臨床標本およびNSCLC細胞系統H1975におけるT790M EGFRエキソン20突然変異体に関する配列クロマトグラム。元の四色カラー配列トレースを白黒トレースに変換した。(A−C)3名の患者−患者1(A)、患者2(B),および患者3(C)−の全てにおいて、二次突然変異体T790Mは、ゲフィチニブまたはエルロチニブいずれかの治療中の進行後に得られた病巣にのみ観察された。
【図7−2】各種臨床標本およびNSCLC細胞系統H1975におけるT790M EGFRエキソン20突然変異体に関する配列クロマトグラム。元の四色カラー配列トレースを白黒トレースに変換した。(D)細胞系統H1975は、エキソン21 L858R突然変異体(上方パネル)およびエキソン20 T790M突然変異体(下方パネル)の両方を含む。星印は、ヌクレオチド2361における共通のSNP(AまたはG)を示す。矢印は、ヌクレオチド2369における突然変異体(C→T)を示す。これは、位置790においてトレオニン(ACG)の代わりにメチオニン(ATG)の置換をもたらす。逆方向では、突然変異ピークは緑色であり、一方、下段の青色ピークは、隣接ヌクレオチドからの「エコー」を表す。
【図8−1】T790M突然変異体を含むEGFR突然変異細胞は、ゲフィチニブまたはエルロチニブによる抑制に対して耐性を持つ。 野生型(WT)EGFR、または、下記の変化:T790M、L858R、L858R+T790M、del L747−E749;A750P、または、del L747−E749;A750P+T790Mを持つEGFR突然変異をコードするプラスミドを、293T細胞に一過性にトランスフェクトした。36時間後、細胞を24時間血清欠乏下に置き、ゲフィチニブまたはエルロチニブで1時間処理し、次いで、抗p−EGFR(Y1092)、抗t−EGFR、抗フォスフォチロシン(p−Tyr)、および抗アクチン抗体によるイムノブロット分析のために採取した。EGFR T790M突然変異体は、野生型EGFRまたは薬剤感受性L858R EGFR突然変異と組み合わせられると、ゲフィチニブによるチロシンリン酸化(A)、またはp−EGFR(B)の抑制を阻止する。同様に、T790M突然変異体は、薬剤反応性del L747−E749;A750P EGFR突然変異と組み合わせられると、エルロチニブによるp−EGFRの抑制を阻止する(C)。
【図8−2】T790M突然変異体を含むEGFR突然変異細胞は、ゲフィチニブまたはエルロチニブによる抑制に対して耐性を持つ。 野生型(WT)EGFR、または、下記の変化:T790M、L858R、L858R+T790M、del L747−E749;A750P、または、del L747−E749;A750P+T790Mを持つEGFR突然変異をコードするプラスミドを、293T細胞に一過性にトランスフェクトした。36時間後、細胞を24時間血清欠乏下に置き、ゲフィチニブまたはエルロチニブで1時間処理し、次いで、抗p−EGFR(Y1092)、抗t−EGFR、抗フォスフォチロシン(p−Tyr)、および抗アクチン抗体によるイムノブロット分析のために採取した。EGFR T790M突然変異体は、野生型EGFRまたは薬剤感受性L858R EGFR突然変異と組み合わせられると、ゲフィチニブによるチロシンリン酸化(A)、またはp−EGFR(B)の抑制を阻止する。同様に、T790M突然変異体は、薬剤反応性del L747−E749;A750P EGFR突然変異と組み合わせられると、エルロチニブによるp−EGFRの抑制を阻止する(C)。
【図9】EGFRまたはKRASにおいて各種突然変異を含むNSCLC細胞系統の間でゲフィチニブに対する感受性は異なる 3種の表示のNSCLC細胞系統(H3255:L858R突然変異;H1975;T790MおよびL858R両突然変異体;野生型EGFR、KRAS突然変異(表7参照))を、漸増濃度のゲフィチニブの存在下に育成し、48時間処理後に生細胞の密度を、Calcein AM蛍光アッセイを用いて測定した。ベヒクル処理細胞の蛍光を100%として表した。結果は、各条件について4から8度の繰り返しを行った、3回の独立実験の平均±SEである。同様の結果がエルロチニブについても得られた。
【図10】EGFRまたはKRASにおいて各種突然変異を含むNSCLC細胞系統の間でエルロチニブに対する感受性は異なる。図9の説明を参照されたい。
【発明を実施するための形態】
【0019】
(発明の詳細な説明)
本明細書に特定される特許、公開特許公報、および特許出願は全て、参照することによりその書の全体が、本明細書に一語一語そのまま現れるように本明細書に含められる。本明細書に特定される技術的出版物も全て引用により本明細書に含める。
【0020】
省略形:CML、慢性骨髄性白血病;CT、X線断層写真;del、欠失;EGFR、上皮増殖因子受容体;GIST、消化管支質腫瘍;HES、好酸球増多症候群;NSCLC、非小細胞型肺癌;p−EGFR、リン−EGFR;PCR−RFLP、PCR制限断片長多型;SNP、一塩基多型;t−EGFR、全体EGFR.
アクセス番号:参照EGFR配列は、LocusLinkアクセス番号1956、およびGenBankアクセス番号NT_033968から入手した。
【0021】
EGFRについては二つの記数システムを用いた。第1のシステムは、シグナル配列における開始メチオニンをアミノ酸−24と表示する。第2は、本明細書で用いるのもこれであるが、メチオニンをアミノ酸+1と表示する。抗体、例えば、Y1068−特異的抗リン−EGFRの供給業者は、第1の命名法を用いる。統一的であるために、我々は、Y1068をY1092と見なす。同様に、本明細書で報告されるT790M突然変異体は、従来T766Mと呼ばれているものである。
【0022】
本説明では、指示代名詞「ある」、および「その」は、単数であれ、複数であれ等価的な意味を持つ。これらの代名詞の特定の意味は、それらの使用される文脈から明白である。
【0023】
本明細書で用いる「腫瘍」という用語は、悪性または良性を問わず、全ての新生の細胞成長および増殖と、全ての前癌および癌細胞ならびに組織を指す。
【0024】
本明細書で用いる「癌」という用語は、無制限増殖、特殊化機能の喪失、恒久性、著明な転移能力、抗アポトーシス活性の著明な増加、急激な成長および増殖速度、および、いくつかの特徴的な形態的マーカーおよび細胞マーカーなどの特徴を持つ細胞または組織を指す。ある状況では、癌細胞は腫瘍の形を取り、そのような細胞は、動物体内の局所に存在するが、別の状況では、癌細胞は、例えば、白血球細胞のような独立の細胞として血流の中を循環する。
【0025】
ゲフィチニブまたはエルロチニブに対して臨床的耐性を獲得した癌が、EGFRキナーゼドメインにさらに突然変異体を出現させるかどうかを決めるために、我々は、これらの薬剤に対して初期には反応したものの、その後進行した13名の患者について、彼等から得た腫瘍においてEGFRエキソン18から24の状態を調べた。これらのエキソンを、肉眼的に完全な腫瘍切除を完了した後、ゲフィチニブで治療中に病気が急速に再発した、14番目の患者から得られた腫瘍細胞でも評価した。ゲフィチニブおよびエルロチニブに対する一次耐性に対しKRASが関連することから[7]、我々はまた、これら6名の患者から得られた腫瘍細胞においてKRASの状態を調べた。EGFRにおいて新たに特定された「耐性」突然変異体−EGFRゲノム配列におけるT790Mアミノ酸置換(別にT766Mとも呼ばれる)、2369C→T変異−を持つ細胞の選択的優位性を説明する努力の一環として、我々はさらに、たまたまT790M突然変異体を含むことが判明したNSLC細胞系統、および、野生型および突然変異EGFR cDNAを一過性にトランスフェクトさせた細胞から得られた細胞分解物の両方を用い野生型または薬剤感受性のEGFR突然変異に対する、耐性を持つと予想されるEGFR突然変異の薬剤感受性の特徴を調べた。
【0026】
配列番号1(表1に示す)は、ヒトのEGFR突然変異遺伝子のcDNA配列を示す。EGFR T790M突然変異体の有無を検出するために、配列決定のために用いたEGFR断片を増幅するのに使用したプライマーペアには下線を施し、かつイタリック体で表した。突然変異のt2369ヌクレオチドは、拡大したボールド体で示す。野生型EGFR配列は、GenBankアクセス番号X00588,および、Ullrich,A.et al.“Human epidermal growth factor receptor cDNA sequence and aberrant expression of the amplified gene in A431 epidermoid carcinoma cells”,Nature309(5967)、418−425(1984)から公知である。翻訳された突然変異タンパク配列を配列番号2(表2)に示す。突然変異M790は、拡大したボールド体で示される。
【0027】
【化1】

【0028】
【化2】

本明細書で用いる「核酸」または「ポリヌクレオチド」、および類似の用語および語句は、天然のヌクレオチドから構成されるポリマーばかりでなく、合成または修飾ヌクレオチドから構成されるポリマーにも関する。従って、本明細書で使用する場合、RNAであるポリヌクレオチド、またはDNAであるポリヌクレオチド、あるいはデオキシリボヌクレオチドおよびリボヌクレオチドの両方を含むポリヌクレオチドは、天然の成分、例えば、天然の塩基およびリボースまたはデオキシリボース環を含んでもよいし、あるいは、それらは、後述するもののような、合成または修飾された成分から構成されていてもよい。本発明に用いられるポリヌクレオチドは、1本鎖であってもよく、または、塩基が対になった2本鎖構造であってもよく、あるいは、塩基が対になった3本鎖構造であってもよい。
【0029】
核酸およびポリヌクレオチドは、長さが20ヌクレオチド以上であっても、または30ヌクレオチド以上、または50ヌクレオチド以上、または100以上、または1000以上、または数千以上、または数十万以上であってもよい。本明細書で用いる「オリゴヌクレオチド」および、これに基づく同様の用語は、前パラグラフで述べたように、天然のヌクレオチドから構成される短いポリマーばかりでなく、合成または修飾ヌクレオチドから構成される短いポリマーをも指す。オリゴヌクレオチドは、長さが10ヌクレオチド以上、または20ヌクレオチド以上、または30ヌクレオチド以上、または40以上で、最大約50であってもよい。オリゴヌクレオチドは化学的に合成されてもよいし、種々の用途がある中でも、PCRプライマーとして、またはプローブとして用いられてもよい。
【0030】
前パラグラフで与えられたサイズ範囲には重複があるために、「ポリヌクレオチド」と「オリゴヌクレオチド」という用語同士は、本明細書では、本発明のプライマーまたはプローブを指すに当たって同義語として使用される可能性があることを理解しなければならない。
【0031】
本明細書で用いる「ヌクレオチド配列」、「オリゴヌクレオチド配列」、または「ポリヌクレオチド配列」、および類似の用語は、オリゴヌクレオチドまたはポリヌクレオチドが有する塩基配列ばかりでなく、該配列を所有するオリゴヌクレオチドまたはポリヌクレオチド構造のいずれに対しても相互交換的に関わる。ヌクレオチド配列またはポリヌクレオチド配列はさらに、その塩基配列が、本技術分野において通例として用いられる、塩基を表示する文字から成る特定配列の記載または口誦によって定義される、任意の、天然または合成ポリヌクレオチドまたはオリゴヌクレオチドに関する。
【0032】
「ヌクレオシド」は、通例として、生化学、分子生物学、ゲノミクス、および本発明の分野に関連する類似の分野における当業者によって、グリコシド結合を通じてプリンまたはピリミジン塩基に連結するモノサッカリドを含むものと理解されているが、「ヌクレオチド」は、通常は、サッカリドの3′または5′位置(ペントースの場合)においてであるが、他の位置であってもよいその位置に、少なくとも1個のリン酸基を付着させたヌクレオシドを含む。ヌクレオチドの修飾体または誘導体は、オリゴヌクレオチドまたはポリヌクレオチドの任意の配列位置において起こってもよい。オリゴヌクレオチドおよびポリヌクレオチドの修飾体および誘導体は全て本発明に含まれ、特許請求の範囲内に納まる。修飾体または誘導体は、リン酸基、モノサッカリド、または塩基において起こることが可能である。
【0033】
非限定的例として述べるのであるが、下記の説明は、全て、本発明のポリヌクレオチドの範囲内にある、いくつかのヌクレオチド修飾体または誘導体を提示する。モノサッカリドは、例えば、リボースまたはデオキシリボース以外のペントースまたはヘキソースであることによって修飾される。モノサッカリドはまた、ヒドロキシル基を、ヒドロまたはアミノ基によって置換することによって、または、別のヒドロキシル基をアルキル化またはエステル化することによって修飾してもよい。2′位置に置換基、例えば、2′−O−メチル、2′−O−エチル、2′−O−プロピル、2′−O−アリル、2′−O−アミノアルキル、または2′−デオキシ−2′−フルオロ基を置くと、それによって、オリゴヌクレオチドに対するハイブリダイゼーション能力が強化される。
【0034】
オリゴヌクレオチドおよびポリヌクレオチドにおける塩基は、「未修飾」または「天然」の塩基であってもよく、プリン塩基アデニン(A)およびグアニン(G)、およびピリミジン塩基チミン(T)、シトシン(C)、およびウラシル(U)を含む。さらに、これらの塩基は、修飾または置換を有する塩基であってもよい。修飾塩基の非限定的例としては、他の合成および天然の塩基、例えば、ヒポキサンチン、キサンチン、4−アセチルシトシン、5−(カルボキシヒドロキシメチル)ウラシル、5−カルボキシメチルアミノメチル−2−チオウリジン、5−カルボキシメチルアミノメチルウラシル、ジヒドロウラシル、ベータ−D−ガラクトシルキューオシン、イノシン、N6−イソペンチルアデニン、1−メチルグアニン、1−メチルイノシン、2,2−ジメチルグアニン、2−メチルアデニン、2−メチルグアニン、3−メチルシトシン、5−メチルシトシン、N6−アデニン、7−メチルグアニン、5−メチルアミノメチルウラシル、5−メトキシアミノメチル−2−チオウラシル、ベータ−D−マンノシルキューオシン、5′−メトキシカルボキシメチルウラシル、5−メトキシウラシル、2−メチルチオ−N6−イソペンテニルアデニン、ウラシル−5−オキシ酢酸(v)、ワイブトキソシン、プソイドウラシル、キューオシン、2−チオシトシン、5−メチル−2−チオウラシル、2−チオウラシル、4−チオウラシル、5−メチルウラシル、ウラシル−5−オキシ酢酸メチルエステル、ウラシル−5−オキシ酢酸(v)、5−メチル−2−チオウラシル、3−(3−アミノ−3−N−2−カルボキシプロピル)ウラシル、(acp3)w、および2,6−ジアミノプリン、5−ヒドロキシメチルシトシン、キサンチン、ヒポキサンチン、2−アミノアデニン、アデニンおよびグアニンの、6−メチルおよび他のアルキル誘導体、アデニンおよびグアニンの2−プロピルおよび他のアルキル誘導体、2−チオウラシル、2−チオチミンおよび2−チオシトシン、5−ハロウラシル、5−ハロ−シトシン、5−プロピル−ウラシル、5−プロピニル−シトシン、およびピリミジン塩基の他のアルキニル誘導体、6−アゾ−ウラシル、6−アゾ−シトシン、6−アゾ−チミン、5−ウラシル(プソイドウラシル)、4−チオウラシル、8−ハロ、8−アミノ−、8−チオール−、8−チオアルキル−、8−ヒドロキシル−、および他の8−置換アデニン類およびグアニン類、5−ハロ、特に5−ブロモ、5−トリフルオロメチル、および他の5−置換ウラシル類およびシトシン類、7−メチルグアニンおよび7−メチルアデニン、2−フルオロ−アデニン、2−アミノ−アデニン、8−アザグアニンおよび8−アザアデニン、7−デアザグアニンおよび7−デアザアデニンおよび3−デアザグアニンおよび3−デアザアデニンが挙げられる。さらにそれ以外の修飾塩基としては、3環ピリミジン、例えば、フェノキサジンシチジン(1H−ピリミド[5,4−b][1,4]ベンゾキサジン−2(3H)−オン)、フェノチアジンシチジン(1−ピリミド[5,4−b][1,4]ベンゾチアジン−2(3H)−オン)、G−clamp類、例えば、フェノキサジンシチジン置換体(例えば、9−(2−アミノエトキシ)−H−ピリミド[5,4−b][1,4]ベンゾキサジン−2(3H)−オン)、カルバゾールシチジン(2H−ピリミド[4,5−b]インドール−2−オン)、ピリドインドールシチジン(H−ピリド[3′,2′:4,5]ピロロ[2,3−d]ピリミジン−2−オン)が挙げられる。修飾塩基はさらに、プリンまたはピリミジン塩基が、他のヘテロ環、例えば、7−デアザアデニン、7−デアザグアノシン、2−アミノピリジン、および2−ピリドンによって置換される塩基を含んでもよい。さらにそれ以外の塩基としては、米国特許第3,687,808号に開示されるもの、The Concise Encyclopedia Of Polymer Science And Engineering,pages858−859,Kroschwitz,J.I.,ed.John Wiley & Sons,1990に開示されるもの、Englisch et al.,Angewandte Chemie,International Edition(1991)30,613に開示されるもの、および、Sanghvi,Y.S.,Chapter 15,Antisense Research and Applications,pages289−302,Crooke,S.T.and Lebleu,B.,ed.,CRC Press,1993に開示されるものを含む。これらの塩基の内のいくつかは、本発明のオリゴマー化合物の結合親和性を増すのに特に有用である。そのようなものとして、5−置換ピリミジン類、6−アザピリミジン類、およびN−2、N−6、およびO−6置換プリン類、例えば、2−アミノプロピニルアデニン、5−プロピニルウラシルおよび5−プロピニルシトシンを含む置換体が挙げられる。5−メチルシトシン置換は、核酸2本鎖の安定性を0.6−1.2度増すことが示されており(Sanghvi,Y.S.,Crooke,S.T.and Lebleu,B.,eds.,Antisense Research and Applications,CRC Press,Boca Raton,1993,pp.276−278)、現在好ましい塩基置換体であり、特に、2′−O−メトキシエチル糖修飾と組み合わされた場合は好ましい。米国特許第6,503,754および第6,506,735号、およびこれらの引用文献を参照されたい。なお、これらを引用することにより本明細書に含める。修飾体はさらに、ポリアミン接合オリゴヌクレオチドを扱う米国特許第5,138,045および第5,218,105号;フォスフォロチオエートを含むリン酸キラル結合を取り込むオリゴヌクレオチドを扱う米国特許第5,212,295、第5,521,302号、第5,587,361号、および第5,599,797号;修飾バックボーンを持つオリゴヌクレオチドを扱う米国特許第5,378,825号、第5,541,307号および第5,386,023号;修飾された核塩基を扱う米国特許第5,457,191および5,459,255号;ペプチド核酸を扱う米国特許第5,539,082号;ベータ−ラクタムバックボーンを有するオリゴヌクレオチドを扱う米国特許第5,554,746号;オリゴヌクレオチドの合成を開示する米国特許第5,571,902号;アルキルチオヌクレオシドを開示する米国特許第5,578,718号;2′−O−アルキルグアノシン、2,6−ジアミノプリン、および関連化合物を扱う米国特許第5,506,351号;N−2置換プリンを有するオリゴヌクレオチドを扱う米国特許第5,587,469号;3−デアザプリンを有するオリゴヌクレオチドを扱う米国特許第5,587,470号;4′−デスメチルヌクレオシド接合類縁体を扱う米国特許第5,223,168号および第5,608,046号;バックボーン修飾オリゴヌクレオチド類縁体を扱う米国特許第5,602,240号および第5,610,289号;特に、2′−フルオロ−オリゴヌクレオチドの合成法を扱う米国特許第6,262,241号および第5,459,255号に開示されるものが挙げられる。
【0035】
ヌクレオチド間の結合は、通常、3′−5′リン酸結合であるが、これは、天然のフォスフォジエステル結合、フォスフォチオエステル結合、またはさらに別の合成結合であってもよい。フォスフォロチオエートバックボーンを含むオリゴヌクレオチドは、そのヌクレアーゼ安定性が強化される。バックボーン修飾体の例としては、フォスフォロチオエート、キラルフォスフォロチオエート、フォスフォロジチオエート、フォスフォトリエステル、アミノアルキルフォスフォロトリエステル、メチルおよび他のアルキルフォスフォネート、例えば、3′−アルキレンフォスフォネート、5′−アルキレンフォスフォネート、およびキラルフォスフォネートが挙げられ、フォスフィネート、フォスフォロアミデート、例えば、3′−アミノフォスフォロアミデート、およびアミノアルキルフォスフォロアミデートが挙げられ、チオノフォスフォルアミデート、チオノアルキルフォスフォネート、チオノアルキルフォスフォトリエステル、セレノフォスフェート、およびボラノフォスフェートが挙げられる。さらにそれ以外の結合としては、フォスフォトリエステル、シロキサン、炭酸塩、カルボキシメチルエステル、アセタミデート、カルバメート、チオエーテル、架橋型フォスフォルアミデート、架橋型メチレンフォスフォネート、架橋型フォスフォロチオエート、およびスルフォンヌクレオチド間結合が挙げられる。他のポリマー結合としては、上記の、2′−5′結合類縁体が挙げられる。米国特許第65,03,754号および第6,506,735号、およびこれらの引用文献を参照されたい。なお、これらを引用することにより本明細書に含める。
【0036】
前述の説明に例示したものを含め、いかなる修飾でも、簡単に、本発明のポリヌクレオチドの中に取り込むこと、その範囲内に含めることが可能である。いずれのヌクレオチド修飾体であっても、その使用は、当業者によって理解されるように、同じ塩基対合性を持つ天然ヌクレオチドの使用と等価である。等価的ヌクレオチド修飾体は全て、本明細書に開示、請求されるとおり本発明の範囲内に納まる。
【0037】
本明細書および特許請求の範囲に用いられる「相補体」、「相補的」、または「相補性」という用語、および類似の単語および語句は、生化学、分子生物学、ゲノミクス、および本発明の分野に関連する類似の分野における当業者によって通例として理解されるように、二つの配列であって、その塩基が、塩基毎に、互いに相補的な塩基対を形成する配列同士に関わる。相補配列を持つ、2本の1本鎖(ss)ポリヌクレオチドは、適切なバッファーおよび温度条件の下で互いにハイブリダイズして、2本鎖(ds)ポリヌクレオチドを形成することが可能である。非限定的例として述べるのであるが、天然の塩基を考えるなら、Aおよび(TまたはU)は互いに相互作用を持ち、GおよびCは互いに相互作用を持つ。別様に指示しない限り、「相補的」とは、「完全に相補的」を意味するという意図を持つ。すなわち、2本のポリヌクレオチド鎖が互いに整列すると、2本の鎖の内の少なくとも一部では、一方の鎖の連続塩基配列の内の各塩基が、対向鎖における同じ長さの連続塩基配列の相互作用塩基に対して相補的となる、そのような一部が見られる。
【0038】
本明細書で用いる「放出する」、および類似の単語および語句は、核酸と結びつけて使用される場合、細胞または組織を処理する際、その中に含まれる核酸が、試薬、例えば、本発明の方法に用いられるPCRプライマーとの相互作用に利用可能となるぐらい十分に処理される工程に関する。
【0039】
本明細書で用いる「ハイブリダイズする」、「ハイブリダイゼーション」、および類似の単語および語句は、相補配列を持つ複数の鎖を互いに作用させることによって核酸、ポリヌクレオチド、またはオリゴヌクレオチド2本鎖を形成する工程に関する。相互作用は、複数の鎖のそれぞれに存在する相補的塩基で、特異的相互作用を持って対を形成する塩基のために起こる。複数の鎖が互いにハイブリダイズする能力は、下記のような種々の条件に依存する。核酸鎖同士は、各鎖において十分な数の対応位置が、相互に作用を持つことが可能なヌクレオチドで占められている場合に互いにハイブリダイズする。互いにハイブリダイズするポリヌクレオチド鎖同士は、完全に相補的であってもよい。それとは別に、2本のハイブリダイズしたポリヌクレオチドは、互いに「実質的に相補的」であってもよい。これは、それらのポリヌクレオチドが少数の不適合塩基を持つことを示す。天然の塩基も、本明細書に記述するような修飾された塩基も、相補的塩基対の形成に参加する。非限定的例として生化学者および分子生物学者を含む、本発明の分野に熟練した当業者であれば、2本鎖を形成する鎖同士の配列は、特異的に配列可能となるために互いに100%相補的である必要はない。
【0040】
本明細書で用いる「断片」および類似の単語および語句は、参照体の完全配列よりも短い、核酸、ポリヌクレオチド、またはオリゴヌクレオチドの一部に関する。断片の中の塩基の配列は、参照体の対応部分の配列と変わらない。すなわち、参照体の対応部分と比較した場合断片には挿入も欠失もない。
【0041】
本明細書で用いる「切断手段」、および類似の用語および語句は、ポリヌクレオチドを配列特異的やり方で切断する物質に関する。切断手段は、ポリヌクレオチドに対し、該ポリヌクレオチドの塩基の内、感受性を持つサブ配列においてのみ相互作用を持ち、そのポリヌクテオチドを、二つのより小さい断片に切断する。切断手段の非限定的例としては、制限ヌクレアーゼ、配列特異的リボザイム、切断活性を持つアプタマー、切断活性を持つ配列特異的有機分子が挙げられる。本発明の分野の当業者には既知の等価的切断手段であれば、いずれのものも本発明の範囲内にある。
【0042】
「相補的DNA」(cDNA)は、逆転写酵素によってmRNA鋳型からコピーされ、mRNAの配列に対して相補的な配列となる1本鎖DNA分子である。当業者達はまた、そのような1本鎖DNA分子、およびその相補的DNA鎖を含む2本鎖DNA分子を指すのにも“cDNA”という用語を用いる。
【0043】
サンプル(癌組織バイオプシー、バイオプシーからレーザー組織捕獲によって得た癌細胞、または血清から単離した癌細胞)に含まれるEGFR T790M突然変異体の存在を検出するには様々な方法がある。そのような方法は、EGFR T790M領域の上流と下流にある2本のプライマーにDNAサンプルを接触させること、標準手順に従ってEGFR T790M領域を増幅すること、および、核酸サンプルの中に増幅された配列があるかどうかを検出することを含む。従って、EGFR T790M上流および下流領域を認識し、結合することが可能なプライマー、およびEGFR T790M突然変異体に対する親和性を持つ核酸プローブは、本法を支える好ましい手段である。例えば、EGFRエキソン20全体は、ゲノムDNAを鋳型として用い、かつ、それぞれ、エキソン20の5′および3′イントロンのフランキング配列(このようなエキソン20フランキング配列を、配列番号3で大文字で示す(表3、GenBankアクセス番号NT_033968)を認識し、結合することが可能なプライマーペアを用い、PCRによって増幅することが可能である。EGFR cDNA配列のヌクレオチド2369を含むこのようなプライマーペアは断片を増幅することができ、次にその断片は、配列決定、制限長多型分析、または、2369C→T突然変異体の有無を決定するための他の任意の技術のために使用することが可能である。
【0044】
【化3】

これらの診断法に限定されることなく、EGFR T790M突然変異体を検出するための方法であって、対立遺伝子コドンにおける制限部位の有無を認識するために制限酵素を用いる方法が提供される。ポリヌクレオチドの生産的切断をもたらす制限部位は、野生型の一方または他方、または多型対立遺伝子が存在する場合、適切に選択的な制限ヌクレアーゼによって得られる。
【0045】
さらに本発明の意図するところは、ヒトにおける悪性腫瘍に関連した突然変異EGFR
T790Mを検出するための診断キットである。このようなキットは、EGFR T790M突然変異体のPCR検出に有用な一組のプライマー、および、突然変異したEGFR配列を含む陽性コントロール、および、非突然変異EGFR配列を含む陰性コントロールが含まれる複数の容器を含むことが好ましい。
【0046】
図2は、本発明のプライマーのいくつかの実施態様の模式図を示す。本発明は、EGFR cDNAの位置2369に対応する塩基を含む、EGFRのゲノムまたはcDNA配列セグメントを増幅するためのプライマーとして使用可能な配列を開示する。この開示されるプライマー配列、例えば、配列番号4−7および12−15は、図2において、明るく陰影を施したブロックによって模式的に表される。図2は、a)“SEQ”として表される開示のプライマーは、その全長が最大200ヌクレオチドにまで広がるさらに大きいポリヌクレオチドに任意に含まれてもよい実施態様を示す。
【0047】
本発明はさらに、上記プライマー配列、すなわち配列番号4−7および12−15の内の任意の一つの断片で、長さが少なくとも11ヌクレトチドであるプライマー配列(参照配列番号よりたかだか1塩基しか短くない、図2bに示されるもの)と共に、配列番号4−7および12−15に示す配列とは、最大5ヌクレオチドしか異ならず(図2cに描か
れる)、この例では、3本の暗い垂直バーで表される3個の変異塩基を示すプライマー配列を提供する。
【0048】
さらに本発明は、前述の配列の任意のものに対して相補的な配列も提供する(図2dに“COMPL”と表示される)。上記配列のいずれも、本発明のオリゴヌクレオチドまたはポリヌクレオチドの中に含まれる。前述したように、本発明の、いずれのプライマーポリヌクレオチドも、200ヌクレオチドの上限まで、任意にさらに新たな塩基を含んでもよい。
【0049】
本発明のプライマーは、増幅されるゲノム座位またはcDNAの各鎖に対して「実質的に」相補的であると表示される。これは、これらのプライマーが、ポリメラーゼ連鎖反応の進行を可能とする条件下において、それぞれの鎖にハイブリダイズするのに十分な相補性を持たなければならないことを意味する。言い換えると、プライマーは、突然変異体に隣接する5′および3′配列に対し、それらとハイブリダイズし、そのゲノム座位の増幅を可能とするほど十分な相補性を持たなければならない。従って、プライマー配列は、その標的配列に対して完全に相補的であることを要しないことがここでは見て取れる。従って、オリゴヌクレオチド配列を参照しながら使われる「実質的に同一」および類似の語句は、突然変異、例えば、本明細書において特定されるSNPの有無を区別可能とするほど十分な特異性をもってハイブリダイズまたはアニールすることができる機能的能力を意味する。このことは、融解温度を測定し、それらが、問題のオリゴヌクレオチドが、正常な遺伝子配列、またはEGFR T790M遺伝子突然変異配列のどちらに結合したかを簡単に特定可能とするほど十分に異なっているかを見ることで測定可能である。本発明のオリゴヌクレオチドプライマーは、経過した反応工程の数に応じて指数関数的に増加する量の多型座位を生産する酵素連鎖反応である増幅過程に用いられる。通常、1本のプライマーは、多型座位の陰性(−)鎖に対して相補的であり、他方のプライマーは、陽性(+)鎖に対して相補的である。プライマーをアニールして変性核酸とし、次いで酵素、DNAポリメラーゼでヌクレオチドを伸長させると、標的多型座位配列を含む、新たに合成された+および−鎖が得られる。これらの新規合成配列も鋳型となるので、変性、プライマーアニーリング、および伸長から成るサイクルを繰り返すことによって、プライマーによって定められる領域(すなわち、標的多型座位配列)の指数関数的生産がもたらされる。連鎖反応の産物は、用いた特異的プライマーの末端に対応する終末部を持つ、独立した核酸2重鎖である。
【0050】
ポリヌクレオチドの合成。本発明のオリゴヌクレオチドプライマーは、適切なものであれば任意の方法によって、例えば、通例のフォスフォトリエステルおよびフォスフォジエステル法、またはその自動化実施態様によって調製することが可能である。そのような一つの自動化実施態様では、ジエチルフォスフォロアミダイトが開始材料として用いられ、Beaucage,et al.,Tetrahedron Letters,22:1859−1862,(1981)に記載されるように合成される。改変固相支持体においてオリゴヌクレオチドを合成するための一つの方法が、米国特許第4,458,066号に記載される。
【0051】
オリゴヌクレオチドおよびポリヌクレオチドは、標準的合成技術、例えば、自動化DNA合成機によって調製される。オリゴヌクレオチドの合成法としては、著名な化学的合成過程、例えば、T.Brown and Dorcas J.S.Brown in Oligonucleotides and Analogues A Practical Approach,F.Eckstein,editor,Oxford University Press,Oxford,pp.1−24(1991)によって記載されるやり方に従って、表面誘導化粒子におけるヌクレオチドフォスフォロアミダイトの順次添加が挙げられるが、ただし、それに限定されない。なお、この文献を引用することにより本明細書に含める。
【0052】
合成過程の一つの例は、Expedite RNAフォスフォロアミダイトおよびチミジンフォスフォロアミダイト(Proligo,ドイツ)を用いる。合成オリゴヌクレオチドは、脱保護され、ゲル精製され(Elbashir et al.(2001)Genes & Dev.15,188−200)、次いで、Sep−Pak C18カートリッジ(Waters,Milford,マサチューセッツ州、米国)精製(Tuschl et al.(1993)Biochemistry,32:11658−11668)される。他のオリゴヌクレオチド合成法としては、フォスフォトリエステルおよびフォスフォジエステル法による固相オリゴヌクレオチド合成(Narang,et al.,(1979)Meth.Enzymol.68:90)、および、H−フォスフォネート法(特に、Garegg,P.J.,et al.,(1985)“Formation of internucleotidic bonds via phosphonate intermediates”,Chem.Scripta 25,280−282;およびFroehler,B.C.,et al.,(1986a)“Synthesis of DNA via deoxynucleoside H−phosphonate intermediates”,Nucleic Acid Res.,14,5399−5407)、および支持体における合成(Beaucage,et al.(1981)Tetrahedron Letters 22:1859−1862)を始め、フォスフォロアミデート技術(Caruthers,M.H.,et al.,“Methods in Enzymology,”Vol.154,pp.287−314(1988),米国特許第5,153,319、5,132,418、4,500,707、4,458,066、4,973,679、4,668,777、および4,415,732号、および、“Synthesis and Applications of DNA and RNA,”S.A.Narang,editor,Academic Press,New York,1987に記載される他のもの、およびそこに含まれる参考文献、および非フォスフォロアミダイト技術が挙げられるが、ただしこれらに限定されない。固相合成は、不純物および過剰な試薬からオリゴヌクレオチドを分離するのに役立つ。固相支持体から切り離された後、オリゴヌクレオチドは、既知の技術を用いてさらに単離されてもよい。
【0053】
精製されたものであれ、非精製形のものであれ、任意の核酸標本を、それが、多型座位を含む特異的核酸配列を含むか、含むことを疑われるものである限り、開始核酸(単数または複数)として用いることが可能である。従って、過程は、例えば、DNA,またはメッセンジャーRNAを含むRNAを、DNAまたはRNAが、単一鎖であれ、二重鎖であれ、増幅することが可能である。RNAを鋳型として用いる場合、この鋳型をcDNAに逆転写するために最適な酵素および/または条件が利用される。さらに、それぞれの1本鎖ずつを含むDNA−RNAハイブリッドを用いてもよい。さらに、核酸混合物を用いても、あるいは、本明細書の先行増幅反応で生産された核酸を、同じ、または別のプライマーを用いてそのまま利用してもよい。増幅される特異的核酸配列、すなわち、多型座位は、より大きな分子の一分画であってもよいし、あるいは、最初から独立分子として存在し、特異的配列が核酸全体を構成するようになっていてもよい。増幅される配列は、最初から純粋形として存在する必要はない。該配列は、例えば、ヒトの全DNAに含まれるもののような複雑な混合物の一小分画として存在してもよい。
【0054】
本発明で用いられるDNAは、体内サンプル、組織試料等から、様々な技術、例えば、Maniatis,et.al.in Molecular Cloning:A Laboratory Manual,Cold Spring Harbor,N.Y.,p280−281,1982に記載される技術を用いて抽出されてもよい。抽出サンプルが不純な場合は、増幅前に、細胞、またはサンプルの動物細胞膜を開放し、核酸(単複)の鎖(単複)を暴露および/または分離するのに有効な量の試薬で、該サンプルを処理してもよい。鎖を暴露し、分離するための、この細胞分解および核酸変性工程によって、増幅をはるかに簡単に実行することが可能となる。
【0055】
DNA重合のための試薬は、プライマー伸長産物の合成を実現するよう機能するものであれば、酵素を含めどのような化合物またはシステムであってもよい。この目的のために好適な酵素としては、例えば、ポリメラーゼムテイン、逆転写酵素、他の酵素、例えば、熱安定性酵素(すなわち、変性を引き起こすほど十分に高い温度に曝された後でもプライマー伸長を実行する酵素)、例えば、Taqポリメラーゼを含む酵素が挙げられる。好適な酵素は、適切なやり方でヌクレオチド同士の組み合わせを助け、互いに、各多型座位核酸鎖に対して相補的なプライマー伸長産物を形成する。一般的に、合成は、各プライマーの3′末端において始まり、鋳型鎖にそって、合成が終了するまで5′方向に進行し、様々な長さの分子を生産する。
【0056】
増幅産物は、放射性プローブを用いなくとも、サザーンブロットによってサンプルを分析することによって検出される。この過程では、例えば、極小濃度の多型座位の核酸配列を含むcDNAの小サンプルが増幅され、サザーンブロット技術か、またはそれと類似のものであるが、ドットブロット分析によって分析される。非放射性プローブまたは標識の使用は、高レベルの増幅信号によってやり易くなる。別態様として、増幅産物を検出するために使用されるプローブは、例えば、放射性同位元素、蛍光化合物、生物発光化合物、化学発光化合物、金属キレート剤、または酵素によって、検出可能となるように直接または間接に標識されてもよい。当業者であれば、他にも、プローブに接着される好適な標識を思いつくであろうし、あるいは、通例の実験を用いてそのような標識を確認することができるであろう。好ましい実施態様では、増幅産物は、DNAを発光させる臭化エチジウムを含むアガロースゲルの上で混合物を分離することによって分析が可能である。
【0057】
本発明の方法によって増幅される配列は、溶液において、または固相支持体に結合させた後で、特異的DNA配列の検出のために通常適用される任意の方法、例えば、PCR、オリゴマー制限(Saiki,et.al.,Bio/Technology,3:1008−1012,(1985))、対立遺伝子特異的オリゴヌクレオチド(ASO)プローブ分析(Conner,et.al.,Proc.Natl.Acad.Sci.U.S.A.,80:278,(1983))、オリゴヌクレオチドライゲーション・アッセイ(OLA)(Landgren,et. al.,Science,241:1007,(1988))等によって、さらに評価、検出、配列決定等を実行することが可能である。DNA分析に関する分子技術の総覧が提出されている(Landgren,et.al.,Science,242:229−237,(1988))。
【0058】
増幅法は、本明細書に記載され、かつ、当業者達によって一般的に用いられるものと同じPCRによるものであることが好ましい。それとは別の増幅法も、本発明のプライマーを用いてPCRによって増幅されるEGFR座位が、その別手段によっても同様に増幅される限り、使用が可能である。このような別法増幅システムとして、対象とする短いRNA配列とT7プロモーターで始める自己持続性配列複製が挙げられるが、ただしそれに限定されない。酵素、逆転写酵素は、RNAを複製してcDNAとし、次いで、この転写RNAを変性する。もう一つの核酸増幅技術は、核酸配列増幅(NASBA)である。これは、逆転写とT7 RNAポリメラーゼを用い、そのサイクルスキームを目標実現するために二つのプライマーを取り込む。NASBAは、DNAかRNAのどちらかで始め、どちらかで終わり、60から90分以内に108コピーまで増幅することが可能である。別態様として、核酸は、ライゲーション活性化転写(LAT)によって増幅することも可能である。LATは、一部1本鎖、一部2本鎖である1本のプライマーと組み合わせた1本鎖鋳型に基づいて動作する。増幅は、プロモーターオリゴヌクレオチドにcDNAを連結することから始まり、数時間以内に、増幅は108から109倍になる。対象とするDNA配列に相補的なRNAに対し、MDV−1と呼ばれるRNA配列を付着させることによって、QBレプリカーゼが利用可能となる。サンプルと混合されると、ハイブリッドRNAは、標本のmRNAの中にその相補体を見つけ、結合し、レプリカーゼを活性化して、対象とする、標識にそう配列をコピーする。もう一つの核酸増幅技術、リガーゼ連鎖反応(LCR)は、対象配列の、二つの別々に標識された半分であって、サンプルの連続配列の存在下にリガーゼによって共有的に結合されて、新規標的を形成する半分同士を用いることによって作動する。修復連鎖反応(RCR)核酸増幅技術は、二つの、相補的で、標的特異的オリゴヌクレオチドプローブ・ペア、熱安定ポリメラーゼとリガーゼ、および、標的配列を幾何学的に増幅するDNAヌクレオチドを用いる。2塩基ギャップが、オリゴヌクレオチドプローブ・ペアを隔て、PCRは、正常のDNA修復を模倣して、このギャップを埋め、ギャップを接合する。鎖転移活性化(SDA)による核酸増幅は、標的DNAに結合する5′末端に短いオーバーハングを有する、Hinc IIの認識部位を含む短いプライマーを利用する。DNAポリメラーゼが、オーバーハングに対向するプライマーの一部に、イオウ含有アデニン類縁体を充填する。Hinc IIが添加されるが、これは、未修飾のDNA鎖しか切断しない。5′エキソヌクレアーゼ活性を欠くDNAポリメラーゼが、ニック部位に進入し、最初のプライマー鎖を下流に向かって切り離し、新規プライマーを構築し、この新規プライマーがその後のプライマーとして作動する。SDAは、37℃、2時間で107倍の増幅を実現する。PCRおよびLCRと違って、SDAは、装置による温度サイクルを必要としない。本発明の方法において有用なもう一つの増幅システムは、QBレプリカーゼシステムである。本発明ではPCRが好ましい増幅法ではあるが、上記他の方法も、本発明の方法に記載される座位の増幅に使用することが可能である。
【0059】
対立遺伝子特異的ハイブリダイゼーションによる、指定配列の変動を検出するには、従来技術で既知の、様々の方法を使用することが可能である。試験遺伝子は、対立遺伝子特異的オリゴヌクレオチド(ASO)によって探査し、かつ、各ASOが既知の突然変異配列を含んでいることが好ましい。ASO分析は、特異的オリゴヌクレオチドプローブが、標的ポリヌクレオチド断片にハイブリダイズする能力を調べることによって、標的ポリヌクレオチド断片における特異的配列の変動を検出する。オリゴヌクレオチド配列は、突然変異配列(またはその相補配列)を含むことが好ましい。標的配列における配列変動の存在は、正常配列を含むオリゴヌクレオチドプローブが標的断片にハイブリダイズしない条件下において得られる、オリゴヌクレオチドプローブと標的断片との間のハイブリダイゼーションによって示される。配列変異(例えば、突然変異)オリゴヌクレオチドプローブと、標的ポリヌクレオチド断片との間にハイブリダイゼーションが欠如することは、標的断片に特異的配列変異(例えば、突然変異)が無いことを示す。好ましい実施態様では、試験サンプルを標準的ドットプロット方式で探査する。ASOに対応する配列を含む試験遺伝子内の各領域を、個別に固相表面に、例えば、膜における個別ドットとして投与する。各個別領域は、従来技術で既知の方法(例えば、Mullis,K.B.,1987、米国特許第4,683,202号に記載される実験的実施態様を参照されたい)を用い、別々のPCR増幅産物として生産される。
【0060】
ASO分析を実行するのに、ドットブロット方式に対する代替として使用が可能な膜依存方式としては、反転ドットブロット(多重増幅アッセイ)、および多重対立遺伝子特異的診断アッセイ(MASDA)が挙げられるが、ただしこれらに限定されない。
【0061】
反転ドットブロット方式では、既知の配列を持つオリゴヌクレオチドまたはポリヌクレオチドが、固相表面に固定され、次いで、標識された試験ポリヌクレオチドサンプルとハイブリダイズさせられる。この状況で、標識試験ポリヌクレオチドサンプルを準備するために、増幅前に、プライマー、またはNTPが標識される。それとは別に、試験ポリヌク
レオチドサンプルは、分離および/または合成後、標識してもよい。多重方式では、個別のサンプルは、単一の標的配列だけではなくて、試験遺伝子の中に多数の標的配列を含む。例えば、それぞれがASO標的配列の内の少なくとも一つを含む、多数のPCR産物が、同じサンプルドット内に投与される。多数PCR産物は、Caskey et al.、米国特許第5,582,989号を用いる単一増幅反応において同時に生産することが可能である。従って、同じブロットを、その対応配列が、サンプルドットにおいて表される各ASOによって探査することが可能である。
【0062】
MASDA方式は、各ブロット(多数標的配列を有するドットを含む)を探査するのに多数ASOを用いることによって多重方式の複雑性レベルを拡大させる。この実行過程は、A.P.Shuberによる米国特許第5,589,330号、および、Michalowsky et al.,American Journal of Human Genetics,59(4):A272,poster 1573(1996年10月)に詳細に記載される。これらの文書、それぞれ、その全体を、引用することにより本明細書に含める。先ず、多数ASOプローブと固定サンプルとの間のハイブリダイゼーションが検出される。この方法は、任意のドット中の多数の標的配列における突然変異体の存在は極めて稀であるから、何か陽性ハイブリダイゼーション信号が得られたとすれば、それは、対応する突然変異標的とハイブリダイズするプローブ混合物の中の単一ASOに由来するものであるとする予測に基づく。次に、このハイブリダイズASOが、ハイブダイゼーション部位からそれを分離し、そのヌクレオチド配列を決定することによって特定される。
【0063】
対立遺伝子特異的オリゴヌクレオチド(ASO)プローブを設計する
対立遺伝子特異的オリゴヌクレオチドプローブは、任意の一組の条件下で標的配列と正確にハイブリダイズするように遺伝子工学的に加工された、短い、単一鎖ポリヌクレオチドである。通常、ASOプローブは、それぞれ、正常対立遺伝子、および配列変異と同一の配列を含むように設計される。標的に対するプローブのハイブリダイゼーションによって変異サンプルの決定が可能となる。厳格条件下では、単一塩基ペアほどの単純な変異を持つプローブでも、正常−変異2重鎖の不安定化作用により正常配列にハイブリダイズしない(Ikuta,S.et al.,Nucleic Acids Research,15:797−811(1987))。
【0064】
ASOハイブリダイゼーションプローブは二つの基本的要求を満たさなければならない。(Current Protocols in Human Genetics,section 9.4,(1995))。先ず、同じプールで共に使用されるプローブは、ほぼ同じ長さを持たなければならない。プローブの標準的長さは、最適として17塩基対であり、その範囲は、短い方は約14、長い方は約27であってもよい。突然変異体が長い挿入体を含む場合、より長いプローブが望ましい場合もある。第2に、不適合領域は、17塩基対プローブの末端に置いてはならず、配列の真ん中、プローブの5′末端から約5−7塩基離れた位置に置かなければならない。さらに、不適合の設置は、比較的長いプローブの場合、末端ではなく、ポリヌクレオチド鎖の強力なハイブリダイゼーションおよび安定化を可能とする位置としなければならない。プローブの塩基組成における変動作用を抑えるために、ASOハイブリッドバッファーの場合(Shuber,T.,米国特許第5,633,134号)のようにテトラメチルアンモニウムクロリドを使用する。ASOプローブは、DNA合成機で合成すると好都合である。プローブは、当業者に馴染みの手段を用いて、同位元素、または非同位元素による検出剤によって標識することが可能である。本出願において略述される、プローブ製造および使用工程は、他の遺伝子配列に対しても応用可能である。
【0065】
ドットブロット、反転ドットブロット、多重方式、およびMASDA方式において使用が可能な好適な材料は、従来技術で既知であるが、ナイロン、およびニトロセルロース膜が挙げられるが、ただしこれらに限定されない。
【0066】
標的配列がPCR増幅によって生産される場合、開始材料は、染色体DNAであってもよい。その場合、そのDNAが直接増幅される。それとは別に、開始材料はmRNAであってもよい。その場合、mRNAは先ず逆転写されてcDNAとし、次に、これが、RT−PCRの既知の技術に従って増幅される(例えば、Gelfand et al.による米国特許第5,561,058号を参照されたい)。
【0067】
前述の方法は、少数の配列変動について中等度のスクリーニングをするのに好適である。しかしながら、高速で、コスト効率的で、大規模なスクリーニングのための分子技術における要求の下に、ASOの基本概念を統合する技術が開発されたが、突然変異体検出およびサンプル数の容量をはるかに上回る。前述の方法に代わるこれら別法としては、チップアレイ配列系技術が挙げられるが、ただしこれのみに限定されない。大規模アレイの使用は、沢山の配列変異の高速分析を可能とする。チップアレイの応用および開発に関する総覧が、Southern,E.M.,Trends In Genetics,12:110−115(1996年3月)、およびCheng et al.,Molecular Diagnosis,1:183−200(1996年9月)によって提出されている。チップアレイの製造に関してはいくつかの方法が存在する。相違としては、固定オリゴヌクレオチドを付着させる固相支持体のタイプ、変異特定用標識技術、および、プローブに対する標的ポリヌクレオチドの配列関連技術における変化が挙げられるが、ただしこれらに限定されない。
【0068】
「DNAチップ」による大規模分析のための有望な方法論が、Hacia et al.,Nature Genetics,14:441−447(1996)に詳細に記載される。なお、この文書の全体を引用することにより本明細書に含める。Hacia等によって記載されるところでは、それぞれが20ヌクレオチド長の、96,000超のオリゴヌクレオチドから成る高密度アレイが、光指示化学合成を用いて、単一のガラスまたはシリコンチップの上に固定される。オリゴヌクレオチドプローブの数と設計に応じて、配列の中の各塩基に対し変化の有無について尋問することが可能である。従って、チップに与えられたオリゴヌクレオチドは、集団においてこれまで見られたことがなかった配列変異をも含むことが可能であり、あるいは、集団の中で起こることが知られている突然変異のみに限定することも可能である。
【0069】
チップ上に置かれたオリゴヌクレオチドプローブとのハイブリダイゼーション前に、試験サンプルは、当業者にはよく知られた手段によって、分離され、増幅され、標識(例えば、蛍光マーカー)される。次に、試験サンプルは、固定されたオリゴヌクレオチドにハイブリダイズさせられる。固定プローブに対する、標的ポリヌクレオチドの配列系技術の強度を定量し、参照配列と比較する。得られた遺伝情報は、分子診断に使用することが可能である。
【0070】
本発明のもう一つの実施態様では、癌の再発、または、肺癌の再発を見た被験体の基礎原因を診断するための方法であって、被験体の標的核酸配列を、該配列の増幅後、配列決定することを含む方法が提供される。EGFR遺伝子、またはその断片がクローンされ、次いで配列決定されて、突然変異の有無が判断される。この状況では、得られた配列を、天然の(野生型)EGFR遺伝子、またはその一部と比較すればよいだけである。
【0071】
他のDNA配列決定法、例えば、Sanger et al,Proc.Natul.Acad.Sci.USA,74:5463(1977)、またはMaxam et al,Proc.Natl.Acad.Sci.USA,74:560(1977)、または他の、従来技術で既知の方法を用いてもよい。
【0072】
本発明の、もう一つの実施態様では、癌の再発を見た被験体から得たサンプルの標的核酸を、本発明の突然変異体の存在を検出し、突然変異体を検出する試薬に接触させることを含む方法を提供する。
【0073】
もう一つの方法は、被験体から得たサンプルの標的核酸を、突然変異体の存在を検出し、突然変異体を検出する試薬に接触させることを含む。当業者には、いくつかのハイブリダイゼーション法がよく知られる。その多くは、本発明の実行に有用である。
【0074】
本発明の方法に使用される材料は、診断キットの作製に理想的に好適である。そのようなキットは、それぞれ、本法で使用される独立要素の一つ以上を含む、瓶、チューブ等のような、1種以上の容器手段をしっかりと緊密に含む搬送手段を含んでもよい。例えば、容器手段の一つは、EGFR DNAまたはその断片を増幅するための手段を含み、該手段は、被験体から得た前記標的DNAを増幅するために必要な、酵素(単複)およびオリゴヌクレオチドプライマーを含むようになっていてもよい。もう一つの容器は、突然変異体の有無を検出するためのオリゴヌクレオチドプローブを含んでもよい。それとは別に、もう一つの容器は、突然変異配列は認識するが、野生型は認識しない、またはその逆の制限酵素を含んでもよい。
【0075】
他の方法は、EGFRタンパクのEGFR T790M形を特異的に検出するが、この突然変異体を含まないEFGRタンパクは検出しない抗体に、癌患者から得た癌組織サンプルを接触させることを含むことが可能である。それとは別に、癌患者の癌組織サンプルからタンパク抽出物を得て、EGFR T790M突然変異体の有無について、この突然変異体の検出には特異的であるが、この突然変異体を含まないEGFRタンパクに対しては特異的ではない抗体を用いて、ウェスタンブロット、ELISA、または、他のタンパク検出技術によって分析することが可能である。EGFR T790M突然変異を検出する抗体は、ハイブリドーマから得た抗体であってもよい。ハイブリドーマを作製するための典型的手順は下記の通りである。(a)マウスをある抗原で免疫化する;(b)免疫化されたマウスから脾臓を摘出し、適当な媒体において脾臓縣濁液を作製する;(c)縣濁脾臓細胞を、マウス骨髄細胞と融合する;(d)未融合脾臓細胞、未融合骨髄細胞、および融合細胞から成る混合物を希釈し、未融合骨髄細胞または脾臓細胞の増殖を支持しない選択性媒体において培養する;(e)ハイブリドーマを含む各容器の上清について、免疫原に対する抗体の存在に関して評価する;および、(f)所望の抗体を生産するハイブリドーマを選択し、クローンする。一旦所望のハイブリドーマが選択、クローンされたならば、それからの抗体は、所望のハイブリドーマを適正な媒体中でインビトロ媒体することによって生産される。別法として、所望のハイブリドーマを直接マウスに注入し、抗体の濃縮量を得ることも可能である[Kennett,et al.,(1981)Ed.,Monoclonal Antibodies.Hybridoma:A new dimension in biological analyses,Plenum Press,New York]。げっ歯類脾臓細胞とげっ歯類骨髄細胞との融合によって生産されるハイブリドーマについては、文献中に、Kohler et al.,によって
Eur. J. Immunol.6,511−519(1976)において;Milstein et al.によってNature,266,550(1977)において;および、WalshによってNature,266,550(1977)に;WalshによってNature,266,495(1977)に記載される。本技術はまた、Herzenberg and Milsteinによって、Handbook on Experimental Immunology,ed.Weir(Blackwell
Scientific,London),1979,pages25.1−25.7、および、Kennett et al.,上記によってやや詳細に記述されている。ハイ
ブリドーマ技術によって生産される、ヒト腫瘍に対するモノクロナール抗体に関連する特許としては、米国特許第4,182,124および4,196,265号が挙げられる。癌細胞上の抗原に対して特異性を持つモノクロナール抗体に関する従来技術の代表的なものとして米国特許第4,350,683号がある。
【0076】
EGFRのチロシンキナーゼドメインにおける特異的突然変異体は、ゲフィチニブまたはエルロチニブに対する感受性と関連するが、この獲得耐性の機構についてはまだ報告されていない。他の疾患における、別のキナーゼ阻害剤イマチニブに関する類似の研究に基づき、NSCLCにおける薬剤耐性にEGFRのエキソン19および21突然変異体の関連が報告される前に、野生型EGFRキナーゼドメインの位置790におけるトレオニンからメチオニンへの単一アミノ酸置換が、この薬剤耐性をもたらすことが予測された。Thr−766をメチオニンで置換する(ACGからATG)CからTへの転移は、インビトロにおいて、野生型EGFRを背景として、ゲフィチニブ[21]、および関連キナゾリン阻害剤、PD153035[22]に対する耐性を付与することが示された。
【実施例】
【0077】
(材料および方法)
組織の調達
パラフィンブロック、細針バイオプシー、および胸水を含む組織標本は、Memorial Sloan−Kettering Cancer Centerのセンター内査察委員会によって承認されたプロトコールに従って得られた(プロトコール92−055[7]およびプロトコール04−103[プロトコール S1])。患者は全てインフォームドコンセントを提出した。
【0078】
肺腫瘍におけるEGFRおよびKRASの突然変異分析
腫瘍標本からゲノムDNAを抽出し、EGFR(エキソン18−24)およびKRAS2(エキソン2)分析のためのプライマーは既報の通りとした[3,7]。配列決定反応は全て、順行および逆行方向に行い、突然変異は全て、独立のPCR分離体から少なくとも2回確認した。
【0079】
さらにエキソン20突然変異(T790M)は、毛細管電気泳動装置(ABI3100
Avant,Applied Biosystems,Foster City,カリフォルニア州、アメリカ合衆国)において、T790M突然変異(2369C→T)によって形成される新規NIaIII制限部位に基づく蛍光標識(FAM)PCR産物の長さ分析によって検出した。下記のプライマーを用いた。
【0080】
EGFR Ex20F,5′−FAM−CTCCCTCCAGGAAGCCTACGTTGAT−3′(配列番号4)、および、
EGFR Ex20R 5′−TTTGCGATCTGCACACACCA−3′(配列番号5)。
較正のためにNSCLC細胞系統(H1975,L858R−およびT790M−陽性;H−2030,EGFR野生型)の連続混合希釈液を用いたところ、このアッセイでは、H1975 DNAが、試験される全体DNAの3%以上を含む時、T790M突然変異の存在が検出される。一方、直接の配列決定の感度は6%であった(データ示さず)。ただし、H1975細胞において、T790M突然変異を含む対立遺伝子は約2倍に増幅されている。
【0081】
エキソンを含むEGFR cDNA断片を生成するために下記のプライマーを用いた。
【0082】
EGFR2095F 5′−CCCAACCAAGCTCTCTTGAG−3′(配列番号6)、および、
EGFR2943R 5′−ATGACAAGGTAGCGCTGGGGG−3′(配列番号7)
EGGR2095FおよびEGFR2943Rによって標的とされる配列は、表1の下線をつけて示されたところである。PCR産物は、TOPO TAクローニングキット(Invitrogen,Carlsbad,カリフォルニア州、米国)を用い、メーカーの指示に従って連結され、プラスミドに挿入された。個々のクローンのDNAの自動分注標本を、クローニングベクターのT7プライム部位を用いて配列決定した。
【0083】
EGFR突然変異の機能分析
部位指向性突然変異クイック発生キット(Stratagen,ラホヤ、カリフォルニア州、米国)を用い、野生型およびEGFR突然変異の全長cDNAの中に突然変異を導入し、既述のように発現ベクターにクローンした[3]。欠失(del)L747−E749;A750P突然変異を生成するために下記のプライマーを用いた。
【0084】
順行 5′−TAAAATTCCCGTCGCTATCAAGGAGCCAACATCTCCGAAAGCCAACAAGG−3′(配列番号8)、および、
逆行 5′−CCTTGTTGGCTTTCGGAGATGTTGGCTCCTTGATAGCGACGGGAATTTTA−3′(配列番号9)
T790M突然変異を導入するために下記のプライマーを用いた。
【0085】
順行 5′−AGCTCATCATGCAGCTCAT−3′(配列番号10)、および、
逆行 5′−ATGAGCTGCATGATGAGCT−3′(配列番号11)
L858R突然変異cDNAは前もって作製しておいた[3]。突然変異クローンは全て、さらに余分の突然変異が導入されていないことを確かめるために、再度、両方向から完全に配列決定した。各種EGFRは、既報[3]通りに、293Tヒト胎生腎臓細胞において一過性に発現させた。細胞を、様々の濃度のゲフィチニブまたはエルロチニブによって処理した。
【0086】
免疫ブロット法
細胞溶解、イムノブロッティング、および抗体試薬に関する詳細については、[3]の中の、方法および補足的方法を参照されたい。
【0087】
細胞培養
NSCLC細胞系統H1650、H1975、H2030、H2347、H2444、H358、およびH1734は、米国基準菌株保存機関(Manassas,バージニア州、米国)から購入した。H3255は、B.JohnsonおよびP.Janeの寄贈によるものである。細胞は、10%ウシ胎児血清、10単位/mlのペニシリン、および10μg/mlのストレプトマイシンを添加した、完全培養液(RPMI−1640、米国基準菌株保存機関カタログ番号30−2001)において37℃で5%CO2下に培養した。生存率実験では、完全培養液で培養した細胞を、黒色96ウェル底部透明ViewPlate(PerkinElmer,Wellesley,マサチューセッツ州、米国)に、ウェル当たり5,000個細胞(H1975およびH2030)、または7,500個(H3255)の密度で撒いた。一晩のインキュベーション後、細胞を、0.1%血清添加RPMI−1640培養液で24時間培養した。次に、細胞(0.1%血清を含む補充RPMI−1640培養液)を、ゲフィチニブまたはエルロチニブの連続共存下48時間インキュベートした。
【0088】
生存率アッセイ
細胞生存率は、Calcein AM(Calceinのアセトキシメチルエステル、Molecular Probes,オレゴン州、米国)を用いて定量した。ゲフィチニブまたはエルロチニブと一緒にインキュベーションした後、単層をPBS(カルシウムとマグネシウムを含む)で2度洗浄し、補充RPMI−164(血清無し)において7.5μmolのCalcein AMと30分インキュベートした。標識媒体を除去し、細胞を3度PBSで洗浄した。直後に、Calcein蛍光(485nm励起;535nM発射)を、Victor V多数標識プレートリーダー(PerkinElmer)を用いて検出した。各細胞系統について3回の独立実験を行った。各実験は、条件当たり4から8回の複製を含んでいた。
【0089】
抗EGFR突然変異モノクロナールおよびポリクロナール抗体の産生
1群3匹から成る雌性Balb/cマウス(Charles River Breeding Laboratories,Wilmington,マサチューセッツ州)に、100ulのDetoxアジュバント(RIBI ImmunoChem Res Inc,Hamilton、ミズーリ州)に溶解した、T790M突然変異を含む、精製された短縮型EGFRタンパクまたはその断片を5ug/用量で、0、3、7、10、および14日目に腹腔注入した。17日目に動物を屠殺し、その脾臓を取り出し、既定の手順(米国特許第5,939,269および5,658,791号を参照、なお、これらの特許文書を引用することにより本明細書に含める)に従って、50%ポリエチレングリコール4000を用いて、リンパ球をマウス骨髄細胞系統653と融合させた。融合細胞を、96ウェルのマイクロタイタープレートに、ウェル当たり2×105細胞の密度で撒き、次いで、融合後1日目にHAT選択を行った。次に、固定されたハイブリドーマ培養体の上清を、ビオチニル化EGFR T790M突然変異と反応させた。抗EGFR抗体に関して陽性のウェルを、その後の実験のためにさらに拡充しておいた。拡充してもこれらの培養体は安定であり、細胞系統は冷凍保存した。親培養体は各異性体に分け、次に、それらの、EGFR T790M突然変異を捕捉し、特異的に認識する能力について定量した。
【0090】
別法として、精製した突然変異タンパクペプチドに対して、ウサギポリクロナール抗血清を作った。EGFR T790M突然変異に対するポリクロナール抗体は、前記ペプチドを、0.05%グルタルアルデヒドと共にフロイントの完全アジュバントに乳化させたキーホールリンペット・ヘモシアニンに結合させ、数箇所の皮下に注入することによって得た。フロイントの不完全アジュバントに乳化させた結合ペプチドによって4および7週後に追加免疫し、最後の注入の10日後に瀉血した。
【0091】
前述の手順に従って調製された抗体を、従来技術、例えば、米国特許第5,601,989、5,563,247、5,610,276、および5,405,941号で既知の標準的手順に従って、EGFR T790M突然変異の発現および/または治療可能性に関して、腫瘍細胞を特定および/または診断(すなわち、癌組織の超薄切切片)するために使用する。なお、前記特許文書を、参照を通じて本明細書に含める。EGFR T790M突然変異の発現の監視にもこの同じ抗体を用いた。
【0092】
(実施例1)
EGFR T790M突然変異の存在を確認するために、対立遺伝子特異的オリゴヌクレオチドPCRアッセイ(Guo,Z.,Liu,Q.& Smith,L.M.Enhanced discrimination of single nucleotide polymorphisms by artificial mismatch hybridization.Nat.Biotechnol.15,331−335(1997))を、3′末端および3−ニトロピロール残基を含む、一塩基ミスマッチPCRプライマーを用いて突然変異対立遺伝子を増幅することによって実行する。PCR産物を、下記の3′突然変異対立遺伝子特異的プライマーによって形成する。
【0093】
(5′CACCGTGCAGCTCATCAT3′(配列番号12)
または、
5′CGAAGGGCATGAGCTGCG3′(配列番号13))
は、3′末端において突然変異塩基に対する相補体を、3′末端の上流に3−ニトロピロール残基を含む。この突然変異対立遺伝子特異的プライマーは、凍結またはパラフィン包埋腫瘍から得られた突然変異DNAを増幅することはできるが、正常DNAの産物を増幅することはできない。同時に、野生型(WT)3′プライマー
(5′CACCGTGCAGCTCATCAC3′(配列番号14)
または、
5′CGAAGGGCATGAGCTGCA3′(配列番号15)
は、正常な野生型DNAのみは増幅するが、突然変異DNAは増幅できない。これらの実験から、腫瘍サンプルでは突然変異対立遺伝子が増幅されるが、一方、正常な隣接組織では対立遺伝子は増幅されないことが示された。
【0094】
(実施例2 EGTR T790M突然変異のクローン起源)
任意のサンプルにおける腫瘍細胞の相対的パーセンテージを上げる試みとして、腫瘍の、注意深いマイクロディセクションを行ったところ、T:C対立遺伝子の比は比例的に増加する。実施例1に記載したプライマーの一方、および、反対方向に増幅するもう一つのプライマーを用いてPCRを実行し、その存在を求めるのが変異型であれ野生型であれ、EGFR配列に関して簡単に検出可能な断片が得られた。このようなプライマーの配列は、当業者によって簡単に設計することが可能である。この工程の結果から、EGFR T790M突然変異は、クローン起源であることが証明された。
【0095】
(実施例3 ゲノムDNAにおけるEGFR T790Mの存在に関するアッセイ)
EGFR T790M突然変異の検出用として、突然変異コドンにおける制限部位の有無を認識するために制限酵素NlaIIIが用いられる方法が提供される。この実施例では、エキソン20のイントロン−エキソン境界に跨るプライマーを用いるアッセイが提供される。この蛍光による検出は、特異的ミスセンス突然変異によって生成される、PCR制限断片長多型(PCR−RFLP)を利用する。ヌクレオチド2369に跨る、エキソン20特異的プライマーEGFR Ex20F(配列番号4)およびEGFR Ex20R(配列番号5)(表4の下線部分)を用いてPCR増幅を実行する。表4は、表3(配列番号3)に示す配列において、位置161904から162970までの比較的長いイントロン−エキソン20−イントロンゲノム配列の一部を含む。エキソン20の上流のイントロンの3′末端をゴシック体で示す。
【0096】
【化4】

野生型配列は、特異的NlaIII部位を含み、そのため、消化されると、106bpの産物を生成する(方法、図3A参照)。突然変異T2369ヌクレオチドの存在は、新規NlaIII制限消化部位を創成し、やや短い産物を生成する(96bp、図3A)。これは、蛍光毛細管電気泳動によって簡単に検出される。この試験は、直接の配列決定よりも約2倍感度が高い。この標識断片長アッセイでは、2369対立遺伝子の一方(野生型または突然変異)を切断するが、他方は切断しないものであれば、いずれの等価的手段であっても有用であると考えられる。このアッセイは、任意の既知の方法に適用が可能であるが、得られた断片が検出可能となるように、PCRアンプリコンに標識を組み込むことを要求する。
【0097】
(実施例4 症例報告)
その病気が、ゲフィチニブまたはエルロチニブの治療中に進行した、6名の個人の3人において二次的EGFR突然変異を特定した(表5)。これら3名の患者の簡単な既往歴を下記に掲げる。
【0098】
患者1
この63歳の女性「禁煙家」(彼女の生涯で吸った煙草は100本未満)は、最初、胸郭両側の瀰漫性陰影、および右側胸水を提示した。経気管支バイオプシーによって腺癌が明らかにされた。2サイクルの全身化学療法の最中に病気は進行し、その後、毎日250mgのゲフィチニブを始めた。ゲフィチニブ開始前に得られた胸部X線(図4A,左パネル)と2週間後(図4A、中央パネル)のものを比較すると、著明な改善が認められた。9ヶ月後、胸部X線によって病気の進行が明らかにされた(図4A、右パネル)。その後、患者に、コンピュータ断層撮影(CT)の下で右肺基部の領域においてバイオプシーを行った(5A、左パネル)。化学療法と組み合わせて、または毎日500mg投与のいずれかを用いた、ゲフィチニブによる連続治療にも拘わらず、ゲフィチニブ治療開始後12ヶ月で胸水滲出が再発した(図5A、右パネル)。分子分析のために胸水を入手した。合計すると、この患者から、分析のために3個の腫瘍標本が得られた。最初の肺腫瘍バイオプシー、進行性肺病巣のバイオプシー、および胸水である。しかしながら、最初の経気管支バイオプシーを再検査したところ、標本は僅かな腫瘍細胞しか有しないことが判明した(表5)。
【0099】
患者2
毎年9箱という喫煙歴を持つこの55歳の婦人は、局所的侵襲を持つ気管支・肺胞癌のために、2年間に2回の摘出手術(右下葉および左上葉摘出術)を受けた。2年後、彼女の病気は、両側肺小結節を伴って再発し、全身化学治療中にもさらに進行した。その後、患者に毎日150mgのエルロチニブを始めた。胸部の基礎的CTにおいて、両側に無数の結節が認められた(図4B、左パネル)。これらの結節は、治療後4ヶ月でその数およびサイズが著明に減少した(図4B、中央パネル)。治療14ヶ月後、疲弊のため、患者のエルロチニブ用量を毎日100mgに減らした。エルロチニブによる治療の23ヶ月目に、CTスキャンを撮ったところ、胸椎に、拡大しつつある硬化病巣が認められた。この病巣について、CT誘導バイオプシーを行い(図5B,左パネル)、エルロチニブ用量を毎日150mgに増した。治療25ヶ月後、病気は肺内で進行した(図4B、右パネル)。エルロチニブを中断し、肺の進行性病巣部位においてX線透視誘導コアニードルバイオプシーを行った(図5B、右パネル)。合計すると、この患者から、分析のために3個の腫瘍標本が得られた。最初の、切除された肺腫瘍、拡大する脊椎病巣のバイオプシー、および進行性肺腫瘍のバイオプシーである(表5)。
【0100】
患者3
この55歳の女性「禁煙家」は、その左下葉、胸膜、および縦隔リンパ節を侵す、気管支・肺胞癌の特徴を持つ腺癌のため、ほぼ4.5年間、週に1度パクリタキセルおよびトラスツズマブ[17]による治療を受けた。治療は疲弊により中断された。その後、患者は摘出手術を受けた。多数の縦隔リンパ結節の転移的侵襲、およびゲフィチニブに対する反応を予測させる、当時知られた臨床的特徴(女性、禁煙家、気管支・肺胞変異組織学的所見)のため、彼女に対して、1ヵ月後、「補足的」ゲフィチニブ投与を行った(図4C、左パネル)。この薬剤は、彼女が新たに左側に悪性の胸水滲出を発症した3ヶ月後に中断した。ドレーン排出および全身化学療法にも拘わらず、胸水滲出は4ヶ月後再発し(図4C、右パネル)、その時点で分析のために胸水を採取した。合計すると、この患者から、分析のために2個の腫瘍標本が得られた。摘出手術によって得られた腫瘍、および胸水である(表5)。
【0101】
【化5】

(実施例5 患者の腫瘍は、EGFRチロシンキナーゼ阻害剤に対する感受性と関連するEGFRチロシンキナーゼドメイン突然変異を含む)
我々は、実施例1に記載の3名の患者から得た利用可能な腫瘍サンプル全てについて、前述の薬剤感受性EGFR突然変異に関して、エキソン19および21を直接DNA配列決定する[3]ことによってスクリーニングした。患者1からの腫瘍サンプルは、ヌクレオチド2573においてT→G変化を示し、薬剤反応性腫瘍に一般的に観察されるエキソン21のL858Rアミノ酸置換をもたらした。この突然変異は、進行性肺病巣(図6A、上方パネル;表5)、および胸水浸出液の細胞(図6A,下方パネル;表5)から得られたバイオプシー試料の中に存在していた。この試料のいずれも、細胞病理学的検査をしたところ、大部分腫瘍細胞から成っていた(表5)。興味あることに、トレースの比較から、突然変異対立遺伝子のコピー数の増加が起こったことが示唆されたことである。具体的に言うと、位置2573における、野生型(ヌクレオチドT)ピークの、突然変異(ヌクレオチドG)ピークに対する比は、肺バイオプシー標本(図6A、上方パネル)では約1:1または1:2であるのに対し、胸水細胞は、突然変異Gピークが優勢であることを示した(図6A、下方パネル)。これと一致して、ヌクレオチド2361に認められた一塩基多型(SNP)(AまたはG)も、A:Gの比に対応的変化を示した。すなわち、経気管支バイオプシーでは1:1比であったものが、胸水ではほぼ5:1比となった(図7A)。注目すべきことに、我々は、最初の経気管支バイオプシー標本では2573T→G突然変異を検出しなかった(表5、データ示さず)。前述したように、この後者の標本は僅かな腫瘍細胞しか含まず、恐らく、直接配列決定によってEGFR突然変異を検出するのに必要なレベルよりもさらに低い数であろうと思われた([7]参照)。
【0102】
最初の肺腫瘍および、骨および肺から得た2個の転移サンプルを含む、患者2の3個の標本は全て、11ヌクレオチド(2238−2248)の排除、および2個のヌクレオチドGおよびCの挿入を含むエキソン19の欠失を示した(図6B、全パネル;表5)。これらのヌクレオチド変化は、アミノ酸L747−E749を欠失させ、アミノ酸750をアラニンからプロリン(A750P)へと変えた。del L747−E749;A750P突然変異は、異なる様々なヌクレオチド変化を伴ってではあるが、以前にも報告された[2]。患者2の全てのサンプルにおいて、野生型配列は、約3:1の比で突然変異配列を上回っていた。
【0103】
患者3からの利用可能サンプルの両方とも、エキソン19において15ヌクレオチド(2236−2250)の欠失を含んでおり(表5;データ示さず)、これは、5個のアミノ酸(del E746−A750)の除去をもたらした。この特異的欠失は既に報告されている[3]。突然変異ピーク対野生型ピークの比は、両標本において約1:1であった(データ示さず)。
【0104】
以上まとめると、これらの結果は、3名の患者の腫瘍は全て、チロシンキナーゼ阻害剤ゲフィチニブおよびエルロチニブに対する感受性と関連するEGFR突然変異を含むことを示す。さらに、これらのデータは、個々の患者内において、脊椎、肺、および胸水に対する転移病巣または再発病巣も同じ突然変異を含むことを示す。この後の方の所見は、個人における再発および転移腫瘍細胞は、元々の先祖クローンに由来するとする考えを支持する。
【0105】
(実施例6 ゲフィチニブまたはエルロチニブの治療中に進行した病巣において、EGFRキナーゼドメインに二次ミスセンス突然変異が検出された)
これらの患者において、EGFRキナーゼドメインにおけるさらに別の突然変異が病気の進行に関連するのかどうかを決定するために、我々は、手元の腫瘍標本のEGFR触媒領域をコードするエキソン(18から24まで)全てについて直接的配列決定を行った。
【0106】
腫瘍細胞を僅かしか含んでいない、患者1のゲフィチニブ治療前標本を分析したところ、当然のことながら野生型EGFR配列しか認められなかった(表5、データ図示せず)。しかしながら、ゲフィチニブ治療中の病気進行後に得られた、この患者の肺バイオプシー標本について順方向および逆方向におけるエキソン20配列クロマトグラムを注意深く分析したところ、ヌクレオチド2369において、C→T突然変異を示唆する新たな小型ピークが明らかにされた(図7A、上方パネル;表5)。このヌクレオチド変化は、位置790においてトレオニンの代わりとしてメチオニンの置換のもたらす(T790M)。この2369C→T突然変異は、ゲフィチニブ治療時にさらに病気が進行した後に得られた患者の胸水細胞ではさらに顕著なものとなった(図7A,下方パネル;表5)。肺標本および胸水の分析から得られた、突然変異ピークの、野生型ピークに対する比の増加は、ヌクレオチド2573における突然変異Gピーク(L858Rをもたらす)の、野生型ピークに対する比の増加(上記参照;図6A)と平行するのみならず、位置2361におけるA:G SNPの比の増加(図7A)とも平行した。これらの所見は、エキソン20 T790M突然変異は、エキソン21 L858R突然変異と同じ対立遺伝子の上に載っていること、および、これらの突然変異を抱える細胞のサブクローンが、薬剤治療中に出現することを意味する。
【0107】
患者2では、エルロチニブによる治療前に得られた腫瘍頻発サンプルは、EGFRチロシンキナーゼドメインをコードするエキソンにおいて新たな突然変異を全く含んでいなかった(図7B、上方パネル;表5)。一方、患者の進行性骨および肺病巣は、ヌクレオチド2369において新たな小型ピークを含んでいた。これは、患者1で観察されたものと同じC→T突然変異を持つ腫瘍細胞サブクローンの存在を示唆する(図7B、中央および下方パネル;表5)。この後の二つのサンプルで見られる2369T突然変異の相対的大きさは、エキソン19欠失の対応ピークの相対的大きさと相関するように見えた(図6B)。興味あることに、ヌクレオチド2361におけるSNP(AまたはG)は、患者2の標本において、エルロチニブ治療前には検出されたが、治療後には検出されなかった。これは、一方のEGFR対立遺伝子が、治療の進行中に、増幅または欠失を経過したことを示唆する(図6B)。
【0108】
患者3は、患者2と類似の結果を示した。腫瘍頻発の治療前標本は、del E746−A450エキソン19欠失以外のEGFR突然変異を示さなかった。具体的に言うと、エキソン20では、二次変化は全く検出されなかった(図7C,上方パネル;表5)。ゲフィチニブ治療後に発症した胸水滲出液の細胞のDNAを分析したところ、エキソン20のヌクレオチド2369においてC→T突然変異が明らかにされた(図7C,下方パネル;表5)。これは、前述のT790M突然変異に対応する。位置2361のA:G SNPの比において、この二つのサンプルの間に目覚しい変化は無かった。突然変異2369Tピークは小さかった。これは恐らく、この患者では、ゲフィチニブが、4ヶ月で、すなわち胸水腫瘍細胞が採取された時点で中断されたため、T790M突然変異を抱える細胞に対し選択的優位性が付与されなかったためであろう。
【0109】
2369C→T突然変異が、従来見過ごされていて、NSCLCでこの度見出されたEGFR突然変異かどうかを決めるために、我々は、全て、EGFRチロシンキナーゼ阻害剤による治療前に患者から摘出した、96種の新鮮凍結腫瘍摘出標本[3]、および59種のパラフィン包埋腫瘍標本[7]の分析から得られた、エキソン20の配列トレースを再検査した。我々は、これら155個の腫瘍においてT790M突然変異の兆候を全く検出しなかった(データ示さず)。以上まとめると、我々の結果は、T790M突然変異は、ゲフィチニブまたはエルロチニブによる治療中に進行する病巣と相関することを示唆する。さらに、少なくとも患者1および2では、この突然変異を帯びる腫瘍細胞のサブクローンが、チロシンキナーゼ阻害剤による治療開始時点と、薬剤耐性の出現の間において現れるものと考えられる。
【0110】
さらに、前述のT790M突然変異を有する3名の患者についてさらに詳細に特徴解明を行った後、別の4名の患者が、イレッサまたはタルセバに対して耐性を発達させた後、T790M突然変異を有することが判明した。これら4名は、治療に対し最初は反応したが、その後再発した、合計13名の患者に含まれる。表6は結果を要約する(表は、治療に全く反応せず、その後T790Mを有することが判明した患者のデータを含まない)。
【0111】
【化6】

肺腺癌患者で、ゲフィチニブまたはエルロチニブによる治療で改善したが、その後進行した7名の患者(その症例報告は本明細書では提示されない)において、我々は、病気進行時に得られた腫瘍標本のDNAを調べた。7名全ての患者において、我々は、薬剤感受性に関連するEGFR突然変異(全てエキソン19の欠失)を認めた。しかしながら、EGFRのエキソン18から24において、位置2369におけるC→T変化を含め、さらに別の突然変異はまったく認められなかった(データ示さず)。これらの結果は、獲得薬剤耐性に関しては、さらに別の機構が存在することを意味する。
【0112】
(実施例7 患者の進行性腫瘍は、KRAS突然変異を欠く)
NSCLCの約4分の1において、KRAS2のエキソン2に突然変異が出現する。このような突然変異は、仮にあったとしても、EFGR突然変異に相伴うことはめったになく、ゲフィチニブまたはエルロチニブに対する一次耐性と関連する[7]。KRASの二次突然変異が、これらの薬剤に対する獲得耐性を付与するかもしれない可能性を評価するために、我々は、患者1から3を始めとして、T790M突然変異の兆候を欠く3名の新たな患者についても、その腫瘍標本のKRAS2エキソン2について突然変異プロファイリングを実施した。これらの標本のいずれも、KRASにおいて全く変化を含まなかった(表5;および、データ示さず)。これは、これらの6名の患者において、KRAS突然変異は、薬剤耐性および腫瘍進行には関与しないことを示す。
【0113】
(実施例8 NSCLC恒久細胞系統も、T790MとL858Rの両突然変異を含む)
我々は、8種のNSCLC恒久細胞系統において、EGFRチロシンキナーゼ(エキソン18から24)およびKRASエキソン2のプロファイリングを行った(表7)。驚くべきことに、一つの細胞系統−H1975−は、位置2369において、前述のものと同じC→T突然変異(T790M)を含んでいた(図7D、下方パネル)。この細胞系統は、以前に、他の人々によって、エキソン21に2573T→G突然変異(L858R)を含むことが示されており[18]、それを我々も確認した(図7D、上方パネル)。さらに、H1975は、野生型EGFRを帯びる他の肺癌細胞系統よりも、ゲフィチニブ抑制に対してより高い感受性を持つことが報告されている[18]。この報告された実験では
、エキソン19および21しか調べなかったようである。
【0114】
【化7】

H1975の我々自身の分析(エキソン18から24)では、T790Mアミノ酸置換をもたらす突然変異2369Tピークが優勢であった。これは、野生型対立遺伝子と比較した場合の、突然変異対立遺伝子のコピー数の増加をしめす。突然変異ピークの、野生型ピークに対する比は、突然変異2573G(L858Rアミノ酸置換に対応)の、野生型ピークに対する比と同様であった(図7D、全パネル)。これは、T790MおよびL858R突然変異は、同じ増幅対立遺伝子の中に存在することを意味する。この可能性をさらに調べるために、我々は、RT−PCRを実行し、EGFRのエキソン20に跨り、エキソン19から21の配列を含むcDNAを生成した。次に、PCR産物をクローンし、個別のコロニーについてEGFR突然変異の有無について分析した。4個のクローンの4個のcDNAの配列クロマトグラムにおいて、2369C→T突然変異および2573T→G突然変異の両突然変異が認められた。これは、両突然変異が、同じ対立遺伝子に含まれることを裏付ける(データ示さず)。
【0115】
他のNSCLC細胞系統も、EFGRまたはKRAS突然変異のどちらかを帯びていたが、いずれも両方は持っていなかった(表7)。報告の通り、H3255は、L858R突然変異を含んでおり[19]、H1650は、エキソン19の欠失を含んでいた[18]。他の分析細胞系統はいずれも、EGFRチロシンキナーゼドメインをコードするエキソンにおいてさらに別の突然変異を含んではいなかった。
【0116】
(実施例9 新規PCR制限断片長多型アッセイは、T790M突然変異の有無を独立に確認する)
前述のように、エキソン20におけるT790M突然変異を示唆する突然変異ピークは、ある配列クロマトグラムでは小さかった。これらのピークが背景「ノイズ」によるものであるという可能性を排除するために、我々は、独立試験を開発することによって、特異的サンプルにおける2369C→T突然変異の存在を確認することを追求した。試験は、特異的ミスセンス突然変異によって生成されるPCR制限断片長多型(PCR−RFLP)を利用する蛍光検出アッセイに基づく。ヌクレオチド2369に跨るエキソン20特異的プライマーによるPCR増幅の後、野生型配列は、特異的NlaIII部位を含む。これは、消化されると、106−bp産物を生成する(方法;図3A参照)。突然変異2369Tヌクレオチドの存在は、新たにNlaIII制限消化部位を形成するので、やや短い産物(97bp)を生産する。これは、蛍光毛細管電気泳動によって簡単に検出される。この試験は、直接配列決定法よりも約2倍感受性が高い(方法参照;データ示さず)。
【0117】
我々は、PCR−RFLPアッセイの特異性を確かめるために、先ずH1975細胞系統(これはT790MおよびL858Rの両突然変異を含む)のDNAを用いた。予想通り、これらの細胞を分析することにより、97−および106bp−の両断片が得られた。一方、H2030(これは野生型EGFRを含む;表7)の分析は、106−bp断片のみを示した(図3A)。これらのデータは、本試験が、DNAサンプルにおいて突然変異対立遺伝子の有無を簡単に示すことが可能であることを示す。しかしながら、この試験は半定量的なものであるにすぎない。なぜなら、突然変異97−bp産物対野生型106−bp産物の比は、独立実験において約1:1から2:1まで変動するからである。
【0118】
我々は次に、T790Mアミノ酸置換に対応する、2369C→T特異的突然変異の有無について各種患者サンプルを評価するためにこのPCR−RFLPを用いた。患者1における進行性骨および肺病巣のDNAは、97−および106−bpの両断片を生産したが、元の腫瘍は生産しなかった(図3B).突然変異産物の、野生型産物に対する比は、胸水由来細胞において比較的高く、これは、エキソン20の直接配列決定で得られたクロマトグラムで見られたピークが比較的高いことと一致する(図7A参照)。同様に、患者2および3の進行性病巣から得られたDNAは、PCR−RFLPアッセイにおいて97−および106−bp断片を生成したが(図3B)、一方、治療前標本は、97−bp産物を生成しなかった。以上まとめると、独立アッセイから得られたこれらのデータからも、T790M突然変異は、3名全ての患者の進行性病巣に存在することが確認された。我々はさらに、直接配列決定によってEGFRエキソン18から24において二次突然変異を証明することができなかった、別の3名の患者において、そのいずれの標本においてもT790M突然変異を検出することができなかった(データ示さず)。
【0119】
(実施例10.EGFR突然変異の生化学的性質)
EGFRチロシンキナーゼ阻害剤に対する感受性と関連する突然変異を既に含むEGFRタンパクに対し、T790M突然変異がどのような影響を及ぼすかを定めるために、我々は、それぞれ、患者1および2に認められたエキソン21および19の突然変異をコードする特異的突然変異を、EGFR cDNAに導入した。対応するタンパク([i]L858R、およびL858RプラスT790M、[ii]del L747−E749;A750Pおよびdel L747−E749;A750PプラスT790M、および[iii]野生型EGFR、および野生型EGFRプラスT790M)を、発現ベクターによる一過性トランスフェクションを通じて、内因性EGFRレベルが極めて低い293T細胞において生産した[3]。血清無添加で、あらかじめゲフィチニブまたはエルロチニブで処理した各種細胞から得られた溶解物をイムノブロッティングによって分析した。抗EGFRモノクロナール抗体を用い、EGFR総量(t−EGFR)を定量した。サンプル当たりのタンパクの相対量のインディケータとしてアクチンを用いた。代行アッセイにおいて各種EGFRキナーゼの薬剤感受性を評価するために、我々は、t−EGFRタンパクレベルに対する、EGFR上の「自己リン酸化」Tyr−1092の相対レベルを測定する、Y1092−フォスフェート特異的抗体(すなわち、リン酸−EGFR[p−EGFR])を用いた。我々はまた、一般的抗フォスフォチロシン試薬(RC−20)を用いて、細胞タンパクの誘発されたチロシンリン酸化の総合パターンおよびレベルを評価した。
【0120】
ゲフィチニブは、チロシンリン酸化タンパクの低下(図8A)、および、p−EGFR:t−EGFR比の減少(図8B)によって示されるように、薬剤濃度の増大と共に漸増的に野生型およびL858R EGFRの活性を抑制した。一方、野生型、および、T790M突然変異を含むEGFR突然変異は、フォスフォチロシン誘発においても、p−E
GFR:t−EGFR比のいずれにおいても著明な変化を示さなかった(図8Aおよび8B)。T790突然変異を含む対応する突然変異種と比較した場合、同様の結果が、野生型およびdel E747−L747;A750P EGFRに対してエルロチニブを用いた場合にも得られた(図8C)。これらの結果は、T790M突然変異は、ゲフィチニブまたはエルロチニブの、EGFRチロシンキナーゼ活性を抑制する能力を、臨床的に薬剤感受性と相関を持つとされるEGFR突然変異(すなわち、L858R、またはエキソン19欠失)においても弱体化することを示唆する。
【0121】
(実施例11.T790MおよびL858R両突然変異を帯するNSCLC細胞系統の、ゲフィチニブまたはエルロチニブに対する耐性)
T790M突然変異の機能的結果についてさらに探求するために、我々は、Calcein AMによるアッセイを用い、ゲフィチニブまたはエルロチニブの存在下に培養された各種NSCLC細胞系統の感受性を定量した。ベヒクル対薬剤処理生細胞による、この蛍光発生エステラーゼ基質の取り込みおよび貯蔵から、各種細胞系統間における相対的細胞生存率の比較が可能である[20]。L858R突然変異を帯するが、他の、EGFR TKドメイン突然変異を含まないH3255細胞系統(表7)は、ゲフィチニブに対する治療に対して感受性を持ち、IC50は約0.01μmolであった(図9)。一方、L858RおよびT790M両突然変異(表7)を含むH1975細胞系統は、薬剤に対して約100倍感受性が低く、IC50は約1μmolであった(図9)。実際、H1975細胞の感受性は、野生型EGFR(エキソン18から24)およびKRAS突然変異を含むH2030により近似していた(図9)。まったく同様の結果がエルロチニブについても得られた(図10)。
【0122】
本発明は、その例示の実施態様を参照しながら、ここに開示され、図示されてきたわけであるが、改変、付加、および省略を含めた、全ての等価的実施態様は、明細書および特許請求の範囲に開示される、本発明の精神および範囲の中に含まれる。
【0123】
(参考文献)
【0124】
【化8】

【0125】
【化9】

【0126】
【化10】

【数1】

【数2】

【数3】

【数4】

【数5】

【数6】

【数7】

【技術分野】
【0001】
(発明の分野)
本発明は、上皮増殖因子受容体(EGFR)遺伝子またはEGFRタンパクにおける突然変異体であって、EGFRの抑制を目的とするある種の癌治療に対する耐性の根本的原因となっている突然変異体の有無を試験する方法に関する。本発明はさらに、前記突然変異EGFRを抑制する新規治療の開発法に関する。
【背景技術】
【0002】
(発明の背景)
上皮増殖因子受容体(EGFR)は、癌細胞の増殖および生存において重要な細胞機能の制御に与っているので、従来から硬組織腫瘍の治療における関連標的として特定されている。EGFRは、種々の腫瘍において広く発現されるが、発現が高いと、多くの場合予後不良に結びつく。EGFRの抑制を目的とする、新しいクラスの標的治療薬、チロシンキナーゼ阻害剤が出現した。例えばゲフィチニブ(イレッサ)およびエルロチニブ(タルセバ)の二つが知られている。これらの治療薬に対しある患者では初期に反応があるにも拘らず、未知の機序によって耐性が「獲得」され、最終的に患者の病気が進行する。
【0003】
EGFRは、肺癌において重要な役割を果たすと考えられている。しかしながら、非小細胞型肺癌(NSCLC)症例のほんの一部にしかイレッサまたはタルセバ(構造については図1を参照)に反応しない。チロシンキナーゼ阻害剤であるゲフィチニブまたはエルロチニブに対して反応する患者の肺腺癌には、通常、EGFRのチロシンキナーゼドメインをコードするエキソンの中に機能増強型体細胞突然変異体が見られる。このような突然変異体は、アメリカのNSCLC症例の約10%に認められるが[非特許文献1、非特許文献2、非特許文献3]、東アジアではさらに高い発生率となっている[非特許文献2、非特許文献4、非特許文献5、非特許文献6]。NSCLC関連突然変異体の約90%は下記の内のいずれかである。すなわち、一つは、4個のアミノ酸Leu−Arg−Glu−Alaの除去を含むエキソン19におけるマルチヌクレオチドのインフレーム欠失であり、もう一つは、エキソン21のヌクレオチド2573における単一ヌクレオチド置換(T→G)であり、これは、位置858においてロイシンに代わるアルギニンの置換をもたらす(L858R)。これらの突然変異体は両方とも、小型分子のキナーゼ阻害剤であるゲフィチニブまたはエルロチニブに対する感受性と関連する[非特許文献1、非特許文献2、非特許文献3]。残念ながら、これらの薬剤に対して著明な改善が見られた患者のほとんど全てで症状が進む結果となる。KRAS(v−Ki−ras2、Kirstenラット肉腫ウィルス癌遺伝子相同体、RASファミリーの一員)突然変異体が、ゲフィチニブまたはエルロチニブに対する一次耐性のいくつかのケースと関連することが示されているが[非特許文献7]、「獲得」または「二次的」耐性の原因となる機序は未知である。
【0004】
従って、この耐性の根本的な原因を特定し、それによって、診断テストの開発を可能とし、より効果的な治療の提供を可能とすることが従来技術において求められている。さらに、現行のEGFR阻害剤に対し初期に反応があったにも拘らず癌の進行または再発を示す患者に対し、その治療を可能とする新規化合物が従来技術において求められている。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Lynch TJ、Bell DW、Sordella R、Gurubhagavatula S、Okimoto RAら、(2004)Activating mutations in the epidermal growth factor receptor underlying responsiveness of non−small−cell lung cancer to gefitinib.N Engl J Med 350: 2129−2139
【非特許文献2】Paez JG、Janne PA、Lee JC、Tracy S、Greulich Hら、(2004)EGFR mutations in lung cancer: Correlation with clinical response to gefitinib therapy. Science 304: 1497− 1500
【非特許文献3】Pao W、Miller V、Zakowski M、Doherty J、Politi Kら、(2004)EGF receptor gene mutations are common in lung cancers from 「never smokers」 and are associated with sensitivity of tumors to gefitinib and erlotinib.Proc Natl Acad Sci U S A 101:13306− 13311
【非特許文献4】Huang SF、Liu HP、Li LH、Ku YC、Fu YNら、(2004) High frequency of epidermal growth factor receptor mutations with complex patterns in non−small cell lung cancers related to gefitinib responsiveness in Taiwan. Clin Cancer Res 10:8195−8203
【非特許文献5】Kosaka T、Yatabe Y、Endoh H、Kuwano H、Takahashi Tら、(2004)Mutations of the epidermal growth factor receptor gene in lung cancer: Biological and clinical implications.Cancer Res 64: 8919−8923
【非特許文献6】Shigematsu H、Lin L、Takahashi T、Nomura M、Suzuki Mら、(2004)Clinical and biological features of epidermal growth factor receptor mutations in lung cancers.J Natl Cancer Inst.In press
【非特許文献7】Pao W、Wang TY、Riely GJ、Miller VA、Pan Qら、(2005)KRAS mutations and primary resistance of lung adenocarcinomas to gefitinib or erlotinib. PLoS Medicine 2:el7
【発明の概要】
【発明が解決しようとする課題】
【0006】
(発明の要旨)
本発明は、EGFR cDNAの塩基2369に対応する位置におけるEGFR突然変異C→Tの検出に向けたポリメラーゼ連鎖反応のプライマーを提供する。この突然変異体は、EGFRタンパクの位置790において、野生型におけるトレオニンから変異種におけるメチオニンへの変化をコードする。この突然変異体は、ゲフィチニブまたはエルロチニブによる治療前、または治療の初期段階の患者ではごく僅かであることが明らかにされている。しかしながら、この突然変異体が、これらの薬剤に対する感受性を打ち消してしまうので、この突然変異体を宿す癌細胞が有利に選択され、結果、患者はさらなる治療に対して不応となる。本発明はさらに、患者において該突然変異体を検出する方法であって、その最終目的は、代替治療を開始可能とするために、不応症例を早期に特定するための方法を提供する。
【0007】
第1局面では、本発明は、EGFRポリペプチドの位置790においてトレオニンのメチオニンによる置換をコードするEGFR遺伝子突然変異体に対し、各鎖の5′側のポリヌクレオチド鎖のセンス鎖またはアンチセンス鎖に対し、適切なPCR条件下でハイブリダイズするPCRプライマーであって、前記突然変異体の200ヌクレオチド以内に結合する、PCRプライマーを提供する。全体的プライマー構造は、配列番号4−7および12−15に基づいて与えられるが、これらの特定配列よりも大きい場合も、小さい場合もあり得る。その外、配列番号4−7および12−15によって示される配列中のいくつかの塩基が他の塩基によって置換される配列を持つプライマーも提供される。
【0008】
もう一つの局面では、本発明は、適切なPCR条件下において、野生型EGFRポリペプチドをコードする第1ポリヌクレオチド、またはそのポリヌクレオチド断片にハイブリダイズするPCRプライマーを提供する。その際、プライマーは、EGFR cDNAの塩基2369に対応する位置において野生型Cを含む、センス鎖配列またはアンチセンス鎖配列にはハイブリダイズするが、プライマーは、PCR条件下、位置2369において突然変異Tを含む、第2EGFRポリヌクレオチドに対しては僅かしか、または全くハイブリダイズしない。
【0009】
さらに別の実施態様では、本発明は、適切なPCR条件下で、突然変異EGFRポリペプチドをコードする第1ポリヌクレオチドまたはそのポリヌクレオチド断片に対してハイブリダイズするPCRプライマーを提供する。その際、該プライマーは、EGFR cDNAの塩基2369に対応する位置において突然変異Tを含む、センス鎖配列またはアンチセンス鎖配列にはハイブリダイズするが、該プライマーは、PCR条件下、位置2369において野生型Cを含む、第2EGFRポリヌクレオチドに対しては僅かしか、または全くハイブリダイズしない。全体的プライマー構造は、配列番号12および13に基づいて与えられるが、これらの特定配列よりも大きい場合も、小さい場合もあり得る。その外、配列番号12および13によって示される配列中のいくつかの塩基が他の塩基によって置換される配列を持つプライマーも提供される。
【0010】
さらに別の局面では、本発明は、サンプルにおいて上皮増殖因子受容体(EGFR)突然変異遺伝子を検出するための方法であって、EGFR cDNAの塩基2369に対応する位置において突然変異Tを含むヌクレオチド配列を選択的に検出する手段によってサンプルを探査すること、および、前記位置における塩基がTであることを特定すること、を含む方法を提供する。ある重要な実施態様では、この手段は、前記位置における突然変異Tと野生型Cの検出を区別する。
【0011】
一般的実施態様では、サンプルは、癌であるかまたは悪性であるか、あるいは、癌または悪性を疑われる組織または細胞を含む。このようなサンプルは、癌または悪性腫瘍を持つか、または持つことを疑われる被験体に起因し、バイオプシーまたは同様の外科処置によって得られる。
【0012】
本方法のいくつかの優勢な実施態様では、探査は、
a)所望される場合、サンプルを処理してその中に含まれる核酸を放出させること;
b)EGFR cDNAの塩基2369に対応する位置において突然変異Tを含む、センス鎖配列またはアンチセンス鎖配列にはハイブリダイズするが、PCR条件下、位置2369において野生型Cを含む、第2EGFRポリヌクレオチドに対しては僅かしか、または全くハイブリダイズしない第1PCRプライマーを含む組成物に、サンプルから得られた核酸を接触させること;および、
c)第2PCRプライマーの存在下にPCR反応を実行し、塩基2369に対応する位置において突然変異Tを含むPCRアンプリコンを得ること、
から成る諸工程を含む。
PCR反応では、PCRアンプリコン中に標識を組み込むと有利である。こうすると特定工程は、該標識を検出することを含むことが可能になる。
【0013】
本方法のしばしば用いられる別の実施態様では、探査は、
a)所望される場合、サンプルを処理してその中に含まれる核酸を放出させること;
b)適切なPCR条件下で、EGFRポリペプチドをコードするポリヌクレオチドに対してハイブリダイズする一対のポリメラーゼ連鎖反応(PCR)プライマーであって、EGFR cDNAの塩基2369に対応する位置を挟持することによってPCR混合物を与える一対のプライマーを含む組成物に、サンプルから得られた核酸を接触させること;
c)該混合物に対してPCR反応を実行して、塩基2369に対応する位置を含むPCRアンプリコンを得ること;および、
d)アンプリコンを切断手段に接触させることから成る諸工程を含み、接触手段は、
i)塩基2369に対応する位置に突然変異Tを持つアンプリコンを、該位置の6塩基内で切断するが、ただし該位置に野生型Cを持つアンプリコンはそのように切断せず、または、
ii)塩基2369に対応する位置に野生型Cを持つアンプリコンを、該位置の6塩基内で切断するが、ただし該位置に突然変異Tを持つアンプリコンはそのように切断しない。
PCR反応では、PCRアンプリコン中に標識を組み込むと有利である。こうすると特定工程は、切断標識ポリヌクレオチドについて長さ多型を検出することを含むことが可能になる。
【0014】
本発明の一般的な、さらに別の実施態様では、探査は、
a)所望される場合、サンプルを処理してその中に含まれる核酸を放出させること;
b)固相支持体の上にサンプルから得られた核酸の少なくとも一部を固定すること;
c)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドであって、該プローブの配列は、適切なハイブリダイゼーション条件下において、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含むが、位置2369において野生型Cを含むポリヌクレオチドに対しては、僅かしかまたは全くハイブリダイズしないプローブ・オリゴヌクレオチドに、固定された核酸を接触させること、
から成る諸工程を含む。
【0015】
上述のものとは逆の方法の一般的実施態様では、探査は、
a)所望される場合、サンプルを処理してその中に含まれる核酸を放出させること;
b)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドであって、該プローブの配列は、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含むが、位置2369において野生型Cを含むポリヌクレオチドに対しては、僅かしかまたは全くハイブリダイズしないプローブ・オリゴヌクレオチドを、固相支持体に固定すること;および、
c)適切なハイブリダイゼーション条件下に、サンプルから得られた核酸の少なくとも一部を固定されたプローブに接触させること、
から成る諸工程を含む。
固相支持体を含むこれらの実施態様では、固定されたパートナーに結合する成分は標識を含み、特定工程は該標識の検出を含む。
【0016】
さらに別の局面では、本発明は、癌に罹患しているか、または癌が疑われる被験体においてゲフィチニブまたはエルロチニブの治療作用に対する耐性を予測する方法を提供する。この方法は、先行パラグラフに記載された、サンプルにおいて上皮増殖因子受容体(EGFR)遺伝子突然変異を検出する方法に記載される工程を用い、位置2369において突然変異があることを陽性に見出した場合、該被験体は、ゲフィチニブまたはエルロチニブによる治療に対して耐性を持つと予測されると結論する。
【0017】
さらに別の局面で、本発明は、少なくとも1個の容器、および、該容器に含まれる、先行パラグラフの中に記載された少なくとも1個のPCRプライマーを含む組成物を含むキットを提供する。ある実施態様では、キットはさらに、切断手段であって、
a)EGFR cDNAの塩基2369に対応する位置に突然変異Tを持つポリヌクレオチドを、該位置の6塩基内で切断することによって、ただし該位置に野生型Cを持つポリヌクレオチドはそのように切断せず、または、
b)EGFR cDNAの塩基2369に対応する位置に野生型Cを持つポリヌクレオチドを、該位置の6塩基内で切断することによって、ただし該位置に突然変異Tを持つポリペプチドはそのように切断せず、
EGFRポリヌクレオチドを切断する切断手段を含む。
本発明はまた、以下の項目を提供する。
(項目1)
上皮増殖因子受容体(EGFR)の位置790において、トレオニンのメチオニンによる置換をコードするEGFR遺伝子の突然変異に対し、5′側のポリヌクレオチド配列のセンス鎖またはアンチセンス鎖に対して適切なPCR条件下でハイブリダイズするポリメラーゼ連鎖反応(PCR)プライマーであって、該PCRプライマーは、該突然変異位置の200ヌクレオチド以内に結合する、PCRプライマー。
(項目2)
長さが200ヌクレオチド以下の項目1に記載のPCRプライマーであって、該PCRプライマーは、第1ヌクレオチド配列を含み、該第一ヌクレオチド配列は、
a)配列番号4−7および12−15から成る群から選ばれる配列;
b)パラグラフa)において与えられる配列の断片であって、少なくとも11ヌクレオチド長の連続塩基配列から成り、該選ばれた配列よりもたかだか1塩基短い断片;
c)パラグラフa)において与えられる配列と最大5ヌクレオチド異なる配列;または、
d)a)−c)において与えられる配列の相補体、
から成る、項目1に記載のPCRプライマー。
(項目3)
野生型上皮増殖因子受容体(EGFR)ポリペプチドをコードする第1ポリヌクレオチド、またはそのポリヌクレオチド断片に対して、適切なPCR条件下でハイブリダイズするPCRプライマーであって、該プライマーは、EGFR cDNAの塩基2369に対応する位置において野生型Cを含むセンス鎖またはアンチセンス鎖に対してはハイブリダイズし、該PCR条件下で、位置2369において突然変異Tを含む第2EGFRポリヌクレオチドに対しては僅かにしかハイブリダイズしないかしかハイブリダイズしないかまたは全くハイブリダイズしない、PCRプライマー。
(項目4)
長さが200ヌクレオチド以下の項目3に記載のPCRプライマーであって、該プライマーは第一ヌクレオチド配列を含み、該第一ヌクレオチド配列は、
a)配列番号14および15から成る群から選ばれる配列;
b)パラグラフa)において与えられる配列の断片であって、少なくとも11ヌクレオチド長の連続塩基配列から成り、該選ばれた配列よりもたかだか1塩基短い断片;
c)パラグラフa)において与えられる配列と最大5ヌクレオチド異なる配列;または、
d)a)−c)において与えられる配列の相補体、
から成る、PCRプライマー。
(項目5)
突然変異型上皮増殖因子受容体(EGFR)ポリペプチドをコードする第1ポリヌクレオチドまたはそのポリヌクレオチド断片に対して、適切なPCR条件下でハイブリダイズするPCRプライマーであって、EGFR cDNAの塩基2369に対応する位置において突然変異Tを含むセンス鎖配列またはアンチセンス鎖配列に対してはハイブリダイズするが、該PCR条件下で、位置2369において野生型Cを含む第2EGFRポリヌクレオチドに対しては僅かにしかハイブリダイズしないかまたは全くハイブリダイズしない、PCRプライマー。
(項目6)
長さが200ヌクレオチド以下の項目5に記載のPCRプライマーであって、該プライマーは、第一ヌクレオチド配列を含み、該第一ヌクレオチド配列は、
a)配列番号12および13から成る群から選ばれる配列;
b)パラグラフa)において与えられる配列の断片であって、少なくとも11ヌクレオチド長の連続塩基配列から成り、該選ばれた配列よりもたかだか1塩基短い断片;
c)パラグラフa)において与えられる配列と最大5ヌクレオチド異なる配列;または、
d)a)−c)において与えられる配列の相補体、
から成る、項目5に記載のPCRプライマー。
(項目7)
サンプルにおいて上皮増殖因子受容体(EGFR)突然変異遺伝子を検出する方法であって、EGFR cDNAの塩基2369に対応する位置において突然変異Tを含むヌクレオチド配列を選択的に検出する手段によって該サンプルを探査すること、および、該位置における塩基がTであることを特定すること、を含む、方法。
(項目8)
上記手段が、上記位置における突然変異Tの検出と野生型Cの検出とを区別する、項目7に記載の方法。
(項目9)
上記サンプルが、癌または悪性であるか、あるいはそれが疑われる組織または細胞を含む、項目7に記載の方法。
(項目10)
上記サンプルまたはその一部が、上記探査前に拡大される、項目7に記載の方法。
(項目11)
上記サンプルまたはその一部の核酸が、上記探査前に増幅される、項目7に記載の方法。
(項目12)
上記探査が、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EGFR cDNAの塩基2369に対応する位置において上記突然変異Tを含む、上記センス鎖配列または上記アンチセンス鎖配列にはハイブリダイズするが、上記PCR条件下で、位置2369において野生型Cを含む第2EGFRポリヌクレオチドに対しては僅かしかハイブリダイズしないかまたは全くハイブリダイズしない第1ポリメラーゼ連鎖反応(PCR)プライマーを含む組成物に、該サンプルから得られた該核酸を接触させること;および、
c)第2PCRプライマーの存在下でPCR反応を実行し、塩基2369に対応する位置において突然変異Tを含むPCRアンプリコンを得ること、
を含む、項目7に記載の方法。
(項目13)
上記PCR反応が、上記PCRアンプリコン中に標識を組み込み、上記特定が、該標識を検出することを含む、項目12に記載の方法。
(項目14)
上記探査は、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EGFRポリペプチドをコードするポリヌクレオチドに対して適切なPCR条件下でハイブリダイズする一対のポリメラーゼ連鎖反応(PCR)プライマーであって、EGFR cDNAの塩基2369に対応する位置を挟持することによってPCR混合物を与える一対のプライマーを含む組成物に、該サンプルから得られた該核酸を接触させること;
c)該混合物に対してPCR反応を実行して、塩基2369に対応する位置を含むPCRアンプリコンを得ること;および、
d)以下:
i)塩基2369に対応する位置に突然変異Tを持つアンプリコンを、該位置の6塩基内で切断するが、該位置に野生型Cを持つアンプリコンについてはそのように切断しないことによってか、または、
ii)塩基2369に対応する位置に野生型Cを持つアンプリコンを、該位置の6塩基内で切断するが、該位置に突然変異Tを持つアンプリコンについてはそのように切断しないことによって、
のいずれかによって該アンプリコンを切断する切断手段に、該アンプリコンを接触させること、
を含む、項目7に記載の方法。
(項目15)
上記PCR反応が、上記PCRアンプリコン中に標識を組み込み、上記特定が、切断され標識された該ポリヌクレオチドについて長さ多型を検出することを含む、項目14に記載の方法。
(項目16)
上記探査が、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)固相支持体の上に、該サンプルから得られた該核酸の少なくとも一部を固定すること;および、
c)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドに、該固定された核酸を接触さること、ここで、該プローブの配列は、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含み、かつ、適切なハイブリダイゼーション条件下で、該プローブは、位置2369において野生型Cを含むポリヌクレオチドに対して、僅かにしかハイブリダイズしないかまたは全くハイブリダイズしない、
を含む、項目7に記載の方法。
(項目17)
上記プローブオリゴヌクレオチドが標識を含み、上記特定が該標識を検出することを含む、項目16に記載の方法。
(項目18)
上記探査は、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドを固相支持体に固定すること、ここで、該プローブの配列は、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含み、該プローブは、位置2369において野生型Cを含むポリヌクレオチドに対し、僅かにしかハイブリダイズしないかまたは全くハイブリダイズしないこと;および、
c)適切なハイブリダイゼーション条件下において、上記固定されたプローブに、該サンプルから得られた該核酸の少なくとも一部を接触させること
を含む、項目7に記載の方法。
(項目19)
上記核酸が標識を含み、上記特定が該標識を検出することを含む、項目18に記載の方法。
(項目20)
癌を患っているか、または癌が疑われる被験体においてゲフィチニブまたはエルロチニブの治療作用に対する耐性を予測する方法であって、
a)該被験体からサンプルを得ること;
b)EGFR cDNAの塩基2369に対応する位置に突然変異Tを含むヌクレオチド配列を選択的に検出する手段によって該サンプルを探査すること;
c)該位置における塩基がTであることを特定すること;
を含み、それによって、該被験体は、ゲフィチニブまたはエルロチニブによる治療に対して耐性を持つと予測される、上記方法。
(項目21)
上記手段が、上記位置における突然変異Tの検出と野生型Cの検出とを区別する、項目20に記載の方法。
(項目22)
上記サンプルが、癌または悪性であるか、それが疑われる組織または細胞を含む、項目20に記載の方法。
(項目23)
上記サンプルまたはその一部が、上記探査の前に拡大される、項目20に記載の方法。
(項目24)
上記サンプルまたはその一部の中の核酸が、上記探査の前に増幅される、項目20に記載の方法。
(項目25)
上記探査が、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EFGR cDNAの塩基2369に対応する位置において上記突然変異Tを含む、上記センス鎖配列または上記アンチセンス鎖配列に対してハイブリダイズする第1ポリメラーゼ連鎖反応(PCR)プライマーであって、上記PCR条件下において、位置2369において野生型Cを含む第2EGFRポリヌクレオチドに対しては、僅かしかハイブリダイズしないかまたは全くハイブリダイズしない第1PCRプライマーを含む組成物に、該サンプルから得られた該核酸を接触させること;および、
c)第2PCRプライマーの存在下においてPCR反応を実行し、塩基2369に対応する位置において突然変異Tを含むPCRアンプリコンを得ること、
を含む、項目20に記載の方法。
(項目26)
上記PCR反応が、上記PCRアンプリコンの中に標識を組み込み、上記特定が該標識を検出することを含む、項目25に記載の方法。
(項目27)
上記探査は、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EGFRポリペプチドをコードするポリヌクレオチドに対して適切なPCR条件下でハイブリダイズする一対のポリメラーゼ連鎖反応(PCR)プライマーであって、EGFR cDNAの塩基2369に対応する位置を挟持することによってPCR混合物を与える一対のプライマーを含む組成物に、該サンプルから得られた該核酸を接触させること;
c)該混合物に対してPCR反応を実行して、塩基2369に対応する位置を含むPCRアンプリコンを得ること;および、
d)以下、
i)塩基2369に対応する位置に突然変異Tを持つアンプリコンを、該位置の6塩基内で切断するが、該位置に野生型Cを持つアンプリコンについてはそのように切断せしないこと、または、
ii)塩基2369に対応する位置に野生型Cを持つアンプリコンを、該位置の6塩基内で切断するが、ただし該位置に突然変異Tを持つアンプリコンについてはそのように切断しないこと
のいじれかによってアンプリコンを切断する切断手段に、該アンプリコンを接触させること、
を含む、項目20に記載の方法。
(項目28)
上記PCR反応が、上記PCRアンプリコンの中に標識を組み込み、上記特定が、切断され標識された該ポリヌクレオチドの長さ多型を検出することを含む、項目27に記載の方法。
(項目29)
上記探査は、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)固相支持体の上に該サンプルから得られた該核酸の少なくとも一部を固定すること;および、
c)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドに該固定された核酸を接触させることであって、ここで、該プローブの配列は、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含み、適切なハイブリダイゼーション条件下で、該プローブは、位置2369において野生型Cを含むポリヌクレオチドに対して、僅かにしかハイブリダイズしないかまたは全くハイブリダイズしないこと、
を含む、項目20に記載の方法。
(項目30)
上記プローブ・オリゴヌクレオチドが標識を含み、上記特定が該標識を検出することを含む、項目28に記載の方法。
(項目31)
上記探査は、
a)所望される場合、上記サンプルを処理してその中に含まれる上記核酸を放出させること;
b)EGFRポリペプチドをコードするポリヌクレオチドにハイブリダイズするプローブ・オリゴヌクレオチドを固相支持体に固定することであって、該プローブの配列は、EGFR cDNAの塩基2396に対応する位置における突然変異Tに対して相補的な塩基を含み、かつ位置2369において野生型Cを含むポリヌクレオチドに対し、僅かにしかハイブリダイズしないかまたは全くハイブリダイズしないこと、;および、
c)適切なハイブリダイゼーション条件下において、該固定されたプローブに、該サンプルから得られた該核酸の少なくとも一部を接触させること
を含む、項目20に記載の方法。
(項目32)
上記核酸が標識を含み、上記特定工程が、該標識を検出することを含む、項目31に記載の方法。
(項目33)
癌に罹患しているか、または癌が疑われる被験体においてゲフィチニブまたはエルロチニブの治療作用に対する耐性を予測するためのキットの製造における、EGFR cDNAの塩基2369に対応する位置に突然変異Tを含むヌクレオチド配列を選択的に検出する手段の使用。
(項目34)
少なくとも1個の容器と、該容器に含まれる、少なくとも1個のポリメラーゼ連鎖反応(PCR)プライマーを含む組成物とを含むキットであって、該PCRプライマーは、上皮増殖因子受容体(EGFR)の位置790においてトレオニンのメチオニンによる置換をコードするEGFR遺伝子の突然変異に対し5′側のポリヌクレオチド配列のセンス鎖またはアンチセンス鎖にハイブリダイズし、ここで、該プライマーは、該突然変異位置の200ヌクレオチド以内に結合する、キット。
(項目35)
以下、
a)EGFR cDNAの塩基2369に対応する位置に突然変異Tを持つポリヌクレオチドを、該位置の6塩基内で切断するが、該位置に野生型Cを持つポリヌクレオチドについてはそのように切断しないこと、または、
b)EGFR cDNAの塩基2369に対応する位置に野生型Cを持つポリヌクレオチドを、該位置の6塩基内で切断するが、該位置に突然変異Tを持つポリペプチドについてはそのように切断しないこと、
のいずれかによってEGFRポリヌクレオチドを切断する切断手段をさらに含む、項目34に記載のキット。
(項目36)
少なくとも1個の容器と、該容器に含まれ、PCRプライマーを含む組成物とを含むキットであって、該PCRプライマーは、適切なPCR条件下において、突然変異上皮増殖因子受容体(EGFR)ポリペプチドをコードする第1ポリヌクレオチドまたはそのポリヌクレオチド断片にハイブリダイズし、該プライマーは、EFGR cDNAの塩基2369に対応する位置において突然変異Tを含むセンス鎖配列またはアンチセンス鎖配列に対してはハイブリダイズし、かつ該プライマーは、該PCR条件下で、位置2369において野生型Cを含む第2EGFRポリヌクレオチドに対しては、僅かにしかハイブリダイズしないかまたは全くハイブリダイズしない、キット。
【図面の簡単な説明】
【0018】
【図1】ゲフィチニブおよびエルロチニブの化学構造。
【図2】本発明のポリヌクレオチドの各種実施態様の模式図。長さは200ヌクレオチド以下で、11ヌクレオチド以上。c)では、影付き垂直バーは、置換されたヌクレオチドを模式的に表す。
【図3】新規PCR−RFLPアッセイは、EGFRキナーゼドメインのエキソン20におけるT790M突然変異体の存在を独立に確認する (A)アッセイの設計(詳細については本文参照)。“F”は蛍光標識、例えばFAMを示す。このパネルの最下部において、本アッセイは、97−bpのNlaIII切断産物をもって、H1975細胞系統においてT790M突然変異体の存在を実証する。この産物は、H2030 DNAには存在しない。野生型EGFRの消化では106−bpのNlaIII産物が生成される。(B)このPCR−RFLPアッセイは、3人の患者から得られた薬剤投与前サンプルは、検出可能なレベルの突然変異97−bp産物を欠くのに対し、一方、病気進行後に得られた標本は、T790M突然変異体を含むことを示す。Ptは患者。
【図4】患者1、2、および3から得られた画像所見 (A)患者1.ゲフィチニブ治療前(0日目)、および治療中(14日、および9ヶ月)における胸部X線撮影の連続記録。画像は、初期の反応と、その後の進行を示す。(B)患者2.エルロチニブ治療前(0日目)、および治療中(4ヶ月、および25ヶ月)におけるCT所見の連続記録。画像は、初期の反応と、その後の進行を示す。(C)患者3.肉学的に目視可能な病巣の完全な摘出後における、補足的ゲフィチニブ治療前(0日目)、および治療中(3ヶ月)における胸部X線撮影の連続記録。3ヶ月において見られた、左側の胸水滲出が4ヵ月後再発した。この時点で、分子分析のために液を採取した。
【図5】再試バイオプシー実験。バイオプシー針を白抜き矢印で示す。(A)患者1.ゲフィチニブ治療10ヶ月後における、進行性肺病巣のCT誘導バイオプシー。2ヶ月後、右側胸水滲出からの液(右パネル)を、分子分析のために採取した。(B)患者2.進行性胸椎病巣のCT誘導バイオプシー(左パネル)および、進行性肺病巣のX線透視誘導バイオプシー(右パネル)。
【図6A】患者1および2において特定されたEGFRエキソン19および21突然変異体を有する配列クロマトグラム。(A)患者1の腫瘍標本におけるEGFRエキソン21の状態。増殖性肺病巣および胸水滲出から得られたDNAは、位置2573において、通常のL858Rアミノ酸置換をもたらすT→Gヘテロ突然変異を示した。
【図6B】患者1および2において特定されたEGFRエキソン19および21突然変異体を有する配列クロマトグラム。(B)患者2の3個の標本は全て、同じエキソン19のヘテロの欠失であって、残基747−749を除去し、位置750におけるアラニンをプロリンに変える欠失を示した。元の四色カラー配列トレースを白黒トレースに変換した。
【図7−1】各種臨床標本およびNSCLC細胞系統H1975におけるT790M EGFRエキソン20突然変異体に関する配列クロマトグラム。元の四色カラー配列トレースを白黒トレースに変換した。(A−C)3名の患者−患者1(A)、患者2(B),および患者3(C)−の全てにおいて、二次突然変異体T790Mは、ゲフィチニブまたはエルロチニブいずれかの治療中の進行後に得られた病巣にのみ観察された。
【図7−2】各種臨床標本およびNSCLC細胞系統H1975におけるT790M EGFRエキソン20突然変異体に関する配列クロマトグラム。元の四色カラー配列トレースを白黒トレースに変換した。(D)細胞系統H1975は、エキソン21 L858R突然変異体(上方パネル)およびエキソン20 T790M突然変異体(下方パネル)の両方を含む。星印は、ヌクレオチド2361における共通のSNP(AまたはG)を示す。矢印は、ヌクレオチド2369における突然変異体(C→T)を示す。これは、位置790においてトレオニン(ACG)の代わりにメチオニン(ATG)の置換をもたらす。逆方向では、突然変異ピークは緑色であり、一方、下段の青色ピークは、隣接ヌクレオチドからの「エコー」を表す。
【図8−1】T790M突然変異体を含むEGFR突然変異細胞は、ゲフィチニブまたはエルロチニブによる抑制に対して耐性を持つ。 野生型(WT)EGFR、または、下記の変化:T790M、L858R、L858R+T790M、del L747−E749;A750P、または、del L747−E749;A750P+T790Mを持つEGFR突然変異をコードするプラスミドを、293T細胞に一過性にトランスフェクトした。36時間後、細胞を24時間血清欠乏下に置き、ゲフィチニブまたはエルロチニブで1時間処理し、次いで、抗p−EGFR(Y1092)、抗t−EGFR、抗フォスフォチロシン(p−Tyr)、および抗アクチン抗体によるイムノブロット分析のために採取した。EGFR T790M突然変異体は、野生型EGFRまたは薬剤感受性L858R EGFR突然変異と組み合わせられると、ゲフィチニブによるチロシンリン酸化(A)、またはp−EGFR(B)の抑制を阻止する。同様に、T790M突然変異体は、薬剤反応性del L747−E749;A750P EGFR突然変異と組み合わせられると、エルロチニブによるp−EGFRの抑制を阻止する(C)。
【図8−2】T790M突然変異体を含むEGFR突然変異細胞は、ゲフィチニブまたはエルロチニブによる抑制に対して耐性を持つ。 野生型(WT)EGFR、または、下記の変化:T790M、L858R、L858R+T790M、del L747−E749;A750P、または、del L747−E749;A750P+T790Mを持つEGFR突然変異をコードするプラスミドを、293T細胞に一過性にトランスフェクトした。36時間後、細胞を24時間血清欠乏下に置き、ゲフィチニブまたはエルロチニブで1時間処理し、次いで、抗p−EGFR(Y1092)、抗t−EGFR、抗フォスフォチロシン(p−Tyr)、および抗アクチン抗体によるイムノブロット分析のために採取した。EGFR T790M突然変異体は、野生型EGFRまたは薬剤感受性L858R EGFR突然変異と組み合わせられると、ゲフィチニブによるチロシンリン酸化(A)、またはp−EGFR(B)の抑制を阻止する。同様に、T790M突然変異体は、薬剤反応性del L747−E749;A750P EGFR突然変異と組み合わせられると、エルロチニブによるp−EGFRの抑制を阻止する(C)。
【図9】EGFRまたはKRASにおいて各種突然変異を含むNSCLC細胞系統の間でゲフィチニブに対する感受性は異なる 3種の表示のNSCLC細胞系統(H3255:L858R突然変異;H1975;T790MおよびL858R両突然変異体;野生型EGFR、KRAS突然変異(表7参照))を、漸増濃度のゲフィチニブの存在下に育成し、48時間処理後に生細胞の密度を、Calcein AM蛍光アッセイを用いて測定した。ベヒクル処理細胞の蛍光を100%として表した。結果は、各条件について4から8度の繰り返しを行った、3回の独立実験の平均±SEである。同様の結果がエルロチニブについても得られた。
【図10】EGFRまたはKRASにおいて各種突然変異を含むNSCLC細胞系統の間でエルロチニブに対する感受性は異なる。図9の説明を参照されたい。
【発明を実施するための形態】
【0019】
(発明の詳細な説明)
本明細書に特定される特許、公開特許公報、および特許出願は全て、参照することによりその書の全体が、本明細書に一語一語そのまま現れるように本明細書に含められる。本明細書に特定される技術的出版物も全て引用により本明細書に含める。
【0020】
省略形:CML、慢性骨髄性白血病;CT、X線断層写真;del、欠失;EGFR、上皮増殖因子受容体;GIST、消化管支質腫瘍;HES、好酸球増多症候群;NSCLC、非小細胞型肺癌;p−EGFR、リン−EGFR;PCR−RFLP、PCR制限断片長多型;SNP、一塩基多型;t−EGFR、全体EGFR.
アクセス番号:参照EGFR配列は、LocusLinkアクセス番号1956、およびGenBankアクセス番号NT_033968から入手した。
【0021】
EGFRについては二つの記数システムを用いた。第1のシステムは、シグナル配列における開始メチオニンをアミノ酸−24と表示する。第2は、本明細書で用いるのもこれであるが、メチオニンをアミノ酸+1と表示する。抗体、例えば、Y1068−特異的抗リン−EGFRの供給業者は、第1の命名法を用いる。統一的であるために、我々は、Y1068をY1092と見なす。同様に、本明細書で報告されるT790M突然変異体は、従来T766Mと呼ばれているものである。
【0022】
本説明では、指示代名詞「ある」、および「その」は、単数であれ、複数であれ等価的な意味を持つ。これらの代名詞の特定の意味は、それらの使用される文脈から明白である。
【0023】
本明細書で用いる「腫瘍」という用語は、悪性または良性を問わず、全ての新生の細胞成長および増殖と、全ての前癌および癌細胞ならびに組織を指す。
【0024】
本明細書で用いる「癌」という用語は、無制限増殖、特殊化機能の喪失、恒久性、著明な転移能力、抗アポトーシス活性の著明な増加、急激な成長および増殖速度、および、いくつかの特徴的な形態的マーカーおよび細胞マーカーなどの特徴を持つ細胞または組織を指す。ある状況では、癌細胞は腫瘍の形を取り、そのような細胞は、動物体内の局所に存在するが、別の状況では、癌細胞は、例えば、白血球細胞のような独立の細胞として血流の中を循環する。
【0025】
ゲフィチニブまたはエルロチニブに対して臨床的耐性を獲得した癌が、EGFRキナーゼドメインにさらに突然変異体を出現させるかどうかを決めるために、我々は、これらの薬剤に対して初期には反応したものの、その後進行した13名の患者について、彼等から得た腫瘍においてEGFRエキソン18から24の状態を調べた。これらのエキソンを、肉眼的に完全な腫瘍切除を完了した後、ゲフィチニブで治療中に病気が急速に再発した、14番目の患者から得られた腫瘍細胞でも評価した。ゲフィチニブおよびエルロチニブに対する一次耐性に対しKRASが関連することから[7]、我々はまた、これら6名の患者から得られた腫瘍細胞においてKRASの状態を調べた。EGFRにおいて新たに特定された「耐性」突然変異体−EGFRゲノム配列におけるT790Mアミノ酸置換(別にT766Mとも呼ばれる)、2369C→T変異−を持つ細胞の選択的優位性を説明する努力の一環として、我々はさらに、たまたまT790M突然変異体を含むことが判明したNSLC細胞系統、および、野生型および突然変異EGFR cDNAを一過性にトランスフェクトさせた細胞から得られた細胞分解物の両方を用い野生型または薬剤感受性のEGFR突然変異に対する、耐性を持つと予想されるEGFR突然変異の薬剤感受性の特徴を調べた。
【0026】
配列番号1(表1に示す)は、ヒトのEGFR突然変異遺伝子のcDNA配列を示す。EGFR T790M突然変異体の有無を検出するために、配列決定のために用いたEGFR断片を増幅するのに使用したプライマーペアには下線を施し、かつイタリック体で表した。突然変異のt2369ヌクレオチドは、拡大したボールド体で示す。野生型EGFR配列は、GenBankアクセス番号X00588,および、Ullrich,A.et al.“Human epidermal growth factor receptor cDNA sequence and aberrant expression of the amplified gene in A431 epidermoid carcinoma cells”,Nature309(5967)、418−425(1984)から公知である。翻訳された突然変異タンパク配列を配列番号2(表2)に示す。突然変異M790は、拡大したボールド体で示される。
【0027】
【化1】

【0028】
【化2】

本明細書で用いる「核酸」または「ポリヌクレオチド」、および類似の用語および語句は、天然のヌクレオチドから構成されるポリマーばかりでなく、合成または修飾ヌクレオチドから構成されるポリマーにも関する。従って、本明細書で使用する場合、RNAであるポリヌクレオチド、またはDNAであるポリヌクレオチド、あるいはデオキシリボヌクレオチドおよびリボヌクレオチドの両方を含むポリヌクレオチドは、天然の成分、例えば、天然の塩基およびリボースまたはデオキシリボース環を含んでもよいし、あるいは、それらは、後述するもののような、合成または修飾された成分から構成されていてもよい。本発明に用いられるポリヌクレオチドは、1本鎖であってもよく、または、塩基が対になった2本鎖構造であってもよく、あるいは、塩基が対になった3本鎖構造であってもよい。
【0029】
核酸およびポリヌクレオチドは、長さが20ヌクレオチド以上であっても、または30ヌクレオチド以上、または50ヌクレオチド以上、または100以上、または1000以上、または数千以上、または数十万以上であってもよい。本明細書で用いる「オリゴヌクレオチド」および、これに基づく同様の用語は、前パラグラフで述べたように、天然のヌクレオチドから構成される短いポリマーばかりでなく、合成または修飾ヌクレオチドから構成される短いポリマーをも指す。オリゴヌクレオチドは、長さが10ヌクレオチド以上、または20ヌクレオチド以上、または30ヌクレオチド以上、または40以上で、最大約50であってもよい。オリゴヌクレオチドは化学的に合成されてもよいし、種々の用途がある中でも、PCRプライマーとして、またはプローブとして用いられてもよい。
【0030】
前パラグラフで与えられたサイズ範囲には重複があるために、「ポリヌクレオチド」と「オリゴヌクレオチド」という用語同士は、本明細書では、本発明のプライマーまたはプローブを指すに当たって同義語として使用される可能性があることを理解しなければならない。
【0031】
本明細書で用いる「ヌクレオチド配列」、「オリゴヌクレオチド配列」、または「ポリヌクレオチド配列」、および類似の用語は、オリゴヌクレオチドまたはポリヌクレオチドが有する塩基配列ばかりでなく、該配列を所有するオリゴヌクレオチドまたはポリヌクレオチド構造のいずれに対しても相互交換的に関わる。ヌクレオチド配列またはポリヌクレオチド配列はさらに、その塩基配列が、本技術分野において通例として用いられる、塩基を表示する文字から成る特定配列の記載または口誦によって定義される、任意の、天然または合成ポリヌクレオチドまたはオリゴヌクレオチドに関する。
【0032】
「ヌクレオシド」は、通例として、生化学、分子生物学、ゲノミクス、および本発明の分野に関連する類似の分野における当業者によって、グリコシド結合を通じてプリンまたはピリミジン塩基に連結するモノサッカリドを含むものと理解されているが、「ヌクレオチド」は、通常は、サッカリドの3′または5′位置(ペントースの場合)においてであるが、他の位置であってもよいその位置に、少なくとも1個のリン酸基を付着させたヌクレオシドを含む。ヌクレオチドの修飾体または誘導体は、オリゴヌクレオチドまたはポリヌクレオチドの任意の配列位置において起こってもよい。オリゴヌクレオチドおよびポリヌクレオチドの修飾体および誘導体は全て本発明に含まれ、特許請求の範囲内に納まる。修飾体または誘導体は、リン酸基、モノサッカリド、または塩基において起こることが可能である。
【0033】
非限定的例として述べるのであるが、下記の説明は、全て、本発明のポリヌクレオチドの範囲内にある、いくつかのヌクレオチド修飾体または誘導体を提示する。モノサッカリドは、例えば、リボースまたはデオキシリボース以外のペントースまたはヘキソースであることによって修飾される。モノサッカリドはまた、ヒドロキシル基を、ヒドロまたはアミノ基によって置換することによって、または、別のヒドロキシル基をアルキル化またはエステル化することによって修飾してもよい。2′位置に置換基、例えば、2′−O−メチル、2′−O−エチル、2′−O−プロピル、2′−O−アリル、2′−O−アミノアルキル、または2′−デオキシ−2′−フルオロ基を置くと、それによって、オリゴヌクレオチドに対するハイブリダイゼーション能力が強化される。
【0034】
オリゴヌクレオチドおよびポリヌクレオチドにおける塩基は、「未修飾」または「天然」の塩基であってもよく、プリン塩基アデニン(A)およびグアニン(G)、およびピリミジン塩基チミン(T)、シトシン(C)、およびウラシル(U)を含む。さらに、これらの塩基は、修飾または置換を有する塩基であってもよい。修飾塩基の非限定的例としては、他の合成および天然の塩基、例えば、ヒポキサンチン、キサンチン、4−アセチルシトシン、5−(カルボキシヒドロキシメチル)ウラシル、5−カルボキシメチルアミノメチル−2−チオウリジン、5−カルボキシメチルアミノメチルウラシル、ジヒドロウラシル、ベータ−D−ガラクトシルキューオシン、イノシン、N6−イソペンチルアデニン、1−メチルグアニン、1−メチルイノシン、2,2−ジメチルグアニン、2−メチルアデニン、2−メチルグアニン、3−メチルシトシン、5−メチルシトシン、N6−アデニン、7−メチルグアニン、5−メチルアミノメチルウラシル、5−メトキシアミノメチル−2−チオウラシル、ベータ−D−マンノシルキューオシン、5′−メトキシカルボキシメチルウラシル、5−メトキシウラシル、2−メチルチオ−N6−イソペンテニルアデニン、ウラシル−5−オキシ酢酸(v)、ワイブトキソシン、プソイドウラシル、キューオシン、2−チオシトシン、5−メチル−2−チオウラシル、2−チオウラシル、4−チオウラシル、5−メチルウラシル、ウラシル−5−オキシ酢酸メチルエステル、ウラシル−5−オキシ酢酸(v)、5−メチル−2−チオウラシル、3−(3−アミノ−3−N−2−カルボキシプロピル)ウラシル、(acp3)w、および2,6−ジアミノプリン、5−ヒドロキシメチルシトシン、キサンチン、ヒポキサンチン、2−アミノアデニン、アデニンおよびグアニンの、6−メチルおよび他のアルキル誘導体、アデニンおよびグアニンの2−プロピルおよび他のアルキル誘導体、2−チオウラシル、2−チオチミンおよび2−チオシトシン、5−ハロウラシル、5−ハロ−シトシン、5−プロピル−ウラシル、5−プロピニル−シトシン、およびピリミジン塩基の他のアルキニル誘導体、6−アゾ−ウラシル、6−アゾ−シトシン、6−アゾ−チミン、5−ウラシル(プソイドウラシル)、4−チオウラシル、8−ハロ、8−アミノ−、8−チオール−、8−チオアルキル−、8−ヒドロキシル−、および他の8−置換アデニン類およびグアニン類、5−ハロ、特に5−ブロモ、5−トリフルオロメチル、および他の5−置換ウラシル類およびシトシン類、7−メチルグアニンおよび7−メチルアデニン、2−フルオロ−アデニン、2−アミノ−アデニン、8−アザグアニンおよび8−アザアデニン、7−デアザグアニンおよび7−デアザアデニンおよび3−デアザグアニンおよび3−デアザアデニンが挙げられる。さらにそれ以外の修飾塩基としては、3環ピリミジン、例えば、フェノキサジンシチジン(1H−ピリミド[5,4−b][1,4]ベンゾキサジン−2(3H)−オン)、フェノチアジンシチジン(1−ピリミド[5,4−b][1,4]ベンゾチアジン−2(3H)−オン)、G−clamp類、例えば、フェノキサジンシチジン置換体(例えば、9−(2−アミノエトキシ)−H−ピリミド[5,4−b][1,4]ベンゾキサジン−2(3H)−オン)、カルバゾールシチジン(2H−ピリミド[4,5−b]インドール−2−オン)、ピリドインドールシチジン(H−ピリド[3′,2′:4,5]ピロロ[2,3−d]ピリミジン−2−オン)が挙げられる。修飾塩基はさらに、プリンまたはピリミジン塩基が、他のヘテロ環、例えば、7−デアザアデニン、7−デアザグアノシン、2−アミノピリジン、および2−ピリドンによって置換される塩基を含んでもよい。さらにそれ以外の塩基としては、米国特許第3,687,808号に開示されるもの、The Concise Encyclopedia Of Polymer Science And Engineering,pages858−859,Kroschwitz,J.I.,ed.John Wiley & Sons,1990に開示されるもの、Englisch et al.,Angewandte Chemie,International Edition(1991)30,613に開示されるもの、および、Sanghvi,Y.S.,Chapter 15,Antisense Research and Applications,pages289−302,Crooke,S.T.and Lebleu,B.,ed.,CRC Press,1993に開示されるものを含む。これらの塩基の内のいくつかは、本発明のオリゴマー化合物の結合親和性を増すのに特に有用である。そのようなものとして、5−置換ピリミジン類、6−アザピリミジン類、およびN−2、N−6、およびO−6置換プリン類、例えば、2−アミノプロピニルアデニン、5−プロピニルウラシルおよび5−プロピニルシトシンを含む置換体が挙げられる。5−メチルシトシン置換は、核酸2本鎖の安定性を0.6−1.2度増すことが示されており(Sanghvi,Y.S.,Crooke,S.T.and Lebleu,B.,eds.,Antisense Research and Applications,CRC Press,Boca Raton,1993,pp.276−278)、現在好ましい塩基置換体であり、特に、2′−O−メトキシエチル糖修飾と組み合わされた場合は好ましい。米国特許第6,503,754および第6,506,735号、およびこれらの引用文献を参照されたい。なお、これらを引用することにより本明細書に含める。修飾体はさらに、ポリアミン接合オリゴヌクレオチドを扱う米国特許第5,138,045および第5,218,105号;フォスフォロチオエートを含むリン酸キラル結合を取り込むオリゴヌクレオチドを扱う米国特許第5,212,295、第5,521,302号、第5,587,361号、および第5,599,797号;修飾バックボーンを持つオリゴヌクレオチドを扱う米国特許第5,378,825号、第5,541,307号および第5,386,023号;修飾された核塩基を扱う米国特許第5,457,191および5,459,255号;ペプチド核酸を扱う米国特許第5,539,082号;ベータ−ラクタムバックボーンを有するオリゴヌクレオチドを扱う米国特許第5,554,746号;オリゴヌクレオチドの合成を開示する米国特許第5,571,902号;アルキルチオヌクレオシドを開示する米国特許第5,578,718号;2′−O−アルキルグアノシン、2,6−ジアミノプリン、および関連化合物を扱う米国特許第5,506,351号;N−2置換プリンを有するオリゴヌクレオチドを扱う米国特許第5,587,469号;3−デアザプリンを有するオリゴヌクレオチドを扱う米国特許第5,587,470号;4′−デスメチルヌクレオシド接合類縁体を扱う米国特許第5,223,168号および第5,608,046号;バックボーン修飾オリゴヌクレオチド類縁体を扱う米国特許第5,602,240号および第5,610,289号;特に、2′−フルオロ−オリゴヌクレオチドの合成法を扱う米国特許第6,262,241号および第5,459,255号に開示されるものが挙げられる。
【0035】
ヌクレオチド間の結合は、通常、3′−5′リン酸結合であるが、これは、天然のフォスフォジエステル結合、フォスフォチオエステル結合、またはさらに別の合成結合であってもよい。フォスフォロチオエートバックボーンを含むオリゴヌクレオチドは、そのヌクレアーゼ安定性が強化される。バックボーン修飾体の例としては、フォスフォロチオエート、キラルフォスフォロチオエート、フォスフォロジチオエート、フォスフォトリエステル、アミノアルキルフォスフォロトリエステル、メチルおよび他のアルキルフォスフォネート、例えば、3′−アルキレンフォスフォネート、5′−アルキレンフォスフォネート、およびキラルフォスフォネートが挙げられ、フォスフィネート、フォスフォロアミデート、例えば、3′−アミノフォスフォロアミデート、およびアミノアルキルフォスフォロアミデートが挙げられ、チオノフォスフォルアミデート、チオノアルキルフォスフォネート、チオノアルキルフォスフォトリエステル、セレノフォスフェート、およびボラノフォスフェートが挙げられる。さらにそれ以外の結合としては、フォスフォトリエステル、シロキサン、炭酸塩、カルボキシメチルエステル、アセタミデート、カルバメート、チオエーテル、架橋型フォスフォルアミデート、架橋型メチレンフォスフォネート、架橋型フォスフォロチオエート、およびスルフォンヌクレオチド間結合が挙げられる。他のポリマー結合としては、上記の、2′−5′結合類縁体が挙げられる。米国特許第65,03,754号および第6,506,735号、およびこれらの引用文献を参照されたい。なお、これらを引用することにより本明細書に含める。
【0036】
前述の説明に例示したものを含め、いかなる修飾でも、簡単に、本発明のポリヌクレオチドの中に取り込むこと、その範囲内に含めることが可能である。いずれのヌクレオチド修飾体であっても、その使用は、当業者によって理解されるように、同じ塩基対合性を持つ天然ヌクレオチドの使用と等価である。等価的ヌクレオチド修飾体は全て、本明細書に開示、請求されるとおり本発明の範囲内に納まる。
【0037】
本明細書および特許請求の範囲に用いられる「相補体」、「相補的」、または「相補性」という用語、および類似の単語および語句は、生化学、分子生物学、ゲノミクス、および本発明の分野に関連する類似の分野における当業者によって通例として理解されるように、二つの配列であって、その塩基が、塩基毎に、互いに相補的な塩基対を形成する配列同士に関わる。相補配列を持つ、2本の1本鎖(ss)ポリヌクレオチドは、適切なバッファーおよび温度条件の下で互いにハイブリダイズして、2本鎖(ds)ポリヌクレオチドを形成することが可能である。非限定的例として述べるのであるが、天然の塩基を考えるなら、Aおよび(TまたはU)は互いに相互作用を持ち、GおよびCは互いに相互作用を持つ。別様に指示しない限り、「相補的」とは、「完全に相補的」を意味するという意図を持つ。すなわち、2本のポリヌクレオチド鎖が互いに整列すると、2本の鎖の内の少なくとも一部では、一方の鎖の連続塩基配列の内の各塩基が、対向鎖における同じ長さの連続塩基配列の相互作用塩基に対して相補的となる、そのような一部が見られる。
【0038】
本明細書で用いる「放出する」、および類似の単語および語句は、核酸と結びつけて使用される場合、細胞または組織を処理する際、その中に含まれる核酸が、試薬、例えば、本発明の方法に用いられるPCRプライマーとの相互作用に利用可能となるぐらい十分に処理される工程に関する。
【0039】
本明細書で用いる「ハイブリダイズする」、「ハイブリダイゼーション」、および類似の単語および語句は、相補配列を持つ複数の鎖を互いに作用させることによって核酸、ポリヌクレオチド、またはオリゴヌクレオチド2本鎖を形成する工程に関する。相互作用は、複数の鎖のそれぞれに存在する相補的塩基で、特異的相互作用を持って対を形成する塩基のために起こる。複数の鎖が互いにハイブリダイズする能力は、下記のような種々の条件に依存する。核酸鎖同士は、各鎖において十分な数の対応位置が、相互に作用を持つことが可能なヌクレオチドで占められている場合に互いにハイブリダイズする。互いにハイブリダイズするポリヌクレオチド鎖同士は、完全に相補的であってもよい。それとは別に、2本のハイブリダイズしたポリヌクレオチドは、互いに「実質的に相補的」であってもよい。これは、それらのポリヌクレオチドが少数の不適合塩基を持つことを示す。天然の塩基も、本明細書に記述するような修飾された塩基も、相補的塩基対の形成に参加する。非限定的例として生化学者および分子生物学者を含む、本発明の分野に熟練した当業者であれば、2本鎖を形成する鎖同士の配列は、特異的に配列可能となるために互いに100%相補的である必要はない。
【0040】
本明細書で用いる「断片」および類似の単語および語句は、参照体の完全配列よりも短い、核酸、ポリヌクレオチド、またはオリゴヌクレオチドの一部に関する。断片の中の塩基の配列は、参照体の対応部分の配列と変わらない。すなわち、参照体の対応部分と比較した場合断片には挿入も欠失もない。
【0041】
本明細書で用いる「切断手段」、および類似の用語および語句は、ポリヌクレオチドを配列特異的やり方で切断する物質に関する。切断手段は、ポリヌクレオチドに対し、該ポリヌクレオチドの塩基の内、感受性を持つサブ配列においてのみ相互作用を持ち、そのポリヌクテオチドを、二つのより小さい断片に切断する。切断手段の非限定的例としては、制限ヌクレアーゼ、配列特異的リボザイム、切断活性を持つアプタマー、切断活性を持つ配列特異的有機分子が挙げられる。本発明の分野の当業者には既知の等価的切断手段であれば、いずれのものも本発明の範囲内にある。
【0042】
「相補的DNA」(cDNA)は、逆転写酵素によってmRNA鋳型からコピーされ、mRNAの配列に対して相補的な配列となる1本鎖DNA分子である。当業者達はまた、そのような1本鎖DNA分子、およびその相補的DNA鎖を含む2本鎖DNA分子を指すのにも“cDNA”という用語を用いる。
【0043】
サンプル(癌組織バイオプシー、バイオプシーからレーザー組織捕獲によって得た癌細胞、または血清から単離した癌細胞)に含まれるEGFR T790M突然変異体の存在を検出するには様々な方法がある。そのような方法は、EGFR T790M領域の上流と下流にある2本のプライマーにDNAサンプルを接触させること、標準手順に従ってEGFR T790M領域を増幅すること、および、核酸サンプルの中に増幅された配列があるかどうかを検出することを含む。従って、EGFR T790M上流および下流領域を認識し、結合することが可能なプライマー、およびEGFR T790M突然変異体に対する親和性を持つ核酸プローブは、本法を支える好ましい手段である。例えば、EGFRエキソン20全体は、ゲノムDNAを鋳型として用い、かつ、それぞれ、エキソン20の5′および3′イントロンのフランキング配列(このようなエキソン20フランキング配列を、配列番号3で大文字で示す(表3、GenBankアクセス番号NT_033968)を認識し、結合することが可能なプライマーペアを用い、PCRによって増幅することが可能である。EGFR cDNA配列のヌクレオチド2369を含むこのようなプライマーペアは断片を増幅することができ、次にその断片は、配列決定、制限長多型分析、または、2369C→T突然変異体の有無を決定するための他の任意の技術のために使用することが可能である。
【0044】
【化3】

これらの診断法に限定されることなく、EGFR T790M突然変異体を検出するための方法であって、対立遺伝子コドンにおける制限部位の有無を認識するために制限酵素を用いる方法が提供される。ポリヌクレオチドの生産的切断をもたらす制限部位は、野生型の一方または他方、または多型対立遺伝子が存在する場合、適切に選択的な制限ヌクレアーゼによって得られる。
【0045】
さらに本発明の意図するところは、ヒトにおける悪性腫瘍に関連した突然変異EGFR
T790Mを検出するための診断キットである。このようなキットは、EGFR T790M突然変異体のPCR検出に有用な一組のプライマー、および、突然変異したEGFR配列を含む陽性コントロール、および、非突然変異EGFR配列を含む陰性コントロールが含まれる複数の容器を含むことが好ましい。
【0046】
図2は、本発明のプライマーのいくつかの実施態様の模式図を示す。本発明は、EGFR cDNAの位置2369に対応する塩基を含む、EGFRのゲノムまたはcDNA配列セグメントを増幅するためのプライマーとして使用可能な配列を開示する。この開示されるプライマー配列、例えば、配列番号4−7および12−15は、図2において、明るく陰影を施したブロックによって模式的に表される。図2は、a)“SEQ”として表される開示のプライマーは、その全長が最大200ヌクレオチドにまで広がるさらに大きいポリヌクレオチドに任意に含まれてもよい実施態様を示す。
【0047】
本発明はさらに、上記プライマー配列、すなわち配列番号4−7および12−15の内の任意の一つの断片で、長さが少なくとも11ヌクレトチドであるプライマー配列(参照配列番号よりたかだか1塩基しか短くない、図2bに示されるもの)と共に、配列番号4−7および12−15に示す配列とは、最大5ヌクレオチドしか異ならず(図2cに描か
れる)、この例では、3本の暗い垂直バーで表される3個の変異塩基を示すプライマー配列を提供する。
【0048】
さらに本発明は、前述の配列の任意のものに対して相補的な配列も提供する(図2dに“COMPL”と表示される)。上記配列のいずれも、本発明のオリゴヌクレオチドまたはポリヌクレオチドの中に含まれる。前述したように、本発明の、いずれのプライマーポリヌクレオチドも、200ヌクレオチドの上限まで、任意にさらに新たな塩基を含んでもよい。
【0049】
本発明のプライマーは、増幅されるゲノム座位またはcDNAの各鎖に対して「実質的に」相補的であると表示される。これは、これらのプライマーが、ポリメラーゼ連鎖反応の進行を可能とする条件下において、それぞれの鎖にハイブリダイズするのに十分な相補性を持たなければならないことを意味する。言い換えると、プライマーは、突然変異体に隣接する5′および3′配列に対し、それらとハイブリダイズし、そのゲノム座位の増幅を可能とするほど十分な相補性を持たなければならない。従って、プライマー配列は、その標的配列に対して完全に相補的であることを要しないことがここでは見て取れる。従って、オリゴヌクレオチド配列を参照しながら使われる「実質的に同一」および類似の語句は、突然変異、例えば、本明細書において特定されるSNPの有無を区別可能とするほど十分な特異性をもってハイブリダイズまたはアニールすることができる機能的能力を意味する。このことは、融解温度を測定し、それらが、問題のオリゴヌクレオチドが、正常な遺伝子配列、またはEGFR T790M遺伝子突然変異配列のどちらに結合したかを簡単に特定可能とするほど十分に異なっているかを見ることで測定可能である。本発明のオリゴヌクレオチドプライマーは、経過した反応工程の数に応じて指数関数的に増加する量の多型座位を生産する酵素連鎖反応である増幅過程に用いられる。通常、1本のプライマーは、多型座位の陰性(−)鎖に対して相補的であり、他方のプライマーは、陽性(+)鎖に対して相補的である。プライマーをアニールして変性核酸とし、次いで酵素、DNAポリメラーゼでヌクレオチドを伸長させると、標的多型座位配列を含む、新たに合成された+および−鎖が得られる。これらの新規合成配列も鋳型となるので、変性、プライマーアニーリング、および伸長から成るサイクルを繰り返すことによって、プライマーによって定められる領域(すなわち、標的多型座位配列)の指数関数的生産がもたらされる。連鎖反応の産物は、用いた特異的プライマーの末端に対応する終末部を持つ、独立した核酸2重鎖である。
【0050】
ポリヌクレオチドの合成。本発明のオリゴヌクレオチドプライマーは、適切なものであれば任意の方法によって、例えば、通例のフォスフォトリエステルおよびフォスフォジエステル法、またはその自動化実施態様によって調製することが可能である。そのような一つの自動化実施態様では、ジエチルフォスフォロアミダイトが開始材料として用いられ、Beaucage,et al.,Tetrahedron Letters,22:1859−1862,(1981)に記載されるように合成される。改変固相支持体においてオリゴヌクレオチドを合成するための一つの方法が、米国特許第4,458,066号に記載される。
【0051】
オリゴヌクレオチドおよびポリヌクレオチドは、標準的合成技術、例えば、自動化DNA合成機によって調製される。オリゴヌクレオチドの合成法としては、著名な化学的合成過程、例えば、T.Brown and Dorcas J.S.Brown in Oligonucleotides and Analogues A Practical Approach,F.Eckstein,editor,Oxford University Press,Oxford,pp.1−24(1991)によって記載されるやり方に従って、表面誘導化粒子におけるヌクレオチドフォスフォロアミダイトの順次添加が挙げられるが、ただし、それに限定されない。なお、この文献を引用することにより本明細書に含める。
【0052】
合成過程の一つの例は、Expedite RNAフォスフォロアミダイトおよびチミジンフォスフォロアミダイト(Proligo,ドイツ)を用いる。合成オリゴヌクレオチドは、脱保護され、ゲル精製され(Elbashir et al.(2001)Genes & Dev.15,188−200)、次いで、Sep−Pak C18カートリッジ(Waters,Milford,マサチューセッツ州、米国)精製(Tuschl et al.(1993)Biochemistry,32:11658−11668)される。他のオリゴヌクレオチド合成法としては、フォスフォトリエステルおよびフォスフォジエステル法による固相オリゴヌクレオチド合成(Narang,et al.,(1979)Meth.Enzymol.68:90)、および、H−フォスフォネート法(特に、Garegg,P.J.,et al.,(1985)“Formation of internucleotidic bonds via phosphonate intermediates”,Chem.Scripta 25,280−282;およびFroehler,B.C.,et al.,(1986a)“Synthesis of DNA via deoxynucleoside H−phosphonate intermediates”,Nucleic Acid Res.,14,5399−5407)、および支持体における合成(Beaucage,et al.(1981)Tetrahedron Letters 22:1859−1862)を始め、フォスフォロアミデート技術(Caruthers,M.H.,et al.,“Methods in Enzymology,”Vol.154,pp.287−314(1988),米国特許第5,153,319、5,132,418、4,500,707、4,458,066、4,973,679、4,668,777、および4,415,732号、および、“Synthesis and Applications of DNA and RNA,”S.A.Narang,editor,Academic Press,New York,1987に記載される他のもの、およびそこに含まれる参考文献、および非フォスフォロアミダイト技術が挙げられるが、ただしこれらに限定されない。固相合成は、不純物および過剰な試薬からオリゴヌクレオチドを分離するのに役立つ。固相支持体から切り離された後、オリゴヌクレオチドは、既知の技術を用いてさらに単離されてもよい。
【0053】
精製されたものであれ、非精製形のものであれ、任意の核酸標本を、それが、多型座位を含む特異的核酸配列を含むか、含むことを疑われるものである限り、開始核酸(単数または複数)として用いることが可能である。従って、過程は、例えば、DNA,またはメッセンジャーRNAを含むRNAを、DNAまたはRNAが、単一鎖であれ、二重鎖であれ、増幅することが可能である。RNAを鋳型として用いる場合、この鋳型をcDNAに逆転写するために最適な酵素および/または条件が利用される。さらに、それぞれの1本鎖ずつを含むDNA−RNAハイブリッドを用いてもよい。さらに、核酸混合物を用いても、あるいは、本明細書の先行増幅反応で生産された核酸を、同じ、または別のプライマーを用いてそのまま利用してもよい。増幅される特異的核酸配列、すなわち、多型座位は、より大きな分子の一分画であってもよいし、あるいは、最初から独立分子として存在し、特異的配列が核酸全体を構成するようになっていてもよい。増幅される配列は、最初から純粋形として存在する必要はない。該配列は、例えば、ヒトの全DNAに含まれるもののような複雑な混合物の一小分画として存在してもよい。
【0054】
本発明で用いられるDNAは、体内サンプル、組織試料等から、様々な技術、例えば、Maniatis,et.al.in Molecular Cloning:A Laboratory Manual,Cold Spring Harbor,N.Y.,p280−281,1982に記載される技術を用いて抽出されてもよい。抽出サンプルが不純な場合は、増幅前に、細胞、またはサンプルの動物細胞膜を開放し、核酸(単複)の鎖(単複)を暴露および/または分離するのに有効な量の試薬で、該サンプルを処理してもよい。鎖を暴露し、分離するための、この細胞分解および核酸変性工程によって、増幅をはるかに簡単に実行することが可能となる。
【0055】
DNA重合のための試薬は、プライマー伸長産物の合成を実現するよう機能するものであれば、酵素を含めどのような化合物またはシステムであってもよい。この目的のために好適な酵素としては、例えば、ポリメラーゼムテイン、逆転写酵素、他の酵素、例えば、熱安定性酵素(すなわち、変性を引き起こすほど十分に高い温度に曝された後でもプライマー伸長を実行する酵素)、例えば、Taqポリメラーゼを含む酵素が挙げられる。好適な酵素は、適切なやり方でヌクレオチド同士の組み合わせを助け、互いに、各多型座位核酸鎖に対して相補的なプライマー伸長産物を形成する。一般的に、合成は、各プライマーの3′末端において始まり、鋳型鎖にそって、合成が終了するまで5′方向に進行し、様々な長さの分子を生産する。
【0056】
増幅産物は、放射性プローブを用いなくとも、サザーンブロットによってサンプルを分析することによって検出される。この過程では、例えば、極小濃度の多型座位の核酸配列を含むcDNAの小サンプルが増幅され、サザーンブロット技術か、またはそれと類似のものであるが、ドットブロット分析によって分析される。非放射性プローブまたは標識の使用は、高レベルの増幅信号によってやり易くなる。別態様として、増幅産物を検出するために使用されるプローブは、例えば、放射性同位元素、蛍光化合物、生物発光化合物、化学発光化合物、金属キレート剤、または酵素によって、検出可能となるように直接または間接に標識されてもよい。当業者であれば、他にも、プローブに接着される好適な標識を思いつくであろうし、あるいは、通例の実験を用いてそのような標識を確認することができるであろう。好ましい実施態様では、増幅産物は、DNAを発光させる臭化エチジウムを含むアガロースゲルの上で混合物を分離することによって分析が可能である。
【0057】
本発明の方法によって増幅される配列は、溶液において、または固相支持体に結合させた後で、特異的DNA配列の検出のために通常適用される任意の方法、例えば、PCR、オリゴマー制限(Saiki,et.al.,Bio/Technology,3:1008−1012,(1985))、対立遺伝子特異的オリゴヌクレオチド(ASO)プローブ分析(Conner,et.al.,Proc.Natl.Acad.Sci.U.S.A.,80:278,(1983))、オリゴヌクレオチドライゲーション・アッセイ(OLA)(Landgren,et. al.,Science,241:1007,(1988))等によって、さらに評価、検出、配列決定等を実行することが可能である。DNA分析に関する分子技術の総覧が提出されている(Landgren,et.al.,Science,242:229−237,(1988))。
【0058】
増幅法は、本明細書に記載され、かつ、当業者達によって一般的に用いられるものと同じPCRによるものであることが好ましい。それとは別の増幅法も、本発明のプライマーを用いてPCRによって増幅されるEGFR座位が、その別手段によっても同様に増幅される限り、使用が可能である。このような別法増幅システムとして、対象とする短いRNA配列とT7プロモーターで始める自己持続性配列複製が挙げられるが、ただしそれに限定されない。酵素、逆転写酵素は、RNAを複製してcDNAとし、次いで、この転写RNAを変性する。もう一つの核酸増幅技術は、核酸配列増幅(NASBA)である。これは、逆転写とT7 RNAポリメラーゼを用い、そのサイクルスキームを目標実現するために二つのプライマーを取り込む。NASBAは、DNAかRNAのどちらかで始め、どちらかで終わり、60から90分以内に108コピーまで増幅することが可能である。別態様として、核酸は、ライゲーション活性化転写(LAT)によって増幅することも可能である。LATは、一部1本鎖、一部2本鎖である1本のプライマーと組み合わせた1本鎖鋳型に基づいて動作する。増幅は、プロモーターオリゴヌクレオチドにcDNAを連結することから始まり、数時間以内に、増幅は108から109倍になる。対象とするDNA配列に相補的なRNAに対し、MDV−1と呼ばれるRNA配列を付着させることによって、QBレプリカーゼが利用可能となる。サンプルと混合されると、ハイブリッドRNAは、標本のmRNAの中にその相補体を見つけ、結合し、レプリカーゼを活性化して、対象とする、標識にそう配列をコピーする。もう一つの核酸増幅技術、リガーゼ連鎖反応(LCR)は、対象配列の、二つの別々に標識された半分であって、サンプルの連続配列の存在下にリガーゼによって共有的に結合されて、新規標的を形成する半分同士を用いることによって作動する。修復連鎖反応(RCR)核酸増幅技術は、二つの、相補的で、標的特異的オリゴヌクレオチドプローブ・ペア、熱安定ポリメラーゼとリガーゼ、および、標的配列を幾何学的に増幅するDNAヌクレオチドを用いる。2塩基ギャップが、オリゴヌクレオチドプローブ・ペアを隔て、PCRは、正常のDNA修復を模倣して、このギャップを埋め、ギャップを接合する。鎖転移活性化(SDA)による核酸増幅は、標的DNAに結合する5′末端に短いオーバーハングを有する、Hinc IIの認識部位を含む短いプライマーを利用する。DNAポリメラーゼが、オーバーハングに対向するプライマーの一部に、イオウ含有アデニン類縁体を充填する。Hinc IIが添加されるが、これは、未修飾のDNA鎖しか切断しない。5′エキソヌクレアーゼ活性を欠くDNAポリメラーゼが、ニック部位に進入し、最初のプライマー鎖を下流に向かって切り離し、新規プライマーを構築し、この新規プライマーがその後のプライマーとして作動する。SDAは、37℃、2時間で107倍の増幅を実現する。PCRおよびLCRと違って、SDAは、装置による温度サイクルを必要としない。本発明の方法において有用なもう一つの増幅システムは、QBレプリカーゼシステムである。本発明ではPCRが好ましい増幅法ではあるが、上記他の方法も、本発明の方法に記載される座位の増幅に使用することが可能である。
【0059】
対立遺伝子特異的ハイブリダイゼーションによる、指定配列の変動を検出するには、従来技術で既知の、様々の方法を使用することが可能である。試験遺伝子は、対立遺伝子特異的オリゴヌクレオチド(ASO)によって探査し、かつ、各ASOが既知の突然変異配列を含んでいることが好ましい。ASO分析は、特異的オリゴヌクレオチドプローブが、標的ポリヌクレオチド断片にハイブリダイズする能力を調べることによって、標的ポリヌクレオチド断片における特異的配列の変動を検出する。オリゴヌクレオチド配列は、突然変異配列(またはその相補配列)を含むことが好ましい。標的配列における配列変動の存在は、正常配列を含むオリゴヌクレオチドプローブが標的断片にハイブリダイズしない条件下において得られる、オリゴヌクレオチドプローブと標的断片との間のハイブリダイゼーションによって示される。配列変異(例えば、突然変異)オリゴヌクレオチドプローブと、標的ポリヌクレオチド断片との間にハイブリダイゼーションが欠如することは、標的断片に特異的配列変異(例えば、突然変異)が無いことを示す。好ましい実施態様では、試験サンプルを標準的ドットプロット方式で探査する。ASOに対応する配列を含む試験遺伝子内の各領域を、個別に固相表面に、例えば、膜における個別ドットとして投与する。各個別領域は、従来技術で既知の方法(例えば、Mullis,K.B.,1987、米国特許第4,683,202号に記載される実験的実施態様を参照されたい)を用い、別々のPCR増幅産物として生産される。
【0060】
ASO分析を実行するのに、ドットブロット方式に対する代替として使用が可能な膜依存方式としては、反転ドットブロット(多重増幅アッセイ)、および多重対立遺伝子特異的診断アッセイ(MASDA)が挙げられるが、ただしこれらに限定されない。
【0061】
反転ドットブロット方式では、既知の配列を持つオリゴヌクレオチドまたはポリヌクレオチドが、固相表面に固定され、次いで、標識された試験ポリヌクレオチドサンプルとハイブリダイズさせられる。この状況で、標識試験ポリヌクレオチドサンプルを準備するために、増幅前に、プライマー、またはNTPが標識される。それとは別に、試験ポリヌク
レオチドサンプルは、分離および/または合成後、標識してもよい。多重方式では、個別のサンプルは、単一の標的配列だけではなくて、試験遺伝子の中に多数の標的配列を含む。例えば、それぞれがASO標的配列の内の少なくとも一つを含む、多数のPCR産物が、同じサンプルドット内に投与される。多数PCR産物は、Caskey et al.、米国特許第5,582,989号を用いる単一増幅反応において同時に生産することが可能である。従って、同じブロットを、その対応配列が、サンプルドットにおいて表される各ASOによって探査することが可能である。
【0062】
MASDA方式は、各ブロット(多数標的配列を有するドットを含む)を探査するのに多数ASOを用いることによって多重方式の複雑性レベルを拡大させる。この実行過程は、A.P.Shuberによる米国特許第5,589,330号、および、Michalowsky et al.,American Journal of Human Genetics,59(4):A272,poster 1573(1996年10月)に詳細に記載される。これらの文書、それぞれ、その全体を、引用することにより本明細書に含める。先ず、多数ASOプローブと固定サンプルとの間のハイブリダイゼーションが検出される。この方法は、任意のドット中の多数の標的配列における突然変異体の存在は極めて稀であるから、何か陽性ハイブリダイゼーション信号が得られたとすれば、それは、対応する突然変異標的とハイブリダイズするプローブ混合物の中の単一ASOに由来するものであるとする予測に基づく。次に、このハイブリダイズASOが、ハイブダイゼーション部位からそれを分離し、そのヌクレオチド配列を決定することによって特定される。
【0063】
対立遺伝子特異的オリゴヌクレオチド(ASO)プローブを設計する
対立遺伝子特異的オリゴヌクレオチドプローブは、任意の一組の条件下で標的配列と正確にハイブリダイズするように遺伝子工学的に加工された、短い、単一鎖ポリヌクレオチドである。通常、ASOプローブは、それぞれ、正常対立遺伝子、および配列変異と同一の配列を含むように設計される。標的に対するプローブのハイブリダイゼーションによって変異サンプルの決定が可能となる。厳格条件下では、単一塩基ペアほどの単純な変異を持つプローブでも、正常−変異2重鎖の不安定化作用により正常配列にハイブリダイズしない(Ikuta,S.et al.,Nucleic Acids Research,15:797−811(1987))。
【0064】
ASOハイブリダイゼーションプローブは二つの基本的要求を満たさなければならない。(Current Protocols in Human Genetics,section 9.4,(1995))。先ず、同じプールで共に使用されるプローブは、ほぼ同じ長さを持たなければならない。プローブの標準的長さは、最適として17塩基対であり、その範囲は、短い方は約14、長い方は約27であってもよい。突然変異体が長い挿入体を含む場合、より長いプローブが望ましい場合もある。第2に、不適合領域は、17塩基対プローブの末端に置いてはならず、配列の真ん中、プローブの5′末端から約5−7塩基離れた位置に置かなければならない。さらに、不適合の設置は、比較的長いプローブの場合、末端ではなく、ポリヌクレオチド鎖の強力なハイブリダイゼーションおよび安定化を可能とする位置としなければならない。プローブの塩基組成における変動作用を抑えるために、ASOハイブリッドバッファーの場合(Shuber,T.,米国特許第5,633,134号)のようにテトラメチルアンモニウムクロリドを使用する。ASOプローブは、DNA合成機で合成すると好都合である。プローブは、当業者に馴染みの手段を用いて、同位元素、または非同位元素による検出剤によって標識することが可能である。本出願において略述される、プローブ製造および使用工程は、他の遺伝子配列に対しても応用可能である。
【0065】
ドットブロット、反転ドットブロット、多重方式、およびMASDA方式において使用が可能な好適な材料は、従来技術で既知であるが、ナイロン、およびニトロセルロース膜が挙げられるが、ただしこれらに限定されない。
【0066】
標的配列がPCR増幅によって生産される場合、開始材料は、染色体DNAであってもよい。その場合、そのDNAが直接増幅される。それとは別に、開始材料はmRNAであってもよい。その場合、mRNAは先ず逆転写されてcDNAとし、次に、これが、RT−PCRの既知の技術に従って増幅される(例えば、Gelfand et al.による米国特許第5,561,058号を参照されたい)。
【0067】
前述の方法は、少数の配列変動について中等度のスクリーニングをするのに好適である。しかしながら、高速で、コスト効率的で、大規模なスクリーニングのための分子技術における要求の下に、ASOの基本概念を統合する技術が開発されたが、突然変異体検出およびサンプル数の容量をはるかに上回る。前述の方法に代わるこれら別法としては、チップアレイ配列系技術が挙げられるが、ただしこれのみに限定されない。大規模アレイの使用は、沢山の配列変異の高速分析を可能とする。チップアレイの応用および開発に関する総覧が、Southern,E.M.,Trends In Genetics,12:110−115(1996年3月)、およびCheng et al.,Molecular Diagnosis,1:183−200(1996年9月)によって提出されている。チップアレイの製造に関してはいくつかの方法が存在する。相違としては、固定オリゴヌクレオチドを付着させる固相支持体のタイプ、変異特定用標識技術、および、プローブに対する標的ポリヌクレオチドの配列関連技術における変化が挙げられるが、ただしこれらに限定されない。
【0068】
「DNAチップ」による大規模分析のための有望な方法論が、Hacia et al.,Nature Genetics,14:441−447(1996)に詳細に記載される。なお、この文書の全体を引用することにより本明細書に含める。Hacia等によって記載されるところでは、それぞれが20ヌクレオチド長の、96,000超のオリゴヌクレオチドから成る高密度アレイが、光指示化学合成を用いて、単一のガラスまたはシリコンチップの上に固定される。オリゴヌクレオチドプローブの数と設計に応じて、配列の中の各塩基に対し変化の有無について尋問することが可能である。従って、チップに与えられたオリゴヌクレオチドは、集団においてこれまで見られたことがなかった配列変異をも含むことが可能であり、あるいは、集団の中で起こることが知られている突然変異のみに限定することも可能である。
【0069】
チップ上に置かれたオリゴヌクレオチドプローブとのハイブリダイゼーション前に、試験サンプルは、当業者にはよく知られた手段によって、分離され、増幅され、標識(例えば、蛍光マーカー)される。次に、試験サンプルは、固定されたオリゴヌクレオチドにハイブリダイズさせられる。固定プローブに対する、標的ポリヌクレオチドの配列系技術の強度を定量し、参照配列と比較する。得られた遺伝情報は、分子診断に使用することが可能である。
【0070】
本発明のもう一つの実施態様では、癌の再発、または、肺癌の再発を見た被験体の基礎原因を診断するための方法であって、被験体の標的核酸配列を、該配列の増幅後、配列決定することを含む方法が提供される。EGFR遺伝子、またはその断片がクローンされ、次いで配列決定されて、突然変異の有無が判断される。この状況では、得られた配列を、天然の(野生型)EGFR遺伝子、またはその一部と比較すればよいだけである。
【0071】
他のDNA配列決定法、例えば、Sanger et al,Proc.Natul.Acad.Sci.USA,74:5463(1977)、またはMaxam et al,Proc.Natl.Acad.Sci.USA,74:560(1977)、または他の、従来技術で既知の方法を用いてもよい。
【0072】
本発明の、もう一つの実施態様では、癌の再発を見た被験体から得たサンプルの標的核酸を、本発明の突然変異体の存在を検出し、突然変異体を検出する試薬に接触させることを含む方法を提供する。
【0073】
もう一つの方法は、被験体から得たサンプルの標的核酸を、突然変異体の存在を検出し、突然変異体を検出する試薬に接触させることを含む。当業者には、いくつかのハイブリダイゼーション法がよく知られる。その多くは、本発明の実行に有用である。
【0074】
本発明の方法に使用される材料は、診断キットの作製に理想的に好適である。そのようなキットは、それぞれ、本法で使用される独立要素の一つ以上を含む、瓶、チューブ等のような、1種以上の容器手段をしっかりと緊密に含む搬送手段を含んでもよい。例えば、容器手段の一つは、EGFR DNAまたはその断片を増幅するための手段を含み、該手段は、被験体から得た前記標的DNAを増幅するために必要な、酵素(単複)およびオリゴヌクレオチドプライマーを含むようになっていてもよい。もう一つの容器は、突然変異体の有無を検出するためのオリゴヌクレオチドプローブを含んでもよい。それとは別に、もう一つの容器は、突然変異配列は認識するが、野生型は認識しない、またはその逆の制限酵素を含んでもよい。
【0075】
他の方法は、EGFRタンパクのEGFR T790M形を特異的に検出するが、この突然変異体を含まないEFGRタンパクは検出しない抗体に、癌患者から得た癌組織サンプルを接触させることを含むことが可能である。それとは別に、癌患者の癌組織サンプルからタンパク抽出物を得て、EGFR T790M突然変異体の有無について、この突然変異体の検出には特異的であるが、この突然変異体を含まないEGFRタンパクに対しては特異的ではない抗体を用いて、ウェスタンブロット、ELISA、または、他のタンパク検出技術によって分析することが可能である。EGFR T790M突然変異を検出する抗体は、ハイブリドーマから得た抗体であってもよい。ハイブリドーマを作製するための典型的手順は下記の通りである。(a)マウスをある抗原で免疫化する;(b)免疫化されたマウスから脾臓を摘出し、適当な媒体において脾臓縣濁液を作製する;(c)縣濁脾臓細胞を、マウス骨髄細胞と融合する;(d)未融合脾臓細胞、未融合骨髄細胞、および融合細胞から成る混合物を希釈し、未融合骨髄細胞または脾臓細胞の増殖を支持しない選択性媒体において培養する;(e)ハイブリドーマを含む各容器の上清について、免疫原に対する抗体の存在に関して評価する;および、(f)所望の抗体を生産するハイブリドーマを選択し、クローンする。一旦所望のハイブリドーマが選択、クローンされたならば、それからの抗体は、所望のハイブリドーマを適正な媒体中でインビトロ媒体することによって生産される。別法として、所望のハイブリドーマを直接マウスに注入し、抗体の濃縮量を得ることも可能である[Kennett,et al.,(1981)Ed.,Monoclonal Antibodies.Hybridoma:A new dimension in biological analyses,Plenum Press,New York]。げっ歯類脾臓細胞とげっ歯類骨髄細胞との融合によって生産されるハイブリドーマについては、文献中に、Kohler et al.,によって
Eur. J. Immunol.6,511−519(1976)において;Milstein et al.によってNature,266,550(1977)において;および、WalshによってNature,266,550(1977)に;WalshによってNature,266,495(1977)に記載される。本技術はまた、Herzenberg and Milsteinによって、Handbook on Experimental Immunology,ed.Weir(Blackwell
Scientific,London),1979,pages25.1−25.7、および、Kennett et al.,上記によってやや詳細に記述されている。ハイ
ブリドーマ技術によって生産される、ヒト腫瘍に対するモノクロナール抗体に関連する特許としては、米国特許第4,182,124および4,196,265号が挙げられる。癌細胞上の抗原に対して特異性を持つモノクロナール抗体に関する従来技術の代表的なものとして米国特許第4,350,683号がある。
【0076】
EGFRのチロシンキナーゼドメインにおける特異的突然変異体は、ゲフィチニブまたはエルロチニブに対する感受性と関連するが、この獲得耐性の機構についてはまだ報告されていない。他の疾患における、別のキナーゼ阻害剤イマチニブに関する類似の研究に基づき、NSCLCにおける薬剤耐性にEGFRのエキソン19および21突然変異体の関連が報告される前に、野生型EGFRキナーゼドメインの位置790におけるトレオニンからメチオニンへの単一アミノ酸置換が、この薬剤耐性をもたらすことが予測された。Thr−766をメチオニンで置換する(ACGからATG)CからTへの転移は、インビトロにおいて、野生型EGFRを背景として、ゲフィチニブ[21]、および関連キナゾリン阻害剤、PD153035[22]に対する耐性を付与することが示された。
【実施例】
【0077】
(材料および方法)
組織の調達
パラフィンブロック、細針バイオプシー、および胸水を含む組織標本は、Memorial Sloan−Kettering Cancer Centerのセンター内査察委員会によって承認されたプロトコールに従って得られた(プロトコール92−055[7]およびプロトコール04−103[プロトコール S1])。患者は全てインフォームドコンセントを提出した。
【0078】
肺腫瘍におけるEGFRおよびKRASの突然変異分析
腫瘍標本からゲノムDNAを抽出し、EGFR(エキソン18−24)およびKRAS2(エキソン2)分析のためのプライマーは既報の通りとした[3,7]。配列決定反応は全て、順行および逆行方向に行い、突然変異は全て、独立のPCR分離体から少なくとも2回確認した。
【0079】
さらにエキソン20突然変異(T790M)は、毛細管電気泳動装置(ABI3100
Avant,Applied Biosystems,Foster City,カリフォルニア州、アメリカ合衆国)において、T790M突然変異(2369C→T)によって形成される新規NIaIII制限部位に基づく蛍光標識(FAM)PCR産物の長さ分析によって検出した。下記のプライマーを用いた。
【0080】
EGFR Ex20F,5′−FAM−CTCCCTCCAGGAAGCCTACGTTGAT−3′(配列番号4)、および、
EGFR Ex20R 5′−TTTGCGATCTGCACACACCA−3′(配列番号5)。
較正のためにNSCLC細胞系統(H1975,L858R−およびT790M−陽性;H−2030,EGFR野生型)の連続混合希釈液を用いたところ、このアッセイでは、H1975 DNAが、試験される全体DNAの3%以上を含む時、T790M突然変異の存在が検出される。一方、直接の配列決定の感度は6%であった(データ示さず)。ただし、H1975細胞において、T790M突然変異を含む対立遺伝子は約2倍に増幅されている。
【0081】
エキソンを含むEGFR cDNA断片を生成するために下記のプライマーを用いた。
【0082】
EGFR2095F 5′−CCCAACCAAGCTCTCTTGAG−3′(配列番号6)、および、
EGFR2943R 5′−ATGACAAGGTAGCGCTGGGGG−3′(配列番号7)
EGGR2095FおよびEGFR2943Rによって標的とされる配列は、表1の下線をつけて示されたところである。PCR産物は、TOPO TAクローニングキット(Invitrogen,Carlsbad,カリフォルニア州、米国)を用い、メーカーの指示に従って連結され、プラスミドに挿入された。個々のクローンのDNAの自動分注標本を、クローニングベクターのT7プライム部位を用いて配列決定した。
【0083】
EGFR突然変異の機能分析
部位指向性突然変異クイック発生キット(Stratagen,ラホヤ、カリフォルニア州、米国)を用い、野生型およびEGFR突然変異の全長cDNAの中に突然変異を導入し、既述のように発現ベクターにクローンした[3]。欠失(del)L747−E749;A750P突然変異を生成するために下記のプライマーを用いた。
【0084】
順行 5′−TAAAATTCCCGTCGCTATCAAGGAGCCAACATCTCCGAAAGCCAACAAGG−3′(配列番号8)、および、
逆行 5′−CCTTGTTGGCTTTCGGAGATGTTGGCTCCTTGATAGCGACGGGAATTTTA−3′(配列番号9)
T790M突然変異を導入するために下記のプライマーを用いた。
【0085】
順行 5′−AGCTCATCATGCAGCTCAT−3′(配列番号10)、および、
逆行 5′−ATGAGCTGCATGATGAGCT−3′(配列番号11)
L858R突然変異cDNAは前もって作製しておいた[3]。突然変異クローンは全て、さらに余分の突然変異が導入されていないことを確かめるために、再度、両方向から完全に配列決定した。各種EGFRは、既報[3]通りに、293Tヒト胎生腎臓細胞において一過性に発現させた。細胞を、様々の濃度のゲフィチニブまたはエルロチニブによって処理した。
【0086】
免疫ブロット法
細胞溶解、イムノブロッティング、および抗体試薬に関する詳細については、[3]の中の、方法および補足的方法を参照されたい。
【0087】
細胞培養
NSCLC細胞系統H1650、H1975、H2030、H2347、H2444、H358、およびH1734は、米国基準菌株保存機関(Manassas,バージニア州、米国)から購入した。H3255は、B.JohnsonおよびP.Janeの寄贈によるものである。細胞は、10%ウシ胎児血清、10単位/mlのペニシリン、および10μg/mlのストレプトマイシンを添加した、完全培養液(RPMI−1640、米国基準菌株保存機関カタログ番号30−2001)において37℃で5%CO2下に培養した。生存率実験では、完全培養液で培養した細胞を、黒色96ウェル底部透明ViewPlate(PerkinElmer,Wellesley,マサチューセッツ州、米国)に、ウェル当たり5,000個細胞(H1975およびH2030)、または7,500個(H3255)の密度で撒いた。一晩のインキュベーション後、細胞を、0.1%血清添加RPMI−1640培養液で24時間培養した。次に、細胞(0.1%血清を含む補充RPMI−1640培養液)を、ゲフィチニブまたはエルロチニブの連続共存下48時間インキュベートした。
【0088】
生存率アッセイ
細胞生存率は、Calcein AM(Calceinのアセトキシメチルエステル、Molecular Probes,オレゴン州、米国)を用いて定量した。ゲフィチニブまたはエルロチニブと一緒にインキュベーションした後、単層をPBS(カルシウムとマグネシウムを含む)で2度洗浄し、補充RPMI−164(血清無し)において7.5μmolのCalcein AMと30分インキュベートした。標識媒体を除去し、細胞を3度PBSで洗浄した。直後に、Calcein蛍光(485nm励起;535nM発射)を、Victor V多数標識プレートリーダー(PerkinElmer)を用いて検出した。各細胞系統について3回の独立実験を行った。各実験は、条件当たり4から8回の複製を含んでいた。
【0089】
抗EGFR突然変異モノクロナールおよびポリクロナール抗体の産生
1群3匹から成る雌性Balb/cマウス(Charles River Breeding Laboratories,Wilmington,マサチューセッツ州)に、100ulのDetoxアジュバント(RIBI ImmunoChem Res Inc,Hamilton、ミズーリ州)に溶解した、T790M突然変異を含む、精製された短縮型EGFRタンパクまたはその断片を5ug/用量で、0、3、7、10、および14日目に腹腔注入した。17日目に動物を屠殺し、その脾臓を取り出し、既定の手順(米国特許第5,939,269および5,658,791号を参照、なお、これらの特許文書を引用することにより本明細書に含める)に従って、50%ポリエチレングリコール4000を用いて、リンパ球をマウス骨髄細胞系統653と融合させた。融合細胞を、96ウェルのマイクロタイタープレートに、ウェル当たり2×105細胞の密度で撒き、次いで、融合後1日目にHAT選択を行った。次に、固定されたハイブリドーマ培養体の上清を、ビオチニル化EGFR T790M突然変異と反応させた。抗EGFR抗体に関して陽性のウェルを、その後の実験のためにさらに拡充しておいた。拡充してもこれらの培養体は安定であり、細胞系統は冷凍保存した。親培養体は各異性体に分け、次に、それらの、EGFR T790M突然変異を捕捉し、特異的に認識する能力について定量した。
【0090】
別法として、精製した突然変異タンパクペプチドに対して、ウサギポリクロナール抗血清を作った。EGFR T790M突然変異に対するポリクロナール抗体は、前記ペプチドを、0.05%グルタルアルデヒドと共にフロイントの完全アジュバントに乳化させたキーホールリンペット・ヘモシアニンに結合させ、数箇所の皮下に注入することによって得た。フロイントの不完全アジュバントに乳化させた結合ペプチドによって4および7週後に追加免疫し、最後の注入の10日後に瀉血した。
【0091】
前述の手順に従って調製された抗体を、従来技術、例えば、米国特許第5,601,989、5,563,247、5,610,276、および5,405,941号で既知の標準的手順に従って、EGFR T790M突然変異の発現および/または治療可能性に関して、腫瘍細胞を特定および/または診断(すなわち、癌組織の超薄切切片)するために使用する。なお、前記特許文書を、参照を通じて本明細書に含める。EGFR T790M突然変異の発現の監視にもこの同じ抗体を用いた。
【0092】
(実施例1)
EGFR T790M突然変異の存在を確認するために、対立遺伝子特異的オリゴヌクレオチドPCRアッセイ(Guo,Z.,Liu,Q.& Smith,L.M.Enhanced discrimination of single nucleotide polymorphisms by artificial mismatch hybridization.Nat.Biotechnol.15,331−335(1997))を、3′末端および3−ニトロピロール残基を含む、一塩基ミスマッチPCRプライマーを用いて突然変異対立遺伝子を増幅することによって実行する。PCR産物を、下記の3′突然変異対立遺伝子特異的プライマーによって形成する。
【0093】
(5′CACCGTGCAGCTCATCAT3′(配列番号12)
または、
5′CGAAGGGCATGAGCTGCG3′(配列番号13))
は、3′末端において突然変異塩基に対する相補体を、3′末端の上流に3−ニトロピロール残基を含む。この突然変異対立遺伝子特異的プライマーは、凍結またはパラフィン包埋腫瘍から得られた突然変異DNAを増幅することはできるが、正常DNAの産物を増幅することはできない。同時に、野生型(WT)3′プライマー
(5′CACCGTGCAGCTCATCAC3′(配列番号14)
または、
5′CGAAGGGCATGAGCTGCA3′(配列番号15)
は、正常な野生型DNAのみは増幅するが、突然変異DNAは増幅できない。これらの実験から、腫瘍サンプルでは突然変異対立遺伝子が増幅されるが、一方、正常な隣接組織では対立遺伝子は増幅されないことが示された。
【0094】
(実施例2 EGTR T790M突然変異のクローン起源)
任意のサンプルにおける腫瘍細胞の相対的パーセンテージを上げる試みとして、腫瘍の、注意深いマイクロディセクションを行ったところ、T:C対立遺伝子の比は比例的に増加する。実施例1に記載したプライマーの一方、および、反対方向に増幅するもう一つのプライマーを用いてPCRを実行し、その存在を求めるのが変異型であれ野生型であれ、EGFR配列に関して簡単に検出可能な断片が得られた。このようなプライマーの配列は、当業者によって簡単に設計することが可能である。この工程の結果から、EGFR T790M突然変異は、クローン起源であることが証明された。
【0095】
(実施例3 ゲノムDNAにおけるEGFR T790Mの存在に関するアッセイ)
EGFR T790M突然変異の検出用として、突然変異コドンにおける制限部位の有無を認識するために制限酵素NlaIIIが用いられる方法が提供される。この実施例では、エキソン20のイントロン−エキソン境界に跨るプライマーを用いるアッセイが提供される。この蛍光による検出は、特異的ミスセンス突然変異によって生成される、PCR制限断片長多型(PCR−RFLP)を利用する。ヌクレオチド2369に跨る、エキソン20特異的プライマーEGFR Ex20F(配列番号4)およびEGFR Ex20R(配列番号5)(表4の下線部分)を用いてPCR増幅を実行する。表4は、表3(配列番号3)に示す配列において、位置161904から162970までの比較的長いイントロン−エキソン20−イントロンゲノム配列の一部を含む。エキソン20の上流のイントロンの3′末端をゴシック体で示す。
【0096】
【化4】

野生型配列は、特異的NlaIII部位を含み、そのため、消化されると、106bpの産物を生成する(方法、図3A参照)。突然変異T2369ヌクレオチドの存在は、新規NlaIII制限消化部位を創成し、やや短い産物を生成する(96bp、図3A)。これは、蛍光毛細管電気泳動によって簡単に検出される。この試験は、直接の配列決定よりも約2倍感度が高い。この標識断片長アッセイでは、2369対立遺伝子の一方(野生型または突然変異)を切断するが、他方は切断しないものであれば、いずれの等価的手段であっても有用であると考えられる。このアッセイは、任意の既知の方法に適用が可能であるが、得られた断片が検出可能となるように、PCRアンプリコンに標識を組み込むことを要求する。
【0097】
(実施例4 症例報告)
その病気が、ゲフィチニブまたはエルロチニブの治療中に進行した、6名の個人の3人において二次的EGFR突然変異を特定した(表5)。これら3名の患者の簡単な既往歴を下記に掲げる。
【0098】
患者1
この63歳の女性「禁煙家」(彼女の生涯で吸った煙草は100本未満)は、最初、胸郭両側の瀰漫性陰影、および右側胸水を提示した。経気管支バイオプシーによって腺癌が明らかにされた。2サイクルの全身化学療法の最中に病気は進行し、その後、毎日250mgのゲフィチニブを始めた。ゲフィチニブ開始前に得られた胸部X線(図4A,左パネル)と2週間後(図4A、中央パネル)のものを比較すると、著明な改善が認められた。9ヶ月後、胸部X線によって病気の進行が明らかにされた(図4A、右パネル)。その後、患者に、コンピュータ断層撮影(CT)の下で右肺基部の領域においてバイオプシーを行った(5A、左パネル)。化学療法と組み合わせて、または毎日500mg投与のいずれかを用いた、ゲフィチニブによる連続治療にも拘わらず、ゲフィチニブ治療開始後12ヶ月で胸水滲出が再発した(図5A、右パネル)。分子分析のために胸水を入手した。合計すると、この患者から、分析のために3個の腫瘍標本が得られた。最初の肺腫瘍バイオプシー、進行性肺病巣のバイオプシー、および胸水である。しかしながら、最初の経気管支バイオプシーを再検査したところ、標本は僅かな腫瘍細胞しか有しないことが判明した(表5)。
【0099】
患者2
毎年9箱という喫煙歴を持つこの55歳の婦人は、局所的侵襲を持つ気管支・肺胞癌のために、2年間に2回の摘出手術(右下葉および左上葉摘出術)を受けた。2年後、彼女の病気は、両側肺小結節を伴って再発し、全身化学治療中にもさらに進行した。その後、患者に毎日150mgのエルロチニブを始めた。胸部の基礎的CTにおいて、両側に無数の結節が認められた(図4B、左パネル)。これらの結節は、治療後4ヶ月でその数およびサイズが著明に減少した(図4B、中央パネル)。治療14ヶ月後、疲弊のため、患者のエルロチニブ用量を毎日100mgに減らした。エルロチニブによる治療の23ヶ月目に、CTスキャンを撮ったところ、胸椎に、拡大しつつある硬化病巣が認められた。この病巣について、CT誘導バイオプシーを行い(図5B,左パネル)、エルロチニブ用量を毎日150mgに増した。治療25ヶ月後、病気は肺内で進行した(図4B、右パネル)。エルロチニブを中断し、肺の進行性病巣部位においてX線透視誘導コアニードルバイオプシーを行った(図5B、右パネル)。合計すると、この患者から、分析のために3個の腫瘍標本が得られた。最初の、切除された肺腫瘍、拡大する脊椎病巣のバイオプシー、および進行性肺腫瘍のバイオプシーである(表5)。
【0100】
患者3
この55歳の女性「禁煙家」は、その左下葉、胸膜、および縦隔リンパ節を侵す、気管支・肺胞癌の特徴を持つ腺癌のため、ほぼ4.5年間、週に1度パクリタキセルおよびトラスツズマブ[17]による治療を受けた。治療は疲弊により中断された。その後、患者は摘出手術を受けた。多数の縦隔リンパ結節の転移的侵襲、およびゲフィチニブに対する反応を予測させる、当時知られた臨床的特徴(女性、禁煙家、気管支・肺胞変異組織学的所見)のため、彼女に対して、1ヵ月後、「補足的」ゲフィチニブ投与を行った(図4C、左パネル)。この薬剤は、彼女が新たに左側に悪性の胸水滲出を発症した3ヶ月後に中断した。ドレーン排出および全身化学療法にも拘わらず、胸水滲出は4ヶ月後再発し(図4C、右パネル)、その時点で分析のために胸水を採取した。合計すると、この患者から、分析のために2個の腫瘍標本が得られた。摘出手術によって得られた腫瘍、および胸水である(表5)。
【0101】
【化5】

(実施例5 患者の腫瘍は、EGFRチロシンキナーゼ阻害剤に対する感受性と関連するEGFRチロシンキナーゼドメイン突然変異を含む)
我々は、実施例1に記載の3名の患者から得た利用可能な腫瘍サンプル全てについて、前述の薬剤感受性EGFR突然変異に関して、エキソン19および21を直接DNA配列決定する[3]ことによってスクリーニングした。患者1からの腫瘍サンプルは、ヌクレオチド2573においてT→G変化を示し、薬剤反応性腫瘍に一般的に観察されるエキソン21のL858Rアミノ酸置換をもたらした。この突然変異は、進行性肺病巣(図6A、上方パネル;表5)、および胸水浸出液の細胞(図6A,下方パネル;表5)から得られたバイオプシー試料の中に存在していた。この試料のいずれも、細胞病理学的検査をしたところ、大部分腫瘍細胞から成っていた(表5)。興味あることに、トレースの比較から、突然変異対立遺伝子のコピー数の増加が起こったことが示唆されたことである。具体的に言うと、位置2573における、野生型(ヌクレオチドT)ピークの、突然変異(ヌクレオチドG)ピークに対する比は、肺バイオプシー標本(図6A、上方パネル)では約1:1または1:2であるのに対し、胸水細胞は、突然変異Gピークが優勢であることを示した(図6A、下方パネル)。これと一致して、ヌクレオチド2361に認められた一塩基多型(SNP)(AまたはG)も、A:Gの比に対応的変化を示した。すなわち、経気管支バイオプシーでは1:1比であったものが、胸水ではほぼ5:1比となった(図7A)。注目すべきことに、我々は、最初の経気管支バイオプシー標本では2573T→G突然変異を検出しなかった(表5、データ示さず)。前述したように、この後者の標本は僅かな腫瘍細胞しか含まず、恐らく、直接配列決定によってEGFR突然変異を検出するのに必要なレベルよりもさらに低い数であろうと思われた([7]参照)。
【0102】
最初の肺腫瘍および、骨および肺から得た2個の転移サンプルを含む、患者2の3個の標本は全て、11ヌクレオチド(2238−2248)の排除、および2個のヌクレオチドGおよびCの挿入を含むエキソン19の欠失を示した(図6B、全パネル;表5)。これらのヌクレオチド変化は、アミノ酸L747−E749を欠失させ、アミノ酸750をアラニンからプロリン(A750P)へと変えた。del L747−E749;A750P突然変異は、異なる様々なヌクレオチド変化を伴ってではあるが、以前にも報告された[2]。患者2の全てのサンプルにおいて、野生型配列は、約3:1の比で突然変異配列を上回っていた。
【0103】
患者3からの利用可能サンプルの両方とも、エキソン19において15ヌクレオチド(2236−2250)の欠失を含んでおり(表5;データ示さず)、これは、5個のアミノ酸(del E746−A750)の除去をもたらした。この特異的欠失は既に報告されている[3]。突然変異ピーク対野生型ピークの比は、両標本において約1:1であった(データ示さず)。
【0104】
以上まとめると、これらの結果は、3名の患者の腫瘍は全て、チロシンキナーゼ阻害剤ゲフィチニブおよびエルロチニブに対する感受性と関連するEGFR突然変異を含むことを示す。さらに、これらのデータは、個々の患者内において、脊椎、肺、および胸水に対する転移病巣または再発病巣も同じ突然変異を含むことを示す。この後の方の所見は、個人における再発および転移腫瘍細胞は、元々の先祖クローンに由来するとする考えを支持する。
【0105】
(実施例6 ゲフィチニブまたはエルロチニブの治療中に進行した病巣において、EGFRキナーゼドメインに二次ミスセンス突然変異が検出された)
これらの患者において、EGFRキナーゼドメインにおけるさらに別の突然変異が病気の進行に関連するのかどうかを決定するために、我々は、手元の腫瘍標本のEGFR触媒領域をコードするエキソン(18から24まで)全てについて直接的配列決定を行った。
【0106】
腫瘍細胞を僅かしか含んでいない、患者1のゲフィチニブ治療前標本を分析したところ、当然のことながら野生型EGFR配列しか認められなかった(表5、データ図示せず)。しかしながら、ゲフィチニブ治療中の病気進行後に得られた、この患者の肺バイオプシー標本について順方向および逆方向におけるエキソン20配列クロマトグラムを注意深く分析したところ、ヌクレオチド2369において、C→T突然変異を示唆する新たな小型ピークが明らかにされた(図7A、上方パネル;表5)。このヌクレオチド変化は、位置790においてトレオニンの代わりとしてメチオニンの置換のもたらす(T790M)。この2369C→T突然変異は、ゲフィチニブ治療時にさらに病気が進行した後に得られた患者の胸水細胞ではさらに顕著なものとなった(図7A,下方パネル;表5)。肺標本および胸水の分析から得られた、突然変異ピークの、野生型ピークに対する比の増加は、ヌクレオチド2573における突然変異Gピーク(L858Rをもたらす)の、野生型ピークに対する比の増加(上記参照;図6A)と平行するのみならず、位置2361におけるA:G SNPの比の増加(図7A)とも平行した。これらの所見は、エキソン20 T790M突然変異は、エキソン21 L858R突然変異と同じ対立遺伝子の上に載っていること、および、これらの突然変異を抱える細胞のサブクローンが、薬剤治療中に出現することを意味する。
【0107】
患者2では、エルロチニブによる治療前に得られた腫瘍頻発サンプルは、EGFRチロシンキナーゼドメインをコードするエキソンにおいて新たな突然変異を全く含んでいなかった(図7B、上方パネル;表5)。一方、患者の進行性骨および肺病巣は、ヌクレオチド2369において新たな小型ピークを含んでいた。これは、患者1で観察されたものと同じC→T突然変異を持つ腫瘍細胞サブクローンの存在を示唆する(図7B、中央および下方パネル;表5)。この後の二つのサンプルで見られる2369T突然変異の相対的大きさは、エキソン19欠失の対応ピークの相対的大きさと相関するように見えた(図6B)。興味あることに、ヌクレオチド2361におけるSNP(AまたはG)は、患者2の標本において、エルロチニブ治療前には検出されたが、治療後には検出されなかった。これは、一方のEGFR対立遺伝子が、治療の進行中に、増幅または欠失を経過したことを示唆する(図6B)。
【0108】
患者3は、患者2と類似の結果を示した。腫瘍頻発の治療前標本は、del E746−A450エキソン19欠失以外のEGFR突然変異を示さなかった。具体的に言うと、エキソン20では、二次変化は全く検出されなかった(図7C,上方パネル;表5)。ゲフィチニブ治療後に発症した胸水滲出液の細胞のDNAを分析したところ、エキソン20のヌクレオチド2369においてC→T突然変異が明らかにされた(図7C,下方パネル;表5)。これは、前述のT790M突然変異に対応する。位置2361のA:G SNPの比において、この二つのサンプルの間に目覚しい変化は無かった。突然変異2369Tピークは小さかった。これは恐らく、この患者では、ゲフィチニブが、4ヶ月で、すなわち胸水腫瘍細胞が採取された時点で中断されたため、T790M突然変異を抱える細胞に対し選択的優位性が付与されなかったためであろう。
【0109】
2369C→T突然変異が、従来見過ごされていて、NSCLCでこの度見出されたEGFR突然変異かどうかを決めるために、我々は、全て、EGFRチロシンキナーゼ阻害剤による治療前に患者から摘出した、96種の新鮮凍結腫瘍摘出標本[3]、および59種のパラフィン包埋腫瘍標本[7]の分析から得られた、エキソン20の配列トレースを再検査した。我々は、これら155個の腫瘍においてT790M突然変異の兆候を全く検出しなかった(データ示さず)。以上まとめると、我々の結果は、T790M突然変異は、ゲフィチニブまたはエルロチニブによる治療中に進行する病巣と相関することを示唆する。さらに、少なくとも患者1および2では、この突然変異を帯びる腫瘍細胞のサブクローンが、チロシンキナーゼ阻害剤による治療開始時点と、薬剤耐性の出現の間において現れるものと考えられる。
【0110】
さらに、前述のT790M突然変異を有する3名の患者についてさらに詳細に特徴解明を行った後、別の4名の患者が、イレッサまたはタルセバに対して耐性を発達させた後、T790M突然変異を有することが判明した。これら4名は、治療に対し最初は反応したが、その後再発した、合計13名の患者に含まれる。表6は結果を要約する(表は、治療に全く反応せず、その後T790Mを有することが判明した患者のデータを含まない)。
【0111】
【化6】

肺腺癌患者で、ゲフィチニブまたはエルロチニブによる治療で改善したが、その後進行した7名の患者(その症例報告は本明細書では提示されない)において、我々は、病気進行時に得られた腫瘍標本のDNAを調べた。7名全ての患者において、我々は、薬剤感受性に関連するEGFR突然変異(全てエキソン19の欠失)を認めた。しかしながら、EGFRのエキソン18から24において、位置2369におけるC→T変化を含め、さらに別の突然変異はまったく認められなかった(データ示さず)。これらの結果は、獲得薬剤耐性に関しては、さらに別の機構が存在することを意味する。
【0112】
(実施例7 患者の進行性腫瘍は、KRAS突然変異を欠く)
NSCLCの約4分の1において、KRAS2のエキソン2に突然変異が出現する。このような突然変異は、仮にあったとしても、EFGR突然変異に相伴うことはめったになく、ゲフィチニブまたはエルロチニブに対する一次耐性と関連する[7]。KRASの二次突然変異が、これらの薬剤に対する獲得耐性を付与するかもしれない可能性を評価するために、我々は、患者1から3を始めとして、T790M突然変異の兆候を欠く3名の新たな患者についても、その腫瘍標本のKRAS2エキソン2について突然変異プロファイリングを実施した。これらの標本のいずれも、KRASにおいて全く変化を含まなかった(表5;および、データ示さず)。これは、これらの6名の患者において、KRAS突然変異は、薬剤耐性および腫瘍進行には関与しないことを示す。
【0113】
(実施例8 NSCLC恒久細胞系統も、T790MとL858Rの両突然変異を含む)
我々は、8種のNSCLC恒久細胞系統において、EGFRチロシンキナーゼ(エキソン18から24)およびKRASエキソン2のプロファイリングを行った(表7)。驚くべきことに、一つの細胞系統−H1975−は、位置2369において、前述のものと同じC→T突然変異(T790M)を含んでいた(図7D、下方パネル)。この細胞系統は、以前に、他の人々によって、エキソン21に2573T→G突然変異(L858R)を含むことが示されており[18]、それを我々も確認した(図7D、上方パネル)。さらに、H1975は、野生型EGFRを帯びる他の肺癌細胞系統よりも、ゲフィチニブ抑制に対してより高い感受性を持つことが報告されている[18]。この報告された実験では
、エキソン19および21しか調べなかったようである。
【0114】
【化7】

H1975の我々自身の分析(エキソン18から24)では、T790Mアミノ酸置換をもたらす突然変異2369Tピークが優勢であった。これは、野生型対立遺伝子と比較した場合の、突然変異対立遺伝子のコピー数の増加をしめす。突然変異ピークの、野生型ピークに対する比は、突然変異2573G(L858Rアミノ酸置換に対応)の、野生型ピークに対する比と同様であった(図7D、全パネル)。これは、T790MおよびL858R突然変異は、同じ増幅対立遺伝子の中に存在することを意味する。この可能性をさらに調べるために、我々は、RT−PCRを実行し、EGFRのエキソン20に跨り、エキソン19から21の配列を含むcDNAを生成した。次に、PCR産物をクローンし、個別のコロニーについてEGFR突然変異の有無について分析した。4個のクローンの4個のcDNAの配列クロマトグラムにおいて、2369C→T突然変異および2573T→G突然変異の両突然変異が認められた。これは、両突然変異が、同じ対立遺伝子に含まれることを裏付ける(データ示さず)。
【0115】
他のNSCLC細胞系統も、EFGRまたはKRAS突然変異のどちらかを帯びていたが、いずれも両方は持っていなかった(表7)。報告の通り、H3255は、L858R突然変異を含んでおり[19]、H1650は、エキソン19の欠失を含んでいた[18]。他の分析細胞系統はいずれも、EGFRチロシンキナーゼドメインをコードするエキソンにおいてさらに別の突然変異を含んではいなかった。
【0116】
(実施例9 新規PCR制限断片長多型アッセイは、T790M突然変異の有無を独立に確認する)
前述のように、エキソン20におけるT790M突然変異を示唆する突然変異ピークは、ある配列クロマトグラムでは小さかった。これらのピークが背景「ノイズ」によるものであるという可能性を排除するために、我々は、独立試験を開発することによって、特異的サンプルにおける2369C→T突然変異の存在を確認することを追求した。試験は、特異的ミスセンス突然変異によって生成されるPCR制限断片長多型(PCR−RFLP)を利用する蛍光検出アッセイに基づく。ヌクレオチド2369に跨るエキソン20特異的プライマーによるPCR増幅の後、野生型配列は、特異的NlaIII部位を含む。これは、消化されると、106−bp産物を生成する(方法;図3A参照)。突然変異2369Tヌクレオチドの存在は、新たにNlaIII制限消化部位を形成するので、やや短い産物(97bp)を生産する。これは、蛍光毛細管電気泳動によって簡単に検出される。この試験は、直接配列決定法よりも約2倍感受性が高い(方法参照;データ示さず)。
【0117】
我々は、PCR−RFLPアッセイの特異性を確かめるために、先ずH1975細胞系統(これはT790MおよびL858Rの両突然変異を含む)のDNAを用いた。予想通り、これらの細胞を分析することにより、97−および106bp−の両断片が得られた。一方、H2030(これは野生型EGFRを含む;表7)の分析は、106−bp断片のみを示した(図3A)。これらのデータは、本試験が、DNAサンプルにおいて突然変異対立遺伝子の有無を簡単に示すことが可能であることを示す。しかしながら、この試験は半定量的なものであるにすぎない。なぜなら、突然変異97−bp産物対野生型106−bp産物の比は、独立実験において約1:1から2:1まで変動するからである。
【0118】
我々は次に、T790Mアミノ酸置換に対応する、2369C→T特異的突然変異の有無について各種患者サンプルを評価するためにこのPCR−RFLPを用いた。患者1における進行性骨および肺病巣のDNAは、97−および106−bpの両断片を生産したが、元の腫瘍は生産しなかった(図3B).突然変異産物の、野生型産物に対する比は、胸水由来細胞において比較的高く、これは、エキソン20の直接配列決定で得られたクロマトグラムで見られたピークが比較的高いことと一致する(図7A参照)。同様に、患者2および3の進行性病巣から得られたDNAは、PCR−RFLPアッセイにおいて97−および106−bp断片を生成したが(図3B)、一方、治療前標本は、97−bp産物を生成しなかった。以上まとめると、独立アッセイから得られたこれらのデータからも、T790M突然変異は、3名全ての患者の進行性病巣に存在することが確認された。我々はさらに、直接配列決定によってEGFRエキソン18から24において二次突然変異を証明することができなかった、別の3名の患者において、そのいずれの標本においてもT790M突然変異を検出することができなかった(データ示さず)。
【0119】
(実施例10.EGFR突然変異の生化学的性質)
EGFRチロシンキナーゼ阻害剤に対する感受性と関連する突然変異を既に含むEGFRタンパクに対し、T790M突然変異がどのような影響を及ぼすかを定めるために、我々は、それぞれ、患者1および2に認められたエキソン21および19の突然変異をコードする特異的突然変異を、EGFR cDNAに導入した。対応するタンパク([i]L858R、およびL858RプラスT790M、[ii]del L747−E749;A750Pおよびdel L747−E749;A750PプラスT790M、および[iii]野生型EGFR、および野生型EGFRプラスT790M)を、発現ベクターによる一過性トランスフェクションを通じて、内因性EGFRレベルが極めて低い293T細胞において生産した[3]。血清無添加で、あらかじめゲフィチニブまたはエルロチニブで処理した各種細胞から得られた溶解物をイムノブロッティングによって分析した。抗EGFRモノクロナール抗体を用い、EGFR総量(t−EGFR)を定量した。サンプル当たりのタンパクの相対量のインディケータとしてアクチンを用いた。代行アッセイにおいて各種EGFRキナーゼの薬剤感受性を評価するために、我々は、t−EGFRタンパクレベルに対する、EGFR上の「自己リン酸化」Tyr−1092の相対レベルを測定する、Y1092−フォスフェート特異的抗体(すなわち、リン酸−EGFR[p−EGFR])を用いた。我々はまた、一般的抗フォスフォチロシン試薬(RC−20)を用いて、細胞タンパクの誘発されたチロシンリン酸化の総合パターンおよびレベルを評価した。
【0120】
ゲフィチニブは、チロシンリン酸化タンパクの低下(図8A)、および、p−EGFR:t−EGFR比の減少(図8B)によって示されるように、薬剤濃度の増大と共に漸増的に野生型およびL858R EGFRの活性を抑制した。一方、野生型、および、T790M突然変異を含むEGFR突然変異は、フォスフォチロシン誘発においても、p−E
GFR:t−EGFR比のいずれにおいても著明な変化を示さなかった(図8Aおよび8B)。T790突然変異を含む対応する突然変異種と比較した場合、同様の結果が、野生型およびdel E747−L747;A750P EGFRに対してエルロチニブを用いた場合にも得られた(図8C)。これらの結果は、T790M突然変異は、ゲフィチニブまたはエルロチニブの、EGFRチロシンキナーゼ活性を抑制する能力を、臨床的に薬剤感受性と相関を持つとされるEGFR突然変異(すなわち、L858R、またはエキソン19欠失)においても弱体化することを示唆する。
【0121】
(実施例11.T790MおよびL858R両突然変異を帯するNSCLC細胞系統の、ゲフィチニブまたはエルロチニブに対する耐性)
T790M突然変異の機能的結果についてさらに探求するために、我々は、Calcein AMによるアッセイを用い、ゲフィチニブまたはエルロチニブの存在下に培養された各種NSCLC細胞系統の感受性を定量した。ベヒクル対薬剤処理生細胞による、この蛍光発生エステラーゼ基質の取り込みおよび貯蔵から、各種細胞系統間における相対的細胞生存率の比較が可能である[20]。L858R突然変異を帯するが、他の、EGFR TKドメイン突然変異を含まないH3255細胞系統(表7)は、ゲフィチニブに対する治療に対して感受性を持ち、IC50は約0.01μmolであった(図9)。一方、L858RおよびT790M両突然変異(表7)を含むH1975細胞系統は、薬剤に対して約100倍感受性が低く、IC50は約1μmolであった(図9)。実際、H1975細胞の感受性は、野生型EGFR(エキソン18から24)およびKRAS突然変異を含むH2030により近似していた(図9)。まったく同様の結果がエルロチニブについても得られた(図10)。
【0122】
本発明は、その例示の実施態様を参照しながら、ここに開示され、図示されてきたわけであるが、改変、付加、および省略を含めた、全ての等価的実施態様は、明細書および特許請求の範囲に開示される、本発明の精神および範囲の中に含まれる。
【0123】
(参考文献)
【0124】
【化8】

【0125】
【化9】

【0126】
【化10】

【数1】

【数2】

【数3】

【数4】

【数5】

【数6】

【数7】

【特許請求の範囲】
【請求項1】
癌を患っているか、または癌を有することが疑われる患者において、上皮増殖因子レセプター(EGFR)のチロシンキナーゼドメインを阻害する薬剤の治療作用に対する獲得耐性の発生の予測を補助する方法であって、該癌は、EGFRのチロシンキナーゼドメイン中に、該癌の該薬剤に対する感受性を強める機能増強型体細胞突然変異を有するものであり、
該患者から得られたサンプルを試験して、上皮増殖因子レセプター(EGFR)をコードする遺伝子が、該機能増強型体細胞突然変異に加えて、EGFRのT790M変異体をコードする変異形態で存在するか否かを決定する工程
を含み、該変異形態で存在することが見出されることは、該癌が該薬剤に対して耐性になったか、または耐性になることを示す、方法。
【請求項1】
癌を患っているか、または癌を有することが疑われる患者において、上皮増殖因子レセプター(EGFR)のチロシンキナーゼドメインを阻害する薬剤の治療作用に対する獲得耐性の発生の予測を補助する方法であって、該癌は、EGFRのチロシンキナーゼドメイン中に、該癌の該薬剤に対する感受性を強める機能増強型体細胞突然変異を有するものであり、
該患者から得られたサンプルを試験して、上皮増殖因子レセプター(EGFR)をコードする遺伝子が、該機能増強型体細胞突然変異に加えて、EGFRのT790M変異体をコードする変異形態で存在するか否かを決定する工程
を含み、該変異形態で存在することが見出されることは、該癌が該薬剤に対して耐性になったか、または耐性になることを示す、方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7−1】


【図7−2】


【図8−1】


【図8−2】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6A】


【図6B】


【図7−1】


【図7−2】


【図8−1】


【図8−2】


【図9】


【図10】


【公開番号】特開2012−70746(P2012−70746A)
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−250657(P2011−250657)
【出願日】平成23年11月16日(2011.11.16)
【分割の表示】特願2007−555320(P2007−555320)の分割
【原出願日】平成18年2月13日(2006.2.13)
【出願人】(500213834)
【Fターム(参考)】
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願番号】特願2011−250657(P2011−250657)
【出願日】平成23年11月16日(2011.11.16)
【分割の表示】特願2007−555320(P2007−555320)の分割
【原出願日】平成18年2月13日(2006.2.13)
【出願人】(500213834)

【Fターム(参考)】
[ Back to top ]

