薬剤選択融合遺伝子を含む高生産性細胞の樹立のための発現ベクター
【課題】目的タンパク質遺伝子を高レベルで発現する形質転換細胞を効率的に樹立するのに効果的な発現ベクターを提供する。
【解決手段】(1)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、(2)遺伝子発現安定化エレメント、及び(3)目的タンパク質遺伝子発現カセットを少なくとも有する発現ベクター。
【解決手段】(1)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、(2)遺伝子発現安定化エレメント、及び(3)目的タンパク質遺伝子発現カセットを少なくとも有する発現ベクター。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、形質転換細胞の中から目的とするタンパク質の遺伝子を高レベルで発現する細胞を効率よく樹立するための発現ベクター、及び形質転換された高生産性細胞に関する。本発明の発現ベクターは、遺伝子工学的手法により、動物細胞、特に哺乳類動物細胞において医薬品などの有用タンパク質を生産するために有用である。
【背景技術】
【0002】
組換えタンパク質を産生する細胞を樹立する方法としては、一般に、目的タンパク質の遺伝子を発現する遺伝子構築物を宿主細胞へ遺伝子導入し、得られた形質転換細胞の中からこの遺伝子構築物が宿主細胞のゲノム上に安定導入された細胞を選別する。この際、前記遺伝子構築物に、薬剤選択マーカーとなる薬剤耐性遺伝子を目的タンパク質の遺伝子と同一プロモーター下あるいは別個のプロモーター下で発現するように挿入しておき、薬剤選択によって生き残った細胞を目的タンパク質の遺伝子が安定導入された細胞として選別する。本発明者らは、薬剤選択マーカーの発現を減弱化するmRNA不安定化配列を発明し、薬剤選択の効果を飛躍的に向上させることに成功した(特許文献1)。
【0003】
さらに、ゲノム導入部位の位置効果による発現低下を低減させるため、本発明者らは遺伝子発現安定化エレメントを発明し、高発現を長時間維持することができた。さらに、mRNA不安定化配列と遺伝子発現安定化エレメントを組み合わせることにより、その相乗効果によって、目的遺伝子を高度に発現する細胞を効率的に選択し、かつそれらの高発現細胞の安定的な維持ができた(特許文献2)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第4491808号
【特許文献2】特許第4525863号
【特許文献3】国際公開第2010/023787号
【非特許文献】
【0005】
【非特許文献1】Bakheet T,Frevel M,Williams B.R.G、 Greer W,Khabar K.S.A.(2001)Nucleic Acids Research 29:246−254
【非特許文献2】Lagnado C.A,Brown C.L,Goodall G.J.(1994) Molecular and Cellular Biology 14:7984−7995
【非特許文献3】Zubiaga A.M,Belasco J.G,Greenberg M.E.(1995) Molecular and Cellular Biology 15:2219−2230
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の目的は、動物細胞、特に哺乳類動物細胞において、組換えタンパク質の生産性の高い細胞を迅速、かつ効率よく樹立するのに効果的な発現ベクター、及び高生産性細胞を提供することにある。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するため鋭意検討した結果、mRNA不安定化配列を含む薬剤選択マーカー遺伝子、及び遺伝子発現安定化エレメントを有する発現ベクターにさらに遺伝子増幅を誘起するシステムを組み合わせることにより、これらの相乗効果によって目的タンパク質の生産量が飛躍的に向上することを見出し、本発明に至った。
【0008】
本発明の特徴は、薬剤選択マーカー遺伝子の発現カセットとジヒドロ葉酸還元酵素遺伝子の発現カセットを独立に存在させるのではなく、薬剤選択マーカー遺伝子とジヒドロ葉酸還元酵素遺伝子を1つの発現カセットで発現させたことである。
【0009】
すなわち、以下の発明が提供される。
【0010】
[1] 発現ベクター
[1−1]
下記(1)〜(3)を少なくとも有する発現ベクター。
(1)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、
(2)遺伝子発現安定化エレメント、及び
(3)目的タンパク質遺伝子発現カセット
[1−2]
下記(1)〜(3)を少なくとも有する発現ベクター
(1)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、
(2)遺伝子発現安定化エレメント、及び
(3)目的タンパク質遺伝子発現カセット
[1−3]
mRNA不安定化配列が、サイトカイン、インターロイキン、又は癌原遺伝子の3’非翻訳領域に存在するATリッチ配列に由来することを特徴とする[1−2]に記載の発現ベクター。
[1−4]
mRNA不安定化配列が、TTATTTA(A/T)(A/T)のモチーフ配列を有することを特徴とする[1−2]に記載の発現ベクター。
[1−5]
モチーフ配列が、2回以上繰り返されていることを特徴とする[1−4]に記載の発現ベクター。
[1−6]
モチーフ配列の繰り返し間に1塩基以上のスペーサー配列を含むことを特徴とする[1−5]に記載の発現ベクター。
[1−7]
mRNA不安定化配列中に1ないし数塩基の置換、挿入または欠失を含むことを特徴とする[1−3]〜[1−6]のいずれかに記載の発現ベクター。
[1−8]
遺伝子発現安定化エレメントが以下のいずれかである、[1−1]〜[1−7]のいずれかに記載の発現ベクター。
(I)配列番号15で示す配列のうち41601〜46746番目までの配列からなるDNA、もしくは41601〜46746番目までの配列の部分配列であって少なくとも41601〜42700番目までの配列を含む塩基配列からなるDNA
(II)上記(I)の配列と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ遺伝子発現安定化機能を有する塩基配列からなるDNA
(III)上記(I)または(II)の配列と相補的な塩基配列からなるDNA
[1−9]
遺伝子発現安定化エレメントを2つ以上含む、[1−1]〜[1−8]のいずれかに記載の発現ベクター。
[1−10]
薬剤選択マーカー遺伝子が、タンパク質合成阻害系抗生物質耐性遺伝子である、[1−1]〜[1−9]のいずれかに記載の発現ベクター。
[1−11]
薬剤選択マーカー遺伝子がピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼ及びネオマイシンホスホトランスフェラーゼからなる群より選択される、[1−10]に記載の発現ベクター。
[1−12]
目的タンパク質の遺伝子発現カセットが、所望の目的タンパク質遺伝子を挿入するためのマルチクローニングサイトを備えていることを特徴とする[1−1]〜[1−11]のいずれかに記載の発現ベクター。
[1−13]
目的タンパク質遺伝子が抗体の重鎖及び/または軽鎖ポリペプチド遺伝子である、[1−1]〜[1−12]のいずれかに記載の発現ベクター。
【0011】
[2] 発現カセット
[2−1]
薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット。
【0012】
[3] 高生産細胞の作製方法
[3−1]
以下の工程を含む、高生産細胞を作製する方法。
(a)[1−1]〜[1−13]のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
[3−2]
以下の工程を含む、高生産細胞を作製する方法。
(a)[1−1]〜[1−13]のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞をヒポキサンチンおよびチミジン不含培地で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
[3−3]
以下の工程を含む、高生産細胞を作製する方法。
(a)[1−1]〜[1−13]のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を、ヒポキサンチンおよびチミジンを含まず、かつ薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
[3−4]
[3−1]〜[3−3]のいずれかに記載の方法において、(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程、及び(d)高発現を示す細胞株を単離する工程を複数回繰り返す、高生産細胞を作製する方法。
[3−5]
宿主細胞が哺乳類動物細胞由来の細胞である、[3−1]〜[3−4]のいずれかに記載の高生産細胞を作製する方法。
[3−6]
宿主細胞がチャイニーズハムスター卵巣(CHO)由来の細胞である、[3−1]〜[3−4]のいずれかに記載の高生産細胞を作製する方法。
[3−7]
宿主細胞がジヒドロ葉酸還元酵素遺伝子欠損細胞である、[3−1]〜[3−4]のいずれかに記載の高生産細胞を作製する方法。
[3−8]
宿主細胞が無血清馴化された細胞である、[3−1]〜[3−4]のいずれかに記載の高生産細胞を作製する方法。
【0013】
[4]高生産細胞
[4−1]
[3−1]〜[3−7]のいずれかに記載の方法により得られた高生産細胞。
【0014】
[5]高生産細胞を用いて生産する方法
[5−1]
[3−1]〜[3−7]のいずれかに記載の方法により得られた高生産細胞を用いてポリペプチドを生産する方法。
[5−2]
[3−1]〜[3−7]のいずれかに記載の方法により得られた高生産細胞を用いて抗体を生産する方法。
[5−3]
[3−1]〜[3−7]のいずれかに記載の方法により得られた高生産細胞を用いてワクチンを生産する方法。
【発明の効果】
【0015】
本発明では、薬剤選択によって形質転換細胞を薬剤選択するとともに、細胞の培養工程中にメトトレキセート(MTX)に代表される薬剤を存在させ、遺伝子増幅を引き起こすことにより、宿主細胞に多数の遺伝子コピーを有する細胞株を作出することができる。しかしながら、発現ベクターに発現カセットを複数存在させた場合、転写干渉が生じることにより各発現カセットの発現量が低下し、各遺伝子の機能が十分に発揮されない。この転写干渉は、目的タンパク質の発現にも影響を及ぼし、全体としてタンパク質生産性の低下を招く。そこで本発明は、薬剤選択マーカー遺伝子とジヒドロ葉酸還元酵素遺伝子を隣接させ、いわゆる融合遺伝子として1つの発現カセットで発現させることにより、転写干渉を低減させて、より生産性を向上させることができる。
【0016】
本発明の別の態様においては、薬剤選択マーカー遺伝子及びジヒドロ葉酸還元酵素遺伝子を含む発現カセットにmRNA不安定化配列が挿入されているため、mRNA不安定化配列を有さない従来の薬剤選択マーカー遺伝子発現カセットに比べて薬剤選択マーカーの発現が減弱化されており、宿主細胞ゲノム内の高発現領域に組み込まれないと、薬剤存在下で形質転換細胞の生存が困難となる。このため、薬剤選択マーカー遺伝子及び目的タンパク質遺伝子が宿主細胞ゲノム内の高発現領域に組み込まれた形質転換細胞のみが薬剤選択によって生き残ることができる。また、遺伝子増幅についても、少量のMTX等の薬剤で最大の効果を得ることができる。その結果、目的タンパク質遺伝子を高レベルで発現する高発現細胞を効率的に選別することができる。
【0017】
本発明の遺伝子発現安定化エレメントにより、細胞ゲノムにおける組換えタンパク質遺伝子への隣接染色体や調節エレメントの影響を低減させて、組換えタンパク質遺伝子の遺伝子発現を安定化し、高発現を長期間維持することができる。そこで本発明は、これらの相乗効果によって、非常に高いレベルのタンパク質生産性を示す高生産細胞株を迅速、容易、且つ効率的に樹立することができる。
【0018】
すなわち本発明によれば、目的タンパク質遺伝子が宿主細胞の高発現領域に導入されている特長、高発現領域に導入された目的タンパク質遺伝子が多数の遺伝子コピーを有している特長、これらの遺伝子発現が安定している特長を有する高生産性細胞を極めて迅速、容易、且つ効率的に樹立することができる。
【図面の簡単な説明】
【0019】
【図1】pPUR・N4の構築を示す図である。以下、図中、Purとは、ピューロマイシン耐性遺伝子のことである。また、図中、iPCRとは、Inverse PCRのことである。
【図2】pEF1α−KOD3G8HC−RE2の構築を示す図である。以下、図中、Neoとは、ネオマイシン耐性遺伝子のことである。
【図3】pEF1α−SNAP26m−Pur・N4及びpEF1α−SNAP26m−Pur−RE2の構築を示す図である。
【図4】pEF1α−KOD3G8HC−1.1k/1.1kの構築を示す図である。
【図5】pEF1α−SNAP26m−Pur・N4−1.1k/1.1k、pEF1α−SNAP26m−Pur−1.1k/1.1kの構築を示す図である。
【図6】pEHXのベクターマップを示す図である。
【図7】pELXのベクターマップを示す図である。
【図8】pELX2のベクターマップを示す図である。
【図9】pEHX−dhfr・N4のベクターマップを示す図である。
【図10】pEHX−Puro・dhfr、pEHX−Puro・dhfr・N4の構築を示す図である。
【図11】pELH2−dhfr・N4(KOD3G8)の構築を示す図である。
【図12】pELH2−Puro・dhfr(KOD3G8)、pELH2−Puro・dhfr・N4(KOD3G8)の構築を示す図である。
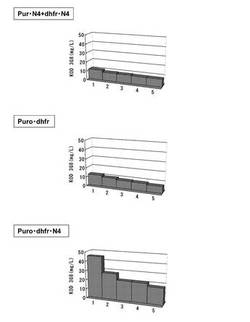
【図13】ピューロマイシン耐性遺伝子、dhfr遺伝子のそれぞれについて、下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Pur・N4+dhfr・N4)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の発現カセットを含むもの(Puro・dhfr)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Puro・dhfr・N4)、について、ポリクローンの培養上清を用いてELISAを行い算出した、抗体生産量をプロットしたグラフである。
【図14】6ウェルプレートの培養上清を用いてELISAを行い算出した、各クローンの抗体生産量をプロットしたグラフである。ピューロマイシン耐性遺伝子、dhfr遺伝子のそれぞれについて、下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Pur・N4+dhfr・N4)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の発現カセットを含むもの(Puro・dhfr)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Puro・dhfr・N4)、について、それぞれ生産量上位5クローンをプロットしている。
【図15】6ウェルプレートの培養上清を用いてELISAを行い算出した、MTXでの選択培養後のポリクローンでの抗体生産量をプロットしたグラフである。ピューロマイシン耐性遺伝子、dhfr遺伝子のそれぞれについて、下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Pur・N4+dhfr・N4)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の発現カセットを含むもの(Puro・dhfr)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Puro・dhfr・N4)、について、それぞれピューロマイシンで選択して取得した生産量上位10クローンをMTXで選択培養後に得られた細胞集団の、生産量上位5クローンの結果をプロットしている。
【図16】pEHX−dhfr・Puro・N4の構築を示す図である。
【図17】pELH2−dhfr・Puro・N4(KOD3G8)の構築を示す図である。
【図18】ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Puro・dhfr・N4)、dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(dhfr・Puro・N4)について、ポリクローンの培養上清を用いてELISAを行い算出した、抗体生産量をプロットしたグラフである。
【図19】dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(dhfr・Puro・N4)について、6ウェルプレートの培養上清を用いてELISAを行い各クローンの抗体生産量を算出し、生産量上位5クローンをプロットしたグラフである。
【図20】6ウェルプレートの培養上清を用いてELISAを行い算出した、MTXで選択後のポリクローンの細胞集団の抗体生産量をプロットしたグラフである。dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(dhfr・Puro・N4)について、ピューロマイシンで選択して取得した生産量上位10クローンをMTXで選択培養後に得られた細胞集団の、生産量上位5クローンの結果をプロットしている。
【図21】6ウェルプレートの培養上清を用いてELISAを行い算出した、ピューロマイシンで選択後の高発現株の1細胞、1日あたりの抗体生産量をプロットしたグラフである。dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(dhfr・Puro・N4)について、無血清馴化されたCHO/dhfr−細胞へ遺伝子導入し、ピューロマイシンで選択して取得した生産量上位5クローンの結果をプロットしている。
【図22】6ウェルプレートの培養上清を用いてELISAを行い算出した、MTXで選択後のポリクローンの細胞集団の1細胞、1日あたりの抗体生産量をプロットしたグラフである。dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(dhfr・Puro・N4)について、無血清馴化されたCHO/dhfr−細胞へ遺伝子導入し、ピューロマイシンで選択して取得した生産量上位10クローンをMTXで選択培養後に得られた細胞集団の、生産量上位5クローンの結果をプロットしている。
【発明を実施するための形態】
【0020】
以下に本発明を詳細に説明する。
【0021】
本発明の第一の側面によれば、(1)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、(2)遺伝子発現安定化エレメント、及び(3)目的タンパク質遺伝子発現カセットを少なくとも有することを特徴とする発現ベクターが提供される。
【0022】
本発明の第二の側面によれば、(1)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、(2)遺伝子発現安定化エレメント、及び(3)目的タンパク質遺伝子発現カセットを少なくとも有することを特徴とする発現ベクターが提供される。
【0023】
本発明において、発現カセットとは、プロモーターから遺伝子コード配列、ターミネーター配列(ポリアデニレーションシグナル)までの遺伝子発現の単位をいう。加えて、イントロン、スペーサー配列、翻訳増強領域等を含むこともある。したがって、例えば「目的タンパク質遺伝子発現カセット」という場合、前記発現カセットの遺伝子コード配列が目的とするタンパク質の遺伝子のコード配列であるものをいう。
【0024】
(薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット)
【0025】
薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットとは、薬剤選択マーカー遺伝子及びジヒドロ葉酸還元酵素遺伝子を遺伝子コード配列として含む発現カセットをいう。
【0026】
本発明の薬剤選択マーカー遺伝子を用いた薬剤選択に使用される薬剤としては、タンパク質合成阻害系抗生物質としてブラストサイジン(Blasticidin)、ジェネティシン(Geneticin)(G418)、ハイグロマイシン(Hygromycin;Hyg)、ピューロマイシン(Puromycin;Pur)が例示される。また、本発明の薬剤選択マーカー遺伝子としては、薬剤選択に一般的に使用される薬剤に対して耐性を示す遺伝子が好適に用いられる。タンパク質合成阻害系抗生物質を薬剤として用いる場合には、タンパク質合成阻害系抗生物質耐性遺伝子を用いることが好ましい。特に限定されるものではないが、ネオマイシン耐性遺伝子(ジェネティシン耐性遺伝子としての機能も有する)として、Tn5由来ネオマイシンホスホトランスフェラーゼ(aminoglycoside 3’−phosphotransferase)(Neo)、ハイグロマイシン耐性遺伝子として、E.coli由来ハイグロマイシン−B−ホスホトランスフェラーゼ(Hph、実施例および図面ではHygと記載)、ピューロマイシン耐性遺伝子として、Streptomyces由来ピューロマイシン−N−アセチルトランスフェラーゼ遺伝子(pac、実施例および図面ではPurと記載)、ブラストサイジン耐性遺伝子として、Bacillus cereus由来ブラストサイジン耐性遺伝子(bsr)などが例示される。これらの中でも、ピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼ、ネオマイシンホスホトランスフェラーゼが好ましく、より好ましくはピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼであり、さらに好ましくはピューロマイシン−N−アセチルトランスフェラーゼである。
【0027】
ジヒドロ葉酸還元酵素(DHFR/dhfr)は核酸の生合成に必須の酵素であり、dhfr遺伝子を欠損する細胞は核酸を含まない培地で生育できない。dhfr遺伝子を欠損する細胞を、dhfr遺伝子を有する発現ベクターで形質転換すると、核酸要求性が回復した形質転換体を得ることができる。
【0028】
細胞ゲノムにおいて、外から適当な圧力をかけると、特定の遺伝子の重複(増幅)が選択的に起こり安定化することが知られている。dhfr遺伝子を有する発現ベクターで形質転換された培養細胞にDHFRの拮抗阻害剤であるメトトレキセート(Methotrexate、MTX)を加えると、ほとんどの細胞は死んでしまうがごくまれに生き残るものがある。このような細胞はdhfr遺伝子のコピー数が増加しており、大量のDHFRを合成できるため、MTXに阻害されないDHFRが、細胞が生き続け増殖するのに必要なテトラヒドロ葉酸を作り出すことができる。段階的に選択を続けると、通常は1もしくは数コピーしかないdhfr遺伝子が最終的には100〜1000倍にも増幅された変異細胞を得ることができる。動物細胞において遺伝子増幅が起こる場合、選択圧をかけたdhfr遺伝子そのものだけでなく、その遺伝子の近傍に存在する他の遺伝子も同時に増幅されるので、結果として目的タンパク質遺伝子も同時に増幅される。
【0029】
本発明におけるdhfr遺伝子は公知のものを使用することができ、由来は限定されないが、マウス由来のdhfr遺伝子が好ましい。dhfr遺伝子は市販のベクターから入手することができ、pSV2−dhfr(ATCC 37146)やpOptiVEC−TOPO(登録商標)(インビトロジェン社)が例示されるが、人工合成により入手することもできる。
【0030】
薬剤選択マーカー遺伝子とdhfr遺伝子が「隣接して存在する」とは、薬剤選択マーカー遺伝子とdhfr遺伝子を融合タンパク質として発現させることを意味し、上流側の遺伝子の終止コドンを削除することで成し遂げられる。薬剤選択マーカー遺伝子とdhfr遺伝子との間は、例えばグリシン・セリンリンカー等の実質的に機能を持たない配列が存在してもよいし、配列を存在させず直接つなげてもよい。下流側の遺伝子から開始コドンのメチオニンをコードするATG配列を除去することも好ましい。
【0031】
薬剤選択マーカー遺伝子とdfhr遺伝子の配置順序はいずれでもよい。
【0032】
本発明の薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットにおけるプロモーターとしては、動物細胞、特に哺乳類細胞で発現可能なプロモーターであれば特に限定されるものではないが、ヒトやマウスのサイトメガロウイルス(CMV)プロモーター、サルウイルス40(SV40)プロモーター、ヒトヘルペス単純ウイルスのチミジンキナーゼ遺伝子(HSV−tk)プロモーター、などのウイルスに由来するものや、マウスphosphoglycerate−kinase1遺伝子(PGK)プロモーターなどの非ウイルス性の細胞遺伝子に由来するプロモーター、及び由来の異なるプロモーターのハイブリッドが挙げられる。ここで、プロモーターは、プロモーターのコア領域に限るものではなく、エンハンサー領域を含む場合もある。薬剤選択マーカーの発現を減弱化するため、転写活性が低いものがより好ましい。転写活性の低いプロモーターとして変異型のプロモーターなどを利用してもよいし、コザック配列を置換してもよい。さらに、mRNA不安定化配列のモチーフ配列の繰り返しの回数を少なくし、転写活性の弱いプロモーターを併用するのも1つの想定される実施態様である。
【0033】
本発明の薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットにおけるポリアデニレーションシグナル(ターミネーター配列)としては、SV40ウイルス由来late polyAシグナル、early polyAシグナル、HSV−tk由来polyAシグナル、ウシ成長因子遺伝子由来polyAシグナル、ウサギβ−グロビン遺伝子由来polyAシグナルなどが例示されるが、特に限定されるものではない。
【0034】
本発明の薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット中でのプロモーター、薬剤選択マーカー遺伝子及びdhfr遺伝子、並びにポリアデニレーションシグナルの配置順序は、薬剤選択マーカー遺伝子及びdhfr遺伝子の発現が可能である限り特に限定されないが、一般的にプロモーター、薬剤選択マーカー遺伝子及びdfhr遺伝子、並びにポリアデニレーションシグナルをこの順序で上流から下流に向かって配置する。これらの三つの要素は、相互に直接連結されている必要はなく、所望により、イントロン、スペーサー配列、翻訳増強領域等を間に有していてもよい。
【0035】
(薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット)
本発明で使用する発現カセットは、mRNA不安定化配列を有することを除いては、前記薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットと同様の構成を有する。そこで、mRNA不安定化配列について説明する。
【0036】
「mRNA不安定化配列」とは、この配列を有するDNAから転写されたmRNAの細胞内半減期を低減させる機能を有するヌクレオチド配列のことであり、自然界では初期応答遺伝子などに存在することが見出されている。
【0037】
mRNA不安定化配列は、いくつかの遺伝子ではコード配列中、あるいは5’UTR(非翻訳領域)に存在するものもあるが、多くは3’UTRに存在する。3’UTRに存在するmRNA不安定化配列としては、AU−rich element(ARE)、histone mRNA 3’−terminal stem−loop、iron−responsive element(IRE)、insulin−like growth factor II(IGF−II)、long stem−loopなどが知られている。これらの中でもAREは、恒常的にmRNAを不安定化できることから、本発明に用いるmRNA不安定化配列として好ましい。
【0038】
AREとは、mRNAにおける「AUが豊富なエレメント」、すなわちアデニン(A)及びウラシル(U)を高い割合で含む配列もしくは領域を意味する。またAREとは、前記エレメントをコードするDNAにおける「ATが豊富なエレメント」、すなわちアデニン(A)及びチミン(T)を高い割合で含む配列もしくは領域を指すためにも用いられる。
【0039】
AREは、造血細胞増殖因子遺伝子、成長因子遺伝子、インターロイキン遺伝子、インターフェロン等のサイトカイン遺伝子、及びいくつかの癌原遺伝子(プロトオンコジーン)などに見られる(非特許文献1)。本発明の発現カセットでは、これらの遺伝子中のAREに相当する核酸配列をそのまま利用してもよいが、ARE中のモチーフ配列として知られるTATTTAT(非特許文献2)やTTATTTA(T/A)(T/A)(非特許文献3)などを利用する方が、不要な制限酵素認識配列を発現ベクターに挿入してしまうことを避けることができ、利便性が高い。
【0040】
AREを持つ遺伝子の例としては、造血細胞増殖因子についてはGranulocyte−monocyte colony sitimulationg factor(GM−CSF),インターロイキンについてはInterleukin−1β、2,3、4、6、8、10、11、インターフェロンについてはInterferon−α、癌原遺伝子についてはc−fos,c−myc,c−jun,c−myb,Pim−1などが例示される。このほかにもTumor necrosis factor,Cyclin D1,Cyclooxygenase,Plasminogen activator inhibitor type2など多くの遺伝子がAREを持つことが知られており、例示された遺伝子に限定されない。
【0041】
本発明おいて使用することができるmRNA不安定化配列としては、下記のものが例示される。
ATTTのモチーフ配列の1ないし2回以上の繰り返し。
ATTTAのモチーフ配列の1ないし2回以上の繰り返し。
TATTTATのモチーフ配列の1ないし2回以上の繰り返し。
TTATTTA(T/A)(T/A)のモチーフ配列の1ないし2回以上の繰り返し。
(T/A)はTまたはAのいずれかである。
【0042】
これらの配列は、1ないし数塩基の置換/挿入/欠失を含んでもよく、DNAの複製の誤りや突然変異などの自然変異によるもの、人為的な変異導入によるもの等が想定される。また、モチーフ配列の繰り返し間には1〜100塩基程度のスペーサー配列またはリンカー配列を含んでもよい。加えて、モチーフ配列の逆位を含むものであってもよい。
【0043】
これらのモチーフ配列の繰り返し数は、1回でもよいが、2回以上、より好ましくは4回以上とすることにより、mRNAの不安定化効果を一層高めることができ、選別効率を顕著に増大させることができる。
【0044】
繰り返しの回数の上限は特に限定されないが、細胞へのベクターの取り込みの観点から、発現ベクターが最大10kbp〜25kbp長となるようなものが望ましい。ただし、繰り返し配列数が増えるにしたがって、mRNAの不安定化の効果は飽和に向かい、一定の繰り返し数を超えるとそれ以上の顕著な効果を望めなくなる。上限値を定めるものではないが、10回以上の繰り返し配列は実用上意味がない。
【0045】
本発明の薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット中でのプロモーター、薬剤選択マーカー遺伝子及びdhfr遺伝子、mRNA不安定化配列、並びにポリアデニレーションシグナルの配置順序は、薬剤選択マーカー遺伝子及びdhfr遺伝子の発現が可能である限り特に限定されないが、一般的にプロモーター、薬剤選択マーカー遺伝子及びdfhr遺伝子、mRNA不安定化配列、並びにポリアデニレーションシグナルをこの順序で上流から下流に向かって配置する。これらの四つの要素は、相互に直接連結されている必要はなく、所望により、イントロン、スペーサー配列、翻訳増強領域等を間に有していてもよい。
【0046】
(遺伝子発現安定化エレメント)
本発明における「遺伝子発現安定化エレメント」とは、目的タンパク質遺伝子発現カセットが宿主ゲノムに挿入された部位近傍のゲノムの転写の活性化の状況に影響を受けてしまう、という位置効果を解消し、遺伝子発現を安定化する機能を有する核酸領域を意味する。
【0047】
遺伝子発現を安定化する機能を有する核酸配列としては、インスレーター、スキャフォールド/マトリックス結合領域(S/MAR)、遺伝子座調節領域(LCR)、遍在作用性クロマチンオープニングエレメント(UCOE)などが利用できる。
【0048】
インスレーターとしては、ニワトリβ-グロビンLCRに由来する1.2kb DNaseI Hypersensitive site(cHS4),バフンウニ由来UR1などが例示される。S/MARとしては、ニワトリリゾチーム5’MARエレメント、ヒトβ−グロビンMARエレメントやヒトインターフェロンβSARエレメントなどが例示される。
【0049】
目的遺伝子を宿主細胞ゲノムへ導入するための遺伝子構築物として、プラスミドベクターが一般に用いられるが、プラスミドベクターの長さは最大10ないし25kbpであることから、遺伝子発現安定化エレメントの鎖長は出来るだけ短い方が好ましい。好ましい長さとしては5kbp以下、より好ましくは1kbp程度である。
【0050】
本発明における実施態様では、遺伝子発現安定化エレメントとして、下記(a)〜(e)のいずれか又はその組み合わせが使用できる。
【0051】
(a)配列番号15で示す配列からなるDNA;
(b)配列番号15で示す配列の部分配列からなるDNAであって、配列番号15で示す配列のうち41820番目から41839番目までの塩基で示す領域の配列を少なくとも含むDNA;
(c)配列番号15で示す配列の部分配列からなるDNAであって、配列番号15で示す配列のうち41821番目から41840番目までの塩基で示す領域の配列を少なくとも含むDNA;
(d)配列番号15で示す配列の部分配列からなるDNAであって、配列番号15で示す配列のうち45182番目から45200番目までの塩基で示す領域の配列を少なくとも含むDNA;及び
(e)配列番号15で示す配列の部分配列からなるDNAであって、配列番号15で示す配列のうち91094番目から91113番目までの塩基で示す領域の配列を少なくとも含むDNA。
【0052】
本発明の遺伝子発現安定化エレメントの好ましい態様では、前記(b)または(c)のDNAは、配列番号15で示す配列のうち41601番目から46746番目までの塩基配列で示す領域、又は配列番号15で示す配列のうち41601番目から46746番目までの配列と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ遺伝子発現安定化機能を有する塩基配列領域である。また、これらの領域からなるDNAと相補的な塩基配列も含まれる。本発明の遺伝子発現安定化エレメントのさらに好ましい態様では、前記(b)または(c)のDNAは、(1)配列番号15で示す配列のうち41601〜46746番目までの配列からなるDNA、もしくは41601〜46746番目までの配列の部分配列であって少なくとも41601〜42700番目までの配列を含む塩基配列からなるDNA、又は(2)(1)で示すDNAと相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ遺伝子発現安定化機能を有する塩基配列からなるDNAであり、又は(3)これらの領域からなるDNAと相補的な塩基配列からなるDNAである。
【0053】
これらのエレメントは、発明者らがCHOゲノム(CHO DR1000L−4N株)から単離同定したものであるが(特許文献3)、これらのエレメントと相同なエレメントは、他の哺乳類細胞ゲノムにも存在することが予想される。従って、(f)配列番号15で示す配列の部分配列からなるDNAであって、宿主細胞中で外来遺伝子発現カセットと近接するように配置された際に、外来遺伝子発現カセットに含まれる外来遺伝子から目的組換えタンパク質の発現を増大または安定化させることができるDNAも、遺伝子発現安定化エレメントとして使用することができる。このような相同エレメントは、この技術分野の周知の技術、例えば、種間ハイブリダイゼーションまたはPCRなどによって容易に単離同定されることができる。
【0054】
また、(g)前記(a)〜(f)のいずれかのDNAと相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ遺伝子発現安定化機能を有するDNAも当然、遺伝子発現安定化エレメントとして使用することができる。本発明の遺伝子発現安定化エレメントは、これらの(a)〜(g)のいずれか一つ又はそれらの任意の組合せからなる。さらに、(h)前記(a)〜(g)のいずれかのDNAと相補的な塩基配列からなるDNAも、遺伝子発現安定化機能を有し、遺伝子発現安定化エレメントとして使用することができるため、本発明に含まれる。
【0055】
ストリンジェントな条件とは、用いられるプローブ・標識方法によっても異なるが、例えば、0.1%SDSを含む0.2×SSC中40〜50℃または0.1%SDSを含む2×SSC中55〜65℃の条件下ハイブリダイズする塩基配列である。さらにストリンジェントな条件は、結合する核酸の融解温度(Tm値)に基づいて決定することができる。また、ハイブリダイズ後の洗浄条件として、「6×SSC、0.1%SDS、Tm値よりも約15〜30℃低い温度」程度の条件をあげることができる。より高いストリンジェントな条件としては「2×SSC、0.1%SDS、Tm値よりも約5〜15℃低い温度」程度、更に高いストリンジェントな条件としては「1×SSC、0.1%SDS、Tm値よりも約5〜15℃低い温度」程度の洗浄条件をあげることができる。更に高いストリンジェントな条件としては「0.1×SSC、0.1%SDS」程度の洗浄条件が例示される。
【0056】
本発明の遺伝子発現安定化エレメントがその発現安定化効果を奏するためには、エレメントが宿主細胞ゲノム中で目的タンパク質遺伝子発現カセットの導入部位に近接する位置に配置されることが必要である。本発明において、用語「近接する」とは、特に制限されるものではないが、好ましくは本発明の遺伝子発現安定化エレメントと目的タンパク質遺伝子発現カセットとの間の距離が5000bp以下、さらに好ましくは500bp以下であることを意味する。
【0057】
このような近接配置は、本発明のエレメントを含む核酸配列断片と、外来遺伝子の発現カセットを含む核酸配列断片との混合物をエレクトロポレーションやトランスフェクションなどによって宿主細胞内へ導入し、外来遺伝子の発現量の高い宿主細胞クローンを選択することによって実現することもできるが、近接配置を確実に達成させるためには、本発明の遺伝子発現安定化エレメント、及びそれに近接して配置された外来遺伝子発現カセットを含む外来遺伝子発現ベクターをあらかじめ作成しておき、この発現ベクターで宿主細胞を形質転換させることが望ましい。
【0058】
(目的タンパク質遺伝子発現カセット)
本発明における目的タンパク質遺伝子の発現カセットは、プロモーター、遺伝子コード配列、及びターミネーター配列(ポリアデニレーションシグナル)からなる。加えて、イントロンやスペーサー配列、翻訳増強領域を含むこともある。目的タンパク質遺伝子の発現プロモーターとしてはできるだけ転写活性の高いものが好ましく、ヒトやマウスのサイトメガロウイルス(CMV)プロモーター、サルウイルス40(SV40)プロモーターなどのウイルスに由来するものや、ヒトやマウス、さらにはCHO由来のElongation Factor 1(EF1α)遺伝子、ユビキチン遺伝子、β−アクチン遺伝子など、非ウイルス性の細胞遺伝子に由来するプロモーター、及び由来の異なるプロモーター/エンハンサーのハイブリッド、例えばCAGプロモーターなどが挙げられる。
【0059】
目的タンパク質遺伝子発現カセットには、該タンパク質遺伝子のコード配列の代わりに、複数の制限酵素認識配列からなるマルチクローニングサイトを配置することができる。外来遺伝子のcDNAやコード配列を導入する際に、クローニング作業が簡便であり、好ましい。
【0060】
他の実施態様としては、目的タンパク質が抗体の重鎖及び/または軽鎖のポリペプチドである、目的タンパク質遺伝子発現カセットである。この場合、目的タンパク質遺伝子の発現カセットは、複数配置してもよく、あるいは複数のポリペプチド遺伝子をIRESでつなぎ、ポリシストロン性の1つの発現カセットの形でもよい。
【0061】
(発現ベクター)
本発明において、発現ベクターとは、遺伝子工学に利用されるベクターである。発現ベクターは、プラスミドベクターであることができる。しかし、これに限らず、例えば、ウイルスベクター、コスミドベクター、細菌人工染色体(BAC)、酵母人工染色体(YAC)及び他の非プラスミドベクターも使用できる。
【0062】
本発明における発現ベクターの実施態様の1つは、目的タンパク質遺伝子発現カセット、薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットが配置されており、その上流若しくは下流に、遺伝子発現安定化エレメントが配置された発現ベクターである。好ましくは、目的タンパク質遺伝子発現カセット、薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットの上流に、遺伝子発現安定化エレメントが配置された発現ベクターである。この場合、目的タンパク質遺伝子発現カセットと薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットとはいずれが上流であってもよいが、好ましくは目的タンパク質遺伝子発現カセットが上流に配置されたものである。
【0063】
本発明における発現ベクターの好ましい実施態様は、目的タンパク質遺伝子発現カセット、薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットが配置されており、その上流及び下流に、それらの発現カセットを挟むように遺伝子発現安定化エレメントが配置されたベクターである。目的タンパク質遺伝子発現カセット、薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットの順序は問わないが、目的タンパク質遺伝子発現カセットが上流に配置されていることが好ましい。
【0064】
遺伝子発現安定化エレメントは、目的タンパク質遺伝子発現カセットと薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットとの間に配置されていてもよい。
【0065】
遺伝子発現安定化エレメント、目的タンパク質遺伝子発現カセット、および薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットとの間は、隣接していてもよいし、スペーサー配列等が挿入されていてもよい。
【0066】
薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットは、1つのベクターに2つ以上含まれていても良い。この場合、同一の薬剤選択マーカーが選ばれる場合もあるし、それぞれ異なる薬剤選択マーカーが選ばれる場合もある。また、各発現カセットは隣接して配置されても良いし、離れて配置されていても良い。
【0067】
目的タンパク質が抗体の重鎖、軽鎖のように複数のポリペプチドからなる場合、目的タンパク質遺伝子の発現カセットを複数配置してもよく、あるいは複数のポリペプチド遺伝子をIRESでつなぎ、ポリシストロン性の1つの発現カセットの形にしてもよい。
【0068】
また、複数のポリペプチド発現カセットをそれぞれ異なるベクターに挿入し、それぞれのベクターを1つの宿主細胞へ導入して形質転換細胞を作製し、目的タンパク質を生産することができる。この場合、各ベクターに遺伝子発現安定化エレメント及び/または薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットを配置することができ、それぞれ同一の薬剤選択マーカーを用いることもできるが、異なる薬剤選択マーカーを用いる方が、各ポリペプチドが全て高発現を示す細胞を効率よく取得する点で有利であり、好ましい。
【0069】
抗体を生産する場合、抗体の重鎖ポリペプチド遺伝子と軽鎖ポリペプチド遺伝子をそれぞれ異なるベクターに挿入して発現させてもよいが、抗体の重鎖ポリペプチド遺伝子と軽鎖ポリペプチド遺伝子とを同一のベクターに挿入して発現させると、同一ベクター上の一種類の薬剤耐性遺伝子を使うことになり導入遺伝子数の差異を軽減でき、抗体の重鎖ポリペプチドと軽鎖ポリペプチドの生産バランスがとれ、重鎖・軽鎖の2つのポリペプチドが2本ずつから成る抗体としての生産性が安定するため、好ましい。
【0070】
本発明の第三の側面では、薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセットのみを提供する。これは、本発明の発現ベクターに限らず、いずれの発現ベクターにも適用できるものである。
【0071】
本発明の第四の側面によれば、以下の工程を含む、高生産細胞を作製する方法が提供される。
(a)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【0072】
本発明の側面の別の実施形態は、以下の工程を含む、高生産細胞を作製する方法である。
(a)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞をヒポキサンチンおよびチミジン不含培地で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【0073】
本発明の側面のさらなる別の実施形態は、以下の工程を含む、高生産細胞を作製する方法である。
(a)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を、ヒポキサンチンおよびチミジンを含まず、かつ薬剤存在下で培養する工程
(d)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(e)高発現を示す細胞株を単離する工程。
【0074】
前記実施形態と同様、下記の工程を含む高生産細胞を作製する方法も提供される。
(a)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【0075】
(a)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞をヒポキサンチンおよびチミジン不含培地で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【0076】
(a)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を、ヒポキサンチンおよびチミジンを含まず、かつ薬剤存在下で培養する工程
(d)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(e)高発現を示す細胞株を単離する工程。
【0077】
前記実施形態において、(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程、及び(d)高発現を示す細胞株を単離する工程は複数回繰り返すことができる。
【0078】
宿主細胞としては、組換えタンパク質の産生に一般的に用いられるチャイニーズハムスター卵巣細胞(CHO)の他、マウスミエローマ細胞(NSO)、ベビーハムスターキドニー細胞(BHK)、ヒト繊維肉腫細胞(HT1080)、COS細胞などの哺乳類由来の細胞が例示されるが、チャイニーズハムスター卵巣細胞(CHO)が好適に使用される。
【0079】
宿主細胞がジヒドロ葉酸還元酵素遺伝子を欠損した細胞でなくても遺伝子増幅を含む本発明の効果を得ることができるが、dhfr遺伝子を有する発現ベクターにより形質転換された細胞のみが生き残れるようにするため、宿主細胞はdhfr遺伝子欠損細胞を用いることが好ましい。dhfr遺伝子欠損細胞の具体例としては、CHO DG44細胞やCHO DUKX−B11細胞、CHO/dhfr−細胞などがある。
【0080】
一般にバイオ医薬品などの工業生産には、ウイルスなどの有害成分の混入を排除するため、動物成分を含まない培地、より好ましくは化学的に組成の明らかな(Chemically Defined)な培地で生産細胞を培養することが求められる。このため、一般的に使用されるウシ胎児血清などを含有した培地で高生産細胞をスクリーニングした後、1〜2ヶ月程度かけて動物成分非含有培地やChemically Definedとされる培地へ細胞を適応させること(無血清馴化)が必要とされる。しかしながら、せっかく取得した高生産性細胞も上手く馴化できないケースもある。そこで、あらかじめ無血清馴化された細胞に遺伝子導入することは、無血清馴化工程を省略して生産細胞の樹立時間を短縮でき、非常に有効である。このような課題達成のため、本発明に用いられる宿主細胞には、CHO細胞等における無血清馴化済み細胞を使用することがさらに例示される。
【0081】
宿主細胞の形質転換方法は、当業者であれば適宜選択しうるが、例えばリポフェクション法、リン酸カルシウム法、エレクトロポレーション法、DEAEデキストラン法、マイクロインジェクション等が挙げられる。
【0082】
形質転換された細胞を薬剤存在下で培養する工程において、薬剤選択に使用する薬剤は、薬剤選択マーカー遺伝子の種類に応じて決定される。また、使用する薬剤の濃度としては、一般に使用される濃度の範囲で高発現細胞の濃縮が可能であるが、少し高めの濃度が好ましい。最適な濃度は、宿主細胞や用いる培地の種類によって変化する。これらの濃度の設定方法は当業者にとっては公知であり、適宜設定しうる。例えば、10%ウシ胎児血清を含むIMDM培地での培養条件下で、ピューロマイシン耐性遺伝子、ジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列をこの順で含む発現カセットを有する発現ベクターで形質転換されたCHO/dhfr−細胞に対するピューロマイシンの濃度としては、5μg/ml以上が好ましく、7.5μg/ml以上がより好ましく、上限として15μg/ml以下が好ましい。同様に、ジヒドロ葉酸還元酵素遺伝子、ピューロマイシン耐性遺伝子及びmRNA不安定化配列をこの順で含む発現カセットを有する発現ベクターで形質転換されたCHO/dhfr−細胞に対するピューロマイシンの濃度としては、5μg/ml以上が好ましく、7.5μg/ml以上がより好ましく、上限として10μg/ml以下が好ましい。
【0083】
本方法を使用した選別方法では、薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセットを有する発現ベクターで形質転換した細胞の方が、薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含み、mRNA不安定化配列を含まない発現カセットを有する発現ベクターを形質転換して薬剤選択を行った細胞群に比べて、目的タンパク質遺伝子を高レベルで発現する細胞の割合が有意に高くなる。本発明によれば、薬剤選択マーカーのmRNA不安定化を含む薬剤選択のみによって、選別の候補となるサンプル数を大幅に絞ることができる。本発明の選別方法を用いれば、薬剤選択後も生存する細胞群(ポリクローン)の状態で目的タンパク質生産量が有意に上昇していて、これらの細胞群から細胞を単離し、培養することにより、容易に高発現を示す細胞株(モノクローン)を取得することができる。本発明の実施態様の一例として、4.0×105個の細胞に本発明の薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセットが挿入されたベクターを遺伝子導入した後、薬剤選択を行って生じた細胞群から100の細胞株をランダムに選択して、個々の細胞株の発現量を調べることにより目的タンパク質の高発現株を容易に取得することができる。
【0084】
本発明の一部の実施形態において、形質転換された細胞をヒポキサンチンおよびチミジン(HT)不含培地中で培養する工程が含まれる。dhfr遺伝子欠損細胞は、細胞増殖のためにヒポキサンチンおよびチミジンを必要とし、培地にヒポキサンチンおよびチミジンを添加しなければ生育することができない。したがって、ヒポキサンチンおよびチミジン不含培地で培養することによって、dhfr遺伝子を含む発現ベクターにより形質転換が成功した細胞を選択することができる。ヒポキサンチンおよびチミジンの濃度は当業者であれば適宜設定しうる。
【0085】
本発明は、形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程を含む。MTXはDHFRの拮抗阻害剤であり、MTX耐性を獲得しなければ細胞は生育することはできない。一般的に、動物細胞はdhfr遺伝子の遺伝子増幅によりMTX耐性を獲得するが、その際にdhfr遺伝子近傍に存在する他の遺伝子も同時に増幅されることを出願人らは利用している。MTXの濃度は1nM〜1000nMの間で使用することが望ましい。1nM未満であれば遺伝子増幅の効果が小さく、1000nMより高い濃度では細胞が死滅してしまう。MTXの存在下で培養する工程は、一定のMTXの濃度下で培養しても良いし、まず低いMTX濃度で培養し、その後段階的に濃度を上昇させて培養しても良い。遺伝子増幅はすべての細胞に同時に起こるのではなく、一部の細胞でさまざまなタイミングで起こるため、MTXの濃度は低い濃度から段階的に上昇させることが好ましい。形質転換細胞を多段階のMTXの濃度で培養する場合、宿主細胞をいきなり高濃度のMTXにさらせば、遺伝子増幅が起こる前に死滅する細胞が多くなる。また、MTXの濃度を急激に上昇させれば、遺伝子増幅以外の機構でMTX耐性を獲得する細胞の出現頻度が高まる。
【0086】
最適なMTX濃度および最適なMTX濃度を上昇させる方法は、細胞の種類、薬剤選択マーカー遺伝子の種類、薬剤選択マーカー遺伝子とジヒドロ葉酸還元酵素遺伝子の配置、mRNA不安定化配列の有無により異なる。薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセットを有する発現ベクターで宿主細胞を形質転換する場合、DHFRの発現量はmRNA不安定化配列により減弱されている。MTX耐性も減弱されているため、mRNA不安定化配列を有さない薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットを有する発現ベクターで形質転換された細胞に比べて低濃度のMTXで遺伝子増幅の効果を得ることができる。一例として、ピューロマイシン耐性遺伝子、ジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列をこの順で含む発現カセットを有する発現ベクターで形質転換された細胞を培養する場合は、MTX濃度は20nM以下が好ましい。多段階のMTXの濃度で培養する場合は、例えば1段階目は4nM、2段階目は10nM、3段階目は20nMで培養することができる。
【0087】
MTX存在下で培養する工程は、形質転換細胞を薬剤存在下で培養する工程を行った後に行うことが好ましい。薬剤選択により、細胞の高発現領域に遺伝子導入された細胞群を取得することができるため、薬剤存在下で培養する工程の後に本工程をおこなうことにより、遺伝子増幅が高発現領域内で起こることになり、より効率的に遺伝子発現することを期待できるからである。
【0088】
高生産を示す細胞株を単離する工程は、まず細胞群(ポリクローン)から細胞株を取得し、次いで細胞株の発現レベルを調べ、高生産を示す細胞株を選択することにより行われる。細胞群(ポリクローン)から細胞株を取得する方法としては、ポリクローンを限界希釈する方法がある。限界希釈は、例えばポリクローンの状態の細胞集団にトリプシン処理を行って細胞を分散し、細胞数が1.0/ウェル以下の濃度となるよう96ウェルプレートに細胞を播種し培養することにより行うことができる。必要に応じて、希釈濃度を変更したり(例えば3.0細胞/ウェル以下の濃度など)、Conditioned Mediumと通常の培地を混合した培地で培養したりすることが当業者間では行われる。
【0089】
細胞の発現レベルはレポーター遺伝子の発現量により調べることができる。一例として、SNAP26m遺伝子(Covalys社)やGFP(Green Fluorescent Protein)遺伝子等の蛍光タンパク質遺伝子を含む発現カセットを本発明の発現ベクターに導入し、FACS(fluorescence activated cell sorting)等のフローサイトメーターを用いて蛍光強度を解析することにより調べることができる。別の例として、ルシフェラーゼ遺伝子を含む発現カセットを本発明による発現ベクターに導入後、細胞溶解液にD−ルシフェリンを添加してルミノメーターで発光量を測定することにより調べることができる。また、レポーター遺伝子に限らず、ELISA(Enzyme−Linked Immunosorbent Assay)、酵素免疫測定法(EIA)等を利用することで抗体等の目的タンパク質の発現を調べることもできる。
【0090】
本工程は、形質転換された細胞を薬剤存在下で培養する工程の後、もしくは形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程の後、または両工程の後のどの段階で行ってもよい。
【0091】
本発明の第四の側面における高生産細胞を作製する方法をより具体的に例示する。
【0092】
第一の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞を薬剤(例えば、ジェネティシン)存在下で培養する。(3)高発現を示すポリクローン(細胞群)を選択し、MTX存在下で培養する。(4)MTX存在下で培養後さらに高発現を示すポリクローンを選択し、モノクローン(細胞株)に単離する。(5)それぞれの細胞株の発現量を調べ、高発現を示す細胞株を選択する。
【0093】
第二の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞を薬剤(例えば、ジェネティシン)存在下で培養する。(3)高い発現レベルを示すポリクローンを選択し、モノクローンに単離する。(4)それぞれの細胞株の発現量を調べ、高発現を示す細胞株を選択し、MTX存在下で培養する。(5)MTXで選択培養後の細胞集団を再度限界希釈して細胞株を単離し、一定期間培養する。(6)(5)で単離された細胞株の発現量を調べ、高発現を示す細胞株を選択する。
【0094】
第三の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞をヒポキサンチンおよびチミジン(HT)不含培地で培養する。(3)HT不含条件下で高発現を示すポリクローンを選択し、MTX存在下で培養する。(4)MTX存在下で培養後さらに高発現を示すポリクローンを選択し、モノクローンに単離する。(5)それぞれのモノクローンの発現量を調べ、高発現を示す細胞株を選択する。
【0095】
第四の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞を、ヒポキサンチンおよびチミジン(HT)を含まない培地で、薬剤(例えば、ジェネティシン)存在下で培養する。(3)高発現を示すポリクローンを選択し、MTX存在下で培養する。(4)MTX存在下で培養後さらに高発現を示すポリクローンを選択し、モノクローンに単離する。(5)それぞれの細胞株の発現量を調べ、高発現を示す細胞株を選択する。
【0096】
第五の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞を、ヒポキサンチンおよびチミジン(HT)を含まない培地で、薬剤(例えば、ジェネティシン)存在下で培養する。(3)高発現を示すポリクローンを選択し、モノクローンに単離する。(4)高発現を示す細胞株を選択し、MTX存在下で培養する。(5)MTXで選択培養後の細胞集団を再度限界希釈して細胞株を単離し、一定期間培養する。(6)(5)で単離された細胞株の発現量を調べ、高発現を示す細胞株を選択する。
【0097】
第六の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞を、ヒポキサンチンおよびチミジン(HT)を含まない培地で、薬剤(例えば、ジェネティシン)存在下で培養する。(3)高発現を示すポリクローンを選択し、モノクローンに単離する。(4)高発現を示す細胞株を選択し、MTX存在下で培養する。(5)MTXで選択培養後の細胞集団を再度限界希釈して細胞株を単離し、一定期間培養する。(6)(5)で単離された細胞株の発現量を調べ、高発現を示す細胞株を選択する。(7)再度MTX存在下で一定期間培養する。(8)(7)で単離された細胞株の発現量を調べ、高発現を示す細胞株を選択する。
【0098】
本発明により、細胞選別の工程及び時間を大幅に短縮することができると共に、高発現を示す細胞の割合が上昇することにより、短時間で効率的に目的タンパク質遺伝子を高レベルで発現する細胞を取得することができ、従来技術と比べて極めて顕著な効果を示す。
【0099】
本発明の第五の側面は、本発明の第四の側面における方法により得られた形質転換細胞である。
【0100】
本発明の第六の側面によれば、本発明の第四の側面における方法により得られた形質転換細胞を用いることを特徴とする、タンパク質を生産する方法が提供される。
【0101】
一つの実施態様では、生産されるタンパク質は、抗体である。この場合、抗体の重鎖ポリペプチド遺伝子と軽鎖ポリペプチド遺伝子は同一のベクター(シングルベクター)に挿入されていても良いし、それぞれ異なるベクターに挿入されて2コンストラクトとされていても良い。
【0102】
哺乳類の抗体には、IgM、IgD、IgG、IgA、IgEの5種類のクラスが存在することが明らかとなっているが、ヒトの各種疾患の診断、予防及び治療には血中半減期が長く、各種エフェクター機能を有する等の機能特性からヒトIgGクラスの抗体が主として利用されている。抗体は、形質転換細胞の培養上清よりプロテインAカラムを用いて精製することができる。また、その他に通常、タンパク質の精製で用いられる精製方法を使用することができる。例えば、ゲル濾過、イオン交換クロマトグラフィー及び限外濾過等を組み合わせて行い、精製することができる。精製したヒト化抗体のH鎖、L鎖或いは抗体分子全体の分子量は、二次元電気泳動等により測定することができる。
【0103】
本発明の方法により生産された抗体は、医薬として使用することができる。かかる医薬は、治療薬として単独で投与することも可能ではあるが、通常は薬理学的に許容される一つあるいはそれ以上の担体と一緒に混合し、製剤学の技術分野にて公知の任意の方法により製造した医薬製剤として提供されるのが好ましい。
【0104】
投与経路は、治療に際して最も効果的なものを使用するのが望ましく、経口投与、または口腔内、気道内、直腸内、皮下、筋肉内および静脈内等の非経口投与をあげることができ、抗体製剤の場合、好ましくは静脈内投与をあげることができる。投与形態としては、噴霧剤、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、座剤、注射剤、軟膏、テープ剤等があげられる。
【0105】
経口投与に適当な製剤としては、乳剤、シロップ剤、カプセル剤、錠剤、散剤、顆粒剤等があげられる。乳剤およびシロップ剤のような液体調製物は、水、ショ糖、ソルビトール、果糖等の糖類、ポリエチレングリコール、プロピレングリコール等のグリコール類、ごま油、オリーブ油、大豆油等の油類、p−ヒドロキシ安息香酸エステル類等の防腐剤、ストロベリーフレーバー、ペパーミント等のフレーバー類等を添加剤として用いて製造できる。カプセル剤、錠剤、散剤、顆粒剤等は、乳糖、ブドウ糖、ショ糖、マンニトール等の賦形剤、デンプン、アルギン酸ナトリウム等の崩壊剤、ステアリン酸マグネシウム、タルク等の滑沢剤、ポリビニルアルコール、ヒドロキシプロピルセルロース、ゼラチン等の結合剤、脂肪酸エステル等の界面活性剤、グリセリン等の可塑剤等を添加剤として用いて製造できる。
【0106】
非経口投与に適当な製剤としては、注射剤、座剤、噴霧剤等があげられる。注射剤は、塩溶液、ブドウ糖溶液、あるいは両者の混合物からなる担体等を用いて調製される。または、ヒト化抗体を常法に従って凍結乾燥し、これに塩化ナトリウムを加えることによって粉末注射剤を調製することもできる。座剤はカカオ脂、水素化脂肪またはカルボン酸等の担体を用いて調製される。また、噴霧剤は該化合物そのもの、ないしは受容者の口腔および気道粘膜を刺激せず、かつ該化合物を微細な粒子として分散させ吸収を容易にさせる担体等を用いて調製される。
【0107】
担体として具体的には乳糖、グリセリン等が例示される。該化合物および用いる担体の性質により、エアロゾル、ドライパウダー等の製剤が可能である。また、これらの非経口剤においても経口剤で添加剤として例示した成分を添加することもできる。
【0108】
別の実施態様では、生産されるタンパク質は、ワクチンである。
【0109】
ワクチンとしては、病原体のエピトープのアミノ酸配列からなるタンパク質をワクチンとして使用することができる。また、ウイルス体の構成タンパク質すべてを生産するのみならず、エンベロープタンパク等を生産し、ワクチンとして使用することができる。
【0110】
ワクチンは任意の経路の投与のための製剤とすることができる。粘膜型投与、例えば、経口経路、経鼻経路、経気道経路、経膣経路、経直腸経路の他、非粘膜経路による投与、例えば皮下、静脈内もしくは筋肉内投与のためのワクチン製剤が挙げられる。
【実施例】
【0111】
以下、実施例を例示することによって、本発明の効果をより一層明確なものとする。
【0112】
実施例1
各種プラスミドベクターの構築
実施例1−1
mRNA不安定化配列を有するベクター
(1)pPUR・N4の構築
図1に示すスキームに従って、pPUR(クロンテック社製)のPuromycin耐性遺伝子のコード配列の3‘末端に、配列番号1、2のプライマーとKOD −Plus− Mutagenesis Kit(東洋紡績社製)を用いたInverse PCR法によって、ARE配列モチーフTTATTTATTの4回繰り返し配列(以下、「N4」と言う。)を挿入してpPUR・N4を構築した。
【0113】
(2)pEF1α−SNAP26m−Pur・N4及びpEF1α−SNAP26m−Pur−RE2の構築
次に、目的遺伝子発現カセットのプロモーターをEF1αプロモーターに置換したプラスミドを構築した。本実験では、図2に示すスキームに従って構築されたプラスミドpEF1α−KOD3G8HC−RE2を利用した。即ち、まず、CMVプロモーターをEF−1αプロモーターに置換したpCI−neoプラスミド(プロメガ社製)の制限酵素XbaI−NotIサイトに抗KOD抗体の重鎖を挿入したプラスミドのpEF1α−KOD3G8HCを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号3、4のプライマーを使って発現カセット上流に制限酵素SalIおよびNheIサイトを付加したpEF1α−KOD3G8HC−REを構築した。更に本プラスミドを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号5、6のプライマーを使って発現カセット下流に制限酵素BsiWIおよびXhoIサイトを付加して構築されたプラスミドがpEF1α−KOD3G8HC−RE2である。
【0114】
このpEF1α−KOD3G8HC−RE2を用いて、図3に示すスキームに従って、プラスミドpEF1α−SNAP26m−Pur・N4およびpEF1α−SNAP26m−Pur−RE2を構築した。即ち、プラスミドpEF1α−KOD3G8HC−RE2から制限酵素EcoRI、NotIで抗KOD抗体の重鎖遺伝子を切出した。一方、SNAPm発現プラスミドpSNAPmからSNAP26m遺伝子を配列番号7、8のプライマーを用いてPCRで増幅し、pEF1α−KOD3G8HC−RE2プラスミドの制限酵素EcoRI、NotIサイトに導入してpEF1α−SNAP26m−Neo−RE2を構築した。本プラスミドから制限酵素AflII、BstBIでネオマイシン耐性遺伝子を切出した。一方、前記(1)で構築したpPUR・N4から下流にN4配列を付加したPuromycin耐性遺伝子を配列番号9,10のプライマーを用いてPCRで増幅し、pEF1α−SNAP26m−RE2プラスミドの制限酵素AflII、BstBIサイトに導入してpEF1α−SNAP26m−Pur・N4を構築した。続いて、本プラスミドを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号11、12のプライマーを使ってPuromycin耐性遺伝子下流のN4配列を削除したプラスミドpEF1α−SNAP26m−Pur−RE2を構築した。
【0115】
実施例1−2
mRNA不安定化配列と遺伝子発現安定化エレメントとを有するベクター
(1)pEF1α−SNAP26m−Pur・N4−1.1k/1.1kの構築
本実験では図4に記載のpEF1α−KOD3G8HC−1.1k/1.1kを利用した。即ち、まず、実施例1−1の途中で構築されたpEF1α−KOD3G8HC−RE2の発現カセット上流の制限酵素NheI、BglIIサイトに、配列番号13、14のプライマーセットを使ってPCRで増幅した被検配列CHO5Δ3−3(配列番号15の41601番目〜42700番目からなる塩基配列。以下、コンストラクト中では1.1kと表記)を挿入して、プラスミドpEF1α−KOD3G8HC−1.1kを構築した。更にプラスミドpEF1α−KOD3G8HC−1.1kの発現カセット下流の制限酵素BsiWI、XhoIサイトに配列番号16、17のプライマーセットを使ってPCRで増幅した被検配列CHO5Δ3−3を挿入して構築されたプラスミドがpEF1α−KOD3G8HC−1.1k/1.1kである。
【0116】
一方、実施例1−1で構築したプラスミドpEF1α−SNAP26m−Pur・N4およびpEF1α−SNAP26m−Pur−RE2を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号18、19のプライマーを使ってPuromycin耐性遺伝子内に存在する制限酵素BsiWIサイトを削除したプラスミドpEF1α−SNAP26m−Pur2・N4およびpEF1α−SNAP26m−Pur2−RE2を構築した。
【0117】
続いて、図5に示すスキームに従って、pEF1α−SNAP26m−Pur・N4−1.1k/1.1kを構築した。即ち、pEF1α−SNAP26m−Pur2・N4、から制限酵素EcoRI、BsiWIで、SNAPm−pA−SV40Promoter−Pur2・N4−pAを切出し、pEF1α−KOD3G8HC−1.1k/1.1kの制限酵素EcoRI、BsiWIサイトに導入してpEF1α−SNAP26m−Pur・N4−1.1k/1.1kを構築した。
【0118】
実施例1−3
発現ベクターにおける各配列要素から制限酵素認識配列を削除したベクター
(1)遺伝子発現安定化エレメントCHO5Δ3−3からの制限酵素認識配列の削除
続いて、遺伝子発現安定化エレメントCHO5Δ3−3から制限酵素認識配列を削除した。まず、実施例1−2に記載のpEF1α−KOD3G8HC−1.1kを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号22、23のプライマーを使ってCHO5Δ3−3内に存在する制限酵素SacIサイトを削除したpEF1α−KOD3G8HC−1.1k−ΔREを構築した。次に、pEF1α−KOD3G8HC−1.1k−ΔREを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号24、25のプライマーを使ってCHO5Δ3−3内に存在する制限酵素SmaIサイトを削除したpEF1α−KOD3G8HC−1.1k−ΔRE2を構築した。更に、pEF1α−KOD3G8HC−1.1k−ΔRE2を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号26、27のプライマーを使ってCHO5Δ3−3内に存在する制限酵素BamHIサイトを削除したpEF1α−KOD3G8HC−1.1k−ΔRE3を構築した。最後に、pEF1α−KOD3G8HC−1.1k−ΔRE3を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号28、29のプライマーを使ってCHO5Δ3−3内に存在する制限酵素HindIIIサイトを削除したpEF1α−KOD3G8HC−1.1k−ΔRE4を構築した。
【0119】
(2)pEHXの構築
マルチクローニングサイトと、上記実施例1−3(1)で作成した4箇所の制限酵素認識配列を削除した遺伝子発現安定化エレメントCHO5Δ3−3を発現カセット上流および下流に配する図6に記載のpEHXを構築した。具体的には、実施例1−2に記載のpEF1α−SNAP26m−Pur2・N4を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号30、31のプライマーを使ってSV40 promoter下流に存在する制限酵素HindIIIサイトを削除したpEF1α−SNAP26m−Pur2・N4−ΔHを構築した。続いて、pEF1α−SNAP26m−Pur2・N4−ΔHを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号32、33のプライマーを使ってPuromycin耐性遺伝子内に存在する制限酵素SalIサイトを削除したpEF1α−SNAP26m−Pur3・N4−ΔHを構築した。更に、pEF1α−SNAP26m−Pur3・N4−ΔHを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号34、35のプライマーを使ってPuromycin耐性遺伝子内に存在する制限酵素SmaIサイトを削除したpEF1α−SNAP26m−Pur4・N4−ΔHを構築した。その後、pEF1α−SNAP26m−Pur4・N4−ΔHを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号36、37のプライマーを使ってf1 oriを削除したpEF1α−SNAP26m−Pur4・N4−ΔH−Δf1を構築した。次に、pEF1α−SNAP26m−Pur4・N4−ΔH−Δf1を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号38、39のプライマーを使って制限酵素NheI、EcoRI、SpeIサイトを挿入したpEF1α−SNAP26m−Pur4・N4−ΔH−Δf1−REを構築した。続いて、pEF1α−SNAP26m−Pur4・N4−ΔH−Δf1−REを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号40、41のプライマーを使って制限酵素HindIII、BsiWI、XbaI、BclIサイトを挿入したpEF1α−MCSpre−Pur4・N4−ΔH−Δf1−REを構築した。そして、pEF1α−MCSpre−Pur4・N4−ΔH−Δf1−REのHindIII、XbaIサイトに、配列番号42、43のプライマーを混合後、95度から60度まで徐々に温度を下げアニールさせて作成したDNA断片を挿入し、pEF1α−MCS−Pur4・N4−ΔH−Δf1−REを構築した。次に、pEF1α−MCS−Pur4・N4−ΔH−Δf1−REのNheI、EcoRIサイトに、配列番号44、45のプライマーセットを使ってpEF1α−KOD3G8HC−1.1k−ΔRE4を鋳型にPCRで増幅した、4箇所の制限酵素認識配列を削除したCHO5Δ3−3を挿入し、pEF1α−MCS−Pur4・N4−1.1kを構築した。更に、pEF1α−MCS−Pur4・N4−1.1kのBamHI、XhoIサイトに、配列番号16、46のプライマーセットを使ってpEF1α−KOD3G8HC−1.1k−ΔRE4を鋳型にPCRで増幅した、4箇所の制限酵素認識配列を削除したCHO5Δ3−3を挿入し、pEHXを構築した。
【0120】
実施例1−4
抗体遺伝子を挿入した、各配列要素から制限酵素認識配列を削除したベクター
【0121】
(1)pELXの構築
マルチクローニングサイトを含む図7に記載のpELXを構築した。
【0122】
具体的には、CMVプロモーターをEF1αプロモーターに変更したpCI−neoプラスミド(プロメガ社製)の制限酵素XbaI−NotIサイトに抗KOD抗体の軽鎖を挿入したプラスミドのpEF1α−KOD3G8LCを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号3、4のプライマーを使って発現カセット上流に制限酵素SalIおよびNheIサイトを付加したpEF1α−KOD3G8LC−REを構築した。更に本プラスミドを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号5、6のプライマーを使って発現カセット下流に制限酵素BsiWIおよびXhoIサイトを付加して、pEF1α−KOD3G8LC−RE2プラスミドを構築した。このpEF1α−KOD3G8LC−RE2をAflII、BstBIで処理し、ネオマイシン耐性遺伝子を切出した。一方、pTK−Hyg(クロンテック社製)からハイグロマイシン耐性遺伝子を配列番号47、48のプライマーを使ってPCRで増幅し、pEF1α−KOD3G8LC−RE2の制限酵素AflII、BstBIサイトに導入してpEF1α−KOD3G8LC−Hyg−RE2を構築した。
【0123】
pEF1α−KOD3G8LC−Hyg−RE2を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号49、50のプライマーを使って制限酵素BglII、SalIサイトを挿入したpEF1α−KOD3G8LC−Hyg−RE3を構築した。続いて、pEF1α−KOD3G8LC−Hyg−RE3を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号51、52のプライマーを使って、f1 oriとハイグロマイシン耐性遺伝子の発現カセットを削除し、制限酵素EcoRI、SpeIサイトを挿入したpEF1α−KOD3G8LC−RE4を構築した。その後、pEF1α−KOD3G8LC−RE4を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号40、41のプライマーを使って制限酵素HindIII、BsiWI、XbaI、BclIサイトを挿入したpEF1α−MCSpre−RE4を構築した。そして、pEF1α−MCSpre−RE4の制限酵素HindIII、XbaIサイトに、配列番号42、43のプライマーを混合後、95度から60度まで徐々に温度を下げアニールさせて作成したDNA断片を挿入し、pELXを構築した。
【0124】
(2)pELX2の構築
実施例1−4(1)で構築したpELXの発現カセット下流に、4箇所の制限酵素認識配列を削除した遺伝子発現安定化エレメントCHO5Δ3−3を配した、図8に記載のpELX2を構築した。具体的には、実施例1−4(1)で構築したpELXを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号51、53のプライマーを使って発現カセット下流に制限酵素NheIサイトを追加したpELX−Nを構築した。そして、pELX−NのNheI、EcoRIサイトに、配列番号13、54のプライマーセットを使って、実施例1−3で構築したpEF1α−KOD3G8HC−1.1k−ΔRE4を鋳型にPCRで増幅した、4箇所の制限酵素認識配列を削除したCHO5Δ3−3を挿入し、pELX2を構築した。
【0125】
(3)pEL2(KOD3G8)の構築
pELX2の制限酵素MluI、NotIサイトに、抗KOD抗体の軽鎖遺伝子を挿入しpEL2(KOD3G8)を構築した。具体的には、実施例1−4(1)に記載のpEF1α−KOD3G8LCから配列番号20,21のプライマーを用いてPCRで増幅し、制限酵素MluI、NotIで処理して調製した抗KOD抗体の軽鎖遺伝子を、pELX2の制限酵素MluI、NotIサイトに導入して、pEL2(KOD3G8)を構築した。
【0126】
実施例2
抗KOD抗体発現系における、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子とmRNA不安定化配列の組み合わせ効果の検討
続いて、dhfr遺伝子、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子、および、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子の下流にmRNA不安定化配列を付加したもの、それぞれの効果を比較検討するため、抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞を、更にMTXで選択して得られたポリクローンの細胞の生産性を評価した。
実施例2−1
dhfr遺伝子を有する発現ベクターの構築
(1)pEHX−dhfr・N4の構築
実施例1−3で構築したpEHXへdhfr遺伝子の発現カセットを挿入した、図9に記載のpEHX−dhfr・N4を構築した。具体的には、pEHXのBamHI、XhoIサイトに、配列番号55、56のプライマーセットを使ってpEHXを鋳型にPCRで増幅し、制限酵素BglII、XhoIで処理して調製したSV40 promoterを挿入し、pEHX−pを構築した。続いて、pEHX−pのBamHI、XhoIサイトに、配列番号57、58のプライマーセットを使って実施例1−3に記載のpEF1α−KOD3G8HC−1.1k−ΔRE4を鋳型にPCRで増幅し、制限酵素BamHI、SalIで処理して調製した、4箇所の制限酵素認識配列を削除したCHO5Δ3−3を挿入し、pEHX−p2を構築した。次に、pEHX−p2のBamHI、XhoIサイトに、配列番号59、60のプライマーセットを使ってpEHXを鋳型にPCRで増幅し、制限酵素BamHI、SalIで処理して調製したSV40 pAを挿入し、pEHX−p3を構築した。一方、dhfr遺伝子の3’末端にタンパク質分解促進配列のPEST配列を付加した配列番号61のDNAを人工合成して、プラスミドベクターpCR2.1−TOPO(インビトロジェン社製)にTOPO TAクローニングし、pCR2.1−dhfr・PESTを構築した。続いて、pCR2.1−dhfr・PESTを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号62、63のプライマーを使って、dhfr遺伝子の3’末端からPEST配列を削除しN4配列を付加したpCR2.1−dhfr・N4を構築した。そして、pEHX−p3のBamHI、XhoIサイトに、配列番号64、65のプライマーセットを使ってpCR2.1−dhfr・N4を鋳型にPCRで増幅し、制限酵素BglII、SalIで処理して調製したDNA断片を挿入し、pEHX−dhfr・N4を構築した。
【0127】
(2)ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子を有する発現ベクター:pEHX−Puro・dhfr、pEHX−Puro・dhfr・N4の構築
図10に示すスキームに従って、実施例1−3で構築したpEHX中の、N4配列を下流に付加したピューロマイシン耐性遺伝子の代わりに、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子、あるいは、N4配列を下流に付加したピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子を挿入した、pEHX−Puro・dhfr、および、pEHX−Puro・dhfr・N4を構築した。具体的には、まず、配列番号36、66のプライマーセットを使ってpEHXを鋳型にPCRで増幅したSV40 promoter、ピューロマイシン耐性遺伝子から成るDNA断片と、配列番号67、68、あるいは、配列番号67、69のプライマーセットを使ってpCR2.1−dhfr・N4を鋳型にPCRで増幅したdhfr遺伝子、あるいは、dhfr遺伝子、N4配列から成るDNA断片を、overlap−extension PCRによりアセンブリし、配列番号36、68、あるいは、配列番号36、69のプライマーセットを使って、SV40 promoter、ピューロマイシン耐性遺伝子、dhfr遺伝子から成るDNA断片、あるいは、SV40 promoter、ピューロマイシン耐性遺伝子、dhfr遺伝子、N4配列から成るDNA断片を調製した。これらのDNA断片をKpnI、Csp45Iで消化し、pEHXのKpnI、Csp45Iサイトに挿入し、pEHX−Puro・dhfr、および、pEHX−Puro・dhfr・N4を構築した。
【0128】
(3)抗KOD抗体発現ベクター:pELH2−dhfr・N4(KOD3G8)、pELH2−Puro・dhfr(KOD3G8)、pELH2−Puro・dhfr・N4(KOD3G8)の構築
続いて、抗KOD抗体発現系で遺伝子増幅の効果を確認すべく、pELH2−dhfr・N4(KOD3G8)、pELH2−Puro・dhfr(KOD3G8)、および、pELH2−Puro・dhfr・N4(KOD3G8)を構築した。
【0129】
まず、pEHX−dhfr・N4、pEHX−Puro・dhfr、および、pEHX−Puro・dhfr・N4の制限酵素MluI、NotIサイトに、それぞれ抗KOD抗体の重鎖遺伝子を挿入し、pEH−dhfr・N4(KOD3G8)、pEH−Puro・dhfr(KOD3G8)、および、pEH−Puro・dhfr・N4(KOD3G8)を構築した。具体的には、実施例1−1に記載のpEF1α−KOD3G8HCから配列番号20,21のプライマーを用いてPCRで増幅し、制限酵素MluI、NotIで処理して調製した抗KOD抗体の重鎖遺伝子を、pEHX−dhfr・N4、pEHX−Puro・dhfr、および、pEHX−Puro・dhfr・N4の制限酵素MluI、NotIサイトに導入して、pEH−dhfr・N4(KOD3G8)、pEH−Puro・dhfr(KOD3G8)、および、pEH−Puro・dhfr・N4(KOD3G8)を構築した。
【0130】
そして、図11に示すスキームに従って、実施例1−4に記載のpEL2(KOD3G8)をBglII、EcoRI、ScaIで処理して調製した抗KOD抗体の軽鎖発現カセットを、pEH−dhfr・N4(KOD3G8)の制限酵素BglII、EcoRIサイトに挿入し、pELH2−dhfr・N4(KOD3G8)を構築した。同様にして、図12に示すスキームに従って、pEL2(KOD3G8)をBglII、EcoRI、ScaIで処理して調製した抗KOD抗体の軽鎖発現カセットを、pEH−Puro・dhfr(KOD3G8)、および、pEH−Puro・dhfr・N4(KOD3G8)の制限酵素BglII、EcoRIサイトに挿入し、pELH2−Puro・dhfr(KOD3G8)、pELH2−Puro・dhfr・N4(KOD3G8)を構築した。
【0131】
実施例2−2
抗KOD抗体発現系においてピューロマイシンで選択して取得したポリクローンの細胞の生産性評価
【0132】
dhfr欠損株のCHO/dhfr−細胞(ATCC、CRL−9096)を1×105cells/mlに調整し、12ウェルプレートに2mlずつ前日に播種し、一晩培養して、トランスフェクション用のCHO/dhfr−細胞を準備した。この際、培地として10%牛胎児血清、4mM Glutamine(ナカライ社製)、1xHTサプリメント(インビトロジェン社製)を添加したIscove’s Modified Dulbecco’s Medium(シグマ社製)を使用した。
【0133】
一方、実施例2−1で構築した抗KOD抗体発現ベクターを制限酵素AhdIでリニアライズした。トランスフェクションは、リニア化したプラスミド1.6μgを200μl Opti−MEM I Reduced−Serum Mediumで希釈した後、Lipofectamine LTX(インビトロジェン社製)4μlを加え、30分間放置した後、この混合液を前記CHO/dhfr−細胞に加え、24時間インキュベートすることにより行った。トランスフェクションの1日後、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、10μg/ml Puromycin、10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で2週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。
【0134】
3日間培養後、培養上清を回収し、ピューロマイシンで選択して取得したポリクローンの細胞でのKOD3G8抗体の生産量をELISAにて測定した。標準品から作成した検量線をもとに抗体濃度を算出した。
【0135】
具体的には、30μg/ml濃度のKOD1由来のDNAポリメラーゼ抗原を固相化したELISAプレートに、培養上清を添加し、35℃で2時間インキュベートした。次に、PBS−T(0.1%Tween20含有リン酸緩衝生理食塩水)で3回洗浄し、10000倍希釈した抗マウス抗体−HRP(DAKO社製)を50μl添加して35℃で1時間インキュベートした後、さらにPBS−Tで3回洗浄し、TMB+(3,3’,5,5’−tetramethylbenzidine;DAKO社製)で5分間反応させた。50μlの1N硫酸を加えて反応停止後、プレートリーダー(製品名 ;SPECTRA CLASSIC、TECAN Auctria社製)(主波長450nm、副波長620nm)で吸光度を測定した。なお、標準品として、KOD1由来のDNAポリメラーゼに特異的な抗体を産生するマウスハイブリドーマ細胞系3G8(入手先:独立行政法人産業技術総合研究所 特許生物寄託センター、寄託番号:FERM BP−6056)から得られた抗体を用いた。
【0136】
結果を図13に示す。その結果、ピューロマイシン耐性遺伝子、dhfr遺伝子の両方の発現カセットを含むpELH2−dhfr・N4(KOD3G8)では、ピューロマイシン耐性遺伝子にmRNA不安定化配列を付加しているにも関わらず、発現量は低かった。発現量が低い原因として、4つの発現カセットを1つのコンストラクトにコードさせたことによる転写干渉が考えられた。一方、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子を採用したpELH2−Puro・dhfr(KOD3G8)では、発現カセットを3つに減らすことができ、pELH2−dhfr・N4(KOD3G8)と比較すると発現量は高い値となった。さらに、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子にmRNA不安定化配列を付加して弱化させたpELH2−Puro・dhfr・N4(KOD3G8)では、ポリクローンでの発現量は極めて高く、pELH2−dhfr・N4(KOD3G8)の約1.9倍、pELH2−Puro・dhfr(KOD3G8)の約1.5倍の生産量を示すことがわかった。
【0137】
実施例2−3
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞の生産性評価
【0138】
続いて、モノクローンでの生産性を比較すべく、限界希釈を行った。具体的には、前記実施例2−2で取得したKOD3G8抗体を安定導入したポリクローンの細胞を、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、0.75細胞/ウェルの濃度で96ウェルプレートに播き込んだ。2週間培養後、培養上清を回収し、KOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。標準品から作成した検量線をもとに各クローンの抗体生産量を算出した。そして、選択した発現量上位クローンを拡大培養した後、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、ピューロマイシンで選択して取得したモノクローンの細胞でのKOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。
【0139】
標準品から作成した検量線をもとに各クローンの抗体生産量を算出した。結果を図14に示す。その結果、ポリクローンでの結果と同様、ピューロマイシン耐性遺伝子、dhfr遺伝子の両方の発現カセットを含むpELH2−dhfr・N4(KOD3G8)では最大6mg/Lであったが、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子を採用したpELH2−Puro・dhfr(KOD3G8)では、最大10mg/Lであった。一方、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子にmRNA不安定化配列を付加して弱化させたpELH2−Puro・dhfr・N4(KOD3G8)では、発現量がさらに顕著に高く、その値は最大で18mg/Lに達した。
【0140】
実施例2−4
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞を、更にMTXで選択して取得したポリクローンの細胞の生産性評価
【0141】
次に、前記実施例2−3で取得した、各々の抗KOD抗体発現ベクターを遺伝子導入し、ピューロマイシンで選択して取得した発現量上位10クローンずつについて、10μg/ml Puromycin、透析した10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で2週間継代培養した。その後、更に、10nM MTX(シグマ社製)、10μg/ml Puromycin、透析した10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で6週間選択培養を行った。
【0142】
選択培養終了後、得られたポリクローンの細胞を2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、MTXで選択して取得したポリクローンの細胞でのKOD3G8抗体の生産量を、前記実施例2−2と同様の方法でELISAにて測定した。
【0143】
標準品から作成した検量線をもとに抗体濃度を算出した。結果を図15に示す。その結果、pELH2−dhfr・N4(KOD3G8)では、MTXでの選択により2倍程度の発現量の上昇が見られたが、最も生産性の高いものでも11mg/Lであった。一方、pELH2−Puro・dhfr(KOD3G8)では、最も生産性の高いものでも12mg/Lであった。原因としては、dhfr遺伝子が弱化されていないため、MTX選択による発現量の上昇はあまり見られなかったと考えられる。他方、ピューロマイシンで選択した時点で発現量の高いクローンを取得できていたpELH2−Puro・dhfr・N4(KOD3G8)では、MTXでの選択により2倍程度の発現量の上昇が見られ、最も生産性の高いものは45mg/Lであった。ピューロマイシン耐性遺伝子とdhfr遺伝子を融合させて選択遺伝子とし、更にその3‘末端にmRNA不安定化配列を付加して弱化させた発現カセットを使用することで、相乗効果によって効果的に発現量の上昇が可能であった。
【0144】
実施例3
dhfr遺伝子とピューロマイシン耐性遺伝子の配置順序の検討
続いて、dhfr遺伝子とピューロマイシン耐性遺伝子の配置順序を検討するため、上流側にdhfr遺伝子を配置し下流側にピューロマイシン耐性遺伝子を配置した融合タンパク質遺伝子を有する発現ベクターを構築し、抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞を、更にMTXで選択して得られたポリクローンの細胞の生産性を評価した。
実施例3−1
dhfr遺伝子を有する発現ベクターの構築
(1)dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子を有する発現ベクター:pEHX−dhfr・Puro・N4の構築
図16に示すスキームに従って、実施例1−3で構築したpEHX中の、N4配列を下流に付加したピューロマイシン耐性遺伝子の代わりに、N4配列を下流に付加したdhfr遺伝子とピューロマイシン耐性遺伝子の融合タンパク質遺伝子を挿入したpEHX−dhfr・Puro・N4を構築した。具体的には、まず、配列番号11、70のプライマーセットを使ってpEHX−dhfr・N4を鋳型にPCRで増幅したSV40 promoter、dhfr遺伝子から成るDNA断片と、配列番号69、71のプライマーセットを使ってpEHXを鋳型にPCRで増幅したN4配列を下流に付加したピューロマイシン耐性遺伝子を、overlap−extension PCRによりアセンブリ、配列番号11、69のプライマーセットを使って、SV40 promoter、dhfr遺伝子、ピューロマイシン耐性遺伝子、N4配列から成るDNA断片を調製した。このDNA断片をKpnI、Csp45Iで消化し、pEHXのKpnI、Csp45Iサイトに挿入し、pEHX−dhfr・Puro・N4を構築した。
【0145】
(2)抗KOD抗体発現ベクター:pELH2−dhfr・Puro・N4(KOD3G8)の構築
続いて、抗KOD抗体発現系で遺伝子増幅の効果を確認すべく、pELH2−dhfr・Puro・N4(KOD3G8)を構築した。
【0146】
まず、pEHX−dhfr・Puro・N4の制限酵素MluI、NotIサイトに抗KOD抗体の重鎖遺伝子を挿入し、pEH−dhfr・Puro・N4(KOD3G8)を構築した。具体的には、実施例1−1に記載のpEF1α−KOD3G8HCから配列番号20,21のプライマーを用いてPCRで増幅し、制限酵素MluI、NotIで処理して調製した抗KOD抗体の重鎖遺伝子を、pEHX−dhfr・Puro・N4の制限酵素MluI、NotIサイトに導入して、pEH−dhfr・Puro・N4(KOD3G8)を構築した。
【0147】
そして、図17に示すスキームに従って、実施例1−4に記載のpEL2(KOD3G8)をBglII、EcoRI、ScaIで処理して調製した抗KOD抗体の軽鎖発現カセットを、pEH−dhfr・Puro・N4(KOD3G8)の制限酵素BglII、EcoRIサイトに挿入し、pELH2−dhfr・Puro・N4(KOD3G8)を構築した。
【0148】
実施例3−2
抗KOD抗体発現系においてピューロマイシンで選択して取得したポリクローンの細胞の生産性評価
dhfr遺伝子をピューロマイシン耐性遺伝子の上流に配置した効果を抗KOD抗体発現系で検討した。dhfr遺伝子をピューロマイシン耐性遺伝子の上流に配した抗KOD抗体発現用シングルベクターとして、実施例3−1で構築したpELH2−dhfr・Puro・N4(KOD3G8)を、dhfr遺伝子をピューロマイシン耐性遺伝子の下流に配した抗KOD抗体発現用シングルベクターとして、実施例2−1で構築したpELH2−Puro・dhfr・N4(KOD3G8)を用いた。制限酵素AhdIでリニアライズしたプラスミド1.6μgを、実施例2−2に記載の方法で準備しておいたCHO/dhfr−細胞にトランスフェクションし、24時間インキュベートした。翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、7.5μg/ml Puromycin、10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で2週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、ピューロマイシンで選択して取得したポリクローンの細胞でのKOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。
【0149】
標準品から作成した検量線をもとに抗体生産量を算出した。結果を図18に示す。dhfr遺伝子をピューロマイシン耐性遺伝子の下流に配したpELH2−Puro・dhfr・N4(KOD3G8)、および、dhfr遺伝子をピューロマイシン耐性遺伝子の上流に配置したpELH2−dhfr・Puro・N4(KOD3G8)の抗体生産量は共に7mg/Lと高い値であった。また、両者に差は認められず、dhfr遺伝子とピューロマイシン耐性遺伝子はどちらが上流に配置された場合でも、ピューロマイシンで選択後に高発現細胞集団の取得が可能であることがわかった。
【0150】
実施例3−3
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞の生産性評価
【0151】
続いて、モノクローンでの生産性を比較すべく、限界希釈を行った。具体的には、前記実施例3−2で取得したpELH2−dhfr・Puro・N4(KOD3G8)を遺伝子導入し、ピューロマイシンで選択して取得したポリクローンの細胞を、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、0.75細胞/ウェルの濃度で96ウェルプレートに播き込んだ。2週間培養後、培養上清を回収し、KOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。標準品から作成した検量線をもとに各クローンの抗体生産量を算出した。そして、選択した発現量上位クローンを拡大培養した後、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、ピューロマイシンで選択して取得したモノクローンの細胞でのKOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。
【0152】
標準品から作成した検量線をもとに各クローンの抗体生産量を算出した。結果を図19に示す。その結果、ポリクローンでの結果と同様、dhfr遺伝子をピューロマイシン耐性遺伝子の上流に配置したpELH2−dhfr・Puro・N4(KOD3G8)では、発現量が高いクローンを取得でき、その値は最大で22mg/Lに達した。
【0153】
実施例3−4
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞を、更にMTXで選択して取得したポリクローンの細胞の生産性評価
【0154】
次に、前記実施例3−3で取得した、pELH2−dhfr・Puro・N4(KOD3G8)を遺伝子導入し、ピューロマイシンで選択して取得した発現量上位10クローンについて、7.5μg/ml Puromycin、透析した10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で2週間継代培養した。その後、更に、10nM MTX(シグマ社製)、7.5μg/ml Puromycin、透析した10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で6週間選択培養を行った。
【0155】
選択培養終了後、得られたポリクローンの細胞を2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、MTXで選択して取得したポリクローンの細胞でのKOD3G8抗体の生産量を、前記実施例2−2と同様の方法でELISAにて測定した。
【0156】
標準品から作成した検量線をもとに抗体濃度を算出した。結果を図20に示す。その結果、pELH2−Puro・dhfr・N4(KOD3G8)の場合と同様に、dhfr遺伝子をピューロマイシン耐性遺伝子の上流に配したpELH2−dhfr・Puro・N4(KOD3G8)でも、MTX選択によって発現量の上昇が見られ、最も生産性の高いものは35mg/Lであった。以上より、ピューロマイシン耐性遺伝子とdhfr遺伝子の配置順序に関わらず、ピューロマイシン耐性遺伝子とdhfr遺伝子を融合させて選択遺伝子とし、更にその3‘末端にmRNA不安定化配列を付加して弱化させた発現カセットを使用することで、ピューロマイシンで選択後に高発現細胞株を取得でき、かつ、この細胞株をMTXで選択培養することで、更に発現量を上昇させることが可能であった。
【0157】
実施例4
無血清馴化CHO/dhfr−細胞を用いた、抗KOD抗体発現系における、dhfr遺伝子とピューロマイシン耐性遺伝子の融合タンパク質遺伝子とmRNA不安定化配列の組み合わせ効果の検討
次に、あらかじめ無血清馴化したCHO/dhfr−細胞を用いて、下流にmRNA不安定化配列を付加したdhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の効果を検討した。
【0158】
実施例4−1
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞の生産性評価
【0159】
1xYeastolate UF溶液(SAFC Biosciences社)、1xHTサプリメント、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells(Irvine Scientific社)を用いて、CHO/dhfr−細胞を無血清馴化した。無血清馴化したCHO/dhfr−細胞を2.5X105cells/mlになるように、1xHTサプリメントを添加したOpti−MEM I Reduced−Serum Mediumに懸濁し、超低接着表面24ウェルプレート(Corning Life Science社)の2ウェルに1mlずつ播種した。
【0160】
一方、実施例3−2で調製した制限酵素AhdIでリニアライズしたpELH2−dhfr・Puro・N4(KOD3G8)3μgを400μl Opti−MEM I Reduced−Serum Mediumで希釈した後、Lipofectamine LTX 10μlを加え、30分間放置した。その後、半量ずつ前記の2ウェルの無血清馴化したCHO/dhfr−細胞に加え、24時間インキュベートした。トランスフェクションの1日後、細胞を回収して800gX3分間遠心して上清を除去し、4mlの1xYeastolate UF溶液、1xHTサプリメント、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地に懸濁し、7.5μg/ml Puromycinを加え、選択培養した。
【0161】
選択培養終了後、10%牛胎児血清、4mM Glutamine、1xHTサプリメントを添加したIscove’s Modified Dulbecco’s Mediumを使用して、ポリクローンの細胞を12ウェルプレートに播き込み、接着状態で培養した。2日間培養後、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、0.75細胞/ウェルの濃度で96ウェルプレートに播き込み、接着状態で限界希釈を行った。2週間培養後、培養上清を回収し、KOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。標準品から作成した検量線をもとに各クローンの抗体生産量を算出した。そして、選択した発現量上位クローンについて、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1xYeastolate UF溶液、1xHTサプリメント、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地を用いて、浮遊状態で拡大培養を行った後、1ウェル当たり4.0×105細胞を超低接着表面6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、ピューロマイシンで選択して取得したモノクローンの細胞でのKOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。更に、標準品から作成した検量線をもとに算出した抗体生産量、3日間培養後に計数した細胞数から、1細胞、1日あたりの生産性(pcd:pg/cell/day)を算出した。結果を図21に示す。その結果、あらかじめ無血清馴化したCHO/dhfr−細胞を宿主に用いた場合でも、ピューロマイシンで選択後に高発現株を取得することができた。
【0162】
実施例4−2
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞を、更にMTXで選択して取得したポリクローンの細胞の生産性評価
【0163】
次に、前記実施例4−1で取得した、pELH2−dhfr・Puro・N4(KOD3G8)を遺伝子導入し、ピューロマイシンで選択して取得した発現量上位10クローンについて、7.5μg/ml Puromycin、1xYeastolate UF溶液、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地で2週間継代培養した。その後、まずは、7.5μg/ml Puromycin、3nM MTX、1xYeastolate UF溶液、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地で、続いて、7.5μg/ml Puromycin、10nM MTX、1xYeastolate UF溶液、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地で、更に、7.5μg/ml Puromycin、30nM MTX、1xYeastolate UF溶液、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地で、計6週間選択培養を行った。
【0164】
選択培養終了後、得られたポリクローンの細胞について、1ウェル当たり4.0×105細胞を超低接着表面6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、MTXで選択して取得したポリクローンの細胞でのKOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。更に、標準品から作成した検量線をもとに算出した抗体生産量、3日間培養後に計数した細胞数から、1細胞、1日あたりの生産性(pcd:pg/cell/day)を算出した。結果を図22に示す。以上より、あらかじめ無血清馴化したCHO/dhfr−細胞を宿主に用いた場合でも、ピューロマイシン耐性遺伝子とdhfr遺伝子を融合させて選択遺伝子とし、更にその3‘末端にmRNA不安定化配列を付加して弱化させた発現カセットを使用することで、ピューロマイシンで選択後に高発現細胞株を取得でき、かつ、この細胞株をMTXで選択培養することで、更に発現量を上昇させることが可能であった。
【産業上の利用可能性】
【0165】
本発明の薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターは、目的タンパク質遺伝子のクローニングから組換えタンパク質の生産性の高い細胞を樹立するに至るまでを、迅速、かつ効率よく行うために大いに効果を発揮する。従って、本発明の発現ベクターを使用した細胞発現システムは、種々の動物細胞、特に哺乳類動物細胞のタンパク質の機能解析は勿論、バイオ医薬品として創薬・医療などの産業界に寄与することが大である。
【技術分野】
【0001】
本発明は、形質転換細胞の中から目的とするタンパク質の遺伝子を高レベルで発現する細胞を効率よく樹立するための発現ベクター、及び形質転換された高生産性細胞に関する。本発明の発現ベクターは、遺伝子工学的手法により、動物細胞、特に哺乳類動物細胞において医薬品などの有用タンパク質を生産するために有用である。
【背景技術】
【0002】
組換えタンパク質を産生する細胞を樹立する方法としては、一般に、目的タンパク質の遺伝子を発現する遺伝子構築物を宿主細胞へ遺伝子導入し、得られた形質転換細胞の中からこの遺伝子構築物が宿主細胞のゲノム上に安定導入された細胞を選別する。この際、前記遺伝子構築物に、薬剤選択マーカーとなる薬剤耐性遺伝子を目的タンパク質の遺伝子と同一プロモーター下あるいは別個のプロモーター下で発現するように挿入しておき、薬剤選択によって生き残った細胞を目的タンパク質の遺伝子が安定導入された細胞として選別する。本発明者らは、薬剤選択マーカーの発現を減弱化するmRNA不安定化配列を発明し、薬剤選択の効果を飛躍的に向上させることに成功した(特許文献1)。
【0003】
さらに、ゲノム導入部位の位置効果による発現低下を低減させるため、本発明者らは遺伝子発現安定化エレメントを発明し、高発現を長時間維持することができた。さらに、mRNA不安定化配列と遺伝子発現安定化エレメントを組み合わせることにより、その相乗効果によって、目的遺伝子を高度に発現する細胞を効率的に選択し、かつそれらの高発現細胞の安定的な維持ができた(特許文献2)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特許第4491808号
【特許文献2】特許第4525863号
【特許文献3】国際公開第2010/023787号
【非特許文献】
【0005】
【非特許文献1】Bakheet T,Frevel M,Williams B.R.G、 Greer W,Khabar K.S.A.(2001)Nucleic Acids Research 29:246−254
【非特許文献2】Lagnado C.A,Brown C.L,Goodall G.J.(1994) Molecular and Cellular Biology 14:7984−7995
【非特許文献3】Zubiaga A.M,Belasco J.G,Greenberg M.E.(1995) Molecular and Cellular Biology 15:2219−2230
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の目的は、動物細胞、特に哺乳類動物細胞において、組換えタンパク質の生産性の高い細胞を迅速、かつ効率よく樹立するのに効果的な発現ベクター、及び高生産性細胞を提供することにある。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するため鋭意検討した結果、mRNA不安定化配列を含む薬剤選択マーカー遺伝子、及び遺伝子発現安定化エレメントを有する発現ベクターにさらに遺伝子増幅を誘起するシステムを組み合わせることにより、これらの相乗効果によって目的タンパク質の生産量が飛躍的に向上することを見出し、本発明に至った。
【0008】
本発明の特徴は、薬剤選択マーカー遺伝子の発現カセットとジヒドロ葉酸還元酵素遺伝子の発現カセットを独立に存在させるのではなく、薬剤選択マーカー遺伝子とジヒドロ葉酸還元酵素遺伝子を1つの発現カセットで発現させたことである。
【0009】
すなわち、以下の発明が提供される。
【0010】
[1] 発現ベクター
[1−1]
下記(1)〜(3)を少なくとも有する発現ベクター。
(1)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、
(2)遺伝子発現安定化エレメント、及び
(3)目的タンパク質遺伝子発現カセット
[1−2]
下記(1)〜(3)を少なくとも有する発現ベクター
(1)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、
(2)遺伝子発現安定化エレメント、及び
(3)目的タンパク質遺伝子発現カセット
[1−3]
mRNA不安定化配列が、サイトカイン、インターロイキン、又は癌原遺伝子の3’非翻訳領域に存在するATリッチ配列に由来することを特徴とする[1−2]に記載の発現ベクター。
[1−4]
mRNA不安定化配列が、TTATTTA(A/T)(A/T)のモチーフ配列を有することを特徴とする[1−2]に記載の発現ベクター。
[1−5]
モチーフ配列が、2回以上繰り返されていることを特徴とする[1−4]に記載の発現ベクター。
[1−6]
モチーフ配列の繰り返し間に1塩基以上のスペーサー配列を含むことを特徴とする[1−5]に記載の発現ベクター。
[1−7]
mRNA不安定化配列中に1ないし数塩基の置換、挿入または欠失を含むことを特徴とする[1−3]〜[1−6]のいずれかに記載の発現ベクター。
[1−8]
遺伝子発現安定化エレメントが以下のいずれかである、[1−1]〜[1−7]のいずれかに記載の発現ベクター。
(I)配列番号15で示す配列のうち41601〜46746番目までの配列からなるDNA、もしくは41601〜46746番目までの配列の部分配列であって少なくとも41601〜42700番目までの配列を含む塩基配列からなるDNA
(II)上記(I)の配列と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ遺伝子発現安定化機能を有する塩基配列からなるDNA
(III)上記(I)または(II)の配列と相補的な塩基配列からなるDNA
[1−9]
遺伝子発現安定化エレメントを2つ以上含む、[1−1]〜[1−8]のいずれかに記載の発現ベクター。
[1−10]
薬剤選択マーカー遺伝子が、タンパク質合成阻害系抗生物質耐性遺伝子である、[1−1]〜[1−9]のいずれかに記載の発現ベクター。
[1−11]
薬剤選択マーカー遺伝子がピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼ及びネオマイシンホスホトランスフェラーゼからなる群より選択される、[1−10]に記載の発現ベクター。
[1−12]
目的タンパク質の遺伝子発現カセットが、所望の目的タンパク質遺伝子を挿入するためのマルチクローニングサイトを備えていることを特徴とする[1−1]〜[1−11]のいずれかに記載の発現ベクター。
[1−13]
目的タンパク質遺伝子が抗体の重鎖及び/または軽鎖ポリペプチド遺伝子である、[1−1]〜[1−12]のいずれかに記載の発現ベクター。
【0011】
[2] 発現カセット
[2−1]
薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット。
【0012】
[3] 高生産細胞の作製方法
[3−1]
以下の工程を含む、高生産細胞を作製する方法。
(a)[1−1]〜[1−13]のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
[3−2]
以下の工程を含む、高生産細胞を作製する方法。
(a)[1−1]〜[1−13]のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞をヒポキサンチンおよびチミジン不含培地で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
[3−3]
以下の工程を含む、高生産細胞を作製する方法。
(a)[1−1]〜[1−13]のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を、ヒポキサンチンおよびチミジンを含まず、かつ薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
[3−4]
[3−1]〜[3−3]のいずれかに記載の方法において、(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程、及び(d)高発現を示す細胞株を単離する工程を複数回繰り返す、高生産細胞を作製する方法。
[3−5]
宿主細胞が哺乳類動物細胞由来の細胞である、[3−1]〜[3−4]のいずれかに記載の高生産細胞を作製する方法。
[3−6]
宿主細胞がチャイニーズハムスター卵巣(CHO)由来の細胞である、[3−1]〜[3−4]のいずれかに記載の高生産細胞を作製する方法。
[3−7]
宿主細胞がジヒドロ葉酸還元酵素遺伝子欠損細胞である、[3−1]〜[3−4]のいずれかに記載の高生産細胞を作製する方法。
[3−8]
宿主細胞が無血清馴化された細胞である、[3−1]〜[3−4]のいずれかに記載の高生産細胞を作製する方法。
【0013】
[4]高生産細胞
[4−1]
[3−1]〜[3−7]のいずれかに記載の方法により得られた高生産細胞。
【0014】
[5]高生産細胞を用いて生産する方法
[5−1]
[3−1]〜[3−7]のいずれかに記載の方法により得られた高生産細胞を用いてポリペプチドを生産する方法。
[5−2]
[3−1]〜[3−7]のいずれかに記載の方法により得られた高生産細胞を用いて抗体を生産する方法。
[5−3]
[3−1]〜[3−7]のいずれかに記載の方法により得られた高生産細胞を用いてワクチンを生産する方法。
【発明の効果】
【0015】
本発明では、薬剤選択によって形質転換細胞を薬剤選択するとともに、細胞の培養工程中にメトトレキセート(MTX)に代表される薬剤を存在させ、遺伝子増幅を引き起こすことにより、宿主細胞に多数の遺伝子コピーを有する細胞株を作出することができる。しかしながら、発現ベクターに発現カセットを複数存在させた場合、転写干渉が生じることにより各発現カセットの発現量が低下し、各遺伝子の機能が十分に発揮されない。この転写干渉は、目的タンパク質の発現にも影響を及ぼし、全体としてタンパク質生産性の低下を招く。そこで本発明は、薬剤選択マーカー遺伝子とジヒドロ葉酸還元酵素遺伝子を隣接させ、いわゆる融合遺伝子として1つの発現カセットで発現させることにより、転写干渉を低減させて、より生産性を向上させることができる。
【0016】
本発明の別の態様においては、薬剤選択マーカー遺伝子及びジヒドロ葉酸還元酵素遺伝子を含む発現カセットにmRNA不安定化配列が挿入されているため、mRNA不安定化配列を有さない従来の薬剤選択マーカー遺伝子発現カセットに比べて薬剤選択マーカーの発現が減弱化されており、宿主細胞ゲノム内の高発現領域に組み込まれないと、薬剤存在下で形質転換細胞の生存が困難となる。このため、薬剤選択マーカー遺伝子及び目的タンパク質遺伝子が宿主細胞ゲノム内の高発現領域に組み込まれた形質転換細胞のみが薬剤選択によって生き残ることができる。また、遺伝子増幅についても、少量のMTX等の薬剤で最大の効果を得ることができる。その結果、目的タンパク質遺伝子を高レベルで発現する高発現細胞を効率的に選別することができる。
【0017】
本発明の遺伝子発現安定化エレメントにより、細胞ゲノムにおける組換えタンパク質遺伝子への隣接染色体や調節エレメントの影響を低減させて、組換えタンパク質遺伝子の遺伝子発現を安定化し、高発現を長期間維持することができる。そこで本発明は、これらの相乗効果によって、非常に高いレベルのタンパク質生産性を示す高生産細胞株を迅速、容易、且つ効率的に樹立することができる。
【0018】
すなわち本発明によれば、目的タンパク質遺伝子が宿主細胞の高発現領域に導入されている特長、高発現領域に導入された目的タンパク質遺伝子が多数の遺伝子コピーを有している特長、これらの遺伝子発現が安定している特長を有する高生産性細胞を極めて迅速、容易、且つ効率的に樹立することができる。
【図面の簡単な説明】
【0019】
【図1】pPUR・N4の構築を示す図である。以下、図中、Purとは、ピューロマイシン耐性遺伝子のことである。また、図中、iPCRとは、Inverse PCRのことである。
【図2】pEF1α−KOD3G8HC−RE2の構築を示す図である。以下、図中、Neoとは、ネオマイシン耐性遺伝子のことである。
【図3】pEF1α−SNAP26m−Pur・N4及びpEF1α−SNAP26m−Pur−RE2の構築を示す図である。
【図4】pEF1α−KOD3G8HC−1.1k/1.1kの構築を示す図である。
【図5】pEF1α−SNAP26m−Pur・N4−1.1k/1.1k、pEF1α−SNAP26m−Pur−1.1k/1.1kの構築を示す図である。
【図6】pEHXのベクターマップを示す図である。
【図7】pELXのベクターマップを示す図である。
【図8】pELX2のベクターマップを示す図である。
【図9】pEHX−dhfr・N4のベクターマップを示す図である。
【図10】pEHX−Puro・dhfr、pEHX−Puro・dhfr・N4の構築を示す図である。
【図11】pELH2−dhfr・N4(KOD3G8)の構築を示す図である。
【図12】pELH2−Puro・dhfr(KOD3G8)、pELH2−Puro・dhfr・N4(KOD3G8)の構築を示す図である。
【図13】ピューロマイシン耐性遺伝子、dhfr遺伝子のそれぞれについて、下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Pur・N4+dhfr・N4)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の発現カセットを含むもの(Puro・dhfr)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Puro・dhfr・N4)、について、ポリクローンの培養上清を用いてELISAを行い算出した、抗体生産量をプロットしたグラフである。
【図14】6ウェルプレートの培養上清を用いてELISAを行い算出した、各クローンの抗体生産量をプロットしたグラフである。ピューロマイシン耐性遺伝子、dhfr遺伝子のそれぞれについて、下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Pur・N4+dhfr・N4)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の発現カセットを含むもの(Puro・dhfr)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Puro・dhfr・N4)、について、それぞれ生産量上位5クローンをプロットしている。
【図15】6ウェルプレートの培養上清を用いてELISAを行い算出した、MTXでの選択培養後のポリクローンでの抗体生産量をプロットしたグラフである。ピューロマイシン耐性遺伝子、dhfr遺伝子のそれぞれについて、下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Pur・N4+dhfr・N4)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の発現カセットを含むもの(Puro・dhfr)、ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Puro・dhfr・N4)、について、それぞれピューロマイシンで選択して取得した生産量上位10クローンをMTXで選択培養後に得られた細胞集団の、生産量上位5クローンの結果をプロットしている。
【図16】pEHX−dhfr・Puro・N4の構築を示す図である。
【図17】pELH2−dhfr・Puro・N4(KOD3G8)の構築を示す図である。
【図18】ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(Puro・dhfr・N4)、dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(dhfr・Puro・N4)について、ポリクローンの培養上清を用いてELISAを行い算出した、抗体生産量をプロットしたグラフである。
【図19】dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(dhfr・Puro・N4)について、6ウェルプレートの培養上清を用いてELISAを行い各クローンの抗体生産量を算出し、生産量上位5クローンをプロットしたグラフである。
【図20】6ウェルプレートの培養上清を用いてELISAを行い算出した、MTXで選択後のポリクローンの細胞集団の抗体生産量をプロットしたグラフである。dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(dhfr・Puro・N4)について、ピューロマイシンで選択して取得した生産量上位10クローンをMTXで選択培養後に得られた細胞集団の、生産量上位5クローンの結果をプロットしている。
【図21】6ウェルプレートの培養上清を用いてELISAを行い算出した、ピューロマイシンで選択後の高発現株の1細胞、1日あたりの抗体生産量をプロットしたグラフである。dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(dhfr・Puro・N4)について、無血清馴化されたCHO/dhfr−細胞へ遺伝子導入し、ピューロマイシンで選択して取得した生産量上位5クローンの結果をプロットしている。
【図22】6ウェルプレートの培養上清を用いてELISAを行い算出した、MTXで選択後のポリクローンの細胞集団の1細胞、1日あたりの抗体生産量をプロットしたグラフである。dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の下流にmRNA不安定化配列(N4配列)を付加した発現カセットを含むもの(dhfr・Puro・N4)について、無血清馴化されたCHO/dhfr−細胞へ遺伝子導入し、ピューロマイシンで選択して取得した生産量上位10クローンをMTXで選択培養後に得られた細胞集団の、生産量上位5クローンの結果をプロットしている。
【発明を実施するための形態】
【0020】
以下に本発明を詳細に説明する。
【0021】
本発明の第一の側面によれば、(1)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、(2)遺伝子発現安定化エレメント、及び(3)目的タンパク質遺伝子発現カセットを少なくとも有することを特徴とする発現ベクターが提供される。
【0022】
本発明の第二の側面によれば、(1)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、(2)遺伝子発現安定化エレメント、及び(3)目的タンパク質遺伝子発現カセットを少なくとも有することを特徴とする発現ベクターが提供される。
【0023】
本発明において、発現カセットとは、プロモーターから遺伝子コード配列、ターミネーター配列(ポリアデニレーションシグナル)までの遺伝子発現の単位をいう。加えて、イントロン、スペーサー配列、翻訳増強領域等を含むこともある。したがって、例えば「目的タンパク質遺伝子発現カセット」という場合、前記発現カセットの遺伝子コード配列が目的とするタンパク質の遺伝子のコード配列であるものをいう。
【0024】
(薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット)
【0025】
薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットとは、薬剤選択マーカー遺伝子及びジヒドロ葉酸還元酵素遺伝子を遺伝子コード配列として含む発現カセットをいう。
【0026】
本発明の薬剤選択マーカー遺伝子を用いた薬剤選択に使用される薬剤としては、タンパク質合成阻害系抗生物質としてブラストサイジン(Blasticidin)、ジェネティシン(Geneticin)(G418)、ハイグロマイシン(Hygromycin;Hyg)、ピューロマイシン(Puromycin;Pur)が例示される。また、本発明の薬剤選択マーカー遺伝子としては、薬剤選択に一般的に使用される薬剤に対して耐性を示す遺伝子が好適に用いられる。タンパク質合成阻害系抗生物質を薬剤として用いる場合には、タンパク質合成阻害系抗生物質耐性遺伝子を用いることが好ましい。特に限定されるものではないが、ネオマイシン耐性遺伝子(ジェネティシン耐性遺伝子としての機能も有する)として、Tn5由来ネオマイシンホスホトランスフェラーゼ(aminoglycoside 3’−phosphotransferase)(Neo)、ハイグロマイシン耐性遺伝子として、E.coli由来ハイグロマイシン−B−ホスホトランスフェラーゼ(Hph、実施例および図面ではHygと記載)、ピューロマイシン耐性遺伝子として、Streptomyces由来ピューロマイシン−N−アセチルトランスフェラーゼ遺伝子(pac、実施例および図面ではPurと記載)、ブラストサイジン耐性遺伝子として、Bacillus cereus由来ブラストサイジン耐性遺伝子(bsr)などが例示される。これらの中でも、ピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼ、ネオマイシンホスホトランスフェラーゼが好ましく、より好ましくはピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼであり、さらに好ましくはピューロマイシン−N−アセチルトランスフェラーゼである。
【0027】
ジヒドロ葉酸還元酵素(DHFR/dhfr)は核酸の生合成に必須の酵素であり、dhfr遺伝子を欠損する細胞は核酸を含まない培地で生育できない。dhfr遺伝子を欠損する細胞を、dhfr遺伝子を有する発現ベクターで形質転換すると、核酸要求性が回復した形質転換体を得ることができる。
【0028】
細胞ゲノムにおいて、外から適当な圧力をかけると、特定の遺伝子の重複(増幅)が選択的に起こり安定化することが知られている。dhfr遺伝子を有する発現ベクターで形質転換された培養細胞にDHFRの拮抗阻害剤であるメトトレキセート(Methotrexate、MTX)を加えると、ほとんどの細胞は死んでしまうがごくまれに生き残るものがある。このような細胞はdhfr遺伝子のコピー数が増加しており、大量のDHFRを合成できるため、MTXに阻害されないDHFRが、細胞が生き続け増殖するのに必要なテトラヒドロ葉酸を作り出すことができる。段階的に選択を続けると、通常は1もしくは数コピーしかないdhfr遺伝子が最終的には100〜1000倍にも増幅された変異細胞を得ることができる。動物細胞において遺伝子増幅が起こる場合、選択圧をかけたdhfr遺伝子そのものだけでなく、その遺伝子の近傍に存在する他の遺伝子も同時に増幅されるので、結果として目的タンパク質遺伝子も同時に増幅される。
【0029】
本発明におけるdhfr遺伝子は公知のものを使用することができ、由来は限定されないが、マウス由来のdhfr遺伝子が好ましい。dhfr遺伝子は市販のベクターから入手することができ、pSV2−dhfr(ATCC 37146)やpOptiVEC−TOPO(登録商標)(インビトロジェン社)が例示されるが、人工合成により入手することもできる。
【0030】
薬剤選択マーカー遺伝子とdhfr遺伝子が「隣接して存在する」とは、薬剤選択マーカー遺伝子とdhfr遺伝子を融合タンパク質として発現させることを意味し、上流側の遺伝子の終止コドンを削除することで成し遂げられる。薬剤選択マーカー遺伝子とdhfr遺伝子との間は、例えばグリシン・セリンリンカー等の実質的に機能を持たない配列が存在してもよいし、配列を存在させず直接つなげてもよい。下流側の遺伝子から開始コドンのメチオニンをコードするATG配列を除去することも好ましい。
【0031】
薬剤選択マーカー遺伝子とdfhr遺伝子の配置順序はいずれでもよい。
【0032】
本発明の薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットにおけるプロモーターとしては、動物細胞、特に哺乳類細胞で発現可能なプロモーターであれば特に限定されるものではないが、ヒトやマウスのサイトメガロウイルス(CMV)プロモーター、サルウイルス40(SV40)プロモーター、ヒトヘルペス単純ウイルスのチミジンキナーゼ遺伝子(HSV−tk)プロモーター、などのウイルスに由来するものや、マウスphosphoglycerate−kinase1遺伝子(PGK)プロモーターなどの非ウイルス性の細胞遺伝子に由来するプロモーター、及び由来の異なるプロモーターのハイブリッドが挙げられる。ここで、プロモーターは、プロモーターのコア領域に限るものではなく、エンハンサー領域を含む場合もある。薬剤選択マーカーの発現を減弱化するため、転写活性が低いものがより好ましい。転写活性の低いプロモーターとして変異型のプロモーターなどを利用してもよいし、コザック配列を置換してもよい。さらに、mRNA不安定化配列のモチーフ配列の繰り返しの回数を少なくし、転写活性の弱いプロモーターを併用するのも1つの想定される実施態様である。
【0033】
本発明の薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットにおけるポリアデニレーションシグナル(ターミネーター配列)としては、SV40ウイルス由来late polyAシグナル、early polyAシグナル、HSV−tk由来polyAシグナル、ウシ成長因子遺伝子由来polyAシグナル、ウサギβ−グロビン遺伝子由来polyAシグナルなどが例示されるが、特に限定されるものではない。
【0034】
本発明の薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット中でのプロモーター、薬剤選択マーカー遺伝子及びdhfr遺伝子、並びにポリアデニレーションシグナルの配置順序は、薬剤選択マーカー遺伝子及びdhfr遺伝子の発現が可能である限り特に限定されないが、一般的にプロモーター、薬剤選択マーカー遺伝子及びdfhr遺伝子、並びにポリアデニレーションシグナルをこの順序で上流から下流に向かって配置する。これらの三つの要素は、相互に直接連結されている必要はなく、所望により、イントロン、スペーサー配列、翻訳増強領域等を間に有していてもよい。
【0035】
(薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット)
本発明で使用する発現カセットは、mRNA不安定化配列を有することを除いては、前記薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットと同様の構成を有する。そこで、mRNA不安定化配列について説明する。
【0036】
「mRNA不安定化配列」とは、この配列を有するDNAから転写されたmRNAの細胞内半減期を低減させる機能を有するヌクレオチド配列のことであり、自然界では初期応答遺伝子などに存在することが見出されている。
【0037】
mRNA不安定化配列は、いくつかの遺伝子ではコード配列中、あるいは5’UTR(非翻訳領域)に存在するものもあるが、多くは3’UTRに存在する。3’UTRに存在するmRNA不安定化配列としては、AU−rich element(ARE)、histone mRNA 3’−terminal stem−loop、iron−responsive element(IRE)、insulin−like growth factor II(IGF−II)、long stem−loopなどが知られている。これらの中でもAREは、恒常的にmRNAを不安定化できることから、本発明に用いるmRNA不安定化配列として好ましい。
【0038】
AREとは、mRNAにおける「AUが豊富なエレメント」、すなわちアデニン(A)及びウラシル(U)を高い割合で含む配列もしくは領域を意味する。またAREとは、前記エレメントをコードするDNAにおける「ATが豊富なエレメント」、すなわちアデニン(A)及びチミン(T)を高い割合で含む配列もしくは領域を指すためにも用いられる。
【0039】
AREは、造血細胞増殖因子遺伝子、成長因子遺伝子、インターロイキン遺伝子、インターフェロン等のサイトカイン遺伝子、及びいくつかの癌原遺伝子(プロトオンコジーン)などに見られる(非特許文献1)。本発明の発現カセットでは、これらの遺伝子中のAREに相当する核酸配列をそのまま利用してもよいが、ARE中のモチーフ配列として知られるTATTTAT(非特許文献2)やTTATTTA(T/A)(T/A)(非特許文献3)などを利用する方が、不要な制限酵素認識配列を発現ベクターに挿入してしまうことを避けることができ、利便性が高い。
【0040】
AREを持つ遺伝子の例としては、造血細胞増殖因子についてはGranulocyte−monocyte colony sitimulationg factor(GM−CSF),インターロイキンについてはInterleukin−1β、2,3、4、6、8、10、11、インターフェロンについてはInterferon−α、癌原遺伝子についてはc−fos,c−myc,c−jun,c−myb,Pim−1などが例示される。このほかにもTumor necrosis factor,Cyclin D1,Cyclooxygenase,Plasminogen activator inhibitor type2など多くの遺伝子がAREを持つことが知られており、例示された遺伝子に限定されない。
【0041】
本発明おいて使用することができるmRNA不安定化配列としては、下記のものが例示される。
ATTTのモチーフ配列の1ないし2回以上の繰り返し。
ATTTAのモチーフ配列の1ないし2回以上の繰り返し。
TATTTATのモチーフ配列の1ないし2回以上の繰り返し。
TTATTTA(T/A)(T/A)のモチーフ配列の1ないし2回以上の繰り返し。
(T/A)はTまたはAのいずれかである。
【0042】
これらの配列は、1ないし数塩基の置換/挿入/欠失を含んでもよく、DNAの複製の誤りや突然変異などの自然変異によるもの、人為的な変異導入によるもの等が想定される。また、モチーフ配列の繰り返し間には1〜100塩基程度のスペーサー配列またはリンカー配列を含んでもよい。加えて、モチーフ配列の逆位を含むものであってもよい。
【0043】
これらのモチーフ配列の繰り返し数は、1回でもよいが、2回以上、より好ましくは4回以上とすることにより、mRNAの不安定化効果を一層高めることができ、選別効率を顕著に増大させることができる。
【0044】
繰り返しの回数の上限は特に限定されないが、細胞へのベクターの取り込みの観点から、発現ベクターが最大10kbp〜25kbp長となるようなものが望ましい。ただし、繰り返し配列数が増えるにしたがって、mRNAの不安定化の効果は飽和に向かい、一定の繰り返し数を超えるとそれ以上の顕著な効果を望めなくなる。上限値を定めるものではないが、10回以上の繰り返し配列は実用上意味がない。
【0045】
本発明の薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット中でのプロモーター、薬剤選択マーカー遺伝子及びdhfr遺伝子、mRNA不安定化配列、並びにポリアデニレーションシグナルの配置順序は、薬剤選択マーカー遺伝子及びdhfr遺伝子の発現が可能である限り特に限定されないが、一般的にプロモーター、薬剤選択マーカー遺伝子及びdfhr遺伝子、mRNA不安定化配列、並びにポリアデニレーションシグナルをこの順序で上流から下流に向かって配置する。これらの四つの要素は、相互に直接連結されている必要はなく、所望により、イントロン、スペーサー配列、翻訳増強領域等を間に有していてもよい。
【0046】
(遺伝子発現安定化エレメント)
本発明における「遺伝子発現安定化エレメント」とは、目的タンパク質遺伝子発現カセットが宿主ゲノムに挿入された部位近傍のゲノムの転写の活性化の状況に影響を受けてしまう、という位置効果を解消し、遺伝子発現を安定化する機能を有する核酸領域を意味する。
【0047】
遺伝子発現を安定化する機能を有する核酸配列としては、インスレーター、スキャフォールド/マトリックス結合領域(S/MAR)、遺伝子座調節領域(LCR)、遍在作用性クロマチンオープニングエレメント(UCOE)などが利用できる。
【0048】
インスレーターとしては、ニワトリβ-グロビンLCRに由来する1.2kb DNaseI Hypersensitive site(cHS4),バフンウニ由来UR1などが例示される。S/MARとしては、ニワトリリゾチーム5’MARエレメント、ヒトβ−グロビンMARエレメントやヒトインターフェロンβSARエレメントなどが例示される。
【0049】
目的遺伝子を宿主細胞ゲノムへ導入するための遺伝子構築物として、プラスミドベクターが一般に用いられるが、プラスミドベクターの長さは最大10ないし25kbpであることから、遺伝子発現安定化エレメントの鎖長は出来るだけ短い方が好ましい。好ましい長さとしては5kbp以下、より好ましくは1kbp程度である。
【0050】
本発明における実施態様では、遺伝子発現安定化エレメントとして、下記(a)〜(e)のいずれか又はその組み合わせが使用できる。
【0051】
(a)配列番号15で示す配列からなるDNA;
(b)配列番号15で示す配列の部分配列からなるDNAであって、配列番号15で示す配列のうち41820番目から41839番目までの塩基で示す領域の配列を少なくとも含むDNA;
(c)配列番号15で示す配列の部分配列からなるDNAであって、配列番号15で示す配列のうち41821番目から41840番目までの塩基で示す領域の配列を少なくとも含むDNA;
(d)配列番号15で示す配列の部分配列からなるDNAであって、配列番号15で示す配列のうち45182番目から45200番目までの塩基で示す領域の配列を少なくとも含むDNA;及び
(e)配列番号15で示す配列の部分配列からなるDNAであって、配列番号15で示す配列のうち91094番目から91113番目までの塩基で示す領域の配列を少なくとも含むDNA。
【0052】
本発明の遺伝子発現安定化エレメントの好ましい態様では、前記(b)または(c)のDNAは、配列番号15で示す配列のうち41601番目から46746番目までの塩基配列で示す領域、又は配列番号15で示す配列のうち41601番目から46746番目までの配列と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ遺伝子発現安定化機能を有する塩基配列領域である。また、これらの領域からなるDNAと相補的な塩基配列も含まれる。本発明の遺伝子発現安定化エレメントのさらに好ましい態様では、前記(b)または(c)のDNAは、(1)配列番号15で示す配列のうち41601〜46746番目までの配列からなるDNA、もしくは41601〜46746番目までの配列の部分配列であって少なくとも41601〜42700番目までの配列を含む塩基配列からなるDNA、又は(2)(1)で示すDNAと相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ遺伝子発現安定化機能を有する塩基配列からなるDNAであり、又は(3)これらの領域からなるDNAと相補的な塩基配列からなるDNAである。
【0053】
これらのエレメントは、発明者らがCHOゲノム(CHO DR1000L−4N株)から単離同定したものであるが(特許文献3)、これらのエレメントと相同なエレメントは、他の哺乳類細胞ゲノムにも存在することが予想される。従って、(f)配列番号15で示す配列の部分配列からなるDNAであって、宿主細胞中で外来遺伝子発現カセットと近接するように配置された際に、外来遺伝子発現カセットに含まれる外来遺伝子から目的組換えタンパク質の発現を増大または安定化させることができるDNAも、遺伝子発現安定化エレメントとして使用することができる。このような相同エレメントは、この技術分野の周知の技術、例えば、種間ハイブリダイゼーションまたはPCRなどによって容易に単離同定されることができる。
【0054】
また、(g)前記(a)〜(f)のいずれかのDNAと相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ遺伝子発現安定化機能を有するDNAも当然、遺伝子発現安定化エレメントとして使用することができる。本発明の遺伝子発現安定化エレメントは、これらの(a)〜(g)のいずれか一つ又はそれらの任意の組合せからなる。さらに、(h)前記(a)〜(g)のいずれかのDNAと相補的な塩基配列からなるDNAも、遺伝子発現安定化機能を有し、遺伝子発現安定化エレメントとして使用することができるため、本発明に含まれる。
【0055】
ストリンジェントな条件とは、用いられるプローブ・標識方法によっても異なるが、例えば、0.1%SDSを含む0.2×SSC中40〜50℃または0.1%SDSを含む2×SSC中55〜65℃の条件下ハイブリダイズする塩基配列である。さらにストリンジェントな条件は、結合する核酸の融解温度(Tm値)に基づいて決定することができる。また、ハイブリダイズ後の洗浄条件として、「6×SSC、0.1%SDS、Tm値よりも約15〜30℃低い温度」程度の条件をあげることができる。より高いストリンジェントな条件としては「2×SSC、0.1%SDS、Tm値よりも約5〜15℃低い温度」程度、更に高いストリンジェントな条件としては「1×SSC、0.1%SDS、Tm値よりも約5〜15℃低い温度」程度の洗浄条件をあげることができる。更に高いストリンジェントな条件としては「0.1×SSC、0.1%SDS」程度の洗浄条件が例示される。
【0056】
本発明の遺伝子発現安定化エレメントがその発現安定化効果を奏するためには、エレメントが宿主細胞ゲノム中で目的タンパク質遺伝子発現カセットの導入部位に近接する位置に配置されることが必要である。本発明において、用語「近接する」とは、特に制限されるものではないが、好ましくは本発明の遺伝子発現安定化エレメントと目的タンパク質遺伝子発現カセットとの間の距離が5000bp以下、さらに好ましくは500bp以下であることを意味する。
【0057】
このような近接配置は、本発明のエレメントを含む核酸配列断片と、外来遺伝子の発現カセットを含む核酸配列断片との混合物をエレクトロポレーションやトランスフェクションなどによって宿主細胞内へ導入し、外来遺伝子の発現量の高い宿主細胞クローンを選択することによって実現することもできるが、近接配置を確実に達成させるためには、本発明の遺伝子発現安定化エレメント、及びそれに近接して配置された外来遺伝子発現カセットを含む外来遺伝子発現ベクターをあらかじめ作成しておき、この発現ベクターで宿主細胞を形質転換させることが望ましい。
【0058】
(目的タンパク質遺伝子発現カセット)
本発明における目的タンパク質遺伝子の発現カセットは、プロモーター、遺伝子コード配列、及びターミネーター配列(ポリアデニレーションシグナル)からなる。加えて、イントロンやスペーサー配列、翻訳増強領域を含むこともある。目的タンパク質遺伝子の発現プロモーターとしてはできるだけ転写活性の高いものが好ましく、ヒトやマウスのサイトメガロウイルス(CMV)プロモーター、サルウイルス40(SV40)プロモーターなどのウイルスに由来するものや、ヒトやマウス、さらにはCHO由来のElongation Factor 1(EF1α)遺伝子、ユビキチン遺伝子、β−アクチン遺伝子など、非ウイルス性の細胞遺伝子に由来するプロモーター、及び由来の異なるプロモーター/エンハンサーのハイブリッド、例えばCAGプロモーターなどが挙げられる。
【0059】
目的タンパク質遺伝子発現カセットには、該タンパク質遺伝子のコード配列の代わりに、複数の制限酵素認識配列からなるマルチクローニングサイトを配置することができる。外来遺伝子のcDNAやコード配列を導入する際に、クローニング作業が簡便であり、好ましい。
【0060】
他の実施態様としては、目的タンパク質が抗体の重鎖及び/または軽鎖のポリペプチドである、目的タンパク質遺伝子発現カセットである。この場合、目的タンパク質遺伝子の発現カセットは、複数配置してもよく、あるいは複数のポリペプチド遺伝子をIRESでつなぎ、ポリシストロン性の1つの発現カセットの形でもよい。
【0061】
(発現ベクター)
本発明において、発現ベクターとは、遺伝子工学に利用されるベクターである。発現ベクターは、プラスミドベクターであることができる。しかし、これに限らず、例えば、ウイルスベクター、コスミドベクター、細菌人工染色体(BAC)、酵母人工染色体(YAC)及び他の非プラスミドベクターも使用できる。
【0062】
本発明における発現ベクターの実施態様の1つは、目的タンパク質遺伝子発現カセット、薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットが配置されており、その上流若しくは下流に、遺伝子発現安定化エレメントが配置された発現ベクターである。好ましくは、目的タンパク質遺伝子発現カセット、薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットの上流に、遺伝子発現安定化エレメントが配置された発現ベクターである。この場合、目的タンパク質遺伝子発現カセットと薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットとはいずれが上流であってもよいが、好ましくは目的タンパク質遺伝子発現カセットが上流に配置されたものである。
【0063】
本発明における発現ベクターの好ましい実施態様は、目的タンパク質遺伝子発現カセット、薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットが配置されており、その上流及び下流に、それらの発現カセットを挟むように遺伝子発現安定化エレメントが配置されたベクターである。目的タンパク質遺伝子発現カセット、薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットの順序は問わないが、目的タンパク質遺伝子発現カセットが上流に配置されていることが好ましい。
【0064】
遺伝子発現安定化エレメントは、目的タンパク質遺伝子発現カセットと薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットとの間に配置されていてもよい。
【0065】
遺伝子発現安定化エレメント、目的タンパク質遺伝子発現カセット、および薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットとの間は、隣接していてもよいし、スペーサー配列等が挿入されていてもよい。
【0066】
薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットは、1つのベクターに2つ以上含まれていても良い。この場合、同一の薬剤選択マーカーが選ばれる場合もあるし、それぞれ異なる薬剤選択マーカーが選ばれる場合もある。また、各発現カセットは隣接して配置されても良いし、離れて配置されていても良い。
【0067】
目的タンパク質が抗体の重鎖、軽鎖のように複数のポリペプチドからなる場合、目的タンパク質遺伝子の発現カセットを複数配置してもよく、あるいは複数のポリペプチド遺伝子をIRESでつなぎ、ポリシストロン性の1つの発現カセットの形にしてもよい。
【0068】
また、複数のポリペプチド発現カセットをそれぞれ異なるベクターに挿入し、それぞれのベクターを1つの宿主細胞へ導入して形質転換細胞を作製し、目的タンパク質を生産することができる。この場合、各ベクターに遺伝子発現安定化エレメント及び/または薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットを配置することができ、それぞれ同一の薬剤選択マーカーを用いることもできるが、異なる薬剤選択マーカーを用いる方が、各ポリペプチドが全て高発現を示す細胞を効率よく取得する点で有利であり、好ましい。
【0069】
抗体を生産する場合、抗体の重鎖ポリペプチド遺伝子と軽鎖ポリペプチド遺伝子をそれぞれ異なるベクターに挿入して発現させてもよいが、抗体の重鎖ポリペプチド遺伝子と軽鎖ポリペプチド遺伝子とを同一のベクターに挿入して発現させると、同一ベクター上の一種類の薬剤耐性遺伝子を使うことになり導入遺伝子数の差異を軽減でき、抗体の重鎖ポリペプチドと軽鎖ポリペプチドの生産バランスがとれ、重鎖・軽鎖の2つのポリペプチドが2本ずつから成る抗体としての生産性が安定するため、好ましい。
【0070】
本発明の第三の側面では、薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセットのみを提供する。これは、本発明の発現ベクターに限らず、いずれの発現ベクターにも適用できるものである。
【0071】
本発明の第四の側面によれば、以下の工程を含む、高生産細胞を作製する方法が提供される。
(a)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【0072】
本発明の側面の別の実施形態は、以下の工程を含む、高生産細胞を作製する方法である。
(a)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞をヒポキサンチンおよびチミジン不含培地で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【0073】
本発明の側面のさらなる別の実施形態は、以下の工程を含む、高生産細胞を作製する方法である。
(a)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を、ヒポキサンチンおよびチミジンを含まず、かつ薬剤存在下で培養する工程
(d)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(e)高発現を示す細胞株を単離する工程。
【0074】
前記実施形態と同様、下記の工程を含む高生産細胞を作製する方法も提供される。
(a)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【0075】
(a)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞をヒポキサンチンおよびチミジン不含培地で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【0076】
(a)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を、ヒポキサンチンおよびチミジンを含まず、かつ薬剤存在下で培養する工程
(d)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(e)高発現を示す細胞株を単離する工程。
【0077】
前記実施形態において、(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程、及び(d)高発現を示す細胞株を単離する工程は複数回繰り返すことができる。
【0078】
宿主細胞としては、組換えタンパク質の産生に一般的に用いられるチャイニーズハムスター卵巣細胞(CHO)の他、マウスミエローマ細胞(NSO)、ベビーハムスターキドニー細胞(BHK)、ヒト繊維肉腫細胞(HT1080)、COS細胞などの哺乳類由来の細胞が例示されるが、チャイニーズハムスター卵巣細胞(CHO)が好適に使用される。
【0079】
宿主細胞がジヒドロ葉酸還元酵素遺伝子を欠損した細胞でなくても遺伝子増幅を含む本発明の効果を得ることができるが、dhfr遺伝子を有する発現ベクターにより形質転換された細胞のみが生き残れるようにするため、宿主細胞はdhfr遺伝子欠損細胞を用いることが好ましい。dhfr遺伝子欠損細胞の具体例としては、CHO DG44細胞やCHO DUKX−B11細胞、CHO/dhfr−細胞などがある。
【0080】
一般にバイオ医薬品などの工業生産には、ウイルスなどの有害成分の混入を排除するため、動物成分を含まない培地、より好ましくは化学的に組成の明らかな(Chemically Defined)な培地で生産細胞を培養することが求められる。このため、一般的に使用されるウシ胎児血清などを含有した培地で高生産細胞をスクリーニングした後、1〜2ヶ月程度かけて動物成分非含有培地やChemically Definedとされる培地へ細胞を適応させること(無血清馴化)が必要とされる。しかしながら、せっかく取得した高生産性細胞も上手く馴化できないケースもある。そこで、あらかじめ無血清馴化された細胞に遺伝子導入することは、無血清馴化工程を省略して生産細胞の樹立時間を短縮でき、非常に有効である。このような課題達成のため、本発明に用いられる宿主細胞には、CHO細胞等における無血清馴化済み細胞を使用することがさらに例示される。
【0081】
宿主細胞の形質転換方法は、当業者であれば適宜選択しうるが、例えばリポフェクション法、リン酸カルシウム法、エレクトロポレーション法、DEAEデキストラン法、マイクロインジェクション等が挙げられる。
【0082】
形質転換された細胞を薬剤存在下で培養する工程において、薬剤選択に使用する薬剤は、薬剤選択マーカー遺伝子の種類に応じて決定される。また、使用する薬剤の濃度としては、一般に使用される濃度の範囲で高発現細胞の濃縮が可能であるが、少し高めの濃度が好ましい。最適な濃度は、宿主細胞や用いる培地の種類によって変化する。これらの濃度の設定方法は当業者にとっては公知であり、適宜設定しうる。例えば、10%ウシ胎児血清を含むIMDM培地での培養条件下で、ピューロマイシン耐性遺伝子、ジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列をこの順で含む発現カセットを有する発現ベクターで形質転換されたCHO/dhfr−細胞に対するピューロマイシンの濃度としては、5μg/ml以上が好ましく、7.5μg/ml以上がより好ましく、上限として15μg/ml以下が好ましい。同様に、ジヒドロ葉酸還元酵素遺伝子、ピューロマイシン耐性遺伝子及びmRNA不安定化配列をこの順で含む発現カセットを有する発現ベクターで形質転換されたCHO/dhfr−細胞に対するピューロマイシンの濃度としては、5μg/ml以上が好ましく、7.5μg/ml以上がより好ましく、上限として10μg/ml以下が好ましい。
【0083】
本方法を使用した選別方法では、薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセットを有する発現ベクターで形質転換した細胞の方が、薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含み、mRNA不安定化配列を含まない発現カセットを有する発現ベクターを形質転換して薬剤選択を行った細胞群に比べて、目的タンパク質遺伝子を高レベルで発現する細胞の割合が有意に高くなる。本発明によれば、薬剤選択マーカーのmRNA不安定化を含む薬剤選択のみによって、選別の候補となるサンプル数を大幅に絞ることができる。本発明の選別方法を用いれば、薬剤選択後も生存する細胞群(ポリクローン)の状態で目的タンパク質生産量が有意に上昇していて、これらの細胞群から細胞を単離し、培養することにより、容易に高発現を示す細胞株(モノクローン)を取得することができる。本発明の実施態様の一例として、4.0×105個の細胞に本発明の薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセットが挿入されたベクターを遺伝子導入した後、薬剤選択を行って生じた細胞群から100の細胞株をランダムに選択して、個々の細胞株の発現量を調べることにより目的タンパク質の高発現株を容易に取得することができる。
【0084】
本発明の一部の実施形態において、形質転換された細胞をヒポキサンチンおよびチミジン(HT)不含培地中で培養する工程が含まれる。dhfr遺伝子欠損細胞は、細胞増殖のためにヒポキサンチンおよびチミジンを必要とし、培地にヒポキサンチンおよびチミジンを添加しなければ生育することができない。したがって、ヒポキサンチンおよびチミジン不含培地で培養することによって、dhfr遺伝子を含む発現ベクターにより形質転換が成功した細胞を選択することができる。ヒポキサンチンおよびチミジンの濃度は当業者であれば適宜設定しうる。
【0085】
本発明は、形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程を含む。MTXはDHFRの拮抗阻害剤であり、MTX耐性を獲得しなければ細胞は生育することはできない。一般的に、動物細胞はdhfr遺伝子の遺伝子増幅によりMTX耐性を獲得するが、その際にdhfr遺伝子近傍に存在する他の遺伝子も同時に増幅されることを出願人らは利用している。MTXの濃度は1nM〜1000nMの間で使用することが望ましい。1nM未満であれば遺伝子増幅の効果が小さく、1000nMより高い濃度では細胞が死滅してしまう。MTXの存在下で培養する工程は、一定のMTXの濃度下で培養しても良いし、まず低いMTX濃度で培養し、その後段階的に濃度を上昇させて培養しても良い。遺伝子増幅はすべての細胞に同時に起こるのではなく、一部の細胞でさまざまなタイミングで起こるため、MTXの濃度は低い濃度から段階的に上昇させることが好ましい。形質転換細胞を多段階のMTXの濃度で培養する場合、宿主細胞をいきなり高濃度のMTXにさらせば、遺伝子増幅が起こる前に死滅する細胞が多くなる。また、MTXの濃度を急激に上昇させれば、遺伝子増幅以外の機構でMTX耐性を獲得する細胞の出現頻度が高まる。
【0086】
最適なMTX濃度および最適なMTX濃度を上昇させる方法は、細胞の種類、薬剤選択マーカー遺伝子の種類、薬剤選択マーカー遺伝子とジヒドロ葉酸還元酵素遺伝子の配置、mRNA不安定化配列の有無により異なる。薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセットを有する発現ベクターで宿主細胞を形質転換する場合、DHFRの発現量はmRNA不安定化配列により減弱されている。MTX耐性も減弱されているため、mRNA不安定化配列を有さない薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセットを有する発現ベクターで形質転換された細胞に比べて低濃度のMTXで遺伝子増幅の効果を得ることができる。一例として、ピューロマイシン耐性遺伝子、ジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列をこの順で含む発現カセットを有する発現ベクターで形質転換された細胞を培養する場合は、MTX濃度は20nM以下が好ましい。多段階のMTXの濃度で培養する場合は、例えば1段階目は4nM、2段階目は10nM、3段階目は20nMで培養することができる。
【0087】
MTX存在下で培養する工程は、形質転換細胞を薬剤存在下で培養する工程を行った後に行うことが好ましい。薬剤選択により、細胞の高発現領域に遺伝子導入された細胞群を取得することができるため、薬剤存在下で培養する工程の後に本工程をおこなうことにより、遺伝子増幅が高発現領域内で起こることになり、より効率的に遺伝子発現することを期待できるからである。
【0088】
高生産を示す細胞株を単離する工程は、まず細胞群(ポリクローン)から細胞株を取得し、次いで細胞株の発現レベルを調べ、高生産を示す細胞株を選択することにより行われる。細胞群(ポリクローン)から細胞株を取得する方法としては、ポリクローンを限界希釈する方法がある。限界希釈は、例えばポリクローンの状態の細胞集団にトリプシン処理を行って細胞を分散し、細胞数が1.0/ウェル以下の濃度となるよう96ウェルプレートに細胞を播種し培養することにより行うことができる。必要に応じて、希釈濃度を変更したり(例えば3.0細胞/ウェル以下の濃度など)、Conditioned Mediumと通常の培地を混合した培地で培養したりすることが当業者間では行われる。
【0089】
細胞の発現レベルはレポーター遺伝子の発現量により調べることができる。一例として、SNAP26m遺伝子(Covalys社)やGFP(Green Fluorescent Protein)遺伝子等の蛍光タンパク質遺伝子を含む発現カセットを本発明の発現ベクターに導入し、FACS(fluorescence activated cell sorting)等のフローサイトメーターを用いて蛍光強度を解析することにより調べることができる。別の例として、ルシフェラーゼ遺伝子を含む発現カセットを本発明による発現ベクターに導入後、細胞溶解液にD−ルシフェリンを添加してルミノメーターで発光量を測定することにより調べることができる。また、レポーター遺伝子に限らず、ELISA(Enzyme−Linked Immunosorbent Assay)、酵素免疫測定法(EIA)等を利用することで抗体等の目的タンパク質の発現を調べることもできる。
【0090】
本工程は、形質転換された細胞を薬剤存在下で培養する工程の後、もしくは形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程の後、または両工程の後のどの段階で行ってもよい。
【0091】
本発明の第四の側面における高生産細胞を作製する方法をより具体的に例示する。
【0092】
第一の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞を薬剤(例えば、ジェネティシン)存在下で培養する。(3)高発現を示すポリクローン(細胞群)を選択し、MTX存在下で培養する。(4)MTX存在下で培養後さらに高発現を示すポリクローンを選択し、モノクローン(細胞株)に単離する。(5)それぞれの細胞株の発現量を調べ、高発現を示す細胞株を選択する。
【0093】
第二の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞を薬剤(例えば、ジェネティシン)存在下で培養する。(3)高い発現レベルを示すポリクローンを選択し、モノクローンに単離する。(4)それぞれの細胞株の発現量を調べ、高発現を示す細胞株を選択し、MTX存在下で培養する。(5)MTXで選択培養後の細胞集団を再度限界希釈して細胞株を単離し、一定期間培養する。(6)(5)で単離された細胞株の発現量を調べ、高発現を示す細胞株を選択する。
【0094】
第三の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞をヒポキサンチンおよびチミジン(HT)不含培地で培養する。(3)HT不含条件下で高発現を示すポリクローンを選択し、MTX存在下で培養する。(4)MTX存在下で培養後さらに高発現を示すポリクローンを選択し、モノクローンに単離する。(5)それぞれのモノクローンの発現量を調べ、高発現を示す細胞株を選択する。
【0095】
第四の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞を、ヒポキサンチンおよびチミジン(HT)を含まない培地で、薬剤(例えば、ジェネティシン)存在下で培養する。(3)高発現を示すポリクローンを選択し、MTX存在下で培養する。(4)MTX存在下で培養後さらに高発現を示すポリクローンを選択し、モノクローンに単離する。(5)それぞれの細胞株の発現量を調べ、高発現を示す細胞株を選択する。
【0096】
第五の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞を、ヒポキサンチンおよびチミジン(HT)を含まない培地で、薬剤(例えば、ジェネティシン)存在下で培養する。(3)高発現を示すポリクローンを選択し、モノクローンに単離する。(4)高発現を示す細胞株を選択し、MTX存在下で培養する。(5)MTXで選択培養後の細胞集団を再度限界希釈して細胞株を単離し、一定期間培養する。(6)(5)で単離された細胞株の発現量を調べ、高発現を示す細胞株を選択する。
【0097】
第六の例は、以下の手順で行う。(1)目的タンパク質遺伝子を挿入した本発明による発現ベクターをdhfr遺伝子欠損宿主細胞にトランスフェクションする。(2)形質転換された細胞を、ヒポキサンチンおよびチミジン(HT)を含まない培地で、薬剤(例えば、ジェネティシン)存在下で培養する。(3)高発現を示すポリクローンを選択し、モノクローンに単離する。(4)高発現を示す細胞株を選択し、MTX存在下で培養する。(5)MTXで選択培養後の細胞集団を再度限界希釈して細胞株を単離し、一定期間培養する。(6)(5)で単離された細胞株の発現量を調べ、高発現を示す細胞株を選択する。(7)再度MTX存在下で一定期間培養する。(8)(7)で単離された細胞株の発現量を調べ、高発現を示す細胞株を選択する。
【0098】
本発明により、細胞選別の工程及び時間を大幅に短縮することができると共に、高発現を示す細胞の割合が上昇することにより、短時間で効率的に目的タンパク質遺伝子を高レベルで発現する細胞を取得することができ、従来技術と比べて極めて顕著な効果を示す。
【0099】
本発明の第五の側面は、本発明の第四の側面における方法により得られた形質転換細胞である。
【0100】
本発明の第六の側面によれば、本発明の第四の側面における方法により得られた形質転換細胞を用いることを特徴とする、タンパク質を生産する方法が提供される。
【0101】
一つの実施態様では、生産されるタンパク質は、抗体である。この場合、抗体の重鎖ポリペプチド遺伝子と軽鎖ポリペプチド遺伝子は同一のベクター(シングルベクター)に挿入されていても良いし、それぞれ異なるベクターに挿入されて2コンストラクトとされていても良い。
【0102】
哺乳類の抗体には、IgM、IgD、IgG、IgA、IgEの5種類のクラスが存在することが明らかとなっているが、ヒトの各種疾患の診断、予防及び治療には血中半減期が長く、各種エフェクター機能を有する等の機能特性からヒトIgGクラスの抗体が主として利用されている。抗体は、形質転換細胞の培養上清よりプロテインAカラムを用いて精製することができる。また、その他に通常、タンパク質の精製で用いられる精製方法を使用することができる。例えば、ゲル濾過、イオン交換クロマトグラフィー及び限外濾過等を組み合わせて行い、精製することができる。精製したヒト化抗体のH鎖、L鎖或いは抗体分子全体の分子量は、二次元電気泳動等により測定することができる。
【0103】
本発明の方法により生産された抗体は、医薬として使用することができる。かかる医薬は、治療薬として単独で投与することも可能ではあるが、通常は薬理学的に許容される一つあるいはそれ以上の担体と一緒に混合し、製剤学の技術分野にて公知の任意の方法により製造した医薬製剤として提供されるのが好ましい。
【0104】
投与経路は、治療に際して最も効果的なものを使用するのが望ましく、経口投与、または口腔内、気道内、直腸内、皮下、筋肉内および静脈内等の非経口投与をあげることができ、抗体製剤の場合、好ましくは静脈内投与をあげることができる。投与形態としては、噴霧剤、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、座剤、注射剤、軟膏、テープ剤等があげられる。
【0105】
経口投与に適当な製剤としては、乳剤、シロップ剤、カプセル剤、錠剤、散剤、顆粒剤等があげられる。乳剤およびシロップ剤のような液体調製物は、水、ショ糖、ソルビトール、果糖等の糖類、ポリエチレングリコール、プロピレングリコール等のグリコール類、ごま油、オリーブ油、大豆油等の油類、p−ヒドロキシ安息香酸エステル類等の防腐剤、ストロベリーフレーバー、ペパーミント等のフレーバー類等を添加剤として用いて製造できる。カプセル剤、錠剤、散剤、顆粒剤等は、乳糖、ブドウ糖、ショ糖、マンニトール等の賦形剤、デンプン、アルギン酸ナトリウム等の崩壊剤、ステアリン酸マグネシウム、タルク等の滑沢剤、ポリビニルアルコール、ヒドロキシプロピルセルロース、ゼラチン等の結合剤、脂肪酸エステル等の界面活性剤、グリセリン等の可塑剤等を添加剤として用いて製造できる。
【0106】
非経口投与に適当な製剤としては、注射剤、座剤、噴霧剤等があげられる。注射剤は、塩溶液、ブドウ糖溶液、あるいは両者の混合物からなる担体等を用いて調製される。または、ヒト化抗体を常法に従って凍結乾燥し、これに塩化ナトリウムを加えることによって粉末注射剤を調製することもできる。座剤はカカオ脂、水素化脂肪またはカルボン酸等の担体を用いて調製される。また、噴霧剤は該化合物そのもの、ないしは受容者の口腔および気道粘膜を刺激せず、かつ該化合物を微細な粒子として分散させ吸収を容易にさせる担体等を用いて調製される。
【0107】
担体として具体的には乳糖、グリセリン等が例示される。該化合物および用いる担体の性質により、エアロゾル、ドライパウダー等の製剤が可能である。また、これらの非経口剤においても経口剤で添加剤として例示した成分を添加することもできる。
【0108】
別の実施態様では、生産されるタンパク質は、ワクチンである。
【0109】
ワクチンとしては、病原体のエピトープのアミノ酸配列からなるタンパク質をワクチンとして使用することができる。また、ウイルス体の構成タンパク質すべてを生産するのみならず、エンベロープタンパク等を生産し、ワクチンとして使用することができる。
【0110】
ワクチンは任意の経路の投与のための製剤とすることができる。粘膜型投与、例えば、経口経路、経鼻経路、経気道経路、経膣経路、経直腸経路の他、非粘膜経路による投与、例えば皮下、静脈内もしくは筋肉内投与のためのワクチン製剤が挙げられる。
【実施例】
【0111】
以下、実施例を例示することによって、本発明の効果をより一層明確なものとする。
【0112】
実施例1
各種プラスミドベクターの構築
実施例1−1
mRNA不安定化配列を有するベクター
(1)pPUR・N4の構築
図1に示すスキームに従って、pPUR(クロンテック社製)のPuromycin耐性遺伝子のコード配列の3‘末端に、配列番号1、2のプライマーとKOD −Plus− Mutagenesis Kit(東洋紡績社製)を用いたInverse PCR法によって、ARE配列モチーフTTATTTATTの4回繰り返し配列(以下、「N4」と言う。)を挿入してpPUR・N4を構築した。
【0113】
(2)pEF1α−SNAP26m−Pur・N4及びpEF1α−SNAP26m−Pur−RE2の構築
次に、目的遺伝子発現カセットのプロモーターをEF1αプロモーターに置換したプラスミドを構築した。本実験では、図2に示すスキームに従って構築されたプラスミドpEF1α−KOD3G8HC−RE2を利用した。即ち、まず、CMVプロモーターをEF−1αプロモーターに置換したpCI−neoプラスミド(プロメガ社製)の制限酵素XbaI−NotIサイトに抗KOD抗体の重鎖を挿入したプラスミドのpEF1α−KOD3G8HCを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号3、4のプライマーを使って発現カセット上流に制限酵素SalIおよびNheIサイトを付加したpEF1α−KOD3G8HC−REを構築した。更に本プラスミドを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号5、6のプライマーを使って発現カセット下流に制限酵素BsiWIおよびXhoIサイトを付加して構築されたプラスミドがpEF1α−KOD3G8HC−RE2である。
【0114】
このpEF1α−KOD3G8HC−RE2を用いて、図3に示すスキームに従って、プラスミドpEF1α−SNAP26m−Pur・N4およびpEF1α−SNAP26m−Pur−RE2を構築した。即ち、プラスミドpEF1α−KOD3G8HC−RE2から制限酵素EcoRI、NotIで抗KOD抗体の重鎖遺伝子を切出した。一方、SNAPm発現プラスミドpSNAPmからSNAP26m遺伝子を配列番号7、8のプライマーを用いてPCRで増幅し、pEF1α−KOD3G8HC−RE2プラスミドの制限酵素EcoRI、NotIサイトに導入してpEF1α−SNAP26m−Neo−RE2を構築した。本プラスミドから制限酵素AflII、BstBIでネオマイシン耐性遺伝子を切出した。一方、前記(1)で構築したpPUR・N4から下流にN4配列を付加したPuromycin耐性遺伝子を配列番号9,10のプライマーを用いてPCRで増幅し、pEF1α−SNAP26m−RE2プラスミドの制限酵素AflII、BstBIサイトに導入してpEF1α−SNAP26m−Pur・N4を構築した。続いて、本プラスミドを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号11、12のプライマーを使ってPuromycin耐性遺伝子下流のN4配列を削除したプラスミドpEF1α−SNAP26m−Pur−RE2を構築した。
【0115】
実施例1−2
mRNA不安定化配列と遺伝子発現安定化エレメントとを有するベクター
(1)pEF1α−SNAP26m−Pur・N4−1.1k/1.1kの構築
本実験では図4に記載のpEF1α−KOD3G8HC−1.1k/1.1kを利用した。即ち、まず、実施例1−1の途中で構築されたpEF1α−KOD3G8HC−RE2の発現カセット上流の制限酵素NheI、BglIIサイトに、配列番号13、14のプライマーセットを使ってPCRで増幅した被検配列CHO5Δ3−3(配列番号15の41601番目〜42700番目からなる塩基配列。以下、コンストラクト中では1.1kと表記)を挿入して、プラスミドpEF1α−KOD3G8HC−1.1kを構築した。更にプラスミドpEF1α−KOD3G8HC−1.1kの発現カセット下流の制限酵素BsiWI、XhoIサイトに配列番号16、17のプライマーセットを使ってPCRで増幅した被検配列CHO5Δ3−3を挿入して構築されたプラスミドがpEF1α−KOD3G8HC−1.1k/1.1kである。
【0116】
一方、実施例1−1で構築したプラスミドpEF1α−SNAP26m−Pur・N4およびpEF1α−SNAP26m−Pur−RE2を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号18、19のプライマーを使ってPuromycin耐性遺伝子内に存在する制限酵素BsiWIサイトを削除したプラスミドpEF1α−SNAP26m−Pur2・N4およびpEF1α−SNAP26m−Pur2−RE2を構築した。
【0117】
続いて、図5に示すスキームに従って、pEF1α−SNAP26m−Pur・N4−1.1k/1.1kを構築した。即ち、pEF1α−SNAP26m−Pur2・N4、から制限酵素EcoRI、BsiWIで、SNAPm−pA−SV40Promoter−Pur2・N4−pAを切出し、pEF1α−KOD3G8HC−1.1k/1.1kの制限酵素EcoRI、BsiWIサイトに導入してpEF1α−SNAP26m−Pur・N4−1.1k/1.1kを構築した。
【0118】
実施例1−3
発現ベクターにおける各配列要素から制限酵素認識配列を削除したベクター
(1)遺伝子発現安定化エレメントCHO5Δ3−3からの制限酵素認識配列の削除
続いて、遺伝子発現安定化エレメントCHO5Δ3−3から制限酵素認識配列を削除した。まず、実施例1−2に記載のpEF1α−KOD3G8HC−1.1kを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号22、23のプライマーを使ってCHO5Δ3−3内に存在する制限酵素SacIサイトを削除したpEF1α−KOD3G8HC−1.1k−ΔREを構築した。次に、pEF1α−KOD3G8HC−1.1k−ΔREを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号24、25のプライマーを使ってCHO5Δ3−3内に存在する制限酵素SmaIサイトを削除したpEF1α−KOD3G8HC−1.1k−ΔRE2を構築した。更に、pEF1α−KOD3G8HC−1.1k−ΔRE2を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号26、27のプライマーを使ってCHO5Δ3−3内に存在する制限酵素BamHIサイトを削除したpEF1α−KOD3G8HC−1.1k−ΔRE3を構築した。最後に、pEF1α−KOD3G8HC−1.1k−ΔRE3を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号28、29のプライマーを使ってCHO5Δ3−3内に存在する制限酵素HindIIIサイトを削除したpEF1α−KOD3G8HC−1.1k−ΔRE4を構築した。
【0119】
(2)pEHXの構築
マルチクローニングサイトと、上記実施例1−3(1)で作成した4箇所の制限酵素認識配列を削除した遺伝子発現安定化エレメントCHO5Δ3−3を発現カセット上流および下流に配する図6に記載のpEHXを構築した。具体的には、実施例1−2に記載のpEF1α−SNAP26m−Pur2・N4を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号30、31のプライマーを使ってSV40 promoter下流に存在する制限酵素HindIIIサイトを削除したpEF1α−SNAP26m−Pur2・N4−ΔHを構築した。続いて、pEF1α−SNAP26m−Pur2・N4−ΔHを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号32、33のプライマーを使ってPuromycin耐性遺伝子内に存在する制限酵素SalIサイトを削除したpEF1α−SNAP26m−Pur3・N4−ΔHを構築した。更に、pEF1α−SNAP26m−Pur3・N4−ΔHを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号34、35のプライマーを使ってPuromycin耐性遺伝子内に存在する制限酵素SmaIサイトを削除したpEF1α−SNAP26m−Pur4・N4−ΔHを構築した。その後、pEF1α−SNAP26m−Pur4・N4−ΔHを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号36、37のプライマーを使ってf1 oriを削除したpEF1α−SNAP26m−Pur4・N4−ΔH−Δf1を構築した。次に、pEF1α−SNAP26m−Pur4・N4−ΔH−Δf1を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号38、39のプライマーを使って制限酵素NheI、EcoRI、SpeIサイトを挿入したpEF1α−SNAP26m−Pur4・N4−ΔH−Δf1−REを構築した。続いて、pEF1α−SNAP26m−Pur4・N4−ΔH−Δf1−REを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号40、41のプライマーを使って制限酵素HindIII、BsiWI、XbaI、BclIサイトを挿入したpEF1α−MCSpre−Pur4・N4−ΔH−Δf1−REを構築した。そして、pEF1α−MCSpre−Pur4・N4−ΔH−Δf1−REのHindIII、XbaIサイトに、配列番号42、43のプライマーを混合後、95度から60度まで徐々に温度を下げアニールさせて作成したDNA断片を挿入し、pEF1α−MCS−Pur4・N4−ΔH−Δf1−REを構築した。次に、pEF1α−MCS−Pur4・N4−ΔH−Δf1−REのNheI、EcoRIサイトに、配列番号44、45のプライマーセットを使ってpEF1α−KOD3G8HC−1.1k−ΔRE4を鋳型にPCRで増幅した、4箇所の制限酵素認識配列を削除したCHO5Δ3−3を挿入し、pEF1α−MCS−Pur4・N4−1.1kを構築した。更に、pEF1α−MCS−Pur4・N4−1.1kのBamHI、XhoIサイトに、配列番号16、46のプライマーセットを使ってpEF1α−KOD3G8HC−1.1k−ΔRE4を鋳型にPCRで増幅した、4箇所の制限酵素認識配列を削除したCHO5Δ3−3を挿入し、pEHXを構築した。
【0120】
実施例1−4
抗体遺伝子を挿入した、各配列要素から制限酵素認識配列を削除したベクター
【0121】
(1)pELXの構築
マルチクローニングサイトを含む図7に記載のpELXを構築した。
【0122】
具体的には、CMVプロモーターをEF1αプロモーターに変更したpCI−neoプラスミド(プロメガ社製)の制限酵素XbaI−NotIサイトに抗KOD抗体の軽鎖を挿入したプラスミドのpEF1α−KOD3G8LCを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号3、4のプライマーを使って発現カセット上流に制限酵素SalIおよびNheIサイトを付加したpEF1α−KOD3G8LC−REを構築した。更に本プラスミドを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号5、6のプライマーを使って発現カセット下流に制限酵素BsiWIおよびXhoIサイトを付加して、pEF1α−KOD3G8LC−RE2プラスミドを構築した。このpEF1α−KOD3G8LC−RE2をAflII、BstBIで処理し、ネオマイシン耐性遺伝子を切出した。一方、pTK−Hyg(クロンテック社製)からハイグロマイシン耐性遺伝子を配列番号47、48のプライマーを使ってPCRで増幅し、pEF1α−KOD3G8LC−RE2の制限酵素AflII、BstBIサイトに導入してpEF1α−KOD3G8LC−Hyg−RE2を構築した。
【0123】
pEF1α−KOD3G8LC−Hyg−RE2を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号49、50のプライマーを使って制限酵素BglII、SalIサイトを挿入したpEF1α−KOD3G8LC−Hyg−RE3を構築した。続いて、pEF1α−KOD3G8LC−Hyg−RE3を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号51、52のプライマーを使って、f1 oriとハイグロマイシン耐性遺伝子の発現カセットを削除し、制限酵素EcoRI、SpeIサイトを挿入したpEF1α−KOD3G8LC−RE4を構築した。その後、pEF1α−KOD3G8LC−RE4を鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号40、41のプライマーを使って制限酵素HindIII、BsiWI、XbaI、BclIサイトを挿入したpEF1α−MCSpre−RE4を構築した。そして、pEF1α−MCSpre−RE4の制限酵素HindIII、XbaIサイトに、配列番号42、43のプライマーを混合後、95度から60度まで徐々に温度を下げアニールさせて作成したDNA断片を挿入し、pELXを構築した。
【0124】
(2)pELX2の構築
実施例1−4(1)で構築したpELXの発現カセット下流に、4箇所の制限酵素認識配列を削除した遺伝子発現安定化エレメントCHO5Δ3−3を配した、図8に記載のpELX2を構築した。具体的には、実施例1−4(1)で構築したpELXを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号51、53のプライマーを使って発現カセット下流に制限酵素NheIサイトを追加したpELX−Nを構築した。そして、pELX−NのNheI、EcoRIサイトに、配列番号13、54のプライマーセットを使って、実施例1−3で構築したpEF1α−KOD3G8HC−1.1k−ΔRE4を鋳型にPCRで増幅した、4箇所の制限酵素認識配列を削除したCHO5Δ3−3を挿入し、pELX2を構築した。
【0125】
(3)pEL2(KOD3G8)の構築
pELX2の制限酵素MluI、NotIサイトに、抗KOD抗体の軽鎖遺伝子を挿入しpEL2(KOD3G8)を構築した。具体的には、実施例1−4(1)に記載のpEF1α−KOD3G8LCから配列番号20,21のプライマーを用いてPCRで増幅し、制限酵素MluI、NotIで処理して調製した抗KOD抗体の軽鎖遺伝子を、pELX2の制限酵素MluI、NotIサイトに導入して、pEL2(KOD3G8)を構築した。
【0126】
実施例2
抗KOD抗体発現系における、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子とmRNA不安定化配列の組み合わせ効果の検討
続いて、dhfr遺伝子、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子、および、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子の下流にmRNA不安定化配列を付加したもの、それぞれの効果を比較検討するため、抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞を、更にMTXで選択して得られたポリクローンの細胞の生産性を評価した。
実施例2−1
dhfr遺伝子を有する発現ベクターの構築
(1)pEHX−dhfr・N4の構築
実施例1−3で構築したpEHXへdhfr遺伝子の発現カセットを挿入した、図9に記載のpEHX−dhfr・N4を構築した。具体的には、pEHXのBamHI、XhoIサイトに、配列番号55、56のプライマーセットを使ってpEHXを鋳型にPCRで増幅し、制限酵素BglII、XhoIで処理して調製したSV40 promoterを挿入し、pEHX−pを構築した。続いて、pEHX−pのBamHI、XhoIサイトに、配列番号57、58のプライマーセットを使って実施例1−3に記載のpEF1α−KOD3G8HC−1.1k−ΔRE4を鋳型にPCRで増幅し、制限酵素BamHI、SalIで処理して調製した、4箇所の制限酵素認識配列を削除したCHO5Δ3−3を挿入し、pEHX−p2を構築した。次に、pEHX−p2のBamHI、XhoIサイトに、配列番号59、60のプライマーセットを使ってpEHXを鋳型にPCRで増幅し、制限酵素BamHI、SalIで処理して調製したSV40 pAを挿入し、pEHX−p3を構築した。一方、dhfr遺伝子の3’末端にタンパク質分解促進配列のPEST配列を付加した配列番号61のDNAを人工合成して、プラスミドベクターpCR2.1−TOPO(インビトロジェン社製)にTOPO TAクローニングし、pCR2.1−dhfr・PESTを構築した。続いて、pCR2.1−dhfr・PESTを鋳型に、KOD −Plus− Mutagenesis Kitを用いたInverse PCR法によって、配列番号62、63のプライマーを使って、dhfr遺伝子の3’末端からPEST配列を削除しN4配列を付加したpCR2.1−dhfr・N4を構築した。そして、pEHX−p3のBamHI、XhoIサイトに、配列番号64、65のプライマーセットを使ってpCR2.1−dhfr・N4を鋳型にPCRで増幅し、制限酵素BglII、SalIで処理して調製したDNA断片を挿入し、pEHX−dhfr・N4を構築した。
【0127】
(2)ピューロマイシン耐性遺伝子(上流)とdhfr遺伝子(下流)の融合タンパク質遺伝子を有する発現ベクター:pEHX−Puro・dhfr、pEHX−Puro・dhfr・N4の構築
図10に示すスキームに従って、実施例1−3で構築したpEHX中の、N4配列を下流に付加したピューロマイシン耐性遺伝子の代わりに、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子、あるいは、N4配列を下流に付加したピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子を挿入した、pEHX−Puro・dhfr、および、pEHX−Puro・dhfr・N4を構築した。具体的には、まず、配列番号36、66のプライマーセットを使ってpEHXを鋳型にPCRで増幅したSV40 promoter、ピューロマイシン耐性遺伝子から成るDNA断片と、配列番号67、68、あるいは、配列番号67、69のプライマーセットを使ってpCR2.1−dhfr・N4を鋳型にPCRで増幅したdhfr遺伝子、あるいは、dhfr遺伝子、N4配列から成るDNA断片を、overlap−extension PCRによりアセンブリし、配列番号36、68、あるいは、配列番号36、69のプライマーセットを使って、SV40 promoter、ピューロマイシン耐性遺伝子、dhfr遺伝子から成るDNA断片、あるいは、SV40 promoter、ピューロマイシン耐性遺伝子、dhfr遺伝子、N4配列から成るDNA断片を調製した。これらのDNA断片をKpnI、Csp45Iで消化し、pEHXのKpnI、Csp45Iサイトに挿入し、pEHX−Puro・dhfr、および、pEHX−Puro・dhfr・N4を構築した。
【0128】
(3)抗KOD抗体発現ベクター:pELH2−dhfr・N4(KOD3G8)、pELH2−Puro・dhfr(KOD3G8)、pELH2−Puro・dhfr・N4(KOD3G8)の構築
続いて、抗KOD抗体発現系で遺伝子増幅の効果を確認すべく、pELH2−dhfr・N4(KOD3G8)、pELH2−Puro・dhfr(KOD3G8)、および、pELH2−Puro・dhfr・N4(KOD3G8)を構築した。
【0129】
まず、pEHX−dhfr・N4、pEHX−Puro・dhfr、および、pEHX−Puro・dhfr・N4の制限酵素MluI、NotIサイトに、それぞれ抗KOD抗体の重鎖遺伝子を挿入し、pEH−dhfr・N4(KOD3G8)、pEH−Puro・dhfr(KOD3G8)、および、pEH−Puro・dhfr・N4(KOD3G8)を構築した。具体的には、実施例1−1に記載のpEF1α−KOD3G8HCから配列番号20,21のプライマーを用いてPCRで増幅し、制限酵素MluI、NotIで処理して調製した抗KOD抗体の重鎖遺伝子を、pEHX−dhfr・N4、pEHX−Puro・dhfr、および、pEHX−Puro・dhfr・N4の制限酵素MluI、NotIサイトに導入して、pEH−dhfr・N4(KOD3G8)、pEH−Puro・dhfr(KOD3G8)、および、pEH−Puro・dhfr・N4(KOD3G8)を構築した。
【0130】
そして、図11に示すスキームに従って、実施例1−4に記載のpEL2(KOD3G8)をBglII、EcoRI、ScaIで処理して調製した抗KOD抗体の軽鎖発現カセットを、pEH−dhfr・N4(KOD3G8)の制限酵素BglII、EcoRIサイトに挿入し、pELH2−dhfr・N4(KOD3G8)を構築した。同様にして、図12に示すスキームに従って、pEL2(KOD3G8)をBglII、EcoRI、ScaIで処理して調製した抗KOD抗体の軽鎖発現カセットを、pEH−Puro・dhfr(KOD3G8)、および、pEH−Puro・dhfr・N4(KOD3G8)の制限酵素BglII、EcoRIサイトに挿入し、pELH2−Puro・dhfr(KOD3G8)、pELH2−Puro・dhfr・N4(KOD3G8)を構築した。
【0131】
実施例2−2
抗KOD抗体発現系においてピューロマイシンで選択して取得したポリクローンの細胞の生産性評価
【0132】
dhfr欠損株のCHO/dhfr−細胞(ATCC、CRL−9096)を1×105cells/mlに調整し、12ウェルプレートに2mlずつ前日に播種し、一晩培養して、トランスフェクション用のCHO/dhfr−細胞を準備した。この際、培地として10%牛胎児血清、4mM Glutamine(ナカライ社製)、1xHTサプリメント(インビトロジェン社製)を添加したIscove’s Modified Dulbecco’s Medium(シグマ社製)を使用した。
【0133】
一方、実施例2−1で構築した抗KOD抗体発現ベクターを制限酵素AhdIでリニアライズした。トランスフェクションは、リニア化したプラスミド1.6μgを200μl Opti−MEM I Reduced−Serum Mediumで希釈した後、Lipofectamine LTX(インビトロジェン社製)4μlを加え、30分間放置した後、この混合液を前記CHO/dhfr−細胞に加え、24時間インキュベートすることにより行った。トランスフェクションの1日後、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、10μg/ml Puromycin、10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で2週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。
【0134】
3日間培養後、培養上清を回収し、ピューロマイシンで選択して取得したポリクローンの細胞でのKOD3G8抗体の生産量をELISAにて測定した。標準品から作成した検量線をもとに抗体濃度を算出した。
【0135】
具体的には、30μg/ml濃度のKOD1由来のDNAポリメラーゼ抗原を固相化したELISAプレートに、培養上清を添加し、35℃で2時間インキュベートした。次に、PBS−T(0.1%Tween20含有リン酸緩衝生理食塩水)で3回洗浄し、10000倍希釈した抗マウス抗体−HRP(DAKO社製)を50μl添加して35℃で1時間インキュベートした後、さらにPBS−Tで3回洗浄し、TMB+(3,3’,5,5’−tetramethylbenzidine;DAKO社製)で5分間反応させた。50μlの1N硫酸を加えて反応停止後、プレートリーダー(製品名 ;SPECTRA CLASSIC、TECAN Auctria社製)(主波長450nm、副波長620nm)で吸光度を測定した。なお、標準品として、KOD1由来のDNAポリメラーゼに特異的な抗体を産生するマウスハイブリドーマ細胞系3G8(入手先:独立行政法人産業技術総合研究所 特許生物寄託センター、寄託番号:FERM BP−6056)から得られた抗体を用いた。
【0136】
結果を図13に示す。その結果、ピューロマイシン耐性遺伝子、dhfr遺伝子の両方の発現カセットを含むpELH2−dhfr・N4(KOD3G8)では、ピューロマイシン耐性遺伝子にmRNA不安定化配列を付加しているにも関わらず、発現量は低かった。発現量が低い原因として、4つの発現カセットを1つのコンストラクトにコードさせたことによる転写干渉が考えられた。一方、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子を採用したpELH2−Puro・dhfr(KOD3G8)では、発現カセットを3つに減らすことができ、pELH2−dhfr・N4(KOD3G8)と比較すると発現量は高い値となった。さらに、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子にmRNA不安定化配列を付加して弱化させたpELH2−Puro・dhfr・N4(KOD3G8)では、ポリクローンでの発現量は極めて高く、pELH2−dhfr・N4(KOD3G8)の約1.9倍、pELH2−Puro・dhfr(KOD3G8)の約1.5倍の生産量を示すことがわかった。
【0137】
実施例2−3
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞の生産性評価
【0138】
続いて、モノクローンでの生産性を比較すべく、限界希釈を行った。具体的には、前記実施例2−2で取得したKOD3G8抗体を安定導入したポリクローンの細胞を、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、0.75細胞/ウェルの濃度で96ウェルプレートに播き込んだ。2週間培養後、培養上清を回収し、KOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。標準品から作成した検量線をもとに各クローンの抗体生産量を算出した。そして、選択した発現量上位クローンを拡大培養した後、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、ピューロマイシンで選択して取得したモノクローンの細胞でのKOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。
【0139】
標準品から作成した検量線をもとに各クローンの抗体生産量を算出した。結果を図14に示す。その結果、ポリクローンでの結果と同様、ピューロマイシン耐性遺伝子、dhfr遺伝子の両方の発現カセットを含むpELH2−dhfr・N4(KOD3G8)では最大6mg/Lであったが、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子を採用したpELH2−Puro・dhfr(KOD3G8)では、最大10mg/Lであった。一方、ピューロマイシン耐性遺伝子とdhfr遺伝子の融合タンパク質遺伝子にmRNA不安定化配列を付加して弱化させたpELH2−Puro・dhfr・N4(KOD3G8)では、発現量がさらに顕著に高く、その値は最大で18mg/Lに達した。
【0140】
実施例2−4
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞を、更にMTXで選択して取得したポリクローンの細胞の生産性評価
【0141】
次に、前記実施例2−3で取得した、各々の抗KOD抗体発現ベクターを遺伝子導入し、ピューロマイシンで選択して取得した発現量上位10クローンずつについて、10μg/ml Puromycin、透析した10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で2週間継代培養した。その後、更に、10nM MTX(シグマ社製)、10μg/ml Puromycin、透析した10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で6週間選択培養を行った。
【0142】
選択培養終了後、得られたポリクローンの細胞を2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、MTXで選択して取得したポリクローンの細胞でのKOD3G8抗体の生産量を、前記実施例2−2と同様の方法でELISAにて測定した。
【0143】
標準品から作成した検量線をもとに抗体濃度を算出した。結果を図15に示す。その結果、pELH2−dhfr・N4(KOD3G8)では、MTXでの選択により2倍程度の発現量の上昇が見られたが、最も生産性の高いものでも11mg/Lであった。一方、pELH2−Puro・dhfr(KOD3G8)では、最も生産性の高いものでも12mg/Lであった。原因としては、dhfr遺伝子が弱化されていないため、MTX選択による発現量の上昇はあまり見られなかったと考えられる。他方、ピューロマイシンで選択した時点で発現量の高いクローンを取得できていたpELH2−Puro・dhfr・N4(KOD3G8)では、MTXでの選択により2倍程度の発現量の上昇が見られ、最も生産性の高いものは45mg/Lであった。ピューロマイシン耐性遺伝子とdhfr遺伝子を融合させて選択遺伝子とし、更にその3‘末端にmRNA不安定化配列を付加して弱化させた発現カセットを使用することで、相乗効果によって効果的に発現量の上昇が可能であった。
【0144】
実施例3
dhfr遺伝子とピューロマイシン耐性遺伝子の配置順序の検討
続いて、dhfr遺伝子とピューロマイシン耐性遺伝子の配置順序を検討するため、上流側にdhfr遺伝子を配置し下流側にピューロマイシン耐性遺伝子を配置した融合タンパク質遺伝子を有する発現ベクターを構築し、抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞を、更にMTXで選択して得られたポリクローンの細胞の生産性を評価した。
実施例3−1
dhfr遺伝子を有する発現ベクターの構築
(1)dhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子を有する発現ベクター:pEHX−dhfr・Puro・N4の構築
図16に示すスキームに従って、実施例1−3で構築したpEHX中の、N4配列を下流に付加したピューロマイシン耐性遺伝子の代わりに、N4配列を下流に付加したdhfr遺伝子とピューロマイシン耐性遺伝子の融合タンパク質遺伝子を挿入したpEHX−dhfr・Puro・N4を構築した。具体的には、まず、配列番号11、70のプライマーセットを使ってpEHX−dhfr・N4を鋳型にPCRで増幅したSV40 promoter、dhfr遺伝子から成るDNA断片と、配列番号69、71のプライマーセットを使ってpEHXを鋳型にPCRで増幅したN4配列を下流に付加したピューロマイシン耐性遺伝子を、overlap−extension PCRによりアセンブリ、配列番号11、69のプライマーセットを使って、SV40 promoter、dhfr遺伝子、ピューロマイシン耐性遺伝子、N4配列から成るDNA断片を調製した。このDNA断片をKpnI、Csp45Iで消化し、pEHXのKpnI、Csp45Iサイトに挿入し、pEHX−dhfr・Puro・N4を構築した。
【0145】
(2)抗KOD抗体発現ベクター:pELH2−dhfr・Puro・N4(KOD3G8)の構築
続いて、抗KOD抗体発現系で遺伝子増幅の効果を確認すべく、pELH2−dhfr・Puro・N4(KOD3G8)を構築した。
【0146】
まず、pEHX−dhfr・Puro・N4の制限酵素MluI、NotIサイトに抗KOD抗体の重鎖遺伝子を挿入し、pEH−dhfr・Puro・N4(KOD3G8)を構築した。具体的には、実施例1−1に記載のpEF1α−KOD3G8HCから配列番号20,21のプライマーを用いてPCRで増幅し、制限酵素MluI、NotIで処理して調製した抗KOD抗体の重鎖遺伝子を、pEHX−dhfr・Puro・N4の制限酵素MluI、NotIサイトに導入して、pEH−dhfr・Puro・N4(KOD3G8)を構築した。
【0147】
そして、図17に示すスキームに従って、実施例1−4に記載のpEL2(KOD3G8)をBglII、EcoRI、ScaIで処理して調製した抗KOD抗体の軽鎖発現カセットを、pEH−dhfr・Puro・N4(KOD3G8)の制限酵素BglII、EcoRIサイトに挿入し、pELH2−dhfr・Puro・N4(KOD3G8)を構築した。
【0148】
実施例3−2
抗KOD抗体発現系においてピューロマイシンで選択して取得したポリクローンの細胞の生産性評価
dhfr遺伝子をピューロマイシン耐性遺伝子の上流に配置した効果を抗KOD抗体発現系で検討した。dhfr遺伝子をピューロマイシン耐性遺伝子の上流に配した抗KOD抗体発現用シングルベクターとして、実施例3−1で構築したpELH2−dhfr・Puro・N4(KOD3G8)を、dhfr遺伝子をピューロマイシン耐性遺伝子の下流に配した抗KOD抗体発現用シングルベクターとして、実施例2−1で構築したpELH2−Puro・dhfr・N4(KOD3G8)を用いた。制限酵素AhdIでリニアライズしたプラスミド1.6μgを、実施例2−2に記載の方法で準備しておいたCHO/dhfr−細胞にトランスフェクションし、24時間インキュベートした。翌日、培地を除去し、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散させ、90mmペトリディッシュに移し、7.5μg/ml Puromycin、10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で2週間選択培養を行った。選択培養中、3〜4日ごとに培地を交換した。選択培養終了後、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、ピューロマイシンで選択して取得したポリクローンの細胞でのKOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。
【0149】
標準品から作成した検量線をもとに抗体生産量を算出した。結果を図18に示す。dhfr遺伝子をピューロマイシン耐性遺伝子の下流に配したpELH2−Puro・dhfr・N4(KOD3G8)、および、dhfr遺伝子をピューロマイシン耐性遺伝子の上流に配置したpELH2−dhfr・Puro・N4(KOD3G8)の抗体生産量は共に7mg/Lと高い値であった。また、両者に差は認められず、dhfr遺伝子とピューロマイシン耐性遺伝子はどちらが上流に配置された場合でも、ピューロマイシンで選択後に高発現細胞集団の取得が可能であることがわかった。
【0150】
実施例3−3
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞の生産性評価
【0151】
続いて、モノクローンでの生産性を比較すべく、限界希釈を行った。具体的には、前記実施例3−2で取得したpELH2−dhfr・Puro・N4(KOD3G8)を遺伝子導入し、ピューロマイシンで選択して取得したポリクローンの細胞を、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、0.75細胞/ウェルの濃度で96ウェルプレートに播き込んだ。2週間培養後、培養上清を回収し、KOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。標準品から作成した検量線をもとに各クローンの抗体生産量を算出した。そして、選択した発現量上位クローンを拡大培養した後、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、ピューロマイシンで選択して取得したモノクローンの細胞でのKOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。
【0152】
標準品から作成した検量線をもとに各クローンの抗体生産量を算出した。結果を図19に示す。その結果、ポリクローンでの結果と同様、dhfr遺伝子をピューロマイシン耐性遺伝子の上流に配置したpELH2−dhfr・Puro・N4(KOD3G8)では、発現量が高いクローンを取得でき、その値は最大で22mg/Lに達した。
【0153】
実施例3−4
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞を、更にMTXで選択して取得したポリクローンの細胞の生産性評価
【0154】
次に、前記実施例3−3で取得した、pELH2−dhfr・Puro・N4(KOD3G8)を遺伝子導入し、ピューロマイシンで選択して取得した発現量上位10クローンについて、7.5μg/ml Puromycin、透析した10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で2週間継代培養した。その後、更に、10nM MTX(シグマ社製)、7.5μg/ml Puromycin、透析した10%牛胎児血清、4mM Glutamineを添加したIscove’s Modified Dulbecco’s Medium中で6週間選択培養を行った。
【0155】
選択培養終了後、得られたポリクローンの細胞を2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1ウェル当たり1.84×105細胞を6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、MTXで選択して取得したポリクローンの細胞でのKOD3G8抗体の生産量を、前記実施例2−2と同様の方法でELISAにて測定した。
【0156】
標準品から作成した検量線をもとに抗体濃度を算出した。結果を図20に示す。その結果、pELH2−Puro・dhfr・N4(KOD3G8)の場合と同様に、dhfr遺伝子をピューロマイシン耐性遺伝子の上流に配したpELH2−dhfr・Puro・N4(KOD3G8)でも、MTX選択によって発現量の上昇が見られ、最も生産性の高いものは35mg/Lであった。以上より、ピューロマイシン耐性遺伝子とdhfr遺伝子の配置順序に関わらず、ピューロマイシン耐性遺伝子とdhfr遺伝子を融合させて選択遺伝子とし、更にその3‘末端にmRNA不安定化配列を付加して弱化させた発現カセットを使用することで、ピューロマイシンで選択後に高発現細胞株を取得でき、かつ、この細胞株をMTXで選択培養することで、更に発現量を上昇させることが可能であった。
【0157】
実施例4
無血清馴化CHO/dhfr−細胞を用いた、抗KOD抗体発現系における、dhfr遺伝子とピューロマイシン耐性遺伝子の融合タンパク質遺伝子とmRNA不安定化配列の組み合わせ効果の検討
次に、あらかじめ無血清馴化したCHO/dhfr−細胞を用いて、下流にmRNA不安定化配列を付加したdhfr遺伝子(上流)とピューロマイシン耐性遺伝子(下流)の融合タンパク質遺伝子の効果を検討した。
【0158】
実施例4−1
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞の生産性評価
【0159】
1xYeastolate UF溶液(SAFC Biosciences社)、1xHTサプリメント、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells(Irvine Scientific社)を用いて、CHO/dhfr−細胞を無血清馴化した。無血清馴化したCHO/dhfr−細胞を2.5X105cells/mlになるように、1xHTサプリメントを添加したOpti−MEM I Reduced−Serum Mediumに懸濁し、超低接着表面24ウェルプレート(Corning Life Science社)の2ウェルに1mlずつ播種した。
【0160】
一方、実施例3−2で調製した制限酵素AhdIでリニアライズしたpELH2−dhfr・Puro・N4(KOD3G8)3μgを400μl Opti−MEM I Reduced−Serum Mediumで希釈した後、Lipofectamine LTX 10μlを加え、30分間放置した。その後、半量ずつ前記の2ウェルの無血清馴化したCHO/dhfr−細胞に加え、24時間インキュベートした。トランスフェクションの1日後、細胞を回収して800gX3分間遠心して上清を除去し、4mlの1xYeastolate UF溶液、1xHTサプリメント、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地に懸濁し、7.5μg/ml Puromycinを加え、選択培養した。
【0161】
選択培養終了後、10%牛胎児血清、4mM Glutamine、1xHTサプリメントを添加したIscove’s Modified Dulbecco’s Mediumを使用して、ポリクローンの細胞を12ウェルプレートに播き込み、接着状態で培養した。2日間培養後、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、0.75細胞/ウェルの濃度で96ウェルプレートに播き込み、接着状態で限界希釈を行った。2週間培養後、培養上清を回収し、KOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。標準品から作成した検量線をもとに各クローンの抗体生産量を算出した。そして、選択した発現量上位クローンについて、2.5g/l−Trypsin・1mmol/l−EDTA Solutionで処理して細胞を分散し、1xYeastolate UF溶液、1xHTサプリメント、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地を用いて、浮遊状態で拡大培養を行った後、1ウェル当たり4.0×105細胞を超低接着表面6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、ピューロマイシンで選択して取得したモノクローンの細胞でのKOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。更に、標準品から作成した検量線をもとに算出した抗体生産量、3日間培養後に計数した細胞数から、1細胞、1日あたりの生産性(pcd:pg/cell/day)を算出した。結果を図21に示す。その結果、あらかじめ無血清馴化したCHO/dhfr−細胞を宿主に用いた場合でも、ピューロマイシンで選択後に高発現株を取得することができた。
【0162】
実施例4−2
抗KOD抗体発現系においてピューロマイシンで選択して取得したモノクローンの細胞を、更にMTXで選択して取得したポリクローンの細胞の生産性評価
【0163】
次に、前記実施例4−1で取得した、pELH2−dhfr・Puro・N4(KOD3G8)を遺伝子導入し、ピューロマイシンで選択して取得した発現量上位10クローンについて、7.5μg/ml Puromycin、1xYeastolate UF溶液、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地で2週間継代培養した。その後、まずは、7.5μg/ml Puromycin、3nM MTX、1xYeastolate UF溶液、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地で、続いて、7.5μg/ml Puromycin、10nM MTX、1xYeastolate UF溶液、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地で、更に、7.5μg/ml Puromycin、30nM MTX、1xYeastolate UF溶液、4mM Glutamineを添加したIS CHO−CD, Chemically Defind Media for CHO cells培地で、計6週間選択培養を行った。
【0164】
選択培養終了後、得られたポリクローンの細胞について、1ウェル当たり4.0×105細胞を超低接着表面6ウェルプレートに播き込んだ。3日間培養後、培養上清を回収し、MTXで選択して取得したポリクローンの細胞でのKOD3G8抗体の生産量を前記実施例2−2と同様の方法でELISAにて測定した。更に、標準品から作成した検量線をもとに算出した抗体生産量、3日間培養後に計数した細胞数から、1細胞、1日あたりの生産性(pcd:pg/cell/day)を算出した。結果を図22に示す。以上より、あらかじめ無血清馴化したCHO/dhfr−細胞を宿主に用いた場合でも、ピューロマイシン耐性遺伝子とdhfr遺伝子を融合させて選択遺伝子とし、更にその3‘末端にmRNA不安定化配列を付加して弱化させた発現カセットを使用することで、ピューロマイシンで選択後に高発現細胞株を取得でき、かつ、この細胞株をMTXで選択培養することで、更に発現量を上昇させることが可能であった。
【産業上の利用可能性】
【0165】
本発明の薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、遺伝子発現安定化エレメント、並びに目的タンパク質遺伝子発現カセットを有する発現ベクターは、目的タンパク質遺伝子のクローニングから組換えタンパク質の生産性の高い細胞を樹立するに至るまでを、迅速、かつ効率よく行うために大いに効果を発揮する。従って、本発明の発現ベクターを使用した細胞発現システムは、種々の動物細胞、特に哺乳類動物細胞のタンパク質の機能解析は勿論、バイオ医薬品として創薬・医療などの産業界に寄与することが大である。
【特許請求の範囲】
【請求項1】
下記(1)〜(3)を少なくとも有する発現ベクター。
(1)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、
(2)遺伝子発現安定化エレメント、及び
(3)目的タンパク質遺伝子発現カセット
【請求項2】
下記(1)〜(3)を少なくとも有する発現ベクター
(1)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、
(2)遺伝子発現安定化エレメント、及び
(3)目的タンパク質遺伝子発現カセット
【請求項3】
mRNA不安定化配列が、サイトカイン、インターロイキン、又は癌原遺伝子の3’非翻訳領域に存在するATリッチ配列に由来することを特徴とする請求項2に記載の発現ベクター。
【請求項4】
mRNA不安定化配列が、TTATTTA(A/T)(A/T)のモチーフ配列を有することを特徴とする請求項2に記載の発現ベクター。
【請求項5】
モチーフ配列が、2回以上繰り返されていることを特徴とする請求項4に記載の発現ベクター。
【請求項6】
モチーフ配列の繰り返し間に1塩基以上のスペーサー配列を含むことを特徴とする請求項5に記載の発現ベクター。
【請求項7】
mRNA不安定化配列中に1ないし数塩基の置換、挿入または欠失を含むことを特徴とする請求項3〜6のいずれかに記載の発現ベクター。
【請求項8】
遺伝子発現安定化エレメントが以下のいずれかである、請求項1〜7のいずれかに記載の発現ベクター。
(I)配列番号15で示す配列のうち41601〜46746番目までの配列からなるDNA、もしくは41601〜46746番目までの配列の部分配列であって少なくとも41601〜42700番目までの配列を含む塩基配列からなるDNA
(II)上記(I)の配列と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ遺伝子発現安定化機能を有する塩基配列からなるDNA
(III)上記(I)または(II)の配列と相補的な塩基配列からなるDNA
【請求項9】
遺伝子発現安定化エレメントを2つ以上含む、請求項1〜8のいずれかに記載の発現ベクター。
【請求項10】
薬剤選択マーカー遺伝子が、タンパク質合成阻害系抗生物質耐性遺伝子である、請求項1〜9のいずれかに記載の発現ベクター。
【請求項11】
薬剤選択マーカー遺伝子がピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼ及びネオマイシンホスホトランスフェラーゼからなる群より選択される、請求項10に記載の発現ベクター。
【請求項12】
目的タンパク質の遺伝子発現カセットが、所望の目的タンパク質遺伝子を挿入するためのマルチクローニングサイトを備えていることを特徴とする請求項1〜11のいずれかに記載の発現ベクター。
【請求項13】
目的タンパク質遺伝子が抗体の重鎖及び/または軽鎖ポリペプチド遺伝子である、請求項1〜12のいずれかに記載の発現ベクター。
【請求項14】
薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット。
【請求項15】
以下の工程を含む、高生産細胞を作製する方法。
(a)請求項1〜13のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【請求項16】
以下の工程を含む、高生産細胞を作製する方法。
(a)請求項1〜13のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞をヒポキサンチンおよびチミジン不含培地で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【請求項17】
以下の工程を含む、高生産細胞を作製する方法。
(a)請求項1〜13のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を、ヒポキサンチンおよびチミジンを含まず、かつ薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【請求項18】
請求項15〜17のいずれかに記載の方法において、(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程、及び(d)高発現を示す細胞株を単離する工程を複数回繰り返す、高生産細胞を作製する方法。
【請求項19】
宿主細胞が哺乳類動物細胞由来の細胞である、請求項15〜18のいずれかに記載の高生産細胞を作製する方法。
【請求項20】
宿主細胞がチャイニーズハムスター卵巣(CHO)由来の細胞である、請求項15〜18のいずれかに記載の高生産細胞を作製する方法。
【請求項21】
宿主細胞がジヒドロ葉酸還元酵素遺伝子欠損細胞である、請求項15〜18のいずれかに記載の高生産細胞を作製する方法。
【請求項22】
宿主細胞が無血清馴化された細胞である、請求項15〜18のいずれかに記載の高生産細胞を作製する方法。
【請求項23】
請求項15〜22のいずれかに記載の方法により得られた高生産細胞。
【請求項24】
請求項15〜22のいずれかに記載の方法により得られた高生産細胞を用いてポリペプチドを生産する方法。
【請求項25】
請求項15〜22のいずれかに記載の方法により得られた高生産細胞を用いて抗体を生産する方法。
【請求項26】
請求項15〜22のいずれかに記載の方法により得られた高生産細胞を用いてワクチンを生産する方法。
【請求項1】
下記(1)〜(3)を少なくとも有する発現ベクター。
(1)薬剤選択マーカー遺伝子及び薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子を含む発現カセット、
(2)遺伝子発現安定化エレメント、及び
(3)目的タンパク質遺伝子発現カセット
【請求項2】
下記(1)〜(3)を少なくとも有する発現ベクター
(1)薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット、
(2)遺伝子発現安定化エレメント、及び
(3)目的タンパク質遺伝子発現カセット
【請求項3】
mRNA不安定化配列が、サイトカイン、インターロイキン、又は癌原遺伝子の3’非翻訳領域に存在するATリッチ配列に由来することを特徴とする請求項2に記載の発現ベクター。
【請求項4】
mRNA不安定化配列が、TTATTTA(A/T)(A/T)のモチーフ配列を有することを特徴とする請求項2に記載の発現ベクター。
【請求項5】
モチーフ配列が、2回以上繰り返されていることを特徴とする請求項4に記載の発現ベクター。
【請求項6】
モチーフ配列の繰り返し間に1塩基以上のスペーサー配列を含むことを特徴とする請求項5に記載の発現ベクター。
【請求項7】
mRNA不安定化配列中に1ないし数塩基の置換、挿入または欠失を含むことを特徴とする請求項3〜6のいずれかに記載の発現ベクター。
【請求項8】
遺伝子発現安定化エレメントが以下のいずれかである、請求項1〜7のいずれかに記載の発現ベクター。
(I)配列番号15で示す配列のうち41601〜46746番目までの配列からなるDNA、もしくは41601〜46746番目までの配列の部分配列であって少なくとも41601〜42700番目までの配列を含む塩基配列からなるDNA
(II)上記(I)の配列と相補的な塩基配列からなるDNAとストリンジェントな条件でハイブリダイズし、かつ遺伝子発現安定化機能を有する塩基配列からなるDNA
(III)上記(I)または(II)の配列と相補的な塩基配列からなるDNA
【請求項9】
遺伝子発現安定化エレメントを2つ以上含む、請求項1〜8のいずれかに記載の発現ベクター。
【請求項10】
薬剤選択マーカー遺伝子が、タンパク質合成阻害系抗生物質耐性遺伝子である、請求項1〜9のいずれかに記載の発現ベクター。
【請求項11】
薬剤選択マーカー遺伝子がピューロマイシン−N−アセチルトランスフェラーゼ、ハイグロマイシン−B−ホスホトランスフェラーゼ及びネオマイシンホスホトランスフェラーゼからなる群より選択される、請求項10に記載の発現ベクター。
【請求項12】
目的タンパク質の遺伝子発現カセットが、所望の目的タンパク質遺伝子を挿入するためのマルチクローニングサイトを備えていることを特徴とする請求項1〜11のいずれかに記載の発現ベクター。
【請求項13】
目的タンパク質遺伝子が抗体の重鎖及び/または軽鎖ポリペプチド遺伝子である、請求項1〜12のいずれかに記載の発現ベクター。
【請求項14】
薬剤選択マーカー遺伝子、薬剤選択マーカー遺伝子に隣接して存在するジヒドロ葉酸還元酵素遺伝子及びmRNA不安定化配列を含む発現カセット。
【請求項15】
以下の工程を含む、高生産細胞を作製する方法。
(a)請求項1〜13のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【請求項16】
以下の工程を含む、高生産細胞を作製する方法。
(a)請求項1〜13のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞をヒポキサンチンおよびチミジン不含培地で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【請求項17】
以下の工程を含む、高生産細胞を作製する方法。
(a)請求項1〜13のいずれかに記載の発現ベクターを用いて宿主細胞を形質転換する工程
(b)形質転換された細胞を、ヒポキサンチンおよびチミジンを含まず、かつ薬剤存在下で培養する工程
(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程
(d)高発現を示す細胞株を単離する工程。
【請求項18】
請求項15〜17のいずれかに記載の方法において、(c)形質転換された細胞をメトトレキセート(MTX)の存在下で培養する工程、及び(d)高発現を示す細胞株を単離する工程を複数回繰り返す、高生産細胞を作製する方法。
【請求項19】
宿主細胞が哺乳類動物細胞由来の細胞である、請求項15〜18のいずれかに記載の高生産細胞を作製する方法。
【請求項20】
宿主細胞がチャイニーズハムスター卵巣(CHO)由来の細胞である、請求項15〜18のいずれかに記載の高生産細胞を作製する方法。
【請求項21】
宿主細胞がジヒドロ葉酸還元酵素遺伝子欠損細胞である、請求項15〜18のいずれかに記載の高生産細胞を作製する方法。
【請求項22】
宿主細胞が無血清馴化された細胞である、請求項15〜18のいずれかに記載の高生産細胞を作製する方法。
【請求項23】
請求項15〜22のいずれかに記載の方法により得られた高生産細胞。
【請求項24】
請求項15〜22のいずれかに記載の方法により得られた高生産細胞を用いてポリペプチドを生産する方法。
【請求項25】
請求項15〜22のいずれかに記載の方法により得られた高生産細胞を用いて抗体を生産する方法。
【請求項26】
請求項15〜22のいずれかに記載の方法により得られた高生産細胞を用いてワクチンを生産する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【公開番号】特開2013−34474(P2013−34474A)
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願番号】特願2012−151248(P2012−151248)
【出願日】平成24年7月5日(2012.7.5)
【出願人】(000003160)東洋紡株式会社 (3,622)
【Fターム(参考)】
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願日】平成24年7月5日(2012.7.5)
【出願人】(000003160)東洋紡株式会社 (3,622)
【Fターム(参考)】
[ Back to top ]

