薬物包装体
【課題】本発明の目的は、プラスチックシートに包装されたプランルカスト水和物を含有するカプセル剤の保存時における崩壊遅延等の品質低下を最小限に抑え、かつカプセルの割れを最小限に抑えることのできる薬物包装体を提供することにある。
【解決手段】シート(1)にてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤(2)と、乾燥剤(3)とが封入され、フィルム(4)にて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が10%〜45%に調節された薬物包装体。
【解決手段】シート(1)にてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤(2)と、乾燥剤(3)とが封入され、フィルム(4)にて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が10%〜45%に調節された薬物包装体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、プランルカスト水和物を含有してなるカプセル剤の薬物包装体に関する。
【背景技術】
【0002】
錠剤やカプセル剤等の固形製剤をプラスチックシート等にて密封する場合の包装形態としては、SP(strip package)包装、PTP(press through package)包装等が一般的に用いられている。そして、これらのSP包装、あるいはPTP包装された製剤は、外気や光による影響を避けるために、さらにアルミフィルム製袋等の密封体に封入した薬物包装体として市場に提供されている。
【0003】
一方、プランルカスト水和物はロイコトリエン(LT)拮抗薬として知られており(特許文献1参照)、また気管支喘息やアレルギー性鼻炎の治療薬として実際に臨床適用されている。プランルカスト水和物を含有する固形製剤は、特にカプセル剤の場合、温度25℃、相対湿度75%において無包装状態で保存すると、1週間で溶出変化が起こることが報告されている(非特許文献1参照)。さらに、該カプセル剤は、PTP包装された状態であっても、含有する水分や外気の湿度等の上昇により、崩壊速度の遅延や溶出が変化することがある。
【0004】
これまで、ペリンドプリルエルブミンを有効成分とする錠剤と、乾燥剤とを共に密封体に封入した薬物包装体について開示されている(特許文献2参照)。しかしながら、プランルカスト水和物のカプセル剤の場合、崩壊速度の遅延や溶出の変化を防ぐために、防湿性のフィルムからなる密封体にPTP包装体と共に乾燥剤を封入した状態では、含有する水分の低下によりカプセルが割れることがあった。したがって、上記したように、プランルカスト水和物のカプセル剤をPTP包装した後、単に密封体に封入するか、または単に乾燥剤と共に密封体に封入するだけでは、包装体内の雰囲気の相対湿度を調節することができないため、該カプセル剤の崩壊遅延、溶出遅延やカプセルの割れを防げない等の問題があった。この問題に関し、薬物包装体の内部雰囲気の相対湿度を調節することについては、上記文献に記載も示唆もなされていない。
【0005】
【特許文献1】特開昭61−050977号公報
【特許文献2】特開平11−206850号公報
【非特許文献1】錠剤・カプセル剤の無包装状態での安定性情報 改訂3版(社団法人日本病院、医薬ジャーナル社)
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明の目的は、プラスチックシートに包装されたプランルカスト水和物を含有するカプセル剤の保存時における崩壊遅延等の品質低下を最小限に抑え、かつカプセルの割れを最小限に抑えることのできる薬物包装体を提供することにある。
【課題を解決するための手段】
【0007】
本発明者らは、上記した目的を達成するためには薬物包装体内の相対湿度を調節することが有効であると考え、プラスチックシートにてPTP包装された、プランルカスト水和物を含有してなる組成物が充填されたカプセル剤を、乾燥剤とともに封入して、フィルムにて密封包装した薬物包装体について、乾燥剤の量、ならびに該カプセル剤中の組成物およびカプセル皮膜の含水率の組合せを鋭意検討した。その結果、驚くべきことに、これらの要素について、ある特定の組合せにすることによって、該カプセル剤の保存時における崩壊遅延およびカプセルの割れを抑えることのできる、内部雰囲気の相対湿度が調節された薬物包装体を提供できることを見出し、本発明を完成させた。
【0008】
すなわち、本発明は、
[1] シートにてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、乾燥剤とが封入され、フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が10%〜45%に調節された薬物包装体、
[2] さらに、保湿剤が封入された、前記[1]記載の薬物包装体、
[3] シートが、プラスチックシートまたはアルミシートである前記[1]記載の薬物包装体、
[4] カプセル剤が、1カプセル当たり、112.5mgまたは225mgのプランルカスト水和物を含むカプセル剤である前記[1]記載の薬物包装体、
[5] カプセル剤が、1カプセル当たり、130mg〜400mgの組成物を含むカプセル剤であって、該1カプセル当たりの空カプセルの重量が30mg〜90mgである前記[1]記載の薬物包装体、
[6] プランルカスト水和物を含有してなる組成物の含水率が1%〜2.7%である前記[1]記載の薬物包装体、
[7] カプセル剤におけるカプセル皮膜の含水率が8%〜17%である前記[1]記載の薬物包装体、
[8] プランルカスト水和物を含有してなる組成物が、さらに糖類、水溶性高分子および滑沢剤を含む組成物である前記[1]記載の薬物包装体、
[9] 糖類が乳糖であって、水溶性高分子がポリエチレングリコールであって、滑沢剤がステアリン酸マグネシウムである前記[8]記載の薬物包装体、
[10] プランルカスト水和物を含有してなる組成物が、プランルカスト水和物100重量部に対して、乳糖を30重量部〜60重量部含み、ポリエチレングリコールを7.5重量部〜15重量部含み、およびステアリン酸マグネシウムを1.0重量部〜4.5重量部含む組成物である前記[9]記載の薬物包装体、
[11] 乾燥剤が、温度25℃、相対湿度50%において20%〜35%の吸湿率を有する乾燥剤である前記[1]記載の薬物包装体、
[12] 乾燥剤が、シリカゲルまたは塩化カルシウムである前記[11]記載の薬物包装体、
[13] 乾燥剤が、シート状乾燥剤である前記[11]記載の薬物包装体、
[14] シート状乾燥剤が、塩化カルシウムを含むシート状乾燥剤である前記[13]記載の薬物包装体、
[15] カプセル剤1カプセルの総重量100重量部当たり、封入される乾燥剤の重量が0.7重量部〜17重量部である前記[11]記載の薬物包装体、
[16] カプセル剤1カプセルの総重量100重量部当たり、封入される乾燥剤の重量が1重量部〜15重量部である前記[11]記載の薬物包装体、
[17] アルミフィルムのピロー包装体である前記[1]記載の薬物包装体、
[18] (I)プラスチックシートにてPTP包装された、下記の(a)〜(e)の特性をすべて有する、プランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、(II)カプセル剤1カプセルの総重量100重量部当たり0.7重量部〜17重量部の、温度25℃、相対湿度50%において20%〜35%の吸湿率を有する乾燥剤とが封入され、(III)フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が10%〜45%に調節された薬物包装体:
(a)1カプセル当たり、112.5mgまたは225mgのプランルカスト水和物を含む、
(b)1カプセル当たり、130mg〜400mgの組成物を含む、
(c)1カプセル当たり、空カプセルの重量が30mg〜90mgである、
(d)組成物の含水率が、1%〜2.7%である、
(e)カプセル皮膜の含水率が8%〜17%である、
[19] プランルカスト水和物を含有してなる組成物が、プランルカスト水和物、糖類、水溶性高分子および滑沢剤を含有してなる組成物であって、乾燥剤がシリカゲルまたは塩化カルシウムを含む乾燥剤である前記[18]記載の薬物包装体、
[20] カプセル剤が、1カプセル当たり、112.5mgのプランルカスト水和物を含むカプセル剤であって、プランルカスト水和物を含有してなる組成物が、プランルカスト水和物100重量部当たり、乳糖を30重量部〜60重量部含み、ポリエチレングリコールを7.5重量部〜15重量部含み、およびステアリン酸マグネシウムを1.0重量部〜4.5重量部含む組成物であって、乾燥剤が塩化カルシウムを含むシート状乾燥剤であって、該シート状乾燥剤が、1カプセルの総重量100重量部当たり、1重量部〜15重量部の割合で封入される前記[19]記載の薬物包装体、
[21] フィルムにて密封包装された薬物包装体内に、プラスチックシートにてPTP包装された、下記の(a)〜(e)の特性をすべて有するように調節された、プランルカスト水和物を含有してなる組成物を充填したカプセル剤と、塩化カルシウムを含むシート状乾燥剤とを、該カプセル剤1カプセルの総重量100重量部当たり、該シート状乾燥剤を0.7重量部〜17重量部含むように調節して、共に封入することにより、該薬物包装体の、温度25℃における温湿度計を用いて測定した内部雰囲気の相対湿度を約10%〜約45%に調節する方法:
(a)1カプセル当たり、112.5mgまたは225mgのプランルカスト水和物を含む、
(b)1カプセル当たり、130mg〜400mgの組成物を含む、
(c)1カプセル当たり、空カプセルの重量が30mg〜90mgである、
(d)組成物の含水率が、1%〜2.7%である、
(e)カプセル皮膜の含水率が8%〜17%である、
等に関する。
【発明の効果】
【0009】
本発明の薬物包装体においては、その内部にプラスチックシートにてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、一定の吸湿率を有する乾燥剤が適宜封入されることによって、薬物包装体の内部雰囲気の相対湿度が好ましい範囲に調節され、水分の影響を受けやすい該組成物を充填してなるカプセル剤の保存時における崩壊遅延、異常(例えば、割れ、欠け等)等を抑える効果を奏する。
【発明を実施するための最良の形態】
【0010】
本発明においては、プランルカスト水和物を含有してなる組成物が充填されたカプセル剤がシートにて包装され、薬物包装体はこのシートにて包装されたカプセル剤と、乾燥剤とを含み、必要に応じて保湿剤を含んでいてもよく、それら全体がフィルムにて密封包装されて構成されている。すなわち、本発明の薬物包装体は、上記シートにて包装されたカプセル剤と、乾燥剤とが封入され、必要に応じて保湿剤が封入されていてもよく、フィルムにて密封包装されてなる薬物包装体である。
【0011】
本発明において、上記のカプセル剤を包装するために用いられるシートとしては、医薬品を包装可能であるシートであれば特に限定されないが、プラスチックシート、アルミシート等が挙げられる。好ましくは、プラスチックシートである。
【0012】
本発明において、プラスチックシートとしては、例えばポリ塩化ビニルシート、ポリ塩化ビニリデン(PVDC)シート、塩化ビニリデンシート、ポリクロロトリフルオロエチレンシート、無延伸ポリプロピレン(CPPまたはIPP)シート、環状ポリオレフィンシート、ポリエチレンシート、無延伸ナイロン(CNy)シート、二軸延伸ナイロン(ONy)シート、二軸延伸ポリプロピレン(OPP)シート、硬質塩化ビニルシート、ポリエチレンテレフタラートシート、ポリアクリロニトリル共重合体(PAN)シート、ポリビニルアルコール(PVA)シート、ポリエステル(PET)シート、エチレン・酢酸ビニル共重合体(EVA)シート、アイオノマー(IO)シート、ポリアミド(PAまたはNy)シート、エチレン・ビニルアルコール共重合体(EVOH)シート、ポリカーボネート(PC)シートおよびポリスチレン(PS)シート等が挙げられる。これらのプラスチックシートは2種以上を適宜組合せた複合体シートとして用いてもよい。
【0013】
本発明で用いられるプラスチックシートとしては、約0.5g/m2・24hr〜約5.0g/m2・24hrの透湿度(水蒸気透過度)を有するものが好ましい。そのような好ましい透湿度を有するプラスチックシートとしては、例えば硬質塩化ビニルシート、硬質塩化ビニルとポリ塩化ビニリデンを組み合わせた複合体シート、無延伸ポリプロピレンシート等が挙げられ、特に硬質塩化ビニルシートが好ましいが、これらに限定されるものではない。
【0014】
上記の透湿度とは、定められた温度及び湿度の条件下に、一定時間に単位面積のシートを通過する水蒸気の量を意味し、その測定は、公知の方法で行うことができる。例えば、一般的にプラスチックシートやシート等の包装材料の透湿度測定法として知られた方法、なかでもカップ法(JIS Z0208)に従って行うことが好ましい。
【0015】
プラスチックシートとしては、平坦なシートである必要はなく、例えばカプセル剤を1個ずつ収納するためのスペースを設けるべく、凹部が成型されたシートを用いることができる。
【0016】
本発明において、カプセル剤をシートにて包装する際には、該シートと他のフィルム状材料とを適宜組み合わせ、両者の間にカプセル剤を内包するようにして貼り合わせて用いてもよい。例えば、アルミニウム、酸化ケイ素、酸化アルミニウム等の無機物を蒸着した蒸着フィルム、紙、アルミフィルム、セロファンフィルム等の通常の包装材料として用いられるフィルム状材料の中から1種または2種以上を選択し、内容物を保護する等の目的で上記シートと適宜組み合わせ、貼り合わせて用いることができる。上記したシートと他のフィルム状材料とを貼り合わせる方法としては、ドライラミネーション、押出コーティング・ラミネーション、ウェットラミネーション、ホットメルトラミネーション、共押出成形ラミネーション、ノンソルベントラミネーション、サーマルラミネーション等が挙げられる。
【0017】
本発明において、プランルカスト水和物等を含有してなる組成物が充填されたカプセル剤をシートで包装する形態としては、SP(strip package)包装、PTP(press through package)包装、ブリスター包装(blister pack)等が挙げられる。好ましくは、PTP包装である。
本発明に用いられるPTP包装としては、例えば、硬質塩化ビニルとアルミフィルムとを組み合わせて、公知の方法により貼り合わせて成型したものが好ましい。
【0018】
本発明において、プランルカスト水和物を含有してなる組成物(以下、本発明の組成物と略記する場合がある。)とは、(1)プランルカスト水和物を含有し、好ましくは(2)糖類および(3)水溶性高分子を含有し、さらに(4)カプセル剤を製造する際に一般的に使用される添加剤(製剤基剤)を含んでいてもよい組成物である。ここで、添加剤(製剤基剤)としては、例えば、賦形剤、結合剤、滑沢剤、安定(化)剤、崩壊剤、矯味剤、界面活性剤、香料、着色料、抗酸化剤、隠蔽剤、静電気防止剤、流動化剤、湿潤剤、溶出補助剤、溶解補助剤、コーティング剤等が挙げられ、これらのうちから1種または2種以上を選択して本発明の組成物に適宜配合して用いることができる。上記の添加剤としては、滑沢剤が好ましい。
【0019】
本発明の組成物に用いられるプランルカスト水和物とは、下記式(A)
【化1】

で示される4−オキソ−8−[4−(4−フェニルブトキシ)ベンゾイルアミノ]−2−(テトラゾール−5−イル)−4H−1−ベンゾピラン 1/2水和物である。プランルカスト水和物の製造は、例えば、特開昭61−050977号明細書記載の方法に準じて行うことができる。
【0020】
本発明の組成物における糖類としては、乳糖、マンニトール、白糖、デキストリン、デキストラン、トレハロース、プルラン、グルコース、果糖、麦芽糖、異性化乳糖、還元乳糖、ショ糖、エリスリトール、マルチトール、キシリトール、パラチノース、ソルビトール、トウモロコシデンプン、馬鈴薯デンプン、コムギデンプン、コメデンプン等が挙げられる。好ましくは、乳糖、白糖、マンニトール等である。より好ましくは、乳糖である。
【0021】
本発明の組成物における水溶性高分子としては、セルロース類(例:ヒドロキシメチルセルロース、ヒドロキシメチルエチルセルロース、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース(HPC)、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルメチルセルロースフタレート(HPMCP)、ヒドロキシプロピルメチルセルロースアセテートスクシネート(HPMCAS)等)、合成高分子類(例:ポリエチレングリコール(例えば、マクロゴール4000等)、ポリビニルピロリドン、ポリビニルアルコール等)、ゼラチン等が挙げられる。好ましくは、ポリエチレングリコール、メチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース等である。より好ましくは、ポリエチレングリコールである。
【0022】
添加剤としての賦形剤としては、例えば、糖類(例えば、乳糖、マンニトール、白糖、デキストリン、デキストラン、トレハロース、プルラン、グルコース、果糖、麦芽糖、異性化乳糖、還元乳糖、ショ糖、エリスリトール、マルチトール、キシリトール、パラチノース、ソルビトール、トウモロコシデンプン、馬鈴薯デンプン、コムギデンプン、コメデンプン等)、微結晶セルロース、無水ケイ酸、無水リン酸カルシウム、沈降炭酸カルシウム、ケイ酸カルシウム等が挙げられる。
【0023】
結合剤としては、例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポビドン(ポリビニルピロリドン)、メチルセルロース、ポリビニルアルコール、カルボキシメチルセルロースナトリウム、部分α化デンプン、α化デンプン、アルギン酸ナトリウム、プルラン、アラビアゴム末、ゼラチン、メタケイ酸アルミン酸マグネシウム等が挙げられる。
【0024】
滑沢剤としては、例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、蔗糖脂肪酸エステル、フマル酸ステアリルナトリウム、ステアリン酸、タルク、ポリエチレングリコール等が挙げられる。好ましくは、ステアリン酸マグネシウムである。
【0025】
安定(化)剤としては、例えば、アジピン酸、アスコルビン酸、L−アスパラギン酸、アルブミン、安息香酸、エタノール、エチレンジアミン、塩化亜鉛、塩化カルシウム、塩化ナトリウム、塩化ベンザルコニウム、塩化ベンゼトニウム、塩化マグネシウム、塩酸、塩酸アルギニン、塩酸システイン、塩酸リジン、カルメロースカルシウム、カルメロースナトリウム、希塩酸、クエン酸、クエン酸カルシウム、クエン酸ナトリウム、グリシン、グリセリン、結晶セルロース、硬化油、ゴマ油、コンドロイチン硫酸ナトリウム、酢酸、酢酸亜鉛、酢酸トコフェロール、酢酸ナトリウム、サリチル酸ナトリウム、サリチル酸フェニル、酸化亜鉛、酸化マグネシウム、ジイソプロパノールアミン、ジエタノールアミン、ジブチルヒドロキシトルエン、ジメチルポリシロキサン、臭化カルシウム、酒石酸、水酸化カルシウム、水酸化ナトリウム、水酸化マグネシウム、ステアリン酸、セタノール、ゼラチン、D−ソルビトール、タルク、炭酸アンモニウム、炭酸カリウム、炭酸水素ナトリウム、炭酸ナトリウム、炭酸マグネシウム、チオグリコール酸、チオグリコール酸ナトリウム、チオ硫酸ナトリウム、デキストリン、トコフェロール、乳酸、乳酸ナトリウム液、乳糖、尿素、濃グリセリン、白糖、微結晶セルロース、ヒドロキシプロピルセルロース、ヒドロキノン、氷酢酸、グルコース、フマル酸、フマル酸一ナトリウム、プロピオン酸ナトリウム、プロピレングリコール、ベンジルアルコール、ポビドン(ポリビニルピロリドン)、ポリビニルアルコール(部分けん化物)、ポリビニルアルコール・ジブチルエーテル混合物、マレイン酸、マロン酸、D−マンニトール、無水クエン酸、無水クエン酸ナトリウム、無水酢酸ナトリウム、無水マレイン酸、無水リン酸一水素ナトリウム、無水リン酸二水素ナトリウム、メタケイ酸アルミン酸マグネシウム、メタスルホ安息香酸ナトリウム、メタリン酸ナトリウム、メチルセルロース、メチルビニルエーテル・無水マレイン酸共重合体、ヨウ化カリウム、ヨウ化ナトリウム、ラウリル硫酸ナトリウム、硫酸亜鉛、硫酸アルミニウムカリウム、硫酸カリウム、硫酸マグネシウム、リン酸、リン酸二水素カリウム、リン酸二水素カルシウム等が挙げられる。
【0026】
崩壊剤としては、例えば、低置換度ヒドロキシプロピルセルロース、カルメロース、カルメロースカルシウム、カルボキシメチルスターチナトリウム、クロスカルメロースナトリウム、クロスポビドン、ヒドロキシプロピルスターチ、トウモロコシデンプン、繊維素グリコール酸カルシウム等が挙げられる。
【0027】
矯味剤としては、例えば、白糖、D−ソルビトール、キシリトール、クエン酸、アスコルビン酸、酒石酸、リンゴ酸、アスパルテーム、アセスルファムカリウム、ソーマチン、サッカリンナトリウム、グリチルリチン二カリウム、グルタミン酸ナトリウム、5'−イノシン酸ナトリウム、5'−グアニル酸ナトリウム等が挙げられる。
【0028】
界面活性剤としては、例えば、ポリソルベート(例えば、ポリソルベート20、ポリソルベート40、ポリソルベート60、ポリソルベート65、ポリソルベート80等)、ポリオキシエチレン・ポリオキシプロピレン共重合物、ポリオキシエチレン硬化ヒマシ油、モノステアリン酸ソルビタン、ラウリル硫酸ナトリウム等が挙げられる。
【0029】
香料としては、例えば、レモン油、オレンジ油、メントール、はっか油等が挙げられる。
着色剤としては、例えば、酸化チタン、食用黄色5号、食用青色2号、三二酸化鉄、黄色三二酸化鉄等が挙げられる。
抗酸化剤としては、例えば、アスコルビン酸ナトリウム、L−システイン、亜硫酸ナトリウム、ビタミンE等が挙げられる。
【0030】
隠蔽剤としては、例えば、酸化チタン等が挙げられる。
静電気防止剤としては、例えば、タルク、酸化チタン等が挙げられる。
流動化剤としては、例えば、軽質無水ケイ酸、タルク、含水二酸化ケイ素等が挙げられる。
湿潤剤としては、例えば、ポリソルベート80、ラウリル酸硫酸ナトリウム、ショ糖脂肪酸エステル、ポリエチレングリコール、ヒドロキシプロピルセルロース(HPC)等が挙げられる。
【0031】
溶出補助剤としては、例えば、乾燥メタクリル酸コポリマーLD、ヒドロキシプロピルメチルセルロースアセテートサクシネート、ヒドロキシプロピルメチルセルロースフタレート等が挙げられる。
溶解補助剤としては、例えば、グルタミン酸、アスパラギン酸等が挙げられる。
コーティング剤としては、例えば、白糖、ゼラチン、ヒドロキシプロピルセルロース、ヒドロキシメチルセルロースフタレート等が挙げられる。
【0032】
また、上記した添加剤は、例示した用途以外に他の用途(例えば、賦形剤、結合剤、滑沢剤、安定(化)剤、崩壊剤、矯味剤、界面活性剤、香料、着色料、抗酸化剤、隠蔽剤、静電気防止剤、流動化剤、湿潤剤、溶出補助剤、溶解補助剤、コーティング剤等)で使用可能であればその用途で用いてもよい。さらに、上記以外にも、公知の文献、例えば、薬事日報社2005年刊「医薬品添加物辞典」(日本医薬品添加剤協会編集)等に記載されているような添加剤を用いてもよい。
【0033】
本発明の組成物は、(1)プランルカスト水和物、(2)糖類、(3)水溶性高分子および(4)カプセル剤を製造する際に一般的に使用される添加剤(製剤基剤)を含有してなる組成物であることが好ましい。該(1)〜(4)の組合せとしては、(1)プランルカスト水和物、(2)乳糖、白糖およびマンニトールからなる群より選択される1種以上の糖類、(3)ポリエチレングリコール、メチルセルロース、ヒドロキシプロピルセルロースおよびヒドロキシプロピルメチルセルロースからなる群より選択される1種以上の水溶性高分子、および(4)滑沢剤の組合せが好ましく、(1)プランルカスト水和物、(2)乳糖、(3)ポリエチレングリコールおよび(4)ステアリン酸マグネシウムの組合せがより好ましい。
【0034】
本発明の組成物において、プランルカスト水和物100重量部に対する糖類の重量比として好ましくは、約20重量部〜約70重量部であり、より好ましくは約25重量部〜約65重量部であり、さらに好ましくは約30重量部〜約60重量部である。また、プランルカスト水和物100重量部に対する水溶性高分子の重量比として好ましくは、約5重量部〜約20重量部であり、より好ましくは、約7.5重量部〜約15重量部である。
【0035】
本発明の組成物において、プランルカスト水和物100重量部に対する滑沢剤の重量比として好ましくは、約0.5重量部〜約5重量部であり、より好ましくは約1.0重量部〜約4.5重量部である。
【0036】
本発明において、カプセル剤に充填される本発明の組成物の重量としては、1カプセル当たり、約130mg〜約400mgが好ましく、約150mg〜約380mgがより好ましい。
【0037】
本発明の組成物の形態としては、造粒物が好ましい。該造粒物としては、一般的に用いられている医薬品製剤の造粒法、例えば、「造粒ハンドブック」(日本粉体工業技術協会編、オーム社、1991年)に記載されている造粒法等によって製造される造粒物であれば特に限定されないが、例えば湿式造粒物、乾式造粒物、転動造粒物、噴霧乾燥造粒物、押出し造粒物、流動層造粒物、撹拌造粒物、圧縮造粒物、溶融造粒物、破砕造粒物、コーティング造粒物、液相造粒物、真空凍結造粒物等が挙げられる。なかでも好ましくは、転動造粒物、噴霧乾燥造粒物、押出し造粒物、流動層造粒物、撹拌造粒物等である。より好ましくは、噴霧乾燥造粒物、撹拌造粒物等である。
なお、撹拌造粒物には、撹拌造粒物、撹拌流動層造粒物、撹拌転動流動層造粒物等が含まれる。
【0038】
本発明の組成物が噴霧乾燥造粒物である場合、噴霧乾燥造粒物100重量%におけるプランルカスト水和物の重量%として好ましくは、約50%〜約98%であり、より好ましくは約55%〜約90%であり、特に好ましくは約60%〜約80%である。
本発明の組成物が撹拌造粒物である場合、撹拌造粒物100重量%におけるプランルカスト水和物の重量%として好ましくは、約30%〜約98%であり、より好ましくは約50%〜約80%である。
【0039】
本発明におけるカプセル剤としては、本発明の組成物が充填されているカプセル剤であれば特に限定されず、医薬品として一般的に用いられるカプセル剤と同様のものでよい。カプセル剤には、ハードカプセル剤、ソフトカプセル剤等が含まれる。
【0040】
本発明におけるカプセル剤は、プランルカスト水和物を含有するカプセル剤であり、本発明の組成物の一定量を、常法にしたがって、カプセル皮膜(空カプセル)の中に充填した製剤である。カプセル皮膜としては、ハードカプセル、ソフトカプセルのいずれであってもよい。
【0041】
上記のカプセル皮膜は、通常はカプセル基剤および可塑剤を含むものであり、必要に応じて、例えば、香料(例えば、ハッカ油、桂皮油、ストロベリーその他の果実エッセンスやフレーバー等)、防腐剤(例えば、パラヒドロキシ安息香酸エチル、パラヒドロキシ安息香酸プロピル等)、色素(例えば、黄色4号、黄色5号、赤色3号、青色1号、銅クロロフィン等)、不透明化剤(例えば、二酸化チタン、ベンガラ、三二酸化鉄等)、滑沢剤(例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、蔗糖脂肪酸エステル、フマル酸ステアリルナトリウム、ステアリン酸、タルク、ポリエチレングリコール、ラウリル硫酸ナトリウム等)、溶解度調節剤(例えば、セルロースアセテートフタレート、ヒドロキシプロピルメチルセルロースのアルカリ金属塩、ヒドロキシメチルセルロースアセテートサクシネートのアルカリ金属塩、アルギン酸アルカリ塩、ポリアクリル酸アルカリ金属塩、メチルセルロース、カルボキシメチルセルロース、カゼイン、コラーゲン、寒天末、ポリビニルアルコール、ペクチン等)等を含んでいてもよい。
【0042】
本発明において、カプセル皮膜に用いられるカプセル基剤は、カプセル皮膜の基剤として使用可能な物質であればどのようなものであってもよい。例えば、蛋白質(例えば、ゼラチン、ゼラチン加水分解物、コラーゲン、コラーゲン加水分解物、カゼイン等)、多糖類(例えば、デンプン、アミロース、ポリガラクツロン酸、寒天、カラギナン、アラビアガム、ジェランガム、キサンタンガム、ペクチン、アルギン酸、プルラン等)、セルロース類(例えば、ヒドロキシメチルセルロース、ヒドロキシメチルエチルセルロース、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース(HPC)、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルメチルセルロースフタレート(HPMCP)、ヒドロキシプロピルメチルセルロースアセテートスクシネート(HPMCAS)等)、生分解性プラスチック(例えば、ポリ乳酸、ポリヒドロキシ酪酸、ポリグルタミン酸等)、硬化油脂(例えば、中鎖脂肪酸のトリグリセリドやジグリセリド(例えば、バター、マーガリン、ショートニング、カカオバター等)等)等が挙げられる。これらのカプセル基剤は、2種以上を適宜組み合わせて用いてもよい。本発明においては、これらのカプセル基剤のなかでも、蛋白質、特にゼラチンが好ましい。
【0043】
また、カプセル皮膜に用いられる可塑剤は、カプセル皮膜の可塑剤として使用可能な物質であればどのようなものであってもよい。例えば、糖(例えば、ショ糖、白糖、水アメ等)、糖アルコール(例えば、ソルビトール、キシリトール、マンニトール等)、多価アルコール(例えば、グリセリン、エチレングリコール、ポリエチレングリコール、プロピレングリコール等)等が挙げられる。なかでも多価アルコール、特にポリエチレングリコールが好ましい。
【0044】
本発明において、カプセル剤に含まれるプランルカスト水和物の含有量としては、1カプセル当たり、約112.5mg〜約450mgが好ましく、より好ましくは112.5mg、225mgまたは450mgであり、さらに好ましくは112.5mgまたは225mgであり、特に好ましくは112.5mgである。また、カプセルの大きさとしては、1号、2号、3号または4号カプセルが好ましく、1カプセル当たりの空カプセルの重量としては、約30mg〜約90mgが好ましい。例えば、プランルカスト水和物を225mg含有する2号カプセル剤もしくは3号カプセル剤、または112.5mg含有する3号カプセル剤もしくは4号カプセル剤等が、服用患者のコンプライアンスの観点から好ましい。
【0045】
したがって、本発明のカプセル剤において、1カプセルの総重量としては、充填される組成物の重量および空カプセルの重量を加算したものであることから、約160mg〜約490mgが好ましく、約180mg〜約470mgがより好ましい。
【0046】
本発明において、乾燥剤としては、一般的に医薬品の保存時に用いられるものであれば特に限定されないが、そのような乾燥剤としては、例えば酸化アルミニウム、カルシウム、塩化カルシウム、水素化カルシウム、酸化カルシウム、硫酸カルシウム、硫酸銅、水素化リチウムアルミニウム、マグネシウム、酸化マグネシウム、過塩素酸マグネシウム、硫酸マグネシウム、合成ゼオライト(例えば、モレキュラーシーブ等)、天然ゼオライト、五酸化二リン、炭酸カリウム、水酸化カリウム、シリカゲル、シリカアルミナゲル、ナトリウム、水酸化ナトリウム、硫酸ナトリウム、ケイ酸アルミン酸マグネシウム、活性炭等が挙げられる。これらは、必要に応じて、2種以上を適宜組み合わせて使用してもよい。
【0047】
上記に列挙した乾燥剤以外に、高分子ポリマーを構成成分とする吸水剤も本発明における乾燥剤の範疇に含まれる。そのような吸水剤としては、特に限定されないが、例えば、酢酸ビニル−(メタ)アクリル酸エステル共重合体、酢酸ビニル−無水マレイン酸共重合体、イソブチレン−無水マレイン酸共重合体、アクリル酸−メタクリル酸共重合体、ポリビニルアルコール、ポリエチレンオキシド、ポリプロピレンオキシド、ポリビニルピロリドン、スルホン化ポリスチレン、ポリビニルピリジン、ポリアクリルアミド、ポリメタクリルアミド等が挙げられる。
【0048】
本発明に用いられる乾燥剤の形態としては、例えば粒状、フィルム状、プレート状もしくはシート状に成形したもの、および粒状のものを通気性のある袋に充填したもの(例えば、ドライヤーン(商品名、山仁株式会社;シリカゲル)、アイディF(商品名、アイディ株式会社;塩化カルシウム)等が挙げられるが、その形態は特に限定されない。
【0049】
本発明においては、シート状に成形した乾燥剤(「シート状乾燥剤」ともいう)が好ましく用いられる。乾燥剤をシート状に成形する場合には、例えば、乾燥剤を適当な支持体、成形用プラスチック等に配合して、乾燥剤をプラスチック内に練り込みシート状に成形する方法、またはパルプ材に乾燥剤の原料となる物質を含む溶液を含浸させて成型する方法等が挙げられる。シート状乾燥剤としては、IDシート(商品名、株式会社アイディ;塩化カルシウム)、ハイシートドライ(商品名、丸谷化工機株式会社;シリカゲル)、ハイドライパック(商品名、丸谷化工機株式会社;シリカゲル)等が挙げられる。好ましくは、IDシートが挙げられる。
【0050】
本発明に用いられる乾燥剤としては、温度25℃、相対湿度50%において約20%〜約35%の吸湿率を有する乾燥剤が好ましい。そのような乾燥剤として好ましくは、例えば、シリカゲル、シリカアルミナゲル、塩化カルシウム、五酸化二リン、合成ゼオライトまたは天然ゼオライト等を含む乾燥剤が挙げられ、より好ましくは、塩化カルシウムまたはシリカゲルを含む乾燥剤等が挙げられ、さらに好ましくは、塩化カルシウムを含むシート状乾燥剤が挙げられ、特に好ましくは、塩化カルシウムを約10重量%〜約30重量%含むシート状乾燥剤が挙げられる。塩化カルシウムを約10重量%〜約30重量%含むシート状乾燥剤としては、例えばIDシート(商品名、株式会社アイディ)が挙げられる。
【0051】
本発明において乾燥剤を用いる場合は、1カプセルの総重量100重量部に対して、乾燥剤を約0.7重量部〜約17重量部用いることが好ましく、約1重量部〜約15重量部用いることがより好ましく、約1.5重量部〜約11重量部用いることが特に好ましい。
【0052】
例えば、本発明の薬物包装体において、プランルカスト水和物112.5mgを含有するカプセル剤をプラスチックシートにてシート1枚当たり14個PTP包装したものを、薬物包装体1個当たり10枚封入する場合には、カプセル剤1カプセルの総重量100重量部に対して約0.7重量部〜約17重量部の「塩化カルシウムまたはシリカゲルを含む乾燥剤」に相当するものとして、約0.22g〜約5.5gの「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」を同時に封入することが好ましい。さらには、1カプセルの総重量100重量部に対して約1重量部〜約15重量部の「塩化カルシウムまたはシリカゲルを含む乾燥剤」に相当するものとして、約0.32g〜約4.8gの「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」を同時に封入することがより好ましく、1カプセルの総重量100重量部に対して約1.5重量部〜約11重量部の「塩化カルシウムまたはシリカゲルを含む乾燥剤」に相当するものとして、約0.48g〜約3.4gの「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」を同時に封入することが特に好ましく、1カプセルの総重量100重量部に対して約3.1重量部〜約9.3重量部の「塩化カルシウムまたはシリカゲルを含む乾燥剤」に相当するものとして、約1g〜約3gの「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」を同時に封入することがとりわけ好ましい。ここで、「塩化カルシウムを含むシート状乾燥剤」を用いる場合の重量は、塩化カルシウムを含浸させたシート状のパルプ材の重量も含めた重量を意味する。
なお、「塩化カルシウムを含むシート状乾燥剤」の厚さとしては、約0.5mm〜約3mmが好ましい。
【0053】
本発明の薬物包装体には、上記の乾燥剤と併用して保湿剤を封入することができる。本発明において、保湿剤とは、吸水、吸湿および放湿機能を有し、かつ一定の湿度に保つことのできる機能、すなわち平衡湿度に調節する機能を有する物質を意味し、調湿剤ともいう。そのような保湿剤としては、含水エチレングリコール含有シート類、ドライキープ(商品名、佐々木化学薬品株式会社)等が挙げられる。
【0054】
本発明の薬物包装体においては、内部雰囲気の相対湿度が一定の範囲に調節されることが重要である。本発明において、内部雰囲気とは、薬物包装体内に封入された、シートにてPTP包装された本発明の組成物が充填されたカプセル剤(以下、「PTP包装体」ということがある。)と、乾燥剤とが置かれている雰囲気を意味する。該内部雰囲気の相対湿度は、PTP包装体内の相対湿度と平衡状態にあるため、PTP包装体内でカプセル剤が接している環境の相対湿度と同等であると考えられる。
【0055】
本発明においては、上記した内部雰囲気の相対湿度が約10%〜約45%に調節される。該内部雰囲気の相対湿度としては、約10%〜約40%が好ましく、約17%〜約40%がより好ましく、約20%〜約35%が特に好ましい。
該内部雰囲気の相対湿度が約10%未満の場合には、上記のカプセル剤に重篤な異常(例えば、割れ、欠け等)が生じる。また、該内部雰囲気の相対湿度が約45%を超える場合には、医薬品としての機能が損なわれるような該カプセル剤の崩壊遅延、溶解遅延等が生じることになる。
ここで、該内部雰囲気の相対湿度は、温度25℃において、温湿度計を用いて測定された相対湿度を意味する。
【0056】
該相対湿度は、公知の方法で測定することができる。例えば、後記実施例に記載した方法(例えば、温湿度計(THARMO RECORDER RS−12;ESPEC社)等を用いた方法)、または水分活性測定装置(例:AQUALAB CX−3TE;デカゴン社等)、透湿度試験装置(例:L80−5005;リッシー社、GTR−WV;GTRテック株式会社等)、熱重量度測定装置(例:TGA−50/50H;株式会社島津製作所等)、水蒸気透過率測定装置(例:PERMATRAN−W(R)3/61;MOCON社等)等を組み合わせて使用し、該相対湿度を測定することができる。
[相対湿度測定法]
上記した水分活性測定装置を用いた相対湿度の測定方法は、以下に示す通りである。
<プランルカスト水和物含有カプセル剤の水分活性値の測定>
PVCを用いてPTP包装されたプランルカスト水和物含有カプセル剤および乾燥剤(例えば、IDシート等)を共にサンプルカップに入れ、水分活性測定装置(AQUALAB CX−3TE:デカゴン社)を用いて、密閉された上記サンプルカップ内の水分活性(Aw;Water Acitvity)値を測定する。得られたAw値を平衡相対湿度(ERH;equilibrium relative humidity)に換算する。
【0057】
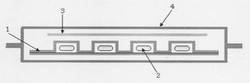
本発明の薬物包装体としては、例えば、図1に示すような薬物包装体が挙げられる。図1に示す薬物包装体は、プラスチックシート(1)にてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤(2)および乾燥剤(3)が、フィルムからなる外装材(4)の中に封入され、密封包装されたものである。
【0058】
外装材に用いられるフィルムとしては、密封可能なフィルム状材料であればよく、特に限定されないが、さらに水蒸気等の気体の流出入を防ぐことのできる性質を有するものが好ましい。そのようなフィルムとしては、例えばアルミフィルム、高密度ポリエチレンフィルム、ポリ塩化ビニリデンフィルム、高密度ポリエチレンラミネート紙、ポリ塩化ビニリデンラミネート紙等が挙げられ、好ましくはアルミフィルムである。外装材の形態としては、缶、瓶、袋(例えば、カートナー包装、シュリンク包装、ピロー包装等)等が挙げられるが、袋が好ましい。さらに、外装材の形態が袋であるとき、チャック(例えば、シングルチャック、ダブルチャック等)を有する袋であってもよい。
【0059】
本発明の薬物包装体として好ましくは、外装材としてアルミフィルムを用いたアルミフィルム包装体であり、より好ましくはアルミフィルムのピロー包装体である。アルミフィルム包装体は、公知の方法、例えば、PTP包装体および乾燥剤を共にアルミフィルムからなる袋等の内に封入し、ヒートシール等することによって製造することができる。
【0060】
また、本発明の薬物包装体内部の空間体積としては、PTP包装体および乾燥剤の体積を除いて算出した場合、約60〜80cm3が好ましく、約65〜75cm3がより好ましい。
【0061】
本発明において、上記した内部雰囲気の相対湿度が「調節」されたとは、後記実施例の如く、本発明の薬物包装体を作製した後、約6時間後にその相対湿度が定常状態に達し、その後、少なくとも約6ヶ月間、その値が所定の範囲内に維持されることを意味する。
【0062】
本発明において、含水率とは、被験物質に含まれる水の量、すなわち水分含有量を意味する。ここで、被験物質とは本発明の薬物包装体を構成する物質であれば特に限定されないが、好ましくは本発明の組成物、カプセル剤を構成するカプセル皮膜等が挙げられる。本発明において、プランルカスト水和物等を含有してなる組成物の含水率は、約1%〜約2.7%であることが好ましく、約1.2%〜約2.5%であることがより好ましい。カプセル皮膜の含水率は、約8%〜約17%であることが好ましく、約9%〜約16%であることがより好ましい。これら被験物質の含水率は、公知の方法で測定することができる。例えば、医薬品の水分測定法で知られた方法、とりわけ日本薬局方収載の水分測定法、なかでも第十五改正日本薬局方に収載の水分測定法(カールフィッシャー法)等に従って測定することができる。
【0063】
本発明においては、薬物包装体に封入される、シートにてPTP包装された本発明の組成物が充填されたカプセル剤と、一定の吸湿率を有する乾燥剤の量、ならびに組成物およびカプセル皮膜の含水率とを、適宜組み合わせることにより、薬物包装体の内部雰囲気の相対湿度を一定範囲に調節することができる。そのようにして内部雰囲気の相対湿度が調節された本発明の薬物包装体は、本発明の組成物が充填されたカプセル剤の保存時における崩壊遅延、溶出遅延、異常(例えば、割れ、欠け等)、風解、潮解等を抑えることができる。
【0064】
本発明において、「崩壊遅延」とは、本発明におけるカプセル剤の内容物の崩壊時間が延長することによって、プランルカスト水和物の溶出速度が遅延することを意味する。当業者にとっては明らかなように、該カプセル剤中の内容物である本発明の組成物が崩壊し、小粒子状に細分化され表面積が増大することで、プランルカスト水和物の溶出が確実になり、消化管壁から速やかに吸収されると考えられる。
【0065】
本発明において、「崩壊遅延」の程度は、本発明の組成物が充填されたカプセル剤を、薬物包装体内外およびPTP包装体外で任意の期間保存した後に、崩壊試験に付し、初期状態での試験結果と比較することで確認することができる。崩壊試験は公知の方法で行うことができ、例えば、一般的に錠剤やカプセル剤等の内用固形製剤の崩壊試験法として知られた方法に従って行うことができるが、日本薬局方収載の崩壊試験法、なかでも第十五改正日本薬局方に収載の崩壊試験法等に従って行うことが好ましい。
【0066】
本発明において、「溶出遅延」とは、プランルカスト水和物の溶出速度が遅延することによって、生体内投与後における生物学的利用能(バイオアベイラビリティ)が変化することを意味する。当業者にとっては明らかなように、カプセル剤における有効成分の溶出速度が該カプセル剤の生物学的利用能(バイオアベイラビリティ)を規定することから、溶出遅延によって、生体内投与後におけるバイオアベイラビリティが変化し、薬効発現が不十分になったり、副作用を伴う虞があると考えられる。
【0067】
本発明において、「溶出遅延」の程度は、本発明の組成物を充填してなるカプセル剤を薬物包装体内外およびPTP包装体外で任意の期間保存した後に、溶出試験に付し、初期状態での試験結果比較することで確認することができる。溶出試験は公知の方法で行うことができ、例えば、一般的に錠剤やカプセル剤等の内用固形製剤の溶出試験法として知られた方法に従って行うことができるが、日本薬局方収載の溶出試験法、なかでも第十四改正日本薬局方に収載の溶出試験法に従って行うことが好ましく、例えば第1法(回転バスケット法)、第2法(パドル法)、第3法(フロースルーセル法)等に従って行うことが好ましい。
【0068】
「溶出遅延」の程度を確認するための保存の条件は特に限定されないが、例えば、通常当業者によって行われるように室温であってもよいし、一般的に加速試験または苛酷試験と称されるように、高温および/または高湿の条件であってもよい。高温および/または高湿の条件にすることで、室温における長期間の保存の結果を、より短期間で得ることができる。
【0069】
上記の「崩壊遅延」や「溶出遅延」が生じる原因としては、一般的に薬物、特にカプセル剤を保存することによって経時的に、有効成分を含む組成物、製剤基剤(例えば、カプセル剤であればカプセル皮膜等)に何らかの変化(例えば、含水率の変化等)が生じることによるものと考えられている。
【0070】
本発明において、カプセル剤の「異常」とは、保存することによって経時的に、該カプセル剤に何らかの変化(例えば、カプセル皮膜の強度の低下等)が生じることにより、割れ、欠け等のプランルカスト水和物を含有する組成物を保護するというカプセル剤の機能を損なう状態になることを意味する。具体的にカプセル剤の割れ、欠け等が生じると、プランルカスト水和物を含有する組成物が流出するだけでなく、水分の流出入、気体の流出入等により該組成物の内容量または状態が変化し、一定量のプランルカスト水和物およびその品質を保持するというカプセル剤の機能が損なわれることになる。
【0071】
上記したカプセル剤の「異常」は、本発明の組成物が充填されたカプセル剤を薬物包装体内外およびPTP包装体外で任意の期間保存した後に、割れ荷重試験に付し、全検体数に対する割れた検体数で算出した割れ率や、保存期間毎の割れ率を比較することで確認することができる。割れ荷重試験は例えば、カプセル剤に一定の衝撃、荷重等を加え、強度を評価する方法等で行うことができ、例えば、後記実施例に示すように落錘衝撃試験等で行うことができる。
【0072】
本発明の薬物包装体が、本発明の目的、すなわち本発明の組成物が充填されたカプセル剤の保存時における崩壊遅延、溶出遅延、異常(例えば、割れ、欠け等)、風解、潮解等を抑えることを達成するためには、上記した本発明の薬物包装体を構成する要素を以下に示すような特定の組合せにすることが好ましい。すなわち、(I)プラスチックシートにてPTP包装された、以下の(a)〜(e)の特性をすべて有するプランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、(II)カプセル剤1カプセルの総重量100重量部当たり約0.7重量部〜約17重量部の、温度25℃、相対湿度50%において約20%〜約35%の吸湿率を有する乾燥剤とが封入され、(III)フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が約10%〜約45%に調節された薬物包装体であることが好ましい。
(a)1カプセル当たり、約112.5mgまたは約225mgのプランルカスト水和物を含む、
(b)1カプセル当たり、約130mg〜約400mgの組成物を含む、
(c)1カプセル当たり、空カプセルの重量が約30mg〜約90mgである、
(d)組成物の含水率が、約1%〜約2.7%である、
(e)カプセル皮膜の含水率が約8%〜約17%である。
【0073】
本発明の薬物包装体における構成要素の組合せとしてより好ましくは、(I)プラスチックシートにてPTP包装された、上記した(a)〜(e)の特性をすべて有する、プランルカスト水和物、糖類、水溶性高分子および滑沢剤を含有してなる組成物が充填されたカプセル剤と、(II)カプセル剤1カプセルの総重量100重量部当たり約0.7重量部〜約17重量部の、シリカゲルまたは塩化カルシウムを含む乾燥剤とが封入され、(III)フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が約10%〜約45%に調節された薬物包装体が挙げられる。特に好ましくは、(I)プラスチックシートにてPTP包装された、下記の(i)〜(vi)の特性をすべて有する、プランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、(II)カプセル剤1カプセルの総重量100重量部当たり約1重量部〜約15重量部の、塩化カルシウムを含むシート状乾燥剤とが封入され、(III)フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が約10%〜約45%に調節された薬物包装体が挙げられる。
(i)1カプセル当たり、約112.5mgのプランルカスト水和物を含む、
(ii)1カプセル当たり、約130mg〜約400mgの組成物を含む、
(iii)組成物が、プランルカスト水和物100重量部当たり、乳糖を約30重量部〜約60重量部含み、ポリエチレングリコールを約7.5重量部〜約15重量部含み、およびステアリン酸マグネシウムを約1重量部〜約4.5重量部含む組成物である、
(iv)1カプセル当たり、空カプセルの重量が約30mg〜約90mgである、
(v)組成物の含水率が、約1%〜約2.7%である、
(vi)カプセル皮膜の含水率が約8%〜約17%である。
【0074】
[医薬品への適用]
本発明の組成物は、プランルカスト水和物を有効成分として含有するため、気管支喘息、アレルギー性鼻炎、副鼻腔炎、慢性閉塞性肺疾患、メニエール病、滲出性中耳炎、偏頭痛、月経困難症等の種々の疾患等の予防および/または治療薬として有用である。
[毒性]
本発明におけるプランルカスト水和物は低毒性であり、医薬として使用するために十分に安全である。
【実施例】
【0075】
以下、実施例によって本発明を具体的に説明するが、本発明はこれらに限定されるものではない。
なお、以下において、PTP包装体または薬物包装体の作製のための包装作業は、常温(約18〜28℃)、常湿(約30〜70%)の環境下で、当業者にとって明らかな常法に従って行なった。
また、各試験例において、6ヶ月間の保存期間中は、各試験区の温度および相対湿度を一定にしたまま保存し、該相対湿度は温湿度計(THERMO RECORDER RS−12:ESPEC社製)を用いて測定した。
【0076】
[製剤例]:プランルカスト水和物(112.5mg)含有カプセル剤の製造
特開昭61−050977号明細書に記載されている方法に準じて、ポリエチレングリコール水溶液にプランルカスト水和物(40kg)および乳糖(18.7kg)を懸濁したものをスプレードライヤーで噴霧することにより噴霧乾燥造粒物を得た。得られた造粒物とステアリン酸マグネシウム(適宜)との混合物を内容物とし、プランルカスト水和物の含量が1カプセル当たり112.5mgになるようにして、3号カプセル(カプスゲル・ジャパン株式会社製またはクオリカプス株式会社製)に常法に従って充填することにより、以下の組成であるプランルカスト水和物を含有するカプセル剤を得た。
<組成(1カプセル当たり)>
・プランルカスト水和物(112.5mg)
・乳糖(52.65mg)
・ポリエチレングリコール(マクロゴール4000)(11.25mg)
・ステアリン酸マグネシウム(3.6mg)
・空カプセル3号(49.0mg)
【0077】
[PTP包装体製造例]
上記製剤例で製造したプランルカスト水和物含有カプセル剤についてPTP包装に用いるプラスチックシートとして、厚み200μmの硬質塩化ビニルシート(スミライト(登録商標)VSS−1104;住友ベークライト社、以下、PVCと略記する。)を用いてPTP包装した(PTP包装体1)。
同様に、プラスチックシートとして、厚み250μmの硬質塩化ビニルと塩化ビニリデンを組み合わせた複合体シート(VSL−4501;住友ベークライト社、以下、PVC/PVDCと略記する。)を用いてPTP包装した(PTP包装体2)。
同様に、プラスチックシートとして、無延伸ポリプロピレン(NS−3451;住友ベークライト社、以下、CPPと略記する。)を用いてPTP包装した(PTP包装体3)。
なお、いずれのPTP包装体も、各プラスチックシートとアルミフィルムを常法により貼り合わせて、1シート当たり14カプセル封入して製造した。
【0078】
[実施例1〜7および比較例1]
上記PTP包装体製造例で得られたPTP包装体1と塩化カルシウム含浸シート状乾燥剤(IDシート;株式会社アイディ)または粒状シリカゲルを含む袋状乾燥剤(ドライヤーン;山仁薬品株式会社)とを、アルミフィルム袋(約110mm×約200mm)に入れて密封包装することにより、下記表1に示す構成の薬物包装体を製造した。ここで、乾燥剤の重量は、塩化カルシウムを含むシート状乾燥剤の場合、塩化カルシウムを含浸させたシート状のパルプ材の重量も含めた重量を意味する。
【0079】
【表1】

【0080】
上記実施例もしくは比較例で得られた薬物包装体、製剤例で得られたカプセル剤(無包装)またはPTP包装体(アルミフィルム袋なし)をサンプルとして、以下の各試験を行った。
なお、試験結果の解釈にあたっては、カプセル剤(無包装)およびPTP包装体(アルミフィルム袋なし)を各試験に用いた場合の相対湿度は、該カプセル剤または該PTP包装体をアルミフィルム袋に入れて密封した薬物包装体の内部雰囲気の相対湿度と同じ値を示すものとみなした。
【0081】
[試験例1:カプセル剤の含水率の測定]
製剤例で得られたカプセル剤(無包装)およびPTP包装体1(アルミフィルム包装なし)のサンプルについて、温度25℃相対湿度22%または75%の条件下での6ヶ月間の保存期間における保存開始時(初期)、2ヶ月、4ヶ月および6ヶ月後に、第十五改正日本薬局方に記載の水分測定法(カールフィッシャー法)に従って、カプセル皮膜およびカプセルに充填された内容物(組成物)の含水率を各3検体測定し、それぞれ平均値を算出した。結果を表2に示す。
【0082】
【表2】

【0083】
上記の結果より、相対湿度22%の条件下で保存した場合、2ヶ月、4ヶ月および6ヶ月後では無包装状態およびPTP包装状態のカプセル剤のいずれであっても、内容物の含水率はほとんど変化しないものの、カプセル皮膜の含水率が初期よりも低下したことがわかった。一方、相対湿度75%の条件下で保存した場合、2ヶ月、4ヶ月および6ヶ月後ではカプセル皮膜および内容物の水分はともに初期よりも上昇した。
【0084】
次に、実施例2および3のサンプルについて、温度25℃相対湿度75%の条件下での6ヶ月間の保存期間における保存開始時(初期)および6ヶ月後に、第十五改正日本薬局方に記載の水分測定法(カールフィッシャー法)に従って、カプセルに充填された内容物(組成物)の含水率を各3検体測定し、それぞれ平均値を算出した。結果を表3に示す。
【0085】
【表3】

【0086】
上記の結果が示すように、温度25℃相対湿度75%の条件下で保存した場合において、上記したPTP包装体1のままで保存したときの結果と異なり、2種の乾燥剤とのいずれの組合せで構成された薬物包装体においても、内容物の含水率の上昇が見られなかった。また、実施例1および実施例4〜7で製造した薬物包装体について、同じ条件で内容物の含水率を測定したところ、上記の結果とほぼ同じ値を示した。一方、比較例1の薬物包装体について、同じ条件で内容物の含水率を測定したところ、内容物の含水率が上昇した。
なお、上記実施例2および3におけるPTP包装体1の代わりにPTP包装体2または3を用いること以外は同じにして製造した薬物包装体について、同じ条件で内容物の含水率を測定したところ、上記の結果とほぼ同じ値を示した。このことから、内容物の含水率はPTP包装体に用いるプラスチックシートの違いによる影響を受けないことがわかった。
【0087】
[試験例2:カプセル剤の崩壊時間の測定]
製剤例で得られたカプセル剤(無包装)およびPTP包装体1(アルミフィルム包装なし)のサンプルについて、温度25℃相対湿度22%または75%の条件下での6ヶ月間の保存期間における保存開始時(初期)、2ヶ月、4ヶ月および6ヶ月後に、第十五改正日本薬局方に記載の崩壊試験法(カプセル剤)に従って、崩壊時間を調べた。試験は各6検体で行ない、20分以内に全数崩壊し、かつ内容物が完全に溶解したものは適合とし、それ以外のものは不適合とした。結果を表4に示す。
【0088】
【表4】

【0089】
次に、下記表5に示す実施例2〜4、6および比較例1のサンプルについて、温度25℃相対湿度75%の条件下での6ヶ月間の保存期間における保存開始時(初期)、2ヶ月、4ヶ月および6ヶ月後に、上記と同じ方法にて崩壊時間を調べた。結果を表5に示す。
【0090】
【表5】

【0091】
また、実施例1、5および7で製造した薬物包装体について、同じ条件で崩壊試験を行ったところ、いずれの実施例においても保存期間における上記すべての時点で、20分以内に全数崩壊し、かつ内容物が完全に溶解したため、適合であった。
【0092】
上記の結果が示すように、温度25℃相対湿度75%の条件下で保存した場合において、上記したPTP包装体1のまま、または比較例1のように乾燥剤なしの薬物包装体として保存したときには4ヶ月および6ヶ月後に不適合であったのと異なり、2種の乾燥剤と、乾燥剤の量(カプセル剤1カプセルの総重量100重量部に対する乾燥剤の量として、約1.52重量部〜約10.3重量部)とのいずれの組合せで構成された薬物包装体においても、崩壊時間の延長が抑制され、すべての時点で適合となった。
【0093】
上記の試験例1および試験例2の結果を総合して見ると、相対湿度75%の条件下で保存した場合、無包装、PTP包装(アルミフィルム包装なし)または比較例1では、試験例1で観察された内容物およびカプセル皮膜の含水率が上昇することに伴って、試験例2で観察された崩壊時間の延長が引き起こされたことが明らかとなり、薬物包装体の内部雰囲気が約75%以上になるとカプセル剤の崩壊遅延が起こることが示唆された。一方、実施例の薬物包装体では、ある一定量の適正な乾燥剤を共に封入してフィルムにて密封包装することによって、内容物の含水率が好ましい範囲(組成物の含水率:約1%〜約2.7%、カプセル皮膜の含水率:約8%〜約17%)に調節されたため、崩壊遅延が抑制されたと考えられる。
【0094】
[試験例3:カプセル剤の強度の測定]
製剤例で得られたカプセル剤(無包装)のサンプルについて、温度25℃相対湿度22%または75%の条件下での6ヶ月間の保存期間における2ヶ月、4ヶ月および6ヶ月後に、以下の落錘衝撃試験方法に従ってカプセル剤の強度を測定した。また、温度25℃相対湿度7%の条件下での37日間の保存期間における7日および37日後にも同じ方法で測定した。結果をまとめて表6に示す。
<落錘衝撃試験>
(1)落錘衝撃試験装置の台座の円内中央に、カプセル剤を横向きに置いた。100gの金属製の錘を円筒の上部に台座から80mmの高さになるように止め金具で固定した。
(2)円筒を台座に設置し、止め金具のフックを押し込んで外し、錘をカプセル剤の胴およびキャップ部分に自然落下させた。
(3)各50検体ずつ試験に付し、カプセル剤の割れ、欠けの有無を確認した。全カプセル剤中における割れ、欠けのいずれかを生じたカプセル剤の割合を割れ率として算出した。
【0095】
【表6】

【0096】
上記の結果から、温度25℃相対湿度22%の条件下では、無包装状態で2ヶ月、4ヶ月および6ヶ月保存後のカプセル剤の割れ率は適合範囲内であり、相対湿度75%の条件下では、無包装状態で2ヶ月、4ヶ月および6ヶ月保存後のカプセル剤の割れ率はいずれの時点でも0%であったことから、いずれの条件下でも適合であった。一方、温度25℃相対湿度7%の乾燥条件下では、急速にカプセル剤の割れ率が上昇し、不適合であることがわかった。
したがって、試験例1の温度25℃の相対湿度22%におけるカプセル皮膜の含水率以下になると、カプセル剤の強度が低下することが明らかとなった。また、相対湿度が約7%以下の雰囲気ではカプセル剤の割れ率が増加するため、薬物包装体の内部雰囲気の相対湿度は少なくとも7%を超えるように調節されるべきことが示唆された。
【0097】
[試験例4:カプセル剤のアルミフィルム包装体内部の相対湿度測定]
上記した実施例1、5および7で製造した薬物包装体において、密封包装時に温湿度計(THERMO RECORDER RS−12:ESPEC社)を共にアルミフィルム製の袋(110mm×200mm)に封入し、常法によりヒートシールした。このヒートシールした温湿度計を内包する薬物包装体を48時間は室温で、その後は温度25℃、相対湿度60%の環境下で24時間静置し、薬物包装体の内部雰囲気の相対湿度をモニタリングした。
温度25℃、相対湿度が定常状態に達した時点での、内部雰囲気の相対湿度を測定した結果を表7に示す。
【0098】
【表7】

【0099】
また、実施例2、3および4の薬物包装体について、上記と同じ方法および同じ条件で各薬物包装体の内部雰囲気の相対湿度をモニタリングしたところ、該相対湿度が約10〜23%の範囲内にあることがわかった。さらに、実施例6の薬物包装体についても、同様に薬物包装体の内部雰囲気の相対湿度をモニタリングしたところ、該相対湿度が約23〜37%の範囲内にあることがわかった。
【0100】
上記の結果より、乾燥剤の量を「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」として、1カプセルの総重量100重量部当たり、約1.5重量部〜約11重量部の範囲で用いれば、フィルム包装体内の温度25℃における相対湿度が約10%〜約40%に調節されることがわかった。
【0101】
試験例1〜3までの結果を総合してみると、実施例1〜7の薬物包装体について、組成物およびカプセル皮膜の含水率は、それぞれ約1%〜約2.7%および約8%〜17%の範囲内にあることから、崩壊遅延およびカプセル剤の割れが共に起こらなかった。さらに、試験例4を合わせて考慮してみると、上記したような組成物およびカプセル皮膜の含水率の範囲内に調節されることによって、薬物包装体の内部雰囲気が約10〜約40%に調節されることがわかった。
【0102】
したがって、プラスチックシートにてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、乾燥剤の量を「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」として、1カプセルの総重量100重量部当たり、約1.5重量部〜約11重量部の範囲に調節して共に封入すれば、該カプセル剤の組成物およびカプセル皮膜の含水率が至適な範囲に調節されるため、薬物包装体の内部雰囲気の相対湿度が約10%〜約40%に調節されることがわかった。
【産業上の利用可能性】
【0103】
本発明によれば、PTP包装されたプランルカスト水和物を含有するカプセル剤の保存時における崩壊遅延等の品質低下や、カプセルの割れ等の異常が最小限に抑えられた薬物包装体を提供することができる。
【図面の簡単な説明】
【0104】
【図1】本発明の薬物包装体の構成を例示する模式図である。
【符号の説明】
【0105】
1:プラスチックシート
2:カプセル剤
3:乾燥剤
4:外装材(フィルム)
【技術分野】
【0001】
本発明は、プランルカスト水和物を含有してなるカプセル剤の薬物包装体に関する。
【背景技術】
【0002】
錠剤やカプセル剤等の固形製剤をプラスチックシート等にて密封する場合の包装形態としては、SP(strip package)包装、PTP(press through package)包装等が一般的に用いられている。そして、これらのSP包装、あるいはPTP包装された製剤は、外気や光による影響を避けるために、さらにアルミフィルム製袋等の密封体に封入した薬物包装体として市場に提供されている。
【0003】
一方、プランルカスト水和物はロイコトリエン(LT)拮抗薬として知られており(特許文献1参照)、また気管支喘息やアレルギー性鼻炎の治療薬として実際に臨床適用されている。プランルカスト水和物を含有する固形製剤は、特にカプセル剤の場合、温度25℃、相対湿度75%において無包装状態で保存すると、1週間で溶出変化が起こることが報告されている(非特許文献1参照)。さらに、該カプセル剤は、PTP包装された状態であっても、含有する水分や外気の湿度等の上昇により、崩壊速度の遅延や溶出が変化することがある。
【0004】
これまで、ペリンドプリルエルブミンを有効成分とする錠剤と、乾燥剤とを共に密封体に封入した薬物包装体について開示されている(特許文献2参照)。しかしながら、プランルカスト水和物のカプセル剤の場合、崩壊速度の遅延や溶出の変化を防ぐために、防湿性のフィルムからなる密封体にPTP包装体と共に乾燥剤を封入した状態では、含有する水分の低下によりカプセルが割れることがあった。したがって、上記したように、プランルカスト水和物のカプセル剤をPTP包装した後、単に密封体に封入するか、または単に乾燥剤と共に密封体に封入するだけでは、包装体内の雰囲気の相対湿度を調節することができないため、該カプセル剤の崩壊遅延、溶出遅延やカプセルの割れを防げない等の問題があった。この問題に関し、薬物包装体の内部雰囲気の相対湿度を調節することについては、上記文献に記載も示唆もなされていない。
【0005】
【特許文献1】特開昭61−050977号公報
【特許文献2】特開平11−206850号公報
【非特許文献1】錠剤・カプセル剤の無包装状態での安定性情報 改訂3版(社団法人日本病院、医薬ジャーナル社)
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明の目的は、プラスチックシートに包装されたプランルカスト水和物を含有するカプセル剤の保存時における崩壊遅延等の品質低下を最小限に抑え、かつカプセルの割れを最小限に抑えることのできる薬物包装体を提供することにある。
【課題を解決するための手段】
【0007】
本発明者らは、上記した目的を達成するためには薬物包装体内の相対湿度を調節することが有効であると考え、プラスチックシートにてPTP包装された、プランルカスト水和物を含有してなる組成物が充填されたカプセル剤を、乾燥剤とともに封入して、フィルムにて密封包装した薬物包装体について、乾燥剤の量、ならびに該カプセル剤中の組成物およびカプセル皮膜の含水率の組合せを鋭意検討した。その結果、驚くべきことに、これらの要素について、ある特定の組合せにすることによって、該カプセル剤の保存時における崩壊遅延およびカプセルの割れを抑えることのできる、内部雰囲気の相対湿度が調節された薬物包装体を提供できることを見出し、本発明を完成させた。
【0008】
すなわち、本発明は、
[1] シートにてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、乾燥剤とが封入され、フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が10%〜45%に調節された薬物包装体、
[2] さらに、保湿剤が封入された、前記[1]記載の薬物包装体、
[3] シートが、プラスチックシートまたはアルミシートである前記[1]記載の薬物包装体、
[4] カプセル剤が、1カプセル当たり、112.5mgまたは225mgのプランルカスト水和物を含むカプセル剤である前記[1]記載の薬物包装体、
[5] カプセル剤が、1カプセル当たり、130mg〜400mgの組成物を含むカプセル剤であって、該1カプセル当たりの空カプセルの重量が30mg〜90mgである前記[1]記載の薬物包装体、
[6] プランルカスト水和物を含有してなる組成物の含水率が1%〜2.7%である前記[1]記載の薬物包装体、
[7] カプセル剤におけるカプセル皮膜の含水率が8%〜17%である前記[1]記載の薬物包装体、
[8] プランルカスト水和物を含有してなる組成物が、さらに糖類、水溶性高分子および滑沢剤を含む組成物である前記[1]記載の薬物包装体、
[9] 糖類が乳糖であって、水溶性高分子がポリエチレングリコールであって、滑沢剤がステアリン酸マグネシウムである前記[8]記載の薬物包装体、
[10] プランルカスト水和物を含有してなる組成物が、プランルカスト水和物100重量部に対して、乳糖を30重量部〜60重量部含み、ポリエチレングリコールを7.5重量部〜15重量部含み、およびステアリン酸マグネシウムを1.0重量部〜4.5重量部含む組成物である前記[9]記載の薬物包装体、
[11] 乾燥剤が、温度25℃、相対湿度50%において20%〜35%の吸湿率を有する乾燥剤である前記[1]記載の薬物包装体、
[12] 乾燥剤が、シリカゲルまたは塩化カルシウムである前記[11]記載の薬物包装体、
[13] 乾燥剤が、シート状乾燥剤である前記[11]記載の薬物包装体、
[14] シート状乾燥剤が、塩化カルシウムを含むシート状乾燥剤である前記[13]記載の薬物包装体、
[15] カプセル剤1カプセルの総重量100重量部当たり、封入される乾燥剤の重量が0.7重量部〜17重量部である前記[11]記載の薬物包装体、
[16] カプセル剤1カプセルの総重量100重量部当たり、封入される乾燥剤の重量が1重量部〜15重量部である前記[11]記載の薬物包装体、
[17] アルミフィルムのピロー包装体である前記[1]記載の薬物包装体、
[18] (I)プラスチックシートにてPTP包装された、下記の(a)〜(e)の特性をすべて有する、プランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、(II)カプセル剤1カプセルの総重量100重量部当たり0.7重量部〜17重量部の、温度25℃、相対湿度50%において20%〜35%の吸湿率を有する乾燥剤とが封入され、(III)フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が10%〜45%に調節された薬物包装体:
(a)1カプセル当たり、112.5mgまたは225mgのプランルカスト水和物を含む、
(b)1カプセル当たり、130mg〜400mgの組成物を含む、
(c)1カプセル当たり、空カプセルの重量が30mg〜90mgである、
(d)組成物の含水率が、1%〜2.7%である、
(e)カプセル皮膜の含水率が8%〜17%である、
[19] プランルカスト水和物を含有してなる組成物が、プランルカスト水和物、糖類、水溶性高分子および滑沢剤を含有してなる組成物であって、乾燥剤がシリカゲルまたは塩化カルシウムを含む乾燥剤である前記[18]記載の薬物包装体、
[20] カプセル剤が、1カプセル当たり、112.5mgのプランルカスト水和物を含むカプセル剤であって、プランルカスト水和物を含有してなる組成物が、プランルカスト水和物100重量部当たり、乳糖を30重量部〜60重量部含み、ポリエチレングリコールを7.5重量部〜15重量部含み、およびステアリン酸マグネシウムを1.0重量部〜4.5重量部含む組成物であって、乾燥剤が塩化カルシウムを含むシート状乾燥剤であって、該シート状乾燥剤が、1カプセルの総重量100重量部当たり、1重量部〜15重量部の割合で封入される前記[19]記載の薬物包装体、
[21] フィルムにて密封包装された薬物包装体内に、プラスチックシートにてPTP包装された、下記の(a)〜(e)の特性をすべて有するように調節された、プランルカスト水和物を含有してなる組成物を充填したカプセル剤と、塩化カルシウムを含むシート状乾燥剤とを、該カプセル剤1カプセルの総重量100重量部当たり、該シート状乾燥剤を0.7重量部〜17重量部含むように調節して、共に封入することにより、該薬物包装体の、温度25℃における温湿度計を用いて測定した内部雰囲気の相対湿度を約10%〜約45%に調節する方法:
(a)1カプセル当たり、112.5mgまたは225mgのプランルカスト水和物を含む、
(b)1カプセル当たり、130mg〜400mgの組成物を含む、
(c)1カプセル当たり、空カプセルの重量が30mg〜90mgである、
(d)組成物の含水率が、1%〜2.7%である、
(e)カプセル皮膜の含水率が8%〜17%である、
等に関する。
【発明の効果】
【0009】
本発明の薬物包装体においては、その内部にプラスチックシートにてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、一定の吸湿率を有する乾燥剤が適宜封入されることによって、薬物包装体の内部雰囲気の相対湿度が好ましい範囲に調節され、水分の影響を受けやすい該組成物を充填してなるカプセル剤の保存時における崩壊遅延、異常(例えば、割れ、欠け等)等を抑える効果を奏する。
【発明を実施するための最良の形態】
【0010】
本発明においては、プランルカスト水和物を含有してなる組成物が充填されたカプセル剤がシートにて包装され、薬物包装体はこのシートにて包装されたカプセル剤と、乾燥剤とを含み、必要に応じて保湿剤を含んでいてもよく、それら全体がフィルムにて密封包装されて構成されている。すなわち、本発明の薬物包装体は、上記シートにて包装されたカプセル剤と、乾燥剤とが封入され、必要に応じて保湿剤が封入されていてもよく、フィルムにて密封包装されてなる薬物包装体である。
【0011】
本発明において、上記のカプセル剤を包装するために用いられるシートとしては、医薬品を包装可能であるシートであれば特に限定されないが、プラスチックシート、アルミシート等が挙げられる。好ましくは、プラスチックシートである。
【0012】
本発明において、プラスチックシートとしては、例えばポリ塩化ビニルシート、ポリ塩化ビニリデン(PVDC)シート、塩化ビニリデンシート、ポリクロロトリフルオロエチレンシート、無延伸ポリプロピレン(CPPまたはIPP)シート、環状ポリオレフィンシート、ポリエチレンシート、無延伸ナイロン(CNy)シート、二軸延伸ナイロン(ONy)シート、二軸延伸ポリプロピレン(OPP)シート、硬質塩化ビニルシート、ポリエチレンテレフタラートシート、ポリアクリロニトリル共重合体(PAN)シート、ポリビニルアルコール(PVA)シート、ポリエステル(PET)シート、エチレン・酢酸ビニル共重合体(EVA)シート、アイオノマー(IO)シート、ポリアミド(PAまたはNy)シート、エチレン・ビニルアルコール共重合体(EVOH)シート、ポリカーボネート(PC)シートおよびポリスチレン(PS)シート等が挙げられる。これらのプラスチックシートは2種以上を適宜組合せた複合体シートとして用いてもよい。
【0013】
本発明で用いられるプラスチックシートとしては、約0.5g/m2・24hr〜約5.0g/m2・24hrの透湿度(水蒸気透過度)を有するものが好ましい。そのような好ましい透湿度を有するプラスチックシートとしては、例えば硬質塩化ビニルシート、硬質塩化ビニルとポリ塩化ビニリデンを組み合わせた複合体シート、無延伸ポリプロピレンシート等が挙げられ、特に硬質塩化ビニルシートが好ましいが、これらに限定されるものではない。
【0014】
上記の透湿度とは、定められた温度及び湿度の条件下に、一定時間に単位面積のシートを通過する水蒸気の量を意味し、その測定は、公知の方法で行うことができる。例えば、一般的にプラスチックシートやシート等の包装材料の透湿度測定法として知られた方法、なかでもカップ法(JIS Z0208)に従って行うことが好ましい。
【0015】
プラスチックシートとしては、平坦なシートである必要はなく、例えばカプセル剤を1個ずつ収納するためのスペースを設けるべく、凹部が成型されたシートを用いることができる。
【0016】
本発明において、カプセル剤をシートにて包装する際には、該シートと他のフィルム状材料とを適宜組み合わせ、両者の間にカプセル剤を内包するようにして貼り合わせて用いてもよい。例えば、アルミニウム、酸化ケイ素、酸化アルミニウム等の無機物を蒸着した蒸着フィルム、紙、アルミフィルム、セロファンフィルム等の通常の包装材料として用いられるフィルム状材料の中から1種または2種以上を選択し、内容物を保護する等の目的で上記シートと適宜組み合わせ、貼り合わせて用いることができる。上記したシートと他のフィルム状材料とを貼り合わせる方法としては、ドライラミネーション、押出コーティング・ラミネーション、ウェットラミネーション、ホットメルトラミネーション、共押出成形ラミネーション、ノンソルベントラミネーション、サーマルラミネーション等が挙げられる。
【0017】
本発明において、プランルカスト水和物等を含有してなる組成物が充填されたカプセル剤をシートで包装する形態としては、SP(strip package)包装、PTP(press through package)包装、ブリスター包装(blister pack)等が挙げられる。好ましくは、PTP包装である。
本発明に用いられるPTP包装としては、例えば、硬質塩化ビニルとアルミフィルムとを組み合わせて、公知の方法により貼り合わせて成型したものが好ましい。
【0018】
本発明において、プランルカスト水和物を含有してなる組成物(以下、本発明の組成物と略記する場合がある。)とは、(1)プランルカスト水和物を含有し、好ましくは(2)糖類および(3)水溶性高分子を含有し、さらに(4)カプセル剤を製造する際に一般的に使用される添加剤(製剤基剤)を含んでいてもよい組成物である。ここで、添加剤(製剤基剤)としては、例えば、賦形剤、結合剤、滑沢剤、安定(化)剤、崩壊剤、矯味剤、界面活性剤、香料、着色料、抗酸化剤、隠蔽剤、静電気防止剤、流動化剤、湿潤剤、溶出補助剤、溶解補助剤、コーティング剤等が挙げられ、これらのうちから1種または2種以上を選択して本発明の組成物に適宜配合して用いることができる。上記の添加剤としては、滑沢剤が好ましい。
【0019】
本発明の組成物に用いられるプランルカスト水和物とは、下記式(A)
【化1】

で示される4−オキソ−8−[4−(4−フェニルブトキシ)ベンゾイルアミノ]−2−(テトラゾール−5−イル)−4H−1−ベンゾピラン 1/2水和物である。プランルカスト水和物の製造は、例えば、特開昭61−050977号明細書記載の方法に準じて行うことができる。
【0020】
本発明の組成物における糖類としては、乳糖、マンニトール、白糖、デキストリン、デキストラン、トレハロース、プルラン、グルコース、果糖、麦芽糖、異性化乳糖、還元乳糖、ショ糖、エリスリトール、マルチトール、キシリトール、パラチノース、ソルビトール、トウモロコシデンプン、馬鈴薯デンプン、コムギデンプン、コメデンプン等が挙げられる。好ましくは、乳糖、白糖、マンニトール等である。より好ましくは、乳糖である。
【0021】
本発明の組成物における水溶性高分子としては、セルロース類(例:ヒドロキシメチルセルロース、ヒドロキシメチルエチルセルロース、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース(HPC)、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルメチルセルロースフタレート(HPMCP)、ヒドロキシプロピルメチルセルロースアセテートスクシネート(HPMCAS)等)、合成高分子類(例:ポリエチレングリコール(例えば、マクロゴール4000等)、ポリビニルピロリドン、ポリビニルアルコール等)、ゼラチン等が挙げられる。好ましくは、ポリエチレングリコール、メチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース等である。より好ましくは、ポリエチレングリコールである。
【0022】
添加剤としての賦形剤としては、例えば、糖類(例えば、乳糖、マンニトール、白糖、デキストリン、デキストラン、トレハロース、プルラン、グルコース、果糖、麦芽糖、異性化乳糖、還元乳糖、ショ糖、エリスリトール、マルチトール、キシリトール、パラチノース、ソルビトール、トウモロコシデンプン、馬鈴薯デンプン、コムギデンプン、コメデンプン等)、微結晶セルロース、無水ケイ酸、無水リン酸カルシウム、沈降炭酸カルシウム、ケイ酸カルシウム等が挙げられる。
【0023】
結合剤としては、例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポビドン(ポリビニルピロリドン)、メチルセルロース、ポリビニルアルコール、カルボキシメチルセルロースナトリウム、部分α化デンプン、α化デンプン、アルギン酸ナトリウム、プルラン、アラビアゴム末、ゼラチン、メタケイ酸アルミン酸マグネシウム等が挙げられる。
【0024】
滑沢剤としては、例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、蔗糖脂肪酸エステル、フマル酸ステアリルナトリウム、ステアリン酸、タルク、ポリエチレングリコール等が挙げられる。好ましくは、ステアリン酸マグネシウムである。
【0025】
安定(化)剤としては、例えば、アジピン酸、アスコルビン酸、L−アスパラギン酸、アルブミン、安息香酸、エタノール、エチレンジアミン、塩化亜鉛、塩化カルシウム、塩化ナトリウム、塩化ベンザルコニウム、塩化ベンゼトニウム、塩化マグネシウム、塩酸、塩酸アルギニン、塩酸システイン、塩酸リジン、カルメロースカルシウム、カルメロースナトリウム、希塩酸、クエン酸、クエン酸カルシウム、クエン酸ナトリウム、グリシン、グリセリン、結晶セルロース、硬化油、ゴマ油、コンドロイチン硫酸ナトリウム、酢酸、酢酸亜鉛、酢酸トコフェロール、酢酸ナトリウム、サリチル酸ナトリウム、サリチル酸フェニル、酸化亜鉛、酸化マグネシウム、ジイソプロパノールアミン、ジエタノールアミン、ジブチルヒドロキシトルエン、ジメチルポリシロキサン、臭化カルシウム、酒石酸、水酸化カルシウム、水酸化ナトリウム、水酸化マグネシウム、ステアリン酸、セタノール、ゼラチン、D−ソルビトール、タルク、炭酸アンモニウム、炭酸カリウム、炭酸水素ナトリウム、炭酸ナトリウム、炭酸マグネシウム、チオグリコール酸、チオグリコール酸ナトリウム、チオ硫酸ナトリウム、デキストリン、トコフェロール、乳酸、乳酸ナトリウム液、乳糖、尿素、濃グリセリン、白糖、微結晶セルロース、ヒドロキシプロピルセルロース、ヒドロキノン、氷酢酸、グルコース、フマル酸、フマル酸一ナトリウム、プロピオン酸ナトリウム、プロピレングリコール、ベンジルアルコール、ポビドン(ポリビニルピロリドン)、ポリビニルアルコール(部分けん化物)、ポリビニルアルコール・ジブチルエーテル混合物、マレイン酸、マロン酸、D−マンニトール、無水クエン酸、無水クエン酸ナトリウム、無水酢酸ナトリウム、無水マレイン酸、無水リン酸一水素ナトリウム、無水リン酸二水素ナトリウム、メタケイ酸アルミン酸マグネシウム、メタスルホ安息香酸ナトリウム、メタリン酸ナトリウム、メチルセルロース、メチルビニルエーテル・無水マレイン酸共重合体、ヨウ化カリウム、ヨウ化ナトリウム、ラウリル硫酸ナトリウム、硫酸亜鉛、硫酸アルミニウムカリウム、硫酸カリウム、硫酸マグネシウム、リン酸、リン酸二水素カリウム、リン酸二水素カルシウム等が挙げられる。
【0026】
崩壊剤としては、例えば、低置換度ヒドロキシプロピルセルロース、カルメロース、カルメロースカルシウム、カルボキシメチルスターチナトリウム、クロスカルメロースナトリウム、クロスポビドン、ヒドロキシプロピルスターチ、トウモロコシデンプン、繊維素グリコール酸カルシウム等が挙げられる。
【0027】
矯味剤としては、例えば、白糖、D−ソルビトール、キシリトール、クエン酸、アスコルビン酸、酒石酸、リンゴ酸、アスパルテーム、アセスルファムカリウム、ソーマチン、サッカリンナトリウム、グリチルリチン二カリウム、グルタミン酸ナトリウム、5'−イノシン酸ナトリウム、5'−グアニル酸ナトリウム等が挙げられる。
【0028】
界面活性剤としては、例えば、ポリソルベート(例えば、ポリソルベート20、ポリソルベート40、ポリソルベート60、ポリソルベート65、ポリソルベート80等)、ポリオキシエチレン・ポリオキシプロピレン共重合物、ポリオキシエチレン硬化ヒマシ油、モノステアリン酸ソルビタン、ラウリル硫酸ナトリウム等が挙げられる。
【0029】
香料としては、例えば、レモン油、オレンジ油、メントール、はっか油等が挙げられる。
着色剤としては、例えば、酸化チタン、食用黄色5号、食用青色2号、三二酸化鉄、黄色三二酸化鉄等が挙げられる。
抗酸化剤としては、例えば、アスコルビン酸ナトリウム、L−システイン、亜硫酸ナトリウム、ビタミンE等が挙げられる。
【0030】
隠蔽剤としては、例えば、酸化チタン等が挙げられる。
静電気防止剤としては、例えば、タルク、酸化チタン等が挙げられる。
流動化剤としては、例えば、軽質無水ケイ酸、タルク、含水二酸化ケイ素等が挙げられる。
湿潤剤としては、例えば、ポリソルベート80、ラウリル酸硫酸ナトリウム、ショ糖脂肪酸エステル、ポリエチレングリコール、ヒドロキシプロピルセルロース(HPC)等が挙げられる。
【0031】
溶出補助剤としては、例えば、乾燥メタクリル酸コポリマーLD、ヒドロキシプロピルメチルセルロースアセテートサクシネート、ヒドロキシプロピルメチルセルロースフタレート等が挙げられる。
溶解補助剤としては、例えば、グルタミン酸、アスパラギン酸等が挙げられる。
コーティング剤としては、例えば、白糖、ゼラチン、ヒドロキシプロピルセルロース、ヒドロキシメチルセルロースフタレート等が挙げられる。
【0032】
また、上記した添加剤は、例示した用途以外に他の用途(例えば、賦形剤、結合剤、滑沢剤、安定(化)剤、崩壊剤、矯味剤、界面活性剤、香料、着色料、抗酸化剤、隠蔽剤、静電気防止剤、流動化剤、湿潤剤、溶出補助剤、溶解補助剤、コーティング剤等)で使用可能であればその用途で用いてもよい。さらに、上記以外にも、公知の文献、例えば、薬事日報社2005年刊「医薬品添加物辞典」(日本医薬品添加剤協会編集)等に記載されているような添加剤を用いてもよい。
【0033】
本発明の組成物は、(1)プランルカスト水和物、(2)糖類、(3)水溶性高分子および(4)カプセル剤を製造する際に一般的に使用される添加剤(製剤基剤)を含有してなる組成物であることが好ましい。該(1)〜(4)の組合せとしては、(1)プランルカスト水和物、(2)乳糖、白糖およびマンニトールからなる群より選択される1種以上の糖類、(3)ポリエチレングリコール、メチルセルロース、ヒドロキシプロピルセルロースおよびヒドロキシプロピルメチルセルロースからなる群より選択される1種以上の水溶性高分子、および(4)滑沢剤の組合せが好ましく、(1)プランルカスト水和物、(2)乳糖、(3)ポリエチレングリコールおよび(4)ステアリン酸マグネシウムの組合せがより好ましい。
【0034】
本発明の組成物において、プランルカスト水和物100重量部に対する糖類の重量比として好ましくは、約20重量部〜約70重量部であり、より好ましくは約25重量部〜約65重量部であり、さらに好ましくは約30重量部〜約60重量部である。また、プランルカスト水和物100重量部に対する水溶性高分子の重量比として好ましくは、約5重量部〜約20重量部であり、より好ましくは、約7.5重量部〜約15重量部である。
【0035】
本発明の組成物において、プランルカスト水和物100重量部に対する滑沢剤の重量比として好ましくは、約0.5重量部〜約5重量部であり、より好ましくは約1.0重量部〜約4.5重量部である。
【0036】
本発明において、カプセル剤に充填される本発明の組成物の重量としては、1カプセル当たり、約130mg〜約400mgが好ましく、約150mg〜約380mgがより好ましい。
【0037】
本発明の組成物の形態としては、造粒物が好ましい。該造粒物としては、一般的に用いられている医薬品製剤の造粒法、例えば、「造粒ハンドブック」(日本粉体工業技術協会編、オーム社、1991年)に記載されている造粒法等によって製造される造粒物であれば特に限定されないが、例えば湿式造粒物、乾式造粒物、転動造粒物、噴霧乾燥造粒物、押出し造粒物、流動層造粒物、撹拌造粒物、圧縮造粒物、溶融造粒物、破砕造粒物、コーティング造粒物、液相造粒物、真空凍結造粒物等が挙げられる。なかでも好ましくは、転動造粒物、噴霧乾燥造粒物、押出し造粒物、流動層造粒物、撹拌造粒物等である。より好ましくは、噴霧乾燥造粒物、撹拌造粒物等である。
なお、撹拌造粒物には、撹拌造粒物、撹拌流動層造粒物、撹拌転動流動層造粒物等が含まれる。
【0038】
本発明の組成物が噴霧乾燥造粒物である場合、噴霧乾燥造粒物100重量%におけるプランルカスト水和物の重量%として好ましくは、約50%〜約98%であり、より好ましくは約55%〜約90%であり、特に好ましくは約60%〜約80%である。
本発明の組成物が撹拌造粒物である場合、撹拌造粒物100重量%におけるプランルカスト水和物の重量%として好ましくは、約30%〜約98%であり、より好ましくは約50%〜約80%である。
【0039】
本発明におけるカプセル剤としては、本発明の組成物が充填されているカプセル剤であれば特に限定されず、医薬品として一般的に用いられるカプセル剤と同様のものでよい。カプセル剤には、ハードカプセル剤、ソフトカプセル剤等が含まれる。
【0040】
本発明におけるカプセル剤は、プランルカスト水和物を含有するカプセル剤であり、本発明の組成物の一定量を、常法にしたがって、カプセル皮膜(空カプセル)の中に充填した製剤である。カプセル皮膜としては、ハードカプセル、ソフトカプセルのいずれであってもよい。
【0041】
上記のカプセル皮膜は、通常はカプセル基剤および可塑剤を含むものであり、必要に応じて、例えば、香料(例えば、ハッカ油、桂皮油、ストロベリーその他の果実エッセンスやフレーバー等)、防腐剤(例えば、パラヒドロキシ安息香酸エチル、パラヒドロキシ安息香酸プロピル等)、色素(例えば、黄色4号、黄色5号、赤色3号、青色1号、銅クロロフィン等)、不透明化剤(例えば、二酸化チタン、ベンガラ、三二酸化鉄等)、滑沢剤(例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、蔗糖脂肪酸エステル、フマル酸ステアリルナトリウム、ステアリン酸、タルク、ポリエチレングリコール、ラウリル硫酸ナトリウム等)、溶解度調節剤(例えば、セルロースアセテートフタレート、ヒドロキシプロピルメチルセルロースのアルカリ金属塩、ヒドロキシメチルセルロースアセテートサクシネートのアルカリ金属塩、アルギン酸アルカリ塩、ポリアクリル酸アルカリ金属塩、メチルセルロース、カルボキシメチルセルロース、カゼイン、コラーゲン、寒天末、ポリビニルアルコール、ペクチン等)等を含んでいてもよい。
【0042】
本発明において、カプセル皮膜に用いられるカプセル基剤は、カプセル皮膜の基剤として使用可能な物質であればどのようなものであってもよい。例えば、蛋白質(例えば、ゼラチン、ゼラチン加水分解物、コラーゲン、コラーゲン加水分解物、カゼイン等)、多糖類(例えば、デンプン、アミロース、ポリガラクツロン酸、寒天、カラギナン、アラビアガム、ジェランガム、キサンタンガム、ペクチン、アルギン酸、プルラン等)、セルロース類(例えば、ヒドロキシメチルセルロース、ヒドロキシメチルエチルセルロース、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース(HPC)、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルメチルセルロースフタレート(HPMCP)、ヒドロキシプロピルメチルセルロースアセテートスクシネート(HPMCAS)等)、生分解性プラスチック(例えば、ポリ乳酸、ポリヒドロキシ酪酸、ポリグルタミン酸等)、硬化油脂(例えば、中鎖脂肪酸のトリグリセリドやジグリセリド(例えば、バター、マーガリン、ショートニング、カカオバター等)等)等が挙げられる。これらのカプセル基剤は、2種以上を適宜組み合わせて用いてもよい。本発明においては、これらのカプセル基剤のなかでも、蛋白質、特にゼラチンが好ましい。
【0043】
また、カプセル皮膜に用いられる可塑剤は、カプセル皮膜の可塑剤として使用可能な物質であればどのようなものであってもよい。例えば、糖(例えば、ショ糖、白糖、水アメ等)、糖アルコール(例えば、ソルビトール、キシリトール、マンニトール等)、多価アルコール(例えば、グリセリン、エチレングリコール、ポリエチレングリコール、プロピレングリコール等)等が挙げられる。なかでも多価アルコール、特にポリエチレングリコールが好ましい。
【0044】
本発明において、カプセル剤に含まれるプランルカスト水和物の含有量としては、1カプセル当たり、約112.5mg〜約450mgが好ましく、より好ましくは112.5mg、225mgまたは450mgであり、さらに好ましくは112.5mgまたは225mgであり、特に好ましくは112.5mgである。また、カプセルの大きさとしては、1号、2号、3号または4号カプセルが好ましく、1カプセル当たりの空カプセルの重量としては、約30mg〜約90mgが好ましい。例えば、プランルカスト水和物を225mg含有する2号カプセル剤もしくは3号カプセル剤、または112.5mg含有する3号カプセル剤もしくは4号カプセル剤等が、服用患者のコンプライアンスの観点から好ましい。
【0045】
したがって、本発明のカプセル剤において、1カプセルの総重量としては、充填される組成物の重量および空カプセルの重量を加算したものであることから、約160mg〜約490mgが好ましく、約180mg〜約470mgがより好ましい。
【0046】
本発明において、乾燥剤としては、一般的に医薬品の保存時に用いられるものであれば特に限定されないが、そのような乾燥剤としては、例えば酸化アルミニウム、カルシウム、塩化カルシウム、水素化カルシウム、酸化カルシウム、硫酸カルシウム、硫酸銅、水素化リチウムアルミニウム、マグネシウム、酸化マグネシウム、過塩素酸マグネシウム、硫酸マグネシウム、合成ゼオライト(例えば、モレキュラーシーブ等)、天然ゼオライト、五酸化二リン、炭酸カリウム、水酸化カリウム、シリカゲル、シリカアルミナゲル、ナトリウム、水酸化ナトリウム、硫酸ナトリウム、ケイ酸アルミン酸マグネシウム、活性炭等が挙げられる。これらは、必要に応じて、2種以上を適宜組み合わせて使用してもよい。
【0047】
上記に列挙した乾燥剤以外に、高分子ポリマーを構成成分とする吸水剤も本発明における乾燥剤の範疇に含まれる。そのような吸水剤としては、特に限定されないが、例えば、酢酸ビニル−(メタ)アクリル酸エステル共重合体、酢酸ビニル−無水マレイン酸共重合体、イソブチレン−無水マレイン酸共重合体、アクリル酸−メタクリル酸共重合体、ポリビニルアルコール、ポリエチレンオキシド、ポリプロピレンオキシド、ポリビニルピロリドン、スルホン化ポリスチレン、ポリビニルピリジン、ポリアクリルアミド、ポリメタクリルアミド等が挙げられる。
【0048】
本発明に用いられる乾燥剤の形態としては、例えば粒状、フィルム状、プレート状もしくはシート状に成形したもの、および粒状のものを通気性のある袋に充填したもの(例えば、ドライヤーン(商品名、山仁株式会社;シリカゲル)、アイディF(商品名、アイディ株式会社;塩化カルシウム)等が挙げられるが、その形態は特に限定されない。
【0049】
本発明においては、シート状に成形した乾燥剤(「シート状乾燥剤」ともいう)が好ましく用いられる。乾燥剤をシート状に成形する場合には、例えば、乾燥剤を適当な支持体、成形用プラスチック等に配合して、乾燥剤をプラスチック内に練り込みシート状に成形する方法、またはパルプ材に乾燥剤の原料となる物質を含む溶液を含浸させて成型する方法等が挙げられる。シート状乾燥剤としては、IDシート(商品名、株式会社アイディ;塩化カルシウム)、ハイシートドライ(商品名、丸谷化工機株式会社;シリカゲル)、ハイドライパック(商品名、丸谷化工機株式会社;シリカゲル)等が挙げられる。好ましくは、IDシートが挙げられる。
【0050】
本発明に用いられる乾燥剤としては、温度25℃、相対湿度50%において約20%〜約35%の吸湿率を有する乾燥剤が好ましい。そのような乾燥剤として好ましくは、例えば、シリカゲル、シリカアルミナゲル、塩化カルシウム、五酸化二リン、合成ゼオライトまたは天然ゼオライト等を含む乾燥剤が挙げられ、より好ましくは、塩化カルシウムまたはシリカゲルを含む乾燥剤等が挙げられ、さらに好ましくは、塩化カルシウムを含むシート状乾燥剤が挙げられ、特に好ましくは、塩化カルシウムを約10重量%〜約30重量%含むシート状乾燥剤が挙げられる。塩化カルシウムを約10重量%〜約30重量%含むシート状乾燥剤としては、例えばIDシート(商品名、株式会社アイディ)が挙げられる。
【0051】
本発明において乾燥剤を用いる場合は、1カプセルの総重量100重量部に対して、乾燥剤を約0.7重量部〜約17重量部用いることが好ましく、約1重量部〜約15重量部用いることがより好ましく、約1.5重量部〜約11重量部用いることが特に好ましい。
【0052】
例えば、本発明の薬物包装体において、プランルカスト水和物112.5mgを含有するカプセル剤をプラスチックシートにてシート1枚当たり14個PTP包装したものを、薬物包装体1個当たり10枚封入する場合には、カプセル剤1カプセルの総重量100重量部に対して約0.7重量部〜約17重量部の「塩化カルシウムまたはシリカゲルを含む乾燥剤」に相当するものとして、約0.22g〜約5.5gの「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」を同時に封入することが好ましい。さらには、1カプセルの総重量100重量部に対して約1重量部〜約15重量部の「塩化カルシウムまたはシリカゲルを含む乾燥剤」に相当するものとして、約0.32g〜約4.8gの「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」を同時に封入することがより好ましく、1カプセルの総重量100重量部に対して約1.5重量部〜約11重量部の「塩化カルシウムまたはシリカゲルを含む乾燥剤」に相当するものとして、約0.48g〜約3.4gの「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」を同時に封入することが特に好ましく、1カプセルの総重量100重量部に対して約3.1重量部〜約9.3重量部の「塩化カルシウムまたはシリカゲルを含む乾燥剤」に相当するものとして、約1g〜約3gの「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」を同時に封入することがとりわけ好ましい。ここで、「塩化カルシウムを含むシート状乾燥剤」を用いる場合の重量は、塩化カルシウムを含浸させたシート状のパルプ材の重量も含めた重量を意味する。
なお、「塩化カルシウムを含むシート状乾燥剤」の厚さとしては、約0.5mm〜約3mmが好ましい。
【0053】
本発明の薬物包装体には、上記の乾燥剤と併用して保湿剤を封入することができる。本発明において、保湿剤とは、吸水、吸湿および放湿機能を有し、かつ一定の湿度に保つことのできる機能、すなわち平衡湿度に調節する機能を有する物質を意味し、調湿剤ともいう。そのような保湿剤としては、含水エチレングリコール含有シート類、ドライキープ(商品名、佐々木化学薬品株式会社)等が挙げられる。
【0054】
本発明の薬物包装体においては、内部雰囲気の相対湿度が一定の範囲に調節されることが重要である。本発明において、内部雰囲気とは、薬物包装体内に封入された、シートにてPTP包装された本発明の組成物が充填されたカプセル剤(以下、「PTP包装体」ということがある。)と、乾燥剤とが置かれている雰囲気を意味する。該内部雰囲気の相対湿度は、PTP包装体内の相対湿度と平衡状態にあるため、PTP包装体内でカプセル剤が接している環境の相対湿度と同等であると考えられる。
【0055】
本発明においては、上記した内部雰囲気の相対湿度が約10%〜約45%に調節される。該内部雰囲気の相対湿度としては、約10%〜約40%が好ましく、約17%〜約40%がより好ましく、約20%〜約35%が特に好ましい。
該内部雰囲気の相対湿度が約10%未満の場合には、上記のカプセル剤に重篤な異常(例えば、割れ、欠け等)が生じる。また、該内部雰囲気の相対湿度が約45%を超える場合には、医薬品としての機能が損なわれるような該カプセル剤の崩壊遅延、溶解遅延等が生じることになる。
ここで、該内部雰囲気の相対湿度は、温度25℃において、温湿度計を用いて測定された相対湿度を意味する。
【0056】
該相対湿度は、公知の方法で測定することができる。例えば、後記実施例に記載した方法(例えば、温湿度計(THARMO RECORDER RS−12;ESPEC社)等を用いた方法)、または水分活性測定装置(例:AQUALAB CX−3TE;デカゴン社等)、透湿度試験装置(例:L80−5005;リッシー社、GTR−WV;GTRテック株式会社等)、熱重量度測定装置(例:TGA−50/50H;株式会社島津製作所等)、水蒸気透過率測定装置(例:PERMATRAN−W(R)3/61;MOCON社等)等を組み合わせて使用し、該相対湿度を測定することができる。
[相対湿度測定法]
上記した水分活性測定装置を用いた相対湿度の測定方法は、以下に示す通りである。
<プランルカスト水和物含有カプセル剤の水分活性値の測定>
PVCを用いてPTP包装されたプランルカスト水和物含有カプセル剤および乾燥剤(例えば、IDシート等)を共にサンプルカップに入れ、水分活性測定装置(AQUALAB CX−3TE:デカゴン社)を用いて、密閉された上記サンプルカップ内の水分活性(Aw;Water Acitvity)値を測定する。得られたAw値を平衡相対湿度(ERH;equilibrium relative humidity)に換算する。
【0057】
本発明の薬物包装体としては、例えば、図1に示すような薬物包装体が挙げられる。図1に示す薬物包装体は、プラスチックシート(1)にてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤(2)および乾燥剤(3)が、フィルムからなる外装材(4)の中に封入され、密封包装されたものである。
【0058】
外装材に用いられるフィルムとしては、密封可能なフィルム状材料であればよく、特に限定されないが、さらに水蒸気等の気体の流出入を防ぐことのできる性質を有するものが好ましい。そのようなフィルムとしては、例えばアルミフィルム、高密度ポリエチレンフィルム、ポリ塩化ビニリデンフィルム、高密度ポリエチレンラミネート紙、ポリ塩化ビニリデンラミネート紙等が挙げられ、好ましくはアルミフィルムである。外装材の形態としては、缶、瓶、袋(例えば、カートナー包装、シュリンク包装、ピロー包装等)等が挙げられるが、袋が好ましい。さらに、外装材の形態が袋であるとき、チャック(例えば、シングルチャック、ダブルチャック等)を有する袋であってもよい。
【0059】
本発明の薬物包装体として好ましくは、外装材としてアルミフィルムを用いたアルミフィルム包装体であり、より好ましくはアルミフィルムのピロー包装体である。アルミフィルム包装体は、公知の方法、例えば、PTP包装体および乾燥剤を共にアルミフィルムからなる袋等の内に封入し、ヒートシール等することによって製造することができる。
【0060】
また、本発明の薬物包装体内部の空間体積としては、PTP包装体および乾燥剤の体積を除いて算出した場合、約60〜80cm3が好ましく、約65〜75cm3がより好ましい。
【0061】
本発明において、上記した内部雰囲気の相対湿度が「調節」されたとは、後記実施例の如く、本発明の薬物包装体を作製した後、約6時間後にその相対湿度が定常状態に達し、その後、少なくとも約6ヶ月間、その値が所定の範囲内に維持されることを意味する。
【0062】
本発明において、含水率とは、被験物質に含まれる水の量、すなわち水分含有量を意味する。ここで、被験物質とは本発明の薬物包装体を構成する物質であれば特に限定されないが、好ましくは本発明の組成物、カプセル剤を構成するカプセル皮膜等が挙げられる。本発明において、プランルカスト水和物等を含有してなる組成物の含水率は、約1%〜約2.7%であることが好ましく、約1.2%〜約2.5%であることがより好ましい。カプセル皮膜の含水率は、約8%〜約17%であることが好ましく、約9%〜約16%であることがより好ましい。これら被験物質の含水率は、公知の方法で測定することができる。例えば、医薬品の水分測定法で知られた方法、とりわけ日本薬局方収載の水分測定法、なかでも第十五改正日本薬局方に収載の水分測定法(カールフィッシャー法)等に従って測定することができる。
【0063】
本発明においては、薬物包装体に封入される、シートにてPTP包装された本発明の組成物が充填されたカプセル剤と、一定の吸湿率を有する乾燥剤の量、ならびに組成物およびカプセル皮膜の含水率とを、適宜組み合わせることにより、薬物包装体の内部雰囲気の相対湿度を一定範囲に調節することができる。そのようにして内部雰囲気の相対湿度が調節された本発明の薬物包装体は、本発明の組成物が充填されたカプセル剤の保存時における崩壊遅延、溶出遅延、異常(例えば、割れ、欠け等)、風解、潮解等を抑えることができる。
【0064】
本発明において、「崩壊遅延」とは、本発明におけるカプセル剤の内容物の崩壊時間が延長することによって、プランルカスト水和物の溶出速度が遅延することを意味する。当業者にとっては明らかなように、該カプセル剤中の内容物である本発明の組成物が崩壊し、小粒子状に細分化され表面積が増大することで、プランルカスト水和物の溶出が確実になり、消化管壁から速やかに吸収されると考えられる。
【0065】
本発明において、「崩壊遅延」の程度は、本発明の組成物が充填されたカプセル剤を、薬物包装体内外およびPTP包装体外で任意の期間保存した後に、崩壊試験に付し、初期状態での試験結果と比較することで確認することができる。崩壊試験は公知の方法で行うことができ、例えば、一般的に錠剤やカプセル剤等の内用固形製剤の崩壊試験法として知られた方法に従って行うことができるが、日本薬局方収載の崩壊試験法、なかでも第十五改正日本薬局方に収載の崩壊試験法等に従って行うことが好ましい。
【0066】
本発明において、「溶出遅延」とは、プランルカスト水和物の溶出速度が遅延することによって、生体内投与後における生物学的利用能(バイオアベイラビリティ)が変化することを意味する。当業者にとっては明らかなように、カプセル剤における有効成分の溶出速度が該カプセル剤の生物学的利用能(バイオアベイラビリティ)を規定することから、溶出遅延によって、生体内投与後におけるバイオアベイラビリティが変化し、薬効発現が不十分になったり、副作用を伴う虞があると考えられる。
【0067】
本発明において、「溶出遅延」の程度は、本発明の組成物を充填してなるカプセル剤を薬物包装体内外およびPTP包装体外で任意の期間保存した後に、溶出試験に付し、初期状態での試験結果比較することで確認することができる。溶出試験は公知の方法で行うことができ、例えば、一般的に錠剤やカプセル剤等の内用固形製剤の溶出試験法として知られた方法に従って行うことができるが、日本薬局方収載の溶出試験法、なかでも第十四改正日本薬局方に収載の溶出試験法に従って行うことが好ましく、例えば第1法(回転バスケット法)、第2法(パドル法)、第3法(フロースルーセル法)等に従って行うことが好ましい。
【0068】
「溶出遅延」の程度を確認するための保存の条件は特に限定されないが、例えば、通常当業者によって行われるように室温であってもよいし、一般的に加速試験または苛酷試験と称されるように、高温および/または高湿の条件であってもよい。高温および/または高湿の条件にすることで、室温における長期間の保存の結果を、より短期間で得ることができる。
【0069】
上記の「崩壊遅延」や「溶出遅延」が生じる原因としては、一般的に薬物、特にカプセル剤を保存することによって経時的に、有効成分を含む組成物、製剤基剤(例えば、カプセル剤であればカプセル皮膜等)に何らかの変化(例えば、含水率の変化等)が生じることによるものと考えられている。
【0070】
本発明において、カプセル剤の「異常」とは、保存することによって経時的に、該カプセル剤に何らかの変化(例えば、カプセル皮膜の強度の低下等)が生じることにより、割れ、欠け等のプランルカスト水和物を含有する組成物を保護するというカプセル剤の機能を損なう状態になることを意味する。具体的にカプセル剤の割れ、欠け等が生じると、プランルカスト水和物を含有する組成物が流出するだけでなく、水分の流出入、気体の流出入等により該組成物の内容量または状態が変化し、一定量のプランルカスト水和物およびその品質を保持するというカプセル剤の機能が損なわれることになる。
【0071】
上記したカプセル剤の「異常」は、本発明の組成物が充填されたカプセル剤を薬物包装体内外およびPTP包装体外で任意の期間保存した後に、割れ荷重試験に付し、全検体数に対する割れた検体数で算出した割れ率や、保存期間毎の割れ率を比較することで確認することができる。割れ荷重試験は例えば、カプセル剤に一定の衝撃、荷重等を加え、強度を評価する方法等で行うことができ、例えば、後記実施例に示すように落錘衝撃試験等で行うことができる。
【0072】
本発明の薬物包装体が、本発明の目的、すなわち本発明の組成物が充填されたカプセル剤の保存時における崩壊遅延、溶出遅延、異常(例えば、割れ、欠け等)、風解、潮解等を抑えることを達成するためには、上記した本発明の薬物包装体を構成する要素を以下に示すような特定の組合せにすることが好ましい。すなわち、(I)プラスチックシートにてPTP包装された、以下の(a)〜(e)の特性をすべて有するプランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、(II)カプセル剤1カプセルの総重量100重量部当たり約0.7重量部〜約17重量部の、温度25℃、相対湿度50%において約20%〜約35%の吸湿率を有する乾燥剤とが封入され、(III)フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が約10%〜約45%に調節された薬物包装体であることが好ましい。
(a)1カプセル当たり、約112.5mgまたは約225mgのプランルカスト水和物を含む、
(b)1カプセル当たり、約130mg〜約400mgの組成物を含む、
(c)1カプセル当たり、空カプセルの重量が約30mg〜約90mgである、
(d)組成物の含水率が、約1%〜約2.7%である、
(e)カプセル皮膜の含水率が約8%〜約17%である。
【0073】
本発明の薬物包装体における構成要素の組合せとしてより好ましくは、(I)プラスチックシートにてPTP包装された、上記した(a)〜(e)の特性をすべて有する、プランルカスト水和物、糖類、水溶性高分子および滑沢剤を含有してなる組成物が充填されたカプセル剤と、(II)カプセル剤1カプセルの総重量100重量部当たり約0.7重量部〜約17重量部の、シリカゲルまたは塩化カルシウムを含む乾燥剤とが封入され、(III)フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が約10%〜約45%に調節された薬物包装体が挙げられる。特に好ましくは、(I)プラスチックシートにてPTP包装された、下記の(i)〜(vi)の特性をすべて有する、プランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、(II)カプセル剤1カプセルの総重量100重量部当たり約1重量部〜約15重量部の、塩化カルシウムを含むシート状乾燥剤とが封入され、(III)フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が約10%〜約45%に調節された薬物包装体が挙げられる。
(i)1カプセル当たり、約112.5mgのプランルカスト水和物を含む、
(ii)1カプセル当たり、約130mg〜約400mgの組成物を含む、
(iii)組成物が、プランルカスト水和物100重量部当たり、乳糖を約30重量部〜約60重量部含み、ポリエチレングリコールを約7.5重量部〜約15重量部含み、およびステアリン酸マグネシウムを約1重量部〜約4.5重量部含む組成物である、
(iv)1カプセル当たり、空カプセルの重量が約30mg〜約90mgである、
(v)組成物の含水率が、約1%〜約2.7%である、
(vi)カプセル皮膜の含水率が約8%〜約17%である。
【0074】
[医薬品への適用]
本発明の組成物は、プランルカスト水和物を有効成分として含有するため、気管支喘息、アレルギー性鼻炎、副鼻腔炎、慢性閉塞性肺疾患、メニエール病、滲出性中耳炎、偏頭痛、月経困難症等の種々の疾患等の予防および/または治療薬として有用である。
[毒性]
本発明におけるプランルカスト水和物は低毒性であり、医薬として使用するために十分に安全である。
【実施例】
【0075】
以下、実施例によって本発明を具体的に説明するが、本発明はこれらに限定されるものではない。
なお、以下において、PTP包装体または薬物包装体の作製のための包装作業は、常温(約18〜28℃)、常湿(約30〜70%)の環境下で、当業者にとって明らかな常法に従って行なった。
また、各試験例において、6ヶ月間の保存期間中は、各試験区の温度および相対湿度を一定にしたまま保存し、該相対湿度は温湿度計(THERMO RECORDER RS−12:ESPEC社製)を用いて測定した。
【0076】
[製剤例]:プランルカスト水和物(112.5mg)含有カプセル剤の製造
特開昭61−050977号明細書に記載されている方法に準じて、ポリエチレングリコール水溶液にプランルカスト水和物(40kg)および乳糖(18.7kg)を懸濁したものをスプレードライヤーで噴霧することにより噴霧乾燥造粒物を得た。得られた造粒物とステアリン酸マグネシウム(適宜)との混合物を内容物とし、プランルカスト水和物の含量が1カプセル当たり112.5mgになるようにして、3号カプセル(カプスゲル・ジャパン株式会社製またはクオリカプス株式会社製)に常法に従って充填することにより、以下の組成であるプランルカスト水和物を含有するカプセル剤を得た。
<組成(1カプセル当たり)>
・プランルカスト水和物(112.5mg)
・乳糖(52.65mg)
・ポリエチレングリコール(マクロゴール4000)(11.25mg)
・ステアリン酸マグネシウム(3.6mg)
・空カプセル3号(49.0mg)
【0077】
[PTP包装体製造例]
上記製剤例で製造したプランルカスト水和物含有カプセル剤についてPTP包装に用いるプラスチックシートとして、厚み200μmの硬質塩化ビニルシート(スミライト(登録商標)VSS−1104;住友ベークライト社、以下、PVCと略記する。)を用いてPTP包装した(PTP包装体1)。
同様に、プラスチックシートとして、厚み250μmの硬質塩化ビニルと塩化ビニリデンを組み合わせた複合体シート(VSL−4501;住友ベークライト社、以下、PVC/PVDCと略記する。)を用いてPTP包装した(PTP包装体2)。
同様に、プラスチックシートとして、無延伸ポリプロピレン(NS−3451;住友ベークライト社、以下、CPPと略記する。)を用いてPTP包装した(PTP包装体3)。
なお、いずれのPTP包装体も、各プラスチックシートとアルミフィルムを常法により貼り合わせて、1シート当たり14カプセル封入して製造した。
【0078】
[実施例1〜7および比較例1]
上記PTP包装体製造例で得られたPTP包装体1と塩化カルシウム含浸シート状乾燥剤(IDシート;株式会社アイディ)または粒状シリカゲルを含む袋状乾燥剤(ドライヤーン;山仁薬品株式会社)とを、アルミフィルム袋(約110mm×約200mm)に入れて密封包装することにより、下記表1に示す構成の薬物包装体を製造した。ここで、乾燥剤の重量は、塩化カルシウムを含むシート状乾燥剤の場合、塩化カルシウムを含浸させたシート状のパルプ材の重量も含めた重量を意味する。
【0079】
【表1】

【0080】
上記実施例もしくは比較例で得られた薬物包装体、製剤例で得られたカプセル剤(無包装)またはPTP包装体(アルミフィルム袋なし)をサンプルとして、以下の各試験を行った。
なお、試験結果の解釈にあたっては、カプセル剤(無包装)およびPTP包装体(アルミフィルム袋なし)を各試験に用いた場合の相対湿度は、該カプセル剤または該PTP包装体をアルミフィルム袋に入れて密封した薬物包装体の内部雰囲気の相対湿度と同じ値を示すものとみなした。
【0081】
[試験例1:カプセル剤の含水率の測定]
製剤例で得られたカプセル剤(無包装)およびPTP包装体1(アルミフィルム包装なし)のサンプルについて、温度25℃相対湿度22%または75%の条件下での6ヶ月間の保存期間における保存開始時(初期)、2ヶ月、4ヶ月および6ヶ月後に、第十五改正日本薬局方に記載の水分測定法(カールフィッシャー法)に従って、カプセル皮膜およびカプセルに充填された内容物(組成物)の含水率を各3検体測定し、それぞれ平均値を算出した。結果を表2に示す。
【0082】
【表2】

【0083】
上記の結果より、相対湿度22%の条件下で保存した場合、2ヶ月、4ヶ月および6ヶ月後では無包装状態およびPTP包装状態のカプセル剤のいずれであっても、内容物の含水率はほとんど変化しないものの、カプセル皮膜の含水率が初期よりも低下したことがわかった。一方、相対湿度75%の条件下で保存した場合、2ヶ月、4ヶ月および6ヶ月後ではカプセル皮膜および内容物の水分はともに初期よりも上昇した。
【0084】
次に、実施例2および3のサンプルについて、温度25℃相対湿度75%の条件下での6ヶ月間の保存期間における保存開始時(初期)および6ヶ月後に、第十五改正日本薬局方に記載の水分測定法(カールフィッシャー法)に従って、カプセルに充填された内容物(組成物)の含水率を各3検体測定し、それぞれ平均値を算出した。結果を表3に示す。
【0085】
【表3】

【0086】
上記の結果が示すように、温度25℃相対湿度75%の条件下で保存した場合において、上記したPTP包装体1のままで保存したときの結果と異なり、2種の乾燥剤とのいずれの組合せで構成された薬物包装体においても、内容物の含水率の上昇が見られなかった。また、実施例1および実施例4〜7で製造した薬物包装体について、同じ条件で内容物の含水率を測定したところ、上記の結果とほぼ同じ値を示した。一方、比較例1の薬物包装体について、同じ条件で内容物の含水率を測定したところ、内容物の含水率が上昇した。
なお、上記実施例2および3におけるPTP包装体1の代わりにPTP包装体2または3を用いること以外は同じにして製造した薬物包装体について、同じ条件で内容物の含水率を測定したところ、上記の結果とほぼ同じ値を示した。このことから、内容物の含水率はPTP包装体に用いるプラスチックシートの違いによる影響を受けないことがわかった。
【0087】
[試験例2:カプセル剤の崩壊時間の測定]
製剤例で得られたカプセル剤(無包装)およびPTP包装体1(アルミフィルム包装なし)のサンプルについて、温度25℃相対湿度22%または75%の条件下での6ヶ月間の保存期間における保存開始時(初期)、2ヶ月、4ヶ月および6ヶ月後に、第十五改正日本薬局方に記載の崩壊試験法(カプセル剤)に従って、崩壊時間を調べた。試験は各6検体で行ない、20分以内に全数崩壊し、かつ内容物が完全に溶解したものは適合とし、それ以外のものは不適合とした。結果を表4に示す。
【0088】
【表4】

【0089】
次に、下記表5に示す実施例2〜4、6および比較例1のサンプルについて、温度25℃相対湿度75%の条件下での6ヶ月間の保存期間における保存開始時(初期)、2ヶ月、4ヶ月および6ヶ月後に、上記と同じ方法にて崩壊時間を調べた。結果を表5に示す。
【0090】
【表5】

【0091】
また、実施例1、5および7で製造した薬物包装体について、同じ条件で崩壊試験を行ったところ、いずれの実施例においても保存期間における上記すべての時点で、20分以内に全数崩壊し、かつ内容物が完全に溶解したため、適合であった。
【0092】
上記の結果が示すように、温度25℃相対湿度75%の条件下で保存した場合において、上記したPTP包装体1のまま、または比較例1のように乾燥剤なしの薬物包装体として保存したときには4ヶ月および6ヶ月後に不適合であったのと異なり、2種の乾燥剤と、乾燥剤の量(カプセル剤1カプセルの総重量100重量部に対する乾燥剤の量として、約1.52重量部〜約10.3重量部)とのいずれの組合せで構成された薬物包装体においても、崩壊時間の延長が抑制され、すべての時点で適合となった。
【0093】
上記の試験例1および試験例2の結果を総合して見ると、相対湿度75%の条件下で保存した場合、無包装、PTP包装(アルミフィルム包装なし)または比較例1では、試験例1で観察された内容物およびカプセル皮膜の含水率が上昇することに伴って、試験例2で観察された崩壊時間の延長が引き起こされたことが明らかとなり、薬物包装体の内部雰囲気が約75%以上になるとカプセル剤の崩壊遅延が起こることが示唆された。一方、実施例の薬物包装体では、ある一定量の適正な乾燥剤を共に封入してフィルムにて密封包装することによって、内容物の含水率が好ましい範囲(組成物の含水率:約1%〜約2.7%、カプセル皮膜の含水率:約8%〜約17%)に調節されたため、崩壊遅延が抑制されたと考えられる。
【0094】
[試験例3:カプセル剤の強度の測定]
製剤例で得られたカプセル剤(無包装)のサンプルについて、温度25℃相対湿度22%または75%の条件下での6ヶ月間の保存期間における2ヶ月、4ヶ月および6ヶ月後に、以下の落錘衝撃試験方法に従ってカプセル剤の強度を測定した。また、温度25℃相対湿度7%の条件下での37日間の保存期間における7日および37日後にも同じ方法で測定した。結果をまとめて表6に示す。
<落錘衝撃試験>
(1)落錘衝撃試験装置の台座の円内中央に、カプセル剤を横向きに置いた。100gの金属製の錘を円筒の上部に台座から80mmの高さになるように止め金具で固定した。
(2)円筒を台座に設置し、止め金具のフックを押し込んで外し、錘をカプセル剤の胴およびキャップ部分に自然落下させた。
(3)各50検体ずつ試験に付し、カプセル剤の割れ、欠けの有無を確認した。全カプセル剤中における割れ、欠けのいずれかを生じたカプセル剤の割合を割れ率として算出した。
【0095】
【表6】

【0096】
上記の結果から、温度25℃相対湿度22%の条件下では、無包装状態で2ヶ月、4ヶ月および6ヶ月保存後のカプセル剤の割れ率は適合範囲内であり、相対湿度75%の条件下では、無包装状態で2ヶ月、4ヶ月および6ヶ月保存後のカプセル剤の割れ率はいずれの時点でも0%であったことから、いずれの条件下でも適合であった。一方、温度25℃相対湿度7%の乾燥条件下では、急速にカプセル剤の割れ率が上昇し、不適合であることがわかった。
したがって、試験例1の温度25℃の相対湿度22%におけるカプセル皮膜の含水率以下になると、カプセル剤の強度が低下することが明らかとなった。また、相対湿度が約7%以下の雰囲気ではカプセル剤の割れ率が増加するため、薬物包装体の内部雰囲気の相対湿度は少なくとも7%を超えるように調節されるべきことが示唆された。
【0097】
[試験例4:カプセル剤のアルミフィルム包装体内部の相対湿度測定]
上記した実施例1、5および7で製造した薬物包装体において、密封包装時に温湿度計(THERMO RECORDER RS−12:ESPEC社)を共にアルミフィルム製の袋(110mm×200mm)に封入し、常法によりヒートシールした。このヒートシールした温湿度計を内包する薬物包装体を48時間は室温で、その後は温度25℃、相対湿度60%の環境下で24時間静置し、薬物包装体の内部雰囲気の相対湿度をモニタリングした。
温度25℃、相対湿度が定常状態に達した時点での、内部雰囲気の相対湿度を測定した結果を表7に示す。
【0098】
【表7】

【0099】
また、実施例2、3および4の薬物包装体について、上記と同じ方法および同じ条件で各薬物包装体の内部雰囲気の相対湿度をモニタリングしたところ、該相対湿度が約10〜23%の範囲内にあることがわかった。さらに、実施例6の薬物包装体についても、同様に薬物包装体の内部雰囲気の相対湿度をモニタリングしたところ、該相対湿度が約23〜37%の範囲内にあることがわかった。
【0100】
上記の結果より、乾燥剤の量を「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」として、1カプセルの総重量100重量部当たり、約1.5重量部〜約11重量部の範囲で用いれば、フィルム包装体内の温度25℃における相対湿度が約10%〜約40%に調節されることがわかった。
【0101】
試験例1〜3までの結果を総合してみると、実施例1〜7の薬物包装体について、組成物およびカプセル皮膜の含水率は、それぞれ約1%〜約2.7%および約8%〜17%の範囲内にあることから、崩壊遅延およびカプセル剤の割れが共に起こらなかった。さらに、試験例4を合わせて考慮してみると、上記したような組成物およびカプセル皮膜の含水率の範囲内に調節されることによって、薬物包装体の内部雰囲気が約10〜約40%に調節されることがわかった。
【0102】
したがって、プラスチックシートにてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、乾燥剤の量を「塩化カルシウムを含むシート状乾燥剤」または「粒状シリカゲルを含む乾燥剤」として、1カプセルの総重量100重量部当たり、約1.5重量部〜約11重量部の範囲に調節して共に封入すれば、該カプセル剤の組成物およびカプセル皮膜の含水率が至適な範囲に調節されるため、薬物包装体の内部雰囲気の相対湿度が約10%〜約40%に調節されることがわかった。
【産業上の利用可能性】
【0103】
本発明によれば、PTP包装されたプランルカスト水和物を含有するカプセル剤の保存時における崩壊遅延等の品質低下や、カプセルの割れ等の異常が最小限に抑えられた薬物包装体を提供することができる。
【図面の簡単な説明】
【0104】
【図1】本発明の薬物包装体の構成を例示する模式図である。
【符号の説明】
【0105】
1:プラスチックシート
2:カプセル剤
3:乾燥剤
4:外装材(フィルム)
【特許請求の範囲】
【請求項1】
シートにてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、乾燥剤とが封入され、フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が10%〜45%に調節された薬物包装体。
【請求項2】
シートが、プラスチックシートまたはアルミシートである請求項1記載の薬物包装体。
【請求項3】
カプセル剤が、1カプセル当たり、112.5mgまたは225mgのプランルカスト水和物を含むカプセル剤である請求項1記載の薬物包装体。
【請求項4】
カプセル剤が、1カプセル当たり、130mg〜400mgの組成物を含むカプセル剤であって、該1カプセル当たりの空カプセルの重量が30mg〜90mgである請求項1記載の薬物包装体。
【請求項5】
プランルカスト水和物を含有してなる組成物の含水率が1%〜2.7%である請求項1記載の薬物包装体。
【請求項6】
カプセル剤におけるカプセル皮膜の含水率が8%〜17%である請求項1記載の薬物包装体。
【請求項7】
プランルカスト水和物を含有してなる組成物が、さらに糖類、水溶性高分子および滑沢剤を含む組成物である請求項1記載の薬物包装体。
【請求項8】
糖類が乳糖であって、水溶性高分子がポリエチレングリコールであって、滑沢剤がステアリン酸マグネシウムである請求項7記載の薬物包装体。
【請求項9】
プランルカスト水和物を含有してなる組成物が、プランルカスト水和物100重量部に対して、乳糖を30重量部〜60重量部含み、ポリエチレングリコールを7.5重量部〜15重量部含み、およびステアリン酸マグネシウムを1.0重量部〜4.5重量部含む組成物である請求項8記載の薬物包装体。
【請求項10】
乾燥剤が、温度25℃、相対湿度50%において20%〜35%の吸湿率を有する乾燥剤である請求項1記載の薬物包装体。
【請求項11】
乾燥剤が、シリカゲルまたは塩化カルシウムである請求項10記載の薬物包装体。
【請求項12】
乾燥剤が、シート状乾燥剤である請求項10記載の薬物包装体。
【請求項13】
シート状乾燥剤が、塩化カルシウムを含むシート状乾燥剤である請求項12記載の薬物包装体。
【請求項14】
カプセル剤1カプセルの総重量100重量部当たり、封入される乾燥剤の重量が0.7重量部〜17重量部である請求項10記載の薬物包装体。
【請求項15】
カプセル剤1カプセルの総重量100重量部当たり、封入される乾燥剤の重量が1重量部〜15重量部である請求項10記載の薬物包装体。
【請求項16】
フィルムにて密封包装された薬物包装体内に、プラスチックシートにてPTP包装された、下記の(a)〜(e)の特性をすべて有するように調節された、プランルカスト水和物を含有してなる組成物を充填したカプセル剤と、塩化カルシウムを含むシート状乾燥剤とを、該カプセル剤1カプセルの総重量100重量部当たり、該シート状乾燥剤を0.7重量部〜17重量部含むように調節して、共に封入することにより、該薬物包装体の、温度25℃における温湿度計を用いて測定した内部雰囲気の相対湿度を約10%〜約45%に調節する方法:
(a)1カプセル当たり、112.5mgまたは225mgのプランルカスト水和物を含む、
(b)1カプセル当たり、130mg〜400mgの組成物を含む、
(c)1カプセル当たり、空カプセルの重量が30mg〜90mgである、
(d)組成物の含水率が、1%〜2.7%である、
(e)カプセル皮膜の含水率が8%〜17%である。
【請求項1】
シートにてPTP包装されたプランルカスト水和物を含有してなる組成物が充填されたカプセル剤と、乾燥剤とが封入され、フィルムにて密封包装されてなり、温度25℃において、温湿度計を用いて測定した内部雰囲気の相対湿度が10%〜45%に調節された薬物包装体。
【請求項2】
シートが、プラスチックシートまたはアルミシートである請求項1記載の薬物包装体。
【請求項3】
カプセル剤が、1カプセル当たり、112.5mgまたは225mgのプランルカスト水和物を含むカプセル剤である請求項1記載の薬物包装体。
【請求項4】
カプセル剤が、1カプセル当たり、130mg〜400mgの組成物を含むカプセル剤であって、該1カプセル当たりの空カプセルの重量が30mg〜90mgである請求項1記載の薬物包装体。
【請求項5】
プランルカスト水和物を含有してなる組成物の含水率が1%〜2.7%である請求項1記載の薬物包装体。
【請求項6】
カプセル剤におけるカプセル皮膜の含水率が8%〜17%である請求項1記載の薬物包装体。
【請求項7】
プランルカスト水和物を含有してなる組成物が、さらに糖類、水溶性高分子および滑沢剤を含む組成物である請求項1記載の薬物包装体。
【請求項8】
糖類が乳糖であって、水溶性高分子がポリエチレングリコールであって、滑沢剤がステアリン酸マグネシウムである請求項7記載の薬物包装体。
【請求項9】
プランルカスト水和物を含有してなる組成物が、プランルカスト水和物100重量部に対して、乳糖を30重量部〜60重量部含み、ポリエチレングリコールを7.5重量部〜15重量部含み、およびステアリン酸マグネシウムを1.0重量部〜4.5重量部含む組成物である請求項8記載の薬物包装体。
【請求項10】
乾燥剤が、温度25℃、相対湿度50%において20%〜35%の吸湿率を有する乾燥剤である請求項1記載の薬物包装体。
【請求項11】
乾燥剤が、シリカゲルまたは塩化カルシウムである請求項10記載の薬物包装体。
【請求項12】
乾燥剤が、シート状乾燥剤である請求項10記載の薬物包装体。
【請求項13】
シート状乾燥剤が、塩化カルシウムを含むシート状乾燥剤である請求項12記載の薬物包装体。
【請求項14】
カプセル剤1カプセルの総重量100重量部当たり、封入される乾燥剤の重量が0.7重量部〜17重量部である請求項10記載の薬物包装体。
【請求項15】
カプセル剤1カプセルの総重量100重量部当たり、封入される乾燥剤の重量が1重量部〜15重量部である請求項10記載の薬物包装体。
【請求項16】
フィルムにて密封包装された薬物包装体内に、プラスチックシートにてPTP包装された、下記の(a)〜(e)の特性をすべて有するように調節された、プランルカスト水和物を含有してなる組成物を充填したカプセル剤と、塩化カルシウムを含むシート状乾燥剤とを、該カプセル剤1カプセルの総重量100重量部当たり、該シート状乾燥剤を0.7重量部〜17重量部含むように調節して、共に封入することにより、該薬物包装体の、温度25℃における温湿度計を用いて測定した内部雰囲気の相対湿度を約10%〜約45%に調節する方法:
(a)1カプセル当たり、112.5mgまたは225mgのプランルカスト水和物を含む、
(b)1カプセル当たり、130mg〜400mgの組成物を含む、
(c)1カプセル当たり、空カプセルの重量が30mg〜90mgである、
(d)組成物の含水率が、1%〜2.7%である、
(e)カプセル皮膜の含水率が8%〜17%である。
【図1】




【公開番号】特開2007−185490(P2007−185490A)
【公開日】平成19年7月26日(2007.7.26)
【国際特許分類】
【出願番号】特願2006−279220(P2006−279220)
【出願日】平成18年10月12日(2006.10.12)
【分割の表示】特願2006−256793(P2006−256793)の分割
【原出願日】平成18年9月22日(2006.9.22)
【出願人】(000185983)小野薬品工業株式会社 (180)
【Fターム(参考)】
【公開日】平成19年7月26日(2007.7.26)
【国際特許分類】
【出願日】平成18年10月12日(2006.10.12)
【分割の表示】特願2006−256793(P2006−256793)の分割
【原出願日】平成18年9月22日(2006.9.22)
【出願人】(000185983)小野薬品工業株式会社 (180)
【Fターム(参考)】
[ Back to top ]

