蛋白質性電子メディエータ
【課題】
酵素と親和性の高い電子メディエータ及び融合体、細胞外分泌型シトクロムと酵素を用いた測定方法、電極、及びセンサを提供すること。
【解決手段】
細胞外分泌型シトクロムから成るグルコース酸化還元酵素用電子メディエータ、該電子メディエータをグルコース酸化還元酵素と融合させた融合体、該電子メディエータ又は融合体を含むグルコース測定用組成物、並びに新規な細胞外分泌型シトクロムをコードする遺伝子、細胞外分泌型シトクロムと酵素を用いた測定方法、電極、及びセンサに関する。
酵素と親和性の高い電子メディエータ及び融合体、細胞外分泌型シトクロムと酵素を用いた測定方法、電極、及びセンサを提供すること。
【解決手段】
細胞外分泌型シトクロムから成るグルコース酸化還元酵素用電子メディエータ、該電子メディエータをグルコース酸化還元酵素と融合させた融合体、該電子メディエータ又は融合体を含むグルコース測定用組成物、並びに新規な細胞外分泌型シトクロムをコードする遺伝子、細胞外分泌型シトクロムと酵素を用いた測定方法、電極、及びセンサに関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、酵素センサ及びバイオ電池等に用いられるグルコース酸化還元酵素用電子メディエータ等に関する。
【背景技術】
【0002】
電子メディエータは、電子伝達物質とも呼ばれ、これは電子供与体から電子を受け取る機能及び/又は電子受容体に電子を渡す機能を有する物質を意味し、酸化型か又は還元型の状態で存在することが知られている。該電子メディエータは、酵素活性の比色定量等に用いられる他、酵素電極で酵素から受け取った電子を電極に渡す役割をしている。
【0003】
酵素電極は、酵素を利用することにより、生体試料中に含まれる特定物質(標的となる物質)の含有量を測定する酵素センサ等に使用されている。既に様々な酵素センサが商品化されているが、例えば、血中グルコース濃度の測定に用いられるグルコースセンサ等が知られており、電極には、金電極、白金電極、カーボン電極等の電極表面上に酵素が固定化された酵素電極が用いられている。グルコースセンサでは、試料中のグルコースと酵素との反応によって生じる物質を電気化学的に検出し、定量している。
【0004】
酵素電極の使用例としては、グルコースやエタノールを基質として、酵素処理することで生じる電子を利用したバイオ電池が知られている。バイオ電池の例としては、体内埋め込み型の電池や、環境負荷の少ない電池等が近年着目されている。
【0005】
一般的に、酵素は電極表面で直接酸化還元されにくいため、生体試料中のグルコース濃度を測定するためには、酵素から電子を受け取り、電極に渡す役割を果たす電子メディエータが必要となる。
【0006】
電子メディエータとしては、蛋白質性の電子メディエータが開発されており、蛋白質性の電子メディエータを使用した電極としては、シトクロームC、シトクロームb562及びシトクロームc551等を用いた酵素電極(特許文献1)が知られている。更に、蛋白質性の電子メディエータであるComamonas testosteroni由来のキノヘモ蛋白質エタノールデヒドロゲナーゼのシトクロームCドメインをピロロキノリンキノングルコース脱水素酵素と融合させた融合蛋白質(特許文献2)等が開発されている。一方、ブルクホルデリア・セパシア由来のフラビンアデニンジヌクレオチド(FAD)依存型グルコース脱水素酵素を用いるグルコースセンサ(特許文献3及び4)が開発され、該ブルクホルデリア・セパシア由来酵素を含む酵素電極及びその製造方法に関する報告もなされている(特許文献5)。
【0007】
特許文献1に記載のシトクロームC及びシトクロームb562はいずれも細胞膜又はペリプラズム等細胞内に存在する電子伝達蛋白質である。この電子伝達蛋白質は、他の電子メディエータ非存在下で電極への電子授受を行う際、グルコース酸化還元酵素に対し、モル比で100倍の量が必要とされるため、グルコース脱水素酵素及びグルコース酸化酵素との親和性が極めて低いといえる。特許文献2に記載の融合蛋白質は、グルコース測定を行う場合に1000ユニットもの莫大な量を必要とする。加えて、該融合蛋白質によるグルコース測定は、測定可能なグルコース濃度範囲が5mM以下であるが、これは、一般的に血糖測定において求められるグルコース濃度の上限が20〜40mMであることと比較すると極めて狭いといえる。特許文献3、4及び5記載のセンサは、本来の野生型酵素が触媒活性サブユニットであるαサブユニット、電子伝達サブユニットであるβサブユニット、及びγサブユニットの3種のサブユニットからなる酵素を使用しており、αβγサブユニットの3量体又はαβサブユニットの2量体を固定化したセンサである。該酵素は、野生型として元々シトクロムCに相当する電子伝達サブユニット(βサブユニット)を有しているため、電極に直接電子移動することが可能な酵素である。しかし、βサブユニットは膜結合性シトクロムであり、該酵素はブルクホルデリア・セパシア由来の膜結合性酵素のため、該酵素のサブユニット又は該酵素を得るためには、可溶化の処理等、煩雑な処理が必要とされる。その上、可溶化処理をした物は不安定であり、乾燥させる等の取扱いを行うと該酵素又はそのサブユニット構造を維持することは難しい。加えて、日本生物工学会大会(2002年10月28日−30日)での発表によれば、該酵素は、対グルコース活性を100%とした場合の対マルトース活性及び対ガラクトース活性において、ブルクホルデリア・セパシアの各株で、SM4株が40%及び105%、JCM5506株が43%及び132%、JCM550株が57%及び123%、JCM2800株が83%及び108%、JCM2801株が74%及び117%、IFO14595株が38%及び104%、IFO15124株が74%及び148%と基質特異性が悪く、演者の発表によれば、マルトース及びガラクトースへの作用性が高いため、自己血糖測定器に使う場合には問題があるとのことであった。
特許文献3、4及び5においては、FAD依存型酵素および電極を用いたグルコースセンサが開示されているが、ここで、酵素は、電極と異なる粉末状の導体、あるいは炭素粒子に固定されている。また、第2の電極である対電極には白金等が用いられ、第2の電極は酸化還元性を有していない。更には酵素の電極への担持には高分子が用いられていない。
【0008】
その他のシトクロムとして、ファネロカエテ・クリソスポリウム由来の細胞外分泌型シトクロムb562が知られており、該シトクロムを酵母で生産させた組換えシトクロムについて、セルロースやキチンに吸着性があることが知られている(非特許文献1)。しかし、該シトクロムについてグルコース酸化還元酵素用メディエータとしての機能は知られていなかった。更に、該組換えシトクロムは酵母を宿主としているため、過剰に糖鎖が付加し分子量が大きいことから、モル当たりの固形分が多く、少量の血液で試薬を溶解させる必要があるセンサ用試薬には、より糖鎖付加が少なく分子量の小さい組換え蛋白質が求められていた。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開第02/073181号パンフレット
【特許文献2】国際公開第05/030807号パンフレット
【特許文献3】国際公開第05/023111号パンフレット
【特許文献4】国際公開第02/036779号パンフレット
【特許文献5】国際公開第09/037838号パンフレット
【非特許文献】
【0010】
【非特許文献1】Makoto Yoshida, Kiyohiko Igarashi, et al., Applied and Environmental Microbiology, 4548-4555(2000)
【発明の概要】
【発明が解決しようとする課題】
【0011】
上述のように、特許文献1、2、3、4及び5に記載されている電子伝達蛋白質又は融合蛋白質は、実用上、十分量といえるほどの応答電流値が得られていない。
【0012】
従って、本発明の目的は、上記の課題を解決し、酵素と親和性の高い蛋白質性の電子メディエータ及び基質に対する特異性の高い酵素と該電子メディエータとの融合体、更には、それらを含む組成物、それらを用いた基質の測定方法、基質に対するセンサ、並びにそれらを含むバイオ電池等を提供することである。
【課題を解決するための手段】
【0013】
本発明者は、従来用いられてきた電子メディエータに代わり、実用上、十分量といえる応答電流値が得られる電子メディエータを自然界から広く探索した結果、可溶性の細胞外分泌型シトクロムがグルコース酸化還元酵素の電子メディエータとして極めて優れた性能を発揮することを見出し、本発明を完成させた。
【0014】
即ち、本発明は以下の態様に係る。
[態様1]
細胞外分泌型シトクロムから成る、グルコース酸化還元酵素用電子メディエータ。
[態様2]
グルコース酸化還元酵素のモル数に対し100倍量未満のモル数でグルコース濃度測定が可能な態様1記載の電子メディエータ。
[態様3]
細胞外分泌型シトクロムが糸状菌に属する菌由来である、態様1記載の電子メディエータ。
[態様4]
糸状菌がアスペルギルス属の菌である、態様3記載の電子メディエータ。
[態様5]
アスペルギルス属の菌がアスペルギルス・テレウス又はアスペルギルス・オリゼである、態様4記載の電子メディエータ。
[態様6]
以下の(a)、(b)又は(c)のポリペプチドから成る、グルコース酸化還元酵素用電子メディエータ。
(a)配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチド
(b)配列番号2又は配列番号4のアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列から成り電子メディエータ機能を有するポリペプチド
(c)配列番号2又は配列番号4のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能を有するポリペプチド
[態様7]
以下の(a)、(b)、(c)、(d)、(e)又は(f)のポリヌクレオチド。
(a)配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチドをコードするポリヌクレオチド
(b)配列番号2又は配列番号4のアミノ酸配列において1個又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列から成り、電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド
(c)配列番号2又は配列番号4のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り、電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド
(d)配列番号1又は配列番号3に示される塩基配列を含み、かつ電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド
(e)(d)から成るポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドと、ストリンジェントな条件下でハイブリダイズし、かつ電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド
(f)(d)から成るポリヌクレオチドと70%以上の相同性を有する塩基配列を含み、かつ電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド
[態様8]
態様7記載の遺伝子を含む組換えベクター。
[態様9]
態様8記載の組換えベクターにより形質転換された形質転換体。
[態様10]
宿主が糸状菌である態様9記載の形質転換体。
[態様11]
細胞外分泌型シトクロムをコードする遺伝子を含む組換えベクターにより形質転換された形質転換体を、栄養培地にて培養し、細胞外分泌型シトクロムを採取することを特徴とする電子メディエータ機能を有する細胞外分泌型シトクロムの製造方法 。
[態様12]
態様11記載の製造方法により得られる細胞外分泌型シトクロム。
[態様13]
細胞外分泌型シトクロムとグルコース酸化還元酵素とを融合させた融合体。
[態様14]
他の電子メディエータ非存在下で、グルコースの測定範囲が5mMより大きい範囲であっても測定可能な態様13記載の融合体。
[態様15]
グルコース酸化還元酵素がグルコース脱水素酵素である態様13記載の融合体。
[態様16]
グルコース酸化還元酵素がグルコース酸化酵素である態様13記載の融合体。
[態様17]
単一分子内に電子メディエータ機能と基質の酸化機能との両機能を有した融合体であって、下記(a)、(b)及び(c)のうち、(a)及び(b)を有することを特徴とする融合体、又は(a)及び(b)を有し、かつ(a)と(b)の間に(c)を有することを特徴とする融合体。
(a)細胞外分泌型シトクロムのアミノ酸配列
(b)グルコース酸化還元酵素のアミノ酸配列
(c)(a)のアミノ酸配列と(b)のアミノ酸配列とを結合するリンカー配列
[態様18]
リンカー配列がGDCSGDGGGGSGPEPVPVPDGであることを特徴とする態様17記載の融合体。
[態様19]
以下の(a)、(b)又は(c)のポリペプチド。
(a)配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチド
(b)配列番号23、配列番号25、配列番号27又は配列番号29において、1個又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列から成り電子メディエータ機能及びグルコース酸化機能を有するポリペプチド
(c)配列番号23、配列番号25、配列番号27又は配列番号29のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能及びグルコース酸化機能を有するポリペプチド
[態様20]
態様13記載の融合体をコードする遺伝子。
[態様21]
態様20記載の遺伝子を含む組換えベクター。
[態様22]
態様21記載の組換えベクターにより形質転換された形質転換体。
[態様23]
態様22記載の形質転換体を栄養培地にて培養し、細胞外分泌型シトクロムとグルコース酸化還元酵素とを融合させた融合体を採取することを特徴とする、態様13記載の融合体の製造方法。
[態様24]
態様1記載の電子メディエータ及びグルコース酸化還元酵素、又は、態様13記載の融合体のいずれかを含むグルコース測定用組成物。
[態様25]
態様1記載の電子メディエータ及びグルコース酸化還元酵素、又は、態様13記載の融合体のいずれかを含むバイオ電池。
[態様26]
態様1から6のいずれか一項に記載の電子メディエータ、又は態様12に記載の細胞外分泌型シトクロムから成るグルコース酸化還元酵素用電子メディエータを用いた酵素活性の測定方法。
[態様27]
細胞外分泌型シトクロム、基質及び酵素を用いる、酵素の活性を測定する測定方法であって、
I) 前記酵素により前記基質を酸化する工程、
II) 前記工程Iにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
III)前記工程IIによって生じる前記細胞外分泌型シトクロムにおける変化を検出する工程、
IV) 前記工程IIIにおいて検出される前記細胞外分泌型シトクロムにおける単位時間当たりの変化の量を、前記酵素の活性と相関付ける工程、
を含む、測定方法。
[態様28]
細胞外分泌型シトクロム、基質、酵素及び電子受容体を用いる、酵素の活性を測定する測定方法であって、
I) 前記酵素により前記基質を酸化する工程、
II) 前記工程Iにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
III)前記工程IIによって生じる前記細胞外分泌型シトクロムにおける電子を前記電子受容体により受容する工程、
IV) 前記工程IIIによって生じる前記電子受容体における変化を検出する工程、
V) 前記工程IVにおいて検出される前記電子受容体における単位時間当たりの変化の量を、前記酵素の活性と相関付ける工程、
を含む、測定方法。
[態様29]
細胞外分泌型シトクロム、酵素、および電子受容体を用いる、測定対象物の測定方法であって、
A)前記酵素により前記測定対象物を酸化する工程、
B)前記工程Aにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
C)前記工程Bによって生じる前記細胞外分泌型シトクロムにおける電子を前記電子受容体により受容する工程、
D)前記工程Cによって生じる前記電子受容体における変化を検出する工程、
E)前記工程Dにおいて検出される前記電子受容体における変化の量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
[態様30]
測定において用いられる、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい、態様29に記載の測定方法。
[態様31]
前記細胞外分泌型シトクロムが糸状菌に属する菌由来である、態様29に記載の測定方法。
[態様32]
前記糸状菌がアスペルギルス属の菌である、態様31に記載の測定方法。
[態様33]
前記アスペルギルス属の菌がアスペルギルス・テレウス、またはアスペルギルス・オリゼである、態様32に記載の測定方法。
[態様34]
前記細胞外分泌型シトクロムが前記態様6に記載の電子メディエータである、態様29に記載の測定方法。
[態様35]
前記酵素が酸化還元酵素あるいは脱水素酵素である、態様29に記載の測定方法。
[態様36]
前記酵素がグルコースに作用する酵素である、態様29に記載の測定方法。
[態様37]
前記酵素がフラビンアデニンジヌクレオチド依存型である、態様29に記載の測定方法。
[態様38]
前記酵素がフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素である、態様29に記載の測定方法。
[態様39]
前記測定対象物がグルコースである、態様29に記載の測定方法。
[態様40]
前記電子受容体が電極である、態様29に記載の測定方法。
[態様41]
前記電子受容体が酸化還元化合物である、態様29に記載の測定方法。
[態様42]
前記工程Dにおける検出が電流、通電電荷量、あるいは分光学的量によってなされる、態様29に記載の測定方法。
[態様43]
前記工程Dにおいて検出される変化が一つ以上の酸化還元物質の反応を介して得られる、態様29に記載の測定方法。
[態様44]
測定可能な前記測定対象物の濃度が5mMよりも大きい、態様29に記載の測定方法。
[態様45]
前記細胞外分泌型シトクロムと前記酵素が融合している、態様29に記載の測定方法。
[態様46]
前記酵素が、グルコース脱水素酵素、あるいはグルコース酸化酵素である、態様45に記載の測定方法。
[態様47]
前記細胞外分泌型シトクロムと前記酵素の融合体が態様17に記載の融合体である、態様45に記載の測定方法。
[態様48]
前記細胞外分泌型シトクロムと前記酵素の融合体が態様19に記載のポリペプチドである、態様45に記載の測定方法。
[態様49]
細胞外分泌型シトクロム、酵素、第1の電極、および第2の電極を用いる、測定対象物の測定方法であって、
F)前記酵素により前記測定対象物を酸化する工程、
G)前記工程Fにおいて前記酵素内に生じる電子を、前記第1の電極に担持された前記細胞外分泌型シトクロムにより受容する工程、
H)前記工程Gによって生じる前記細胞外分泌型シトクロムにおける電子を前記第1の電極により受容する工程、
I)前記工程Hによって前記第1の電極と前記第2の電極との間に流れる電流あるいは通電電荷量を検出する工程、
J)前記工程Iにおいて検出される電流あるいは通電電荷量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
[態様50]
前記酵素が前記第1の電極に担持されている、態様49に記載の測定方法。
[態様51]
前記酵素と前記細胞外分泌型シトクロムが融合している、態様49に記載の測定方法。
[態様52]
前記酵素、前記細胞外分泌型シトクロム、あるいはそれらの融合体が高分子によって前記第1の電極に担持されている、態様49に記載の測定方法。
[態様53]
前記工程Hが前記第1の電極への電位の印加により誘起される、態様49に記載の測定方法。
[態様54]
前記第1の電極への電位の印加が前記第2の電極に対してなされる、態様53に記載の測定方法。
[態様55]
前記第2の電極が酸化還元性である、態様54に記載の測定方法。
[態様56]
前記第2の電極がAg/AgClである、態様55に記載の測定方法。
[態様57]
酸化還元性の第3の電極を更に用い、前記第1の電極への電位の印加が前記第3の電極に対してなされる、態様53に記載の測定方法。
[態様58]
前記第3の電極がAg/AgClである、態様57に記載の測定方法。
[態様59]
前記工程F、および前記工程Gが並行して実施される、態様49に記載の測定方法。
[態様60]
前記第1の電極への電位の印加が前記工程Fに先立って行われる、態様49に記載の測定方法。
[態様61]
細胞外分泌型シトクロム、および酵素を用いる、測定対象物の測定方法であって、
K)前記酵素により前記測定対象物を酸化する工程、
L)前記工程Kにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
M)前記工程Lによって生じる前記細胞外分泌型シトクロムの分光学的特性の変化を検出する工程、
N)前記工程Mにおいて検出される特性変化を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
[態様62]
測定対象物の濃度あるいは量を測定するための電極であって、細胞外分泌型シトクロムおよび酵素が担持された電極。
[態様63]
前記細胞外分泌型シトクロムおよび前記酵素が高分子によって担持された、態様62記載の電極。
[態様64]
前記細胞外分泌型シトクロムおよび前記酵素が融合している、態様62記載の電極。
[態様65]
前記電極がカーボン、金、白金、あるいはパラジウムのいずれかを含む、態様62記載の電極。
[態様66]
試料液中に含まれる測定対象物の測定をするためのセンサであって、
前記センサは、少なくとも、
i) 絶縁性の第1の基板、
ii) 前記第1の基板上に配置された第1および第2の電極、
iii)前記第1の電極の上に配置された試薬層、
iv) 前記第1の電極あるいは前記試薬層、および前記第2の電極と接する、試料液保持部から成り、前記試薬層は細胞外分泌型シトクロムを含み、前記試薬層あるいは前記試料液保持部のいずれかに酵素が配置された、センサ。
[態様67]
前記第1および第2の電極のいずれかが、カーボン、金、白金、あるいはパラジウムのいずれかを含む、態様66記載のセンサ。
[態様68]
前記第2の電極が、酸化還元性の電極である、態様66記載のセンサ。
[態様69]
前記第2の電極が、Ag/AgClである、態様68記載のセンサ。
[態様70]
前記試薬層が前記第1の電極上にのみ配置されている、態様66記載のセンサ。
[態様71]
前記細胞外分泌型シトクロムと前記酵素が融合している、態様66記載のセンサ。
[態様72]
測定において用いられる、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい、態様66に記載のセンサ。
[態様73]
前記細胞外分泌型シトクロムが、糸状菌に属する菌、アスペルギルス属の菌、アスペルギルス・テレウス、あるいはアスペルギルス・オリゼのいずれかに由来する、態様66に記載のセンサ。
[態様74]
前記細胞外分泌型シトクロムが前記態様6に記載の電子メディエータである、態様66に記載のセンサ。
[態様75]
前記細胞外分泌型シトクロムと前記酵素の融合体が態様17に記載の融合体である、態様71に記載のセンサ。
[態様76]
前記細胞外分泌型シトクロムと前記酵素の融合体が態様19に記載のポリペプチドである、態様71に記載のセンサ。
[態様77]
前記酵素が酸化還元酵素あるいは脱水素酵素である、態様66に記載のセンサ。
[態様78]
前記酵素がグルコースに作用する酵素である、態様66に記載のセンサ。
[態様79]
前記酵素がフラビンアデニンジヌクレオチド依存型である、態様66に記載のセンサ。
[態様80]
前記酵素がフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素である、態様66に記載のセンサ。
[態様81]
前記測定対象物がグルコースである、態様66に記載のセンサ。
[態様82]
態様66に記載のセンサであって、更にv)切欠部を有する第2の基板を含み、前記第2の基板が前記試料液保持部の少なくとも一部を形成しているセンサ。
[態様83]
前記切欠部の形状が矩形、あるいはU字型である、態様82に記載のセンサ。
[態様84]
態様82に記載のセンサであって、更にvi)第3の基板を含み、前記第3の基板が前記試料液保持部の少なくとも一部を形成しているセンサ。
[態様85]
測定可能な前記測定対象物の濃度が5mMよりも大きい、態様66に記載のセンサ。
【発明の効果】
【0015】
本発明の可溶性細胞外分泌型シトクロムをグルコース酸化還元酵素用に使用することによって、酵素と親和性の高い電子メディエータが得られ、電極への直接の電子伝達が可能になった。更に、細胞外分泌型シトクロムは、可溶性蛋白質の為、回収が容易であり、かつ精製途中に不溶化せず安定性が高い等、従来のグルコース酸化還元酵素用電子メディエータとして知られていた膜結合性シトクロムに無い優れた性質を有している。その上、細胞外分泌型シトクロムは、グルコース酸化還元酵素に対する親和性が高いため、電子メディエータとしてグルコース測定に使用する場合の該シトクロム使用量を抑えることが可能になった。
【図面の簡単な説明】
【0016】
【図1】本発明の細胞外分泌型シトクロムを用いた酵素電極による、グルコースに対する応答電流値測定の結果を示すグラフである。
【図2】本発明の細胞外分泌型シトクロムを用いた酵素電極による、グルコースに対する応答電流値測定の結果を示すグラフである。
【図3】本発明の融合体について、シトクロムCに対する電子供与能の測定の結果を示すグラフである。上の曲線がAoCytb-AtGLDを示し、下の曲線がAtGLDを示す。
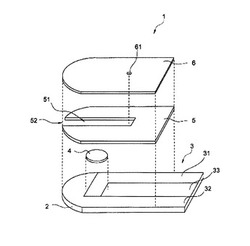
【図4】本発明の一実施形態であるセンサの概略を示す分解斜視図である。
【図5】測定システムの概略構成を示す斜視図である。
【図6】測定システムの概略構成を示すブロック図である。
【図7】本発明の一実施形態であるセンサを用いたときの、グルコース濃度と応答電流の関係を示すグラフである。
【発明を実施するための形態】
【0017】
本発明は、細胞外分泌型シトクロムをグルコース酸化還元酵素等の酵素用電子メディエータとして使用することを特徴とする。
【0018】
今回、本発明者等は、細胞外分泌型シトクロムが、グルコース酸化還元酵素用の電子メディエータとして極めて優れた機能を発揮することを見出した。本発明の細胞外分泌型シトクロムは生物が生産する蛋白質性の天然物質である為に安全性にも優れている。
【0019】
本発明に係るグルコース酸化還元酵素は、グルコースと電子受容体の酸化還元反応を触媒する酵素である。該グルコース酸化還元酵素は、グルコース酸化酵素又はグルコース脱水素酵素であれば良く、好ましくは、グルコースに対する作用性を100%としたときにマルトース及びガラクトースに対する夫々の作用性が多くとも10%であるグルコース酸化還元酵素が良く、より好ましくはグルコースに対する作用性を100%としたときにマルトース及びガラクトースに対する夫々の作用性が多くとも8%であるグルコース酸化還元酵素が良く、更に好ましくは夫々の作用性が多くとも5%であるグルコース酸化還元酵素が良い。使用できる該グルコース酸化還元酵素の例としては、フラビンアデニンジヌクレオチドを補酵素とするグルコース酸化酵素、ニコチンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素又はフラビンアデニンジヌクレオチドを補酵素とする(フラビンアデニンジヌクレオチド依存型)グルコース脱水素酵素がある。
フラビンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素の場合、グルコースに対する作用性を100%としたときにマルトース及びガラクトースに対する夫々の作用性が10%以下であれば、その種類及び由来等に関する制限は特にないが、国際公開第2004/058958号、国際公開第2006/101239号及び国際公開第2008/001903号の各パンフレットに記載されているアスペルギルス属、ペニシリウム属若しくはガノデルマ属等の糸状菌に属する菌に由来するグルコース脱水素酵素、又はProc.Natl.Acad.Sci.USA Vol.80,pp.6286−6288(1983)に記載されているドロソフィラ属由来のグルコース脱水素酵素が好ましく、より好ましくは、国際公開第2004/058958号パンフレットに記載されているアスペルギルス・テレウスFERM BP−08578株又は国際公開第2008/001903号パンフレットに記載されているアスペルギルス・オリゼ株の様々な菌株(RIB40は除く)に由来するグルコース脱水素酵素が良い。このような糸状菌に属する菌に由来するフラビンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素では、グルコースの1位の水酸基を酸化する反応を触媒する理化学的性質、及びマルトースやガラクトースに対する作用性が低い等の性質が共通しており、同様の酵素活性を有している。
【0020】
更に、フラビンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素として、例えば、アミノ酸配列の一部の遺伝子工学的な改変によって、野生型グルコース脱水素酵素に対するキシロース作用性/グルコース作用性の低下、及び低温域での作用性向上又は安定性等の諸性質が改良されているような各種の改変型グルコース脱水素酵素を使用することができる。
【0021】
上記のアミノ酸配列の一部の遺伝子工学的な改変の例としては、アスペルギルス・テレウスFERM BP−08578株由来のグルコース脱水素酵素のアミノ酸配列において、D72A、G73D、G73A、G73S、G73C、G73Q、G73W、G73Y、G73E、G73H、R102H、Y228H、V356A、及びP527Lからなる群から選択されるアミノ酸置換を挙げることができる。
【0022】
本発明で使用するグルコース酸化還元酵素は、例えば、上記で引用された各特許文献の開示に基づき、当業者に公知の任意の方法で容易に調製・取得することができる。尚、本発明のグルコース酸化還元酵素には、N末端にシグナル配列又はその一部を含むもの、及び、N末端からシグナル配列が切断されたものも含まれる。
【0023】
本発明の細胞外分泌型シトクロムは、ヘム鉄を含有するヘムタンパク質の一種である。細胞外分泌型シトクロムとは、野生株が細胞外に可溶性蛋白質として分泌生産するシトクロムを意味し、具体的には該シトクロムを構成するアミノ酸配列のN末端にシグナル配列を有するシトクロムである。該シトクロムは細胞外に分泌されるシトクロムであれば特に限定されないが、シトクロムbが好ましく、特にシトクロムb562が好ましい。該シトクロムをコードする遺伝子を組み込んだグラム陰性菌による生産や該シトクロムをコードする遺伝子の内、シグナル配列部分を除去した遺伝子を組み込んだ組換え体により細胞内に生産されるようになった蛋白質も含む。尚、本発明の細胞外分泌型シトクロムには、N末端にシグナル配列又はその一部を含むもの、及び、N末端からシグナル配列が切断されたものも含まれる。
【0024】
上記の電子メディエータとして有用な細胞外分泌型シトクロムの例としては、糸状菌に属する菌に由来する細胞外分泌型シトクロムが挙げられる。細胞外分泌型シトクロムであれば、由来に関する制限は特にないが、非特許文献1のTable3に開示されている白色腐朽菌であるファネロカエテ属、マグナポルテ属又はジベレラ属の菌に由来する細胞外分泌型シトクロムを用いることができる。更に、非特許文献1のTable3に記載のExtracellular cytochrome遺伝子であるAccession no.AB193288、XM_382527若しくはXM_369170のポリヌクレオチドにコードされる(Accession no.BAD95668.1、XP_382527若しくはXP_369170のポリペプチドからなる)細胞外分泌型シトクロム、又は非特許文献1のTable3に記載のCDH(セロビオース脱水素酵素)のN末端に位置する電子伝達ヘム含有ドメインを使用することができる。細胞外分泌型シトクロムは、好ましくはカビに属する菌に由来する細胞外分泌型シトクロムが良く、より好ましくはアスペルギルス属の菌に由来する細胞外分泌型シトクロムが良く、特に好ましくは、アスペルギルス・テレウス又はアスペルギルス・オリゼに由来する細胞外分泌型シトクロムが良い。
【0025】
更に、本発明のグルコース酸化還元酵素用電子メディエータを構成するポリペプチドとして、以下のポリペプチド:
(a)配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチド、
(b)配列番号2又は配列番号4のアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入、付加されたアミノ酸配列から成り電子メディエータ機能を有するポリペプチド、又は
(c)配列番号2又は配列番号4のアミノ酸配列と70%以上、好ましくは75%以上、より好ましくは80%以上、更に好ましくは90%以上、特に好ましくは95%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能を有するポリペプチド、を挙げることができる。ここで、配列番号2及び配列番号4で示されるアミノ酸配列から成るポリペプチドは、夫々、アスペルギルス・テレウス及びアスペルギルス・オリゼの菌株に由来する細胞外分泌型シトクロムである。
【0026】
本発明のポリヌクレオチドは、以下のポリヌクレオチド:
(a)配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチドをコードするポリヌクレオチド、
(b)配列番号2又は配列番号4のアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入、付加されたアミノ酸配列から成り電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド、
(c)配列番号2又は配列番号4のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド、
(d)配列番号1又は配列番号3に示される塩基配列を含み、かつ電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド、
(e)塩基配列(d)から成るポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件下でハイブリダイズし、かつ、電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド、又は
(f)塩基配列(d)から成るポリヌクレオチドと70%以上、好ましくは75%以上、より好ましくは80%以上、更に好ましくは90%以上、特に好ましくは95%以上の相同性を有する塩基配列を含み、かつ電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド、を挙げることができる。更に本発明のポリヌクレオチドはイントロンを含む配列であっても良い。加えて、上記ポリペプチドのシグナルペプチド部分をコードするポリヌクレオチドは、用いる宿主ベクター系により、それぞれ適切なものに一部又は全部を置換又は除去したポリヌクレオチドであっても良い。
【0027】
本発明において「電子メディエータ」とは、電子供与体から電子を受け取る機能及び/又は電子受容体に電子を渡す機能を有する物質を意味し、例えば、グルコース酸化還元酵素から電子を受け取り、電子を電極又は他の電子メディエータに供与する物質である。従って、配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチドから成るタンパク質から構成される細胞外分泌型シトクロムと実質的に同程度の「電子メディエータ」機能を有するポリペプチドも、グルコース酸化還元酵素用電子メディエータとして使用することができる。
【0028】
本発明において、アミノ酸配列又は塩基配列における相同性とは、比較対象となる基準配列の全長にわたり、所定の同一性を有する各配列をいう。このような配列の同一性パーセンテージは、基準配列を照会配列として比較するアルゴリズムをもった公開又は市販されているソフトウエアを用いて計算することができる。例として、BLAST、FASTA、又はGENETYX(ソフトウエア開発株式会社製)等を用いることができ、これらはデフォルトパラメーターで使用することができる。
【0029】
本発明において、ポリヌクレオチド間のハイブリダイズに際しての「ストリンジェントな条件下でハイブリダイズ」の具体的な条件とは、例えば、50%ホルムアミド、5×SSC(150mM塩化ナトリウム、15mMクエン酸三ナトリウム、10mMリン酸ナトリウム、1mMエチレンジアミン四酢酸、pH7.2)、5×デンハート(Denhardt’s)溶液、0.1%SDS、10%デキストラン硫酸及び100μg/mLの変性サケ精子DNAで42℃インキュベーションした後、フィルターを0.2×SSC中42℃で洗浄することを例示することができる。
【0030】
尚、本発明において、「ポリヌクレオチド」とは、プリン又はピリミジンが糖にβ‐N‐グリコシド結合したヌクレオシドのリン酸エステル(ATP(アデノシン三リン酸)、GTP(グアノシン三リン酸)、CTP(シチジン三リン酸)、UTP(ウリジン三リン酸);又はdATP(デオキシアデノシン三リン酸)、dGTP(デオキシグアノシン三リン酸)、dCTP(デオキシシチジン三リン酸)、dTTP(デオキシチミジン三リン酸))が100個以上結合した分子をいい、具体的にはグルコース酸化還元酵素をコードする染色体DNA、染色体DNAから転写されたmRNA、mRNAから合成されたcDNA及び、それらを鋳型としてPCR増幅したポリヌクレオチドを含む。「オリゴヌクレオチド」とはヌクレオチドが2‐99個連結した分子をいう。「ポリペプチド」とは、アミド結合(ペプチド結合)又は非天然の残基連結によって互いに結合した30個以上のアミノ酸残基から構成された分子を意味し、更には、これらに糖鎖が付加したものや、人工的に化学的修飾がなされたもの等も含む。
【0031】
本発明の細胞外分泌型シトクロム(ポリペプチド)及びそれをコードするポリヌクレオチドは、当業者に公知の任意の方法で容易に調製・取得することができる。例えば、アスペルギルス属、ファネロカエテ属、マグナポルテ属又はジベレラ属等の糸状菌に由来する細胞外分泌型シトクロム及びそれをコードするポリヌクレオチドは、本明細書の実施例に記載の遺伝子工学的方法に準じて調製することができる。ポリヌクレオチドの取得方法として、例えば、アスペルギルス・テレウスNIH2624若しくはアスペルギルス・オリゼRIB40のcDNAライブラリーを鋳型とし、配列番号5及び6のプライマーセット若しくは配列番号7及び8のプライマーセットを用いたPCR法によって、又はアスペルギルス・テレウスNIH2624若しくはアスペルギルス・オリゼRIB40から抽出した全RNA若しくはmRNAを鋳型とするRT−PCR法によって、いずれの方法によっても目的の細胞外分泌型シトクロム遺伝子を得ることができる。更に、非特許文献1のTable3に記載のExtracellular cytochrome遺伝子であるAccession no.AB193288、XM_382527若しくはXM_369170の既知配列、又は非特許文献1のTable3に記載のCDH(セロビオース脱水素酵素)のN末端に位置する電子伝達ヘム含有ドメインをコードする既知配列から、センス鎖及びアンチセンス鎖からなる1対のプライマーセットを作成し、上記方法と同様の方法により目的の細胞外分泌型シトクロムをコードするポリヌクレオチドを得ることができる。加えて、次の細胞外分泌型シトクロムをコードするポリヌクレオチドを取得できる。即ち、細胞外分泌型シトクロムを構成するポリペプチドが、アミノ酸配列のN末端にシグナル配列を含み、N末端のMetから54番目から110番目のいずれかの位置にヘムリガンドである「Gly−Xaa−Met」(Xaaは任意のアミノ酸)を含み、かつ該配列のMetから9アミノ酸を挟んでProを含む。更にN末端のMetから101番目から160番目のいずれかの位置に「Asn−Xaa−Thr」(Xaaは任意のアミノ酸)を含み、かつ該配列のThrから7アミノ酸を挟んで、S−S結合ドメインである「Cys−Xaa−Xaa−Cys」(Xaaは任意のアミノ酸)を含む。その上、N末端配列のMetから158番目から214番目の位置に、ヘムリガンドである「His」を含む。該ポリペプチドをコードするポリヌクレオチドは、既知配列から、センス鎖及びアンチセンス鎖からなる1対のプライマーセットを作成し、上記方法と同様の方法により目的の細胞外分泌型シトクロムをコードするポリヌクレオチドを得ることができる。
尚、プライマーを設計する場合には、プライマーのサイズ(塩基数)は鋳型DNAとの間の特異的なアニーリングを満足させることを考慮し、15-60塩基、望ましくは20-50塩基である。センス鎖(5’末端側)とアンチセンス鎖(3’末端側)からなる一組あるいは一対(2本)のプライマーが互いにアニールしないよう、両プライマー間の相補的配列を避けるようにする。更に、鋳型DNAとの安定な結合を確保するためにはGC含量が約50%程度であり、プライマー内においてGC-richあるいはAT-richが偏在しないようにすることが望ましい。アニーリング温度はTm値(melting temperature)に依存するので、特異性の高いPCR産物を得るため、Tm値が55-65℃で互いに近似したプライマーを選定する。加えて、PCRにおけるプライマー使用の最終濃度が約0.1から約1μMになるよう調製する等を留意することも必要である。プライマー設計には、プライマー設計用の市販のソフトウエア、例えばOligoTM [National Bioscience Inc.(米国)製]、GENETYX(ソフトウエア開発社製)等を用いることもできる。
【0032】
なお、上記のオリゴヌクレオチドプライマーセットは、例えば上記cDNAを適当な制限酵素で切断して作成することもでき、あるいは文献(例えばCarruthers(1982)Cold Spring Harbor Symp. Quant. Biol. 47:411−418; Adams(1983)J. Am. Chem. Soc. 105:661; Belousov(1997)Nucleic Acid Res. 25:3440−3444; Frenkel(1995)Free Radic. Biol. Med. 19:373−380; Blommers(1994)Biochemistry 33:7886−7896; Narang(1979)Meth. Enzymol. 68:90; Brown(1979)Meth. Enzymol. 68:109; Beaucage(1981)Tetra. Lett. 22:1859; 米国特許第4,458,066号)に記載されているような周知の化学合成技術により、in vitroにおいて合成することができる。
【0033】
本発明の組換えベクターは、クローニングベクター又は発現ベクターであり、インサートとしてのポリヌクレオチドの種類や、その使用目的等に応じて適宜必要なベクターを使用する。
【0034】
本発明の形質転換細胞(形質転換体)は、例えば、細胞外分泌型シトクロムやその類似蛋白質を大量製造する場合には、大腸菌、枯草菌等の原核細胞や、酵母、カビ、糸状菌、昆虫細胞又は哺乳動物細胞等の真核細胞等を使用することができ、糖鎖の要、不要又はその他のペプチド修飾の必要性に応じて、適宜選択することができる。形質転換細胞は特に限定されないが、糸状菌が好ましく、更にアスペルギルス属が好ましく、特にアスペルギルス・オリゼが好ましい。これらの形質転換細胞は、電気穿孔法、リン酸カルシウム法、リポソーム法、DEAEデキストラン法等公知の方法によって組換えベクターを細胞に導入することによって調製することができる。組換えベクター及び形質転換細胞の具体例として、下記実施例に示した組換えベクターと、組換えカビが挙げられる。
【0035】
細胞外分泌型シトクロムは、上記の細胞外分泌型シトクロムポリヌクレオチドを用いた組換えDNA技術によって取得できる。例えば上記のポリヌクレオチドを有するベクターからin vitro転写によってRNAを調製し、これを鋳型としてin vitro翻訳を行うことによりin vitroで細胞外分泌型シトクロムを作成することができる。更に、非特許文献1のTable3に記載のExtracellular cytochrome遺伝子であるAccession no.AB193288、XM_382527若しくはXM_369170のポリヌクレオチド、又は非特許文献1のTable3に記載のCDH(セロビオース脱水素酵素)のN末端に位置する電子伝達ヘム含有ドメインをコードするポリヌクレオチドを用いたDNA技術によっても同様に取得できる。 細胞外分泌型シトクロムをin vitro発現させて生産させる場合には、上記のポリヌクレオチドを、RNAポリメラーゼが結合できるプロモーターを有するベクターに挿入して組換えベクターを作成し、このベクターを、プロモーターに対応するRNAポリメラーゼを含むウサギ網状赤血球溶解物や小麦胚芽抽出物等のin vitro翻訳系に添加すれば、細胞外分泌型シトクロムをin vitroで生産することができる。RNAポリメラーゼが結合できるプロモーターとしては、T3、T7、SP6等が例示できる。これらのプロモーターを含むベクターとしては、pKA1、pCDM8、pT3/T718、pT7/319、pBluescriptII等が例示できる。
【0036】
細胞外分泌型シトクロムを大腸菌等の微生物でDNAを発現させて生産させる場合には、微生物中で複製可能なオリジン、プロモーター、リボソーム結合部位、DNAクローニング部位及びターミネーター配列等を有する発現ベクターに上記のポリヌクレオチドを組換えた発現ベクターを作成し、この発現ベクターで宿主細胞を形質転換したのち、得られた形質転換体を適当な培地(例えば、栄養培地)で培養すれば、細胞外分泌型シトクロムを微生物内で大量生産することができる。この際、任意の翻訳領域の前後に開始コドンと停止コドンを付加して発現させれば、任意の領域を含む細胞外分泌型シトクロム断片を得ることもできる。あるいは、他の蛋白質との融合蛋白質として発現させることもできる。この融合蛋白質を適当なプロテアーゼで切断することによっても目的とする細胞外分泌型シトクロムを取得することができる。大腸菌用発現ベクターとしては、pUC系、pBluescriptII、pET発現システム、pGEX発現システム又はpCold発現システム等が例示できる。
【0037】
細胞外分泌型シトクロムを、真核細胞で発現させて生産させる場合には、上記ポリヌクレオチドを、プロモーター、スプライシング領域及びポリ(A)付加部位等を有する真核細胞用発現ベクターに挿入して組換えベクターを作成し、真核細胞内に導入して形質転換体を作製し、この形質転換体を適当な培地(例えば、栄養培地)で培養すれば、細胞外分泌型シトクロムを真核細胞で生産することができる。更に、非特許文献1のTable3に記載のExtracellular cytochrome遺伝子であるAccession no.AB193288、XM_382527若しくはXM_369170のポリヌクレオチド、又は非特許文献1のTable3に記載のCDH(セロビオース脱水素酵素)のN末端に位置する電子伝達ヘム含有ドメインをコードするポリヌクレオチドを用いて、同様に細胞外分泌型シトクロムを真核細胞で生産することができる。組換えベクターは、プラスミドのような状態で細胞内に維持することもできるし、染色体中に組みこませて維持することもできる。発現ベクターとしては、pKA1、pCDM8、pSVK3、pSVL、pBK−CMV、pBK−RSV、EBVベクター、pRS、pYE82又はpUSA等が例示できる。pIND/V5−His、pFLAG−CMV−2、pEGFP−N1又はpEGFP−C1等を発現ベクターとして用いれば、Hisタグ、FLAGタグ又はGFP等各種タグを付加した融合蛋白質として細胞外分泌型シトクロムポリペプチドを発現させることもできる。真核細胞としては、サル腎臓細胞COS−7、チャイニーズハムスター卵巣細胞CHO等の哺乳動物培養細胞、出芽酵母、分裂酵母、カビ、糸状菌、カイコ細胞、アフリカツメガエル卵細胞等が一般に用いられるが、細胞外分泌型シトクロムを発現できるものであれば、いかなる真核細胞でも良いが、特に好ましくはヘムbを生産できる細胞である。ヘムb生産能を持たない細胞の場合には、上記細胞外分泌型シトクロムを生産させる場合と同様に、ヘムbの生産に必要な遺伝子を細胞内に導入すれば良い。特に、アスペルギルス属の菌が好ましく、アスペルギルス・オリゼが最も好ましい。発現ベクターを真核細胞に導入するには、電気穿孔法、リン酸カルシウム法、リポソーム法、DEAEデキストラン法等公知の方法を用いることができる。
【0038】
細胞外分泌型シトクロムを原核細胞や真核細胞で発現させた後、培養物(菌体、もしくは菌体外に分泌された酵素を含む培養液、培地組成物等)から目的蛋白質を単離精製するためには、公知の分離操作を組み合わせて行うことができる。例えば、尿素等の変性剤や界面活性剤による処理、熱処理、pH処理、超音波処理、酵素消化、塩析や溶媒沈殿法、透析、遠心分離、限外濾過、ゲル濾過、SDS−PAGE、等電点電気泳動、イオン交換クロマトグラフィー、疎水性クロマトグラフィー、逆相クロマトグラフィー、アフィニティークロマトグラフィー(タグ配列を利用した方法及びUKC1に特異的なポリクローナル抗体、モノクローナル抗体を用いる方法も含む)、等が挙げられる。
【0039】
細胞外分泌型シトクロムは、例えば配列番号2若しくは配列番号4のアミノ酸配列又はその類似配列に基づいて、公知のペプチド合成法(Merrifield, R.B. J. Solid phase peptide synthesis I. The synthesis of tetrapeptide. J. Amer. Chem. Soc. 85, 2149−2154, 1963; Fmoc Solid Phase Peptide Synthesis. A Practical Approach. Chan, W.C. and White, P.D., Oxford University Press, 2000)によって作成することができる。更に、これらのペプチドは天然のアミド結合以外の残基連結からなるものであっても良い。天然のアミド結合以外の残基連結は、例えばグルタルアルデヒド、N−ヒドロキシスクシンイミドエステル、2官能マレイミド、N,N’−ジシクロヘキシルカルボジイミド(DCC)、又はN,N’−ジイソプロピルカルボジイミド(DIC)等の化学結合又はカップリング手段を例示することができる。ペプチド結合の代替となり得る連結基は、例えばケトメチレン(例えば、−C(=O)−CH2−に対する−C(=O)−NH−)、アミノメチレン(CH2−NH)、エチレン、オレフィン(CH=CH)、エーテル(CH2−O)、チオエーテル(CH2−S)、テトラゾール(CN4−)、チアゾール、レトロアミド、チオアミド、又はエステルを含む(例えば、Spatola (1983) in Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, Vol. 7, pp 267−357, “Peptide Backbone Modifications,” Marcell Dekker, NYを参照)。
【0040】
以上の通りの方法によって作成された本発明の細胞外分泌型シトクロムの代表的な特性として以下のものを挙げることが出来る。
(1)グルコース酸化還元酵素から電子を受け取る機能及び/又は電子受容体に電子を受け渡す機能を共に有する。
(2)分子量:約30kDa(配列番号1又は配列番号3記載のポリヌクレオチドを導入した糸状菌による組換え細胞外分泌型シトクロムを、ポリアクリルアミドゲル電気泳動(SDS−PAGE)に供した際のサブユニット分子量である。)
なお、上記分子量については、本酵素には元来糖鎖が付加している為、培養条件又は精製条件により糖鎖の付き方が変われば分子量は異なり、形質転換細胞又はベクター系の種類等によっても糖鎖や付加するアミノ酸が変わり分子量は異なってくる。更に導入するポリヌクレオチドの種類によりアミノ酸配列長又は糖鎖の付き方が変われば分子量は異なる。
(3)赤色を呈している。
(4)還元型で427nm、531nm及び562nmに特徴的な吸収スペクトルを有する。
(5)シトクロムb562である。
(6)可溶性蛋白質である。 更に、本発明の細胞外分泌型シトクロムから成る電子メディエータは、グルコース酸化還元酵素との親和性が高く、グルコース酸化還元酵素のモル数に対し好ましくは100倍量未満、より好ましくは50倍量未満、更に好ましくは20倍量未満、特に好ましくは10倍量未満のモル数で使用可能な電子メディエータである。
【0041】
本発明は更に、上記の細胞外分泌型シトクロムと上記のグルコース酸化還元酵素を人工的に融合させた融合体を提供するものである。融合体は、単一分子内に電子メディエータ機能とグルコース酸化機能との両機能を有した融合体であって、下記(a)、(b)及び(c)のうち、アミノ酸配列のN末端側に(a)及びC末端側に(b)を有することを特徴とする融合体、N末端側に(a)及びC末端側に(b)を有し、かつ(a)と(b)の間に(c)を有することを特徴とする融合体、アミノ酸配列のC末端側に(a)及びN末端側に(b)を有することを特徴とする融合体、又はC末端側に(a)及びN末端側に(b)を有し、かつ(a)と(b)の間に(c)を有することを特徴とする融合体を挙げることができる:
(a)細胞外分泌型シトクロムのアミノ酸配列;
(b)グルコース酸化還元酵素のアミノ酸配列;及び、
(c)(a)のアミノ酸配列と(b)のアミノ酸配列とを結合するリンカー配列。
尚、細胞外分泌型シトクロムのアミノ酸配列は、電子メディエータ機能を有するポリペプチドを構成するアミノ酸配列であれば、例えば、融合体ポリペプチドのN末端側に該ポリペプチドを有する場合、ポリペプチドのC末端側のアミノ酸配列部分(例えば、数個〜数十個のアミノ酸)を適宜削除したアミノ酸配列でも良い。更に、細胞外分泌型シトクロムのアミノ酸配列を融合体ポリペプチドのC末端側に有する場合、該細胞外分泌型シトクロムの全アミノ酸配列からシグナル配列の一部又は全部を含むアミノ酸配列部分を適宜削除した配列を用いることができる。一方、グルコース酸化還元酵素のアミノ酸配列は、グルコース酸化機能を有するポリペプチドを構成するアミノ酸配列であれば、ポリペプチドのN末端側のアミノ酸配列部分(例えば、数個〜数十個のアミノ酸)を適宜削除したアミノ酸配列でも良い。特に、グルコース酸化還元酵素のアミノ酸配列を融合体ポリペプチドのC末端側に有する場合、該グルコース酸化還元酵素の全アミノ酸配列からシグナル配列の一部又は全部を含むアミノ酸配列部分を適宜削除した配列を用いることができる。シグナル配列部分は、例えばSignalPを用いて、予測することができる。
【0042】
本発明の融合体を構成するポリペプチドとして、以下のポリペプチド:
(a)配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチド、
(b)配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチドにおいて、1個又は数個のアミノ酸が置換、欠失、挿入、付加されたアミノ酸配列から成り電子メディエータ機能を有するポリペプチド、又は
(c)配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチドと70%以上、好ましくは75%以上、より好ましくは80%以上、更に好ましくは90%以上、特に好ましくは95%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能を有するポリペプチド、を挙げることができる。ここで、配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチドは、細胞外分泌型シトクロム及びグルコース脱水素酵素を融合させたポリペプチドであり、配列番号25及び配列番号29で示されるアミノ酸配列から成るポリペプチドは細胞外分泌型シトクロムとグルコース脱水素酵素の間にペプチドリンカーを含んでいる。
【0043】
上記の細胞外分泌型シトクロムをコードする塩基配列を有する遺伝子と上記のグルコース酸化還元酵素をコードする塩基配列を有する遺伝子を通常の遺伝子操作方法により連結し、単一の遺伝子とし、細胞外分泌型シトクロムの有する電子メディエータ機能及びグルコース酸化還元酵素の有するグルコース酸化機能を同一分子内に有する融合体をコードする融合体遺伝子を構築する。
【0044】
細胞外分泌型シトクロムをコードする塩基配列を有する遺伝子は、例えば段落番号0026に記載のポリヌクレオチドが使用でき、更に段落番号0031に記載の方法で取得したポリヌクレオチドも使用できる。該ポリヌクレオチドは、全長を使用することができ、又は電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチドであれば、ポリペプチドのC末端側又はN末端側のアミノ酸部分をコードする塩基配列を適宜削除したポリヌクレオチドでも良い。
【0045】
グルコース酸化還元酵素をコードする塩基配列を有する遺伝子は、例えば段落番号0019に記載のグルコース酸化還元酵素をコードする塩基配列であって、当業者に公知の遺伝子を使用できる。例えば、グルコース酸化酵素をコードする配列はアスペルギルス・ニガーから通常の方法で取得でき、ニコチンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素をコードする配列はバチルス・メガテリウムから通常の方法で取得でき、又はフラビンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素をコードする配列はアスペルギルス・テレウス若しくはアスペルギルス・オリゼ(RIB40株を除く)のようなアスペルギルス属、ペニシリウム属若しくはドロソフィラ属から通常の方法で取得できる。該遺伝子からなるポリヌクレオチドは、グルコース酸化機能を有するポリペプチドをコードするポリヌクレオチドであれば、ポリペプチドのN末端側のシグナル配列部分の一部又は全部を含むアミノ酸配列をコードする塩基配列を削除したポリヌクレオチドが使用できる。シグナル配列部分は、例えばSignalPを用いて、予測することができる。
【0046】
細胞外分泌型シトクロムをコードする塩基配列を有する遺伝子とグルコース酸化還元酵素をコードする塩基配列を有する遺伝子は、通常の遺伝子操作方法により連結でき、遺伝子の連結に関して制限は特に無いが、例えば2つの遺伝子の間にリンカー配列をコードする塩基配列を挿入して連結しても良い。リンカー配列は通常のリンカー配列であれば良く、例えばアスペルギルス・テレウス由来のセロビオース脱水素酵素のリンカー配列が挙げられる。具体的には、アミノ酸配列がGDCSGDGGGGSGPEPVPVPDGからなるリンカー配列が例示でき、該アミノ酸配列をコードする塩基配列を介して2つの遺伝子を連結することができる。
【0047】
本発明の融合体は、上記融合体遺伝子を使用し、又はペプチド合成法により、例えば段落番号0033から0039に記載の細胞外分泌型シトクロムの製造方法と同様の方法で製造することができる。
該製造方法によって製造された本発明の融合体は、細胞外分泌型シトクロムに特徴的な吸収スペクトルを有し、グルコース酸化還元酵素から電子を受け取る機能及び/又は電子受容体に電子を受け渡す機能並びにグルコース酸化還元酵素活性を有する。更に、本発明の融合体は、電子伝達能が優れているために、1回の測定系において、グルコース酸化還元酵素活性値で、好ましくは0.05〜400ユニット、より好ましくは0.1〜200ユニット、更に好ましくは0.2〜100ユニットという少ない使用量で測定対象物を有意に測定することができる、という特長を有する。
【0048】
更に本発明は、上記の細胞外分泌型シトクロムから成る電子メディエータ及びグルコース酸化還元酵素、又は融合体を含む、グルコース測定用組成物に関する。該組成物は、液状、凍結状、又は凍結乾燥等による固体状等の任意の形態をとり得る。該組成物中に於ける細胞外分泌型シトクロムから成る電子メディエータ及びグルコース酸化還元酵素の含有量は、目的又は形態等に応じて当業者が適宜選択することができるが、通常、夫々、0.01〜1,000μg/mL及び0.01〜1,000μg/mL程度である。該組成物中に於ける細胞外分泌型シトクロムから成る電子メディエータとグルコース酸化還元酵素との比率は、グルコース酸化還元酵素のモル数に対し、電子メディエータのモル数が好ましくは100倍量未満、より好ましくは50倍量未満、更に好ましくは20倍量未満、特に好ましくは10倍量未満である。一方、該組成物中に於ける融合体の含有量は、目的又は形態等に応じて当業者が適宜選択することができるが、通常、0.01〜1,000μg/mLである。融合体の含有量に関して特に制限はないが、1回の測定系に使用する量は、グルコース酸化還元酵素活性値で、0.05〜400ユニットが好ましく、より好ましくは0.1〜200ユニット、更に好ましくは0.2〜100ユニットである。更に、本発明の融合体は、フェリシアン化カリウム等の他の電子メディエータ非存在下で、基質とするグルコースの測定範囲が5mM又は10mMより大きい範囲であっても測定可能な融合体である。該組成物には牛血清アルブミン(BSA)若しくは卵白アルブミン、グルコース酸化還元酵素と作用性のない糖類若しくは糖アルコール類、カルボキシル基含有化合物、アルカリ土類金属化合物、アンモニウム塩、硫酸塩又は蛋白質等から成る群より選ばれる熱安定化剤、又は緩衝剤等の当業者に公知の他の任意成分を適宜含有させ、該電子メディエータ及びグルコース酸化還元酵素又は融合体を安定化させることができる。
【0049】
本発明は、上記の電子メディエータ又は融合体の酵素電極への使用に関する。酵素電極は、当業者に公知の任意の方法によって、上記の電子メディエータ及びグルコース脱水素酵素等のグルコース酸化還元酵素又は上記の融合体を表面上に固定することによって容易に作製することができる。
該酵素電極は、グルコースセンサ等のバイオセンサ及びバイオ電池等の広範囲な用途に使用することができる。
【0050】
本発明の電子メディエータ又は融合体を含む酵素電極を使用したグルコースセンサは、試料液中のグルコース濃度を測定するセンサである。かかるグルコースセンサは当業者に公知の、任意の方法で作製することできる。例えば、適当な絶縁性基板上にスクリーン印刷等の方法を利用して作用極、その対極及び参照極からなる電極系を形成し、この電極系上に上記の電子メディエータ及びグルコース酸化還元酵素又は上記の融合体を含む酵素反応層を形成することによって作製される。このバイオセンサの酵素反応層上に基質を含む試料液を滴下すると、酵素反応層が溶解して酵素と基質が反応し、これにともなって電子メディエータが還元される。酵素反応終了後、還元された電子メディエータを電気化学的に酸化させ、このとき、このバイオセンサは、得られる酸化電流値から試料液中の基質濃度を測定することが可能である。この他に、発色強度あるいはpH変化等を検知する方式のバイオセンサも構築可能である。
【0051】
更に本発明は、上記の電子メディエータ及びグルコース酸化還元酵素、又は融合体を含むバイオ電池に関する。本発明のバイオ電池は、酸化反応を行うアノード極及び還元反応を行うカソード極から構成され、必要に応じてアノードとカソードを隔離する電解質層を含んで構成される。上記の電子メディエータ及びグルコース酸化還元酵素又は上記の融合体を含む酵素電極をアノード電極に使用し、基質を酸化することによって生じた電子を電極に取り出すと共に、プロトンを発生させる。一方、カソード側には、一般的にカソード電極に使用される酵素を使用すれば良く、例えばラッカーゼ、アスコルビン酸オキシダーゼ又はビリルビンオキシダーゼを使用し、アノード側で発生させたプロトンを酸素と反応させることによって水を生成させる。電極としては、カーボン、金、白金等、一般的にバイオ電池に使用される電極を用いることができる。
【0052】
更に本発明は、上記の電子メディエータを用いた酵素の活性測定に関する。酵素の活性測定において、酵素、基質及び本発明の電子メディエータを用い、該電子メディエータの電子受容状態を、例えば吸光度又は吸光スペクトル等の分光学的特性の検出によって知ることができ、酵素活性の測定を行うことができる。これには市販の分光測定装置を用いれば良い。又は、酵素の活性測定において、酵素、基質及び本発明の電子メディエータに加え、フェリシアン化カリウム、フェナジンメトスルフェート、ジクロロフェノールインドフェノール又はシトクロムC等、細胞外分泌型シトクロム以外の一つ又は一つ以上の電子メディエータを用い、該電子メディエータの電子受容状態を、例えば吸光度又は吸光スペクトル等の分光学的特性の検出によって知ることができ、酵素活性の測定を行うことができる。
【0053】
尚、本発明を実施するために使用する様々な技術は、特にその出典を明示した技術を除いては、公知の文献等に基づいて当業者であれば容易かつ確実に実施可能である。例えば、遺伝子工学及び分子生物学的技術はSambrook and Maniatis, in Molecular Cloning-A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, 1989; Ausubel, F. M. et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, N.Y, 1995等に記載の方法あるいはそこで引用された文献記載の方法又はそれらと実質的に同様な方法や改変法に基づき実施可能である。更に、この発明における用語は基本的にはIUPAC-IUB Commission on Biochemical Nomenclatureによるものであり、あるいは当該分野において慣用的に使用される用語の意味に基づくものである。尚、本明細書において、特に断りがない限り、グルコース等の単糖類はD‐体を意味するが、本発明を限定するものではない。
【0054】
本発明の一つの態様は、細胞外分泌型シトクロム、酵素、および電子受容体を用いる、測定対象物の測定方法であって、
A)前記酵素により前記測定対象物を酸化する工程、
B)前記工程Aにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
C)前記工程Bによって生じる前記細胞外分泌型シトクロムにおける電子を前記電子受容体により受容する工程、
D)前記工程Cによって生じる前記電子受容体における変化を検出する工程、
E)前記工程Dにおいて検出される前記電子受容体における変化の量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法、である。このようにすると、細胞外分泌型シトクロムと酵素の間の親和性が良いため、測定対象物の測定を高感度に行うことができる。また、細胞外分泌型シトクロムは水溶性が高いため、特に水溶性の測定対象物を含む水溶液、例えば、血液、血漿、血清、尿などの生体試料を用いる場合に、本発明は特に好適である。細胞外分泌型シトクロム、酵素、および電子受容体を生体試料に溶解させて用いることができる。本発明は、酵素、および細胞外分泌型シトクロムを介して伝達された測定対象物由来の電子を効率よく電子受容体へと蓄積させ、電子受容体の変化によって測定対象物の量または濃度を得る方法である。
【0055】
前記細胞外分泌型シトクロムとしては、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい量を測定に用いることができる。また、前記細胞外分泌型シトクロムが糸状菌に属する菌、アスペルギルス属の菌、アスペルギルス・テレウス、あるいはアスペルギルス・オリゼのいずれか由来であるものを用いることができる。更には、前記細胞外分泌型シトクロムとして前記態様6に記載の電子メディエータを用いることができる。前述した細胞外分泌型シトクロムの特長を反映する測定対象物の測定方法を提供することができる。
【0056】
前記酵素としては、酸化還元酵素あるいは脱水素酵素を用いることができる。これらの酵素は測定対象物である基質から電子を受容するため、この受容した電子を前記細胞外分泌型シトクロムへと伝達することが可能である。医学的、および臨床学的に意義のある測定対象物に対する酸化還元酵素あるいは脱水素酵素を用いることが好ましい。酵素の例として、グルコース酸化酵素、グルコース脱水素酵素、乳酸酸化酵素、乳酸脱水素酵素、コレステロール酸化酵素、コレステロール脱水素酵素などを挙げることができる。中でも、前記酵素がグルコースに作用する酵素であることがより好ましい。生体液、特に血液および尿に含まれるグルコースの濃度は糖尿病の診断、経過観察、あるいは発見において重要な指標となる。この場合、測定対象物としてグルコースを用いることができる。また、前記酵素としてはフラビンアデニンジヌクレオチド依存型のものを用いることができ、これらは細胞外シトクロムとの親和性が高く、測定対象物である基質に対する特異性が高いため、測定対象物の測定を高感度かつ選択的に実施することが可能である。したがって、特に、前記酵素がフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素を用いることが好適である。
【0057】
上記発明の態様において、前記電子受容体として電極を用いることが可能である。このようにすると、電子受容体における変化を電極への電子の流れとして捉えることができるため、測定がより簡便になる。電極への電子の流れは、電流、あるいは通電電荷量を市販の電流計、あるいはクーロンメータなど用いて検出することが可能である。電極としては、金、白金、パラジウム、カーボンなどを含むものを用いることができ、これら化学的に安定な材料を含むことが、安定な測定の実施において好ましい。また、後述の実施例において述べるとおり、電極以外の導体あるいはカーボンの粉末は必ずしも必要ではない。これは、本発明における細胞外分泌型シトクロムが、電極をはじめとする電子受容体への電子伝達能に優れているためと推察される。
【0058】
また、前記電子受容体としては酸化還元化合物を用いることができる。該化合物の分光学的特性あるいは量が酸化体と還元体とで異なれば、該化合物の電子受容状態を、例えば吸光度、あるいは吸光スペクトルなどの分光学的特性の検出によって知ることができ、測定対象物の測定を行うことができる。これには市販の分光測定装置を用いればよい。そのような測定は、例えば以下のように実行される。酵素および細胞分泌型シトクロム、酸化還元化合物を含む光透過性のセルに、液体試料を添加する。セルとしては、例えば、ガラスやポリスチレン製の市販の光学測定用セルを用いることができる。市販の分光光度計を用いて、セルに光を照射し、透過する光を検出する。照射する光、および検出する光の波長としては、酸化還元化合物の酸化および還元に伴い、吸光度が大きく変化する波長を適宜選択することが好ましい。これにより、液体試料に含まれる酸化還元化合物の酸化にともなう、細胞外分泌型シトクロムの酸化体の減少、又は還元体の増加を、光によって検出することができる。なお、細胞外分泌型シトクロムの酸化体の減少、又は還元体の増加は、細胞外分泌型シトクロムそのものの分光学的特性の変化を観測することによっても実現可能であり、測定対象物の測定も可能である。酸化型の細胞外分泌型シトクロムは419nmに吸収ピークを持つが、これが還元型になると427nmへシフトし、加えて531および562nmに吸収ピークを呈するようになる。
あるいは、別途電極を用いて、該化合物を酸化し、電極への電子の流れを、電流、あるいは通電電荷量として市販の電流計、あるいはクーロンメータなど用いて検出してもよい。電極としては、金、白金、パラジウム、カーボンなどを含むものを用いることができる。電子受容体としては、フェリシアン化物イオン、フェロセン誘導体などの金属錯体、フェナジニウム誘導体、キノン誘導体などの有機化合物を用いることができる。
【0059】
前記工程Dにおいて検出される変化を、一つ以上の酸化還元物質の反応を介して得ることも可能である。例えば電子受容体に伝達された電子を、該酸化還元物質へと更に伝達し、該酸化還元物質の変化として間接的に変化を見ることができる。例えば、前記電子受容体としてフェナジンメトスルフェート、前記酸化還元物質としてジクロロフェノールインドフェノールを用い、ジクロロフェノールインドフェノールの分光特性の変化を検出する方法が挙げられる。本態様は、電子受容体よりも酸化還元物質の特性変化がより大きい、あるいは検出分解能が高い場合により好ましい。
【0060】
測定可能な前記測定対象物の濃度が5mMよりも大きいことが好ましく、このような態様は酵素と細胞外分泌型シトクロムとの間の親和性に加え、細胞外分泌型シトクロムと電子受容体との間の親和性および電子伝達能の高い、本発明の細胞外分泌型シトクロムによって実現される。他の好ましい濃度範囲は、測定可能な前記測定対象物の濃度が5〜10mM、5〜20mM、5〜30mM、あるいは5〜40mMである。例えば、測定対象が血中のグルコースの場合、健常人は5mM程度であるが、糖尿病患者においては、上記上限濃度に達することもある。糖尿病患者のみを対象とする場合、測定可能な前記測定対象物の濃度は10mMより大きくても良い。例えば、10〜20mM、10〜30mM、あるいは10〜40mMである。他の態様として好ましい範囲は、0.08mM(=約1.5mg/dL)よりも大きい範囲である。より具体的には、0.08〜8mM、0.08〜10mM、0.08〜20mM、0.08〜30mM、あるいは0.08〜40mMである。糖尿病患者においては、インスリンの投与により自己の血糖値を下げることがあるが、その際、過剰投与により低血糖値を示す場合がある。この場合、健康に傷害をきたす恐れがあるため、低い濃度を測定する必要がある際には、本態様が更に好ましいことになる。以上のような態様は酵素と細胞外分泌型シトクロムとの間の親和性に加え、細胞外分泌型シトクロムと電子受容体との間の親和性および電子伝達能の高い、本発明の細胞外分泌型シトクロムによって実現される。
【0061】
前記細胞外分泌型シトクロムと前記酵素は融合していても良い。融合の方法は本明細書の他の部分に記述する通りである。例えば、前記細胞外分泌型シトクロムと前記酵素の融合体には、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい量のものを測定において用いることができる。また、前記細胞外分泌型シトクロムが糸状菌に属する菌、アスペルギルス属の菌、アスペルギルス・テレウス、あるいはアスペルギルス・オリゼのいずれか由来であるものを用いることができる。更には、前記細胞外分泌型シトクロムが前記態様6に記載の電子メディエータを用いることができる。このようにすると、前述した細胞外分泌型シトクロムの特長を反映する測定対象物の測定方法を提供することができる。融合体を用いることにより、測定対象物の測定方法に用いる材料が、操作上減少するため、より方法が簡素化される。合わせて、融合化による電子伝達効率の向上、それによる、より高感度な測定が期待される。
【0062】
本発明の一態様は、細胞外分泌型シトクロム、酵素、第1の電極、および第2の電極を用いる、測定対象物の測定方法であって、
F)前記酵素により前記測定対象物を酸化する工程、
G)前記工程Fにおいて前記酵素内に生じる電子を、前記第1の電極に担持された前記細胞外分泌型シトクロムにより受容する工程、
H)前記工程Gによって生じる前記細胞外分泌型シトクロムにおける電子を前記第1の電極により受容する工程、
I)前記工程Hによって前記第1の電極と前記第2の電極との間に流れる電流あるいは通電電荷量を検出する工程、
J)前記工程Iにおいて検出される電流あるいは通電電荷量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法である。このようにすると、測定対象物由来の電子を酵素の触媒反応、細胞外分泌型シトクロムによる電子伝達反応を介して、電極によって電気化学的に簡便かつ精度よく検出することができる。本態様は酵素と細胞外分泌型シトクロムとの間の親和性に加え、細胞外分泌型シトクロムと電子受容体との間の親和性および電子伝達能の高い、本発明の細胞外分泌型シトクロムによって実現される。前記第1の電極、および前記第2の電極としては、カーボン、金、白金、あるいはパラジウムのいずれかを含むものを用いることができる。細胞外分泌型シトクロム、および酵素は前述のものを用いることができる。
【0063】
前記酵素は前記第1の電極に担持されていてもよい。このようにすると、反応の場が検出に用いる第1の電極上に限定される上、用いる酵素の量が液に溶解するよりも少なくなるため、酵素をより効率的に利用することができる。また、前記酵素と前記細胞外分泌型シトクロムが融合していてもよい。本融合体には前述のものを用いることができる。
【0064】
また、前記酵素、前記細胞外分泌型シトクロム、あるいはそれらの融合体が高分子によって前記第1の電極に担持されていることが好ましい。このようにすると、測定対象物の測定に必要な要素がほぼ一体化され、測定が簡便になる。更には、高分子による担持により、電流あるいは通電電荷量の出力が大きくなる。これは、高分子による担持で高密度に細胞外分泌型シトクロムが集積・配向し、電極細胞外分泌型シトクロムの電極への電子伝達効率が向上するためと考えられる。用いる高分子としては例えば、カルボキシメチルセルロースを用いることができる。
【0065】
前記工程Hは前記第1の電極への電位の印加により誘起することができる。例えば、市販のポテンシオスタットの電位制御端子を前記第1の電極に、電位基準端子と補助電極端子前記第2の電極に接続し、所定の電位を該ポテンシオスタットにより印加することにより、前記第1の電極の電位を前記第2の電極に対して印加することができる。このとき、前記第1の電極に流れる電流と同じ電流が前記第2の電極に流れる。このような場合、前記第2の電極が酸化還元性であることが好ましい。このようにすると、前記第2の電極に流れる電流が前記第2の電極の酸化還元反応に基づくものとなるため、未知の測定試料において発生する前記第2の電極での未知の反応が起こらない。前記第2の電極での未知の反応は、測定対象物の測定において予測し得ない誤差要因となるため、本形態により誤差要因を排除した測定対象物の測定が実施できる。上記のような酸化還元性の電極の例はAg/AgClである。Ag/AgClは、酸化されるとAg→Ag+Cl−、還元されるとAgCl→Agの反応がそれぞれ進行する酸化還元性の電極である。
酸化還元性の第3の電極を更に用い、前記第1の電極への電位の印加が前記第3の電極に対してなされてもよい。例えば、市販のポテンシオスタットの電位制御端子を前記第1の電極に、補助電極端子を前記第2の電極に、電位基準端子を前記第3の電極にそれぞれ接続し、所定の電位を該ポテンシオスタットにより印加することにより、前記第1の電極の電位を前記第3の電極に対して印加することができる。このとき、前記第3の電極は酸化還元性であるので、該電極の酸化および還元反応が平衡状態を保っている。そのため、第3の電極の電位はほぼ一定している。よって、第3の電極に対して印加された第1の電極の電位もほぼ一定するため、測定対象物の測定がより安定になる。前記第3の電極の例としてAg/AgClを挙げることができる。
【0066】
前記工程F、および前記工程Gは並行して行うことができる。測定対象物、酵素、および細胞外分泌型シトクロムを同時に接触させればよい。このようにすると工程に要する時間が短縮されるため、測定対象物の測定が迅速に行える。また、前記第1の電極への電位の印加が前記工程Fに先立って行われてもよい。前述したような電位印加の方法を用いて前記第1の電極へ電位を印加してから、測定対象物、酵素、および細胞外分泌型シトクロムを前記第1の電極に接触させることにより実施可能である。このようにすると細胞外分泌型シトクロムが酵素より電子を受容するとすぐ前記第1の電極に電子が供与され、細胞外分泌型シトクロムは再び酵素より電子を受容できる形態となる。よって、細胞外分泌型シトクロムの第1の電極への電子伝達効率が向上し、測定対象物の感度よい測定が可能となる。
【0067】
また、本発明の他の一実施形態は、細胞外分泌型シトクロム、および酵素を用いる、測定対象物の測定方法であって、
K)前記酵素により前記測定対象物を酸化する工程、
L)前記工程Kにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
M)前記工程Lによって生じる前記細胞外分泌型シトクロムの分光学的特性の変化を検出する工程、
N)前記工程Mにおいて検出される特性変化を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法である。このようにすると、測定対象物の濃度に応じた細胞外分泌型シトクロムの酸化体の減少、又は還元体の増加を検出することができる。酸化型の細胞外分泌型シトクロムは419nmに吸収ピークを持つが、これが還元型になると427nmへシフトし、加えて531および562nmに吸収ピークを呈するようになる。このような変化は市販の分光光度計を用いて測定することが可能である。
【0068】
本発明の他の一実施形態は、測定対象物の濃度あるいは量を測定するための電極であって、細胞外分泌型シトクロムおよび酵素が担持された電極である。このようにすると、測定対象物の測定に用いる電極上に反応の場が限定される上、用いる酵素の量が液に溶解するよりも少なくなるため、酵素をより効率的に利用することができる。また、前記酵素と前記細胞外分泌型シトクロムが融合していてもよい。本融合体には前述のものを用いることができる。このようにすると、測定対象物の測定に必要な要素がほぼ一体化され、該電極を他の容易に入手できる第2の電極、更には第3の電極と組み合わせて簡便に測定が実施できる。細胞外分泌型シトクロムおよび酵素の担持には、高分子を用いることができる。これにより、電流あるいは通電電荷量の出力が大きくなる。これは、高分子による担持で高密度に細胞外分泌型シトクロムが集積・配向し、電極細胞外分泌型シトクロムの電極への電子伝達効率が向上するためと考えられる。用いる高分子としては例えば、カルボキシメチルセルロースを用いることができる。
【0069】
前記電極はカーボン、金、白金、あるいはパラジウムのいずれかを含むことが好ましい。これらの材料は化学的に安定であるため、測定対象物の測定が安定になる。例えば、カーボン、金、白金、あるいはパラジウムのいずれかを材料とする平板の電極に、細胞外分泌型シトクロムおよび酵素を含む高分子溶液を滴下・乾燥させることにより、電極を作成することができる。
【0070】
本発明の更なる他の一実施形態は、試料液中に含まれる測定対象物の測定をするためのセンサであって、
前記センサは、少なくとも、
i) 絶縁性の第1の基板、
ii) 前記第1の基板上に配置された第1および第2の電極、
iii)前記第1の電極の上に配置された試薬層、
iv) 前記第1の電極あるいは前記試薬層、および前記第2の電極と接する、試料液保持部から成り、前記試薬層は細胞外分泌型シトクロムを含み、前記試薬層あるいは前記試料液保持部のいずれかに酵素が配置された、センサである。
【0071】
本実施形態を図面を用いて以下に詳細に説明する。
【0072】
(センサの概略構成)
センサ1は、具体的には、基板2、導電層3、試薬層4、スペーサ5、カバー6を有する。図4に示すように、基板2は板状の部材である。基板2は絶縁性を有する。基板2を構成する材料としては、例えば、ポリエチレンテレフタレート、ビニルポリマ、ポリイミド、ポリエステル、及びスチレニクス等の樹脂;ガラス;並びにセラミックス等が挙げられる。
【0073】
基板2の寸法は、具体的な数値に限定されないが、例えば、基板2の幅は、好ましくは4〜20mm、より好ましくは5〜10mmに設定される。また、基板2の長さは、好ましくは20〜40mmに設定される。また、基板2の厚みは、好ましくは0.1〜1mmに設定される。基板2の幅、長さ、及び厚みが、全てこれらの範囲内にあることが、より好ましい。
【0074】
図4に示すように、導電層3は、基板2上に略均一な厚みに形成されている。導電層3は、3つの電極31〜33を含む。第1の電極である電極31は作用電極、第2の電極である電極32は対電極、電極33は検知電極と称されることがある。なお、検知電極33は省略可能である。
【0075】
電極31〜33のそれぞれの一部分は、キャピラリ51に面するように配置される。電極31〜33の他の一部分は、センサ1の導入口52とは逆の端部において、スペーサ5及びカバー6で覆われずに露出している。この露出部分は、リードとして機能し、測定器101から電圧の印加を受けたり、電流を測定器101に伝えたりする。
【0076】
各電極は、導電性材料を用いた印刷等により形成されてもよいし、基板2を導電性材料で覆った後、レーザアブレーション等で非導電トラックを形成することで形成されてもよい。例えば非限定的な例として、基板2にパラジウムをスパッタリングすることによって導電層3を形成し、レーザアブレーションにより、非導電トラックを形成することができる。非導電トラックは、好ましくは0.01〜0.5mm、より好ましくは0.05mm〜0.3mmの幅を有する
【0077】
なお、導電層3の構成材料は、導電性材料(導電性物質)であればよく、特に限定されるものではない。導電性材料の例としては、金属、金属混合物、合金、金属酸化物、及び金属化合物に代表される無機導電性物質等、炭化水素系導電性ポリマー及びヘテロ原子含有系導電性ポリマー等の有機導電性物質、又はこれらの物質の組み合わせが挙げられる。導電層3の構成材料としては、パラジウム、金、白金、炭素などが好ましく、パラジウムが特に好ましい。これらの材料は化学的に安定であるため、電極として安定に機能し、測定対象物の測定が安定になる。
【0078】
導電層3の厚さは、その形成方法及び構成材料により変更可能である。例えば、スパッタリングによって導電層3が形成された場合、導電層3の厚さは、好ましくは0.1〜20nm、より好ましくは1〜10nmである。印刷により導電層3が形成された場合、導電層3の厚さは、好ましくは0.1〜50μm、より好ましくは1〜30μmである。
【0079】
導電層3の電極32(第2の電極)に対応する部分に酸化還元性の物質を塗布し、これを電極32としてもよい。このようにすると、前記第2の電極に流れる電流が前記第2の電極の酸化還元反応に基づくものとなるため、未知の測定試料において発生する前記第2の電極での未知の反応が起こらない。前記第2の電極での未知の反応は、測定対象物の測定において予測し得ない誤差要因となるため、本形態により誤差要因を排除した測定対象物の測定が実施できる。上記のような酸化還元性の電極の例はAg/AgClである。Ag/AgClは、酸化されるとAg→Ag+Cl−、還元されるとAgCl→Agの反応がそれぞれ進行する酸化還元性の電極である。
【0080】
図4に示すように、試薬層4は、少なくとも電極31(第1の電極)に接するように配されている。また、試薬層4が電極31上のみに配置されている形態がより好ましい。このようにすると、測定対象物の反応の場が検出に用いる第1の電極上に限定され、酵素をより効率的に利用することができる。更には、第2の電極である電極32における還元反応を第1の電極とは独立させて行わせることができる。よって、上述したような酸化還元性の電極を第2の電極として供することがより容易になる。
【0081】
試薬層4は、電極31及び32と共に、センサ1の活性部として機能する。活性部とは、電気化学的に活性な領域であって、液体試料中の特定の物質に反応し、電気信号を生じる部分である。具体的には、試薬層4は、酵素および/または細胞外分泌型シトクロムを含む。
【0082】
試薬層4には、1種又は複数種の酵素が含まれる。試薬層4に含まれる酵素は、具体的には、測定対象物を基質とする酵素であり、特に測定対象物に特異的に反応する酵素であることが好ましい。酵素は、測定対象物の濃度、つまり測定対象物との反応量に応じて、細胞外分泌型シトクロムに電子を供与する。
【0083】
試薬層4に含まれる酵素としては、酸化還元酵素が特に好ましい。酸化還元酵素としては、具体的には、測定対象物を基質とする酸化酵素及び脱水素酵素が挙げられる。これらの酸化還元酵素の具体例としては、測定対象物がブドウ糖である場合は、グルコースオキシダーゼ、グルコースデヒドロゲナーゼが、測定対象物が乳酸である場合には、乳酸オキシダーゼ、又は乳酸デヒドロゲナーゼが、測定対象物がコレステロールである場合には、コレステロールエステラーゼ、又はコレステロールオキシダーゼが、測定対象物がアルコールである場合には、アルコールオキシダーゼが、測定対象物がビリルビンである場合にはビリルビンオキシダーゼが挙げられる。
【0084】
酵素は、その補酵素依存性について、特に限定されるものではない。例えば、試薬層4に含まれる酵素は、NAD(nicotinamide adenine dinucleotide)、NADP(nicotinamide adenine dinucleotide phosphate)、PQQ(Pyrroloquinoline quinone)、又はFAD(flavin adenine dinucleotide)等の補酵素に対して依存性を有する酵素であってもよい。
【0085】
酵素の補酵素は、FAD又はPQQであることが好ましい。これらの補酵素に対応する酵素において、補酵素は、その酵素タンパク質に結合するか、又は包含される。よって、センサの作製および測定方法の実施において、酵素とは別途に補酵素を添加する必要がない。その結果、センサの構成、製造工程、及び測定工程が簡素化される。
【0086】
NADおよびNADP依存性の酵素の場合は、酵素蛋白に結合しない状態で機能する補酵素NADおよびNADPを酵素と共に別途添加する必要がある。構成および工程はFADおよびPQQを補酵素とする酵素の場合と比較して複雑にはなるが、本願発明は実施可能である。
【0087】
例えば、酵素は、FAD依存性の酸化酵素、NAD依存性、PQQ依存性、又はFAD依存性の脱水素酵素等であってもよい。酸化酵素及び脱水素酵素の具体例は、上述したとおりである。
【0088】
試薬層4中の酵素は、前記細胞外分泌型シトクロムと融合していてもよく、本融合体には前述のものを用いることができる。また細胞外分泌型シトクロムは前述のものを用いることができる。
【0089】
試薬層4における酵素の含有量は、標的物質の検出が可能な程度に設定され、1回の測定当たり又はセンサ1個当たりにつき、好ましくは0.2〜20U(ユニット)、より好ましくは0.5〜10U程度に設定される。
【0090】
また、試薬層4には、酵素に合う補酵素が含まれていてもよい。
【0091】
試薬層4は、細胞外分泌型シトクロムを含む。細胞外分泌型シトクロムは、可逆的に酸化体及び還元体となることができ、直接または別の物質と協働して、物質間における電子の移動を媒介する。例えば、試薬層4に、基質を酸化する酵素が含まれる場合、酵素は、基質を酸化することで、基質からの電子を受け取り、補酵素に電子を与える。その結果、補酵素は、酸化体から還元体になる。酸化体の細胞外分泌型シトクロムは、還元体になった補酵素から電子を受け取って、補酵素を酸化体に戻す。その結果、細胞外分泌型シトクロム自身は還元体となる。還元体となった細胞外分泌型シトクロムは、電極31又は32に電子を与えて、自身は酸化体となる。このようにして、細胞外分泌型シトクロムは、酵素と電極間の電子移動を媒介する。
【0092】
上記補酵素は、酵素タンパク質(酵素分子)に結合することで、酵素タンパク質に保持されてもよい。また、補酵素は、酵素タンパク質とは別に、溶存してもよい。
【0093】
試薬層4は、酵素及び細胞外分泌型シトクロム以外の他の成分を含んでいてもよい。そのような成分としては、酵素又は細胞外分泌型シトクロムの保存性を高めたり、酵素と標的物質との反応性を高めたりすることができる種々の物質が用いられる。そのような成分として、例えば緩衝剤が挙げられる。
【0094】
試薬層4は、種々の方法によって形成可能である。形成方法としては、例えば印刷法、塗布法等が挙げられる。
【0095】
形成方法の一例を以下に述べる。酵素、細胞外分泌型シトクロム、及び必要に応じてその他の成分を含んだ水溶液を、マイクロシリンジなどを用いて、電極31上に一定量滴下した後、適切な環境に静置して乾燥させることにより、試薬層4を形成することができる。なお、試薬層4で電極31のより広い表面を被覆する場合には滴下した水溶液をシリンジの先端などで塗り広げてもよい。
【0096】
水溶液の滴下量は特定の数値に限定されないが、好ましくは0.5〜5μL、より好ましくは1〜2μLである。
【0097】
試薬層4の形状は、具体的な形状に限定されない。この形状は、矩形状や円形状などであってもよい。試薬層4の面積(基板2の平面方向における面積)は、デバイスの特性及びサイズに応じて決定される。この面積は、好ましくは1〜25mm2、より好ましくは2〜10mm2とすることができる。
【0098】
塗布される水溶液が含む、酵素及び細胞外分泌型シトクロム並びにその他の成分の含有量は、必要とするデバイスの特性やサイズに応じて選択される。
【0099】
図4に示すように、第2の基板であるスペーサ5は、測定対象物を含む試料液保持部を形成するための部材である。
【0100】
具体的には、スペーサ5は、板状の部材であって、電極31〜33のリード部分及び後述のキャピラリ51部分を除いて、導電層3の全体を覆うようになっている。スペーサ5は、電極31〜33のリード部分とは逆の端部を露出させる矩形の切り欠きを備える。切り欠き部はU字型であっても良い。スペーサ5がこの切り欠きを備えることで、試料液保持部が形成される。更に第3の基板であるカバー6をスペーサ5と貼り合わせることにより、カバー6により試料液保持部の一部が形成される。このようにスペーサ5、導電層3、及びカバー6とで囲まれた試料液保持部として機能するキャピラリ51が形成される。このように、スペーサ5は、キャピラリ51の側壁を提供し、さらにキャピラリ51の長さ、幅、高さ等を規定することができる。
【0101】
キャピラリ51の容量は、好ましくは0.1〜1.0μL(マイクロリットル)程度に設定される。スペーサ5の厚みは0.1〜0.2mmが好ましく、スペーサが備える切り欠きの長さは1〜5mmが好ましく、スペーサが備える幅は0.5〜2mmが好ましい。なお、これらの寸法は、キャピラリ51が所望の容量になるように適宜選択されればよい。例えば、長さが3.4mm、幅が1.2mmの切り欠きを備える厚さ0.145mmのスペーサ5を用いた場合、長さが3.4mm、幅が1.2mm、高さが0.145mm、容量が0.6μLのキャピラリ51が提供される。
【0102】
キャピラリ51は、その開口部である導入口52から毛細管現象によって液体試料を吸引し、電極31〜33上に保持する。
【0103】
図4に示すように、カバー6はスペーサ5全体を覆う板状の部材である。カバー6は、表面から裏面まで貫通する孔を備える。この孔は、キャピラリ51から外部に通じる通気口61として機能する。通気口61は、液体試料がキャピラリ51に吸引されるとき、キャピラリ51内の空気をキャピラリ外へ排出するための排気孔である。このように空気が排出されることで、液体試料がキャピラリ51内に容易に吸引されやすい。通気口61は、導入口52から離れた位置に、つまり、導入口52から見てキャピラリ51の奥に設けられることが好ましい。導入口52がこのように配置されることで、液体試料が、導入口52からキャピラリ51の奥まで、速やかに移動することができる。
【0104】
なお、上記の実施の形態においては、第1および第2の電極が同一基板上に配置された例を記したが、これに限定されない。例えば一方の電極を前記基板の上に配置し、もう一方をカバー基板上に配置させても良い。
【0105】
上述のセンサ1は、図5に示す測定システム100で用いられる。測定システム100は、センサ1及び測定器101を有する。
【0106】
図5及び図6に示すように、測定器101は、表示部102、装着部103、切替回路107、基準電圧源108、電流/電圧変換回路109、A/D変換回路110、演算部111を備える。測定器101は、さらに、センサ1の各電極に対応するコネクタを有する。図6には、コネクタ104〜106が描かれる。
【0107】
表示部102は、測定器101の状態、測定結果、操作内容等を表示する。表示部102は、具体的には液晶表示パネルによって実現される。
【0108】
図5に示すように、装着部103には、センサ1が着脱可能に挿入される。
【0109】
図6に示すように、コネクタ104〜106は、センサ1が装着部103に装着されることで、それぞれセンサ1の電極31〜33に接続される。
【0110】
切替回路107は、コネクタ104〜106を、基準電圧源108に接続したり、電流/電圧変換回路109したりする。
【0111】
基準電圧源108は、コネクタ104〜106を介して、電極31〜33に電圧を印加する。
【0112】
電流/電圧変換回路109は、センサ1からの電流を、コネクタ104〜106を介して受け取り、電圧に変換して、A/D変換回路110に出力する。
【0113】
A/D変換回路110は、電流/電圧変換回路109からの出力値(アナログ値)をパルス(デジタル値)に変換する。
【0114】
演算部111は、CPU(Central Processing Unit)並びにROM(Read Only Memory)及びRAM(Random Access Memory)等の記録媒体を有する。演算部111は、標的物質の濃度算出を行ったり、測定器101内の各部の動作を制御したりする。
【0115】
演算部111の濃度算出機能について説明する。演算部111の記憶媒体中には、試料中の標的物質の濃度の決定に用いられる換算テーブル、この濃度の補正量の決定に用いられる補正量テーブル等が記憶される。演算部111は、A/D変換回路110からのパルスに基づいて、換算テーブルを参照することにより、標的物質の仮の濃度を算出する。演算部111は、さらに、補正量テーブル中の補正量を用いて、標的物質の最終的な濃度を決定する。こうして算出された濃度は、表示部102に表示される。
【0116】
また、演算部111は、濃度算出機能以外に、切換回路107の切替制御、基準電圧源108の電圧制御、濃度測定や補正量選択時の時間の測定(タイマ機能)、表示部102への表示データ出力、及び外部機器との通信機能等を有する。
【0117】
演算部111の各種機能は、CPUが、図示しないROM等に格納されたプログラムを読み出して実行することにより実現される。
【0118】
以下、測定システム100による濃度測定について説明する。
【0119】
センサ1が装着部103に差し込まれると、コネクタ104〜106が、電極31〜33にそれぞれ接続される。また、装着部103内のスイッチ(図示せず)がセンサ1に押下される。スイッチの押下により、演算部111はセンサ1が装着されたと判断し、測定器101を試料待機状態とする。試料待機状態とは、演算部111の制御の下、基準電圧源108がコネクタ104及び106を介して、作用電極31及び検知電極33間への電圧印加を開始し、かつ電流/電圧変換回路109が電流測定を開始した後であって、液体試料がまだ測定に供されていない状態である。
【0120】
使用者が、センサ1の導入口51に液体試料を付着させると、毛細管現象によって、導入口51からキャピラリ52に液体試料が引き込まれる。
【0121】
液体試料としては、例えば、血液、汗、尿等の生体由来の液体試料や、環境由来の液体試料、食品由来の液体試料等が用いられる。例えば、センサ1を血糖値センサとして用いる場合、使用者は、自身の指、掌、又は腕等を穿刺して、少量の血液を搾り出し、この血液を液体試料として、センサ1での測定に供する。
【0122】
液体試料が作用電極31及び検知電極33に到達すると、演算部111が、電流/電圧変換回路109を介して受け取る電流値が変化する。この変化から、演算部111は、液体試料がセンサ1に吸引されたと判断する。こうして液体試料の吸引が検知されると、測定が開始される。
【0123】
センサ1内では、電極31及び32上で、液体試料、酵素、及びメディエータが互いに接触する。
【0124】
演算部111の制御により、切替回路107は、コネクタ104とコネクタ105とを基準電圧源108及び電流/電圧変換回路109に接続する。こうして、作用電極31と対電極32との間に電圧が印加され、作用電極31と対電極32との間に生じた電流が、電流/電圧変換回路109に伝達される。
【0125】
電流/電圧変換回路109へ流れた電流は電圧へ変換される。そして、この電圧はA/D変換回路110によりさらにパルスへと変換される。演算部111は、このパルスから、特定成分の濃度を算出する。演算部111により算出された値は、表示部202に表示される。その際、使用者へのその他の情報が共に表示されることもある。
【0126】
測定終了後は、使用者はセンサ1を装着部103から取り外すことができる。
【0127】
なお、基準電圧源108は、2つの電極31及び32間に、目的の電気化学反応を起こすのに十分な電圧を与えられるようになっている。この電圧は主に、利用する化学反応および電極に応じて設定される。
【0128】
また、上記(f)は、例えば、演算装置が、標的物質の濃度が既知である標準溶液を用いて得られる検量線を用いて、標的物質の濃度を算出することによって、実行される。
【0129】
本発明の他の一実施形態は、測定対象物の濃度あるいは量を測定するための電極であって、細胞外分泌型シトクロムおよび酵素が担持された電極である。このようにすると、測定対象物の測定に用いる電極上に反応の場が限定される上、用いる酵素の量が液に溶解するよりも少なくなるため、酵素をより効率的に利用することができる。また、前記酵素と前記細胞外分泌型シトクロムが融合していてもよい。本融合体には前述のものを用いることができる。このようにすると、測定対象物の測定に必要な要素がほぼ一体化され、該電極を他の容易に入手できる第2の電極、更には第3の電極と組み合わせて簡便に測定が実施できる。細胞外分泌型シトクロムおよび酵素の担持には、高分子を用いることができる。これにより、電流あるいは通電電荷量の出力が大きくなる。これは、高分子による担持で高密度に細胞外分泌型シトクロムが集積・配向し、電極細胞外分泌型シトクロムの電極への電子伝達効率が向上するためと考えられる。用いる高分子としては例えば、カルボキシメチルセルロースを用いることができる。
【0130】
以下、実施例に則して本発明を更に詳しく説明する。尚、本発明の技術的範囲はこれらの記載によって何等制限されるものではない。本明細書中に引用される文献に記載された内容は、本明細書の一部として本明細書の開示内容を構成するものである。
【実施例1】
【0131】
細胞外分泌型シトクロム遺伝子の取得
1)培養
パインデックス2%(松谷化学工業社製)(W/V)、トリプトン1%(BD社製)(W/V)、リン酸二水素カリウム0.5%(ナカライテスク社製)(W/V)、硫酸マグネシウム七水和物0.05%(W/V)(ナカライテスク社製)及び水からなる液体培地150mLを、500mL容の坂口フラスコに入れ、シリコセンで栓をした後、121℃、20分間オートクレーブした。冷却したこの液体培地にアスペルギルス・テレウスNIH2624株又はアスペルギルス・オリゼRIB40株を接種し、30℃で62時間振とう培養した。
2)Total RNA抽出
実施例1−1)に記載の方法によって培養したアスペルギルス・テレウスNIH2624株又はアスペルギルス・オリゼRIB40株の湿菌体2gを各々液体窒素によって凍結し磨砕した後、illustra RNAspin Mini Kit(GEヘルスケア・ジャパン社製)を用いて、各々0.1mgのTotal RNAを抽出した。
3)cDNAライブラリーの調製
アスペルギルス・テレウスNIH2624株又はアスペルギルス・オリゼRIB40株の各々のTotal RNAから、逆転写酵素及びアダプター付きオリゴdTプライマーを用いた逆転写反応により各々のcDNAライブラリーを調製した。反応にはPrime Script RT-PCR Kit(タカラバイオ社製)を使用し、反応条件は説明書記載のプロトコールに準じて行った。
4)細胞外分泌型シトクロム遺伝子の大腸菌へのサブクローニング
以下の表1に示した2組のプライマーを合成し、該プライマーにより、アスペルギルス・テレウスNIH2624株又はアスペルギルス・オリゼRIB40株のcDNAライブラリーを鋳型として、各々の細胞外分泌型シトクロム遺伝子をPCR増幅した。
【0132】
なお、表1のプライマーはNCBI(National Center for Biotechnology Information)(ウェブサイトhttp://www.ncbi.nlm.nih.gov/)で公開されている遺伝子データベースより、XM_001216771(アスペルギルス・テレウス:mRNAの一部でタンパク質をコードしていると推定されている)及びXM_001820457(アスペルギルス・オリゼ:mRNAの一部でタンパク質をコードしていると推定されている)の配列を基に設計した。その理由は、SMART(ウェブサイトhttp://smart.embl-heidelberg.de/)を用いて上記XM_001216771のドメイン構造予測を行った結果、電子伝達能を有するタンパク質(シトクロム)であると推測されたためである。更に、フォワード側に制限酵素BglIIで認識される配列(四角枠内)を付加し(AT Cytb Bgl2_F、AO Cytb Bgl2_F)、リバース側にXhoI又はNcoIで認識される配列(四角枠内)を付加した(AT Cytb Xho1_R、AO Cytb Nco1_R)。
【0133】
【表1】

【0134】
アスペルギルス・テレウスNIH2624株に対してはAT Cytb Bgl2_FとAT Cytb Xho1_Rの組み合わせ、アスペルギルス・オリゼRIB40株に対してはAO Cytb Bgl2_FとAO Cytb Nco1_Rの組み合わせでPCRを行い、それぞれの目的の遺伝子領域を増幅した。なお、PCRは、市販のポリメラーゼpfu ultra(STRATAGENE社製)を使用し、反応条件は〔94℃/2分→(94℃/30秒→55℃/30秒→72℃/1分)×30サイクル〕とした。
次いで、アスペルギルス・テレウスNIH2624株由来増幅遺伝子断片を制限酵素BglII及びXhoIで切断し、アスペルギルス・オリゼRIB40株由来増幅遺伝子断片を制限酵素BglII及びNcoIで切断し、同様にBglII及びXhoI又はBglII及びNcoIで各々制限酵素処理したカビでの発現用ベクターにライゲーションし、アスペルギルス・テレウスNIH2624株由来又はアスペルギルス・オリゼRIB40株由来の細胞外分泌型シトクロム発現用ベクターを各々構築した。なお、本ベクターは公知文献1(アスペルギルス属の異種遺伝子発現系、峰時俊貴、化学と生物、38、12、P831-838、2000)に記載してある、アスペルギルス・オリゼ由来のアミラーゼ系の改良プロモーターを使用し、目的遺伝子が発現可能なベクターを調製した。上記、細胞外分泌型シトクロム発現用ベクターを各々大腸菌JM109株に導入して形質転換した。illustra plasmidPrep Midi Flow Kit(GEヘルスケア・ジャパン社製)を用いて、各々得られた形質転換体のうち各々3クローンずつよりプラスミドを抽出し、インサートの配列解析をおこなったところ、全てのプラスミドで目的の遺伝子が確認できた。
5)アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム遺伝子の取得
しかしながら、取得したアスペルギルス・テレウスNIH2624株由来の遺伝子が公開配列(配列番号1)と比べて10塩基欠失していたため、欠失箇所を含む周辺275塩基を人工合成し、アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム遺伝子の該当箇所を置換した。作製した遺伝子断片は実施例1−4)記載の方法と同様にして、大腸菌にクローニングした後、遺伝子解析を行った結果、公開配列XM_001216771と同じ配列の遺伝子が取得できた。
なお、本発明により取得したアスペルギルス・テレウスNIH2624株及びアスペルギルス・オリゼRIB40株由来の細胞外分泌型シトクロムの遺伝子配列及びアミノ酸配列を配列番号1及び2、並びに、配列番号3及び4に夫々示す。
【実施例2】
【0135】
細胞外分泌型シトクロムの発現・精製
1)カビの形質転換と目的タンパク質の発現確認
実施例1−4)又は1−5)で調製した、アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム発現用ベクター又はアスペルギルス・オリゼRIB40株由来細胞外分泌型シトクロム発現用ベクターを用いて、公知文献1及び3(清酒用麹菌の遺伝子操作技術、五味勝也、醸協、P494−502、2000)に記載の方法に準じて、各細胞外分泌型シトクロムを生産する組み換えカビ(アスペルギルス・オリゼ)を各々作製した。なお、使用する宿主カビは公知文献2(BioSci. Biotech. Biochem., 61(8), 1367-1369, 1997)にあるように、1997年(平成9年)に醸造試験場で育種され、転写因子の解析、各種酵素の高生産株の育種等に利用され、分譲されているものが入手可能である。Czapek-Dox固体培地で各形質転換体を選択した後、実施例1−1)に記載の液体培地10mLを各々入れた太試験管(22mm×200mm)に、各形質転換体を植菌し、30℃で62時間振とう培養した。培養終了後、各培養液を遠心(3,000×g、20分)し、沈殿を取り除いたものを粗タンパク質サンプルとした。各粗タンパク質を15.0%ポリアクリルアミドゲルを使用しLaemmLiらの方法に従い、SDS−ポリアクリルアミドゲル電気泳動(SDS-PAGE)に掛けた。泳動後にクマシーブリリアントブルー(CBB)染色し、移動度を分子量マーカー(GEヘルスケア・ジャパン社製のLMW Marker)のそれと比較して各目的タンパク質の発現を確認したところ、いずれも分子量約30kDaの目的タンパク質の発現が確認された。
2)組換えカビの種培養
実施例1−1)に記載の坂口フラスコに実施例2−1)で作製した各組換えカビを接種し、30℃で62時間振とう培養したものを各種培養液とした。
3)本培養
パインデックス2%(松谷化学工業社製)(W/V)、トリプトン1%(BD社製)(W/V)、リン酸二水素カリウム0.5%(ナカライテスク社製)(W/V)、硫酸マグネシウム七水和物0.05%(W/V)(ナカライテスク社製)、消泡剤及び水からなる液体培地各3.5LをpH6.0に調製し、5L容の各ジャーファメンターに入れ、121℃、20分間オートクレーブした。冷却したこの液体培地に、実施例2−2)で調製した各培養液45mLを各々接種し、30℃で62時間、通気撹拌の条件で培養した。各培養液をろ過して得た培養上清を各粗タンパク質溶液として使用した。該粗タンパク質溶液から更に、以下4)‐6)により各細胞外分泌型シトクロムを単離精製した。
4)濃縮・脱塩
各粗タンパク質溶液を各々分画分子量10,000の限外ろ過膜「ペリコン2モジュール」(ミリポア社製)で濃縮し、20mMリン酸カリウム緩衝液(pH7.0)に置換して、各粗タンパク質濃縮液を調製した。
5)Butyl-TOYOPEAL650M(東ソー社製)による精製
上記各粗タンパク質濃縮液を、60% 飽和硫酸アンモニウム液(pH7.5)になるように各々調整後、遠心分離し得られた各上清を、60% 硫酸アンモニウムを含む20mM リン酸カリウム緩衝液(pH7.0)で平衡化したButyl-TOYOPEAL650Mカラムに各々通液して各目的タンパク質を吸着させ、同緩衝液で洗浄したのち、60%−30% の硫酸アンモニウム濃度でのグラジエント溶出法で各タンパク質を各々溶出させた。各目的画分については、350nm‐600nmのスペクトル解析を行い、シトクロムb562に特徴的な562nmにおける還元スペクトルが観察されたものについて各々回収した。
6)DEAE-セルロファインA-500(生化学工業社製)による精製
上記各回収画分を各々限外濾過膜「ペリコン2モジュール」で濃縮し、脱塩後5mM トリス・塩酸緩衝液(pH8.0)と平衡化させ、上記緩衝液で平衡化したDEAE-セルロファインA-500に各々吸着させ、同緩衝液で洗浄したのち、同緩衝液と0.2M NaClを含む同緩衝液でグラジエント溶出法で各タンパク質を各々溶出させて、目的画分を集めた。得られた各精製タンパク質を、15.0%ポリアクリルアミドゲルを使用しLaemmLiらの方法に従い、SDS-PAGEに掛けた。泳動後にCBB染色し、移動度を分子量マーカー(GEヘルスケア社製のLMW Marker)のそれと比較した結果、単一(分子量約30kDa)になっていることが確認できた。このように、アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム又はアスペルギルス・オリゼRIB40株由来細胞外分泌型シトクロムは、各形質転換体の培養上清から容易に回収でき、安定的に精製し、単離できた。更に、糸状菌であるアスペルギルス属に属する菌であるアスペルギルス・オリゼを宿主とした製造方法を確立したことによって、酵母を宿主とした製造方法に比べ、過剰な糖鎖付加のない組換え細胞外分泌型シトクロムを得ることができるようになった。
【0136】
更に、実施例2−6)で得られた、アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム(AtCytb)又はアスペルギルス・オリゼRIB40株由来細胞外分泌型シトクロム(AoCytb)は以下の物理化学的性質を有していた。
(1)グルコース酸化還元酵素から電子を受け取る機能及び/又は電子受容体に電子を受け渡す機能を共に有する。
(2)分子量:約30kDa(配列番号1又は配列番号3記載のポリヌクレオチドを導入した糸状菌による組換え細胞外分泌型シトクロムを、ポリアクリルアミドゲル電気泳動(SDS-PAGE)に供した際のサブユニット分子量である。)
なお、上記分子量については、本酵素には元来糖鎖が付加している為、培養条件又は精製条件により糖鎖の付き方が変われば分子量は異なり、形質転換細胞又はベクター系の種類等によっても糖鎖や付加するアミノ酸が変わり分子量は異なってくる。更に導入するポリヌクレオチドの種類によりアミノ酸配列長又は糖鎖の付き方が変われば分子量は異なる。
(3)赤色を呈している。
(4)還元型でシトクロムb562に特徴的な吸収スペクトル(427、531、562nm)を有する。
(5)可溶性蛋白質である。
【実施例3】
【0137】
グルコースに対する応答電流値測定
酵素電極は、グラッシーカーボン(直径6mm、電極表面の直径)の表面に、酵素と電子メディエータを固定化した構成とした。酵素電極は、使用する前に、1Mのリン酸カリウム緩衝液(pH7.0)に浸漬して平衡化しておいた。酵素としては、国際公開第2006/101239に記載のアスペルギルス・テレウス由来のグルコース脱水素酵素(AtGLD、2,000U/mg)並びに国際公開第2008/001903号記載のアスペルギルス・オリゼ由来のグルコース脱水素酵素(AoGLD、2,000U/mg)を使用し、電子メディエータとしては、実施例2で得られたAtCytb、AoCytb、馬心筋由来シトクロムC(HCytC)、大腸菌由来シトクロムb(EcCytb)、並びにフェリシアン化カリウムを使用して酵素電極を作成した。酵素電極においては、酵素の含有量を5U、電子メディエータの含有量を0.28×10−10molに相当する量とした((モル比)酵素:電子メディエータ=1:1)。
【0138】
応答特性は、濃度の異なる複数のグルコース溶液について、応答電流を測定した結果に基づいて検討した。応答電流値は、目的濃度に調整されたグルコース溶液を保持した反応槽に対して、酵素電極、参照電極及び対極を浸漬するとともに、酵素電極と対極との間に電圧を印加し、参照電極を基準電極として測定した。グルコース溶液は、グルコースを1Mのリン酸カリウム緩衝液(pH7.0)に溶解させることにより作成した。グルコース溶液の濃度は、0.1mM〜40mMに設定した。参照電極としてはAg/AgCl電極を用い、対極としてはPt電極を用いた。印加電圧値は+500mVとし、応答電流値の測定は、反応槽の温度を30℃に維持して行った。応答電流値の測定結果については、表2及び表3、並びに、図1及び図2に示した。
【0139】
【表2】

【0140】
【表3】

【0141】
これらの結果から分かるように、電子メディエータを使用しない酵素電極、又はHCytC、EcCytb若しくはフェリシアン化カリウムを用いた酵素電極では、グルコース濃度の増加に伴う応答電流値の増加量が非常に小さく、酵素と電極間で、適切な電子伝達が行われていないことが示された。これに対して、AoCytb又はAtCytbを用いた酵素電極では、グルコース濃度の増加に伴う応答電流値の増加量が大きく良好な応答特性が得られた。特に、AtGLDを用いた場合には高グルコース濃度領域、AoGLDを用いた場合には低グルコース濃度領域において、顕著な応答特性が得られた。このように、取得した細胞外分泌型シトクロムを電子メディエータとして用いた酵素電極では、金属錯体等の電子メディエータを用いることなく、グルコース酸化還元酵素のモル数と等モルの細胞外分泌型シトクロムを用いて電極法においてグルコース濃度40mMまでの測定を行うことができ、グルコース酸化還元酵素と親和性の高い、細胞外分泌型シトクロムから成る電子メディエータが得られた。
[測定法]:アンペロメトリー
[条件]:Init E=0.5V、Smpl Intvl=1、Run Time=1400sec、
[Buffer及び電解質濃度]:1M KPB+0.1M KCl
【実施例4】
【0142】
融合体遺伝子の取得
1)細胞外分泌型シトクロム遺伝子の取得
実施例1−4)で取得したアスペルギルス・テレウスNIH2624株由来増幅遺伝子断片をテンプレートA又はアスペルギルス・オリゼRIB40株由来増幅遺伝子断片をテンプレートBとして、下記反応条件でPCRを行った。PCRは、テンプレートAに対してはプライマー:AtC-Kpn-F及びAtC-Rを用いて行った結果、アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム(AtCytb)遺伝子断片を取得した。一方、テンプレートBに対してはプライマー:AoC-Kpn-F及びAoC-Rを用いて行った結果、アスペルギルス・オリゼRIB40株由来細胞外分泌型シトクロム(AoCytb)遺伝子断片を取得した。尚、フォワード側のプライマー:AtC-Kpn-Fは、ベクターと相同性のある相同配列及び制限酵素サイト(KpnI)をAtCytb遺伝子に付加するよう設計されたプライマーである。リバース側のプライマー:AtC-Rは、AtCytb遺伝子の開始コドンから726番目の塩基までを増幅するよう設計されたプライマーである。726番目の塩基までを増幅する理由は、AtCytbアミノ酸配列のC末端側に位置するフラビンドメインである56アミノ酸を削除し、酸化機能を有するサブユニットを融合させる為である。もう一方のフォワード側のプライマー:AoC-Kpn-Fは、ベクターと相同性のある相同配列及び制限酵素サイト(KpnI)をAoCytb遺伝子に付加するよう設計されたプライマーである。もう一方のリバース側のプライマー:AoC-Rは、AoCytb遺伝子の開始コドンから557番目の塩基までを増幅するよう設計されたプライマーである。557番目の塩基までを増幅する理由は、AoCytbアミノ酸配列のC末端側に位置する5アミノ酸を削除し、リンカー配列を融合させる為である。
プライマー:
AtC-Kpn-F(配列番号9)
5’-CGAATTCGAGCTCGGGTACCATGCGTTCCTTTCTC-3’
AtC-R(配列番号10)
5’-GTTGGAAACGGTTGCCGGGCACGCT-3’
AoC-Kpn-F(配列番号11)
5’-CGAATTCGAGCTCGGGTACCATGACATTAAGAAAC-3’
AoC-R(配列番号12)
5’-AGGAACTGCATCCTTCGCCAGAGCCCGCCACTTGTCATAGGAG-3’
反応条件: 変性94℃、2分(1サイクル)、 変性94℃、30秒、アニーリング55℃、30秒、伸長反応72℃、1分(30サイクル) 伸長72℃、10分(1サイクル)
2)グルコース脱水素酵素遺伝子の取得
実施例1−1)から実施例1−3)に記載の方法と同様に調製したアスペルギルス・テレウスFERM BP-08578株のcDNAライブラリーをテンプレートC又はアスペルギルス・オリゼNBRC5375株のcDNAライブラリーをテンプレートDとして、下記反応条件でPCRを行った。PCRは、テンプレートCに対してはプライマー:AtC-AtG-F及びAtG-Kpn-Rを用いて行った結果、アスペルギルス・テレウスFERM BP-08578株由来で基質酸化機能を有するグルコース脱水素酵素(AtGLD)遺伝子断片Eを取得した。また一方で、テンプレートCに対してプライマー:AtG-F及びAtG-Kpn-Rを用いてPCRを行った結果、アスペルギルス・テレウスFERM BP-08578株由来で基質酸化機能を有するグルコース脱水素酵素(AtGLD)遺伝子断片Fを取得した。更に、テンプレートDに対してはプライマー:AtC-AoG-F及びAoG-Kpn-Rを用いて行った結果、アスペルギルス・オリゼNBRC5375株由来で基質酸化機能を有するグルコース脱水素酵素(AoGLD)遺伝子断片Gを取得した。また一方で、テンプレートDに対してプライマー:AoG-F及びAoG-Kpn-Rを用いてPCRを行った結果、アスペルギルス・オリゼNBRC5375株由来で基質酸化機能を有するグルコース脱水素酵素(AoGLD)遺伝子断片Hを取得した。尚、AtGLD遺伝子増幅用のフォワード側のプライマー:AtC-AtG-Fは、AtCytb遺伝子と相同性のある相同配列をAtGLD遺伝子に付加し、更にAtGLD遺伝子の開始コドンから73番目の塩基から増幅するよう設計されたプライマーである。AtGLD遺伝子増幅用のリバース側のプライマー:AtG-Kpn-Rは、ベクターと相同性のある相同配列及び制限酵素サイト(KpnI)をAtGLD遺伝子に付加するよう設計されたプライマーである。73番目の塩基から増幅する理由は、72番目までの遺伝子部分が、アミノ酸配列のN末端側における立体構造においてゆらぎ部分にあたり、その部分を除去する為である。AtGLD遺伝子増幅用のもう一方のフォワード側のプライマー:AtG-Fは、AtGLD遺伝子の開始コドンから73番目の塩基から増幅するよう設計されたプライマーである。AoGLD遺伝子増幅用のフォワード側のプライマー:AtC-AoG-Fは、AtCytb遺伝子と相同性のある相同配列をAoGLD遺伝子に付加し、更にAoGLD遺伝子の開始コドンから76番目の塩基から増幅するよう設計されたプライマーである。AoGLD遺伝子増幅用のリバース側のプライマー:AoG-Kpn-Rは、ベクターと相同性のある相同配列及び制限酵素サイト(KpnI)をAoGLD遺伝子に付加するよう設計されたプライマーである。76番目の塩基から増幅する理由は、75番目までの遺伝子部分が、アミノ酸配列のN末端側における立体構造においてゆらぎ部分にあたり、その部分を除去する為である。AoGLD遺伝子増幅用のもう一方のフォワード側のプライマー:AoG-Fは、AoGLD遺伝子の開始コドンから76番目の塩基から増幅するよう設計されたプライマーである。
プライマー:
AtC-AtG-F(配列番号13)
5’-CCGGCAACCGTTTCCAACGCCAAATATGATTATATCGTTATTG-3’
AtG-Kpn-R(配列番号14)
5’-CTACAGATCCCCGGGGTACCCTAACGACGACCAGC-3’
AtG-F(配列番号15)
5’-GCCAAATATGATTATATCGTTATTGGAGGCGGTACTAGCGGTT-3’
AtC-AoG-F(配列番号16)
5’-CCGGCAACCGTTTCCAACACGACATACGACTACATCGTTGTGG-3’
AoG-Kpn-R(配列番号17)
5’-CTACAGATCCCCGGGGTACCCTAAGCACTCTTCGC-3’
AoG-F(配列番号18)
5’-ACGACATACGACTACATCGTTGTGGGAGGCGGCACAAGTGGTC-3’
反応条件: 変性94℃、2分(1サイクル)、 変性94℃、30秒、アニーリング55℃、30秒、伸長反応72℃、1分(30サイクル) 伸長72℃、10分(1サイクル)
3)リンカー配列遺伝子の取得
実施例1−3)で調製したアスペルギルス・テレウスNIH2624株のcDNAライブラリーをテンプレートとして、下記反応条件でPCRを行った。PCRは、プライマー:AoC-L-F及びL-AtG-Rを用いて行った結果、リンカー配列遺伝子断片Iを取得した。また一方で、プライマー:AoC-L-F及びL-AoG-Rを用いてPCRを行った結果、リンカー配列遺伝子断片Jを取得した。尚、フォワード側のプライマー:AoC-L-FはAoCytb遺伝子と相同性のある相同配列をリンカー遺伝子に付加するよう設計されたプライマーである。リバース側のプライマー:L-AtG-RはAtGLD遺伝子と相同性のある相同配列をリンカー配列遺伝子に付加するよう設計されたプライマーである。もう一方のリバース側のプライマー:L-AoG-RはAoGLD遺伝子と相同性のある相同配列をリンカー配列遺伝子に付加するよう設計されたプライマーである。
プライマー:
L-AoG-R(配列番号19)
5’-GATGTAGTCGTATGTCGTACCGTCAGGGACAGGAACAGGCTCG-3’
AoC-L-F(配列番号20)
5’-GCGAAGGATGCAGTTCCTGGAGACTGCTCCGGCGATGGCGGTG-3’
L-AtG-R(配列番号21)
5’-CAATAACGATATAATCATATTTGGCACCGTCAGGGACAGGAAC-3’
反応条件: 変性94℃、2分(1サイクル)、 変性94℃、30秒、アニーリング55℃、30秒、伸長反応72℃、1分(30サイクル) 伸長72℃、10分(1サイクル)
4)融合体遺伝子の大腸菌へのサブクローニング
実施例4−1)で取得したAtCytb遺伝子断片、実施例4−2)で取得したAtGLD遺伝子断片E及びベクターpUSAを制限酵素KpnIで処理し、In-Fusion(商標)Advantage PCR Cloning Kit(タカラバイオ社製)を用い、発現ベクターpTCTGを作成した。尚、ベクターpUSAは(独)酒類総合研究所より分譲いただいた。更に、実施例4−1)で取得したAoCytb遺伝子断片、実施例4−2)で取得したAtGLD遺伝子断片F及びベクターpUSAを制限酵素KpnIで処理し、実施例4−3)で取得したリンカー遺伝子断片Iと共に、In-Fusion(商標)Advantage PCR Cloning Kit(タカラバイオ社製)を用い、発現ベクターpOCTGを作成した。加えて、実施例4−1)で取得したAtCytb遺伝子断片、実施例4−2)で取得したAoGLD遺伝子断片G及びベクターpUSAを制限酵素KpnIで処理し、In-Fusion(商標)Advantage PCR Cloning Kit(タカラバイオ社製)を用い、発現ベクターpTCOGを作成した。その上、実施例4−1)で取得したAoCytb遺伝子断片、実施例4−2)で取得したAoGLD遺伝子断片F及びベクターpUSAを制限酵素KpnIで処理し、実施例4−3)で取得したリンカー遺伝子断片Jと共に、In-Fusion(商標)Advantage PCR Cloning Kit(タカラバイオ社製)を用い、発現ベクターpOCOGを作成した。発現ベクターpTCTG、pOCTG、pTCOG又はpOCOGを各々大腸菌JM109株に導入して形質転換した。illustra plasmidPrep Midi Flow Kit(GEヘルスケア・ジャパン社製)を用いて、各々得られた形質転換体のうち各々3クローンずつよりプラスミドを抽出し、インサートの配列解析をおこなったところ、全てのプラスミドで各々目的の遺伝子が確認できた。これにより、(1)AtCytb遺伝子及びAtGLD遺伝子、(2)AoCytb遺伝子、リンカー配列遺伝子及びAtGLD遺伝子、(3)AtCytb遺伝子及びAoGLD遺伝子、並びに、(4)AoCytb遺伝子、リンカー配列遺伝子及びAoGLD遺伝子を各々融合させた融合体遺伝子(配列番号22,24,26及び28)を含むベクターpTCTG、pOCTG、pTCOG及びpOCOGを取得できた。
【実施例5】
【0143】
融合体の発現・精製
1)カビの形質転換と融合体の発現確認
実施例4−4)で取得した、pTCTG、pOCTG、pTCOG又はpOCOGを用いて、公知文献1及び3(清酒用麹菌の遺伝子操作技術、五味勝也、醸協、P494−502、2000)に記載の方法に準じて、各融合体を生産する組み換えカビ(アスペルギルス・オリゼ)を各々作製した。尚、使用する宿主カビは公知文献2(BioSci. Biotech. Biochem., 61(8), 1367-1369, 1997)にあるように、1997年(平成9年)に醸造試験場で育種され、転写因子の解析、各種酵素の高生産株の育種などに利用され、分譲されているものが入手可能である。Czapek-Dox固体培地で各形質転換体を選択した後、実施例1−1)に記載の液体培地10mLを各々入れた太試験管(22mm×200mm)に、各形質転換体を植菌し、30℃で40時間振とう培養した。培養終了後、各培養液を遠心(3,000×g、20分)し、沈殿を取り除いたものを粗タンパク質サンプルとした。各粗タンパク質を15.0%ポリアクリルアミドゲルを使用しLaemmLiらの方法に従い、SDS-PAGEに掛けた。泳動後にCBB染色し、移動度を分子量マーカー(Bio Dynamics Laboratory Inc社製のDyna Marker Protein Recombinant)のそれと比較して各融合体の発現を確認したところ、可溶性のAtCytb及び基質特異性の高いAtGLDを融合させた融合体AtCytb-AtGLD(配列番号23)、可溶性のAoCytb及び基質特異性の高いAtGLDをリンカー配列で架橋し融合させた融合体AoCytb-AtGLD(配列番号25)、可溶性のAtCytb及び基質特異性の高いAoGLDを融合させた融合体AtCytb-AoGLD(配列番号27)、又は可溶性のAoCytb及び基質特異性の高いAoGLDをリンカー配列で架橋し融合させた融合体AoCytb-AoGLD(配列番号29)は、それぞれ124kDa、115kDa、124kDa又は115kDaの位置にバンドが染色され、各融合体の発現が確認された。更に、国際公開第2004/058958号記載の酵素活性測定法1により融合体のグルコース脱水素酵素活性を測定したところ、AtCytb-AtGLD、AoCytb-AtGLD、AtCytb-AoGLD又はAoCytb-AoGLDで、それぞれグルコース脱水素酵素活性を確認できた。
2)組換えカビの種培養
実施例1−1)に記載の坂口フラスコを2つ準備し、この坂口フラスコに実施例5−1)でpTCTG又はpOCTGを用いて作製した組換えカビ2種を各々接種し、30℃で62時間振とう培養したものを各種培養液とした。
3)本培養
パインデックス2%(松谷化学工業社製)(W/V)、トリプトン1%(BD社製)(W/V)、リン酸二水素カリウム0.5%(ナカライテスク社製)(W/V)、硫酸マグネシウム七水和物0.05%(W/V)(ナカライテスク社製)、消泡剤および水からなる液体培地各3.5LをpH6.0に調製し、5L容の各ジャーファメンターに入れ、121℃、20分間オートクレーブした。冷却したこの液体培地に、実施例5−2)で調製した各培養液45mLを各々接種し、30℃で62時間、通気撹拌の条件で培養した。各培養液をろ過して得た培養上清を各粗タンパク質溶液として使用した。該粗タンパク質溶液から更に、以下4)‐6)により各融合体を単離、精製した。
4)濃縮・脱塩
各粗タンパク質溶液に各々終濃度0.4mMになるようにペファブロック SC(ロシュ・ダイアグノスティックス社製)を添加し、各々分画分子量10,000の限外ろ過膜「ペリコン2モジュール」(ミリポア社製)で濃縮し、0.4mMペファブロック SCを含む50mMリン酸カリウム緩衝液(pH7.0)に置換して、各粗タンパク質濃縮液を調製した。
5)Butyl-TOYOPEAL650M(東ソー社製)による精製
前記各粗タンパク質濃縮液を、60%飽和硫酸アンモニウム液(pH7.0)になるように各々調整後、遠心分離し得られた各上清を、60%硫酸アンモニウムを含む50mMリン酸カリウム緩衝液(pH7.0)で平衡化したButyl-TOYOPEAL650Mカラムに各々通液して各目的タンパク質を吸着させ、同緩衝液で洗浄したのち、60%−0%の硫酸アンモニウム濃度でのグラジエント溶出法で各タンパク質を各々溶出させた。各目的画分については、グルコース脱水素酵素活性を有する画分を各々回収した。
6)DEAE-セルロファインA-500(生化学工業社製)による精製
前記各回収画分を各々限外濾過膜「ペリコン2モジュール」で濃縮し、脱塩後1mMリン酸カリウム緩衝液(pH7.0)と平衡化させ、前記緩衝液で平衡化したDEAE-セルロファインA-500に各々吸着させ、同緩衝液で洗浄したのち、同緩衝液と1mM−150mMのリン酸カリウム緩衝液濃度でのグラジエント溶出法で各タンパク質を各々溶出させて、目的画分を集めた。得られた各精製タンパク質を、15.0%ポリアクリルアミドゲルを使用しLaemmLiらの方法に従い、SDS-PAGEに掛けた。泳動後にCBB染色し、移動度を分子量マーカー(Bio Dynamics Laboratory Inc社製のDyna Marker Protein Recombinant)のそれと比較した結果、各々のタンパク質が単一(分子量約124kDa又は115kDa)になっていることが確認できた。これにより、可溶性のAtCytb及び基質特異性の高いAtGLDを融合させた融合体AtCytb-AtGLD、又は可溶性のAoCytb及び基質特異性の高いAtGLDをリンカー配列で架橋し融合させた融合体AoCytb-AtGLDを単離できた。即ち、電子メディエータ機能を有する可溶性の細胞外分泌型シトクロムと基質酸化機能を有し、かつ基質特異性が高いグルコース脱水素酵素とを融合させた融合体を取得し、分離・精製できた。
【0144】
更に、実施例5−6)で得られた、融合体AtCytb-AtGLD又はAoCytb-AtGLDは、以下の物理化学的性質を有していた。(1)フラビンアデニンジヌクレオチドに特徴的な吸収スペクトル(374nm及び460nm)並びに酸化型の細胞外分泌型シトクロムに特徴的な吸収スペクトル(419nm)を有しており、該融合体を含む溶液にグルコースを添加することで、374nm、460nm及び419nmのピークが消失すると共に、還元型細胞外シトクロムに特徴的な428nm、532nm及び562nmのピークがみられる。(2)グルコース脱水素酵素活性を有する。
【実施例6】
【0145】
融合体から電子メディエータへの電子供与能の測定
細胞外分泌型シトクロムをAtGLDに融合させた融合体であるAoCytb-AtGLDからシトクロムCへの電子供与能を測定するため、50mM MES緩衝液(pH6.0)、1.0mM D−グルコース、0.05mM シトクロムC及び1μM AoCytb-AtGLD又は1μM AtGLDから成る0.5mL反応液中でシトクロムCの550nmにおける吸光度(ΔABS)を測定した。1μM AoCytb-AtGLD又は1μM AtGLDを除く反応液を恒温セルホルダー付き分光光度計にセットして、30℃で5分間インキュベート後、終濃度が1μMになるようにAoCytb-AtGLD又はAtGLDを添加し、550nmにおける吸光度(ΔABS)を測定した。吸光度の測定結果について、図3に示した。吸光度は還元されたシトクロムCの増加に伴い上昇し、吸光度変化は酵素からシトクロムCへの電子供与能を表しており、グラフの傾きが大きい程、反応速度が速いことを意味する。
【0146】
図3に示した通り、AtGLDはシトクロムCが低濃度になる反応後半になると反応速度が落ちているが、融合体であるAoCytb-AtGLDは反応後半でも反応速度が落ちていない。このことから、AoCytb-AtGLDがシトクロムCに対して優れた電子供与能を有することが分かり、シトクロムCに対して高い親和性を有することが示された。
【実施例7】
【0147】
本実施例におけるセンサは前述のセンサの実施の形態に基づき作製した。導電層、電極の材料はパラジウムである。絶縁性の樹脂であるポリエチレンテレフタレート基板上に導電層を、スパッタリング蒸着により形成後、YAGレーザーを用いて導電層に非導電トラックを設けることで第1の電極(作用極)および第2の電極(対極)を形成した。このようにして得た作用極上にのみ、試薬液を円形に塗布し、室温で乾燥させることにより試薬層を形成した。前記試薬液は以下の組成であり、アスペルギルス・テレウス由来のフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素(4ユニット/0.6マイクロリットル)、アスペルギルス・テレウス由来の細胞外分泌型シトクロム(前記酵素と等モル濃度)、カルボキシメチルセルロース(0.25重量%)、およびリン酸カリウム緩衝剤(15mM、pH7.0)を含む。なお、前記酵素と前記シトクロムは実施の形態で記した融合体で存在している。滴下した試薬液の量は、1つのセンサにつき酵素が4ユニット含有される量とした。一方、対極上には銀塩化銀(Ag/AgCl)のペースト(BAS社製)を塗布し細い棒状の器具で対極全体を覆うよう塗り広げた。塗布したペーストは室温で乾燥させた。この基板上に、切り欠き部を有するスペーサ、更にカバーを貼り合わせることにより、試料溶液が供給されるキャビティを形成した。
上記のようにして作製したセンサの電流応答を、濃度の異なる複数のグルコース溶液を用いて測定した。グルコース溶液は、グルコースをリン酸緩衝生理食塩水(PBS)に溶解させることにより作製した。その濃度範囲は0〜150mg/dL(8.3mM)と正常よりやや高血糖濃度までに設定した。電流応答は、作用極に+350mVの電位を対極に対してポテンシオスタット(BAS社製、ALS−660B)を用いて印加ながら、グルコース溶液を前記キャビティに導入し、導入後の電流の経時変化を25℃で測定した。図7は導入したグルコース溶液の濃度に対する電流値の依存性である。図7にプロットした電流値は溶液導入後、2および5秒後の電流である。どちらの電流も共に、グルコース濃度の増加(約0.08〜8.3mM、1.56〜150mg/dL)に伴う応答電流値の増加が確認され、本センサ、および測定方法において、測定対象物であるグルコースの測定が可能であった。
【産業上の利用可能性】
【0148】
本発明の電子メディエータ及び融合体は、血糖値を測定するグルコースセンサ用又は電池用の電極等に有用である。本発明の測定法、電極、およびセンサは測定対象物の測定に有用である。
【符号の説明】
【0149】
1 センサ
2 基板
3 導電層
31 作用電極
32 対電極
33 検知電極
4 試薬層
5 スペーサ
51 導入口
52 キャピラリ
6 カバー
61 通気口
【技術分野】
【0001】
本発明は、酵素センサ及びバイオ電池等に用いられるグルコース酸化還元酵素用電子メディエータ等に関する。
【背景技術】
【0002】
電子メディエータは、電子伝達物質とも呼ばれ、これは電子供与体から電子を受け取る機能及び/又は電子受容体に電子を渡す機能を有する物質を意味し、酸化型か又は還元型の状態で存在することが知られている。該電子メディエータは、酵素活性の比色定量等に用いられる他、酵素電極で酵素から受け取った電子を電極に渡す役割をしている。
【0003】
酵素電極は、酵素を利用することにより、生体試料中に含まれる特定物質(標的となる物質)の含有量を測定する酵素センサ等に使用されている。既に様々な酵素センサが商品化されているが、例えば、血中グルコース濃度の測定に用いられるグルコースセンサ等が知られており、電極には、金電極、白金電極、カーボン電極等の電極表面上に酵素が固定化された酵素電極が用いられている。グルコースセンサでは、試料中のグルコースと酵素との反応によって生じる物質を電気化学的に検出し、定量している。
【0004】
酵素電極の使用例としては、グルコースやエタノールを基質として、酵素処理することで生じる電子を利用したバイオ電池が知られている。バイオ電池の例としては、体内埋め込み型の電池や、環境負荷の少ない電池等が近年着目されている。
【0005】
一般的に、酵素は電極表面で直接酸化還元されにくいため、生体試料中のグルコース濃度を測定するためには、酵素から電子を受け取り、電極に渡す役割を果たす電子メディエータが必要となる。
【0006】
電子メディエータとしては、蛋白質性の電子メディエータが開発されており、蛋白質性の電子メディエータを使用した電極としては、シトクロームC、シトクロームb562及びシトクロームc551等を用いた酵素電極(特許文献1)が知られている。更に、蛋白質性の電子メディエータであるComamonas testosteroni由来のキノヘモ蛋白質エタノールデヒドロゲナーゼのシトクロームCドメインをピロロキノリンキノングルコース脱水素酵素と融合させた融合蛋白質(特許文献2)等が開発されている。一方、ブルクホルデリア・セパシア由来のフラビンアデニンジヌクレオチド(FAD)依存型グルコース脱水素酵素を用いるグルコースセンサ(特許文献3及び4)が開発され、該ブルクホルデリア・セパシア由来酵素を含む酵素電極及びその製造方法に関する報告もなされている(特許文献5)。
【0007】
特許文献1に記載のシトクロームC及びシトクロームb562はいずれも細胞膜又はペリプラズム等細胞内に存在する電子伝達蛋白質である。この電子伝達蛋白質は、他の電子メディエータ非存在下で電極への電子授受を行う際、グルコース酸化還元酵素に対し、モル比で100倍の量が必要とされるため、グルコース脱水素酵素及びグルコース酸化酵素との親和性が極めて低いといえる。特許文献2に記載の融合蛋白質は、グルコース測定を行う場合に1000ユニットもの莫大な量を必要とする。加えて、該融合蛋白質によるグルコース測定は、測定可能なグルコース濃度範囲が5mM以下であるが、これは、一般的に血糖測定において求められるグルコース濃度の上限が20〜40mMであることと比較すると極めて狭いといえる。特許文献3、4及び5記載のセンサは、本来の野生型酵素が触媒活性サブユニットであるαサブユニット、電子伝達サブユニットであるβサブユニット、及びγサブユニットの3種のサブユニットからなる酵素を使用しており、αβγサブユニットの3量体又はαβサブユニットの2量体を固定化したセンサである。該酵素は、野生型として元々シトクロムCに相当する電子伝達サブユニット(βサブユニット)を有しているため、電極に直接電子移動することが可能な酵素である。しかし、βサブユニットは膜結合性シトクロムであり、該酵素はブルクホルデリア・セパシア由来の膜結合性酵素のため、該酵素のサブユニット又は該酵素を得るためには、可溶化の処理等、煩雑な処理が必要とされる。その上、可溶化処理をした物は不安定であり、乾燥させる等の取扱いを行うと該酵素又はそのサブユニット構造を維持することは難しい。加えて、日本生物工学会大会(2002年10月28日−30日)での発表によれば、該酵素は、対グルコース活性を100%とした場合の対マルトース活性及び対ガラクトース活性において、ブルクホルデリア・セパシアの各株で、SM4株が40%及び105%、JCM5506株が43%及び132%、JCM550株が57%及び123%、JCM2800株が83%及び108%、JCM2801株が74%及び117%、IFO14595株が38%及び104%、IFO15124株が74%及び148%と基質特異性が悪く、演者の発表によれば、マルトース及びガラクトースへの作用性が高いため、自己血糖測定器に使う場合には問題があるとのことであった。
特許文献3、4及び5においては、FAD依存型酵素および電極を用いたグルコースセンサが開示されているが、ここで、酵素は、電極と異なる粉末状の導体、あるいは炭素粒子に固定されている。また、第2の電極である対電極には白金等が用いられ、第2の電極は酸化還元性を有していない。更には酵素の電極への担持には高分子が用いられていない。
【0008】
その他のシトクロムとして、ファネロカエテ・クリソスポリウム由来の細胞外分泌型シトクロムb562が知られており、該シトクロムを酵母で生産させた組換えシトクロムについて、セルロースやキチンに吸着性があることが知られている(非特許文献1)。しかし、該シトクロムについてグルコース酸化還元酵素用メディエータとしての機能は知られていなかった。更に、該組換えシトクロムは酵母を宿主としているため、過剰に糖鎖が付加し分子量が大きいことから、モル当たりの固形分が多く、少量の血液で試薬を溶解させる必要があるセンサ用試薬には、より糖鎖付加が少なく分子量の小さい組換え蛋白質が求められていた。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開第02/073181号パンフレット
【特許文献2】国際公開第05/030807号パンフレット
【特許文献3】国際公開第05/023111号パンフレット
【特許文献4】国際公開第02/036779号パンフレット
【特許文献5】国際公開第09/037838号パンフレット
【非特許文献】
【0010】
【非特許文献1】Makoto Yoshida, Kiyohiko Igarashi, et al., Applied and Environmental Microbiology, 4548-4555(2000)
【発明の概要】
【発明が解決しようとする課題】
【0011】
上述のように、特許文献1、2、3、4及び5に記載されている電子伝達蛋白質又は融合蛋白質は、実用上、十分量といえるほどの応答電流値が得られていない。
【0012】
従って、本発明の目的は、上記の課題を解決し、酵素と親和性の高い蛋白質性の電子メディエータ及び基質に対する特異性の高い酵素と該電子メディエータとの融合体、更には、それらを含む組成物、それらを用いた基質の測定方法、基質に対するセンサ、並びにそれらを含むバイオ電池等を提供することである。
【課題を解決するための手段】
【0013】
本発明者は、従来用いられてきた電子メディエータに代わり、実用上、十分量といえる応答電流値が得られる電子メディエータを自然界から広く探索した結果、可溶性の細胞外分泌型シトクロムがグルコース酸化還元酵素の電子メディエータとして極めて優れた性能を発揮することを見出し、本発明を完成させた。
【0014】
即ち、本発明は以下の態様に係る。
[態様1]
細胞外分泌型シトクロムから成る、グルコース酸化還元酵素用電子メディエータ。
[態様2]
グルコース酸化還元酵素のモル数に対し100倍量未満のモル数でグルコース濃度測定が可能な態様1記載の電子メディエータ。
[態様3]
細胞外分泌型シトクロムが糸状菌に属する菌由来である、態様1記載の電子メディエータ。
[態様4]
糸状菌がアスペルギルス属の菌である、態様3記載の電子メディエータ。
[態様5]
アスペルギルス属の菌がアスペルギルス・テレウス又はアスペルギルス・オリゼである、態様4記載の電子メディエータ。
[態様6]
以下の(a)、(b)又は(c)のポリペプチドから成る、グルコース酸化還元酵素用電子メディエータ。
(a)配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチド
(b)配列番号2又は配列番号4のアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列から成り電子メディエータ機能を有するポリペプチド
(c)配列番号2又は配列番号4のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能を有するポリペプチド
[態様7]
以下の(a)、(b)、(c)、(d)、(e)又は(f)のポリヌクレオチド。
(a)配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチドをコードするポリヌクレオチド
(b)配列番号2又は配列番号4のアミノ酸配列において1個又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列から成り、電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド
(c)配列番号2又は配列番号4のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り、電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド
(d)配列番号1又は配列番号3に示される塩基配列を含み、かつ電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド
(e)(d)から成るポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドと、ストリンジェントな条件下でハイブリダイズし、かつ電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド
(f)(d)から成るポリヌクレオチドと70%以上の相同性を有する塩基配列を含み、かつ電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド
[態様8]
態様7記載の遺伝子を含む組換えベクター。
[態様9]
態様8記載の組換えベクターにより形質転換された形質転換体。
[態様10]
宿主が糸状菌である態様9記載の形質転換体。
[態様11]
細胞外分泌型シトクロムをコードする遺伝子を含む組換えベクターにより形質転換された形質転換体を、栄養培地にて培養し、細胞外分泌型シトクロムを採取することを特徴とする電子メディエータ機能を有する細胞外分泌型シトクロムの製造方法 。
[態様12]
態様11記載の製造方法により得られる細胞外分泌型シトクロム。
[態様13]
細胞外分泌型シトクロムとグルコース酸化還元酵素とを融合させた融合体。
[態様14]
他の電子メディエータ非存在下で、グルコースの測定範囲が5mMより大きい範囲であっても測定可能な態様13記載の融合体。
[態様15]
グルコース酸化還元酵素がグルコース脱水素酵素である態様13記載の融合体。
[態様16]
グルコース酸化還元酵素がグルコース酸化酵素である態様13記載の融合体。
[態様17]
単一分子内に電子メディエータ機能と基質の酸化機能との両機能を有した融合体であって、下記(a)、(b)及び(c)のうち、(a)及び(b)を有することを特徴とする融合体、又は(a)及び(b)を有し、かつ(a)と(b)の間に(c)を有することを特徴とする融合体。
(a)細胞外分泌型シトクロムのアミノ酸配列
(b)グルコース酸化還元酵素のアミノ酸配列
(c)(a)のアミノ酸配列と(b)のアミノ酸配列とを結合するリンカー配列
[態様18]
リンカー配列がGDCSGDGGGGSGPEPVPVPDGであることを特徴とする態様17記載の融合体。
[態様19]
以下の(a)、(b)又は(c)のポリペプチド。
(a)配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチド
(b)配列番号23、配列番号25、配列番号27又は配列番号29において、1個又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列から成り電子メディエータ機能及びグルコース酸化機能を有するポリペプチド
(c)配列番号23、配列番号25、配列番号27又は配列番号29のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能及びグルコース酸化機能を有するポリペプチド
[態様20]
態様13記載の融合体をコードする遺伝子。
[態様21]
態様20記載の遺伝子を含む組換えベクター。
[態様22]
態様21記載の組換えベクターにより形質転換された形質転換体。
[態様23]
態様22記載の形質転換体を栄養培地にて培養し、細胞外分泌型シトクロムとグルコース酸化還元酵素とを融合させた融合体を採取することを特徴とする、態様13記載の融合体の製造方法。
[態様24]
態様1記載の電子メディエータ及びグルコース酸化還元酵素、又は、態様13記載の融合体のいずれかを含むグルコース測定用組成物。
[態様25]
態様1記載の電子メディエータ及びグルコース酸化還元酵素、又は、態様13記載の融合体のいずれかを含むバイオ電池。
[態様26]
態様1から6のいずれか一項に記載の電子メディエータ、又は態様12に記載の細胞外分泌型シトクロムから成るグルコース酸化還元酵素用電子メディエータを用いた酵素活性の測定方法。
[態様27]
細胞外分泌型シトクロム、基質及び酵素を用いる、酵素の活性を測定する測定方法であって、
I) 前記酵素により前記基質を酸化する工程、
II) 前記工程Iにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
III)前記工程IIによって生じる前記細胞外分泌型シトクロムにおける変化を検出する工程、
IV) 前記工程IIIにおいて検出される前記細胞外分泌型シトクロムにおける単位時間当たりの変化の量を、前記酵素の活性と相関付ける工程、
を含む、測定方法。
[態様28]
細胞外分泌型シトクロム、基質、酵素及び電子受容体を用いる、酵素の活性を測定する測定方法であって、
I) 前記酵素により前記基質を酸化する工程、
II) 前記工程Iにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
III)前記工程IIによって生じる前記細胞外分泌型シトクロムにおける電子を前記電子受容体により受容する工程、
IV) 前記工程IIIによって生じる前記電子受容体における変化を検出する工程、
V) 前記工程IVにおいて検出される前記電子受容体における単位時間当たりの変化の量を、前記酵素の活性と相関付ける工程、
を含む、測定方法。
[態様29]
細胞外分泌型シトクロム、酵素、および電子受容体を用いる、測定対象物の測定方法であって、
A)前記酵素により前記測定対象物を酸化する工程、
B)前記工程Aにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
C)前記工程Bによって生じる前記細胞外分泌型シトクロムにおける電子を前記電子受容体により受容する工程、
D)前記工程Cによって生じる前記電子受容体における変化を検出する工程、
E)前記工程Dにおいて検出される前記電子受容体における変化の量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
[態様30]
測定において用いられる、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい、態様29に記載の測定方法。
[態様31]
前記細胞外分泌型シトクロムが糸状菌に属する菌由来である、態様29に記載の測定方法。
[態様32]
前記糸状菌がアスペルギルス属の菌である、態様31に記載の測定方法。
[態様33]
前記アスペルギルス属の菌がアスペルギルス・テレウス、またはアスペルギルス・オリゼである、態様32に記載の測定方法。
[態様34]
前記細胞外分泌型シトクロムが前記態様6に記載の電子メディエータである、態様29に記載の測定方法。
[態様35]
前記酵素が酸化還元酵素あるいは脱水素酵素である、態様29に記載の測定方法。
[態様36]
前記酵素がグルコースに作用する酵素である、態様29に記載の測定方法。
[態様37]
前記酵素がフラビンアデニンジヌクレオチド依存型である、態様29に記載の測定方法。
[態様38]
前記酵素がフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素である、態様29に記載の測定方法。
[態様39]
前記測定対象物がグルコースである、態様29に記載の測定方法。
[態様40]
前記電子受容体が電極である、態様29に記載の測定方法。
[態様41]
前記電子受容体が酸化還元化合物である、態様29に記載の測定方法。
[態様42]
前記工程Dにおける検出が電流、通電電荷量、あるいは分光学的量によってなされる、態様29に記載の測定方法。
[態様43]
前記工程Dにおいて検出される変化が一つ以上の酸化還元物質の反応を介して得られる、態様29に記載の測定方法。
[態様44]
測定可能な前記測定対象物の濃度が5mMよりも大きい、態様29に記載の測定方法。
[態様45]
前記細胞外分泌型シトクロムと前記酵素が融合している、態様29に記載の測定方法。
[態様46]
前記酵素が、グルコース脱水素酵素、あるいはグルコース酸化酵素である、態様45に記載の測定方法。
[態様47]
前記細胞外分泌型シトクロムと前記酵素の融合体が態様17に記載の融合体である、態様45に記載の測定方法。
[態様48]
前記細胞外分泌型シトクロムと前記酵素の融合体が態様19に記載のポリペプチドである、態様45に記載の測定方法。
[態様49]
細胞外分泌型シトクロム、酵素、第1の電極、および第2の電極を用いる、測定対象物の測定方法であって、
F)前記酵素により前記測定対象物を酸化する工程、
G)前記工程Fにおいて前記酵素内に生じる電子を、前記第1の電極に担持された前記細胞外分泌型シトクロムにより受容する工程、
H)前記工程Gによって生じる前記細胞外分泌型シトクロムにおける電子を前記第1の電極により受容する工程、
I)前記工程Hによって前記第1の電極と前記第2の電極との間に流れる電流あるいは通電電荷量を検出する工程、
J)前記工程Iにおいて検出される電流あるいは通電電荷量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
[態様50]
前記酵素が前記第1の電極に担持されている、態様49に記載の測定方法。
[態様51]
前記酵素と前記細胞外分泌型シトクロムが融合している、態様49に記載の測定方法。
[態様52]
前記酵素、前記細胞外分泌型シトクロム、あるいはそれらの融合体が高分子によって前記第1の電極に担持されている、態様49に記載の測定方法。
[態様53]
前記工程Hが前記第1の電極への電位の印加により誘起される、態様49に記載の測定方法。
[態様54]
前記第1の電極への電位の印加が前記第2の電極に対してなされる、態様53に記載の測定方法。
[態様55]
前記第2の電極が酸化還元性である、態様54に記載の測定方法。
[態様56]
前記第2の電極がAg/AgClである、態様55に記載の測定方法。
[態様57]
酸化還元性の第3の電極を更に用い、前記第1の電極への電位の印加が前記第3の電極に対してなされる、態様53に記載の測定方法。
[態様58]
前記第3の電極がAg/AgClである、態様57に記載の測定方法。
[態様59]
前記工程F、および前記工程Gが並行して実施される、態様49に記載の測定方法。
[態様60]
前記第1の電極への電位の印加が前記工程Fに先立って行われる、態様49に記載の測定方法。
[態様61]
細胞外分泌型シトクロム、および酵素を用いる、測定対象物の測定方法であって、
K)前記酵素により前記測定対象物を酸化する工程、
L)前記工程Kにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
M)前記工程Lによって生じる前記細胞外分泌型シトクロムの分光学的特性の変化を検出する工程、
N)前記工程Mにおいて検出される特性変化を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
[態様62]
測定対象物の濃度あるいは量を測定するための電極であって、細胞外分泌型シトクロムおよび酵素が担持された電極。
[態様63]
前記細胞外分泌型シトクロムおよび前記酵素が高分子によって担持された、態様62記載の電極。
[態様64]
前記細胞外分泌型シトクロムおよび前記酵素が融合している、態様62記載の電極。
[態様65]
前記電極がカーボン、金、白金、あるいはパラジウムのいずれかを含む、態様62記載の電極。
[態様66]
試料液中に含まれる測定対象物の測定をするためのセンサであって、
前記センサは、少なくとも、
i) 絶縁性の第1の基板、
ii) 前記第1の基板上に配置された第1および第2の電極、
iii)前記第1の電極の上に配置された試薬層、
iv) 前記第1の電極あるいは前記試薬層、および前記第2の電極と接する、試料液保持部から成り、前記試薬層は細胞外分泌型シトクロムを含み、前記試薬層あるいは前記試料液保持部のいずれかに酵素が配置された、センサ。
[態様67]
前記第1および第2の電極のいずれかが、カーボン、金、白金、あるいはパラジウムのいずれかを含む、態様66記載のセンサ。
[態様68]
前記第2の電極が、酸化還元性の電極である、態様66記載のセンサ。
[態様69]
前記第2の電極が、Ag/AgClである、態様68記載のセンサ。
[態様70]
前記試薬層が前記第1の電極上にのみ配置されている、態様66記載のセンサ。
[態様71]
前記細胞外分泌型シトクロムと前記酵素が融合している、態様66記載のセンサ。
[態様72]
測定において用いられる、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい、態様66に記載のセンサ。
[態様73]
前記細胞外分泌型シトクロムが、糸状菌に属する菌、アスペルギルス属の菌、アスペルギルス・テレウス、あるいはアスペルギルス・オリゼのいずれかに由来する、態様66に記載のセンサ。
[態様74]
前記細胞外分泌型シトクロムが前記態様6に記載の電子メディエータである、態様66に記載のセンサ。
[態様75]
前記細胞外分泌型シトクロムと前記酵素の融合体が態様17に記載の融合体である、態様71に記載のセンサ。
[態様76]
前記細胞外分泌型シトクロムと前記酵素の融合体が態様19に記載のポリペプチドである、態様71に記載のセンサ。
[態様77]
前記酵素が酸化還元酵素あるいは脱水素酵素である、態様66に記載のセンサ。
[態様78]
前記酵素がグルコースに作用する酵素である、態様66に記載のセンサ。
[態様79]
前記酵素がフラビンアデニンジヌクレオチド依存型である、態様66に記載のセンサ。
[態様80]
前記酵素がフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素である、態様66に記載のセンサ。
[態様81]
前記測定対象物がグルコースである、態様66に記載のセンサ。
[態様82]
態様66に記載のセンサであって、更にv)切欠部を有する第2の基板を含み、前記第2の基板が前記試料液保持部の少なくとも一部を形成しているセンサ。
[態様83]
前記切欠部の形状が矩形、あるいはU字型である、態様82に記載のセンサ。
[態様84]
態様82に記載のセンサであって、更にvi)第3の基板を含み、前記第3の基板が前記試料液保持部の少なくとも一部を形成しているセンサ。
[態様85]
測定可能な前記測定対象物の濃度が5mMよりも大きい、態様66に記載のセンサ。
【発明の効果】
【0015】
本発明の可溶性細胞外分泌型シトクロムをグルコース酸化還元酵素用に使用することによって、酵素と親和性の高い電子メディエータが得られ、電極への直接の電子伝達が可能になった。更に、細胞外分泌型シトクロムは、可溶性蛋白質の為、回収が容易であり、かつ精製途中に不溶化せず安定性が高い等、従来のグルコース酸化還元酵素用電子メディエータとして知られていた膜結合性シトクロムに無い優れた性質を有している。その上、細胞外分泌型シトクロムは、グルコース酸化還元酵素に対する親和性が高いため、電子メディエータとしてグルコース測定に使用する場合の該シトクロム使用量を抑えることが可能になった。
【図面の簡単な説明】
【0016】
【図1】本発明の細胞外分泌型シトクロムを用いた酵素電極による、グルコースに対する応答電流値測定の結果を示すグラフである。
【図2】本発明の細胞外分泌型シトクロムを用いた酵素電極による、グルコースに対する応答電流値測定の結果を示すグラフである。
【図3】本発明の融合体について、シトクロムCに対する電子供与能の測定の結果を示すグラフである。上の曲線がAoCytb-AtGLDを示し、下の曲線がAtGLDを示す。
【図4】本発明の一実施形態であるセンサの概略を示す分解斜視図である。
【図5】測定システムの概略構成を示す斜視図である。
【図6】測定システムの概略構成を示すブロック図である。
【図7】本発明の一実施形態であるセンサを用いたときの、グルコース濃度と応答電流の関係を示すグラフである。
【発明を実施するための形態】
【0017】
本発明は、細胞外分泌型シトクロムをグルコース酸化還元酵素等の酵素用電子メディエータとして使用することを特徴とする。
【0018】
今回、本発明者等は、細胞外分泌型シトクロムが、グルコース酸化還元酵素用の電子メディエータとして極めて優れた機能を発揮することを見出した。本発明の細胞外分泌型シトクロムは生物が生産する蛋白質性の天然物質である為に安全性にも優れている。
【0019】
本発明に係るグルコース酸化還元酵素は、グルコースと電子受容体の酸化還元反応を触媒する酵素である。該グルコース酸化還元酵素は、グルコース酸化酵素又はグルコース脱水素酵素であれば良く、好ましくは、グルコースに対する作用性を100%としたときにマルトース及びガラクトースに対する夫々の作用性が多くとも10%であるグルコース酸化還元酵素が良く、より好ましくはグルコースに対する作用性を100%としたときにマルトース及びガラクトースに対する夫々の作用性が多くとも8%であるグルコース酸化還元酵素が良く、更に好ましくは夫々の作用性が多くとも5%であるグルコース酸化還元酵素が良い。使用できる該グルコース酸化還元酵素の例としては、フラビンアデニンジヌクレオチドを補酵素とするグルコース酸化酵素、ニコチンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素又はフラビンアデニンジヌクレオチドを補酵素とする(フラビンアデニンジヌクレオチド依存型)グルコース脱水素酵素がある。
フラビンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素の場合、グルコースに対する作用性を100%としたときにマルトース及びガラクトースに対する夫々の作用性が10%以下であれば、その種類及び由来等に関する制限は特にないが、国際公開第2004/058958号、国際公開第2006/101239号及び国際公開第2008/001903号の各パンフレットに記載されているアスペルギルス属、ペニシリウム属若しくはガノデルマ属等の糸状菌に属する菌に由来するグルコース脱水素酵素、又はProc.Natl.Acad.Sci.USA Vol.80,pp.6286−6288(1983)に記載されているドロソフィラ属由来のグルコース脱水素酵素が好ましく、より好ましくは、国際公開第2004/058958号パンフレットに記載されているアスペルギルス・テレウスFERM BP−08578株又は国際公開第2008/001903号パンフレットに記載されているアスペルギルス・オリゼ株の様々な菌株(RIB40は除く)に由来するグルコース脱水素酵素が良い。このような糸状菌に属する菌に由来するフラビンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素では、グルコースの1位の水酸基を酸化する反応を触媒する理化学的性質、及びマルトースやガラクトースに対する作用性が低い等の性質が共通しており、同様の酵素活性を有している。
【0020】
更に、フラビンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素として、例えば、アミノ酸配列の一部の遺伝子工学的な改変によって、野生型グルコース脱水素酵素に対するキシロース作用性/グルコース作用性の低下、及び低温域での作用性向上又は安定性等の諸性質が改良されているような各種の改変型グルコース脱水素酵素を使用することができる。
【0021】
上記のアミノ酸配列の一部の遺伝子工学的な改変の例としては、アスペルギルス・テレウスFERM BP−08578株由来のグルコース脱水素酵素のアミノ酸配列において、D72A、G73D、G73A、G73S、G73C、G73Q、G73W、G73Y、G73E、G73H、R102H、Y228H、V356A、及びP527Lからなる群から選択されるアミノ酸置換を挙げることができる。
【0022】
本発明で使用するグルコース酸化還元酵素は、例えば、上記で引用された各特許文献の開示に基づき、当業者に公知の任意の方法で容易に調製・取得することができる。尚、本発明のグルコース酸化還元酵素には、N末端にシグナル配列又はその一部を含むもの、及び、N末端からシグナル配列が切断されたものも含まれる。
【0023】
本発明の細胞外分泌型シトクロムは、ヘム鉄を含有するヘムタンパク質の一種である。細胞外分泌型シトクロムとは、野生株が細胞外に可溶性蛋白質として分泌生産するシトクロムを意味し、具体的には該シトクロムを構成するアミノ酸配列のN末端にシグナル配列を有するシトクロムである。該シトクロムは細胞外に分泌されるシトクロムであれば特に限定されないが、シトクロムbが好ましく、特にシトクロムb562が好ましい。該シトクロムをコードする遺伝子を組み込んだグラム陰性菌による生産や該シトクロムをコードする遺伝子の内、シグナル配列部分を除去した遺伝子を組み込んだ組換え体により細胞内に生産されるようになった蛋白質も含む。尚、本発明の細胞外分泌型シトクロムには、N末端にシグナル配列又はその一部を含むもの、及び、N末端からシグナル配列が切断されたものも含まれる。
【0024】
上記の電子メディエータとして有用な細胞外分泌型シトクロムの例としては、糸状菌に属する菌に由来する細胞外分泌型シトクロムが挙げられる。細胞外分泌型シトクロムであれば、由来に関する制限は特にないが、非特許文献1のTable3に開示されている白色腐朽菌であるファネロカエテ属、マグナポルテ属又はジベレラ属の菌に由来する細胞外分泌型シトクロムを用いることができる。更に、非特許文献1のTable3に記載のExtracellular cytochrome遺伝子であるAccession no.AB193288、XM_382527若しくはXM_369170のポリヌクレオチドにコードされる(Accession no.BAD95668.1、XP_382527若しくはXP_369170のポリペプチドからなる)細胞外分泌型シトクロム、又は非特許文献1のTable3に記載のCDH(セロビオース脱水素酵素)のN末端に位置する電子伝達ヘム含有ドメインを使用することができる。細胞外分泌型シトクロムは、好ましくはカビに属する菌に由来する細胞外分泌型シトクロムが良く、より好ましくはアスペルギルス属の菌に由来する細胞外分泌型シトクロムが良く、特に好ましくは、アスペルギルス・テレウス又はアスペルギルス・オリゼに由来する細胞外分泌型シトクロムが良い。
【0025】
更に、本発明のグルコース酸化還元酵素用電子メディエータを構成するポリペプチドとして、以下のポリペプチド:
(a)配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチド、
(b)配列番号2又は配列番号4のアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入、付加されたアミノ酸配列から成り電子メディエータ機能を有するポリペプチド、又は
(c)配列番号2又は配列番号4のアミノ酸配列と70%以上、好ましくは75%以上、より好ましくは80%以上、更に好ましくは90%以上、特に好ましくは95%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能を有するポリペプチド、を挙げることができる。ここで、配列番号2及び配列番号4で示されるアミノ酸配列から成るポリペプチドは、夫々、アスペルギルス・テレウス及びアスペルギルス・オリゼの菌株に由来する細胞外分泌型シトクロムである。
【0026】
本発明のポリヌクレオチドは、以下のポリヌクレオチド:
(a)配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチドをコードするポリヌクレオチド、
(b)配列番号2又は配列番号4のアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入、付加されたアミノ酸配列から成り電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド、
(c)配列番号2又は配列番号4のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド、
(d)配列番号1又は配列番号3に示される塩基配列を含み、かつ電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド、
(e)塩基配列(d)から成るポリヌクレオチドと相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件下でハイブリダイズし、かつ、電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド、又は
(f)塩基配列(d)から成るポリヌクレオチドと70%以上、好ましくは75%以上、より好ましくは80%以上、更に好ましくは90%以上、特に好ましくは95%以上の相同性を有する塩基配列を含み、かつ電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチド、を挙げることができる。更に本発明のポリヌクレオチドはイントロンを含む配列であっても良い。加えて、上記ポリペプチドのシグナルペプチド部分をコードするポリヌクレオチドは、用いる宿主ベクター系により、それぞれ適切なものに一部又は全部を置換又は除去したポリヌクレオチドであっても良い。
【0027】
本発明において「電子メディエータ」とは、電子供与体から電子を受け取る機能及び/又は電子受容体に電子を渡す機能を有する物質を意味し、例えば、グルコース酸化還元酵素から電子を受け取り、電子を電極又は他の電子メディエータに供与する物質である。従って、配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチドから成るタンパク質から構成される細胞外分泌型シトクロムと実質的に同程度の「電子メディエータ」機能を有するポリペプチドも、グルコース酸化還元酵素用電子メディエータとして使用することができる。
【0028】
本発明において、アミノ酸配列又は塩基配列における相同性とは、比較対象となる基準配列の全長にわたり、所定の同一性を有する各配列をいう。このような配列の同一性パーセンテージは、基準配列を照会配列として比較するアルゴリズムをもった公開又は市販されているソフトウエアを用いて計算することができる。例として、BLAST、FASTA、又はGENETYX(ソフトウエア開発株式会社製)等を用いることができ、これらはデフォルトパラメーターで使用することができる。
【0029】
本発明において、ポリヌクレオチド間のハイブリダイズに際しての「ストリンジェントな条件下でハイブリダイズ」の具体的な条件とは、例えば、50%ホルムアミド、5×SSC(150mM塩化ナトリウム、15mMクエン酸三ナトリウム、10mMリン酸ナトリウム、1mMエチレンジアミン四酢酸、pH7.2)、5×デンハート(Denhardt’s)溶液、0.1%SDS、10%デキストラン硫酸及び100μg/mLの変性サケ精子DNAで42℃インキュベーションした後、フィルターを0.2×SSC中42℃で洗浄することを例示することができる。
【0030】
尚、本発明において、「ポリヌクレオチド」とは、プリン又はピリミジンが糖にβ‐N‐グリコシド結合したヌクレオシドのリン酸エステル(ATP(アデノシン三リン酸)、GTP(グアノシン三リン酸)、CTP(シチジン三リン酸)、UTP(ウリジン三リン酸);又はdATP(デオキシアデノシン三リン酸)、dGTP(デオキシグアノシン三リン酸)、dCTP(デオキシシチジン三リン酸)、dTTP(デオキシチミジン三リン酸))が100個以上結合した分子をいい、具体的にはグルコース酸化還元酵素をコードする染色体DNA、染色体DNAから転写されたmRNA、mRNAから合成されたcDNA及び、それらを鋳型としてPCR増幅したポリヌクレオチドを含む。「オリゴヌクレオチド」とはヌクレオチドが2‐99個連結した分子をいう。「ポリペプチド」とは、アミド結合(ペプチド結合)又は非天然の残基連結によって互いに結合した30個以上のアミノ酸残基から構成された分子を意味し、更には、これらに糖鎖が付加したものや、人工的に化学的修飾がなされたもの等も含む。
【0031】
本発明の細胞外分泌型シトクロム(ポリペプチド)及びそれをコードするポリヌクレオチドは、当業者に公知の任意の方法で容易に調製・取得することができる。例えば、アスペルギルス属、ファネロカエテ属、マグナポルテ属又はジベレラ属等の糸状菌に由来する細胞外分泌型シトクロム及びそれをコードするポリヌクレオチドは、本明細書の実施例に記載の遺伝子工学的方法に準じて調製することができる。ポリヌクレオチドの取得方法として、例えば、アスペルギルス・テレウスNIH2624若しくはアスペルギルス・オリゼRIB40のcDNAライブラリーを鋳型とし、配列番号5及び6のプライマーセット若しくは配列番号7及び8のプライマーセットを用いたPCR法によって、又はアスペルギルス・テレウスNIH2624若しくはアスペルギルス・オリゼRIB40から抽出した全RNA若しくはmRNAを鋳型とするRT−PCR法によって、いずれの方法によっても目的の細胞外分泌型シトクロム遺伝子を得ることができる。更に、非特許文献1のTable3に記載のExtracellular cytochrome遺伝子であるAccession no.AB193288、XM_382527若しくはXM_369170の既知配列、又は非特許文献1のTable3に記載のCDH(セロビオース脱水素酵素)のN末端に位置する電子伝達ヘム含有ドメインをコードする既知配列から、センス鎖及びアンチセンス鎖からなる1対のプライマーセットを作成し、上記方法と同様の方法により目的の細胞外分泌型シトクロムをコードするポリヌクレオチドを得ることができる。加えて、次の細胞外分泌型シトクロムをコードするポリヌクレオチドを取得できる。即ち、細胞外分泌型シトクロムを構成するポリペプチドが、アミノ酸配列のN末端にシグナル配列を含み、N末端のMetから54番目から110番目のいずれかの位置にヘムリガンドである「Gly−Xaa−Met」(Xaaは任意のアミノ酸)を含み、かつ該配列のMetから9アミノ酸を挟んでProを含む。更にN末端のMetから101番目から160番目のいずれかの位置に「Asn−Xaa−Thr」(Xaaは任意のアミノ酸)を含み、かつ該配列のThrから7アミノ酸を挟んで、S−S結合ドメインである「Cys−Xaa−Xaa−Cys」(Xaaは任意のアミノ酸)を含む。その上、N末端配列のMetから158番目から214番目の位置に、ヘムリガンドである「His」を含む。該ポリペプチドをコードするポリヌクレオチドは、既知配列から、センス鎖及びアンチセンス鎖からなる1対のプライマーセットを作成し、上記方法と同様の方法により目的の細胞外分泌型シトクロムをコードするポリヌクレオチドを得ることができる。
尚、プライマーを設計する場合には、プライマーのサイズ(塩基数)は鋳型DNAとの間の特異的なアニーリングを満足させることを考慮し、15-60塩基、望ましくは20-50塩基である。センス鎖(5’末端側)とアンチセンス鎖(3’末端側)からなる一組あるいは一対(2本)のプライマーが互いにアニールしないよう、両プライマー間の相補的配列を避けるようにする。更に、鋳型DNAとの安定な結合を確保するためにはGC含量が約50%程度であり、プライマー内においてGC-richあるいはAT-richが偏在しないようにすることが望ましい。アニーリング温度はTm値(melting temperature)に依存するので、特異性の高いPCR産物を得るため、Tm値が55-65℃で互いに近似したプライマーを選定する。加えて、PCRにおけるプライマー使用の最終濃度が約0.1から約1μMになるよう調製する等を留意することも必要である。プライマー設計には、プライマー設計用の市販のソフトウエア、例えばOligoTM [National Bioscience Inc.(米国)製]、GENETYX(ソフトウエア開発社製)等を用いることもできる。
【0032】
なお、上記のオリゴヌクレオチドプライマーセットは、例えば上記cDNAを適当な制限酵素で切断して作成することもでき、あるいは文献(例えばCarruthers(1982)Cold Spring Harbor Symp. Quant. Biol. 47:411−418; Adams(1983)J. Am. Chem. Soc. 105:661; Belousov(1997)Nucleic Acid Res. 25:3440−3444; Frenkel(1995)Free Radic. Biol. Med. 19:373−380; Blommers(1994)Biochemistry 33:7886−7896; Narang(1979)Meth. Enzymol. 68:90; Brown(1979)Meth. Enzymol. 68:109; Beaucage(1981)Tetra. Lett. 22:1859; 米国特許第4,458,066号)に記載されているような周知の化学合成技術により、in vitroにおいて合成することができる。
【0033】
本発明の組換えベクターは、クローニングベクター又は発現ベクターであり、インサートとしてのポリヌクレオチドの種類や、その使用目的等に応じて適宜必要なベクターを使用する。
【0034】
本発明の形質転換細胞(形質転換体)は、例えば、細胞外分泌型シトクロムやその類似蛋白質を大量製造する場合には、大腸菌、枯草菌等の原核細胞や、酵母、カビ、糸状菌、昆虫細胞又は哺乳動物細胞等の真核細胞等を使用することができ、糖鎖の要、不要又はその他のペプチド修飾の必要性に応じて、適宜選択することができる。形質転換細胞は特に限定されないが、糸状菌が好ましく、更にアスペルギルス属が好ましく、特にアスペルギルス・オリゼが好ましい。これらの形質転換細胞は、電気穿孔法、リン酸カルシウム法、リポソーム法、DEAEデキストラン法等公知の方法によって組換えベクターを細胞に導入することによって調製することができる。組換えベクター及び形質転換細胞の具体例として、下記実施例に示した組換えベクターと、組換えカビが挙げられる。
【0035】
細胞外分泌型シトクロムは、上記の細胞外分泌型シトクロムポリヌクレオチドを用いた組換えDNA技術によって取得できる。例えば上記のポリヌクレオチドを有するベクターからin vitro転写によってRNAを調製し、これを鋳型としてin vitro翻訳を行うことによりin vitroで細胞外分泌型シトクロムを作成することができる。更に、非特許文献1のTable3に記載のExtracellular cytochrome遺伝子であるAccession no.AB193288、XM_382527若しくはXM_369170のポリヌクレオチド、又は非特許文献1のTable3に記載のCDH(セロビオース脱水素酵素)のN末端に位置する電子伝達ヘム含有ドメインをコードするポリヌクレオチドを用いたDNA技術によっても同様に取得できる。 細胞外分泌型シトクロムをin vitro発現させて生産させる場合には、上記のポリヌクレオチドを、RNAポリメラーゼが結合できるプロモーターを有するベクターに挿入して組換えベクターを作成し、このベクターを、プロモーターに対応するRNAポリメラーゼを含むウサギ網状赤血球溶解物や小麦胚芽抽出物等のin vitro翻訳系に添加すれば、細胞外分泌型シトクロムをin vitroで生産することができる。RNAポリメラーゼが結合できるプロモーターとしては、T3、T7、SP6等が例示できる。これらのプロモーターを含むベクターとしては、pKA1、pCDM8、pT3/T718、pT7/319、pBluescriptII等が例示できる。
【0036】
細胞外分泌型シトクロムを大腸菌等の微生物でDNAを発現させて生産させる場合には、微生物中で複製可能なオリジン、プロモーター、リボソーム結合部位、DNAクローニング部位及びターミネーター配列等を有する発現ベクターに上記のポリヌクレオチドを組換えた発現ベクターを作成し、この発現ベクターで宿主細胞を形質転換したのち、得られた形質転換体を適当な培地(例えば、栄養培地)で培養すれば、細胞外分泌型シトクロムを微生物内で大量生産することができる。この際、任意の翻訳領域の前後に開始コドンと停止コドンを付加して発現させれば、任意の領域を含む細胞外分泌型シトクロム断片を得ることもできる。あるいは、他の蛋白質との融合蛋白質として発現させることもできる。この融合蛋白質を適当なプロテアーゼで切断することによっても目的とする細胞外分泌型シトクロムを取得することができる。大腸菌用発現ベクターとしては、pUC系、pBluescriptII、pET発現システム、pGEX発現システム又はpCold発現システム等が例示できる。
【0037】
細胞外分泌型シトクロムを、真核細胞で発現させて生産させる場合には、上記ポリヌクレオチドを、プロモーター、スプライシング領域及びポリ(A)付加部位等を有する真核細胞用発現ベクターに挿入して組換えベクターを作成し、真核細胞内に導入して形質転換体を作製し、この形質転換体を適当な培地(例えば、栄養培地)で培養すれば、細胞外分泌型シトクロムを真核細胞で生産することができる。更に、非特許文献1のTable3に記載のExtracellular cytochrome遺伝子であるAccession no.AB193288、XM_382527若しくはXM_369170のポリヌクレオチド、又は非特許文献1のTable3に記載のCDH(セロビオース脱水素酵素)のN末端に位置する電子伝達ヘム含有ドメインをコードするポリヌクレオチドを用いて、同様に細胞外分泌型シトクロムを真核細胞で生産することができる。組換えベクターは、プラスミドのような状態で細胞内に維持することもできるし、染色体中に組みこませて維持することもできる。発現ベクターとしては、pKA1、pCDM8、pSVK3、pSVL、pBK−CMV、pBK−RSV、EBVベクター、pRS、pYE82又はpUSA等が例示できる。pIND/V5−His、pFLAG−CMV−2、pEGFP−N1又はpEGFP−C1等を発現ベクターとして用いれば、Hisタグ、FLAGタグ又はGFP等各種タグを付加した融合蛋白質として細胞外分泌型シトクロムポリペプチドを発現させることもできる。真核細胞としては、サル腎臓細胞COS−7、チャイニーズハムスター卵巣細胞CHO等の哺乳動物培養細胞、出芽酵母、分裂酵母、カビ、糸状菌、カイコ細胞、アフリカツメガエル卵細胞等が一般に用いられるが、細胞外分泌型シトクロムを発現できるものであれば、いかなる真核細胞でも良いが、特に好ましくはヘムbを生産できる細胞である。ヘムb生産能を持たない細胞の場合には、上記細胞外分泌型シトクロムを生産させる場合と同様に、ヘムbの生産に必要な遺伝子を細胞内に導入すれば良い。特に、アスペルギルス属の菌が好ましく、アスペルギルス・オリゼが最も好ましい。発現ベクターを真核細胞に導入するには、電気穿孔法、リン酸カルシウム法、リポソーム法、DEAEデキストラン法等公知の方法を用いることができる。
【0038】
細胞外分泌型シトクロムを原核細胞や真核細胞で発現させた後、培養物(菌体、もしくは菌体外に分泌された酵素を含む培養液、培地組成物等)から目的蛋白質を単離精製するためには、公知の分離操作を組み合わせて行うことができる。例えば、尿素等の変性剤や界面活性剤による処理、熱処理、pH処理、超音波処理、酵素消化、塩析や溶媒沈殿法、透析、遠心分離、限外濾過、ゲル濾過、SDS−PAGE、等電点電気泳動、イオン交換クロマトグラフィー、疎水性クロマトグラフィー、逆相クロマトグラフィー、アフィニティークロマトグラフィー(タグ配列を利用した方法及びUKC1に特異的なポリクローナル抗体、モノクローナル抗体を用いる方法も含む)、等が挙げられる。
【0039】
細胞外分泌型シトクロムは、例えば配列番号2若しくは配列番号4のアミノ酸配列又はその類似配列に基づいて、公知のペプチド合成法(Merrifield, R.B. J. Solid phase peptide synthesis I. The synthesis of tetrapeptide. J. Amer. Chem. Soc. 85, 2149−2154, 1963; Fmoc Solid Phase Peptide Synthesis. A Practical Approach. Chan, W.C. and White, P.D., Oxford University Press, 2000)によって作成することができる。更に、これらのペプチドは天然のアミド結合以外の残基連結からなるものであっても良い。天然のアミド結合以外の残基連結は、例えばグルタルアルデヒド、N−ヒドロキシスクシンイミドエステル、2官能マレイミド、N,N’−ジシクロヘキシルカルボジイミド(DCC)、又はN,N’−ジイソプロピルカルボジイミド(DIC)等の化学結合又はカップリング手段を例示することができる。ペプチド結合の代替となり得る連結基は、例えばケトメチレン(例えば、−C(=O)−CH2−に対する−C(=O)−NH−)、アミノメチレン(CH2−NH)、エチレン、オレフィン(CH=CH)、エーテル(CH2−O)、チオエーテル(CH2−S)、テトラゾール(CN4−)、チアゾール、レトロアミド、チオアミド、又はエステルを含む(例えば、Spatola (1983) in Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, Vol. 7, pp 267−357, “Peptide Backbone Modifications,” Marcell Dekker, NYを参照)。
【0040】
以上の通りの方法によって作成された本発明の細胞外分泌型シトクロムの代表的な特性として以下のものを挙げることが出来る。
(1)グルコース酸化還元酵素から電子を受け取る機能及び/又は電子受容体に電子を受け渡す機能を共に有する。
(2)分子量:約30kDa(配列番号1又は配列番号3記載のポリヌクレオチドを導入した糸状菌による組換え細胞外分泌型シトクロムを、ポリアクリルアミドゲル電気泳動(SDS−PAGE)に供した際のサブユニット分子量である。)
なお、上記分子量については、本酵素には元来糖鎖が付加している為、培養条件又は精製条件により糖鎖の付き方が変われば分子量は異なり、形質転換細胞又はベクター系の種類等によっても糖鎖や付加するアミノ酸が変わり分子量は異なってくる。更に導入するポリヌクレオチドの種類によりアミノ酸配列長又は糖鎖の付き方が変われば分子量は異なる。
(3)赤色を呈している。
(4)還元型で427nm、531nm及び562nmに特徴的な吸収スペクトルを有する。
(5)シトクロムb562である。
(6)可溶性蛋白質である。 更に、本発明の細胞外分泌型シトクロムから成る電子メディエータは、グルコース酸化還元酵素との親和性が高く、グルコース酸化還元酵素のモル数に対し好ましくは100倍量未満、より好ましくは50倍量未満、更に好ましくは20倍量未満、特に好ましくは10倍量未満のモル数で使用可能な電子メディエータである。
【0041】
本発明は更に、上記の細胞外分泌型シトクロムと上記のグルコース酸化還元酵素を人工的に融合させた融合体を提供するものである。融合体は、単一分子内に電子メディエータ機能とグルコース酸化機能との両機能を有した融合体であって、下記(a)、(b)及び(c)のうち、アミノ酸配列のN末端側に(a)及びC末端側に(b)を有することを特徴とする融合体、N末端側に(a)及びC末端側に(b)を有し、かつ(a)と(b)の間に(c)を有することを特徴とする融合体、アミノ酸配列のC末端側に(a)及びN末端側に(b)を有することを特徴とする融合体、又はC末端側に(a)及びN末端側に(b)を有し、かつ(a)と(b)の間に(c)を有することを特徴とする融合体を挙げることができる:
(a)細胞外分泌型シトクロムのアミノ酸配列;
(b)グルコース酸化還元酵素のアミノ酸配列;及び、
(c)(a)のアミノ酸配列と(b)のアミノ酸配列とを結合するリンカー配列。
尚、細胞外分泌型シトクロムのアミノ酸配列は、電子メディエータ機能を有するポリペプチドを構成するアミノ酸配列であれば、例えば、融合体ポリペプチドのN末端側に該ポリペプチドを有する場合、ポリペプチドのC末端側のアミノ酸配列部分(例えば、数個〜数十個のアミノ酸)を適宜削除したアミノ酸配列でも良い。更に、細胞外分泌型シトクロムのアミノ酸配列を融合体ポリペプチドのC末端側に有する場合、該細胞外分泌型シトクロムの全アミノ酸配列からシグナル配列の一部又は全部を含むアミノ酸配列部分を適宜削除した配列を用いることができる。一方、グルコース酸化還元酵素のアミノ酸配列は、グルコース酸化機能を有するポリペプチドを構成するアミノ酸配列であれば、ポリペプチドのN末端側のアミノ酸配列部分(例えば、数個〜数十個のアミノ酸)を適宜削除したアミノ酸配列でも良い。特に、グルコース酸化還元酵素のアミノ酸配列を融合体ポリペプチドのC末端側に有する場合、該グルコース酸化還元酵素の全アミノ酸配列からシグナル配列の一部又は全部を含むアミノ酸配列部分を適宜削除した配列を用いることができる。シグナル配列部分は、例えばSignalPを用いて、予測することができる。
【0042】
本発明の融合体を構成するポリペプチドとして、以下のポリペプチド:
(a)配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチド、
(b)配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチドにおいて、1個又は数個のアミノ酸が置換、欠失、挿入、付加されたアミノ酸配列から成り電子メディエータ機能を有するポリペプチド、又は
(c)配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチドと70%以上、好ましくは75%以上、より好ましくは80%以上、更に好ましくは90%以上、特に好ましくは95%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能を有するポリペプチド、を挙げることができる。ここで、配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチドは、細胞外分泌型シトクロム及びグルコース脱水素酵素を融合させたポリペプチドであり、配列番号25及び配列番号29で示されるアミノ酸配列から成るポリペプチドは細胞外分泌型シトクロムとグルコース脱水素酵素の間にペプチドリンカーを含んでいる。
【0043】
上記の細胞外分泌型シトクロムをコードする塩基配列を有する遺伝子と上記のグルコース酸化還元酵素をコードする塩基配列を有する遺伝子を通常の遺伝子操作方法により連結し、単一の遺伝子とし、細胞外分泌型シトクロムの有する電子メディエータ機能及びグルコース酸化還元酵素の有するグルコース酸化機能を同一分子内に有する融合体をコードする融合体遺伝子を構築する。
【0044】
細胞外分泌型シトクロムをコードする塩基配列を有する遺伝子は、例えば段落番号0026に記載のポリヌクレオチドが使用でき、更に段落番号0031に記載の方法で取得したポリヌクレオチドも使用できる。該ポリヌクレオチドは、全長を使用することができ、又は電子メディエータ機能を有するポリペプチドをコードするポリヌクレオチドであれば、ポリペプチドのC末端側又はN末端側のアミノ酸部分をコードする塩基配列を適宜削除したポリヌクレオチドでも良い。
【0045】
グルコース酸化還元酵素をコードする塩基配列を有する遺伝子は、例えば段落番号0019に記載のグルコース酸化還元酵素をコードする塩基配列であって、当業者に公知の遺伝子を使用できる。例えば、グルコース酸化酵素をコードする配列はアスペルギルス・ニガーから通常の方法で取得でき、ニコチンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素をコードする配列はバチルス・メガテリウムから通常の方法で取得でき、又はフラビンアデニンジヌクレオチドを補酵素とするグルコース脱水素酵素をコードする配列はアスペルギルス・テレウス若しくはアスペルギルス・オリゼ(RIB40株を除く)のようなアスペルギルス属、ペニシリウム属若しくはドロソフィラ属から通常の方法で取得できる。該遺伝子からなるポリヌクレオチドは、グルコース酸化機能を有するポリペプチドをコードするポリヌクレオチドであれば、ポリペプチドのN末端側のシグナル配列部分の一部又は全部を含むアミノ酸配列をコードする塩基配列を削除したポリヌクレオチドが使用できる。シグナル配列部分は、例えばSignalPを用いて、予測することができる。
【0046】
細胞外分泌型シトクロムをコードする塩基配列を有する遺伝子とグルコース酸化還元酵素をコードする塩基配列を有する遺伝子は、通常の遺伝子操作方法により連結でき、遺伝子の連結に関して制限は特に無いが、例えば2つの遺伝子の間にリンカー配列をコードする塩基配列を挿入して連結しても良い。リンカー配列は通常のリンカー配列であれば良く、例えばアスペルギルス・テレウス由来のセロビオース脱水素酵素のリンカー配列が挙げられる。具体的には、アミノ酸配列がGDCSGDGGGGSGPEPVPVPDGからなるリンカー配列が例示でき、該アミノ酸配列をコードする塩基配列を介して2つの遺伝子を連結することができる。
【0047】
本発明の融合体は、上記融合体遺伝子を使用し、又はペプチド合成法により、例えば段落番号0033から0039に記載の細胞外分泌型シトクロムの製造方法と同様の方法で製造することができる。
該製造方法によって製造された本発明の融合体は、細胞外分泌型シトクロムに特徴的な吸収スペクトルを有し、グルコース酸化還元酵素から電子を受け取る機能及び/又は電子受容体に電子を受け渡す機能並びにグルコース酸化還元酵素活性を有する。更に、本発明の融合体は、電子伝達能が優れているために、1回の測定系において、グルコース酸化還元酵素活性値で、好ましくは0.05〜400ユニット、より好ましくは0.1〜200ユニット、更に好ましくは0.2〜100ユニットという少ない使用量で測定対象物を有意に測定することができる、という特長を有する。
【0048】
更に本発明は、上記の細胞外分泌型シトクロムから成る電子メディエータ及びグルコース酸化還元酵素、又は融合体を含む、グルコース測定用組成物に関する。該組成物は、液状、凍結状、又は凍結乾燥等による固体状等の任意の形態をとり得る。該組成物中に於ける細胞外分泌型シトクロムから成る電子メディエータ及びグルコース酸化還元酵素の含有量は、目的又は形態等に応じて当業者が適宜選択することができるが、通常、夫々、0.01〜1,000μg/mL及び0.01〜1,000μg/mL程度である。該組成物中に於ける細胞外分泌型シトクロムから成る電子メディエータとグルコース酸化還元酵素との比率は、グルコース酸化還元酵素のモル数に対し、電子メディエータのモル数が好ましくは100倍量未満、より好ましくは50倍量未満、更に好ましくは20倍量未満、特に好ましくは10倍量未満である。一方、該組成物中に於ける融合体の含有量は、目的又は形態等に応じて当業者が適宜選択することができるが、通常、0.01〜1,000μg/mLである。融合体の含有量に関して特に制限はないが、1回の測定系に使用する量は、グルコース酸化還元酵素活性値で、0.05〜400ユニットが好ましく、より好ましくは0.1〜200ユニット、更に好ましくは0.2〜100ユニットである。更に、本発明の融合体は、フェリシアン化カリウム等の他の電子メディエータ非存在下で、基質とするグルコースの測定範囲が5mM又は10mMより大きい範囲であっても測定可能な融合体である。該組成物には牛血清アルブミン(BSA)若しくは卵白アルブミン、グルコース酸化還元酵素と作用性のない糖類若しくは糖アルコール類、カルボキシル基含有化合物、アルカリ土類金属化合物、アンモニウム塩、硫酸塩又は蛋白質等から成る群より選ばれる熱安定化剤、又は緩衝剤等の当業者に公知の他の任意成分を適宜含有させ、該電子メディエータ及びグルコース酸化還元酵素又は融合体を安定化させることができる。
【0049】
本発明は、上記の電子メディエータ又は融合体の酵素電極への使用に関する。酵素電極は、当業者に公知の任意の方法によって、上記の電子メディエータ及びグルコース脱水素酵素等のグルコース酸化還元酵素又は上記の融合体を表面上に固定することによって容易に作製することができる。
該酵素電極は、グルコースセンサ等のバイオセンサ及びバイオ電池等の広範囲な用途に使用することができる。
【0050】
本発明の電子メディエータ又は融合体を含む酵素電極を使用したグルコースセンサは、試料液中のグルコース濃度を測定するセンサである。かかるグルコースセンサは当業者に公知の、任意の方法で作製することできる。例えば、適当な絶縁性基板上にスクリーン印刷等の方法を利用して作用極、その対極及び参照極からなる電極系を形成し、この電極系上に上記の電子メディエータ及びグルコース酸化還元酵素又は上記の融合体を含む酵素反応層を形成することによって作製される。このバイオセンサの酵素反応層上に基質を含む試料液を滴下すると、酵素反応層が溶解して酵素と基質が反応し、これにともなって電子メディエータが還元される。酵素反応終了後、還元された電子メディエータを電気化学的に酸化させ、このとき、このバイオセンサは、得られる酸化電流値から試料液中の基質濃度を測定することが可能である。この他に、発色強度あるいはpH変化等を検知する方式のバイオセンサも構築可能である。
【0051】
更に本発明は、上記の電子メディエータ及びグルコース酸化還元酵素、又は融合体を含むバイオ電池に関する。本発明のバイオ電池は、酸化反応を行うアノード極及び還元反応を行うカソード極から構成され、必要に応じてアノードとカソードを隔離する電解質層を含んで構成される。上記の電子メディエータ及びグルコース酸化還元酵素又は上記の融合体を含む酵素電極をアノード電極に使用し、基質を酸化することによって生じた電子を電極に取り出すと共に、プロトンを発生させる。一方、カソード側には、一般的にカソード電極に使用される酵素を使用すれば良く、例えばラッカーゼ、アスコルビン酸オキシダーゼ又はビリルビンオキシダーゼを使用し、アノード側で発生させたプロトンを酸素と反応させることによって水を生成させる。電極としては、カーボン、金、白金等、一般的にバイオ電池に使用される電極を用いることができる。
【0052】
更に本発明は、上記の電子メディエータを用いた酵素の活性測定に関する。酵素の活性測定において、酵素、基質及び本発明の電子メディエータを用い、該電子メディエータの電子受容状態を、例えば吸光度又は吸光スペクトル等の分光学的特性の検出によって知ることができ、酵素活性の測定を行うことができる。これには市販の分光測定装置を用いれば良い。又は、酵素の活性測定において、酵素、基質及び本発明の電子メディエータに加え、フェリシアン化カリウム、フェナジンメトスルフェート、ジクロロフェノールインドフェノール又はシトクロムC等、細胞外分泌型シトクロム以外の一つ又は一つ以上の電子メディエータを用い、該電子メディエータの電子受容状態を、例えば吸光度又は吸光スペクトル等の分光学的特性の検出によって知ることができ、酵素活性の測定を行うことができる。
【0053】
尚、本発明を実施するために使用する様々な技術は、特にその出典を明示した技術を除いては、公知の文献等に基づいて当業者であれば容易かつ確実に実施可能である。例えば、遺伝子工学及び分子生物学的技術はSambrook and Maniatis, in Molecular Cloning-A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, 1989; Ausubel, F. M. et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, N.Y, 1995等に記載の方法あるいはそこで引用された文献記載の方法又はそれらと実質的に同様な方法や改変法に基づき実施可能である。更に、この発明における用語は基本的にはIUPAC-IUB Commission on Biochemical Nomenclatureによるものであり、あるいは当該分野において慣用的に使用される用語の意味に基づくものである。尚、本明細書において、特に断りがない限り、グルコース等の単糖類はD‐体を意味するが、本発明を限定するものではない。
【0054】
本発明の一つの態様は、細胞外分泌型シトクロム、酵素、および電子受容体を用いる、測定対象物の測定方法であって、
A)前記酵素により前記測定対象物を酸化する工程、
B)前記工程Aにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
C)前記工程Bによって生じる前記細胞外分泌型シトクロムにおける電子を前記電子受容体により受容する工程、
D)前記工程Cによって生じる前記電子受容体における変化を検出する工程、
E)前記工程Dにおいて検出される前記電子受容体における変化の量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法、である。このようにすると、細胞外分泌型シトクロムと酵素の間の親和性が良いため、測定対象物の測定を高感度に行うことができる。また、細胞外分泌型シトクロムは水溶性が高いため、特に水溶性の測定対象物を含む水溶液、例えば、血液、血漿、血清、尿などの生体試料を用いる場合に、本発明は特に好適である。細胞外分泌型シトクロム、酵素、および電子受容体を生体試料に溶解させて用いることができる。本発明は、酵素、および細胞外分泌型シトクロムを介して伝達された測定対象物由来の電子を効率よく電子受容体へと蓄積させ、電子受容体の変化によって測定対象物の量または濃度を得る方法である。
【0055】
前記細胞外分泌型シトクロムとしては、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい量を測定に用いることができる。また、前記細胞外分泌型シトクロムが糸状菌に属する菌、アスペルギルス属の菌、アスペルギルス・テレウス、あるいはアスペルギルス・オリゼのいずれか由来であるものを用いることができる。更には、前記細胞外分泌型シトクロムとして前記態様6に記載の電子メディエータを用いることができる。前述した細胞外分泌型シトクロムの特長を反映する測定対象物の測定方法を提供することができる。
【0056】
前記酵素としては、酸化還元酵素あるいは脱水素酵素を用いることができる。これらの酵素は測定対象物である基質から電子を受容するため、この受容した電子を前記細胞外分泌型シトクロムへと伝達することが可能である。医学的、および臨床学的に意義のある測定対象物に対する酸化還元酵素あるいは脱水素酵素を用いることが好ましい。酵素の例として、グルコース酸化酵素、グルコース脱水素酵素、乳酸酸化酵素、乳酸脱水素酵素、コレステロール酸化酵素、コレステロール脱水素酵素などを挙げることができる。中でも、前記酵素がグルコースに作用する酵素であることがより好ましい。生体液、特に血液および尿に含まれるグルコースの濃度は糖尿病の診断、経過観察、あるいは発見において重要な指標となる。この場合、測定対象物としてグルコースを用いることができる。また、前記酵素としてはフラビンアデニンジヌクレオチド依存型のものを用いることができ、これらは細胞外シトクロムとの親和性が高く、測定対象物である基質に対する特異性が高いため、測定対象物の測定を高感度かつ選択的に実施することが可能である。したがって、特に、前記酵素がフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素を用いることが好適である。
【0057】
上記発明の態様において、前記電子受容体として電極を用いることが可能である。このようにすると、電子受容体における変化を電極への電子の流れとして捉えることができるため、測定がより簡便になる。電極への電子の流れは、電流、あるいは通電電荷量を市販の電流計、あるいはクーロンメータなど用いて検出することが可能である。電極としては、金、白金、パラジウム、カーボンなどを含むものを用いることができ、これら化学的に安定な材料を含むことが、安定な測定の実施において好ましい。また、後述の実施例において述べるとおり、電極以外の導体あるいはカーボンの粉末は必ずしも必要ではない。これは、本発明における細胞外分泌型シトクロムが、電極をはじめとする電子受容体への電子伝達能に優れているためと推察される。
【0058】
また、前記電子受容体としては酸化還元化合物を用いることができる。該化合物の分光学的特性あるいは量が酸化体と還元体とで異なれば、該化合物の電子受容状態を、例えば吸光度、あるいは吸光スペクトルなどの分光学的特性の検出によって知ることができ、測定対象物の測定を行うことができる。これには市販の分光測定装置を用いればよい。そのような測定は、例えば以下のように実行される。酵素および細胞分泌型シトクロム、酸化還元化合物を含む光透過性のセルに、液体試料を添加する。セルとしては、例えば、ガラスやポリスチレン製の市販の光学測定用セルを用いることができる。市販の分光光度計を用いて、セルに光を照射し、透過する光を検出する。照射する光、および検出する光の波長としては、酸化還元化合物の酸化および還元に伴い、吸光度が大きく変化する波長を適宜選択することが好ましい。これにより、液体試料に含まれる酸化還元化合物の酸化にともなう、細胞外分泌型シトクロムの酸化体の減少、又は還元体の増加を、光によって検出することができる。なお、細胞外分泌型シトクロムの酸化体の減少、又は還元体の増加は、細胞外分泌型シトクロムそのものの分光学的特性の変化を観測することによっても実現可能であり、測定対象物の測定も可能である。酸化型の細胞外分泌型シトクロムは419nmに吸収ピークを持つが、これが還元型になると427nmへシフトし、加えて531および562nmに吸収ピークを呈するようになる。
あるいは、別途電極を用いて、該化合物を酸化し、電極への電子の流れを、電流、あるいは通電電荷量として市販の電流計、あるいはクーロンメータなど用いて検出してもよい。電極としては、金、白金、パラジウム、カーボンなどを含むものを用いることができる。電子受容体としては、フェリシアン化物イオン、フェロセン誘導体などの金属錯体、フェナジニウム誘導体、キノン誘導体などの有機化合物を用いることができる。
【0059】
前記工程Dにおいて検出される変化を、一つ以上の酸化還元物質の反応を介して得ることも可能である。例えば電子受容体に伝達された電子を、該酸化還元物質へと更に伝達し、該酸化還元物質の変化として間接的に変化を見ることができる。例えば、前記電子受容体としてフェナジンメトスルフェート、前記酸化還元物質としてジクロロフェノールインドフェノールを用い、ジクロロフェノールインドフェノールの分光特性の変化を検出する方法が挙げられる。本態様は、電子受容体よりも酸化還元物質の特性変化がより大きい、あるいは検出分解能が高い場合により好ましい。
【0060】
測定可能な前記測定対象物の濃度が5mMよりも大きいことが好ましく、このような態様は酵素と細胞外分泌型シトクロムとの間の親和性に加え、細胞外分泌型シトクロムと電子受容体との間の親和性および電子伝達能の高い、本発明の細胞外分泌型シトクロムによって実現される。他の好ましい濃度範囲は、測定可能な前記測定対象物の濃度が5〜10mM、5〜20mM、5〜30mM、あるいは5〜40mMである。例えば、測定対象が血中のグルコースの場合、健常人は5mM程度であるが、糖尿病患者においては、上記上限濃度に達することもある。糖尿病患者のみを対象とする場合、測定可能な前記測定対象物の濃度は10mMより大きくても良い。例えば、10〜20mM、10〜30mM、あるいは10〜40mMである。他の態様として好ましい範囲は、0.08mM(=約1.5mg/dL)よりも大きい範囲である。より具体的には、0.08〜8mM、0.08〜10mM、0.08〜20mM、0.08〜30mM、あるいは0.08〜40mMである。糖尿病患者においては、インスリンの投与により自己の血糖値を下げることがあるが、その際、過剰投与により低血糖値を示す場合がある。この場合、健康に傷害をきたす恐れがあるため、低い濃度を測定する必要がある際には、本態様が更に好ましいことになる。以上のような態様は酵素と細胞外分泌型シトクロムとの間の親和性に加え、細胞外分泌型シトクロムと電子受容体との間の親和性および電子伝達能の高い、本発明の細胞外分泌型シトクロムによって実現される。
【0061】
前記細胞外分泌型シトクロムと前記酵素は融合していても良い。融合の方法は本明細書の他の部分に記述する通りである。例えば、前記細胞外分泌型シトクロムと前記酵素の融合体には、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい量のものを測定において用いることができる。また、前記細胞外分泌型シトクロムが糸状菌に属する菌、アスペルギルス属の菌、アスペルギルス・テレウス、あるいはアスペルギルス・オリゼのいずれか由来であるものを用いることができる。更には、前記細胞外分泌型シトクロムが前記態様6に記載の電子メディエータを用いることができる。このようにすると、前述した細胞外分泌型シトクロムの特長を反映する測定対象物の測定方法を提供することができる。融合体を用いることにより、測定対象物の測定方法に用いる材料が、操作上減少するため、より方法が簡素化される。合わせて、融合化による電子伝達効率の向上、それによる、より高感度な測定が期待される。
【0062】
本発明の一態様は、細胞外分泌型シトクロム、酵素、第1の電極、および第2の電極を用いる、測定対象物の測定方法であって、
F)前記酵素により前記測定対象物を酸化する工程、
G)前記工程Fにおいて前記酵素内に生じる電子を、前記第1の電極に担持された前記細胞外分泌型シトクロムにより受容する工程、
H)前記工程Gによって生じる前記細胞外分泌型シトクロムにおける電子を前記第1の電極により受容する工程、
I)前記工程Hによって前記第1の電極と前記第2の電極との間に流れる電流あるいは通電電荷量を検出する工程、
J)前記工程Iにおいて検出される電流あるいは通電電荷量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法である。このようにすると、測定対象物由来の電子を酵素の触媒反応、細胞外分泌型シトクロムによる電子伝達反応を介して、電極によって電気化学的に簡便かつ精度よく検出することができる。本態様は酵素と細胞外分泌型シトクロムとの間の親和性に加え、細胞外分泌型シトクロムと電子受容体との間の親和性および電子伝達能の高い、本発明の細胞外分泌型シトクロムによって実現される。前記第1の電極、および前記第2の電極としては、カーボン、金、白金、あるいはパラジウムのいずれかを含むものを用いることができる。細胞外分泌型シトクロム、および酵素は前述のものを用いることができる。
【0063】
前記酵素は前記第1の電極に担持されていてもよい。このようにすると、反応の場が検出に用いる第1の電極上に限定される上、用いる酵素の量が液に溶解するよりも少なくなるため、酵素をより効率的に利用することができる。また、前記酵素と前記細胞外分泌型シトクロムが融合していてもよい。本融合体には前述のものを用いることができる。
【0064】
また、前記酵素、前記細胞外分泌型シトクロム、あるいはそれらの融合体が高分子によって前記第1の電極に担持されていることが好ましい。このようにすると、測定対象物の測定に必要な要素がほぼ一体化され、測定が簡便になる。更には、高分子による担持により、電流あるいは通電電荷量の出力が大きくなる。これは、高分子による担持で高密度に細胞外分泌型シトクロムが集積・配向し、電極細胞外分泌型シトクロムの電極への電子伝達効率が向上するためと考えられる。用いる高分子としては例えば、カルボキシメチルセルロースを用いることができる。
【0065】
前記工程Hは前記第1の電極への電位の印加により誘起することができる。例えば、市販のポテンシオスタットの電位制御端子を前記第1の電極に、電位基準端子と補助電極端子前記第2の電極に接続し、所定の電位を該ポテンシオスタットにより印加することにより、前記第1の電極の電位を前記第2の電極に対して印加することができる。このとき、前記第1の電極に流れる電流と同じ電流が前記第2の電極に流れる。このような場合、前記第2の電極が酸化還元性であることが好ましい。このようにすると、前記第2の電極に流れる電流が前記第2の電極の酸化還元反応に基づくものとなるため、未知の測定試料において発生する前記第2の電極での未知の反応が起こらない。前記第2の電極での未知の反応は、測定対象物の測定において予測し得ない誤差要因となるため、本形態により誤差要因を排除した測定対象物の測定が実施できる。上記のような酸化還元性の電極の例はAg/AgClである。Ag/AgClは、酸化されるとAg→Ag+Cl−、還元されるとAgCl→Agの反応がそれぞれ進行する酸化還元性の電極である。
酸化還元性の第3の電極を更に用い、前記第1の電極への電位の印加が前記第3の電極に対してなされてもよい。例えば、市販のポテンシオスタットの電位制御端子を前記第1の電極に、補助電極端子を前記第2の電極に、電位基準端子を前記第3の電極にそれぞれ接続し、所定の電位を該ポテンシオスタットにより印加することにより、前記第1の電極の電位を前記第3の電極に対して印加することができる。このとき、前記第3の電極は酸化還元性であるので、該電極の酸化および還元反応が平衡状態を保っている。そのため、第3の電極の電位はほぼ一定している。よって、第3の電極に対して印加された第1の電極の電位もほぼ一定するため、測定対象物の測定がより安定になる。前記第3の電極の例としてAg/AgClを挙げることができる。
【0066】
前記工程F、および前記工程Gは並行して行うことができる。測定対象物、酵素、および細胞外分泌型シトクロムを同時に接触させればよい。このようにすると工程に要する時間が短縮されるため、測定対象物の測定が迅速に行える。また、前記第1の電極への電位の印加が前記工程Fに先立って行われてもよい。前述したような電位印加の方法を用いて前記第1の電極へ電位を印加してから、測定対象物、酵素、および細胞外分泌型シトクロムを前記第1の電極に接触させることにより実施可能である。このようにすると細胞外分泌型シトクロムが酵素より電子を受容するとすぐ前記第1の電極に電子が供与され、細胞外分泌型シトクロムは再び酵素より電子を受容できる形態となる。よって、細胞外分泌型シトクロムの第1の電極への電子伝達効率が向上し、測定対象物の感度よい測定が可能となる。
【0067】
また、本発明の他の一実施形態は、細胞外分泌型シトクロム、および酵素を用いる、測定対象物の測定方法であって、
K)前記酵素により前記測定対象物を酸化する工程、
L)前記工程Kにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
M)前記工程Lによって生じる前記細胞外分泌型シトクロムの分光学的特性の変化を検出する工程、
N)前記工程Mにおいて検出される特性変化を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法である。このようにすると、測定対象物の濃度に応じた細胞外分泌型シトクロムの酸化体の減少、又は還元体の増加を検出することができる。酸化型の細胞外分泌型シトクロムは419nmに吸収ピークを持つが、これが還元型になると427nmへシフトし、加えて531および562nmに吸収ピークを呈するようになる。このような変化は市販の分光光度計を用いて測定することが可能である。
【0068】
本発明の他の一実施形態は、測定対象物の濃度あるいは量を測定するための電極であって、細胞外分泌型シトクロムおよび酵素が担持された電極である。このようにすると、測定対象物の測定に用いる電極上に反応の場が限定される上、用いる酵素の量が液に溶解するよりも少なくなるため、酵素をより効率的に利用することができる。また、前記酵素と前記細胞外分泌型シトクロムが融合していてもよい。本融合体には前述のものを用いることができる。このようにすると、測定対象物の測定に必要な要素がほぼ一体化され、該電極を他の容易に入手できる第2の電極、更には第3の電極と組み合わせて簡便に測定が実施できる。細胞外分泌型シトクロムおよび酵素の担持には、高分子を用いることができる。これにより、電流あるいは通電電荷量の出力が大きくなる。これは、高分子による担持で高密度に細胞外分泌型シトクロムが集積・配向し、電極細胞外分泌型シトクロムの電極への電子伝達効率が向上するためと考えられる。用いる高分子としては例えば、カルボキシメチルセルロースを用いることができる。
【0069】
前記電極はカーボン、金、白金、あるいはパラジウムのいずれかを含むことが好ましい。これらの材料は化学的に安定であるため、測定対象物の測定が安定になる。例えば、カーボン、金、白金、あるいはパラジウムのいずれかを材料とする平板の電極に、細胞外分泌型シトクロムおよび酵素を含む高分子溶液を滴下・乾燥させることにより、電極を作成することができる。
【0070】
本発明の更なる他の一実施形態は、試料液中に含まれる測定対象物の測定をするためのセンサであって、
前記センサは、少なくとも、
i) 絶縁性の第1の基板、
ii) 前記第1の基板上に配置された第1および第2の電極、
iii)前記第1の電極の上に配置された試薬層、
iv) 前記第1の電極あるいは前記試薬層、および前記第2の電極と接する、試料液保持部から成り、前記試薬層は細胞外分泌型シトクロムを含み、前記試薬層あるいは前記試料液保持部のいずれかに酵素が配置された、センサである。
【0071】
本実施形態を図面を用いて以下に詳細に説明する。
【0072】
(センサの概略構成)
センサ1は、具体的には、基板2、導電層3、試薬層4、スペーサ5、カバー6を有する。図4に示すように、基板2は板状の部材である。基板2は絶縁性を有する。基板2を構成する材料としては、例えば、ポリエチレンテレフタレート、ビニルポリマ、ポリイミド、ポリエステル、及びスチレニクス等の樹脂;ガラス;並びにセラミックス等が挙げられる。
【0073】
基板2の寸法は、具体的な数値に限定されないが、例えば、基板2の幅は、好ましくは4〜20mm、より好ましくは5〜10mmに設定される。また、基板2の長さは、好ましくは20〜40mmに設定される。また、基板2の厚みは、好ましくは0.1〜1mmに設定される。基板2の幅、長さ、及び厚みが、全てこれらの範囲内にあることが、より好ましい。
【0074】
図4に示すように、導電層3は、基板2上に略均一な厚みに形成されている。導電層3は、3つの電極31〜33を含む。第1の電極である電極31は作用電極、第2の電極である電極32は対電極、電極33は検知電極と称されることがある。なお、検知電極33は省略可能である。
【0075】
電極31〜33のそれぞれの一部分は、キャピラリ51に面するように配置される。電極31〜33の他の一部分は、センサ1の導入口52とは逆の端部において、スペーサ5及びカバー6で覆われずに露出している。この露出部分は、リードとして機能し、測定器101から電圧の印加を受けたり、電流を測定器101に伝えたりする。
【0076】
各電極は、導電性材料を用いた印刷等により形成されてもよいし、基板2を導電性材料で覆った後、レーザアブレーション等で非導電トラックを形成することで形成されてもよい。例えば非限定的な例として、基板2にパラジウムをスパッタリングすることによって導電層3を形成し、レーザアブレーションにより、非導電トラックを形成することができる。非導電トラックは、好ましくは0.01〜0.5mm、より好ましくは0.05mm〜0.3mmの幅を有する
【0077】
なお、導電層3の構成材料は、導電性材料(導電性物質)であればよく、特に限定されるものではない。導電性材料の例としては、金属、金属混合物、合金、金属酸化物、及び金属化合物に代表される無機導電性物質等、炭化水素系導電性ポリマー及びヘテロ原子含有系導電性ポリマー等の有機導電性物質、又はこれらの物質の組み合わせが挙げられる。導電層3の構成材料としては、パラジウム、金、白金、炭素などが好ましく、パラジウムが特に好ましい。これらの材料は化学的に安定であるため、電極として安定に機能し、測定対象物の測定が安定になる。
【0078】
導電層3の厚さは、その形成方法及び構成材料により変更可能である。例えば、スパッタリングによって導電層3が形成された場合、導電層3の厚さは、好ましくは0.1〜20nm、より好ましくは1〜10nmである。印刷により導電層3が形成された場合、導電層3の厚さは、好ましくは0.1〜50μm、より好ましくは1〜30μmである。
【0079】
導電層3の電極32(第2の電極)に対応する部分に酸化還元性の物質を塗布し、これを電極32としてもよい。このようにすると、前記第2の電極に流れる電流が前記第2の電極の酸化還元反応に基づくものとなるため、未知の測定試料において発生する前記第2の電極での未知の反応が起こらない。前記第2の電極での未知の反応は、測定対象物の測定において予測し得ない誤差要因となるため、本形態により誤差要因を排除した測定対象物の測定が実施できる。上記のような酸化還元性の電極の例はAg/AgClである。Ag/AgClは、酸化されるとAg→Ag+Cl−、還元されるとAgCl→Agの反応がそれぞれ進行する酸化還元性の電極である。
【0080】
図4に示すように、試薬層4は、少なくとも電極31(第1の電極)に接するように配されている。また、試薬層4が電極31上のみに配置されている形態がより好ましい。このようにすると、測定対象物の反応の場が検出に用いる第1の電極上に限定され、酵素をより効率的に利用することができる。更には、第2の電極である電極32における還元反応を第1の電極とは独立させて行わせることができる。よって、上述したような酸化還元性の電極を第2の電極として供することがより容易になる。
【0081】
試薬層4は、電極31及び32と共に、センサ1の活性部として機能する。活性部とは、電気化学的に活性な領域であって、液体試料中の特定の物質に反応し、電気信号を生じる部分である。具体的には、試薬層4は、酵素および/または細胞外分泌型シトクロムを含む。
【0082】
試薬層4には、1種又は複数種の酵素が含まれる。試薬層4に含まれる酵素は、具体的には、測定対象物を基質とする酵素であり、特に測定対象物に特異的に反応する酵素であることが好ましい。酵素は、測定対象物の濃度、つまり測定対象物との反応量に応じて、細胞外分泌型シトクロムに電子を供与する。
【0083】
試薬層4に含まれる酵素としては、酸化還元酵素が特に好ましい。酸化還元酵素としては、具体的には、測定対象物を基質とする酸化酵素及び脱水素酵素が挙げられる。これらの酸化還元酵素の具体例としては、測定対象物がブドウ糖である場合は、グルコースオキシダーゼ、グルコースデヒドロゲナーゼが、測定対象物が乳酸である場合には、乳酸オキシダーゼ、又は乳酸デヒドロゲナーゼが、測定対象物がコレステロールである場合には、コレステロールエステラーゼ、又はコレステロールオキシダーゼが、測定対象物がアルコールである場合には、アルコールオキシダーゼが、測定対象物がビリルビンである場合にはビリルビンオキシダーゼが挙げられる。
【0084】
酵素は、その補酵素依存性について、特に限定されるものではない。例えば、試薬層4に含まれる酵素は、NAD(nicotinamide adenine dinucleotide)、NADP(nicotinamide adenine dinucleotide phosphate)、PQQ(Pyrroloquinoline quinone)、又はFAD(flavin adenine dinucleotide)等の補酵素に対して依存性を有する酵素であってもよい。
【0085】
酵素の補酵素は、FAD又はPQQであることが好ましい。これらの補酵素に対応する酵素において、補酵素は、その酵素タンパク質に結合するか、又は包含される。よって、センサの作製および測定方法の実施において、酵素とは別途に補酵素を添加する必要がない。その結果、センサの構成、製造工程、及び測定工程が簡素化される。
【0086】
NADおよびNADP依存性の酵素の場合は、酵素蛋白に結合しない状態で機能する補酵素NADおよびNADPを酵素と共に別途添加する必要がある。構成および工程はFADおよびPQQを補酵素とする酵素の場合と比較して複雑にはなるが、本願発明は実施可能である。
【0087】
例えば、酵素は、FAD依存性の酸化酵素、NAD依存性、PQQ依存性、又はFAD依存性の脱水素酵素等であってもよい。酸化酵素及び脱水素酵素の具体例は、上述したとおりである。
【0088】
試薬層4中の酵素は、前記細胞外分泌型シトクロムと融合していてもよく、本融合体には前述のものを用いることができる。また細胞外分泌型シトクロムは前述のものを用いることができる。
【0089】
試薬層4における酵素の含有量は、標的物質の検出が可能な程度に設定され、1回の測定当たり又はセンサ1個当たりにつき、好ましくは0.2〜20U(ユニット)、より好ましくは0.5〜10U程度に設定される。
【0090】
また、試薬層4には、酵素に合う補酵素が含まれていてもよい。
【0091】
試薬層4は、細胞外分泌型シトクロムを含む。細胞外分泌型シトクロムは、可逆的に酸化体及び還元体となることができ、直接または別の物質と協働して、物質間における電子の移動を媒介する。例えば、試薬層4に、基質を酸化する酵素が含まれる場合、酵素は、基質を酸化することで、基質からの電子を受け取り、補酵素に電子を与える。その結果、補酵素は、酸化体から還元体になる。酸化体の細胞外分泌型シトクロムは、還元体になった補酵素から電子を受け取って、補酵素を酸化体に戻す。その結果、細胞外分泌型シトクロム自身は還元体となる。還元体となった細胞外分泌型シトクロムは、電極31又は32に電子を与えて、自身は酸化体となる。このようにして、細胞外分泌型シトクロムは、酵素と電極間の電子移動を媒介する。
【0092】
上記補酵素は、酵素タンパク質(酵素分子)に結合することで、酵素タンパク質に保持されてもよい。また、補酵素は、酵素タンパク質とは別に、溶存してもよい。
【0093】
試薬層4は、酵素及び細胞外分泌型シトクロム以外の他の成分を含んでいてもよい。そのような成分としては、酵素又は細胞外分泌型シトクロムの保存性を高めたり、酵素と標的物質との反応性を高めたりすることができる種々の物質が用いられる。そのような成分として、例えば緩衝剤が挙げられる。
【0094】
試薬層4は、種々の方法によって形成可能である。形成方法としては、例えば印刷法、塗布法等が挙げられる。
【0095】
形成方法の一例を以下に述べる。酵素、細胞外分泌型シトクロム、及び必要に応じてその他の成分を含んだ水溶液を、マイクロシリンジなどを用いて、電極31上に一定量滴下した後、適切な環境に静置して乾燥させることにより、試薬層4を形成することができる。なお、試薬層4で電極31のより広い表面を被覆する場合には滴下した水溶液をシリンジの先端などで塗り広げてもよい。
【0096】
水溶液の滴下量は特定の数値に限定されないが、好ましくは0.5〜5μL、より好ましくは1〜2μLである。
【0097】
試薬層4の形状は、具体的な形状に限定されない。この形状は、矩形状や円形状などであってもよい。試薬層4の面積(基板2の平面方向における面積)は、デバイスの特性及びサイズに応じて決定される。この面積は、好ましくは1〜25mm2、より好ましくは2〜10mm2とすることができる。
【0098】
塗布される水溶液が含む、酵素及び細胞外分泌型シトクロム並びにその他の成分の含有量は、必要とするデバイスの特性やサイズに応じて選択される。
【0099】
図4に示すように、第2の基板であるスペーサ5は、測定対象物を含む試料液保持部を形成するための部材である。
【0100】
具体的には、スペーサ5は、板状の部材であって、電極31〜33のリード部分及び後述のキャピラリ51部分を除いて、導電層3の全体を覆うようになっている。スペーサ5は、電極31〜33のリード部分とは逆の端部を露出させる矩形の切り欠きを備える。切り欠き部はU字型であっても良い。スペーサ5がこの切り欠きを備えることで、試料液保持部が形成される。更に第3の基板であるカバー6をスペーサ5と貼り合わせることにより、カバー6により試料液保持部の一部が形成される。このようにスペーサ5、導電層3、及びカバー6とで囲まれた試料液保持部として機能するキャピラリ51が形成される。このように、スペーサ5は、キャピラリ51の側壁を提供し、さらにキャピラリ51の長さ、幅、高さ等を規定することができる。
【0101】
キャピラリ51の容量は、好ましくは0.1〜1.0μL(マイクロリットル)程度に設定される。スペーサ5の厚みは0.1〜0.2mmが好ましく、スペーサが備える切り欠きの長さは1〜5mmが好ましく、スペーサが備える幅は0.5〜2mmが好ましい。なお、これらの寸法は、キャピラリ51が所望の容量になるように適宜選択されればよい。例えば、長さが3.4mm、幅が1.2mmの切り欠きを備える厚さ0.145mmのスペーサ5を用いた場合、長さが3.4mm、幅が1.2mm、高さが0.145mm、容量が0.6μLのキャピラリ51が提供される。
【0102】
キャピラリ51は、その開口部である導入口52から毛細管現象によって液体試料を吸引し、電極31〜33上に保持する。
【0103】
図4に示すように、カバー6はスペーサ5全体を覆う板状の部材である。カバー6は、表面から裏面まで貫通する孔を備える。この孔は、キャピラリ51から外部に通じる通気口61として機能する。通気口61は、液体試料がキャピラリ51に吸引されるとき、キャピラリ51内の空気をキャピラリ外へ排出するための排気孔である。このように空気が排出されることで、液体試料がキャピラリ51内に容易に吸引されやすい。通気口61は、導入口52から離れた位置に、つまり、導入口52から見てキャピラリ51の奥に設けられることが好ましい。導入口52がこのように配置されることで、液体試料が、導入口52からキャピラリ51の奥まで、速やかに移動することができる。
【0104】
なお、上記の実施の形態においては、第1および第2の電極が同一基板上に配置された例を記したが、これに限定されない。例えば一方の電極を前記基板の上に配置し、もう一方をカバー基板上に配置させても良い。
【0105】
上述のセンサ1は、図5に示す測定システム100で用いられる。測定システム100は、センサ1及び測定器101を有する。
【0106】
図5及び図6に示すように、測定器101は、表示部102、装着部103、切替回路107、基準電圧源108、電流/電圧変換回路109、A/D変換回路110、演算部111を備える。測定器101は、さらに、センサ1の各電極に対応するコネクタを有する。図6には、コネクタ104〜106が描かれる。
【0107】
表示部102は、測定器101の状態、測定結果、操作内容等を表示する。表示部102は、具体的には液晶表示パネルによって実現される。
【0108】
図5に示すように、装着部103には、センサ1が着脱可能に挿入される。
【0109】
図6に示すように、コネクタ104〜106は、センサ1が装着部103に装着されることで、それぞれセンサ1の電極31〜33に接続される。
【0110】
切替回路107は、コネクタ104〜106を、基準電圧源108に接続したり、電流/電圧変換回路109したりする。
【0111】
基準電圧源108は、コネクタ104〜106を介して、電極31〜33に電圧を印加する。
【0112】
電流/電圧変換回路109は、センサ1からの電流を、コネクタ104〜106を介して受け取り、電圧に変換して、A/D変換回路110に出力する。
【0113】
A/D変換回路110は、電流/電圧変換回路109からの出力値(アナログ値)をパルス(デジタル値)に変換する。
【0114】
演算部111は、CPU(Central Processing Unit)並びにROM(Read Only Memory)及びRAM(Random Access Memory)等の記録媒体を有する。演算部111は、標的物質の濃度算出を行ったり、測定器101内の各部の動作を制御したりする。
【0115】
演算部111の濃度算出機能について説明する。演算部111の記憶媒体中には、試料中の標的物質の濃度の決定に用いられる換算テーブル、この濃度の補正量の決定に用いられる補正量テーブル等が記憶される。演算部111は、A/D変換回路110からのパルスに基づいて、換算テーブルを参照することにより、標的物質の仮の濃度を算出する。演算部111は、さらに、補正量テーブル中の補正量を用いて、標的物質の最終的な濃度を決定する。こうして算出された濃度は、表示部102に表示される。
【0116】
また、演算部111は、濃度算出機能以外に、切換回路107の切替制御、基準電圧源108の電圧制御、濃度測定や補正量選択時の時間の測定(タイマ機能)、表示部102への表示データ出力、及び外部機器との通信機能等を有する。
【0117】
演算部111の各種機能は、CPUが、図示しないROM等に格納されたプログラムを読み出して実行することにより実現される。
【0118】
以下、測定システム100による濃度測定について説明する。
【0119】
センサ1が装着部103に差し込まれると、コネクタ104〜106が、電極31〜33にそれぞれ接続される。また、装着部103内のスイッチ(図示せず)がセンサ1に押下される。スイッチの押下により、演算部111はセンサ1が装着されたと判断し、測定器101を試料待機状態とする。試料待機状態とは、演算部111の制御の下、基準電圧源108がコネクタ104及び106を介して、作用電極31及び検知電極33間への電圧印加を開始し、かつ電流/電圧変換回路109が電流測定を開始した後であって、液体試料がまだ測定に供されていない状態である。
【0120】
使用者が、センサ1の導入口51に液体試料を付着させると、毛細管現象によって、導入口51からキャピラリ52に液体試料が引き込まれる。
【0121】
液体試料としては、例えば、血液、汗、尿等の生体由来の液体試料や、環境由来の液体試料、食品由来の液体試料等が用いられる。例えば、センサ1を血糖値センサとして用いる場合、使用者は、自身の指、掌、又は腕等を穿刺して、少量の血液を搾り出し、この血液を液体試料として、センサ1での測定に供する。
【0122】
液体試料が作用電極31及び検知電極33に到達すると、演算部111が、電流/電圧変換回路109を介して受け取る電流値が変化する。この変化から、演算部111は、液体試料がセンサ1に吸引されたと判断する。こうして液体試料の吸引が検知されると、測定が開始される。
【0123】
センサ1内では、電極31及び32上で、液体試料、酵素、及びメディエータが互いに接触する。
【0124】
演算部111の制御により、切替回路107は、コネクタ104とコネクタ105とを基準電圧源108及び電流/電圧変換回路109に接続する。こうして、作用電極31と対電極32との間に電圧が印加され、作用電極31と対電極32との間に生じた電流が、電流/電圧変換回路109に伝達される。
【0125】
電流/電圧変換回路109へ流れた電流は電圧へ変換される。そして、この電圧はA/D変換回路110によりさらにパルスへと変換される。演算部111は、このパルスから、特定成分の濃度を算出する。演算部111により算出された値は、表示部202に表示される。その際、使用者へのその他の情報が共に表示されることもある。
【0126】
測定終了後は、使用者はセンサ1を装着部103から取り外すことができる。
【0127】
なお、基準電圧源108は、2つの電極31及び32間に、目的の電気化学反応を起こすのに十分な電圧を与えられるようになっている。この電圧は主に、利用する化学反応および電極に応じて設定される。
【0128】
また、上記(f)は、例えば、演算装置が、標的物質の濃度が既知である標準溶液を用いて得られる検量線を用いて、標的物質の濃度を算出することによって、実行される。
【0129】
本発明の他の一実施形態は、測定対象物の濃度あるいは量を測定するための電極であって、細胞外分泌型シトクロムおよび酵素が担持された電極である。このようにすると、測定対象物の測定に用いる電極上に反応の場が限定される上、用いる酵素の量が液に溶解するよりも少なくなるため、酵素をより効率的に利用することができる。また、前記酵素と前記細胞外分泌型シトクロムが融合していてもよい。本融合体には前述のものを用いることができる。このようにすると、測定対象物の測定に必要な要素がほぼ一体化され、該電極を他の容易に入手できる第2の電極、更には第3の電極と組み合わせて簡便に測定が実施できる。細胞外分泌型シトクロムおよび酵素の担持には、高分子を用いることができる。これにより、電流あるいは通電電荷量の出力が大きくなる。これは、高分子による担持で高密度に細胞外分泌型シトクロムが集積・配向し、電極細胞外分泌型シトクロムの電極への電子伝達効率が向上するためと考えられる。用いる高分子としては例えば、カルボキシメチルセルロースを用いることができる。
【0130】
以下、実施例に則して本発明を更に詳しく説明する。尚、本発明の技術的範囲はこれらの記載によって何等制限されるものではない。本明細書中に引用される文献に記載された内容は、本明細書の一部として本明細書の開示内容を構成するものである。
【実施例1】
【0131】
細胞外分泌型シトクロム遺伝子の取得
1)培養
パインデックス2%(松谷化学工業社製)(W/V)、トリプトン1%(BD社製)(W/V)、リン酸二水素カリウム0.5%(ナカライテスク社製)(W/V)、硫酸マグネシウム七水和物0.05%(W/V)(ナカライテスク社製)及び水からなる液体培地150mLを、500mL容の坂口フラスコに入れ、シリコセンで栓をした後、121℃、20分間オートクレーブした。冷却したこの液体培地にアスペルギルス・テレウスNIH2624株又はアスペルギルス・オリゼRIB40株を接種し、30℃で62時間振とう培養した。
2)Total RNA抽出
実施例1−1)に記載の方法によって培養したアスペルギルス・テレウスNIH2624株又はアスペルギルス・オリゼRIB40株の湿菌体2gを各々液体窒素によって凍結し磨砕した後、illustra RNAspin Mini Kit(GEヘルスケア・ジャパン社製)を用いて、各々0.1mgのTotal RNAを抽出した。
3)cDNAライブラリーの調製
アスペルギルス・テレウスNIH2624株又はアスペルギルス・オリゼRIB40株の各々のTotal RNAから、逆転写酵素及びアダプター付きオリゴdTプライマーを用いた逆転写反応により各々のcDNAライブラリーを調製した。反応にはPrime Script RT-PCR Kit(タカラバイオ社製)を使用し、反応条件は説明書記載のプロトコールに準じて行った。
4)細胞外分泌型シトクロム遺伝子の大腸菌へのサブクローニング
以下の表1に示した2組のプライマーを合成し、該プライマーにより、アスペルギルス・テレウスNIH2624株又はアスペルギルス・オリゼRIB40株のcDNAライブラリーを鋳型として、各々の細胞外分泌型シトクロム遺伝子をPCR増幅した。
【0132】
なお、表1のプライマーはNCBI(National Center for Biotechnology Information)(ウェブサイトhttp://www.ncbi.nlm.nih.gov/)で公開されている遺伝子データベースより、XM_001216771(アスペルギルス・テレウス:mRNAの一部でタンパク質をコードしていると推定されている)及びXM_001820457(アスペルギルス・オリゼ:mRNAの一部でタンパク質をコードしていると推定されている)の配列を基に設計した。その理由は、SMART(ウェブサイトhttp://smart.embl-heidelberg.de/)を用いて上記XM_001216771のドメイン構造予測を行った結果、電子伝達能を有するタンパク質(シトクロム)であると推測されたためである。更に、フォワード側に制限酵素BglIIで認識される配列(四角枠内)を付加し(AT Cytb Bgl2_F、AO Cytb Bgl2_F)、リバース側にXhoI又はNcoIで認識される配列(四角枠内)を付加した(AT Cytb Xho1_R、AO Cytb Nco1_R)。
【0133】
【表1】

【0134】
アスペルギルス・テレウスNIH2624株に対してはAT Cytb Bgl2_FとAT Cytb Xho1_Rの組み合わせ、アスペルギルス・オリゼRIB40株に対してはAO Cytb Bgl2_FとAO Cytb Nco1_Rの組み合わせでPCRを行い、それぞれの目的の遺伝子領域を増幅した。なお、PCRは、市販のポリメラーゼpfu ultra(STRATAGENE社製)を使用し、反応条件は〔94℃/2分→(94℃/30秒→55℃/30秒→72℃/1分)×30サイクル〕とした。
次いで、アスペルギルス・テレウスNIH2624株由来増幅遺伝子断片を制限酵素BglII及びXhoIで切断し、アスペルギルス・オリゼRIB40株由来増幅遺伝子断片を制限酵素BglII及びNcoIで切断し、同様にBglII及びXhoI又はBglII及びNcoIで各々制限酵素処理したカビでの発現用ベクターにライゲーションし、アスペルギルス・テレウスNIH2624株由来又はアスペルギルス・オリゼRIB40株由来の細胞外分泌型シトクロム発現用ベクターを各々構築した。なお、本ベクターは公知文献1(アスペルギルス属の異種遺伝子発現系、峰時俊貴、化学と生物、38、12、P831-838、2000)に記載してある、アスペルギルス・オリゼ由来のアミラーゼ系の改良プロモーターを使用し、目的遺伝子が発現可能なベクターを調製した。上記、細胞外分泌型シトクロム発現用ベクターを各々大腸菌JM109株に導入して形質転換した。illustra plasmidPrep Midi Flow Kit(GEヘルスケア・ジャパン社製)を用いて、各々得られた形質転換体のうち各々3クローンずつよりプラスミドを抽出し、インサートの配列解析をおこなったところ、全てのプラスミドで目的の遺伝子が確認できた。
5)アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム遺伝子の取得
しかしながら、取得したアスペルギルス・テレウスNIH2624株由来の遺伝子が公開配列(配列番号1)と比べて10塩基欠失していたため、欠失箇所を含む周辺275塩基を人工合成し、アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム遺伝子の該当箇所を置換した。作製した遺伝子断片は実施例1−4)記載の方法と同様にして、大腸菌にクローニングした後、遺伝子解析を行った結果、公開配列XM_001216771と同じ配列の遺伝子が取得できた。
なお、本発明により取得したアスペルギルス・テレウスNIH2624株及びアスペルギルス・オリゼRIB40株由来の細胞外分泌型シトクロムの遺伝子配列及びアミノ酸配列を配列番号1及び2、並びに、配列番号3及び4に夫々示す。
【実施例2】
【0135】
細胞外分泌型シトクロムの発現・精製
1)カビの形質転換と目的タンパク質の発現確認
実施例1−4)又は1−5)で調製した、アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム発現用ベクター又はアスペルギルス・オリゼRIB40株由来細胞外分泌型シトクロム発現用ベクターを用いて、公知文献1及び3(清酒用麹菌の遺伝子操作技術、五味勝也、醸協、P494−502、2000)に記載の方法に準じて、各細胞外分泌型シトクロムを生産する組み換えカビ(アスペルギルス・オリゼ)を各々作製した。なお、使用する宿主カビは公知文献2(BioSci. Biotech. Biochem., 61(8), 1367-1369, 1997)にあるように、1997年(平成9年)に醸造試験場で育種され、転写因子の解析、各種酵素の高生産株の育種等に利用され、分譲されているものが入手可能である。Czapek-Dox固体培地で各形質転換体を選択した後、実施例1−1)に記載の液体培地10mLを各々入れた太試験管(22mm×200mm)に、各形質転換体を植菌し、30℃で62時間振とう培養した。培養終了後、各培養液を遠心(3,000×g、20分)し、沈殿を取り除いたものを粗タンパク質サンプルとした。各粗タンパク質を15.0%ポリアクリルアミドゲルを使用しLaemmLiらの方法に従い、SDS−ポリアクリルアミドゲル電気泳動(SDS-PAGE)に掛けた。泳動後にクマシーブリリアントブルー(CBB)染色し、移動度を分子量マーカー(GEヘルスケア・ジャパン社製のLMW Marker)のそれと比較して各目的タンパク質の発現を確認したところ、いずれも分子量約30kDaの目的タンパク質の発現が確認された。
2)組換えカビの種培養
実施例1−1)に記載の坂口フラスコに実施例2−1)で作製した各組換えカビを接種し、30℃で62時間振とう培養したものを各種培養液とした。
3)本培養
パインデックス2%(松谷化学工業社製)(W/V)、トリプトン1%(BD社製)(W/V)、リン酸二水素カリウム0.5%(ナカライテスク社製)(W/V)、硫酸マグネシウム七水和物0.05%(W/V)(ナカライテスク社製)、消泡剤及び水からなる液体培地各3.5LをpH6.0に調製し、5L容の各ジャーファメンターに入れ、121℃、20分間オートクレーブした。冷却したこの液体培地に、実施例2−2)で調製した各培養液45mLを各々接種し、30℃で62時間、通気撹拌の条件で培養した。各培養液をろ過して得た培養上清を各粗タンパク質溶液として使用した。該粗タンパク質溶液から更に、以下4)‐6)により各細胞外分泌型シトクロムを単離精製した。
4)濃縮・脱塩
各粗タンパク質溶液を各々分画分子量10,000の限外ろ過膜「ペリコン2モジュール」(ミリポア社製)で濃縮し、20mMリン酸カリウム緩衝液(pH7.0)に置換して、各粗タンパク質濃縮液を調製した。
5)Butyl-TOYOPEAL650M(東ソー社製)による精製
上記各粗タンパク質濃縮液を、60% 飽和硫酸アンモニウム液(pH7.5)になるように各々調整後、遠心分離し得られた各上清を、60% 硫酸アンモニウムを含む20mM リン酸カリウム緩衝液(pH7.0)で平衡化したButyl-TOYOPEAL650Mカラムに各々通液して各目的タンパク質を吸着させ、同緩衝液で洗浄したのち、60%−30% の硫酸アンモニウム濃度でのグラジエント溶出法で各タンパク質を各々溶出させた。各目的画分については、350nm‐600nmのスペクトル解析を行い、シトクロムb562に特徴的な562nmにおける還元スペクトルが観察されたものについて各々回収した。
6)DEAE-セルロファインA-500(生化学工業社製)による精製
上記各回収画分を各々限外濾過膜「ペリコン2モジュール」で濃縮し、脱塩後5mM トリス・塩酸緩衝液(pH8.0)と平衡化させ、上記緩衝液で平衡化したDEAE-セルロファインA-500に各々吸着させ、同緩衝液で洗浄したのち、同緩衝液と0.2M NaClを含む同緩衝液でグラジエント溶出法で各タンパク質を各々溶出させて、目的画分を集めた。得られた各精製タンパク質を、15.0%ポリアクリルアミドゲルを使用しLaemmLiらの方法に従い、SDS-PAGEに掛けた。泳動後にCBB染色し、移動度を分子量マーカー(GEヘルスケア社製のLMW Marker)のそれと比較した結果、単一(分子量約30kDa)になっていることが確認できた。このように、アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム又はアスペルギルス・オリゼRIB40株由来細胞外分泌型シトクロムは、各形質転換体の培養上清から容易に回収でき、安定的に精製し、単離できた。更に、糸状菌であるアスペルギルス属に属する菌であるアスペルギルス・オリゼを宿主とした製造方法を確立したことによって、酵母を宿主とした製造方法に比べ、過剰な糖鎖付加のない組換え細胞外分泌型シトクロムを得ることができるようになった。
【0136】
更に、実施例2−6)で得られた、アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム(AtCytb)又はアスペルギルス・オリゼRIB40株由来細胞外分泌型シトクロム(AoCytb)は以下の物理化学的性質を有していた。
(1)グルコース酸化還元酵素から電子を受け取る機能及び/又は電子受容体に電子を受け渡す機能を共に有する。
(2)分子量:約30kDa(配列番号1又は配列番号3記載のポリヌクレオチドを導入した糸状菌による組換え細胞外分泌型シトクロムを、ポリアクリルアミドゲル電気泳動(SDS-PAGE)に供した際のサブユニット分子量である。)
なお、上記分子量については、本酵素には元来糖鎖が付加している為、培養条件又は精製条件により糖鎖の付き方が変われば分子量は異なり、形質転換細胞又はベクター系の種類等によっても糖鎖や付加するアミノ酸が変わり分子量は異なってくる。更に導入するポリヌクレオチドの種類によりアミノ酸配列長又は糖鎖の付き方が変われば分子量は異なる。
(3)赤色を呈している。
(4)還元型でシトクロムb562に特徴的な吸収スペクトル(427、531、562nm)を有する。
(5)可溶性蛋白質である。
【実施例3】
【0137】
グルコースに対する応答電流値測定
酵素電極は、グラッシーカーボン(直径6mm、電極表面の直径)の表面に、酵素と電子メディエータを固定化した構成とした。酵素電極は、使用する前に、1Mのリン酸カリウム緩衝液(pH7.0)に浸漬して平衡化しておいた。酵素としては、国際公開第2006/101239に記載のアスペルギルス・テレウス由来のグルコース脱水素酵素(AtGLD、2,000U/mg)並びに国際公開第2008/001903号記載のアスペルギルス・オリゼ由来のグルコース脱水素酵素(AoGLD、2,000U/mg)を使用し、電子メディエータとしては、実施例2で得られたAtCytb、AoCytb、馬心筋由来シトクロムC(HCytC)、大腸菌由来シトクロムb(EcCytb)、並びにフェリシアン化カリウムを使用して酵素電極を作成した。酵素電極においては、酵素の含有量を5U、電子メディエータの含有量を0.28×10−10molに相当する量とした((モル比)酵素:電子メディエータ=1:1)。
【0138】
応答特性は、濃度の異なる複数のグルコース溶液について、応答電流を測定した結果に基づいて検討した。応答電流値は、目的濃度に調整されたグルコース溶液を保持した反応槽に対して、酵素電極、参照電極及び対極を浸漬するとともに、酵素電極と対極との間に電圧を印加し、参照電極を基準電極として測定した。グルコース溶液は、グルコースを1Mのリン酸カリウム緩衝液(pH7.0)に溶解させることにより作成した。グルコース溶液の濃度は、0.1mM〜40mMに設定した。参照電極としてはAg/AgCl電極を用い、対極としてはPt電極を用いた。印加電圧値は+500mVとし、応答電流値の測定は、反応槽の温度を30℃に維持して行った。応答電流値の測定結果については、表2及び表3、並びに、図1及び図2に示した。
【0139】
【表2】

【0140】
【表3】

【0141】
これらの結果から分かるように、電子メディエータを使用しない酵素電極、又はHCytC、EcCytb若しくはフェリシアン化カリウムを用いた酵素電極では、グルコース濃度の増加に伴う応答電流値の増加量が非常に小さく、酵素と電極間で、適切な電子伝達が行われていないことが示された。これに対して、AoCytb又はAtCytbを用いた酵素電極では、グルコース濃度の増加に伴う応答電流値の増加量が大きく良好な応答特性が得られた。特に、AtGLDを用いた場合には高グルコース濃度領域、AoGLDを用いた場合には低グルコース濃度領域において、顕著な応答特性が得られた。このように、取得した細胞外分泌型シトクロムを電子メディエータとして用いた酵素電極では、金属錯体等の電子メディエータを用いることなく、グルコース酸化還元酵素のモル数と等モルの細胞外分泌型シトクロムを用いて電極法においてグルコース濃度40mMまでの測定を行うことができ、グルコース酸化還元酵素と親和性の高い、細胞外分泌型シトクロムから成る電子メディエータが得られた。
[測定法]:アンペロメトリー
[条件]:Init E=0.5V、Smpl Intvl=1、Run Time=1400sec、
[Buffer及び電解質濃度]:1M KPB+0.1M KCl
【実施例4】
【0142】
融合体遺伝子の取得
1)細胞外分泌型シトクロム遺伝子の取得
実施例1−4)で取得したアスペルギルス・テレウスNIH2624株由来増幅遺伝子断片をテンプレートA又はアスペルギルス・オリゼRIB40株由来増幅遺伝子断片をテンプレートBとして、下記反応条件でPCRを行った。PCRは、テンプレートAに対してはプライマー:AtC-Kpn-F及びAtC-Rを用いて行った結果、アスペルギルス・テレウスNIH2624株由来細胞外分泌型シトクロム(AtCytb)遺伝子断片を取得した。一方、テンプレートBに対してはプライマー:AoC-Kpn-F及びAoC-Rを用いて行った結果、アスペルギルス・オリゼRIB40株由来細胞外分泌型シトクロム(AoCytb)遺伝子断片を取得した。尚、フォワード側のプライマー:AtC-Kpn-Fは、ベクターと相同性のある相同配列及び制限酵素サイト(KpnI)をAtCytb遺伝子に付加するよう設計されたプライマーである。リバース側のプライマー:AtC-Rは、AtCytb遺伝子の開始コドンから726番目の塩基までを増幅するよう設計されたプライマーである。726番目の塩基までを増幅する理由は、AtCytbアミノ酸配列のC末端側に位置するフラビンドメインである56アミノ酸を削除し、酸化機能を有するサブユニットを融合させる為である。もう一方のフォワード側のプライマー:AoC-Kpn-Fは、ベクターと相同性のある相同配列及び制限酵素サイト(KpnI)をAoCytb遺伝子に付加するよう設計されたプライマーである。もう一方のリバース側のプライマー:AoC-Rは、AoCytb遺伝子の開始コドンから557番目の塩基までを増幅するよう設計されたプライマーである。557番目の塩基までを増幅する理由は、AoCytbアミノ酸配列のC末端側に位置する5アミノ酸を削除し、リンカー配列を融合させる為である。
プライマー:
AtC-Kpn-F(配列番号9)
5’-CGAATTCGAGCTCGGGTACCATGCGTTCCTTTCTC-3’
AtC-R(配列番号10)
5’-GTTGGAAACGGTTGCCGGGCACGCT-3’
AoC-Kpn-F(配列番号11)
5’-CGAATTCGAGCTCGGGTACCATGACATTAAGAAAC-3’
AoC-R(配列番号12)
5’-AGGAACTGCATCCTTCGCCAGAGCCCGCCACTTGTCATAGGAG-3’
反応条件: 変性94℃、2分(1サイクル)、 変性94℃、30秒、アニーリング55℃、30秒、伸長反応72℃、1分(30サイクル) 伸長72℃、10分(1サイクル)
2)グルコース脱水素酵素遺伝子の取得
実施例1−1)から実施例1−3)に記載の方法と同様に調製したアスペルギルス・テレウスFERM BP-08578株のcDNAライブラリーをテンプレートC又はアスペルギルス・オリゼNBRC5375株のcDNAライブラリーをテンプレートDとして、下記反応条件でPCRを行った。PCRは、テンプレートCに対してはプライマー:AtC-AtG-F及びAtG-Kpn-Rを用いて行った結果、アスペルギルス・テレウスFERM BP-08578株由来で基質酸化機能を有するグルコース脱水素酵素(AtGLD)遺伝子断片Eを取得した。また一方で、テンプレートCに対してプライマー:AtG-F及びAtG-Kpn-Rを用いてPCRを行った結果、アスペルギルス・テレウスFERM BP-08578株由来で基質酸化機能を有するグルコース脱水素酵素(AtGLD)遺伝子断片Fを取得した。更に、テンプレートDに対してはプライマー:AtC-AoG-F及びAoG-Kpn-Rを用いて行った結果、アスペルギルス・オリゼNBRC5375株由来で基質酸化機能を有するグルコース脱水素酵素(AoGLD)遺伝子断片Gを取得した。また一方で、テンプレートDに対してプライマー:AoG-F及びAoG-Kpn-Rを用いてPCRを行った結果、アスペルギルス・オリゼNBRC5375株由来で基質酸化機能を有するグルコース脱水素酵素(AoGLD)遺伝子断片Hを取得した。尚、AtGLD遺伝子増幅用のフォワード側のプライマー:AtC-AtG-Fは、AtCytb遺伝子と相同性のある相同配列をAtGLD遺伝子に付加し、更にAtGLD遺伝子の開始コドンから73番目の塩基から増幅するよう設計されたプライマーである。AtGLD遺伝子増幅用のリバース側のプライマー:AtG-Kpn-Rは、ベクターと相同性のある相同配列及び制限酵素サイト(KpnI)をAtGLD遺伝子に付加するよう設計されたプライマーである。73番目の塩基から増幅する理由は、72番目までの遺伝子部分が、アミノ酸配列のN末端側における立体構造においてゆらぎ部分にあたり、その部分を除去する為である。AtGLD遺伝子増幅用のもう一方のフォワード側のプライマー:AtG-Fは、AtGLD遺伝子の開始コドンから73番目の塩基から増幅するよう設計されたプライマーである。AoGLD遺伝子増幅用のフォワード側のプライマー:AtC-AoG-Fは、AtCytb遺伝子と相同性のある相同配列をAoGLD遺伝子に付加し、更にAoGLD遺伝子の開始コドンから76番目の塩基から増幅するよう設計されたプライマーである。AoGLD遺伝子増幅用のリバース側のプライマー:AoG-Kpn-Rは、ベクターと相同性のある相同配列及び制限酵素サイト(KpnI)をAoGLD遺伝子に付加するよう設計されたプライマーである。76番目の塩基から増幅する理由は、75番目までの遺伝子部分が、アミノ酸配列のN末端側における立体構造においてゆらぎ部分にあたり、その部分を除去する為である。AoGLD遺伝子増幅用のもう一方のフォワード側のプライマー:AoG-Fは、AoGLD遺伝子の開始コドンから76番目の塩基から増幅するよう設計されたプライマーである。
プライマー:
AtC-AtG-F(配列番号13)
5’-CCGGCAACCGTTTCCAACGCCAAATATGATTATATCGTTATTG-3’
AtG-Kpn-R(配列番号14)
5’-CTACAGATCCCCGGGGTACCCTAACGACGACCAGC-3’
AtG-F(配列番号15)
5’-GCCAAATATGATTATATCGTTATTGGAGGCGGTACTAGCGGTT-3’
AtC-AoG-F(配列番号16)
5’-CCGGCAACCGTTTCCAACACGACATACGACTACATCGTTGTGG-3’
AoG-Kpn-R(配列番号17)
5’-CTACAGATCCCCGGGGTACCCTAAGCACTCTTCGC-3’
AoG-F(配列番号18)
5’-ACGACATACGACTACATCGTTGTGGGAGGCGGCACAAGTGGTC-3’
反応条件: 変性94℃、2分(1サイクル)、 変性94℃、30秒、アニーリング55℃、30秒、伸長反応72℃、1分(30サイクル) 伸長72℃、10分(1サイクル)
3)リンカー配列遺伝子の取得
実施例1−3)で調製したアスペルギルス・テレウスNIH2624株のcDNAライブラリーをテンプレートとして、下記反応条件でPCRを行った。PCRは、プライマー:AoC-L-F及びL-AtG-Rを用いて行った結果、リンカー配列遺伝子断片Iを取得した。また一方で、プライマー:AoC-L-F及びL-AoG-Rを用いてPCRを行った結果、リンカー配列遺伝子断片Jを取得した。尚、フォワード側のプライマー:AoC-L-FはAoCytb遺伝子と相同性のある相同配列をリンカー遺伝子に付加するよう設計されたプライマーである。リバース側のプライマー:L-AtG-RはAtGLD遺伝子と相同性のある相同配列をリンカー配列遺伝子に付加するよう設計されたプライマーである。もう一方のリバース側のプライマー:L-AoG-RはAoGLD遺伝子と相同性のある相同配列をリンカー配列遺伝子に付加するよう設計されたプライマーである。
プライマー:
L-AoG-R(配列番号19)
5’-GATGTAGTCGTATGTCGTACCGTCAGGGACAGGAACAGGCTCG-3’
AoC-L-F(配列番号20)
5’-GCGAAGGATGCAGTTCCTGGAGACTGCTCCGGCGATGGCGGTG-3’
L-AtG-R(配列番号21)
5’-CAATAACGATATAATCATATTTGGCACCGTCAGGGACAGGAAC-3’
反応条件: 変性94℃、2分(1サイクル)、 変性94℃、30秒、アニーリング55℃、30秒、伸長反応72℃、1分(30サイクル) 伸長72℃、10分(1サイクル)
4)融合体遺伝子の大腸菌へのサブクローニング
実施例4−1)で取得したAtCytb遺伝子断片、実施例4−2)で取得したAtGLD遺伝子断片E及びベクターpUSAを制限酵素KpnIで処理し、In-Fusion(商標)Advantage PCR Cloning Kit(タカラバイオ社製)を用い、発現ベクターpTCTGを作成した。尚、ベクターpUSAは(独)酒類総合研究所より分譲いただいた。更に、実施例4−1)で取得したAoCytb遺伝子断片、実施例4−2)で取得したAtGLD遺伝子断片F及びベクターpUSAを制限酵素KpnIで処理し、実施例4−3)で取得したリンカー遺伝子断片Iと共に、In-Fusion(商標)Advantage PCR Cloning Kit(タカラバイオ社製)を用い、発現ベクターpOCTGを作成した。加えて、実施例4−1)で取得したAtCytb遺伝子断片、実施例4−2)で取得したAoGLD遺伝子断片G及びベクターpUSAを制限酵素KpnIで処理し、In-Fusion(商標)Advantage PCR Cloning Kit(タカラバイオ社製)を用い、発現ベクターpTCOGを作成した。その上、実施例4−1)で取得したAoCytb遺伝子断片、実施例4−2)で取得したAoGLD遺伝子断片F及びベクターpUSAを制限酵素KpnIで処理し、実施例4−3)で取得したリンカー遺伝子断片Jと共に、In-Fusion(商標)Advantage PCR Cloning Kit(タカラバイオ社製)を用い、発現ベクターpOCOGを作成した。発現ベクターpTCTG、pOCTG、pTCOG又はpOCOGを各々大腸菌JM109株に導入して形質転換した。illustra plasmidPrep Midi Flow Kit(GEヘルスケア・ジャパン社製)を用いて、各々得られた形質転換体のうち各々3クローンずつよりプラスミドを抽出し、インサートの配列解析をおこなったところ、全てのプラスミドで各々目的の遺伝子が確認できた。これにより、(1)AtCytb遺伝子及びAtGLD遺伝子、(2)AoCytb遺伝子、リンカー配列遺伝子及びAtGLD遺伝子、(3)AtCytb遺伝子及びAoGLD遺伝子、並びに、(4)AoCytb遺伝子、リンカー配列遺伝子及びAoGLD遺伝子を各々融合させた融合体遺伝子(配列番号22,24,26及び28)を含むベクターpTCTG、pOCTG、pTCOG及びpOCOGを取得できた。
【実施例5】
【0143】
融合体の発現・精製
1)カビの形質転換と融合体の発現確認
実施例4−4)で取得した、pTCTG、pOCTG、pTCOG又はpOCOGを用いて、公知文献1及び3(清酒用麹菌の遺伝子操作技術、五味勝也、醸協、P494−502、2000)に記載の方法に準じて、各融合体を生産する組み換えカビ(アスペルギルス・オリゼ)を各々作製した。尚、使用する宿主カビは公知文献2(BioSci. Biotech. Biochem., 61(8), 1367-1369, 1997)にあるように、1997年(平成9年)に醸造試験場で育種され、転写因子の解析、各種酵素の高生産株の育種などに利用され、分譲されているものが入手可能である。Czapek-Dox固体培地で各形質転換体を選択した後、実施例1−1)に記載の液体培地10mLを各々入れた太試験管(22mm×200mm)に、各形質転換体を植菌し、30℃で40時間振とう培養した。培養終了後、各培養液を遠心(3,000×g、20分)し、沈殿を取り除いたものを粗タンパク質サンプルとした。各粗タンパク質を15.0%ポリアクリルアミドゲルを使用しLaemmLiらの方法に従い、SDS-PAGEに掛けた。泳動後にCBB染色し、移動度を分子量マーカー(Bio Dynamics Laboratory Inc社製のDyna Marker Protein Recombinant)のそれと比較して各融合体の発現を確認したところ、可溶性のAtCytb及び基質特異性の高いAtGLDを融合させた融合体AtCytb-AtGLD(配列番号23)、可溶性のAoCytb及び基質特異性の高いAtGLDをリンカー配列で架橋し融合させた融合体AoCytb-AtGLD(配列番号25)、可溶性のAtCytb及び基質特異性の高いAoGLDを融合させた融合体AtCytb-AoGLD(配列番号27)、又は可溶性のAoCytb及び基質特異性の高いAoGLDをリンカー配列で架橋し融合させた融合体AoCytb-AoGLD(配列番号29)は、それぞれ124kDa、115kDa、124kDa又は115kDaの位置にバンドが染色され、各融合体の発現が確認された。更に、国際公開第2004/058958号記載の酵素活性測定法1により融合体のグルコース脱水素酵素活性を測定したところ、AtCytb-AtGLD、AoCytb-AtGLD、AtCytb-AoGLD又はAoCytb-AoGLDで、それぞれグルコース脱水素酵素活性を確認できた。
2)組換えカビの種培養
実施例1−1)に記載の坂口フラスコを2つ準備し、この坂口フラスコに実施例5−1)でpTCTG又はpOCTGを用いて作製した組換えカビ2種を各々接種し、30℃で62時間振とう培養したものを各種培養液とした。
3)本培養
パインデックス2%(松谷化学工業社製)(W/V)、トリプトン1%(BD社製)(W/V)、リン酸二水素カリウム0.5%(ナカライテスク社製)(W/V)、硫酸マグネシウム七水和物0.05%(W/V)(ナカライテスク社製)、消泡剤および水からなる液体培地各3.5LをpH6.0に調製し、5L容の各ジャーファメンターに入れ、121℃、20分間オートクレーブした。冷却したこの液体培地に、実施例5−2)で調製した各培養液45mLを各々接種し、30℃で62時間、通気撹拌の条件で培養した。各培養液をろ過して得た培養上清を各粗タンパク質溶液として使用した。該粗タンパク質溶液から更に、以下4)‐6)により各融合体を単離、精製した。
4)濃縮・脱塩
各粗タンパク質溶液に各々終濃度0.4mMになるようにペファブロック SC(ロシュ・ダイアグノスティックス社製)を添加し、各々分画分子量10,000の限外ろ過膜「ペリコン2モジュール」(ミリポア社製)で濃縮し、0.4mMペファブロック SCを含む50mMリン酸カリウム緩衝液(pH7.0)に置換して、各粗タンパク質濃縮液を調製した。
5)Butyl-TOYOPEAL650M(東ソー社製)による精製
前記各粗タンパク質濃縮液を、60%飽和硫酸アンモニウム液(pH7.0)になるように各々調整後、遠心分離し得られた各上清を、60%硫酸アンモニウムを含む50mMリン酸カリウム緩衝液(pH7.0)で平衡化したButyl-TOYOPEAL650Mカラムに各々通液して各目的タンパク質を吸着させ、同緩衝液で洗浄したのち、60%−0%の硫酸アンモニウム濃度でのグラジエント溶出法で各タンパク質を各々溶出させた。各目的画分については、グルコース脱水素酵素活性を有する画分を各々回収した。
6)DEAE-セルロファインA-500(生化学工業社製)による精製
前記各回収画分を各々限外濾過膜「ペリコン2モジュール」で濃縮し、脱塩後1mMリン酸カリウム緩衝液(pH7.0)と平衡化させ、前記緩衝液で平衡化したDEAE-セルロファインA-500に各々吸着させ、同緩衝液で洗浄したのち、同緩衝液と1mM−150mMのリン酸カリウム緩衝液濃度でのグラジエント溶出法で各タンパク質を各々溶出させて、目的画分を集めた。得られた各精製タンパク質を、15.0%ポリアクリルアミドゲルを使用しLaemmLiらの方法に従い、SDS-PAGEに掛けた。泳動後にCBB染色し、移動度を分子量マーカー(Bio Dynamics Laboratory Inc社製のDyna Marker Protein Recombinant)のそれと比較した結果、各々のタンパク質が単一(分子量約124kDa又は115kDa)になっていることが確認できた。これにより、可溶性のAtCytb及び基質特異性の高いAtGLDを融合させた融合体AtCytb-AtGLD、又は可溶性のAoCytb及び基質特異性の高いAtGLDをリンカー配列で架橋し融合させた融合体AoCytb-AtGLDを単離できた。即ち、電子メディエータ機能を有する可溶性の細胞外分泌型シトクロムと基質酸化機能を有し、かつ基質特異性が高いグルコース脱水素酵素とを融合させた融合体を取得し、分離・精製できた。
【0144】
更に、実施例5−6)で得られた、融合体AtCytb-AtGLD又はAoCytb-AtGLDは、以下の物理化学的性質を有していた。(1)フラビンアデニンジヌクレオチドに特徴的な吸収スペクトル(374nm及び460nm)並びに酸化型の細胞外分泌型シトクロムに特徴的な吸収スペクトル(419nm)を有しており、該融合体を含む溶液にグルコースを添加することで、374nm、460nm及び419nmのピークが消失すると共に、還元型細胞外シトクロムに特徴的な428nm、532nm及び562nmのピークがみられる。(2)グルコース脱水素酵素活性を有する。
【実施例6】
【0145】
融合体から電子メディエータへの電子供与能の測定
細胞外分泌型シトクロムをAtGLDに融合させた融合体であるAoCytb-AtGLDからシトクロムCへの電子供与能を測定するため、50mM MES緩衝液(pH6.0)、1.0mM D−グルコース、0.05mM シトクロムC及び1μM AoCytb-AtGLD又は1μM AtGLDから成る0.5mL反応液中でシトクロムCの550nmにおける吸光度(ΔABS)を測定した。1μM AoCytb-AtGLD又は1μM AtGLDを除く反応液を恒温セルホルダー付き分光光度計にセットして、30℃で5分間インキュベート後、終濃度が1μMになるようにAoCytb-AtGLD又はAtGLDを添加し、550nmにおける吸光度(ΔABS)を測定した。吸光度の測定結果について、図3に示した。吸光度は還元されたシトクロムCの増加に伴い上昇し、吸光度変化は酵素からシトクロムCへの電子供与能を表しており、グラフの傾きが大きい程、反応速度が速いことを意味する。
【0146】
図3に示した通り、AtGLDはシトクロムCが低濃度になる反応後半になると反応速度が落ちているが、融合体であるAoCytb-AtGLDは反応後半でも反応速度が落ちていない。このことから、AoCytb-AtGLDがシトクロムCに対して優れた電子供与能を有することが分かり、シトクロムCに対して高い親和性を有することが示された。
【実施例7】
【0147】
本実施例におけるセンサは前述のセンサの実施の形態に基づき作製した。導電層、電極の材料はパラジウムである。絶縁性の樹脂であるポリエチレンテレフタレート基板上に導電層を、スパッタリング蒸着により形成後、YAGレーザーを用いて導電層に非導電トラックを設けることで第1の電極(作用極)および第2の電極(対極)を形成した。このようにして得た作用極上にのみ、試薬液を円形に塗布し、室温で乾燥させることにより試薬層を形成した。前記試薬液は以下の組成であり、アスペルギルス・テレウス由来のフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素(4ユニット/0.6マイクロリットル)、アスペルギルス・テレウス由来の細胞外分泌型シトクロム(前記酵素と等モル濃度)、カルボキシメチルセルロース(0.25重量%)、およびリン酸カリウム緩衝剤(15mM、pH7.0)を含む。なお、前記酵素と前記シトクロムは実施の形態で記した融合体で存在している。滴下した試薬液の量は、1つのセンサにつき酵素が4ユニット含有される量とした。一方、対極上には銀塩化銀(Ag/AgCl)のペースト(BAS社製)を塗布し細い棒状の器具で対極全体を覆うよう塗り広げた。塗布したペーストは室温で乾燥させた。この基板上に、切り欠き部を有するスペーサ、更にカバーを貼り合わせることにより、試料溶液が供給されるキャビティを形成した。
上記のようにして作製したセンサの電流応答を、濃度の異なる複数のグルコース溶液を用いて測定した。グルコース溶液は、グルコースをリン酸緩衝生理食塩水(PBS)に溶解させることにより作製した。その濃度範囲は0〜150mg/dL(8.3mM)と正常よりやや高血糖濃度までに設定した。電流応答は、作用極に+350mVの電位を対極に対してポテンシオスタット(BAS社製、ALS−660B)を用いて印加ながら、グルコース溶液を前記キャビティに導入し、導入後の電流の経時変化を25℃で測定した。図7は導入したグルコース溶液の濃度に対する電流値の依存性である。図7にプロットした電流値は溶液導入後、2および5秒後の電流である。どちらの電流も共に、グルコース濃度の増加(約0.08〜8.3mM、1.56〜150mg/dL)に伴う応答電流値の増加が確認され、本センサ、および測定方法において、測定対象物であるグルコースの測定が可能であった。
【産業上の利用可能性】
【0148】
本発明の電子メディエータ及び融合体は、血糖値を測定するグルコースセンサ用又は電池用の電極等に有用である。本発明の測定法、電極、およびセンサは測定対象物の測定に有用である。
【符号の説明】
【0149】
1 センサ
2 基板
3 導電層
31 作用電極
32 対電極
33 検知電極
4 試薬層
5 スペーサ
51 導入口
52 キャピラリ
6 カバー
61 通気口
【特許請求の範囲】
【請求項1】
細胞外分泌型シトクロム、酵素、および電子受容体を用いる、測定対象物の測定方法であって、
A)前記酵素により前記測定対象物を酸化する工程、
B)前記工程Aにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
C)前記工程Bによって生じる前記細胞外分泌型シトクロムにおける電子を前記電子受容体により受容する工程、
D)前記工程Cによって生じる前記電子受容体における変化を検出する工程、
E)前記工程Dにおいて検出される前記電子受容体における変化の量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
【請求項2】
測定において用いられる、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい、請求項1に記載の測定方法。
【請求項3】
前記細胞外分泌型シトクロムが糸状菌に属する菌由来である、請求項1に記載の測定方法。
【請求項4】
前記糸状菌がアスペルギルス属の菌である、請求項3に記載の測定方法。
【請求項5】
前記アスペルギルス属の菌がアスペルギルス・テレウス、またはアスペルギルス・オリゼである、請求項4に記載の測定方法。
【請求項6】
前記細胞外分泌型シトクロムが前記請求項6に記載の電子メディエータである、請求項1に記載の測定方法。
【請求項7】
前記酵素が酸化還元酵素あるいは脱水素酵素である、請求項1に記載の測定方法。
【請求項8】
前記酵素がグルコースに作用する酵素である、請求項1に記載の測定方法。
【請求項9】
前記酵素がフラビンアデニンジヌクレオチド依存型である、請求項1に記載の測定方法。
【請求項10】
前記酵素がフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素である、請求項1に記載の測定方法。
【請求項11】
前記測定対象物がグルコースである、請求項1に記載の測定方法。
【請求項12】
前記電子受容体が電極である、請求項1に記載の測定方法。
【請求項13】
前記電子受容体が酸化還元化合物である、請求項1に記載の測定方法。
【請求項14】
前記工程Dにおける検出が電流、通電電荷量、あるいは分光学的量によってなされる、請求項1に記載の測定方法。
【請求項15】
前記工程Dにおいて検出される変化が一つ以上の酸化還元物質の反応を介して得られる、請求項1に記載の測定方法。
【請求項16】
測定可能な前記測定対象物の濃度が5mMよりも大きい、請求項1に記載の測定方法。
【請求項17】
前記細胞外分泌型シトクロムと前記酵素が融合している、請求項1に記載の測定方法。
【請求項18】
前記酵素が、グルコース脱水素酵素、あるいはグルコース酸化酵素である、請求項17に記載の測定方法。
【請求項19】
前記細胞外分泌型シトクロムと前記酵素の融合体が、単一分子内に電子メディエータ機能と基質の酸化機能との両機能を有した融合体であって、下記(a)、(b)及び(c)のうち、(a)及び(b)を有することを特徴とする融合体、又は(a)及び(b)を有し、かつ(a)と(b)の間に(c)を有することを特徴とする融合体:
(a)細胞外分泌型シトクロムのアミノ酸配列
(b)グルコース酸化還元酵素のアミノ酸配列
(c)(a)のアミノ酸配列と(b)のアミノ酸配列とを結合するリンカー配列
である、請求項17に記載の測定方法。
【請求項20】
前記細胞外分泌型シトクロムと前記酵素の融合体が、以下の(a)、(b)又は(c)のポリペプチド:
(a)配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチド
(b)配列番号23、配列番号25、配列番号27又は配列番号29において、1個又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列から成り電子メディエータ機能及びグルコース酸化機能を有するポリペプチド
(c)配列番号23、配列番号25、配列番号27又は配列番号29のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能及びグルコース酸化機能を有するポリペプチド、である、請求項17に記載の測定方法。
【請求項21】
細胞外分泌型シトクロム、酵素、第1の電極、および第2の電極を用いる、測定対象物の測定方法であって、
F)前記酵素により前記測定対象物を酸化する工程、
G)前記工程Fにおいて前記酵素内に生じる電子を、前記第1の電極に担持された前記細胞外分泌型シトクロムにより受容する工程、
H)前記工程Gによって生じる前記細胞外分泌型シトクロムにおける電子を前記第1の電極により受容する工程、
I)前記工程Hによって前記第1の電極と前記第2の電極との間に流れる電流あるいは通電電荷量を検出する工程、
J)前記工程Iにおいて検出される電流あるいは通電電荷量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
【請求項22】
前記酵素が前記第1の電極に担持されている、請求項21に記載の測定方法。
【請求項23】
前記酵素と前記細胞外分泌型シトクロムが融合している、請求項21に記載の測定方法。
【請求項24】
前記酵素、前記細胞外分泌型シトクロム、あるいはそれらの融合体が高分子によって前記第1の電極に担持されている、請求項21に記載の測定方法。
【請求項25】
前記工程Hが前記第1の電極への電位の印加により誘起される、請求項21に記載の測定方法。
【請求項26】
前記第1の電極への電位の印加が前記第2の電極に対してなされる、請求項25に記載の測定方法。
【請求項27】
前記第2の電極が酸化還元性である、請求項26に記載の測定方法。
【請求項28】
前記第2の電極がAg/AgClである、請求項27に記載の測定方法。
【請求項29】
酸化還元性の第3の電極を更に用い、前記第1の電極への電位の印加が前記第3の電極に対してなされる、請求項25に記載の測定方法。
【請求項30】
前記第3の電極がAg/AgClである、請求項29に記載の測定方法。
【請求項31】
前記工程F、および前記工程Gが並行して実施される、請求項21に記載の測定方法。
【請求項32】
前記第1の電極への電位の印加が前記工程Fに先立って行われる、請求項21に記載の測定方法。
【請求項33】
細胞外分泌型シトクロム、および酵素を用いる、測定対象物の測定方法であって、
K)前記酵素により前記測定対象物を酸化する工程、
L)前記工程Kにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
M)前記工程Lによって生じる前記細胞外分泌型シトクロムの分光学的特性の変化を検出する工程、
N)前記工程Mにおいて検出される特性変化を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
【請求項34】
測定対象物の濃度あるいは量を測定するための電極であって、細胞外分泌型シトクロムおよび酵素が担持された電極。
【請求項35】
前記細胞外分泌型シトクロムおよび前記酵素が高分子によって担持された、請求項34記載の電極。
【請求項36】
前記細胞外分泌型シトクロムおよび前記酵素が融合している、請求項34記載の電極。
【請求項37】
前記電極がカーボン、金、白金、あるいはパラジウムのいずれかを含む、請求項34記載の電極。
【請求項38】
試料液中に含まれる測定対象物の測定をするためのセンサであって、
前記センサは、少なくとも、
i) 絶縁性の第1の基板、
ii) 前記第1の基板上に配置された第1および第2の電極、
iii)前記第1の電極の上に配置された試薬層、
iv) 前記第1の電極あるいは前記試薬層、および前記第2の電極と接する、試料液保持部から成り、前記試薬層は細胞外分泌型シトクロムを含み、前記試薬層あるいは前記試料液保持部のいずれかに酵素が配置された、センサ。
【請求項39】
前記第1および第2の電極のいずれかが、カーボン、金、白金、あるいはパラジウムのいずれかを含む、請求項38記載のセンサ。
【請求項40】
前記第2の電極が、酸化還元性の電極である、請求項38記載のセンサ。
【請求項41】
前記第2の電極が、Ag/AgClである、請求項40記載のセンサ。
【請求項42】
前記試薬層が前記第1の電極上にのみ配置されている、請求項38記載のセンサ。
【請求項43】
前記細胞外分泌型シトクロムと前記酵素が融合している、請求項38記載のセンサ。
【請求項44】
測定において用いられる、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい、請求項38に記載のセンサ。
【請求項45】
前記細胞外分泌型シトクロムが、糸状菌に属する菌、アスペルギルス属の菌、アスペルギルス・テレウス、あるいはアスペルギルス・オリゼのいずれかに由来する、請求項38に記載のセンサ。
【請求項46】
前記細胞外分泌型シトクロムが、 以下の(a)、(b)又は(c)のポリペプチドから成る、グルコース酸化還元酵素用電子メディエータ:
(a)配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチド
(b)配列番号2又は配列番号4のアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列から成り電子メディエータ機能を有するポリペプチド
(c)配列番号2又は配列番号4のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能を有するポリペプチド、である請求項38に記載のセンサ。
【請求項47】
前記細胞外分泌型シトクロムと前記酵素の融合体が、単一分子内に電子メディエータ機能と基質の酸化機能との両機能を有した融合体であって、下記(a)、(b)及び(c)のうち、(a)及び(b)を有することを特徴とする融合体、又は(a)及び(b)を有し、かつ(a)と(b)の間に(c)を有することを特徴とする融合体:
(a)細胞外分泌型シトクロムのアミノ酸配列
(b)グルコース酸化還元酵素のアミノ酸配列
(c)(a)のアミノ酸配列と(b)のアミノ酸配列とを結合するリンカー配列、である請求項43に記載のセンサ。
【請求項48】
前記細胞外分泌型シトクロムと前記酵素の融合体が請求項19に記載のポリペプチドである、請求項43に記載のセンサ。
【請求項49】
前記酵素が酸化還元酵素あるいは脱水素酵素である、請求項38に記載のセンサ。
【請求項50】
前記酵素がグルコースに作用する酵素である、請求項38に記載のセンサ。
【請求項51】
前記酵素がフラビンアデニンジヌクレオチド依存型である、請求項38に記載のセンサ。
【請求項52】
前記酵素がフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素である、請求項38に記載のセンサ。
【請求項53】
前記測定対象物がグルコースである、請求項38に記載のセンサ。
【請求項54】
請求項66に記載のセンサであって、更にv)切欠部を有する第2の基板を含み、前記第2の基板が前記試料液保持部の少なくとも一部を形成しているセンサ。
【請求項55】
前記切欠部の形状が矩形、あるいはU字型である、請求項54に記載のセンサ。
【請求項56】
請求項54に記載のセンサであって、更にvi)第3の基板を含み、前記第3の基板が前記試料液保持部の少なくとも一部を形成しているセンサ。
【請求項57】
測定可能な前記測定対象物の濃度が5mMよりも大きい、請求項38に記載のセンサ。
【請求項1】
細胞外分泌型シトクロム、酵素、および電子受容体を用いる、測定対象物の測定方法であって、
A)前記酵素により前記測定対象物を酸化する工程、
B)前記工程Aにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
C)前記工程Bによって生じる前記細胞外分泌型シトクロムにおける電子を前記電子受容体により受容する工程、
D)前記工程Cによって生じる前記電子受容体における変化を検出する工程、
E)前記工程Dにおいて検出される前記電子受容体における変化の量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
【請求項2】
測定において用いられる、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい、請求項1に記載の測定方法。
【請求項3】
前記細胞外分泌型シトクロムが糸状菌に属する菌由来である、請求項1に記載の測定方法。
【請求項4】
前記糸状菌がアスペルギルス属の菌である、請求項3に記載の測定方法。
【請求項5】
前記アスペルギルス属の菌がアスペルギルス・テレウス、またはアスペルギルス・オリゼである、請求項4に記載の測定方法。
【請求項6】
前記細胞外分泌型シトクロムが前記請求項6に記載の電子メディエータである、請求項1に記載の測定方法。
【請求項7】
前記酵素が酸化還元酵素あるいは脱水素酵素である、請求項1に記載の測定方法。
【請求項8】
前記酵素がグルコースに作用する酵素である、請求項1に記載の測定方法。
【請求項9】
前記酵素がフラビンアデニンジヌクレオチド依存型である、請求項1に記載の測定方法。
【請求項10】
前記酵素がフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素である、請求項1に記載の測定方法。
【請求項11】
前記測定対象物がグルコースである、請求項1に記載の測定方法。
【請求項12】
前記電子受容体が電極である、請求項1に記載の測定方法。
【請求項13】
前記電子受容体が酸化還元化合物である、請求項1に記載の測定方法。
【請求項14】
前記工程Dにおける検出が電流、通電電荷量、あるいは分光学的量によってなされる、請求項1に記載の測定方法。
【請求項15】
前記工程Dにおいて検出される変化が一つ以上の酸化還元物質の反応を介して得られる、請求項1に記載の測定方法。
【請求項16】
測定可能な前記測定対象物の濃度が5mMよりも大きい、請求項1に記載の測定方法。
【請求項17】
前記細胞外分泌型シトクロムと前記酵素が融合している、請求項1に記載の測定方法。
【請求項18】
前記酵素が、グルコース脱水素酵素、あるいはグルコース酸化酵素である、請求項17に記載の測定方法。
【請求項19】
前記細胞外分泌型シトクロムと前記酵素の融合体が、単一分子内に電子メディエータ機能と基質の酸化機能との両機能を有した融合体であって、下記(a)、(b)及び(c)のうち、(a)及び(b)を有することを特徴とする融合体、又は(a)及び(b)を有し、かつ(a)と(b)の間に(c)を有することを特徴とする融合体:
(a)細胞外分泌型シトクロムのアミノ酸配列
(b)グルコース酸化還元酵素のアミノ酸配列
(c)(a)のアミノ酸配列と(b)のアミノ酸配列とを結合するリンカー配列
である、請求項17に記載の測定方法。
【請求項20】
前記細胞外分泌型シトクロムと前記酵素の融合体が、以下の(a)、(b)又は(c)のポリペプチド:
(a)配列番号23、配列番号25、配列番号27又は配列番号29で示されるアミノ酸配列から成るポリペプチド
(b)配列番号23、配列番号25、配列番号27又は配列番号29において、1個又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列から成り電子メディエータ機能及びグルコース酸化機能を有するポリペプチド
(c)配列番号23、配列番号25、配列番号27又は配列番号29のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能及びグルコース酸化機能を有するポリペプチド、である、請求項17に記載の測定方法。
【請求項21】
細胞外分泌型シトクロム、酵素、第1の電極、および第2の電極を用いる、測定対象物の測定方法であって、
F)前記酵素により前記測定対象物を酸化する工程、
G)前記工程Fにおいて前記酵素内に生じる電子を、前記第1の電極に担持された前記細胞外分泌型シトクロムにより受容する工程、
H)前記工程Gによって生じる前記細胞外分泌型シトクロムにおける電子を前記第1の電極により受容する工程、
I)前記工程Hによって前記第1の電極と前記第2の電極との間に流れる電流あるいは通電電荷量を検出する工程、
J)前記工程Iにおいて検出される電流あるいは通電電荷量を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
【請求項22】
前記酵素が前記第1の電極に担持されている、請求項21に記載の測定方法。
【請求項23】
前記酵素と前記細胞外分泌型シトクロムが融合している、請求項21に記載の測定方法。
【請求項24】
前記酵素、前記細胞外分泌型シトクロム、あるいはそれらの融合体が高分子によって前記第1の電極に担持されている、請求項21に記載の測定方法。
【請求項25】
前記工程Hが前記第1の電極への電位の印加により誘起される、請求項21に記載の測定方法。
【請求項26】
前記第1の電極への電位の印加が前記第2の電極に対してなされる、請求項25に記載の測定方法。
【請求項27】
前記第2の電極が酸化還元性である、請求項26に記載の測定方法。
【請求項28】
前記第2の電極がAg/AgClである、請求項27に記載の測定方法。
【請求項29】
酸化還元性の第3の電極を更に用い、前記第1の電極への電位の印加が前記第3の電極に対してなされる、請求項25に記載の測定方法。
【請求項30】
前記第3の電極がAg/AgClである、請求項29に記載の測定方法。
【請求項31】
前記工程F、および前記工程Gが並行して実施される、請求項21に記載の測定方法。
【請求項32】
前記第1の電極への電位の印加が前記工程Fに先立って行われる、請求項21に記載の測定方法。
【請求項33】
細胞外分泌型シトクロム、および酵素を用いる、測定対象物の測定方法であって、
K)前記酵素により前記測定対象物を酸化する工程、
L)前記工程Kにおいて前記酵素内に生じる電子を、前記細胞外分泌型シトクロムにより受容する工程、
M)前記工程Lによって生じる前記細胞外分泌型シトクロムの分光学的特性の変化を検出する工程、
N)前記工程Mにおいて検出される特性変化を、前記測定対象物の量あるいは濃度と相関付ける工程、
を含む、測定方法。
【請求項34】
測定対象物の濃度あるいは量を測定するための電極であって、細胞外分泌型シトクロムおよび酵素が担持された電極。
【請求項35】
前記細胞外分泌型シトクロムおよび前記酵素が高分子によって担持された、請求項34記載の電極。
【請求項36】
前記細胞外分泌型シトクロムおよび前記酵素が融合している、請求項34記載の電極。
【請求項37】
前記電極がカーボン、金、白金、あるいはパラジウムのいずれかを含む、請求項34記載の電極。
【請求項38】
試料液中に含まれる測定対象物の測定をするためのセンサであって、
前記センサは、少なくとも、
i) 絶縁性の第1の基板、
ii) 前記第1の基板上に配置された第1および第2の電極、
iii)前記第1の電極の上に配置された試薬層、
iv) 前記第1の電極あるいは前記試薬層、および前記第2の電極と接する、試料液保持部から成り、前記試薬層は細胞外分泌型シトクロムを含み、前記試薬層あるいは前記試料液保持部のいずれかに酵素が配置された、センサ。
【請求項39】
前記第1および第2の電極のいずれかが、カーボン、金、白金、あるいはパラジウムのいずれかを含む、請求項38記載のセンサ。
【請求項40】
前記第2の電極が、酸化還元性の電極である、請求項38記載のセンサ。
【請求項41】
前記第2の電極が、Ag/AgClである、請求項40記載のセンサ。
【請求項42】
前記試薬層が前記第1の電極上にのみ配置されている、請求項38記載のセンサ。
【請求項43】
前記細胞外分泌型シトクロムと前記酵素が融合している、請求項38記載のセンサ。
【請求項44】
測定において用いられる、前記酵素に対する前記細胞外分泌型シトクロムの量が100倍より小さい、請求項38に記載のセンサ。
【請求項45】
前記細胞外分泌型シトクロムが、糸状菌に属する菌、アスペルギルス属の菌、アスペルギルス・テレウス、あるいはアスペルギルス・オリゼのいずれかに由来する、請求項38に記載のセンサ。
【請求項46】
前記細胞外分泌型シトクロムが、 以下の(a)、(b)又は(c)のポリペプチドから成る、グルコース酸化還元酵素用電子メディエータ:
(a)配列番号2又は配列番号4で示されるアミノ酸配列から成るポリペプチド
(b)配列番号2又は配列番号4のアミノ酸配列において、1個又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列から成り電子メディエータ機能を有するポリペプチド
(c)配列番号2又は配列番号4のアミノ酸配列と70%以上の相同性を有するアミノ酸配列から成り電子メディエータ機能を有するポリペプチド、である請求項38に記載のセンサ。
【請求項47】
前記細胞外分泌型シトクロムと前記酵素の融合体が、単一分子内に電子メディエータ機能と基質の酸化機能との両機能を有した融合体であって、下記(a)、(b)及び(c)のうち、(a)及び(b)を有することを特徴とする融合体、又は(a)及び(b)を有し、かつ(a)と(b)の間に(c)を有することを特徴とする融合体:
(a)細胞外分泌型シトクロムのアミノ酸配列
(b)グルコース酸化還元酵素のアミノ酸配列
(c)(a)のアミノ酸配列と(b)のアミノ酸配列とを結合するリンカー配列、である請求項43に記載のセンサ。
【請求項48】
前記細胞外分泌型シトクロムと前記酵素の融合体が請求項19に記載のポリペプチドである、請求項43に記載のセンサ。
【請求項49】
前記酵素が酸化還元酵素あるいは脱水素酵素である、請求項38に記載のセンサ。
【請求項50】
前記酵素がグルコースに作用する酵素である、請求項38に記載のセンサ。
【請求項51】
前記酵素がフラビンアデニンジヌクレオチド依存型である、請求項38に記載のセンサ。
【請求項52】
前記酵素がフラビンアデニンジヌクレオチド依存型グルコース脱水素酵素である、請求項38に記載のセンサ。
【請求項53】
前記測定対象物がグルコースである、請求項38に記載のセンサ。
【請求項54】
請求項66に記載のセンサであって、更にv)切欠部を有する第2の基板を含み、前記第2の基板が前記試料液保持部の少なくとも一部を形成しているセンサ。
【請求項55】
前記切欠部の形状が矩形、あるいはU字型である、請求項54に記載のセンサ。
【請求項56】
請求項54に記載のセンサであって、更にvi)第3の基板を含み、前記第3の基板が前記試料液保持部の少なくとも一部を形成しているセンサ。
【請求項57】
測定可能な前記測定対象物の濃度が5mMよりも大きい、請求項38に記載のセンサ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−132926(P2012−132926A)
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2012−22582(P2012−22582)
【出願日】平成24年2月4日(2012.2.4)
【分割の表示】特願2011−511473(P2011−511473)の分割
【原出願日】平成22年4月30日(2010.4.30)
【出願人】(000210067)池田食研株式会社 (35)
【Fターム(参考)】
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願日】平成24年2月4日(2012.2.4)
【分割の表示】特願2011−511473(P2011−511473)の分割
【原出願日】平成22年4月30日(2010.4.30)
【出願人】(000210067)池田食研株式会社 (35)
【Fターム(参考)】
[ Back to top ]

