蛋白質組成物の加水分解物を含有する抗酸化剤
【課題】高い抗酸化活性を有する抗酸化剤を提供。
【解決手段】大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物を含む、抗酸化剤。該加水分解物中の分子量500未満のペプチドの含量がペプチド及び遊離アミノ酸の合計量に対して50重量%以上である、抗酸化剤。該抗酸化剤を有効成分とする、細胞障害抑制剤。該抗酸化剤を有効成分とする、肝障害抑制剤。抗酸化剤の製造における、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物の使用方法。
【解決手段】大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物を含む、抗酸化剤。該加水分解物中の分子量500未満のペプチドの含量がペプチド及び遊離アミノ酸の合計量に対して50重量%以上である、抗酸化剤。該抗酸化剤を有効成分とする、細胞障害抑制剤。該抗酸化剤を有効成分とする、肝障害抑制剤。抗酸化剤の製造における、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物の使用方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、蛋白質組成物の加水分解物を含有する抗酸化剤、及び該加水分解物の抗酸化剤としての使用方法に関する。より詳しくは、蛋白質組成物は、大豆グリシニンを含有する蛋白質組成物である。
【背景技術】
【0002】
スーパーオキシドアニオンラジカル、ヒドロキシラジカル、過酸化水素等の活性酸素種は、生体内のエネルギー代謝の過程で発生する。その反応は生命の維持に必須のものであるが、その反応性の高さゆえに分解しきれず過剰に存在すると細胞に損傷を与える。例えば、活性酸素種は、脂質、核酸、酵素その他のタンパク質等を標的に反応し、酸化変性させて、老化、ガン、動脈硬化等多くの疾患を発症させる。そこで、この活性酸素種を除去し、酸化から生体を防御する抗酸化物質が注目されている。中でも、食品由来の抗酸化物質摂取は、その安全性の点から健康維持に重要と考えられてきている。
【0003】
大豆、大豆蛋白質及び大豆蛋白質加水分解物は、多くの生理機能を有していることが報告されており、抗酸化活性についても報告されている。例えば、特許文献1には、大豆蛋白質の、平均分子量が500〜5000である抗酸化力を示す加水分解物が記載されている。特許文献2には、抗酸化活性を有する大豆蛋白質加水分解物として、バチルス・ズブチリスやアスペルギルス・オリゼ等種々のプロテアーゼによる加水分解物が記載されており、該加水分解物は分子量が2000以下のものをろ取すること、該加水分解物の遊離アミノ酸の含有割合が20〜30重量%であることが記されている。また、特許文献3にはそれぞれの大豆蛋白質やその画分に抗酸化効果があることが記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平10−203994号公報
【特許文献2】特開2003−210138号公報
【特許文献3】特開2003−321381号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
特許文献1〜3に記載の抗酸化活性を示す大豆蛋白質や大豆蛋白質加水分解物は、一定の抗酸化活性を有すると認められる。しかしながら、これらを抗酸化剤として食品や医薬品に適用するにあたっては、さらに高い抗酸化活性が必要とされる。そこで、本発明は、高い抗酸化活性を有する抗酸化剤を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、上記の課題に対して鋭意研究を重ねた結果、大豆グリシニンを高い割合で含有する蛋白質組成物の加水分解物が、従来よりも高い抗酸化活性を示すことを見出し、本発明を完成するに至った。
【0007】
即ち、本発明は、以下の(1)〜(5)を提供する。
(1)大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物を含む、抗酸化剤。
(2)上記加水分解物中の分子量500未満のペプチドの含量がペプチド及び遊離アミノ酸の合計量に対して50重量%以上である、上記(1)に記載の抗酸化剤。
(3)上記(1)又は(2)に記載の抗酸化剤を有効成分とする、細胞障害抑制剤。
(4)上記(1)又は(2)に記載の抗酸化剤を有効成分とする、肝障害抑制剤。
(5)抗酸化剤の製造における、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物の使用方法。
【発明の効果】
【0008】
本発明によれば、高い抗酸化活性を有する抗酸化剤を提供することができる。
【図面の簡単な説明】
【0009】
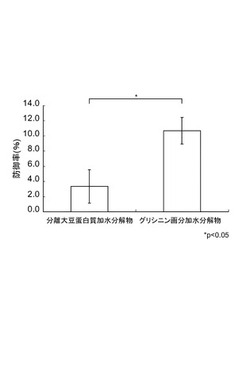
【図1】肝ガン細胞の、t−ブチルヒドロペルオキシド(TBH)誘導酸化ストレスに対する防御率を示す図である。
【発明を実施するための形態】
【0010】
以下、本発明を具体的に説明する。
【0011】
(大豆グリシニン)
本発明に係る加水分解物は、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物を加水分解したものである。大豆に含まれる蛋白質は、超遠心分析による沈降係数から、2S,7S,11S及び15Sの各グロブリン画分に分類され、このうち、7Sグロブリン画分と11Sグロブリン画分は主要な構成蛋白質成分である。グリシニンは11Sグロブリン画分に豊富に含まれている。したがって、本明細書においては、11Sグロブリン画分を「グリシニン画分」と規定する。
【0012】
(蛋白質組成物)
本発明に係る蛋白質組成物は、大豆グリシニンを蛋白質組成物中の総蛋白質の60重量%以上含んでいる。大豆グリシニンの含有量は総蛋白質の70重量%以上であることが好ましく、75重量%以上であることがより好ましく、80重量%以上であることがさらに好ましい。本発明の蛋白質組成物は、主に大豆由来の蛋白質を含むが、大豆由来以外の蛋白質を含んでいてもよい。また、蛋白質以外の物質、例えば、糖、脂質、ペプチドやアミノ酸等を含んでいてもよい。
【0013】
(蛋白質組成物の調整法)
本発明で使用される、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物は、一般的な蛋白質組成の大豆から蛋白質を抽出、濃縮し、グリシニン画分を分画する方法により調製される。そのような方法としては、例えば、大豆蛋白質にフィチン酸分解活性を有する酵素または酵素剤を作用させてグリシニン画分を分画する方法(国際公開00/58492号パンフレット参照)、大豆蛋白質を含む溶液を微酸性条件下で加温してグリシニン画分を分画する方法(国際公開02/028198号パンフレット参照)、又は、Thahn,V.H.ら、Food.Chem.、24、117、1976に記載の方法等が挙げられるが、どのような方法によって分画してもよい。また、育種や遺伝子組み換え技術等によりグリシニン画分を濃縮した大豆から上述の方法等で分画してもよい。
【0014】
(加水分解物)
本発明に係る蛋白質組成物の加水分解物は、上記蛋白質組成物をプロテアーゼ処理することによって得られるペプチド混合物であることが好ましい。該加水分解物は分解度がより高いことが好ましく、特に加水分解物中におけるペプチド及び遊離アミノ酸の合計量に占める分子量500未満のペプチドの割合が高いことが好ましい。具体的には、加水分解物中の分子量500未満のペプチドの含量がペプチド及び遊離アミノ酸の合計量に対して50重量%以上であることが重要であり、60重量%以上であることがさらに好ましい。
【0015】
この分子量500未満のペプチドは、アミノ酸が2〜3分子結合したジペプチド及びトリペプチドから実質的に構成されるものである。分子量500未満のペプチドの含量は、蛋白質組成物の加水分解物における分子量500未満のペプチド及び遊離アミノ酸の画分の割合をペプチド用ゲルろ過クロマトグラフィーにより測定した後、アミノ酸分析により算出した該加水分解物中の遊離アミノ酸含量を差し引くことにより算出するものとする。
【0016】
上記加水分解物は分子量500未満のペプチド以外のペプチド及び遊離アミノ酸の割合をできるだけ低減したものが好ましい。すなわち、加水分解物中の遊離アミノ酸含量はペプチド及び遊離アミノ酸の合計量に対して12重量%以下であることが好ましく、5重量%以下であることがより好ましく、3重量%以下がさらに好ましい。
さらに、該加水分解物中のペプチド体はより低分子であることが望ましいことから、加水分解物中の分子量500以上の画分の割合がペプチド及び遊離アミノ酸の合計量に対して40重量%未満であることが好ましく、38重量%以下であることがより好ましく、35重量%以下がさらに好ましい。
【0017】
(プロテアーゼ)
本発明に係る蛋白質組成物の加水分解物を得るために使用するプロテアーゼは、動物起源、植物起源又は微生物起源を問わず、プロテアーゼの分類において「金属プロテアーゼ」、「酸性プロテアーゼ」、「チオールプロテアーゼ」、「セリンプロテアーゼ」に分類されるプロテアーゼ、好ましくは「金属プロテアーゼ」、「チオールプロテアーゼ」、「セリンプロテアーゼ」に分類されるプロテアーゼの中から適宜選択することができる。特に2種類以上、あるいは3種類以上の異なった分類に属する酵素を、順次若しくは同時に作用させる分解方法が分子量500未満のペプチドの割合を増加させることができ、好ましい。
【0018】
このプロテアーゼの分類は、酵素科学の分野において通常行なわれている活性中心のアミノ酸の種類による分類方法である。各々の代表として「金属プロテアーゼ」にはBacillus由来中性プロテアーゼ、Streptomyces由来中性プロテアーゼ、Aspergillus由来中性プロテアーゼ、『サモアーゼ』等が挙げられ、「酸性プロテアーゼ」にはペプシン、Aspergillus由来酸性プロテアーゼ、『スミチームFP』等が挙げられ、「チオールプロテアーゼ」にはブロメライン、パパイン等が挙げられ、「セリンプロテアーゼ」にはトリプシン、キモトリプシン、ズブチリシン、Streptomyces由来アルカリプロテアーゼ、『アルカラーゼ』、『ビオプラーゼ』等が挙げられる。これら以外の酵素でも作用pHや阻害剤との反応性により、その分類を確認することができる。活性中心が異なる酵素間では、基質への作用部位が大きく異なるため、「切れ残り」を減らし、効率よく酵素分解物を得ることができる。また、異なった起源の(起源生物)の酵素を併用することで、更に効率よく酵素分解物を製造することができる。同分類でも起源が異なれば、基質である蛋白質への作用部位も異なり、結果として分子量500未満のペプチドの割合を増やすことができる。これらプロテアーゼはエキソプロテアーゼ活性が少ないことが好ましい。
【0019】
プロテアーゼ処理の反応pHや反応温度は、用いるプロテアーゼの特性に合わせて設定すれば良く、通常、反応pHは至適pH付近で行ない、反応温度は至適温度付近で行なえば良い。概ね反応温度は20〜80℃、好ましくは40〜60℃である。反応後は酵素を失活させるのに十分な温度(60〜170℃程度)まで加熱し、残存酵素活性を失活させる。
【0020】
プロテアーゼ処理後の反応液は、そのまま又は濃縮して用いることもできるが、通常、殺菌し、噴霧乾燥、凍結乾燥等して乾燥粉末の状態で利用する。殺菌は、加熱殺菌が好ましく、加熱温度は110〜170℃が好ましく、130〜170℃が更に好ましい。加熱時間は3〜20秒間が好ましい。また、反応液を任意のpHに調整してもよい。加熱殺菌は前述した酵素失活処理を兼ねることもできる。プロテアーゼ処理時やpH調整時に発生する不溶物(沈殿物や懸濁物)を遠心分離やろ過等により除去してもよい。不溶物の除去は、得られる加水分解物の抗酸化活性を向上させることができるため、好ましい。更に活性炭や吸着樹脂により精製してもよい。
【0021】
(抗酸化作用)
本発明に係る大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物は、高い抗酸化活性を有する。そのため、該加水分解物を有効成分とする抗酸化剤として使用することができる。該抗酸化剤は生体に対しても有効に働き、酸化ストレス由来の細胞障害を抑制する。その結果、酸化ストレス由来の細胞障害が原因となる老化、ガン、動脈硬化等多くの疾患が予防され、又は、疾患の進行が抑制される。したがって、該抗酸化剤は、これを有効成分とする細胞障害抑制剤として利用することができ、このような細胞障害抑制剤によれば、上記細胞障害が原因となる疾患を予防又は治療することができる。また、該抗酸化剤は特に肝細胞に対して有効に働き、該抗酸化剤を有効成分とする肝障害抑制剤として利用することができる。このような肝障害抑制剤によれば肝障害を予防又は治療することができる。
【0022】
(医薬品や飲食品における利用)
本発明に係る、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物を含む抗酸化剤は、医薬品や飲食品として、または医薬品や飲食品の添加剤等として利用することができる。
医薬品として利用する場合、その製剤形態としては種々の形態を取り得、例えば粉末状、液状、錠剤、カプセル等様々な形態で使用することができる。
また、飲食品として利用する場合、その形態としては、生理機能としての抗酸化力が発揮される飲料、タブレット、フードバー、サラダ用ドレッシング、肉製品、スナック菓子、デザート、菓子類及び栄養補助剤等、種々の形態を取り得る。また、飲食品自体の酸化防止を目的として種々の飲食品に添加することもできる。
【実施例】
【0023】
以下に本発明の実施例を示し、本発明を詳細に説明するが、本発明の技術範囲は以下の実施例に限定されるものではない。
【0024】
(製造例)グリシニン画分の調製
M Samotoら、Food Chemistry、102、317−322、2007に記載の方法に準じて以下の通りグリシニン画分を調製した。
低変性脱脂大豆に加熱処理を施して水溶性窒素指数(NSI)を低下させた(NSI 70%)。なお、NSIはAOCS(American Oil Chemist’s Society)の公式分析法BA−11−65 NSIに基づく。脱脂大豆(NSI 70%)に15重量倍の温水を加えて調製した温水抽出スラリーを、遠心分離機に供してオカラ画分を除き、脱脂豆乳とした。
次に、脱脂豆乳のpHを5.8に調整して遠心分離機に供し、沈殿カード画分を回収した。この画分が11Sグロブリンの画分であり、グリシニン画分である。得られた画分を中和して、120℃で10秒間加熱殺菌を行った。
加熱殺菌後の画分をSDS−電気泳動法で展開分離し、CBB蛋白質染色後、デンシトメトリー測定によるピークエリアを求めた。得られた総ピークエリアを100%としたときのグリシニンのピークエリアの比率から、グリシニン画分中のグリシニン含量を算出し、総蛋白質に対するグリシニンの含有量を求めた(表1)。
【0025】
(比較製造例)分離大豆蛋白質の調製
製造例とは別に、低変性脱脂大豆から以下のようにして分離大豆蛋白質を調製した。
低変性脱脂大豆に15重量倍の温水を加えて調製した温水抽出スラリーを、遠心分離機に供してオカラ画分を除き、脱脂豆乳とした。
次に、得られた脱脂豆乳のpHを4.5に調整して等電点沈殿し、遠心分離機に供して酸沈殿カードを得た。得られた画分を中和して、120℃で10秒間加熱殺菌を行った。
加熱殺菌後の画分を、SDS−電気泳動法で展開分離し、CBB蛋白質染色後、デンシトメトリー測定によるピークエリアを求めた。得られた総ピークエリアを100%としたときのグリシニンのピークエリアの比率から、分離大豆蛋白質のグリシニン含量を算出し、総蛋白質に対するグリシニンの含有量を求めた(表1)。
【0026】
【表1】

【0027】
(蛋白質組成物の加水分解物の調製)
製造例で得られたグリシニン画分及び比較製造例で得られた分離大豆蛋白質の各蛋白質組成物を以下のようにプロテアーゼにより処理し、加水分解物を調製した。
各蛋白質組成物の3重量%溶液に対して、『サモアーゼ』(起源;Bacillus thermoproteolyticus、金属プロテアーゼ、大和化成)を対蛋白質あたり2重量%加え、pH9.0、58℃で60分間作用させた。
次に、『ビオプラーゼ』(起源;Bacillus sp.、セリンプロテアーゼ、ナガセケムテック)を対蛋白質当たり1重量%加え、pH7.5、58℃で60分間作用させた。
次に、『スミチームFP』(起源;Asprgillus sp.、金属プロテアーゼ、新日本化学工業)を対蛋白質当たり1重量%加え、pH7.5、58℃で60分間作用させた。
以上の酵素反応後、酵素反応液を90℃、20分間加熱処理して反応を停止させた後、凍結乾燥し、製造例及び比較製造例それぞれの蛋白質組成物の加水分解物試料とした。
【0028】
(蛋白質含量(CP)の測定)
105℃、12時間乾燥した各加水分解物試料の乾燥重量に対する粗蛋白質量をケルダール法により測定した。表2に粗蛋白質量の含量を重量%で表す。なお、窒素係数は6.25とした。
【0029】
【表2】

【0030】
(分子量500未満のペプチド含量)
各加水分解物の分子量分布を、以下のゲルろ過カラムを用いたHPLC法により測定した。
ペプチド用ゲルろ過カラムを用いたHPLCシステムを組み、分子量マーカーとなる既知のペプチドを供し、分子量と保持時間の関係において検量線を求めた。
なお、分子量マーカーは、オクタペプチドとして[β−Asp]−Angiotensin IIのβ−Asp−Arg−Val−Tyr−Ile−His−Pro−PHe(分子量1046)、ヘキサペプチドとしてAngiotensin IVのVal−Tyr−Ile−His−Pro−PHe(分子量775)、ペンタペプチドとしてLeu−EnkepHalinのTyr−Gly−Gly−PHe−Leu(分子量555)、トリペプチドとしてGlu−Glu−Glu(分子量405)、遊離アミノ酸としてPro(分子量115)を用いた。
各加水分解物試料(1%)を10000rpm、10分間遠心分離し、上清をゲルろ過用溶媒で2倍に希釈し、その5μlをHPLCに供した。
加水分解物試料中の、遊離アミノ酸及び分子量500未満のペプチド画分の割合(%)を、全体の吸光度のチャート面積に対する、分子量500未満の範囲(時間範囲)の面積の割合によって求めた(使用カラム:Superdex Peptide 7.5/300GL(GEヘルスケア・ジャパン株式会社製)、溶媒:1%SDS/10mMリン酸緩衝液、pH8.0、カラム温度25℃、流速0.25ml/min、検出波長:220nm)。
【0031】
次に、アミノ酸分析により各加水分解物中の遊離アミノ酸含量の測定を行った。
加水分解物(4mg/ml)を等量の3%スルホサリチル酸に加え、室温で15分間振とうした。10000rpmで10分間遠心分離し、上清を0.45μmフィルターでろ過し、アミノ酸分析器(日本電子製 JLC500V)にて、遊離アミノ酸を測定した。加水分解物中の遊離アミノ酸含量は、ケルダール法にて得られた蛋白質含量に対する割合として算出した。
以上より得られた「遊離アミノ酸及び分子量500未満のペプチド画分の割合」から「遊離アミノ酸含量」を差し引いた値を、加水分解物中の「分子量500未満のペプチド含量」とした。結果を表3に示す。
【0032】
【表3】

【0033】
(抗酸化活性の評価)
分離大豆蛋白質及びグリシニン画分の各加水分解物の抗酸化活性を評価するために、培養細胞に対する検討を行った。
培養細胞に用いる細胞株としてヒト肝ガン細胞であるHepG2細胞(理研バンクより購入)を用いた。培養は10%FBSを含むDMEM培地にて行い、培地には終濃度100IU/mlペニシリン及び100μg/mlストレプトマイシンを添加した。培養は37℃、5%CO2条件下で行った。
HepG2細胞を96wellプレートに10000cells/wellで播種し、24時間前培養した後、1mg/mlの各加水分解物試料を含む培地に交換し、24時間培養した。その後、酸化ストレスを誘導するために、終濃度120mMになるようにt−ブチルヒドロペルオキシド(TBH)を添加して、2時間曝露した。
培養終了後に、Cell−Counting Kit−8(同仁化学研究所)を用いて、生細胞数を測定した。また、WST−8試薬を10μlずつ添加し、450nmにて吸光度を測定した。
肝ガン細胞の酸化ストレスに対する防御率を、
防御率(%)=((細胞培養培地+TBHの吸光度)−(培地+TBHの吸光度))/((培地のみの吸光度)−(培地+TBHの吸光度))×100 により算出した。
有意差検定はDr.SPSS II(SPSS社製)を使用し、二群間の検定をstudenntのt検定により評価した。
【0034】
結果を図1に示す。図1中、「グリシニン画分加水分解物」及び「分離大豆蛋白質加水分解物」は、製造例(グリシニン画分)及び比較製造例(分離大豆蛋白質)の各蛋白質組成物の加水分解物を加えた培地における、肝ガン細胞の酸化ストレスに対する防御率を示す。
グリシニン画分の加水分解物を添加した細胞の方が、分離大豆蛋白質の加水分解物を添加した細胞に比べて、酸化ストレスに対して高い防御率を有することが確認された。
【0035】
このように、ヒト肝ガン細胞(HepG2)において、グリシニン画分の加水分解物は、TBH処理による酸化ストレスからの強い保護作用を示した。これは、グリシニン画分の加水分解物が、TBHが代謝される際に生成するヒドロキシラジカルを除去し、細胞死を抑制しているのだと考えられる。
【技術分野】
【0001】
本発明は、蛋白質組成物の加水分解物を含有する抗酸化剤、及び該加水分解物の抗酸化剤としての使用方法に関する。より詳しくは、蛋白質組成物は、大豆グリシニンを含有する蛋白質組成物である。
【背景技術】
【0002】
スーパーオキシドアニオンラジカル、ヒドロキシラジカル、過酸化水素等の活性酸素種は、生体内のエネルギー代謝の過程で発生する。その反応は生命の維持に必須のものであるが、その反応性の高さゆえに分解しきれず過剰に存在すると細胞に損傷を与える。例えば、活性酸素種は、脂質、核酸、酵素その他のタンパク質等を標的に反応し、酸化変性させて、老化、ガン、動脈硬化等多くの疾患を発症させる。そこで、この活性酸素種を除去し、酸化から生体を防御する抗酸化物質が注目されている。中でも、食品由来の抗酸化物質摂取は、その安全性の点から健康維持に重要と考えられてきている。
【0003】
大豆、大豆蛋白質及び大豆蛋白質加水分解物は、多くの生理機能を有していることが報告されており、抗酸化活性についても報告されている。例えば、特許文献1には、大豆蛋白質の、平均分子量が500〜5000である抗酸化力を示す加水分解物が記載されている。特許文献2には、抗酸化活性を有する大豆蛋白質加水分解物として、バチルス・ズブチリスやアスペルギルス・オリゼ等種々のプロテアーゼによる加水分解物が記載されており、該加水分解物は分子量が2000以下のものをろ取すること、該加水分解物の遊離アミノ酸の含有割合が20〜30重量%であることが記されている。また、特許文献3にはそれぞれの大豆蛋白質やその画分に抗酸化効果があることが記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平10−203994号公報
【特許文献2】特開2003−210138号公報
【特許文献3】特開2003−321381号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
特許文献1〜3に記載の抗酸化活性を示す大豆蛋白質や大豆蛋白質加水分解物は、一定の抗酸化活性を有すると認められる。しかしながら、これらを抗酸化剤として食品や医薬品に適用するにあたっては、さらに高い抗酸化活性が必要とされる。そこで、本発明は、高い抗酸化活性を有する抗酸化剤を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、上記の課題に対して鋭意研究を重ねた結果、大豆グリシニンを高い割合で含有する蛋白質組成物の加水分解物が、従来よりも高い抗酸化活性を示すことを見出し、本発明を完成するに至った。
【0007】
即ち、本発明は、以下の(1)〜(5)を提供する。
(1)大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物を含む、抗酸化剤。
(2)上記加水分解物中の分子量500未満のペプチドの含量がペプチド及び遊離アミノ酸の合計量に対して50重量%以上である、上記(1)に記載の抗酸化剤。
(3)上記(1)又は(2)に記載の抗酸化剤を有効成分とする、細胞障害抑制剤。
(4)上記(1)又は(2)に記載の抗酸化剤を有効成分とする、肝障害抑制剤。
(5)抗酸化剤の製造における、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物の使用方法。
【発明の効果】
【0008】
本発明によれば、高い抗酸化活性を有する抗酸化剤を提供することができる。
【図面の簡単な説明】
【0009】
【図1】肝ガン細胞の、t−ブチルヒドロペルオキシド(TBH)誘導酸化ストレスに対する防御率を示す図である。
【発明を実施するための形態】
【0010】
以下、本発明を具体的に説明する。
【0011】
(大豆グリシニン)
本発明に係る加水分解物は、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物を加水分解したものである。大豆に含まれる蛋白質は、超遠心分析による沈降係数から、2S,7S,11S及び15Sの各グロブリン画分に分類され、このうち、7Sグロブリン画分と11Sグロブリン画分は主要な構成蛋白質成分である。グリシニンは11Sグロブリン画分に豊富に含まれている。したがって、本明細書においては、11Sグロブリン画分を「グリシニン画分」と規定する。
【0012】
(蛋白質組成物)
本発明に係る蛋白質組成物は、大豆グリシニンを蛋白質組成物中の総蛋白質の60重量%以上含んでいる。大豆グリシニンの含有量は総蛋白質の70重量%以上であることが好ましく、75重量%以上であることがより好ましく、80重量%以上であることがさらに好ましい。本発明の蛋白質組成物は、主に大豆由来の蛋白質を含むが、大豆由来以外の蛋白質を含んでいてもよい。また、蛋白質以外の物質、例えば、糖、脂質、ペプチドやアミノ酸等を含んでいてもよい。
【0013】
(蛋白質組成物の調整法)
本発明で使用される、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物は、一般的な蛋白質組成の大豆から蛋白質を抽出、濃縮し、グリシニン画分を分画する方法により調製される。そのような方法としては、例えば、大豆蛋白質にフィチン酸分解活性を有する酵素または酵素剤を作用させてグリシニン画分を分画する方法(国際公開00/58492号パンフレット参照)、大豆蛋白質を含む溶液を微酸性条件下で加温してグリシニン画分を分画する方法(国際公開02/028198号パンフレット参照)、又は、Thahn,V.H.ら、Food.Chem.、24、117、1976に記載の方法等が挙げられるが、どのような方法によって分画してもよい。また、育種や遺伝子組み換え技術等によりグリシニン画分を濃縮した大豆から上述の方法等で分画してもよい。
【0014】
(加水分解物)
本発明に係る蛋白質組成物の加水分解物は、上記蛋白質組成物をプロテアーゼ処理することによって得られるペプチド混合物であることが好ましい。該加水分解物は分解度がより高いことが好ましく、特に加水分解物中におけるペプチド及び遊離アミノ酸の合計量に占める分子量500未満のペプチドの割合が高いことが好ましい。具体的には、加水分解物中の分子量500未満のペプチドの含量がペプチド及び遊離アミノ酸の合計量に対して50重量%以上であることが重要であり、60重量%以上であることがさらに好ましい。
【0015】
この分子量500未満のペプチドは、アミノ酸が2〜3分子結合したジペプチド及びトリペプチドから実質的に構成されるものである。分子量500未満のペプチドの含量は、蛋白質組成物の加水分解物における分子量500未満のペプチド及び遊離アミノ酸の画分の割合をペプチド用ゲルろ過クロマトグラフィーにより測定した後、アミノ酸分析により算出した該加水分解物中の遊離アミノ酸含量を差し引くことにより算出するものとする。
【0016】
上記加水分解物は分子量500未満のペプチド以外のペプチド及び遊離アミノ酸の割合をできるだけ低減したものが好ましい。すなわち、加水分解物中の遊離アミノ酸含量はペプチド及び遊離アミノ酸の合計量に対して12重量%以下であることが好ましく、5重量%以下であることがより好ましく、3重量%以下がさらに好ましい。
さらに、該加水分解物中のペプチド体はより低分子であることが望ましいことから、加水分解物中の分子量500以上の画分の割合がペプチド及び遊離アミノ酸の合計量に対して40重量%未満であることが好ましく、38重量%以下であることがより好ましく、35重量%以下がさらに好ましい。
【0017】
(プロテアーゼ)
本発明に係る蛋白質組成物の加水分解物を得るために使用するプロテアーゼは、動物起源、植物起源又は微生物起源を問わず、プロテアーゼの分類において「金属プロテアーゼ」、「酸性プロテアーゼ」、「チオールプロテアーゼ」、「セリンプロテアーゼ」に分類されるプロテアーゼ、好ましくは「金属プロテアーゼ」、「チオールプロテアーゼ」、「セリンプロテアーゼ」に分類されるプロテアーゼの中から適宜選択することができる。特に2種類以上、あるいは3種類以上の異なった分類に属する酵素を、順次若しくは同時に作用させる分解方法が分子量500未満のペプチドの割合を増加させることができ、好ましい。
【0018】
このプロテアーゼの分類は、酵素科学の分野において通常行なわれている活性中心のアミノ酸の種類による分類方法である。各々の代表として「金属プロテアーゼ」にはBacillus由来中性プロテアーゼ、Streptomyces由来中性プロテアーゼ、Aspergillus由来中性プロテアーゼ、『サモアーゼ』等が挙げられ、「酸性プロテアーゼ」にはペプシン、Aspergillus由来酸性プロテアーゼ、『スミチームFP』等が挙げられ、「チオールプロテアーゼ」にはブロメライン、パパイン等が挙げられ、「セリンプロテアーゼ」にはトリプシン、キモトリプシン、ズブチリシン、Streptomyces由来アルカリプロテアーゼ、『アルカラーゼ』、『ビオプラーゼ』等が挙げられる。これら以外の酵素でも作用pHや阻害剤との反応性により、その分類を確認することができる。活性中心が異なる酵素間では、基質への作用部位が大きく異なるため、「切れ残り」を減らし、効率よく酵素分解物を得ることができる。また、異なった起源の(起源生物)の酵素を併用することで、更に効率よく酵素分解物を製造することができる。同分類でも起源が異なれば、基質である蛋白質への作用部位も異なり、結果として分子量500未満のペプチドの割合を増やすことができる。これらプロテアーゼはエキソプロテアーゼ活性が少ないことが好ましい。
【0019】
プロテアーゼ処理の反応pHや反応温度は、用いるプロテアーゼの特性に合わせて設定すれば良く、通常、反応pHは至適pH付近で行ない、反応温度は至適温度付近で行なえば良い。概ね反応温度は20〜80℃、好ましくは40〜60℃である。反応後は酵素を失活させるのに十分な温度(60〜170℃程度)まで加熱し、残存酵素活性を失活させる。
【0020】
プロテアーゼ処理後の反応液は、そのまま又は濃縮して用いることもできるが、通常、殺菌し、噴霧乾燥、凍結乾燥等して乾燥粉末の状態で利用する。殺菌は、加熱殺菌が好ましく、加熱温度は110〜170℃が好ましく、130〜170℃が更に好ましい。加熱時間は3〜20秒間が好ましい。また、反応液を任意のpHに調整してもよい。加熱殺菌は前述した酵素失活処理を兼ねることもできる。プロテアーゼ処理時やpH調整時に発生する不溶物(沈殿物や懸濁物)を遠心分離やろ過等により除去してもよい。不溶物の除去は、得られる加水分解物の抗酸化活性を向上させることができるため、好ましい。更に活性炭や吸着樹脂により精製してもよい。
【0021】
(抗酸化作用)
本発明に係る大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物は、高い抗酸化活性を有する。そのため、該加水分解物を有効成分とする抗酸化剤として使用することができる。該抗酸化剤は生体に対しても有効に働き、酸化ストレス由来の細胞障害を抑制する。その結果、酸化ストレス由来の細胞障害が原因となる老化、ガン、動脈硬化等多くの疾患が予防され、又は、疾患の進行が抑制される。したがって、該抗酸化剤は、これを有効成分とする細胞障害抑制剤として利用することができ、このような細胞障害抑制剤によれば、上記細胞障害が原因となる疾患を予防又は治療することができる。また、該抗酸化剤は特に肝細胞に対して有効に働き、該抗酸化剤を有効成分とする肝障害抑制剤として利用することができる。このような肝障害抑制剤によれば肝障害を予防又は治療することができる。
【0022】
(医薬品や飲食品における利用)
本発明に係る、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物を含む抗酸化剤は、医薬品や飲食品として、または医薬品や飲食品の添加剤等として利用することができる。
医薬品として利用する場合、その製剤形態としては種々の形態を取り得、例えば粉末状、液状、錠剤、カプセル等様々な形態で使用することができる。
また、飲食品として利用する場合、その形態としては、生理機能としての抗酸化力が発揮される飲料、タブレット、フードバー、サラダ用ドレッシング、肉製品、スナック菓子、デザート、菓子類及び栄養補助剤等、種々の形態を取り得る。また、飲食品自体の酸化防止を目的として種々の飲食品に添加することもできる。
【実施例】
【0023】
以下に本発明の実施例を示し、本発明を詳細に説明するが、本発明の技術範囲は以下の実施例に限定されるものではない。
【0024】
(製造例)グリシニン画分の調製
M Samotoら、Food Chemistry、102、317−322、2007に記載の方法に準じて以下の通りグリシニン画分を調製した。
低変性脱脂大豆に加熱処理を施して水溶性窒素指数(NSI)を低下させた(NSI 70%)。なお、NSIはAOCS(American Oil Chemist’s Society)の公式分析法BA−11−65 NSIに基づく。脱脂大豆(NSI 70%)に15重量倍の温水を加えて調製した温水抽出スラリーを、遠心分離機に供してオカラ画分を除き、脱脂豆乳とした。
次に、脱脂豆乳のpHを5.8に調整して遠心分離機に供し、沈殿カード画分を回収した。この画分が11Sグロブリンの画分であり、グリシニン画分である。得られた画分を中和して、120℃で10秒間加熱殺菌を行った。
加熱殺菌後の画分をSDS−電気泳動法で展開分離し、CBB蛋白質染色後、デンシトメトリー測定によるピークエリアを求めた。得られた総ピークエリアを100%としたときのグリシニンのピークエリアの比率から、グリシニン画分中のグリシニン含量を算出し、総蛋白質に対するグリシニンの含有量を求めた(表1)。
【0025】
(比較製造例)分離大豆蛋白質の調製
製造例とは別に、低変性脱脂大豆から以下のようにして分離大豆蛋白質を調製した。
低変性脱脂大豆に15重量倍の温水を加えて調製した温水抽出スラリーを、遠心分離機に供してオカラ画分を除き、脱脂豆乳とした。
次に、得られた脱脂豆乳のpHを4.5に調整して等電点沈殿し、遠心分離機に供して酸沈殿カードを得た。得られた画分を中和して、120℃で10秒間加熱殺菌を行った。
加熱殺菌後の画分を、SDS−電気泳動法で展開分離し、CBB蛋白質染色後、デンシトメトリー測定によるピークエリアを求めた。得られた総ピークエリアを100%としたときのグリシニンのピークエリアの比率から、分離大豆蛋白質のグリシニン含量を算出し、総蛋白質に対するグリシニンの含有量を求めた(表1)。
【0026】
【表1】

【0027】
(蛋白質組成物の加水分解物の調製)
製造例で得られたグリシニン画分及び比較製造例で得られた分離大豆蛋白質の各蛋白質組成物を以下のようにプロテアーゼにより処理し、加水分解物を調製した。
各蛋白質組成物の3重量%溶液に対して、『サモアーゼ』(起源;Bacillus thermoproteolyticus、金属プロテアーゼ、大和化成)を対蛋白質あたり2重量%加え、pH9.0、58℃で60分間作用させた。
次に、『ビオプラーゼ』(起源;Bacillus sp.、セリンプロテアーゼ、ナガセケムテック)を対蛋白質当たり1重量%加え、pH7.5、58℃で60分間作用させた。
次に、『スミチームFP』(起源;Asprgillus sp.、金属プロテアーゼ、新日本化学工業)を対蛋白質当たり1重量%加え、pH7.5、58℃で60分間作用させた。
以上の酵素反応後、酵素反応液を90℃、20分間加熱処理して反応を停止させた後、凍結乾燥し、製造例及び比較製造例それぞれの蛋白質組成物の加水分解物試料とした。
【0028】
(蛋白質含量(CP)の測定)
105℃、12時間乾燥した各加水分解物試料の乾燥重量に対する粗蛋白質量をケルダール法により測定した。表2に粗蛋白質量の含量を重量%で表す。なお、窒素係数は6.25とした。
【0029】
【表2】

【0030】
(分子量500未満のペプチド含量)
各加水分解物の分子量分布を、以下のゲルろ過カラムを用いたHPLC法により測定した。
ペプチド用ゲルろ過カラムを用いたHPLCシステムを組み、分子量マーカーとなる既知のペプチドを供し、分子量と保持時間の関係において検量線を求めた。
なお、分子量マーカーは、オクタペプチドとして[β−Asp]−Angiotensin IIのβ−Asp−Arg−Val−Tyr−Ile−His−Pro−PHe(分子量1046)、ヘキサペプチドとしてAngiotensin IVのVal−Tyr−Ile−His−Pro−PHe(分子量775)、ペンタペプチドとしてLeu−EnkepHalinのTyr−Gly−Gly−PHe−Leu(分子量555)、トリペプチドとしてGlu−Glu−Glu(分子量405)、遊離アミノ酸としてPro(分子量115)を用いた。
各加水分解物試料(1%)を10000rpm、10分間遠心分離し、上清をゲルろ過用溶媒で2倍に希釈し、その5μlをHPLCに供した。
加水分解物試料中の、遊離アミノ酸及び分子量500未満のペプチド画分の割合(%)を、全体の吸光度のチャート面積に対する、分子量500未満の範囲(時間範囲)の面積の割合によって求めた(使用カラム:Superdex Peptide 7.5/300GL(GEヘルスケア・ジャパン株式会社製)、溶媒:1%SDS/10mMリン酸緩衝液、pH8.0、カラム温度25℃、流速0.25ml/min、検出波長:220nm)。
【0031】
次に、アミノ酸分析により各加水分解物中の遊離アミノ酸含量の測定を行った。
加水分解物(4mg/ml)を等量の3%スルホサリチル酸に加え、室温で15分間振とうした。10000rpmで10分間遠心分離し、上清を0.45μmフィルターでろ過し、アミノ酸分析器(日本電子製 JLC500V)にて、遊離アミノ酸を測定した。加水分解物中の遊離アミノ酸含量は、ケルダール法にて得られた蛋白質含量に対する割合として算出した。
以上より得られた「遊離アミノ酸及び分子量500未満のペプチド画分の割合」から「遊離アミノ酸含量」を差し引いた値を、加水分解物中の「分子量500未満のペプチド含量」とした。結果を表3に示す。
【0032】
【表3】

【0033】
(抗酸化活性の評価)
分離大豆蛋白質及びグリシニン画分の各加水分解物の抗酸化活性を評価するために、培養細胞に対する検討を行った。
培養細胞に用いる細胞株としてヒト肝ガン細胞であるHepG2細胞(理研バンクより購入)を用いた。培養は10%FBSを含むDMEM培地にて行い、培地には終濃度100IU/mlペニシリン及び100μg/mlストレプトマイシンを添加した。培養は37℃、5%CO2条件下で行った。
HepG2細胞を96wellプレートに10000cells/wellで播種し、24時間前培養した後、1mg/mlの各加水分解物試料を含む培地に交換し、24時間培養した。その後、酸化ストレスを誘導するために、終濃度120mMになるようにt−ブチルヒドロペルオキシド(TBH)を添加して、2時間曝露した。
培養終了後に、Cell−Counting Kit−8(同仁化学研究所)を用いて、生細胞数を測定した。また、WST−8試薬を10μlずつ添加し、450nmにて吸光度を測定した。
肝ガン細胞の酸化ストレスに対する防御率を、
防御率(%)=((細胞培養培地+TBHの吸光度)−(培地+TBHの吸光度))/((培地のみの吸光度)−(培地+TBHの吸光度))×100 により算出した。
有意差検定はDr.SPSS II(SPSS社製)を使用し、二群間の検定をstudenntのt検定により評価した。
【0034】
結果を図1に示す。図1中、「グリシニン画分加水分解物」及び「分離大豆蛋白質加水分解物」は、製造例(グリシニン画分)及び比較製造例(分離大豆蛋白質)の各蛋白質組成物の加水分解物を加えた培地における、肝ガン細胞の酸化ストレスに対する防御率を示す。
グリシニン画分の加水分解物を添加した細胞の方が、分離大豆蛋白質の加水分解物を添加した細胞に比べて、酸化ストレスに対して高い防御率を有することが確認された。
【0035】
このように、ヒト肝ガン細胞(HepG2)において、グリシニン画分の加水分解物は、TBH処理による酸化ストレスからの強い保護作用を示した。これは、グリシニン画分の加水分解物が、TBHが代謝される際に生成するヒドロキシラジカルを除去し、細胞死を抑制しているのだと考えられる。
【特許請求の範囲】
【請求項1】
大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物を含む、抗酸化剤。
【請求項2】
前記加水分解物中の分子量500未満のペプチドの含量がペプチド及び遊離アミノ酸の合計量に対して50重量%以上である、請求項1に記載の抗酸化剤。
【請求項3】
請求項1又は2に記載の抗酸化剤を有効成分とする、細胞障害抑制剤。
【請求項4】
請求項1又は2に記載の抗酸化剤を有効成分とする、肝障害抑制剤。
【請求項5】
抗酸化剤の製造における、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物の使用方法。
【請求項1】
大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物を含む、抗酸化剤。
【請求項2】
前記加水分解物中の分子量500未満のペプチドの含量がペプチド及び遊離アミノ酸の合計量に対して50重量%以上である、請求項1に記載の抗酸化剤。
【請求項3】
請求項1又は2に記載の抗酸化剤を有効成分とする、細胞障害抑制剤。
【請求項4】
請求項1又は2に記載の抗酸化剤を有効成分とする、肝障害抑制剤。
【請求項5】
抗酸化剤の製造における、大豆グリシニンを総蛋白質の60重量%以上含有する蛋白質組成物の加水分解物の使用方法。
【図1】




【公開番号】特開2012−116817(P2012−116817A)
【公開日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願番号】特願2010−270383(P2010−270383)
【出願日】平成22年12月3日(2010.12.3)
【出願人】(000236768)不二製油株式会社 (386)
【Fターム(参考)】
【公開日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願日】平成22年12月3日(2010.12.3)
【出願人】(000236768)不二製油株式会社 (386)
【Fターム(参考)】
[ Back to top ]

