蛍光ナノ粒子
【課題】蛍光ナノ粒子の用途を提供すること
【解決手段】インビボ診断補助薬を調製するための蛍光ナノ粒子の使用であって、この蛍光ナノ粒子は、無機核と、不動態化層と、特異的リガンドとを含み、この不動態化層を有するこの無機核の流体力学的直径は15nm以下であり、好ましくは10nm以下であり、特に好ましくは5nm以下であり、このナノ粒子は、700nm未満の発光を示す。この診断補助薬は好ましくはインビボ造影剤であり、このインビボ造影剤は、ヒトにおける局所適用に適していることがより好ましい。
【解決手段】インビボ診断補助薬を調製するための蛍光ナノ粒子の使用であって、この蛍光ナノ粒子は、無機核と、不動態化層と、特異的リガンドとを含み、この不動態化層を有するこの無機核の流体力学的直径は15nm以下であり、好ましくは10nm以下であり、特に好ましくは5nm以下であり、このナノ粒子は、700nm未満の発光を示す。この診断補助薬は好ましくはインビボ造影剤であり、このインビボ造影剤は、ヒトにおける局所適用に適していることがより好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、インビボ診断補助薬として特に適しており、特に異なる組織型を識別するための造影剤として特に適している、蛍光ナノ粒子に関し、かつその内容が参照されている欧州特許出願第05 025 022.4号の優先権を主張する。
【背景技術】
【0002】
数多くの障害において、可能な限り早くかつ有益な診断は、必要な医療手順の選択、調和および実行において極めて重要である。このことは、数多くの腫瘍型に特に当てはまり、これらの腫瘍型の決定および治療には、(可能性のある部分を含めて)健常組織と発癌性組織との間の識別が必須である。従って、患者の回復または生存でさえも、処置および/または手術を行う臨床医が異なる組織型を識別できるかどうか、ならびにどれほど良好に識別できるかに決定的に依存している。
【0003】
これまで、診断および医療手順を改善するために、造影剤が開発されてきており、その助けにより、イメージング法による体内の機能および構造の視覚化が可能である。これらの方法は、癌に関連する細胞変化の標的化された検出のためにとりわけ使用されている。
【0004】
このように、例えば、非特許文献1は、初期の発癌性トランスフォーメーションのマーカーとしての有機発蛍光体に基づく分子特異的造影剤を開発した。この場合、上皮増殖因子受容体(EGFR)の腫瘍に関連した過剰発現は、赤色蛍光抗EGFR抗体結合体(Alexa660)を介して口内の組織変化を同定するために利用される。
【0005】
有機発蛍光体の一般的な欠点は、これらが体内で代謝され、蛍光色素が分解または不活性化されることである。このように代謝は、診断に必要な高標識強度を打ち消す。インビボでの有機発蛍光体の滞留時間が長引くにつれて、この問題は激しくなり、特により深い組織層の細胞を標識する際にかなりの困難を呈する。
【0006】
さらに、より長い波長で発光する有機発蛍光体は、特に、化学結合プロセスで量子収率が減少するという欠点を有する。さらに、有機発蛍光体は、光退色に対して非常に敏感であり、短時間の照射の後でさえも蛍光の相当な損失につながり得る。従って、これらの蛍光体に基づく造影剤は、長期化した励起時間と共に蛍光強度および安定性を有するが、より深い組織層の細胞を検出/標識する(「深部組織イメージング」)ために適切であるには低すぎる。このように、非特許文献1の研究から、Alexa660結合体は最大浸透深さが0.5mmであり、そのため蛍光の検出がもはや合理的に可能なものではないことが明らかになっている。
【0007】
細胞変化の蛍光標識に関するさらに公知の可能性は、いわゆる量子ドット(QD)の使用からなる。QDは、サイズが数ナノメートルの蛍光ナノ粒子であり、その核は、CdSe、CdTe、InP等の半導体物質からなる。
【0008】
しかしながら、既知のQDが生物系で使用される場合、QDは、いわゆるブリンキング現象(すなわち、ナノ粒子が蛍光状態と非蛍光状態とで交互に入れ替わる)を示す。この現象は、量子ドッドを特にインビボでの適用に無用にしてしまう。さらに「ブリンキング」はまた、ナノ粒子の核の崩壊を示す可能性があり、それによって有毒なカドミウムが体内に放出される可能性がある。量子ドットは体内、例えば肝臓または脾臓に蓄積されるので、このことは特に不利である。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Hsu et al.(2004)(「A far−red fluorescent contrast agent to image epidermal growth factor receptor expression」, Photochemistry and Photobiology,79(3):272−279)
【発明の概要】
【発明が解決しようとする課題】
【0010】
従って、本発明は、診断補助薬として、特にインビボでの造影剤として使用するのに特に適している蛍光ナノ粒子を提供するという目的に基づいている。
【課題を解決するための手段】
【0011】
この主題は、主な請求項に記載するように達成される。従属請求項および個別の独立請求項は、有利な実施形態に関する。本発明のナノ粒子は、選択された生物学的な構造または機能の特異的な標識のために、インビトロおよびインビボの両方で使用され得る。特に、ここで選択されるナノ粒子は、医学的介入、特に外科的介入を支援するためのインビボでの造影剤として役立ち得る。
【図面の簡単な説明】
【0012】
【図1】赤色シグナル(GLUT1膜タンパク質に対するニュートラビジンおよびビオチン化抗体の結合体)。マウス細胞に対する特異的結合は明らかでないが、HT−29細胞に対する特異的結合は明らかである(腫瘍全体の均一なマーキングはまだ達成されてない)。
【図2】赤色シグナル(GLUT1膜タンパク質に対するニュートラビジンおよびビオチン化抗体の結合体)。マウス細胞に対する特異的結合は明らかでないが、腫瘍内管の直接近傍でHT−29細胞に対する特異的結合は明らかである(腫瘍全体の均一なマーキングはまだ達成されてない)。
【図3】図3は、分光分析によるBioPixels 618(本発明による物質)の強度とCrystalplexアロイナノ粒子630(NC630)の比較を示す。
【図4】図4は、ゲルろ過の結果を示す。
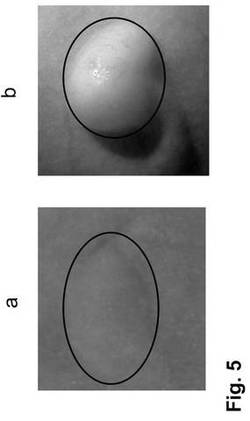
【図5】図5は、写真記録を示す。NC630物質が注入された腫瘍は、蛍光を示さなかった(図5a、マーキングを参照のこと)のに対して、本発明のEGF結合BioPixels 619の使用では蛍光が極めて明らかである(図5b、マーキングを参照のこと)。
【図6】図6は、顕微鏡での分析の結果を示す。腫瘍のマーキング(図6を参照のこと;暗い背景上の白い領域)は、均一でなく、一部の領域は、より強度が低くマーキングされた(図6aを参照のこと)、他の領域は、より強いマーキングを示す(図6bを参照のこと)。
【図7】図7は、BioPixelsの細胞内取り込みによる本発明のEGF結合BioPixels 619を使用する腫瘍細胞のマーキングを示す。図7aは、BP619蛍光を示す。この場合、蛍光がBP619によって独占的に引き起こされる一部のシグナルを、円で印を付けた。抗体A488の蛍光を図7bに検出した。ここで使用した第1抗体は、EGFR抗体であり、第2抗体は、ヤギ抗マウスA488であった(1dを参照んこと)。もう一度、その蛍光がA488に独占的に起因する一部のシグナルを円で囲んだ。最後に、図7cは、図7aおよび図7bからコピーした画像を示す。シグナルの多くは、共局在を明らかにする、すなわち、それらのシグナルは、図7aおよび図7bの両方で見られる。
【発明を実施するための形態】
【0013】
本発明のナノ粒子は、少なくとも3つの構造体、特に無機核を含む。無機核は、不動態化層によって被覆され、不動態化層はさらに特異的なリガンドを担持し、この特異的なリガンドは不動態化層の一部であり得る。これらは、生物系の標的分子(標的)に対するナノ粒子の特異的な結合につながる。周りが不動態化層で被覆された本発明のナノ粒子の無機核は、15nm以下の、好ましくは10nm以下の流体力学的直径を有する。8nm以下の、または5nm以下の熱力学的直径が特に好ましい。
【0014】
不動態化層は、特に蛍光強度ならびに無機核の化学的および物理的な安定性を高める役割を担う。不動態化層で被覆される無機核は、少なくとも10%、有利には少なくとも30、50、または70%もの量子収率を特徴とする。これに関して、量子収率とは、試料によって放出された光の量の、試料によって吸収された光の量に対する比率を意味する。不動態化層は、1nm以下の厚さを有利に有する。この場合、不動態化核の直径は、2nm以下増加する。
【0015】
いずれの場合もナノ粒子にとって、特に、生物環境との適合性を改善するために修飾因子もまた備わっていることが有利である。修飾因子の使用による流体力学半径の増加は、好ましくは2nmを超えない。個々の場合の不動態化層および修飾因子の厚さは、2つの構造体の相互関係および無機核に対する関係にも依存する。
【0016】
本発明のナノ粒子の大きさに対する制約により、ナノ粒子は、生存する患者における診断補助薬としての使用に特に適している。従って、大きさが減少すれば、拡散速度および組織への浸透深さの増加をもたらす。これは、生物環境におけるナノ粒子の均一で急速な分布、および局所投与後の組織(例えば腫瘍)を通る可能な限り深い浸透を可能にする。本発明のナノ粒子は、同様に、注入によっても行われ得る全身投与を可能にする。しかしながら、局所(lokale)投与(腫瘍の治療に関しては、例えば表面(topische)投与または腫瘍内もしくは腫瘍周辺の投与等)が好ましい。
【0017】
本発明のナノ粒子の特に有利な実施形態は、8nm以下の、特に好ましくは4nm以下の流体力学的直径を有する。この桁の大きさのナノ粒子は腎臓を通って排出されることさえ可能であり、その結果、体内でのそれら粒子の蓄積は明確に少ないかまたはゼロである。本発明のナノ粒子は、従って、おそらく既知の量子ドットと関連する、長期毒性の問題を大幅に軽減させる。
【0018】
さらに有利な実施形態において、本発明のナノ粒子は、600〜700nmの範囲で、特に好ましくは600〜650nmで、具体的に好ましくは620〜650nmで蛍光スペクトルを発する。この発光スペクトルは、生体系(水を含む)中のヘモグロビンおよび他の吸光物質による吸収がごくわずかであるため、最大の組織透過という利点を有する。これらの波長の光は、ヒトの眼でまだ知覚できるので、処置する臨床医は、さらに精巧な検出補助技術(例えば、CCDカメラ)を使用せずに標識組織を同定することができる。これは、本発明のナノ粒子が、(例えば)発癌性組織と健常組織とを識別するための外科的介入中に造影剤として使用される際に、特に有利である。
【0019】
一実施形態において、本発明に従って使用され得るナノ粒子は、例えば、科学出版物を参照する米国特許出願公開第2004/0247861号に記載される(段落番号[0006]を参照)とおりの、例えばCdSe、CdSまたはCdTeから構成される核を有する既知のナノ粒子である。本公報ではまた、核の材料の調製に関する文書(段落番号[0007]を参照)、例えば米国特許第6,179,912号を参照する。これらの文書は、これらの既知のナノ粒子の特性およびその調製の開示に関して、全体が参照されている。
【0020】
本発明のナノ粒子の無機核が本質的に半導体から構成される場合、それは特に有利である。これらの核は、それらの個々の大きさおよび/または組成に依存して、種々の色の光を発するが、光スペクトルの同一領域(UVからVIS領域まで)ですべて広域なバンド吸収を示す。高いストークスシフトのために、励起および発光のスペクトルは、遠く離れて存在し、異なる量子ドットの単純でかつ同時の励起を可能にする。それらは、わずかにしか重ならないかまたは全く重ならない、狭くかつ対称的な発光スペクトルを有する。さらに、特に、浸透の深さおよびインビボでの標識の向上のために極めて重要である陽性特性は、80%までの高い量子収率および高い光安定性である。
【0021】
本発明のナノ粒子の無機核を表し得る量子ドットは、国際公開第2005/001889号に開示される。これに基づいて、均一に分散するか、それとも各々の場合にアロイ内の濃度勾配が存在するかのどちらかである、少なくとも2つの半導体のアロイから構成される無機核が関与する。上記で引用された国際公開第2005/001889号は、これらの量子ドットの性質および調製の開示に関して参照されている。核は、いずれの場合にも大きさが5%まで異なる可能性がある。
【0022】
従って、本発明のナノ粒子の無機核は、少なくとも2つの半導体のアロイを含むことが可能であり、核は均一な組成を有し、かつ2つの半導体のモル比に関して非線形であるバンドギャップエネルギーによって特徴付けられる。
【0023】
あるいは、核は、全く不均一であり得、この場合には、第1の半導体の濃度は核の中心から始まって核の表面まで徐々に上昇し、および第2の半導体の濃度は、核の中心からその表面に向かって徐々に減少する。
【0024】
半導体の少なくとも1つはII族〜VI族の半導体であるか、またはIII族〜V族の半導体である(族の定義は、元素周期表の族に対応する)ことは、両方の核について同様に当てはまる。アロイは、例えば以下のアロイの群から選択され得る:CdSeTe、CdSSe、CdSTe、ZnSeTe、ZnCdTe、CdHgS、CdHgTe、InGaAs、InGaP、GaAlAs、InGaN。これらの核は、さらに、例えば半導体(例えばZnS)等の無機物質の被覆を有することも可能である。この付加的な層は、「キャッピング」または「シェル」として当業者に既知である。
【0025】
II族〜VI族およびIII族〜V族の半導体は、一般的に知られており、例えば、CdS1−xSex、CdS1−xTex、CdSe1−xTex、ZnSe1−xTex、Zn1−xCdxTe、Cd1−xHgxS、Cd1−xHgxTe、In1−xGaxAs、Ga1−xAlxAsおよびIn1−xGaxPが挙げられる。好ましくは使用される半導体は、CdSe1−xTex、CdS1−xTex、ZnSe1−xTex、Zn1−xCdxTe、Cd1−xHgxS、Cd1−xHgxTe、In1−xGaxAs、In1−xGaxPであり、xは0〜1の有理数である。
【0026】
半導体のモル比は任意のモル比をとり得る。しかしながら、アロイがCdSSeを含む場合、好ましいアロイは、分子式CdS1−xSexを有する。アロイがCdSTeを含む場合、好ましいアロイは、分子式CdS1−xTexを有する。アロイがZnSeTeを含む場合、好ましいアロイは、分子式ZnSe1−xTexを有する。アロイがZnCdTeを含む場合、好ましいアロイは、CdTeのみからなる分子式を有する。これらの記述において、xはいずれの場合にも、0〜1の有理数である。
【0027】
本発明のナノ粒子のこれらの好ましい無機核は、以下の工程で調製され得る:(i)ナノ結晶の形成を可能にする条件下で第1溶液を調製する、(ii)ナノ結晶の形成が不可能な条件下のモル比で半導体の前駆体を含む第2溶液を調製する、(iii)第2溶液を第1溶液に添加して、ナノ粒子を形成させる、および(iv)ナノ結晶の成長およびその形成を終結/停止させる条件を変更する。核を調製する方法については、国際公開第2005/001889号に記載されており、本公報は、本発明のナノ粒子の無機核のこの好ましい実施形態の調製の開示に関して参照されている。
【0028】
別の実施形態において、無機核は、(好ましくは2および27個の貴金属原子を含む)貴金属クラスターから本質的に構成され得る。好ましい実施形態において、貴金属は、金、銀、銅、プラチナ、パラジウム、オスミウム、イリジウム、ルテニウム、およびロジウムからなる群から選択される。クラスターは、様々な電荷を有し得る。
【0029】
これらの核は、それらの強力な吸収および発光のために、単一の、いわゆるナノドットとして、水銀ランプの弱い励起で容易に検出され得るという利点を有する。これらの核を有する本発明のナノ粒子は、単一分子の蛍光標識および複数の標識として有利に使用される。
【0030】
本発明と関連して、「貴金属」という用語は、金、銀および銅、ならびに白金族金属(PGM)プラチナ、パラジウム、オスミウム、イリジウム、ルテニウム、およびロジウムからなる群から選択される元素群を指す。本発明の好ましい実施形態において、貴金属は、金、銀、および銅からなる群から選択される。特に好ましい実施形態において、貴金属は、銀または金である。
【0031】
「クラスター」という用語は、2〜27個の金属原子の組み合わせを指す。クラスターは、とりわけ化学触媒作用、セラミックス、半導体技術、および物質科学の領域で知られている。従って、当業者は、その調製を熟知している。国際公開第2004/003558号は、とりわけ貴金属クラスターの調製を記載し、それらに関する文献の広範な参照をさらに含む。特に、有機分子に関連する貴金属ナノクラスターの調製について開示されている。これに関連して、結合という用語は、結合の化学的性質または物理的性質(例えば、共有結合、非共有結合、静電気結合、またはファンデルワールス結合)にかかわりなくすべてのタイプの結合と理解されるものとする。国際公開第2004/003558号は、本発明のナノ粒子の核としてのナノクラスターの調製に関して参照されている。
【0032】
本発明のナノ粒子は、蛍光強度を増加させ、無機核の化学的および物理的な安定性を改善させる不動態化層を有する。従って、ナノ粒子は、10%を超える、好ましくは50%を超える量子収率で光を発光する。
【0033】
本発明のナノ粒子は、好ましくは4℃の水性の環境で少なくとも12ヵ月の貯蔵安定性を示し、好ましくはpH5〜pH10の範囲のpHで安定しており、すなわち、本発明のナノ粒子は、量子収率、最大放出の位置、発光スペクトルの半値幅等のそれらの特定のスペクトル特性に関して50%未満の偏差を示す。好ましい粒子は、これらの特定のスペクトル特性に関して10%未満の偏差を示す。
【0034】
本発明のナノ粒子はまた、生物学的条件下またはインビボで、少なくとも3日間にわたり核(それを囲む不動態化層を含む)の特性の本質的に定常性/安定性を示す。好ましい粒子は、7〜14日間、または数週間までの期間にわたって、このような定常性/安定性を示す。ここで定常性は、本発明では、上述の一部またはすべての特性の50%までの偏差/変化を意味する。特に好ましい粒子は、10%未満の偏差/変化を示す。
【0035】
不動態化層は、金属原子または金属イオン(例えば、亜鉛、水銀、またはカドミウムのイオン)と配位結合することができる少なくとも1つの化合物を含む。この化合物は、ルイス塩基、または共鳴電子を有する環状もしくは直鎖状の不飽和化合物であり得る。環状の不飽和化合物として、それはまた、複素環またはヘテロ芳香族の化合物であり得る。好ましい実施形態において、不飽和基または結合基は、分子の構造に関して末端の位置に位置する。不動態化層は、さらに架橋剤を含むことが可能であり、または環状もしくは直鎖状の不飽和化合物も架橋剤として機能し得る。
【0036】
金属原子または金属イオンと配位結合する化合物は、キレート化、配位、またはルイス塩基の電子供与体の特性によって蛍光無機核に機能的に結合でき、そして対応して結合した部分/基を含み得る。これらの分子は、さらに、それらで被覆される核に、水溶液中での溶解性または湿潤性を付与する部分を含み得る。
【0037】
これらの分子または化合物は、1つ、2つ、またはより多くの結合した(さもなければ、融合した)環を有する均一のまたは不均一の(複素環式の)環系を含み得る。好ましい複素芳香族系の例は、チアゾール、チアゾール誘導体、オキサゾール、オキサゾール誘導体、ピロール、ピロール誘導体(ドープされたかまたは非ドープのポリピロールオリゴマーを含む)、チオフェン、チオフェン誘導体(ドープされたかまたは非ドープのポリチオフェンを含む)、フラン、フラン誘導体、ピリジンおよびピリジン誘導体、ピリミジンおよびその誘導体、ピラジン、ピラジン誘導体、トリアジンおよびトリアジン誘導体、トリアゾール、トリアゾール誘導体、フタロシアニンおよびフタロシアニン誘導体、ポルフィリンおよびポルフィリン誘導体である。これらの化合物は、アセチレン、プロピン、およびアレンも含み得る、不飽和(オレフィン)炭化水素またはそれらのアミン、リン誘導体もしくは酸素誘導体を含み得るが、これらに限定されるものではない。半導体核の表面上で付加物形成または共鳴に加わるために、分子は適切なpもしくはpi電子密度を有することが好ましい。
【0038】
ヘテロ芳香族化合物は、好ましくはイミダゾール成分である。さらに、アルキルホスフィン化合物が架橋剤として添加されることが好ましい。
【0039】
「イミダゾール成分」という用語は、この記載において、少なくとも1つのイミダゾール基(イミダゾール誘導体を含む)を含み、かつ、カドミウム、亜鉛、ガリウム、または金属陽イオンもしくはこのような陽イオンを含む基板等の金属への無機核または不動態化層の結合に利用できる、複素環式分子またはヘテロ芳香族分子を意味する。これに関連して、少なくとも1つのイミダゾール基は、好ましくは、分子の構造に関して末端位置にあるべきである。イミダゾール成分は、非局在分子軌道を含む環を介してその機能的な形態で蛍光ナノ結晶に結合する。イミダゾール環の窒素は、通常、カドミウムまたは亜鉛などの金属イオンを機能的な様式で結合するための配位リガンドとしての働きをする。
【0040】
一実施形態において、イミダゾール成分は、1つもしくは2つのアミノ酸、例えばヒスチジン、カルノシン、アンセリン、バレイン(Balein)、ホモカルノシン、ヒスチジルフェニルアラニン、シクロ−ヒスチジルフェニルアラニン、5−アミノ−4−イミダゾールカルボキサミド、ヒスチジルロイシン、2−メルカプトイミダゾール、Boc−ヒスチジン、ヒドラジド、ヒスチノール、1−メチルヒスチジン、3−メチルヒスチジン、イミダゾリジン、イミダゾール含有オルニチン(例えば、5−メチルイミダゾール)、イミダゾール含有アラニン(例えば、β−(2−イミダゾリル)−Lαアラニン)、カルジニン(Carzinin)、ヒスタミン等の反応性官能基を含む。これらのヒスチジンに基づく分子またはイミダゾール含有アミノ酸は、一般的に公知の方法で合成され得る。
【0041】
「アルキルホスフィン」という用語は、本発明では、Se、S、もしくは他の非金属等の非金属を結合もしくはキレート化するための少なくとも1つのホスフィン基(その誘導体を含む)、またはこのような原子を含む基質を含み、かつ隣接する分子との反応のため少なくとも1つの官能基(例えば、ヒドロキシル−、アミノ−、チオール−、カルボキシル−、カルボキサミド−等)を提供する分子を意味する。
【0042】
好ましくは少なくとも1つのホスフィン基は、分子の構造に関連して末端位置に位置すべきである。ホスフィン部分は、機能的な形態のSeまたはS等の非金属またはイオンを蛍光核またはシールド層からの化合物に結合するために、配位リガンドとしての働きをする。
【0043】
好ましい実施形態において、アルキルホスフィン含有化合物は、共に連結される(例えば重合形態の)1つ、2つ、またはそれより多くのホスフィン基を含み、そしてヒドロキシメチルホスフィン化合物等も含み得るが、これらに限定されることはない。アルキルホスフィン含有化合物は、一般に公知の方法で合成され得る。さらに公知のように、アルキルホスフィン含有化合物は、さらに、1つ以上の付加的な官能基(例えば、ヒドロキシル−、アミノ−、チオール−、カルボキシル−、カルボキサミド−等)を含み得る。誘導体の例は、誘導体が、本明細書に記載される被覆としてのアルキルホスフィンの機能に適合する限り、ヒドロキシメチルホスフィン誘導体、アミド、またはエステルである。
【0044】
特に、本発明のナノ粒子の蛍光無機核を被覆するために好ましいのは、トリス(ヒドロキシメチル)ホスフィンおよびβ−[トリス(ヒドロキシメチル)ホスフィノ]プロパン酸である。架橋したアルキルホスフィン含有化合物が、ZnまたはCd等の金属原子および/またはイオンに機能的に結合するさらなる可能性を有することは一般に公知である。これに関して、官能化イソシアネートまたはアルキルシアノアクリレートは、リガンドおよび蛍光核との付加物形成にとってさらに有用な架橋剤であり得る。
【0045】
本発明に従って存在する不動態化層の不動態化効果は、ヘテロ芳香族化合物または複素環(好ましくはイミダゾール成分を有する)との錯体形成(Komplexierung)による表面のカドミウム原子または亜鉛原子等のシールド、およびアルキルホスフィン含有化合物との錯体形成による逆原子(SeもしくはS等)のシールドに基づく。
【0046】
本発明のナノ粒子の不動態化層は、米国特許出願公開第2004/0247861A1号に開示される。この公開された明細書は、不動態化層、例えば量子ドットで被覆した無機核の調製を記載する。従って、米国特許出願公開第2004/0247861号は、本発明に従って使用される不動態化層およびそれによって被覆した無機核の調製を開示する目的で参照されている。
【0047】
不動態化層の分子は、標的分子および細胞(特異的リガンド)を結合および架橋するために、化学基をさらに含み得るかまたは保有し得る。ZnSO4およびNa2S等の対応する不動態化試薬の存在下で、これらの分子または化合物は、蛍光核上の分子によって不動態化層を形成することができる(「キャッピング」または「シェル」)。
【0048】
これらの試薬はまた、このさらなる不動態化層もまた核の表面上に直接形成され得るように蛍光ナノ結晶の表面上で原子またはイオンに機能的に結合することが可能である。
【0049】
有利な実施形態において、本発明のナノ粒子はさらに、有機および/または無機の部分からなり得る修飾因子を含み得る。修飾因子は、液体媒体または懸濁媒体、特に生理環境でのナノ粒子の適合性、有効性、および/または溶解性を向上させる働きをする。この表面改変は、生物系、特に人体において最小の非特異的吸着および上昇した適合性を達成するために、特に有利である。
【0050】
1つの可能性としては、ナノ粒子の小さい全体サイズを維持するために、特定の医療応用で、特に低分子量型ですでに承認されているポリエチレングリコール(PEG)を使用して表面を改変する方法がある。これにより、ナノ粒子の生体適合性とその血液循環時間の両方および細胞への取り込み効率を上昇させ得る。低分子量PEG層と例えば葉酸等のビタミンのようなさらなる物質とを組み合わせることによって、マクロファージ内でのナノ粒子のより少量の取り込みを達成することが可能である。なぜなら、ナノ粒子へのタンパク質吸着はそれによって低減し、従って免疫系によるナノ粒子の認識が妨げられるからである。
【0051】
1つまたは異なる単糖から構成される低分子量多糖までの、単糖、二糖、または三糖で被覆することは、修飾因子の使用による有利な表面改変のさらなる可能性を表す。可能性ある1つの実施形態は、例えばポリグルコースを使用した改変であり、ここでは代用血液として医学的に承認されているデキストランを使用することが可能である。デキストランは良好な生体適合性/耐性を示す。さらなる実施形態は、あり得る分解を妨害するための糖類の立体異性体形態(D体/L体)の使用である。
【0052】
さらなる実施形態は、例えば、チアミン、リボフラビン、ナイアシン、ピリドキシン、コバラミン、パントテン酸、アスコルビン酸、および葉酸等の生物学的に適合性の親水性ビタミンの修飾因子としての使用である。従って、例えば、葉酸は癌細胞へのナノ粒子の好ましい結合につながり得る。このビタミンは、ごく低い免疫原性しか示さず、従って高い生体適合性を示す。膜結合型葉酸受容体への結合は、ナノ粒子の内在化を促進する。
【0053】
レチノール、コレカルシフェロール、トコフェロール、およびフィロキノン等の親油性ビタミンによる表面改変は、同様に可能である。従って、例えば、ビタミンEは、ナノ粒子の増大した細胞取り込みにつながり得る。
【0054】
例えば、1−オクタデセンまたは18−メチルエイコサン酸およびその誘導体等の脂肪酸は、コロイドの溶解性および安定性を増大させることが可能であり、その後の特異的リガンドの結合に利用することが可能な末端官能性カルボキシル基を有し得る。従って、修飾因子として脂肪酸を含むことも価値がある。
【0055】
表面改変のさらなる実施形態は、非特異的タンパク質吸着を特に十分に減少させることができる、例えばジエチレングリコール(DEG)等の多価アルコールを使用する被覆である。同様のことが、減少したタンパク質吸着を達成することが可能であることに基づき、ポリテトラフルオロエチレン(PTFE、テフロン(登録商標))にも、特に、その低分子量の形態に当てはまる。ポリテトラフルオロエチレンは、心臓外科での適用で頻繁に使用される。
【0056】
表面改変は、タンパク新生アミノ酸および非タンパク新生アミノ酸の両方を含む1つ以上の天然に存在するアミノ酸、ならびに合成アミノ酸で行われることが可能である。これに関連して、両方の立体異性体(D体およびL体)を使用することが可能である。上述のアミノ酸から、構成されているジ、トリ、テトラから小さいポリペプチドまでのものは、免疫系をほとんど刺激せず、従って同様に薄い適合性層に適している。これに関連する可能性は、人工アミノ酸配列および生物学的タンパク質由来の配列である。例えば、フィトケラチン等の天然タンパク質のペプチド誘導体は、表面改変で同様に使用され得る。TatペプチドおよびTatペプチド含有ペプチドを使用する表面改変は、ナノ粒子を生物医学的適用で使用できるようにするさらなる可能性である。Tatペプチドは、例えば、細胞膜を通って細胞核に金のナノ粒子を運ぶのに有効な分子である。
【0057】
可能性のある修飾因子のさらなる実施形態は、ホスホリルコリン被覆の形成である。ホスホリルコリンは、例えばコンタクトレンズ上での可能性のある非特異的なタンパク質の吸着を低減させる。非血栓形成特性のために、ホスホリルコリンの改変は生物系で十分に使用されることが可能であり、かつ長期安定性が高いことによって区別される。
【0058】
ポリ乳酸は生体適合性であるので、この物質は、様々な医療適用で使用されている。特に、ポリ乳酸の低分子量の形態は、本発明のナノ粒子の表面改変にとってさらなる可能性を示す。これに関連して、可能性のある生分解を低減させるために両方の立体異性体(D/L体)を使用することが可能である。
【0059】
記載した表面改変に加えて、タンパク質分解により切断可能な様式で非特異的タンパク質をナノ粒子に結合させることが可能である。これにより、生体適合性/耐性が上昇し得る。巨大タンパク質の除去が標的部位で起こって、組織内で小さいナノ粒子が放出され得る。同様に、適切な滞留時間後に、除去が起こることも可能である。この目的に適した好ましいものは、例えば、トランスフェリン、ラクトフェリン、セルロプラスミン、エラスチン、およびアルブミンなどの広範に使用されるタンパク質、ならびに非特異的な吸着を低減させる他のタンパク質である。このように、例えば、ポリペプチドとエラスチンの組み合わせから構成される表面被覆は、望ましくない血栓形成を防止し得、従って、ナノ粒子の生体適合性を上昇させ得る。
【0060】
主要な血清タンパク質アルブミンは、原形質膜との非特異的な相互作用を低減させることができる。対応して改変されたナノ粒子は、該粒子表面への特異的リガンドの同時結合を介して、標的細胞との特異的相互作用を形成する能力をさらに維持する。血清アルブミンによる被覆は、静脈内投与後のマクロファージによる迅速な取り込みを防止することによって、非被覆ナノ粒子の場合よりも実質的に長い血液循環時間につながり得る。
【0061】
上記に概略を述べた非特異的被覆に加えて、本発明のナノ粒子は、標的細胞に特異的なリガンドによる選択的標的を保有し、それらは、例えば、腫瘍細胞特異的な構造もしくは他の標的に結合する、例えば、タンパク質、抗体、ペプチドに結合される、または特に好ましくは小さな高親和性のタンパク質ドメイン、抗体断片、または他の有機分子に結合される。
【0062】
記載したより高い速度の拡散および灌流をもたらす減少した流体力学的直径を、前述の特性および改善と組み合わせこと、ならびに特に光の可視赤色領域で高い蛍光強度と組み合わせることにより、本発明のナノ粒子を、インビボでの組織型の選択的で正確な識別のための可能な様々な用途を有する容易な診断補助薬とする。組織特異的な生物マーカーとの組み合わせでのこれらの可能性は、特に、異常な、(前)発癌性組織と正常な組織を識別して外科的介入中の、より正確な腫瘍切除のための視覚的評価を支援するのに役立つ。これに関連して使用され得る本発明のナノ粒子は、このように造影剤として役立つ。
【0063】
本発明に従って、ナノ粒子は、インビトロまたはインビボでの診断補助薬として、テラノスティック薬(Theranostikum)および/または治療薬のいずれかで使用され得る。この目的でナノ粒子は、局所投与(例えば、腫瘍内に、筋肉内に、もしくは外科的に到達可能な組織/器官に)、さもなければ全身投与(例えば静脈内に)され得る。局所/表面投与は、液体、噴霧溶液、ゲル、泡、クリーム、活性パッチとして想定され得る。これは、特に、中空器官の治療/診断で好まれ得る。経口摂取も、例えば液体としてまたは錠剤もしくはカプセルの形態で可能である。吸入も、同様に(例えばスプレー)可能である。坐薬による経肛門投与が想定される。1つの変異形では、ナノ粒子は、デポー形態で移植され得る。「診断補助薬」という用語は、本発明と関連して、「造影剤」と同義語として使用される、すなわち医療介入を支援するために、生物系、特に生存するヒトにおける形態的もしくは機能的な構造を識別する視覚化のために役立つ。
【0064】
ナノ粒子は、特に外科的介入で診断補助薬として使用され得る。ナノ粒子は、同様に最小侵襲法(例えば、内視鏡検査、腹腔鏡検査)で使用され得る。PET、MRI、CT等の画像化法との組み合わせは、価値がある。
【0065】
すでに上述したように、本発明による局所投与の形態での使用は、特に有利である。これに関連して局所投与で使用されるCdの量は、有利にも、高齢で通常の生活様式の人がいずれにしても一生の間に肝臓および腎臓に通常蓄積する総曝露量の10分の1を超えない。これらの器官の総曝露量は、約18mg(Saturag et al.,2000;British Journal of Nutrition;2000,(84),791−802)である。従って、供給されるCdの量が2mgの値を少なくとも実質的に超えないようにナノ粒子の量を制限することは、局所投与では有利である。特に好ましい実施形態において、カドミウムが0.6mg、特に好ましくは0.2mgの総量を超えない造影剤の量の場合でも腫瘍の視覚化は可能である。
【0066】
この実施形態の特定の利点は、生存するヒトに対する医療適用でのナノ粒子の使用が、それによって初めて可能となることである。さもなければ(すなわち、全身投与の場合)これは、それに関連する毒性のために除外されてしまうからである。これは、局所投与が、適切な視覚化に必要とされるナノ粒子の用量を低減させるためである。
【0067】
Cdを含有する造影剤は、本発明に従って、インビボで腫瘍を視覚化するために、腫瘍組織1cm3あたり0.002〜0.02mgのCdの量に対応する用量で有利に使用されることが明らかになった。腫瘍組織1cm3あたり0.002〜0.015mgのCdの造影剤の投与量は、特に、有利であり、とりわけ1cm3あたり0.002〜0.010mgのCdの範囲が有利である。この有利な用量を使用して、ヒトに対して通常許容される曝露量の上限を超えることなく、インビボで約150cm3までの体積の腫瘍を視覚化することが可能である。
【0068】
検査は、患者の到達可能なすべての組織/器官、特に皮膚、中空器官(例えば、消化管、泌尿生殖器、気道内の)、さもなければ感覚器官の外部から到達可能な領域および心血管系に関し得る。
【0069】
インビトロ診断補助薬としての使用(例えば、免疫組織化学またはFACS、およびELISA)も可能である。インビボおよびインビトロでの診断の組み合わせ(例えば生検材料)は、特に有利である。
【0070】
ナノ粒子が本発明に従って治療目的で使用される場合、ナノ粒子の一部のリガンドだけが、エフェクター分子または活性物質(すなわち、エフェクターを表す)を有し得る。これに関連したエフェクターは選択された機能を有するリガンドである。ナノ粒子は、体内または組織内でナノ粒子の標的化された局在化のための特異的なリガンド、およびエフェクター分子を有するリガンドの両方を有利に保有する。
【0071】
エフェクターは、ナノ粒子に結合されたままであってもよく、または除去されてもよく、または脱離もしくは放出されてもよい。エフェクターは、例えば、受容体の活性化/不活性化、(表面)構造のマスキング、免疫系の活性化(「プライミング」)、シグナル伝達経路の調節、酵素の活性化または非活性化、遺伝子治療(例えば、プラスミドもしくはsiRNAの標的化された送達による)、毒素/化学療法剤/細胞増殖抑制薬の標的化された送達、または例えば、代謝、とりわけホルモン生成に対する刺激効果を介してその機能を発揮し得る。細胞(例えば、インスリン産生B細胞)の保護も可能である。
【0072】
1.方法
a)ビオチン化モノクローナル抗体が結合されたBP619−ニュートラビジン結合体の調製
(化学物質および材料)
ナノ粒子
BP619 200μg/mL
BP619またはBP617ナノ粒子は、本発明のナノ粒子であり、すなわち、米国特許出願公開第2004/0247861A1号に開示されるように、CdSxSe核(「アロイ核」)および不動態化層を有する。
【0073】
タンパク質
精製タンパク質は、リン酸/NaCl緩衝液(−80℃にて貯蔵)中に存在する。
【0074】
MES緩衝物質(Sigma)、NaCl、KCl、Na2HPO4、KH2PC4、EDC(1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩)、S−NHS(N−ヒドロキシスルホスクシンイミド)、透析チャンバー(Slide−A−Lyzer)、Vivaspin(MWCO 50kDa、VivaScience)。
【0075】
(緩衝液)
D−PBS(10×)
1370mM NaCl(80g/L)
27mM KCl(2g/L)
42mM Na2HPO4*12H2O(15.4g/L)/7.652g/L Na2HPO4*2H2O
14mM KH2PO4(2g/L)
1000mL溶液にする。pHは約7.5にするべきである。オートクレーブし、室温にて貯蔵する。
【0076】
1×PBS溶液については、100mLの10×緩衝液をddH2Oで希釈して、数滴の2M NaOHで所望のpH(pH7.4(抗体)または8.0(QD))に調整してから完全に1Lにする。
【0077】
MES緩衝液=活性化緩衝液
新たに生成する(有機緩衝液、オートクレーブは不可)
0.8Lの配合(0.1M MES、0.25M NaCl、pH6.0):
15.616g MES
11.688g NaCl
800mLのddH2Oを加えて、pH6.0に調整する。
ddH2Oで最高0.7Lにする。次いで、2Mまたは5MのNaOHでpHを調整する。続いて、ddH2Oで800mLにする。
【0078】
1Mグリシン溶液(ろ過して無菌化される場合は、4℃にて長期保存が可能である)、アリコートを除去する。
【0079】
(手順)
最初に、MES緩衝液(活性化緩衝液)をガラス製のメスシリンダーで調製する。透析チャンバーをMES緩衝液中で1〜2分間水和させてから使用する。100μLのBP619(20μg)を無菌のエッペンドルフバイアル中でMES緩衝液を加えて400μLの最終容量にして、ピペットで十分に混合する。BP619を透析チャンバー(3.5kDa)に移す。1回目の透析で、BP619を、室温にて連続混合し、遮光しながら1時間にわたって800mLのMES活性化緩衝液に対して透析する。1回目の透析後、BP619を透析チャンバーから取り出し、エッペンドルフバイアルに移す。EDCおよびS−NHSとBP619を混合させるために、いずれの場合にも100mM EDCおよび100mM S−NHSの貯蔵液を使用直前に調製する。1回目の透析後、33μLの100mM S−NHSおよび13μLの100mM EDCをピペットで採取してBP619に添加し、遮光して室温にて15分間、350rpmで振盪させる。インキュベーション後、BP619をPBSに対して透析する。この目的のために、BP619を透析チャンバー(MWCO 3.5kDa)に移し、遮光して1時間、pH8.0のPBSに対して透析する。2回目の透析後、BP619を透析チャンバーから取り出し、エッペンドルフバイアルに移す。活性化したBP619を80μgのニュートラビジン(10mg/mLで8μL、D−PBSとの最終容量20μL)と混合させる。この反応混合物を、次いで、遮光して室温にて2時間、350rpmで振盪させる。結合の後、結合体混合物を4℃にて、遮光して貯蔵する。次の日、依然として残っているあらゆる反応性基を飽和させるために、1Mグリシンをピペットで採取して、最終濃度10mMのグリシンに添加する。
【0080】
BP619結合体を、Vivaspin遠心管を使用して濃縮させる。所望の濃度に達するまで結合体を遠心分離する。その後、膜関連および腫瘍関連のグルコース輸送体1(GLUT1)抗原に対するビオチン化モノクローナル抗体を化学量論的に添加する。
【0081】
b)EGF−HisとBP619との結合
(化学物質および材料)
ナノ粒子
BP619 200μg/mL。
【0082】
タンパク質
精製タンパク質は、リン酸/NaCl緩衝液(−80℃にて貯蔵)中に存在する。
【0083】
MES緩衝物質(Sigma)、NaCl、KCl、Na2HPO4、KH2PO4、EDC(1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩)、S−NHS(N−ヒドロキシスルホスクシンイミド)、透析チャンバー(Slide−A−Lyzer)、Vivaspin(MWCO 50kDa、VivaScience)。
【0084】
(緩衝液)
D−PBS(10×)
1370mM NaCl(80g/L)
27mM KCl(2g/L)
42mM Na2HPO4*12H2O(15.4g/L)/7.652g/L Na2HPO4*2H2O
14mM KH2PO4(2g/L)
1000mL溶液にする。pHは約7.5にするべきである。オートクレーブし、室温にて貯蔵する。
【0085】
1×PBS溶液については、100mLの10×緩衝液をddH2Oで希釈して、数滴の2M NaOHで所望のpH(pH7.4(抗体)または8.0(QD))に調整してから完全に1Lにする。
【0086】
MES緩衝液=活性化緩衝液
新たに生成する(有機緩衝液、オートクレーブは不可)
0.8Lの配合(0.1M MES、0.25M NaCl、pH6.0):
15.616g MES
11.688g NaCl
800mLのddH2Oを加えて、pH6.0に調整する。
ddH2Oで最高0.7Lにする。次いで、2Mまたは5MのNaOHでpHを調整する。続いて、ddH2Oで800mLにする。
【0087】
1Mグリシン溶液(ろ過して無菌化される場合は、4℃にて長期保存が可能である)、アリコートを除去する。
【0088】
(手順)
最初に、MES緩衝液(活性化緩衝液)をガラス製のメスシリンダーで調製する。透析チャンバー(3.5kDa)をMES緩衝液中で1〜2分間水和させてから使用する。100μLのBP619(20μg)を無菌のエッペンドルフバイアル中でMES緩衝液を加えて400μLの最終容量にし、ピペットで十分に混合する。BP619を透析チャンバー(3.5kDa)に移す。1回目の透析で、BP619を、室温にて連続して攪拌し、1時間遮光しながら800mLのMES活性化緩衝液に対して透析する。1回目の透析後、BP619を透析チャンバーから取り出し、エッペンドルフバイアルに移す。EDCおよびS−NHSとBP619を混合させるために、いずれの場合にも100mM EDCおよび100mM S−NHSの貯蔵液を使用直前に調製する。1回目の透析後、33μLの100mM S−NHSおよび13μLの100mM EDCをピペットで採取してBP619に添加し、遮光して室温にて15分間、350rpmで振とうさせる。インキュベーション後、BP619をPBSに対して透析する。この目的のために、BP619を透析チャンバー(3.5kDa)に移し、遮光して1時間、pH8.0のPBSに対して透析する。2回目の透析後、BP619を透析チャンバーから取り出し、エッペンドルフバイアルに移す。活性化したBP619を4.92μgのEGF−His(20μLの最終容量までPBSで希釈させる)と結合させる。この目的のために、活性化BP619をピペットで採取してEGF−Hisに添加し、ピペットで十分に混合する。この反応混合物を、次いで、遮光して室温にて2時間、350rpmで振盪させる。結合の後、結合混合物を4℃にて、遮光して貯蔵する。次の日、依然として残っているあらゆる反応性基を飽和させるために、1Mグリシンをピペットで採取して、最終濃度10mMのグリシンに添加する。
【0089】
BP619−EGF−His結合体を、Vivaspin遠心管(50kDa MWCO)を使用して濃縮させる。この場合、膜を4mLのddH2Oで1回予洗し、次いで再び4mLのPBSで洗浄する。BP619−EGF−His結合体を2mLのPBSで希釈し、膜にローディングする。次いで、BP619−EGF−His結合体を2mLのPBSで再び洗浄する。所望の濃度に達するまで結合体を遠心分離させる。
【0090】
c)動物実験
i)手順
この目的のために、HT29細胞株のヒト結腸癌細胞をヌードマウス(胸腺がなく従って免疫抑制されている)に皮下注入し、約2〜3週間の成長期間後、固形腫瘍が形成された。
【0091】
注入を行うために、各マウスにヒプノミデート(Hypnomidate)で麻酔し、25μLのナノ粒子溶液を腫瘍内注入する。この場合、注入は腫瘍内の中央の1ヵ所に行う。
【0092】
腫瘍内の物質の蛍光の反応速度を、0分〜5分、次いで60分に記録する。
【0093】
屠殺後、まず表皮と共に腫瘍を摘出し、次いで脾臓、肝臓、腎臓の臓器を摘出する。
【0094】
腫瘍を表皮−真皮と共に摘出し、アルミ箔の上で(外側を上向きにして)OCTを1滴滴下して凍らせ、アルミ箔で包み、N2中でショック凍結させる。次いで、ドライアイスの上で送り返すまで−80℃にて貯蔵し、さらに−80℃にて貯蔵する。
【0095】
すべてのマウスから脾臓、肝臓、腎臓の臓器を摘出して、N2中でショック凍結させ、送り返すまで−80℃にて貯蔵する。
【0096】
ii)写真記録
(使用した材料/装置)
Nikon Coolpix P2カメラ
24W冷光源(Eltrotec LB24)
光学フィルター:
・ショートパスフィルター 50%カットオフ波長550nm(Melles Geriot 03SWP408または03SWP608)
・「緑色」カラーフィルター 550nm(Melles Geriot 03FCG087/OG550)
・「橙色」カラーフィルター 570nm(Melles Geriot 03FCG089/OG570)
・「赤色」カラーフィルター 590nm(Melles Geriot)03FCG098/OG590)
背景として黒色の粘土板。
【0097】
(カメラの設定)
蛍光を記録する写真を市販のデジタルコンパクトカメラ(Nikon Coolpix
P2)で撮影する。設定したカメラ設定を以下に要約する。
【0098】
【表1】

それぞれの画像設定は、画像ファイル(例えば、PhotoshopまたはPixVue)のEXIF情報から得られ得る。
【0099】
(手順)
三脚上のカメラにフィルターホルダーを取り付け、レンズとマウス/表面の距離が15〜20cmになるよう、3Dヘッドを使用して調整する。角度は、三脚の位置調整によって可能な限り上からの角度で、可能な限り鋭角にすべきである。レンズとの距離ができるだけ小さくなるように、写真フィルターを取り付ける。
【0100】
物質の照明および励起は、ショートパスフィルター(上記参照)によってスペクトルが調整される冷光源によって行われる。光源が発生する熱のためおよび操作性を向上させるために、柔軟性のあるレンズ付きライトガイドを使用して光円錐を集中させる。ショートパスフィルター付きフィルターホルダーをこのライトガイドの上に取り付ける。次いで、表面までの距離が約15cmになるようにライトガイドを実験用スタンドに固定する。さらに、光円錐の直径が約8cmになるようにさらに調整すべきである。影を減らすために、上からの照明の角度をさらに可能な限り鋭角にするべきである。
【0101】
照明のためにマウスおよび実験用スタンドを黒の粘土板の上に置いて、コントラストを向上させる。次いで、マウスを光円錐の中央に配置する。これに関連して、腫瘍の影が最小限になり、十分に照明が当たるよう注意を払うべきである。
【0102】
写真を撮るときに、オートフォーカスの表示に注意すべきである。
【0103】
通常の場合、写真を最大の広角度で撮るべきである。比較的大きなズームでは、カメラは焦点が合わなくなることもあり、さらに開口設定が変わる。
【0104】
写真フィルターを写真ごとに変える場合、可能であれば、比較性を確保し、その後の処理を容易にするために、実験用の他の設定を何も変えないべきである。
【0105】
d)細胞結合アッセイ
(材料および装置)
蛍光顕微鏡:Leica DMIL, Zeiss LSM510METAシグナルエンハンサー、ProLong Gold褪色防止試薬
(緩衝液)
D−PBS(pH7.4)(10×)
1370mM NaCl(80g/L)
27mM KCl(2g/L)
42mM Na2HPO4*12H2O(15.4g/L)/7.652g/L Na2HPO4*2H2O
14mM KH2PO4(2g/L)
pH7.4に調整して、1000mL溶液にする
オートクレーブし、室温にて貯蔵する。
【0106】
Triton X−100溶液
D−PBS中0.1%(v/v)
4℃にて貯蔵する。
【0107】
BSA溶液
D−PBS中3%(w/v)
新たに作製するかまたは−20℃の貯蔵液から作製する。
【0108】
4%PFA溶液
5.71mLのホルムアルデヒド(35%)
5mLの10×D−PBS
pH7.4に調整/確認する
50mLのddH2Oを加えて、4℃にて貯蔵する。
【0109】
0.1Mグリシン溶液
0.375gのグリシン
50mLのD−PBSを加え、pH7.4に調整/確認し、ろ過によって無菌化して、4℃にて貯蔵する。
【0110】
Mowiol/DABCO
2.4gのMowiolを6gのグリセリン(最高純度)と混合させ、続いて6mLのddH2Oを加え、次いで室温にて数時間攪拌する。12mLの0.2M tris(pH8.5)をそれに加えて、混合物を攪拌しながら10分間、50℃にて加熱する。Mowiolが溶解したら(10分より長くかかる)、混合物を5000×gで15分間遠心分離させて、最後に20mg/mLのDABCOを加える。
【0111】
貯蔵:−20℃にてアリコートにおいて、4℃にてわずかに数週間の間使用可能、徐々に硬化する。
【0112】
(抗体)
一次抗体:抗EGFRmAb(マウス)Dianova Ab−5 1:100
二次抗体:Alexa488を有するヤギ抗マウス
(手順)
二日前に、HT29細胞を円形のカバースリップの上に播種する。播種に関しては、37℃にて48時間増殖させた後、50〜70%のコンフルエントな単層が免疫染色の開始時に存在するように、5×104細胞を移植する。
【0113】
BP619−EGF−His結合体を、3%BSAを含有する50μLのマッコイ培地で室温にて30分間プレインキュベートする。
【0114】
HT29細胞がコンフルエントに達すると、培地を吸引して取り除き、細胞をD−PBSで少なくとも1回洗浄する。
【0115】
30〜50μLのプレインキュベートしたBP619−EGF−His結合体をピペットで採取して、洗浄した細胞の上に移し、次いで37℃/7.5%CO2のインキュベーター内で1時間インキュベートする。
【0116】
細胞をBP619−EGF−His結合体で染色した後、細胞をPBSで一度洗浄し、次いで300μLの4%PFA溶液を使用して室温にて15〜20分間固定する。固定後、細胞をD−PBSで一度洗浄し、0.1Mグリシンを使用して室温にて5分間クエンチングする。クエンチング後、細胞をD−PBSで一度洗浄し、次いで、0.1%のTriton X−100−PBSを使用して室温にて10分間透過処理をする。その後、3%BSAを使用して室温にて30分間細胞をインキュベートすることによって細胞をブロックする。
【0117】
染色した細胞をブロックした後、細胞を対比染色することが可能になるか、またはBP619−EGF−His結合体染色を顕微鏡下で直接分析することが可能になる。対比染色は、共局在を分析するために必要である。
【0118】
対比染色をDianova由来の第1抗体、抗EGFR、モノクローナル抗体で行う。抗EGFR抗体を30μLの1%BSA−PBSで1:100に希釈し、次いでピペットで採取して細胞の上に移す。抗EGFRを細胞上で、室温にて60分間インキュベートする。インキュベーションの後、細胞をD−PBSで3回、5分間洗浄を行う。対比染色用の蛍光染色を有する第2抗体は、Alexa488を有するヤギ抗マウスである。この目的のために、第2抗体を30μLの1%BSAで1:200に希釈し、次いでピペットで採取して細胞の上に移す。ヤギ抗マウスAlexa488第2抗体を細胞上で、室温にて60分間インキュベートする。インキュベーション後、細胞をD−PBSで3回、5分間洗浄する。細胞をMowiol/DABCO内に包埋して、顕微鏡下で分析する。
【0119】
e)凍結切片の調製および染色
腫瘍を−80℃にて貯蔵し、切片作製のために冷却ユニット(−80℃まで冷却)付きStyroporボックスに移す。切片作製は、クリオミクロトームで行う。結果として生じる切片は10μmの厚さである。
【0120】
(材料および装置)
蛍光顕微鏡:Leica DMIL、Zeiss LSM510META、洗浄用トラフ、湿度チャンバー、組織領域のマーキング用グリースペン、4%濃度のパラホルムアルデヒド溶液(細胞結合アッセイを参照)、PBS(細胞結合アッセイを参照)、3%濃度のBSA溶液(細胞結合アッセイを参照)、Triton X−100溶液(細胞結合アッセイを参照)、0.1Mグリシン溶液(細胞結合アッセイを参照)。
【0121】
対比染色用のさらなる試薬として、適切な場合には、適切な第1抗体および第2抗体。
【0122】
(手順)
凍結切片を室温にて解凍し、乾燥させる(約10〜20分)。組織の領域をグリースペンで印を付けた後、組織を湿度チャンバー内で20分間、4%濃度のパラホルムアルデヒド溶液で固定する。D−PBSで洗浄した後、続いて0.1Mグリシン溶液で5分間クエンチングさせる。
【0123】
PBSで洗浄し、0.1%Triton X−100での透過処理の後、室温にて1時間、3%濃度のBSA溶液でブロッキングを行う。
【0124】
抗EGFR−A488直接結合体を使用して、原形質膜内のEGFRを検出する。この結合体を1%BSA/PBSで1:100に希釈し、そして切片をそれと共に湿度チャンバー内で室温にて1時間インキュベートする。D−PBSでの洗浄をトラフ内で少なくとも15分間、少なくとも緩衝液を一回変えて行う。
【0125】
Mowiol/DABCOを包埋のために使用し、そして切片(無染色および染色した)を顕微鏡下で分析する。
【0126】
f)顕微鏡分析
試料の顕微鏡分析をZeiss LSM510で行う。以下のフィルターをこの目的のために使用する:
NP蛍光分析用:
FSet 15=フィルターセット15 488015−0000
励起:BP546
ビームスプリッター:FT580
発光:LP 590。
【0127】
Alexa488蛍光分析用:
FSet 46=フィルターセット46 1196−681
励起:BP500/20
ビームスプリッター:FT515
発光:BP535/30。
【0128】
共焦点レーザー分析も一部の試料で実行した(顕微鏡操作の指示書を参照のこと)。
【実施例】
【0129】
2.例示的な実施形態
例示的な実施形態1:
インビボ実験:本発明に従ってヌードマウスへのニュートラビンジン−抗体複合体の腫瘍内注入によるHT29異種移植片腫瘍を使用する動物実験
本発明に従う抗体結合体の特異的腫瘍標的化が、異種移植片腫瘍を有するマウスでのインビボ実験で示された。この目的のために、HT29細胞株のヒト結腸癌細胞をヌードマウス(胸腺がなく従って免疫抑制されている)に皮下注入し、3週間の成長期間後、固形腫瘍が形成された。
【0130】
選択的な腫瘍マーキングのために、本発明に従う抗体複合体を調製したか、またはニュートラビジン結合体を結合した本発明に従うビオチン化モノクローナル抗体を調製した。このモノクローナル抗体は、多数の型のヒト結腸直腸癌で発現する膜関連腫瘍関連グルコース輸送体1抗原(GLUT1)に対するものである。
【0131】
複合体の腫瘍内への注入後、腫瘍は、UV励起を使用して、赤色蛍光によって直ちに視覚的に識別可能になった。注入後48時間までの間に、腫瘍の調製した凍結切片内で本発明の複合体を検出することが可能になった。
【0132】
例示的実施形態2:
i)分光分析によるBiopixels 618(本発明による物質)の強度とCrystalplexアロイナノ粒子630(NC630)の比較。NC630ナノ粒子は、CdSxSe1−x/Zn5核を有し、かつCOOH基で官能基化されたナノ粒子である。
【0133】
以下の値は、図3より明らかである:
BP618濃度 1.67μg/mL
NC630濃度 6.70μg/mL
BP618励起360nm 55000cps
NC630励起360nm 22000cps
BP618励起488nm 25000cps
NC630励起488nm 10000cps。
【0134】
4倍のNC630ナノ粒子のより高い濃度を考慮に入れると、本発明のBP618物質の発光強度は、10倍高い。
【0135】
強度のこの違いは、本発明による直接の視覚化(例えば外科での医療適用に関する)のための造影剤の使用に極めて必須のものである。本発明の物質を使用して、処置を行う臨床医は、直接的にかつ単に蛍光フィルターの支援を使用して、蛍光を観察することが可能であるのに対して、NC630ナノ粒子は、視覚化するためにさらに電子増幅が必要である。
【0136】
ii)ゲルろ過によるBioPixels 619の特徴付け
図4は、溶出容積が16.2mLであることを明らかにする。この値は、10.8nmのストークス直径と相関する。
【0137】
iii)EGF結合BioPixels 619NC630ナノ粒子の注入後の、マウス腫瘍の比較
EGF−HisとBP619の結合を1b)に記載した方法によって実行した。この場合、1.4μMタンパク質を使用して、40μgのナノ粒子(=複製)を結合した。Vivaspin遠心濃縮器を使用する精製/濃縮の後、計約14.3μgのナノ粒子を腫瘍に注入した。
【0138】
1c)に記載するように、写真記録を行った。NC630物質が注入された腫瘍は、蛍光を示さなかった(図5a、マーキングを参照のこと)のに対して、本発明のEGF結合BioPixels 619の使用では蛍光が極めて明らかである(図5b、マーキングを参照のこと)。
【0139】
iv)本発明のEGF結合BioPixels 619を使用する腫瘍内の組織マーキングの顕微鏡法
クリオトームを使用して摘出した腫瘍を切片化し(切片の厚み10μm)、上述(1e)のように顕微鏡分析のために処理した。Biopixel蛍光検出用のFSet15(1fを参照)を使用して、Zeiss顕微鏡(LSM510)で分析を行った。腫瘍のマーキング(図6を参照のこと;暗い背景上の白い領域)は、均一でなく、一部の領域は、より強度が低くマーキングされた(図6aを参照のこと)、他の領域は、より強いマーキングを示す(図6bを参照のこと)。
【0140】
c)例示的な実施形態3
BioPixelsの細胞内取り込みによる本発明のEGF結合BioPixels 619を使用する腫瘍細胞のマーキング
この場合、(1d)に記載する方法によってHT29腫瘍細胞を使用して細胞結合アッセイを実施した。図7aは、BP619蛍光を示す。この場合、蛍光がBP619によって独占的に引き起こされる一部のシグナルを、円で印を付けた。抗体A488の蛍光を図7bに検出した。ここで使用した第1抗体は、EGFR抗体であり、第2抗体は、ヤギ抗マウスA488であった(1dを参照のこと)。もう一度、その蛍光がA488に独占的に起因する一部のシグナルを円で囲んだ。最後に、図7cは、図7aおよび図7bからコピーした画像を示す。シグナルの多くは、共局在を明らかにする、すなわち、それらのシグナルは、図7aおよび図7bの両方で見られる。
本発明の好ましい実施形態によれば、例えば、以下が提供される。
(項1)
インビボ造影剤を調製するための蛍光ナノ粒子の使用であって、該蛍光ナノ粒子は、無機核と、イミダゾール成分を含む不動態化層と、特異的リガンドとを含み、該不動態化層を有する該無機核の流体力学的直径は、15nm以下、好ましくは10nm以下、特に好ましくは5nm以下であり、該ナノ粒子は、700nm未満の発光を示し、該造影剤は、ヒトにおける局所適用に適していることを特徴とする、使用。
(項2)
発光スペクトルが600〜650nm、好ましくは620〜650nmであることを特徴とする、上記項1に記載の使用。
(項3)
前記ナノ粒子が全身的、局所的または表面的に投与または注入されることを特徴とする、上記項1または2のいずれかに記載の使用。
(項4)
特に外科的介入、内視鏡的介入、または最小侵襲的介入で組織をマーキングするための造影剤としての、上記項1〜3のいずれかに記載の使用。
(項5)
前記ナノ粒子がさらに少なくとも1つの修飾因子も含むことを特徴とする、上記項1〜4のいずれかに記載の使用。
(項6)
前記無機核が本質的に貴金属原子を含むクラスター、好ましくは2〜27個の原子を有するクラスターであることを特徴とする、上記項1〜5のいずれかに記載の使用。
(項7)
前記無機核がアロイ/半導体核を含み、該核が均一な組成を有し、かつ2つの半導体のモル比に関して非線形であるバンドギャップエネルギーによって特徴付けられることを特徴とする、上記項1〜5のいずれかに記載の使用。
(項8)
前記無機核が第1の半導体および第2の半導体のアロイを含み、該第1の半導体の濃度が該核の中心からその表面に向かって徐々に増加し、該第2の半導体の濃度が該核の中心からその表面に向かって徐々に減少することを特徴とする、上記項1〜5のいずれかに記載の使用。
(項9)
前記半導体の少なくとも1つがII族〜VI族の半導体またはIII族〜V族の半導体であることを特徴とする、上記項7および8のいずれかに記載の使用。
(項10)
前記核が、以下のアロイ:CdSeTe、CdSSe、CdSTe、ZnSeTe、ZnCdTe、CdHgS、CdHgTe、InGaAs、GaAlAs、InGaN、InGaP、CdSe、またはCdTeの群から選択されるアロイを含むことを特徴とする、上記項7〜9のいずれかに記載の使用。
(項11)
前記不動態化層が、金属原子または金属イオンと配位結合することができかつルイス塩基機能またはヘテロ芳香族系を有する少なくとも1つの化合物を含むことを特徴とする、上記項1〜10のいずれかに記載の使用。
(項12)
前記イミダゾール成分が、以下の群:ヒスチジン、カルノシン、アンセリン、バレイン、ホモカルノシン、ヒスチジルフェニルアラニン、シクロヒスチジルフェニルアラニン、5−アミノ−4−イミダゾールカルボキサミド、ヒスチジルロイシン、2−メルカプトイミダゾール、Boc−ヒスチジン、ヒドラジド、ヒスチノール、1−メチルヒスチジン、3−メチルヒスチジン、イミダゾリジン、イミダゾール含有オルニチン(例えば5−メチルイミダゾール)、イミダゾール含有アラニン(例えばβ−(2−イミダゾリル)−Lαアラニン)、カルジニン、ヒスタミンから選択される1つ以上の化合物を含み、次にこれらのそれぞれが反応基(例えば、アミノ、チオール、カルボキシル、またはカルボキサミド)によって置換され得ることを特徴とする、上記項11に記載の使用。
(項13)
前記不動態化層が前記イミダゾール成分を架橋するための架橋剤を含むことを特徴とする、上記項11または12のいずれかに記載の使用。
(項14)
前記架橋成分がアルキルホスフィンおよび/またはアルキルホスフィン誘導体を含むことを特徴とする、上記項13に記載の使用。
(項15)
前記修飾因子が、以下の化合物:ポリエチレングリコール、単糖、二糖、三糖、低分子量の多糖、親水性ビタミン、親油性ビタミン、脂肪酸、多価アルコール、テフロン(登録商標)、アミノ酸、非特異的なペプチドもしくはタンパク質、ホスホリルコリン、ポリ乳酸、および該化合物の誘導体からなる群から選択されることを特徴とする、上記項5〜14のいずれかに記載の使用。
(項16)
無機核と、不動態化層と、特異的リガンドとを含むナノ粒子であって、該不動態化層を有する該無機核の流体力学的直径が15nm以下、好ましくは10nm以下、特に好ましくは5nm以下であり、該ナノ粒子が600〜700nm、好ましくは620〜650nmの発光を示すことを特徴とする、ナノ粒子。
(項17)
前記ナノ粒子がさらに少なくとも1つの修飾因子も含むことを特徴とする、上記項16に記載のナノ粒子。
(項18)
前記無機核が、本質的に貴金属原子を含むクラスターを含み、好ましくは2〜27個の、好ましくは金、銀および銅の群からのクラスターを含むことを特徴とする、上記項16〜17のいずれかに記載のナノ粒子。
(項19)
前記無機核がアロイ/半導体核を含み、該核が均一な組成を有し、かつ2つの半導体のモル比に関して非線形であるバンドギャップエネルギーによって特徴付けられることを特徴とする、上記項16または17のいずれかに記載のナノ粒子。
(項20)
前記無機核が第1の半導体および第2の半導体のアロイを含み、該第1の半導体の濃度が該核の中心からその表面に向かって徐々に増加し、該第2の半導体の濃度が該核の中心からその表面に向かって徐々に減少することを特徴とする、上記項16または17のいずれかに記載のナノ粒子。
(項21)
前記半導体の少なくとも1つがII族〜VI族の半導体またはIII族〜V族の半導体であることを特徴とする、上記項19または20のいずれかに記載のナノ粒子。
(項22)
前記核が、以下のアロイ:CdSeTe、CdSSe、CdSTe、ZnSeTe、ZnCdTe、CdHgS、CdHgTe、InGaAs、GaAlAs、InGaN、InGaP、CdSeおよびCdTeの群から選択されるアロイを含むことを特徴とする、上記項21に記載のナノ粒子。
(項23)
前記不動態化層が、金属原子または金属イオンと配位結合することができかつルイス塩基機能または芳香族複素環系、好ましくはイミダゾール成分を有する少なくとも1つの化合物を含むことを特徴とする、上記項16〜22のいずれかに記載のナノ粒子。
(項24)
前記イミダゾール成分が、ヒスチジン、カルノシン、アンセリン、バレイン、ホモカルノシン、ヒスチジルフェニルアラニン、シクロヒスチジルフェニルアラニン、5−アミノ−4−イミダゾールカルボキサミド、ヒスチジルロイシン、2−メルカプトイミダゾール、Boc−ヒスチジン、ヒドラジド、ヒスチノール、1−メチルヒスチジン、3−メチルヒスチジン、イミダゾリジン、イミダゾール含有オルニチン(例えば5−メチルイミダゾール)、イミダゾール含有アラニン(例えばβ−(2−イミダゾリル)−Lαアラニン)、カルジニン、ヒスタミンからなる群から選択される1つ以上の化合物を含み、次いでこれらのそれぞれが反応基(例えば、アミノ、チオール、カルボキシル、またはカルボキサミド)によって置換され得ることを特徴とする、上記項23に記載のナノ粒子。
(項25)
前記架橋成分がアルキルホスフィンおよび/またはアルキルホスフィン誘導体を含むことを特徴とする、上記項24に記載のナノ粒子。
(項26)
前記修飾因子が、ポリエチレングリコール、単糖、二糖、三糖、低分子量の多糖、親水性ビタミン、親油性ビタミン、脂肪酸、多価アルコール、テフロン(登録商標)、アミノ酸、非特異的なペプチドもしくはタンパク質、ホスホリルコリン、ポリ乳酸、および該化合物の誘導体を含む群から選択されることを特徴とする、上記項17〜25のいずれかに記載のナノ粒子。
(項27)
上記項16〜26のいずれかに記載のナノ粒子を少なくとも1つ含む、薬学的組成物。
(項28)
治療薬、インビトロ診断補助剤、またはテラノスティック薬としての、上記項16〜26のいずれかに記載のナノ粒子の使用。
【技術分野】
【0001】
本発明は、インビボ診断補助薬として特に適しており、特に異なる組織型を識別するための造影剤として特に適している、蛍光ナノ粒子に関し、かつその内容が参照されている欧州特許出願第05 025 022.4号の優先権を主張する。
【背景技術】
【0002】
数多くの障害において、可能な限り早くかつ有益な診断は、必要な医療手順の選択、調和および実行において極めて重要である。このことは、数多くの腫瘍型に特に当てはまり、これらの腫瘍型の決定および治療には、(可能性のある部分を含めて)健常組織と発癌性組織との間の識別が必須である。従って、患者の回復または生存でさえも、処置および/または手術を行う臨床医が異なる組織型を識別できるかどうか、ならびにどれほど良好に識別できるかに決定的に依存している。
【0003】
これまで、診断および医療手順を改善するために、造影剤が開発されてきており、その助けにより、イメージング法による体内の機能および構造の視覚化が可能である。これらの方法は、癌に関連する細胞変化の標的化された検出のためにとりわけ使用されている。
【0004】
このように、例えば、非特許文献1は、初期の発癌性トランスフォーメーションのマーカーとしての有機発蛍光体に基づく分子特異的造影剤を開発した。この場合、上皮増殖因子受容体(EGFR)の腫瘍に関連した過剰発現は、赤色蛍光抗EGFR抗体結合体(Alexa660)を介して口内の組織変化を同定するために利用される。
【0005】
有機発蛍光体の一般的な欠点は、これらが体内で代謝され、蛍光色素が分解または不活性化されることである。このように代謝は、診断に必要な高標識強度を打ち消す。インビボでの有機発蛍光体の滞留時間が長引くにつれて、この問題は激しくなり、特により深い組織層の細胞を標識する際にかなりの困難を呈する。
【0006】
さらに、より長い波長で発光する有機発蛍光体は、特に、化学結合プロセスで量子収率が減少するという欠点を有する。さらに、有機発蛍光体は、光退色に対して非常に敏感であり、短時間の照射の後でさえも蛍光の相当な損失につながり得る。従って、これらの蛍光体に基づく造影剤は、長期化した励起時間と共に蛍光強度および安定性を有するが、より深い組織層の細胞を検出/標識する(「深部組織イメージング」)ために適切であるには低すぎる。このように、非特許文献1の研究から、Alexa660結合体は最大浸透深さが0.5mmであり、そのため蛍光の検出がもはや合理的に可能なものではないことが明らかになっている。
【0007】
細胞変化の蛍光標識に関するさらに公知の可能性は、いわゆる量子ドット(QD)の使用からなる。QDは、サイズが数ナノメートルの蛍光ナノ粒子であり、その核は、CdSe、CdTe、InP等の半導体物質からなる。
【0008】
しかしながら、既知のQDが生物系で使用される場合、QDは、いわゆるブリンキング現象(すなわち、ナノ粒子が蛍光状態と非蛍光状態とで交互に入れ替わる)を示す。この現象は、量子ドッドを特にインビボでの適用に無用にしてしまう。さらに「ブリンキング」はまた、ナノ粒子の核の崩壊を示す可能性があり、それによって有毒なカドミウムが体内に放出される可能性がある。量子ドットは体内、例えば肝臓または脾臓に蓄積されるので、このことは特に不利である。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Hsu et al.(2004)(「A far−red fluorescent contrast agent to image epidermal growth factor receptor expression」, Photochemistry and Photobiology,79(3):272−279)
【発明の概要】
【発明が解決しようとする課題】
【0010】
従って、本発明は、診断補助薬として、特にインビボでの造影剤として使用するのに特に適している蛍光ナノ粒子を提供するという目的に基づいている。
【課題を解決するための手段】
【0011】
この主題は、主な請求項に記載するように達成される。従属請求項および個別の独立請求項は、有利な実施形態に関する。本発明のナノ粒子は、選択された生物学的な構造または機能の特異的な標識のために、インビトロおよびインビボの両方で使用され得る。特に、ここで選択されるナノ粒子は、医学的介入、特に外科的介入を支援するためのインビボでの造影剤として役立ち得る。
【図面の簡単な説明】
【0012】
【図1】赤色シグナル(GLUT1膜タンパク質に対するニュートラビジンおよびビオチン化抗体の結合体)。マウス細胞に対する特異的結合は明らかでないが、HT−29細胞に対する特異的結合は明らかである(腫瘍全体の均一なマーキングはまだ達成されてない)。
【図2】赤色シグナル(GLUT1膜タンパク質に対するニュートラビジンおよびビオチン化抗体の結合体)。マウス細胞に対する特異的結合は明らかでないが、腫瘍内管の直接近傍でHT−29細胞に対する特異的結合は明らかである(腫瘍全体の均一なマーキングはまだ達成されてない)。
【図3】図3は、分光分析によるBioPixels 618(本発明による物質)の強度とCrystalplexアロイナノ粒子630(NC630)の比較を示す。
【図4】図4は、ゲルろ過の結果を示す。
【図5】図5は、写真記録を示す。NC630物質が注入された腫瘍は、蛍光を示さなかった(図5a、マーキングを参照のこと)のに対して、本発明のEGF結合BioPixels 619の使用では蛍光が極めて明らかである(図5b、マーキングを参照のこと)。
【図6】図6は、顕微鏡での分析の結果を示す。腫瘍のマーキング(図6を参照のこと;暗い背景上の白い領域)は、均一でなく、一部の領域は、より強度が低くマーキングされた(図6aを参照のこと)、他の領域は、より強いマーキングを示す(図6bを参照のこと)。
【図7】図7は、BioPixelsの細胞内取り込みによる本発明のEGF結合BioPixels 619を使用する腫瘍細胞のマーキングを示す。図7aは、BP619蛍光を示す。この場合、蛍光がBP619によって独占的に引き起こされる一部のシグナルを、円で印を付けた。抗体A488の蛍光を図7bに検出した。ここで使用した第1抗体は、EGFR抗体であり、第2抗体は、ヤギ抗マウスA488であった(1dを参照んこと)。もう一度、その蛍光がA488に独占的に起因する一部のシグナルを円で囲んだ。最後に、図7cは、図7aおよび図7bからコピーした画像を示す。シグナルの多くは、共局在を明らかにする、すなわち、それらのシグナルは、図7aおよび図7bの両方で見られる。
【発明を実施するための形態】
【0013】
本発明のナノ粒子は、少なくとも3つの構造体、特に無機核を含む。無機核は、不動態化層によって被覆され、不動態化層はさらに特異的なリガンドを担持し、この特異的なリガンドは不動態化層の一部であり得る。これらは、生物系の標的分子(標的)に対するナノ粒子の特異的な結合につながる。周りが不動態化層で被覆された本発明のナノ粒子の無機核は、15nm以下の、好ましくは10nm以下の流体力学的直径を有する。8nm以下の、または5nm以下の熱力学的直径が特に好ましい。
【0014】
不動態化層は、特に蛍光強度ならびに無機核の化学的および物理的な安定性を高める役割を担う。不動態化層で被覆される無機核は、少なくとも10%、有利には少なくとも30、50、または70%もの量子収率を特徴とする。これに関して、量子収率とは、試料によって放出された光の量の、試料によって吸収された光の量に対する比率を意味する。不動態化層は、1nm以下の厚さを有利に有する。この場合、不動態化核の直径は、2nm以下増加する。
【0015】
いずれの場合もナノ粒子にとって、特に、生物環境との適合性を改善するために修飾因子もまた備わっていることが有利である。修飾因子の使用による流体力学半径の増加は、好ましくは2nmを超えない。個々の場合の不動態化層および修飾因子の厚さは、2つの構造体の相互関係および無機核に対する関係にも依存する。
【0016】
本発明のナノ粒子の大きさに対する制約により、ナノ粒子は、生存する患者における診断補助薬としての使用に特に適している。従って、大きさが減少すれば、拡散速度および組織への浸透深さの増加をもたらす。これは、生物環境におけるナノ粒子の均一で急速な分布、および局所投与後の組織(例えば腫瘍)を通る可能な限り深い浸透を可能にする。本発明のナノ粒子は、同様に、注入によっても行われ得る全身投与を可能にする。しかしながら、局所(lokale)投与(腫瘍の治療に関しては、例えば表面(topische)投与または腫瘍内もしくは腫瘍周辺の投与等)が好ましい。
【0017】
本発明のナノ粒子の特に有利な実施形態は、8nm以下の、特に好ましくは4nm以下の流体力学的直径を有する。この桁の大きさのナノ粒子は腎臓を通って排出されることさえ可能であり、その結果、体内でのそれら粒子の蓄積は明確に少ないかまたはゼロである。本発明のナノ粒子は、従って、おそらく既知の量子ドットと関連する、長期毒性の問題を大幅に軽減させる。
【0018】
さらに有利な実施形態において、本発明のナノ粒子は、600〜700nmの範囲で、特に好ましくは600〜650nmで、具体的に好ましくは620〜650nmで蛍光スペクトルを発する。この発光スペクトルは、生体系(水を含む)中のヘモグロビンおよび他の吸光物質による吸収がごくわずかであるため、最大の組織透過という利点を有する。これらの波長の光は、ヒトの眼でまだ知覚できるので、処置する臨床医は、さらに精巧な検出補助技術(例えば、CCDカメラ)を使用せずに標識組織を同定することができる。これは、本発明のナノ粒子が、(例えば)発癌性組織と健常組織とを識別するための外科的介入中に造影剤として使用される際に、特に有利である。
【0019】
一実施形態において、本発明に従って使用され得るナノ粒子は、例えば、科学出版物を参照する米国特許出願公開第2004/0247861号に記載される(段落番号[0006]を参照)とおりの、例えばCdSe、CdSまたはCdTeから構成される核を有する既知のナノ粒子である。本公報ではまた、核の材料の調製に関する文書(段落番号[0007]を参照)、例えば米国特許第6,179,912号を参照する。これらの文書は、これらの既知のナノ粒子の特性およびその調製の開示に関して、全体が参照されている。
【0020】
本発明のナノ粒子の無機核が本質的に半導体から構成される場合、それは特に有利である。これらの核は、それらの個々の大きさおよび/または組成に依存して、種々の色の光を発するが、光スペクトルの同一領域(UVからVIS領域まで)ですべて広域なバンド吸収を示す。高いストークスシフトのために、励起および発光のスペクトルは、遠く離れて存在し、異なる量子ドットの単純でかつ同時の励起を可能にする。それらは、わずかにしか重ならないかまたは全く重ならない、狭くかつ対称的な発光スペクトルを有する。さらに、特に、浸透の深さおよびインビボでの標識の向上のために極めて重要である陽性特性は、80%までの高い量子収率および高い光安定性である。
【0021】
本発明のナノ粒子の無機核を表し得る量子ドットは、国際公開第2005/001889号に開示される。これに基づいて、均一に分散するか、それとも各々の場合にアロイ内の濃度勾配が存在するかのどちらかである、少なくとも2つの半導体のアロイから構成される無機核が関与する。上記で引用された国際公開第2005/001889号は、これらの量子ドットの性質および調製の開示に関して参照されている。核は、いずれの場合にも大きさが5%まで異なる可能性がある。
【0022】
従って、本発明のナノ粒子の無機核は、少なくとも2つの半導体のアロイを含むことが可能であり、核は均一な組成を有し、かつ2つの半導体のモル比に関して非線形であるバンドギャップエネルギーによって特徴付けられる。
【0023】
あるいは、核は、全く不均一であり得、この場合には、第1の半導体の濃度は核の中心から始まって核の表面まで徐々に上昇し、および第2の半導体の濃度は、核の中心からその表面に向かって徐々に減少する。
【0024】
半導体の少なくとも1つはII族〜VI族の半導体であるか、またはIII族〜V族の半導体である(族の定義は、元素周期表の族に対応する)ことは、両方の核について同様に当てはまる。アロイは、例えば以下のアロイの群から選択され得る:CdSeTe、CdSSe、CdSTe、ZnSeTe、ZnCdTe、CdHgS、CdHgTe、InGaAs、InGaP、GaAlAs、InGaN。これらの核は、さらに、例えば半導体(例えばZnS)等の無機物質の被覆を有することも可能である。この付加的な層は、「キャッピング」または「シェル」として当業者に既知である。
【0025】
II族〜VI族およびIII族〜V族の半導体は、一般的に知られており、例えば、CdS1−xSex、CdS1−xTex、CdSe1−xTex、ZnSe1−xTex、Zn1−xCdxTe、Cd1−xHgxS、Cd1−xHgxTe、In1−xGaxAs、Ga1−xAlxAsおよびIn1−xGaxPが挙げられる。好ましくは使用される半導体は、CdSe1−xTex、CdS1−xTex、ZnSe1−xTex、Zn1−xCdxTe、Cd1−xHgxS、Cd1−xHgxTe、In1−xGaxAs、In1−xGaxPであり、xは0〜1の有理数である。
【0026】
半導体のモル比は任意のモル比をとり得る。しかしながら、アロイがCdSSeを含む場合、好ましいアロイは、分子式CdS1−xSexを有する。アロイがCdSTeを含む場合、好ましいアロイは、分子式CdS1−xTexを有する。アロイがZnSeTeを含む場合、好ましいアロイは、分子式ZnSe1−xTexを有する。アロイがZnCdTeを含む場合、好ましいアロイは、CdTeのみからなる分子式を有する。これらの記述において、xはいずれの場合にも、0〜1の有理数である。
【0027】
本発明のナノ粒子のこれらの好ましい無機核は、以下の工程で調製され得る:(i)ナノ結晶の形成を可能にする条件下で第1溶液を調製する、(ii)ナノ結晶の形成が不可能な条件下のモル比で半導体の前駆体を含む第2溶液を調製する、(iii)第2溶液を第1溶液に添加して、ナノ粒子を形成させる、および(iv)ナノ結晶の成長およびその形成を終結/停止させる条件を変更する。核を調製する方法については、国際公開第2005/001889号に記載されており、本公報は、本発明のナノ粒子の無機核のこの好ましい実施形態の調製の開示に関して参照されている。
【0028】
別の実施形態において、無機核は、(好ましくは2および27個の貴金属原子を含む)貴金属クラスターから本質的に構成され得る。好ましい実施形態において、貴金属は、金、銀、銅、プラチナ、パラジウム、オスミウム、イリジウム、ルテニウム、およびロジウムからなる群から選択される。クラスターは、様々な電荷を有し得る。
【0029】
これらの核は、それらの強力な吸収および発光のために、単一の、いわゆるナノドットとして、水銀ランプの弱い励起で容易に検出され得るという利点を有する。これらの核を有する本発明のナノ粒子は、単一分子の蛍光標識および複数の標識として有利に使用される。
【0030】
本発明と関連して、「貴金属」という用語は、金、銀および銅、ならびに白金族金属(PGM)プラチナ、パラジウム、オスミウム、イリジウム、ルテニウム、およびロジウムからなる群から選択される元素群を指す。本発明の好ましい実施形態において、貴金属は、金、銀、および銅からなる群から選択される。特に好ましい実施形態において、貴金属は、銀または金である。
【0031】
「クラスター」という用語は、2〜27個の金属原子の組み合わせを指す。クラスターは、とりわけ化学触媒作用、セラミックス、半導体技術、および物質科学の領域で知られている。従って、当業者は、その調製を熟知している。国際公開第2004/003558号は、とりわけ貴金属クラスターの調製を記載し、それらに関する文献の広範な参照をさらに含む。特に、有機分子に関連する貴金属ナノクラスターの調製について開示されている。これに関連して、結合という用語は、結合の化学的性質または物理的性質(例えば、共有結合、非共有結合、静電気結合、またはファンデルワールス結合)にかかわりなくすべてのタイプの結合と理解されるものとする。国際公開第2004/003558号は、本発明のナノ粒子の核としてのナノクラスターの調製に関して参照されている。
【0032】
本発明のナノ粒子は、蛍光強度を増加させ、無機核の化学的および物理的な安定性を改善させる不動態化層を有する。従って、ナノ粒子は、10%を超える、好ましくは50%を超える量子収率で光を発光する。
【0033】
本発明のナノ粒子は、好ましくは4℃の水性の環境で少なくとも12ヵ月の貯蔵安定性を示し、好ましくはpH5〜pH10の範囲のpHで安定しており、すなわち、本発明のナノ粒子は、量子収率、最大放出の位置、発光スペクトルの半値幅等のそれらの特定のスペクトル特性に関して50%未満の偏差を示す。好ましい粒子は、これらの特定のスペクトル特性に関して10%未満の偏差を示す。
【0034】
本発明のナノ粒子はまた、生物学的条件下またはインビボで、少なくとも3日間にわたり核(それを囲む不動態化層を含む)の特性の本質的に定常性/安定性を示す。好ましい粒子は、7〜14日間、または数週間までの期間にわたって、このような定常性/安定性を示す。ここで定常性は、本発明では、上述の一部またはすべての特性の50%までの偏差/変化を意味する。特に好ましい粒子は、10%未満の偏差/変化を示す。
【0035】
不動態化層は、金属原子または金属イオン(例えば、亜鉛、水銀、またはカドミウムのイオン)と配位結合することができる少なくとも1つの化合物を含む。この化合物は、ルイス塩基、または共鳴電子を有する環状もしくは直鎖状の不飽和化合物であり得る。環状の不飽和化合物として、それはまた、複素環またはヘテロ芳香族の化合物であり得る。好ましい実施形態において、不飽和基または結合基は、分子の構造に関して末端の位置に位置する。不動態化層は、さらに架橋剤を含むことが可能であり、または環状もしくは直鎖状の不飽和化合物も架橋剤として機能し得る。
【0036】
金属原子または金属イオンと配位結合する化合物は、キレート化、配位、またはルイス塩基の電子供与体の特性によって蛍光無機核に機能的に結合でき、そして対応して結合した部分/基を含み得る。これらの分子は、さらに、それらで被覆される核に、水溶液中での溶解性または湿潤性を付与する部分を含み得る。
【0037】
これらの分子または化合物は、1つ、2つ、またはより多くの結合した(さもなければ、融合した)環を有する均一のまたは不均一の(複素環式の)環系を含み得る。好ましい複素芳香族系の例は、チアゾール、チアゾール誘導体、オキサゾール、オキサゾール誘導体、ピロール、ピロール誘導体(ドープされたかまたは非ドープのポリピロールオリゴマーを含む)、チオフェン、チオフェン誘導体(ドープされたかまたは非ドープのポリチオフェンを含む)、フラン、フラン誘導体、ピリジンおよびピリジン誘導体、ピリミジンおよびその誘導体、ピラジン、ピラジン誘導体、トリアジンおよびトリアジン誘導体、トリアゾール、トリアゾール誘導体、フタロシアニンおよびフタロシアニン誘導体、ポルフィリンおよびポルフィリン誘導体である。これらの化合物は、アセチレン、プロピン、およびアレンも含み得る、不飽和(オレフィン)炭化水素またはそれらのアミン、リン誘導体もしくは酸素誘導体を含み得るが、これらに限定されるものではない。半導体核の表面上で付加物形成または共鳴に加わるために、分子は適切なpもしくはpi電子密度を有することが好ましい。
【0038】
ヘテロ芳香族化合物は、好ましくはイミダゾール成分である。さらに、アルキルホスフィン化合物が架橋剤として添加されることが好ましい。
【0039】
「イミダゾール成分」という用語は、この記載において、少なくとも1つのイミダゾール基(イミダゾール誘導体を含む)を含み、かつ、カドミウム、亜鉛、ガリウム、または金属陽イオンもしくはこのような陽イオンを含む基板等の金属への無機核または不動態化層の結合に利用できる、複素環式分子またはヘテロ芳香族分子を意味する。これに関連して、少なくとも1つのイミダゾール基は、好ましくは、分子の構造に関して末端位置にあるべきである。イミダゾール成分は、非局在分子軌道を含む環を介してその機能的な形態で蛍光ナノ結晶に結合する。イミダゾール環の窒素は、通常、カドミウムまたは亜鉛などの金属イオンを機能的な様式で結合するための配位リガンドとしての働きをする。
【0040】
一実施形態において、イミダゾール成分は、1つもしくは2つのアミノ酸、例えばヒスチジン、カルノシン、アンセリン、バレイン(Balein)、ホモカルノシン、ヒスチジルフェニルアラニン、シクロ−ヒスチジルフェニルアラニン、5−アミノ−4−イミダゾールカルボキサミド、ヒスチジルロイシン、2−メルカプトイミダゾール、Boc−ヒスチジン、ヒドラジド、ヒスチノール、1−メチルヒスチジン、3−メチルヒスチジン、イミダゾリジン、イミダゾール含有オルニチン(例えば、5−メチルイミダゾール)、イミダゾール含有アラニン(例えば、β−(2−イミダゾリル)−Lαアラニン)、カルジニン(Carzinin)、ヒスタミン等の反応性官能基を含む。これらのヒスチジンに基づく分子またはイミダゾール含有アミノ酸は、一般的に公知の方法で合成され得る。
【0041】
「アルキルホスフィン」という用語は、本発明では、Se、S、もしくは他の非金属等の非金属を結合もしくはキレート化するための少なくとも1つのホスフィン基(その誘導体を含む)、またはこのような原子を含む基質を含み、かつ隣接する分子との反応のため少なくとも1つの官能基(例えば、ヒドロキシル−、アミノ−、チオール−、カルボキシル−、カルボキサミド−等)を提供する分子を意味する。
【0042】
好ましくは少なくとも1つのホスフィン基は、分子の構造に関連して末端位置に位置すべきである。ホスフィン部分は、機能的な形態のSeまたはS等の非金属またはイオンを蛍光核またはシールド層からの化合物に結合するために、配位リガンドとしての働きをする。
【0043】
好ましい実施形態において、アルキルホスフィン含有化合物は、共に連結される(例えば重合形態の)1つ、2つ、またはそれより多くのホスフィン基を含み、そしてヒドロキシメチルホスフィン化合物等も含み得るが、これらに限定されることはない。アルキルホスフィン含有化合物は、一般に公知の方法で合成され得る。さらに公知のように、アルキルホスフィン含有化合物は、さらに、1つ以上の付加的な官能基(例えば、ヒドロキシル−、アミノ−、チオール−、カルボキシル−、カルボキサミド−等)を含み得る。誘導体の例は、誘導体が、本明細書に記載される被覆としてのアルキルホスフィンの機能に適合する限り、ヒドロキシメチルホスフィン誘導体、アミド、またはエステルである。
【0044】
特に、本発明のナノ粒子の蛍光無機核を被覆するために好ましいのは、トリス(ヒドロキシメチル)ホスフィンおよびβ−[トリス(ヒドロキシメチル)ホスフィノ]プロパン酸である。架橋したアルキルホスフィン含有化合物が、ZnまたはCd等の金属原子および/またはイオンに機能的に結合するさらなる可能性を有することは一般に公知である。これに関して、官能化イソシアネートまたはアルキルシアノアクリレートは、リガンドおよび蛍光核との付加物形成にとってさらに有用な架橋剤であり得る。
【0045】
本発明に従って存在する不動態化層の不動態化効果は、ヘテロ芳香族化合物または複素環(好ましくはイミダゾール成分を有する)との錯体形成(Komplexierung)による表面のカドミウム原子または亜鉛原子等のシールド、およびアルキルホスフィン含有化合物との錯体形成による逆原子(SeもしくはS等)のシールドに基づく。
【0046】
本発明のナノ粒子の不動態化層は、米国特許出願公開第2004/0247861A1号に開示される。この公開された明細書は、不動態化層、例えば量子ドットで被覆した無機核の調製を記載する。従って、米国特許出願公開第2004/0247861号は、本発明に従って使用される不動態化層およびそれによって被覆した無機核の調製を開示する目的で参照されている。
【0047】
不動態化層の分子は、標的分子および細胞(特異的リガンド)を結合および架橋するために、化学基をさらに含み得るかまたは保有し得る。ZnSO4およびNa2S等の対応する不動態化試薬の存在下で、これらの分子または化合物は、蛍光核上の分子によって不動態化層を形成することができる(「キャッピング」または「シェル」)。
【0048】
これらの試薬はまた、このさらなる不動態化層もまた核の表面上に直接形成され得るように蛍光ナノ結晶の表面上で原子またはイオンに機能的に結合することが可能である。
【0049】
有利な実施形態において、本発明のナノ粒子はさらに、有機および/または無機の部分からなり得る修飾因子を含み得る。修飾因子は、液体媒体または懸濁媒体、特に生理環境でのナノ粒子の適合性、有効性、および/または溶解性を向上させる働きをする。この表面改変は、生物系、特に人体において最小の非特異的吸着および上昇した適合性を達成するために、特に有利である。
【0050】
1つの可能性としては、ナノ粒子の小さい全体サイズを維持するために、特定の医療応用で、特に低分子量型ですでに承認されているポリエチレングリコール(PEG)を使用して表面を改変する方法がある。これにより、ナノ粒子の生体適合性とその血液循環時間の両方および細胞への取り込み効率を上昇させ得る。低分子量PEG層と例えば葉酸等のビタミンのようなさらなる物質とを組み合わせることによって、マクロファージ内でのナノ粒子のより少量の取り込みを達成することが可能である。なぜなら、ナノ粒子へのタンパク質吸着はそれによって低減し、従って免疫系によるナノ粒子の認識が妨げられるからである。
【0051】
1つまたは異なる単糖から構成される低分子量多糖までの、単糖、二糖、または三糖で被覆することは、修飾因子の使用による有利な表面改変のさらなる可能性を表す。可能性ある1つの実施形態は、例えばポリグルコースを使用した改変であり、ここでは代用血液として医学的に承認されているデキストランを使用することが可能である。デキストランは良好な生体適合性/耐性を示す。さらなる実施形態は、あり得る分解を妨害するための糖類の立体異性体形態(D体/L体)の使用である。
【0052】
さらなる実施形態は、例えば、チアミン、リボフラビン、ナイアシン、ピリドキシン、コバラミン、パントテン酸、アスコルビン酸、および葉酸等の生物学的に適合性の親水性ビタミンの修飾因子としての使用である。従って、例えば、葉酸は癌細胞へのナノ粒子の好ましい結合につながり得る。このビタミンは、ごく低い免疫原性しか示さず、従って高い生体適合性を示す。膜結合型葉酸受容体への結合は、ナノ粒子の内在化を促進する。
【0053】
レチノール、コレカルシフェロール、トコフェロール、およびフィロキノン等の親油性ビタミンによる表面改変は、同様に可能である。従って、例えば、ビタミンEは、ナノ粒子の増大した細胞取り込みにつながり得る。
【0054】
例えば、1−オクタデセンまたは18−メチルエイコサン酸およびその誘導体等の脂肪酸は、コロイドの溶解性および安定性を増大させることが可能であり、その後の特異的リガンドの結合に利用することが可能な末端官能性カルボキシル基を有し得る。従って、修飾因子として脂肪酸を含むことも価値がある。
【0055】
表面改変のさらなる実施形態は、非特異的タンパク質吸着を特に十分に減少させることができる、例えばジエチレングリコール(DEG)等の多価アルコールを使用する被覆である。同様のことが、減少したタンパク質吸着を達成することが可能であることに基づき、ポリテトラフルオロエチレン(PTFE、テフロン(登録商標))にも、特に、その低分子量の形態に当てはまる。ポリテトラフルオロエチレンは、心臓外科での適用で頻繁に使用される。
【0056】
表面改変は、タンパク新生アミノ酸および非タンパク新生アミノ酸の両方を含む1つ以上の天然に存在するアミノ酸、ならびに合成アミノ酸で行われることが可能である。これに関連して、両方の立体異性体(D体およびL体)を使用することが可能である。上述のアミノ酸から、構成されているジ、トリ、テトラから小さいポリペプチドまでのものは、免疫系をほとんど刺激せず、従って同様に薄い適合性層に適している。これに関連する可能性は、人工アミノ酸配列および生物学的タンパク質由来の配列である。例えば、フィトケラチン等の天然タンパク質のペプチド誘導体は、表面改変で同様に使用され得る。TatペプチドおよびTatペプチド含有ペプチドを使用する表面改変は、ナノ粒子を生物医学的適用で使用できるようにするさらなる可能性である。Tatペプチドは、例えば、細胞膜を通って細胞核に金のナノ粒子を運ぶのに有効な分子である。
【0057】
可能性のある修飾因子のさらなる実施形態は、ホスホリルコリン被覆の形成である。ホスホリルコリンは、例えばコンタクトレンズ上での可能性のある非特異的なタンパク質の吸着を低減させる。非血栓形成特性のために、ホスホリルコリンの改変は生物系で十分に使用されることが可能であり、かつ長期安定性が高いことによって区別される。
【0058】
ポリ乳酸は生体適合性であるので、この物質は、様々な医療適用で使用されている。特に、ポリ乳酸の低分子量の形態は、本発明のナノ粒子の表面改変にとってさらなる可能性を示す。これに関連して、可能性のある生分解を低減させるために両方の立体異性体(D/L体)を使用することが可能である。
【0059】
記載した表面改変に加えて、タンパク質分解により切断可能な様式で非特異的タンパク質をナノ粒子に結合させることが可能である。これにより、生体適合性/耐性が上昇し得る。巨大タンパク質の除去が標的部位で起こって、組織内で小さいナノ粒子が放出され得る。同様に、適切な滞留時間後に、除去が起こることも可能である。この目的に適した好ましいものは、例えば、トランスフェリン、ラクトフェリン、セルロプラスミン、エラスチン、およびアルブミンなどの広範に使用されるタンパク質、ならびに非特異的な吸着を低減させる他のタンパク質である。このように、例えば、ポリペプチドとエラスチンの組み合わせから構成される表面被覆は、望ましくない血栓形成を防止し得、従って、ナノ粒子の生体適合性を上昇させ得る。
【0060】
主要な血清タンパク質アルブミンは、原形質膜との非特異的な相互作用を低減させることができる。対応して改変されたナノ粒子は、該粒子表面への特異的リガンドの同時結合を介して、標的細胞との特異的相互作用を形成する能力をさらに維持する。血清アルブミンによる被覆は、静脈内投与後のマクロファージによる迅速な取り込みを防止することによって、非被覆ナノ粒子の場合よりも実質的に長い血液循環時間につながり得る。
【0061】
上記に概略を述べた非特異的被覆に加えて、本発明のナノ粒子は、標的細胞に特異的なリガンドによる選択的標的を保有し、それらは、例えば、腫瘍細胞特異的な構造もしくは他の標的に結合する、例えば、タンパク質、抗体、ペプチドに結合される、または特に好ましくは小さな高親和性のタンパク質ドメイン、抗体断片、または他の有機分子に結合される。
【0062】
記載したより高い速度の拡散および灌流をもたらす減少した流体力学的直径を、前述の特性および改善と組み合わせこと、ならびに特に光の可視赤色領域で高い蛍光強度と組み合わせることにより、本発明のナノ粒子を、インビボでの組織型の選択的で正確な識別のための可能な様々な用途を有する容易な診断補助薬とする。組織特異的な生物マーカーとの組み合わせでのこれらの可能性は、特に、異常な、(前)発癌性組織と正常な組織を識別して外科的介入中の、より正確な腫瘍切除のための視覚的評価を支援するのに役立つ。これに関連して使用され得る本発明のナノ粒子は、このように造影剤として役立つ。
【0063】
本発明に従って、ナノ粒子は、インビトロまたはインビボでの診断補助薬として、テラノスティック薬(Theranostikum)および/または治療薬のいずれかで使用され得る。この目的でナノ粒子は、局所投与(例えば、腫瘍内に、筋肉内に、もしくは外科的に到達可能な組織/器官に)、さもなければ全身投与(例えば静脈内に)され得る。局所/表面投与は、液体、噴霧溶液、ゲル、泡、クリーム、活性パッチとして想定され得る。これは、特に、中空器官の治療/診断で好まれ得る。経口摂取も、例えば液体としてまたは錠剤もしくはカプセルの形態で可能である。吸入も、同様に(例えばスプレー)可能である。坐薬による経肛門投与が想定される。1つの変異形では、ナノ粒子は、デポー形態で移植され得る。「診断補助薬」という用語は、本発明と関連して、「造影剤」と同義語として使用される、すなわち医療介入を支援するために、生物系、特に生存するヒトにおける形態的もしくは機能的な構造を識別する視覚化のために役立つ。
【0064】
ナノ粒子は、特に外科的介入で診断補助薬として使用され得る。ナノ粒子は、同様に最小侵襲法(例えば、内視鏡検査、腹腔鏡検査)で使用され得る。PET、MRI、CT等の画像化法との組み合わせは、価値がある。
【0065】
すでに上述したように、本発明による局所投与の形態での使用は、特に有利である。これに関連して局所投与で使用されるCdの量は、有利にも、高齢で通常の生活様式の人がいずれにしても一生の間に肝臓および腎臓に通常蓄積する総曝露量の10分の1を超えない。これらの器官の総曝露量は、約18mg(Saturag et al.,2000;British Journal of Nutrition;2000,(84),791−802)である。従って、供給されるCdの量が2mgの値を少なくとも実質的に超えないようにナノ粒子の量を制限することは、局所投与では有利である。特に好ましい実施形態において、カドミウムが0.6mg、特に好ましくは0.2mgの総量を超えない造影剤の量の場合でも腫瘍の視覚化は可能である。
【0066】
この実施形態の特定の利点は、生存するヒトに対する医療適用でのナノ粒子の使用が、それによって初めて可能となることである。さもなければ(すなわち、全身投与の場合)これは、それに関連する毒性のために除外されてしまうからである。これは、局所投与が、適切な視覚化に必要とされるナノ粒子の用量を低減させるためである。
【0067】
Cdを含有する造影剤は、本発明に従って、インビボで腫瘍を視覚化するために、腫瘍組織1cm3あたり0.002〜0.02mgのCdの量に対応する用量で有利に使用されることが明らかになった。腫瘍組織1cm3あたり0.002〜0.015mgのCdの造影剤の投与量は、特に、有利であり、とりわけ1cm3あたり0.002〜0.010mgのCdの範囲が有利である。この有利な用量を使用して、ヒトに対して通常許容される曝露量の上限を超えることなく、インビボで約150cm3までの体積の腫瘍を視覚化することが可能である。
【0068】
検査は、患者の到達可能なすべての組織/器官、特に皮膚、中空器官(例えば、消化管、泌尿生殖器、気道内の)、さもなければ感覚器官の外部から到達可能な領域および心血管系に関し得る。
【0069】
インビトロ診断補助薬としての使用(例えば、免疫組織化学またはFACS、およびELISA)も可能である。インビボおよびインビトロでの診断の組み合わせ(例えば生検材料)は、特に有利である。
【0070】
ナノ粒子が本発明に従って治療目的で使用される場合、ナノ粒子の一部のリガンドだけが、エフェクター分子または活性物質(すなわち、エフェクターを表す)を有し得る。これに関連したエフェクターは選択された機能を有するリガンドである。ナノ粒子は、体内または組織内でナノ粒子の標的化された局在化のための特異的なリガンド、およびエフェクター分子を有するリガンドの両方を有利に保有する。
【0071】
エフェクターは、ナノ粒子に結合されたままであってもよく、または除去されてもよく、または脱離もしくは放出されてもよい。エフェクターは、例えば、受容体の活性化/不活性化、(表面)構造のマスキング、免疫系の活性化(「プライミング」)、シグナル伝達経路の調節、酵素の活性化または非活性化、遺伝子治療(例えば、プラスミドもしくはsiRNAの標的化された送達による)、毒素/化学療法剤/細胞増殖抑制薬の標的化された送達、または例えば、代謝、とりわけホルモン生成に対する刺激効果を介してその機能を発揮し得る。細胞(例えば、インスリン産生B細胞)の保護も可能である。
【0072】
1.方法
a)ビオチン化モノクローナル抗体が結合されたBP619−ニュートラビジン結合体の調製
(化学物質および材料)
ナノ粒子
BP619 200μg/mL
BP619またはBP617ナノ粒子は、本発明のナノ粒子であり、すなわち、米国特許出願公開第2004/0247861A1号に開示されるように、CdSxSe核(「アロイ核」)および不動態化層を有する。
【0073】
タンパク質
精製タンパク質は、リン酸/NaCl緩衝液(−80℃にて貯蔵)中に存在する。
【0074】
MES緩衝物質(Sigma)、NaCl、KCl、Na2HPO4、KH2PC4、EDC(1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩)、S−NHS(N−ヒドロキシスルホスクシンイミド)、透析チャンバー(Slide−A−Lyzer)、Vivaspin(MWCO 50kDa、VivaScience)。
【0075】
(緩衝液)
D−PBS(10×)
1370mM NaCl(80g/L)
27mM KCl(2g/L)
42mM Na2HPO4*12H2O(15.4g/L)/7.652g/L Na2HPO4*2H2O
14mM KH2PO4(2g/L)
1000mL溶液にする。pHは約7.5にするべきである。オートクレーブし、室温にて貯蔵する。
【0076】
1×PBS溶液については、100mLの10×緩衝液をddH2Oで希釈して、数滴の2M NaOHで所望のpH(pH7.4(抗体)または8.0(QD))に調整してから完全に1Lにする。
【0077】
MES緩衝液=活性化緩衝液
新たに生成する(有機緩衝液、オートクレーブは不可)
0.8Lの配合(0.1M MES、0.25M NaCl、pH6.0):
15.616g MES
11.688g NaCl
800mLのddH2Oを加えて、pH6.0に調整する。
ddH2Oで最高0.7Lにする。次いで、2Mまたは5MのNaOHでpHを調整する。続いて、ddH2Oで800mLにする。
【0078】
1Mグリシン溶液(ろ過して無菌化される場合は、4℃にて長期保存が可能である)、アリコートを除去する。
【0079】
(手順)
最初に、MES緩衝液(活性化緩衝液)をガラス製のメスシリンダーで調製する。透析チャンバーをMES緩衝液中で1〜2分間水和させてから使用する。100μLのBP619(20μg)を無菌のエッペンドルフバイアル中でMES緩衝液を加えて400μLの最終容量にして、ピペットで十分に混合する。BP619を透析チャンバー(3.5kDa)に移す。1回目の透析で、BP619を、室温にて連続混合し、遮光しながら1時間にわたって800mLのMES活性化緩衝液に対して透析する。1回目の透析後、BP619を透析チャンバーから取り出し、エッペンドルフバイアルに移す。EDCおよびS−NHSとBP619を混合させるために、いずれの場合にも100mM EDCおよび100mM S−NHSの貯蔵液を使用直前に調製する。1回目の透析後、33μLの100mM S−NHSおよび13μLの100mM EDCをピペットで採取してBP619に添加し、遮光して室温にて15分間、350rpmで振盪させる。インキュベーション後、BP619をPBSに対して透析する。この目的のために、BP619を透析チャンバー(MWCO 3.5kDa)に移し、遮光して1時間、pH8.0のPBSに対して透析する。2回目の透析後、BP619を透析チャンバーから取り出し、エッペンドルフバイアルに移す。活性化したBP619を80μgのニュートラビジン(10mg/mLで8μL、D−PBSとの最終容量20μL)と混合させる。この反応混合物を、次いで、遮光して室温にて2時間、350rpmで振盪させる。結合の後、結合体混合物を4℃にて、遮光して貯蔵する。次の日、依然として残っているあらゆる反応性基を飽和させるために、1Mグリシンをピペットで採取して、最終濃度10mMのグリシンに添加する。
【0080】
BP619結合体を、Vivaspin遠心管を使用して濃縮させる。所望の濃度に達するまで結合体を遠心分離する。その後、膜関連および腫瘍関連のグルコース輸送体1(GLUT1)抗原に対するビオチン化モノクローナル抗体を化学量論的に添加する。
【0081】
b)EGF−HisとBP619との結合
(化学物質および材料)
ナノ粒子
BP619 200μg/mL。
【0082】
タンパク質
精製タンパク質は、リン酸/NaCl緩衝液(−80℃にて貯蔵)中に存在する。
【0083】
MES緩衝物質(Sigma)、NaCl、KCl、Na2HPO4、KH2PO4、EDC(1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミド塩酸塩)、S−NHS(N−ヒドロキシスルホスクシンイミド)、透析チャンバー(Slide−A−Lyzer)、Vivaspin(MWCO 50kDa、VivaScience)。
【0084】
(緩衝液)
D−PBS(10×)
1370mM NaCl(80g/L)
27mM KCl(2g/L)
42mM Na2HPO4*12H2O(15.4g/L)/7.652g/L Na2HPO4*2H2O
14mM KH2PO4(2g/L)
1000mL溶液にする。pHは約7.5にするべきである。オートクレーブし、室温にて貯蔵する。
【0085】
1×PBS溶液については、100mLの10×緩衝液をddH2Oで希釈して、数滴の2M NaOHで所望のpH(pH7.4(抗体)または8.0(QD))に調整してから完全に1Lにする。
【0086】
MES緩衝液=活性化緩衝液
新たに生成する(有機緩衝液、オートクレーブは不可)
0.8Lの配合(0.1M MES、0.25M NaCl、pH6.0):
15.616g MES
11.688g NaCl
800mLのddH2Oを加えて、pH6.0に調整する。
ddH2Oで最高0.7Lにする。次いで、2Mまたは5MのNaOHでpHを調整する。続いて、ddH2Oで800mLにする。
【0087】
1Mグリシン溶液(ろ過して無菌化される場合は、4℃にて長期保存が可能である)、アリコートを除去する。
【0088】
(手順)
最初に、MES緩衝液(活性化緩衝液)をガラス製のメスシリンダーで調製する。透析チャンバー(3.5kDa)をMES緩衝液中で1〜2分間水和させてから使用する。100μLのBP619(20μg)を無菌のエッペンドルフバイアル中でMES緩衝液を加えて400μLの最終容量にし、ピペットで十分に混合する。BP619を透析チャンバー(3.5kDa)に移す。1回目の透析で、BP619を、室温にて連続して攪拌し、1時間遮光しながら800mLのMES活性化緩衝液に対して透析する。1回目の透析後、BP619を透析チャンバーから取り出し、エッペンドルフバイアルに移す。EDCおよびS−NHSとBP619を混合させるために、いずれの場合にも100mM EDCおよび100mM S−NHSの貯蔵液を使用直前に調製する。1回目の透析後、33μLの100mM S−NHSおよび13μLの100mM EDCをピペットで採取してBP619に添加し、遮光して室温にて15分間、350rpmで振とうさせる。インキュベーション後、BP619をPBSに対して透析する。この目的のために、BP619を透析チャンバー(3.5kDa)に移し、遮光して1時間、pH8.0のPBSに対して透析する。2回目の透析後、BP619を透析チャンバーから取り出し、エッペンドルフバイアルに移す。活性化したBP619を4.92μgのEGF−His(20μLの最終容量までPBSで希釈させる)と結合させる。この目的のために、活性化BP619をピペットで採取してEGF−Hisに添加し、ピペットで十分に混合する。この反応混合物を、次いで、遮光して室温にて2時間、350rpmで振盪させる。結合の後、結合混合物を4℃にて、遮光して貯蔵する。次の日、依然として残っているあらゆる反応性基を飽和させるために、1Mグリシンをピペットで採取して、最終濃度10mMのグリシンに添加する。
【0089】
BP619−EGF−His結合体を、Vivaspin遠心管(50kDa MWCO)を使用して濃縮させる。この場合、膜を4mLのddH2Oで1回予洗し、次いで再び4mLのPBSで洗浄する。BP619−EGF−His結合体を2mLのPBSで希釈し、膜にローディングする。次いで、BP619−EGF−His結合体を2mLのPBSで再び洗浄する。所望の濃度に達するまで結合体を遠心分離させる。
【0090】
c)動物実験
i)手順
この目的のために、HT29細胞株のヒト結腸癌細胞をヌードマウス(胸腺がなく従って免疫抑制されている)に皮下注入し、約2〜3週間の成長期間後、固形腫瘍が形成された。
【0091】
注入を行うために、各マウスにヒプノミデート(Hypnomidate)で麻酔し、25μLのナノ粒子溶液を腫瘍内注入する。この場合、注入は腫瘍内の中央の1ヵ所に行う。
【0092】
腫瘍内の物質の蛍光の反応速度を、0分〜5分、次いで60分に記録する。
【0093】
屠殺後、まず表皮と共に腫瘍を摘出し、次いで脾臓、肝臓、腎臓の臓器を摘出する。
【0094】
腫瘍を表皮−真皮と共に摘出し、アルミ箔の上で(外側を上向きにして)OCTを1滴滴下して凍らせ、アルミ箔で包み、N2中でショック凍結させる。次いで、ドライアイスの上で送り返すまで−80℃にて貯蔵し、さらに−80℃にて貯蔵する。
【0095】
すべてのマウスから脾臓、肝臓、腎臓の臓器を摘出して、N2中でショック凍結させ、送り返すまで−80℃にて貯蔵する。
【0096】
ii)写真記録
(使用した材料/装置)
Nikon Coolpix P2カメラ
24W冷光源(Eltrotec LB24)
光学フィルター:
・ショートパスフィルター 50%カットオフ波長550nm(Melles Geriot 03SWP408または03SWP608)
・「緑色」カラーフィルター 550nm(Melles Geriot 03FCG087/OG550)
・「橙色」カラーフィルター 570nm(Melles Geriot 03FCG089/OG570)
・「赤色」カラーフィルター 590nm(Melles Geriot)03FCG098/OG590)
背景として黒色の粘土板。
【0097】
(カメラの設定)
蛍光を記録する写真を市販のデジタルコンパクトカメラ(Nikon Coolpix
P2)で撮影する。設定したカメラ設定を以下に要約する。
【0098】
【表1】

それぞれの画像設定は、画像ファイル(例えば、PhotoshopまたはPixVue)のEXIF情報から得られ得る。
【0099】
(手順)
三脚上のカメラにフィルターホルダーを取り付け、レンズとマウス/表面の距離が15〜20cmになるよう、3Dヘッドを使用して調整する。角度は、三脚の位置調整によって可能な限り上からの角度で、可能な限り鋭角にすべきである。レンズとの距離ができるだけ小さくなるように、写真フィルターを取り付ける。
【0100】
物質の照明および励起は、ショートパスフィルター(上記参照)によってスペクトルが調整される冷光源によって行われる。光源が発生する熱のためおよび操作性を向上させるために、柔軟性のあるレンズ付きライトガイドを使用して光円錐を集中させる。ショートパスフィルター付きフィルターホルダーをこのライトガイドの上に取り付ける。次いで、表面までの距離が約15cmになるようにライトガイドを実験用スタンドに固定する。さらに、光円錐の直径が約8cmになるようにさらに調整すべきである。影を減らすために、上からの照明の角度をさらに可能な限り鋭角にするべきである。
【0101】
照明のためにマウスおよび実験用スタンドを黒の粘土板の上に置いて、コントラストを向上させる。次いで、マウスを光円錐の中央に配置する。これに関連して、腫瘍の影が最小限になり、十分に照明が当たるよう注意を払うべきである。
【0102】
写真を撮るときに、オートフォーカスの表示に注意すべきである。
【0103】
通常の場合、写真を最大の広角度で撮るべきである。比較的大きなズームでは、カメラは焦点が合わなくなることもあり、さらに開口設定が変わる。
【0104】
写真フィルターを写真ごとに変える場合、可能であれば、比較性を確保し、その後の処理を容易にするために、実験用の他の設定を何も変えないべきである。
【0105】
d)細胞結合アッセイ
(材料および装置)
蛍光顕微鏡:Leica DMIL, Zeiss LSM510METAシグナルエンハンサー、ProLong Gold褪色防止試薬
(緩衝液)
D−PBS(pH7.4)(10×)
1370mM NaCl(80g/L)
27mM KCl(2g/L)
42mM Na2HPO4*12H2O(15.4g/L)/7.652g/L Na2HPO4*2H2O
14mM KH2PO4(2g/L)
pH7.4に調整して、1000mL溶液にする
オートクレーブし、室温にて貯蔵する。
【0106】
Triton X−100溶液
D−PBS中0.1%(v/v)
4℃にて貯蔵する。
【0107】
BSA溶液
D−PBS中3%(w/v)
新たに作製するかまたは−20℃の貯蔵液から作製する。
【0108】
4%PFA溶液
5.71mLのホルムアルデヒド(35%)
5mLの10×D−PBS
pH7.4に調整/確認する
50mLのddH2Oを加えて、4℃にて貯蔵する。
【0109】
0.1Mグリシン溶液
0.375gのグリシン
50mLのD−PBSを加え、pH7.4に調整/確認し、ろ過によって無菌化して、4℃にて貯蔵する。
【0110】
Mowiol/DABCO
2.4gのMowiolを6gのグリセリン(最高純度)と混合させ、続いて6mLのddH2Oを加え、次いで室温にて数時間攪拌する。12mLの0.2M tris(pH8.5)をそれに加えて、混合物を攪拌しながら10分間、50℃にて加熱する。Mowiolが溶解したら(10分より長くかかる)、混合物を5000×gで15分間遠心分離させて、最後に20mg/mLのDABCOを加える。
【0111】
貯蔵:−20℃にてアリコートにおいて、4℃にてわずかに数週間の間使用可能、徐々に硬化する。
【0112】
(抗体)
一次抗体:抗EGFRmAb(マウス)Dianova Ab−5 1:100
二次抗体:Alexa488を有するヤギ抗マウス
(手順)
二日前に、HT29細胞を円形のカバースリップの上に播種する。播種に関しては、37℃にて48時間増殖させた後、50〜70%のコンフルエントな単層が免疫染色の開始時に存在するように、5×104細胞を移植する。
【0113】
BP619−EGF−His結合体を、3%BSAを含有する50μLのマッコイ培地で室温にて30分間プレインキュベートする。
【0114】
HT29細胞がコンフルエントに達すると、培地を吸引して取り除き、細胞をD−PBSで少なくとも1回洗浄する。
【0115】
30〜50μLのプレインキュベートしたBP619−EGF−His結合体をピペットで採取して、洗浄した細胞の上に移し、次いで37℃/7.5%CO2のインキュベーター内で1時間インキュベートする。
【0116】
細胞をBP619−EGF−His結合体で染色した後、細胞をPBSで一度洗浄し、次いで300μLの4%PFA溶液を使用して室温にて15〜20分間固定する。固定後、細胞をD−PBSで一度洗浄し、0.1Mグリシンを使用して室温にて5分間クエンチングする。クエンチング後、細胞をD−PBSで一度洗浄し、次いで、0.1%のTriton X−100−PBSを使用して室温にて10分間透過処理をする。その後、3%BSAを使用して室温にて30分間細胞をインキュベートすることによって細胞をブロックする。
【0117】
染色した細胞をブロックした後、細胞を対比染色することが可能になるか、またはBP619−EGF−His結合体染色を顕微鏡下で直接分析することが可能になる。対比染色は、共局在を分析するために必要である。
【0118】
対比染色をDianova由来の第1抗体、抗EGFR、モノクローナル抗体で行う。抗EGFR抗体を30μLの1%BSA−PBSで1:100に希釈し、次いでピペットで採取して細胞の上に移す。抗EGFRを細胞上で、室温にて60分間インキュベートする。インキュベーションの後、細胞をD−PBSで3回、5分間洗浄を行う。対比染色用の蛍光染色を有する第2抗体は、Alexa488を有するヤギ抗マウスである。この目的のために、第2抗体を30μLの1%BSAで1:200に希釈し、次いでピペットで採取して細胞の上に移す。ヤギ抗マウスAlexa488第2抗体を細胞上で、室温にて60分間インキュベートする。インキュベーション後、細胞をD−PBSで3回、5分間洗浄する。細胞をMowiol/DABCO内に包埋して、顕微鏡下で分析する。
【0119】
e)凍結切片の調製および染色
腫瘍を−80℃にて貯蔵し、切片作製のために冷却ユニット(−80℃まで冷却)付きStyroporボックスに移す。切片作製は、クリオミクロトームで行う。結果として生じる切片は10μmの厚さである。
【0120】
(材料および装置)
蛍光顕微鏡:Leica DMIL、Zeiss LSM510META、洗浄用トラフ、湿度チャンバー、組織領域のマーキング用グリースペン、4%濃度のパラホルムアルデヒド溶液(細胞結合アッセイを参照)、PBS(細胞結合アッセイを参照)、3%濃度のBSA溶液(細胞結合アッセイを参照)、Triton X−100溶液(細胞結合アッセイを参照)、0.1Mグリシン溶液(細胞結合アッセイを参照)。
【0121】
対比染色用のさらなる試薬として、適切な場合には、適切な第1抗体および第2抗体。
【0122】
(手順)
凍結切片を室温にて解凍し、乾燥させる(約10〜20分)。組織の領域をグリースペンで印を付けた後、組織を湿度チャンバー内で20分間、4%濃度のパラホルムアルデヒド溶液で固定する。D−PBSで洗浄した後、続いて0.1Mグリシン溶液で5分間クエンチングさせる。
【0123】
PBSで洗浄し、0.1%Triton X−100での透過処理の後、室温にて1時間、3%濃度のBSA溶液でブロッキングを行う。
【0124】
抗EGFR−A488直接結合体を使用して、原形質膜内のEGFRを検出する。この結合体を1%BSA/PBSで1:100に希釈し、そして切片をそれと共に湿度チャンバー内で室温にて1時間インキュベートする。D−PBSでの洗浄をトラフ内で少なくとも15分間、少なくとも緩衝液を一回変えて行う。
【0125】
Mowiol/DABCOを包埋のために使用し、そして切片(無染色および染色した)を顕微鏡下で分析する。
【0126】
f)顕微鏡分析
試料の顕微鏡分析をZeiss LSM510で行う。以下のフィルターをこの目的のために使用する:
NP蛍光分析用:
FSet 15=フィルターセット15 488015−0000
励起:BP546
ビームスプリッター:FT580
発光:LP 590。
【0127】
Alexa488蛍光分析用:
FSet 46=フィルターセット46 1196−681
励起:BP500/20
ビームスプリッター:FT515
発光:BP535/30。
【0128】
共焦点レーザー分析も一部の試料で実行した(顕微鏡操作の指示書を参照のこと)。
【実施例】
【0129】
2.例示的な実施形態
例示的な実施形態1:
インビボ実験:本発明に従ってヌードマウスへのニュートラビンジン−抗体複合体の腫瘍内注入によるHT29異種移植片腫瘍を使用する動物実験
本発明に従う抗体結合体の特異的腫瘍標的化が、異種移植片腫瘍を有するマウスでのインビボ実験で示された。この目的のために、HT29細胞株のヒト結腸癌細胞をヌードマウス(胸腺がなく従って免疫抑制されている)に皮下注入し、3週間の成長期間後、固形腫瘍が形成された。
【0130】
選択的な腫瘍マーキングのために、本発明に従う抗体複合体を調製したか、またはニュートラビジン結合体を結合した本発明に従うビオチン化モノクローナル抗体を調製した。このモノクローナル抗体は、多数の型のヒト結腸直腸癌で発現する膜関連腫瘍関連グルコース輸送体1抗原(GLUT1)に対するものである。
【0131】
複合体の腫瘍内への注入後、腫瘍は、UV励起を使用して、赤色蛍光によって直ちに視覚的に識別可能になった。注入後48時間までの間に、腫瘍の調製した凍結切片内で本発明の複合体を検出することが可能になった。
【0132】
例示的実施形態2:
i)分光分析によるBiopixels 618(本発明による物質)の強度とCrystalplexアロイナノ粒子630(NC630)の比較。NC630ナノ粒子は、CdSxSe1−x/Zn5核を有し、かつCOOH基で官能基化されたナノ粒子である。
【0133】
以下の値は、図3より明らかである:
BP618濃度 1.67μg/mL
NC630濃度 6.70μg/mL
BP618励起360nm 55000cps
NC630励起360nm 22000cps
BP618励起488nm 25000cps
NC630励起488nm 10000cps。
【0134】
4倍のNC630ナノ粒子のより高い濃度を考慮に入れると、本発明のBP618物質の発光強度は、10倍高い。
【0135】
強度のこの違いは、本発明による直接の視覚化(例えば外科での医療適用に関する)のための造影剤の使用に極めて必須のものである。本発明の物質を使用して、処置を行う臨床医は、直接的にかつ単に蛍光フィルターの支援を使用して、蛍光を観察することが可能であるのに対して、NC630ナノ粒子は、視覚化するためにさらに電子増幅が必要である。
【0136】
ii)ゲルろ過によるBioPixels 619の特徴付け
図4は、溶出容積が16.2mLであることを明らかにする。この値は、10.8nmのストークス直径と相関する。
【0137】
iii)EGF結合BioPixels 619NC630ナノ粒子の注入後の、マウス腫瘍の比較
EGF−HisとBP619の結合を1b)に記載した方法によって実行した。この場合、1.4μMタンパク質を使用して、40μgのナノ粒子(=複製)を結合した。Vivaspin遠心濃縮器を使用する精製/濃縮の後、計約14.3μgのナノ粒子を腫瘍に注入した。
【0138】
1c)に記載するように、写真記録を行った。NC630物質が注入された腫瘍は、蛍光を示さなかった(図5a、マーキングを参照のこと)のに対して、本発明のEGF結合BioPixels 619の使用では蛍光が極めて明らかである(図5b、マーキングを参照のこと)。
【0139】
iv)本発明のEGF結合BioPixels 619を使用する腫瘍内の組織マーキングの顕微鏡法
クリオトームを使用して摘出した腫瘍を切片化し(切片の厚み10μm)、上述(1e)のように顕微鏡分析のために処理した。Biopixel蛍光検出用のFSet15(1fを参照)を使用して、Zeiss顕微鏡(LSM510)で分析を行った。腫瘍のマーキング(図6を参照のこと;暗い背景上の白い領域)は、均一でなく、一部の領域は、より強度が低くマーキングされた(図6aを参照のこと)、他の領域は、より強いマーキングを示す(図6bを参照のこと)。
【0140】
c)例示的な実施形態3
BioPixelsの細胞内取り込みによる本発明のEGF結合BioPixels 619を使用する腫瘍細胞のマーキング
この場合、(1d)に記載する方法によってHT29腫瘍細胞を使用して細胞結合アッセイを実施した。図7aは、BP619蛍光を示す。この場合、蛍光がBP619によって独占的に引き起こされる一部のシグナルを、円で印を付けた。抗体A488の蛍光を図7bに検出した。ここで使用した第1抗体は、EGFR抗体であり、第2抗体は、ヤギ抗マウスA488であった(1dを参照のこと)。もう一度、その蛍光がA488に独占的に起因する一部のシグナルを円で囲んだ。最後に、図7cは、図7aおよび図7bからコピーした画像を示す。シグナルの多くは、共局在を明らかにする、すなわち、それらのシグナルは、図7aおよび図7bの両方で見られる。
本発明の好ましい実施形態によれば、例えば、以下が提供される。
(項1)
インビボ造影剤を調製するための蛍光ナノ粒子の使用であって、該蛍光ナノ粒子は、無機核と、イミダゾール成分を含む不動態化層と、特異的リガンドとを含み、該不動態化層を有する該無機核の流体力学的直径は、15nm以下、好ましくは10nm以下、特に好ましくは5nm以下であり、該ナノ粒子は、700nm未満の発光を示し、該造影剤は、ヒトにおける局所適用に適していることを特徴とする、使用。
(項2)
発光スペクトルが600〜650nm、好ましくは620〜650nmであることを特徴とする、上記項1に記載の使用。
(項3)
前記ナノ粒子が全身的、局所的または表面的に投与または注入されることを特徴とする、上記項1または2のいずれかに記載の使用。
(項4)
特に外科的介入、内視鏡的介入、または最小侵襲的介入で組織をマーキングするための造影剤としての、上記項1〜3のいずれかに記載の使用。
(項5)
前記ナノ粒子がさらに少なくとも1つの修飾因子も含むことを特徴とする、上記項1〜4のいずれかに記載の使用。
(項6)
前記無機核が本質的に貴金属原子を含むクラスター、好ましくは2〜27個の原子を有するクラスターであることを特徴とする、上記項1〜5のいずれかに記載の使用。
(項7)
前記無機核がアロイ/半導体核を含み、該核が均一な組成を有し、かつ2つの半導体のモル比に関して非線形であるバンドギャップエネルギーによって特徴付けられることを特徴とする、上記項1〜5のいずれかに記載の使用。
(項8)
前記無機核が第1の半導体および第2の半導体のアロイを含み、該第1の半導体の濃度が該核の中心からその表面に向かって徐々に増加し、該第2の半導体の濃度が該核の中心からその表面に向かって徐々に減少することを特徴とする、上記項1〜5のいずれかに記載の使用。
(項9)
前記半導体の少なくとも1つがII族〜VI族の半導体またはIII族〜V族の半導体であることを特徴とする、上記項7および8のいずれかに記載の使用。
(項10)
前記核が、以下のアロイ:CdSeTe、CdSSe、CdSTe、ZnSeTe、ZnCdTe、CdHgS、CdHgTe、InGaAs、GaAlAs、InGaN、InGaP、CdSe、またはCdTeの群から選択されるアロイを含むことを特徴とする、上記項7〜9のいずれかに記載の使用。
(項11)
前記不動態化層が、金属原子または金属イオンと配位結合することができかつルイス塩基機能またはヘテロ芳香族系を有する少なくとも1つの化合物を含むことを特徴とする、上記項1〜10のいずれかに記載の使用。
(項12)
前記イミダゾール成分が、以下の群:ヒスチジン、カルノシン、アンセリン、バレイン、ホモカルノシン、ヒスチジルフェニルアラニン、シクロヒスチジルフェニルアラニン、5−アミノ−4−イミダゾールカルボキサミド、ヒスチジルロイシン、2−メルカプトイミダゾール、Boc−ヒスチジン、ヒドラジド、ヒスチノール、1−メチルヒスチジン、3−メチルヒスチジン、イミダゾリジン、イミダゾール含有オルニチン(例えば5−メチルイミダゾール)、イミダゾール含有アラニン(例えばβ−(2−イミダゾリル)−Lαアラニン)、カルジニン、ヒスタミンから選択される1つ以上の化合物を含み、次にこれらのそれぞれが反応基(例えば、アミノ、チオール、カルボキシル、またはカルボキサミド)によって置換され得ることを特徴とする、上記項11に記載の使用。
(項13)
前記不動態化層が前記イミダゾール成分を架橋するための架橋剤を含むことを特徴とする、上記項11または12のいずれかに記載の使用。
(項14)
前記架橋成分がアルキルホスフィンおよび/またはアルキルホスフィン誘導体を含むことを特徴とする、上記項13に記載の使用。
(項15)
前記修飾因子が、以下の化合物:ポリエチレングリコール、単糖、二糖、三糖、低分子量の多糖、親水性ビタミン、親油性ビタミン、脂肪酸、多価アルコール、テフロン(登録商標)、アミノ酸、非特異的なペプチドもしくはタンパク質、ホスホリルコリン、ポリ乳酸、および該化合物の誘導体からなる群から選択されることを特徴とする、上記項5〜14のいずれかに記載の使用。
(項16)
無機核と、不動態化層と、特異的リガンドとを含むナノ粒子であって、該不動態化層を有する該無機核の流体力学的直径が15nm以下、好ましくは10nm以下、特に好ましくは5nm以下であり、該ナノ粒子が600〜700nm、好ましくは620〜650nmの発光を示すことを特徴とする、ナノ粒子。
(項17)
前記ナノ粒子がさらに少なくとも1つの修飾因子も含むことを特徴とする、上記項16に記載のナノ粒子。
(項18)
前記無機核が、本質的に貴金属原子を含むクラスターを含み、好ましくは2〜27個の、好ましくは金、銀および銅の群からのクラスターを含むことを特徴とする、上記項16〜17のいずれかに記載のナノ粒子。
(項19)
前記無機核がアロイ/半導体核を含み、該核が均一な組成を有し、かつ2つの半導体のモル比に関して非線形であるバンドギャップエネルギーによって特徴付けられることを特徴とする、上記項16または17のいずれかに記載のナノ粒子。
(項20)
前記無機核が第1の半導体および第2の半導体のアロイを含み、該第1の半導体の濃度が該核の中心からその表面に向かって徐々に増加し、該第2の半導体の濃度が該核の中心からその表面に向かって徐々に減少することを特徴とする、上記項16または17のいずれかに記載のナノ粒子。
(項21)
前記半導体の少なくとも1つがII族〜VI族の半導体またはIII族〜V族の半導体であることを特徴とする、上記項19または20のいずれかに記載のナノ粒子。
(項22)
前記核が、以下のアロイ:CdSeTe、CdSSe、CdSTe、ZnSeTe、ZnCdTe、CdHgS、CdHgTe、InGaAs、GaAlAs、InGaN、InGaP、CdSeおよびCdTeの群から選択されるアロイを含むことを特徴とする、上記項21に記載のナノ粒子。
(項23)
前記不動態化層が、金属原子または金属イオンと配位結合することができかつルイス塩基機能または芳香族複素環系、好ましくはイミダゾール成分を有する少なくとも1つの化合物を含むことを特徴とする、上記項16〜22のいずれかに記載のナノ粒子。
(項24)
前記イミダゾール成分が、ヒスチジン、カルノシン、アンセリン、バレイン、ホモカルノシン、ヒスチジルフェニルアラニン、シクロヒスチジルフェニルアラニン、5−アミノ−4−イミダゾールカルボキサミド、ヒスチジルロイシン、2−メルカプトイミダゾール、Boc−ヒスチジン、ヒドラジド、ヒスチノール、1−メチルヒスチジン、3−メチルヒスチジン、イミダゾリジン、イミダゾール含有オルニチン(例えば5−メチルイミダゾール)、イミダゾール含有アラニン(例えばβ−(2−イミダゾリル)−Lαアラニン)、カルジニン、ヒスタミンからなる群から選択される1つ以上の化合物を含み、次いでこれらのそれぞれが反応基(例えば、アミノ、チオール、カルボキシル、またはカルボキサミド)によって置換され得ることを特徴とする、上記項23に記載のナノ粒子。
(項25)
前記架橋成分がアルキルホスフィンおよび/またはアルキルホスフィン誘導体を含むことを特徴とする、上記項24に記載のナノ粒子。
(項26)
前記修飾因子が、ポリエチレングリコール、単糖、二糖、三糖、低分子量の多糖、親水性ビタミン、親油性ビタミン、脂肪酸、多価アルコール、テフロン(登録商標)、アミノ酸、非特異的なペプチドもしくはタンパク質、ホスホリルコリン、ポリ乳酸、および該化合物の誘導体を含む群から選択されることを特徴とする、上記項17〜25のいずれかに記載のナノ粒子。
(項27)
上記項16〜26のいずれかに記載のナノ粒子を少なくとも1つ含む、薬学的組成物。
(項28)
治療薬、インビトロ診断補助剤、またはテラノスティック薬としての、上記項16〜26のいずれかに記載のナノ粒子の使用。
【特許請求の範囲】
【請求項1】
本願明細書または図面に記載の発明。
【請求項1】
本願明細書または図面に記載の発明。
【図3】


【図1】


【図2】


【図4】


【図5】


【図6】


【図7】




【図1】


【図2】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2013−79962(P2013−79962A)
【公開日】平成25年5月2日(2013.5.2)
【国際特許分類】
【出願番号】特願2012−228086(P2012−228086)
【出願日】平成24年10月15日(2012.10.15)
【分割の表示】特願2008−540516(P2008−540516)の分割
【原出願日】平成18年11月16日(2006.11.16)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.PHOTOSHOP
【出願人】(508146662)シグナロミクス ゲーエムベーハー (3)
【Fターム(参考)】
【公開日】平成25年5月2日(2013.5.2)
【国際特許分類】
【出願日】平成24年10月15日(2012.10.15)
【分割の表示】特願2008−540516(P2008−540516)の分割
【原出願日】平成18年11月16日(2006.11.16)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.PHOTOSHOP
【出願人】(508146662)シグナロミクス ゲーエムベーハー (3)
【Fターム(参考)】
[ Back to top ]

