蛍光寿命を利用した細胞内のpHイメージング方法とその装置
【課題】励起光強度や蛍光物質の濃度、及び周辺環境に影響されることなく、高精度に被測定物質のpH測定を可能にする。
【解決手段】生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質Pを励起可能な波長を含み、生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、前記生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生させ、該パルス励起光を生体物質の所定の位置に照射し、該照射により励起された前記蛍光物質から生じる蛍光を含む光を受光し、該受光した蛍光の強度を時間分解して前記蛍光の蛍光寿命を算出し、該蛍光寿命から前記生体物質のpHを測定する。
【解決手段】生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質Pを励起可能な波長を含み、生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、前記生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生させ、該パルス励起光を生体物質の所定の位置に照射し、該照射により励起された前記蛍光物質から生じる蛍光を含む光を受光し、該受光した蛍光の強度を時間分解して前記蛍光の蛍光寿命を算出し、該蛍光寿命から前記生体物質のpHを測定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体物質のpHを測定する方法、該pHから異常領域を検出する方法、及び、これらの結果より生体物質を分析する方法、並びにこれらを実施する装置に関する。
【背景技術】
【0002】
細胞内/組織内のpHは、生体機能の調節因子として重要であり、細胞内/組織内のエネルギー代謝環境や酸化還元状態と密接に関係している。細胞内/組織内のpH変化が関係している疾患として、癌や臓器機能低下などが挙げられる。
【0003】
癌及び悪性腫瘍は、日本国内における死亡原因の第1位とされており、その大部分が臓器の細胞が癌化した固形癌によるものである。癌の治療においては、早期発見及び悪性化部位の特定が非常に重要であり、その診断において、疑わしい組織を採取して判断する病理組織検査が行われる。
【0004】
病理組織検査には、検体を肉眼で観察する方法や、光学顕微鏡を用いて組織学的な検索を行う方法、また、検体を標識して顕微鏡下でその標識の物理特性の検出により生物化学的に診断する方法がある。組織学的な方法は、病理対象の形態により判断されるものであるため、診断者の経験によるところが多いという問題があった。また、検体を標識する方法は、蛍光色素により標識して、その蛍光強度を検出する方法など検出感度が良好な方法であることから多方面で用いられている。
【0005】
特許文献1には、蛍光色素により標識した細胞のpH変化を、その蛍光強度により測定して腸管の薬剤吸収性を評価する方法が開示されている。また、特許文献2には、蛍光染色することにより細胞を標識して、蛍光スペクトルに応じて細胞をグルーピングする方法が記載されている。しかしながら、蛍光色素は生体に対して有毒であることから、測定対象にダメージを与える可能性があり、また、蛍光強度や蛍光スペクトルは励起光波長や強度、蛍光物質の濃度や退色等の影響を受けて変化するうえ、複数物質からの蛍光や周囲からの蛍光の影響も分析結果に反映されることから精度の高い評価が難しい。
【0006】
一方、蛍光寿命は、その物質の環境に反映して固有の値を有するため、励起光条件や周囲の不要な蛍光物質の影響を受けずに精度良く生体物質の環境(状態)を知ることのできる有望な情報である。特許文献3には、2つ以上の分光学的手法を組み合わせることにより、生体組織の変化に関連する形態学的変化と生物化学的変化を分離して評価して、当該組織の正確な診断を行う方法が開示されている。特許文献3には、生物化学的変化を評価する分光学的手法として、生体物質中に存在する蛍光物質を標識とし、該蛍光物質を励起して発せられる蛍光(自家蛍光)を時間分解蛍光発光測定(蛍光寿命測定)により、評価する方法が開示されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2000−139462号公報
【特許文献2】特表2001−523334号公報
【特許文献3】特表2003−512085号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、特許文献3の方法では、分光学的手法による評価を少なくとも2つ実施しなければ正確な診断を行うことができないとされている。診断の簡易性、迅速性を考慮すると、診断にはできるだけ1つの評価により診断可能であることが好ましい。
【0009】
本発明は、上記事情に鑑みてなされたものであり、測定対象に大きなダメージを与えることなく、迅速に、感度良く生体物質のpHを測定することのできるpH測定方法、ならびに、該pHから異常領域を検出する方法、そして、これらの結果から生体物質を分析する方法を提供することを目的とする。
【0010】
また本発明は、上記pH測定方法、検出方法、及び生体物質分析方法を実現可能な装置を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明のpH測定方法は、生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、前記生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、前記生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生させ、該パルス励起光を前記生体物質の所定の位置に照射し、該照射により励起された前記蛍光物質から生じる蛍光を含む光を受光し、該受光した蛍光の強度を時間分解して前記蛍光の蛍光寿命を算出し、該蛍光寿命から前記生体物質のpHを測定することを特徴とするものである。
【0012】
また、本発明のpH測定装置は、生体物質中に含まれる生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、前記生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、前記生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生する励起光発生手段と、該パルス励起光を前記生体物質の所定の位置に照射する励起光照射手段と、前記パルス励起光が照射されることにより励起された前記蛍光物質から生じる蛍光を含む光を受光する受光手段と、前記パルス励起光の照射と同期して前記蛍光を時間分解する時間分解手段と、該時間分解された前記蛍光を検出する検出手段と、該検出手段により検出された前記蛍光から該蛍光の蛍光寿命を算出し、該蛍光寿命に基づいて前記生体物質のpHを測定する測定手段とを備えたことを特徴とするものである。
【0013】
ここで、蛍光物質によっては細胞内で、プロテインボンド状態とフリー状態などが存在する場合があるが、プロテインボンド状態、フリー状態などいずれの状態でも良い。組織や細胞中のある領域の平均値でも良い。また、「生体物質」とは、ヒト、動物の細胞や組織、体液等の生物組織を意味し、生物から採取したもの、培養したもの、in vivoの細胞や組織全てを含むものとする。
【0014】
本発明のpH測定方法及びpH測定装置において、前記蛍光物質は、NADH、NADPH、及びFADからなる群より選ばれる少なくとも1種の蛍光物質であることが好ましい。
【0015】
本発明のpH測定方法において、前記受光した蛍光を波長分解した蛍光スペクトルとした後、該蛍光スペクトルから波長毎に前記蛍光強度を時間分解して波長毎の前記蛍光の蛍光寿命を算出することが好ましい。従って、本発明のpH測定装置は、かかる蛍光スペクトルを得る受光手段を備えていることが好ましい。
【0016】
本発明のpH測定方法において、前記蛍光が、多光子励起により励起されるものであることが好ましい。かかる構成では、前記励起光発生手段としてピコ秒からフェムト秒レーザを用いることにより、生体物質の深部の情報を容易に得ることができる。
【0017】
また、本発明のpH測定方法及びpH測定装置では、前記所定の位置は、複数の位置とすることができる。かかる構成のpH測定装置に、前記生体物質の異常領域を検出する検出手段を備えた構成とすることにより、前記生体物質の異常領域を検出することができる。
【0018】
異常領域の検出は、前記生体物質の異常領域を画像化して表示して検出してもよい。
【0019】
本発明のpH測定方法及び検出方法により得られたpHや異常領域に基づいて、前記生体物質の病理学的性質を特定して生体物質を分析することができる。
【0020】
本発明のpH測定装置の好適な態様としては、表面に前記生体物質を接触させて保持するステージであって、前記生体物質の任意の位置に前記パルス励起光を照射できるように3次元方向に可動なステージと、該ステージを3次元方向の任意の位置に動かす位置調節手段とを備え、前記励起光照射手段が、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備え、前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えた顕微鏡の態様が挙げられる。
【0021】
また、本発明の測定装置の他の好適な態様としては、表面に前記生体物質を接触させて保持するステージであって、前記生体物質の、少なくとも前記パルス励起光の光軸方向の任意の位置に該パルス励起光を照射できるように可動なステージと、
該ステージを少なくとも光軸方向の任意の位置に動かす第1の位置調節手段と、
前記生体物質の、少なくとも前記パルス励起光の光軸に垂直な面内方向の任意の位置に該パルス励起光を照射できるように前記励起光照射手段を動かす第2の位置調節手段とを更に備えたものであり、
前記励起光照射手段は、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備えたものであり、
前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えたものが挙げられる。
【0022】
また、本発明の測定装置の他の好適な態様としては、前記生体物質の3次元方向の任意の位置に、前記パルス励起光を照射できるように前記励起光照射手段を動かす位置調節手段を更に備え、
前記励起光照射手段は、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備えたものであり、
前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えたものが挙げられる。
【0023】
また、本発明のpH測定装置の他の好適な態様としては、前記励起光照射手段が、前記パルス励起光を前記生体物質に照射する少なくとも1本の照射用光ファイバを備えたものであり、前記受光手段が、前記照射により励起された前記蛍光物質から生じる蛍光を受光して該蛍光を前記時間分解手段に導く少なくとも1本の受光用光ファイバを備えたファイバプローブの態様が挙げられる。かかる態様では、前記少なくとも1本の照射用光ファイバと前記少なくとも1本の受光用光ファイバとが、1本のバンドルファイバを形成していることが好ましく、このバンドルファイバは、略中心部に配された1本の前記照射用光ファイバの外周を、複数本の前記受光用光ファイバで囲むように束ねられたものであることがより好ましい。
【0024】
「背景技術」の項において述べたように、特許文献3には、生体物質中に存在する蛍光物質を標識とし、該蛍光物質を励起して発せられる蛍光(自家蛍光)を時間分解蛍光発光測定(蛍光寿命測定)により、生体組織の変化を生物化学的に評価する方法が開示されており、細胞内のpHが蛍光寿命の変化に寄与する細胞内環境の1つであることが記載されている。しかしながら、特許文献3には、蛍光寿命測定だけでは正確な診断が難しいことが記載されている。
【0025】
本発明者は、自家蛍光の蛍光寿命の測定によりpHの変化をとらえるだけでは正確な診断ができないとされる原因を解明し、自家蛍光の蛍光寿命測定のみにより正確なpHを測定し、該測定の結果から正確な生体組織の変化を生物化学的に評価する方法及びそれを実現する装置を見出した。
【0026】
本発明者は、細胞内pHが、ピルビン酸から乳酸を産生する産生因子として働くことに注目した。ピルビン酸から乳酸を産生する反応においては、水素イオンが不可欠であり、細胞内pHによる水素イオン濃度によって、ピルビン酸濃度と乳酸濃度が影響される。ピルビン酸からの乳酸の産生、ピルビン酸から産生されたアセチルCoAから始まるクエン酸回路、アセチルCoAからの脂肪酸合成において、いくつかの酸化還元反応が生じるが、NADH、NADPH、及びFADは、これらの酸化還元反応において、補酵素として働く。例えば、NADHはピルビン酸から乳酸の産生やクエン酸回路の過程、NADPHはアセチルCoAからの脂肪酸合成過程、FADはクエン酸回路の過程における補酵素となる。
【0027】
これらの過程において、上記自家蛍光物質は、自らも酸化還元反応による水素イオンの解離/結合を生じ、吸収スペクトルが変化するため、波長によっては励起できず、蛍光を発しない場合が存在する。更に、これらの物質には、同一の励起波長で励起され、異なる蛍光寿命を有するフリー状態とプロテインボンド状態が存在する(後記実施例を参照)。
【0028】
つまり、我々の解釈によれば、細胞内pH変化で生じた酸化還元反応によって、補酵素の水素イオンの解離/結合が生じ、補酵素の吸収スペクトルが変化することで蛍光寿命に寄与する濃度が変化する。そしてこの変化は、プロテインボンド状態に比べ、フリー状態の方が顕著に起こるため、細胞全体の平均的な蛍光寿命が変化することになる。従って、これら補酵素として働く自家蛍光物質の蛍光寿命の変化を測定することで、細胞内pHに対し、精度の良い評価ができることを見出した。
【0029】
特許文献3には、細胞内のpHが蛍光寿命の変化に寄与する細胞内環境の1つとして記載されているのみであり、好ましい自家蛍光物質の存在も示唆していない。このことは、蛍光寿命による評価だけでは正確な評価ができないという記載からも明確である。
【0030】
本発明は、生体物質のpHを考慮して感度の良い蛍光寿命を有する自家蛍光物質を見出し、正常細胞と異常細胞との精度のよい評価を蛍光寿命の評価によるpH測定のみの簡易な方法により初めて実現したものである。
【発明の効果】
【0031】
本発明は、生体物質に含まれる生体内の酸化還元反応において補酵素として働く自家蛍光物質の蛍光寿命を測定することにより、生体物質のpHを高精度に測定し、正常細胞と異常細胞の特定を高精度に実施することを可能にしたものである。蛍光寿命は、物質固有の値であるため、励起光強度や蛍光物質の濃度、及び不要な物質の蛍光に影響されることなく、生体物質のpHを測定することができる。従って本発明によれば、励起光強度や蛍光物質の濃度、及び不要な物質の蛍光に影響されることなく、高精度に生体物質のpHを測定し、病理学的性質の正常・異常の特定することができる。
【0032】
また、本発明では、自家蛍光物質の蛍光寿命を測定対象とするので、生体物質に薬物の投与等の必要がない。従って、生体物質に大きなダメージを与えることなくpHの測定を実施することができる。
【図面の簡単な説明】
【0033】
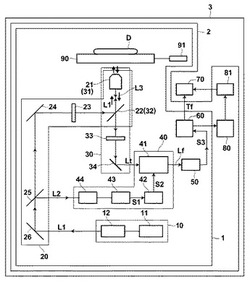
【図1】本発明の第1の実施形態によるpH測定装置並びに異常領域検出装置、及び、生体物質分析装置の概略構成図
【図2】細胞内のpHに対するイメージング画像全体において蛍光寿命が短い自家蛍光成分の平均蛍光寿命測定結果を示す図
【図3A】生物物質中に含まれる主な自家蛍光発光物質の励起光吸収特性を示す図
【図3B】図3Aに示される自家蛍光発光物質の蛍光特性を示す図
【図4】時間分解による蛍光寿命の算出方法を示す図
【図5】励起光照射手段の光学系に走査手段を備えたpH測定装置並びに異常領域検出装置、及び、生体物質分析装置の概略構成図
【図6】図5のpH測定装置の受光手段に分光素子を備えたpH測定装置並びに異常領域検出装置、及び、生体物質分析装置の概略構成図
【図7】本発明の第2の実施形態によるpH測定装置並びに異常領域検出装置、及び、生体物質分析装置の概略構成図
【図8A】内視鏡スコープにファイババンドルを備えた場合の内視鏡スコープの構成を示す概略図。
【図8B】内視鏡スコープにファイバプローブを備えた場合の内視鏡スコープの構成を示す概略図。
【図9A】実施例1のHeLa細胞の蛍光強度イメージング結果
【図9B】実施例1のHeLa細胞の蛍光寿命イメージング結果
【発明を実施するための形態】
【0034】
「pH測定装置の第1実施形態(顕微鏡)」
以下、図面を参照して本発明にかかる第1実施形態のpH測定装置およびpH測定方法について説明する。図1は、本実施形態のpH測定装置1の概略構成図である。視認しやすくするため、各部の縮尺は適宜変更して示してある。
【0035】
図1に示されるように、pH測定装置1は、生体物質である被測定物質Dにパルス励起光L1(以下、励起光L1とする)を励起光照射手段20により照射し、励起光L1が照射されることにより被測定物質D中の蛍光物質Pから生じる蛍光Lfを含む光L3を受光手段30により受光して蛍光を得、この蛍光から所定の蛍光Lfを時間分解手段40により時間分解し、時間分解された蛍光Lfを検出手段50により検出し、検出された蛍光Lfの強度から測定手段60により蛍光減衰曲線を得て蛍光寿命Tfを算出し、蛍光寿命Tfに基づいて被測定物質DのpHを測定するものである。励起光L1は、被測定物質D中に含まれる生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質Pを励起可能な波長を含み、生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、生体物質内のpHを実質的に変化させない強度を有するパルス励起光である。
【0036】
蛍光寿命の測定方法は、時間領域測定法と周波数領域測定法に大別され、本実施形態においては時間領域測定法を採用する。時間領域測定法には、ストリークカメラ法、時間相関単一光子計数法、時間ゲート法等があるが、本実施形態では、時間ゲート法により蛍光寿命の測定を行う例について説明する。
【0037】
時間ゲート法は、パルス励起光の照射と同期して、発光した蛍光をある時間領域で区切り、その範囲の蛍光強度積分値をCCD等の固体検出器で検出して時間領域を変えて測定することで近似的に蛍光減衰曲線を得る方法である。本実施形態では、ビームスプリッタ25により励起光L1から分けられた信号光L2がフォトダイオード44により検出されると、同期制御装置43によりゲートコントローラ42に対して同期信号S1が送られる。ゲートコントローラ42は、同期信号S1を受けて予め設定された所定の時間領域にゲート信号S2を発信し、ゲート機能つきイメージインテンシファイア41を駆動する。ゲート機能つきイメージインテンシファイア41に入力された蛍光像Lfは、ゲート信号S2に応じた時間領域において増強されて、検出手段50により、所定の蛍光Lfの蛍光強度の積分値(蛍光信号)Ltが検出される。この工程をゲート信号S2に応じて繰り返し、測定手段60により単一指数関数による解析を行って蛍光寿命Tfを算出する。
【0038】
本発明者らは、各種自家蛍光物質の蛍光寿命を時間相関単一光子計数法(TCSPC)、時間ゲート法により測定を重ね、現状の蛍光寿命測定において2つの蛍光寿命を分離できる限界値が蛍光寿命が0.03nsecであることを見出した。本実施形態のpH測定装置では、正常細胞と異常細胞とのpH変化により、蛍光寿命が0.03nsec以上異なる自家蛍光物質を励起して、その蛍光寿命を測定することにより高精度にpHを測定して生体物質の正常と異常を特定するものである。
【0039】
既に述べたように、細胞内pHが、ピルビン酸から乳酸の産生因子として働き、細胞内pHによる水素イオン濃度によってピルビン酸濃度と乳酸濃度が影響される。ピルビン酸からの乳酸の産生、ピルビン酸から産生されたアセチルCoAから始まるクエン酸回路、アセチルCoAからの脂肪酸合成において、いくつかの酸化還元反応が生じるが、NADH、NADPH、及びFADは、これらの酸化還元反応において、補酵素として働く。例えば、NADHはピルビン酸から乳酸の産生やクエン酸回路の過程、NADPHはアセチルCoAからの脂肪酸合成過程、FADはクエン酸回路の過程における補酵素となる。
【0040】
これらの過程において、自らも酸化還元反応による水素イオンの解離/結合を生じ、吸収スペクトルが変化するため、波長によっては励起できず、蛍光を発しない場合が存在する。更に、これらの物質には、同一の励起波長で励起され、異なる蛍光寿命を有するフリー状態とプロテインボンド状態が存在する(後記実施例を参照)。
【0041】
我々は、細胞内pH変化で生じた酸化還元反応によって、補酵素の水素イオンの解離/結合が生じ、補酵素の吸収スペクトルが変化することで蛍光寿命に寄与する濃度が変化し、この変化は、プロテインボンド状態に比べ、フリー状態の方が顕著に起こるため、細胞全体の平均的な蛍光寿命が変化すると考えている。従って、これら補酵素として働く自家蛍光物質の蛍光寿命の変化を測定することで、細胞内pHに対し、精度の良い評価ができることを見出した。
【0042】
図1に示される顕微鏡型のpH測定装置及び異常領域検出装置を用いて、培養したHeLa細胞のpHの測定を行った。
まず、pHの異なるHeLa細胞を調製し、HeLa細胞のpHと蛍光寿命との関係を導出した。所定のpHのHeLa細胞は、培地としてD-MEM(Dulbecco's Modified Eagle Medium;SIGMA社)を用い、石英ガラスボトムディッシュにHeLa細胞を適量まき、37℃、5%CO2下のインキュベータで1〜2日培養した後、0.1 mol/L のNaOH溶液、HCl溶液でpHを調整したKCl-rich mediaに適量のニゲリシンを加え、前記培地をKCl-rich mediaに置換して調製した。ニゲリシンはエンドソームのpH低下阻害剤であり、K+/H+のイオノフォアとして働き、細胞内外のpHを同じにする役割を果たす。HeLa細胞がそれぞれのpHになっていることを確認した後、顕微鏡のxyzステージ上に設置したインキュベータ(37℃、5%CO2)に15分ほどおいて、pHの異なる複数の測定試料を用意した。
【0043】
これらの試料に対して、蛍光寿命の測定を行った。ここで、励起する自家蛍光物質はNADHとNADPHとし、励起光として、1ピコ秒パルス幅のチタンサファイアレーザのSHG光を使用し、NADHとNADPHの励起波長である370nmの光(還元型のみ励起される)となるように励起光の波長を調整し、417〜477nmの蛍光フィルターを用いて蛍光寿命の測定を行った。このとき、励起光の平均パワーは0.9mW、パルスエネルギーは12pJとし、HeLa細胞の所定の位置にレーザ光が照射され、レーザ光の焦点がHeLa細胞に合うようにxyzステージを調整した。測定温度は23度である。
【0044】
得られた結果を図2に示す。図2においては、縦軸は細胞内のpHに対するイメージング画像全体の平均蛍光寿命を示しており、更に、それぞれのpHに対して試料を変え、複数回測定した結果を平均して求めた値とした。図2を最小二乗法でフィッティングした結果、以下の関係式を導出することができた。
【0045】
[pH] =33.3-11.9×[蛍光寿命(nsec.)] ・・・(1)
また、図2に示されるように、NADHとNADPHは、pHが6.5から7.5の間で蛍光寿命は0.08nsec変化しており、上記した蛍光寿命の測定限界を考慮すると、pH差0.3〜0.4の測定が十分に可能であり、高い感度を有していることが確認された。
【0046】
以上の結果より、生体物質に含まれる生体内の酸化還元反応において補酵素として働く自家蛍光物質の蛍光寿命を測定することにより、生体物質のpHを高精度に測定し、励起光強度や蛍光物質の濃度、及び不要な物質の蛍光に影響されることなく、高精度に生体物質のpHを測定し、病理学的性質の正常・異常の特定することができることがわかった。
【0047】
細胞内において、NADH、NADPH及びFADは主に細胞質またはミトコンドリア存在する。従って、細胞質またはミトコンドリアの領域を計測すれば、細胞内のpHの分析が可能であり、好ましい。また、核におけるNADH、NADPH及びFADの量は少量であるが、核周辺の細胞質またはミトコンドリアからのNADH、NADPH及びFADが自家蛍光を発するため、核の領域を計測してもよい。
【0048】
pH測定装置1は共焦点系顕微鏡であり、被測定物質Dは、位置調節手段91によりxyz方向に移動可能なサンプルステージ90上に接触されており、位置調節手段91により、サンプルステージ90の位置を調節して、被測定物質Dの所定の位置に対物レンズ(光学系)21(31)により集光された励起光L1を照射することができる。pH測定装置1には、正確に所定の位置に励起光L1が照射できるように、被測定物質Dの上方から被測定物質Dにおける励起光L1の照射位置を確認することができるように、拡大レンズ等を備えた窓(図史略)を備えた構成としてもよい。
【0049】
pH測定装置1において、励起光発生手段10は、被測定物質D中の生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生するパルスレーザ11と、パルスレーザ11より発振されたパルスを、所定の間隔にて出射させるように間引くパルスピッカー12とを含む。パルスレーザ11は、特に制限されないが、超短パルス光を発振できるレーザであることが好ましく、数十フェムト秒〜数十ピコ秒の時間範囲内でパルス発振可能なレーザであることがより好ましい。パルスレーザ11としては、例えば、発振波長840nmのチタンサファイアレーザの第2次高調波(SHG)である波長420nm、パルス幅3ps、繰り返し周波数80MHz、ピークパワー8kW、平均パワー2W等を用いることができる。また、励起光発生手段10には、第3次高調波(THG)や光パラメトリック発信器(Optical Parametric Oscillator:OPO)等の波長変換素子を備えた構成としてもよい。本実施形態ではパルスピッカー12を用いているが、パルスピッカーで間引きせず、所望の繰り返しに調整した光源を使用してもよい。
【0050】
また、被測定物質D内において励起される蛍光Lfは多光子励起によるものでもよい。その場合は、多光子励起可能な波長及びパルス幅の励起光L1として、発振波長840nmのチタンサファイアレーザ、パルス幅100fs、繰り返し周波数80MHz、ピークパワー100kW、平均パワー0.8W等を用いる。多光子励起では、所望の箇所だけ励起が可能なので、周辺部の蛍光低減ができより低雑音化ができ、また観察箇所より前の部分での吸収減衰を低減できるので効率よく観察箇所に励起光L1を照射することができる。また、高い空間分解能で分析もできる。
【0051】
励起光発生手段10から出射された励起光L1は、励起光照射手段20に入射され、励起光照射手段20により被測定物質Dの所定の位置に照射される。励起光照射手段20の構成は特に制限されないが、本実施形態では、励起光L1の照射と被測定物質Dから発生した、蛍光物質Pの励起による蛍光Lfを含む光L3の受光を同一の対物レンズ(光学系)21(31)で行う構成としている。従って、励起光照射手段20には、被測定物質Dの所定位置に励起光L1を照射し、且つ、光L3を受光できるように配された対物レンズ21及び、励起光L1を対物レンズ21に入射させ、且つ、光L3を時間分解手段40に導くダイクロイックミラー22(32)を備えている。対物レンズ21としては、励起光L1及び蛍光の透過率が高く、レンズ素材による蛍光の発生の少ないものが好ましい。
【0052】
また、本実施形態では、励起光L1の照射と時間分解手段40を同期して駆動させるため、励起光照射手段20に同期信号S1を発信させる信号光L2を励起光L1から分割させるビームスプリッタ25を、そして、励起光L1を蛍光物質Pの励起波長の光に絞り込む励起フィルター23を備えている。励起光照射手段20には、必要に応じて励起光L1を導光するミラー(24,26)やレンズ等(図示略)を備えてよい。
【0053】
受光手段30は、励起光L1の照射により被測定物質Dにおいて生じた光L3を受光して時間分解手段40に目的とする蛍光Lfを出力できれば特に制限されないが、本実施形態では、被測定物質Dから発生した光L3を受光する対物レンズ31(21)と、光L3を時間分解手段40に導くダイクロイックミラー32(22)と、光L3から散乱光等のノイズ光を除去するフィルター33とを備えている。
【0054】
対物レンズ(光学系)31及びダイクロイックミラー32については上述の通りである。フィルター34は、検出する蛍光Lfの波長に応じて、バンドパスフィルターやショートパスフィルタ等適宜選択して用いればよい。複数種類の蛍光Lfを観測するときは、異なる透過波長帯域を有する複数のバンドパスフィルターを用いたり、あるいは透過波長帯域が可変のものを用いるようにしてもよい。
【0055】
受光手段30により得られた蛍光Lfは、時間分解手段40に入力される。時間分解手段40は、蛍光Lfの、所定の時間領域の蛍光信号Ltを取り出して検出手段50に出力するものである。蛍光の時間分解は、励起光L1の照射に対する最初の同期信号S1の受信時t0から開始する。同期信号S1は、励起光L1からビームスプリッタ25により分けられた信号光L2が、光検出器44で電気信号に変換されて同期制御装置43から、ゲートコントローラ42に送られる。
【0056】
受光手段30により得られた蛍光Lfは、時間分解手段40に入力される。時間分解手段40は、所定の蛍光Lfの、所定の時間領域の蛍光像を取り出して検出手段50に出力するものである。蛍光の時間分解は、励起光L1の照射に対する最初の同期信号S1の受信時t0から開始する。同期信号S1は、励起光L1からビームスプリッタ25により分けられた信号光L2が、光検出器44で電気信号に変換されて同期制御装置43から、ゲートコントローラ42に送られる。
【0057】
光検出器44としては特に制限なく、一般的に用いられているフォトダイオード等を用いることが好ましい。
【0058】
同期制御装置43は、光検出器44から出力された信号を受けてゲートコントローラ42に同期信号S1を出力できれば特に制限なく、パーソナルコンピュータ(PC)等を用いることができる。ゲートコントローラ42は、同期信号S1を受けて予め設定された所定の時間領域にゲート信号S2を発信し、ゲート機能つきイメージインテンシファイア41のゲートの開閉を指示する。ゲート機能つきイメージインテンシファイア41には、CCDカメラ等の検出手段50が接続されており、ゲート信号S2に基づいてゲートを開閉し、ゲートが開いているときに受光した蛍光信号Ltを増幅させ、コントラストの向上した蛍光像LsをCCDやPMT等の検出手段50により受光して電気信号として蓄積し、検出する。例えば、ゲートコントローラ42が同期信号S1を最初に受けた時刻を基準時刻t0として、時間Δtの間だけゲート機能付きイメージインテンシファイア41のゲートを開くように指示するゲート信号S2を出力すると、ゲート機能付きイメージインテンシファイア41により、t0〜Δtの間の蛍光信号Ltを増幅させて検出手段50に出力し、検出手段50は、その時間範囲の蛍光Lfを検出して、その蛍光強度の積分値S3を測定手段60に出力する。この蛍光強度S3の検出工程を、ゲート信号に応じて繰り返すことにより、時間分解された蛍光強度を測定手段60に出力する。
【0059】
測定手段60としては特に制限ないが、PC等のコンピュータシステムを用いることが簡易であり好ましい。測定手段60は、同期制御装置43とを同じ装置により兼ねてもよい。測定手段60は、時間分解された蛍光強度S3から蛍光減衰曲線を求めて蛍光強度時間分布を得る。この蛍光減衰曲線において、蛍光強度が1/eになった時間tfと発光の開始時t0との差を蛍光寿命Tfとして算出する。図4に、時間分解された蛍光強度から得られた蛍光強度時間分布及び蛍光減衰曲線から求められた蛍光寿命Tfを示す。図4において、t0からの経過時間tにおける蛍光強度Iとt0における蛍光強度I0とは、下記式の関係で表される。分析手段60では、S3がある時間tにおける蛍光強度Iとなる。
【0060】
I=I0e−t/Tf
次に、測定手段60は得られた蛍光寿命Tfに基づいて、被測定物質Dの所定の位置におけるpHを測定する。自家蛍光物質の蛍光寿命は、その周辺のpHにより変化することが知られている。
【0061】
従って、正常状態の被測定物質Dにおける蛍光寿命を予め調べておくことにより、被測定物質Dの所定の位置における自家蛍光物質の蛍光寿命から、その位置のpHの変化を、また、pHに対する蛍光寿命の変化率を予め得ておくことにより、具体的なpH値を測定することができる。時間ゲート法の蛍光寿命イメージングを利用したpH分析においては、ゲート数を増やして分析することにより、より分析精度は高くなる。
【0062】
pH測定装置1では、ステージ90をxyz方向(励起光照射面の面内方向及び深さ方向)に移動させることができるので、被測定物質Dの複数の所定の位置において2次元あるいは3次元のpHの測定が可能である。
【0063】
また図5に示されるpH測定装置4のように、ステージ90’をz方向のみ可動とし、走査光学系27をxy方向に走査させる共焦点系の光学系としてもよい。走査光学系27としては、ガルバノミラーやポリゴンミラー、レゾナントミラー等が挙げられる。
【0064】
かかる構成とする場合は、励起光L1により励起される蛍光の種類が複数になる可能性が高いため、図6に示されるpH測定装置7のように、受光手段30により受光した蛍光Lfを分光して時間分解手段40に蛍光Lfの蛍光スペクトルLsを出力する分光手段35を備えた構成とすることが好ましい。蛍光Lfを分光して蛍光スペクトルLsを時間分解することにより、より高精度に複数の蛍光を分離して所定の波長の蛍光の蛍光寿命を測定することができる。分光素子35としては、蛍光Lfを分光可能なものであれば特に制限なく、回折格子やプリズム等が挙げられる。
【0065】
図5又は図6に示される走査光学系を備えた構成は、局所的な励起を行う多光子励起の場合等に、特に好ましく用いることができる。
【0066】
複数の位置におけるpH測定により、被測定物質Dの異常領域を分析する方法については後記する。
本実施形態のpH測定装置1,4,7は以上のように構成されている。
【0067】
次に、pH測定装置1を例に本実施形態のpH測定装置の動作例について説明する。
まず、ステージ90上に被測定物質Dを接触させ、所定の位置に励起光L1が照射されるように位置調節手段91によりステージ90の位置を調整する。
【0068】
励起光発生手段10からは被測定物質D中の生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、生体物質内のpHを実質的に変化させない強度を有するパルス励起光L1が出射されて、励起光照射手段20に入射する。励起光照射手段20に入射された励起光L1は、ビームスプリッタ25により同期用信号光L2を分離した後、に対物レンズ(光学系)21により集光されて、被測定物質Dの所定の位置に照射される。この照射により、被測定物質Dからは、蛍光物質Pが励起されて蛍光Lfが発せられる。受光手段30の対物レンズ31は、被測定物質Dから発せられた光L3を受光する。光L3には、蛍光Lf以外のノイズ光も含まれているが、フィルター34を通過することにより、ほぼ蛍光Lf以外の光が排除される。
【0069】
ほぼ蛍光のみとなった光L3は、時間分解手段40に入射されて、所定の蛍光Lfを取り出して時間分解され、検出手段50により各時間における蛍光強度S3が検出され、電気信号として測定手段60に出力される。測定手段60は、時間分解された蛍光強度から蛍光強度−時間曲線を得、この曲線において、蛍光強度が略1/eになった時間tfとt0との差を蛍光寿命Tfとして算出し、蛍光寿命Tfに基づいて、被測定物質DのpHを測定する。
【0070】
上記のように、本実施形態のpH測定方法及びpH測定装置1,4,7は、生体物質に含まれる生体内の酸化還元反応において補酵素として働く自家蛍光物質の蛍光寿命を測定することにより、生体物質のpHを高精度に測定し、正常細胞と異常細胞の特定を高精度に実施することを可能にしたものである。蛍光寿命は、物質固有の値であるため、励起光強度や蛍光物質の濃度、及び不要な物質の蛍光に影響されることなく、生体物質のpHを測定することができる。従って本発明によれば、励起光強度や蛍光物質の濃度、及び不要な物質の蛍光に影響されることなく、高精度に生体物質のpHを測定し、病理学的性質の正常・異常の特定することができる。
【0071】
また、本実施形態では、自家蛍光物質の蛍光寿命を測定対象とするので、生体物質に薬物の投与等の必要がない。従って、生体物質に大きなダメージを与えることなくpHの測定を実施することができる。
【0072】
以上述べたpH測定装置1,4,7の効果は、後述の実施形態のpH測定装置も同様に奏するものである。
【0073】
また、被測定物質に対して照射する励起光のスポット径を絞って微小領域での蛍光寿命を測定し、測定位置をずらして被測定物質の測定対象領域の測定を行う共焦点顕微鏡方式である場合について説明したが、被測定物質に応じて広範囲の画像化が必要な場合等は、励起光のスポット径を絞らずに一度に広範囲のxy面の情報を取得するワイドフィールド方式としてもよく、走査手段を用いずに、検出手段としてCCDカメラ等を用いて画面全体を撮像する。また、この場合、ステージ90(90’)をxy方向に走査可能とし、複数のxy面領域を検出しそれらを合成することでより広範囲な領域の画像化が可能となる。
【0074】
「pH測定装置の第2実施形態(ファイバプローブ)」
次に、本発明の別の実施形態にかかるpH測定装置について説明する。第1実施形態のpH測定装置1,4,7は、顕微鏡であったが、本実施形態のpH測定装置10は、ファイバプローブである点で第1実施形態と異なっている。なお、以降の実施形態の説明および図面においては、前述の実施形態の構成要素と実質的に同一の機能を有する構成要素については、同一の符号を付することにより重複説明を省略する。
【0075】
図7に示されるように、pH測定装置10は、第1実施形態の対物レンズ21(31)が、バンドルファイバ21’(31’)である点を除けば、第1実施形態と同様の構成としている。
【0076】
バンドルファイバ21’(31’)は、中央部にパルス励起光L1を導光させ、励起光L1を被測定物質Dの所定の位置に照射する照射用光ファイバ200が略中心部に配され、励起光L1の照射により被測定物質D中に含まれる生体内の酸化還元反応において補酵素として働く自家蛍光物質Pから生じる蛍光Lfを含む光L3を受光して、光L3を時間分解手段40に導く複数の受光用光ファイバ300を照射用光ファイバ200の外周を囲むように配して束ねられた構成としている。図7では、受光用光ファイバ300が7本である構成を示しているが、その本数は限られるものではなく、照射用光ファイバ及び受光用光ファイバは共に1本以上であれば、受光可能な蛍光強度等に応じて適宜本数及びファイバ径は選択することができる。
【0077】
バンドルファイバ21’(31’)は、照射用光ファイバ200と受光用光ファイバ300とを所定の配置となるように、接着剤等により固定して作製される。接着剤としては、使用する励起光L1に合わせた耐熱温度を有するものが好ましい。要求される耐熱温度が300℃を超える場合は無機系の耐熱接着剤が用いられる。固定されたバンドルファイバは、体腔内に挿入される略円筒形の長尺のシース内に備えられた構成としたファイバプローブとして使用することができる(図示略)。
【0078】
照射用光ファイバ200及び受光用光ファイバ300としては特に制限ないが、励起光L1の透過率が良く、また、励起光L1による劣化を生じない材料を用いることが好ましい。特に、励起光L1が紫外光や紫外光に近い短波長光である場合は、光エネルギーが大きいため、石英系の光ファイバであることが好ましい。
【0079】
第2実施形態では、被測定物質Dへの励起光L1の照射と蛍光Lfを含む光L3の受光をファイバプローブFで行うことができるため、in vivoでの測定など、生体内での測定が可能であり、また、被測定物質Dの所定の位置の位置決めも、測定者自身が直接プローブを動かして行うことができる。例えば、図8A及びBに示されるような内視鏡スコープ100の鉗子口チャンネル101に上記バンドファイバ21’(31’)を備えた構成、または、内視鏡スコープ100の鉗子口チャンネル101にファイバプローブFを通して使用することができる。この場合、図8A及び図8Bに示されるように、内視鏡スコープ100には、体腔内の所定の位置に照明光を照射する照明部102と、所定の位置で反射された反射光L4を撮像する撮像部103と、送気送水ノズル104が備えられている。照明部102は所定の位置を照明可能な光源に接続されており、撮像部103は所定の位置を測定者が視認可能なモニター等に接続されているがここでは図示は省略する。
【0080】
第2実施形態の構成では、動物はもちろん、ヒトの体内の組織のpHを直接測定することができる。例えば、ヒトの消化器や気管等の検査に好ましく用いることができる。
【0081】
「異常領域検出装置(検出装置)」
図1,図5,図6を参照して、本実施形態の異常領域検出装置(検出装置)2,5,8について説明する。
既に述べたように、pH測定装置1(4,7)では、ステージ90(90’)をxy方向(励起光照射面の面内方向)及びz方向(光軸方向)に移動させることができるので、被測定物質Dの複数の所定の位置においてpHの測定が可能である。従って、例えば、複数の所定の位置を被測定物質Dのx−y面内にむらなく設定することにより、被測定物質Dの面内pH分布を得ることができる。また、2光子蛍光等の多光子励起を利用することにより、被測定物質の深部の蛍光を検出することもできる。従って、その際は、被測定物質Dのz方向にも測定点を設定することによって3次元のpH分布を得ることができる。
【0082】
また、ワイドフィールド方式のpH測定装置とした場合でも、上記pH測定装置の実施形態において述べたように、一度にxy面の情報を取得することができるので、同様に被測定物質Dの面内pH分布を容易に得ることができる。
【0083】
従って、pH測定装置1,4,7に、被測定物質DのpH分布を検出可能な異常領域検出手段80を備えた構成とすることにより、例えば、異常領域を検出する異常領域検出装置2(5,8)とすることができる。
【0084】
異常領域検出手段80としては、CCD又は冷却CCD等のアレイ検出器等を用いることができる。
【0085】
更に、異常領域検出装置2(2’)は、異常領域検出手段80による検出結果を画像化して表示する表示手段81を更に備えた構成とすることにより、面内pH分布や異常領域を明確に視認することができる。画像化の手法は、従来から用いられている方法を用いればよく、面内pH分布を色別に表示する手法や、3次元的に面内濃度分布を表す手法を用いてもよい。複数画像を取得した場合など、それらを画像合成して表示してもよい。
【0086】
また、図7に示されるようなファイバプローブ型のpH測定装置10の場合は、測定者自身が直接プローブを動かして任意の領域におけるpHを測定することができるので、pH測定装置1を用いる場合と同様に、被測定物質DのpH分布を検出可能な異常領域検出手段80を備えた構成とすることにより異常領域検出装置11とすることができる。
【0087】
かかる実施形態では、異常領域検出手段80としては、ファイバプローブの先端に取り付けて使用するMEMSスキャナ等を使用したり、被測定物質を配置するステージ90に稼動部91を設けることにより好適に画像検出を行うことができる。
【0088】
本実施形態の異常検出装置2(2’)は、上記実施形態のpH測定装置を備えた構成としているので、上記pH測定装置1(1’)と同様の効果を奏する。
【0089】
「生体物質分析装置」
図1,図5,図6,図7を参照して、本実施形態の生体物質分析装置3(6,9,12)について説明する。生体物質分析装置3(6,9,12)は、上記異常領域検出装置2(5,8,11)に、測定されたpHから、被測定物質Dの病理学的性質を特定する分析手段70を備えた構成としている。
生体組織に異常を生じると、その組織内のpHが変化することが知られている。例えば、癌化(悪性腫瘍化)した場合や、肝臓疾患等の疾患の場合は、pHが低くなる。従って、上記pH測定装置1(4,7,10)又は、異常領域検出装置2(5,8,11)に、より、被測定物質Dの所定の位置又は領域における、悪性腫瘍状態の有無等の病理学的性質、及びその度合いを特定することができる。
【0090】
本実施形態の構成では、被測定物質Dの面内のpH分布を得ることができることから、被測定物質Dの面内において、病理学的性質の異常範囲を特定することができ、また、その範囲内での異常の度合いを特定することができる。
【0091】
悪性腫瘍(癌)の治療では、患部を切除して摘出する外科療法と、切除せずに放射線を照射することにより癌細胞を死滅させる放射線療法などがある。本実施形態の生体物質分析装置によれば、癌化した範囲を特定できることから、外科療法においては、的確に切除する必要範囲のみを切除することができる。癌腫瘍の摘出手術では、癌細胞が患者の身体に残存すると再発の可能性が高まり好ましくないが、再発を恐れるあまり、過剰に組織を切除するのも患者の身体の負担が増大し好ましくない。そこで、必要範囲と判断される部分のみを摘出し、その後、摘出腫瘍が接していた領域の組織を微少量切り取り、本発明のpH測定装置を用いて癌細胞の有無を調べる、或いは、摘出腫瘍自体を被測定物質(サンプル)とし、その切除面に対してpH測定装置によりpHの測定を行い切除面の癌細胞の有無を調べる。いずれの場合も、癌細胞が検出された場合はさらなる切除が必要と判断し、癌細胞が検出されなかった場合は摘出が十分であったと判断することができる
また、放射線療法においても、放射線照射が必要な範囲を的確に認識して照射することができるため、放射線によりダメージを受ける正常細胞を極力少なくすることができる。
【0092】
上記したように、本実施形態の生体物質分析装置では、高精度にpHを測定することのできるpH測定装置を備えた構成としているので、癌化した部分等の患部の高精度なpH情報を、患部の位置情報とともに得ることが可能である。従って、本実施形態の生体物質分析装置によれば、放射線療法において、患部の状態に応じた的確な放射線の種類及び強度を選択することができるため、良好な治療効果を得ることができる。また、内視鏡的粘膜下層剥離術(ESD)を施術する場合においても、患部の範囲及び状態を特定することができるため、的確な部位を剥離して、患者への負担を最小限に抑えた治療を行うことができる。
【0093】
また、癌腫瘍の摘出の判断は手術中に短時間で行う必要がある。上記したように、上記実施形態のpH測定装置は、迅速な測定を行う事ができるため、癌治療の治療方針の決定に用いる分析装置としては、スループットが高く、好ましい。
【0094】
細胞または組織は個々で細胞環境にばらつきがある。その要因は、同じ正常細胞または癌細胞中における、細胞の活性状態やストレス状態、衰弱状態の違いなどが挙げられる。そのため、細胞または組織からの自家蛍光寿命もまた、その個々の環境に反映してばらついてしまう。
【0095】
実際の疾患部の測定においては、十分な臨床データから検量線を作成することが必要である。次に、測定したい部位の測定を測定領域を変えて繰り返し、より確からしいデータを取得することが必要である。このように測定することで、ばらつきが大きい細胞や組織においても、より精度の高いpH測定と臨床的判断をすることができる。
【0096】
一例として、担癌マウスにおける癌組織と正常組織の境界部のpH測定を行った。ここで、励起する自家蛍光物質はNADHとNADPHとし、励起光として、1ピコ秒パルス幅のチタンサファイアレーザのSHG光を使用し、NADHとNADPHの励起波長である370nmの光(還元型のみ励起される)となるように励起光の波長を調整し、417〜477nmの蛍光フィルターを用いて蛍光寿命の測定を行った。このとき、励起光の平均パワーは0.9mW、パルスエネルギーは12pJとし、癌組織と正常組織の境界部の所定の位置にレーザ光が照射され、レーザ光の焦点が癌組織と正常組織の境界部に合うようにxyzステージを調整した。
【0097】
検量線は十分な臨床データから作成したものである。癌組織、正常組織の別々の3領域をそれぞれ測定し、3つの値から蛍光寿命平均値を求め、検量線と比較したところ、癌細胞がpH7.1、正常細胞がpH7.2と求められた。しかし、今度は癌組織、正常組織の別々の10領域をそれぞれ測定し、10つの値から蛍光寿命平均値を求めたところ、癌細胞がpH6.8、正常細胞がpH7.3と求められた。pH差0.5は蛍光寿命によるpH分解能0.3〜0.4より大きな値である。このように、測定回数を増やすことで、より精度の高い測定かつ臨床的判断が可能となった。
【0098】
「設計変更」
以上、本発明によるpH測定装置、該pH測定装置を備えた異常領域検出装置、及び生体物質分析装置の好ましい実施の形態について説明したが、本発明は上記実施の形態に限定されるものではなく、発明の要旨を変更しない限りにおいて、種々変更することが可能である。
【0099】
被測定物質Dの病理学的性質の特定は、分析手段70を用いて行う構成について説明したが、pHと病理学的性質の異常度合いとの関係が明確となっている場合には、上記実施形態のpH測定装置及び異常領域検出装置のみによっても、生体物質の病理学的性質を特定することができる。従って、上記した生体物質分析装置において述べた治療効果は、上記実施形態のpH測定装置及び異常領域検出装置によっても得ることができる。
【実施例】
【0100】
以下に、本発明に係る実施例について説明する。
(実施例1)
図1に示される顕微鏡型のpH測定装置及び異常領域検出装置を用いて、培養したpH無調整のHeLa細胞のpHの測定を行った。図9に測定したHeLa細胞の蛍光強度画像(図9A)と蛍光寿命画像(図9B)を示す。同じ条件のサンプルに対し、測定領域を変えて3回測定した。3枚の画像全体の平均蛍光寿命は2.24nsecであった。従って、(1)式により、得られた蛍光寿命からpHを導出した結果、このHeLa細胞のpHは、6.6であると見積もることができた。
【産業上の利用可能性】
【0101】
本発明のpH測定方法、異常領域検出方法、及び生体物質分析方法、並びに各装置は、正常細胞と異常細胞(癌細胞等)の診断及び分離に好ましく用いることができる。
【符号の説明】
【0102】
1,4,7,10 pH測定装置
2,5,8,11 異常領域検出装置
3,6,9,12 生体物質分析装置
10 励起光発生手段
11 レーザ(光源)
20 励起光照射手段
21,31 対物レンズ(光学系)
21’,31’ 光ファイバ(バンドルファイバ)
200 照射用光ファイバ
300 受光用光ファイバ
30 受光手段
40 時間分解手段
50 検出手段
60 測定手段
70 分析手段
80 異常領域検出手段
81 表示手段
90,90’ ステージ
91,90’ 位置調節手段
100 内視鏡スコープ
101 鉗子口チャンネル
102 照明部
103 撮像部
L1 パルス励起光
Ls 蛍光スペクトル
Lf 蛍光
Tf 蛍光寿命
D 被測定物質(生体物質)
F ファイバプローブ
【技術分野】
【0001】
本発明は、生体物質のpHを測定する方法、該pHから異常領域を検出する方法、及び、これらの結果より生体物質を分析する方法、並びにこれらを実施する装置に関する。
【背景技術】
【0002】
細胞内/組織内のpHは、生体機能の調節因子として重要であり、細胞内/組織内のエネルギー代謝環境や酸化還元状態と密接に関係している。細胞内/組織内のpH変化が関係している疾患として、癌や臓器機能低下などが挙げられる。
【0003】
癌及び悪性腫瘍は、日本国内における死亡原因の第1位とされており、その大部分が臓器の細胞が癌化した固形癌によるものである。癌の治療においては、早期発見及び悪性化部位の特定が非常に重要であり、その診断において、疑わしい組織を採取して判断する病理組織検査が行われる。
【0004】
病理組織検査には、検体を肉眼で観察する方法や、光学顕微鏡を用いて組織学的な検索を行う方法、また、検体を標識して顕微鏡下でその標識の物理特性の検出により生物化学的に診断する方法がある。組織学的な方法は、病理対象の形態により判断されるものであるため、診断者の経験によるところが多いという問題があった。また、検体を標識する方法は、蛍光色素により標識して、その蛍光強度を検出する方法など検出感度が良好な方法であることから多方面で用いられている。
【0005】
特許文献1には、蛍光色素により標識した細胞のpH変化を、その蛍光強度により測定して腸管の薬剤吸収性を評価する方法が開示されている。また、特許文献2には、蛍光染色することにより細胞を標識して、蛍光スペクトルに応じて細胞をグルーピングする方法が記載されている。しかしながら、蛍光色素は生体に対して有毒であることから、測定対象にダメージを与える可能性があり、また、蛍光強度や蛍光スペクトルは励起光波長や強度、蛍光物質の濃度や退色等の影響を受けて変化するうえ、複数物質からの蛍光や周囲からの蛍光の影響も分析結果に反映されることから精度の高い評価が難しい。
【0006】
一方、蛍光寿命は、その物質の環境に反映して固有の値を有するため、励起光条件や周囲の不要な蛍光物質の影響を受けずに精度良く生体物質の環境(状態)を知ることのできる有望な情報である。特許文献3には、2つ以上の分光学的手法を組み合わせることにより、生体組織の変化に関連する形態学的変化と生物化学的変化を分離して評価して、当該組織の正確な診断を行う方法が開示されている。特許文献3には、生物化学的変化を評価する分光学的手法として、生体物質中に存在する蛍光物質を標識とし、該蛍光物質を励起して発せられる蛍光(自家蛍光)を時間分解蛍光発光測定(蛍光寿命測定)により、評価する方法が開示されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2000−139462号公報
【特許文献2】特表2001−523334号公報
【特許文献3】特表2003−512085号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、特許文献3の方法では、分光学的手法による評価を少なくとも2つ実施しなければ正確な診断を行うことができないとされている。診断の簡易性、迅速性を考慮すると、診断にはできるだけ1つの評価により診断可能であることが好ましい。
【0009】
本発明は、上記事情に鑑みてなされたものであり、測定対象に大きなダメージを与えることなく、迅速に、感度良く生体物質のpHを測定することのできるpH測定方法、ならびに、該pHから異常領域を検出する方法、そして、これらの結果から生体物質を分析する方法を提供することを目的とする。
【0010】
また本発明は、上記pH測定方法、検出方法、及び生体物質分析方法を実現可能な装置を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明のpH測定方法は、生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、前記生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、前記生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生させ、該パルス励起光を前記生体物質の所定の位置に照射し、該照射により励起された前記蛍光物質から生じる蛍光を含む光を受光し、該受光した蛍光の強度を時間分解して前記蛍光の蛍光寿命を算出し、該蛍光寿命から前記生体物質のpHを測定することを特徴とするものである。
【0012】
また、本発明のpH測定装置は、生体物質中に含まれる生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、前記生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、前記生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生する励起光発生手段と、該パルス励起光を前記生体物質の所定の位置に照射する励起光照射手段と、前記パルス励起光が照射されることにより励起された前記蛍光物質から生じる蛍光を含む光を受光する受光手段と、前記パルス励起光の照射と同期して前記蛍光を時間分解する時間分解手段と、該時間分解された前記蛍光を検出する検出手段と、該検出手段により検出された前記蛍光から該蛍光の蛍光寿命を算出し、該蛍光寿命に基づいて前記生体物質のpHを測定する測定手段とを備えたことを特徴とするものである。
【0013】
ここで、蛍光物質によっては細胞内で、プロテインボンド状態とフリー状態などが存在する場合があるが、プロテインボンド状態、フリー状態などいずれの状態でも良い。組織や細胞中のある領域の平均値でも良い。また、「生体物質」とは、ヒト、動物の細胞や組織、体液等の生物組織を意味し、生物から採取したもの、培養したもの、in vivoの細胞や組織全てを含むものとする。
【0014】
本発明のpH測定方法及びpH測定装置において、前記蛍光物質は、NADH、NADPH、及びFADからなる群より選ばれる少なくとも1種の蛍光物質であることが好ましい。
【0015】
本発明のpH測定方法において、前記受光した蛍光を波長分解した蛍光スペクトルとした後、該蛍光スペクトルから波長毎に前記蛍光強度を時間分解して波長毎の前記蛍光の蛍光寿命を算出することが好ましい。従って、本発明のpH測定装置は、かかる蛍光スペクトルを得る受光手段を備えていることが好ましい。
【0016】
本発明のpH測定方法において、前記蛍光が、多光子励起により励起されるものであることが好ましい。かかる構成では、前記励起光発生手段としてピコ秒からフェムト秒レーザを用いることにより、生体物質の深部の情報を容易に得ることができる。
【0017】
また、本発明のpH測定方法及びpH測定装置では、前記所定の位置は、複数の位置とすることができる。かかる構成のpH測定装置に、前記生体物質の異常領域を検出する検出手段を備えた構成とすることにより、前記生体物質の異常領域を検出することができる。
【0018】
異常領域の検出は、前記生体物質の異常領域を画像化して表示して検出してもよい。
【0019】
本発明のpH測定方法及び検出方法により得られたpHや異常領域に基づいて、前記生体物質の病理学的性質を特定して生体物質を分析することができる。
【0020】
本発明のpH測定装置の好適な態様としては、表面に前記生体物質を接触させて保持するステージであって、前記生体物質の任意の位置に前記パルス励起光を照射できるように3次元方向に可動なステージと、該ステージを3次元方向の任意の位置に動かす位置調節手段とを備え、前記励起光照射手段が、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備え、前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えた顕微鏡の態様が挙げられる。
【0021】
また、本発明の測定装置の他の好適な態様としては、表面に前記生体物質を接触させて保持するステージであって、前記生体物質の、少なくとも前記パルス励起光の光軸方向の任意の位置に該パルス励起光を照射できるように可動なステージと、
該ステージを少なくとも光軸方向の任意の位置に動かす第1の位置調節手段と、
前記生体物質の、少なくとも前記パルス励起光の光軸に垂直な面内方向の任意の位置に該パルス励起光を照射できるように前記励起光照射手段を動かす第2の位置調節手段とを更に備えたものであり、
前記励起光照射手段は、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備えたものであり、
前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えたものが挙げられる。
【0022】
また、本発明の測定装置の他の好適な態様としては、前記生体物質の3次元方向の任意の位置に、前記パルス励起光を照射できるように前記励起光照射手段を動かす位置調節手段を更に備え、
前記励起光照射手段は、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備えたものであり、
前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えたものが挙げられる。
【0023】
また、本発明のpH測定装置の他の好適な態様としては、前記励起光照射手段が、前記パルス励起光を前記生体物質に照射する少なくとも1本の照射用光ファイバを備えたものであり、前記受光手段が、前記照射により励起された前記蛍光物質から生じる蛍光を受光して該蛍光を前記時間分解手段に導く少なくとも1本の受光用光ファイバを備えたファイバプローブの態様が挙げられる。かかる態様では、前記少なくとも1本の照射用光ファイバと前記少なくとも1本の受光用光ファイバとが、1本のバンドルファイバを形成していることが好ましく、このバンドルファイバは、略中心部に配された1本の前記照射用光ファイバの外周を、複数本の前記受光用光ファイバで囲むように束ねられたものであることがより好ましい。
【0024】
「背景技術」の項において述べたように、特許文献3には、生体物質中に存在する蛍光物質を標識とし、該蛍光物質を励起して発せられる蛍光(自家蛍光)を時間分解蛍光発光測定(蛍光寿命測定)により、生体組織の変化を生物化学的に評価する方法が開示されており、細胞内のpHが蛍光寿命の変化に寄与する細胞内環境の1つであることが記載されている。しかしながら、特許文献3には、蛍光寿命測定だけでは正確な診断が難しいことが記載されている。
【0025】
本発明者は、自家蛍光の蛍光寿命の測定によりpHの変化をとらえるだけでは正確な診断ができないとされる原因を解明し、自家蛍光の蛍光寿命測定のみにより正確なpHを測定し、該測定の結果から正確な生体組織の変化を生物化学的に評価する方法及びそれを実現する装置を見出した。
【0026】
本発明者は、細胞内pHが、ピルビン酸から乳酸を産生する産生因子として働くことに注目した。ピルビン酸から乳酸を産生する反応においては、水素イオンが不可欠であり、細胞内pHによる水素イオン濃度によって、ピルビン酸濃度と乳酸濃度が影響される。ピルビン酸からの乳酸の産生、ピルビン酸から産生されたアセチルCoAから始まるクエン酸回路、アセチルCoAからの脂肪酸合成において、いくつかの酸化還元反応が生じるが、NADH、NADPH、及びFADは、これらの酸化還元反応において、補酵素として働く。例えば、NADHはピルビン酸から乳酸の産生やクエン酸回路の過程、NADPHはアセチルCoAからの脂肪酸合成過程、FADはクエン酸回路の過程における補酵素となる。
【0027】
これらの過程において、上記自家蛍光物質は、自らも酸化還元反応による水素イオンの解離/結合を生じ、吸収スペクトルが変化するため、波長によっては励起できず、蛍光を発しない場合が存在する。更に、これらの物質には、同一の励起波長で励起され、異なる蛍光寿命を有するフリー状態とプロテインボンド状態が存在する(後記実施例を参照)。
【0028】
つまり、我々の解釈によれば、細胞内pH変化で生じた酸化還元反応によって、補酵素の水素イオンの解離/結合が生じ、補酵素の吸収スペクトルが変化することで蛍光寿命に寄与する濃度が変化する。そしてこの変化は、プロテインボンド状態に比べ、フリー状態の方が顕著に起こるため、細胞全体の平均的な蛍光寿命が変化することになる。従って、これら補酵素として働く自家蛍光物質の蛍光寿命の変化を測定することで、細胞内pHに対し、精度の良い評価ができることを見出した。
【0029】
特許文献3には、細胞内のpHが蛍光寿命の変化に寄与する細胞内環境の1つとして記載されているのみであり、好ましい自家蛍光物質の存在も示唆していない。このことは、蛍光寿命による評価だけでは正確な評価ができないという記載からも明確である。
【0030】
本発明は、生体物質のpHを考慮して感度の良い蛍光寿命を有する自家蛍光物質を見出し、正常細胞と異常細胞との精度のよい評価を蛍光寿命の評価によるpH測定のみの簡易な方法により初めて実現したものである。
【発明の効果】
【0031】
本発明は、生体物質に含まれる生体内の酸化還元反応において補酵素として働く自家蛍光物質の蛍光寿命を測定することにより、生体物質のpHを高精度に測定し、正常細胞と異常細胞の特定を高精度に実施することを可能にしたものである。蛍光寿命は、物質固有の値であるため、励起光強度や蛍光物質の濃度、及び不要な物質の蛍光に影響されることなく、生体物質のpHを測定することができる。従って本発明によれば、励起光強度や蛍光物質の濃度、及び不要な物質の蛍光に影響されることなく、高精度に生体物質のpHを測定し、病理学的性質の正常・異常の特定することができる。
【0032】
また、本発明では、自家蛍光物質の蛍光寿命を測定対象とするので、生体物質に薬物の投与等の必要がない。従って、生体物質に大きなダメージを与えることなくpHの測定を実施することができる。
【図面の簡単な説明】
【0033】
【図1】本発明の第1の実施形態によるpH測定装置並びに異常領域検出装置、及び、生体物質分析装置の概略構成図
【図2】細胞内のpHに対するイメージング画像全体において蛍光寿命が短い自家蛍光成分の平均蛍光寿命測定結果を示す図
【図3A】生物物質中に含まれる主な自家蛍光発光物質の励起光吸収特性を示す図
【図3B】図3Aに示される自家蛍光発光物質の蛍光特性を示す図
【図4】時間分解による蛍光寿命の算出方法を示す図
【図5】励起光照射手段の光学系に走査手段を備えたpH測定装置並びに異常領域検出装置、及び、生体物質分析装置の概略構成図
【図6】図5のpH測定装置の受光手段に分光素子を備えたpH測定装置並びに異常領域検出装置、及び、生体物質分析装置の概略構成図
【図7】本発明の第2の実施形態によるpH測定装置並びに異常領域検出装置、及び、生体物質分析装置の概略構成図
【図8A】内視鏡スコープにファイババンドルを備えた場合の内視鏡スコープの構成を示す概略図。
【図8B】内視鏡スコープにファイバプローブを備えた場合の内視鏡スコープの構成を示す概略図。
【図9A】実施例1のHeLa細胞の蛍光強度イメージング結果
【図9B】実施例1のHeLa細胞の蛍光寿命イメージング結果
【発明を実施するための形態】
【0034】
「pH測定装置の第1実施形態(顕微鏡)」
以下、図面を参照して本発明にかかる第1実施形態のpH測定装置およびpH測定方法について説明する。図1は、本実施形態のpH測定装置1の概略構成図である。視認しやすくするため、各部の縮尺は適宜変更して示してある。
【0035】
図1に示されるように、pH測定装置1は、生体物質である被測定物質Dにパルス励起光L1(以下、励起光L1とする)を励起光照射手段20により照射し、励起光L1が照射されることにより被測定物質D中の蛍光物質Pから生じる蛍光Lfを含む光L3を受光手段30により受光して蛍光を得、この蛍光から所定の蛍光Lfを時間分解手段40により時間分解し、時間分解された蛍光Lfを検出手段50により検出し、検出された蛍光Lfの強度から測定手段60により蛍光減衰曲線を得て蛍光寿命Tfを算出し、蛍光寿命Tfに基づいて被測定物質DのpHを測定するものである。励起光L1は、被測定物質D中に含まれる生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質Pを励起可能な波長を含み、生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、生体物質内のpHを実質的に変化させない強度を有するパルス励起光である。
【0036】
蛍光寿命の測定方法は、時間領域測定法と周波数領域測定法に大別され、本実施形態においては時間領域測定法を採用する。時間領域測定法には、ストリークカメラ法、時間相関単一光子計数法、時間ゲート法等があるが、本実施形態では、時間ゲート法により蛍光寿命の測定を行う例について説明する。
【0037】
時間ゲート法は、パルス励起光の照射と同期して、発光した蛍光をある時間領域で区切り、その範囲の蛍光強度積分値をCCD等の固体検出器で検出して時間領域を変えて測定することで近似的に蛍光減衰曲線を得る方法である。本実施形態では、ビームスプリッタ25により励起光L1から分けられた信号光L2がフォトダイオード44により検出されると、同期制御装置43によりゲートコントローラ42に対して同期信号S1が送られる。ゲートコントローラ42は、同期信号S1を受けて予め設定された所定の時間領域にゲート信号S2を発信し、ゲート機能つきイメージインテンシファイア41を駆動する。ゲート機能つきイメージインテンシファイア41に入力された蛍光像Lfは、ゲート信号S2に応じた時間領域において増強されて、検出手段50により、所定の蛍光Lfの蛍光強度の積分値(蛍光信号)Ltが検出される。この工程をゲート信号S2に応じて繰り返し、測定手段60により単一指数関数による解析を行って蛍光寿命Tfを算出する。
【0038】
本発明者らは、各種自家蛍光物質の蛍光寿命を時間相関単一光子計数法(TCSPC)、時間ゲート法により測定を重ね、現状の蛍光寿命測定において2つの蛍光寿命を分離できる限界値が蛍光寿命が0.03nsecであることを見出した。本実施形態のpH測定装置では、正常細胞と異常細胞とのpH変化により、蛍光寿命が0.03nsec以上異なる自家蛍光物質を励起して、その蛍光寿命を測定することにより高精度にpHを測定して生体物質の正常と異常を特定するものである。
【0039】
既に述べたように、細胞内pHが、ピルビン酸から乳酸の産生因子として働き、細胞内pHによる水素イオン濃度によってピルビン酸濃度と乳酸濃度が影響される。ピルビン酸からの乳酸の産生、ピルビン酸から産生されたアセチルCoAから始まるクエン酸回路、アセチルCoAからの脂肪酸合成において、いくつかの酸化還元反応が生じるが、NADH、NADPH、及びFADは、これらの酸化還元反応において、補酵素として働く。例えば、NADHはピルビン酸から乳酸の産生やクエン酸回路の過程、NADPHはアセチルCoAからの脂肪酸合成過程、FADはクエン酸回路の過程における補酵素となる。
【0040】
これらの過程において、自らも酸化還元反応による水素イオンの解離/結合を生じ、吸収スペクトルが変化するため、波長によっては励起できず、蛍光を発しない場合が存在する。更に、これらの物質には、同一の励起波長で励起され、異なる蛍光寿命を有するフリー状態とプロテインボンド状態が存在する(後記実施例を参照)。
【0041】
我々は、細胞内pH変化で生じた酸化還元反応によって、補酵素の水素イオンの解離/結合が生じ、補酵素の吸収スペクトルが変化することで蛍光寿命に寄与する濃度が変化し、この変化は、プロテインボンド状態に比べ、フリー状態の方が顕著に起こるため、細胞全体の平均的な蛍光寿命が変化すると考えている。従って、これら補酵素として働く自家蛍光物質の蛍光寿命の変化を測定することで、細胞内pHに対し、精度の良い評価ができることを見出した。
【0042】
図1に示される顕微鏡型のpH測定装置及び異常領域検出装置を用いて、培養したHeLa細胞のpHの測定を行った。
まず、pHの異なるHeLa細胞を調製し、HeLa細胞のpHと蛍光寿命との関係を導出した。所定のpHのHeLa細胞は、培地としてD-MEM(Dulbecco's Modified Eagle Medium;SIGMA社)を用い、石英ガラスボトムディッシュにHeLa細胞を適量まき、37℃、5%CO2下のインキュベータで1〜2日培養した後、0.1 mol/L のNaOH溶液、HCl溶液でpHを調整したKCl-rich mediaに適量のニゲリシンを加え、前記培地をKCl-rich mediaに置換して調製した。ニゲリシンはエンドソームのpH低下阻害剤であり、K+/H+のイオノフォアとして働き、細胞内外のpHを同じにする役割を果たす。HeLa細胞がそれぞれのpHになっていることを確認した後、顕微鏡のxyzステージ上に設置したインキュベータ(37℃、5%CO2)に15分ほどおいて、pHの異なる複数の測定試料を用意した。
【0043】
これらの試料に対して、蛍光寿命の測定を行った。ここで、励起する自家蛍光物質はNADHとNADPHとし、励起光として、1ピコ秒パルス幅のチタンサファイアレーザのSHG光を使用し、NADHとNADPHの励起波長である370nmの光(還元型のみ励起される)となるように励起光の波長を調整し、417〜477nmの蛍光フィルターを用いて蛍光寿命の測定を行った。このとき、励起光の平均パワーは0.9mW、パルスエネルギーは12pJとし、HeLa細胞の所定の位置にレーザ光が照射され、レーザ光の焦点がHeLa細胞に合うようにxyzステージを調整した。測定温度は23度である。
【0044】
得られた結果を図2に示す。図2においては、縦軸は細胞内のpHに対するイメージング画像全体の平均蛍光寿命を示しており、更に、それぞれのpHに対して試料を変え、複数回測定した結果を平均して求めた値とした。図2を最小二乗法でフィッティングした結果、以下の関係式を導出することができた。
【0045】
[pH] =33.3-11.9×[蛍光寿命(nsec.)] ・・・(1)
また、図2に示されるように、NADHとNADPHは、pHが6.5から7.5の間で蛍光寿命は0.08nsec変化しており、上記した蛍光寿命の測定限界を考慮すると、pH差0.3〜0.4の測定が十分に可能であり、高い感度を有していることが確認された。
【0046】
以上の結果より、生体物質に含まれる生体内の酸化還元反応において補酵素として働く自家蛍光物質の蛍光寿命を測定することにより、生体物質のpHを高精度に測定し、励起光強度や蛍光物質の濃度、及び不要な物質の蛍光に影響されることなく、高精度に生体物質のpHを測定し、病理学的性質の正常・異常の特定することができることがわかった。
【0047】
細胞内において、NADH、NADPH及びFADは主に細胞質またはミトコンドリア存在する。従って、細胞質またはミトコンドリアの領域を計測すれば、細胞内のpHの分析が可能であり、好ましい。また、核におけるNADH、NADPH及びFADの量は少量であるが、核周辺の細胞質またはミトコンドリアからのNADH、NADPH及びFADが自家蛍光を発するため、核の領域を計測してもよい。
【0048】
pH測定装置1は共焦点系顕微鏡であり、被測定物質Dは、位置調節手段91によりxyz方向に移動可能なサンプルステージ90上に接触されており、位置調節手段91により、サンプルステージ90の位置を調節して、被測定物質Dの所定の位置に対物レンズ(光学系)21(31)により集光された励起光L1を照射することができる。pH測定装置1には、正確に所定の位置に励起光L1が照射できるように、被測定物質Dの上方から被測定物質Dにおける励起光L1の照射位置を確認することができるように、拡大レンズ等を備えた窓(図史略)を備えた構成としてもよい。
【0049】
pH測定装置1において、励起光発生手段10は、被測定物質D中の生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生するパルスレーザ11と、パルスレーザ11より発振されたパルスを、所定の間隔にて出射させるように間引くパルスピッカー12とを含む。パルスレーザ11は、特に制限されないが、超短パルス光を発振できるレーザであることが好ましく、数十フェムト秒〜数十ピコ秒の時間範囲内でパルス発振可能なレーザであることがより好ましい。パルスレーザ11としては、例えば、発振波長840nmのチタンサファイアレーザの第2次高調波(SHG)である波長420nm、パルス幅3ps、繰り返し周波数80MHz、ピークパワー8kW、平均パワー2W等を用いることができる。また、励起光発生手段10には、第3次高調波(THG)や光パラメトリック発信器(Optical Parametric Oscillator:OPO)等の波長変換素子を備えた構成としてもよい。本実施形態ではパルスピッカー12を用いているが、パルスピッカーで間引きせず、所望の繰り返しに調整した光源を使用してもよい。
【0050】
また、被測定物質D内において励起される蛍光Lfは多光子励起によるものでもよい。その場合は、多光子励起可能な波長及びパルス幅の励起光L1として、発振波長840nmのチタンサファイアレーザ、パルス幅100fs、繰り返し周波数80MHz、ピークパワー100kW、平均パワー0.8W等を用いる。多光子励起では、所望の箇所だけ励起が可能なので、周辺部の蛍光低減ができより低雑音化ができ、また観察箇所より前の部分での吸収減衰を低減できるので効率よく観察箇所に励起光L1を照射することができる。また、高い空間分解能で分析もできる。
【0051】
励起光発生手段10から出射された励起光L1は、励起光照射手段20に入射され、励起光照射手段20により被測定物質Dの所定の位置に照射される。励起光照射手段20の構成は特に制限されないが、本実施形態では、励起光L1の照射と被測定物質Dから発生した、蛍光物質Pの励起による蛍光Lfを含む光L3の受光を同一の対物レンズ(光学系)21(31)で行う構成としている。従って、励起光照射手段20には、被測定物質Dの所定位置に励起光L1を照射し、且つ、光L3を受光できるように配された対物レンズ21及び、励起光L1を対物レンズ21に入射させ、且つ、光L3を時間分解手段40に導くダイクロイックミラー22(32)を備えている。対物レンズ21としては、励起光L1及び蛍光の透過率が高く、レンズ素材による蛍光の発生の少ないものが好ましい。
【0052】
また、本実施形態では、励起光L1の照射と時間分解手段40を同期して駆動させるため、励起光照射手段20に同期信号S1を発信させる信号光L2を励起光L1から分割させるビームスプリッタ25を、そして、励起光L1を蛍光物質Pの励起波長の光に絞り込む励起フィルター23を備えている。励起光照射手段20には、必要に応じて励起光L1を導光するミラー(24,26)やレンズ等(図示略)を備えてよい。
【0053】
受光手段30は、励起光L1の照射により被測定物質Dにおいて生じた光L3を受光して時間分解手段40に目的とする蛍光Lfを出力できれば特に制限されないが、本実施形態では、被測定物質Dから発生した光L3を受光する対物レンズ31(21)と、光L3を時間分解手段40に導くダイクロイックミラー32(22)と、光L3から散乱光等のノイズ光を除去するフィルター33とを備えている。
【0054】
対物レンズ(光学系)31及びダイクロイックミラー32については上述の通りである。フィルター34は、検出する蛍光Lfの波長に応じて、バンドパスフィルターやショートパスフィルタ等適宜選択して用いればよい。複数種類の蛍光Lfを観測するときは、異なる透過波長帯域を有する複数のバンドパスフィルターを用いたり、あるいは透過波長帯域が可変のものを用いるようにしてもよい。
【0055】
受光手段30により得られた蛍光Lfは、時間分解手段40に入力される。時間分解手段40は、蛍光Lfの、所定の時間領域の蛍光信号Ltを取り出して検出手段50に出力するものである。蛍光の時間分解は、励起光L1の照射に対する最初の同期信号S1の受信時t0から開始する。同期信号S1は、励起光L1からビームスプリッタ25により分けられた信号光L2が、光検出器44で電気信号に変換されて同期制御装置43から、ゲートコントローラ42に送られる。
【0056】
受光手段30により得られた蛍光Lfは、時間分解手段40に入力される。時間分解手段40は、所定の蛍光Lfの、所定の時間領域の蛍光像を取り出して検出手段50に出力するものである。蛍光の時間分解は、励起光L1の照射に対する最初の同期信号S1の受信時t0から開始する。同期信号S1は、励起光L1からビームスプリッタ25により分けられた信号光L2が、光検出器44で電気信号に変換されて同期制御装置43から、ゲートコントローラ42に送られる。
【0057】
光検出器44としては特に制限なく、一般的に用いられているフォトダイオード等を用いることが好ましい。
【0058】
同期制御装置43は、光検出器44から出力された信号を受けてゲートコントローラ42に同期信号S1を出力できれば特に制限なく、パーソナルコンピュータ(PC)等を用いることができる。ゲートコントローラ42は、同期信号S1を受けて予め設定された所定の時間領域にゲート信号S2を発信し、ゲート機能つきイメージインテンシファイア41のゲートの開閉を指示する。ゲート機能つきイメージインテンシファイア41には、CCDカメラ等の検出手段50が接続されており、ゲート信号S2に基づいてゲートを開閉し、ゲートが開いているときに受光した蛍光信号Ltを増幅させ、コントラストの向上した蛍光像LsをCCDやPMT等の検出手段50により受光して電気信号として蓄積し、検出する。例えば、ゲートコントローラ42が同期信号S1を最初に受けた時刻を基準時刻t0として、時間Δtの間だけゲート機能付きイメージインテンシファイア41のゲートを開くように指示するゲート信号S2を出力すると、ゲート機能付きイメージインテンシファイア41により、t0〜Δtの間の蛍光信号Ltを増幅させて検出手段50に出力し、検出手段50は、その時間範囲の蛍光Lfを検出して、その蛍光強度の積分値S3を測定手段60に出力する。この蛍光強度S3の検出工程を、ゲート信号に応じて繰り返すことにより、時間分解された蛍光強度を測定手段60に出力する。
【0059】
測定手段60としては特に制限ないが、PC等のコンピュータシステムを用いることが簡易であり好ましい。測定手段60は、同期制御装置43とを同じ装置により兼ねてもよい。測定手段60は、時間分解された蛍光強度S3から蛍光減衰曲線を求めて蛍光強度時間分布を得る。この蛍光減衰曲線において、蛍光強度が1/eになった時間tfと発光の開始時t0との差を蛍光寿命Tfとして算出する。図4に、時間分解された蛍光強度から得られた蛍光強度時間分布及び蛍光減衰曲線から求められた蛍光寿命Tfを示す。図4において、t0からの経過時間tにおける蛍光強度Iとt0における蛍光強度I0とは、下記式の関係で表される。分析手段60では、S3がある時間tにおける蛍光強度Iとなる。
【0060】
I=I0e−t/Tf
次に、測定手段60は得られた蛍光寿命Tfに基づいて、被測定物質Dの所定の位置におけるpHを測定する。自家蛍光物質の蛍光寿命は、その周辺のpHにより変化することが知られている。
【0061】
従って、正常状態の被測定物質Dにおける蛍光寿命を予め調べておくことにより、被測定物質Dの所定の位置における自家蛍光物質の蛍光寿命から、その位置のpHの変化を、また、pHに対する蛍光寿命の変化率を予め得ておくことにより、具体的なpH値を測定することができる。時間ゲート法の蛍光寿命イメージングを利用したpH分析においては、ゲート数を増やして分析することにより、より分析精度は高くなる。
【0062】
pH測定装置1では、ステージ90をxyz方向(励起光照射面の面内方向及び深さ方向)に移動させることができるので、被測定物質Dの複数の所定の位置において2次元あるいは3次元のpHの測定が可能である。
【0063】
また図5に示されるpH測定装置4のように、ステージ90’をz方向のみ可動とし、走査光学系27をxy方向に走査させる共焦点系の光学系としてもよい。走査光学系27としては、ガルバノミラーやポリゴンミラー、レゾナントミラー等が挙げられる。
【0064】
かかる構成とする場合は、励起光L1により励起される蛍光の種類が複数になる可能性が高いため、図6に示されるpH測定装置7のように、受光手段30により受光した蛍光Lfを分光して時間分解手段40に蛍光Lfの蛍光スペクトルLsを出力する分光手段35を備えた構成とすることが好ましい。蛍光Lfを分光して蛍光スペクトルLsを時間分解することにより、より高精度に複数の蛍光を分離して所定の波長の蛍光の蛍光寿命を測定することができる。分光素子35としては、蛍光Lfを分光可能なものであれば特に制限なく、回折格子やプリズム等が挙げられる。
【0065】
図5又は図6に示される走査光学系を備えた構成は、局所的な励起を行う多光子励起の場合等に、特に好ましく用いることができる。
【0066】
複数の位置におけるpH測定により、被測定物質Dの異常領域を分析する方法については後記する。
本実施形態のpH測定装置1,4,7は以上のように構成されている。
【0067】
次に、pH測定装置1を例に本実施形態のpH測定装置の動作例について説明する。
まず、ステージ90上に被測定物質Dを接触させ、所定の位置に励起光L1が照射されるように位置調節手段91によりステージ90の位置を調整する。
【0068】
励起光発生手段10からは被測定物質D中の生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、生体物質内のpHを実質的に変化させない強度を有するパルス励起光L1が出射されて、励起光照射手段20に入射する。励起光照射手段20に入射された励起光L1は、ビームスプリッタ25により同期用信号光L2を分離した後、に対物レンズ(光学系)21により集光されて、被測定物質Dの所定の位置に照射される。この照射により、被測定物質Dからは、蛍光物質Pが励起されて蛍光Lfが発せられる。受光手段30の対物レンズ31は、被測定物質Dから発せられた光L3を受光する。光L3には、蛍光Lf以外のノイズ光も含まれているが、フィルター34を通過することにより、ほぼ蛍光Lf以外の光が排除される。
【0069】
ほぼ蛍光のみとなった光L3は、時間分解手段40に入射されて、所定の蛍光Lfを取り出して時間分解され、検出手段50により各時間における蛍光強度S3が検出され、電気信号として測定手段60に出力される。測定手段60は、時間分解された蛍光強度から蛍光強度−時間曲線を得、この曲線において、蛍光強度が略1/eになった時間tfとt0との差を蛍光寿命Tfとして算出し、蛍光寿命Tfに基づいて、被測定物質DのpHを測定する。
【0070】
上記のように、本実施形態のpH測定方法及びpH測定装置1,4,7は、生体物質に含まれる生体内の酸化還元反応において補酵素として働く自家蛍光物質の蛍光寿命を測定することにより、生体物質のpHを高精度に測定し、正常細胞と異常細胞の特定を高精度に実施することを可能にしたものである。蛍光寿命は、物質固有の値であるため、励起光強度や蛍光物質の濃度、及び不要な物質の蛍光に影響されることなく、生体物質のpHを測定することができる。従って本発明によれば、励起光強度や蛍光物質の濃度、及び不要な物質の蛍光に影響されることなく、高精度に生体物質のpHを測定し、病理学的性質の正常・異常の特定することができる。
【0071】
また、本実施形態では、自家蛍光物質の蛍光寿命を測定対象とするので、生体物質に薬物の投与等の必要がない。従って、生体物質に大きなダメージを与えることなくpHの測定を実施することができる。
【0072】
以上述べたpH測定装置1,4,7の効果は、後述の実施形態のpH測定装置も同様に奏するものである。
【0073】
また、被測定物質に対して照射する励起光のスポット径を絞って微小領域での蛍光寿命を測定し、測定位置をずらして被測定物質の測定対象領域の測定を行う共焦点顕微鏡方式である場合について説明したが、被測定物質に応じて広範囲の画像化が必要な場合等は、励起光のスポット径を絞らずに一度に広範囲のxy面の情報を取得するワイドフィールド方式としてもよく、走査手段を用いずに、検出手段としてCCDカメラ等を用いて画面全体を撮像する。また、この場合、ステージ90(90’)をxy方向に走査可能とし、複数のxy面領域を検出しそれらを合成することでより広範囲な領域の画像化が可能となる。
【0074】
「pH測定装置の第2実施形態(ファイバプローブ)」
次に、本発明の別の実施形態にかかるpH測定装置について説明する。第1実施形態のpH測定装置1,4,7は、顕微鏡であったが、本実施形態のpH測定装置10は、ファイバプローブである点で第1実施形態と異なっている。なお、以降の実施形態の説明および図面においては、前述の実施形態の構成要素と実質的に同一の機能を有する構成要素については、同一の符号を付することにより重複説明を省略する。
【0075】
図7に示されるように、pH測定装置10は、第1実施形態の対物レンズ21(31)が、バンドルファイバ21’(31’)である点を除けば、第1実施形態と同様の構成としている。
【0076】
バンドルファイバ21’(31’)は、中央部にパルス励起光L1を導光させ、励起光L1を被測定物質Dの所定の位置に照射する照射用光ファイバ200が略中心部に配され、励起光L1の照射により被測定物質D中に含まれる生体内の酸化還元反応において補酵素として働く自家蛍光物質Pから生じる蛍光Lfを含む光L3を受光して、光L3を時間分解手段40に導く複数の受光用光ファイバ300を照射用光ファイバ200の外周を囲むように配して束ねられた構成としている。図7では、受光用光ファイバ300が7本である構成を示しているが、その本数は限られるものではなく、照射用光ファイバ及び受光用光ファイバは共に1本以上であれば、受光可能な蛍光強度等に応じて適宜本数及びファイバ径は選択することができる。
【0077】
バンドルファイバ21’(31’)は、照射用光ファイバ200と受光用光ファイバ300とを所定の配置となるように、接着剤等により固定して作製される。接着剤としては、使用する励起光L1に合わせた耐熱温度を有するものが好ましい。要求される耐熱温度が300℃を超える場合は無機系の耐熱接着剤が用いられる。固定されたバンドルファイバは、体腔内に挿入される略円筒形の長尺のシース内に備えられた構成としたファイバプローブとして使用することができる(図示略)。
【0078】
照射用光ファイバ200及び受光用光ファイバ300としては特に制限ないが、励起光L1の透過率が良く、また、励起光L1による劣化を生じない材料を用いることが好ましい。特に、励起光L1が紫外光や紫外光に近い短波長光である場合は、光エネルギーが大きいため、石英系の光ファイバであることが好ましい。
【0079】
第2実施形態では、被測定物質Dへの励起光L1の照射と蛍光Lfを含む光L3の受光をファイバプローブFで行うことができるため、in vivoでの測定など、生体内での測定が可能であり、また、被測定物質Dの所定の位置の位置決めも、測定者自身が直接プローブを動かして行うことができる。例えば、図8A及びBに示されるような内視鏡スコープ100の鉗子口チャンネル101に上記バンドファイバ21’(31’)を備えた構成、または、内視鏡スコープ100の鉗子口チャンネル101にファイバプローブFを通して使用することができる。この場合、図8A及び図8Bに示されるように、内視鏡スコープ100には、体腔内の所定の位置に照明光を照射する照明部102と、所定の位置で反射された反射光L4を撮像する撮像部103と、送気送水ノズル104が備えられている。照明部102は所定の位置を照明可能な光源に接続されており、撮像部103は所定の位置を測定者が視認可能なモニター等に接続されているがここでは図示は省略する。
【0080】
第2実施形態の構成では、動物はもちろん、ヒトの体内の組織のpHを直接測定することができる。例えば、ヒトの消化器や気管等の検査に好ましく用いることができる。
【0081】
「異常領域検出装置(検出装置)」
図1,図5,図6を参照して、本実施形態の異常領域検出装置(検出装置)2,5,8について説明する。
既に述べたように、pH測定装置1(4,7)では、ステージ90(90’)をxy方向(励起光照射面の面内方向)及びz方向(光軸方向)に移動させることができるので、被測定物質Dの複数の所定の位置においてpHの測定が可能である。従って、例えば、複数の所定の位置を被測定物質Dのx−y面内にむらなく設定することにより、被測定物質Dの面内pH分布を得ることができる。また、2光子蛍光等の多光子励起を利用することにより、被測定物質の深部の蛍光を検出することもできる。従って、その際は、被測定物質Dのz方向にも測定点を設定することによって3次元のpH分布を得ることができる。
【0082】
また、ワイドフィールド方式のpH測定装置とした場合でも、上記pH測定装置の実施形態において述べたように、一度にxy面の情報を取得することができるので、同様に被測定物質Dの面内pH分布を容易に得ることができる。
【0083】
従って、pH測定装置1,4,7に、被測定物質DのpH分布を検出可能な異常領域検出手段80を備えた構成とすることにより、例えば、異常領域を検出する異常領域検出装置2(5,8)とすることができる。
【0084】
異常領域検出手段80としては、CCD又は冷却CCD等のアレイ検出器等を用いることができる。
【0085】
更に、異常領域検出装置2(2’)は、異常領域検出手段80による検出結果を画像化して表示する表示手段81を更に備えた構成とすることにより、面内pH分布や異常領域を明確に視認することができる。画像化の手法は、従来から用いられている方法を用いればよく、面内pH分布を色別に表示する手法や、3次元的に面内濃度分布を表す手法を用いてもよい。複数画像を取得した場合など、それらを画像合成して表示してもよい。
【0086】
また、図7に示されるようなファイバプローブ型のpH測定装置10の場合は、測定者自身が直接プローブを動かして任意の領域におけるpHを測定することができるので、pH測定装置1を用いる場合と同様に、被測定物質DのpH分布を検出可能な異常領域検出手段80を備えた構成とすることにより異常領域検出装置11とすることができる。
【0087】
かかる実施形態では、異常領域検出手段80としては、ファイバプローブの先端に取り付けて使用するMEMSスキャナ等を使用したり、被測定物質を配置するステージ90に稼動部91を設けることにより好適に画像検出を行うことができる。
【0088】
本実施形態の異常検出装置2(2’)は、上記実施形態のpH測定装置を備えた構成としているので、上記pH測定装置1(1’)と同様の効果を奏する。
【0089】
「生体物質分析装置」
図1,図5,図6,図7を参照して、本実施形態の生体物質分析装置3(6,9,12)について説明する。生体物質分析装置3(6,9,12)は、上記異常領域検出装置2(5,8,11)に、測定されたpHから、被測定物質Dの病理学的性質を特定する分析手段70を備えた構成としている。
生体組織に異常を生じると、その組織内のpHが変化することが知られている。例えば、癌化(悪性腫瘍化)した場合や、肝臓疾患等の疾患の場合は、pHが低くなる。従って、上記pH測定装置1(4,7,10)又は、異常領域検出装置2(5,8,11)に、より、被測定物質Dの所定の位置又は領域における、悪性腫瘍状態の有無等の病理学的性質、及びその度合いを特定することができる。
【0090】
本実施形態の構成では、被測定物質Dの面内のpH分布を得ることができることから、被測定物質Dの面内において、病理学的性質の異常範囲を特定することができ、また、その範囲内での異常の度合いを特定することができる。
【0091】
悪性腫瘍(癌)の治療では、患部を切除して摘出する外科療法と、切除せずに放射線を照射することにより癌細胞を死滅させる放射線療法などがある。本実施形態の生体物質分析装置によれば、癌化した範囲を特定できることから、外科療法においては、的確に切除する必要範囲のみを切除することができる。癌腫瘍の摘出手術では、癌細胞が患者の身体に残存すると再発の可能性が高まり好ましくないが、再発を恐れるあまり、過剰に組織を切除するのも患者の身体の負担が増大し好ましくない。そこで、必要範囲と判断される部分のみを摘出し、その後、摘出腫瘍が接していた領域の組織を微少量切り取り、本発明のpH測定装置を用いて癌細胞の有無を調べる、或いは、摘出腫瘍自体を被測定物質(サンプル)とし、その切除面に対してpH測定装置によりpHの測定を行い切除面の癌細胞の有無を調べる。いずれの場合も、癌細胞が検出された場合はさらなる切除が必要と判断し、癌細胞が検出されなかった場合は摘出が十分であったと判断することができる
また、放射線療法においても、放射線照射が必要な範囲を的確に認識して照射することができるため、放射線によりダメージを受ける正常細胞を極力少なくすることができる。
【0092】
上記したように、本実施形態の生体物質分析装置では、高精度にpHを測定することのできるpH測定装置を備えた構成としているので、癌化した部分等の患部の高精度なpH情報を、患部の位置情報とともに得ることが可能である。従って、本実施形態の生体物質分析装置によれば、放射線療法において、患部の状態に応じた的確な放射線の種類及び強度を選択することができるため、良好な治療効果を得ることができる。また、内視鏡的粘膜下層剥離術(ESD)を施術する場合においても、患部の範囲及び状態を特定することができるため、的確な部位を剥離して、患者への負担を最小限に抑えた治療を行うことができる。
【0093】
また、癌腫瘍の摘出の判断は手術中に短時間で行う必要がある。上記したように、上記実施形態のpH測定装置は、迅速な測定を行う事ができるため、癌治療の治療方針の決定に用いる分析装置としては、スループットが高く、好ましい。
【0094】
細胞または組織は個々で細胞環境にばらつきがある。その要因は、同じ正常細胞または癌細胞中における、細胞の活性状態やストレス状態、衰弱状態の違いなどが挙げられる。そのため、細胞または組織からの自家蛍光寿命もまた、その個々の環境に反映してばらついてしまう。
【0095】
実際の疾患部の測定においては、十分な臨床データから検量線を作成することが必要である。次に、測定したい部位の測定を測定領域を変えて繰り返し、より確からしいデータを取得することが必要である。このように測定することで、ばらつきが大きい細胞や組織においても、より精度の高いpH測定と臨床的判断をすることができる。
【0096】
一例として、担癌マウスにおける癌組織と正常組織の境界部のpH測定を行った。ここで、励起する自家蛍光物質はNADHとNADPHとし、励起光として、1ピコ秒パルス幅のチタンサファイアレーザのSHG光を使用し、NADHとNADPHの励起波長である370nmの光(還元型のみ励起される)となるように励起光の波長を調整し、417〜477nmの蛍光フィルターを用いて蛍光寿命の測定を行った。このとき、励起光の平均パワーは0.9mW、パルスエネルギーは12pJとし、癌組織と正常組織の境界部の所定の位置にレーザ光が照射され、レーザ光の焦点が癌組織と正常組織の境界部に合うようにxyzステージを調整した。
【0097】
検量線は十分な臨床データから作成したものである。癌組織、正常組織の別々の3領域をそれぞれ測定し、3つの値から蛍光寿命平均値を求め、検量線と比較したところ、癌細胞がpH7.1、正常細胞がpH7.2と求められた。しかし、今度は癌組織、正常組織の別々の10領域をそれぞれ測定し、10つの値から蛍光寿命平均値を求めたところ、癌細胞がpH6.8、正常細胞がpH7.3と求められた。pH差0.5は蛍光寿命によるpH分解能0.3〜0.4より大きな値である。このように、測定回数を増やすことで、より精度の高い測定かつ臨床的判断が可能となった。
【0098】
「設計変更」
以上、本発明によるpH測定装置、該pH測定装置を備えた異常領域検出装置、及び生体物質分析装置の好ましい実施の形態について説明したが、本発明は上記実施の形態に限定されるものではなく、発明の要旨を変更しない限りにおいて、種々変更することが可能である。
【0099】
被測定物質Dの病理学的性質の特定は、分析手段70を用いて行う構成について説明したが、pHと病理学的性質の異常度合いとの関係が明確となっている場合には、上記実施形態のpH測定装置及び異常領域検出装置のみによっても、生体物質の病理学的性質を特定することができる。従って、上記した生体物質分析装置において述べた治療効果は、上記実施形態のpH測定装置及び異常領域検出装置によっても得ることができる。
【実施例】
【0100】
以下に、本発明に係る実施例について説明する。
(実施例1)
図1に示される顕微鏡型のpH測定装置及び異常領域検出装置を用いて、培養したpH無調整のHeLa細胞のpHの測定を行った。図9に測定したHeLa細胞の蛍光強度画像(図9A)と蛍光寿命画像(図9B)を示す。同じ条件のサンプルに対し、測定領域を変えて3回測定した。3枚の画像全体の平均蛍光寿命は2.24nsecであった。従って、(1)式により、得られた蛍光寿命からpHを導出した結果、このHeLa細胞のpHは、6.6であると見積もることができた。
【産業上の利用可能性】
【0101】
本発明のpH測定方法、異常領域検出方法、及び生体物質分析方法、並びに各装置は、正常細胞と異常細胞(癌細胞等)の診断及び分離に好ましく用いることができる。
【符号の説明】
【0102】
1,4,7,10 pH測定装置
2,5,8,11 異常領域検出装置
3,6,9,12 生体物質分析装置
10 励起光発生手段
11 レーザ(光源)
20 励起光照射手段
21,31 対物レンズ(光学系)
21’,31’ 光ファイバ(バンドルファイバ)
200 照射用光ファイバ
300 受光用光ファイバ
30 受光手段
40 時間分解手段
50 検出手段
60 測定手段
70 分析手段
80 異常領域検出手段
81 表示手段
90,90’ ステージ
91,90’ 位置調節手段
100 内視鏡スコープ
101 鉗子口チャンネル
102 照明部
103 撮像部
L1 パルス励起光
Ls 蛍光スペクトル
Lf 蛍光
Tf 蛍光寿命
D 被測定物質(生体物質)
F ファイバプローブ
【特許請求の範囲】
【請求項1】
生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、前記生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、前記生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生させ、
該パルス励起光を前記生体物質の所定の位置に照射し、
該照射により励起された前記蛍光物質から生じる蛍光を含む光を受光し、
該受光した蛍光の強度を時間分解して前記蛍光の蛍光寿命を算出し、
該蛍光寿命から前記生体物質のpHを測定することを特徴とするpH測定方法。
【請求項2】
前記蛍光物質が、pH6.5〜7.5の範囲において、前記蛍光寿命が0.03ナノ秒以上変化するものであることを特徴とする請求項1に記載のpH測定方法。
【請求項3】
前記蛍光物質が、NADH、NADPH、及びFADからなる群より選ばれる少なくとも1種の蛍光物質であることを特徴とする請求項1又は2に記載のpH測定方法。
【請求項4】
前記生体物質が細胞質、ミトコンドリア、核であることを特徴とする請求項1〜3のいずれかに記載のpH測定方法。
【請求項5】
前記受光した蛍光を波長分解した蛍光スペクトルとした後、該蛍光スペクトルから波長毎に前記蛍光強度を時間分解して波長毎の前記蛍光の蛍光寿命を算出することを特徴とする請求項1〜4のいずれかに記載のpH測定方法。
【請求項6】
前記蛍光が、多光子励起により励起されるものであることを特徴とする請求項1〜5のいずれかに記載のpH測定方法。
【請求項7】
前記所定の位置が、複数の位置であることを特徴とする請求項1〜6のいずれかに記載のpH測定方法。
【請求項8】
前記所定の位置が、前記生体物質の所定領域に一様に分布された位置である請求項1〜7のいずれかに記載のpH測定方法により、前記所定の位置のpHを測定し、得られた前記所定の位置のpHに基づいて、前記所定領域の前記生体物質の異常領域を検出することを特徴とする検出方法。
【請求項9】
前記生体物質の異常領域を画像化して表示して検出することを特徴とする請求項8に記載の検出方法。
【請求項10】
請求項1〜7のいずれかに記載のpH測定方法により測定したpHに基づいて、前記生体物質の病理学的性質を特定することを特徴とする生体物質分析方法。
【請求項11】
請求項8又は9に記載の検出方法により前記異常領域を検出し、前記所定の領域の病理学的性質を特定することを特徴とする生体物質分析方法。
【請求項12】
前記病理学的性質が悪性腫瘍状態の有無であることを特徴とする請求項10又は11に記載の生体物質分析方法。
【請求項13】
生体物質中に含まれる生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、前記生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、前記生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生する励起光発生手段と、
該パルス励起光を前記生体物質の所定の位置に照射する励起光照射手段と、
前記パルス励起光が照射されることにより励起された前記蛍光物質から生じる蛍光を含む光を受光する受光手段と、
前記パルス励起光の照射と同期して前記蛍光を時間分解する時間分解手段と、
該時間分解された前記蛍光を検出する検出手段と、
該検出手段により検出された前記蛍光から該蛍光の蛍光寿命を算出し、該蛍光寿命に基づいて前記生体物質のpHを測定する測定手段とを備えたことを特徴とするpH測定装置。
【請求項14】
前記受光手段により受光した前記蛍光を分光して前記時間分解手段に波長分解された前記蛍光を出力する分光手段を更に備えたことを特徴とする請求項13に記載のpH測定装置。
【請求項15】
前記蛍光物質が、NADH、NADPH、及びFADからなる群より選ばれる少なくとも1種の蛍光物質であることを特徴とする請求項13又は14に記載のpH測定装置。
【請求項16】
前記生体物質が細胞質、ミトコンドリア、核であることを特徴とする請求項13〜15のいずれかに記載のpH測定装置。
【請求項17】
前記蛍光が、多光子励起により励起されるものであることを特徴とする請求項13〜16のいずれかに記載のpH測定装置。
【請求項18】
ピコ秒からフェムト秒レーザを前記励起光発生手段に備えたことを特徴とする請求項17に記載のpH測定装置。
【請求項19】
表面に前記生体物質を接触させて保持するステージであって、前記生体物質の任意の位置に前記パルス励起光を照射できるように3次元方向に可動なステージと、
該ステージを3次元方向の任意の位置に動かす位置調節手段とを更に備えたものであり、
前記励起光照射手段は、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備えたものであり、
前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えたものであることを特徴とする請求項13〜18のいずれかに記載のpH測定装置。
【請求項20】
表面に前記生体物質を接触させて保持するステージであって、前記生体物質の、少なくとも前記パルス励起光の光軸方向の任意の位置に該パルス励起光を照射できるように可動なステージと、
該ステージを少なくとも光軸方向の任意の位置に動かす第1の位置調節手段と、
前記生体物質の、少なくとも前記パルス励起光の光軸に垂直な面内方向の任意の位置に該パルス励起光を照射できるように前記励起光照射手段を動かす第2の位置調節手段とを更に備えたものであり、
前記励起光照射手段は、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備えたものであり、
前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えたものであることを特徴とする請求項13〜19のいずれかに記載のpH測定装置。
【請求項21】
前記生体物質の3次元方向の任意の位置に、前記パルス励起光を照射できるように前記励起光照射手段を動かす位置調節手段を更に備え、
前記励起光照射手段は、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備えたものであり、
前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えたものであることを特徴とする請求項13〜19のいずれかに記載のpH測定装置。
【請求項22】
前記励起光照射手段は、前記パルス励起光を前記生体物質に照射する少なくとも1本の照射用光ファイバを備えたものであり、前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該蛍光を前記時間分解手段13〜21のいずれかに記載のpH測定装置。
【請求項23】
前記少なくとも1本の照射用光ファイバと前記少なくとも1本の受光用光ファイバとが、1本のバンドルファイバを形成していることを特徴とする請求項22に記載のpH測定装置。
【請求項24】
前記バンドルファイバは、略中心部に配された1本の前記照射用光ファイバの外周を、複数本の前記受光用光ファイバで囲むように束ねられたものであることを特徴とする請求項23に記載のpH測定装置。
【請求項25】
前記バンドルファイバが体腔内に挿入される略円筒形の長尺のシース内に備えられたファイバプローブであることを特徴とする請求項23又は24に記載のpH測定装置。
【請求項26】
前記バンドルファイバが、体腔内の所定の位置に照明光を照射する照明部と、前記所定の位置で反射された反射光を撮像する撮像部と、鉗子チャンネルとを備えた内視鏡スコープの前記鉗子チャンネルに備えられたものであることを特徴とする請求項23又は24に記載のpH測定装置。
【請求項27】
前記ファイバプローブが、体腔内所定の位置に照明光を照射する照明部と、前記所定の位置で反射された反射光を撮像する撮像部と、鉗子チャンネルとを備えた内視鏡スコープの前記鉗子チャンネルに、前記所定の位置側の前記鉗子チャンネルの出口から突出して備えられたことを特徴とする請求項25に記載のpH測定装置。
【請求項28】
前記所定の位置が、複数の位置であることを特徴とする請求項13〜27のいずれかに記載のpH測定装置。
【請求項29】
前記複数の所定の位置が、前記生体物質の所定領域に一様に分布された位置である請求項28に記載のpH測定装置と、
該pH測定装置により測定された前記複数の位置の前記複数の所定の位置のpHに基づいて、前記所定領域の異常領域を検出する検出手段とを備えたことを特徴とする検出装置。
【請求項30】
前記検出手段において検出された前記異常領域を画像化して表示する表示装置を更に備えたことを特徴とする請求項29に記載の検出装置。
【請求項31】
請求項13〜28のいずれかに記載の測定装置と、
該pH測定装置により測定したpHに基づいて、前記生体物質の病理学的性質を特定する分析手段とを有することを特徴とする生体物質分析装置。
【請求項32】
前記病理学的性質が悪性腫瘍状態の有無であることを特徴とする請求項31に記載の生体物質分析装置。
【請求項33】
前記検出手段と、
該低検出手段により検出された前記領域の異常領域の病理学的性質を特定する分析手段とを備えたことを特徴とする請求項31又は32に記載の生体物質分析装置。
【請求項1】
生体物質中に含まれる、生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、前記生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、前記生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生させ、
該パルス励起光を前記生体物質の所定の位置に照射し、
該照射により励起された前記蛍光物質から生じる蛍光を含む光を受光し、
該受光した蛍光の強度を時間分解して前記蛍光の蛍光寿命を算出し、
該蛍光寿命から前記生体物質のpHを測定することを特徴とするpH測定方法。
【請求項2】
前記蛍光物質が、pH6.5〜7.5の範囲において、前記蛍光寿命が0.03ナノ秒以上変化するものであることを特徴とする請求項1に記載のpH測定方法。
【請求項3】
前記蛍光物質が、NADH、NADPH、及びFADからなる群より選ばれる少なくとも1種の蛍光物質であることを特徴とする請求項1又は2に記載のpH測定方法。
【請求項4】
前記生体物質が細胞質、ミトコンドリア、核であることを特徴とする請求項1〜3のいずれかに記載のpH測定方法。
【請求項5】
前記受光した蛍光を波長分解した蛍光スペクトルとした後、該蛍光スペクトルから波長毎に前記蛍光強度を時間分解して波長毎の前記蛍光の蛍光寿命を算出することを特徴とする請求項1〜4のいずれかに記載のpH測定方法。
【請求項6】
前記蛍光が、多光子励起により励起されるものであることを特徴とする請求項1〜5のいずれかに記載のpH測定方法。
【請求項7】
前記所定の位置が、複数の位置であることを特徴とする請求項1〜6のいずれかに記載のpH測定方法。
【請求項8】
前記所定の位置が、前記生体物質の所定領域に一様に分布された位置である請求項1〜7のいずれかに記載のpH測定方法により、前記所定の位置のpHを測定し、得られた前記所定の位置のpHに基づいて、前記所定領域の前記生体物質の異常領域を検出することを特徴とする検出方法。
【請求項9】
前記生体物質の異常領域を画像化して表示して検出することを特徴とする請求項8に記載の検出方法。
【請求項10】
請求項1〜7のいずれかに記載のpH測定方法により測定したpHに基づいて、前記生体物質の病理学的性質を特定することを特徴とする生体物質分析方法。
【請求項11】
請求項8又は9に記載の検出方法により前記異常領域を検出し、前記所定の領域の病理学的性質を特定することを特徴とする生体物質分析方法。
【請求項12】
前記病理学的性質が悪性腫瘍状態の有無であることを特徴とする請求項10又は11に記載の生体物質分析方法。
【請求項13】
生体物質中に含まれる生体内の酸化還元反応において補酵素として働く所定の蛍光物質を励起可能な波長を含み、前記生体物質に組織破壊又は細胞破壊を引き起こさず、且つ、前記生体物質内のpHを実質的に変化させない強度を有するパルス励起光を発生する励起光発生手段と、
該パルス励起光を前記生体物質の所定の位置に照射する励起光照射手段と、
前記パルス励起光が照射されることにより励起された前記蛍光物質から生じる蛍光を含む光を受光する受光手段と、
前記パルス励起光の照射と同期して前記蛍光を時間分解する時間分解手段と、
該時間分解された前記蛍光を検出する検出手段と、
該検出手段により検出された前記蛍光から該蛍光の蛍光寿命を算出し、該蛍光寿命に基づいて前記生体物質のpHを測定する測定手段とを備えたことを特徴とするpH測定装置。
【請求項14】
前記受光手段により受光した前記蛍光を分光して前記時間分解手段に波長分解された前記蛍光を出力する分光手段を更に備えたことを特徴とする請求項13に記載のpH測定装置。
【請求項15】
前記蛍光物質が、NADH、NADPH、及びFADからなる群より選ばれる少なくとも1種の蛍光物質であることを特徴とする請求項13又は14に記載のpH測定装置。
【請求項16】
前記生体物質が細胞質、ミトコンドリア、核であることを特徴とする請求項13〜15のいずれかに記載のpH測定装置。
【請求項17】
前記蛍光が、多光子励起により励起されるものであることを特徴とする請求項13〜16のいずれかに記載のpH測定装置。
【請求項18】
ピコ秒からフェムト秒レーザを前記励起光発生手段に備えたことを特徴とする請求項17に記載のpH測定装置。
【請求項19】
表面に前記生体物質を接触させて保持するステージであって、前記生体物質の任意の位置に前記パルス励起光を照射できるように3次元方向に可動なステージと、
該ステージを3次元方向の任意の位置に動かす位置調節手段とを更に備えたものであり、
前記励起光照射手段は、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備えたものであり、
前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えたものであることを特徴とする請求項13〜18のいずれかに記載のpH測定装置。
【請求項20】
表面に前記生体物質を接触させて保持するステージであって、前記生体物質の、少なくとも前記パルス励起光の光軸方向の任意の位置に該パルス励起光を照射できるように可動なステージと、
該ステージを少なくとも光軸方向の任意の位置に動かす第1の位置調節手段と、
前記生体物質の、少なくとも前記パルス励起光の光軸に垂直な面内方向の任意の位置に該パルス励起光を照射できるように前記励起光照射手段を動かす第2の位置調節手段とを更に備えたものであり、
前記励起光照射手段は、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備えたものであり、
前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えたものであることを特徴とする請求項13〜19のいずれかに記載のpH測定装置。
【請求項21】
前記生体物質の3次元方向の任意の位置に、前記パルス励起光を照射できるように前記励起光照射手段を動かす位置調節手段を更に備え、
前記励起光照射手段は、前記パルス励起光を受光して、該パルス励起光を前記生体物質に照射する光学系を備えたものであり、
前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該光を前記時間分解手段に導く光学系を備えたものであることを特徴とする請求項13〜19のいずれかに記載のpH測定装置。
【請求項22】
前記励起光照射手段は、前記パルス励起光を前記生体物質に照射する少なくとも1本の照射用光ファイバを備えたものであり、前記受光手段は、前記照射により励起された前記蛍光物質から生じる蛍光を含む光を受光して該蛍光を前記時間分解手段13〜21のいずれかに記載のpH測定装置。
【請求項23】
前記少なくとも1本の照射用光ファイバと前記少なくとも1本の受光用光ファイバとが、1本のバンドルファイバを形成していることを特徴とする請求項22に記載のpH測定装置。
【請求項24】
前記バンドルファイバは、略中心部に配された1本の前記照射用光ファイバの外周を、複数本の前記受光用光ファイバで囲むように束ねられたものであることを特徴とする請求項23に記載のpH測定装置。
【請求項25】
前記バンドルファイバが体腔内に挿入される略円筒形の長尺のシース内に備えられたファイバプローブであることを特徴とする請求項23又は24に記載のpH測定装置。
【請求項26】
前記バンドルファイバが、体腔内の所定の位置に照明光を照射する照明部と、前記所定の位置で反射された反射光を撮像する撮像部と、鉗子チャンネルとを備えた内視鏡スコープの前記鉗子チャンネルに備えられたものであることを特徴とする請求項23又は24に記載のpH測定装置。
【請求項27】
前記ファイバプローブが、体腔内所定の位置に照明光を照射する照明部と、前記所定の位置で反射された反射光を撮像する撮像部と、鉗子チャンネルとを備えた内視鏡スコープの前記鉗子チャンネルに、前記所定の位置側の前記鉗子チャンネルの出口から突出して備えられたことを特徴とする請求項25に記載のpH測定装置。
【請求項28】
前記所定の位置が、複数の位置であることを特徴とする請求項13〜27のいずれかに記載のpH測定装置。
【請求項29】
前記複数の所定の位置が、前記生体物質の所定領域に一様に分布された位置である請求項28に記載のpH測定装置と、
該pH測定装置により測定された前記複数の位置の前記複数の所定の位置のpHに基づいて、前記所定領域の異常領域を検出する検出手段とを備えたことを特徴とする検出装置。
【請求項30】
前記検出手段において検出された前記異常領域を画像化して表示する表示装置を更に備えたことを特徴とする請求項29に記載の検出装置。
【請求項31】
請求項13〜28のいずれかに記載の測定装置と、
該pH測定装置により測定したpHに基づいて、前記生体物質の病理学的性質を特定する分析手段とを有することを特徴とする生体物質分析装置。
【請求項32】
前記病理学的性質が悪性腫瘍状態の有無であることを特徴とする請求項31に記載の生体物質分析装置。
【請求項33】
前記検出手段と、
該低検出手段により検出された前記領域の異常領域の病理学的性質を特定する分析手段とを備えたことを特徴とする請求項31又は32に記載の生体物質分析装置。
【図1】


【図2】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図9A】


【図9B】




【図2】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図9A】


【図9B】


【公開番号】特開2011−185843(P2011−185843A)
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願番号】特願2010−53215(P2010−53215)
【出願日】平成22年3月10日(2010.3.10)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【出願人】(504173471)国立大学法人北海道大学 (971)
【Fターム(参考)】
【公開日】平成23年9月22日(2011.9.22)
【国際特許分類】
【出願日】平成22年3月10日(2010.3.10)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【出願人】(504173471)国立大学法人北海道大学 (971)
【Fターム(参考)】
[ Back to top ]

