蛍光標識剤を含むスクリーニング用キット及びスクリーニング方法
【課題】本発明は、特定のタンパク質又は細胞と結合若しくは相互作用しうるプローブ分子を候補化合物群からスクリーニングするに際し、生体類似の溶液環境で実施可能なスクリーニング用キットを提供することを課題とし、更には生体類似の溶液環境で実施可能なスクリーニング方法を提供することを課題とする。
【解決手段】蛍光波長及び/又は励起波長が異なる複数種の蛍光標識剤を含むキットによる。さらには、該キットを用いて、以下の工程を含む方法による。1)候補化合物に蛍光標識剤を付加する工程;2)特定のタンパク質又は細胞と、上記1)の蛍光標識剤を付加した対象化合物を水溶液中で混合する工程;3)上記2)で混合した物質を分画する工程;4)上記3)で得た、各分画について、2次元蛍光スペクトルを測定する工程;5)2次元蛍光スペクトルの測定結果を解析する工程。
【解決手段】蛍光波長及び/又は励起波長が異なる複数種の蛍光標識剤を含むキットによる。さらには、該キットを用いて、以下の工程を含む方法による。1)候補化合物に蛍光標識剤を付加する工程;2)特定のタンパク質又は細胞と、上記1)の蛍光標識剤を付加した対象化合物を水溶液中で混合する工程;3)上記2)で混合した物質を分画する工程;4)上記3)で得た、各分画について、2次元蛍光スペクトルを測定する工程;5)2次元蛍光スペクトルの測定結果を解析する工程。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、特定の細胞や特定のタンパク質に結合若しくは相互作用しうるプローブ分子を、候補化合物群からスクリーニングするためのスクリーニング用キットに関し、更には該スクリーニング用キットを用いたスクリーニング方法に関する。
【背景技術】
【0002】
薬剤探索方法としては、多数の化合物ライブラリー中から特定のプローブ分子を選択する方法が有用である。従来、これらの方法には例えば、リボソームセレクション(非特許文献1〜3参照)、特開2004−506898公報(特許文献1)や特開2007−89490(特許文献2)にあるようなファージディスプレイ、特開平9−101306(特許文献3)のような1ビーズ−1ペプチドライブラリー、その他にも特開2002−107364(特許文献4)のような基板や特開2004−537975(特許文献5)にあるような細胞をライブラリーの担体として利用したものなどが使われている。
【0003】
従来技術では、RNA共存下、基板上、あるいは固体ビーズ上などで標的タンパク質や細胞と結合する分子を探索していた。これらの方法では、標的タンパク質とプローブ分子との結合を、RNA共存下、基板上又は固体ビーズ上などで検出しなければならなかった。そのためにこの方法で見出された分子は、それらを基板、RNA又はビーズから切り離すと標的タンパク質には結合しなくなることが多かった。プローブ分子のスクリーニングを生体類似の水溶液環境で行うことができれば、この問題は解決する。しかし水溶液中で多くの成分を同時に定量する方法が今まで見出されていなかったために、これは不可能であった。
【非特許文献1】L.C. Mattheakis et. al. Proc. Natl. Acad. Sci. USA, 91, 9022-9026 (1994).
【非特許文献2】J. Hanes et. al. A. Proc. Natl. Acad. Sci. USA, 94, 4939-4942 (1997).
【非特許文献3】J. Hanes et. al. Methods Enzymol., 328, 404-430 (2000).
【特許文献1】特開2004−506898号公報
【特許文献2】特開2007−89490号公報
【特許文献3】特開平9−101306号公報
【特許文献4】特開2002−107364号公報
【特許文献5】特開2004−537975号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、特定のタンパク質又は細胞と結合若しくは相互作用しうるプローブ分子を候補化合物群からスクリーニングするに際し、生体類似の溶液環境で実施可能なスクリーニング用キットを提供することを課題とし、更には生体類似の溶液環境で実施可能なスクリーニング方法を提供することを課題とする。
【課題を解決するための手段】
【0005】
蛍光波長及び/又は励起波長が異なる複数種の蛍光標識用非天然アミノ酸を含むキットによる。さらには、該キットを用いて、以下の工程を含む方法による。1)候補化合物に蛍光標識用非天然アミノ酸ユニットを付加する工程;2)特定のタンパク質又は細胞と、上記1)の蛍光標識用非天然アミノ酸ユニットを付加した対象化合物を水溶液中で混合する工程;3)上記2)で混合した物質を分画する工程;4)上記3)で得た、各分画について、2次元蛍光スペクトルを測定する工程;5)2次元蛍光スペクトルの測定結果を解析する工程。
【0006】
すなわち本発明は以下よりなる。
1.蛍光波長及び/又は励起波長が各々異なる少なくとも3種類の蛍光標識剤を構成要素とし、2次元蛍光スペクトル解析を用いて、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうる物質をスクリーニングするためのスクリーニング用キット。
2.蛍光標識剤が蛍光標識非天然アミノ酸である前項1に記載のスクリーニング用キット。
3.蛍光標識剤の両端に水溶性物質が付加されている構造からなる蛍光標識用ユニットを含む前項1又は2に記載のスクリーニング用キット。
4.蛍光標識用ユニットが、蛍光標識用非天然アミノ酸ユニットであり、蛍光標識非天然アミノ酸の両端に水溶性アミノ酸が付加されているペプチド配列を含む前項3に記載のスクリーニング用キット。
5.蛍光標識用非天然アミノ酸ユニットが、蛍光標識非天然アミノ酸の両端に水溶性アミノ酸が付加されているペプチド配列と、そのN側、C側または両側にさらに水溶性リンカー化合物を含むことを特徴とする前項4に記載のスクリーニング用キット。
6.前項1〜5のいずれか1に記載のキットを用いて、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうる物質をスクリーニングすることを特徴とするスクリーニング方法。
7.少なくとも以下の工程を含む、前項6に記載のスクリーニング方法:
1)候補化合物に蛍光標識剤を付加する工程;
2)特定のタンパク質又は細胞と、上記1)の蛍光標識剤を付加した対象化合物を水溶液中で混合する工程;
3)上記2)で混合した物質を分画する工程;
4)上記3)で得た、各分画について、2次元蛍光スペクトルを測定する工程;
5)2次元蛍光スペクトルの測定結果を解析する工程。
8.候補化合物が、アミノ酸残基数が3〜50の長さからなるペプチドである、前項6又は7に記載のスクリーニング方法。
【発明の効果】
【0007】
本発明のスクリーニング用キットを用いて、特定のタンパク質又は細胞と結合若しくは相互作用しうるプローブ分子を候補化合物群からのスクリーニングを行うに際し、(1)スクリーニングが水溶液中で行われること、(2)一挙に20種類、あるいは位置スキャン法を適用すれば1013種類もの混合物から適切なプローブ分子を見出すことが可能であること、(3)操作が簡単で、迅速であること、の優れた効果を有する。本発明のスクリーニング方法は、生体類似の溶液環境で実施可能であり、化合物ライブラリーからプローブ分子を見出す最も簡便な方法であるといえる。
【発明を実施するための最良の形態】
【0008】
本発明のスクリーニング用キットには、複数種(多成分)の蛍光標識剤が含まれる。蛍光標識剤は、自体公知のものであっても良いし、今後開発される新たなものであっても良いが、複数種の蛍光標識剤各々について、蛍光波長及び/又は励起波長が異なるものであればよい。スクリーニング用キットに含まれる蛍光標識剤の種類は、多ければ多いほど多様なスクリーニングが可能であるが、少なくとも3種類以上であればよく、好ましくは6〜20種類である。なお、本発明のスクリーニング用キットを用いて、候補化合物に各々異なる種類の蛍光標識剤を付加し、多成分蛍光標識化合物ライブラリーを作製することができる。従って、本発明のスクリーニング用キットは、多成分蛍光標識化合物ライブラリー作製用キットとしての意義を有する。
【0009】
該蛍光標識剤は、蛍光検出部としての発色団を含み、該発色団はベンゼン環又はヘテロ環を有する。該発色団に含まれるヘテロ環の数は特に制限されるものではないが、例えば2〜6個、好ましくは2〜4個、更に好ましくは3個である。
【0010】
蛍光標識剤は、蛍光標識した非天然アミノ酸であることが好ましい。蛍光標識剤が、蛍光標識非天然アミノ酸である場合、いずれのアミノ酸も、そのN末端にはFmoc基(9-フルオレニルメトキシカルボニル基)が1つ修飾されていることが好ましい。具体的には、例えば以下に示すいずれかの蛍光標識用非天然アミノ酸から選択される。また、図1に蛍光標識用非天然アミノ酸の構造を示した。
【0011】
1 :Ant = 3-(2-アンスリル)アラニン
2 :Pyr = 3-(1-ピレニル)アラニン
3 :Acd = 3-(9-オキソ-9,10-ジヒドロ-アクリジン-2-イル)アラニン
4 :Bacd = 3-(12-オキソ-5,12-ジヒドロ-ベンゾ[b]アクリジン-2-イル)アラニン
5 :EDANS = γ[β-(5-ナフチルスルホン酸)-エチレンジアミン]グルタミン酸
6 :Cmr = 3-(7-メトキシ-クマリン-4-イル)アラニン
7 :FAM = N-ε-(フルオルセイン-5,6-イル)カルボニル-リシン
8 :RhoB = N-ε-(テトラエチルローダミン-5,6-イル)チオウレイド-リシン
9 :HOMCmr = N-ε-(7-ヒドロキシ-4-メチル-クマリン-3-イル)アセチル-リシン
10:DMACmr = N-ε-(7-ジメチルアミノ-クマリン-4-イル)アセチル-リシン
11:DEACmr = N-ε-(7-ジエチルアミノ-クマリン-3-イル)カルボニル-リシン
12:DMAMCmr = N-ε-(7-ジメチルアミノ-4-メチル-クマリン-3-イル)チオウレイド-リシン
13:MeONaph = 3-(6-メトキシ-ナフタレン-2-イル)アラニン
14:DBD = N-ε-(7-ジメチルスルファモイル-ベンゾ[1,2,5]オキサジアゾル-4-イル)チオウレイド-リシン
15:DMANaph = N-ε-(4-ジメチルアミノ-ナフタレン-1-イル)チオウレイド-リシン
16:HOCmr = N-ε-(7-ヒドロキシ-クマリン-3-イル)カルボニル-リシン
17:MeOCmr = N-ε-(7-メトキシ-クマリン-3-イル)カルボニル-リシン
18:TAMRA = N-ε-(テトラメチルローダミン-5,6-イル)カルボニル-リシン
19:Acr = 3-(1-アクリジン-9-イル-2,5-ジオキソ-ピロリジン-3-イル)システイン
20:Bn3Imd = N-ε-(4,5-ジフェニル-1H-イミダゾール-2-イル)ベンゾイル-リシン
21:Nap = 3-(ナフタレン-2-イル)アラニン
22:Phen = 3-(フェナンスレン-9-イル)アラニン
23:PheNap = 3-(4-ナフタレン-2-イル-フェニル)アラニン
24:Psl = N-ε-[4-(7-オキソ-7H-フロ[3,2-γ]クロメン-9-イルオキシ)]ブチリル-リシン
25:Dns = N-ε-(5-ジメチルアミノ-ナフタレン-1-スルホニル)-リシン
26:DMOBcC = N,N'-δ-[tert-ブトキシカルボニル-(6,7-ジメトキシ-クマリン-4-イルメチル)]-オルニチン
27:DMOAcC = N,N'-δ-[アセチル-(6,7-ジメトキシ-クマリン-4-イルメチル)]-オルニチン
28:CDOCA = N-δ-[2-(6-オキソ-6H-フロ[1,3-γ]クロメン-8-イル)]アセチル-リシン
29:MOCA = N-ε-(7-メトキシ-クマリン-4-イル)アセチル-リシン
30:AcrMe = 3-(アクリジン-9-イル)アラニン
31:AcrAc = N,N'-δ-(アセチル-アクリジン-9-イルメチル)-オルニチン
32:AntSO = N-ε-(アンスラセン-2-スルホニル)-リシン
33:Qui = 3-(キノリン-2-イル)アラニン
34:NDACN = N-ε-(1-シアノ-ベンゾ[φ]イソインドール-2-イル)-リシン
35:C343 = N -δ-(10-オキソ-2,3,5,6-テトラヒドロ-1H,4H,10H-11-オキサ-3 -アザ-ベンゾ[de]アンスラセン-9-カルボニル)-オルニチン
【0012】
本発明における蛍光標識剤は、特定の細胞や特定のタンパク質に対して、該蛍光標識剤の非特異的結合を防ぐように、蛍光標識剤に水溶性物質を付加した蛍光標識用ユニットであってもよい。蛍光標識用ユニットとしては、上述の蛍光標識非天然アミノ酸を含むものが好適であり、水溶性物質としては、水溶性アミノ酸であることが好適である。具体的には、蛍光標識非天然アミノ酸の両端に水溶性アミノ酸を結合していても良い。水溶性アミノ酸の例として、グルタミン酸、アスパラギン酸、リジン、アルギニンなどが挙げられるが、より好適にはグルタミン酸である。さらには、蛍光標識用非天然アミノ酸ユニットを候補化合物に効果的に付加するために、水溶性のリンカー化合物を含んでいてもよい。水溶性のリンカー化合物としては、水溶性であり、蛍光標識用非天然アミノ酸ユニットと候補化合物を結合しうる構造であれば良く、特に制限されないが、例えば-NH-(CH2CH2O)6-(CH2)2-CO-が挙げられる。
【0013】
本発明のスクリーニング用キットに含まれる構成物は、上述の蛍光標識剤の他、スクリーニングに必要な試薬や容器などを含んでいても良い。さらには、スクリーニングの解析に必要な解析ソフトを含んでいても良く、解析用機器を含んでいても良い。上述の試薬、容器、ソフト及び機器等は、本発明のスクリーニングに利用可能であれば、自体公知の既存のものであっても良いし、今後開発されるより好適なものであってもよい。
【0014】
上述のスクリーニング用キットを用いて、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうる物質をスクリーニングすることができる。そのスクリーニング方法は、少なくとも以下の工程を含む。
【0015】
1)候補化合物に蛍光標識剤を付加する工程;
2)特定のタンパク質又は細胞と、上記1)の蛍光標識剤を付加した対象化合物を水溶液中で混合する工程;
3)上記2)で混合した物質を分画する工程;
4)上記3)で得た、各分画について、2次元蛍光スペクトルを測定する工程;
5)2次元蛍光スペクトルの測定結果を解析する工程。
【0016】
本発明において、候補化合物に各々異なる種類の蛍光標識剤を付加したものを、蛍光標識化合物ライブラリーとすることができる。蛍光標識化合物ライブラリーは、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうるプローブ機能を有する化合物をスクリーニングするために作製される。本発明において、該蛍光標識化合物ライブラリーをスクリーニング用キットに含めてもよい。
【0017】
前記蛍光標識化合物ライブラリーを構成する候補化合物は、カルボン酸若しくはアミノ基と結合することのできる化合物を好適に用いることができる。このような化合物としては、例えばペプチド、タンパク質、糖、DNA、RNA、低分子有機化合物、脂質及び/又は高分子材料等が例示され、好適にはペプチドを挙げることができる。
【0018】
前記候補化合物にペプチドが含まれる場合、ペプチドを構成するアミノ酸の残基数は、特定のタンパク質又は細胞と結合若しくは相互作用し、プローブ機能を有する長さであれば良く、特に制限されないが、例えば6〜50個、好ましくは8〜20個、さらに好ましくは8個程度が挙げられる。
【0019】
候補化合物と各々異なる種類の蛍光標識剤の組合せは、スクリーニングの目的に応じて適宜決定することができる。例えば、複数回のスクリーニングを行う場合に、各々のスクリーニングの目的、例えば類似するペプチド化合物やDNA、RNAの場合、変異するアミノ酸若しくは核酸の位置や、配列の特徴等、あるいは低分子化合物の場合は構造の特徴点等に応じて、異なる種類の蛍光標識剤を付加することができる。
【0020】
候補化合物に蛍光標識剤を付加する方法は、特に限定されず、自体公知の方法を適用することができる。例えば、蛍光標識用非天然アミノ酸ユニットを候補化合物であるペプチドに付加する場合は、Fmocペプチド固相合成法によることも可能であるし、その他の一般的な合成方法によることも可能である。
【0021】
複数の蛍光標識剤を各々付加した蛍光標識化合物群、すなわち多成分蛍光標識化合物ライブラリーと、特定のタンパク質又は細胞を水溶液中で混合する。ここにおいて、特定のタンパク質又は細胞は特に限定されず、候補化合物の目的用途や必要に応じて適宜決定される。また、混合のために用いる水溶液は、リン酸緩衝液やトリス緩衝液など一般的に用いられる溶液を用いることができる。
【0022】
また、特定のタンパク質又は細胞は、蛍光標識を行わなくともスクリーニング操作上問題ないが、より正確に検出するために部分的に蛍光標識を行っても良い。標識しうる蛍光物質は特に限定されないが、例えばフルオレセイン、テトラメチルローダミンなどを用いることができる。
【0023】
前記多成分蛍光標識化合物ライブラリーから、特定のタンパク質及び/又は特定の細胞と結合若しくは相互作用しうるプローブ機能を有する物質を検出する方法として、蛍光スペクトルを利用することができるが、情報量の多さの観点から、2次元蛍光スペクトルを用いて測定するのがより好適である。具体的には、多成分蛍光標識化合物ライブラリーと特定のタンパク質又は細胞を混合した水溶液について、通常の方法で各種励起波長と蛍光波長を測定することができる。
【0024】
2次元蛍光スペクトルの解析のために、多成分蛍光標識化合物ライブラリーの各標識化合物及び化合物と結合していない各蛍光標識用非天然アミノ酸ユニットについて、予め2次元蛍光スペクトルを測定しておくことが必要である。蛍光標識化合物ライブラリー中の各候補化合物に関する2次元蛍光スペクトルの解析は、自体公知の方法により解析することができる。例えば最小二乗法や多変量解析法の原理を利用した解析用ソフトを用いて解析することができる。
【0025】
特定のタンパク質及び/又は特定の細胞と結合若しくは相互作用しうるプローブ分子を検出するために、2次元蛍光スペクトルの測定前に、特定のタンパク質及び/又は特定の細胞と特定のタンパク質及び/又は特定の細胞に結合した多成分蛍光標識化合物ライブラリーを分画することが必要である。該分画する方法は特に限定されないが、物理化学的性質や免疫学的性質を利用したものが挙げられる。具体的には、例えばゲル濾過、HPLC、疎水性クロマトグラフィー、イオン交換クロマトグラフィー、電気泳動、蛍光顕微鏡等が例示される。各々分画した画分について、2次元蛍光スペクトルを測定し、通常の方法に従って解析することができる。例えばゲル濾過クロマトグラフィーにより分画した各試料の測定結果について、特定のタンパク質及び/又は特定の細胞から得られるピークから最も近いピークを有する画分に含まれる候補化合物が、特定のタンパク質及び/又は特定の細胞と結合若しくは相互作用しうるプローブ分子であると考えられる。
【実施例】
【0026】
以下、本発明を更に詳しく説明するため実施例を挙げる。これらの実施例は、単なる例示であり、本発明を限定するものではない。
【0027】
(実施例1)種類の異なる蛍光標識用非天然アミノ酸を含む多成分蛍光標識化合物ライブラリーの合成
【0028】
本実施例における多成分蛍光標識化合物ライブラリーのもととなる化合物、すなわちペプチド群は、いずれもFmocペプチド固相合成法により得られた。Fmocアミノ酸モノマー及びFmoc蛍光アミノ酸、ペプチド合成に必要な溶媒とその他の試薬類はいずれも渡辺化学工業より購入した。FmocのO(6)リンカーはNeo MPS社より購入した。
【0029】
具体的には、合成は以下のように行なった。合成にはFmoc-NH-SAL-PEG-resin の樹脂を用い、該樹脂を膨潤させるためジクロロメタン/ジメチルホルムアミド(DMF) 混合溶媒で室温3時間撹拌した。樹脂をDMF溶液で洗浄後、20%ピペリジンを含むDMF溶液で40℃にて10分間撹拌し、その後DMF溶液で洗浄した(この操作を以下「脱保護」と表記する)。
【0030】
次に、目的ペプチドの配列を作るのに対応するFmocアミノ酸、HATU(O-(ベンゾトリアゾール-1-イル)-N,N,N',N'-テトラメチルウロニウムヘキサフルオロリン酸塩)、及びDIPEA(N,N-ジイソプロピルエチルアミン)をDMF溶液に溶解した後、上記膨潤させた樹脂に加えた。40℃にて60分間撹拌した後、DMF溶液で洗浄した(この操作を以下「カップリング」と表記する)。
【0031】
続いて、5%無水酢酸及び6%ルチジンを含むDMF溶液で40℃にて5分間撹拌した後、DMF溶液で洗浄した(この操作を以下「キャッピング」と表記する)。
【0032】
樹脂表面上に、目的の配列のペプチドが伸長するまで、脱保護、カップリング、キャッピングの操作を繰り返した。最後のアミノ酸のFmoc基を脱保護した後、樹脂にトリフルオロ酢酸/水/トリイソプロピルシラン(= 95/2.5/2.5 v/v/v)を加えて、室温にて60分間撹拌した。これにより樹脂から切り出された目的のペプチドの溶液はジエチルエーテルを加えることで沈殿物を得た。これらのペプチドはメタノール溶液として冷凍庫に保管した。
【0033】
本実施例では6種類のペプチドを作製した。合成したペプチド群の構造を以下に示す。
Bacd-ペプチド :H-E-Bacd-E-O(6)-DYKADDDK-NH2(配列番号1)
Cmr-ペプチド :H-E-Cmr-E-O(6)-DYDKDDDK-NH2(配列番号2)
Pyr-ペプチド :H-E-Pyr-E-O(6)-DYKEEDDK-NH2(配列番号3)
EDANS-ペプチド:H-E-EDANS-E-O(6)-DYDDDDDK-NH2(配列番号4)
Ant-ペプチド :H-E-Ant-E-O(6)-DYAAADDK-NH2(配列番号5)
Acd-ペプチド :H-E-Acd-E-O(6)-DYKDDDDK-NH2(配列番号6)
【0034】
E、D、Y、K、及びAは一文字表記法によるアミノ酸ユニットを示す。O(6)の化学構造は-NH-(CH2CH2O)6-(CH2)2-CO-である。例えばE-Bacd-E-O(6)のように、グルタミン酸(E)及びO(6)を付加した非天然アミノ酸は、蛍光標識用非天然アミノ酸ユニットを示しており、Bacd、Cmr、Pyr、EDANS、Ant、及びAcdはいずれも蛍光標識用非天然アミノ酸であり、それぞれ3-(12-オキソ-5,12-ジヒドロ-ベンゾ[b]アクリジン-2-イル)アラニン、3-(7-メトキシ-クマリン-4-イル)アラニン、3-(1-ピレニル)アラニン、γ[β-(5-ナフチルスルホン酸)-エチレンジアミン]グルタミン酸、3-(2-アンスリル)アラニン、及び3-(9-オキソ-9,10-ジヒドロ-アクリジン-2-イル)アラニンを示している。上記化合物内の左端のH及び右端のNH2はそれぞれ化合物のN末端がフリーアミンであること、C末端が第一アミドであることを示している。本実施例及び以降の実施例において、候補化合物に該当する部分を、成分ペプチドと呼ぶ。
【0035】
上記のうち、Acd-ペプチド中の成分ペプチドのアミノ酸配列はFLAGペプチドの配列と同じである。これ以外の5種類の成分ペプチドはいずれもFLAGペプチドの配列中、1〜3個のアミノ酸配列が異なる。蛍光標識用非天然アミノ酸の両端のグルタミン酸は、蛍光標識用非天然アミノ酸ユニットにより減少すると予想される水溶性を獲得するのと同時に、立体障害による蛍光標識用非天然アミノ酸の非特異的吸着を防ぐ役割がある。
【0036】
(実施例2)多成分蛍光標識化合物ライブラリー中の各成分ペプチドの2次元蛍光スペクトルの測定及び自作の最小二乗法をもちいた解析ソフトウェアによる成分解析
【0037】
実施例1で作製された多成分蛍光標識化合物ライブラリーの溶液中の各成分ペプチドの同定、定量を行うために、はじめに各成分ペプチドの2次元蛍光スペクトルを測定した。Bacd-ペプチド、Cmr-ペプチド、Pyr-ペプチド、EDANS-ペプチド、Ant-ペプチド、及びAcd-ペプチドを含むメタノール溶液をHEPES緩衝溶液(pH=7.4)/メタノール(1/1 v/v)で希釈した。各溶液中のペプチドのモル濃度は2次元蛍光スペクトル装置の検出限界を超えないように設定し、Bacd-ペプチド、Cmr-ペプチド、EDANS-ペプチド、Ant-ペプチドでは 5.0 μM、Pyr-ペプチドでは2.0μM、及びAcd-ペプチドでは4.0μMに調整した。また、後ほどの実施例3,4で使用するCy-3 標識抗FLAG 抗体(Sigma社製、以下anti-FLAG-Cy3と表記する)についても、同様に3.8nMのモル濃度で測定した。
【0038】
これらの溶液2.7mLを光路長が1cmの石英セルに加え、2次元蛍光スペクトル(日本分光社製、FP-6600)を用いて測定した。測定条件はいずれも励起バンド幅が3nm、蛍光バンド幅が2nm、レスポンスが0.1秒、データ取り込み間隔が励起側で1nm、蛍光側で1nm、走査速度は2000nm/分で行なった。
【0039】
図2に結果を示した。各図の横軸は励起波長、縦軸は蛍光波長を示した。蛍光強度は図内の等高線に従った。
Bacd-ペプチドでは極大励起波長が300nm、極大蛍光波長が518nmであった。また励起波長が487nmのときにも519nmに強い蛍光発光が見られた。見た目に台形の特徴的なパターンを示した。
Cmr-ペプチドでは極大励起波長が330nm、極大蛍光波長が390nmであった。楕円形の特徴的なパターンを示した。
Pyr-ペプチドでは極大励起波長が330nm、極大蛍光波長が390nmであった。4つのピークをもつ非常に狭いパターンを示した。
EDANS-ペプチドでは極大励起波長が343nm、極大蛍光波長が468nmであった。卵形で比較的幅の広いパターンを示した。
Ant-ペプチドでは極大励起波長が358nm、極大蛍光波長が408nmであった。9つのピークをもつパターンが得られた。
Acd-ペプチドでは極大励起波長が406nm、極大蛍光波長が421nmであった。4つのピークをもつパターンが得られた。また、anti-FLAG-Cy3では極大励起波長が555nm、極大蛍光波長が570nmの十字型の特徴的なパターンを示した。これらはいずれも特徴的なパターンを示した。
【0040】
このように2次元蛍光スペクトルは各成分ペプチドの成分解析を容易にすることが期待できる。また例えば、Ant-ペプチドとAcd-ペプチドの極大蛍光波長はそれぞれ408nmと421 nmと非常に近い位置にあるが、これらの極大励起波長はそれぞれ358nmと406nmであり、非常に幅があり、2次元蛍光スペクトルにおいてこれらを同定することは容易である。その他にもPyr-ペプチドとEDANS-ペプチドの極大励起波長はいずれも343nmであるが極大蛍光波長はそれぞれ378nmと486nmと全く異なるので、2次元蛍光スペクトルにおいてこれらを同定することは容易である。結論として2次元蛍光スペクトルを用いることで各蛍光基はそれぞれに特徴なパターンを表示するので、後に示すように各成分ペプチドを分離し、解析、定量するのに非常に有用である。
【0041】
(実施例3)多成分蛍光ペプチドライブラリーの定量
実施例1で行なった各ペプチドの2次元蛍光スペクトルを成分スペクトルとして用い、6種類の各ペプチドの等モル混合物の2次元スペクトルを測定した後、解析した。6種類の各ペプチドの最終モル濃度はそれぞれ0.1μM、anti-FLAG-Cy3の最終モル濃度は0.001μMにした。しかし、このままではどの化合物がどの程度含まれているかはわからない。この2次元蛍光スペクトルを自作の解析ソフトウェアを用いて計算し、各成分のモル濃度を算出した。
【0042】
理論上はBacd-ペプチド、Cmr-ペプチド、Pyr-ペプチド、EDANS-ペプチド、Ant-ペプチド、及びAcd-ペプチドの全体に対する割合はそれぞれ16.7%、anti-FLAG-Cy3は0.2%となる。解析ソフトウェアを用いて2次元蛍光スペクトルを解析した結果を表1にした。Bacd-ペプチド、Cmr-ペプチド、Pyr-ペプチド、Pyr-ペプチド、EDANS-ペプチド、Ant-ペプチド、及びAcd-ペプチドではモル濃度はそれぞれ0.0824 μM、0.0784 μM、0.0650 μM、0.0860 μM、0.0729 μM、及び0.0651 μMとなった。またこれらより全体の割合はそれぞれ18.3 %、17.4 %、14.4 %、19.1 %、16.2 %、及び14.5 %とであった。またanti-FLAG-Cy3のモル濃度は0.0010 μMで全体に対する割合は0.2 %となった。これらの結果は、今回の解析ソフトウェアによる成分解析が良好に行なえたことを示している。
【表1】

【0043】
(実施例4)多成分蛍光標識化合物ライブラリー中から抗FLAG抗体に結合するプローブ分子を同定する手法
【0044】
各ペプチドの1 μM、anti-FLAG-Cy3 0.01 μM、及びCy3で標識されていない抗FLAG抗体9.9 μMの水溶液(HEPES緩衝水溶液、pH=7.4)を室温で1時間インキュベートした後、SephadexTM G-50(Pharmacia製)にて、ゲル濾過を行なった。このとき得られた各フラクション(画分)に同量のメタノールを加えた後、実施例2、3と同様に2次元蛍光スペクトルを測定し、さらに実施例3と同様に自作の解析ソフトにより、各フラクション中に含まれる各ペプチド及びFLAG抗体のモル濃度を算出した。
図4に各フラクションにおける2次元蛍光スペクトルを示す。各フラクションによりスペクトルパターンが異なる。これらの結果を自作の解析ソフトウェアより成分解析を行なった。
【0045】
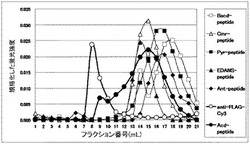
図5ではその成分解析によって得られた各フラクションにおける成分ペプチド及び抗FLAG抗体の各フラクション中のモル濃度を示した。各成分ペプチドは各フラクションによって濃度が異なることがわかった。各ペプチド及び抗体は特定のピークを持っており、今回の実験がうまくいっていることを示している。Bacd-ペプチドではフラクション18でその濃度が極大になった。Cmr-ペプチドではフラクション14でその濃度が極大になった。Pyr-ペプチドではフラクション17でその濃度が極大になった。EDAN-ペプチドでは多少ばらつきがあるもののフラクション14でその濃度が極大になった。Ant-ペプチドではフラクション17でその濃度が極大になった。Acd-ペプチドではフラクション14でその濃度が極大になり、またフラクション9でも比較的濃度が高くなった。抗FLAG抗体はフラクション8でその濃度が極大になった。Acd-ペプチドが抗FLAG抗体の濃度の極大付近に比較的濃度の高い部分をもつことはAcd-ペプチドが抗FLAG抗体に結合していることを強く示している。その他のペプチドではフラクション9付近に濃度の高い部分をもたない。Acd-ペプチドは実施例1にも示したようにFLAGペプチドの配列である。
これらのことから、本方法が溶液中で、2次元蛍光スペクトルと解析ソフトウェアを併用することにより、特定のタンパク質に結合若しくは相互作用しうるプローブ分子を、複数のプローブ分子群の中から特に何ら精製をする必要もなく同定しうることが明らかとなった。
【産業上の利用可能性】
【0046】
本発明は、特定の疾病についての薬剤を開発することを目的にするものではなく、一般的な薬剤開発の方法を提供するものである。この方法の従来技術よりも優れている画期的な点は、(1)スクリーニングが水溶液中で行われること、(2)一挙に20種類、あるいは位置スキャン法を適用すれば1013種類もの混合物から適切なプローブ分子を見出すことが可能であること、(3)操作が簡単で、迅速であること、にある。この方法は、化合物ライブラリーからプローブ分子を見出す最も簡便な方法であり、国内外の製薬企業を中心に莫大な需要が見込まれる。
【0047】
本発明は(1)種々の蛍光性非天然アミノ酸誘導体、(2)2次元蛍光測定装置あるいは2次元リアルタイム蛍光モニター、(3)2次元蛍光スペクトル解析ソフトウェアを組み合わせて実現できる。
【図面の簡単な説明】
【0048】
【図1】蛍光性非天然アミノ酸誘導体の例を示す図であり、具体的な構造を示す図である。
【図2】実施例2において、実施例1で合成した6種類の成分ペプチド及びanti-FLAG-Cy3の水(pH=7.4)/メタノール 1/1混合溶液中における各2次元蛍光スペクトルの結果を示す図である。
【図3】実施例3において、実施例1で得た6種類の成分ペプチドを等モル混合物とCy3標識FLAG抗体との水(pH=7.4)/メタノール 1/1混合溶液中の2次元蛍光スペクトルの結果を示す図である。
【図4】実施例4において、実施例1で得た6種類の成分ペプチドを等モル量混合物と抗FLAG抗体との混合物のゲルろ過後の各フラクションにおける水(pH=7.4)/メタノール 1/1混合溶液中の2次元蛍光スペクトルの結果を示す図である。
【図5】実施例4において、図3の各フラクションにおける2次元蛍光スペクトルを解析し、各フラクションにおける各ペプチド成分量を示す図である。
【技術分野】
【0001】
本発明は、特定の細胞や特定のタンパク質に結合若しくは相互作用しうるプローブ分子を、候補化合物群からスクリーニングするためのスクリーニング用キットに関し、更には該スクリーニング用キットを用いたスクリーニング方法に関する。
【背景技術】
【0002】
薬剤探索方法としては、多数の化合物ライブラリー中から特定のプローブ分子を選択する方法が有用である。従来、これらの方法には例えば、リボソームセレクション(非特許文献1〜3参照)、特開2004−506898公報(特許文献1)や特開2007−89490(特許文献2)にあるようなファージディスプレイ、特開平9−101306(特許文献3)のような1ビーズ−1ペプチドライブラリー、その他にも特開2002−107364(特許文献4)のような基板や特開2004−537975(特許文献5)にあるような細胞をライブラリーの担体として利用したものなどが使われている。
【0003】
従来技術では、RNA共存下、基板上、あるいは固体ビーズ上などで標的タンパク質や細胞と結合する分子を探索していた。これらの方法では、標的タンパク質とプローブ分子との結合を、RNA共存下、基板上又は固体ビーズ上などで検出しなければならなかった。そのためにこの方法で見出された分子は、それらを基板、RNA又はビーズから切り離すと標的タンパク質には結合しなくなることが多かった。プローブ分子のスクリーニングを生体類似の水溶液環境で行うことができれば、この問題は解決する。しかし水溶液中で多くの成分を同時に定量する方法が今まで見出されていなかったために、これは不可能であった。
【非特許文献1】L.C. Mattheakis et. al. Proc. Natl. Acad. Sci. USA, 91, 9022-9026 (1994).
【非特許文献2】J. Hanes et. al. A. Proc. Natl. Acad. Sci. USA, 94, 4939-4942 (1997).
【非特許文献3】J. Hanes et. al. Methods Enzymol., 328, 404-430 (2000).
【特許文献1】特開2004−506898号公報
【特許文献2】特開2007−89490号公報
【特許文献3】特開平9−101306号公報
【特許文献4】特開2002−107364号公報
【特許文献5】特開2004−537975号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、特定のタンパク質又は細胞と結合若しくは相互作用しうるプローブ分子を候補化合物群からスクリーニングするに際し、生体類似の溶液環境で実施可能なスクリーニング用キットを提供することを課題とし、更には生体類似の溶液環境で実施可能なスクリーニング方法を提供することを課題とする。
【課題を解決するための手段】
【0005】
蛍光波長及び/又は励起波長が異なる複数種の蛍光標識用非天然アミノ酸を含むキットによる。さらには、該キットを用いて、以下の工程を含む方法による。1)候補化合物に蛍光標識用非天然アミノ酸ユニットを付加する工程;2)特定のタンパク質又は細胞と、上記1)の蛍光標識用非天然アミノ酸ユニットを付加した対象化合物を水溶液中で混合する工程;3)上記2)で混合した物質を分画する工程;4)上記3)で得た、各分画について、2次元蛍光スペクトルを測定する工程;5)2次元蛍光スペクトルの測定結果を解析する工程。
【0006】
すなわち本発明は以下よりなる。
1.蛍光波長及び/又は励起波長が各々異なる少なくとも3種類の蛍光標識剤を構成要素とし、2次元蛍光スペクトル解析を用いて、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうる物質をスクリーニングするためのスクリーニング用キット。
2.蛍光標識剤が蛍光標識非天然アミノ酸である前項1に記載のスクリーニング用キット。
3.蛍光標識剤の両端に水溶性物質が付加されている構造からなる蛍光標識用ユニットを含む前項1又は2に記載のスクリーニング用キット。
4.蛍光標識用ユニットが、蛍光標識用非天然アミノ酸ユニットであり、蛍光標識非天然アミノ酸の両端に水溶性アミノ酸が付加されているペプチド配列を含む前項3に記載のスクリーニング用キット。
5.蛍光標識用非天然アミノ酸ユニットが、蛍光標識非天然アミノ酸の両端に水溶性アミノ酸が付加されているペプチド配列と、そのN側、C側または両側にさらに水溶性リンカー化合物を含むことを特徴とする前項4に記載のスクリーニング用キット。
6.前項1〜5のいずれか1に記載のキットを用いて、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうる物質をスクリーニングすることを特徴とするスクリーニング方法。
7.少なくとも以下の工程を含む、前項6に記載のスクリーニング方法:
1)候補化合物に蛍光標識剤を付加する工程;
2)特定のタンパク質又は細胞と、上記1)の蛍光標識剤を付加した対象化合物を水溶液中で混合する工程;
3)上記2)で混合した物質を分画する工程;
4)上記3)で得た、各分画について、2次元蛍光スペクトルを測定する工程;
5)2次元蛍光スペクトルの測定結果を解析する工程。
8.候補化合物が、アミノ酸残基数が3〜50の長さからなるペプチドである、前項6又は7に記載のスクリーニング方法。
【発明の効果】
【0007】
本発明のスクリーニング用キットを用いて、特定のタンパク質又は細胞と結合若しくは相互作用しうるプローブ分子を候補化合物群からのスクリーニングを行うに際し、(1)スクリーニングが水溶液中で行われること、(2)一挙に20種類、あるいは位置スキャン法を適用すれば1013種類もの混合物から適切なプローブ分子を見出すことが可能であること、(3)操作が簡単で、迅速であること、の優れた効果を有する。本発明のスクリーニング方法は、生体類似の溶液環境で実施可能であり、化合物ライブラリーからプローブ分子を見出す最も簡便な方法であるといえる。
【発明を実施するための最良の形態】
【0008】
本発明のスクリーニング用キットには、複数種(多成分)の蛍光標識剤が含まれる。蛍光標識剤は、自体公知のものであっても良いし、今後開発される新たなものであっても良いが、複数種の蛍光標識剤各々について、蛍光波長及び/又は励起波長が異なるものであればよい。スクリーニング用キットに含まれる蛍光標識剤の種類は、多ければ多いほど多様なスクリーニングが可能であるが、少なくとも3種類以上であればよく、好ましくは6〜20種類である。なお、本発明のスクリーニング用キットを用いて、候補化合物に各々異なる種類の蛍光標識剤を付加し、多成分蛍光標識化合物ライブラリーを作製することができる。従って、本発明のスクリーニング用キットは、多成分蛍光標識化合物ライブラリー作製用キットとしての意義を有する。
【0009】
該蛍光標識剤は、蛍光検出部としての発色団を含み、該発色団はベンゼン環又はヘテロ環を有する。該発色団に含まれるヘテロ環の数は特に制限されるものではないが、例えば2〜6個、好ましくは2〜4個、更に好ましくは3個である。
【0010】
蛍光標識剤は、蛍光標識した非天然アミノ酸であることが好ましい。蛍光標識剤が、蛍光標識非天然アミノ酸である場合、いずれのアミノ酸も、そのN末端にはFmoc基(9-フルオレニルメトキシカルボニル基)が1つ修飾されていることが好ましい。具体的には、例えば以下に示すいずれかの蛍光標識用非天然アミノ酸から選択される。また、図1に蛍光標識用非天然アミノ酸の構造を示した。
【0011】
1 :Ant = 3-(2-アンスリル)アラニン
2 :Pyr = 3-(1-ピレニル)アラニン
3 :Acd = 3-(9-オキソ-9,10-ジヒドロ-アクリジン-2-イル)アラニン
4 :Bacd = 3-(12-オキソ-5,12-ジヒドロ-ベンゾ[b]アクリジン-2-イル)アラニン
5 :EDANS = γ[β-(5-ナフチルスルホン酸)-エチレンジアミン]グルタミン酸
6 :Cmr = 3-(7-メトキシ-クマリン-4-イル)アラニン
7 :FAM = N-ε-(フルオルセイン-5,6-イル)カルボニル-リシン
8 :RhoB = N-ε-(テトラエチルローダミン-5,6-イル)チオウレイド-リシン
9 :HOMCmr = N-ε-(7-ヒドロキシ-4-メチル-クマリン-3-イル)アセチル-リシン
10:DMACmr = N-ε-(7-ジメチルアミノ-クマリン-4-イル)アセチル-リシン
11:DEACmr = N-ε-(7-ジエチルアミノ-クマリン-3-イル)カルボニル-リシン
12:DMAMCmr = N-ε-(7-ジメチルアミノ-4-メチル-クマリン-3-イル)チオウレイド-リシン
13:MeONaph = 3-(6-メトキシ-ナフタレン-2-イル)アラニン
14:DBD = N-ε-(7-ジメチルスルファモイル-ベンゾ[1,2,5]オキサジアゾル-4-イル)チオウレイド-リシン
15:DMANaph = N-ε-(4-ジメチルアミノ-ナフタレン-1-イル)チオウレイド-リシン
16:HOCmr = N-ε-(7-ヒドロキシ-クマリン-3-イル)カルボニル-リシン
17:MeOCmr = N-ε-(7-メトキシ-クマリン-3-イル)カルボニル-リシン
18:TAMRA = N-ε-(テトラメチルローダミン-5,6-イル)カルボニル-リシン
19:Acr = 3-(1-アクリジン-9-イル-2,5-ジオキソ-ピロリジン-3-イル)システイン
20:Bn3Imd = N-ε-(4,5-ジフェニル-1H-イミダゾール-2-イル)ベンゾイル-リシン
21:Nap = 3-(ナフタレン-2-イル)アラニン
22:Phen = 3-(フェナンスレン-9-イル)アラニン
23:PheNap = 3-(4-ナフタレン-2-イル-フェニル)アラニン
24:Psl = N-ε-[4-(7-オキソ-7H-フロ[3,2-γ]クロメン-9-イルオキシ)]ブチリル-リシン
25:Dns = N-ε-(5-ジメチルアミノ-ナフタレン-1-スルホニル)-リシン
26:DMOBcC = N,N'-δ-[tert-ブトキシカルボニル-(6,7-ジメトキシ-クマリン-4-イルメチル)]-オルニチン
27:DMOAcC = N,N'-δ-[アセチル-(6,7-ジメトキシ-クマリン-4-イルメチル)]-オルニチン
28:CDOCA = N-δ-[2-(6-オキソ-6H-フロ[1,3-γ]クロメン-8-イル)]アセチル-リシン
29:MOCA = N-ε-(7-メトキシ-クマリン-4-イル)アセチル-リシン
30:AcrMe = 3-(アクリジン-9-イル)アラニン
31:AcrAc = N,N'-δ-(アセチル-アクリジン-9-イルメチル)-オルニチン
32:AntSO = N-ε-(アンスラセン-2-スルホニル)-リシン
33:Qui = 3-(キノリン-2-イル)アラニン
34:NDACN = N-ε-(1-シアノ-ベンゾ[φ]イソインドール-2-イル)-リシン
35:C343 = N -δ-(10-オキソ-2,3,5,6-テトラヒドロ-1H,4H,10H-11-オキサ-3 -アザ-ベンゾ[de]アンスラセン-9-カルボニル)-オルニチン
【0012】
本発明における蛍光標識剤は、特定の細胞や特定のタンパク質に対して、該蛍光標識剤の非特異的結合を防ぐように、蛍光標識剤に水溶性物質を付加した蛍光標識用ユニットであってもよい。蛍光標識用ユニットとしては、上述の蛍光標識非天然アミノ酸を含むものが好適であり、水溶性物質としては、水溶性アミノ酸であることが好適である。具体的には、蛍光標識非天然アミノ酸の両端に水溶性アミノ酸を結合していても良い。水溶性アミノ酸の例として、グルタミン酸、アスパラギン酸、リジン、アルギニンなどが挙げられるが、より好適にはグルタミン酸である。さらには、蛍光標識用非天然アミノ酸ユニットを候補化合物に効果的に付加するために、水溶性のリンカー化合物を含んでいてもよい。水溶性のリンカー化合物としては、水溶性であり、蛍光標識用非天然アミノ酸ユニットと候補化合物を結合しうる構造であれば良く、特に制限されないが、例えば-NH-(CH2CH2O)6-(CH2)2-CO-が挙げられる。
【0013】
本発明のスクリーニング用キットに含まれる構成物は、上述の蛍光標識剤の他、スクリーニングに必要な試薬や容器などを含んでいても良い。さらには、スクリーニングの解析に必要な解析ソフトを含んでいても良く、解析用機器を含んでいても良い。上述の試薬、容器、ソフト及び機器等は、本発明のスクリーニングに利用可能であれば、自体公知の既存のものであっても良いし、今後開発されるより好適なものであってもよい。
【0014】
上述のスクリーニング用キットを用いて、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうる物質をスクリーニングすることができる。そのスクリーニング方法は、少なくとも以下の工程を含む。
【0015】
1)候補化合物に蛍光標識剤を付加する工程;
2)特定のタンパク質又は細胞と、上記1)の蛍光標識剤を付加した対象化合物を水溶液中で混合する工程;
3)上記2)で混合した物質を分画する工程;
4)上記3)で得た、各分画について、2次元蛍光スペクトルを測定する工程;
5)2次元蛍光スペクトルの測定結果を解析する工程。
【0016】
本発明において、候補化合物に各々異なる種類の蛍光標識剤を付加したものを、蛍光標識化合物ライブラリーとすることができる。蛍光標識化合物ライブラリーは、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうるプローブ機能を有する化合物をスクリーニングするために作製される。本発明において、該蛍光標識化合物ライブラリーをスクリーニング用キットに含めてもよい。
【0017】
前記蛍光標識化合物ライブラリーを構成する候補化合物は、カルボン酸若しくはアミノ基と結合することのできる化合物を好適に用いることができる。このような化合物としては、例えばペプチド、タンパク質、糖、DNA、RNA、低分子有機化合物、脂質及び/又は高分子材料等が例示され、好適にはペプチドを挙げることができる。
【0018】
前記候補化合物にペプチドが含まれる場合、ペプチドを構成するアミノ酸の残基数は、特定のタンパク質又は細胞と結合若しくは相互作用し、プローブ機能を有する長さであれば良く、特に制限されないが、例えば6〜50個、好ましくは8〜20個、さらに好ましくは8個程度が挙げられる。
【0019】
候補化合物と各々異なる種類の蛍光標識剤の組合せは、スクリーニングの目的に応じて適宜決定することができる。例えば、複数回のスクリーニングを行う場合に、各々のスクリーニングの目的、例えば類似するペプチド化合物やDNA、RNAの場合、変異するアミノ酸若しくは核酸の位置や、配列の特徴等、あるいは低分子化合物の場合は構造の特徴点等に応じて、異なる種類の蛍光標識剤を付加することができる。
【0020】
候補化合物に蛍光標識剤を付加する方法は、特に限定されず、自体公知の方法を適用することができる。例えば、蛍光標識用非天然アミノ酸ユニットを候補化合物であるペプチドに付加する場合は、Fmocペプチド固相合成法によることも可能であるし、その他の一般的な合成方法によることも可能である。
【0021】
複数の蛍光標識剤を各々付加した蛍光標識化合物群、すなわち多成分蛍光標識化合物ライブラリーと、特定のタンパク質又は細胞を水溶液中で混合する。ここにおいて、特定のタンパク質又は細胞は特に限定されず、候補化合物の目的用途や必要に応じて適宜決定される。また、混合のために用いる水溶液は、リン酸緩衝液やトリス緩衝液など一般的に用いられる溶液を用いることができる。
【0022】
また、特定のタンパク質又は細胞は、蛍光標識を行わなくともスクリーニング操作上問題ないが、より正確に検出するために部分的に蛍光標識を行っても良い。標識しうる蛍光物質は特に限定されないが、例えばフルオレセイン、テトラメチルローダミンなどを用いることができる。
【0023】
前記多成分蛍光標識化合物ライブラリーから、特定のタンパク質及び/又は特定の細胞と結合若しくは相互作用しうるプローブ機能を有する物質を検出する方法として、蛍光スペクトルを利用することができるが、情報量の多さの観点から、2次元蛍光スペクトルを用いて測定するのがより好適である。具体的には、多成分蛍光標識化合物ライブラリーと特定のタンパク質又は細胞を混合した水溶液について、通常の方法で各種励起波長と蛍光波長を測定することができる。
【0024】
2次元蛍光スペクトルの解析のために、多成分蛍光標識化合物ライブラリーの各標識化合物及び化合物と結合していない各蛍光標識用非天然アミノ酸ユニットについて、予め2次元蛍光スペクトルを測定しておくことが必要である。蛍光標識化合物ライブラリー中の各候補化合物に関する2次元蛍光スペクトルの解析は、自体公知の方法により解析することができる。例えば最小二乗法や多変量解析法の原理を利用した解析用ソフトを用いて解析することができる。
【0025】
特定のタンパク質及び/又は特定の細胞と結合若しくは相互作用しうるプローブ分子を検出するために、2次元蛍光スペクトルの測定前に、特定のタンパク質及び/又は特定の細胞と特定のタンパク質及び/又は特定の細胞に結合した多成分蛍光標識化合物ライブラリーを分画することが必要である。該分画する方法は特に限定されないが、物理化学的性質や免疫学的性質を利用したものが挙げられる。具体的には、例えばゲル濾過、HPLC、疎水性クロマトグラフィー、イオン交換クロマトグラフィー、電気泳動、蛍光顕微鏡等が例示される。各々分画した画分について、2次元蛍光スペクトルを測定し、通常の方法に従って解析することができる。例えばゲル濾過クロマトグラフィーにより分画した各試料の測定結果について、特定のタンパク質及び/又は特定の細胞から得られるピークから最も近いピークを有する画分に含まれる候補化合物が、特定のタンパク質及び/又は特定の細胞と結合若しくは相互作用しうるプローブ分子であると考えられる。
【実施例】
【0026】
以下、本発明を更に詳しく説明するため実施例を挙げる。これらの実施例は、単なる例示であり、本発明を限定するものではない。
【0027】
(実施例1)種類の異なる蛍光標識用非天然アミノ酸を含む多成分蛍光標識化合物ライブラリーの合成
【0028】
本実施例における多成分蛍光標識化合物ライブラリーのもととなる化合物、すなわちペプチド群は、いずれもFmocペプチド固相合成法により得られた。Fmocアミノ酸モノマー及びFmoc蛍光アミノ酸、ペプチド合成に必要な溶媒とその他の試薬類はいずれも渡辺化学工業より購入した。FmocのO(6)リンカーはNeo MPS社より購入した。
【0029】
具体的には、合成は以下のように行なった。合成にはFmoc-NH-SAL-PEG-resin の樹脂を用い、該樹脂を膨潤させるためジクロロメタン/ジメチルホルムアミド(DMF) 混合溶媒で室温3時間撹拌した。樹脂をDMF溶液で洗浄後、20%ピペリジンを含むDMF溶液で40℃にて10分間撹拌し、その後DMF溶液で洗浄した(この操作を以下「脱保護」と表記する)。
【0030】
次に、目的ペプチドの配列を作るのに対応するFmocアミノ酸、HATU(O-(ベンゾトリアゾール-1-イル)-N,N,N',N'-テトラメチルウロニウムヘキサフルオロリン酸塩)、及びDIPEA(N,N-ジイソプロピルエチルアミン)をDMF溶液に溶解した後、上記膨潤させた樹脂に加えた。40℃にて60分間撹拌した後、DMF溶液で洗浄した(この操作を以下「カップリング」と表記する)。
【0031】
続いて、5%無水酢酸及び6%ルチジンを含むDMF溶液で40℃にて5分間撹拌した後、DMF溶液で洗浄した(この操作を以下「キャッピング」と表記する)。
【0032】
樹脂表面上に、目的の配列のペプチドが伸長するまで、脱保護、カップリング、キャッピングの操作を繰り返した。最後のアミノ酸のFmoc基を脱保護した後、樹脂にトリフルオロ酢酸/水/トリイソプロピルシラン(= 95/2.5/2.5 v/v/v)を加えて、室温にて60分間撹拌した。これにより樹脂から切り出された目的のペプチドの溶液はジエチルエーテルを加えることで沈殿物を得た。これらのペプチドはメタノール溶液として冷凍庫に保管した。
【0033】
本実施例では6種類のペプチドを作製した。合成したペプチド群の構造を以下に示す。
Bacd-ペプチド :H-E-Bacd-E-O(6)-DYKADDDK-NH2(配列番号1)
Cmr-ペプチド :H-E-Cmr-E-O(6)-DYDKDDDK-NH2(配列番号2)
Pyr-ペプチド :H-E-Pyr-E-O(6)-DYKEEDDK-NH2(配列番号3)
EDANS-ペプチド:H-E-EDANS-E-O(6)-DYDDDDDK-NH2(配列番号4)
Ant-ペプチド :H-E-Ant-E-O(6)-DYAAADDK-NH2(配列番号5)
Acd-ペプチド :H-E-Acd-E-O(6)-DYKDDDDK-NH2(配列番号6)
【0034】
E、D、Y、K、及びAは一文字表記法によるアミノ酸ユニットを示す。O(6)の化学構造は-NH-(CH2CH2O)6-(CH2)2-CO-である。例えばE-Bacd-E-O(6)のように、グルタミン酸(E)及びO(6)を付加した非天然アミノ酸は、蛍光標識用非天然アミノ酸ユニットを示しており、Bacd、Cmr、Pyr、EDANS、Ant、及びAcdはいずれも蛍光標識用非天然アミノ酸であり、それぞれ3-(12-オキソ-5,12-ジヒドロ-ベンゾ[b]アクリジン-2-イル)アラニン、3-(7-メトキシ-クマリン-4-イル)アラニン、3-(1-ピレニル)アラニン、γ[β-(5-ナフチルスルホン酸)-エチレンジアミン]グルタミン酸、3-(2-アンスリル)アラニン、及び3-(9-オキソ-9,10-ジヒドロ-アクリジン-2-イル)アラニンを示している。上記化合物内の左端のH及び右端のNH2はそれぞれ化合物のN末端がフリーアミンであること、C末端が第一アミドであることを示している。本実施例及び以降の実施例において、候補化合物に該当する部分を、成分ペプチドと呼ぶ。
【0035】
上記のうち、Acd-ペプチド中の成分ペプチドのアミノ酸配列はFLAGペプチドの配列と同じである。これ以外の5種類の成分ペプチドはいずれもFLAGペプチドの配列中、1〜3個のアミノ酸配列が異なる。蛍光標識用非天然アミノ酸の両端のグルタミン酸は、蛍光標識用非天然アミノ酸ユニットにより減少すると予想される水溶性を獲得するのと同時に、立体障害による蛍光標識用非天然アミノ酸の非特異的吸着を防ぐ役割がある。
【0036】
(実施例2)多成分蛍光標識化合物ライブラリー中の各成分ペプチドの2次元蛍光スペクトルの測定及び自作の最小二乗法をもちいた解析ソフトウェアによる成分解析
【0037】
実施例1で作製された多成分蛍光標識化合物ライブラリーの溶液中の各成分ペプチドの同定、定量を行うために、はじめに各成分ペプチドの2次元蛍光スペクトルを測定した。Bacd-ペプチド、Cmr-ペプチド、Pyr-ペプチド、EDANS-ペプチド、Ant-ペプチド、及びAcd-ペプチドを含むメタノール溶液をHEPES緩衝溶液(pH=7.4)/メタノール(1/1 v/v)で希釈した。各溶液中のペプチドのモル濃度は2次元蛍光スペクトル装置の検出限界を超えないように設定し、Bacd-ペプチド、Cmr-ペプチド、EDANS-ペプチド、Ant-ペプチドでは 5.0 μM、Pyr-ペプチドでは2.0μM、及びAcd-ペプチドでは4.0μMに調整した。また、後ほどの実施例3,4で使用するCy-3 標識抗FLAG 抗体(Sigma社製、以下anti-FLAG-Cy3と表記する)についても、同様に3.8nMのモル濃度で測定した。
【0038】
これらの溶液2.7mLを光路長が1cmの石英セルに加え、2次元蛍光スペクトル(日本分光社製、FP-6600)を用いて測定した。測定条件はいずれも励起バンド幅が3nm、蛍光バンド幅が2nm、レスポンスが0.1秒、データ取り込み間隔が励起側で1nm、蛍光側で1nm、走査速度は2000nm/分で行なった。
【0039】
図2に結果を示した。各図の横軸は励起波長、縦軸は蛍光波長を示した。蛍光強度は図内の等高線に従った。
Bacd-ペプチドでは極大励起波長が300nm、極大蛍光波長が518nmであった。また励起波長が487nmのときにも519nmに強い蛍光発光が見られた。見た目に台形の特徴的なパターンを示した。
Cmr-ペプチドでは極大励起波長が330nm、極大蛍光波長が390nmであった。楕円形の特徴的なパターンを示した。
Pyr-ペプチドでは極大励起波長が330nm、極大蛍光波長が390nmであった。4つのピークをもつ非常に狭いパターンを示した。
EDANS-ペプチドでは極大励起波長が343nm、極大蛍光波長が468nmであった。卵形で比較的幅の広いパターンを示した。
Ant-ペプチドでは極大励起波長が358nm、極大蛍光波長が408nmであった。9つのピークをもつパターンが得られた。
Acd-ペプチドでは極大励起波長が406nm、極大蛍光波長が421nmであった。4つのピークをもつパターンが得られた。また、anti-FLAG-Cy3では極大励起波長が555nm、極大蛍光波長が570nmの十字型の特徴的なパターンを示した。これらはいずれも特徴的なパターンを示した。
【0040】
このように2次元蛍光スペクトルは各成分ペプチドの成分解析を容易にすることが期待できる。また例えば、Ant-ペプチドとAcd-ペプチドの極大蛍光波長はそれぞれ408nmと421 nmと非常に近い位置にあるが、これらの極大励起波長はそれぞれ358nmと406nmであり、非常に幅があり、2次元蛍光スペクトルにおいてこれらを同定することは容易である。その他にもPyr-ペプチドとEDANS-ペプチドの極大励起波長はいずれも343nmであるが極大蛍光波長はそれぞれ378nmと486nmと全く異なるので、2次元蛍光スペクトルにおいてこれらを同定することは容易である。結論として2次元蛍光スペクトルを用いることで各蛍光基はそれぞれに特徴なパターンを表示するので、後に示すように各成分ペプチドを分離し、解析、定量するのに非常に有用である。
【0041】
(実施例3)多成分蛍光ペプチドライブラリーの定量
実施例1で行なった各ペプチドの2次元蛍光スペクトルを成分スペクトルとして用い、6種類の各ペプチドの等モル混合物の2次元スペクトルを測定した後、解析した。6種類の各ペプチドの最終モル濃度はそれぞれ0.1μM、anti-FLAG-Cy3の最終モル濃度は0.001μMにした。しかし、このままではどの化合物がどの程度含まれているかはわからない。この2次元蛍光スペクトルを自作の解析ソフトウェアを用いて計算し、各成分のモル濃度を算出した。
【0042】
理論上はBacd-ペプチド、Cmr-ペプチド、Pyr-ペプチド、EDANS-ペプチド、Ant-ペプチド、及びAcd-ペプチドの全体に対する割合はそれぞれ16.7%、anti-FLAG-Cy3は0.2%となる。解析ソフトウェアを用いて2次元蛍光スペクトルを解析した結果を表1にした。Bacd-ペプチド、Cmr-ペプチド、Pyr-ペプチド、Pyr-ペプチド、EDANS-ペプチド、Ant-ペプチド、及びAcd-ペプチドではモル濃度はそれぞれ0.0824 μM、0.0784 μM、0.0650 μM、0.0860 μM、0.0729 μM、及び0.0651 μMとなった。またこれらより全体の割合はそれぞれ18.3 %、17.4 %、14.4 %、19.1 %、16.2 %、及び14.5 %とであった。またanti-FLAG-Cy3のモル濃度は0.0010 μMで全体に対する割合は0.2 %となった。これらの結果は、今回の解析ソフトウェアによる成分解析が良好に行なえたことを示している。
【表1】

【0043】
(実施例4)多成分蛍光標識化合物ライブラリー中から抗FLAG抗体に結合するプローブ分子を同定する手法
【0044】
各ペプチドの1 μM、anti-FLAG-Cy3 0.01 μM、及びCy3で標識されていない抗FLAG抗体9.9 μMの水溶液(HEPES緩衝水溶液、pH=7.4)を室温で1時間インキュベートした後、SephadexTM G-50(Pharmacia製)にて、ゲル濾過を行なった。このとき得られた各フラクション(画分)に同量のメタノールを加えた後、実施例2、3と同様に2次元蛍光スペクトルを測定し、さらに実施例3と同様に自作の解析ソフトにより、各フラクション中に含まれる各ペプチド及びFLAG抗体のモル濃度を算出した。
図4に各フラクションにおける2次元蛍光スペクトルを示す。各フラクションによりスペクトルパターンが異なる。これらの結果を自作の解析ソフトウェアより成分解析を行なった。
【0045】
図5ではその成分解析によって得られた各フラクションにおける成分ペプチド及び抗FLAG抗体の各フラクション中のモル濃度を示した。各成分ペプチドは各フラクションによって濃度が異なることがわかった。各ペプチド及び抗体は特定のピークを持っており、今回の実験がうまくいっていることを示している。Bacd-ペプチドではフラクション18でその濃度が極大になった。Cmr-ペプチドではフラクション14でその濃度が極大になった。Pyr-ペプチドではフラクション17でその濃度が極大になった。EDAN-ペプチドでは多少ばらつきがあるもののフラクション14でその濃度が極大になった。Ant-ペプチドではフラクション17でその濃度が極大になった。Acd-ペプチドではフラクション14でその濃度が極大になり、またフラクション9でも比較的濃度が高くなった。抗FLAG抗体はフラクション8でその濃度が極大になった。Acd-ペプチドが抗FLAG抗体の濃度の極大付近に比較的濃度の高い部分をもつことはAcd-ペプチドが抗FLAG抗体に結合していることを強く示している。その他のペプチドではフラクション9付近に濃度の高い部分をもたない。Acd-ペプチドは実施例1にも示したようにFLAGペプチドの配列である。
これらのことから、本方法が溶液中で、2次元蛍光スペクトルと解析ソフトウェアを併用することにより、特定のタンパク質に結合若しくは相互作用しうるプローブ分子を、複数のプローブ分子群の中から特に何ら精製をする必要もなく同定しうることが明らかとなった。
【産業上の利用可能性】
【0046】
本発明は、特定の疾病についての薬剤を開発することを目的にするものではなく、一般的な薬剤開発の方法を提供するものである。この方法の従来技術よりも優れている画期的な点は、(1)スクリーニングが水溶液中で行われること、(2)一挙に20種類、あるいは位置スキャン法を適用すれば1013種類もの混合物から適切なプローブ分子を見出すことが可能であること、(3)操作が簡単で、迅速であること、にある。この方法は、化合物ライブラリーからプローブ分子を見出す最も簡便な方法であり、国内外の製薬企業を中心に莫大な需要が見込まれる。
【0047】
本発明は(1)種々の蛍光性非天然アミノ酸誘導体、(2)2次元蛍光測定装置あるいは2次元リアルタイム蛍光モニター、(3)2次元蛍光スペクトル解析ソフトウェアを組み合わせて実現できる。
【図面の簡単な説明】
【0048】
【図1】蛍光性非天然アミノ酸誘導体の例を示す図であり、具体的な構造を示す図である。
【図2】実施例2において、実施例1で合成した6種類の成分ペプチド及びanti-FLAG-Cy3の水(pH=7.4)/メタノール 1/1混合溶液中における各2次元蛍光スペクトルの結果を示す図である。
【図3】実施例3において、実施例1で得た6種類の成分ペプチドを等モル混合物とCy3標識FLAG抗体との水(pH=7.4)/メタノール 1/1混合溶液中の2次元蛍光スペクトルの結果を示す図である。
【図4】実施例4において、実施例1で得た6種類の成分ペプチドを等モル量混合物と抗FLAG抗体との混合物のゲルろ過後の各フラクションにおける水(pH=7.4)/メタノール 1/1混合溶液中の2次元蛍光スペクトルの結果を示す図である。
【図5】実施例4において、図3の各フラクションにおける2次元蛍光スペクトルを解析し、各フラクションにおける各ペプチド成分量を示す図である。
【特許請求の範囲】
【請求項1】
蛍光波長及び/又は励起波長が各々異なる少なくとも3種類の蛍光標識剤を構成要素とし、2次元蛍光スペクトル解析を用いて、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうる物質をスクリーニングするためのスクリーニング用キット。
【請求項2】
蛍光標識剤が蛍光標識非天然アミノ酸である請求項1に記載のスクリーニング用キット。
【請求項3】
蛍光標識剤の両端に水溶性物質が付加されている構造からなる蛍光標識用ユニットを含む請求項1または2に記載のスクリーニング用キット。
【請求項4】
蛍光標識用ユニットが、蛍光標識用非天然アミノ酸ユニットであり、蛍光標識非天然アミノ酸の両端に水溶性アミノ酸が付加されているペプチド配列を含む請求項3に記載のスクリーニング用キット。
【請求項5】
蛍光標識用非天然アミノ酸ユニットが、蛍光標識非天然アミノ酸の両端に水溶性アミノ酸が付加されているペプチド配列と、そのN側、C側または両側にさらに水溶性リンカー化合物を含むことを特徴とする請求項4に記載のスクリーニング用キット。
【請求項6】
請求項1〜5のいずれか1に記載のキットを用いて、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうる物質をスクリーニングすることを特徴とするスクリーニング方法。
【請求項7】
少なくとも以下の工程を含む、請求項6に記載のスクリーニング方法:
1)候補化合物に蛍光標識剤を付加する工程;
2)特定のタンパク質又は細胞と、上記1)の蛍光標識剤を付加した対象化合物を水溶液中で混合する工程;
3)上記2)で混合した物質を分画する工程;
4)上記3)で得た、各分画について、2次元蛍光スペクトルを測定する工程;
5)2次元蛍光スペクトルの測定結果を解析する工程。
【請求項8】
候補化合物が、アミノ酸残基数が3〜50の長さからなるペプチドである、請求項6又は7に記載のスクリーニング方法。
【請求項1】
蛍光波長及び/又は励起波長が各々異なる少なくとも3種類の蛍光標識剤を構成要素とし、2次元蛍光スペクトル解析を用いて、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうる物質をスクリーニングするためのスクリーニング用キット。
【請求項2】
蛍光標識剤が蛍光標識非天然アミノ酸である請求項1に記載のスクリーニング用キット。
【請求項3】
蛍光標識剤の両端に水溶性物質が付加されている構造からなる蛍光標識用ユニットを含む請求項1または2に記載のスクリーニング用キット。
【請求項4】
蛍光標識用ユニットが、蛍光標識用非天然アミノ酸ユニットであり、蛍光標識非天然アミノ酸の両端に水溶性アミノ酸が付加されているペプチド配列を含む請求項3に記載のスクリーニング用キット。
【請求項5】
蛍光標識用非天然アミノ酸ユニットが、蛍光標識非天然アミノ酸の両端に水溶性アミノ酸が付加されているペプチド配列と、そのN側、C側または両側にさらに水溶性リンカー化合物を含むことを特徴とする請求項4に記載のスクリーニング用キット。
【請求項6】
請求項1〜5のいずれか1に記載のキットを用いて、候補化合物群から、特定のタンパク質又は細胞と結合若しくは相互作用しうる物質をスクリーニングすることを特徴とするスクリーニング方法。
【請求項7】
少なくとも以下の工程を含む、請求項6に記載のスクリーニング方法:
1)候補化合物に蛍光標識剤を付加する工程;
2)特定のタンパク質又は細胞と、上記1)の蛍光標識剤を付加した対象化合物を水溶液中で混合する工程;
3)上記2)で混合した物質を分画する工程;
4)上記3)で得た、各分画について、2次元蛍光スペクトルを測定する工程;
5)2次元蛍光スペクトルの測定結果を解析する工程。
【請求項8】
候補化合物が、アミノ酸残基数が3〜50の長さからなるペプチドである、請求項6又は7に記載のスクリーニング方法。
【図1】


【図5】


【図2】


【図3】


【図4】




【図5】


【図2】


【図3】


【図4】


【公開番号】特開2009−92654(P2009−92654A)
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願番号】特願2008−240242(P2008−240242)
【出願日】平成20年9月19日(2008.9.19)
【出願人】(504147243)国立大学法人 岡山大学 (444)
【Fターム(参考)】
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願日】平成20年9月19日(2008.9.19)
【出願人】(504147243)国立大学法人 岡山大学 (444)
【Fターム(参考)】
[ Back to top ]

