蛍光消光及び/又は蛍光退色を用いて個々の細胞又は粒状物質を分析するための方法及び装置
【課題】静止状態の血液試料中の構成成分を分析するための方法及び装置を提供する。
【解決手段】第1のパネル12と第2のパネル16とにより画定された分析チャンバ10を用いて、血液試料中の構成成分22を分析する方法であって、該試料が、第1の光の波長に曝露すると蛍光を発するように機能する着色剤と該試料とを混和し、1つ又は複数の第1の光の波長で照明するステップと、該試料を撮像するステップであって、離散的な時点において画像信号を生成することを含み、画像信号が、構成成分内に存在する着色剤からの蛍光発光を示すステップと、離散的な時点からの画像信号を用いて、構成成分内に存在する着色剤に関連する1つ又は複数の蛍光発光値と蛍光発光値の変化率とを決定するステップと、該蛍光発光値の決定された変化率を用いて、構成成分を分析するステップと、を含む、方法。
【解決手段】第1のパネル12と第2のパネル16とにより画定された分析チャンバ10を用いて、血液試料中の構成成分22を分析する方法であって、該試料が、第1の光の波長に曝露すると蛍光を発するように機能する着色剤と該試料とを混和し、1つ又は複数の第1の光の波長で照明するステップと、該試料を撮像するステップであって、離散的な時点において画像信号を生成することを含み、画像信号が、構成成分内に存在する着色剤からの蛍光発光を示すステップと、離散的な時点からの画像信号を用いて、構成成分内に存在する着色剤に関連する1つ又は複数の蛍光発光値と蛍光発光値の変化率とを決定するステップと、該蛍光発光値の決定された変化率を用いて、構成成分を分析するステップと、を含む、方法。
【発明の詳細な説明】
【技術分野】
【0001】
本願は、2008年3月21日に出願された米国仮特許出願第61/038,578号明細書に開示される本質的主題の利益を享受し、それを参照により援用する。
【0002】
本発明は、概して血液試料を分析するための装置及び方法に関し、特に、細胞又は粒状物質などの、試料中の構成成分を検出、同定、及び計数するための装置及び方法に関する。
【背景技術】
【0003】
医師、獣医師及び科学者は、構成物質の量を決定し、さらに健常な被験体には見られない異常な構成物質の存在を同定するため、ヒト及び動物の生体体液、特に血液を調べている。一般に計測、定量及び同定される構成物質としては、赤血球(RBC)、白血球(WBC)、及び血小板が挙げられる。RBC分析には、RBCの数、大きさ、容積、形状、ヘモグロビン含有量及び濃度、並びにヘマトクリット(血中血球容積とも称される)の測定が含まれ得る。RBC分析にはまた、RBCにおける住血原虫(例えば、マラリア原虫)か、又はWBCにおける細胞外の、若しくはリーシュマニア症の病原生物であるトリパノソーマ、並びに他の多くの住血原虫の存在の検出及び/又は計数を含め、赤血球細胞中の特定の成分、例えばDNA、RNAの存在及び/又は濃度の決定も関わり得る。WBC分析には、一般にはWBC分画と称されるWBCサブタイプの集団内頻度の決定、並びに健常な被験体には見られない任意の異常な細胞タイプの報告が含まれ得る。血小板(又は、鳥類、爬虫類及び魚類を含む特定の動物においては栓球、これは、哺乳類における血小板の機能と同様だが、10倍程大きく有核である)の分析には、試料中の血小板又は栓球の凝集塊の存在についての決定を含め、血小板の数、大きさ、形状・構造、及び容積の決定が含まれ得る。
【0004】
「Wintrobe’s Clinical Hematology」第12版などの医学テキストに詳細に記載されている公知の血液検査手法では、概して検査方法は、手動、遠心、及びインピーダンスを用いるタイプの方法に分けられる。手動で行う方法には、典型的には、正確に測定された容積の血液又は体液試料を作成し、それを定量的に希釈して、計数チャンバにおいて目視で数をカウントすることが関わる。手動での検査方法には、末梢血スメアを調べることが含まれ、そこでは目視検査により各粒状物質タイプの相対量が決定される。遠心による検査方法には、試料を遠心し、試料を構成成分の相対密度に従う構成成分層に分離させることが関わる。成分層は染色して、可視性又は検出を高めることができる。インピーダンスによる方法には、計測対象の粒状物質に従い処理された血液の正確な容積を調べることが関わる;例えば、有核細胞を計数するためRBCを溶解し、容積測定に基づき試料を導電性流体中に希釈する。この過程には、典型的には、狭小な通路を通る試料に印加される電流又は電圧をモニタすることにより、粒子が一列で通過するときの電流/電圧に対する粒子の影響を決定することが関わる。他の手法では、光線の中を一列に通過する粒状物質に入射する光の散乱の強度及び角度を分析することが関わる。フローサイトメトリーによる方法もまた用いることができ、これには、各細胞又は粒子タイプに存在する表面エピトープに対する抗体と結合したフルオロフォアにより、懸濁液中の対象の粒状物質を染色し、染色した粒状物質を適切な波長の光で励起して、個々の粒状物質/細胞の発光を分析することが関わる。
【発明の概要】
【発明が解決しようとする課題】
【0005】
前述の方法は全て、末梢血スメア又は遠心分離を除き、正確な容積の試料を計量分配する必要がある。試料容積が不正確であると、関連する分析において同じ規模の定量誤差が生じ得る。遠心による方法を除き、前述の方法は全て、試料を1つ又は複数の液体試薬又は希釈剤と混合することも必要で、且つ正確な結果を得るために器具のキャリブレーションも必要となる。末梢血スメアの場合、スメアを正しく検査するには高度な訓練が必要とされる。前述の方法の多くは、処理費用が高額な大量の汚染廃棄物が発生する。加えて、赤血球及び栓球が有核である鳥類、爬虫類、魚類、及び赤血球の大きさが極めて小さく、血小板と混同し得る特定の哺乳類では、上述の方法は全血球計算値(CBC)の決定には好適でない。
【0006】
ヒト又は動物の血液検査により決定することのできる情報量は膨大である。特に、RBC指数;例えば、個々の細胞の大きさ、個々の細胞のヘモグロビン含有量及び濃度、並びに試料中のRBCの集団統計量の決定が有用である。上記に参照したWintrobeのテキスト中の論考によって明らかなとおり、前述のパラメータの各々についての平均及び分散統計量(例えば、変動係数)もまた重要な情報を提供することができ、それにより医師は、RBCの障害をより適切に分類することが可能となっている。
【課題を解決するための手段】
【0007】
静止状態の血液試料中の構成成分を分析するための方法及び装置が提供される。本発明の一態様に従えば、血液試料を分析するための方法が提供され、この方法は、a)1つ又は複数の第1の構成成分と、1つ又は複数の第2の構成成分であって、第1の構成成分とは異なる第2の構成成分とを有する実質的に無希釈の血液試料を提供するステップと;b)被分析試料を静止状態に保つように構成された分析チャンバに試料を入れるステップであって、チャンバが第1のパネルと第2のパネルとにより画定され、それらのパネルは双方とも透明である、ステップと;c)着色剤を試料と混和するステップであって、この着色剤が、所定の第1の光の波長に曝露すると第1の構成成分及び第2の構成成分に蛍光を発生させるように機能し、及びこの着色剤が、1つ又は複数の所定の第2の光の波長の光を吸収するように機能する、ステップと;d)第1の構成成分と第2の構成成分とを含む試料の少なくとも一部分を第1の波長及び第2の波長で照明するステップと;e)その試料の少なくとも一部分を撮像するステップであって、第1の構成成分及び第2の構成成分からの蛍光発光と第1の構成成分及び第2の構成成分の光学濃度とを示す画像信号の生成を含む、ステップと;f)それらの画像信号を用いて、第1の構成成分及び第2の構成成分の各々についての蛍光値を決定するステップと;g)それらの画像信号を用いて、第1の構成成分及び第2の構成成分の各々についての光学濃度値を決定するステップであって、この光学濃度が、構成成分により吸収された着色剤に従い変わる、ステップと;h)決定された蛍光値と光学濃度値とを用いて、第1の構成成分及び第2の構成成分を同定するステップとを含む。
【0008】
本発明の別の態様に従えば、血液試料を分析するための方法が提供され、この方法は、a)1つ又は複数の第1の粒状物質と、1つ又は複数の第2の粒状物質であって、第1の粒状物質とは異なる第2の粒状物質とを有する実質的に無希釈の血液試料を提供するステップと;b)被分析試料を静止状態に保つように構成された分析チャンバに試料を入れるステップであって、チャンバが第1のパネルと第2のパネルとにより画定され、それらのパネルは双方とも透明である、ステップと;c)着色剤を試料と混和するステップであって、この着色剤が、所定の第1の光の波長に曝露すると第1の粒状物質及び第2の粒状物質に蛍光を発生させるように機能し、及びこの着色剤が、1つ又は複数の所定の第2の光の波長の光を吸収するように機能する、ステップと;d)第1の粒状物質と第2の粒状物質とを含む試料の少なくとも一部分を第1の波長及び第2の波長で照明するステップと;e)その試料の少なくとも一部分を撮像するステップであって、第1の粒状物質及び第2の粒状物質からの蛍光発光と第1の粒状物質及び第2の粒状物質の光学濃度とを示す画像信号の生成を含む、ステップと;f)それらの画像信号を用いて、第1の粒状物質及び第2の粒状物質の各々についての1つ又は複数の蛍光発光値を決定するステップと;g)それらの画像信号を用いて、第1の粒状物質及び第2の粒状物質の各々についての1つ又は複数の光学濃度値を決定するステップであって、この光学濃度が、粒状物質により吸収された着色剤に従い変わる、ステップと;h)決定された蛍光値と光学濃度値とを用いて、第1の粒状物質及び第2の粒状物質を同定するステップとを含む。
【0009】
本発明のさらに別の態様に従えば、血液試料を分析するための方法が提供され、この方法は、a)1つ又は複数の第1の構成成分と、1つ又は複数の第2の構成成分であって、第1の構成成分とは異なる第2の構成成分とを有する実質的に無希釈の血液試料を提供するステップと;b)被分析試料を静止状態に保つように構成された分析チャンバに試料を入れるステップであって、チャンバが第1のパネルと第2のパネルとにより画定され、それらのパネルは双方とも透明である、ステップと;c)着色剤を試料と混和するステップであって、この着色剤が、所定の光の波長に曝露すると第1の構成成分及び第2の構成成分に蛍光を発生させるように機能する、ステップと;d)第1の構成成分と第2の構成成分とを含む試料の少なくとも一部分を、その光の波長で一定のままある期間にわたり照明するステップと;e)その期間内の離散的な時点において試料の少なくとも一部分を撮像し、離散的な時点の各々についての第1の構成成分及び第2の構成成分からの蛍光発光を示す画像信号を生成するステップと;f)離散的な時点の各々についての画像信号を用いて、試料中に静止状態で含まれる第1の構成成分及び第2の構成成分の各々についての1つ又は複数の蛍光発光値を決定し、第1及び第2の構成成分の各々についての離散的な時点間における蛍光発光値の変化率を決定するステップと;g)決定された第1及び第2の構成成分の各々についての蛍光発光値の変化率を用いて、第1の構成成分及び第2の構成成分を同定するステップとを含む。
【0010】
本発明の利点は、毛細血管を穿刺することにより患者から直接採取され得るか(これは、ポイント・オブ・ケア用途に一層有用となる)、又は必要に応じて静脈血試料から得ることのできる極めて少量の試料容積を使用した血液試料の特性決定に用い得ることである。
【0011】
本方法の別の利点は、外部及び内部流動体なしに、且つ重力又は向きとは無関係に機能するため、手持ち型機器として微小重力条件下での使用に適応可能なことである。
【0012】
本方法及びそれに関連する利点が、添付の図面を含め、以下に提供される詳細な説明を考慮することでさらに容易に明らかとなるであろう。
【図面の簡単な説明】
【0013】
【図1】本方法で使用し得る分析チャンバの図式的な断面表示である。
【図2】本方法で使用し得る分析チャンバの図式的な断面表示である。
【図3】本方法で使用し得る分析チャンバの図式的な断面表示である。
【図4】本方法で使用し得る分析チャンバの図式的な断面表示である。
【図5】複数の分析チャンバを有するテープの図式的な平面図である。
【図6】分析チャンバを有する使い捨て容器の図式的な平面図である。
【図7】分析チャンバを有する使い捨て容器の図式的な断面図である。
【図8】本方法で使用し得る分析機器の図式的な略図である。
【図9】好中球についての時間に伴う蛍光減衰量を図式的に示すグラフである。
【図10】リンパ球についての時間に伴う蛍光減衰量を図式的に示すグラフである。
【発明を実施するための形態】
【0014】
本方法は、実質的に無希釈の抗凝固処理された全血の被分析試料を静止状態に保つように機能する分析チャンバを利用する。このチャンバは、典型的には約0.2〜1.0μlの試料を保持するサイズであるが、チャンバはいかなる特定の容積容量にも限定されず、容量は分析用途に合わせて変更することができる。語句「実質的に無希釈の」は、本明細書で使用されるとき、全く希釈されていないか、又は意図的に希釈されたわけではないが、分析のためにそこに何らかの試薬が添加されている血液試料を指す。試薬の添加により試料が希釈される程度では、あったとしても、かかる希釈は実施される分析に対して何ら臨床的に有意な影響をもたない。典型的には、本方法の実施に使用され得る試薬は、抗凝固薬(例えば、EDTA、ヘパリン)及び着色剤のみである。これらの試薬は一般に乾燥形態で添加され、試料の希釈を目的とするものではない。ある状況下では(例えば、超高速分析)、抗凝固剤の添加は必要でないこともあるが、試料が分析に適した形態であることを確実にするため、ほとんどの場合には添加することが好ましい。用語「静止状態」は、試料が分析用チャンバの中に入れられ、分析中、その試料がチャンバに対して意図的に動かされることがない;すなわち、試料がチャンバ内に静止状態で存在することを表すために用いられる。血液試料中に存在する運動の程度では、それは主に血液試料の有形の構成成分のブラウン運動によるもので、そうした運動によってこの発明の機器が使用不能になることはない。
【0015】
血液試料の少なくとも一部分と混和される着色剤(例えば、色素、染色剤等)は、着色剤を吸収する構成成分(例えば、WBC及び他の核を含む細胞、並びに血小板を含む粒状物質、並びにDNA及び/又はRNAを含む他の構成成分−例えば、細胞内又は細胞外の住血原虫−等)の定量分析を促進する。細胞及び粒状物質は、本明細書ではまとめて試料中の「構成成分」と称され得る。着色剤は、特定の波長(例えば、約470nm)に従う光によって励起されると、固有波長(例えば、530nm、585nm、及び660nm)に従う蛍光を発する。細胞が蛍光を発する具体的な波長は、当該の細胞及び励起光の1つ又は複数の波長の特性である。着色剤はまた、細胞内の着色剤濃度に従い1つ又は複数の所定波長の光を吸収する。許容可能な着色剤の例としては、超生体染色色素のアクリジンオレンジ及びアストロゾンオレンジ(astrozone orange)が挙げられる。しかしながら、本発明は超生体染色色素に限定されるものではない。
【0016】
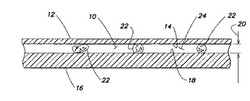
ここで図1を参照すると、分析チャンバ10は、内表面14を有する第1のパネル12と、内表面18を有する第2のパネル16とにより画定される。パネル12、16は双方とも十分に透明なため、以下に記載される光学濃度分析の実施に十分な量の所定波長に従う光を、それらのパネルに透過させることが可能である。パネル12、16の少なくとも一部分は互いに平行であり、その部分の範囲内で内表面14、18は高さ20だけ互いに隔たり、この高さは、既知であり得るか、又は計測可能であり得る。チャンバ10内に配置されているRBC22が示される。
【0017】
本方法は、前記特徴を有する様々な異なる分析チャンバタイプを利用することができ、従っていかなる特定のタイプの分析チャンバにも限定されることはない。平行なパネル12、16を有する分析チャンバは、それにより分析が簡略化されるため好ましいが、本発明に必須ではない;例えば、一方のパネルが他方のパネルに対して既知の非平行な角度で配置されたチャンバを使用してもよい。
【0018】
ここで図2〜5を参照すると、許容可能なチャンバ10の例が示され、これは、第1のパネル12と、第2のパネル16と、パネル12、16の間に配置された少なくとも3つのセパレータ26とを含む。セパレータ26は、パネル12、16の間に配置可能な、パネル12、16を互いに離間させるように機能する任意の構造であってよい。パネル12、16間に延在するセパレータ26の寸法28は、本明細書ではセパレータ26の高さ28と称される。セパレータ26の高さ28は、典型的には互いに正確に等しいわけではないが(例えば、製造公差)、同様の分析装置に使用される間隔保持手段についての商業的に許容可能な公差の範囲内である。球形ビーズは許容可能なセパレータ26の一例であり、例えば、Bangs Laboratories of Fishers、米国Indianaから市販されている。
【0019】
図3に示されるチャンバの実施形態では、セパレータ26は、第1のパネル12及び第2のパネル16の一方又は双方と比べて可撓性が高い材料からなる。図3で分かるとおり、より大きいセパレータ26は、ほとんどのセパレータ26がパネル12、16の内表面に接触している点まで圧縮され、そのためチャンバ高さはセパレータ26の平均直径よりほんの僅かに小さくなる。図4に示されるチャンバの実施形態では、セパレータ26は、第1のパネル12及び第2のパネル16の一方又は双方と比べて可撓性が低い材料からなる。図4では、第1のパネル12は球形セパレータ26及び第2のパネル16より可撓性の高い材料によって形成され、テントのような形でセパレータ26に被さる。この実施形態において、チャンバ10の局所的な小さい領域は所望のチャンバ高さ20から逸脱し得るが、チャンバ10の平均高さ20は、セパレータ26の平均直径の高さに極めて近似する。分析では、平均チャンバ高さ20は、この実施形態を使用する4μm未満のチャンバ高さにおいて約1パーセント(1%)又はそれ以上まで制御され得ることが示されている。上記の可撓性を有するという特性(並びにセパレータの分布密度などの他の要因)を前提として、セパレータ26及びパネル12、16は様々な材料で作製することができ、但しパネル12、16は十分に透明であるものとする。アクリル又はポリスチレンからなる透明プラスチックフィルムが、許容可能なパネル12、16の例であり、ポリスチレン、ポリカーボネート、シリコーンなどから作製される球形ビーズが、許容可能なセパレータ26である。許容可能なセパレータの具体例は、例えば、Thermo Scientific of Fremont、米国Californiaから、カタログ番号4204A、直径4ミクロン(4μm)で市販されているポリスチレン製の球体である。図5を参照すると、他方の上側に垂直方向に配置されるパネル12が、等間隔に配置された複数のポート30(例えば、通気孔として働く)を含み、パネル12、16は所定箇所で互いに結合される。いくつかの実施形態では、結合材料32がチャンバ外壁を形成し、試料34を分析チャンバ10内に横方向に収容するように機能する。許容可能な分析チャンバのこの例は、米国特許出願公開第2007/0243117号明細書、米国特許出願公開第2007/0087442号明細書、及び2008年4月2日に出願された米国仮特許出願第61/041,783号明細書;及び2008年10月31日に出願された米国仮特許出願第61/110,341号明細書(これらは全て、全体として参照により本明細書に援用される)にさらに詳細に記載されている。
【0020】
許容可能なチャンバ10の別の例は、図6及び図7に示されるとおりの使い捨て容器36に配置される。チャンバ10は、第1のパネル12と第2のパネル16との間に形成される。第1のパネル12及び第2のパネル16の双方とも透明なため、チャンバ10に光を通過させることができる。第1のパネル12及び第2のパネル16の少なくとも一部分は互いに平行であり、その部分の範囲内で内表面14、18は高さ20だけ互いに隔たっている。このチャンバ10の実施形態は、米国特許第6,723,290号明細書にさらに詳細に記載されており、この特許は、全体として参照により本明細書に援用される。図2〜図7に示される分析チャンバは、本方法における使用に適したチャンバに相当する。しかしながら、本方法はそれらの特定の実施形態に限定されるものではない。
【0021】
試料中のWBCは、チャンバパネルの双方の内表面に接触するものもあれば、そうでないものもあると思われる。本発明の目的上、それらが内表面に接触することは必須ではなく、且つチャンバの正確な高さが既知である必要はない。典型的なWBCの大きさと、WBCはある程度変形し得る(例えば、チャンバ内表面間に部分的に圧縮される)という事実とに基づくと、約2〜6ミクロン(2〜6μ)のチャンバ高さがほとんどの動物種に適している。約3〜5ミクロン(3〜5μ)のチャンバ高さ20が、特にヒト血液の分析には非常に好適である。ヒトWBCより実質的に大きい、又は小さいWBCを有する動物種の分析は、それぞれ、チャンバ高さがより高い、又はより低いそれぞれのチャンバで実施することができる。
【0022】
チャンバ10内に静止状態で配置された試料の分析は、試料の少なくとも一部分を照明して撮像し、画像に関する分析を実施するように機能する分析機器を使用して実施される。画像は、試料の一部分からの蛍光発光、及びその光学濃度を、ユニット毎ベースで決定することが可能な形で生成される。用語「ユニット毎ベース」又は「画像ユニット」は、試料の画像を解像することのできる定義された増分単位を意味する。「画素」は、特定の撮像システムにおいて個々に処理することのできる画像の最小要素として一般に定義され、画像ユニットの一例であり、また画像ユニットとしては、集合的な単位としての少数の画素も含まれ得る。撮像機器の拡大率は、線形的な関係(例えば、焦点面におけるマイクロメートル毎画素)として表すこともでき、この場合、線の寸法は、画像に適用される直交格子の特定の軸に従う。そのため、焦点面においてセンサの画素により捕捉される実際の試料面積は、撮像機器が適用する拡大倍率に従い変わる。従って、必須ではないが、撮像機器の拡大率が既知であることは有用である。従って、当該の画素に関連する容積は、画素毎の画像の面積にチャンバ高さを掛けたものである。例えば、拡大率が0.5μm毎画素であったならば、200画素を占有する画像の面積は50平方μmとなり、容積は50平方μm×チャンバ高さとなる。
【0023】
ここで図8を参照すると、本方法での使用向けに構成することのできる分析機器44の例であり、これは、試料照明器46と、解像装置48と、プログラム可能分析器50とを含む。試料照明器46は、特定の所望の波長に従う光を選択的に発生する光源を含む。例えば、所望の波長(例えば、420nm、440nm、470nm等)を発するLEDを使用することができる。或いは、広い波長範囲(例えば、約400〜670nm)を生じる光源を使用してもよく、しかし場合によっては、かかる光源はフィルタリングが必要となり得る。分析機器44は、光を操作するための光学素子を含む。試料照明器46は透過光源と落射光源とを含み、各々、チャンバ10内に存在する試料の一部又は全部を照明するように機能する。許容可能な解像装置48の一例は、試料を通過する光の像を電子データ形式(すなわち、信号)に変換する電荷結合素子(CCD)である。プログラム可能分析器50は中央演算処理装置(CPU)を含み、試料照明器46及び解像装置48に接続される。CPUは、本方法の実施に必要な機能を選択的に実行するように構成される(例えば、プログラムされる)。全体として参照により本明細書に援用される、「Apparatus for Analyzing Biologic Fluids」と題される2005年3月15日に発行された米国特許第6,866,823号明細書が、かかる分析機器44を開示している。
【0024】
分析機器は、1)試料の少なくとも一部分を撮像し、撮像された試料からの蛍光発光と撮像された試料の光学濃度とを示す画像信号を画素毎ベースで生成し;2)それらの画像信号を用いて、全て静止状態で試料部分内に存在する第1のタイプの1つ又は複数の構成成分及び第2のタイプの1つ又は複数の構成成分についての蛍光値を決定し;3)撮像された第1及び第2のタイプの構成成分の各々についての光学濃度値を決定し;及び4)決定された蛍光値及び光学濃度値を用いて、第1のタイプの構成成分及び第2のタイプの構成成分を同定するように構成される。
【0025】
本方法に従えば、実質的に無希釈の全血の試料は、チャンバ10に導入された後、上記のとおり静止状態で存在する。試料のチャンバへの導入前か、又はチャンバへの導入時に、抗凝固剤及び着色剤が試料と混和される。着色剤は、試料中の細胞(例えば、WBC及び血小板)により吸収される。以下において個々のWBCを参照する場合、個々の血小板、又は試料中の他の構成成分に対しても同じ手順が適用される。チャンバ内に静止状態で存在する試料の少なくとも一部分が分析機器44により照明され、それにより試料に光が透過する。チャンバ内に存在する試料の全体を撮像することは必須ではないが、そうすることで、典型的には試料のより完全な分析が提供され、それに伴い精度が増すため、好ましい。
【0026】
試料は、WBCにより吸収された着色剤に関連して細胞からの蛍光発光を励起することが分かっている波長によって照明される。アクリジンオレンジで染色されたWBCは、約470nmの波長の紫色光で照明すると、蛍光発光を生じる。具体的な発光は、用いられる着色剤と、照明された細胞の細胞内組成とに依存する(例えば、着色剤が細胞のRNA及び/又はDNAと相互作用すると、発光が生じる)。一部のWBCは、蛍光定量上のシグネチャとして働く蛍光発光を有し、この蛍光発光は当該のWBCに比較的特有であるため、当該のWBCの同定に用いることができる。他のWBCは、互いを容易には識別することのできない蛍光発光シグネチャを有する。こうした「共通の」発光シグネチャを有するWBCは、第1のタイプのWBC又は第2のタイプのWBCとして分類され得るが、2つのWBCタイプの識別には、何らか別のものが必要である。
【0027】
試料は、蛍光発光を生じさせるために照明されると同時に(又はその後に続いて)、着色剤によって吸収される1つ又は複数の波長に従ってもまた照明される。例えば、アクリジンオレンジで染色されたWBCは、アクリジンオレンジが存在するため、約420nmの波長の光を吸収する。光学濃度(OD)で示され得る吸収量は、WBC内の着色剤の濃度及び局所条件(例えば、pH)に従い変わる。同じ量の着色剤に曝露されたときの、WBCの着色剤を吸収する性質は、一部のWBC細胞タイプ間で、細胞の生物学的特性に従い異なる。例えば、WBC内の生物学的特性(例えば、核材料、細胞質等)が異なると、吸収する色素の濃度が異なる。各細胞タイプのこうした異なる生物学的特性、及びそれに関連して異なる、それらの特性によって吸収される着色剤の濃度を利用して、特定の細胞タイプを識別することができる。細胞内の着色剤の濃度に従い変わる細胞のODを利用して、種々の細胞タイプを識別及び同定することができる。用途によっては、細胞間のODの違いは、細胞の同定を可能とするのに十分な情報を提供することができる。他の場合には、蛍光定量上のシグネチャと細胞のODとを用いて同定が達成される。
【0028】
本発明の例を示すため、実質的に無希釈の血液試料をアクリジンオレンジと混和し、2枚の透明パネルを有するチャンバに導入する。試料は静止状態で存在し、試料中の複数のWBCがチャンバの双方の内表面と接触する。試料は、470nm及び420nmで照明する。470nmでの照明は、蛍光発光を生じさせる。420nmでの照明は、着色剤によって吸収される。照明された試料のデジタル画像を取得する。好中球と好酸球とを含むWBC群が、撮像された試料内に存在するWBC集団全体の中に同定され、当該の群を画像内で「分離」する;これは例えば、その群のみが見えるように画像をフィルタリングすることによる。好中球及び好酸球の各々は、励起すると、顕著な細胞質の赤色蛍光と核の緑色蛍光とからなるシグネチャ蛍光パターンを生じるため、これらのWBCタイプが同定される。しかしながら、群内の好中球と好酸球との蛍光発光は、互いにかなり類似しているため、WBCのこの2つのタイプを識別することは困難である。
【0029】
群内のこの2つのタイプのWBCを識別するため、分離したWBCの光学濃度を比較する。平均して、好酸球中に吸収されたアクリジンオレンジの濃度は、好中球中に吸収されたアクリジンオレンジの濃度より高く、しかし蛍光は同等であり得る。これは、好酸球内の着色剤の蛍光が、好中球内の着色剤の蛍光と比べて、好酸球の細胞内容物に特有の性質に起因して消光されるためである。WBCの2つの異なるタイプは、例えば、所定のODカットオフ値を用いて;例えば、分離された群内でカットオフ値より大きいODを有する細胞を好酸球と見なし、カットオフ値未満のODを有する細胞を好中球と見なすことにより、別個のサブ群として識別することができる。
【0030】
或いは、WBCの2つのタイプは、そのOD計測値を、分析機器;例えばルックアップテーブル等に格納されている実験的に求めたOD値と比較することにより識別することができる。
【0031】
さらに別のものとして、2つのWBCサブ群は、細胞質蛍光の細胞質ODに対する比(蛍光/OD)を個々の細胞ベースで決定することにより互いに識別することができる。この比を与えるため、特定の細胞についての画素毎ベースでの蛍光発光値及び光学濃度値を決定して平均値を求めてもよく、その平均値を比に用いることができる。比は、画素毎ベースで比を決定して、画素毎の比の平均値を求めるなど、代替的方法を用いて決定してもよい。蛍光のODに対する比は、特定の細胞内における染色剤の蛍光の消光を定量的に表す。比が低い細胞は、蛍光信号の「消光」を示している。分離した群内の全ての細胞の比を統計的に評価して、2つの集団間の分離点を決定することができる。統計的に分離点を下回る細胞は、その蛍光のODに対する比が好中球の集団に関連する比より低いため、好酸球である。同様に、統計的に分離点を上回る細胞は、その蛍光のODに対する比が好酸球の集団に関連する比より高いため、好中球である。
【0032】
上記の蛍光/OD比の分析のさらなる実施形態において、比は、被験細胞からの上記の平均OD値及び蛍光発光値(又は50%より大きい割合の範囲内にあるOD値及び蛍光発光値)を用いて決定することができる。説明のため、着色剤に曝露された特定の細胞における着色剤の濃度が、第1の領域(例えば、核の領域)において、第2の領域(例えば、細胞質の領域)より低いものとし得る。結果的に、細胞の第2の領域(例えば細胞質)のODは、細胞の第1の領域(例えば、核)のODより高くなる。同様に、細胞の特定の領域からの蛍光発光が、別の領域からの発光より大きいものとし得る。蛍光発光/OD値のうち、その値がより高い発光強度又はODを表す部分を選択的に用いると、結果として雑音対信号比が向上し、分析が促進される。この態様は、着色剤が典型的には、例えば細胞の細胞質内の顆粒の中で、選択的に分散するという事実を利用している。
【0033】
本発明のさらなる実施形態において、試料中の細胞は、着色剤と混和した細胞を、蛍光発光を励起する波長(例えば、470nm)の光を一定に放射して「退色」させ、ある期間内の離散的な時点で発光の大きさを検知することにより、互いに識別することができる。特定の細胞タイプからの蛍光発光強度の平均低下率は、当該の細胞タイプについて一定であり、しかしこの平均の率は、細胞のタイプによって異なる。従って、発光強度の減少率を用いて細胞タイプを識別することができる。例えば、図9は、光退色に供された個々の好中球についての緑色蛍光発光の減衰率52、54、56と、それらの好中球についての平均減衰率58とを示す。図10は、同じ光退色に供された個々のリンパ球についての緑色蛍光発光の減衰率60、62と、それらのリンパ球の平均値64とを示す。図9及び図10に示される曲線は、異なる細胞タイプについては減衰率が異なり、そうした異なる減衰率を用いて被分析細胞のタイプを同定し得ることを明らかに示している。発光の減少率を用いると、年齢などの他の特徴により細胞を識別することもできる;例えば、あるタイプの、但し年齢が異なる細胞は、固有の発光減少率を有し、これを用いて様々な異なる年齢群を識別することができる。
【0034】
本発明は、その詳細な実施形態に関して図示及び説明されているが、当業者は、本発明の趣旨及び範囲から逸脱することなく、様々な形態及び詳細の変更が行われ得ることを理解するであろう。
【0035】
特許請求の範囲は以下のとおりである。
【技術分野】
【0001】
本願は、2008年3月21日に出願された米国仮特許出願第61/038,578号明細書に開示される本質的主題の利益を享受し、それを参照により援用する。
【0002】
本発明は、概して血液試料を分析するための装置及び方法に関し、特に、細胞又は粒状物質などの、試料中の構成成分を検出、同定、及び計数するための装置及び方法に関する。
【背景技術】
【0003】
医師、獣医師及び科学者は、構成物質の量を決定し、さらに健常な被験体には見られない異常な構成物質の存在を同定するため、ヒト及び動物の生体体液、特に血液を調べている。一般に計測、定量及び同定される構成物質としては、赤血球(RBC)、白血球(WBC)、及び血小板が挙げられる。RBC分析には、RBCの数、大きさ、容積、形状、ヘモグロビン含有量及び濃度、並びにヘマトクリット(血中血球容積とも称される)の測定が含まれ得る。RBC分析にはまた、RBCにおける住血原虫(例えば、マラリア原虫)か、又はWBCにおける細胞外の、若しくはリーシュマニア症の病原生物であるトリパノソーマ、並びに他の多くの住血原虫の存在の検出及び/又は計数を含め、赤血球細胞中の特定の成分、例えばDNA、RNAの存在及び/又は濃度の決定も関わり得る。WBC分析には、一般にはWBC分画と称されるWBCサブタイプの集団内頻度の決定、並びに健常な被験体には見られない任意の異常な細胞タイプの報告が含まれ得る。血小板(又は、鳥類、爬虫類及び魚類を含む特定の動物においては栓球、これは、哺乳類における血小板の機能と同様だが、10倍程大きく有核である)の分析には、試料中の血小板又は栓球の凝集塊の存在についての決定を含め、血小板の数、大きさ、形状・構造、及び容積の決定が含まれ得る。
【0004】
「Wintrobe’s Clinical Hematology」第12版などの医学テキストに詳細に記載されている公知の血液検査手法では、概して検査方法は、手動、遠心、及びインピーダンスを用いるタイプの方法に分けられる。手動で行う方法には、典型的には、正確に測定された容積の血液又は体液試料を作成し、それを定量的に希釈して、計数チャンバにおいて目視で数をカウントすることが関わる。手動での検査方法には、末梢血スメアを調べることが含まれ、そこでは目視検査により各粒状物質タイプの相対量が決定される。遠心による検査方法には、試料を遠心し、試料を構成成分の相対密度に従う構成成分層に分離させることが関わる。成分層は染色して、可視性又は検出を高めることができる。インピーダンスによる方法には、計測対象の粒状物質に従い処理された血液の正確な容積を調べることが関わる;例えば、有核細胞を計数するためRBCを溶解し、容積測定に基づき試料を導電性流体中に希釈する。この過程には、典型的には、狭小な通路を通る試料に印加される電流又は電圧をモニタすることにより、粒子が一列で通過するときの電流/電圧に対する粒子の影響を決定することが関わる。他の手法では、光線の中を一列に通過する粒状物質に入射する光の散乱の強度及び角度を分析することが関わる。フローサイトメトリーによる方法もまた用いることができ、これには、各細胞又は粒子タイプに存在する表面エピトープに対する抗体と結合したフルオロフォアにより、懸濁液中の対象の粒状物質を染色し、染色した粒状物質を適切な波長の光で励起して、個々の粒状物質/細胞の発光を分析することが関わる。
【発明の概要】
【発明が解決しようとする課題】
【0005】
前述の方法は全て、末梢血スメア又は遠心分離を除き、正確な容積の試料を計量分配する必要がある。試料容積が不正確であると、関連する分析において同じ規模の定量誤差が生じ得る。遠心による方法を除き、前述の方法は全て、試料を1つ又は複数の液体試薬又は希釈剤と混合することも必要で、且つ正確な結果を得るために器具のキャリブレーションも必要となる。末梢血スメアの場合、スメアを正しく検査するには高度な訓練が必要とされる。前述の方法の多くは、処理費用が高額な大量の汚染廃棄物が発生する。加えて、赤血球及び栓球が有核である鳥類、爬虫類、魚類、及び赤血球の大きさが極めて小さく、血小板と混同し得る特定の哺乳類では、上述の方法は全血球計算値(CBC)の決定には好適でない。
【0006】
ヒト又は動物の血液検査により決定することのできる情報量は膨大である。特に、RBC指数;例えば、個々の細胞の大きさ、個々の細胞のヘモグロビン含有量及び濃度、並びに試料中のRBCの集団統計量の決定が有用である。上記に参照したWintrobeのテキスト中の論考によって明らかなとおり、前述のパラメータの各々についての平均及び分散統計量(例えば、変動係数)もまた重要な情報を提供することができ、それにより医師は、RBCの障害をより適切に分類することが可能となっている。
【課題を解決するための手段】
【0007】
静止状態の血液試料中の構成成分を分析するための方法及び装置が提供される。本発明の一態様に従えば、血液試料を分析するための方法が提供され、この方法は、a)1つ又は複数の第1の構成成分と、1つ又は複数の第2の構成成分であって、第1の構成成分とは異なる第2の構成成分とを有する実質的に無希釈の血液試料を提供するステップと;b)被分析試料を静止状態に保つように構成された分析チャンバに試料を入れるステップであって、チャンバが第1のパネルと第2のパネルとにより画定され、それらのパネルは双方とも透明である、ステップと;c)着色剤を試料と混和するステップであって、この着色剤が、所定の第1の光の波長に曝露すると第1の構成成分及び第2の構成成分に蛍光を発生させるように機能し、及びこの着色剤が、1つ又は複数の所定の第2の光の波長の光を吸収するように機能する、ステップと;d)第1の構成成分と第2の構成成分とを含む試料の少なくとも一部分を第1の波長及び第2の波長で照明するステップと;e)その試料の少なくとも一部分を撮像するステップであって、第1の構成成分及び第2の構成成分からの蛍光発光と第1の構成成分及び第2の構成成分の光学濃度とを示す画像信号の生成を含む、ステップと;f)それらの画像信号を用いて、第1の構成成分及び第2の構成成分の各々についての蛍光値を決定するステップと;g)それらの画像信号を用いて、第1の構成成分及び第2の構成成分の各々についての光学濃度値を決定するステップであって、この光学濃度が、構成成分により吸収された着色剤に従い変わる、ステップと;h)決定された蛍光値と光学濃度値とを用いて、第1の構成成分及び第2の構成成分を同定するステップとを含む。
【0008】
本発明の別の態様に従えば、血液試料を分析するための方法が提供され、この方法は、a)1つ又は複数の第1の粒状物質と、1つ又は複数の第2の粒状物質であって、第1の粒状物質とは異なる第2の粒状物質とを有する実質的に無希釈の血液試料を提供するステップと;b)被分析試料を静止状態に保つように構成された分析チャンバに試料を入れるステップであって、チャンバが第1のパネルと第2のパネルとにより画定され、それらのパネルは双方とも透明である、ステップと;c)着色剤を試料と混和するステップであって、この着色剤が、所定の第1の光の波長に曝露すると第1の粒状物質及び第2の粒状物質に蛍光を発生させるように機能し、及びこの着色剤が、1つ又は複数の所定の第2の光の波長の光を吸収するように機能する、ステップと;d)第1の粒状物質と第2の粒状物質とを含む試料の少なくとも一部分を第1の波長及び第2の波長で照明するステップと;e)その試料の少なくとも一部分を撮像するステップであって、第1の粒状物質及び第2の粒状物質からの蛍光発光と第1の粒状物質及び第2の粒状物質の光学濃度とを示す画像信号の生成を含む、ステップと;f)それらの画像信号を用いて、第1の粒状物質及び第2の粒状物質の各々についての1つ又は複数の蛍光発光値を決定するステップと;g)それらの画像信号を用いて、第1の粒状物質及び第2の粒状物質の各々についての1つ又は複数の光学濃度値を決定するステップであって、この光学濃度が、粒状物質により吸収された着色剤に従い変わる、ステップと;h)決定された蛍光値と光学濃度値とを用いて、第1の粒状物質及び第2の粒状物質を同定するステップとを含む。
【0009】
本発明のさらに別の態様に従えば、血液試料を分析するための方法が提供され、この方法は、a)1つ又は複数の第1の構成成分と、1つ又は複数の第2の構成成分であって、第1の構成成分とは異なる第2の構成成分とを有する実質的に無希釈の血液試料を提供するステップと;b)被分析試料を静止状態に保つように構成された分析チャンバに試料を入れるステップであって、チャンバが第1のパネルと第2のパネルとにより画定され、それらのパネルは双方とも透明である、ステップと;c)着色剤を試料と混和するステップであって、この着色剤が、所定の光の波長に曝露すると第1の構成成分及び第2の構成成分に蛍光を発生させるように機能する、ステップと;d)第1の構成成分と第2の構成成分とを含む試料の少なくとも一部分を、その光の波長で一定のままある期間にわたり照明するステップと;e)その期間内の離散的な時点において試料の少なくとも一部分を撮像し、離散的な時点の各々についての第1の構成成分及び第2の構成成分からの蛍光発光を示す画像信号を生成するステップと;f)離散的な時点の各々についての画像信号を用いて、試料中に静止状態で含まれる第1の構成成分及び第2の構成成分の各々についての1つ又は複数の蛍光発光値を決定し、第1及び第2の構成成分の各々についての離散的な時点間における蛍光発光値の変化率を決定するステップと;g)決定された第1及び第2の構成成分の各々についての蛍光発光値の変化率を用いて、第1の構成成分及び第2の構成成分を同定するステップとを含む。
【0010】
本発明の利点は、毛細血管を穿刺することにより患者から直接採取され得るか(これは、ポイント・オブ・ケア用途に一層有用となる)、又は必要に応じて静脈血試料から得ることのできる極めて少量の試料容積を使用した血液試料の特性決定に用い得ることである。
【0011】
本方法の別の利点は、外部及び内部流動体なしに、且つ重力又は向きとは無関係に機能するため、手持ち型機器として微小重力条件下での使用に適応可能なことである。
【0012】
本方法及びそれに関連する利点が、添付の図面を含め、以下に提供される詳細な説明を考慮することでさらに容易に明らかとなるであろう。
【図面の簡単な説明】
【0013】
【図1】本方法で使用し得る分析チャンバの図式的な断面表示である。
【図2】本方法で使用し得る分析チャンバの図式的な断面表示である。
【図3】本方法で使用し得る分析チャンバの図式的な断面表示である。
【図4】本方法で使用し得る分析チャンバの図式的な断面表示である。
【図5】複数の分析チャンバを有するテープの図式的な平面図である。
【図6】分析チャンバを有する使い捨て容器の図式的な平面図である。
【図7】分析チャンバを有する使い捨て容器の図式的な断面図である。
【図8】本方法で使用し得る分析機器の図式的な略図である。
【図9】好中球についての時間に伴う蛍光減衰量を図式的に示すグラフである。
【図10】リンパ球についての時間に伴う蛍光減衰量を図式的に示すグラフである。
【発明を実施するための形態】
【0014】
本方法は、実質的に無希釈の抗凝固処理された全血の被分析試料を静止状態に保つように機能する分析チャンバを利用する。このチャンバは、典型的には約0.2〜1.0μlの試料を保持するサイズであるが、チャンバはいかなる特定の容積容量にも限定されず、容量は分析用途に合わせて変更することができる。語句「実質的に無希釈の」は、本明細書で使用されるとき、全く希釈されていないか、又は意図的に希釈されたわけではないが、分析のためにそこに何らかの試薬が添加されている血液試料を指す。試薬の添加により試料が希釈される程度では、あったとしても、かかる希釈は実施される分析に対して何ら臨床的に有意な影響をもたない。典型的には、本方法の実施に使用され得る試薬は、抗凝固薬(例えば、EDTA、ヘパリン)及び着色剤のみである。これらの試薬は一般に乾燥形態で添加され、試料の希釈を目的とするものではない。ある状況下では(例えば、超高速分析)、抗凝固剤の添加は必要でないこともあるが、試料が分析に適した形態であることを確実にするため、ほとんどの場合には添加することが好ましい。用語「静止状態」は、試料が分析用チャンバの中に入れられ、分析中、その試料がチャンバに対して意図的に動かされることがない;すなわち、試料がチャンバ内に静止状態で存在することを表すために用いられる。血液試料中に存在する運動の程度では、それは主に血液試料の有形の構成成分のブラウン運動によるもので、そうした運動によってこの発明の機器が使用不能になることはない。
【0015】
血液試料の少なくとも一部分と混和される着色剤(例えば、色素、染色剤等)は、着色剤を吸収する構成成分(例えば、WBC及び他の核を含む細胞、並びに血小板を含む粒状物質、並びにDNA及び/又はRNAを含む他の構成成分−例えば、細胞内又は細胞外の住血原虫−等)の定量分析を促進する。細胞及び粒状物質は、本明細書ではまとめて試料中の「構成成分」と称され得る。着色剤は、特定の波長(例えば、約470nm)に従う光によって励起されると、固有波長(例えば、530nm、585nm、及び660nm)に従う蛍光を発する。細胞が蛍光を発する具体的な波長は、当該の細胞及び励起光の1つ又は複数の波長の特性である。着色剤はまた、細胞内の着色剤濃度に従い1つ又は複数の所定波長の光を吸収する。許容可能な着色剤の例としては、超生体染色色素のアクリジンオレンジ及びアストロゾンオレンジ(astrozone orange)が挙げられる。しかしながら、本発明は超生体染色色素に限定されるものではない。
【0016】
ここで図1を参照すると、分析チャンバ10は、内表面14を有する第1のパネル12と、内表面18を有する第2のパネル16とにより画定される。パネル12、16は双方とも十分に透明なため、以下に記載される光学濃度分析の実施に十分な量の所定波長に従う光を、それらのパネルに透過させることが可能である。パネル12、16の少なくとも一部分は互いに平行であり、その部分の範囲内で内表面14、18は高さ20だけ互いに隔たり、この高さは、既知であり得るか、又は計測可能であり得る。チャンバ10内に配置されているRBC22が示される。
【0017】
本方法は、前記特徴を有する様々な異なる分析チャンバタイプを利用することができ、従っていかなる特定のタイプの分析チャンバにも限定されることはない。平行なパネル12、16を有する分析チャンバは、それにより分析が簡略化されるため好ましいが、本発明に必須ではない;例えば、一方のパネルが他方のパネルに対して既知の非平行な角度で配置されたチャンバを使用してもよい。
【0018】
ここで図2〜5を参照すると、許容可能なチャンバ10の例が示され、これは、第1のパネル12と、第2のパネル16と、パネル12、16の間に配置された少なくとも3つのセパレータ26とを含む。セパレータ26は、パネル12、16の間に配置可能な、パネル12、16を互いに離間させるように機能する任意の構造であってよい。パネル12、16間に延在するセパレータ26の寸法28は、本明細書ではセパレータ26の高さ28と称される。セパレータ26の高さ28は、典型的には互いに正確に等しいわけではないが(例えば、製造公差)、同様の分析装置に使用される間隔保持手段についての商業的に許容可能な公差の範囲内である。球形ビーズは許容可能なセパレータ26の一例であり、例えば、Bangs Laboratories of Fishers、米国Indianaから市販されている。
【0019】
図3に示されるチャンバの実施形態では、セパレータ26は、第1のパネル12及び第2のパネル16の一方又は双方と比べて可撓性が高い材料からなる。図3で分かるとおり、より大きいセパレータ26は、ほとんどのセパレータ26がパネル12、16の内表面に接触している点まで圧縮され、そのためチャンバ高さはセパレータ26の平均直径よりほんの僅かに小さくなる。図4に示されるチャンバの実施形態では、セパレータ26は、第1のパネル12及び第2のパネル16の一方又は双方と比べて可撓性が低い材料からなる。図4では、第1のパネル12は球形セパレータ26及び第2のパネル16より可撓性の高い材料によって形成され、テントのような形でセパレータ26に被さる。この実施形態において、チャンバ10の局所的な小さい領域は所望のチャンバ高さ20から逸脱し得るが、チャンバ10の平均高さ20は、セパレータ26の平均直径の高さに極めて近似する。分析では、平均チャンバ高さ20は、この実施形態を使用する4μm未満のチャンバ高さにおいて約1パーセント(1%)又はそれ以上まで制御され得ることが示されている。上記の可撓性を有するという特性(並びにセパレータの分布密度などの他の要因)を前提として、セパレータ26及びパネル12、16は様々な材料で作製することができ、但しパネル12、16は十分に透明であるものとする。アクリル又はポリスチレンからなる透明プラスチックフィルムが、許容可能なパネル12、16の例であり、ポリスチレン、ポリカーボネート、シリコーンなどから作製される球形ビーズが、許容可能なセパレータ26である。許容可能なセパレータの具体例は、例えば、Thermo Scientific of Fremont、米国Californiaから、カタログ番号4204A、直径4ミクロン(4μm)で市販されているポリスチレン製の球体である。図5を参照すると、他方の上側に垂直方向に配置されるパネル12が、等間隔に配置された複数のポート30(例えば、通気孔として働く)を含み、パネル12、16は所定箇所で互いに結合される。いくつかの実施形態では、結合材料32がチャンバ外壁を形成し、試料34を分析チャンバ10内に横方向に収容するように機能する。許容可能な分析チャンバのこの例は、米国特許出願公開第2007/0243117号明細書、米国特許出願公開第2007/0087442号明細書、及び2008年4月2日に出願された米国仮特許出願第61/041,783号明細書;及び2008年10月31日に出願された米国仮特許出願第61/110,341号明細書(これらは全て、全体として参照により本明細書に援用される)にさらに詳細に記載されている。
【0020】
許容可能なチャンバ10の別の例は、図6及び図7に示されるとおりの使い捨て容器36に配置される。チャンバ10は、第1のパネル12と第2のパネル16との間に形成される。第1のパネル12及び第2のパネル16の双方とも透明なため、チャンバ10に光を通過させることができる。第1のパネル12及び第2のパネル16の少なくとも一部分は互いに平行であり、その部分の範囲内で内表面14、18は高さ20だけ互いに隔たっている。このチャンバ10の実施形態は、米国特許第6,723,290号明細書にさらに詳細に記載されており、この特許は、全体として参照により本明細書に援用される。図2〜図7に示される分析チャンバは、本方法における使用に適したチャンバに相当する。しかしながら、本方法はそれらの特定の実施形態に限定されるものではない。
【0021】
試料中のWBCは、チャンバパネルの双方の内表面に接触するものもあれば、そうでないものもあると思われる。本発明の目的上、それらが内表面に接触することは必須ではなく、且つチャンバの正確な高さが既知である必要はない。典型的なWBCの大きさと、WBCはある程度変形し得る(例えば、チャンバ内表面間に部分的に圧縮される)という事実とに基づくと、約2〜6ミクロン(2〜6μ)のチャンバ高さがほとんどの動物種に適している。約3〜5ミクロン(3〜5μ)のチャンバ高さ20が、特にヒト血液の分析には非常に好適である。ヒトWBCより実質的に大きい、又は小さいWBCを有する動物種の分析は、それぞれ、チャンバ高さがより高い、又はより低いそれぞれのチャンバで実施することができる。
【0022】
チャンバ10内に静止状態で配置された試料の分析は、試料の少なくとも一部分を照明して撮像し、画像に関する分析を実施するように機能する分析機器を使用して実施される。画像は、試料の一部分からの蛍光発光、及びその光学濃度を、ユニット毎ベースで決定することが可能な形で生成される。用語「ユニット毎ベース」又は「画像ユニット」は、試料の画像を解像することのできる定義された増分単位を意味する。「画素」は、特定の撮像システムにおいて個々に処理することのできる画像の最小要素として一般に定義され、画像ユニットの一例であり、また画像ユニットとしては、集合的な単位としての少数の画素も含まれ得る。撮像機器の拡大率は、線形的な関係(例えば、焦点面におけるマイクロメートル毎画素)として表すこともでき、この場合、線の寸法は、画像に適用される直交格子の特定の軸に従う。そのため、焦点面においてセンサの画素により捕捉される実際の試料面積は、撮像機器が適用する拡大倍率に従い変わる。従って、必須ではないが、撮像機器の拡大率が既知であることは有用である。従って、当該の画素に関連する容積は、画素毎の画像の面積にチャンバ高さを掛けたものである。例えば、拡大率が0.5μm毎画素であったならば、200画素を占有する画像の面積は50平方μmとなり、容積は50平方μm×チャンバ高さとなる。
【0023】
ここで図8を参照すると、本方法での使用向けに構成することのできる分析機器44の例であり、これは、試料照明器46と、解像装置48と、プログラム可能分析器50とを含む。試料照明器46は、特定の所望の波長に従う光を選択的に発生する光源を含む。例えば、所望の波長(例えば、420nm、440nm、470nm等)を発するLEDを使用することができる。或いは、広い波長範囲(例えば、約400〜670nm)を生じる光源を使用してもよく、しかし場合によっては、かかる光源はフィルタリングが必要となり得る。分析機器44は、光を操作するための光学素子を含む。試料照明器46は透過光源と落射光源とを含み、各々、チャンバ10内に存在する試料の一部又は全部を照明するように機能する。許容可能な解像装置48の一例は、試料を通過する光の像を電子データ形式(すなわち、信号)に変換する電荷結合素子(CCD)である。プログラム可能分析器50は中央演算処理装置(CPU)を含み、試料照明器46及び解像装置48に接続される。CPUは、本方法の実施に必要な機能を選択的に実行するように構成される(例えば、プログラムされる)。全体として参照により本明細書に援用される、「Apparatus for Analyzing Biologic Fluids」と題される2005年3月15日に発行された米国特許第6,866,823号明細書が、かかる分析機器44を開示している。
【0024】
分析機器は、1)試料の少なくとも一部分を撮像し、撮像された試料からの蛍光発光と撮像された試料の光学濃度とを示す画像信号を画素毎ベースで生成し;2)それらの画像信号を用いて、全て静止状態で試料部分内に存在する第1のタイプの1つ又は複数の構成成分及び第2のタイプの1つ又は複数の構成成分についての蛍光値を決定し;3)撮像された第1及び第2のタイプの構成成分の各々についての光学濃度値を決定し;及び4)決定された蛍光値及び光学濃度値を用いて、第1のタイプの構成成分及び第2のタイプの構成成分を同定するように構成される。
【0025】
本方法に従えば、実質的に無希釈の全血の試料は、チャンバ10に導入された後、上記のとおり静止状態で存在する。試料のチャンバへの導入前か、又はチャンバへの導入時に、抗凝固剤及び着色剤が試料と混和される。着色剤は、試料中の細胞(例えば、WBC及び血小板)により吸収される。以下において個々のWBCを参照する場合、個々の血小板、又は試料中の他の構成成分に対しても同じ手順が適用される。チャンバ内に静止状態で存在する試料の少なくとも一部分が分析機器44により照明され、それにより試料に光が透過する。チャンバ内に存在する試料の全体を撮像することは必須ではないが、そうすることで、典型的には試料のより完全な分析が提供され、それに伴い精度が増すため、好ましい。
【0026】
試料は、WBCにより吸収された着色剤に関連して細胞からの蛍光発光を励起することが分かっている波長によって照明される。アクリジンオレンジで染色されたWBCは、約470nmの波長の紫色光で照明すると、蛍光発光を生じる。具体的な発光は、用いられる着色剤と、照明された細胞の細胞内組成とに依存する(例えば、着色剤が細胞のRNA及び/又はDNAと相互作用すると、発光が生じる)。一部のWBCは、蛍光定量上のシグネチャとして働く蛍光発光を有し、この蛍光発光は当該のWBCに比較的特有であるため、当該のWBCの同定に用いることができる。他のWBCは、互いを容易には識別することのできない蛍光発光シグネチャを有する。こうした「共通の」発光シグネチャを有するWBCは、第1のタイプのWBC又は第2のタイプのWBCとして分類され得るが、2つのWBCタイプの識別には、何らか別のものが必要である。
【0027】
試料は、蛍光発光を生じさせるために照明されると同時に(又はその後に続いて)、着色剤によって吸収される1つ又は複数の波長に従ってもまた照明される。例えば、アクリジンオレンジで染色されたWBCは、アクリジンオレンジが存在するため、約420nmの波長の光を吸収する。光学濃度(OD)で示され得る吸収量は、WBC内の着色剤の濃度及び局所条件(例えば、pH)に従い変わる。同じ量の着色剤に曝露されたときの、WBCの着色剤を吸収する性質は、一部のWBC細胞タイプ間で、細胞の生物学的特性に従い異なる。例えば、WBC内の生物学的特性(例えば、核材料、細胞質等)が異なると、吸収する色素の濃度が異なる。各細胞タイプのこうした異なる生物学的特性、及びそれに関連して異なる、それらの特性によって吸収される着色剤の濃度を利用して、特定の細胞タイプを識別することができる。細胞内の着色剤の濃度に従い変わる細胞のODを利用して、種々の細胞タイプを識別及び同定することができる。用途によっては、細胞間のODの違いは、細胞の同定を可能とするのに十分な情報を提供することができる。他の場合には、蛍光定量上のシグネチャと細胞のODとを用いて同定が達成される。
【0028】
本発明の例を示すため、実質的に無希釈の血液試料をアクリジンオレンジと混和し、2枚の透明パネルを有するチャンバに導入する。試料は静止状態で存在し、試料中の複数のWBCがチャンバの双方の内表面と接触する。試料は、470nm及び420nmで照明する。470nmでの照明は、蛍光発光を生じさせる。420nmでの照明は、着色剤によって吸収される。照明された試料のデジタル画像を取得する。好中球と好酸球とを含むWBC群が、撮像された試料内に存在するWBC集団全体の中に同定され、当該の群を画像内で「分離」する;これは例えば、その群のみが見えるように画像をフィルタリングすることによる。好中球及び好酸球の各々は、励起すると、顕著な細胞質の赤色蛍光と核の緑色蛍光とからなるシグネチャ蛍光パターンを生じるため、これらのWBCタイプが同定される。しかしながら、群内の好中球と好酸球との蛍光発光は、互いにかなり類似しているため、WBCのこの2つのタイプを識別することは困難である。
【0029】
群内のこの2つのタイプのWBCを識別するため、分離したWBCの光学濃度を比較する。平均して、好酸球中に吸収されたアクリジンオレンジの濃度は、好中球中に吸収されたアクリジンオレンジの濃度より高く、しかし蛍光は同等であり得る。これは、好酸球内の着色剤の蛍光が、好中球内の着色剤の蛍光と比べて、好酸球の細胞内容物に特有の性質に起因して消光されるためである。WBCの2つの異なるタイプは、例えば、所定のODカットオフ値を用いて;例えば、分離された群内でカットオフ値より大きいODを有する細胞を好酸球と見なし、カットオフ値未満のODを有する細胞を好中球と見なすことにより、別個のサブ群として識別することができる。
【0030】
或いは、WBCの2つのタイプは、そのOD計測値を、分析機器;例えばルックアップテーブル等に格納されている実験的に求めたOD値と比較することにより識別することができる。
【0031】
さらに別のものとして、2つのWBCサブ群は、細胞質蛍光の細胞質ODに対する比(蛍光/OD)を個々の細胞ベースで決定することにより互いに識別することができる。この比を与えるため、特定の細胞についての画素毎ベースでの蛍光発光値及び光学濃度値を決定して平均値を求めてもよく、その平均値を比に用いることができる。比は、画素毎ベースで比を決定して、画素毎の比の平均値を求めるなど、代替的方法を用いて決定してもよい。蛍光のODに対する比は、特定の細胞内における染色剤の蛍光の消光を定量的に表す。比が低い細胞は、蛍光信号の「消光」を示している。分離した群内の全ての細胞の比を統計的に評価して、2つの集団間の分離点を決定することができる。統計的に分離点を下回る細胞は、その蛍光のODに対する比が好中球の集団に関連する比より低いため、好酸球である。同様に、統計的に分離点を上回る細胞は、その蛍光のODに対する比が好酸球の集団に関連する比より高いため、好中球である。
【0032】
上記の蛍光/OD比の分析のさらなる実施形態において、比は、被験細胞からの上記の平均OD値及び蛍光発光値(又は50%より大きい割合の範囲内にあるOD値及び蛍光発光値)を用いて決定することができる。説明のため、着色剤に曝露された特定の細胞における着色剤の濃度が、第1の領域(例えば、核の領域)において、第2の領域(例えば、細胞質の領域)より低いものとし得る。結果的に、細胞の第2の領域(例えば細胞質)のODは、細胞の第1の領域(例えば、核)のODより高くなる。同様に、細胞の特定の領域からの蛍光発光が、別の領域からの発光より大きいものとし得る。蛍光発光/OD値のうち、その値がより高い発光強度又はODを表す部分を選択的に用いると、結果として雑音対信号比が向上し、分析が促進される。この態様は、着色剤が典型的には、例えば細胞の細胞質内の顆粒の中で、選択的に分散するという事実を利用している。
【0033】
本発明のさらなる実施形態において、試料中の細胞は、着色剤と混和した細胞を、蛍光発光を励起する波長(例えば、470nm)の光を一定に放射して「退色」させ、ある期間内の離散的な時点で発光の大きさを検知することにより、互いに識別することができる。特定の細胞タイプからの蛍光発光強度の平均低下率は、当該の細胞タイプについて一定であり、しかしこの平均の率は、細胞のタイプによって異なる。従って、発光強度の減少率を用いて細胞タイプを識別することができる。例えば、図9は、光退色に供された個々の好中球についての緑色蛍光発光の減衰率52、54、56と、それらの好中球についての平均減衰率58とを示す。図10は、同じ光退色に供された個々のリンパ球についての緑色蛍光発光の減衰率60、62と、それらのリンパ球の平均値64とを示す。図9及び図10に示される曲線は、異なる細胞タイプについては減衰率が異なり、そうした異なる減衰率を用いて被分析細胞のタイプを同定し得ることを明らかに示している。発光の減少率を用いると、年齢などの他の特徴により細胞を識別することもできる;例えば、あるタイプの、但し年齢が異なる細胞は、固有の発光減少率を有し、これを用いて様々な異なる年齢群を識別することができる。
【0034】
本発明は、その詳細な実施形態に関して図示及び説明されているが、当業者は、本発明の趣旨及び範囲から逸脱することなく、様々な形態及び詳細の変更が行われ得ることを理解するであろう。
【0035】
特許請求の範囲は以下のとおりである。
【特許請求の範囲】
【請求項1】
第1のパネルと第2のパネルとにより画定された分析チャンバ内に静止状態で存在する生体体液試料の少なくとも1つの構成成分を分析するための方法であって、前記生体体液試料が、前記構成成分内に存在すると共に所定の第1の光の波長に曝露すると蛍光を発するように機能する着色剤と混和された方法において、
前記構成成分を含む前記生体体液試料の少なくとも一部分を1つ又は複数の第1の光の波長で一定のままある期間にわたり照明するステップと、
前記期間内の離散的な時点において前記生体体液試料の前記少なくとも一部分を撮像するステップであって、前記離散的な時点において画像信号を生成することを含み、前記画像信号が、前記構成成分内に存在する着色剤からの蛍光発光を示すステップと、
前記離散的な時点からの前記画像信号を用いて、前記構成成分内に存在する着色剤に関連する1つ又は複数の蛍光発光値を決定し、複数の前記離散的な時点間における前記蛍光発光値の変化率とを決定するステップと、
前記構成成分についての前記蛍光発光値の前記決定された変化率を用いて、前記構成成分を分析するステップと、
を含む、方法。
【請求項2】
前記分析するステップが、前記構成成分の特性を決定することを含む、請求項1に記載の方法。
【請求項3】
前記特性が、前記構成成分の年齢である、請求項2に記載の方法。
【請求項4】
前記少なくとも1つの構成成分が、第1の構成成分と第2の構成成分とを含む、請求項1に記載の方法であって、
前記1つ又は複数の蛍光発光値を決定するステップが、
前記離散的な時点からの前記画像信号を用いて、前記第1の構成成分及び前記第2の構成成分内に存在する前記着色剤からの1つ又は複数の蛍光発光値を決定し、前記第1の構成成分及び前記第2の構成成分の各々についての複数の前記離散的な時点間における前記蛍光発光値の変化率を決定すること、
前記第1の構成成分及び前記第2の構成成分の各々についての前記蛍光発光値の前記決定された変化率を用いて、前記第1の構成成分及び前記第2の構成成分を分析すること、
を含む、方法。
【請求項5】
前記第1の構成成分及び前記第2の構成成分が、構成成分のいくつかのタイプである、請求項4に記載の方法。
【請求項6】
前記分析するステップが、前記第1の構成成分及び前記第2の構成成分の特性を決定することを含む、請求項5に記載の方法。
【請求項7】
前記特性が、前記第1の構成成分及び前記第2の構成成分の各々の年齢である、請求項6に記載の方法。
【請求項8】
前記生体体液試料が、実質的に無希釈な全血である、請求項4に記載の方法。
【請求項9】
前記第1の構成成分及び前記第2の構成成分が、白血球及び粒状物質からなる群から選択される、請求項8に記載の方法。
【請求項10】
前記第1の構成成分及び前記第2の構成成分が、白血球の各タイプである、請求項9に記載の方法。
【請求項11】
前記第1の構成成分及び前記第2の構成成分が、好酸球、好中球、及び好塩基球からなる群から選択される、請求項10に記載の方法。
【請求項12】
前記第1の構成成分及び前記第2の構成成分が、粒状物質の各タイプである、請求項9に記載の方法。
【請求項13】
前記第1の構成成分及び前記第2の構成成分が、血小板及び住血原虫からなる群から選択される、請求項12に記載の方法。
【請求項14】
前記構成成分の各々についての前記1つ又は複数の蛍光発光値が、画素毎ベースで決定される、請求項1に記載の方法。
【請求項15】
前記1つ又は複数の蛍光発光値を決定するステップと前記構成成分を分析するステップが、前記画像信号を処理するように構成された1つ又は複数の処理装置を用いて実行される、請求項1に記載の方法。
【請求項16】
血液試料を分析するための装置であって、
前記血液試料を静止状態に保つように構成されたチャンバと、
構成成分を含む前記血液試料の少なくとも一部分を、1つ又は複数の蛍光励起波長に従い一定のままある期間にわたり照明するように機能する照明器と、
前記期間内の離散的な時点において前記血液試料の前記少なくとも一部分を撮像し、前記離散的な時点において前記構成成分からの蛍光発光の各々についての画像信号を生成するように機能する解像装置と、
前記離散的な時点についての画像信号を用いて、前記血液試料中に静止状態で含まれる前記構成成分についての1つ又は複数の蛍光発光値を決定し、前記離散的な時点間における前記蛍光発光値の変化率を決定し、前記構成成分についての前記蛍光発光値の前記決定された変化率を用いて、前記構成成分を分析するように構成された分析機器と、
を含む、装置。
【請求項17】
前記構成成分が、白血球及び粒状物質からなる群から選択される、請求項16に記載の装置。
【請求項18】
前記分析機器が、前記離散的な時点についての画像信号を用いて、前記構成成分の特性を決定し、前記離散的な時点間における前記蛍光発光値の前記変化率を決定するように機能する、請求項16に記載の装置。
【請求項19】
前記特性が、前記構成成分の年齢である、請求項18に記載の装置。
【請求項1】
第1のパネルと第2のパネルとにより画定された分析チャンバ内に静止状態で存在する生体体液試料の少なくとも1つの構成成分を分析するための方法であって、前記生体体液試料が、前記構成成分内に存在すると共に所定の第1の光の波長に曝露すると蛍光を発するように機能する着色剤と混和された方法において、
前記構成成分を含む前記生体体液試料の少なくとも一部分を1つ又は複数の第1の光の波長で一定のままある期間にわたり照明するステップと、
前記期間内の離散的な時点において前記生体体液試料の前記少なくとも一部分を撮像するステップであって、前記離散的な時点において画像信号を生成することを含み、前記画像信号が、前記構成成分内に存在する着色剤からの蛍光発光を示すステップと、
前記離散的な時点からの前記画像信号を用いて、前記構成成分内に存在する着色剤に関連する1つ又は複数の蛍光発光値を決定し、複数の前記離散的な時点間における前記蛍光発光値の変化率とを決定するステップと、
前記構成成分についての前記蛍光発光値の前記決定された変化率を用いて、前記構成成分を分析するステップと、
を含む、方法。
【請求項2】
前記分析するステップが、前記構成成分の特性を決定することを含む、請求項1に記載の方法。
【請求項3】
前記特性が、前記構成成分の年齢である、請求項2に記載の方法。
【請求項4】
前記少なくとも1つの構成成分が、第1の構成成分と第2の構成成分とを含む、請求項1に記載の方法であって、
前記1つ又は複数の蛍光発光値を決定するステップが、
前記離散的な時点からの前記画像信号を用いて、前記第1の構成成分及び前記第2の構成成分内に存在する前記着色剤からの1つ又は複数の蛍光発光値を決定し、前記第1の構成成分及び前記第2の構成成分の各々についての複数の前記離散的な時点間における前記蛍光発光値の変化率を決定すること、
前記第1の構成成分及び前記第2の構成成分の各々についての前記蛍光発光値の前記決定された変化率を用いて、前記第1の構成成分及び前記第2の構成成分を分析すること、
を含む、方法。
【請求項5】
前記第1の構成成分及び前記第2の構成成分が、構成成分のいくつかのタイプである、請求項4に記載の方法。
【請求項6】
前記分析するステップが、前記第1の構成成分及び前記第2の構成成分の特性を決定することを含む、請求項5に記載の方法。
【請求項7】
前記特性が、前記第1の構成成分及び前記第2の構成成分の各々の年齢である、請求項6に記載の方法。
【請求項8】
前記生体体液試料が、実質的に無希釈な全血である、請求項4に記載の方法。
【請求項9】
前記第1の構成成分及び前記第2の構成成分が、白血球及び粒状物質からなる群から選択される、請求項8に記載の方法。
【請求項10】
前記第1の構成成分及び前記第2の構成成分が、白血球の各タイプである、請求項9に記載の方法。
【請求項11】
前記第1の構成成分及び前記第2の構成成分が、好酸球、好中球、及び好塩基球からなる群から選択される、請求項10に記載の方法。
【請求項12】
前記第1の構成成分及び前記第2の構成成分が、粒状物質の各タイプである、請求項9に記載の方法。
【請求項13】
前記第1の構成成分及び前記第2の構成成分が、血小板及び住血原虫からなる群から選択される、請求項12に記載の方法。
【請求項14】
前記構成成分の各々についての前記1つ又は複数の蛍光発光値が、画素毎ベースで決定される、請求項1に記載の方法。
【請求項15】
前記1つ又は複数の蛍光発光値を決定するステップと前記構成成分を分析するステップが、前記画像信号を処理するように構成された1つ又は複数の処理装置を用いて実行される、請求項1に記載の方法。
【請求項16】
血液試料を分析するための装置であって、
前記血液試料を静止状態に保つように構成されたチャンバと、
構成成分を含む前記血液試料の少なくとも一部分を、1つ又は複数の蛍光励起波長に従い一定のままある期間にわたり照明するように機能する照明器と、
前記期間内の離散的な時点において前記血液試料の前記少なくとも一部分を撮像し、前記離散的な時点において前記構成成分からの蛍光発光の各々についての画像信号を生成するように機能する解像装置と、
前記離散的な時点についての画像信号を用いて、前記血液試料中に静止状態で含まれる前記構成成分についての1つ又は複数の蛍光発光値を決定し、前記離散的な時点間における前記蛍光発光値の変化率を決定し、前記構成成分についての前記蛍光発光値の前記決定された変化率を用いて、前記構成成分を分析するように構成された分析機器と、
を含む、装置。
【請求項17】
前記構成成分が、白血球及び粒状物質からなる群から選択される、請求項16に記載の装置。
【請求項18】
前記分析機器が、前記離散的な時点についての画像信号を用いて、前記構成成分の特性を決定し、前記離散的な時点間における前記蛍光発光値の前記変化率を決定するように機能する、請求項16に記載の装置。
【請求項19】
前記特性が、前記構成成分の年齢である、請求項18に記載の装置。
【図1】


【図2】


【図3】


【図4】


【図6】


【図7】


【図8】


【図9】


【図10】


【図5】




【図2】


【図3】


【図4】


【図6】


【図7】


【図8】


【図9】


【図10】


【図5】


【公開番号】特開2013−68631(P2013−68631A)
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−270407(P2012−270407)
【出願日】平成24年12月11日(2012.12.11)
【分割の表示】特願2011−500992(P2011−500992)の分割
【原出願日】平成21年3月20日(2009.3.20)
【出願人】(510252553)
【Fターム(参考)】
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願番号】特願2012−270407(P2012−270407)
【出願日】平成24年12月11日(2012.12.11)
【分割の表示】特願2011−500992(P2011−500992)の分割
【原出願日】平成21年3月20日(2009.3.20)
【出願人】(510252553)

【Fターム(参考)】
[ Back to top ]

