蛍光粒子およびその製造方法
【課題】新規な蛍光粒子の製造方法を提供することを目的とする。
【解決手段】蛍光粒子の製造方法は、溶媒5中のターゲット7にレーザー光を照射する方法である。ここで、前記ターゲット7はアップコンバージョン特性を有する蛍光材料からなる。ターゲット7の材質は、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。溶媒5は、純水、メタノール、エタノール、プロパノール等の極性溶媒、ヘキサン、ベンゼン等の非極性溶媒のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。この方法により作製された蛍光粒子は、アップコンバージョン特性を有する。
【解決手段】蛍光粒子の製造方法は、溶媒5中のターゲット7にレーザー光を照射する方法である。ここで、前記ターゲット7はアップコンバージョン特性を有する蛍光材料からなる。ターゲット7の材質は、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。溶媒5は、純水、メタノール、エタノール、プロパノール等の極性溶媒、ヘキサン、ベンゼン等の非極性溶媒のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。この方法により作製された蛍光粒子は、アップコンバージョン特性を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規な蛍光粒子に関する。
また、本発明は、新規な蛍光粒子の製造方法に関する。
【背景技術】
【0002】
従来、ナノメータサイズの粒径を持つナノ粒子はコロイドと呼ばれ古くから研究されてきたが、近年、その光学的特異性から注目を浴びている。作製方法としては、気相法と液相法に大別できるが、バイオメディカル用途等では液体中のナノ粒子を用いることが多いこともあり液相法が適していると考えられる。
【0003】
これまで液相法としては沈降法、ゾルゲル法、ソルボサーマル法、ホットソープ法等の方法がある。これにより量子ドットやドープ型蛍光体が数多く作製され、その応用が検討されている。
【0004】
一方、アップコンバージョン特性を有する材料について、これまでに多くの報告がある(例えば、非特許文献1参照)。なお、アップコンバージョン特性とは、赤外光等のエネルギーが低い光を励起光として用い、可視光の蛍光光を得る現象である。
【0005】
また、長残光材料をターゲットとして用いて、液中レーザーアブレーション法により長残光ナノ粒子の分散溶液を作製したとの報告がある(特許文献1参照)。
【0006】
また、バイオイメージングは、生体内の特定の部位や細胞等をマーカにより染色するものであり、バイオメディカル分野での研究開発を加速したり、早期診断に役立てたりするものである。これは、マーカに励起光である紫外光を照射すると可視光の蛍光を発する現象を利用しているものである。
【0007】
マーカとしては有機系蛍光色素であるシアニン系色素、フルオレセイン系色素、ローダミン系色素等が用いられているが、これらはストークスシフトが小さい、数分で褪色しマーカとして使えなくなる等の問題点があり、近年、量子ドット等のナノ粒子がバイオイメージング用に研究されている(例えば、非特許文献2,3参照)。
【0008】
また、アップコンバージョンナノ粒子と光増感剤で光線力学療法により、がん治療ができるとの報告がある(例えば、非特許文献4参照)。
【0009】
なお、発明者は、本発明に関連する技術内容を開示している(非特許文献5〜7参照)。これらは、特許法第30条第1項を適用できるものと考えられる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2010−242059号公報
【非特許文献】
【0011】
【非特許文献1】F. Auzel, Chem. Rev. 104 (2004) p.139-173.
【非特許文献2】M. Bruchez, M. Moronne, P. Gin, S. Weiss, A. P. Alivisatos, Science 281 (1998) 2013.
【非特許文献3】W. C. W. Chan and S. Nie, Science 281 (1998) 2016.
【非特許文献4】P. Zhang et al. J Am. Chem. Soc. 129 (2007) 4526.
【非特許文献5】小野寺裕司、中村一隆、小田原修、和田裕之、「Y2O3:Erの液中レーザーアブレーションにおけるパワー密度の影響」、レーザー学会2011年年会(2011/1/9)、講演予稿集, D610pVI04, p.126.
【非特許文献6】小野寺裕司、中村一隆、小田原修、和田裕之、「Y2O3:Erナノ粒子の液中レーザーアブレーション法による作製」、電気化学会第78回大会(2011/3/29)、講演予稿集, 3K30, p.278.
【非特許文献7】T. Nunokawa, Y. Onodera, K. Nakamura, O. Odawara, H. Wada, 5th Int. Conf. Sci. Technol. for Advanced Ceramics (STAC5), 2nd Int. Conf. Advanced Materials Development and Integration (AMDI2), June 22-24, 2011, Yokohama, JAPAN , 23pP107
【発明の概要】
【発明が解決しようとする課題】
【0012】
しかしながら、上述したように、アップコンバージョン特性を有する材料について、これまでに多くの報告があるが、アップコンバージョン特性を有する材料は、すべて単結晶または凝集した多結晶の固体である。溶液中に分散したアップコンバージョン特性を持つナノ粒子の効率的な製造方法はこれまでに例がない。
【0013】
また、長残光材料をターゲットとして用いて、液中レーザーアブレーション法により長残光ナノ粒子の分散溶液を作製したとの報告があるが、この方法は実験パラメータや溶媒との反応性からアップコンバージョンナノ粒子の分散溶液ができるかが不明である。
【0014】
また、量子ドット等のナノ粒子がバイオイメージング用に研究されているが、励起光が生体によってさえぎられる、また励起光により細胞の損傷が生じる、等の問題がある。
【0015】
また、アップコンバージョンナノ粒子と光増感剤で光線力学療法により、がん治療ができるとの報告があるが、これはフッ化物(NaYF4)を用いているものであり、実際に生体で用いる場合、安全上の問題が懸念される。
【0016】
そのため、このような課題を解決する、新規な蛍光粒子およびその製造方法の開発が望まれている。
【0017】
本発明は、このような課題に鑑みてなされたものであり、新規な蛍光粒子を提供することを目的とする。
【0018】
また、本発明は、新規な蛍光粒子の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0019】
上記課題を解決し、本発明の目的を達成するため、本発明の蛍光粒子の製造方法は、液体中のターゲットにレーザー光を照射する、蛍光粒子の製造方法において、前記ターゲットが、アップコンバージョン特性を有する蛍光材料からなる。
【0020】
ここで、限定されるわけではないが、ターゲットの材質は、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。また、限定されるわけではないが、液体は、純水、メタノール、エタノール、プロパノール等の極性溶媒、ヘキサン、ベンゼン等の非極性溶媒のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。また、限定されるわけではないが、液体に添加するものは、ドデシル硫酸ナトリウム(SDS)等のアニオン性界面活性剤、セチルトリメチルアンモニウムブロマイド(CTAB)等のカチオン性界面活性剤、アルキルカルボキシベタイン等の両性界面活性剤、ポリエチレングリコール(PEG)、ポリビニルピロリドン(PVP)等の非イオン性界面活性剤のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。
【0021】
本発明の蛍光粒子は、アップコンバージョン特性を有するものである。
【0022】
ここで、限定されるわけではないが、蛍光粒子の材質は、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。また、限定されるわけではないが、平均粒子径は5〜200nmの範囲内にあることが好ましい。
【0023】
本発明の蛍光粒子は、バイオイメージングに用いる蛍光粒子であって、前記蛍光粒子を生体内に投与し、生体外から赤外励起光を照射することにより、前記蛍光粒子を発光させる。
【0024】
本発明の蛍光粒子は、がん治療に用いる蛍光粒子であって、光感受性物質と前記蛍光粒子を生体内に投与して、がん細胞に前記光感受性物質と前記蛍光粒子を取り込ませ、生体外から赤外励起光を照射することにより前記蛍光粒子を発光させ、前記光感受性物質の光化学反応により活性酸素を発生させ、前記がん細胞を死滅させる。
【発明の効果】
【0025】
本発明は、以下に記載されるような効果を奏する。
【0026】
本発明の蛍光粒子の製造方法は、液体中のターゲットにレーザー光を照射する、蛍光粒子の製造方法において、前記ターゲットがアップコンバージョン特性を有する蛍光材料からなるので、新規な蛍光粒子の製造方法を提供することができる。
【0027】
本発明の蛍光粒子は、アップコンバージョン特性を有するので、新規な蛍光粒子を提供することができる。
【0028】
本発明の蛍光粒子は、バイオイメージングに用いる蛍光粒子であって、前記蛍光粒子を生体内に投与し、生体外から赤外励起光を照射することにより、前記蛍光粒子を発光させるので、新規な蛍光粒子を提供することができる。
【0029】
本発明の蛍光粒子は、がん治療に用いる蛍光粒子であって、光感受性物質と前記蛍光粒子を生体内に投与して、がん細胞に前記光感受性物質と前記蛍光粒子を取り込ませ、生体外から赤外励起光を照射することにより前記蛍光粒子を発光させ、前記光感受性物質の光化学反応により活性酸素を発生させ、前記がん細胞を死滅させるので、新規な蛍光粒子を提供することができる。
【図面の簡単な説明】
【0030】
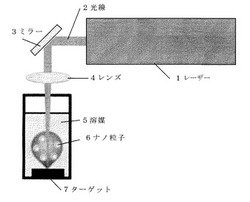
【図1】実施例において用いた装置の概略図である。
【図2】レーザーのエネルギー密度の変化に対する、粒子径の変化を示す図である。
【図3】赤外光で励起した、粒子が分散したコロイド溶液の発光特性を示す図である。
【発明を実施するための形態】
【0031】
以下、蛍光粒子およびその製造方法にかかる発明を実施するための形態について説明する。
蛍光粒子の製造方法は、液体中のターゲットにレーザー光を照射する、蛍光粒子の製造方法において、前記ターゲットがアップコンバージョン特性を有する蛍光材料からなる、方法である。
蛍光粒子は、アップコンバージョン特性を有するものである。
【0032】
蛍光粒子の製造方法について説明する。
【0033】
ターゲットの材質としては、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+等のEr3+を付活剤として含む単結晶、多結晶、ガラス等を採用することができる。また、上記化合物のいずれか2種以上の組み合わせであってもよい。
【0034】
ターゲットの組成元素のうち、添加元素Er3+の濃度は0.5〜10mol%の範囲内にあることが好ましい。添加元素Er3+の濃度が0.5mol%以上であると、アップコンバージョン発光が増加するという利点がある。添加元素Er3+の濃度が10mol%以下であると、濃度消光によりアップコンバージョン発光が大きく減少しないという利点がある。
【0035】
ターゲットの組成元素のうち、添加元素Yb3+の濃度は1〜20mol%の範囲内にあることが好ましい。添加元素Yb3+の濃度が1mol%以上であると、アップコンバージョン発光が増加するという利点がある。添加元素Yb3+の濃度が20mol%以下であると、濃度消光によりアップコンバージョン発光が大きく減少しないという利点がある。
【0036】
レーザーとしては、固体レーザー、ガスレーザー、半導体レーザー等を採用することができる。
【0037】
用いるレーザーの波長の基準は、ターゲットに対して吸収を持つものがアブレーションをしやすいため、一般に、400nm以下の紫外光をもちいるが、十分に高いエネルギー密度を有するものであれば多光子吸収等による吸収もあるため、長波長のレーザー光でもアブレーションが可能である。また、物質の吸収端は物質の種類によって異なるため、最適な波長は用いるターゲットの種類により異なる。
【0038】
用いるレーザー強度は、アブレーションを生じる閾値以上でなくてはならない。この値はターゲットの種類、および、ターゲットの作製方法、溶媒の種類によって変化するため各系で最適なものとすることが望ましい。
【0039】
レーザーの発振方式はパルス発振だけでなく、十分な出力を有すれば連続発振でも利用することができる。
用いるパルス幅は、アブレーションを生じる閾値に大きな影響を与える。これは、パルス幅を変えることにより、同じエネルギーのパルスでもピーク値(尖頭値)が変わるためであり、パルス幅を狭くすると、ピーク値は高くなる。
【0040】
繰り返し周波数は、高い程単位時間あたりに作製できるナノ粒子の量が増えるため、高い程望ましい。
【0041】
焦点位置での光線の直径は、アブレーションのためのエネルギー密度と密接な関係がある。1パルス当たりのエネルギーが同じレーザーでも、焦点位置での光線の直径が小さい程、エネルギー密度は大きくなる。また、焦点位置での光線の直径が大きい程、エネルギー密度は小さくなる。これにより、焦点位置での光線の直径は、アブレーションの閾値を超えるか超えないかが決定されるパラメータとなる。
【0042】
上記焦点位置での光線の直径は、レーザーより出射される光線の直径が一定の場合、配置するレンズの焦点距離と大きく関連する。焦点距離が大きくなると焦点位置での光線の直径は大きくなり、焦点距離が小さくなると焦点位置での光線の直径も小さくなる。この値は幾何光学的に算出できる。
【0043】
レーザーの照射時間は長い程、作製できるナノ粒子の量が増える。照射時間とナノ粒子の生成量はほぼ比例関係にあり、時間を長くすることにより多くのナノ粒子が得られる。
【0044】
レーザーアブレーションに用いる液体としては、純水、メタノール、エタノール、プロパノール等の極性溶媒や、ヘキサン、ベンゼン等の非極性溶媒のうちいずれか1種、またいずれか2種以上の組み合わせ等を採用することができる。
【0045】
液体に添加するものとしては、ドデシル硫酸ナトリウム(SDS)等のアニオン性界面活性剤、セチルトリメチルアンモニウムブロマイド(CTAB)等のカチオン性界面活性剤、アルキルカルボキシベタイン等の両性界面活性剤、ポリエチレングリコール(PEG)、ポリビニルピロリドン(PVP)等の非イオン性界面活性剤等のうちいずれか1種、またいずれか2種以上の組み合わせを採用することができる。
【0046】
これらの添加物を入れることにより、蛍光強度が増加すると同時に単位時間当たりの蛍光強度の減衰が小さくなり、残光特性が向上する。また、適切な添加剤を選択することにより分散性も向上する。
【0047】
上述の製造方法により作製された蛍光粒子について説明する。
【0048】
蛍光粒子の材質としては、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+等のEr3+を付活剤として含むもの等から選ばれるいずれか1種、またはいずれか2種以上の組み合わせを採用することができる。
【0049】
蛍光粒子の形状は、球、楕円体、ロッド状、リボン状等がある。
【0050】
蛍光粒子の平均粒子径は5〜200nmの範囲内にあることが好ましい。生体内では、細網内皮系組織のクッパー細胞等により、200nmより大きい微粒子は貪食され肝臓や脾臓に蓄積されてしまう。このため生体内で微粒子を用いる場合は200nm以下にする必要がある。また、5nmより小さい微粒子は腎臓で体外に排出されてしまう。このため、生体内で微粒子を用いる場合は5nm以上にする必要がある。これらはEPR(Enhanced Permeability and Retention effect)として知られている。本方法で得られた粒子は粒径の分布をもつが、必要に応じて、遠心分離や透析等により所望の粒径のみを取り出して利用することが可能である。
【0051】
蛍光粒子の励起光波長は600〜1400nmの範囲内にあることが好ましい。励起光波長がこの範囲内にあると、励起光が生体によってさえぎられることがなく、バイオイメージングの際に開腹手術をしなくてもよい、また励起光による細胞の損傷の低減が図れる等の利点がある。
【0052】
蛍光粒子の蛍光光波長は600〜1400nmの範囲内にあることが好ましい。蛍光光波長がこの範囲内にあると、蛍光光が生体によってさえぎられることがなく、バイオイメージングの際に開腹手術をしなくてもよい、また励起光による細胞の損傷の低減が図れる等の利点がある。
【0053】
蛍光粒子は、以下のような用途に用いることができる。
本方法で作製した蛍光粒子を、特定の細胞や薬剤の蛍光マーカとするために、生体内に投与する。投与の方法は径呼吸器投与、経口投与、口腔・舌下・鼻空内投与、皮膚を介したTTS(transdermal therapeutic system)、皮下注射、筋肉注射、局所投与等がある。この際、目的部位への受動ターゲティングによる薬物輸送システム(DDS)の他に、モノクローナル抗体等の抗体やペプチド、磁性ナノ粒子等を用いた能動ターゲッティングも用いることができる。その後、生体外から発振波長980nmの赤外線レーザー等の励起光を照射することにより、蛍光粒子を発光させることができ、特定の細胞のバイオイメージングや薬剤の移動経路の特定等が実現できる。
【0054】
アップコンバージョンナノ粒子を用いた場合、次のような利点がある。すなわち、(1)高い生体透過性(透過する領域は「生体の窓」と言われる。)[1]のために、励起光が生体によってさえぎられることがなく、バイオイメージングの際に開腹手術をしなくてもよい。(2)高い生体透過性のため、励起光による細胞の損傷の低減が図れる。(3)励起光を照射した際に細胞自体が蛍光光を発する自家蛍光の問題を解決できる。赤外光では細胞内の蛍光物質を励起できないからである。(4)バイオイメージングの際には細胞による散乱光も問題となるが、散乱強度は波長の4乗に反比例するため、散乱光の低減も図れる。(5)蛍光色素に比べて、褪色の問題がない。
【0055】
がん治療方法への用途について説明する。先ず、生体内にポルフィリン等の光感受性物質を投与する。次に、本方法で作製した蛍光粒子を生体内に投与する。この2つの物質はリガンド等を用いて結合させ、同時に投与することも可能である。がん細胞は活発に分裂しているため、これらの物質は受動的に取り込まれる傾向がある。投与の方法は径呼吸器投与、経口投与、口腔・舌下・鼻空内投与、皮膚を介したTTS(transdermal therapeutic system)、皮下注射、筋肉注射、局所投与等がある。また、モノクローナル抗体等の抗体やペプチド、磁性ナノ粒子等を用いた能動ターゲッティングを用いても、がん細胞に蛍光粒子を効果的に薬物輸送できる。ここで生体外から、生体外から発振波長980nmの赤外線レーザー等の励起光を照射することにより、蛍光粒子を発光させることができ、この光でポルフィリン等の光感受性物質において光化学反応により活性酸素が発生し、がん細胞が死滅させることができる。
【0056】
今回作製したナノ粒子は安定な酸化物であり、フッ化物(NaYF4)のようなフッ素に起因した問題が解決できる。また、従来の光線力学療法では可視光を用いるため、小さな初期段階の腫瘍しか治療できないが、アップコンバージョンナノ粒子を用いた光線力学療法では生体透過性が高い赤外光を用いるため、大きな腫瘍も治療できるようになる。従来の光線力学療法は低侵襲性で患者の負担が小さいがん治療法であるが、小さな腫瘍しか治療できないことが問題であったが、アップコンバージョンナノ粒子を用いることによりこれを解決でき、がん患者の大半を占める高齢者の治療法として潜在的に高い可能性を持っている。
【0057】
なお、本発明は上述の発明を実施するための形態に限らず本発明の要旨を逸脱することなくその他種々の構成を採り得ることはもちろんである。
【0058】
[参考文献]
[1] Michael S. Patterson, Brian C. Wilson, Douglas R. Wyman, Laser in Medical Science, 6 (1991) p.379-390.
【実施例】
【0059】
つぎに、本発明にかかる実施例について具体的に説明する。ただし、本発明はこれら実施例に限定されるものではないことはもちろんである。
【0060】
<試料の調製>
【0061】
a) ターゲットの作製
ターゲットは、以下の方法で作製した。
Y(NO3)3・6H2O(関東化学社製)4.3g、Er(NO3)3・5H2O(関東化学社製)55mg、および、Yb(NO3)3・5H2O(和光純薬社製)560mgを純水に溶かしてアンモニア水(関東化学社製)を加える共沈法を用いて、前駆体であるY(OH)3、Yb(OH)3、および、Er(OH)3を合成した。それを900℃で2時間焼成しY2O3:Er3+,Yb3+の粉体を得る。この粉体をペレットにし1250℃で4時間焼結し、ターゲット(直径9mm、高さ3mmの円柱状)を得る。なお、ターゲットを構成するY2O3:Er3+,Yb3+において、Er3+の含有量は1mol%であり、Yb3+の含有量は12mol%である。
【0062】
b) レーザーアブレーション
図1の装置概略図においてレーザー1から発振した光線2を所望の位置に配置したミラー3で折り返し、焦点距離80mmの平凸レンズ4で集光する。本実施例では、集光面積を変化させることによりエネルギー密度を変えた。具体的には、集光面積を0.066cm2、0.039cm2、0.022cm2と変化させた。この焦点位置に、溶媒を入れた石英セル内のターゲット7を配置することにより液相レーザーアブレーションを実施する。集光されたパルスレーザー光は高いエネルギー(1パルス当たりのエネルギー密度:0.35〜1.06 J/cm2)を有しており、ターゲット7からナノ粒子を作製することができる。溶媒は超純水を使用した。レーザーアブレーションは室温で実施し、溶媒の温度も室温である。照射時間は30分であったが、長くするとこによりナノ粒子の作製量を増やすことができる。用いたレーザーはNd:YAG固体レーザー(Spectron Laser社製 SL802,パルス発振,パルス幅13ns,発振波長532nm,繰り返し周波数10Hz,1パルス当たりのエネルギー23.1mJ/pulse)である。
【0063】
<評価方法>
【0064】
a) 平均粒子径
動的光散乱法を用いて、粒子径測定装置 (Spectris社製Zetasizer Nano)で粒径を測定した。
【0065】
b) 光学特性
分光装置には蛍光分光光度計(日立ハイテクノロジーズ社製 F-7000)を用い、励起光源にはレーザーダイオード(Thorlabs社製 L980P300J,波長980nm,出力300mW)を用い、アップコンバージョン特性を測定した。
【0066】
<評価結果>
【0067】
a) 平均粒子径
本実施例では、統計的に全体の粒子径を示せるように動的光散乱法を用いた。図2に示すように、レーザーのエネルギー密度を0.35J/cm2,0.59J/cm2,1.06J/cm2と変化させると、エネルギー密度の上昇と共に平均粒子径がそれぞれ164nm,277nm,346nmと増加した。
【0068】
b) 光学特性
一般に、生体内に入ったナノ粒子は、200nmより大きい場合は肝臓のクッパー細胞に貪食されてしまいバイオイメージングやがん治療に用いることができない。このため、図2中の164nmのナノ粒子に関してアップコンバージョン特性測定を行った。図3に、980nmの赤外光で励起したナノ粒子が水に分散したコロイド溶液の発光特性を示す。660nm付近にピークを持つ赤色の発光が確認できた。これにより、アップコンバージョンナノ粒子の作製が確認できた。
【符号の説明】
【0069】
1‥‥レーザー、2‥‥光線、3‥‥ミラー、4‥‥レンズ、5‥‥溶媒、6‥‥ナノ粒子、7‥‥ターゲット
【技術分野】
【0001】
本発明は、新規な蛍光粒子に関する。
また、本発明は、新規な蛍光粒子の製造方法に関する。
【背景技術】
【0002】
従来、ナノメータサイズの粒径を持つナノ粒子はコロイドと呼ばれ古くから研究されてきたが、近年、その光学的特異性から注目を浴びている。作製方法としては、気相法と液相法に大別できるが、バイオメディカル用途等では液体中のナノ粒子を用いることが多いこともあり液相法が適していると考えられる。
【0003】
これまで液相法としては沈降法、ゾルゲル法、ソルボサーマル法、ホットソープ法等の方法がある。これにより量子ドットやドープ型蛍光体が数多く作製され、その応用が検討されている。
【0004】
一方、アップコンバージョン特性を有する材料について、これまでに多くの報告がある(例えば、非特許文献1参照)。なお、アップコンバージョン特性とは、赤外光等のエネルギーが低い光を励起光として用い、可視光の蛍光光を得る現象である。
【0005】
また、長残光材料をターゲットとして用いて、液中レーザーアブレーション法により長残光ナノ粒子の分散溶液を作製したとの報告がある(特許文献1参照)。
【0006】
また、バイオイメージングは、生体内の特定の部位や細胞等をマーカにより染色するものであり、バイオメディカル分野での研究開発を加速したり、早期診断に役立てたりするものである。これは、マーカに励起光である紫外光を照射すると可視光の蛍光を発する現象を利用しているものである。
【0007】
マーカとしては有機系蛍光色素であるシアニン系色素、フルオレセイン系色素、ローダミン系色素等が用いられているが、これらはストークスシフトが小さい、数分で褪色しマーカとして使えなくなる等の問題点があり、近年、量子ドット等のナノ粒子がバイオイメージング用に研究されている(例えば、非特許文献2,3参照)。
【0008】
また、アップコンバージョンナノ粒子と光増感剤で光線力学療法により、がん治療ができるとの報告がある(例えば、非特許文献4参照)。
【0009】
なお、発明者は、本発明に関連する技術内容を開示している(非特許文献5〜7参照)。これらは、特許法第30条第1項を適用できるものと考えられる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2010−242059号公報
【非特許文献】
【0011】
【非特許文献1】F. Auzel, Chem. Rev. 104 (2004) p.139-173.
【非特許文献2】M. Bruchez, M. Moronne, P. Gin, S. Weiss, A. P. Alivisatos, Science 281 (1998) 2013.
【非特許文献3】W. C. W. Chan and S. Nie, Science 281 (1998) 2016.
【非特許文献4】P. Zhang et al. J Am. Chem. Soc. 129 (2007) 4526.
【非特許文献5】小野寺裕司、中村一隆、小田原修、和田裕之、「Y2O3:Erの液中レーザーアブレーションにおけるパワー密度の影響」、レーザー学会2011年年会(2011/1/9)、講演予稿集, D610pVI04, p.126.
【非特許文献6】小野寺裕司、中村一隆、小田原修、和田裕之、「Y2O3:Erナノ粒子の液中レーザーアブレーション法による作製」、電気化学会第78回大会(2011/3/29)、講演予稿集, 3K30, p.278.
【非特許文献7】T. Nunokawa, Y. Onodera, K. Nakamura, O. Odawara, H. Wada, 5th Int. Conf. Sci. Technol. for Advanced Ceramics (STAC5), 2nd Int. Conf. Advanced Materials Development and Integration (AMDI2), June 22-24, 2011, Yokohama, JAPAN , 23pP107
【発明の概要】
【発明が解決しようとする課題】
【0012】
しかしながら、上述したように、アップコンバージョン特性を有する材料について、これまでに多くの報告があるが、アップコンバージョン特性を有する材料は、すべて単結晶または凝集した多結晶の固体である。溶液中に分散したアップコンバージョン特性を持つナノ粒子の効率的な製造方法はこれまでに例がない。
【0013】
また、長残光材料をターゲットとして用いて、液中レーザーアブレーション法により長残光ナノ粒子の分散溶液を作製したとの報告があるが、この方法は実験パラメータや溶媒との反応性からアップコンバージョンナノ粒子の分散溶液ができるかが不明である。
【0014】
また、量子ドット等のナノ粒子がバイオイメージング用に研究されているが、励起光が生体によってさえぎられる、また励起光により細胞の損傷が生じる、等の問題がある。
【0015】
また、アップコンバージョンナノ粒子と光増感剤で光線力学療法により、がん治療ができるとの報告があるが、これはフッ化物(NaYF4)を用いているものであり、実際に生体で用いる場合、安全上の問題が懸念される。
【0016】
そのため、このような課題を解決する、新規な蛍光粒子およびその製造方法の開発が望まれている。
【0017】
本発明は、このような課題に鑑みてなされたものであり、新規な蛍光粒子を提供することを目的とする。
【0018】
また、本発明は、新規な蛍光粒子の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0019】
上記課題を解決し、本発明の目的を達成するため、本発明の蛍光粒子の製造方法は、液体中のターゲットにレーザー光を照射する、蛍光粒子の製造方法において、前記ターゲットが、アップコンバージョン特性を有する蛍光材料からなる。
【0020】
ここで、限定されるわけではないが、ターゲットの材質は、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。また、限定されるわけではないが、液体は、純水、メタノール、エタノール、プロパノール等の極性溶媒、ヘキサン、ベンゼン等の非極性溶媒のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。また、限定されるわけではないが、液体に添加するものは、ドデシル硫酸ナトリウム(SDS)等のアニオン性界面活性剤、セチルトリメチルアンモニウムブロマイド(CTAB)等のカチオン性界面活性剤、アルキルカルボキシベタイン等の両性界面活性剤、ポリエチレングリコール(PEG)、ポリビニルピロリドン(PVP)等の非イオン性界面活性剤のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。
【0021】
本発明の蛍光粒子は、アップコンバージョン特性を有するものである。
【0022】
ここで、限定されるわけではないが、蛍光粒子の材質は、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+のうちいずれか1種、またいずれか2種以上の組み合わせであることが好ましい。また、限定されるわけではないが、平均粒子径は5〜200nmの範囲内にあることが好ましい。
【0023】
本発明の蛍光粒子は、バイオイメージングに用いる蛍光粒子であって、前記蛍光粒子を生体内に投与し、生体外から赤外励起光を照射することにより、前記蛍光粒子を発光させる。
【0024】
本発明の蛍光粒子は、がん治療に用いる蛍光粒子であって、光感受性物質と前記蛍光粒子を生体内に投与して、がん細胞に前記光感受性物質と前記蛍光粒子を取り込ませ、生体外から赤外励起光を照射することにより前記蛍光粒子を発光させ、前記光感受性物質の光化学反応により活性酸素を発生させ、前記がん細胞を死滅させる。
【発明の効果】
【0025】
本発明は、以下に記載されるような効果を奏する。
【0026】
本発明の蛍光粒子の製造方法は、液体中のターゲットにレーザー光を照射する、蛍光粒子の製造方法において、前記ターゲットがアップコンバージョン特性を有する蛍光材料からなるので、新規な蛍光粒子の製造方法を提供することができる。
【0027】
本発明の蛍光粒子は、アップコンバージョン特性を有するので、新規な蛍光粒子を提供することができる。
【0028】
本発明の蛍光粒子は、バイオイメージングに用いる蛍光粒子であって、前記蛍光粒子を生体内に投与し、生体外から赤外励起光を照射することにより、前記蛍光粒子を発光させるので、新規な蛍光粒子を提供することができる。
【0029】
本発明の蛍光粒子は、がん治療に用いる蛍光粒子であって、光感受性物質と前記蛍光粒子を生体内に投与して、がん細胞に前記光感受性物質と前記蛍光粒子を取り込ませ、生体外から赤外励起光を照射することにより前記蛍光粒子を発光させ、前記光感受性物質の光化学反応により活性酸素を発生させ、前記がん細胞を死滅させるので、新規な蛍光粒子を提供することができる。
【図面の簡単な説明】
【0030】
【図1】実施例において用いた装置の概略図である。
【図2】レーザーのエネルギー密度の変化に対する、粒子径の変化を示す図である。
【図3】赤外光で励起した、粒子が分散したコロイド溶液の発光特性を示す図である。
【発明を実施するための形態】
【0031】
以下、蛍光粒子およびその製造方法にかかる発明を実施するための形態について説明する。
蛍光粒子の製造方法は、液体中のターゲットにレーザー光を照射する、蛍光粒子の製造方法において、前記ターゲットがアップコンバージョン特性を有する蛍光材料からなる、方法である。
蛍光粒子は、アップコンバージョン特性を有するものである。
【0032】
蛍光粒子の製造方法について説明する。
【0033】
ターゲットの材質としては、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+等のEr3+を付活剤として含む単結晶、多結晶、ガラス等を採用することができる。また、上記化合物のいずれか2種以上の組み合わせであってもよい。
【0034】
ターゲットの組成元素のうち、添加元素Er3+の濃度は0.5〜10mol%の範囲内にあることが好ましい。添加元素Er3+の濃度が0.5mol%以上であると、アップコンバージョン発光が増加するという利点がある。添加元素Er3+の濃度が10mol%以下であると、濃度消光によりアップコンバージョン発光が大きく減少しないという利点がある。
【0035】
ターゲットの組成元素のうち、添加元素Yb3+の濃度は1〜20mol%の範囲内にあることが好ましい。添加元素Yb3+の濃度が1mol%以上であると、アップコンバージョン発光が増加するという利点がある。添加元素Yb3+の濃度が20mol%以下であると、濃度消光によりアップコンバージョン発光が大きく減少しないという利点がある。
【0036】
レーザーとしては、固体レーザー、ガスレーザー、半導体レーザー等を採用することができる。
【0037】
用いるレーザーの波長の基準は、ターゲットに対して吸収を持つものがアブレーションをしやすいため、一般に、400nm以下の紫外光をもちいるが、十分に高いエネルギー密度を有するものであれば多光子吸収等による吸収もあるため、長波長のレーザー光でもアブレーションが可能である。また、物質の吸収端は物質の種類によって異なるため、最適な波長は用いるターゲットの種類により異なる。
【0038】
用いるレーザー強度は、アブレーションを生じる閾値以上でなくてはならない。この値はターゲットの種類、および、ターゲットの作製方法、溶媒の種類によって変化するため各系で最適なものとすることが望ましい。
【0039】
レーザーの発振方式はパルス発振だけでなく、十分な出力を有すれば連続発振でも利用することができる。
用いるパルス幅は、アブレーションを生じる閾値に大きな影響を与える。これは、パルス幅を変えることにより、同じエネルギーのパルスでもピーク値(尖頭値)が変わるためであり、パルス幅を狭くすると、ピーク値は高くなる。
【0040】
繰り返し周波数は、高い程単位時間あたりに作製できるナノ粒子の量が増えるため、高い程望ましい。
【0041】
焦点位置での光線の直径は、アブレーションのためのエネルギー密度と密接な関係がある。1パルス当たりのエネルギーが同じレーザーでも、焦点位置での光線の直径が小さい程、エネルギー密度は大きくなる。また、焦点位置での光線の直径が大きい程、エネルギー密度は小さくなる。これにより、焦点位置での光線の直径は、アブレーションの閾値を超えるか超えないかが決定されるパラメータとなる。
【0042】
上記焦点位置での光線の直径は、レーザーより出射される光線の直径が一定の場合、配置するレンズの焦点距離と大きく関連する。焦点距離が大きくなると焦点位置での光線の直径は大きくなり、焦点距離が小さくなると焦点位置での光線の直径も小さくなる。この値は幾何光学的に算出できる。
【0043】
レーザーの照射時間は長い程、作製できるナノ粒子の量が増える。照射時間とナノ粒子の生成量はほぼ比例関係にあり、時間を長くすることにより多くのナノ粒子が得られる。
【0044】
レーザーアブレーションに用いる液体としては、純水、メタノール、エタノール、プロパノール等の極性溶媒や、ヘキサン、ベンゼン等の非極性溶媒のうちいずれか1種、またいずれか2種以上の組み合わせ等を採用することができる。
【0045】
液体に添加するものとしては、ドデシル硫酸ナトリウム(SDS)等のアニオン性界面活性剤、セチルトリメチルアンモニウムブロマイド(CTAB)等のカチオン性界面活性剤、アルキルカルボキシベタイン等の両性界面活性剤、ポリエチレングリコール(PEG)、ポリビニルピロリドン(PVP)等の非イオン性界面活性剤等のうちいずれか1種、またいずれか2種以上の組み合わせを採用することができる。
【0046】
これらの添加物を入れることにより、蛍光強度が増加すると同時に単位時間当たりの蛍光強度の減衰が小さくなり、残光特性が向上する。また、適切な添加剤を選択することにより分散性も向上する。
【0047】
上述の製造方法により作製された蛍光粒子について説明する。
【0048】
蛍光粒子の材質としては、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+等のEr3+を付活剤として含むもの等から選ばれるいずれか1種、またはいずれか2種以上の組み合わせを採用することができる。
【0049】
蛍光粒子の形状は、球、楕円体、ロッド状、リボン状等がある。
【0050】
蛍光粒子の平均粒子径は5〜200nmの範囲内にあることが好ましい。生体内では、細網内皮系組織のクッパー細胞等により、200nmより大きい微粒子は貪食され肝臓や脾臓に蓄積されてしまう。このため生体内で微粒子を用いる場合は200nm以下にする必要がある。また、5nmより小さい微粒子は腎臓で体外に排出されてしまう。このため、生体内で微粒子を用いる場合は5nm以上にする必要がある。これらはEPR(Enhanced Permeability and Retention effect)として知られている。本方法で得られた粒子は粒径の分布をもつが、必要に応じて、遠心分離や透析等により所望の粒径のみを取り出して利用することが可能である。
【0051】
蛍光粒子の励起光波長は600〜1400nmの範囲内にあることが好ましい。励起光波長がこの範囲内にあると、励起光が生体によってさえぎられることがなく、バイオイメージングの際に開腹手術をしなくてもよい、また励起光による細胞の損傷の低減が図れる等の利点がある。
【0052】
蛍光粒子の蛍光光波長は600〜1400nmの範囲内にあることが好ましい。蛍光光波長がこの範囲内にあると、蛍光光が生体によってさえぎられることがなく、バイオイメージングの際に開腹手術をしなくてもよい、また励起光による細胞の損傷の低減が図れる等の利点がある。
【0053】
蛍光粒子は、以下のような用途に用いることができる。
本方法で作製した蛍光粒子を、特定の細胞や薬剤の蛍光マーカとするために、生体内に投与する。投与の方法は径呼吸器投与、経口投与、口腔・舌下・鼻空内投与、皮膚を介したTTS(transdermal therapeutic system)、皮下注射、筋肉注射、局所投与等がある。この際、目的部位への受動ターゲティングによる薬物輸送システム(DDS)の他に、モノクローナル抗体等の抗体やペプチド、磁性ナノ粒子等を用いた能動ターゲッティングも用いることができる。その後、生体外から発振波長980nmの赤外線レーザー等の励起光を照射することにより、蛍光粒子を発光させることができ、特定の細胞のバイオイメージングや薬剤の移動経路の特定等が実現できる。
【0054】
アップコンバージョンナノ粒子を用いた場合、次のような利点がある。すなわち、(1)高い生体透過性(透過する領域は「生体の窓」と言われる。)[1]のために、励起光が生体によってさえぎられることがなく、バイオイメージングの際に開腹手術をしなくてもよい。(2)高い生体透過性のため、励起光による細胞の損傷の低減が図れる。(3)励起光を照射した際に細胞自体が蛍光光を発する自家蛍光の問題を解決できる。赤外光では細胞内の蛍光物質を励起できないからである。(4)バイオイメージングの際には細胞による散乱光も問題となるが、散乱強度は波長の4乗に反比例するため、散乱光の低減も図れる。(5)蛍光色素に比べて、褪色の問題がない。
【0055】
がん治療方法への用途について説明する。先ず、生体内にポルフィリン等の光感受性物質を投与する。次に、本方法で作製した蛍光粒子を生体内に投与する。この2つの物質はリガンド等を用いて結合させ、同時に投与することも可能である。がん細胞は活発に分裂しているため、これらの物質は受動的に取り込まれる傾向がある。投与の方法は径呼吸器投与、経口投与、口腔・舌下・鼻空内投与、皮膚を介したTTS(transdermal therapeutic system)、皮下注射、筋肉注射、局所投与等がある。また、モノクローナル抗体等の抗体やペプチド、磁性ナノ粒子等を用いた能動ターゲッティングを用いても、がん細胞に蛍光粒子を効果的に薬物輸送できる。ここで生体外から、生体外から発振波長980nmの赤外線レーザー等の励起光を照射することにより、蛍光粒子を発光させることができ、この光でポルフィリン等の光感受性物質において光化学反応により活性酸素が発生し、がん細胞が死滅させることができる。
【0056】
今回作製したナノ粒子は安定な酸化物であり、フッ化物(NaYF4)のようなフッ素に起因した問題が解決できる。また、従来の光線力学療法では可視光を用いるため、小さな初期段階の腫瘍しか治療できないが、アップコンバージョンナノ粒子を用いた光線力学療法では生体透過性が高い赤外光を用いるため、大きな腫瘍も治療できるようになる。従来の光線力学療法は低侵襲性で患者の負担が小さいがん治療法であるが、小さな腫瘍しか治療できないことが問題であったが、アップコンバージョンナノ粒子を用いることによりこれを解決でき、がん患者の大半を占める高齢者の治療法として潜在的に高い可能性を持っている。
【0057】
なお、本発明は上述の発明を実施するための形態に限らず本発明の要旨を逸脱することなくその他種々の構成を採り得ることはもちろんである。
【0058】
[参考文献]
[1] Michael S. Patterson, Brian C. Wilson, Douglas R. Wyman, Laser in Medical Science, 6 (1991) p.379-390.
【実施例】
【0059】
つぎに、本発明にかかる実施例について具体的に説明する。ただし、本発明はこれら実施例に限定されるものではないことはもちろんである。
【0060】
<試料の調製>
【0061】
a) ターゲットの作製
ターゲットは、以下の方法で作製した。
Y(NO3)3・6H2O(関東化学社製)4.3g、Er(NO3)3・5H2O(関東化学社製)55mg、および、Yb(NO3)3・5H2O(和光純薬社製)560mgを純水に溶かしてアンモニア水(関東化学社製)を加える共沈法を用いて、前駆体であるY(OH)3、Yb(OH)3、および、Er(OH)3を合成した。それを900℃で2時間焼成しY2O3:Er3+,Yb3+の粉体を得る。この粉体をペレットにし1250℃で4時間焼結し、ターゲット(直径9mm、高さ3mmの円柱状)を得る。なお、ターゲットを構成するY2O3:Er3+,Yb3+において、Er3+の含有量は1mol%であり、Yb3+の含有量は12mol%である。
【0062】
b) レーザーアブレーション
図1の装置概略図においてレーザー1から発振した光線2を所望の位置に配置したミラー3で折り返し、焦点距離80mmの平凸レンズ4で集光する。本実施例では、集光面積を変化させることによりエネルギー密度を変えた。具体的には、集光面積を0.066cm2、0.039cm2、0.022cm2と変化させた。この焦点位置に、溶媒を入れた石英セル内のターゲット7を配置することにより液相レーザーアブレーションを実施する。集光されたパルスレーザー光は高いエネルギー(1パルス当たりのエネルギー密度:0.35〜1.06 J/cm2)を有しており、ターゲット7からナノ粒子を作製することができる。溶媒は超純水を使用した。レーザーアブレーションは室温で実施し、溶媒の温度も室温である。照射時間は30分であったが、長くするとこによりナノ粒子の作製量を増やすことができる。用いたレーザーはNd:YAG固体レーザー(Spectron Laser社製 SL802,パルス発振,パルス幅13ns,発振波長532nm,繰り返し周波数10Hz,1パルス当たりのエネルギー23.1mJ/pulse)である。
【0063】
<評価方法>
【0064】
a) 平均粒子径
動的光散乱法を用いて、粒子径測定装置 (Spectris社製Zetasizer Nano)で粒径を測定した。
【0065】
b) 光学特性
分光装置には蛍光分光光度計(日立ハイテクノロジーズ社製 F-7000)を用い、励起光源にはレーザーダイオード(Thorlabs社製 L980P300J,波長980nm,出力300mW)を用い、アップコンバージョン特性を測定した。
【0066】
<評価結果>
【0067】
a) 平均粒子径
本実施例では、統計的に全体の粒子径を示せるように動的光散乱法を用いた。図2に示すように、レーザーのエネルギー密度を0.35J/cm2,0.59J/cm2,1.06J/cm2と変化させると、エネルギー密度の上昇と共に平均粒子径がそれぞれ164nm,277nm,346nmと増加した。
【0068】
b) 光学特性
一般に、生体内に入ったナノ粒子は、200nmより大きい場合は肝臓のクッパー細胞に貪食されてしまいバイオイメージングやがん治療に用いることができない。このため、図2中の164nmのナノ粒子に関してアップコンバージョン特性測定を行った。図3に、980nmの赤外光で励起したナノ粒子が水に分散したコロイド溶液の発光特性を示す。660nm付近にピークを持つ赤色の発光が確認できた。これにより、アップコンバージョンナノ粒子の作製が確認できた。
【符号の説明】
【0069】
1‥‥レーザー、2‥‥光線、3‥‥ミラー、4‥‥レンズ、5‥‥溶媒、6‥‥ナノ粒子、7‥‥ターゲット
【特許請求の範囲】
【請求項1】
液体中のターゲットにレーザー光を照射する、蛍光粒子の製造方法において、
前記ターゲットが、アップコンバージョン特性を有する蛍光材料からなる
ことを特徴とする蛍光粒子の製造方法。
【請求項2】
ターゲットの材質は、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+のうちいずれか1種、またいずれか2種以上の組み合わせである
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項3】
ターゲットの材質は、Y2O3:Er3+,Yb3+である
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項4】
液体は、純水、メタノール、エタノール、プロパノール等の極性溶媒、ヘキサン、ベンゼン等の非極性溶媒のうちいずれか1種、またいずれか2種以上の組み合わせである
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項5】
液体は、純水である
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項6】
液体に添加するものは、ドデシル硫酸ナトリウム(SDS)等のアニオン性界面活性剤、セチルトリメチルアンモニウムブロマイド(CTAB)等のカチオン性界面活性剤、アルキルカルボキシベタイン等の両性界面活性剤、ポリエチレングリコール(PEG)、ポリビニルピロリドン(PVP)等の非イオン性界面活性剤のうちいずれか1種、またいずれか2種以上の組み合わせである
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項7】
ターゲットの材質は、Y2O3:Er3+,Yb3+であり、
液体は、純水である
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項8】
アップコンバージョン特性を有する
ことを特徴とする蛍光粒子。
【請求項9】
蛍光粒子の材質は、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+のうちいずれか1種、またいずれか2種以上の組み合わせである
ことを特徴とする請求項8記載の蛍光粒子。
【請求項10】
蛍光粒子の材質は、Y2O3:Er3+,Yb3+である
ことを特徴とする請求項8記載の蛍光粒子。
【請求項11】
平均粒子径は、5〜200nmの範囲内にある
ことを特徴とする請求項8記載の蛍光粒子。
【請求項12】
蛍光粒子の材質は、Y2O3:Er3+,Yb3+であり、
平均粒子径は、5〜200nmの範囲内にある
ことを特徴とする請求項8記載の蛍光粒子。
【請求項13】
バイオイメージングに用いる蛍光粒子であって、
前記蛍光粒子を生体内に投与し、
生体外から赤外励起光を照射することにより、前記蛍光粒子を発光させる
ことを特徴とする請求項8記載の蛍光粒子。
【請求項14】
がん治療に用いる蛍光粒子であって、
光感受性物質と前記蛍光粒子を生体内に投与して、がん細胞に前記光感受性物質と前記蛍光粒子を取り込ませ、
生体外から赤外励起光を照射することにより、前記蛍光粒子を発光させ、
前記光感受性物質の光化学反応により活性酸素を発生させ、前記がん細胞を死滅させる
ことを特徴とする請求項8記載の蛍光粒子。
【請求項1】
液体中のターゲットにレーザー光を照射する、蛍光粒子の製造方法において、
前記ターゲットが、アップコンバージョン特性を有する蛍光材料からなる
ことを特徴とする蛍光粒子の製造方法。
【請求項2】
ターゲットの材質は、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+のうちいずれか1種、またいずれか2種以上の組み合わせである
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項3】
ターゲットの材質は、Y2O3:Er3+,Yb3+である
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項4】
液体は、純水、メタノール、エタノール、プロパノール等の極性溶媒、ヘキサン、ベンゼン等の非極性溶媒のうちいずれか1種、またいずれか2種以上の組み合わせである
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項5】
液体は、純水である
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項6】
液体に添加するものは、ドデシル硫酸ナトリウム(SDS)等のアニオン性界面活性剤、セチルトリメチルアンモニウムブロマイド(CTAB)等のカチオン性界面活性剤、アルキルカルボキシベタイン等の両性界面活性剤、ポリエチレングリコール(PEG)、ポリビニルピロリドン(PVP)等の非イオン性界面活性剤のうちいずれか1種、またいずれか2種以上の組み合わせである
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項7】
ターゲットの材質は、Y2O3:Er3+,Yb3+であり、
液体は、純水である
ことを特徴とする請求項1記載の蛍光粒子の製造方法。
【請求項8】
アップコンバージョン特性を有する
ことを特徴とする蛍光粒子。
【請求項9】
蛍光粒子の材質は、Y2O3:Er3+,Yb3+、Y2O3:Er3+、NaYF4:Er3+,Yb3+のうちいずれか1種、またいずれか2種以上の組み合わせである
ことを特徴とする請求項8記載の蛍光粒子。
【請求項10】
蛍光粒子の材質は、Y2O3:Er3+,Yb3+である
ことを特徴とする請求項8記載の蛍光粒子。
【請求項11】
平均粒子径は、5〜200nmの範囲内にある
ことを特徴とする請求項8記載の蛍光粒子。
【請求項12】
蛍光粒子の材質は、Y2O3:Er3+,Yb3+であり、
平均粒子径は、5〜200nmの範囲内にある
ことを特徴とする請求項8記載の蛍光粒子。
【請求項13】
バイオイメージングに用いる蛍光粒子であって、
前記蛍光粒子を生体内に投与し、
生体外から赤外励起光を照射することにより、前記蛍光粒子を発光させる
ことを特徴とする請求項8記載の蛍光粒子。
【請求項14】
がん治療に用いる蛍光粒子であって、
光感受性物質と前記蛍光粒子を生体内に投与して、がん細胞に前記光感受性物質と前記蛍光粒子を取り込ませ、
生体外から赤外励起光を照射することにより、前記蛍光粒子を発光させ、
前記光感受性物質の光化学反応により活性酸素を発生させ、前記がん細胞を死滅させる
ことを特徴とする請求項8記載の蛍光粒子。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2013−14651(P2013−14651A)
【公開日】平成25年1月24日(2013.1.24)
【国際特許分類】
【出願番号】特願2011−147041(P2011−147041)
【出願日】平成23年7月1日(2011.7.1)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り (1)レーザー学会学術講演会第31回年次大会、社団法人レーザー学会、2011年1月9〜10日 (2)電気化学会第78回大会、社団法人電気化学会、平成23年3月29〜31日 (3)5th Int.Conf.Sci.Technol.for Advanced Ceramics(STAC5),独立行政法人物質・材料研究機構,2011年6月22〜24日
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
【公開日】平成25年1月24日(2013.1.24)
【国際特許分類】
【出願日】平成23年7月1日(2011.7.1)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り (1)レーザー学会学術講演会第31回年次大会、社団法人レーザー学会、2011年1月9〜10日 (2)電気化学会第78回大会、社団法人電気化学会、平成23年3月29〜31日 (3)5th Int.Conf.Sci.Technol.for Advanced Ceramics(STAC5),独立行政法人物質・材料研究機構,2011年6月22〜24日
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
[ Back to top ]

