蛍光色素
【課題】標識時の蛍光強度を向上させ、より高感度の生体分子の検出が可能な蛍光色素を提供すること。
【解決手段】本発明の蛍光色素は、共役系を有し、1種以上のヘテロ原子、セレン原子又はボロン原子を含むアゾール誘導体又はイミダゾール誘導体から成る有機EL色素であり、二重結合を含むリンカーを介して結合した窒素カチオン含有基又は窒素含有基を有する。その高い水溶性により、生体分子に対する標識率を向上させることができ、高感度の生体分子の検出が可能となる。
【解決手段】本発明の蛍光色素は、共役系を有し、1種以上のヘテロ原子、セレン原子又はボロン原子を含むアゾール誘導体又はイミダゾール誘導体から成る有機EL色素であり、二重結合を含むリンカーを介して結合した窒素カチオン含有基又は窒素含有基を有する。その高い水溶性により、生体分子に対する標識率を向上させることができ、高感度の生体分子の検出が可能となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、核酸、タンパク質、ペプチド類、そして糖類等の生体分子の検出に用いる蛍光色素であって、固体状態で発光し、水溶性を有する蛍光色素に関する。
【背景技術】
【0002】
近年、ヒトゲノムの全容が明らかにされ、遺伝子治療、遺伝子診断などを目的としたポストゲノム研究が盛んに行われている。例えば、DNA解析は、DNAマイクロアレイ基盤上に固定されたプローブDNAと、蛍光色素等で標識されたサンプルDNAとをハイブリダイズさせて二本鎖を形成させ、サンプルDNAの検出を行っている。これは蛍光色素で標識した核酸をPCR伸長し、基盤上でハイブリダイゼーションを行った後に測定する手法である。最近では、より多くのアミノ基を有するプライマーを用いた手法、DNAにアミノ基を導入する手法がとられている。
【0003】
標識には、蛍光色素が広く使用されており、高い蛍光強度を有すること、乾燥状態(固体状態)でも発光すること、そして水溶性を有することなどが要求されている。蛍光色素としては、例えば、Cy3やCy5が使用されている(例えば、非特許文献1)。
【非特許文献1】Science 283,1,January,1999,83-87
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかしながら、乾燥状態でも発光する蛍光色素は油溶性であり、水溶性が低いという問題がある。そのため、試料溶液に蛍光色素が十分溶解することができず、標識率が上がらない結果、十分な蛍光強度が得られないという問題があった。
【課題を解決するための手段】
【0005】
上記の課題を解決するため、本発明者は鋭意努力した結果、アゾール誘導体又はイミダゾール誘導体から成る有機EL色素に二重結合を含むリンカーを介して窒素カチオン含有基又は窒素含有基を導入することにより、蛍光色素の水溶性を向上させ、標識時の蛍光強度を大幅に向上させることが可能なことを見出して本発明を完成させたものである。
すなわち、本発明に係る一の蛍光色素は、以下の一般式(1)、(2)又は(3)で表されるアゾール誘導体から成ることを特徴とする。
【0006】
【化1】

【0007】
ここで、(1)及び(3)ではR1は、そして(2)ではR1とR4の一方は、一般式L-Mで示され、Mは、置換基を有しても良いピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカー、(2)のR1とR4の残部、そしてR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示し、Xは置換基を有していてもよい炭素原子、窒素原子、硫黄原子、酸素原子、セレン原子又はボロン原子を示し、R’は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基、An-は、ハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。
【0008】
また、上記のR2とR3には、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種を用いることができる。
【0009】
また、上記のR2とR3には、スルホニル基を有するアリール基を用いることができる。
【0010】
また、上記窒素カチオン含有基あるいは上記窒素含有基に生体分子と結合する反応性基を結合させることもできる。
【0011】
また、本発明に係る別の蛍光色素は、以下の一般式(4)、(5)、(6)、(7)又は(8)で表されるイミダゾール誘導体から成ることを特徴とする蛍光色素である。
【0012】
【化2】

【0013】
ここで、(4)、(6)及び(7)のR1とR4の一方、そして(5)及び(8)のR1、R4及びR5のいずれか一つは、一般式L-Mで示され、Mは、置換基を有しても良いピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカー、(4)、(6)及び(7)のR1とR4の残部、(5)及び(8)のR1、R4及びR5の残部、そしてR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示し、R’、R”は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基、An-は、ハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。
【0014】
また、上記のR2とR3には、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種を用いることができる。
【0015】
また、上記のR2とR3には、スルホニル基を有するアリール基を用いることができる。
【0016】
また、上記窒素カチオン含有基あるいは上記窒素含有基に生体分子と結合する反応性基を結合させることもできる。
【発明の効果】
【0017】
本発明の蛍光色素は、共役系を有し、1種以上のヘテロ原子、セレン原子又はボロン原子を含むアゾール誘導体又はイミダゾール誘導体から成る有機EL色素であり、二重結合を含むリンカーを介して結合した窒素カチオン含有基又は窒素含有基を有する。その高い水溶性により、生体分子に対する標識率を向上させることができ、高感度の生体分子の検出が可能となる。これにより使用する標識色素の量を大幅に低減できることから、標的分子の検出費用を大幅にコストダウンすることも可能となる。また、有機EL色素は固体状態(固体及び半固体を含む)で高い量子収率を有しているので、マイクロアレイなどの基盤上、もしくはビーズ上の乾燥状態でも高い蛍光強度を与える。また、有機EL色素はCy3やCy5に比べ安価であるので、より低コストで生体分子の検出を行うことができる。また、有機EL色素の置換基を変えることにより励起波長及び発光波長を変化させることができるので、蛍光波長の選択の自由度が増加し、レッド、オレンジ、イエロー、グリーン、ブルーなど多くの蛍光波長を用いることができる。これにより、ストークスシフトの大きい(励起波長と蛍光波長の差が大きい)2種以上の蛍光色素を用いることが可能となり、一つの試料中に含まれる複数の標的核酸を同時に検出することも可能となる。また、Cy3やCy5は冷凍保存する必要があるのに対し、有機EL色素は化学的に安定であり、常温での長期保存に耐えることができるので、取り扱いが容易である。
【発明を実施するための最良の形態】
【0018】
以下、本発明の実施の形態について詳細に説明する。
本発明の蛍光色素の発色部は、共役系を有し、1種以上のヘテロ原子、セレン原子又はボロン原子を含むアゾール誘導体又はイミダゾール誘導体から成る有機EL色素である。
【0019】
アゾール誘導体から成る蛍光色素は、以下の一般式(1)、(2)、(3)で示すことができる。
【0020】
【化3】

【0021】
ここで、(1)及び(3)ではR1は、そして(2)ではR1とR4の一方は、一般式L-Mで示され、Mは、ピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカーを示す。リンカーを用いることが好ましい。リンカーは、発色部と標識対象である生体分子との間の立体障害を緩和させ、結合部と生体分子の標識部位との結合を容易にするので、より高い標識率を与えることが可能だからである。
【0022】
また、(2)のR1とR4の残部及びR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示す。上記のアルキル基は、例えば炭素数1から6の直鎖状又は分岐状のアルキル基である。また、上記のアルコキシ基は、例えばメトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、ペンチロキシ基又はフェノキシ基である。また、上記のアルキルエステル基は、炭素数1から6の直鎖状又は分岐状のアルキルエステルである。また、上記の芳香族炭化水素基は単環又は多環を含むアリール基、具体的にはフェニル基、トリル基、キシリル基又はナフチル基であり、より好ましくはフェニル基である。また、上記の複素環基は、例えばピロール基、フラン基、チオフェン基、イミダゾール基、オキサゾール基、チアゾール基、ピラゾール基、ピリジン基又はキノリン基であり、より好ましくはフラン基、イミダゾール基又はチオフェン基である。また、上記の脂肪族炭化水素基は、好ましくは炭素数1から6の直鎖状又は分岐状のアルキル基である。好ましくは、R2、R3が、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種である。あるいは、好ましくは、R2、R3が、スルホニル基を有するアリール基である。
【0023】
また、Xは置換基を有していてもよい炭素原子、窒素原子、硫黄原子、酸素原子、セレン原子又はボロン原子を示す。
【0024】
また、R’は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基を示す。ここで、その脂肪族炭化水素基あるいは芳香族炭化水素基には、上記と同様のものを用いることができる。
【0025】
また、An-は、Cl-、Br-、I-等のハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。
【0026】
アゾール誘導体として、ジアゾール誘導体の例を示したが、以下の一般式で表されるトリアゾール誘導体を用いることもできる。トリアゾール誘導体を用いても、ジアゾール誘導体の場合と同様の効果を得ることができる。
【0027】
【化4】

【0028】
ここで、(9)及び(11)ではR1は、そして(10)ではR1とR7の一方は、一般式L-Mで示され、Mは、ピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカーを示す。リンカーを用いることが好ましい。
【0029】
また、(10)のR1とR7の残部及びR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示す。上記のアルキル基は、例えば炭素数1から6の直鎖状又は分岐状のアルキル基である。また、上記のアルコキシ基は、例えばメトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、ペンチロキシ基又はフェノキシ基である。また、上記のアルキルエステル基は、炭素数1から6の直鎖状又は分岐状のアルキルエステルである。また、上記の芳香族炭化水素基は単環又は多環を含むアリール基、具体的にはフェニル基、トリル基、キシリル基又はナフチル基であり、より好ましくはフェニル基である。また、上記の複素環基は、例えばピロール基、フラン基、チオフェン基、イミダゾール基、オキサゾール基、チアゾール基、ピラゾール基、ピリジン基又はキノリン基であり、より好ましくはフラン基、イミダゾール基又はチオフェン基である。また、上記の脂肪族炭化水素基は、好ましくは炭素数1から6の直鎖状又は分岐状のアルキル基である。好ましくは、R2、R3が、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種である。あるいは、好ましくは、R2、R3が、スルホニル基を有するアリール基である。
【0030】
また、R'は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基を示す。ここで、その脂肪族炭化水素基あるいは芳香族炭化水素基には、上記と同様のものを用いることができる。
【0031】
また、An-は、Cl-、Br-、I-等のハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。
【0032】
イミダゾール誘導体から成る蛍光色素は、以下の一般式で示すことができる。
【0033】
【化5】

【0034】
ここで、(4)、(6)及び(7)のR1とR4の一方、そして(5)及び(8)のR1、R4及びR5のいずれか一つは、一般式L-Mで示され、Mは、ピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカーを示す。
【0035】
また、(4)、(6)及び(7)のR1とR4の残部、(5)及び(8)のR1、R4及びR5の残部、そしてR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示す。上記のアルキル基は、例えば炭素数1から6の直鎖状又は分岐状のアルキル基である。また、上記のアルコキシ基は、例えばメトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、ペンチロキシ基又はフェノキシ基である。また、上記のアルキルエステル基は、炭素数1から6の直鎖状又は分岐状のアルキルエステルである。また、上記の芳香族炭化水素基は単環又は多環を含むアリール基、具体的にはフェニル基、トリル基、キシリル基又はナフチル基であり、より好ましくはフェニル基である。また、上記の複素環基は、例えばピロール基、フラン基、チオフェン基、イミダゾール基、オキサゾール基、チアゾール基、ピラゾール基、ピリジン基又はキノリン基であり、より好ましくはフラン基、イミダゾール基又はチオフェン基である。また、上記の脂肪族炭化水素基は、好ましくは炭素数1から6の直鎖状又は分岐状のアルキル基である。好ましくは、R2、R3が、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種である。あるいは、好ましくは、R2、R3が、スルホニル基を有するアリール基である。
【0036】
また、R'、R"は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基を示す。ここで、その脂肪族炭化水素基あるいは芳香族炭化水素基には、上記と同様のものを用いることができる。
【0037】
また、An-は、Cl-、Br-、I-等のハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。
【0038】
本発明の蛍光色素は、例えば窒素含有基としてピリジン基を含む場合、以下の方法により製造することができる。すなわち、アゾール誘導体又はイミダゾール誘導体のハロアルキル体とトリフェニルホスフィンとを反応させてホスホニウム塩を調製し、このホスホニウム塩とフォルミルピリジンとを用いてウィッティヒ反応により二重結合を介してピリジン基を導入してピリジン体を得る。また、窒素カチオン含有基として、ピリジニウム基を含む場合には、そのピリジン体と、活性エステルのブロモ体とを反応させて、ピリジニウム塩を得ることにより製造することができる。ここで、ハロアルキル体は、アゾール誘導体又はイミダゾール誘導体のヒドロキシ体にハロゲン化剤を反応させる方法を用いることにより得ることができる。ハロゲン化剤には、塩化チオニル、塩化ホスホリル、三塩化リン、五塩化リン、塩化スルフリル、塩素、臭化チオニル、臭素等を用いることができ、好ましくは塩化チオニル又は塩化ホスホリルである。
【0039】
上記の方法は、窒素カチオン含有基の場合、活性エステルのブロモ体を用い、以下に述べる結合部となる活性エステルを含むピリジニウム塩を得る方法について説明したが、上記において導入したピリジンにヨウ化メチルなどのハロアルカン類、ハロアルケン類あるいはハロカルボン酸類を反応させることによりピリジニウム塩を製造することもできる。この場合、ハロアルカン類、ハロアルケン類の末端にイソチオシアネート基、無水マレイン酸などの、以下に述べる結合部となる官能基を含む場合、生体分子と結合させることができる。また、ハロカルボン酸類を用いた場合、ピリジンに化学結合させることで末端にカルボン酸を有するピリジニウム体となるため、ヒドロキシスクシンイミドなどの活性エステル基を導入することもできる。
【0040】
また、本発明の蛍光色素に生体分子に結合する結合部を設けることもできる。結合部は例えば窒素カチオン含有基又は窒素含有基に設けることができる。結合部は、生体分子と結合する反応性基を有し、その反応性基は共有結合又はイオン結合により生体分子と結合する。
【0041】
共有結合として、例えばアミド結合、イミド結合、ウレタン結合、エステル結合、又はグアニジン結合を形成する場合、反応性基には、生体分子のアミノ基、イミノ基、チオール基、カルボキシル基又はヒドロキシル基と反応可能な官能基が好ましい。その官能基には、例えば、イソチオシアネート基、イソシアネート基、無水マレイン酸基、エポキシ基、ハロゲン化スルホニル基、塩化アシル基、ハロゲン化アルキル基、グリオキザル基、アルデヒド基、トリアジン基、カルボジイミド基そして活性エステル化したカルボニル基等を用いることができる。好ましくは、イソチオシアネート基、イソシアネート基、エポキシ基、ハロゲン化アルキル基、トリアジン基、カルボジイミド基そして活性エステル化したカルボニル基から選択されたいずれか1種を用いることが好ましい。より好ましくは、イソチオシアネート基、イソシアネート基、エポキシ基、ハロゲン化アルキル基、トリアジン基、カルボジイミド基そして活性エステル化したカルボニル基から選択されたいずれか1種を用いることが好ましい。さらに好ましくはトリアジン基、カルボジイミド基又は活性エステル化したカルボニル基である。これら反応性基と反応する窒素カチオン含有基の官能基としては、例えばカルボキシル基を用いることができる。例えば、活性エステル化したカルボニル基には、N−ヒドロキシ−スクシンイミドエステルやマレイミドエステルを用いることができる。N−ヒドロキシ−スクシンイミドを用い、縮合剤としてDCCを用いることによりN−ヒドロキシ−スクシンイミドエステル体を経由してアミド結合により蛍光色素と生体分子が結合する。また、カルボジイミド基には、N,N'-ジシクロヘキシルカルボジイミド(DCC)や1-シクロヘキシル-3-(2-モルホリノエチル)カルボジイミド等のカルボジイミド試薬を用いることができる。カルボジイミド体を経由してアミド結合により蛍光色素と生体分子とを結合させることができる。
【0042】
また、イオン結合を形成する反応性基には、アニオン性基やカチオン性基を用いることができる。アニオン性基としては、例えばスルホニル基やカルボキシル基を用いることができる。これらのアニオン性基は、生体分子のカチオン性基、例えばアミノ基とイオン結合する。また、カチオン性基としては、4級アンモニウム基やピリジニウム基等の窒素カチオン含有基を用いることができる。これらカチオン性基は、生体分子のアニオン性基、例えばカルボキシル基とイオン結合する。なお、本発明においては、発色部に結合した窒素カチオン含有基が反応性基としてのカチオン性基を兼ねることができる。
【0043】
本発明の蛍光色素は、標識された固体あるいは半固体状態の生体分子の蛍光を測定する検出方法であれば、あらゆる生体分子の検出方法に適用することができる。従来の蛍光色素に代えて用いることにより、高感度で、化学的に安定で操作性に優れ、さらに低コストの検出方法を提供することができる。本発明の蛍光色素は、生体分子試料に蛍光色素を直接反応させて標識しても良く、あるいは生体分子試料と、本発明の蛍光色素で標識されたプローブとを反応させて標識する方法を用いることもできる。さらに、本発明の蛍光色素で標識した生体分子試料を電気泳動によりサイズ分離する方法を用いることもできる。例えば、核酸を検出対象とするDNAマイクロアレイ法や、プライマーやターミネータを用いるPCR法に用いることができる。
【0044】
また、タンパク質を検出対象とする場合、通常、電気泳動後のタンパク質の検出には染色色素が用いられている。泳動後のゲル中に、染色色素、例えばクーマシーブリリアントブルー(CBB)を浸透させてタンパク質を染色し、UVを照射して発光させる方法が用いられる。しかしながら、従来の染色色素を用いる方法は簡便であるが、感度が100ng程度と低く微量のタンパク質の検出には適さない。また、ゲルを介して染色色素を浸透させるため、染色に長時間を要するという問題もある。これに対し、本発明の蛍光色素を用いると高感度であり、微量タンパク質の検出には好適である。さらに、サイズ分離したタンパク質を質量分析して同定することもできる。
【0045】
ここで、タンパク質には、アルブミン、グロブリン、グルテリン、ヒストン、プロタミン、そしてコラーゲン等の単純タンパク質、核タンパク質、糖タンパク質、リボタンパク質、リンタンパク質、金属タンパク質等の複合タンパク質のいずれも検出対象とすることができる。例えば、リンタンパク質、糖タンパク質、総タンパク質の染色色素に対応させて3種の蛍光色素を用い、二次元電気泳動で分離したタンパク質試料において、リンタンパク質、糖タンパク質及び総タンパク質を染色することができる。また、TOF-Mass等の質量分析を行うことにより、タンパク質を同定できるので、特殊なタンパク質を生成させる、ガンやウィルスによる感染症などの疾病の診断や治療に応用することが可能である。また、コラーゲンは、動物の結合組織を構成するタンパク質であり、独特の繊維状構造をとる。すなわち、3本のポリペプチド鎖からなり、そのペプチド鎖が寄り集まって三重鎖を形成する。コラーゲンは、一般に極めて免疫原性が低いタンパク質であり、食品、化粧品、医薬品等の分野で広く利用されている。しかし、コラーゲンのペプチド鎖に蛍光色素を導入しても、従来の蛍光色素ではその安定性が十分とは言えず、より安定な蛍光色素が必要とされている。そこで、本発明の蛍光色素を用いてコラーゲンを標識することにより、安定かつ高感度な検出を行うことが可能となる。
【0046】
また、タンパク質と特異的に結合する抗体を本発明の蛍光色素で標識することにより、タンパク質を標識することもできる。例えば、IgG抗体をペプシンで処理するとF(ab’)2と呼ばれるフラグメントが得られる。このフラグメントをジチオスレイトール等で還元するとFab’と呼ばれるフラグメントが得られる。Fab’フラグメントは1つもしくは2つのチオール基(-SH)を有している。このチオール基に対してマレイミド基を作用させて特異的な反応を行うことができる。すなわち、本発明の蛍光色素に反応性基としてマレイミド基を導入し、フラグメントのチオール基と反応させることにより抗体を標識することができる。この場合、抗体の生理活性(抗原捕捉能)を失うことがない。
【0047】
なお、本発明の蛍光色素でアプタマーを標識することもできる。アプタマーはオリゴ核酸からなり、塩基配列に依存して種々の特徴ある立体構造をとることができるので、その立体構造を介してタンパク質を含むあらゆる生体分子に結合することができる。この性質を利用し、本発明の蛍光色素で標識したアプタマーを特定のタンパク質に結合させ、被検出物質との結合によるそのタンパク質の構造変化に伴う蛍光変化から間接的に被検出物質を検出することができる。
【0048】
また、本発明の蛍光色素を用いて金属イオンの検出を行うこともできる。体内のDNAやタンパク質などの安定性や高次構造の維持、機能発現、そして生体内のすべての化学反応を司る酵素の活性化など、生体内で起こるあらゆる生命現象に金属イオンは関与している。そのため、生体内での金属イオンの動きをリアルタイムで観察できる金属イオンセンサは医療分野を初めとしてその重要性が叫ばれている。従来、生体分子に蛍光色素を導入した金属イオンセンサが知られている。例えば、K+イオン存在化において、K+イオン取り込んで特殊な構造をとる配列を有する核酸を利用する金属イオンセンサが提案されている(J. AM. CHEM. SOC. 2002, 124, 14286-14287)。エネルギートランスファーを起こす蛍光色素を核酸の両端に導入する。通常は色素間距離があるためエネルギートランスファーは起きない。しかし、K+イオン存在下では核酸が特殊な形をとる結果、蛍光色素がエネルギートランスファーを起こす距離に近接することで、蛍光を観察することができる。また、ペプチドに蛍光色素を導入した亜鉛イオンセンサも提案されている(J. Am. Chem. Soc. 1996, 118, 3053-3054)。これらの従来の蛍光色素に代えて本発明の蛍光色素を用いることにより、従来に比べ高感度で取り扱いが容易な金属イオンセンサを提供することが可能となる。なお、生体内に存在する金属イオンであれば、すべての金属イオンを検出することが可能である。
【0049】
また、本発明の蛍光色素を用いて、細胞内のシグナル観察を行うこともできる。内部シグナルや環境情報に対する細胞の応答には、イオンから酵素へと多大な分子が関与している。シグナル伝達過程では特殊なプロテインキナーゼが活性化し、特殊な細胞タンパク質のリン酸化を導くことで様々な細胞応答の初期応答を担っていることが知られている。ヌクレオチドの結合と加水分解はこれらの活性に重大な役割を果たしており、ヌクレオチド誘導体を用いることで、シグナル伝達挙動を素早く観察することが出来る。例えば、プロテインキナーゼC(PKC)は細胞膜におけるシグナル伝達において重要な役割を果たしている。このCa2+依存セリン/スレオニンプロテインキナーゼはジアシルグリセロールやフォスファティジルセリンの様な膜構成脂質上で活性化され、イオンチャネルや細胞骨格タンパク質に存在するセリンやスレオニンをリン酸化することで膜表面電化を変えシグナル伝達を行っている。これらを生細胞において動的に観察することで細胞のシグナル伝達の観察を行うことができる。
【0050】
ここで、ヌクレオチド誘導体は酵素の基質や阻害剤として供給され、孤立性タンパク質の構造と力学の探査、膜結合タンパク酵素の再構成、ミトコンドリアのようなオルガネラ、除膜筋線維のような組織のヌクレオチド結合タンパク質部分に、結合してその調節を行っている。また、最近ではG-タンパク質の阻害剤や活性体のようなシグナル伝達に影響を与える化合物の存在も解ってきている。このヌクレオチド誘導体に本発明の有機EL色素からなる標識色素を導入することで、これらの細胞内シグナル伝達の動的観察を高感度で、かつ取り扱い容易に行うことが可能となる。
【0051】
また、本発明の蛍光色素を、組織又は細胞試料中の標的核酸や標的タンパク質の発現レベルの検討に用いる組織又は細胞の染色色素としても用いることができる。すなわち、本発明の染色色素を真核細胞の染色に用いると、乾燥状態でも蛍光を発することから標識後の保存などの点で従来の色素よりも優れた性能を示す。また、真核細胞のみならず、細胞骨格用色素としても十分に用いることが可能である。この他、ミトコンドリア、ゴルジ体、小胞体、ソリゾーム、脂質二重膜などの標識に用いることが可能である。これら、標識された細胞等は、湿潤及び乾燥のあらゆる条件下で観測が可能であるため、汎用性が大きい。観測に際しては、蛍光顕微鏡などを用いることができる。
【0052】
また、臨床段階で人体より採取された組織は、ミクロトームなどの機器を用いて薄膜にスライスした後、染色されている。ここでは、Cy色素及びAlexa色素が用いられている。しかしながら、既存の色素は安定性が非常に悪く、再診断の際には、再びサンプルを作製する必要がある。また、作製されたサンプルは標本として保存することが不可能である。しかし、上記の従来の色素に比べ本発明の蛍光色素は、非常に安定な色素であるので、染色した組織を標本として保存することが可能である。
【0053】
また、ガンや感染症等の診断には、抗体の特異的認識能を利用したイムノアッセイが用いられている。イムノアッセイは、標識抗体を用いて目的の抗原を検出する方法であり、標識物質に酵素を用いる酵素イムノアッセイ(ELISA法)や標識物質に蛍光色素を用いる蛍光イムノアッセイ(FIA法)等が用いられている。ELISA法は、最終的な検出は標識物質である酵素の反応によって生じるさまざまなシグナル(発色、発光、化学発光等)を検出及び定量することにより行う。一方、FIA法は、標識物質である蛍光色素に励起光を照射し、それによる蛍光を検出及び定量することにより行う。FIA法は蛍光色素を用いるため鮮明なコントラストを有し定量性に優れ、またELISA法に比べ、より短時間での検出が可能でかつ操作も簡便であるという特徴を有している。しかしながら、従来の蛍光色素は標識率が低いという問題がある。例えば、抗体に対して200倍モル程度の蛍光色素を用いているが、この条件下においても標識率は50−60%程度であった。そのため、蛍光色素を大量に使用する必要があるため検出費用が高コストになったり、未反応の蛍光色素を除去するための処理工程が必要となり検出に長時間を要するという問題があった。これに対し、本発明の蛍光色素を用いることにより、標識率を向上させることができるので、より高感度の検出を行うことが可能となる。
【0054】
また、本発明の蛍光色素を化粧用組成物に用いることもできる。蛍光色素を含む化粧用組成物は、夜間や室内における演出用の化粧としてだけでなく、蛍光色素の明色化効果を利用して、ファンデーションや毛髪の染色剤等に用いられている。ここで、明色化効果とは、蛍光色素が紫外光を吸収して可視光を放出して、皮膚や毛髪に明るさや鮮やかさを与える効果をいう。日本の室内照明には、昼光色や白色の蛍光灯が使われているが、これらの蛍光灯からの光は、青や緑が主であり赤が少ない。そのため、女性の化粧肌は青白くくすんで見えるという問題がある。これに対し、本発明の蛍光色素を用いることにより、例えば、橙色の光を放出する蛍光色素を用い、鮮やかな赤味の色を発色させてくすみの解消を図ることが可能である。また、毛髪の染色に用いると、蛍光色素は可視領域の放出光線により毛髪の色を変えるだけでなく、毛髪の輝きを増加させることも可能である。
【0055】
また、本発明の蛍光色素をマーキング剤に用いることもできる。本発明の蛍光色素を含むマーキング剤は、通常の可視光下では不可視であるが、紫外線等の励起光を照射することにより蛍光色素を発光させて視認することができる。この性質を利用し、犯罪防止や犯罪捜査を目的として、物品や人体等の識別や物質の検出等に使用することができる。マーキング剤の対象物には、偽造や盗難等の犯罪の防止や犯罪捜査の対象となる物品や人体が含まれる。例えば、紙幣、小切手、株券、各種証明書等の重要文書や、自動車、オートバイ、自転車、美術品、家具、ブランド品、衣服等の物品、人体の皮膚、頭髪、爪等の身体表面部分、潜在指紋等の遺留物質等を挙げることができる。さらに、対象物を構成する材料に関しては、上質紙、OCR紙、ノーカーボン紙、アート紙等の紙や、塩化ビニル、ポリエステル、ポリエチレンテレフタレート、ポリプロピレン等のプラスチックや、金属や、ガラスや、セラミックスや、羊毛、木綿、絹、麻等の天然繊維や、再生セルロース繊維、ポリビニルアルコール繊維、ポリアミド繊維、ポリエステル繊維等の合成繊維や、人体皮膚や体液中のタンパク質等を挙げることができる。
【実施例】
【0056】
以下、実施例を用いて本発明をさらに詳細に説明するが、本発明の範囲は以下の実施例により限定されるものではない。
合成例1.
有機EL色素としてオキサジアゾロピリジン誘導体を用いた。
以下に、4,7-ジフェニル-1,2,5-オキサジアゾロピリジンエチルエステルの合成スキームを示す。
【0057】
【化6】

スキーム1
【0058】
(1)ジケトン誘導体(2)の合成
500mL三口フラスコに4-メトキシアセトフェノン(1)30.0 g (0.25 mol)、亜硝酸ナトリウム0.15 gを酢酸100 mLに溶解した。水浴中、HNO3 100 mLを酢酸100 mLに溶解したものを1時間かけて滴下した。その後、室温で2日間撹拌した。反応混合物を500mLの水にゆっくりと入れ、沈殿を生成させた。沈殿物は濾過し、クロロホルムに溶解した。クロロホルム相を飽和重曹水で洗浄し、10% NaCl 水溶液で2回洗浄した。MgSO4で脱水した後、減圧下、クロロホルムを留去し、オキサジアゾール-N-オキサイド(2)を30.5 g (収率82%)で得た。
【0059】
(2)ジケトン誘導体(3)の合成
500mL三口フラスコにオキサジアゾール-N-オキサイド(2)14.7 g (0.05 mol)をアセトニトリル400 mLに溶解した。それにZn 6.0 g、AcOH 7 mL、Ac2O 20mLを添加した。水浴中で反応温度が35℃を超えないように冷却した。6時間撹拌して反応終点とした。反応混合物を濾過し、不溶分を除去した。アセトニトリルを減圧下留去して残渣を得た。残渣をクロロホルムで再結晶し、オキサジアゾールジベンゾイル体(3)を9.6 g (収率69%)で得た。
【0060】
(3)オキサジアゾロピリジンエチルエステル(4)の合成
500mL三口フラスコでオキサジアゾールジベンゾイル体(3)10.0 g (0.035 mol)をブタノール300 mLに溶解した。そこへグリシンエチルエステル塩酸塩 32.0 g (0.23 mol)を添加した。24時間加熱還流を行った。ブタノールを減圧下留去し、残渣を得た。残渣を200mLのクロロホルムに溶解し、10% HCl、飽和NaHCO3、10%NaClで洗浄した。MgSO4で乾燥し、溶媒を留去した。得られた残渣をクロロホルムで再結晶し、オキサジアゾロピリジンエチルエステル(4)を7.6 g (収率 65%)で得た。
【0061】
次いで、ジフェニルオキサジアゾロピリジンエチルエステル体(4)をNaBH4存在下、還元反応を行い、ジアミノアルコール体(5)を得、これと塩化チオニルを反応させチアジアゾロピリジンクロロメチル体(6)を得、これにトリフェニルホスフィンを反応させてホスホニウム塩(7)を得、さらにWittig反応によりビニル体(8)を得、そして活性エステルを含むピリジニウム塩(9)(Lが-CH=CH-の場合)を合成した。以下に反応例を示す。
【0062】
【化7】

スキーム2
【0063】
(1)ジアミノアルコール体(5)の合成
エステル体(4)(1.73 g, 5 mmol)とNaBH4(1.30 g, 35 mmol)のエタノール溶液(100 mL)を12時間加熱環流。反応液を水に注入、一夜放置後に沈澱をろ過してジアミノアルコール体 (5)(1.17 g, 80%)を得た。
【0064】
(2)クロロメチル化閉環体(6)の合成
室温下、アルコール体 (5)(1.17 g)のクロロホルム溶液(60 mL)にSOCl2(6mL)、ピリジンNaBH4(3 mL)をこの順で滴下、その後3時間30分加熱環流。反応液を水に注入、NaHCO3で中和、クロロホルムで抽出。抽出液をMgSO4で乾燥、減圧留去して得た残さをカラム(Kanto C-60; Hexane/CHCl3 = 3/1 (v/v))処理してクロロメチル化閉環体 (6)(1.11 g, 82%)を得た。
【0065】
(3)ホスホニウム塩(7)の合成
クロロメチル体2(112.6 mg, 0.33 mmol)とPh3P(96 mg, 0.37 mmol)のトルエン溶液(5 mL)を3日間加熱環流。沈澱をろ過、エーテルで洗浄してホスホニウム塩 (7)(108 mg, 55%)を得た。
【0066】
(4)ビニル体(8)の合成
氷冷下、m-フォルミルピリジン(16 microL, 0.18 mmol)と水酸化カリウム(85% purity, 15 mg)のエタノール溶液(1 mL)にホスホニウム塩(7)(140.5 mg, 0.23 mmol)を加え、その温度で1時間30分撹拌。沈澱をろ過、エタノール、水で洗浄、乾燥してビニル体(8)(44 mg, 62%)を得た。
【0067】
(5)活性エステルを含むピリジニウム塩(9)の合成
ビニル体(8)(40 mg, 0.10 mmol)とブロムヘキサン酸活性エステル(32 mg, 0.11 mol)のトルエン溶液(2 mL)を5日間加熱環流。沈澱をろ過して活性エステル含有ピリジニウム塩(9)を得た。
【0068】
合成例2.
以下に、4,7-ジ(メトキシフェニル)-1,2,5-オキサジアゾロピリジンエチルエステルの合成スキームを示す。
【0069】
【化8】

スキーム3
【0070】
(1)ジケトン誘導体(11)の合成
500mL三口フラスコに4-メトキシアセトフェノン(10)37.5 g (0.25 mol)、亜硝酸ナトリウム0.15 gを酢酸100 mLに溶解した。水浴中、HNO3 100 mLを酢酸100 mLに溶解したものを2時間かけて滴下した。その後、室温で2日間撹拌した。反応混合物を500mLの水にゆっくりと入れ、沈殿を生成させた。沈殿物は濾過し、クロロホルムに溶解した。クロロホルム相を飽和重曹水で洗浄し、10% NaCl 水溶液で2回洗浄した。MgSO4で脱水した後、減圧下、クロロホルムを留去し、オキサジアゾール-N-オキサイド(11)を34.5 g (収率78%)で得た。
【0071】
(2)ジケトン誘導体(12)の合成
500mL三口フラスコにオキサジアゾール-N-オキサイド(11)17.7 g (0.05 mol)をアセトニトリル400 mLに溶解した。それにZn 12.0 g、AcOH 7 mL、Ac2O 20mLを添加した。水浴中で反応温度が30℃を超えないように冷却した。12時間撹拌して反応終点とした。反応混合物を濾過し、不溶分を除去した。アセトニトリルを減圧下留去して残渣を得た。残渣をクロロホルムで再結晶し、オキサジアゾール-N-オキサイド(12)を10.2 g (収率60%)で得た。
【0072】
(3)オキサジアゾロピリジンエチルエステル(13)の合成
500mL三口フラスコでオキサジアゾール-N-オキサイド(12)15.6 g (0.046 mol)をブタノール300 mLに溶解した。そこへグリシンエチルエステル塩酸塩 32.0 g (0.23 mol)を添加した。24時間加熱還流を行った。ブタノールを減圧下留去し、残渣を得た。残渣を200mLのクロロホルムに溶解し、10% HCl、飽和NaHCO3、10%NaClで洗浄した。MgSO4で乾燥し、溶媒を留去した。得られた残渣をクロロホルムで再結晶し、オキサジアゾロピリジンエチルエステル(13)を13.0 g (収率 70%)で得た。
【0073】
次いで、ジ(メトキシ)フェニルオキサジアゾロピリジンエチルエステル体(13)をNaBH4存在下、還元反応を行い、ヒドロキシメチル体(14)を得、これと塩化チオニルを反応させオキサジアゾロピリジンクロロメチル体(15)を得、これにトリフェニルホスフィンを反応させてホスホニウム塩(16)を得、そしてWittig反応により活性エステルを含むピリジニウム塩(18)(Lが-CH=CH-の場合)を合成した。以下に反応例を示す。
【0074】
【化9】

スキーム4
【0075】
(1)ヒドロキシメチル体(14)の合成
氷冷下、エステル体 13(202 mg, 0.50 mmol)のTHF溶液(3 mL)に DIBALのトルエン溶液(Aldrich, conc 1.5 mol/L, 6 μL)を滴下、その後氷冷下で30分、続いて室温で30分撹拌。反応液を水に注入、3% HCl aq を加えて酸性(沈澱が消失)とし、クロロホルムで抽出。抽出液をMgSO4で乾燥、減圧留去して得た残さをシリカゲル(Kanto C-60)に分散させて一夜80度で加熱。このシリカゲルをAcOEtで洗浄、洗浄液を減圧留去して得た残さをカラム(Kanto C-60; Hexane/AcOEt = 2/1 (v/v))処理してヒドロキシメチル体 (14)(69 mg, 41%)を得た。
【0076】
(2)クロロメチル体(15)の合成
ヒドロキシメチル体 14(95 mg)とSOCl2(3 mL)のクロロホルム溶液(3 mL)を2時間加熱環流。反応液を水に注入、NaHCO3で中和、クロロホルムで抽出。抽出液をMgSO4で乾燥、減圧留去して得た残さをカラム(Kanto C-60; Hexane/CHCl3 = 5/1 (v/v))処理してクロロメチル体 (15)(quant.)を得た。
【0077】
(3)ホスホニウム塩(16)の合成
クロロメチル体 15(127 mg, 0.44 mmol)とPh3P(126 mg, 0.48 mmol)のトルエン溶液(4 mL)を24時間加熱環流。沈澱をろ過してホスホニウム塩(16)(168.6 mg, 54%)を得た。
【0078】
(4)ビニル体(17)の合成
氷冷下、ホスホニウム塩(16)(168.6 mg, 0.26 mmol)と水酸化カリウム(85% purity, 30 mg)のエタノール溶液(3 mL)にm-フォルミルピリジン(27 μL, 0.29 mmol)を加え、その温度で1時間、続いて室温で1時間撹拌。沈澱をろ過、カラム(Kanto C-60; CHCl3/AcOEt = 10/1 (v/v))処理してビニル体(17)(86 mg, 76%)を得た。
【0079】
(5)活性エステルを含むピリジニウム塩(18)の合成
ビニル体(17)(86 mg, 0.20 mmol)とブロムヘキサン酸活性エステル(63 mg, 0.22 mol)のトルエン溶液(2 mL)を3日間加熱環流。沈澱をろ過して活性エステルを含むピリジニウム塩 (18) を得た。
【0080】
(評価)
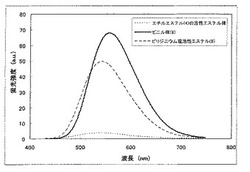
ピリジン基を含むビニル体(8)と、活性エステルを含むピリジニウム塩(9)の水溶液中における蛍光スペクトルを測定した。比較として、窒素カチオン含有基も窒素含有基を含まない、エチルエステル(4)の活性エステル体を測定した。結果を図1に示す。ビニル体(8)とピリジニウム塩(9)は、比較の活性エステル体に比べ、約10倍の蛍光強度を有していた。これにより、本発明の蛍光色素を用いることにより、生体分子の高感度の検出が可能であることを確認できた。
【図面の簡単な説明】
【0081】
【図1】本発明の蛍光色素の水溶液中での励起スペクトルの一例である。
【技術分野】
【0001】
本発明は、核酸、タンパク質、ペプチド類、そして糖類等の生体分子の検出に用いる蛍光色素であって、固体状態で発光し、水溶性を有する蛍光色素に関する。
【背景技術】
【0002】
近年、ヒトゲノムの全容が明らかにされ、遺伝子治療、遺伝子診断などを目的としたポストゲノム研究が盛んに行われている。例えば、DNA解析は、DNAマイクロアレイ基盤上に固定されたプローブDNAと、蛍光色素等で標識されたサンプルDNAとをハイブリダイズさせて二本鎖を形成させ、サンプルDNAの検出を行っている。これは蛍光色素で標識した核酸をPCR伸長し、基盤上でハイブリダイゼーションを行った後に測定する手法である。最近では、より多くのアミノ基を有するプライマーを用いた手法、DNAにアミノ基を導入する手法がとられている。
【0003】
標識には、蛍光色素が広く使用されており、高い蛍光強度を有すること、乾燥状態(固体状態)でも発光すること、そして水溶性を有することなどが要求されている。蛍光色素としては、例えば、Cy3やCy5が使用されている(例えば、非特許文献1)。
【非特許文献1】Science 283,1,January,1999,83-87
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかしながら、乾燥状態でも発光する蛍光色素は油溶性であり、水溶性が低いという問題がある。そのため、試料溶液に蛍光色素が十分溶解することができず、標識率が上がらない結果、十分な蛍光強度が得られないという問題があった。
【課題を解決するための手段】
【0005】
上記の課題を解決するため、本発明者は鋭意努力した結果、アゾール誘導体又はイミダゾール誘導体から成る有機EL色素に二重結合を含むリンカーを介して窒素カチオン含有基又は窒素含有基を導入することにより、蛍光色素の水溶性を向上させ、標識時の蛍光強度を大幅に向上させることが可能なことを見出して本発明を完成させたものである。
すなわち、本発明に係る一の蛍光色素は、以下の一般式(1)、(2)又は(3)で表されるアゾール誘導体から成ることを特徴とする。
【0006】
【化1】

【0007】
ここで、(1)及び(3)ではR1は、そして(2)ではR1とR4の一方は、一般式L-Mで示され、Mは、置換基を有しても良いピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカー、(2)のR1とR4の残部、そしてR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示し、Xは置換基を有していてもよい炭素原子、窒素原子、硫黄原子、酸素原子、セレン原子又はボロン原子を示し、R’は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基、An-は、ハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。
【0008】
また、上記のR2とR3には、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種を用いることができる。
【0009】
また、上記のR2とR3には、スルホニル基を有するアリール基を用いることができる。
【0010】
また、上記窒素カチオン含有基あるいは上記窒素含有基に生体分子と結合する反応性基を結合させることもできる。
【0011】
また、本発明に係る別の蛍光色素は、以下の一般式(4)、(5)、(6)、(7)又は(8)で表されるイミダゾール誘導体から成ることを特徴とする蛍光色素である。
【0012】
【化2】

【0013】
ここで、(4)、(6)及び(7)のR1とR4の一方、そして(5)及び(8)のR1、R4及びR5のいずれか一つは、一般式L-Mで示され、Mは、置換基を有しても良いピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカー、(4)、(6)及び(7)のR1とR4の残部、(5)及び(8)のR1、R4及びR5の残部、そしてR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示し、R’、R”は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基、An-は、ハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。
【0014】
また、上記のR2とR3には、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種を用いることができる。
【0015】
また、上記のR2とR3には、スルホニル基を有するアリール基を用いることができる。
【0016】
また、上記窒素カチオン含有基あるいは上記窒素含有基に生体分子と結合する反応性基を結合させることもできる。
【発明の効果】
【0017】
本発明の蛍光色素は、共役系を有し、1種以上のヘテロ原子、セレン原子又はボロン原子を含むアゾール誘導体又はイミダゾール誘導体から成る有機EL色素であり、二重結合を含むリンカーを介して結合した窒素カチオン含有基又は窒素含有基を有する。その高い水溶性により、生体分子に対する標識率を向上させることができ、高感度の生体分子の検出が可能となる。これにより使用する標識色素の量を大幅に低減できることから、標的分子の検出費用を大幅にコストダウンすることも可能となる。また、有機EL色素は固体状態(固体及び半固体を含む)で高い量子収率を有しているので、マイクロアレイなどの基盤上、もしくはビーズ上の乾燥状態でも高い蛍光強度を与える。また、有機EL色素はCy3やCy5に比べ安価であるので、より低コストで生体分子の検出を行うことができる。また、有機EL色素の置換基を変えることにより励起波長及び発光波長を変化させることができるので、蛍光波長の選択の自由度が増加し、レッド、オレンジ、イエロー、グリーン、ブルーなど多くの蛍光波長を用いることができる。これにより、ストークスシフトの大きい(励起波長と蛍光波長の差が大きい)2種以上の蛍光色素を用いることが可能となり、一つの試料中に含まれる複数の標的核酸を同時に検出することも可能となる。また、Cy3やCy5は冷凍保存する必要があるのに対し、有機EL色素は化学的に安定であり、常温での長期保存に耐えることができるので、取り扱いが容易である。
【発明を実施するための最良の形態】
【0018】
以下、本発明の実施の形態について詳細に説明する。
本発明の蛍光色素の発色部は、共役系を有し、1種以上のヘテロ原子、セレン原子又はボロン原子を含むアゾール誘導体又はイミダゾール誘導体から成る有機EL色素である。
【0019】
アゾール誘導体から成る蛍光色素は、以下の一般式(1)、(2)、(3)で示すことができる。
【0020】
【化3】

【0021】
ここで、(1)及び(3)ではR1は、そして(2)ではR1とR4の一方は、一般式L-Mで示され、Mは、ピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカーを示す。リンカーを用いることが好ましい。リンカーは、発色部と標識対象である生体分子との間の立体障害を緩和させ、結合部と生体分子の標識部位との結合を容易にするので、より高い標識率を与えることが可能だからである。
【0022】
また、(2)のR1とR4の残部及びR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示す。上記のアルキル基は、例えば炭素数1から6の直鎖状又は分岐状のアルキル基である。また、上記のアルコキシ基は、例えばメトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、ペンチロキシ基又はフェノキシ基である。また、上記のアルキルエステル基は、炭素数1から6の直鎖状又は分岐状のアルキルエステルである。また、上記の芳香族炭化水素基は単環又は多環を含むアリール基、具体的にはフェニル基、トリル基、キシリル基又はナフチル基であり、より好ましくはフェニル基である。また、上記の複素環基は、例えばピロール基、フラン基、チオフェン基、イミダゾール基、オキサゾール基、チアゾール基、ピラゾール基、ピリジン基又はキノリン基であり、より好ましくはフラン基、イミダゾール基又はチオフェン基である。また、上記の脂肪族炭化水素基は、好ましくは炭素数1から6の直鎖状又は分岐状のアルキル基である。好ましくは、R2、R3が、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種である。あるいは、好ましくは、R2、R3が、スルホニル基を有するアリール基である。
【0023】
また、Xは置換基を有していてもよい炭素原子、窒素原子、硫黄原子、酸素原子、セレン原子又はボロン原子を示す。
【0024】
また、R’は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基を示す。ここで、その脂肪族炭化水素基あるいは芳香族炭化水素基には、上記と同様のものを用いることができる。
【0025】
また、An-は、Cl-、Br-、I-等のハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。
【0026】
アゾール誘導体として、ジアゾール誘導体の例を示したが、以下の一般式で表されるトリアゾール誘導体を用いることもできる。トリアゾール誘導体を用いても、ジアゾール誘導体の場合と同様の効果を得ることができる。
【0027】
【化4】

【0028】
ここで、(9)及び(11)ではR1は、そして(10)ではR1とR7の一方は、一般式L-Mで示され、Mは、ピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカーを示す。リンカーを用いることが好ましい。
【0029】
また、(10)のR1とR7の残部及びR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示す。上記のアルキル基は、例えば炭素数1から6の直鎖状又は分岐状のアルキル基である。また、上記のアルコキシ基は、例えばメトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、ペンチロキシ基又はフェノキシ基である。また、上記のアルキルエステル基は、炭素数1から6の直鎖状又は分岐状のアルキルエステルである。また、上記の芳香族炭化水素基は単環又は多環を含むアリール基、具体的にはフェニル基、トリル基、キシリル基又はナフチル基であり、より好ましくはフェニル基である。また、上記の複素環基は、例えばピロール基、フラン基、チオフェン基、イミダゾール基、オキサゾール基、チアゾール基、ピラゾール基、ピリジン基又はキノリン基であり、より好ましくはフラン基、イミダゾール基又はチオフェン基である。また、上記の脂肪族炭化水素基は、好ましくは炭素数1から6の直鎖状又は分岐状のアルキル基である。好ましくは、R2、R3が、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種である。あるいは、好ましくは、R2、R3が、スルホニル基を有するアリール基である。
【0030】
また、R'は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基を示す。ここで、その脂肪族炭化水素基あるいは芳香族炭化水素基には、上記と同様のものを用いることができる。
【0031】
また、An-は、Cl-、Br-、I-等のハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。
【0032】
イミダゾール誘導体から成る蛍光色素は、以下の一般式で示すことができる。
【0033】
【化5】

【0034】
ここで、(4)、(6)及び(7)のR1とR4の一方、そして(5)及び(8)のR1、R4及びR5のいずれか一つは、一般式L-Mで示され、Mは、ピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカーを示す。
【0035】
また、(4)、(6)及び(7)のR1とR4の残部、(5)及び(8)のR1、R4及びR5の残部、そしてR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示す。上記のアルキル基は、例えば炭素数1から6の直鎖状又は分岐状のアルキル基である。また、上記のアルコキシ基は、例えばメトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、ペンチロキシ基又はフェノキシ基である。また、上記のアルキルエステル基は、炭素数1から6の直鎖状又は分岐状のアルキルエステルである。また、上記の芳香族炭化水素基は単環又は多環を含むアリール基、具体的にはフェニル基、トリル基、キシリル基又はナフチル基であり、より好ましくはフェニル基である。また、上記の複素環基は、例えばピロール基、フラン基、チオフェン基、イミダゾール基、オキサゾール基、チアゾール基、ピラゾール基、ピリジン基又はキノリン基であり、より好ましくはフラン基、イミダゾール基又はチオフェン基である。また、上記の脂肪族炭化水素基は、好ましくは炭素数1から6の直鎖状又は分岐状のアルキル基である。好ましくは、R2、R3が、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種である。あるいは、好ましくは、R2、R3が、スルホニル基を有するアリール基である。
【0036】
また、R'、R"は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基を示す。ここで、その脂肪族炭化水素基あるいは芳香族炭化水素基には、上記と同様のものを用いることができる。
【0037】
また、An-は、Cl-、Br-、I-等のハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。
【0038】
本発明の蛍光色素は、例えば窒素含有基としてピリジン基を含む場合、以下の方法により製造することができる。すなわち、アゾール誘導体又はイミダゾール誘導体のハロアルキル体とトリフェニルホスフィンとを反応させてホスホニウム塩を調製し、このホスホニウム塩とフォルミルピリジンとを用いてウィッティヒ反応により二重結合を介してピリジン基を導入してピリジン体を得る。また、窒素カチオン含有基として、ピリジニウム基を含む場合には、そのピリジン体と、活性エステルのブロモ体とを反応させて、ピリジニウム塩を得ることにより製造することができる。ここで、ハロアルキル体は、アゾール誘導体又はイミダゾール誘導体のヒドロキシ体にハロゲン化剤を反応させる方法を用いることにより得ることができる。ハロゲン化剤には、塩化チオニル、塩化ホスホリル、三塩化リン、五塩化リン、塩化スルフリル、塩素、臭化チオニル、臭素等を用いることができ、好ましくは塩化チオニル又は塩化ホスホリルである。
【0039】
上記の方法は、窒素カチオン含有基の場合、活性エステルのブロモ体を用い、以下に述べる結合部となる活性エステルを含むピリジニウム塩を得る方法について説明したが、上記において導入したピリジンにヨウ化メチルなどのハロアルカン類、ハロアルケン類あるいはハロカルボン酸類を反応させることによりピリジニウム塩を製造することもできる。この場合、ハロアルカン類、ハロアルケン類の末端にイソチオシアネート基、無水マレイン酸などの、以下に述べる結合部となる官能基を含む場合、生体分子と結合させることができる。また、ハロカルボン酸類を用いた場合、ピリジンに化学結合させることで末端にカルボン酸を有するピリジニウム体となるため、ヒドロキシスクシンイミドなどの活性エステル基を導入することもできる。
【0040】
また、本発明の蛍光色素に生体分子に結合する結合部を設けることもできる。結合部は例えば窒素カチオン含有基又は窒素含有基に設けることができる。結合部は、生体分子と結合する反応性基を有し、その反応性基は共有結合又はイオン結合により生体分子と結合する。
【0041】
共有結合として、例えばアミド結合、イミド結合、ウレタン結合、エステル結合、又はグアニジン結合を形成する場合、反応性基には、生体分子のアミノ基、イミノ基、チオール基、カルボキシル基又はヒドロキシル基と反応可能な官能基が好ましい。その官能基には、例えば、イソチオシアネート基、イソシアネート基、無水マレイン酸基、エポキシ基、ハロゲン化スルホニル基、塩化アシル基、ハロゲン化アルキル基、グリオキザル基、アルデヒド基、トリアジン基、カルボジイミド基そして活性エステル化したカルボニル基等を用いることができる。好ましくは、イソチオシアネート基、イソシアネート基、エポキシ基、ハロゲン化アルキル基、トリアジン基、カルボジイミド基そして活性エステル化したカルボニル基から選択されたいずれか1種を用いることが好ましい。より好ましくは、イソチオシアネート基、イソシアネート基、エポキシ基、ハロゲン化アルキル基、トリアジン基、カルボジイミド基そして活性エステル化したカルボニル基から選択されたいずれか1種を用いることが好ましい。さらに好ましくはトリアジン基、カルボジイミド基又は活性エステル化したカルボニル基である。これら反応性基と反応する窒素カチオン含有基の官能基としては、例えばカルボキシル基を用いることができる。例えば、活性エステル化したカルボニル基には、N−ヒドロキシ−スクシンイミドエステルやマレイミドエステルを用いることができる。N−ヒドロキシ−スクシンイミドを用い、縮合剤としてDCCを用いることによりN−ヒドロキシ−スクシンイミドエステル体を経由してアミド結合により蛍光色素と生体分子が結合する。また、カルボジイミド基には、N,N'-ジシクロヘキシルカルボジイミド(DCC)や1-シクロヘキシル-3-(2-モルホリノエチル)カルボジイミド等のカルボジイミド試薬を用いることができる。カルボジイミド体を経由してアミド結合により蛍光色素と生体分子とを結合させることができる。
【0042】
また、イオン結合を形成する反応性基には、アニオン性基やカチオン性基を用いることができる。アニオン性基としては、例えばスルホニル基やカルボキシル基を用いることができる。これらのアニオン性基は、生体分子のカチオン性基、例えばアミノ基とイオン結合する。また、カチオン性基としては、4級アンモニウム基やピリジニウム基等の窒素カチオン含有基を用いることができる。これらカチオン性基は、生体分子のアニオン性基、例えばカルボキシル基とイオン結合する。なお、本発明においては、発色部に結合した窒素カチオン含有基が反応性基としてのカチオン性基を兼ねることができる。
【0043】
本発明の蛍光色素は、標識された固体あるいは半固体状態の生体分子の蛍光を測定する検出方法であれば、あらゆる生体分子の検出方法に適用することができる。従来の蛍光色素に代えて用いることにより、高感度で、化学的に安定で操作性に優れ、さらに低コストの検出方法を提供することができる。本発明の蛍光色素は、生体分子試料に蛍光色素を直接反応させて標識しても良く、あるいは生体分子試料と、本発明の蛍光色素で標識されたプローブとを反応させて標識する方法を用いることもできる。さらに、本発明の蛍光色素で標識した生体分子試料を電気泳動によりサイズ分離する方法を用いることもできる。例えば、核酸を検出対象とするDNAマイクロアレイ法や、プライマーやターミネータを用いるPCR法に用いることができる。
【0044】
また、タンパク質を検出対象とする場合、通常、電気泳動後のタンパク質の検出には染色色素が用いられている。泳動後のゲル中に、染色色素、例えばクーマシーブリリアントブルー(CBB)を浸透させてタンパク質を染色し、UVを照射して発光させる方法が用いられる。しかしながら、従来の染色色素を用いる方法は簡便であるが、感度が100ng程度と低く微量のタンパク質の検出には適さない。また、ゲルを介して染色色素を浸透させるため、染色に長時間を要するという問題もある。これに対し、本発明の蛍光色素を用いると高感度であり、微量タンパク質の検出には好適である。さらに、サイズ分離したタンパク質を質量分析して同定することもできる。
【0045】
ここで、タンパク質には、アルブミン、グロブリン、グルテリン、ヒストン、プロタミン、そしてコラーゲン等の単純タンパク質、核タンパク質、糖タンパク質、リボタンパク質、リンタンパク質、金属タンパク質等の複合タンパク質のいずれも検出対象とすることができる。例えば、リンタンパク質、糖タンパク質、総タンパク質の染色色素に対応させて3種の蛍光色素を用い、二次元電気泳動で分離したタンパク質試料において、リンタンパク質、糖タンパク質及び総タンパク質を染色することができる。また、TOF-Mass等の質量分析を行うことにより、タンパク質を同定できるので、特殊なタンパク質を生成させる、ガンやウィルスによる感染症などの疾病の診断や治療に応用することが可能である。また、コラーゲンは、動物の結合組織を構成するタンパク質であり、独特の繊維状構造をとる。すなわち、3本のポリペプチド鎖からなり、そのペプチド鎖が寄り集まって三重鎖を形成する。コラーゲンは、一般に極めて免疫原性が低いタンパク質であり、食品、化粧品、医薬品等の分野で広く利用されている。しかし、コラーゲンのペプチド鎖に蛍光色素を導入しても、従来の蛍光色素ではその安定性が十分とは言えず、より安定な蛍光色素が必要とされている。そこで、本発明の蛍光色素を用いてコラーゲンを標識することにより、安定かつ高感度な検出を行うことが可能となる。
【0046】
また、タンパク質と特異的に結合する抗体を本発明の蛍光色素で標識することにより、タンパク質を標識することもできる。例えば、IgG抗体をペプシンで処理するとF(ab’)2と呼ばれるフラグメントが得られる。このフラグメントをジチオスレイトール等で還元するとFab’と呼ばれるフラグメントが得られる。Fab’フラグメントは1つもしくは2つのチオール基(-SH)を有している。このチオール基に対してマレイミド基を作用させて特異的な反応を行うことができる。すなわち、本発明の蛍光色素に反応性基としてマレイミド基を導入し、フラグメントのチオール基と反応させることにより抗体を標識することができる。この場合、抗体の生理活性(抗原捕捉能)を失うことがない。
【0047】
なお、本発明の蛍光色素でアプタマーを標識することもできる。アプタマーはオリゴ核酸からなり、塩基配列に依存して種々の特徴ある立体構造をとることができるので、その立体構造を介してタンパク質を含むあらゆる生体分子に結合することができる。この性質を利用し、本発明の蛍光色素で標識したアプタマーを特定のタンパク質に結合させ、被検出物質との結合によるそのタンパク質の構造変化に伴う蛍光変化から間接的に被検出物質を検出することができる。
【0048】
また、本発明の蛍光色素を用いて金属イオンの検出を行うこともできる。体内のDNAやタンパク質などの安定性や高次構造の維持、機能発現、そして生体内のすべての化学反応を司る酵素の活性化など、生体内で起こるあらゆる生命現象に金属イオンは関与している。そのため、生体内での金属イオンの動きをリアルタイムで観察できる金属イオンセンサは医療分野を初めとしてその重要性が叫ばれている。従来、生体分子に蛍光色素を導入した金属イオンセンサが知られている。例えば、K+イオン存在化において、K+イオン取り込んで特殊な構造をとる配列を有する核酸を利用する金属イオンセンサが提案されている(J. AM. CHEM. SOC. 2002, 124, 14286-14287)。エネルギートランスファーを起こす蛍光色素を核酸の両端に導入する。通常は色素間距離があるためエネルギートランスファーは起きない。しかし、K+イオン存在下では核酸が特殊な形をとる結果、蛍光色素がエネルギートランスファーを起こす距離に近接することで、蛍光を観察することができる。また、ペプチドに蛍光色素を導入した亜鉛イオンセンサも提案されている(J. Am. Chem. Soc. 1996, 118, 3053-3054)。これらの従来の蛍光色素に代えて本発明の蛍光色素を用いることにより、従来に比べ高感度で取り扱いが容易な金属イオンセンサを提供することが可能となる。なお、生体内に存在する金属イオンであれば、すべての金属イオンを検出することが可能である。
【0049】
また、本発明の蛍光色素を用いて、細胞内のシグナル観察を行うこともできる。内部シグナルや環境情報に対する細胞の応答には、イオンから酵素へと多大な分子が関与している。シグナル伝達過程では特殊なプロテインキナーゼが活性化し、特殊な細胞タンパク質のリン酸化を導くことで様々な細胞応答の初期応答を担っていることが知られている。ヌクレオチドの結合と加水分解はこれらの活性に重大な役割を果たしており、ヌクレオチド誘導体を用いることで、シグナル伝達挙動を素早く観察することが出来る。例えば、プロテインキナーゼC(PKC)は細胞膜におけるシグナル伝達において重要な役割を果たしている。このCa2+依存セリン/スレオニンプロテインキナーゼはジアシルグリセロールやフォスファティジルセリンの様な膜構成脂質上で活性化され、イオンチャネルや細胞骨格タンパク質に存在するセリンやスレオニンをリン酸化することで膜表面電化を変えシグナル伝達を行っている。これらを生細胞において動的に観察することで細胞のシグナル伝達の観察を行うことができる。
【0050】
ここで、ヌクレオチド誘導体は酵素の基質や阻害剤として供給され、孤立性タンパク質の構造と力学の探査、膜結合タンパク酵素の再構成、ミトコンドリアのようなオルガネラ、除膜筋線維のような組織のヌクレオチド結合タンパク質部分に、結合してその調節を行っている。また、最近ではG-タンパク質の阻害剤や活性体のようなシグナル伝達に影響を与える化合物の存在も解ってきている。このヌクレオチド誘導体に本発明の有機EL色素からなる標識色素を導入することで、これらの細胞内シグナル伝達の動的観察を高感度で、かつ取り扱い容易に行うことが可能となる。
【0051】
また、本発明の蛍光色素を、組織又は細胞試料中の標的核酸や標的タンパク質の発現レベルの検討に用いる組織又は細胞の染色色素としても用いることができる。すなわち、本発明の染色色素を真核細胞の染色に用いると、乾燥状態でも蛍光を発することから標識後の保存などの点で従来の色素よりも優れた性能を示す。また、真核細胞のみならず、細胞骨格用色素としても十分に用いることが可能である。この他、ミトコンドリア、ゴルジ体、小胞体、ソリゾーム、脂質二重膜などの標識に用いることが可能である。これら、標識された細胞等は、湿潤及び乾燥のあらゆる条件下で観測が可能であるため、汎用性が大きい。観測に際しては、蛍光顕微鏡などを用いることができる。
【0052】
また、臨床段階で人体より採取された組織は、ミクロトームなどの機器を用いて薄膜にスライスした後、染色されている。ここでは、Cy色素及びAlexa色素が用いられている。しかしながら、既存の色素は安定性が非常に悪く、再診断の際には、再びサンプルを作製する必要がある。また、作製されたサンプルは標本として保存することが不可能である。しかし、上記の従来の色素に比べ本発明の蛍光色素は、非常に安定な色素であるので、染色した組織を標本として保存することが可能である。
【0053】
また、ガンや感染症等の診断には、抗体の特異的認識能を利用したイムノアッセイが用いられている。イムノアッセイは、標識抗体を用いて目的の抗原を検出する方法であり、標識物質に酵素を用いる酵素イムノアッセイ(ELISA法)や標識物質に蛍光色素を用いる蛍光イムノアッセイ(FIA法)等が用いられている。ELISA法は、最終的な検出は標識物質である酵素の反応によって生じるさまざまなシグナル(発色、発光、化学発光等)を検出及び定量することにより行う。一方、FIA法は、標識物質である蛍光色素に励起光を照射し、それによる蛍光を検出及び定量することにより行う。FIA法は蛍光色素を用いるため鮮明なコントラストを有し定量性に優れ、またELISA法に比べ、より短時間での検出が可能でかつ操作も簡便であるという特徴を有している。しかしながら、従来の蛍光色素は標識率が低いという問題がある。例えば、抗体に対して200倍モル程度の蛍光色素を用いているが、この条件下においても標識率は50−60%程度であった。そのため、蛍光色素を大量に使用する必要があるため検出費用が高コストになったり、未反応の蛍光色素を除去するための処理工程が必要となり検出に長時間を要するという問題があった。これに対し、本発明の蛍光色素を用いることにより、標識率を向上させることができるので、より高感度の検出を行うことが可能となる。
【0054】
また、本発明の蛍光色素を化粧用組成物に用いることもできる。蛍光色素を含む化粧用組成物は、夜間や室内における演出用の化粧としてだけでなく、蛍光色素の明色化効果を利用して、ファンデーションや毛髪の染色剤等に用いられている。ここで、明色化効果とは、蛍光色素が紫外光を吸収して可視光を放出して、皮膚や毛髪に明るさや鮮やかさを与える効果をいう。日本の室内照明には、昼光色や白色の蛍光灯が使われているが、これらの蛍光灯からの光は、青や緑が主であり赤が少ない。そのため、女性の化粧肌は青白くくすんで見えるという問題がある。これに対し、本発明の蛍光色素を用いることにより、例えば、橙色の光を放出する蛍光色素を用い、鮮やかな赤味の色を発色させてくすみの解消を図ることが可能である。また、毛髪の染色に用いると、蛍光色素は可視領域の放出光線により毛髪の色を変えるだけでなく、毛髪の輝きを増加させることも可能である。
【0055】
また、本発明の蛍光色素をマーキング剤に用いることもできる。本発明の蛍光色素を含むマーキング剤は、通常の可視光下では不可視であるが、紫外線等の励起光を照射することにより蛍光色素を発光させて視認することができる。この性質を利用し、犯罪防止や犯罪捜査を目的として、物品や人体等の識別や物質の検出等に使用することができる。マーキング剤の対象物には、偽造や盗難等の犯罪の防止や犯罪捜査の対象となる物品や人体が含まれる。例えば、紙幣、小切手、株券、各種証明書等の重要文書や、自動車、オートバイ、自転車、美術品、家具、ブランド品、衣服等の物品、人体の皮膚、頭髪、爪等の身体表面部分、潜在指紋等の遺留物質等を挙げることができる。さらに、対象物を構成する材料に関しては、上質紙、OCR紙、ノーカーボン紙、アート紙等の紙や、塩化ビニル、ポリエステル、ポリエチレンテレフタレート、ポリプロピレン等のプラスチックや、金属や、ガラスや、セラミックスや、羊毛、木綿、絹、麻等の天然繊維や、再生セルロース繊維、ポリビニルアルコール繊維、ポリアミド繊維、ポリエステル繊維等の合成繊維や、人体皮膚や体液中のタンパク質等を挙げることができる。
【実施例】
【0056】
以下、実施例を用いて本発明をさらに詳細に説明するが、本発明の範囲は以下の実施例により限定されるものではない。
合成例1.
有機EL色素としてオキサジアゾロピリジン誘導体を用いた。
以下に、4,7-ジフェニル-1,2,5-オキサジアゾロピリジンエチルエステルの合成スキームを示す。
【0057】
【化6】

スキーム1
【0058】
(1)ジケトン誘導体(2)の合成
500mL三口フラスコに4-メトキシアセトフェノン(1)30.0 g (0.25 mol)、亜硝酸ナトリウム0.15 gを酢酸100 mLに溶解した。水浴中、HNO3 100 mLを酢酸100 mLに溶解したものを1時間かけて滴下した。その後、室温で2日間撹拌した。反応混合物を500mLの水にゆっくりと入れ、沈殿を生成させた。沈殿物は濾過し、クロロホルムに溶解した。クロロホルム相を飽和重曹水で洗浄し、10% NaCl 水溶液で2回洗浄した。MgSO4で脱水した後、減圧下、クロロホルムを留去し、オキサジアゾール-N-オキサイド(2)を30.5 g (収率82%)で得た。
【0059】
(2)ジケトン誘導体(3)の合成
500mL三口フラスコにオキサジアゾール-N-オキサイド(2)14.7 g (0.05 mol)をアセトニトリル400 mLに溶解した。それにZn 6.0 g、AcOH 7 mL、Ac2O 20mLを添加した。水浴中で反応温度が35℃を超えないように冷却した。6時間撹拌して反応終点とした。反応混合物を濾過し、不溶分を除去した。アセトニトリルを減圧下留去して残渣を得た。残渣をクロロホルムで再結晶し、オキサジアゾールジベンゾイル体(3)を9.6 g (収率69%)で得た。
【0060】
(3)オキサジアゾロピリジンエチルエステル(4)の合成
500mL三口フラスコでオキサジアゾールジベンゾイル体(3)10.0 g (0.035 mol)をブタノール300 mLに溶解した。そこへグリシンエチルエステル塩酸塩 32.0 g (0.23 mol)を添加した。24時間加熱還流を行った。ブタノールを減圧下留去し、残渣を得た。残渣を200mLのクロロホルムに溶解し、10% HCl、飽和NaHCO3、10%NaClで洗浄した。MgSO4で乾燥し、溶媒を留去した。得られた残渣をクロロホルムで再結晶し、オキサジアゾロピリジンエチルエステル(4)を7.6 g (収率 65%)で得た。
【0061】
次いで、ジフェニルオキサジアゾロピリジンエチルエステル体(4)をNaBH4存在下、還元反応を行い、ジアミノアルコール体(5)を得、これと塩化チオニルを反応させチアジアゾロピリジンクロロメチル体(6)を得、これにトリフェニルホスフィンを反応させてホスホニウム塩(7)を得、さらにWittig反応によりビニル体(8)を得、そして活性エステルを含むピリジニウム塩(9)(Lが-CH=CH-の場合)を合成した。以下に反応例を示す。
【0062】
【化7】

スキーム2
【0063】
(1)ジアミノアルコール体(5)の合成
エステル体(4)(1.73 g, 5 mmol)とNaBH4(1.30 g, 35 mmol)のエタノール溶液(100 mL)を12時間加熱環流。反応液を水に注入、一夜放置後に沈澱をろ過してジアミノアルコール体 (5)(1.17 g, 80%)を得た。
【0064】
(2)クロロメチル化閉環体(6)の合成
室温下、アルコール体 (5)(1.17 g)のクロロホルム溶液(60 mL)にSOCl2(6mL)、ピリジンNaBH4(3 mL)をこの順で滴下、その後3時間30分加熱環流。反応液を水に注入、NaHCO3で中和、クロロホルムで抽出。抽出液をMgSO4で乾燥、減圧留去して得た残さをカラム(Kanto C-60; Hexane/CHCl3 = 3/1 (v/v))処理してクロロメチル化閉環体 (6)(1.11 g, 82%)を得た。
【0065】
(3)ホスホニウム塩(7)の合成
クロロメチル体2(112.6 mg, 0.33 mmol)とPh3P(96 mg, 0.37 mmol)のトルエン溶液(5 mL)を3日間加熱環流。沈澱をろ過、エーテルで洗浄してホスホニウム塩 (7)(108 mg, 55%)を得た。
【0066】
(4)ビニル体(8)の合成
氷冷下、m-フォルミルピリジン(16 microL, 0.18 mmol)と水酸化カリウム(85% purity, 15 mg)のエタノール溶液(1 mL)にホスホニウム塩(7)(140.5 mg, 0.23 mmol)を加え、その温度で1時間30分撹拌。沈澱をろ過、エタノール、水で洗浄、乾燥してビニル体(8)(44 mg, 62%)を得た。
【0067】
(5)活性エステルを含むピリジニウム塩(9)の合成
ビニル体(8)(40 mg, 0.10 mmol)とブロムヘキサン酸活性エステル(32 mg, 0.11 mol)のトルエン溶液(2 mL)を5日間加熱環流。沈澱をろ過して活性エステル含有ピリジニウム塩(9)を得た。
【0068】
合成例2.
以下に、4,7-ジ(メトキシフェニル)-1,2,5-オキサジアゾロピリジンエチルエステルの合成スキームを示す。
【0069】
【化8】

スキーム3
【0070】
(1)ジケトン誘導体(11)の合成
500mL三口フラスコに4-メトキシアセトフェノン(10)37.5 g (0.25 mol)、亜硝酸ナトリウム0.15 gを酢酸100 mLに溶解した。水浴中、HNO3 100 mLを酢酸100 mLに溶解したものを2時間かけて滴下した。その後、室温で2日間撹拌した。反応混合物を500mLの水にゆっくりと入れ、沈殿を生成させた。沈殿物は濾過し、クロロホルムに溶解した。クロロホルム相を飽和重曹水で洗浄し、10% NaCl 水溶液で2回洗浄した。MgSO4で脱水した後、減圧下、クロロホルムを留去し、オキサジアゾール-N-オキサイド(11)を34.5 g (収率78%)で得た。
【0071】
(2)ジケトン誘導体(12)の合成
500mL三口フラスコにオキサジアゾール-N-オキサイド(11)17.7 g (0.05 mol)をアセトニトリル400 mLに溶解した。それにZn 12.0 g、AcOH 7 mL、Ac2O 20mLを添加した。水浴中で反応温度が30℃を超えないように冷却した。12時間撹拌して反応終点とした。反応混合物を濾過し、不溶分を除去した。アセトニトリルを減圧下留去して残渣を得た。残渣をクロロホルムで再結晶し、オキサジアゾール-N-オキサイド(12)を10.2 g (収率60%)で得た。
【0072】
(3)オキサジアゾロピリジンエチルエステル(13)の合成
500mL三口フラスコでオキサジアゾール-N-オキサイド(12)15.6 g (0.046 mol)をブタノール300 mLに溶解した。そこへグリシンエチルエステル塩酸塩 32.0 g (0.23 mol)を添加した。24時間加熱還流を行った。ブタノールを減圧下留去し、残渣を得た。残渣を200mLのクロロホルムに溶解し、10% HCl、飽和NaHCO3、10%NaClで洗浄した。MgSO4で乾燥し、溶媒を留去した。得られた残渣をクロロホルムで再結晶し、オキサジアゾロピリジンエチルエステル(13)を13.0 g (収率 70%)で得た。
【0073】
次いで、ジ(メトキシ)フェニルオキサジアゾロピリジンエチルエステル体(13)をNaBH4存在下、還元反応を行い、ヒドロキシメチル体(14)を得、これと塩化チオニルを反応させオキサジアゾロピリジンクロロメチル体(15)を得、これにトリフェニルホスフィンを反応させてホスホニウム塩(16)を得、そしてWittig反応により活性エステルを含むピリジニウム塩(18)(Lが-CH=CH-の場合)を合成した。以下に反応例を示す。
【0074】
【化9】

スキーム4
【0075】
(1)ヒドロキシメチル体(14)の合成
氷冷下、エステル体 13(202 mg, 0.50 mmol)のTHF溶液(3 mL)に DIBALのトルエン溶液(Aldrich, conc 1.5 mol/L, 6 μL)を滴下、その後氷冷下で30分、続いて室温で30分撹拌。反応液を水に注入、3% HCl aq を加えて酸性(沈澱が消失)とし、クロロホルムで抽出。抽出液をMgSO4で乾燥、減圧留去して得た残さをシリカゲル(Kanto C-60)に分散させて一夜80度で加熱。このシリカゲルをAcOEtで洗浄、洗浄液を減圧留去して得た残さをカラム(Kanto C-60; Hexane/AcOEt = 2/1 (v/v))処理してヒドロキシメチル体 (14)(69 mg, 41%)を得た。
【0076】
(2)クロロメチル体(15)の合成
ヒドロキシメチル体 14(95 mg)とSOCl2(3 mL)のクロロホルム溶液(3 mL)を2時間加熱環流。反応液を水に注入、NaHCO3で中和、クロロホルムで抽出。抽出液をMgSO4で乾燥、減圧留去して得た残さをカラム(Kanto C-60; Hexane/CHCl3 = 5/1 (v/v))処理してクロロメチル体 (15)(quant.)を得た。
【0077】
(3)ホスホニウム塩(16)の合成
クロロメチル体 15(127 mg, 0.44 mmol)とPh3P(126 mg, 0.48 mmol)のトルエン溶液(4 mL)を24時間加熱環流。沈澱をろ過してホスホニウム塩(16)(168.6 mg, 54%)を得た。
【0078】
(4)ビニル体(17)の合成
氷冷下、ホスホニウム塩(16)(168.6 mg, 0.26 mmol)と水酸化カリウム(85% purity, 30 mg)のエタノール溶液(3 mL)にm-フォルミルピリジン(27 μL, 0.29 mmol)を加え、その温度で1時間、続いて室温で1時間撹拌。沈澱をろ過、カラム(Kanto C-60; CHCl3/AcOEt = 10/1 (v/v))処理してビニル体(17)(86 mg, 76%)を得た。
【0079】
(5)活性エステルを含むピリジニウム塩(18)の合成
ビニル体(17)(86 mg, 0.20 mmol)とブロムヘキサン酸活性エステル(63 mg, 0.22 mol)のトルエン溶液(2 mL)を3日間加熱環流。沈澱をろ過して活性エステルを含むピリジニウム塩 (18) を得た。
【0080】
(評価)
ピリジン基を含むビニル体(8)と、活性エステルを含むピリジニウム塩(9)の水溶液中における蛍光スペクトルを測定した。比較として、窒素カチオン含有基も窒素含有基を含まない、エチルエステル(4)の活性エステル体を測定した。結果を図1に示す。ビニル体(8)とピリジニウム塩(9)は、比較の活性エステル体に比べ、約10倍の蛍光強度を有していた。これにより、本発明の蛍光色素を用いることにより、生体分子の高感度の検出が可能であることを確認できた。
【図面の簡単な説明】
【0081】
【図1】本発明の蛍光色素の水溶液中での励起スペクトルの一例である。
【特許請求の範囲】
【請求項1】
以下の一般式(1)、(2)又は(3)で表されるアゾール誘導体から成る蛍光色素。
【化1】

(式中、(1)及び(3)ではR1は、そして(2)ではR1とR4の一方は、一般式L-Mで示され、Mは、置換基を有しても良いピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカー、(2)のR1とR4の残部、そしてR2及びR3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示し、Xは置換基を有していてもよい炭素原子、窒素原子、硫黄原子、酸素原子、セレン原子又はボロン原子を示し、R'は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基、An-は、ハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。)
【請求項2】
上記のR2とR3が、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種である請求項1記載の蛍光色素。
【請求項3】
上記のR2とR3が、スルホニル基を有するアリール基である請求項1記載の蛍光色素。
【請求項4】
上記窒素カチオン含有基に生体分子と結合する反応性基を結合してなる請求項1記載の蛍光色素。
【請求項5】
上記窒素含有基に生体分子と結合する反応性基を結合してなる請求項1記載の蛍光色素。
【請求項6】
以下の一般式(4)、(5)、(6)、(7)又は(8)で表されるイミダゾール誘導体から成る蛍光色素。
【化2】

(式中、(4)、(6)及び(7)のR1とR4の一方、そして(5)及び(8)のR1、R4及びR5のいずれか一つは、一般式L-Mで示され、Mは、置換基を有しても良いピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカー、(4)、(6)及び(7)のR1とR4の残部、(5)及び(8)のR1、R4及びR5の残部、そしてR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示し、R’、R”は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基、An-は、ハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。)
【請求項7】
上記のR2とR3が、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種である請求項6記載の蛍光色素。
【請求項8】
上記のR2とR3が、スルホニル基を有するアリール基である請求項6記載の蛍光色素。
【請求項9】
上記窒素カチオン含有基に生体分子と結合する反応性基を結合してなる請求項6記載の蛍光色素。
【請求項10】
上記窒素含有基に生体分子と結合する反応性基を結合してなる請求項6記載の蛍光色素。
【請求項1】
以下の一般式(1)、(2)又は(3)で表されるアゾール誘導体から成る蛍光色素。
【化1】

(式中、(1)及び(3)ではR1は、そして(2)ではR1とR4の一方は、一般式L-Mで示され、Mは、置換基を有しても良いピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカー、(2)のR1とR4の残部、そしてR2及びR3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示し、Xは置換基を有していてもよい炭素原子、窒素原子、硫黄原子、酸素原子、セレン原子又はボロン原子を示し、R'は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基、An-は、ハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。)
【請求項2】
上記のR2とR3が、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種である請求項1記載の蛍光色素。
【請求項3】
上記のR2とR3が、スルホニル基を有するアリール基である請求項1記載の蛍光色素。
【請求項4】
上記窒素カチオン含有基に生体分子と結合する反応性基を結合してなる請求項1記載の蛍光色素。
【請求項5】
上記窒素含有基に生体分子と結合する反応性基を結合してなる請求項1記載の蛍光色素。
【請求項6】
以下の一般式(4)、(5)、(6)、(7)又は(8)で表されるイミダゾール誘導体から成る蛍光色素。
【化2】

(式中、(4)、(6)及び(7)のR1とR4の一方、そして(5)及び(8)のR1、R4及びR5のいずれか一つは、一般式L-Mで示され、Mは、置換基を有しても良いピリジニウム基、2級アミノ基、3級アミノ基、4級アミノ基、ピペリジニウム基、ピペラジニウム基、イミダゾリウム基、チアゾリウム基、オキサゾリウム基、キノリウム基、ベンゾイミダゾリウム基、ベンゾチアゾリウム基又はベンゾオキサゾリウム基である窒素カチオン含有基、あるいは置換基を有しても良いピリジン基、2級アミノ基、3級アミノ基、ピペリジン基、ピペラジン基、イミダゾール基、チアゾール基、オキサゾール基、キノリン基、ベンゾイミダゾール基、ベンゾチアゾール基又はベンゾオキサゾール基である窒素含有基を示し、Lは、-(CH=CR6)n-で表され、ここでnは1から5の整数からなり、R6は水素原子あるいは置換基として、メチル基、エチル基等のアルキル基、アルキル基を有するスルホ基、イミダゾリウム基、ピリジニウム基、ピペリジニウム基、フラン基等の複素環基、2級アミノ基、3級アミノ基そして4級アミノ基等のアミノ基、ヒドロキシ基、アルコキシ基、アルデヒド基、カルボキシル基又は芳香族基を示し、Mと発色部とを連結するリンカー、(4)、(6)及び(7)のR1とR4の残部、(5)及び(8)のR1、R4及びR5の残部、そしてR2、R3は、それぞれ独立に、水素原子、ハロゲン原子、置換基としてアルキル基、アルコキシ基、アルキルエステル基、リン酸エステル基、硫酸エステル基、ニトリル基、ヒドロキシル基、シアノ基、スルホニル基、芳香族炭化水素基又は複素環基を有してもよい芳香族炭化水素基又は脂肪族炭化水素基又は複素環基を示し、R’、R”は芳香環を含んでも良いアルキル基からなる脂肪族炭化水素基あるいは芳香族炭化水素基、An-は、ハロゲン化物イオン、CF3SO3-、BF4-又はPF6-を示す。)
【請求項7】
上記のR2とR3が、それぞれ独立に、チオフェン誘導体、フラン誘導体、ピロール誘導体、イミダゾール誘導体、オキサゾール誘導体、チジアゾール誘導体、ピラゾール誘導体、ピリジン誘導体及びキノリン誘導体からなる群から選択された1種である請求項6記載の蛍光色素。
【請求項8】
上記のR2とR3が、スルホニル基を有するアリール基である請求項6記載の蛍光色素。
【請求項9】
上記窒素カチオン含有基に生体分子と結合する反応性基を結合してなる請求項6記載の蛍光色素。
【請求項10】
上記窒素含有基に生体分子と結合する反応性基を結合してなる請求項6記載の蛍光色素。
【図1】




【公開番号】特開2010−37511(P2010−37511A)
【公開日】平成22年2月18日(2010.2.18)
【国際特許分類】
【出願番号】特願2008−205238(P2008−205238)
【出願日】平成20年8月8日(2008.8.8)
【出願人】(503474098)
【Fターム(参考)】
【公開日】平成22年2月18日(2010.2.18)
【国際特許分類】
【出願日】平成20年8月8日(2008.8.8)
【出願人】(503474098)

【Fターム(参考)】
[ Back to top ]

