血中脂質降下剤及び高分子アディポネクチン産生促進剤
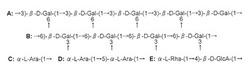
【課題】 白甘藷の皮部及び/又は塊根部の水系抽出物から得られるアラビノガラクタンプロテインの新規な用途を提供する。
【解決手段】 白甘藷の皮部及び/又は塊根部の水系抽出物から得られる、90〜95質量%の下記構成を有する糖鎖と5〜10質量%の下記構成を有するタンパク質とからなる約10〜15万Daの分子量を有するアラビノガラクタンプロテインを、血中脂質低下作用剤及びアディポネクチン産生作用剤として使用する。
【解決手段】 白甘藷の皮部及び/又は塊根部の水系抽出物から得られる、90〜95質量%の下記構成を有する糖鎖と5〜10質量%の下記構成を有するタンパク質とからなる約10〜15万Daの分子量を有するアラビノガラクタンプロテインを、血中脂質低下作用剤及びアディポネクチン産生作用剤として使用する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血中脂質降下剤及び高分子アディポネクチン産生促進剤に関する。
【背景技術】
【0002】
近年、腹部に脂肪の蓄積が認められる内臓脂肪型肥満が、脂質異常症、糖尿病、高血圧症、虚血性心疾患などのいわゆる生活習慣病の発症リスクを高めることが明らかとなったことから、「メタボリックシンドローム(内臓脂肪症候群)」の概念が提唱されている。厚生労働省が公表した「平成19年国民健康・栄養調査結果」によると、40〜74歳でみた場合のメタボリックシンドロームが強く疑われる者及びその予備軍と考えられる者の合計が推定2,010万人であり、男性の2人に1人が、女性の5人に1人がメタボリックシンドロームに該当すると言われている。メタボリックシンドロームの診断基準は、腹囲が男性:85cm、女性:90cm以上であって、その他3つの項目(脂質:高トリグリセライド150mg/dL以上かつ/または低HDLコレステロール40mg/dL未満、血圧:収縮期130mmHgかつ/または拡張期85mmHg以上、空腹時血糖値:110mg/dL以上)の内2つ以上の項目に該当することである(非特許文献1)。メタボリックシンドロームと診断されるヒトでは、動脈硬化が招かれやすく、その結果として狭心症、心筋梗塞、脳出血、脳梗塞といった命に関わる疾病をひきおこす危険性が非常に高い。事実、厚生労働省「平成22年人口動態統計の年間推計」においても、3大死因は1990年以降代わることなく第1位が悪性新生物、第2位が心疾患、第3位が脳血管疾患である。メタボリックシンドロームが要因の一つとして考えられる心疾患(狭心症、心筋梗塞)と脳血管疾患による死亡者数は悪性新生物による死亡者数に匹敵する(平成22年:悪性新生物・35万2,000人、心疾患と脳血管疾患・31万2,000人)。このことを考慮すると、事態は極めて深刻であり、メタボリックシンドローム該当者及びこれに該当する可能性の高い者を少なくすることは急務といえる。
【0003】
生活習慣病の増加は食生活の変化が主な原因であるといわれており、これは内臓脂肪蓄積、つまり腹囲が必須の判断基準に位置付けられていることから考えても容易に推測される。この原因として、脂肪や食塩の摂取量が増加したことに加え、運動不足によるエネルギー消費の低下が主たる原因として考えられている。このため、肥満の是正とりわけ脂質代謝の改善が一つの予防策として重要であるといえる。
【0004】
肥満や脂質代謝異常の評価指標として、血中におけるトリグリセライド(中性脂肪:以下「TG」と記される場合がある。)やアディポネクチンが用いられる。近年においては、とりわけアディポネクチンが注目されている。アディポネクチンは、脂肪細胞から分泌される特異的なサイトカインである。また、アディポネクチンは高血圧、脂質代謝及びインスリン抵抗性の改善など多岐にわたる作用を有することが見出されている(非特許文献2)。さらに、近年、アディポネクチンには3量体(低分子アディポネクチン)、6量体(中分子アディポネクチン)及び12〜18量体(高分子アディポネクチン)が存在することが明らかにされ(非特許文献3)、中でも高分子アディポネクチンは低・中分子アディポネクチンと比較して細胞膜表面への結合性が高く、糖の取り込みや脂肪酸燃焼に関与するAMPキナーゼの活性化能に優れていることが明らかにされている(非特許文献3及び4)。このことから、評価指標として、総アディポネクチン濃度よりも、高分子アディポネクチン濃度や高分子アディポネクチン/総アディポネクチン比が重要視されている。従って、血中TG濃度の低下だけでなく血中の高分子アディポネクチン濃度や高分子アディポネクチン/総アディポネクチン比を高めることは、メタボリックシンドロームを抑制するだけでなく、それに関連する疾病の予防や改善につながることが期待される。
【0005】
このような状況下、メタボリックシンドロームの予防や改善を目的として様々な素材が提供されている。例えば、血中TG降下作用が期待される素材としてグァバ葉(特許文献1)やキトサン(特許文献2)が、また、アディポネクチン産生促進作用が期待される素材として柿(特許文献3)、西洋梨(特許文献4)などが提供されている。さらにはイソフラボンやコエンザイムQ10などの抗酸化剤とグルコサミン類やコンドロイチン硫酸コンドロイチンを組み合わせてアディポネクチンの分泌を促進させる方法も提供されている(特許文献5)。
【0006】
ところで、アラビノガラクタンプロテイン(以下、「AGP」と記される場合がある。)は、糖鎖であるアラビノガラクタンと、ペプチド又はタンパク質とから構成される糖タンパクである。AGPは、植物の細胞壁や滲出物にその存在が確認され、植物界では普遍的に存在する成分として知られている。植物における生理機能として、細胞増殖や分化、組織伸張、細胞間相互作用など細胞壁のネットワークにおいて、AGPが重要な役割を果たす(非特許文献5)。
【0007】
代表的なAGPの一つに、アラビアガムが挙げられる。これはアカシア セネガル(Acacia senegal)の滲出液より回収されるAGP(以下「GA」と記される場合がある。)である(非特許文献6)。GAは、前述の生理機能の他に優れた乳化作用を有することから、現在では食品、薬品及び化粧品において広く応用されている。また、GAは、コレステロール降下作用を有することも知られている(非特許文献6)。このコレステロール降下作用は、水溶性食物繊維におけるコレステロール降下作用と同様であって、コレステロールの吸収が抑制された結果、胆汁酸の腸内濃度が低下することによるものであると考えられている。つまり、腸内胆汁酸濃度が低下すると、コレステロールからの胆汁酸合成が増加し、肝臓でのコレステロール合成が上昇する。その結果、血中コレステロール濃度が低下すると考えられている。他には、腸内細菌の作用を受け産生される短鎖脂肪酸が肝臓でのコレステロール合成を抑制することも知られており、これもまた、コレステロール降下のメカニズムの一つとして考えられている(非特許文献7、8)。
【0008】
さらに、他のAGPとして、白甘藷に含まれるAGPが知られている(非特許文献9)。このAGPは、90〜95質量%の糖鎖と、5〜10質量%のタンパク質とからなる約10〜15万Daの分子量を有する糖タンパクであって、前記糖鎖は、主にラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)であり、前記タンパク質は、17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は、それぞれ13〜25:10〜15:13〜20(モル%)である。
【0009】
なるほど、白甘藷の抽出物が血中TG濃度の降下作用を有するとの報告もあるが(非特許文献11)、その活性本態は十分に検討されていない。また、白甘藷に含まれるアラビノガラクタン(以下、「AG」と略記される場合がある。)が血糖降下作用を示すこと(特許文献6)やAGが免疫賦活作用を示すこと(特許文献7)が報告されているが、AGPが血中TG濃度の降下作用やアディポネクチンの産生促進作用を示すとの報告はない。さらに、AGPが投与された糖尿病マウスにおける血中TG濃度変化や血中アディポネクチン濃度変化が報告されているが(非特許文献10)、この報告では、白甘藷由来のAGPは、糖尿病マウスにおいて、血中TG濃度や血中アディポネクチン濃度に影響は与えないことが示されている。
【0010】
このように、これまでのところ、GAや他のAGPにおける血中TG降下作用や高分子アディポネクチン産生促進作用に関連する報告は知られていない。さらに、血中TG降下作用と高分子アディポネクチン産生促進作用の二つの作用を有する化合物は知られておらず、双方の作用を有する化合物を利用すれば、肥満などに代表されるメタボリックシンドロームに対して、より優れた予防効果や治療効果が期待される。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2008−001615号公報
【特許文献2】特開2007−332336号公報
【特許文献3】特開2010−083838号公報
【特許文献4】特開2010−088403号公報
【特許文献5】特開2011−063543号公報
【特許文献6】国際公開 WO2005/105852号公報
【特許文献7】特開2008−208102号公報
【非特許文献】
【0012】
【非特許文献1】メタボリックシンドローム診断基準検討委員会,日本内科学会誌,94,794−809(2005)
【非特許文献2】Kadowaki T., Yamauchi T., Endcrine Rev, 26, 439-451(2005)
【非特許文献3】Aso Y. et al., Diabetes, 55, 1954-1960(2006)
【非特許文献4】Kubota N. et al., Cell Metab., 6, 55-68(2007)
【非特許文献5】Showalter A. M., CMLS,58, 1399-1417(2001)
【非特許文献6】Ali, B.H. et al., Food. Chem. Toxicol., 47, 1-8(2009)
【非特許文献7】Bridges, S. R. et al., Am J Clin Nutr., 56. 455-459(1992)
【非特許文献8】Furgal-Dierzuk, J Animal Food Sci., 13, 31-34(2004)
【非特許文献9】Ozaki Sei, et al., J. Agric. Food Chem. 58, 11593-11599(2010)
【非特許文献10】Naoko Oki, et al., Biosci. Biotechnol. Biochem., 75, 596-698(2011)
【非特許文献11】Shuichi Kusano et al., Biol. Pharm. Bull. 23(1), 23-26(2000)
【発明の概要】
【発明が解決しようとする課題】
【0013】
本願に係る発明は、白甘藷由来のAGPが有する血中TG濃度の降下作用及び高分子アディポネクチンの産生促進作用を利用したものであって、新規な血中脂質降下剤及び新規な高分子アディポネクチンの産生促進剤を提供することを目的としている。
【課題を解決するための手段】
【0014】
本願発明においては、アラビノガラクタンプロテイン及び/又はアラビノガラクタンプロテインを含む白甘藷の皮部及び/又は塊根部の水系抽出物が、血中脂質降下剤及び高分子アディポネクチン産生促進剤の有効成分として利用される。
【発明の効果】
【0015】
本願発明に係るアラビノガラクタンの服用は、高い血中TG濃度を低下させ、また、血中における高分子アディポネクチン濃度を上昇させる。この結果、脂質代謝異常や肥満の改善が図られ、メタボリックシンドロームに起因する生活習慣病が未然に防止される。
【図面の簡単な説明】
【0016】
【図1】図1は、白甘藷由来のアラビノガラクタンプロテインの糖鎖構造を示した図である。Aは主鎖の部分構造を、Bは主鎖の部分構造Aに結合する側鎖の部分構造を、C、D、Eはそれぞれ側鎖Bに結合する部分構造を示す。
【図2】図2は、白甘藷由来のアラビノガラクタンプロテインがZucker Fattyラットにおける血中トリグリセライド濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図3】図3は、白甘藷由来のアラビノガラクタンプロテインがZucker Fattyラットにおける血中遊離脂肪酸濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図4】図4は、白甘藷由来のアラビノガラクタンプロテインがKKAyマウスにおける血中トリグリセライド濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図5】図5は、白甘藷由来のアラビノガラクタンプロテインがKKAyマウスにおける血中総コレステロール濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図6】図6は、白甘藷由来のアラビノガラクタンプロテインがTSODマウスにおける血中トリグリセライド濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図7】図7は、白甘藷由来のアラビノガラクタンプロテインがTSODマウスにおける血中高分子アディポネクチン濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図8】図8は、白甘藷由来のアラビノガラクタンプロテインがTSODマウスにおける血中高分子アディポネクチン濃度比に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【発明を実施するための形態】
【0017】
本発明の血中脂質降下剤又は高分子アディポネクチン産生促進剤は、いずれも白甘藷由来のアラビノガラクタンプロテイン及び/又は当該アラビノガラクタンプロテインを含む白甘藷の水系抽出物を有効成分とする。
【0018】
有効成分であるアラビノガラクタンプロテイン(AGP)は、90〜95質量%の糖鎖と、5〜10質量%のタンパク質とからなる約10〜15万Daの分子量を有する糖タンパクである。その糖鎖は主としてラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)である。AGPを構成するタンパク質は17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は、13〜25:10〜15:13〜20(モル%)である。
【0019】
当該AGPは、白甘藷、主としてその皮部及び/又は塊根部の抽出物から得られる。白甘藷は、その学名をIpomoea Batatas spといい、さつま芋(ヒルガオ科の草本Ipomoea Batatas Poiret)の一種である。本発明においては、白甘藷の塊茎、特にその皮から得られたものが好ましく用いられる。しかし、以下の構造を有するものであれば、白甘藷及びその近縁植物から得られたものに限られるものではない。
【0020】
抽出溶媒は水系溶媒が好ましく用いられる。水系溶媒とは、水やメタノール、エタノール、イソプロパノール(直鎖、分岐鎖を問わない)、ブタノールなど水と混和可能な有機溶媒である。抽出には、これらの水系溶媒の1種又は2種以上が用いられる。抽出方法は特に限定されず、浸漬などの公知の方法が用いられる。また、抽出は加温して行うこともできるが、室温〜40℃の温度で行うのが好ましい。40℃を超えた加温を行うと不溶成分が抽出液に多く含まれることになるからである。
【0021】
AGPは、抽出された溶媒から公知の分離手段によって分離精製される。分離手段として、液−液分配法や液体クロマトグラフィなどのカラムクロマトグラフィが例示される。白甘藷からの単離・精製方法として、例えば、非特許文献9に示された方法が例示される。さらに具体的に言うと、白甘藷の皮又は塊根部の抽出物を煮沸して生じた沈殿物を除去した後、水及び0.01〜1N塩化ナトリウム溶液のイオン強度に相当するイオン強度を有する溶離液を用いた陰イオン交換クロマトグラフィ、好ましくは溶離液のイオン強度を次第に変化させるグラジエントクロマトグラフィによって分離精製される。得られたAGPは、血中脂質降下剤又は高分子アディポネクチン産生促進剤の有効成分として用いられる。その他に、脂質異常症、動脈硬化、高血圧などのいわゆる生活習慣病やメタボリックシンドロームの予防や改善を目的とした健康食品(特定保健用食品を含む)の製造に用いられる。もっとも、効能を標榜するしないに関係なく、おやつや飲料などの各種食品の製造のための添加物として使用することもできる。
【0022】
本発明において血中脂質降下作用とは、ヒトやその他哺乳動物における血中のTG濃度を低下させることであって、AGPは正常値よりも高い血中TG濃度を低下させることに有効である。また、本発明において高分子アディポネクチン産生促進作用は、ヒトやその他哺乳動物における血中の高分子アディポネクチン量を増加させることであって、AGPは血中における総アディポネクチン量における高分子アディポネクチン量の割合を増加させることに有効である。ここで、総アディポネクチン量とは3量体(低分子アディポネクチン)、6量体(中分子アディポネクチン)、12〜18量体(高分子アディポネクチン)を含むアディポネクチンの総量を意味し、高分子アディポネクチン量とは12〜18量体のアディポネクチン量を意味する。
【0023】
本発明に係る血中脂質降下剤及び高分子アディポネクチン産生促進剤は、精製されたAGPであり、AGPの粗精製物であり、AGPを含む白甘藷の抽出物であり、これらの混合物でもあり得る。また、AGP、AGPの粗精製物、AGPを含む白甘藷の抽出物の少なくとも何れかと薬理学的に不活性な賦形剤のような担体を含む組成物であり得る。当該組成物は、担体の他に乳化剤、甘味料、保存料、酸化防止剤、増粘安定剤、防腐剤等の添加剤を適宜含み得る。
【0024】
組成物は医薬品であり、あるいは食品、好ましくはいわゆる健康食品であり得る。ここで、健康食品とは、血中脂質を低下させることを目的として摂取され、血中脂質の低下作用を発揮する食品ないし高分子アディポネクチンの産生を促進させることを目的として摂取され、高分子アディポネクチンの産生促進作用を発揮する食品を意味し、これらの作用効果の標榜が公的に認められた食品(いわゆる特定保健用食品)でもあり得る。
【0025】
組成物の形態は、特に制約されず、錠剤であり、顆粒剤であり、散剤であり、チュアブル錠であり、カプセル剤であり、液剤であり、ゼリーであり、飴やガムであり得る。
【0026】
当該組成物中におけるAGP含有量の下限は、0.00001質量%であり、0.00001質量%であり、0.0001質量%であり、0.001質量%であり、0.01質量%であり、0.05質量%であり、0.1質量%であり得る。また、その上限は、99.9999質量%であり、99.999質量%であり、99.99質量%であり、99.9質量%であり、99質量%であり、90質量%であり、80質量%であり、70質量%であり、50質量
%であり、30質量%であり、20質量%であり、10質量%であり、5質量%であり得る。
【0027】
AGPの摂取量は、血中TG値を正常と考えられる範囲に維持可能な量、あるいは血中高分子アディポネクチン濃度を上昇させ得る量であり、適用対象や症状によって適宜増減され得る。AGPの1日摂取量は、体重1kg当たり0.001ng〜10g、具体的には、その下限は体重1kg当たり0.001ngであり、0.01ngであり、0.1ngであり、1ngであり、0.01mgであり、0.1mgであり、0.5mgであり、1mgであり、5mgであり、10mgであり、50mgであり、100mgであり、200mgであり得る。また、その上限は、体重1kg当たり10gであり、5gであり、2gであり、1gであり、500mgであり得る。
【0028】
以下、下記の実施例に基づいてさらに本発明を詳細に説明するが、下記の実施例は例示であって、本発明は下記の実施例に限定されないのは言うまでもない。
【実施例1】
【0029】
〔AGPの分析〕
白甘藷の皮部破砕物又は皮部乾燥粉末1kgに対し水10Lを加え、40℃に加温して1時間撹拌抽出した。得られた混合液は、遠心分離(8,000 rpm/30分間)後、濾別し抽出液を得た。残渣に更に水を加えて同一の操作を繰り返した。
【0030】
得られた抽出液(約9L)は、減圧下にて4Lまで濃縮された。その後、この濃縮液につき加熱処理(90〜100℃)を行った。具体的には、得られた濃縮液をビーカーに移し、湯浴中にて15分程度撹拌した。生じた沈殿を遠心分離(8,000rpm/30分間)により濾別除去した。得られた濾液につき、ダイアライシスメンブランsize36(分画分子量:14,000、和光純薬工業株式会社製)を用い、脱イオン水中にて4℃で3日間脱塩を行った。ここで得られた透析内液につき、陰イオン交換クロマトグラフィを用いて精製を行った。具体的には、表1に記載の分離条件下にて操作を行い、精製AGPを得た(1.2g、収率0.12%)。
【表1】

【0031】
得られた白甘藷由来AGPの分子量は、多角度光散乱検出器及びサイズ排除クロマトグラフィ(SEC−MALLS:DAWN-E, Wyatt Technology Corporation)を用いた測定から、約13万であった。AGPを構成する糖は、アセチル誘導体化後のGC分析及びギ酸及びトリフルオロ酢酸による完全加水分解後のHPAEC−PAD分析から、表2に示す4種の糖から構成されることが明らかとなった。
【表2】

【0032】
構成アミノ酸は、6M塩酸による酸加水分解後(110℃、22時間)、アミノ酸分析計(L−8800,日立製作所)により確認した。その結果、AGPを構成するタンパク質はハイドロキシプロリン、アラニン及びセリンを主とする計17種のアミノ酸から構成されることが明らかとなった。アミノ酸分析結果を表3に示した。
【表3】

【0033】
更に、各糖残基の結合様式を明らかにするため、メチル化分析を行った。メチル化分析の分析条件は、表4に示した。
【表4】

【0034】
その結果、末端α−Araf、1,5結合−α−Araf、1,3結合−β−Galp、1,6結合−β−Galp及び1,3,6結合−β−Galp残基を含む8種類の結合様式を有することが明らかとなった。
【0035】
次いで、各糖残基の連結パターンを明らかにするため、各種NMRスペクトル(1H、13C−NMR、1H−1H COSY、HOHAHA、HMQC、HMBC)を用い解析した。その結果、白甘藷由来AGPの糖鎖部分は図1に示す部分構造から構成されることが明らかとなった。すなわち、当該糖鎖部分は、図1に示す部分構造A:(1→3)−β−D−ガラクタンからなる主鎖に、次の側鎖がO−6位に結合した構造を有する。この側鎖は、部分構造B:(1→6)−β−D−ガラクタンからなり、O-3位に部分構造C及びD、O−6位に部分構造Eが結合した構造を有する。
【0036】
〔Zucker fatty ラットに対する脂質代謝改善作用〕
試験開始前に、明暗周期(7:00−19:00照明ONの12時間周期)、温度23〜24℃、湿度60〜70%の条件下で、5週齢の雄性Zucker fattyラットを1週間予備飼育した。その後、ラットを2群(各群10匹)に分け、それぞれ対照群(精製水)及び白甘藷由来AGP投与群とした。白甘藷由来AGPの投与量は20mg/kgである。ゾンデを用いて、1日1回12週間、AGPを経口投与した。試験期間中の飼料及び飲料水の摂取はともに自由とした。投与開始以降2週間ごとに、AGP投与後16時間絶食させたマウスの尾静脈から採血した。得られた血漿を用い、血中TG及び血中遊離脂肪酸(以下、NEFA)を測定し、脂質代謝改善作用を評価した。ともに、市販されるキットを用いて測定を行った(TG:トリグリセライドE−テストワコー、NEFA:NEFA C−テストワコー、いずれも和光純薬工業株式会社製)。
【0037】
血中TGの測定結果及びNEFAの測定結果をそれぞれ図2、図3に示す。測定結果は、全て平均値±標準誤差で示され、図中のアスタリスクはStudent's t−検定による対照群との比較結果を示し、一つのアスタリスク(*)は危険率p<0.05で有意差が認められたことを、2つのアスタリスク(**)は危険率p<0.01で有意差が認められたことを、3つのアスタリスク(***)は危険率p<0.001で有意差が認められたことを意味する。
【0038】
図2に示されたように、白甘藷由来AGP投与群の血中TG濃度は、常に対照群よりも低く推移し、投与2週後、6週後及び12週後には対照群と比較して有意に低い値を示した(投与2週後及び6週後:p<0.05、投与12週後:p<0.01)。図3に示されたように、白甘藷由来AGP投与群のNEFAは、投与2週後に対照群と比較して有意に低い値を示し(p<0.05)、その後、投与8週後まで対照群よりも低く推移しながらも、ほぼ同様な挙動を示した。AGPの投与10週後及び12週後までは、有意に低い値を示した(投与10週後:p<0.05、投与12週後:p<0.001)。
【0039】
〔KKAyマウスに対する血中TG低下作用〕
試験開始前に、明暗周期(7:00−19:00照明ONの12時間周期)、温度23〜24℃、湿度60〜70%の条件下で、5週齢の雄性KKAyマウスを1週間予備飼育した。その後、ラットを2群(各群8匹)に分け、それぞれ対照群(精製水)及び白甘藷由来AGP投与群とした。白甘藷由来AGPの投与量は20mg/kgである。ゾンデを用いて、1日1回、5週間、AGPを経口投与した。試験期間中の飼料及び飲料水の摂取はともに自由とした。投与開始以降2週間ごとに、16時間絶食させたマウスの尾静脈から採血した。得られた血漿を用い、血中TG及び総コレステロール(以下、T−Cho)を測定した。ともに、市販されるキットを用いて測定を行った(TG:トリグリセライドE−テストワコー、T−Cho:コレステロールE−テストワコー、いずれも和光純薬工業株式会社製)。
【0040】
血中TGの測定結果及びT−Choの測定結果をそれぞれ図4、図5に示す。測定結果は、全て平均値±標準誤差で示され、図中のアスタリスクはStudent's t−検定による対照群との比較結果を示し、一つのアスタリスク(*)は危険率p<0.05で有意差が認められたことを、2つのアスタリスク(**)は危険率p<0.01で有意差が認められたことを意味する。
【0041】
図4に示されたように、白甘藷由来AGP投与群の血中TG濃度は、投与4週後、5週後に対照群よりも有意に低い値を示した(投与4週後:p<0.05、投与5週後:p<0.01)。また、図5に示されたように、白甘藷由来AGP投与群の血中T−Cho濃度は、対照群よりも低く推移したが、有意な差は認められなかった。投与前後を比較した場合、対照群が投与前の176.5±11.3mg/dLから最終投与後の184.8±9.6 mg/dL(+8.3mg/dL)と推移したのに対し、白甘藷由来AGP投与群は投与前の161.9±16.8mg/dLから投与後の159.5±13.8 mg/dL(−2.4mg/dL)と推移した。血中T−Cho濃度には有意な減少は観察されず、AGPはCho代謝にはほとんど影響を及ぼさないと考えられる。
【0042】
〔Tsumura, Suzuki, Obese, Diabetesマウスに対する血中TG低下作用及び高分子アディポネクチン産生促進作用〕
試験開始前に、明暗周期(7:00−19:00照明ONの12時間周期)、温度23〜24℃、湿度60〜70%の条件下で、5週齢の雄性Tsumura, Suzuki, Obese, Diabetesマウス(以下、「TOSDマウス」と言う)を1週間予備飼育した。その後、TOSDマウスを3群(各群6匹)に分け、それぞれ対照群(精製水)及び白甘藷由来AGP投与群(低用量群と高用量群)とした。低用量群の白甘藷由来AGPの投与量は2mg/kg、高低用量群の白甘藷由来AGPの投与量は20mg/kgである。ゾンデを用いて、1日1回、8週間AGPを経口投与した。試験期間中の飼料及び飲料水の摂取はともに自由とした。8週間の投与後に、16時間絶食させたマウスの尾静脈から採血した。得られた血漿を用い、血中TG、総アディポネクチン(以下、「T−Adipo」と言う)及び高分子アディポネクチン(以下、「HMW−Adipo」と言う)を測定した。これらは、市販されるキットを用いて測定を行った(TG:トリグリセライドE−テストワコー <和光純薬工業株式会社製>、T−Adipo:マウス/ラット アディポネクチン ELISAキット <大塚製薬株式会社製>、HMW−Adipo:マウス/ラット 高分子アディポネクチン ELISAキット <株式会社シバヤギ製>)。
【0043】
血中TGの測定結果及びHMW−Adipoの測定結果をそれぞれ図6〜8に示す。測定結果は、全て平均値±標準誤差で示され、図中のアスタリスクはDunnett's検定による対照群との比較結果を示し、一つのアスタリスク(*)は危険率p<0.05で有意差が認められたことを、2つのアスタリスク(**)は危険率p<0.01で有意差が認められたことを意味する。
【0044】
図6に示されたように、低用量群の血中TG濃度は、対照群と比較して低下傾向(p<0.1)を示したが、有意な差はみられなかった。一方、高用量群の血中TG濃度は、投与8週後に対照群に比べて有意に低い値を示した(p<0.05)。図7に示されたように、低用量群及び高用量群はそれぞれ、投与8週後に対照群に比べてそれぞれ血中HMW−Adipo濃度が有意に高い値を示した(低用量群:p<0.05及び高用量群:p<0.01)。一方、この時のT-Adipo濃度は、対照群の6.70±0.53μg/mLに対し、低用量群のそれは6.88±0.80μg/mL、高用量群のそれは5.98±0.66μg/mLであり、対照群と比較して有意な差は認められなかった。また、図8に示されたように血中の総アディポネクチン濃度に対するHMW−Adipo濃度の比(HMW−Adipo濃度/T-Adipo濃度)は、低用量群のそれは0.17±0.01、高用量群のそれは0.26±0.03であり、低用量群及び高用量群共に、対照群と比較してそれぞれ有意に高い値を示していた(低用量群:p<0.05及び高用量群:p<0.01)。
【0045】
Zucker fatty ラットは、エネルギー消費や摂食抑制にかかわるレプチンの受容体が変異したモデルであり、過食とともにエネルギー代謝が抑制される結果、顕著な体重増加や耐糖能異常、高インスリン血症を発症する。また、KKAYラットは、レプチンの受容体は維持されているが、レプチンシグナルの伝達系に障害があるラットである。KKAYラットにおける症状やその機序は、Zucker fatty ラットのそれと類似する。これらは生活習慣病の一つである糖尿病モデル動物であり、血中TG濃度が上昇したメタボリックシンドローム患者における血中TG降下作用を観察する上では好適である。TSODマウスは、内臓脂肪を蓄積しやすく、その結果、インスリン抵抗性が進行し、糖尿病を誘発する。このマウスは、ヒトにおけるメタボリックシンドロームに近い症状を示す。
【0046】
このように、本発明に係るAGPは、高血糖症状や肥満症状などヒトにおけるメタボリックシンドロームに近い症状を示すモデル動物において、血中のTG濃度を低下させ、血中の高分子アディポネクチン濃度を高める作用を有することが示された。なお、データは示されていないが、本発明のAGPにはリパーゼ阻害作用は認められず、当該AGPの血中TG濃度の低下作用は脂質の吸収抑制作用によるものとは考えられない。
【産業上の利用可能性】
【0047】
本発明によると、白甘藷由来のAGPを有効成分とする新規な血中脂質降下剤及び高分子量アディポネクチン産生促進剤が提供される。
【技術分野】
【0001】
本発明は、血中脂質降下剤及び高分子アディポネクチン産生促進剤に関する。
【背景技術】
【0002】
近年、腹部に脂肪の蓄積が認められる内臓脂肪型肥満が、脂質異常症、糖尿病、高血圧症、虚血性心疾患などのいわゆる生活習慣病の発症リスクを高めることが明らかとなったことから、「メタボリックシンドローム(内臓脂肪症候群)」の概念が提唱されている。厚生労働省が公表した「平成19年国民健康・栄養調査結果」によると、40〜74歳でみた場合のメタボリックシンドロームが強く疑われる者及びその予備軍と考えられる者の合計が推定2,010万人であり、男性の2人に1人が、女性の5人に1人がメタボリックシンドロームに該当すると言われている。メタボリックシンドロームの診断基準は、腹囲が男性:85cm、女性:90cm以上であって、その他3つの項目(脂質:高トリグリセライド150mg/dL以上かつ/または低HDLコレステロール40mg/dL未満、血圧:収縮期130mmHgかつ/または拡張期85mmHg以上、空腹時血糖値:110mg/dL以上)の内2つ以上の項目に該当することである(非特許文献1)。メタボリックシンドロームと診断されるヒトでは、動脈硬化が招かれやすく、その結果として狭心症、心筋梗塞、脳出血、脳梗塞といった命に関わる疾病をひきおこす危険性が非常に高い。事実、厚生労働省「平成22年人口動態統計の年間推計」においても、3大死因は1990年以降代わることなく第1位が悪性新生物、第2位が心疾患、第3位が脳血管疾患である。メタボリックシンドロームが要因の一つとして考えられる心疾患(狭心症、心筋梗塞)と脳血管疾患による死亡者数は悪性新生物による死亡者数に匹敵する(平成22年:悪性新生物・35万2,000人、心疾患と脳血管疾患・31万2,000人)。このことを考慮すると、事態は極めて深刻であり、メタボリックシンドローム該当者及びこれに該当する可能性の高い者を少なくすることは急務といえる。
【0003】
生活習慣病の増加は食生活の変化が主な原因であるといわれており、これは内臓脂肪蓄積、つまり腹囲が必須の判断基準に位置付けられていることから考えても容易に推測される。この原因として、脂肪や食塩の摂取量が増加したことに加え、運動不足によるエネルギー消費の低下が主たる原因として考えられている。このため、肥満の是正とりわけ脂質代謝の改善が一つの予防策として重要であるといえる。
【0004】
肥満や脂質代謝異常の評価指標として、血中におけるトリグリセライド(中性脂肪:以下「TG」と記される場合がある。)やアディポネクチンが用いられる。近年においては、とりわけアディポネクチンが注目されている。アディポネクチンは、脂肪細胞から分泌される特異的なサイトカインである。また、アディポネクチンは高血圧、脂質代謝及びインスリン抵抗性の改善など多岐にわたる作用を有することが見出されている(非特許文献2)。さらに、近年、アディポネクチンには3量体(低分子アディポネクチン)、6量体(中分子アディポネクチン)及び12〜18量体(高分子アディポネクチン)が存在することが明らかにされ(非特許文献3)、中でも高分子アディポネクチンは低・中分子アディポネクチンと比較して細胞膜表面への結合性が高く、糖の取り込みや脂肪酸燃焼に関与するAMPキナーゼの活性化能に優れていることが明らかにされている(非特許文献3及び4)。このことから、評価指標として、総アディポネクチン濃度よりも、高分子アディポネクチン濃度や高分子アディポネクチン/総アディポネクチン比が重要視されている。従って、血中TG濃度の低下だけでなく血中の高分子アディポネクチン濃度や高分子アディポネクチン/総アディポネクチン比を高めることは、メタボリックシンドロームを抑制するだけでなく、それに関連する疾病の予防や改善につながることが期待される。
【0005】
このような状況下、メタボリックシンドロームの予防や改善を目的として様々な素材が提供されている。例えば、血中TG降下作用が期待される素材としてグァバ葉(特許文献1)やキトサン(特許文献2)が、また、アディポネクチン産生促進作用が期待される素材として柿(特許文献3)、西洋梨(特許文献4)などが提供されている。さらにはイソフラボンやコエンザイムQ10などの抗酸化剤とグルコサミン類やコンドロイチン硫酸コンドロイチンを組み合わせてアディポネクチンの分泌を促進させる方法も提供されている(特許文献5)。
【0006】
ところで、アラビノガラクタンプロテイン(以下、「AGP」と記される場合がある。)は、糖鎖であるアラビノガラクタンと、ペプチド又はタンパク質とから構成される糖タンパクである。AGPは、植物の細胞壁や滲出物にその存在が確認され、植物界では普遍的に存在する成分として知られている。植物における生理機能として、細胞増殖や分化、組織伸張、細胞間相互作用など細胞壁のネットワークにおいて、AGPが重要な役割を果たす(非特許文献5)。
【0007】
代表的なAGPの一つに、アラビアガムが挙げられる。これはアカシア セネガル(Acacia senegal)の滲出液より回収されるAGP(以下「GA」と記される場合がある。)である(非特許文献6)。GAは、前述の生理機能の他に優れた乳化作用を有することから、現在では食品、薬品及び化粧品において広く応用されている。また、GAは、コレステロール降下作用を有することも知られている(非特許文献6)。このコレステロール降下作用は、水溶性食物繊維におけるコレステロール降下作用と同様であって、コレステロールの吸収が抑制された結果、胆汁酸の腸内濃度が低下することによるものであると考えられている。つまり、腸内胆汁酸濃度が低下すると、コレステロールからの胆汁酸合成が増加し、肝臓でのコレステロール合成が上昇する。その結果、血中コレステロール濃度が低下すると考えられている。他には、腸内細菌の作用を受け産生される短鎖脂肪酸が肝臓でのコレステロール合成を抑制することも知られており、これもまた、コレステロール降下のメカニズムの一つとして考えられている(非特許文献7、8)。
【0008】
さらに、他のAGPとして、白甘藷に含まれるAGPが知られている(非特許文献9)。このAGPは、90〜95質量%の糖鎖と、5〜10質量%のタンパク質とからなる約10〜15万Daの分子量を有する糖タンパクであって、前記糖鎖は、主にラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)であり、前記タンパク質は、17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は、それぞれ13〜25:10〜15:13〜20(モル%)である。
【0009】
なるほど、白甘藷の抽出物が血中TG濃度の降下作用を有するとの報告もあるが(非特許文献11)、その活性本態は十分に検討されていない。また、白甘藷に含まれるアラビノガラクタン(以下、「AG」と略記される場合がある。)が血糖降下作用を示すこと(特許文献6)やAGが免疫賦活作用を示すこと(特許文献7)が報告されているが、AGPが血中TG濃度の降下作用やアディポネクチンの産生促進作用を示すとの報告はない。さらに、AGPが投与された糖尿病マウスにおける血中TG濃度変化や血中アディポネクチン濃度変化が報告されているが(非特許文献10)、この報告では、白甘藷由来のAGPは、糖尿病マウスにおいて、血中TG濃度や血中アディポネクチン濃度に影響は与えないことが示されている。
【0010】
このように、これまでのところ、GAや他のAGPにおける血中TG降下作用や高分子アディポネクチン産生促進作用に関連する報告は知られていない。さらに、血中TG降下作用と高分子アディポネクチン産生促進作用の二つの作用を有する化合物は知られておらず、双方の作用を有する化合物を利用すれば、肥満などに代表されるメタボリックシンドロームに対して、より優れた予防効果や治療効果が期待される。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2008−001615号公報
【特許文献2】特開2007−332336号公報
【特許文献3】特開2010−083838号公報
【特許文献4】特開2010−088403号公報
【特許文献5】特開2011−063543号公報
【特許文献6】国際公開 WO2005/105852号公報
【特許文献7】特開2008−208102号公報
【非特許文献】
【0012】
【非特許文献1】メタボリックシンドローム診断基準検討委員会,日本内科学会誌,94,794−809(2005)
【非特許文献2】Kadowaki T., Yamauchi T., Endcrine Rev, 26, 439-451(2005)
【非特許文献3】Aso Y. et al., Diabetes, 55, 1954-1960(2006)
【非特許文献4】Kubota N. et al., Cell Metab., 6, 55-68(2007)
【非特許文献5】Showalter A. M., CMLS,58, 1399-1417(2001)
【非特許文献6】Ali, B.H. et al., Food. Chem. Toxicol., 47, 1-8(2009)
【非特許文献7】Bridges, S. R. et al., Am J Clin Nutr., 56. 455-459(1992)
【非特許文献8】Furgal-Dierzuk, J Animal Food Sci., 13, 31-34(2004)
【非特許文献9】Ozaki Sei, et al., J. Agric. Food Chem. 58, 11593-11599(2010)
【非特許文献10】Naoko Oki, et al., Biosci. Biotechnol. Biochem., 75, 596-698(2011)
【非特許文献11】Shuichi Kusano et al., Biol. Pharm. Bull. 23(1), 23-26(2000)
【発明の概要】
【発明が解決しようとする課題】
【0013】
本願に係る発明は、白甘藷由来のAGPが有する血中TG濃度の降下作用及び高分子アディポネクチンの産生促進作用を利用したものであって、新規な血中脂質降下剤及び新規な高分子アディポネクチンの産生促進剤を提供することを目的としている。
【課題を解決するための手段】
【0014】
本願発明においては、アラビノガラクタンプロテイン及び/又はアラビノガラクタンプロテインを含む白甘藷の皮部及び/又は塊根部の水系抽出物が、血中脂質降下剤及び高分子アディポネクチン産生促進剤の有効成分として利用される。
【発明の効果】
【0015】
本願発明に係るアラビノガラクタンの服用は、高い血中TG濃度を低下させ、また、血中における高分子アディポネクチン濃度を上昇させる。この結果、脂質代謝異常や肥満の改善が図られ、メタボリックシンドロームに起因する生活習慣病が未然に防止される。
【図面の簡単な説明】
【0016】
【図1】図1は、白甘藷由来のアラビノガラクタンプロテインの糖鎖構造を示した図である。Aは主鎖の部分構造を、Bは主鎖の部分構造Aに結合する側鎖の部分構造を、C、D、Eはそれぞれ側鎖Bに結合する部分構造を示す。
【図2】図2は、白甘藷由来のアラビノガラクタンプロテインがZucker Fattyラットにおける血中トリグリセライド濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図3】図3は、白甘藷由来のアラビノガラクタンプロテインがZucker Fattyラットにおける血中遊離脂肪酸濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図4】図4は、白甘藷由来のアラビノガラクタンプロテインがKKAyマウスにおける血中トリグリセライド濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図5】図5は、白甘藷由来のアラビノガラクタンプロテインがKKAyマウスにおける血中総コレステロール濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図6】図6は、白甘藷由来のアラビノガラクタンプロテインがTSODマウスにおける血中トリグリセライド濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図7】図7は、白甘藷由来のアラビノガラクタンプロテインがTSODマウスにおける血中高分子アディポネクチン濃度に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【図8】図8は、白甘藷由来のアラビノガラクタンプロテインがTSODマウスにおける血中高分子アディポネクチン濃度比に及ぼす影響を示す図である。図中のアスタリスクは、対照群と比較して有意差が認められたことを示す。
【発明を実施するための形態】
【0017】
本発明の血中脂質降下剤又は高分子アディポネクチン産生促進剤は、いずれも白甘藷由来のアラビノガラクタンプロテイン及び/又は当該アラビノガラクタンプロテインを含む白甘藷の水系抽出物を有効成分とする。
【0018】
有効成分であるアラビノガラクタンプロテイン(AGP)は、90〜95質量%の糖鎖と、5〜10質量%のタンパク質とからなる約10〜15万Daの分子量を有する糖タンパクである。その糖鎖は主としてラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)である。AGPを構成するタンパク質は17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は、13〜25:10〜15:13〜20(モル%)である。
【0019】
当該AGPは、白甘藷、主としてその皮部及び/又は塊根部の抽出物から得られる。白甘藷は、その学名をIpomoea Batatas spといい、さつま芋(ヒルガオ科の草本Ipomoea Batatas Poiret)の一種である。本発明においては、白甘藷の塊茎、特にその皮から得られたものが好ましく用いられる。しかし、以下の構造を有するものであれば、白甘藷及びその近縁植物から得られたものに限られるものではない。
【0020】
抽出溶媒は水系溶媒が好ましく用いられる。水系溶媒とは、水やメタノール、エタノール、イソプロパノール(直鎖、分岐鎖を問わない)、ブタノールなど水と混和可能な有機溶媒である。抽出には、これらの水系溶媒の1種又は2種以上が用いられる。抽出方法は特に限定されず、浸漬などの公知の方法が用いられる。また、抽出は加温して行うこともできるが、室温〜40℃の温度で行うのが好ましい。40℃を超えた加温を行うと不溶成分が抽出液に多く含まれることになるからである。
【0021】
AGPは、抽出された溶媒から公知の分離手段によって分離精製される。分離手段として、液−液分配法や液体クロマトグラフィなどのカラムクロマトグラフィが例示される。白甘藷からの単離・精製方法として、例えば、非特許文献9に示された方法が例示される。さらに具体的に言うと、白甘藷の皮又は塊根部の抽出物を煮沸して生じた沈殿物を除去した後、水及び0.01〜1N塩化ナトリウム溶液のイオン強度に相当するイオン強度を有する溶離液を用いた陰イオン交換クロマトグラフィ、好ましくは溶離液のイオン強度を次第に変化させるグラジエントクロマトグラフィによって分離精製される。得られたAGPは、血中脂質降下剤又は高分子アディポネクチン産生促進剤の有効成分として用いられる。その他に、脂質異常症、動脈硬化、高血圧などのいわゆる生活習慣病やメタボリックシンドロームの予防や改善を目的とした健康食品(特定保健用食品を含む)の製造に用いられる。もっとも、効能を標榜するしないに関係なく、おやつや飲料などの各種食品の製造のための添加物として使用することもできる。
【0022】
本発明において血中脂質降下作用とは、ヒトやその他哺乳動物における血中のTG濃度を低下させることであって、AGPは正常値よりも高い血中TG濃度を低下させることに有効である。また、本発明において高分子アディポネクチン産生促進作用は、ヒトやその他哺乳動物における血中の高分子アディポネクチン量を増加させることであって、AGPは血中における総アディポネクチン量における高分子アディポネクチン量の割合を増加させることに有効である。ここで、総アディポネクチン量とは3量体(低分子アディポネクチン)、6量体(中分子アディポネクチン)、12〜18量体(高分子アディポネクチン)を含むアディポネクチンの総量を意味し、高分子アディポネクチン量とは12〜18量体のアディポネクチン量を意味する。
【0023】
本発明に係る血中脂質降下剤及び高分子アディポネクチン産生促進剤は、精製されたAGPであり、AGPの粗精製物であり、AGPを含む白甘藷の抽出物であり、これらの混合物でもあり得る。また、AGP、AGPの粗精製物、AGPを含む白甘藷の抽出物の少なくとも何れかと薬理学的に不活性な賦形剤のような担体を含む組成物であり得る。当該組成物は、担体の他に乳化剤、甘味料、保存料、酸化防止剤、増粘安定剤、防腐剤等の添加剤を適宜含み得る。
【0024】
組成物は医薬品であり、あるいは食品、好ましくはいわゆる健康食品であり得る。ここで、健康食品とは、血中脂質を低下させることを目的として摂取され、血中脂質の低下作用を発揮する食品ないし高分子アディポネクチンの産生を促進させることを目的として摂取され、高分子アディポネクチンの産生促進作用を発揮する食品を意味し、これらの作用効果の標榜が公的に認められた食品(いわゆる特定保健用食品)でもあり得る。
【0025】
組成物の形態は、特に制約されず、錠剤であり、顆粒剤であり、散剤であり、チュアブル錠であり、カプセル剤であり、液剤であり、ゼリーであり、飴やガムであり得る。
【0026】
当該組成物中におけるAGP含有量の下限は、0.00001質量%であり、0.00001質量%であり、0.0001質量%であり、0.001質量%であり、0.01質量%であり、0.05質量%であり、0.1質量%であり得る。また、その上限は、99.9999質量%であり、99.999質量%であり、99.99質量%であり、99.9質量%であり、99質量%であり、90質量%であり、80質量%であり、70質量%であり、50質量
%であり、30質量%であり、20質量%であり、10質量%であり、5質量%であり得る。
【0027】
AGPの摂取量は、血中TG値を正常と考えられる範囲に維持可能な量、あるいは血中高分子アディポネクチン濃度を上昇させ得る量であり、適用対象や症状によって適宜増減され得る。AGPの1日摂取量は、体重1kg当たり0.001ng〜10g、具体的には、その下限は体重1kg当たり0.001ngであり、0.01ngであり、0.1ngであり、1ngであり、0.01mgであり、0.1mgであり、0.5mgであり、1mgであり、5mgであり、10mgであり、50mgであり、100mgであり、200mgであり得る。また、その上限は、体重1kg当たり10gであり、5gであり、2gであり、1gであり、500mgであり得る。
【0028】
以下、下記の実施例に基づいてさらに本発明を詳細に説明するが、下記の実施例は例示であって、本発明は下記の実施例に限定されないのは言うまでもない。
【実施例1】
【0029】
〔AGPの分析〕
白甘藷の皮部破砕物又は皮部乾燥粉末1kgに対し水10Lを加え、40℃に加温して1時間撹拌抽出した。得られた混合液は、遠心分離(8,000 rpm/30分間)後、濾別し抽出液を得た。残渣に更に水を加えて同一の操作を繰り返した。
【0030】
得られた抽出液(約9L)は、減圧下にて4Lまで濃縮された。その後、この濃縮液につき加熱処理(90〜100℃)を行った。具体的には、得られた濃縮液をビーカーに移し、湯浴中にて15分程度撹拌した。生じた沈殿を遠心分離(8,000rpm/30分間)により濾別除去した。得られた濾液につき、ダイアライシスメンブランsize36(分画分子量:14,000、和光純薬工業株式会社製)を用い、脱イオン水中にて4℃で3日間脱塩を行った。ここで得られた透析内液につき、陰イオン交換クロマトグラフィを用いて精製を行った。具体的には、表1に記載の分離条件下にて操作を行い、精製AGPを得た(1.2g、収率0.12%)。
【表1】

【0031】
得られた白甘藷由来AGPの分子量は、多角度光散乱検出器及びサイズ排除クロマトグラフィ(SEC−MALLS:DAWN-E, Wyatt Technology Corporation)を用いた測定から、約13万であった。AGPを構成する糖は、アセチル誘導体化後のGC分析及びギ酸及びトリフルオロ酢酸による完全加水分解後のHPAEC−PAD分析から、表2に示す4種の糖から構成されることが明らかとなった。
【表2】

【0032】
構成アミノ酸は、6M塩酸による酸加水分解後(110℃、22時間)、アミノ酸分析計(L−8800,日立製作所)により確認した。その結果、AGPを構成するタンパク質はハイドロキシプロリン、アラニン及びセリンを主とする計17種のアミノ酸から構成されることが明らかとなった。アミノ酸分析結果を表3に示した。
【表3】

【0033】
更に、各糖残基の結合様式を明らかにするため、メチル化分析を行った。メチル化分析の分析条件は、表4に示した。
【表4】

【0034】
その結果、末端α−Araf、1,5結合−α−Araf、1,3結合−β−Galp、1,6結合−β−Galp及び1,3,6結合−β−Galp残基を含む8種類の結合様式を有することが明らかとなった。
【0035】
次いで、各糖残基の連結パターンを明らかにするため、各種NMRスペクトル(1H、13C−NMR、1H−1H COSY、HOHAHA、HMQC、HMBC)を用い解析した。その結果、白甘藷由来AGPの糖鎖部分は図1に示す部分構造から構成されることが明らかとなった。すなわち、当該糖鎖部分は、図1に示す部分構造A:(1→3)−β−D−ガラクタンからなる主鎖に、次の側鎖がO−6位に結合した構造を有する。この側鎖は、部分構造B:(1→6)−β−D−ガラクタンからなり、O-3位に部分構造C及びD、O−6位に部分構造Eが結合した構造を有する。
【0036】
〔Zucker fatty ラットに対する脂質代謝改善作用〕
試験開始前に、明暗周期(7:00−19:00照明ONの12時間周期)、温度23〜24℃、湿度60〜70%の条件下で、5週齢の雄性Zucker fattyラットを1週間予備飼育した。その後、ラットを2群(各群10匹)に分け、それぞれ対照群(精製水)及び白甘藷由来AGP投与群とした。白甘藷由来AGPの投与量は20mg/kgである。ゾンデを用いて、1日1回12週間、AGPを経口投与した。試験期間中の飼料及び飲料水の摂取はともに自由とした。投与開始以降2週間ごとに、AGP投与後16時間絶食させたマウスの尾静脈から採血した。得られた血漿を用い、血中TG及び血中遊離脂肪酸(以下、NEFA)を測定し、脂質代謝改善作用を評価した。ともに、市販されるキットを用いて測定を行った(TG:トリグリセライドE−テストワコー、NEFA:NEFA C−テストワコー、いずれも和光純薬工業株式会社製)。
【0037】
血中TGの測定結果及びNEFAの測定結果をそれぞれ図2、図3に示す。測定結果は、全て平均値±標準誤差で示され、図中のアスタリスクはStudent's t−検定による対照群との比較結果を示し、一つのアスタリスク(*)は危険率p<0.05で有意差が認められたことを、2つのアスタリスク(**)は危険率p<0.01で有意差が認められたことを、3つのアスタリスク(***)は危険率p<0.001で有意差が認められたことを意味する。
【0038】
図2に示されたように、白甘藷由来AGP投与群の血中TG濃度は、常に対照群よりも低く推移し、投与2週後、6週後及び12週後には対照群と比較して有意に低い値を示した(投与2週後及び6週後:p<0.05、投与12週後:p<0.01)。図3に示されたように、白甘藷由来AGP投与群のNEFAは、投与2週後に対照群と比較して有意に低い値を示し(p<0.05)、その後、投与8週後まで対照群よりも低く推移しながらも、ほぼ同様な挙動を示した。AGPの投与10週後及び12週後までは、有意に低い値を示した(投与10週後:p<0.05、投与12週後:p<0.001)。
【0039】
〔KKAyマウスに対する血中TG低下作用〕
試験開始前に、明暗周期(7:00−19:00照明ONの12時間周期)、温度23〜24℃、湿度60〜70%の条件下で、5週齢の雄性KKAyマウスを1週間予備飼育した。その後、ラットを2群(各群8匹)に分け、それぞれ対照群(精製水)及び白甘藷由来AGP投与群とした。白甘藷由来AGPの投与量は20mg/kgである。ゾンデを用いて、1日1回、5週間、AGPを経口投与した。試験期間中の飼料及び飲料水の摂取はともに自由とした。投与開始以降2週間ごとに、16時間絶食させたマウスの尾静脈から採血した。得られた血漿を用い、血中TG及び総コレステロール(以下、T−Cho)を測定した。ともに、市販されるキットを用いて測定を行った(TG:トリグリセライドE−テストワコー、T−Cho:コレステロールE−テストワコー、いずれも和光純薬工業株式会社製)。
【0040】
血中TGの測定結果及びT−Choの測定結果をそれぞれ図4、図5に示す。測定結果は、全て平均値±標準誤差で示され、図中のアスタリスクはStudent's t−検定による対照群との比較結果を示し、一つのアスタリスク(*)は危険率p<0.05で有意差が認められたことを、2つのアスタリスク(**)は危険率p<0.01で有意差が認められたことを意味する。
【0041】
図4に示されたように、白甘藷由来AGP投与群の血中TG濃度は、投与4週後、5週後に対照群よりも有意に低い値を示した(投与4週後:p<0.05、投与5週後:p<0.01)。また、図5に示されたように、白甘藷由来AGP投与群の血中T−Cho濃度は、対照群よりも低く推移したが、有意な差は認められなかった。投与前後を比較した場合、対照群が投与前の176.5±11.3mg/dLから最終投与後の184.8±9.6 mg/dL(+8.3mg/dL)と推移したのに対し、白甘藷由来AGP投与群は投与前の161.9±16.8mg/dLから投与後の159.5±13.8 mg/dL(−2.4mg/dL)と推移した。血中T−Cho濃度には有意な減少は観察されず、AGPはCho代謝にはほとんど影響を及ぼさないと考えられる。
【0042】
〔Tsumura, Suzuki, Obese, Diabetesマウスに対する血中TG低下作用及び高分子アディポネクチン産生促進作用〕
試験開始前に、明暗周期(7:00−19:00照明ONの12時間周期)、温度23〜24℃、湿度60〜70%の条件下で、5週齢の雄性Tsumura, Suzuki, Obese, Diabetesマウス(以下、「TOSDマウス」と言う)を1週間予備飼育した。その後、TOSDマウスを3群(各群6匹)に分け、それぞれ対照群(精製水)及び白甘藷由来AGP投与群(低用量群と高用量群)とした。低用量群の白甘藷由来AGPの投与量は2mg/kg、高低用量群の白甘藷由来AGPの投与量は20mg/kgである。ゾンデを用いて、1日1回、8週間AGPを経口投与した。試験期間中の飼料及び飲料水の摂取はともに自由とした。8週間の投与後に、16時間絶食させたマウスの尾静脈から採血した。得られた血漿を用い、血中TG、総アディポネクチン(以下、「T−Adipo」と言う)及び高分子アディポネクチン(以下、「HMW−Adipo」と言う)を測定した。これらは、市販されるキットを用いて測定を行った(TG:トリグリセライドE−テストワコー <和光純薬工業株式会社製>、T−Adipo:マウス/ラット アディポネクチン ELISAキット <大塚製薬株式会社製>、HMW−Adipo:マウス/ラット 高分子アディポネクチン ELISAキット <株式会社シバヤギ製>)。
【0043】
血中TGの測定結果及びHMW−Adipoの測定結果をそれぞれ図6〜8に示す。測定結果は、全て平均値±標準誤差で示され、図中のアスタリスクはDunnett's検定による対照群との比較結果を示し、一つのアスタリスク(*)は危険率p<0.05で有意差が認められたことを、2つのアスタリスク(**)は危険率p<0.01で有意差が認められたことを意味する。
【0044】
図6に示されたように、低用量群の血中TG濃度は、対照群と比較して低下傾向(p<0.1)を示したが、有意な差はみられなかった。一方、高用量群の血中TG濃度は、投与8週後に対照群に比べて有意に低い値を示した(p<0.05)。図7に示されたように、低用量群及び高用量群はそれぞれ、投与8週後に対照群に比べてそれぞれ血中HMW−Adipo濃度が有意に高い値を示した(低用量群:p<0.05及び高用量群:p<0.01)。一方、この時のT-Adipo濃度は、対照群の6.70±0.53μg/mLに対し、低用量群のそれは6.88±0.80μg/mL、高用量群のそれは5.98±0.66μg/mLであり、対照群と比較して有意な差は認められなかった。また、図8に示されたように血中の総アディポネクチン濃度に対するHMW−Adipo濃度の比(HMW−Adipo濃度/T-Adipo濃度)は、低用量群のそれは0.17±0.01、高用量群のそれは0.26±0.03であり、低用量群及び高用量群共に、対照群と比較してそれぞれ有意に高い値を示していた(低用量群:p<0.05及び高用量群:p<0.01)。
【0045】
Zucker fatty ラットは、エネルギー消費や摂食抑制にかかわるレプチンの受容体が変異したモデルであり、過食とともにエネルギー代謝が抑制される結果、顕著な体重増加や耐糖能異常、高インスリン血症を発症する。また、KKAYラットは、レプチンの受容体は維持されているが、レプチンシグナルの伝達系に障害があるラットである。KKAYラットにおける症状やその機序は、Zucker fatty ラットのそれと類似する。これらは生活習慣病の一つである糖尿病モデル動物であり、血中TG濃度が上昇したメタボリックシンドローム患者における血中TG降下作用を観察する上では好適である。TSODマウスは、内臓脂肪を蓄積しやすく、その結果、インスリン抵抗性が進行し、糖尿病を誘発する。このマウスは、ヒトにおけるメタボリックシンドロームに近い症状を示す。
【0046】
このように、本発明に係るAGPは、高血糖症状や肥満症状などヒトにおけるメタボリックシンドロームに近い症状を示すモデル動物において、血中のTG濃度を低下させ、血中の高分子アディポネクチン濃度を高める作用を有することが示された。なお、データは示されていないが、本発明のAGPにはリパーゼ阻害作用は認められず、当該AGPの血中TG濃度の低下作用は脂質の吸収抑制作用によるものとは考えられない。
【産業上の利用可能性】
【0047】
本発明によると、白甘藷由来のAGPを有効成分とする新規な血中脂質降下剤及び高分子量アディポネクチン産生促進剤が提供される。
【特許請求の範囲】
【請求項1】
白甘藷由来のアラビノガラクタンプロテイン及び/又はアラビノガラクタンプロテインを含む白甘藷の皮部及び/又は塊根部の水系抽出物を有効成分とする血中脂質降下剤。
【請求項2】
白甘藷由来のアラビノガラクタンプロテイン及び/又はアラビノガラクタンプロテインを含む白甘藷の皮部及び/又は塊根部の水系抽出物を有効成分とする高分子アディポネクチン産生促進剤。
【請求項3】
90〜95質量%の下記構成を有する糖鎖と、5〜10質量%の下記構成を有するタンパク質とからなる約10〜15万Daの分子量を有する白甘藷由来のアラビノガラクタンプロテインを有効成分とする血中脂質降下剤。
前記糖鎖:主にラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)、
前記タンパク質:17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は13〜25:10〜15:13〜20(モル%)
【請求項4】
90〜95質量%の下記構成を有する糖鎖と、5〜10質量%の下記構成を有するタンパク質とからなる約10〜15万Daの分子量を有する白甘藷由来のアラビノガラクタンプロテインを有効成分とする高分子アディポネクチン産生促進剤。
前記糖鎖:主にラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)、
前記タンパク質:17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は13〜25:10〜15:13〜20(モル%)
【請求項5】
血中脂質降下剤又は高分子アディポネクチン産生促進剤の製造方法であって、
90〜95質量%の下記構成を有する糖鎖と、5〜10質量%の下記構成を有するタンパク質とからなる約10〜15万Daの分子量を有する白甘藷由来のアラビノガラクタンプロテインを使用することを特徴とする製造方法。
前記糖鎖:主にラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)、
前記タンパク質:17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は13〜25:10〜15:13〜20(モル%)
【請求項6】
食品の製造方法であって、
90〜95質量%の下記構成を有する糖鎖と、5〜10質量%の下記構成を有するタンパク質とからなる約10〜15万Daの分子量を有する白甘藷由来のアラビノガラクタンプロテインを含有せしめることを特徴とする製造方法。
前記糖鎖:主にラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)
前記タンパク質:17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は13〜25:10〜15:13〜20(モル%)
【請求項7】
前記食品が、錠剤、カプセル剤、液体、ゼリー、飴の何れかの形態である請求項6に記載の製造方法。
【請求項8】
血中脂質降下作用又は高分子アディポネクチン産生促進作用を発揮する量の前記白甘藷由来のアラビノガラクタンを含有せしめる請求項6又は7に記載の製造方法。
【請求項1】
白甘藷由来のアラビノガラクタンプロテイン及び/又はアラビノガラクタンプロテインを含む白甘藷の皮部及び/又は塊根部の水系抽出物を有効成分とする血中脂質降下剤。
【請求項2】
白甘藷由来のアラビノガラクタンプロテイン及び/又はアラビノガラクタンプロテインを含む白甘藷の皮部及び/又は塊根部の水系抽出物を有効成分とする高分子アディポネクチン産生促進剤。
【請求項3】
90〜95質量%の下記構成を有する糖鎖と、5〜10質量%の下記構成を有するタンパク質とからなる約10〜15万Daの分子量を有する白甘藷由来のアラビノガラクタンプロテインを有効成分とする血中脂質降下剤。
前記糖鎖:主にラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)、
前記タンパク質:17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は13〜25:10〜15:13〜20(モル%)
【請求項4】
90〜95質量%の下記構成を有する糖鎖と、5〜10質量%の下記構成を有するタンパク質とからなる約10〜15万Daの分子量を有する白甘藷由来のアラビノガラクタンプロテインを有効成分とする高分子アディポネクチン産生促進剤。
前記糖鎖:主にラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)、
前記タンパク質:17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は13〜25:10〜15:13〜20(モル%)
【請求項5】
血中脂質降下剤又は高分子アディポネクチン産生促進剤の製造方法であって、
90〜95質量%の下記構成を有する糖鎖と、5〜10質量%の下記構成を有するタンパク質とからなる約10〜15万Daの分子量を有する白甘藷由来のアラビノガラクタンプロテインを使用することを特徴とする製造方法。
前記糖鎖:主にラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)、
前記タンパク質:17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は13〜25:10〜15:13〜20(モル%)
【請求項6】
食品の製造方法であって、
90〜95質量%の下記構成を有する糖鎖と、5〜10質量%の下記構成を有するタンパク質とからなる約10〜15万Daの分子量を有する白甘藷由来のアラビノガラクタンプロテインを含有せしめることを特徴とする製造方法。
前記糖鎖:主にラムノース、アラビノース、ガラクトース及びグルクロン酸で構成され、その構成比は0.6〜1.2:3.5〜4.5:6.5〜7.5:0.8〜1.6(モル比)
前記タンパク質:17種のアミノ酸から構成され、ヒドロキシプロリン、セリン及びアラニンが主要な構成アミノ酸であって、その構成比は13〜25:10〜15:13〜20(モル%)
【請求項7】
前記食品が、錠剤、カプセル剤、液体、ゼリー、飴の何れかの形態である請求項6に記載の製造方法。
【請求項8】
血中脂質降下作用又は高分子アディポネクチン産生促進作用を発揮する量の前記白甘藷由来のアラビノガラクタンを含有せしめる請求項6又は7に記載の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2013−43865(P2013−43865A)
【公開日】平成25年3月4日(2013.3.4)
【国際特許分類】
【出願番号】特願2011−183349(P2011−183349)
【出願日】平成23年8月25日(2011.8.25)
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【出願人】(504173600)有限会社 IPE (12)
【出願人】(591046892)富士産業株式会社 (12)
【Fターム(参考)】
【公開日】平成25年3月4日(2013.3.4)
【国際特許分類】
【出願日】平成23年8月25日(2011.8.25)
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【出願人】(504173600)有限会社 IPE (12)
【出願人】(591046892)富士産業株式会社 (12)
【Fターム(参考)】
[ Back to top ]

