血小板減少症を治療する化合物および方法
特定の実施形態における本発明は、ヒトTPO受容体のrhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物;およびrhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第2の薬物を含む医薬剤形に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、トロンボポエチン受容体作動薬により血小板減少症を治療または予防する剤形および方法に関する。
【背景技術】
【0002】
血小板は、生理的止血および病的血栓症において重要な働きをする無核血液細胞であり、生体内で巨核球から継続的に産生される。血小板は、他の血球と同様に、多能性幹細胞に由来する。特に、多能性幹細胞は巨核球前駆細胞になり、それから巨核芽球、前巨核球、および巨核球が形成される。巨核球の成熟の過程において、未熟な巨核球は、細胞分裂を伴わずにDNA合成だけを行い、倍数体となる。その後、細胞質は成熟し始め、血小板分離膜が形成され、細胞質が断裂することにより血小板が放出される。
【0003】
骨髄異形成症候群のような種々の造血機能不全、あるいは悪性腫瘍のための化学療法または放射線療法等による血小板数の減少は、出血傾向のような重篤な症状を引き起こす。このような機能障害を治療する目的で血小板数を増加させるための種々の薬物療法および非薬物療法を開発する多くの試みが行われている。そのような治療の1つが血小板輸血である。血小板輸血は血小板減少症を治療する有効な手段となったが、十分量の血小板を供給することができず、輸血した血小板の寿命が短い等の理由により血小板減少症を十分に改善することは困難である。さらに、血小板輸血には、ウイルス感染、全抗体の産生、移植細胞対宿主病(GVHD)等の問題点がある。このため、種々の状態により引き起こされる造血抑制を軽減する薬剤または血小板数の回復を促進する治療の開発に対する需要がある。
【0004】
巨核球への分化において重要な働きをするc-Mplリガンドであるトロンボポエチン(本明細書中、以下「TPO」と呼ぶ)がクローニングされ、それが巨核球の分化および増殖を刺激して、血小板産生を促進するということが報告されている(Kaushansky K. et al., Nature, 369, 568-571, 1994)。血小板数を増加させる薬物としてのTPOに関する臨床試験が行われており、ヒトでのその有効性および許容性が確認されている。しかしながら、TPOの一種であるPEG-rHuMGDF(ポリエチレングリコールで修飾された天然のTPOの163個のN末端アミノ酸)の臨床試験において中和抗体が確認されたために(Li J. et. al., Blood, 98, 3241-3248, 2001, およびBasser R. L. et. al., Blood, 99, 2599-2602, 2002)、TPOの免疫原性が懸念されている。さらに、TPOはタンパク質であるため、消化管内で分解され、よって、経口投与用の薬剤として実用的ではない。同様の理由から、低分子ペプチドも経口投与用の薬剤として実用的ではないと考えられる。このような状況下、血小板減少症の治療の目的で、免疫原性が低く経口投与可能である非ペプチド性c-Mplリガンドを開発する研究が行われてきた。
【0005】
例えば、ベンザゼピン誘導体は特開平11-152276号公報(日本国)に開示されている。アシルヒドラゾン誘導体は国際公開第99/11262号に記載されている。ジアゾナフタレン誘導体は国際公開第00/35446号に記載されている。ピロロカルバゾール誘導体は国際公開第98/09967号に記載されている。ピロロフェナンスリジン誘導体は特開平10-212289号公報(日本国)に記載されており、ピロロフタルイミド誘導体は特開2000-44562号公報(日本国)に記載されている。
【0006】
さらに、国際公開第01/07423号には、血小板増多作用を有する、以下の一般式(VII)で表される化合物:
【化1】

【0007】
(式中、記号は公報に定義されている通りである)
が記載されている。
【0008】
国際公開第01/53267号には、血小板増多作用を有する、以下の一般式(VIII)で表される化合物:
【化2】

【0009】
(式中、記号は公報に定義されている通りである)
が記載されている。
【0010】
日本特許第3199451号明細書には、2-アシルアミノチアゾール化合物がコレシストキニンおよびガストリン受容体作動薬の効果を有することが記載されている。Chemical and Pharmaceutical Bulletin, 25, 9, 2292-2299, 1977には、2-アシルアミノチアゾール化合物が抗炎症作用を有することが記載されている。しかしながら、血小板増多作用についての記載はない。
【0011】
国際公開第03/062233号および欧州特許出願公開第1466912(A1)号には、ヒトc-Mpl-Ba/F3細胞の増殖に影響を与え、巨核球コロニーの形成を促進する効果に基づいて血小板増多作用を有する2-アシルアミノチアゾール誘導体が開示されている。
【0012】
国際公開第04/029049号には、2-アシルアミノチアゾール誘導体のマレイン酸塩が開示されている。
【特許文献1】特開平11-152276号公報
【特許文献2】国際公開第99/11262号パンフレット
【特許文献3】国際公開第00/35446号パンフレット
【特許文献4】国際公開第98/09967号パンフレット
【特許文献5】特開平10-212289号公報
【特許文献6】特開2000-44562公報
【特許文献7】国際公開第01/07423号パンフレット
【特許文献8】国際公開第01/53267号パンフレット
【特許文献9】日本特許第3199451号明細書
【特許文献10】国際公開第03/062233号パンフレット
【特許文献11】欧州特許出願公開第1466912(A1)号明細書
【特許文献12】国際公開第04/029049号パンフレット
【非特許文献1】Kaushansky K. et al., Nature, 369, 568-571, 1994
【非特許文献2】Li J. et. al., Blood, 98, 3241-3248, 2001
【非特許文献3】Basser R. L. et. al., Blood, 99, 2599-2602, 2002
【非特許文献4】Chemical and Pharmaceutical Bulletin, 25, 9, 2292-2299, 1977
【発明の開示】
【発明が解決しようとする課題】
【0013】
したがって、当技術分野において、血小板減少症を治療する組成物および方法が必要とされている。
【0014】
本明細書に引用される全ての参考文献は、上記のものも含めて、すべての目的で、その全体が参照により本明細書に組み込まれている。
【0015】
本発明の特定の実施形態の目的は、血小板減少症の治療用のTPO受容体作動薬の医薬組成物を提供することである。
【0016】
本発明の特定の実施形態の目的は、TPO受容体作動薬を使用する血小板減少症の治療方法を提供することである。
【課題を解決するための手段】
【0017】
上記および他の目的に鑑み、特定の実施形態において、本発明は、rhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物;およびrhTPO結合部位とは異なる結合部位においてヒトTPO受容体を作動する治療有効量の第2の薬物を含む医薬剤形に関する。
【0018】
特定の実施形態において、本発明は、治療を必要とする患者に、rhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物およびrhTPO結合部位とは異なる結合部位においてヒトTPO受容体を作動する治療有効量の第2の薬物を共投与することを含む、血小板減少症の治療方法に関する。
【0019】
特定の実施形態において、本発明は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の有効量を投与して、血小板を少なくとも約150%、少なくとも約200%、少なくとも約270%、少なくとも約300%、少なくとも約1,000%または少なくとも約5,000%増加させることを含む、血小板減少症の治療方法に関する。
【0020】
特定の実施形態において、本発明は、患者に治療有効量のヒトTPO受容体作動薬を投与して、作動薬の投与が血小板を約300%まで、約500%まで、約1,000%まで、約5,000%までまたは約10,000%まで増加させることを含む、血小板減少症の治療方法に関する。
【0021】
特定の実施形態において、本発明は、既に血小板減少症の治療を受けている患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量を投与することを含む、血小板減少症の治療方法に関する。
【0022】
特定の実施形態において、本発明は、治療を必要とする患者に、少なくとも0.01 mg/kg/日の用量の、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物を投与すること;投与後に患者の血小板数を測定すること;および、場合により化合物の用量を調整することを含む、血小板減少症の治療方法に関する。
【0023】
特定の実施形態において、本発明は、治療を必要とする患者に、rhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物、およびrhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第2の薬物を共投与する(ここで、第2の薬物は第1の薬物と置き換わらない)ことを含む、血小板減少症の治療方法に関する。
【0024】
特定の実施形態において、本発明は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量および輸血製剤を投与して、作動薬の投与が血液製剤単独の投与と比較して血小板を増加させることによる、輸血を必要とする患者における血小板減少症の治療方法に関する。
【0025】
特定の実施形態において、本発明は、治療を必要とする患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量を投与することによる、血小板減少症の治療方法、ならびに輸血に伴うウイルス感染および抗体の発生率を減少させる方法に関する。
【0026】
特定の実施形態において、本発明は、治療を必要とするヒトまたは動物に、少なくとも 0.01 mg/kg/日の用量の、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物を投与すること、産生される血小板の増加を監視すること;および用量の調整が必要であるか確認するために化合物の用量を調整することによる、血小板減少症の治療方法に関する。
【0027】
特定の実施形態において、本発明は、治療を必要とする患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量を投与することによる、患者の血小板を増加させる方法に関する。
【0028】
特定の実施形態において、本発明は、rhTPO結合部位とは異なる結合部位におけるヒトTPO受容体の作動を必要とする患者を診断すること、および該患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量を投与することよる、血小板減少症の治療方法に関する。
【0029】
特定の実施形態において、本発明は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物をスクリーニングすること、および治療を必要とする患者に治療有効量の上記薬物を投与して血小板を増加させることによる、血小板減少症の治療方法に関する。
【0030】
本発明の実施形態において、TPO作動薬は、約0.01 mg/kg/日〜約10 mg/kg/日、約0.01 mg/kg/日〜約3 mg/kg/日、約0.5 mg/kg/日〜約3 mg/kg/日、約0.1 mg/kg/日〜約2 mg/kg/日または約1 mg/kg/日〜約3 mg/kg/日の量で投与される。好ましくは、この量で投与されるTPO作動薬は、本明細書に開示されている式Xの化合物である。
【0031】
本発明の特定の実施形態において、TPO作動薬は、約1 mg/日〜約50 mg/日、約5 mg/kg/日〜約30 mg/日、約10 mg/日〜約25 mg/日、または約15 mg/日〜約20 mg/日の量で投与される。
【0032】
好ましい実施形態において、TPO作動薬は経口投与される。
【0033】
特定の実施形態において、本発明は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位においてヒトTPO受容体を作動する化合物をスクリーニングすること;および供給網において上記化合物を販売することを含む、医薬ビジネスを行う方法に関する。
【0034】
特定の実施形態において、本発明は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物をスクリーニングすること;および医療従事者に上記化合物が血小板を増加させることを研修することを含む、医薬ビジネスを行う方法に関する。
【0035】
本明細書に開示される特定の実施形態において、TPO受容体作動薬は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物である。
【0036】
本明細書に開示される特定の実施形態において、TPO受容体作動薬は、式(I)の2-アシルアミノチアゾール化合物:
【化3】

【0037】
[式中、
Ar1は、それぞれ置換されていてもよいアリール、単環芳香族ヘテロ環、または二環系縮合ヘテロ環であり(ただし、R1が、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいアリールまたはピリジルであり、かつR2が以下の一般式(II)で表される基である場合、Ar1は、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいフェニルまたはピリジルではない);
R1は、それぞれ置換されていてもよいアリールまたは単環芳香族ヘテロ環であり;
R2は、以下の一般式(II)、(III)または(IV)で表される基:
【化4】

【0038】
(式中、nは1〜3の整数であり;mは1〜3の整数であり、(nまたはmが2以上の整数である場合、CR20R21およびCR22R23は同一でも異なっていてもよい);XはO、S、またはN-R26もしくはC(-R27)-R28で表される基であり;E、G、J、Lは独立にNまたはC-R29で表される基であり(ただし、それらの少なくとも1つはC-R29である)、R20、R21、R22、R23、R26、R27、R28、R29は同一または異なって、-H;-OH;-O-低級アルキル;置換されていてもよい低級アルキル;置換されていてもよいシクロアルキル;置換されていてもよいアリール;置換されていてもよいアリールアルキル;置換されていてもよい芳香族ヘテロ環;置換されていてもよい芳香族ヘテロ環アルキル;置換されていてもよい非芳香族ヘテロ環;置換されていてもよい低級アルケニル;置換されていてもよい低級アルキリデン;-COOH;-COO-低級アルキル;-COO-低級アルケニル;-COO-低級アルキレン-アリール;-COO-低級アルキレン-芳香族ヘテロ環;ハロゲン、-OH、-O-低級アルキル、もしくは-O-アリールでそれぞれ置換されていてもよい低級アルキルおよびシクロアルキルからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいカルバモイルもしくはアミノ;-NHCO-低級アルキル;またはオキソであり;R24、R25は同一または異なって、-H、置換されていてもよい低級アルキル、置換されていてもよいシクロアルキル、または置換されていてもよい非芳香族ヘテロ環である。)
である。]
あるいはその医薬上許容される塩、塩基、多形体、代謝産物または誘導体である。
【0039】
本発明の特定の実施形態において、一般式(I)で表される化合物におけるAr1は、好ましくは、それぞれ置換されていてもよいフェニルまたは単環芳香族ヘテロ環である。他の特定の実施形態において、Ar1は、好ましくは、それぞれ置換されていてもよいフェニルまたはピリジルである。他の実施形態において、Ar1は、好ましくは、2および6位が無置換であり、3位が-H、-F、-Clまたは-Brで置換されており、5位が-F、-Clまたは-Brで置換されており、4位が置換されているフェニル、あるいは2および4位が無置換であり、5位が-F、-Clまたは-Brで置換されており、6位が置換されているピリジン-3-イルである。他の特定の実施形態において、Ar1は、好ましくは、4位が、-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イルおよび置換されていてもよいピペラジン-1-イルからなる基で置換されているフェニル、または6位が、-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イル、および置換されていてもよいピペラジン-1-イルからなる基で置換されているピリジン-3-イルである。
【0040】
「RY」は、-OH、-O-低級アルキル、1または2つの低級アルキルで置換されていてもよいアミノ、-CO2H、-CO2-低級アルキル、1または2つの低級アルキルで置換されていてもよいカルバモイル、シアノ、アリール、芳香族ヘテロ環、非芳香族ヘテロ環、およびハロゲン原子からなる群より選択される1つ以上の基で置換されていてもよい低級アルキルである。
【0041】
一般式(I)の化合物におけるR1は、好ましくは、それぞれ置換されていてもよいフェニルまたはチエニルである。他の特定の実施形態において、R1は、好ましくは、ハロゲン原子およびトリフルオロメチルからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいフェニルまたはチエニルである。他の特定の実施形態において、R1は、好ましくは、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい。)でそれぞれ置換されているフェニルまたはチエニルである。
【0042】
一般式(I)の化合物におけるR2は、好ましくは、一般式(II)で表される基である。他の実施形態において、R2は、好ましくは、一般式(II)で表される基であって、nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である基である。他の特定の実施形態において、R2は、好ましくは、4-(ピペリジン-1-イル)ピペリジン-1-イル、4-プロピルピペリジン-1-イル、4-シクロヘキシルピペラジン-1-イル、または4-プロピルピペラジン-1-イルである。
【0043】
他の特定の実施形態において、本発明は、上記式(I)の化合物であって、R1は、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい)でそれぞれ置換されていてもよいフェニルまたはチエニルであり;R2は、一般式(II)で表される基(式中、nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である。)であり;Ar1は、それぞれ置換されていてもよいフェニルまたはピリジルである化合物に関する。
【0044】
本明細書に開示されている特定の実施形態において、TPO受容体作動薬は、式(V)の2-アシルアミノチアゾール化合物:
【化5】

【0045】
[式中、Ar2は(1)に記載されているAr1で表される基であり(ただし、インドール-2-イルを除く);R3は(1)に記載されているR1で表される基であり;R4は(1)に記載されているR2で表される基である(ただし、一般式(IV)で表される基を除く)。]
あるいはその医薬上許容される塩、塩基、多形体、代謝産物または誘導体である。
【0046】
特定の実施形態において、一般式(V)の化合物におけるAr2は、好ましくは、それぞれ置換されていてもよいフェニルまたは単環芳香族ヘテロ環である。特定の実施形態において、Ar2は、好ましくは、それぞれ置換されていてもよいフェニルまたはピリジルである。さらに別の実施形態において、Ar2は、好ましくは、2および6位が無置換であり、3位が-H、-F、-Cl、または-Brで置換されており、5位が-F、-Cl、または-Brで置換されており、4位が置換されているフェニル、あるいは2および4位が無置換であり、5位が-F、-Cl、または-Brで置換されており、6位が置換されているピリジン-3-イルである。他の特定の実施形態において、Ar2は、好ましくは、4位が-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イルおよび置換されていてもよいピペラジン-1-イルからなる群より選択される置換基で置換されているフェニル、または6位が-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イルおよび置換されていてもよいピペラジン-1-イルからなる群より選択される置換基で置換されているピリジン-3-イルである。
【0047】
特定の実施形態において、一般式(V)の化合物におけるR3は、好ましくは、それぞれ置換されていてもよいフェニルまたはチエニルである。特定の実施形態において、R3は、好ましくは、ハロゲン原子およびトリフルオロメチルからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいフェニルまたはチエニルである。他の特定の実施形態において、R3は、好ましくは、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい)でそれぞれ置換されていてもよいフェニルまたはチエニルである。
【0048】
特定の実施形態において、一般式(V)の化合物におけるR4は、好ましくは、一般式(II)で表される基である。特定の実施形態において、R4は、より好ましくは、一般式(II)で表される基であって、nは2であり、mは2であり、XはN-R26またはC-(R27)-R28である基である。他の特定の実施形態において、R4は、より好ましくは、4-(ピペリジン-1-イル)ピペリジン-1-イル、4-プロピルピペリジン-1-イル、4-シクロヘキシルピペラジン-1-イル、または4-プロピルピペラジン-1-イルである。
【0049】
特定の実施形態において、本発明は、式(V)の化合物であって、Ar2はそれぞれ置換されていてもよいフェニルまたは単環芳香族ヘテロ環である化合物を使用する。
【0050】
別の実施形態において、本発明は、式(V)の化合物であって、R3はそれぞれ置換されていてもよいフェニルまたはチエニルであり;R4は一般式(II)で表される基であり;Ar2はそれぞれ置換されていてもよいフェニルまたはピリジルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である化合物を使用する。
【0051】
さらに別の実施形態において、本発明は、式(V)の化合物であって、R3は、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい。)でそれぞれ置換されているフェニルまたはチエニルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基であり;R4は一般式(II)で表される基であり;Ar2はそれぞれ置換されていてもよいフェニルまたはピリジルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である化合物を使用する。
【0052】
さらに別の実施形態において、本発明は、式(V)の化合物であって、R4は、4-(ピペリジン-1-イル)ピペリジン-1-イル、4-プロピルピペリジン-1-イル、4-シクロヘキシルピペラジン-1-イル、または4-プロピルピペラジン-1-イルであり;R3は、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい。)でそれぞれ置換されているフェニルまたはチエニルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基であり;R4は一般式(II)で表される基であり;Ar2はそれぞれ置換されていてもよいフェニルまたはピリジルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である化合物を使用する。
【0053】
さらに別の実施形態において、本発明は、式(V)の化合物であって、Ar2は、2および6位が無置換であり、3位が-H、-F、-Cl、または-Brで置換されており、5位が-F、-Cl、または-Brで置換されており、4位が置換されているフェニル;あるいは2および4位が無置換であり、5位が-F、-Cl、または-Brで置換されており、6位が置換されているピリジン-3-イルであり;R4は、4-(ピペリジン-1-イル)ピペリジン-1-イル、4-プロピルピペリジン-1-イル、4-シクロヘキシルピペラジン-1-イル、または4-プロピルピペラジン-1-イルであり;R3は、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい。)でそれぞれ置換されているフェニルまたはチエニルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基であり;R4は一般式(II)で表される基であり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である化合物を使用する。
【0054】
さらに別の実施形態において、本発明は、式(V)の化合物であって、Ar2は、4位が-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イルおよび置換されていてもよいピペラジン-1-イルからなる群より選択される基で置換されているフェニル;または6位が-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イルおよび置換されていてもよいピペラジン-1-イル(RYは、-OH、-O-低級アルキル、1または2つの低級アルキルで置換されていてもよいアミノ、-CO2H、-CO-低級アルキル、1または2つの低級アルキルで置換されていてもよいカルバモイル、シアノ、アリール、芳香族ヘテロ環、非芳香族ヘテロ環、およびハロゲン原子からなる群より選択される1つ以上の基で置換されていてもよい低級アルキルである。)からなる群より選択される基で置換されているピリジン-3-イルであり;R4は、4-(ピペリジン-1-イル)ピペリジン-1-イル、4-プロピルピペリジン-1-イル、4-シクロヘキシルピペラジン-1-イル、または4-プロピルピペラジン-1-イルであり;R3は、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい。)でそれぞれ置換されているフェニルまたはチエニルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基であり;R4は一般式(II)で表される基であり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である化合物を使用する。
【0055】
本明細書に記載されている本発明がより完全に理解されように、この開示のための定義を以下に提供する:
本発明の目的のために、「放出制御型」は、活性薬物(1または複数)の治療に有益な血中濃度(少なくとも最低有効レベルかつ毒性レベル未満)が、長期間(例えば約8〜約24時間)にわたって維持され、その結果、製剤が1日に3回、2回または1回の投与に適しているように、活性薬剤あるいはその医薬上許容される遊離塩基、塩、多形体、誘導体または組み合わせが制御した速度で製剤から放出されることを意味する。
【0056】
本発明の目的のために、用語「ヒト患者」は、投与中の薬剤に関連する病気に苦しむ個人であることを意味する。
【0057】
共投与は、本明細書中に開示されている第1の薬物と第2の薬物との両方を含む単一組成物の投与、または本明細書中に開示されている第1の薬物および第2の薬物の、少なくともそれぞれの投与間隔の一部が重複する別の組成物としての投与のいずれか一方を意味する。
【発明を実施するための最良の形態】
【0058】
特定の実施形態において、本発明で使用される化合物は、アシルアミノ基がその2位で置換されており、含窒素ヘテロ環の窒素原子がその5位に直接結合しているという点で構造的に特徴づけられる2-アシルアミノチアゾール誘導体である。このような化合物は国際公開第03/062233号および欧州特許出願公開第1466912(A1)号に開示されており、これらは参照により本明細書に組み込まれている。
【0059】
特定の実施形態において、本発明の化合物は、血小板の増加を提供する。「c-Mplリガンド」としても知られるこれらの化合物は、ヒトc-Mpl Ba/F3細胞を増殖させ、ヒトCD34+の巨核球への分化を促進することによって作用し、結果的に血小板を増加させる。これらの細胞の増殖は、ヒトトロンボポエチン受容体(以下「TPO受容体」という)に結合する化合物の能力の結果であろう。
【0060】
血小板は、生理的止血および病的血栓症において重要な働きをする無核血液細胞であり、生体内で巨核球から継続的に産生される。血小板は、他の血球と同様に多能性幹細胞に由来する。特に、多能性幹細胞は巨核球前駆細胞となり、それから巨核芽球、前巨核球、および巨核球が形成される。巨核球の成熟の過程において、未熟な巨核球は、細胞分裂を伴わずにDNA合成だけを行い、倍数体となる。その後、細胞質は成熟し始め、血小板分離膜が形成され、細胞質が断裂することにより血小板が放出される。
【0061】
本発明の化合物の血小板を増加させる能力の結果として、本明細書中に記載されている組成物および方法は、これらに限定されないが、AIDS、進行した肝疾患、骨髄異形成症候群のような既存の疾患により引き起こされる血小板減少症、または現在行われているもしくは以前に行われた薬物療法により引き起こされる血小板減少症の治療または予防に有用となる。血小板減少症は、特発性血小板減少性紫斑病または疾患内在性血小板減少症(disease inherent thrombocytopenia)によっても引き起こされ得る。
【0062】
血小板減少症は、血小板数が異常に低い疾患である。血小板減少症は、場合によっては、異常出血、薬物療法(例えば、化学療法)、および多くの内科的疾患にも関連する。兆候および症状としては、通常、凝固困難、鼻出血およびあざが挙げられる。
【0063】
現在の血小板減少症の治療には、これらに限定されないが、輸血、経口コルチコステロイド剤、免疫抑制剤、脾摘または基礎疾患の治療が含まれる。
【0064】
他の特定の実施形態において、本明細書に記載されている化合物は、血小板減少症および/または他の血液疾患の治療に有用である追加の活性薬物とともに投与されてもよい。特定の実施形態において、作動薬は、エリスロポエチン、幹細胞因子、インターロイキン(インターロイキン1-12)、顆粒球/マクロファージコロニー刺激因子(GM-CSF)、顆粒球コロニー刺激因子(G-CSF)、単球/マクロファージコロニー刺激因子(M-CSFもしくはCSF-1)、マクロファージコロニー刺激因子(M-CSF)、トロンボポエチン(TPO)またはそれらのいずれの組み合わせおよび混合物のような、別の造血成長因子とともに共投与される。
【0065】
他の特定の実施形態において、本明細書に記載されている化合物は、これらに限定されないが、rトロンボポエチン(CIT/Plivaで開発中)、AMG-531(ITP/AmgenでPhase II試験中)およびGSK-115(Glaxo-SmithklineでPhase II試験中)のような、他の実験用または治験用の造血因子とともに共投与されてもよい。
【0066】
本発明のさらに別の実施形態において、本明細書に記載されている化合物は、 多くの他の医薬品とともに共投与されてもよい。例えば、本明細書に記載されている化合物は、鎮痛薬、抗血友病因子、抗出血剤、抗腫瘍薬、抗潰瘍薬、制酸薬、コルチコステロイド、成長ホルモン、造血薬、免疫抑制剤、血小板活性化因子ならびにそれらのいずれの組み合わせおよび混合物とともに共投与されてもよい。
【0067】
特定の実施形態において、本発明において使用される化合物は、これらに限定されないが、以下のものを含む:
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-3-フルオロ-4-ヒドロキシベンズアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(2-ヒドロキシエトキシ)ベンズアミド、
N-[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペリジノ)チアゾール-2-イル]-2-メトキシイソニコチンアミド、
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]イソキノリン-6-カルボキサミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]-4-(2-ヒドロキシエトキシ)ベンズアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(3-ヒドロキシプロポキシ)ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-[(3-ヒドロキシプロピル)アミノ)]ニコチンアミド、
1-(3-クロロ-5-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-カルボン酸、
1-(3-クロロ-5-{[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-カルボン酸、
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(4-シアノピペリジノ)-3,5-ジフルオロベンズアミド、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボン酸、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-6-フルオロフェニル)ピペリジン-4-カルボン酸、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボキサミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(4-ヒドロキシメチルピペリジノ)ニコチンアミド、
1-(3-クロロ-5-{[5-(4-シクロヘキシルピペラジン-1-イル)-4-(4-フルオロフェニル-)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-カルボン酸、
1-(3-クロロ-5-{[5-(4-シクロヘキシルピペラジン-1-イル)-4-(3-トリフルオロメチル-フェニル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-カルボン酸、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-{4-[(2-メトキシエチル)カルバモイル]ピペリジノ}ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-{4-[(3-メトキシプロピル)カルバモイル]ピペリジノ}ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-[4-(モルホリノカルボニル)ピペリジノ]ニコチンアミド、および
その医薬上許容される塩。
【0068】
他の特定の実施形態において、本発明において使用される化合物は、これらに限定されないが、以下のものを含む:
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-2-メトキシイソニコチンアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(2-メトキシエトキシ)ベンズアミド、
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル-]キノリン-6-カルボキサミド、
3-クロロ-N-[4-(5-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)- チアゾール-2-イル]-4-(2-ヒドロキシエトキシ)ベンズアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-5-フルオロ-4-(2-ヒドロキシエトキシ)ベンズアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(3-ヒドロキシプロポキシ)ベンズアミド、
3,5-ジクロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(2-ヒドロキシエトキシ)ベンズアミド、
3-ブロモ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)- チアゾール-2-イル]-4-(2-ヒドロキシエトキシ)ベンズアミド、
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-2-オキソ-2,3-ジヒドロベンゾオキサゾール-6-カルボキサミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-ヒドロキシベンズアミド、
(.+-.)-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(3-ヒドロキシピロリジン-1-イル)ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(4-ヒドロキシピペリジノ)ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル-]-6-[(2-ヒドロキシエチル)アミノ]ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]-6-(4-ヒドロキシピペリジノ)ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(3-オキソピペラジン-1-イル)ニコチンアミド、
6-(4-カルバモイルピペリジノ)-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(- 4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]ニコチンアミド、
(±)-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-[(2,3-ジヒドロキシプロピル)アミノ]ニコチンアミド、
(.+-.)-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-[(テトラヒドロ-3-フリル)メトキシ]ニコチンアミド、
6-(4-カルバモイルピペリジノ)-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(- 4-プロピルピペラジン-1-イル)チアゾール-2-イル]ニコチンアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(4-ヒドロキシピペリジノ)ベンズアミド、
1-(2-ブロモ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボン酸、
1-(2-ブロモ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボキサミド、
1-(4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル-2,6-ジフルオロフェニル)ピペリジン-4-カルボン酸、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(4-シアノピペリジノ)ベンズアミド、
1-(4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2,6-ジフルオロフェニル)ピペリジン-4-カルボキサミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]-4-(4-ヒドロキシピペリジノ)ベンズアミド、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボキサミド、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボン酸、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(4-シアノピペリジノ)-5-フルオロベンズアミド、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-6-フルオロフェニル)ピペリジン-4-カルボキサミド、
1-(3-クロロ-5-{[4-(3-クロロフェニル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-カルボン酸、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(5-オキソ-1,4-ジアゼパン-1-イル)ニコチンアミド、
[1-(3-クロロ-5-{[4-(4-クロロチオフェン2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-イル]酢酸、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-{4-[(ジメチルアミノ)カルボニル]ピペリジノ}ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-{4-[(メチルアミノ)カルボニル]ピペリジノ}ニコチンアミド、
[4-(3-クロロ-5-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペラジン-1-イル]酢酸、
6-[4-(アセチルアミノ)ピペリジノ]-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]ニコチンアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-5-フルオロ-4-[4-(メトキシアセチル)ピペラジン-1-イル]ベンズアミド、
[4-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-6-フルオロフェニル)ピペラジン-1-イル]酢酸、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-5-フルオロ-4-(4-スルファモイルピペラジン-1-イル)ベンズアミド、
4-[4-(カルバモイルメチル)ピペラジン-1-イル]-3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-5-フルオロベンズアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-[4-(プロピルカルバモイル)ピペリジノ]ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-{4-[(2-エトキシエチル)カルバモイル]ピペリジノ}ニコチンアミド、および
その医薬上許容される塩。
【0069】
好ましくは、本発明において使用される化合物は、以下の構造式を有する式Xの化合物(またはその医薬上許容される塩)である:
【化6】

【0070】
本発明の特定の実施形態において、式(I)〜(V)および(X)の化合物は、血小板数を増加させることにより血小板減少症を治療または予防する薬物として使用することができる。
【0071】
本発明の化合物の一般式の定義において、用語「低級」は、別段の指示がない限り、1〜6個の炭素原子を有する直鎖状または分岐状の炭素鎖を意味する。
【0072】
したがって、「低級アルキル」は1〜6個の炭素原子を有するアルキルを意味し、その例としてはメチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec-ブチル、tert-ブチル、ペンチル、ネオペンチル、ヘキシル等が挙げられ、その中で、メチル、エチル、プロピル、およびイソプロピルのような1〜3個の炭素原子を有するものが好ましい。
【0073】
「低級アルケニル」は2〜6個の炭素原子を有するアルケニルを意味し、その例としてはエテニル、プロペニル、ブテニル、ペンテニル、ヘキセニル等が挙げられ、その中で、エテニル、1-プロペニル、2-プロペニル、および3-プロペニルのような2〜3個の炭素原子を有するものが好ましい。
【0074】
「低級アルキリデン」は1〜6個の炭素原子を有するアルキリデンを意味し、その例としてはメチリデン、エチリデン、プロピリデン、ブチリデン、ペンチリデン、ヘキシリデン等が挙げられ、その中で、メチリデン、エチリデン、1-プロピリデン、および2-プロピリデンのような1〜3個の炭素原子を有するものが好ましい。
【0075】
「低級アルキレン」は1〜6個の炭素原子有するアルキルの2価基を意味し、その中で、メチレン、エチレン、トリメチレン、メチルエチレン、テトラメチレン、ジメチルメチレン、およびジメチルエチレンのような1〜4個の炭素原子を有するものが好ましい。
【0076】
「シクロアルキル」は3〜8個の炭素原子を有する炭素環を意味し、部分的に不飽和を有してもよい。その例としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロオクチル、シクロブテニル、シクロヘキセニル、シクロオクタジエニル等が挙げられる。
【0077】
「アリール」は6〜14個の炭素原子を有する単環から三環系芳香環を意味し、その中で、フェニルおよびナフチルが好ましく、フェニルがより好ましい。
【0078】
「アリールアルキル」は「アリール」で置換されている「低級アルキル」を意味し、その例としては、ベンジル、1-フェネチル、2-フェネチル、ナフチルメチル、1-ナフチルエチル、2-ナフチルエチル等がある。
【0079】
「単環芳香族ヘテロ環」は、窒素、酸素、または硫黄原子を含んでいてもよい5〜6員芳香族ヘテロ環またはその部分的に水素化された環の1価基を意味し、その例としては、チエニル、フリル、ピロリル、チアゾリル、オキサゾリル、イミダゾリル、イソチアゾリル、イソキサゾリル、ピラゾリル、チアジアゾリル、オキサジアゾリル、トリアゾリル、テトラゾリル、ピリジル、ピラジニル、ピリミジニル、ピリダジニル等が挙げられる。
【0080】
「二環系縮合ヘテロ環」は、アリールまたは単環芳香族ヘテロ環と縮合した、窒素、酸素、または硫黄原子を含んでいてもよい芳香族ヘテロ環、あるいはその部分的に水素化された環の1価基を意味し、その例としては、インドリル、イソインドリル、インドリジニル、インダゾリル、キノリル、イソキノリル、キノリジニル、フタラジニル、ナフチリジニル、キノキサリニル、キナゾリニル、シノリニル、ベンズイミダゾリル、イミダゾピリジル、ベンゾフラニル、ベンゾオキサゾリル、1,2-ベンゾイソキサゾリル、ベンゾチエニル、ベンゾチアゾリル、オキサゾロピリジル、チアゾロピリジル、インドリニル、イソインドリニル、1,2-ジヒドロキノリニル、1,2,3,4-テトラヒドロキノリニル、3,4-ジヒドロ-2H-1,4-ベンゾオキサジニル、1,4-ジヒドロ-2H-3,1-ベンゾオキサジニル、クロマニル、イソクロマニル、ベンゾオキソラニル、ベンゾジオキソラニル、ベンゾジオキサニル等が挙げられる。
【0081】
「芳香族ヘテロ環」は、「単環芳香族ヘテロ環」および「二環系縮合ヘテロ環」を合わせたものを意味する。
【0082】
「芳香族ヘテロ環アルキル」は、「芳香族ヘテロ環」で置換されている「低級アルキル」を意味し、その例としては、チエニルメチル、フリルメチル、ピリジルメチル、チアゾリルメチル、オキサゾリルメチル、イミダゾリルメチル、チエニルエチル、フリルエチル、ピリジルエチル等が挙げられる。
【0083】
「非芳香族ヘテロ環」は、アリールまたは単環芳香族ヘテロ環と縮合していてもよい、窒素、酸素、および硫黄からなる群より選択される1つ以上の同一または異なるヘテロ原子を有する非芳香族ヘテロ環の1価基を意味し、その例としては、アゼチジニル、ピロリジニル、イミダゾリニル、イミダゾリジニル、ピラゾリジニル、ピラゾリニル、ピペリジニル、アゼピニル、ピペラジニル、ホモピペラジニル、モルホリニル、チオモルホリニル、インドリニル、イソインドリニル等が挙げられる。
【0084】
用語「ハロゲン」は、フッ素、塩素、臭素、およびヨウ素原子を含む。
【0085】
「リガンド」は、酵素、受容体、タンパク質等に結合する低分子量の物質を意味し、作動薬および拮抗薬、好ましくは作動薬を含む。
【0086】
用語「置換されていてもよい(optionally substituted)」または「置換されていてもよい(which may be substituted)」に使用することができる置換基としては、それぞれの基の置換基として共通に使用されるものを使用することができ、それぞれの基は、1つ以上の置換基を有していてもよい。
【0087】
R1の定義における「それぞれ置換されていてもよいアリールまたは単環芳香族ヘテロ環」、R20、R21、R22、R23、R26、R27、R28、およびR29の定義における「置換されていてもよいシクロアルキル」、「置換されていてもよいアリール」、「置換されていてもよいアリールアルキル」、「置換されていてもよい芳香族ヘテロ環」、「置換されていてもよい芳香族ヘテロ環アルキル」、および「置換されていてもよい非芳香族ヘテロ環」、ならびにR24およびR25の定義における「置換されていてもよいシクロアルキル」および「置換されていてもよい非芳香族ヘテロ環」に使用することができる置換基としては、以下の(a)〜(h)の基が挙げられる。式中、「RZ」は、-OH、-O-低級アルキル、1または2つの低級アルキルで置換されていてもよいアミノ、1または2つの低級アルキルで置換されていてもよいカルバモイル、アリール、芳香族ヘテロ環、およびハロゲンからなる群より選択される1つ以上の基で置換されていてもよい低級アルキルである。
【0088】
(a)ハロゲン;
(b)-OH、-O-RZ、-O-アリール、-OCO-RZ、オキソ(=O);
(c)-SH、-S-RZ、-S-アリール、-SO-RZ、-SO-アリール、SO2-RZ、-SO2-アリール、1または2つのRZで置換されていてもよいスルファモイル;
(d)1または2つのRZで置換されていてもよいアミノ、-NHCO-RZ、-NHCO-アリール、-NHCO2-RZ、-NHCONH2、-NHSO2-RZ、-NHSO2-アリール、-NHSO2NH2、ニトロ;
(e)-CHO、-CO-RZ、-CO2H、-CO2-RZ、1または2つのRZで置換されていてもよいカルバモイル、シアノ;
(f)-OH、-O-低級アルキル、1または2つの低級アルキルで置換されていてもよいアミノ、ハロゲンおよびRZからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいアリールまたはシクロアルキル;
(g)-OH、-O-低級アルキル、1または2つの低級アルキルで置換されていてもよいアミノ、ハロゲンおよびRZからなる群より選択される1つ以上の基でそれぞれ置換されていてもよい芳香族ヘテロ環または非芳香族ヘテロ環;
(h)(a)〜(g)に記載されている置換基から選択される1つ以上の基で置換されていてもよい低級アルキル。
【0089】
R20、R21、R22、R23、R26、R27、R28、およびR29の定義における「置換されていてもよい低級アルキル」、「置換されていてもよい低級アルケニル」、および「置換されていてもよい低級アルキリデン」、ならびにR24およびR25の定義における「置換されていてもよい低級アルキル」に使用することができる置換基としては、(a)〜(g)に記載されている基が挙げられる。
【0090】
Ar1の定義における「それぞれ置換されていてもよいアリール、単環芳香族ヘテロ環、または二環系縮合ヘテロ環」に使用することができる置換基としては、オキソ(ただし、オキソは二環系縮合ヘテロ環のみに使用することができる);および一般式(VI)で表される基が挙げられる。
【化7】

【0091】
[式中、
Aは、単結合、または置換されていてもよい環状アミンジイル(ただし、環状アミンジイルはその環状アミンの窒素原子でAr1と結合している。)であり;
Bは、単結合、-O-、-NH-、-N(-RZ)-、-NHCO-、-CO-、-CONH-、または-CON(-RZ)であり;
Cは、単結合;または、ハロゲンおよび-OHからなる群より選択される1つ以上の基でそれぞれ置換されていてもよい低級アルキレンもしくは低級アルケニレンであり;
Dは、単結合、-NHCO-、-NHSO2-、-CO-、または-SO2-であり;
Eは、H;ハロゲン;-OH;-O-RZ;-O-CO-RZ;1もしくは2つのRZで置換されていてもよいアミノ;-RZ;シアノ;それぞれ置換されていてもよいアリール、シクロアルキル、芳香族ヘテロ環または非芳香族ヘテロ環であり、ただし、-CH2-非芳香族ヘテロ環、および-CH=CH-非芳香族ヘテロ環(ただし、非芳香族ヘテロ環の炭素原子はメチンで置換されている。)は一般式(VI)で表される基から除かれる;そしてAr1が、それぞれ置換されていてもよいアリールまたは単環芳香族ヘテロ環である場合、以下の基を除く:
-A-および-B-が単結合を形成し、-C-が単結合、またはハロゲンおよび-OHからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいエチレンもしくはビニレンであり、-D-が-CO-である基、
-A-および-B-が単結合を形成し、-C-が単結合、またはハロゲンおよび-OHからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいエチレンもしくはビニレンであり、-D-が-SO2-であり、-E-が1または2つのRZで置換されていてもよいアミノである基、
-A-および-B-が単結合を形成し、-C-が単結合、またはハロゲンおよび-OHからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいエチレンもしくはビニレンであり、-D-が単結合であり、-E-が、それぞれ置換されていてもよいアリール、部分的に水素化されていない単環芳香族ヘテロ環、または部分的に水素化されていない単環芳香族ヘテロ環と縮合している環の1価基である基、
-A-が単結合であり、-B-が-CO-である基、
-A-、-B-、-C-および-D-が単結合を形成し、-E-がアリール、部分的に水素化されていない単環芳香族ヘテロ環、または部分的に水素化されていない単環芳香族ヘテロ環と縮合している環の1価基である基]。
【0092】
-A-の定義における「環状アミンジイル(ただし、環状アミンジイルはその環状アミンの窒素原子でAr1と結合している。)」は、例えば縮合環およびスピロ環などの、3〜8員(縮合環またはスピロ環の場合には5〜15員)芳香族または非芳香族環状アミンの2価基を意味し、これは少なくとも1つの窒素原子を有し、さらに窒素、酸素、および硫黄からなる群より選択される1つ以上の同一または異なるヘテロ原子を有していてもよく、Ar1は少なくとも1つの窒素原子で直接置換されている。その例としては、アゼピン、ピロリジン、ピペリジン、ピペラジン、N-メチルピペラジン、アゼパン、ジアゼパン、N-メチルジアゼパン、モルホリン、チオモルホリン、イソインドリン、1,4-ジオキサ-8-アザスピロ[4,5]デカン、1-オキサ-8-アザスピロ-[4,5]デカン、1-オキサ-8-アザスピロ[4,5]ウンデカン等の2価基が挙げられる。
【0093】
-A-の定義における「置換されていてもよい環状アミンジイル」および-E-の定義における「それぞれ置換されていてもよいアリール、シクロアルキル、芳香族ヘテロ環、または非芳香族ヘテロ環」に使用される置換基としては、(a)〜(h)に記載されている基、および (a)〜(h)の基で置換されていてもよい低級アルキリデンが挙げられる。
【0094】
一般式(I)または(V)で表される本発明のヒトTPO受容体作動薬は、置換基の種類によって不斉炭素原子を含んでいてもよい。特定の実施形態において、不斉炭素原子に基づいて光学異性体が存在することもある。本発明のヒトTPO受容体作動薬は、これらの光学異性体の混合物または分離したものを含んでいてもよい。特定の実施形態において、本発明のヒトTPO受容体作動薬の互変異性体(該互変異性体としては、2-ヒドロキシピリジンおよび2-ピリドンが挙げられる)が存在してもよい。さらに別の実施形態において、本発明のヒトTPO受容体作動薬は、異性体を混合物としてまたは分離された異性体として含むことができる。特定の実施形態において、ヒトTPO受容体作動薬は標識化合物である、すなわち、1つ以上の原子が放射性同位体または非放射性同位体で標識されている化合物も本発明に含まれる。
【0095】
本発明において使用されるヒトTPO受容体作動薬は、遊離塩基、医薬上許容される塩、多形体、代謝産物、誘導体または上記のいずれかの組み合わせの形態であってもよい。
【0096】
医薬上許容される塩としては、これらに限定されないが、鉱酸、例えば塩酸、臭化水素酸、ヨウ化水素酸、硫酸、硝酸、リン酸等;有機酸、例えばギ酸、酢酸、プロピオン酸、シュウ酸、マロン酸、コハク酸、フマル酸、マレイン酸、乳酸、リンゴ酸、酒石酸、クエン酸、メタンスルホン酸、エタンスルホン酸、p-トルエンスルホン酸、アスパラギン酸、グルタミン酸等;ナトリウム、カリウム、マグネシウム、カルシウム等のような無機塩基との塩;メチルアミン、エチルアミン、エタノールアミン、リジン、オルニチン等のような有機塩基との塩;およびアンモニウム塩等が挙げられる。
【0097】
他の特定の実施形態において、ヒトTPO受容体作動薬は、水和物または溶媒和物の形態であってもよい。別の実施形態において、ヒトTPO受容体作動薬は、代謝されて1つ以上の一般式(I)または(V)のヒトTPO受容体作動薬となるプロドラッグを含んでいてもよい。
【0098】
本発明において使用される薬物(1または複数)は、医薬上許容される成分と一緒に経口剤形中に含まれてもよい。
【0099】
医薬上許容される成分としては、これらに限定されないが、酸性化剤、抗菌剤、アルカリ化剤、抗酸化剤、防腐剤、静菌剤、結合剤、緩衝剤、コーティング剤、乾燥剤、希釈剤、分散剤、皮膚軟化剤、乳化剤、充填剤、膜形成剤(film-formers)、香料添加剤、ゲル化剤、造粒剤、滑沢剤、可塑剤、防腐剤、可溶化剤、硬化剤、懸濁化剤、甘味剤、増粘剤(viscosity increasing agents)、湿潤剤等が挙げられる。
【0100】
特定の好ましい実施形態において、薬物(1または複数)は、短時間作用型経口剤形中に含まれている。他の好ましい実施形態において、薬物(1または複数)は放出制御型剤形中に含まれてもよい。本発明の剤形は、これらに限定されないが、錠剤および軟または硬ゼラチンカプセル剤であってもよい。
【0101】
特定の実施形態において、薬物(1または複数)は、錠剤に圧縮することができる、あるいは軟または硬ゼラチンカプセル剤に充填することができる多粒子中に含まれてもよい。多粒子は、球状、ビーズ、ペレット、棒状、微小粒子、例えば、ミクロスフェア等である。
【0102】
特定の実施形態において、経口剤形は、放出制御型剤形であってもよく、薬物(1または複数)は放出制御型マトリクス中に含まれる。他の実施形態において、薬物(1または複数)は、放出制御型多粒子中に含まれてもよい。さらに別の実施形態において、薬物(1または複数)は、放出制御コーティングを有する短時間作用型剤形中に含まれてもよい。
【0103】
本発明の多粒子は、錠剤に圧縮されて、または軟もしくは硬ゼラチンカプセル剤に充填されて、経口固体剤形を提供してもよい。特定の実施形態において、本発明の錠剤およびカプセル剤は、短時間作用コーティング、放出制御コーティングまたは腸溶コーティングで被覆されてもよい。
【0104】
別の実施形態において、薬物(1または複数)は、ビーズ上に被覆されて、短時間作用型ビーズを提供してもよい。特定の実施形態において、ビーズは、短時間作用コーティングで被覆されてもよい。他の実施形態において、ビーズは、放出制御コーティングで被覆されてもよい。
【0105】
他の特定の実施形態において、薬物(1または複数)は、経口液剤、乳剤、懸濁剤等中に含まれてもよい。
【0106】
経口剤形が好ましいが、薬物(1または複数)は、注射として非経口で、または溶剤、懸濁剤、乳剤等として経鼻胃で投与することも意図している。
【0107】
併用療法を考える場合、薬物は同一のまたは異なる剤形で、および同一のまたは異なる投与経路により投与することができる。
【0108】
好適な実施形態の詳細な説明
以下の実施例は、本発明の種々の態様を例示する。これらは、いかなる方法でも特許請求の範囲を限定するものとはみなされない。
【実施例1】
【0109】
トロンボポエチン(TPO)は、血小板産生の主要な生理的調節因子である332アミノ酸のサイトカインである。ヒト受容体(c-Mpl)を発現しているBa/F3細胞(c-Mpl-Ba/F3細胞)の増殖に基づくハイスループット増殖アッセイを用いてライブラリーのスクリーニングを行い、一連の新規c-Mpl作動薬が同定された。その構造を変更することにより式Xが発見され、式Xは、c-Mpl依存的な増殖(EC50=3.3 nM、Ba/F3細胞増殖に影響なし)またヒト臍帯血CD34+細胞の巨核球コロニー形成の誘発(EC50=25 nM)のような、いくつかの細胞に基づいたアッセイにおいてTPOと同等の有効性を示した。
【0110】
G-CSF動員ヒト末梢血CD34+細胞をrhTPOまたは式Xとともに12日間インキュベートして、倍数性の程度を試験した場合、式Xで処理した細胞の倍数性レベルはrhTPOで処理した細胞と変わらないことがわかった。重要なことに、式X処理は、rhTPO処理の場合と同様に、ヒトc-Mplを発現しているBa/F3細胞において、STAT3、STAT5、およびERK活性化のようなシグナル伝達応答を誘発した。この点において、シグナル伝達経路の活性化がヒトおよびチンパンジーの血小板中だけで起こることから、式XはTPO受容体作動薬活性に対する顕著な種特異性を示した。
【0111】
他の種の血小板、例えば、ヒヒ、アカゲザル、カニクイザル、リスザル、コモンマーモセット、ビーグル犬、モルモット、ブタ、ウサギ、ハムスター、ラット、またはマウスの血小板は、抗ホスホ-STAT5イムノブロットアッセイにより判断した場合に、式X処理に対してシグナル伝達応答を示さなかったが、これらの全ての種の血小板はrhTPO処理に対してシグナル伝達応答を示した。
【0112】
ヒト血小板を用いて、ヒトc-Mplに結合するTPOに対する式Xの効果も試験したところ、式Xは100 μMまでの濃度においてヒトc-MplへのrhTPOの結合に影響を及ぼさないことがわかった。したがって、これらの知見はヒトc-Mplに対する式Xの作用部位がrhTPOのものとは異なることを示す。したがって、本発明者らのデータは、式Xが、ヒト血小板に特異的に作用する新規TPO受容体作動薬であること、および人間の血小板減少症治療用の有用な薬剤となる可能性があることを示唆する。
【実施例2】
【0113】
ヒトCD34+細胞の巨核球への分化に対するTPOと組み合わせた式Xの効果
本研究において、TPOと組み合わせた式Xの巨核球形成に対する効果を試験した。
【0114】
G-SCF動員ヒト末梢血CD34+細胞を、無血清液体培養系において、式XとTPOの組み合わせ、式X、またはrhTPOとともに培養した。CD34+CD41−細胞(造血前駆細胞)、CD34+CD41+細胞(巨核球前駆細胞)、およびCD34−CD41+細胞(巨核球)の数を、フローサイトメトリーを用いて測定した。
【0115】
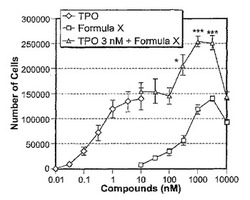
14日目に、式XまたはTPO単独は、用量依存的に巨核球の数を増加させ、式Xの最高活性はTPOと同様であった(図1)。さらに、式Xは、3 nM TPOの存在下、用量依存的に巨核球の数を増加させ、巨核球分化に対し最大の効果を示した(図1)。
【0116】
TPOと組み合わせた式Xの使用は、巨核球形成に対して相加的作用を有すると想定された。式XとTPOの組み合わせにより、式XまたはTPO単独と比較して造血前駆細胞(図2)および巨核球前駆細胞(図3)の数はかなり増加する。これらの結果は、式Xが、TPOと組み合わせると、巨核球だけでなく、造血前駆細胞および巨核球前駆細胞も増加させることを示した。
【0117】
次に、それぞれの種類の細胞数の経時変化を、3 μM式X、3nM TPO、または3 μM式X+3nM TPO(図4、5および6)の存在下で評価した。式XまたはTPO単独と比較して、式XとTPOの組み合わせは、6日目以降の造血前駆細胞の数(図4)、10日目および14日目の巨核球前駆細胞の数(図5)、そして6日目以降の巨核球の数(図6)を増加させた。これらの結果は、式XおよびTPOの相加的作用が、培養初期段階の造血前駆細胞の数をかなり増加させることを示唆した。
【0118】
本研究の目的で、図1に示した巨核球(CD34−CD41+細胞)の数をフローサイトメトリーを用いて計数した。データは、5つの独立した実験の平均値±SEを表す。*:p<0.05、***p<0.001(ダネット検定を用いて3 nM TPOと比較)。
【0119】
それぞれ図2および図3に示した造血前駆細胞(CD34−CD41+細胞:a)および巨核球前駆細胞(CD34+CD41+細胞:b)の数を、フローサイトメトリーを用いて計数し、次にダネット検定を用いて3 nM TPOと比較した。
【0120】
図4、5、および6に示した造血前駆細胞(CD34−CD41+細胞:a)、巨核球前駆細胞(CD34+CD41+細胞:b)、および巨核球(CD34−CD41+細胞:c)の数を、図に示した日にフローサイトメトリーを用いて計数した。データは5つの独立した実験の平均値±SEを表す。*:p<0.05、**p<0.01、***p<0.001(ダネット検定を用いて3 nM TPOと比較)。
【実施例3】
【0121】
非肥満性糖尿病/重症複合免疫不全症(NOD/SCID)マウスは、このモデルがヒト血小板の産生を生じるために、ヒト造血幹細胞の有効な移植モデルとして特徴づけられている。このように、ヒト造血幹細胞を移植したヒト血小板産生NOD/SCIDマウスにおける式Xのin vivo血小板増多効果を試験した。
【0122】
本研究において、本発明者らは、ヒト造血幹細胞の供給源として、市販の凍結保存されたヒト胎児肝臓CD34+細胞を使用した。細胞を亜致死的に照射した(240 cGy)NOD/SCIDマウスに移植した。移植後4週のこれらのマウスの末梢血中にヒト血小板が現れ始めた。ヒト血小板の産生は移植後6ヶ月まで続いた。種々の用量の式X(0、0.3、および3 mg/kg/日)を、ヒト血小板を安定に産生することが確認されたNOD/SCIDマウスに14日間経口投与した。
【0123】
式Xの経口投与により、マウスにより産生されたヒト血小板の数は、用量依存的に、1 mg/kg/日以上で有意に増加した。ヒト血小板数の増加は、14日目で、1 mg/kg/日において約2.7倍および3 mg/kg/日において約3.0倍に達した。式X投与を中止すると、ヒト血小板数が処理前のレベルに戻った。マウス血小板の数は、試験期間中変化しなかった。
【0124】
次に、これらのマウスの末梢血液中で産生されたヒト血小板の機能を評価するために、トロンビン受容体作動薬ペプチド(TRAP)で刺激したヒト血小板上の活性化依存性マーカーCD62P(P-セレクチン)の発現を試験した。ヒト血小板上のCD62P発現は移植マウスからの血液をTRAPで刺激することにより誘発され、このことは、NOD/SCIDマウス中で産生されるヒト血小板が機能的であったことを示唆する。さらに、式Xの投与前および後に、TRAPにより誘発されたヒト血小板上のCD62P発現の最大応答を評価したところ、ビヒクル群で得られた結果と同様であった。これらの結果は、式Xが、血小板減少症を有する患者の治療に有用な経口活性TPO受容体作動薬であることを示唆する。
【0125】
先の本明細書においては、本発明は、特定の典型的な実施形態およびその実施例に関して記載されている。しかしながら、添付の特許請求の範囲に記載される本発明のより広い精神および範囲から逸脱することなく、それに種々の改良および改変がされてもよいことは明らかであろう。したがって、本明細書および図面は、限定的な意味ではなく例示的にみなされるべきである。
【図面の簡単な説明】
【0126】
【図1】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後に産生された巨核球の数を示す図である。
【図2】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後に産生された造血前駆細胞(図2)および巨核球前駆細胞(図3)の数を示す図である。
【図3】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後に産生された造血前駆細胞(図2)および巨核球前駆細胞(図3)の数を示す図である。
【図4】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後の、造血前駆細胞(図4)、巨核球前駆細胞(図5)および巨核球(図6)の経時変化を示す図である。
【図5】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後の、造血前駆細胞(図4)、巨核球前駆細胞(図5)および巨核球(図6)の経時変化を示す図である。
【図6】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後の、造血前駆細胞(図4)、巨核球前駆細胞(図5)および巨核球(図6)の経時変化を示す図である。
【技術分野】
【0001】
本発明は、トロンボポエチン受容体作動薬により血小板減少症を治療または予防する剤形および方法に関する。
【背景技術】
【0002】
血小板は、生理的止血および病的血栓症において重要な働きをする無核血液細胞であり、生体内で巨核球から継続的に産生される。血小板は、他の血球と同様に、多能性幹細胞に由来する。特に、多能性幹細胞は巨核球前駆細胞になり、それから巨核芽球、前巨核球、および巨核球が形成される。巨核球の成熟の過程において、未熟な巨核球は、細胞分裂を伴わずにDNA合成だけを行い、倍数体となる。その後、細胞質は成熟し始め、血小板分離膜が形成され、細胞質が断裂することにより血小板が放出される。
【0003】
骨髄異形成症候群のような種々の造血機能不全、あるいは悪性腫瘍のための化学療法または放射線療法等による血小板数の減少は、出血傾向のような重篤な症状を引き起こす。このような機能障害を治療する目的で血小板数を増加させるための種々の薬物療法および非薬物療法を開発する多くの試みが行われている。そのような治療の1つが血小板輸血である。血小板輸血は血小板減少症を治療する有効な手段となったが、十分量の血小板を供給することができず、輸血した血小板の寿命が短い等の理由により血小板減少症を十分に改善することは困難である。さらに、血小板輸血には、ウイルス感染、全抗体の産生、移植細胞対宿主病(GVHD)等の問題点がある。このため、種々の状態により引き起こされる造血抑制を軽減する薬剤または血小板数の回復を促進する治療の開発に対する需要がある。
【0004】
巨核球への分化において重要な働きをするc-Mplリガンドであるトロンボポエチン(本明細書中、以下「TPO」と呼ぶ)がクローニングされ、それが巨核球の分化および増殖を刺激して、血小板産生を促進するということが報告されている(Kaushansky K. et al., Nature, 369, 568-571, 1994)。血小板数を増加させる薬物としてのTPOに関する臨床試験が行われており、ヒトでのその有効性および許容性が確認されている。しかしながら、TPOの一種であるPEG-rHuMGDF(ポリエチレングリコールで修飾された天然のTPOの163個のN末端アミノ酸)の臨床試験において中和抗体が確認されたために(Li J. et. al., Blood, 98, 3241-3248, 2001, およびBasser R. L. et. al., Blood, 99, 2599-2602, 2002)、TPOの免疫原性が懸念されている。さらに、TPOはタンパク質であるため、消化管内で分解され、よって、経口投与用の薬剤として実用的ではない。同様の理由から、低分子ペプチドも経口投与用の薬剤として実用的ではないと考えられる。このような状況下、血小板減少症の治療の目的で、免疫原性が低く経口投与可能である非ペプチド性c-Mplリガンドを開発する研究が行われてきた。
【0005】
例えば、ベンザゼピン誘導体は特開平11-152276号公報(日本国)に開示されている。アシルヒドラゾン誘導体は国際公開第99/11262号に記載されている。ジアゾナフタレン誘導体は国際公開第00/35446号に記載されている。ピロロカルバゾール誘導体は国際公開第98/09967号に記載されている。ピロロフェナンスリジン誘導体は特開平10-212289号公報(日本国)に記載されており、ピロロフタルイミド誘導体は特開2000-44562号公報(日本国)に記載されている。
【0006】
さらに、国際公開第01/07423号には、血小板増多作用を有する、以下の一般式(VII)で表される化合物:
【化1】

【0007】
(式中、記号は公報に定義されている通りである)
が記載されている。
【0008】
国際公開第01/53267号には、血小板増多作用を有する、以下の一般式(VIII)で表される化合物:
【化2】

【0009】
(式中、記号は公報に定義されている通りである)
が記載されている。
【0010】
日本特許第3199451号明細書には、2-アシルアミノチアゾール化合物がコレシストキニンおよびガストリン受容体作動薬の効果を有することが記載されている。Chemical and Pharmaceutical Bulletin, 25, 9, 2292-2299, 1977には、2-アシルアミノチアゾール化合物が抗炎症作用を有することが記載されている。しかしながら、血小板増多作用についての記載はない。
【0011】
国際公開第03/062233号および欧州特許出願公開第1466912(A1)号には、ヒトc-Mpl-Ba/F3細胞の増殖に影響を与え、巨核球コロニーの形成を促進する効果に基づいて血小板増多作用を有する2-アシルアミノチアゾール誘導体が開示されている。
【0012】
国際公開第04/029049号には、2-アシルアミノチアゾール誘導体のマレイン酸塩が開示されている。
【特許文献1】特開平11-152276号公報
【特許文献2】国際公開第99/11262号パンフレット
【特許文献3】国際公開第00/35446号パンフレット
【特許文献4】国際公開第98/09967号パンフレット
【特許文献5】特開平10-212289号公報
【特許文献6】特開2000-44562公報
【特許文献7】国際公開第01/07423号パンフレット
【特許文献8】国際公開第01/53267号パンフレット
【特許文献9】日本特許第3199451号明細書
【特許文献10】国際公開第03/062233号パンフレット
【特許文献11】欧州特許出願公開第1466912(A1)号明細書
【特許文献12】国際公開第04/029049号パンフレット
【非特許文献1】Kaushansky K. et al., Nature, 369, 568-571, 1994
【非特許文献2】Li J. et. al., Blood, 98, 3241-3248, 2001
【非特許文献3】Basser R. L. et. al., Blood, 99, 2599-2602, 2002
【非特許文献4】Chemical and Pharmaceutical Bulletin, 25, 9, 2292-2299, 1977
【発明の開示】
【発明が解決しようとする課題】
【0013】
したがって、当技術分野において、血小板減少症を治療する組成物および方法が必要とされている。
【0014】
本明細書に引用される全ての参考文献は、上記のものも含めて、すべての目的で、その全体が参照により本明細書に組み込まれている。
【0015】
本発明の特定の実施形態の目的は、血小板減少症の治療用のTPO受容体作動薬の医薬組成物を提供することである。
【0016】
本発明の特定の実施形態の目的は、TPO受容体作動薬を使用する血小板減少症の治療方法を提供することである。
【課題を解決するための手段】
【0017】
上記および他の目的に鑑み、特定の実施形態において、本発明は、rhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物;およびrhTPO結合部位とは異なる結合部位においてヒトTPO受容体を作動する治療有効量の第2の薬物を含む医薬剤形に関する。
【0018】
特定の実施形態において、本発明は、治療を必要とする患者に、rhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物およびrhTPO結合部位とは異なる結合部位においてヒトTPO受容体を作動する治療有効量の第2の薬物を共投与することを含む、血小板減少症の治療方法に関する。
【0019】
特定の実施形態において、本発明は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の有効量を投与して、血小板を少なくとも約150%、少なくとも約200%、少なくとも約270%、少なくとも約300%、少なくとも約1,000%または少なくとも約5,000%増加させることを含む、血小板減少症の治療方法に関する。
【0020】
特定の実施形態において、本発明は、患者に治療有効量のヒトTPO受容体作動薬を投与して、作動薬の投与が血小板を約300%まで、約500%まで、約1,000%まで、約5,000%までまたは約10,000%まで増加させることを含む、血小板減少症の治療方法に関する。
【0021】
特定の実施形態において、本発明は、既に血小板減少症の治療を受けている患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量を投与することを含む、血小板減少症の治療方法に関する。
【0022】
特定の実施形態において、本発明は、治療を必要とする患者に、少なくとも0.01 mg/kg/日の用量の、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物を投与すること;投与後に患者の血小板数を測定すること;および、場合により化合物の用量を調整することを含む、血小板減少症の治療方法に関する。
【0023】
特定の実施形態において、本発明は、治療を必要とする患者に、rhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物、およびrhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第2の薬物を共投与する(ここで、第2の薬物は第1の薬物と置き換わらない)ことを含む、血小板減少症の治療方法に関する。
【0024】
特定の実施形態において、本発明は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量および輸血製剤を投与して、作動薬の投与が血液製剤単独の投与と比較して血小板を増加させることによる、輸血を必要とする患者における血小板減少症の治療方法に関する。
【0025】
特定の実施形態において、本発明は、治療を必要とする患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量を投与することによる、血小板減少症の治療方法、ならびに輸血に伴うウイルス感染および抗体の発生率を減少させる方法に関する。
【0026】
特定の実施形態において、本発明は、治療を必要とするヒトまたは動物に、少なくとも 0.01 mg/kg/日の用量の、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物を投与すること、産生される血小板の増加を監視すること;および用量の調整が必要であるか確認するために化合物の用量を調整することによる、血小板減少症の治療方法に関する。
【0027】
特定の実施形態において、本発明は、治療を必要とする患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量を投与することによる、患者の血小板を増加させる方法に関する。
【0028】
特定の実施形態において、本発明は、rhTPO結合部位とは異なる結合部位におけるヒトTPO受容体の作動を必要とする患者を診断すること、および該患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量を投与することよる、血小板減少症の治療方法に関する。
【0029】
特定の実施形態において、本発明は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物をスクリーニングすること、および治療を必要とする患者に治療有効量の上記薬物を投与して血小板を増加させることによる、血小板減少症の治療方法に関する。
【0030】
本発明の実施形態において、TPO作動薬は、約0.01 mg/kg/日〜約10 mg/kg/日、約0.01 mg/kg/日〜約3 mg/kg/日、約0.5 mg/kg/日〜約3 mg/kg/日、約0.1 mg/kg/日〜約2 mg/kg/日または約1 mg/kg/日〜約3 mg/kg/日の量で投与される。好ましくは、この量で投与されるTPO作動薬は、本明細書に開示されている式Xの化合物である。
【0031】
本発明の特定の実施形態において、TPO作動薬は、約1 mg/日〜約50 mg/日、約5 mg/kg/日〜約30 mg/日、約10 mg/日〜約25 mg/日、または約15 mg/日〜約20 mg/日の量で投与される。
【0032】
好ましい実施形態において、TPO作動薬は経口投与される。
【0033】
特定の実施形態において、本発明は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位においてヒトTPO受容体を作動する化合物をスクリーニングすること;および供給網において上記化合物を販売することを含む、医薬ビジネスを行う方法に関する。
【0034】
特定の実施形態において、本発明は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物をスクリーニングすること;および医療従事者に上記化合物が血小板を増加させることを研修することを含む、医薬ビジネスを行う方法に関する。
【0035】
本明細書に開示される特定の実施形態において、TPO受容体作動薬は、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物である。
【0036】
本明細書に開示される特定の実施形態において、TPO受容体作動薬は、式(I)の2-アシルアミノチアゾール化合物:
【化3】

【0037】
[式中、
Ar1は、それぞれ置換されていてもよいアリール、単環芳香族ヘテロ環、または二環系縮合ヘテロ環であり(ただし、R1が、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいアリールまたはピリジルであり、かつR2が以下の一般式(II)で表される基である場合、Ar1は、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいフェニルまたはピリジルではない);
R1は、それぞれ置換されていてもよいアリールまたは単環芳香族ヘテロ環であり;
R2は、以下の一般式(II)、(III)または(IV)で表される基:
【化4】

【0038】
(式中、nは1〜3の整数であり;mは1〜3の整数であり、(nまたはmが2以上の整数である場合、CR20R21およびCR22R23は同一でも異なっていてもよい);XはO、S、またはN-R26もしくはC(-R27)-R28で表される基であり;E、G、J、Lは独立にNまたはC-R29で表される基であり(ただし、それらの少なくとも1つはC-R29である)、R20、R21、R22、R23、R26、R27、R28、R29は同一または異なって、-H;-OH;-O-低級アルキル;置換されていてもよい低級アルキル;置換されていてもよいシクロアルキル;置換されていてもよいアリール;置換されていてもよいアリールアルキル;置換されていてもよい芳香族ヘテロ環;置換されていてもよい芳香族ヘテロ環アルキル;置換されていてもよい非芳香族ヘテロ環;置換されていてもよい低級アルケニル;置換されていてもよい低級アルキリデン;-COOH;-COO-低級アルキル;-COO-低級アルケニル;-COO-低級アルキレン-アリール;-COO-低級アルキレン-芳香族ヘテロ環;ハロゲン、-OH、-O-低級アルキル、もしくは-O-アリールでそれぞれ置換されていてもよい低級アルキルおよびシクロアルキルからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいカルバモイルもしくはアミノ;-NHCO-低級アルキル;またはオキソであり;R24、R25は同一または異なって、-H、置換されていてもよい低級アルキル、置換されていてもよいシクロアルキル、または置換されていてもよい非芳香族ヘテロ環である。)
である。]
あるいはその医薬上許容される塩、塩基、多形体、代謝産物または誘導体である。
【0039】
本発明の特定の実施形態において、一般式(I)で表される化合物におけるAr1は、好ましくは、それぞれ置換されていてもよいフェニルまたは単環芳香族ヘテロ環である。他の特定の実施形態において、Ar1は、好ましくは、それぞれ置換されていてもよいフェニルまたはピリジルである。他の実施形態において、Ar1は、好ましくは、2および6位が無置換であり、3位が-H、-F、-Clまたは-Brで置換されており、5位が-F、-Clまたは-Brで置換されており、4位が置換されているフェニル、あるいは2および4位が無置換であり、5位が-F、-Clまたは-Brで置換されており、6位が置換されているピリジン-3-イルである。他の特定の実施形態において、Ar1は、好ましくは、4位が、-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イルおよび置換されていてもよいピペラジン-1-イルからなる基で置換されているフェニル、または6位が、-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イル、および置換されていてもよいピペラジン-1-イルからなる基で置換されているピリジン-3-イルである。
【0040】
「RY」は、-OH、-O-低級アルキル、1または2つの低級アルキルで置換されていてもよいアミノ、-CO2H、-CO2-低級アルキル、1または2つの低級アルキルで置換されていてもよいカルバモイル、シアノ、アリール、芳香族ヘテロ環、非芳香族ヘテロ環、およびハロゲン原子からなる群より選択される1つ以上の基で置換されていてもよい低級アルキルである。
【0041】
一般式(I)の化合物におけるR1は、好ましくは、それぞれ置換されていてもよいフェニルまたはチエニルである。他の特定の実施形態において、R1は、好ましくは、ハロゲン原子およびトリフルオロメチルからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいフェニルまたはチエニルである。他の特定の実施形態において、R1は、好ましくは、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい。)でそれぞれ置換されているフェニルまたはチエニルである。
【0042】
一般式(I)の化合物におけるR2は、好ましくは、一般式(II)で表される基である。他の実施形態において、R2は、好ましくは、一般式(II)で表される基であって、nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である基である。他の特定の実施形態において、R2は、好ましくは、4-(ピペリジン-1-イル)ピペリジン-1-イル、4-プロピルピペリジン-1-イル、4-シクロヘキシルピペラジン-1-イル、または4-プロピルピペラジン-1-イルである。
【0043】
他の特定の実施形態において、本発明は、上記式(I)の化合物であって、R1は、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい)でそれぞれ置換されていてもよいフェニルまたはチエニルであり;R2は、一般式(II)で表される基(式中、nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である。)であり;Ar1は、それぞれ置換されていてもよいフェニルまたはピリジルである化合物に関する。
【0044】
本明細書に開示されている特定の実施形態において、TPO受容体作動薬は、式(V)の2-アシルアミノチアゾール化合物:
【化5】

【0045】
[式中、Ar2は(1)に記載されているAr1で表される基であり(ただし、インドール-2-イルを除く);R3は(1)に記載されているR1で表される基であり;R4は(1)に記載されているR2で表される基である(ただし、一般式(IV)で表される基を除く)。]
あるいはその医薬上許容される塩、塩基、多形体、代謝産物または誘導体である。
【0046】
特定の実施形態において、一般式(V)の化合物におけるAr2は、好ましくは、それぞれ置換されていてもよいフェニルまたは単環芳香族ヘテロ環である。特定の実施形態において、Ar2は、好ましくは、それぞれ置換されていてもよいフェニルまたはピリジルである。さらに別の実施形態において、Ar2は、好ましくは、2および6位が無置換であり、3位が-H、-F、-Cl、または-Brで置換されており、5位が-F、-Cl、または-Brで置換されており、4位が置換されているフェニル、あるいは2および4位が無置換であり、5位が-F、-Cl、または-Brで置換されており、6位が置換されているピリジン-3-イルである。他の特定の実施形態において、Ar2は、好ましくは、4位が-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イルおよび置換されていてもよいピペラジン-1-イルからなる群より選択される置換基で置換されているフェニル、または6位が-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イルおよび置換されていてもよいピペラジン-1-イルからなる群より選択される置換基で置換されているピリジン-3-イルである。
【0047】
特定の実施形態において、一般式(V)の化合物におけるR3は、好ましくは、それぞれ置換されていてもよいフェニルまたはチエニルである。特定の実施形態において、R3は、好ましくは、ハロゲン原子およびトリフルオロメチルからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいフェニルまたはチエニルである。他の特定の実施形態において、R3は、好ましくは、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい)でそれぞれ置換されていてもよいフェニルまたはチエニルである。
【0048】
特定の実施形態において、一般式(V)の化合物におけるR4は、好ましくは、一般式(II)で表される基である。特定の実施形態において、R4は、より好ましくは、一般式(II)で表される基であって、nは2であり、mは2であり、XはN-R26またはC-(R27)-R28である基である。他の特定の実施形態において、R4は、より好ましくは、4-(ピペリジン-1-イル)ピペリジン-1-イル、4-プロピルピペリジン-1-イル、4-シクロヘキシルピペラジン-1-イル、または4-プロピルピペラジン-1-イルである。
【0049】
特定の実施形態において、本発明は、式(V)の化合物であって、Ar2はそれぞれ置換されていてもよいフェニルまたは単環芳香族ヘテロ環である化合物を使用する。
【0050】
別の実施形態において、本発明は、式(V)の化合物であって、R3はそれぞれ置換されていてもよいフェニルまたはチエニルであり;R4は一般式(II)で表される基であり;Ar2はそれぞれ置換されていてもよいフェニルまたはピリジルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である化合物を使用する。
【0051】
さらに別の実施形態において、本発明は、式(V)の化合物であって、R3は、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい。)でそれぞれ置換されているフェニルまたはチエニルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基であり;R4は一般式(II)で表される基であり;Ar2はそれぞれ置換されていてもよいフェニルまたはピリジルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である化合物を使用する。
【0052】
さらに別の実施形態において、本発明は、式(V)の化合物であって、R4は、4-(ピペリジン-1-イル)ピペリジン-1-イル、4-プロピルピペリジン-1-イル、4-シクロヘキシルピペラジン-1-イル、または4-プロピルピペラジン-1-イルであり;R3は、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい。)でそれぞれ置換されているフェニルまたはチエニルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基であり;R4は一般式(II)で表される基であり;Ar2はそれぞれ置換されていてもよいフェニルまたはピリジルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である化合物を使用する。
【0053】
さらに別の実施形態において、本発明は、式(V)の化合物であって、Ar2は、2および6位が無置換であり、3位が-H、-F、-Cl、または-Brで置換されており、5位が-F、-Cl、または-Brで置換されており、4位が置換されているフェニル;あるいは2および4位が無置換であり、5位が-F、-Cl、または-Brで置換されており、6位が置換されているピリジン-3-イルであり;R4は、4-(ピペリジン-1-イル)ピペリジン-1-イル、4-プロピルピペリジン-1-イル、4-シクロヘキシルピペラジン-1-イル、または4-プロピルピペラジン-1-イルであり;R3は、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい。)でそれぞれ置換されているフェニルまたはチエニルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基であり;R4は一般式(II)で表される基であり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である化合物を使用する。
【0054】
さらに別の実施形態において、本発明は、式(V)の化合物であって、Ar2は、4位が-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イルおよび置換されていてもよいピペラジン-1-イルからなる群より選択される基で置換されているフェニル;または6位が-O-RY、-NH-RY、置換されていてもよいピペリジン-1-イルおよび置換されていてもよいピペラジン-1-イル(RYは、-OH、-O-低級アルキル、1または2つの低級アルキルで置換されていてもよいアミノ、-CO2H、-CO-低級アルキル、1または2つの低級アルキルで置換されていてもよいカルバモイル、シアノ、アリール、芳香族ヘテロ環、非芳香族ヘテロ環、およびハロゲン原子からなる群より選択される1つ以上の基で置換されていてもよい低級アルキルである。)からなる群より選択される基で置換されているピリジン-3-イルであり;R4は、4-(ピペリジン-1-イル)ピペリジン-1-イル、4-プロピルピペリジン-1-イル、4-シクロヘキシルピペラジン-1-イル、または4-プロピルピペラジン-1-イルであり;R3は、1〜3つのハロゲン原子(2または3つのハロゲン原子で置換されている場合、該ハロゲン原子は同一でも異なっていてもよい。)でそれぞれ置換されているフェニルまたはチエニルであり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基であり;R4は一般式(II)で表される基であり;nは2であり、mは2であり、XはN-R26またはC(-R27)-R28で表される基である化合物を使用する。
【0055】
本明細書に記載されている本発明がより完全に理解されように、この開示のための定義を以下に提供する:
本発明の目的のために、「放出制御型」は、活性薬物(1または複数)の治療に有益な血中濃度(少なくとも最低有効レベルかつ毒性レベル未満)が、長期間(例えば約8〜約24時間)にわたって維持され、その結果、製剤が1日に3回、2回または1回の投与に適しているように、活性薬剤あるいはその医薬上許容される遊離塩基、塩、多形体、誘導体または組み合わせが制御した速度で製剤から放出されることを意味する。
【0056】
本発明の目的のために、用語「ヒト患者」は、投与中の薬剤に関連する病気に苦しむ個人であることを意味する。
【0057】
共投与は、本明細書中に開示されている第1の薬物と第2の薬物との両方を含む単一組成物の投与、または本明細書中に開示されている第1の薬物および第2の薬物の、少なくともそれぞれの投与間隔の一部が重複する別の組成物としての投与のいずれか一方を意味する。
【発明を実施するための最良の形態】
【0058】
特定の実施形態において、本発明で使用される化合物は、アシルアミノ基がその2位で置換されており、含窒素ヘテロ環の窒素原子がその5位に直接結合しているという点で構造的に特徴づけられる2-アシルアミノチアゾール誘導体である。このような化合物は国際公開第03/062233号および欧州特許出願公開第1466912(A1)号に開示されており、これらは参照により本明細書に組み込まれている。
【0059】
特定の実施形態において、本発明の化合物は、血小板の増加を提供する。「c-Mplリガンド」としても知られるこれらの化合物は、ヒトc-Mpl Ba/F3細胞を増殖させ、ヒトCD34+の巨核球への分化を促進することによって作用し、結果的に血小板を増加させる。これらの細胞の増殖は、ヒトトロンボポエチン受容体(以下「TPO受容体」という)に結合する化合物の能力の結果であろう。
【0060】
血小板は、生理的止血および病的血栓症において重要な働きをする無核血液細胞であり、生体内で巨核球から継続的に産生される。血小板は、他の血球と同様に多能性幹細胞に由来する。特に、多能性幹細胞は巨核球前駆細胞となり、それから巨核芽球、前巨核球、および巨核球が形成される。巨核球の成熟の過程において、未熟な巨核球は、細胞分裂を伴わずにDNA合成だけを行い、倍数体となる。その後、細胞質は成熟し始め、血小板分離膜が形成され、細胞質が断裂することにより血小板が放出される。
【0061】
本発明の化合物の血小板を増加させる能力の結果として、本明細書中に記載されている組成物および方法は、これらに限定されないが、AIDS、進行した肝疾患、骨髄異形成症候群のような既存の疾患により引き起こされる血小板減少症、または現在行われているもしくは以前に行われた薬物療法により引き起こされる血小板減少症の治療または予防に有用となる。血小板減少症は、特発性血小板減少性紫斑病または疾患内在性血小板減少症(disease inherent thrombocytopenia)によっても引き起こされ得る。
【0062】
血小板減少症は、血小板数が異常に低い疾患である。血小板減少症は、場合によっては、異常出血、薬物療法(例えば、化学療法)、および多くの内科的疾患にも関連する。兆候および症状としては、通常、凝固困難、鼻出血およびあざが挙げられる。
【0063】
現在の血小板減少症の治療には、これらに限定されないが、輸血、経口コルチコステロイド剤、免疫抑制剤、脾摘または基礎疾患の治療が含まれる。
【0064】
他の特定の実施形態において、本明細書に記載されている化合物は、血小板減少症および/または他の血液疾患の治療に有用である追加の活性薬物とともに投与されてもよい。特定の実施形態において、作動薬は、エリスロポエチン、幹細胞因子、インターロイキン(インターロイキン1-12)、顆粒球/マクロファージコロニー刺激因子(GM-CSF)、顆粒球コロニー刺激因子(G-CSF)、単球/マクロファージコロニー刺激因子(M-CSFもしくはCSF-1)、マクロファージコロニー刺激因子(M-CSF)、トロンボポエチン(TPO)またはそれらのいずれの組み合わせおよび混合物のような、別の造血成長因子とともに共投与される。
【0065】
他の特定の実施形態において、本明細書に記載されている化合物は、これらに限定されないが、rトロンボポエチン(CIT/Plivaで開発中)、AMG-531(ITP/AmgenでPhase II試験中)およびGSK-115(Glaxo-SmithklineでPhase II試験中)のような、他の実験用または治験用の造血因子とともに共投与されてもよい。
【0066】
本発明のさらに別の実施形態において、本明細書に記載されている化合物は、 多くの他の医薬品とともに共投与されてもよい。例えば、本明細書に記載されている化合物は、鎮痛薬、抗血友病因子、抗出血剤、抗腫瘍薬、抗潰瘍薬、制酸薬、コルチコステロイド、成長ホルモン、造血薬、免疫抑制剤、血小板活性化因子ならびにそれらのいずれの組み合わせおよび混合物とともに共投与されてもよい。
【0067】
特定の実施形態において、本発明において使用される化合物は、これらに限定されないが、以下のものを含む:
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-3-フルオロ-4-ヒドロキシベンズアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(2-ヒドロキシエトキシ)ベンズアミド、
N-[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペリジノ)チアゾール-2-イル]-2-メトキシイソニコチンアミド、
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]イソキノリン-6-カルボキサミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]-4-(2-ヒドロキシエトキシ)ベンズアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(3-ヒドロキシプロポキシ)ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-[(3-ヒドロキシプロピル)アミノ)]ニコチンアミド、
1-(3-クロロ-5-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-カルボン酸、
1-(3-クロロ-5-{[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-カルボン酸、
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(4-シアノピペリジノ)-3,5-ジフルオロベンズアミド、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボン酸、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-6-フルオロフェニル)ピペリジン-4-カルボン酸、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボキサミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(4-ヒドロキシメチルピペリジノ)ニコチンアミド、
1-(3-クロロ-5-{[5-(4-シクロヘキシルピペラジン-1-イル)-4-(4-フルオロフェニル-)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-カルボン酸、
1-(3-クロロ-5-{[5-(4-シクロヘキシルピペラジン-1-イル)-4-(3-トリフルオロメチル-フェニル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-カルボン酸、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-{4-[(2-メトキシエチル)カルバモイル]ピペリジノ}ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-{4-[(3-メトキシプロピル)カルバモイル]ピペリジノ}ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-[4-(モルホリノカルボニル)ピペリジノ]ニコチンアミド、および
その医薬上許容される塩。
【0068】
他の特定の実施形態において、本発明において使用される化合物は、これらに限定されないが、以下のものを含む:
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-2-メトキシイソニコチンアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(2-メトキシエトキシ)ベンズアミド、
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル-]キノリン-6-カルボキサミド、
3-クロロ-N-[4-(5-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)- チアゾール-2-イル]-4-(2-ヒドロキシエトキシ)ベンズアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-5-フルオロ-4-(2-ヒドロキシエトキシ)ベンズアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(3-ヒドロキシプロポキシ)ベンズアミド、
3,5-ジクロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(2-ヒドロキシエトキシ)ベンズアミド、
3-ブロモ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)- チアゾール-2-イル]-4-(2-ヒドロキシエトキシ)ベンズアミド、
N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-2-オキソ-2,3-ジヒドロベンゾオキサゾール-6-カルボキサミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-ヒドロキシベンズアミド、
(.+-.)-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(3-ヒドロキシピロリジン-1-イル)ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(4-ヒドロキシピペリジノ)ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル-]-6-[(2-ヒドロキシエチル)アミノ]ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]-6-(4-ヒドロキシピペリジノ)ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(3-オキソピペラジン-1-イル)ニコチンアミド、
6-(4-カルバモイルピペリジノ)-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(- 4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]ニコチンアミド、
(±)-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-[(2,3-ジヒドロキシプロピル)アミノ]ニコチンアミド、
(.+-.)-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-[(テトラヒドロ-3-フリル)メトキシ]ニコチンアミド、
6-(4-カルバモイルピペリジノ)-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(- 4-プロピルピペラジン-1-イル)チアゾール-2-イル]ニコチンアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(4-ヒドロキシピペリジノ)ベンズアミド、
1-(2-ブロモ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボン酸、
1-(2-ブロモ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボキサミド、
1-(4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル-2,6-ジフルオロフェニル)ピペリジン-4-カルボン酸、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(4-シアノピペリジノ)ベンズアミド、
1-(4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2,6-ジフルオロフェニル)ピペリジン-4-カルボキサミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]-4-(4-ヒドロキシピペリジノ)ベンズアミド、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボキサミド、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-プロピルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}フェニル)ピペリジン-4-カルボン酸、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-4-(4-シアノピペリジノ)-5-フルオロベンズアミド、
1-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-6-フルオロフェニル)ピペリジン-4-カルボキサミド、
1-(3-クロロ-5-{[4-(3-クロロフェニル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-カルボン酸、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-(5-オキソ-1,4-ジアゼパン-1-イル)ニコチンアミド、
[1-(3-クロロ-5-{[4-(4-クロロチオフェン2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペリジン-4-イル]酢酸、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-{4-[(ジメチルアミノ)カルボニル]ピペリジノ}ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-{4-[(メチルアミノ)カルボニル]ピペリジノ}ニコチンアミド、
[4-(3-クロロ-5-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-2-ピリジル)ピペラジン-1-イル]酢酸、
6-[4-(アセチルアミノ)ピペリジノ]-5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]ニコチンアミド、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-5-フルオロ-4-[4-(メトキシアセチル)ピペラジン-1-イル]ベンズアミド、
[4-(2-クロロ-4-{[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]カルバモイル}-6-フルオロフェニル)ピペラジン-1-イル]酢酸、
3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-5-フルオロ-4-(4-スルファモイルピペラジン-1-イル)ベンズアミド、
4-[4-(カルバモイルメチル)ピペラジン-1-イル]-3-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-5-フルオロベンズアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-[4-(プロピルカルバモイル)ピペリジノ]ニコチンアミド、
5-クロロ-N-[4-(4-クロロチオフェン-2-イル)-5-(4-シクロヘキシルピペラジン-1-イル)チアゾール-2-イル]-6-{4-[(2-エトキシエチル)カルバモイル]ピペリジノ}ニコチンアミド、および
その医薬上許容される塩。
【0069】
好ましくは、本発明において使用される化合物は、以下の構造式を有する式Xの化合物(またはその医薬上許容される塩)である:
【化6】

【0070】
本発明の特定の実施形態において、式(I)〜(V)および(X)の化合物は、血小板数を増加させることにより血小板減少症を治療または予防する薬物として使用することができる。
【0071】
本発明の化合物の一般式の定義において、用語「低級」は、別段の指示がない限り、1〜6個の炭素原子を有する直鎖状または分岐状の炭素鎖を意味する。
【0072】
したがって、「低級アルキル」は1〜6個の炭素原子を有するアルキルを意味し、その例としてはメチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec-ブチル、tert-ブチル、ペンチル、ネオペンチル、ヘキシル等が挙げられ、その中で、メチル、エチル、プロピル、およびイソプロピルのような1〜3個の炭素原子を有するものが好ましい。
【0073】
「低級アルケニル」は2〜6個の炭素原子を有するアルケニルを意味し、その例としてはエテニル、プロペニル、ブテニル、ペンテニル、ヘキセニル等が挙げられ、その中で、エテニル、1-プロペニル、2-プロペニル、および3-プロペニルのような2〜3個の炭素原子を有するものが好ましい。
【0074】
「低級アルキリデン」は1〜6個の炭素原子を有するアルキリデンを意味し、その例としてはメチリデン、エチリデン、プロピリデン、ブチリデン、ペンチリデン、ヘキシリデン等が挙げられ、その中で、メチリデン、エチリデン、1-プロピリデン、および2-プロピリデンのような1〜3個の炭素原子を有するものが好ましい。
【0075】
「低級アルキレン」は1〜6個の炭素原子有するアルキルの2価基を意味し、その中で、メチレン、エチレン、トリメチレン、メチルエチレン、テトラメチレン、ジメチルメチレン、およびジメチルエチレンのような1〜4個の炭素原子を有するものが好ましい。
【0076】
「シクロアルキル」は3〜8個の炭素原子を有する炭素環を意味し、部分的に不飽和を有してもよい。その例としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロオクチル、シクロブテニル、シクロヘキセニル、シクロオクタジエニル等が挙げられる。
【0077】
「アリール」は6〜14個の炭素原子を有する単環から三環系芳香環を意味し、その中で、フェニルおよびナフチルが好ましく、フェニルがより好ましい。
【0078】
「アリールアルキル」は「アリール」で置換されている「低級アルキル」を意味し、その例としては、ベンジル、1-フェネチル、2-フェネチル、ナフチルメチル、1-ナフチルエチル、2-ナフチルエチル等がある。
【0079】
「単環芳香族ヘテロ環」は、窒素、酸素、または硫黄原子を含んでいてもよい5〜6員芳香族ヘテロ環またはその部分的に水素化された環の1価基を意味し、その例としては、チエニル、フリル、ピロリル、チアゾリル、オキサゾリル、イミダゾリル、イソチアゾリル、イソキサゾリル、ピラゾリル、チアジアゾリル、オキサジアゾリル、トリアゾリル、テトラゾリル、ピリジル、ピラジニル、ピリミジニル、ピリダジニル等が挙げられる。
【0080】
「二環系縮合ヘテロ環」は、アリールまたは単環芳香族ヘテロ環と縮合した、窒素、酸素、または硫黄原子を含んでいてもよい芳香族ヘテロ環、あるいはその部分的に水素化された環の1価基を意味し、その例としては、インドリル、イソインドリル、インドリジニル、インダゾリル、キノリル、イソキノリル、キノリジニル、フタラジニル、ナフチリジニル、キノキサリニル、キナゾリニル、シノリニル、ベンズイミダゾリル、イミダゾピリジル、ベンゾフラニル、ベンゾオキサゾリル、1,2-ベンゾイソキサゾリル、ベンゾチエニル、ベンゾチアゾリル、オキサゾロピリジル、チアゾロピリジル、インドリニル、イソインドリニル、1,2-ジヒドロキノリニル、1,2,3,4-テトラヒドロキノリニル、3,4-ジヒドロ-2H-1,4-ベンゾオキサジニル、1,4-ジヒドロ-2H-3,1-ベンゾオキサジニル、クロマニル、イソクロマニル、ベンゾオキソラニル、ベンゾジオキソラニル、ベンゾジオキサニル等が挙げられる。
【0081】
「芳香族ヘテロ環」は、「単環芳香族ヘテロ環」および「二環系縮合ヘテロ環」を合わせたものを意味する。
【0082】
「芳香族ヘテロ環アルキル」は、「芳香族ヘテロ環」で置換されている「低級アルキル」を意味し、その例としては、チエニルメチル、フリルメチル、ピリジルメチル、チアゾリルメチル、オキサゾリルメチル、イミダゾリルメチル、チエニルエチル、フリルエチル、ピリジルエチル等が挙げられる。
【0083】
「非芳香族ヘテロ環」は、アリールまたは単環芳香族ヘテロ環と縮合していてもよい、窒素、酸素、および硫黄からなる群より選択される1つ以上の同一または異なるヘテロ原子を有する非芳香族ヘテロ環の1価基を意味し、その例としては、アゼチジニル、ピロリジニル、イミダゾリニル、イミダゾリジニル、ピラゾリジニル、ピラゾリニル、ピペリジニル、アゼピニル、ピペラジニル、ホモピペラジニル、モルホリニル、チオモルホリニル、インドリニル、イソインドリニル等が挙げられる。
【0084】
用語「ハロゲン」は、フッ素、塩素、臭素、およびヨウ素原子を含む。
【0085】
「リガンド」は、酵素、受容体、タンパク質等に結合する低分子量の物質を意味し、作動薬および拮抗薬、好ましくは作動薬を含む。
【0086】
用語「置換されていてもよい(optionally substituted)」または「置換されていてもよい(which may be substituted)」に使用することができる置換基としては、それぞれの基の置換基として共通に使用されるものを使用することができ、それぞれの基は、1つ以上の置換基を有していてもよい。
【0087】
R1の定義における「それぞれ置換されていてもよいアリールまたは単環芳香族ヘテロ環」、R20、R21、R22、R23、R26、R27、R28、およびR29の定義における「置換されていてもよいシクロアルキル」、「置換されていてもよいアリール」、「置換されていてもよいアリールアルキル」、「置換されていてもよい芳香族ヘテロ環」、「置換されていてもよい芳香族ヘテロ環アルキル」、および「置換されていてもよい非芳香族ヘテロ環」、ならびにR24およびR25の定義における「置換されていてもよいシクロアルキル」および「置換されていてもよい非芳香族ヘテロ環」に使用することができる置換基としては、以下の(a)〜(h)の基が挙げられる。式中、「RZ」は、-OH、-O-低級アルキル、1または2つの低級アルキルで置換されていてもよいアミノ、1または2つの低級アルキルで置換されていてもよいカルバモイル、アリール、芳香族ヘテロ環、およびハロゲンからなる群より選択される1つ以上の基で置換されていてもよい低級アルキルである。
【0088】
(a)ハロゲン;
(b)-OH、-O-RZ、-O-アリール、-OCO-RZ、オキソ(=O);
(c)-SH、-S-RZ、-S-アリール、-SO-RZ、-SO-アリール、SO2-RZ、-SO2-アリール、1または2つのRZで置換されていてもよいスルファモイル;
(d)1または2つのRZで置換されていてもよいアミノ、-NHCO-RZ、-NHCO-アリール、-NHCO2-RZ、-NHCONH2、-NHSO2-RZ、-NHSO2-アリール、-NHSO2NH2、ニトロ;
(e)-CHO、-CO-RZ、-CO2H、-CO2-RZ、1または2つのRZで置換されていてもよいカルバモイル、シアノ;
(f)-OH、-O-低級アルキル、1または2つの低級アルキルで置換されていてもよいアミノ、ハロゲンおよびRZからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいアリールまたはシクロアルキル;
(g)-OH、-O-低級アルキル、1または2つの低級アルキルで置換されていてもよいアミノ、ハロゲンおよびRZからなる群より選択される1つ以上の基でそれぞれ置換されていてもよい芳香族ヘテロ環または非芳香族ヘテロ環;
(h)(a)〜(g)に記載されている置換基から選択される1つ以上の基で置換されていてもよい低級アルキル。
【0089】
R20、R21、R22、R23、R26、R27、R28、およびR29の定義における「置換されていてもよい低級アルキル」、「置換されていてもよい低級アルケニル」、および「置換されていてもよい低級アルキリデン」、ならびにR24およびR25の定義における「置換されていてもよい低級アルキル」に使用することができる置換基としては、(a)〜(g)に記載されている基が挙げられる。
【0090】
Ar1の定義における「それぞれ置換されていてもよいアリール、単環芳香族ヘテロ環、または二環系縮合ヘテロ環」に使用することができる置換基としては、オキソ(ただし、オキソは二環系縮合ヘテロ環のみに使用することができる);および一般式(VI)で表される基が挙げられる。
【化7】

【0091】
[式中、
Aは、単結合、または置換されていてもよい環状アミンジイル(ただし、環状アミンジイルはその環状アミンの窒素原子でAr1と結合している。)であり;
Bは、単結合、-O-、-NH-、-N(-RZ)-、-NHCO-、-CO-、-CONH-、または-CON(-RZ)であり;
Cは、単結合;または、ハロゲンおよび-OHからなる群より選択される1つ以上の基でそれぞれ置換されていてもよい低級アルキレンもしくは低級アルケニレンであり;
Dは、単結合、-NHCO-、-NHSO2-、-CO-、または-SO2-であり;
Eは、H;ハロゲン;-OH;-O-RZ;-O-CO-RZ;1もしくは2つのRZで置換されていてもよいアミノ;-RZ;シアノ;それぞれ置換されていてもよいアリール、シクロアルキル、芳香族ヘテロ環または非芳香族ヘテロ環であり、ただし、-CH2-非芳香族ヘテロ環、および-CH=CH-非芳香族ヘテロ環(ただし、非芳香族ヘテロ環の炭素原子はメチンで置換されている。)は一般式(VI)で表される基から除かれる;そしてAr1が、それぞれ置換されていてもよいアリールまたは単環芳香族ヘテロ環である場合、以下の基を除く:
-A-および-B-が単結合を形成し、-C-が単結合、またはハロゲンおよび-OHからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいエチレンもしくはビニレンであり、-D-が-CO-である基、
-A-および-B-が単結合を形成し、-C-が単結合、またはハロゲンおよび-OHからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいエチレンもしくはビニレンであり、-D-が-SO2-であり、-E-が1または2つのRZで置換されていてもよいアミノである基、
-A-および-B-が単結合を形成し、-C-が単結合、またはハロゲンおよび-OHからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいエチレンもしくはビニレンであり、-D-が単結合であり、-E-が、それぞれ置換されていてもよいアリール、部分的に水素化されていない単環芳香族ヘテロ環、または部分的に水素化されていない単環芳香族ヘテロ環と縮合している環の1価基である基、
-A-が単結合であり、-B-が-CO-である基、
-A-、-B-、-C-および-D-が単結合を形成し、-E-がアリール、部分的に水素化されていない単環芳香族ヘテロ環、または部分的に水素化されていない単環芳香族ヘテロ環と縮合している環の1価基である基]。
【0092】
-A-の定義における「環状アミンジイル(ただし、環状アミンジイルはその環状アミンの窒素原子でAr1と結合している。)」は、例えば縮合環およびスピロ環などの、3〜8員(縮合環またはスピロ環の場合には5〜15員)芳香族または非芳香族環状アミンの2価基を意味し、これは少なくとも1つの窒素原子を有し、さらに窒素、酸素、および硫黄からなる群より選択される1つ以上の同一または異なるヘテロ原子を有していてもよく、Ar1は少なくとも1つの窒素原子で直接置換されている。その例としては、アゼピン、ピロリジン、ピペリジン、ピペラジン、N-メチルピペラジン、アゼパン、ジアゼパン、N-メチルジアゼパン、モルホリン、チオモルホリン、イソインドリン、1,4-ジオキサ-8-アザスピロ[4,5]デカン、1-オキサ-8-アザスピロ-[4,5]デカン、1-オキサ-8-アザスピロ[4,5]ウンデカン等の2価基が挙げられる。
【0093】
-A-の定義における「置換されていてもよい環状アミンジイル」および-E-の定義における「それぞれ置換されていてもよいアリール、シクロアルキル、芳香族ヘテロ環、または非芳香族ヘテロ環」に使用される置換基としては、(a)〜(h)に記載されている基、および (a)〜(h)の基で置換されていてもよい低級アルキリデンが挙げられる。
【0094】
一般式(I)または(V)で表される本発明のヒトTPO受容体作動薬は、置換基の種類によって不斉炭素原子を含んでいてもよい。特定の実施形態において、不斉炭素原子に基づいて光学異性体が存在することもある。本発明のヒトTPO受容体作動薬は、これらの光学異性体の混合物または分離したものを含んでいてもよい。特定の実施形態において、本発明のヒトTPO受容体作動薬の互変異性体(該互変異性体としては、2-ヒドロキシピリジンおよび2-ピリドンが挙げられる)が存在してもよい。さらに別の実施形態において、本発明のヒトTPO受容体作動薬は、異性体を混合物としてまたは分離された異性体として含むことができる。特定の実施形態において、ヒトTPO受容体作動薬は標識化合物である、すなわち、1つ以上の原子が放射性同位体または非放射性同位体で標識されている化合物も本発明に含まれる。
【0095】
本発明において使用されるヒトTPO受容体作動薬は、遊離塩基、医薬上許容される塩、多形体、代謝産物、誘導体または上記のいずれかの組み合わせの形態であってもよい。
【0096】
医薬上許容される塩としては、これらに限定されないが、鉱酸、例えば塩酸、臭化水素酸、ヨウ化水素酸、硫酸、硝酸、リン酸等;有機酸、例えばギ酸、酢酸、プロピオン酸、シュウ酸、マロン酸、コハク酸、フマル酸、マレイン酸、乳酸、リンゴ酸、酒石酸、クエン酸、メタンスルホン酸、エタンスルホン酸、p-トルエンスルホン酸、アスパラギン酸、グルタミン酸等;ナトリウム、カリウム、マグネシウム、カルシウム等のような無機塩基との塩;メチルアミン、エチルアミン、エタノールアミン、リジン、オルニチン等のような有機塩基との塩;およびアンモニウム塩等が挙げられる。
【0097】
他の特定の実施形態において、ヒトTPO受容体作動薬は、水和物または溶媒和物の形態であってもよい。別の実施形態において、ヒトTPO受容体作動薬は、代謝されて1つ以上の一般式(I)または(V)のヒトTPO受容体作動薬となるプロドラッグを含んでいてもよい。
【0098】
本発明において使用される薬物(1または複数)は、医薬上許容される成分と一緒に経口剤形中に含まれてもよい。
【0099】
医薬上許容される成分としては、これらに限定されないが、酸性化剤、抗菌剤、アルカリ化剤、抗酸化剤、防腐剤、静菌剤、結合剤、緩衝剤、コーティング剤、乾燥剤、希釈剤、分散剤、皮膚軟化剤、乳化剤、充填剤、膜形成剤(film-formers)、香料添加剤、ゲル化剤、造粒剤、滑沢剤、可塑剤、防腐剤、可溶化剤、硬化剤、懸濁化剤、甘味剤、増粘剤(viscosity increasing agents)、湿潤剤等が挙げられる。
【0100】
特定の好ましい実施形態において、薬物(1または複数)は、短時間作用型経口剤形中に含まれている。他の好ましい実施形態において、薬物(1または複数)は放出制御型剤形中に含まれてもよい。本発明の剤形は、これらに限定されないが、錠剤および軟または硬ゼラチンカプセル剤であってもよい。
【0101】
特定の実施形態において、薬物(1または複数)は、錠剤に圧縮することができる、あるいは軟または硬ゼラチンカプセル剤に充填することができる多粒子中に含まれてもよい。多粒子は、球状、ビーズ、ペレット、棒状、微小粒子、例えば、ミクロスフェア等である。
【0102】
特定の実施形態において、経口剤形は、放出制御型剤形であってもよく、薬物(1または複数)は放出制御型マトリクス中に含まれる。他の実施形態において、薬物(1または複数)は、放出制御型多粒子中に含まれてもよい。さらに別の実施形態において、薬物(1または複数)は、放出制御コーティングを有する短時間作用型剤形中に含まれてもよい。
【0103】
本発明の多粒子は、錠剤に圧縮されて、または軟もしくは硬ゼラチンカプセル剤に充填されて、経口固体剤形を提供してもよい。特定の実施形態において、本発明の錠剤およびカプセル剤は、短時間作用コーティング、放出制御コーティングまたは腸溶コーティングで被覆されてもよい。
【0104】
別の実施形態において、薬物(1または複数)は、ビーズ上に被覆されて、短時間作用型ビーズを提供してもよい。特定の実施形態において、ビーズは、短時間作用コーティングで被覆されてもよい。他の実施形態において、ビーズは、放出制御コーティングで被覆されてもよい。
【0105】
他の特定の実施形態において、薬物(1または複数)は、経口液剤、乳剤、懸濁剤等中に含まれてもよい。
【0106】
経口剤形が好ましいが、薬物(1または複数)は、注射として非経口で、または溶剤、懸濁剤、乳剤等として経鼻胃で投与することも意図している。
【0107】
併用療法を考える場合、薬物は同一のまたは異なる剤形で、および同一のまたは異なる投与経路により投与することができる。
【0108】
好適な実施形態の詳細な説明
以下の実施例は、本発明の種々の態様を例示する。これらは、いかなる方法でも特許請求の範囲を限定するものとはみなされない。
【実施例1】
【0109】
トロンボポエチン(TPO)は、血小板産生の主要な生理的調節因子である332アミノ酸のサイトカインである。ヒト受容体(c-Mpl)を発現しているBa/F3細胞(c-Mpl-Ba/F3細胞)の増殖に基づくハイスループット増殖アッセイを用いてライブラリーのスクリーニングを行い、一連の新規c-Mpl作動薬が同定された。その構造を変更することにより式Xが発見され、式Xは、c-Mpl依存的な増殖(EC50=3.3 nM、Ba/F3細胞増殖に影響なし)またヒト臍帯血CD34+細胞の巨核球コロニー形成の誘発(EC50=25 nM)のような、いくつかの細胞に基づいたアッセイにおいてTPOと同等の有効性を示した。
【0110】
G-CSF動員ヒト末梢血CD34+細胞をrhTPOまたは式Xとともに12日間インキュベートして、倍数性の程度を試験した場合、式Xで処理した細胞の倍数性レベルはrhTPOで処理した細胞と変わらないことがわかった。重要なことに、式X処理は、rhTPO処理の場合と同様に、ヒトc-Mplを発現しているBa/F3細胞において、STAT3、STAT5、およびERK活性化のようなシグナル伝達応答を誘発した。この点において、シグナル伝達経路の活性化がヒトおよびチンパンジーの血小板中だけで起こることから、式XはTPO受容体作動薬活性に対する顕著な種特異性を示した。
【0111】
他の種の血小板、例えば、ヒヒ、アカゲザル、カニクイザル、リスザル、コモンマーモセット、ビーグル犬、モルモット、ブタ、ウサギ、ハムスター、ラット、またはマウスの血小板は、抗ホスホ-STAT5イムノブロットアッセイにより判断した場合に、式X処理に対してシグナル伝達応答を示さなかったが、これらの全ての種の血小板はrhTPO処理に対してシグナル伝達応答を示した。
【0112】
ヒト血小板を用いて、ヒトc-Mplに結合するTPOに対する式Xの効果も試験したところ、式Xは100 μMまでの濃度においてヒトc-MplへのrhTPOの結合に影響を及ぼさないことがわかった。したがって、これらの知見はヒトc-Mplに対する式Xの作用部位がrhTPOのものとは異なることを示す。したがって、本発明者らのデータは、式Xが、ヒト血小板に特異的に作用する新規TPO受容体作動薬であること、および人間の血小板減少症治療用の有用な薬剤となる可能性があることを示唆する。
【実施例2】
【0113】
ヒトCD34+細胞の巨核球への分化に対するTPOと組み合わせた式Xの効果
本研究において、TPOと組み合わせた式Xの巨核球形成に対する効果を試験した。
【0114】
G-SCF動員ヒト末梢血CD34+細胞を、無血清液体培養系において、式XとTPOの組み合わせ、式X、またはrhTPOとともに培養した。CD34+CD41−細胞(造血前駆細胞)、CD34+CD41+細胞(巨核球前駆細胞)、およびCD34−CD41+細胞(巨核球)の数を、フローサイトメトリーを用いて測定した。
【0115】
14日目に、式XまたはTPO単独は、用量依存的に巨核球の数を増加させ、式Xの最高活性はTPOと同様であった(図1)。さらに、式Xは、3 nM TPOの存在下、用量依存的に巨核球の数を増加させ、巨核球分化に対し最大の効果を示した(図1)。
【0116】
TPOと組み合わせた式Xの使用は、巨核球形成に対して相加的作用を有すると想定された。式XとTPOの組み合わせにより、式XまたはTPO単独と比較して造血前駆細胞(図2)および巨核球前駆細胞(図3)の数はかなり増加する。これらの結果は、式Xが、TPOと組み合わせると、巨核球だけでなく、造血前駆細胞および巨核球前駆細胞も増加させることを示した。
【0117】
次に、それぞれの種類の細胞数の経時変化を、3 μM式X、3nM TPO、または3 μM式X+3nM TPO(図4、5および6)の存在下で評価した。式XまたはTPO単独と比較して、式XとTPOの組み合わせは、6日目以降の造血前駆細胞の数(図4)、10日目および14日目の巨核球前駆細胞の数(図5)、そして6日目以降の巨核球の数(図6)を増加させた。これらの結果は、式XおよびTPOの相加的作用が、培養初期段階の造血前駆細胞の数をかなり増加させることを示唆した。
【0118】
本研究の目的で、図1に示した巨核球(CD34−CD41+細胞)の数をフローサイトメトリーを用いて計数した。データは、5つの独立した実験の平均値±SEを表す。*:p<0.05、***p<0.001(ダネット検定を用いて3 nM TPOと比較)。
【0119】
それぞれ図2および図3に示した造血前駆細胞(CD34−CD41+細胞:a)および巨核球前駆細胞(CD34+CD41+細胞:b)の数を、フローサイトメトリーを用いて計数し、次にダネット検定を用いて3 nM TPOと比較した。
【0120】
図4、5、および6に示した造血前駆細胞(CD34−CD41+細胞:a)、巨核球前駆細胞(CD34+CD41+細胞:b)、および巨核球(CD34−CD41+細胞:c)の数を、図に示した日にフローサイトメトリーを用いて計数した。データは5つの独立した実験の平均値±SEを表す。*:p<0.05、**p<0.01、***p<0.001(ダネット検定を用いて3 nM TPOと比較)。
【実施例3】
【0121】
非肥満性糖尿病/重症複合免疫不全症(NOD/SCID)マウスは、このモデルがヒト血小板の産生を生じるために、ヒト造血幹細胞の有効な移植モデルとして特徴づけられている。このように、ヒト造血幹細胞を移植したヒト血小板産生NOD/SCIDマウスにおける式Xのin vivo血小板増多効果を試験した。
【0122】
本研究において、本発明者らは、ヒト造血幹細胞の供給源として、市販の凍結保存されたヒト胎児肝臓CD34+細胞を使用した。細胞を亜致死的に照射した(240 cGy)NOD/SCIDマウスに移植した。移植後4週のこれらのマウスの末梢血中にヒト血小板が現れ始めた。ヒト血小板の産生は移植後6ヶ月まで続いた。種々の用量の式X(0、0.3、および3 mg/kg/日)を、ヒト血小板を安定に産生することが確認されたNOD/SCIDマウスに14日間経口投与した。
【0123】
式Xの経口投与により、マウスにより産生されたヒト血小板の数は、用量依存的に、1 mg/kg/日以上で有意に増加した。ヒト血小板数の増加は、14日目で、1 mg/kg/日において約2.7倍および3 mg/kg/日において約3.0倍に達した。式X投与を中止すると、ヒト血小板数が処理前のレベルに戻った。マウス血小板の数は、試験期間中変化しなかった。
【0124】
次に、これらのマウスの末梢血液中で産生されたヒト血小板の機能を評価するために、トロンビン受容体作動薬ペプチド(TRAP)で刺激したヒト血小板上の活性化依存性マーカーCD62P(P-セレクチン)の発現を試験した。ヒト血小板上のCD62P発現は移植マウスからの血液をTRAPで刺激することにより誘発され、このことは、NOD/SCIDマウス中で産生されるヒト血小板が機能的であったことを示唆する。さらに、式Xの投与前および後に、TRAPにより誘発されたヒト血小板上のCD62P発現の最大応答を評価したところ、ビヒクル群で得られた結果と同様であった。これらの結果は、式Xが、血小板減少症を有する患者の治療に有用な経口活性TPO受容体作動薬であることを示唆する。
【0125】
先の本明細書においては、本発明は、特定の典型的な実施形態およびその実施例に関して記載されている。しかしながら、添付の特許請求の範囲に記載される本発明のより広い精神および範囲から逸脱することなく、それに種々の改良および改変がされてもよいことは明らかであろう。したがって、本明細書および図面は、限定的な意味ではなく例示的にみなされるべきである。
【図面の簡単な説明】
【0126】
【図1】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後に産生された巨核球の数を示す図である。
【図2】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後に産生された造血前駆細胞(図2)および巨核球前駆細胞(図3)の数を示す図である。
【図3】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後に産生された造血前駆細胞(図2)および巨核球前駆細胞(図3)の数を示す図である。
【図4】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後の、造血前駆細胞(図4)、巨核球前駆細胞(図5)および巨核球(図6)の経時変化を示す図である。
【図5】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後の、造血前駆細胞(図4)、巨核球前駆細胞(図5)および巨核球(図6)の経時変化を示す図である。
【図6】G-CSF動員ヒト末梢血CD34+細胞を、(i)式X、(ii)TPO、または(iii)TPO+式Xの存在下、無血清液体培地中で14日間培養した後の、造血前駆細胞(図4)、巨核球前駆細胞(図5)および巨核球(図6)の経時変化を示す図である。
【特許請求の範囲】
【請求項1】
ヒトTPO受容体のrhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物、およびrhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第2の薬物を含む医薬剤形。
【請求項2】
第1および第2の薬物がヒトTPO受容体を相加的に作動する、請求項1に記載の医薬剤形。
【請求項3】
第2の薬物がヒトTPO受容体のrhTPO結合部位から第1の薬物と置き換わらない、請求項1に記載の医薬剤形。
【請求項4】
第2の薬物が、式(I)の化合物:
【化1】

[式中、
Ar1は、それぞれ置換されていてもよいアリール、単環芳香族ヘテロ環、または二環系縮合ヘテロ環であり(ただし、R1が、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいアリールまたはピリジルであり、かつR2が以下の一般式(II)で表される基である場合、Ar1は、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいフェニルまたはピリジルではない);
R1は、それぞれ置換されていてもよいアリールまたは単環芳香族ヘテロ環であり;
R2は、以下の一般式(II)、(III)または(IV)で表される基:
【化2】

(式中、nは1〜3の整数であり;mは1〜3の整数であり、(nまたはmが2以上の整数である場合、CR20R21およびCR22R23は同一でも異なっていてもよい);XはO、S、またはN-R26もしくはC(-R27)-R28で表される基であり;E、G、J、Lは独立にNまたはC-R29で表される基であり(ただし、それらの少なくとも1つはC-R29である)、R20、R21、R22、R23、R26、R27、R28、R29は同一または異なって、-H;-OH;-O-低級アルキル;置換されていてもよい低級アルキル;置換されていてもよいシクロアルキル;置換されていてもよいアリール;置換されていてもよいアリールアルキル;置換されていてもよい芳香族ヘテロ環;置換されていてもよい芳香族ヘテロ環アルキル;置換されていてもよい非芳香族ヘテロ環;置換されていてもよい低級アルケニル;置換されていてもよい低級アルキリデン;-COOH;-COO-低級アルキル;-COO-低級アルケニル;-COO-低級アルキレン-アリール;-COO-低級アルキレン-芳香族ヘテロ環;ハロゲン、-OH、-O-低級アルキル、もしくは-O-アリールでそれぞれ置換されていてもよい低級アルキルおよびシクロアルキルからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいカルバモイルもしくはアミノ;-NHCO-低級アルキル;またはオキソであり;R24、R25は同一または異なって、-H、置換されていてもよい低級アルキル、置換されていてもよいシクロアルキル、または置換されていてもよい非芳香族ヘテロ環である。)
である。]
あるいはその医薬上許容される塩、多形体、誘導体、遊離塩基または組み合わせである、請求項1に記載の医薬剤形。
【請求項5】
第2の薬物が、式Xの化合物:
【化3】

あるいはその医薬上許容される塩、多形体、誘導体、遊離塩基または組み合わせである、請求項4に記載の医薬剤形。
【請求項6】
第1の薬物がrhTPOである、請求項1に記載の医薬剤形。
【請求項7】
医薬上許容される賦形剤をさらに含む、請求項1に記載の医薬剤形。
【請求項8】
短時間作用型剤形である、請求項1に記載の医薬剤形。
【請求項9】
放出制御型剤形である、請求項1に記載の医薬剤形。
【請求項10】
錠剤またはカプセル剤である、請求項8または9に記載の医薬剤形。
【請求項11】
治療を必要とする患者に、ヒトTPO受容体のrhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物およびrhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第2の薬物を共投与することを含む、血小板減少症の治療方法。
【請求項12】
第1の薬物および第2の薬物を同時にまたは連続して投与する、請求項11に記載の方法。
【請求項13】
第1の薬物および第2の薬物が同一の製剤中に含まれる、請求項11に記載の方法。
【請求項14】
第1の薬物および第2の薬物が異なる製剤中に含まれる、請求項11に記載の方法。
【請求項15】
第1の薬物と第2の薬物との共投与がヒトTPO受容体を相加的に作動する、請求項11に記載の方法。
【請求項16】
第2の薬物が、式(I)の化合物:
【化4】

[式中、
Ar1は、それぞれ置換されていてもよいアリール、単環芳香族ヘテロ環、または二環系縮合ヘテロ環であり(ただし、R1が、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいアリールまたはピリジルであり、かつR2が以下の一般式(II)で表される基である場合、Ar1は、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいフェニルまたはピリジルではない);
R1は、それぞれ置換されていてもよいアリールまたは単環芳香族ヘテロ環であり;
R2は、以下の一般式(II)、(III)または(IV)で表される基:
【化5】

(式中、nは1〜3の整数であり;mは1〜3の整数であり、(nまたはmが2以上の整数である場合、CR20R21およびCR22R23は同一でも異なっていてもよい);XはO、S、またはN-R26もしくはC(-R27)-R28で表される基であり;E、G、J、Lは独立にNまたはC-R29で表される基であり(ただし、それらの少なくとも1つはC-R29である)、R20、R21、R22、R23、R26、R27、R28、R29は同一または異なって、-H;-OH;-O-低級アルキル;置換されていてもよい低級アルキル;置換されていてもよいシクロアルキル;置換されていてもよいアリール;置換されていてもよいアリールアルキル;置換されていてもよい芳香族ヘテロ環;置換されていてもよい芳香族ヘテロ環アルキル;置換されていてもよい非芳香族ヘテロ環;置換されていてもよい低級アルケニル;置換されていてもよい低級アルキリデン;-COOH;-COO-低級アルキル;-COO-低級アルケニル;-COO-低級アルキレン-アリール;-COO-低級アルキレン-芳香族ヘテロ環;ハロゲン、-OH、-O-低級アルキル、もしくは-O-アリールでそれぞれ置換されていてもよい低級アルキルおよびシクロアルキルからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいカルバモイルもしくはアミノ;-NHCO-低級アルキル;またはオキソであり;R24、R25は同一または異なって、-H、置換されていてもよい低級アルキル、置換されていてもよいシクロアルキル、または置換されていてもよい非芳香族ヘテロ環である。)
である。]
あるいはその医薬上許容される塩、多形体、誘導体、遊離塩基または組み合わせである、請求項11に記載の方法。
【請求項17】
第2の化合物が、式Xの化合物:
【化6】

あるいはその医薬上許容される塩、多形体、誘導体、遊離塩基または組み合わせである、請求項16に記載の方法。
【請求項18】
第2の薬物を、約0.01 mg/kg/日〜約10 mg/kg/日、約0.01 mg/kg/日〜約3 mg/kg/日、約0.5 mg/kg/日〜約3 mg/kg/日、約0.1 mg/kg/日〜約2 mg/kg/日または約1 mg/kg/日〜約3 mg/kg/日の用量で投与する、請求項11に記載の方法。
【請求項19】
第1の薬物がrhTPOである、請求項11に記載の方法。
【請求項20】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の有効量を投与して、血小板を少なくとも150%増加させることを含む、血小板減少症の治療方法。
【請求項21】
有効量の化合物を投与して血小板を少なくとも200%増加させることを含む、請求項20に記載の方法。
【請求項22】
有効量の化合物を投与して血小板を少なくとも270%増加させることを含む、請求項20に記載の方法。
【請求項23】
有効量の化合物を投与して血小板を少なくとも300%増加させることを含む、請求項20に記載の方法。
【請求項24】
ヒトTPO受容体を作動する化合物の有効量を投与して血小板を約300%まで、約500%まで、約1,000%まで、約5,000%までまたは約10,000%まで増加させることを含む、血小板減少症の治療方法。
【請求項25】
薬物を、約0.01 mg/kg/日〜約10 mg/kg/日、約0.01 mg/kg/日〜約3 mg/kg/日、約0.5 mg/kg/日〜約3 mg/kg/日、約0.1 mg/kg/日〜約2 mg/kg/日または約1 mg/kg/日〜約3 mg/kg/日の量で投与する、請求項20〜24のいずれかに記載の方法。
【請求項26】
血小板減少症が特発性血小板減少性紫斑病または疾患内在性血小板減少症(disease inherent thrombocytopenia)の結果である、請求項25に記載の方法。
【請求項27】
血小板減少症が薬物療法(例えば、化学療法)により誘発される、請求項25に記載の方法。
【請求項28】
血小板減少症が既存の病状の結果である、請求項25に記載の方法。
【請求項29】
既に血小板減少症の治療を受けている患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量を投与することを含む、血小板減少症の治療方法。
【請求項30】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量および輸血製剤を共投与し、作動薬の投与が輸血製剤単独の投与と比較して血小板を増加させることを含む、輸血を必要とするヒトまたは動物における血小板減少症の治療方法。
【請求項31】
治療を必要とする患者に、少なくとも0.01mg/kg/日の用量の式Xの化合物:
【化7】

を投与すること、
投与後に患者の血小板数を測定すること;および
場合により化合物の用量を調整すること
を含む、血小板減少症の治療方法。
【請求項32】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによるヒトTPO受容体の作動を必要とする患者を診断すること;および
該患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の有効量を投与すること
を含む、血小板減少症の治療方法。
【請求項33】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位においてヒトTPO受容体を作動する化合物をスクリーニングすること;および
治療を必要とする患者に、有効量の上記薬物を投与して血小板を増加させること
を含む、血小板減少症の治療方法。
【請求項34】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物をスクリーニングすること;および
供給網において上記化合物を販売すること
を含む、医薬ビジネスを行う方法。
【請求項35】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物をスクリーニングすること;および
医療従事者に上記化合物が血小板を増加させることを研修すること
を含む、医薬ビジネスを行う方法。
【請求項36】
治療を必要とする患者に、約1 mg/日〜約50 mg/日、約5 mg/kg/日〜約30 mg/日、約10 mg/日〜約25 mg/日、または約15 mg/日〜約20 mg/日の式Xの化合物:
【化8】

またはその医薬上許容される塩を投与することを含む、血小板減少症の治療方法。
【請求項37】
少なくとも1つの賦形剤、および
約1 mg/日〜約50 mg/日、約5 mg/kg/日〜約30 mg/日、約10 mg/日〜約25 mg/日、または約15 mg/日〜約20 mg/日の式Xの化合物:
【化9】

またはその医薬上許容される塩
を含む医薬組成物。
【請求項1】
ヒトTPO受容体のrhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物、およびrhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第2の薬物を含む医薬剤形。
【請求項2】
第1および第2の薬物がヒトTPO受容体を相加的に作動する、請求項1に記載の医薬剤形。
【請求項3】
第2の薬物がヒトTPO受容体のrhTPO結合部位から第1の薬物と置き換わらない、請求項1に記載の医薬剤形。
【請求項4】
第2の薬物が、式(I)の化合物:
【化1】

[式中、
Ar1は、それぞれ置換されていてもよいアリール、単環芳香族ヘテロ環、または二環系縮合ヘテロ環であり(ただし、R1が、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいアリールまたはピリジルであり、かつR2が以下の一般式(II)で表される基である場合、Ar1は、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいフェニルまたはピリジルではない);
R1は、それぞれ置換されていてもよいアリールまたは単環芳香族ヘテロ環であり;
R2は、以下の一般式(II)、(III)または(IV)で表される基:
【化2】

(式中、nは1〜3の整数であり;mは1〜3の整数であり、(nまたはmが2以上の整数である場合、CR20R21およびCR22R23は同一でも異なっていてもよい);XはO、S、またはN-R26もしくはC(-R27)-R28で表される基であり;E、G、J、Lは独立にNまたはC-R29で表される基であり(ただし、それらの少なくとも1つはC-R29である)、R20、R21、R22、R23、R26、R27、R28、R29は同一または異なって、-H;-OH;-O-低級アルキル;置換されていてもよい低級アルキル;置換されていてもよいシクロアルキル;置換されていてもよいアリール;置換されていてもよいアリールアルキル;置換されていてもよい芳香族ヘテロ環;置換されていてもよい芳香族ヘテロ環アルキル;置換されていてもよい非芳香族ヘテロ環;置換されていてもよい低級アルケニル;置換されていてもよい低級アルキリデン;-COOH;-COO-低級アルキル;-COO-低級アルケニル;-COO-低級アルキレン-アリール;-COO-低級アルキレン-芳香族ヘテロ環;ハロゲン、-OH、-O-低級アルキル、もしくは-O-アリールでそれぞれ置換されていてもよい低級アルキルおよびシクロアルキルからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいカルバモイルもしくはアミノ;-NHCO-低級アルキル;またはオキソであり;R24、R25は同一または異なって、-H、置換されていてもよい低級アルキル、置換されていてもよいシクロアルキル、または置換されていてもよい非芳香族ヘテロ環である。)
である。]
あるいはその医薬上許容される塩、多形体、誘導体、遊離塩基または組み合わせである、請求項1に記載の医薬剤形。
【請求項5】
第2の薬物が、式Xの化合物:
【化3】

あるいはその医薬上許容される塩、多形体、誘導体、遊離塩基または組み合わせである、請求項4に記載の医薬剤形。
【請求項6】
第1の薬物がrhTPOである、請求項1に記載の医薬剤形。
【請求項7】
医薬上許容される賦形剤をさらに含む、請求項1に記載の医薬剤形。
【請求項8】
短時間作用型剤形である、請求項1に記載の医薬剤形。
【請求項9】
放出制御型剤形である、請求項1に記載の医薬剤形。
【請求項10】
錠剤またはカプセル剤である、請求項8または9に記載の医薬剤形。
【請求項11】
治療を必要とする患者に、ヒトTPO受容体のrhTPO結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第1の薬物およびrhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する治療有効量の第2の薬物を共投与することを含む、血小板減少症の治療方法。
【請求項12】
第1の薬物および第2の薬物を同時にまたは連続して投与する、請求項11に記載の方法。
【請求項13】
第1の薬物および第2の薬物が同一の製剤中に含まれる、請求項11に記載の方法。
【請求項14】
第1の薬物および第2の薬物が異なる製剤中に含まれる、請求項11に記載の方法。
【請求項15】
第1の薬物と第2の薬物との共投与がヒトTPO受容体を相加的に作動する、請求項11に記載の方法。
【請求項16】
第2の薬物が、式(I)の化合物:
【化4】

[式中、
Ar1は、それぞれ置換されていてもよいアリール、単環芳香族ヘテロ環、または二環系縮合ヘテロ環であり(ただし、R1が、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいアリールまたはピリジルであり、かつR2が以下の一般式(II)で表される基である場合、Ar1は、低級アルキル、-CO-低級アルキル、-COO-低級アルキル、-OH、-O-低級アルキル、-OCO-低級アルキル、およびハロゲン原子からなる群より選択される1つ以上の基でそれぞれ置換されていてもよいフェニルまたはピリジルではない);
R1は、それぞれ置換されていてもよいアリールまたは単環芳香族ヘテロ環であり;
R2は、以下の一般式(II)、(III)または(IV)で表される基:
【化5】

(式中、nは1〜3の整数であり;mは1〜3の整数であり、(nまたはmが2以上の整数である場合、CR20R21およびCR22R23は同一でも異なっていてもよい);XはO、S、またはN-R26もしくはC(-R27)-R28で表される基であり;E、G、J、Lは独立にNまたはC-R29で表される基であり(ただし、それらの少なくとも1つはC-R29である)、R20、R21、R22、R23、R26、R27、R28、R29は同一または異なって、-H;-OH;-O-低級アルキル;置換されていてもよい低級アルキル;置換されていてもよいシクロアルキル;置換されていてもよいアリール;置換されていてもよいアリールアルキル;置換されていてもよい芳香族ヘテロ環;置換されていてもよい芳香族ヘテロ環アルキル;置換されていてもよい非芳香族ヘテロ環;置換されていてもよい低級アルケニル;置換されていてもよい低級アルキリデン;-COOH;-COO-低級アルキル;-COO-低級アルケニル;-COO-低級アルキレン-アリール;-COO-低級アルキレン-芳香族ヘテロ環;ハロゲン、-OH、-O-低級アルキル、もしくは-O-アリールでそれぞれ置換されていてもよい低級アルキルおよびシクロアルキルからなる群より選択される1つ以上の基でそれぞれ置換されていてもよいカルバモイルもしくはアミノ;-NHCO-低級アルキル;またはオキソであり;R24、R25は同一または異なって、-H、置換されていてもよい低級アルキル、置換されていてもよいシクロアルキル、または置換されていてもよい非芳香族ヘテロ環である。)
である。]
あるいはその医薬上許容される塩、多形体、誘導体、遊離塩基または組み合わせである、請求項11に記載の方法。
【請求項17】
第2の化合物が、式Xの化合物:
【化6】

あるいはその医薬上許容される塩、多形体、誘導体、遊離塩基または組み合わせである、請求項16に記載の方法。
【請求項18】
第2の薬物を、約0.01 mg/kg/日〜約10 mg/kg/日、約0.01 mg/kg/日〜約3 mg/kg/日、約0.5 mg/kg/日〜約3 mg/kg/日、約0.1 mg/kg/日〜約2 mg/kg/日または約1 mg/kg/日〜約3 mg/kg/日の用量で投与する、請求項11に記載の方法。
【請求項19】
第1の薬物がrhTPOである、請求項11に記載の方法。
【請求項20】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の有効量を投与して、血小板を少なくとも150%増加させることを含む、血小板減少症の治療方法。
【請求項21】
有効量の化合物を投与して血小板を少なくとも200%増加させることを含む、請求項20に記載の方法。
【請求項22】
有効量の化合物を投与して血小板を少なくとも270%増加させることを含む、請求項20に記載の方法。
【請求項23】
有効量の化合物を投与して血小板を少なくとも300%増加させることを含む、請求項20に記載の方法。
【請求項24】
ヒトTPO受容体を作動する化合物の有効量を投与して血小板を約300%まで、約500%まで、約1,000%まで、約5,000%までまたは約10,000%まで増加させることを含む、血小板減少症の治療方法。
【請求項25】
薬物を、約0.01 mg/kg/日〜約10 mg/kg/日、約0.01 mg/kg/日〜約3 mg/kg/日、約0.5 mg/kg/日〜約3 mg/kg/日、約0.1 mg/kg/日〜約2 mg/kg/日または約1 mg/kg/日〜約3 mg/kg/日の量で投与する、請求項20〜24のいずれかに記載の方法。
【請求項26】
血小板減少症が特発性血小板減少性紫斑病または疾患内在性血小板減少症(disease inherent thrombocytopenia)の結果である、請求項25に記載の方法。
【請求項27】
血小板減少症が薬物療法(例えば、化学療法)により誘発される、請求項25に記載の方法。
【請求項28】
血小板減少症が既存の病状の結果である、請求項25に記載の方法。
【請求項29】
既に血小板減少症の治療を受けている患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量を投与することを含む、血小板減少症の治療方法。
【請求項30】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の治療有効量および輸血製剤を共投与し、作動薬の投与が輸血製剤単独の投与と比較して血小板を増加させることを含む、輸血を必要とするヒトまたは動物における血小板減少症の治療方法。
【請求項31】
治療を必要とする患者に、少なくとも0.01mg/kg/日の用量の式Xの化合物:
【化7】

を投与すること、
投与後に患者の血小板数を測定すること;および
場合により化合物の用量を調整すること
を含む、血小板減少症の治療方法。
【請求項32】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによるヒトTPO受容体の作動を必要とする患者を診断すること;および
該患者に、rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物の有効量を投与すること
を含む、血小板減少症の治療方法。
【請求項33】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位においてヒトTPO受容体を作動する化合物をスクリーニングすること;および
治療を必要とする患者に、有効量の上記薬物を投与して血小板を増加させること
を含む、血小板減少症の治療方法。
【請求項34】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物をスクリーニングすること;および
供給網において上記化合物を販売すること
を含む、医薬ビジネスを行う方法。
【請求項35】
rhTPO結合部位とは異なるヒトTPO受容体の結合部位に結合することによりヒトTPO受容体を作動する化合物をスクリーニングすること;および
医療従事者に上記化合物が血小板を増加させることを研修すること
を含む、医薬ビジネスを行う方法。
【請求項36】
治療を必要とする患者に、約1 mg/日〜約50 mg/日、約5 mg/kg/日〜約30 mg/日、約10 mg/日〜約25 mg/日、または約15 mg/日〜約20 mg/日の式Xの化合物:
【化8】

またはその医薬上許容される塩を投与することを含む、血小板減少症の治療方法。
【請求項37】
少なくとも1つの賦形剤、および
約1 mg/日〜約50 mg/日、約5 mg/kg/日〜約30 mg/日、約10 mg/日〜約25 mg/日、または約15 mg/日〜約20 mg/日の式Xの化合物:
【化9】

またはその医薬上許容される塩
を含む医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2009−514941(P2009−514941A)
【公表日】平成21年4月9日(2009.4.9)
【国際特許分類】
【出願番号】特願2008−539527(P2008−539527)
【出願日】平成18年11月7日(2006.11.7)
【国際出願番号】PCT/IB2006/003142
【国際公開番号】WO2007/054783
【国際公開日】平成19年5月18日(2007.5.18)
【出願人】(000006677)アステラス製薬株式会社 (274)
【Fターム(参考)】
【公表日】平成21年4月9日(2009.4.9)
【国際特許分類】
【出願日】平成18年11月7日(2006.11.7)
【国際出願番号】PCT/IB2006/003142
【国際公開番号】WO2007/054783
【国際公開日】平成19年5月18日(2007.5.18)
【出願人】(000006677)アステラス製薬株式会社 (274)
【Fターム(参考)】
[ Back to top ]

