血液採取の際に成分を除去するための装置並びにその使用法
【課題】血液サンプル採取装置、この装置を使用する方法、及びエラーや汚染のリスクが無く、しかも目標とする成分を特別に分離するプロセスを提供する。
【解決手段】容器130と機械的密度分離器170と親和性分子とを具えた血液採取装置120であって、血液採取時において血液が最初に前記容器に入ることに伴って前記親和性分子が前記血液に曝される。
【解決手段】容器130と機械的密度分離器170と親和性分子とを具えた血液採取装置120であって、血液採取時において血液が最初に前記容器に入ることに伴って前記親和性分子が前記血液に曝される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血液採取時に特定の目標成分を血液サンプルから分離・除去する血液採取装置並びに方法、及びその装置を使用する方法に関する。
【背景技術】
【0002】
今日、プロティオミクス(proteomics) の進歩に伴い、蛋白質の大規模な分離と識別が研究、薬物開発及び診断の焦点となりつつある。蛋白質の分離方法は、分子的及び生化学的技術において確立されているが、プロティオミクスの進歩に伴って、別の、更に厳密な蛋白質分離技術を必要とする新しい技術が起こっている。例えば、プラズマプロテオム (plasma proteome)の探索は、大量の低蛋白質の分離・識別と、二次元(2D)ゲルシステムにおける電気泳動を用いたそれらの決定を必要とする。しかし、高濃度液中のプラズマ蛋白質やのその他の成分、例えばアルブミン等は分離を妨げ、これらの大量の低蛋白質の識別を不分明にし、時として2Dゲル上での、或いは血液サンプルのその他の下流側でのテストによるその識別を困難にし、又は不可能にする。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】米国特許第6479298号
【特許文献2】米国特許第4449539号
【非特許文献】
【0004】
【非特許文献1】Tijssen, P.,Practice and Theory of Enzyme ImmunoAssays, in Burdon, RH and Knippenberg, PH, (Eds.), Laboratory Techniques in Biochemistry and Molecular Biology, Elsevier Science Publisher, Vol. 15: 297-329 (1985)
【非特許文献2】Celis, JE, and Bravo R, (Eds.), Two-Dimensional gel Electrophoresis of Protein, Academic Press (1984)
【非特許文献3】Worral, TA, et al., Anal. Chem. 70: 750 (1998)
【非特許文献4】Tijssen, P., Practice and Theory of Enzyme ImmunoAssays, in Burdon, RH and Lnippenberg, PH, (Eds.), Laboratory Techniques in Biolochemistry and Molecular Biology, Elsevier Science Publishers, Vol. 15 (1985)
【発明の概要】
【発明が解決しようとする課題】
【0005】
最近、血液サンプルからアルブミン及びその他の大量の成分を除去する多くの異なる方法が存在している。しかし、これらの除去方法の大部分は充分なものではなく、必要な蛋白質や成分の多くを実際に除去してしまうことがある。例えば、最近のアルブミン除去方法は、サンプルを別の容器に移し替えることを要し、これによって付加的な取り扱いステップが必要となり、処理エラー、サンプル汚染、作業者が感染の可能性のある血液成分に触れる危険性が増加する。更に、最近の方法は、除去プロセスにおいて目標成分を狙う特に指向性を有する親和性のある種類の分子を使用せずに、対象とする成分を除去する。したがって、血液サンプル採取装置、この装置を使用する方法、及びエラーや汚染のリスクが無く、しかも目標とする成分を特別に分離するプロセスが必要となる。
【0006】
本発明は、容器と、親和性のよい分子とを具えた血液採取装置に関し、この親和性分子は血液採取の際に血液に曝される。
【0007】
本発明は、血液採取の際に血液を親和性分子に曝することを含む血液採取方法にも関する。
【課題を解決するための手段】
【0008】
本発明は、容器と機械的密度分離器と親和性分子とを具えた血液採取装置であって、血液採取時において血液が最初に前記容器に入ることに伴って前記親和性分子が前記血液に曝されることを特徴とする。
【図面の簡単な説明】
【0009】
【図1】本発明の一つを示す図である。
【図2】図1の装置の長手方向断面図である。
【図3】図1の装置の長手方向断面であって、装置内の流体の流れを示す。
【図4】分離器が解放された遠心分離作用の際の図1の装置を示す図である。
【図5】分離器が解放された遠心分離作用の際の図1の装置を示す図である。
【図6】遠心分離作用の後の図1の装置を示す図であり、液体サンプルが高低比重成分に分離された状態を示す。
【図7】本発明の別の装置を示す図である。
【図8】図7の装置の長手方向断面図である。
【図9】図7の装置の長手方向断面図であり、装置内への流体の流れを示す。
【図10】分離器が解放された遠心分離作用の際の図7の装置を示す図である。
【図11】分離器が解放された遠心分離作用の際の図7の装置を示す図である。
【図12】遠心分離作用の後の図7の装置を示す図であり、液体サンプルが高低比重成分に分離された状態を示す。
【図13】本発明の別の装置を示す図である。
【図14】本発明の別の装置を示す図であり、抗体で被覆されたビーズが注射器アセンブリ内に配置されている。
【図15】本発明の別の装置を示す図であり、抗体で被覆されたチューブがライン内の成分の除去のために使用されている。
【発明を実施するための形態】
【0010】
本発明は、容器と親和性分子とを具えた血液採取装置に関し、この親和性分子は血液採取の際に血液に曝される。
【0011】
本発明は、血液採取の際に血液を親和性分子に曝することを含む血液採取方法にも関する。親和性分子は血液中の目標分子と結合する。ここで用いられているように、「目標分子」又は「目標」は、血液の実際のサンプル中に存在していてもいなくてもよいが、存在している場合には親和性分子と結合する成分を意味する。この目標は、親和性分子の相手となる分子が引き続く処理や分析のための対象となることを「望まれている」。別の例では、目標は「望ましくない」ものであり、不純物と考えられ、或いは引き続く処理や分析ステップにおいて不要又は望ましくない。
【0012】
ここで使われている「血液」とは、動物の全血或いは全血の分離成分を意味している。血液の分離成分は、血漿と血清を含み、ここでこれらの定義は普通に当該技術で使われているものである。例えば、血漿は、血小板を含む細胞が実質的に皆無の全血の成分である。血清は、フィブリノーゲンその他の凝固因子が除去されたプラズマである。即ち、ここで使用されている「血液」は、全血、血漿、血清、血液の細胞部分、及び全血の蛋白質部分さえも含んでいる。更に、本発明の目的のために、例えば血液からの蛋白質その他の分子、例えばフィブリノーゲンの分離等のように血液の成分は分離され、或いは血漿や血清のような分子との混合を行うこともできる。ここで用いられている「成分」は、血液の細胞部分を含まず、一方、「細胞成分」は細胞部分を含んでいる。細胞成分は、体のすべての組織のT−細胞、B−細胞、健常又は病気の細胞を含むヘマトポエティック細胞、骨髄性基幹細胞、赤血球、好中球、好塩基球、好酸球、巨核球、血小板、単核細胞、肥満細胞、リンパ細胞を含んでいても、いなくてもよく、更にこれらに限定されない。
【0013】
更に、「採取」は、血液をその通常の環境から抽出することを意味し、血液はそれが抽出された個体に戻され、或いは輸血の際等に異なる個体に移されてもよいし、そうされなくてもよい。ここで「個体」、「主体」及び「患者」と云う用語は、相互に同じ意味に使用され、好ましくは哺乳類、更に好ましくは人間又は人間以外の霊長類である全ての動物を意味している。
【0014】
本発明の装置は容器を具えている。この容器は、環境に対して開閉可能であり、少なくとも一時的に或る量の血液を保持可能な装置である。勿論、容器は任意の量の血液を長期に保持することも可能である。容器は突き刺され、そして再びシールされることも可能である。本発明の容器の例は、空のチューブ、ペトリ皿、微小滴定プレート、注射器胴部、針、血液の処理又は分析する機械、献血の時に使用される血液採取袋、プラスチックのチューブ等の血液採取システムを含むが、これらに限定されるものではない。
【0015】
血液は容器内に静止している必要はなく、定置されたり、動いたり流れたりしてもよい。一実施形態においては容器は密度勾配障壁を具え、容器内に採取されたサンプルは遠心分離作用の際に高い密度と低い密度に分別される。任意のタイプの血液採取装置やシステムを容器として用いることができる。容器として作用することができる好適な装置は、例えば、Becton Dickinson and Company (BD)の血清凝固作用チューブ、血清ゲル凝固作用チューブ、リチウム・ヘパリンチューブ、フッ化ナトリウムチューブ、クエン酸ナトリウムチューブ、ESRクエン酸チューブ、微量金属(Trace Mettal)チューブであるが、これらに限定されるものではない。更に、Microvette(登録商標)システムを含む任意の製造業者によって製造された毛管式血液採取システムが容器として作動可能である。本発明で使用されることを意図した容器の幾つかの例が、特許文献1に開示されており、その全体が参考として本明細書に組み入れられている。
【0016】
一実施形態においては、容器は更にインサートを具えている。ここで「インサート」とは、固体の計量棒、機械式密度分別エレメント、或いは空のチューブ内のパドル等の、容器に完全に封入された材料を意味する。「インサート」と云う用語は、容器にその一部だけが入っている材料も称する。これらのインサートはパドル等の固体物体であってもよく、又は液体、ゲル又は気体であてもよい。インサートの他の例は、ビーズ、粒子又は微粒子を含むが、これらに限定されるものではない。ビーズの例は、磁場によって操作される磁気ビーズである。これらのインサートは、インサートの少なくとも一部が容器の内部に位置するならば任意の形状を持つことができる。インサートの形状の例は、矩形、円形、楕円形、直線のロッド及び螺旋形のロッドであるが、これらに限定されるものではない。
【0017】
別の実施形態においては、容器の内壁は平滑或いは突起を有していてもよい。突起を容器に設けると、容器の内側表面積を増加させるのに役立つ。別の実施形態においても、インサートが突起を有し、各々の表面積を増大させている。更に別の実施形態においては、インサートと容器の内壁が突起を有し、更に表面積を増加させている。本発明の実施形態のいずれかにおいて表面積を増加させる目的は、血液採取の際に血液に接触する、表面から移動しない親和性分子の量を増やすことにある。
【0018】
容器の他に、本発明の装置は、一つ以上の親和性分子を具えている。ここで用いられている「親和性分子」は、血液の一つ又は複数の成分に対して親和性を有する任意のタイプの分子である。この親和性は、親和性分子が、フィブリノーゲンに対して特効のある抗体等の成分の集中した部分集合に対して親和性を有する特定の親和性である。親和性分子のこの親和性は、蛋白質A等の一般的なクラスのイムノグロブリンと結合する蛋白質のように、より特性的ではない。更に、本発明で意図しているこの親和性分子は、より広い親和性を示し、親和性分子は異なるクラスの蛋白質の混合物に対して親和性を有することができるようになっている。
【0019】
親和性分子の例は、抗体、抗体の破片、酵素、酵素の破片、酵素基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、レセプターの破片、リガンド、酵素の破片、他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、プロテオグリカン、天然及び合成ポリマー、ナノボディーを含むが、これらに限定されるものではない。一実施形態においては、親和性分子は抗体又は抗体の破片、例えばFab 破片、F(ab')2 破片及びscFv破片であるが、これらに限定されるものではない。これらの抗体は合成又は天然で生じるポリクロナール、モノクロナール、キメラであってもよい。
【0020】
別の実施形態においては、本発明の親和性分子は、血液内の成分と結合する。好ましくは、前記親和性分子は、血液蛋白質と結合する。親和性分子が結合する蛋白質の例は、フィブリノーゲン、アルブミン、アルファ、ベータ、及びガンマグロブリンを含むイムノグロブリン、キモトリプシン及びトロンビン等のプロテアーゼ、抗キモトリプシン、抗トロンビン、マクログロブリン等のプロテアーゼ抑制因子、インター・アルファ・トリプシン抑制因子、Cl抑制因子、血漿抑制因子、ヘパリン補助因子II、アポプロテインA及びフィブロネクチンを含むが、これらに限定されるものではない。
【0021】
一実施形態においては、親和性分子或いは親和性分子のセットは、同時に一つ以上の望ましくない成分と結合可能であり、その結果、サンプルから一つ以上の望ましくない成分が除去される。別の実施形態においては、親和性分子或いは親和性分子のセットは、同時に望ましい成分と結合可能であり、その結果、一つ以上の望ましい成分が分離される。別の実施形態においては、一つ以上の親和性分子或いは親和性分子のセットが採用され、各親和性分子或いは親和性分子のセットは異なる望ましくない成分と結合し、その結果、サンプルから一つ以上の望ましくない成分が除去される。勿論、本発明は、一つだけの望ましくない成分とだけ結合可能な一つの親和性分子或いは親和性分子のセットを利用することも包含している。場合によっては、本発明は、元の試料から少数種類の望ましい成分を除去することによって、サンプルを濃いものにすることが可能な一つの親和性分子或いは親和性分子のセットを利用することも包含している。ここで、「親和性分子のセット」とは、特殊性と強度の両方において独特のタイプの親和性を有する複数の親和性分子を意味する。ここで、「親和性分子」とは、一つ以上の親和性分子及び一つ以上の親和性分子のセットを意味している。一実施形態においては、本発明は、一つの親和性分子或いは親和性分子のセットを具えた容器或いは単一の装置を包含している。別の実施形態においては、本発明は、一つ以上の異なる親和性分子或いは親和性分子のセットの混合物を具えた単一の装置を包含している。更に別の実施形態におては、本発明は、それぞれが、例えばイムノグロブリン及び凝固因子に対して親和性を有する異なる一つの親和性分子或いは親和性分子のセットを具えた複数の装置も包含している。別の実施形態においては、本発明は複数の装置を具え、各装置は、一つ以上の異なる親和性分子或いは親和性分子のセットの混合物を具えている。更に別の実施形態において、本発明は複数の装置のキットを具え、各装置は一つ以上の異なる親和性分子或いは親和性分子のセットの混合物を具えている。
【0022】
本発明の親和性分子は、可溶性或いは不溶性の形態であってもよい。例えば、親和性分子が可溶性の形態の場合、これは容器内に液状或いは凍結乾燥形状で存在している。血液はこの可溶性の親和性分子に添加され、次いで、最終サンプルに対する特別な使用者の必要性に応じて、サンプルから引き出され、又は分離される。例えば、親和性分子は、ガラス、ポリプロピレン、ナイロン、ニトロセルロース、ポリメタクリレート、ポリスチレン、ポリ塩化ビニール、スチレンブタジエン・コポリマー、スチレンアクリル・コポリマー、ラテックス、化学的に改変されたプラスチック、ゴム、赤血球、高分子材料又は生物学的細胞等の不活性物質に結合或いは付着可能である。本発明によれば、不活性材料が見出される表面の例は、容器の任意の部分、チューブの側面及び/又は底面、培養皿の側面及び/又は底面、パドル、計量棒、ゲル、ビーズ、粒子、微粒子等の任意のタイプのインサート及びチューブのライニングであるが、これらに限定されるものではない。親和性分子は、例えば親和性分子を不活性表面に直接に取り付けたり、親和性分子を派生及び/又は被覆された表面に直接的に付着させる等して、共有結合的或いは非共有結合的に公知の方法で表面に取付けられ、或いは接続されるが、これに限定されるものではない。
【0023】
一実施形態においては、ビーズ等の微粒子が本発明において使用され、これらのビーズはセファローゼ又はポリスチレンを含んでいる。別の実施形態においては、ビーズは、Dynal AS (Oslo, Norway) によって製造され、DYNABEADS(登録商標) として販売されている磁気及び超磁気ビーズ等の磁気粒子である。磁気ビーズが使用される場合、製造業者に関係なく、このビーズに結合した蛋白質の動きを操作するのに磁石が使用される。磁石は、血液サンプルの残りからビーズを分離するのにも使用される。
【0024】
本発明の別の実施形態においては、採取されたサンプルの密度位相を更に分別するのに分離器の密度勾配が導入されている。この密度勾配は、チクソトロピーゲルと機械的分離器からなる群から選ばれる。更に、ビーズ或いは微粒子は、その密度が密度分離器よりも大きくなるように選ばれている。例えば、分離器の密度が約1.02〜約1.08g/cm3 の場合、ビーズの密度はビーズ全部又は一部のビーズが約1.08g/cm3 より大きい密度を有するように選ばれる。高い密度のビーズは、遠心分離作用の際に容器の底に溜まり、結合された目標の一部を密度分離器の下に移動させる。目標の分子が非常に大量の場合、ビーズ或いは微粒子の除去は、容器に残っているサンプルを濃いものにする。本発明の別の実施形態においては、ビーズは、その密度が密度分離器の密度よりも小さくなるように選ばれる。例えば、分離器の密度が約1.02〜約1.08g/cm3 の場合、ビーズの密度は、ビーズの全部又は一部が約1.02g/cm3 より低い密度を持つように選ばれる。低い密度のビーズはサンプルの上方に浮遊し、結合された目標蛋白質の一部を分離器の上に移動させる。目標分子が非常に大量の場合、ビーズ或いは微粒子の除去は、容器に残っているサンプルを濃いものにする。
【0025】
チクソトロピーゲル分離器が、容器の内面に付与される。別の例では、機械的な分離器がチューブの中に挿入されて、流体を分離する。血液採取チューブが遠心力を受けると、分離器は、それが血液サンプルと密度的に均衡するようにチューブを上下して、血液の密度勾配を設定するように作用する。分離器と連携して、本発明にビーズが使用されている場合には、ビーズが内部で作用して密度勾配を確立することを助け、血液の種々の成分の分離を容易にする。
【0026】
本発明は他の形式で具体化されてもよく、詳細に説明された特定の実施形態に限定されるものではなく、これらは単なる例示に過ぎない。当業者であれば、本発明の範囲と精神から逸脱することなく、他の種々の改変が容易に可能なことは明らかであろう。本発明の範囲は特許請求の範囲及びその均等物によって決められている。
【0027】
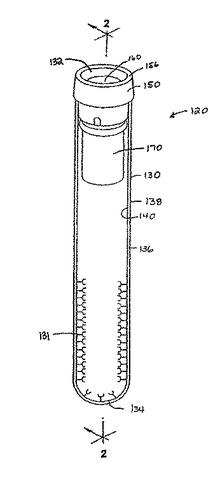
本発明の一実施形態が図1〜6に示され、ここでアセンブリ120は、容器130(ここではチューブとして描かれている)、蓋150及び分離器170を具えている。
【0028】
容器130は、上縁(図示しない)を具えた開放端132、閉鎖端135、及び開放端と閉鎖端との間に延びる側壁136を有する。側壁136は外側表面138と内側表面140を有する。容器130は中心軸Aを有する受容器を規定している。アセンブリ120は、側壁136の内側表面140に位置決めされた親和性分子131を具えている。
【0029】
蓋150は、容器130の開放端132に嵌まるように設けられている。蓋150は、側壁136の上縁の上に被さる環状の上方部分152と、側壁136の内側表面140の方に延在してこれに嵌合して蓋150を開放端132の所定位置に維持する、環状の上方部分152より小径の環状の下方部分即ちスカート154とを具えている。
【0030】
環状の上方部分152は、上部表面領域156と、該表面領域156から上部くぼみ領域160の方に傾いた側壁158とを具えている。下部環状スカート部分154は、下部くぼみ162、内側壁表面164、外側壁表面166及び底面168を規定している。くぼみ領域160と下部くぼみ領域162は、細いダイアフラム即ち自己シール隔壁を規定し、これを通じて針が挿入可能になっている。この自己シール隔壁材料は針等の穿刺エレメントによって破られるが、これを引き抜けば再びシールされる。
【0031】
環状棚即ち突出部157が環状上方部分152と環状下方部分154とを分離している。
【0032】
好ましくは、蓋150は天然ゴム、合成熱可塑性材料又は熱硬化性材料で作られている。好ましくは、蓋は隔壁が自己シールされるように弾性エラストマー材料で作られている。
【0033】
図3に示されているように、液体サンプルAが、上部くぼみ領域160において蓋150を貫通している針によってチューブに供給される。図示の目的だけのために、この液体サンプルは血液である。この液体サンプルは分離器170の通路に供給され、容器130の閉鎖端134と分離器170との間に導入され、これによって分離器170のすべての部品の外側表面は流体サンプルと実質的に自由に接触し得る。
【0034】
図4と5に示されているように、アセンブリ120が遠心作用力又は軸遠心力を受けると、分離器170のシール本体191は偏って、その直径が減少して容器の内側表面との接触嵌合が解消される。分離器170は容器の内側表面から解放され、分離器170は容器130の閉鎖端134の方に下降する。これによって容器と分離器との間の通路300が開かれ、分離器が容器を下降するにつれて流体の低密度成分Bが分離器を通って上方に流れることを可能にする。分離器の通路の内側の低密度成分は分離器を通って上下に移動する。こうして、分離器170は流体サンプルの中に浸ることができる。
【0035】
図6に示されるように、遠心分離作用が終わった後に、遠心荷重の欠如によってシール本体191は下に形成された状態に弾性的に復帰し、チューブの内壁を緊密に密閉する。こうして、分離器170は液体サンプルの低比重部分Bと高比重部分Cとの間を分ける手段として役立つ。
【0036】
図7〜12は本発明の別の実施形態を示す。図7〜12の実施形態は図1〜6の実施形態と同様に作用するが、親和性分子131′のビーズ135′を含み、そして親和性分子131′が側壁136′の内側表面140′に配置されている。図1〜6の実施形態と図7〜12の実施形態に共通のエレメントは同じ符号で示されているが、後者の場合にはダッシュ( ′) が付けられている。
【0037】
図13は、図1〜6の装置とホルダー42との相互作用を示している。このホルダー42は静脈入口端48と非患者側端46を具えたカニューレ44を有し、アセンブリ120がホルダー42に挿入される時に、蓋150の自己シール隔壁が非患者側端46によって突き刺され、容器130への血液採取のプロセスが開始されるようになっている。
【0038】
一実施形態においては、容器は当該技術において使用されている種々の添加物、例えばクエン酸塩、シリコーン、シリケート、エチレンジアミンテトラ酢酸(EDTA)等と共存可能である。これらの添加物は、凝固を促進させたり遅らせたり、特別な分析のためにサンプルを貯蔵したりするのに使用される。一つ以上の添加物を使用することが本発明の範囲に入っている。
【0039】
親和性分子自体は分離が容易なようになっていてもいなくてもよい。例えば、親和性分子はビオチニール化(訳者註:意味不明)され、目標成分と結合した後にビオチニール化された親和性分子を除去するのに使用可能である。こうして、採取時に先ず親和性分子をサンプルに曝し、次ぎにビオチニール化された非親和性分子抗体を用いることによって、サンプルから一成分が除去可能となる。ビオチニール化された抗体は、例えばアビジン、ストレプタビジン或いはNeutravidin (登録商標)を用いて、捕捉され、その結果、そのサンプルは目標とする成分が実質的に使われることとなる。
【0040】
一実施形態においては、親和性分子は容器の中で見出される。例えば、親和性分子はビーズに入れられて容器内で見出される。こうして、本発明は、例えばチューブに付加された抗体被覆ビーズを有する瀉出型の血液採取装置を具えている。ビーズを含むこのチューブは、人間及び/又は動物の静脈穿刺血液採取の際に使用される。同様な実施形態において、本発明は抗体被覆ビーズを含む非瀉出型微小採取容器でもある。例えば、前述の実施形態は、不活性物質又は表面がここにはリストされていてもいなくても、ビーズを任意の不活性物質又は表面に置き換えることによって修正可能である。
【0041】
別の実施形態においては、親和性分子は容器の外にあってもよい。例えば、親和性分子は容器の外にあるビーズに入れられて、親和性ビーズにパックされた親和性コラムを形成する。こうして、本発明は、血液採取容器と、該容器に順次に、前に又は後ろに連接され、そして場合によっては該容器と一体化された一つ以上の親和性コラムも具えることができる。前述の実施形態は、ビーズを容器の任意の部分、チューブの側部及び/又は底部、粒子、微粒子、保温皿の側部及び/又は底部、チューブのライニングに置き換えることによって修正可能である。
【0042】
実際、前述の実施形態は、ビーズを、ここにリストアップされているか否かに関わらず、任意の不活性物質や表面と置き換えることによって修正可能である。更に、ここに述べられているすべての実施形態は、抗体を抗体破片、酵素、酵素の破片、酵素の基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、レセプターの破片、リガンド、酵素の破片、他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、天然及び合成ポリマー等の任意のタイプの親和性分子と置き換えることによって修正可能である。さらに、ここに記載された全ての実施形態は、血液にとって望ましくない成分に対し他の蛋白質に変更可能である。
【0043】
本発明は、従来の方法に勝る明確な利点を提供する。これらの利点は、血液採取プロセスの際及び/又はその直後に親和性分子を血液に曝すことによって得られる。ここで用いられている「採取の際」とは、親和性分子が血液採取プロセスで血液に曝されることを意味する。親和性分子に血液を曝すのは短時間又は瞬間的でなくてもよく、血液サンプルの次の処理や分析の前までであればよい。このように、親和性分子は、血液の採取時に血液に接触するように置かれていなければならない。即ち、親和性分子は、それが血液採取時に血液に接触するように、血液が容器に採取される前か後のいずれかに血液に接触する場所に置かれてもよい。採取時に親和性分子と血液を接触させる目的は、取り扱い及び処理ステップを減らすことにある。
【0044】
したがって、本発明は、血液蛋白質その他の成分に特別な関係を有する抗体で被覆されたポリスチレンの微粒子等を添加することによって、血液から余分な蛋白質その他の成分を分離する手段を提供する。この微粒子は、微球体の製造者から容易に購入可能であり、免疫学的用途のために構成されている。この微球体は抗体付き或いは抗体無しで販売され、又は抗体接合が容易である。
【0045】
本発明の方法は、血液採取プロセスの下流側テストのための一体化された自己完結式一ステップ型除去手段として、或いは一体化された自己完結式一ステップ式濃縮手段として役立つ。即ち、血液サンプルから少なくとも一つの好ましくない成分を採取・除去することが、同じ処理の際に行われる。血清中における凝塊形成(或いは血漿中における凝塊の非形成)の後に、サンプルは被覆されたポリスチレンのビーズに対して結合反応が起こる短い待機時間を持つ。この反応に要する時間は、意図する目標に対する結合に関連した力学に対応するものであり、限定はされないが拡散や混合等の他の因子に影響される。
【0046】
血液を親和性分子に曝した後に、製造者の推奨によればサンプルは遠心分離され、結合された望ましくない成分と共に粒子を、血液の凝塊その他の細胞部分と同じか或いはそれよりも速い速度で沈降させる。親和性分子で被覆された粒子は、凝塊又は細胞と似た密度を持ち、結合成分のすべては血清又は血漿から沈殿して分離する。別の例では、密度とサイズは、結合された成分が浮くように選ばれることができる。親和性分子で被覆された粒子は、特定のサイズと密度に基づいて選ばれる。即ち、本発明の方法は、遠心分離の前に潜伏期間に基づいて目標とする血液成分の大部分或いは全部を除去することができる。この除去は、望ましくない成分の100%を血液から除去するように完全でなくてもよい。むしろ、必要なのは、血液中の少なくとも一つの成分の除去が、望ましくない成分が除去されなかった血液に比べて、血液のより正確な分析及び/又は効率的な処理を可能にする程度になるようにすることである。例えば、得られた血漿や血清は望ましくない成分が充分に少なく、大部分の他の成分が、特定の成分に対する親和性分子の特異性の故に影響を受けないようにすべきである。
【0047】
別の実施形態においては、チューブの壁は親和性分子によって被覆されることができる。この場合、チューブの壁は固体の支持体として機能し、親和性分子は共有原子価的或いは非共有原子価的にチューブのポリマーや粒子と接合される。目標の成分はチューブ壁に付着し、前分析ステップの際にそこに留まる。即ち、サンプルは採取プロセスにおて濃厚になり、遠心分離後にこの濃厚になったサンプルはこの第1のチューブから直接に使用され、或いは第2の容器に移される。
【0048】
図14に示されているように、別の実施形態においては、容器は注射器胴部とストッパーの組立体によって構成されている。注射器20は、末端27と基端25を有する注射器本体22と、該注射器本体内を軸方向に動き得るストッパー31と、針アセンブリ37と係合する末端30を具えている。針アセンブリと係合するこの末端は、一実施形態においては円錐台状に傾斜した雄型ルエル28を具え、これによって容器から末端の雄型ルエル傾斜部までの導管を提供している。典型的な例では、雌型ルエルを具えた皮下注射用針が、注射器本体の末端の円錐台状に傾斜した雄型ルエル上に用いられる。この皮下注射用針は末端方向に延びて雌型ルエルから末端の内腔先端までの導管を形成している。
【0049】
他の実施形態においては、針アセンブリに係合する末端は弾性体で作られたアクセス用シールを具え、針アセンブリと一体化されたカニューレがこのアクセス用弾性体シールを突き破り、容器との流体的連通を確立するようになっている。この針アセンブリは、弾性体シール穿刺用カニューレと、ステンレス針等の静脈アクセス用カニューレの両方を具えている。詳しくは、弾性体シール穿刺用カニューレはアクセス用弾性体シールを突き刺して、容器と患者の静脈との間の流体的連通を確立する。或る実施形態においては、針アセンブリはフックエレメントを有し、注射器胴部の末端部分から放射状に延在する突出部と可逆的に係合する。このような装置の例は、例えば、特許文献2に開示され、その内容は本明細書中に参考として組み入れられている。
【0050】
注射器本体22は軸方向に可動の公知のストッパー31を収容している。好ましくは、ストッパー31に一体化されたプランジャーのロッド32が、ストッパー31から基端方向に延在し、使用者によって操作されてストッパー31を注射器本体22の軸に沿って動かす。ストッパーの動きによって、容器の圧縮と膨張が生じる。本発明によれば、親和性分子(図示しない)は容器の内側に位置決めされている。或る実施形態においては、親和性分子は注射器本体の内部側壁上に配置されている。他の実施形態においては、親和性分子は、注射器アセンブリの容器内に配置された一つ以上のインサートに付着している。ストッパーと注射器本体の末端との間に初期空間を設け、採取前にこれらのインサートの入る空間を形成しておくことが可能である。更に別の実施形態においては、親和性分子は一つ以上のインサートと注射器の内部側壁上に配置されている。好ましくは、これらのインサートは微粒子或いはビーズを具えている。幾つかの実施形態においては、これらのインサートは充分に小さく、雄型ルエルの傾斜部を貫通する内腔又は前述の弾性体シールを穿刺するカニューレの内腔を通ってアセンブリを分解することなく容器から取り出すことが可能である。他の実施形態においては、これらのインサートは容器の内部に保持されるのに充分な大きさを有し、或いは微粒子のような小さいインサートの脱出を防ぐために、メッシュやフィルターを設けることも可能である。更に別の実施形態においては、容器内に保持されるのに充分なサイズを持つ大きいインサートと、注射器胴部とストッパーによって限定された容器から取り出し可能なサイズを持つ小さいインサートとの組合せが用いられる。前述の実施形態においては、インサートは、注射器アセンブリの近くに置かれた磁場に呼応する、或いは呼応しない粒子で構成されてもよい。
【0051】
図15には、親和性分子410が採取容器と静脈アクセスエレメントとの間を連通する導管426の中に配置されている、本発明の別の実施形態が示されている。静脈アクセスエレメントは、カテーテル、血液採取セット、透析針セット、流体投与セット、血液透析針セット、アフェレーシス針、ポートアクセスエレメント或いは皮膚穿刺針等を有するチューブに取付けられた血液袋を具えている。幾つかの実施形態においては、静脈アクセスポイントが、経皮的穿刺によって静脈に直接に、或いは静脈に流体的に連通しているポートにアクセスすることによって静脈に間接的にアクセス可能である。導管は、好ましくはPVC等のポリマーのチューブの可撓性部分である。親和性分子は、導管の内部側壁面428に直接付着させて配置される。別の例では、親和性分子は、ビーズや微粒子等のインサートを導管に入れて導管内部に配置される。これらのインサートのサイズと形状は、これらが導管内部に維持され、サイズの制限やこれらを所定の位置に保持するための添加されたその他のエレメントによって、導管内部を自由に動き回ることがないように選ばれている。
【0052】
図15は、静脈穿刺針422、容器アクセス針424、及び親和性分子410を含み、両者間に延在する導管426を有する血液採取セット420を示している。この静脈穿刺針の両側に横方向に張り出した翼状エレメント430が静脈穿刺針422と一体化されている。この翼状エレメントは、静脈穿刺針422の内腔に導管426を対面させるのを助けるハブ432も構成している。導管426は、容器アクセス針424に直接或いは間接に対面可能である。間接的には、導管426は雌型ルエルコネクターと一体化可能であり、このコネクターは容器アクセス針に接合された雄型ルエルハブと一体化されている。好ましくは、容器アクセス針424の周囲には採取容器ホルダー440があり、血液採取チューブ又は血液保温ボトルを血液採取セット420に接続することを容易にしている。更に、導管の末端部分の周囲にはシールドエレメントが配置され、静脈アクセス針の末端をシールドしている。別の実施形態においては、静脈穿刺針がルエル作動弁等の弁に置き換えられている。ルエル作動弁の例は、Alaris Medical Systemsから販売されているAlarais SmartSite(登録商標) Needleless valve及びICU Medical から販売されているClave(登録商標) valve 等である。別の例では、静脈穿刺針は、Baxter International, Inc.から販売されているInterlink(登録商標) 等のストップ−コックポート又は分割隔壁ポートで置き換えられている。
【0053】
実施例1−高い親和性を有する抗体による空のポリスチレン製チューブの被覆
【0054】
アルブミンに対して高い親和性を有する抗体(10-8M 〜10-12 M)(アルブミン抗体)は多くの供給業者から購入可能である。ポリスチレン製チューブは消毒され、非特許文献1に概括されているように、アルブミン抗体が共有原子価的にチューブに結合される。この文献の全体は参考として本明細書に組み入れられている。短く云えば、チューブはpH5.0の100mMの燐酸ナトリウム緩衝液中で0.2%(v/v)のグルタルアルデヒドで室温で4時間前処理される。次ぎにチューブは、同じ緩衝液と抗体溶液中で2回洗浄され、この溶液は100mMの燐酸ナトリウムに2〜10ug/mLを添加することによってpH8.0に調製され、チューブに注入されて3時間、37℃に保温される。保温の後、チューブは0.9%の食塩水で2回洗浄される。洗浄の後、pH8.0の燐酸ナトリウム緩衝液中の100mMのリシンが37℃で1時間、チューブに入れられ、残っている自由アルデヒドをチューブの側面にブロックする。次ぎにチューブは0.05%のTween ( 登録商標)20を含むPBSを数回取り替えて洗浄される。次ぎに、従来から行われているようにチューブの組み立てと空にする作業が完了する。
【0055】
実施例2−被覆されたチューブへの血液採取
【0056】
実施例1で準備された被覆された空のチューブに患者から血液が吸引される。血液は約5〜90分(チューブを被覆するのに使用された抗体の親和性と濃度によって異なるが)、室温でチューブ内で保温可能であり、一方、チューブは静かに揺すられるか攪拌されて、アルブミンがチューブの側面の抗体と結合できるようにされる。チューブは室温で一晩保温可能である。
【0057】
実施例3−被覆されたチューブがアルブミンその他の阻害蛋白質を除去する能力のテスト
【0058】
実施例2で採取された血液は、次ぎに1100Gで約10分間、遠心分離作用を受け、成分毎に分離される。成分分離の後、アルブミンが除かれた血漿中の蛋白質は、本明細書中に参考として組み入れられている非特許文献2に記載されているように、2Dゲルの作用を受ける。2Dゲル電気泳動は、分子量と等電気点に基づいて残存蛋白質を分離する。分離された蛋白質は、次ぎに製造業者のプロトコールにしたがってMontage In-Gel Digest% Kit(登録商標) (Millipore Corp.)を用いて純化される。対象とする蛋白質は、非特許文献3に記載されているように、Axima CFR MALDI-TOF Mass Spectrometer (Kratos Analytical, Inc.) 上で、飛行質量分光分析のマトリックス補助によるレーザー脱離/イオン化時間(MALDI-TOF MS)を使用して、或いは液体クロマトグラフィーを使用して識別される。
【0059】
対象蛋白質の回復量は、実施例1において使用される抗体の濃度及び/又は親和性を変更することによって調節可能である。
【0060】
実施例4−ポリスチレン製のビーズに対する抗体の共有結合的連鎖
【0061】
50mMのpH7.0の燐酸ナトリウムの12.5%(v/v)のグルタルアルデヒド5mLを約25ヒドラジドの派生ポリスチレンビーズ(6.4mm直径; Pierce Chemical Company)に添加し、室温で約2時間、非常に静かに揺さぶる。次ぎにビーズは100mLの水とpH6.0の100mM燐酸ナトリウム緩衝液20mLによってBuchner ファンネル(フィルター紙無し)中で洗浄される。次ぎに、このグルタルアルデヒドによって活性化されたビーズは、2.5mgのAbを5mLの燐酸ナトリウム緩衝液に溶解して調製された抗体溶液中に入れられる。ビーズがこのAb溶液に入れられた後、1mgのNaCNBH3 がこの溶液に添加される。室温で一晩静かに揺すぶられる。揺すぶられた後、ビーズは100mLのpH6.0の100mM燐酸ナトリウム緩衝液で洗浄され、次ぎに5mLの100mMのNaHCO3で洗浄される。ビーズに残ったアルデヒドは、5mLの100mMリシンを用いて、室温で1時間保温されてブロックされる。リシンで保温された後、ビーズは100mLの100mMのNa2CO3と100mLの水で洗浄され、乾かされる。Abで被覆されたビーズは4℃で乾燥保存される。上述の方法は、非特許文献4に開示されている。
【0062】
本発明の種々の実施形態を説明したが、これらの実施例や実施形態は単なる例示に過ぎず、限定的なものではないことを銘記すべきである。本発明の範囲は、上述の如何なる実施形態によっても限定されるものではない。
【技術分野】
【0001】
本発明は、血液採取時に特定の目標成分を血液サンプルから分離・除去する血液採取装置並びに方法、及びその装置を使用する方法に関する。
【背景技術】
【0002】
今日、プロティオミクス(proteomics) の進歩に伴い、蛋白質の大規模な分離と識別が研究、薬物開発及び診断の焦点となりつつある。蛋白質の分離方法は、分子的及び生化学的技術において確立されているが、プロティオミクスの進歩に伴って、別の、更に厳密な蛋白質分離技術を必要とする新しい技術が起こっている。例えば、プラズマプロテオム (plasma proteome)の探索は、大量の低蛋白質の分離・識別と、二次元(2D)ゲルシステムにおける電気泳動を用いたそれらの決定を必要とする。しかし、高濃度液中のプラズマ蛋白質やのその他の成分、例えばアルブミン等は分離を妨げ、これらの大量の低蛋白質の識別を不分明にし、時として2Dゲル上での、或いは血液サンプルのその他の下流側でのテストによるその識別を困難にし、又は不可能にする。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】米国特許第6479298号
【特許文献2】米国特許第4449539号
【非特許文献】
【0004】
【非特許文献1】Tijssen, P.,Practice and Theory of Enzyme ImmunoAssays, in Burdon, RH and Knippenberg, PH, (Eds.), Laboratory Techniques in Biochemistry and Molecular Biology, Elsevier Science Publisher, Vol. 15: 297-329 (1985)
【非特許文献2】Celis, JE, and Bravo R, (Eds.), Two-Dimensional gel Electrophoresis of Protein, Academic Press (1984)
【非特許文献3】Worral, TA, et al., Anal. Chem. 70: 750 (1998)
【非特許文献4】Tijssen, P., Practice and Theory of Enzyme ImmunoAssays, in Burdon, RH and Lnippenberg, PH, (Eds.), Laboratory Techniques in Biolochemistry and Molecular Biology, Elsevier Science Publishers, Vol. 15 (1985)
【発明の概要】
【発明が解決しようとする課題】
【0005】
最近、血液サンプルからアルブミン及びその他の大量の成分を除去する多くの異なる方法が存在している。しかし、これらの除去方法の大部分は充分なものではなく、必要な蛋白質や成分の多くを実際に除去してしまうことがある。例えば、最近のアルブミン除去方法は、サンプルを別の容器に移し替えることを要し、これによって付加的な取り扱いステップが必要となり、処理エラー、サンプル汚染、作業者が感染の可能性のある血液成分に触れる危険性が増加する。更に、最近の方法は、除去プロセスにおいて目標成分を狙う特に指向性を有する親和性のある種類の分子を使用せずに、対象とする成分を除去する。したがって、血液サンプル採取装置、この装置を使用する方法、及びエラーや汚染のリスクが無く、しかも目標とする成分を特別に分離するプロセスが必要となる。
【0006】
本発明は、容器と、親和性のよい分子とを具えた血液採取装置に関し、この親和性分子は血液採取の際に血液に曝される。
【0007】
本発明は、血液採取の際に血液を親和性分子に曝することを含む血液採取方法にも関する。
【課題を解決するための手段】
【0008】
本発明は、容器と機械的密度分離器と親和性分子とを具えた血液採取装置であって、血液採取時において血液が最初に前記容器に入ることに伴って前記親和性分子が前記血液に曝されることを特徴とする。
【図面の簡単な説明】
【0009】
【図1】本発明の一つを示す図である。
【図2】図1の装置の長手方向断面図である。
【図3】図1の装置の長手方向断面であって、装置内の流体の流れを示す。
【図4】分離器が解放された遠心分離作用の際の図1の装置を示す図である。
【図5】分離器が解放された遠心分離作用の際の図1の装置を示す図である。
【図6】遠心分離作用の後の図1の装置を示す図であり、液体サンプルが高低比重成分に分離された状態を示す。
【図7】本発明の別の装置を示す図である。
【図8】図7の装置の長手方向断面図である。
【図9】図7の装置の長手方向断面図であり、装置内への流体の流れを示す。
【図10】分離器が解放された遠心分離作用の際の図7の装置を示す図である。
【図11】分離器が解放された遠心分離作用の際の図7の装置を示す図である。
【図12】遠心分離作用の後の図7の装置を示す図であり、液体サンプルが高低比重成分に分離された状態を示す。
【図13】本発明の別の装置を示す図である。
【図14】本発明の別の装置を示す図であり、抗体で被覆されたビーズが注射器アセンブリ内に配置されている。
【図15】本発明の別の装置を示す図であり、抗体で被覆されたチューブがライン内の成分の除去のために使用されている。
【発明を実施するための形態】
【0010】
本発明は、容器と親和性分子とを具えた血液採取装置に関し、この親和性分子は血液採取の際に血液に曝される。
【0011】
本発明は、血液採取の際に血液を親和性分子に曝することを含む血液採取方法にも関する。親和性分子は血液中の目標分子と結合する。ここで用いられているように、「目標分子」又は「目標」は、血液の実際のサンプル中に存在していてもいなくてもよいが、存在している場合には親和性分子と結合する成分を意味する。この目標は、親和性分子の相手となる分子が引き続く処理や分析のための対象となることを「望まれている」。別の例では、目標は「望ましくない」ものであり、不純物と考えられ、或いは引き続く処理や分析ステップにおいて不要又は望ましくない。
【0012】
ここで使われている「血液」とは、動物の全血或いは全血の分離成分を意味している。血液の分離成分は、血漿と血清を含み、ここでこれらの定義は普通に当該技術で使われているものである。例えば、血漿は、血小板を含む細胞が実質的に皆無の全血の成分である。血清は、フィブリノーゲンその他の凝固因子が除去されたプラズマである。即ち、ここで使用されている「血液」は、全血、血漿、血清、血液の細胞部分、及び全血の蛋白質部分さえも含んでいる。更に、本発明の目的のために、例えば血液からの蛋白質その他の分子、例えばフィブリノーゲンの分離等のように血液の成分は分離され、或いは血漿や血清のような分子との混合を行うこともできる。ここで用いられている「成分」は、血液の細胞部分を含まず、一方、「細胞成分」は細胞部分を含んでいる。細胞成分は、体のすべての組織のT−細胞、B−細胞、健常又は病気の細胞を含むヘマトポエティック細胞、骨髄性基幹細胞、赤血球、好中球、好塩基球、好酸球、巨核球、血小板、単核細胞、肥満細胞、リンパ細胞を含んでいても、いなくてもよく、更にこれらに限定されない。
【0013】
更に、「採取」は、血液をその通常の環境から抽出することを意味し、血液はそれが抽出された個体に戻され、或いは輸血の際等に異なる個体に移されてもよいし、そうされなくてもよい。ここで「個体」、「主体」及び「患者」と云う用語は、相互に同じ意味に使用され、好ましくは哺乳類、更に好ましくは人間又は人間以外の霊長類である全ての動物を意味している。
【0014】
本発明の装置は容器を具えている。この容器は、環境に対して開閉可能であり、少なくとも一時的に或る量の血液を保持可能な装置である。勿論、容器は任意の量の血液を長期に保持することも可能である。容器は突き刺され、そして再びシールされることも可能である。本発明の容器の例は、空のチューブ、ペトリ皿、微小滴定プレート、注射器胴部、針、血液の処理又は分析する機械、献血の時に使用される血液採取袋、プラスチックのチューブ等の血液採取システムを含むが、これらに限定されるものではない。
【0015】
血液は容器内に静止している必要はなく、定置されたり、動いたり流れたりしてもよい。一実施形態においては容器は密度勾配障壁を具え、容器内に採取されたサンプルは遠心分離作用の際に高い密度と低い密度に分別される。任意のタイプの血液採取装置やシステムを容器として用いることができる。容器として作用することができる好適な装置は、例えば、Becton Dickinson and Company (BD)の血清凝固作用チューブ、血清ゲル凝固作用チューブ、リチウム・ヘパリンチューブ、フッ化ナトリウムチューブ、クエン酸ナトリウムチューブ、ESRクエン酸チューブ、微量金属(Trace Mettal)チューブであるが、これらに限定されるものではない。更に、Microvette(登録商標)システムを含む任意の製造業者によって製造された毛管式血液採取システムが容器として作動可能である。本発明で使用されることを意図した容器の幾つかの例が、特許文献1に開示されており、その全体が参考として本明細書に組み入れられている。
【0016】
一実施形態においては、容器は更にインサートを具えている。ここで「インサート」とは、固体の計量棒、機械式密度分別エレメント、或いは空のチューブ内のパドル等の、容器に完全に封入された材料を意味する。「インサート」と云う用語は、容器にその一部だけが入っている材料も称する。これらのインサートはパドル等の固体物体であってもよく、又は液体、ゲル又は気体であてもよい。インサートの他の例は、ビーズ、粒子又は微粒子を含むが、これらに限定されるものではない。ビーズの例は、磁場によって操作される磁気ビーズである。これらのインサートは、インサートの少なくとも一部が容器の内部に位置するならば任意の形状を持つことができる。インサートの形状の例は、矩形、円形、楕円形、直線のロッド及び螺旋形のロッドであるが、これらに限定されるものではない。
【0017】
別の実施形態においては、容器の内壁は平滑或いは突起を有していてもよい。突起を容器に設けると、容器の内側表面積を増加させるのに役立つ。別の実施形態においても、インサートが突起を有し、各々の表面積を増大させている。更に別の実施形態においては、インサートと容器の内壁が突起を有し、更に表面積を増加させている。本発明の実施形態のいずれかにおいて表面積を増加させる目的は、血液採取の際に血液に接触する、表面から移動しない親和性分子の量を増やすことにある。
【0018】
容器の他に、本発明の装置は、一つ以上の親和性分子を具えている。ここで用いられている「親和性分子」は、血液の一つ又は複数の成分に対して親和性を有する任意のタイプの分子である。この親和性は、親和性分子が、フィブリノーゲンに対して特効のある抗体等の成分の集中した部分集合に対して親和性を有する特定の親和性である。親和性分子のこの親和性は、蛋白質A等の一般的なクラスのイムノグロブリンと結合する蛋白質のように、より特性的ではない。更に、本発明で意図しているこの親和性分子は、より広い親和性を示し、親和性分子は異なるクラスの蛋白質の混合物に対して親和性を有することができるようになっている。
【0019】
親和性分子の例は、抗体、抗体の破片、酵素、酵素の破片、酵素基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、レセプターの破片、リガンド、酵素の破片、他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、プロテオグリカン、天然及び合成ポリマー、ナノボディーを含むが、これらに限定されるものではない。一実施形態においては、親和性分子は抗体又は抗体の破片、例えばFab 破片、F(ab')2 破片及びscFv破片であるが、これらに限定されるものではない。これらの抗体は合成又は天然で生じるポリクロナール、モノクロナール、キメラであってもよい。
【0020】
別の実施形態においては、本発明の親和性分子は、血液内の成分と結合する。好ましくは、前記親和性分子は、血液蛋白質と結合する。親和性分子が結合する蛋白質の例は、フィブリノーゲン、アルブミン、アルファ、ベータ、及びガンマグロブリンを含むイムノグロブリン、キモトリプシン及びトロンビン等のプロテアーゼ、抗キモトリプシン、抗トロンビン、マクログロブリン等のプロテアーゼ抑制因子、インター・アルファ・トリプシン抑制因子、Cl抑制因子、血漿抑制因子、ヘパリン補助因子II、アポプロテインA及びフィブロネクチンを含むが、これらに限定されるものではない。
【0021】
一実施形態においては、親和性分子或いは親和性分子のセットは、同時に一つ以上の望ましくない成分と結合可能であり、その結果、サンプルから一つ以上の望ましくない成分が除去される。別の実施形態においては、親和性分子或いは親和性分子のセットは、同時に望ましい成分と結合可能であり、その結果、一つ以上の望ましい成分が分離される。別の実施形態においては、一つ以上の親和性分子或いは親和性分子のセットが採用され、各親和性分子或いは親和性分子のセットは異なる望ましくない成分と結合し、その結果、サンプルから一つ以上の望ましくない成分が除去される。勿論、本発明は、一つだけの望ましくない成分とだけ結合可能な一つの親和性分子或いは親和性分子のセットを利用することも包含している。場合によっては、本発明は、元の試料から少数種類の望ましい成分を除去することによって、サンプルを濃いものにすることが可能な一つの親和性分子或いは親和性分子のセットを利用することも包含している。ここで、「親和性分子のセット」とは、特殊性と強度の両方において独特のタイプの親和性を有する複数の親和性分子を意味する。ここで、「親和性分子」とは、一つ以上の親和性分子及び一つ以上の親和性分子のセットを意味している。一実施形態においては、本発明は、一つの親和性分子或いは親和性分子のセットを具えた容器或いは単一の装置を包含している。別の実施形態においては、本発明は、一つ以上の異なる親和性分子或いは親和性分子のセットの混合物を具えた単一の装置を包含している。更に別の実施形態におては、本発明は、それぞれが、例えばイムノグロブリン及び凝固因子に対して親和性を有する異なる一つの親和性分子或いは親和性分子のセットを具えた複数の装置も包含している。別の実施形態においては、本発明は複数の装置を具え、各装置は、一つ以上の異なる親和性分子或いは親和性分子のセットの混合物を具えている。更に別の実施形態において、本発明は複数の装置のキットを具え、各装置は一つ以上の異なる親和性分子或いは親和性分子のセットの混合物を具えている。
【0022】
本発明の親和性分子は、可溶性或いは不溶性の形態であってもよい。例えば、親和性分子が可溶性の形態の場合、これは容器内に液状或いは凍結乾燥形状で存在している。血液はこの可溶性の親和性分子に添加され、次いで、最終サンプルに対する特別な使用者の必要性に応じて、サンプルから引き出され、又は分離される。例えば、親和性分子は、ガラス、ポリプロピレン、ナイロン、ニトロセルロース、ポリメタクリレート、ポリスチレン、ポリ塩化ビニール、スチレンブタジエン・コポリマー、スチレンアクリル・コポリマー、ラテックス、化学的に改変されたプラスチック、ゴム、赤血球、高分子材料又は生物学的細胞等の不活性物質に結合或いは付着可能である。本発明によれば、不活性材料が見出される表面の例は、容器の任意の部分、チューブの側面及び/又は底面、培養皿の側面及び/又は底面、パドル、計量棒、ゲル、ビーズ、粒子、微粒子等の任意のタイプのインサート及びチューブのライニングであるが、これらに限定されるものではない。親和性分子は、例えば親和性分子を不活性表面に直接に取り付けたり、親和性分子を派生及び/又は被覆された表面に直接的に付着させる等して、共有結合的或いは非共有結合的に公知の方法で表面に取付けられ、或いは接続されるが、これに限定されるものではない。
【0023】
一実施形態においては、ビーズ等の微粒子が本発明において使用され、これらのビーズはセファローゼ又はポリスチレンを含んでいる。別の実施形態においては、ビーズは、Dynal AS (Oslo, Norway) によって製造され、DYNABEADS(登録商標) として販売されている磁気及び超磁気ビーズ等の磁気粒子である。磁気ビーズが使用される場合、製造業者に関係なく、このビーズに結合した蛋白質の動きを操作するのに磁石が使用される。磁石は、血液サンプルの残りからビーズを分離するのにも使用される。
【0024】
本発明の別の実施形態においては、採取されたサンプルの密度位相を更に分別するのに分離器の密度勾配が導入されている。この密度勾配は、チクソトロピーゲルと機械的分離器からなる群から選ばれる。更に、ビーズ或いは微粒子は、その密度が密度分離器よりも大きくなるように選ばれている。例えば、分離器の密度が約1.02〜約1.08g/cm3 の場合、ビーズの密度はビーズ全部又は一部のビーズが約1.08g/cm3 より大きい密度を有するように選ばれる。高い密度のビーズは、遠心分離作用の際に容器の底に溜まり、結合された目標の一部を密度分離器の下に移動させる。目標の分子が非常に大量の場合、ビーズ或いは微粒子の除去は、容器に残っているサンプルを濃いものにする。本発明の別の実施形態においては、ビーズは、その密度が密度分離器の密度よりも小さくなるように選ばれる。例えば、分離器の密度が約1.02〜約1.08g/cm3 の場合、ビーズの密度は、ビーズの全部又は一部が約1.02g/cm3 より低い密度を持つように選ばれる。低い密度のビーズはサンプルの上方に浮遊し、結合された目標蛋白質の一部を分離器の上に移動させる。目標分子が非常に大量の場合、ビーズ或いは微粒子の除去は、容器に残っているサンプルを濃いものにする。
【0025】
チクソトロピーゲル分離器が、容器の内面に付与される。別の例では、機械的な分離器がチューブの中に挿入されて、流体を分離する。血液採取チューブが遠心力を受けると、分離器は、それが血液サンプルと密度的に均衡するようにチューブを上下して、血液の密度勾配を設定するように作用する。分離器と連携して、本発明にビーズが使用されている場合には、ビーズが内部で作用して密度勾配を確立することを助け、血液の種々の成分の分離を容易にする。
【0026】
本発明は他の形式で具体化されてもよく、詳細に説明された特定の実施形態に限定されるものではなく、これらは単なる例示に過ぎない。当業者であれば、本発明の範囲と精神から逸脱することなく、他の種々の改変が容易に可能なことは明らかであろう。本発明の範囲は特許請求の範囲及びその均等物によって決められている。
【0027】
本発明の一実施形態が図1〜6に示され、ここでアセンブリ120は、容器130(ここではチューブとして描かれている)、蓋150及び分離器170を具えている。
【0028】
容器130は、上縁(図示しない)を具えた開放端132、閉鎖端135、及び開放端と閉鎖端との間に延びる側壁136を有する。側壁136は外側表面138と内側表面140を有する。容器130は中心軸Aを有する受容器を規定している。アセンブリ120は、側壁136の内側表面140に位置決めされた親和性分子131を具えている。
【0029】
蓋150は、容器130の開放端132に嵌まるように設けられている。蓋150は、側壁136の上縁の上に被さる環状の上方部分152と、側壁136の内側表面140の方に延在してこれに嵌合して蓋150を開放端132の所定位置に維持する、環状の上方部分152より小径の環状の下方部分即ちスカート154とを具えている。
【0030】
環状の上方部分152は、上部表面領域156と、該表面領域156から上部くぼみ領域160の方に傾いた側壁158とを具えている。下部環状スカート部分154は、下部くぼみ162、内側壁表面164、外側壁表面166及び底面168を規定している。くぼみ領域160と下部くぼみ領域162は、細いダイアフラム即ち自己シール隔壁を規定し、これを通じて針が挿入可能になっている。この自己シール隔壁材料は針等の穿刺エレメントによって破られるが、これを引き抜けば再びシールされる。
【0031】
環状棚即ち突出部157が環状上方部分152と環状下方部分154とを分離している。
【0032】
好ましくは、蓋150は天然ゴム、合成熱可塑性材料又は熱硬化性材料で作られている。好ましくは、蓋は隔壁が自己シールされるように弾性エラストマー材料で作られている。
【0033】
図3に示されているように、液体サンプルAが、上部くぼみ領域160において蓋150を貫通している針によってチューブに供給される。図示の目的だけのために、この液体サンプルは血液である。この液体サンプルは分離器170の通路に供給され、容器130の閉鎖端134と分離器170との間に導入され、これによって分離器170のすべての部品の外側表面は流体サンプルと実質的に自由に接触し得る。
【0034】
図4と5に示されているように、アセンブリ120が遠心作用力又は軸遠心力を受けると、分離器170のシール本体191は偏って、その直径が減少して容器の内側表面との接触嵌合が解消される。分離器170は容器の内側表面から解放され、分離器170は容器130の閉鎖端134の方に下降する。これによって容器と分離器との間の通路300が開かれ、分離器が容器を下降するにつれて流体の低密度成分Bが分離器を通って上方に流れることを可能にする。分離器の通路の内側の低密度成分は分離器を通って上下に移動する。こうして、分離器170は流体サンプルの中に浸ることができる。
【0035】
図6に示されるように、遠心分離作用が終わった後に、遠心荷重の欠如によってシール本体191は下に形成された状態に弾性的に復帰し、チューブの内壁を緊密に密閉する。こうして、分離器170は液体サンプルの低比重部分Bと高比重部分Cとの間を分ける手段として役立つ。
【0036】
図7〜12は本発明の別の実施形態を示す。図7〜12の実施形態は図1〜6の実施形態と同様に作用するが、親和性分子131′のビーズ135′を含み、そして親和性分子131′が側壁136′の内側表面140′に配置されている。図1〜6の実施形態と図7〜12の実施形態に共通のエレメントは同じ符号で示されているが、後者の場合にはダッシュ( ′) が付けられている。
【0037】
図13は、図1〜6の装置とホルダー42との相互作用を示している。このホルダー42は静脈入口端48と非患者側端46を具えたカニューレ44を有し、アセンブリ120がホルダー42に挿入される時に、蓋150の自己シール隔壁が非患者側端46によって突き刺され、容器130への血液採取のプロセスが開始されるようになっている。
【0038】
一実施形態においては、容器は当該技術において使用されている種々の添加物、例えばクエン酸塩、シリコーン、シリケート、エチレンジアミンテトラ酢酸(EDTA)等と共存可能である。これらの添加物は、凝固を促進させたり遅らせたり、特別な分析のためにサンプルを貯蔵したりするのに使用される。一つ以上の添加物を使用することが本発明の範囲に入っている。
【0039】
親和性分子自体は分離が容易なようになっていてもいなくてもよい。例えば、親和性分子はビオチニール化(訳者註:意味不明)され、目標成分と結合した後にビオチニール化された親和性分子を除去するのに使用可能である。こうして、採取時に先ず親和性分子をサンプルに曝し、次ぎにビオチニール化された非親和性分子抗体を用いることによって、サンプルから一成分が除去可能となる。ビオチニール化された抗体は、例えばアビジン、ストレプタビジン或いはNeutravidin (登録商標)を用いて、捕捉され、その結果、そのサンプルは目標とする成分が実質的に使われることとなる。
【0040】
一実施形態においては、親和性分子は容器の中で見出される。例えば、親和性分子はビーズに入れられて容器内で見出される。こうして、本発明は、例えばチューブに付加された抗体被覆ビーズを有する瀉出型の血液採取装置を具えている。ビーズを含むこのチューブは、人間及び/又は動物の静脈穿刺血液採取の際に使用される。同様な実施形態において、本発明は抗体被覆ビーズを含む非瀉出型微小採取容器でもある。例えば、前述の実施形態は、不活性物質又は表面がここにはリストされていてもいなくても、ビーズを任意の不活性物質又は表面に置き換えることによって修正可能である。
【0041】
別の実施形態においては、親和性分子は容器の外にあってもよい。例えば、親和性分子は容器の外にあるビーズに入れられて、親和性ビーズにパックされた親和性コラムを形成する。こうして、本発明は、血液採取容器と、該容器に順次に、前に又は後ろに連接され、そして場合によっては該容器と一体化された一つ以上の親和性コラムも具えることができる。前述の実施形態は、ビーズを容器の任意の部分、チューブの側部及び/又は底部、粒子、微粒子、保温皿の側部及び/又は底部、チューブのライニングに置き換えることによって修正可能である。
【0042】
実際、前述の実施形態は、ビーズを、ここにリストアップされているか否かに関わらず、任意の不活性物質や表面と置き換えることによって修正可能である。更に、ここに述べられているすべての実施形態は、抗体を抗体破片、酵素、酵素の破片、酵素の基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、レセプターの破片、リガンド、酵素の破片、他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、天然及び合成ポリマー等の任意のタイプの親和性分子と置き換えることによって修正可能である。さらに、ここに記載された全ての実施形態は、血液にとって望ましくない成分に対し他の蛋白質に変更可能である。
【0043】
本発明は、従来の方法に勝る明確な利点を提供する。これらの利点は、血液採取プロセスの際及び/又はその直後に親和性分子を血液に曝すことによって得られる。ここで用いられている「採取の際」とは、親和性分子が血液採取プロセスで血液に曝されることを意味する。親和性分子に血液を曝すのは短時間又は瞬間的でなくてもよく、血液サンプルの次の処理や分析の前までであればよい。このように、親和性分子は、血液の採取時に血液に接触するように置かれていなければならない。即ち、親和性分子は、それが血液採取時に血液に接触するように、血液が容器に採取される前か後のいずれかに血液に接触する場所に置かれてもよい。採取時に親和性分子と血液を接触させる目的は、取り扱い及び処理ステップを減らすことにある。
【0044】
したがって、本発明は、血液蛋白質その他の成分に特別な関係を有する抗体で被覆されたポリスチレンの微粒子等を添加することによって、血液から余分な蛋白質その他の成分を分離する手段を提供する。この微粒子は、微球体の製造者から容易に購入可能であり、免疫学的用途のために構成されている。この微球体は抗体付き或いは抗体無しで販売され、又は抗体接合が容易である。
【0045】
本発明の方法は、血液採取プロセスの下流側テストのための一体化された自己完結式一ステップ型除去手段として、或いは一体化された自己完結式一ステップ式濃縮手段として役立つ。即ち、血液サンプルから少なくとも一つの好ましくない成分を採取・除去することが、同じ処理の際に行われる。血清中における凝塊形成(或いは血漿中における凝塊の非形成)の後に、サンプルは被覆されたポリスチレンのビーズに対して結合反応が起こる短い待機時間を持つ。この反応に要する時間は、意図する目標に対する結合に関連した力学に対応するものであり、限定はされないが拡散や混合等の他の因子に影響される。
【0046】
血液を親和性分子に曝した後に、製造者の推奨によればサンプルは遠心分離され、結合された望ましくない成分と共に粒子を、血液の凝塊その他の細胞部分と同じか或いはそれよりも速い速度で沈降させる。親和性分子で被覆された粒子は、凝塊又は細胞と似た密度を持ち、結合成分のすべては血清又は血漿から沈殿して分離する。別の例では、密度とサイズは、結合された成分が浮くように選ばれることができる。親和性分子で被覆された粒子は、特定のサイズと密度に基づいて選ばれる。即ち、本発明の方法は、遠心分離の前に潜伏期間に基づいて目標とする血液成分の大部分或いは全部を除去することができる。この除去は、望ましくない成分の100%を血液から除去するように完全でなくてもよい。むしろ、必要なのは、血液中の少なくとも一つの成分の除去が、望ましくない成分が除去されなかった血液に比べて、血液のより正確な分析及び/又は効率的な処理を可能にする程度になるようにすることである。例えば、得られた血漿や血清は望ましくない成分が充分に少なく、大部分の他の成分が、特定の成分に対する親和性分子の特異性の故に影響を受けないようにすべきである。
【0047】
別の実施形態においては、チューブの壁は親和性分子によって被覆されることができる。この場合、チューブの壁は固体の支持体として機能し、親和性分子は共有原子価的或いは非共有原子価的にチューブのポリマーや粒子と接合される。目標の成分はチューブ壁に付着し、前分析ステップの際にそこに留まる。即ち、サンプルは採取プロセスにおて濃厚になり、遠心分離後にこの濃厚になったサンプルはこの第1のチューブから直接に使用され、或いは第2の容器に移される。
【0048】
図14に示されているように、別の実施形態においては、容器は注射器胴部とストッパーの組立体によって構成されている。注射器20は、末端27と基端25を有する注射器本体22と、該注射器本体内を軸方向に動き得るストッパー31と、針アセンブリ37と係合する末端30を具えている。針アセンブリと係合するこの末端は、一実施形態においては円錐台状に傾斜した雄型ルエル28を具え、これによって容器から末端の雄型ルエル傾斜部までの導管を提供している。典型的な例では、雌型ルエルを具えた皮下注射用針が、注射器本体の末端の円錐台状に傾斜した雄型ルエル上に用いられる。この皮下注射用針は末端方向に延びて雌型ルエルから末端の内腔先端までの導管を形成している。
【0049】
他の実施形態においては、針アセンブリに係合する末端は弾性体で作られたアクセス用シールを具え、針アセンブリと一体化されたカニューレがこのアクセス用弾性体シールを突き破り、容器との流体的連通を確立するようになっている。この針アセンブリは、弾性体シール穿刺用カニューレと、ステンレス針等の静脈アクセス用カニューレの両方を具えている。詳しくは、弾性体シール穿刺用カニューレはアクセス用弾性体シールを突き刺して、容器と患者の静脈との間の流体的連通を確立する。或る実施形態においては、針アセンブリはフックエレメントを有し、注射器胴部の末端部分から放射状に延在する突出部と可逆的に係合する。このような装置の例は、例えば、特許文献2に開示され、その内容は本明細書中に参考として組み入れられている。
【0050】
注射器本体22は軸方向に可動の公知のストッパー31を収容している。好ましくは、ストッパー31に一体化されたプランジャーのロッド32が、ストッパー31から基端方向に延在し、使用者によって操作されてストッパー31を注射器本体22の軸に沿って動かす。ストッパーの動きによって、容器の圧縮と膨張が生じる。本発明によれば、親和性分子(図示しない)は容器の内側に位置決めされている。或る実施形態においては、親和性分子は注射器本体の内部側壁上に配置されている。他の実施形態においては、親和性分子は、注射器アセンブリの容器内に配置された一つ以上のインサートに付着している。ストッパーと注射器本体の末端との間に初期空間を設け、採取前にこれらのインサートの入る空間を形成しておくことが可能である。更に別の実施形態においては、親和性分子は一つ以上のインサートと注射器の内部側壁上に配置されている。好ましくは、これらのインサートは微粒子或いはビーズを具えている。幾つかの実施形態においては、これらのインサートは充分に小さく、雄型ルエルの傾斜部を貫通する内腔又は前述の弾性体シールを穿刺するカニューレの内腔を通ってアセンブリを分解することなく容器から取り出すことが可能である。他の実施形態においては、これらのインサートは容器の内部に保持されるのに充分な大きさを有し、或いは微粒子のような小さいインサートの脱出を防ぐために、メッシュやフィルターを設けることも可能である。更に別の実施形態においては、容器内に保持されるのに充分なサイズを持つ大きいインサートと、注射器胴部とストッパーによって限定された容器から取り出し可能なサイズを持つ小さいインサートとの組合せが用いられる。前述の実施形態においては、インサートは、注射器アセンブリの近くに置かれた磁場に呼応する、或いは呼応しない粒子で構成されてもよい。
【0051】
図15には、親和性分子410が採取容器と静脈アクセスエレメントとの間を連通する導管426の中に配置されている、本発明の別の実施形態が示されている。静脈アクセスエレメントは、カテーテル、血液採取セット、透析針セット、流体投与セット、血液透析針セット、アフェレーシス針、ポートアクセスエレメント或いは皮膚穿刺針等を有するチューブに取付けられた血液袋を具えている。幾つかの実施形態においては、静脈アクセスポイントが、経皮的穿刺によって静脈に直接に、或いは静脈に流体的に連通しているポートにアクセスすることによって静脈に間接的にアクセス可能である。導管は、好ましくはPVC等のポリマーのチューブの可撓性部分である。親和性分子は、導管の内部側壁面428に直接付着させて配置される。別の例では、親和性分子は、ビーズや微粒子等のインサートを導管に入れて導管内部に配置される。これらのインサートのサイズと形状は、これらが導管内部に維持され、サイズの制限やこれらを所定の位置に保持するための添加されたその他のエレメントによって、導管内部を自由に動き回ることがないように選ばれている。
【0052】
図15は、静脈穿刺針422、容器アクセス針424、及び親和性分子410を含み、両者間に延在する導管426を有する血液採取セット420を示している。この静脈穿刺針の両側に横方向に張り出した翼状エレメント430が静脈穿刺針422と一体化されている。この翼状エレメントは、静脈穿刺針422の内腔に導管426を対面させるのを助けるハブ432も構成している。導管426は、容器アクセス針424に直接或いは間接に対面可能である。間接的には、導管426は雌型ルエルコネクターと一体化可能であり、このコネクターは容器アクセス針に接合された雄型ルエルハブと一体化されている。好ましくは、容器アクセス針424の周囲には採取容器ホルダー440があり、血液採取チューブ又は血液保温ボトルを血液採取セット420に接続することを容易にしている。更に、導管の末端部分の周囲にはシールドエレメントが配置され、静脈アクセス針の末端をシールドしている。別の実施形態においては、静脈穿刺針がルエル作動弁等の弁に置き換えられている。ルエル作動弁の例は、Alaris Medical Systemsから販売されているAlarais SmartSite(登録商標) Needleless valve及びICU Medical から販売されているClave(登録商標) valve 等である。別の例では、静脈穿刺針は、Baxter International, Inc.から販売されているInterlink(登録商標) 等のストップ−コックポート又は分割隔壁ポートで置き換えられている。
【0053】
実施例1−高い親和性を有する抗体による空のポリスチレン製チューブの被覆
【0054】
アルブミンに対して高い親和性を有する抗体(10-8M 〜10-12 M)(アルブミン抗体)は多くの供給業者から購入可能である。ポリスチレン製チューブは消毒され、非特許文献1に概括されているように、アルブミン抗体が共有原子価的にチューブに結合される。この文献の全体は参考として本明細書に組み入れられている。短く云えば、チューブはpH5.0の100mMの燐酸ナトリウム緩衝液中で0.2%(v/v)のグルタルアルデヒドで室温で4時間前処理される。次ぎにチューブは、同じ緩衝液と抗体溶液中で2回洗浄され、この溶液は100mMの燐酸ナトリウムに2〜10ug/mLを添加することによってpH8.0に調製され、チューブに注入されて3時間、37℃に保温される。保温の後、チューブは0.9%の食塩水で2回洗浄される。洗浄の後、pH8.0の燐酸ナトリウム緩衝液中の100mMのリシンが37℃で1時間、チューブに入れられ、残っている自由アルデヒドをチューブの側面にブロックする。次ぎにチューブは0.05%のTween ( 登録商標)20を含むPBSを数回取り替えて洗浄される。次ぎに、従来から行われているようにチューブの組み立てと空にする作業が完了する。
【0055】
実施例2−被覆されたチューブへの血液採取
【0056】
実施例1で準備された被覆された空のチューブに患者から血液が吸引される。血液は約5〜90分(チューブを被覆するのに使用された抗体の親和性と濃度によって異なるが)、室温でチューブ内で保温可能であり、一方、チューブは静かに揺すられるか攪拌されて、アルブミンがチューブの側面の抗体と結合できるようにされる。チューブは室温で一晩保温可能である。
【0057】
実施例3−被覆されたチューブがアルブミンその他の阻害蛋白質を除去する能力のテスト
【0058】
実施例2で採取された血液は、次ぎに1100Gで約10分間、遠心分離作用を受け、成分毎に分離される。成分分離の後、アルブミンが除かれた血漿中の蛋白質は、本明細書中に参考として組み入れられている非特許文献2に記載されているように、2Dゲルの作用を受ける。2Dゲル電気泳動は、分子量と等電気点に基づいて残存蛋白質を分離する。分離された蛋白質は、次ぎに製造業者のプロトコールにしたがってMontage In-Gel Digest% Kit(登録商標) (Millipore Corp.)を用いて純化される。対象とする蛋白質は、非特許文献3に記載されているように、Axima CFR MALDI-TOF Mass Spectrometer (Kratos Analytical, Inc.) 上で、飛行質量分光分析のマトリックス補助によるレーザー脱離/イオン化時間(MALDI-TOF MS)を使用して、或いは液体クロマトグラフィーを使用して識別される。
【0059】
対象蛋白質の回復量は、実施例1において使用される抗体の濃度及び/又は親和性を変更することによって調節可能である。
【0060】
実施例4−ポリスチレン製のビーズに対する抗体の共有結合的連鎖
【0061】
50mMのpH7.0の燐酸ナトリウムの12.5%(v/v)のグルタルアルデヒド5mLを約25ヒドラジドの派生ポリスチレンビーズ(6.4mm直径; Pierce Chemical Company)に添加し、室温で約2時間、非常に静かに揺さぶる。次ぎにビーズは100mLの水とpH6.0の100mM燐酸ナトリウム緩衝液20mLによってBuchner ファンネル(フィルター紙無し)中で洗浄される。次ぎに、このグルタルアルデヒドによって活性化されたビーズは、2.5mgのAbを5mLの燐酸ナトリウム緩衝液に溶解して調製された抗体溶液中に入れられる。ビーズがこのAb溶液に入れられた後、1mgのNaCNBH3 がこの溶液に添加される。室温で一晩静かに揺すぶられる。揺すぶられた後、ビーズは100mLのpH6.0の100mM燐酸ナトリウム緩衝液で洗浄され、次ぎに5mLの100mMのNaHCO3で洗浄される。ビーズに残ったアルデヒドは、5mLの100mMリシンを用いて、室温で1時間保温されてブロックされる。リシンで保温された後、ビーズは100mLの100mMのNa2CO3と100mLの水で洗浄され、乾かされる。Abで被覆されたビーズは4℃で乾燥保存される。上述の方法は、非特許文献4に開示されている。
【0062】
本発明の種々の実施形態を説明したが、これらの実施例や実施形態は単なる例示に過ぎず、限定的なものではないことを銘記すべきである。本発明の範囲は、上述の如何なる実施形態によっても限定されるものではない。
【特許請求の範囲】
【請求項1】
容器と機械的密度分離器と親和性分子とを具えた血液採取装置であって、血液採取時において血液が最初に前記容器に入ることに伴って前記親和性分子が前記血液に曝されることを特徴とする装置。
【請求項2】
前記親和性分子が前記容器中に完全に含まれていることを特徴とすることを特徴とする請求項1に記載の装置。
【請求項3】
前記容器が少なくとも一つのインサートを具えていることを特徴とする請求項1に記載の装置。
【請求項4】
前記少なくとも一つのインサートが前記親和性分子を具えていることを特徴とする請求項3に記載の装置。
【請求項5】
前記少なくとも一つのインサートが一つ以上のビーズであることを特徴とする請求項4に記載の装置。
【請求項6】
前記少なくとも一つのインサートがパドルであることを特徴とする請求項4に記載の装置。
【請求項7】
前記親和性分子が望ましくない目標に対する親和性を有することを特徴とする請求項4に記載の装置。
【請求項8】
前記親和性分子が望ましい目標に対する親和性を有することを特徴とする請求項4に記載の装置。
【請求項9】
前記親和性分子が、抗体、抗体の破片、酵素、酵素の破片、酵素基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、アプタマー、ナノボディー、レセプターの破片、リガンド、酵素の破片、他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、天然及び合成ポリマーからなる群から選ばれていることを特徴とする請求項4に記載の装置。
【請求項10】
前記親和性分子が抗体又はその破片であることを特徴とする請求項9に記載の装置。
【請求項11】
前記抗体又はそれの破片が、前記血液中の少なくとも一つの蛋白質と結合していることを特徴とする請求項10に記載の装置。
【請求項12】
前記少なくとも一つの蛋白質が、アルブミン、イムノグロブリン、フィブリノーゲン、プロテアーゼ抑制物質、抗キモトリプシン、抗トロンビン、マクログロブリン、インターアルファトリプシン抑制物質、Cl抑制物質、プラスミン抑制物質、ヘパリン補因子II、トランフェリン、イムノグロブリンM、ハプトグロビン補体、アルファ−1アンチトリプシンからなる群から選ばれていることを特徴とする請求項11に記載の装置。
【請求項13】
前記蛋白質がアルブミンであることを特徴とする請求項12に記載の装置。
【請求項14】
前記親和性分子が前記容器の内部に被覆されていることを特徴とする請求項2に記載の装置。
【請求項15】
前記親和性分子が前記容器の側壁の内部に被覆されていることを特徴とする請求項14に記載の装置。
【請求項16】
前記内側側壁が隆起していることを特徴とする請求項15に記載の装置。
【請求項17】
前記親和性分子が望ましくない目標に親和性を有することを特徴とする請求項14に記載の装置。
【請求項18】
前記親和性分子が望ましい目標に親和性を有することを特徴とする請求項14に記載の装置。
【請求項19】
前記親和性分子が、抗体、抗体の破片、酵素、酵素の破片、酵素基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、アプタマー、ナノボディー、レセプターの破片、リガンド、酵素の破片、その他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、天然及び合成ポリマーからなる群から選ばれていることを特徴とする請求項14に記載の装置。
【請求項20】
前記親和性分子が抗体又はその破片であることを特徴とする請求項19に記載の装置。
【請求項21】
前記抗体又はその破片が前記血液中の少なくとも一つの蛋白質と結合することを特徴とする請求項20に記載の装置。
【請求項22】
前記少なくとも一つの蛋白質が、アルブミン、イムノグロブリン、フィブリノーゲン、プロテアーゼ抑制物質、抗キモトリプシン、抗トロンビン、マクログロブリン、インターアルファトリプシン抑制物質、Cl抑制物質、プラスミン抑制物質、ヘパリン補因子II、トランフェリン、イムノグロブリンM、ハプトグロビン補体、アルファ−1アンチトリプシンからなる群から選ばれていることを特徴とする請求項21に記載の装置。
【請求項23】
前記蛋白質がアルブミンであることを特徴とする請求項22に記載の装置。
【請求項24】
前記親和性分子が前記容器中に完全には含まれていないことを特徴とする請求項1に記載の装置。
【請求項25】
前記親和性分子が親和性コラム中に配置され、該親和性コラムは前記容器に連結されていることを特徴とする請求項1に記載の装置。
【請求項26】
前記親和性コラムの内壁が前記親和性分子を具えていることを特徴とする請求項25に記載の装置。
【請求項27】
前記親和性コラムがビーズを具えていることを特徴とする請求項25に記載の装置。
【請求項28】
前記ビーズが前記親和性分子を具えていることを特徴とする請求項27に記載の装置。
【請求項29】
前記親和性分子が望ましくない目標に対して親和性を有することを特徴とする請求項25に記載の装置。
【請求項30】
前記親和性分子が望ましい目標に対して親和性を有することを特徴とする請求項25に記載の装置。
【請求項31】
前記容器がチューブを具えていることを特徴とする請求項1に記載の装置。
【請求項32】
前記チューブが前記親和性分子を具えていることを特徴とする請求項31に記載の装置。
【請求項33】
前記親和性分子が前記チューブの内壁に被覆されていることを特徴とする請求項32に記載の装置。
【請求項34】
前記チューブが、更にビーズを具えていることを特徴とする請求項31に記載の装置。
【請求項35】
前記ビーズが前記親和性分子を具えていることを特徴とする請求項34に記載の装置。
【請求項36】
前記親和性分子が望ましくない目標に対して親和性を有することを特徴とする請求項31に記載の装置。
【請求項37】
前記親和性分子が望ましい目標に対して親和性を有することを特徴とする請求項31に記載の装置。
【請求項38】
液体から一つ以上の望ましい成分を分離するための方法であって、
針の外へ排出された液体が、最初に前記容器に入ることに伴って前記液化体を前記容器内に設けた親和性分子に曝すステップと、機械的密度分離器の使用によって前記液体の密度位相を分離するステップと、を含むことを特徴とする方法。
【請求項39】
容器と機械的密度分離器と親和性分子とを備えた装置を使用する方法であって、
針の外に排出された液体が、最初に前記容器に入ることに伴って前記液化体を前記容器内に設けた親和性分子に曝すステップを含むことを特徴とする方法。
【請求項40】
静脈にアクセスすることで前記採取を開始することを特徴とする請求項38または39に記載の方法。
【請求項41】
前記親和性分子が、抗体、抗体の破片、酵素、酵素の破片、酵素基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、アプタマー、ナノボディー、レセプターの破片、リガンド、酵素の破片、他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、天然及び合成ポリマーからなる群から選ばれていることを特徴とする請求項38または39に記載の方法。
【請求項42】
前記親和性分子が抗体又はその破片であることを特徴とする請求項41に記載の方法。
【請求項43】
前記抗体又はその破片が前記血液中の少なくとも一つの蛋白質に結合することを特徴とする請求項42に記載の方法。
【請求項44】
前記少なくとも一つの蛋白質が、アルブミン、イムノグロブリン、フィブリノーゲン、プロテアーゼ抑制物質、抗キモトリプシン、抗トロンビン、マクログロブリン、インターアルファトリプシン抑制物質、Cl抑制物質、プラスミン抑制物質、ヘパリン補因子II、トランフェリン、イムノグロブリンM、ハプトグロビン補体、アルファ−1アンチトリプシンからなる群から選ばれていることを特徴とする請求項43に記載の方法。
【請求項45】
前記蛋白質がアルブミンであることを特徴とする請求項44に記載の方法。
【請求項46】
前記親和性分子が前記容器中に完全に含まれていることを特徴とする請求項45に記載の方法。
【請求項47】
前記容器が少なくとも一つのインサートを具えていることを特徴とする請求項46に記載の方法。
【請求項48】
前記少なくとも一つのインサートが前記親和性分子を具えていることを特徴とする請求項47に記載の方法。
【請求項49】
前記親和性分子が、抗体、抗体の破片、酵素、酵素の破片、酵素基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、アプタマー、ナノボディー、レセプターの破片、リガンド、酵素の破片、他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、天然及び合成ポリマーからなる群から選ばれていることを特徴とする請求項48に記載の方法。
【請求項50】
前記親和性分子が抗体又はその破片であることを特徴とする請求項49に記載の方法。
【請求項51】
前記抗体又はその破片が前記血液中の少なくとも一つの蛋白質に結合することを特徴とする請求項50に記載の方法。
【請求項52】
前記少なくとも一つの蛋白質が、アルブミン、イムノグロブリン、フィブリノーゲン、プロテアーゼ抑制物質、抗キモトリプシン、抗トロンビン、マクログロブリン、インターアルファトリプシン抑制物質、Cl抑制物質、プラスミン抑制物質、ヘパリン補因子II、トランフェリン、イムノグロブリンM、ハプトグロビン補体、アルファ−1アンチトリプシンからなる群から選ばれていることを特徴とする請求項51に記載の方法。
【請求項53】
前記蛋白質がアルブミンであることを特徴とする請求項52に記載の方法。
【請求項54】
前記親和性分子が前記容器中に完全には含まれていない請求項38または39に記載の方法。
【請求項55】
前記親和性分子が親和性コラム中に配置され、該親和性コラムは前記容器に連結されていることを特徴とする請求項54に記載の方法。
【請求項56】
前記容器がチューブを具えていることを特徴とする請求項46に記載の方法。
【請求項57】
前記チューブが前記親和性分子を具えていることを特徴とする請求項56に記載の方法。
【請求項58】
液体から一つ以上の望ましい成分を分離するための方法であって、
a)親和性分子と機械的密度分離器とを備えた真空容器を準備し、
b)針の外に排出された液体が、最初に真空容器に入ることに伴って前記液化体を前記容器内に設けた親和性分子に曝す、ことを特徴とする方法。
【請求項59】
前記親和性分子が、アルブミン、イムノグロブリンG(IgG)、トランスフェリン、イムノグロブリンA(IgA)、イムノグロブリンM(IgM)及びα1アンチトリプシンからなる群から選ばれた少なくとも二つの分子を目標にしていることを特徴とする請求項58に記載の方法。
【請求項60】
前記目標分子がIgGとアルブミンであることを特徴とする請求項59に記載の方法。
【請求項61】
前記空のサンプル採取容器が、プロテアーゼ抑制物質、エチレンジアミンテトラ酢酸(EDTA)、クエン酸ナトリウム、ヘパリン、凝固因子からなる群から選ばれた添加物を具えていることを特徴とする請求項58に記載の方法。
【請求項62】
曝された液体のゲル電気泳動が、親和性分子の入っていない同じ空のサンプル採取容器に入っている同じ液体のゲル電気泳動と比べて可視的に判別可能な結果を示すことを特徴とする請求項58に記載の方法。
【請求項1】
容器と機械的密度分離器と親和性分子とを具えた血液採取装置であって、血液採取時において血液が最初に前記容器に入ることに伴って前記親和性分子が前記血液に曝されることを特徴とする装置。
【請求項2】
前記親和性分子が前記容器中に完全に含まれていることを特徴とすることを特徴とする請求項1に記載の装置。
【請求項3】
前記容器が少なくとも一つのインサートを具えていることを特徴とする請求項1に記載の装置。
【請求項4】
前記少なくとも一つのインサートが前記親和性分子を具えていることを特徴とする請求項3に記載の装置。
【請求項5】
前記少なくとも一つのインサートが一つ以上のビーズであることを特徴とする請求項4に記載の装置。
【請求項6】
前記少なくとも一つのインサートがパドルであることを特徴とする請求項4に記載の装置。
【請求項7】
前記親和性分子が望ましくない目標に対する親和性を有することを特徴とする請求項4に記載の装置。
【請求項8】
前記親和性分子が望ましい目標に対する親和性を有することを特徴とする請求項4に記載の装置。
【請求項9】
前記親和性分子が、抗体、抗体の破片、酵素、酵素の破片、酵素基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、アプタマー、ナノボディー、レセプターの破片、リガンド、酵素の破片、他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、天然及び合成ポリマーからなる群から選ばれていることを特徴とする請求項4に記載の装置。
【請求項10】
前記親和性分子が抗体又はその破片であることを特徴とする請求項9に記載の装置。
【請求項11】
前記抗体又はそれの破片が、前記血液中の少なくとも一つの蛋白質と結合していることを特徴とする請求項10に記載の装置。
【請求項12】
前記少なくとも一つの蛋白質が、アルブミン、イムノグロブリン、フィブリノーゲン、プロテアーゼ抑制物質、抗キモトリプシン、抗トロンビン、マクログロブリン、インターアルファトリプシン抑制物質、Cl抑制物質、プラスミン抑制物質、ヘパリン補因子II、トランフェリン、イムノグロブリンM、ハプトグロビン補体、アルファ−1アンチトリプシンからなる群から選ばれていることを特徴とする請求項11に記載の装置。
【請求項13】
前記蛋白質がアルブミンであることを特徴とする請求項12に記載の装置。
【請求項14】
前記親和性分子が前記容器の内部に被覆されていることを特徴とする請求項2に記載の装置。
【請求項15】
前記親和性分子が前記容器の側壁の内部に被覆されていることを特徴とする請求項14に記載の装置。
【請求項16】
前記内側側壁が隆起していることを特徴とする請求項15に記載の装置。
【請求項17】
前記親和性分子が望ましくない目標に親和性を有することを特徴とする請求項14に記載の装置。
【請求項18】
前記親和性分子が望ましい目標に親和性を有することを特徴とする請求項14に記載の装置。
【請求項19】
前記親和性分子が、抗体、抗体の破片、酵素、酵素の破片、酵素基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、アプタマー、ナノボディー、レセプターの破片、リガンド、酵素の破片、その他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、天然及び合成ポリマーからなる群から選ばれていることを特徴とする請求項14に記載の装置。
【請求項20】
前記親和性分子が抗体又はその破片であることを特徴とする請求項19に記載の装置。
【請求項21】
前記抗体又はその破片が前記血液中の少なくとも一つの蛋白質と結合することを特徴とする請求項20に記載の装置。
【請求項22】
前記少なくとも一つの蛋白質が、アルブミン、イムノグロブリン、フィブリノーゲン、プロテアーゼ抑制物質、抗キモトリプシン、抗トロンビン、マクログロブリン、インターアルファトリプシン抑制物質、Cl抑制物質、プラスミン抑制物質、ヘパリン補因子II、トランフェリン、イムノグロブリンM、ハプトグロビン補体、アルファ−1アンチトリプシンからなる群から選ばれていることを特徴とする請求項21に記載の装置。
【請求項23】
前記蛋白質がアルブミンであることを特徴とする請求項22に記載の装置。
【請求項24】
前記親和性分子が前記容器中に完全には含まれていないことを特徴とする請求項1に記載の装置。
【請求項25】
前記親和性分子が親和性コラム中に配置され、該親和性コラムは前記容器に連結されていることを特徴とする請求項1に記載の装置。
【請求項26】
前記親和性コラムの内壁が前記親和性分子を具えていることを特徴とする請求項25に記載の装置。
【請求項27】
前記親和性コラムがビーズを具えていることを特徴とする請求項25に記載の装置。
【請求項28】
前記ビーズが前記親和性分子を具えていることを特徴とする請求項27に記載の装置。
【請求項29】
前記親和性分子が望ましくない目標に対して親和性を有することを特徴とする請求項25に記載の装置。
【請求項30】
前記親和性分子が望ましい目標に対して親和性を有することを特徴とする請求項25に記載の装置。
【請求項31】
前記容器がチューブを具えていることを特徴とする請求項1に記載の装置。
【請求項32】
前記チューブが前記親和性分子を具えていることを特徴とする請求項31に記載の装置。
【請求項33】
前記親和性分子が前記チューブの内壁に被覆されていることを特徴とする請求項32に記載の装置。
【請求項34】
前記チューブが、更にビーズを具えていることを特徴とする請求項31に記載の装置。
【請求項35】
前記ビーズが前記親和性分子を具えていることを特徴とする請求項34に記載の装置。
【請求項36】
前記親和性分子が望ましくない目標に対して親和性を有することを特徴とする請求項31に記載の装置。
【請求項37】
前記親和性分子が望ましい目標に対して親和性を有することを特徴とする請求項31に記載の装置。
【請求項38】
液体から一つ以上の望ましい成分を分離するための方法であって、
針の外へ排出された液体が、最初に前記容器に入ることに伴って前記液化体を前記容器内に設けた親和性分子に曝すステップと、機械的密度分離器の使用によって前記液体の密度位相を分離するステップと、を含むことを特徴とする方法。
【請求項39】
容器と機械的密度分離器と親和性分子とを備えた装置を使用する方法であって、
針の外に排出された液体が、最初に前記容器に入ることに伴って前記液化体を前記容器内に設けた親和性分子に曝すステップを含むことを特徴とする方法。
【請求項40】
静脈にアクセスすることで前記採取を開始することを特徴とする請求項38または39に記載の方法。
【請求項41】
前記親和性分子が、抗体、抗体の破片、酵素、酵素の破片、酵素基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、アプタマー、ナノボディー、レセプターの破片、リガンド、酵素の破片、他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、天然及び合成ポリマーからなる群から選ばれていることを特徴とする請求項38または39に記載の方法。
【請求項42】
前記親和性分子が抗体又はその破片であることを特徴とする請求項41に記載の方法。
【請求項43】
前記抗体又はその破片が前記血液中の少なくとも一つの蛋白質に結合することを特徴とする請求項42に記載の方法。
【請求項44】
前記少なくとも一つの蛋白質が、アルブミン、イムノグロブリン、フィブリノーゲン、プロテアーゼ抑制物質、抗キモトリプシン、抗トロンビン、マクログロブリン、インターアルファトリプシン抑制物質、Cl抑制物質、プラスミン抑制物質、ヘパリン補因子II、トランフェリン、イムノグロブリンM、ハプトグロビン補体、アルファ−1アンチトリプシンからなる群から選ばれていることを特徴とする請求項43に記載の方法。
【請求項45】
前記蛋白質がアルブミンであることを特徴とする請求項44に記載の方法。
【請求項46】
前記親和性分子が前記容器中に完全に含まれていることを特徴とする請求項45に記載の方法。
【請求項47】
前記容器が少なくとも一つのインサートを具えていることを特徴とする請求項46に記載の方法。
【請求項48】
前記少なくとも一つのインサートが前記親和性分子を具えていることを特徴とする請求項47に記載の方法。
【請求項49】
前記親和性分子が、抗体、抗体の破片、酵素、酵素の破片、酵素基体、酵素基体の破片、ヌクレオチド、オリゴヌクレオチド、ポリヌクレオチド、レセプター、アプタマー、ナノボディー、レセプターの破片、リガンド、酵素の破片、他の蛋白質、アミノ酸、ペプチド、ポリペプチド、オリゴペプチド、サッカリド、ジサッカリド、ポリサッカリド、糖蛋白質、天然及び合成ポリマーからなる群から選ばれていることを特徴とする請求項48に記載の方法。
【請求項50】
前記親和性分子が抗体又はその破片であることを特徴とする請求項49に記載の方法。
【請求項51】
前記抗体又はその破片が前記血液中の少なくとも一つの蛋白質に結合することを特徴とする請求項50に記載の方法。
【請求項52】
前記少なくとも一つの蛋白質が、アルブミン、イムノグロブリン、フィブリノーゲン、プロテアーゼ抑制物質、抗キモトリプシン、抗トロンビン、マクログロブリン、インターアルファトリプシン抑制物質、Cl抑制物質、プラスミン抑制物質、ヘパリン補因子II、トランフェリン、イムノグロブリンM、ハプトグロビン補体、アルファ−1アンチトリプシンからなる群から選ばれていることを特徴とする請求項51に記載の方法。
【請求項53】
前記蛋白質がアルブミンであることを特徴とする請求項52に記載の方法。
【請求項54】
前記親和性分子が前記容器中に完全には含まれていない請求項38または39に記載の方法。
【請求項55】
前記親和性分子が親和性コラム中に配置され、該親和性コラムは前記容器に連結されていることを特徴とする請求項54に記載の方法。
【請求項56】
前記容器がチューブを具えていることを特徴とする請求項46に記載の方法。
【請求項57】
前記チューブが前記親和性分子を具えていることを特徴とする請求項56に記載の方法。
【請求項58】
液体から一つ以上の望ましい成分を分離するための方法であって、
a)親和性分子と機械的密度分離器とを備えた真空容器を準備し、
b)針の外に排出された液体が、最初に真空容器に入ることに伴って前記液化体を前記容器内に設けた親和性分子に曝す、ことを特徴とする方法。
【請求項59】
前記親和性分子が、アルブミン、イムノグロブリンG(IgG)、トランスフェリン、イムノグロブリンA(IgA)、イムノグロブリンM(IgM)及びα1アンチトリプシンからなる群から選ばれた少なくとも二つの分子を目標にしていることを特徴とする請求項58に記載の方法。
【請求項60】
前記目標分子がIgGとアルブミンであることを特徴とする請求項59に記載の方法。
【請求項61】
前記空のサンプル採取容器が、プロテアーゼ抑制物質、エチレンジアミンテトラ酢酸(EDTA)、クエン酸ナトリウム、ヘパリン、凝固因子からなる群から選ばれた添加物を具えていることを特徴とする請求項58に記載の方法。
【請求項62】
曝された液体のゲル電気泳動が、親和性分子の入っていない同じ空のサンプル採取容器に入っている同じ液体のゲル電気泳動と比べて可視的に判別可能な結果を示すことを特徴とする請求項58に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2011−158480(P2011−158480A)
【公開日】平成23年8月18日(2011.8.18)
【国際特許分類】
【出願番号】特願2011−43195(P2011−43195)
【出願日】平成23年2月28日(2011.2.28)
【分割の表示】特願2006−502993(P2006−502993)の分割
【原出願日】平成16年2月13日(2004.2.13)
【出願人】(595117091)ベクトン・ディキンソン・アンド・カンパニー (539)
【氏名又は名称原語表記】BECTON, DICKINSON AND COMPANY
【住所又は居所原語表記】1 BECTON DRIVE, FRANKLIN LAKES, NEW JERSEY 07417−1880, UNITED STATES OF AMERICA
【Fターム(参考)】
【公開日】平成23年8月18日(2011.8.18)
【国際特許分類】
【出願日】平成23年2月28日(2011.2.28)
【分割の表示】特願2006−502993(P2006−502993)の分割
【原出願日】平成16年2月13日(2004.2.13)
【出願人】(595117091)ベクトン・ディキンソン・アンド・カンパニー (539)
【氏名又は名称原語表記】BECTON, DICKINSON AND COMPANY
【住所又は居所原語表記】1 BECTON DRIVE, FRANKLIN LAKES, NEW JERSEY 07417−1880, UNITED STATES OF AMERICA
【Fターム(参考)】
[ Back to top ]

