血清中の脂質成分の分析方法および分析装置
【課題】従来よりも少ない工程で簡易に脂質成分を検出することができる分析方法、および分析装置を提供する。
【解決手段】血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第1の総酸濃度計測工程と;前記第1の総酸濃度計測工程後に、前記血清中の各種脂質成分と、前記各種脂質成分と特異的に作用する1又は2以上の酵素とを反応させて、脂肪酸を生成させる脂肪酸生成工程と;前記脂肪酸生成工程後に、前記血清を含む測定溶液の総酸濃度を、前記水溶性キノン誘導体存在下で電気化学計測する第2の総酸濃度計測工程と;前記第1の総酸濃度計測工程と前記第2の総酸濃度計測工程とで計測されるそれぞれの前記総酸濃度とに基づき、前記測定溶液に含まれる血清中の脂質成分濃度を算出する脂質成分濃度算出工程とを有する、血清中の脂質成分の分析方法。
【解決手段】血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第1の総酸濃度計測工程と;前記第1の総酸濃度計測工程後に、前記血清中の各種脂質成分と、前記各種脂質成分と特異的に作用する1又は2以上の酵素とを反応させて、脂肪酸を生成させる脂肪酸生成工程と;前記脂肪酸生成工程後に、前記血清を含む測定溶液の総酸濃度を、前記水溶性キノン誘導体存在下で電気化学計測する第2の総酸濃度計測工程と;前記第1の総酸濃度計測工程と前記第2の総酸濃度計測工程とで計測されるそれぞれの前記総酸濃度とに基づき、前記測定溶液に含まれる血清中の脂質成分濃度を算出する脂質成分濃度算出工程とを有する、血清中の脂質成分の分析方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血清中の脂質成分を分析する方法、およびそれに用いる分析装置に関する。
【背景技術】
【0002】
血清に含まれる脂質成分を検出する方法として、酵素法がよく知られている。現在主として用いられている脂質成分を検出する酵素法では、4種類あるいは3種類の異なる酵素及び数多くの試薬を用い、最終的に生成された物質を呈色反応させるなどして、脂質成分の定量を行っている。例えば血清に含まれる脂質成分、具体的にはコレステロール脂肪酸エステル、グリセリン脂肪酸エステルおよびリン脂質などの各脂質成分の濃度の分析方法において、酵素反応により各脂質成分から生じた脂肪酸を測定することで、血清中の脂質成分の濃度を定量する手法が知られている(例えば、特許文献1参照)。
【0003】
上記特許文献1に開示されている方法を用いて血清に含まれる脂質成分の測定を行う工程を図1に示す。図1に示すように、(脂質成分から脂肪酸及び有機酸を生成させる前における)血清を含む測定溶液の総酸濃度を計測する第1工程11と、血清中の各種脂質成分にそれぞれ特異的に作用する酵素を用いて脂肪酸及び有機酸を生成する第2工程12と、第2工程12において脂肪酸及び有機酸が生成した後にキノン誘導体を導入して血清中の総酸濃度を計測する第3工程13と、第1工程11における計測値と第3工程13における計測値に基づいて前記血清中の各種脂質成分濃度を算出する第4工程14の4つの工程が必要である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平11−89595号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、上記特許文献1に開示されている血清に含まれる脂質成分の測定方法は、キノン誘導体を溶解させるために、第3工程において有機溶媒を使用する必要がある。この有機溶媒は、血清の凝集、及び脂質成分から脂肪酸を生成させるための酵素の活性低下を引き起す。そのため、酵素反応を行う第2工程12を、有機溶媒を必要とするキノン誘導体存在下で行うことは好ましくない。仮に、第2工程12の酵素反応を有機溶媒存在下で行った場合には、第3工程13の計測の前に、凝集物を除去するために測定溶液をフィルタ処理しなければならず、酵素反応を行う反応槽と、キノン誘導体と有機溶媒を含む電気化学測定を行う反応槽とは別個にする必要があった。このように、上記特許文献1に開示されている測定方法では測定工程数が多くなり、また操作が煩雑になるという課題を有していた。
【0006】
本発明は、従来よりも少ない工程で、簡易に血清中の脂質成分を検出することができる分析方法、および分析装置を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明の血清中の脂質成分の分析方法は、以下の工程1)〜4)を有する。
1)血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第1の総酸濃度計測工程。
2)第1の総酸濃度計測工程後に、前記血清中の各種脂質成分と、前記各種脂質成分と特異的に作用する1又は2以上の酵素とを反応させて、脂肪酸を生成させる脂肪酸生成工程。
3)脂肪酸生成工程後に、前記血清を含む測定溶液の総酸濃度を、前記水溶性キノン誘導体存在下で電気化学計測する第2の総酸濃度計測工程。
4)前記第1の総酸濃度計測工程と前記第2の総酸濃度計測工程で計測されるそれぞれの総酸濃度に基づき、前記測定溶液に含まれる血清中の脂質成分濃度を算出する脂質成分濃度算出工程。
【0008】
第1の総酸濃度計測工程および第2の総酸濃度計測工程における、好ましい「水溶性キノン誘導体存在下での電気化学計測」は、ボルタンメトリーにより測定溶液のボルタモグラムを得る工程と、得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波の変化量に基づいて総酸濃度を計測する工程とを含む。
【0009】
還元前置波の変化量とは、測定試料で得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波のピーク電流値と、総酸濃度が0である場合の還元前置波または酵素処理をする前(酵素未処理)の血清中の総酸濃度における還元前置波のピーク電流値との差異であるか;または、測定試料で得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波の電荷量と、総酸濃度が0である場合の還元前置波または酵素処理をする前(酵素未処理)の血清中の総酸濃度における還元前置波の電荷量との差異でありうる。
なお、総酸濃度が0である場合の還元前置波のピーク電流値は0であるので、得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波のピーク電流値自体が変化量となる。
【0010】
従来の酵素法による脂質成分検出法では、血清を含む測定溶液の総酸濃度を電気化学計測するために水不溶性キノン誘導体を用いるため、水不溶性キノン誘導体を溶解するための有機溶媒を測定溶液に加える必要があった。ところが、有機溶媒を測定サンプルに加えると、有機溶媒により血清が凝集し、かつ使用する酵素の活性が低下する。そのため、脂肪酸生成工程を、有機溶媒を必要とするキノン誘導体存在下で行うことは好ましくない。
【0011】
これに対して本発明では、水不溶性キノン誘導体を用いる従来の方法と異なり、血清を含む測定溶液の総酸濃度を電気化学計測するために水溶性キノン誘導体を用いる。水溶性キノン誘導体の血清への溶解度は高いので、キノン誘導体を溶解させるための有機溶媒を測定溶液に加える必要がない。もちろん、酵素反応後に測定溶液の溶媒を有機溶媒に置換したり、凝集が生じないので測定溶液をフィルタ処理する必要もない。さらに、有機溶媒による酵素の失活の危険性もない。つまり本発明では、酵素による脂肪酸生成工程を、水溶性キノン誘導体存在下で行うことができる。そのため、本発明の分析法は、従来法よりも工程が少なく、簡便な操作で短時間に脂質成分を分析することができる。
【0012】
血清中の脂質成分は、コレステロール脂肪酸エステル、グリセリン脂肪酸エステル、またはリン脂質を含むことが好ましい。これらは臨床的に重要な測定項目であるからである。
【0013】
本発明の血清中の脂質成分の分析方法および分析装置は、血清を含む測定溶液中の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する。水溶性キノン誘導体は、水溶媒に1mM以上溶解可能なベンゾキノン誘導体でありうる。測定対象となる血清中の脂質成分よりもベンゾキノン誘導体の溶解量が多くなければ、脂質成分を測定することができないからである。また、ヒト血清中には、遊離脂肪酸(基準値 100μEq/L〜800μEq/L)や乳酸(成人基準値 4mg/dL〜16mg/dL)などの酸が含まれていると考えられ、これら血清中に含まれる酸の濃度よりもベンゾキノン誘導体が十分高い濃度で測定溶液に溶解しなければ、血清中の脂質成分を測定することができないためである。
【0014】
前記ベンゾキノン誘導体の酸化還元電位は、−400mV〜1000mVの範囲でありうる。酸化還元電位が−400mV未満では、測定溶液の溶媒中の溶存酸素の影響を受けて正確な電気化学的シグナルを測定することが難しく、一方、酸化還元電位が1000mVを超えると、分析装置の電極(作用電極、対極など)が溶媒中に溶出する恐れがあるためである。
【0015】
また、前記ベンゾキノン誘導体は、それを用いて血清中の酸濃度を電気化学的に測定が可能であるものである。ベンゾキノン誘導体を用いて酸濃度を電気化学的に測定するとは、ボルタンメトリーを利用して酸濃度を測定することである。具体的には、分析対象である酸とキノン誘導体と電解質とを含む測定溶液に電位を掃印し、その過程で発生する電流を計測してボルタモグラムを得る。得られるボルタモグラムには、測定溶液中に酸が存在する場合にのみ、キノン誘導体の還元前置波が観測される。キノン誘導体の還元前置波に基づいて、酸の濃度を求める。したがって、前記ベンゾキノン誘導体には、ボルタモグラムに還元前置波を生じさせることが求められる。
【0016】
さらに、前記ベンゾキノン誘導体は、2,3-Dimethoxy-5-methyl-p-benzoquinone、または2,6-Dimethyl-1,4-benzoquinoneでありうる。これらは水溶媒に高濃度で溶解しやすく、試薬として用いた際安定であるためである。
【0017】
本発明のある実施形態の血清中の脂質成分の分析装置は、以下の部材を有する。
1)血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体の存在下で電気化学計測する第1の総酸濃度計測部。
2)血清中の各種脂質成分と、各種脂質成分と特異的に作用する1又は2以上の酵素とを反応させて、脂肪酸を生成させる脂肪酸生成部。
3)脂肪酸生成工程後に、前記血清を含む測定溶液の総酸濃度を、前記水溶性キノン誘導体存在下で電気化学計測する第2の総酸濃度計測部。
4)前記第1の総酸濃度計測工程と前記第2の総酸濃度計測工程とで得られるそれぞれの前記血清中の総酸濃度とに基づき、前記血清中の脂質成分濃度を算出する脂質成分濃度算出部。
【0018】
ここで本発明の分析装置は、1)第1の総酸濃度計測部と、2)脂肪酸生成部と、3)第2の総酸濃度計測部とが同一反応槽であることを特徴とする装置である。すなわち、1)第1の総酸濃度計測部と、2)脂肪酸生成部と、3)第2の総酸濃度計測部は、いずれも反応槽であるが、1つの反応槽を共有する。前記反応槽には、測定溶液を収容する反応場と、反応場に収容される測定溶液に接触する作用電極および対極と、を具備する。
【0019】
反応場に収容された測定溶液は、ボルタンメトリー法によりボルタモグラムを測定される。そして、得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波の変化量に基づいて総酸濃度を測定する。
【0020】
従来の酵素法を用いた測定法では、血清を含む測定溶液の総酸濃度を電気化学計測するために水不溶性キノン誘導体を用いるため、有機溶媒を使用する必要があるが、有機溶媒を使用すると血清が凝集し、酵素の活性が低下する。そのため、従来の酵素法を用いた測定法を実施するための装置は、血清中の各種脂質成分にそれぞれ特異的に作用する酵素を用いて脂肪酸を生成するための反応槽と、脂肪酸が生成された後にキノン誘導体存在下で血清中の総酸濃度を計測するための反応槽とを、別個に具備する必要があった。
【0021】
これに対して本発明では、水不溶性キノン誘導体を用いる従来法と異なり、血清を含む測定溶液の総酸濃度を電気化学計測するために水溶性キノン誘導体を用いる。水溶性キノン誘導体は血清への溶解度が高いため、キノン誘導体を有機溶媒に溶解させたり、測定溶液の溶媒を有機溶媒に置換したりする必要がない。従って、本発明の分析法を実施するための装置では、一つの反応槽で、酵素反応による脂肪酸生成と、キノン誘導体存在下での総酸濃度の電気化学的測定とを行うことができる。さらに、本発明の分析装置では、測定溶液の溶媒に有機溶媒を含む必要がないので、カーボンペースト電極などの安価な電極を採用することも可能である。結果として、従来よりも、簡易な構成で迅速、安価に測定することが可能である。
【発明の効果】
【0022】
本発明の血清中の脂質成分の分析方法では、血清を含む測定溶液の総酸濃度を電気化学計測するために水不溶性キノン誘導体を用いる従来法と異なり、水溶性キノン誘導体を用いる。水溶性キノン誘導体は血清への溶解度が高いため、キノン誘導体を有機溶媒に溶解させたり、測定溶液の溶媒を有機溶媒に置換したりする必要がない。従って、キノン誘導体存在下で酵素による脂肪酸生成工程を行っても、有機溶媒による血清の凝集が生じることがなく、測定溶液をフィルタ処理する必要がない。もちろん、、有機溶媒による酵素の失活が生じる危険性もない。このように、本発明の分析法は、従来法よりも少ない工程で短時間に脂質成分の分析を高精度にすることができる。
【図面の簡単な説明】
【0023】
【図1】従来例による検出手順を示したフローチャート
【図2】本発明による検出手順を示したフローチャート
【図3】本発明の分析装置の構成を示すブロック図
【図4】DMBQで酸測定を行ったリニアスイープボルタモグラム(参照実験1参照)
【図5】DMBQで酸を定量した結果を示す図(参照実験1参照)
【図6】2,3-Dimethoxy-5-methyl-p-benzoquinoneを用いて酸測定を行ったサイクリックボルタモグラム(参照実験2参照)
【図7】2,3-Dimethoxy-5-methyl-p-benzoquinoneを用いて酸を定量した結果を示す図(参照実験2参照)
【図8】DBBQで血清中遊離脂肪酸および総酸(血清遊離脂肪酸+血清TG由来脂肪酸)を測定したリニアスイープボルタモグラム(参照実験3参照)
【図9】DMBQで血清中遊離脂肪酸および総酸(血清遊離脂肪酸+血清TG由来脂肪酸)を測定したリニアスイープボルタモグラム(実施の形態1参照)
【図10】DMBQで血中TGを定量した結果を示す図(実施の形態2参照)
【発明を実施するための形態】
【0024】
以下に、本発明の血清中の脂質成分の分析方法および分析装置の実施の形態を図面とともに詳細に説明する。
【0025】
1.本発明の分析方法
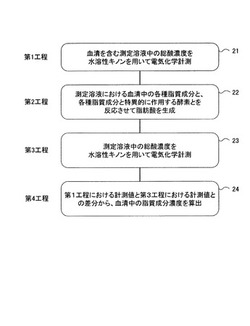
本発明の血清中の脂質成分を分析する手順(第1工程〜第4工程)を図2に示す。1)血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第1工程21と、2)前記血清中の各種脂質成分と、各種脂質成分と特異的に作用する酵素とを反応させて脂肪酸を生成させる第2工程22と、3)脂肪酸を生成させた後に、血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第3工程23と、4)第1工程21において計測された総酸濃度と、第3工程23において計測された総酸濃度とに基づいて、前記血清中の脂質成分濃度を算出する第4工程24とを含む。以下に、各工程について詳細な説明を行う。
【0026】
[第1工程21:血清を含む測定溶液の総酸濃度の計測]
第1の工程21では、血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体の存在下で電気化学的に測定する。より具体的には、ボルタンメトリーを利用して総酸濃度を測定する。
【0027】
まず、血清を含む測定溶液を準備する。測定溶液には、溶媒と血清以外に、水溶性キノン誘導体および電解質を含有する。測定溶液中の酸濃度を電気化学的に測定する際に、測定溶液中に酸が存在すると、キノン誘導体は酸(プロトン供与体)により多段階反応をおこして、ボルタモグラムに還元前置波を生じさせる。電解質は、溶液中の測定物質と電極との間で起こる電子伝達を容易にする。
【0028】
血清を含む測定溶液中の酸の濃度を電気化学的に測定する。具体的には、酵素処理によって血清中の脂質成分を脂肪酸に分解する(第2工程22)前に、血清を含む測定溶液に電荷をかけ、電荷をかける過程で発生する電流を計測してボルタモグラムを得る。得られるボルタモグラムには、酸が測定溶液中に存在する場合にのみ、特徴的な還元前置波が観測される。ボルタモグラムにおける還元前置波の変化量を求めることによって、血清を含む測定溶液の総酸濃度が測定される。
【0029】
ボルタモグラムにおける還元前置波の変化量とは、還元前置波のピーク電流値の変化量、または還元前置波の電荷量の変化でありうる。還元前置波のピークが確認できる場合には、ピーク電流値の大きさに基づいて総酸濃度を測定することができる。しかしながら、還元前置波のピークは、測定溶液の組成によって確認できたり、できなかったりする。例えば、測定溶液に緩衝液が含まれていると、還元前置波のピークが確認できないことがある(実施の形態2を参照)。還元前置波のピークが確認できない場合には、還元前置波の電荷量の変化に基づいて総酸濃度を測定することができる。
【0030】
測定溶液において、脂肪酸は強いプロトン供与体として作用し、測定溶液中に共存する水溶性キノン誘導体にプロトンを与える。脂肪酸のようなプロトン供与体によってプロトンを供与されたキノン誘導体は、キノン誘導体単体よりも易還元性である。そのため、プロトンを供与されたキノン誘導体は、ボルタモグラムにおいてキノン誘導体が通常示す還元波とは別の還元波を生じさせる。このキノン誘導体が通常示す還元波とは別に生じる還元波を「キノン誘導体の還元前置波」と称する。「キノン誘導体の還元前置波」は「キノン誘導体が通常示す還元波」よりも、正電位側に生じることもあるし、負電位側に生じることもある。
【0031】
キノン誘導体の還元前置波の変化量は、溶液中の酸の濃度と比例関係にあることが分かっており、予め既知の酸濃度の溶液で求めておいた検量線に照らし合わせることで、測定溶液中の総酸濃度を正確に定量することができる。
【0032】
ボルタモグラムにおいて、キノン誘導体の還元前置波が観測される位置(電位)は、プロトン供与体である酸(主に脂肪酸)の種類によってほとんど変化しない。そのため、血清中に多種類の脂肪酸が存在していても、キノン誘導体の還元前置波の変化量に基づいて、測定溶液中の酸の合計量を正確に測定することができる。
【0033】
測定溶液に含まれる、水溶性キノン誘導体、電解質、あるいは溶媒の種類や量は、ボルタモグラムにキノン誘導体の還元前置波が生じ、その還元前置波の変化量が酸濃度に比例するように選択および設定されればよい。
【0034】
水溶性キノン誘導体は、例えば、オルトベンゾキノン誘導体もしくはパラベンゾキノン誘導体などのベンゾキノン誘導体でありうる。ベンゾキノン誘導体は、ボルタモグラムにおける還元前置波の位置が、測定溶液中の溶存酸素の還元波形の位置と大きく異なるため、測定溶液の溶存酸素を除去せずとも正確に酸の濃度分析を行うことができるからである。
【0035】
また、測定に用いる水溶性キノン誘導体は、水への溶解度が高いほど好ましい。上述した通り、測定対象となる血清中の脂質成分よりもベンゾキノン誘導体の溶解量が多くなければ、脂質成分を測定することができない。血清中には、遊離脂肪酸(基準値 100μEq/L〜800μEq/L)や、乳酸(成人基準値 4mg/dL〜16mg/dL)などの酸が存在していると考えられる。これらの血清中の酸濃度よりもベンゾキノン誘導体が十分高い濃度で存在しなければ、脂質成分を測定できないため、キノン誘導体の水への溶解量は1mM以上であることが好ましい。
【0036】
水への溶解量が1mM以上であるキノン誘導体の種類は少ないが、例えば2,3-Dimethoxy-5-methyl-p-benzoquinone、および2,6-Dimethyl-1,4-benzoquinone(「DMBQ」ともいう)が好ましい。
【0037】
さらに、水溶性キノン誘導体の酸化還元電位が−400mV〜1000mVであることが好ましい。水溶性キノン誘導体の酸化還元電位が−400mV未満であると、測定溶液中の溶存酸素の影響を受けて、正確な電気化学的シグナルを測定することができない。一方、水溶性キノン誘導体の酸化還元電位が1000mV以上であると、分析装置の電極が測定溶液中に溶出するおそれがある。
【0038】
これらの条件を満たす水溶性キノン誘導体として、特に2,3-Dimethoxy-5-methyl-p-benzoquinone(「DMBQ」ともいう)が好ましい。
【0039】
測定溶液中の水溶性キノン誘導体の濃度の目安は1mM以上である。測定溶液中の水溶性キノン誘導体の濃度は、測定対象物の濃度よりも、十分高い濃度でなければ測定が実現できない。想定される血清中の酸のバックグラウンドは、主に遊離脂肪酸(基準値 100μEq/L〜800μEq/L)、乳酸(成人基準値 4mg/dL〜16mg/dL)などであるので、これらを鑑みて1mM以上とすることが好ましい。
【0040】
電界質は、塩化カリウムや塩化ナトリウムなどの水溶性の電解質である。測定溶液における電解液の濃度は、電気化学測定可能な濃度であれば、特に限定されず、適宜測定に応じて設定される。一般的な電界質濃度は、10〜200mM程度である。
【0041】
測定溶液の溶媒は、有機溶媒を含まない水であることが好ましい。好ましくない有機溶媒には、アルコールなどの水溶性有機溶媒を含む。有機溶媒は、測定溶液における血清を凝集させることがあるからである。血清を含む測定溶液に有機溶媒が添加されると、測定溶液中で血清が凝集する。測定溶液中の凝集は、酸濃度を電気化学的に測定しようとするときに測定ノイズを生じさせるため、電気化学測定前にフィルタによる測定溶液をろ過する必要がある。本発明では、測定溶液に有機溶媒を添加する必要がないので、フィルタ操作を必要としない。
【0042】
また、測定溶液の溶媒を水とすると、凍結乾燥試薬を用いることが可能になるという利点もある。さらに、有機溶媒に溶出するために使用できなかったカーボンペースト電極などの安価な電極を、分析装置の電極として採用することも可能になる。
【0043】
[第2工程22:酵素反応による血清中の脂質成分からの脂肪酸の生成]
第2の工程22では、血清を含む測定溶液中に、各種脂質成分のみに特異的に作用するような酵素を混合して、脂質成分から脂肪酸を生成させる。脂質成分と酵素の種類によっては、脂肪酸以外の有機酸が生成されることもある。酵素は、第1工程21で電気化学測定される測定溶液に、予め添加されていてもよいし;第1工程21での電気化学測定後の測定溶液に、添加されてもよい。
【0044】
従来法のように、測定溶液中に有機溶媒が存在すると、脂質成分と反応させるための酵素の活性が低下し、測定感度が低下する恐れがあった。そのため、有機溶媒を含有する測定溶液中において、脂質成分と酵素とを反応させることはできなかった。つまり、従来法のように、水不溶性キノン誘導体を用いると有機溶媒を用いざるを得ないため、キノン誘導体の存在下で脂質成分と酵素とを反応させることはできなかった。
【0045】
一方、本発明では、水溶性キノン誘導体を用いるため、測定溶液に有機溶媒を含ませる必要がない。そのため、キノン誘導体を含む測定溶液中で、血清中の脂質成分と酵素とを反応させることができる。つまり、測定溶液中に血清と酵素とキノン誘導体とを共存させても、血清の凝集を抑制することが可能となり、測定溶液中の酸濃度を電気的に測定(第3工程23)する前に、測定溶液をろ過処理する必要もなくなる。そのため、従来の酵素反応を用いた脂質成分の測定法よりも迅速で簡便に血清中の脂質成分を測定可能になった。
【0046】
各種脂質成分のみに特異的に作用する酵素について以下に述べる。各種脂質成分から遊離脂肪酸を生成する例として知られているもののうち、血清中のコレステロール脂肪酸エステルを、コレステロールエステラーゼによって加水分解して遊離型コレステロールと遊離脂肪酸を生成するものがある。その反応式を以下に示す。
【化1】

【0047】
また、血清中のグリセリン脂肪酸エステルを、リポプロテインリパーゼによって加水分解してグリセロールと遊離脂肪酸を生成するものがある。その反応式を以下に示す。グリセリン脂肪酸エステルのグリセロールにエステル結合している脂肪酸の数は、1〜3個の何れかであるが、血清に含まれるグリセリン脂肪酸エステルのうち90〜95%が3個の脂肪酸がエステル結合したトリグリセリドであることが判っている。そのため、ここでグリセリン脂肪酸エステルとトリグリセリン脂肪酸エステルは、ほぼ同意と考えられる。従って、血清中のグリセリン脂肪酸エステルを分析対象にする場合、グリセリン脂肪酸エステル1分子から3個の遊離脂肪酸が生成すると考えても差し支えない。
【化2】

【0048】
更に、血清中のリン脂質を、ホスホリパーゼAによって加水分解して遊離脂肪酸を生成するものがある。その反応式を以下に示す。以下に示す化学式における「リン脂質」という語は、単一の化学物質を示すものではなく、ホスファチジルコリン、スフィンゴミエリン、ホスファチジルエタノールアミン等の化合物の総称である。例示した化合物を含むリン脂質の大部分から、ホスホリパーゼAによって遊離脂肪酸が生成する。
【化3】

【0049】
各種脂質成分からの酵素による脂肪酸生成反応は、上に例示した反応のみを対象とするものではなく、各種脂質成分から特異的に脂肪酸を生成できる方法であればいずれも利用することができる。ただし、酵素による脂質成分からの脂肪酸生成反応は、簡便性を考慮すると1段階反応で各種脂質成分から脂肪酸を生成するものを選ぶ方が望ましい。
【0050】
上記の各種酵素類の起源は、特に指定されるものではなく、動物臓器、微生物さらには遺伝子操作等により人工的に作製・改変したDNAを用いたもの、等々いかなる起源由来のものであってもよい。注意すべきことは、酵素反応によって生成される物質が、次の測定、すなわち脂肪酸の分析(水溶性キノン誘導体存在下での電気化学測定)を阻害しないことである。上に例示した酵素反応においては問題になるようなことは見出せなかった。
【0051】
本発明で用いる酵素類として例示した酵素は、全て市販のものをそのまま利用することができる。酵素使用量や使用時の反応温度、反応時間等々の諸条件は、発売元が望ましいとして提示している数字をそのまま利用することも可能であるが、分析者が目的に応じて設定を自由に変更することも可能である。
【0052】
[第3工程23:酵素反応後の測定溶液の総酸濃度の計測]
第3工程23では、第2工程22での酵素反応によって脂質成分から脂肪酸を生成させた後、第1工程21と同様に、水溶性キノン誘導体および電解質の存在下で、測定溶液の総酸濃度を、ボルタンメトリーを利用して電気化学的に測定する。
【0053】
第1工程21において、測定溶液に水溶性キノン誘導体および電解質は添加してあるので、第3工程23においてさらにそれらを添加混合する必要は必ずしもないが、さらに追添加してもよい。
【0054】
[第4工程24:血清中の脂質成分濃度の算出]
第4工程24では、第1工程21における総酸濃度の計測値と第3工程23における総酸濃度の計測値とに基づいて、前記測定溶液に含まれる血清中の脂質成分濃度を算出する。具体的には、第3工程23で計測した酵素反応後の総酸量と、第1工程21で計測した酵素反応前の総酸量との差を算出することによって、第2工程22の酵素反応によって各種脂質成分から生成した脂肪酸の量が定量される。定量された各種脂質成分由来の脂肪酸の量から、血清中に存在していた各種脂質成分の定量が可能となる。
【0055】
酵素の種類によって脂肪酸を発生させる脂質成分は異なるので、脂質成分(具体的には、コレステロール脂肪酸エステル、グリセリン脂肪酸エステル、リン脂質)毎に定量を行うことが可能である。
【0056】
2.本発明の脂質成分分析装置
以下に本発明の脂質成分の分析方法の原理を応用した分析装置の一実施形態を述べる。
【0057】
図3は、本発明の血清中の脂質成分の分析装置の例を示す。図3に示される脂質成分分析装置は、本発明の分析方法における電気化学的な酸濃度測定法を利用している。図3に示される脂質成分分析装置は、解析部31、電気化学測定装置32、検出部39を具備する。
【0058】
検出部39は、反応場33、参照電極34、作用極35、対極36、反応容器37、温度保持装置38を含む。反応容器37の内部が反応場33となり、反応場33には参照電極33と、作用極35と、対極36とが配置される。さらに反応容器37には、反応場33に入れられた溶液の温度を維持するための温度保持装置38が備わる。
【0059】
反応容器37の反応場33では、測定溶液の酸の濃度を電気化学的に測定することができる。また、反応場33に、血清と血清中の各種脂質成分に特異的に作用する酵素とを含む測定溶液を収容して、酵素反応で各種脂質成分から脂肪酸を生成させることもできる。酵素反応をする際には、温度保持装置38を用いて、測定溶液の温度を維持して酵素反応を促進する。酵素反応の温度は、例えば30℃ 〜40℃の範囲に維持することが多い。反応場33において酵素反応を生じさせることで、血清中の脂質成分から脂肪酸を生成させることができる。多くの場合、酵素反応により血清中の脂質成分から脂肪酸が生成するが、リン脂質に作用する酵素のなかには、血清中のリン脂質から有機酸を生成させるものもある。
【0060】
反応場33で酵素反応を受ける測定溶液には、水溶性キノン誘導体や電解質が共存していてもよい。したがって、反応場33で、酵素反応される前の測定溶液の酸濃度を電気化学測定し、その測定後の溶液で酵素反応をさせることができる。
【0061】
また、反応容器37の反応場33で酵素反応されて生成した脂肪酸を含む測定溶液は、そのまま反応場33において酸濃度を測定される。本発明では、水不溶性キノンではなく、水溶性キノンを用いるので、測定溶液に有機溶媒を含ませる必要がなく、血清の凝集が生じない。そのため、酵素反応後の酸濃度の測定前に、測定溶液をろ過処理するなどの前処理が必要なく、そのまま酸濃度をすることができる。
【0062】
酵素反応前および酵素反応後の、測定溶液の酸濃度の電気化学的測定では、測定溶液に参照電極34の電極電位から所定の範囲の作用極35の印加電位を掃引する。掃引しながら、作用極35と対極36間を流れる電流値を測定する。このような測定方法は、通常「ボルタンメトリー」と呼称される。マイクロコンピューター等から構成される電気化学測定装置32がこれらの操作を行う。
【0063】
解析部31は、電気化学測定装置32が測定した電流値から、キノン誘導体が示す還元前置波を検出し、その還元前置波ピークの電流値、或いは、還元前置波の電荷量を測定する。キノン誘導体が示す還元前置波とは、キノン誘導体のプロトン付加体の還元波であり、キノン誘導体の通常の還元波よりも正電位側に現れることもあれば、負電位側に現れることもある。この還元前置波の変化量は、測定溶液中の総酸濃度に比例する。ここでいう変化量は、還元前置波ピークの電流値の変化量、あるいは還元前置波の電荷量の変化量をいう。
【0064】
次に、解析部31は、酵素反応後に測定した還元前置波と酵素反応前に測定した還元前置波との、ピークの電流値の差異、或いは、電荷量の差異を求める。その差異に基づいて、酵素反応により生じた酸(主に脂肪酸)の量、およびその酸(主に脂肪酸)を生じさせた脂質成分の量を、検量線と照らし合わせることにより算出する。
【0065】
従来の酵素法による分析は、3〜4段階の酵素反応の後に過酸化水素の濃度分析を行うため、正確さが十分でないという問題があり、測定時間も長時間であった。それに対して、本実施の形態のボルタンメトリーによる血清脂質成分分析装置によれば、血清から1段階の酵素反応により生じた遊離脂肪酸を直接測定することで血清脂質成分の濃度を特異的、簡便、迅速、高感度に定量することができる。
【0066】
(参照実験1)
参照実験1として、水溶性キノン誘導体として2,6-Dimethyl-1,4-benzoquinoneを用いて、クエン酸測定を行った結果を示す。
【0067】
1.試薬
水溶性キノン誘導体として、2,6-Dimethyl-1,4-benzoquinone[DMBQ](SIGMA社製)を用いた。その他の試薬は、電解質として塩化カリウム(ナカライテスク株式会社)を、測定される酸としてクエン酸(和光純薬株式会社)を用いた。試薬はすべて特級か、それに準ずるものを用い、超純水を溶媒として用いて測定溶液を調製した。
【0068】
2.測定溶液の調製
クエン酸濃度を測定する直前に、DMBQ、塩化カリウム、クエン酸を含む測定溶液を2.55mL(最終濃度:塩化カリウム111mM、DMBQ 9.7mM、クエン酸濃度 0mM、0.02mM、0.05mM、0.1mM、0.15mM、0.2mM、0.49mM、0.98mM、1.47mM、1.96mMのいずれか(N=5))調製した。
【0069】
3.クエン酸測定
図3に示す測定装置を準備した。作用極にGCEグラッシーカーボン電極(電極面積:(1.5)2π cm2)を、参照電極にAg/AgCl(ビー・エー・エス株式会社)を、対極にPt線(φ1.0mm)を用いた。電気化学アナライザ(BAS100B;ビー・エー・エス株式会社)を用いた。ソフトウエアはBAS100B Windows(登録商標) Control Software(ビー・エー・エス株式会社)を用いた。掃引速度は5mV/s、電位範囲−600mV〜400mV(vs Ag/AgCl)の還元方向へリニアスイープボルタンメトリを行った。
【0070】
4.結果
図4のグラフは、クエン酸濃度毎のサイクリックボルタモグラムである。DMBQ還元波ピークαを、−300mM付近に確認することができた。そして、DMBQ濃度が9.7mMであり、クエン酸濃度が2mM以下の場合に、DMBQ還元前置波ピークβを、−50〜150mVの範囲に確認することができた。
【0071】
図5のグラフは、クエン酸濃度(X軸)に対する、DMBQ還元前置波ピークの電流値(Y軸)を示している。ここでは、還元前置波ピークの電流値の変化を、還元前置波の変化量として評価している。1次線形近似では、クエン酸濃度に対する、DMBQ還元前置波ピークの電流値の応答がR2=0.99であり、高い定量性を示した。
【0072】
このように、DMBQ存在下で電気化学的測定することで得られるボルタモグラムにおける還元前置波ピークに基づいて、クエン酸の濃度を定量可能であることがわかった。
【0073】
(参照実験2)
参照実験2として、水溶性キノン誘導体として2,3-Dimethoxy-5-methyl-p-benzoquinoneを用いて、クエン酸測定を行った結果を示す。
【0074】
1.試薬
水溶性キノン誘導体として2,3-Dimethoxy-5-methyl-p-benzoquinone(SIGMA)を用いた。その他の試薬は、電解質として塩化カリウム、クエン酸、水酸化ナトリウム、リン酸2水素ナトリウム、塩化ナトリウム、リン酸2水素カリウム、塩酸(和光純薬工業株式会社)を用いた。試薬はすべて特級か、それに準ずるものを用い、超純水を溶媒として用いて測定溶液を調製した。
【0075】
2.測定溶液の調製
クエン酸濃度を測定する直前に、2,3-Dimethoxy-5-methyl-p-benzoquinoneおよび各種試薬を含む測定溶液を1mL(最終濃度:リン酸2水素ナトリウム 4mM、塩化ナトリウム 68mM、リン酸2水素カリウム 1mM、塩化カリウム1mM、2,3-Dimethoxy-5-methyl-p-benzoquinone 10mM、クエン酸濃度0mM、0.5mM、1mM、3mM、5mM、10mMのいずれか(N=3))調製した。
【0076】
3.測定
図3に示す測定装置を準備した。作用極にGCEグラッシーカーボン電極(電極面積:(0.5)2π cm2)を、参照電極にAg/AgCl(ビー・エー・エス株式会社)を、対極にPt線(φ1.0mm)を用いた。電気化学アナライザ(BAS100B;ビー・エー・エス株式会社)を用いた。ソフトウエアはBAS100B Windows(登録商標) Control Software(ビー・エー・エス株式会社)を用いた。掃引速度は50mV/s、電位範囲−600〜400mV(vs Ag/AgCl)の還元方向へサイクリックボルタンメトリを行った。
【0077】
4.結果
図6のグラフは、クエン酸濃度毎のサイクリックボルタモグラムである。キノン還元波ピークαを、−300mM付近に確認できた。そして、拡大図に示すように、2,3-Dimethoxy-5-methyl-p-benzoquinone濃度が10mMであり、クエン酸濃度が5mM以下の場合に、キノン還元前置波ピークを、−150〜50mVの範囲で確認することができた。
【0078】
図7のグラフは、クエン酸濃度(X軸)に対する還元前置波ピークの電流値(Y軸)を示している。1次線形近似では、クエン酸濃度5mM以下でR2=0.99の高い定量性を示した。
【0079】
このように、2,3-Dimethoxy-5-methyl-p-benzoquinone存在下で電気化学的測定することで得られるボルタモグラムにおける還元前置波ピークの電流値の変化量を、還元前置波の変化量とみなして評価することで、クエン酸の濃度を定量可能であることがわかった。
【0080】
(参照実験3)
参照実験3として、キノン誘導体として3,5-Di-tert-butyl-1,2-benzoquinone[DBBQ]を用いて、ヒト血清の脂質(TG)を測定した結果について示す。
【0081】
1.試薬
キノン誘導体として3,5-Di-tert-butyl-1,2-benzoquinone[DBBQ](98%;ALDRICH社製)を用いた。酵素としてリポプロテインリパーゼ[LPL](LPL−311 from Pseudomonas sp.;東洋紡績株式会社製)を用いた。その他の試薬として、過塩素酸リチウム、リン酸水素2カリウム、リン酸2水素カリウム(和光純薬工業株式会社)を用いた。試薬はすべて特級か、それに準ずるものを用い、超純水を溶媒として用いて測定溶液を調製した。
【0082】
2.ヒト血清TGを含む測定溶液の調製
リン酸水素2カリウムおよびリン酸2水素カリウムを用いて、リン酸緩衝液(pH 7.0)を調製した。調製したリン酸緩衝液およびヒト血清(最終濃度:リン酸緩衝液 10mM)を混合、懸濁し、32℃で一晩静置した。ろ過処理を行わなかった溶液をヒト血清溶液(A)とし、水溶性フィルタ(0.45μm;アドバンテック株式会社)でろ過処理した溶液をヒト血清溶液(B)とした。
【0083】
ヒト血清溶液(A)または(B)0.5mLに、100% エタノール1.5mLを添加し、さらに各種試薬を加えて、2.5mLのヒト血清懸濁測定溶液(最終濃度:過塩素酸リチウム 50mM、DBBQ 5mM)を調製した。ヒト血清溶液(A)から調製し、ろ過処理を行わなかった溶液をヒト血清懸濁測定溶液(1)とした。ヒト血清溶液(B)から調製し、水溶性フィルタでろ過した溶液をヒト血清懸濁測定溶液(2)とした。
【0084】
3.ヒト血清TG由来の脂肪酸を含む測定溶液の調製
リン酸緩衝液(pH 7.0)、リポプロテインリパーゼおよびヒト血清(最終濃度:LPL 18U、リン酸緩衝液 10mM)を混合懸濁し、得られた懸濁物を32℃で一晩静置した。ろ過処理を行わなかった溶液をヒト血清TG由来の脂肪酸を含む溶液(C)とし、水溶性フィルタでろ過処理した溶液をヒト血清TG由来の脂肪酸を含む溶液(D)とした。
【0085】
ヒト血清TG由来の脂肪酸を含む測定溶液(C)または(D)0.5mLに、100% エタノール1.5mL添加し、さらに各種試薬を加えて2.5mLのヒト血清懸濁測定溶液(最終濃度:過塩素酸リチウム 50mM、DBBQ 5mM)を調製した。ヒト血清TG由来の脂肪酸を含む溶液(C)から調製し、ろ過処理を行わなかったものをヒト血清懸濁測定溶液(3)とした。ヒト血清TG由来の脂肪酸を含む溶液(D)から調製し、水溶性フィルタでろ過したものをヒト血清懸濁測定溶液(4)とした。
【0086】
4.測定
図3に示す測定装置を準備した。作用極にGCEグラッシーカーボン電極(電極面積:(3.0)2π cm2)を、参照電極にAg/AgCl(ビー・エー・エス株式会社)を、対極にPt線(φ1.0mm)を用いた。電気化学アナライザ(ALS611A;ビー・エー・エス株式会社)を用い、ソフトウエアはALS611A Windows(登録商標) Control Software(ビー・エー・エス株式会社)を用いた。掃引速度は50mV/s、電位範囲−0.2〜0.1mV(vs Ag/AgCl)の還元方向へリニアスイープボルタンメトリを行った。
【0087】
5.結果
図8のグラフは、各ヒト血清懸濁測定溶液(1)〜(4)を測定した際のリニアスイープボルタモグラムである。図8から分かるように、フィルタ処理を行わなかったヒト血清濁測定溶液(1)および(3)では、還元波自体(例えば、−0.15V〜ー0.1Vの範囲)に大きなずれが生じていたため、このずれにより、安定したキノン還元前置波の電荷量を測定することができなかった。一方、フィルタ処理を行ったヒト血清懸濁測定溶液(2)および(4)では、還元波自体(例えば、−0.15V〜ー0.1Vの範囲)にはほとんどずれが生じなかった。そのため、安定したキノン還元前置波(約ー0.05V〜0Vの範囲)の電荷量の測定を行うことができた。
【0088】
ヒト血清懸濁測定溶液(1)および(3)では、有機溶媒であるエタノールによる血清の凝集が、測定ノイズの要因となり、安定した還元波を得られないことから、還元前置波(約ー0.05V〜0Vの範囲)の電荷量を測定することができなかった。一方、ヒト血清懸濁測定溶液(2)および(4)ではフィルタ処理によって測定溶液中の血清の凝集を取り除いたため、安定した還元波を得ることができ、結果として、還元前置波(約ー0.05V〜0Vの範囲)の電荷量を測定することが可能になった。このように、水不溶性キノンを用いて測定溶液に有機溶媒を含有させると、電気的測定前にフィルタ処理をしなければならないことがわかる。
【0089】
(実施の形態1)
本発明の実施の形態1として、水溶性キノン誘導体としてDMBQを用いて、ヒト血清の脂質(TG)を測定した結果について示す。
【0090】
1.試薬
水溶性キノン誘導体として、2,6-Dimethyl-1,4-benzoquinone[DMBQ](98%;ALDRICH)を用いた。酵素としてリポプロテインリパーゼ[LPL](LPL−311 from Pseudomonas sp.;東洋紡績株式会社)を、その他の試薬として過塩素酸リチウム、リン酸水素2カリウム、リン酸2水素カリウム(和光純薬工業株式会社)を用いた。試薬はすべて特級か、それに準ずるものを用い、超純水を用いて調整した。
【0091】
2.ヒト血清TGを含む測定溶液の調製
リン酸水素2カリウムおよびリン酸2水素カリウムを用いて、リン酸緩衝液(pH 7.0)を調製した。調製したリン酸緩衝液およびヒト血清(最終濃度:リン酸緩衝液 10mM)を混合懸濁し、得られた懸濁物を32℃で一晩静置した。ろ過処理を行わなかった溶液をヒト血清溶液(A)、水溶性フィルタでろ過処理したものをヒト血清溶液(B)とした。調製したヒト血清溶液(A)または(B)0.5mLに試薬を加え、2.5mLのヒト血清懸濁測定溶液(最終濃度:過塩素酸リチウム 50mM、DMBQ 5mM)を調製した。ヒト血清溶液(A)から調製した溶液をヒト血清懸濁測定溶液(1)とした。ヒト血清溶液(B)から調製した溶液をヒト血清懸濁測定溶液(2)とした。
【0092】
3.ヒト血清TG由来の脂肪酸を含む測定溶液の調製
リン酸緩衝液(pH 7.0)、リポプロテインリパーゼおよびヒト血清(最終濃度:LPL 18U、リン酸緩衝液 10mM)を混合懸濁し、得られた懸濁物を32℃で一晩静置した。ろ過処理を行わなかった溶液をヒト血清TG由来の脂肪酸を含む溶液液(C)、水溶性フィルタでろ過した溶液をヒト血清TG由来の脂肪酸を含む溶液(D)とした。ヒト血清TG由来脂肪酸抽出液(C)または(D)0.5mLに各種試薬を加え、2.5mLのヒト血清懸濁測定溶液(最終濃度:過塩素酸リチウム 50mM、DMBQ 5mM)を調製した。ヒト血清TG由来の脂肪酸を含む溶液(C)から調製した溶液をヒト血清懸濁測定溶液(3)とした。ヒト血清TG由来の脂肪酸を含む溶液(D)から調製した溶液をヒト血清懸濁測定溶液(4)とした。
【0093】
4.測定
参照実験3と同様に測定した。
【0094】
5.結果
図9のグラフは、各ヒト血清懸濁測定溶液(1)〜(4)を電気化学測定して得たリニアスイープボルタモグラムである。フィルタ処理を行わなかったヒト血清懸濁測定溶液(1)と、フィルタ処理を行ったヒト血清懸濁測定溶液(2)で電圧電流曲線が一致し、さらに還元前置波もほぼ同じ電流応答を得られた。
一方、脂肪酸抽出液のフィルタ処理を行わなかったヒト血清懸濁測定溶液(3)とフィルタ処理を行ったヒト血清懸濁測定溶液(4)でも、電圧電流曲線が一致し、さらに還元前置波ピークもほぼ同じ電流応答を得られた。
【0095】
このように、水溶性キノン誘導体を用いて測定溶媒を水溶媒とする(有機溶媒を用いない)と、フィルタ処理を行った場合でもフィルタ処理を行わない場合でも安定したシグナルを得ることができた。
【0096】
(実施の形態2)
本発明の実施の形態1として、水溶性キノン誘導体としてDMBQを用いて、ヒト血清の脂質(TG)を定量した結果について示す。
【0097】
1.試薬
水溶性キノン誘導体として、2,6-Dimethyl-1,4-benzoquinone[DMBQ](98%;ALDRICH)を用いた。酵素としてリポプロテインリパーゼ[LPL](LPL−311 from Pseudomonas sp.;東洋紡績株式会社)、その他の試薬として過塩素酸リチウム、リン酸水素2カリウム、リン酸2水素カリウム、液状コントロール血清ワコーI(TG=86mg/dL)、液状コントロール血清ワコーII(TG=192mg/dL)(和光純薬工業株式会社)を用いた。試薬はすべて特級か、それに準ずるものを用い、超純水を溶媒として用いて測定溶液を調製した。
【0098】
2.ヒト血清サンプルの調製
液状コントロール血清ワコーIおよび液状コントロール血清ワコーIIを混合し、TG濃度(86mg/dL、112.5mg/dL、139mg/dL、165.5mg/dL、192mg/dL)のヒト血清サンプルを調製した。
【0099】
3.ヒト血清TGを含む測定溶液の調製
リン酸水素2カリウムおよびリン酸2水素カリウムを用いて、リン酸緩衝液(pH 7.0)を調製した。調製したリン酸緩衝液(pH 7.0)と、上記ヒト血清サンプルとを混合懸濁し、32℃で一晩静置した(最終濃度:リン酸緩衝液 10mM)。水溶性フィルタでろ過したものをヒト血清溶液とした。調製したヒト血清溶液0.5mLに各種試薬を加え、2.5mLのヒト血清懸濁測定溶液(A)を調製した(最終濃度:過塩素酸リチウム 50mM、DMBQ 5mM)。
【0100】
4.ヒト血清TG由来の脂肪酸を含む測定溶液の調製
調製したヒト血清サンプルと、リン酸緩衝液(pH 7.0)と、リポプロテインリパーゼとを懸濁し、32℃で一晩静置した(最終濃度:LPL 18U、リン酸緩衝液 10mM)。水溶性フィルタでろ過したものをヒト血清TG由来の脂肪酸を含む溶液とした。ヒト血清TG由来の脂肪酸を含む溶液0.5mLに各種試薬を加え、2.5mLのヒト血清懸濁測定溶液(B)を調製した(最終濃度:過塩素酸リチウム 50mM、DMBQ 5mM)。
【0101】
5.測定
参照実験3と同様に測定した。
【0102】
6.結果
参照実験1及び2の測定においては還元前置波ピークが明確に現れたのに対し、実施の形態2の測定においては、還元前置波ピークが明確に現れなかった。これは、緩衝液によるものであり、測定に緩衝液を混在させた場合、還元前置波ピークが明確に現れない。還元前置波ピークが明確に現れない場合には、参照実験1及び2のように、還元前置波ピークの電流値を還元前置波の変化量としてTG濃度を測定することはできない。
【0103】
そこで、リポプロテインリパーゼ処理前のヒト血清懸濁測定溶液とリポプロテインリパーゼで処理されたヒト血清懸濁測定溶液のリニアスイープボルタモグラムを取得し、両者のリニアスイープボルタモグラムが顕著に変動する「還元前置波領域の電荷量の差」を還元前置波の変化量として、TG濃度を評価した。
【0104】
実施の形態2において、ヒト血清懸濁測定溶液(A)とヒト血清懸濁測定溶液(B)のリニアスイープボルタモグラムを取得した際、0A〜1.2×10−6Aに、この還元前置波の顕著な変動部分が現れた。そのため、ヒト血清懸濁測定溶液(A)とヒト血清懸濁測定溶液(B)の0A〜1.2×10−6Aの範囲における両者の電荷量の差をTG濃度として評価を行った。
【0105】
図10のグラフは、血清中のTG濃度(X軸)に対する、電荷量の差異(Y軸)を示すグラフである。TG濃度の差異が増加するにつれて、電荷量の増加が観察され、血中TG量を定量できることがわかる。
【産業上の利用可能性】
【0106】
本発明の検出方法および検出装置は、血清中のコレステロール脂肪酸エステル、グリセリン脂肪酸エステル及びリン脂質等の各成分濃度を特異的、高感度、簡便、迅速に測定でき、このような分析を行なうための血清中の脂質成分分析装置を安価に提供できる。
【符号の説明】
【0107】
11 第1工程
12 第2工程
13 第3工程
14 第4工程
21 第1工程
22 第2工程
23 第3工程
24 第4工程
31 解析部
32 電気化学測定装置
33 反応場
34 参照電極
35 作用極
36 対極
37 反応容器
38 温度保持装置
39 検出部
【技術分野】
【0001】
本発明は、血清中の脂質成分を分析する方法、およびそれに用いる分析装置に関する。
【背景技術】
【0002】
血清に含まれる脂質成分を検出する方法として、酵素法がよく知られている。現在主として用いられている脂質成分を検出する酵素法では、4種類あるいは3種類の異なる酵素及び数多くの試薬を用い、最終的に生成された物質を呈色反応させるなどして、脂質成分の定量を行っている。例えば血清に含まれる脂質成分、具体的にはコレステロール脂肪酸エステル、グリセリン脂肪酸エステルおよびリン脂質などの各脂質成分の濃度の分析方法において、酵素反応により各脂質成分から生じた脂肪酸を測定することで、血清中の脂質成分の濃度を定量する手法が知られている(例えば、特許文献1参照)。
【0003】
上記特許文献1に開示されている方法を用いて血清に含まれる脂質成分の測定を行う工程を図1に示す。図1に示すように、(脂質成分から脂肪酸及び有機酸を生成させる前における)血清を含む測定溶液の総酸濃度を計測する第1工程11と、血清中の各種脂質成分にそれぞれ特異的に作用する酵素を用いて脂肪酸及び有機酸を生成する第2工程12と、第2工程12において脂肪酸及び有機酸が生成した後にキノン誘導体を導入して血清中の総酸濃度を計測する第3工程13と、第1工程11における計測値と第3工程13における計測値に基づいて前記血清中の各種脂質成分濃度を算出する第4工程14の4つの工程が必要である。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平11−89595号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、上記特許文献1に開示されている血清に含まれる脂質成分の測定方法は、キノン誘導体を溶解させるために、第3工程において有機溶媒を使用する必要がある。この有機溶媒は、血清の凝集、及び脂質成分から脂肪酸を生成させるための酵素の活性低下を引き起す。そのため、酵素反応を行う第2工程12を、有機溶媒を必要とするキノン誘導体存在下で行うことは好ましくない。仮に、第2工程12の酵素反応を有機溶媒存在下で行った場合には、第3工程13の計測の前に、凝集物を除去するために測定溶液をフィルタ処理しなければならず、酵素反応を行う反応槽と、キノン誘導体と有機溶媒を含む電気化学測定を行う反応槽とは別個にする必要があった。このように、上記特許文献1に開示されている測定方法では測定工程数が多くなり、また操作が煩雑になるという課題を有していた。
【0006】
本発明は、従来よりも少ない工程で、簡易に血清中の脂質成分を検出することができる分析方法、および分析装置を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明の血清中の脂質成分の分析方法は、以下の工程1)〜4)を有する。
1)血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第1の総酸濃度計測工程。
2)第1の総酸濃度計測工程後に、前記血清中の各種脂質成分と、前記各種脂質成分と特異的に作用する1又は2以上の酵素とを反応させて、脂肪酸を生成させる脂肪酸生成工程。
3)脂肪酸生成工程後に、前記血清を含む測定溶液の総酸濃度を、前記水溶性キノン誘導体存在下で電気化学計測する第2の総酸濃度計測工程。
4)前記第1の総酸濃度計測工程と前記第2の総酸濃度計測工程で計測されるそれぞれの総酸濃度に基づき、前記測定溶液に含まれる血清中の脂質成分濃度を算出する脂質成分濃度算出工程。
【0008】
第1の総酸濃度計測工程および第2の総酸濃度計測工程における、好ましい「水溶性キノン誘導体存在下での電気化学計測」は、ボルタンメトリーにより測定溶液のボルタモグラムを得る工程と、得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波の変化量に基づいて総酸濃度を計測する工程とを含む。
【0009】
還元前置波の変化量とは、測定試料で得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波のピーク電流値と、総酸濃度が0である場合の還元前置波または酵素処理をする前(酵素未処理)の血清中の総酸濃度における還元前置波のピーク電流値との差異であるか;または、測定試料で得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波の電荷量と、総酸濃度が0である場合の還元前置波または酵素処理をする前(酵素未処理)の血清中の総酸濃度における還元前置波の電荷量との差異でありうる。
なお、総酸濃度が0である場合の還元前置波のピーク電流値は0であるので、得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波のピーク電流値自体が変化量となる。
【0010】
従来の酵素法による脂質成分検出法では、血清を含む測定溶液の総酸濃度を電気化学計測するために水不溶性キノン誘導体を用いるため、水不溶性キノン誘導体を溶解するための有機溶媒を測定溶液に加える必要があった。ところが、有機溶媒を測定サンプルに加えると、有機溶媒により血清が凝集し、かつ使用する酵素の活性が低下する。そのため、脂肪酸生成工程を、有機溶媒を必要とするキノン誘導体存在下で行うことは好ましくない。
【0011】
これに対して本発明では、水不溶性キノン誘導体を用いる従来の方法と異なり、血清を含む測定溶液の総酸濃度を電気化学計測するために水溶性キノン誘導体を用いる。水溶性キノン誘導体の血清への溶解度は高いので、キノン誘導体を溶解させるための有機溶媒を測定溶液に加える必要がない。もちろん、酵素反応後に測定溶液の溶媒を有機溶媒に置換したり、凝集が生じないので測定溶液をフィルタ処理する必要もない。さらに、有機溶媒による酵素の失活の危険性もない。つまり本発明では、酵素による脂肪酸生成工程を、水溶性キノン誘導体存在下で行うことができる。そのため、本発明の分析法は、従来法よりも工程が少なく、簡便な操作で短時間に脂質成分を分析することができる。
【0012】
血清中の脂質成分は、コレステロール脂肪酸エステル、グリセリン脂肪酸エステル、またはリン脂質を含むことが好ましい。これらは臨床的に重要な測定項目であるからである。
【0013】
本発明の血清中の脂質成分の分析方法および分析装置は、血清を含む測定溶液中の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する。水溶性キノン誘導体は、水溶媒に1mM以上溶解可能なベンゾキノン誘導体でありうる。測定対象となる血清中の脂質成分よりもベンゾキノン誘導体の溶解量が多くなければ、脂質成分を測定することができないからである。また、ヒト血清中には、遊離脂肪酸(基準値 100μEq/L〜800μEq/L)や乳酸(成人基準値 4mg/dL〜16mg/dL)などの酸が含まれていると考えられ、これら血清中に含まれる酸の濃度よりもベンゾキノン誘導体が十分高い濃度で測定溶液に溶解しなければ、血清中の脂質成分を測定することができないためである。
【0014】
前記ベンゾキノン誘導体の酸化還元電位は、−400mV〜1000mVの範囲でありうる。酸化還元電位が−400mV未満では、測定溶液の溶媒中の溶存酸素の影響を受けて正確な電気化学的シグナルを測定することが難しく、一方、酸化還元電位が1000mVを超えると、分析装置の電極(作用電極、対極など)が溶媒中に溶出する恐れがあるためである。
【0015】
また、前記ベンゾキノン誘導体は、それを用いて血清中の酸濃度を電気化学的に測定が可能であるものである。ベンゾキノン誘導体を用いて酸濃度を電気化学的に測定するとは、ボルタンメトリーを利用して酸濃度を測定することである。具体的には、分析対象である酸とキノン誘導体と電解質とを含む測定溶液に電位を掃印し、その過程で発生する電流を計測してボルタモグラムを得る。得られるボルタモグラムには、測定溶液中に酸が存在する場合にのみ、キノン誘導体の還元前置波が観測される。キノン誘導体の還元前置波に基づいて、酸の濃度を求める。したがって、前記ベンゾキノン誘導体には、ボルタモグラムに還元前置波を生じさせることが求められる。
【0016】
さらに、前記ベンゾキノン誘導体は、2,3-Dimethoxy-5-methyl-p-benzoquinone、または2,6-Dimethyl-1,4-benzoquinoneでありうる。これらは水溶媒に高濃度で溶解しやすく、試薬として用いた際安定であるためである。
【0017】
本発明のある実施形態の血清中の脂質成分の分析装置は、以下の部材を有する。
1)血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体の存在下で電気化学計測する第1の総酸濃度計測部。
2)血清中の各種脂質成分と、各種脂質成分と特異的に作用する1又は2以上の酵素とを反応させて、脂肪酸を生成させる脂肪酸生成部。
3)脂肪酸生成工程後に、前記血清を含む測定溶液の総酸濃度を、前記水溶性キノン誘導体存在下で電気化学計測する第2の総酸濃度計測部。
4)前記第1の総酸濃度計測工程と前記第2の総酸濃度計測工程とで得られるそれぞれの前記血清中の総酸濃度とに基づき、前記血清中の脂質成分濃度を算出する脂質成分濃度算出部。
【0018】
ここで本発明の分析装置は、1)第1の総酸濃度計測部と、2)脂肪酸生成部と、3)第2の総酸濃度計測部とが同一反応槽であることを特徴とする装置である。すなわち、1)第1の総酸濃度計測部と、2)脂肪酸生成部と、3)第2の総酸濃度計測部は、いずれも反応槽であるが、1つの反応槽を共有する。前記反応槽には、測定溶液を収容する反応場と、反応場に収容される測定溶液に接触する作用電極および対極と、を具備する。
【0019】
反応場に収容された測定溶液は、ボルタンメトリー法によりボルタモグラムを測定される。そして、得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波の変化量に基づいて総酸濃度を測定する。
【0020】
従来の酵素法を用いた測定法では、血清を含む測定溶液の総酸濃度を電気化学計測するために水不溶性キノン誘導体を用いるため、有機溶媒を使用する必要があるが、有機溶媒を使用すると血清が凝集し、酵素の活性が低下する。そのため、従来の酵素法を用いた測定法を実施するための装置は、血清中の各種脂質成分にそれぞれ特異的に作用する酵素を用いて脂肪酸を生成するための反応槽と、脂肪酸が生成された後にキノン誘導体存在下で血清中の総酸濃度を計測するための反応槽とを、別個に具備する必要があった。
【0021】
これに対して本発明では、水不溶性キノン誘導体を用いる従来法と異なり、血清を含む測定溶液の総酸濃度を電気化学計測するために水溶性キノン誘導体を用いる。水溶性キノン誘導体は血清への溶解度が高いため、キノン誘導体を有機溶媒に溶解させたり、測定溶液の溶媒を有機溶媒に置換したりする必要がない。従って、本発明の分析法を実施するための装置では、一つの反応槽で、酵素反応による脂肪酸生成と、キノン誘導体存在下での総酸濃度の電気化学的測定とを行うことができる。さらに、本発明の分析装置では、測定溶液の溶媒に有機溶媒を含む必要がないので、カーボンペースト電極などの安価な電極を採用することも可能である。結果として、従来よりも、簡易な構成で迅速、安価に測定することが可能である。
【発明の効果】
【0022】
本発明の血清中の脂質成分の分析方法では、血清を含む測定溶液の総酸濃度を電気化学計測するために水不溶性キノン誘導体を用いる従来法と異なり、水溶性キノン誘導体を用いる。水溶性キノン誘導体は血清への溶解度が高いため、キノン誘導体を有機溶媒に溶解させたり、測定溶液の溶媒を有機溶媒に置換したりする必要がない。従って、キノン誘導体存在下で酵素による脂肪酸生成工程を行っても、有機溶媒による血清の凝集が生じることがなく、測定溶液をフィルタ処理する必要がない。もちろん、、有機溶媒による酵素の失活が生じる危険性もない。このように、本発明の分析法は、従来法よりも少ない工程で短時間に脂質成分の分析を高精度にすることができる。
【図面の簡単な説明】
【0023】
【図1】従来例による検出手順を示したフローチャート
【図2】本発明による検出手順を示したフローチャート
【図3】本発明の分析装置の構成を示すブロック図
【図4】DMBQで酸測定を行ったリニアスイープボルタモグラム(参照実験1参照)
【図5】DMBQで酸を定量した結果を示す図(参照実験1参照)
【図6】2,3-Dimethoxy-5-methyl-p-benzoquinoneを用いて酸測定を行ったサイクリックボルタモグラム(参照実験2参照)
【図7】2,3-Dimethoxy-5-methyl-p-benzoquinoneを用いて酸を定量した結果を示す図(参照実験2参照)
【図8】DBBQで血清中遊離脂肪酸および総酸(血清遊離脂肪酸+血清TG由来脂肪酸)を測定したリニアスイープボルタモグラム(参照実験3参照)
【図9】DMBQで血清中遊離脂肪酸および総酸(血清遊離脂肪酸+血清TG由来脂肪酸)を測定したリニアスイープボルタモグラム(実施の形態1参照)
【図10】DMBQで血中TGを定量した結果を示す図(実施の形態2参照)
【発明を実施するための形態】
【0024】
以下に、本発明の血清中の脂質成分の分析方法および分析装置の実施の形態を図面とともに詳細に説明する。
【0025】
1.本発明の分析方法
本発明の血清中の脂質成分を分析する手順(第1工程〜第4工程)を図2に示す。1)血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第1工程21と、2)前記血清中の各種脂質成分と、各種脂質成分と特異的に作用する酵素とを反応させて脂肪酸を生成させる第2工程22と、3)脂肪酸を生成させた後に、血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第3工程23と、4)第1工程21において計測された総酸濃度と、第3工程23において計測された総酸濃度とに基づいて、前記血清中の脂質成分濃度を算出する第4工程24とを含む。以下に、各工程について詳細な説明を行う。
【0026】
[第1工程21:血清を含む測定溶液の総酸濃度の計測]
第1の工程21では、血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体の存在下で電気化学的に測定する。より具体的には、ボルタンメトリーを利用して総酸濃度を測定する。
【0027】
まず、血清を含む測定溶液を準備する。測定溶液には、溶媒と血清以外に、水溶性キノン誘導体および電解質を含有する。測定溶液中の酸濃度を電気化学的に測定する際に、測定溶液中に酸が存在すると、キノン誘導体は酸(プロトン供与体)により多段階反応をおこして、ボルタモグラムに還元前置波を生じさせる。電解質は、溶液中の測定物質と電極との間で起こる電子伝達を容易にする。
【0028】
血清を含む測定溶液中の酸の濃度を電気化学的に測定する。具体的には、酵素処理によって血清中の脂質成分を脂肪酸に分解する(第2工程22)前に、血清を含む測定溶液に電荷をかけ、電荷をかける過程で発生する電流を計測してボルタモグラムを得る。得られるボルタモグラムには、酸が測定溶液中に存在する場合にのみ、特徴的な還元前置波が観測される。ボルタモグラムにおける還元前置波の変化量を求めることによって、血清を含む測定溶液の総酸濃度が測定される。
【0029】
ボルタモグラムにおける還元前置波の変化量とは、還元前置波のピーク電流値の変化量、または還元前置波の電荷量の変化でありうる。還元前置波のピークが確認できる場合には、ピーク電流値の大きさに基づいて総酸濃度を測定することができる。しかしながら、還元前置波のピークは、測定溶液の組成によって確認できたり、できなかったりする。例えば、測定溶液に緩衝液が含まれていると、還元前置波のピークが確認できないことがある(実施の形態2を参照)。還元前置波のピークが確認できない場合には、還元前置波の電荷量の変化に基づいて総酸濃度を測定することができる。
【0030】
測定溶液において、脂肪酸は強いプロトン供与体として作用し、測定溶液中に共存する水溶性キノン誘導体にプロトンを与える。脂肪酸のようなプロトン供与体によってプロトンを供与されたキノン誘導体は、キノン誘導体単体よりも易還元性である。そのため、プロトンを供与されたキノン誘導体は、ボルタモグラムにおいてキノン誘導体が通常示す還元波とは別の還元波を生じさせる。このキノン誘導体が通常示す還元波とは別に生じる還元波を「キノン誘導体の還元前置波」と称する。「キノン誘導体の還元前置波」は「キノン誘導体が通常示す還元波」よりも、正電位側に生じることもあるし、負電位側に生じることもある。
【0031】
キノン誘導体の還元前置波の変化量は、溶液中の酸の濃度と比例関係にあることが分かっており、予め既知の酸濃度の溶液で求めておいた検量線に照らし合わせることで、測定溶液中の総酸濃度を正確に定量することができる。
【0032】
ボルタモグラムにおいて、キノン誘導体の還元前置波が観測される位置(電位)は、プロトン供与体である酸(主に脂肪酸)の種類によってほとんど変化しない。そのため、血清中に多種類の脂肪酸が存在していても、キノン誘導体の還元前置波の変化量に基づいて、測定溶液中の酸の合計量を正確に測定することができる。
【0033】
測定溶液に含まれる、水溶性キノン誘導体、電解質、あるいは溶媒の種類や量は、ボルタモグラムにキノン誘導体の還元前置波が生じ、その還元前置波の変化量が酸濃度に比例するように選択および設定されればよい。
【0034】
水溶性キノン誘導体は、例えば、オルトベンゾキノン誘導体もしくはパラベンゾキノン誘導体などのベンゾキノン誘導体でありうる。ベンゾキノン誘導体は、ボルタモグラムにおける還元前置波の位置が、測定溶液中の溶存酸素の還元波形の位置と大きく異なるため、測定溶液の溶存酸素を除去せずとも正確に酸の濃度分析を行うことができるからである。
【0035】
また、測定に用いる水溶性キノン誘導体は、水への溶解度が高いほど好ましい。上述した通り、測定対象となる血清中の脂質成分よりもベンゾキノン誘導体の溶解量が多くなければ、脂質成分を測定することができない。血清中には、遊離脂肪酸(基準値 100μEq/L〜800μEq/L)や、乳酸(成人基準値 4mg/dL〜16mg/dL)などの酸が存在していると考えられる。これらの血清中の酸濃度よりもベンゾキノン誘導体が十分高い濃度で存在しなければ、脂質成分を測定できないため、キノン誘導体の水への溶解量は1mM以上であることが好ましい。
【0036】
水への溶解量が1mM以上であるキノン誘導体の種類は少ないが、例えば2,3-Dimethoxy-5-methyl-p-benzoquinone、および2,6-Dimethyl-1,4-benzoquinone(「DMBQ」ともいう)が好ましい。
【0037】
さらに、水溶性キノン誘導体の酸化還元電位が−400mV〜1000mVであることが好ましい。水溶性キノン誘導体の酸化還元電位が−400mV未満であると、測定溶液中の溶存酸素の影響を受けて、正確な電気化学的シグナルを測定することができない。一方、水溶性キノン誘導体の酸化還元電位が1000mV以上であると、分析装置の電極が測定溶液中に溶出するおそれがある。
【0038】
これらの条件を満たす水溶性キノン誘導体として、特に2,3-Dimethoxy-5-methyl-p-benzoquinone(「DMBQ」ともいう)が好ましい。
【0039】
測定溶液中の水溶性キノン誘導体の濃度の目安は1mM以上である。測定溶液中の水溶性キノン誘導体の濃度は、測定対象物の濃度よりも、十分高い濃度でなければ測定が実現できない。想定される血清中の酸のバックグラウンドは、主に遊離脂肪酸(基準値 100μEq/L〜800μEq/L)、乳酸(成人基準値 4mg/dL〜16mg/dL)などであるので、これらを鑑みて1mM以上とすることが好ましい。
【0040】
電界質は、塩化カリウムや塩化ナトリウムなどの水溶性の電解質である。測定溶液における電解液の濃度は、電気化学測定可能な濃度であれば、特に限定されず、適宜測定に応じて設定される。一般的な電界質濃度は、10〜200mM程度である。
【0041】
測定溶液の溶媒は、有機溶媒を含まない水であることが好ましい。好ましくない有機溶媒には、アルコールなどの水溶性有機溶媒を含む。有機溶媒は、測定溶液における血清を凝集させることがあるからである。血清を含む測定溶液に有機溶媒が添加されると、測定溶液中で血清が凝集する。測定溶液中の凝集は、酸濃度を電気化学的に測定しようとするときに測定ノイズを生じさせるため、電気化学測定前にフィルタによる測定溶液をろ過する必要がある。本発明では、測定溶液に有機溶媒を添加する必要がないので、フィルタ操作を必要としない。
【0042】
また、測定溶液の溶媒を水とすると、凍結乾燥試薬を用いることが可能になるという利点もある。さらに、有機溶媒に溶出するために使用できなかったカーボンペースト電極などの安価な電極を、分析装置の電極として採用することも可能になる。
【0043】
[第2工程22:酵素反応による血清中の脂質成分からの脂肪酸の生成]
第2の工程22では、血清を含む測定溶液中に、各種脂質成分のみに特異的に作用するような酵素を混合して、脂質成分から脂肪酸を生成させる。脂質成分と酵素の種類によっては、脂肪酸以外の有機酸が生成されることもある。酵素は、第1工程21で電気化学測定される測定溶液に、予め添加されていてもよいし;第1工程21での電気化学測定後の測定溶液に、添加されてもよい。
【0044】
従来法のように、測定溶液中に有機溶媒が存在すると、脂質成分と反応させるための酵素の活性が低下し、測定感度が低下する恐れがあった。そのため、有機溶媒を含有する測定溶液中において、脂質成分と酵素とを反応させることはできなかった。つまり、従来法のように、水不溶性キノン誘導体を用いると有機溶媒を用いざるを得ないため、キノン誘導体の存在下で脂質成分と酵素とを反応させることはできなかった。
【0045】
一方、本発明では、水溶性キノン誘導体を用いるため、測定溶液に有機溶媒を含ませる必要がない。そのため、キノン誘導体を含む測定溶液中で、血清中の脂質成分と酵素とを反応させることができる。つまり、測定溶液中に血清と酵素とキノン誘導体とを共存させても、血清の凝集を抑制することが可能となり、測定溶液中の酸濃度を電気的に測定(第3工程23)する前に、測定溶液をろ過処理する必要もなくなる。そのため、従来の酵素反応を用いた脂質成分の測定法よりも迅速で簡便に血清中の脂質成分を測定可能になった。
【0046】
各種脂質成分のみに特異的に作用する酵素について以下に述べる。各種脂質成分から遊離脂肪酸を生成する例として知られているもののうち、血清中のコレステロール脂肪酸エステルを、コレステロールエステラーゼによって加水分解して遊離型コレステロールと遊離脂肪酸を生成するものがある。その反応式を以下に示す。
【化1】

【0047】
また、血清中のグリセリン脂肪酸エステルを、リポプロテインリパーゼによって加水分解してグリセロールと遊離脂肪酸を生成するものがある。その反応式を以下に示す。グリセリン脂肪酸エステルのグリセロールにエステル結合している脂肪酸の数は、1〜3個の何れかであるが、血清に含まれるグリセリン脂肪酸エステルのうち90〜95%が3個の脂肪酸がエステル結合したトリグリセリドであることが判っている。そのため、ここでグリセリン脂肪酸エステルとトリグリセリン脂肪酸エステルは、ほぼ同意と考えられる。従って、血清中のグリセリン脂肪酸エステルを分析対象にする場合、グリセリン脂肪酸エステル1分子から3個の遊離脂肪酸が生成すると考えても差し支えない。
【化2】

【0048】
更に、血清中のリン脂質を、ホスホリパーゼAによって加水分解して遊離脂肪酸を生成するものがある。その反応式を以下に示す。以下に示す化学式における「リン脂質」という語は、単一の化学物質を示すものではなく、ホスファチジルコリン、スフィンゴミエリン、ホスファチジルエタノールアミン等の化合物の総称である。例示した化合物を含むリン脂質の大部分から、ホスホリパーゼAによって遊離脂肪酸が生成する。
【化3】

【0049】
各種脂質成分からの酵素による脂肪酸生成反応は、上に例示した反応のみを対象とするものではなく、各種脂質成分から特異的に脂肪酸を生成できる方法であればいずれも利用することができる。ただし、酵素による脂質成分からの脂肪酸生成反応は、簡便性を考慮すると1段階反応で各種脂質成分から脂肪酸を生成するものを選ぶ方が望ましい。
【0050】
上記の各種酵素類の起源は、特に指定されるものではなく、動物臓器、微生物さらには遺伝子操作等により人工的に作製・改変したDNAを用いたもの、等々いかなる起源由来のものであってもよい。注意すべきことは、酵素反応によって生成される物質が、次の測定、すなわち脂肪酸の分析(水溶性キノン誘導体存在下での電気化学測定)を阻害しないことである。上に例示した酵素反応においては問題になるようなことは見出せなかった。
【0051】
本発明で用いる酵素類として例示した酵素は、全て市販のものをそのまま利用することができる。酵素使用量や使用時の反応温度、反応時間等々の諸条件は、発売元が望ましいとして提示している数字をそのまま利用することも可能であるが、分析者が目的に応じて設定を自由に変更することも可能である。
【0052】
[第3工程23:酵素反応後の測定溶液の総酸濃度の計測]
第3工程23では、第2工程22での酵素反応によって脂質成分から脂肪酸を生成させた後、第1工程21と同様に、水溶性キノン誘導体および電解質の存在下で、測定溶液の総酸濃度を、ボルタンメトリーを利用して電気化学的に測定する。
【0053】
第1工程21において、測定溶液に水溶性キノン誘導体および電解質は添加してあるので、第3工程23においてさらにそれらを添加混合する必要は必ずしもないが、さらに追添加してもよい。
【0054】
[第4工程24:血清中の脂質成分濃度の算出]
第4工程24では、第1工程21における総酸濃度の計測値と第3工程23における総酸濃度の計測値とに基づいて、前記測定溶液に含まれる血清中の脂質成分濃度を算出する。具体的には、第3工程23で計測した酵素反応後の総酸量と、第1工程21で計測した酵素反応前の総酸量との差を算出することによって、第2工程22の酵素反応によって各種脂質成分から生成した脂肪酸の量が定量される。定量された各種脂質成分由来の脂肪酸の量から、血清中に存在していた各種脂質成分の定量が可能となる。
【0055】
酵素の種類によって脂肪酸を発生させる脂質成分は異なるので、脂質成分(具体的には、コレステロール脂肪酸エステル、グリセリン脂肪酸エステル、リン脂質)毎に定量を行うことが可能である。
【0056】
2.本発明の脂質成分分析装置
以下に本発明の脂質成分の分析方法の原理を応用した分析装置の一実施形態を述べる。
【0057】
図3は、本発明の血清中の脂質成分の分析装置の例を示す。図3に示される脂質成分分析装置は、本発明の分析方法における電気化学的な酸濃度測定法を利用している。図3に示される脂質成分分析装置は、解析部31、電気化学測定装置32、検出部39を具備する。
【0058】
検出部39は、反応場33、参照電極34、作用極35、対極36、反応容器37、温度保持装置38を含む。反応容器37の内部が反応場33となり、反応場33には参照電極33と、作用極35と、対極36とが配置される。さらに反応容器37には、反応場33に入れられた溶液の温度を維持するための温度保持装置38が備わる。
【0059】
反応容器37の反応場33では、測定溶液の酸の濃度を電気化学的に測定することができる。また、反応場33に、血清と血清中の各種脂質成分に特異的に作用する酵素とを含む測定溶液を収容して、酵素反応で各種脂質成分から脂肪酸を生成させることもできる。酵素反応をする際には、温度保持装置38を用いて、測定溶液の温度を維持して酵素反応を促進する。酵素反応の温度は、例えば30℃ 〜40℃の範囲に維持することが多い。反応場33において酵素反応を生じさせることで、血清中の脂質成分から脂肪酸を生成させることができる。多くの場合、酵素反応により血清中の脂質成分から脂肪酸が生成するが、リン脂質に作用する酵素のなかには、血清中のリン脂質から有機酸を生成させるものもある。
【0060】
反応場33で酵素反応を受ける測定溶液には、水溶性キノン誘導体や電解質が共存していてもよい。したがって、反応場33で、酵素反応される前の測定溶液の酸濃度を電気化学測定し、その測定後の溶液で酵素反応をさせることができる。
【0061】
また、反応容器37の反応場33で酵素反応されて生成した脂肪酸を含む測定溶液は、そのまま反応場33において酸濃度を測定される。本発明では、水不溶性キノンではなく、水溶性キノンを用いるので、測定溶液に有機溶媒を含ませる必要がなく、血清の凝集が生じない。そのため、酵素反応後の酸濃度の測定前に、測定溶液をろ過処理するなどの前処理が必要なく、そのまま酸濃度をすることができる。
【0062】
酵素反応前および酵素反応後の、測定溶液の酸濃度の電気化学的測定では、測定溶液に参照電極34の電極電位から所定の範囲の作用極35の印加電位を掃引する。掃引しながら、作用極35と対極36間を流れる電流値を測定する。このような測定方法は、通常「ボルタンメトリー」と呼称される。マイクロコンピューター等から構成される電気化学測定装置32がこれらの操作を行う。
【0063】
解析部31は、電気化学測定装置32が測定した電流値から、キノン誘導体が示す還元前置波を検出し、その還元前置波ピークの電流値、或いは、還元前置波の電荷量を測定する。キノン誘導体が示す還元前置波とは、キノン誘導体のプロトン付加体の還元波であり、キノン誘導体の通常の還元波よりも正電位側に現れることもあれば、負電位側に現れることもある。この還元前置波の変化量は、測定溶液中の総酸濃度に比例する。ここでいう変化量は、還元前置波ピークの電流値の変化量、あるいは還元前置波の電荷量の変化量をいう。
【0064】
次に、解析部31は、酵素反応後に測定した還元前置波と酵素反応前に測定した還元前置波との、ピークの電流値の差異、或いは、電荷量の差異を求める。その差異に基づいて、酵素反応により生じた酸(主に脂肪酸)の量、およびその酸(主に脂肪酸)を生じさせた脂質成分の量を、検量線と照らし合わせることにより算出する。
【0065】
従来の酵素法による分析は、3〜4段階の酵素反応の後に過酸化水素の濃度分析を行うため、正確さが十分でないという問題があり、測定時間も長時間であった。それに対して、本実施の形態のボルタンメトリーによる血清脂質成分分析装置によれば、血清から1段階の酵素反応により生じた遊離脂肪酸を直接測定することで血清脂質成分の濃度を特異的、簡便、迅速、高感度に定量することができる。
【0066】
(参照実験1)
参照実験1として、水溶性キノン誘導体として2,6-Dimethyl-1,4-benzoquinoneを用いて、クエン酸測定を行った結果を示す。
【0067】
1.試薬
水溶性キノン誘導体として、2,6-Dimethyl-1,4-benzoquinone[DMBQ](SIGMA社製)を用いた。その他の試薬は、電解質として塩化カリウム(ナカライテスク株式会社)を、測定される酸としてクエン酸(和光純薬株式会社)を用いた。試薬はすべて特級か、それに準ずるものを用い、超純水を溶媒として用いて測定溶液を調製した。
【0068】
2.測定溶液の調製
クエン酸濃度を測定する直前に、DMBQ、塩化カリウム、クエン酸を含む測定溶液を2.55mL(最終濃度:塩化カリウム111mM、DMBQ 9.7mM、クエン酸濃度 0mM、0.02mM、0.05mM、0.1mM、0.15mM、0.2mM、0.49mM、0.98mM、1.47mM、1.96mMのいずれか(N=5))調製した。
【0069】
3.クエン酸測定
図3に示す測定装置を準備した。作用極にGCEグラッシーカーボン電極(電極面積:(1.5)2π cm2)を、参照電極にAg/AgCl(ビー・エー・エス株式会社)を、対極にPt線(φ1.0mm)を用いた。電気化学アナライザ(BAS100B;ビー・エー・エス株式会社)を用いた。ソフトウエアはBAS100B Windows(登録商標) Control Software(ビー・エー・エス株式会社)を用いた。掃引速度は5mV/s、電位範囲−600mV〜400mV(vs Ag/AgCl)の還元方向へリニアスイープボルタンメトリを行った。
【0070】
4.結果
図4のグラフは、クエン酸濃度毎のサイクリックボルタモグラムである。DMBQ還元波ピークαを、−300mM付近に確認することができた。そして、DMBQ濃度が9.7mMであり、クエン酸濃度が2mM以下の場合に、DMBQ還元前置波ピークβを、−50〜150mVの範囲に確認することができた。
【0071】
図5のグラフは、クエン酸濃度(X軸)に対する、DMBQ還元前置波ピークの電流値(Y軸)を示している。ここでは、還元前置波ピークの電流値の変化を、還元前置波の変化量として評価している。1次線形近似では、クエン酸濃度に対する、DMBQ還元前置波ピークの電流値の応答がR2=0.99であり、高い定量性を示した。
【0072】
このように、DMBQ存在下で電気化学的測定することで得られるボルタモグラムにおける還元前置波ピークに基づいて、クエン酸の濃度を定量可能であることがわかった。
【0073】
(参照実験2)
参照実験2として、水溶性キノン誘導体として2,3-Dimethoxy-5-methyl-p-benzoquinoneを用いて、クエン酸測定を行った結果を示す。
【0074】
1.試薬
水溶性キノン誘導体として2,3-Dimethoxy-5-methyl-p-benzoquinone(SIGMA)を用いた。その他の試薬は、電解質として塩化カリウム、クエン酸、水酸化ナトリウム、リン酸2水素ナトリウム、塩化ナトリウム、リン酸2水素カリウム、塩酸(和光純薬工業株式会社)を用いた。試薬はすべて特級か、それに準ずるものを用い、超純水を溶媒として用いて測定溶液を調製した。
【0075】
2.測定溶液の調製
クエン酸濃度を測定する直前に、2,3-Dimethoxy-5-methyl-p-benzoquinoneおよび各種試薬を含む測定溶液を1mL(最終濃度:リン酸2水素ナトリウム 4mM、塩化ナトリウム 68mM、リン酸2水素カリウム 1mM、塩化カリウム1mM、2,3-Dimethoxy-5-methyl-p-benzoquinone 10mM、クエン酸濃度0mM、0.5mM、1mM、3mM、5mM、10mMのいずれか(N=3))調製した。
【0076】
3.測定
図3に示す測定装置を準備した。作用極にGCEグラッシーカーボン電極(電極面積:(0.5)2π cm2)を、参照電極にAg/AgCl(ビー・エー・エス株式会社)を、対極にPt線(φ1.0mm)を用いた。電気化学アナライザ(BAS100B;ビー・エー・エス株式会社)を用いた。ソフトウエアはBAS100B Windows(登録商標) Control Software(ビー・エー・エス株式会社)を用いた。掃引速度は50mV/s、電位範囲−600〜400mV(vs Ag/AgCl)の還元方向へサイクリックボルタンメトリを行った。
【0077】
4.結果
図6のグラフは、クエン酸濃度毎のサイクリックボルタモグラムである。キノン還元波ピークαを、−300mM付近に確認できた。そして、拡大図に示すように、2,3-Dimethoxy-5-methyl-p-benzoquinone濃度が10mMであり、クエン酸濃度が5mM以下の場合に、キノン還元前置波ピークを、−150〜50mVの範囲で確認することができた。
【0078】
図7のグラフは、クエン酸濃度(X軸)に対する還元前置波ピークの電流値(Y軸)を示している。1次線形近似では、クエン酸濃度5mM以下でR2=0.99の高い定量性を示した。
【0079】
このように、2,3-Dimethoxy-5-methyl-p-benzoquinone存在下で電気化学的測定することで得られるボルタモグラムにおける還元前置波ピークの電流値の変化量を、還元前置波の変化量とみなして評価することで、クエン酸の濃度を定量可能であることがわかった。
【0080】
(参照実験3)
参照実験3として、キノン誘導体として3,5-Di-tert-butyl-1,2-benzoquinone[DBBQ]を用いて、ヒト血清の脂質(TG)を測定した結果について示す。
【0081】
1.試薬
キノン誘導体として3,5-Di-tert-butyl-1,2-benzoquinone[DBBQ](98%;ALDRICH社製)を用いた。酵素としてリポプロテインリパーゼ[LPL](LPL−311 from Pseudomonas sp.;東洋紡績株式会社製)を用いた。その他の試薬として、過塩素酸リチウム、リン酸水素2カリウム、リン酸2水素カリウム(和光純薬工業株式会社)を用いた。試薬はすべて特級か、それに準ずるものを用い、超純水を溶媒として用いて測定溶液を調製した。
【0082】
2.ヒト血清TGを含む測定溶液の調製
リン酸水素2カリウムおよびリン酸2水素カリウムを用いて、リン酸緩衝液(pH 7.0)を調製した。調製したリン酸緩衝液およびヒト血清(最終濃度:リン酸緩衝液 10mM)を混合、懸濁し、32℃で一晩静置した。ろ過処理を行わなかった溶液をヒト血清溶液(A)とし、水溶性フィルタ(0.45μm;アドバンテック株式会社)でろ過処理した溶液をヒト血清溶液(B)とした。
【0083】
ヒト血清溶液(A)または(B)0.5mLに、100% エタノール1.5mLを添加し、さらに各種試薬を加えて、2.5mLのヒト血清懸濁測定溶液(最終濃度:過塩素酸リチウム 50mM、DBBQ 5mM)を調製した。ヒト血清溶液(A)から調製し、ろ過処理を行わなかった溶液をヒト血清懸濁測定溶液(1)とした。ヒト血清溶液(B)から調製し、水溶性フィルタでろ過した溶液をヒト血清懸濁測定溶液(2)とした。
【0084】
3.ヒト血清TG由来の脂肪酸を含む測定溶液の調製
リン酸緩衝液(pH 7.0)、リポプロテインリパーゼおよびヒト血清(最終濃度:LPL 18U、リン酸緩衝液 10mM)を混合懸濁し、得られた懸濁物を32℃で一晩静置した。ろ過処理を行わなかった溶液をヒト血清TG由来の脂肪酸を含む溶液(C)とし、水溶性フィルタでろ過処理した溶液をヒト血清TG由来の脂肪酸を含む溶液(D)とした。
【0085】
ヒト血清TG由来の脂肪酸を含む測定溶液(C)または(D)0.5mLに、100% エタノール1.5mL添加し、さらに各種試薬を加えて2.5mLのヒト血清懸濁測定溶液(最終濃度:過塩素酸リチウム 50mM、DBBQ 5mM)を調製した。ヒト血清TG由来の脂肪酸を含む溶液(C)から調製し、ろ過処理を行わなかったものをヒト血清懸濁測定溶液(3)とした。ヒト血清TG由来の脂肪酸を含む溶液(D)から調製し、水溶性フィルタでろ過したものをヒト血清懸濁測定溶液(4)とした。
【0086】
4.測定
図3に示す測定装置を準備した。作用極にGCEグラッシーカーボン電極(電極面積:(3.0)2π cm2)を、参照電極にAg/AgCl(ビー・エー・エス株式会社)を、対極にPt線(φ1.0mm)を用いた。電気化学アナライザ(ALS611A;ビー・エー・エス株式会社)を用い、ソフトウエアはALS611A Windows(登録商標) Control Software(ビー・エー・エス株式会社)を用いた。掃引速度は50mV/s、電位範囲−0.2〜0.1mV(vs Ag/AgCl)の還元方向へリニアスイープボルタンメトリを行った。
【0087】
5.結果
図8のグラフは、各ヒト血清懸濁測定溶液(1)〜(4)を測定した際のリニアスイープボルタモグラムである。図8から分かるように、フィルタ処理を行わなかったヒト血清濁測定溶液(1)および(3)では、還元波自体(例えば、−0.15V〜ー0.1Vの範囲)に大きなずれが生じていたため、このずれにより、安定したキノン還元前置波の電荷量を測定することができなかった。一方、フィルタ処理を行ったヒト血清懸濁測定溶液(2)および(4)では、還元波自体(例えば、−0.15V〜ー0.1Vの範囲)にはほとんどずれが生じなかった。そのため、安定したキノン還元前置波(約ー0.05V〜0Vの範囲)の電荷量の測定を行うことができた。
【0088】
ヒト血清懸濁測定溶液(1)および(3)では、有機溶媒であるエタノールによる血清の凝集が、測定ノイズの要因となり、安定した還元波を得られないことから、還元前置波(約ー0.05V〜0Vの範囲)の電荷量を測定することができなかった。一方、ヒト血清懸濁測定溶液(2)および(4)ではフィルタ処理によって測定溶液中の血清の凝集を取り除いたため、安定した還元波を得ることができ、結果として、還元前置波(約ー0.05V〜0Vの範囲)の電荷量を測定することが可能になった。このように、水不溶性キノンを用いて測定溶液に有機溶媒を含有させると、電気的測定前にフィルタ処理をしなければならないことがわかる。
【0089】
(実施の形態1)
本発明の実施の形態1として、水溶性キノン誘導体としてDMBQを用いて、ヒト血清の脂質(TG)を測定した結果について示す。
【0090】
1.試薬
水溶性キノン誘導体として、2,6-Dimethyl-1,4-benzoquinone[DMBQ](98%;ALDRICH)を用いた。酵素としてリポプロテインリパーゼ[LPL](LPL−311 from Pseudomonas sp.;東洋紡績株式会社)を、その他の試薬として過塩素酸リチウム、リン酸水素2カリウム、リン酸2水素カリウム(和光純薬工業株式会社)を用いた。試薬はすべて特級か、それに準ずるものを用い、超純水を用いて調整した。
【0091】
2.ヒト血清TGを含む測定溶液の調製
リン酸水素2カリウムおよびリン酸2水素カリウムを用いて、リン酸緩衝液(pH 7.0)を調製した。調製したリン酸緩衝液およびヒト血清(最終濃度:リン酸緩衝液 10mM)を混合懸濁し、得られた懸濁物を32℃で一晩静置した。ろ過処理を行わなかった溶液をヒト血清溶液(A)、水溶性フィルタでろ過処理したものをヒト血清溶液(B)とした。調製したヒト血清溶液(A)または(B)0.5mLに試薬を加え、2.5mLのヒト血清懸濁測定溶液(最終濃度:過塩素酸リチウム 50mM、DMBQ 5mM)を調製した。ヒト血清溶液(A)から調製した溶液をヒト血清懸濁測定溶液(1)とした。ヒト血清溶液(B)から調製した溶液をヒト血清懸濁測定溶液(2)とした。
【0092】
3.ヒト血清TG由来の脂肪酸を含む測定溶液の調製
リン酸緩衝液(pH 7.0)、リポプロテインリパーゼおよびヒト血清(最終濃度:LPL 18U、リン酸緩衝液 10mM)を混合懸濁し、得られた懸濁物を32℃で一晩静置した。ろ過処理を行わなかった溶液をヒト血清TG由来の脂肪酸を含む溶液液(C)、水溶性フィルタでろ過した溶液をヒト血清TG由来の脂肪酸を含む溶液(D)とした。ヒト血清TG由来脂肪酸抽出液(C)または(D)0.5mLに各種試薬を加え、2.5mLのヒト血清懸濁測定溶液(最終濃度:過塩素酸リチウム 50mM、DMBQ 5mM)を調製した。ヒト血清TG由来の脂肪酸を含む溶液(C)から調製した溶液をヒト血清懸濁測定溶液(3)とした。ヒト血清TG由来の脂肪酸を含む溶液(D)から調製した溶液をヒト血清懸濁測定溶液(4)とした。
【0093】
4.測定
参照実験3と同様に測定した。
【0094】
5.結果
図9のグラフは、各ヒト血清懸濁測定溶液(1)〜(4)を電気化学測定して得たリニアスイープボルタモグラムである。フィルタ処理を行わなかったヒト血清懸濁測定溶液(1)と、フィルタ処理を行ったヒト血清懸濁測定溶液(2)で電圧電流曲線が一致し、さらに還元前置波もほぼ同じ電流応答を得られた。
一方、脂肪酸抽出液のフィルタ処理を行わなかったヒト血清懸濁測定溶液(3)とフィルタ処理を行ったヒト血清懸濁測定溶液(4)でも、電圧電流曲線が一致し、さらに還元前置波ピークもほぼ同じ電流応答を得られた。
【0095】
このように、水溶性キノン誘導体を用いて測定溶媒を水溶媒とする(有機溶媒を用いない)と、フィルタ処理を行った場合でもフィルタ処理を行わない場合でも安定したシグナルを得ることができた。
【0096】
(実施の形態2)
本発明の実施の形態1として、水溶性キノン誘導体としてDMBQを用いて、ヒト血清の脂質(TG)を定量した結果について示す。
【0097】
1.試薬
水溶性キノン誘導体として、2,6-Dimethyl-1,4-benzoquinone[DMBQ](98%;ALDRICH)を用いた。酵素としてリポプロテインリパーゼ[LPL](LPL−311 from Pseudomonas sp.;東洋紡績株式会社)、その他の試薬として過塩素酸リチウム、リン酸水素2カリウム、リン酸2水素カリウム、液状コントロール血清ワコーI(TG=86mg/dL)、液状コントロール血清ワコーII(TG=192mg/dL)(和光純薬工業株式会社)を用いた。試薬はすべて特級か、それに準ずるものを用い、超純水を溶媒として用いて測定溶液を調製した。
【0098】
2.ヒト血清サンプルの調製
液状コントロール血清ワコーIおよび液状コントロール血清ワコーIIを混合し、TG濃度(86mg/dL、112.5mg/dL、139mg/dL、165.5mg/dL、192mg/dL)のヒト血清サンプルを調製した。
【0099】
3.ヒト血清TGを含む測定溶液の調製
リン酸水素2カリウムおよびリン酸2水素カリウムを用いて、リン酸緩衝液(pH 7.0)を調製した。調製したリン酸緩衝液(pH 7.0)と、上記ヒト血清サンプルとを混合懸濁し、32℃で一晩静置した(最終濃度:リン酸緩衝液 10mM)。水溶性フィルタでろ過したものをヒト血清溶液とした。調製したヒト血清溶液0.5mLに各種試薬を加え、2.5mLのヒト血清懸濁測定溶液(A)を調製した(最終濃度:過塩素酸リチウム 50mM、DMBQ 5mM)。
【0100】
4.ヒト血清TG由来の脂肪酸を含む測定溶液の調製
調製したヒト血清サンプルと、リン酸緩衝液(pH 7.0)と、リポプロテインリパーゼとを懸濁し、32℃で一晩静置した(最終濃度:LPL 18U、リン酸緩衝液 10mM)。水溶性フィルタでろ過したものをヒト血清TG由来の脂肪酸を含む溶液とした。ヒト血清TG由来の脂肪酸を含む溶液0.5mLに各種試薬を加え、2.5mLのヒト血清懸濁測定溶液(B)を調製した(最終濃度:過塩素酸リチウム 50mM、DMBQ 5mM)。
【0101】
5.測定
参照実験3と同様に測定した。
【0102】
6.結果
参照実験1及び2の測定においては還元前置波ピークが明確に現れたのに対し、実施の形態2の測定においては、還元前置波ピークが明確に現れなかった。これは、緩衝液によるものであり、測定に緩衝液を混在させた場合、還元前置波ピークが明確に現れない。還元前置波ピークが明確に現れない場合には、参照実験1及び2のように、還元前置波ピークの電流値を還元前置波の変化量としてTG濃度を測定することはできない。
【0103】
そこで、リポプロテインリパーゼ処理前のヒト血清懸濁測定溶液とリポプロテインリパーゼで処理されたヒト血清懸濁測定溶液のリニアスイープボルタモグラムを取得し、両者のリニアスイープボルタモグラムが顕著に変動する「還元前置波領域の電荷量の差」を還元前置波の変化量として、TG濃度を評価した。
【0104】
実施の形態2において、ヒト血清懸濁測定溶液(A)とヒト血清懸濁測定溶液(B)のリニアスイープボルタモグラムを取得した際、0A〜1.2×10−6Aに、この還元前置波の顕著な変動部分が現れた。そのため、ヒト血清懸濁測定溶液(A)とヒト血清懸濁測定溶液(B)の0A〜1.2×10−6Aの範囲における両者の電荷量の差をTG濃度として評価を行った。
【0105】
図10のグラフは、血清中のTG濃度(X軸)に対する、電荷量の差異(Y軸)を示すグラフである。TG濃度の差異が増加するにつれて、電荷量の増加が観察され、血中TG量を定量できることがわかる。
【産業上の利用可能性】
【0106】
本発明の検出方法および検出装置は、血清中のコレステロール脂肪酸エステル、グリセリン脂肪酸エステル及びリン脂質等の各成分濃度を特異的、高感度、簡便、迅速に測定でき、このような分析を行なうための血清中の脂質成分分析装置を安価に提供できる。
【符号の説明】
【0107】
11 第1工程
12 第2工程
13 第3工程
14 第4工程
21 第1工程
22 第2工程
23 第3工程
24 第4工程
31 解析部
32 電気化学測定装置
33 反応場
34 参照電極
35 作用極
36 対極
37 反応容器
38 温度保持装置
39 検出部
【特許請求の範囲】
【請求項1】
血清中の脂質成分の分析方法であって、
血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第1の総酸濃度計測工程と、
前記第1の総酸濃度計測工程後に、前記血清中の各種脂質成分と、前記各種脂質成分と特異的に作用する1又は2以上の酵素とを反応させて、脂肪酸を生成させる脂肪酸生成工程と、
前記脂肪酸生成工程後に、前記血清を含む測定溶液の総酸濃度を、前記水溶性キノン誘導体存在下で電気化学計測する第2の総酸濃度計測工程と、
前記第1の総酸濃度計測工程と前記第2の総酸濃度計測工程とで計測されるそれぞれの前記総酸濃度とに基づき、前記測定溶液に含まれる血清中の脂質成分濃度を算出する脂質成分濃度算出工程とを有する、血清中の脂質成分の分析方法。
【請求項2】
第1の総酸濃度計測工程および第2の総酸濃度計測工程における前記水溶性キノン誘導体存在下での電気化学計測は、ボルタモグラムを得る工程と、得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波の変化量に基づいて総酸濃度を測定する工程とを含む、請求項1に記載の血清中の脂質成分の分析方法。
【請求項3】
前記第1の総酸濃度計測工程、前記脂肪酸生成工程及び第2の総酸濃度計測工程は、同一反応槽で実施される、請求項1に記載の血清中の脂質成分の分析方法。
【請求項4】
前記第1の総酸濃度計測工程、前記脂肪酸生成工程及び第2の総酸濃度計測工程はいずれも、前記水溶性キノン誘導体存在下で実施される、請求項1に記載の血清中の脂質成分の分析方法。
【請求項5】
前記血清中の脂質成分は、コレステロール脂肪酸エステル、グリセリン脂肪酸エステル、またはリン脂質を含む、請求項1に記載の血清中の脂質成分の分析方法。
【請求項6】
前記水溶性キノン誘導体はベンゾキノン誘導体である、請求項1に記載の血清中の脂質成分の分析方法。
【請求項7】
前記水溶性キノン誘導体は、水溶媒に1mM以上溶解する、請求項1に記載の血清中の脂質成分の分析方法。
【請求項8】
前記水溶性キノン誘導体は、酸化還元電位が−400mV〜1000mVである、請求項1に記載の血清中の脂質成分の分析方法。
【請求項9】
前記水溶性キノン誘導体は、ボルタモグラムに還元前置波を生じさせる、請求項1に記載の血清中の脂質成分の分析方法。
【請求項10】
前記水溶性キノン誘導体は、2,3-Dimethoxy-5-methyl-p-benzoquinoneまたは2,6-Dimethyl-1,4-benzoquinoneである、請求項1に記載の血清中の脂質成分の分析方法。
【請求項11】
血清中の脂質成分を分析する装置であって、
血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第1の総酸濃度計測部と、
前記血清中の各種脂質成分と、前記各種脂質成分と特異的に作用する1又は2以上の酵素とを反応させて、脂肪酸を生成させる脂肪酸生成部と、
前記脂肪酸生成工程後に、前記血清を含む測定溶液の総酸濃度を、前記水溶性キノン誘導体存在下で電気化学計測する第2の総酸濃度計測部と、
前記第1の総酸濃度計測工程と前記第2の総酸濃度計測工程とで得られるそれぞれの前記血清中の総酸濃度とに基づき、前記血清中の脂質成分濃度を算出する脂質成分濃度算出部とを有し、
前記脂肪酸生成部と第1の総酸濃度計測部と第2の総酸濃度計測部は、測定溶液を収容可能な反応場と、反応場に収容される測定溶液に接触する作用極および対極と、を具備する同一反応槽である、血清中の脂質成分の分析装置。
【請求項12】
第1の総酸濃度計測部および第2の総酸濃度計測部における前記水溶性キノン誘導体存在下での電気化学計測は、ボルタモグラムを得る工程と、得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波の変化量に基づいて総酸濃度を測定する工程とを含む、請求項11に記載の血清中の脂質成分の分析装置。
【請求項1】
血清中の脂質成分の分析方法であって、
血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第1の総酸濃度計測工程と、
前記第1の総酸濃度計測工程後に、前記血清中の各種脂質成分と、前記各種脂質成分と特異的に作用する1又は2以上の酵素とを反応させて、脂肪酸を生成させる脂肪酸生成工程と、
前記脂肪酸生成工程後に、前記血清を含む測定溶液の総酸濃度を、前記水溶性キノン誘導体存在下で電気化学計測する第2の総酸濃度計測工程と、
前記第1の総酸濃度計測工程と前記第2の総酸濃度計測工程とで計測されるそれぞれの前記総酸濃度とに基づき、前記測定溶液に含まれる血清中の脂質成分濃度を算出する脂質成分濃度算出工程とを有する、血清中の脂質成分の分析方法。
【請求項2】
第1の総酸濃度計測工程および第2の総酸濃度計測工程における前記水溶性キノン誘導体存在下での電気化学計測は、ボルタモグラムを得る工程と、得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波の変化量に基づいて総酸濃度を測定する工程とを含む、請求項1に記載の血清中の脂質成分の分析方法。
【請求項3】
前記第1の総酸濃度計測工程、前記脂肪酸生成工程及び第2の総酸濃度計測工程は、同一反応槽で実施される、請求項1に記載の血清中の脂質成分の分析方法。
【請求項4】
前記第1の総酸濃度計測工程、前記脂肪酸生成工程及び第2の総酸濃度計測工程はいずれも、前記水溶性キノン誘導体存在下で実施される、請求項1に記載の血清中の脂質成分の分析方法。
【請求項5】
前記血清中の脂質成分は、コレステロール脂肪酸エステル、グリセリン脂肪酸エステル、またはリン脂質を含む、請求項1に記載の血清中の脂質成分の分析方法。
【請求項6】
前記水溶性キノン誘導体はベンゾキノン誘導体である、請求項1に記載の血清中の脂質成分の分析方法。
【請求項7】
前記水溶性キノン誘導体は、水溶媒に1mM以上溶解する、請求項1に記載の血清中の脂質成分の分析方法。
【請求項8】
前記水溶性キノン誘導体は、酸化還元電位が−400mV〜1000mVである、請求項1に記載の血清中の脂質成分の分析方法。
【請求項9】
前記水溶性キノン誘導体は、ボルタモグラムに還元前置波を生じさせる、請求項1に記載の血清中の脂質成分の分析方法。
【請求項10】
前記水溶性キノン誘導体は、2,3-Dimethoxy-5-methyl-p-benzoquinoneまたは2,6-Dimethyl-1,4-benzoquinoneである、請求項1に記載の血清中の脂質成分の分析方法。
【請求項11】
血清中の脂質成分を分析する装置であって、
血清を含む測定溶液の総酸濃度を、水溶性キノン誘導体存在下で電気化学計測する第1の総酸濃度計測部と、
前記血清中の各種脂質成分と、前記各種脂質成分と特異的に作用する1又は2以上の酵素とを反応させて、脂肪酸を生成させる脂肪酸生成部と、
前記脂肪酸生成工程後に、前記血清を含む測定溶液の総酸濃度を、前記水溶性キノン誘導体存在下で電気化学計測する第2の総酸濃度計測部と、
前記第1の総酸濃度計測工程と前記第2の総酸濃度計測工程とで得られるそれぞれの前記血清中の総酸濃度とに基づき、前記血清中の脂質成分濃度を算出する脂質成分濃度算出部とを有し、
前記脂肪酸生成部と第1の総酸濃度計測部と第2の総酸濃度計測部は、測定溶液を収容可能な反応場と、反応場に収容される測定溶液に接触する作用極および対極と、を具備する同一反応槽である、血清中の脂質成分の分析装置。
【請求項12】
第1の総酸濃度計測部および第2の総酸濃度計測部における前記水溶性キノン誘導体存在下での電気化学計測は、ボルタモグラムを得る工程と、得られたボルタモグラムにおける水溶性キノン誘導体の還元前置波の変化量に基づいて総酸濃度を測定する工程とを含む、請求項11に記載の血清中の脂質成分の分析装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2011−47924(P2011−47924A)
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願番号】特願2010−163771(P2010−163771)
【出願日】平成22年7月21日(2010.7.21)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願日】平成22年7月21日(2010.7.21)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

