血球細胞分析装置、血球細胞分析方法及び血球細胞分析システム
【課題】薬剤の効果や副作用を短時間で評価することができる血球細胞分析装置、血球細胞分析方法及び血球細胞分析システムを提供する。
【解決手段】測定部3において、1又は複数の血球細胞を含む懸濁液2の複素誘電率スペクトルを測定する。そして、検出部4において、測定された複素誘電率スペクトルに基づいて、懸濁液2の誘電変数及び/又は電気的物性値を算出し、薬剤投与に伴う血球細胞の状態変化を検出する。更に、必要に応じて、その結果や警告を表示部8に表示する。
【解決手段】測定部3において、1又は複数の血球細胞を含む懸濁液2の複素誘電率スペクトルを測定する。そして、検出部4において、測定された複素誘電率スペクトルに基づいて、懸濁液2の誘電変数及び/又は電気的物性値を算出し、薬剤投与に伴う血球細胞の状態変化を検出する。更に、必要に応じて、その結果や警告を表示部8に表示する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、赤血球や白血球などの各種血球細胞の状態を分析する血球細胞分析装置、血球細胞分析方法及び血球細胞分析システムに関する。より詳しくは、誘電分光法を利用した血球細胞の分析技術に関する。
【背景技術】
【0002】
効果的な治療を行うためには、患者に対する薬剤の効果や副作用を的確に把握することが重要である。例えば、骨髄移植治療などの後に投与される免疫抑制剤は、臓器移植に伴う合併症の1つである移植片対宿主病(graft versus host disease:GVDH)を抑制する働きがあるが、その一方で、血栓性微小血管症(Thrombotic microangiopathy:TMA)などの副作用を引き起こすことが知られている。
【0003】
この免疫抑制剤のように、血中濃度における治療域と毒性域が近接し、いわゆる安全域が狭い薬剤に対しては、血中濃度測定による正確な用量調節(Therapeutic Drug Monitoring:TDM)が必要である。これは、免疫抑制剤に限らず、高血圧治療薬及び心臓病治療薬など、幅広い薬剤においても同様である。
【0004】
一般に、服薬中の患者の状態は、臨床所見や各種臨床検査による所見などから総合的に判断されるが、特に正確なTDMが必要な薬剤に関しては、定期的に血球の薬剤濃度を測定している。また、従来、血中濃度データに基づいて、薬剤の摂取用量を調節するための解析又は支援システムも提案されている(特許文献1,2参照)。
【0005】
一方、血中の薬剤濃度の測定には、薬剤の種類や特性などに応じて種々の方法が提案されており、例えば、代表的な免疫抑制剤であるシクロスポリンAの場合は、蛍光偏光免疫測定法などの分析方法によって、末梢血中の濃度が測定されている。また、薬剤濃度の測定には一般に血漿検体が用いられているが、シクロスポリンAの測定では、全血検体が用いられており、前処理溶液で溶血してから分析を行っている。これは、シクロスポリンAが脂溶性で、脂質二重層で構成される細胞膜に吸収されやすく、その大部分が細胞膜中、特に数の多い赤血球膜中に偏在していると考えられるからである。
【0006】
更に、血球細胞の誘電特性は、その大きさ、形状、細胞膜の状態及び密度などによって異なり、従来、誘電分光法により、血球細胞の定性・定量分析又は物性値の測定を行う方法も提案されている(特許文献3,4参照)。これら特許文献3,4に記載の方法によれば、血球細胞を破壊せずに、その状態を分析することができる。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平7−124125号公報
【特許文献2】特開2007−296214号公報
【特許文献3】特開2008−215901号公報
【特許文献4】特開2009−42141号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
例えば、シクロスポリンAは、主としてT細胞(ヘルパーT細胞)によるインターロイキン−2(IL−2)などのサイトカイン産生を阻害することにより、強力な免疫抑制作用を示すことが知られている。このため、シクロスポリンAについて、薬効を評価するのであれば、本来は、T細胞に実効的に作用する濃度を測定すべきであり、また、TMAなどの副作用を評価するのであれば、赤血球に実効的に作用する濃度を測定すべきである。
【0009】
しかしながら、これらの値は、標的とする血液細胞成分を分離抽出し、更にそれを溶解した上で、抗体試薬を用いた蛍光偏光免疫測定法などの分析方法で測定しなければならず、煩雑な作業を多忙極める臨床現場で行うことは困難である。このように、シクロスポリンAなどの一部の薬剤に関しては、入院患者に対してさえ容易ではないTDMを、医療関係者が常時管理することができない通院患者に適用することは、なおさら困難である。
【0010】
即ち、血中の薬剤濃度から薬物動態を分析する従来の手法は、作業が繁雑で、結果が出るまでに時間を要するため、医薬品の研究開発には適用できても、臨床検査、特に通院患者への適用は困難であるという問題点がある。
【0011】
そこで、本発明は、薬剤の効果や副作用を短時間で評価することができる血球細胞分析装置、血球細胞分析方法及び血球細胞分析システムを提供することを主目的とする。
【課題を解決するための手段】
【0012】
本発明に係る血球細胞分析装置は、1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する測定部と、この測定部で測定された複素誘電率スペクトルに基づいて、懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する検出部と、を有するものである。
本発明においては、血球細胞を含む懸濁液の複素誘電率スペクトルを測定し、その値から求めた誘電変数や電気的物性値から血球細胞の状態変化を検出しているため、従来の方法に比べて、手間や時間がかからない。このため、薬剤の効果や副作用を、容易にかつ短時間で評価することが可能となる。
この血球分析装置では、誘電変数として誘電緩和強度及び/又は誘電緩和周波数を算出してもよく、また、電気的物性値として、膜キャパシタンス及び/又は細胞質導電率を算出してもよい。
また、前述した測定部及び検出部に加えて、基準となる誘電変数及び/又は電気的物性値が記憶された記憶部を有していてもよく、その場合、検出部において、記憶部に記憶された値と比較して、血球細胞の状態変化の有無又は程度を検出することができる。
更に、この装置には、採取血液から測定用の懸濁液を調整する前処理部を設けてもよい。
更にまた、検出結果を表示する表示部を設け、誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値が、設定された範囲から外れているときに、前記表示部に警告を表示することもできる。
更にまた、この装置には、誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値に基づいて、適正な薬剤投与量を算出する解析部を設けてもよい。
更にまた、測定部に、懸濁液が通流する流路の一部に血球細胞が個別に通過可能な狭窄部を形成した流路デバイスを設け、この狭窄部において一の血球細胞を含む懸濁液の複素誘電率スペクトルを測定することもできる。
【0013】
本発明に係る血球細胞分析方法は、1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する工程と、測定された複素誘電率スペクトルに基づいて、懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する工程と、を有する。
本発明においては、血球細胞を含む懸濁液の複素誘電率スペクトルを測定し、その値から求めた誘電変数や電気的物性値から血球細胞の状態変化を検出しているため、薬剤の効果や副作用を、手間をかけずに短時間で評価することが可能である。
この分析方法では、懸濁液に、検出対象の血球細胞以外の血球細胞が含まれていてもよい。
また、検出対象の血球細胞は、例えば赤血球又は白血球である。
【0014】
本発明に係る血球細胞分析システムは、1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する測定装置と、この測定装置で測定された複素誘電率スペクトルに基づいて、懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する検出装置と、を有するものである。
本発明においては、血球細胞を含む懸濁液の誘電変数や電気的物性値から血球細胞の状態変化を検出しているため、入院患者、通院患者にかかわらず、更に在宅患者であっても、薬剤の効果や副作用を、容易に評価することが可能となる。
この分析システムでは、測定装置と検出装置とが通信ネットワークを介して接続されていてもよい。
【発明の効果】
【0015】
本発明によれば、血球細胞を含む懸濁液の複素誘電率スペクトルを測定し、その値から求めた誘電変数や電気的物性値から血球細胞の状態変化を検出しているため、薬剤の効果や副作用を短時間で評価することができる。
【図面の簡単な説明】
【0016】
【図1】本発明の第1の実施形態に係る血球細胞分析装置の構成を示すブロック図である。
【図2】図1に示す測定部3の構成を模式的に示す図である。
【図3】本発明の第1の実施形態に係る血球細胞分析装置の動作例を示すフローチャート図である。
【図4】本発明の第1の実施形態に係る血球細胞分析装置の他の動作例を示すフローチャート図である。
【図5】本発明の第1の実施形態に係る血球細胞分析装置の他の動作例を示すフローチャート図である。
【図6】(a)は本発明の第1の実施形態の血球細胞分析装置における複素誘電率スペクトル測定時の懸濁液の状態を示す概念図であり、(b)は第2の実施形態の血球細胞分析装置における複素誘電率スペクトル測定時の懸濁液の状態を示す概念図である。
【図7】本発明の第2の実施形態に係る血球細胞分析装置で使用する流路デバイスの構成例を示す断面図である。
【図8】横軸に薬剤投与開始後の経過日数をとり、縦軸に誘電緩和強度Δεと誘電緩和周波数fをとって、面積抑制剤服用患者から採取した赤血球の誘電変数の変化を示すグラフ図である。
【図9】横軸に単位面積あたりの膜キャパシタンスCMをとり、縦軸に細胞質の導電率σCをとって、健常者及び免疫抑制剤服用患者の赤血球構成相の電気的物性値を示した図である。
【発明を実施するための形態】
【0017】
以下、本発明を実施するための形態について、添付の図面を参照して詳細に説明する。なお、本発明は、以下に示す各実施形態に限定されるものではない。また、説明は、以下の順序で行う。
1.第1の実施の形態
(血球細胞分析装置により複数の血球細胞を含む懸濁液全体を評価する例)
2.第2の実施の形態
(血球細胞分析装置により個々の血球細胞を評価する例)
3.第3の実施の形態
(誘電分光法により血球細胞の状態を分析する血球細胞分析システムの例)
【0018】
<1.第1の実施の形態>
[血球細胞分析装置の全体構成]
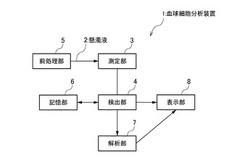
本発明の第1の実施形態に係る血球細胞分析装置は、誘電分光法により、懸濁液に含まれる血球細胞の状態変化を検出し、創薬プロセスや臨床現場において、薬剤の効果や副作用について評価する際に使用されるものである。図1は本実施形態の血球細胞分析装置の構成を示すブロック図である。
【0019】
具体的には、図1に示すように、本実施形態の血球細胞分析装置1は、懸濁液2の複素誘電率スペクトルを測定する測定部3と、測定結果から血球細胞の状態変化を検出する検出部4とを備えている。また、血球細胞分析装置1には、測定用の懸濁液2を調整する前処理部5、基準となる誘電変数や電気的物性値が記憶された記憶部6、適正な薬剤投与量を算出する解析部7、検出及び/又は解析結果を表示する表示部8などが設けられていてもよい。
【0020】
[懸濁液2について]
本実施形態の血球細胞分析装置1では、少なくとも検出対象の血球細胞を含有する懸濁液2を使用して測定を行う。ここで、検出対象とする血球細胞は、薬剤投与に伴い、その薬効や副作用によって状態が変化するものであればよく、例えば赤血球、白血球及び血小板などが挙げられる。
【0021】
また、懸濁液2は、検出対象の血球細胞のみを含有していてもよいが、検出対象でない血球細胞が含まれていてもよい。更に、懸濁液2に含まれる血球細胞は、ヒトのものに限定されるものではなく、本実施形態の血球細胞分析装置1では、ラット、マウス及びウサギなどの動物の血球細胞についても分析可能である。
【0022】
[測定部3の構成]
図2は図1に示す測定部3の構成を模式的に示す図である。図2に示すように、測定部3は、一対の平行平板電極32a,32bを備えた測定用セル31を備えており、検出対象の血球細胞20を含む懸濁液2は、測定用セル31内に充填される。また、測定用セル31の電極32a,32bは、それぞれ伝送線33を介して測定器34に接続されており、この測定器34により懸濁液2の複素誘電率スペクトルが測定される。
【0023】
(測定用セル31)
測定用セル31は、懸濁液2の複素誘電率スペクトル測定に影響しないものであればよく、例えばアクリル系樹脂やポリエーテルサルフォン樹脂などにより形成することができる。また、電極32a,32bの大きさ及び間隔も特に限定されるものではなく、測定周波数や印加電圧などに応じて適宜設定することができる。更に、測定用セル31やその周辺部には、測定用セル31に懸濁液2を導入するための機構、測定後の懸濁液2を排出するための機構、測定の前後に測定用セル31内を溶媒などで洗浄するための機構など、測定に付随する作業に関する種々の機構を設けることもできる。
【0024】
(測定器34)
測定器34は、測定対象の周波数範囲において、複素誘電率測定を実施できるものであればよく、例えばインピーダンスアナライザー、ネットワークアナライザー及び時間領域反射オシロスコープなどを使用することができる。
【0025】
[検出部4の構成]
検出部4では、電子計算機などにより、測定部3で測定された複素誘電率スペクトルに基づいて、懸濁液2の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞20の状態変化を検出する。具体的には、先ず、複素誘電率スペクトルから、誘電変数である誘電緩和強度や誘電緩和周波数などを、また、電気的物性値である膜キャパシタンスや細胞質導電率などを算出する。
【0026】
そして、算出した誘電変数及び/又は電気的物性値と、過去に測定した誘電変数や電気的物性値、或いは後述する記憶部6に記憶された基準値とを比較して、薬剤投与に伴う血球細胞20の状態変化を検出する。例えば、免疫抑制剤の場合、赤血球の誘電緩和周波数の低下や誘電緩和強度の上昇により、副作用についての評価を行うことができる。
【0027】
この検出部4において、検出された結果は、後述する表示部8に表示される。また、検出部4で検出した値が予め設定された範囲から外れていた場合は、表示部8に警告が表示されるようにしてもよい。具体的には、誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値が、設定範囲から外れていたときに、表示部8に警告を表示する。これにより、臨床現場における服薬用量管理が容易になる。
【0028】
[前処理部5]
前述した測定部3で測定する懸濁液2は、検体毎に作業者が調整してもよいが、血球細胞分析装置1に、患者などから採取した血液検体に対して、必要に応じて、分離、抽出及び希釈などの前処理を自動で行う前処理部5を設けてもよい。その場合、調整された懸濁液2を、測定部3の測定セル31内に自動で注入する機構を設けることにより、人手を介さずに、全ての作業を行うことができるため、分析時間を短縮できると共に、作業効率を向上させることができる。
【0029】
[記憶部6]
記憶部6は、基準となる誘電変数及び/又は電気的物性値などが記憶されたデータベースであり、例えば、健常者で測定した値や同じ患者について過去に測定した値、或いはシミュレーションなどにより求めた値が記憶されている。そして、検出部4において、これらの値と測定部3で測定された値とを比較することにより、血球細胞20の状態変化の有無や程度を、容易に検出することができる。
【0030】
[解析部7]
解析部7は、誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値に基づいて、適正な薬剤投与量を算出するものである。そして、その算出結果は、検出部4における検出結果と共に、表示部8に表示される。これにより、臨床現場における服薬用量管理を効率化することができる。
【0031】
[表示部8]
表示部8は、検出部4や解析部7と接続されている。そして、この表示部8には、例えば、検出部4で算出した誘電変数や電気的物性値、検出部4で検出した血球細胞の状態、検出部4での検出結果が設定範囲から外れていたときの警告、解析部7で算出した適正な薬剤投与量などが表示される。
【0032】
[血球細胞分析装置1の動作]
次に、前述の如く構成された血球細胞分析装置1の動作、即ち、血球細胞分析装置1を使用して血球細胞に対する薬剤の影響を評価する方法について説明する。図3は本実施形態の血球細胞分析装置1の動作例を示すフローチャート図である。
【0033】
[ステップS1:懸濁液2の調整]
図3に示すように、本実施形態の血球細胞分析装置1では、先ず、前処理部5において、血液検体に、分離、抽出、希釈などの処理を施し、測定に使用する懸濁液2を調整する。その際用いる血液の採取方法は、特に限定されるものではなく、公知の方法を適用することができる。また、必要に応じて、調整された懸濁液2に、適切な濃度で薬剤を添加してもよい。
【0034】
血液に含まれる赤血球の数は、他の成分よりもはるかに多く、健常なヒトの場合は白血球の数百倍から数千倍含まれている。このため、薬剤が赤血球に与える影響を評価する場合は、白血球の数は無視することができ、懸濁液2として、採取した血液(全血)を、適当な溶媒により測定に適した濃度にまで希釈した溶液を使用することができる。更に、当然ながら、厳密を期して、生化学的操作により、血液から白血球や血小板などの測定対象外の成分を除去したものを使用してもよい。
【0035】
ここで、血液などを希釈する際に使用する溶媒は、赤血球などの検出対象の血球細胞と等張、即ち、血漿成分と同じ塩濃度を有し、検出対象の血球細胞の性状に影響を与えないと考えられる緩衝溶液を使用することができる。具体的には、pH7.4のリン酸緩衝生理食塩水(Phosphate Buffered Saline:PBS)などを使用することができる。
【0036】
一方、薬剤が白血球に与える影響を評価する場合は、血液臨床検査法で一般に利用されている方法によって、全血から赤血球や血小板などの白血球以外の成分を除去し、適当な溶媒により測定に適した濃度にまで希釈した溶液を使用することができる。例えば、自動血球計測検査においては、全血に溶血剤を加えて赤血球を溶血させ、その溶液中に残存する有核細胞を数えて白血球数としている。
【0037】
また、薬剤が、単球、好酸球、好中球、好塩基球及びリンパ球などの白血球中の特定成分に与える影響を評価する場合は、適切な生化学的操作によって更に分離操作を行う。特定成分の分離抽出操作は、公知の方法を適用することができ、例えば、特定の白血球成分の表面に表出する抗原と、特異的に結合する抗体で被覆された磁気ビーズを用いると、その成分のみを分離抽出することができる。
【0038】
更に、図2に示すような平行平板キャパシタ型セルで測定する場合、血球細胞の体積分率は0.5〜25%であることが望ましい。血球細胞の体積分率が25%を超えると、細胞間の相互作用の影響で、データ解析が複雑になるからである。一方、血球細胞の体積分率が0.5%未満の場合、誘電緩和の振幅が小さくなり、測定データの信頼性が低下することがある。
【0039】
[ステップS2:複素誘電率スペクトル測定]
次に、測定部3において、複数の血球細胞20を含む懸濁液2全体の複素誘電率を、印加する交流電圧の周波数の関数として測定する。具体的には、所定間隔を空けて対向配置された平行平板電極31a,32bを備える測定用セル31に、懸濁液2を充填する。そして、伝送線33を介して電極31a,32bと電気的導通が確保された精密インピーダンス測定器(測定器34)により、予め設定した周波数範囲にわたり、複素インピーダンス測定を行う。
【0040】
ここで、複素インピーダンス測定を行う周波数範囲は、検出対象の血球細胞や薬剤の種類などに応じて適宜設定することができるが、観測対象となる誘電緩和の緩和周波数を基準とし、その前後それぞれ2桁程度を含むことが望ましい。例えば、免疫抑制剤の赤血球に対する影響を評価する場合には、赤血球懸濁液の緩和周波数が1MHz程度であるため、10kHz〜100MHzの範囲で測定すればよい。
【0041】
また、測定した複素インピーダンスは、公知の方法により複素誘電率に変換することができる。その際、測定系の配線や測定用セル31に起因するインダクタンスや浮遊容量についての補正、電極分極の補正を行う必要があるが、これらについても、公知の方法を適用することができる(例えば、日本化学会著、「実験化学講座9 電気磁気」、丸善、1991年発行 参照。)。
【0042】
[ステップS3:検出用データの算出]
次に、検出部4において、複素誘電率スペクトルから検出用データFn(t)を算出する。なお、ここでいう検出用データにおける「Fn」は誘電変数又は電気的物性値を示し、「t」は測定時刻である。
【0043】
(誘電変数の算出)
懸濁液2のように、細胞を含む溶液の複素誘電率の周波数依存性(周波数分散)、即ち、複素誘電率スペクトルは、おおよそ1MHz〜数十MHzの領域に、含有する細胞の性状に応じて特徴的な変化、即ち、誘電緩和を示すことが知られている。このような細胞溶液の複素誘電率スペクトルは、下記数式(1)に示す緩和関数の和として表すことができる。
【0044】
【数1】

【0045】
なお、上記数式1におけるaは、複数の誘電緩和がある場合に、それらを区別するためのものであり、a番目の誘電緩和における緩和強度がΔεa、緩和時間がτaである。この緩和時間τaと、緩和周波数faとの関係は、下記数式(2)で表される。また、βaは、緩和の広がりを示すCole−Coleパラメータで、スペクトルの形状を特徴付ける変数である。更に、ε∞は高周波極限での比誘電率であり、ωは角周波数であり、i2=−1である。
【0046】
【数2】

【0047】
そして、全ての誘電緩和についての緩和強度Δε、緩和周波数f、Cole−Coleパラメータβを「誘電変数」といい、本実施形態の血球細胞分析装置1においては、特に緩和強度Δε及び緩和周波数fを算出する。具体的には、先ず、周波数点毎に仮定した誘電変数で表現される誘電緩和関数の値と実測値との差を求める。そして、各周波数点における差を二乗した値を測定周波数全体で足し合わせて、その総和が最小になるように、誘電変数を最適化することにより、血球細胞20を含む懸濁液2の誘電スペクトルを特徴付ける誘電変数を決定する。
【0048】
(電気的物性値の算出)
細胞溶液の複素誘電率スペクトルは、細胞を取り巻く溶媒の誘電率や導電率にも依存し、純粋に細胞を構成する相の電気的物性値のみを反映したものではない。しかしながら、公知の解析手法を利用することにより、この複素誘電率スペクトルから細胞を構成する相(例えば、細胞膜、細胞質、核膜、核質など)の電気的物性値、即ち、誘電率及び導電率を得ることができる。
【0049】
例えば、細胞膜と細胞質のみから形成されている球形細胞などの場合は、解析式を用いることにより、複素誘電率スペクトルから、細胞膜及び細胞質それぞれの電気的物性値を直接求めることができる(花井哲也著、「不均質構造と誘電率−物質を壊さずに内部構造を探る」、吉岡書店、2000年発行 参照)。
【0050】
一方、複雑な構造を有する細胞については、数値的シミュレーションを利用することにより、膜キャパシタンスCMや細胞質導電率σCを求めることができる(特許文献4参照)。具体的には、測定対象の細胞の形状をモデル化し、その細胞にAC電場が印可されたときの複素誘電率応答を数値解析により求める。その結果に基づいて、膜キャパシタンスCM及び細胞質導電率σCの値を変化させながら数値計算して、誘電スペクトルを算出する。
【0051】
次に、算出した誘電スペクトルを誘電緩和式に回帰させて、誘電緩和強度Δε及び緩和時間τを求める。更に、(Δε,τ)の(CM,σC)への依存性を求め、測定対象の細胞の形状に応じた回帰式を作成する。そして、細胞の誘電スペクトルを実測し、その値と回帰式とを比較することで、測定対象の細胞の膜キャパシタンスCM,exp及び細胞質導電率σC,expを求める。
【0052】
[ステップS4:記憶部6のデータと照合]
次に、検出部4において、算出した検出用データFn(t)と、例えば記憶部6に記憶された健常者のデータとを照合し、血球細胞の状態変化を検出する。具体的には、検出用データFn(t)が、予め設定された健常域の範囲内であるか、否かを判定する。その際、検出用データFn(t)としては、誘電変数及び電気的物性値のうち1又は2以上の値を使用することができる。
【0053】
[ステップS5,S6:検出結果の表示]
ステップS4における照合の結果、検出用データFn(t)の値が、健常域の範囲内である場合は、表示部8に問題ない旨表示する(ステップS5)。一方、検出用データFn(t)の値が、健常域の範囲から外れていた場合は、表示部8に警告を表示する(ステップS6)。
【0054】
[他の動作例]
なお、図3に示す動作例では、検出部4で算出した検出用データFn(t)そのものを基に、血球細胞の状態変化を検出しているが、本発明はこれに限定されるものではなく、血球細胞の状態変化の度合いに基づき検出することもできる。図4及び図5は本実施形態の血球細胞分析装置1における他の動作例を示すフローチャート図である。
【0055】
例えば、図4に示すように、薬剤投与前又は薬剤が表れてないときに測定した比較用データFn(0)と、検出用データFn(t)とから算出した増減幅Gn(t)を基に、血球細胞の状態変化を検出することもできる。この動作例では、ステップS13において算出した検出用データFn(t)を、例えば測定日や付加情報データなどと共に、記憶部6に記憶し、保存する(ステップS14)。このように、測定日や付加情報データを併せて保存しておくと、担当医師などが、血球細胞分析装置1での検出結果と、血液検査データやその他臨床所見と組み合わせて判定を行う場合に、便利である。
【0056】
次に、検出部4において、下記数式(3)に基づき、予め記憶部6に記憶しておいた比較用データFn(0)と、ステップS13で算出した検出用データFn(t)から、増減幅Gn(t)を算出する(ステップS15)。その際、検出用データFn(t)及び比較用データFn(0)としては、誘電変数及び電気的物性値のうち1又は2以上の値を使用することができる。なお、「n(=1,2,・・・)」はそのための識別子である。
【0057】
【数3】

【0058】
そして、算出した増減幅Gn(t)と、例えば記憶部6に記憶された基準値Gnとを照合し、血球細胞の状態変化を検出する。具体的には、増減幅Gn(t)が、予め設定された健常域の範囲内であるか、否かを判定する。その結果、増減幅Gn(t)の値が、健常域の範囲内である場合は、表示部8に問題ない旨表示し(ステップS17)、増減幅Gn(t)の値が、健常域の範囲から外れていた場合は、表示部8に警告を表示する(ステップS18)。
【0059】
この動作例は、投薬前から、誘電変数や電気的物性値が健常域から外れている患者に、特に有効な方法である。なお、図4に示す動作例において、ステップS11〜S13は前述したステップS1〜S3と同様であるため、具体的説明は省略する。
【0060】
また、図5に示すように、検出用データFn(t)の時間変化の大きさF´n(t)を基に、血球細胞の状態変化を検出することもできる。この動作例でも、図4に示す動作例同様、ステップS23において算出した検出用データFn(t)を、例えば測定日及び付加情報データなどと共に、記憶部6に記憶し、保存する(ステップS24)。
【0061】
次に、検出部4において、下記数式(4)に基づき、時間変化の大きさF´n(t)を算出する(ステップS25)。なお、下記数式(4)におけるΔtは、前回又は数回前の測定時刻からの経過時間であり、Fn(t−Δt)は、前回又は数回前の測定値である。また、その際、検出用データFn(t)及び過去の測定値Δtとしては、誘電変数及び電気的物性値のうち1又は2以上の値を使用することができる。
【0062】
【数4】

【0063】
そして、時間変化の大きさF´n(t)と、例えば記憶部6に記憶された基準値F´nとを照合し、血球細胞の状態変化を検出する。具体的には、時間変化の大きさF´n(t)が、予め設定された健常域の範囲内であるか、否かを判定する。その結果、時間変化の大きさF´n(t)の値が、健常域の範囲内である場合は、表示部8に問題ない旨表示し(ステップS27)、時間変化の大きさF´n(t)の値が、健常域の範囲から外れていた場合は、表示部8に警告を表示する(ステップS28)。
【0064】
この動作例では、投薬量に対する応答を検知することができるため、担当医などが、容易に次の投薬量を見積もることができる。また、検出値が健常域の範囲内の場合でも、急変の予兆を検知することが可能となる。なお、図5に示す動作例において、ステップS21〜S23は前述したステップS1〜S3と同様であるため、具体的説明は省略する。
【0065】
[薬剤投与量の算出]
更に、本実施形態の血球細胞分析装置1では、解析部8において適正な薬剤投与量を算出し、その結果を表示部8に表示することもできる。具体的には、前述した検出用データFn(t)、増減幅Gn(t)又は時間変化の大きさF´n(t)の値や、記憶部6に記憶された基準値などに基づき、血球細胞が適正状態になる薬剤投与量を算出する。
【0066】
例えば、各Fn(t)が健常域の範囲内であった場合は、当初医師により決定された標準の投与量を採用し、提示する。一方、各Fn(t)が健常域の範囲から外れていた患者の場合は、各Gn(t)を用いて、個別に病状変化がないか確認する。その結果、特に問題がなければ当初医師により決定された標準の投与量を選択し、提示する。
【0067】
また、病状変化があるが、その程度が軽微な投薬量の減少で対応可能である場合は、各Fn(t)又は各Gn(t)の余裕値と、F´n(t)とから予測される投与後の各Fn(t)又はGn(t)に基づいて、投薬量の減量又は増加量を算出し、提示する。このように、血球細胞の状態及びその変化に関する各種データから総合的に判定することで、適正な薬剤投与量を提案することができる。
【0068】
本実施形態の血球細胞分析装置1では、血球細胞20を含む懸濁液2の誘電変数や電気的物性値から血球細胞の状態変化を検出しているため、薬剤の効果や副作用を、容易にかつ短時間で評価することができる。また、この血球細胞分析装置1では、懸濁液2全体の複素誘電率スペクトルを測定し、その平均的情報により、検出対象の血球細胞20の状態変化を検出しているため、懸濁液2に検出対象外の血球細胞が含まれていても分析が可能である。その結果、検出対象外の血球細胞を分離・除去する必要がなく、作業効率を向上させることができる。
【0069】
更に、本実施形態の血球細胞分析装置1は、高血圧治療薬、心臓病治療薬及び免疫抑制剤などの特定の薬剤を、長期間服用している患者が、正しく服用し、かつしかるべき薬効が得られているかを、モニタリングすることも可能である。例えば、誘電変数又は電気的物性値の値が特定範囲(健常域)に収まっているときは、別の分析手段で調べられたこの薬剤の体内濃度が適正であるか、臨床的見地から望ましい薬効が得られていると、患者への応用に先立った臨床試験によって明らかになっているとする。
【0070】
このような場合、測定値から算出された値が正常域を外れたときに、血球細胞分析装置1が警告を発することで、担当の医師などがより詳細に患者の状態を調べ、必要に応じて適正な服薬指導などを行うことができる。
【0071】
更にまた、血球細胞分析装置1では、高血圧治療薬、心臓病治療薬及び免疫抑制剤などの特定の薬剤を、長期間服用している患者が、重篤な副作用に陥らないように、モニタリングすることもできる。例えば、誘電変数又は電気的物性値の値が特定範囲(健常域)から外れると、臨床的見地から重篤な副作用が発生する可能性が高いことが、患者への応用に先立った臨床試験によって明らかになっているとする。
【0072】
このような場合、測定値から算出された値が正常域を外れたときに、血球細胞分析装置1が警告を発することで、担当の医師などがより詳細に患者の状態を調べ、必要に応じて服薬の中止、服薬量の減量、その他副作用に関する治療を行うことができる。
【0073】
<2.第2の実施の形態>
[血球細胞分析装置の全体構成]
図6(a)は本発明の第1の実施形態の血球細胞分析装置における複素誘電率スペクトル測定時の懸濁液の状態を示す概念図であり、図6(b)は第2の実施形態の血球細胞分析装置における複素誘電率スペクトル測定時の懸濁液の状態を示す概念図である。図6(a)に示すように、第1の実施形態の血球細胞分析装置では、溶媒22中に複数の血球細胞20,21が分散されている懸濁液2について評価しているが、本発明はこれに限定されるものではなく、血球細胞20を個別に評価することもできる。
【0074】
前述した第1の実施形態の血球細胞分析装置では、検出対象外の血球細胞21と検出対象の血球細胞20が混在している懸濁液2について複素誘電率スペクトルを測定し、その平均的情報により検出対象の血球細胞20の状態を評価している。これに対して、第2の実施形態の血球細胞分析装置では、図6(b)に示すように、溶媒22に検出対象の血球細胞20が1個含まれている状態で、複素誘電率スペクトル測定を行う。
【0075】
即ち、本発明の第2の実施形態に係る血球細胞分析装置は、測定部に、懸濁液が通流する流路の一部に血球細胞が個別に通過可能な狭窄部が設けられた流路デバイスを備えている。そして、この狭窄部において、血球細胞を1個だけ含む懸濁液の複素誘電率スペクトルを測定することができるようになっている。
【0076】
[流路デバイス]
図7は本実施形態の血球細胞分析装置で使用する流路デバイスの構成例を示す断面図である。図7に示すように、本実施形態の血球細胞分析装置で使用する流路デバイス40は、例えば、厚さ方向の通流位置が相互に異なる2本の流路47a,47bを、狭窄部42aを介して連通する構成とすることができる。
【0077】
具体的には、ポリイミドなどからなるカバー層41と、中間層42とが、所定厚さの接着層44を介して積層されており、更に接着層44の他方の面には、所定厚さの接着層45を介してカバー層43が積層されている。これら接着層44,45は、中間層42の一部にのみ貼着されており、接着層44,45が貼着されていない空隙部分には、懸濁液が通流する流路47a,47bが形成されている。
【0078】
また、中間層42とカバー層43との間に形成され流路47aと、中間層42とカバー層41との間に形成された流路47bとは、中間層42に形成された狭窄部42aを介して連通している。この狭窄部42aは、懸濁液に含まれる血球細胞が、1個ずつ通過する大きさであればよい。更に、中間層42の流路47a側の面には電極46aが設けられており、中間層42の流路47b側の面には電極46bが設けられている。そして、これら電極46a,46b間に所定の電圧を印加することにより、狭窄部42aを通過する懸濁液の複素誘電率スペクトルを測定することができる。
【0079】
この流路デバイス40を使用して、複素誘電率スペクトル測定を行うことにより、個々の血球細胞の状態を評価することが可能となる。また、この流路デバイス40を使用することにより、白血球などのように血中濃度が低い細胞であっても、分離や抽出処理を行わずに分析することも可能となる。
【0080】
なお、本実施形態の血球細胞分析装置に使用される流路デバイスは、図7に示す構成のものに限定されるものではなく、流路の一部に、血球細胞が1個ずつ通流する大きさの狭窄部が形成されていればよい。また、本実施形態の血球細胞分析装置の動作、並びに、流路デバイス40以外の構成及び効果は、前述した第1の実施形態と同様である。
【0081】
<3.第3の実施の形態>
[血球細胞分析システムの構成]
本発明の第3の実施形態に係る血球細胞分析システムは、誘電分光法により、懸濁液に含まれる血球細胞の状態変化を検出するものであり、薬剤の効果や副作用を評価する際に使用される。具体的には、本実施形態の血球細胞分析システムは、少なくとも、懸濁液の複素誘電率スペクトルを測定する測定装置と、測定結果から血球細胞の状態変化を検出する検出装置とを備えている。
【0082】
また、本実施形態の血球細胞分析システムにおける検出装置は、測定装置で測定された複素誘電率スペクトルに基づいて、懸濁液の誘電変数及び/又は電気的物性値を算出し、血球細胞の状態変化を検出するものである。更に、この血球細胞分析システムでは、測定装置と検出装置がそれぞれ離れた場所に設置され、通信ネットワークを介して相互に接続されていてもよい。
【0083】
本実施形態の血球細胞分析システムは、懸濁液を調整する前処理装置、基準となる誘電変数や電気的物性値などが記憶された記憶装置、適正な薬剤投与量を算出する解析装置、検出及び/又は解析結果を表示する表示装置などを設けることもできる。また、これらの装置は、全て同じ場所(部屋)に設置されている必要はなく、例えば、前処理装置、測定装置及び表示装置を診察室に設置し、それ以外の装置は別の部屋に設置し、それぞれ通信ネットワークを介して相互に接続することもできる。更に、1つの検出装置に、複数の測定装置が接続することもできる。
【0084】
一方、本実施形態の血球細胞分析システムにおいて複素誘電率スペクトルを測定する懸濁液は、1又は複数個の血球細胞を含有していればよく、懸濁液に含まれる血球細胞は1種類でも複数種でもよい。この懸濁液は、被験者から採取した血液から調整されるが、その採取方法は、特に限定されるものではなく、公知の方法を適用することができる。
【0085】
例えば、被験者が入院患者の場合は、病床又は院内の中央検査室などにおいて、医師や看護婦などが定期的に採血を行うことができる。また、被験者が、自宅などで服薬を続けている通院患者の場合は、通院時に採血を行えばよい。これらの場合、血液は、真空採血管などの標準的に用いられている器具内に採血されることとなるが、本実施形態の血球細胞分析システムでは、採血器具をそのまま前処理装置や測定装置にセットし、全自動で測定を行うことも可能である。
【0086】
一方、本実施形態の血球細胞分析システムでは、前処理装置及び測定装置として、自宅などに設置し、患者自ら測定・管理できるような形態のもの、所謂その場検査(Point-of-Care Testing:POCT)用の小型デバイスを用いることもできる。例えば、I型糖尿病患者の場合、血糖値管理のPOCT用途で用いられる穿刺器などにより少量の血液を採取し、測定することができる。
【0087】
また、自宅で採取した血液を、適当な保存溶液に溶解させて、郵送などの手段で測定装置が設置されている医療機関などに送付して検査を行うことも可能である。なお、動物実験においても、同様の採血方法及び装置を適用することができる。
【0088】
本実施形態の血球細胞分析システムでは、細胞の溶解、抗体試薬を用いた蛍光分析など、煩雑でコストがかかる作業を行わずに、血球細胞に対する薬剤の影響を評価することができる。その結果、患者などの服薬量管理を、病院内あるいは自宅などで、簡便に行うことが可能となる。
【0089】
また、本実施形態の血球細胞分析システムは、薬剤の研究開発にも適用可能であり、関心のある特定の血球細胞に対する薬剤の効果や副作用について、容易に評価することができる。そして、この血球細胞分析システムは、適正な服薬量の管理又は副作用リスク検知を通して、患者個人の状態に応じた治療の質の向上に寄与するものである。
【実施例】
【0090】
以下、本発明の実施例により、本発明の効果について具体的に説明する。本実施例においては、前述した第1の実施形態の血球細胞分析装置を用いて、免疫抑制剤の赤血球に対する影響を評価した。具体的には、骨髄移植を受ける患者について、免疫抑制剤服用9日前から91日後までの期間血液を採取し、赤血球を含む懸濁液の誘電分光測定を行った。なお、この患者は、治療の経過に伴い、血液採取期間の後期に、服薬量を徐々に減らし、最終的には服用を止めた。
【0091】
(測定方法)
血液は、真空採血管(EDTA 2k入り)を用いて、約2ml採取した。そして、採血管を静かに2回転倒混和した後、ヘマトクリット遠心機専用のガラスキャピラリー3本に全血を充填して、ヘマトクリット遠心機にセットし、回転数を7000rpmとして、3分間遠心した。遠心後直ちに、装置に備わる目盛りを用いて、血漿と分離された赤血球成分の割合、即ちヘマトクリット値(Hct)を読み取った。
【0092】
次に、赤血球の形態異常を確認するため、ピペットにより採血管から約3μLの全血を採取し、顕微鏡観察用スライドガラスの端部付近に滴下した。そして、顕微鏡観察用カバーガラスを用いて、滴下した全血をスライドガラス全面に塗沫した。この塗沫標本を40倍の対物レンズを有する光学顕微鏡により観察し、スライドガラス上の十分に離れた3点の血液像を、撮影し保存した。
【0093】
また、複素誘電率スペクトル測定用として、懸濁液中の血球細胞の濃度が体積分率で約10%になるように、全血300mLに、pH7.4のリン酸緩衝生理食塩水(PBS):(30×Hct−300)mLを添加し、これらをポリプロピレン製マイクロテストチューブ中で混合した。
【0094】
複素誘電率スペクトルの測定には、ポリスチレン樹脂製で、直径8mmの白金板電極が3.5mm間隔で対向配置された平行平板キャパシタ型セルを使用した。そして、この測定用セルを、精密インピーダンス測定器と電気的に接続されているテストフィクスチャに搭載して測定を行った。その際、ピペットを用いて、測定用セルに濃度を調整した懸濁液を190μL注入し、懸濁液の温度が安定するまで2分間待機した。
【0095】
その後、精密インピーダンス測定器により、測定用セルの各電極間に、振幅300mVの交流電圧を印加し、40〜110MHzの範囲で、141点の周波数における複素インピーダンスを測定した。なお、測定周波数点は、対数スケールでほぼ等間隔になるよう設定した。また、この系の複素インピーダンスは、精密インピーダンス測定器が発生する電極間に流れる電流を周波数の関数として測定し、その電圧と電流から計算することができる。
【0096】
次に、前述した方法で測定した複素インピーダンススペクトルを、複素誘電率スペクトルに変化した。今回検出対象としている赤血球は、細胞核を持たないため、単一の誘電緩和で表わされる。そこで、本実施例においては、複素誘電率スペクトルに対して、誘電緩和関数をフィッティングすることにより、誘電変数である緩和強度Δε1、緩和周波数f1、Cole−Coleパラメータβ1を求めた。更に、これらの誘電変数から、特許文献4に記載の方法により、電気的物性値である単位面積当たりの細胞膜のキャパシタンスCMと細胞質の導電率σCを算出した。
【0097】
(結果)
図8は横軸に薬剤投与開始後の経過日数をとり、縦軸に誘電緩和強度Δεと誘電緩和周波数fをとって、免疫抑制剤服用患者から採取した赤血球の誘電変数の変化を示すグラフ図である。また、図9は横軸に単位面積あたりの膜キャパシタンスCMをとり、縦軸に細胞質の導電率σCをとって、健常者及び免疫抑制剤服用患者の赤血球構成相の電気的物性値を示した図である。
【0098】
図8に示すように、免疫抑制剤を服用すると、その数日後から、緩和強度Δε1が上昇すると共に、緩和周波数f1が減少し、健常者の値(健常域)から大きく外れた。一方、治療が終了し、服薬を中止した後の91日目の測定では、緩和強度Δε1及び緩和周波数f1共に、健常域に戻っていた。これにより、観察された誘電変数の変化は、免疫抑制剤の赤血球に対する作用と関連することが確認された。
【0099】
また、これらの誘電変数から、膜キャパシタンスCMと細胞質の導電率σCを算出したところ、観測された大きな変化は、膜キャパシタンスCMの顕著な増加に起因していることがわかった。この膜キャパシタンスCMが増加するということは、膜の実効的な厚みが減少していることを意味する。その原因は完全には理解されていないが、薬剤の作用により、細胞膜の所謂裏打ちタンパク(例えば、Band3など)が影響を受けたことなどが考えられる。
【0100】
そこで、同様の測定を複数の患者に対しても実施したところ、どの患者でも、基本的には図8と同様の変化を示したが、変化の大きさ、変化の時期、誘電変数が正常値に戻るまでの日数などには個人差が見られた。従って、図8のような誘電変数の経時変化を測定することは、個々の患者ごとに薬剤の副作用を予測するために有用である。即ち、赤血球を含む懸濁液の誘電変数の変化を確認することにより、免疫抑制剤における副作用に関する評価を行うことができる。
【0101】
一方、図9に示すように、健常者のデータは比較的狭い範囲に集まっているが、免疫抑制剤服用患者については、膜キャパシタンスCMの顕著な増加が認められる。興味深いことに、異なる免疫抑制剤を服用している患者では、膜キャパシタンスCMは同様に増加するが、細胞質の導電率σCが変化する方向は異なる。これにより、薬剤の作用及び副作用は、このような細胞構成相の物性値を表すグラフ上に位置づけられることが確認された。
【符号の説明】
【0102】
1 血球細胞分析装置
2 懸濁液
3 測定部
4 検出部
5 前処理部
6 記憶部
7 解析部
8 表示部
20、21 血球細胞
22 溶媒
31 測定用セル
32a、32b 電極
33 伝送線
34 測定器
40 流路デバイス
41、43 カバー層
42 中間層
42a 狭窄部
44、45 接着層
46a、46b 電極
47a、47b 流路
【技術分野】
【0001】
本発明は、赤血球や白血球などの各種血球細胞の状態を分析する血球細胞分析装置、血球細胞分析方法及び血球細胞分析システムに関する。より詳しくは、誘電分光法を利用した血球細胞の分析技術に関する。
【背景技術】
【0002】
効果的な治療を行うためには、患者に対する薬剤の効果や副作用を的確に把握することが重要である。例えば、骨髄移植治療などの後に投与される免疫抑制剤は、臓器移植に伴う合併症の1つである移植片対宿主病(graft versus host disease:GVDH)を抑制する働きがあるが、その一方で、血栓性微小血管症(Thrombotic microangiopathy:TMA)などの副作用を引き起こすことが知られている。
【0003】
この免疫抑制剤のように、血中濃度における治療域と毒性域が近接し、いわゆる安全域が狭い薬剤に対しては、血中濃度測定による正確な用量調節(Therapeutic Drug Monitoring:TDM)が必要である。これは、免疫抑制剤に限らず、高血圧治療薬及び心臓病治療薬など、幅広い薬剤においても同様である。
【0004】
一般に、服薬中の患者の状態は、臨床所見や各種臨床検査による所見などから総合的に判断されるが、特に正確なTDMが必要な薬剤に関しては、定期的に血球の薬剤濃度を測定している。また、従来、血中濃度データに基づいて、薬剤の摂取用量を調節するための解析又は支援システムも提案されている(特許文献1,2参照)。
【0005】
一方、血中の薬剤濃度の測定には、薬剤の種類や特性などに応じて種々の方法が提案されており、例えば、代表的な免疫抑制剤であるシクロスポリンAの場合は、蛍光偏光免疫測定法などの分析方法によって、末梢血中の濃度が測定されている。また、薬剤濃度の測定には一般に血漿検体が用いられているが、シクロスポリンAの測定では、全血検体が用いられており、前処理溶液で溶血してから分析を行っている。これは、シクロスポリンAが脂溶性で、脂質二重層で構成される細胞膜に吸収されやすく、その大部分が細胞膜中、特に数の多い赤血球膜中に偏在していると考えられるからである。
【0006】
更に、血球細胞の誘電特性は、その大きさ、形状、細胞膜の状態及び密度などによって異なり、従来、誘電分光法により、血球細胞の定性・定量分析又は物性値の測定を行う方法も提案されている(特許文献3,4参照)。これら特許文献3,4に記載の方法によれば、血球細胞を破壊せずに、その状態を分析することができる。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平7−124125号公報
【特許文献2】特開2007−296214号公報
【特許文献3】特開2008−215901号公報
【特許文献4】特開2009−42141号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
例えば、シクロスポリンAは、主としてT細胞(ヘルパーT細胞)によるインターロイキン−2(IL−2)などのサイトカイン産生を阻害することにより、強力な免疫抑制作用を示すことが知られている。このため、シクロスポリンAについて、薬効を評価するのであれば、本来は、T細胞に実効的に作用する濃度を測定すべきであり、また、TMAなどの副作用を評価するのであれば、赤血球に実効的に作用する濃度を測定すべきである。
【0009】
しかしながら、これらの値は、標的とする血液細胞成分を分離抽出し、更にそれを溶解した上で、抗体試薬を用いた蛍光偏光免疫測定法などの分析方法で測定しなければならず、煩雑な作業を多忙極める臨床現場で行うことは困難である。このように、シクロスポリンAなどの一部の薬剤に関しては、入院患者に対してさえ容易ではないTDMを、医療関係者が常時管理することができない通院患者に適用することは、なおさら困難である。
【0010】
即ち、血中の薬剤濃度から薬物動態を分析する従来の手法は、作業が繁雑で、結果が出るまでに時間を要するため、医薬品の研究開発には適用できても、臨床検査、特に通院患者への適用は困難であるという問題点がある。
【0011】
そこで、本発明は、薬剤の効果や副作用を短時間で評価することができる血球細胞分析装置、血球細胞分析方法及び血球細胞分析システムを提供することを主目的とする。
【課題を解決するための手段】
【0012】
本発明に係る血球細胞分析装置は、1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する測定部と、この測定部で測定された複素誘電率スペクトルに基づいて、懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する検出部と、を有するものである。
本発明においては、血球細胞を含む懸濁液の複素誘電率スペクトルを測定し、その値から求めた誘電変数や電気的物性値から血球細胞の状態変化を検出しているため、従来の方法に比べて、手間や時間がかからない。このため、薬剤の効果や副作用を、容易にかつ短時間で評価することが可能となる。
この血球分析装置では、誘電変数として誘電緩和強度及び/又は誘電緩和周波数を算出してもよく、また、電気的物性値として、膜キャパシタンス及び/又は細胞質導電率を算出してもよい。
また、前述した測定部及び検出部に加えて、基準となる誘電変数及び/又は電気的物性値が記憶された記憶部を有していてもよく、その場合、検出部において、記憶部に記憶された値と比較して、血球細胞の状態変化の有無又は程度を検出することができる。
更に、この装置には、採取血液から測定用の懸濁液を調整する前処理部を設けてもよい。
更にまた、検出結果を表示する表示部を設け、誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値が、設定された範囲から外れているときに、前記表示部に警告を表示することもできる。
更にまた、この装置には、誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値に基づいて、適正な薬剤投与量を算出する解析部を設けてもよい。
更にまた、測定部に、懸濁液が通流する流路の一部に血球細胞が個別に通過可能な狭窄部を形成した流路デバイスを設け、この狭窄部において一の血球細胞を含む懸濁液の複素誘電率スペクトルを測定することもできる。
【0013】
本発明に係る血球細胞分析方法は、1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する工程と、測定された複素誘電率スペクトルに基づいて、懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する工程と、を有する。
本発明においては、血球細胞を含む懸濁液の複素誘電率スペクトルを測定し、その値から求めた誘電変数や電気的物性値から血球細胞の状態変化を検出しているため、薬剤の効果や副作用を、手間をかけずに短時間で評価することが可能である。
この分析方法では、懸濁液に、検出対象の血球細胞以外の血球細胞が含まれていてもよい。
また、検出対象の血球細胞は、例えば赤血球又は白血球である。
【0014】
本発明に係る血球細胞分析システムは、1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する測定装置と、この測定装置で測定された複素誘電率スペクトルに基づいて、懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する検出装置と、を有するものである。
本発明においては、血球細胞を含む懸濁液の誘電変数や電気的物性値から血球細胞の状態変化を検出しているため、入院患者、通院患者にかかわらず、更に在宅患者であっても、薬剤の効果や副作用を、容易に評価することが可能となる。
この分析システムでは、測定装置と検出装置とが通信ネットワークを介して接続されていてもよい。
【発明の効果】
【0015】
本発明によれば、血球細胞を含む懸濁液の複素誘電率スペクトルを測定し、その値から求めた誘電変数や電気的物性値から血球細胞の状態変化を検出しているため、薬剤の効果や副作用を短時間で評価することができる。
【図面の簡単な説明】
【0016】
【図1】本発明の第1の実施形態に係る血球細胞分析装置の構成を示すブロック図である。
【図2】図1に示す測定部3の構成を模式的に示す図である。
【図3】本発明の第1の実施形態に係る血球細胞分析装置の動作例を示すフローチャート図である。
【図4】本発明の第1の実施形態に係る血球細胞分析装置の他の動作例を示すフローチャート図である。
【図5】本発明の第1の実施形態に係る血球細胞分析装置の他の動作例を示すフローチャート図である。
【図6】(a)は本発明の第1の実施形態の血球細胞分析装置における複素誘電率スペクトル測定時の懸濁液の状態を示す概念図であり、(b)は第2の実施形態の血球細胞分析装置における複素誘電率スペクトル測定時の懸濁液の状態を示す概念図である。
【図7】本発明の第2の実施形態に係る血球細胞分析装置で使用する流路デバイスの構成例を示す断面図である。
【図8】横軸に薬剤投与開始後の経過日数をとり、縦軸に誘電緩和強度Δεと誘電緩和周波数fをとって、面積抑制剤服用患者から採取した赤血球の誘電変数の変化を示すグラフ図である。
【図9】横軸に単位面積あたりの膜キャパシタンスCMをとり、縦軸に細胞質の導電率σCをとって、健常者及び免疫抑制剤服用患者の赤血球構成相の電気的物性値を示した図である。
【発明を実施するための形態】
【0017】
以下、本発明を実施するための形態について、添付の図面を参照して詳細に説明する。なお、本発明は、以下に示す各実施形態に限定されるものではない。また、説明は、以下の順序で行う。
1.第1の実施の形態
(血球細胞分析装置により複数の血球細胞を含む懸濁液全体を評価する例)
2.第2の実施の形態
(血球細胞分析装置により個々の血球細胞を評価する例)
3.第3の実施の形態
(誘電分光法により血球細胞の状態を分析する血球細胞分析システムの例)
【0018】
<1.第1の実施の形態>
[血球細胞分析装置の全体構成]
本発明の第1の実施形態に係る血球細胞分析装置は、誘電分光法により、懸濁液に含まれる血球細胞の状態変化を検出し、創薬プロセスや臨床現場において、薬剤の効果や副作用について評価する際に使用されるものである。図1は本実施形態の血球細胞分析装置の構成を示すブロック図である。
【0019】
具体的には、図1に示すように、本実施形態の血球細胞分析装置1は、懸濁液2の複素誘電率スペクトルを測定する測定部3と、測定結果から血球細胞の状態変化を検出する検出部4とを備えている。また、血球細胞分析装置1には、測定用の懸濁液2を調整する前処理部5、基準となる誘電変数や電気的物性値が記憶された記憶部6、適正な薬剤投与量を算出する解析部7、検出及び/又は解析結果を表示する表示部8などが設けられていてもよい。
【0020】
[懸濁液2について]
本実施形態の血球細胞分析装置1では、少なくとも検出対象の血球細胞を含有する懸濁液2を使用して測定を行う。ここで、検出対象とする血球細胞は、薬剤投与に伴い、その薬効や副作用によって状態が変化するものであればよく、例えば赤血球、白血球及び血小板などが挙げられる。
【0021】
また、懸濁液2は、検出対象の血球細胞のみを含有していてもよいが、検出対象でない血球細胞が含まれていてもよい。更に、懸濁液2に含まれる血球細胞は、ヒトのものに限定されるものではなく、本実施形態の血球細胞分析装置1では、ラット、マウス及びウサギなどの動物の血球細胞についても分析可能である。
【0022】
[測定部3の構成]
図2は図1に示す測定部3の構成を模式的に示す図である。図2に示すように、測定部3は、一対の平行平板電極32a,32bを備えた測定用セル31を備えており、検出対象の血球細胞20を含む懸濁液2は、測定用セル31内に充填される。また、測定用セル31の電極32a,32bは、それぞれ伝送線33を介して測定器34に接続されており、この測定器34により懸濁液2の複素誘電率スペクトルが測定される。
【0023】
(測定用セル31)
測定用セル31は、懸濁液2の複素誘電率スペクトル測定に影響しないものであればよく、例えばアクリル系樹脂やポリエーテルサルフォン樹脂などにより形成することができる。また、電極32a,32bの大きさ及び間隔も特に限定されるものではなく、測定周波数や印加電圧などに応じて適宜設定することができる。更に、測定用セル31やその周辺部には、測定用セル31に懸濁液2を導入するための機構、測定後の懸濁液2を排出するための機構、測定の前後に測定用セル31内を溶媒などで洗浄するための機構など、測定に付随する作業に関する種々の機構を設けることもできる。
【0024】
(測定器34)
測定器34は、測定対象の周波数範囲において、複素誘電率測定を実施できるものであればよく、例えばインピーダンスアナライザー、ネットワークアナライザー及び時間領域反射オシロスコープなどを使用することができる。
【0025】
[検出部4の構成]
検出部4では、電子計算機などにより、測定部3で測定された複素誘電率スペクトルに基づいて、懸濁液2の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞20の状態変化を検出する。具体的には、先ず、複素誘電率スペクトルから、誘電変数である誘電緩和強度や誘電緩和周波数などを、また、電気的物性値である膜キャパシタンスや細胞質導電率などを算出する。
【0026】
そして、算出した誘電変数及び/又は電気的物性値と、過去に測定した誘電変数や電気的物性値、或いは後述する記憶部6に記憶された基準値とを比較して、薬剤投与に伴う血球細胞20の状態変化を検出する。例えば、免疫抑制剤の場合、赤血球の誘電緩和周波数の低下や誘電緩和強度の上昇により、副作用についての評価を行うことができる。
【0027】
この検出部4において、検出された結果は、後述する表示部8に表示される。また、検出部4で検出した値が予め設定された範囲から外れていた場合は、表示部8に警告が表示されるようにしてもよい。具体的には、誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値が、設定範囲から外れていたときに、表示部8に警告を表示する。これにより、臨床現場における服薬用量管理が容易になる。
【0028】
[前処理部5]
前述した測定部3で測定する懸濁液2は、検体毎に作業者が調整してもよいが、血球細胞分析装置1に、患者などから採取した血液検体に対して、必要に応じて、分離、抽出及び希釈などの前処理を自動で行う前処理部5を設けてもよい。その場合、調整された懸濁液2を、測定部3の測定セル31内に自動で注入する機構を設けることにより、人手を介さずに、全ての作業を行うことができるため、分析時間を短縮できると共に、作業効率を向上させることができる。
【0029】
[記憶部6]
記憶部6は、基準となる誘電変数及び/又は電気的物性値などが記憶されたデータベースであり、例えば、健常者で測定した値や同じ患者について過去に測定した値、或いはシミュレーションなどにより求めた値が記憶されている。そして、検出部4において、これらの値と測定部3で測定された値とを比較することにより、血球細胞20の状態変化の有無や程度を、容易に検出することができる。
【0030】
[解析部7]
解析部7は、誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値に基づいて、適正な薬剤投与量を算出するものである。そして、その算出結果は、検出部4における検出結果と共に、表示部8に表示される。これにより、臨床現場における服薬用量管理を効率化することができる。
【0031】
[表示部8]
表示部8は、検出部4や解析部7と接続されている。そして、この表示部8には、例えば、検出部4で算出した誘電変数や電気的物性値、検出部4で検出した血球細胞の状態、検出部4での検出結果が設定範囲から外れていたときの警告、解析部7で算出した適正な薬剤投与量などが表示される。
【0032】
[血球細胞分析装置1の動作]
次に、前述の如く構成された血球細胞分析装置1の動作、即ち、血球細胞分析装置1を使用して血球細胞に対する薬剤の影響を評価する方法について説明する。図3は本実施形態の血球細胞分析装置1の動作例を示すフローチャート図である。
【0033】
[ステップS1:懸濁液2の調整]
図3に示すように、本実施形態の血球細胞分析装置1では、先ず、前処理部5において、血液検体に、分離、抽出、希釈などの処理を施し、測定に使用する懸濁液2を調整する。その際用いる血液の採取方法は、特に限定されるものではなく、公知の方法を適用することができる。また、必要に応じて、調整された懸濁液2に、適切な濃度で薬剤を添加してもよい。
【0034】
血液に含まれる赤血球の数は、他の成分よりもはるかに多く、健常なヒトの場合は白血球の数百倍から数千倍含まれている。このため、薬剤が赤血球に与える影響を評価する場合は、白血球の数は無視することができ、懸濁液2として、採取した血液(全血)を、適当な溶媒により測定に適した濃度にまで希釈した溶液を使用することができる。更に、当然ながら、厳密を期して、生化学的操作により、血液から白血球や血小板などの測定対象外の成分を除去したものを使用してもよい。
【0035】
ここで、血液などを希釈する際に使用する溶媒は、赤血球などの検出対象の血球細胞と等張、即ち、血漿成分と同じ塩濃度を有し、検出対象の血球細胞の性状に影響を与えないと考えられる緩衝溶液を使用することができる。具体的には、pH7.4のリン酸緩衝生理食塩水(Phosphate Buffered Saline:PBS)などを使用することができる。
【0036】
一方、薬剤が白血球に与える影響を評価する場合は、血液臨床検査法で一般に利用されている方法によって、全血から赤血球や血小板などの白血球以外の成分を除去し、適当な溶媒により測定に適した濃度にまで希釈した溶液を使用することができる。例えば、自動血球計測検査においては、全血に溶血剤を加えて赤血球を溶血させ、その溶液中に残存する有核細胞を数えて白血球数としている。
【0037】
また、薬剤が、単球、好酸球、好中球、好塩基球及びリンパ球などの白血球中の特定成分に与える影響を評価する場合は、適切な生化学的操作によって更に分離操作を行う。特定成分の分離抽出操作は、公知の方法を適用することができ、例えば、特定の白血球成分の表面に表出する抗原と、特異的に結合する抗体で被覆された磁気ビーズを用いると、その成分のみを分離抽出することができる。
【0038】
更に、図2に示すような平行平板キャパシタ型セルで測定する場合、血球細胞の体積分率は0.5〜25%であることが望ましい。血球細胞の体積分率が25%を超えると、細胞間の相互作用の影響で、データ解析が複雑になるからである。一方、血球細胞の体積分率が0.5%未満の場合、誘電緩和の振幅が小さくなり、測定データの信頼性が低下することがある。
【0039】
[ステップS2:複素誘電率スペクトル測定]
次に、測定部3において、複数の血球細胞20を含む懸濁液2全体の複素誘電率を、印加する交流電圧の周波数の関数として測定する。具体的には、所定間隔を空けて対向配置された平行平板電極31a,32bを備える測定用セル31に、懸濁液2を充填する。そして、伝送線33を介して電極31a,32bと電気的導通が確保された精密インピーダンス測定器(測定器34)により、予め設定した周波数範囲にわたり、複素インピーダンス測定を行う。
【0040】
ここで、複素インピーダンス測定を行う周波数範囲は、検出対象の血球細胞や薬剤の種類などに応じて適宜設定することができるが、観測対象となる誘電緩和の緩和周波数を基準とし、その前後それぞれ2桁程度を含むことが望ましい。例えば、免疫抑制剤の赤血球に対する影響を評価する場合には、赤血球懸濁液の緩和周波数が1MHz程度であるため、10kHz〜100MHzの範囲で測定すればよい。
【0041】
また、測定した複素インピーダンスは、公知の方法により複素誘電率に変換することができる。その際、測定系の配線や測定用セル31に起因するインダクタンスや浮遊容量についての補正、電極分極の補正を行う必要があるが、これらについても、公知の方法を適用することができる(例えば、日本化学会著、「実験化学講座9 電気磁気」、丸善、1991年発行 参照。)。
【0042】
[ステップS3:検出用データの算出]
次に、検出部4において、複素誘電率スペクトルから検出用データFn(t)を算出する。なお、ここでいう検出用データにおける「Fn」は誘電変数又は電気的物性値を示し、「t」は測定時刻である。
【0043】
(誘電変数の算出)
懸濁液2のように、細胞を含む溶液の複素誘電率の周波数依存性(周波数分散)、即ち、複素誘電率スペクトルは、おおよそ1MHz〜数十MHzの領域に、含有する細胞の性状に応じて特徴的な変化、即ち、誘電緩和を示すことが知られている。このような細胞溶液の複素誘電率スペクトルは、下記数式(1)に示す緩和関数の和として表すことができる。
【0044】
【数1】

【0045】
なお、上記数式1におけるaは、複数の誘電緩和がある場合に、それらを区別するためのものであり、a番目の誘電緩和における緩和強度がΔεa、緩和時間がτaである。この緩和時間τaと、緩和周波数faとの関係は、下記数式(2)で表される。また、βaは、緩和の広がりを示すCole−Coleパラメータで、スペクトルの形状を特徴付ける変数である。更に、ε∞は高周波極限での比誘電率であり、ωは角周波数であり、i2=−1である。
【0046】
【数2】

【0047】
そして、全ての誘電緩和についての緩和強度Δε、緩和周波数f、Cole−Coleパラメータβを「誘電変数」といい、本実施形態の血球細胞分析装置1においては、特に緩和強度Δε及び緩和周波数fを算出する。具体的には、先ず、周波数点毎に仮定した誘電変数で表現される誘電緩和関数の値と実測値との差を求める。そして、各周波数点における差を二乗した値を測定周波数全体で足し合わせて、その総和が最小になるように、誘電変数を最適化することにより、血球細胞20を含む懸濁液2の誘電スペクトルを特徴付ける誘電変数を決定する。
【0048】
(電気的物性値の算出)
細胞溶液の複素誘電率スペクトルは、細胞を取り巻く溶媒の誘電率や導電率にも依存し、純粋に細胞を構成する相の電気的物性値のみを反映したものではない。しかしながら、公知の解析手法を利用することにより、この複素誘電率スペクトルから細胞を構成する相(例えば、細胞膜、細胞質、核膜、核質など)の電気的物性値、即ち、誘電率及び導電率を得ることができる。
【0049】
例えば、細胞膜と細胞質のみから形成されている球形細胞などの場合は、解析式を用いることにより、複素誘電率スペクトルから、細胞膜及び細胞質それぞれの電気的物性値を直接求めることができる(花井哲也著、「不均質構造と誘電率−物質を壊さずに内部構造を探る」、吉岡書店、2000年発行 参照)。
【0050】
一方、複雑な構造を有する細胞については、数値的シミュレーションを利用することにより、膜キャパシタンスCMや細胞質導電率σCを求めることができる(特許文献4参照)。具体的には、測定対象の細胞の形状をモデル化し、その細胞にAC電場が印可されたときの複素誘電率応答を数値解析により求める。その結果に基づいて、膜キャパシタンスCM及び細胞質導電率σCの値を変化させながら数値計算して、誘電スペクトルを算出する。
【0051】
次に、算出した誘電スペクトルを誘電緩和式に回帰させて、誘電緩和強度Δε及び緩和時間τを求める。更に、(Δε,τ)の(CM,σC)への依存性を求め、測定対象の細胞の形状に応じた回帰式を作成する。そして、細胞の誘電スペクトルを実測し、その値と回帰式とを比較することで、測定対象の細胞の膜キャパシタンスCM,exp及び細胞質導電率σC,expを求める。
【0052】
[ステップS4:記憶部6のデータと照合]
次に、検出部4において、算出した検出用データFn(t)と、例えば記憶部6に記憶された健常者のデータとを照合し、血球細胞の状態変化を検出する。具体的には、検出用データFn(t)が、予め設定された健常域の範囲内であるか、否かを判定する。その際、検出用データFn(t)としては、誘電変数及び電気的物性値のうち1又は2以上の値を使用することができる。
【0053】
[ステップS5,S6:検出結果の表示]
ステップS4における照合の結果、検出用データFn(t)の値が、健常域の範囲内である場合は、表示部8に問題ない旨表示する(ステップS5)。一方、検出用データFn(t)の値が、健常域の範囲から外れていた場合は、表示部8に警告を表示する(ステップS6)。
【0054】
[他の動作例]
なお、図3に示す動作例では、検出部4で算出した検出用データFn(t)そのものを基に、血球細胞の状態変化を検出しているが、本発明はこれに限定されるものではなく、血球細胞の状態変化の度合いに基づき検出することもできる。図4及び図5は本実施形態の血球細胞分析装置1における他の動作例を示すフローチャート図である。
【0055】
例えば、図4に示すように、薬剤投与前又は薬剤が表れてないときに測定した比較用データFn(0)と、検出用データFn(t)とから算出した増減幅Gn(t)を基に、血球細胞の状態変化を検出することもできる。この動作例では、ステップS13において算出した検出用データFn(t)を、例えば測定日や付加情報データなどと共に、記憶部6に記憶し、保存する(ステップS14)。このように、測定日や付加情報データを併せて保存しておくと、担当医師などが、血球細胞分析装置1での検出結果と、血液検査データやその他臨床所見と組み合わせて判定を行う場合に、便利である。
【0056】
次に、検出部4において、下記数式(3)に基づき、予め記憶部6に記憶しておいた比較用データFn(0)と、ステップS13で算出した検出用データFn(t)から、増減幅Gn(t)を算出する(ステップS15)。その際、検出用データFn(t)及び比較用データFn(0)としては、誘電変数及び電気的物性値のうち1又は2以上の値を使用することができる。なお、「n(=1,2,・・・)」はそのための識別子である。
【0057】
【数3】

【0058】
そして、算出した増減幅Gn(t)と、例えば記憶部6に記憶された基準値Gnとを照合し、血球細胞の状態変化を検出する。具体的には、増減幅Gn(t)が、予め設定された健常域の範囲内であるか、否かを判定する。その結果、増減幅Gn(t)の値が、健常域の範囲内である場合は、表示部8に問題ない旨表示し(ステップS17)、増減幅Gn(t)の値が、健常域の範囲から外れていた場合は、表示部8に警告を表示する(ステップS18)。
【0059】
この動作例は、投薬前から、誘電変数や電気的物性値が健常域から外れている患者に、特に有効な方法である。なお、図4に示す動作例において、ステップS11〜S13は前述したステップS1〜S3と同様であるため、具体的説明は省略する。
【0060】
また、図5に示すように、検出用データFn(t)の時間変化の大きさF´n(t)を基に、血球細胞の状態変化を検出することもできる。この動作例でも、図4に示す動作例同様、ステップS23において算出した検出用データFn(t)を、例えば測定日及び付加情報データなどと共に、記憶部6に記憶し、保存する(ステップS24)。
【0061】
次に、検出部4において、下記数式(4)に基づき、時間変化の大きさF´n(t)を算出する(ステップS25)。なお、下記数式(4)におけるΔtは、前回又は数回前の測定時刻からの経過時間であり、Fn(t−Δt)は、前回又は数回前の測定値である。また、その際、検出用データFn(t)及び過去の測定値Δtとしては、誘電変数及び電気的物性値のうち1又は2以上の値を使用することができる。
【0062】
【数4】

【0063】
そして、時間変化の大きさF´n(t)と、例えば記憶部6に記憶された基準値F´nとを照合し、血球細胞の状態変化を検出する。具体的には、時間変化の大きさF´n(t)が、予め設定された健常域の範囲内であるか、否かを判定する。その結果、時間変化の大きさF´n(t)の値が、健常域の範囲内である場合は、表示部8に問題ない旨表示し(ステップS27)、時間変化の大きさF´n(t)の値が、健常域の範囲から外れていた場合は、表示部8に警告を表示する(ステップS28)。
【0064】
この動作例では、投薬量に対する応答を検知することができるため、担当医などが、容易に次の投薬量を見積もることができる。また、検出値が健常域の範囲内の場合でも、急変の予兆を検知することが可能となる。なお、図5に示す動作例において、ステップS21〜S23は前述したステップS1〜S3と同様であるため、具体的説明は省略する。
【0065】
[薬剤投与量の算出]
更に、本実施形態の血球細胞分析装置1では、解析部8において適正な薬剤投与量を算出し、その結果を表示部8に表示することもできる。具体的には、前述した検出用データFn(t)、増減幅Gn(t)又は時間変化の大きさF´n(t)の値や、記憶部6に記憶された基準値などに基づき、血球細胞が適正状態になる薬剤投与量を算出する。
【0066】
例えば、各Fn(t)が健常域の範囲内であった場合は、当初医師により決定された標準の投与量を採用し、提示する。一方、各Fn(t)が健常域の範囲から外れていた患者の場合は、各Gn(t)を用いて、個別に病状変化がないか確認する。その結果、特に問題がなければ当初医師により決定された標準の投与量を選択し、提示する。
【0067】
また、病状変化があるが、その程度が軽微な投薬量の減少で対応可能である場合は、各Fn(t)又は各Gn(t)の余裕値と、F´n(t)とから予測される投与後の各Fn(t)又はGn(t)に基づいて、投薬量の減量又は増加量を算出し、提示する。このように、血球細胞の状態及びその変化に関する各種データから総合的に判定することで、適正な薬剤投与量を提案することができる。
【0068】
本実施形態の血球細胞分析装置1では、血球細胞20を含む懸濁液2の誘電変数や電気的物性値から血球細胞の状態変化を検出しているため、薬剤の効果や副作用を、容易にかつ短時間で評価することができる。また、この血球細胞分析装置1では、懸濁液2全体の複素誘電率スペクトルを測定し、その平均的情報により、検出対象の血球細胞20の状態変化を検出しているため、懸濁液2に検出対象外の血球細胞が含まれていても分析が可能である。その結果、検出対象外の血球細胞を分離・除去する必要がなく、作業効率を向上させることができる。
【0069】
更に、本実施形態の血球細胞分析装置1は、高血圧治療薬、心臓病治療薬及び免疫抑制剤などの特定の薬剤を、長期間服用している患者が、正しく服用し、かつしかるべき薬効が得られているかを、モニタリングすることも可能である。例えば、誘電変数又は電気的物性値の値が特定範囲(健常域)に収まっているときは、別の分析手段で調べられたこの薬剤の体内濃度が適正であるか、臨床的見地から望ましい薬効が得られていると、患者への応用に先立った臨床試験によって明らかになっているとする。
【0070】
このような場合、測定値から算出された値が正常域を外れたときに、血球細胞分析装置1が警告を発することで、担当の医師などがより詳細に患者の状態を調べ、必要に応じて適正な服薬指導などを行うことができる。
【0071】
更にまた、血球細胞分析装置1では、高血圧治療薬、心臓病治療薬及び免疫抑制剤などの特定の薬剤を、長期間服用している患者が、重篤な副作用に陥らないように、モニタリングすることもできる。例えば、誘電変数又は電気的物性値の値が特定範囲(健常域)から外れると、臨床的見地から重篤な副作用が発生する可能性が高いことが、患者への応用に先立った臨床試験によって明らかになっているとする。
【0072】
このような場合、測定値から算出された値が正常域を外れたときに、血球細胞分析装置1が警告を発することで、担当の医師などがより詳細に患者の状態を調べ、必要に応じて服薬の中止、服薬量の減量、その他副作用に関する治療を行うことができる。
【0073】
<2.第2の実施の形態>
[血球細胞分析装置の全体構成]
図6(a)は本発明の第1の実施形態の血球細胞分析装置における複素誘電率スペクトル測定時の懸濁液の状態を示す概念図であり、図6(b)は第2の実施形態の血球細胞分析装置における複素誘電率スペクトル測定時の懸濁液の状態を示す概念図である。図6(a)に示すように、第1の実施形態の血球細胞分析装置では、溶媒22中に複数の血球細胞20,21が分散されている懸濁液2について評価しているが、本発明はこれに限定されるものではなく、血球細胞20を個別に評価することもできる。
【0074】
前述した第1の実施形態の血球細胞分析装置では、検出対象外の血球細胞21と検出対象の血球細胞20が混在している懸濁液2について複素誘電率スペクトルを測定し、その平均的情報により検出対象の血球細胞20の状態を評価している。これに対して、第2の実施形態の血球細胞分析装置では、図6(b)に示すように、溶媒22に検出対象の血球細胞20が1個含まれている状態で、複素誘電率スペクトル測定を行う。
【0075】
即ち、本発明の第2の実施形態に係る血球細胞分析装置は、測定部に、懸濁液が通流する流路の一部に血球細胞が個別に通過可能な狭窄部が設けられた流路デバイスを備えている。そして、この狭窄部において、血球細胞を1個だけ含む懸濁液の複素誘電率スペクトルを測定することができるようになっている。
【0076】
[流路デバイス]
図7は本実施形態の血球細胞分析装置で使用する流路デバイスの構成例を示す断面図である。図7に示すように、本実施形態の血球細胞分析装置で使用する流路デバイス40は、例えば、厚さ方向の通流位置が相互に異なる2本の流路47a,47bを、狭窄部42aを介して連通する構成とすることができる。
【0077】
具体的には、ポリイミドなどからなるカバー層41と、中間層42とが、所定厚さの接着層44を介して積層されており、更に接着層44の他方の面には、所定厚さの接着層45を介してカバー層43が積層されている。これら接着層44,45は、中間層42の一部にのみ貼着されており、接着層44,45が貼着されていない空隙部分には、懸濁液が通流する流路47a,47bが形成されている。
【0078】
また、中間層42とカバー層43との間に形成され流路47aと、中間層42とカバー層41との間に形成された流路47bとは、中間層42に形成された狭窄部42aを介して連通している。この狭窄部42aは、懸濁液に含まれる血球細胞が、1個ずつ通過する大きさであればよい。更に、中間層42の流路47a側の面には電極46aが設けられており、中間層42の流路47b側の面には電極46bが設けられている。そして、これら電極46a,46b間に所定の電圧を印加することにより、狭窄部42aを通過する懸濁液の複素誘電率スペクトルを測定することができる。
【0079】
この流路デバイス40を使用して、複素誘電率スペクトル測定を行うことにより、個々の血球細胞の状態を評価することが可能となる。また、この流路デバイス40を使用することにより、白血球などのように血中濃度が低い細胞であっても、分離や抽出処理を行わずに分析することも可能となる。
【0080】
なお、本実施形態の血球細胞分析装置に使用される流路デバイスは、図7に示す構成のものに限定されるものではなく、流路の一部に、血球細胞が1個ずつ通流する大きさの狭窄部が形成されていればよい。また、本実施形態の血球細胞分析装置の動作、並びに、流路デバイス40以外の構成及び効果は、前述した第1の実施形態と同様である。
【0081】
<3.第3の実施の形態>
[血球細胞分析システムの構成]
本発明の第3の実施形態に係る血球細胞分析システムは、誘電分光法により、懸濁液に含まれる血球細胞の状態変化を検出するものであり、薬剤の効果や副作用を評価する際に使用される。具体的には、本実施形態の血球細胞分析システムは、少なくとも、懸濁液の複素誘電率スペクトルを測定する測定装置と、測定結果から血球細胞の状態変化を検出する検出装置とを備えている。
【0082】
また、本実施形態の血球細胞分析システムにおける検出装置は、測定装置で測定された複素誘電率スペクトルに基づいて、懸濁液の誘電変数及び/又は電気的物性値を算出し、血球細胞の状態変化を検出するものである。更に、この血球細胞分析システムでは、測定装置と検出装置がそれぞれ離れた場所に設置され、通信ネットワークを介して相互に接続されていてもよい。
【0083】
本実施形態の血球細胞分析システムは、懸濁液を調整する前処理装置、基準となる誘電変数や電気的物性値などが記憶された記憶装置、適正な薬剤投与量を算出する解析装置、検出及び/又は解析結果を表示する表示装置などを設けることもできる。また、これらの装置は、全て同じ場所(部屋)に設置されている必要はなく、例えば、前処理装置、測定装置及び表示装置を診察室に設置し、それ以外の装置は別の部屋に設置し、それぞれ通信ネットワークを介して相互に接続することもできる。更に、1つの検出装置に、複数の測定装置が接続することもできる。
【0084】
一方、本実施形態の血球細胞分析システムにおいて複素誘電率スペクトルを測定する懸濁液は、1又は複数個の血球細胞を含有していればよく、懸濁液に含まれる血球細胞は1種類でも複数種でもよい。この懸濁液は、被験者から採取した血液から調整されるが、その採取方法は、特に限定されるものではなく、公知の方法を適用することができる。
【0085】
例えば、被験者が入院患者の場合は、病床又は院内の中央検査室などにおいて、医師や看護婦などが定期的に採血を行うことができる。また、被験者が、自宅などで服薬を続けている通院患者の場合は、通院時に採血を行えばよい。これらの場合、血液は、真空採血管などの標準的に用いられている器具内に採血されることとなるが、本実施形態の血球細胞分析システムでは、採血器具をそのまま前処理装置や測定装置にセットし、全自動で測定を行うことも可能である。
【0086】
一方、本実施形態の血球細胞分析システムでは、前処理装置及び測定装置として、自宅などに設置し、患者自ら測定・管理できるような形態のもの、所謂その場検査(Point-of-Care Testing:POCT)用の小型デバイスを用いることもできる。例えば、I型糖尿病患者の場合、血糖値管理のPOCT用途で用いられる穿刺器などにより少量の血液を採取し、測定することができる。
【0087】
また、自宅で採取した血液を、適当な保存溶液に溶解させて、郵送などの手段で測定装置が設置されている医療機関などに送付して検査を行うことも可能である。なお、動物実験においても、同様の採血方法及び装置を適用することができる。
【0088】
本実施形態の血球細胞分析システムでは、細胞の溶解、抗体試薬を用いた蛍光分析など、煩雑でコストがかかる作業を行わずに、血球細胞に対する薬剤の影響を評価することができる。その結果、患者などの服薬量管理を、病院内あるいは自宅などで、簡便に行うことが可能となる。
【0089】
また、本実施形態の血球細胞分析システムは、薬剤の研究開発にも適用可能であり、関心のある特定の血球細胞に対する薬剤の効果や副作用について、容易に評価することができる。そして、この血球細胞分析システムは、適正な服薬量の管理又は副作用リスク検知を通して、患者個人の状態に応じた治療の質の向上に寄与するものである。
【実施例】
【0090】
以下、本発明の実施例により、本発明の効果について具体的に説明する。本実施例においては、前述した第1の実施形態の血球細胞分析装置を用いて、免疫抑制剤の赤血球に対する影響を評価した。具体的には、骨髄移植を受ける患者について、免疫抑制剤服用9日前から91日後までの期間血液を採取し、赤血球を含む懸濁液の誘電分光測定を行った。なお、この患者は、治療の経過に伴い、血液採取期間の後期に、服薬量を徐々に減らし、最終的には服用を止めた。
【0091】
(測定方法)
血液は、真空採血管(EDTA 2k入り)を用いて、約2ml採取した。そして、採血管を静かに2回転倒混和した後、ヘマトクリット遠心機専用のガラスキャピラリー3本に全血を充填して、ヘマトクリット遠心機にセットし、回転数を7000rpmとして、3分間遠心した。遠心後直ちに、装置に備わる目盛りを用いて、血漿と分離された赤血球成分の割合、即ちヘマトクリット値(Hct)を読み取った。
【0092】
次に、赤血球の形態異常を確認するため、ピペットにより採血管から約3μLの全血を採取し、顕微鏡観察用スライドガラスの端部付近に滴下した。そして、顕微鏡観察用カバーガラスを用いて、滴下した全血をスライドガラス全面に塗沫した。この塗沫標本を40倍の対物レンズを有する光学顕微鏡により観察し、スライドガラス上の十分に離れた3点の血液像を、撮影し保存した。
【0093】
また、複素誘電率スペクトル測定用として、懸濁液中の血球細胞の濃度が体積分率で約10%になるように、全血300mLに、pH7.4のリン酸緩衝生理食塩水(PBS):(30×Hct−300)mLを添加し、これらをポリプロピレン製マイクロテストチューブ中で混合した。
【0094】
複素誘電率スペクトルの測定には、ポリスチレン樹脂製で、直径8mmの白金板電極が3.5mm間隔で対向配置された平行平板キャパシタ型セルを使用した。そして、この測定用セルを、精密インピーダンス測定器と電気的に接続されているテストフィクスチャに搭載して測定を行った。その際、ピペットを用いて、測定用セルに濃度を調整した懸濁液を190μL注入し、懸濁液の温度が安定するまで2分間待機した。
【0095】
その後、精密インピーダンス測定器により、測定用セルの各電極間に、振幅300mVの交流電圧を印加し、40〜110MHzの範囲で、141点の周波数における複素インピーダンスを測定した。なお、測定周波数点は、対数スケールでほぼ等間隔になるよう設定した。また、この系の複素インピーダンスは、精密インピーダンス測定器が発生する電極間に流れる電流を周波数の関数として測定し、その電圧と電流から計算することができる。
【0096】
次に、前述した方法で測定した複素インピーダンススペクトルを、複素誘電率スペクトルに変化した。今回検出対象としている赤血球は、細胞核を持たないため、単一の誘電緩和で表わされる。そこで、本実施例においては、複素誘電率スペクトルに対して、誘電緩和関数をフィッティングすることにより、誘電変数である緩和強度Δε1、緩和周波数f1、Cole−Coleパラメータβ1を求めた。更に、これらの誘電変数から、特許文献4に記載の方法により、電気的物性値である単位面積当たりの細胞膜のキャパシタンスCMと細胞質の導電率σCを算出した。
【0097】
(結果)
図8は横軸に薬剤投与開始後の経過日数をとり、縦軸に誘電緩和強度Δεと誘電緩和周波数fをとって、免疫抑制剤服用患者から採取した赤血球の誘電変数の変化を示すグラフ図である。また、図9は横軸に単位面積あたりの膜キャパシタンスCMをとり、縦軸に細胞質の導電率σCをとって、健常者及び免疫抑制剤服用患者の赤血球構成相の電気的物性値を示した図である。
【0098】
図8に示すように、免疫抑制剤を服用すると、その数日後から、緩和強度Δε1が上昇すると共に、緩和周波数f1が減少し、健常者の値(健常域)から大きく外れた。一方、治療が終了し、服薬を中止した後の91日目の測定では、緩和強度Δε1及び緩和周波数f1共に、健常域に戻っていた。これにより、観察された誘電変数の変化は、免疫抑制剤の赤血球に対する作用と関連することが確認された。
【0099】
また、これらの誘電変数から、膜キャパシタンスCMと細胞質の導電率σCを算出したところ、観測された大きな変化は、膜キャパシタンスCMの顕著な増加に起因していることがわかった。この膜キャパシタンスCMが増加するということは、膜の実効的な厚みが減少していることを意味する。その原因は完全には理解されていないが、薬剤の作用により、細胞膜の所謂裏打ちタンパク(例えば、Band3など)が影響を受けたことなどが考えられる。
【0100】
そこで、同様の測定を複数の患者に対しても実施したところ、どの患者でも、基本的には図8と同様の変化を示したが、変化の大きさ、変化の時期、誘電変数が正常値に戻るまでの日数などには個人差が見られた。従って、図8のような誘電変数の経時変化を測定することは、個々の患者ごとに薬剤の副作用を予測するために有用である。即ち、赤血球を含む懸濁液の誘電変数の変化を確認することにより、免疫抑制剤における副作用に関する評価を行うことができる。
【0101】
一方、図9に示すように、健常者のデータは比較的狭い範囲に集まっているが、免疫抑制剤服用患者については、膜キャパシタンスCMの顕著な増加が認められる。興味深いことに、異なる免疫抑制剤を服用している患者では、膜キャパシタンスCMは同様に増加するが、細胞質の導電率σCが変化する方向は異なる。これにより、薬剤の作用及び副作用は、このような細胞構成相の物性値を表すグラフ上に位置づけられることが確認された。
【符号の説明】
【0102】
1 血球細胞分析装置
2 懸濁液
3 測定部
4 検出部
5 前処理部
6 記憶部
7 解析部
8 表示部
20、21 血球細胞
22 溶媒
31 測定用セル
32a、32b 電極
33 伝送線
34 測定器
40 流路デバイス
41、43 カバー層
42 中間層
42a 狭窄部
44、45 接着層
46a、46b 電極
47a、47b 流路
【特許請求の範囲】
【請求項1】
1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する測定部と、
該測定部で測定された複素誘電率スペクトルに基づいて、前記懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する検出部と、
を有する血球細胞分析装置。
【請求項2】
前記誘電変数は誘電緩和強度及び/又は誘電緩和周波数であり、前記電気的物性値は膜キャパシタンス及び/又は細胞質導電率である請求項1に記載の血球細胞分析装置。
【請求項3】
更に、基準となる誘電変数及び/又は電気的物性値が記憶された記憶部を有し、
前記検出部では、前記記憶部に記憶された値と比較して、血球細胞の状態変化の有無又は程度を検出する請求項1又は2に記載の血球細胞分析装置。
【請求項4】
採取血液から測定用の懸濁液を調整する前処理部を有する請求項1乃至3のいずれか1項に記載の血球細胞分析装置。
【請求項5】
更に、検出結果を表示する表示部を有し、
誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値が、設定された範囲から外れているときは、前記表示部に警告が表示される請求項1乃至4のいずれか1項に記載の血球細胞分析装置。
【請求項6】
誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値に基づいて、適正な薬剤投与量を算出する解析部を有する請求項1乃至5のいずれか1項に記載の血球細胞分析装置。
【請求項7】
前記測定部は、前記懸濁液が通流する流路の一部に血球細胞が個別に通過可能な狭窄部が設けられた流路デバイスを備えており、
前記狭窄部において一の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する請求項1乃至6のいずれか1項に記載の血球細胞分析装置。
【請求項8】
1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する工程と、
測定された複素誘電率スペクトルに基づいて、前記懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する工程と、
を有する血球細胞分析方法。
【請求項9】
前記懸濁液に検出対象の血球細胞以外の血球細胞が含まれている請求項8に記載の血球細胞分析方法。
【請求項10】
検出対象の血球細胞が赤血球である請求項8又は9に記載の血球細胞分析方法。
【請求項11】
検出対象の血球細胞が白血球である請求項8又は9に記載の血球細胞分析方法。
【請求項12】
1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する測定装置と、
該測定装置で測定された複素誘電率スペクトルに基づいて、前記懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する検出装置と、
を有する血球細胞分析システム。
【請求項13】
前記測定装置と前記検出装置とが通信ネットワークを介して接続されている請求項12に記載の血球細胞分析システム。
【請求項1】
1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する測定部と、
該測定部で測定された複素誘電率スペクトルに基づいて、前記懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する検出部と、
を有する血球細胞分析装置。
【請求項2】
前記誘電変数は誘電緩和強度及び/又は誘電緩和周波数であり、前記電気的物性値は膜キャパシタンス及び/又は細胞質導電率である請求項1に記載の血球細胞分析装置。
【請求項3】
更に、基準となる誘電変数及び/又は電気的物性値が記憶された記憶部を有し、
前記検出部では、前記記憶部に記憶された値と比較して、血球細胞の状態変化の有無又は程度を検出する請求項1又は2に記載の血球細胞分析装置。
【請求項4】
採取血液から測定用の懸濁液を調整する前処理部を有する請求項1乃至3のいずれか1項に記載の血球細胞分析装置。
【請求項5】
更に、検出結果を表示する表示部を有し、
誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値が、設定された範囲から外れているときは、前記表示部に警告が表示される請求項1乃至4のいずれか1項に記載の血球細胞分析装置。
【請求項6】
誘電変数、電気的物性値及び血球細胞の状態変化の程度のうち1又は2以上の値に基づいて、適正な薬剤投与量を算出する解析部を有する請求項1乃至5のいずれか1項に記載の血球細胞分析装置。
【請求項7】
前記測定部は、前記懸濁液が通流する流路の一部に血球細胞が個別に通過可能な狭窄部が設けられた流路デバイスを備えており、
前記狭窄部において一の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する請求項1乃至6のいずれか1項に記載の血球細胞分析装置。
【請求項8】
1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する工程と、
測定された複素誘電率スペクトルに基づいて、前記懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する工程と、
を有する血球細胞分析方法。
【請求項9】
前記懸濁液に検出対象の血球細胞以外の血球細胞が含まれている請求項8に記載の血球細胞分析方法。
【請求項10】
検出対象の血球細胞が赤血球である請求項8又は9に記載の血球細胞分析方法。
【請求項11】
検出対象の血球細胞が白血球である請求項8又は9に記載の血球細胞分析方法。
【請求項12】
1又は複数の血球細胞を含む懸濁液の複素誘電率スペクトルを測定する測定装置と、
該測定装置で測定された複素誘電率スペクトルに基づいて、前記懸濁液の誘電変数及び/又は電気的物性値を算出し、その値から薬剤投与に伴う血球細胞の状態変化を検出する検出装置と、
を有する血球細胞分析システム。
【請求項13】
前記測定装置と前記検出装置とが通信ネットワークを介して接続されている請求項12に記載の血球細胞分析システム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2011−112497(P2011−112497A)
【公開日】平成23年6月9日(2011.6.9)
【国際特許分類】
【出願番号】特願2009−268879(P2009−268879)
【出願日】平成21年11月26日(2009.11.26)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 日本小児血液学会,特定非営利活動法人日本小児がん学会,日本小児がん看護学会,財団法人がんの子供を守る会、「第51回日本小児血液学会プログラム・総会号」、平成21年10月14日
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成23年6月9日(2011.6.9)
【国際特許分類】
【出願日】平成21年11月26日(2009.11.26)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 日本小児血液学会,特定非営利活動法人日本小児がん学会,日本小児がん看護学会,財団法人がんの子供を守る会、「第51回日本小児血液学会プログラム・総会号」、平成21年10月14日
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

