血管の形成ならびに血管新生および栄養因子の生産に使用するための骨髄間質細胞に由来する物質
【課題】血管新生および脈管形成の誘導に使用するための治療薬を提供する。
【解決手段】治療薬は幹細胞から単離した血管新生および脈管形成誘導因子を製薬学的に許容され得る細胞治療と一緒に含む。血管新生および脈管形成誘導因子の生産を増加させるために、幹細胞を暴露し、そして幹細胞と化合物を共培養することにより分泌される血管新生および脈管形成誘導因子の生産増幅法。治療に使用するために幹細胞から単離そして精製された血管新生および脈管形成誘導因子。上に説明した血管新生および脈管形成誘導因子を得る方法、その工程はヒトの間葉系幹細胞を分化前の組織から単離そして精製し、そして次いで間葉系幹細胞を培養拡大して神経学的および筋骨格治療用の道具を生産する工程を含む。組織修復に必要な所望の細胞表現型に分化し、そして生産することができる、単離され、そして必要な化合物の影響下で培養拡大した間葉系幹細胞。
【解決手段】治療薬は幹細胞から単離した血管新生および脈管形成誘導因子を製薬学的に許容され得る細胞治療と一緒に含む。血管新生および脈管形成誘導因子の生産を増加させるために、幹細胞を暴露し、そして幹細胞と化合物を共培養することにより分泌される血管新生および脈管形成誘導因子の生産増幅法。治療に使用するために幹細胞から単離そして精製された血管新生および脈管形成誘導因子。上に説明した血管新生および脈管形成誘導因子を得る方法、その工程はヒトの間葉系幹細胞を分化前の組織から単離そして精製し、そして次いで間葉系幹細胞を培養拡大して神経学的および筋骨格治療用の道具を生産する工程を含む。組織修復に必要な所望の細胞表現型に分化し、そして生産することができる、単離され、そして必要な化合物の影響下で培養拡大した間葉系幹細胞。
【発明の詳細な説明】
【技術分野】
【0001】
発明の背景
技術分野
本発明は治療薬として使用するための方法および組成物に関する。より詳細には本発明は血管新生(angiogenesis)の治療的生成の使用および血管新生および栄養(trophic)因子の生産に関する。
【背景技術】
【0002】
背景技術
発作は米国の成人人口において3番目に多い死因であり、そして障害の主要因である。発作は脳の一部が梗塞するようになった時に起こり、大脳の血液供給の妨害から脳組織の死をもたらす。急性発作に伴う脳梗塞は急激な、しかも劇的な神経的損傷を引き起こす。他の神経性疾患も組織の死および神経的損傷をもたらす。
【0003】
発作により影響を受けた、生存できるかもしれない脳の領域への血流を最大とするために薬理学的介入が試みられたが、臨床的効果は曖昧であった。非特許文献1では、「....[脳拡張薬]が酸化窒素法により測定される脳の血流を上昇させる実験的証拠にもかかわらず、それらはヒトの一時的な虚血性の攻撃、血栓症の進行、または慢性の発作の段階でヒトの発作の症例を慎重に研究すると有益ではないことが示された。これはニコチン酸、プリスコリン(Proscoline)、アルコール、パパベリンおよび5%二酸化炭素の吸収にもあてはまる。.....これらの方法の使用に対して、血管拡張薬は全身の血圧を下げることにより頭蓋内吻合流を低下させ、あるいは脳の正常な部分の血管を拡張することにより血管が梗塞から血液を取るので、有利というよりはむしろ有害であると示唆している」と述べている。
【0004】
さらに心血管系の疾患は死亡率および罹病率の世界的な原因を導いている。例えば心不全の有病率は増加してきている。心不全は心臓が十分な血液を身体の様々な臓器に送ることができないことを特徴とする。現在の推定では5百万以上のアメリカ人が心不全の診断を受け、毎年ほぼ500,000人の新たな症例が診断され、そして年間250,000人がこの疾患により死んでいる。この二十年間におけるかなりの治療的完成度にもかかわらず、心不全の発症は増え続け、流行病の比率に達し、そして開発国における主な経済的負担を表している。
【0005】
心不全は心拍出量の障害または静脈圧の上昇から生じる明白な症状および兆候を特徴とする臨床的症候群である。さらに心不全は進行性の障害であり、これにより心臓の機能は副作用が無くても時間経過に伴い悪化し続ける。心不全により、不十分な心拍出量が生じる。
【0006】
一般に2種類の心不全がある。右心不全は心臓の右側が静脈血を肺の循環に送ることができない。身体に液体の停滞が生じ、そして腫張および水腫が生じる。左心不全は心臓の左側が血液を全身の循環に送れないことである。次に左心室の後ろの停滞が肺に流体の蓄積を引き起こす。
【0007】
心不全から生じる主な影響は、流体のうっ血である。心臓がポンプとして効率的でなくなると、身体は例えば血液容量を上昇させるためのホルモンおよび神経シグナルを使用することによりそれを補おうとする。
【0008】
心不全には多数の原因がある。例えば心臓組織の疾患はもはや機能しない死んだ心筋細胞を生じる。左心室不全の進行は、部分的にこれら心筋細胞の損失の進行が原因であった。
【0009】
心不全を処置し、そして防止する多数の方法があった。例えば幹細胞は動物モデルを対象として急性心虚血および/または梗塞または損傷における心細胞を再生するために使用されてきた。1つの特別な例では、ドナーの足の骨から単離された生きている骨髄間質細胞(marrow stromal cell)が培養−拡大され(culture−expanded)、標識され、そして次いで同系成体ラットレシピエントの心筋層に注射された。移植から4日〜12週後に心臓を回収した後、移植部位を調査し、そして移植された間質細胞が心筋の環境で成長する可能性を示すことが分かった(Wang,et al.)。
【0010】
心筋細胞は、胚様凝集物(embryo−like aggregates)(胚様体:embryoid bodies)を介してD3系の多能性の胚性幹細胞(ES)からインビトロで分化することが示された。細胞は全分化期間中、全細胞パッチ−クランプ技法、形態学および遺伝子発現の類似により特徴つけられた。(Maltsev,et al.,1994)。さらに多能性のマウスES細胞は哺乳動物の心臓の主な特徴を発現する心筋細胞に分化できた(Maltsev,et al.,1993)。
【0011】
幹細胞はそれらの起源(胚性、骨髄、骨格筋等)にかかわらず、すべてではないが身体の細胞型に分化する可能性を有する。幹細胞は機能的な心筋細胞にも分化することができる。すなわち心不全を処置するための幹細胞に基づく治療の開発は、既存の治療よりも多くの利点を有する。
【先行技術文献】
【非特許文献】
【0012】
【非特許文献1】Harrisonの内科学の原理(Principle of Internal Medicine)(第9版、1980、第1926頁)
【発明の概要】
【0013】
発明の要約
本発明に従い、血管新生および脈管形成の誘導に使用する治療薬が提供される。治療薬は幹細胞から単離された血管新生および脈管形成誘導因子を、血管新生および脈管形成を誘導するための製薬学的に許容され得る細胞治療薬と一緒に含むことができる。また間質細胞を血管新生および脈管形成誘導因子の生産を増すための化合物に暴露し、そして共培養することにより分泌される血管新生および脈管形成誘導因子の生産を増幅させる方法も提供する。幹細胞から単離され、そして精製された治療に使用するための血管新生および脈管形成誘導因子も提供する。上に説明した血管新生および脈管形成誘導因子を得る方法を提供し、この方法は分化前の組織からヒト間葉系幹細胞(mesenchymal stem cell)を単離し、そして精製し、そして次いで神経学的および筋骨格治療用の道具を生産するために間葉系幹細胞を培養拡大する工程を含む。組織修復に必要な所望する細胞表現型に分化し、そして生産することができる、単離され、そして必要な化合物の影響下で培養拡大された間葉系幹細胞も提供する。
【発明を実施するための形態】
【0014】
発明の説明
一般に本発明は血管新生および脈管形成を誘導するための細胞治療の一部として、骨髄間質細胞または他の幹細胞に由来する血管新生および脈管形成誘導因子の使用を提供する
。より詳細には本発明は、治療に使用するための間質細胞または他の幹細胞により分泌される血管新生および脈管形成誘導因子(例えば血管新生、栄養および増殖因子)の生産を増幅させる方法を提供し、この因子は投与されると血管新生または他の有益な増殖を誘導する。増幅は細胞を脳抽出物および/またはカルシウムに暴露し、そして共培養することにより起こる。
【0015】
用語「血管新生」とは新しい、および/または発育中の血管の組織への成長が関与する組織の脈管化のプロセスと定義され、そして新脈管形成(neo−vascularization)とも呼ばれる。このプロセスは内皮細胞および平滑筋細胞の浸潤により媒介される。このプロセスは3つのうちの1つの様式で進行する:血管が既存の血管から発出し、血管のデノボ成長が前駆細胞から生じることができ(脈管形成)、かつ/または既存の小さい血管の直径が拡大することができる。
【0016】
本明細書で使用する用語「強化する」または「強化」は、限定するわけではないが幾つかの望ましい質または量の物質を加えるかまたは増すことにより、豊富またはより豊富にすることを含むことを意味する。
【0017】
本明細書で使用する「脳抽出物」という句は、限定するわけではないが脳細胞または脳から得られる他の類似の細胞を含むことを意味する。これらの細胞は培地で培養することができ、そして上清を脳抽出物として使用することができる。
【0018】
本明細書で使用する用語「損傷」は、限定するわけではないが遺伝子障害、疾患および年齢により発症する障害を含む身体的または生物学的損傷を含むことを意図する。例えば患者は発作、CNS損傷および神経変性疾患後に神経および機能的障害に罹る。
【0019】
本明細書で使用する用語「細胞治療」は限定するわけではないが、幹細胞の治療的使用を含む。幹細胞はその子孫が種々の細胞型に特異化する分化していない母細胞である。幹細胞は限定するわけではないが、胚、骨髄、肝臓、間質、脂肪組織および当業者に知られている他の幹細胞起源を含む種々の起源を有する。これらの幹細胞はそれらが自然に発生する所望の領域に置くことができ、または当業者に知られている様式で工作することができる。すなわち限定するわけではないがトランスフェクション、削除等を含む種々の遺伝子工学的手法を介して、幹細胞はそれらの生存の見込みを上げるために、または他の所望する目的のために工作されることができる。
【0020】
幹細胞はヒト個体に提供された時、インビボで自己再生することができ、そして系統が制限された子孫となることができ、これはさらに特異的な系統に分化し、そして拡がる。本明細書で使用する「幹細胞」はヒトの骨髄細胞を指し、そして他の細胞型の幹細胞ではない。好ましくは「幹細胞」はヒト骨髄間質細胞を指す。
【0021】
用語「幹細胞」または「多能性」幹細胞は互換的に使用して、(1)すべての定義された造血系統における子孫(progeny)を生じる能力、および(2)自己−再生(self−renewal)により多能性造血幹細胞を含むすべての血液細胞型およびそれらの子孫において、重度な免疫抑制宿主を完全に再構成することができる幹細胞、を有する幹細胞を意味する。
【0022】
骨髄は長骨の骨髄腔、幾つかのハヴァーズ管および海綿質すなわちスポンジ状の骨の小柱間の空間を占める柔軟組織である。骨髄には2種類ある:赤色、これは生まれたばかりのすべての骨、および成人の限定された場所(すなわち海綿質中)に見いだされ、血液細胞(すなわち増血)およびヘモグロビン(すなわち赤色)の生産に関する;および黄色、これはほとんどが脂肪細胞(すなわち黄色)および結合組織からなる。
【0023】
全体として骨髄は造血幹細胞、赤および白血球およびそれらの前駆体、間葉系幹細胞、間質細胞およびその前駆体、ならびに「間質」と呼ばれる結合組織網を形成する繊維芽細胞、網状白血球、脂肪細胞および内皮細胞を含む細胞群を含む複雑な組織である。間質に由来する細胞は、細胞表面タンパク質および増殖因子の分泌を介して直接的な相互作用を通した造血細胞の分化を形態学的に調節し、そして骨構造の基礎および支持に関与している。
【0024】
動物モデルを使用した実験では、骨髄が軟骨、骨および他の結合組織細胞に分化する能力を有する「前−間質(pre−stromal)」細胞を含むことが示唆された。(Beresford,J.N.:骨および骨髄の骨形成幹細胞および間質系(Osteogenic Stem Cells and the Stromal System of Bone and Marrow)、Clin.Orthop.,240:270,1989)。最近の証拠では多能性間質幹細胞または間葉系幹細胞と呼ばれるこれらの細胞が、活性化で幾つかの異なる型の細胞系(すなわち骨細胞、軟骨細胞、脂肪細胞等)を生成する能力を有することを示す。しかし間葉系幹細胞は広い種々の他の細胞(すなわち、赤血球、血小板、好中球、リンパ球、単球、好酸球、好塩基球、脂肪細胞等)と組織中に大変微量で存在し、そして年齢に逆行する関係で、多数の生物活性因子の影響に依存して寄せ集めの結合組織に分化することができる。
【0025】
本発明の目的は、骨髄間質細胞、骨髄間質細胞に由来する上清、または骨髄間質細胞と他の幹細胞の相互作用から生じる分泌物を、疾患を処置するために利用することである。これらの分泌物には限定するわけではないが多数の増殖、栄養および血管新生因子を含む。本発明の方法は、処置の効果を増すこと、例えば血管新生、および存在しないまたは既存の血管から形成される血管生産を増すことにより、神経損傷または他の損傷からの回復に改善された結果を促進する。また本発明はCNS傷害または変性後の機能を向上させるために、脳の補完メカニズムを強化する手段を提供するためにも使用することができる。さらに本発明の方法および組成物は、細胞治療の効力を強化することができる。
【0026】
損傷した細胞に分化する移植した幹細胞を介して、損傷した細胞の濃度を高め(enriching)かつ/または増やす(repopulating)ことは機能を上げる。例えばこの治療が心臓で使用される時、治療は心臓の筋節(contractile units)を増すことができる。筋節の増加は心臓の機能を上げる。さらに幹細胞は栄養因子のような種々の物質の放出の原因ともなり得る。すなわち例えば栄養因子の放出は、心機能を上げ、かつ/または心不全を処置するために血管新生を誘導する(血管の数を増す)。したがって幹細胞は単に機能的な心筋細胞に分化する以外に様々なメカニズムを介して心機能を上げ、かつ/または心不全を処置するように作用する。
【0027】
栄養因子、増殖因子および血管新生因子の生産は典型的には経費がかさむ難しい方法である。本発明の方法および組成物は、本発明の治療を単に投与することにより、純粋な栄養因子、増殖因子および他の関連因子を生産する廉価で、しかも簡単な方法を提供する。これらの因子は患者の処置に使用することができる。例えば因子はインビボおよびインビトロの両方で血管新生、脈管形成を誘導するために、および組織の機能を強化し、そして修復するために使用することができる。したがって栄養、増殖および血管新生因子を生産し、そして分泌するために、どの骨髄間質細胞が細胞工場として使用できるかを決定することが有益である。これらの因子には限定するわけではないが、VEGF、HGF、BDNF、NGF、bFGF等を含む。本発明の方法は培養条件によりこれらの因子の生産を操作することを可能とする。例えば培養条件は、細胞を培養基中で組織および/または種々のカルシウム濃度で共培養することにより操作することができる。
【0028】
本発明は疾患を処置するための細胞治療の使用に基づく。幹細胞は異なる起源(胚、骨髄、肝臓、脂肪組織等)であるが、それらの重要な共通の特徴は、それらがすべてではないが身体の様々な細胞型に分化する可能性を有するということである。すでに述べたように、幹細胞は心筋細胞に分化できることが示された(Maltsev et al.,1993;1994)。
【0029】
出願人は神経学および筋骨格治療用の価値ある道具を生産するために、分化前の組織からヒト間葉系幹細胞を単離し、そして精製し、次いで間葉系幹細胞を培養拡大する方法を開発した。そのような操作の目的は、間葉系幹細胞の数を大きく増加させ、そしてこれらの細胞を身体の正常な修復能力に方向転換かつ/または強制させるために利用することである。間葉系幹細胞は多数で回収され、そして再生および/または修復のためのインビボ成長を強化または刺激するために、後の活性化および分化等を介して種々の人工器官デバイスへの移植付着を向上させるために、組織損傷の領域に適用され、造血細胞の生産等を強化する。
【0030】
発明者は培養で拡大され、精製された間葉系幹細胞を修復、移植等の部位に転移し、固定化し、そして活性化するための様々な手法を企図し、それらには細胞を骨格欠損の部位に注射すること、細胞を人工器官とインキューベーションすること、および人工器官を移植すること等を含む。このように分化前の細胞を単離し、精製し、そして数を大きく拡大し、そして次いで組織傷害の部位にそれらを配置することにより、またはそれらを移植前にインビトロで前処理することにより分化プロセスを能動的に制御することにより、培養拡大した未分化間葉系幹細胞を多数の神経疾患、神経損傷、代謝性骨疾患、骨格筋形成異常、軟骨欠損、靭帯および腱の損傷および他の筋骨格および結合組織障害における細胞的、分子的および遺伝的障害を解明するためのような種々の治療目的に利用することができる。
【0031】
発明者は細胞を損傷の部位に注射することを含め、種々の多孔質セラミック媒体または担体の使用を介して、修復、移植等の部位に間葉系幹細胞または前駆細胞を転移し、固定化し、そして活性化するための種々の手順を企図する。
【0032】
ヒト間葉系幹細胞は、変性関節疾患の患者から腰または膝の代替手術中に得られる大腿頭海綿質骨片の栓を含む多数の異なる供給源から、および将来の骨髄移植のために骨髄が回収される正常ドナーおよびガン患者から得られる吸引された骨髄から得ることができる。回収された骨髄は回収された骨髄の供給源に依存して(すなわち骨片、末梢血の存在等)、多数の異なる機械的単離法により細胞培養分離のために調製されるが、単離法に含まれる重要な工程は分化無しに間葉系幹細胞の成長を可能とするだけではなく、培養皿のプラスチックまたはガラス表面領域に間葉系幹細胞だけを直接付着させる作用物質を含む特別に調製した培地の使用であった。骨髄サンプル中に大変少量で存在する所望の間葉系幹細胞の選択的付着を可能とする培地を生産することにより、骨髄に存在する他の細胞(すなわち赤および白血球、他の分化した間葉系幹細胞等)から間葉系幹細胞を分離することが可能となった。
【0033】
上に示したように完全な培地は、細胞培養分離のために回収された骨髄を調製するために使用した最初の回収工程の具体的な種類に依存して、多数の異なる単離法に利用することができる。海綿質骨髄の栓を利用する時、骨髄を完全な培地に加え、そしてボルテックス処理して分散物を形成し、これを次いで遠心して骨片等から骨髄細胞を分離する。次いで骨髄細胞(主に赤および白血球および大変少量の間葉系幹細胞等からなる)は骨髄細胞を含有する完全培地を、一連の16、18および20ゲイジ針を備えたシリンジに通すことにより単一細胞に解離する。酵素的分離法に対して機械的分離法の使用を介して生産する利点は、機械的方法では細胞の変化がほとんど生じず、一方酵素的方法は特に培養付着
および選択的分離に必要なタンパク質結合部位、および/または該間葉系幹細胞に特異的なモノクローナル抗体の生産に必要なタンパク質部位に細胞傷害を生じ得る点であると考えられる。次いで単一細胞懸濁液(これは約50〜100×106の有核細胞からなる)が、続いて懸濁液中に見いだされる残りの細胞から間葉系幹細胞を選択的に分離し、かつ/または単離する目的で100mmの皿にまかれた。
【0034】
ヒト間葉系幹細胞源として吸引した骨髄を利用する時、骨髄幹細胞(これは骨片をほとんど含まないか、または全く含まないが、大量の血液を含む)を完全培地に加え、そして以下にさらに詳細に記載するようにPercoll(シグマ(Sigma)、セントルイス、ミズーリ州)勾配で分画した。Percoll勾配は、骨髄に由来する間葉系幹細胞を含む低密度血小板画分から大部分の赤血球および単核造血細胞を分離する。約30〜50×106細胞を含む血小板画分は、骨髄ドナーの年齢に依存して未確定量の血小板細胞、30〜50×106の有核細胞およびわずか約50〜500の間葉系幹細胞からなった。次いで低密度血小板画分は細胞付着性に基づき選択的に分離するためにペトリ皿にまいた。
【0035】
海綿質骨または腸骨吸引物のいずれかから得た骨髄細胞(すなわち初代培養)を完全培地中で成長させ、そして以下に説明する条件に従い1〜7日間、ペトリ皿の表面に接着させた。3日目以降は細胞接着に増加が観察されなかったので、非接着細胞は元の完全培地を新しい完全媒体と交換することにより培養から除去する時期の標準的な長さとして3日を選択した。引き続く培地交換は、培養皿がコンフルエントになるまで(これには通常、14〜21日を要する)4日毎に行った。これは未分化ヒト間葉系幹細胞に103〜104倍の上昇を示した。
【0036】
次いで細胞はEDTA(エチレンジアミン四酢酸)を含むトリプシンのような放出剤(0.25%trysin、1mM EDTA(1.倍)、ギブコ(Gibco)、グランアイランド、ニューヨーク州)またはEGTA(エチレングリコール−ビス−(2−アミノエチルエーテル)N,N’−四酢酸、シグマケミカル社、セントルイス、ミズーリ州)のような錯化剤を利用して培養皿から脱着させた。錯化剤の使用を介して生じるトリプシンに優る利点は、トリプシンには間葉系幹細胞の多数の結合タンパク質を開裂させる可能性がある点である。これらの結合タンパク質はモノクローナル抗体が生産されると想定される時の認識部位を含むので、トリプシンに対してEGTAのような錯化剤を放出剤として利用した。次いで放出剤を不活性化し、そして脱着した培養した未分化間葉系幹細胞を続いて使用するために完全培地で洗浄した。
【0037】
特定の条件下で培養拡大した間葉系幹細胞は、多孔質のリン酸カルシウムセラミックス中で移植片としてインキューベーションした時、骨に分化する能力を有する。間葉系幹細胞が軟骨細胞に反して骨に分化することに影響を及ぼす内部因子はよく知られていないが、間葉系幹細胞の拡散チャンバーに反して多孔質のリン酸カルシウムセラミックス中で脈管により供給される増殖および栄養因子への直接的な接近性が、間葉系幹細胞の骨への分化に影響を及ぼしたと思われる。さらに脳抽出物は幹細胞がさらなる栄養因子を生産することを引き起こし、さらに幹細胞のこの効果を強化する。
【0038】
結果として、単離され、そして培養拡大された間葉系幹細胞は特定の特異的条件下および/または特定の因子の影響下で利用されて、分化し、そして組織修復に必要な所望する細胞の表現型を生産することができる。
【0039】
間葉系幹細胞の単回用量の投与は、T細胞と同種系の組織に、または「非−自己」組織に対して、特にTリンパ球が間葉系幹細胞から分離された後に同種細胞に対するそれらの非応答性(すなわち寛容またはアネルジー)を保持する場合、T細胞応答を下げるか、ま
たは排除するために効果的となることができる。
【0040】
脳抽出物と幹細胞を心筋に移植する一般法は以下の手順により行われる。幹細胞および脳抽出物を患者に投与する。投与は皮下、静脈内、動脈内、筋肉内、腹腔内を含む非経口、および鼻内投与ならびにくも膜下内および注入技法であることができる。
【0041】
間葉系幹細胞の投薬用量は広い限界内で変動し、そして各々の特定の症例で個々の要件に合わせる。一般に非経口投与の場合、通常、受容体の体重1キログラムあたり約0.01〜約5百万個の細胞を投与する。使用する細胞数は受容体の体重および状態、投与の回数または頻度、および当業者に知られている他の変数に依存する。間葉系幹細胞は組織、器官または移植する細胞に適する経路により投与することができる。それらは全身的に、すなわち非経口的に、静脈内注射により投与することができ、または骨髄のような特定の組織もしくは器官を標的とすることができる。ヒト間葉系幹細胞は細胞の皮下移植を介して、または幹細胞を結合組織、例えば筋肉に注射することにより投与することができる。
【0042】
細胞は適当な希釈剤中に約0.01〜約5×106細胞/mlの濃度で懸濁することができる。注射溶液に適する賦形剤は、緩衝化塩溶液または他の適当な賦形剤のような生物学的および生理学的に細胞および受容体と適合性があるものである。投与用の組成物は適切な殺菌性および安定性を順守する標準法に従い配合され、製造され、そして保存されるなければならない。
【0043】
本発明はこれらに限定されることはないが、間葉系幹細胞を好ましくは骨髄から単離し、精製し、そして培養で拡大(すなわちインビトロで)して、本明細書に記載する方法で使用するために十分な数の細胞を得ることができる。骨に見いだされる新細胞を形成する多能性の芽細胞である間葉系幹細胞は通常、骨髄(1:100,000)および他の間葉系組織に大変低い頻度で存在する。Caplan and Haynesworth、米国特許第5,486,359号明細書を参照にされたい。間葉系幹細胞の遺伝子形質導入は、Gerson et al、米国特許第5,591,625号明細書に開示されている。
【0044】
特に言及しない限り、遺伝子操作はSambrook and Maniatis、モレキュラークローニング:ア ラボラトリーマニュアル(Molecular Cloning:A Laboratory Manual)、第2版;コールドスプリングハーバーラボラトリー出版、コールドスプリングハーバー、ニューヨーク州(1989)に記載されているように行う。
【0045】
心不全における機能悪化の病因に関するメカニズムの1つが、一部は心筋細胞の進行している死によることが益々明らかになったので(Sabbah,2000)、本発明は価値がある。この問題に対する解決は、失った細胞の代わりとなるか、または現在機能している心細胞のさらなる強化を提供する新たな心細胞で、心筋の濃度を高め(enrich)かつ/または増やし、これにより欠けている心臓のポンプ機能を改善することである。
【0046】
本発明は副作用が知られておらず、しかも処置が比較的非侵襲的であるので、すべての既存の処置よりも有利である。例えば心不全の処置は現在、主に神経体液系を妨害する薬剤の使用に基づく。さらに心臓移植ならびに心室または両心室補補助デバイスの使用を含む外科的処置が存在する。本発明により提供される利点は、疾患の主原因、すなわち筋節の損失に直接取り組むことにより心不全を処置する能力である。それ故に欠けている心臓の全体的機能に寄与する筋節に分化する幹細胞による心筋の増加(re−population)は新規であり、そして問題の核心をついている。他の利点には薬理学的治療の使用にしばしば伴う副作用の不存在、および心臓移植または他の臓器移植でかかる免疫拒絶
の不存在および幹細胞により生成される栄養因子を増加させる能力を含む。
【0047】
本発明は多くの現行の外科的治療および恐らく薬理学的治療にも代わる可能性を有する。カテーテルに基づく取り組みを使用して脳抽出物と一緒に幹細胞を欠けている心臓へ送達できるようにする既存のデバイスは、このように開胸手術の必要性を排除する。さらに本発明はヒトの医学的環境および獣医学的状況の両方に応用可能である。
【0048】
本発明の方法および組成物は、本明細書に含む実施例で例示する。具体的態様を本明細書では開示するが、それらは可能性を全て試したわけではなく、そして当業者に知られている計画および方法で変動する他の適当な計画も含むことができる。基本的には当業者に知られている任意の種々の計画、方法、構造および材料を、本発明の精神から逸脱することなく利用することができる。
【実施例】
【0049】
方法:
分子生物学の一般法:当該技術分野で知られており、そして具体的には記載しない標準的な分子生物学技術は、一般にSambrook et al.,モレキュラークローニング:ア ラボラトリーマニュアル、コールドスプリングハーバーラボラトリー出版、ニューヨーク(1989)、およびAusubel et al.,分子生物学の現在の手法(Current Protocols in Molecular Biology)、ジョン ウィリー アンド サンズ(Jone Wiley and Sons)、バルチモア、メリーランド(1989)およびPerbal、分子クローニングの実践的手引き(A Practical Guide to Molecular Cloning)、ジョン ウィリー アンド サンズ、ニューヨーク(1988)、およびWatson et al.,組換えDNA(Recombinant DNA)、サイエンティフィック アメリカン ブックス(Scientific American Books)、ニューヨーク、およびBirren et al(編集)、ゲノム分析:ア ラボラトリーマニュアルシリーズ(Genome Analysis:A Laboratory Manual Series),第1〜4巻、コールドスプリングハーバーラボラトリー出版、ニューヨーク(1998)、および米国特許第4,666,828号;同第4,683,202号;同第4,801,531号;同第5,192,659号および同第5,272,057号明細書および引用により編入されている参考文献に説明されている方法論に従った。ポリメラーゼ連鎖反応(PCR)は一般に、PCRプロトコール:方法および応用の手引き(PCR Protocols:A Guide To Methods And Applications)、アカデミック出版、サンディエゴ、カリフォルニア州(1990)のように行った。フローサイトメトリーと組み合わせたIn−situ(In−cell)PCRは、特異的DNAおよびmRNA配列を含む細胞を検出するために使用することができる(Testoni et al,1996,Blood 87:3822)。
【0050】
免疫学の一般法:当該技術分野で知られており、そして具体的には記載しない免疫学における標準法は、 一般にStites et al(編集)、基礎的および臨床的免疫学(Basic and Clinical Immunology)(第8版)、アップレトン アンド レンゲ(Appleton & Lange)、ノルウォーク、コネチカット州(1994)およびMishell and Shiigi(編集)、細胞免疫学における選択された方法(Selected Methods in Cellular Immunology)、W.H.フリーマン社(W.H.Freeman and Co)、ニューヨーク(1980)に従う。
【0051】
治療薬の送達
本発明の細胞は個々の患者の臨床的状態、投与の部位および方法、投与計画、患者の年齢、性別、体重および医療専従者に知られている他の因子を考慮して良好な医学的プラクティスに従い投与そして投薬される。本発明の目的について製薬学的な「有効量」は、このように当該技術分野で知られているような考察に従い決定される。この量は限定するわけではないが改善された生存率またはより早い回復、あるいは当業者により適切な基準として選択されるような症状および他の兆候の改善または排除を含む改善を達成するために効果的でなければならない。
【0052】
本発明の方法では、本発明の細胞は種々の方法で投与することができる。これは細胞として、または製薬学的に許容され得る塩として投与することができ、そして単独で、または有効成分として製薬学的に許容され得る担体、希釈剤、補助剤および補形剤と組み合わせて投与することができることに注目すべきである。細胞は経口で、皮下に、または静脈内、動脈内、筋肉内、腹腔内を含む非経口的に、および鼻内投与ならびにくも膜下および注入技術で投与することができる。細胞のインプラントも有用である。処置される患者は温血動物、そして特に人間を含む哺乳動物である。製薬学的に許容され得る担体、希釈剤、補助剤および補形剤ならびにインプラント担体は一般に、本発明の有効成分と反応しない不活性な非毒性の固体または液体充填剤、希釈剤またはカプセル化材料を称する。
【0053】
ヒトは一般に本明細書に例示するマウスまたは他の実験動物よりも長期間、処置され、その処置は疾患プロセスの長さおよび薬剤の効力に比例する長さを有する。投薬は単回投与または数日の期間にわたる多回投与であることができるが、単回投与が好ましい。
【0054】
投薬は単回投与または数日間の多回投与であることができる。処置は一般に疾患プロセスの長さおよび薬剤の効力および処置する患者の種に比例する長さを有する。
【0055】
本発明の細胞を非経口的に投与する時、一般に単位注射剤形(溶液、懸濁液、乳液)に配合される。注射に適する製剤には滅菌水溶液または分散剤および滅菌の注射可能な溶液または分散剤に再構成するための滅菌粉末を含む。担体は例えば水、エタノール、ポリオール(例えばグリセロール、プロピレングリコール、液体ポリエチレングリコール等)、それらの適当な混合物、および植物油を含む溶媒または分散媒質であることができる。
【0056】
適切な流動性は、例えばレシチンのようなコーティングの使用により、分散剤の場合は必要な粒子サイズを維持することにより、および表面活性剤の使用により維持することができる。綿実油、ゴマ油、オリーブ油、大豆油、トウモロコシ油、ヒマワリ油またはピーナッツ油およびミリスチン酸イソプロピルのようなエステルのような非水性補形剤も、細胞組成物の溶媒系として使用することができる。さらに抗微生物剤、保存剤、酸化防止剤、錯化剤およびバッファーを含む組成物の安定性、殺菌性および等張性を強化する種々の添加剤を加えることができる。微生物の作用の防止は、種々の抗バクテリアおよび抗菌・カビ剤、例えばパラベン、クロロブタノール、フェノール、ソルビン酸等により確実にすることができる。多くの場合で、張性調整剤、例えば糖、塩化ナトリウム等を含むことが望ましい。注射可能な剤形の長期吸収は、吸収を遅らせる作用物質、例えばモノステアリン酸アルミニウムおよびゼラチンの使用によりもたらすことができる。しかし本発明に従い、任意の補形剤、希釈剤または添加剤の使用は細胞と適合しなければならない。
【0057】
滅菌した注射可能な溶液は、本発明を実施するために利用する細胞を、所望により様々な他の成分を含む必要量の適切な溶媒に必要な量で包含することにより調製することができる。
【0058】
本発明の薬理学的製剤は、種々の補形剤、補助剤、添加剤および希釈剤のような適合性のある担体を含む注射可能な製剤で患者に投与することができ;または本発明で利用する
細胞は、モノクローナル抗体、媒介型送達、イオン導入的、ポリマーマトリックス、リポソームおよび微小球のような緩効性の皮下インプラントまたは標的化送達系の状態で患者に非経口的に投与することができる。本発明に有用な送達系の例には:5,225,182;5,169,383;5,167,616;4,959,217;4,925,678;4,487,603;4,486,194;4,447,233;4,447,224;4,439,196;および4,475,196を含む。多くの他のそのようなインプラント送達系およびモジュールが当業者には周知である。
【0059】
本発明で利用する細胞の薬理学的製剤は、患者に経口的に投与することができる。錠剤、懸濁液、溶液、乳液、カプセル、粉末、シロップ等の中で細胞を投与するような常法を利用することが可能である。経口的または静脈内に細胞を送達し、そして生物学的活性を保持する既知の技術が好適である。
【0060】
1つの態様では、本発明の細胞を最初に静脈内注入により投与して血液レベルを適当なレベルにすることができる。次いで患者のレベルは経口剤形により維持されるが、患者の状態に依存して、そして上に示したように他の投与形態を使用することもできる。投与する量は処置する患者について変動し、そして1日あたり約100ng/kgの体重から100mg/kg体重で変動し、そして好ましくは1日あたり約10mg/kg〜10mg/kgである。
【0061】
実施例1
骨髄間質細胞(MSCs)を用いた外傷性の脳損傷(TBI)の処置は、ラットの機能的成果を改善する。組織交換は細胞移植治療の単なる代償的手段ではない。種々の増殖因子が傷害を受けた組織の修復および交換を媒介することが示されたので、MSCsは傷害を受けた組織の処置に役割を果たす栄養的支援を提供する。TBIに由来する大脳組織抽出物に対するヒトMSCs(hMSCs)の応答を調査し、そしてTBI環境がhMSCsの分化および増殖因子の分泌を誘導するかどうかを決定するために実験した。hMSCsはTBI抽出物とインビトロで培養し、そして免疫細胞化学および定量的サンドイッチ酵素−連結免疫吸着アッセイ(ELISA)を行った。結果はTBIでコンディショニングしたhMSCsが特異的な細胞性タンパク質マーカー:神経細胞核用のNeuN(全hMSCsの0.2〜0.5%)、初期ニューロンの分化および神経突起の伸長用のTuj−1(6〜10%)、星状膠細胞用のGFAP(4〜7%)および小突起膠細胞用のMBP(3〜5%)を発現したことを示す。加えて、TBI抽出物で処置したhMSCsは脳由来神経栄養因子(BDNF)、神経成長因子(NGF)、塩基性繊維芽細胞増殖因子(bFGF)、血管内皮増殖因子(VEGF)および肝細胞増殖因子(HGF)の分泌を時間依存的様式でアップ−レギュレーションすることにより応答する。これらのデータはTBI抽出物が、hMSCsが脳組織の神経形態およびタンパク質表現型を発現するようにさせていることを示している。さらにELISAデータは移植したhMSCsが、神経保護および血管新生を助長することができる多くの増殖因子の反応性分泌を介して治療的利益を提供することを示す。
【0062】
骨髄間質細胞(MSCs)は外傷的損傷(TBI)に供されたラットに静脈内から移植された時、神経機能の回復を促進する(Lu et al.,2001a)。移植でMSCsは損傷を受けた組織の場所に優先的に移動し、そして幾つかの細胞が脳内因性−様細胞の表現型のタンパク質を発現する(Lu et al.,2001b;Lu et al.,2001a;Mahmood et al.,2001)。幹細胞群による損傷した組織の長期交換法は、神経損傷の処置に対する簡単な取り組みであり、TBIモデルの急性および短期の治療用移植において、低レベルのMSC分化が機能的利益を提供することはないようで(Lu et al.,2001b;Lu et al.,2001a;Mahmood et al.,2001)、そして利益を提供するメカニズムは未知の
ままである。
【0063】
MSCsは種々のサイトカインおよび増殖因子を自然に生産し(Takai et al.,1997;Labouyrie et al.,1999;Bjorklund and Lindvall,2000;Dormady et al.,2001)、その分泌特性はそれらの微小環境によって影響を受ける(Dormady et al.,2001)。脳−由来神経栄養因子(BDNF)および神経成長因子(NGF)のようなニュートロフィンは、インビボおよびインビトロの両方で損傷したCNS組織の生存を増加させる(Hefti,1986;Kromer,1987;Koliatsos et
al.,1993;Bullock et al.,1999;Gage,2000)。前臨床実験で広く実験された増殖因子は塩基性繊維芽細胞増殖因子(bFGF)(Ay
et al.,1999)である。虚血の発生から数時間内にbFGFを静脈内に投与すると、恐らく脳梗塞の境界(周縁部)で細胞を直接的に保護することにより梗塞のサイズを低減させる(Ay et al.,1999)。血管内皮増殖因子(VEGF)発現も血管新生および神経修復を促進する(Papavassiliou et al.,1997)。VEGFによる発作の処置は、機能的成果を向上させる(Zhang et al.,2000b)。肝細胞増殖因子(HGF)の発現は、損傷後の脳内で自然にアップ−レギュレーションされ、そしてインビトロで脳のニューロンに対して抗−アポトーシス効果を示す(Zhang et al.,2000a)。
【0064】
材料および方法
試薬
ハンクスのバランス塩溶液(HBSS)、ダルベッコの改良イーグル培地(DMEM)、ノックアウトDMEM、ノックアウト血清代替、ウシ胎児血清(FBS)、トリプシンおよびエチレンジアミン−四酢酸(EDTA)は、ギブコ(GIBCO)(グランドアイランド、ニューヨーク州)から購入した。Ficollはファルマシア(Pharmacia)(ピスカタウェイ、ニュージャージー州)から購入した。モノクローナル神経核抗原(NeuN)、ポリクローナルβ−チューブリンアイソタイプ1(Tuj−1)、グリア繊維酸性タンパク質(GFAP)およびミエリン塩基性タンパク質(MBP)に対する抗体は、ケミコン(CHEMICON)(テメクーラ、カリフォルニア州)から購入した。BDNF、bFGF、VEGFおよびHGF用のサンドイッチ酵素−連結免疫吸着アッセイ(ELISA)のキットは、R&Dシステムズ(ミネアポリス、ミネソタ州)から得た。NGF ELISAキットは、研究室で作成した。抗−β(2.5S、7S)NGFモノクローナル抗体、抗−β(2.5S、7S)NGF−β−gal、NGF−β標準は、ロッシュ モレキュラー バイオケミカルズ(Roche Molecular Biochemicals)(インディアナポリス、イリノイ州)から購入した。特に示さない限り、試薬はシグマケミカルズ社(セントルイス、ミズーリ州)から得た。
【0065】
初代hMSCs培養
初代骨髄は3名の正常なヒトドナーの腸骨稜に由来する15〜16mlの吸引物から得た。各吸引物はHBSSで1:1に希釈し、そして約10mlのFicollに重層した。2,500×gで30分間遠心した後、単核細胞層を界面から取り出し、そしてHBSSに懸濁した。細胞は1,000×gで10分間遠心し、そして5×106細胞を各100mmの組織培養皿(ファルコン(Falcon)、ベクトン−デッキンソン(Becton−Dickinson)、ニュージャージー州)で完全DMEM(10%FBSを含有する)に再懸濁した。細胞を5%CO2のフラスコ中、37℃で3日間インキューベーションし、そして非付着細胞は培地を交換することにより除去した。培養がコンフルエントに達した時(通常は2〜3週間で)、細胞はリン酸緩衝化生理食塩水(PBS、pH7.4)中の0.05重量/容量%トリプシンおよび0.02重量/容量%EDTAを用いて37℃で5分間回収し、もう一度まき、そして再度2週間培養し、そして回収した。次
いで細胞を後で使用するために凍結した。これらの実験に使用した細胞は、3〜5継代で回収した。
【0066】
外傷的に損傷した脳に由来する抽出物
実験は体重が250〜350gのオスのウィスター(Wistar)ラットで行った(n=21)。麻酔はラットに抱水クローラル(35mg/100g体重)を腹腔内注射することにより誘導した。直腸温度はフィードバック−調節された水加熱システムを使用して外科的手順の間、37℃に維持した。ラットを定位枠に配置した。損傷は左皮質(同側皮質)に、直径6mmのチップを有する気体ピストンで4m/秒の速度および2.5mmの圧縮で衝撃を与えることにより誘導した(Dixon et al.,1991)。対照動物には開頭術を行ったが損傷は与えなかった。ラットは術後1、4および7日に屠殺した(各時期あたりn=6)。脳組織抽出物は実験および正常対照(n=3)ラットから直ちに得た。両実験ラットおよび対照ラットの左半球のセグメントを氷上に置き、そして湿潤重量をグラムで迅速に測定した。続いて組織片はDMEM(150mg組織/mlDMEM)を加えることにより均一化し、そして氷上で10分間、インキューベーションした。ホモジネートは4℃で10,000×gにて10分間遠心した。上清を集め、そしてhMSCsの処置のために−80℃で保存した。
【0067】
細胞分化
タンパク質の表現型実験は、1.0×106細胞を35mm皿に播種し、そしてそれらを新鮮なノックアウトDMEM(10%、20%または40%のTBI組織抽出上清を含む20%ノックアウト血清代替を含む)で処理することにより行った。すべての細胞を7日間インキューベーションした。免疫反応性神経−様細胞の予測は、細胞を3枚の培養皿中、10の無作為視野(10×対物)で、最少3つの異なる実験で計数することに基づいた。神経細胞の表現型の割合は、細胞総数から算出した。
【0068】
二重および三重染色免疫細胞化学
hMSCsは、上記の異なる処理を使用して1.0×106の密度で35mm皿中のガラスカバースリップ(18×18mm2)にまいた。ガラスカバースリップ上の細胞を免疫細胞化学に使用した。培養基の上清は、以下に記載するように定量的ELISA測定に使用した。細胞をPBS(pH7.4)で洗浄し、そして4%パラホルムアルデヒドで10分間固定した。非特異的結合部位は、4%正常ウマ血清、2%ウシ血清アルブミンおよび0.1%Triton X−100で1時間ブロックした。カバースリップをPBSで洗浄し、そしてTuj−1、GFAPまたはMBPに対する1次抗体と1時間インキューベーションした。それらを再度PBSで洗浄し、そしてフルオレセイン−イソチオシアネート(FITC)結合ヤギ抗−マウスまたは抗−ウサギIgG2次抗体と1時間インキューベーションした。Tuj−1染色したhMSCカバースリップをもう一度洗浄し、そして第2の1次抗体NeuNと一晩インキューベーションし、次いでPBSで洗浄し、そしてシアニン−5.18(Cy5)結合抗−マウスIgG2次抗体と1時間インキューベーションした。4’b−ジアミジン−2−フェニルインドールジヒドロクロライド(DAPI)色素を使用して、視野の核を計数することにより細胞数を決定した。次いでカバースリップにグリセルゲル上層媒質(glycergel mounting medium)をのせた。
【0069】
ELISA
ELISAを使用してhMSCsによるBDNF、NGF、bFGF、VEGFおよびHGFの分泌を、TBIおよび正常脳抽出物上清によりコンディショニングした培養の1、4および7日に測定した。簡単に説明すると、すべての試薬および作業標準は製造元により指示された通りに準備し、そして50〜150μlの標準またはアッセイ希釈溶液を96ウェルプレートのウェル毎に加えた。ウェルは穏やかに混合し、そして室温で2〜4
時間インキューベーションした。各ウェルを吸引し、そして洗浄し、このプロセスを3回繰り返した。最後の洗浄後、残るいかなるバッファーもウェルを吸引、またはデカントすることにより除去し、そして200μlの種々の増殖因子結合物を各ウェルに加えた。次いでプレートを室温で2〜4時間インキューベーションした。吸引および洗浄を繰り返した。200μlの基質溶液を各ウェルに加え、そして室温で15〜30分間インキューベーションした。50μlの停止溶液を加え、そして穏やかに混合した。各ウェルの光学密度は、450〜620nmに設定したマイクロプレートリーダーを使用して、30分以内に決定した。
【0070】
統計分析
スチューデントt検定を使用して刺激したサンプルとそれらの各対照との間の形態学的差異を評価した。時間応答の有意さは、分散の繰り返し測定分析により評価した(ANOVA)。ELISAデータは種々の増殖因子濃度の対数 対 光学密度の対数をプロットすることにより直線化し、そして最も合う直線を回帰分析により決定した。各標準、対照およびサンプルについて二重の読み取りの平均を作成し、そしてゼロ標準光学密度の平均を引いた。すべての値は平均±SDで表す。p<0.05を統計的に有意と考えた。
【0071】
結果
hMSCsの神経様細胞への形態的分化
位相差顕微鏡は、10%FBSを補充した完全DMEM中で培養した繊維芽細胞様hMSCsの正常形態を示す。7日間の暴露後、20%ノックアウト血清代替を含むノックアウトDEME中、いくらかの屈折性(refractive)細胞が短い突起を表した。わずかな細胞(全細胞〜2〜3%、表1)が、正常脳組織抽出上清で培養したhMSCs中でニューロン様細胞の形態を表した。しかし正常脳抽出物が誘導するhMSCs増殖(1.56×104±0.2×104/ml)は、20%ノックアウト血清代替を含むノックアウトDMEM中で培養したhMSCs(1.24×104±0.5×104/ml)に匹敵した(p<0.05)。多様な形態であるが、しかし典型的には長い分枝突起(突起長>10μm)および成長円錐様末端構造を持つ屈折性細胞(全細胞の〜13〜30%のニューロン様細胞、表)、および小さく、そして多極突起(multipolar process)を持つ星状細胞が20%〜40%TBI抽出上清中で培養したhMSCs中に検出された。TBI(1.08×104±0.3×104/ml)抽出物カルチャー中の全細胞数に関しては減少する傾向があったが、これは統計的に有意には至らなかった。種々の濃度のTBI組織抽出物のすべてが、hMSCsを形態学的に似ている神経様細胞に誘導した。
【0072】
hMSCsによる神経マーカーの発現
20%ノックアウト血清代替を含むノックアウトDMEMおよび10%、20%または40%のTBI脳組織抽出物カルチャーを含む中で7日後、hMSCsを免疫細胞蛍光法のために処理した。このhMSCsのDAPI(核の同定には紫青色)、FITC(緑色)での二重標識、またはCY5(赤色)の三重標識により、骨髄起源の細胞がニューロン(NeuN、Tuj−1)、星状膠細胞(GFAP)および小突起膠細胞(MBP)の神経特異的マーカーを発現するかどうかの決定が可能となった。細胞核はDAPIにより染色された。免疫反応性について染色したカルチャーでは、0.2〜0.5%のhMSCsがNeuNタンパク質を発現し、そして6〜10%のhMSCsがTuj−1表現型により標識された。NeuNおよびTuj−1免疫反応性は同じ細胞に同時に局在した(ピンク色)。4〜7%のhMSCs由来細胞がGFAP免疫反応性を発現した。3〜5%のhMSCs由来細胞がMBP免疫反応性を発現した。調査した種々の濃度のTBI抽出物のすべてが、hMSCsが神経の表現型の免疫反応性を発現することを誘導した。
【0073】
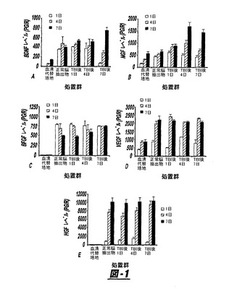
TBI組織抽出物上清で処置したhMSCsによる増殖因子の分泌
20%ノックアウト血清代替培地を含むノックアウトDMEMおよび20%のTBI抽出物上清を含む中で1、4および7日後、hMSCsにより分泌される増殖因子を図1に示す。正常脳およびTBI組織抽出物は、インビトロでhMSCsのBDNF(図1a)、NGF(図1b)、bFGF(図1c)、VEGF(図1d)およびHGF(図1e)の分泌に影響を与えた。正常脳組織抽出物は培地単独の対照と比較して、インビトロですべての検出される増殖因子について分泌を増加した。各実験群で、BDNF、NGFおよびHGF分泌は、TBI抽出物によるコンディショニングで1日から7日を通して増加した。VEGF分泌は正常脳およびTBI後の脳の群で同様であった。VEGF分泌は1日のカルチャー中よりも4日および7日間のカルチャー中で一貫して大きかった。bFGF分泌のプロフィールは、他の栄養因子とは異なった。1日の期間のカルチャー中でbFGFの分泌値は、他の増加因子とは異なり、4日および7日の値を越えるか、または等しかった。これらのデータはTBIがインビトロでhMSCsによるNGFおよびBDNFの分泌を促進することを表し、そしてすべてのニューロトロフィンおよび試験した増殖因子が、血清代用培地中のhMSCsに比べて正常脳中でのhMSCs分泌に有意な上昇を示した。
【0074】
考察
TBI抽出物で処置したヒト骨髄間質細胞は、形態学的に神経様細胞に分化し、そして大脳実質細胞の表現型のタンパク質を発現することができる。hMSCsはBDNF、NGF、bFGF、VEGF、HGFを分泌し、そして分泌レベルはカルチャー中のTBI抽出物への暴露時期およびTBI組織が抽出された時期の両方に依存する。
【0075】
データはhMSCsがインビトロでTBI組織抽出物に暴露されることにより、形態学的に神経様細胞の亜群に似るように仕向けられ得ることを示す。処置したhMSCsはNeuN(神経に)、Tuj−1(初期分化および神経突起の伸長に)、GFAP(星状膠細胞に)およびMBP(小突起膠細胞に)のような特異的な脳タンパク質マーカーも発現する。すなわちhMSCsは多くの細胞系統に分化できる。研究ではMSCsが試薬(Sanchez−Ramos et al.,2000;Woodbury et al.,2000;Deng et al.,2001)によりカルチャー中で、および損傷したCNS中で(Azizi et al.,1998;Kopen et al.,1999;Chopp et al.,2000;Li et al.,2000;Chen
et al.,2001;Lu et al.,2001b;Lu et al.,2001a;Mahmood et al.,2001)、ニューロン様細胞へ分化させられ得ることが報告された。このデータは初めて、幾らかのhMSCsがTBI組織抽出物を含む特異的な微小環境内にインビトロで置かれた時、脳実質細胞の形態学的ならびに表現型的特徴の推定により応答することを示す。治療用の移植で、これらの細胞はTBI傷害脳における細胞代替物の供給源を提供することができる。
【0076】
骨髄間質細胞は正常な造血に必要である。MSCsにより分泌される造血を媒介する多数の可溶性因子が特徴付けられた(Berezovskaya et al.,1995;Majumdar et al.,1998;Majumdar et al.,2000)。MSCsはIL−6、−7、−8、−11、−12、−14、−15およびFlt−3リガンドを生産し、そして定常状態レベルのM−CSF、G−CSF、GM−CSFおよびSCFを誘導する。しかしこれらの因子単独ではTBIのMSC処置の治療的利益の基になるメカニズムを提供しないようである。他の未だに未知の間質因子の存在が仮定された。ここに提示する実験において、定量的なELISAデータは、TBI組織抽出物で処置したhMSCが培養時期ならびにTBI組織抽出物が得られた時期の両方に依存する様式でBDNF、NGF、bFGF、VEGFおよびHGFを同時に分泌することを示している。BDNFの静脈内投与により、ラットにおけるTBI後の損傷容量は減少し、そして脳損傷におけるBDNFの神経保護的役割を支持する(Koliatsos e
t al.,1993;Bullock et al.,1999)。NGF注射後、またはNGF−生産繊維芽細胞を介して、およびNGFトランスジェニックマウスの神経保護的能力は、実験的な脳損傷の異なるパラダイムを証明した(Hefti,1986;Kromer,1987;Caneva et al.,1995;Gage,2000)。bFGFの静脈内投与はラット、マウスおよびネコを対象とした局所脳虚血のモデルにおいて、梗塞容量を減少させた(Sugimori et al.,2001)。血管新生の強力なプロモーターであるVEGFも、軸索伸長、神経細胞生存およびシュワン細胞増殖を刺激する(Sondell et al.,1999)。挫骨神経の挫壊損傷後のVEGF増加は、VEGFが神経再生に役割を果たしていることを示唆する(Sondell and Kanje,2001)。ラットの実験的発作をVEGFで処置すると、機能欠損が有意に減少する(Zhang et al.,2000b)。hMSCsはHGFを構成的に生産し(Takai et al.,1997)、そしてHGFは組織修復に重要な分子である(Mizuno et al.,2000)。したがってこの知見はhMSCsが正常な脳およびTBI環境に感受性であり、そして多くの因子の生産を有意に増加することにより応答することを強く示す。外傷的に損傷した神経組織に移植したMSCsの生存を仮定すると(Lu et al.,2001b;Lu et al.,2001a;Mahmood et al.,2001)、傷つけられた組織の局所レベルでのMSCsによる神経保護および血管新生因子の連続的および微小環境的応答分泌は、MSC移植により提供される機能的利益における鍵である。
【0077】
データは成熟(adult)MSCsが誘導されて、それらの間葉系拘束を克服し、そして種々の神経性疾患を処置するために豊富かつ接近可能な脳細胞的および分子的リザーバーを構成することができる。この結果は移植されたMSCsがTBI後の機能的利益を提供することを示す(Lu et al.,2001b;Lu et al.,2001a;Mahmood et al.,2001)。特にMSCsは患者自身の腸骨稜に由来する少量の骨髄から容易に得、そして培養で拡大することができる。したがってMSCsは移植用の自家細胞の容易に入手可能かつ補充可能な供給源を提供する。損傷した組織中のこれらの細胞は、損傷した能の修復および可塑性のために活力のある増殖因子の連続的供給源を提供する。
【0078】
図1は、TBI組織抽出物上清で処置したhMSCsからBDNF(図1A)、NGF(図1B)、bFGF(図1C)、VEGF(図1D)およびHGF(図1E)の成長因子の分泌を示す。この分泌はELISAで定量した。正常な能組織抽出物は、培地単独の対照に比べてインビトロで検出されたすべての増殖因子の分泌を増加させた。各実験群においてTBI抽出物でのコンディショニングで1日から7日にBDNF、NGFおよびHGF分泌が増加した。VEGF分泌は正常脳およびTBI後の脳群については同様であった。VEGF分泌は4日および7日間のカルチャー中で、1日目のカルチャー中よりも一貫して大きかった。bFGF分泌に関するプロフィールは他の栄養因子とは異なった。1日目のカルチャー中、bFGF分泌値は他の増殖因子とは対照的に、4日および7日の分泌値を越えるか、またはそれに等しかった。
【0079】
実施例2
方法:
ラットを一時的な中大脳動脈閉塞に供し、そして発作から1日後に3×106hMSCをIV注射した。機能的な成果を発作前および1、7および14日後に測定した。混合リンパ球反応および細胞傷害性Tリンパ球の発生は、hMSCの免疫拒絶を測定した。ヒト細胞核に特異的なモノクローナル抗体(mAb1281)を使用してhMSCを同定し、そして神経の表現型を測定した。ELISAはhMSC−処置または未処置ラットに由来する脳組織中のニュートロフィンレベルを分析した。ブロモデオキシウリジン注射を使用して新たに形成された細胞を同定した。結果:機能の有意な回復が虚血の対照ラットに比
べてhMSCで処置したラットに14日で見いだされた。わずか(1〜5%)なhMSCが脳実質細胞の表現型のタンパク質を発現した。脳由来神経栄養因子および神経成長因子は有意に増加し、そしてアポトーシス細胞は虚血境界領域で有意に減少し;ブロモデオキシウリジン反応性細胞がhMSCで処置したラットの虚血性半球の脳室下領域でより有意により多く検出された。hMSCは細胞傷害性Tリンパ球の誘導なしにリンパ球の増殖を誘導した。
【0080】
結論:
ラットの発作のhMSC処置から生じる神経学的利益は、虚血組織中の増殖因子の増加、損傷の半影領域のアポトーシスの減少、および脳室下領域中の内因性細胞の増殖からもたらされ得る。
【0081】
骨髄間質細胞(MSC;間葉系幹および前駆細胞とも呼ばれる)は多能性であり、しかもインビトロおよびインビボで組織の修復を補助することができる。MSCは通常、骨、軟骨および間葉系細胞で生じ、そしてMSCは筋細胞、肝臓細胞、グリア細胞およびニューロンに分化できる。MSCは血液脳関門を通過し、そして前脳および小脳全体に移動することができる。メスの虚血性ラットに全身的に注入されたオスに由来する骨髄細胞は、虚血性皮質に優先的に移動する。照射されたメスのマウスに投与されたオスのマウスの骨髄細胞は数日から数週間にわたり脳に入り、そしてミクログリアおよび星状膠細胞に分化する。
【0082】
発作後の成果を改善した神経保護薬はなかった。ラットにおける心筋虚血および心疾患のためのヒトMSC(hMSC)の治療的利益は、組織の置き換えおよび血管新生および脈管形成の誘導からもたらされると思われる。MSCは多数の増殖因子およびサイトカインを分泌し、これらは通常、造血前駆体が増殖し、そして分化することを支持する。骨髄はVEGFおよびbFGFを含む数種の血管新生増殖因子を分泌する種々の原始細胞を含む。このようにMSCは神経性疾患を処置するための価値ある治療に発展することができる。中大脳動脈閉塞(MCAO)のラットモデルでは、齧歯類MSCで処置した時、有意な機能的回復が証明された。
材料および方法。
【0083】
hMSC調製およびインビトロでの増殖キネティクス。インビトロでのhMSCの細胞増殖キネティクスおよび拡大を調査するために、骨髄吸引物を局所麻酔下で3名の健康なヒトドナーの後部腸骨稜の穿刺により得た。骨髄検体の単核細胞(1人あたり15〜16mL)をFicoll密度勾配(Ficoll−Paque、[密度、1.073]、ファルマシア、カリフォルニア州)で分離した。hMSCカルチャーの単離および樹立は、Digirolamo et al.により記載されているように行った。簡単に説明すると、単核細胞を1×106細胞/75cm2組織培養フラスコの密度で、20mLの低−グルコースダルベッコ改良イーグル培地(ギブコ−BRL、グランドアイランド、ニューヨーク州)にまき、そして20%のウシ胎児血清(ギブコ−BRL)、100単位/mLのペニシリン、100μg/mLストレプトマイシンおよび2ミリモル/リットルのL−グルタミンを補充した。72時間のインキューベーション後、非付着細胞をカルチャーから除去し、そして新たな培養基をフラスコに加えた。細胞増殖および細胞収量を評価するために、プラスチックに付着したhMSCを14日(90%の集密度)およびその後7日毎に分けた。有核骨髄細胞はサイトメーターを使用して計数して移植に十分な細胞数を確保した。3×106hMSC用量を各ラットに注射した。5継代目から回収し、そしてさらに20%のノックアウト血清代用培地(ギブコ−BRL)を含むノックアウトダルベッコ改良イーグル培地(無血清;ギブコ−BRL)で培養したhMSCを、ELISA測定に使用した(n=6)。hMSCによる脳由来の神経栄養因子(BDNF)および神経増殖因子(NGF)の分泌は、無血清ダルベッコ改良イーグル培地中で1、4および7日
に測定した。
【0084】
インビトロでのラット脾臓細胞とhMSCとの間の混合リンパ球反応。抗原が誘導するリンパ球の増殖を研究するために、健康なラットまたは2週間前に3×106hMSCを注射したラットに由来する2×105の脾臓細胞を3連で、照射(20Gy)hMSC有り、または無しで96時間、10:1の応答物(脾臓細胞)−対−刺激物(hMSC)比で培養した。混合細胞は3H−チミジン(0.25μCi/ウェル)で16時間、パルスをかけた。hMSCによる脾臓リンパ球増殖の誘導は、複製している脾臓細胞への3H−チミジンの取り込みにより測定した。カルチャーを自動化細胞回収機で回収し、そして3H−チミジンの取り込みを液体シンチレーションにより測定した。
【0085】
挿入式
インビトロでのhMSCに対するラット細胞傷害性Tリンパ球応答
Tリンパ球は移植片−対−宿主の致死的医原性疾患のイニシエーターとして関わっている。したがってヒトの移植片−対−ラット宿主T細胞応答を、51Crアッセイを使用して測定して溶解効果(lytic effect)を決定する。健康なラットの脾臓細胞または2週間前に3×106のhMSCを注射したラットの脾臓細胞を、照射hMSCと5日間、10:1の応答物(脾臓細胞)−対−刺激物(hMSC)比で培養した。インキューベーション期間の終わりに、生きている細胞をカルチャーから回収し、そして51Cr−標識hMSCに対する細胞傷害性について8時間の51Cr放出アッセイで試験した。
【0086】
動物MCAOモデル
成体のオスウィスターラット(体重270〜300g)を、チャールズリバーブリーデング社(Charles River Breeding Company)(ウィルミントン、マサチューセッツ州)から購入した。ラットは最初に3.5%ハロタンで麻酔をかけ、そしてフェイスマスクを使用して1.0%〜2.0%のハロタン(70%N2Oおよび30%O2中)で維持した。直腸温度はフィードバック調節温水システムを使用して、外科的手順の間を通して37℃に維持した。一過性のMCAOは、研究室で改良した血管内脈管閉塞(intraluminal vascular occlusion)の方法を使用して誘導した。右頸動脈、外頸動脈および内頸動脈を露出した。動物の体重により決定した長さの4−0のモノフィラメントナイロン糸(18.5〜19.5mm)を、その先端付近を焼炎加熱することにより丸くし、これを外頸動脈から内頸動脈の管腔へMCAの起点で遮断されるまで進めた。MCAOから2時間後、ハロタンで動物に再度麻酔をかけ、そして縫合糸をその先端が外頸動脈の管腔からとり除かれるまで引っ張ることにより再潅流を行った。
【0087】
実験群。
群1。
ニュートロフィンを測定するために、ラットは処置無しで(n=3)MCAOに供するか、または発作から1日後に1mLの全液体用量中に3×106MSC(n=3)または3×106肝臓繊維芽細胞(n=3)を尾の静脈に注射した。肝臓繊維芽細胞の実験は「対照」として限定され、ここで繊維芽細胞は対照細胞の宿主ラットに対する予期せぬ免疫応答を回避するために同種のウィスターラットから集めた。ラットはMCAOから7日後にニュートロフィンの測定のために屠殺した。3匹の健康なラットも対照個体として使用した。
【0088】
群2。
ラットは3×106hMSC(n=9)または3×106ラット肝臓繊維芽細胞(n=9;対照)を1日目に注射するMCAOに、あるいは細胞ドナー無しのMCAO単独(n
=10;対照)に供した。ラットは細胞の形態を測定するためにMCAOから14日後に屠殺した。MCAOは上衣および上衣下領域(脳室領域/脳室下領域[VZ/SVZ]とも呼ばれる)中の内因性の神経幹細胞および前駆細胞の増殖を誘導するので、群2の17匹のラットは細胞増殖を確認するために、ドナー細胞のIV注射有り、または無しでMCAO後から14日間、連続して毎日、ブロモデオキシウリジン(BrdU、新たに合成されたDNAを標識するチミジン類似体[50mg/kg];シグマ、セントルイス)の腹腔内注射を受けた。対照としてさらに2匹の健康な動物に50mg/kgのBrdUの腹腔内注射を毎日、14日間、死ぬ前まで与えた。
【0089】
行動試験。
すべての動物はMCAO前、およびMCAOから1、7および14日後に、実験群に対して知らされていない調査者による行動試験を受けた。前肢体性感覚不均斉を測定するために、小さい接着剤付きペーパードット(113.1mm2)を両側の触覚の刺激物として使用し、そしてホームケージ中、1日に5回の実験について各前肢の手首の橈側面に適用した。ラットの刺激物への接触および除去の時期を記録した。個々の実験は少なくとも5分間の間隔をあけた。動物は手術前に3日間、接着−除去ドット試験に慣らされた。いったんラットが10秒以内にドットを除去できれば、ラットをMCAOに供した。改良した神経学的重症度の採点(mNSS)を使用して、神経的機能の様々な観点を等級分けした。mNSSは運動(筋肉状態および異常な運動)、感覚(視覚、触覚および自己刺激感応性)および反射試験の複合である。
【0090】
【表1】

【0091】
改良した神経学的重症度の採点試験
虚血脳から抽出物の調製:
MCAOから7日後、群1のラットにハロタンで麻酔をかけ;脳を摘出し、そして虚血性半球を氷上で切開した。次いでサンプルを−80℃に保存した。続いて各組織サンプルを1g/mLのホモジネートバッファー中で均一化した。ホモジネートを4℃で10分間遠心し(10,000g)、そして上清を分泌を測定するために集めた。
【0092】
サンドイッチELISAを使用した増殖因子の分泌の測定
BDNF ELISAキットはR&Dシステムズ(ミネアポリス、ミネソタ州)から得、そしてELISAは製造元の指示に従い調製した。ELISA溶液はNGFについて作成した。抗−β(2.5S、7S)NGFモノクローナル抗体、抗−β(2.5S、7S)NGF−β−ゲルおよびNGF−β標準は、ロッシュモレキュラーバイオケミカルズ(インディアナポリス、インディアナ州)から購入した。簡単に説明すると、虚血性組織から集めた上清またはhMSCからの無血清培養基を、100−〜200−μLの3連サンプルに分割した。BDNFおよびNGFに対するモノクローナル抗体は、製造元の使用説明に従い使用した。続いて各1次抗体に対する2次特異的ポリクローナル抗体を加えた。発色基質とのインキューベーション期間の後、増殖因子の量に比例して発色し、そしてマイクロプレートリーダー(450〜620nm)を使用して測定する。
【0093】
組織学的、免疫組織化学的およびアポトーシス評価。
スライドの調製
MCAOから14日後まで生かした群2のラットを、形態学的分析に使用した。その時点で、ラットにケタミン(44〜80mg/kgを腹腔内に)およびキシラジン(13mg/kgを腹腔内に)で麻酔をかけ、そしてヘパリンを加えたリン酸緩衝化生理食塩水(PBS)、続いてPBS中の4%パラホルムアルデヒドを管系に経心臓的に潅流した。脳はPBS中の4%パラホルムアルデヒドに2日間浸し、そして次に脳組織を7つの等しい間隔(2mm)の皮質塊に切断した。組織を処理し、そして各塊から100μm厚の自由に流動するビブラトーム(vibratome)皮質スライド(1つの塊あたり5個のビブラトームスライド)を切断した。すべての残りの脳塊はパラフィンに包埋し、そして連続して隣接する6μm厚のスライドを切断した。
【0094】
梗塞容量の測定
7個の塊から各皮質パラフィンスライドの1つ(6μm厚)をヘマトキシリン−エオシン(H−E)で染色した。7個の脳スライドはGlobal Lab Image分析システム(データ トランスレーション(Data Translation)、マルボロ、マサチューセッツ州)を使用して追跡した。間接的な損傷領域(ここで同側半球の完全な領域を反対側半球の領域から引く)を算出した。損傷容量は反対側半球と比較した損傷容量の割合として提示する。
【0095】
免疫組織化学染色。
正常血清でブロッキングした後、すべてのビブラトームスライドはPBS中で1:100に希釈したヒト核に特異的なモノクローナル抗体(mAb1281;ケミコン(Chemicon)、テメキューラ、カリフォルニア州)で4℃にて3日間処理した。マウスIgGに対するフルオレセインイソチオシアネート−結合ウサギ抗体(希釈、1:100、ダコパッツ、カリフォルニア州)との順次インキューベーション後、2次抗体をmAb1281に対する1次抗体に結合させた。hMSCに由来する細胞は形態学的基準およびドナー細胞に存在するが実質細胞には存在しないmAb1281での免疫組織化学的染色を使用して同定した。同じ細胞中でmAb1281および細胞型に特異的なマーカーの、細胞性同時局在を視覚化するために、二重染色を虚血中心部が中央にある連続参照ビブラトームスライド(100μm)に使用した(ブレグマで座標を取る−1.0、1.0mm)。各皮質スライドを第1の1次抗体、mAb1281で上記のように処理し、そして次にシアニン−5.18に結合した細胞型に特異的な第2の1次抗体(カルビオケム(calbiochem)、カリフォルニア州)で4℃にて3日間処理した:神経核抗原(神経核用のNeuN[希釈、1:200];ケミコン)、微小管−結合タンパク質2(神経樹状突起用のMAP−2[希釈、1:200];シグマ)、グリア繊維酸性タンパク質(星状細胞用のGFAP[希釈、1:1000];DAKO、カルピンテリア、カリフォルニア
州)およびvWF(内皮細胞用[希釈、1:400];DAKO)。各動物に関する陰性対照スライドは、免疫組織化学染色については1次抗体を省略した点を除き同一の調製を受けた。
【0096】
レーザー走査共焦点顕微鏡。
皮質のビブラトームスライドは、ツァイス(Zeiss)顕微鏡(バイオ−ラッド、ケンブリッジ、マサチューセッツ州)に乗せたバイオ−ラッド(Bio−Rad)のMSC1024(アルゴンおよびクリプトン)レーザー走査共焦点撮像システムで分析した。免疫蛍光標識スライドには、スライド上の緑(フルオレセインイソチオシアネート)および赤(シアニン−5.18)フルオロクロムを488nmおよび647nmのレーザービームにより励起し、そして発光を522nmおよび670nmの発光フィルターを通す光電子倍増管を用いて順次獲得した。mAb1281陽性細胞の総数は、全7個の塊に由来する各塊について5枚の連続スライド(100μm厚)を、細胞計数用のXYZステージエンコーダーを使用することにより測定した。26 次いで全前脳のmAb1281−陽性細胞の総数は、すべての7個の塊からmAb1281−陽性細胞数を合わせることにより算出した。動物あたり全部で500個のmAb1281−陽性細胞を計数して、細胞型に特異的なマーカー(NeuN、MAP−2、vWFおよびGFAP)と同時に局在するmAb1281−陽性細胞の割合を二重染色により得た。
【0097】
アポトーシス細胞染色。
ブレグマ−1.0に位置する上記の参照塊に由来する5枚の皮質パラフィンスライド(6μm厚;25−μm間隔)、1.0mmをアポトーシス細胞分析に使用した。これらのスライドはin situアポトーシス細胞検出のために、ターミナルデオキシヌクレオチジルトランスフェラーゼが媒介するdUTP−ビオチンニックエンド−ラベリング(TUNEL)法により染色された(ApopTag キット;オンコール(Oncor)、ゲチスバーグ、メリーランド州)。PBS中のH2O2で内因性のペルオキシダーゼ活性を消した後、スライドをターミナルデオキシヌクレオチジルトランスフェラーゼの中に置いた。抗−ジゴキシゲニン−ペルオキシダーゼをスライドに加え、そしてペルオキシダーゼを3,3’−ジアミノベンジジンで検出した。TUNEL染色後、スライドをメイヤー(Mayer)のヘマトキシリンでカウンター染色した。陰性対照スライドは各塊から行った。TUNEL調製物では、暗く茶色いアポトーシス体(>2)を含む細胞のみをアポトーシス細胞とした。
【0098】
図2は、右半球を3つのサブ領域(虚血中心部、虚血境界領域およびVZ/SVZ)に分割したラット脳の前交連のレベルで同定された標準的な皮質区画を表す。外因性のhMSC(mAb1281)で、同側および反対側半球のこれらの領域の細胞型陽性細胞(NeuN、MAP−2、GFAPおよびvWF)、およびアポトーシス細胞(TUNEL−陽性細胞)について測定した。日常的なH−E染色の組織的特徴を使用して3つの領域を同定した:虚血損傷の虚血中心部(エオシン好性バックグラウンドの拡散蒼白)および内側(神経網の空胞化または海綿状)および外側境界領域(海綿状から全体的に完全な組織[ほとんどの細胞が完全であった;しかし散乱した損傷および死んだ細胞も観察できた])、ならびに細胞の形状および染色能における改変。図2は処置に対する応答を分析するために、右半球を3つのサブ領域(虚血中心部[IC]、虚血境界領域[IBZ];および脳室領域/脳室下領域[VZ/SVZ])および8つの場(1、IC中の皮質;2、IC中の線条;3−4、IBZ中の皮質;5−6、IBZ中の線条;および7−8、VZ/SVZ中の線条)に分割したラット脳の前交連のレベルで同定された標準的な皮質区画を示す。
【0099】
統計分析
すべての測定は盲検的に行った。行動の採点(接着−除去ドット試験およびmNSS)
は正常について評価した。反復測定分析を行って行動の採点に及ぼす処置の効果を試験した。分析は0.1の有意さレベルで処置−時間の相互関係について試験することから始まり;全体の処置効果についての試験は、0.05の有意さレベルで相互関係が検出されない場合に行った。0.1の有意さレベルでの処置−時間の相互関係または0.05の有意さレベルでの全体的処置効果が存在するならば、各時点で各々の行動の採点に及ぼす処置効果のサブグループ分析を有意さレベル0.05で行った。あるいはサブグループ分析は予備的と考えた。損傷容量および細胞数という意味で、スチューデントt検定を使用して対照群と処置群との間の差異を評価した。ELISAデータはBDNFおよびNGF濃度の対数 対 光学密度の対数をプロットすることにより直線化し、そして回帰分析により最も合った直線を決定した。各標準、対照およびサンプルについて二連の読み取りの平均を作成し、そしてゼロ標準の光学密度の平均を引いた。処置および対照群の間の差異を試験するために、平均(SD)およびp値を提示する。
【0100】
結果。
インビトロでのhMSCの増殖動力学
3名の健康なヒトドナーからの骨髄由来hMSCを、培養拡大により試験した。初代培養では、hMSCは形態学的に均一な繊維芽様細胞群に成長した。通常7日の間隔でその後の継代中、hMSCは密に詰められた螺旋状細胞の一巻として成長した。5週目の終わりに(4継代)、hMSCは5.4から6.6×107細胞の間の範囲になった(表2)。
【0101】
【表2】

【0102】
インビトロでラット脾臓細胞とhMSCとの間の混合リンパ球反応および細胞傷害性Tリンパ球応答は、非刺激脾臓細胞に比べてhMSCが健康なラット脾臓細胞の増殖を有意に増加させた(刺激指数=18.8)(図2A)。hMSCを注射したラットに由来する脾臓細胞の増殖も、インビトロでhMSCを用いて再刺激した後に増加した(刺激指数=15.6);しかしこれらの細胞の増殖応答は健康なラットの脾臓細胞中と有意に異なら
なかった。これらのデータはhMSCがラット脾臓リンパ球に1次増殖応答を誘導でき、hMSCのラットへの投与は2次的なインビトロ増殖応答についてリンパ球をインビボで感作できないことを示す。
【0103】
図8Aはラット脾臓細胞とヒト骨髄間質細胞(hMSC)との間の混合リンパ球反応を示す;2×105の健康なラット脾臓細胞(N−Spl)または2週間前にhMSCでIV処置したラットからの脾臓細胞(T−Spl)を3連で、照射した(20Gy)hMSCを含んで、または含まずに96時間、10:1の応答物:刺激物比で培養した。カルチャーは3H−チミジン(0.25μCi/ウェル)で16時間パルスをかけ、そして自動化細胞回収機で回収した。3H−チミジンの取り込みを液体シンチレーションにより測定した。hMSC−処置と未処置ラットから得た脾臓細胞の間に差異は観察されなかった。SI=刺激指数。(B)ラット脾臓細胞(1×107)は、1×106照射(20Gy)hMSCと5日間培養した。インキューベーション期間の終わりに、生きている細胞をカルチャーから回収し、そして51Cr−標識hMSCに対する細胞傷害性について、8時間の51Cr−放出アッセイにてエフェクター:標的(E:T)比で試験した。ラット脾臓細胞はhMSCに応答する細胞傷害性Tリンパ球を生じなかった。すべての値は平均±SDとして表す。図8Bは、刺激物(hMSC)と共に、または無しでインキューベーションした健康なラット脾臓細胞による<4%の標的細胞(hMSC)の溶解(lysis)を示す。同様に、hMSCの投与によりインビボで脾臓細胞をプライムし、続いて培養中5日間、hMSCを用いた再刺激では、それらに細胞傷害性を誘発することはできず、hMSCがラットの脾臓細胞に細胞傷害性Tリンパ球応答を誘導できないことを示す。
【0104】
神経学的機能試験。
発作から14日後に、接着−除去ドット試験(p<0.05;図3A)およびmNSS試験(p<0.05;図3Bを参照にされたい)により示された機能的回復は、MCAOのみに供された対照ラットおよび3×106ラット肝臓繊維芽細胞を注射したラットに比べて、MCAOから1日後に3×106hMSCを注射したラットで見いだされた。
【0105】
図3は、中大脳動脈閉塞(MCAO)前後の行動的機能試験の結果を示す(A:接着−除去ドット試験;改良された神経学的重症度の採点[mNSS]試験)。ラットを2時間のMCAOのみ(n=10)に供するか、または培養したヒト骨髄間質細胞(hMSC)(n=9)またはラット肝臓繊維芽細胞(LC;n=9)をMCAOの1日後に注射した。有意な機能的回復は、対照個体と比較してhMSCで処置したラットで検出された。白丸=MCAO;黒丸=+LC;三角=+hMSC。
【0106】
サンドイッチELISA定量
サンドイッチELISA法を使用して、BDNF(969±198pg/mL対434±59pg/mLおよび498±76pg/mL)およびNGF(1,227±111pg/mL対834±123pg/mLおよび980±55pg/mL)の分泌レベルは、細胞処置無しでMCAOのみから7日後の動物およびラット肝臓繊維芽細胞で処置したラットに比べて、hMSC処置ラットの虚血半球で増加した(p<0.05)。インビトロのデータは、hMSCがBDNFおよびNGFを時間依存的様式で分泌することを示す。BDNFおよびNGFにおける有意な上昇は、1日に比べて4および7日の培養で無血清培地中に検出された(表3)。
【0107】
【表3】

【0108】
形態学的分析。
2時間のMCAOに供したラットに、虚血から1日後に3×106hMSCを注入し、そして形態学的分析のためにMCAOから14日後に屠殺した。H−Eで染色した皮質スライド内に、暗く、そして赤いニューロンがhMSC注射を含む、または含まないMCAOに供したすべてのラットの虚血中心部で観察された。虚血傷害の容量における有意な減少は、MCAOのみ(36.3%±10.5%)に供した対照ラット、またはMCAOから14日後にラットの肝臓繊維芽細胞を注射したラット(34.6%±9.1%)に比べて、hMSC−処置ラット(損傷容量、33.3%±7.6%)で検出されなかった。
【0109】
脳組織内で、hMSCに由来する細胞はヒト特異的抗体mAb1281により同定される丸から卵形の核を特徴とした。hMSC(124×103±46×103;3×106hMSCの4%)が生き残り、そして受容マウスの虚血性傷害脳全体に分布した。mAb1281反応性細胞は皮質および線条を含む同側半球の多くの領域で観察されたが、最も
多くのmAb1281で標識されたhMSC(全124×103±46×103の60%)が虚血境界領域に位置した。数個の細胞が反対側半球でも観察された(9×103±2×103;3×106hMSCの0.3%)。
【0110】
二重染色免疫組織化学では、使用した神経マーカーに反応性のmAb1281陽性細胞はほとんど無いことが明らかになった。NeuN、MAP−2、GFAPおよびvWFを発現するmAb1281標識hMSCの割合は、1%、1%。5%および2%であった。レーザー走査共焦点顕微鏡画像は、ヒトの核mAb1281(hMSC同定については緑)とNeuN、MAP−2、GFAPまたはvWF(細胞型特異的マーカーについては赤)に対して特異的なモノクローナル抗体の受容体ラット脳中での同時局在化を示した(図4、aからh)。ほとんどのmAb1281陽性細胞は管の回りを取り囲むが、実質に局在する細胞はほとんどない。
【0111】
図9はラット脳中の外因性ヒト骨髄間質細胞(hMSC)および内因性脳細胞の形態学的特徴を示す顕微鏡写真である。二重免疫蛍光染色を使用して、mAb1281(ヒト核に特異的なモノクローナル抗体)−反応性細胞が脳の傷害を受けた領域に存在した。レーザー走査共焦点顕微鏡画像は、mAb1281(hMSC[a、c、d、f−h]については緑)、神経核抗原(NeuN)(b、c)、微小管−結合タンパク質2(MAP−2)(e、f)、グリア繊維酸性タンパク質(GFAP)(g)およびvWF(h)(細胞型特異的マーカーについては赤)を受容体ラット脳内に示した。尺度の棒=50μm。
【0112】
TUNEL(図7、a、cおよびd)、およびH−E染色(図7bを参照にされたい)を使用して、典型的な焦げ茶色の丸い、または卵形のアポトーシス体を持つアポトーシス細胞を虚血境界領域で計数した。参照皮質の6μm厚切片内で測定されたアポトーシス細胞数は、MCAOのみから14日後の動物または肝臓繊維芽細胞で処置した虚血性ラットと比較して、hMSC処置ラットの虚血境界領域で減少した(38.5±3.4対82.6±3.8または76.4±6.8;p<0.05)。
【0113】
図7は、アポトーシス細胞(a:ターミナルデオキシヌクレオチジルトランスフェラーゼが媒介するdUTP−ビオチンニックエンドラベリング[TUNEL]−陽性細胞[矢印];b:ヘマトキシリン−エオシン[H&E]染色)が、中大脳動脈閉塞(MCAO)のみの後に虚血境界領域に存在することを示す。減少したアポトーシス細胞(d:青−ヘマトキシリン−カウンター染色細胞のより多い生存;矢頭)は、肝臓繊維芽細胞を注射したラット(c)に比べてヒト骨髄間質細胞(hMSC)を注射したラットで検出された。ブロモデオキシウリジン(BrdU;新たに合成されたDNAのマーカー)−陽性細胞(矢印)は、健康な脳の脳室領域/脳室下領域(VZ/SVZ)にはほとんど存在しなかった(e)。増加したBrdU−陽性細胞は、MCAOのみに供したラット(f)および肝臓繊維芽細胞を注射したラット(g)の同側半球のVZ/SVZに検出された。BrdU−陽性細胞の有意な増加は、肝臓細胞処置を含むか、または含まないMCAOに供したラットに比べて、hMSC(h)で処置したラットのVZ/SVZで検出された。尺度の棒=15μm。
【0114】
BrdU−陽性細胞はVZ/SVZにほとんど存在しなかった(図7、eからhを参照にされたい)。有意により多くのBrdU−反応性細胞が、MCAOのみに供したラット(図7f)または肝臓繊維芽細胞で処置したラット(図7gを参照にされたい)よりも
hMSC処置を含むMCAOに供されたラットの同側半球のVZ/SVZで検出された(図7hを参照にされたい)。ブレグマ−1.0 1.0mmに位置する標準参照切片から5枚の皮質パラフィンスライド(6μm厚;25μm間隔)を、BrdU反応性細胞分析に使用した。hMSC処置を含むMCAOに供されたラットのVZ/SVZ中のスライドあたりBrdU−陽性細胞の数(95.3±24.1)は、MCAOのみに供したラット
(27.5±18.5)または肝臓繊維芽細胞で処置した虚血ラットのVZ/SVZ(37.8±11.2)よりも有意に高かった。発作から14日後、hMSC処置を含むMCAOに供したラットは、MCAOのみに供したラットまたは肝臓繊維芽細胞で処置したラットよりも、スライドあたり多数のBrdU陽性細胞が、NeuN(2.5±0.4対0.5±0.6または0.6±0.4;p<0.05)およびGFAP(4.4±2.3対1.4±1.1または1.7±0.5;p<0.05)を発現した。
【0115】
考察。
発作から1日後のhMSCのIV注射は、MCAOのみに供したラットまたは肝臓繊維芽細胞を注射したラットに比べて、体性感覚採点およびmNSSに従い機能的成果を有意に改善した。この利点はラットにおいて、発作後に傷害を受けた実質細胞の修復を促進できるニュートロフィンを含む増殖因子の生産に影響を及ぼし、虚血境界領域のアポトーシスを減少し、そしてVZ/SVZ中の内因性神経幹および前駆細胞の増殖および分化を強化することができる。
【0116】
神経移植片は脳傷害に伴う機能的欠損を逆転した。本発明のヒト移植片−対−ラット宿主データは、照射した動物7に永久的なMCAOおよび非照射動物にMCAOを一時的に2時間発生させた後の損傷部位に対して、IV移植した自家骨髄細胞の優先的ホーミングを示す他の研究からの知見と一致する。形態学的分析では、hMSCが虚血性傷害を受けたラット脳に選択的に移動する能力を有することを示す。hMSCは生き残り、そして分散した幾つかが実質脳細胞のタンパク質マーカーを発現する。
【0117】
hMSCは失ったニューロンを交換する能力を有することができるが、治療的利益を提供するメカニズムは多面的であるらしい。データでは発作から1日後の3×106hMSCの注射が、投与から7および14日後の未処置ラットに比べて(p<0.01)、体性感覚採点およびmNSSに従う機能的成果を改善することを示す。しかしhMSCのわずか1%、5%および2%がすぐに完全な細胞分化および組織へ一体化される神経、星状膠および内皮細胞タンパク質を発現するだけである。したがってより短期的利益のメディエーターは、hMSCが虚血境界領域中に残るニューロンの機能的回復を促進し、そしてアポトーシスを減らす多数の増殖因子で傷害を受けた組織を補充することであるらしい。MSCは虚血性の傷害を受けたニューロンの可塑性を促進し、またはグリア細胞がニュートロフィン(例えばBDNFおよびNGF)を分泌することを刺激することに直接関与することができる。hMSCと宿主脳との相互作用はhMSCおよび実質細胞が豊富な栄養因子を生産することを導くことができ、これが損傷の結果として失った機能の回復に貢献する。30,31この研究においてサンドイッチELISA法を使用して、BDNFおよびNGFの分泌レベルは、細胞処置無しのMCAOのみから7日後の動物、および肝臓細胞処置を行ったラットに比べて、hMSC−処置ラットの虚血半球で有意に上昇したことが示される。虚血脳におけるBDNFおよびNGFの存在を測定したが、他の増殖因子(血管新生因子VEGF32およびHGF33のような)が、血管新生を増すことにより少なくとも部分的に機能回復を改善できる可能性は排除されなかった。血管新生は発作からの改善された神経的回復と関連する。
【0118】
MSCは低分子「工場」として行動する。これらの細胞は多くのサイトカインおよび栄養因子を生産する。それらはまた長期間にわたりこれらの因子を分泌し、そして単回のボーラス投与ではない。MSCは造血に役割を果たすことが知られている多くのサイトカインを発現し、そしてまた骨髄微小環境自体の細胞に影響を及ぼすオートクリン、パラクリンおよびジャクスタクリン因子も供給する。大脳組織中のMSCはこれらの因子を発現しているらしく、そして機能の回復を迅速かつ効率的に促進することがこれらサイトカインおよび栄養因子が脳組織に及ぼす効果である。これらの細胞は異なるイオン的微小環境下(例えばカルシウム)で培養した時、増殖因子の発現を調整することによりイオン的微小
環境の信号(cue)に応答する。これは損傷した組織中の細胞が組織の必要性に滴定された(titrated)栄養および増殖因子を発現することを示唆している。脳での発作のMSCを用いた処置では、特異的因子の単回の局在化注射とは明らかに対照的に、種々の栄養因子およびサイトカインが解剖学的に分布され、組織感受性で、しかも一時的に進行する様式で生産される。
【0119】
神経幹細胞はVZ/SVZ内に存在し、そしてこれらの細胞は発達している脳内でそれらの運命に移行する。健康な成人の脳では、前脳のニューロン生産の欠如は適切なニューロン前駆細胞の欠如に影響せずに、むしろ有糸分裂後の栄養および移動サポートの持続的(tonic)阻害および/または欠如に影響する。この実験はBrdU反応性細胞は、MCAOのみに比べてhMSC処置を含むMCAO後のVZ/SVZで増加し、IV注射したhMSCは内因性の脳細胞が増殖し、そして虚血傷害を受けた脳の修復への参加を刺激することを示唆する。これらの知見はラット由来のMSCのIV投与を使用して得た結果と一致する。
【0120】
hMSCのラット中へのIV移植は、インビトロで混合リンパ球反応により測定した時、ラットをhMSCに対して感作しない。同様に健康なラットまたはhMSCを注射したラットの脾臓細胞はhMSCに対する細胞傷害性T細胞応答、外来臓器/細胞移植の拒絶に関わる機能的免疫応答を生じることができない。これらのデータはラットによるhMSCの免疫学的拒絶が発作の処置としてhMSCを試験することと関係しないことを示唆する。潜在的に、そしてより重要なことは、ラット脾臓が注射したhMSCに対する感度をほとんど示さないか、または感度が無いことである。hMSCが強力な免疫応答を誘導できないことは、主要組織適合性遺伝子複合体(クラスIおよびクラスII)および同時刺激(CD40、CD80およびCD86)分子の発現が無いか、またはほとんど無いために、これら細胞の弱い免疫原性と関連している可能性がある。さらにhMSCは異種移植の拒絶に関与する免疫応答の発生をダウンレギュレートする可溶性メディエーターも分泌することができる。これらのデータは、MSCの同種細胞−付着群の免疫原性を調査するさらなる実験を要求する。
【0121】
データはIV投与したhMSCが発作から2週間後に神経学的機能の回復を促進することを示す。hMSCは選択的に大脳虚血領域に入る。hMSCと虚血脳との間の相互関係はニューロトロフィンの分泌を強化し、これが虚血境界領域におけるニューロンのアポトーシスを減少させ、そして虚血脳中の比較的完全なSVZからの細胞増殖を促進することができる。しかしSVZから始まる細胞が虚血脳に移動し、一体化されるかどうかは決定されなかった。CNSでは神経損傷の効果的処置が、大脳循環のリモデリングを含む内因性の補償機能の活性化を要求することができ、その正確なメカニズムは不明である。MSCが誘起する神経欠損の減少の元にあるメカニズムの解明ならびに長期の治療的利益の証明により、hMSCが発作、そして恐らくは広い多数のヒトの神経学的障害の強力な分子および細胞治療を提供することができる。
【0122】
実施例3
神経損傷の処置:前臨床プロトコール
MSCが発作後の機能的回復を促進するという仮定の調査において、出願人は前臨床細胞治療プロトコールを実施するための様々な選択に直面した。中でも取り組むべき問題は、何時そして何処に細胞を移植するかということである。関心は修復治療であるので、虚血損傷のサイズが効果的な修復治療により改変しないと仮定して、出願人は最初に動物を発作から1日以上後に処置することを選んだ。31,32この時期は臨床的に合理的である。欠損が発作から1日持続する場合、この出来事は発作と分類され、そして一過性の虚血性攻撃とは分類されない。1日で患者は安定し、そして神経欠損の重症度を容易に評価することができる。
【0123】
最も直接的な細胞の脳への配置経路は、外科的移植を介する。細胞は損傷内に、健康な非虚血性組織内に、または境界領域内に配置されるべきであるか?脳の観察を引き出して、特に発生状態における損傷の境界領域を考慮して、初期の実験で出願人は境界組織内にナイーブな全骨髄細胞を配置することを選んだ。32すなわち細胞はドナーのラットから抽出し、そして外科的および定位的に皮質下および皮質組織内の虚血損傷の境界領域に移植した。31−33試験すべき主な仮定は、これらの細胞が機能的回復を促進するかであり、そのような神経学的および機能的試験を動物で行った。完全な神経学的調査(表1)を行った。この調査、改良された神経学的重症度の採点(mNSS)は、運動指数、感覚反射および筋肉状態を提供する。34−38加えて出願人は体性感覚試験を使用し、この試験は足の平から粘着性のタブの除去39、およびラットが加速して踏み車を持続する時間を測定する運動協調性試験40を含んだ。測定は発作前およびその後7および14日に行った。31動物を14日に屠殺し、そして移植した細胞を組織学により大脳組織で探した。この組織学的分析で扱う1つの疑問は、MSCが脳の実質細胞に分化するかどうかであった。同様な実験を中大脳動脈の塞栓性閉塞に供したマウスで行い、そしてドナーマウスからのナイーブな全骨髄細胞の脳内移植で処理した。機能的測定は移植から28日後に行った。注目すべきかつ迅速な機能的回復は、これらの細胞を虚血損傷の境界内に配置した後にあった。パーキンソン様損傷を1−メチル−4−フェニル−1,2,3,6−テトラヒドロピリジンで誘導したマウスの線条へのMSCの実質内移植の同様な実験では、運動機能の有意な回復が示された。42同様にMSCを脊髄の挫傷に隣接して移植し、そして有意な機能的利益が明らかであった。
【0124】
これら実験の変動により、MSCと脳由来神経成長因子のような栄養因子の同時投与が機能的回復を促進し、そしてこれら細胞の増殖因子中での前培養が機能的利益ならびに脳細胞表現型タンパク質を発現する細胞数の増加を助長することが示された。カルチャー中の細胞の脳の環境への順化は、インビトロからインビボへの移行を容易にすると思われる。多くの移植された骨髄細胞が虚血脳中でアポトーシスを受けた。したがって出願人は骨髄細胞をZ−Val−Ala−DL−Asp−フルオロメチルケトン(Z−VAD)、カスパーゼインヒビターと同時投与した。この仮定は確認された;アポトーシス細胞の数は有意に減少し、そして運動協調性試験で測定した機能は利益の増加を示した。このように細胞治療でも併用療法が所望の成果を改善することができる。
【0125】
類似の治療的介入が、外傷性脳損傷、脊髄損傷およびパーキンソン病の動物モデルで効果的であった:すべての3つのモデルで、MSCの外科的移植により神経学的欠損の有意な減少があった。治療的利益は移植から数日以内で明らかになった。しかしわずか1〜3%の細胞が実質細胞の表現型のタンパク質を発現しただけであった。そのようなタンパク質を発現する細胞の比率は前培養で増加させることができたが、移植された細胞数は中大脳動脈の閉塞後に梗塞した半球脳組織の量に比べてわずかである(大体40%)。閉塞から14日後、約50,000個の細胞(SE18000)、すなわち移植した400,000個の12.5%が生存し;少ない割合が神経タンパク質を発現し、少なすぎて梗塞組織を交換できない。
【0126】
これらの細胞の脳への直接移植の成功は、侵襲性が低い血管経路の投与を試験する実験を促した。ラットを中大脳動脈の閉塞に供し、そして虚血損傷がある半球に対して同側の頸動脈に細胞注入のためのカニューレを挿入した。約2百万個のMSCを発作から1日後に注射した。一連の神経学的試験は処置の前後で行った。組織学的分析では少量の細胞が実質細胞の表現型のタンパク質を発現することが示された。しかし有意な機能的利益が明らかであった。出願人は外傷性脳損傷を処置するためにMSC投与の動脈経路の可能性も試験した。頸動脈経路を介して投与した時、細胞は脳に入ったが、恐らく投与経路が内部頸動脈の連結を要し、外傷性脳損傷を悪化させる低潅流を負わせるので、機能的利益は無
かった。
【0127】
次に出願人は、より臨床的に直接関連する静脈内の投与経路の可能性を調査した。この取り組みは頸動脈または直接的な組織注射よりも明らかに侵襲性が低く、そして悪影響も少ない。静脈経路は多回および長期の細胞処置にも利用が可能である。
【0128】
他では静脈内に注射された細胞が脳へ入って行く道を見いだすことが示された。しかし発作または外傷のような損傷内で、静脈内注射した細胞が虚血損傷の部位に選択的に移動し、そして機能的利益を促進することを示す研究はなかった。したがって出願人はこの仮説を中大脳動脈の閉鎖に供したラットで試験した。発作から1日以上後、1〜3百万個のMSCを尾静脈に注射した。出願人は一連の神経学的成果の測定(表1)を行った。発作から1日後に細胞を投与した動物は、発作から14日後に屠殺し(図1)、そして発作から7日後に処置した動物は35日に屠殺した。以前の実験のように、新たな細胞の生成を示すために細胞をブロモデオキシウリジン(新たに合成されたDNAのマーカー)で標識した。またオスのラットからのMSCをメスの動物に注射し、そして細胞をY染色体に対するin−situハイブリダイゼーションにより同定した。処置した動物は処置により有意な機能的改善が示された(図2)。改善された機能の促進における細胞型の特異性について試験するために、細胞の対照群も使用した。死んだMSCおよび肝臓および肺の繊維芽細胞(非実質細胞対照として)は治療的利益を示さず、そしてリン酸緩衝化生理食塩水対照よりも良くなかった。このように静脈内経路は発作および外傷後に有意な機能的改善を提供する。これは発作から7日後に開始する処置にもあてはまり、そして機能的利益はオスおよびメスのラットで同様であった。
【0129】
ヒトの試験条件により詳細に似せるために、ラットMSCではなくヒトの骨髄間質細胞をドナー細胞群として使用する。ヒト細胞は局所麻酔下で健康なドナーの後部腸骨稜の穿刺により抽出した。骨髄抽出物(15〜16mL)の単核細胞を分離した。3百万個のヒトMSC用量を各ラットに閉塞または外傷性脳損傷から1日後に静脈内注射した。強力な機能的改善が発作および外傷後の両方で見いだされた。ヒト細胞はドナーから簡単に得た。それらは容易に大変多数に拡大することができ、そして抗体をフローサイトメトリーまたは磁気細胞ソーティングによる分離のために利用することができる。ヒトMSCは癌および多発性硬化症の患者を処置するために使用されてきた。すなわちヒトにおける安全性のデータは入手可能である。
【0130】
出願人はいかなる免疫拒絶の兆候も観察しなかった(公開していない考察)。未処置ラットおよびヒトMSCで処置した動物の脾臓を摘出し、そしてヒトMSCと培養した。ヒトMSCを注射したラットに由来する脾臓細胞の増殖は、これらの細胞でインビトロにて再刺激した後に増加した;しかし増殖応答は未処置ラットに由来する脾臓細胞の応答と有意に異ならなかった。すなわちヒトMSCはラット脾臓リンパ球に1次的増殖応答を誘導することができるが、これらの細胞のラットへの投与はインビトロでの2次的な増殖応答についてインビボでリンパ球を感作しない。Tリンパ球は移植片−対−宿主疾患のイニシエーターとして関与する。したがってヒト移植片に対するラット宿主T細胞の応答は、溶解効果を評価するための標準的なクロム−51アッセイで測定した。ヒトMSCはラット脾臓細胞に細胞傷害性−T−リンパ球応答を誘導しなかった。出願人は齧歯類とヒトがMSC処置に対して異なって応答し得る可能性を排除できない。しかし別の可能性は、ユニバーサル細胞、同種細胞および自己ではない細胞を患者を処置するために使用することができるということである。明らかにヒトにおいてより多くのデータが、この仮定を試験するために必要である。初期の臨床的応用は自家移植を必要とするだろう。
【0131】
これらの細胞をどのように損傷の部位に標的とさせるか、およびそれらがどのように利益を提供するかを含め、取り組まなければならない多くの問題がある。細胞はどのように
して行くべき場所を知るのか?どのメカニズムがこれらの細胞を損傷部位に特異的に標的させるのか?しかし最も興味深い問題は細胞が脳に及ぼす効果、およびこれらの効果がどのように治療的利益に翻訳されるのかである。
【0132】
大脳損傷部位へのMSCの標的化
静脈内注射された細胞はどこへ行くのか?最初に、注射された細胞を、それらが組織中で同定できるようにするために印を付けなければならない。MSCは種々の標識に反応性の抗体により同定することができる。MSCはブロモデオキシウリジンで標識することができる;オスに由来する細胞をメスの動物に注射し、そしてin−situハイブリダイゼーションによりY染色体を同定することができる;あるいはヒト細胞をラットに注射し、そしてヒト抗原に対する抗体を使用することができる。静脈内に注射された細胞は肝臓、腎臓、脾臓および骨髄内に見いだされた。しかし最も確認されたMSCはこれらの器官内で微血管を囲み、実質に局在する細胞はほとんど無い。大変わずかな細胞(処置から14〜35日後に、3百万個の注射されたMSCの1.5〜3.0%)が脳組織の実質に検出された。損傷した脳では、発作後または外的損傷後であろうとも、ほとんどの細胞が損傷の領域を標的とした。例えば発作後、80%より多くの細胞が影響を受けた半球内にあり、これら細胞のほとんどが損傷の回りの領域内に集まった。多くの細胞が血管に隣接またはその中にも存在した。細胞はどのようにして損傷した組織を標的とし、そしてこれら細胞の微小脈管への局在化は重要なのか?
【0133】
損傷の部位へのMSCのホーミングは、炎症細胞の損傷組織への応答の記憶である。好中球および単球は、損傷および炎症組織を脈管性および細胞性分子シグナリングの調和した因果的連鎖により標的とする。炎症細胞および脈管上に発現される接着分子およびそれらのレセプターが細胞を損傷組織へと導き、そしてこれらの細胞を脈管境界を渡して、通常は血液脳関門を通して輸送する。これらの標的化および接着分子はケモカインと協調して働く。したがって出願人は接着分子および誘引剤が作用し、そしてMSCを脳に標的させるかどうかを試験した。出願人は、透過性の膜により分けられた2つのチャンバーの間の細胞移動に関するアッセイであるBoydenチャンバーを使用した。MSCは移動媒質(5%ウシ血清アルブミンを含むIscoveの改良ダルベッコ培地)中、5×105細胞/mLに調整された。50・Lの細胞懸濁液を各上部ウェルに加えた。底面に移動したMSCの数を5個の視野(0.12mm2面積)で計数した。虚血脳組織は誘引タンパク質1およびマクロファージ炎症タンパク質1のような走化性タンパク質を発現するので、出願人はこれらの物質を下のチャンバーに配置して、用量依存的な移動の増加を提供した。同様の応答が細胞間接着分子1のような接着分子を下のチャンバーに配置した時に見いだされた。移動の上昇は付着分子に対する抗体またはケモカインを下のチャンバーに加えた時に効果的に遮断された。外的損傷または発作に供した脳由来の組織が下のチャンバーに配置された時、細胞の移動は有意に増加した。これらの知見は細胞がどのように炎症細胞様の同定を仮定し、そしてそれらがどのように損傷した組織を特異的に標的とすることを「知る」かという洞察を提供する。このようにパーキンソン病および多発性硬化症のような神経変性的プロセスを含め、炎症応答を有する任意の損傷は、MSCを傷つけられた組織に導くことができる。損傷の程度による指針の依存性も、細胞の「効果的」な用量の滴定状態を提供する。損傷および相伴う炎症応答が重症なほど、その部位に向けられる細胞数が多くなる。
【0134】
作用のメカニズム
細胞がどのように脳に影響を及ぼし、そしてそれにより損傷および病理的プロセスから機能的回復が促進されるのか?脳細胞になることによりMSCが大脳組織に与える利益の可能性の見込は無いようである。静脈内注射および多くても数十万を数える実質内細胞数で、たとえそれらが脳細胞になっても、数立方ミリメートル強の組織容量を交換するための大変少量の細胞が存在するだけである。多くの場合で利益は処置から2、3日に検出さ
れる。多くてもわずかな比率の細胞が実質細胞の表現型のタンパク質を発現する。これらタンパク質の発現は真の分化およびニューロンまたはグリア−細胞機能を示さない。そのような短期間の後、さらに分化した細胞が組織に真に一体化され、そして機能を向上させる複雑な結合を形成する見込みはほとんどない。このようにMSCがそれらの有益な効果を促進することによるメカニズムとしての組織代替はありそうにもない。この利益についてより合理的な説明は、MSCが脳の内因性の回復効果を活性化するように大脳組織を誘導するということである。MSCは反応を始め、そして脳と相互作用して回復的、そして恐らくは再生的メカニズムを活性化することができる。
【0135】
MSCは低分子工場として行動し、多くの種々のサイトカインおよび栄養因子を生産する。大脳組織中または損傷した脳の微小脈管中のMSCはこれら因子を発現するらしく、そして栄養因子が脳組織に及ぼす効果は、機能の回復を迅速かつ効果的に促進するメカニズムである。出願人は多くの他の栄養および増殖因子の中でも、MSCが肝細胞増殖因子、VEGF、神経成長因子(NGF)および脳由来神経栄養因子(BDNF)を生産することを示した。この様々な因子、そして特定の増殖因子の単一の一丸(bullet)ではないことが、有益な効果を助長する。大変重要な観察は、MSCを異なるイオン的微小環境下で培養した時に、増殖因子の発現を調整することにより信号に応答するということである。この知見は損傷した組織中の細胞が組織の必要性に合った栄養因子および増殖因子を発現することを示唆している。異なる環境がこれら因子の分泌に影響を及ぼす。すなわち組織損傷の程度および対応するイオン的な環境の混乱(disruption)が栄養因子の分泌を記録するのだろう。出願人はこの仮説をいくつかの実験条件下で試験した。発作または損傷により傷つけられた脳から抽出した組織中でMSCを培養すると、栄養因子の分泌は有意に増加する。損傷した脳に対するMSCの応答分泌は、傷を受けた脳から組織が抽出される時期に従い異なる。これらの実験はMSCで処置した脳内の成長因子の発現の測定において、一歩前進ととらえられた。出願人は定量的なサンドイッチELISAを使用し、これは免疫標識法により脳中の増殖因子の発現を測定する。栄養因子の発現は、発作または外傷に供された未処置動物よりも、MSC処置動物で有意に大きかった。
【0136】
MSCが選択的に損傷した脳に入り、そして増殖および栄養因子を組織フィードバックループで分泌するとすれば、これらの因子は脳をどのように改変して治療的利益を促進するのだろうか?操作上の仮説は治療的利益が脳の可塑性に関係する1組の出来事により誘導される;このプロセスは限定するわけではないが血管新生、神経細胞新生(neurogenesis)、シナプス形成(synaptogenesis)、樹状突起の分枝、および組織の境界領域中で戦略的に重要な組織中のアポトーシスの減少を含む。
【0137】
VEGFおよび塩基性繊維芽細胞増殖因子は、有力な血管新生剤である。出願人はMSCまたはMSCの上清が血管新生の誘導に及ぼす効果を試験した。測定はヒト脳の内皮細胞に関するアッセイで行い、ここでMSCからの上清が管の迅速な形成を誘導することが示され、構造的および血管新生プロセスを反映している。インビボで使用したアッセイは古典的な無血管角膜アッセイであった。外科的切開で角膜にポケットを作成し、そしてMSC上清またはMSC自体をコートしたコラーゲンオブラードをポケットに挿入した。対照条件は外科的切開およびコラーゲンオブラード単独またはVEGFのポケットへの直接的配置からなった。出願人は迅速かつ強固な血管新生を、MSC上清を乗せたオブラードで処理した角膜で観察した。角膜切開に直接配置した細胞のほとんどが部位から拡散したが、血管新生は明らかであった。対照動物には血管新生はなかった(図2)。血管新生の誘導は、VEGFの直接使用よりはMSC上清でより強固であり、これは上清が血管新生因子の高度に効果的な供給源であることを示唆している。脳組織のMSC処置による血管新生誘導の予備実験も、新規血管形成の増加を示唆する(報告していない観察)。血管新生の誘導は機能の促進に直接翻訳されないが、出願人は以前に発作から1日以上後のVE
GFでの発作の処置が機能的回復を有意に改善し、そして血管新生を増加することを示した。
【0138】
MSCによる神経細胞新生の誘導も、発作後の機能的改善に貢献することができる。神経細胞新生の重要な部位は、脳側室に隣接する領域−脳室下領域である。神経細胞新生は齧歯類の脳の嗅球および歯状回にも見いだされる。発作のような大脳損傷は、脳の特定領域内のニューロンの生産を増幅する。特に発作後長期における機能的修復は、新規脳細胞の生産に関連し得る。これらの細胞の生産を促進するメカニズムは、回復を改善することができる。出願人はMSCでの発作の処置が神経細胞新生の誘導に及ぼす効果を試験した。細胞数の有意な増加は、発作後の脳室下領域で測定された。多くのこれらの細胞はTUJ−1のような特異的分子マーカーの発現により示されるような、新たに形成された前駆様細胞のマーカーを有した。同側半球内の大脳組織も幹細胞マーカーであるネスチンの発現の大きな増加を示し、大脳組織の前駆体または発生状態への活性化を示す。MSCを移植した大脳組織の組織学的分析も、虚血組織内の神経幹細胞(neurosphere)ロゼットの存在を示した。これら神経細胞のロゼットは、発生中の脳で見いだされるものに類似する。これらの細胞系の大脳組織への移動は、脳室領域から発出する星状膠細胞様の放出により導かれることができ、これも発生中の脳内の出来事に似ている。このように骨髄細胞の存在は、脳室領域内の1次供給源から新規細胞の、および脈絡叢の損傷した脳への迅速な誘導および移動を促進するように思われる。これらの細胞は機能的修復に貢献することができるが、神経細胞新生の誘導およびこれらの細胞の機能回復への移行の関係は、直接試験されなかった。
【0139】
MSCにより生産される増殖および栄養因子は、損傷したおよび虚血脳におけるシナプス形成に影響を与え、そして樹状分枝を増加させることができる。発作のMSCによる処置が樹状分枝に及ぼす直接的効果は、さらなる実験が待たれることろである。予備実験で出願人は、発作後の虚血性損傷の境界領域内にシナプスタンパク質であるシナプトフィシンの発現増加を示した。
【0140】
グリオーシスは神経損傷後の軸索伸長および分枝の障害になり得る。トランスフォーミング増殖因子・タンパク質は創傷治癒に主に重要であり、そして皮膚および心筋における瘢痕の抑制、および胎児で観察される瘢痕が無い創傷修復に関わってきた。MSCはこの増殖因子を生産するので、治療的利益は瘢痕の減少および続くシナプス形成および樹状分枝の改善からももたらされ得る。
【0141】
サイトカインおよび増殖および栄養因子に加えて、MSCは骨芽細胞に特異的なファクター2および骨形成タンパク質1のような骨形成に関係する因子を発現する。MSCはまた神経細胞−接着分子ニューロピリンおよびNGFおよびBDNFを含む神経栄養因子も発現する。最近の研究は、骨形成タンパク質、ソニック ヘジホック(sonic hedehog)、副甲状腺ホルモンおよび繊維芽増殖因子8は、中胚葉および神経外胚葉経路を修飾することにより、胚性細胞の分化中に調節の役割を有することが示された。MSCによる損傷脳中のこのサイトカインカスケードの分泌が機能的利益に貢献するかどうかを、慎重な考察およびさらなる実験で実証する。
【0142】
損傷周辺領域は、アポトーシス細胞死に高度に感受性である。アポトーシスは発作または脳の外傷後数カ月間持続する。回復に及ぼす効果は未知である。出願人はMSCを用いた発作および脳外傷の処置がこの領域内のアポトーシスを有意に減少させることを示した。この効果は損傷した脳内のNGFのような増殖因子の生産により媒介されることができる。出願人はこの領域内のアポトーシスの選択的減少は、大脳の再配線(rewiring)を支持することができると推測する。
【0143】
脳のリモデリング、神経細胞新生および神経保護的メカニズムが損傷後に機能的改善を喚起するメカニズムは不確定であり、そして重要な研究課題である。MSCを用いた処置により増幅されるこれらすべての出来事が、実際に発作および外傷後の改善された成果に貢献するのかどうかは現在調査中である。
【0144】
この時点で、神経学的機能の回復を促進する特異的な出来事を単離することはできない。しかし出願人は機能の回復を促進するプロセスが組織の1つの修飾ではなく(例えば神経細胞新生)、恐らくは機能を改善するために、相乗的様式でなくても組合わさって貢献する出来事である血管新生、神経細胞新生、シナプス形成、ならびに瘢痕およびアポトーシスの境界での減少の混交された組み合わせであろうと推測する。この仮説を試験し、そして改善された神経学的機能に貢献する特異的因子の同定はやりがいがあるが、出願人は神経細胞新生に影響を及ぼさずに血管新生を減少するために、境界領域内でアポトーシスを選択的に増加させる能力に限界がある。
【0145】
損傷した大脳組織は多くの方法で個体発生を繰り返す。発作または損傷後、大脳組織は発生のより早い段階に戻り、このようにして侵入するMSCからのサイトカインおよび栄養および増殖因子による刺激に対して高度に応答性となる。MSCは恐らく準発生的(quasidevelopmental)大脳組織内の構造および血管新生、脈管形成、神経発生および樹状分枝を含む再生的変化を刺激する。MSCの初期状態よりは種々の刺激物および増殖因子に対して高度に感受性の組織の初期状態は、主に治療的応用を促進する。MSCは大脳リモデリングを刺激するために、個体発生性大脳組織により必要とされる資源を単に提供できるだけである。出願人は他の細胞またはサイトカインおよび増殖因子を調和のとれた因果的連鎖で滴定して注入することにより、傷つけられた脳細胞を刺激して反応させ、そして機能を回復させることができる可能性を排除しない。同様に出願人はMSCの亜集団が幹様または前駆様であり、そして損傷した組織と相乗的に反応する可能性も排除することができない。しかし出願人は、少なくとも出願人が見る機能的利益の時間規模では、脳内のMSCは組織とは置き換わらず、そしてそれらは機能するニューロンおよび支持的な星状膠細胞に分化しないという自信がある。主な利益は損傷をリモデルし、そして補償するための損傷した組織の活性化により得られる。図3はMSCが回収され、そして損傷した大脳組織を処置するために使用することができるこのプロセスの現在の解釈を具体的に説明する。
【0146】
患者への移植
この細胞治療の形態が発作の患者に使用できる前に、明らかに安全性の問題に取り組まなければならない。骨髄移植は癌処置では普通の手順であり、そして多発性硬化症における併用療法としても使用されてきたが、発作における安全性に関するフェイズI実験が認められている。今日まで発作を生じたほぼ2000匹の動物に関する実験で、出願人は治療のいかなる副作用または腫瘍形成の兆候も検出しなかった。患者は彼ら自身の細胞、HLAが合った細胞またはユニバーサル−ドナー群で処置されるべきか?これまでの前臨床データは、ドナー細胞による処置が可能であることを示唆している。しかし前臨床およびフェイズI臨床試験はこの問題に取り組むために行なわなければならない。この再考を説明する前臨床および基本的試験は、MSCでの発作の処置が現実的かつ高度に効果的な回復的治療を提供することができることを示す。すなわち臨床試験は実証される。
【0147】
本出願を通して、米国特許を含む種々の刊行物が著者および年号および特許番号により引用されている。刊行物に関する完全な引用を以下に掲載する。これら刊行物および特許の開示は、本発明の技術分野の状況をより完全に説明するために全部、引用により本明細書に編入する。
【0148】
本発明を具体的に説明する様式で記載してきたが、使用した用語術は限定ではなく言葉
の説明的性質を持つことを意図していると理解される。
【0149】
明らかに本発明の多くの修飾および変更が上記の教示に照らして可能である。したがって記載した本発明の範囲内で、本発明は具体的に記載した以外に実施できると理解される。
【0150】
【表4】

【0151】
TBI組織抽出物で処置したhMSCsを、ノックアウト血清代替および正常脳抽出物を含むノックアウトDMEMと比べる。★P<0.01
【0152】
以下に本発明の主な特徴と態様を列挙する。
【0153】
1.血管新生および脈管形成の誘導に使用する治療薬であって、該治療薬が幹細胞から単離された血管新生および脈管形成誘導因子を、血管新生および脈管形成を誘導するための製薬学的に許容され得る細胞治療薬と一緒に含んでなる上記治療薬。
【0154】
2.上記血管新生および脈管形成誘導因子が血管新生、栄養および増殖因子から本質的になる群から選択される1.に記載の治療薬。
【0155】
3.上記細胞治療薬が間葉系幹細胞、間質細胞およびその前駆体、繊維芽細胞、網状赤血球、脂肪細胞および内皮細胞から本質的になる群から選択される幹細胞である、1.に記載の治療薬。
【0156】
4.血管新生および脈管形成誘導因子の生産を増すために、間質細胞を分化誘導化合物に暴露し、そして共培養することにより、間質細胞から分泌される血管新生および脈管形成誘導因子の生産を増幅させる方法。
【0157】
5.上記方法が血管新生および脈管形成誘導因子の生産を増すために、間質細胞を分化誘導化合物に暴露し、そして共培養することを含み、該分化誘導化合物が脳抽出物およびカルシウムから本質的になる群から選択される、4.に記載の方法。
【0158】
6.治療として使用するために幹細胞から単離され、そして精製された血管新生および脈管形成誘導因子。
【0159】
7.血管新生および脈管形成を誘導する処置が必要な患者に投与した時、血管新生および脈管形成を誘導する、6.に記載の血管新生および脈管形成誘導因子。
【0160】
8.上記血管新生および脈管形成誘導因子が、所望の因子の生産を増すために分化誘導化合物に暴露され、そして共培養された時、幹細胞により分泌される因子である6.に記載の血管新生および脈管形成誘導因子。
【0161】
9.上記分化誘導化合物が脳抽出物およびカルシウムから本質的になる群から選択される、8.に記載の血管新生および脈管形成誘導因子。
【0162】
10.上記脳抽出物が脳細胞、脳から得られる細胞および培地で培養された間質細胞からの上清から本質的になる群から選択される、9.に記載の血管新生および脈管形成誘導因子。
【0163】
11.6.に記載の血管新生および脈管形成誘導因子を得る方法であって:
分化前の組織からヒト間葉系幹細胞を単離し、そして精製し;そして
神経学的および筋骨格治療用の道具を生産するために間葉系幹細胞を培養拡大する、
工程を含んでなる上記方法。
【0164】
12.幹細胞が組織修復に必要な所望する細胞表現型に分化し、そして生産することができる、単離され、そして分化を誘導する化合物の影響下で培養拡大された間葉系幹細胞。
【0165】
13.上記の分化を誘導する化合物が脳抽出物およびカルシウムから本質的になる群から選択される、12.に記載の幹細胞。
【0166】
14.上記の脳抽出物が脳細胞、脳から得られる細胞および培地で培養された間質細胞からの上清から本質的になる群から選択される、13.に記載の幹細胞。
【0167】
15.細胞の修復能力の方向転換に使用するための12.に記載の幹細胞。
【0168】
16.幹細胞から単離した血管新生および脈管形成誘導因子を製薬学的に許容され得る細胞治療薬と一緒に含んでなる治療薬を投与することによる、治療が必要な患者の血管新生および脈管形成を誘導するための治療であって、治療薬が患者に血管新生および脈管形成を誘導する上記治療。
【0169】
17.上記投与工程が、皮下、非経口的、静脈内、動脈内、筋肉内、腹腔内、鼻内、くも膜下内、および注入技術を介することから本質的になる群から選択される様式で治療薬を投与することを含む、16.に記載の治療。
【0170】
18.幹細胞から単離した血管新生および脈管形成誘導因子を製薬学的に許容され得る細胞治療薬と一緒に含んでなる治療薬を投与することによる組織修復を誘導する方法であって、治療薬が組織修復を誘導する上記方法。
【0171】
19.上記投与工程が、皮下、非経口的、静脈内、動脈内、筋肉内、腹腔内、鼻内、くも膜下内、および注入技術を介することから本質的になる群から選択される様式で治療薬を投与することを含む、18.に記載の方法。
【0172】
20.細胞の機能の増大に使用するための治療薬であって、該治療薬が幹細胞から単離された細胞機能の増強因子を、細胞の機能を増大するための製薬学的に許容され得る細胞治療薬と一緒に含んでなる上記治療薬。
【0173】
【表5】

【0174】
【表6】

【0175】
【表7】

【0176】
【表8】

【0177】
本発明の他の利点は容易に評価され、それは前述の詳細な説明を参照にして添付の図面と一緒に考える時、よりよく理解される。
【図面の簡単な説明】
【0178】
【図1】図1AからEはBDNF(図1A)、NGF(図1B)、bFGF(図1C)、VEGF(図1D)およびHGF(図1E)の増殖因子の分泌を示す写真である。
【図2】図2AおよびBは中大脳動脈の閉塞そして静脈内MSCでの処置有り、または処置無しの前後のラットにおける行動機能試験の結果を表すグラフである。
【図3】図3AおよびBはMSC分泌がインビボで血管新生を誘導するかどうかを試験するためのラット角膜の新生血管形成モデルの使用を示す写真であり、図3Aは模擬−手術した角膜には新生血管形成の根拠はないことを示し、そして図3Bは角膜ポケット内に挿入されたコラーゲン水中に配置されたMSC上清を示し、ここでは強固な角膜の新生血管形成が明らかである。
【図4】本発明を支持するために行った実験の具体的説明を示し、ここでは骨髄が動物から抽出され、そしてMSCが分離され、そして3〜5継代まで培養され、MSCが神経損傷の動物に注射され、そして細胞は損傷組織に選択的に移動し、そして損傷の境界領域に局在し、次いでMSCが、MSC、実質細胞分泌および増殖および栄養因子により媒介される一連の修復的出来事を活性化し、これが神経学的機能を改善する。
【図5】図5は8つの右半球を3つのサブ領域および8つの場に分割する、ラット脳の前交連のレベルで同定された標準的な皮質切片を示す。
【図6】図6AおよびBは中大脳動脈閉塞の前後の、行動的機能試験の結果を示すグラフである。
【図7】図7はアポトーシス細胞(図7a−d)およびBrdU−陽性細胞(図7e−h)を示す。
【図8】図8AおよびBは、脾臓細胞とhMSCとの間の混合リンパ球反応を示すグラフである。
【図9】図9はラット脳における外因性ヒト骨髄間質細胞(hMSC)および内因性脳細胞の形態学的特徴を示す顕微鏡写真である。
【技術分野】
【0001】
発明の背景
技術分野
本発明は治療薬として使用するための方法および組成物に関する。より詳細には本発明は血管新生(angiogenesis)の治療的生成の使用および血管新生および栄養(trophic)因子の生産に関する。
【背景技術】
【0002】
背景技術
発作は米国の成人人口において3番目に多い死因であり、そして障害の主要因である。発作は脳の一部が梗塞するようになった時に起こり、大脳の血液供給の妨害から脳組織の死をもたらす。急性発作に伴う脳梗塞は急激な、しかも劇的な神経的損傷を引き起こす。他の神経性疾患も組織の死および神経的損傷をもたらす。
【0003】
発作により影響を受けた、生存できるかもしれない脳の領域への血流を最大とするために薬理学的介入が試みられたが、臨床的効果は曖昧であった。非特許文献1では、「....[脳拡張薬]が酸化窒素法により測定される脳の血流を上昇させる実験的証拠にもかかわらず、それらはヒトの一時的な虚血性の攻撃、血栓症の進行、または慢性の発作の段階でヒトの発作の症例を慎重に研究すると有益ではないことが示された。これはニコチン酸、プリスコリン(Proscoline)、アルコール、パパベリンおよび5%二酸化炭素の吸収にもあてはまる。.....これらの方法の使用に対して、血管拡張薬は全身の血圧を下げることにより頭蓋内吻合流を低下させ、あるいは脳の正常な部分の血管を拡張することにより血管が梗塞から血液を取るので、有利というよりはむしろ有害であると示唆している」と述べている。
【0004】
さらに心血管系の疾患は死亡率および罹病率の世界的な原因を導いている。例えば心不全の有病率は増加してきている。心不全は心臓が十分な血液を身体の様々な臓器に送ることができないことを特徴とする。現在の推定では5百万以上のアメリカ人が心不全の診断を受け、毎年ほぼ500,000人の新たな症例が診断され、そして年間250,000人がこの疾患により死んでいる。この二十年間におけるかなりの治療的完成度にもかかわらず、心不全の発症は増え続け、流行病の比率に達し、そして開発国における主な経済的負担を表している。
【0005】
心不全は心拍出量の障害または静脈圧の上昇から生じる明白な症状および兆候を特徴とする臨床的症候群である。さらに心不全は進行性の障害であり、これにより心臓の機能は副作用が無くても時間経過に伴い悪化し続ける。心不全により、不十分な心拍出量が生じる。
【0006】
一般に2種類の心不全がある。右心不全は心臓の右側が静脈血を肺の循環に送ることができない。身体に液体の停滞が生じ、そして腫張および水腫が生じる。左心不全は心臓の左側が血液を全身の循環に送れないことである。次に左心室の後ろの停滞が肺に流体の蓄積を引き起こす。
【0007】
心不全から生じる主な影響は、流体のうっ血である。心臓がポンプとして効率的でなくなると、身体は例えば血液容量を上昇させるためのホルモンおよび神経シグナルを使用することによりそれを補おうとする。
【0008】
心不全には多数の原因がある。例えば心臓組織の疾患はもはや機能しない死んだ心筋細胞を生じる。左心室不全の進行は、部分的にこれら心筋細胞の損失の進行が原因であった。
【0009】
心不全を処置し、そして防止する多数の方法があった。例えば幹細胞は動物モデルを対象として急性心虚血および/または梗塞または損傷における心細胞を再生するために使用されてきた。1つの特別な例では、ドナーの足の骨から単離された生きている骨髄間質細胞(marrow stromal cell)が培養−拡大され(culture−expanded)、標識され、そして次いで同系成体ラットレシピエントの心筋層に注射された。移植から4日〜12週後に心臓を回収した後、移植部位を調査し、そして移植された間質細胞が心筋の環境で成長する可能性を示すことが分かった(Wang,et al.)。
【0010】
心筋細胞は、胚様凝集物(embryo−like aggregates)(胚様体:embryoid bodies)を介してD3系の多能性の胚性幹細胞(ES)からインビトロで分化することが示された。細胞は全分化期間中、全細胞パッチ−クランプ技法、形態学および遺伝子発現の類似により特徴つけられた。(Maltsev,et al.,1994)。さらに多能性のマウスES細胞は哺乳動物の心臓の主な特徴を発現する心筋細胞に分化できた(Maltsev,et al.,1993)。
【0011】
幹細胞はそれらの起源(胚性、骨髄、骨格筋等)にかかわらず、すべてではないが身体の細胞型に分化する可能性を有する。幹細胞は機能的な心筋細胞にも分化することができる。すなわち心不全を処置するための幹細胞に基づく治療の開発は、既存の治療よりも多くの利点を有する。
【先行技術文献】
【非特許文献】
【0012】
【非特許文献1】Harrisonの内科学の原理(Principle of Internal Medicine)(第9版、1980、第1926頁)
【発明の概要】
【0013】
発明の要約
本発明に従い、血管新生および脈管形成の誘導に使用する治療薬が提供される。治療薬は幹細胞から単離された血管新生および脈管形成誘導因子を、血管新生および脈管形成を誘導するための製薬学的に許容され得る細胞治療薬と一緒に含むことができる。また間質細胞を血管新生および脈管形成誘導因子の生産を増すための化合物に暴露し、そして共培養することにより分泌される血管新生および脈管形成誘導因子の生産を増幅させる方法も提供する。幹細胞から単離され、そして精製された治療に使用するための血管新生および脈管形成誘導因子も提供する。上に説明した血管新生および脈管形成誘導因子を得る方法を提供し、この方法は分化前の組織からヒト間葉系幹細胞(mesenchymal stem cell)を単離し、そして精製し、そして次いで神経学的および筋骨格治療用の道具を生産するために間葉系幹細胞を培養拡大する工程を含む。組織修復に必要な所望する細胞表現型に分化し、そして生産することができる、単離され、そして必要な化合物の影響下で培養拡大された間葉系幹細胞も提供する。
【発明を実施するための形態】
【0014】
発明の説明
一般に本発明は血管新生および脈管形成を誘導するための細胞治療の一部として、骨髄間質細胞または他の幹細胞に由来する血管新生および脈管形成誘導因子の使用を提供する
。より詳細には本発明は、治療に使用するための間質細胞または他の幹細胞により分泌される血管新生および脈管形成誘導因子(例えば血管新生、栄養および増殖因子)の生産を増幅させる方法を提供し、この因子は投与されると血管新生または他の有益な増殖を誘導する。増幅は細胞を脳抽出物および/またはカルシウムに暴露し、そして共培養することにより起こる。
【0015】
用語「血管新生」とは新しい、および/または発育中の血管の組織への成長が関与する組織の脈管化のプロセスと定義され、そして新脈管形成(neo−vascularization)とも呼ばれる。このプロセスは内皮細胞および平滑筋細胞の浸潤により媒介される。このプロセスは3つのうちの1つの様式で進行する:血管が既存の血管から発出し、血管のデノボ成長が前駆細胞から生じることができ(脈管形成)、かつ/または既存の小さい血管の直径が拡大することができる。
【0016】
本明細書で使用する用語「強化する」または「強化」は、限定するわけではないが幾つかの望ましい質または量の物質を加えるかまたは増すことにより、豊富またはより豊富にすることを含むことを意味する。
【0017】
本明細書で使用する「脳抽出物」という句は、限定するわけではないが脳細胞または脳から得られる他の類似の細胞を含むことを意味する。これらの細胞は培地で培養することができ、そして上清を脳抽出物として使用することができる。
【0018】
本明細書で使用する用語「損傷」は、限定するわけではないが遺伝子障害、疾患および年齢により発症する障害を含む身体的または生物学的損傷を含むことを意図する。例えば患者は発作、CNS損傷および神経変性疾患後に神経および機能的障害に罹る。
【0019】
本明細書で使用する用語「細胞治療」は限定するわけではないが、幹細胞の治療的使用を含む。幹細胞はその子孫が種々の細胞型に特異化する分化していない母細胞である。幹細胞は限定するわけではないが、胚、骨髄、肝臓、間質、脂肪組織および当業者に知られている他の幹細胞起源を含む種々の起源を有する。これらの幹細胞はそれらが自然に発生する所望の領域に置くことができ、または当業者に知られている様式で工作することができる。すなわち限定するわけではないがトランスフェクション、削除等を含む種々の遺伝子工学的手法を介して、幹細胞はそれらの生存の見込みを上げるために、または他の所望する目的のために工作されることができる。
【0020】
幹細胞はヒト個体に提供された時、インビボで自己再生することができ、そして系統が制限された子孫となることができ、これはさらに特異的な系統に分化し、そして拡がる。本明細書で使用する「幹細胞」はヒトの骨髄細胞を指し、そして他の細胞型の幹細胞ではない。好ましくは「幹細胞」はヒト骨髄間質細胞を指す。
【0021】
用語「幹細胞」または「多能性」幹細胞は互換的に使用して、(1)すべての定義された造血系統における子孫(progeny)を生じる能力、および(2)自己−再生(self−renewal)により多能性造血幹細胞を含むすべての血液細胞型およびそれらの子孫において、重度な免疫抑制宿主を完全に再構成することができる幹細胞、を有する幹細胞を意味する。
【0022】
骨髄は長骨の骨髄腔、幾つかのハヴァーズ管および海綿質すなわちスポンジ状の骨の小柱間の空間を占める柔軟組織である。骨髄には2種類ある:赤色、これは生まれたばかりのすべての骨、および成人の限定された場所(すなわち海綿質中)に見いだされ、血液細胞(すなわち増血)およびヘモグロビン(すなわち赤色)の生産に関する;および黄色、これはほとんどが脂肪細胞(すなわち黄色)および結合組織からなる。
【0023】
全体として骨髄は造血幹細胞、赤および白血球およびそれらの前駆体、間葉系幹細胞、間質細胞およびその前駆体、ならびに「間質」と呼ばれる結合組織網を形成する繊維芽細胞、網状白血球、脂肪細胞および内皮細胞を含む細胞群を含む複雑な組織である。間質に由来する細胞は、細胞表面タンパク質および増殖因子の分泌を介して直接的な相互作用を通した造血細胞の分化を形態学的に調節し、そして骨構造の基礎および支持に関与している。
【0024】
動物モデルを使用した実験では、骨髄が軟骨、骨および他の結合組織細胞に分化する能力を有する「前−間質(pre−stromal)」細胞を含むことが示唆された。(Beresford,J.N.:骨および骨髄の骨形成幹細胞および間質系(Osteogenic Stem Cells and the Stromal System of Bone and Marrow)、Clin.Orthop.,240:270,1989)。最近の証拠では多能性間質幹細胞または間葉系幹細胞と呼ばれるこれらの細胞が、活性化で幾つかの異なる型の細胞系(すなわち骨細胞、軟骨細胞、脂肪細胞等)を生成する能力を有することを示す。しかし間葉系幹細胞は広い種々の他の細胞(すなわち、赤血球、血小板、好中球、リンパ球、単球、好酸球、好塩基球、脂肪細胞等)と組織中に大変微量で存在し、そして年齢に逆行する関係で、多数の生物活性因子の影響に依存して寄せ集めの結合組織に分化することができる。
【0025】
本発明の目的は、骨髄間質細胞、骨髄間質細胞に由来する上清、または骨髄間質細胞と他の幹細胞の相互作用から生じる分泌物を、疾患を処置するために利用することである。これらの分泌物には限定するわけではないが多数の増殖、栄養および血管新生因子を含む。本発明の方法は、処置の効果を増すこと、例えば血管新生、および存在しないまたは既存の血管から形成される血管生産を増すことにより、神経損傷または他の損傷からの回復に改善された結果を促進する。また本発明はCNS傷害または変性後の機能を向上させるために、脳の補完メカニズムを強化する手段を提供するためにも使用することができる。さらに本発明の方法および組成物は、細胞治療の効力を強化することができる。
【0026】
損傷した細胞に分化する移植した幹細胞を介して、損傷した細胞の濃度を高め(enriching)かつ/または増やす(repopulating)ことは機能を上げる。例えばこの治療が心臓で使用される時、治療は心臓の筋節(contractile units)を増すことができる。筋節の増加は心臓の機能を上げる。さらに幹細胞は栄養因子のような種々の物質の放出の原因ともなり得る。すなわち例えば栄養因子の放出は、心機能を上げ、かつ/または心不全を処置するために血管新生を誘導する(血管の数を増す)。したがって幹細胞は単に機能的な心筋細胞に分化する以外に様々なメカニズムを介して心機能を上げ、かつ/または心不全を処置するように作用する。
【0027】
栄養因子、増殖因子および血管新生因子の生産は典型的には経費がかさむ難しい方法である。本発明の方法および組成物は、本発明の治療を単に投与することにより、純粋な栄養因子、増殖因子および他の関連因子を生産する廉価で、しかも簡単な方法を提供する。これらの因子は患者の処置に使用することができる。例えば因子はインビボおよびインビトロの両方で血管新生、脈管形成を誘導するために、および組織の機能を強化し、そして修復するために使用することができる。したがって栄養、増殖および血管新生因子を生産し、そして分泌するために、どの骨髄間質細胞が細胞工場として使用できるかを決定することが有益である。これらの因子には限定するわけではないが、VEGF、HGF、BDNF、NGF、bFGF等を含む。本発明の方法は培養条件によりこれらの因子の生産を操作することを可能とする。例えば培養条件は、細胞を培養基中で組織および/または種々のカルシウム濃度で共培養することにより操作することができる。
【0028】
本発明は疾患を処置するための細胞治療の使用に基づく。幹細胞は異なる起源(胚、骨髄、肝臓、脂肪組織等)であるが、それらの重要な共通の特徴は、それらがすべてではないが身体の様々な細胞型に分化する可能性を有するということである。すでに述べたように、幹細胞は心筋細胞に分化できることが示された(Maltsev et al.,1993;1994)。
【0029】
出願人は神経学および筋骨格治療用の価値ある道具を生産するために、分化前の組織からヒト間葉系幹細胞を単離し、そして精製し、次いで間葉系幹細胞を培養拡大する方法を開発した。そのような操作の目的は、間葉系幹細胞の数を大きく増加させ、そしてこれらの細胞を身体の正常な修復能力に方向転換かつ/または強制させるために利用することである。間葉系幹細胞は多数で回収され、そして再生および/または修復のためのインビボ成長を強化または刺激するために、後の活性化および分化等を介して種々の人工器官デバイスへの移植付着を向上させるために、組織損傷の領域に適用され、造血細胞の生産等を強化する。
【0030】
発明者は培養で拡大され、精製された間葉系幹細胞を修復、移植等の部位に転移し、固定化し、そして活性化するための様々な手法を企図し、それらには細胞を骨格欠損の部位に注射すること、細胞を人工器官とインキューベーションすること、および人工器官を移植すること等を含む。このように分化前の細胞を単離し、精製し、そして数を大きく拡大し、そして次いで組織傷害の部位にそれらを配置することにより、またはそれらを移植前にインビトロで前処理することにより分化プロセスを能動的に制御することにより、培養拡大した未分化間葉系幹細胞を多数の神経疾患、神経損傷、代謝性骨疾患、骨格筋形成異常、軟骨欠損、靭帯および腱の損傷および他の筋骨格および結合組織障害における細胞的、分子的および遺伝的障害を解明するためのような種々の治療目的に利用することができる。
【0031】
発明者は細胞を損傷の部位に注射することを含め、種々の多孔質セラミック媒体または担体の使用を介して、修復、移植等の部位に間葉系幹細胞または前駆細胞を転移し、固定化し、そして活性化するための種々の手順を企図する。
【0032】
ヒト間葉系幹細胞は、変性関節疾患の患者から腰または膝の代替手術中に得られる大腿頭海綿質骨片の栓を含む多数の異なる供給源から、および将来の骨髄移植のために骨髄が回収される正常ドナーおよびガン患者から得られる吸引された骨髄から得ることができる。回収された骨髄は回収された骨髄の供給源に依存して(すなわち骨片、末梢血の存在等)、多数の異なる機械的単離法により細胞培養分離のために調製されるが、単離法に含まれる重要な工程は分化無しに間葉系幹細胞の成長を可能とするだけではなく、培養皿のプラスチックまたはガラス表面領域に間葉系幹細胞だけを直接付着させる作用物質を含む特別に調製した培地の使用であった。骨髄サンプル中に大変少量で存在する所望の間葉系幹細胞の選択的付着を可能とする培地を生産することにより、骨髄に存在する他の細胞(すなわち赤および白血球、他の分化した間葉系幹細胞等)から間葉系幹細胞を分離することが可能となった。
【0033】
上に示したように完全な培地は、細胞培養分離のために回収された骨髄を調製するために使用した最初の回収工程の具体的な種類に依存して、多数の異なる単離法に利用することができる。海綿質骨髄の栓を利用する時、骨髄を完全な培地に加え、そしてボルテックス処理して分散物を形成し、これを次いで遠心して骨片等から骨髄細胞を分離する。次いで骨髄細胞(主に赤および白血球および大変少量の間葉系幹細胞等からなる)は骨髄細胞を含有する完全培地を、一連の16、18および20ゲイジ針を備えたシリンジに通すことにより単一細胞に解離する。酵素的分離法に対して機械的分離法の使用を介して生産する利点は、機械的方法では細胞の変化がほとんど生じず、一方酵素的方法は特に培養付着
および選択的分離に必要なタンパク質結合部位、および/または該間葉系幹細胞に特異的なモノクローナル抗体の生産に必要なタンパク質部位に細胞傷害を生じ得る点であると考えられる。次いで単一細胞懸濁液(これは約50〜100×106の有核細胞からなる)が、続いて懸濁液中に見いだされる残りの細胞から間葉系幹細胞を選択的に分離し、かつ/または単離する目的で100mmの皿にまかれた。
【0034】
ヒト間葉系幹細胞源として吸引した骨髄を利用する時、骨髄幹細胞(これは骨片をほとんど含まないか、または全く含まないが、大量の血液を含む)を完全培地に加え、そして以下にさらに詳細に記載するようにPercoll(シグマ(Sigma)、セントルイス、ミズーリ州)勾配で分画した。Percoll勾配は、骨髄に由来する間葉系幹細胞を含む低密度血小板画分から大部分の赤血球および単核造血細胞を分離する。約30〜50×106細胞を含む血小板画分は、骨髄ドナーの年齢に依存して未確定量の血小板細胞、30〜50×106の有核細胞およびわずか約50〜500の間葉系幹細胞からなった。次いで低密度血小板画分は細胞付着性に基づき選択的に分離するためにペトリ皿にまいた。
【0035】
海綿質骨または腸骨吸引物のいずれかから得た骨髄細胞(すなわち初代培養)を完全培地中で成長させ、そして以下に説明する条件に従い1〜7日間、ペトリ皿の表面に接着させた。3日目以降は細胞接着に増加が観察されなかったので、非接着細胞は元の完全培地を新しい完全媒体と交換することにより培養から除去する時期の標準的な長さとして3日を選択した。引き続く培地交換は、培養皿がコンフルエントになるまで(これには通常、14〜21日を要する)4日毎に行った。これは未分化ヒト間葉系幹細胞に103〜104倍の上昇を示した。
【0036】
次いで細胞はEDTA(エチレンジアミン四酢酸)を含むトリプシンのような放出剤(0.25%trysin、1mM EDTA(1.倍)、ギブコ(Gibco)、グランアイランド、ニューヨーク州)またはEGTA(エチレングリコール−ビス−(2−アミノエチルエーテル)N,N’−四酢酸、シグマケミカル社、セントルイス、ミズーリ州)のような錯化剤を利用して培養皿から脱着させた。錯化剤の使用を介して生じるトリプシンに優る利点は、トリプシンには間葉系幹細胞の多数の結合タンパク質を開裂させる可能性がある点である。これらの結合タンパク質はモノクローナル抗体が生産されると想定される時の認識部位を含むので、トリプシンに対してEGTAのような錯化剤を放出剤として利用した。次いで放出剤を不活性化し、そして脱着した培養した未分化間葉系幹細胞を続いて使用するために完全培地で洗浄した。
【0037】
特定の条件下で培養拡大した間葉系幹細胞は、多孔質のリン酸カルシウムセラミックス中で移植片としてインキューベーションした時、骨に分化する能力を有する。間葉系幹細胞が軟骨細胞に反して骨に分化することに影響を及ぼす内部因子はよく知られていないが、間葉系幹細胞の拡散チャンバーに反して多孔質のリン酸カルシウムセラミックス中で脈管により供給される増殖および栄養因子への直接的な接近性が、間葉系幹細胞の骨への分化に影響を及ぼしたと思われる。さらに脳抽出物は幹細胞がさらなる栄養因子を生産することを引き起こし、さらに幹細胞のこの効果を強化する。
【0038】
結果として、単離され、そして培養拡大された間葉系幹細胞は特定の特異的条件下および/または特定の因子の影響下で利用されて、分化し、そして組織修復に必要な所望する細胞の表現型を生産することができる。
【0039】
間葉系幹細胞の単回用量の投与は、T細胞と同種系の組織に、または「非−自己」組織に対して、特にTリンパ球が間葉系幹細胞から分離された後に同種細胞に対するそれらの非応答性(すなわち寛容またはアネルジー)を保持する場合、T細胞応答を下げるか、ま
たは排除するために効果的となることができる。
【0040】
脳抽出物と幹細胞を心筋に移植する一般法は以下の手順により行われる。幹細胞および脳抽出物を患者に投与する。投与は皮下、静脈内、動脈内、筋肉内、腹腔内を含む非経口、および鼻内投与ならびにくも膜下内および注入技法であることができる。
【0041】
間葉系幹細胞の投薬用量は広い限界内で変動し、そして各々の特定の症例で個々の要件に合わせる。一般に非経口投与の場合、通常、受容体の体重1キログラムあたり約0.01〜約5百万個の細胞を投与する。使用する細胞数は受容体の体重および状態、投与の回数または頻度、および当業者に知られている他の変数に依存する。間葉系幹細胞は組織、器官または移植する細胞に適する経路により投与することができる。それらは全身的に、すなわち非経口的に、静脈内注射により投与することができ、または骨髄のような特定の組織もしくは器官を標的とすることができる。ヒト間葉系幹細胞は細胞の皮下移植を介して、または幹細胞を結合組織、例えば筋肉に注射することにより投与することができる。
【0042】
細胞は適当な希釈剤中に約0.01〜約5×106細胞/mlの濃度で懸濁することができる。注射溶液に適する賦形剤は、緩衝化塩溶液または他の適当な賦形剤のような生物学的および生理学的に細胞および受容体と適合性があるものである。投与用の組成物は適切な殺菌性および安定性を順守する標準法に従い配合され、製造され、そして保存されるなければならない。
【0043】
本発明はこれらに限定されることはないが、間葉系幹細胞を好ましくは骨髄から単離し、精製し、そして培養で拡大(すなわちインビトロで)して、本明細書に記載する方法で使用するために十分な数の細胞を得ることができる。骨に見いだされる新細胞を形成する多能性の芽細胞である間葉系幹細胞は通常、骨髄(1:100,000)および他の間葉系組織に大変低い頻度で存在する。Caplan and Haynesworth、米国特許第5,486,359号明細書を参照にされたい。間葉系幹細胞の遺伝子形質導入は、Gerson et al、米国特許第5,591,625号明細書に開示されている。
【0044】
特に言及しない限り、遺伝子操作はSambrook and Maniatis、モレキュラークローニング:ア ラボラトリーマニュアル(Molecular Cloning:A Laboratory Manual)、第2版;コールドスプリングハーバーラボラトリー出版、コールドスプリングハーバー、ニューヨーク州(1989)に記載されているように行う。
【0045】
心不全における機能悪化の病因に関するメカニズムの1つが、一部は心筋細胞の進行している死によることが益々明らかになったので(Sabbah,2000)、本発明は価値がある。この問題に対する解決は、失った細胞の代わりとなるか、または現在機能している心細胞のさらなる強化を提供する新たな心細胞で、心筋の濃度を高め(enrich)かつ/または増やし、これにより欠けている心臓のポンプ機能を改善することである。
【0046】
本発明は副作用が知られておらず、しかも処置が比較的非侵襲的であるので、すべての既存の処置よりも有利である。例えば心不全の処置は現在、主に神経体液系を妨害する薬剤の使用に基づく。さらに心臓移植ならびに心室または両心室補補助デバイスの使用を含む外科的処置が存在する。本発明により提供される利点は、疾患の主原因、すなわち筋節の損失に直接取り組むことにより心不全を処置する能力である。それ故に欠けている心臓の全体的機能に寄与する筋節に分化する幹細胞による心筋の増加(re−population)は新規であり、そして問題の核心をついている。他の利点には薬理学的治療の使用にしばしば伴う副作用の不存在、および心臓移植または他の臓器移植でかかる免疫拒絶
の不存在および幹細胞により生成される栄養因子を増加させる能力を含む。
【0047】
本発明は多くの現行の外科的治療および恐らく薬理学的治療にも代わる可能性を有する。カテーテルに基づく取り組みを使用して脳抽出物と一緒に幹細胞を欠けている心臓へ送達できるようにする既存のデバイスは、このように開胸手術の必要性を排除する。さらに本発明はヒトの医学的環境および獣医学的状況の両方に応用可能である。
【0048】
本発明の方法および組成物は、本明細書に含む実施例で例示する。具体的態様を本明細書では開示するが、それらは可能性を全て試したわけではなく、そして当業者に知られている計画および方法で変動する他の適当な計画も含むことができる。基本的には当業者に知られている任意の種々の計画、方法、構造および材料を、本発明の精神から逸脱することなく利用することができる。
【実施例】
【0049】
方法:
分子生物学の一般法:当該技術分野で知られており、そして具体的には記載しない標準的な分子生物学技術は、一般にSambrook et al.,モレキュラークローニング:ア ラボラトリーマニュアル、コールドスプリングハーバーラボラトリー出版、ニューヨーク(1989)、およびAusubel et al.,分子生物学の現在の手法(Current Protocols in Molecular Biology)、ジョン ウィリー アンド サンズ(Jone Wiley and Sons)、バルチモア、メリーランド(1989)およびPerbal、分子クローニングの実践的手引き(A Practical Guide to Molecular Cloning)、ジョン ウィリー アンド サンズ、ニューヨーク(1988)、およびWatson et al.,組換えDNA(Recombinant DNA)、サイエンティフィック アメリカン ブックス(Scientific American Books)、ニューヨーク、およびBirren et al(編集)、ゲノム分析:ア ラボラトリーマニュアルシリーズ(Genome Analysis:A Laboratory Manual Series),第1〜4巻、コールドスプリングハーバーラボラトリー出版、ニューヨーク(1998)、および米国特許第4,666,828号;同第4,683,202号;同第4,801,531号;同第5,192,659号および同第5,272,057号明細書および引用により編入されている参考文献に説明されている方法論に従った。ポリメラーゼ連鎖反応(PCR)は一般に、PCRプロトコール:方法および応用の手引き(PCR Protocols:A Guide To Methods And Applications)、アカデミック出版、サンディエゴ、カリフォルニア州(1990)のように行った。フローサイトメトリーと組み合わせたIn−situ(In−cell)PCRは、特異的DNAおよびmRNA配列を含む細胞を検出するために使用することができる(Testoni et al,1996,Blood 87:3822)。
【0050】
免疫学の一般法:当該技術分野で知られており、そして具体的には記載しない免疫学における標準法は、 一般にStites et al(編集)、基礎的および臨床的免疫学(Basic and Clinical Immunology)(第8版)、アップレトン アンド レンゲ(Appleton & Lange)、ノルウォーク、コネチカット州(1994)およびMishell and Shiigi(編集)、細胞免疫学における選択された方法(Selected Methods in Cellular Immunology)、W.H.フリーマン社(W.H.Freeman and Co)、ニューヨーク(1980)に従う。
【0051】
治療薬の送達
本発明の細胞は個々の患者の臨床的状態、投与の部位および方法、投与計画、患者の年齢、性別、体重および医療専従者に知られている他の因子を考慮して良好な医学的プラクティスに従い投与そして投薬される。本発明の目的について製薬学的な「有効量」は、このように当該技術分野で知られているような考察に従い決定される。この量は限定するわけではないが改善された生存率またはより早い回復、あるいは当業者により適切な基準として選択されるような症状および他の兆候の改善または排除を含む改善を達成するために効果的でなければならない。
【0052】
本発明の方法では、本発明の細胞は種々の方法で投与することができる。これは細胞として、または製薬学的に許容され得る塩として投与することができ、そして単独で、または有効成分として製薬学的に許容され得る担体、希釈剤、補助剤および補形剤と組み合わせて投与することができることに注目すべきである。細胞は経口で、皮下に、または静脈内、動脈内、筋肉内、腹腔内を含む非経口的に、および鼻内投与ならびにくも膜下および注入技術で投与することができる。細胞のインプラントも有用である。処置される患者は温血動物、そして特に人間を含む哺乳動物である。製薬学的に許容され得る担体、希釈剤、補助剤および補形剤ならびにインプラント担体は一般に、本発明の有効成分と反応しない不活性な非毒性の固体または液体充填剤、希釈剤またはカプセル化材料を称する。
【0053】
ヒトは一般に本明細書に例示するマウスまたは他の実験動物よりも長期間、処置され、その処置は疾患プロセスの長さおよび薬剤の効力に比例する長さを有する。投薬は単回投与または数日の期間にわたる多回投与であることができるが、単回投与が好ましい。
【0054】
投薬は単回投与または数日間の多回投与であることができる。処置は一般に疾患プロセスの長さおよび薬剤の効力および処置する患者の種に比例する長さを有する。
【0055】
本発明の細胞を非経口的に投与する時、一般に単位注射剤形(溶液、懸濁液、乳液)に配合される。注射に適する製剤には滅菌水溶液または分散剤および滅菌の注射可能な溶液または分散剤に再構成するための滅菌粉末を含む。担体は例えば水、エタノール、ポリオール(例えばグリセロール、プロピレングリコール、液体ポリエチレングリコール等)、それらの適当な混合物、および植物油を含む溶媒または分散媒質であることができる。
【0056】
適切な流動性は、例えばレシチンのようなコーティングの使用により、分散剤の場合は必要な粒子サイズを維持することにより、および表面活性剤の使用により維持することができる。綿実油、ゴマ油、オリーブ油、大豆油、トウモロコシ油、ヒマワリ油またはピーナッツ油およびミリスチン酸イソプロピルのようなエステルのような非水性補形剤も、細胞組成物の溶媒系として使用することができる。さらに抗微生物剤、保存剤、酸化防止剤、錯化剤およびバッファーを含む組成物の安定性、殺菌性および等張性を強化する種々の添加剤を加えることができる。微生物の作用の防止は、種々の抗バクテリアおよび抗菌・カビ剤、例えばパラベン、クロロブタノール、フェノール、ソルビン酸等により確実にすることができる。多くの場合で、張性調整剤、例えば糖、塩化ナトリウム等を含むことが望ましい。注射可能な剤形の長期吸収は、吸収を遅らせる作用物質、例えばモノステアリン酸アルミニウムおよびゼラチンの使用によりもたらすことができる。しかし本発明に従い、任意の補形剤、希釈剤または添加剤の使用は細胞と適合しなければならない。
【0057】
滅菌した注射可能な溶液は、本発明を実施するために利用する細胞を、所望により様々な他の成分を含む必要量の適切な溶媒に必要な量で包含することにより調製することができる。
【0058】
本発明の薬理学的製剤は、種々の補形剤、補助剤、添加剤および希釈剤のような適合性のある担体を含む注射可能な製剤で患者に投与することができ;または本発明で利用する
細胞は、モノクローナル抗体、媒介型送達、イオン導入的、ポリマーマトリックス、リポソームおよび微小球のような緩効性の皮下インプラントまたは標的化送達系の状態で患者に非経口的に投与することができる。本発明に有用な送達系の例には:5,225,182;5,169,383;5,167,616;4,959,217;4,925,678;4,487,603;4,486,194;4,447,233;4,447,224;4,439,196;および4,475,196を含む。多くの他のそのようなインプラント送達系およびモジュールが当業者には周知である。
【0059】
本発明で利用する細胞の薬理学的製剤は、患者に経口的に投与することができる。錠剤、懸濁液、溶液、乳液、カプセル、粉末、シロップ等の中で細胞を投与するような常法を利用することが可能である。経口的または静脈内に細胞を送達し、そして生物学的活性を保持する既知の技術が好適である。
【0060】
1つの態様では、本発明の細胞を最初に静脈内注入により投与して血液レベルを適当なレベルにすることができる。次いで患者のレベルは経口剤形により維持されるが、患者の状態に依存して、そして上に示したように他の投与形態を使用することもできる。投与する量は処置する患者について変動し、そして1日あたり約100ng/kgの体重から100mg/kg体重で変動し、そして好ましくは1日あたり約10mg/kg〜10mg/kgである。
【0061】
実施例1
骨髄間質細胞(MSCs)を用いた外傷性の脳損傷(TBI)の処置は、ラットの機能的成果を改善する。組織交換は細胞移植治療の単なる代償的手段ではない。種々の増殖因子が傷害を受けた組織の修復および交換を媒介することが示されたので、MSCsは傷害を受けた組織の処置に役割を果たす栄養的支援を提供する。TBIに由来する大脳組織抽出物に対するヒトMSCs(hMSCs)の応答を調査し、そしてTBI環境がhMSCsの分化および増殖因子の分泌を誘導するかどうかを決定するために実験した。hMSCsはTBI抽出物とインビトロで培養し、そして免疫細胞化学および定量的サンドイッチ酵素−連結免疫吸着アッセイ(ELISA)を行った。結果はTBIでコンディショニングしたhMSCsが特異的な細胞性タンパク質マーカー:神経細胞核用のNeuN(全hMSCsの0.2〜0.5%)、初期ニューロンの分化および神経突起の伸長用のTuj−1(6〜10%)、星状膠細胞用のGFAP(4〜7%)および小突起膠細胞用のMBP(3〜5%)を発現したことを示す。加えて、TBI抽出物で処置したhMSCsは脳由来神経栄養因子(BDNF)、神経成長因子(NGF)、塩基性繊維芽細胞増殖因子(bFGF)、血管内皮増殖因子(VEGF)および肝細胞増殖因子(HGF)の分泌を時間依存的様式でアップ−レギュレーションすることにより応答する。これらのデータはTBI抽出物が、hMSCsが脳組織の神経形態およびタンパク質表現型を発現するようにさせていることを示している。さらにELISAデータは移植したhMSCsが、神経保護および血管新生を助長することができる多くの増殖因子の反応性分泌を介して治療的利益を提供することを示す。
【0062】
骨髄間質細胞(MSCs)は外傷的損傷(TBI)に供されたラットに静脈内から移植された時、神経機能の回復を促進する(Lu et al.,2001a)。移植でMSCsは損傷を受けた組織の場所に優先的に移動し、そして幾つかの細胞が脳内因性−様細胞の表現型のタンパク質を発現する(Lu et al.,2001b;Lu et al.,2001a;Mahmood et al.,2001)。幹細胞群による損傷した組織の長期交換法は、神経損傷の処置に対する簡単な取り組みであり、TBIモデルの急性および短期の治療用移植において、低レベルのMSC分化が機能的利益を提供することはないようで(Lu et al.,2001b;Lu et al.,2001a;Mahmood et al.,2001)、そして利益を提供するメカニズムは未知の
ままである。
【0063】
MSCsは種々のサイトカインおよび増殖因子を自然に生産し(Takai et al.,1997;Labouyrie et al.,1999;Bjorklund and Lindvall,2000;Dormady et al.,2001)、その分泌特性はそれらの微小環境によって影響を受ける(Dormady et al.,2001)。脳−由来神経栄養因子(BDNF)および神経成長因子(NGF)のようなニュートロフィンは、インビボおよびインビトロの両方で損傷したCNS組織の生存を増加させる(Hefti,1986;Kromer,1987;Koliatsos et
al.,1993;Bullock et al.,1999;Gage,2000)。前臨床実験で広く実験された増殖因子は塩基性繊維芽細胞増殖因子(bFGF)(Ay
et al.,1999)である。虚血の発生から数時間内にbFGFを静脈内に投与すると、恐らく脳梗塞の境界(周縁部)で細胞を直接的に保護することにより梗塞のサイズを低減させる(Ay et al.,1999)。血管内皮増殖因子(VEGF)発現も血管新生および神経修復を促進する(Papavassiliou et al.,1997)。VEGFによる発作の処置は、機能的成果を向上させる(Zhang et al.,2000b)。肝細胞増殖因子(HGF)の発現は、損傷後の脳内で自然にアップ−レギュレーションされ、そしてインビトロで脳のニューロンに対して抗−アポトーシス効果を示す(Zhang et al.,2000a)。
【0064】
材料および方法
試薬
ハンクスのバランス塩溶液(HBSS)、ダルベッコの改良イーグル培地(DMEM)、ノックアウトDMEM、ノックアウト血清代替、ウシ胎児血清(FBS)、トリプシンおよびエチレンジアミン−四酢酸(EDTA)は、ギブコ(GIBCO)(グランドアイランド、ニューヨーク州)から購入した。Ficollはファルマシア(Pharmacia)(ピスカタウェイ、ニュージャージー州)から購入した。モノクローナル神経核抗原(NeuN)、ポリクローナルβ−チューブリンアイソタイプ1(Tuj−1)、グリア繊維酸性タンパク質(GFAP)およびミエリン塩基性タンパク質(MBP)に対する抗体は、ケミコン(CHEMICON)(テメクーラ、カリフォルニア州)から購入した。BDNF、bFGF、VEGFおよびHGF用のサンドイッチ酵素−連結免疫吸着アッセイ(ELISA)のキットは、R&Dシステムズ(ミネアポリス、ミネソタ州)から得た。NGF ELISAキットは、研究室で作成した。抗−β(2.5S、7S)NGFモノクローナル抗体、抗−β(2.5S、7S)NGF−β−gal、NGF−β標準は、ロッシュ モレキュラー バイオケミカルズ(Roche Molecular Biochemicals)(インディアナポリス、イリノイ州)から購入した。特に示さない限り、試薬はシグマケミカルズ社(セントルイス、ミズーリ州)から得た。
【0065】
初代hMSCs培養
初代骨髄は3名の正常なヒトドナーの腸骨稜に由来する15〜16mlの吸引物から得た。各吸引物はHBSSで1:1に希釈し、そして約10mlのFicollに重層した。2,500×gで30分間遠心した後、単核細胞層を界面から取り出し、そしてHBSSに懸濁した。細胞は1,000×gで10分間遠心し、そして5×106細胞を各100mmの組織培養皿(ファルコン(Falcon)、ベクトン−デッキンソン(Becton−Dickinson)、ニュージャージー州)で完全DMEM(10%FBSを含有する)に再懸濁した。細胞を5%CO2のフラスコ中、37℃で3日間インキューベーションし、そして非付着細胞は培地を交換することにより除去した。培養がコンフルエントに達した時(通常は2〜3週間で)、細胞はリン酸緩衝化生理食塩水(PBS、pH7.4)中の0.05重量/容量%トリプシンおよび0.02重量/容量%EDTAを用いて37℃で5分間回収し、もう一度まき、そして再度2週間培養し、そして回収した。次
いで細胞を後で使用するために凍結した。これらの実験に使用した細胞は、3〜5継代で回収した。
【0066】
外傷的に損傷した脳に由来する抽出物
実験は体重が250〜350gのオスのウィスター(Wistar)ラットで行った(n=21)。麻酔はラットに抱水クローラル(35mg/100g体重)を腹腔内注射することにより誘導した。直腸温度はフィードバック−調節された水加熱システムを使用して外科的手順の間、37℃に維持した。ラットを定位枠に配置した。損傷は左皮質(同側皮質)に、直径6mmのチップを有する気体ピストンで4m/秒の速度および2.5mmの圧縮で衝撃を与えることにより誘導した(Dixon et al.,1991)。対照動物には開頭術を行ったが損傷は与えなかった。ラットは術後1、4および7日に屠殺した(各時期あたりn=6)。脳組織抽出物は実験および正常対照(n=3)ラットから直ちに得た。両実験ラットおよび対照ラットの左半球のセグメントを氷上に置き、そして湿潤重量をグラムで迅速に測定した。続いて組織片はDMEM(150mg組織/mlDMEM)を加えることにより均一化し、そして氷上で10分間、インキューベーションした。ホモジネートは4℃で10,000×gにて10分間遠心した。上清を集め、そしてhMSCsの処置のために−80℃で保存した。
【0067】
細胞分化
タンパク質の表現型実験は、1.0×106細胞を35mm皿に播種し、そしてそれらを新鮮なノックアウトDMEM(10%、20%または40%のTBI組織抽出上清を含む20%ノックアウト血清代替を含む)で処理することにより行った。すべての細胞を7日間インキューベーションした。免疫反応性神経−様細胞の予測は、細胞を3枚の培養皿中、10の無作為視野(10×対物)で、最少3つの異なる実験で計数することに基づいた。神経細胞の表現型の割合は、細胞総数から算出した。
【0068】
二重および三重染色免疫細胞化学
hMSCsは、上記の異なる処理を使用して1.0×106の密度で35mm皿中のガラスカバースリップ(18×18mm2)にまいた。ガラスカバースリップ上の細胞を免疫細胞化学に使用した。培養基の上清は、以下に記載するように定量的ELISA測定に使用した。細胞をPBS(pH7.4)で洗浄し、そして4%パラホルムアルデヒドで10分間固定した。非特異的結合部位は、4%正常ウマ血清、2%ウシ血清アルブミンおよび0.1%Triton X−100で1時間ブロックした。カバースリップをPBSで洗浄し、そしてTuj−1、GFAPまたはMBPに対する1次抗体と1時間インキューベーションした。それらを再度PBSで洗浄し、そしてフルオレセイン−イソチオシアネート(FITC)結合ヤギ抗−マウスまたは抗−ウサギIgG2次抗体と1時間インキューベーションした。Tuj−1染色したhMSCカバースリップをもう一度洗浄し、そして第2の1次抗体NeuNと一晩インキューベーションし、次いでPBSで洗浄し、そしてシアニン−5.18(Cy5)結合抗−マウスIgG2次抗体と1時間インキューベーションした。4’b−ジアミジン−2−フェニルインドールジヒドロクロライド(DAPI)色素を使用して、視野の核を計数することにより細胞数を決定した。次いでカバースリップにグリセルゲル上層媒質(glycergel mounting medium)をのせた。
【0069】
ELISA
ELISAを使用してhMSCsによるBDNF、NGF、bFGF、VEGFおよびHGFの分泌を、TBIおよび正常脳抽出物上清によりコンディショニングした培養の1、4および7日に測定した。簡単に説明すると、すべての試薬および作業標準は製造元により指示された通りに準備し、そして50〜150μlの標準またはアッセイ希釈溶液を96ウェルプレートのウェル毎に加えた。ウェルは穏やかに混合し、そして室温で2〜4
時間インキューベーションした。各ウェルを吸引し、そして洗浄し、このプロセスを3回繰り返した。最後の洗浄後、残るいかなるバッファーもウェルを吸引、またはデカントすることにより除去し、そして200μlの種々の増殖因子結合物を各ウェルに加えた。次いでプレートを室温で2〜4時間インキューベーションした。吸引および洗浄を繰り返した。200μlの基質溶液を各ウェルに加え、そして室温で15〜30分間インキューベーションした。50μlの停止溶液を加え、そして穏やかに混合した。各ウェルの光学密度は、450〜620nmに設定したマイクロプレートリーダーを使用して、30分以内に決定した。
【0070】
統計分析
スチューデントt検定を使用して刺激したサンプルとそれらの各対照との間の形態学的差異を評価した。時間応答の有意さは、分散の繰り返し測定分析により評価した(ANOVA)。ELISAデータは種々の増殖因子濃度の対数 対 光学密度の対数をプロットすることにより直線化し、そして最も合う直線を回帰分析により決定した。各標準、対照およびサンプルについて二重の読み取りの平均を作成し、そしてゼロ標準光学密度の平均を引いた。すべての値は平均±SDで表す。p<0.05を統計的に有意と考えた。
【0071】
結果
hMSCsの神経様細胞への形態的分化
位相差顕微鏡は、10%FBSを補充した完全DMEM中で培養した繊維芽細胞様hMSCsの正常形態を示す。7日間の暴露後、20%ノックアウト血清代替を含むノックアウトDEME中、いくらかの屈折性(refractive)細胞が短い突起を表した。わずかな細胞(全細胞〜2〜3%、表1)が、正常脳組織抽出上清で培養したhMSCs中でニューロン様細胞の形態を表した。しかし正常脳抽出物が誘導するhMSCs増殖(1.56×104±0.2×104/ml)は、20%ノックアウト血清代替を含むノックアウトDMEM中で培養したhMSCs(1.24×104±0.5×104/ml)に匹敵した(p<0.05)。多様な形態であるが、しかし典型的には長い分枝突起(突起長>10μm)および成長円錐様末端構造を持つ屈折性細胞(全細胞の〜13〜30%のニューロン様細胞、表)、および小さく、そして多極突起(multipolar process)を持つ星状細胞が20%〜40%TBI抽出上清中で培養したhMSCs中に検出された。TBI(1.08×104±0.3×104/ml)抽出物カルチャー中の全細胞数に関しては減少する傾向があったが、これは統計的に有意には至らなかった。種々の濃度のTBI組織抽出物のすべてが、hMSCsを形態学的に似ている神経様細胞に誘導した。
【0072】
hMSCsによる神経マーカーの発現
20%ノックアウト血清代替を含むノックアウトDMEMおよび10%、20%または40%のTBI脳組織抽出物カルチャーを含む中で7日後、hMSCsを免疫細胞蛍光法のために処理した。このhMSCsのDAPI(核の同定には紫青色)、FITC(緑色)での二重標識、またはCY5(赤色)の三重標識により、骨髄起源の細胞がニューロン(NeuN、Tuj−1)、星状膠細胞(GFAP)および小突起膠細胞(MBP)の神経特異的マーカーを発現するかどうかの決定が可能となった。細胞核はDAPIにより染色された。免疫反応性について染色したカルチャーでは、0.2〜0.5%のhMSCsがNeuNタンパク質を発現し、そして6〜10%のhMSCsがTuj−1表現型により標識された。NeuNおよびTuj−1免疫反応性は同じ細胞に同時に局在した(ピンク色)。4〜7%のhMSCs由来細胞がGFAP免疫反応性を発現した。3〜5%のhMSCs由来細胞がMBP免疫反応性を発現した。調査した種々の濃度のTBI抽出物のすべてが、hMSCsが神経の表現型の免疫反応性を発現することを誘導した。
【0073】
TBI組織抽出物上清で処置したhMSCsによる増殖因子の分泌
20%ノックアウト血清代替培地を含むノックアウトDMEMおよび20%のTBI抽出物上清を含む中で1、4および7日後、hMSCsにより分泌される増殖因子を図1に示す。正常脳およびTBI組織抽出物は、インビトロでhMSCsのBDNF(図1a)、NGF(図1b)、bFGF(図1c)、VEGF(図1d)およびHGF(図1e)の分泌に影響を与えた。正常脳組織抽出物は培地単独の対照と比較して、インビトロですべての検出される増殖因子について分泌を増加した。各実験群で、BDNF、NGFおよびHGF分泌は、TBI抽出物によるコンディショニングで1日から7日を通して増加した。VEGF分泌は正常脳およびTBI後の脳の群で同様であった。VEGF分泌は1日のカルチャー中よりも4日および7日間のカルチャー中で一貫して大きかった。bFGF分泌のプロフィールは、他の栄養因子とは異なった。1日の期間のカルチャー中でbFGFの分泌値は、他の増加因子とは異なり、4日および7日の値を越えるか、または等しかった。これらのデータはTBIがインビトロでhMSCsによるNGFおよびBDNFの分泌を促進することを表し、そしてすべてのニューロトロフィンおよび試験した増殖因子が、血清代用培地中のhMSCsに比べて正常脳中でのhMSCs分泌に有意な上昇を示した。
【0074】
考察
TBI抽出物で処置したヒト骨髄間質細胞は、形態学的に神経様細胞に分化し、そして大脳実質細胞の表現型のタンパク質を発現することができる。hMSCsはBDNF、NGF、bFGF、VEGF、HGFを分泌し、そして分泌レベルはカルチャー中のTBI抽出物への暴露時期およびTBI組織が抽出された時期の両方に依存する。
【0075】
データはhMSCsがインビトロでTBI組織抽出物に暴露されることにより、形態学的に神経様細胞の亜群に似るように仕向けられ得ることを示す。処置したhMSCsはNeuN(神経に)、Tuj−1(初期分化および神経突起の伸長に)、GFAP(星状膠細胞に)およびMBP(小突起膠細胞に)のような特異的な脳タンパク質マーカーも発現する。すなわちhMSCsは多くの細胞系統に分化できる。研究ではMSCsが試薬(Sanchez−Ramos et al.,2000;Woodbury et al.,2000;Deng et al.,2001)によりカルチャー中で、および損傷したCNS中で(Azizi et al.,1998;Kopen et al.,1999;Chopp et al.,2000;Li et al.,2000;Chen
et al.,2001;Lu et al.,2001b;Lu et al.,2001a;Mahmood et al.,2001)、ニューロン様細胞へ分化させられ得ることが報告された。このデータは初めて、幾らかのhMSCsがTBI組織抽出物を含む特異的な微小環境内にインビトロで置かれた時、脳実質細胞の形態学的ならびに表現型的特徴の推定により応答することを示す。治療用の移植で、これらの細胞はTBI傷害脳における細胞代替物の供給源を提供することができる。
【0076】
骨髄間質細胞は正常な造血に必要である。MSCsにより分泌される造血を媒介する多数の可溶性因子が特徴付けられた(Berezovskaya et al.,1995;Majumdar et al.,1998;Majumdar et al.,2000)。MSCsはIL−6、−7、−8、−11、−12、−14、−15およびFlt−3リガンドを生産し、そして定常状態レベルのM−CSF、G−CSF、GM−CSFおよびSCFを誘導する。しかしこれらの因子単独ではTBIのMSC処置の治療的利益の基になるメカニズムを提供しないようである。他の未だに未知の間質因子の存在が仮定された。ここに提示する実験において、定量的なELISAデータは、TBI組織抽出物で処置したhMSCが培養時期ならびにTBI組織抽出物が得られた時期の両方に依存する様式でBDNF、NGF、bFGF、VEGFおよびHGFを同時に分泌することを示している。BDNFの静脈内投与により、ラットにおけるTBI後の損傷容量は減少し、そして脳損傷におけるBDNFの神経保護的役割を支持する(Koliatsos e
t al.,1993;Bullock et al.,1999)。NGF注射後、またはNGF−生産繊維芽細胞を介して、およびNGFトランスジェニックマウスの神経保護的能力は、実験的な脳損傷の異なるパラダイムを証明した(Hefti,1986;Kromer,1987;Caneva et al.,1995;Gage,2000)。bFGFの静脈内投与はラット、マウスおよびネコを対象とした局所脳虚血のモデルにおいて、梗塞容量を減少させた(Sugimori et al.,2001)。血管新生の強力なプロモーターであるVEGFも、軸索伸長、神経細胞生存およびシュワン細胞増殖を刺激する(Sondell et al.,1999)。挫骨神経の挫壊損傷後のVEGF増加は、VEGFが神経再生に役割を果たしていることを示唆する(Sondell and Kanje,2001)。ラットの実験的発作をVEGFで処置すると、機能欠損が有意に減少する(Zhang et al.,2000b)。hMSCsはHGFを構成的に生産し(Takai et al.,1997)、そしてHGFは組織修復に重要な分子である(Mizuno et al.,2000)。したがってこの知見はhMSCsが正常な脳およびTBI環境に感受性であり、そして多くの因子の生産を有意に増加することにより応答することを強く示す。外傷的に損傷した神経組織に移植したMSCsの生存を仮定すると(Lu et al.,2001b;Lu et al.,2001a;Mahmood et al.,2001)、傷つけられた組織の局所レベルでのMSCsによる神経保護および血管新生因子の連続的および微小環境的応答分泌は、MSC移植により提供される機能的利益における鍵である。
【0077】
データは成熟(adult)MSCsが誘導されて、それらの間葉系拘束を克服し、そして種々の神経性疾患を処置するために豊富かつ接近可能な脳細胞的および分子的リザーバーを構成することができる。この結果は移植されたMSCsがTBI後の機能的利益を提供することを示す(Lu et al.,2001b;Lu et al.,2001a;Mahmood et al.,2001)。特にMSCsは患者自身の腸骨稜に由来する少量の骨髄から容易に得、そして培養で拡大することができる。したがってMSCsは移植用の自家細胞の容易に入手可能かつ補充可能な供給源を提供する。損傷した組織中のこれらの細胞は、損傷した能の修復および可塑性のために活力のある増殖因子の連続的供給源を提供する。
【0078】
図1は、TBI組織抽出物上清で処置したhMSCsからBDNF(図1A)、NGF(図1B)、bFGF(図1C)、VEGF(図1D)およびHGF(図1E)の成長因子の分泌を示す。この分泌はELISAで定量した。正常な能組織抽出物は、培地単独の対照に比べてインビトロで検出されたすべての増殖因子の分泌を増加させた。各実験群においてTBI抽出物でのコンディショニングで1日から7日にBDNF、NGFおよびHGF分泌が増加した。VEGF分泌は正常脳およびTBI後の脳群については同様であった。VEGF分泌は4日および7日間のカルチャー中で、1日目のカルチャー中よりも一貫して大きかった。bFGF分泌に関するプロフィールは他の栄養因子とは異なった。1日目のカルチャー中、bFGF分泌値は他の増殖因子とは対照的に、4日および7日の分泌値を越えるか、またはそれに等しかった。
【0079】
実施例2
方法:
ラットを一時的な中大脳動脈閉塞に供し、そして発作から1日後に3×106hMSCをIV注射した。機能的な成果を発作前および1、7および14日後に測定した。混合リンパ球反応および細胞傷害性Tリンパ球の発生は、hMSCの免疫拒絶を測定した。ヒト細胞核に特異的なモノクローナル抗体(mAb1281)を使用してhMSCを同定し、そして神経の表現型を測定した。ELISAはhMSC−処置または未処置ラットに由来する脳組織中のニュートロフィンレベルを分析した。ブロモデオキシウリジン注射を使用して新たに形成された細胞を同定した。結果:機能の有意な回復が虚血の対照ラットに比
べてhMSCで処置したラットに14日で見いだされた。わずか(1〜5%)なhMSCが脳実質細胞の表現型のタンパク質を発現した。脳由来神経栄養因子および神経成長因子は有意に増加し、そしてアポトーシス細胞は虚血境界領域で有意に減少し;ブロモデオキシウリジン反応性細胞がhMSCで処置したラットの虚血性半球の脳室下領域でより有意により多く検出された。hMSCは細胞傷害性Tリンパ球の誘導なしにリンパ球の増殖を誘導した。
【0080】
結論:
ラットの発作のhMSC処置から生じる神経学的利益は、虚血組織中の増殖因子の増加、損傷の半影領域のアポトーシスの減少、および脳室下領域中の内因性細胞の増殖からもたらされ得る。
【0081】
骨髄間質細胞(MSC;間葉系幹および前駆細胞とも呼ばれる)は多能性であり、しかもインビトロおよびインビボで組織の修復を補助することができる。MSCは通常、骨、軟骨および間葉系細胞で生じ、そしてMSCは筋細胞、肝臓細胞、グリア細胞およびニューロンに分化できる。MSCは血液脳関門を通過し、そして前脳および小脳全体に移動することができる。メスの虚血性ラットに全身的に注入されたオスに由来する骨髄細胞は、虚血性皮質に優先的に移動する。照射されたメスのマウスに投与されたオスのマウスの骨髄細胞は数日から数週間にわたり脳に入り、そしてミクログリアおよび星状膠細胞に分化する。
【0082】
発作後の成果を改善した神経保護薬はなかった。ラットにおける心筋虚血および心疾患のためのヒトMSC(hMSC)の治療的利益は、組織の置き換えおよび血管新生および脈管形成の誘導からもたらされると思われる。MSCは多数の増殖因子およびサイトカインを分泌し、これらは通常、造血前駆体が増殖し、そして分化することを支持する。骨髄はVEGFおよびbFGFを含む数種の血管新生増殖因子を分泌する種々の原始細胞を含む。このようにMSCは神経性疾患を処置するための価値ある治療に発展することができる。中大脳動脈閉塞(MCAO)のラットモデルでは、齧歯類MSCで処置した時、有意な機能的回復が証明された。
材料および方法。
【0083】
hMSC調製およびインビトロでの増殖キネティクス。インビトロでのhMSCの細胞増殖キネティクスおよび拡大を調査するために、骨髄吸引物を局所麻酔下で3名の健康なヒトドナーの後部腸骨稜の穿刺により得た。骨髄検体の単核細胞(1人あたり15〜16mL)をFicoll密度勾配(Ficoll−Paque、[密度、1.073]、ファルマシア、カリフォルニア州)で分離した。hMSCカルチャーの単離および樹立は、Digirolamo et al.により記載されているように行った。簡単に説明すると、単核細胞を1×106細胞/75cm2組織培養フラスコの密度で、20mLの低−グルコースダルベッコ改良イーグル培地(ギブコ−BRL、グランドアイランド、ニューヨーク州)にまき、そして20%のウシ胎児血清(ギブコ−BRL)、100単位/mLのペニシリン、100μg/mLストレプトマイシンおよび2ミリモル/リットルのL−グルタミンを補充した。72時間のインキューベーション後、非付着細胞をカルチャーから除去し、そして新たな培養基をフラスコに加えた。細胞増殖および細胞収量を評価するために、プラスチックに付着したhMSCを14日(90%の集密度)およびその後7日毎に分けた。有核骨髄細胞はサイトメーターを使用して計数して移植に十分な細胞数を確保した。3×106hMSC用量を各ラットに注射した。5継代目から回収し、そしてさらに20%のノックアウト血清代用培地(ギブコ−BRL)を含むノックアウトダルベッコ改良イーグル培地(無血清;ギブコ−BRL)で培養したhMSCを、ELISA測定に使用した(n=6)。hMSCによる脳由来の神経栄養因子(BDNF)および神経増殖因子(NGF)の分泌は、無血清ダルベッコ改良イーグル培地中で1、4および7日
に測定した。
【0084】
インビトロでのラット脾臓細胞とhMSCとの間の混合リンパ球反応。抗原が誘導するリンパ球の増殖を研究するために、健康なラットまたは2週間前に3×106hMSCを注射したラットに由来する2×105の脾臓細胞を3連で、照射(20Gy)hMSC有り、または無しで96時間、10:1の応答物(脾臓細胞)−対−刺激物(hMSC)比で培養した。混合細胞は3H−チミジン(0.25μCi/ウェル)で16時間、パルスをかけた。hMSCによる脾臓リンパ球増殖の誘導は、複製している脾臓細胞への3H−チミジンの取り込みにより測定した。カルチャーを自動化細胞回収機で回収し、そして3H−チミジンの取り込みを液体シンチレーションにより測定した。
【0085】
挿入式
インビトロでのhMSCに対するラット細胞傷害性Tリンパ球応答
Tリンパ球は移植片−対−宿主の致死的医原性疾患のイニシエーターとして関わっている。したがってヒトの移植片−対−ラット宿主T細胞応答を、51Crアッセイを使用して測定して溶解効果(lytic effect)を決定する。健康なラットの脾臓細胞または2週間前に3×106のhMSCを注射したラットの脾臓細胞を、照射hMSCと5日間、10:1の応答物(脾臓細胞)−対−刺激物(hMSC)比で培養した。インキューベーション期間の終わりに、生きている細胞をカルチャーから回収し、そして51Cr−標識hMSCに対する細胞傷害性について8時間の51Cr放出アッセイで試験した。
【0086】
動物MCAOモデル
成体のオスウィスターラット(体重270〜300g)を、チャールズリバーブリーデング社(Charles River Breeding Company)(ウィルミントン、マサチューセッツ州)から購入した。ラットは最初に3.5%ハロタンで麻酔をかけ、そしてフェイスマスクを使用して1.0%〜2.0%のハロタン(70%N2Oおよび30%O2中)で維持した。直腸温度はフィードバック調節温水システムを使用して、外科的手順の間を通して37℃に維持した。一過性のMCAOは、研究室で改良した血管内脈管閉塞(intraluminal vascular occlusion)の方法を使用して誘導した。右頸動脈、外頸動脈および内頸動脈を露出した。動物の体重により決定した長さの4−0のモノフィラメントナイロン糸(18.5〜19.5mm)を、その先端付近を焼炎加熱することにより丸くし、これを外頸動脈から内頸動脈の管腔へMCAの起点で遮断されるまで進めた。MCAOから2時間後、ハロタンで動物に再度麻酔をかけ、そして縫合糸をその先端が外頸動脈の管腔からとり除かれるまで引っ張ることにより再潅流を行った。
【0087】
実験群。
群1。
ニュートロフィンを測定するために、ラットは処置無しで(n=3)MCAOに供するか、または発作から1日後に1mLの全液体用量中に3×106MSC(n=3)または3×106肝臓繊維芽細胞(n=3)を尾の静脈に注射した。肝臓繊維芽細胞の実験は「対照」として限定され、ここで繊維芽細胞は対照細胞の宿主ラットに対する予期せぬ免疫応答を回避するために同種のウィスターラットから集めた。ラットはMCAOから7日後にニュートロフィンの測定のために屠殺した。3匹の健康なラットも対照個体として使用した。
【0088】
群2。
ラットは3×106hMSC(n=9)または3×106ラット肝臓繊維芽細胞(n=9;対照)を1日目に注射するMCAOに、あるいは細胞ドナー無しのMCAO単独(n
=10;対照)に供した。ラットは細胞の形態を測定するためにMCAOから14日後に屠殺した。MCAOは上衣および上衣下領域(脳室領域/脳室下領域[VZ/SVZ]とも呼ばれる)中の内因性の神経幹細胞および前駆細胞の増殖を誘導するので、群2の17匹のラットは細胞増殖を確認するために、ドナー細胞のIV注射有り、または無しでMCAO後から14日間、連続して毎日、ブロモデオキシウリジン(BrdU、新たに合成されたDNAを標識するチミジン類似体[50mg/kg];シグマ、セントルイス)の腹腔内注射を受けた。対照としてさらに2匹の健康な動物に50mg/kgのBrdUの腹腔内注射を毎日、14日間、死ぬ前まで与えた。
【0089】
行動試験。
すべての動物はMCAO前、およびMCAOから1、7および14日後に、実験群に対して知らされていない調査者による行動試験を受けた。前肢体性感覚不均斉を測定するために、小さい接着剤付きペーパードット(113.1mm2)を両側の触覚の刺激物として使用し、そしてホームケージ中、1日に5回の実験について各前肢の手首の橈側面に適用した。ラットの刺激物への接触および除去の時期を記録した。個々の実験は少なくとも5分間の間隔をあけた。動物は手術前に3日間、接着−除去ドット試験に慣らされた。いったんラットが10秒以内にドットを除去できれば、ラットをMCAOに供した。改良した神経学的重症度の採点(mNSS)を使用して、神経的機能の様々な観点を等級分けした。mNSSは運動(筋肉状態および異常な運動)、感覚(視覚、触覚および自己刺激感応性)および反射試験の複合である。
【0090】
【表1】

【0091】
改良した神経学的重症度の採点試験
虚血脳から抽出物の調製:
MCAOから7日後、群1のラットにハロタンで麻酔をかけ;脳を摘出し、そして虚血性半球を氷上で切開した。次いでサンプルを−80℃に保存した。続いて各組織サンプルを1g/mLのホモジネートバッファー中で均一化した。ホモジネートを4℃で10分間遠心し(10,000g)、そして上清を分泌を測定するために集めた。
【0092】
サンドイッチELISAを使用した増殖因子の分泌の測定
BDNF ELISAキットはR&Dシステムズ(ミネアポリス、ミネソタ州)から得、そしてELISAは製造元の指示に従い調製した。ELISA溶液はNGFについて作成した。抗−β(2.5S、7S)NGFモノクローナル抗体、抗−β(2.5S、7S)NGF−β−ゲルおよびNGF−β標準は、ロッシュモレキュラーバイオケミカルズ(インディアナポリス、インディアナ州)から購入した。簡単に説明すると、虚血性組織から集めた上清またはhMSCからの無血清培養基を、100−〜200−μLの3連サンプルに分割した。BDNFおよびNGFに対するモノクローナル抗体は、製造元の使用説明に従い使用した。続いて各1次抗体に対する2次特異的ポリクローナル抗体を加えた。発色基質とのインキューベーション期間の後、増殖因子の量に比例して発色し、そしてマイクロプレートリーダー(450〜620nm)を使用して測定する。
【0093】
組織学的、免疫組織化学的およびアポトーシス評価。
スライドの調製
MCAOから14日後まで生かした群2のラットを、形態学的分析に使用した。その時点で、ラットにケタミン(44〜80mg/kgを腹腔内に)およびキシラジン(13mg/kgを腹腔内に)で麻酔をかけ、そしてヘパリンを加えたリン酸緩衝化生理食塩水(PBS)、続いてPBS中の4%パラホルムアルデヒドを管系に経心臓的に潅流した。脳はPBS中の4%パラホルムアルデヒドに2日間浸し、そして次に脳組織を7つの等しい間隔(2mm)の皮質塊に切断した。組織を処理し、そして各塊から100μm厚の自由に流動するビブラトーム(vibratome)皮質スライド(1つの塊あたり5個のビブラトームスライド)を切断した。すべての残りの脳塊はパラフィンに包埋し、そして連続して隣接する6μm厚のスライドを切断した。
【0094】
梗塞容量の測定
7個の塊から各皮質パラフィンスライドの1つ(6μm厚)をヘマトキシリン−エオシン(H−E)で染色した。7個の脳スライドはGlobal Lab Image分析システム(データ トランスレーション(Data Translation)、マルボロ、マサチューセッツ州)を使用して追跡した。間接的な損傷領域(ここで同側半球の完全な領域を反対側半球の領域から引く)を算出した。損傷容量は反対側半球と比較した損傷容量の割合として提示する。
【0095】
免疫組織化学染色。
正常血清でブロッキングした後、すべてのビブラトームスライドはPBS中で1:100に希釈したヒト核に特異的なモノクローナル抗体(mAb1281;ケミコン(Chemicon)、テメキューラ、カリフォルニア州)で4℃にて3日間処理した。マウスIgGに対するフルオレセインイソチオシアネート−結合ウサギ抗体(希釈、1:100、ダコパッツ、カリフォルニア州)との順次インキューベーション後、2次抗体をmAb1281に対する1次抗体に結合させた。hMSCに由来する細胞は形態学的基準およびドナー細胞に存在するが実質細胞には存在しないmAb1281での免疫組織化学的染色を使用して同定した。同じ細胞中でmAb1281および細胞型に特異的なマーカーの、細胞性同時局在を視覚化するために、二重染色を虚血中心部が中央にある連続参照ビブラトームスライド(100μm)に使用した(ブレグマで座標を取る−1.0、1.0mm)。各皮質スライドを第1の1次抗体、mAb1281で上記のように処理し、そして次にシアニン−5.18に結合した細胞型に特異的な第2の1次抗体(カルビオケム(calbiochem)、カリフォルニア州)で4℃にて3日間処理した:神経核抗原(神経核用のNeuN[希釈、1:200];ケミコン)、微小管−結合タンパク質2(神経樹状突起用のMAP−2[希釈、1:200];シグマ)、グリア繊維酸性タンパク質(星状細胞用のGFAP[希釈、1:1000];DAKO、カルピンテリア、カリフォルニア
州)およびvWF(内皮細胞用[希釈、1:400];DAKO)。各動物に関する陰性対照スライドは、免疫組織化学染色については1次抗体を省略した点を除き同一の調製を受けた。
【0096】
レーザー走査共焦点顕微鏡。
皮質のビブラトームスライドは、ツァイス(Zeiss)顕微鏡(バイオ−ラッド、ケンブリッジ、マサチューセッツ州)に乗せたバイオ−ラッド(Bio−Rad)のMSC1024(アルゴンおよびクリプトン)レーザー走査共焦点撮像システムで分析した。免疫蛍光標識スライドには、スライド上の緑(フルオレセインイソチオシアネート)および赤(シアニン−5.18)フルオロクロムを488nmおよび647nmのレーザービームにより励起し、そして発光を522nmおよび670nmの発光フィルターを通す光電子倍増管を用いて順次獲得した。mAb1281陽性細胞の総数は、全7個の塊に由来する各塊について5枚の連続スライド(100μm厚)を、細胞計数用のXYZステージエンコーダーを使用することにより測定した。26 次いで全前脳のmAb1281−陽性細胞の総数は、すべての7個の塊からmAb1281−陽性細胞数を合わせることにより算出した。動物あたり全部で500個のmAb1281−陽性細胞を計数して、細胞型に特異的なマーカー(NeuN、MAP−2、vWFおよびGFAP)と同時に局在するmAb1281−陽性細胞の割合を二重染色により得た。
【0097】
アポトーシス細胞染色。
ブレグマ−1.0に位置する上記の参照塊に由来する5枚の皮質パラフィンスライド(6μm厚;25−μm間隔)、1.0mmをアポトーシス細胞分析に使用した。これらのスライドはin situアポトーシス細胞検出のために、ターミナルデオキシヌクレオチジルトランスフェラーゼが媒介するdUTP−ビオチンニックエンド−ラベリング(TUNEL)法により染色された(ApopTag キット;オンコール(Oncor)、ゲチスバーグ、メリーランド州)。PBS中のH2O2で内因性のペルオキシダーゼ活性を消した後、スライドをターミナルデオキシヌクレオチジルトランスフェラーゼの中に置いた。抗−ジゴキシゲニン−ペルオキシダーゼをスライドに加え、そしてペルオキシダーゼを3,3’−ジアミノベンジジンで検出した。TUNEL染色後、スライドをメイヤー(Mayer)のヘマトキシリンでカウンター染色した。陰性対照スライドは各塊から行った。TUNEL調製物では、暗く茶色いアポトーシス体(>2)を含む細胞のみをアポトーシス細胞とした。
【0098】
図2は、右半球を3つのサブ領域(虚血中心部、虚血境界領域およびVZ/SVZ)に分割したラット脳の前交連のレベルで同定された標準的な皮質区画を表す。外因性のhMSC(mAb1281)で、同側および反対側半球のこれらの領域の細胞型陽性細胞(NeuN、MAP−2、GFAPおよびvWF)、およびアポトーシス細胞(TUNEL−陽性細胞)について測定した。日常的なH−E染色の組織的特徴を使用して3つの領域を同定した:虚血損傷の虚血中心部(エオシン好性バックグラウンドの拡散蒼白)および内側(神経網の空胞化または海綿状)および外側境界領域(海綿状から全体的に完全な組織[ほとんどの細胞が完全であった;しかし散乱した損傷および死んだ細胞も観察できた])、ならびに細胞の形状および染色能における改変。図2は処置に対する応答を分析するために、右半球を3つのサブ領域(虚血中心部[IC]、虚血境界領域[IBZ];および脳室領域/脳室下領域[VZ/SVZ])および8つの場(1、IC中の皮質;2、IC中の線条;3−4、IBZ中の皮質;5−6、IBZ中の線条;および7−8、VZ/SVZ中の線条)に分割したラット脳の前交連のレベルで同定された標準的な皮質区画を示す。
【0099】
統計分析
すべての測定は盲検的に行った。行動の採点(接着−除去ドット試験およびmNSS)
は正常について評価した。反復測定分析を行って行動の採点に及ぼす処置の効果を試験した。分析は0.1の有意さレベルで処置−時間の相互関係について試験することから始まり;全体の処置効果についての試験は、0.05の有意さレベルで相互関係が検出されない場合に行った。0.1の有意さレベルでの処置−時間の相互関係または0.05の有意さレベルでの全体的処置効果が存在するならば、各時点で各々の行動の採点に及ぼす処置効果のサブグループ分析を有意さレベル0.05で行った。あるいはサブグループ分析は予備的と考えた。損傷容量および細胞数という意味で、スチューデントt検定を使用して対照群と処置群との間の差異を評価した。ELISAデータはBDNFおよびNGF濃度の対数 対 光学密度の対数をプロットすることにより直線化し、そして回帰分析により最も合った直線を決定した。各標準、対照およびサンプルについて二連の読み取りの平均を作成し、そしてゼロ標準の光学密度の平均を引いた。処置および対照群の間の差異を試験するために、平均(SD)およびp値を提示する。
【0100】
結果。
インビトロでのhMSCの増殖動力学
3名の健康なヒトドナーからの骨髄由来hMSCを、培養拡大により試験した。初代培養では、hMSCは形態学的に均一な繊維芽様細胞群に成長した。通常7日の間隔でその後の継代中、hMSCは密に詰められた螺旋状細胞の一巻として成長した。5週目の終わりに(4継代)、hMSCは5.4から6.6×107細胞の間の範囲になった(表2)。
【0101】
【表2】

【0102】
インビトロでラット脾臓細胞とhMSCとの間の混合リンパ球反応および細胞傷害性Tリンパ球応答は、非刺激脾臓細胞に比べてhMSCが健康なラット脾臓細胞の増殖を有意に増加させた(刺激指数=18.8)(図2A)。hMSCを注射したラットに由来する脾臓細胞の増殖も、インビトロでhMSCを用いて再刺激した後に増加した(刺激指数=15.6);しかしこれらの細胞の増殖応答は健康なラットの脾臓細胞中と有意に異なら
なかった。これらのデータはhMSCがラット脾臓リンパ球に1次増殖応答を誘導でき、hMSCのラットへの投与は2次的なインビトロ増殖応答についてリンパ球をインビボで感作できないことを示す。
【0103】
図8Aはラット脾臓細胞とヒト骨髄間質細胞(hMSC)との間の混合リンパ球反応を示す;2×105の健康なラット脾臓細胞(N−Spl)または2週間前にhMSCでIV処置したラットからの脾臓細胞(T−Spl)を3連で、照射した(20Gy)hMSCを含んで、または含まずに96時間、10:1の応答物:刺激物比で培養した。カルチャーは3H−チミジン(0.25μCi/ウェル)で16時間パルスをかけ、そして自動化細胞回収機で回収した。3H−チミジンの取り込みを液体シンチレーションにより測定した。hMSC−処置と未処置ラットから得た脾臓細胞の間に差異は観察されなかった。SI=刺激指数。(B)ラット脾臓細胞(1×107)は、1×106照射(20Gy)hMSCと5日間培養した。インキューベーション期間の終わりに、生きている細胞をカルチャーから回収し、そして51Cr−標識hMSCに対する細胞傷害性について、8時間の51Cr−放出アッセイにてエフェクター:標的(E:T)比で試験した。ラット脾臓細胞はhMSCに応答する細胞傷害性Tリンパ球を生じなかった。すべての値は平均±SDとして表す。図8Bは、刺激物(hMSC)と共に、または無しでインキューベーションした健康なラット脾臓細胞による<4%の標的細胞(hMSC)の溶解(lysis)を示す。同様に、hMSCの投与によりインビボで脾臓細胞をプライムし、続いて培養中5日間、hMSCを用いた再刺激では、それらに細胞傷害性を誘発することはできず、hMSCがラットの脾臓細胞に細胞傷害性Tリンパ球応答を誘導できないことを示す。
【0104】
神経学的機能試験。
発作から14日後に、接着−除去ドット試験(p<0.05;図3A)およびmNSS試験(p<0.05;図3Bを参照にされたい)により示された機能的回復は、MCAOのみに供された対照ラットおよび3×106ラット肝臓繊維芽細胞を注射したラットに比べて、MCAOから1日後に3×106hMSCを注射したラットで見いだされた。
【0105】
図3は、中大脳動脈閉塞(MCAO)前後の行動的機能試験の結果を示す(A:接着−除去ドット試験;改良された神経学的重症度の採点[mNSS]試験)。ラットを2時間のMCAOのみ(n=10)に供するか、または培養したヒト骨髄間質細胞(hMSC)(n=9)またはラット肝臓繊維芽細胞(LC;n=9)をMCAOの1日後に注射した。有意な機能的回復は、対照個体と比較してhMSCで処置したラットで検出された。白丸=MCAO;黒丸=+LC;三角=+hMSC。
【0106】
サンドイッチELISA定量
サンドイッチELISA法を使用して、BDNF(969±198pg/mL対434±59pg/mLおよび498±76pg/mL)およびNGF(1,227±111pg/mL対834±123pg/mLおよび980±55pg/mL)の分泌レベルは、細胞処置無しでMCAOのみから7日後の動物およびラット肝臓繊維芽細胞で処置したラットに比べて、hMSC処置ラットの虚血半球で増加した(p<0.05)。インビトロのデータは、hMSCがBDNFおよびNGFを時間依存的様式で分泌することを示す。BDNFおよびNGFにおける有意な上昇は、1日に比べて4および7日の培養で無血清培地中に検出された(表3)。
【0107】
【表3】

【0108】
形態学的分析。
2時間のMCAOに供したラットに、虚血から1日後に3×106hMSCを注入し、そして形態学的分析のためにMCAOから14日後に屠殺した。H−Eで染色した皮質スライド内に、暗く、そして赤いニューロンがhMSC注射を含む、または含まないMCAOに供したすべてのラットの虚血中心部で観察された。虚血傷害の容量における有意な減少は、MCAOのみ(36.3%±10.5%)に供した対照ラット、またはMCAOから14日後にラットの肝臓繊維芽細胞を注射したラット(34.6%±9.1%)に比べて、hMSC−処置ラット(損傷容量、33.3%±7.6%)で検出されなかった。
【0109】
脳組織内で、hMSCに由来する細胞はヒト特異的抗体mAb1281により同定される丸から卵形の核を特徴とした。hMSC(124×103±46×103;3×106hMSCの4%)が生き残り、そして受容マウスの虚血性傷害脳全体に分布した。mAb1281反応性細胞は皮質および線条を含む同側半球の多くの領域で観察されたが、最も
多くのmAb1281で標識されたhMSC(全124×103±46×103の60%)が虚血境界領域に位置した。数個の細胞が反対側半球でも観察された(9×103±2×103;3×106hMSCの0.3%)。
【0110】
二重染色免疫組織化学では、使用した神経マーカーに反応性のmAb1281陽性細胞はほとんど無いことが明らかになった。NeuN、MAP−2、GFAPおよびvWFを発現するmAb1281標識hMSCの割合は、1%、1%。5%および2%であった。レーザー走査共焦点顕微鏡画像は、ヒトの核mAb1281(hMSC同定については緑)とNeuN、MAP−2、GFAPまたはvWF(細胞型特異的マーカーについては赤)に対して特異的なモノクローナル抗体の受容体ラット脳中での同時局在化を示した(図4、aからh)。ほとんどのmAb1281陽性細胞は管の回りを取り囲むが、実質に局在する細胞はほとんどない。
【0111】
図9はラット脳中の外因性ヒト骨髄間質細胞(hMSC)および内因性脳細胞の形態学的特徴を示す顕微鏡写真である。二重免疫蛍光染色を使用して、mAb1281(ヒト核に特異的なモノクローナル抗体)−反応性細胞が脳の傷害を受けた領域に存在した。レーザー走査共焦点顕微鏡画像は、mAb1281(hMSC[a、c、d、f−h]については緑)、神経核抗原(NeuN)(b、c)、微小管−結合タンパク質2(MAP−2)(e、f)、グリア繊維酸性タンパク質(GFAP)(g)およびvWF(h)(細胞型特異的マーカーについては赤)を受容体ラット脳内に示した。尺度の棒=50μm。
【0112】
TUNEL(図7、a、cおよびd)、およびH−E染色(図7bを参照にされたい)を使用して、典型的な焦げ茶色の丸い、または卵形のアポトーシス体を持つアポトーシス細胞を虚血境界領域で計数した。参照皮質の6μm厚切片内で測定されたアポトーシス細胞数は、MCAOのみから14日後の動物または肝臓繊維芽細胞で処置した虚血性ラットと比較して、hMSC処置ラットの虚血境界領域で減少した(38.5±3.4対82.6±3.8または76.4±6.8;p<0.05)。
【0113】
図7は、アポトーシス細胞(a:ターミナルデオキシヌクレオチジルトランスフェラーゼが媒介するdUTP−ビオチンニックエンドラベリング[TUNEL]−陽性細胞[矢印];b:ヘマトキシリン−エオシン[H&E]染色)が、中大脳動脈閉塞(MCAO)のみの後に虚血境界領域に存在することを示す。減少したアポトーシス細胞(d:青−ヘマトキシリン−カウンター染色細胞のより多い生存;矢頭)は、肝臓繊維芽細胞を注射したラット(c)に比べてヒト骨髄間質細胞(hMSC)を注射したラットで検出された。ブロモデオキシウリジン(BrdU;新たに合成されたDNAのマーカー)−陽性細胞(矢印)は、健康な脳の脳室領域/脳室下領域(VZ/SVZ)にはほとんど存在しなかった(e)。増加したBrdU−陽性細胞は、MCAOのみに供したラット(f)および肝臓繊維芽細胞を注射したラット(g)の同側半球のVZ/SVZに検出された。BrdU−陽性細胞の有意な増加は、肝臓細胞処置を含むか、または含まないMCAOに供したラットに比べて、hMSC(h)で処置したラットのVZ/SVZで検出された。尺度の棒=15μm。
【0114】
BrdU−陽性細胞はVZ/SVZにほとんど存在しなかった(図7、eからhを参照にされたい)。有意により多くのBrdU−反応性細胞が、MCAOのみに供したラット(図7f)または肝臓繊維芽細胞で処置したラット(図7gを参照にされたい)よりも
hMSC処置を含むMCAOに供されたラットの同側半球のVZ/SVZで検出された(図7hを参照にされたい)。ブレグマ−1.0 1.0mmに位置する標準参照切片から5枚の皮質パラフィンスライド(6μm厚;25μm間隔)を、BrdU反応性細胞分析に使用した。hMSC処置を含むMCAOに供されたラットのVZ/SVZ中のスライドあたりBrdU−陽性細胞の数(95.3±24.1)は、MCAOのみに供したラット
(27.5±18.5)または肝臓繊維芽細胞で処置した虚血ラットのVZ/SVZ(37.8±11.2)よりも有意に高かった。発作から14日後、hMSC処置を含むMCAOに供したラットは、MCAOのみに供したラットまたは肝臓繊維芽細胞で処置したラットよりも、スライドあたり多数のBrdU陽性細胞が、NeuN(2.5±0.4対0.5±0.6または0.6±0.4;p<0.05)およびGFAP(4.4±2.3対1.4±1.1または1.7±0.5;p<0.05)を発現した。
【0115】
考察。
発作から1日後のhMSCのIV注射は、MCAOのみに供したラットまたは肝臓繊維芽細胞を注射したラットに比べて、体性感覚採点およびmNSSに従い機能的成果を有意に改善した。この利点はラットにおいて、発作後に傷害を受けた実質細胞の修復を促進できるニュートロフィンを含む増殖因子の生産に影響を及ぼし、虚血境界領域のアポトーシスを減少し、そしてVZ/SVZ中の内因性神経幹および前駆細胞の増殖および分化を強化することができる。
【0116】
神経移植片は脳傷害に伴う機能的欠損を逆転した。本発明のヒト移植片−対−ラット宿主データは、照射した動物7に永久的なMCAOおよび非照射動物にMCAOを一時的に2時間発生させた後の損傷部位に対して、IV移植した自家骨髄細胞の優先的ホーミングを示す他の研究からの知見と一致する。形態学的分析では、hMSCが虚血性傷害を受けたラット脳に選択的に移動する能力を有することを示す。hMSCは生き残り、そして分散した幾つかが実質脳細胞のタンパク質マーカーを発現する。
【0117】
hMSCは失ったニューロンを交換する能力を有することができるが、治療的利益を提供するメカニズムは多面的であるらしい。データでは発作から1日後の3×106hMSCの注射が、投与から7および14日後の未処置ラットに比べて(p<0.01)、体性感覚採点およびmNSSに従う機能的成果を改善することを示す。しかしhMSCのわずか1%、5%および2%がすぐに完全な細胞分化および組織へ一体化される神経、星状膠および内皮細胞タンパク質を発現するだけである。したがってより短期的利益のメディエーターは、hMSCが虚血境界領域中に残るニューロンの機能的回復を促進し、そしてアポトーシスを減らす多数の増殖因子で傷害を受けた組織を補充することであるらしい。MSCは虚血性の傷害を受けたニューロンの可塑性を促進し、またはグリア細胞がニュートロフィン(例えばBDNFおよびNGF)を分泌することを刺激することに直接関与することができる。hMSCと宿主脳との相互作用はhMSCおよび実質細胞が豊富な栄養因子を生産することを導くことができ、これが損傷の結果として失った機能の回復に貢献する。30,31この研究においてサンドイッチELISA法を使用して、BDNFおよびNGFの分泌レベルは、細胞処置無しのMCAOのみから7日後の動物、および肝臓細胞処置を行ったラットに比べて、hMSC−処置ラットの虚血半球で有意に上昇したことが示される。虚血脳におけるBDNFおよびNGFの存在を測定したが、他の増殖因子(血管新生因子VEGF32およびHGF33のような)が、血管新生を増すことにより少なくとも部分的に機能回復を改善できる可能性は排除されなかった。血管新生は発作からの改善された神経的回復と関連する。
【0118】
MSCは低分子「工場」として行動する。これらの細胞は多くのサイトカインおよび栄養因子を生産する。それらはまた長期間にわたりこれらの因子を分泌し、そして単回のボーラス投与ではない。MSCは造血に役割を果たすことが知られている多くのサイトカインを発現し、そしてまた骨髄微小環境自体の細胞に影響を及ぼすオートクリン、パラクリンおよびジャクスタクリン因子も供給する。大脳組織中のMSCはこれらの因子を発現しているらしく、そして機能の回復を迅速かつ効率的に促進することがこれらサイトカインおよび栄養因子が脳組織に及ぼす効果である。これらの細胞は異なるイオン的微小環境下(例えばカルシウム)で培養した時、増殖因子の発現を調整することによりイオン的微小
環境の信号(cue)に応答する。これは損傷した組織中の細胞が組織の必要性に滴定された(titrated)栄養および増殖因子を発現することを示唆している。脳での発作のMSCを用いた処置では、特異的因子の単回の局在化注射とは明らかに対照的に、種々の栄養因子およびサイトカインが解剖学的に分布され、組織感受性で、しかも一時的に進行する様式で生産される。
【0119】
神経幹細胞はVZ/SVZ内に存在し、そしてこれらの細胞は発達している脳内でそれらの運命に移行する。健康な成人の脳では、前脳のニューロン生産の欠如は適切なニューロン前駆細胞の欠如に影響せずに、むしろ有糸分裂後の栄養および移動サポートの持続的(tonic)阻害および/または欠如に影響する。この実験はBrdU反応性細胞は、MCAOのみに比べてhMSC処置を含むMCAO後のVZ/SVZで増加し、IV注射したhMSCは内因性の脳細胞が増殖し、そして虚血傷害を受けた脳の修復への参加を刺激することを示唆する。これらの知見はラット由来のMSCのIV投与を使用して得た結果と一致する。
【0120】
hMSCのラット中へのIV移植は、インビトロで混合リンパ球反応により測定した時、ラットをhMSCに対して感作しない。同様に健康なラットまたはhMSCを注射したラットの脾臓細胞はhMSCに対する細胞傷害性T細胞応答、外来臓器/細胞移植の拒絶に関わる機能的免疫応答を生じることができない。これらのデータはラットによるhMSCの免疫学的拒絶が発作の処置としてhMSCを試験することと関係しないことを示唆する。潜在的に、そしてより重要なことは、ラット脾臓が注射したhMSCに対する感度をほとんど示さないか、または感度が無いことである。hMSCが強力な免疫応答を誘導できないことは、主要組織適合性遺伝子複合体(クラスIおよびクラスII)および同時刺激(CD40、CD80およびCD86)分子の発現が無いか、またはほとんど無いために、これら細胞の弱い免疫原性と関連している可能性がある。さらにhMSCは異種移植の拒絶に関与する免疫応答の発生をダウンレギュレートする可溶性メディエーターも分泌することができる。これらのデータは、MSCの同種細胞−付着群の免疫原性を調査するさらなる実験を要求する。
【0121】
データはIV投与したhMSCが発作から2週間後に神経学的機能の回復を促進することを示す。hMSCは選択的に大脳虚血領域に入る。hMSCと虚血脳との間の相互関係はニューロトロフィンの分泌を強化し、これが虚血境界領域におけるニューロンのアポトーシスを減少させ、そして虚血脳中の比較的完全なSVZからの細胞増殖を促進することができる。しかしSVZから始まる細胞が虚血脳に移動し、一体化されるかどうかは決定されなかった。CNSでは神経損傷の効果的処置が、大脳循環のリモデリングを含む内因性の補償機能の活性化を要求することができ、その正確なメカニズムは不明である。MSCが誘起する神経欠損の減少の元にあるメカニズムの解明ならびに長期の治療的利益の証明により、hMSCが発作、そして恐らくは広い多数のヒトの神経学的障害の強力な分子および細胞治療を提供することができる。
【0122】
実施例3
神経損傷の処置:前臨床プロトコール
MSCが発作後の機能的回復を促進するという仮定の調査において、出願人は前臨床細胞治療プロトコールを実施するための様々な選択に直面した。中でも取り組むべき問題は、何時そして何処に細胞を移植するかということである。関心は修復治療であるので、虚血損傷のサイズが効果的な修復治療により改変しないと仮定して、出願人は最初に動物を発作から1日以上後に処置することを選んだ。31,32この時期は臨床的に合理的である。欠損が発作から1日持続する場合、この出来事は発作と分類され、そして一過性の虚血性攻撃とは分類されない。1日で患者は安定し、そして神経欠損の重症度を容易に評価することができる。
【0123】
最も直接的な細胞の脳への配置経路は、外科的移植を介する。細胞は損傷内に、健康な非虚血性組織内に、または境界領域内に配置されるべきであるか?脳の観察を引き出して、特に発生状態における損傷の境界領域を考慮して、初期の実験で出願人は境界組織内にナイーブな全骨髄細胞を配置することを選んだ。32すなわち細胞はドナーのラットから抽出し、そして外科的および定位的に皮質下および皮質組織内の虚血損傷の境界領域に移植した。31−33試験すべき主な仮定は、これらの細胞が機能的回復を促進するかであり、そのような神経学的および機能的試験を動物で行った。完全な神経学的調査(表1)を行った。この調査、改良された神経学的重症度の採点(mNSS)は、運動指数、感覚反射および筋肉状態を提供する。34−38加えて出願人は体性感覚試験を使用し、この試験は足の平から粘着性のタブの除去39、およびラットが加速して踏み車を持続する時間を測定する運動協調性試験40を含んだ。測定は発作前およびその後7および14日に行った。31動物を14日に屠殺し、そして移植した細胞を組織学により大脳組織で探した。この組織学的分析で扱う1つの疑問は、MSCが脳の実質細胞に分化するかどうかであった。同様な実験を中大脳動脈の塞栓性閉塞に供したマウスで行い、そしてドナーマウスからのナイーブな全骨髄細胞の脳内移植で処理した。機能的測定は移植から28日後に行った。注目すべきかつ迅速な機能的回復は、これらの細胞を虚血損傷の境界内に配置した後にあった。パーキンソン様損傷を1−メチル−4−フェニル−1,2,3,6−テトラヒドロピリジンで誘導したマウスの線条へのMSCの実質内移植の同様な実験では、運動機能の有意な回復が示された。42同様にMSCを脊髄の挫傷に隣接して移植し、そして有意な機能的利益が明らかであった。
【0124】
これら実験の変動により、MSCと脳由来神経成長因子のような栄養因子の同時投与が機能的回復を促進し、そしてこれら細胞の増殖因子中での前培養が機能的利益ならびに脳細胞表現型タンパク質を発現する細胞数の増加を助長することが示された。カルチャー中の細胞の脳の環境への順化は、インビトロからインビボへの移行を容易にすると思われる。多くの移植された骨髄細胞が虚血脳中でアポトーシスを受けた。したがって出願人は骨髄細胞をZ−Val−Ala−DL−Asp−フルオロメチルケトン(Z−VAD)、カスパーゼインヒビターと同時投与した。この仮定は確認された;アポトーシス細胞の数は有意に減少し、そして運動協調性試験で測定した機能は利益の増加を示した。このように細胞治療でも併用療法が所望の成果を改善することができる。
【0125】
類似の治療的介入が、外傷性脳損傷、脊髄損傷およびパーキンソン病の動物モデルで効果的であった:すべての3つのモデルで、MSCの外科的移植により神経学的欠損の有意な減少があった。治療的利益は移植から数日以内で明らかになった。しかしわずか1〜3%の細胞が実質細胞の表現型のタンパク質を発現しただけであった。そのようなタンパク質を発現する細胞の比率は前培養で増加させることができたが、移植された細胞数は中大脳動脈の閉塞後に梗塞した半球脳組織の量に比べてわずかである(大体40%)。閉塞から14日後、約50,000個の細胞(SE18000)、すなわち移植した400,000個の12.5%が生存し;少ない割合が神経タンパク質を発現し、少なすぎて梗塞組織を交換できない。
【0126】
これらの細胞の脳への直接移植の成功は、侵襲性が低い血管経路の投与を試験する実験を促した。ラットを中大脳動脈の閉塞に供し、そして虚血損傷がある半球に対して同側の頸動脈に細胞注入のためのカニューレを挿入した。約2百万個のMSCを発作から1日後に注射した。一連の神経学的試験は処置の前後で行った。組織学的分析では少量の細胞が実質細胞の表現型のタンパク質を発現することが示された。しかし有意な機能的利益が明らかであった。出願人は外傷性脳損傷を処置するためにMSC投与の動脈経路の可能性も試験した。頸動脈経路を介して投与した時、細胞は脳に入ったが、恐らく投与経路が内部頸動脈の連結を要し、外傷性脳損傷を悪化させる低潅流を負わせるので、機能的利益は無
かった。
【0127】
次に出願人は、より臨床的に直接関連する静脈内の投与経路の可能性を調査した。この取り組みは頸動脈または直接的な組織注射よりも明らかに侵襲性が低く、そして悪影響も少ない。静脈経路は多回および長期の細胞処置にも利用が可能である。
【0128】
他では静脈内に注射された細胞が脳へ入って行く道を見いだすことが示された。しかし発作または外傷のような損傷内で、静脈内注射した細胞が虚血損傷の部位に選択的に移動し、そして機能的利益を促進することを示す研究はなかった。したがって出願人はこの仮説を中大脳動脈の閉鎖に供したラットで試験した。発作から1日以上後、1〜3百万個のMSCを尾静脈に注射した。出願人は一連の神経学的成果の測定(表1)を行った。発作から1日後に細胞を投与した動物は、発作から14日後に屠殺し(図1)、そして発作から7日後に処置した動物は35日に屠殺した。以前の実験のように、新たな細胞の生成を示すために細胞をブロモデオキシウリジン(新たに合成されたDNAのマーカー)で標識した。またオスのラットからのMSCをメスの動物に注射し、そして細胞をY染色体に対するin−situハイブリダイゼーションにより同定した。処置した動物は処置により有意な機能的改善が示された(図2)。改善された機能の促進における細胞型の特異性について試験するために、細胞の対照群も使用した。死んだMSCおよび肝臓および肺の繊維芽細胞(非実質細胞対照として)は治療的利益を示さず、そしてリン酸緩衝化生理食塩水対照よりも良くなかった。このように静脈内経路は発作および外傷後に有意な機能的改善を提供する。これは発作から7日後に開始する処置にもあてはまり、そして機能的利益はオスおよびメスのラットで同様であった。
【0129】
ヒトの試験条件により詳細に似せるために、ラットMSCではなくヒトの骨髄間質細胞をドナー細胞群として使用する。ヒト細胞は局所麻酔下で健康なドナーの後部腸骨稜の穿刺により抽出した。骨髄抽出物(15〜16mL)の単核細胞を分離した。3百万個のヒトMSC用量を各ラットに閉塞または外傷性脳損傷から1日後に静脈内注射した。強力な機能的改善が発作および外傷後の両方で見いだされた。ヒト細胞はドナーから簡単に得た。それらは容易に大変多数に拡大することができ、そして抗体をフローサイトメトリーまたは磁気細胞ソーティングによる分離のために利用することができる。ヒトMSCは癌および多発性硬化症の患者を処置するために使用されてきた。すなわちヒトにおける安全性のデータは入手可能である。
【0130】
出願人はいかなる免疫拒絶の兆候も観察しなかった(公開していない考察)。未処置ラットおよびヒトMSCで処置した動物の脾臓を摘出し、そしてヒトMSCと培養した。ヒトMSCを注射したラットに由来する脾臓細胞の増殖は、これらの細胞でインビトロにて再刺激した後に増加した;しかし増殖応答は未処置ラットに由来する脾臓細胞の応答と有意に異ならなかった。すなわちヒトMSCはラット脾臓リンパ球に1次的増殖応答を誘導することができるが、これらの細胞のラットへの投与はインビトロでの2次的な増殖応答についてインビボでリンパ球を感作しない。Tリンパ球は移植片−対−宿主疾患のイニシエーターとして関与する。したがってヒト移植片に対するラット宿主T細胞の応答は、溶解効果を評価するための標準的なクロム−51アッセイで測定した。ヒトMSCはラット脾臓細胞に細胞傷害性−T−リンパ球応答を誘導しなかった。出願人は齧歯類とヒトがMSC処置に対して異なって応答し得る可能性を排除できない。しかし別の可能性は、ユニバーサル細胞、同種細胞および自己ではない細胞を患者を処置するために使用することができるということである。明らかにヒトにおいてより多くのデータが、この仮定を試験するために必要である。初期の臨床的応用は自家移植を必要とするだろう。
【0131】
これらの細胞をどのように損傷の部位に標的とさせるか、およびそれらがどのように利益を提供するかを含め、取り組まなければならない多くの問題がある。細胞はどのように
して行くべき場所を知るのか?どのメカニズムがこれらの細胞を損傷部位に特異的に標的させるのか?しかし最も興味深い問題は細胞が脳に及ぼす効果、およびこれらの効果がどのように治療的利益に翻訳されるのかである。
【0132】
大脳損傷部位へのMSCの標的化
静脈内注射された細胞はどこへ行くのか?最初に、注射された細胞を、それらが組織中で同定できるようにするために印を付けなければならない。MSCは種々の標識に反応性の抗体により同定することができる。MSCはブロモデオキシウリジンで標識することができる;オスに由来する細胞をメスの動物に注射し、そしてin−situハイブリダイゼーションによりY染色体を同定することができる;あるいはヒト細胞をラットに注射し、そしてヒト抗原に対する抗体を使用することができる。静脈内に注射された細胞は肝臓、腎臓、脾臓および骨髄内に見いだされた。しかし最も確認されたMSCはこれらの器官内で微血管を囲み、実質に局在する細胞はほとんど無い。大変わずかな細胞(処置から14〜35日後に、3百万個の注射されたMSCの1.5〜3.0%)が脳組織の実質に検出された。損傷した脳では、発作後または外的損傷後であろうとも、ほとんどの細胞が損傷の領域を標的とした。例えば発作後、80%より多くの細胞が影響を受けた半球内にあり、これら細胞のほとんどが損傷の回りの領域内に集まった。多くの細胞が血管に隣接またはその中にも存在した。細胞はどのようにして損傷した組織を標的とし、そしてこれら細胞の微小脈管への局在化は重要なのか?
【0133】
損傷の部位へのMSCのホーミングは、炎症細胞の損傷組織への応答の記憶である。好中球および単球は、損傷および炎症組織を脈管性および細胞性分子シグナリングの調和した因果的連鎖により標的とする。炎症細胞および脈管上に発現される接着分子およびそれらのレセプターが細胞を損傷組織へと導き、そしてこれらの細胞を脈管境界を渡して、通常は血液脳関門を通して輸送する。これらの標的化および接着分子はケモカインと協調して働く。したがって出願人は接着分子および誘引剤が作用し、そしてMSCを脳に標的させるかどうかを試験した。出願人は、透過性の膜により分けられた2つのチャンバーの間の細胞移動に関するアッセイであるBoydenチャンバーを使用した。MSCは移動媒質(5%ウシ血清アルブミンを含むIscoveの改良ダルベッコ培地)中、5×105細胞/mLに調整された。50・Lの細胞懸濁液を各上部ウェルに加えた。底面に移動したMSCの数を5個の視野(0.12mm2面積)で計数した。虚血脳組織は誘引タンパク質1およびマクロファージ炎症タンパク質1のような走化性タンパク質を発現するので、出願人はこれらの物質を下のチャンバーに配置して、用量依存的な移動の増加を提供した。同様の応答が細胞間接着分子1のような接着分子を下のチャンバーに配置した時に見いだされた。移動の上昇は付着分子に対する抗体またはケモカインを下のチャンバーに加えた時に効果的に遮断された。外的損傷または発作に供した脳由来の組織が下のチャンバーに配置された時、細胞の移動は有意に増加した。これらの知見は細胞がどのように炎症細胞様の同定を仮定し、そしてそれらがどのように損傷した組織を特異的に標的とすることを「知る」かという洞察を提供する。このようにパーキンソン病および多発性硬化症のような神経変性的プロセスを含め、炎症応答を有する任意の損傷は、MSCを傷つけられた組織に導くことができる。損傷の程度による指針の依存性も、細胞の「効果的」な用量の滴定状態を提供する。損傷および相伴う炎症応答が重症なほど、その部位に向けられる細胞数が多くなる。
【0134】
作用のメカニズム
細胞がどのように脳に影響を及ぼし、そしてそれにより損傷および病理的プロセスから機能的回復が促進されるのか?脳細胞になることによりMSCが大脳組織に与える利益の可能性の見込は無いようである。静脈内注射および多くても数十万を数える実質内細胞数で、たとえそれらが脳細胞になっても、数立方ミリメートル強の組織容量を交換するための大変少量の細胞が存在するだけである。多くの場合で利益は処置から2、3日に検出さ
れる。多くてもわずかな比率の細胞が実質細胞の表現型のタンパク質を発現する。これらタンパク質の発現は真の分化およびニューロンまたはグリア−細胞機能を示さない。そのような短期間の後、さらに分化した細胞が組織に真に一体化され、そして機能を向上させる複雑な結合を形成する見込みはほとんどない。このようにMSCがそれらの有益な効果を促進することによるメカニズムとしての組織代替はありそうにもない。この利益についてより合理的な説明は、MSCが脳の内因性の回復効果を活性化するように大脳組織を誘導するということである。MSCは反応を始め、そして脳と相互作用して回復的、そして恐らくは再生的メカニズムを活性化することができる。
【0135】
MSCは低分子工場として行動し、多くの種々のサイトカインおよび栄養因子を生産する。大脳組織中または損傷した脳の微小脈管中のMSCはこれら因子を発現するらしく、そして栄養因子が脳組織に及ぼす効果は、機能の回復を迅速かつ効果的に促進するメカニズムである。出願人は多くの他の栄養および増殖因子の中でも、MSCが肝細胞増殖因子、VEGF、神経成長因子(NGF)および脳由来神経栄養因子(BDNF)を生産することを示した。この様々な因子、そして特定の増殖因子の単一の一丸(bullet)ではないことが、有益な効果を助長する。大変重要な観察は、MSCを異なるイオン的微小環境下で培養した時に、増殖因子の発現を調整することにより信号に応答するということである。この知見は損傷した組織中の細胞が組織の必要性に合った栄養因子および増殖因子を発現することを示唆している。異なる環境がこれら因子の分泌に影響を及ぼす。すなわち組織損傷の程度および対応するイオン的な環境の混乱(disruption)が栄養因子の分泌を記録するのだろう。出願人はこの仮説をいくつかの実験条件下で試験した。発作または損傷により傷つけられた脳から抽出した組織中でMSCを培養すると、栄養因子の分泌は有意に増加する。損傷した脳に対するMSCの応答分泌は、傷を受けた脳から組織が抽出される時期に従い異なる。これらの実験はMSCで処置した脳内の成長因子の発現の測定において、一歩前進ととらえられた。出願人は定量的なサンドイッチELISAを使用し、これは免疫標識法により脳中の増殖因子の発現を測定する。栄養因子の発現は、発作または外傷に供された未処置動物よりも、MSC処置動物で有意に大きかった。
【0136】
MSCが選択的に損傷した脳に入り、そして増殖および栄養因子を組織フィードバックループで分泌するとすれば、これらの因子は脳をどのように改変して治療的利益を促進するのだろうか?操作上の仮説は治療的利益が脳の可塑性に関係する1組の出来事により誘導される;このプロセスは限定するわけではないが血管新生、神経細胞新生(neurogenesis)、シナプス形成(synaptogenesis)、樹状突起の分枝、および組織の境界領域中で戦略的に重要な組織中のアポトーシスの減少を含む。
【0137】
VEGFおよび塩基性繊維芽細胞増殖因子は、有力な血管新生剤である。出願人はMSCまたはMSCの上清が血管新生の誘導に及ぼす効果を試験した。測定はヒト脳の内皮細胞に関するアッセイで行い、ここでMSCからの上清が管の迅速な形成を誘導することが示され、構造的および血管新生プロセスを反映している。インビボで使用したアッセイは古典的な無血管角膜アッセイであった。外科的切開で角膜にポケットを作成し、そしてMSC上清またはMSC自体をコートしたコラーゲンオブラードをポケットに挿入した。対照条件は外科的切開およびコラーゲンオブラード単独またはVEGFのポケットへの直接的配置からなった。出願人は迅速かつ強固な血管新生を、MSC上清を乗せたオブラードで処理した角膜で観察した。角膜切開に直接配置した細胞のほとんどが部位から拡散したが、血管新生は明らかであった。対照動物には血管新生はなかった(図2)。血管新生の誘導は、VEGFの直接使用よりはMSC上清でより強固であり、これは上清が血管新生因子の高度に効果的な供給源であることを示唆している。脳組織のMSC処置による血管新生誘導の予備実験も、新規血管形成の増加を示唆する(報告していない観察)。血管新生の誘導は機能の促進に直接翻訳されないが、出願人は以前に発作から1日以上後のVE
GFでの発作の処置が機能的回復を有意に改善し、そして血管新生を増加することを示した。
【0138】
MSCによる神経細胞新生の誘導も、発作後の機能的改善に貢献することができる。神経細胞新生の重要な部位は、脳側室に隣接する領域−脳室下領域である。神経細胞新生は齧歯類の脳の嗅球および歯状回にも見いだされる。発作のような大脳損傷は、脳の特定領域内のニューロンの生産を増幅する。特に発作後長期における機能的修復は、新規脳細胞の生産に関連し得る。これらの細胞の生産を促進するメカニズムは、回復を改善することができる。出願人はMSCでの発作の処置が神経細胞新生の誘導に及ぼす効果を試験した。細胞数の有意な増加は、発作後の脳室下領域で測定された。多くのこれらの細胞はTUJ−1のような特異的分子マーカーの発現により示されるような、新たに形成された前駆様細胞のマーカーを有した。同側半球内の大脳組織も幹細胞マーカーであるネスチンの発現の大きな増加を示し、大脳組織の前駆体または発生状態への活性化を示す。MSCを移植した大脳組織の組織学的分析も、虚血組織内の神経幹細胞(neurosphere)ロゼットの存在を示した。これら神経細胞のロゼットは、発生中の脳で見いだされるものに類似する。これらの細胞系の大脳組織への移動は、脳室領域から発出する星状膠細胞様の放出により導かれることができ、これも発生中の脳内の出来事に似ている。このように骨髄細胞の存在は、脳室領域内の1次供給源から新規細胞の、および脈絡叢の損傷した脳への迅速な誘導および移動を促進するように思われる。これらの細胞は機能的修復に貢献することができるが、神経細胞新生の誘導およびこれらの細胞の機能回復への移行の関係は、直接試験されなかった。
【0139】
MSCにより生産される増殖および栄養因子は、損傷したおよび虚血脳におけるシナプス形成に影響を与え、そして樹状分枝を増加させることができる。発作のMSCによる処置が樹状分枝に及ぼす直接的効果は、さらなる実験が待たれることろである。予備実験で出願人は、発作後の虚血性損傷の境界領域内にシナプスタンパク質であるシナプトフィシンの発現増加を示した。
【0140】
グリオーシスは神経損傷後の軸索伸長および分枝の障害になり得る。トランスフォーミング増殖因子・タンパク質は創傷治癒に主に重要であり、そして皮膚および心筋における瘢痕の抑制、および胎児で観察される瘢痕が無い創傷修復に関わってきた。MSCはこの増殖因子を生産するので、治療的利益は瘢痕の減少および続くシナプス形成および樹状分枝の改善からももたらされ得る。
【0141】
サイトカインおよび増殖および栄養因子に加えて、MSCは骨芽細胞に特異的なファクター2および骨形成タンパク質1のような骨形成に関係する因子を発現する。MSCはまた神経細胞−接着分子ニューロピリンおよびNGFおよびBDNFを含む神経栄養因子も発現する。最近の研究は、骨形成タンパク質、ソニック ヘジホック(sonic hedehog)、副甲状腺ホルモンおよび繊維芽増殖因子8は、中胚葉および神経外胚葉経路を修飾することにより、胚性細胞の分化中に調節の役割を有することが示された。MSCによる損傷脳中のこのサイトカインカスケードの分泌が機能的利益に貢献するかどうかを、慎重な考察およびさらなる実験で実証する。
【0142】
損傷周辺領域は、アポトーシス細胞死に高度に感受性である。アポトーシスは発作または脳の外傷後数カ月間持続する。回復に及ぼす効果は未知である。出願人はMSCを用いた発作および脳外傷の処置がこの領域内のアポトーシスを有意に減少させることを示した。この効果は損傷した脳内のNGFのような増殖因子の生産により媒介されることができる。出願人はこの領域内のアポトーシスの選択的減少は、大脳の再配線(rewiring)を支持することができると推測する。
【0143】
脳のリモデリング、神経細胞新生および神経保護的メカニズムが損傷後に機能的改善を喚起するメカニズムは不確定であり、そして重要な研究課題である。MSCを用いた処置により増幅されるこれらすべての出来事が、実際に発作および外傷後の改善された成果に貢献するのかどうかは現在調査中である。
【0144】
この時点で、神経学的機能の回復を促進する特異的な出来事を単離することはできない。しかし出願人は機能の回復を促進するプロセスが組織の1つの修飾ではなく(例えば神経細胞新生)、恐らくは機能を改善するために、相乗的様式でなくても組合わさって貢献する出来事である血管新生、神経細胞新生、シナプス形成、ならびに瘢痕およびアポトーシスの境界での減少の混交された組み合わせであろうと推測する。この仮説を試験し、そして改善された神経学的機能に貢献する特異的因子の同定はやりがいがあるが、出願人は神経細胞新生に影響を及ぼさずに血管新生を減少するために、境界領域内でアポトーシスを選択的に増加させる能力に限界がある。
【0145】
損傷した大脳組織は多くの方法で個体発生を繰り返す。発作または損傷後、大脳組織は発生のより早い段階に戻り、このようにして侵入するMSCからのサイトカインおよび栄養および増殖因子による刺激に対して高度に応答性となる。MSCは恐らく準発生的(quasidevelopmental)大脳組織内の構造および血管新生、脈管形成、神経発生および樹状分枝を含む再生的変化を刺激する。MSCの初期状態よりは種々の刺激物および増殖因子に対して高度に感受性の組織の初期状態は、主に治療的応用を促進する。MSCは大脳リモデリングを刺激するために、個体発生性大脳組織により必要とされる資源を単に提供できるだけである。出願人は他の細胞またはサイトカインおよび増殖因子を調和のとれた因果的連鎖で滴定して注入することにより、傷つけられた脳細胞を刺激して反応させ、そして機能を回復させることができる可能性を排除しない。同様に出願人はMSCの亜集団が幹様または前駆様であり、そして損傷した組織と相乗的に反応する可能性も排除することができない。しかし出願人は、少なくとも出願人が見る機能的利益の時間規模では、脳内のMSCは組織とは置き換わらず、そしてそれらは機能するニューロンおよび支持的な星状膠細胞に分化しないという自信がある。主な利益は損傷をリモデルし、そして補償するための損傷した組織の活性化により得られる。図3はMSCが回収され、そして損傷した大脳組織を処置するために使用することができるこのプロセスの現在の解釈を具体的に説明する。
【0146】
患者への移植
この細胞治療の形態が発作の患者に使用できる前に、明らかに安全性の問題に取り組まなければならない。骨髄移植は癌処置では普通の手順であり、そして多発性硬化症における併用療法としても使用されてきたが、発作における安全性に関するフェイズI実験が認められている。今日まで発作を生じたほぼ2000匹の動物に関する実験で、出願人は治療のいかなる副作用または腫瘍形成の兆候も検出しなかった。患者は彼ら自身の細胞、HLAが合った細胞またはユニバーサル−ドナー群で処置されるべきか?これまでの前臨床データは、ドナー細胞による処置が可能であることを示唆している。しかし前臨床およびフェイズI臨床試験はこの問題に取り組むために行なわなければならない。この再考を説明する前臨床および基本的試験は、MSCでの発作の処置が現実的かつ高度に効果的な回復的治療を提供することができることを示す。すなわち臨床試験は実証される。
【0147】
本出願を通して、米国特許を含む種々の刊行物が著者および年号および特許番号により引用されている。刊行物に関する完全な引用を以下に掲載する。これら刊行物および特許の開示は、本発明の技術分野の状況をより完全に説明するために全部、引用により本明細書に編入する。
【0148】
本発明を具体的に説明する様式で記載してきたが、使用した用語術は限定ではなく言葉
の説明的性質を持つことを意図していると理解される。
【0149】
明らかに本発明の多くの修飾および変更が上記の教示に照らして可能である。したがって記載した本発明の範囲内で、本発明は具体的に記載した以外に実施できると理解される。
【0150】
【表4】

【0151】
TBI組織抽出物で処置したhMSCsを、ノックアウト血清代替および正常脳抽出物を含むノックアウトDMEMと比べる。★P<0.01
【0152】
以下に本発明の主な特徴と態様を列挙する。
【0153】
1.血管新生および脈管形成の誘導に使用する治療薬であって、該治療薬が幹細胞から単離された血管新生および脈管形成誘導因子を、血管新生および脈管形成を誘導するための製薬学的に許容され得る細胞治療薬と一緒に含んでなる上記治療薬。
【0154】
2.上記血管新生および脈管形成誘導因子が血管新生、栄養および増殖因子から本質的になる群から選択される1.に記載の治療薬。
【0155】
3.上記細胞治療薬が間葉系幹細胞、間質細胞およびその前駆体、繊維芽細胞、網状赤血球、脂肪細胞および内皮細胞から本質的になる群から選択される幹細胞である、1.に記載の治療薬。
【0156】
4.血管新生および脈管形成誘導因子の生産を増すために、間質細胞を分化誘導化合物に暴露し、そして共培養することにより、間質細胞から分泌される血管新生および脈管形成誘導因子の生産を増幅させる方法。
【0157】
5.上記方法が血管新生および脈管形成誘導因子の生産を増すために、間質細胞を分化誘導化合物に暴露し、そして共培養することを含み、該分化誘導化合物が脳抽出物およびカルシウムから本質的になる群から選択される、4.に記載の方法。
【0158】
6.治療として使用するために幹細胞から単離され、そして精製された血管新生および脈管形成誘導因子。
【0159】
7.血管新生および脈管形成を誘導する処置が必要な患者に投与した時、血管新生および脈管形成を誘導する、6.に記載の血管新生および脈管形成誘導因子。
【0160】
8.上記血管新生および脈管形成誘導因子が、所望の因子の生産を増すために分化誘導化合物に暴露され、そして共培養された時、幹細胞により分泌される因子である6.に記載の血管新生および脈管形成誘導因子。
【0161】
9.上記分化誘導化合物が脳抽出物およびカルシウムから本質的になる群から選択される、8.に記載の血管新生および脈管形成誘導因子。
【0162】
10.上記脳抽出物が脳細胞、脳から得られる細胞および培地で培養された間質細胞からの上清から本質的になる群から選択される、9.に記載の血管新生および脈管形成誘導因子。
【0163】
11.6.に記載の血管新生および脈管形成誘導因子を得る方法であって:
分化前の組織からヒト間葉系幹細胞を単離し、そして精製し;そして
神経学的および筋骨格治療用の道具を生産するために間葉系幹細胞を培養拡大する、
工程を含んでなる上記方法。
【0164】
12.幹細胞が組織修復に必要な所望する細胞表現型に分化し、そして生産することができる、単離され、そして分化を誘導する化合物の影響下で培養拡大された間葉系幹細胞。
【0165】
13.上記の分化を誘導する化合物が脳抽出物およびカルシウムから本質的になる群から選択される、12.に記載の幹細胞。
【0166】
14.上記の脳抽出物が脳細胞、脳から得られる細胞および培地で培養された間質細胞からの上清から本質的になる群から選択される、13.に記載の幹細胞。
【0167】
15.細胞の修復能力の方向転換に使用するための12.に記載の幹細胞。
【0168】
16.幹細胞から単離した血管新生および脈管形成誘導因子を製薬学的に許容され得る細胞治療薬と一緒に含んでなる治療薬を投与することによる、治療が必要な患者の血管新生および脈管形成を誘導するための治療であって、治療薬が患者に血管新生および脈管形成を誘導する上記治療。
【0169】
17.上記投与工程が、皮下、非経口的、静脈内、動脈内、筋肉内、腹腔内、鼻内、くも膜下内、および注入技術を介することから本質的になる群から選択される様式で治療薬を投与することを含む、16.に記載の治療。
【0170】
18.幹細胞から単離した血管新生および脈管形成誘導因子を製薬学的に許容され得る細胞治療薬と一緒に含んでなる治療薬を投与することによる組織修復を誘導する方法であって、治療薬が組織修復を誘導する上記方法。
【0171】
19.上記投与工程が、皮下、非経口的、静脈内、動脈内、筋肉内、腹腔内、鼻内、くも膜下内、および注入技術を介することから本質的になる群から選択される様式で治療薬を投与することを含む、18.に記載の方法。
【0172】
20.細胞の機能の増大に使用するための治療薬であって、該治療薬が幹細胞から単離された細胞機能の増強因子を、細胞の機能を増大するための製薬学的に許容され得る細胞治療薬と一緒に含んでなる上記治療薬。
【0173】
【表5】

【0174】
【表6】

【0175】
【表7】

【0176】
【表8】

【0177】
本発明の他の利点は容易に評価され、それは前述の詳細な説明を参照にして添付の図面と一緒に考える時、よりよく理解される。
【図面の簡単な説明】
【0178】
【図1】図1AからEはBDNF(図1A)、NGF(図1B)、bFGF(図1C)、VEGF(図1D)およびHGF(図1E)の増殖因子の分泌を示す写真である。
【図2】図2AおよびBは中大脳動脈の閉塞そして静脈内MSCでの処置有り、または処置無しの前後のラットにおける行動機能試験の結果を表すグラフである。
【図3】図3AおよびBはMSC分泌がインビボで血管新生を誘導するかどうかを試験するためのラット角膜の新生血管形成モデルの使用を示す写真であり、図3Aは模擬−手術した角膜には新生血管形成の根拠はないことを示し、そして図3Bは角膜ポケット内に挿入されたコラーゲン水中に配置されたMSC上清を示し、ここでは強固な角膜の新生血管形成が明らかである。
【図4】本発明を支持するために行った実験の具体的説明を示し、ここでは骨髄が動物から抽出され、そしてMSCが分離され、そして3〜5継代まで培養され、MSCが神経損傷の動物に注射され、そして細胞は損傷組織に選択的に移動し、そして損傷の境界領域に局在し、次いでMSCが、MSC、実質細胞分泌および増殖および栄養因子により媒介される一連の修復的出来事を活性化し、これが神経学的機能を改善する。
【図5】図5は8つの右半球を3つのサブ領域および8つの場に分割する、ラット脳の前交連のレベルで同定された標準的な皮質切片を示す。
【図6】図6AおよびBは中大脳動脈閉塞の前後の、行動的機能試験の結果を示すグラフである。
【図7】図7はアポトーシス細胞(図7a−d)およびBrdU−陽性細胞(図7e−h)を示す。
【図8】図8AおよびBは、脾臓細胞とhMSCとの間の混合リンパ球反応を示すグラフである。
【図9】図9はラット脳における外因性ヒト骨髄間質細胞(hMSC)および内因性脳細胞の形態学的特徴を示す顕微鏡写真である。
【特許請求の範囲】
【請求項1】
血管新生および脈管形成の誘導に使用する治療薬であって、該治療薬が幹細胞から単離された血管新生および脈管形成誘導因子を、血管新生および脈管形成を誘導するための製薬学的に許容され得る細胞治療薬と一緒に含んでなる上記治療薬。
【請求項1】
血管新生および脈管形成の誘導に使用する治療薬であって、該治療薬が幹細胞から単離された血管新生および脈管形成誘導因子を、血管新生および脈管形成を誘導するための製薬学的に許容され得る細胞治療薬と一緒に含んでなる上記治療薬。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2010−18627(P2010−18627A)
【公開日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願番号】特願2009−219774(P2009−219774)
【出願日】平成21年9月24日(2009.9.24)
【分割の表示】特願2003−559437(P2003−559437)の分割
【原出願日】平成15年1月14日(2003.1.14)
【出願人】(504263602)ヘンリー・フオード・ヘルス・システム (2)
【Fターム(参考)】
【公開日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願日】平成21年9月24日(2009.9.24)
【分割の表示】特願2003−559437(P2003−559437)の分割
【原出願日】平成15年1月14日(2003.1.14)
【出願人】(504263602)ヘンリー・フオード・ヘルス・システム (2)
【Fターム(参考)】
[ Back to top ]

