血管内皮増殖因子に対する抗体と、2型ヒト上皮成長因子受容体に対する抗体を用いた腫瘍治療
【課題】HER2受容体タンパク質の過剰発現を特徴とする癌を有する患者であって、抗VEGF抗体を用いた事前の治療に失敗した患者の転移を低減するための医薬組成物の提供。
【解決手段】本発明は、抗HER2抗体を含んで成る医薬組成物であって、有効な量の抗HER2抗体及び抗VEGF抗体が前記患者に投与される、医薬組成物を提供する。
【解決手段】本発明は、抗HER2抗体を含んで成る医薬組成物であって、有効な量の抗HER2抗体及び抗VEGF抗体が前記患者に投与される、医薬組成物を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、抗HER2と抗VEGF抗体を用いた併用療法に関する。特に、本発明は、抗VEGF抗体を用いた前治療に失敗した患者の乳癌疾患を治療するための前述の抗体の使用に関係する。
【背景技術】
【0002】
血管新生は、固形腫瘍、増殖性網膜症若しくは加齢黄斑変性症(AMD)などの眼内の新生血管症候群、関節リウマチ、及び乾癬を含めたさまざまな障害の病因に関係する(Folkman, J., et al, J. Biol. Chem. 267(1992)10931- 10934;Klagsbrun, M., et al., Annu. Rev. Physiol. 53(1991)217-239;及びGarner, A, Vascular diseases, In:Pathobiology of ocular disease, A dynamic approach,(eds.)Garner and A, Klintworthi G K, 2nd Edition Marcel Dekker, New York,(1994), pp 1625-1710)。固形腫瘍の場合では、新生血管形成は、正常細胞と比べて、腫瘍細胞が成長の優位性と増殖の自律性を確保することを可能にする。従って、腫瘍切片の微小血管の密度と、乳癌、並びに他の数種類の腫瘍における患者生存率の間には相関関係が観察されている(Weidner, N., et al., N. Engl. J. Med. 324(1991)1-6;Horak, E.R., et al., Lancet 340(1992)1120-1124;及びMacchiarini, P., et al., Lancet 340(1992)145-146)。
【0003】
血管内皮増殖因子(VEGF)は、正常及び異常な血管新生の調整と、腫瘍及び眼内障害に関連する新生血管形成に関与している(Ferrara, N., et al., Endocr. Rev. 18(1997)4-25;Berkman, R. A., et al., J. Clin. Invest. 91(1993)153-159;Brown, L. F., et al., Human Pathol. 26(1995)86-91;Brown, L. F., et al., Cancer Res. 53(1993)4727-4735;Mattern, J., et al., Brit. J. Cancer 73(1996)931-934;及びDvorak, H. F., et al., Am. J. Pathol. 146(1995)1029-1039)。抗VEGF中和抗体は、マウスにおいてさまざまなヒト腫瘍細胞株の増殖を抑制する(Kim, K. J., et al., Nature 362(1993)841-844;Warren, R. S., et al., J. Clin. Invest. 95(1995)1789-1797;Borgstrom, P., et al., Cancer Res. 56(1996)4032-4039;及びMelnyk, O., et al., Cancer Res. 56(1996)921-924)。WO 94/10202、WO 98/45332、WO 2005/00900、及びWO 00/35956は、VEGFに対する抗体に言及している。ヒト化モノクローナル抗体である(商品名Avastin(登録商標)として販売されている)ベバシズマブは、腫瘍治療に使用される抗VEGF抗体であり、癌治療のために承認された唯一の抗血管新生剤である(WO 98/45331)。
【0004】
HER2は、ヒト上皮成長因子受容体ファミリーのメンバーであり、その細胞質領域にプロテインキナーゼ活性を有する。HER2は、腫瘍細胞において過剰発現され、そして、予後不良及び生存率に関連する。HER2は、そのため、乳癌治療の重要な標的である。HER2に対する抗体は、Takai, N., et al., Cancer 104(2005)2701-2708;Yeon, C. H., et al., Invest. New Drugs 23(2005)391-409;Wong, W. M., et al., Cancer Pract. 7(1999)48-50;Albanell, J., et al., Drugs Today(Bare). 35(1999)931-46により知られている。
【0005】
(商品名Herceptin(登録商標)として販売されている)トラスツズマブは、HER2過剰発現/HER2遺伝子増幅転移性乳癌の治療に使用される組み換え型ヒト化抗HER2モノクローナル抗体である。前臨床研究で、前記抗体が、生体内及び試験管内において抗腫瘍活性を有することが実証された。そのうえ、トラスツズマブの抗腫瘍活性の相加的な又は相乗的な亢進が、マウス・モデルにおいて様々な抗腫瘍作用物質との組み合わせで観察された。臨床試験では、HER2を過剰発現している転移性乳癌の患者において、生存の延長が観察された。
【0006】
WO 98/45331によると、疾患の予防又は治療における抗VEGF抗体の有効性は、例えば、HER2受容体に結合することができる抗体のような、それらの目的に有効な別の作用物質と連続的に又は組み合わせてその抗体を投与することによって改善され得る。WO 2005/012531は、結腸直腸癌、転移性乳癌、及び腎癌の治療において、抗VEGF抗体(例えば、Avastin(登録商標))、及び/又は抗ErbB抗体(例えば、Herceptin(登録商標))と併用されるかもしれない抗体を説明している。WO 2005/063816によると、抗VEGF抗体は、転移性乳癌の治療において抗ErbB抗体と併用されてもよい。WO 2005/00090及びWO 2003/077841は、また、腫瘍治療のための抗VEGF抗体と抗ErbB2抗体の併用を開示している。
【0007】
癌治療の失敗が、外科手術を使用して一般に対処されている原発腫瘍の増殖によって必ずしも引き起こされるわけではなく、むしろ別の臓器への転移拡散によって引き起こされるということで、臨床腫瘍学者は意見が一致している。異なった細胞毒性薬物による原発腫瘍の退縮が、抗転移活性それ自体を常に示唆しているわけではない。これに反して、増大した転移が、いくつかの抗癌剤に対応して観察された(Geldof, A. A., et al., Anticancer Res. 8(1988)1335-1339;Murphy, S. B., J. din. Oncol. 11(1993)199-201;及びDe LarcoJ. E., et al., Cancer Res. 61(2001)2857-2861)。明らかに、原発腫瘍だけではなく、転移の抑制も対象とする治療法を開発する必要性が存在している。
【発明の概要】
【0008】
発明の概要
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患を治療するための医薬品の製造のための抗HER2抗体及び抗VEGF抗体の使用であって、治療上有効な量の抗HER2抗体及び抗VEGF抗体を前記患者に投与することを含めた前記使用を含む。
【0009】
好ましい態様において、本発明は、ベバシズマブなどの抗VEGF抗体を用いた事前の治療に失敗した患者におけるHER2受容体タンパク質の過剰発現を特徴とする乳癌疾患を治療するための医薬品の製造のためのトラスツズマブ及びベバシズマブの使用であって、治療上有効な量のトラスツズマブ及びベバシズマブを前記患者に投与することを含めた前記使用を含む。
【0010】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患の治療方法であって、上述の抗VEGF抗体療法を続けながら、前記患者に治療上有効な量の抗HER2抗体を投与することを含めた前記治療方法をさらに含む。
【0011】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者におけるHER2受容体タンパク質の過剰発現を特徴とする乳癌疾患の治療方法であって、ベバシズマブ療法を続けながら、治療上有効な量のトラスツズマブを前記患者に投与することを含めた前記治療方法をさらに含む。
【0012】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者の生存期間を延長する方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗HER2抗体及び抗VEGF抗体の併用投与が生存期間を効果的に延長することを含めた前記方法をさらに含む。
【0013】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者の無増悪生存率を高める方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与が無増悪生存期間を効果的に延長することを含めた前記方法をさらに含む。
【0014】
本発明は、乳癌疾患にかかっていて、且つ、抗VEGF抗体を用いた事前の治療に失敗した患者群の治療方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与がその患者群の奏功率(response rate)を効果的に高めることを含めた前記方法をさらに含む。
【0015】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者の奏功期間を延長する方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与が奏功期間を効果的に延長することを含めた前記方法をさらに含む。
【0016】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者の治療方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与が生存期間、無増悪生存率、奏功率、又は奏功期間によって計測されるような治療患者の統計的に有意な、且つ、臨床的に重要な改善をもたらすことを含めた前記方法をさらに含む。
【0017】
本願発明は、抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者における転移を低減する方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与が転移を効果的に低減することを含めた前記方法をさらに含む。
【0018】
本発明は、乳癌疾患にかかっていて、且つ、抗VEGF抗体を用いた事前の治療に失敗した患者群の治療方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与がその患者群における転移を効果的に低減することを含めた前記方法をさらに含む。
【0019】
本発明は、容器、当該容器内の抗VEGF抗体を含む組成物、及び抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者に抗VEGF抗体と抗HER2抗体を投与することを前記組成物の使用者に指図する添付文書、を含む製品を提供する。
【0020】
本発明は、容器、当該容器内の抗HER2抗体を含む組成物、及び抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者に抗HER2抗体及び抗VEGF抗体を投与することを組成物の使用者に指図する添付文書、を含む製品をさらに提供する。
【0021】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患の治療に有用な抗HER2抗体及び抗VEGF抗体を含む組成物をさらに提供する。好ましくは、抗HER2抗体は、トラスツズマブである。また、好ましくは、抗VEGF抗体は、ベバシズマブである。
【図面の簡単な説明】
【0022】
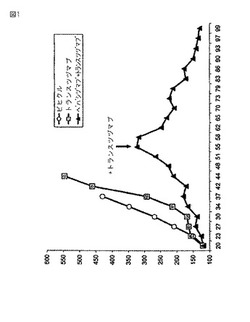
【図1】ベバシズマブ治療に失敗した後の腫瘍増殖に対する併用したトラスツズマブ及びベバシズマブによる治療の抗腫瘍活性。腫瘍体積(mm3)の平均値をY軸上にプロットし;腫瘍細胞注射後の日数をX軸にプロットした。溶媒(丸)、30mg/kgの初回負荷量、そして15mg/kgの維持量のトラスツズマブ(四角)、治療が15mg/kgのトラスツズマブも含む55日目までが、5mg/kgのベバシズマブ(三角)。
【図2】併用したトラスツズマブ及びベバシズマブによる治療の肺転移に対する効果。ヒトAlu DNA配列の平均値(ng/ml)を、リアルタイムPCR法を使用して肺組織から定量し、そして、Y軸上にプロットした。
【発明を実施するための形態】
【0023】
発明の詳細な説明
本発明による用語「VEGF」は、血管内皮細胞増殖因子(Swiss-Prot番号P15692)、その選択的スプライシング型(例えば、Leung, D. W., et al., Science, 246(1989)1306-1309;及びHouck, K. A., et al., Mol. Endocrin. 5(1991)1806-1814を参照のこと)、及び活性断片、好ましくは、N末端断片を指す。
【0024】
本発明による用語「抗VEGF抗体」は、VEGFに特異的に結合する抗体である。本明細書中の好ましいヒト化抗VEGF抗体又は変異型抗VEGF抗体は、1×10-8M以下、そして、好ましくは5×10-9M以下のKd値でヒトVEGFに結合する。好ましくは、抗VEGF抗体は、Presta, L. G., et al., Cancer Res. 57(1997)4593-4599に従って作り出された組み換え型ヒト化抗VEGFモノクローナル抗体と同じエピトープに結合するモノクローナル抗体である。好ましい抗体は、ベバシズマブである。抗VEGF抗体、及びその製造方法は、例えば、US 6,054,297、US 2003/0190317、US 6,632,926、US 6,884,879、及びUS 2005/0112126に記載されている。
【0025】
ベバシズマブには、突然変異型ヒトIgG1フレームワーク領域、及び、ヒトVEGFがその受容体に結合するのを阻止する、マウス抗hVEGFモノクローナル抗体由来の抗原結合相補性決定領域、が含まれる。フレームワーク領域の大部分を含めたベバシズマブのアミノ酸配列の約93%がヒトIgG1由来であり、そして、前記配列の約7%がマウス抗体A4.6.1由来である。ベバシズマブは、約149,000ダルトンの分子質量を持ち、且つ、グリコシル化されている。ベバシズマブとその調製法は、EP 1 325 932に記載されている。
【0026】
HER2は、neuやc-erbB-2とも呼ばれる185kDaの成長因子受容体であり(Slamon, D, J., et al., Science 235(1987)177-182;Swiss-Prot P04626)、その機能は、ヒト乳癌細胞への腫瘍性形質転換に関連する。このタンパク質の過剰発現は、20〜30 %の乳癌患者において同定されており、これは局所的な進行疾患、腫瘍再発の確率の増大、及び患者生存率の低下と相関している。胃癌、子宮内膜癌、唾液腺癌、非小細胞肺癌、膵臓癌、卵巣癌、腹膜癌、前立腺癌、又は結腸直腸癌にかかった患者の30〜40%ほどが同様に、このタンパク質の過剰発現を示すかもしれない。抗HER2抗体とその製造方法は、例えば、US 6,054,297、WO 89/06692、US 6,953,842、US 6,949,245、US 6,399,063、US 6,165,464、US 6,054,297、US 5,772,997、WO 2003/087131、WO 01/00245、WO 01/00238、WO 00/69460、WO 00/52054、WO 99/31140、及びWO 98/17797に記載されている。本発明の好ましい態様において、抗HER2抗体はトラスツズマブである。トラスツズマブとその調製法は、EP 0 590 058に記載されている。
【0027】
HER2受容体タンパク質の「過剰発現」という用語は、患者の特定の組織又は臓器内の腫瘍からの細胞におけるHER2受容体タンパク質発現が、その組織又は臓器からの正常細胞における発現レベルに対して異常なレベルを示すことを意味する。HER2受容体の過剰発現を特徴とする癌にかかっている患者は、当該技術分野で知られている標準的なアッセイによって診断され得る。好ましくは、過剰発現は、免疫組織化学的(IHC)検出法を使用することで、凍結又はパラフィン包埋組織切片の固定細胞において計測される。組織学染色と組み合わせた場合には、標的タンパク質の局在性を断定することができ、且つ、腫瘍内でのその発現を質的にも半定量的にも計測することができる。そのようなIHC検出アッセイが、当該技術分野で知られていて、そして、臨床試験アッセイ(CTA)、市販のLabCorp 4D5テスト、及び市販のDAKO HercepTest(登録商標)(DAKO、Carpinteria, Calif.)に含まれている。後者のアッセイは、HER2タンパク質の過剰発現している癌を特定するのに、0〜3+の固有の範囲の細胞染色(0が正常発現であり、3+が最も強い陽性の発現を示す)を使用する(Herceptin(登録商標)(トラスツズマブ)の全面的な指図情報を参照のこと、1998年9月、Genentech Inc.、San Francisco, Calif.)。これにより、1+、2+、又は3+の範囲、好ましくは2+又は3+、より好ましくは3+のHER2タンパク質の過剰発現を特徴とする癌にかかっている患者は、本発明の療法から恩恵を受けるだろう。
【0028】
用語「乳癌疾患」は、異常乳房細胞の無制限増殖を指す。それには、非浸潤性乳管癌、浸潤性乳管癌、非浸潤性小葉癌、浸潤性小葉癌、髄様癌、乳頭のページェット病、及び転移性乳癌が含まれる。
【0029】
用語「抗VEGF抗体を用いた事前の治療に失敗した」又は「治療失敗」は、本明細書中では、抗VEGF抗体を用いた過去の療法に対して反応がない腫瘍患者か(「無奏功患者」)、又は過去の療法に対して初めは効果を示したが、療法への反応が維持されなかった腫瘍患者(「再発患者(relapsers)」とも呼ばれる)を指す。好ましくは、用語「抗VEGF抗体を用いた事前の治療に失敗した」は、再発患者を指す。治療失敗(それぞれ奏功(RE)と非奏功(NR))は、患者治療を評価することが当該技術分野で一般に知られている臨床データ及び実験データからの結果によって確認される施術者の医学的判断に基づいて定められる。そのようなデータは、一例として、臨床検査、細胞学的及び組織学的技術、内視鏡検査及び腹腔鏡検査、超音波、CT、PET、及びMRIスキャン、胸部X線写真及びマンモグラフィー、並びに、例えば、CEA、Cyfra、CA15-3、インターロイキン8、及び可溶性HER2などの腫瘍マーカーの濃度の計測、から得られるかもしれない。このような関係において、「治療失敗」は、臨床的改善の不存在と規定される。あるいは、RECIST基準が、腫瘍反応を測定するために使用されるかもしれない(Therasse, P., et al., J. Nat. Cancer Institute 92(2000)205-216)。このような関係において、「治療失敗」は、「不完全奏功/安定(stable disease)」又は「進行(progressive disease)」のいずれかと規定される。
【0030】
RECIST評価基準に従って、固形腫瘍に関する腫瘍反応は(Therasse, P., et al., J. Nat. Cancer Institute 92(2000)205-216)、(例えば、CTにより計測される)腫瘍の体積の増悪又は退縮に依存して以下の4つのレベル:完全奏功(complete response)(CR)又は部分奏功(partial response)(PR)、安定(stable disease)(SD)、及び進行(progressive disease)(PD)に分類される(表1を参照のこと)。さらに、欧州癌研究治療機関(EORTC)は、2-[18F]-フルオロ-2-デオキシグルコース陽電子放出断層撮影(FDG-PET)により計測される腫瘍の代謝に依存する以下の4つのレベル:完全奏功(CMR)又は部分奏功(PMR)、安定(SMD)、及び進行(PMD)への分類を提案した(Young H., et al., Eur. J. Cancer 35(1999)1773-1782 and Kellof, G. J., et al., Clin. Cancer Res. 11(2005)2785- 2808)(表2を参照のこと)。
【0031】
【表1】

【0032】
【表2】

【0033】
これにより、好ましくは、本願発明による「奏功(RE)」と「非奏功(NR)」は、先に記載のRECIST及びFDG-PET基準の両方を使用した、コンピュータ断層撮影(CT)と2-[18F]-フルオロ-2-ジオキシグルコース陽電子放出断層撮影(FDG-PET)の組み合わせによって得られるデータに基づいて定められる(Kellof, G. J., et al., Clin. Cancer Res. 11(2005)2785-2808及びYoung H., et al., Eur. J. Cane. 35(1999)1773-1782)。従って、本願発明による奏功(RE)と非奏功(NR)は、好ましくは以下のとおり決定される:
奏功(RE):CR又はPRは、CT-RECIST基準(表1)によって定められ、それと同時に、CMR又はPMRは、FDG-PET(表2)によって定められる。これにより、奏功(RE)は、組み合わせられたCTとPETの測定に関する以下の4つのケース:CRとCMR、PRとPMR、CRとPMR、及びPRとCMR、の中のいずれかを意味する。
【0034】
非奏功(NR):SD又はPDは、CT-RECIST基準(表1)によって定められ、それと同時に、SMD又はPMDは、FDG-PET(表2)によって定められる。これにより、組み合わせられたCTとPETの測定に関する以下の4つのケース:SDとSMD、SDとPMD、PDとSMD、及びPDとPMDが、非奏功(NR)を意味する。
【0035】
通常、奏功は、治療開始後約3〜8週間、好ましくは約6週間にて測定される。この奏功判定は、4〜8週間ごとに、好ましくは6〜8週間ごとに通常繰り返される。最初の判定の時点で、顕著な奏功(RE)が確認されたなら、その後、(最初の判定後の非奏功(RE)を意味する)再発は、早くて、2番目の奏功判定の時点で判定され得る。
【0036】
このような関係において、用語「抗VEGF抗体を用いた事前の治療に失敗した患者」は、最初の奏功判定の時点で、非奏功(NR)と定められる患者か(「非奏功患者」)、又は最初の奏功判定の時点で、奏功(RE)と定められ、2番目若しくはその後の奏功判定において、非奏功(NR)と定められる患者(「再発患者」)を指す。
【0037】
本発明による用語「転移」は、続発性腫瘍を引き起こす、原発腫瘍から患者の他の部分の1ヶ所以上の部位への癌細胞の伝播を指す。拡散した細胞によって形成された腫瘍は、「転移性腫瘍」又は「転移癌」と呼ばれる。転移性腫瘍には、本来の(原発)腫瘍の中にあるもののような細胞が含まれる。癌が転移したかどうか判定する手段は、当該技術分野で知られていて、そして、癌マーカー試験、骨スキャン、胸部X線写真、コンピュータ断層撮影(CT)、コンピューター横断断層撮影(CAT)、分子共鳴画像法(MRI)、陽電子放出断層撮影(PET)、単光子放出コンピュータ断層撮影(SPECT)、蛍光画像法(FI)、及び生物発光画像法(BLI)と癌マーカー試験が含まれる(例えば、Helms, M. W., et al., Contributions to microbiology 13(2006)209-231及びPantel, K., et al., J. Nat. Cancer Inst. 91(1999)1113-1124を参照のこと)。
【0038】
本明細書中に使用される場合、用語「患者」は、好ましくは、癌、前癌状態、又は病巣を治すために治療を必要としているヒトを指す。しかしながら、用語「患者」は、治療を必要としているヒト以外の動物、好ましくは、特に、イヌや、ネコや、ウマや、ウシや、ブタや、ヒツジや、ヒト以外の霊長動物などの哺乳動物を指す可能性もある。
【0039】
用語「群」は、患者群、並びに患者亜群を指す。
【0040】
用語「添付文書」は、治療薬の商用パッケージ内に通例含まれている取扱説明書を指し、その治療薬の使用に関する適応症、用法、用量、投与、禁忌、及び/又は警告に関する情報を含んでもよい。
【0041】
前記癌は、例えば、肺癌、非小細胞肺(NSCL)癌、細気管支肺胞細胞肺癌、骨癌、膵臓癌、皮膚癌、頭部若しくは頚部の癌、皮膚若しくは眼内黒色腫、子宮癌、卵巣癌、直腸癌、肛門部の癌、胃癌(stomach cancer、gastric cancer)、結腸癌、乳癌、子宮癌、卵管癌、子宮内膜の癌腫、子宮頚部の癌腫、膣癌、外陰癌、ホジキン病、食道癌、小腸癌、内分泌系の癌、甲状腺癌、傍甲状腺の癌、副腎の癌、軟組織の肉腫、尿道の癌、陰茎の癌、前立腺癌、膀胱癌、腎臓若しくは尿道の癌、腎細胞癌、腎盂癌、中皮腫、肝細胞癌、胆道癌、慢性若しくは急性白血病、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、脊髄軸腫瘍、脳幹膠腫、多形膠芽腫、星状細胞腫、シュワン腫、上衣腫、髄芽腫、髄腹腫、扁平上皮癌、脳下垂体腺腫、前記の癌のいずれかの難治性異形を含めたもの、又は前記の癌の1種類以上の組み合わせであるかもしれない。前癌状態又は病巣には、例えば、口腔白板症、光線性角化症(日光性角化症)、結腸若しくは直腸の前癌状態のポリープ、胃上皮形成異常、腺腫様の形成異常、遺伝性非腺腫性大腸癌症候群(HNPCC)、バレット食道、膀胱形成不全、及び前癌状態の子宮頚部の病態から成る群が含まれる。好ましい態様において、治療されるべき癌は乳癌疾患である。また、好ましい態様において、癌はHER2受容体タンパク質の過剰発現を特徴とする。
【0042】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患の治療方法であって、上述の抗VEGF抗体療法を続けながら、治療上有効な量の抗HER2抗体を前記患者に投与することを含めた前記方法を含む。
【0043】
本明細書中に使用される用語「治療する」は、別段の指示がない限り、患者の腫瘍、腫瘍転移、又はその他の発癌性若しくは腫瘍性細胞の進行を回復させること、緩和すること、抑制すること、あるいは、その増殖を部分的に若しくは完全に予防することを意味する。本明細書中に使用される用語「治療」は、別段の指示がない限り、治療行為を指す。
【0044】
語句「治療方法」又はその相当語句は、例えば、癌に対して用いられると、患者の癌細胞の数を減少させるか、排除するように、若しくは癌の症状を緩和するように設計された手順又は行動方針を指す。癌又は別の増殖性障害の「治療方法」は、癌細胞又は他の障害が実際に取り除かれること、細胞数又は障害が実際に低減すること、あるいは、癌又は他の障害の症状が実際に緩和されることを必ずしも意味するとは限らない。多くの場合、たとえ成功の可能性が低くても、それでもなお、患者の病歴と推定の生存予測を加味し、総合的に有益な行動方針であると考えられる癌の治療方法が実施される。
【0045】
用語「治療的有効量」又は「有効量」は、研究者、獣医、医師、若しくは他の臨床医によって求められている組織、系、動物、又はヒトの生物学的又は医学的奏功を引き出す対象の化合物又は組み合わせ物の量を意味する。
【0046】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患を治療するための医薬品の製造のための抗HER2抗体及び抗VEGF抗体の使用であって、上述の抗VEGF抗体療法を続けながら、治療上有効な量の抗HER2抗体を前記患者に投与することを含めた前記方法をさらに含む。抗体は、別々に又は同時に投与されるかもしれない。
【0047】
用語「医薬品の製造方法」は、本明細書中に指定した適応症、及び、特に、腫瘍、腫瘍転移、又は一般的な癌の治療に使用するための医薬品の製造に関する。前記用語は、指定された適応症における、いわゆる「スイス・タイプ」クレーム形式に関する。
【0048】
本願発明との関連において、追加的な他の細胞傷害性、化学療法剤、若しくは抗癌剤、又はそのような作用物質の効果を高める化合物が、抗VEGF抗体と抗HER2抗体を組み合わせた状態で使用されるかもしれない。そのような作用物質には、例えば:シクロホスファミド(CTX;例えば、cytoxan(登録商標))、クロラムブシル(CHL;例えば、leukeran(登録商標))、シスプラチン(CisP;例えば、platinol(登録商標))、ブスルファン(例えば、myleran(登録商標))、メルファラン、カルムスチン(BCNU)、ストレプトゾトシン、トリエチレンメラミン(TEM)、マイトマイシンCなどのアルキル化作用を有するアルキル化剤(単数若しくは複数);メトトレキサート(MTX)、エトポシド(VP16;例えば、vepesid(登録商標))、6-メルカプトプリン(6MP)、6-チオグアニン(6TG)、シタラビン(Ara-C)、5-フルオロウラシル(5-FU)、カペシタビン(例えば、Xeloda(登録商標))、ダカルバジン(DTIC)などの代謝拮抗剤;アクチノマイシンD、ドキソルビシン(DXR;例えば、adriamycin(登録商標))、ダウノルビシン(ダウノマイシン)、ブレオマイシン、ミトラマイシンなどの抗生物質;ビンクリスチン(VCR)、ビンブラスチンなどの、例えば、ビンカ・アルカロイドなどのアルカロイド;そして、パクリタキセル(例えば、taxol(登録商標))や、パクリタキセル誘導体などの他の抗腫瘍剤、細胞増殖抑制剤、デキサメサゾン(DEX;例えば、decadron(登録商標))などのグルココルチコイド、並びに、プレドニゾンなどのコルチコステロイド、ヒドロキシウレアなどのヌクレオシド酵素阻害剤、アスパラギナーゼや、ロイコボリンや、他の葉酸誘導体などのアミノ酸除去酵素、そして、類似のさまざまな抗腫瘍剤が含まれる。以下の医薬品:アミホスチン(例えば、ethyol(登録商標))、ダクチノマイシン、メクロルエタミン(ナイトロジェン・マスタード)、ストレプトゾシン、シクロホスファミド、ロムスチン(CCNU)、ドキソルビシン・リポ(例えば、doxil(登録商標))、ゲムシタビン(例えば、gemzar(登録商標))、ダウノルビシン・リポ(例えば、daunoxome(登録商標))、プロカルバジン、マイトマイシン、ドセタクセル(例えば、taxotere(登録商標))、アルデスロイキン、カルボプラチン、オキサリプラチン、クラドリビン、カンプトテシン、CPT11(イリノテカン)、10-ヒドロキシ7-エチル-カンプトテシン(SN38)、フロクシウリジン、フルダラビン、イホスファミド、イダルビシン、メスナ、インターフェロンβ、インターフェロンα、ミトキサントロン、トポテカン、ロイプロリド、メゲストロール、メルファラン、メルカプトプリン、プリカマイシン、ミトタン、ペガスパルガーゼ、ペントスタチン、ピポブロマン、プリカマイシン、タモキシフェン、テニポシド、テストラクトン、チオグアニン、チオテパ、ウラシル・マスタード、ビノレルビン、クロラムブシルもまた、追加的な作用物質として使用されるかもしれない。
【0049】
本願発明との関連において、抗ホルモン剤が、抗VEGF抗体と抗HER2抗体を組み合わせた状態で使用されるかもしれない。本明細書中に使用される用語「抗ホルモン剤」には、腫瘍に対するホルモン作用を調節又は抑制するように作用する天然若しくは合成の有機若しくはペプチド化合物が含まれる。抗ホルモン作用物質には、例えば、以下の:ステロイド受容体アンタゴニスト、例えば、タモキシフェン、ラロキシフェン、アロマターゼ抑制性4(5)-イミダゾール、他のアロマターゼ阻害剤、42-ヒドロキシタモキシフェン、トリオキシフェン、ケオキシフェン、LY 117018、オナプリストン、及びトレミフェン(例えば、Fareston(登録商標))などの抗エストロゲン剤;例えば、フルタミド、ニルタミド、ビカルタミド、ロイプロリド、及びゴセレリンなどの抗アンドロゲン;並びに前記のいずれかの医薬として許容されるな塩、酸、又は誘導体;例えば、濾胞刺激ホルモン(FSH)、甲状腺刺激ホルモン(TSH)、及び黄体形成ホルモン(LH)とLHRH(黄体形成ホルモン放出ホルモン)などの糖タンパク質ホルモンの作動薬、及び/又は拮抗薬;Zoladex(登録商標)(AstraZeneca)として市販のLHRH作動薬である酢酸ゴセレリン;LHRH拮抗薬であるD-アラニンアミドN-アセチル-3-(2-ナフタレニル)-D-アラニル-4-クロロ-D-フェニルアラニル-3-(3-ピリジニル)-D-アラニル-L-セリル-N6-(3-ピリジニルカルボニル)-L-リシル-N6-(3-ピリジニルカルボニル)-D-リシル-L-ロイシル-N6-(1-メチルエチル)-L-リシル-L-プロリン(例えば、Antide(登録商標)、Ares-Serono);LHRH拮抗薬である酢酸ガニレリクス;ステロイド系抗アンドロゲン剤である酢酸シプロテロン(CPA)及びMegace(登録商標)としての市販の酢酸メゲステロール(Bristol-Myers Oncology);Eulexin(登録商標)(Schering Corp.)としての市販の非ステロイド系抗アンドロゲン剤であるフルタミド(2-メチル-N-[4,20-ニトロ-3-(トリフルオロメチル)フェニルプロパンアミド);非ステロイド系抗アンドロゲン剤であるニルタミド(5,5-ジメチル-3-[4-ニトロ-3-(トリフルオロメチル-4’-ニトロフェニル)-4,4-ジメチル-イミダゾリン-ジオン);そして、例えば、RAR(レチノイン酸受容体)、RXR(レチノイドX受容体)、TR(甲状腺受容体)、VDR(ビタミンD受容体)の拮抗薬などの他の非許容受容体の拮抗薬が含まれる。
【0050】
化学療法の投薬計画における先に記載の細胞傷害性抗癌剤及び他の抗癌剤の使用は、一般に、癌療法技術において十分に特徴づけされており、そして、本明細書中でのその利用は、多少の調整により、寛容性と有効性の観察、及び投与経路と投薬量の管理に関して同じ考慮事項に該当する。例えば、細胞毒性薬の実際の投薬量は、組織培養法(histoculture methods)を使用することによって判断される患者の培養細胞反応によって異なるかもしれない。一般に、投薬量は、他の追加の作用物質が存在しない状態で使用される量と比較して、低減される。
【0051】
有効な細胞毒性薬の標準的な投薬量は、製造業者によって推奨される範囲内であり得、そして、試験管内における反応、又は動物モデルでの反応が示された場合には、濃度又は量を最大で約1桁下げてもよい。よって、実際の投薬量は、医師の判断、患者の状態、そして、初代培養悪性細胞、若しくは組織培養した組織サンプルの試験管内における反応性、又は適切な動物モデルで観察された反応に基づく療法の有効性に依存する。
【0052】
本願発明との関連において、例えば:米国特許番号第6,080,769号;同第6,194,438号;同第6,258,824号;同第6,586,447号;同第6,071,935号;同第6,495,564号;同第6,150,377号;同第6,596,735号;及び同第6,479,513号、並びに国際公開WO 01/40217で開示され、特許を主張している化合物を含む、酵素であるファルネシル・タンパク質トランスフェラーゼの阻害剤や、受容体チロシンキナーゼPDGFRの阻害剤を含めた追加的な抗増殖剤は、抗VEGF抗体と抗HER2抗体を組み合わせた状態で使用してもよい。
【0053】
本願発明との関連において、抗VEGF抗体と抗HER2抗体の組み合わせに加えて、有効量のイオン化放射が実施されてもよく、そして/あるいは放射性医薬品が使用されてもよい。放射線源は、治療される患者の体外にあるか、又は体内にある。線源が患者の体外にあるとき、療法は、外照射療法(EBRT)として知られている。放射線源が患者の体内にあるとき、治療は、小線源療法(BT)と呼ばれる。本願発明との関連において使用するための放射性原子は、これだけに制限されることなく、ラジウム、セシウム137、イリジウム192、アメリシウム241、金198、コバルト57、銅67、テクネチウム99、ヨウ素-123、ヨウ素131、及びインジウム111を含めた群から選択され得る。本願発明によるEGFRキナーゼ阻害剤が抗体である場合には、その抗体をそのような放射性同位体で標識することも可能である。
【0054】
放射線療法は、切除不能な腫瘍、若しくは手術不能な腫瘍、及び/又は腫瘍転移を管理するための標準的な治療である。放射線照射療法が化学療法と組み合わせられた時に、改善された結果が見られた。放射線療法は、目標領域にデリバリーされた高線量の放射線照射が腫瘍と正常組織の両方の生殖細胞(reproductive cell)の死滅をもたらすという原理に基づいている。放射線照射線量は、一般に、放射線吸収線量(Gy)、時間、及び分割により規定され、且つ、腫瘍学者によって慎重に規定されなければならない。患者が受ける放射線量は、様々な考慮事項に依存するが、2つの最も重要な点は、体の他の危険構造体又は臓器と関連した腫瘍の位置と、腫瘍が広がった程度である。放射線療法を受けている患者に関する代表的な治療方針は、約1.8〜2.0Gyの1日1回の分割線量で、1週間あたり5日間、患者に投与される、全量10〜80Gyの1〜6週間にわたる治療スケジュールになる。本願発明の好ましい態様において、ヒト患者の腫瘍を本発明のものと放射線照射の併用療法で治療したときに、相乗効果がある。言い換えれば、放射線照射と併用されると、場合により、追加的な化学療法剤又は抗癌剤と併用されると、本発明の併用物を含めた作用物質による腫瘍増殖の阻害が増強される。補助放射線療法に関するパラメーターは、例えば、国際公開WO 99/60023に含まれている。
【0055】
抗体は、ボーラスとして静脈内投与によって、若しくは一定期間にわたる連続点滴によって、筋肉内、腹腔内、脳脊髄内、皮下、関節内、滑液嚢内、若しくはくも膜下腔内経路によって、公知の方法により患者に投与される。抗体の静脈内又は皮下投与が好まれる。
【0056】
抗VEGF抗体及び抗HER2抗体投与の量、並びに投与のタイミングは、治療される患者のタイプ(種、性別、年齢、体重など)、状態、及び治療される疾患又は病態の重症度に依存する。
本発明による抗体の投与のための投薬量は、1回以上の別々の投与によるか、又は連続点滴による約1μg/kg〜50mg/kg(例えば、0.1〜20mg/kg)の抗体である。代表的な1日投与量は、約1μg/kg〜約100mg/kgの範囲におよんでもよい。好ましい側面において、抗体は、約1mg/kg〜約15 mg/kgの範囲におよぶ用量にて、2〜3週間毎に投与される。ベバシズマブの好ましい用量は、疾病の進行が検出されるまで、IV注入として14日間に1回、5mg/kgである。トラスツズマブの好ましい用量は、越えるのに90分間にわたって投与される4mg/kgの負荷投与量と、その後の30分間にわたり投与される2mg/kgの毎週の注入である。
【0057】
本発明は、抗VEGF抗体、並びに抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者に抗VEGF抗体と抗HER2抗体を投与することを組成物の使用者に指図する添付文書を含むキットをさらに提供する。好ましい態様において、キット・容器は、医薬として許容される担体をさらに含んでもよい。前記キットは、無菌の希釈剤をさらに含むかもしれず、それは、別々の追加の容器内に好ましくは保存される。前記キットは、乳癌疾患に関する方法としての併用治療の使用を指示する印刷された指示書を含めた添付文書をさらに含んでもよい。
【0058】
本発明は、特に、抗HER2抗体及び抗VEGF抗体を含めた、抗VEGF抗体を用いた事前の治療に失敗した乳癌疾患の治療において有用な医薬組成物をさらに提供する。そのような組成物は、場合により、医薬として許容される担体、及び/又は賦形剤を含む。好ましい態様において、抗VEGF抗体はベバシズマブであり、そして、抗HER2抗体はトラスツズマブである。
【実施例】
【0059】
以下の実験の詳細は、本発明の理解を助けるために提供され、本発明の真の範囲は、添付の請求項に規定される。特定の方法及び議論されている結果は、本発明の単なる例証にすぎないので、決してそれに制限されるものではないことは理解されよう。
【0060】
序論
この研究は、ヒト乳房異種移植モデルにおける単独ベバシズマブ治療の失敗後のベバシズマブとトラスツズマブの併用に関する抗腫瘍活性を調べた。本研究のさらなる目的は、転移に対する治療効果を調べることである。
【0061】
試験薬
トラスツズマブを、ヒスチジン-HCl、α-αトレハロース(60mM)、0.01%のPolysorb、pH6.0中、25mg/mlの原液として提供した(Herceptin(登録商標))。ベバシズマブを、Na-リン酸、α-αトレハロース(60mM)、0.01%のPolysorb、pH6.0中、25mg/mlの原液として提供した(Avastin(登録商標))。両方の溶液を、注射用にPBSにより適切に希釈した。
【0062】
細胞株と培養条件
ヒト乳癌細胞株KPL-4を、炎症性皮膚転移を患っている乳癌患者の悪性胸水から株化したところ、これはErbBファミリー受容体を過剰発現している(Kurebayashi, J., et al., Br. J. Cancer 79(1999)707-17)。腫瘍細胞を、水飽和雰囲気中、5%のCO2、37℃にて、10%のウシ胎仔血清(PAA)及び2mMのL-グルタミン(Gibco)を補ったDMEM培地(PAA Laboratories, Austria)中、ごく普通に培養する。培養物の継代を、トリプシン/EDTA 1×(PAA)を用いて実施し、2倍/週に分ける。細胞継代P6を、生体内研究に使用する。
【0063】
動物
SCIDベージュ(C.B.-17)マウス;10〜12週齢;体重18〜20g(Charles River, Sulzfeld, Germany)を、国際的なガイドライン(GV-Solas;Felasa;TierschG)に従って12h明/12h暗の一日サイクルを用いて、特定病原体を含まない条件下で維持する。到着後に、動物を、新しい環境に慣れさせ、そして、観察するために、動物飼育施設の隔離部分に1週間収容する。連続した健康状態の観察を、定期的におこなう。減量食(Alltromin)と水(pH2.5〜3に酸性化)を自由にとらせる。
【0064】
生体内における腫瘍増殖阻害の研究
腫瘍細胞を、培養フラスコ(Greiner TriFlask)から採取し(トリプシン-EDTA)、50mlの培地中に移し、1回洗浄し、そして、PBS中に再懸濁した。追加のPBSでの洗浄ステップと濾過(細胞濾過器;Falcon 100μm)の後に、最終的な細胞価を、0.75×108/mlに調整した。腫瘍細胞懸濁液を、細胞凝集を避けるようにホールピペットを用いて慎重に混合する。麻酔を、閉鎖型循環装置内、プレインキュベーション・チャンバー(プラキシガラス)、個別のマウス鼻マスク(シリコン)、及びイソフルラン(Pharmacia-Upjohn、Germany)を用いた小動物用Stephens吸入ユニットを使用して実施した。注射の2日前に、動物の毛皮を剃った。乳腺脂肪体内(i.f.m.p.)注射に関しては、細胞を、20μlの容量にて、それぞれの麻酔下マウスの右側の2番目の鼠径部乳腺脂肪体へと同所に注射した。同所性移植に関しては、前記細胞懸濁液を、乳頭下に皮膚を貫いて注射した。腫瘍細胞注射は、実験の1日目に相当する。
【0065】
観察
悪影響の臨床的症状の検出のために、動物を毎日管理した。実験中の観察に関しては、動物の体重を週2回記録し、且つ、腫瘍体積を週2回、カリパスによって計測した。原発腫瘍体積を、NCIプロトコールに従って計算した(TW=1/2ab2、ここで、aとbは、mm単位による腫瘍サイズの長径と短径である、Teicher, B., Anticancer drug development guide, Humana Press 5(1997)92)。計算値を、平均値及び標準偏差値として記録した。
【0066】
動物の治療
腫瘍体積が、約100mm3になったときに、腫瘍を持つマウスを、無作為化した(各群に関してn=10)。各群を治療前によく一致させた。治療は腫瘍細胞注射の20日後に開始した。溶媒群(第1群)には、週1回、腹腔内(i.p.)に10ml/kgのPBSバッファーを与えた。トラスツズマブ(第2群)には、30mg/kgの初回負荷量にてi.p.に投与し、それに続いて、週1回、15mg/kg(維持量)の用量にて投与した。抗VEGF抗体であるベバシズマブを、週2回、5mg/kgの投薬量にてi.p.に与えた(第3群)。40日目に、第3群の治療を、トラスツズマブ(i.p.に週1回、15mg/kg)を伴うベバシズマブ(i.p.に週2回、5mg/kg)の併用療法に切り換えた。
【0067】
転移の評価
肺内への腫瘍細胞の拡散は、屠殺した動物で測定した。転移はSchneider, T., et al., Clin. Exp. Metastasis 19(2002)571-582に従って計測した。要約すると、肺組織を採取し、そして、ヒトAlu配列をリアルタイムPCR法によって定量化した。リアルタイムPCR法によって定量化された、より高いヒトDNAレベルは、より高い転移レベルに相当する。
【0068】
結果
原発腫瘍の増殖に対する治療効果を、図1と表3に示す。溶媒群(第1群)の腫瘍は急速に増殖したので、腫瘍による潰瘍形成と臨床的症状の進行のため、腫瘍細胞注射の38日後にマウスを屠殺した。トラスツズマブによる単独療法(第2群)は、腫瘍体積に対して有意な効果を発揮しなかったので、そのため、44日目にマウスを屠殺した。ベバシズマブを用いた治療は、腫瘍増殖を有意に抑制した;しかしながら、44日目前後に腫瘍が再発し始めた。55日目に開始したベバシズマブとトラスツズマブの併用療法は、実験期間(99日目)の間、腫瘍増殖の完全な阻害をもたらし、且つ、治療は良好な耐容性を示した。
【0069】
【表3】

【0070】
肺転移に対する治療効果を、図2と表4に示す。ベバシズマブ治療が失敗した後の、トラスツズマブ及びベバシズマブの併用は、転移の急激な減少をもたらした。(二次組織内への腫瘍細胞の侵襲に関連する)ヒトAlu配列のレベルは、28日目に屠殺した溶媒治療動物を制し、且つ、44日目に屠殺したトラスツズマブ治療動物を制して、99日目に併用療法で治療した動物において有意に低かった。転移に対するこの驚くべき効果は、他の細胞毒性薬物で見られた効果とは対照的である(Geldof, A. A., et al., Anticancer Res. 8(1988)1335-1339;Murphy, J. Clin. Oncol. 11(1993)199-201、及びDe Larco, J. E., et al., Cancer Res. 61(2001)2857-2861)。
【0071】
【表4】

【技術分野】
【0001】
本発明は、抗HER2と抗VEGF抗体を用いた併用療法に関する。特に、本発明は、抗VEGF抗体を用いた前治療に失敗した患者の乳癌疾患を治療するための前述の抗体の使用に関係する。
【背景技術】
【0002】
血管新生は、固形腫瘍、増殖性網膜症若しくは加齢黄斑変性症(AMD)などの眼内の新生血管症候群、関節リウマチ、及び乾癬を含めたさまざまな障害の病因に関係する(Folkman, J., et al, J. Biol. Chem. 267(1992)10931- 10934;Klagsbrun, M., et al., Annu. Rev. Physiol. 53(1991)217-239;及びGarner, A, Vascular diseases, In:Pathobiology of ocular disease, A dynamic approach,(eds.)Garner and A, Klintworthi G K, 2nd Edition Marcel Dekker, New York,(1994), pp 1625-1710)。固形腫瘍の場合では、新生血管形成は、正常細胞と比べて、腫瘍細胞が成長の優位性と増殖の自律性を確保することを可能にする。従って、腫瘍切片の微小血管の密度と、乳癌、並びに他の数種類の腫瘍における患者生存率の間には相関関係が観察されている(Weidner, N., et al., N. Engl. J. Med. 324(1991)1-6;Horak, E.R., et al., Lancet 340(1992)1120-1124;及びMacchiarini, P., et al., Lancet 340(1992)145-146)。
【0003】
血管内皮増殖因子(VEGF)は、正常及び異常な血管新生の調整と、腫瘍及び眼内障害に関連する新生血管形成に関与している(Ferrara, N., et al., Endocr. Rev. 18(1997)4-25;Berkman, R. A., et al., J. Clin. Invest. 91(1993)153-159;Brown, L. F., et al., Human Pathol. 26(1995)86-91;Brown, L. F., et al., Cancer Res. 53(1993)4727-4735;Mattern, J., et al., Brit. J. Cancer 73(1996)931-934;及びDvorak, H. F., et al., Am. J. Pathol. 146(1995)1029-1039)。抗VEGF中和抗体は、マウスにおいてさまざまなヒト腫瘍細胞株の増殖を抑制する(Kim, K. J., et al., Nature 362(1993)841-844;Warren, R. S., et al., J. Clin. Invest. 95(1995)1789-1797;Borgstrom, P., et al., Cancer Res. 56(1996)4032-4039;及びMelnyk, O., et al., Cancer Res. 56(1996)921-924)。WO 94/10202、WO 98/45332、WO 2005/00900、及びWO 00/35956は、VEGFに対する抗体に言及している。ヒト化モノクローナル抗体である(商品名Avastin(登録商標)として販売されている)ベバシズマブは、腫瘍治療に使用される抗VEGF抗体であり、癌治療のために承認された唯一の抗血管新生剤である(WO 98/45331)。
【0004】
HER2は、ヒト上皮成長因子受容体ファミリーのメンバーであり、その細胞質領域にプロテインキナーゼ活性を有する。HER2は、腫瘍細胞において過剰発現され、そして、予後不良及び生存率に関連する。HER2は、そのため、乳癌治療の重要な標的である。HER2に対する抗体は、Takai, N., et al., Cancer 104(2005)2701-2708;Yeon, C. H., et al., Invest. New Drugs 23(2005)391-409;Wong, W. M., et al., Cancer Pract. 7(1999)48-50;Albanell, J., et al., Drugs Today(Bare). 35(1999)931-46により知られている。
【0005】
(商品名Herceptin(登録商標)として販売されている)トラスツズマブは、HER2過剰発現/HER2遺伝子増幅転移性乳癌の治療に使用される組み換え型ヒト化抗HER2モノクローナル抗体である。前臨床研究で、前記抗体が、生体内及び試験管内において抗腫瘍活性を有することが実証された。そのうえ、トラスツズマブの抗腫瘍活性の相加的な又は相乗的な亢進が、マウス・モデルにおいて様々な抗腫瘍作用物質との組み合わせで観察された。臨床試験では、HER2を過剰発現している転移性乳癌の患者において、生存の延長が観察された。
【0006】
WO 98/45331によると、疾患の予防又は治療における抗VEGF抗体の有効性は、例えば、HER2受容体に結合することができる抗体のような、それらの目的に有効な別の作用物質と連続的に又は組み合わせてその抗体を投与することによって改善され得る。WO 2005/012531は、結腸直腸癌、転移性乳癌、及び腎癌の治療において、抗VEGF抗体(例えば、Avastin(登録商標))、及び/又は抗ErbB抗体(例えば、Herceptin(登録商標))と併用されるかもしれない抗体を説明している。WO 2005/063816によると、抗VEGF抗体は、転移性乳癌の治療において抗ErbB抗体と併用されてもよい。WO 2005/00090及びWO 2003/077841は、また、腫瘍治療のための抗VEGF抗体と抗ErbB2抗体の併用を開示している。
【0007】
癌治療の失敗が、外科手術を使用して一般に対処されている原発腫瘍の増殖によって必ずしも引き起こされるわけではなく、むしろ別の臓器への転移拡散によって引き起こされるということで、臨床腫瘍学者は意見が一致している。異なった細胞毒性薬物による原発腫瘍の退縮が、抗転移活性それ自体を常に示唆しているわけではない。これに反して、増大した転移が、いくつかの抗癌剤に対応して観察された(Geldof, A. A., et al., Anticancer Res. 8(1988)1335-1339;Murphy, S. B., J. din. Oncol. 11(1993)199-201;及びDe LarcoJ. E., et al., Cancer Res. 61(2001)2857-2861)。明らかに、原発腫瘍だけではなく、転移の抑制も対象とする治療法を開発する必要性が存在している。
【発明の概要】
【0008】
発明の概要
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患を治療するための医薬品の製造のための抗HER2抗体及び抗VEGF抗体の使用であって、治療上有効な量の抗HER2抗体及び抗VEGF抗体を前記患者に投与することを含めた前記使用を含む。
【0009】
好ましい態様において、本発明は、ベバシズマブなどの抗VEGF抗体を用いた事前の治療に失敗した患者におけるHER2受容体タンパク質の過剰発現を特徴とする乳癌疾患を治療するための医薬品の製造のためのトラスツズマブ及びベバシズマブの使用であって、治療上有効な量のトラスツズマブ及びベバシズマブを前記患者に投与することを含めた前記使用を含む。
【0010】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患の治療方法であって、上述の抗VEGF抗体療法を続けながら、前記患者に治療上有効な量の抗HER2抗体を投与することを含めた前記治療方法をさらに含む。
【0011】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者におけるHER2受容体タンパク質の過剰発現を特徴とする乳癌疾患の治療方法であって、ベバシズマブ療法を続けながら、治療上有効な量のトラスツズマブを前記患者に投与することを含めた前記治療方法をさらに含む。
【0012】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者の生存期間を延長する方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗HER2抗体及び抗VEGF抗体の併用投与が生存期間を効果的に延長することを含めた前記方法をさらに含む。
【0013】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者の無増悪生存率を高める方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与が無増悪生存期間を効果的に延長することを含めた前記方法をさらに含む。
【0014】
本発明は、乳癌疾患にかかっていて、且つ、抗VEGF抗体を用いた事前の治療に失敗した患者群の治療方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与がその患者群の奏功率(response rate)を効果的に高めることを含めた前記方法をさらに含む。
【0015】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者の奏功期間を延長する方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与が奏功期間を効果的に延長することを含めた前記方法をさらに含む。
【0016】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者の治療方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与が生存期間、無増悪生存率、奏功率、又は奏功期間によって計測されるような治療患者の統計的に有意な、且つ、臨床的に重要な改善をもたらすことを含めた前記方法をさらに含む。
【0017】
本願発明は、抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者における転移を低減する方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与が転移を効果的に低減することを含めた前記方法をさらに含む。
【0018】
本発明は、乳癌疾患にかかっていて、且つ、抗VEGF抗体を用いた事前の治療に失敗した患者群の治療方法であって、前記患者に有効量の抗VEGF抗体と抗HER2抗体を投与し、それにより、抗VEGF抗体と抗HER2抗体の併用投与がその患者群における転移を効果的に低減することを含めた前記方法をさらに含む。
【0019】
本発明は、容器、当該容器内の抗VEGF抗体を含む組成物、及び抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者に抗VEGF抗体と抗HER2抗体を投与することを前記組成物の使用者に指図する添付文書、を含む製品を提供する。
【0020】
本発明は、容器、当該容器内の抗HER2抗体を含む組成物、及び抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者に抗HER2抗体及び抗VEGF抗体を投与することを組成物の使用者に指図する添付文書、を含む製品をさらに提供する。
【0021】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患の治療に有用な抗HER2抗体及び抗VEGF抗体を含む組成物をさらに提供する。好ましくは、抗HER2抗体は、トラスツズマブである。また、好ましくは、抗VEGF抗体は、ベバシズマブである。
【図面の簡単な説明】
【0022】
【図1】ベバシズマブ治療に失敗した後の腫瘍増殖に対する併用したトラスツズマブ及びベバシズマブによる治療の抗腫瘍活性。腫瘍体積(mm3)の平均値をY軸上にプロットし;腫瘍細胞注射後の日数をX軸にプロットした。溶媒(丸)、30mg/kgの初回負荷量、そして15mg/kgの維持量のトラスツズマブ(四角)、治療が15mg/kgのトラスツズマブも含む55日目までが、5mg/kgのベバシズマブ(三角)。
【図2】併用したトラスツズマブ及びベバシズマブによる治療の肺転移に対する効果。ヒトAlu DNA配列の平均値(ng/ml)を、リアルタイムPCR法を使用して肺組織から定量し、そして、Y軸上にプロットした。
【発明を実施するための形態】
【0023】
発明の詳細な説明
本発明による用語「VEGF」は、血管内皮細胞増殖因子(Swiss-Prot番号P15692)、その選択的スプライシング型(例えば、Leung, D. W., et al., Science, 246(1989)1306-1309;及びHouck, K. A., et al., Mol. Endocrin. 5(1991)1806-1814を参照のこと)、及び活性断片、好ましくは、N末端断片を指す。
【0024】
本発明による用語「抗VEGF抗体」は、VEGFに特異的に結合する抗体である。本明細書中の好ましいヒト化抗VEGF抗体又は変異型抗VEGF抗体は、1×10-8M以下、そして、好ましくは5×10-9M以下のKd値でヒトVEGFに結合する。好ましくは、抗VEGF抗体は、Presta, L. G., et al., Cancer Res. 57(1997)4593-4599に従って作り出された組み換え型ヒト化抗VEGFモノクローナル抗体と同じエピトープに結合するモノクローナル抗体である。好ましい抗体は、ベバシズマブである。抗VEGF抗体、及びその製造方法は、例えば、US 6,054,297、US 2003/0190317、US 6,632,926、US 6,884,879、及びUS 2005/0112126に記載されている。
【0025】
ベバシズマブには、突然変異型ヒトIgG1フレームワーク領域、及び、ヒトVEGFがその受容体に結合するのを阻止する、マウス抗hVEGFモノクローナル抗体由来の抗原結合相補性決定領域、が含まれる。フレームワーク領域の大部分を含めたベバシズマブのアミノ酸配列の約93%がヒトIgG1由来であり、そして、前記配列の約7%がマウス抗体A4.6.1由来である。ベバシズマブは、約149,000ダルトンの分子質量を持ち、且つ、グリコシル化されている。ベバシズマブとその調製法は、EP 1 325 932に記載されている。
【0026】
HER2は、neuやc-erbB-2とも呼ばれる185kDaの成長因子受容体であり(Slamon, D, J., et al., Science 235(1987)177-182;Swiss-Prot P04626)、その機能は、ヒト乳癌細胞への腫瘍性形質転換に関連する。このタンパク質の過剰発現は、20〜30 %の乳癌患者において同定されており、これは局所的な進行疾患、腫瘍再発の確率の増大、及び患者生存率の低下と相関している。胃癌、子宮内膜癌、唾液腺癌、非小細胞肺癌、膵臓癌、卵巣癌、腹膜癌、前立腺癌、又は結腸直腸癌にかかった患者の30〜40%ほどが同様に、このタンパク質の過剰発現を示すかもしれない。抗HER2抗体とその製造方法は、例えば、US 6,054,297、WO 89/06692、US 6,953,842、US 6,949,245、US 6,399,063、US 6,165,464、US 6,054,297、US 5,772,997、WO 2003/087131、WO 01/00245、WO 01/00238、WO 00/69460、WO 00/52054、WO 99/31140、及びWO 98/17797に記載されている。本発明の好ましい態様において、抗HER2抗体はトラスツズマブである。トラスツズマブとその調製法は、EP 0 590 058に記載されている。
【0027】
HER2受容体タンパク質の「過剰発現」という用語は、患者の特定の組織又は臓器内の腫瘍からの細胞におけるHER2受容体タンパク質発現が、その組織又は臓器からの正常細胞における発現レベルに対して異常なレベルを示すことを意味する。HER2受容体の過剰発現を特徴とする癌にかかっている患者は、当該技術分野で知られている標準的なアッセイによって診断され得る。好ましくは、過剰発現は、免疫組織化学的(IHC)検出法を使用することで、凍結又はパラフィン包埋組織切片の固定細胞において計測される。組織学染色と組み合わせた場合には、標的タンパク質の局在性を断定することができ、且つ、腫瘍内でのその発現を質的にも半定量的にも計測することができる。そのようなIHC検出アッセイが、当該技術分野で知られていて、そして、臨床試験アッセイ(CTA)、市販のLabCorp 4D5テスト、及び市販のDAKO HercepTest(登録商標)(DAKO、Carpinteria, Calif.)に含まれている。後者のアッセイは、HER2タンパク質の過剰発現している癌を特定するのに、0〜3+の固有の範囲の細胞染色(0が正常発現であり、3+が最も強い陽性の発現を示す)を使用する(Herceptin(登録商標)(トラスツズマブ)の全面的な指図情報を参照のこと、1998年9月、Genentech Inc.、San Francisco, Calif.)。これにより、1+、2+、又は3+の範囲、好ましくは2+又は3+、より好ましくは3+のHER2タンパク質の過剰発現を特徴とする癌にかかっている患者は、本発明の療法から恩恵を受けるだろう。
【0028】
用語「乳癌疾患」は、異常乳房細胞の無制限増殖を指す。それには、非浸潤性乳管癌、浸潤性乳管癌、非浸潤性小葉癌、浸潤性小葉癌、髄様癌、乳頭のページェット病、及び転移性乳癌が含まれる。
【0029】
用語「抗VEGF抗体を用いた事前の治療に失敗した」又は「治療失敗」は、本明細書中では、抗VEGF抗体を用いた過去の療法に対して反応がない腫瘍患者か(「無奏功患者」)、又は過去の療法に対して初めは効果を示したが、療法への反応が維持されなかった腫瘍患者(「再発患者(relapsers)」とも呼ばれる)を指す。好ましくは、用語「抗VEGF抗体を用いた事前の治療に失敗した」は、再発患者を指す。治療失敗(それぞれ奏功(RE)と非奏功(NR))は、患者治療を評価することが当該技術分野で一般に知られている臨床データ及び実験データからの結果によって確認される施術者の医学的判断に基づいて定められる。そのようなデータは、一例として、臨床検査、細胞学的及び組織学的技術、内視鏡検査及び腹腔鏡検査、超音波、CT、PET、及びMRIスキャン、胸部X線写真及びマンモグラフィー、並びに、例えば、CEA、Cyfra、CA15-3、インターロイキン8、及び可溶性HER2などの腫瘍マーカーの濃度の計測、から得られるかもしれない。このような関係において、「治療失敗」は、臨床的改善の不存在と規定される。あるいは、RECIST基準が、腫瘍反応を測定するために使用されるかもしれない(Therasse, P., et al., J. Nat. Cancer Institute 92(2000)205-216)。このような関係において、「治療失敗」は、「不完全奏功/安定(stable disease)」又は「進行(progressive disease)」のいずれかと規定される。
【0030】
RECIST評価基準に従って、固形腫瘍に関する腫瘍反応は(Therasse, P., et al., J. Nat. Cancer Institute 92(2000)205-216)、(例えば、CTにより計測される)腫瘍の体積の増悪又は退縮に依存して以下の4つのレベル:完全奏功(complete response)(CR)又は部分奏功(partial response)(PR)、安定(stable disease)(SD)、及び進行(progressive disease)(PD)に分類される(表1を参照のこと)。さらに、欧州癌研究治療機関(EORTC)は、2-[18F]-フルオロ-2-デオキシグルコース陽電子放出断層撮影(FDG-PET)により計測される腫瘍の代謝に依存する以下の4つのレベル:完全奏功(CMR)又は部分奏功(PMR)、安定(SMD)、及び進行(PMD)への分類を提案した(Young H., et al., Eur. J. Cancer 35(1999)1773-1782 and Kellof, G. J., et al., Clin. Cancer Res. 11(2005)2785- 2808)(表2を参照のこと)。
【0031】
【表1】

【0032】
【表2】

【0033】
これにより、好ましくは、本願発明による「奏功(RE)」と「非奏功(NR)」は、先に記載のRECIST及びFDG-PET基準の両方を使用した、コンピュータ断層撮影(CT)と2-[18F]-フルオロ-2-ジオキシグルコース陽電子放出断層撮影(FDG-PET)の組み合わせによって得られるデータに基づいて定められる(Kellof, G. J., et al., Clin. Cancer Res. 11(2005)2785-2808及びYoung H., et al., Eur. J. Cane. 35(1999)1773-1782)。従って、本願発明による奏功(RE)と非奏功(NR)は、好ましくは以下のとおり決定される:
奏功(RE):CR又はPRは、CT-RECIST基準(表1)によって定められ、それと同時に、CMR又はPMRは、FDG-PET(表2)によって定められる。これにより、奏功(RE)は、組み合わせられたCTとPETの測定に関する以下の4つのケース:CRとCMR、PRとPMR、CRとPMR、及びPRとCMR、の中のいずれかを意味する。
【0034】
非奏功(NR):SD又はPDは、CT-RECIST基準(表1)によって定められ、それと同時に、SMD又はPMDは、FDG-PET(表2)によって定められる。これにより、組み合わせられたCTとPETの測定に関する以下の4つのケース:SDとSMD、SDとPMD、PDとSMD、及びPDとPMDが、非奏功(NR)を意味する。
【0035】
通常、奏功は、治療開始後約3〜8週間、好ましくは約6週間にて測定される。この奏功判定は、4〜8週間ごとに、好ましくは6〜8週間ごとに通常繰り返される。最初の判定の時点で、顕著な奏功(RE)が確認されたなら、その後、(最初の判定後の非奏功(RE)を意味する)再発は、早くて、2番目の奏功判定の時点で判定され得る。
【0036】
このような関係において、用語「抗VEGF抗体を用いた事前の治療に失敗した患者」は、最初の奏功判定の時点で、非奏功(NR)と定められる患者か(「非奏功患者」)、又は最初の奏功判定の時点で、奏功(RE)と定められ、2番目若しくはその後の奏功判定において、非奏功(NR)と定められる患者(「再発患者」)を指す。
【0037】
本発明による用語「転移」は、続発性腫瘍を引き起こす、原発腫瘍から患者の他の部分の1ヶ所以上の部位への癌細胞の伝播を指す。拡散した細胞によって形成された腫瘍は、「転移性腫瘍」又は「転移癌」と呼ばれる。転移性腫瘍には、本来の(原発)腫瘍の中にあるもののような細胞が含まれる。癌が転移したかどうか判定する手段は、当該技術分野で知られていて、そして、癌マーカー試験、骨スキャン、胸部X線写真、コンピュータ断層撮影(CT)、コンピューター横断断層撮影(CAT)、分子共鳴画像法(MRI)、陽電子放出断層撮影(PET)、単光子放出コンピュータ断層撮影(SPECT)、蛍光画像法(FI)、及び生物発光画像法(BLI)と癌マーカー試験が含まれる(例えば、Helms, M. W., et al., Contributions to microbiology 13(2006)209-231及びPantel, K., et al., J. Nat. Cancer Inst. 91(1999)1113-1124を参照のこと)。
【0038】
本明細書中に使用される場合、用語「患者」は、好ましくは、癌、前癌状態、又は病巣を治すために治療を必要としているヒトを指す。しかしながら、用語「患者」は、治療を必要としているヒト以外の動物、好ましくは、特に、イヌや、ネコや、ウマや、ウシや、ブタや、ヒツジや、ヒト以外の霊長動物などの哺乳動物を指す可能性もある。
【0039】
用語「群」は、患者群、並びに患者亜群を指す。
【0040】
用語「添付文書」は、治療薬の商用パッケージ内に通例含まれている取扱説明書を指し、その治療薬の使用に関する適応症、用法、用量、投与、禁忌、及び/又は警告に関する情報を含んでもよい。
【0041】
前記癌は、例えば、肺癌、非小細胞肺(NSCL)癌、細気管支肺胞細胞肺癌、骨癌、膵臓癌、皮膚癌、頭部若しくは頚部の癌、皮膚若しくは眼内黒色腫、子宮癌、卵巣癌、直腸癌、肛門部の癌、胃癌(stomach cancer、gastric cancer)、結腸癌、乳癌、子宮癌、卵管癌、子宮内膜の癌腫、子宮頚部の癌腫、膣癌、外陰癌、ホジキン病、食道癌、小腸癌、内分泌系の癌、甲状腺癌、傍甲状腺の癌、副腎の癌、軟組織の肉腫、尿道の癌、陰茎の癌、前立腺癌、膀胱癌、腎臓若しくは尿道の癌、腎細胞癌、腎盂癌、中皮腫、肝細胞癌、胆道癌、慢性若しくは急性白血病、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、脊髄軸腫瘍、脳幹膠腫、多形膠芽腫、星状細胞腫、シュワン腫、上衣腫、髄芽腫、髄腹腫、扁平上皮癌、脳下垂体腺腫、前記の癌のいずれかの難治性異形を含めたもの、又は前記の癌の1種類以上の組み合わせであるかもしれない。前癌状態又は病巣には、例えば、口腔白板症、光線性角化症(日光性角化症)、結腸若しくは直腸の前癌状態のポリープ、胃上皮形成異常、腺腫様の形成異常、遺伝性非腺腫性大腸癌症候群(HNPCC)、バレット食道、膀胱形成不全、及び前癌状態の子宮頚部の病態から成る群が含まれる。好ましい態様において、治療されるべき癌は乳癌疾患である。また、好ましい態様において、癌はHER2受容体タンパク質の過剰発現を特徴とする。
【0042】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患の治療方法であって、上述の抗VEGF抗体療法を続けながら、治療上有効な量の抗HER2抗体を前記患者に投与することを含めた前記方法を含む。
【0043】
本明細書中に使用される用語「治療する」は、別段の指示がない限り、患者の腫瘍、腫瘍転移、又はその他の発癌性若しくは腫瘍性細胞の進行を回復させること、緩和すること、抑制すること、あるいは、その増殖を部分的に若しくは完全に予防することを意味する。本明細書中に使用される用語「治療」は、別段の指示がない限り、治療行為を指す。
【0044】
語句「治療方法」又はその相当語句は、例えば、癌に対して用いられると、患者の癌細胞の数を減少させるか、排除するように、若しくは癌の症状を緩和するように設計された手順又は行動方針を指す。癌又は別の増殖性障害の「治療方法」は、癌細胞又は他の障害が実際に取り除かれること、細胞数又は障害が実際に低減すること、あるいは、癌又は他の障害の症状が実際に緩和されることを必ずしも意味するとは限らない。多くの場合、たとえ成功の可能性が低くても、それでもなお、患者の病歴と推定の生存予測を加味し、総合的に有益な行動方針であると考えられる癌の治療方法が実施される。
【0045】
用語「治療的有効量」又は「有効量」は、研究者、獣医、医師、若しくは他の臨床医によって求められている組織、系、動物、又はヒトの生物学的又は医学的奏功を引き出す対象の化合物又は組み合わせ物の量を意味する。
【0046】
本発明は、抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患を治療するための医薬品の製造のための抗HER2抗体及び抗VEGF抗体の使用であって、上述の抗VEGF抗体療法を続けながら、治療上有効な量の抗HER2抗体を前記患者に投与することを含めた前記方法をさらに含む。抗体は、別々に又は同時に投与されるかもしれない。
【0047】
用語「医薬品の製造方法」は、本明細書中に指定した適応症、及び、特に、腫瘍、腫瘍転移、又は一般的な癌の治療に使用するための医薬品の製造に関する。前記用語は、指定された適応症における、いわゆる「スイス・タイプ」クレーム形式に関する。
【0048】
本願発明との関連において、追加的な他の細胞傷害性、化学療法剤、若しくは抗癌剤、又はそのような作用物質の効果を高める化合物が、抗VEGF抗体と抗HER2抗体を組み合わせた状態で使用されるかもしれない。そのような作用物質には、例えば:シクロホスファミド(CTX;例えば、cytoxan(登録商標))、クロラムブシル(CHL;例えば、leukeran(登録商標))、シスプラチン(CisP;例えば、platinol(登録商標))、ブスルファン(例えば、myleran(登録商標))、メルファラン、カルムスチン(BCNU)、ストレプトゾトシン、トリエチレンメラミン(TEM)、マイトマイシンCなどのアルキル化作用を有するアルキル化剤(単数若しくは複数);メトトレキサート(MTX)、エトポシド(VP16;例えば、vepesid(登録商標))、6-メルカプトプリン(6MP)、6-チオグアニン(6TG)、シタラビン(Ara-C)、5-フルオロウラシル(5-FU)、カペシタビン(例えば、Xeloda(登録商標))、ダカルバジン(DTIC)などの代謝拮抗剤;アクチノマイシンD、ドキソルビシン(DXR;例えば、adriamycin(登録商標))、ダウノルビシン(ダウノマイシン)、ブレオマイシン、ミトラマイシンなどの抗生物質;ビンクリスチン(VCR)、ビンブラスチンなどの、例えば、ビンカ・アルカロイドなどのアルカロイド;そして、パクリタキセル(例えば、taxol(登録商標))や、パクリタキセル誘導体などの他の抗腫瘍剤、細胞増殖抑制剤、デキサメサゾン(DEX;例えば、decadron(登録商標))などのグルココルチコイド、並びに、プレドニゾンなどのコルチコステロイド、ヒドロキシウレアなどのヌクレオシド酵素阻害剤、アスパラギナーゼや、ロイコボリンや、他の葉酸誘導体などのアミノ酸除去酵素、そして、類似のさまざまな抗腫瘍剤が含まれる。以下の医薬品:アミホスチン(例えば、ethyol(登録商標))、ダクチノマイシン、メクロルエタミン(ナイトロジェン・マスタード)、ストレプトゾシン、シクロホスファミド、ロムスチン(CCNU)、ドキソルビシン・リポ(例えば、doxil(登録商標))、ゲムシタビン(例えば、gemzar(登録商標))、ダウノルビシン・リポ(例えば、daunoxome(登録商標))、プロカルバジン、マイトマイシン、ドセタクセル(例えば、taxotere(登録商標))、アルデスロイキン、カルボプラチン、オキサリプラチン、クラドリビン、カンプトテシン、CPT11(イリノテカン)、10-ヒドロキシ7-エチル-カンプトテシン(SN38)、フロクシウリジン、フルダラビン、イホスファミド、イダルビシン、メスナ、インターフェロンβ、インターフェロンα、ミトキサントロン、トポテカン、ロイプロリド、メゲストロール、メルファラン、メルカプトプリン、プリカマイシン、ミトタン、ペガスパルガーゼ、ペントスタチン、ピポブロマン、プリカマイシン、タモキシフェン、テニポシド、テストラクトン、チオグアニン、チオテパ、ウラシル・マスタード、ビノレルビン、クロラムブシルもまた、追加的な作用物質として使用されるかもしれない。
【0049】
本願発明との関連において、抗ホルモン剤が、抗VEGF抗体と抗HER2抗体を組み合わせた状態で使用されるかもしれない。本明細書中に使用される用語「抗ホルモン剤」には、腫瘍に対するホルモン作用を調節又は抑制するように作用する天然若しくは合成の有機若しくはペプチド化合物が含まれる。抗ホルモン作用物質には、例えば、以下の:ステロイド受容体アンタゴニスト、例えば、タモキシフェン、ラロキシフェン、アロマターゼ抑制性4(5)-イミダゾール、他のアロマターゼ阻害剤、42-ヒドロキシタモキシフェン、トリオキシフェン、ケオキシフェン、LY 117018、オナプリストン、及びトレミフェン(例えば、Fareston(登録商標))などの抗エストロゲン剤;例えば、フルタミド、ニルタミド、ビカルタミド、ロイプロリド、及びゴセレリンなどの抗アンドロゲン;並びに前記のいずれかの医薬として許容されるな塩、酸、又は誘導体;例えば、濾胞刺激ホルモン(FSH)、甲状腺刺激ホルモン(TSH)、及び黄体形成ホルモン(LH)とLHRH(黄体形成ホルモン放出ホルモン)などの糖タンパク質ホルモンの作動薬、及び/又は拮抗薬;Zoladex(登録商標)(AstraZeneca)として市販のLHRH作動薬である酢酸ゴセレリン;LHRH拮抗薬であるD-アラニンアミドN-アセチル-3-(2-ナフタレニル)-D-アラニル-4-クロロ-D-フェニルアラニル-3-(3-ピリジニル)-D-アラニル-L-セリル-N6-(3-ピリジニルカルボニル)-L-リシル-N6-(3-ピリジニルカルボニル)-D-リシル-L-ロイシル-N6-(1-メチルエチル)-L-リシル-L-プロリン(例えば、Antide(登録商標)、Ares-Serono);LHRH拮抗薬である酢酸ガニレリクス;ステロイド系抗アンドロゲン剤である酢酸シプロテロン(CPA)及びMegace(登録商標)としての市販の酢酸メゲステロール(Bristol-Myers Oncology);Eulexin(登録商標)(Schering Corp.)としての市販の非ステロイド系抗アンドロゲン剤であるフルタミド(2-メチル-N-[4,20-ニトロ-3-(トリフルオロメチル)フェニルプロパンアミド);非ステロイド系抗アンドロゲン剤であるニルタミド(5,5-ジメチル-3-[4-ニトロ-3-(トリフルオロメチル-4’-ニトロフェニル)-4,4-ジメチル-イミダゾリン-ジオン);そして、例えば、RAR(レチノイン酸受容体)、RXR(レチノイドX受容体)、TR(甲状腺受容体)、VDR(ビタミンD受容体)の拮抗薬などの他の非許容受容体の拮抗薬が含まれる。
【0050】
化学療法の投薬計画における先に記載の細胞傷害性抗癌剤及び他の抗癌剤の使用は、一般に、癌療法技術において十分に特徴づけされており、そして、本明細書中でのその利用は、多少の調整により、寛容性と有効性の観察、及び投与経路と投薬量の管理に関して同じ考慮事項に該当する。例えば、細胞毒性薬の実際の投薬量は、組織培養法(histoculture methods)を使用することによって判断される患者の培養細胞反応によって異なるかもしれない。一般に、投薬量は、他の追加の作用物質が存在しない状態で使用される量と比較して、低減される。
【0051】
有効な細胞毒性薬の標準的な投薬量は、製造業者によって推奨される範囲内であり得、そして、試験管内における反応、又は動物モデルでの反応が示された場合には、濃度又は量を最大で約1桁下げてもよい。よって、実際の投薬量は、医師の判断、患者の状態、そして、初代培養悪性細胞、若しくは組織培養した組織サンプルの試験管内における反応性、又は適切な動物モデルで観察された反応に基づく療法の有効性に依存する。
【0052】
本願発明との関連において、例えば:米国特許番号第6,080,769号;同第6,194,438号;同第6,258,824号;同第6,586,447号;同第6,071,935号;同第6,495,564号;同第6,150,377号;同第6,596,735号;及び同第6,479,513号、並びに国際公開WO 01/40217で開示され、特許を主張している化合物を含む、酵素であるファルネシル・タンパク質トランスフェラーゼの阻害剤や、受容体チロシンキナーゼPDGFRの阻害剤を含めた追加的な抗増殖剤は、抗VEGF抗体と抗HER2抗体を組み合わせた状態で使用してもよい。
【0053】
本願発明との関連において、抗VEGF抗体と抗HER2抗体の組み合わせに加えて、有効量のイオン化放射が実施されてもよく、そして/あるいは放射性医薬品が使用されてもよい。放射線源は、治療される患者の体外にあるか、又は体内にある。線源が患者の体外にあるとき、療法は、外照射療法(EBRT)として知られている。放射線源が患者の体内にあるとき、治療は、小線源療法(BT)と呼ばれる。本願発明との関連において使用するための放射性原子は、これだけに制限されることなく、ラジウム、セシウム137、イリジウム192、アメリシウム241、金198、コバルト57、銅67、テクネチウム99、ヨウ素-123、ヨウ素131、及びインジウム111を含めた群から選択され得る。本願発明によるEGFRキナーゼ阻害剤が抗体である場合には、その抗体をそのような放射性同位体で標識することも可能である。
【0054】
放射線療法は、切除不能な腫瘍、若しくは手術不能な腫瘍、及び/又は腫瘍転移を管理するための標準的な治療である。放射線照射療法が化学療法と組み合わせられた時に、改善された結果が見られた。放射線療法は、目標領域にデリバリーされた高線量の放射線照射が腫瘍と正常組織の両方の生殖細胞(reproductive cell)の死滅をもたらすという原理に基づいている。放射線照射線量は、一般に、放射線吸収線量(Gy)、時間、及び分割により規定され、且つ、腫瘍学者によって慎重に規定されなければならない。患者が受ける放射線量は、様々な考慮事項に依存するが、2つの最も重要な点は、体の他の危険構造体又は臓器と関連した腫瘍の位置と、腫瘍が広がった程度である。放射線療法を受けている患者に関する代表的な治療方針は、約1.8〜2.0Gyの1日1回の分割線量で、1週間あたり5日間、患者に投与される、全量10〜80Gyの1〜6週間にわたる治療スケジュールになる。本願発明の好ましい態様において、ヒト患者の腫瘍を本発明のものと放射線照射の併用療法で治療したときに、相乗効果がある。言い換えれば、放射線照射と併用されると、場合により、追加的な化学療法剤又は抗癌剤と併用されると、本発明の併用物を含めた作用物質による腫瘍増殖の阻害が増強される。補助放射線療法に関するパラメーターは、例えば、国際公開WO 99/60023に含まれている。
【0055】
抗体は、ボーラスとして静脈内投与によって、若しくは一定期間にわたる連続点滴によって、筋肉内、腹腔内、脳脊髄内、皮下、関節内、滑液嚢内、若しくはくも膜下腔内経路によって、公知の方法により患者に投与される。抗体の静脈内又は皮下投与が好まれる。
【0056】
抗VEGF抗体及び抗HER2抗体投与の量、並びに投与のタイミングは、治療される患者のタイプ(種、性別、年齢、体重など)、状態、及び治療される疾患又は病態の重症度に依存する。
本発明による抗体の投与のための投薬量は、1回以上の別々の投与によるか、又は連続点滴による約1μg/kg〜50mg/kg(例えば、0.1〜20mg/kg)の抗体である。代表的な1日投与量は、約1μg/kg〜約100mg/kgの範囲におよんでもよい。好ましい側面において、抗体は、約1mg/kg〜約15 mg/kgの範囲におよぶ用量にて、2〜3週間毎に投与される。ベバシズマブの好ましい用量は、疾病の進行が検出されるまで、IV注入として14日間に1回、5mg/kgである。トラスツズマブの好ましい用量は、越えるのに90分間にわたって投与される4mg/kgの負荷投与量と、その後の30分間にわたり投与される2mg/kgの毎週の注入である。
【0057】
本発明は、抗VEGF抗体、並びに抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者に抗VEGF抗体と抗HER2抗体を投与することを組成物の使用者に指図する添付文書を含むキットをさらに提供する。好ましい態様において、キット・容器は、医薬として許容される担体をさらに含んでもよい。前記キットは、無菌の希釈剤をさらに含むかもしれず、それは、別々の追加の容器内に好ましくは保存される。前記キットは、乳癌疾患に関する方法としての併用治療の使用を指示する印刷された指示書を含めた添付文書をさらに含んでもよい。
【0058】
本発明は、特に、抗HER2抗体及び抗VEGF抗体を含めた、抗VEGF抗体を用いた事前の治療に失敗した乳癌疾患の治療において有用な医薬組成物をさらに提供する。そのような組成物は、場合により、医薬として許容される担体、及び/又は賦形剤を含む。好ましい態様において、抗VEGF抗体はベバシズマブであり、そして、抗HER2抗体はトラスツズマブである。
【実施例】
【0059】
以下の実験の詳細は、本発明の理解を助けるために提供され、本発明の真の範囲は、添付の請求項に規定される。特定の方法及び議論されている結果は、本発明の単なる例証にすぎないので、決してそれに制限されるものではないことは理解されよう。
【0060】
序論
この研究は、ヒト乳房異種移植モデルにおける単独ベバシズマブ治療の失敗後のベバシズマブとトラスツズマブの併用に関する抗腫瘍活性を調べた。本研究のさらなる目的は、転移に対する治療効果を調べることである。
【0061】
試験薬
トラスツズマブを、ヒスチジン-HCl、α-αトレハロース(60mM)、0.01%のPolysorb、pH6.0中、25mg/mlの原液として提供した(Herceptin(登録商標))。ベバシズマブを、Na-リン酸、α-αトレハロース(60mM)、0.01%のPolysorb、pH6.0中、25mg/mlの原液として提供した(Avastin(登録商標))。両方の溶液を、注射用にPBSにより適切に希釈した。
【0062】
細胞株と培養条件
ヒト乳癌細胞株KPL-4を、炎症性皮膚転移を患っている乳癌患者の悪性胸水から株化したところ、これはErbBファミリー受容体を過剰発現している(Kurebayashi, J., et al., Br. J. Cancer 79(1999)707-17)。腫瘍細胞を、水飽和雰囲気中、5%のCO2、37℃にて、10%のウシ胎仔血清(PAA)及び2mMのL-グルタミン(Gibco)を補ったDMEM培地(PAA Laboratories, Austria)中、ごく普通に培養する。培養物の継代を、トリプシン/EDTA 1×(PAA)を用いて実施し、2倍/週に分ける。細胞継代P6を、生体内研究に使用する。
【0063】
動物
SCIDベージュ(C.B.-17)マウス;10〜12週齢;体重18〜20g(Charles River, Sulzfeld, Germany)を、国際的なガイドライン(GV-Solas;Felasa;TierschG)に従って12h明/12h暗の一日サイクルを用いて、特定病原体を含まない条件下で維持する。到着後に、動物を、新しい環境に慣れさせ、そして、観察するために、動物飼育施設の隔離部分に1週間収容する。連続した健康状態の観察を、定期的におこなう。減量食(Alltromin)と水(pH2.5〜3に酸性化)を自由にとらせる。
【0064】
生体内における腫瘍増殖阻害の研究
腫瘍細胞を、培養フラスコ(Greiner TriFlask)から採取し(トリプシン-EDTA)、50mlの培地中に移し、1回洗浄し、そして、PBS中に再懸濁した。追加のPBSでの洗浄ステップと濾過(細胞濾過器;Falcon 100μm)の後に、最終的な細胞価を、0.75×108/mlに調整した。腫瘍細胞懸濁液を、細胞凝集を避けるようにホールピペットを用いて慎重に混合する。麻酔を、閉鎖型循環装置内、プレインキュベーション・チャンバー(プラキシガラス)、個別のマウス鼻マスク(シリコン)、及びイソフルラン(Pharmacia-Upjohn、Germany)を用いた小動物用Stephens吸入ユニットを使用して実施した。注射の2日前に、動物の毛皮を剃った。乳腺脂肪体内(i.f.m.p.)注射に関しては、細胞を、20μlの容量にて、それぞれの麻酔下マウスの右側の2番目の鼠径部乳腺脂肪体へと同所に注射した。同所性移植に関しては、前記細胞懸濁液を、乳頭下に皮膚を貫いて注射した。腫瘍細胞注射は、実験の1日目に相当する。
【0065】
観察
悪影響の臨床的症状の検出のために、動物を毎日管理した。実験中の観察に関しては、動物の体重を週2回記録し、且つ、腫瘍体積を週2回、カリパスによって計測した。原発腫瘍体積を、NCIプロトコールに従って計算した(TW=1/2ab2、ここで、aとbは、mm単位による腫瘍サイズの長径と短径である、Teicher, B., Anticancer drug development guide, Humana Press 5(1997)92)。計算値を、平均値及び標準偏差値として記録した。
【0066】
動物の治療
腫瘍体積が、約100mm3になったときに、腫瘍を持つマウスを、無作為化した(各群に関してn=10)。各群を治療前によく一致させた。治療は腫瘍細胞注射の20日後に開始した。溶媒群(第1群)には、週1回、腹腔内(i.p.)に10ml/kgのPBSバッファーを与えた。トラスツズマブ(第2群)には、30mg/kgの初回負荷量にてi.p.に投与し、それに続いて、週1回、15mg/kg(維持量)の用量にて投与した。抗VEGF抗体であるベバシズマブを、週2回、5mg/kgの投薬量にてi.p.に与えた(第3群)。40日目に、第3群の治療を、トラスツズマブ(i.p.に週1回、15mg/kg)を伴うベバシズマブ(i.p.に週2回、5mg/kg)の併用療法に切り換えた。
【0067】
転移の評価
肺内への腫瘍細胞の拡散は、屠殺した動物で測定した。転移はSchneider, T., et al., Clin. Exp. Metastasis 19(2002)571-582に従って計測した。要約すると、肺組織を採取し、そして、ヒトAlu配列をリアルタイムPCR法によって定量化した。リアルタイムPCR法によって定量化された、より高いヒトDNAレベルは、より高い転移レベルに相当する。
【0068】
結果
原発腫瘍の増殖に対する治療効果を、図1と表3に示す。溶媒群(第1群)の腫瘍は急速に増殖したので、腫瘍による潰瘍形成と臨床的症状の進行のため、腫瘍細胞注射の38日後にマウスを屠殺した。トラスツズマブによる単独療法(第2群)は、腫瘍体積に対して有意な効果を発揮しなかったので、そのため、44日目にマウスを屠殺した。ベバシズマブを用いた治療は、腫瘍増殖を有意に抑制した;しかしながら、44日目前後に腫瘍が再発し始めた。55日目に開始したベバシズマブとトラスツズマブの併用療法は、実験期間(99日目)の間、腫瘍増殖の完全な阻害をもたらし、且つ、治療は良好な耐容性を示した。
【0069】
【表3】

【0070】
肺転移に対する治療効果を、図2と表4に示す。ベバシズマブ治療が失敗した後の、トラスツズマブ及びベバシズマブの併用は、転移の急激な減少をもたらした。(二次組織内への腫瘍細胞の侵襲に関連する)ヒトAlu配列のレベルは、28日目に屠殺した溶媒治療動物を制し、且つ、44日目に屠殺したトラスツズマブ治療動物を制して、99日目に併用療法で治療した動物において有意に低かった。転移に対するこの驚くべき効果は、他の細胞毒性薬物で見られた効果とは対照的である(Geldof, A. A., et al., Anticancer Res. 8(1988)1335-1339;Murphy, J. Clin. Oncol. 11(1993)199-201、及びDe Larco, J. E., et al., Cancer Res. 61(2001)2857-2861)。
【0071】
【表4】

【特許請求の範囲】
【請求項1】
抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患を治療するための医薬品の製造のための抗HER2抗体及び抗VEGF抗体の使用であって、治療上有効な量の抗HER2抗体及び抗VEGF抗体を前記患者に投与することを含む使用。
【請求項2】
前記医薬品で使用される抗VEGF抗体がベバシズマブである、請求項1に記載の使用。
【請求項3】
前記患者がヒトである、請求項1又は2に記載の使用。
【請求項4】
抗HER2抗体がトラスツズマブである、請求項1〜3のいずれか1項に記載の使用。
【請求項5】
前記乳癌疾患がHER2受容体タンパク質の過剰発現を特徴とする、請求項1〜4のいずれか1項に記載の使用。
【請求項6】
抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患を治療する方法であって、治療上有効な量の抗HER2抗体及び抗VEGF抗体を前記患者に投与することを含む方法。
【請求項7】
前記抗VEGF抗体がベバシズマブである、請求項6に記載の方法。
【請求項8】
前記患者がヒトである、請求項7又は8に記載の方法。
【請求項9】
前記抗HER2抗体がトラスツズマブである、請求項6〜8のいずれか1項に記載の方法。
【請求項10】
前記乳癌疾患がHER2受容体タンパク質の過剰発現を特徴とする、請求項6〜9のいずれか1項に記載の方法。
【請求項11】
容器、当該容器内の抗VEGF抗体を含む組成物、及び抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者に抗VEGF抗体と抗HER2抗体を投与することを前記組成物の使用者に指図する添付文書、を含む製品。
【請求項12】
前記抗VEGF抗体がベバシズマブである、請求項11に記載の製品。
【請求項13】
前記抗HER2抗体がトラスツズマブである、請求項11又は12に記載の製品。
【請求項14】
容器、当該容器内の抗HER2抗体を含む組成物、及び抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者に抗HER2抗体及び抗VEGF抗体を投与することを前記組成物の使用者に指図する添付文書、を含む製品。
【請求項15】
前記抗VEGF抗体がベバシズマブである、請求項14に記載の製品。
【請求項16】
前記抗HER2抗体がトラスツズマブである、請求項14又は15に記載の製品。
【請求項17】
抗HER2抗体及び抗VEGF抗体を含む、抗VEGF抗体を用いた事前の治療に失敗した乳癌疾患の治療において有用な医薬組成物。
【請求項18】
前記抗VEGF抗体がベバシズマブであり、前記抗HER2抗体がトラスツズマブである、請求項17に記載の医薬組成物。
【請求項1】
抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患を治療するための医薬品の製造のための抗HER2抗体及び抗VEGF抗体の使用であって、治療上有効な量の抗HER2抗体及び抗VEGF抗体を前記患者に投与することを含む使用。
【請求項2】
前記医薬品で使用される抗VEGF抗体がベバシズマブである、請求項1に記載の使用。
【請求項3】
前記患者がヒトである、請求項1又は2に記載の使用。
【請求項4】
抗HER2抗体がトラスツズマブである、請求項1〜3のいずれか1項に記載の使用。
【請求項5】
前記乳癌疾患がHER2受容体タンパク質の過剰発現を特徴とする、請求項1〜4のいずれか1項に記載の使用。
【請求項6】
抗VEGF抗体を用いた事前の治療に失敗した患者の乳癌疾患を治療する方法であって、治療上有効な量の抗HER2抗体及び抗VEGF抗体を前記患者に投与することを含む方法。
【請求項7】
前記抗VEGF抗体がベバシズマブである、請求項6に記載の方法。
【請求項8】
前記患者がヒトである、請求項7又は8に記載の方法。
【請求項9】
前記抗HER2抗体がトラスツズマブである、請求項6〜8のいずれか1項に記載の方法。
【請求項10】
前記乳癌疾患がHER2受容体タンパク質の過剰発現を特徴とする、請求項6〜9のいずれか1項に記載の方法。
【請求項11】
容器、当該容器内の抗VEGF抗体を含む組成物、及び抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者に抗VEGF抗体と抗HER2抗体を投与することを前記組成物の使用者に指図する添付文書、を含む製品。
【請求項12】
前記抗VEGF抗体がベバシズマブである、請求項11に記載の製品。
【請求項13】
前記抗HER2抗体がトラスツズマブである、請求項11又は12に記載の製品。
【請求項14】
容器、当該容器内の抗HER2抗体を含む組成物、及び抗VEGF抗体を用いた事前の治療に失敗した、乳癌疾患にかかっている患者に抗HER2抗体及び抗VEGF抗体を投与することを前記組成物の使用者に指図する添付文書、を含む製品。
【請求項15】
前記抗VEGF抗体がベバシズマブである、請求項14に記載の製品。
【請求項16】
前記抗HER2抗体がトラスツズマブである、請求項14又は15に記載の製品。
【請求項17】
抗HER2抗体及び抗VEGF抗体を含む、抗VEGF抗体を用いた事前の治療に失敗した乳癌疾患の治療において有用な医薬組成物。
【請求項18】
前記抗VEGF抗体がベバシズマブであり、前記抗HER2抗体がトラスツズマブである、請求項17に記載の医薬組成物。
【図1】


【図2】




【図2】


【公開番号】特開2012−207036(P2012−207036A)
【公開日】平成24年10月25日(2012.10.25)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−157442(P2012−157442)
【出願日】平成24年7月13日(2012.7.13)
【分割の表示】特願2009−500761(P2009−500761)の分割
【原出願日】平成19年3月20日(2007.3.20)
【出願人】(591003013)エフ.ホフマン−ラ ロシュ アーゲー (1,754)
【氏名又は名称原語表記】F. HOFFMANN−LA ROCHE AKTIENGESELLSCHAFT
【Fターム(参考)】
【公開日】平成24年10月25日(2012.10.25)
【国際特許分類】
【出願番号】特願2012−157442(P2012−157442)
【出願日】平成24年7月13日(2012.7.13)
【分割の表示】特願2009−500761(P2009−500761)の分割
【原出願日】平成19年3月20日(2007.3.20)
【出願人】(591003013)エフ.ホフマン−ラ ロシュ アーゲー (1,754)
【氏名又は名称原語表記】F. HOFFMANN−LA ROCHE AKTIENGESELLSCHAFT
【Fターム(参考)】
[ Back to top ]

