血管内皮細胞成長因子受容体の阻害によるTh17炎症疾患治療方法およびこのための薬学的組成物
【課題】血管内皮細胞成長因子受容体の阻害によるTh17炎症疾患治療方法およびこのための薬学的組成物を提供する。
【解決手段】本発明は、血管内皮細胞成長因子受容体を阻害する薬剤を投与し、IL−6或いはIL−17を媒介とするTh17炎症疾患を治療または予防する方法およびこのための薬学的組成物に関する。
【解決手段】本発明は、血管内皮細胞成長因子受容体を阻害する薬剤を投与し、IL−6或いはIL−17を媒介とするTh17炎症疾患を治療または予防する方法およびこのための薬学的組成物に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、非好酸球性或いは好中球性炎症を特徴とするTh17炎症疾患治療または予防方法、およびこのための薬学的組成物に関する。
【背景技術】
【0002】
呼吸器炎症性疾患、たとえば喘息や慢性閉塞性肺疾患(chronic obstructive pulmonary disease、COPD)などの治療において、炎症を抑制することは非常に重要である。
【0003】
喘息は免疫体系の過剰反応による呼吸器炎症である。1980年代後半に、ヘルパーT細胞(helper T cell)として、細胞性免疫を活性化するTh1細胞および体液性免疫を活性化するTh2細胞があることが発見され、Th1、Th2細胞が互いに拮抗作用をすることが知られている。これにより、喘息はアレルギー抗原に反応する抗体IgEにより刺激されたTh2細胞が分泌するサイトカインによって好酸球(eosinophile)が主に関与する炎症であると理解されている(非特許文献1)。Th2が分泌するIL−13がマウス喘息モデルで喘息を誘発することが確認された(非特許文献2、非特許文献3)。
【0004】
ところが、喘息の中でも、相当数を占める非好酸球性喘息(non-eosinophilic asthma)はTh2細胞で説明することができない(非特許文献4、非特許文献5)。非好酸球性或いは好中球性喘息では好酸球より好中球(neutrophils)が一層多く発見され、喘息の度合いがさらに激しい。コルチコステロイドと偽薬(placebo)の吸入治療効果を比較した臨床研究においても、非好酸球性喘息は好酸球性喘息とは顕著に区分され、ステロイドによる治療効果が殆どなかった(非特許文献6)。
【0005】
最近、Th1、Th2と区分される新しいヘルパーT細胞としてのTh17細胞が発見されており、CD4+細胞またはCD8+細胞がIL−17を分泌することが知られている(非特許文献7、非特許文献8、非特許文献9)。Th17細胞が好中球性炎症に関連するという予想はあるが、Th17細胞またはTh17細胞が分泌するIL−17と喘息との関連は知られていない(非特許文献10)。さらに興味深い事実は、Th17炎症反応が持続したとき、粘膜に大腸癌が発生するという事実が最近報告された(非特許文献11)。
【0006】
一方、過多発現した血管内皮細胞成長因子(vascular endothelial growth factor、VEGF)は気道リモデリング(airway remodeling)を起こし、アレルギー炎症において内皮細胞とともにTh2細胞がVEGFを分泌すると報告された(非特許文献12)。ところが、Th17細胞とVEGFまたはその受容体(vascular endothelial growth factor、VEGF)との関係は知られていない。
【0007】
VEGFR群にはVEGFR−1、VEGFR−2、VEGFR−3の3つの受容体がある。これらの中でも、VEGFR−1はFlt−1という名称で、VEGFR−2はKDRまたはFlk−1という名称で、VEGFR−3はFlt−4という名称で呼ばれることもある。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Robinson DS, Hamid Q, Ying S, Tsicopoulos A, Barkans J, Bentley AM, Corrigan C, Durham SR, Kay AB. Predominant Th2−like bronchoalveolar T−lymphocyte population in atopic asthma. N Engl J Med 1992;326:298−304
【非特許文献2】Grunig G, Warnock M, Wakil AE, Venkayya R, Brombacher F, Rennick DM, Sheppard D, Mohrs M, Donaldson DD, Locksley RM, et al. Requirement for IL−13 independently of IL−4 in experimental asthma. Science 1998;282:2261−2263
【非特許文献3】Wills−Karp M, Luyimbazi J, Xu X, Schofield B, Neben TY, Karp CL, Donaldson DD. Interleukin−13: central mediator of allergic asthma. Science 1998;282:2258−2261
【非特許文献4】Douwes J, Gibson P, Pekkanen J, Pearce N. Non−eosinophilic asthma: importance and possible mechanisms. Thorax. 2002;57:643−8
【非特許文献5】Fahy JV. Eosinophilic and neutrophilic inflammation in asthma: insights from clinical studies. Proc Am Thorac Soc. 2009;6:256−9
【非特許文献6】Berry M, Morgan A, Shaw DE, Parker D, Green R, Brightling C, Bradding P, Wardlaw AJ, Pavord ID. Pathological features and inhaled corticosteroid response of eosinophilic and non−eosinophilic asthma. Thorax. 2007;62(12):1043−9
【非特許文献7】Langrish CL, Chen Y, Blumenschein WM, Mattson J, Basham B, Sedgwick JD, McClanahan T, Kastelein RA, Cua DJ. IL−23 drives a pathogenic T cell population that induces autoimmune inflammation. J Exp Med 2005; 201:233−240
【非特許文献8】Curtis MM, Way SS, Wilson CB. IL−23 promotes the production of IL−17 by antigen−specific CD8 T cells in the absence of IL−12 and type−I interferons. J Immunol 2009;1:381−7
【非特許文献9】Ciric B, El−behi M, Cabrera R, Zhang GX, Rostami A. IL−23 drives pathogenic IL−17−producing CD8+ T cells. J Immunol 2009;182:5296−305
【非特許文献10】モジフン著、T細胞の分化とTh17、大韓耳鼻咽喉科学会誌2008;51:688−93
【非特許文献11】Wu et al. A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses. Nat Med. 5(9):1016−22 (2009)
【非特許文献12】Lee CG, Link H, Baluk P, Homer RJ, Chapoval S, Bhandari V, Kang MJ, Cohn L, Kim YK, McDonald DM, Elias JA. Vascular endothelial growth factor (VEGF) induces remodeling and enhances TH2−mediated sensitization and inflammation in the lung. Nat Med 2004;10:1095−1103
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、Th17細胞と血管内皮細胞成長因子またはその受容体の関連性と、Th17細胞と炎症性疾患との関連性を解明することにより、Th17炎症性疾患を治療および/予防する方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
前述した課題を達成するための技術的手段として、本発明の第1側面は、血管内皮細胞成長因子受容体(VEGFR)の経路阻害物質を有効成分として含有する、IL(interleukin)−6或いはIL−17を媒介とするTh17炎症性疾患を治療および/または予防するための薬学的組成物を提供する。
【0011】
本発明の第2側面は、血管内皮細胞成長因子受容体(VEGFR)の経路阻害物質を有効成分として含有する薬学的組成物を哺乳動物に投与する段階を含む、IL−6或いはIL−17を媒介とするTh17(T helper type 17)炎症性疾患を治療および/または予防する方法を提供する。
【発明の効果】
【0012】
本発明に係る血管内皮細胞成長因子受容体(VEGFR)の経路阻害物質を有効成分とする薬学的組成物は、IL−6或いはIL−17を媒介とするTh17炎症性疾患を効果的に治療することができる。特に、非好酸球性または好中球性炎症を特徴とする喘息或いは慢性閉塞性肺疾患の治療および予防に優れた効能を持つことができる。
【0013】
これに加えて、本発明に係るVEGFR−2経路の選択的な阻害物質を介してTh−17細胞免疫反応を選択的に減少させることにより、非好酸球性或いは好中球性炎症疾患を効果的に治療することができるとともに、Th−1細胞の免疫反応を阻害しないことにより細菌感染などの副作用を減らすことができるという利点がある。
【図面の簡単な説明】
【0014】
【図1】アレルゲンと内毒素で鼻腔を介して感作して6時間、24時間後に血管内皮細胞成長因子とIL−6の分泌量をBAL fluidで確認した結果である。
【図2】アレルゲンと内毒素或いはアレルゲンと組み換え血管内皮成長因子で感作し、アレルゲンを投与して喘息動物モデルを作った後、BAL fluid内で炎症反応を確認した結果である。
【図3】アレルゲンと内毒素或いはアレルゲンと組み換え血管内皮成長因子で感作した後、アレルゲンを投与して6時間後に肺組織からTh1、Th17免疫反応を確認した結果である。
【図4】アレルゲンと内毒素或いは血管内皮成長因子で感作し、アレルゲンを投与して作った喘息動物モデルにアレルゲンを投与した後、表示された時間でBAL fluidを確認することを図式化した図である。
【図5】図4で表示された時間にBAL fluid内の炎症反応とIL−17分泌量を測定した結果である。
【図6】IL−17欠乏マウスで喘息動物モデルを作り、BAL fluid内の炎症反応を確認した結果である。
【図7】IL−6欠乏マウスで喘息動物モデルを作り、BAL fluid内の炎症反応とIL−17の分泌量を測定した結果である。
【図8】実施例1の喘息動物モデル製造プロトコルを示す図である。
【図9】SU5416を感作時期に処理した後、喘息動物モデルを作り、炎症反応を確認した結果である。
【図10】SU5416を感作時期に処理し、アレルゲンを投与して6時間後にBAL fluid内でガンマインターフェロンとIL−17の分泌量を確認した結果、および局所リンパ節からTh1、Th17免疫反応を確認した結果を示す。
【図11】SU5416を感作時期に処理し、BAL fluidでIL−6の分泌量を確認した結果である。
【図12】実施例2の喘息動物モデル製造プロトコルを示す。
【図13】anti−Flk−1を感作時期に処理し、感作時にBAL fluidで炎症反応とIL−6の分泌量を測定した結果である。
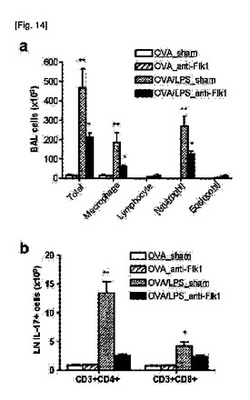
【図14】anti−Flk−1を感作時期に処理し、アレルゲンを投与して喘息動物モデルを作り、BAL fluidにおける炎症反応と局所リンパ節におけるTh17免疫反応を確認した結果である。
【発明を実施するための形態】
【0015】
以下、添付図面を参照して、本発明の属する技術分野における通常の知識を有する者が容易に実施し得るように本発明の具現例および実施例を詳細に説明する。
【0016】
ところが、以下の説明は、本発明を特定の実施形態について限定しようとするものではなく、本発明の思想および技術範囲に含まれるすべての変換、均等物ないし代替物を含むものと理解されるべきである。
【0017】
本発明の第1側面によれば、血管内皮細胞成長因子受容体(VEGFR)の経路阻害物質を有効成分として含有する、IL−6或いはIL−17を媒介とするTh17炎症性疾患の治療または予防のための薬学的組成物が提供される。
【0018】
前記血管内皮細胞成長因子受容体は、VEGFR−1、VEGFR−2およびVEGFR−3を含み、好ましくはVEGFR−2でありうる。また、前記血管内皮細胞成長因子受容体の経路阻害物質は、好ましくはVEGFR−2の経路を選択的に阻害するものでありうる。
【0019】
本発明の一具現例として、前記Th17炎症性疾患は、非好酸球性或いは好中球性喘息または慢性閉塞性肺疾患を含む。
【0020】
本発明の一具現例として、前記Th17炎症性疾患は、非好酸球性或いは好中球性炎症を特徴とする炎症性腸炎、アトピー性皮膚炎、リウマチ性疾患、または自己免疫疾患でありうる。
【0021】
本発明の一具現例として、前記Th17炎症性疾患は、IL−6或いはIL−17によって媒介される大腸癌、胃癌または肺癌でありうる。
【0022】
前記VEGFR経路阻害物質は、VEGFRに直接作用して経路(pathway)を阻害する物質であり、或いはキナーゼ阻害剤のようにVEGFRの経路を遮断することが可能な物質を含む意味である。また、VEGFR−2経路阻害物質も同様に、VEGFR−2に直接作用して経路を阻害する物質であり、或いはキナーゼ阻害剤のようにVEGFR−2の経路を遮断することが可能な物質を含む意味である。
【0023】
前記VEGFR−2経路阻害物質は、Th−17細胞免疫反応を減少させるものであってもよく、Th−17細胞が分泌するサイトカインIL−17の分泌を減少させるものであってもよい。
【0024】
本発明の一具現例によれば、前記血管内皮細胞成長因子受容体の経路阻害物質は、VEGFR−2を抑制する水溶性VEGFR組み換えタンパク質でありうる。
【0025】
本発明の一具現例によれば、前記血管内皮細胞成長因子受容体の経路阻害物質はセマキサニブ(SU5416)、anti−Flk−1抗体、CT−322ペプチド、KR−31831、バタラニブ(PTK787)およびこれらの組み合わせよりなる群から選ばれるものであり、好ましくは、前記血管内皮細胞成長因子受容体の経路阻害物質はVEGFR−2の経路を選択的に阻害するanti−Flk−1抗体、CT−322ペプチド、KR−31831、バタラニブ(PTK787)およびこれらの組み合わせよりなる群から選ばれるものでありうるが、これに限定されるものではない。
【0026】
前記セマキサニブ(semaxanib)は、セマキシニブ(semaxinib)またはSUS5416ともいわれる、下記化学式1で表される化合物であって、血管新生抑制による抗腫瘍効果があるものと知られている。
【化1】

【0027】
前記anti−Flk−1抗体は、VEGFR−2(Flk−1ともいわれる)に特異的な抗体であって、VEGFR−2の経路を特異的に阻害する物質である。本発明の一実施例によれば、市販する多様な種類のanti−Flk−1抗体(たとえば、anti−mouse VEGFR2(Flk−1)antibody、R&D systems)を使用することが可能である。
【0028】
前記CT−322ペプチドは、ヒトのフィブロネクチンドメインに由来した小型タンパク質であり、VEGFR−2の経路を特異的に阻害する血管新生抑制剤であって、抗腫瘍効果が知られている物質である。本発明の一実施例によれば、AngioceptTM(Adnexus)などの市販中のCT−322を使用することが可能である。
【0029】
前記KR−31831は、下記化学式2で表される化合物であって、VEGFR−2の経路を特異的に阻害する血管新生抑制剤であって、抗腫瘍効果が知られている物質である[Park SY, Seo EH, Song HS, Jung SY, Lee YK, Yi KY, Yoo SE, Kim YJ. KR−31831, benzopyran derivative, inhibits VEGF−induced angiogenesis of HUVECs through suppressing KDR expression. Int J Oncol. 2008;32:1311−5]。
【化2】

【0030】
前記バタラニブ(vatalanib)は、PTK787またはPTK/ZKともいわれる、下記化学式3で表される化合物であって、VEGFR−2に対する選択性に優れたタンパク質キナーゼ阻害剤であり、血管新生抑制剤として抗腫瘍効果が知られている物質である。
【化3】

【0031】
本発明の第2側面によれば、血管内皮細胞成長因子受容体(VEGFR)の経路阻害物質を有効成分として含有する薬学的組成物を哺乳動物に投与する段階を含む、IL−6或いはIL−17を媒介とするTh17炎症疾患の治療または予防方法が提供される。
【0032】
ここで、前記投与は、全身投与、経口投与または呼吸器を介しての吸入投与よりなる群から選ばれる方法で行われるが、これに限定されるものではなく、その他の多様な投与方法で投与することが可能である。
【0033】
本発明の第1側面に係るIL−6或いはIL−17を媒介とするTh17炎症疾患の治療または予防のための薬学的組成物に関連して説明した前記血管内皮細胞成長因子受容体(VEGFR)、前記VEGFR経路阻害物質、前記VEGFR−2経路の選択的阻害物質などに対する記載は、本発明の第2側面に係るIL−6或いはIL−17を媒介とするTh17炎症疾患の治療または予防方法に関連しても同様に適用できる。
【0034】
以下、本発明の理解を助けるために好適な実施例によってさらに具体的に説明する。ところが、下記実施例は本発明をより容易に理解するために提供されるものに過ぎず、実施例によって本発明の内容を限定するものではない。
【実施例】
【0035】
Th17免疫反応を特徴として炎症を起こす喘息動物モデルを用いて、VEGFR阻害剤の効能を評価した。
【0036】
喘息動物モデルを作るために、C57BL/6(雌、6週)マウスに対して、実験群と対照群各5匹に0、1、2及び7日にアレルゲンとしてオボアルブミン(OVA)75μg、補強剤として内毒素(リポ多糖類、LPS)10μgを麻酔後に鼻腔投与して感作した。一部の実験群に属したマウスは、鼻腔内にOVAとLPSを投与する30分前に腹腔にそれぞれSU5416(Sigmaから収得)1mg/kg及び10mg/kg又はanti−Flk−1(R&D systemsから収得)0.1、1及び10μgを注射して投与した。14、15、21日および22日にOVA(50μg)を麻酔後に鼻腔投与した。
【0037】
最後のOVA投与6時間(22日)、48時間(24日)後に肺炎症を測定した。ケタミン(ketamin)とキシラジン(xylazine)とを混合した麻酔液をマウスの腹腔に投与して麻酔した後、胸部を切開し気管を露出させてカテーテルを気道に挿入し結紮させた。無菌性生理食塩水を1mLずつ2回注入し、気道を洗浄して気管支肺胞洗浄液(bronchoalveolar lavage、BAL fluid)を得た。そして、肺組織内Tリンパ球の分析のために肺を摘出し、局所リンパ節から細胞を抽出した。
【0038】
BAL fluidを4℃で3000rpmにて10分間遠心分離した後、細胞ペレット(cell pellet)をPBS(phosphate buffered saline)溶液に溶かした。前記細胞ペレットをサイトスピン(cytospin)してスライドに塗抹し、Diff Quick染色を行って光学顕微鏡1000倍の視野で300個以上の炎症細胞を観察し、マクロファージ細胞、リンパ球、好中球、好酸球に分類して各炎症細胞の数を測定した。また、BAL fluidでTh1炎症反応を反映するサイトカインとしてのガンマインターフェロン、Th17炎症反応を反映するIL−17及びIL−6をELISA方法で測定した。
【0039】
摘出した肺組織をコラゲナーゼタイプIV(collagenase type IV、Sigma)で処理して細胞を分離した。細胞の表面を蛍光物質付きanti−CD3、CD4、CD8(BD pharmingen)抗体で染色した後、ホルマリンで細胞膜に穿孔し、anti−IFN−γ、IL−17で細胞内サイトカイン染色(intracellular cytokine staining)を行った。FACSCaliburTM(Becton Dickinson)を用いて、肺に流入したT細胞の種類を判断し、T細胞の発現を測定した。
【0040】
リンパ節から得た細胞を、OVA 100μg/mL濃度のRPMI(Gibco)、10% FBSおよび抗生物質が入っている溶液で72時間培養した後、溶液に含まれたTh1、Th17及びTh2炎症反応を反映するサイトカインをそれぞれELISA方法で測定した。
【0041】
図1aは、OVAとLPSを共に投与して6時間と24時間後に、BAL fluidに含まれたVEGFの量を測定した結果を示す。図1bは同じ実験条件でBAL fluidに含まれたIL−6の量を測定した結果を示す。LPS10μgを投与した場合、BAL fluidでVEGFの量が初期の6時間に増加した(図1a)。LPS10μgを投与した場合、BAL fluidで炎症の程度を示すIL−6の量は6時間目と24時間目の両方ともに増加した(図1b)。
【0042】
OVAと組み換えVEGF、又はOVAとLPSを鼻腔内投与した後でOVAを投与した実験群(OVA/VEGF及びOVA/LPS)と、PBS或いはVEGFのみを処理した後でOVAを投与した対照群(PBS及びVEGF)とを比較し、実験群(OVA/LPS及びOVA/VEGF)のBAL fluid内の炎症細胞数を図2に示し、肺組織から分離したT細胞におけるガンマインターフェロン(INF−γ)の量とIL−17の量をそれぞれ図3aと図3bに示した。
【0043】
組み換えVEGFを単独で投与したときは、炎症細胞の数が増加しなかったが、組み換えVEGFをOVAと共に投与したときは、(OVA/VEGF)炎症細胞の数が増加した(図2参照)。組み換えVEGFを単独で投与したときは、炎症の程度を示すINF−γの量とIL−17の量が増加しなかったが、組み換えVEGFをOVAとともに投与したときは、INF−γの量とIL−17の量が増加した(図3a及び図3b参照)。
【0044】
図4のプロトコルに従い、OVAとLPSで感作した後、OVAを投与して作った炎症モデルにおいて、14、15及び21日に麻酔の後にOVAを鼻腔内投与した後、図4に示した時間帯別にBAL fluid内の炎症細胞の数とIL−17の量を測定し、その結果を図5a及び図5bにそれぞれ示した。
【0045】
IL−17の量は最後のOVA投与4時間後から増加し(図5b参照)、炎症細胞の数は12時間後に増加した(図5a参照)。
【0046】
また、同じ実験条件でIL−17欠乏マウスを使用した場合、正常マウス(WT_OVA/LPS)と比較して、IL−17欠乏マウス(IL−17−/−_OVA/LPS)では、炎症細胞の数が一層少なく増加した(図6参照)。
【0047】
同じ実験条件でIL−6欠乏マウスを使用した場合、正常マウス(IL−16−/−_OVA/LPS)と比較して、IL−6欠乏マウス(IL−6−/−_OVA/LPS)では炎症細胞の数が一層少なく増加し(図7a)、IL−17の量が増加しなかった(図7b)。
【0048】
実施例1:VEGFR−1及びVEGFR−2を同時に抑制するSUS5416の効能評価
C57BL/6(雌、6週)マウスを実験群と対照群5匹ずつ使用して図8のプロトコルにしたがって喘息動物モデルを作った。実験群としては、有機溶媒のDMSO(dimethyl sulfoxide)に溶かしたVEGFR−1とVEGFR−2のチロシンキナーゼ作用を阻害する化合物(SU5416)1mg/kg及び10mg/kgをそれぞれ腹腔に注射し、30分後にOVAとLPSを鼻腔投与したマウス(0、1、2及び7日)を用い、対照群としては、有機溶媒DMSOのみを腹腔投与した後、OVAとLPSを鼻腔投与したマウスを用いた。14、15、21及び22日に麻酔の後にOVAを鼻腔投与し後、最後の投与24時間後(24日)にBAL fluidの炎症細胞の数を図9に示した。
【0049】
図9に示すように、初期感作時期にSU5416を使用して血管内皮細胞成長因子の全ての受容体を介した信号伝達を阻害したとき、SU5416の濃度に依存的に炎症細胞数の増加が抑制されることが分かる。
【0050】
図10は、感作の後、3回OVA投与6時間後(21日)に免疫反応を評価した結果を示す。感作の際にSU5416で治療したマウス(OVA/LPS_SU)は、BAL fluidでガンマインターフェロンとIL−17の分泌量が顕著に減少し(図10a参照)、局所リンパ節から分離した免疫細胞においても、アレルゲンで刺激したときに分泌されるガンマインターフェロンとIL−17が顕著に減少するものと示された(図10b及び図10c参照)。
【0051】
また、OVAとLPSで3回感作して6時間後にBAL fluidでIL−6の量を測定した結果を図11に示した。10mg/kgのSU5416を投与したマウス(OVA/LPS_SU)は、対照群(OVA/LPS_sham)に比べてIL−6の分泌量が減少するものと示された(図11参照)。
【0052】
実施例2:VEGFR−2を阻害するモノクローナル抗体の効能評価
C57BL/6(雌、6週)マウスを実験群と対照群各5匹ずつ使用して図12のプロトコルにしたがって喘息動物モデルを作った。
【0053】
具体的に、VEGF−2を阻害するモノクローナル抗体(anti−Flk−1、R&D Systems)0.1、1.0及び10μgをそれぞれ腹腔に注射したマウスを実験群として用い、PBSを腹腔内に注射したマウスを対照群として用いた。anti−Flk−1或いはPBSの注射後から30分が経過したときにOVAとLPSを鼻腔投与し、24時間後(1日)にBAL fluidの炎症細胞の数及びIL−6の量を測定した結果を図13に示した。
【0054】
Anti−Flk−1の濃度に依存的にBAL fluid内の炎症細胞数の増加が抑制された(図13a参照)。anti−Flk−1を10μg腹腔に注射した場合(OVA/LPS_anti−Flk−1)は、対照群(OVA/LPS_sham)と比較してBAL luid内のIL−6量の増加が抑制された(図13b参照)。
【0055】
また、図12の喘息モデルでanti−Flk−1を10μg腹腔投与したマウスを実験群として用い、偽薬(sham)を腹腔投与したマウスを対照群として用いた。0、1、2及び7日にanti−Flk−1又は偽薬を腹腔投与し、その30分後にOVAとLPSを鼻腔投与し、14、15、21及び22日にOVAを鼻腔内注射し、4回OVAを投与して48時間後に肺炎症と免疫反応を評価した結果を図14に示した。
【0056】
Anti−Flk−1で治療した場合(OVA/LPS_anti−Flk−1)は、偽薬を投与したマウス(OVA/LPS_sham)と比較して、BAL fluid内の炎症細胞の数が顕著に減少し(図14a参照)、局所リンパ節から分離したT細胞における、IL−17を分泌するCD4+及びCD8+細胞が顕著に減少した(図14b参照)。
【0057】
以上の結果をまとめると、非特異的VEGF受容体抑制剤としてのSU5416を投与したマウスと、VEGFR−2抑制剤としてのanti−Flk−1モノクローナル抗体を投与したマウスの両方ともにおいて肺炎症を抑制する効果が優れた。
【0058】
免疫学的な作用メカニズムによって、SU5416を投与した場合にはTh1とTh17免疫反応を減少させ、anti−Flk−1を投与した場合にはTh17免疫反応を減少させた。ところが、Th1は、細胞性免疫を担当するため、SU5416のようにTh1とTh17の免疫反応を全て減少させる薬剤を長期的に投与すると、細菌感染に脆弱となる副作用がある。Anti−Flk−1でVEGFR−2のみを阻害する場合、細菌感染を減らすTh1免疫反応は維持し、Th17免疫反応による慢性炎症反応のみを減らすことができるという利点がある。よって、非好酸球性或いは好中球性呼吸器炎症を治療する目的では、VEGFR−2のみを選択的に阻害する方がさらに好ましい。
【0059】
SU5416とanti−Flk−1を使用する実施例を示したが、VEGFR又はVEGFR−2に直接作用し、或いはキナーゼ阻害剤のようにVEGFR又はVEGFR−2経路を遮断する他の物質も本発明の目的に使用することができる。VEGFR−2を選択的に阻害する物質としては、モノクローナル抗体としてのanti−Flk−1以外にも、フィブロネクチン(fibronectin)ドメインに由来したCT−322などのタンパク質が知られている。VEGFR−2を阻害すると知られたKR−31831を使用することもできる。また、全てのVEGFRに作用するが、VEGFR−2に対する選択性に優れたバタラニブ(vatalanib)、PTK787又はPTK/ZKとして知られているキナーゼ阻害剤を使用することもできる。
【0060】
これに加えて、VEGFR−2を選択的に抑制するアプタマー(aptamer)、siRNA、miRNAなどを開発して使用することも予想することができる。
【0061】
注射で全身投与する実施例を示したが、VEGFR又はVEGFR−2阻害剤を経口投与してもよく、吸入、皮膚塗布などの方法で投与してもよい。
【0062】
前述した本発明の説明は例示のためのものに過ぎず、本発明の属する技術分野における通常の知識を有する者は、本発明の技術的思想又は必須的な特徴を変更することなく、他の具体的な形態に容易に変形可能であることを理解することができる。したがって、上述した実施例は全ての面で例示的なもので、限定的なものではないと理解すべきである。
【産業上の利用可能性】
【0063】
本発明に係る血管内皮細胞成長因子受容体(VEGFR)経路阻害物質を有効成分とする薬学的組成物を用いて、IL−6或いはIL−17を媒介とするTh17炎症性疾患を効果的に治療することができ、特にVEGFR−2経路の選択的な阻害物質を含有する組成物を用いて非好酸球性或いは好中球性炎症疾患を効果的に治療することができる。
【技術分野】
【0001】
本発明は、非好酸球性或いは好中球性炎症を特徴とするTh17炎症疾患治療または予防方法、およびこのための薬学的組成物に関する。
【背景技術】
【0002】
呼吸器炎症性疾患、たとえば喘息や慢性閉塞性肺疾患(chronic obstructive pulmonary disease、COPD)などの治療において、炎症を抑制することは非常に重要である。
【0003】
喘息は免疫体系の過剰反応による呼吸器炎症である。1980年代後半に、ヘルパーT細胞(helper T cell)として、細胞性免疫を活性化するTh1細胞および体液性免疫を活性化するTh2細胞があることが発見され、Th1、Th2細胞が互いに拮抗作用をすることが知られている。これにより、喘息はアレルギー抗原に反応する抗体IgEにより刺激されたTh2細胞が分泌するサイトカインによって好酸球(eosinophile)が主に関与する炎症であると理解されている(非特許文献1)。Th2が分泌するIL−13がマウス喘息モデルで喘息を誘発することが確認された(非特許文献2、非特許文献3)。
【0004】
ところが、喘息の中でも、相当数を占める非好酸球性喘息(non-eosinophilic asthma)はTh2細胞で説明することができない(非特許文献4、非特許文献5)。非好酸球性或いは好中球性喘息では好酸球より好中球(neutrophils)が一層多く発見され、喘息の度合いがさらに激しい。コルチコステロイドと偽薬(placebo)の吸入治療効果を比較した臨床研究においても、非好酸球性喘息は好酸球性喘息とは顕著に区分され、ステロイドによる治療効果が殆どなかった(非特許文献6)。
【0005】
最近、Th1、Th2と区分される新しいヘルパーT細胞としてのTh17細胞が発見されており、CD4+細胞またはCD8+細胞がIL−17を分泌することが知られている(非特許文献7、非特許文献8、非特許文献9)。Th17細胞が好中球性炎症に関連するという予想はあるが、Th17細胞またはTh17細胞が分泌するIL−17と喘息との関連は知られていない(非特許文献10)。さらに興味深い事実は、Th17炎症反応が持続したとき、粘膜に大腸癌が発生するという事実が最近報告された(非特許文献11)。
【0006】
一方、過多発現した血管内皮細胞成長因子(vascular endothelial growth factor、VEGF)は気道リモデリング(airway remodeling)を起こし、アレルギー炎症において内皮細胞とともにTh2細胞がVEGFを分泌すると報告された(非特許文献12)。ところが、Th17細胞とVEGFまたはその受容体(vascular endothelial growth factor、VEGF)との関係は知られていない。
【0007】
VEGFR群にはVEGFR−1、VEGFR−2、VEGFR−3の3つの受容体がある。これらの中でも、VEGFR−1はFlt−1という名称で、VEGFR−2はKDRまたはFlk−1という名称で、VEGFR−3はFlt−4という名称で呼ばれることもある。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Robinson DS, Hamid Q, Ying S, Tsicopoulos A, Barkans J, Bentley AM, Corrigan C, Durham SR, Kay AB. Predominant Th2−like bronchoalveolar T−lymphocyte population in atopic asthma. N Engl J Med 1992;326:298−304
【非特許文献2】Grunig G, Warnock M, Wakil AE, Venkayya R, Brombacher F, Rennick DM, Sheppard D, Mohrs M, Donaldson DD, Locksley RM, et al. Requirement for IL−13 independently of IL−4 in experimental asthma. Science 1998;282:2261−2263
【非特許文献3】Wills−Karp M, Luyimbazi J, Xu X, Schofield B, Neben TY, Karp CL, Donaldson DD. Interleukin−13: central mediator of allergic asthma. Science 1998;282:2258−2261
【非特許文献4】Douwes J, Gibson P, Pekkanen J, Pearce N. Non−eosinophilic asthma: importance and possible mechanisms. Thorax. 2002;57:643−8
【非特許文献5】Fahy JV. Eosinophilic and neutrophilic inflammation in asthma: insights from clinical studies. Proc Am Thorac Soc. 2009;6:256−9
【非特許文献6】Berry M, Morgan A, Shaw DE, Parker D, Green R, Brightling C, Bradding P, Wardlaw AJ, Pavord ID. Pathological features and inhaled corticosteroid response of eosinophilic and non−eosinophilic asthma. Thorax. 2007;62(12):1043−9
【非特許文献7】Langrish CL, Chen Y, Blumenschein WM, Mattson J, Basham B, Sedgwick JD, McClanahan T, Kastelein RA, Cua DJ. IL−23 drives a pathogenic T cell population that induces autoimmune inflammation. J Exp Med 2005; 201:233−240
【非特許文献8】Curtis MM, Way SS, Wilson CB. IL−23 promotes the production of IL−17 by antigen−specific CD8 T cells in the absence of IL−12 and type−I interferons. J Immunol 2009;1:381−7
【非特許文献9】Ciric B, El−behi M, Cabrera R, Zhang GX, Rostami A. IL−23 drives pathogenic IL−17−producing CD8+ T cells. J Immunol 2009;182:5296−305
【非特許文献10】モジフン著、T細胞の分化とTh17、大韓耳鼻咽喉科学会誌2008;51:688−93
【非特許文献11】Wu et al. A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses. Nat Med. 5(9):1016−22 (2009)
【非特許文献12】Lee CG, Link H, Baluk P, Homer RJ, Chapoval S, Bhandari V, Kang MJ, Cohn L, Kim YK, McDonald DM, Elias JA. Vascular endothelial growth factor (VEGF) induces remodeling and enhances TH2−mediated sensitization and inflammation in the lung. Nat Med 2004;10:1095−1103
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、Th17細胞と血管内皮細胞成長因子またはその受容体の関連性と、Th17細胞と炎症性疾患との関連性を解明することにより、Th17炎症性疾患を治療および/予防する方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
前述した課題を達成するための技術的手段として、本発明の第1側面は、血管内皮細胞成長因子受容体(VEGFR)の経路阻害物質を有効成分として含有する、IL(interleukin)−6或いはIL−17を媒介とするTh17炎症性疾患を治療および/または予防するための薬学的組成物を提供する。
【0011】
本発明の第2側面は、血管内皮細胞成長因子受容体(VEGFR)の経路阻害物質を有効成分として含有する薬学的組成物を哺乳動物に投与する段階を含む、IL−6或いはIL−17を媒介とするTh17(T helper type 17)炎症性疾患を治療および/または予防する方法を提供する。
【発明の効果】
【0012】
本発明に係る血管内皮細胞成長因子受容体(VEGFR)の経路阻害物質を有効成分とする薬学的組成物は、IL−6或いはIL−17を媒介とするTh17炎症性疾患を効果的に治療することができる。特に、非好酸球性または好中球性炎症を特徴とする喘息或いは慢性閉塞性肺疾患の治療および予防に優れた効能を持つことができる。
【0013】
これに加えて、本発明に係るVEGFR−2経路の選択的な阻害物質を介してTh−17細胞免疫反応を選択的に減少させることにより、非好酸球性或いは好中球性炎症疾患を効果的に治療することができるとともに、Th−1細胞の免疫反応を阻害しないことにより細菌感染などの副作用を減らすことができるという利点がある。
【図面の簡単な説明】
【0014】
【図1】アレルゲンと内毒素で鼻腔を介して感作して6時間、24時間後に血管内皮細胞成長因子とIL−6の分泌量をBAL fluidで確認した結果である。
【図2】アレルゲンと内毒素或いはアレルゲンと組み換え血管内皮成長因子で感作し、アレルゲンを投与して喘息動物モデルを作った後、BAL fluid内で炎症反応を確認した結果である。
【図3】アレルゲンと内毒素或いはアレルゲンと組み換え血管内皮成長因子で感作した後、アレルゲンを投与して6時間後に肺組織からTh1、Th17免疫反応を確認した結果である。
【図4】アレルゲンと内毒素或いは血管内皮成長因子で感作し、アレルゲンを投与して作った喘息動物モデルにアレルゲンを投与した後、表示された時間でBAL fluidを確認することを図式化した図である。
【図5】図4で表示された時間にBAL fluid内の炎症反応とIL−17分泌量を測定した結果である。
【図6】IL−17欠乏マウスで喘息動物モデルを作り、BAL fluid内の炎症反応を確認した結果である。
【図7】IL−6欠乏マウスで喘息動物モデルを作り、BAL fluid内の炎症反応とIL−17の分泌量を測定した結果である。
【図8】実施例1の喘息動物モデル製造プロトコルを示す図である。
【図9】SU5416を感作時期に処理した後、喘息動物モデルを作り、炎症反応を確認した結果である。
【図10】SU5416を感作時期に処理し、アレルゲンを投与して6時間後にBAL fluid内でガンマインターフェロンとIL−17の分泌量を確認した結果、および局所リンパ節からTh1、Th17免疫反応を確認した結果を示す。
【図11】SU5416を感作時期に処理し、BAL fluidでIL−6の分泌量を確認した結果である。
【図12】実施例2の喘息動物モデル製造プロトコルを示す。
【図13】anti−Flk−1を感作時期に処理し、感作時にBAL fluidで炎症反応とIL−6の分泌量を測定した結果である。
【図14】anti−Flk−1を感作時期に処理し、アレルゲンを投与して喘息動物モデルを作り、BAL fluidにおける炎症反応と局所リンパ節におけるTh17免疫反応を確認した結果である。
【発明を実施するための形態】
【0015】
以下、添付図面を参照して、本発明の属する技術分野における通常の知識を有する者が容易に実施し得るように本発明の具現例および実施例を詳細に説明する。
【0016】
ところが、以下の説明は、本発明を特定の実施形態について限定しようとするものではなく、本発明の思想および技術範囲に含まれるすべての変換、均等物ないし代替物を含むものと理解されるべきである。
【0017】
本発明の第1側面によれば、血管内皮細胞成長因子受容体(VEGFR)の経路阻害物質を有効成分として含有する、IL−6或いはIL−17を媒介とするTh17炎症性疾患の治療または予防のための薬学的組成物が提供される。
【0018】
前記血管内皮細胞成長因子受容体は、VEGFR−1、VEGFR−2およびVEGFR−3を含み、好ましくはVEGFR−2でありうる。また、前記血管内皮細胞成長因子受容体の経路阻害物質は、好ましくはVEGFR−2の経路を選択的に阻害するものでありうる。
【0019】
本発明の一具現例として、前記Th17炎症性疾患は、非好酸球性或いは好中球性喘息または慢性閉塞性肺疾患を含む。
【0020】
本発明の一具現例として、前記Th17炎症性疾患は、非好酸球性或いは好中球性炎症を特徴とする炎症性腸炎、アトピー性皮膚炎、リウマチ性疾患、または自己免疫疾患でありうる。
【0021】
本発明の一具現例として、前記Th17炎症性疾患は、IL−6或いはIL−17によって媒介される大腸癌、胃癌または肺癌でありうる。
【0022】
前記VEGFR経路阻害物質は、VEGFRに直接作用して経路(pathway)を阻害する物質であり、或いはキナーゼ阻害剤のようにVEGFRの経路を遮断することが可能な物質を含む意味である。また、VEGFR−2経路阻害物質も同様に、VEGFR−2に直接作用して経路を阻害する物質であり、或いはキナーゼ阻害剤のようにVEGFR−2の経路を遮断することが可能な物質を含む意味である。
【0023】
前記VEGFR−2経路阻害物質は、Th−17細胞免疫反応を減少させるものであってもよく、Th−17細胞が分泌するサイトカインIL−17の分泌を減少させるものであってもよい。
【0024】
本発明の一具現例によれば、前記血管内皮細胞成長因子受容体の経路阻害物質は、VEGFR−2を抑制する水溶性VEGFR組み換えタンパク質でありうる。
【0025】
本発明の一具現例によれば、前記血管内皮細胞成長因子受容体の経路阻害物質はセマキサニブ(SU5416)、anti−Flk−1抗体、CT−322ペプチド、KR−31831、バタラニブ(PTK787)およびこれらの組み合わせよりなる群から選ばれるものであり、好ましくは、前記血管内皮細胞成長因子受容体の経路阻害物質はVEGFR−2の経路を選択的に阻害するanti−Flk−1抗体、CT−322ペプチド、KR−31831、バタラニブ(PTK787)およびこれらの組み合わせよりなる群から選ばれるものでありうるが、これに限定されるものではない。
【0026】
前記セマキサニブ(semaxanib)は、セマキシニブ(semaxinib)またはSUS5416ともいわれる、下記化学式1で表される化合物であって、血管新生抑制による抗腫瘍効果があるものと知られている。
【化1】

【0027】
前記anti−Flk−1抗体は、VEGFR−2(Flk−1ともいわれる)に特異的な抗体であって、VEGFR−2の経路を特異的に阻害する物質である。本発明の一実施例によれば、市販する多様な種類のanti−Flk−1抗体(たとえば、anti−mouse VEGFR2(Flk−1)antibody、R&D systems)を使用することが可能である。
【0028】
前記CT−322ペプチドは、ヒトのフィブロネクチンドメインに由来した小型タンパク質であり、VEGFR−2の経路を特異的に阻害する血管新生抑制剤であって、抗腫瘍効果が知られている物質である。本発明の一実施例によれば、AngioceptTM(Adnexus)などの市販中のCT−322を使用することが可能である。
【0029】
前記KR−31831は、下記化学式2で表される化合物であって、VEGFR−2の経路を特異的に阻害する血管新生抑制剤であって、抗腫瘍効果が知られている物質である[Park SY, Seo EH, Song HS, Jung SY, Lee YK, Yi KY, Yoo SE, Kim YJ. KR−31831, benzopyran derivative, inhibits VEGF−induced angiogenesis of HUVECs through suppressing KDR expression. Int J Oncol. 2008;32:1311−5]。
【化2】

【0030】
前記バタラニブ(vatalanib)は、PTK787またはPTK/ZKともいわれる、下記化学式3で表される化合物であって、VEGFR−2に対する選択性に優れたタンパク質キナーゼ阻害剤であり、血管新生抑制剤として抗腫瘍効果が知られている物質である。
【化3】

【0031】
本発明の第2側面によれば、血管内皮細胞成長因子受容体(VEGFR)の経路阻害物質を有効成分として含有する薬学的組成物を哺乳動物に投与する段階を含む、IL−6或いはIL−17を媒介とするTh17炎症疾患の治療または予防方法が提供される。
【0032】
ここで、前記投与は、全身投与、経口投与または呼吸器を介しての吸入投与よりなる群から選ばれる方法で行われるが、これに限定されるものではなく、その他の多様な投与方法で投与することが可能である。
【0033】
本発明の第1側面に係るIL−6或いはIL−17を媒介とするTh17炎症疾患の治療または予防のための薬学的組成物に関連して説明した前記血管内皮細胞成長因子受容体(VEGFR)、前記VEGFR経路阻害物質、前記VEGFR−2経路の選択的阻害物質などに対する記載は、本発明の第2側面に係るIL−6或いはIL−17を媒介とするTh17炎症疾患の治療または予防方法に関連しても同様に適用できる。
【0034】
以下、本発明の理解を助けるために好適な実施例によってさらに具体的に説明する。ところが、下記実施例は本発明をより容易に理解するために提供されるものに過ぎず、実施例によって本発明の内容を限定するものではない。
【実施例】
【0035】
Th17免疫反応を特徴として炎症を起こす喘息動物モデルを用いて、VEGFR阻害剤の効能を評価した。
【0036】
喘息動物モデルを作るために、C57BL/6(雌、6週)マウスに対して、実験群と対照群各5匹に0、1、2及び7日にアレルゲンとしてオボアルブミン(OVA)75μg、補強剤として内毒素(リポ多糖類、LPS)10μgを麻酔後に鼻腔投与して感作した。一部の実験群に属したマウスは、鼻腔内にOVAとLPSを投与する30分前に腹腔にそれぞれSU5416(Sigmaから収得)1mg/kg及び10mg/kg又はanti−Flk−1(R&D systemsから収得)0.1、1及び10μgを注射して投与した。14、15、21日および22日にOVA(50μg)を麻酔後に鼻腔投与した。
【0037】
最後のOVA投与6時間(22日)、48時間(24日)後に肺炎症を測定した。ケタミン(ketamin)とキシラジン(xylazine)とを混合した麻酔液をマウスの腹腔に投与して麻酔した後、胸部を切開し気管を露出させてカテーテルを気道に挿入し結紮させた。無菌性生理食塩水を1mLずつ2回注入し、気道を洗浄して気管支肺胞洗浄液(bronchoalveolar lavage、BAL fluid)を得た。そして、肺組織内Tリンパ球の分析のために肺を摘出し、局所リンパ節から細胞を抽出した。
【0038】
BAL fluidを4℃で3000rpmにて10分間遠心分離した後、細胞ペレット(cell pellet)をPBS(phosphate buffered saline)溶液に溶かした。前記細胞ペレットをサイトスピン(cytospin)してスライドに塗抹し、Diff Quick染色を行って光学顕微鏡1000倍の視野で300個以上の炎症細胞を観察し、マクロファージ細胞、リンパ球、好中球、好酸球に分類して各炎症細胞の数を測定した。また、BAL fluidでTh1炎症反応を反映するサイトカインとしてのガンマインターフェロン、Th17炎症反応を反映するIL−17及びIL−6をELISA方法で測定した。
【0039】
摘出した肺組織をコラゲナーゼタイプIV(collagenase type IV、Sigma)で処理して細胞を分離した。細胞の表面を蛍光物質付きanti−CD3、CD4、CD8(BD pharmingen)抗体で染色した後、ホルマリンで細胞膜に穿孔し、anti−IFN−γ、IL−17で細胞内サイトカイン染色(intracellular cytokine staining)を行った。FACSCaliburTM(Becton Dickinson)を用いて、肺に流入したT細胞の種類を判断し、T細胞の発現を測定した。
【0040】
リンパ節から得た細胞を、OVA 100μg/mL濃度のRPMI(Gibco)、10% FBSおよび抗生物質が入っている溶液で72時間培養した後、溶液に含まれたTh1、Th17及びTh2炎症反応を反映するサイトカインをそれぞれELISA方法で測定した。
【0041】
図1aは、OVAとLPSを共に投与して6時間と24時間後に、BAL fluidに含まれたVEGFの量を測定した結果を示す。図1bは同じ実験条件でBAL fluidに含まれたIL−6の量を測定した結果を示す。LPS10μgを投与した場合、BAL fluidでVEGFの量が初期の6時間に増加した(図1a)。LPS10μgを投与した場合、BAL fluidで炎症の程度を示すIL−6の量は6時間目と24時間目の両方ともに増加した(図1b)。
【0042】
OVAと組み換えVEGF、又はOVAとLPSを鼻腔内投与した後でOVAを投与した実験群(OVA/VEGF及びOVA/LPS)と、PBS或いはVEGFのみを処理した後でOVAを投与した対照群(PBS及びVEGF)とを比較し、実験群(OVA/LPS及びOVA/VEGF)のBAL fluid内の炎症細胞数を図2に示し、肺組織から分離したT細胞におけるガンマインターフェロン(INF−γ)の量とIL−17の量をそれぞれ図3aと図3bに示した。
【0043】
組み換えVEGFを単独で投与したときは、炎症細胞の数が増加しなかったが、組み換えVEGFをOVAと共に投与したときは、(OVA/VEGF)炎症細胞の数が増加した(図2参照)。組み換えVEGFを単独で投与したときは、炎症の程度を示すINF−γの量とIL−17の量が増加しなかったが、組み換えVEGFをOVAとともに投与したときは、INF−γの量とIL−17の量が増加した(図3a及び図3b参照)。
【0044】
図4のプロトコルに従い、OVAとLPSで感作した後、OVAを投与して作った炎症モデルにおいて、14、15及び21日に麻酔の後にOVAを鼻腔内投与した後、図4に示した時間帯別にBAL fluid内の炎症細胞の数とIL−17の量を測定し、その結果を図5a及び図5bにそれぞれ示した。
【0045】
IL−17の量は最後のOVA投与4時間後から増加し(図5b参照)、炎症細胞の数は12時間後に増加した(図5a参照)。
【0046】
また、同じ実験条件でIL−17欠乏マウスを使用した場合、正常マウス(WT_OVA/LPS)と比較して、IL−17欠乏マウス(IL−17−/−_OVA/LPS)では、炎症細胞の数が一層少なく増加した(図6参照)。
【0047】
同じ実験条件でIL−6欠乏マウスを使用した場合、正常マウス(IL−16−/−_OVA/LPS)と比較して、IL−6欠乏マウス(IL−6−/−_OVA/LPS)では炎症細胞の数が一層少なく増加し(図7a)、IL−17の量が増加しなかった(図7b)。
【0048】
実施例1:VEGFR−1及びVEGFR−2を同時に抑制するSUS5416の効能評価
C57BL/6(雌、6週)マウスを実験群と対照群5匹ずつ使用して図8のプロトコルにしたがって喘息動物モデルを作った。実験群としては、有機溶媒のDMSO(dimethyl sulfoxide)に溶かしたVEGFR−1とVEGFR−2のチロシンキナーゼ作用を阻害する化合物(SU5416)1mg/kg及び10mg/kgをそれぞれ腹腔に注射し、30分後にOVAとLPSを鼻腔投与したマウス(0、1、2及び7日)を用い、対照群としては、有機溶媒DMSOのみを腹腔投与した後、OVAとLPSを鼻腔投与したマウスを用いた。14、15、21及び22日に麻酔の後にOVAを鼻腔投与し後、最後の投与24時間後(24日)にBAL fluidの炎症細胞の数を図9に示した。
【0049】
図9に示すように、初期感作時期にSU5416を使用して血管内皮細胞成長因子の全ての受容体を介した信号伝達を阻害したとき、SU5416の濃度に依存的に炎症細胞数の増加が抑制されることが分かる。
【0050】
図10は、感作の後、3回OVA投与6時間後(21日)に免疫反応を評価した結果を示す。感作の際にSU5416で治療したマウス(OVA/LPS_SU)は、BAL fluidでガンマインターフェロンとIL−17の分泌量が顕著に減少し(図10a参照)、局所リンパ節から分離した免疫細胞においても、アレルゲンで刺激したときに分泌されるガンマインターフェロンとIL−17が顕著に減少するものと示された(図10b及び図10c参照)。
【0051】
また、OVAとLPSで3回感作して6時間後にBAL fluidでIL−6の量を測定した結果を図11に示した。10mg/kgのSU5416を投与したマウス(OVA/LPS_SU)は、対照群(OVA/LPS_sham)に比べてIL−6の分泌量が減少するものと示された(図11参照)。
【0052】
実施例2:VEGFR−2を阻害するモノクローナル抗体の効能評価
C57BL/6(雌、6週)マウスを実験群と対照群各5匹ずつ使用して図12のプロトコルにしたがって喘息動物モデルを作った。
【0053】
具体的に、VEGF−2を阻害するモノクローナル抗体(anti−Flk−1、R&D Systems)0.1、1.0及び10μgをそれぞれ腹腔に注射したマウスを実験群として用い、PBSを腹腔内に注射したマウスを対照群として用いた。anti−Flk−1或いはPBSの注射後から30分が経過したときにOVAとLPSを鼻腔投与し、24時間後(1日)にBAL fluidの炎症細胞の数及びIL−6の量を測定した結果を図13に示した。
【0054】
Anti−Flk−1の濃度に依存的にBAL fluid内の炎症細胞数の増加が抑制された(図13a参照)。anti−Flk−1を10μg腹腔に注射した場合(OVA/LPS_anti−Flk−1)は、対照群(OVA/LPS_sham)と比較してBAL luid内のIL−6量の増加が抑制された(図13b参照)。
【0055】
また、図12の喘息モデルでanti−Flk−1を10μg腹腔投与したマウスを実験群として用い、偽薬(sham)を腹腔投与したマウスを対照群として用いた。0、1、2及び7日にanti−Flk−1又は偽薬を腹腔投与し、その30分後にOVAとLPSを鼻腔投与し、14、15、21及び22日にOVAを鼻腔内注射し、4回OVAを投与して48時間後に肺炎症と免疫反応を評価した結果を図14に示した。
【0056】
Anti−Flk−1で治療した場合(OVA/LPS_anti−Flk−1)は、偽薬を投与したマウス(OVA/LPS_sham)と比較して、BAL fluid内の炎症細胞の数が顕著に減少し(図14a参照)、局所リンパ節から分離したT細胞における、IL−17を分泌するCD4+及びCD8+細胞が顕著に減少した(図14b参照)。
【0057】
以上の結果をまとめると、非特異的VEGF受容体抑制剤としてのSU5416を投与したマウスと、VEGFR−2抑制剤としてのanti−Flk−1モノクローナル抗体を投与したマウスの両方ともにおいて肺炎症を抑制する効果が優れた。
【0058】
免疫学的な作用メカニズムによって、SU5416を投与した場合にはTh1とTh17免疫反応を減少させ、anti−Flk−1を投与した場合にはTh17免疫反応を減少させた。ところが、Th1は、細胞性免疫を担当するため、SU5416のようにTh1とTh17の免疫反応を全て減少させる薬剤を長期的に投与すると、細菌感染に脆弱となる副作用がある。Anti−Flk−1でVEGFR−2のみを阻害する場合、細菌感染を減らすTh1免疫反応は維持し、Th17免疫反応による慢性炎症反応のみを減らすことができるという利点がある。よって、非好酸球性或いは好中球性呼吸器炎症を治療する目的では、VEGFR−2のみを選択的に阻害する方がさらに好ましい。
【0059】
SU5416とanti−Flk−1を使用する実施例を示したが、VEGFR又はVEGFR−2に直接作用し、或いはキナーゼ阻害剤のようにVEGFR又はVEGFR−2経路を遮断する他の物質も本発明の目的に使用することができる。VEGFR−2を選択的に阻害する物質としては、モノクローナル抗体としてのanti−Flk−1以外にも、フィブロネクチン(fibronectin)ドメインに由来したCT−322などのタンパク質が知られている。VEGFR−2を阻害すると知られたKR−31831を使用することもできる。また、全てのVEGFRに作用するが、VEGFR−2に対する選択性に優れたバタラニブ(vatalanib)、PTK787又はPTK/ZKとして知られているキナーゼ阻害剤を使用することもできる。
【0060】
これに加えて、VEGFR−2を選択的に抑制するアプタマー(aptamer)、siRNA、miRNAなどを開発して使用することも予想することができる。
【0061】
注射で全身投与する実施例を示したが、VEGFR又はVEGFR−2阻害剤を経口投与してもよく、吸入、皮膚塗布などの方法で投与してもよい。
【0062】
前述した本発明の説明は例示のためのものに過ぎず、本発明の属する技術分野における通常の知識を有する者は、本発明の技術的思想又は必須的な特徴を変更することなく、他の具体的な形態に容易に変形可能であることを理解することができる。したがって、上述した実施例は全ての面で例示的なもので、限定的なものではないと理解すべきである。
【産業上の利用可能性】
【0063】
本発明に係る血管内皮細胞成長因子受容体(VEGFR)経路阻害物質を有効成分とする薬学的組成物を用いて、IL−6或いはIL−17を媒介とするTh17炎症性疾患を効果的に治療することができ、特にVEGFR−2経路の選択的な阻害物質を含有する組成物を用いて非好酸球性或いは好中球性炎症疾患を効果的に治療することができる。
【特許請求の範囲】
【請求項1】
血管内皮細胞成長因子受容体(vascular endothelial growth factor receptor、VEGFR)経路阻害物質を有効成分として含有する、IL(interleukin)−6或いはIL(interleukin)−17を媒介とするTh17(T helper type 17)炎症疾患の治療又は予防のための薬学的組成物。
【請求項2】
前記Th17炎症疾患が非好酸球性或いは好中球性喘息又は慢性閉塞性肺疾患である、請求項1に記載の薬学的組成物。
【請求項3】
前記Th17炎症疾患が、非好酸球性或いは好中球性炎症を特徴とする炎症性腸炎、アトピー性皮膚炎、リウマチ性疾患又は自己免疫疾患である、請求項1に記載の薬学的組成物。
【請求項4】
前記Th17炎症疾患が、IL−6或いはIL−17によって媒介される大腸癌、胃癌または肺癌である、請求項1に記載の薬学的組成物。
【請求項5】
前記血管内皮細胞成長因子受容体経路阻害物質がセマキサニブ(semaxanib、SU5416)である、請求項1に記載の薬学的組成物。
【請求項6】
前記血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)経路を選択的に阻害する物質である、請求項1に記載の薬学的組成物。
【請求項7】
前記血管内皮細胞成長因子受容体経路阻害物質がanti−Flk−1モノクローナル抗体である、請求項6に記載の薬学的組成物。
【請求項8】
血管内皮細胞成長因子受容体経路阻害物質がCT−322ペプチドである、請求項1に記載の薬学的組成物。
【請求項9】
血管内皮細胞成長因子受容体経路阻害物質がバタラニブ(vatalanib、PTK787)でる、請求項1に記載の薬学的組成物。
【請求項10】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制する水溶性VEGFR組み換えタンパク質である、請求項1に記載の薬学的組成物。
【請求項11】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制するアプタマー(aptamer)である、請求項1に記載の薬学的組成物。
【請求項12】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制するsiRNA或いはmiRNAである、請求項1に記載の薬学的組成物。
【請求項13】
血管内皮細胞成長因子受容体経路阻害物質(vascular endothelial growth factor receptor、VEGFR)を有効成分として含有する薬学的組成物を哺乳動物に投与する段階を含む、IL(interleukin)−6或いはIl(interleukin)−17を媒介とするTh17(T helper type 17)炎症疾患の治療又は予防方法。
【請求項14】
前記投与は全身投与、経口投与、及び呼吸器を介しての吸入投与よりなる群から選ばれる方法で行われる、請求項13に記載の方法。
【請求項15】
前記Th17炎症疾患が非好酸球性及び好中球性喘息又は慢性閉塞性肺疾患である、請求項13に記載の方法。
【請求項16】
前記Th17炎症疾患が、非好酸球性或いは好中球性炎症を特徴とする炎症性腸炎、アトピー性皮膚炎、リウマチ性疾患又は自己免疫疾患である、請求項13に記載の方法。
【請求項17】
前記Th17炎症疾患が、IL−6或いはIL−17によって媒介される大腸癌、胃癌又は肺癌である、請求項13に記載の方法。
【請求項18】
前記血管内皮細胞成長因子受容体経路阻害物質がセマキサニブ(semaxanib、SU5416)である、請求項13に記載の方法。
【請求項19】
前記血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)経路を選択的に阻害する物質である、請求項13に記載の方法。
【請求項20】
前記血管内皮細胞成長因子受容体経路阻害物質がanti−Flk−1モノクローナル抗体である、請求項19に記載の方法。
【請求項21】
血管内皮細胞成長因子受容体経路阻害物質がCT−322ペプチドである、請求項13に記載の方法。
【請求項22】
血管内皮細胞成長因子受容体経路阻害物質がバタラニブ(vatalanib、PTK787)である、請求項13に記載の方法。
【請求項23】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制する水溶性VEGFR組み換えタンパク質である、請求項13に記載の方法。
【請求項24】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制するアプタマーである、請求項13に記載の方法。
【請求項25】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制するsiRNA或いはmiRNAである、請求項13に記載の方法。
【請求項1】
血管内皮細胞成長因子受容体(vascular endothelial growth factor receptor、VEGFR)経路阻害物質を有効成分として含有する、IL(interleukin)−6或いはIL(interleukin)−17を媒介とするTh17(T helper type 17)炎症疾患の治療又は予防のための薬学的組成物。
【請求項2】
前記Th17炎症疾患が非好酸球性或いは好中球性喘息又は慢性閉塞性肺疾患である、請求項1に記載の薬学的組成物。
【請求項3】
前記Th17炎症疾患が、非好酸球性或いは好中球性炎症を特徴とする炎症性腸炎、アトピー性皮膚炎、リウマチ性疾患又は自己免疫疾患である、請求項1に記載の薬学的組成物。
【請求項4】
前記Th17炎症疾患が、IL−6或いはIL−17によって媒介される大腸癌、胃癌または肺癌である、請求項1に記載の薬学的組成物。
【請求項5】
前記血管内皮細胞成長因子受容体経路阻害物質がセマキサニブ(semaxanib、SU5416)である、請求項1に記載の薬学的組成物。
【請求項6】
前記血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)経路を選択的に阻害する物質である、請求項1に記載の薬学的組成物。
【請求項7】
前記血管内皮細胞成長因子受容体経路阻害物質がanti−Flk−1モノクローナル抗体である、請求項6に記載の薬学的組成物。
【請求項8】
血管内皮細胞成長因子受容体経路阻害物質がCT−322ペプチドである、請求項1に記載の薬学的組成物。
【請求項9】
血管内皮細胞成長因子受容体経路阻害物質がバタラニブ(vatalanib、PTK787)でる、請求項1に記載の薬学的組成物。
【請求項10】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制する水溶性VEGFR組み換えタンパク質である、請求項1に記載の薬学的組成物。
【請求項11】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制するアプタマー(aptamer)である、請求項1に記載の薬学的組成物。
【請求項12】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制するsiRNA或いはmiRNAである、請求項1に記載の薬学的組成物。
【請求項13】
血管内皮細胞成長因子受容体経路阻害物質(vascular endothelial growth factor receptor、VEGFR)を有効成分として含有する薬学的組成物を哺乳動物に投与する段階を含む、IL(interleukin)−6或いはIl(interleukin)−17を媒介とするTh17(T helper type 17)炎症疾患の治療又は予防方法。
【請求項14】
前記投与は全身投与、経口投与、及び呼吸器を介しての吸入投与よりなる群から選ばれる方法で行われる、請求項13に記載の方法。
【請求項15】
前記Th17炎症疾患が非好酸球性及び好中球性喘息又は慢性閉塞性肺疾患である、請求項13に記載の方法。
【請求項16】
前記Th17炎症疾患が、非好酸球性或いは好中球性炎症を特徴とする炎症性腸炎、アトピー性皮膚炎、リウマチ性疾患又は自己免疫疾患である、請求項13に記載の方法。
【請求項17】
前記Th17炎症疾患が、IL−6或いはIL−17によって媒介される大腸癌、胃癌又は肺癌である、請求項13に記載の方法。
【請求項18】
前記血管内皮細胞成長因子受容体経路阻害物質がセマキサニブ(semaxanib、SU5416)である、請求項13に記載の方法。
【請求項19】
前記血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)経路を選択的に阻害する物質である、請求項13に記載の方法。
【請求項20】
前記血管内皮細胞成長因子受容体経路阻害物質がanti−Flk−1モノクローナル抗体である、請求項19に記載の方法。
【請求項21】
血管内皮細胞成長因子受容体経路阻害物質がCT−322ペプチドである、請求項13に記載の方法。
【請求項22】
血管内皮細胞成長因子受容体経路阻害物質がバタラニブ(vatalanib、PTK787)である、請求項13に記載の方法。
【請求項23】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制する水溶性VEGFR組み換えタンパク質である、請求項13に記載の方法。
【請求項24】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制するアプタマーである、請求項13に記載の方法。
【請求項25】
血管内皮細胞成長因子受容体経路阻害物質が、血管内皮細胞成長因子受容体−2(VEGFR−2)を抑制するsiRNA或いはmiRNAである、請求項13に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公表番号】特表2013−503154(P2013−503154A)
【公表日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願番号】特願2012−526617(P2012−526617)
【出願日】平成22年5月20日(2010.5.20)
【国際出願番号】PCT/KR2010/003182
【国際公開番号】WO2011/025128
【国際公開日】平成23年3月3日(2011.3.3)
【出願人】(505282042)ポステック・アカデミー‐インダストリー・ファウンデーション (34)
【Fターム(参考)】
【公表日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願日】平成22年5月20日(2010.5.20)
【国際出願番号】PCT/KR2010/003182
【国際公開番号】WO2011/025128
【国際公開日】平成23年3月3日(2011.3.3)
【出願人】(505282042)ポステック・アカデミー‐インダストリー・ファウンデーション (34)
【Fターム(参考)】
[ Back to top ]

