血管壁モニタリング装置、制御プログラム、プログラムを記録したコンピュータ読み取り可能な記録媒体
【課題】 被験者の負担度を低減する。
【解決手段】 血管壁モニタリング装置100は、被験者の心電図を出力する心電計102と、上記被験者の血管におけるプレチスモグラムを出力する光電脈波計103と、上記血管における血圧値を検出するフィナプレス101と、上記心電図、プレチスモグラム、および血圧値に基づいて、上記被験者の血管壁を粘弾性モデルにモデル化した場合における粘性、剛性、慣性を出力する制御部120と、を含む。
【解決手段】 血管壁モニタリング装置100は、被験者の心電図を出力する心電計102と、上記被験者の血管におけるプレチスモグラムを出力する光電脈波計103と、上記血管における血圧値を検出するフィナプレス101と、上記心電図、プレチスモグラム、および血圧値に基づいて、上記被験者の血管壁を粘弾性モデルにモデル化した場合における粘性、剛性、慣性を出力する制御部120と、を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血管壁を粘弾性モデルにモデル化した場合における上記血管壁の粘性、剛性、慣性等の力学特性をモニタリングできる血管モニタリング装置に関するものである。
【背景技術】
【0002】
人体の血管における末梢循環は、該人体に対する刺激に応じて調整されるものである。これは、人体外部からの刺激に応じて自律神経の交感神経が反応し、この交感神経の反応によって血管が収縮、弛緩されることによるものである。
【0003】
したがって、人体の手術時において、上記末梢循環は影響を受けやすく、この末梢循環の状態変化を把握するために、血管の力学特性をモニタリングすることが重要となる。
【0004】
特に、多汗症患者に対して行われる胸部交換神経遮断術では、血管の力学特性のモニタリングが非常に重要となる。この理由を以下説明する。
【0005】
この胸部交換神経遮断術では、交感神経をクリップで遮断することで発汗を抑制するものであるが、手術中に交感神経が適切に遮断されているか否かを判断することは困難であり、手術後における患者の発汗の有無を経過観察することによって、交感神経が適切に遮断されているか否かの判断が行われている。したがって、この遮断が適切に行われていないと判断された場合、再手術を行う必要があり、患者に負担を与えていた。
【0006】
一方、交感神経が適切に遮断されると、血管が弛緩することが従来から知られている。したがって、手術中に患者の血管の力学特性をモニタリングできれば、交感神経が適切に遮断されたか否かを手術中に確認でき、上述した手術後の経過観察や再手術が不要になる。このような理由により、胸部交換神経遮断術では、血管壁の力学特性をモニタリングし、該血管壁の状態の把握を行う必然性が高い。
【非特許文献1】坂根 彰等:動脈壁インピーダンスのセンシング,第4回計測自動制御学会システムインテグレーション部門講演会論文集,1G4-4,pp.237-238,2003.
【発明の開示】
【発明が解決しようとする課題】
【0007】
そこで、上記した非特許文献1によれば、血管壁を粘弾性モデルにモデル化し、血管壁の慣性、粘性、剛性といった要素を出力する計測装置が提案されている。この装置によれば、患者の心電図、血圧値、血管を流れる血液のプレチスモグラムに基づいて、上述した血管壁の慣性、粘性、剛性の力学特性を出力できる。よって、手術中の患者に対して、この手法を用いれば、患者の血管の慣性、粘性、剛性等の力学特性をモニタリングでき、患者の血管壁の状態を把握できる。
【0008】
しかしながら、非特許文献1に開示されている装置によれば、カテーテルを血管壁まで挿入し、このカテーテルから血液を採取することによって、上記挿入箇所の血圧値を計測している。それゆえ、患者の血管の慣性、粘性、剛性等の力学特性をモニタリングするには、カテーテルを患者の血管まで挿入しなければならず、手術による出血以外の余計な出血を伴い、手術中の患者にとって余計な負担が生じることとなる。
【0009】
本発明は、患者の負担を抑制する血管モニタリング装置、制御プログラム、プログラムを記録したコンピュータ読み取り可能な記録媒体を提供することを目的とする。
【課題を解決するための手段】
【0010】
以上の目的を達成するために、本発明の血管壁モニタリング装置は、被験者の心電図を出力する心電図出力手段と、上記被験者の血管におけるプレチスモグラムを出力するプレチスモグラム出力手段と、上記血管における血圧値を検出する血圧値出力手段と、上記心電図、プレチスモグラム、および血圧値に基づいて、上記被験者の血管壁を粘弾性モデルにモデル化した場合における粘性、剛性、慣性の力学特性値のうちの少なくとも1以上の特性値を出力する制御手段と、を含む血管壁モニタリング装置であって、上記血圧値出力手段は間接的動脈圧測定器であることを特徴とする。
【0011】
血管壁モニタリング装置において、被験者の血管壁を粘弾性モデルにモデル化した場合における粘性、剛性、慣性の力学特性値のうちの少なくとも1以上の特性値を出力する場合、その被験者の心電図、プレチスモグラム、血圧値の計測が最低限必要となる。ここで、従来構成の血管壁モニタリング装置によれば、カテーテルを被験者の血管まで挿入することによって当該被験者の血圧を検出していたため、被験者は出血を伴っていた。
【0012】
これに対し、本発明の構成によれば、被験者の血圧値を検出する手段として、非観血で血圧を検出できる間接的動脈圧測定器を用いている。したがって、血管まで挿入するカテーテルによって被験者の血圧を検出していた従来構成と比べ、被験者に対しての負担度を大幅に低減することができるという効果を奏する。
【0013】
本発明の血管壁モニタリング装置は、上記構成に加えて、上記制御手段は、上記心電図におけるR波の出現タイミングをt0とし、この出現タイミングから次のR波の出現タイミングまでの時間をtとし、上記血圧値をPb(t)とした場合、dPb(t)=Pb(t)−Pb(t0)を出力する第一関数設定手段と、上記プレチスモグラムをPl(t)とした場合、Pl(t)の一階微分であるPl(t)´と、Pl(t)の二階微分であるPl(t)´´とを算出する微分演算手段と、dPl(t)=Pl(t)−Pl(t0)、dPl(t)´=Pl(t)´−Pl(t0)´、dPl(t)´´=Pl(t)´´−Pl(t0)´´を出力する第二関数設定手段と、上記dPb(t)、dPl(t)、dPl(t)´、dPl(t)´´を標本として、dPb(t)=M´・dPl(t)´´+B´・dPl(t)´+K´dPl(t)(なお、M´は上記慣性、B´は上記粘性、K´は上記剛性)に対して回帰計算を行い、M´、B´、K´を出力する演算手段と、を含むことを特徴とする。
【0014】
上記被験者の血管壁を粘弾性モデルにモデル化した場合、dPb(t)=M´・dPl(t)´´+B´・dPl(t)´+K´dPl(t)が成立することが知られている。したがって、上記dPb(t)およびdPl(t)を標本として回帰計算を行えば、上記慣性、上記粘性、上記剛性を算出することが可能となる。
【0015】
本発明の血管壁モニタリング装置は、上記構成に加えて、上記制御手段は、上記dPb(t)における変曲点の出現タイミングと、上記dPl(t)における変曲点の出現タイミングとの時間差nを出力し、上記dPb(t)を上記dPb(t−n)に補正する補正手段を含むことを特徴とする。
【0016】
従来構成によれば、血管までカテーテルを直接挿入することによって該血管の血圧値を検出しているが、本発明の血管壁モニタリング装置によれば、血管に直接接触しない間接的動脈圧測定器によって血圧を検出しているため、血管における血圧が間接的動脈圧測定器まで伝達される時間だけ、検出される血圧値が遅延したものとなり、最終的に出力される慣性、粘性、剛性に悪影響を及ぼす可能性が生じる。
【0017】
その一方、dPb(t)は血圧値に基づくものであり、dPl(t)はプレチスモグラムに基づくものである。したがって、両者の示す波形は、脈拍の挙動を示した波形と同様の挙動を示すため、波形の変曲点出現タイミングは本来、略一致するものと考えられる。
【0018】
そこで、上記構成によれば、上記dPb(t)における変曲点の出現タイミングと、上記dPl(t)における変曲点の出現タイミングとの時間差nを出力し、上記dPb(t)を上記dPb(t−n)に補正している。これにより、検出される血圧値が遅延することによってdPb(t)の示す波形の挙動が、本来のものから遅延したものであっても、dPb(t)のタイミングとdPl(t)のタイミングとを相対的に一致させることにより、上記遅延を補正することができる。これにより、出力される慣性、粘性、剛性に悪影響を及ぼす可能性を抑制することができる。
【0019】
なお、上記血管壁モニタリング装置は、コンピュータによって実現してもよく、この場合には、コンピュータを上記制御手段として動作させる制御プログラムによって実現できる。また、上記の制御プログラムを記録したコンピュータ読み取り可能な記録媒体も、本発明の範疇に入る。
【発明の効果】
【0020】
以上のように、本発明の血管壁モニタリング装置は、被験者の心電図を出力する心電図出力手段と、上記被験者の血管におけるプレチスモグラムを出力するプレチスモグラム出力手段と、上記血管における血圧値を検出する血圧値出力手段と、上記心電図、プレチスモグラム、および血圧値に基づいて、上記被験者の血管壁を粘弾性モデルにモデル化した場合における粘性、剛性、慣性の力学特性値のうちの少なくとも1以上の特性値を出力する制御手段と、を含む血管壁モニタリング装置であって、上記血圧値出力手段は間接的動脈圧測定器であることを特徴とする。
【0021】
それゆえ、血管まで挿入するカテーテルによって被験者の血圧を検出していた従来構成と比べ、被験者に対しての負担度を大幅に低減することができるという効果を奏する。
【発明を実施するための最良の形態】
【0022】
本発明の実施の一形態を図に基づいて以下説明する。本実施形態の血管壁モニタリング装置は、以下で説明するように、被験者の心電図、血圧値、プレチスモグラムに基づいて、動脈血管壁(以下、単に「血管壁」とする)を粘弾性モデルにモデル化した場合における該血管壁の粘性、剛性(弾性)、慣性の力学特性値を出力するものである。以下では、説明の便宜のために、まず、上記モデル化、プレチスモグラム、上記力学特性値の算出方法について順に説明し、その後、血管壁モニタリング装置の構成について説明する。
【0023】
(血管壁のモデル化)
人体の血管壁10は、図2に示すように、内膜11、中膜12、外膜13の3層から構成され、各々の層には固有の構成因子が含まれる。
【0024】
外膜13には、結合組織、エラスチン、コラーゲンといった動脈スティフネスやコンプライアンスに影響を及ぼす因子が含まれていると共に、大動脈の血管壁に栄養素を供給する脈管血管が含まれる。
【0025】
内膜11には、一酸化炭素やEDHF(endothelium-derived hyperpolarizing factor)などの内皮由来血管作動性物質を産出する脈管内皮が存在する。
【0026】
中膜12には、エラスチン、コラーゲン等の平滑筋が含まれる。ここで、平滑筋は、交感神経やホルモンによって刺激されると収縮し、血流量を下げる機能を担う。
【0027】
したがって、血管壁10は、中膜12に含まれている平滑筋の作用によって収縮または弛緩する。そこで、本実施形態では、血管壁10の収縮または弛緩の程度を数値化する手段として、血管壁10を粘弾性モデルにモデル化する。
【0028】
図3において、血管壁10の粘弾性モデルを示す。図3に示す粘弾性モデルにおけるM(慣性),B(粘性),K(剛性)の各力学特性値は、〔数1〕の関係を示す。
【0029】
【数1】

【0030】
なお、〔数1〕において、r(t)´はr(t)の一階微分を示し、r(t)´´はr(t)の二階微分を示す。
【0031】
ここで、血管壁10の変位開始時刻をt0とすると、時刻tにおける上記各力学特性値は、〔数2〕の関係を示す。
【0032】
【数2】

【0033】
ここで、〔数2〕に基づいて、M,B,Kを推定するためには、F(t),r(t)を算出する必要がある。
【0034】
F(t)は、血管壁10に作用する血圧と比例関係にあるため、血圧値に基づいてF(t)を算出する。具体的には、以下の〔数3〕に基づいてF(t)を算出する。
【0035】
【数3】

【0036】
一方、血管半径であるr(t)は、直接測定することが困難であるため、血管内の血液のプレチスモグラムに基づいてr(t)を定めることとする。なお、プレチスモグラムに基づいてr(t)を定める原理については、以下詳細に説明する。
【0037】
(プレチスモグラム)
脈波には、血管内の血液圧変動を記録した圧脈波と、血液の容積変化を記録した容積脈波とがあるが、本明細書におけるプレチスモグラムとは上記容積脈波に該当するものである。
【0038】
以下、血管のプレチスモグラムの検出方法について説明する。この検出には、図5に示すような、LED(light emitting diode)とフォトダイオードとから構成される光電脈波計103が用いられる。
【0039】
LEDから出射する光を人体の指にあてた場合、この光は指および指内部の血管を透過して、フォトダイオードに到達するが、この場合、Lambert-Beerの法則により、以下に示す〔数4〕が成立する。
【0040】
【数4】

【0041】
なお、〔数4〕において、Dは血管の直径、ADは直径Dの血管に対する減光度、Cは吸光物質(血管および血液)の濃度、IOは入射光強度、IDは透過光強度、Eは吸光物質の吸光係数である。
【0042】
ここで、血管の直径がDからD+ΔD(t)に変化することによって、減光度がA(t)になって、透過光強度がID−ΔI(t)になったとすると、血管の減光度の変動分ΔA(t)は、以下に示す〔数5〕のようになる。
【0043】
【数5】

【0044】
そして、この減光度の変動分ΔA(t)を計測したものが、上述したプレチスモグラムに該当する。但し、〔数5〕においては、Cは血液の濃度に依存する等、個々の測定条件に依存する不確定要素が含まれているため、〔数5〕によってΔA(t)を直接計算により求めることはできない。
【0045】
そこで、本実施形態では、〔数5〕に対する近似式を設定し、この近似式によってΔA(t)を求めることとする。以下では、この近似式の設定方法について説明する。
【0046】
上述したように、LEDから出射する光を直径Dの血管にあてた場合、血管の透過光強度は、図4の参照符aのグラフに示すように、周期的に変動する。ここで、図4に示すIsは、心臓の収縮期(Systolic)における血管の透過光強度であり、Idは、心臓の拡張期(Diastolic)における血管の透過光強度である。
【0047】
ここで、透過光強度IDを示す状態から心臓収縮期へ移行した血管の透過光強度変動分をΔIs(t)=ID−IS(t)、透過光強度IDを示す状態からから心臓収縮期への移行した血管の減光度の変動分をΔAs(t)とし、透過光強度IDを示す状態から心臓拡張期へ移行した血管の透過光強度変動分をΔId(t)=Id(t)−ID、透過光強度IDを示す状態から心臓拡張期へ移行した血管の減光度の変動分をΔAd(t)とすると、以下に示す〔数6〕〔数7〕が成立する。
【0048】
【数6】

【0049】
【数7】

【0050】
ここで、心臓収縮期においてはΔId(t)=0、心臓拡張期においてはΔIs(t)=0であるため、減光度の変動分ΔA(t)は以下の〔数8〕で表すことができる。
【0051】
【数8】

【0052】
また、透過光強度の変動分はΔI(t)=ΔIs(t)+ΔId(t)であることから、〔数8〕においては、ΔI(t)/IDを十分小と判断できる。したがって、〔数8〕において、2次以降の項を無視することができ、血管の減光度の変動分ΔA(t)およびプレチモグラムPl(t)は、〔数9〕のように近似することができる。
【0053】
【数9】

【0054】
さらに、ΔA(t)は、収縮または弛緩による血管壁の変位に比例すると考えられるため、以下に示す〔数10〕が成立する。
【0055】
【数10】

【0056】
なお、kpは比例定数、rv(t)を計測部位における血管壁の半径である。そして、〔数9〕および〔数10〕から、以下の〔数11〕を得ることができる。
【0057】
【数11】

【0058】
以下では、上述したPb(t)およびPl(t)に基づいて、血管を粘弾性モデルにモデル化した場合のM(慣性),B(粘性),K(剛性)の各力学特性値の算出方法について説明する。
【0059】
(力学特性値の算出方法)
〔数2〕のr(t)に対して、〔数11〕のrv(t)を代入すると共に、〔数3〕を用いて式を整理すると、
【0060】
【数12】

【0061】
が得られる。
【0062】
よって、被験者の血圧およびプレチスモグラムを計測し、計測した血圧をPb(t)、計測したプレチスモグラムをPl(t)とする。そして、このPb(t)およびPl(t)を標本として、〔数12〕を用いて回帰計算すれば、M´(慣性),B´(粘性),K´(剛性)の各力学特性値を推定することが可能となる。
【0063】
(血管壁モニタリング装置の構成)
つぎに、被験者の血管壁の状態をモニタリングできる血管壁モニタリング装置100の構成について説明する。この血管壁モニタリング装置100は、被験者の血管壁を粘弾性モデルにモデル化した場合における該血管壁のM´(慣性),B´(粘性),K´(剛性)を出力する。これにより、オペレータは、被験者の血管壁の状態(収縮または弛緩度合)をモニタリングすることが可能となる
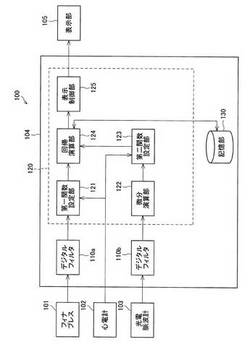
図1に示すように、血管壁モニタリング装置100は、血圧測定手段としてのフィナプレス(商品名)101、心電計(心電図出力手段)102、光電脈波計(プレチスモグラム出力手段)103、コンピュータ104、表示部105を備えている。
【0064】
フィナプレス(血圧値出力手段)101は、図6に示すように、カフを被験者のいずれかの指に装着し、この指における血管の血圧データを一脈毎に検出し、この血圧データをコンピュータ104へ入力する間接的動脈圧測定器であり、例えば、Ohmeda社のフィナプレスが用いられる。なお、ここで、フィナプレス101から出力される血液データ(信号)を上述したPb(t)とする。
【0065】
心電計102は、被験者の心電図データを検出し、この心電図データをコンピュータ104へ入力するデバイスである。
【0066】
光電脈波計103は、図5に示すように、LEDとフォトダイオードとから構成され、被験者の指の血管におけるプレチスモグラムを検出するデバイスである。具体的には、被験者のいずれかの指を介して上記LEDと上記フォトダイオードとを対向配置させ、この指へ向けてLEDから光を放出させると共に、指を透過した光を上記フォトダイオードが受光する。そして、LEDの発光量と、フォトダイオードの受光量とから、血管を透過する光の透過率を検出し、検出結果から被験者のプレチスモグラムデータを求める。さらに、光電脈波計103は、検出したプレチスモグラムデータをコンピュータ104へ入力する。なお、ここで、光電脈波計103から出力されるプレチスモグラムデータ(信号)を上述したPl(t)とする。
【0067】
なお、フィナプレス101のカフを装着する指と、光電脈波計103のLEDおよびフォトダイオードを対向させる指とは、同じ腕であって互いに異なる指であることが好ましい。具体的に、本実施形態の血管壁モニタリング装置100を試験運用した際には、被験者の左手中指にフィナプレス101のカフを装着すると共に、被験者の左手拇指を介して光電脈波計103のLEDおよびフォトダイオードを対向させた。
【0068】
コンピュータ104は、フィナプレス101、心電計102、光電脈波計103から入力されるデータを処理し、処理結果を表示部105に出力するものである。なお、コンピュータ104の構成の詳細については後に詳述する。
【0069】
表示部105は、コンピュータ104によって処理された情報を画像として表示するためのデバイスであり、液晶ディスプレィが用いられる。但し、液晶ディスプレィに限られるものではなく、例えば、プラズマディスプレィ、CRT(cathode ray tube)、有機EL(Electro Luminescence)ディスプレィ、無機ELディスプレィであってもよい。
【0070】
次に、コンピュータ104の構成について説明する。コンピュータ104は、デジタルフィルタ110a・110b、制御部120、記憶部130から構成される。また、制御部120は、第一関数設定部121、微分演算部122、第二関数設定部123、回帰演算部124、表示制御部125から構成される。
【0071】
デジタルフィルタ110aは、フィナプレス101からPb(t)を入力し、入力したPb(t)の周波数特性を調整することによってPb(t)からノイズ成分を除去し、ノイズ成分を除去したPb(t)を制御部120へ入力する回路である。また、デジタルフィルタ110bは、光電脈波計103からPl(t)を入力し、入力したPl(t)の周波数特性を調整することによってPl(t)からノイズ成分を除去し、ノイズ成分を除去したPl(t)を制御部120へ入力する回路である。
【0072】
なお、これらデジタルフィルタとしては、LPF(low pass filter)またはHPF(high pass filter)を用いることができる。
【0073】
制御部(制御手段)120は、血管壁モニタリング装置100における各種構成の動作を統括的に制御するものであると共に、各種データ処理を行う制御装置である。この制御部120は、CPU(Central Processing Unit,中央演算処理装置),RAM(Random Access Memory,随時書込・読出メモリ)等によって構成される。そして、各種構成の動作制御は、制御プログラムをCPUに実行させることによって行われる。この制御プログラムは、例えばCD−ROM(Compact Disc Read Only Memory)などのリムーバブルメディアに記録されているものを読み出してRAMに書き込み、CPUがRAMにアクセスして使用する形態であってもよいし、記憶部130などにインストールされたものを読み出してRAMに展開し、CPUがRAMにアクセスして使用する形態であってもよい。また、制御部120がインターネットなどの通信ネットワークに接続された構成とする場合、この通信ネットワークを介して上記制御プログラムをダウンロードして記憶部130にインストールして実行する形態なども考えられる。なお、制御部120の構成の詳細については後述する。
【0074】
記憶部130は、ハードディスクまたはフラッシュメモリなどの不揮発性の記憶装置によって構成されるものである。この記憶部130に記憶される内容としては、上記した制御プログラム、OS(Operating System)プログラム、およびその他各種プログラムなどが挙げられるが、本実施形態では、上述した〔数12〕における(a)式を回帰計算式として格納している。
【0075】
つぎに、制御部120の構成の詳細について説明する。
【0076】
第一関数設定部(第一関数設定手段)121は、心電計102から心電図データを入力すると共に、デジタルフィルタ110aからPb(t)を入力する。そして、第一関数設定部121は、上記心電図データのR波の出現タイミングをt0(t0=0)として、dPb(t)=Pb(t)−Pb(t0)とした関数を設定し、この関数を回帰演算部124へ入力する。
【0077】
つまり、第一関数設定部121は、上記心電図データにおいてR波が出現するタイミングから次にR波が出現するタイミングまでの期間を1周期として、周期毎に、dPb(t)を抽出している。したがって、第一関数設定部121は、抽出した周期毎のdPb(t)を回帰演算部124へ入力することとなる。なお、図8(d)において、1周期分のdPb(t)の例を示す。
【0078】
微分演算部(微分演算手段)122は、デジタルフィルタ110bからPl(t)を入力する。そして、微分演算部122は、Pl(t)の一階微分であるPl(t)´と、Pl(t)の二階微分であるPl(t)´´とを算出し、Pl(t)、Pl(t)´、Pl(t)´´を第二関数設定部123へ入力する。
【0079】
第二関数設定部(第二関数設定手段)123は、心電計102から心電図データを入力すると共に、微分演算部122からPl(t)、Pl(t)´、Pl(t)´´を入力する。そして、第二関数設定部123は、上記心電図データのR波の出現タイミングをt0(t=0)として、dPl(t)=Pl(t)−Pl(t0),dPl(t)´=Pl(t)´−Pl(t0)´,dPl(t)´´=Pl(t)´´−Pl(t0)´´とした関数を設定し、これらdPl(t),dPl(t)´およびdPl(t)´´を回帰演算部124へ入力する。
【0080】
つまり、第二関数設定部123は、上記心電図データにおいてR波が出現するタイミングから次にR波が出現するタイミングまでの期間を1周期として、周期毎に、dPl(t)、dPl(t)´、dPl(t)´´を抽出している。したがって、第二関数設定部123は、抽出した周期毎のdPl(t)、dPl(t)´、dPl(t)´´を回帰演算部124へ入力することとなる。なお、図8(a)において、1周期分のdPl(t)の例を示し、図8(b)において、1周期分のdPl(t)´の例を示し、図8(c)において、1周期分のdPl(t)´´の例を示す。
【0081】
回帰演算部(演算手段)124は、記憶部130に格納されている回帰計算式(〔数12〕における(a)式)を読み出し、入力したdPb(t)、dPl(t)、dPl(t)´、dPl(t)´´を標本として、読み出した回帰計算式に基づいて回帰計算を行い、この回帰計算式におけるM´、B´、K´を算出する。
【0082】
また、回帰演算部124は、全周期におけるM´、B´、K´の算出を行い、全測定時間に対するM´、B´、K´の変動度を示したグラフを作成する。
【0083】
表示制御部125は、回帰演算部124が作成したグラフを入力すると共に、このグラフを表示部105に表示する制御を行うブロックである。なお、図7(b)において、M´、B´、K´の変動度を示したグラフの例を示す。
【0084】
以上の構成によれば、被験者の心電図、該被験者のいずれかの指における血管の血圧データ、プレチスモグラムから、該被験者の血管を粘弾性モデルにモデル化した場合のM(慣性),B(粘性),K(剛性)をリアルタイムで表示部105に表示させることができる。
【0085】
したがって、例えば、胸部交換神経遮断術において、本実施形態の血管壁モニタリング装置100を用いて患者の血管の慣性、粘性、剛性等の力学特性をモニタリングすれば、患者の血管壁の状態を手術中に把握でき、交換神経が適切に遮断されているか否かを手術中に把握することが可能となる。
【0086】
また、本実施形態の血管壁モニタリング装置100によれば、被験者の血圧値を検出する手段として、非観血で血圧を検出できるフィナプレス101を用いている。したがって、血管までチューブを挿入するカテーテルによって被験者の血圧を検出していた非特許文献1の構成と比べ、被験者に対しての負担度を大幅に低減することができる。
【0087】
さらに、胸部交換神経遮断術を施している患者に対して、非特許文献1の計測装置および血管壁モニタリング装置100を用いて、当該患者の血管のM(慣性),B(粘性),K(剛性)を出力した結果を図7に示す。図7(a)は、非特許文献1の計測装置によって出力したデータを示し、図7(b)は、血管壁モニタリング装置100によって出力したデータを示す。
【0088】
なお、図7(a)および図7(b)において、患者は同一であるものとし、計測時刻も同一である。また、非特許文献1の構成および血管壁モニタリング装置100においては、患者の左手母指に光電脈波計を近接させることによって、当該中指の血管におけるプレチスモグラムを検出した。但し、非特許文献1の構成においては、患者の左撓骨動脈にカテーテルを挿入して血圧を測定し、血管壁モニタリング装置100においては、患者の左手中指にフィナプレスのカフを装着することによって血圧を測定した。
【0089】
図7(a)および図7(b)において、参照符Aで示される時刻は、患者の交換神経をクリップで遮断した時点を示している。
【0090】
図7(a)および図7(b)共に、参照符Aで示される時刻より前の時間帯では、B(粘性),K(剛性)が増加傾向にある。これは、医師の手術が行われている状況では、患者に対して刺激が与えられているため、血管が収縮して硬くなっていると考えられるからである。
【0091】
また、図7(a)および図7(b)共に、参照符Aで示される時刻より後の時間帯では、B(粘性),K(剛性)が減少傾向にある。これは、交換神経がクリップによって適切に遮断されると、血管が弛緩すると考えられるからである。
【0092】
このように、本実施形態の血管壁モニタリング装置100によれば、従来の計測装置と比べ(非特許文献1の計測装置)、M(慣性)、B(粘性),K(剛性)の大小において若干の相違があるものの、各値の増加および減少のタイミングは一致しているため、本実施形態の血管壁モニタリング装置100によっても、血管壁の状態を推測することが十分に可能であると言える。
【0093】
なお、従来の計測装置では血管までカテーテルを直接挿入することによって該血管の血圧値を検出しているが、本実施形態の血管壁モニタリング装置100によれば、フィナプレス101によって血圧を検出しているため、血管における血圧がカフまで伝達される時間だけ、検出される血圧値が遅延したものとなる。これにより、出力されるM(慣性)、B(粘性),K(剛性)に悪影響を及ぼす可能性もある。
【0094】
そこで、以下では、上述した遅延を補正できる血管壁モニタリング装置100について、図9に基づいて説明する。
【0095】
図9に示す血管壁モニタリング装置100は、図1に示す血管壁モニタリング装置100と比べて、時間差補正部150が備えられている点、記憶部130において以下の〔数13〕に示される回帰計算式が格納されている点が相違するが、その他の構成については同様である。
【0096】
【数13】

【0097】
時間差補正部(補正手段)150は、第一関数設定部121から、ある周期におけるdPb(t)を入力すると共に、第二関数設定部123から当該周期におけるdPl(t)を入力する。
【0098】
そして、時間差補正部150は、dPb(t)の波形における立ち上がりから最大点に到達するまでの間に存在する変曲点のタイミングを示すt値をt1として検出する。また、時間差補正部150は、dPl(t)の波形における立ち上がりから最大点に到達するまでの間に存在する変曲点のタイミングを示すt値をt2として検出する。
【0099】
さらに、時間差補正部150は、t1−t2=nを演算し、記憶部130から〔数13〕に示される回帰計算式を読み出し、この回帰計算式にnを代入する。そして、時間差補正部150は、この回帰計算式を回帰演算部124へ入力する。
【0100】
そして、回帰演算部124は、時間差補正部150から入力した回帰計算式によって上述の回帰計算を行う。
【0101】
以上の構成において、dPb(t)は血圧値に基づくものであり、dPl(t)はプレチスモグラムに基づくものである。したがって、両者の示す波形は、脈拍の挙動を示した波形と同様の挙動を示すため、波形の立ち上がりタイミング、最大点到達タイミング、変曲点出現タイミングは、本来、略一致するものと考えられる。
【0102】
そこで、図9の構成によれば、上述した時間差補正部150において、t1−t2=nを演算し、〔数13〕に示される回帰計算式にnを代入している。これにより、回帰演算部124によって実行される回帰計算において、dPb(t)の各値はdPb(t−n)に補正されることとなり、dPb(t)のタイミングとdPl(t)のタイミングとを相対的に一致させることができる。
【0103】
つまり、検出される血圧値が遅延することによってdPb(t)の示す波形の挙動が、本来のものから遅延したものであっても、dPb(t)のタイミングとdPl(t)のタイミングとを相対的に一致させることができ、上記遅延を補正することができる。これにより、出力されるM(慣性)、B(粘性),K(剛性)に悪影響を及ぼす可能性を抑制することができる。
【0104】
なお、本実施形態における血管壁は動脈血管壁であるが、本実施形態の血管壁モニタリング装置は動脈血管壁における力学特性を計測するものに限定されるものではなく、静脈血管壁における力学特性を計測することも可能である。
【0105】
また、本実施形態において、粘弾性モデルとして、図3に示すように骨格筋インピーダンス推定モデルを用いているが、これに限定されるものではなく、フォークトモデル、マックスウェルモデル、ケルビンモデルなどであってもよい。また、粘弾性モデルであればよく、様々な変形も可能である。
【0106】
さらに、本実施形態の血管壁モニタリング装置100は、手術現場における患者の血管壁のモニタリングに好適であるが、用途としては手術現場のみに限られるものではなく、例えば、トレーニング機器、マッサージ機器等の健康用機器に適用することも可能である。
【0107】
なお、上述した実施形態では、血圧値出力手段としてフィナプレスを用いているが、間接的動脈圧測定器であればよく、フィナプレスに限定されるものではない。
【0108】
なお、以上の実施の形態で説明した血管壁モニタリング装置は、コンピュータに制御プログラムを読み込ませることによって実現させてもよく、このプログラムをコンピュータ読み取り可能な記録媒体に、記録するものとすることもできる。この結果、上記制御プログラムを記録した記録媒体を持ち運び自在に提供することができる。
【0109】
なお、この記録媒体としては、マイクロコンピュータで処理が行われるために図示していないメモリ、例えばROM(Read only memory)のようなものそのものがプログラムメディアであっても良いし、また、図示していないが外部記憶装置としてプログラム読み取り装置が設けられ、そこに記録媒体を挿入することで読み取り可能なプログラムメディアであっても良い。
【0110】
いずれの場合においても、格納されているプログラムはマイクロプロセッサがアクセスして実行させる構成であっても良いし、あるいは、いずれの場合もプログラムを読み出し、読み出されたプログラムは、マイクロコンピュータの図示されていないプログラム記憶エリアにダウンロードされて、そのプログラムが実行される方式であってもよい。このダウンロード用のプログラムは予め本体装置に格納されているものとする。
【0111】
ここで、上記プログラムメディアは、本体と分離可能に構成される記録媒体であり、磁気テープやカセットテープ等のテープ系、フロッピー(登録商標)ディスクやハードディスク等の磁気ディスクやCD−ROM/MO/MD/DVD等の光ディスクのディスク系、ICカード(メモリカードを含む)/光カード等のカード系、あるいはマスクROM、EPROM(Erasable Programmable Read Only Memory)、EEPROM(Electrically Erasable Programmable Read Only Memory)、フラッシュROM等による半導体メモリを含めた固定的にプログラムを担持する媒体であっても良い。
【0112】
また、本実施の形態においては、コンピュータ104を、インターネットを含む通信ネットワークと接続可能な構成とし、通信ネットワークからプログラムをダウンロードするように流動的にプログラムを担持する媒体であっても良い。なお、このように通信ネットワークからプログラムをダウンロードする場合には、そのダウンロード用のプログラムは予め本体装置に格納しておくか、あるいは別な記録媒体からインストールされるものであっても良い。上記記録媒体は、コンピュータ104に備えられるプログラム読み取り装置により読み取られることで上述した処理が実行される。
【0113】
本発明は上述した各実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、上述した実施形態において開示された各技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【産業上の利用可能性】
【0114】
本発明の血管壁モニタリング装置は、手術時の患者の血管壁のモニタリングに好適であるが、これに限定されず、トレーニング機器、マッサージ機器等の健康用機器に備えることも可能である。また、本発明の血管壁モニタリング装置における被験者は人間に限定されるものではなく、動物が被験者であってもよい。
【図面の簡単な説明】
【0115】
【図1】本発明の一実施形態に係る血管壁モニタリング装置の構成を示すブロック図である。
【図2】人体の血管の構造を示した模式図である。
【図3】図2に示す血管を粘弾性モデルにモデル化した模式図である。
【図4】血管の透過光強度、減光度、減光度の変動分を示したグラフである。
【図5】図1に示す光電脈波計の構成を示す模式図である。
【図6】図1に示すフィナプレスの外観構成の画像を示す図である。
【図7】被験者の血管の慣性、粘性、剛性を示したグラフであって、(a)は、従来構成の継続装置によって得られたグラフであり、(b)は、本発明の一実施形態に係る血管壁モニタリング装置によって得られたグラフである。
【図8】本発明の一実施形態に係る血管壁モニタリング装置によって得られたグラフであり、(a)は時間とプレチスモグラムとの関数を示したグラフであり、(b)は、プレチスモグラムPl(t)を一階微分し、初期時刻における一階微分値を差し引くことによって得られる関数のグラフであり、(c)は、プレチスモグラムPl(t)を二階微分し、初期時刻における二階微分値を差し引くことによって得られる関数のグラフであり、(d)は、時間と血圧値との関数を示したグラフである。
【図9】本発明の他の実施形態に係る血管壁モニタリング装置の構成を示すブロック図である。
【符号の説明】
【0116】
10 血管壁
11 内膜
12 中膜
13 外膜
100 血管壁モニタリング装置
101 フィナプレス(血圧値出力手段、間接的動脈圧測定器)
102 心電計(心電図出力手段)
103 光電脈波計(プレチスモグラム検出手段)
104 コンピュータ
105 表示部
110a・110b デジタルフィルタ
120 制御部(制御手段)
121 第一関数設定部(第一関数設定手段)
122 微分演算部(微分演算手段)
123 第二関数設定部(第二関数設定手段)
124 回帰演算部(演算手段)
125 表示制御部
130 記憶部
150 時間差補正部(補正手段)
【技術分野】
【0001】
本発明は、血管壁を粘弾性モデルにモデル化した場合における上記血管壁の粘性、剛性、慣性等の力学特性をモニタリングできる血管モニタリング装置に関するものである。
【背景技術】
【0002】
人体の血管における末梢循環は、該人体に対する刺激に応じて調整されるものである。これは、人体外部からの刺激に応じて自律神経の交感神経が反応し、この交感神経の反応によって血管が収縮、弛緩されることによるものである。
【0003】
したがって、人体の手術時において、上記末梢循環は影響を受けやすく、この末梢循環の状態変化を把握するために、血管の力学特性をモニタリングすることが重要となる。
【0004】
特に、多汗症患者に対して行われる胸部交換神経遮断術では、血管の力学特性のモニタリングが非常に重要となる。この理由を以下説明する。
【0005】
この胸部交換神経遮断術では、交感神経をクリップで遮断することで発汗を抑制するものであるが、手術中に交感神経が適切に遮断されているか否かを判断することは困難であり、手術後における患者の発汗の有無を経過観察することによって、交感神経が適切に遮断されているか否かの判断が行われている。したがって、この遮断が適切に行われていないと判断された場合、再手術を行う必要があり、患者に負担を与えていた。
【0006】
一方、交感神経が適切に遮断されると、血管が弛緩することが従来から知られている。したがって、手術中に患者の血管の力学特性をモニタリングできれば、交感神経が適切に遮断されたか否かを手術中に確認でき、上述した手術後の経過観察や再手術が不要になる。このような理由により、胸部交換神経遮断術では、血管壁の力学特性をモニタリングし、該血管壁の状態の把握を行う必然性が高い。
【非特許文献1】坂根 彰等:動脈壁インピーダンスのセンシング,第4回計測自動制御学会システムインテグレーション部門講演会論文集,1G4-4,pp.237-238,2003.
【発明の開示】
【発明が解決しようとする課題】
【0007】
そこで、上記した非特許文献1によれば、血管壁を粘弾性モデルにモデル化し、血管壁の慣性、粘性、剛性といった要素を出力する計測装置が提案されている。この装置によれば、患者の心電図、血圧値、血管を流れる血液のプレチスモグラムに基づいて、上述した血管壁の慣性、粘性、剛性の力学特性を出力できる。よって、手術中の患者に対して、この手法を用いれば、患者の血管の慣性、粘性、剛性等の力学特性をモニタリングでき、患者の血管壁の状態を把握できる。
【0008】
しかしながら、非特許文献1に開示されている装置によれば、カテーテルを血管壁まで挿入し、このカテーテルから血液を採取することによって、上記挿入箇所の血圧値を計測している。それゆえ、患者の血管の慣性、粘性、剛性等の力学特性をモニタリングするには、カテーテルを患者の血管まで挿入しなければならず、手術による出血以外の余計な出血を伴い、手術中の患者にとって余計な負担が生じることとなる。
【0009】
本発明は、患者の負担を抑制する血管モニタリング装置、制御プログラム、プログラムを記録したコンピュータ読み取り可能な記録媒体を提供することを目的とする。
【課題を解決するための手段】
【0010】
以上の目的を達成するために、本発明の血管壁モニタリング装置は、被験者の心電図を出力する心電図出力手段と、上記被験者の血管におけるプレチスモグラムを出力するプレチスモグラム出力手段と、上記血管における血圧値を検出する血圧値出力手段と、上記心電図、プレチスモグラム、および血圧値に基づいて、上記被験者の血管壁を粘弾性モデルにモデル化した場合における粘性、剛性、慣性の力学特性値のうちの少なくとも1以上の特性値を出力する制御手段と、を含む血管壁モニタリング装置であって、上記血圧値出力手段は間接的動脈圧測定器であることを特徴とする。
【0011】
血管壁モニタリング装置において、被験者の血管壁を粘弾性モデルにモデル化した場合における粘性、剛性、慣性の力学特性値のうちの少なくとも1以上の特性値を出力する場合、その被験者の心電図、プレチスモグラム、血圧値の計測が最低限必要となる。ここで、従来構成の血管壁モニタリング装置によれば、カテーテルを被験者の血管まで挿入することによって当該被験者の血圧を検出していたため、被験者は出血を伴っていた。
【0012】
これに対し、本発明の構成によれば、被験者の血圧値を検出する手段として、非観血で血圧を検出できる間接的動脈圧測定器を用いている。したがって、血管まで挿入するカテーテルによって被験者の血圧を検出していた従来構成と比べ、被験者に対しての負担度を大幅に低減することができるという効果を奏する。
【0013】
本発明の血管壁モニタリング装置は、上記構成に加えて、上記制御手段は、上記心電図におけるR波の出現タイミングをt0とし、この出現タイミングから次のR波の出現タイミングまでの時間をtとし、上記血圧値をPb(t)とした場合、dPb(t)=Pb(t)−Pb(t0)を出力する第一関数設定手段と、上記プレチスモグラムをPl(t)とした場合、Pl(t)の一階微分であるPl(t)´と、Pl(t)の二階微分であるPl(t)´´とを算出する微分演算手段と、dPl(t)=Pl(t)−Pl(t0)、dPl(t)´=Pl(t)´−Pl(t0)´、dPl(t)´´=Pl(t)´´−Pl(t0)´´を出力する第二関数設定手段と、上記dPb(t)、dPl(t)、dPl(t)´、dPl(t)´´を標本として、dPb(t)=M´・dPl(t)´´+B´・dPl(t)´+K´dPl(t)(なお、M´は上記慣性、B´は上記粘性、K´は上記剛性)に対して回帰計算を行い、M´、B´、K´を出力する演算手段と、を含むことを特徴とする。
【0014】
上記被験者の血管壁を粘弾性モデルにモデル化した場合、dPb(t)=M´・dPl(t)´´+B´・dPl(t)´+K´dPl(t)が成立することが知られている。したがって、上記dPb(t)およびdPl(t)を標本として回帰計算を行えば、上記慣性、上記粘性、上記剛性を算出することが可能となる。
【0015】
本発明の血管壁モニタリング装置は、上記構成に加えて、上記制御手段は、上記dPb(t)における変曲点の出現タイミングと、上記dPl(t)における変曲点の出現タイミングとの時間差nを出力し、上記dPb(t)を上記dPb(t−n)に補正する補正手段を含むことを特徴とする。
【0016】
従来構成によれば、血管までカテーテルを直接挿入することによって該血管の血圧値を検出しているが、本発明の血管壁モニタリング装置によれば、血管に直接接触しない間接的動脈圧測定器によって血圧を検出しているため、血管における血圧が間接的動脈圧測定器まで伝達される時間だけ、検出される血圧値が遅延したものとなり、最終的に出力される慣性、粘性、剛性に悪影響を及ぼす可能性が生じる。
【0017】
その一方、dPb(t)は血圧値に基づくものであり、dPl(t)はプレチスモグラムに基づくものである。したがって、両者の示す波形は、脈拍の挙動を示した波形と同様の挙動を示すため、波形の変曲点出現タイミングは本来、略一致するものと考えられる。
【0018】
そこで、上記構成によれば、上記dPb(t)における変曲点の出現タイミングと、上記dPl(t)における変曲点の出現タイミングとの時間差nを出力し、上記dPb(t)を上記dPb(t−n)に補正している。これにより、検出される血圧値が遅延することによってdPb(t)の示す波形の挙動が、本来のものから遅延したものであっても、dPb(t)のタイミングとdPl(t)のタイミングとを相対的に一致させることにより、上記遅延を補正することができる。これにより、出力される慣性、粘性、剛性に悪影響を及ぼす可能性を抑制することができる。
【0019】
なお、上記血管壁モニタリング装置は、コンピュータによって実現してもよく、この場合には、コンピュータを上記制御手段として動作させる制御プログラムによって実現できる。また、上記の制御プログラムを記録したコンピュータ読み取り可能な記録媒体も、本発明の範疇に入る。
【発明の効果】
【0020】
以上のように、本発明の血管壁モニタリング装置は、被験者の心電図を出力する心電図出力手段と、上記被験者の血管におけるプレチスモグラムを出力するプレチスモグラム出力手段と、上記血管における血圧値を検出する血圧値出力手段と、上記心電図、プレチスモグラム、および血圧値に基づいて、上記被験者の血管壁を粘弾性モデルにモデル化した場合における粘性、剛性、慣性の力学特性値のうちの少なくとも1以上の特性値を出力する制御手段と、を含む血管壁モニタリング装置であって、上記血圧値出力手段は間接的動脈圧測定器であることを特徴とする。
【0021】
それゆえ、血管まで挿入するカテーテルによって被験者の血圧を検出していた従来構成と比べ、被験者に対しての負担度を大幅に低減することができるという効果を奏する。
【発明を実施するための最良の形態】
【0022】
本発明の実施の一形態を図に基づいて以下説明する。本実施形態の血管壁モニタリング装置は、以下で説明するように、被験者の心電図、血圧値、プレチスモグラムに基づいて、動脈血管壁(以下、単に「血管壁」とする)を粘弾性モデルにモデル化した場合における該血管壁の粘性、剛性(弾性)、慣性の力学特性値を出力するものである。以下では、説明の便宜のために、まず、上記モデル化、プレチスモグラム、上記力学特性値の算出方法について順に説明し、その後、血管壁モニタリング装置の構成について説明する。
【0023】
(血管壁のモデル化)
人体の血管壁10は、図2に示すように、内膜11、中膜12、外膜13の3層から構成され、各々の層には固有の構成因子が含まれる。
【0024】
外膜13には、結合組織、エラスチン、コラーゲンといった動脈スティフネスやコンプライアンスに影響を及ぼす因子が含まれていると共に、大動脈の血管壁に栄養素を供給する脈管血管が含まれる。
【0025】
内膜11には、一酸化炭素やEDHF(endothelium-derived hyperpolarizing factor)などの内皮由来血管作動性物質を産出する脈管内皮が存在する。
【0026】
中膜12には、エラスチン、コラーゲン等の平滑筋が含まれる。ここで、平滑筋は、交感神経やホルモンによって刺激されると収縮し、血流量を下げる機能を担う。
【0027】
したがって、血管壁10は、中膜12に含まれている平滑筋の作用によって収縮または弛緩する。そこで、本実施形態では、血管壁10の収縮または弛緩の程度を数値化する手段として、血管壁10を粘弾性モデルにモデル化する。
【0028】
図3において、血管壁10の粘弾性モデルを示す。図3に示す粘弾性モデルにおけるM(慣性),B(粘性),K(剛性)の各力学特性値は、〔数1〕の関係を示す。
【0029】
【数1】

【0030】
なお、〔数1〕において、r(t)´はr(t)の一階微分を示し、r(t)´´はr(t)の二階微分を示す。
【0031】
ここで、血管壁10の変位開始時刻をt0とすると、時刻tにおける上記各力学特性値は、〔数2〕の関係を示す。
【0032】
【数2】

【0033】
ここで、〔数2〕に基づいて、M,B,Kを推定するためには、F(t),r(t)を算出する必要がある。
【0034】
F(t)は、血管壁10に作用する血圧と比例関係にあるため、血圧値に基づいてF(t)を算出する。具体的には、以下の〔数3〕に基づいてF(t)を算出する。
【0035】
【数3】

【0036】
一方、血管半径であるr(t)は、直接測定することが困難であるため、血管内の血液のプレチスモグラムに基づいてr(t)を定めることとする。なお、プレチスモグラムに基づいてr(t)を定める原理については、以下詳細に説明する。
【0037】
(プレチスモグラム)
脈波には、血管内の血液圧変動を記録した圧脈波と、血液の容積変化を記録した容積脈波とがあるが、本明細書におけるプレチスモグラムとは上記容積脈波に該当するものである。
【0038】
以下、血管のプレチスモグラムの検出方法について説明する。この検出には、図5に示すような、LED(light emitting diode)とフォトダイオードとから構成される光電脈波計103が用いられる。
【0039】
LEDから出射する光を人体の指にあてた場合、この光は指および指内部の血管を透過して、フォトダイオードに到達するが、この場合、Lambert-Beerの法則により、以下に示す〔数4〕が成立する。
【0040】
【数4】

【0041】
なお、〔数4〕において、Dは血管の直径、ADは直径Dの血管に対する減光度、Cは吸光物質(血管および血液)の濃度、IOは入射光強度、IDは透過光強度、Eは吸光物質の吸光係数である。
【0042】
ここで、血管の直径がDからD+ΔD(t)に変化することによって、減光度がA(t)になって、透過光強度がID−ΔI(t)になったとすると、血管の減光度の変動分ΔA(t)は、以下に示す〔数5〕のようになる。
【0043】
【数5】

【0044】
そして、この減光度の変動分ΔA(t)を計測したものが、上述したプレチスモグラムに該当する。但し、〔数5〕においては、Cは血液の濃度に依存する等、個々の測定条件に依存する不確定要素が含まれているため、〔数5〕によってΔA(t)を直接計算により求めることはできない。
【0045】
そこで、本実施形態では、〔数5〕に対する近似式を設定し、この近似式によってΔA(t)を求めることとする。以下では、この近似式の設定方法について説明する。
【0046】
上述したように、LEDから出射する光を直径Dの血管にあてた場合、血管の透過光強度は、図4の参照符aのグラフに示すように、周期的に変動する。ここで、図4に示すIsは、心臓の収縮期(Systolic)における血管の透過光強度であり、Idは、心臓の拡張期(Diastolic)における血管の透過光強度である。
【0047】
ここで、透過光強度IDを示す状態から心臓収縮期へ移行した血管の透過光強度変動分をΔIs(t)=ID−IS(t)、透過光強度IDを示す状態からから心臓収縮期への移行した血管の減光度の変動分をΔAs(t)とし、透過光強度IDを示す状態から心臓拡張期へ移行した血管の透過光強度変動分をΔId(t)=Id(t)−ID、透過光強度IDを示す状態から心臓拡張期へ移行した血管の減光度の変動分をΔAd(t)とすると、以下に示す〔数6〕〔数7〕が成立する。
【0048】
【数6】

【0049】
【数7】

【0050】
ここで、心臓収縮期においてはΔId(t)=0、心臓拡張期においてはΔIs(t)=0であるため、減光度の変動分ΔA(t)は以下の〔数8〕で表すことができる。
【0051】
【数8】

【0052】
また、透過光強度の変動分はΔI(t)=ΔIs(t)+ΔId(t)であることから、〔数8〕においては、ΔI(t)/IDを十分小と判断できる。したがって、〔数8〕において、2次以降の項を無視することができ、血管の減光度の変動分ΔA(t)およびプレチモグラムPl(t)は、〔数9〕のように近似することができる。
【0053】
【数9】

【0054】
さらに、ΔA(t)は、収縮または弛緩による血管壁の変位に比例すると考えられるため、以下に示す〔数10〕が成立する。
【0055】
【数10】

【0056】
なお、kpは比例定数、rv(t)を計測部位における血管壁の半径である。そして、〔数9〕および〔数10〕から、以下の〔数11〕を得ることができる。
【0057】
【数11】

【0058】
以下では、上述したPb(t)およびPl(t)に基づいて、血管を粘弾性モデルにモデル化した場合のM(慣性),B(粘性),K(剛性)の各力学特性値の算出方法について説明する。
【0059】
(力学特性値の算出方法)
〔数2〕のr(t)に対して、〔数11〕のrv(t)を代入すると共に、〔数3〕を用いて式を整理すると、
【0060】
【数12】

【0061】
が得られる。
【0062】
よって、被験者の血圧およびプレチスモグラムを計測し、計測した血圧をPb(t)、計測したプレチスモグラムをPl(t)とする。そして、このPb(t)およびPl(t)を標本として、〔数12〕を用いて回帰計算すれば、M´(慣性),B´(粘性),K´(剛性)の各力学特性値を推定することが可能となる。
【0063】
(血管壁モニタリング装置の構成)
つぎに、被験者の血管壁の状態をモニタリングできる血管壁モニタリング装置100の構成について説明する。この血管壁モニタリング装置100は、被験者の血管壁を粘弾性モデルにモデル化した場合における該血管壁のM´(慣性),B´(粘性),K´(剛性)を出力する。これにより、オペレータは、被験者の血管壁の状態(収縮または弛緩度合)をモニタリングすることが可能となる
図1に示すように、血管壁モニタリング装置100は、血圧測定手段としてのフィナプレス(商品名)101、心電計(心電図出力手段)102、光電脈波計(プレチスモグラム出力手段)103、コンピュータ104、表示部105を備えている。
【0064】
フィナプレス(血圧値出力手段)101は、図6に示すように、カフを被験者のいずれかの指に装着し、この指における血管の血圧データを一脈毎に検出し、この血圧データをコンピュータ104へ入力する間接的動脈圧測定器であり、例えば、Ohmeda社のフィナプレスが用いられる。なお、ここで、フィナプレス101から出力される血液データ(信号)を上述したPb(t)とする。
【0065】
心電計102は、被験者の心電図データを検出し、この心電図データをコンピュータ104へ入力するデバイスである。
【0066】
光電脈波計103は、図5に示すように、LEDとフォトダイオードとから構成され、被験者の指の血管におけるプレチスモグラムを検出するデバイスである。具体的には、被験者のいずれかの指を介して上記LEDと上記フォトダイオードとを対向配置させ、この指へ向けてLEDから光を放出させると共に、指を透過した光を上記フォトダイオードが受光する。そして、LEDの発光量と、フォトダイオードの受光量とから、血管を透過する光の透過率を検出し、検出結果から被験者のプレチスモグラムデータを求める。さらに、光電脈波計103は、検出したプレチスモグラムデータをコンピュータ104へ入力する。なお、ここで、光電脈波計103から出力されるプレチスモグラムデータ(信号)を上述したPl(t)とする。
【0067】
なお、フィナプレス101のカフを装着する指と、光電脈波計103のLEDおよびフォトダイオードを対向させる指とは、同じ腕であって互いに異なる指であることが好ましい。具体的に、本実施形態の血管壁モニタリング装置100を試験運用した際には、被験者の左手中指にフィナプレス101のカフを装着すると共に、被験者の左手拇指を介して光電脈波計103のLEDおよびフォトダイオードを対向させた。
【0068】
コンピュータ104は、フィナプレス101、心電計102、光電脈波計103から入力されるデータを処理し、処理結果を表示部105に出力するものである。なお、コンピュータ104の構成の詳細については後に詳述する。
【0069】
表示部105は、コンピュータ104によって処理された情報を画像として表示するためのデバイスであり、液晶ディスプレィが用いられる。但し、液晶ディスプレィに限られるものではなく、例えば、プラズマディスプレィ、CRT(cathode ray tube)、有機EL(Electro Luminescence)ディスプレィ、無機ELディスプレィであってもよい。
【0070】
次に、コンピュータ104の構成について説明する。コンピュータ104は、デジタルフィルタ110a・110b、制御部120、記憶部130から構成される。また、制御部120は、第一関数設定部121、微分演算部122、第二関数設定部123、回帰演算部124、表示制御部125から構成される。
【0071】
デジタルフィルタ110aは、フィナプレス101からPb(t)を入力し、入力したPb(t)の周波数特性を調整することによってPb(t)からノイズ成分を除去し、ノイズ成分を除去したPb(t)を制御部120へ入力する回路である。また、デジタルフィルタ110bは、光電脈波計103からPl(t)を入力し、入力したPl(t)の周波数特性を調整することによってPl(t)からノイズ成分を除去し、ノイズ成分を除去したPl(t)を制御部120へ入力する回路である。
【0072】
なお、これらデジタルフィルタとしては、LPF(low pass filter)またはHPF(high pass filter)を用いることができる。
【0073】
制御部(制御手段)120は、血管壁モニタリング装置100における各種構成の動作を統括的に制御するものであると共に、各種データ処理を行う制御装置である。この制御部120は、CPU(Central Processing Unit,中央演算処理装置),RAM(Random Access Memory,随時書込・読出メモリ)等によって構成される。そして、各種構成の動作制御は、制御プログラムをCPUに実行させることによって行われる。この制御プログラムは、例えばCD−ROM(Compact Disc Read Only Memory)などのリムーバブルメディアに記録されているものを読み出してRAMに書き込み、CPUがRAMにアクセスして使用する形態であってもよいし、記憶部130などにインストールされたものを読み出してRAMに展開し、CPUがRAMにアクセスして使用する形態であってもよい。また、制御部120がインターネットなどの通信ネットワークに接続された構成とする場合、この通信ネットワークを介して上記制御プログラムをダウンロードして記憶部130にインストールして実行する形態なども考えられる。なお、制御部120の構成の詳細については後述する。
【0074】
記憶部130は、ハードディスクまたはフラッシュメモリなどの不揮発性の記憶装置によって構成されるものである。この記憶部130に記憶される内容としては、上記した制御プログラム、OS(Operating System)プログラム、およびその他各種プログラムなどが挙げられるが、本実施形態では、上述した〔数12〕における(a)式を回帰計算式として格納している。
【0075】
つぎに、制御部120の構成の詳細について説明する。
【0076】
第一関数設定部(第一関数設定手段)121は、心電計102から心電図データを入力すると共に、デジタルフィルタ110aからPb(t)を入力する。そして、第一関数設定部121は、上記心電図データのR波の出現タイミングをt0(t0=0)として、dPb(t)=Pb(t)−Pb(t0)とした関数を設定し、この関数を回帰演算部124へ入力する。
【0077】
つまり、第一関数設定部121は、上記心電図データにおいてR波が出現するタイミングから次にR波が出現するタイミングまでの期間を1周期として、周期毎に、dPb(t)を抽出している。したがって、第一関数設定部121は、抽出した周期毎のdPb(t)を回帰演算部124へ入力することとなる。なお、図8(d)において、1周期分のdPb(t)の例を示す。
【0078】
微分演算部(微分演算手段)122は、デジタルフィルタ110bからPl(t)を入力する。そして、微分演算部122は、Pl(t)の一階微分であるPl(t)´と、Pl(t)の二階微分であるPl(t)´´とを算出し、Pl(t)、Pl(t)´、Pl(t)´´を第二関数設定部123へ入力する。
【0079】
第二関数設定部(第二関数設定手段)123は、心電計102から心電図データを入力すると共に、微分演算部122からPl(t)、Pl(t)´、Pl(t)´´を入力する。そして、第二関数設定部123は、上記心電図データのR波の出現タイミングをt0(t=0)として、dPl(t)=Pl(t)−Pl(t0),dPl(t)´=Pl(t)´−Pl(t0)´,dPl(t)´´=Pl(t)´´−Pl(t0)´´とした関数を設定し、これらdPl(t),dPl(t)´およびdPl(t)´´を回帰演算部124へ入力する。
【0080】
つまり、第二関数設定部123は、上記心電図データにおいてR波が出現するタイミングから次にR波が出現するタイミングまでの期間を1周期として、周期毎に、dPl(t)、dPl(t)´、dPl(t)´´を抽出している。したがって、第二関数設定部123は、抽出した周期毎のdPl(t)、dPl(t)´、dPl(t)´´を回帰演算部124へ入力することとなる。なお、図8(a)において、1周期分のdPl(t)の例を示し、図8(b)において、1周期分のdPl(t)´の例を示し、図8(c)において、1周期分のdPl(t)´´の例を示す。
【0081】
回帰演算部(演算手段)124は、記憶部130に格納されている回帰計算式(〔数12〕における(a)式)を読み出し、入力したdPb(t)、dPl(t)、dPl(t)´、dPl(t)´´を標本として、読み出した回帰計算式に基づいて回帰計算を行い、この回帰計算式におけるM´、B´、K´を算出する。
【0082】
また、回帰演算部124は、全周期におけるM´、B´、K´の算出を行い、全測定時間に対するM´、B´、K´の変動度を示したグラフを作成する。
【0083】
表示制御部125は、回帰演算部124が作成したグラフを入力すると共に、このグラフを表示部105に表示する制御を行うブロックである。なお、図7(b)において、M´、B´、K´の変動度を示したグラフの例を示す。
【0084】
以上の構成によれば、被験者の心電図、該被験者のいずれかの指における血管の血圧データ、プレチスモグラムから、該被験者の血管を粘弾性モデルにモデル化した場合のM(慣性),B(粘性),K(剛性)をリアルタイムで表示部105に表示させることができる。
【0085】
したがって、例えば、胸部交換神経遮断術において、本実施形態の血管壁モニタリング装置100を用いて患者の血管の慣性、粘性、剛性等の力学特性をモニタリングすれば、患者の血管壁の状態を手術中に把握でき、交換神経が適切に遮断されているか否かを手術中に把握することが可能となる。
【0086】
また、本実施形態の血管壁モニタリング装置100によれば、被験者の血圧値を検出する手段として、非観血で血圧を検出できるフィナプレス101を用いている。したがって、血管までチューブを挿入するカテーテルによって被験者の血圧を検出していた非特許文献1の構成と比べ、被験者に対しての負担度を大幅に低減することができる。
【0087】
さらに、胸部交換神経遮断術を施している患者に対して、非特許文献1の計測装置および血管壁モニタリング装置100を用いて、当該患者の血管のM(慣性),B(粘性),K(剛性)を出力した結果を図7に示す。図7(a)は、非特許文献1の計測装置によって出力したデータを示し、図7(b)は、血管壁モニタリング装置100によって出力したデータを示す。
【0088】
なお、図7(a)および図7(b)において、患者は同一であるものとし、計測時刻も同一である。また、非特許文献1の構成および血管壁モニタリング装置100においては、患者の左手母指に光電脈波計を近接させることによって、当該中指の血管におけるプレチスモグラムを検出した。但し、非特許文献1の構成においては、患者の左撓骨動脈にカテーテルを挿入して血圧を測定し、血管壁モニタリング装置100においては、患者の左手中指にフィナプレスのカフを装着することによって血圧を測定した。
【0089】
図7(a)および図7(b)において、参照符Aで示される時刻は、患者の交換神経をクリップで遮断した時点を示している。
【0090】
図7(a)および図7(b)共に、参照符Aで示される時刻より前の時間帯では、B(粘性),K(剛性)が増加傾向にある。これは、医師の手術が行われている状況では、患者に対して刺激が与えられているため、血管が収縮して硬くなっていると考えられるからである。
【0091】
また、図7(a)および図7(b)共に、参照符Aで示される時刻より後の時間帯では、B(粘性),K(剛性)が減少傾向にある。これは、交換神経がクリップによって適切に遮断されると、血管が弛緩すると考えられるからである。
【0092】
このように、本実施形態の血管壁モニタリング装置100によれば、従来の計測装置と比べ(非特許文献1の計測装置)、M(慣性)、B(粘性),K(剛性)の大小において若干の相違があるものの、各値の増加および減少のタイミングは一致しているため、本実施形態の血管壁モニタリング装置100によっても、血管壁の状態を推測することが十分に可能であると言える。
【0093】
なお、従来の計測装置では血管までカテーテルを直接挿入することによって該血管の血圧値を検出しているが、本実施形態の血管壁モニタリング装置100によれば、フィナプレス101によって血圧を検出しているため、血管における血圧がカフまで伝達される時間だけ、検出される血圧値が遅延したものとなる。これにより、出力されるM(慣性)、B(粘性),K(剛性)に悪影響を及ぼす可能性もある。
【0094】
そこで、以下では、上述した遅延を補正できる血管壁モニタリング装置100について、図9に基づいて説明する。
【0095】
図9に示す血管壁モニタリング装置100は、図1に示す血管壁モニタリング装置100と比べて、時間差補正部150が備えられている点、記憶部130において以下の〔数13〕に示される回帰計算式が格納されている点が相違するが、その他の構成については同様である。
【0096】
【数13】

【0097】
時間差補正部(補正手段)150は、第一関数設定部121から、ある周期におけるdPb(t)を入力すると共に、第二関数設定部123から当該周期におけるdPl(t)を入力する。
【0098】
そして、時間差補正部150は、dPb(t)の波形における立ち上がりから最大点に到達するまでの間に存在する変曲点のタイミングを示すt値をt1として検出する。また、時間差補正部150は、dPl(t)の波形における立ち上がりから最大点に到達するまでの間に存在する変曲点のタイミングを示すt値をt2として検出する。
【0099】
さらに、時間差補正部150は、t1−t2=nを演算し、記憶部130から〔数13〕に示される回帰計算式を読み出し、この回帰計算式にnを代入する。そして、時間差補正部150は、この回帰計算式を回帰演算部124へ入力する。
【0100】
そして、回帰演算部124は、時間差補正部150から入力した回帰計算式によって上述の回帰計算を行う。
【0101】
以上の構成において、dPb(t)は血圧値に基づくものであり、dPl(t)はプレチスモグラムに基づくものである。したがって、両者の示す波形は、脈拍の挙動を示した波形と同様の挙動を示すため、波形の立ち上がりタイミング、最大点到達タイミング、変曲点出現タイミングは、本来、略一致するものと考えられる。
【0102】
そこで、図9の構成によれば、上述した時間差補正部150において、t1−t2=nを演算し、〔数13〕に示される回帰計算式にnを代入している。これにより、回帰演算部124によって実行される回帰計算において、dPb(t)の各値はdPb(t−n)に補正されることとなり、dPb(t)のタイミングとdPl(t)のタイミングとを相対的に一致させることができる。
【0103】
つまり、検出される血圧値が遅延することによってdPb(t)の示す波形の挙動が、本来のものから遅延したものであっても、dPb(t)のタイミングとdPl(t)のタイミングとを相対的に一致させることができ、上記遅延を補正することができる。これにより、出力されるM(慣性)、B(粘性),K(剛性)に悪影響を及ぼす可能性を抑制することができる。
【0104】
なお、本実施形態における血管壁は動脈血管壁であるが、本実施形態の血管壁モニタリング装置は動脈血管壁における力学特性を計測するものに限定されるものではなく、静脈血管壁における力学特性を計測することも可能である。
【0105】
また、本実施形態において、粘弾性モデルとして、図3に示すように骨格筋インピーダンス推定モデルを用いているが、これに限定されるものではなく、フォークトモデル、マックスウェルモデル、ケルビンモデルなどであってもよい。また、粘弾性モデルであればよく、様々な変形も可能である。
【0106】
さらに、本実施形態の血管壁モニタリング装置100は、手術現場における患者の血管壁のモニタリングに好適であるが、用途としては手術現場のみに限られるものではなく、例えば、トレーニング機器、マッサージ機器等の健康用機器に適用することも可能である。
【0107】
なお、上述した実施形態では、血圧値出力手段としてフィナプレスを用いているが、間接的動脈圧測定器であればよく、フィナプレスに限定されるものではない。
【0108】
なお、以上の実施の形態で説明した血管壁モニタリング装置は、コンピュータに制御プログラムを読み込ませることによって実現させてもよく、このプログラムをコンピュータ読み取り可能な記録媒体に、記録するものとすることもできる。この結果、上記制御プログラムを記録した記録媒体を持ち運び自在に提供することができる。
【0109】
なお、この記録媒体としては、マイクロコンピュータで処理が行われるために図示していないメモリ、例えばROM(Read only memory)のようなものそのものがプログラムメディアであっても良いし、また、図示していないが外部記憶装置としてプログラム読み取り装置が設けられ、そこに記録媒体を挿入することで読み取り可能なプログラムメディアであっても良い。
【0110】
いずれの場合においても、格納されているプログラムはマイクロプロセッサがアクセスして実行させる構成であっても良いし、あるいは、いずれの場合もプログラムを読み出し、読み出されたプログラムは、マイクロコンピュータの図示されていないプログラム記憶エリアにダウンロードされて、そのプログラムが実行される方式であってもよい。このダウンロード用のプログラムは予め本体装置に格納されているものとする。
【0111】
ここで、上記プログラムメディアは、本体と分離可能に構成される記録媒体であり、磁気テープやカセットテープ等のテープ系、フロッピー(登録商標)ディスクやハードディスク等の磁気ディスクやCD−ROM/MO/MD/DVD等の光ディスクのディスク系、ICカード(メモリカードを含む)/光カード等のカード系、あるいはマスクROM、EPROM(Erasable Programmable Read Only Memory)、EEPROM(Electrically Erasable Programmable Read Only Memory)、フラッシュROM等による半導体メモリを含めた固定的にプログラムを担持する媒体であっても良い。
【0112】
また、本実施の形態においては、コンピュータ104を、インターネットを含む通信ネットワークと接続可能な構成とし、通信ネットワークからプログラムをダウンロードするように流動的にプログラムを担持する媒体であっても良い。なお、このように通信ネットワークからプログラムをダウンロードする場合には、そのダウンロード用のプログラムは予め本体装置に格納しておくか、あるいは別な記録媒体からインストールされるものであっても良い。上記記録媒体は、コンピュータ104に備えられるプログラム読み取り装置により読み取られることで上述した処理が実行される。
【0113】
本発明は上述した各実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、上述した実施形態において開示された各技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【産業上の利用可能性】
【0114】
本発明の血管壁モニタリング装置は、手術時の患者の血管壁のモニタリングに好適であるが、これに限定されず、トレーニング機器、マッサージ機器等の健康用機器に備えることも可能である。また、本発明の血管壁モニタリング装置における被験者は人間に限定されるものではなく、動物が被験者であってもよい。
【図面の簡単な説明】
【0115】
【図1】本発明の一実施形態に係る血管壁モニタリング装置の構成を示すブロック図である。
【図2】人体の血管の構造を示した模式図である。
【図3】図2に示す血管を粘弾性モデルにモデル化した模式図である。
【図4】血管の透過光強度、減光度、減光度の変動分を示したグラフである。
【図5】図1に示す光電脈波計の構成を示す模式図である。
【図6】図1に示すフィナプレスの外観構成の画像を示す図である。
【図7】被験者の血管の慣性、粘性、剛性を示したグラフであって、(a)は、従来構成の継続装置によって得られたグラフであり、(b)は、本発明の一実施形態に係る血管壁モニタリング装置によって得られたグラフである。
【図8】本発明の一実施形態に係る血管壁モニタリング装置によって得られたグラフであり、(a)は時間とプレチスモグラムとの関数を示したグラフであり、(b)は、プレチスモグラムPl(t)を一階微分し、初期時刻における一階微分値を差し引くことによって得られる関数のグラフであり、(c)は、プレチスモグラムPl(t)を二階微分し、初期時刻における二階微分値を差し引くことによって得られる関数のグラフであり、(d)は、時間と血圧値との関数を示したグラフである。
【図9】本発明の他の実施形態に係る血管壁モニタリング装置の構成を示すブロック図である。
【符号の説明】
【0116】
10 血管壁
11 内膜
12 中膜
13 外膜
100 血管壁モニタリング装置
101 フィナプレス(血圧値出力手段、間接的動脈圧測定器)
102 心電計(心電図出力手段)
103 光電脈波計(プレチスモグラム検出手段)
104 コンピュータ
105 表示部
110a・110b デジタルフィルタ
120 制御部(制御手段)
121 第一関数設定部(第一関数設定手段)
122 微分演算部(微分演算手段)
123 第二関数設定部(第二関数設定手段)
124 回帰演算部(演算手段)
125 表示制御部
130 記憶部
150 時間差補正部(補正手段)
【特許請求の範囲】
【請求項1】
被験者の心電図を出力する心電図出力手段と、
上記被験者の血管におけるプレチスモグラムを出力するプレチスモグラム出力手段と、
上記血管における血圧値を検出する血圧値出力手段と、
上記心電図、プレチスモグラム、および血圧値に基づいて、上記被験者の血管壁を粘弾性モデルにモデル化した場合における粘性、剛性、慣性の力学特性値のうちの少なくとも1以上の特性値を出力する制御手段と、を含む血管壁モニタリング装置であって、
上記血圧値出力手段は間接的動脈圧測定器であることを特徴とする血管壁モニタリング装置。
【請求項2】
上記制御手段は、
上記心電図におけるR波の出現タイミングをt0とし、この出現タイミングから次のR波の出現タイミングまでの時間をtとし、上記血圧値をPb(t)とした場合、dPb(t)=Pb(t)−Pb(t0)を出力する第一関数設定手段と、
上記プレチスモグラムをPl(t)とした場合、Pl(t)の一階微分であるPl(t)´と、Pl(t)の二階微分であるPl(t)´´とを算出する微分演算手段と、
dPl(t)=Pl(t)−Pl(t0)、dPl(t)´=Pl(t)´−Pl(t0)´、dPl(t)´´=Pl(t)´´−Pl(t0)´´を出力する第二関数設定手段と、
上記dPb(t)、dPl(t)、dPl(t)´、dPl(t)´´を標本として、
dPb(t)=M´・dPl(t)´´+B´・dPl(t)´+K´dPl(t)
(なお、M´は上記慣性、B´は上記粘性、K´は上記剛性)
に対して回帰計算を行い、M´、B´、K´を出力する演算手段と、
を含むことを特徴とする請求項1に記載の血管壁モニタリング装置。
【請求項3】
上記制御手段は、
上記dPb(t)における変曲点の出現タイミングと、上記dPl(t)における変曲点の出現タイミングとの時間差nを出力し、上記dPb(t)を上記dPb(t−n)に補正する補正手段を含むことを特徴とする請求項2に記載の血管壁モニタリング装置。
【請求項4】
請求項1ないし3のいずれか1項に記載の血管壁モニタリング装置を制御する制御プログラムであって、上記制御手段の機能をコンピュータで実現する制御プログラム。
【請求項5】
請求項4に記載の制御プログラムを記録したコンピュータ読み取り可能な記録媒体。
【請求項1】
被験者の心電図を出力する心電図出力手段と、
上記被験者の血管におけるプレチスモグラムを出力するプレチスモグラム出力手段と、
上記血管における血圧値を検出する血圧値出力手段と、
上記心電図、プレチスモグラム、および血圧値に基づいて、上記被験者の血管壁を粘弾性モデルにモデル化した場合における粘性、剛性、慣性の力学特性値のうちの少なくとも1以上の特性値を出力する制御手段と、を含む血管壁モニタリング装置であって、
上記血圧値出力手段は間接的動脈圧測定器であることを特徴とする血管壁モニタリング装置。
【請求項2】
上記制御手段は、
上記心電図におけるR波の出現タイミングをt0とし、この出現タイミングから次のR波の出現タイミングまでの時間をtとし、上記血圧値をPb(t)とした場合、dPb(t)=Pb(t)−Pb(t0)を出力する第一関数設定手段と、
上記プレチスモグラムをPl(t)とした場合、Pl(t)の一階微分であるPl(t)´と、Pl(t)の二階微分であるPl(t)´´とを算出する微分演算手段と、
dPl(t)=Pl(t)−Pl(t0)、dPl(t)´=Pl(t)´−Pl(t0)´、dPl(t)´´=Pl(t)´´−Pl(t0)´´を出力する第二関数設定手段と、
上記dPb(t)、dPl(t)、dPl(t)´、dPl(t)´´を標本として、
dPb(t)=M´・dPl(t)´´+B´・dPl(t)´+K´dPl(t)
(なお、M´は上記慣性、B´は上記粘性、K´は上記剛性)
に対して回帰計算を行い、M´、B´、K´を出力する演算手段と、
を含むことを特徴とする請求項1に記載の血管壁モニタリング装置。
【請求項3】
上記制御手段は、
上記dPb(t)における変曲点の出現タイミングと、上記dPl(t)における変曲点の出現タイミングとの時間差nを出力し、上記dPb(t)を上記dPb(t−n)に補正する補正手段を含むことを特徴とする請求項2に記載の血管壁モニタリング装置。
【請求項4】
請求項1ないし3のいずれか1項に記載の血管壁モニタリング装置を制御する制御プログラムであって、上記制御手段の機能をコンピュータで実現する制御プログラム。
【請求項5】
請求項4に記載の制御プログラムを記録したコンピュータ読み取り可能な記録媒体。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2006−129958(P2006−129958A)
【公開日】平成18年5月25日(2006.5.25)
【国際特許分類】
【出願番号】特願2004−319934(P2004−319934)
【出願日】平成16年11月2日(2004.11.2)
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
【公開日】平成18年5月25日(2006.5.25)
【国際特許分類】
【出願日】平成16年11月2日(2004.11.2)
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
[ Back to top ]

